術後の腸閉塞および胃の通過停滞を予防または軽減するための組成物および方法
【課題】術後の腸閉塞および胃の通過停滞を予防し、あるいは軽減するための組成物および方法を提供する。
【解決手段】このような組成物は、酸化再生セルロース成分と、シクロオキシゲナーゼ酵素(Cox酵素)作用の阻害剤として作用する非ステロイド系抗炎症剤(NSAID)との組み合わせを含む。上述の方法は、上記組成物を、有効量で、胃腸あるいは他の内臓器官の漿膜表面に直接的に投与するステップを含む。
【解決手段】このような組成物は、酸化再生セルロース成分と、シクロオキシゲナーゼ酵素(Cox酵素)作用の阻害剤として作用する非ステロイド系抗炎症剤(NSAID)との組み合わせを含む。上述の方法は、上記組成物を、有効量で、胃腸あるいは他の内臓器官の漿膜表面に直接的に投与するステップを含む。
【発明の詳細な説明】
【開示の内容】
【0001】
本発明は、術後の腸閉塞および胃の通過停滞(gastric stasis)の予防または軽減に関連している。
【0002】
術後の腸閉塞(POI)および胃の通過停滞は、腹部に関係する多くの外科手術に共通する課題である。さらに、腸閉塞および胃の通過停滞は、患者の退院を妨げる主な要因でもある。
【0003】
腸閉塞は、腹部手術後、特に、腸および腹部の他の器官を処置することを含む腹部手術の後に生じる主な合併症の一つである。具体的には、麻痺性腸閉塞は、腸の蠕動運動性を機能的に阻害するものである。この麻痺性腸閉塞は、薬剤および栄養素の吸収を妨げ、患者が受ける不快感および痛みを強め、患者の入院期間を長引かせ、術後の医療保険費用を増大させる。
【0004】
術後の患者に対する介護において、高い頻度で、腸閉塞症状がほとんど処置されることがなく、実際には、多くの場合、患者は合併症に至ることになる。鎮静剤が腸の運動性を低減させるので、術後のみに投与されたモルヒネおよびコデイン等の鎮痛剤は、腸閉塞症状を悪化させ、かつ、術後の腸閉塞の罹患率を増大させる。
【0005】
術後の腸閉塞および胃の通過停滞の症状を治療するための主な解決手段には、全身性薬剤を使用する方法がある。現在、当該症状を治療するための暫定的な承認を得ている唯一の薬剤が存在する。具体的には、術後の腸閉塞(POI)を治療するための局所麻酔性拮抗剤であるエンテレグ(Entereg)の申請書は、アドラー(adolar)およびグラクソスミスクライン(GlaxoSmithKline)により、米国食品医薬品局(FDA)に提出されている。局所麻酔受容体を阻害することは、実際には、術後の腸閉塞を予防する際の実行可能な解決手段の一つである(例えば、米国特許出願第2002/0188005号参照)。それにもかかわらず、この解決手段は、術後に鎮痛剤として一般的に投与される、鎮静剤の胃腸への影響を遮断することのみに有用である。このような薬剤は、腸および胃の通過停滞に対する個別の鎮痛効果を発揮しそうにない。他の解決手段には、アデノシンA1受容体を阻害し、Cox2酵素を阻害し、抗炎症性サイトカインIL-11を用いるなど、他のメディエータが関与している。また、PAR-2酵素を阻害することは、一つの解決手段として示唆されている(例えば、国際公開第9843477号参照)。
【0006】
胃腸の運動性を強化し、あるいは、胃腸の通過停滞および閉塞を予防する薬剤の全身性送出は、上述した全解決手段に共通している。しかし、全身性薬剤の送出は、簡単であるが、当該薬剤の副作用の面も有する。例えば、非ステロイド系抗炎症剤(NSAID)等の抗炎症性の薬剤を全身性送出する際には、回復中の組織に作用するはずである。IL-11等のサイトカイン注射は、患者の免疫反応に影響を与えるはずであり、かつ、A1拮抗剤の全身性投与は、神経系に対する作用を有するはずである。さらに、全身性薬剤の送出は、当該薬剤が標的としていない器官に対しても影響を与えるはずである。
【0007】
腸閉塞および胃の通過停滞の症状を仲介する病変が明確でないが、このような症状に少なくとも部分的に関与するものとして、シクロオキシゲナーゼ酵素(Cox1およびCox2)の活性化に焦点をあてた動物実験がなされている。多くのCox1およびCox2阻害剤が市販されているが、術後の患者に対して当該Cox1およびCox2阻害剤を全身投与することは、他の全身性送出薬剤と同様に、望ましくない。なぜなら、当該阻害剤の胃腸への副作用に起因して、当該阻害剤は、創傷治癒および血小板阻害に影響を与えるからである。
【0008】
上述した検討事項には、術後の腸閉塞および胃の通過停滞を予防し、かつ、治療して改善するうえで、適切、かつ、有用な治療あるいは予防の方法および製品を確認していく必要が引き続き存在している。このような方法および製品は理想的には、病変の症状を、直接的に処置するものであり、望ましくない副作用を生じ得る薬剤の全身投与を含むものではない。したがって、本発明は、胃の通過停滞および術後の腸閉塞を予防し、あるいは、軽減するための組成物および方法を提供するものであり、当該組成物および方法は、患部器官の漿膜表面に治療薬を直接、投与することに関連している。
【0009】
〔発明の概要〕
本発明は、一つの実施の形態において、術後の腸閉塞および胃の通過停滞を予防し、あるいは、軽減するために、胃腸および他の内臓器官の漿膜表面に投与されるうえで、適切な組成物に関連している。このような組成物は、酸化再生セルロース成分と、シクロオキシゲナーゼ酵素阻害剤すなわちCox1酵素および/またはCox2酵素の阻害剤として作用する非ステロイド系抗炎症剤(NSAID)とを含む。
【0010】
本発明は、他の実施の形態において、術後の腸閉塞および胃の通過停滞を予防し、あるいは、軽減するための方法に関連している。このような方法は、酸化再生セルロース成分と、シクロオキシゲナーゼ酵素阻害剤すなわちCox1酵素および/またはCox2酵素の阻害剤として作用する非ステロイド系抗炎症剤(NSAID)とを含む組成物を、有効量で、胃腸あるいは他の内臓器官の漿膜表面に直接的に投与することを含む。
【0011】
本発明は、微粒子あるいはシート状の酸化再生セルロース(ORC)によるシクロオキシゲナーゼ酵素(Cox酵素)阻害剤の局所送出力と共に、当該酸化再生セルロースの腸あるいは他の器官の漿膜表面に対する付着力を利用している。ここで、組織が手術中に炎症を起こしたときの炎症過程で、プロスタノイド類の分子が放出されるが、このプロスタノイド類の分子が、その後、腸閉塞を起こし、かつ、保持する場合があるものとして留意される。漿膜表面にCox酵素阻害剤を局所的に放出することによって、処置された漿膜からのプロスタノイド類の生成は低減され、かつ、胃腸の運動性は改善される。
【0012】
本発明は、酸化再生セルロース繊維あるいは酸化再生セルロース(ORC)微粒子あるいは酸化再生セルロース(ORC)含有の発泡体あるいは凝集体が、腸および他の内臓器官の湿潤状態の漿膜に関与したときに生じる、当該漿膜に対するしっかりとした付着力に基づいている。したがって、本発明に係る組成物の必須成分は、活性状態のCox酵素阻害剤の送出剤として役立つような適切な形態の酸化再生セルロースである。
【0013】
酸化再生セルロースおよびその製造方法の詳細は、フレオン(商標)媒体中で、四酸化二窒素等の酸化剤を用いたカルボキシル化酸化セルロースの調製方法を開示する米国特許第3,364,200号明細書、および、ペルフルオロカーボン溶媒中で、二酸化窒素等の酸化剤を用いたカルボキシル化酸化セルロースの調製方法を開示する米国特許第5,180,398号明細書に述べられている。これら両米国特許は、参照によって、その内容がそっくりそのまま、この明細書に述べられているかのように、この明細書に組み込まれる。上述した複数の方法のうち、いずれかの方法による酸化後に、カルボキシル化酸化セルロースは、四塩化炭素等の溶媒で、十分に洗浄され、その後、50%のイソプロピルアルコール(IPA)水溶液で洗浄され、最終的に、99%のイソプロピルアルコール(IPA)で洗浄される。
【0014】
一つの実施の形態に使用され得る酸化再生セルロースには、従来の粘着性バリアあるいは従来の止血用創被覆材として利用される繊維がさらに含まれる。このような繊維としては、米国ニュージャージー州のモーリスプレインズ(Morris Plains)を居所とするベクトン・ディキンソン・アンド・カンパニー(Beckton Dickinson and Company)から入手できる吸収性セルロース製の外科用被覆材としてのオキシセル(登録商標:Oxycel)だけでなく、ジョンソン・アンド・ジョンソン・カンパニー(Johnson & Johnson Company)におけるニュージャージー州ソマービル(Somerville)を居所とするエシコン・インコーポレイテッド(Ethicon, Inc.)の部門であるジーンケアワールドワイド(Gynecare Worldwide)またはジョンソン・アンド・ジョンソン・ウーンド・マネジメント・ワールドワイド(Johnson & Johnson Wound Management Worldwide)から入手できる、吸収性の粘着性バリアとしてのインターシード(登録商標:Interceed)、吸収性の止血材としてのサージセル(登録商標:Surgicel)、吸収性の止血材としてのサージセルエヌユーニット(登録商標:Surgicel Nu-Knit)および吸収性の止血材としてのサージセルフィブリラ(登録商標:Surgicel Fibrillar)が挙げられる。また、オランダ国のキュラスポン・ヘルスケア(Curaspon Healthcare)から入手できる酸化再生セルロース粉末としてのキュラセル(登録商標:Curacel)等の酸化セルロース粉末、または、吸収性の止血材としてのサージセルフィブリラ(登録商標:Surgicel Fibrillar)あるいは吸収性の粘着性バリアとしてのインターシード(登録商標:Interceed)から作製された微粒子も使用されてもよい。
【0015】
この明細書における組成物および方法は、種々の技術および後述の助剤を用いて調製された種々の形態での酸化再生セルロースと、シクロオキシゲナーゼ酵素(Cox1酵素および/またはCox2酵素)の活性を阻害する阻害剤として作用する薬理学的に活性な成分との組み合わせに関連している。このようなCox酵素阻害剤は、一般に、非ステロイド系抗炎症剤(NSAID)の形態で、周知の物質である。
【0016】
Cox酵素阻害剤として利用される非ステロイド系抗炎症剤(NSAID)は、非選択性あるいは選択性の阻害剤のいずれでもよい。非選択性のCox酵素阻害剤は、シクロオキシゲナーゼ酵素のCox1酵素およびCox2酵素の両変異体の活性を阻害するものである。選択性のCox酵素阻害剤は、特異的に構成されたCox1酵素あるいはCox2酵素のいずれかの活性を選択的に阻害するものである。
【0017】
本発明に有用な非ステロイド系抗炎症剤(NSAID)系のCox酵素阻害剤は、次のようなカテゴリーから選択される。
(1)プロピオン酸誘導体;
(2)酢酸誘導体;
(3)フェナム酸誘導体;
(4)ビフェニルカルボン酸誘導体;
(5)オキシカム類;および
(6)Cox2酵素阻害剤。
【0018】
上述したグループ(1)からグループ(4)までにおけるCox酵素阻害剤は、主として、カルボン酸作用を有している。しかし、これらの酸類は、薬理学的に許容される酸付加物、あるいは、例えばナトリウム塩類などのアルカリ金属塩類の形態で、投与されることもある。
【0019】
本発明において、Cox酵素阻害剤として使用されるプロピオン酸誘導体には、イブプロフェン、ナプロキセン、ベノキサプロフェン、フルルビプロフェン、フェノプロフェン、フェンブフェン、ケトプロフェン、インドプロフェン、ピルプロフェン、カルプロフェン、オキサプロジン、プラノプロフェン、ミロプロフェン、チオキサプロフェン、スプロフェン、アミノプロフェン、チアプロフェン酸、フルプロフェンおよびブクロキシ酸が含まれるが、これらに限定されるものではない。また、プロピオン酸誘導体に構造的に関連し、かつ、プロピオン酸誘導体と同様のシクロオキシゲナーゼ酵素阻害性を有する物質も、上述したグループ内に網羅されるものである。プロピオン酸グループにおいて、現在、好適とされるプロピオン酸誘導体には、イブプロフェン、ナプロキセン、フルルビプロフェン、ケトプロフェンおよびフェンブフェンが含まれる。
【0020】
本発明において、Cox酵素阻害剤として使用される酢酸誘導体には、インドメタシン、スリンダク、トルメチン、ゾメピラク、ジクロフェナク、フェンクロフェナク、アルクロフェナク、イブフェナク、イソキセパック、フロフェナック、チオピナク、ジドメタシン、アセメタシン、フェンチアザク、クリダナクおよびオキシピナクが含まれるが、これらに限定されるものではない。また、酢酸誘導体に構造的に関連し、かつ、酢酸誘導体と同様のシクロオキシゲナーゼ酵素阻害性を有する物質も、上述したグループ内に網羅されるものである。酢酸グループにおいて、現在、好適とされる酢酸誘導体には、ゾメピラク、ジクロフェナク、インドメタシンおよびこれらのナトリウム塩が含まれる。
【0021】
本発明において、Cox酵素阻害剤として使用されるフェナム酸誘導体には、メフェナム酸、メクロフェナム酸、フルフェナム酸、ニフルム酸およびトルフェナム酸が含まれるが、これらに限定されるものではない。また、フェナム酸誘導体に構造的に関連し、かつ、フェナム酸誘導体と同様のシクロオキシゲナーゼ酵素阻害性を有する物質も、上述したグループ内に網羅されるものである。フェナム酸グループにおいて、現在、好適とされるフェナム酸誘導体には、メフェナム酸、メクロフェナム酸およびこれらのナトリウム塩が含まれる。
【0022】
本発明において、Cox酵素阻害剤として使用されるビフェニルカルボン酸誘導体には、ジフルニサルおよびフルフェニサルが含まれるが、これらに限定されるものではない。また、ビフェニルカルボン酸誘導体に構造的に関連し、かつ、ビフェニルカルボン酸誘導体と同様のシクロオキシゲナーゼ酵素阻害性を有する物質も、上述したグループ内に網羅されるものである。ビフェニルカルボン酸誘導体グループにおいて、好適とされるビフェニルカルボン酸誘導体は、ジフルニサルおよびフルフェニサルである。
【0023】
本発明において、Cox酵素阻害剤として使用されるオキシカム類には、ピロキシカム、イソキシカムおよびCP-14, 304(4-ヒドロキシ-2-メチル-N-フェニル-2H-1,2-ベンゾチアジキシン-3-カルボキシアミド-1,1-ジオキシド)が含まれるが、これらに限定されるものではない。また、オキシカム類に構造的に関連し、かつ、オキシカム類と同様のシクロオキシゲナーゼ酵素阻害性を有する物質も、上述したグループ内に網羅されるものである。オキシカム類グループにおいて、好適とされるオキシカム類は、ピロキシカムである。
【0024】
本発明において使用される選択性のCox2酵素阻害剤には、セレコキシブ、ロフェコキシブ、バルデコキシブ、パラコキシブおよびMK 663(エトリコキシブ)が含まれるが、これらに限定されるものではない。また、非ステロイド系抗炎症剤(NSAID)に構造的に関連し、かつ、非ステロイド系抗炎症剤(NSAID)と同様のCox2酵素阻害性を有する物質も、上述したグループ内に網羅されるものである。このグループにおいて、好適とされるCox2酵素阻害剤には、セレコキシブおよびロフェコキシブが含まれる。
【0025】
Cox酵素阻害剤として適切な他の非ステロイド系抗炎症剤(NSAID)のみならず、上述したすべてのCox酵素阻害剤は、米国特許第6,689,382号明細書、同第6,231,888号明細書、米国特許出願公開第2003/0212050号公報および欧州特許出願第EP-A-485,111号に詳述されている。これらすべての特許文献は、参照によって、その内容がそっくりそのまま、この明細書に組み込まれる。
【0026】
本発明において、特に好適に使用されるCox酵素阻害剤は、2級アミン基を有する酸類タイプの非ステロイド系抗炎症剤(NSAID)である。このタイプのうち、特に好適な非ステロイド系抗炎症剤(NSAID)には、2−[(2,6−1 ジクロロフェニル)アミノ]ベンゼン酢酸(ジクロフェナクともいう)、2−[(2,6−ジクロロフェニル)アミノ]ベンゼン酢酸の1ナトリウム塩、あるいは、2−[(2,3−ジメチルフェニル)アミノ]安息香酸(メフェナム酸ともいう)が含まれる。これら特定の非ステロイド系抗炎症剤(NSAID)系のCox酵素阻害剤の化合物は、術後の腸閉塞および胃の通過停滞の予防に有効である。
【0027】
本発明では、上述した非ステロイド系抗炎症剤(NSAID)系のCox酵素阻害剤の化合物自体の使用ばかりでなく、当該化合物と同様の薬理学的結果を与える光学的異性体の使用に加えて、体内で代謝されて当該化合物となるプロドラッグおよび当該化合物の類似体およびこれらの生物活性を有する塩類の使用をも意図しているものとして理解される。したがって、本発明の目的を達成するために、用語「非ステロイド系抗炎症剤」は、非ステロイド系抗炎症剤(NSAID)自体あるいは当該非ステロイド系抗炎症剤(NSAID)として作用する生成物質の塩類、エステル類、プロドラッグ類、類似体、異性体等、すべての誘導体または前駆体を含むことを意味している。
【0028】
本発明において、組成物は、上述したタイプによって、また、当該組成物を調製する上で使用される酸化再生セルロースによって定まる多くの様々な形態を採用できる。また、当該組成物を様々な形態で調製する際の助剤として、種々の組成物を利用することは、妥当である。
【0029】
酸化再生セルロース製の繊維あるいは繊維製品が利用される場合における実施の形態では、Cox酵素阻害活性成分溶液は、(a)酸化再生セルロース製の繊維あるいは繊維製品をCox酵素剤の溶液あるいは懸濁液中に浸漬被覆させることによって、(b)酸化再生セルロース製の繊維あるいは繊維製品の表面上にCox酵素剤の溶液あるいは懸濁液を噴霧被覆させることによって、(c)酸化再生セルロース製の繊維あるいは繊維製品の表面上に、Cox酵素剤の水性溶液あるいは懸濁液、非水性溶液あるいは懸濁液または有機性溶液あるいは懸濁液から形成された少なくとも一層のポリマーフィルムを積層させることによって、あるいは(d)Cox酵素剤および酸化再生セルロースの粉末あるいは繊維製品を含む微小孔性ポリマーマトリックスを形成することによって、上述した組成物内に組み入れてもよい。
【0030】
酸化再生セルロース製の繊維あるいは繊維製品上に積層されるポリマー類は、水溶性ポリマー類であってもよく、これらの水溶性ポリマー類には、ポリ(アクリル酸)、ヒドロキシルプロピルメチルセルロース、ポリビニルピロリドン、ポリエチレングリコールおよびポリエチレンオキシドが含まれるが、これらに限定されるものではない。これらのポリマー類は、処理中に、繊維あるいは繊維製品上へのCox酵素阻害剤の用量を正確に制御するために使用されるが、当該ポリマー類は、水性環境中に迅速に溶解していく。
【0031】
Cox酵素剤が酸化再生セルロースの繊維(fabric)あるいは繊維製品(textile)上にある微小孔性ポリマーマトリックスを形成するための結合成分として使用されるポリマー類には、多糖類および蛋白質が含まれるが、これらに限定されるものではない。このような多糖類には、セルロース、例えばメチルセルロース、アルキルヒドロキシアルキルセルロース、ヒドロキシアルキルセルロース等のアルキルセルロース、硫酸セルロース、カルボキシメチルセルロース塩類、カルボキシメチルセルロース、カルボキシエチルセルロース、キチン、カルボキシメチルキチン、ヒアルロン酸、ヒアルロン酸塩類、アルギン酸塩、アルギン酸、アルギン酸プロピレングリコール、グリコーゲン、デキストラン、硫酸デキストラン、カードラン、ペクチン、プルラン、キサンタン、コンドロイチン、コンドロイチン硫酸、カルボキシメチルデキストラン、カルボキシメチルキトサン、キトサン、ヘパリン、ヘパリン硫酸、ヘパラン、ヘパラン硫酸、デルマタン硫酸、ケラタン硫酸、カラギーナン類、キトサン、澱粉、アミロース、アミロペクチン、ポリ-N-グルコサミン、ポリマンヌロン酸、ポリグルクロン酸、ポリグルロン酸およびこれらの誘導体が含まれるが、これらに限定されるものではない。蛋白質の例には、コラーゲンおよびゼラチンが含まれるが、これらに限定されるものではない。
【0032】
繊維あるいは繊維製品の形態に加えて、酸化再生セルロース成分は、粒子の形態であってもよい。例えば、一つの実施の形態では、酸化再生セルロース製の繊維製品は、ベックマン・コールター(Beckman Coulter)粒径分析装置[LF13320、トルネード・ドライ・パウダー・システム・アンド・ユニバーサル・リキッド・モジュール(Tornado Dry Powder System and Universal Liquid Module)]によって測定された場合に、1μm〜1000μmの平均粒径、好ましくは20μm〜25μmの平均粒径を有する粒子に微細化されてもよい。この実施の形態では、組成物は、上述した酸化再生セルロース粒子と、1μm〜1000μmの平均粒径、好ましくは1μm〜100μmの平均粒径を有するCox酵素剤粒子とを含む。例えば、上述した酸化再生セルロース粉末は、最終用途のために、Cox酵素剤粉末と混合されてもよい。混合粉末中に使用される酸化再生セルロースの粒径範囲を得るためには、酸化再生セルロースは、例えば、極低温粉砕法で処理されてもよい。
【0033】
他の実施の形態では、本発明の組成物は、酸化再生セルロース粒子と、微小孔性の結合成分と、Cox酵素剤とを含有してもよく、発泡スポンジ、発泡ビーズあるいは凝集体の形態であってもよい。
【0034】
他の実施の形態では、発泡スポンジ、発泡ビーズあるいは凝集体を形成するために利用される酸化再生セルロースの粒子あるいは短繊維は、約10μm〜約5000μmの平均粒径、好ましくは約680μm〜約4350μmの平均粒径を有してもよい。このような酸化再生セルロース粒子は、上述した酸化再生セルロース繊維、あるいは、任意の酸化再生セルロース繊維製品を、中級モデルのトーマス−ワイリー(登録商標:Thomas-Wiley)ラボラトリー・ミルの切断刃等のモータ駆動式の粉砕機の切断刃で、所望の繊維長さとなるように、粉砕することによって、作製されてもよい。二つの固定刃と、高速で回転して剪断作用を発揮する四つの切断刃を備えたモータとを有するモータ駆動式の粉砕機は、サンプル繊維を急速に粉砕するうえで適している。例えば、酸化再生セルロース粒子は、サージセル(登録商標:Surgicel)吸収性止血材、サージセルエヌユーニット(登録商標:Surgicel Nu-Knit)吸収性止血材、あるいはサージセルフィブリラ(登録商標:Surgicel Fibrillar)吸収性止血材等の酸化再生セルロース繊維製品、あるいは、酸化再生セルロースを、液体窒素が充填されたステンレス鋼製ホイルの小袋中に入れ、当該ホイル小袋を液体窒素中に浸漬させることによって、作製されてもよい。その後、当該ホイル小袋を、例えば、毎分6インチ(1インチ=2.54cm)で回転する複輪ローラを通過させることで、0.035mm〜4.35mmの平均粒径を有する酸化再生セルロースが得られる。
【0035】
本発明の組成物の上述したすべての実施の形態において、および、本発明の方法において、Cox酵素剤の酸化再生セルロース(ORC)に対する質量比は、概ね、約1:1000〜約1:3の範囲とされる。より好ましくは、このCox酵素剤の酸化再生セルロース(ORC)に対する質量比は、約1:100〜約1:10の範囲となる。本発明の組成物においては、活性状態のCox酵素剤は、概ね、組成物に対して、約0.01重量%〜約10重量%の濃度範囲内とされ、より好ましくは、約0.1重量%〜約3重量%の濃度範囲内とされる。
【0036】
また、組成物は、安定剤、湿潤剤あるいは保存剤等の種々の物質を含むことによる恩恵を受けてもよい。また、当該組成物には、非ステロイド系抗炎症剤(NSAID)系のCox酵素阻害剤および残余の成分との相溶性がある限り、他の薬剤も添加されてもよい。これらの薬剤には、抗生剤、抗ウィルス剤および抗真菌剤が含まれる。組織部位が感染することがあるので、抗生剤あるいは抗菌剤も、上述した組成物と組み合わせられてもよい。
【0037】
漿膜水、血液あるいは腹水等の腹腔内の流体に接触した場合に、本発明の組成物は、酸化再生セルロースの親水性の結果として、膨潤する。また、組成物は、該組成物を送出するうえで役立つように、使用直前に、外因性の水性流体、好ましくはリン酸緩衝生理食塩水に曝されてもよい。移植直前に使用されるうえで適切な他の水性溶液には、殺菌形態のリンゲル液、生理食塩水およびデキストロース溶液が含まれる。上述した形態の場合では、湿潤状態の組成物の流動性は、当該組成物が、組織部位の漿膜に内在する凹凸、裂け目、隙間、あるいは皺に適合することを可能にする。
【0038】
本発明の方法の態様では、本発明は、上述した組成物を、有効量で、胃腸あるいは他の内臓器官の漿膜表面に直接、投与するステップを含む。このような組成物は、Cox1酵素阻害剤および/またはCox2酵素阻害剤として作用する非ステロイド系抗炎症剤(NSAID)用の担体として、酸化再生セルロースを利用する。
【0039】
上述したように、酸化再生セルロース(ORC)は、腸あるいは他の器官の漿膜層に組み込まれ、当該漿膜表面にしっかりと付着する。Cox酵素阻害剤等の任意の治療薬を処置中の漿膜に送出しようとする場合には、当該治療薬が投与された領域から当該治療薬が洗い流されないことが重要である。それゆえに、酸化再生セルロース(ORC)等の担体は、特に有効である。酸化再生セルロース(ORC)担体は、腸および他の器官の術後の付着を促進せず、実際には、当該腸および他の器官の術後の付着を予防できる。
【0040】
酸化再生セルロース(ORC)粒子は、乾燥状態では、漿膜にしっかりと付着するが、当該粒子が湿潤状態になった後では、腸が互いに付着することなく、薄い被膜が漿膜上に残る。編んだ繊維状の酸化再生セルロース(ORC)は、同様に機能する。したがって、術後の腸閉塞を予防するためのCox酵素阻害剤の非全身送出に加えて、当該繊維も、腹部手術後に、腸管および他の腸器官の付着を防止する上で、有用である。
【0041】
<実験例>
本発明を説明するために、種々の形態の酸化再生セルロースと、Cox酵素阻害剤として公知のジクロフェナクとを含有する数種のタイプの組成物が調製されている。また、本発明の組成物および方法で使用されるような、酸化再生セルロースとジクロフェナクとの組み合わせは、術後の腸閉塞を軽減する能力を生体内検査で判断されている。
【0042】
<実験例1>
<乾燥した混合粉末>
酸化再生セルロースとジクロフェナクとの混合粉末は、ジクロフェナクナトリウム成分の粒子と酸化再生セルロース粒子とを混合することによって調製される。酸化再生セルロース粒子は、サージセルフィブリラ(登録商標:Surgicel Fibrillar)吸収性止血材をまず液体窒素中で凍結した後に、極低温粉砕機を用いて粉砕することによって、作製される。
【0043】
酸化再生セルロース(ORC)粒子の作製に使用される極低温粉砕法は、次に詳述される。約0.5グラムで、2cm×2cm四方のサージセルフィブリラ(登録商標:Surgicel Fibrillar)吸収性止血材を、鋼鉄製の凍結管内に充填する。この凍結管は、金属製の内部衝突体を内蔵したステンレス鋼製の同心状の筒であり、その両端部は、ステンレス鋼製のバイアル蓋で密閉されている。酸化再生セルロースを収容した凍結管を、液体窒素容器を内蔵した断熱容器を備えた極低温衝撃粉砕機である極低温粉砕機SPEX-6750-115内に配置する。蓋が閉じられたときに、凍結管を収容しているチャージローダ(charge loader)を液体窒素中に浸漬する。極低温粉砕処理が始まる前に、4分間の予備冷却時間が予め設定されている。極低温粉砕の処理時間は、3分間に設定され、衝突速度は10レベル(すなわち、衝突が毎秒2回となるレベル)に設定されている。粉砕機が起動されたときに、金属製の撹拌機が、機器によって生成された変動磁場によって、急速に駆動し、これにより、当該粉砕機内に収容された材料を粉末状に加工処理する。この粉末状の材料を、清浄なガラス製の広口瓶内に収集し、当該粉末状の材料上に溜まることがある全ての残留湿気を除去するために、真空下に保持する。この粉末状の材料を、使用前に、真空下で保存する。粉砕された材料の粒径は、ベックマン・コールター(Beckman Coulter)粒径分析装置を用いることによって、測定される。平均粒径は、20μm〜25μmの範囲内であった。
【0044】
このような方法で調製された酸化再生セルロース粒子を、乾燥混合法によってジクロフェナクナトリウム塩と混合する。このような混合物を調製する際には、約20mgの酸化再生セルロース粉末と1mgのジクロフェナクナトリウム塩粉末とを個別に計量し、清浄なガラス製のバイアル瓶内で一緒に混合する。この混合物は、酸化再生セルロース粉末のジクロフェナクナトリウム塩粉末に対する重量比が20:1の混合物に相当する。また、酸化再生セルロース粉末のジクロフェナクナトリウム塩粉末に対する他の重量比を40:1〜2:1の範囲内とした混合物も調製する。この重量比は、約2.5重量%〜約50重量%の範囲とされる、組成物中の非ステロイド系抗炎症剤(NSAID)系のCox酵素阻害剤の濃度に相当する。
【0045】
このように調製されたジクロフェナクナトリウム塩粉末と酸化再生セルロース粉末との混合物を、すべての光源から遮光する。これらの組成物サンプルを、ガラス製のホイートンバイアル瓶中で保存し、室温で、24時間、真空乾燥し、窒素環境下で封止し、低温ホイル小袋内に収容し、コバルト(25kGy)で殺菌する。その後、サンプルを、窒素ガス充填された室温のキャビネット内に保存する。
【0046】
<実験例2>
<ジクロフェナクを被覆したインターシード(登録商標:Interceed)>
ジクロフェナクナトリウム塩を取り込んだインターシード(登録商標:Interceed:以下、ICとも云う)繊維製品の複数のサンプルは、溶液被覆法によって調製される。数種のジクロフェナクナトリウム塩(DFNa)の水性溶液は、25ml入りのガラス製のバイアル瓶内で、20mlの脱イオン水中に特定のジクロフェナクナトリウム塩を添加することによって、調製される。これらの溶液に対して、すべてのジクロフェナクナトリウム塩(DFNa)が水に溶解するまで、振動を加える。次の表1には、調製されたすべての溶液が挙げられている。
【表1】

【0047】
インターシード(登録商標:Interceed)繊維製品の複数のサンプルを1インチ(1インチ=2.54cm)四方のサイズに切断する。テフロン製の剥離フィルムをアルミニウム製の平皿内に置き、この平皿を秤の上に置く。テフロン製の剥離フィルムの重量を風袋として差し引くように、秤に対して零点補正を行う。1滴あるいは複数滴のジクロフェナクナトリウム塩(DFNa)溶液を、テフロン製の剥離フィルム上に滴下することで、約133mgになるまで秤量する。平皿を秤から取り外す。一つのインターシード(登録商標:Interceed)繊維製品のサンプルを滴下された溶液の上に配し、この溶液をインターシード(登録商標:Interceed)繊維製品のサンプルに浸透させる。この溶液で、インターシード(登録商標:Interceed)繊維製品のサンプルを均一に湿潤させるために、すべての溶液が当該サンプルに吸収されるように、当該サンプルを僅かに動かす。その後、当該サンプルを載せた平皿を、真空オーブン内に置き、少なくとも48時間の真空乾燥を行う。ジクロフェナクを被覆したインターシード(登録商標:Interceed)の複数のサンプルを作製するように、上述した処理を繰り返す。
【0048】
次に、ジクロフェナクを被覆したインターシード(登録商標:Interceed)の複数の乾燥サンプルをタイヴェック(登録商標:Tyvek)封筒内に包装し、その後、当該封筒を窒素環境下でホイル小袋中に入れる。この包装物をコバルト(25kGy)で殺菌する。
【0049】
ジクロフェナクを被覆したインターシード(登録商標:Interceed)の複数のサンプルを走査型電子顕微鏡で検査する場合には、インターシード(登録商標:Interceed)繊維の両側および当該繊維の間隙にジクロフェナクの結晶が存在することが明瞭に観察される。インターシード(登録商標:Interceed)繊維に吸収される溶液の全量がインターシード(登録商標:Interceed)繊維を湿潤させるうえで、過不足なく、十分であるので、繊維の縁部分の硬化は観察されない。さらに、溶液が過剰に存在しないので、インターシード(登録商標:Interceed)繊維上では、ジクロフェナクナトリウム塩(DFNa)溶液の代わりに、ジクロフェナクナトリウム塩(DFNa)がその酸形態であるジクロフェナク酸(DFH)へ変換する。したがって、溶液中でのジクロフェナク酸(DFH)の沈殿による薬剤の変化が回避される。
【0050】
IC-2.0mgサンプルグループに含有された総薬剤量は、高速液体クロマトグラフィー(HPLC)法によって測定される。この測定結果は、表2に示されている。表2中の測定結果は、HPLC法によって測定されたジクロフェナクナトリウム塩(DFNa)含有量が、重量測定法によって算出された値に関連していることを示している。この相関関係は、総薬剤量が、インターシード(登録商標:Interceed)上に塗布されたジクロフェナクナトリウム塩(DFNa)溶液の総量によって容易に制御できることを示唆している。
【表2】

【0051】
<実験例3>
<腸閉塞軽減に関する生体内検査>
本発明の組成物および方法の有効性を検査するために、術後の腸閉塞に罹患した動物モデルが用いられる。本発明で使用される検査用のモデルおよび方法は、デ・ウィンター(De Winter)らによる「実験用ラットの腸閉塞に対するアドレナリンおよび一酸化窒素作動遮断作用の効果」(Br J Pharmacol. 1997年2月、120(3)巻、第464頁〜第468頁)と、デ・ウィンター(De Winter)らによる「ラットの術後の腸閉塞に対するμおよびκオピオイド受容体の効果」(Eur J Pharmacol. 1997年11月19日、339(1)巻、第63頁〜第67頁)に記述されている。これらの文献は、参照によって、その内容がそっくりそのまま、この明細書に組み込まれる。
【0052】
この生体内検査では、体重250g〜275gで、雄のSD(Sprague Dawley)ラット(1グループ当たり6〜8個体)を24時間、絶食させ、これらのラットを、異なる治療計画を受けるグループに分ける。各グループおよびこれらのグループが受ける治療計画を以下に記述する。(検査グループ4〜7および9〜10に関して、前述の実験例2に記述されたインターシード(登録商標:Interceed)系組成物を使用する。)
【0053】
検査グループ4〜7および9〜10に使用される、ジクロフェナクナトリウム塩(DFNa)を被覆したインターシード(登録商標:Interceed)サンプルは、実験例2に記述された溶液被覆法によって調製される。すべてのサンプルは2cm×2.5cmのサイズである。表3には、サンプルの識別番号およびジクロフェナクナトリウム塩(DFNa)の総含有量が挙げられている。
【表3】

【0054】
*サンプル当たりのジクロフェナクナトリウム塩の含有量は、重量測定法に基づいて算出されている。
1.対照グループ(「麻酔」とラベル表記される)に対しては、キシラジンとケタミンとの混合物の筋肉注射(IM)によって麻酔を行う。
2.検査グループ2(「Sx」とラベル表記される)に対しては、キシラジンとケタミンとの混合物の筋肉注射(IM)によって麻酔を行い、腹部を剃毛し、アルコールおよびベタダイン(登録商標:Betadyne)で殺菌する。ラットの尾部からみぞおち付近を通る線で切開する方法(xyphoid process:Sx)上に2.5cmの切開部分を形成する。湿ったガーゼ上に腸の内容物を取り出す。盲腸を1分間、穏やかに処置する。その後、腹腔の内容物を元の位置に戻し、体壁を、筋膜用の4-0 PDS縫合糸および皮膚用の創傷クリップで閉じる。
3.実験グループ3(「Sx+モルヒネ」とラベル表記される)に対しては、検査グループ2と同様に処置する。動物モデルを麻酔状態から回復させたときに、ラット体重1kg当たり3mgのジクロフェナクナトリウム塩(DFNa)の用量を含む硫酸モルヒネの皮下注射を行うことによって処置する。
4.検査グループ4(「Sx+IC-2mg」とラベル表記される)に対しては、検査グループ2と同様に処置する。腹部を閉じる前に、2mgのジクロフェナクナトリウム塩(DFNa)を含有するインターシード(登録商標:Interceed)(2cm×2.5cm)であるIC-2mgを、処置済の盲腸上に配置する。
5.検査グループ5(「Sx+IC-1.0mg」とラベル表記される)に対しては、検査グループ2と同様に処置する。腹部を閉じる前に、1mgのジクロフェナクナトリウム塩(DFNa)を含有するインターシード(登録商標:Interceed)(2cm×2.5cm)であるIC-1.0を、処置済の盲腸上に配置する。
6.検査グループ6(「Sx+IC-0.3mg」とラベル表記される)に対しては、検査グループ2と同様に処置する。腹部を閉じる前に、0.3mgのジクロフェナクナトリウム塩(DFNa)を含有するインターシード(登録商標:Interceed)(2cm×2.5cm)であるIC-0.3-Aを、処置済の盲腸上に配置する。
7.検査グループ7(「Sx+IC-0.1mg」とラベル表記される)に対しては、検査グループ2と同様に処置する。腹部を閉じる前に、0.1mgのジクロフェナクナトリウム塩(DFNa)を含有するインターシード(登録商標:Interceed)(2cm×2.5cm)であるIC-0.1を、処置済の盲腸上に配置する。
8.実験グループ8(「Sx+IC」とラベル表記される)に対しては、検査グループ2と同様に処置する。腹部を閉じる前に、全く薬剤を添加していないインターシード(登録商標:Interceed)(2cm×2.5cm)を、処置済の盲腸上に配置する。
9.検査グループ9(「Sx+モルヒネ+IC-0.3mg」とラベル表記される)に対しては、実験グループ3と同様に処置する。腹部を閉じる前に、0.3mgのジクロフェナクナトリウム塩(DFNa)を含有するインターシード(登録商標:Interceed)(2cm×2.5cm)であるIC-0.3-Bを、処置済の盲腸上に配置する。
10.検査グループ10(「Sx+モルヒネ+IC-2.0mg」とラベル表記される)に対しては、実験グループ3と同様に処置する。腹部を閉じる前に、2.0mgのジクロフェナクナトリウム塩(DFNa)を含有するインターシード(登録商標:Interceed)(2cm×2.5cm)であるIC-2.0を、処置済の盲腸上に配置する。
11.実験グループ11(「Sx+0.3mg DCF」とラベル表記される)に対しては、検査グループ2と同様に処置する。腹部を閉じる前に、0.3mgのジクロフェナクナトリウム塩(DFNa)を含有する50μlの生理食塩水のスラリーを、処置済の盲腸上に配置する。
【0055】
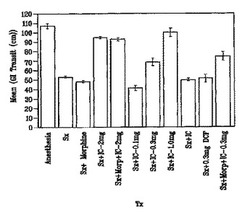
すべてのグループに対しては、2%のアラビアガム(acacia gum)中に10%の活性炭(charcoal)を混ぜた経口液剤をチューブにより強制飼養する。この経口投与後の4時間の時点で、ラットを二酸化炭素で安楽死させる。腸を取り出し、腸(幽門から肛門まで)の全長ばかりでなく、活性炭餌の到達距離を測定する。この測定結果では、腸の全長に対する到達距離の百分率ばかりでなく、到達距離をcm単位で表している。
【0056】
この生体内検査の結果は、図1および図2に示されている。両図から明らかなように、腸管輸送は、手術によって顕著に低下し、かつ、術後のモルヒネ治療によって、さらに低下する。ジクロフェナクを含むインターシード(登録商標:Interceed)を配置すると、Cox酵素阻害剤は、腸管輸送の低下をうまく軽減する。用量反応は、ジクロフェナクの効果から明らかである。この検査において、0.1mgのジクロフェナクの用量では、腸管輸送の低下を軽減するうえで十分ではなく、1.0mgのジクロフェナクの用量で、最大の効果を達成する。2mgのジクロフェナクを含むインターシード(登録商標:Interceed)サンプルでは、腸管輸送をさらに高める効果を観察できない。(この検査において、ジクロフェナクを0.1mgの用量で使用することは腸管輸送の低下を軽減するうえで十分ではないが、より強力な非ステロイド系抗炎症剤(NSAID)系のCox酵素阻害剤では、0.1mg以下の用量でも、非常に有効である点に留意する必要がある。)
【0057】
ジクロフェナク単独でも、インターシード(登録商標:Interceed)単独でも、観察できる薬理学的効果を得るうえで、十分はない。0.3mgのジクロフェナクナトリウム塩(DFNa)を含むインターシード(登録商標:Interceed)では、(手術およびモルヒネ治療においても、手術においても)薬理学的効果が得られる。他方、0.3mgのジクロフェナクの盲腸への使用、あるいは、インターシード(登録商標:Interceed)の盲腸への使用では、薬理学的効果が得られない。
【0058】
〔実施の態様〕
本発明の好適な実施態様を以下に示す。
(1)腸管および他の内臓器官の漿膜表面に付与されることで、術後の腸閉塞および胃の通過停滞を予防するか、あるいは軽減する組成物において、
酸化再生セルロースと、
非ステロイド系抗炎症剤と、
を含み、
前記非ステロイド系抗炎症剤は、Cox酵素阻害剤である、組成物。
(2)実施態様(1)記載の組成物において、
前記非ステロイド系抗炎症剤は、プロピオン酸誘導体;酢酸誘導体;フェナム酸誘導体;ビフェニルカルボン酸誘導体;オキシカム類;およびCox2酵素阻害剤からなる群より選択されるCox酵素阻害剤である、組成物。
(3)実施態様(1)記載の組成物において、
前記非ステロイド系抗炎症剤は、ジクロフェナク酸あるいはメフェナム酸、あるいは、これらの薬理学的に許容される塩からなる群より選択される、組成物。
(4)実施態様(1)記載の組成物において、
前記非ステロイド系抗炎症剤は、ジクロフェナク、あるいは、この薬理学的に許容される塩である、組成物。
(5)実施態様(1)〜(4)のうち、いずれか1項に記載の組成物において、
前記組成物中における前記Cox酵素阻害剤の前記酸化再生セルロースに対する重量比は、約1:1000〜約1:35の範囲である、組成物。
(6)実施態様(1)〜(5)のうち、いずれか1項に記載の組成物において、
前記非ステロイド系抗炎症剤の濃度は、前記組成物に対して、約0.01重量%〜約10重量%の範囲内である、組成物。
(7)実施態様(1)〜(6)のうち、いずれか1項に記載の組成物において、
前記組成物は、繊維製品、粒子の混合物、発泡スポンジ、発泡ビーズおよび凝集体からなる群より選択される形態である、組成物。
【0059】
(8)実施態様(7)記載の組成物において、
酸化再生セルロースの繊維製品あるいは粒子と、
非ステロイド系抗炎症剤と、
を含み、
前記非ステロイド系抗炎症剤は、(a)前記酸化再生セルロースの繊維製品を前記非ステロイド系抗炎症剤の溶液あるいは懸濁液中に浸漬被覆させることによって、(b)前記酸化再生セルロースの繊維製品の表面上に前記非ステロイド系抗炎症剤の溶液あるいは懸濁液を噴霧被覆させることによって、(c)前記酸化再生セルロースの繊維製品の表面上に前記非ステロイド系抗炎症剤の溶液あるいは懸濁液から形成された少なくとも一層のポリマーフィルムを積層させることによって、あるいは(d)前記非ステロイド系抗炎症剤と酸化再生セルロースの繊維製品あるいは粒子とを含む微小孔性ポリマーマトリックスを形成することによって、前記組成物内に組み入れられる、組成物。
(9)実施態様(8)記載の組成物において、
前記積層の過程で使用される前記ポリマーフィルムは、ポリ(アクリル酸)、ヒドロキシルプロピルメチルセルロース、ポリビニルピロリドン、ポリエチレングリコールおよびポリエチレンオキシドからなる群より選択されるポリマーを含む、組成物。
(10)実施態様(8)記載の組成物において、
前記非ステロイド系抗炎症剤は、セルロース、アルキルセルロース、アルキルヒドロキシアルキルセルロース、ヒドロキシアルキルセルロース、硫酸セルロース、カルボキシメチルセルロース塩類、カルボキシメチルセルロース、カルボキシエチルセルロース、キチン、カルボキシメチルキチン、ヒアルロン酸、ヒアルロン酸塩類、アルギン酸塩、アルギン酸、アルギン酸プロピレングリコール、グリコーゲン、デキストラン、硫酸デキストラン、カードラン、ペクチン、プルラン、キサンタン、コンドロイチン、コンドロイチン硫酸、カルボキシメチルデキストラン、カルボキシメチルキトサン、キトサン、ヘパリン、ヘパリン硫酸、ヘパラン、ヘパラン硫酸、デルマタン硫酸、ケラタン硫酸、カラギーナン類、キトサン、澱粉、アミロース、アミロペクチン、ポリ-N-グルコサミン、ポリマンヌロン酸、ポリグルクロン酸、ポリグルロン酸およびこれらの誘導体からなる群より選択される少なくとも一つの多糖類を含む結合剤を用いて微小孔性ポリマーマトリックスへと形成される、組成物。
(11)実施態様(7)記載の組成物において、
前記組成物は、粒子の混合物の形態であり、前記粒子は、1μm〜1000μmの平均粒径を有する酸化再生セルロース粒子と、非ステロイド系抗炎症剤の粒子とを含む、組成物。
(12)実施態様(11)記載の組成物において、
前記酸化再生セルロース粒子は、20μm〜25μmの平均粒径を有する、組成物。
(13)実施態様(1)〜(12)のうち、いずれか1項に記載の組成物において、
前記組成物は、安定剤、湿潤剤、保存剤、抗生剤、抗ウィルス剤、抗真菌剤、抗菌剤およびこれらの混合物からなる群より選択される添加剤をさらに含む、組成物。
【0060】
(14)術後の腸閉塞および胃の通過停滞を予防するか、あるいは軽減するための方法において、
前記方法は、酸化再生セルロース成分とシクロオキシゲナーゼ酵素阻害剤として作用する非ステロイド系抗炎症剤とを含む組成物を、有効量で、胃腸あるいは他の内臓器官の漿膜表面に直接的に投与することを含む、方法。
(15)実施態様(14)記載の方法において、
前記投与された組成物の前記非ステロイド系抗炎症剤は、プロピオン酸誘導体;酢酸誘導体;フェナム酸誘導体;ビフェニルカルボン酸誘導体;オキシカム類;およびCox2酵素阻害剤からなる群より選択されるCox酵素阻害剤である、方法。
(16)実施態様(14)記載の方法において、
前記非ステロイド系抗炎症剤は、ジクロフェナク酸あるいはメフェナム酸、あるいは、これらの薬理学的に許容される塩からなる群より選択される、方法。
(17)実施態様(14)、(15)あるいは(16)に記載の方法において、
前記投与された前記組成物中における前記Cox酵素阻害剤の前記酸化再生セルロースに対する重量比は、約1:1000〜約1:35の範囲である、方法。
(18)実施態様(14)、(15)、(16)あるいは(17)に記載の方法において、
前記非ステロイド系抗炎症剤の濃度は、前記投与された前記組成物に対して、約0.01重量%〜約10重量%の範囲内である、方法。
(19)実施態様(14)、(15)、(16)、(17)あるいは(18)に記載の方法において、
前記投与された前記組成物は、繊維製品、粒子の混合物、発泡スポンジ、発泡ビーズおよび凝集体からなる群より選択される形態である、方法。
(20)実施態様(19)記載の方法において、
前記投与された前記組成物は、酸化再生セルロースの繊維製品あるいは粒子と、非ステロイド系抗炎症剤とを含み、
前記非ステロイド系抗炎症剤は、(a)前記酸化再生セルロースの繊維製品を前記非ステロイド系抗炎症剤の溶液あるいは懸濁液中に浸漬被覆させることによって、(b)前記酸化再生セルロースの繊維製品の表面上に前記非ステロイド系抗炎症剤の溶液あるいは懸濁液を噴霧被覆させることによって、(c)前記酸化再生セルロースの繊維製品の表面上に前記非ステロイド系抗炎症剤の溶液あるいは懸濁液から形成された少なくとも一層のポリマーフィルムを積層させることによって、あるいは(d)前記非ステロイド系抗炎症剤と酸化再生セルロースの粉末あるいは繊維製品とを含む微小孔性ポリマーマトリックスを形成することによって、前記組成物内に組み入れられる、方法。
【図面の簡単な説明】
【0061】
【図1】本発明の腸閉塞予防用の組成物および方法に関する生体内検査に従って、誘導され、かつ、処置された腸閉塞を患うラットに対する給餌の4時間後において、胃腸(GI)内での活性炭餌(charcoal meal)の平均輸送距離を示すグラフである。
【図2】本発明の腸閉塞予防用の組成物および方法に関する生体内検査に従って、誘導され、かつ、処置された腸閉塞を患うラットに対する給餌の4時間後において、胃腸(GI)の全長に対する胃腸(GI)内での活性炭餌の輸送距離の平均百分率を示すグラフである。
【開示の内容】
【0001】
本発明は、術後の腸閉塞および胃の通過停滞(gastric stasis)の予防または軽減に関連している。
【0002】
術後の腸閉塞(POI)および胃の通過停滞は、腹部に関係する多くの外科手術に共通する課題である。さらに、腸閉塞および胃の通過停滞は、患者の退院を妨げる主な要因でもある。
【0003】
腸閉塞は、腹部手術後、特に、腸および腹部の他の器官を処置することを含む腹部手術の後に生じる主な合併症の一つである。具体的には、麻痺性腸閉塞は、腸の蠕動運動性を機能的に阻害するものである。この麻痺性腸閉塞は、薬剤および栄養素の吸収を妨げ、患者が受ける不快感および痛みを強め、患者の入院期間を長引かせ、術後の医療保険費用を増大させる。
【0004】
術後の患者に対する介護において、高い頻度で、腸閉塞症状がほとんど処置されることがなく、実際には、多くの場合、患者は合併症に至ることになる。鎮静剤が腸の運動性を低減させるので、術後のみに投与されたモルヒネおよびコデイン等の鎮痛剤は、腸閉塞症状を悪化させ、かつ、術後の腸閉塞の罹患率を増大させる。
【0005】
術後の腸閉塞および胃の通過停滞の症状を治療するための主な解決手段には、全身性薬剤を使用する方法がある。現在、当該症状を治療するための暫定的な承認を得ている唯一の薬剤が存在する。具体的には、術後の腸閉塞(POI)を治療するための局所麻酔性拮抗剤であるエンテレグ(Entereg)の申請書は、アドラー(adolar)およびグラクソスミスクライン(GlaxoSmithKline)により、米国食品医薬品局(FDA)に提出されている。局所麻酔受容体を阻害することは、実際には、術後の腸閉塞を予防する際の実行可能な解決手段の一つである(例えば、米国特許出願第2002/0188005号参照)。それにもかかわらず、この解決手段は、術後に鎮痛剤として一般的に投与される、鎮静剤の胃腸への影響を遮断することのみに有用である。このような薬剤は、腸および胃の通過停滞に対する個別の鎮痛効果を発揮しそうにない。他の解決手段には、アデノシンA1受容体を阻害し、Cox2酵素を阻害し、抗炎症性サイトカインIL-11を用いるなど、他のメディエータが関与している。また、PAR-2酵素を阻害することは、一つの解決手段として示唆されている(例えば、国際公開第9843477号参照)。
【0006】
胃腸の運動性を強化し、あるいは、胃腸の通過停滞および閉塞を予防する薬剤の全身性送出は、上述した全解決手段に共通している。しかし、全身性薬剤の送出は、簡単であるが、当該薬剤の副作用の面も有する。例えば、非ステロイド系抗炎症剤(NSAID)等の抗炎症性の薬剤を全身性送出する際には、回復中の組織に作用するはずである。IL-11等のサイトカイン注射は、患者の免疫反応に影響を与えるはずであり、かつ、A1拮抗剤の全身性投与は、神経系に対する作用を有するはずである。さらに、全身性薬剤の送出は、当該薬剤が標的としていない器官に対しても影響を与えるはずである。
【0007】
腸閉塞および胃の通過停滞の症状を仲介する病変が明確でないが、このような症状に少なくとも部分的に関与するものとして、シクロオキシゲナーゼ酵素(Cox1およびCox2)の活性化に焦点をあてた動物実験がなされている。多くのCox1およびCox2阻害剤が市販されているが、術後の患者に対して当該Cox1およびCox2阻害剤を全身投与することは、他の全身性送出薬剤と同様に、望ましくない。なぜなら、当該阻害剤の胃腸への副作用に起因して、当該阻害剤は、創傷治癒および血小板阻害に影響を与えるからである。
【0008】
上述した検討事項には、術後の腸閉塞および胃の通過停滞を予防し、かつ、治療して改善するうえで、適切、かつ、有用な治療あるいは予防の方法および製品を確認していく必要が引き続き存在している。このような方法および製品は理想的には、病変の症状を、直接的に処置するものであり、望ましくない副作用を生じ得る薬剤の全身投与を含むものではない。したがって、本発明は、胃の通過停滞および術後の腸閉塞を予防し、あるいは、軽減するための組成物および方法を提供するものであり、当該組成物および方法は、患部器官の漿膜表面に治療薬を直接、投与することに関連している。
【0009】
〔発明の概要〕
本発明は、一つの実施の形態において、術後の腸閉塞および胃の通過停滞を予防し、あるいは、軽減するために、胃腸および他の内臓器官の漿膜表面に投与されるうえで、適切な組成物に関連している。このような組成物は、酸化再生セルロース成分と、シクロオキシゲナーゼ酵素阻害剤すなわちCox1酵素および/またはCox2酵素の阻害剤として作用する非ステロイド系抗炎症剤(NSAID)とを含む。
【0010】
本発明は、他の実施の形態において、術後の腸閉塞および胃の通過停滞を予防し、あるいは、軽減するための方法に関連している。このような方法は、酸化再生セルロース成分と、シクロオキシゲナーゼ酵素阻害剤すなわちCox1酵素および/またはCox2酵素の阻害剤として作用する非ステロイド系抗炎症剤(NSAID)とを含む組成物を、有効量で、胃腸あるいは他の内臓器官の漿膜表面に直接的に投与することを含む。
【0011】
本発明は、微粒子あるいはシート状の酸化再生セルロース(ORC)によるシクロオキシゲナーゼ酵素(Cox酵素)阻害剤の局所送出力と共に、当該酸化再生セルロースの腸あるいは他の器官の漿膜表面に対する付着力を利用している。ここで、組織が手術中に炎症を起こしたときの炎症過程で、プロスタノイド類の分子が放出されるが、このプロスタノイド類の分子が、その後、腸閉塞を起こし、かつ、保持する場合があるものとして留意される。漿膜表面にCox酵素阻害剤を局所的に放出することによって、処置された漿膜からのプロスタノイド類の生成は低減され、かつ、胃腸の運動性は改善される。
【0012】
本発明は、酸化再生セルロース繊維あるいは酸化再生セルロース(ORC)微粒子あるいは酸化再生セルロース(ORC)含有の発泡体あるいは凝集体が、腸および他の内臓器官の湿潤状態の漿膜に関与したときに生じる、当該漿膜に対するしっかりとした付着力に基づいている。したがって、本発明に係る組成物の必須成分は、活性状態のCox酵素阻害剤の送出剤として役立つような適切な形態の酸化再生セルロースである。
【0013】
酸化再生セルロースおよびその製造方法の詳細は、フレオン(商標)媒体中で、四酸化二窒素等の酸化剤を用いたカルボキシル化酸化セルロースの調製方法を開示する米国特許第3,364,200号明細書、および、ペルフルオロカーボン溶媒中で、二酸化窒素等の酸化剤を用いたカルボキシル化酸化セルロースの調製方法を開示する米国特許第5,180,398号明細書に述べられている。これら両米国特許は、参照によって、その内容がそっくりそのまま、この明細書に述べられているかのように、この明細書に組み込まれる。上述した複数の方法のうち、いずれかの方法による酸化後に、カルボキシル化酸化セルロースは、四塩化炭素等の溶媒で、十分に洗浄され、その後、50%のイソプロピルアルコール(IPA)水溶液で洗浄され、最終的に、99%のイソプロピルアルコール(IPA)で洗浄される。
【0014】
一つの実施の形態に使用され得る酸化再生セルロースには、従来の粘着性バリアあるいは従来の止血用創被覆材として利用される繊維がさらに含まれる。このような繊維としては、米国ニュージャージー州のモーリスプレインズ(Morris Plains)を居所とするベクトン・ディキンソン・アンド・カンパニー(Beckton Dickinson and Company)から入手できる吸収性セルロース製の外科用被覆材としてのオキシセル(登録商標:Oxycel)だけでなく、ジョンソン・アンド・ジョンソン・カンパニー(Johnson & Johnson Company)におけるニュージャージー州ソマービル(Somerville)を居所とするエシコン・インコーポレイテッド(Ethicon, Inc.)の部門であるジーンケアワールドワイド(Gynecare Worldwide)またはジョンソン・アンド・ジョンソン・ウーンド・マネジメント・ワールドワイド(Johnson & Johnson Wound Management Worldwide)から入手できる、吸収性の粘着性バリアとしてのインターシード(登録商標:Interceed)、吸収性の止血材としてのサージセル(登録商標:Surgicel)、吸収性の止血材としてのサージセルエヌユーニット(登録商標:Surgicel Nu-Knit)および吸収性の止血材としてのサージセルフィブリラ(登録商標:Surgicel Fibrillar)が挙げられる。また、オランダ国のキュラスポン・ヘルスケア(Curaspon Healthcare)から入手できる酸化再生セルロース粉末としてのキュラセル(登録商標:Curacel)等の酸化セルロース粉末、または、吸収性の止血材としてのサージセルフィブリラ(登録商標:Surgicel Fibrillar)あるいは吸収性の粘着性バリアとしてのインターシード(登録商標:Interceed)から作製された微粒子も使用されてもよい。
【0015】
この明細書における組成物および方法は、種々の技術および後述の助剤を用いて調製された種々の形態での酸化再生セルロースと、シクロオキシゲナーゼ酵素(Cox1酵素および/またはCox2酵素)の活性を阻害する阻害剤として作用する薬理学的に活性な成分との組み合わせに関連している。このようなCox酵素阻害剤は、一般に、非ステロイド系抗炎症剤(NSAID)の形態で、周知の物質である。
【0016】
Cox酵素阻害剤として利用される非ステロイド系抗炎症剤(NSAID)は、非選択性あるいは選択性の阻害剤のいずれでもよい。非選択性のCox酵素阻害剤は、シクロオキシゲナーゼ酵素のCox1酵素およびCox2酵素の両変異体の活性を阻害するものである。選択性のCox酵素阻害剤は、特異的に構成されたCox1酵素あるいはCox2酵素のいずれかの活性を選択的に阻害するものである。
【0017】
本発明に有用な非ステロイド系抗炎症剤(NSAID)系のCox酵素阻害剤は、次のようなカテゴリーから選択される。
(1)プロピオン酸誘導体;
(2)酢酸誘導体;
(3)フェナム酸誘導体;
(4)ビフェニルカルボン酸誘導体;
(5)オキシカム類;および
(6)Cox2酵素阻害剤。
【0018】
上述したグループ(1)からグループ(4)までにおけるCox酵素阻害剤は、主として、カルボン酸作用を有している。しかし、これらの酸類は、薬理学的に許容される酸付加物、あるいは、例えばナトリウム塩類などのアルカリ金属塩類の形態で、投与されることもある。
【0019】
本発明において、Cox酵素阻害剤として使用されるプロピオン酸誘導体には、イブプロフェン、ナプロキセン、ベノキサプロフェン、フルルビプロフェン、フェノプロフェン、フェンブフェン、ケトプロフェン、インドプロフェン、ピルプロフェン、カルプロフェン、オキサプロジン、プラノプロフェン、ミロプロフェン、チオキサプロフェン、スプロフェン、アミノプロフェン、チアプロフェン酸、フルプロフェンおよびブクロキシ酸が含まれるが、これらに限定されるものではない。また、プロピオン酸誘導体に構造的に関連し、かつ、プロピオン酸誘導体と同様のシクロオキシゲナーゼ酵素阻害性を有する物質も、上述したグループ内に網羅されるものである。プロピオン酸グループにおいて、現在、好適とされるプロピオン酸誘導体には、イブプロフェン、ナプロキセン、フルルビプロフェン、ケトプロフェンおよびフェンブフェンが含まれる。
【0020】
本発明において、Cox酵素阻害剤として使用される酢酸誘導体には、インドメタシン、スリンダク、トルメチン、ゾメピラク、ジクロフェナク、フェンクロフェナク、アルクロフェナク、イブフェナク、イソキセパック、フロフェナック、チオピナク、ジドメタシン、アセメタシン、フェンチアザク、クリダナクおよびオキシピナクが含まれるが、これらに限定されるものではない。また、酢酸誘導体に構造的に関連し、かつ、酢酸誘導体と同様のシクロオキシゲナーゼ酵素阻害性を有する物質も、上述したグループ内に網羅されるものである。酢酸グループにおいて、現在、好適とされる酢酸誘導体には、ゾメピラク、ジクロフェナク、インドメタシンおよびこれらのナトリウム塩が含まれる。
【0021】
本発明において、Cox酵素阻害剤として使用されるフェナム酸誘導体には、メフェナム酸、メクロフェナム酸、フルフェナム酸、ニフルム酸およびトルフェナム酸が含まれるが、これらに限定されるものではない。また、フェナム酸誘導体に構造的に関連し、かつ、フェナム酸誘導体と同様のシクロオキシゲナーゼ酵素阻害性を有する物質も、上述したグループ内に網羅されるものである。フェナム酸グループにおいて、現在、好適とされるフェナム酸誘導体には、メフェナム酸、メクロフェナム酸およびこれらのナトリウム塩が含まれる。
【0022】
本発明において、Cox酵素阻害剤として使用されるビフェニルカルボン酸誘導体には、ジフルニサルおよびフルフェニサルが含まれるが、これらに限定されるものではない。また、ビフェニルカルボン酸誘導体に構造的に関連し、かつ、ビフェニルカルボン酸誘導体と同様のシクロオキシゲナーゼ酵素阻害性を有する物質も、上述したグループ内に網羅されるものである。ビフェニルカルボン酸誘導体グループにおいて、好適とされるビフェニルカルボン酸誘導体は、ジフルニサルおよびフルフェニサルである。
【0023】
本発明において、Cox酵素阻害剤として使用されるオキシカム類には、ピロキシカム、イソキシカムおよびCP-14, 304(4-ヒドロキシ-2-メチル-N-フェニル-2H-1,2-ベンゾチアジキシン-3-カルボキシアミド-1,1-ジオキシド)が含まれるが、これらに限定されるものではない。また、オキシカム類に構造的に関連し、かつ、オキシカム類と同様のシクロオキシゲナーゼ酵素阻害性を有する物質も、上述したグループ内に網羅されるものである。オキシカム類グループにおいて、好適とされるオキシカム類は、ピロキシカムである。
【0024】
本発明において使用される選択性のCox2酵素阻害剤には、セレコキシブ、ロフェコキシブ、バルデコキシブ、パラコキシブおよびMK 663(エトリコキシブ)が含まれるが、これらに限定されるものではない。また、非ステロイド系抗炎症剤(NSAID)に構造的に関連し、かつ、非ステロイド系抗炎症剤(NSAID)と同様のCox2酵素阻害性を有する物質も、上述したグループ内に網羅されるものである。このグループにおいて、好適とされるCox2酵素阻害剤には、セレコキシブおよびロフェコキシブが含まれる。
【0025】
Cox酵素阻害剤として適切な他の非ステロイド系抗炎症剤(NSAID)のみならず、上述したすべてのCox酵素阻害剤は、米国特許第6,689,382号明細書、同第6,231,888号明細書、米国特許出願公開第2003/0212050号公報および欧州特許出願第EP-A-485,111号に詳述されている。これらすべての特許文献は、参照によって、その内容がそっくりそのまま、この明細書に組み込まれる。
【0026】
本発明において、特に好適に使用されるCox酵素阻害剤は、2級アミン基を有する酸類タイプの非ステロイド系抗炎症剤(NSAID)である。このタイプのうち、特に好適な非ステロイド系抗炎症剤(NSAID)には、2−[(2,6−1 ジクロロフェニル)アミノ]ベンゼン酢酸(ジクロフェナクともいう)、2−[(2,6−ジクロロフェニル)アミノ]ベンゼン酢酸の1ナトリウム塩、あるいは、2−[(2,3−ジメチルフェニル)アミノ]安息香酸(メフェナム酸ともいう)が含まれる。これら特定の非ステロイド系抗炎症剤(NSAID)系のCox酵素阻害剤の化合物は、術後の腸閉塞および胃の通過停滞の予防に有効である。
【0027】
本発明では、上述した非ステロイド系抗炎症剤(NSAID)系のCox酵素阻害剤の化合物自体の使用ばかりでなく、当該化合物と同様の薬理学的結果を与える光学的異性体の使用に加えて、体内で代謝されて当該化合物となるプロドラッグおよび当該化合物の類似体およびこれらの生物活性を有する塩類の使用をも意図しているものとして理解される。したがって、本発明の目的を達成するために、用語「非ステロイド系抗炎症剤」は、非ステロイド系抗炎症剤(NSAID)自体あるいは当該非ステロイド系抗炎症剤(NSAID)として作用する生成物質の塩類、エステル類、プロドラッグ類、類似体、異性体等、すべての誘導体または前駆体を含むことを意味している。
【0028】
本発明において、組成物は、上述したタイプによって、また、当該組成物を調製する上で使用される酸化再生セルロースによって定まる多くの様々な形態を採用できる。また、当該組成物を様々な形態で調製する際の助剤として、種々の組成物を利用することは、妥当である。
【0029】
酸化再生セルロース製の繊維あるいは繊維製品が利用される場合における実施の形態では、Cox酵素阻害活性成分溶液は、(a)酸化再生セルロース製の繊維あるいは繊維製品をCox酵素剤の溶液あるいは懸濁液中に浸漬被覆させることによって、(b)酸化再生セルロース製の繊維あるいは繊維製品の表面上にCox酵素剤の溶液あるいは懸濁液を噴霧被覆させることによって、(c)酸化再生セルロース製の繊維あるいは繊維製品の表面上に、Cox酵素剤の水性溶液あるいは懸濁液、非水性溶液あるいは懸濁液または有機性溶液あるいは懸濁液から形成された少なくとも一層のポリマーフィルムを積層させることによって、あるいは(d)Cox酵素剤および酸化再生セルロースの粉末あるいは繊維製品を含む微小孔性ポリマーマトリックスを形成することによって、上述した組成物内に組み入れてもよい。
【0030】
酸化再生セルロース製の繊維あるいは繊維製品上に積層されるポリマー類は、水溶性ポリマー類であってもよく、これらの水溶性ポリマー類には、ポリ(アクリル酸)、ヒドロキシルプロピルメチルセルロース、ポリビニルピロリドン、ポリエチレングリコールおよびポリエチレンオキシドが含まれるが、これらに限定されるものではない。これらのポリマー類は、処理中に、繊維あるいは繊維製品上へのCox酵素阻害剤の用量を正確に制御するために使用されるが、当該ポリマー類は、水性環境中に迅速に溶解していく。
【0031】
Cox酵素剤が酸化再生セルロースの繊維(fabric)あるいは繊維製品(textile)上にある微小孔性ポリマーマトリックスを形成するための結合成分として使用されるポリマー類には、多糖類および蛋白質が含まれるが、これらに限定されるものではない。このような多糖類には、セルロース、例えばメチルセルロース、アルキルヒドロキシアルキルセルロース、ヒドロキシアルキルセルロース等のアルキルセルロース、硫酸セルロース、カルボキシメチルセルロース塩類、カルボキシメチルセルロース、カルボキシエチルセルロース、キチン、カルボキシメチルキチン、ヒアルロン酸、ヒアルロン酸塩類、アルギン酸塩、アルギン酸、アルギン酸プロピレングリコール、グリコーゲン、デキストラン、硫酸デキストラン、カードラン、ペクチン、プルラン、キサンタン、コンドロイチン、コンドロイチン硫酸、カルボキシメチルデキストラン、カルボキシメチルキトサン、キトサン、ヘパリン、ヘパリン硫酸、ヘパラン、ヘパラン硫酸、デルマタン硫酸、ケラタン硫酸、カラギーナン類、キトサン、澱粉、アミロース、アミロペクチン、ポリ-N-グルコサミン、ポリマンヌロン酸、ポリグルクロン酸、ポリグルロン酸およびこれらの誘導体が含まれるが、これらに限定されるものではない。蛋白質の例には、コラーゲンおよびゼラチンが含まれるが、これらに限定されるものではない。
【0032】
繊維あるいは繊維製品の形態に加えて、酸化再生セルロース成分は、粒子の形態であってもよい。例えば、一つの実施の形態では、酸化再生セルロース製の繊維製品は、ベックマン・コールター(Beckman Coulter)粒径分析装置[LF13320、トルネード・ドライ・パウダー・システム・アンド・ユニバーサル・リキッド・モジュール(Tornado Dry Powder System and Universal Liquid Module)]によって測定された場合に、1μm〜1000μmの平均粒径、好ましくは20μm〜25μmの平均粒径を有する粒子に微細化されてもよい。この実施の形態では、組成物は、上述した酸化再生セルロース粒子と、1μm〜1000μmの平均粒径、好ましくは1μm〜100μmの平均粒径を有するCox酵素剤粒子とを含む。例えば、上述した酸化再生セルロース粉末は、最終用途のために、Cox酵素剤粉末と混合されてもよい。混合粉末中に使用される酸化再生セルロースの粒径範囲を得るためには、酸化再生セルロースは、例えば、極低温粉砕法で処理されてもよい。
【0033】
他の実施の形態では、本発明の組成物は、酸化再生セルロース粒子と、微小孔性の結合成分と、Cox酵素剤とを含有してもよく、発泡スポンジ、発泡ビーズあるいは凝集体の形態であってもよい。
【0034】
他の実施の形態では、発泡スポンジ、発泡ビーズあるいは凝集体を形成するために利用される酸化再生セルロースの粒子あるいは短繊維は、約10μm〜約5000μmの平均粒径、好ましくは約680μm〜約4350μmの平均粒径を有してもよい。このような酸化再生セルロース粒子は、上述した酸化再生セルロース繊維、あるいは、任意の酸化再生セルロース繊維製品を、中級モデルのトーマス−ワイリー(登録商標:Thomas-Wiley)ラボラトリー・ミルの切断刃等のモータ駆動式の粉砕機の切断刃で、所望の繊維長さとなるように、粉砕することによって、作製されてもよい。二つの固定刃と、高速で回転して剪断作用を発揮する四つの切断刃を備えたモータとを有するモータ駆動式の粉砕機は、サンプル繊維を急速に粉砕するうえで適している。例えば、酸化再生セルロース粒子は、サージセル(登録商標:Surgicel)吸収性止血材、サージセルエヌユーニット(登録商標:Surgicel Nu-Knit)吸収性止血材、あるいはサージセルフィブリラ(登録商標:Surgicel Fibrillar)吸収性止血材等の酸化再生セルロース繊維製品、あるいは、酸化再生セルロースを、液体窒素が充填されたステンレス鋼製ホイルの小袋中に入れ、当該ホイル小袋を液体窒素中に浸漬させることによって、作製されてもよい。その後、当該ホイル小袋を、例えば、毎分6インチ(1インチ=2.54cm)で回転する複輪ローラを通過させることで、0.035mm〜4.35mmの平均粒径を有する酸化再生セルロースが得られる。
【0035】
本発明の組成物の上述したすべての実施の形態において、および、本発明の方法において、Cox酵素剤の酸化再生セルロース(ORC)に対する質量比は、概ね、約1:1000〜約1:3の範囲とされる。より好ましくは、このCox酵素剤の酸化再生セルロース(ORC)に対する質量比は、約1:100〜約1:10の範囲となる。本発明の組成物においては、活性状態のCox酵素剤は、概ね、組成物に対して、約0.01重量%〜約10重量%の濃度範囲内とされ、より好ましくは、約0.1重量%〜約3重量%の濃度範囲内とされる。
【0036】
また、組成物は、安定剤、湿潤剤あるいは保存剤等の種々の物質を含むことによる恩恵を受けてもよい。また、当該組成物には、非ステロイド系抗炎症剤(NSAID)系のCox酵素阻害剤および残余の成分との相溶性がある限り、他の薬剤も添加されてもよい。これらの薬剤には、抗生剤、抗ウィルス剤および抗真菌剤が含まれる。組織部位が感染することがあるので、抗生剤あるいは抗菌剤も、上述した組成物と組み合わせられてもよい。
【0037】
漿膜水、血液あるいは腹水等の腹腔内の流体に接触した場合に、本発明の組成物は、酸化再生セルロースの親水性の結果として、膨潤する。また、組成物は、該組成物を送出するうえで役立つように、使用直前に、外因性の水性流体、好ましくはリン酸緩衝生理食塩水に曝されてもよい。移植直前に使用されるうえで適切な他の水性溶液には、殺菌形態のリンゲル液、生理食塩水およびデキストロース溶液が含まれる。上述した形態の場合では、湿潤状態の組成物の流動性は、当該組成物が、組織部位の漿膜に内在する凹凸、裂け目、隙間、あるいは皺に適合することを可能にする。
【0038】
本発明の方法の態様では、本発明は、上述した組成物を、有効量で、胃腸あるいは他の内臓器官の漿膜表面に直接、投与するステップを含む。このような組成物は、Cox1酵素阻害剤および/またはCox2酵素阻害剤として作用する非ステロイド系抗炎症剤(NSAID)用の担体として、酸化再生セルロースを利用する。
【0039】
上述したように、酸化再生セルロース(ORC)は、腸あるいは他の器官の漿膜層に組み込まれ、当該漿膜表面にしっかりと付着する。Cox酵素阻害剤等の任意の治療薬を処置中の漿膜に送出しようとする場合には、当該治療薬が投与された領域から当該治療薬が洗い流されないことが重要である。それゆえに、酸化再生セルロース(ORC)等の担体は、特に有効である。酸化再生セルロース(ORC)担体は、腸および他の器官の術後の付着を促進せず、実際には、当該腸および他の器官の術後の付着を予防できる。
【0040】
酸化再生セルロース(ORC)粒子は、乾燥状態では、漿膜にしっかりと付着するが、当該粒子が湿潤状態になった後では、腸が互いに付着することなく、薄い被膜が漿膜上に残る。編んだ繊維状の酸化再生セルロース(ORC)は、同様に機能する。したがって、術後の腸閉塞を予防するためのCox酵素阻害剤の非全身送出に加えて、当該繊維も、腹部手術後に、腸管および他の腸器官の付着を防止する上で、有用である。
【0041】
<実験例>
本発明を説明するために、種々の形態の酸化再生セルロースと、Cox酵素阻害剤として公知のジクロフェナクとを含有する数種のタイプの組成物が調製されている。また、本発明の組成物および方法で使用されるような、酸化再生セルロースとジクロフェナクとの組み合わせは、術後の腸閉塞を軽減する能力を生体内検査で判断されている。
【0042】
<実験例1>
<乾燥した混合粉末>
酸化再生セルロースとジクロフェナクとの混合粉末は、ジクロフェナクナトリウム成分の粒子と酸化再生セルロース粒子とを混合することによって調製される。酸化再生セルロース粒子は、サージセルフィブリラ(登録商標:Surgicel Fibrillar)吸収性止血材をまず液体窒素中で凍結した後に、極低温粉砕機を用いて粉砕することによって、作製される。
【0043】
酸化再生セルロース(ORC)粒子の作製に使用される極低温粉砕法は、次に詳述される。約0.5グラムで、2cm×2cm四方のサージセルフィブリラ(登録商標:Surgicel Fibrillar)吸収性止血材を、鋼鉄製の凍結管内に充填する。この凍結管は、金属製の内部衝突体を内蔵したステンレス鋼製の同心状の筒であり、その両端部は、ステンレス鋼製のバイアル蓋で密閉されている。酸化再生セルロースを収容した凍結管を、液体窒素容器を内蔵した断熱容器を備えた極低温衝撃粉砕機である極低温粉砕機SPEX-6750-115内に配置する。蓋が閉じられたときに、凍結管を収容しているチャージローダ(charge loader)を液体窒素中に浸漬する。極低温粉砕処理が始まる前に、4分間の予備冷却時間が予め設定されている。極低温粉砕の処理時間は、3分間に設定され、衝突速度は10レベル(すなわち、衝突が毎秒2回となるレベル)に設定されている。粉砕機が起動されたときに、金属製の撹拌機が、機器によって生成された変動磁場によって、急速に駆動し、これにより、当該粉砕機内に収容された材料を粉末状に加工処理する。この粉末状の材料を、清浄なガラス製の広口瓶内に収集し、当該粉末状の材料上に溜まることがある全ての残留湿気を除去するために、真空下に保持する。この粉末状の材料を、使用前に、真空下で保存する。粉砕された材料の粒径は、ベックマン・コールター(Beckman Coulter)粒径分析装置を用いることによって、測定される。平均粒径は、20μm〜25μmの範囲内であった。
【0044】
このような方法で調製された酸化再生セルロース粒子を、乾燥混合法によってジクロフェナクナトリウム塩と混合する。このような混合物を調製する際には、約20mgの酸化再生セルロース粉末と1mgのジクロフェナクナトリウム塩粉末とを個別に計量し、清浄なガラス製のバイアル瓶内で一緒に混合する。この混合物は、酸化再生セルロース粉末のジクロフェナクナトリウム塩粉末に対する重量比が20:1の混合物に相当する。また、酸化再生セルロース粉末のジクロフェナクナトリウム塩粉末に対する他の重量比を40:1〜2:1の範囲内とした混合物も調製する。この重量比は、約2.5重量%〜約50重量%の範囲とされる、組成物中の非ステロイド系抗炎症剤(NSAID)系のCox酵素阻害剤の濃度に相当する。
【0045】
このように調製されたジクロフェナクナトリウム塩粉末と酸化再生セルロース粉末との混合物を、すべての光源から遮光する。これらの組成物サンプルを、ガラス製のホイートンバイアル瓶中で保存し、室温で、24時間、真空乾燥し、窒素環境下で封止し、低温ホイル小袋内に収容し、コバルト(25kGy)で殺菌する。その後、サンプルを、窒素ガス充填された室温のキャビネット内に保存する。
【0046】
<実験例2>
<ジクロフェナクを被覆したインターシード(登録商標:Interceed)>
ジクロフェナクナトリウム塩を取り込んだインターシード(登録商標:Interceed:以下、ICとも云う)繊維製品の複数のサンプルは、溶液被覆法によって調製される。数種のジクロフェナクナトリウム塩(DFNa)の水性溶液は、25ml入りのガラス製のバイアル瓶内で、20mlの脱イオン水中に特定のジクロフェナクナトリウム塩を添加することによって、調製される。これらの溶液に対して、すべてのジクロフェナクナトリウム塩(DFNa)が水に溶解するまで、振動を加える。次の表1には、調製されたすべての溶液が挙げられている。
【表1】

【0047】
インターシード(登録商標:Interceed)繊維製品の複数のサンプルを1インチ(1インチ=2.54cm)四方のサイズに切断する。テフロン製の剥離フィルムをアルミニウム製の平皿内に置き、この平皿を秤の上に置く。テフロン製の剥離フィルムの重量を風袋として差し引くように、秤に対して零点補正を行う。1滴あるいは複数滴のジクロフェナクナトリウム塩(DFNa)溶液を、テフロン製の剥離フィルム上に滴下することで、約133mgになるまで秤量する。平皿を秤から取り外す。一つのインターシード(登録商標:Interceed)繊維製品のサンプルを滴下された溶液の上に配し、この溶液をインターシード(登録商標:Interceed)繊維製品のサンプルに浸透させる。この溶液で、インターシード(登録商標:Interceed)繊維製品のサンプルを均一に湿潤させるために、すべての溶液が当該サンプルに吸収されるように、当該サンプルを僅かに動かす。その後、当該サンプルを載せた平皿を、真空オーブン内に置き、少なくとも48時間の真空乾燥を行う。ジクロフェナクを被覆したインターシード(登録商標:Interceed)の複数のサンプルを作製するように、上述した処理を繰り返す。
【0048】
次に、ジクロフェナクを被覆したインターシード(登録商標:Interceed)の複数の乾燥サンプルをタイヴェック(登録商標:Tyvek)封筒内に包装し、その後、当該封筒を窒素環境下でホイル小袋中に入れる。この包装物をコバルト(25kGy)で殺菌する。
【0049】
ジクロフェナクを被覆したインターシード(登録商標:Interceed)の複数のサンプルを走査型電子顕微鏡で検査する場合には、インターシード(登録商標:Interceed)繊維の両側および当該繊維の間隙にジクロフェナクの結晶が存在することが明瞭に観察される。インターシード(登録商標:Interceed)繊維に吸収される溶液の全量がインターシード(登録商標:Interceed)繊維を湿潤させるうえで、過不足なく、十分であるので、繊維の縁部分の硬化は観察されない。さらに、溶液が過剰に存在しないので、インターシード(登録商標:Interceed)繊維上では、ジクロフェナクナトリウム塩(DFNa)溶液の代わりに、ジクロフェナクナトリウム塩(DFNa)がその酸形態であるジクロフェナク酸(DFH)へ変換する。したがって、溶液中でのジクロフェナク酸(DFH)の沈殿による薬剤の変化が回避される。
【0050】
IC-2.0mgサンプルグループに含有された総薬剤量は、高速液体クロマトグラフィー(HPLC)法によって測定される。この測定結果は、表2に示されている。表2中の測定結果は、HPLC法によって測定されたジクロフェナクナトリウム塩(DFNa)含有量が、重量測定法によって算出された値に関連していることを示している。この相関関係は、総薬剤量が、インターシード(登録商標:Interceed)上に塗布されたジクロフェナクナトリウム塩(DFNa)溶液の総量によって容易に制御できることを示唆している。
【表2】

【0051】
<実験例3>
<腸閉塞軽減に関する生体内検査>
本発明の組成物および方法の有効性を検査するために、術後の腸閉塞に罹患した動物モデルが用いられる。本発明で使用される検査用のモデルおよび方法は、デ・ウィンター(De Winter)らによる「実験用ラットの腸閉塞に対するアドレナリンおよび一酸化窒素作動遮断作用の効果」(Br J Pharmacol. 1997年2月、120(3)巻、第464頁〜第468頁)と、デ・ウィンター(De Winter)らによる「ラットの術後の腸閉塞に対するμおよびκオピオイド受容体の効果」(Eur J Pharmacol. 1997年11月19日、339(1)巻、第63頁〜第67頁)に記述されている。これらの文献は、参照によって、その内容がそっくりそのまま、この明細書に組み込まれる。
【0052】
この生体内検査では、体重250g〜275gで、雄のSD(Sprague Dawley)ラット(1グループ当たり6〜8個体)を24時間、絶食させ、これらのラットを、異なる治療計画を受けるグループに分ける。各グループおよびこれらのグループが受ける治療計画を以下に記述する。(検査グループ4〜7および9〜10に関して、前述の実験例2に記述されたインターシード(登録商標:Interceed)系組成物を使用する。)
【0053】
検査グループ4〜7および9〜10に使用される、ジクロフェナクナトリウム塩(DFNa)を被覆したインターシード(登録商標:Interceed)サンプルは、実験例2に記述された溶液被覆法によって調製される。すべてのサンプルは2cm×2.5cmのサイズである。表3には、サンプルの識別番号およびジクロフェナクナトリウム塩(DFNa)の総含有量が挙げられている。
【表3】

【0054】
*サンプル当たりのジクロフェナクナトリウム塩の含有量は、重量測定法に基づいて算出されている。
1.対照グループ(「麻酔」とラベル表記される)に対しては、キシラジンとケタミンとの混合物の筋肉注射(IM)によって麻酔を行う。
2.検査グループ2(「Sx」とラベル表記される)に対しては、キシラジンとケタミンとの混合物の筋肉注射(IM)によって麻酔を行い、腹部を剃毛し、アルコールおよびベタダイン(登録商標:Betadyne)で殺菌する。ラットの尾部からみぞおち付近を通る線で切開する方法(xyphoid process:Sx)上に2.5cmの切開部分を形成する。湿ったガーゼ上に腸の内容物を取り出す。盲腸を1分間、穏やかに処置する。その後、腹腔の内容物を元の位置に戻し、体壁を、筋膜用の4-0 PDS縫合糸および皮膚用の創傷クリップで閉じる。
3.実験グループ3(「Sx+モルヒネ」とラベル表記される)に対しては、検査グループ2と同様に処置する。動物モデルを麻酔状態から回復させたときに、ラット体重1kg当たり3mgのジクロフェナクナトリウム塩(DFNa)の用量を含む硫酸モルヒネの皮下注射を行うことによって処置する。
4.検査グループ4(「Sx+IC-2mg」とラベル表記される)に対しては、検査グループ2と同様に処置する。腹部を閉じる前に、2mgのジクロフェナクナトリウム塩(DFNa)を含有するインターシード(登録商標:Interceed)(2cm×2.5cm)であるIC-2mgを、処置済の盲腸上に配置する。
5.検査グループ5(「Sx+IC-1.0mg」とラベル表記される)に対しては、検査グループ2と同様に処置する。腹部を閉じる前に、1mgのジクロフェナクナトリウム塩(DFNa)を含有するインターシード(登録商標:Interceed)(2cm×2.5cm)であるIC-1.0を、処置済の盲腸上に配置する。
6.検査グループ6(「Sx+IC-0.3mg」とラベル表記される)に対しては、検査グループ2と同様に処置する。腹部を閉じる前に、0.3mgのジクロフェナクナトリウム塩(DFNa)を含有するインターシード(登録商標:Interceed)(2cm×2.5cm)であるIC-0.3-Aを、処置済の盲腸上に配置する。
7.検査グループ7(「Sx+IC-0.1mg」とラベル表記される)に対しては、検査グループ2と同様に処置する。腹部を閉じる前に、0.1mgのジクロフェナクナトリウム塩(DFNa)を含有するインターシード(登録商標:Interceed)(2cm×2.5cm)であるIC-0.1を、処置済の盲腸上に配置する。
8.実験グループ8(「Sx+IC」とラベル表記される)に対しては、検査グループ2と同様に処置する。腹部を閉じる前に、全く薬剤を添加していないインターシード(登録商標:Interceed)(2cm×2.5cm)を、処置済の盲腸上に配置する。
9.検査グループ9(「Sx+モルヒネ+IC-0.3mg」とラベル表記される)に対しては、実験グループ3と同様に処置する。腹部を閉じる前に、0.3mgのジクロフェナクナトリウム塩(DFNa)を含有するインターシード(登録商標:Interceed)(2cm×2.5cm)であるIC-0.3-Bを、処置済の盲腸上に配置する。
10.検査グループ10(「Sx+モルヒネ+IC-2.0mg」とラベル表記される)に対しては、実験グループ3と同様に処置する。腹部を閉じる前に、2.0mgのジクロフェナクナトリウム塩(DFNa)を含有するインターシード(登録商標:Interceed)(2cm×2.5cm)であるIC-2.0を、処置済の盲腸上に配置する。
11.実験グループ11(「Sx+0.3mg DCF」とラベル表記される)に対しては、検査グループ2と同様に処置する。腹部を閉じる前に、0.3mgのジクロフェナクナトリウム塩(DFNa)を含有する50μlの生理食塩水のスラリーを、処置済の盲腸上に配置する。
【0055】
すべてのグループに対しては、2%のアラビアガム(acacia gum)中に10%の活性炭(charcoal)を混ぜた経口液剤をチューブにより強制飼養する。この経口投与後の4時間の時点で、ラットを二酸化炭素で安楽死させる。腸を取り出し、腸(幽門から肛門まで)の全長ばかりでなく、活性炭餌の到達距離を測定する。この測定結果では、腸の全長に対する到達距離の百分率ばかりでなく、到達距離をcm単位で表している。
【0056】
この生体内検査の結果は、図1および図2に示されている。両図から明らかなように、腸管輸送は、手術によって顕著に低下し、かつ、術後のモルヒネ治療によって、さらに低下する。ジクロフェナクを含むインターシード(登録商標:Interceed)を配置すると、Cox酵素阻害剤は、腸管輸送の低下をうまく軽減する。用量反応は、ジクロフェナクの効果から明らかである。この検査において、0.1mgのジクロフェナクの用量では、腸管輸送の低下を軽減するうえで十分ではなく、1.0mgのジクロフェナクの用量で、最大の効果を達成する。2mgのジクロフェナクを含むインターシード(登録商標:Interceed)サンプルでは、腸管輸送をさらに高める効果を観察できない。(この検査において、ジクロフェナクを0.1mgの用量で使用することは腸管輸送の低下を軽減するうえで十分ではないが、より強力な非ステロイド系抗炎症剤(NSAID)系のCox酵素阻害剤では、0.1mg以下の用量でも、非常に有効である点に留意する必要がある。)
【0057】
ジクロフェナク単独でも、インターシード(登録商標:Interceed)単独でも、観察できる薬理学的効果を得るうえで、十分はない。0.3mgのジクロフェナクナトリウム塩(DFNa)を含むインターシード(登録商標:Interceed)では、(手術およびモルヒネ治療においても、手術においても)薬理学的効果が得られる。他方、0.3mgのジクロフェナクの盲腸への使用、あるいは、インターシード(登録商標:Interceed)の盲腸への使用では、薬理学的効果が得られない。
【0058】
〔実施の態様〕
本発明の好適な実施態様を以下に示す。
(1)腸管および他の内臓器官の漿膜表面に付与されることで、術後の腸閉塞および胃の通過停滞を予防するか、あるいは軽減する組成物において、
酸化再生セルロースと、
非ステロイド系抗炎症剤と、
を含み、
前記非ステロイド系抗炎症剤は、Cox酵素阻害剤である、組成物。
(2)実施態様(1)記載の組成物において、
前記非ステロイド系抗炎症剤は、プロピオン酸誘導体;酢酸誘導体;フェナム酸誘導体;ビフェニルカルボン酸誘導体;オキシカム類;およびCox2酵素阻害剤からなる群より選択されるCox酵素阻害剤である、組成物。
(3)実施態様(1)記載の組成物において、
前記非ステロイド系抗炎症剤は、ジクロフェナク酸あるいはメフェナム酸、あるいは、これらの薬理学的に許容される塩からなる群より選択される、組成物。
(4)実施態様(1)記載の組成物において、
前記非ステロイド系抗炎症剤は、ジクロフェナク、あるいは、この薬理学的に許容される塩である、組成物。
(5)実施態様(1)〜(4)のうち、いずれか1項に記載の組成物において、
前記組成物中における前記Cox酵素阻害剤の前記酸化再生セルロースに対する重量比は、約1:1000〜約1:35の範囲である、組成物。
(6)実施態様(1)〜(5)のうち、いずれか1項に記載の組成物において、
前記非ステロイド系抗炎症剤の濃度は、前記組成物に対して、約0.01重量%〜約10重量%の範囲内である、組成物。
(7)実施態様(1)〜(6)のうち、いずれか1項に記載の組成物において、
前記組成物は、繊維製品、粒子の混合物、発泡スポンジ、発泡ビーズおよび凝集体からなる群より選択される形態である、組成物。
【0059】
(8)実施態様(7)記載の組成物において、
酸化再生セルロースの繊維製品あるいは粒子と、
非ステロイド系抗炎症剤と、
を含み、
前記非ステロイド系抗炎症剤は、(a)前記酸化再生セルロースの繊維製品を前記非ステロイド系抗炎症剤の溶液あるいは懸濁液中に浸漬被覆させることによって、(b)前記酸化再生セルロースの繊維製品の表面上に前記非ステロイド系抗炎症剤の溶液あるいは懸濁液を噴霧被覆させることによって、(c)前記酸化再生セルロースの繊維製品の表面上に前記非ステロイド系抗炎症剤の溶液あるいは懸濁液から形成された少なくとも一層のポリマーフィルムを積層させることによって、あるいは(d)前記非ステロイド系抗炎症剤と酸化再生セルロースの繊維製品あるいは粒子とを含む微小孔性ポリマーマトリックスを形成することによって、前記組成物内に組み入れられる、組成物。
(9)実施態様(8)記載の組成物において、
前記積層の過程で使用される前記ポリマーフィルムは、ポリ(アクリル酸)、ヒドロキシルプロピルメチルセルロース、ポリビニルピロリドン、ポリエチレングリコールおよびポリエチレンオキシドからなる群より選択されるポリマーを含む、組成物。
(10)実施態様(8)記載の組成物において、
前記非ステロイド系抗炎症剤は、セルロース、アルキルセルロース、アルキルヒドロキシアルキルセルロース、ヒドロキシアルキルセルロース、硫酸セルロース、カルボキシメチルセルロース塩類、カルボキシメチルセルロース、カルボキシエチルセルロース、キチン、カルボキシメチルキチン、ヒアルロン酸、ヒアルロン酸塩類、アルギン酸塩、アルギン酸、アルギン酸プロピレングリコール、グリコーゲン、デキストラン、硫酸デキストラン、カードラン、ペクチン、プルラン、キサンタン、コンドロイチン、コンドロイチン硫酸、カルボキシメチルデキストラン、カルボキシメチルキトサン、キトサン、ヘパリン、ヘパリン硫酸、ヘパラン、ヘパラン硫酸、デルマタン硫酸、ケラタン硫酸、カラギーナン類、キトサン、澱粉、アミロース、アミロペクチン、ポリ-N-グルコサミン、ポリマンヌロン酸、ポリグルクロン酸、ポリグルロン酸およびこれらの誘導体からなる群より選択される少なくとも一つの多糖類を含む結合剤を用いて微小孔性ポリマーマトリックスへと形成される、組成物。
(11)実施態様(7)記載の組成物において、
前記組成物は、粒子の混合物の形態であり、前記粒子は、1μm〜1000μmの平均粒径を有する酸化再生セルロース粒子と、非ステロイド系抗炎症剤の粒子とを含む、組成物。
(12)実施態様(11)記載の組成物において、
前記酸化再生セルロース粒子は、20μm〜25μmの平均粒径を有する、組成物。
(13)実施態様(1)〜(12)のうち、いずれか1項に記載の組成物において、
前記組成物は、安定剤、湿潤剤、保存剤、抗生剤、抗ウィルス剤、抗真菌剤、抗菌剤およびこれらの混合物からなる群より選択される添加剤をさらに含む、組成物。
【0060】
(14)術後の腸閉塞および胃の通過停滞を予防するか、あるいは軽減するための方法において、
前記方法は、酸化再生セルロース成分とシクロオキシゲナーゼ酵素阻害剤として作用する非ステロイド系抗炎症剤とを含む組成物を、有効量で、胃腸あるいは他の内臓器官の漿膜表面に直接的に投与することを含む、方法。
(15)実施態様(14)記載の方法において、
前記投与された組成物の前記非ステロイド系抗炎症剤は、プロピオン酸誘導体;酢酸誘導体;フェナム酸誘導体;ビフェニルカルボン酸誘導体;オキシカム類;およびCox2酵素阻害剤からなる群より選択されるCox酵素阻害剤である、方法。
(16)実施態様(14)記載の方法において、
前記非ステロイド系抗炎症剤は、ジクロフェナク酸あるいはメフェナム酸、あるいは、これらの薬理学的に許容される塩からなる群より選択される、方法。
(17)実施態様(14)、(15)あるいは(16)に記載の方法において、
前記投与された前記組成物中における前記Cox酵素阻害剤の前記酸化再生セルロースに対する重量比は、約1:1000〜約1:35の範囲である、方法。
(18)実施態様(14)、(15)、(16)あるいは(17)に記載の方法において、
前記非ステロイド系抗炎症剤の濃度は、前記投与された前記組成物に対して、約0.01重量%〜約10重量%の範囲内である、方法。
(19)実施態様(14)、(15)、(16)、(17)あるいは(18)に記載の方法において、
前記投与された前記組成物は、繊維製品、粒子の混合物、発泡スポンジ、発泡ビーズおよび凝集体からなる群より選択される形態である、方法。
(20)実施態様(19)記載の方法において、
前記投与された前記組成物は、酸化再生セルロースの繊維製品あるいは粒子と、非ステロイド系抗炎症剤とを含み、
前記非ステロイド系抗炎症剤は、(a)前記酸化再生セルロースの繊維製品を前記非ステロイド系抗炎症剤の溶液あるいは懸濁液中に浸漬被覆させることによって、(b)前記酸化再生セルロースの繊維製品の表面上に前記非ステロイド系抗炎症剤の溶液あるいは懸濁液を噴霧被覆させることによって、(c)前記酸化再生セルロースの繊維製品の表面上に前記非ステロイド系抗炎症剤の溶液あるいは懸濁液から形成された少なくとも一層のポリマーフィルムを積層させることによって、あるいは(d)前記非ステロイド系抗炎症剤と酸化再生セルロースの粉末あるいは繊維製品とを含む微小孔性ポリマーマトリックスを形成することによって、前記組成物内に組み入れられる、方法。
【図面の簡単な説明】
【0061】
【図1】本発明の腸閉塞予防用の組成物および方法に関する生体内検査に従って、誘導され、かつ、処置された腸閉塞を患うラットに対する給餌の4時間後において、胃腸(GI)内での活性炭餌(charcoal meal)の平均輸送距離を示すグラフである。
【図2】本発明の腸閉塞予防用の組成物および方法に関する生体内検査に従って、誘導され、かつ、処置された腸閉塞を患うラットに対する給餌の4時間後において、胃腸(GI)の全長に対する胃腸(GI)内での活性炭餌の輸送距離の平均百分率を示すグラフである。
【特許請求の範囲】
【請求項1】
腸管および他の内臓器官の漿膜表面に付与されることで、術後の腸閉塞および胃の通過停滞を予防するか、あるいは軽減する組成物において、
酸化再生セルロースと、
非ステロイド系抗炎症剤と、
を含み、
前記非ステロイド系抗炎症剤は、Cox酵素阻害剤である、組成物。
【請求項2】
請求項1記載の組成物において、
前記非ステロイド系抗炎症剤は、プロピオン酸誘導体;酢酸誘導体;フェナム酸誘導体;ビフェニルカルボン酸誘導体;オキシカム類;およびCox2酵素阻害剤からなる群より選択されるCox酵素阻害剤である、組成物。
【請求項3】
請求項1記載の組成物において、
前記非ステロイド系抗炎症剤は、ジクロフェナク酸あるいはメフェナム酸、あるいは、これらの薬理学的に許容される塩からなる群より選択される、組成物。
【請求項4】
請求項1記載の組成物において、
前記非ステロイド系抗炎症剤は、ジクロフェナク、あるいは、この薬理学的に許容される塩である、組成物。
【請求項5】
請求項1〜4のうち、いずれか1項に記載の組成物において、
前記組成物中における前記Cox酵素阻害剤の前記酸化再生セルロースに対する重量比は、約1:1000〜約1:35の範囲である、組成物。
【請求項6】
請求項1〜5のうち、いずれか1項に記載の組成物において、
前記非ステロイド系抗炎症剤の濃度は、前記組成物に対して、約0.01重量%〜約10重量%の範囲内である、組成物。
【請求項7】
請求項1〜6のうち、いずれか1項に記載の組成物において、
前記組成物は、繊維製品、粒子の混合物、発泡スポンジ、発泡ビーズおよび凝集体からなる群より選択される形態である、組成物。
【請求項8】
請求項7記載の組成物において、
酸化再生セルロースの繊維製品あるいは粒子と、
非ステロイド系抗炎症剤と、
を含み、
前記非ステロイド系抗炎症剤は、(a)前記酸化再生セルロースの繊維製品を前記非ステロイド系抗炎症剤の溶液あるいは懸濁液中に浸漬被覆させることによって、(b)前記酸化再生セルロースの繊維製品の表面上に前記非ステロイド系抗炎症剤の溶液あるいは懸濁液を噴霧被覆させることによって、(c)前記酸化再生セルロースの繊維製品の表面上に前記非ステロイド系抗炎症剤の溶液あるいは懸濁液から形成された少なくとも一層のポリマーフィルムを積層させることによって、あるいは(d)前記非ステロイド系抗炎症剤と酸化再生セルロースの繊維製品あるいは粒子とを含む微小孔性ポリマーマトリックスを形成することによって、前記組成物内に組み入れられる、組成物。
【請求項9】
請求項8記載の組成物において、
前記積層の過程で使用される前記ポリマーフィルムは、ポリ(アクリル酸)、ヒドロキシルプロピルメチルセルロース、ポリビニルピロリドン、ポリエチレングリコールおよびポリエチレンオキシドからなる群より選択されるポリマーを含む、組成物。
【請求項10】
請求項8記載の組成物において、
前記非ステロイド系抗炎症剤は、セルロース、アルキルセルロース、アルキルヒドロキシアルキルセルロース、ヒドロキシアルキルセルロース、硫酸セルロース、カルボキシメチルセルロース塩類、カルボキシメチルセルロース、カルボキシエチルセルロース、キチン、カルボキシメチルキチン、ヒアルロン酸、ヒアルロン酸塩類、アルギン酸塩、アルギン酸、アルギン酸プロピレングリコール、グリコーゲン、デキストラン、硫酸デキストラン、カードラン、ペクチン、プルラン、キサンタン、コンドロイチン、コンドロイチン硫酸、カルボキシメチルデキストラン、カルボキシメチルキトサン、キトサン、ヘパリン、ヘパリン硫酸、ヘパラン、ヘパラン硫酸、デルマタン硫酸、ケラタン硫酸、カラギーナン類、キトサン、澱粉、アミロース、アミロペクチン、ポリ-N-グルコサミン、ポリマンヌロン酸、ポリグルクロン酸、ポリグルロン酸およびこれらの誘導体からなる群より選択される少なくとも一つの多糖類を含む結合剤を用いて微小孔性ポリマーマトリックスへと形成される、組成物。
【請求項11】
請求項7記載の組成物において、
前記組成物は、粒子の混合物の形態であり、前記粒子は、1μm〜1000μmの平均粒径を有する酸化再生セルロース粒子と、非ステロイド系抗炎症剤の粒子とを含む、組成物。
【請求項12】
請求項11記載の組成物において、
前記酸化再生セルロース粒子は、20μm〜25μmの平均粒径を有する、組成物。
【請求項13】
請求項1〜12のうち、いずれか1項に記載の組成物において、
前記組成物は、安定剤、湿潤剤、保存剤、抗生剤、抗ウィルス剤、抗真菌剤、抗菌剤およびこれらの混合物からなる群より選択される添加剤をさらに含む、組成物。
【請求項14】
術後の腸閉塞および胃の通過停滞を予防するか、あるいは軽減するための方法において、
前記方法は、酸化再生セルロース成分とシクロオキシゲナーゼ酵素阻害剤として作用する非ステロイド系抗炎症剤とを含む組成物を、有効量で、胃腸あるいは他の内臓器官の漿膜表面に直接的に投与することを含む、方法。
【請求項1】
腸管および他の内臓器官の漿膜表面に付与されることで、術後の腸閉塞および胃の通過停滞を予防するか、あるいは軽減する組成物において、
酸化再生セルロースと、
非ステロイド系抗炎症剤と、
を含み、
前記非ステロイド系抗炎症剤は、Cox酵素阻害剤である、組成物。
【請求項2】
請求項1記載の組成物において、
前記非ステロイド系抗炎症剤は、プロピオン酸誘導体;酢酸誘導体;フェナム酸誘導体;ビフェニルカルボン酸誘導体;オキシカム類;およびCox2酵素阻害剤からなる群より選択されるCox酵素阻害剤である、組成物。
【請求項3】
請求項1記載の組成物において、
前記非ステロイド系抗炎症剤は、ジクロフェナク酸あるいはメフェナム酸、あるいは、これらの薬理学的に許容される塩からなる群より選択される、組成物。
【請求項4】
請求項1記載の組成物において、
前記非ステロイド系抗炎症剤は、ジクロフェナク、あるいは、この薬理学的に許容される塩である、組成物。
【請求項5】
請求項1〜4のうち、いずれか1項に記載の組成物において、
前記組成物中における前記Cox酵素阻害剤の前記酸化再生セルロースに対する重量比は、約1:1000〜約1:35の範囲である、組成物。
【請求項6】
請求項1〜5のうち、いずれか1項に記載の組成物において、
前記非ステロイド系抗炎症剤の濃度は、前記組成物に対して、約0.01重量%〜約10重量%の範囲内である、組成物。
【請求項7】
請求項1〜6のうち、いずれか1項に記載の組成物において、
前記組成物は、繊維製品、粒子の混合物、発泡スポンジ、発泡ビーズおよび凝集体からなる群より選択される形態である、組成物。
【請求項8】
請求項7記載の組成物において、
酸化再生セルロースの繊維製品あるいは粒子と、
非ステロイド系抗炎症剤と、
を含み、
前記非ステロイド系抗炎症剤は、(a)前記酸化再生セルロースの繊維製品を前記非ステロイド系抗炎症剤の溶液あるいは懸濁液中に浸漬被覆させることによって、(b)前記酸化再生セルロースの繊維製品の表面上に前記非ステロイド系抗炎症剤の溶液あるいは懸濁液を噴霧被覆させることによって、(c)前記酸化再生セルロースの繊維製品の表面上に前記非ステロイド系抗炎症剤の溶液あるいは懸濁液から形成された少なくとも一層のポリマーフィルムを積層させることによって、あるいは(d)前記非ステロイド系抗炎症剤と酸化再生セルロースの繊維製品あるいは粒子とを含む微小孔性ポリマーマトリックスを形成することによって、前記組成物内に組み入れられる、組成物。
【請求項9】
請求項8記載の組成物において、
前記積層の過程で使用される前記ポリマーフィルムは、ポリ(アクリル酸)、ヒドロキシルプロピルメチルセルロース、ポリビニルピロリドン、ポリエチレングリコールおよびポリエチレンオキシドからなる群より選択されるポリマーを含む、組成物。
【請求項10】
請求項8記載の組成物において、
前記非ステロイド系抗炎症剤は、セルロース、アルキルセルロース、アルキルヒドロキシアルキルセルロース、ヒドロキシアルキルセルロース、硫酸セルロース、カルボキシメチルセルロース塩類、カルボキシメチルセルロース、カルボキシエチルセルロース、キチン、カルボキシメチルキチン、ヒアルロン酸、ヒアルロン酸塩類、アルギン酸塩、アルギン酸、アルギン酸プロピレングリコール、グリコーゲン、デキストラン、硫酸デキストラン、カードラン、ペクチン、プルラン、キサンタン、コンドロイチン、コンドロイチン硫酸、カルボキシメチルデキストラン、カルボキシメチルキトサン、キトサン、ヘパリン、ヘパリン硫酸、ヘパラン、ヘパラン硫酸、デルマタン硫酸、ケラタン硫酸、カラギーナン類、キトサン、澱粉、アミロース、アミロペクチン、ポリ-N-グルコサミン、ポリマンヌロン酸、ポリグルクロン酸、ポリグルロン酸およびこれらの誘導体からなる群より選択される少なくとも一つの多糖類を含む結合剤を用いて微小孔性ポリマーマトリックスへと形成される、組成物。
【請求項11】
請求項7記載の組成物において、
前記組成物は、粒子の混合物の形態であり、前記粒子は、1μm〜1000μmの平均粒径を有する酸化再生セルロース粒子と、非ステロイド系抗炎症剤の粒子とを含む、組成物。
【請求項12】
請求項11記載の組成物において、
前記酸化再生セルロース粒子は、20μm〜25μmの平均粒径を有する、組成物。
【請求項13】
請求項1〜12のうち、いずれか1項に記載の組成物において、
前記組成物は、安定剤、湿潤剤、保存剤、抗生剤、抗ウィルス剤、抗真菌剤、抗菌剤およびこれらの混合物からなる群より選択される添加剤をさらに含む、組成物。
【請求項14】
術後の腸閉塞および胃の通過停滞を予防するか、あるいは軽減するための方法において、
前記方法は、酸化再生セルロース成分とシクロオキシゲナーゼ酵素阻害剤として作用する非ステロイド系抗炎症剤とを含む組成物を、有効量で、胃腸あるいは他の内臓器官の漿膜表面に直接的に投与することを含む、方法。
【図1】


【図2】




【図2】


【公表番号】特表2009−521502(P2009−521502A)
【公表日】平成21年6月4日(2009.6.4)
【国際特許分類】
【出願番号】特願2008−547758(P2008−547758)
【出願日】平成18年12月20日(2006.12.20)
【国際出願番号】PCT/US2006/062433
【国際公開番号】WO2007/076415
【国際公開日】平成19年7月5日(2007.7.5)
【公序良俗違反の表示】
(特許庁注:以下のものは登録商標)
1.テフロン
【出願人】(507209506)エシコン・インコーポレイテッド (12)
【氏名又は名称原語表記】Ethicon Incorporated
【住所又は居所原語表記】Rt. 22 West,P.O.Box 151,Somerville,NJ 08876−0151 United States of America
【Fターム(参考)】
【公表日】平成21年6月4日(2009.6.4)
【国際特許分類】
【出願日】平成18年12月20日(2006.12.20)
【国際出願番号】PCT/US2006/062433
【国際公開番号】WO2007/076415
【国際公開日】平成19年7月5日(2007.7.5)
【公序良俗違反の表示】
(特許庁注:以下のものは登録商標)
1.テフロン
【出願人】(507209506)エシコン・インコーポレイテッド (12)
【氏名又は名称原語表記】Ethicon Incorporated
【住所又は居所原語表記】Rt. 22 West,P.O.Box 151,Somerville,NJ 08876−0151 United States of America
【Fターム(参考)】
[ Back to top ]

