表面プラズモン励起増強蛍光分光法を利用して蛍光量を測定する定量分析方法ならびにそれに用いられる定量分析用キットおよびアナライト解離抑制剤
【課題】表面プラズモン励起増強蛍光分光法を利用して蛍光量を測定する定量分析方法において、リガンド−アナライト間の解離を抑制することができ、得られるシグナルの変動が抑制された高感度且つ高精度な検出を行うことができる定量分析方法、ならびにそれに用いられる定量分析用キット及びアナライト解離抑制剤を提供すること。
【解決手段】本発明の定量分析方法は、特定のセンサチップと、ナノ構造粒子、および特定の第3リガンドを有し、特定の第2リガンドと、該第3リガンドが該ナノ構造粒子上に固定されてなるナノ構造体とを用いた、表面プラズモン励起増強蛍光分光法によるアナライトの定量分析方法であって、所定の工程を実施することを特徴とする。
【解決手段】本発明の定量分析方法は、特定のセンサチップと、ナノ構造粒子、および特定の第3リガンドを有し、特定の第2リガンドと、該第3リガンドが該ナノ構造粒子上に固定されてなるナノ構造体とを用いた、表面プラズモン励起増強蛍光分光法によるアナライトの定量分析方法であって、所定の工程を実施することを特徴とする。
【発明の詳細な説明】
【技術分野】
【0001】
本発明は、表面プラズモン共鳴現象を応用した表面プラズモン励起増強蛍光分光法を用いて蛍光を測定する分析方法ならびにそれに用いられる定量分析用キットおよびアナライト解離抑制剤に関する。
【背景技術】
【0002】
従来から、ナノメートルレベルの微細金属近傍において電子と光が共鳴する現象(表面プラズモン共鳴(SPR;Surface Plasmon Resonance)現象や局在プラズモン共鳴(LPR; Localized Plasmon Resonance))を応用し、例えば生体内の極微少なアナライト(測定対象物)の検出が行われている。例えば、SPR現象を応用した特定のアナライトの検出に用いられる測定としてSPR測定がある。SPR測定は、プリズムなどの誘電体部材上に形成された金などの金属薄膜上においてSPR現象を誘起することで、金属薄膜上の極小さな屈折率変化を測定することを原理としている。例えば、アナライトに特異的に結合するリガンドを金属薄膜上に固定し、該金属薄膜上に特定のアナライトを含んだ試料を供給することで、特定のアナライトのリガンドへの結合によって屈折率変化が誘起され、特定のアナライトの定量分析が可能となる。
【0003】
このようなSPR現象を応用した他の測定として、近年、表面プラズモン励起増強蛍光分光法(SPFS)を利用した測定方法(SPFS測定)が開発されている。このSPFS測定は、励起光と金属薄膜中の電子振動がカップリングすることで形成される増強電場を励起エネルギーとして、リガンドに特異的に結合したアナライトを標識する蛍光色素が発する蛍光を測定する方法である。金属薄膜の極表面に形成される増強電場を利用した蛍光色素の蛍光発光を測定するため、例えば、リガンド−アナライト間の結合等によって増強電場中に配置された蛍光色素からの蛍光シグナルを極めて効率的に測定することが可能で、高いシグナル(S)と低いノイズ(N)に裏付けられた高感度かつ高精度な分析(高いS/N比)により、SPR測定による屈折率変化の測定よりもさらに高精度に特定のアナライトの定量分を行うことができる。
【0004】
このようなSPFSを利用して蛍光量を測定する特定のアナライトの定量分析において、本出願人は、さらに高いS/N比を得るための改良を施した、技術を既に出願している(例えば、特許文献1)。この特許文献1には、金属薄膜上にアナライトと特異的に結合するリガンド(以下、第1リガンドともいう)を備えたセンサに、特定のアナライトを含む溶液を供給して第1リガンドにアナライトを補足させ、アナライトを標識するための蛍光色素を有し且つアナライトと特異的に結合するリガンド(以下、第2リガンドともいう)を含む溶液を供給して第1リガンドと結合されたアナライトに、該アナライトを標識するための蛍光色素を有する第2リガンドを結合させ、その後、金属コロイド粒子を分散させたコロイド液を供給しつつ蛍光色素の蛍光量を測定することで、通常の表面プラズモン共鳴による電場増強効果に、該金属コロイド粒子からの局在プラズモン共鳴による電場増強効果を組み合わせて、通常の表面プラズモン共鳴による蛍光量の測定よりも、さらに蛍光増幅を図り、より高いS/N比を得る高感度かつ高精度にアナライトの定量分析を行う方法が記載されている。
【先行技術文献】
【特許文献】
【0005】
【特許文献1】特開2010−145272号公報
【発明の概要】
【発明が解決しようとする課題】
【0006】
特許文献1に記載の定量分析方法は、SPFSを利用して蛍光量を測定するアナライトの定量分析において、より高いS/N比を得るための一つの手法である。しかしながら、特許文献1には、第1リガンドとアナライトとの結合や該アナライトと第2リガンドとの結合といった、リガンド−アナライト間の結合そのものに関する課題については何ら言及されていない。上記記載の技術のようにリガンド−アナライト間の結合により金属薄膜の極表面に局在化された蛍光色素に基づくアナライトの定量分析においては、リガンド−アナライト間の結合が解離すること(以下、リガンド−アナライト間の解離ともいう)によって一旦は局在化された蛍光色素が分散してしまうといった問題がある。特に、SPFSを利用して蛍光量を測定する定量分析においては、蛍光色素の存在が必須であり、蛍光性を有しないアナライトを分析するにあたっては、金属膜上に設けられ、アナライトと特異的に結合する第1リガンド以外に、該第1リガンドに捕捉されたアナライトを第1リガンドとサンドイッチするような形態でアナライトと特異的に結合する、蛍光色素を有する第2リガンドが多用される。そのため、1つのアナライトに対して、少なくとも二個以上のリガンド(第1リガンド及び第2リガンド)が必要なSPFS測定では、SPR測定よりもリガンド−アナライト間の解離が生じてしまう危険性が高いと言える。
【0007】
このことは特に、精度が要求されるSPFS測定にとって、本来のシグナル(S)を失うことによるS/N比の低下や変動を生じさせる致命的な問題である。このような問題がSPFSを利用して蛍光量を測定する定量分析の汎用を困難にさせている要因の一つとなっていることがわかった。
【0008】
本発明は、上記の点に鑑みてなされたものであり、表面プラズモン励起増強蛍光分光法を利用して蛍光量を測定する定量分析方法において、リガンド−アナライト間の解離を抑制することができ、得られるシグナル(以下、アッセイ発光シグナルともいう)の変動が抑制された高感度且つ高精度な検出を行うことができる定量分析方法、ならびにそれに用いられる定量分析用キット及びアナライト解離抑制剤を提供することを目的とする。
【課題を解決するための手段】
【0009】
本発明に係るアナライトの定量分析方法は、透明支持体、該透明支持体上に形成された金属膜、および該金属膜上に固定され、かつアナライトに特異的に結合する第1リガンドを備えたセンサチップと、表面プラズモンにより励起されて蛍光する蛍光色素を有し、かつ前記アナライトに特異的に結合する第2リガンドと、ナノ構造粒子、および第2リガンドに特異的に結合する第3リガンドを有し、該第3リガンドが該ナノ構造粒子上に固定されてなるナノ構造体とを用いた、表面プラズモン励起増強蛍光分光法によるアナライトの定量分析方法であって、下記工程(a)〜(c)を実施して、下記工程(d)を実施することを特徴とする。
【0010】
工程(a):前記センサチップ上の第1リガンドと前記アナライトとを接触させて、該第1リガンドにアナライトを結合させる工程
工程(b):前記第2リガンドと前記アナライトとを接触させて、該第2リガンドにアナライトを結合させる工程
(c):前記第2リガンドに前記ナノ構造体を接触させて、該第2リガンドにナノ構造体を結合させる工程
(d):前記センサチップの透明支持体を介して前記金属膜に励起光を照射して表面プラズモンを生じさせ、該表面プラズモンにより蛍光色素を励起させて蛍光を生じさせ、該蛍光の蛍光量を測定する工程
【0011】
本発明の定量分析方法において、前記ナノ構造体の体積平均粒径は、1nm以上、50nm以下であることが好ましい。
本発明の定量分析方法において、前記ナノ構造体は、前記ナノ構造粒子上に複数の前記第3リガンドが固定されてなることが好ましい。
【0012】
本発明の定量分析方法において、前記ナノ構造体は、前記ナノ構造粒子上に、前記第2リガンドおよび第1リガンドに特異的に結合する第3リガンド(A)が、および/または、第3リガンドと、第1リガンドに特異的に結合する第3´リガンドとが固定されてなり、前記工程(a)〜(b)を任意の順でまたは同時に実施して、工程(c)〜(d)を順次実施し、工程(c)において、前記ナノ構造体を前記第2リガンドに接触させるとともに、前記第1リガンドにも接触させて、前記ナノ構造体に前記第2リガンドおよび前記第1リガンドを結合させる工程を実施することが好ましい。
【0013】
本発明の定量分析方法において、前記ナノ構造体は、金属で構成されたナノ構造粒子を含むことが好ましい。
本発明の定量分析方法において、前記工程(a)、前記工程(b)及び前記工程(c)を順次実施することが好ましい。
【0014】
本発明の定量分析方法において、前記センサチップが、金属膜上に、さらにカルボキシメチルデキストラン層を備え、前記第1リガンドが該カルボキシメチルデキストラン層に固定化されてなることが好ましい。
【0015】
本発明に係る表面プラズモン励起増強蛍光分光法によるアナライトの定量分析に用いるためのキットは、透明支持体、該透明支持体上に形成された金属膜、および該金属膜上に固定され、かつアナライトに特異的に結合する第1リガンドを備えたセンサチップと、表面プラズモンにより励起されて蛍光する蛍光色素を有し、かつ前記アナライトに特異的に結合する第2リガンドと、ナノ構造粒子、および第2リガンドに特異的に結合する第3リガンドを有し、該第3リガンドが該ナノ構造粒子上に固定されてなるナノ構造体とを含むことを特徴とする。
【0016】
本発明に係るアナライト解離抑制剤は、透明支持体、該透明支持体上に形成された金属膜、および該金属膜上に固定され、かつアナライトに特異的に結合する第1リガンドを備えたセンサチップと、表面プラズモンにより励起されて蛍光する蛍光色素を有し、かつ前記アナライトに特異的に結合する第2リガンドと、ナノ構造粒子、および第2リガンドに特異的に結合する第3リガンドを有し、該第3リガンドが該ナノ構造粒子上に固定されてなるナノ構造体とを用いた、表面プラズモン励起増強蛍光分光法によるアナライトの定量分析方法において、第1リガンドおよび第2リガンドとアナライトとの解離を抑制するために使用され、ナノ構造粒子、および第2リガンドに特異的に結合する第3リガンドを有し、該第3リガンドが該ナノ構造粒子上に固定されてなるナノ構造体を含むことを特徴とする。
【発明の効果】
【0017】
本発明に係る、表面プラズモン励起増強蛍光分光法(SPFS)を利用して蛍光量を測定する定量分析方法は、特定のナノ構造体を用いることで、測定対象物(アナライト)と第1リガンド(アナライトに対して特異的な結合性を有する分子)間の解離や、アナライトと蛍光色素を有する第2リガンド(アナライトに対して特異的な結合性を有する分子)間の解離を抑制することができ、本来の測定されるべきシグナルの変動を抑制することができる。そのため、本発明は、従来よりも高感度且つ高精度な検出を行うことができる定量分析方法、ならびに該定量分析方法に用いられ、高感度且つ高精度な検出を可能にする定量分析用キットおよびアナライト解離抑制剤を提供することができる。
【図面の簡単な説明】
【0018】
【図1】図1は、ナノ構造体を示した図面である。図1(a)は、ナノ構造粒子1粒子あたりに一つの第3リガンドを備えるナノ構造体の形態を示す図面である。図1(b)は、ナノ構造粒子1粒子あたりに二つの第3リガンドを備えるナノ構造体の形態を示す図面である。図1(c)は、ナノ構造粒子1粒子あたりに四つの第3リガンドを備えるナノ構造体の形態を示す図面である。
【図2】図2は、表面プラズモン励起増強蛍光分光法(SPFS)を利用する蛍光定量分析において、ナノ構造体を用いた際のSPFSセンサチップ表面の好ましい一態様を模式的に示した概念図である。
【発明を実施するための形態】
【0019】
本発明は、表面プラズモン励起増強蛍光分光法(SPFS)を利用して蛍光量を測定する定量分析方法において、少なくとも第2リガンドに対して結合性を有する第3リガンドとナノ構造粒子を有するナノ構造体を、該第2リガンドに接触させる工程を有することを特徴とし、好ましくはSPFSセンサチップ表面にあらかじめ固定化されている第1リガンドに対しても結合性を有する第3リガンドとナノ構造粒子を有するナノ構造体を、該第1リガンドにも接触させる工程を有することである。このような工程を有することにより、リガンド−アナライト間の解離を抑制することができる。
【0020】
なお、リガンド−アナライト間の解離抑制とは、第1リガンドとアナライト間の解離抑制、あるいは第2リガンドとアナライト間の解離抑制を指し、ナノ構造体は、少なくともどちらか一方の解離を抑制するものである。
【0021】
また、第3リガンドを有するナノ構造体の好ましい形態としては、一つのナノ構造粒子に対し、二つ以上の(複数の)第3リガンドを有する形態である。このように、一つのナノ構造粒子中の二つ以上の(複数の)第3リガンドを各々、上記工程(C)において、第2リガンドに、好ましくは第2リガンドや第1リガンドに結合させる際に、ナノ構造粒子1粒子中1つの第3リガンドを有する形態に比較して、第3リガンドが上記リガンドに強固に結合するので、効果的に解離を抑制することができる。
【0022】
すなわち、一つのナノ構造粒子に対し二つ以上の第3リガンドが固定されていると、それぞれの第3リガンドが各々異なる第2リガンドに結合することができる。さらには、後述するように、前記ナノ構造体は、前記ナノ構造粒子上に、前記第2リガンドおよび第1リガンドに特異的に結合する第3リガンド(A)が、および/または、第3リガンドと、第1リガンドに特異的に結合する第3´リガンドとが固定されてなる場合、第3リガンド(A)が第2リガンドだけでなく第1リガンドにも結合したり、第3リガンドおよび第3´リガンドがそれぞれ第2リガンドおよび第1リガンドに結合したりすることが可能となる。
【0023】
このような場合、ナノ構造体により第2リガンド−第2リガンド間や第2リガンド−第1リガンド間を架橋する形態となり、リガンド−アナライト間の解離を効果的に抑制することができる。
【0024】
なお、ナノ構造体が、一つのナノ構造粒子に対し、一つの第3リガンドを有する形態である場合、第2リガンドに対する結合部位が異なるリガンドを有する2種類以上のナノ構造体を使用することが好ましい。このようなナノ構造体を用いると、アナライトに結合した第2リガンドに、各異なる部位で複数のナノ構造体が結合して、アナライトが解離し難い構造を採ることができる。
【0025】
以下、本発明のSPFSを利用して蛍光量を測定する定量分析方法及び蛍光定量分析用キットについて具体的に説明する。
なお、本発明では、蛍光分析の対象となる物質(主に生体関連物質)を「アナライト」と称し、アナライトと特異的に結合する物質を「第1リガンド及び第2リガンド」と称する。第1リガンドは、アナライトに対して特異的な結合性を有し、SPFSセンサチップ表面にあらかじめ固定化されている分子である。第2リガンドは、アナライトに対して特異的な結合性を有し、蛍光性を有する分子である。
【0026】
そして、ナノ構造体の構成物であり、少なくとも第2リガンドに対して特異的な結合性を有するリガンドを「第3リガンド」と称し、「第3リガンド」の中でも、第1リガンドに対しても特異的な結合性を有するリガンドを「第3リガンド(A)」と称する。
【0027】
〈ナノ構造体〉
本発明に係るナノ構造体は、図1(a)〜(c)に示すように、ナノ構造粒子1、および第2リガンドに特異的に結合する第3リガンド2を有し、該第3リガンド2が該ナノ構造粒子上に固定されてなり、第1リガンドとアナライト間の解離、または第2リガンドとアナライト間の解離を抑制する目的で用いられる。
【0028】
ナノ構造体として、図1(a)は、ナノ構造粒子1に第3リガンド2が一つ固定されてなる態様(ナノ構造体A)、図1(b)は、ナノ構造粒子1に第3リガンド2が二つ固定されてなる態様(ナノ構造体B)、図1(c)は、ナノ構造粒子1に第3リガンド2が四つ固定されてなる態様(ナノ構造体C)を示す。このように、本発明に係るナノ構造体は、一つのナノ構造粒子に対し、1つ以上の第3リガンドが結合しているものであり、好ましい態様としては2つ以上(複数)の第3リガンドが結合しているものである。ナノ構造粒子に結合する第3リガンドの数を2つ以上にするには、例えば、ナノ構造体を作製する際に、単純にナノ構造粒子の数に対し第3リガンドの数を増やして結合させることで可能である。具体的には、ナノ構造粒子に第3リガンドを1つ結合させる場合に比べて、第3リガンドの濃度を高くすることで2つ以上結合させることができる。
【0029】
ナノ構造粒子と第3リガンドとの結合(第3リガンドの固定化)は、物理吸着によるものや化学吸着によるものに限定されない。化学吸着としては、本来の(修飾されていない)第3リガンドがナノ構造粒子と直接反応して結合する場合に限らず、いわゆるリンカー分子、スペーサー分子のように、本来は結合し得ない2つの物質を連結する機能を果たす所定の分子を介してそれらが結合する場合や、ナノ構造粒子(コア)の表面に特定の被覆層(シェル)が形成されていて、第3リガンドがその被覆層と結合する(第3リガンドが被覆層を介してナノ構造粒子に結合する)場合などがあげられる。また、これらの結合が直接的であるか間接的であるかも問わない。後述する蛍光色素と第2リガンドとの結合についても同様である。
【0030】
第3リガンドは、公知の方法に従ってナノ構造粒子上(ナノ構造粒子の表面またはナノ構造粒子の表面に形成された被覆層)に結合し得る(固定され得る)。例えば、ナノ構造粒子上(ナノ構造粒子の表面またはナノ構造粒子の表面に形成された被覆層)に結合する官能基(チオール基、シラノール基等)を一端に有し、もう一端に第3リガンドと結合しうる官能基(アミノ基、カルボキシル基、水酸基等)を有する分子(SAM、シランカップリング剤など)を用いて、第3リガンドをナノ構造粒子上(ナノ構造粒子の表面またはナノ構造粒子の表面に形成された被覆層)に結合させることができる。このような官能基を有する分子であるSAM試薬としては、例えば10−カルボキシ−1−デカンチオール、7−カルボキシ−1−ヘプタンチオール、5−カルボキシ−1−ペンタンチオール、チオセミカルバジド、チオ尿素、チオアセトアミド、チオカルバジド(チオカルボヒドラジド)、11−アミノ−1−ウンデカンチオール、8−アミノ−1−オクタンチオール、6−アミノ−1−ヘキサンチオールが挙げられる。また、シランカップリング剤としては、たとえば(Me)2SiCl−(CH2)m−CO−NHS、2−(3,4−エポキシシクロヘキシル)エチルトリメトキシシラン、3−グリシドキシプロピルトリメトキシシラン、3−グリシドキシプロピルメチルジエトキシシラン、3−グリシドキシプロピルトリエトキシシラン、N−2−(アミノエチル)−3−アミノプロピルメチルジメトキシシラン、N−2−(アミノエチル)−3−アミノプロピルトリメトキシシラン、N−2−(アミノエチル)−3−アミノプロピルトリエトキシシラン、3−アミノプロピルトリメトキシシラン、3−アミノプロピルトリエトキシシランが挙げられる。第3リガンドをナノ構造粒子上に固定するにあたっては、上記のような分子を先に第3リガンドと反応させて第3リガンド誘導体を調製し、得られた第3リガンド誘導体をナノ構造粒子の表面または上記被覆層と反応させてもよいし、また先にナノ構造粒子の表面または上記被覆層と反応させて、そのような分子で表面が修飾されたナノ構造粒子に第3リガンドを反応させてもよい。反応条件を調整することにより、ナノ構造粒子に結合する第3リガンドの数(密度)を増減させることも可能である。
【0031】
〈第3リガンド〉
第3リガンドは、後述する第2リガンドに反応性を有するものであり、好ましくは第1リガンドにも反応性を有する(第2リガンドおよび第1リガンドに特異的に結合する機能を有する)リガンド(第3リガンド(A))である。また、ナノ構造体は、前記ナノ構造粒子上に、第3リガンドとして、第3リガンド(A)が固定されてなることや、前記ナノ構造粒子上に、第3リガンドと、第1リガンドに特異的に結合する第3´リガンドとが固定されてなることが好ましい。本発明の定量分析方法において、このようなナノ構造体を用いる場合、前記工程(a)〜(b)を任意の順でまたは同時に実施して、工程(c)〜(d)を順次実施し、工程(c)において、前記ナノ構造体を前記第2リガンドに接触させるとともに、前記第1リガンドにも接触させて、ナノ構造体に前記第2リガンドおよび第1のリガンドを結合させる工程を実施する。
【0032】
なお、第3リガンドは、少なくとも第2リガンドに反応し得る分子または分子断片であるが、このような「分子」または「分子断片」としては、例えば、核酸(一本鎖であっても二本鎖であってもよいDNA、RNA、ポリヌクレオチド、オリゴヌクレオチド、PNA(ペプチド核酸)等、またはヌクレオシド、ヌクレオチドおよびそれらの修飾分子)、タンパク質(ポリペプチド、オリゴペプチド等)、アミノ酸(修飾アミノ酸も含む。)、糖質(オリゴ糖、多糖類、糖鎖等)、脂質、またはこれらの修飾分子、複合体などが挙げられるが、これらに限定されるものではない。また、上記「タンパク質」としては、例えば、抗体などが挙げられ、具体的には、抗αフェトプロテイン〔AFP〕モノクローナル抗体((株)日本医学臨床検査研究所などから入手可能)、抗ガン胎児性抗原〔CEA〕モノクローナル抗体、抗CA19−9モノクローナル抗体、抗PSAモノクローナル抗体及び抗cTnlモノクローナル抗体などが挙げられる。
【0033】
なお、本明細書において、「抗体」という用語は、ポリクローナル抗体またはモノクローナル抗体、遺伝子組換えにより得られる抗体、および抗体断片を包含する。抗体断片は、例えば、抗体(Fab領域およびFc領域を含む全体)ではなく、Fab、Fab‘、F(ab’)2などの抗原認識部位を有する抗体断片などである。
【0034】
〈ナノ構造粒子〉
本発明に係るナノ構造体の一部を構成するナノ構造粒子は、たとえば、その体積平均粒径が1nm以上、100nm以下の範囲にあるものを指し、その形状及び材質は特に限定されない。好ましくは体積平均粒径が1以上、50nm以下の範囲にあるものであり、上記ナノ構造粒子の大きさの平均が、そのような範囲にあるナノ構造粒子の集団を利用することが好適である。なお、ナノ構造粒子が被覆層を有する場合には、被覆層を含めた大きさが上記の範囲であることを意味する。また、本発明におけるナノ構造粒子は、微細粒子の集合体であってもよい。SPFS法を用いた蛍光量測定では、蛍光色素を励起するため表面プラズモンを用いるが、この表面プラズモンは、後述する金属膜の厚さ、励起波長、誘電体屈折率等の条件によっては、金属膜上200以上、300nm以下の範囲と限られた領域にしか生じないため、ナノ構造粒子の体積平均粒径が100nmを超えてしまうと、蛍光色素からの発光を該ナノ構造粒子が遮光してしまう可能性が高くなり蛍光色素からの蛍光量を測定できず、アナライトの高感度検出には不向きである。上述のナノ構造粒子の体積平均粒径は、例えば、ナノトラック粒度分布測定装置 UPA−EX150(日機装製、動的光散乱法/レーザードップラー法)で測定されたものである。具体的な測定方法としては、ナノ構造粒子が分散された分散液を測定濃度範囲に調整して測定する。その際、あらかじめ分散液の分散溶媒のみでバッククラウンド測定をしておく。この測定法により、本発明で用いられるナノ構造粒子の体積平均粒径範囲を測定することが可能である。
【0035】
形状については、任意の形状のものでよく、例えば、球状、楕円状または円柱状などの形状を有するものも挙げられるが、好ましい形状としては球状である。このように本発明のナノ構造粒子は様々な形状を有するものであり、様々な形状のなか体積平均粒径が1nm以上、100nm以下の範囲にあるものとは、そのナノ構造粒子が取り得る最大の大きさ(長さ)が1nm以上、100nm以下の範囲にあるものを指し、例えばナノ構造粒子が長方体に近いような形状の場合、対角線の長さが1nm以上、100nm以下の範囲にあるものである。上記の体積平均粒径の測定方法は、既存の測定装置等で測定できる。例えば、電子顕微鏡による目視の測定や、粒度分布測定装置により体積粒度分布から体積平均粒子径の測定が挙げられる。ナノ構造粒子に前述の第3リガンドが結合している場合は、第3リガンドを処理してからナノ構造粒子を測定する。処理方法としては、ナノ構造粒子の構造が壊れたり、その特性を失ったりしなければ特に限定はなく、例えば、第3リガンドを酸やアルカリで処理したり、熱をかけて処理したり、あるいは紫外線を照射して処理したりすることができる。
【0036】
材質については、有機物質、無機物質あるいはこれらのハイブリット物質等に限定されないが、好ましくは無機物質であり、無機物質の中でも金属が好ましく用いられる。金属の種類としては、特に限定されるものではないが、金、銀、銅、アルミニウム、白金、亜鉛、またはこれら2種以上の合金が好ましい。また、半導体素材であるCdSeやCdTeといったナノメートル−スケールの結晶から成る物質を用いることもできる。これらの半導体素材は光学特性を改良するため半導体シェル(ZnS) がコーティングされていても良い。
【0037】
さらに、酵素などのタンパク質を用いることもできる。このタンパク質には、アミノ酸 だけからなる単純タンパク質や、核酸 ・リン酸 ・脂質 ・糖・金属 などを含む複合タンパク質 等に限定されない。また、分子の形状も、繊維状タンパク質 や、球状タンパク質 等に限定されるものではない。
【0038】
具体的なナノ構造粒子として好ましく用いられるのは、金属粒子である。金属粒子の場合には、さらに局在プラズモンを誘起させることが可能である。このような金属粒子と第3リガンドを有するナノ構造体を、励起された表面プラズモンの電場増強効果が生じる金属膜から200nm程度の範囲に配置することで、局在プラズモンを誘起させると共にアナライトとリガンドとの解離を抑制することができる。この局在プラズモンは、表面プラズモンによる電場増強効果と合わさることにより、電場増強効果は非常に高くなり、その電場増強効果は、金属粒子が存在しない場合と比べて70倍程度に上る。金属粒子を構成する金属種には、特に制限はないものの、試料等に対する化学的安定性が高く、可視光によりプラズモン共鳴が効率的に発生することから、金、銀、白金等の金属、あるいはこれらの合金が好ましく、その中で、金が特に好ましい。また、この金属粒子を構成する金属は、後述する金属膜を構成する金属と同じでもよく、あるいは異なっていてもよい。
【0039】
このような金属粒子は、様々な粒径を有する金属粒子のコロイド溶液の形態で市販品として入手可能である。あるいは、このような金属粒子を、従来公知の方法、例えば、HAuCl4、H2PtCl4、硝酸銀などの金属化合物の溶液を還元することによって得ることもできる。
【0040】
また、この「コロイド液」中での金属粒子の分散性を向上させ、また、非特異吸着を防止するため、金属粒子の表面にPEG(ポリエチレングリコール)修飾等の表面処理を施すことが望ましい。PEG修飾金属コロイド粒子は、例えば、特開2001−200050号公報および特開2005−328809号公報等に記載されているように、メルカプト基またはポリアミンを有するPEGを金属微粒子と混合することによる調製することができる。あるいは、HAuCl4、H2PtCl4、硝酸銀などの金属化合物の溶液を還元する際に、このような官能基を有するPEGを共存させることにより調製してもよい。
【0041】
また、ナノ構造粒子は、誘電体からなる層で被覆されていてもよい。そのような誘電体層を構成する誘電体としては、たとえばSiO2やデキストランまたはその誘導体(カルボキシメチルデキストラン等)が好適であり、その他の公知の誘電体を用いることもできる。
【0042】
表面に誘電体からなる層が形成されたナノ構造粒子は公知の方法に従って調製することができる。たとえば、ナノ構造粒子または被覆層に結合する官能基(チオール基、シラノール基等)を一端に有し、もう一端にデキストラン等の還元性末端のアルデヒド基等と結合しうる官能基(アミノ基等)を有する分子(いわゆるシランカップリング剤)を用いることにより、デキストラン等でナノ構造粒子表面を修飾することができる。また、SiO2からなる層を有するナノ構造粒子は、ナノ構造粒子を酸性ケイ酸液に添加するなどの方法により調製することができる。
【0043】
〈SPFSを利用するセンサチップ〉
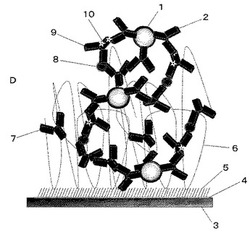
本発明に用いられる、SPFSを利用する蛍光定量分析において、ナノ構造体を用いた際のSPFSセンサチップ(以下、単にセンサチップともいう)の好ましい一態様を模式的に示した概念図を図2に示す。図2に示すように、本発明に用いられるセンサチップDは、透明支持体3上に少なくとも金属膜4、アラライト8と特異的に結合する第1リガンド7を備えている。
【0044】
そして、適宜必要に応じて、自己組織化単分子膜(SAM)5、固相化層6をセンサチップDに備えても良い。
なお、図2に示す固相化層6を形成するカルボキシメチルデキストランは3次元構造を備えるものであるが、デキストラン1本1本がそれぞれ垂直に近い状態で透明支持体3上に固定化されていてもよく、デキストラン等の1本が複数箇所で透明支持体3上に固定化されていてもよく、本発明はいずれの態様にも限定されるものではない。
【0045】
〈透明支持体〉
後述する金属膜への励起光の照射をこの透明支持体を通じて行うため支持体は透明なものを用いる。
【0046】
透明支持体は、本発明の目的が達せられる限り、材質に特に制限はない。例えば、この透明支持体はガラス製であってもよく、また、ポリカーボネート〔PC〕、シクロオレフィンポリマー〔COP〕などのプラスチック製であってもよい。
【0047】
また、透明支持体は、d線(588nm)における屈折率〔nd〕が好ましくは1.40以上、2.20以下であり、厚さが好ましくは0.01mm以上、10mm以下、より好ましくは0.5mm以上、5mm以下である。大きさ(縦×横)は特に限定されない。透明支持体はプリズム形状であっても良い。
【0048】
なお、ガラス製の透明支持体は、市販品として、ショット日本(株)製の「BK7」(屈折率〔nd〕1.52)および「LaSFN9」(屈折率〔nd〕1.85)、(株)住田光学ガラス製の「K−PSFn3」(屈折率〔nd〕1.84)、「K−LaSFn17」(屈折率〔nd〕1.88)および「K−LaSFn22」(屈折率〔nd〕1.90)、ならびに(株)オハラ製の「S−LAL10」(屈折率〔nd〕1.72)などが、光学的特性と洗浄性との観点から好ましい。
【0049】
透明支持体の表面に金属膜を形成する前に、透明支持体の表面を酸および/またはプラズマにより洗浄することが好ましい。
酸による洗浄処理としては、0.001mol/リットル以上、1mol/リットル以下の塩酸中に、1時間以上、3時間以下浸漬することが好ましい。
【0050】
プラズマによる洗浄処理としては、例えば、プラズマドライクリーナー(ヤマト科学(株)製の「PDC200」)中に、0.1分間以上、30分間以下の範囲で浸漬させる方法が挙げられる。
【0051】
〈金属膜〉
センサチップは、上述した透明支持体上に金属膜を備える。金属膜は、光源からの照射光(励起光)により表面プラズモンを発生させる役割を有する。この金属膜は、光源から照射された励起光により表面プラズモンを誘起させ、さらには該表面プラズモンにより後述する蛍光色素を効率的に励起させる役割を有する。
【0052】
上記透明支持体の表面に形成される金属膜の金属としては、金、銀、アルミニウム、銅および白金からなる群から選ばれる少なくとも1種の金属からなることが好ましく、金からなることがより好ましい。また、金属膜は、これらの金属の幾つかの合金からなる形態であってもよく、また金属膜を複数積層したものであってもよい。このような金属種は、酸化に対して安定であり、かつプラズモン共鳴による電場増強が大きくなることから好適である。
【0053】
なお、透明支持体としてガラス製の支持体を用いる場合には、ガラスと上記金属膜とをより強固に接着するために、あらかじめクロム、ニッケルクロム合金またはチタンの薄膜を透明支持体上に形成することが好ましい。
【0054】
透明支持体上に金属膜を形成する方法としては、例えば、スパッタリング法、蒸着法(抵抗加熱蒸着法、電子線蒸着法等)、電解メッキ法、無電解メッキ法などが挙げられる。膜形成条件の調整が容易なことから、スパッタリング法または蒸着法により金属膜を形成することが好ましい。また、あらかじめクロム、ニッケルクロム合金またはチタンの薄膜を透明支持体上に形成する場合も同様である。
【0055】
金属膜の厚さとしては、金の場合5nm以上、500nm以下、銀の場合5nm以上、500nm以下、アルミニウムの場合5nm以上、500nm以下、銅の場合5nm以上、500nm以下、白金の場合5nm以上、500nm以下、およびそれらの合金の場合5nm以上、500nm以下が好ましく、クロムの薄膜の厚さとしては、1nm以上、20nm以下が好ましい。
【0056】
電場増強効果の観点から、金:20nm以上、70nm以下、銀:20nm以上、70nm以下、アルミニウム:10nm以上、50nm以下、銅:20nm以上、70nm以下、白金:20nm以上、70nm以下およびそれらの合金:10nm以上、70nm以下がより好ましく、クロムの薄膜の厚さとしては、1nm以上、3nm以下がより好ましい。金属膜の厚さが上記範囲内であると、表面プラズモンが発生し易いので好適である。また、金属膜の面積(縦×横)は特に限定されない。
【0057】
〈自己組織化単分子膜(SAM)〉
SAM〔Self−Assembled Monolayer;自己組織化単分子膜〕は、後述する固相化層を固相化する足場として、また蛍光測定の際に蛍光分子の金属消光を防止する目的で、上記金属膜の、上記支持体とは接していないもう一方の表面に形成される。
【0058】
SAMを形成する単分子としては、通常、炭素原子数4以上、20以下程度のカルボキシアルカンチオール(例えば、(株)同仁化学研究所、シグマ アルドリッチ ジャパン(株)などから入手可能)、特に好ましくは10−カルボキシ−1−デカンチオールが用いられる。炭素原子数4以上、20以下のカルボキシアルカンチオールは、それを用いて形成されたSAMの光学的な影響が少ない、すなわち透明性が高く、屈折率が低く、膜厚が薄いなどの性質を有していることから好適である。
【0059】
このようなSAMの形成方法としては、特に限定されず、従来公知の方法を用いることができる。具体例として、金属膜が形成された支持体を、10−カルボキシ−1−デカンチオール((株)同仁化学研究所製)を含むエタノール溶液に浸漬する方法などが挙げられる。この場合、10−カルボキシ−1−デカンチオールが有するチオール基が、金属膜の金属と結合して固定化され、金属膜の表面上で自己組織化することにより、SAMが形成される。
【0060】
また、SAMを形成する前に「誘電体からなるスペーサ層」を形成してもよく、この場合、SAMを形成する単分子としては、加水分解でシラノール基〔Si−OH〕を与えるエトキシ基(またはメトキシ基)を有し、一端にアミノ基やグリシジル基、カルボキシル基などの反応基を有するシランカップリング剤であれば特に限定されず、従来公知のシランカップリング剤を用いることができる。
【0061】
このような「誘電体からなるスペーサ層」に用いられる誘電体としては、光学的に透明な各種無機物、天然または合成ポリマーなどを用いることができる。その中で、化学的安定性、製造安定性および光学的透明性に優れていることから、二酸化ケイ素〔SiO2〕、二酸化チタン〔TiO2〕または酸化アルミニウム〔Al2O3〕を含む誘電体を用いることが好ましい。
【0062】
誘電体からなるスペーサ層の厚さは、通常10nm以上、1mm以下であり、共鳴角安定性の観点からは、好ましくは30nm以下、より好ましくは10以上、20nm以下である。一方、電場増強の観点から、好ましくは200nm以上、1mm以下であり、さらに電場増強の効果の安定性から、400nm以上、1,600nm以下がより好ましい。
【0063】
誘電体からなるスペーサ層の形成方法としては、例えば、スパッタリング法、電子線蒸着法、熱蒸着法、ポリシラザン等の材料を用いた化学反応による形成方法、またはスピンコータによる塗布などが挙げられる。
【0064】
〈固相化層〉
固相化層は、上記SAMの、上記金属膜とは接していないもう一方の表面に形成され、2次元構造、好ましくは3次元構造を有するものである。
【0065】
この「3次元構造」とは、後述する第1リガンドの固定化を、「センサチップ」表面(およびその近傍)の2次元に限定することなく、該基板表面から遊離した3次元空間にまで広げられる固相化層の構造をいう。
【0066】
このような固相化層は、グルコース,カルボキシメチル化グルコース,ならびにビニルエステル類,アクリル酸エステル類,メタクリル酸エステル類,オレフィン類,スチレン類,クロトン酸エステル類,イタコン酸ジエステル類,マレイン酸ジエステル類,フマル酸ジエステル類,アリル化合物類,ビニルエーテル類およびビニルケトン類それぞれに包含される単量体からなる群より選択される少なくとも1種の単量体から構成される高分子を含むことが好ましく、デキストランおよびデキストラン誘導体などの親水性高分子ならびにビニルエステル類,アクリル酸エステル類,メタクリル酸エステル類,オレフィン類,スチレン類,クロトン酸エステル類,イタコン酸ジエステル類,マレイン酸ジエステル類,フマル酸ジエステル類,アリル化合物類,ビニルエーテル類およびビニルケトン類それぞれに包含される疎水性単量体から構成される疎水性高分子を含むことがより好ましく、カルボキシメチルデキストラン〔CMD〕などのデキストランが生体親和性、非特異的な吸着反応の抑制性、高い親水性の観点から特に好適である。
【0067】
CMDの分子量は、1kDa以上5,000kDa以下が好ましく、4kDa以上1,000kDaがより好ましい。
固相化層(例えば、デキストランまたはデキストラン誘導体からなるもの)は、その密度として2ng/mm2未満を有することが好ましい。固相化層の密度は、用いる高分子の種類に応じて適宜調整することができる。上記高分子が上記SAMに、このような密度の範囲内で固相化されていると、SPFS用センサチップをアッセイ法に用いた場合に、アッセイのシグナルが安定化し、かつ増加するため好適である。なお、Biacoreライフサイエンス社製「Sensor Chip CM5」の密度は2ng/mm2であった。この密度は、このCM5基板および金膜のみの基板を用いて、Biacoreライフサイエンス社製のSPR測定機器により得られた測定シグナルにおいて、平均2000RUを測定した結果、2ng/mm2と見積もられたものである。
【0068】
固相化層の平均膜厚は、3nm以上80nm以下であることが好ましい。この膜厚は原子間力顕微鏡〔AFM〕などを用いて測定することができる。固相化層の平均膜厚がこのような範囲内であると、SPFS用センサチップをアッセイ法に用いた場合に、アッセイのシグナルが安定化し、かつ増加するため好適である。
【0069】
固相化層の形成方法は、分子量1kDa以上5,000kDa以下の上記高分子を0.01mg/mL以上100mg/mL以下、N−ヒドロキシコハク酸イミド〔NHS〕を0.01mM以上300mM以下及び水溶性カルボジイミド〔WSC〕を0.01mM以上500mM以下含む、pH4.0以上pH6.5以下のMES緩衝生理食塩水(イオン強度:0.1mM以上300mM以下)に、金属膜を有する透明支持体を0.2時間以上3.0時間以下浸漬して形成される。
【0070】
固相化層に含まれる高分子としては、好ましくはカルボキシメチルデキストラン〔CMD〕が用いられる。このような場合、カルボキシメチルデキストランは分子量1kDa以上5,000kDa以下であり、上述したようなカルボキシメチルデキストランを0.01mg/mL以上100mg/mL以下、N−ヒドロキシコハク酸イミド〔NHS〕を0.01mM以上300mM以下及び水溶性カルボジイミド〔WSC〕を0.01mM以上500mM以下含むMES緩衝生理食塩水〔MES〕に、金属膜を有する透明支持体を0.2時間以上3.0時間以下浸漬し、カルボキシメチルデキストランを固定化することができる。
【0071】
このようにして得られた固相化層の密度は、反応点数(SAMの官能基数)、反応溶液のイオン強度およびpH、ならびにカルボキシメチルデキストラン分子のカルボキシル基数に対するWSC濃度によって調整することができる。また固相化層の平均膜厚は、カルボキシメチルデキストランの分子量および反応時間によって適宜調整することができる。
【0072】
〈第1リガンド及び第2リガンド〉
第1リガンドは、検体中の特定のアナライトに特異的に結合して、アナライトを固定(捕捉)する目的で用いられるものを指し、上記固化層または金属膜に固定化される。固相化層が2次元構造の場合、第1リガンドは固層化層の外面に固定化され、固相化層が3次元構造の場合、第1リガンドは固相化層の層中および/または外面に固定化される。固相化層が3次元構造の場合、一般には第1リガンドの多くは固相化層の3次元構造の中に分散して固定化されることが好ましい。リガンドの種類としては、上述した第3リガンドと異なることが望ましい。
【0073】
第2リガンドは、特定のアナライトに特異的に結合するものを指し、蛍光色素を有する(蛍光色素で標識化された)リガンドである。この第2リガンドは、特定のアナライトに蛍光色素による標識化を行う目的で用いられ、リガンドの種類としては、上述した第1リガンドと同じでもよいし、異なっていてもよいが、上述した第3リガンドとは異なることが望ましい。
【0074】
ただし、第1リガンドとして用いる1次抗体がポリクローナル抗体である場合、第2リガンドとして用いる、2次抗体は、モノクローナル抗体であってもポリクローナル抗体であってもよいが、該1次抗体がモノクローナル抗体である場合、2次抗体は、該1次抗体が認識しないエピトープを認識するモノクローナル抗体であるか、またはポリクローナル抗体であることが望ましい。
【0075】
第2リガンドは、蛍光色素と反応させられ、蛍光色素を有するコンジュゲート(蛍光色素を有する第2リガンド)として作製される。蛍光色素を有する第2リガンドの作製方法としては、第2リガンドとして2次抗体を用いる場合、例えば、まず蛍光色素にカルボキシル基を付与し、該カルボキシル基を、水溶性カルボジイミド〔WSC〕(例えば、1−エチル−3−(3−ジメチルアミノプロピル)カルボジイミド塩酸塩〔EDC〕など)とN−ヒドロキシコハク酸イミド〔NHS〕とにより活性エステル化し、次いで活性エステル化したカルボキシル基と2次抗体が有するアミノ基とを水溶性カルボジイミドを用いて脱水反応させ固定化させる方法;イソチオシアネートおよびアミノ基をそれぞれ有する2次抗体および蛍光色素を反応させ固定化する方法;スルホニルハライドおよびアミノ基をそれぞれ有する2次抗体および蛍光色素を反応させ固定化する方法;ヨードアセトアミドおよびチオール基をそれぞれ有する2次抗体および蛍光色素を反応させ固定化する方法;ビオチン化された蛍光色素とストレプトアビジン化された2次抗体(あるいは、ストレプトアビジン化された蛍光色素とビオチン化された2次抗体)とを反応させ固定化する方法などが挙げられる。
【0076】
なお、上記第1リガンドを固定化させた後に、後述する検体等がセンサチップに非特異的に吸着することを防止するため、センサチップの表面を牛血清アルブミン〔BSA〕等のブロッキング剤により処理することが好ましい。
【0077】
上記固相化層に固定化された第1リガンドの密度は、1フェムトmol/cm2以上1ナノmol/cm2以下が好ましく、10フェムトmol/cm2以上100ピコmol/cm2以下がより好ましい。第1リガンドの密度が上記範囲内であると、アッセイ蛍光シグナルの信号強度が大きくなるため好適である。
【0078】
〈アッセイ(アナライトの定量分析方法)〉
本発明のアナライトの定量分析方法は、上述したセンサチップ(透明支持体、該透明支持体上に形成された金属膜、および該金属膜上に固定され、かつアナライトに特異的に結合する第1リガンドを備えたセンサチップ)と、上記第2リガンドの他に、上記ナノ構造体とを用いた、表面プラズモン励起増強蛍光分光法によるアナライトの定量分析方法である。ここで、本発明に係る孔ライトの定量分析方法は、下記工程(a)〜(c)を実施した後に、下記工程(d)を実施することを特徴とし、必要により下記の洗浄工程(1)〜(3)を実施してもよい。
【0079】
工程(a):前記センサチップ上の第1リガンドと前記アナライトとを接触させて、該第1リガンドにアナライトを結合させる工程
工程(b):前記第2リガンドと前記アナライトとを接触させて、該第2リガンドにアナライトを結合させる工程
(c):前記第2リガンドに前記ナノ構造体を接触させて、該第2リガンドにナノ構造体を結合させる工程
(d):前記センサチップの透明支持体を介して前記金属膜に励起光を照射して表面プラズモンを生じさせ、該表面プラズモンにより蛍光色素を励起させて蛍光を生じさせ、該蛍光の蛍光量を測定する工程
洗浄工程(1):上記工程(a)を実施した後、センサチップ内を、洗浄液を用いて洗浄する工程
洗浄工程(2):上記工程(b)を実施した後、センサチップ内を、洗浄液を用いて洗浄する工程
洗浄工程(3):上記工程(c)を実施した後、センサチップ内を、洗浄液を用いて洗浄する工程
【0080】
また、さらに工程(d)の後、該工程(d)で得られた測定結果から、アナライト量を算出する以下の工程(工程(e))を含んでも良い。
工程(e):上記工程(d)で得られた測定結果から、アナライト溶液中に含有されるアナライト量を算出する工程である。
【0081】
[工程(a)]
工程(a)は、前記センサチップ上の第1リガンドと前記アナライトとを接触させて、該第1リガンドにアナライトを結合させる工程である。
【0082】
(アナライト)
本発明において「アナライト」とは、金属膜上の第1リガンドに特異的に認識され(または、第1のリガンドを特異的に認識し)結合し得る分子または分子断片を意味する。このような「分子」または「分子断片」として、例えば、核酸(一本鎖であっても二本鎖であってもよいDNA、RNA、ポリヌクレオチド、オリゴヌクレオチド、PNA(ペプチド核酸)等、またはヌクレオシド、ヌクレオチドおよびそれらの修飾分子)、タンパク質(ポリペプチド、オリゴペプチドを含む)、アミノ酸(修飾アミノ酸も含む)、糖質(オリゴ糖、多糖類、糖鎖等)、脂質、またはこれらの修飾分子、複合体などが挙げられ、具体的には、AFP(αフェトプロテイン)、癌胎児性抗原等の腫瘍マーカー、シグナル伝達物質、ホルモンなどであってもよく、特に限定されるものではない。
このアナライトは、アナライトを含む溶液の形で接触させることが好ましい。
【0083】
(アナライト溶液)
アナライト溶液とは、測定対象となる種々のアナライトを含む溶液をいう。
アナライト溶液としては、アナライトを含む溶液であれば何れでもよいが、例えば、検体が挙げられる。検体としては、例えば、血液(血清・血漿)、尿、鼻孔液、唾液、便、体腔液(髄液、腹水、胸水等)などが挙げられ、所望の溶媒、緩衝液等に適宜希釈して用いてもよい。これら検体のうち、血液、尿、鼻孔液および唾液が好ましい。これらは1種単独で用いてもよく、また、2種以上を併用してもよい。
【0084】
(アナライトの接触)
センサチップには流路が形成されていることが好ましく、流路中の少なくとも一部が透明支持体上に金属膜、金属膜上に第1リガンドを備えた構成とされ、アナライト溶液を前記流路中に送液して第1リガンドがアナライト溶液で浸漬されることにより、アナライトを第1リガンドに接触させる態様であることが好ましい。
【0085】
「流路」の形状は、角筒(管)状であっても丸筒(管)状であってもよく、アナライトと第1リガンド等を結合させ、蛍光測定する反応部・測定部は角筒状であることが好ましく、それ以外の薬液等の送液のみに利用される流路部分は丸筒状であることが好ましい。
【0086】
センサチップの外壁をなす部材、例えば流路基板と流路天板とで構成される場合等、それら部材の反応部・測定部に対応する部分(透明支持体)または流路天板の材料としては、メチルメタクリレート、スチレン等を原料として含有するホモポリマーまたは共重合体;ポリエチレン等のポリオレフィンなどからなり、流路部分はシリコーンゴム、テフロン(登録商標)、ポリエチレン、ポリプロピレン等のポリマーを用いることが好ましい。
【0087】
反応部・測定部においては、アナライトとの接触効率を高め、拡散距離を短くする観点から、流路の断面として、縦と横がそれぞれ100nm以上、1mm以下程度であることが好ましい。
【0088】
センサチップに流路を形成する方法としては、小規模ロット(実験室レベル)では、まず、センサチップの金属膜が形成されている表面側に、流路高さ0.5mmを有するポリジメチルシロキサン〔PDMS〕製シートを該センサチップの金属膜が形成されている部位を囲むようにして圧着し、次に、該ポリジメチルシロキサン〔PDMS〕製シートとセンサチップとをビス等の閉め具により固定する方法が好ましい。
【0089】
工業的に製造される大規模ロット(工場レベル)では、センサチップに流路を形成する方法としては、センサチップに流路基板と流路天板に相当するプラスチックの一体成形品を形成する方法、または別途作製した金属膜が形成された支持体に流路基板を形成し、金属膜表面に(好ましくは誘電体からなるスペーサ層)SAM、固定化層および第1リガンドの固定化を行った後に、流路天板に相当するプラスチックの一体成形品により、流路基板を形成されたセンサチップに蓋をする方法がある。
【0090】
流路に送液するアナライト溶液において、アナライトを希釈するために用いる溶媒としては、例えば、リン酸緩衝生理食塩水〔PBS〕、トリス緩衝生理食塩水〔TBS〕、HEPES緩衝生理食塩水〔HBS〕などが挙げられるが、特に限定されるものではない。
【0091】
第1リガンドに多くのアナライトを補足させるために、送液されたアナライト溶液を流路中に循環させることが好ましいが、その際のアナライト溶液の温度および時間としては、検体の種類などにより異なり、特に限定されるものではないが、通常20℃以上、40℃以下で1分間以上、60分間以下、好ましくは37℃で5分間以上、15分間以下である。
【0092】
アナライト溶液を流路に送液する場合、該アナライト溶液中に含有されるアナライトの初期濃度(送液前の濃度)は、100μg/ml以上、0.001pg/ml以下であってもよい。
【0093】
流路に送液するアナライト溶液の総量は、通常0.001ml以上、20ml以下、好ましくは0.1ml以上、1ml以下である。
また、流路に送液するアナライト溶液の流速は、通常1μL/min以上、5,0000μL/min以下、好ましくは5,000μL/min以上、1,0000μl/min以下である。
【0094】
[洗浄工程]
洗浄工程としては、上記工程(a)を実施した後にセンサチップ内を洗浄液で洗浄する洗浄工程(1)、上記工程(b)を実施した後にセンサチップ内を洗浄液で洗浄する洗浄工程(2)と、上記工程(c)を実施した後にセンサチップ内を洗浄液で洗浄する工程(3)が挙げられる。
【0095】
これら洗浄工程(1)〜(3)の何れかに使用される洗浄液は、例えば、工程(a)〜(c)の何れかの反応で用いられた溶媒または緩衝液と同一種類の溶媒または緩衝液に、Tween20、TritonX100などの界面活性剤を好ましくは0.00001質量%以上、1質量%以下含有するように溶解させたもの、または塩化ナトリウムや塩化カリウムなどの塩を10mM以上、500mM以下含有させたものであることが望ましい。あるいは、低pHの緩衝液、例えば、10mM Glycine HClで、pHが1.5以上、4.0以下のものを洗浄液として用いてもよい。
【0096】
洗浄工程における洗浄液の温度および流速は、上記工程(a)におけるアナライト溶液の送液時の温度および流速と同じであることが好ましい。
洗浄工程(洗浄液による洗浄時間)は、通常0.5分間以上、180分間以下、好ましくは5分間以上、60分間以下である。
【0097】
[工程(b)]
工程(b)は、前記第2リガンドと前記アナライトとを接触させて、該第2リガンドにアナライトを結合させる工程である。工程(b)は、好ましくは上記工程(a)の後、さらに好ましくは上記洗浄工程(1)を経た後に実施される。
【0098】
(蛍光色素)
「蛍光色素(蛍光分子ともいう)」は、所定の励起光を照射することによって、または電界効果を利用して励起することによって蛍光を発光する(表面プラズモンにより励起されて蛍光する)物質の総称であり、該「蛍光」は、燐光など各種の発光も含む。
【0099】
本発明で用いられる蛍光色素は、金属膜による吸光に起因して完全に消光しない限りにおいて、その種類に特に制限はなく、公知の蛍光色素のいずれであってもよい。一般に、単色比色計〔monochromometer〕よりむしろフィルタを備えた蛍光計の使用をも可能にし、かつ検出の効率を高める大きなストークス・シフトを有する蛍光色素が好ましい。
【0100】
このような蛍光色素としては、例えば、フルオレセイン・ファミリーの蛍光色素(Integrated DNA Technologies社製)、ポリハロフルオレセイン・ファミリーの蛍光色素(アプライドバイオシステムズジャパン(株)製)、ヘキサクロロフルオレセイン・ファミリーの蛍光色素(アプライドバイオシステムズジャパン(株)製)、クマリン・ファミリーの蛍光色素(インビトロジェン(株)製)、ローダミン・ファミリーの蛍光色素(GEヘルスケア バイオサイエンス(株)製)、シアニン・ファミリーの蛍光色素、インドカルボシアニン・ファミリーの蛍光色素、オキサジン・ファミリーの蛍光色素、チアジン・ファミリーの蛍光色素、スクアライン・ファミリーの蛍光色素、キレート化ランタニド・ファミリーの蛍光色素、BODIPY(登録商標)・ファミリーの蛍光色素(インビトロジェン(株)製)、ナフタレンスルホン酸・ファミリーの蛍光色素、ピレン・ファミリーの蛍光色素、トリフェニルメタン・ファミリーの蛍光色素、Alexa Fluor(登録商標)色素シリーズ(インビトロジェン(株)製)などが挙げられ、さらに米国特許番号第6,406,297号、同第6,221,604号、同第5,994,063号、同第5,808,044号、同第5,880,287号、同第5,556,959号および同第5,135,717号に記載の蛍光色素を用いることもできる。
【0101】
これらファミリーに含まれる代表的な蛍光色素の吸収波長(nm)および発光波長(nm)を表1に示す。
【0102】
【表1】

また、蛍光色素は、上記有機蛍光色素に限られない。例えば、Eu、Tb等の希土類錯体系の蛍光色素も用いることができる。希土類錯体は、一般的に励起波長(310以上、340nm以下程度)と発光波長(Eu錯体で615nm付近、Tb錯体で545nm付近)との波長差が大きく、蛍光寿命が数百マイクロ秒以上と長い特徴がある。市販されている希土類錯体系の蛍光色素の一例としては、ATBTA−Eu3+が挙げられる。
【0103】
本発明においては、後述する蛍光量の測定を行う際に、金属膜に含まれる金属による吸光の少ない波長領域に最大蛍光波長を有する蛍光色素を用いることが望ましい。例えば、金属膜として金膜を用いる場合には、金膜による吸光による影響を最小限に抑えるため、最大蛍光波長が600nm以上である蛍光色素を使用することが望ましい。したがって、この場合には、Cy5、Alexa Fluor(登録商標)647等近赤外領域に最大蛍光波長を有する蛍光色素を用いることが特に望ましい。このような近赤外領域に最大蛍光波長を有する蛍光色素を用いることは、血液中の血球成分由来の鉄による吸光の影響を最小限に抑えることができる点で、検体として血液を用いる場合においても有用である。一方、金属膜として銀を用いる場合には、最大蛍光波長が400nm以上である蛍光色素を使用することが望ましい。
【0104】
これら蛍光色素は1種単独でも、2種以上併用してもよい。
蛍光色素を有する第2リガンドを含む溶液をセンサチップに送液して反応させる際、送液される該溶液の濃度は、0.001μg/ml以上、10,000μg/ml以下が好ましく、1μg/ml以上、1,000μg/ml以下がより好ましい。
【0105】
この溶液を送液する際の溶液の温度、流速および工程(b)の時間(送液時間)は、それぞれ上記工程(a)の場合と同様である。
【0106】
[工程(c)]
工程(c)は、第2リガンドに上記ナノ構造体を接触させて、該第2リガンドにナノ構造体を結合させる工程である。
【0107】
接触させる方法としては特に限定されず、例えば、上記工程(b)を実施した後、センサチップにナノ構造体を含む溶液(ナノ構造体溶液)を送液して、上記第2リガンドにナノ構造体を接触させる方法、上記工程(b)を実施した後、センサチップに、ナノ構造粒子含む溶液及び第3リガンドを含む溶液を別々に送液する方法が挙げられる。好ましくは上記工程(b)を経たセンサチップにナノ構造体を含む溶液(ナノ構造体溶液)を送液して、上記第2リガンドにナノ構造体を接触させて、該第2リガンドにナノ構造体を結合させることである。
【0108】
このナノ構造体溶液の作製方法としては、例えば、ナノ構造粒子を含む溶液と第3リガンドを含む溶液とを混合してナノ構造粒子と第3リガンドを結合させて作製すること、あるいは、ナノ構造粒子単体(ナノ構造粒子と第3リガンドが初めから結合した単体)を溶液に入れ作製することが挙げられる。ナノ構造体を、ナノ構造粒子を含む溶液と第3リガンドを含む溶液とを混合して作製する場合、各溶液の濃度にもよるが、通常、ナノ構造粒子を含む溶液と第3リガンドを含む溶液とを、ナノ構造粒子の個数:第3リガンドの個数が1:1の割合になるように混合させると、1つのナノ構造粒子に対して、平均1つの第3リガンドが結合したナノ構造体を作製することができる。そして、ナノ構造粒子を含む溶液と第3リガンドを含む溶液とを、例えば、ナノ構造粒子の個数:第3リガンドの個数が1:2以上の割合になるように混合することで、1つのナノ構造粒子に対して、平均2つ以上(複数)の第3リガンドを結合させることができる。該ナノ構造粒子を含む溶液中のナノ構造粒子の濃度は、ナノ構造体粒子の粒径等により適宜異なるが、0.01μg/ml以上、10,000μg/ml以下が好ましく、1μg/ml以上、100μg/ml以下がより好ましい。
【0109】
なお、工程(b)を実施した後のセンサチップに対して、上記洗浄工程(2)を行う方が好ましい。ナノ構造体を含む溶液に用いられる溶媒としては例えば、リン酸緩衝生理食塩水〔PBS〕、トリス緩衝生理食塩水〔TBS〕、HEPES緩衝生理食塩水〔HBS〕などが挙げられるが、特に限定されるものではない。
【0110】
第2リガンドに多くの第3リガンドを結合させるために、好ましくは第2リガンド及び第1リガンドに多くの第3リガンドを結合させるために、送液されたナノ構造体溶液を流路中に循環させることが好ましい。その際のナノ構造体溶液の温度および循環させる時間としては、ナノ構造体の第3リガンドやナノ構造粒子等により異なり、特に限定されるものではないが、例えば、20℃以上、40℃以下で1分間以上、60分間以下、好ましくは30℃以上、38℃以下で5分間以上、15分間以下が挙げられる。
【0111】
流路に送液するナノ構造体溶液の総量は、通常0.001ml以上、20ml以下、好ましくは0.1ml以上、1ml以下である。
また、流路に送液するナノ構造体溶液の流速は、通常1μL/min以上、5,0000μL/min以下、好ましくは5,000μl/min以上、1,0000μl/min以下である。
【0112】
上記第2リガンドとナノ構造体との接触は、詳細には、第2リガンドとナノ構造体の第3リガンド部の接触を指し、例えば、上述の工程(b)で用いる「蛍光色素を有する第2リガンドを含む溶液」にナノ構造体を含有させて該溶液中で行っても良い。また、工程(a)で用いる「アナライト溶液」にナノ構造体を含有させて該溶液中で行っても良い。
【0113】
上述のように、上記第2リガンドとナノ構造体との接触方法は如何なる方法に限定されず、上記第2リガンドとナノ構造体とが接触すれば如何なる方法でも良い。
上記第2リガンドにナノ構造体を接触させた際に、ナノ構造体の第3リガンド部は第2リガンドと反応性を有するため、上記第2リガンドとナノ構造体の第3リガンド部は反応し結合する。このように、第2リガンドと第3リガンドを接触させ結合させることで、アナライト−第1リガンド間、及び/またはアナライト−第2リガンド間の解離を抑制することができる。
【0114】
[工程(d)]
工程(d)は、上記工程(a)、(b)及び(c)を実施した後、センサチップに、上記透明支持体の、上記金属膜を形成していないもう一方の表面から(透明支持体を介して)、励起光を照射し金属膜表面に表面プラズモンを生じさせ、該表面プラズモンにより蛍光色素を励起させて発光を生じさせ、該蛍光の蛍光量を測定する工程である。この工程において、表面プラズモンを生じさせる方法は特に限定されるものではないが、例えば、プリズムを経由してレーザ光(励起光)を照射して表面プラズモンを生じさせる方法等がある。この工程(d)は、上記洗浄工程(3)を経た後のセンサチップに対して行うことが好ましい。
【0115】
(光学系)
蛍光を測定する際に照射される光源は、金属膜に表面プラズモンを生じさせることができるものであれば、特に制限がないものの、波長分布の単一性および光エネルギーの強さの点で、レーザ光(励起光)を光源として用いることが好ましい。レーザ光(励起光)は、光学フィルタを通して、プリズムに入射する直前のエネルギーおよびフォトン量を調節することが望ましい。
【0116】
レーザ光(励起光)の照射により、全反射減衰条件〔ATR〕において、金属膜の表面に表面プラズモンが発生する。表面プラズモンの電場増強効果により、照射したフォトン量の数十倍以上、数百倍以下に増えたフォトンにより蛍光色素を励起する。なお、該電場増強効果によるフォトン増加量は、支持体の屈折率、金属膜の金属種およびその膜厚に依存するが、通常、金では約10倍以上、20倍以下の増加量となる。
【0117】
蛍光色素は、光吸収により分子内の電子が励起され、短時間のうちに第一電子励起状態に移動し、この状態(準位)から基底状態に戻る際、そのエネルギー差に相当する波長の蛍光を発する。
【0118】
励起光として使用される「レーザ光」としては、例えば、波長200nm以上、900nm以下、0.001mW以上、1,000mW以下のLD;波長230nm以上、800nm以下(金属部材に用いる金属種によって共鳴波長が決まる。)、0.01mW以上、100mW以下の半導体レーザなどが挙げられる。
【0119】
「プリズム」は、必要に応じて用いられる光学フィルタ、偏光フィルタ及びカットフィルタ等の各種フィルタを介したレーザ光が、金属膜に効率よく入射されることを目的としており、屈折率が透明支持体と同じであることが好ましい。本発明は、全反射条件を設定できる各種プリズムを適宜選択することができることから、角度、形状に特に制限はなく、例えば、60度分散プリズムなどであってもよい。このようなプリズムの市販品としては、上述した「ガラス製の透明支持体」の市販品と同様のものが挙げられる。本発明の透明支持体がこのプリズムであっても良い。
【0120】
「光学フィルタ」としては、例えば、減光〔ND〕フィルタ、ダイアフラムレンズなどが挙げられる。「減光〔ND〕フィルタ」(または、中性濃度フィルタ)は、入射レーザ光量を調節することを目的とするものである。特に、ダイナミックレンジの狭い検出器を使用するときには精度の高い測定を実施する上で用いることが好ましい。
【0121】
「偏光フィルタ」は、レーザ光を、表面プラズモンを効率よく発生させるP偏光とするために用いられるものである。
「カットフィルタ」は、外光(装置外の照明光)、励起光(励起光の透過成分)、迷光(各所での励起光の散乱成分)、プラズモンの散乱光(励起光を起源とし、センサチップ表面上の構造体または付着物などの影響で発生する散乱光)などの光学ノイズ、および蛍光色素の自家蛍光を除去するフィルタであって、例えば、干渉フィルタ、色フィルタなどが挙げられる。
【0122】
「集光レンズ」は、蛍光量を測定する検出器に、蛍光シグナルを効率よく集光することを目的とするものであり、任意の集光レンズでよい。簡易な集光レンズとして、顕微鏡などで使用されている、市販の対物レンズ(例えば、(株)ニコン製またはオリンパス(株)製等)を転用してもよい。対物レンズの倍率としては、10倍以上、100倍以下が好ましい。
【0123】
「検出器」としては、超高感度の観点からは光電子増倍管(浜松ホトニクス(株)製のフォトマルチプライヤー)が好ましい。また、これらに比べると感度は下がるが、画像として見ることができ、かつノイズ光の除去が容易なことから、多点計測が可能なCCDイメージセンサも好適である。
【0124】
[工程(e)]
工程(e)は、上記工程(d)で得られた測定結果から、アナライト量(たとえば、アナライト溶液中に含まれるアナライト量)を算出(定量)する工程である。
【0125】
より具体的には、工程(e)は、既知濃度のアナライト(たとえば、標的抗原または標的抗体)を用いて、本願発明の定量分析法を実施することで検量線を作成し、作成された検量線に基づいて、工程(d)で得られた測定シグナルから、被測定アナライト溶液中のアナライト(たとえば、標的抗原)量を算出する工程である。
【0126】
[S/N比の算出]
さらに、工程(e)においては、予め上記工程(b)の前に測定した“ブランク発光シグナル”、上記工程(d)で得られた“アッセイ発光シグナル(単にシグナルともいう)”、および何も修飾していない金属基板を流路に固定し、超純水を流しながら測定して得られた“初期ノイズシグナル”を用いて、下記式(1a)で表されるS/N比を算出することができる:
S/N=|Ia/Io|/In (1a)
(上記式(1a)において、Iaはアッセイ発光シグナル、Ioはブランク発光シグナル、Inは初期ノイズシグナルである)。
ただし、S/Nを算出するにあたっては、実用上、上記式(1a)に代えて、アナライト溶液中に含まれるアナライトの濃度が0の場合における“アッセイノイズシグナル(単にノイズともいう)”を基準として、下記式(1b)にしたがって算出してもよい:
S/N=|Ia|/|Ian| (1b)
(上記式(1b)において、Ianはアッセイノイズシグナル、Iaは上記式(1a)の場合と同様にアッセイ発光シグナルである)。
【0127】
〔キット〕
本発明に係る定量分析用キットは、上記センサチップと、上記ナノ構造体と、上記第2リガンドとを含み、表面プラズモン励起増強蛍光分光法によるアナライトの定量分析に用いられることを特徴とする。ここで、本発明の定量分析方法を実施するにあたり、上記のセンサチップ等の他に、アナライト溶液を除き必要とされるすべてのものを含むことが好ましい。
【0128】
たとえば、本発明の定量分析用キットに含まれるものとしては、少なくともセンサチップ(透明支持体上に少なくとも金属膜を有する)、第1リガンドを含む溶液、第2リガンドを含む溶液、およびナノ構造体を含むアナライト解離抑制剤(溶液)である。
【0129】
これら蛍光量測定用キットと、例えば、アラナイト溶液としてアナライトを含む血液または血清と、特定の腫瘍マーカーに対する抗体とを用いることによって、特定の腫瘍マーカーの含有量を、高感度かつ高精度で検出することができる。この結果から、触診などによって検出することができない前臨床期の非浸潤癌(上皮内癌)の存在も高精度で予測することができる。
【0130】
さらに、キット要素として、検量線作成用の標準物質、説明書、多数アナライトの同時処理ができるマイクロタイタープレートなどの必要な器材一式などを含んでもよい。
以上の説明において、本発明の定量分析方法では、工程(d)が工程(a)〜(c)の後に実施する限り、工程(a)〜工程(c)の各工程は、任意の順番で実施してもよく、工程(a)〜工程(c)のうち、2種類の工程または3種類の工程を同時に実施してもよい。
【0131】
本発明の定量分析方法を実施するに当たり、工程(a)〜(b)を任意の順でまたは同時に実施し、工程(c)〜(d)を順次実施することが好ましく、工程(a)〜工程(d)の順番で順次行う方が、各工程を、センサチップを処理対象にして、センサチップに対して順次処理を行うことができ好ましい。
【実施例】
【0132】
次に、本発明について実施例を示してさらに詳細に説明するが、本発明はこれらによって限定されるものではない。
【0133】
(蛍光色素を有する第2リガンド溶液の準備)
第2リガンドとして、抗cTnl IgG2aモノクローナル抗体(4C2;2.5mg/ml、Hytest社製)の溶液とAlexa Fluor(登録商標)647(Molecular Probes社製)標識キットを用い、キット使用方法の手順に従い、室温(25℃)で60分間、攪拌混合することで反応させ、蛍光色素標識された抗体を準備した。
【0134】
最後に、未反応抗体および未反応酵素を、分子量カットフィルタ(日本ミリポア(株)製)を用いて精製することで、Alexa Fluor(登録商標)647標識抗AFPモノクローナル抗体溶液を得た。得られた標識2次抗体(蛍光色素を有する第2リガンド)溶液はタンパク定量後、4℃で保存した。
【0135】
(ナノ構造体溶液の準備)
第3リガンドとして、第2リガンドに結合性を有する抗mouse IgG2aポリクロ―ナル抗体(100μg/ml、(株)ミクリ免疫研究所)100μlと、体積平均粒径8nmの金コロイド(WRGM3;金コロイド液:OD525=12 (株)ワインレッドケミカル)溶液100μlとを混合し抗体を結合させるpHのbufferなどで希釈しpHを調節した後、15分間静置した。その後、混合液(1%牛血清アルブミン(BSA)溶液と1%PEG溶液を9:1の割合で混合した溶液)1mlを第3リガンド及び金コロイド含有溶液100μlに加え、市販の遠心分離機を用いて5000rpmで5分間、遠心分離を行なって上清を取り除いた。さらに、上記混合液2mlを加えて、市販の超音波分散器で約30秒間分散した。再度、遠心分離機を用いて5000rpmで5分間、遠心分離を行って上清を取り除き、ナノ構造体を含む溶液(ナノ構造体溶液)を得た。得られたナノ構造体溶液は4℃で保存した。なお、得られたナノ構造体は、1粒子当たり、平均すると、複数個の第3リガンドが固定されるように調製した。
【0136】
[実施例1]
(センサチップ(A)の製造)
屈折率〔nd〕1.72、厚さ1mmのガラス製の透明支持体((株)オハラ製の「S−LAL 10」)をプラズマ洗浄し、該支持体の片面にクロム薄膜をスパッタリング法により形成した後、その表面にさらに金属膜として金薄膜をスパッタリング法により該透明支持体に形成した。クロム薄膜の厚さは1nm以上、3nm以下、金薄膜の厚さは42nm以上、47nm以下であった。この半値幅(β)は7.6°であった。
【0137】
こうして金属膜が形成された透明支持体を、1mMに調製した10−カルボキシ−1−デカンチオールのエタノール溶液10mlに24時間浸漬し、金薄膜の片面にSAMを形成した。この透明支持体を、該エタノール溶液から取り出し、エタノールおよびイソプロパノールでそれぞれ洗浄した後、エアガンを用いて乾燥させた。
【0138】
続いて、分子量50万のカルボキシメチルデキストラン〔CMD〕を1mg/mlと、N−ヒドロキシコハク酸イミド〔NHS〕を0.5mMと、水溶性カルボジイミド〔WSC〕を1mMとを含むpH7.4のMES緩衝生理食塩水〔MES〕(イオン強度:10mM)にSAMを形成した透明支持体を1時間浸漬し、SAM上に固相化層としてCMDを固定化し、1モル/リットルのNaOH水溶液に30分間浸漬することで未反応のコハク酸エステルを加水分解させた。CMD層の平均膜厚は70nmであり、密度は1.9ng/mm2であった。
【0139】
続いて、NHSを50mM(モル)と、WSCを100mMとを含むMESに1時間浸漬させた後に、抗cTnl IgG1モノクローナル抗体(MF4;2.5μg/ml、Hytest社製)(第1リガンド)溶液に30分間浸漬することで、CMDに1次抗体(第1リガンド)を固定化した。
【0140】
さらに、1質量%の牛血清アルブミン〔BSA〕および1Mのアミノエタノールを含むPBSにて30分間循環送液することで、非特異的吸着防止処理を行なった。
非特異吸着防止処理を行なった第1リガンドが固定化された透明支持体上に、流路高さ0.5mmを有し、かつ適当な形状および大きさを有する穴のあいたポリジメチルシロキサン〔PDMS〕製シートを設け、さらに、このPDMS製シートの周囲にシリコーンゴム製スペーサを配置した(このシリコーンゴム製スペーサは流路に送液する溶液に触れない状態にある)。該PDMS製シートおよび該シリコーンゴム製スペーサの上に、送液導入用の穴および送液排出用の穴を予めそれぞれ形成してあるPMMA基板を、PDMS製シートで囲まれた領域の内側にこれらの穴が位置するように配置した(このとき、抗体を固定化した表面が流路の内側となるように、PMMA基板が配置されている)。これらを流路の外側から圧着し、ビスを用いて、PMMA基板と流路シート(すなわち、前記PDMS製シート)、該流路シートと支持体を固定し、センサチップ(A)を製造した。
【0141】
(アッセイの実施)
上述のように製造したセンサチップ(A)を用いて、以下の工程によりアッセイを実施した。
【0142】
工程(a)として、上述のようにして得られたセンサチップ(A)の流路に、標的抗原(アナライト)としてcTnlを0.1ng/ml含む0.1mlPBS溶液(アナライト溶液)を25分間循環させた。
【0143】
洗浄工程(1)として、工程(a)の後、センサチップ(A)の流路に、Tween20を0.05質量%含むトリス緩衝生理食塩水〔TBS〕を送液させ10分間循環させることによって洗浄した。
【0144】
工程(b)として、洗浄工程(1)の後、センサチップ(A)の流路に、上記で準備した蛍光色素を有する第2リガンド溶液(2μg/mlとなるように調製したPBS溶液)0.1mlを送液させ5分間循環させた。
【0145】
洗浄工程(2)として、工程(b)の後、センサチップ(A)の流路に、Tween20を0.05質量%含むTBSを送液させ10分間循環させることによって洗浄した。
工程(c)として、洗浄工程(2)の後、センサチップ(A)の流路に、上記で準備したナノ構造体溶液(2μg/mlとなるように調製したPBS溶液)0.1mlを送液させ5分間循環させた。
【0146】
工程(d)として、工程(a)、(b)及び(c)を経たセンサチップ(A)の、金属膜を形成していないもう一方の表面から、プリズム(シグマ光機(株)製)を経由してレーザ光(640nm、40μW)を金属膜に照射し表面プラズモンを生じ、この表面プラズモンにより励起された蛍光色素から発光された蛍光量を光電子増倍管〔PMT〕で検出した光量(シグナル値)を計測し「アッセイ発光シグナル」とした。
【0147】
一方、前記工程(a)〜(d)において、上記工程(a)でcTnlを全く含まない(0ng/ml)0.1mlPBS溶液をフローさせた以外は上記と同じ手順で蛍光量を測定し、その測定値を「アッセイノイズシグナル」とした。
【0148】
[実施例2]
上記実施例1において、ナノ構造体溶液を準備する際に、第3リガンドの濃度を100μg/mlから、70μg/mlに変更した以外は同様にして蛍光量を測定した。
【0149】
[実施例3]
上記実施例1において、ナノ構造体溶液を準備する際に、第3リガンドとして、第2リガンドと結合性を有する抗mouse IgG2aポリクロ―ナル抗体(100μg/ml、(株)ミクリ免疫研究所)100μlから、第1リガンド及び第2リガンドと共に結合性を有する抗mouse IgGポリクロ―ナル抗体(50μg/ml、(株)ミクリ免疫研究所)100μlに変更し、該第3リガンドを第2リガンド及び第1リガンドの両方に接触させた以外は同様にして蛍光量を測定した。
【0150】
[実施例4]
上記実施例1において、ナノ構造体溶液を準備する際に、第3リガンドの濃度を100μg/mlから、1μg/mlに変更した以外は同様にして蛍光量を測定した。
【0151】
[実施例5]
上記実施例3において、ナノ構造体溶液を準備する際に、第3リガンドの濃度を20μg/mlから、1.25μg/mlに変更した以外は同様にして蛍光量を測定した。
【0152】
[実施例6]
上記実施例1において、ナノ構造体溶液を準備する際に、第3リガンドの濃度を100μg/mlから、0.85μg/mlに変更した以外は同様にして蛍光量を測定した。
【0153】
[実施例7]
上記実施例1において、ナノ構造体溶液を準備する際に、第3リガンドの濃度を100μg/mlから、10μg/mlに変更し、体積平均粒径8nmの金コロイド(WRGM3;金コロイド液:OD525=12 (株)ワインレッドケミカル)溶液100μlから、体積平均粒径20nmの金コロイド(WRGM2;金コロイド液:OD525=12 (株)ワインレッドケミカル)溶液100μlに変更した以外は同様にして蛍光量を測定した。
【0154】
[実施例8]
上記実施例1において、ナノ構造体溶液を準備する際に、第3リガンドの濃度を100μg/mlから、30μg/mlに変更し、体積平均粒径8nmの金コロイド(WRGM3;金コロイド液:OD525=12 (株)ワインレッドケミカル)溶液100μlから、体積平均粒径40nmの金コロイド(WRGH1;金コロイド液:OD525=12 (株)ワインレッドケミカル)溶液100μlに変更した以外は同様にして蛍光量を測定した。
【0155】
[実施例9]
上記実施例1において、ナノ構造体溶液を準備する際に、第3リガンドの濃度を100μg/mlから、10μg/mlに変更し、体積平均粒径8nmの金コロイド(WRGM3;金コロイド液:OD525=12 (株)ワインレッドケミカル)溶液100μlから、体積平均粒径60nmの金コロイド(WRGH1;金コロイド液:OD525=12 (株)ワインレッドケミカル)溶液100μlに変更した以外は同様にして蛍光量を測定した。
【0156】
[実施例10]
上記実施例1において、ナノ構造体溶液を準備する際に、金コロイド溶液100μlの代わりに、体積平均粒径は20nmのセレン化カドミウムである「Qdot(登録商標) 525 nanocrystals」(インビトロジェン株式会社製)を含む溶液(1μM)100μlを用いた以外は同様にして蛍光量を測定した。
【0157】
[実施例11]
上記実施例1において、ナノ構造体溶液を準備する際に、第3リガンドとして、第2リガンドと結合性を有する抗mouse IgG2aポリクロ―ナル抗体(100μg/ml、(株)ミクリ免疫研究所)100μlから、第1リガンド及び第2リガンドと共に結合性を有する抗mouse IgGポリクロ―ナル抗体(100μg/ml、(株)ミクリ免疫研究所)100μlに変更し、金コロイド溶液の代わりに体積平均粒径20nmのタンパク質を含む溶液(100μg/ml)100μlを用いた以外は同様にして蛍光量を測定した。
【0158】
[実施例12]
上記実施例1において、ナノ構造体溶液を準備する際に、第3リガンドの濃度を100μg/mlから、120μg/mlに変更し、体積平均粒径8nmの金コロイド(WRGM3;金コロイド液:OD525=12 (株)ワインレッドケミカル)溶液100μlから、体積平均粒径60nmのタンパク質を含む溶液(100μg/ml)100μlに変更した以外は同様にして蛍光量を測定した。
【0159】
[比較例1]
上記実施例1において、工程(c)を除いた以外は同様の工程で蛍光量を測定した。すなわち、ナノ構造体溶液は使用していない(送液を行っていない)。
【0160】
[比較例2]
上記実施例1において、ナノ構造対溶液の代わりに、ナノ構造粒子を用いることなく第3リガンドのみ分散させた第3リガンド溶液を以下のようにして準備し、該第3リガンド溶液を使用した以外は同様にして蛍光量を測定した。
【0161】
(第3リガンド溶液の準備)
第3リガンドとして、第2リガンドと反応性を有する抗mouse IgG2aポリクロ―ナル抗体(100μg/ml、(株)ミクリ免疫研究所)溶液を準備した。
【0162】
[ナノ構造粒子体積平均粒径の測定方法]
ナノ構造粒子の体積平均粒径は、ナノ構造体溶液を作製する前のナノ構造粒子溶液をクロロホルム/ヘキサン混合溶媒(体積比:4/6)で10倍に希釈し、動的光散乱式ナノトラック粒度分析計(UPA−EX150、日機装株式会社)を用いて算出した。
【0163】
[アッセイ発光シグナルの評価]
実施例1〜9及び比較例1〜2で実施したそれぞれの蛍光量測定のアッセイ蛍光シグナルに注目し、比較例1のアッセイ発光シグナルを基準として、以下の通り評価した。結果を表1に示した。なお、アッセイノイズシグナルについては、実施例1〜9及び比較例1〜2においてそれぞれ測定したものの、いずれのアッセイノイズシグナルの値にも大差はなかった。また、アッセイ発光シグナルは、工程(d)で得たもので評価したが、工程(c)以降であれば、どのような時に測定したとしても同様の結果が得られる。
【0164】
A:比較例1のアッセイ発光シグナルに比較し1.5倍を超える値である場合
B:比較例1のアッセイ発光シグナルに比較し1.35倍以上、1.5倍未満である値である場合
C:比較例1のアッセイ発光シグナルに比較し1.2倍以上、1.35倍未満である値である場合
D:比較例1のアッセイ発光シグナルに比較し1.05倍以上、1.2倍未満である値である場合
E:比較例1のアッセイ発光シグナルに比較し1.0倍以上、1.05倍未満である値である場合
【0165】
[S/N比のバラつきの評価]
実施例1〜9及び比較例1〜2で実施したそれぞれの蛍光量測定を全く同じ条件にて各々5回ずつ行い、上記アッセイ発光シグナルの評価と同じように、各々5回のアッセイ発光シグナルから該アッセイ発光シグナルの平均及び該アッセイ発光シグナルの標準偏差を求め、変動係数(CV値(%))にて以下の通り評価した。結果を表1に示した。なお、CV値(%)は、下記式に基づいて算出した。
CV値(%)=(アッセイ発光シグナルにおける標準偏差/アッセイ発光シグナルの平均)×100
A:CV値(%)が0以上、8未満である場合
B:CV値(%)が8以上、13未満である場合
C:CV値(%)が13以上、18未満である場合
D:CV値(%)が18以上である場合
【0166】
【表2】

表2から、ナノ構造体を、蛍光色素を有する第2リガンドに接触させた実施例1〜11は、比較例1〜2に比較しアッセイ発光シグナルが高く、蛍光測定時のアッセイ発光シグナルのバラつきが小さいことがわかる。これは、蛍光色素を有する第2リガンドにナノ構造体を接触させたことにより、第1リガンド−アナライト間、あるいは第2リガンド−アナライト間の解離が抑制されたためである。
【0167】
実施例3及び5では、「アッセイ発光シグナル」及び「バラつき」の評価が最も良かった。この理由として、「アッセイ発光シグナル」に関しては、ナノ構造粒子の材質が「金」であり、体積平均粒径が「1nm以上、50nm以下の範囲」であり、第3リガンドの濃度が「1μg/ml以上、100μg/ml以下の範囲」であり、接触が「第1リガンド及び第2リガンド」であるという本発明の最も好ましい形態を満たしているからである。そして、「バラつき」に関しては、第3リガンドの濃度が「1μg/ml以上、100μg/ml以下の範囲」である、及び接触が「第1リガンド及び第2リガンド」であるという好ましい形態を満たしているからである。
【0168】
また、この表2から、リガンド−アナライト間の解離は、第3リガンドの濃度が大きいこと、第1リガンド及び第2リガンドと共に結合性を有する第3リガンドを用いることによりさらに抑制されていることがわかる(バラつきの評価より)。これは、第3リガンドの濃度が大きい方が、一つのナノ構造粒子に結合する第3リガンド数が単純に多くなるため、及び第3リガンドは第2リガンドのみに結合するより第1及び第2リガンドに結合する方がより強固に結合されるため解離がより抑制されるためである。
【0169】
一方、比較例1〜2は、ナノ構造体を用いていないので、リガンド−アナライト間の解離が抑制されず、解離が起こってしまった結果、各蛍光量測定で得られるアッセイ発光シグナルが実施例1〜11に比較し低く、かつ蛍光測定時のアッセイ発光シグナルのバラつきが大きいので安定したアナライトの定量分析ができなかった。これは、比較例ではナノ構造体を用いていないために、各蛍光量測定において第1リガンド−アナライト間、あるいは第2リガンド−アナライト間で解離が起こってしまい、各蛍光量測定が同じ条件で行っているにも関わらず、測定したアッセイ発光シグナルにバラつきが生じてしまった結果である。
【符号の説明】
【0170】
A 一つの第3リガンドを有するナノ構造体
B 二つの第3リガンドを有するナノ構造体
C 四つの第3リガンドを有するナノ構造体
D センサチップ
1 ナノ構造粒子
2 第3リガンド
3 透明支持体
4 金属膜
5 自己組織化単分子膜(SAM)
6 カルボキシメチルデキストラン
7 第1リガンド
8 アナライト
9 第2リガンド
10 蛍光色素
【技術分野】
【0001】
本発明は、表面プラズモン共鳴現象を応用した表面プラズモン励起増強蛍光分光法を用いて蛍光を測定する分析方法ならびにそれに用いられる定量分析用キットおよびアナライト解離抑制剤に関する。
【背景技術】
【0002】
従来から、ナノメートルレベルの微細金属近傍において電子と光が共鳴する現象(表面プラズモン共鳴(SPR;Surface Plasmon Resonance)現象や局在プラズモン共鳴(LPR; Localized Plasmon Resonance))を応用し、例えば生体内の極微少なアナライト(測定対象物)の検出が行われている。例えば、SPR現象を応用した特定のアナライトの検出に用いられる測定としてSPR測定がある。SPR測定は、プリズムなどの誘電体部材上に形成された金などの金属薄膜上においてSPR現象を誘起することで、金属薄膜上の極小さな屈折率変化を測定することを原理としている。例えば、アナライトに特異的に結合するリガンドを金属薄膜上に固定し、該金属薄膜上に特定のアナライトを含んだ試料を供給することで、特定のアナライトのリガンドへの結合によって屈折率変化が誘起され、特定のアナライトの定量分析が可能となる。
【0003】
このようなSPR現象を応用した他の測定として、近年、表面プラズモン励起増強蛍光分光法(SPFS)を利用した測定方法(SPFS測定)が開発されている。このSPFS測定は、励起光と金属薄膜中の電子振動がカップリングすることで形成される増強電場を励起エネルギーとして、リガンドに特異的に結合したアナライトを標識する蛍光色素が発する蛍光を測定する方法である。金属薄膜の極表面に形成される増強電場を利用した蛍光色素の蛍光発光を測定するため、例えば、リガンド−アナライト間の結合等によって増強電場中に配置された蛍光色素からの蛍光シグナルを極めて効率的に測定することが可能で、高いシグナル(S)と低いノイズ(N)に裏付けられた高感度かつ高精度な分析(高いS/N比)により、SPR測定による屈折率変化の測定よりもさらに高精度に特定のアナライトの定量分を行うことができる。
【0004】
このようなSPFSを利用して蛍光量を測定する特定のアナライトの定量分析において、本出願人は、さらに高いS/N比を得るための改良を施した、技術を既に出願している(例えば、特許文献1)。この特許文献1には、金属薄膜上にアナライトと特異的に結合するリガンド(以下、第1リガンドともいう)を備えたセンサに、特定のアナライトを含む溶液を供給して第1リガンドにアナライトを補足させ、アナライトを標識するための蛍光色素を有し且つアナライトと特異的に結合するリガンド(以下、第2リガンドともいう)を含む溶液を供給して第1リガンドと結合されたアナライトに、該アナライトを標識するための蛍光色素を有する第2リガンドを結合させ、その後、金属コロイド粒子を分散させたコロイド液を供給しつつ蛍光色素の蛍光量を測定することで、通常の表面プラズモン共鳴による電場増強効果に、該金属コロイド粒子からの局在プラズモン共鳴による電場増強効果を組み合わせて、通常の表面プラズモン共鳴による蛍光量の測定よりも、さらに蛍光増幅を図り、より高いS/N比を得る高感度かつ高精度にアナライトの定量分析を行う方法が記載されている。
【先行技術文献】
【特許文献】
【0005】
【特許文献1】特開2010−145272号公報
【発明の概要】
【発明が解決しようとする課題】
【0006】
特許文献1に記載の定量分析方法は、SPFSを利用して蛍光量を測定するアナライトの定量分析において、より高いS/N比を得るための一つの手法である。しかしながら、特許文献1には、第1リガンドとアナライトとの結合や該アナライトと第2リガンドとの結合といった、リガンド−アナライト間の結合そのものに関する課題については何ら言及されていない。上記記載の技術のようにリガンド−アナライト間の結合により金属薄膜の極表面に局在化された蛍光色素に基づくアナライトの定量分析においては、リガンド−アナライト間の結合が解離すること(以下、リガンド−アナライト間の解離ともいう)によって一旦は局在化された蛍光色素が分散してしまうといった問題がある。特に、SPFSを利用して蛍光量を測定する定量分析においては、蛍光色素の存在が必須であり、蛍光性を有しないアナライトを分析するにあたっては、金属膜上に設けられ、アナライトと特異的に結合する第1リガンド以外に、該第1リガンドに捕捉されたアナライトを第1リガンドとサンドイッチするような形態でアナライトと特異的に結合する、蛍光色素を有する第2リガンドが多用される。そのため、1つのアナライトに対して、少なくとも二個以上のリガンド(第1リガンド及び第2リガンド)が必要なSPFS測定では、SPR測定よりもリガンド−アナライト間の解離が生じてしまう危険性が高いと言える。
【0007】
このことは特に、精度が要求されるSPFS測定にとって、本来のシグナル(S)を失うことによるS/N比の低下や変動を生じさせる致命的な問題である。このような問題がSPFSを利用して蛍光量を測定する定量分析の汎用を困難にさせている要因の一つとなっていることがわかった。
【0008】
本発明は、上記の点に鑑みてなされたものであり、表面プラズモン励起増強蛍光分光法を利用して蛍光量を測定する定量分析方法において、リガンド−アナライト間の解離を抑制することができ、得られるシグナル(以下、アッセイ発光シグナルともいう)の変動が抑制された高感度且つ高精度な検出を行うことができる定量分析方法、ならびにそれに用いられる定量分析用キット及びアナライト解離抑制剤を提供することを目的とする。
【課題を解決するための手段】
【0009】
本発明に係るアナライトの定量分析方法は、透明支持体、該透明支持体上に形成された金属膜、および該金属膜上に固定され、かつアナライトに特異的に結合する第1リガンドを備えたセンサチップと、表面プラズモンにより励起されて蛍光する蛍光色素を有し、かつ前記アナライトに特異的に結合する第2リガンドと、ナノ構造粒子、および第2リガンドに特異的に結合する第3リガンドを有し、該第3リガンドが該ナノ構造粒子上に固定されてなるナノ構造体とを用いた、表面プラズモン励起増強蛍光分光法によるアナライトの定量分析方法であって、下記工程(a)〜(c)を実施して、下記工程(d)を実施することを特徴とする。
【0010】
工程(a):前記センサチップ上の第1リガンドと前記アナライトとを接触させて、該第1リガンドにアナライトを結合させる工程
工程(b):前記第2リガンドと前記アナライトとを接触させて、該第2リガンドにアナライトを結合させる工程
(c):前記第2リガンドに前記ナノ構造体を接触させて、該第2リガンドにナノ構造体を結合させる工程
(d):前記センサチップの透明支持体を介して前記金属膜に励起光を照射して表面プラズモンを生じさせ、該表面プラズモンにより蛍光色素を励起させて蛍光を生じさせ、該蛍光の蛍光量を測定する工程
【0011】
本発明の定量分析方法において、前記ナノ構造体の体積平均粒径は、1nm以上、50nm以下であることが好ましい。
本発明の定量分析方法において、前記ナノ構造体は、前記ナノ構造粒子上に複数の前記第3リガンドが固定されてなることが好ましい。
【0012】
本発明の定量分析方法において、前記ナノ構造体は、前記ナノ構造粒子上に、前記第2リガンドおよび第1リガンドに特異的に結合する第3リガンド(A)が、および/または、第3リガンドと、第1リガンドに特異的に結合する第3´リガンドとが固定されてなり、前記工程(a)〜(b)を任意の順でまたは同時に実施して、工程(c)〜(d)を順次実施し、工程(c)において、前記ナノ構造体を前記第2リガンドに接触させるとともに、前記第1リガンドにも接触させて、前記ナノ構造体に前記第2リガンドおよび前記第1リガンドを結合させる工程を実施することが好ましい。
【0013】
本発明の定量分析方法において、前記ナノ構造体は、金属で構成されたナノ構造粒子を含むことが好ましい。
本発明の定量分析方法において、前記工程(a)、前記工程(b)及び前記工程(c)を順次実施することが好ましい。
【0014】
本発明の定量分析方法において、前記センサチップが、金属膜上に、さらにカルボキシメチルデキストラン層を備え、前記第1リガンドが該カルボキシメチルデキストラン層に固定化されてなることが好ましい。
【0015】
本発明に係る表面プラズモン励起増強蛍光分光法によるアナライトの定量分析に用いるためのキットは、透明支持体、該透明支持体上に形成された金属膜、および該金属膜上に固定され、かつアナライトに特異的に結合する第1リガンドを備えたセンサチップと、表面プラズモンにより励起されて蛍光する蛍光色素を有し、かつ前記アナライトに特異的に結合する第2リガンドと、ナノ構造粒子、および第2リガンドに特異的に結合する第3リガンドを有し、該第3リガンドが該ナノ構造粒子上に固定されてなるナノ構造体とを含むことを特徴とする。
【0016】
本発明に係るアナライト解離抑制剤は、透明支持体、該透明支持体上に形成された金属膜、および該金属膜上に固定され、かつアナライトに特異的に結合する第1リガンドを備えたセンサチップと、表面プラズモンにより励起されて蛍光する蛍光色素を有し、かつ前記アナライトに特異的に結合する第2リガンドと、ナノ構造粒子、および第2リガンドに特異的に結合する第3リガンドを有し、該第3リガンドが該ナノ構造粒子上に固定されてなるナノ構造体とを用いた、表面プラズモン励起増強蛍光分光法によるアナライトの定量分析方法において、第1リガンドおよび第2リガンドとアナライトとの解離を抑制するために使用され、ナノ構造粒子、および第2リガンドに特異的に結合する第3リガンドを有し、該第3リガンドが該ナノ構造粒子上に固定されてなるナノ構造体を含むことを特徴とする。
【発明の効果】
【0017】
本発明に係る、表面プラズモン励起増強蛍光分光法(SPFS)を利用して蛍光量を測定する定量分析方法は、特定のナノ構造体を用いることで、測定対象物(アナライト)と第1リガンド(アナライトに対して特異的な結合性を有する分子)間の解離や、アナライトと蛍光色素を有する第2リガンド(アナライトに対して特異的な結合性を有する分子)間の解離を抑制することができ、本来の測定されるべきシグナルの変動を抑制することができる。そのため、本発明は、従来よりも高感度且つ高精度な検出を行うことができる定量分析方法、ならびに該定量分析方法に用いられ、高感度且つ高精度な検出を可能にする定量分析用キットおよびアナライト解離抑制剤を提供することができる。
【図面の簡単な説明】
【0018】
【図1】図1は、ナノ構造体を示した図面である。図1(a)は、ナノ構造粒子1粒子あたりに一つの第3リガンドを備えるナノ構造体の形態を示す図面である。図1(b)は、ナノ構造粒子1粒子あたりに二つの第3リガンドを備えるナノ構造体の形態を示す図面である。図1(c)は、ナノ構造粒子1粒子あたりに四つの第3リガンドを備えるナノ構造体の形態を示す図面である。
【図2】図2は、表面プラズモン励起増強蛍光分光法(SPFS)を利用する蛍光定量分析において、ナノ構造体を用いた際のSPFSセンサチップ表面の好ましい一態様を模式的に示した概念図である。
【発明を実施するための形態】
【0019】
本発明は、表面プラズモン励起増強蛍光分光法(SPFS)を利用して蛍光量を測定する定量分析方法において、少なくとも第2リガンドに対して結合性を有する第3リガンドとナノ構造粒子を有するナノ構造体を、該第2リガンドに接触させる工程を有することを特徴とし、好ましくはSPFSセンサチップ表面にあらかじめ固定化されている第1リガンドに対しても結合性を有する第3リガンドとナノ構造粒子を有するナノ構造体を、該第1リガンドにも接触させる工程を有することである。このような工程を有することにより、リガンド−アナライト間の解離を抑制することができる。
【0020】
なお、リガンド−アナライト間の解離抑制とは、第1リガンドとアナライト間の解離抑制、あるいは第2リガンドとアナライト間の解離抑制を指し、ナノ構造体は、少なくともどちらか一方の解離を抑制するものである。
【0021】
また、第3リガンドを有するナノ構造体の好ましい形態としては、一つのナノ構造粒子に対し、二つ以上の(複数の)第3リガンドを有する形態である。このように、一つのナノ構造粒子中の二つ以上の(複数の)第3リガンドを各々、上記工程(C)において、第2リガンドに、好ましくは第2リガンドや第1リガンドに結合させる際に、ナノ構造粒子1粒子中1つの第3リガンドを有する形態に比較して、第3リガンドが上記リガンドに強固に結合するので、効果的に解離を抑制することができる。
【0022】
すなわち、一つのナノ構造粒子に対し二つ以上の第3リガンドが固定されていると、それぞれの第3リガンドが各々異なる第2リガンドに結合することができる。さらには、後述するように、前記ナノ構造体は、前記ナノ構造粒子上に、前記第2リガンドおよび第1リガンドに特異的に結合する第3リガンド(A)が、および/または、第3リガンドと、第1リガンドに特異的に結合する第3´リガンドとが固定されてなる場合、第3リガンド(A)が第2リガンドだけでなく第1リガンドにも結合したり、第3リガンドおよび第3´リガンドがそれぞれ第2リガンドおよび第1リガンドに結合したりすることが可能となる。
【0023】
このような場合、ナノ構造体により第2リガンド−第2リガンド間や第2リガンド−第1リガンド間を架橋する形態となり、リガンド−アナライト間の解離を効果的に抑制することができる。
【0024】
なお、ナノ構造体が、一つのナノ構造粒子に対し、一つの第3リガンドを有する形態である場合、第2リガンドに対する結合部位が異なるリガンドを有する2種類以上のナノ構造体を使用することが好ましい。このようなナノ構造体を用いると、アナライトに結合した第2リガンドに、各異なる部位で複数のナノ構造体が結合して、アナライトが解離し難い構造を採ることができる。
【0025】
以下、本発明のSPFSを利用して蛍光量を測定する定量分析方法及び蛍光定量分析用キットについて具体的に説明する。
なお、本発明では、蛍光分析の対象となる物質(主に生体関連物質)を「アナライト」と称し、アナライトと特異的に結合する物質を「第1リガンド及び第2リガンド」と称する。第1リガンドは、アナライトに対して特異的な結合性を有し、SPFSセンサチップ表面にあらかじめ固定化されている分子である。第2リガンドは、アナライトに対して特異的な結合性を有し、蛍光性を有する分子である。
【0026】
そして、ナノ構造体の構成物であり、少なくとも第2リガンドに対して特異的な結合性を有するリガンドを「第3リガンド」と称し、「第3リガンド」の中でも、第1リガンドに対しても特異的な結合性を有するリガンドを「第3リガンド(A)」と称する。
【0027】
〈ナノ構造体〉
本発明に係るナノ構造体は、図1(a)〜(c)に示すように、ナノ構造粒子1、および第2リガンドに特異的に結合する第3リガンド2を有し、該第3リガンド2が該ナノ構造粒子上に固定されてなり、第1リガンドとアナライト間の解離、または第2リガンドとアナライト間の解離を抑制する目的で用いられる。
【0028】
ナノ構造体として、図1(a)は、ナノ構造粒子1に第3リガンド2が一つ固定されてなる態様(ナノ構造体A)、図1(b)は、ナノ構造粒子1に第3リガンド2が二つ固定されてなる態様(ナノ構造体B)、図1(c)は、ナノ構造粒子1に第3リガンド2が四つ固定されてなる態様(ナノ構造体C)を示す。このように、本発明に係るナノ構造体は、一つのナノ構造粒子に対し、1つ以上の第3リガンドが結合しているものであり、好ましい態様としては2つ以上(複数)の第3リガンドが結合しているものである。ナノ構造粒子に結合する第3リガンドの数を2つ以上にするには、例えば、ナノ構造体を作製する際に、単純にナノ構造粒子の数に対し第3リガンドの数を増やして結合させることで可能である。具体的には、ナノ構造粒子に第3リガンドを1つ結合させる場合に比べて、第3リガンドの濃度を高くすることで2つ以上結合させることができる。
【0029】
ナノ構造粒子と第3リガンドとの結合(第3リガンドの固定化)は、物理吸着によるものや化学吸着によるものに限定されない。化学吸着としては、本来の(修飾されていない)第3リガンドがナノ構造粒子と直接反応して結合する場合に限らず、いわゆるリンカー分子、スペーサー分子のように、本来は結合し得ない2つの物質を連結する機能を果たす所定の分子を介してそれらが結合する場合や、ナノ構造粒子(コア)の表面に特定の被覆層(シェル)が形成されていて、第3リガンドがその被覆層と結合する(第3リガンドが被覆層を介してナノ構造粒子に結合する)場合などがあげられる。また、これらの結合が直接的であるか間接的であるかも問わない。後述する蛍光色素と第2リガンドとの結合についても同様である。
【0030】
第3リガンドは、公知の方法に従ってナノ構造粒子上(ナノ構造粒子の表面またはナノ構造粒子の表面に形成された被覆層)に結合し得る(固定され得る)。例えば、ナノ構造粒子上(ナノ構造粒子の表面またはナノ構造粒子の表面に形成された被覆層)に結合する官能基(チオール基、シラノール基等)を一端に有し、もう一端に第3リガンドと結合しうる官能基(アミノ基、カルボキシル基、水酸基等)を有する分子(SAM、シランカップリング剤など)を用いて、第3リガンドをナノ構造粒子上(ナノ構造粒子の表面またはナノ構造粒子の表面に形成された被覆層)に結合させることができる。このような官能基を有する分子であるSAM試薬としては、例えば10−カルボキシ−1−デカンチオール、7−カルボキシ−1−ヘプタンチオール、5−カルボキシ−1−ペンタンチオール、チオセミカルバジド、チオ尿素、チオアセトアミド、チオカルバジド(チオカルボヒドラジド)、11−アミノ−1−ウンデカンチオール、8−アミノ−1−オクタンチオール、6−アミノ−1−ヘキサンチオールが挙げられる。また、シランカップリング剤としては、たとえば(Me)2SiCl−(CH2)m−CO−NHS、2−(3,4−エポキシシクロヘキシル)エチルトリメトキシシラン、3−グリシドキシプロピルトリメトキシシラン、3−グリシドキシプロピルメチルジエトキシシラン、3−グリシドキシプロピルトリエトキシシラン、N−2−(アミノエチル)−3−アミノプロピルメチルジメトキシシラン、N−2−(アミノエチル)−3−アミノプロピルトリメトキシシラン、N−2−(アミノエチル)−3−アミノプロピルトリエトキシシラン、3−アミノプロピルトリメトキシシラン、3−アミノプロピルトリエトキシシランが挙げられる。第3リガンドをナノ構造粒子上に固定するにあたっては、上記のような分子を先に第3リガンドと反応させて第3リガンド誘導体を調製し、得られた第3リガンド誘導体をナノ構造粒子の表面または上記被覆層と反応させてもよいし、また先にナノ構造粒子の表面または上記被覆層と反応させて、そのような分子で表面が修飾されたナノ構造粒子に第3リガンドを反応させてもよい。反応条件を調整することにより、ナノ構造粒子に結合する第3リガンドの数(密度)を増減させることも可能である。
【0031】
〈第3リガンド〉
第3リガンドは、後述する第2リガンドに反応性を有するものであり、好ましくは第1リガンドにも反応性を有する(第2リガンドおよび第1リガンドに特異的に結合する機能を有する)リガンド(第3リガンド(A))である。また、ナノ構造体は、前記ナノ構造粒子上に、第3リガンドとして、第3リガンド(A)が固定されてなることや、前記ナノ構造粒子上に、第3リガンドと、第1リガンドに特異的に結合する第3´リガンドとが固定されてなることが好ましい。本発明の定量分析方法において、このようなナノ構造体を用いる場合、前記工程(a)〜(b)を任意の順でまたは同時に実施して、工程(c)〜(d)を順次実施し、工程(c)において、前記ナノ構造体を前記第2リガンドに接触させるとともに、前記第1リガンドにも接触させて、ナノ構造体に前記第2リガンドおよび第1のリガンドを結合させる工程を実施する。
【0032】
なお、第3リガンドは、少なくとも第2リガンドに反応し得る分子または分子断片であるが、このような「分子」または「分子断片」としては、例えば、核酸(一本鎖であっても二本鎖であってもよいDNA、RNA、ポリヌクレオチド、オリゴヌクレオチド、PNA(ペプチド核酸)等、またはヌクレオシド、ヌクレオチドおよびそれらの修飾分子)、タンパク質(ポリペプチド、オリゴペプチド等)、アミノ酸(修飾アミノ酸も含む。)、糖質(オリゴ糖、多糖類、糖鎖等)、脂質、またはこれらの修飾分子、複合体などが挙げられるが、これらに限定されるものではない。また、上記「タンパク質」としては、例えば、抗体などが挙げられ、具体的には、抗αフェトプロテイン〔AFP〕モノクローナル抗体((株)日本医学臨床検査研究所などから入手可能)、抗ガン胎児性抗原〔CEA〕モノクローナル抗体、抗CA19−9モノクローナル抗体、抗PSAモノクローナル抗体及び抗cTnlモノクローナル抗体などが挙げられる。
【0033】
なお、本明細書において、「抗体」という用語は、ポリクローナル抗体またはモノクローナル抗体、遺伝子組換えにより得られる抗体、および抗体断片を包含する。抗体断片は、例えば、抗体(Fab領域およびFc領域を含む全体)ではなく、Fab、Fab‘、F(ab’)2などの抗原認識部位を有する抗体断片などである。
【0034】
〈ナノ構造粒子〉
本発明に係るナノ構造体の一部を構成するナノ構造粒子は、たとえば、その体積平均粒径が1nm以上、100nm以下の範囲にあるものを指し、その形状及び材質は特に限定されない。好ましくは体積平均粒径が1以上、50nm以下の範囲にあるものであり、上記ナノ構造粒子の大きさの平均が、そのような範囲にあるナノ構造粒子の集団を利用することが好適である。なお、ナノ構造粒子が被覆層を有する場合には、被覆層を含めた大きさが上記の範囲であることを意味する。また、本発明におけるナノ構造粒子は、微細粒子の集合体であってもよい。SPFS法を用いた蛍光量測定では、蛍光色素を励起するため表面プラズモンを用いるが、この表面プラズモンは、後述する金属膜の厚さ、励起波長、誘電体屈折率等の条件によっては、金属膜上200以上、300nm以下の範囲と限られた領域にしか生じないため、ナノ構造粒子の体積平均粒径が100nmを超えてしまうと、蛍光色素からの発光を該ナノ構造粒子が遮光してしまう可能性が高くなり蛍光色素からの蛍光量を測定できず、アナライトの高感度検出には不向きである。上述のナノ構造粒子の体積平均粒径は、例えば、ナノトラック粒度分布測定装置 UPA−EX150(日機装製、動的光散乱法/レーザードップラー法)で測定されたものである。具体的な測定方法としては、ナノ構造粒子が分散された分散液を測定濃度範囲に調整して測定する。その際、あらかじめ分散液の分散溶媒のみでバッククラウンド測定をしておく。この測定法により、本発明で用いられるナノ構造粒子の体積平均粒径範囲を測定することが可能である。
【0035】
形状については、任意の形状のものでよく、例えば、球状、楕円状または円柱状などの形状を有するものも挙げられるが、好ましい形状としては球状である。このように本発明のナノ構造粒子は様々な形状を有するものであり、様々な形状のなか体積平均粒径が1nm以上、100nm以下の範囲にあるものとは、そのナノ構造粒子が取り得る最大の大きさ(長さ)が1nm以上、100nm以下の範囲にあるものを指し、例えばナノ構造粒子が長方体に近いような形状の場合、対角線の長さが1nm以上、100nm以下の範囲にあるものである。上記の体積平均粒径の測定方法は、既存の測定装置等で測定できる。例えば、電子顕微鏡による目視の測定や、粒度分布測定装置により体積粒度分布から体積平均粒子径の測定が挙げられる。ナノ構造粒子に前述の第3リガンドが結合している場合は、第3リガンドを処理してからナノ構造粒子を測定する。処理方法としては、ナノ構造粒子の構造が壊れたり、その特性を失ったりしなければ特に限定はなく、例えば、第3リガンドを酸やアルカリで処理したり、熱をかけて処理したり、あるいは紫外線を照射して処理したりすることができる。
【0036】
材質については、有機物質、無機物質あるいはこれらのハイブリット物質等に限定されないが、好ましくは無機物質であり、無機物質の中でも金属が好ましく用いられる。金属の種類としては、特に限定されるものではないが、金、銀、銅、アルミニウム、白金、亜鉛、またはこれら2種以上の合金が好ましい。また、半導体素材であるCdSeやCdTeといったナノメートル−スケールの結晶から成る物質を用いることもできる。これらの半導体素材は光学特性を改良するため半導体シェル(ZnS) がコーティングされていても良い。
【0037】
さらに、酵素などのタンパク質を用いることもできる。このタンパク質には、アミノ酸 だけからなる単純タンパク質や、核酸 ・リン酸 ・脂質 ・糖・金属 などを含む複合タンパク質 等に限定されない。また、分子の形状も、繊維状タンパク質 や、球状タンパク質 等に限定されるものではない。
【0038】
具体的なナノ構造粒子として好ましく用いられるのは、金属粒子である。金属粒子の場合には、さらに局在プラズモンを誘起させることが可能である。このような金属粒子と第3リガンドを有するナノ構造体を、励起された表面プラズモンの電場増強効果が生じる金属膜から200nm程度の範囲に配置することで、局在プラズモンを誘起させると共にアナライトとリガンドとの解離を抑制することができる。この局在プラズモンは、表面プラズモンによる電場増強効果と合わさることにより、電場増強効果は非常に高くなり、その電場増強効果は、金属粒子が存在しない場合と比べて70倍程度に上る。金属粒子を構成する金属種には、特に制限はないものの、試料等に対する化学的安定性が高く、可視光によりプラズモン共鳴が効率的に発生することから、金、銀、白金等の金属、あるいはこれらの合金が好ましく、その中で、金が特に好ましい。また、この金属粒子を構成する金属は、後述する金属膜を構成する金属と同じでもよく、あるいは異なっていてもよい。
【0039】
このような金属粒子は、様々な粒径を有する金属粒子のコロイド溶液の形態で市販品として入手可能である。あるいは、このような金属粒子を、従来公知の方法、例えば、HAuCl4、H2PtCl4、硝酸銀などの金属化合物の溶液を還元することによって得ることもできる。
【0040】
また、この「コロイド液」中での金属粒子の分散性を向上させ、また、非特異吸着を防止するため、金属粒子の表面にPEG(ポリエチレングリコール)修飾等の表面処理を施すことが望ましい。PEG修飾金属コロイド粒子は、例えば、特開2001−200050号公報および特開2005−328809号公報等に記載されているように、メルカプト基またはポリアミンを有するPEGを金属微粒子と混合することによる調製することができる。あるいは、HAuCl4、H2PtCl4、硝酸銀などの金属化合物の溶液を還元する際に、このような官能基を有するPEGを共存させることにより調製してもよい。
【0041】
また、ナノ構造粒子は、誘電体からなる層で被覆されていてもよい。そのような誘電体層を構成する誘電体としては、たとえばSiO2やデキストランまたはその誘導体(カルボキシメチルデキストラン等)が好適であり、その他の公知の誘電体を用いることもできる。
【0042】
表面に誘電体からなる層が形成されたナノ構造粒子は公知の方法に従って調製することができる。たとえば、ナノ構造粒子または被覆層に結合する官能基(チオール基、シラノール基等)を一端に有し、もう一端にデキストラン等の還元性末端のアルデヒド基等と結合しうる官能基(アミノ基等)を有する分子(いわゆるシランカップリング剤)を用いることにより、デキストラン等でナノ構造粒子表面を修飾することができる。また、SiO2からなる層を有するナノ構造粒子は、ナノ構造粒子を酸性ケイ酸液に添加するなどの方法により調製することができる。
【0043】
〈SPFSを利用するセンサチップ〉
本発明に用いられる、SPFSを利用する蛍光定量分析において、ナノ構造体を用いた際のSPFSセンサチップ(以下、単にセンサチップともいう)の好ましい一態様を模式的に示した概念図を図2に示す。図2に示すように、本発明に用いられるセンサチップDは、透明支持体3上に少なくとも金属膜4、アラライト8と特異的に結合する第1リガンド7を備えている。
【0044】
そして、適宜必要に応じて、自己組織化単分子膜(SAM)5、固相化層6をセンサチップDに備えても良い。
なお、図2に示す固相化層6を形成するカルボキシメチルデキストランは3次元構造を備えるものであるが、デキストラン1本1本がそれぞれ垂直に近い状態で透明支持体3上に固定化されていてもよく、デキストラン等の1本が複数箇所で透明支持体3上に固定化されていてもよく、本発明はいずれの態様にも限定されるものではない。
【0045】
〈透明支持体〉
後述する金属膜への励起光の照射をこの透明支持体を通じて行うため支持体は透明なものを用いる。
【0046】
透明支持体は、本発明の目的が達せられる限り、材質に特に制限はない。例えば、この透明支持体はガラス製であってもよく、また、ポリカーボネート〔PC〕、シクロオレフィンポリマー〔COP〕などのプラスチック製であってもよい。
【0047】
また、透明支持体は、d線(588nm)における屈折率〔nd〕が好ましくは1.40以上、2.20以下であり、厚さが好ましくは0.01mm以上、10mm以下、より好ましくは0.5mm以上、5mm以下である。大きさ(縦×横)は特に限定されない。透明支持体はプリズム形状であっても良い。
【0048】
なお、ガラス製の透明支持体は、市販品として、ショット日本(株)製の「BK7」(屈折率〔nd〕1.52)および「LaSFN9」(屈折率〔nd〕1.85)、(株)住田光学ガラス製の「K−PSFn3」(屈折率〔nd〕1.84)、「K−LaSFn17」(屈折率〔nd〕1.88)および「K−LaSFn22」(屈折率〔nd〕1.90)、ならびに(株)オハラ製の「S−LAL10」(屈折率〔nd〕1.72)などが、光学的特性と洗浄性との観点から好ましい。
【0049】
透明支持体の表面に金属膜を形成する前に、透明支持体の表面を酸および/またはプラズマにより洗浄することが好ましい。
酸による洗浄処理としては、0.001mol/リットル以上、1mol/リットル以下の塩酸中に、1時間以上、3時間以下浸漬することが好ましい。
【0050】
プラズマによる洗浄処理としては、例えば、プラズマドライクリーナー(ヤマト科学(株)製の「PDC200」)中に、0.1分間以上、30分間以下の範囲で浸漬させる方法が挙げられる。
【0051】
〈金属膜〉
センサチップは、上述した透明支持体上に金属膜を備える。金属膜は、光源からの照射光(励起光)により表面プラズモンを発生させる役割を有する。この金属膜は、光源から照射された励起光により表面プラズモンを誘起させ、さらには該表面プラズモンにより後述する蛍光色素を効率的に励起させる役割を有する。
【0052】
上記透明支持体の表面に形成される金属膜の金属としては、金、銀、アルミニウム、銅および白金からなる群から選ばれる少なくとも1種の金属からなることが好ましく、金からなることがより好ましい。また、金属膜は、これらの金属の幾つかの合金からなる形態であってもよく、また金属膜を複数積層したものであってもよい。このような金属種は、酸化に対して安定であり、かつプラズモン共鳴による電場増強が大きくなることから好適である。
【0053】
なお、透明支持体としてガラス製の支持体を用いる場合には、ガラスと上記金属膜とをより強固に接着するために、あらかじめクロム、ニッケルクロム合金またはチタンの薄膜を透明支持体上に形成することが好ましい。
【0054】
透明支持体上に金属膜を形成する方法としては、例えば、スパッタリング法、蒸着法(抵抗加熱蒸着法、電子線蒸着法等)、電解メッキ法、無電解メッキ法などが挙げられる。膜形成条件の調整が容易なことから、スパッタリング法または蒸着法により金属膜を形成することが好ましい。また、あらかじめクロム、ニッケルクロム合金またはチタンの薄膜を透明支持体上に形成する場合も同様である。
【0055】
金属膜の厚さとしては、金の場合5nm以上、500nm以下、銀の場合5nm以上、500nm以下、アルミニウムの場合5nm以上、500nm以下、銅の場合5nm以上、500nm以下、白金の場合5nm以上、500nm以下、およびそれらの合金の場合5nm以上、500nm以下が好ましく、クロムの薄膜の厚さとしては、1nm以上、20nm以下が好ましい。
【0056】
電場増強効果の観点から、金:20nm以上、70nm以下、銀:20nm以上、70nm以下、アルミニウム:10nm以上、50nm以下、銅:20nm以上、70nm以下、白金:20nm以上、70nm以下およびそれらの合金:10nm以上、70nm以下がより好ましく、クロムの薄膜の厚さとしては、1nm以上、3nm以下がより好ましい。金属膜の厚さが上記範囲内であると、表面プラズモンが発生し易いので好適である。また、金属膜の面積(縦×横)は特に限定されない。
【0057】
〈自己組織化単分子膜(SAM)〉
SAM〔Self−Assembled Monolayer;自己組織化単分子膜〕は、後述する固相化層を固相化する足場として、また蛍光測定の際に蛍光分子の金属消光を防止する目的で、上記金属膜の、上記支持体とは接していないもう一方の表面に形成される。
【0058】
SAMを形成する単分子としては、通常、炭素原子数4以上、20以下程度のカルボキシアルカンチオール(例えば、(株)同仁化学研究所、シグマ アルドリッチ ジャパン(株)などから入手可能)、特に好ましくは10−カルボキシ−1−デカンチオールが用いられる。炭素原子数4以上、20以下のカルボキシアルカンチオールは、それを用いて形成されたSAMの光学的な影響が少ない、すなわち透明性が高く、屈折率が低く、膜厚が薄いなどの性質を有していることから好適である。
【0059】
このようなSAMの形成方法としては、特に限定されず、従来公知の方法を用いることができる。具体例として、金属膜が形成された支持体を、10−カルボキシ−1−デカンチオール((株)同仁化学研究所製)を含むエタノール溶液に浸漬する方法などが挙げられる。この場合、10−カルボキシ−1−デカンチオールが有するチオール基が、金属膜の金属と結合して固定化され、金属膜の表面上で自己組織化することにより、SAMが形成される。
【0060】
また、SAMを形成する前に「誘電体からなるスペーサ層」を形成してもよく、この場合、SAMを形成する単分子としては、加水分解でシラノール基〔Si−OH〕を与えるエトキシ基(またはメトキシ基)を有し、一端にアミノ基やグリシジル基、カルボキシル基などの反応基を有するシランカップリング剤であれば特に限定されず、従来公知のシランカップリング剤を用いることができる。
【0061】
このような「誘電体からなるスペーサ層」に用いられる誘電体としては、光学的に透明な各種無機物、天然または合成ポリマーなどを用いることができる。その中で、化学的安定性、製造安定性および光学的透明性に優れていることから、二酸化ケイ素〔SiO2〕、二酸化チタン〔TiO2〕または酸化アルミニウム〔Al2O3〕を含む誘電体を用いることが好ましい。
【0062】
誘電体からなるスペーサ層の厚さは、通常10nm以上、1mm以下であり、共鳴角安定性の観点からは、好ましくは30nm以下、より好ましくは10以上、20nm以下である。一方、電場増強の観点から、好ましくは200nm以上、1mm以下であり、さらに電場増強の効果の安定性から、400nm以上、1,600nm以下がより好ましい。
【0063】
誘電体からなるスペーサ層の形成方法としては、例えば、スパッタリング法、電子線蒸着法、熱蒸着法、ポリシラザン等の材料を用いた化学反応による形成方法、またはスピンコータによる塗布などが挙げられる。
【0064】
〈固相化層〉
固相化層は、上記SAMの、上記金属膜とは接していないもう一方の表面に形成され、2次元構造、好ましくは3次元構造を有するものである。
【0065】
この「3次元構造」とは、後述する第1リガンドの固定化を、「センサチップ」表面(およびその近傍)の2次元に限定することなく、該基板表面から遊離した3次元空間にまで広げられる固相化層の構造をいう。
【0066】
このような固相化層は、グルコース,カルボキシメチル化グルコース,ならびにビニルエステル類,アクリル酸エステル類,メタクリル酸エステル類,オレフィン類,スチレン類,クロトン酸エステル類,イタコン酸ジエステル類,マレイン酸ジエステル類,フマル酸ジエステル類,アリル化合物類,ビニルエーテル類およびビニルケトン類それぞれに包含される単量体からなる群より選択される少なくとも1種の単量体から構成される高分子を含むことが好ましく、デキストランおよびデキストラン誘導体などの親水性高分子ならびにビニルエステル類,アクリル酸エステル類,メタクリル酸エステル類,オレフィン類,スチレン類,クロトン酸エステル類,イタコン酸ジエステル類,マレイン酸ジエステル類,フマル酸ジエステル類,アリル化合物類,ビニルエーテル類およびビニルケトン類それぞれに包含される疎水性単量体から構成される疎水性高分子を含むことがより好ましく、カルボキシメチルデキストラン〔CMD〕などのデキストランが生体親和性、非特異的な吸着反応の抑制性、高い親水性の観点から特に好適である。
【0067】
CMDの分子量は、1kDa以上5,000kDa以下が好ましく、4kDa以上1,000kDaがより好ましい。
固相化層(例えば、デキストランまたはデキストラン誘導体からなるもの)は、その密度として2ng/mm2未満を有することが好ましい。固相化層の密度は、用いる高分子の種類に応じて適宜調整することができる。上記高分子が上記SAMに、このような密度の範囲内で固相化されていると、SPFS用センサチップをアッセイ法に用いた場合に、アッセイのシグナルが安定化し、かつ増加するため好適である。なお、Biacoreライフサイエンス社製「Sensor Chip CM5」の密度は2ng/mm2であった。この密度は、このCM5基板および金膜のみの基板を用いて、Biacoreライフサイエンス社製のSPR測定機器により得られた測定シグナルにおいて、平均2000RUを測定した結果、2ng/mm2と見積もられたものである。
【0068】
固相化層の平均膜厚は、3nm以上80nm以下であることが好ましい。この膜厚は原子間力顕微鏡〔AFM〕などを用いて測定することができる。固相化層の平均膜厚がこのような範囲内であると、SPFS用センサチップをアッセイ法に用いた場合に、アッセイのシグナルが安定化し、かつ増加するため好適である。
【0069】
固相化層の形成方法は、分子量1kDa以上5,000kDa以下の上記高分子を0.01mg/mL以上100mg/mL以下、N−ヒドロキシコハク酸イミド〔NHS〕を0.01mM以上300mM以下及び水溶性カルボジイミド〔WSC〕を0.01mM以上500mM以下含む、pH4.0以上pH6.5以下のMES緩衝生理食塩水(イオン強度:0.1mM以上300mM以下)に、金属膜を有する透明支持体を0.2時間以上3.0時間以下浸漬して形成される。
【0070】
固相化層に含まれる高分子としては、好ましくはカルボキシメチルデキストラン〔CMD〕が用いられる。このような場合、カルボキシメチルデキストランは分子量1kDa以上5,000kDa以下であり、上述したようなカルボキシメチルデキストランを0.01mg/mL以上100mg/mL以下、N−ヒドロキシコハク酸イミド〔NHS〕を0.01mM以上300mM以下及び水溶性カルボジイミド〔WSC〕を0.01mM以上500mM以下含むMES緩衝生理食塩水〔MES〕に、金属膜を有する透明支持体を0.2時間以上3.0時間以下浸漬し、カルボキシメチルデキストランを固定化することができる。
【0071】
このようにして得られた固相化層の密度は、反応点数(SAMの官能基数)、反応溶液のイオン強度およびpH、ならびにカルボキシメチルデキストラン分子のカルボキシル基数に対するWSC濃度によって調整することができる。また固相化層の平均膜厚は、カルボキシメチルデキストランの分子量および反応時間によって適宜調整することができる。
【0072】
〈第1リガンド及び第2リガンド〉
第1リガンドは、検体中の特定のアナライトに特異的に結合して、アナライトを固定(捕捉)する目的で用いられるものを指し、上記固化層または金属膜に固定化される。固相化層が2次元構造の場合、第1リガンドは固層化層の外面に固定化され、固相化層が3次元構造の場合、第1リガンドは固相化層の層中および/または外面に固定化される。固相化層が3次元構造の場合、一般には第1リガンドの多くは固相化層の3次元構造の中に分散して固定化されることが好ましい。リガンドの種類としては、上述した第3リガンドと異なることが望ましい。
【0073】
第2リガンドは、特定のアナライトに特異的に結合するものを指し、蛍光色素を有する(蛍光色素で標識化された)リガンドである。この第2リガンドは、特定のアナライトに蛍光色素による標識化を行う目的で用いられ、リガンドの種類としては、上述した第1リガンドと同じでもよいし、異なっていてもよいが、上述した第3リガンドとは異なることが望ましい。
【0074】
ただし、第1リガンドとして用いる1次抗体がポリクローナル抗体である場合、第2リガンドとして用いる、2次抗体は、モノクローナル抗体であってもポリクローナル抗体であってもよいが、該1次抗体がモノクローナル抗体である場合、2次抗体は、該1次抗体が認識しないエピトープを認識するモノクローナル抗体であるか、またはポリクローナル抗体であることが望ましい。
【0075】
第2リガンドは、蛍光色素と反応させられ、蛍光色素を有するコンジュゲート(蛍光色素を有する第2リガンド)として作製される。蛍光色素を有する第2リガンドの作製方法としては、第2リガンドとして2次抗体を用いる場合、例えば、まず蛍光色素にカルボキシル基を付与し、該カルボキシル基を、水溶性カルボジイミド〔WSC〕(例えば、1−エチル−3−(3−ジメチルアミノプロピル)カルボジイミド塩酸塩〔EDC〕など)とN−ヒドロキシコハク酸イミド〔NHS〕とにより活性エステル化し、次いで活性エステル化したカルボキシル基と2次抗体が有するアミノ基とを水溶性カルボジイミドを用いて脱水反応させ固定化させる方法;イソチオシアネートおよびアミノ基をそれぞれ有する2次抗体および蛍光色素を反応させ固定化する方法;スルホニルハライドおよびアミノ基をそれぞれ有する2次抗体および蛍光色素を反応させ固定化する方法;ヨードアセトアミドおよびチオール基をそれぞれ有する2次抗体および蛍光色素を反応させ固定化する方法;ビオチン化された蛍光色素とストレプトアビジン化された2次抗体(あるいは、ストレプトアビジン化された蛍光色素とビオチン化された2次抗体)とを反応させ固定化する方法などが挙げられる。
【0076】
なお、上記第1リガンドを固定化させた後に、後述する検体等がセンサチップに非特異的に吸着することを防止するため、センサチップの表面を牛血清アルブミン〔BSA〕等のブロッキング剤により処理することが好ましい。
【0077】
上記固相化層に固定化された第1リガンドの密度は、1フェムトmol/cm2以上1ナノmol/cm2以下が好ましく、10フェムトmol/cm2以上100ピコmol/cm2以下がより好ましい。第1リガンドの密度が上記範囲内であると、アッセイ蛍光シグナルの信号強度が大きくなるため好適である。
【0078】
〈アッセイ(アナライトの定量分析方法)〉
本発明のアナライトの定量分析方法は、上述したセンサチップ(透明支持体、該透明支持体上に形成された金属膜、および該金属膜上に固定され、かつアナライトに特異的に結合する第1リガンドを備えたセンサチップ)と、上記第2リガンドの他に、上記ナノ構造体とを用いた、表面プラズモン励起増強蛍光分光法によるアナライトの定量分析方法である。ここで、本発明に係る孔ライトの定量分析方法は、下記工程(a)〜(c)を実施した後に、下記工程(d)を実施することを特徴とし、必要により下記の洗浄工程(1)〜(3)を実施してもよい。
【0079】
工程(a):前記センサチップ上の第1リガンドと前記アナライトとを接触させて、該第1リガンドにアナライトを結合させる工程
工程(b):前記第2リガンドと前記アナライトとを接触させて、該第2リガンドにアナライトを結合させる工程
(c):前記第2リガンドに前記ナノ構造体を接触させて、該第2リガンドにナノ構造体を結合させる工程
(d):前記センサチップの透明支持体を介して前記金属膜に励起光を照射して表面プラズモンを生じさせ、該表面プラズモンにより蛍光色素を励起させて蛍光を生じさせ、該蛍光の蛍光量を測定する工程
洗浄工程(1):上記工程(a)を実施した後、センサチップ内を、洗浄液を用いて洗浄する工程
洗浄工程(2):上記工程(b)を実施した後、センサチップ内を、洗浄液を用いて洗浄する工程
洗浄工程(3):上記工程(c)を実施した後、センサチップ内を、洗浄液を用いて洗浄する工程
【0080】
また、さらに工程(d)の後、該工程(d)で得られた測定結果から、アナライト量を算出する以下の工程(工程(e))を含んでも良い。
工程(e):上記工程(d)で得られた測定結果から、アナライト溶液中に含有されるアナライト量を算出する工程である。
【0081】
[工程(a)]
工程(a)は、前記センサチップ上の第1リガンドと前記アナライトとを接触させて、該第1リガンドにアナライトを結合させる工程である。
【0082】
(アナライト)
本発明において「アナライト」とは、金属膜上の第1リガンドに特異的に認識され(または、第1のリガンドを特異的に認識し)結合し得る分子または分子断片を意味する。このような「分子」または「分子断片」として、例えば、核酸(一本鎖であっても二本鎖であってもよいDNA、RNA、ポリヌクレオチド、オリゴヌクレオチド、PNA(ペプチド核酸)等、またはヌクレオシド、ヌクレオチドおよびそれらの修飾分子)、タンパク質(ポリペプチド、オリゴペプチドを含む)、アミノ酸(修飾アミノ酸も含む)、糖質(オリゴ糖、多糖類、糖鎖等)、脂質、またはこれらの修飾分子、複合体などが挙げられ、具体的には、AFP(αフェトプロテイン)、癌胎児性抗原等の腫瘍マーカー、シグナル伝達物質、ホルモンなどであってもよく、特に限定されるものではない。
このアナライトは、アナライトを含む溶液の形で接触させることが好ましい。
【0083】
(アナライト溶液)
アナライト溶液とは、測定対象となる種々のアナライトを含む溶液をいう。
アナライト溶液としては、アナライトを含む溶液であれば何れでもよいが、例えば、検体が挙げられる。検体としては、例えば、血液(血清・血漿)、尿、鼻孔液、唾液、便、体腔液(髄液、腹水、胸水等)などが挙げられ、所望の溶媒、緩衝液等に適宜希釈して用いてもよい。これら検体のうち、血液、尿、鼻孔液および唾液が好ましい。これらは1種単独で用いてもよく、また、2種以上を併用してもよい。
【0084】
(アナライトの接触)
センサチップには流路が形成されていることが好ましく、流路中の少なくとも一部が透明支持体上に金属膜、金属膜上に第1リガンドを備えた構成とされ、アナライト溶液を前記流路中に送液して第1リガンドがアナライト溶液で浸漬されることにより、アナライトを第1リガンドに接触させる態様であることが好ましい。
【0085】
「流路」の形状は、角筒(管)状であっても丸筒(管)状であってもよく、アナライトと第1リガンド等を結合させ、蛍光測定する反応部・測定部は角筒状であることが好ましく、それ以外の薬液等の送液のみに利用される流路部分は丸筒状であることが好ましい。
【0086】
センサチップの外壁をなす部材、例えば流路基板と流路天板とで構成される場合等、それら部材の反応部・測定部に対応する部分(透明支持体)または流路天板の材料としては、メチルメタクリレート、スチレン等を原料として含有するホモポリマーまたは共重合体;ポリエチレン等のポリオレフィンなどからなり、流路部分はシリコーンゴム、テフロン(登録商標)、ポリエチレン、ポリプロピレン等のポリマーを用いることが好ましい。
【0087】
反応部・測定部においては、アナライトとの接触効率を高め、拡散距離を短くする観点から、流路の断面として、縦と横がそれぞれ100nm以上、1mm以下程度であることが好ましい。
【0088】
センサチップに流路を形成する方法としては、小規模ロット(実験室レベル)では、まず、センサチップの金属膜が形成されている表面側に、流路高さ0.5mmを有するポリジメチルシロキサン〔PDMS〕製シートを該センサチップの金属膜が形成されている部位を囲むようにして圧着し、次に、該ポリジメチルシロキサン〔PDMS〕製シートとセンサチップとをビス等の閉め具により固定する方法が好ましい。
【0089】
工業的に製造される大規模ロット(工場レベル)では、センサチップに流路を形成する方法としては、センサチップに流路基板と流路天板に相当するプラスチックの一体成形品を形成する方法、または別途作製した金属膜が形成された支持体に流路基板を形成し、金属膜表面に(好ましくは誘電体からなるスペーサ層)SAM、固定化層および第1リガンドの固定化を行った後に、流路天板に相当するプラスチックの一体成形品により、流路基板を形成されたセンサチップに蓋をする方法がある。
【0090】
流路に送液するアナライト溶液において、アナライトを希釈するために用いる溶媒としては、例えば、リン酸緩衝生理食塩水〔PBS〕、トリス緩衝生理食塩水〔TBS〕、HEPES緩衝生理食塩水〔HBS〕などが挙げられるが、特に限定されるものではない。
【0091】
第1リガンドに多くのアナライトを補足させるために、送液されたアナライト溶液を流路中に循環させることが好ましいが、その際のアナライト溶液の温度および時間としては、検体の種類などにより異なり、特に限定されるものではないが、通常20℃以上、40℃以下で1分間以上、60分間以下、好ましくは37℃で5分間以上、15分間以下である。
【0092】
アナライト溶液を流路に送液する場合、該アナライト溶液中に含有されるアナライトの初期濃度(送液前の濃度)は、100μg/ml以上、0.001pg/ml以下であってもよい。
【0093】
流路に送液するアナライト溶液の総量は、通常0.001ml以上、20ml以下、好ましくは0.1ml以上、1ml以下である。
また、流路に送液するアナライト溶液の流速は、通常1μL/min以上、5,0000μL/min以下、好ましくは5,000μL/min以上、1,0000μl/min以下である。
【0094】
[洗浄工程]
洗浄工程としては、上記工程(a)を実施した後にセンサチップ内を洗浄液で洗浄する洗浄工程(1)、上記工程(b)を実施した後にセンサチップ内を洗浄液で洗浄する洗浄工程(2)と、上記工程(c)を実施した後にセンサチップ内を洗浄液で洗浄する工程(3)が挙げられる。
【0095】
これら洗浄工程(1)〜(3)の何れかに使用される洗浄液は、例えば、工程(a)〜(c)の何れかの反応で用いられた溶媒または緩衝液と同一種類の溶媒または緩衝液に、Tween20、TritonX100などの界面活性剤を好ましくは0.00001質量%以上、1質量%以下含有するように溶解させたもの、または塩化ナトリウムや塩化カリウムなどの塩を10mM以上、500mM以下含有させたものであることが望ましい。あるいは、低pHの緩衝液、例えば、10mM Glycine HClで、pHが1.5以上、4.0以下のものを洗浄液として用いてもよい。
【0096】
洗浄工程における洗浄液の温度および流速は、上記工程(a)におけるアナライト溶液の送液時の温度および流速と同じであることが好ましい。
洗浄工程(洗浄液による洗浄時間)は、通常0.5分間以上、180分間以下、好ましくは5分間以上、60分間以下である。
【0097】
[工程(b)]
工程(b)は、前記第2リガンドと前記アナライトとを接触させて、該第2リガンドにアナライトを結合させる工程である。工程(b)は、好ましくは上記工程(a)の後、さらに好ましくは上記洗浄工程(1)を経た後に実施される。
【0098】
(蛍光色素)
「蛍光色素(蛍光分子ともいう)」は、所定の励起光を照射することによって、または電界効果を利用して励起することによって蛍光を発光する(表面プラズモンにより励起されて蛍光する)物質の総称であり、該「蛍光」は、燐光など各種の発光も含む。
【0099】
本発明で用いられる蛍光色素は、金属膜による吸光に起因して完全に消光しない限りにおいて、その種類に特に制限はなく、公知の蛍光色素のいずれであってもよい。一般に、単色比色計〔monochromometer〕よりむしろフィルタを備えた蛍光計の使用をも可能にし、かつ検出の効率を高める大きなストークス・シフトを有する蛍光色素が好ましい。
【0100】
このような蛍光色素としては、例えば、フルオレセイン・ファミリーの蛍光色素(Integrated DNA Technologies社製)、ポリハロフルオレセイン・ファミリーの蛍光色素(アプライドバイオシステムズジャパン(株)製)、ヘキサクロロフルオレセイン・ファミリーの蛍光色素(アプライドバイオシステムズジャパン(株)製)、クマリン・ファミリーの蛍光色素(インビトロジェン(株)製)、ローダミン・ファミリーの蛍光色素(GEヘルスケア バイオサイエンス(株)製)、シアニン・ファミリーの蛍光色素、インドカルボシアニン・ファミリーの蛍光色素、オキサジン・ファミリーの蛍光色素、チアジン・ファミリーの蛍光色素、スクアライン・ファミリーの蛍光色素、キレート化ランタニド・ファミリーの蛍光色素、BODIPY(登録商標)・ファミリーの蛍光色素(インビトロジェン(株)製)、ナフタレンスルホン酸・ファミリーの蛍光色素、ピレン・ファミリーの蛍光色素、トリフェニルメタン・ファミリーの蛍光色素、Alexa Fluor(登録商標)色素シリーズ(インビトロジェン(株)製)などが挙げられ、さらに米国特許番号第6,406,297号、同第6,221,604号、同第5,994,063号、同第5,808,044号、同第5,880,287号、同第5,556,959号および同第5,135,717号に記載の蛍光色素を用いることもできる。
【0101】
これらファミリーに含まれる代表的な蛍光色素の吸収波長(nm)および発光波長(nm)を表1に示す。
【0102】
【表1】

また、蛍光色素は、上記有機蛍光色素に限られない。例えば、Eu、Tb等の希土類錯体系の蛍光色素も用いることができる。希土類錯体は、一般的に励起波長(310以上、340nm以下程度)と発光波長(Eu錯体で615nm付近、Tb錯体で545nm付近)との波長差が大きく、蛍光寿命が数百マイクロ秒以上と長い特徴がある。市販されている希土類錯体系の蛍光色素の一例としては、ATBTA−Eu3+が挙げられる。
【0103】
本発明においては、後述する蛍光量の測定を行う際に、金属膜に含まれる金属による吸光の少ない波長領域に最大蛍光波長を有する蛍光色素を用いることが望ましい。例えば、金属膜として金膜を用いる場合には、金膜による吸光による影響を最小限に抑えるため、最大蛍光波長が600nm以上である蛍光色素を使用することが望ましい。したがって、この場合には、Cy5、Alexa Fluor(登録商標)647等近赤外領域に最大蛍光波長を有する蛍光色素を用いることが特に望ましい。このような近赤外領域に最大蛍光波長を有する蛍光色素を用いることは、血液中の血球成分由来の鉄による吸光の影響を最小限に抑えることができる点で、検体として血液を用いる場合においても有用である。一方、金属膜として銀を用いる場合には、最大蛍光波長が400nm以上である蛍光色素を使用することが望ましい。
【0104】
これら蛍光色素は1種単独でも、2種以上併用してもよい。
蛍光色素を有する第2リガンドを含む溶液をセンサチップに送液して反応させる際、送液される該溶液の濃度は、0.001μg/ml以上、10,000μg/ml以下が好ましく、1μg/ml以上、1,000μg/ml以下がより好ましい。
【0105】
この溶液を送液する際の溶液の温度、流速および工程(b)の時間(送液時間)は、それぞれ上記工程(a)の場合と同様である。
【0106】
[工程(c)]
工程(c)は、第2リガンドに上記ナノ構造体を接触させて、該第2リガンドにナノ構造体を結合させる工程である。
【0107】
接触させる方法としては特に限定されず、例えば、上記工程(b)を実施した後、センサチップにナノ構造体を含む溶液(ナノ構造体溶液)を送液して、上記第2リガンドにナノ構造体を接触させる方法、上記工程(b)を実施した後、センサチップに、ナノ構造粒子含む溶液及び第3リガンドを含む溶液を別々に送液する方法が挙げられる。好ましくは上記工程(b)を経たセンサチップにナノ構造体を含む溶液(ナノ構造体溶液)を送液して、上記第2リガンドにナノ構造体を接触させて、該第2リガンドにナノ構造体を結合させることである。
【0108】
このナノ構造体溶液の作製方法としては、例えば、ナノ構造粒子を含む溶液と第3リガンドを含む溶液とを混合してナノ構造粒子と第3リガンドを結合させて作製すること、あるいは、ナノ構造粒子単体(ナノ構造粒子と第3リガンドが初めから結合した単体)を溶液に入れ作製することが挙げられる。ナノ構造体を、ナノ構造粒子を含む溶液と第3リガンドを含む溶液とを混合して作製する場合、各溶液の濃度にもよるが、通常、ナノ構造粒子を含む溶液と第3リガンドを含む溶液とを、ナノ構造粒子の個数:第3リガンドの個数が1:1の割合になるように混合させると、1つのナノ構造粒子に対して、平均1つの第3リガンドが結合したナノ構造体を作製することができる。そして、ナノ構造粒子を含む溶液と第3リガンドを含む溶液とを、例えば、ナノ構造粒子の個数:第3リガンドの個数が1:2以上の割合になるように混合することで、1つのナノ構造粒子に対して、平均2つ以上(複数)の第3リガンドを結合させることができる。該ナノ構造粒子を含む溶液中のナノ構造粒子の濃度は、ナノ構造体粒子の粒径等により適宜異なるが、0.01μg/ml以上、10,000μg/ml以下が好ましく、1μg/ml以上、100μg/ml以下がより好ましい。
【0109】
なお、工程(b)を実施した後のセンサチップに対して、上記洗浄工程(2)を行う方が好ましい。ナノ構造体を含む溶液に用いられる溶媒としては例えば、リン酸緩衝生理食塩水〔PBS〕、トリス緩衝生理食塩水〔TBS〕、HEPES緩衝生理食塩水〔HBS〕などが挙げられるが、特に限定されるものではない。
【0110】
第2リガンドに多くの第3リガンドを結合させるために、好ましくは第2リガンド及び第1リガンドに多くの第3リガンドを結合させるために、送液されたナノ構造体溶液を流路中に循環させることが好ましい。その際のナノ構造体溶液の温度および循環させる時間としては、ナノ構造体の第3リガンドやナノ構造粒子等により異なり、特に限定されるものではないが、例えば、20℃以上、40℃以下で1分間以上、60分間以下、好ましくは30℃以上、38℃以下で5分間以上、15分間以下が挙げられる。
【0111】
流路に送液するナノ構造体溶液の総量は、通常0.001ml以上、20ml以下、好ましくは0.1ml以上、1ml以下である。
また、流路に送液するナノ構造体溶液の流速は、通常1μL/min以上、5,0000μL/min以下、好ましくは5,000μl/min以上、1,0000μl/min以下である。
【0112】
上記第2リガンドとナノ構造体との接触は、詳細には、第2リガンドとナノ構造体の第3リガンド部の接触を指し、例えば、上述の工程(b)で用いる「蛍光色素を有する第2リガンドを含む溶液」にナノ構造体を含有させて該溶液中で行っても良い。また、工程(a)で用いる「アナライト溶液」にナノ構造体を含有させて該溶液中で行っても良い。
【0113】
上述のように、上記第2リガンドとナノ構造体との接触方法は如何なる方法に限定されず、上記第2リガンドとナノ構造体とが接触すれば如何なる方法でも良い。
上記第2リガンドにナノ構造体を接触させた際に、ナノ構造体の第3リガンド部は第2リガンドと反応性を有するため、上記第2リガンドとナノ構造体の第3リガンド部は反応し結合する。このように、第2リガンドと第3リガンドを接触させ結合させることで、アナライト−第1リガンド間、及び/またはアナライト−第2リガンド間の解離を抑制することができる。
【0114】
[工程(d)]
工程(d)は、上記工程(a)、(b)及び(c)を実施した後、センサチップに、上記透明支持体の、上記金属膜を形成していないもう一方の表面から(透明支持体を介して)、励起光を照射し金属膜表面に表面プラズモンを生じさせ、該表面プラズモンにより蛍光色素を励起させて発光を生じさせ、該蛍光の蛍光量を測定する工程である。この工程において、表面プラズモンを生じさせる方法は特に限定されるものではないが、例えば、プリズムを経由してレーザ光(励起光)を照射して表面プラズモンを生じさせる方法等がある。この工程(d)は、上記洗浄工程(3)を経た後のセンサチップに対して行うことが好ましい。
【0115】
(光学系)
蛍光を測定する際に照射される光源は、金属膜に表面プラズモンを生じさせることができるものであれば、特に制限がないものの、波長分布の単一性および光エネルギーの強さの点で、レーザ光(励起光)を光源として用いることが好ましい。レーザ光(励起光)は、光学フィルタを通して、プリズムに入射する直前のエネルギーおよびフォトン量を調節することが望ましい。
【0116】
レーザ光(励起光)の照射により、全反射減衰条件〔ATR〕において、金属膜の表面に表面プラズモンが発生する。表面プラズモンの電場増強効果により、照射したフォトン量の数十倍以上、数百倍以下に増えたフォトンにより蛍光色素を励起する。なお、該電場増強効果によるフォトン増加量は、支持体の屈折率、金属膜の金属種およびその膜厚に依存するが、通常、金では約10倍以上、20倍以下の増加量となる。
【0117】
蛍光色素は、光吸収により分子内の電子が励起され、短時間のうちに第一電子励起状態に移動し、この状態(準位)から基底状態に戻る際、そのエネルギー差に相当する波長の蛍光を発する。
【0118】
励起光として使用される「レーザ光」としては、例えば、波長200nm以上、900nm以下、0.001mW以上、1,000mW以下のLD;波長230nm以上、800nm以下(金属部材に用いる金属種によって共鳴波長が決まる。)、0.01mW以上、100mW以下の半導体レーザなどが挙げられる。
【0119】
「プリズム」は、必要に応じて用いられる光学フィルタ、偏光フィルタ及びカットフィルタ等の各種フィルタを介したレーザ光が、金属膜に効率よく入射されることを目的としており、屈折率が透明支持体と同じであることが好ましい。本発明は、全反射条件を設定できる各種プリズムを適宜選択することができることから、角度、形状に特に制限はなく、例えば、60度分散プリズムなどであってもよい。このようなプリズムの市販品としては、上述した「ガラス製の透明支持体」の市販品と同様のものが挙げられる。本発明の透明支持体がこのプリズムであっても良い。
【0120】
「光学フィルタ」としては、例えば、減光〔ND〕フィルタ、ダイアフラムレンズなどが挙げられる。「減光〔ND〕フィルタ」(または、中性濃度フィルタ)は、入射レーザ光量を調節することを目的とするものである。特に、ダイナミックレンジの狭い検出器を使用するときには精度の高い測定を実施する上で用いることが好ましい。
【0121】
「偏光フィルタ」は、レーザ光を、表面プラズモンを効率よく発生させるP偏光とするために用いられるものである。
「カットフィルタ」は、外光(装置外の照明光)、励起光(励起光の透過成分)、迷光(各所での励起光の散乱成分)、プラズモンの散乱光(励起光を起源とし、センサチップ表面上の構造体または付着物などの影響で発生する散乱光)などの光学ノイズ、および蛍光色素の自家蛍光を除去するフィルタであって、例えば、干渉フィルタ、色フィルタなどが挙げられる。
【0122】
「集光レンズ」は、蛍光量を測定する検出器に、蛍光シグナルを効率よく集光することを目的とするものであり、任意の集光レンズでよい。簡易な集光レンズとして、顕微鏡などで使用されている、市販の対物レンズ(例えば、(株)ニコン製またはオリンパス(株)製等)を転用してもよい。対物レンズの倍率としては、10倍以上、100倍以下が好ましい。
【0123】
「検出器」としては、超高感度の観点からは光電子増倍管(浜松ホトニクス(株)製のフォトマルチプライヤー)が好ましい。また、これらに比べると感度は下がるが、画像として見ることができ、かつノイズ光の除去が容易なことから、多点計測が可能なCCDイメージセンサも好適である。
【0124】
[工程(e)]
工程(e)は、上記工程(d)で得られた測定結果から、アナライト量(たとえば、アナライト溶液中に含まれるアナライト量)を算出(定量)する工程である。
【0125】
より具体的には、工程(e)は、既知濃度のアナライト(たとえば、標的抗原または標的抗体)を用いて、本願発明の定量分析法を実施することで検量線を作成し、作成された検量線に基づいて、工程(d)で得られた測定シグナルから、被測定アナライト溶液中のアナライト(たとえば、標的抗原)量を算出する工程である。
【0126】
[S/N比の算出]
さらに、工程(e)においては、予め上記工程(b)の前に測定した“ブランク発光シグナル”、上記工程(d)で得られた“アッセイ発光シグナル(単にシグナルともいう)”、および何も修飾していない金属基板を流路に固定し、超純水を流しながら測定して得られた“初期ノイズシグナル”を用いて、下記式(1a)で表されるS/N比を算出することができる:
S/N=|Ia/Io|/In (1a)
(上記式(1a)において、Iaはアッセイ発光シグナル、Ioはブランク発光シグナル、Inは初期ノイズシグナルである)。
ただし、S/Nを算出するにあたっては、実用上、上記式(1a)に代えて、アナライト溶液中に含まれるアナライトの濃度が0の場合における“アッセイノイズシグナル(単にノイズともいう)”を基準として、下記式(1b)にしたがって算出してもよい:
S/N=|Ia|/|Ian| (1b)
(上記式(1b)において、Ianはアッセイノイズシグナル、Iaは上記式(1a)の場合と同様にアッセイ発光シグナルである)。
【0127】
〔キット〕
本発明に係る定量分析用キットは、上記センサチップと、上記ナノ構造体と、上記第2リガンドとを含み、表面プラズモン励起増強蛍光分光法によるアナライトの定量分析に用いられることを特徴とする。ここで、本発明の定量分析方法を実施するにあたり、上記のセンサチップ等の他に、アナライト溶液を除き必要とされるすべてのものを含むことが好ましい。
【0128】
たとえば、本発明の定量分析用キットに含まれるものとしては、少なくともセンサチップ(透明支持体上に少なくとも金属膜を有する)、第1リガンドを含む溶液、第2リガンドを含む溶液、およびナノ構造体を含むアナライト解離抑制剤(溶液)である。
【0129】
これら蛍光量測定用キットと、例えば、アラナイト溶液としてアナライトを含む血液または血清と、特定の腫瘍マーカーに対する抗体とを用いることによって、特定の腫瘍マーカーの含有量を、高感度かつ高精度で検出することができる。この結果から、触診などによって検出することができない前臨床期の非浸潤癌(上皮内癌)の存在も高精度で予測することができる。
【0130】
さらに、キット要素として、検量線作成用の標準物質、説明書、多数アナライトの同時処理ができるマイクロタイタープレートなどの必要な器材一式などを含んでもよい。
以上の説明において、本発明の定量分析方法では、工程(d)が工程(a)〜(c)の後に実施する限り、工程(a)〜工程(c)の各工程は、任意の順番で実施してもよく、工程(a)〜工程(c)のうち、2種類の工程または3種類の工程を同時に実施してもよい。
【0131】
本発明の定量分析方法を実施するに当たり、工程(a)〜(b)を任意の順でまたは同時に実施し、工程(c)〜(d)を順次実施することが好ましく、工程(a)〜工程(d)の順番で順次行う方が、各工程を、センサチップを処理対象にして、センサチップに対して順次処理を行うことができ好ましい。
【実施例】
【0132】
次に、本発明について実施例を示してさらに詳細に説明するが、本発明はこれらによって限定されるものではない。
【0133】
(蛍光色素を有する第2リガンド溶液の準備)
第2リガンドとして、抗cTnl IgG2aモノクローナル抗体(4C2;2.5mg/ml、Hytest社製)の溶液とAlexa Fluor(登録商標)647(Molecular Probes社製)標識キットを用い、キット使用方法の手順に従い、室温(25℃)で60分間、攪拌混合することで反応させ、蛍光色素標識された抗体を準備した。
【0134】
最後に、未反応抗体および未反応酵素を、分子量カットフィルタ(日本ミリポア(株)製)を用いて精製することで、Alexa Fluor(登録商標)647標識抗AFPモノクローナル抗体溶液を得た。得られた標識2次抗体(蛍光色素を有する第2リガンド)溶液はタンパク定量後、4℃で保存した。
【0135】
(ナノ構造体溶液の準備)
第3リガンドとして、第2リガンドに結合性を有する抗mouse IgG2aポリクロ―ナル抗体(100μg/ml、(株)ミクリ免疫研究所)100μlと、体積平均粒径8nmの金コロイド(WRGM3;金コロイド液:OD525=12 (株)ワインレッドケミカル)溶液100μlとを混合し抗体を結合させるpHのbufferなどで希釈しpHを調節した後、15分間静置した。その後、混合液(1%牛血清アルブミン(BSA)溶液と1%PEG溶液を9:1の割合で混合した溶液)1mlを第3リガンド及び金コロイド含有溶液100μlに加え、市販の遠心分離機を用いて5000rpmで5分間、遠心分離を行なって上清を取り除いた。さらに、上記混合液2mlを加えて、市販の超音波分散器で約30秒間分散した。再度、遠心分離機を用いて5000rpmで5分間、遠心分離を行って上清を取り除き、ナノ構造体を含む溶液(ナノ構造体溶液)を得た。得られたナノ構造体溶液は4℃で保存した。なお、得られたナノ構造体は、1粒子当たり、平均すると、複数個の第3リガンドが固定されるように調製した。
【0136】
[実施例1]
(センサチップ(A)の製造)
屈折率〔nd〕1.72、厚さ1mmのガラス製の透明支持体((株)オハラ製の「S−LAL 10」)をプラズマ洗浄し、該支持体の片面にクロム薄膜をスパッタリング法により形成した後、その表面にさらに金属膜として金薄膜をスパッタリング法により該透明支持体に形成した。クロム薄膜の厚さは1nm以上、3nm以下、金薄膜の厚さは42nm以上、47nm以下であった。この半値幅(β)は7.6°であった。
【0137】
こうして金属膜が形成された透明支持体を、1mMに調製した10−カルボキシ−1−デカンチオールのエタノール溶液10mlに24時間浸漬し、金薄膜の片面にSAMを形成した。この透明支持体を、該エタノール溶液から取り出し、エタノールおよびイソプロパノールでそれぞれ洗浄した後、エアガンを用いて乾燥させた。
【0138】
続いて、分子量50万のカルボキシメチルデキストラン〔CMD〕を1mg/mlと、N−ヒドロキシコハク酸イミド〔NHS〕を0.5mMと、水溶性カルボジイミド〔WSC〕を1mMとを含むpH7.4のMES緩衝生理食塩水〔MES〕(イオン強度:10mM)にSAMを形成した透明支持体を1時間浸漬し、SAM上に固相化層としてCMDを固定化し、1モル/リットルのNaOH水溶液に30分間浸漬することで未反応のコハク酸エステルを加水分解させた。CMD層の平均膜厚は70nmであり、密度は1.9ng/mm2であった。
【0139】
続いて、NHSを50mM(モル)と、WSCを100mMとを含むMESに1時間浸漬させた後に、抗cTnl IgG1モノクローナル抗体(MF4;2.5μg/ml、Hytest社製)(第1リガンド)溶液に30分間浸漬することで、CMDに1次抗体(第1リガンド)を固定化した。
【0140】
さらに、1質量%の牛血清アルブミン〔BSA〕および1Mのアミノエタノールを含むPBSにて30分間循環送液することで、非特異的吸着防止処理を行なった。
非特異吸着防止処理を行なった第1リガンドが固定化された透明支持体上に、流路高さ0.5mmを有し、かつ適当な形状および大きさを有する穴のあいたポリジメチルシロキサン〔PDMS〕製シートを設け、さらに、このPDMS製シートの周囲にシリコーンゴム製スペーサを配置した(このシリコーンゴム製スペーサは流路に送液する溶液に触れない状態にある)。該PDMS製シートおよび該シリコーンゴム製スペーサの上に、送液導入用の穴および送液排出用の穴を予めそれぞれ形成してあるPMMA基板を、PDMS製シートで囲まれた領域の内側にこれらの穴が位置するように配置した(このとき、抗体を固定化した表面が流路の内側となるように、PMMA基板が配置されている)。これらを流路の外側から圧着し、ビスを用いて、PMMA基板と流路シート(すなわち、前記PDMS製シート)、該流路シートと支持体を固定し、センサチップ(A)を製造した。
【0141】
(アッセイの実施)
上述のように製造したセンサチップ(A)を用いて、以下の工程によりアッセイを実施した。
【0142】
工程(a)として、上述のようにして得られたセンサチップ(A)の流路に、標的抗原(アナライト)としてcTnlを0.1ng/ml含む0.1mlPBS溶液(アナライト溶液)を25分間循環させた。
【0143】
洗浄工程(1)として、工程(a)の後、センサチップ(A)の流路に、Tween20を0.05質量%含むトリス緩衝生理食塩水〔TBS〕を送液させ10分間循環させることによって洗浄した。
【0144】
工程(b)として、洗浄工程(1)の後、センサチップ(A)の流路に、上記で準備した蛍光色素を有する第2リガンド溶液(2μg/mlとなるように調製したPBS溶液)0.1mlを送液させ5分間循環させた。
【0145】
洗浄工程(2)として、工程(b)の後、センサチップ(A)の流路に、Tween20を0.05質量%含むTBSを送液させ10分間循環させることによって洗浄した。
工程(c)として、洗浄工程(2)の後、センサチップ(A)の流路に、上記で準備したナノ構造体溶液(2μg/mlとなるように調製したPBS溶液)0.1mlを送液させ5分間循環させた。
【0146】
工程(d)として、工程(a)、(b)及び(c)を経たセンサチップ(A)の、金属膜を形成していないもう一方の表面から、プリズム(シグマ光機(株)製)を経由してレーザ光(640nm、40μW)を金属膜に照射し表面プラズモンを生じ、この表面プラズモンにより励起された蛍光色素から発光された蛍光量を光電子増倍管〔PMT〕で検出した光量(シグナル値)を計測し「アッセイ発光シグナル」とした。
【0147】
一方、前記工程(a)〜(d)において、上記工程(a)でcTnlを全く含まない(0ng/ml)0.1mlPBS溶液をフローさせた以外は上記と同じ手順で蛍光量を測定し、その測定値を「アッセイノイズシグナル」とした。
【0148】
[実施例2]
上記実施例1において、ナノ構造体溶液を準備する際に、第3リガンドの濃度を100μg/mlから、70μg/mlに変更した以外は同様にして蛍光量を測定した。
【0149】
[実施例3]
上記実施例1において、ナノ構造体溶液を準備する際に、第3リガンドとして、第2リガンドと結合性を有する抗mouse IgG2aポリクロ―ナル抗体(100μg/ml、(株)ミクリ免疫研究所)100μlから、第1リガンド及び第2リガンドと共に結合性を有する抗mouse IgGポリクロ―ナル抗体(50μg/ml、(株)ミクリ免疫研究所)100μlに変更し、該第3リガンドを第2リガンド及び第1リガンドの両方に接触させた以外は同様にして蛍光量を測定した。
【0150】
[実施例4]
上記実施例1において、ナノ構造体溶液を準備する際に、第3リガンドの濃度を100μg/mlから、1μg/mlに変更した以外は同様にして蛍光量を測定した。
【0151】
[実施例5]
上記実施例3において、ナノ構造体溶液を準備する際に、第3リガンドの濃度を20μg/mlから、1.25μg/mlに変更した以外は同様にして蛍光量を測定した。
【0152】
[実施例6]
上記実施例1において、ナノ構造体溶液を準備する際に、第3リガンドの濃度を100μg/mlから、0.85μg/mlに変更した以外は同様にして蛍光量を測定した。
【0153】
[実施例7]
上記実施例1において、ナノ構造体溶液を準備する際に、第3リガンドの濃度を100μg/mlから、10μg/mlに変更し、体積平均粒径8nmの金コロイド(WRGM3;金コロイド液:OD525=12 (株)ワインレッドケミカル)溶液100μlから、体積平均粒径20nmの金コロイド(WRGM2;金コロイド液:OD525=12 (株)ワインレッドケミカル)溶液100μlに変更した以外は同様にして蛍光量を測定した。
【0154】
[実施例8]
上記実施例1において、ナノ構造体溶液を準備する際に、第3リガンドの濃度を100μg/mlから、30μg/mlに変更し、体積平均粒径8nmの金コロイド(WRGM3;金コロイド液:OD525=12 (株)ワインレッドケミカル)溶液100μlから、体積平均粒径40nmの金コロイド(WRGH1;金コロイド液:OD525=12 (株)ワインレッドケミカル)溶液100μlに変更した以外は同様にして蛍光量を測定した。
【0155】
[実施例9]
上記実施例1において、ナノ構造体溶液を準備する際に、第3リガンドの濃度を100μg/mlから、10μg/mlに変更し、体積平均粒径8nmの金コロイド(WRGM3;金コロイド液:OD525=12 (株)ワインレッドケミカル)溶液100μlから、体積平均粒径60nmの金コロイド(WRGH1;金コロイド液:OD525=12 (株)ワインレッドケミカル)溶液100μlに変更した以外は同様にして蛍光量を測定した。
【0156】
[実施例10]
上記実施例1において、ナノ構造体溶液を準備する際に、金コロイド溶液100μlの代わりに、体積平均粒径は20nmのセレン化カドミウムである「Qdot(登録商標) 525 nanocrystals」(インビトロジェン株式会社製)を含む溶液(1μM)100μlを用いた以外は同様にして蛍光量を測定した。
【0157】
[実施例11]
上記実施例1において、ナノ構造体溶液を準備する際に、第3リガンドとして、第2リガンドと結合性を有する抗mouse IgG2aポリクロ―ナル抗体(100μg/ml、(株)ミクリ免疫研究所)100μlから、第1リガンド及び第2リガンドと共に結合性を有する抗mouse IgGポリクロ―ナル抗体(100μg/ml、(株)ミクリ免疫研究所)100μlに変更し、金コロイド溶液の代わりに体積平均粒径20nmのタンパク質を含む溶液(100μg/ml)100μlを用いた以外は同様にして蛍光量を測定した。
【0158】
[実施例12]
上記実施例1において、ナノ構造体溶液を準備する際に、第3リガンドの濃度を100μg/mlから、120μg/mlに変更し、体積平均粒径8nmの金コロイド(WRGM3;金コロイド液:OD525=12 (株)ワインレッドケミカル)溶液100μlから、体積平均粒径60nmのタンパク質を含む溶液(100μg/ml)100μlに変更した以外は同様にして蛍光量を測定した。
【0159】
[比較例1]
上記実施例1において、工程(c)を除いた以外は同様の工程で蛍光量を測定した。すなわち、ナノ構造体溶液は使用していない(送液を行っていない)。
【0160】
[比較例2]
上記実施例1において、ナノ構造対溶液の代わりに、ナノ構造粒子を用いることなく第3リガンドのみ分散させた第3リガンド溶液を以下のようにして準備し、該第3リガンド溶液を使用した以外は同様にして蛍光量を測定した。
【0161】
(第3リガンド溶液の準備)
第3リガンドとして、第2リガンドと反応性を有する抗mouse IgG2aポリクロ―ナル抗体(100μg/ml、(株)ミクリ免疫研究所)溶液を準備した。
【0162】
[ナノ構造粒子体積平均粒径の測定方法]
ナノ構造粒子の体積平均粒径は、ナノ構造体溶液を作製する前のナノ構造粒子溶液をクロロホルム/ヘキサン混合溶媒(体積比:4/6)で10倍に希釈し、動的光散乱式ナノトラック粒度分析計(UPA−EX150、日機装株式会社)を用いて算出した。
【0163】
[アッセイ発光シグナルの評価]
実施例1〜9及び比較例1〜2で実施したそれぞれの蛍光量測定のアッセイ蛍光シグナルに注目し、比較例1のアッセイ発光シグナルを基準として、以下の通り評価した。結果を表1に示した。なお、アッセイノイズシグナルについては、実施例1〜9及び比較例1〜2においてそれぞれ測定したものの、いずれのアッセイノイズシグナルの値にも大差はなかった。また、アッセイ発光シグナルは、工程(d)で得たもので評価したが、工程(c)以降であれば、どのような時に測定したとしても同様の結果が得られる。
【0164】
A:比較例1のアッセイ発光シグナルに比較し1.5倍を超える値である場合
B:比較例1のアッセイ発光シグナルに比較し1.35倍以上、1.5倍未満である値である場合
C:比較例1のアッセイ発光シグナルに比較し1.2倍以上、1.35倍未満である値である場合
D:比較例1のアッセイ発光シグナルに比較し1.05倍以上、1.2倍未満である値である場合
E:比較例1のアッセイ発光シグナルに比較し1.0倍以上、1.05倍未満である値である場合
【0165】
[S/N比のバラつきの評価]
実施例1〜9及び比較例1〜2で実施したそれぞれの蛍光量測定を全く同じ条件にて各々5回ずつ行い、上記アッセイ発光シグナルの評価と同じように、各々5回のアッセイ発光シグナルから該アッセイ発光シグナルの平均及び該アッセイ発光シグナルの標準偏差を求め、変動係数(CV値(%))にて以下の通り評価した。結果を表1に示した。なお、CV値(%)は、下記式に基づいて算出した。
CV値(%)=(アッセイ発光シグナルにおける標準偏差/アッセイ発光シグナルの平均)×100
A:CV値(%)が0以上、8未満である場合
B:CV値(%)が8以上、13未満である場合
C:CV値(%)が13以上、18未満である場合
D:CV値(%)が18以上である場合
【0166】
【表2】

表2から、ナノ構造体を、蛍光色素を有する第2リガンドに接触させた実施例1〜11は、比較例1〜2に比較しアッセイ発光シグナルが高く、蛍光測定時のアッセイ発光シグナルのバラつきが小さいことがわかる。これは、蛍光色素を有する第2リガンドにナノ構造体を接触させたことにより、第1リガンド−アナライト間、あるいは第2リガンド−アナライト間の解離が抑制されたためである。
【0167】
実施例3及び5では、「アッセイ発光シグナル」及び「バラつき」の評価が最も良かった。この理由として、「アッセイ発光シグナル」に関しては、ナノ構造粒子の材質が「金」であり、体積平均粒径が「1nm以上、50nm以下の範囲」であり、第3リガンドの濃度が「1μg/ml以上、100μg/ml以下の範囲」であり、接触が「第1リガンド及び第2リガンド」であるという本発明の最も好ましい形態を満たしているからである。そして、「バラつき」に関しては、第3リガンドの濃度が「1μg/ml以上、100μg/ml以下の範囲」である、及び接触が「第1リガンド及び第2リガンド」であるという好ましい形態を満たしているからである。
【0168】
また、この表2から、リガンド−アナライト間の解離は、第3リガンドの濃度が大きいこと、第1リガンド及び第2リガンドと共に結合性を有する第3リガンドを用いることによりさらに抑制されていることがわかる(バラつきの評価より)。これは、第3リガンドの濃度が大きい方が、一つのナノ構造粒子に結合する第3リガンド数が単純に多くなるため、及び第3リガンドは第2リガンドのみに結合するより第1及び第2リガンドに結合する方がより強固に結合されるため解離がより抑制されるためである。
【0169】
一方、比較例1〜2は、ナノ構造体を用いていないので、リガンド−アナライト間の解離が抑制されず、解離が起こってしまった結果、各蛍光量測定で得られるアッセイ発光シグナルが実施例1〜11に比較し低く、かつ蛍光測定時のアッセイ発光シグナルのバラつきが大きいので安定したアナライトの定量分析ができなかった。これは、比較例ではナノ構造体を用いていないために、各蛍光量測定において第1リガンド−アナライト間、あるいは第2リガンド−アナライト間で解離が起こってしまい、各蛍光量測定が同じ条件で行っているにも関わらず、測定したアッセイ発光シグナルにバラつきが生じてしまった結果である。
【符号の説明】
【0170】
A 一つの第3リガンドを有するナノ構造体
B 二つの第3リガンドを有するナノ構造体
C 四つの第3リガンドを有するナノ構造体
D センサチップ
1 ナノ構造粒子
2 第3リガンド
3 透明支持体
4 金属膜
5 自己組織化単分子膜(SAM)
6 カルボキシメチルデキストラン
7 第1リガンド
8 アナライト
9 第2リガンド
10 蛍光色素
【特許請求の範囲】
【請求項1】
透明支持体、該透明支持体上に形成された金属膜、および該金属膜上に固定され、かつアナライトと特異的に結合する第1リガンドを備えたセンサチップと、
表面プラズモンにより励起されて蛍光する蛍光色素を有し、かつ前記アナライトに特異的に結合する第2リガンドと
ナノ構造粒子、および第2リガンドに特異的に結合する第3リガンドを有し、該第3リガンドが該ナノ構造粒子上に固定されてなるナノ構造体とを用いた、表面プラズモン励起増強蛍光分光法によるアナライトの定量分析方法であって、
下記工程(a)〜(c)を実施して、下記工程(d)を実施することを特徴とする定量分析方法。
工程(a):前記センサチップ上の第1リガンドと前記アナライトとを接触させて、該第1リガンドと該アナライトを結合させる工程
工程(b):前記第2リガンドと前記アナライトとを接触させて、該第2リガンドと該アナライトを結合させる工程
(c):前記第2リガンドと前記ナノ構造体とを接触させて、該第2リガンドとナノ構造体を結合させる工程
(d):前記センサチップの透明支持体を介して前記金属膜に励起光を照射して表面プラズモンを生じさせ、該表面プラズモンにより蛍光色素を励起させて蛍光を生じさせ、該蛍光の蛍光量を測定する工程
【請求項2】
前記ナノ構造体の体積平均粒径は、1nm以上、50nm以下であることを特徴とする請求項1に記載の定量分析方法。
【請求項3】
前記ナノ構造体は、前記ナノ構造粒子上に複数の前記第3リガンドが固定されてなることを特徴とする請求項1または2に記載の定量分析方法。
【請求項4】
前記第3リガンドは、前記第2リガンドおよび前記第1リガンドに特異的に結合する第3リガンド(A)であり、
前記工程(a)〜(b)を任意の順でまたは同時に実施して、工程(c)〜(d)を順次実施し、
工程(c)において、前記ナノ構造体と前記第2リガンドとを接触させるとともに、前記ナノ構造体と前記第1リガンドとを接触させて、前記ナノ構造体に前記第2リガンドおよび前記第1リガンドを結合させる工程を実施することを特徴とする請求項1〜3の何れか一項に記載の定量分析方法。
【請求項5】
前記ナノ構造体は、金属で構成されたナノ構造粒子を含むことを特徴とする請求項1〜4の何れか一項に記載の定量分析方法。
【請求項6】
前記工程(a)、前記工程(b)及び前記工程(c)を順次実施することを特徴とする請求項1〜5の何れか一項に記載の定量分析方法。
【請求項7】
前記センサチップが、金属膜上に、さらにカルボキシメチルデキストラン層を備え、前記第1リガンドが該カルボキシメチルデキストラン層に固定化されてなることを特徴とする請求項1〜6の何れか一項に記載の定量分析方法。
【請求項8】
透明支持体、該透明支持体上に形成された金属膜、および該金属膜上に固定され、かつアナライトに特異的に結合する第1リガンドを備えたセンサチップと、
表面プラズモンにより励起されて蛍光する蛍光色素を有し、かつ前記アナライトに特異的に結合する第2リガンドと
ナノ構造粒子、および第2リガンドに特異的に結合する第3リガンドを有し、該第3リガンドが該ナノ構造粒子上に固定されてなるナノ構造体と、
を含み、
表面プラズモン励起増強蛍光分光法によるアナライトの定量分析に用いるためのキット。
【請求項9】
透明支持体、該透明支持体上に形成された金属膜、および該金属膜上に固定され、かつアナライトに特異的に結合する第1リガンドを備えたセンサチップと、
表面プラズモンにより励起されて蛍光する蛍光色素を有し、かつ前記アナライトに特異的に結合する第2リガンドと
ナノ構造粒子、および第2リガンドに特異的に結合する第3リガンドを有し、該第3リガンドが該ナノ構造粒子上に固定されてなるナノ構造体とを用いた、表面プラズモン励起増強蛍光分光法によるアナライトの定量分析方法において、第1リガンドおよび第2リガンドとアナライトとの解離を抑制するために使用されるアナライト解離抑制剤であって、
ナノ構造粒子、および第2リガンドに特異的に結合する第3リガンドを有し、該第3リガンドが該ナノ構造粒子上に固定されてなるナノ構造体を含むことを特徴とするアナライト解離抑制剤。
【請求項1】
透明支持体、該透明支持体上に形成された金属膜、および該金属膜上に固定され、かつアナライトと特異的に結合する第1リガンドを備えたセンサチップと、
表面プラズモンにより励起されて蛍光する蛍光色素を有し、かつ前記アナライトに特異的に結合する第2リガンドと
ナノ構造粒子、および第2リガンドに特異的に結合する第3リガンドを有し、該第3リガンドが該ナノ構造粒子上に固定されてなるナノ構造体とを用いた、表面プラズモン励起増強蛍光分光法によるアナライトの定量分析方法であって、
下記工程(a)〜(c)を実施して、下記工程(d)を実施することを特徴とする定量分析方法。
工程(a):前記センサチップ上の第1リガンドと前記アナライトとを接触させて、該第1リガンドと該アナライトを結合させる工程
工程(b):前記第2リガンドと前記アナライトとを接触させて、該第2リガンドと該アナライトを結合させる工程
(c):前記第2リガンドと前記ナノ構造体とを接触させて、該第2リガンドとナノ構造体を結合させる工程
(d):前記センサチップの透明支持体を介して前記金属膜に励起光を照射して表面プラズモンを生じさせ、該表面プラズモンにより蛍光色素を励起させて蛍光を生じさせ、該蛍光の蛍光量を測定する工程
【請求項2】
前記ナノ構造体の体積平均粒径は、1nm以上、50nm以下であることを特徴とする請求項1に記載の定量分析方法。
【請求項3】
前記ナノ構造体は、前記ナノ構造粒子上に複数の前記第3リガンドが固定されてなることを特徴とする請求項1または2に記載の定量分析方法。
【請求項4】
前記第3リガンドは、前記第2リガンドおよび前記第1リガンドに特異的に結合する第3リガンド(A)であり、
前記工程(a)〜(b)を任意の順でまたは同時に実施して、工程(c)〜(d)を順次実施し、
工程(c)において、前記ナノ構造体と前記第2リガンドとを接触させるとともに、前記ナノ構造体と前記第1リガンドとを接触させて、前記ナノ構造体に前記第2リガンドおよび前記第1リガンドを結合させる工程を実施することを特徴とする請求項1〜3の何れか一項に記載の定量分析方法。
【請求項5】
前記ナノ構造体は、金属で構成されたナノ構造粒子を含むことを特徴とする請求項1〜4の何れか一項に記載の定量分析方法。
【請求項6】
前記工程(a)、前記工程(b)及び前記工程(c)を順次実施することを特徴とする請求項1〜5の何れか一項に記載の定量分析方法。
【請求項7】
前記センサチップが、金属膜上に、さらにカルボキシメチルデキストラン層を備え、前記第1リガンドが該カルボキシメチルデキストラン層に固定化されてなることを特徴とする請求項1〜6の何れか一項に記載の定量分析方法。
【請求項8】
透明支持体、該透明支持体上に形成された金属膜、および該金属膜上に固定され、かつアナライトに特異的に結合する第1リガンドを備えたセンサチップと、
表面プラズモンにより励起されて蛍光する蛍光色素を有し、かつ前記アナライトに特異的に結合する第2リガンドと
ナノ構造粒子、および第2リガンドに特異的に結合する第3リガンドを有し、該第3リガンドが該ナノ構造粒子上に固定されてなるナノ構造体と、
を含み、
表面プラズモン励起増強蛍光分光法によるアナライトの定量分析に用いるためのキット。
【請求項9】
透明支持体、該透明支持体上に形成された金属膜、および該金属膜上に固定され、かつアナライトに特異的に結合する第1リガンドを備えたセンサチップと、
表面プラズモンにより励起されて蛍光する蛍光色素を有し、かつ前記アナライトに特異的に結合する第2リガンドと
ナノ構造粒子、および第2リガンドに特異的に結合する第3リガンドを有し、該第3リガンドが該ナノ構造粒子上に固定されてなるナノ構造体とを用いた、表面プラズモン励起増強蛍光分光法によるアナライトの定量分析方法において、第1リガンドおよび第2リガンドとアナライトとの解離を抑制するために使用されるアナライト解離抑制剤であって、
ナノ構造粒子、および第2リガンドに特異的に結合する第3リガンドを有し、該第3リガンドが該ナノ構造粒子上に固定されてなるナノ構造体を含むことを特徴とするアナライト解離抑制剤。
【図1】


【図2】




【図2】


【公開番号】特開2013−53902(P2013−53902A)
【公開日】平成25年3月21日(2013.3.21)
【国際特許分類】
【出願番号】特願2011−191571(P2011−191571)
【出願日】平成23年9月2日(2011.9.2)
【出願人】(000001270)コニカミノルタホールディングス株式会社 (4,463)
【Fターム(参考)】
【公開日】平成25年3月21日(2013.3.21)
【国際特許分類】
【出願日】平成23年9月2日(2011.9.2)
【出願人】(000001270)コニカミノルタホールディングス株式会社 (4,463)
【Fターム(参考)】
[ Back to top ]

