被検体組織内の被分析物の濃度測定のための光音響分析方法及び光音響分析装置
【課題】被検体内対象組織で発生し伝播してきた超音波パルスに対して、対象組織内の被分析物濃度の非侵襲測定に対するバルク組織特性の影響を補償する。
【解決手段】被検体部位にレーザ源15−18から近赤外線レーザパルスを照射して対象組織に超音波パルスを発生させるステップaと、検出器32で超音波パルスを検出して第1信号を発生するステップbと、超音波パルスが吸光物質内で発生し組織を伝播して検出器で検出されるようにレーザー源と被検体部位の間に吸光物質を配置期間にステップbと波長とエネルギーとが同じレーザパルスを用いて対象組織内に超音波パルスを発生させるステップcと、吸光物質で発生した超音波パルスを検出して第2信号を発生するステップdと、第1、第2信号の強度比を各波長ごとに算出するステップeと、被分析物の吸光係数を強度比と吸光物質の光学特性とから算出するステップfと、算出された吸光係数から被分析物の濃度を算出し被分析物のモル吸光係数を算出するステップgとを備える。
【解決手段】被検体部位にレーザ源15−18から近赤外線レーザパルスを照射して対象組織に超音波パルスを発生させるステップaと、検出器32で超音波パルスを検出して第1信号を発生するステップbと、超音波パルスが吸光物質内で発生し組織を伝播して検出器で検出されるようにレーザー源と被検体部位の間に吸光物質を配置期間にステップbと波長とエネルギーとが同じレーザパルスを用いて対象組織内に超音波パルスを発生させるステップcと、吸光物質で発生した超音波パルスを検出して第2信号を発生するステップdと、第1、第2信号の強度比を各波長ごとに算出するステップeと、被分析物の吸光係数を強度比と吸光物質の光学特性とから算出するステップfと、算出された吸光係数から被分析物の濃度を算出し被分析物のモル吸光係数を算出するステップgとを備える。
【発明の詳細な説明】
【技術分野】
【0001】
本発明は、光音響相互作用を用いた、被検体対象組織内の被分析物の濃度測定のための非侵襲光測定のための方法及び装置である。より詳細には、本発明は、光音響信号の生成、伝播および検出への組織特性の影響を補償する方法であり、したがって、組織内の被分析物の定量分析につながる。
【背景技術】
【0002】
光音響測定は、近赤外線光の組織との相互作用の代替検出技術である。光音響分光法は、液体や気体の弱い吸光度を検出するために用いられる(非特許文献1参照)。組織は近赤外線レーザー光のパルスによって、レーザー励起の領域に吸収帯を有する分子に吸収される波長で励起される。引き続いた光学吸収は媒質に微小で局所的な加熱を生起させる。温度の上昇は急激な熱膨張を引き起こし、それは、測定セルの表面上または皮膚表面に配置されたハイドロホン、圧電素子、またはポリフッ化ビニリデン(PVDF)膜などの超音波トランスデューサにより検出できる超音波圧力波を生成する。
【0003】
光パルスの圧力(超音波)パルスへの変換は、光音響効果によりもたらされる。光の波長の関数としての測定された超音波パルスの強度のスペクトル分布の研究は、光音響分光法である。オレフスキーら(Oraevsky et al)は、学術誌論文(非特許文献2)にて、光音響分光法の理論について論じた。この技術に関する彼らの要旨は、組織を照射して生成した圧力は、以下の式のごとく媒質の吸光係数に関連していることを示した。
【0004】
ΔP=[(βv2)/Cp]μa.E0 (1)
この式は3つの項として表すことができる。
バルク媒質熱応答項(吸光係数)=[(βv2)/Cp]
吸光体の特性項=cm−1で表されるμa
源エネルギー・フルエンス項=cm2当りのジュール数で表されるE0
但し、
E0は、cm2当りのジュール数で表されるレーザー・フルエンスであり、
μaは媒質内の吸光種の吸光係数であり、
βは媒質または組織の熱膨張係数であり、(°K−1)
vは媒質または組織内の音速であり、
Cpは一定圧力下での媒質の比熱である。
【0005】
圧力波が媒質を横断した後に超音波トランスデューサによってパルス振幅として計測される光音響信号は、以下のように表される。
【0006】
PA=ΔP・RTDΛS (2)
但し、
PAは、光音響相互作用の結果として作り出された超音波のパルス振幅であり、
ΔPは、光音響相互作用の結果としての媒質内の圧力変化であり、
Rはレーザーパルス幅に依存する応力緩和因子であり、
Tは、インターフェースを介した音響伝達であり、
Dは、媒質または組織内の音響回折パターンであり、
Λは、媒質または組織=e−αd内の音波の減衰であり、αは媒質または組織内の吸光体の音響減衰係数であり、dは音パルスが移動する距離であり、
Sは、超音波検出器の応答である。
【0007】
式(1)から式(2)に代入すると以下となる。
PA=RTDΛS.[(βv2)/Cp]μa.E0 (3)
従来の研究は、(PA/E0)の値を被分析物の濃度(すなわち、その吸光係数μa)と相関させるが、それは、この測定された超音波パルスの全振幅が、対象元素種の吸光の結果として生成すると想定している。光音響信号の振幅変化のすべてが、媒質に添加された溶質の吸光係数μaの寄与(contribution)によるものというわけではない。媒質への溶質の添加は、その媒質の内部熱弾性特性および媒質中での超音波伝播に実際影響する。従って、グルコースの非侵襲測定の場合は、発生した超音波パルス振幅は媒質内の被分析物の吸光係数μaに依存し、また、式(3)内の別のパラメータにも依存する。
【0008】
媒質内の光音響から得られる測定された超音波パルスの振幅は、3つのパラメータ、すなわち、媒質の熱膨張係数β、媒質内の音速v、および定圧での媒質の比熱Cpに対する被分析物の濃度の影響に依存している。所与の溶液または組織で、グルコース濃度の上昇とともに音速vが増加する傍ら、溶液または組織のCpは減少してβが影響を受ける。グルコース吸光波長でレーザーパルスが溶液を励起すると、得られる超音波パルスの振幅の変化は、μa、v、Cpおよびβの変化によるものである。これらの3つのパラメータの相乗効果は、濃度の関数として光音響信号を増加させるが、それは濃度と光音響信号の間の関係をやや複雑にする。
【0009】
v、Cpおよびβの値は、組織の充填度(Packing)、組織の寸法(指または耳たぶのサイズなどの)、たこ(calluses)の存在や表面の凹凸といった被検体部位の表面特性に依存する。v、Cpおよびβすべてが温度と圧力によって変化するため、組織の熱弾性特性は、そこに印加される圧力およびその温度に依存する。
【0010】
計測された信号は、超音波パルスが生成した後の、その伝播に作用する因子に依存し、また、検出器の能力に依存する。このように、計測された信号は、応力緩和因子(R)、インターフェースを介した音響電圧(T)、組織内の音響回折パターン(D)、組織内の音波減衰(Λ)、および超音波検出器の応答(S)に依存する。パラメータR、TおよびSは機器の設定に依存する。パラメータDおよびLは人によって異なり、溶質濃度にも依存性がある。これらの3つの因子は人によって異なり、実験設定ごとに差が出るので、組織内の被分析物の濃度の直接測定を不可能にし、被分析物濃度の相対変化の監視のみを可能にする。
【0011】
トランスデューサ信号の振幅は、吸光種の濃度に関連した信号成分、および、生成ポイントから検出器までの超音波の生成と伝播への、媒質(組織)の影響に関連した信号成分の合成物である。
【0012】
パルス光音響(PA)技法は、A.A.カラブトフとA.A.オラエフスキー(A. A. Karabutov,A. A. Oraevsky)による本(非特許文献3)に論評されている。PA検出器は、励起された組織内の全ての被サンプリング容量内で生成した信号を全て収集し、シリコンまたはガリウムヒ素検出器の動作スペクトル域より長い波長で生成した信号を検出するので、光音響測定は近赤外検出法よりも検出感度において幾分優位にある。したがって、組織内の被分析物の測定のために光音響効果を利用することが重要である。しかし、組織内の被分析物を定量化する試みは、分子吸収の影響を、検出された超音波信号の生成と伝播に対するバルク熱弾性の影響から分離することができないことによって妨げられている。したがって、検出された超音波パルス振幅の生成と伝播への組織の内部特性の影響を分離する、あるいは補償することを可能にする方法が、光音響分光法を用いた組織内の被分析物の非侵襲測定のために決定的に重要である。
【0013】
ローゼンワイグ(Roscenwaig)の米国特許(特許文献1)は、物質の分析のための光音響測定の使用を提案したが、ヒト組織内の被分析物の測定のためにそれを使用することは開示していない。
【0014】
ダウリング(Dowling)は、公開された欧州特許出願(特許文献2)で、グルコースなどの血液分析測定のために光音響分光法を使用することを提案しているが、組織内のグルコース濃度を算出するための、超音波伝播に対する被検体部位の内部特性の影響を補償する方法は一切論じておらず提案もしていない。
【0015】
パテルおよびタム(PAtel and Tam)の米国特許(特許文献3)は、ナノ秒のレーザーパルスを用いて固体内に光音響効果を励起したが、それをヒト組織内の被分析物の測定のために使用することは開示していない。
【0016】
カロ(Caro)の、米国特許(特許文献4および5)は、生体内での血液成分の測定に光音響測定を吸光と組み合わせて用いることを提案した。カロは、グルコースの濃度を算出するために、組織内での超音波の生成と伝播に対する内部特性の影響を補償する方法は一切提案していない。
【0017】
マッケンジーら(McKenzie,et.)の国際特許公開(特許文献6)および米国特許(特許文献7)は、高音響エネルギーの方向に信号を計測する方法を述べた。マッケンジーらは、組織内でのグルコースの濃度を算出するための、組織内での超音波の生成と伝播に対する組織の熱弾性の影響を補償する方法は一切開示も教授もしていない。
【0018】
チャウ(Chou)の米国特許(特許文献8)は、プローブを用いて光音響信号を検出する方法を述べており、その方法は測定セル、参照セル、ウィンドウおよび差動マイクロフォンを含む。励起波長は1580〜1850nmおよび2050〜2340nmの範囲である。チャウは、組織内でのグルコースの濃度を算出するための、組織内での超音波の生成と伝播に対する組織熱弾性の影響を補償する方法は一切開示も教授もしていない。
【0019】
オラエフスキーとカラブトフの米国特許(特許文献9)は、パルス光音響法を開示しており、そこでパルス形状の分析が散乱係数に関する情報を与え、それは後にグルコースと相関される。オラエフスキーらは、組織内でのグルコースの濃度を算出するための、組織内での超音波の生成と伝播に対する組織の熱弾性の影響を補償する方法は一切開示も教授もしていない。
【0020】
このように、従来の光音響分光法は、ヒト組織内のグルコースの非侵襲測定のための実行可能な方法または実用的な装置を提供できなかった。それは、従来の方法が、組織の内部熱弾性特性の、ヒト組織内での超音波の生成と伝播に対する寄与の影響を軽視していたからである。従来の方法は、この、測定された信号におけるヒト組織内の超音波の生成と伝播に対する、ひいては測定されたヒト組織内のグルコース濃度に対する、組織の内部熱弾性特性の寄与の影響を補償する手段について論じていない。
【0021】
エプスタインら(Eppstein et al)の米国特許(特許文献11)は、連続的なレーザーパルスと、皮膚に接触させた導熱性吸光染料の使用を伴った、被分析物の濃度を監視するためのヒト皮膚のマイクロ穿孔(microporation)方法を開示した。レーザーと強度吸光染料との相互作用により発生した熱は、角質層を腐食して皮膚に穴を空けた。次に、空けられた穴から間質液が採取された。特許文献11の方法は、体液の試料採取を包含し、非侵襲光音響測定法については記述していない。ジャックら(Jacques et al)の米国特許(特許文献12)は、血液を化学分析用に採集するための、パルス・レーザーによるヒトの角質層の制御式除去方法を記述している。エプスタインとジャックによるパルス・レーザーの使用は、角質層を破壊せずに非侵襲方式でグルコースを測定するために組織内に光音響波を生成する目的ではなく、ヒト組織から体液サンプルを抽出する目的のものであった。
【特許文献1】米国特許第3,948,345号明細書
【特許文献2】欧州特許出願公開第0282234A1号明細書
【特許文献3】米国特許第4,303,343号明細書
【特許文献4】米国特許第5,348,002号
【特許文献5】米国特許第5,348,003号
【特許文献6】国際公開第98/38904号パンフレット
【特許文献7】米国特許第6,403,944号明細書
【特許文献8】米国特許第5,941,821号明細書
【特許文献9】米国特許第6,405,069号明細書
【特許文献10】米国特許第6,846,288号明細書
【特許文献11】米国特許第5,885,211号明細書
【特許文献12】米国特許第4,775,361号明細書
【非特許文献1】A.C.タム(A. C. Tam)による総論、「光音響感知技術の応用」(Appiication of photoacoustic sensing techniques)、現代物理学概説(Reviews of Modern Physics)、1986年第58巻第2号、p381−431
【非特許文献2】オレフスキーら(Oraevsky et al)、「レーザー誘起された過渡応力の時間分解検出による組織の光学特性の計測」(Measurement of tissue opticalproperties by time−resolved detection of laser−induced transient stress)、応用光学(applied optics)、1997年第36巻、p.402−415
【非特許文献3】A.A.カラブトフとA.A.オラエフスキー(A. A. Karabutov,A. A. Oraevsky)、「組織内の光学エネルギー分布測定のための光音響プロファイルの時間分解」(Time−resolved detection of optoacoustic profiles for measurement of optical energy distribution in tissues)、光学生物医学診断ハンドブック(Handbook of Optical Biomedical Diagnostics)、Valery V. Tuchin, Ed., SPIE Press, Billingham, WA, USA, 2002年、第10章、p585−646
【発明の開示】
【発明が解決しようとする課題】
【0022】
本発明の目的は、被検体内対象組織で発生し伝播してきた超音波パルスに対して、対象組織内の被分析物濃度の非侵襲測定に対するバルク組織特性の影響を補償する光音響分析方法及び装置を提供する。
【課題を解決するための手段】
【0023】
本発明のある局面において光音響分析方法は、信号に対する組織特性の変動の影響からの、および、組織の内部熱弾性特性に対する、対象被分析物またはその他の組織構成要素の影響からの、信号振幅に対する寄与なしで、被分析物の濃度と相関されることができる、正規化した信号に帰着する。本方法は、超音波の生成、伝播および伝播と検出に対する、組織とトランスデューサの影響の矯正も行う。
本発明の他の局面は、組織構成要素による短時間レーザーパルスの吸収によって誘起される超音波信号の生成と伝播への、可変な組織特性の影響を補償する方法である。
本発明の方法によれば、光音響信号は被検体部位に関して2つの相異なる条件下で生成し検出される。
a)ヘモグロビン、水、脂肪およびグルコースなどの被検体部位内にある自然吸光体を、この自然発生的な吸収分子に特有の波長で励起し、この吸収事象から得られる超音波パルスを検出する。
b)被検体部位の組織に結合されており周知の吸光度を有した外部吸光体を、ステップ(a)で用いたのと同じ温度、圧力および同じ波長で励起し、その外部吸光体の存在下でのこの吸収事象から得られる超音波パルスを検出する。
これら2つの信号および外部吸光体の光学特性を用いて、吸光係数、ひいてはヒト組織内の対象被分析物の濃度を割り出す。外部吸光体という用語は、媒質に付加された物質または生体系に強力に結合された別の物質を指す。それは、対象分子よりもずっと高い吸光係数で光を吸収し、その吸収は、対照被分析物の吸光の方式と同様に経時変化しない。
自然な状態での被検体部位内での光音響(PA)信号の励起と、生成して伝播された超音波信号の計測は、ヘモグロビン、水、グルコースまたは他の所望の被分析物の近赤外スペクトル吸収帯内の1つまたは複数の波長でのレーザーパルスを用いて被検体部位を照射することによって達成される。超音波信号は、組織内の自然吸光体(μa項)による光吸収によって光音響信号に対応する。それは、βおよびCpの変化による、組織の内部熱弾性特性の、パルス生成に対する影響による寄与も有する。その信号は、組織(Tissue)の機械的および音響伝播特性(v,DおよびΛ)に関する溶質の影響、インターフェースの影響および超音波検出器の応答からの寄与をも有する。
【0024】
本発明の一態様は、ヒト組織内のグルコースなどの被分析物の測定のための方法であって、a.ヒト組織内に、被検体部位を近赤外線短時間レーザーパルスで照射することによって超音波パルスを生成するステップと、b.各励起波長に付随した超音波パルスとして得られる第1の信号を検出するステップと、c.該組織外部のレーザー源と組織の間の光学経路に吸光物質を付加して、前記吸光物質内に超音波パルスが生成して前記組織内へと前記超音波検出器まで伝播するような形にして、同じレーザー波長とエネルギーを用いて同じ組織に超音波パルスを生成するステップと、d.該外部吸光物質の存在下で得られた第2の信号を、各波長で生成した超音波として検出するステップと、e.各照射波長において、ステップ(b)で生成したパルスの強度の、ステップ(d)で生成したパルスの強度に対する割合を算出するステップと、f.ステップ(e)において割り出された信号強度の割合と、外部吸光物質の所定の光学特性から組織内の被分析物の吸光係数を算出するステップと、g.ステップ(f)で算出された吸光係数と、光音響励起波長での被分析物のモル吸光係数から、被分析物の濃度を算出するステップと、を備えた方法である。
本発明の他の局面では、被検体部位の対象組織内の被分析物を測定して得られた信号に対する前記組織の内部特性の影響を補償する光音響分析方法において、前記被検体部位にレーザー源からの近赤外線レーザーパルスを照射することによって前記対象組織に超音波パルスを発生させるステップ(a)と、前記被検体部位近傍に配置された超音波検出器を用いて前記超音波パルスを検出して第1の信号を発生するステップ(b)と、前記超音波パルスが吸光物質内で発生して前記組織を伝播して前記超音波検出器で検出されるように前記レーザー源と前記被検体部位との間に前記吸光物質を配置している期間に、前記ステップ(b)とレーザー波長とエネルギーとが同じレーザーパルスを用いて前記対象組織内に超音波パルスを発生させるステップ(c)と、前記吸光物質で発生した超音波パルスを検出して第2の信号を発生するステップ(d)と、前記ステップ(b)で発生した第1の信号と前記ステップ(d)で発生した第2の信号と比を各レーザー波長ごとに算出するステップ(e)と、前記被分析物の吸光係数を、前記ステップ(e)で算出した比と、前記吸光物質の所定の光学特性とから算出するステップ(f)と、前記ステップ(f)で算出された吸光係数から前記被分析物の濃度を算出し、光音響励起波長における前記被分析物のモル吸光係数を算出するステップ(g)とを備える。
【発明の効果】
【0025】
本発明によれば、光音響測定において、超音波パルスの振幅に対して、被検体組織内の被分析物濃度の非侵襲測定に対するバルク組織特性の影響を補償することができる。
【発明を実施するための最良の形態】
【0026】
本発明の実施形態は、ヒト組織内での超音波パルスの生成および伝播に対する被検体部位の内部特性の寄与(contribution)の影響の、組織内に光音響効果によって誘起された超音波信号の振幅に対する影響を補償する手段を提供する。得られる正規化した信号を用いて、ヒト組織内の被分析物の濃度を測定する。
【0027】
本発明の実施形態の補償方法は、被分析物の濃度変化が、組織の内部特性、具体的にはβ、Cp、DおよびΛ、に与える影響からの、信号振幅に対する寄与なしで、被分析物濃度と相関させることができる光音響信号に帰結する。本方法は、さらに、超音波パルス(R、D、Λ、TおよびS)の伝播および検出への、組織とトランスデューサの影響を矯正する。
【0028】
本発明の実施形態は、光音響効果によって生成され、被検体部位を貫通して伝播する超音波信号への、可変な組織の内部特性の影響を補償する方法である。本方法は、ヒト組織内の被分析物の非侵襲測定を可能にする。
【0029】
本発明の実施形態の方法によれば、光音響信号は被検体部位に関して2つの相異なる条件下で生成し検出される。
a)ヘモグロビン、水、脂肪およびグルコースなどの被検体部位内にある自然吸光体を、この自然発生的吸光分子に特有の波長で励起し、この吸光事象から得られる超音波パルスを検出する。
b)被検体部位の組織に結合されており周知の光学濃度を有した人体の外部の吸光物質を、前のステップで用いたのと同じ温度と圧力および同じ波長で励起し、その外部吸光体の存在下で生起するこの吸収事象から得られる超音波パルスを検出する。
【0030】
人体内の自然吸光体から、および被検体部位外部の吸光物質からの2つの信号を、該外部吸光体の光学特性と併せて用いて、ヒト組織内のこれらの被分析物の吸光係数を測定する。被分析物の濃度は、吸光係数(absorption coefficient)を光音響励起波長での被分析物の吸光係数(extinction coefficient)で割ることによって算出される。本発明の実施形態の方法を説明したフローチャートが図1に示されている。
【0031】
人体内での光音響信号の励起、および被検体部位において自然の状態で生成した超音波信号の計測は、ヘモグロビン、水、グルコースまたは他の所望の被分析物の近赤外スペクトル吸収帯内に規定された波長でのレーザーパルスによって被検体部位を照射することによって達成される。超音波信号は、組織内の自然吸光体による光吸収の結果として生成した光音響信号に対応する。その信号はさらに、超音波パルスの生成と伝播への、組織の内部特性の影響からの寄与を受ける。さらに、信号はβ、Cp、v、DおよびΛといった、組織における熱弾性特性に対する被分析物の影響からの寄与を受ける。
【0032】
組織内に見出された自然吸収分子の励起から得られる測定された超音波パルスの強度は、以下のステップを備える。
a.自然発生的分子はレーザーパルスからの光を吸収する。
b.組織内に圧力波(超音波パルス)が生成し、組織の塊を貫通して検出器へと伝播する。
c.組織の内部特性が、得られる超音波パルスの生成と伝播に影響する。
d.検出器は超音波パルスを電気信号に変換し、その強度は収集効率とトランスデューサの感度に依存する。
被検体部位の外部にあり、組織と接触させられた吸光物質の励起から得られる、計測された超音波パルスの強度は、以下のステップを備える。
a.組織に結合された外部吸光物質は、その高い吸光度値(光学濃度)のために、レーザーパルスからの光の大部分を吸収する。
b.圧力波(超音波パルス)が、組織との界面での外部吸光層に生成し、組織の塊を貫通して検出器へと伝播する。
c.組織の内部特性が、得られる超音波パルスの生成と伝播に影響する。
d.検出器は超音波パルスを電圧信号に変換し、その強度は収集効率とトランスデューサの感度に依存する。
【0033】
被検体部位の外部にある吸光物質は、例えば励起に用いられる全波長において1.0を超えるような周知の高い光学濃度を有した物質(すなわち、光強度を90%を越えて吸収する)である。レーザーパルスが、被検体部位に結合された外部吸光体に作用するとき、超音波パルスが生成して被検体部位の組織に伝播する。組織に結合された外部吸光体の光音響励起から得られる超音波パルスが次いで計測される。組織内の自然発生的吸光分子の励起からの信号と、自然吸光体の存在下での信号を用いて、ヒト組織内のグルコース、ヘモグロビン、水および脂質などの、被分析物の濃度を算出する。
【0034】
超音波の反射を最低限にし、検出器の皮膚への正しい結合が本発明の実施形態の方法において用いられることを確実にするために、超音波イメージングで用いられる方法がいくつかある。従って、皮膚と検出器との間に高効率の結合を達成するために、超音波結合ジェルが塗布されることができる。高効率の結合を達成するために、皮膚と外部吸光体との間に塗布されることもできる。
【0035】
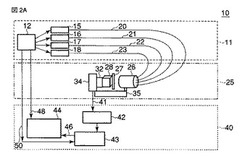
光源によるサンプルの照射と光音響信号の生成は、従来の機器と同様なデバイスによって達成されることができる。光音響信号の生成と検出のための装置構成例が図2Aに示されている。
【0036】
機器(10)は、光源モジュール(11)、体部インターフェースモジュール(25)、および検出エレクトロニクスモジュール(40)を備える。光源モジュール(11)は、電源(12)およびレーザー源(15〜18)を備える。レーザー源(15〜18)には石英光ファイバー(20〜23)がそれぞれ接続される。それらのファイバー(20〜23)は、光をサンプル(28)に集束させる集光レンズ(27)を収容したレンズ・ハウジング(26)の終端に接続される。圧電検出器(32)が、レンズの反対側に、ビームと伝送配置になって整列してホルダー(34)上に搭載されている。反射配置の場合は、検出器(32)および集光光学素子はサンプルと同じ側にあることになる。垂直配置では、検出器(32)および集光光学素子は互いに直角になる。他の角度での他の配置をも設計することができる。検出器の位置を変えて垂直配置(照射ビームに対して直角に)にすることも可能である。検出器(32)は、機構(35)を介して、周知の重みの付加により、または周知の重みの下で組織の移動を制御することにより、サンプルまたは被検体部位と密着して保たれる。
【0037】
検出電子回路・モジュール(40)は遮断コネクタ(41)と、増幅器(42)と、デジタルストレージスコープ(43)と、制御PC(44)とを備える。PC(44)は信号線(46)によってスコープ(43)に接続され、信号線(48)によって光源モジュール11の電源(12)に接続されている。電源(12)は信号線(50)によってスコープ(43)にも接続されている。
【0038】
本実施形態では、検出器(32)として、国際公開第2004/1042382A1号パンフレットに記載された超音波トランスデューサを用いる。このトランスデューサは反射モードで用いられ、その場合逆伝播した超音波パルスが検出される。チタン酸鉛を含有した単結晶の形状の圧電デバイスは、一般式Pb[(B1,B2)1−x Tix]O3で表され、端数x=0.5〜0.55であり、B1はZn、Mg、Ni、Sc、InおよびYbから選択される元素を表し、B2はニオブ、Nbおよびタンタル、Taから選択される1元素を表す。これらのPZNTトランスデューサとして知られる結晶性トランスデューサは、近赤外光を通し、超音波を検出することができる。それゆえPZNT結晶が、光励起の窓口かつ光パルスによって生成した超音波の検出器として用いられる。
【0039】
別の実施形態では、PZNT結晶が、ヒトの皮膚の音響伝播特性に一致する音響伝播特性を有したポリマーフィルムで被覆される。
【0040】
他の装置構成例が図2Bに示されている。機器は、光源モジュール(100)、体部インターフェースモジュール(110)、および検出エレクトロニクスモジュール(120)を備える。光源モジュール(100)は、電源(103)およびランプ等の光源(102)を備える。光源(102)には石英光ファイバー(104)が接続される。ファイバー(104)は、光をサンプル(113)に集束させる集光レンズ(112)を収容したレンズ・ハウジング(111)の終端に接続される。圧電検出器(114)が、レンズの反対側に、ビームと伝送配置になって整列してホルダー(115)上に搭載されている。反射配置の場合は、検出器(114)および集光光学素子はサンプルと同じ側にあることになる。垂直配置では、検出器(114)および集光光学素子は互いに直角になる。他の角度での他の配置をも設計することができる。検出器の位置を変えて垂直配置(照射ビームに対して直角に)にすることも可能である。検出器(114)は、機構(116)を介して、周知の重みの付加により、または周知の重みの下で組織の移動を制御することにより、サンプルまたは被検体部位と密着して保たれる。
【0041】
検出電子回路・モジュール(120)は遮断コネクタ(117)と、増幅器(121)と、デジタルストレージスコープ(123)と、制御PC(125)とを備える。PCは信号線(124)によってスコープ(123)に接続され、信号線(126)によって光源モジュール(100)の電源(103)に接続されている。電源(103)は信号線(127)によってスコープ(123)にも接続されている。
【0042】
生体内実験のため、サンプルは、石英セル内に配置されるが、それは1μmの金の層で被覆されたPZNT超音波検出器に一つの側を接触させている。図3は、媒質に添加されて905nm、1459nm、1550nmおよび1649nmで照射されたグルコースの、濃度の関数としての光音響信号を示す。グルコースに対する1459nm、1550nmおよび1649nmでの信号のプロットから、3本の線図が得られた。1459nmは水の吸光波長であり、1550nmと1649nmはグルコースの波長である。グルコース水溶液が905nm以下で励起された場合は、グルコース濃度に対する光音響信号の検出できる依存性は皆無であった。
【0043】
図3は、905nmでのPA信号(光音響信号)には勾配がゼロであり、その実験で用いられた濃度(0−20g/dL)ではPA信号が皆無であったということを示している。1459nmでは線として適合することができるPA信号が存在し、PA(mv)at1459nm=11.366[グルコースg/dL]+7.7661,R2=0.9757であった。1550nmと1649nmで励起された場合は、直線として適合することができる、より弱いPA信号があり、PA(mv)at1550nm=5.1247[グルコースg/dL]+5.0825、R2=0.9569、および、PA(mv)at1649nm=5.2031[グルコースg/dL]+9.3373、R2=0.9224であった。1459nmでのグルコース濃度に対するPA信号の線形勾配は、1550nmおよび1649nmにおけるグルコース吸光波長の線形勾配の二倍であった。
【0044】
水吸光波長の1459nmで励起された光音響信号の挙動は予期せぬものであった。グルコース濃度の上昇とともにパルス振幅が増加した。それは、超音波パルスの生成を後に伴う1459nmでの吸光プロセスは、グルコース濃度が増えると強度が増加するということを示した。光音響信号がグルコース分子による吸光によるものだとすれば、溶液の超音波パルス振幅と赤外吸光スペクトルが一致するか、または、少なくとも光音響信号の変化と平行に変化するはずである。
【0045】
図4は、グルコース溶液の赤外線吸光スペクトル(1mmセルで、ブルーカー(Bruker)FT−IR分光計で実施)を示す。1459nmでの光吸収はグルコースの濃度上昇とともに減少し、それは図3で示したグルコース濃度の関数としてのPA信号挙動と全く対照的である。水吸収帯でのグルコースの吸光度の減少は当技術分野で周知であり、グルコース分子による水分子の置換に起因する。
【0046】
1459nmで励起された光音響信号と、1459nm前後のグルコース水溶液の近赤外吸収信号との間には相違がある。これらのグラフでは、グルコース水溶液の光音響信号と吸水波長はグルコース濃度に依存するということが明白である。その依存性の1つの解釈としては、水が1459nm光子を吸収して、光音響信号が生成し、次いで、特にグルコース濃度の、溶液の内部特性に対する影響で、媒質により変調されたということである。これらの溶液の内部特性は、それがセルを通して検出器へと伝播されるとき、式(3)におけるβ、v、Cp、DおよびΛの値を含む。こうして従来技術の光音響分光法は、グルコース濃度などの被分析物濃度などが媒質の内部熱弾性特性に対して及ぼす影響が、光音響信号の強度に対して果たす役割を軽視している。
【0047】
媒質の内部熱弾性特性ひいては光音響信号の振幅に対する、グルコースなどの添加溶質濃度の影響の別の例が図5に示されている。905nmでcm当り2単位の光学濃度を有する固定量の近赤外吸光染料を含有した0.9%塩化ナトリウム溶液でグルコース濃度が調整された。4つの線形応答プロットが得られた。最強の光音響信号は905nmでの励起で得られ、そこではグルコースも水も目立つ吸光度がなく、近赤外吸光染料アシッドブラック2(ニュージャージー州アクロース・オーガニックス(Acrose Organics)製で、ペンシルバニア州ピッツバーグ、フィッシャー・サイエンティフィック(Fischer Scientific)供給の水溶性ニグロシン)は905nmで大きな吸光度値を示した。
【0048】
図5におけるPA信号強度は、図3に示した純水の場合と比べると、外部吸光体ニグロシン染料の存在下では6倍に増えた。グルコース濃度の関数としての905nmでの超音波パルス振幅は、図3の純水でゼロ応答だったのに比べて最高の応答を示した。対グルコース濃度のPA信号は、一次方程式、PA(mv)at905nm=79.246[G g/dL]+44.144に適合する。勾配はグルコース1グラムにつき79mvであった(r2=0.997)。水の波長1459nmでのパルス振幅は、PA(mv)at1459nm=16.3[G g/dL]+44.144、R2=0.965であり、勾配は図3の水の場合の勾配と近かった。グルコース波長の1550nmおよび1649nmでのパルス振幅は、PA(mv)=5.6[G g/dL]+5.4,r2=0.92であり、染料を含まない水溶液の場合と同様であった。グルコースまたは水によるPA信号は、905nmにその最大吸光度を有する高吸光ニグロシン染料の存在によって影響を受けなかった。ニグロシン染料吸光波長での強い光音響信号は、添加された外部吸光体、この例の場合はニグロシン、が光を吸収して光音響パルスを生成し、それが、溶液の内部熱弾性特性、すなわち、式(1)および(2)のβ、vおよびCpの値、に対するグルコース濃度の影響によって変調されたということを改めて示唆している。このように従来技術の光音響分光法研究は、媒質の内部熱弾性特性に対して、グルコースまたは他の溶質の影響が果たす役割を軽視していた。従来技術の光音響分光法は、グルコース濃度の、組織の熱弾性特性に対する、ひいては検出される超音波パルス振幅の強度に対する影響を考慮することはなく、光音響信号を、グルコース分子などの溶質分子による光吸収に起因するものとしていた。
【0049】
第3の例が図5に示されている。犬の血液から作られて、可変な濃度のグルコースを含有した0.9%の塩化ナトリウム溶液に懸濁された固定赤血球の懸濁液の光音響信号が、グルコース濃度に対してプロットされている。905nmでグルコース濃度の関数としてプロットされた光音響信号は、グルコース1グラム当り17.3mVの線形最小二乗に適合する勾配を示した(r2=0.995)。水の波長1459nmでの光音響信号は、グルコース1グラム当り18.5mVの勾配を示し(r2=0.994)、グルコース波長の1550nmおよび1649nmでの光音響信号は、グルコース1グラム当り約5.9mVという同じ勾配を示した(r2=0.904)。ヘモグロビン吸光波長905nmでの強い光音響信号は、グルコース水溶液系に添加されると、固定赤血球が外部吸光体として働いたということを再び示している。固定赤血球は光を吸収して光音響信号を生成し、それが、溶液の内部熱弾性特性、すなわち、式(3)のβ、v、Cp、DおよびΛの値、に対するグルコース濃度の影響によって変調された。
【0050】
犬の固定赤血球の1:50懸濁液を用いて同じ実験を繰り返し、図6Bに示すPA信号を得た。一次方程式は、
PA(mv)at905nm=16.3[Gg/dL]+14.747,R2=0.983
PA(mv)at1459nm=19.641[Gg/dL]+7.7765,R2=0.995
PA(mv)at1550nm=5.616[Gg/dL]−3.07,R2=0.977
PA(mv)at1649nm=7.283[Gg/dL]+4.205,R2=0.965
1459nm、1550nmおよび1649nmでの勾配の強度は、図6Aの犬の固定赤血球の1:100希釈物の場合、図5のニグロシン染料の場合、および図3に示した純水の場合と同様であった。905nmで励起され犬の固定赤血球の1:50懸濁液を含有したグルコースのPA信号は、図6Aの犬の固定赤血球の1:100希釈物の場合よりも低い勾配を有した。より高濃度の懸濁液による光散乱が、この波長のPA信号に影響を与えた可能性がある。
【0051】
このように、グルコース測定のための従来技術の光音響分光法は、媒質(組織)の内部熱弾性特性に対する、グルコースまたはその他の溶質の影響が果たす役割を軽視していた。従来の方法は、後に検出される光音響信号を生成するエネルギー吸収体としてのグルコースの影響を、媒質または組織の内部熱弾性特性の改質剤としてのグルコースの役割から分離していない。従来技術では、媒質の熱弾性特性ひいては測定された信号の改質に対する、グルコースまたは他の対象被分析物の寄与を矯正する試みがなされていない。従来技術は、計測された信号に対する、バルク組織特性の影響を矯正する方法を論じていない。
【0052】
従来技術は、ニグロシン染料添加の場合、または、ヘモグロビンを含有した犬の固定赤血球の場合に示した如くの、媒質の内部熱弾性特性に対する溶質の影響の測定における、外部または添加された吸光体の使用について論じていない。
【0053】
従来技術は、媒質の外部に吸光体を加えたことの結果として生成した超音波パルスの振幅を変更するにあたっての媒質構成要素の役割についても論じていない。別の吸光体(システムに付加された)によって生成したパルスの振幅の変更は、905nmのレーザーパルスによってグルコース濃度の関数として励起されたニグロシン染料からの光音響信号間の線形関係の場合で示されている。別の例は、グルコース濃度の増加に伴う、水の光音響信号の増加である。媒質の熱弾性特性に対する溶質の影響の第3の例は、固定赤血球の光音響信号と添加されたグルコースの濃度の間の線形関係である。
【0054】
上記に論じた生体内の実験では、外部吸光体が媒質に添加された。被検体部位への生体内光音響実験の場合は、外部吸光体は、皮膚に塗布される染料、皮膚と接触させられる周知の光学濃度(OD)を有したフィルム、または、検出器として励起の窓口として用いられるPZNT結晶のポリマーコーティングに配合された染料、または他の同様な吸光物質の形態であってよい。この場合PZNTトランスデューサが反射モードで用いられ、そこで逆伝播した超音波パルスが検出される。
【0055】
本発明の実施形態の外部吸光体は対象波長での周知の高い光学濃度を有している。この光学濃度は、光パルスの光音響信号を励起する能力を消さずに信号に影響を与えるのに十分なほど大きくなければならない。例えば、励起に用いられる全波長で、0.5から1.0の間である。光学濃度1.0で、添加された物質は入射光強度の90%より多くを吸収する。外部吸光体は2.0より高い光学濃度を有している(すなわち、光強度の99%を超えて吸収する)。レーザーパルスが被検体部位の組織に結合された外部吸光体に作用するとき、超音波パルスがその被検体部位に伝播する。組織内の自然吸収化合物と、外部吸光体の、生成した光音響信号に対する寄与の比較が表1に示されている。
【表1】

【0056】
光音響信号は2つの異なる配置で検出されることができる。第1の配置は、励起光ビームと検出器が被検体部位の逆の側にある、インラインまたは透過配置である。ビームと検出器はインラインでも、または、直接の光が検出器に作用する可能性を避けるためにオフラインであってもよい。別の配置は、励起光ビームと検出器の両方が被検体部位の同じ表面上にある反射配置である。この配置は光音響イメージングに用いられる。イメージングと分析用途でのPZNT検出器の使用は、国際公開第2004/042382号パンフレットに開示されている。
【0057】
外部に付加された吸光体は中性濃度フィルター(銀粒子を含有したラッテン(Wratten)ゼラチンフィルターなど)、露光され現像された写真フィルムまたはX線フィルム、高吸光係数近赤外吸収染料で被覆されたフィルム、カーボンブラック粒子被覆フィルム、染料、着色ポリマー粒子および同様のものであってよい。外部吸光体は、単結晶圧電トランスデューサ(PZNT)のポリマーコーティング材料に含有されていてもよい。その場合PZNTトランスデューサは反射モードで用いられ、逆伝播した超音波パルスが検出される。
【0058】
外部付加吸光体はレーザーパルスのエネルギーの大部分を効率よく吸収し、それを、被検体部位の中に伝播して検出器に到達し組織の内部特性、被検体部位の寸法、およびその表面の特徴に関する信号を与える超音波エネルギーに変換する。組織の内部特性、被検体部位の寸法、およびその表面の特徴ならびにその被検体部位に埋設された異質な構造は、光パルスから超音波パルスへの効率よい変換条件下で生成した超音波パルスの振幅に影響を及ぼす。全光エネルギーが外部吸収層に吸収され、それ故同じ実験条件下で計測される同じ被検体部位に関して伝播信号が一定となることが好ましい。
【0059】
(PA)NAは、ヘモグロビン、水またはグルコースなどの、被検体部位内の自然発生的な吸収分子による光吸収による光音響信号である。(PA)NAは以下で表されることができる。
【0060】
(PA)NA=RTDΛS.[(βv2)/Cp]bulk(μa)NAE0 (4)
但し、(μa)NAは、ヘモグロビン、水またはグルコースなどの、対象被分析物の光吸収を表す項であり、式(4)の(μa)NAは、この被分析物の濃度の変化の、吸光プロセスおよび光音響信号生成に対する影響を表す。((βv2)/Cp)bulkとして表される式(4)の第二項は、媒質の内部熱弾性特性を表し、RTDΛSの積は組織内の音響伝播を表す。
【0061】
測定の必要がある被分析物よりもODすなわち吸光係数が高い外部吸光体を付加すると、得られる信号は式5によって表される。(PA)EAは、付加された外部吸光体の存在下で生成する光音響信号である。それは以下のように表される。
【0062】
(PA)EA=RTDΛS[(βv2)/Cp]bulk(μa)EA.E0 (5)
但し、(μa)EAは付加された外部吸光体の光吸収を表す項である。それは意図的に高い吸光度を有し、したがって、この被分析物の濃度の、組織内の吸光プロセスおよび光音響信号の生成に対する影響とは別個のものである。式(4)および(5)の、RTDΛSおよび[(βv2)/Cp]bulkとして表された別の項は、組織内の音響伝播と組織の内部熱弾性特性を表し、自然吸光体の場合と同様である。
【0063】
照射エネルギー、吸光、圧縮波の生成および超音波パルスの検出に関する従来技術の光音響信号の式は、完全な効率での、光の組織への結合、および生成した圧縮波の組織界面への結合、ひいては検出器への結合を想定している。より説明的な式では、式(4)および(5)に倍数因子γを導入してこれらの結合効率を勘案するべきであるが、それは以下の式をもたらす。
【0064】
(PA)NA=γNARTDΛS[(βv2)/Cp)bulk](μa)NA.E0 (6)
および、
(PA)EA=γEARTDΛS[(βv2)/Cp]bulk](μa)EA.E0 (7)
但し、γNAおよびγEAは2つの光音響測定の結合効率項である。
【0065】
本発明の実施形態の方法の重要な態様は外部吸光体である。その目的は、皮膚に照射される光強度を減衰することではなく、以下の特性に基づいて光強度を吸収し、音響信号に変換することである。
【0066】
1)外部吸光体は、測定対象の被分析物よりもずっと高い吸光係数を有している。
2)外部吸光体は極めて薄く、皮膚上の染料層は数マイクロメートルの厚みといったところである。外部吸光体の別の形態は吸光体を上に有した薄膜である。その膜と吸光体の厚みは100μm程度である。
3)外部吸光体は組織、この場合は皮膚に効率よく結合されており、その結合は超音波と、伝熱ジェルまたは接着剤の使用によって影響されている。
4)外部吸光体はそれ自体には内部特性がない。そのかわり、それは光を吸収して熱に変換し、それが、結合先の組織内への圧力波の生成につながる。
5)組織への機械的応力の伝達が、得られる超音波パルスの伝播を、組織の内部特性に制御させる。
【0067】
このように、式(7)の項[(βv2)/Cp)bulk]および項R、DおよびΛは、式(6)の同じバルク組織特性に関する。組織に結合された外部吸光体内での光音響信号の励起および組織への機械的応力の伝達は、吸光体層または皮膚に熱融解によって穴を開けることのないような低エネルギーのレーザーパルスで実行される。皮膚上への強い吸光体およびレーザーパルスの使用が皮膚に穴を開けることは、エプスタインらにより米国特許第5885211号明細書にて記述された。このように本発明の実施形態の目的は、皮膚へのダメージ、角質層の除去、あるいは皮膚に穴が開くこと、を防止しながら組織内に光音響信号を励起することである。
【0068】
次に各波長(PA)NAおよび(PA)EAで生成した2つの計測信号を用い、自然状態のPAを、外部吸光体が付加された場合の光音響信号の強度で割って、割合(PA)NA/(PA)EAを算出した。得られた割合は、組織内の吸収種(ヘモグロビン、水およびグルコース)から生成した正規化した信号の、より高い吸光度で生成されて超音波エネルギーへと変換される信号に対する割合である。各波長における、光音響(自然状態)の、光音響(外部吸光体)に対する割合は、以下に示す演算でさらに用いられる。
【0069】
式(6)を式(7)で割ると、
[(PA)NA/(PA)EA]=(γNA/γEA).[(μa)NA/(μa)EA] (8)
所与の機器と実験条件での式(8)の結合効率は以下のように表すことができる。
Γ=(γNA/γEA) (9)
(γNA/γEA)と外部吸光体としての吸光係数を代入すると、
(μa)EA=2.303[(OD/l)EA (10)
サンプルに付加した、またはサンプル表面に塗布した染料を使用した場合、外部吸光体の吸収係は式10aで表されることができる。
(μa)EA=2.303εNACNA (10a)
式(10)における光学パラメータODは、同じ波長λにおける付加した外部吸光体の光学濃度であり、lは自然吸光体の厚みである。式(9)におけるこれらの表現を置換すると式(11)となる。
[(PA)NA/(PA)EA]λ=Γ[(μa)NA/2.303[(OD/l)EA]λ (11)
式(11)を用いて自然吸光体(μa)NAの吸光係数を求めることができ、この場合自然吸光体は、水、グルコース、ヘモグロビン、その他同等物を含む分子代謝産物のグループのうちの1つである。自然吸光体は、組織内でのその濃度を追跡するために重要な、化学療法薬または光療法薬またはその他の分野の薬であってよい。
【0070】
自然吸光体の吸光係数を以下のように表す。
(μa)NA=2.303εNACNA (12)
εNAは、波長λでの自然発生被分析物のモル吸光係数(molar extinction coefficient)(またはモル吸光係数(molar absorption coefficient))であり、CNAは自然吸光体のモル濃度であり、以下の式へと導かれる。
[(PA)NA/(PA)EA]λ=Γ.[2.303εNACNA/2.303[(OD/l)EA]λ (13)
すると、自然発生的な吸光体、つまり組織内の対照被分析物のモル濃度は、以下で表されることになる。
CNA=Γ−1.[(PA)NA/(PA)EA]λ.[(OD/l)EA〜/εNA]λ (14)
なお、「A〜」は「A」の上部に「〜」が配置されることを表す表記である。この式は、組織内の自然発生的な吸光体(水、ヘモグロビン、グルコースまたは同等物といった)の絶対モル濃度を表す。組織内の自然発生的な被分析物のモル濃度は以下に関連して表現される。
a.自然発生的な吸光体による光音響信号
b.付加された外部吸光体の存在下での光音響信号
c.付加された外部吸光体の光学濃度
d.付加された吸収層の厚み
e.同じ波長における自然発生的な吸光体の吸光係数
濃度は、リットル当りのモルから、組織内のグルコースのmg/dL、ヘモグロビンのg/dL、または水の%といった慣例的な臨床濃度単位へと変更されてよい。本発明の実施形態の方法は、図1のフローチャートに示す。
【0071】
自然発生的な吸光体を励起する場合の第1の計測γNAの結合効率が、外部吸光体を励起する場合の第2の計測γEAと同じであれば、式14の結合効率項Γは、Γ=(γNA/γEA)=1であるということが導き出され、式(14)は以下に簡略化される。
【0072】
CNA=[(PA)NA/(PA)EA]λ.[(OD/l)EA〜/εNA]λ (15)
結合効率項Γは、被検体部位への計測デバイスの圧力、超音波検出器の収集効率、レーザー光源および光学素子の照射効率を組み込んでいる。圧力の制御、再配置のバリエーションおよび他の実験パラメータは、式(15)へと導かれる条件を達成するために極めて厳重である。別法として結合効率パラメータΓは、自然発生的な被分析物CNAの濃度を測定するために実験的に測定される。
【0073】
本発明の実施形態は、ヒト組織内のグルコースの測定方法であり、以下のステップを備える。
a.近赤外短時間レーザーパルスで被検体部位を照射することによりヒト組織内に超音波を生成する。
b.各波長において得られた超音波パルスとしての第1の信号を検出する。
c.同じレーザー波長とエネルギーを用いるとともに、組織の外部のレーザー源と組織の間に、組織に強固に結合させて吸光物質を挿入し、前記吸光物質内に超音波パルスが生成して前記組織を貫通して超音波検出器まで伝播するような形で、同じ組織内に超音波パルスを生成する。
d.前記外部吸光物質の存在下で得られた第2の信号を、各前記波長で生成した超音波パルスとして検出する。
e.各照射波長において、ステップ(b)で生成したパルスの強度の、ステップ(d)で生成したパルスの強度に対する割合を算出する。
f.前記組織内のグルコースの吸光係数を、ステップ(e)で求めた前記信号の強度の割合と、前記外部吸光物質の所定の光学特性から算出する。
g.ステップ(f)で算出された吸光係数からグルコースの濃度を算出し、該光音響励起波長における被分析物のモル吸光係数を算出する。
【0074】
本発明の実施形態の光音響分析方法によるグルコースの非侵襲測定の場合、1660nmなどの、グルコースの吸光度がより高い近赤外波長が、励起波長として用いられる。式(14)に値を代入すると以下となる。
【0075】
Cglucose=Γ−1.[(PA)NA/(PA)EA]@1660nm[(OD/l)EA〜/εglucose]@1660nm (16)
食物負荷試験または経口ブドウ糖負荷試験といった異なる血液グルコース濃度で一連の光音響計測が実行された。Cglucose対[(PA)NA/(PA)EA]@1660nmがプロットされて、そのプロットの勾配はΓ―1と同じであると算出された。
【0076】
本発明の実施形態の方法の別の態様は、人体内のグルコースの測定方法であるが、外部吸光体も、少なくとも1つの波長においてはグルコースよりも高い吸光係数を有した、人体内の自然発生的な分子である。人体内の水も外部吸光体として用いられることができる。この場合少なくとも2つのレーザー波長が使われ、そのうち1つは水の近赤外吸収帯での波長であり、第2の波長は、近赤外領域にあるグルコースの倍音や結合音の吸収帯の波長である。
【0077】
本発明の実施形態の方法の別の態様は、水を外部吸光体として用い、少なくとも2つのレーザー励起波長を用いてヒト組織内のグルコースを測定する光音響法である。同一の測定で複数波長の計測を実行することにより、CglucoseとΓを測定するための1つの方法である。この実験では、自然吸光体(グルコース)のPA信号および外部吸光体(水)のPA信号が(少なくとも)2つの波長で測定される。1つの波長は、例えば1660nmの、グルコース吸光波長に選択される。第2の波長は1250nm、1400nm、1450nm、1459nmといったように水吸光波長で選択される。すると式(14)は以下のように書かれる。
【0078】
Cglucose=Γ−1.[(PA)NA/(PA)EA]@1660nm[(OD/l)EA/εglucose]@1660nm (16)
Cwater=Γ−1.[(PA)NA/(PA)EA]@1450nm[(OD/l)EA/εwater]@1450nm (17)
正常な人体内で維持されている厳密な電解質バランスによって、組織の水含有量はゆっくりと変動していて恒常的であると考えられ、例外は、脱水症、浮腫、腎不全などである。水分は恒常的であり、組織重量の約70%であると想定することが可能である。したがって組織内の水の濃度はリットル当たり0.70x55=38.5モルとなる。式(17)に代入すると2つの式(18)と(19)となる。
【0079】
38.5=Γ−1.[(PA)NA/(PA)EA]@1450nm[(OD/l)EA/εwater]@1450nm (18)
Γ−1=0.2579[(PA)NA/(PA)EA]@1450nm[(OD/l)EA/εwater]@1450nm (19)
そして結果的に、
Cglucose={0.2579[(PA)NA/(PA)EA]@1450nm[(OD/l)EA/εwater]@1450nm}−1x{[(PA)NA/(PA)EA]@1660nm[(OD/l)EA/εglucolse]@1660nm} (20)
Cglucose=38.5{[(PA)EA/(PA)NA]@1450nm[(PA)NA/(PA)EA]@1660nm}x[εwater@1450nm/εglucolse@1660nm]x[(OD/l)EA@1660nm/(OD/l)EA@1450nm (21)
Cglucose=38.5[(PA)NA@1660nm/(PA)NA@1450nm][(PA)EA@1450nm/(PA)EA@1660nm]x[εwater@1450nm/εglucolse@1660nm]x[(OD/l)EA@1660nm/(OD/l)EA@1450nm] (22)
自然吸光体(グルコース)に関する光音響信号の振幅の強度[(PA)NA@1660/(PA)NA@1450]、一波長でのグルコースのモル吸光係数の値、別の波長での水の吸光係数の値、および2つの波長での外部吸光体(水)の光学濃度から組織内のグルコース濃度が算出される。式(22)は、脱水症のない被検体で、浮腫、腎不全もない場合に適用される。
【0080】
本発明の実施形態の別の態様は、6つの光音響信号を3つの波長で用いて組織内のグルコース濃度を測定する方法である。これらの計測のうち3つは、標準状態の組織に、水励起波長とグルコース励起波長での信号を得るために実行される。他の3つの計測は、前述したように組織と接している外部吸光物質の存在下で実行される。水励起波長を含む複数の波長と外部吸光体を使用することは、人体の定常的な水分に関する推定なしにグルコースのNIR測定を可能にする。この場合、脱水症または浮腫が存在してもグルコースの測定が可能になり得る。
【0081】
こうして、組織内のグルコース濃度の非侵襲測定では、組織の水分に関する或る種の推定をせずに、計測は(少なくとも)3つの波長で実行されなければならない。これらの波長の1つは、水がかなりのNIR吸収度を有する波長である。想定できる1つの波長選択スキームは、グルコースには1550nmと1660nmの波長を選択し、水には1450nmの波長を選択することである。すると式(14)は式(23)(24)および(25)として書かれる。
【0082】
Cglucose=Γ−1.[(PA)NA/(PA)EA]@1550nm[(OD/l)EA/εglucose]@1550nm (23)
Cglucose=Γ−1.[(PA)NA/(PA)EA]@1660nm[(OD/l)EA/εglucose]@1660nm (24)
Cglucose=Γ−1.[(PA)NA/(PA)EA]@1450nm[(OD/l)EA/εwater]@1450nm (25)
これらの式を同時に解くと、組織内のグルコースのモル濃度Cglucoseが得られる。この場合1つの外部吸光体が用いられ、超音波パルス振幅は3つの近赤外波長で測定される。これらの波長のうち2つがグルコース吸光波長であり、3つ目のものが近赤外水吸収帯内にある。εwaterとεglucoseの値は、組織の温度と同温度(37℃)の水性媒質で、例えばフーリエ変換NIR機器を用いた独立した近赤外計測から測定される。
【0083】
別案として、超音波パルス振幅は、2つの水吸光波長と1つのグルコース吸光波長で測定されて以下の形式の式(11)の変形をもたらす。
【0084】
Cwater=Γ−1.[(PA)NA/(PA)EA]@λ1water[(OD/l)EA/εwater]@λ1water (26)
Cwater=Γ−1.[(PA)NA/(PA)EA]@λ2water[(OD/l)EA/εwater]@λ2water (27)
Cglucose=Γ−1.[(PA)NA/(PA)EA]@λglucose[(OD/l)EA/εGlucose]@λglucose (28)
これら3つの式は、グルコースのモル濃度Cglucoseと水のモル濃度Cwaterに関して解かれる。水のモル濃度は、組織の水和状態を査定するために用いられることができる。試験的計測は、外部吸光体のOD値が1つと、3つのレーザー照射波長での2段式実験である。
【0085】
したがって、本発明の別の実施形態は、組織の水和状態と、同組織内のグルコース濃度の測定のための光音響分析方法である。試験的計測は、外部吸光体の光学濃度(OD)値が1つと、3つのレーザー照射波長での2段式実験である。
【0086】
本発明のもう1つの実施形態は、組織内のグルコースの測定のための光音響分析方法である。組織内のCglucoseの測定のためのこの方法は、外部吸光体2つの光学濃度の値と、2つの照射波長の使用を伴う。この方法では、3つの光音響計測が実行される。
【0087】
ステップ(1)光路に外部吸光体が一切ない自然状態での超音波パルス振幅計測は、グルコース波長および水波長での(PA)NAをもたらす。
【0088】
ステップ(2)cm当りの光学濃度が(OD/l)EA1である外部吸光体層が光源と被検体部位の間に挿入され、第2の超音波パルス振幅計測が2つの波長で実行され、グルコースと水の波長での(PA)EA1を得た。
【0089】
ステップ(3)cm当りの光学濃度が異なる(OD/l)EA1である第2層の外部吸光体が光源と組織の間に挿入され、第3の超音波パルス振幅計測が2つの波長で実行され、グルコースと水の波長での(PA)EA2を得た。以下の3つの式(29)、(30)および(31)が生成し、解かれてグルコースのモル濃度、Cglucoseを得た。
【0090】
Cglucose=Γ−1[(PA)NA/(PA)EA1]@λglucose[(OD/l)EA1/εglucose]@λglucose (29)
Cglucose=Γ−1[(PA)NA/(PA)EA2]@λglucose[(OD/l)EA2/εglucose]@λglucose (30)
Cwater=Γ−1[(PA)NA/(PA)EA1]@λwater[(OD/l)EA1/εwater]@λwater (31)
式を解いて組織内のグルコースのモル濃度を割り出した。同じ手順を適用し、照射波長の適切な使用と、外部吸光体にとって適切なモル吸光係数と光学濃度を挿入することによって、組織内のヘモグロビン、脂質または水のモル濃度を測定することが可能である。水とヘモグロビンの測定は、患者の水和状態と貧血状態を、同患者の血糖状態とともに査定するのに役立つ。これら3つのパラメータの測定は、例えば糖尿病を患っている間容易に貧血または脱水症になりがちである高齢な患者の診療のために重要である。こうして本発明の実施形態の方法は、自らの糖尿病に加えて脱水状態または貧血を進行させる危険があるこれらの患者の健康状態のより高度な追跡を提供する。
【0091】
本発明の実施形態すべてにおいて、
1.レーザー波長のうち少なくとも1つは、被分析物に特有の波長である。
2.波長のうち少なくとも1つは、水に特有の波長である。
3.レーザーパルス継続時間は10−9〜10−6秒であるべきである。
4.検出器は、圧電性結晶(PZT、鉛、ジルコニウム、タンタル結晶)、ハイドロホンまたはポリフッ化ビニリデン(PVDF)膜である。
5.検出器は、圧電性結晶(PZNT、鉛、ジルコニウム、ヌイビウム(nuibium)、タンタル結晶)である。
6.検出器は、組織の音響インピーダンス特性と一致させるためにポリマー層で被覆されている。
7.外部吸光体は、分散カーボンブラック粒子などの高吸光係数吸光物質で被覆された膜である。
8.外部吸光体は、分散高濃度分散吸光染料などの高吸光係数吸光物質で被覆された膜である。
9.外部吸光体は、分散吸光染料などの高吸光係数吸光物質で被覆された膜である。
10.外部吸光体は、分散着色高分子材料などの高吸光係数吸光物質で被覆された膜である。
【0092】
以下の本発明の実施形態を詳細に説明する。
(第1実施形態) 外部吸光体アシッドブラック2の存在下でのグルコース水溶液の光音響応答
図1に説明した機器セットを用いて本発明の実施形態の方法を試験した。生体外実験として、サンプルは、ポリマー層で被覆されたPZNT超音波検出器にその一面を接触させた石英セルに入れられた。透過配置にある検出器にレーザービームが直接作用することを防止するため、1μm厚みの金フィルムが配置された。グルコース溶液(0−20g/dL)が調整された。グルコース溶液は、そのねじ込み口金を介して2つの連結テフロン(登録商標)管(Teflon(登録商標) Tube)を有する遠心分離機水薬瓶に入れられた。水薬瓶は一定温度の水経路に配置され、1CMの石英フローセル(quartz flow cell)とペリスタルティック・ポンプ(peristaltic pump)に結合された。計測中サンプルは循環された。図3は、905nm、1459nm、1550nmおよび1649nmで照射され、媒質に添加されたグルコースの濃度の関数としての光音響信号を示す。1459nm、1550nmおよび1649nmでのグルコースに対する信号のプロットから3つの線を得た。1459nmは水の吸光波長であり、1550nmおよび1649nmはグルコースの吸光波長である。グルコース水溶液が905nm以下で励起された場合は、検出できる光音響信号はなかった。
【0093】
グルコースの濃度変化から得られる光音響信号に対する、付加された外部吸光体の影響について調べた。固定量の近赤外吸収染料を含有した0.9%塩化ナトリウム溶液で、異なるグルコース濃度の溶液を調製した。近赤外吸収染料はアシッドブラック2(ニュージャージー州アクロース・オーガニックス(Acrose Organics)製、ペンシルバニア州ピッツバーグ、フィッシャー・サイエンティフィック(Fischer Scientific)供給の水溶性ニグロシン)であった。全溶液は、905nmで吸光係数μa=2.0CM−1(905nmでcm当り2単位の光学濃度)を有した。サンプルは、純水溶液の場合のように、1cmの石英フローセルで循環された。
【0094】
PA信号は905nm、1459nm、1550nmおよび1649nmで記録された。図5に示すように、4つの線形応答プロットがグルコース濃度の関数として得られた。グルコース濃度と線形に関連する最強の光音響信号は、905nmでの励起から得られ、そこではグルコースも水も、感知できる吸光度を有していない。それは、外部吸光体のニグロシン染料が、2.0CM−1のμa値を有した波長である。染料が光を吸収し、ニグロシン染料励起によるPA信号振幅が、内部熱弾性特性に対するグルコースの線形の関係により変調されたということが明白である。図5に示すように、グルコース濃度の変化に対する応答の強度は、グルコース溶液に加えられた外部吸光体の励起波長において最高となり、グルコースの吸光波長で最低となった。このように外部吸光体の使用は、水系媒質におけるグルコース濃度変化に対する光音響信号の感度を増強する。
【0095】
(第2実施形態) 外部吸光体として犬の固定赤血球の存在下でのグルコース水溶液の光音響応答
水系媒質内のグルコース濃度変化から得られる光音響信号に対する、ヒト血液のスペクトルを模倣する付加外部吸光体の影響について調べた。
【0096】
犬の固定赤血球の1:100希釈を含有した0.9%塩化ナトリウム溶液で、異なるグルコース濃度の溶液を調製した。ここでは新鮮な犬の赤血球で試験したが、赤血球に対するグルコースの浸透圧効果のためデータには再現性がなかった。顕微鏡精査では、高いグルコース濃度においては赤血球の収縮と異形が見られた。犬の赤血球はグルタルアルデヒド溶液を用いて固定され、紡がれ洗浄された。固定赤血球はヘモグロビンを収容した高分子嚢であり、時間経過とともに特性が変化することがない。添加した赤血球内のヘモグロビンは、システムに添加された外部吸光体として働く。
【0097】
PA信号は905nm、1459nm、1550nmおよび1649nmで記録された。図6Aに示すように、4つの線形応答プロットが、グルコース溶液内の犬の固定赤血球の1:100懸濁液に関して示されているグルコース濃度の関数として得られた。グルコース濃度と線形に関連する最強の光音響信号は、905nmでの励起から得られ、そこはグルコースも水も、感知できる吸光度を有していない。それは、外部吸光体である固定赤血球のヘモグロビンが光を吸収した波長である。ヘモグロビンが905nmで光を吸収し、ヘモグロビン励起によるPA信号振幅が、内部熱弾性特性へのグルコースの線形の関係により変調されたということが明白である。図6Aに示すように、グルコース濃度の変化に対する応答の強度は、グルコース溶液に加えられた外部吸光体の励起波長において最高となり、グルコースの吸光波長で最低となった。このように組織内のヒト血液を模倣する外部吸光体の使用は、水系媒質におけるグルコース濃度変化に対する光音響信号の感度を増強する。
【0098】
外部吸光体として犬の固定赤血球の1:50懸濁液を使用した実験を繰り返した。グルコース濃度の関数としての光音響信号の挙動は、1:100懸濁液の場合と同様であった。905nm波長は純水の場合、すなわちゼロ、よりも高かったが、1:100懸濁液の場合よりも少なかった。より高濃度な固定赤血球による散乱は信号に影響した。PA信号への散乱の影響は当技術分野で報告されている。そのデータを図6Bに示す。
【0099】
(第3実施形態) 外部吸光体として黒色高分子フィルムを加えた前と後の、被検体部位の光音響応答
被検体部位に生成する光音響信号への添加外部吸光体の影響を調べるため、図2Aにします光音響分析システムを用いた。905nm、1459nm、1550nmおよび1649nmの4パルスの固体レーザーである。各レーザーからの光は、光ファイバーによってレンズ・ハウジングに届けられた。レンズはレーザーパルスをヒトの指に集束した。
【0100】
被検体は、光学素子テーブルに手を載せ、その指をレンズハウジング(26)とPZNT検出器(32)の間に置いて実験室スツールに座った。検出器は、東芝メディカルシステムズ株式会社(日本、東京)で製造されたPZNT単結晶検出器で、検出器と皮膚の間の超音波結合損失を最低限にするためにインピーダンス適合ポリマーフィルムで被覆されたものである。検出器と接する指の側に超音波結合ジェルが塗布された。PZNT検出器からの信号は増幅されてテクトロニクス(Tektronix)社のデジタルストレージスコープにルーティングされた。レーザー・トリガーはラボビュー(LabView)ソフトウェアを用いたパーソナルコンピュータによって制御された。レーザー・トリガー・モジュールからのトリガー・パルスは、デジタルストレージスコープによるデータ取得を始動した。圧力過渡信号、すなわち検出された超音波信号の時間発展が記録された。各光音響励起波長でのデータから2つのパラメータが抽出された。第1に、レーザー・トリガー・パルスと圧力過渡信号の第1のピークの間の遅延時間である。この時間は、サンプルの厚みとその不透明度次第で5μsから15μsまでの幅がある。第2のパラメータは、第1の記録パルスの最高から最低までの振幅である。
【0101】
図7A、図7B、図7C、図7Dは、それぞれ905nm、1459nm、1550nmおよび1649nmで励起されたヒトの指から生成したPA信号を示す。図7A、図7B、図7C、図7Dまでの4つのグラフの実線は、自然状態での指の励起で生成した信号を表す。パルスの振幅は、励起の波長によって350mVから800mVまでの幅があった。
【0102】
次に、外部吸収フィルムがレンズと指の間に付加された。外部吸光体は、微小なカーボンブラックを拡散させた80μm厚みのポリエチレン・テレフタレート(PET)フィルムである。接着剤内のカーボン含有量は2%のアセチレン・ブラックであった。アセチレン・ブラック被覆フィルムの吸光スペクトルが近赤外FTIR機器(ブルーカーのエキノクス(Bruker, Equinox)55/S分光計)で実行された。外部吸光体の4つの励起波長での光学濃度は、905nmで4.12、1459nmで3.2、1550nmで3.12および1649nmで3.04であった。
【0103】
PETフィルム(外部吸光体)の小片が切り取られ、ポリマーの裏紙が剥離され、次いで、皮膚への効率良い結合を達成するため、その接着剤側が皮膚に触れるフィルムが皮膚に押し付けられた。指の、検出器と接触する側に超音波結合ジェルが塗布された。指はレンズホルダーと検出器の間に、レンズホルダーがフィルムを圧迫し、検出器が指の反対側の皮膚を圧迫するように置かれた。皮膚に印加されたレンズ・ハウジングと検出器の間の応力は200gであった。
【0104】
図7A、図7B、図7C、図7Dまでの4つのグラフの実線は、指と、外部吸光体としてアセチレン・ブラックを持つ付加PETフィルムの励起により生成した信号を表す。光音響信号は905nm、1459nm、1550nmおよび1649nmで励起された。パルスの振幅は、光音響信号の励起の波長によって560mVから4700mVまでの幅があった。重要な観測結果は、すべての波長における光音響信号振幅の増加である。この実施形態における被検者の指に関して、外部吸光体の添加によって光音響信号は次の増強を見た。905nm励起での信号は600mVから4700mVに増加、1459nm励起の信号は800mVから1700mVに増加、1550nm励起の信号は350mVから560mVに増加、そして1649nm励起の信号は350mVから660mVへと増加した。PA信号の振幅の最高の増加は、外部吸光体が最高の吸光度を有する905nmにおいて得られた。この実験の結果は、ヒトの指の皮膚への吸光フィルムの結合、および光音響信号の生成が可能であることを示唆している。増強された信号は、ヒトの指の皮膚に結合された高光学濃度外部吸光体による光の吸収と、指の組織内に超音波が生成してそれが指を介して伝達され、超音波結合ジェルによって指の反対側に結合された圧電検出器によって検出されたことによる。
【0105】
外部吸光体の存在下でのPA信号の挙動は、グルコース水溶液での生体外の実験の場合と同じであった。当業者は、信号強度、種々の波長における吸光体およびグルコースの吸光係数、本発明の実施形態の詳細な説明で説明した式を用いて、人体内でグルコースの濃度測定またはグルコースの濃度の変化を測定することができる。当業者は、線形最小二乗以外のデータ約分ルーチンまたは高度なデータ処理方法を用いて自然の吸収計測および外部吸光体の存在下での計測から得られた信号を、本発明の真髄から解離することなく処理することができる。
【0106】
なお、本発明は上記実施形態そのままに限定されるものではなく、実施段階ではその要旨を逸脱しない範囲で構成要素を変形して具体化できる。また、上記実施形態に開示されている複数の構成要素の適宜な組み合わせにより、種々の発明を形成できる。例えば、実施形態に示される全構成要素から幾つかの構成要素を削除してもよい。さらに、異なる実施形態にわたる構成要素を適宜組み合わせてもよい。
【図面の簡単な説明】
【0107】
【図1】本発明の実施形態の方法を示したフローチャートを示す。
【図2A】本発明の実施形態の方法で使用する光音響分析システムの構成例を示す。
【図2B】本発明の実施形態の方法で使用する光音響分析システムの他の構成例を示す。
【図3】本実施形態において、1cmの石英セル内のグルコース溶液から生成した光音響信号を示す。
【図4】本実施形態において、1459nm、1550nmおよび1649nmでのグルコース水溶液の赤外線吸光度を示す。
【図5】本実施形態において、アシッドブラック2染料という周知の添付吸光体(905nmで2.0光学濃度単位)の存在下でのグルコースの種々の濃度のPA信号を示す。
【図6A】本実施形態において、周知の添付吸光体として2%の犬の固定血球(905nmで2.0光学濃度単位)を1:100の希釈濃度の塩水存在下でのグルコースの種々の濃度のPA信号を示す。
【図6B】本実施形態において、周知の添付吸光体、2%の犬の固定血球(905nmで2.0光学濃度単位)を1:50の希釈濃度の塩水存在下でのグルコースの種々の濃度のPA信号を示す。
【図7A】905nmで励起されたヒトの指から生成した光音響信号を示す(実線)。破線は、付加された外部吸光体である、吸光体として炭素粒子を有するポリエチレン・テレフタレート(PET)フィルムでの信号である。905nmでのフィルムのODは4.2であった。
【図7B】1459nmで励起されたヒトの指から生成した光音響信号を示す(実線)。破線は、添加された外部吸光体である、吸光体として炭素粒子を有するPETフィルムでの信号である。1459nmでのフィルムのODは3.2であった。
【図7C】1550nmで励起されたヒトの指から生成した光音響信号を示す(実線)。破線は、添加された外部吸光体である、吸光体として炭素粒子を有するPETフィルムでの信号である。1550nmでのフィルムのODは3.12であった。
【図7D】1649nmで励起されたヒトの指から生成した光音響信号を示す(実線)。破線は、添加された外部吸光体である、吸光体として炭素粒子を有するPETフィルムでの信号である。1649nmでのフィルムのODは3.04であった。
【符号の説明】
【0108】
10…機器、11…光源モジュール、12…電源、15、16、17、18…レーザー源、20、21、22、23…石英光ファイバー、25…体部インターフェースモジュール、28…サンプル、27…集光レンズ、26…レンズ・ハウジング、32…圧電検出器、34…ホルダー、35…機構、40…検出電子回路・モジュール、41…遮断コネクタ、42…増幅器、43…デジタルストレージスコープ、44…制御PC、46…信号線、48…信号線、50…信号線。
【技術分野】
【0001】
本発明は、光音響相互作用を用いた、被検体対象組織内の被分析物の濃度測定のための非侵襲光測定のための方法及び装置である。より詳細には、本発明は、光音響信号の生成、伝播および検出への組織特性の影響を補償する方法であり、したがって、組織内の被分析物の定量分析につながる。
【背景技術】
【0002】
光音響測定は、近赤外線光の組織との相互作用の代替検出技術である。光音響分光法は、液体や気体の弱い吸光度を検出するために用いられる(非特許文献1参照)。組織は近赤外線レーザー光のパルスによって、レーザー励起の領域に吸収帯を有する分子に吸収される波長で励起される。引き続いた光学吸収は媒質に微小で局所的な加熱を生起させる。温度の上昇は急激な熱膨張を引き起こし、それは、測定セルの表面上または皮膚表面に配置されたハイドロホン、圧電素子、またはポリフッ化ビニリデン(PVDF)膜などの超音波トランスデューサにより検出できる超音波圧力波を生成する。
【0003】
光パルスの圧力(超音波)パルスへの変換は、光音響効果によりもたらされる。光の波長の関数としての測定された超音波パルスの強度のスペクトル分布の研究は、光音響分光法である。オレフスキーら(Oraevsky et al)は、学術誌論文(非特許文献2)にて、光音響分光法の理論について論じた。この技術に関する彼らの要旨は、組織を照射して生成した圧力は、以下の式のごとく媒質の吸光係数に関連していることを示した。
【0004】
ΔP=[(βv2)/Cp]μa.E0 (1)
この式は3つの項として表すことができる。
バルク媒質熱応答項(吸光係数)=[(βv2)/Cp]
吸光体の特性項=cm−1で表されるμa
源エネルギー・フルエンス項=cm2当りのジュール数で表されるE0
但し、
E0は、cm2当りのジュール数で表されるレーザー・フルエンスであり、
μaは媒質内の吸光種の吸光係数であり、
βは媒質または組織の熱膨張係数であり、(°K−1)
vは媒質または組織内の音速であり、
Cpは一定圧力下での媒質の比熱である。
【0005】
圧力波が媒質を横断した後に超音波トランスデューサによってパルス振幅として計測される光音響信号は、以下のように表される。
【0006】
PA=ΔP・RTDΛS (2)
但し、
PAは、光音響相互作用の結果として作り出された超音波のパルス振幅であり、
ΔPは、光音響相互作用の結果としての媒質内の圧力変化であり、
Rはレーザーパルス幅に依存する応力緩和因子であり、
Tは、インターフェースを介した音響伝達であり、
Dは、媒質または組織内の音響回折パターンであり、
Λは、媒質または組織=e−αd内の音波の減衰であり、αは媒質または組織内の吸光体の音響減衰係数であり、dは音パルスが移動する距離であり、
Sは、超音波検出器の応答である。
【0007】
式(1)から式(2)に代入すると以下となる。
PA=RTDΛS.[(βv2)/Cp]μa.E0 (3)
従来の研究は、(PA/E0)の値を被分析物の濃度(すなわち、その吸光係数μa)と相関させるが、それは、この測定された超音波パルスの全振幅が、対象元素種の吸光の結果として生成すると想定している。光音響信号の振幅変化のすべてが、媒質に添加された溶質の吸光係数μaの寄与(contribution)によるものというわけではない。媒質への溶質の添加は、その媒質の内部熱弾性特性および媒質中での超音波伝播に実際影響する。従って、グルコースの非侵襲測定の場合は、発生した超音波パルス振幅は媒質内の被分析物の吸光係数μaに依存し、また、式(3)内の別のパラメータにも依存する。
【0008】
媒質内の光音響から得られる測定された超音波パルスの振幅は、3つのパラメータ、すなわち、媒質の熱膨張係数β、媒質内の音速v、および定圧での媒質の比熱Cpに対する被分析物の濃度の影響に依存している。所与の溶液または組織で、グルコース濃度の上昇とともに音速vが増加する傍ら、溶液または組織のCpは減少してβが影響を受ける。グルコース吸光波長でレーザーパルスが溶液を励起すると、得られる超音波パルスの振幅の変化は、μa、v、Cpおよびβの変化によるものである。これらの3つのパラメータの相乗効果は、濃度の関数として光音響信号を増加させるが、それは濃度と光音響信号の間の関係をやや複雑にする。
【0009】
v、Cpおよびβの値は、組織の充填度(Packing)、組織の寸法(指または耳たぶのサイズなどの)、たこ(calluses)の存在や表面の凹凸といった被検体部位の表面特性に依存する。v、Cpおよびβすべてが温度と圧力によって変化するため、組織の熱弾性特性は、そこに印加される圧力およびその温度に依存する。
【0010】
計測された信号は、超音波パルスが生成した後の、その伝播に作用する因子に依存し、また、検出器の能力に依存する。このように、計測された信号は、応力緩和因子(R)、インターフェースを介した音響電圧(T)、組織内の音響回折パターン(D)、組織内の音波減衰(Λ)、および超音波検出器の応答(S)に依存する。パラメータR、TおよびSは機器の設定に依存する。パラメータDおよびLは人によって異なり、溶質濃度にも依存性がある。これらの3つの因子は人によって異なり、実験設定ごとに差が出るので、組織内の被分析物の濃度の直接測定を不可能にし、被分析物濃度の相対変化の監視のみを可能にする。
【0011】
トランスデューサ信号の振幅は、吸光種の濃度に関連した信号成分、および、生成ポイントから検出器までの超音波の生成と伝播への、媒質(組織)の影響に関連した信号成分の合成物である。
【0012】
パルス光音響(PA)技法は、A.A.カラブトフとA.A.オラエフスキー(A. A. Karabutov,A. A. Oraevsky)による本(非特許文献3)に論評されている。PA検出器は、励起された組織内の全ての被サンプリング容量内で生成した信号を全て収集し、シリコンまたはガリウムヒ素検出器の動作スペクトル域より長い波長で生成した信号を検出するので、光音響測定は近赤外検出法よりも検出感度において幾分優位にある。したがって、組織内の被分析物の測定のために光音響効果を利用することが重要である。しかし、組織内の被分析物を定量化する試みは、分子吸収の影響を、検出された超音波信号の生成と伝播に対するバルク熱弾性の影響から分離することができないことによって妨げられている。したがって、検出された超音波パルス振幅の生成と伝播への組織の内部特性の影響を分離する、あるいは補償することを可能にする方法が、光音響分光法を用いた組織内の被分析物の非侵襲測定のために決定的に重要である。
【0013】
ローゼンワイグ(Roscenwaig)の米国特許(特許文献1)は、物質の分析のための光音響測定の使用を提案したが、ヒト組織内の被分析物の測定のためにそれを使用することは開示していない。
【0014】
ダウリング(Dowling)は、公開された欧州特許出願(特許文献2)で、グルコースなどの血液分析測定のために光音響分光法を使用することを提案しているが、組織内のグルコース濃度を算出するための、超音波伝播に対する被検体部位の内部特性の影響を補償する方法は一切論じておらず提案もしていない。
【0015】
パテルおよびタム(PAtel and Tam)の米国特許(特許文献3)は、ナノ秒のレーザーパルスを用いて固体内に光音響効果を励起したが、それをヒト組織内の被分析物の測定のために使用することは開示していない。
【0016】
カロ(Caro)の、米国特許(特許文献4および5)は、生体内での血液成分の測定に光音響測定を吸光と組み合わせて用いることを提案した。カロは、グルコースの濃度を算出するために、組織内での超音波の生成と伝播に対する内部特性の影響を補償する方法は一切提案していない。
【0017】
マッケンジーら(McKenzie,et.)の国際特許公開(特許文献6)および米国特許(特許文献7)は、高音響エネルギーの方向に信号を計測する方法を述べた。マッケンジーらは、組織内でのグルコースの濃度を算出するための、組織内での超音波の生成と伝播に対する組織の熱弾性の影響を補償する方法は一切開示も教授もしていない。
【0018】
チャウ(Chou)の米国特許(特許文献8)は、プローブを用いて光音響信号を検出する方法を述べており、その方法は測定セル、参照セル、ウィンドウおよび差動マイクロフォンを含む。励起波長は1580〜1850nmおよび2050〜2340nmの範囲である。チャウは、組織内でのグルコースの濃度を算出するための、組織内での超音波の生成と伝播に対する組織熱弾性の影響を補償する方法は一切開示も教授もしていない。
【0019】
オラエフスキーとカラブトフの米国特許(特許文献9)は、パルス光音響法を開示しており、そこでパルス形状の分析が散乱係数に関する情報を与え、それは後にグルコースと相関される。オラエフスキーらは、組織内でのグルコースの濃度を算出するための、組織内での超音波の生成と伝播に対する組織の熱弾性の影響を補償する方法は一切開示も教授もしていない。
【0020】
このように、従来の光音響分光法は、ヒト組織内のグルコースの非侵襲測定のための実行可能な方法または実用的な装置を提供できなかった。それは、従来の方法が、組織の内部熱弾性特性の、ヒト組織内での超音波の生成と伝播に対する寄与の影響を軽視していたからである。従来の方法は、この、測定された信号におけるヒト組織内の超音波の生成と伝播に対する、ひいては測定されたヒト組織内のグルコース濃度に対する、組織の内部熱弾性特性の寄与の影響を補償する手段について論じていない。
【0021】
エプスタインら(Eppstein et al)の米国特許(特許文献11)は、連続的なレーザーパルスと、皮膚に接触させた導熱性吸光染料の使用を伴った、被分析物の濃度を監視するためのヒト皮膚のマイクロ穿孔(microporation)方法を開示した。レーザーと強度吸光染料との相互作用により発生した熱は、角質層を腐食して皮膚に穴を空けた。次に、空けられた穴から間質液が採取された。特許文献11の方法は、体液の試料採取を包含し、非侵襲光音響測定法については記述していない。ジャックら(Jacques et al)の米国特許(特許文献12)は、血液を化学分析用に採集するための、パルス・レーザーによるヒトの角質層の制御式除去方法を記述している。エプスタインとジャックによるパルス・レーザーの使用は、角質層を破壊せずに非侵襲方式でグルコースを測定するために組織内に光音響波を生成する目的ではなく、ヒト組織から体液サンプルを抽出する目的のものであった。
【特許文献1】米国特許第3,948,345号明細書
【特許文献2】欧州特許出願公開第0282234A1号明細書
【特許文献3】米国特許第4,303,343号明細書
【特許文献4】米国特許第5,348,002号
【特許文献5】米国特許第5,348,003号
【特許文献6】国際公開第98/38904号パンフレット
【特許文献7】米国特許第6,403,944号明細書
【特許文献8】米国特許第5,941,821号明細書
【特許文献9】米国特許第6,405,069号明細書
【特許文献10】米国特許第6,846,288号明細書
【特許文献11】米国特許第5,885,211号明細書
【特許文献12】米国特許第4,775,361号明細書
【非特許文献1】A.C.タム(A. C. Tam)による総論、「光音響感知技術の応用」(Appiication of photoacoustic sensing techniques)、現代物理学概説(Reviews of Modern Physics)、1986年第58巻第2号、p381−431
【非特許文献2】オレフスキーら(Oraevsky et al)、「レーザー誘起された過渡応力の時間分解検出による組織の光学特性の計測」(Measurement of tissue opticalproperties by time−resolved detection of laser−induced transient stress)、応用光学(applied optics)、1997年第36巻、p.402−415
【非特許文献3】A.A.カラブトフとA.A.オラエフスキー(A. A. Karabutov,A. A. Oraevsky)、「組織内の光学エネルギー分布測定のための光音響プロファイルの時間分解」(Time−resolved detection of optoacoustic profiles for measurement of optical energy distribution in tissues)、光学生物医学診断ハンドブック(Handbook of Optical Biomedical Diagnostics)、Valery V. Tuchin, Ed., SPIE Press, Billingham, WA, USA, 2002年、第10章、p585−646
【発明の開示】
【発明が解決しようとする課題】
【0022】
本発明の目的は、被検体内対象組織で発生し伝播してきた超音波パルスに対して、対象組織内の被分析物濃度の非侵襲測定に対するバルク組織特性の影響を補償する光音響分析方法及び装置を提供する。
【課題を解決するための手段】
【0023】
本発明のある局面において光音響分析方法は、信号に対する組織特性の変動の影響からの、および、組織の内部熱弾性特性に対する、対象被分析物またはその他の組織構成要素の影響からの、信号振幅に対する寄与なしで、被分析物の濃度と相関されることができる、正規化した信号に帰着する。本方法は、超音波の生成、伝播および伝播と検出に対する、組織とトランスデューサの影響の矯正も行う。
本発明の他の局面は、組織構成要素による短時間レーザーパルスの吸収によって誘起される超音波信号の生成と伝播への、可変な組織特性の影響を補償する方法である。
本発明の方法によれば、光音響信号は被検体部位に関して2つの相異なる条件下で生成し検出される。
a)ヘモグロビン、水、脂肪およびグルコースなどの被検体部位内にある自然吸光体を、この自然発生的な吸収分子に特有の波長で励起し、この吸収事象から得られる超音波パルスを検出する。
b)被検体部位の組織に結合されており周知の吸光度を有した外部吸光体を、ステップ(a)で用いたのと同じ温度、圧力および同じ波長で励起し、その外部吸光体の存在下でのこの吸収事象から得られる超音波パルスを検出する。
これら2つの信号および外部吸光体の光学特性を用いて、吸光係数、ひいてはヒト組織内の対象被分析物の濃度を割り出す。外部吸光体という用語は、媒質に付加された物質または生体系に強力に結合された別の物質を指す。それは、対象分子よりもずっと高い吸光係数で光を吸収し、その吸収は、対照被分析物の吸光の方式と同様に経時変化しない。
自然な状態での被検体部位内での光音響(PA)信号の励起と、生成して伝播された超音波信号の計測は、ヘモグロビン、水、グルコースまたは他の所望の被分析物の近赤外スペクトル吸収帯内の1つまたは複数の波長でのレーザーパルスを用いて被検体部位を照射することによって達成される。超音波信号は、組織内の自然吸光体(μa項)による光吸収によって光音響信号に対応する。それは、βおよびCpの変化による、組織の内部熱弾性特性の、パルス生成に対する影響による寄与も有する。その信号は、組織(Tissue)の機械的および音響伝播特性(v,DおよびΛ)に関する溶質の影響、インターフェースの影響および超音波検出器の応答からの寄与をも有する。
【0024】
本発明の一態様は、ヒト組織内のグルコースなどの被分析物の測定のための方法であって、a.ヒト組織内に、被検体部位を近赤外線短時間レーザーパルスで照射することによって超音波パルスを生成するステップと、b.各励起波長に付随した超音波パルスとして得られる第1の信号を検出するステップと、c.該組織外部のレーザー源と組織の間の光学経路に吸光物質を付加して、前記吸光物質内に超音波パルスが生成して前記組織内へと前記超音波検出器まで伝播するような形にして、同じレーザー波長とエネルギーを用いて同じ組織に超音波パルスを生成するステップと、d.該外部吸光物質の存在下で得られた第2の信号を、各波長で生成した超音波として検出するステップと、e.各照射波長において、ステップ(b)で生成したパルスの強度の、ステップ(d)で生成したパルスの強度に対する割合を算出するステップと、f.ステップ(e)において割り出された信号強度の割合と、外部吸光物質の所定の光学特性から組織内の被分析物の吸光係数を算出するステップと、g.ステップ(f)で算出された吸光係数と、光音響励起波長での被分析物のモル吸光係数から、被分析物の濃度を算出するステップと、を備えた方法である。
本発明の他の局面では、被検体部位の対象組織内の被分析物を測定して得られた信号に対する前記組織の内部特性の影響を補償する光音響分析方法において、前記被検体部位にレーザー源からの近赤外線レーザーパルスを照射することによって前記対象組織に超音波パルスを発生させるステップ(a)と、前記被検体部位近傍に配置された超音波検出器を用いて前記超音波パルスを検出して第1の信号を発生するステップ(b)と、前記超音波パルスが吸光物質内で発生して前記組織を伝播して前記超音波検出器で検出されるように前記レーザー源と前記被検体部位との間に前記吸光物質を配置している期間に、前記ステップ(b)とレーザー波長とエネルギーとが同じレーザーパルスを用いて前記対象組織内に超音波パルスを発生させるステップ(c)と、前記吸光物質で発生した超音波パルスを検出して第2の信号を発生するステップ(d)と、前記ステップ(b)で発生した第1の信号と前記ステップ(d)で発生した第2の信号と比を各レーザー波長ごとに算出するステップ(e)と、前記被分析物の吸光係数を、前記ステップ(e)で算出した比と、前記吸光物質の所定の光学特性とから算出するステップ(f)と、前記ステップ(f)で算出された吸光係数から前記被分析物の濃度を算出し、光音響励起波長における前記被分析物のモル吸光係数を算出するステップ(g)とを備える。
【発明の効果】
【0025】
本発明によれば、光音響測定において、超音波パルスの振幅に対して、被検体組織内の被分析物濃度の非侵襲測定に対するバルク組織特性の影響を補償することができる。
【発明を実施するための最良の形態】
【0026】
本発明の実施形態は、ヒト組織内での超音波パルスの生成および伝播に対する被検体部位の内部特性の寄与(contribution)の影響の、組織内に光音響効果によって誘起された超音波信号の振幅に対する影響を補償する手段を提供する。得られる正規化した信号を用いて、ヒト組織内の被分析物の濃度を測定する。
【0027】
本発明の実施形態の補償方法は、被分析物の濃度変化が、組織の内部特性、具体的にはβ、Cp、DおよびΛ、に与える影響からの、信号振幅に対する寄与なしで、被分析物濃度と相関させることができる光音響信号に帰結する。本方法は、さらに、超音波パルス(R、D、Λ、TおよびS)の伝播および検出への、組織とトランスデューサの影響を矯正する。
【0028】
本発明の実施形態は、光音響効果によって生成され、被検体部位を貫通して伝播する超音波信号への、可変な組織の内部特性の影響を補償する方法である。本方法は、ヒト組織内の被分析物の非侵襲測定を可能にする。
【0029】
本発明の実施形態の方法によれば、光音響信号は被検体部位に関して2つの相異なる条件下で生成し検出される。
a)ヘモグロビン、水、脂肪およびグルコースなどの被検体部位内にある自然吸光体を、この自然発生的吸光分子に特有の波長で励起し、この吸光事象から得られる超音波パルスを検出する。
b)被検体部位の組織に結合されており周知の光学濃度を有した人体の外部の吸光物質を、前のステップで用いたのと同じ温度と圧力および同じ波長で励起し、その外部吸光体の存在下で生起するこの吸収事象から得られる超音波パルスを検出する。
【0030】
人体内の自然吸光体から、および被検体部位外部の吸光物質からの2つの信号を、該外部吸光体の光学特性と併せて用いて、ヒト組織内のこれらの被分析物の吸光係数を測定する。被分析物の濃度は、吸光係数(absorption coefficient)を光音響励起波長での被分析物の吸光係数(extinction coefficient)で割ることによって算出される。本発明の実施形態の方法を説明したフローチャートが図1に示されている。
【0031】
人体内での光音響信号の励起、および被検体部位において自然の状態で生成した超音波信号の計測は、ヘモグロビン、水、グルコースまたは他の所望の被分析物の近赤外スペクトル吸収帯内に規定された波長でのレーザーパルスによって被検体部位を照射することによって達成される。超音波信号は、組織内の自然吸光体による光吸収の結果として生成した光音響信号に対応する。その信号はさらに、超音波パルスの生成と伝播への、組織の内部特性の影響からの寄与を受ける。さらに、信号はβ、Cp、v、DおよびΛといった、組織における熱弾性特性に対する被分析物の影響からの寄与を受ける。
【0032】
組織内に見出された自然吸収分子の励起から得られる測定された超音波パルスの強度は、以下のステップを備える。
a.自然発生的分子はレーザーパルスからの光を吸収する。
b.組織内に圧力波(超音波パルス)が生成し、組織の塊を貫通して検出器へと伝播する。
c.組織の内部特性が、得られる超音波パルスの生成と伝播に影響する。
d.検出器は超音波パルスを電気信号に変換し、その強度は収集効率とトランスデューサの感度に依存する。
被検体部位の外部にあり、組織と接触させられた吸光物質の励起から得られる、計測された超音波パルスの強度は、以下のステップを備える。
a.組織に結合された外部吸光物質は、その高い吸光度値(光学濃度)のために、レーザーパルスからの光の大部分を吸収する。
b.圧力波(超音波パルス)が、組織との界面での外部吸光層に生成し、組織の塊を貫通して検出器へと伝播する。
c.組織の内部特性が、得られる超音波パルスの生成と伝播に影響する。
d.検出器は超音波パルスを電圧信号に変換し、その強度は収集効率とトランスデューサの感度に依存する。
【0033】
被検体部位の外部にある吸光物質は、例えば励起に用いられる全波長において1.0を超えるような周知の高い光学濃度を有した物質(すなわち、光強度を90%を越えて吸収する)である。レーザーパルスが、被検体部位に結合された外部吸光体に作用するとき、超音波パルスが生成して被検体部位の組織に伝播する。組織に結合された外部吸光体の光音響励起から得られる超音波パルスが次いで計測される。組織内の自然発生的吸光分子の励起からの信号と、自然吸光体の存在下での信号を用いて、ヒト組織内のグルコース、ヘモグロビン、水および脂質などの、被分析物の濃度を算出する。
【0034】
超音波の反射を最低限にし、検出器の皮膚への正しい結合が本発明の実施形態の方法において用いられることを確実にするために、超音波イメージングで用いられる方法がいくつかある。従って、皮膚と検出器との間に高効率の結合を達成するために、超音波結合ジェルが塗布されることができる。高効率の結合を達成するために、皮膚と外部吸光体との間に塗布されることもできる。
【0035】
光源によるサンプルの照射と光音響信号の生成は、従来の機器と同様なデバイスによって達成されることができる。光音響信号の生成と検出のための装置構成例が図2Aに示されている。
【0036】
機器(10)は、光源モジュール(11)、体部インターフェースモジュール(25)、および検出エレクトロニクスモジュール(40)を備える。光源モジュール(11)は、電源(12)およびレーザー源(15〜18)を備える。レーザー源(15〜18)には石英光ファイバー(20〜23)がそれぞれ接続される。それらのファイバー(20〜23)は、光をサンプル(28)に集束させる集光レンズ(27)を収容したレンズ・ハウジング(26)の終端に接続される。圧電検出器(32)が、レンズの反対側に、ビームと伝送配置になって整列してホルダー(34)上に搭載されている。反射配置の場合は、検出器(32)および集光光学素子はサンプルと同じ側にあることになる。垂直配置では、検出器(32)および集光光学素子は互いに直角になる。他の角度での他の配置をも設計することができる。検出器の位置を変えて垂直配置(照射ビームに対して直角に)にすることも可能である。検出器(32)は、機構(35)を介して、周知の重みの付加により、または周知の重みの下で組織の移動を制御することにより、サンプルまたは被検体部位と密着して保たれる。
【0037】
検出電子回路・モジュール(40)は遮断コネクタ(41)と、増幅器(42)と、デジタルストレージスコープ(43)と、制御PC(44)とを備える。PC(44)は信号線(46)によってスコープ(43)に接続され、信号線(48)によって光源モジュール11の電源(12)に接続されている。電源(12)は信号線(50)によってスコープ(43)にも接続されている。
【0038】
本実施形態では、検出器(32)として、国際公開第2004/1042382A1号パンフレットに記載された超音波トランスデューサを用いる。このトランスデューサは反射モードで用いられ、その場合逆伝播した超音波パルスが検出される。チタン酸鉛を含有した単結晶の形状の圧電デバイスは、一般式Pb[(B1,B2)1−x Tix]O3で表され、端数x=0.5〜0.55であり、B1はZn、Mg、Ni、Sc、InおよびYbから選択される元素を表し、B2はニオブ、Nbおよびタンタル、Taから選択される1元素を表す。これらのPZNTトランスデューサとして知られる結晶性トランスデューサは、近赤外光を通し、超音波を検出することができる。それゆえPZNT結晶が、光励起の窓口かつ光パルスによって生成した超音波の検出器として用いられる。
【0039】
別の実施形態では、PZNT結晶が、ヒトの皮膚の音響伝播特性に一致する音響伝播特性を有したポリマーフィルムで被覆される。
【0040】
他の装置構成例が図2Bに示されている。機器は、光源モジュール(100)、体部インターフェースモジュール(110)、および検出エレクトロニクスモジュール(120)を備える。光源モジュール(100)は、電源(103)およびランプ等の光源(102)を備える。光源(102)には石英光ファイバー(104)が接続される。ファイバー(104)は、光をサンプル(113)に集束させる集光レンズ(112)を収容したレンズ・ハウジング(111)の終端に接続される。圧電検出器(114)が、レンズの反対側に、ビームと伝送配置になって整列してホルダー(115)上に搭載されている。反射配置の場合は、検出器(114)および集光光学素子はサンプルと同じ側にあることになる。垂直配置では、検出器(114)および集光光学素子は互いに直角になる。他の角度での他の配置をも設計することができる。検出器の位置を変えて垂直配置(照射ビームに対して直角に)にすることも可能である。検出器(114)は、機構(116)を介して、周知の重みの付加により、または周知の重みの下で組織の移動を制御することにより、サンプルまたは被検体部位と密着して保たれる。
【0041】
検出電子回路・モジュール(120)は遮断コネクタ(117)と、増幅器(121)と、デジタルストレージスコープ(123)と、制御PC(125)とを備える。PCは信号線(124)によってスコープ(123)に接続され、信号線(126)によって光源モジュール(100)の電源(103)に接続されている。電源(103)は信号線(127)によってスコープ(123)にも接続されている。
【0042】
生体内実験のため、サンプルは、石英セル内に配置されるが、それは1μmの金の層で被覆されたPZNT超音波検出器に一つの側を接触させている。図3は、媒質に添加されて905nm、1459nm、1550nmおよび1649nmで照射されたグルコースの、濃度の関数としての光音響信号を示す。グルコースに対する1459nm、1550nmおよび1649nmでの信号のプロットから、3本の線図が得られた。1459nmは水の吸光波長であり、1550nmと1649nmはグルコースの波長である。グルコース水溶液が905nm以下で励起された場合は、グルコース濃度に対する光音響信号の検出できる依存性は皆無であった。
【0043】
図3は、905nmでのPA信号(光音響信号)には勾配がゼロであり、その実験で用いられた濃度(0−20g/dL)ではPA信号が皆無であったということを示している。1459nmでは線として適合することができるPA信号が存在し、PA(mv)at1459nm=11.366[グルコースg/dL]+7.7661,R2=0.9757であった。1550nmと1649nmで励起された場合は、直線として適合することができる、より弱いPA信号があり、PA(mv)at1550nm=5.1247[グルコースg/dL]+5.0825、R2=0.9569、および、PA(mv)at1649nm=5.2031[グルコースg/dL]+9.3373、R2=0.9224であった。1459nmでのグルコース濃度に対するPA信号の線形勾配は、1550nmおよび1649nmにおけるグルコース吸光波長の線形勾配の二倍であった。
【0044】
水吸光波長の1459nmで励起された光音響信号の挙動は予期せぬものであった。グルコース濃度の上昇とともにパルス振幅が増加した。それは、超音波パルスの生成を後に伴う1459nmでの吸光プロセスは、グルコース濃度が増えると強度が増加するということを示した。光音響信号がグルコース分子による吸光によるものだとすれば、溶液の超音波パルス振幅と赤外吸光スペクトルが一致するか、または、少なくとも光音響信号の変化と平行に変化するはずである。
【0045】
図4は、グルコース溶液の赤外線吸光スペクトル(1mmセルで、ブルーカー(Bruker)FT−IR分光計で実施)を示す。1459nmでの光吸収はグルコースの濃度上昇とともに減少し、それは図3で示したグルコース濃度の関数としてのPA信号挙動と全く対照的である。水吸収帯でのグルコースの吸光度の減少は当技術分野で周知であり、グルコース分子による水分子の置換に起因する。
【0046】
1459nmで励起された光音響信号と、1459nm前後のグルコース水溶液の近赤外吸収信号との間には相違がある。これらのグラフでは、グルコース水溶液の光音響信号と吸水波長はグルコース濃度に依存するということが明白である。その依存性の1つの解釈としては、水が1459nm光子を吸収して、光音響信号が生成し、次いで、特にグルコース濃度の、溶液の内部特性に対する影響で、媒質により変調されたということである。これらの溶液の内部特性は、それがセルを通して検出器へと伝播されるとき、式(3)におけるβ、v、Cp、DおよびΛの値を含む。こうして従来技術の光音響分光法は、グルコース濃度などの被分析物濃度などが媒質の内部熱弾性特性に対して及ぼす影響が、光音響信号の強度に対して果たす役割を軽視している。
【0047】
媒質の内部熱弾性特性ひいては光音響信号の振幅に対する、グルコースなどの添加溶質濃度の影響の別の例が図5に示されている。905nmでcm当り2単位の光学濃度を有する固定量の近赤外吸光染料を含有した0.9%塩化ナトリウム溶液でグルコース濃度が調整された。4つの線形応答プロットが得られた。最強の光音響信号は905nmでの励起で得られ、そこではグルコースも水も目立つ吸光度がなく、近赤外吸光染料アシッドブラック2(ニュージャージー州アクロース・オーガニックス(Acrose Organics)製で、ペンシルバニア州ピッツバーグ、フィッシャー・サイエンティフィック(Fischer Scientific)供給の水溶性ニグロシン)は905nmで大きな吸光度値を示した。
【0048】
図5におけるPA信号強度は、図3に示した純水の場合と比べると、外部吸光体ニグロシン染料の存在下では6倍に増えた。グルコース濃度の関数としての905nmでの超音波パルス振幅は、図3の純水でゼロ応答だったのに比べて最高の応答を示した。対グルコース濃度のPA信号は、一次方程式、PA(mv)at905nm=79.246[G g/dL]+44.144に適合する。勾配はグルコース1グラムにつき79mvであった(r2=0.997)。水の波長1459nmでのパルス振幅は、PA(mv)at1459nm=16.3[G g/dL]+44.144、R2=0.965であり、勾配は図3の水の場合の勾配と近かった。グルコース波長の1550nmおよび1649nmでのパルス振幅は、PA(mv)=5.6[G g/dL]+5.4,r2=0.92であり、染料を含まない水溶液の場合と同様であった。グルコースまたは水によるPA信号は、905nmにその最大吸光度を有する高吸光ニグロシン染料の存在によって影響を受けなかった。ニグロシン染料吸光波長での強い光音響信号は、添加された外部吸光体、この例の場合はニグロシン、が光を吸収して光音響パルスを生成し、それが、溶液の内部熱弾性特性、すなわち、式(1)および(2)のβ、vおよびCpの値、に対するグルコース濃度の影響によって変調されたということを改めて示唆している。このように従来技術の光音響分光法研究は、媒質の内部熱弾性特性に対して、グルコースまたは他の溶質の影響が果たす役割を軽視していた。従来技術の光音響分光法は、グルコース濃度の、組織の熱弾性特性に対する、ひいては検出される超音波パルス振幅の強度に対する影響を考慮することはなく、光音響信号を、グルコース分子などの溶質分子による光吸収に起因するものとしていた。
【0049】
第3の例が図5に示されている。犬の血液から作られて、可変な濃度のグルコースを含有した0.9%の塩化ナトリウム溶液に懸濁された固定赤血球の懸濁液の光音響信号が、グルコース濃度に対してプロットされている。905nmでグルコース濃度の関数としてプロットされた光音響信号は、グルコース1グラム当り17.3mVの線形最小二乗に適合する勾配を示した(r2=0.995)。水の波長1459nmでの光音響信号は、グルコース1グラム当り18.5mVの勾配を示し(r2=0.994)、グルコース波長の1550nmおよび1649nmでの光音響信号は、グルコース1グラム当り約5.9mVという同じ勾配を示した(r2=0.904)。ヘモグロビン吸光波長905nmでの強い光音響信号は、グルコース水溶液系に添加されると、固定赤血球が外部吸光体として働いたということを再び示している。固定赤血球は光を吸収して光音響信号を生成し、それが、溶液の内部熱弾性特性、すなわち、式(3)のβ、v、Cp、DおよびΛの値、に対するグルコース濃度の影響によって変調された。
【0050】
犬の固定赤血球の1:50懸濁液を用いて同じ実験を繰り返し、図6Bに示すPA信号を得た。一次方程式は、
PA(mv)at905nm=16.3[Gg/dL]+14.747,R2=0.983
PA(mv)at1459nm=19.641[Gg/dL]+7.7765,R2=0.995
PA(mv)at1550nm=5.616[Gg/dL]−3.07,R2=0.977
PA(mv)at1649nm=7.283[Gg/dL]+4.205,R2=0.965
1459nm、1550nmおよび1649nmでの勾配の強度は、図6Aの犬の固定赤血球の1:100希釈物の場合、図5のニグロシン染料の場合、および図3に示した純水の場合と同様であった。905nmで励起され犬の固定赤血球の1:50懸濁液を含有したグルコースのPA信号は、図6Aの犬の固定赤血球の1:100希釈物の場合よりも低い勾配を有した。より高濃度の懸濁液による光散乱が、この波長のPA信号に影響を与えた可能性がある。
【0051】
このように、グルコース測定のための従来技術の光音響分光法は、媒質(組織)の内部熱弾性特性に対する、グルコースまたはその他の溶質の影響が果たす役割を軽視していた。従来の方法は、後に検出される光音響信号を生成するエネルギー吸収体としてのグルコースの影響を、媒質または組織の内部熱弾性特性の改質剤としてのグルコースの役割から分離していない。従来技術では、媒質の熱弾性特性ひいては測定された信号の改質に対する、グルコースまたは他の対象被分析物の寄与を矯正する試みがなされていない。従来技術は、計測された信号に対する、バルク組織特性の影響を矯正する方法を論じていない。
【0052】
従来技術は、ニグロシン染料添加の場合、または、ヘモグロビンを含有した犬の固定赤血球の場合に示した如くの、媒質の内部熱弾性特性に対する溶質の影響の測定における、外部または添加された吸光体の使用について論じていない。
【0053】
従来技術は、媒質の外部に吸光体を加えたことの結果として生成した超音波パルスの振幅を変更するにあたっての媒質構成要素の役割についても論じていない。別の吸光体(システムに付加された)によって生成したパルスの振幅の変更は、905nmのレーザーパルスによってグルコース濃度の関数として励起されたニグロシン染料からの光音響信号間の線形関係の場合で示されている。別の例は、グルコース濃度の増加に伴う、水の光音響信号の増加である。媒質の熱弾性特性に対する溶質の影響の第3の例は、固定赤血球の光音響信号と添加されたグルコースの濃度の間の線形関係である。
【0054】
上記に論じた生体内の実験では、外部吸光体が媒質に添加された。被検体部位への生体内光音響実験の場合は、外部吸光体は、皮膚に塗布される染料、皮膚と接触させられる周知の光学濃度(OD)を有したフィルム、または、検出器として励起の窓口として用いられるPZNT結晶のポリマーコーティングに配合された染料、または他の同様な吸光物質の形態であってよい。この場合PZNTトランスデューサが反射モードで用いられ、そこで逆伝播した超音波パルスが検出される。
【0055】
本発明の実施形態の外部吸光体は対象波長での周知の高い光学濃度を有している。この光学濃度は、光パルスの光音響信号を励起する能力を消さずに信号に影響を与えるのに十分なほど大きくなければならない。例えば、励起に用いられる全波長で、0.5から1.0の間である。光学濃度1.0で、添加された物質は入射光強度の90%より多くを吸収する。外部吸光体は2.0より高い光学濃度を有している(すなわち、光強度の99%を超えて吸収する)。レーザーパルスが被検体部位の組織に結合された外部吸光体に作用するとき、超音波パルスがその被検体部位に伝播する。組織内の自然吸収化合物と、外部吸光体の、生成した光音響信号に対する寄与の比較が表1に示されている。
【表1】

【0056】
光音響信号は2つの異なる配置で検出されることができる。第1の配置は、励起光ビームと検出器が被検体部位の逆の側にある、インラインまたは透過配置である。ビームと検出器はインラインでも、または、直接の光が検出器に作用する可能性を避けるためにオフラインであってもよい。別の配置は、励起光ビームと検出器の両方が被検体部位の同じ表面上にある反射配置である。この配置は光音響イメージングに用いられる。イメージングと分析用途でのPZNT検出器の使用は、国際公開第2004/042382号パンフレットに開示されている。
【0057】
外部に付加された吸光体は中性濃度フィルター(銀粒子を含有したラッテン(Wratten)ゼラチンフィルターなど)、露光され現像された写真フィルムまたはX線フィルム、高吸光係数近赤外吸収染料で被覆されたフィルム、カーボンブラック粒子被覆フィルム、染料、着色ポリマー粒子および同様のものであってよい。外部吸光体は、単結晶圧電トランスデューサ(PZNT)のポリマーコーティング材料に含有されていてもよい。その場合PZNTトランスデューサは反射モードで用いられ、逆伝播した超音波パルスが検出される。
【0058】
外部付加吸光体はレーザーパルスのエネルギーの大部分を効率よく吸収し、それを、被検体部位の中に伝播して検出器に到達し組織の内部特性、被検体部位の寸法、およびその表面の特徴に関する信号を与える超音波エネルギーに変換する。組織の内部特性、被検体部位の寸法、およびその表面の特徴ならびにその被検体部位に埋設された異質な構造は、光パルスから超音波パルスへの効率よい変換条件下で生成した超音波パルスの振幅に影響を及ぼす。全光エネルギーが外部吸収層に吸収され、それ故同じ実験条件下で計測される同じ被検体部位に関して伝播信号が一定となることが好ましい。
【0059】
(PA)NAは、ヘモグロビン、水またはグルコースなどの、被検体部位内の自然発生的な吸収分子による光吸収による光音響信号である。(PA)NAは以下で表されることができる。
【0060】
(PA)NA=RTDΛS.[(βv2)/Cp]bulk(μa)NAE0 (4)
但し、(μa)NAは、ヘモグロビン、水またはグルコースなどの、対象被分析物の光吸収を表す項であり、式(4)の(μa)NAは、この被分析物の濃度の変化の、吸光プロセスおよび光音響信号生成に対する影響を表す。((βv2)/Cp)bulkとして表される式(4)の第二項は、媒質の内部熱弾性特性を表し、RTDΛSの積は組織内の音響伝播を表す。
【0061】
測定の必要がある被分析物よりもODすなわち吸光係数が高い外部吸光体を付加すると、得られる信号は式5によって表される。(PA)EAは、付加された外部吸光体の存在下で生成する光音響信号である。それは以下のように表される。
【0062】
(PA)EA=RTDΛS[(βv2)/Cp]bulk(μa)EA.E0 (5)
但し、(μa)EAは付加された外部吸光体の光吸収を表す項である。それは意図的に高い吸光度を有し、したがって、この被分析物の濃度の、組織内の吸光プロセスおよび光音響信号の生成に対する影響とは別個のものである。式(4)および(5)の、RTDΛSおよび[(βv2)/Cp]bulkとして表された別の項は、組織内の音響伝播と組織の内部熱弾性特性を表し、自然吸光体の場合と同様である。
【0063】
照射エネルギー、吸光、圧縮波の生成および超音波パルスの検出に関する従来技術の光音響信号の式は、完全な効率での、光の組織への結合、および生成した圧縮波の組織界面への結合、ひいては検出器への結合を想定している。より説明的な式では、式(4)および(5)に倍数因子γを導入してこれらの結合効率を勘案するべきであるが、それは以下の式をもたらす。
【0064】
(PA)NA=γNARTDΛS[(βv2)/Cp)bulk](μa)NA.E0 (6)
および、
(PA)EA=γEARTDΛS[(βv2)/Cp]bulk](μa)EA.E0 (7)
但し、γNAおよびγEAは2つの光音響測定の結合効率項である。
【0065】
本発明の実施形態の方法の重要な態様は外部吸光体である。その目的は、皮膚に照射される光強度を減衰することではなく、以下の特性に基づいて光強度を吸収し、音響信号に変換することである。
【0066】
1)外部吸光体は、測定対象の被分析物よりもずっと高い吸光係数を有している。
2)外部吸光体は極めて薄く、皮膚上の染料層は数マイクロメートルの厚みといったところである。外部吸光体の別の形態は吸光体を上に有した薄膜である。その膜と吸光体の厚みは100μm程度である。
3)外部吸光体は組織、この場合は皮膚に効率よく結合されており、その結合は超音波と、伝熱ジェルまたは接着剤の使用によって影響されている。
4)外部吸光体はそれ自体には内部特性がない。そのかわり、それは光を吸収して熱に変換し、それが、結合先の組織内への圧力波の生成につながる。
5)組織への機械的応力の伝達が、得られる超音波パルスの伝播を、組織の内部特性に制御させる。
【0067】
このように、式(7)の項[(βv2)/Cp)bulk]および項R、DおよびΛは、式(6)の同じバルク組織特性に関する。組織に結合された外部吸光体内での光音響信号の励起および組織への機械的応力の伝達は、吸光体層または皮膚に熱融解によって穴を開けることのないような低エネルギーのレーザーパルスで実行される。皮膚上への強い吸光体およびレーザーパルスの使用が皮膚に穴を開けることは、エプスタインらにより米国特許第5885211号明細書にて記述された。このように本発明の実施形態の目的は、皮膚へのダメージ、角質層の除去、あるいは皮膚に穴が開くこと、を防止しながら組織内に光音響信号を励起することである。
【0068】
次に各波長(PA)NAおよび(PA)EAで生成した2つの計測信号を用い、自然状態のPAを、外部吸光体が付加された場合の光音響信号の強度で割って、割合(PA)NA/(PA)EAを算出した。得られた割合は、組織内の吸収種(ヘモグロビン、水およびグルコース)から生成した正規化した信号の、より高い吸光度で生成されて超音波エネルギーへと変換される信号に対する割合である。各波長における、光音響(自然状態)の、光音響(外部吸光体)に対する割合は、以下に示す演算でさらに用いられる。
【0069】
式(6)を式(7)で割ると、
[(PA)NA/(PA)EA]=(γNA/γEA).[(μa)NA/(μa)EA] (8)
所与の機器と実験条件での式(8)の結合効率は以下のように表すことができる。
Γ=(γNA/γEA) (9)
(γNA/γEA)と外部吸光体としての吸光係数を代入すると、
(μa)EA=2.303[(OD/l)EA (10)
サンプルに付加した、またはサンプル表面に塗布した染料を使用した場合、外部吸光体の吸収係は式10aで表されることができる。
(μa)EA=2.303εNACNA (10a)
式(10)における光学パラメータODは、同じ波長λにおける付加した外部吸光体の光学濃度であり、lは自然吸光体の厚みである。式(9)におけるこれらの表現を置換すると式(11)となる。
[(PA)NA/(PA)EA]λ=Γ[(μa)NA/2.303[(OD/l)EA]λ (11)
式(11)を用いて自然吸光体(μa)NAの吸光係数を求めることができ、この場合自然吸光体は、水、グルコース、ヘモグロビン、その他同等物を含む分子代謝産物のグループのうちの1つである。自然吸光体は、組織内でのその濃度を追跡するために重要な、化学療法薬または光療法薬またはその他の分野の薬であってよい。
【0070】
自然吸光体の吸光係数を以下のように表す。
(μa)NA=2.303εNACNA (12)
εNAは、波長λでの自然発生被分析物のモル吸光係数(molar extinction coefficient)(またはモル吸光係数(molar absorption coefficient))であり、CNAは自然吸光体のモル濃度であり、以下の式へと導かれる。
[(PA)NA/(PA)EA]λ=Γ.[2.303εNACNA/2.303[(OD/l)EA]λ (13)
すると、自然発生的な吸光体、つまり組織内の対照被分析物のモル濃度は、以下で表されることになる。
CNA=Γ−1.[(PA)NA/(PA)EA]λ.[(OD/l)EA〜/εNA]λ (14)
なお、「A〜」は「A」の上部に「〜」が配置されることを表す表記である。この式は、組織内の自然発生的な吸光体(水、ヘモグロビン、グルコースまたは同等物といった)の絶対モル濃度を表す。組織内の自然発生的な被分析物のモル濃度は以下に関連して表現される。
a.自然発生的な吸光体による光音響信号
b.付加された外部吸光体の存在下での光音響信号
c.付加された外部吸光体の光学濃度
d.付加された吸収層の厚み
e.同じ波長における自然発生的な吸光体の吸光係数
濃度は、リットル当りのモルから、組織内のグルコースのmg/dL、ヘモグロビンのg/dL、または水の%といった慣例的な臨床濃度単位へと変更されてよい。本発明の実施形態の方法は、図1のフローチャートに示す。
【0071】
自然発生的な吸光体を励起する場合の第1の計測γNAの結合効率が、外部吸光体を励起する場合の第2の計測γEAと同じであれば、式14の結合効率項Γは、Γ=(γNA/γEA)=1であるということが導き出され、式(14)は以下に簡略化される。
【0072】
CNA=[(PA)NA/(PA)EA]λ.[(OD/l)EA〜/εNA]λ (15)
結合効率項Γは、被検体部位への計測デバイスの圧力、超音波検出器の収集効率、レーザー光源および光学素子の照射効率を組み込んでいる。圧力の制御、再配置のバリエーションおよび他の実験パラメータは、式(15)へと導かれる条件を達成するために極めて厳重である。別法として結合効率パラメータΓは、自然発生的な被分析物CNAの濃度を測定するために実験的に測定される。
【0073】
本発明の実施形態は、ヒト組織内のグルコースの測定方法であり、以下のステップを備える。
a.近赤外短時間レーザーパルスで被検体部位を照射することによりヒト組織内に超音波を生成する。
b.各波長において得られた超音波パルスとしての第1の信号を検出する。
c.同じレーザー波長とエネルギーを用いるとともに、組織の外部のレーザー源と組織の間に、組織に強固に結合させて吸光物質を挿入し、前記吸光物質内に超音波パルスが生成して前記組織を貫通して超音波検出器まで伝播するような形で、同じ組織内に超音波パルスを生成する。
d.前記外部吸光物質の存在下で得られた第2の信号を、各前記波長で生成した超音波パルスとして検出する。
e.各照射波長において、ステップ(b)で生成したパルスの強度の、ステップ(d)で生成したパルスの強度に対する割合を算出する。
f.前記組織内のグルコースの吸光係数を、ステップ(e)で求めた前記信号の強度の割合と、前記外部吸光物質の所定の光学特性から算出する。
g.ステップ(f)で算出された吸光係数からグルコースの濃度を算出し、該光音響励起波長における被分析物のモル吸光係数を算出する。
【0074】
本発明の実施形態の光音響分析方法によるグルコースの非侵襲測定の場合、1660nmなどの、グルコースの吸光度がより高い近赤外波長が、励起波長として用いられる。式(14)に値を代入すると以下となる。
【0075】
Cglucose=Γ−1.[(PA)NA/(PA)EA]@1660nm[(OD/l)EA〜/εglucose]@1660nm (16)
食物負荷試験または経口ブドウ糖負荷試験といった異なる血液グルコース濃度で一連の光音響計測が実行された。Cglucose対[(PA)NA/(PA)EA]@1660nmがプロットされて、そのプロットの勾配はΓ―1と同じであると算出された。
【0076】
本発明の実施形態の方法の別の態様は、人体内のグルコースの測定方法であるが、外部吸光体も、少なくとも1つの波長においてはグルコースよりも高い吸光係数を有した、人体内の自然発生的な分子である。人体内の水も外部吸光体として用いられることができる。この場合少なくとも2つのレーザー波長が使われ、そのうち1つは水の近赤外吸収帯での波長であり、第2の波長は、近赤外領域にあるグルコースの倍音や結合音の吸収帯の波長である。
【0077】
本発明の実施形態の方法の別の態様は、水を外部吸光体として用い、少なくとも2つのレーザー励起波長を用いてヒト組織内のグルコースを測定する光音響法である。同一の測定で複数波長の計測を実行することにより、CglucoseとΓを測定するための1つの方法である。この実験では、自然吸光体(グルコース)のPA信号および外部吸光体(水)のPA信号が(少なくとも)2つの波長で測定される。1つの波長は、例えば1660nmの、グルコース吸光波長に選択される。第2の波長は1250nm、1400nm、1450nm、1459nmといったように水吸光波長で選択される。すると式(14)は以下のように書かれる。
【0078】
Cglucose=Γ−1.[(PA)NA/(PA)EA]@1660nm[(OD/l)EA/εglucose]@1660nm (16)
Cwater=Γ−1.[(PA)NA/(PA)EA]@1450nm[(OD/l)EA/εwater]@1450nm (17)
正常な人体内で維持されている厳密な電解質バランスによって、組織の水含有量はゆっくりと変動していて恒常的であると考えられ、例外は、脱水症、浮腫、腎不全などである。水分は恒常的であり、組織重量の約70%であると想定することが可能である。したがって組織内の水の濃度はリットル当たり0.70x55=38.5モルとなる。式(17)に代入すると2つの式(18)と(19)となる。
【0079】
38.5=Γ−1.[(PA)NA/(PA)EA]@1450nm[(OD/l)EA/εwater]@1450nm (18)
Γ−1=0.2579[(PA)NA/(PA)EA]@1450nm[(OD/l)EA/εwater]@1450nm (19)
そして結果的に、
Cglucose={0.2579[(PA)NA/(PA)EA]@1450nm[(OD/l)EA/εwater]@1450nm}−1x{[(PA)NA/(PA)EA]@1660nm[(OD/l)EA/εglucolse]@1660nm} (20)
Cglucose=38.5{[(PA)EA/(PA)NA]@1450nm[(PA)NA/(PA)EA]@1660nm}x[εwater@1450nm/εglucolse@1660nm]x[(OD/l)EA@1660nm/(OD/l)EA@1450nm (21)
Cglucose=38.5[(PA)NA@1660nm/(PA)NA@1450nm][(PA)EA@1450nm/(PA)EA@1660nm]x[εwater@1450nm/εglucolse@1660nm]x[(OD/l)EA@1660nm/(OD/l)EA@1450nm] (22)
自然吸光体(グルコース)に関する光音響信号の振幅の強度[(PA)NA@1660/(PA)NA@1450]、一波長でのグルコースのモル吸光係数の値、別の波長での水の吸光係数の値、および2つの波長での外部吸光体(水)の光学濃度から組織内のグルコース濃度が算出される。式(22)は、脱水症のない被検体で、浮腫、腎不全もない場合に適用される。
【0080】
本発明の実施形態の別の態様は、6つの光音響信号を3つの波長で用いて組織内のグルコース濃度を測定する方法である。これらの計測のうち3つは、標準状態の組織に、水励起波長とグルコース励起波長での信号を得るために実行される。他の3つの計測は、前述したように組織と接している外部吸光物質の存在下で実行される。水励起波長を含む複数の波長と外部吸光体を使用することは、人体の定常的な水分に関する推定なしにグルコースのNIR測定を可能にする。この場合、脱水症または浮腫が存在してもグルコースの測定が可能になり得る。
【0081】
こうして、組織内のグルコース濃度の非侵襲測定では、組織の水分に関する或る種の推定をせずに、計測は(少なくとも)3つの波長で実行されなければならない。これらの波長の1つは、水がかなりのNIR吸収度を有する波長である。想定できる1つの波長選択スキームは、グルコースには1550nmと1660nmの波長を選択し、水には1450nmの波長を選択することである。すると式(14)は式(23)(24)および(25)として書かれる。
【0082】
Cglucose=Γ−1.[(PA)NA/(PA)EA]@1550nm[(OD/l)EA/εglucose]@1550nm (23)
Cglucose=Γ−1.[(PA)NA/(PA)EA]@1660nm[(OD/l)EA/εglucose]@1660nm (24)
Cglucose=Γ−1.[(PA)NA/(PA)EA]@1450nm[(OD/l)EA/εwater]@1450nm (25)
これらの式を同時に解くと、組織内のグルコースのモル濃度Cglucoseが得られる。この場合1つの外部吸光体が用いられ、超音波パルス振幅は3つの近赤外波長で測定される。これらの波長のうち2つがグルコース吸光波長であり、3つ目のものが近赤外水吸収帯内にある。εwaterとεglucoseの値は、組織の温度と同温度(37℃)の水性媒質で、例えばフーリエ変換NIR機器を用いた独立した近赤外計測から測定される。
【0083】
別案として、超音波パルス振幅は、2つの水吸光波長と1つのグルコース吸光波長で測定されて以下の形式の式(11)の変形をもたらす。
【0084】
Cwater=Γ−1.[(PA)NA/(PA)EA]@λ1water[(OD/l)EA/εwater]@λ1water (26)
Cwater=Γ−1.[(PA)NA/(PA)EA]@λ2water[(OD/l)EA/εwater]@λ2water (27)
Cglucose=Γ−1.[(PA)NA/(PA)EA]@λglucose[(OD/l)EA/εGlucose]@λglucose (28)
これら3つの式は、グルコースのモル濃度Cglucoseと水のモル濃度Cwaterに関して解かれる。水のモル濃度は、組織の水和状態を査定するために用いられることができる。試験的計測は、外部吸光体のOD値が1つと、3つのレーザー照射波長での2段式実験である。
【0085】
したがって、本発明の別の実施形態は、組織の水和状態と、同組織内のグルコース濃度の測定のための光音響分析方法である。試験的計測は、外部吸光体の光学濃度(OD)値が1つと、3つのレーザー照射波長での2段式実験である。
【0086】
本発明のもう1つの実施形態は、組織内のグルコースの測定のための光音響分析方法である。組織内のCglucoseの測定のためのこの方法は、外部吸光体2つの光学濃度の値と、2つの照射波長の使用を伴う。この方法では、3つの光音響計測が実行される。
【0087】
ステップ(1)光路に外部吸光体が一切ない自然状態での超音波パルス振幅計測は、グルコース波長および水波長での(PA)NAをもたらす。
【0088】
ステップ(2)cm当りの光学濃度が(OD/l)EA1である外部吸光体層が光源と被検体部位の間に挿入され、第2の超音波パルス振幅計測が2つの波長で実行され、グルコースと水の波長での(PA)EA1を得た。
【0089】
ステップ(3)cm当りの光学濃度が異なる(OD/l)EA1である第2層の外部吸光体が光源と組織の間に挿入され、第3の超音波パルス振幅計測が2つの波長で実行され、グルコースと水の波長での(PA)EA2を得た。以下の3つの式(29)、(30)および(31)が生成し、解かれてグルコースのモル濃度、Cglucoseを得た。
【0090】
Cglucose=Γ−1[(PA)NA/(PA)EA1]@λglucose[(OD/l)EA1/εglucose]@λglucose (29)
Cglucose=Γ−1[(PA)NA/(PA)EA2]@λglucose[(OD/l)EA2/εglucose]@λglucose (30)
Cwater=Γ−1[(PA)NA/(PA)EA1]@λwater[(OD/l)EA1/εwater]@λwater (31)
式を解いて組織内のグルコースのモル濃度を割り出した。同じ手順を適用し、照射波長の適切な使用と、外部吸光体にとって適切なモル吸光係数と光学濃度を挿入することによって、組織内のヘモグロビン、脂質または水のモル濃度を測定することが可能である。水とヘモグロビンの測定は、患者の水和状態と貧血状態を、同患者の血糖状態とともに査定するのに役立つ。これら3つのパラメータの測定は、例えば糖尿病を患っている間容易に貧血または脱水症になりがちである高齢な患者の診療のために重要である。こうして本発明の実施形態の方法は、自らの糖尿病に加えて脱水状態または貧血を進行させる危険があるこれらの患者の健康状態のより高度な追跡を提供する。
【0091】
本発明の実施形態すべてにおいて、
1.レーザー波長のうち少なくとも1つは、被分析物に特有の波長である。
2.波長のうち少なくとも1つは、水に特有の波長である。
3.レーザーパルス継続時間は10−9〜10−6秒であるべきである。
4.検出器は、圧電性結晶(PZT、鉛、ジルコニウム、タンタル結晶)、ハイドロホンまたはポリフッ化ビニリデン(PVDF)膜である。
5.検出器は、圧電性結晶(PZNT、鉛、ジルコニウム、ヌイビウム(nuibium)、タンタル結晶)である。
6.検出器は、組織の音響インピーダンス特性と一致させるためにポリマー層で被覆されている。
7.外部吸光体は、分散カーボンブラック粒子などの高吸光係数吸光物質で被覆された膜である。
8.外部吸光体は、分散高濃度分散吸光染料などの高吸光係数吸光物質で被覆された膜である。
9.外部吸光体は、分散吸光染料などの高吸光係数吸光物質で被覆された膜である。
10.外部吸光体は、分散着色高分子材料などの高吸光係数吸光物質で被覆された膜である。
【0092】
以下の本発明の実施形態を詳細に説明する。
(第1実施形態) 外部吸光体アシッドブラック2の存在下でのグルコース水溶液の光音響応答
図1に説明した機器セットを用いて本発明の実施形態の方法を試験した。生体外実験として、サンプルは、ポリマー層で被覆されたPZNT超音波検出器にその一面を接触させた石英セルに入れられた。透過配置にある検出器にレーザービームが直接作用することを防止するため、1μm厚みの金フィルムが配置された。グルコース溶液(0−20g/dL)が調整された。グルコース溶液は、そのねじ込み口金を介して2つの連結テフロン(登録商標)管(Teflon(登録商標) Tube)を有する遠心分離機水薬瓶に入れられた。水薬瓶は一定温度の水経路に配置され、1CMの石英フローセル(quartz flow cell)とペリスタルティック・ポンプ(peristaltic pump)に結合された。計測中サンプルは循環された。図3は、905nm、1459nm、1550nmおよび1649nmで照射され、媒質に添加されたグルコースの濃度の関数としての光音響信号を示す。1459nm、1550nmおよび1649nmでのグルコースに対する信号のプロットから3つの線を得た。1459nmは水の吸光波長であり、1550nmおよび1649nmはグルコースの吸光波長である。グルコース水溶液が905nm以下で励起された場合は、検出できる光音響信号はなかった。
【0093】
グルコースの濃度変化から得られる光音響信号に対する、付加された外部吸光体の影響について調べた。固定量の近赤外吸収染料を含有した0.9%塩化ナトリウム溶液で、異なるグルコース濃度の溶液を調製した。近赤外吸収染料はアシッドブラック2(ニュージャージー州アクロース・オーガニックス(Acrose Organics)製、ペンシルバニア州ピッツバーグ、フィッシャー・サイエンティフィック(Fischer Scientific)供給の水溶性ニグロシン)であった。全溶液は、905nmで吸光係数μa=2.0CM−1(905nmでcm当り2単位の光学濃度)を有した。サンプルは、純水溶液の場合のように、1cmの石英フローセルで循環された。
【0094】
PA信号は905nm、1459nm、1550nmおよび1649nmで記録された。図5に示すように、4つの線形応答プロットがグルコース濃度の関数として得られた。グルコース濃度と線形に関連する最強の光音響信号は、905nmでの励起から得られ、そこではグルコースも水も、感知できる吸光度を有していない。それは、外部吸光体のニグロシン染料が、2.0CM−1のμa値を有した波長である。染料が光を吸収し、ニグロシン染料励起によるPA信号振幅が、内部熱弾性特性に対するグルコースの線形の関係により変調されたということが明白である。図5に示すように、グルコース濃度の変化に対する応答の強度は、グルコース溶液に加えられた外部吸光体の励起波長において最高となり、グルコースの吸光波長で最低となった。このように外部吸光体の使用は、水系媒質におけるグルコース濃度変化に対する光音響信号の感度を増強する。
【0095】
(第2実施形態) 外部吸光体として犬の固定赤血球の存在下でのグルコース水溶液の光音響応答
水系媒質内のグルコース濃度変化から得られる光音響信号に対する、ヒト血液のスペクトルを模倣する付加外部吸光体の影響について調べた。
【0096】
犬の固定赤血球の1:100希釈を含有した0.9%塩化ナトリウム溶液で、異なるグルコース濃度の溶液を調製した。ここでは新鮮な犬の赤血球で試験したが、赤血球に対するグルコースの浸透圧効果のためデータには再現性がなかった。顕微鏡精査では、高いグルコース濃度においては赤血球の収縮と異形が見られた。犬の赤血球はグルタルアルデヒド溶液を用いて固定され、紡がれ洗浄された。固定赤血球はヘモグロビンを収容した高分子嚢であり、時間経過とともに特性が変化することがない。添加した赤血球内のヘモグロビンは、システムに添加された外部吸光体として働く。
【0097】
PA信号は905nm、1459nm、1550nmおよび1649nmで記録された。図6Aに示すように、4つの線形応答プロットが、グルコース溶液内の犬の固定赤血球の1:100懸濁液に関して示されているグルコース濃度の関数として得られた。グルコース濃度と線形に関連する最強の光音響信号は、905nmでの励起から得られ、そこはグルコースも水も、感知できる吸光度を有していない。それは、外部吸光体である固定赤血球のヘモグロビンが光を吸収した波長である。ヘモグロビンが905nmで光を吸収し、ヘモグロビン励起によるPA信号振幅が、内部熱弾性特性へのグルコースの線形の関係により変調されたということが明白である。図6Aに示すように、グルコース濃度の変化に対する応答の強度は、グルコース溶液に加えられた外部吸光体の励起波長において最高となり、グルコースの吸光波長で最低となった。このように組織内のヒト血液を模倣する外部吸光体の使用は、水系媒質におけるグルコース濃度変化に対する光音響信号の感度を増強する。
【0098】
外部吸光体として犬の固定赤血球の1:50懸濁液を使用した実験を繰り返した。グルコース濃度の関数としての光音響信号の挙動は、1:100懸濁液の場合と同様であった。905nm波長は純水の場合、すなわちゼロ、よりも高かったが、1:100懸濁液の場合よりも少なかった。より高濃度な固定赤血球による散乱は信号に影響した。PA信号への散乱の影響は当技術分野で報告されている。そのデータを図6Bに示す。
【0099】
(第3実施形態) 外部吸光体として黒色高分子フィルムを加えた前と後の、被検体部位の光音響応答
被検体部位に生成する光音響信号への添加外部吸光体の影響を調べるため、図2Aにします光音響分析システムを用いた。905nm、1459nm、1550nmおよび1649nmの4パルスの固体レーザーである。各レーザーからの光は、光ファイバーによってレンズ・ハウジングに届けられた。レンズはレーザーパルスをヒトの指に集束した。
【0100】
被検体は、光学素子テーブルに手を載せ、その指をレンズハウジング(26)とPZNT検出器(32)の間に置いて実験室スツールに座った。検出器は、東芝メディカルシステムズ株式会社(日本、東京)で製造されたPZNT単結晶検出器で、検出器と皮膚の間の超音波結合損失を最低限にするためにインピーダンス適合ポリマーフィルムで被覆されたものである。検出器と接する指の側に超音波結合ジェルが塗布された。PZNT検出器からの信号は増幅されてテクトロニクス(Tektronix)社のデジタルストレージスコープにルーティングされた。レーザー・トリガーはラボビュー(LabView)ソフトウェアを用いたパーソナルコンピュータによって制御された。レーザー・トリガー・モジュールからのトリガー・パルスは、デジタルストレージスコープによるデータ取得を始動した。圧力過渡信号、すなわち検出された超音波信号の時間発展が記録された。各光音響励起波長でのデータから2つのパラメータが抽出された。第1に、レーザー・トリガー・パルスと圧力過渡信号の第1のピークの間の遅延時間である。この時間は、サンプルの厚みとその不透明度次第で5μsから15μsまでの幅がある。第2のパラメータは、第1の記録パルスの最高から最低までの振幅である。
【0101】
図7A、図7B、図7C、図7Dは、それぞれ905nm、1459nm、1550nmおよび1649nmで励起されたヒトの指から生成したPA信号を示す。図7A、図7B、図7C、図7Dまでの4つのグラフの実線は、自然状態での指の励起で生成した信号を表す。パルスの振幅は、励起の波長によって350mVから800mVまでの幅があった。
【0102】
次に、外部吸収フィルムがレンズと指の間に付加された。外部吸光体は、微小なカーボンブラックを拡散させた80μm厚みのポリエチレン・テレフタレート(PET)フィルムである。接着剤内のカーボン含有量は2%のアセチレン・ブラックであった。アセチレン・ブラック被覆フィルムの吸光スペクトルが近赤外FTIR機器(ブルーカーのエキノクス(Bruker, Equinox)55/S分光計)で実行された。外部吸光体の4つの励起波長での光学濃度は、905nmで4.12、1459nmで3.2、1550nmで3.12および1649nmで3.04であった。
【0103】
PETフィルム(外部吸光体)の小片が切り取られ、ポリマーの裏紙が剥離され、次いで、皮膚への効率良い結合を達成するため、その接着剤側が皮膚に触れるフィルムが皮膚に押し付けられた。指の、検出器と接触する側に超音波結合ジェルが塗布された。指はレンズホルダーと検出器の間に、レンズホルダーがフィルムを圧迫し、検出器が指の反対側の皮膚を圧迫するように置かれた。皮膚に印加されたレンズ・ハウジングと検出器の間の応力は200gであった。
【0104】
図7A、図7B、図7C、図7Dまでの4つのグラフの実線は、指と、外部吸光体としてアセチレン・ブラックを持つ付加PETフィルムの励起により生成した信号を表す。光音響信号は905nm、1459nm、1550nmおよび1649nmで励起された。パルスの振幅は、光音響信号の励起の波長によって560mVから4700mVまでの幅があった。重要な観測結果は、すべての波長における光音響信号振幅の増加である。この実施形態における被検者の指に関して、外部吸光体の添加によって光音響信号は次の増強を見た。905nm励起での信号は600mVから4700mVに増加、1459nm励起の信号は800mVから1700mVに増加、1550nm励起の信号は350mVから560mVに増加、そして1649nm励起の信号は350mVから660mVへと増加した。PA信号の振幅の最高の増加は、外部吸光体が最高の吸光度を有する905nmにおいて得られた。この実験の結果は、ヒトの指の皮膚への吸光フィルムの結合、および光音響信号の生成が可能であることを示唆している。増強された信号は、ヒトの指の皮膚に結合された高光学濃度外部吸光体による光の吸収と、指の組織内に超音波が生成してそれが指を介して伝達され、超音波結合ジェルによって指の反対側に結合された圧電検出器によって検出されたことによる。
【0105】
外部吸光体の存在下でのPA信号の挙動は、グルコース水溶液での生体外の実験の場合と同じであった。当業者は、信号強度、種々の波長における吸光体およびグルコースの吸光係数、本発明の実施形態の詳細な説明で説明した式を用いて、人体内でグルコースの濃度測定またはグルコースの濃度の変化を測定することができる。当業者は、線形最小二乗以外のデータ約分ルーチンまたは高度なデータ処理方法を用いて自然の吸収計測および外部吸光体の存在下での計測から得られた信号を、本発明の真髄から解離することなく処理することができる。
【0106】
なお、本発明は上記実施形態そのままに限定されるものではなく、実施段階ではその要旨を逸脱しない範囲で構成要素を変形して具体化できる。また、上記実施形態に開示されている複数の構成要素の適宜な組み合わせにより、種々の発明を形成できる。例えば、実施形態に示される全構成要素から幾つかの構成要素を削除してもよい。さらに、異なる実施形態にわたる構成要素を適宜組み合わせてもよい。
【図面の簡単な説明】
【0107】
【図1】本発明の実施形態の方法を示したフローチャートを示す。
【図2A】本発明の実施形態の方法で使用する光音響分析システムの構成例を示す。
【図2B】本発明の実施形態の方法で使用する光音響分析システムの他の構成例を示す。
【図3】本実施形態において、1cmの石英セル内のグルコース溶液から生成した光音響信号を示す。
【図4】本実施形態において、1459nm、1550nmおよび1649nmでのグルコース水溶液の赤外線吸光度を示す。
【図5】本実施形態において、アシッドブラック2染料という周知の添付吸光体(905nmで2.0光学濃度単位)の存在下でのグルコースの種々の濃度のPA信号を示す。
【図6A】本実施形態において、周知の添付吸光体として2%の犬の固定血球(905nmで2.0光学濃度単位)を1:100の希釈濃度の塩水存在下でのグルコースの種々の濃度のPA信号を示す。
【図6B】本実施形態において、周知の添付吸光体、2%の犬の固定血球(905nmで2.0光学濃度単位)を1:50の希釈濃度の塩水存在下でのグルコースの種々の濃度のPA信号を示す。
【図7A】905nmで励起されたヒトの指から生成した光音響信号を示す(実線)。破線は、付加された外部吸光体である、吸光体として炭素粒子を有するポリエチレン・テレフタレート(PET)フィルムでの信号である。905nmでのフィルムのODは4.2であった。
【図7B】1459nmで励起されたヒトの指から生成した光音響信号を示す(実線)。破線は、添加された外部吸光体である、吸光体として炭素粒子を有するPETフィルムでの信号である。1459nmでのフィルムのODは3.2であった。
【図7C】1550nmで励起されたヒトの指から生成した光音響信号を示す(実線)。破線は、添加された外部吸光体である、吸光体として炭素粒子を有するPETフィルムでの信号である。1550nmでのフィルムのODは3.12であった。
【図7D】1649nmで励起されたヒトの指から生成した光音響信号を示す(実線)。破線は、添加された外部吸光体である、吸光体として炭素粒子を有するPETフィルムでの信号である。1649nmでのフィルムのODは3.04であった。
【符号の説明】
【0108】
10…機器、11…光源モジュール、12…電源、15、16、17、18…レーザー源、20、21、22、23…石英光ファイバー、25…体部インターフェースモジュール、28…サンプル、27…集光レンズ、26…レンズ・ハウジング、32…圧電検出器、34…ホルダー、35…機構、40…検出電子回路・モジュール、41…遮断コネクタ、42…増幅器、43…デジタルストレージスコープ、44…制御PC、46…信号線、48…信号線、50…信号線。
【特許請求の範囲】
【請求項1】
被検体部位の対象組織内の被分析物を測定して得られた信号に対する前記組織の内部特性の影響を補償する光音響分析方法において、
前記被検体部位にレーザー源からの近赤外線レーザーパルスを照射することによって前記対象組織に超音波パルスを発生させるステップ(a)と、
前記被検体部位近傍に配置された超音波検出器を用いて前記超音波パルスを検出して第1の信号を発生するステップ(b)と、
前記超音波パルスが吸光物質内で発生して前記組織を伝播して前記超音波検出器で検出されるように前記レーザー源と前記被検体部位との間に前記吸光物質を配置している期間に、前記ステップ(b)とレーザー波長とエネルギーとが同じレーザーパルスを用いて前記対象組織内に超音波パルスを発生させるステップ(c)と、
前記吸光物質で発生した超音波パルスを検出して第2の信号を発生するステップ(d)と、
前記ステップ(b)で発生した第1の信号と前記ステップ(d)で発生した第2の信号と比を各レーザー波長ごとに算出するステップ(e)と、
前記被分析物の吸光係数を、前記ステップ(e)で算出した比と、前記吸光物質の所定の光学特性とから算出するステップ(f)と、
前記ステップ(f)で算出された吸光係数から前記被分析物の濃度を算出し、光音響励起波長における前記被分析物のモル吸光係数を算出するステップ(g)とを備える光音響分析方法。
【請求項2】
前記被分析物がグルコースである請求項1記載の方法。
【請求項3】
前記被分析物が組織液である請求項1記載の方法。
【請求項4】
前記被分析物がヘモグロビンである請求項1記載の方法。
【請求項5】
前記被分析物が体脂肪である請求項1記載の方法。
【請求項6】
前記被分析物が化学療法造影剤または診断造影剤である請求項1記載の方法。
【請求項7】
前記レーザー波長のうち少なくとも1つはグルコースに特有の波長である請求項1記載の方法。
【請求項8】
前記レーザー波長のうち少なくとも1つは水に特有の波長である請求項1記載の方法。
【請求項9】
前記レーザーパルスは数1x10−9秒から1x10−6秒までの継続時間を有している請求項1記載の方法。
【請求項10】
前記検出器は、圧電性結晶(PZT、鉛、ジルコニウム、タンタル結晶)、ニオブ酸リチウム結晶、ハイドロホンまたはポリフッ化ビニリデン(PVDF)膜のうち1つである請求項1記載の方法。
【請求項11】
前記検出器は、圧電性結晶(PZNT、鉛、ジルコニウム、ヌイビウム(nuibium)、タンタル結晶)であり得る請求項1記載の方法。
【請求項12】
前記検出器は、チタン酸鉛を含有する単結晶の形状をした圧電性結晶であり、一般式Pb[(B1,B2)1−x Tix]O3で表されることができ、端数x=0.5〜0.55であり、B1はZn、Mg、Ni、Sc、InおよびYbから選択される元素を表し、B2はニオブ、Nbおよびタンタル、Taから選択される1元素を表す請求項11記載の方法。
【請求項13】
前記検出器は、組織の音響インピーダンス特性と一致させるためにポリマー層で被覆されている請求項1記載の方法。
【請求項14】
前記外部付加吸光体は、分散カーボンブラック粒子を含む高吸光係数の吸光物質で被覆された膜である請求項1記載の方法。
【請求項15】
前記外部吸光体は、高濃度分散吸光染料を含む高吸光係数の吸光物質で被覆された膜である請求項1記載の方法。
【請求項16】
前記被検体部位には計測プローブによって所定圧力が印加される請求項1記載の方法。
【請求項17】
被検体組織内のグルコースの測定して得られた信号に対する組織の内部特性の影響を補償するための光音響分析方法において、
前記被検体の対象部位をレーザー源からの近赤外線レーザーパルスで照射することによって超音波パルスを発生させ、各波長で得られた第1の超音波パルスを検出するステップ(a)と、
前記超音波パルスが吸光物質内で発生して前記組織を伝播して前記超音波検出器で検出されるように前記レーザー源と前記被検体部位との間に前記吸光物質を配置している期間に、前記ステップ(a)とレーザー波長とエネルギーとが同じレーザーパルスを用いて前記対象組織内に第2の超音波パルスを発生させるステップ(b)と、
前記ステップ(a)で発生させた前記第1の超音波パルスと、前記ステップ(b)で発生させた前記第2の超音波パルスとの強度比を各照射波長ごとに算出して、前記ステップ(a)で発生させた前記第1の超音波パルスの測定値に対して前記被検体部位のバルク組織特性の影響を補償することにより、正規化した被分析物関連光音響信号を発生するステップ(c)と、
前記超音波パルスの強度比と、2つの波長におけるグルコースの吸光係数値と、別の波長における水の吸光係数値と、前記3つの波長における外部吸光体の吸光度値とを用いて前記組織内のグルコース濃度を算出するステップとを備える光音響分析方法。
【請求項18】
被検体組織内のグルコースを含む被分析物を測定して得られた信号に対する組織の内部特性の影響を補償するための光音響分析方法であって、
前記被検体部位内に、前記被検体部位をレーザー源からの近赤外線レーザーパルスで照射して各レーザー波長ごとに第1の超音波パルスを発生させるステップ(a)と、
前記超音波パルスが吸光物質内で発生して前記組織を伝播して前記超音波検出器で検出されるように前記レーザー源と前記被検体部位との間に前記吸光物質を配置している期間に、前記ステップ(a)とレーザー波長とエネルギーとが同じレーザーパルスを用いて前記対象組織内に第2の超音波パルスを発生させるステップ(b)と、
前記ステップ(a)で発生させた第1の超音波パルスと、前記ステップ(b)で発生させた第2の超音波パルスとの強度比を算出して、前記ステップ(a)で発生させた第1の超音波パルスの計測値を前記被検体部位のバルク組織特性の影響で補償して、正規化した被分析物関連光音響信号を発生するステップ(c)と、
前記超音波パルスの強度比と、1つの波長におけるグルコースの吸光係数値と、別の2つの波長における水の吸光係数値と、前記3つの波長における外部吸光体の吸光度値とを用いて前記組織内のグルコース濃度を算出するステップ(d)とを備える光音響分析方法。
【請求項19】
被検体の対象組織内の被分析物を非侵襲で測定する光音響分析装置であって、
複数の波長でレーザーパルスを発生する手段と、
前記レーザーパルスを前記対象組織に照射する手段と、
前記レーザーパルスにより励起された前記対象組織からの光音響信号を検出する手段と、
前記レーザーパルスの照射部分と前記対象組織との間に外部吸光体を配置する手段と、
複数の光音響信号の強度比を生成する手段と、
前記光音響信号の強度比と、前記対象組織内の被分析物の光学パラメータと、前記外部吸光体の光学パラメータとから、前記被分析物の濃度を算出する演算手段とを具備する光音響分析装置。
【請求項1】
被検体部位の対象組織内の被分析物を測定して得られた信号に対する前記組織の内部特性の影響を補償する光音響分析方法において、
前記被検体部位にレーザー源からの近赤外線レーザーパルスを照射することによって前記対象組織に超音波パルスを発生させるステップ(a)と、
前記被検体部位近傍に配置された超音波検出器を用いて前記超音波パルスを検出して第1の信号を発生するステップ(b)と、
前記超音波パルスが吸光物質内で発生して前記組織を伝播して前記超音波検出器で検出されるように前記レーザー源と前記被検体部位との間に前記吸光物質を配置している期間に、前記ステップ(b)とレーザー波長とエネルギーとが同じレーザーパルスを用いて前記対象組織内に超音波パルスを発生させるステップ(c)と、
前記吸光物質で発生した超音波パルスを検出して第2の信号を発生するステップ(d)と、
前記ステップ(b)で発生した第1の信号と前記ステップ(d)で発生した第2の信号と比を各レーザー波長ごとに算出するステップ(e)と、
前記被分析物の吸光係数を、前記ステップ(e)で算出した比と、前記吸光物質の所定の光学特性とから算出するステップ(f)と、
前記ステップ(f)で算出された吸光係数から前記被分析物の濃度を算出し、光音響励起波長における前記被分析物のモル吸光係数を算出するステップ(g)とを備える光音響分析方法。
【請求項2】
前記被分析物がグルコースである請求項1記載の方法。
【請求項3】
前記被分析物が組織液である請求項1記載の方法。
【請求項4】
前記被分析物がヘモグロビンである請求項1記載の方法。
【請求項5】
前記被分析物が体脂肪である請求項1記載の方法。
【請求項6】
前記被分析物が化学療法造影剤または診断造影剤である請求項1記載の方法。
【請求項7】
前記レーザー波長のうち少なくとも1つはグルコースに特有の波長である請求項1記載の方法。
【請求項8】
前記レーザー波長のうち少なくとも1つは水に特有の波長である請求項1記載の方法。
【請求項9】
前記レーザーパルスは数1x10−9秒から1x10−6秒までの継続時間を有している請求項1記載の方法。
【請求項10】
前記検出器は、圧電性結晶(PZT、鉛、ジルコニウム、タンタル結晶)、ニオブ酸リチウム結晶、ハイドロホンまたはポリフッ化ビニリデン(PVDF)膜のうち1つである請求項1記載の方法。
【請求項11】
前記検出器は、圧電性結晶(PZNT、鉛、ジルコニウム、ヌイビウム(nuibium)、タンタル結晶)であり得る請求項1記載の方法。
【請求項12】
前記検出器は、チタン酸鉛を含有する単結晶の形状をした圧電性結晶であり、一般式Pb[(B1,B2)1−x Tix]O3で表されることができ、端数x=0.5〜0.55であり、B1はZn、Mg、Ni、Sc、InおよびYbから選択される元素を表し、B2はニオブ、Nbおよびタンタル、Taから選択される1元素を表す請求項11記載の方法。
【請求項13】
前記検出器は、組織の音響インピーダンス特性と一致させるためにポリマー層で被覆されている請求項1記載の方法。
【請求項14】
前記外部付加吸光体は、分散カーボンブラック粒子を含む高吸光係数の吸光物質で被覆された膜である請求項1記載の方法。
【請求項15】
前記外部吸光体は、高濃度分散吸光染料を含む高吸光係数の吸光物質で被覆された膜である請求項1記載の方法。
【請求項16】
前記被検体部位には計測プローブによって所定圧力が印加される請求項1記載の方法。
【請求項17】
被検体組織内のグルコースの測定して得られた信号に対する組織の内部特性の影響を補償するための光音響分析方法において、
前記被検体の対象部位をレーザー源からの近赤外線レーザーパルスで照射することによって超音波パルスを発生させ、各波長で得られた第1の超音波パルスを検出するステップ(a)と、
前記超音波パルスが吸光物質内で発生して前記組織を伝播して前記超音波検出器で検出されるように前記レーザー源と前記被検体部位との間に前記吸光物質を配置している期間に、前記ステップ(a)とレーザー波長とエネルギーとが同じレーザーパルスを用いて前記対象組織内に第2の超音波パルスを発生させるステップ(b)と、
前記ステップ(a)で発生させた前記第1の超音波パルスと、前記ステップ(b)で発生させた前記第2の超音波パルスとの強度比を各照射波長ごとに算出して、前記ステップ(a)で発生させた前記第1の超音波パルスの測定値に対して前記被検体部位のバルク組織特性の影響を補償することにより、正規化した被分析物関連光音響信号を発生するステップ(c)と、
前記超音波パルスの強度比と、2つの波長におけるグルコースの吸光係数値と、別の波長における水の吸光係数値と、前記3つの波長における外部吸光体の吸光度値とを用いて前記組織内のグルコース濃度を算出するステップとを備える光音響分析方法。
【請求項18】
被検体組織内のグルコースを含む被分析物を測定して得られた信号に対する組織の内部特性の影響を補償するための光音響分析方法であって、
前記被検体部位内に、前記被検体部位をレーザー源からの近赤外線レーザーパルスで照射して各レーザー波長ごとに第1の超音波パルスを発生させるステップ(a)と、
前記超音波パルスが吸光物質内で発生して前記組織を伝播して前記超音波検出器で検出されるように前記レーザー源と前記被検体部位との間に前記吸光物質を配置している期間に、前記ステップ(a)とレーザー波長とエネルギーとが同じレーザーパルスを用いて前記対象組織内に第2の超音波パルスを発生させるステップ(b)と、
前記ステップ(a)で発生させた第1の超音波パルスと、前記ステップ(b)で発生させた第2の超音波パルスとの強度比を算出して、前記ステップ(a)で発生させた第1の超音波パルスの計測値を前記被検体部位のバルク組織特性の影響で補償して、正規化した被分析物関連光音響信号を発生するステップ(c)と、
前記超音波パルスの強度比と、1つの波長におけるグルコースの吸光係数値と、別の2つの波長における水の吸光係数値と、前記3つの波長における外部吸光体の吸光度値とを用いて前記組織内のグルコース濃度を算出するステップ(d)とを備える光音響分析方法。
【請求項19】
被検体の対象組織内の被分析物を非侵襲で測定する光音響分析装置であって、
複数の波長でレーザーパルスを発生する手段と、
前記レーザーパルスを前記対象組織に照射する手段と、
前記レーザーパルスにより励起された前記対象組織からの光音響信号を検出する手段と、
前記レーザーパルスの照射部分と前記対象組織との間に外部吸光体を配置する手段と、
複数の光音響信号の強度比を生成する手段と、
前記光音響信号の強度比と、前記対象組織内の被分析物の光学パラメータと、前記外部吸光体の光学パラメータとから、前記被分析物の濃度を算出する演算手段とを具備する光音響分析装置。
【図1】


【図2A】


【図2B】


【図3】


【図4】


【図5】


【図6A】


【図6B】


【図7A】


【図7B】


【図7C】


【図7D】




【図2A】


【図2B】


【図3】


【図4】


【図5】


【図6A】


【図6B】


【図7A】


【図7B】


【図7C】


【図7D】


【公開番号】特開2008−45938(P2008−45938A)
【公開日】平成20年2月28日(2008.2.28)
【国際特許分類】
【出願番号】特願2006−220289(P2006−220289)
【出願日】平成18年8月11日(2006.8.11)
【出願人】(594164542)東芝メディカルシステムズ株式会社 (4,066)
【出願人】(391008788)アボット・ラボラトリーズ (650)
【氏名又は名称原語表記】ABBOTT LABORATORIES
【出願人】(000003078)株式会社東芝 (54,554)
【Fターム(参考)】
【公開日】平成20年2月28日(2008.2.28)
【国際特許分類】
【出願日】平成18年8月11日(2006.8.11)
【出願人】(594164542)東芝メディカルシステムズ株式会社 (4,066)
【出願人】(391008788)アボット・ラボラトリーズ (650)
【氏名又は名称原語表記】ABBOTT LABORATORIES
【出願人】(000003078)株式会社東芝 (54,554)
【Fターム(参考)】
[ Back to top ]

