被検知物質の検知方法
【課題】プロテアーゼ活性などの加水分解活性を有した化学物質群あるいは加水分解活性に影響を及ぼす化学物質群に対して汎用性が高く、前記化学物質を特異的かつ迅速簡単に検知する方法を提供することを目的とする。
【解決手段】加水分解される基質3が固定化された固相面4を利用し、加水分解活性を有するかあるいは他の加水分解酵素活性を増減させる性質をもった被検知物質を含んだ検体を前記固相面4に反応させ、加水分解されずに固相面4上に残った基質量を検知することで、抗体を用いることなく加水分解活性に依存した被検知物質を特異的に迅速且つ簡単に検知する事のできる検知方法が得られる。
【解決手段】加水分解される基質3が固定化された固相面4を利用し、加水分解活性を有するかあるいは他の加水分解酵素活性を増減させる性質をもった被検知物質を含んだ検体を前記固相面4に反応させ、加水分解されずに固相面4上に残った基質量を検知することで、抗体を用いることなく加水分解活性に依存した被検知物質を特異的に迅速且つ簡単に検知する事のできる検知方法が得られる。
【発明の詳細な説明】
【技術分野】
【0001】
本発明は、バイオセンサーを用いて加水分解活性を検知することにより、加水分解活性を持つ化学物質もしくは加水分解活性に影響を及ぼす化学物質が存在することを検知する方法に関する。
【背景技術】
【0002】
従来、この種の加水分解活性を検知する方法として、プロテアーゼ活性をもつボツリヌス毒素や破傷風毒素を検知するイムノアッセイ法を利用した方法がある(例えば、特許文献1参照)。
【0003】
以下、その毒素検知方法について図17を参照しながら説明する。
【0004】
図17に示すように、ペプチダーゼ活性を持つボツリヌス毒素あるいは破傷風毒素を被検知物質101とし、図17a)に示すように前記ペプチダーゼ活性による切断部位102すなわち加水分解される部位をもった基質103と前記被検知物質101を反応させ、図17b)に示すように前記基質103の切断部位102を露出させる、次に図17c)に示すように酵素104に連結され前記切断部位を認識する抗体105を前記切断部位102と反応させ、次に図17d)に示すように抗体105に連結された酵素104によって反応基質106が生成物107に変換される量を検知することによって、ペプチダーゼ活性をもつ被検知物質101を検知する。
【特許文献1】特開平10−504801号公報
【発明の開示】
【発明が解決しようとする課題】
【0005】
従来のイムノアッセイ法を利用した加水分解活性検知方法では、基質の切断部位を特異的に認識する抗体を作成する必要があるが、抗体作成技術には専門性が必要であり、専門性を有した場合においても目的にかなう特性を有した抗体を作成することは難しく、また抗体作成に要する期間が長期にわたり、かつ抗体は高価であるという課題があり、抗体を利用しないで加水分解活性を特異的に迅速かつ検知する方法が要求されている。
【0006】
また、イムノアッセイ法の性質上、被検知物質を検知するためには複数の工程、すなわち基質と被検知物質との反応工程と、抗体と基質の切断部位との反応工程と、抗体に連結された酵素の検出工程を続けて行う必要があり、反応工程が複雑であるという課題があり、簡略化した工程で検知する方法が要求されている。
【0007】
また、被検知物質として基質特異性の高い加水分解活性を有した酵素を検知することしかできず、このような被検知物質が限定されるため汎用性が低いという課題があり、汎用性の高い検知方法が要求されている。
【0008】
本発明は、このような従来の課題を解決するものであり、抗体を利用しないで加水分解活性を特異的に迅速かつ検知することができ、また、簡略化した工程で検知することができ、また、基質特異性の高い加水分解活性を有したもの以外の被検知物質に対して汎用性の高い検知方法を提供することを目的としている。
【課題を解決するための手段】
【0009】
本発明の被検知物質検知方法は上記目的を達成するために、加水分解される基質が固定化された固相面を利用し、加水分解活性を有するかあるいは他の加水分解酵素活性を増減させる性質をもった被検知物質を含んだ検体と前記固相面を接触させ、加水分解されずに前記固相面上に残った基質を検知することで検体の加水分解活性を検知し、検体中の被検知物質を検知するとしたものである。
【0010】
この手段により抗体を使用せずに被検知物質を検知することができ、また、簡単な反応工程で被検知物質を迅速に検知できる検知方法が得られる。
【0011】
また、基質に対して特異性の高い加水分解活性を持っていない被検知物質であっても容易に検知できる検知方法が得られる。
【0012】
また、加水分解活性を持つもの以外の活性に影響を及ぼす化学物質であればいずれも検知することができ、汎用性の高い検知方法が得られる。
【発明の効果】
【0013】
本発明によれば抗体を利用することなく加水分解活性を持った被検知物質を迅速に検知できるという効果のある被検知物質検知方法を提供できる。
【0014】
また、簡単な反応工程にて被検知物質を検知することができる効果のある被検知物質検知方法を提供できる。
【0015】
また、基質に対して特異性の高い加水分解活性を持っていない被検知物質であっても容易に検知することができる効果のある被検知物質検知方法を提供できる。
また、本発明によれば加水分解活性を有した被検知物質だけでなく加水分解活性に影響を及ぼすもの、即ち、基質を直接加水分解する物質に対して作用し、その結果間接的に基質に対する加水分解活性に影響を及ぼすものであれば、いずれの化学物質も検知することができる効果のある汎用性の高い被検知物質検知方法を提供できる。
【発明を実施するための最良の形態】
【0016】
本発明の請求項1記載の発明は、基質を加水分解する酵素活性を利用した被検知物質検知方法であって、被検知物質は加水分解活性を有するかあるいは他の加水分解酵素活性を増減させる性質をもっており、加水分解される基質が固定化された固相面を利用し、前記被検知物質を含んだ検体と前記固相面を接触させ、加水分解されずに前記固相面上に残った基質を検知することで検体の加水分解活性を検知し、検体中の被検知物質を検知することを特徴とした被検知物質の検知方法としたものであり、抗体を利用しない簡単な工程で被検知物質を検知し、加水分解活性を有した化学物質以外でも加水分解活性に影響を及ぼす化学物質であればいずれも検知できるという作用を有する。
【0017】
また、被検知物質が加水分解活性を持つ酵素であり、被検知物質によって固相面上の基質が加水分解され、被検知物質量によって固相面上に残る基質量が変化することを特徴とした請求項1記載の被検知物質の検知方法としたものであり、加水分解活性を有した酵素を選択的に検知することができる。
【0018】
また、被検知物質が加水分解活性を持つ酵素に対する阻害物質であり、検体は当該被検知物質が阻害する酵素活性を含んでおり、検体の加水分解活性によって固相面上の基質が加水分解され、被検知物質量によって固相面上に残る基質量が変化することを特徴とした請求項1に記載の被検知物質の検知方法としたものであり、加水分解活性を有した酵素に対する活性阻害物質を選択的に検知できるという作用を有する。
【0019】
また、被検知物質がプロテアーゼもしくはプロテアーゼの阻害物質であり、固相面上の基質が当該プロテアーゼもしくは当該プロテアーゼの阻害物質が阻害するプロテアーゼの認識するアミノ酸配列を含んだポリペプチドからなることを特徴とした請求項1〜3のいずれかに記載の被検知物質の検知方法としたものであり、プロテアーゼもしくはプロテアーゼの阻害物質を選択的に検知できるという作用を有する。
【0020】
また、被検知物質がヌクレアーゼもしくはヌクレアーゼの阻害物質であり、固相面上の基質が当該ヌクレアーゼもしくは当該ヌクレアーゼの阻害物質が阻害するヌクレアーゼの認識する塩基配列を含んだ核酸からなることを特徴とした請求項1〜3のいずれかに記載の被検知物質の検知方法としたものであり、ヌクレアーゼもしくはヌクレアーゼの阻害物質を選択的に検知できるという作用を有する。
【0021】
また、被検知物質がグリコシダーゼもしくはグリコシダーゼの阻害物質であり、固相面上の基質が当該グリコシダーゼもしくは当該グリコシダーゼの阻害物質が阻害するグリコシダーゼの認識する糖鎖構造を含んだ糖鎖からなることを特徴とした請求項1〜3のいずれかに記載の被検知物質の検知方法としたものであり、グリコシダーゼもしくはグリコシダーゼの阻害物質を選択的に検知できるという作用を有する。
【0022】
また、被検知物質がリパーゼもしくはリパーゼの阻害物質であり、固相面上の基質が当該リパーゼもしくは当該リパーゼの阻害物質が阻害するリパーゼの認識する脂肪酸を含んだ有機酸からなることを特徴とした請求項1〜3のいずれかに記載の被検知物質の検知方法としたものであり、リパーゼもしくはリパーゼの阻害物質を選択的に検知できるという作用を有する。
【0023】
また、加水分解活性を持つ酵素が認識する認識配列をもつ基質を固定化した固相面と、加水分解活性を持つ酵素が認識する認識配列を持たない基質を固定化した固相面に、被検知物質を含んだ検体を接触させ、認識配列をもつ基質を固定化した前記固相面上に残った基質量と認識配列を持たない基質を固定化した前記固相面上に残った基質量の差を比較することで被検知物質を検知することを特徴とした請求項4〜7のいずれかに記載の被検知物質の検知方法としたものであり、認識配列に特異的な加水分解活性に関する被検知物質をより正確に検知できるという作用を有する。
【0024】
また、加水分解活性を持つ酵素が認識する配列をもつ基質が複数の固相面に異なる濃度で固定化されていることを特徴とし、前記記載の複数の固相面に被検知物質を含んだ検体を接触させ、固相面上に残った基質量の基質濃度依存性を指標に検体中の被検知物質を検知することを特徴とした請求項4〜7のいずれかに記載の被検知物質の検知方法としたものであり、基質濃度に依存した加水分解活性を解析することで加水分解活性の速度論的解析が容易となり、加水分解活性の特性を詳しく知ることができるという作用を有する。
【0025】
また、被検知物質を含んだ検体を固相面上に接して流れるように反応させることを特徴とし、被検知物質を連続的に検知する請求項1〜9のいずれかに記載の被検知物質の検知方法としたものであり、被検知物質を連続的にモニタリングすることができるという作用を有する。
【0026】
また、固相面上の基質を検知し易くするための信号物質を基質に結合してあることを特徴とし、信号物質の減少量を指標にして固相面上に残った基質量を検知する請求項1〜10のいずれかに記載の被検知物質の検知方法としたものであり、固相面上に残った基質量を簡単に検知でき、その結果、被検知物質を簡単に検知できるという作用を有する。
【0027】
また、基質に結合した信号物質が蛍光色素であり、固相面上に残った基質量を蛍光強度の減少量によって測定することを特徴とした請求項11に記載の被検知物質の検知方法としたものであり、固相面上に残った基質量を光学的検知によって迅速且つ正確に検知でき、その結果、被検知物質を迅速且つ正確に検知できるという作用を有する。
【0028】
また、信号物質が酸化還元電位を発生させる物質であることを特徴とし、固相面上に残っている基質の量を酸化還元電流の減少量によって測定する請求項11に記載の被検知物質の検知方法としたものであり、固相面上に残った基質量を電気化学的検知によって簡便且つ安価に検知でき、その結果、被検知物質を簡便且つ安価に検知できるという作用を有する。
【0029】
また、信号物質が磁化特性をもつことを特徴とし、固相面上に残っている基質の量を磁化特性の変化量によって測定する請求項11に記載の被検知物質の検知方法としたものであり、信号物質の劣化が起こることなく固相面上に残った基質量を磁気センサーによって迅速且つ簡便に検知でき、その結果、被検知物質を迅速且つ簡便に検知できるという作用を有する。
【0030】
また、信号物質が色素化合物であることを特徴とし、固相面上に残っている基質の量を色素の減少量によって測定する請求項11に記載の被検知物質の検知方法としたものであり、信号物質の検知手段として特別な検出装置を使うことなく固相面上に残った基質量を簡単且つ安価に検知できその結果、被検知物質を簡単且つ安価に検知できるという作用を有する。
【0031】
また、基質が固定化された固相面が電極であることを特徴とし、固相面上の基質の分子量に基づく電極活性の変化を指標にして固相面上に残った基質量を検知する請求項1〜10のいずれかに記載の被検知物質の検知方法としたものであり、信号物質を基質に連結することなく簡単に固相面上に残った基質量を検知することができるという作用を有する。
【0032】
以下、本発明の実施の形態について図面を参照しながら説明する。
【0033】
(実施の形態1)
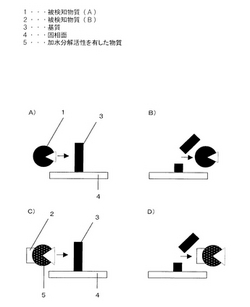
図1a)b)に、加水分解活性を有した被検知物質(A)1を検出する方法を示し、図1c)d)に他の加水分解活性を増減させる性質を持った被検知物質(B)2を検出する方法を示す。ここで、加水分解活性を増減させる性質とは、例えば加水分解活性を持つものに作用してその加水分解活性を強くしたり、弱くしたりする効果を示す性質である。
【0034】
図1a)に示すように、加水分解活性を有した被検知物質(A)1を、加水分解される基質3が固定化された固相面4に接触させ、図1b)に示すように、固相面4上に残った基質3を検知することで、加水分解活性を検知し、検体中の被検知物質(A)1を検知する。
【0035】
図1a)b)において、被検知物質(A)1とは、例えばDNAやRNAなどの核酸を加水分解する希土類の一種セリウム(IV)イオンであり、この場合、基質3はDNAやRNAなどの核酸であって固相面4に固定化されている。DNAやRNAを固定化する固相面4は例えばガラスや酸化スズに代表される導電性酸化物などの鉱物で形成されたものであって、この場合の固定化手段としては、γ―アミノプロピルトリエトキシランなどのシランカップリング剤で処理し導入されたアミノ基にグルタルアルデヒドなどのニ官能性試薬を作用させた後DNAのアミノ基と反応させる方法がある。なお、被検知物質(A)1は基質3を加水分解するものであれば上記記載のもの以外であっても同様の検知ができ、上記方法以外に、例えば、アビジンを吸着させたガラスなどの固相面4にアビジンを吸着させ、ビオチンを化学結合させたDNAもしくはRNAを反応し結合させる方法がある。なお、基質3は被検知物質(A)1によって加水分解されるものであれば上記記載のもの以外であっても同様の検知ができる。なお、基質3を固定化する手段と固相面4は基質3を堅持させることができれば上記記載のもの以外であっても同様の検知ができる。
【0036】
また、図1a)b)において、被検知物質(A)1を固相面4に接触させる方法としては、例えば被検知物質(A)1であるセリウム(IV)イオンが溶解した溶液をピペットなどの操作で固相面4上に滴下する方法であり、これ以外の方法であっても被検知物質(A)1を固相面4に接触させる方法であれば同様の検知ができる。
【0037】
また、図1a)b)において、固相面4上に残った基質3を検知する手段としては、例えば基質3であるDNAをあらかじめキレート剤であるDAPIで染色し、DAPIによる発光強度をUV励起によって光学的に検知し、被検知物質(A)1を接触させる前と接触させた後の変化量を検知する方法であり、あるいは、DNAにその他の色素をあらかじめ結合させておき、同様に変化量を検知する方法である。なお、上記記載の方法以外であっても、被検知物質(A)1を固相面4に接触させる前後の基質変化量を検知できるものであればいずれの場合でも同様の検知ができる。
【0038】
上記構成において、被検知物質(A)1であるセリウム(IV)イオンに対する抗体がなくても、セリウム(IV)イオンの持つDNAに対する加水分解活性を指標に、セリウム(IV)イオンの存在を検出することができるようになる。また、検知するための工程は、被検知物質(A)1と固相面4の接触工程と固相面4上に残った基質3の量を検知するという単純な工程であるため、簡単に被検知物質(A)1を検知することができる。また、被検知物質(A)1が加水分解活性を持つものであれば、その加水分解活性を指標に検知することができるため、様々なタイプの被検知物質(A)1を検知することができ、汎用性が高い検知方法となる。従って、セリウム(IV)イオンのようにDNA上の特定の塩基配列に対して高い基質特異性を持たずDNAの塩基配列であれば加水分解活性を示すものであっても、上記方法によって高い基質特異性を持っていなくても簡単に検知することができる。
【0039】
図1c)に示すように、加水分解活性を増減させる性質を持った被検知物質(B)2と加水分解活性を有した物質5を結合させ、加水分解される基質3が固定化された固相面4に接触させ、図1d)に示すように、固相面4上に残った基質3の量を検知することで、加水分解活性を検知し、検体中の被検知物質を検知する。
【0040】
図1c)d)において、被検知物質(B)2とは、例えば金属プロテアーゼであるマトリックスメタロプロテイナーゼの補酵素であるZnイオンであり、Znイオンは加水分解活性を有した物質5であるマトリックスメタロプロテイナーゼに結合する事で加水分解活性を増大させる。
【0041】
また、図1c)d)において、加水分解活性を有した物質5は被検知物質(B)2と混合した状態で固相面4に接触される必要があり、例えばマトリックスメタロプロテイナーゼが溶解しZnイオンを含んでいない溶液中にZnイオンが含まれている溶液を混合し、混合溶液を例えばピペットなどの操作で固相面4に滴下される。
【0042】
また、図1c)d)において、加水分解活性を有した物質5がマトリックスメタロプロテイナーゼである場合、基質3はゼラチンなどのタンパク質であって固相面4に固定化されている。ゼラチンなどのタンパク質を固定化する固相面4は例えばガラスや酸化スズに代表される導電性酸化物などの鉱物で形成されたものであって、この場合の固定化手段としては、γ―アミノプロピルトリエトキシランなどのシランカップリング剤で処理し導入されたアミノ基にグルタルアルデヒドなどのニ官能性試薬を作用させた後ゼラチンのアミノ基と反応させる方法がある。なお、被検知物質(B)2は上記記載のもの以外であっても加水分解活性を有した物質5の加水分解活性を増減させるものであればいずれの場合であっても同様の検知ができる。なお、加水分解活性を有した物質5は基質3を加水分解するものであれば上記記載のもの以外であっても同様の検知ができる。なお、基質3は加水分解活性を有した物質5によって加水分解されるものであれば上記記載のもの以外であっても同様の検知ができる。なお、基質3を固定化する手段と固相面4は基質3を堅持させることができれば上記記載のもの以外であっても同様の検知ができる。
【0043】
また、図1c)d)において、固相面4上に残った基質3を検知する手段としては、例えば基質3であるゼラチンに色素をあらかじめ結合させておき、被検知物質(B)2と加水分解活性を有した物質5を接触させる前後の変化量を検知する方法である。なお、上記記載の方法以外であっても、被検知物質(B)2と加水分解活性を有した物質5を接触させる前後の変化量を検知できるものであればいずれの場合でも同様の検知ができる。
【0044】
上記構成において、被検知物質(B)2であるZnイオンに対する抗体がなくても、Znイオンの持つマトリックスメタロプロテイナーゼに対する加水分解活性増減効果を指標に、Znイオンの存在を検出することができるようになる。また、検知するための工程は、被検知物質(B)2と加水分解活性を有した物質5を混合させる工程と、固相面4の接触工程と、固相面4上に残った基質3の量を検知するという単純な工程であるため、簡単に被検知物質(B)2を検知することができる。また、被検知物質(B)2が加水分解活性を有した物質5の加水分解活性を増減させるものであれば、その加水分解活性増減効果を指標に検知することができるため、様々なタイプの被検知物質(A)1を検知することができ、汎用性が高い検知方法となる。
【0045】
(実施の形態2)
図2に、被検知物質である加水分解酵素6を検出する方法を示す。
【0046】
図2a)に示すように、加水分解酵素6を、加水分解される基質3が固定化された固相面4に接触させ、図2b)に示すように、固相面4上に残った基質3の量を検知することで、加水分解酵素6を検知する。
【0047】
また、図2c)に示すように、被検知物質である加水分解酵素6が図2a)に比べて多く存在する場合は、図2d)に示すように、固相面4上の基質3が図2b)に比べて多く加水分解され、すなわち、加水分解酵素6の存在量に依存して固相面4上に残る基質3の量が変わる。このように固相面4上の基質3の量を検知することで、被検知物質である加水分解酵素の量を検知する。
【0048】
図2において、加水分解酵素6とは、例えばDNaseなどの核酸を加水分解するヌクレアーゼであり、この場合、基質3はDNAであって固相面4に固定化されている。なお、加水分解酵素はヌクレアーゼ以外でもプロテアーゼやグリコシダーゼなど多の加水分解酵素であっても、加水分解酵素によって切断されるタンパク質や糖鎖などの高分子を基質3として用いることで同様の検知ができる。また、基質3を固相面4に固定化する方法としては、例えば実施の形態1に示した方法などがあり、また、被検知物質である加水分解酵素6を固相面4に接触させる方法としては、例えば実施の形態1に記した方法があり、また、固相面4上に残った基質3を検知する手段としては、例えば実施の形態1に記した方法がある。
【0049】
上記構成において、加水分解酵素6であるヌクレアーゼがヌクレアーゼの存在量に依存して固相面4上のDNAを切断し、固相面4上に残った基質3はヌクレアーゼの存在量に反比例して減少する。そして、固相面4上に残った基質3の量を検知し、あらかじめ存在量のわかっているヌクレアーゼを用いて検知した固相面4上に残った基質3の量と比較することで、存在量のわからないヌクレアーゼの存在量を検知することができる。このようにして基質3に対して加水分解活性をもった加水分解酵素6を簡単に検知することができる。
【0050】
(実施の形態3)
図3に、被検知物質である加水分解活性をもった酵素に対する阻害物質7を検出する方法を示す。ここで、酵素に対する阻害物質とは、酵素に直接作用して酵素活性を損なわせる、あるいは酵素と基質との反応を競合的に阻害するものである。
【0051】
図3a)に示すように、加水分解酵素6と阻害物質7を混合し、加水分解される基質3が固定化された固相面4に接触させ、図3b)に示すように、固相面4上に残った基質3の量を検知することで、阻害物質7を検知する。
【0052】
また、図3c)に示すように、被検知物質である阻害物質7が図3a)に比べて多く存在する場合は、図3d)に示すように、固相面4上の基質3が図3b)に比べて多く残り、すなわち、阻害物質7の存在量に依存して固相面4上に残る基質3の量が変わる。このように固相面4上の基質3の量を検知することで、被検知物質である加水分解酵素の量を検知する。
【0053】
図3において、阻害物質7とは、例えばセルピンの一種であるアンチトロンビンであり、この場合、加水分解酵素6とは、例えばセリンプロテアーゼの一種であるトロンビンである。この場合、基質3はトロンビンによって加水分解されるタンパク質であって固相面4に固定化されている。なお、阻害物質7はセルピン以外であっても、加水分解酵素6の酵素活性を阻害するものであれば加水分解酵素6によって切断される高分子を基質3として用いることで同様の検知ができる。また、基質3を固相面4に固定化する方法としては、例えば実施の形態1に示した方法などがあり、また、被検知物質である加水分解酵素6を固相面4に接触させる方法としては、例えば実施の形態1に記した方法があり、また、固相面4上に残った基質3を検知する手段としては、例えば実施の形態1に記した方法がある。なお、基質3となるタンパク質を固定化する手段として固相面4に導入されたアミノ基に縮合剤を用いてFmoc−アミノ酸をアミド結合あるいはエステル結合させ、固相面上でタンパク質合成する方法などを用いてもかまわない。
【0054】
上記構成において、阻害物質7であるアンチトロンビンによって酵素活性を阻害される加水分解酵素が、アンチトロンビンの存在量に反比例して固相面4上の基質3であるタンパク質を切断し、固相面4上に残った基質3はセルピンの存在量に比例して多くなる。そして、固相面4上に残った基質3の量を検知し、あらかじめ存在量のわかっているアンチトロンビンとトロンビンを用いて検知した固相面4上に残った基質3の量と比較することで、存在量のわからないアンチトロンビンの存在量を検知することができる。このようにして基質3を分解する加水分解酵素に対して阻害活性を持った阻害物質7を簡単に検知することができる。
【0055】
(実施の形態4)
図4a)b)に、プロテアーゼ8を検出する方法を示し、図4c)d)にプロテアーゼ阻害物質9を検出する方法を示す。
【0056】
図4a)に示すように、タンパク質やペプチドを加水分解する加勢を持ったプロテアーゼ8を、加水分解される基質3が固定化された固相面4に接触させ、図4b)に示すように、固相面4上に残った基質3を検知することで、加水分解活性を検知し、検体中のプロテアーゼ8を検知する。この際、プロテアーゼ8は基質3が持つ認識配列10を特異的に切断する。
【0057】
図4において、プロテアーゼ8とは、例えばプロテアーゼ活性をもったボツリヌス毒素であり、この場合、基質3が持つ認識配列10はボツリヌス毒素が特異的に認識し切断するアミノ酸配列であり、例えばVANPやSNAP−25あるいはシンタキシンなどの神経伝達物質の分泌に関与しているタンパク質もしくはこれらタンパク質の一部の配列を含むものである。そして、基質3はVANPやSNAP−25あるいはシンタキシンなどのタンパク質そのもの、あるいはこれらタンパク質のアミノ酸配列を持った融合タンパク質であり固相面4に固定化されている。なお、プロテアーゼ8はボツリヌス毒素以外であっても、特定のアミノ酸配列を認識し切断する活性を持つものであれば、認識配列10として特定のアミノ酸配列を持つ基質3を用いることで同様の検知ができる。また、基質3を固相面4に固定化する方法としては、例えば実施の形態1に示した方法などがあり、また、被検知物質である加水分解酵素6を固相面4に接触させる方法としては、例えば実施の形態1に記した方法があり、また、固相面4上に残った基質3を検知する手段としては、例えば実施の形態1に記した方法がある。なお、基質3となるタンパク質を固定化する手段として固相面4に導入されたアミノ基に縮合剤を用いてFmoc−アミノ酸をアミド結合あるいはエステル結合させ、固相面上でタンパク質合成する方法などを用いてもかまわない。
【0058】
上記構成において、プロテアーゼ8であるボツリヌス毒素によって基質3のもつ認識配列10が選択的に加水分解され、ボツリヌス毒素の存在量に反比例して固相面4上の基質3であるタンパク質が減少する。そして、固相面4上に残った基質3の量を検知し、あらかじめ存在量のわかっているボツリヌス毒素を用いて検知した固相面4上に残った基質3の量と比較することで、存在量のわからないボツリヌス毒素の存在量を検知することができる。このようにして基質3を分解するプロテアーゼ8を特異的に検知することができる。
【0059】
図4c)に示すように、プロテアーゼ8とプロテアーゼ阻害物質9を混合し、加水分解される基質3が固定化された固相面4に接触させ、図4d)に示すように、固相面4上に残った基質3の量を検知することで、プロテアーゼ阻害物質9を検知する。
【0060】
図4において、プロテアーゼ阻害物質9とは、例えばα2−マクログロブリンであり、この場合、共存させるプロテアーゼ8とは例えばトロンビンなどである。この場合、基質3はトロンビンによって加水分解されるタンパク質であって、例えば分子内にバリン−プロリン−アルギニンといったトロンビンに選択的に切断される認識配列10を持っており固相面4に固定化されている。なお、プロテアーゼ阻害物質9はα2−マクログロブリン以外であっても、プロテアーゼ8の酵素活性を阻害するものであればプロテアーゼ8によって特異的に切断される認識配列10を持ったタンパク質あるいは認識配列10を含んだ融合タンパク質あるいはペプチドを基質3として用いることで同様の検知ができる。また、基質3を固相面4に固定化する方法としては、例えば実施の形態1に示した方法などがあり、また、被検知物質である加水分解酵素6を固相面4に接触させる方法としては、例えば実施の形態1に記した方法があり、また、固相面4上に残った基質3を検知する手段としては、例えば実施の形態1に記した方法がある。
【0061】
上記構成において、プロテアーゼ阻害物質9であるα2−マクログロブリンによって阻害されるプロテアーゼ8が、α2−マクログロブリンの存在量に反比例して固相面4上の認識配列10を持った基質3を特異的に切断し、固相面4上に残った基質3はα2−マクログロブリンの存在量に比例して多くなる。そして、固相面4上に残った基質3の量を検知し、あらかじめ存在量のわかっているα2−マクログロブリンを用いて検知した固相面4上に残った基質3の量と比較することで、存在量のわからないα2−マクログロブリンの存在量を検知することができる。このようにして基質3を分解するプロテアーゼ8に対して阻害活性を持ったプロテアーゼ阻害物質9の量を特異的に検知することができる。
【0062】
上記構成の検知方法を用いることで、プロテアーゼである毒素や、血液中に含まれる臨床マーカーを抗体の使用なしに簡単に特異的に検知することができる。
【0063】
上記方法の検知方法で検知可能なものとしては、プロテアーゼ活性を持ったボツリヌス毒素や破傷風毒素のほかある種の蛇毒や、癌マーカーのひとつであるアンジオスタチンやエイズウイルスに含まれるHIVプロテアーゼや、ネフローゼ症候群のマーカーであるα2マクログロブリンなどその他プロテアーゼ活性やプロテアーゼ阻害活性を持ったものが挙げられる。
【0064】
(実施の形態5)
図5a)b)に、ヌクレアーゼ11を検出する方法を示し、図5c)d)にヌクレアーゼ阻害物質12を検出する方法を示す。
【0065】
図5a)に示すように、DNAやRNAなどの核酸を加水分解する活性を持ったヌクレアーゼ11を、加水分解される基質3が固定化された固相面4に接触させ、図5b)に示すように、固相面4上に残った基質3を検知することで、加水分解活性を検知し、検体中のヌクレアーゼ11を検知する。この際、ヌクレアーゼ11は基質3が持つ認識配列10を特異的に切断する。
【0066】
図5において、ヌクレアーゼ11とは、例えばヌクレアーゼ活性をもった制限酵素SmaIであり、この場合、基質3が持つ認識配列10は−CCCGGG−で示される塩基配列であり、基質3は認識配列10を含んだDNAであり固相面4に固定化されている。なお、ヌクレアーゼ11は制限酵素SmaI以外であっても、DNA上の特定の塩基配列を認識し切断する活性を持つものであれば、認識配列10として特定の塩基配列を持つ基質3を用いることで同様の検知ができる。また、基質3を固相面4に固定化する方法としては、例えば実施の形態1に示した方法などがあり、また、ヌクレアーゼ11を固相面4に接触させる方法としては、例えば実施の形態1に記した方法があり、また、固相面4上に残った基質3を検知する手段としては、例えば実施の形態1に記した方法がある。なお、基質3となるDNAを固定化する手段として固相面4をポリ−L−リジンで被覆し、静電的に固定化する方法などを用いてもかまわない。
【0067】
上記構成において、ヌクレアーゼ11であるSmaIによって基質3のもつ認識配列10が選択的に加水分解され、SmaIの存在量に反比例して固相面4上の基質3であるDNAが減少する。そして、固相面4上に残った基質3の量を検知し、あらかじめ存在量のわかっているSmaIを用いて検知した固相面4上に残った基質3の量と比較することで、存在量のわからないSmaIの存在量を検知することができる。このようにして基質3を分解するヌクレアーゼ11を特異的に検知することができる。
【0068】
図5c)に示すように、ヌクレアーゼ11とヌクレアーゼ阻害物質12を混合し、加水分解される基質3が固定化された固相面4に接触させ、図5d)に示すように、固相面4上に残った基質3の量を検知することで、ヌクレアーゼ阻害物質12を検知する。
【0069】
図5において、ヌクレアーゼ阻害物質12とは、例えば−CCCGGG−で示される塩基配列を持ったDNAであり、この場合、共存させるヌクレアーゼ11とは例えば制限酵素であるSmaIである。この場合、基質3はSmaIによって特異的に切断される−CCCGGG−で示される塩基配列を持った認識配列10を持っており、固相面4に固定化されている。ここで、ヌクレアーゼ阻害物質12と認識配列10は同じ塩基配列を持っており、ヌクレアーゼ阻害物質12が存在することでヌクレアーゼ11が認識配列10を切断する活性を競合的に阻害する。なお、ヌクレアーゼ11とヌクレアーゼ阻害物質12の組み合わせは上記以外のものであっても、特異的な配列を認識して切断するヌクレアーゼ11であれば、ヌクレアーゼ阻害物質12と同じ塩基配列を持った認識配列10を用いることで同様の検知ができる。また、基質3を固相面4に固定化する方法としては、例えば実施の形態1に示した方法などがあり、また、ヌクレアーゼ阻害物質12を固相面4に接触させる方法としては、例えば実施の形態1に記した方法があり、また、固相面4上に残った基質3を検知する手段としては、例えば実施の形態1に記した方法がある。
【0070】
上記構成において、ヌクレアーゼ阻害物質12である−CCCGGG−で示される塩基配列を持ったDNAによって阻害されるヌクレアーゼ11が、ヌクレアーゼ阻害物質12の存在量に反比例して固相面4上の認識配列10を持った基質3を特異的に切断し、固相面4上に残った基質3はヌクレアーゼ阻害物質12の存在量に比例して多くなる。そして、固相面4上に残った基質3の量を検知し、あらかじめ存在量のわかっている−CCCGGG−で示される塩基配列を持ったDNAを用いて検知した固相面4上に残った基質3の量と比較することで、存在量のわからない−CCCGGG−で示される塩基配列を持ったDNAの存在量を検知することができる。このようにして基質3を分解するヌクレアーゼ11に対して阻害活性を持ったヌクレアーゼ阻害物質12の量を特異的に検知することができる。
【0071】
(実施の形態6)
図6a)b)に、グリコシダーゼ13を検出する方法を示し、図6c)d)にグリコシダーゼ阻害物質14を検出する方法を示す。
【0072】
図6a)に示すように、糖鎖を加水分解する活性を持ったグリコシダーゼ13を、加水分解される基質3が固定化された固相面4に接触させ、図6b)に示すように、固相面4上に残った基質3を検知することで、加水分解活性を検知し、検体中のグリコシダーゼ13を検知する。この際、グリコシダーゼ13は基質3が持つ認識配列10を特異的に切断する。
【0073】
図6において、グリコシダーゼ13とは、例えばシアル酸を加水分解する活性をもったインフルエンザウイルスのノイラミンデースであり、この場合、基質3が持つ認識配列10はノイラミンデースが特異的に加水分解するノイラミン酸であり、基質3は認識配列10を含んだ糖鎖であり固相面4に固定化されている。なお、グリコシダーゼ13はノイラミンデース以外であっても、糖鎖構造の特定の糖鎖を認識し切断する活性を持つものであれば、認識配列10として特定の糖鎖構造を持つ基質3を用いることで同様の検知ができる。また、基質3を固相面4に固定化する方法としては、例えば実施の形態1に示した方法などがあり、また、グリコシダーゼ13を固相面4に接触させる方法としては、例えば実施の形態1に記した方法があり、また、固相面4上に残った基質3を検知する手段としては、例えば実施の形態1に記した方法がある。なお、基質3となる糖鎖を固定化する手段として固相面4をアビジンで被覆し、ビオチン標識した糖鎖をビオチンーアビジン反応によって固定化する方法などを用いてもかまわない。
【0074】
上記構成において、グリコシダーゼ13であるノイラミンデースによって基質3のもつ認識配列10が選択的に加水分解され、ノイラミンデースの存在量に反比例して固相面4上の基質3である糖鎖が減少する。そして、固相面4上に残った基質3の量を検知し、あらかじめ存在量のわかっているノイラミンデースを用いて検知した固相面4上に残った基質3の量と比較することで、存在量のわからないノイラミンデースの存在量を検知することができ、インフルエンザウイルスの存在量を検知することができる。このようにして基質3を分解するグリコシダーゼ13を特異的に検知することができる。
【0075】
図6c)に示すように、グリコシダーゼ13とグリコシダーゼ阻害物質14を混合し、加水分解される基質3が固定化された固相面4に接触させ、図6d)に示すように、固相面4上に残った基質3の量を検知することで、グリコシダーゼ阻害物質14を検知する。
【0076】
図6において、グリコシダーゼ阻害物質14とは、例えばインフルエンザ治療薬などのノイラミン酸の誘導体であり、この場合、共存させるグリコシダーゼ13とはノイラミンデースである。この場合、基質3はノイラミンデースによって特異的に切断されるノイラミン酸を含んだ糖鎖である認識配列10を持っており固相面4に固定化されている。なお、グリコシダーゼ13とグリコシダーゼ阻害物質14の組み合わせは上記以外のものであっても、特異的な糖鎖構造を認識して切断するグリコシダーゼ13であれば同様の検知ができる。また、基質3を固相面4に固定化する方法としては、例えば実施の形態1に示した方法などがあり、また、ヌクレアーゼ阻害物質12を固相面4に接触させる方法としては、例えば実施の形態1に記した方法があり、また、固相面4上に残った基質3を検知する手段としては、例えば実施の形態1に記した方法がある。
【0077】
上記構成において、グリコシダーゼ阻害物質14であるノイラミン酸誘導体によって阻害されるグリコシダーゼ13が、グリコシダーゼ阻害物質14の存在量に反比例して固相面4上の認識配列10を持った基質3を特異的に切断し、固相面4上に残った基質3はグリコシダーゼ阻害物質14の存在量に比例して多くなる。そして、固相面4上に残った基質3の量を検知し、あらかじめ存在量のわかっているノイラミン酸誘導体を用いて検知した固相面4上に残った基質3の量と比較することで、存在量のわかっていないノイラミン酸誘導体の存在量を検知することができる。このようにして基質3を分解するグリコシダーゼ13に対して阻害活性を持ったグリコシダーゼ阻害物質14の量を特異的に検知することができる。
【0078】
上記構成の検知方法を用いることでインフルエンザウイルスなどを抗体の利用なしに特異的に簡単に検知することができ、また、上記方法を用いて効果的なインフルエンザ治療薬をスクリーニング方法としても利用することができる。
【0079】
(実施の形態7)
図7a)b)に、リパーゼ15を検出する方法を示し、図7c)d)にリパーゼ阻害物質16を検出する方法を示す。
【0080】
図7a)に示すように、脂肪酸を加水分解する活性を持ったリパーゼ15を、加水分解される基質3が固定化された固相面4に接触させ、図7b)に示すように、固相面4上に残った基質3を検知することで、加水分解活性を検知し、検体中のリパーゼ15を検知する。この際、リパーゼ15は基質3が持つ認識配列10を特異的に切断する。
【0081】
図7において、リパーゼ15とは、例えばスフィンゴミエリンを加水分解する活性をもったスフィンゴミエリナーゼあり、この場合、基質3が持つ認識配列10はスフィンゴミエリナーゼが特異的に加水分解するスフィンゴミエリンであり、基質3は認識配列10を含んだ脂肪酸であり固相面4に固定化されている。なお、リパーゼ15はスフィンゴミエリナーゼ以外であっても、脂肪酸の特定の構造を認識し切断する活性を持つものであれば、認識配列10として特定の脂肪酸を持つ基質3を用いることで同様の検知ができる。また、基質3を固相面4に固定化する方法としては、例えば実施の形態1に示した方法などがあり、また、リパーゼ15を固相面4に接触させる方法としては、例えば実施の形態1に記した方法があり、また、固相面4上に残った基質3を検知する手段としては、例えば実施の形態1に記した方法がある。
【0082】
上記構成において、リパーゼ15であるスフィンゴミエリナーゼによって基質3のもつ認識配列10が選択的に加水分解され、スフィンゴミエリナーゼの存在量に反比例して固相面4上の基質3である糖鎖が減少する。そして、固相面4上に残った基質3の量を検知し、あらかじめ存在量のわかっているスフィンゴミエリナーゼを用いて検知した固相面4上に残った基質3の量と比較することで、存在量のわからないスフィンゴミエリナーゼの存在量を検知することができる。このようにして基質3を分解するリパーゼ15を特異的に検知することができる。
【0083】
図7c)に示すように、リパーゼ15とリパーゼ阻害物質16を混合し、加水分解される基質3が固定化された固相面4に接触させ、図5d)に示すように、固相面4上に残った基質3の量を検知することで、リパーゼ阻害物質16を検知する。
【0084】
図7において、リパーゼ阻害物質16とは、例えばスフィンゴミエリナーゼに加水分解されるスフィンゴミエリンであり、この場合、共存させるリパーゼ15とは例えばスフィンゴミエリナーゼである。この場合、基質3はスフィンゴミエリナーゼによって特異的に切断されるスフィンゴミエリンを持った認識配列10を持っており固相面4に固定化されている。ここで、リパーゼ阻害物質16と認識配列10は同じ脂肪酸を含んであり、リパーゼ阻害物質16が存在することでリパーゼ15が認識配列10を切断する活性を競合的に阻害する。なお、リパーゼ15とリパーゼ阻害物質16の組み合わせは上記以外のものであっても、特異的な配列を認識して切断するリパーゼ15であれば、リパーゼ阻害物質16と同じ脂肪酸を持った認識配列10を用いることで同様の検知ができる。また、基質3を固相面4に固定化する方法としては、例えば実施の形態1に示した方法などがあり、また、リパーゼ阻害物質16を固相面4に接触させる方法としては、例えば実施の形態1に記した方法があり、また、固相面4上に残った基質3を検知する手段としては、例えば実施の形態1に記した方法がある。
【0085】
上記構成において、リパーゼ阻害物質16であるスフィンゴミエリンによって阻害されるリパーゼ15が、リパーゼ阻害物質16の存在量に反比例して固相面4上の認識配列10を持った基質3を特異的に切断し、固相面4上に残った基質3はリパーゼ阻害物質16の存在量に比例して多くなる。そして、固相面4上に残った基質3の量を検知し、あらかじめ存在量のわかっているスフィンゴミエリンを用いて検知した固相面4上に残った基質3の量と比較することで、存在量のわかっていないスフィンゴミエリンの存在量を検知することができる。このようにして基質3を分解するリパーゼ15に対して阻害活性を持ったリパーゼ阻害物質16の量を特異的に検知することができる。
【0086】
上記構成の検知方法を用いることでウルシュ菌のもつα毒素などリパーゼ活性を持った酵素を抗体の使用なしに特異的に簡単に検知することができる。
【0087】
(実施の形態8)
図8には、酵素の認識配列10を含んだ基質3を固定化した固相面4と認識配列10を含まない基質3を固定化した固相面4に被検知物質(A)1を反応させ、両固相面4に残った基質3量の差を比較することで被検知物質(A)1を検知する方法を示した。
【0088】
実施の形態1〜7に示した様に被検知物質を検知する際、図8のa)に示したように、被検知物質(A)1を、認識配列10を含んだ基質3を固定化した固相面4と認識配列10を含まない基質3を固定化した固相面4に接触させ、図8のb)に示したように、認識配列10を含んだ基質3のみ加水分解させ、認識配列10を含まない基質3は加水分解されない状況をつくる。そして両固相面4上に残った基質3の量を比較し、認識配列10を含んだ基質3の方が認識配列10を含まない基質3よりも減っていた場合は認識配列10を特異的に加水分解する被検知物質(A)1が存在していると判断される。ここで、認識配列10を含んだ基質3と認識配列10を含まない基質3が同等に減っていた場合は、認識配列に特異的でない加水分解活性を持った被検知物質(A)1が存在していると判断される。ここで、例えばヌクレアーゼ11である制限酵素SmaIを被検知物質(A)1とした場合、認識配列10として−CCCGGG−で示される塩基配列があり、−CCCGGG−塩基配列を持ったDNAと−CCCGGG−塩基配列を持たないDNAをそれぞれ固相面4に固定化する。固定化手段と固相面は例えば実施の形態1に示した方法がある。また、固相面4上に残った基質3を検知する方法としては例えば実施の形態1に示した方法がある。
【0089】
すなわち図8c)のフローチャートに示したように、被検知物質(A)1を含んだ検体を固相面4に反応させ基質3を切断させる工程、認識配列10を含んだ基質3の残量と認識配列10を含まない基質3の残量を検知する工程、両基質3の残量を比較判断し、認識配列10を含んだ基質3特異的に減った量を検知する工程、認識配列10を含んだ基質3特異的に減った基質3量を元に加水分解活性を検知し、被検知物質(A)1量に換算する工程を含む。
【0090】
なお、ここでは認識配列10が1種類の場合において認識配列10を持つ基質3の残量と持たない基質3の残量を比較する場合を示したが、複数の認識配列10を別々の固相面4に固定化することで、加水分解活性を持つ複数の被検知物質を同時に検知することができるようになる。
【0091】
上記構成において、被検知物質(A)1の存在量に依存して認識配列10を含んだ基質3が加水分解され、認識配列10に特異的な加水分解活性を指標に被検知物質(A)1を検知することができる。そして、あらかじめ存在量のわかっている被検知物質(A)1を用いて検知した固相面4上に残った基質3の量と比較することで、存在量のわからない被検知物質(A)1の存在量を検知することができる。このようにして認識配列10に対して特異的な加水分解活性をもった被検知物質(A)1を簡単に検知することができる。
【0092】
(実施の形態9)
図9には、加水分解活性を持つ酵素が認識する配列をもつ基質3が複数の固相面4に異なる濃度で固定化させ、被検知物質(A)1を反応させた後固相面4上に残った基質量の基質濃度依存性を指標に被検知物質(A)1を検知する方法を示した。
【0093】
実施の形態1〜7に示した被検知物質を検知する際、図9a)に示したように、被検知物質(A)1を、認識配列10を含んだ基質3を異なる濃度で固定化した固相面4に接触させ、図9b)に示したように、認識配列10を持った基質3の濃度に依存して被検知物質(A)1が基質を加水分解する状況をつくる。そして、これら異なる濃度の認識配列10を持つ基質3が固定化された固相面に残った基質量を検知し比較することで、加水分解活性の異なる基質濃度に対する分解速度を知ることができる。異なる基質濃度に対する分解速度をプロットすることで、被検知物質(A)1を特徴付ける酵素活性の反応速度論的な解釈、即ち、加水分解される基質の生成速度から個々の加水分解酵素特有の加水分解速度を推測することができる。図9c)に示したようなプロット図から、酵素活性のVmaxを知ることができ、被検知物質(A)1の酵素活性がどの程度特異性を持っているか知ることができ、また、酵素は特有の分解速度を有していることから、被検知物質(A)1を特定することも可能となる。
【0094】
上記構成において、被検知物質(A)1を検知することができ、また、異なる濃度の認識配列10を持った基質3に対する分解速度を知ることができ、被検知物質(A)1の加水分解活性の反応速度論的解釈が可能となる。
【0095】
また、上記記載の方法を利用して、被検知物質(A)1の酵素活性に影響する物質で、例えばウイルスの治療薬などをスクリーニングすることも可能となる。
【0096】
(実施の形態10)
図10に、被検知物質(A)1を含んだ検体17を固相面4上に接して流れるように反応させることを特徴とし、被検知物質を連続的に検知する方法を示した。
【0097】
実施の形態1〜7に示した様に被検知物質を検知する際、図10a)〜c)に示したように、被検知物質(A)1を含む検体17を固相面4上に接する要に連続的に流す。連続的に流す手段としては、例えば固相面4上に溶液の流れる流路を設け、流路に被検知物質(A)1を含んだ検体をポンプなど用いて流入させる方法がある。また、図10a)に示したように、検体17中に被検知物質(A)1以外の混合物質18が多数含まれており、被検知物質(A)1が含まれていない時は、被検知物質(A)1によって特異的に加水分解される認識配列10を持った基質3は分解されない。図10b)に示したように、被検知物質(A)1が含まれた検体17が固相面4上に流れてきたさい、被検知物質(A)1によって固相面4上の基質3が認識配列10で加水分解される。固相面4上の基質量を連続的にモニタリングすることで、基質3が加水分解されるタイミングを知ることができる、検体17中に被検知物質(A)1が混入されたタイミングを知ることができる。
【0098】
上記構成において、認識配列10に対して特異的は酵素活性を持った被検知物質(A)1を連続的にモニタリングすることができる。
【0099】
(実施の形態11)
図11に、基質を検知しやすくするための信号物質19を基質3に結合させた検知方法を示した。
【0100】
実施の形態1〜7に示した様に被検知物質(A)1を検知する際、固相面4上に残った基質3の量を検知する必要がある。固相面4上に固定化されたタンパク質やDNAなどの高分子を検知しやすくするための信号物質19として、例えばFITCなどの蛍光物質やGFPなどの蛍光タンパク質、あるいは、磁化特性や酸化還元力を持った希土類などを利用することで、信号物質の量を蛍光強度あるいは磁力あるいは酸化還元電流を検知し、基質量を検知することができるようになる。また、信号物質19を基質3である高分子に結合させる手段として、例えばグルタルアルデヒドなどの架橋試薬を用いる方法があり、あるいはGFPやHRPなどの酵素を結合させる方法としては、基質3であるタンパク質もしくはペプチドと融合タンパク質として合成する方法がある。なお、信号物質19を重量のある大きな高分子とする場合は固相面4に金を用い、表面プラズモンを利用して検知することもできる。
【0101】
上記構成において、基質3単独では検知しにくい場合であっても、信号物質19を結合することで基質3量を簡単に検知することができるようになり、被検知物質(A)1を簡単に検知することができるようになる。
【0102】
(実施の形態12)
図12に信号物質を蛍光色素20とした検知方法を示す。
【0103】
実施の形態1〜7に示した様に被検知物質(A)1を検知する際、図12a)b)に示したように蛍光色素20を結合させた基質3を固相面4に固定化させ、蛍光検知手段21を用いて蛍光色素20を検知する。蛍光色素20としては、例えばFITCなどがあり、蛍光色素20を基質3に結合させる手段としてはグルタルアルデヒドを用いて架橋する方法があるが、その他の蛍光色素20を他の架橋手段を用いて基質3に結合させてもかまわない。なお、蛍光色素20としてGFPなどの蛍光タンパク質を用いる場合は、基質3であるタンパク質と融合タンパク質として合成してもかまわない。また、蛍光検知手段21としては発光素子としてLEDを用い、受光素子としてフォトダイオードなどを利用した光センサなどを用いて蛍光強度を検知する方法がある。
【0104】
また、図12a)に示すような被検知物質(A)1を反応させる前の蛍光強度と図12b)に示すような被検知物質(A)1を反応させた後の蛍光強度を比較することで、被検知物質によって特異的に加水分解された基質3の量を知ることができる。
【0105】
上記構成において、蛍光色素20による蛍光強度を蛍光検知手段21で検知することで簡単に固相面4上の基質3を検知することができるようになり、被検知物質(A)1を簡単に高感度に検知することができるようになる。
【0106】
(実施の形態13)
図13に、信号物質として、酸化還元電位を発生させる物質22を利用した検知方法を示す。
【0107】
実施の形態1〜7に示した様に被検知物質(A)1を検知する際、図13a)b)に示したように酸化還元電位を発生させる物質22を結合させた基質3を固相面4に固定化させ、電流検知手段23を用いて酸化還元電流を検知する。酸化還元電位を発生させる物質22としては、例えばHRPなどの酸化還元酵素があり、この場合電流検知手段23としてはHRPによって過酸化水素が酸化される際に放出される電子をFMAなどのメディエーターを通じて金電極を用いて電流知として検知する方法がある。なお、基質3をDNAとした場合、へキストなどのインターカレーターをDNAに結合させ、ヘキストによる酸化電流を検知する方法でもかまわない。なお、希土類などを酸化還元電位を発生させる物質22として使用することもできる。
【0108】
また、図13a)に示すような被検知物質(A)1を反応させる前の電流量と図13b)に示すような被検知物質(A)1を反応させる後の電流量を比較することで、被検知物質(A)1によって特異的に加水分解された基質3の量を知ることができる。
【0109】
上記構成において、酸化還元電位を発生させる物質22により発生する酸化還元電流を電流検知手段23で検知することで、被検知物質(A)1を簡単に検知することができるようになる。
【0110】
(実施の形態14)
図14に、信号物質として、磁化特性をもった磁化物質24を利用した検知方法を示す。
【0111】
実施の形態1〜7に示した様に被検知物質(A)1を検知する際、図14a)b)に示したように磁化物質24を結合させた基質3を固相面4に固定化させ、磁気検知手段25を用いて磁気を検知する。磁化物質24としては、例えば希土類などの硬質磁性材料があり、この場合磁気検知手段25としては可飽和コイルなどを用いた磁気センサーを用いて検知する方法がある。なお、上記記載以外のものであっても、磁化特性を有する材料であれば同様に磁気センサーを用いて検知することが可能となる。
【0112】
また、図14a)に示すような被検知物質(A)1を反応させる前の磁気量と図14b)に示すような被検知物質(A)1を反応させる後の磁気量を比較することで、被検知物質(A)1によって特異的に加水分解された基質3の量を知ることができる。
【0113】
上記構成において、磁化物質24の磁化特性を磁気検知手段25で検知することで、被検知物質(A)1を簡単に検知することができるようになる。
【0114】
(実施の形態15)
図15に、信号物質として、可視できる色素26を利用した検知方法を示す。
【0115】
実施の形態1〜7に示した様に被検知物質(A)1を検知する際、図15a)b)に示したように色素26を結合させた基質3を固相面4に固定化させ、肉眼で基質量を確認する。色素26としては、例えばルテニウムなどの金属錯体があり、その他、可視光に吸収ピークのある色素であれば同様に用いることができる。図14a)に示すような被検知物質(A)1を反応させる前の色素量と図14b)に示すような被検知物質(A)1を反応させる後の色素量を比較することで、被検知物質(A)1によって特異的に加水分解された基質3の量を知ることができる。
【0116】
上記構成において、色素26を用いることで、被検知物質(A)1を特別な検知手段を必要とせず簡単に検知することができるようになる。
【0117】
(実施の形態16)
図16に、電極27を固相面とし、電極27に基質3を固定化し、電極27上の基質3の分子量に基づく電極27の電極活性を指標にして、電気化学測定法にて基質量を検知する方法を示す。ここで電極活性とは、電極界面の電子の移動しやすさのことである。
【0118】
実施の形態1〜7に示した様に被検知物質(A)1を検知する際、図16a)b)に示した様に固相面を電極27とし、電極27上に基質3を固定化してある。固定化された基質量は、基質3の分子量に応じて電極27の電極活性が変化することを利用して検知される。電極としては、白金、金、グラッシーカーボン、グラファイトや酸化スズに代表される導電性酸化物などで構成されており、電極27の電極活性を検知する手段としては、例えば水などの電解質を介し基質3を固定化した電極と基質3を固定化していない電極間を流れる電流を測定する方法があり、電極27上に固定化された基質3の分子量に応じて電極間を流れる電流が阻害されるため、流れる電流量から基質3の量を見積もることができる。なお電気化学的に電極の特性を測定する方法であればいずれの場合であっても同様の検知方法ができる。また、図15a)に示すような被検知物質(A)1を反応させる前の基質量と図15b)に示すような被検知物質(A)1を反応させる後の基質量を比較することで、被検知物質(A)1によって特異的に加水分解された基質3の量を知ることができる。
【0119】
上記構成において、特別な信号物質を基質3に導入することなく電極活性の変化を利用することで基質量を検知することができ、簡単な構成の固相面を用いて被検知物質(A)1を検知することができるようになる。
【産業上の利用可能性】
【0120】
本発明の被検知物質検知方法を用いて、加水分解活性に関与する様々な化学物質を選択的に検知することができ、且つ抗体の特性に依存しないバイオセンサーをつくることができる。本発明の検知方法を利用したバイオセンサーを用いることで、食品中に混入したボツリヌス毒素に代表されるプロテアーゼ活性を有した毒素を容易に検知することができ、また、血液中の前立腺特異的抗原(PSA)に代表される様々な疾患マーカーを容易に検知することができ、また、ノイラミンデース活性を有したインフルエンザウイルスやプロテアーゼ活性を有したダニアレルゲンなど空気中を浮遊し人体の健康に悪影響を及ぼす化学物質を検知することにも応用できる。また、加水分解活性を有した酵素やその阻害物質等のスクリーニング、活性測定などの研究用途にも利用することができる。
【図面の簡単な説明】
【0121】
【図1】本発明の実施の形態1の被検知物質検知方法を示す図
【図2】本発明の実施の形態2の被検知物質検知方法を示す図
【図3】本発明の実施の形態3の被検知物質検知方法を示す図
【図4】本発明の実施の形態4の被検知物質検知方法を示す図
【図5】本発明の実施の形態5の被検知物質検知方法を示す図
【図6】本発明の実施の形態6の被検知物質検知方法を示す図
【図7】本発明の実施の形態7の被検知物質検知方法を示す図
【図8】本発明の実施の形態8の被検知物質検知方法を示す図
【図9】本発明の実施の形態9の被検知物質検知方法を示す図
【図10】本発明の実施の形態10の被検知物質検知方法を示す図
【図11】本発明の実施の形態11の被検知物質検知方法を示す図
【図12】本発明の実施の形態12の被検知物質検知方法を示す図
【図13】本発明の実施の形態13の被検知物質検知方法を示す図
【図14】本発明の実施の形態14の被検知物質検知方法を示す図
【図15】本発明の実施の形態15の被検知物質検知方法を示す図
【図16】本発明の実施の形態16の被検知物質検知方法を示す図
【図17】従来の被検知方法を示す図
【符号の説明】
【0122】
1 被検知物質(A)
2 被検知物質(B)
3 基質
4 固相面
5 加水分解活性を有した物質
6 加水分解酵素
7 阻害物質
8 プロテアーゼ
9 プロテアーゼ阻害物質
10 認識配列
11 ヌクレアーゼ
12 ヌクレアーゼ阻害物質
13 グリコシダーゼ
14 グリコシダーゼ阻害物質
15 リパーゼ
16 リパーゼ阻害物質
17 検体
18 混合物質
19 信号物質
20 蛍光色素
21 蛍光検知手段
22 酸化還元電位を発生させる物質
23 電流検知手段
24 磁化物質
25 磁気検知手段
26 色素
27 電極
101 被検知物質
102 切断部位
103 基質
104 酵素
105 抗体
106 反応基質
107 生成物
【技術分野】
【0001】
本発明は、バイオセンサーを用いて加水分解活性を検知することにより、加水分解活性を持つ化学物質もしくは加水分解活性に影響を及ぼす化学物質が存在することを検知する方法に関する。
【背景技術】
【0002】
従来、この種の加水分解活性を検知する方法として、プロテアーゼ活性をもつボツリヌス毒素や破傷風毒素を検知するイムノアッセイ法を利用した方法がある(例えば、特許文献1参照)。
【0003】
以下、その毒素検知方法について図17を参照しながら説明する。
【0004】
図17に示すように、ペプチダーゼ活性を持つボツリヌス毒素あるいは破傷風毒素を被検知物質101とし、図17a)に示すように前記ペプチダーゼ活性による切断部位102すなわち加水分解される部位をもった基質103と前記被検知物質101を反応させ、図17b)に示すように前記基質103の切断部位102を露出させる、次に図17c)に示すように酵素104に連結され前記切断部位を認識する抗体105を前記切断部位102と反応させ、次に図17d)に示すように抗体105に連結された酵素104によって反応基質106が生成物107に変換される量を検知することによって、ペプチダーゼ活性をもつ被検知物質101を検知する。
【特許文献1】特開平10−504801号公報
【発明の開示】
【発明が解決しようとする課題】
【0005】
従来のイムノアッセイ法を利用した加水分解活性検知方法では、基質の切断部位を特異的に認識する抗体を作成する必要があるが、抗体作成技術には専門性が必要であり、専門性を有した場合においても目的にかなう特性を有した抗体を作成することは難しく、また抗体作成に要する期間が長期にわたり、かつ抗体は高価であるという課題があり、抗体を利用しないで加水分解活性を特異的に迅速かつ検知する方法が要求されている。
【0006】
また、イムノアッセイ法の性質上、被検知物質を検知するためには複数の工程、すなわち基質と被検知物質との反応工程と、抗体と基質の切断部位との反応工程と、抗体に連結された酵素の検出工程を続けて行う必要があり、反応工程が複雑であるという課題があり、簡略化した工程で検知する方法が要求されている。
【0007】
また、被検知物質として基質特異性の高い加水分解活性を有した酵素を検知することしかできず、このような被検知物質が限定されるため汎用性が低いという課題があり、汎用性の高い検知方法が要求されている。
【0008】
本発明は、このような従来の課題を解決するものであり、抗体を利用しないで加水分解活性を特異的に迅速かつ検知することができ、また、簡略化した工程で検知することができ、また、基質特異性の高い加水分解活性を有したもの以外の被検知物質に対して汎用性の高い検知方法を提供することを目的としている。
【課題を解決するための手段】
【0009】
本発明の被検知物質検知方法は上記目的を達成するために、加水分解される基質が固定化された固相面を利用し、加水分解活性を有するかあるいは他の加水分解酵素活性を増減させる性質をもった被検知物質を含んだ検体と前記固相面を接触させ、加水分解されずに前記固相面上に残った基質を検知することで検体の加水分解活性を検知し、検体中の被検知物質を検知するとしたものである。
【0010】
この手段により抗体を使用せずに被検知物質を検知することができ、また、簡単な反応工程で被検知物質を迅速に検知できる検知方法が得られる。
【0011】
また、基質に対して特異性の高い加水分解活性を持っていない被検知物質であっても容易に検知できる検知方法が得られる。
【0012】
また、加水分解活性を持つもの以外の活性に影響を及ぼす化学物質であればいずれも検知することができ、汎用性の高い検知方法が得られる。
【発明の効果】
【0013】
本発明によれば抗体を利用することなく加水分解活性を持った被検知物質を迅速に検知できるという効果のある被検知物質検知方法を提供できる。
【0014】
また、簡単な反応工程にて被検知物質を検知することができる効果のある被検知物質検知方法を提供できる。
【0015】
また、基質に対して特異性の高い加水分解活性を持っていない被検知物質であっても容易に検知することができる効果のある被検知物質検知方法を提供できる。
また、本発明によれば加水分解活性を有した被検知物質だけでなく加水分解活性に影響を及ぼすもの、即ち、基質を直接加水分解する物質に対して作用し、その結果間接的に基質に対する加水分解活性に影響を及ぼすものであれば、いずれの化学物質も検知することができる効果のある汎用性の高い被検知物質検知方法を提供できる。
【発明を実施するための最良の形態】
【0016】
本発明の請求項1記載の発明は、基質を加水分解する酵素活性を利用した被検知物質検知方法であって、被検知物質は加水分解活性を有するかあるいは他の加水分解酵素活性を増減させる性質をもっており、加水分解される基質が固定化された固相面を利用し、前記被検知物質を含んだ検体と前記固相面を接触させ、加水分解されずに前記固相面上に残った基質を検知することで検体の加水分解活性を検知し、検体中の被検知物質を検知することを特徴とした被検知物質の検知方法としたものであり、抗体を利用しない簡単な工程で被検知物質を検知し、加水分解活性を有した化学物質以外でも加水分解活性に影響を及ぼす化学物質であればいずれも検知できるという作用を有する。
【0017】
また、被検知物質が加水分解活性を持つ酵素であり、被検知物質によって固相面上の基質が加水分解され、被検知物質量によって固相面上に残る基質量が変化することを特徴とした請求項1記載の被検知物質の検知方法としたものであり、加水分解活性を有した酵素を選択的に検知することができる。
【0018】
また、被検知物質が加水分解活性を持つ酵素に対する阻害物質であり、検体は当該被検知物質が阻害する酵素活性を含んでおり、検体の加水分解活性によって固相面上の基質が加水分解され、被検知物質量によって固相面上に残る基質量が変化することを特徴とした請求項1に記載の被検知物質の検知方法としたものであり、加水分解活性を有した酵素に対する活性阻害物質を選択的に検知できるという作用を有する。
【0019】
また、被検知物質がプロテアーゼもしくはプロテアーゼの阻害物質であり、固相面上の基質が当該プロテアーゼもしくは当該プロテアーゼの阻害物質が阻害するプロテアーゼの認識するアミノ酸配列を含んだポリペプチドからなることを特徴とした請求項1〜3のいずれかに記載の被検知物質の検知方法としたものであり、プロテアーゼもしくはプロテアーゼの阻害物質を選択的に検知できるという作用を有する。
【0020】
また、被検知物質がヌクレアーゼもしくはヌクレアーゼの阻害物質であり、固相面上の基質が当該ヌクレアーゼもしくは当該ヌクレアーゼの阻害物質が阻害するヌクレアーゼの認識する塩基配列を含んだ核酸からなることを特徴とした請求項1〜3のいずれかに記載の被検知物質の検知方法としたものであり、ヌクレアーゼもしくはヌクレアーゼの阻害物質を選択的に検知できるという作用を有する。
【0021】
また、被検知物質がグリコシダーゼもしくはグリコシダーゼの阻害物質であり、固相面上の基質が当該グリコシダーゼもしくは当該グリコシダーゼの阻害物質が阻害するグリコシダーゼの認識する糖鎖構造を含んだ糖鎖からなることを特徴とした請求項1〜3のいずれかに記載の被検知物質の検知方法としたものであり、グリコシダーゼもしくはグリコシダーゼの阻害物質を選択的に検知できるという作用を有する。
【0022】
また、被検知物質がリパーゼもしくはリパーゼの阻害物質であり、固相面上の基質が当該リパーゼもしくは当該リパーゼの阻害物質が阻害するリパーゼの認識する脂肪酸を含んだ有機酸からなることを特徴とした請求項1〜3のいずれかに記載の被検知物質の検知方法としたものであり、リパーゼもしくはリパーゼの阻害物質を選択的に検知できるという作用を有する。
【0023】
また、加水分解活性を持つ酵素が認識する認識配列をもつ基質を固定化した固相面と、加水分解活性を持つ酵素が認識する認識配列を持たない基質を固定化した固相面に、被検知物質を含んだ検体を接触させ、認識配列をもつ基質を固定化した前記固相面上に残った基質量と認識配列を持たない基質を固定化した前記固相面上に残った基質量の差を比較することで被検知物質を検知することを特徴とした請求項4〜7のいずれかに記載の被検知物質の検知方法としたものであり、認識配列に特異的な加水分解活性に関する被検知物質をより正確に検知できるという作用を有する。
【0024】
また、加水分解活性を持つ酵素が認識する配列をもつ基質が複数の固相面に異なる濃度で固定化されていることを特徴とし、前記記載の複数の固相面に被検知物質を含んだ検体を接触させ、固相面上に残った基質量の基質濃度依存性を指標に検体中の被検知物質を検知することを特徴とした請求項4〜7のいずれかに記載の被検知物質の検知方法としたものであり、基質濃度に依存した加水分解活性を解析することで加水分解活性の速度論的解析が容易となり、加水分解活性の特性を詳しく知ることができるという作用を有する。
【0025】
また、被検知物質を含んだ検体を固相面上に接して流れるように反応させることを特徴とし、被検知物質を連続的に検知する請求項1〜9のいずれかに記載の被検知物質の検知方法としたものであり、被検知物質を連続的にモニタリングすることができるという作用を有する。
【0026】
また、固相面上の基質を検知し易くするための信号物質を基質に結合してあることを特徴とし、信号物質の減少量を指標にして固相面上に残った基質量を検知する請求項1〜10のいずれかに記載の被検知物質の検知方法としたものであり、固相面上に残った基質量を簡単に検知でき、その結果、被検知物質を簡単に検知できるという作用を有する。
【0027】
また、基質に結合した信号物質が蛍光色素であり、固相面上に残った基質量を蛍光強度の減少量によって測定することを特徴とした請求項11に記載の被検知物質の検知方法としたものであり、固相面上に残った基質量を光学的検知によって迅速且つ正確に検知でき、その結果、被検知物質を迅速且つ正確に検知できるという作用を有する。
【0028】
また、信号物質が酸化還元電位を発生させる物質であることを特徴とし、固相面上に残っている基質の量を酸化還元電流の減少量によって測定する請求項11に記載の被検知物質の検知方法としたものであり、固相面上に残った基質量を電気化学的検知によって簡便且つ安価に検知でき、その結果、被検知物質を簡便且つ安価に検知できるという作用を有する。
【0029】
また、信号物質が磁化特性をもつことを特徴とし、固相面上に残っている基質の量を磁化特性の変化量によって測定する請求項11に記載の被検知物質の検知方法としたものであり、信号物質の劣化が起こることなく固相面上に残った基質量を磁気センサーによって迅速且つ簡便に検知でき、その結果、被検知物質を迅速且つ簡便に検知できるという作用を有する。
【0030】
また、信号物質が色素化合物であることを特徴とし、固相面上に残っている基質の量を色素の減少量によって測定する請求項11に記載の被検知物質の検知方法としたものであり、信号物質の検知手段として特別な検出装置を使うことなく固相面上に残った基質量を簡単且つ安価に検知できその結果、被検知物質を簡単且つ安価に検知できるという作用を有する。
【0031】
また、基質が固定化された固相面が電極であることを特徴とし、固相面上の基質の分子量に基づく電極活性の変化を指標にして固相面上に残った基質量を検知する請求項1〜10のいずれかに記載の被検知物質の検知方法としたものであり、信号物質を基質に連結することなく簡単に固相面上に残った基質量を検知することができるという作用を有する。
【0032】
以下、本発明の実施の形態について図面を参照しながら説明する。
【0033】
(実施の形態1)
図1a)b)に、加水分解活性を有した被検知物質(A)1を検出する方法を示し、図1c)d)に他の加水分解活性を増減させる性質を持った被検知物質(B)2を検出する方法を示す。ここで、加水分解活性を増減させる性質とは、例えば加水分解活性を持つものに作用してその加水分解活性を強くしたり、弱くしたりする効果を示す性質である。
【0034】
図1a)に示すように、加水分解活性を有した被検知物質(A)1を、加水分解される基質3が固定化された固相面4に接触させ、図1b)に示すように、固相面4上に残った基質3を検知することで、加水分解活性を検知し、検体中の被検知物質(A)1を検知する。
【0035】
図1a)b)において、被検知物質(A)1とは、例えばDNAやRNAなどの核酸を加水分解する希土類の一種セリウム(IV)イオンであり、この場合、基質3はDNAやRNAなどの核酸であって固相面4に固定化されている。DNAやRNAを固定化する固相面4は例えばガラスや酸化スズに代表される導電性酸化物などの鉱物で形成されたものであって、この場合の固定化手段としては、γ―アミノプロピルトリエトキシランなどのシランカップリング剤で処理し導入されたアミノ基にグルタルアルデヒドなどのニ官能性試薬を作用させた後DNAのアミノ基と反応させる方法がある。なお、被検知物質(A)1は基質3を加水分解するものであれば上記記載のもの以外であっても同様の検知ができ、上記方法以外に、例えば、アビジンを吸着させたガラスなどの固相面4にアビジンを吸着させ、ビオチンを化学結合させたDNAもしくはRNAを反応し結合させる方法がある。なお、基質3は被検知物質(A)1によって加水分解されるものであれば上記記載のもの以外であっても同様の検知ができる。なお、基質3を固定化する手段と固相面4は基質3を堅持させることができれば上記記載のもの以外であっても同様の検知ができる。
【0036】
また、図1a)b)において、被検知物質(A)1を固相面4に接触させる方法としては、例えば被検知物質(A)1であるセリウム(IV)イオンが溶解した溶液をピペットなどの操作で固相面4上に滴下する方法であり、これ以外の方法であっても被検知物質(A)1を固相面4に接触させる方法であれば同様の検知ができる。
【0037】
また、図1a)b)において、固相面4上に残った基質3を検知する手段としては、例えば基質3であるDNAをあらかじめキレート剤であるDAPIで染色し、DAPIによる発光強度をUV励起によって光学的に検知し、被検知物質(A)1を接触させる前と接触させた後の変化量を検知する方法であり、あるいは、DNAにその他の色素をあらかじめ結合させておき、同様に変化量を検知する方法である。なお、上記記載の方法以外であっても、被検知物質(A)1を固相面4に接触させる前後の基質変化量を検知できるものであればいずれの場合でも同様の検知ができる。
【0038】
上記構成において、被検知物質(A)1であるセリウム(IV)イオンに対する抗体がなくても、セリウム(IV)イオンの持つDNAに対する加水分解活性を指標に、セリウム(IV)イオンの存在を検出することができるようになる。また、検知するための工程は、被検知物質(A)1と固相面4の接触工程と固相面4上に残った基質3の量を検知するという単純な工程であるため、簡単に被検知物質(A)1を検知することができる。また、被検知物質(A)1が加水分解活性を持つものであれば、その加水分解活性を指標に検知することができるため、様々なタイプの被検知物質(A)1を検知することができ、汎用性が高い検知方法となる。従って、セリウム(IV)イオンのようにDNA上の特定の塩基配列に対して高い基質特異性を持たずDNAの塩基配列であれば加水分解活性を示すものであっても、上記方法によって高い基質特異性を持っていなくても簡単に検知することができる。
【0039】
図1c)に示すように、加水分解活性を増減させる性質を持った被検知物質(B)2と加水分解活性を有した物質5を結合させ、加水分解される基質3が固定化された固相面4に接触させ、図1d)に示すように、固相面4上に残った基質3の量を検知することで、加水分解活性を検知し、検体中の被検知物質を検知する。
【0040】
図1c)d)において、被検知物質(B)2とは、例えば金属プロテアーゼであるマトリックスメタロプロテイナーゼの補酵素であるZnイオンであり、Znイオンは加水分解活性を有した物質5であるマトリックスメタロプロテイナーゼに結合する事で加水分解活性を増大させる。
【0041】
また、図1c)d)において、加水分解活性を有した物質5は被検知物質(B)2と混合した状態で固相面4に接触される必要があり、例えばマトリックスメタロプロテイナーゼが溶解しZnイオンを含んでいない溶液中にZnイオンが含まれている溶液を混合し、混合溶液を例えばピペットなどの操作で固相面4に滴下される。
【0042】
また、図1c)d)において、加水分解活性を有した物質5がマトリックスメタロプロテイナーゼである場合、基質3はゼラチンなどのタンパク質であって固相面4に固定化されている。ゼラチンなどのタンパク質を固定化する固相面4は例えばガラスや酸化スズに代表される導電性酸化物などの鉱物で形成されたものであって、この場合の固定化手段としては、γ―アミノプロピルトリエトキシランなどのシランカップリング剤で処理し導入されたアミノ基にグルタルアルデヒドなどのニ官能性試薬を作用させた後ゼラチンのアミノ基と反応させる方法がある。なお、被検知物質(B)2は上記記載のもの以外であっても加水分解活性を有した物質5の加水分解活性を増減させるものであればいずれの場合であっても同様の検知ができる。なお、加水分解活性を有した物質5は基質3を加水分解するものであれば上記記載のもの以外であっても同様の検知ができる。なお、基質3は加水分解活性を有した物質5によって加水分解されるものであれば上記記載のもの以外であっても同様の検知ができる。なお、基質3を固定化する手段と固相面4は基質3を堅持させることができれば上記記載のもの以外であっても同様の検知ができる。
【0043】
また、図1c)d)において、固相面4上に残った基質3を検知する手段としては、例えば基質3であるゼラチンに色素をあらかじめ結合させておき、被検知物質(B)2と加水分解活性を有した物質5を接触させる前後の変化量を検知する方法である。なお、上記記載の方法以外であっても、被検知物質(B)2と加水分解活性を有した物質5を接触させる前後の変化量を検知できるものであればいずれの場合でも同様の検知ができる。
【0044】
上記構成において、被検知物質(B)2であるZnイオンに対する抗体がなくても、Znイオンの持つマトリックスメタロプロテイナーゼに対する加水分解活性増減効果を指標に、Znイオンの存在を検出することができるようになる。また、検知するための工程は、被検知物質(B)2と加水分解活性を有した物質5を混合させる工程と、固相面4の接触工程と、固相面4上に残った基質3の量を検知するという単純な工程であるため、簡単に被検知物質(B)2を検知することができる。また、被検知物質(B)2が加水分解活性を有した物質5の加水分解活性を増減させるものであれば、その加水分解活性増減効果を指標に検知することができるため、様々なタイプの被検知物質(A)1を検知することができ、汎用性が高い検知方法となる。
【0045】
(実施の形態2)
図2に、被検知物質である加水分解酵素6を検出する方法を示す。
【0046】
図2a)に示すように、加水分解酵素6を、加水分解される基質3が固定化された固相面4に接触させ、図2b)に示すように、固相面4上に残った基質3の量を検知することで、加水分解酵素6を検知する。
【0047】
また、図2c)に示すように、被検知物質である加水分解酵素6が図2a)に比べて多く存在する場合は、図2d)に示すように、固相面4上の基質3が図2b)に比べて多く加水分解され、すなわち、加水分解酵素6の存在量に依存して固相面4上に残る基質3の量が変わる。このように固相面4上の基質3の量を検知することで、被検知物質である加水分解酵素の量を検知する。
【0048】
図2において、加水分解酵素6とは、例えばDNaseなどの核酸を加水分解するヌクレアーゼであり、この場合、基質3はDNAであって固相面4に固定化されている。なお、加水分解酵素はヌクレアーゼ以外でもプロテアーゼやグリコシダーゼなど多の加水分解酵素であっても、加水分解酵素によって切断されるタンパク質や糖鎖などの高分子を基質3として用いることで同様の検知ができる。また、基質3を固相面4に固定化する方法としては、例えば実施の形態1に示した方法などがあり、また、被検知物質である加水分解酵素6を固相面4に接触させる方法としては、例えば実施の形態1に記した方法があり、また、固相面4上に残った基質3を検知する手段としては、例えば実施の形態1に記した方法がある。
【0049】
上記構成において、加水分解酵素6であるヌクレアーゼがヌクレアーゼの存在量に依存して固相面4上のDNAを切断し、固相面4上に残った基質3はヌクレアーゼの存在量に反比例して減少する。そして、固相面4上に残った基質3の量を検知し、あらかじめ存在量のわかっているヌクレアーゼを用いて検知した固相面4上に残った基質3の量と比較することで、存在量のわからないヌクレアーゼの存在量を検知することができる。このようにして基質3に対して加水分解活性をもった加水分解酵素6を簡単に検知することができる。
【0050】
(実施の形態3)
図3に、被検知物質である加水分解活性をもった酵素に対する阻害物質7を検出する方法を示す。ここで、酵素に対する阻害物質とは、酵素に直接作用して酵素活性を損なわせる、あるいは酵素と基質との反応を競合的に阻害するものである。
【0051】
図3a)に示すように、加水分解酵素6と阻害物質7を混合し、加水分解される基質3が固定化された固相面4に接触させ、図3b)に示すように、固相面4上に残った基質3の量を検知することで、阻害物質7を検知する。
【0052】
また、図3c)に示すように、被検知物質である阻害物質7が図3a)に比べて多く存在する場合は、図3d)に示すように、固相面4上の基質3が図3b)に比べて多く残り、すなわち、阻害物質7の存在量に依存して固相面4上に残る基質3の量が変わる。このように固相面4上の基質3の量を検知することで、被検知物質である加水分解酵素の量を検知する。
【0053】
図3において、阻害物質7とは、例えばセルピンの一種であるアンチトロンビンであり、この場合、加水分解酵素6とは、例えばセリンプロテアーゼの一種であるトロンビンである。この場合、基質3はトロンビンによって加水分解されるタンパク質であって固相面4に固定化されている。なお、阻害物質7はセルピン以外であっても、加水分解酵素6の酵素活性を阻害するものであれば加水分解酵素6によって切断される高分子を基質3として用いることで同様の検知ができる。また、基質3を固相面4に固定化する方法としては、例えば実施の形態1に示した方法などがあり、また、被検知物質である加水分解酵素6を固相面4に接触させる方法としては、例えば実施の形態1に記した方法があり、また、固相面4上に残った基質3を検知する手段としては、例えば実施の形態1に記した方法がある。なお、基質3となるタンパク質を固定化する手段として固相面4に導入されたアミノ基に縮合剤を用いてFmoc−アミノ酸をアミド結合あるいはエステル結合させ、固相面上でタンパク質合成する方法などを用いてもかまわない。
【0054】
上記構成において、阻害物質7であるアンチトロンビンによって酵素活性を阻害される加水分解酵素が、アンチトロンビンの存在量に反比例して固相面4上の基質3であるタンパク質を切断し、固相面4上に残った基質3はセルピンの存在量に比例して多くなる。そして、固相面4上に残った基質3の量を検知し、あらかじめ存在量のわかっているアンチトロンビンとトロンビンを用いて検知した固相面4上に残った基質3の量と比較することで、存在量のわからないアンチトロンビンの存在量を検知することができる。このようにして基質3を分解する加水分解酵素に対して阻害活性を持った阻害物質7を簡単に検知することができる。
【0055】
(実施の形態4)
図4a)b)に、プロテアーゼ8を検出する方法を示し、図4c)d)にプロテアーゼ阻害物質9を検出する方法を示す。
【0056】
図4a)に示すように、タンパク質やペプチドを加水分解する加勢を持ったプロテアーゼ8を、加水分解される基質3が固定化された固相面4に接触させ、図4b)に示すように、固相面4上に残った基質3を検知することで、加水分解活性を検知し、検体中のプロテアーゼ8を検知する。この際、プロテアーゼ8は基質3が持つ認識配列10を特異的に切断する。
【0057】
図4において、プロテアーゼ8とは、例えばプロテアーゼ活性をもったボツリヌス毒素であり、この場合、基質3が持つ認識配列10はボツリヌス毒素が特異的に認識し切断するアミノ酸配列であり、例えばVANPやSNAP−25あるいはシンタキシンなどの神経伝達物質の分泌に関与しているタンパク質もしくはこれらタンパク質の一部の配列を含むものである。そして、基質3はVANPやSNAP−25あるいはシンタキシンなどのタンパク質そのもの、あるいはこれらタンパク質のアミノ酸配列を持った融合タンパク質であり固相面4に固定化されている。なお、プロテアーゼ8はボツリヌス毒素以外であっても、特定のアミノ酸配列を認識し切断する活性を持つものであれば、認識配列10として特定のアミノ酸配列を持つ基質3を用いることで同様の検知ができる。また、基質3を固相面4に固定化する方法としては、例えば実施の形態1に示した方法などがあり、また、被検知物質である加水分解酵素6を固相面4に接触させる方法としては、例えば実施の形態1に記した方法があり、また、固相面4上に残った基質3を検知する手段としては、例えば実施の形態1に記した方法がある。なお、基質3となるタンパク質を固定化する手段として固相面4に導入されたアミノ基に縮合剤を用いてFmoc−アミノ酸をアミド結合あるいはエステル結合させ、固相面上でタンパク質合成する方法などを用いてもかまわない。
【0058】
上記構成において、プロテアーゼ8であるボツリヌス毒素によって基質3のもつ認識配列10が選択的に加水分解され、ボツリヌス毒素の存在量に反比例して固相面4上の基質3であるタンパク質が減少する。そして、固相面4上に残った基質3の量を検知し、あらかじめ存在量のわかっているボツリヌス毒素を用いて検知した固相面4上に残った基質3の量と比較することで、存在量のわからないボツリヌス毒素の存在量を検知することができる。このようにして基質3を分解するプロテアーゼ8を特異的に検知することができる。
【0059】
図4c)に示すように、プロテアーゼ8とプロテアーゼ阻害物質9を混合し、加水分解される基質3が固定化された固相面4に接触させ、図4d)に示すように、固相面4上に残った基質3の量を検知することで、プロテアーゼ阻害物質9を検知する。
【0060】
図4において、プロテアーゼ阻害物質9とは、例えばα2−マクログロブリンであり、この場合、共存させるプロテアーゼ8とは例えばトロンビンなどである。この場合、基質3はトロンビンによって加水分解されるタンパク質であって、例えば分子内にバリン−プロリン−アルギニンといったトロンビンに選択的に切断される認識配列10を持っており固相面4に固定化されている。なお、プロテアーゼ阻害物質9はα2−マクログロブリン以外であっても、プロテアーゼ8の酵素活性を阻害するものであればプロテアーゼ8によって特異的に切断される認識配列10を持ったタンパク質あるいは認識配列10を含んだ融合タンパク質あるいはペプチドを基質3として用いることで同様の検知ができる。また、基質3を固相面4に固定化する方法としては、例えば実施の形態1に示した方法などがあり、また、被検知物質である加水分解酵素6を固相面4に接触させる方法としては、例えば実施の形態1に記した方法があり、また、固相面4上に残った基質3を検知する手段としては、例えば実施の形態1に記した方法がある。
【0061】
上記構成において、プロテアーゼ阻害物質9であるα2−マクログロブリンによって阻害されるプロテアーゼ8が、α2−マクログロブリンの存在量に反比例して固相面4上の認識配列10を持った基質3を特異的に切断し、固相面4上に残った基質3はα2−マクログロブリンの存在量に比例して多くなる。そして、固相面4上に残った基質3の量を検知し、あらかじめ存在量のわかっているα2−マクログロブリンを用いて検知した固相面4上に残った基質3の量と比較することで、存在量のわからないα2−マクログロブリンの存在量を検知することができる。このようにして基質3を分解するプロテアーゼ8に対して阻害活性を持ったプロテアーゼ阻害物質9の量を特異的に検知することができる。
【0062】
上記構成の検知方法を用いることで、プロテアーゼである毒素や、血液中に含まれる臨床マーカーを抗体の使用なしに簡単に特異的に検知することができる。
【0063】
上記方法の検知方法で検知可能なものとしては、プロテアーゼ活性を持ったボツリヌス毒素や破傷風毒素のほかある種の蛇毒や、癌マーカーのひとつであるアンジオスタチンやエイズウイルスに含まれるHIVプロテアーゼや、ネフローゼ症候群のマーカーであるα2マクログロブリンなどその他プロテアーゼ活性やプロテアーゼ阻害活性を持ったものが挙げられる。
【0064】
(実施の形態5)
図5a)b)に、ヌクレアーゼ11を検出する方法を示し、図5c)d)にヌクレアーゼ阻害物質12を検出する方法を示す。
【0065】
図5a)に示すように、DNAやRNAなどの核酸を加水分解する活性を持ったヌクレアーゼ11を、加水分解される基質3が固定化された固相面4に接触させ、図5b)に示すように、固相面4上に残った基質3を検知することで、加水分解活性を検知し、検体中のヌクレアーゼ11を検知する。この際、ヌクレアーゼ11は基質3が持つ認識配列10を特異的に切断する。
【0066】
図5において、ヌクレアーゼ11とは、例えばヌクレアーゼ活性をもった制限酵素SmaIであり、この場合、基質3が持つ認識配列10は−CCCGGG−で示される塩基配列であり、基質3は認識配列10を含んだDNAであり固相面4に固定化されている。なお、ヌクレアーゼ11は制限酵素SmaI以外であっても、DNA上の特定の塩基配列を認識し切断する活性を持つものであれば、認識配列10として特定の塩基配列を持つ基質3を用いることで同様の検知ができる。また、基質3を固相面4に固定化する方法としては、例えば実施の形態1に示した方法などがあり、また、ヌクレアーゼ11を固相面4に接触させる方法としては、例えば実施の形態1に記した方法があり、また、固相面4上に残った基質3を検知する手段としては、例えば実施の形態1に記した方法がある。なお、基質3となるDNAを固定化する手段として固相面4をポリ−L−リジンで被覆し、静電的に固定化する方法などを用いてもかまわない。
【0067】
上記構成において、ヌクレアーゼ11であるSmaIによって基質3のもつ認識配列10が選択的に加水分解され、SmaIの存在量に反比例して固相面4上の基質3であるDNAが減少する。そして、固相面4上に残った基質3の量を検知し、あらかじめ存在量のわかっているSmaIを用いて検知した固相面4上に残った基質3の量と比較することで、存在量のわからないSmaIの存在量を検知することができる。このようにして基質3を分解するヌクレアーゼ11を特異的に検知することができる。
【0068】
図5c)に示すように、ヌクレアーゼ11とヌクレアーゼ阻害物質12を混合し、加水分解される基質3が固定化された固相面4に接触させ、図5d)に示すように、固相面4上に残った基質3の量を検知することで、ヌクレアーゼ阻害物質12を検知する。
【0069】
図5において、ヌクレアーゼ阻害物質12とは、例えば−CCCGGG−で示される塩基配列を持ったDNAであり、この場合、共存させるヌクレアーゼ11とは例えば制限酵素であるSmaIである。この場合、基質3はSmaIによって特異的に切断される−CCCGGG−で示される塩基配列を持った認識配列10を持っており、固相面4に固定化されている。ここで、ヌクレアーゼ阻害物質12と認識配列10は同じ塩基配列を持っており、ヌクレアーゼ阻害物質12が存在することでヌクレアーゼ11が認識配列10を切断する活性を競合的に阻害する。なお、ヌクレアーゼ11とヌクレアーゼ阻害物質12の組み合わせは上記以外のものであっても、特異的な配列を認識して切断するヌクレアーゼ11であれば、ヌクレアーゼ阻害物質12と同じ塩基配列を持った認識配列10を用いることで同様の検知ができる。また、基質3を固相面4に固定化する方法としては、例えば実施の形態1に示した方法などがあり、また、ヌクレアーゼ阻害物質12を固相面4に接触させる方法としては、例えば実施の形態1に記した方法があり、また、固相面4上に残った基質3を検知する手段としては、例えば実施の形態1に記した方法がある。
【0070】
上記構成において、ヌクレアーゼ阻害物質12である−CCCGGG−で示される塩基配列を持ったDNAによって阻害されるヌクレアーゼ11が、ヌクレアーゼ阻害物質12の存在量に反比例して固相面4上の認識配列10を持った基質3を特異的に切断し、固相面4上に残った基質3はヌクレアーゼ阻害物質12の存在量に比例して多くなる。そして、固相面4上に残った基質3の量を検知し、あらかじめ存在量のわかっている−CCCGGG−で示される塩基配列を持ったDNAを用いて検知した固相面4上に残った基質3の量と比較することで、存在量のわからない−CCCGGG−で示される塩基配列を持ったDNAの存在量を検知することができる。このようにして基質3を分解するヌクレアーゼ11に対して阻害活性を持ったヌクレアーゼ阻害物質12の量を特異的に検知することができる。
【0071】
(実施の形態6)
図6a)b)に、グリコシダーゼ13を検出する方法を示し、図6c)d)にグリコシダーゼ阻害物質14を検出する方法を示す。
【0072】
図6a)に示すように、糖鎖を加水分解する活性を持ったグリコシダーゼ13を、加水分解される基質3が固定化された固相面4に接触させ、図6b)に示すように、固相面4上に残った基質3を検知することで、加水分解活性を検知し、検体中のグリコシダーゼ13を検知する。この際、グリコシダーゼ13は基質3が持つ認識配列10を特異的に切断する。
【0073】
図6において、グリコシダーゼ13とは、例えばシアル酸を加水分解する活性をもったインフルエンザウイルスのノイラミンデースであり、この場合、基質3が持つ認識配列10はノイラミンデースが特異的に加水分解するノイラミン酸であり、基質3は認識配列10を含んだ糖鎖であり固相面4に固定化されている。なお、グリコシダーゼ13はノイラミンデース以外であっても、糖鎖構造の特定の糖鎖を認識し切断する活性を持つものであれば、認識配列10として特定の糖鎖構造を持つ基質3を用いることで同様の検知ができる。また、基質3を固相面4に固定化する方法としては、例えば実施の形態1に示した方法などがあり、また、グリコシダーゼ13を固相面4に接触させる方法としては、例えば実施の形態1に記した方法があり、また、固相面4上に残った基質3を検知する手段としては、例えば実施の形態1に記した方法がある。なお、基質3となる糖鎖を固定化する手段として固相面4をアビジンで被覆し、ビオチン標識した糖鎖をビオチンーアビジン反応によって固定化する方法などを用いてもかまわない。
【0074】
上記構成において、グリコシダーゼ13であるノイラミンデースによって基質3のもつ認識配列10が選択的に加水分解され、ノイラミンデースの存在量に反比例して固相面4上の基質3である糖鎖が減少する。そして、固相面4上に残った基質3の量を検知し、あらかじめ存在量のわかっているノイラミンデースを用いて検知した固相面4上に残った基質3の量と比較することで、存在量のわからないノイラミンデースの存在量を検知することができ、インフルエンザウイルスの存在量を検知することができる。このようにして基質3を分解するグリコシダーゼ13を特異的に検知することができる。
【0075】
図6c)に示すように、グリコシダーゼ13とグリコシダーゼ阻害物質14を混合し、加水分解される基質3が固定化された固相面4に接触させ、図6d)に示すように、固相面4上に残った基質3の量を検知することで、グリコシダーゼ阻害物質14を検知する。
【0076】
図6において、グリコシダーゼ阻害物質14とは、例えばインフルエンザ治療薬などのノイラミン酸の誘導体であり、この場合、共存させるグリコシダーゼ13とはノイラミンデースである。この場合、基質3はノイラミンデースによって特異的に切断されるノイラミン酸を含んだ糖鎖である認識配列10を持っており固相面4に固定化されている。なお、グリコシダーゼ13とグリコシダーゼ阻害物質14の組み合わせは上記以外のものであっても、特異的な糖鎖構造を認識して切断するグリコシダーゼ13であれば同様の検知ができる。また、基質3を固相面4に固定化する方法としては、例えば実施の形態1に示した方法などがあり、また、ヌクレアーゼ阻害物質12を固相面4に接触させる方法としては、例えば実施の形態1に記した方法があり、また、固相面4上に残った基質3を検知する手段としては、例えば実施の形態1に記した方法がある。
【0077】
上記構成において、グリコシダーゼ阻害物質14であるノイラミン酸誘導体によって阻害されるグリコシダーゼ13が、グリコシダーゼ阻害物質14の存在量に反比例して固相面4上の認識配列10を持った基質3を特異的に切断し、固相面4上に残った基質3はグリコシダーゼ阻害物質14の存在量に比例して多くなる。そして、固相面4上に残った基質3の量を検知し、あらかじめ存在量のわかっているノイラミン酸誘導体を用いて検知した固相面4上に残った基質3の量と比較することで、存在量のわかっていないノイラミン酸誘導体の存在量を検知することができる。このようにして基質3を分解するグリコシダーゼ13に対して阻害活性を持ったグリコシダーゼ阻害物質14の量を特異的に検知することができる。
【0078】
上記構成の検知方法を用いることでインフルエンザウイルスなどを抗体の利用なしに特異的に簡単に検知することができ、また、上記方法を用いて効果的なインフルエンザ治療薬をスクリーニング方法としても利用することができる。
【0079】
(実施の形態7)
図7a)b)に、リパーゼ15を検出する方法を示し、図7c)d)にリパーゼ阻害物質16を検出する方法を示す。
【0080】
図7a)に示すように、脂肪酸を加水分解する活性を持ったリパーゼ15を、加水分解される基質3が固定化された固相面4に接触させ、図7b)に示すように、固相面4上に残った基質3を検知することで、加水分解活性を検知し、検体中のリパーゼ15を検知する。この際、リパーゼ15は基質3が持つ認識配列10を特異的に切断する。
【0081】
図7において、リパーゼ15とは、例えばスフィンゴミエリンを加水分解する活性をもったスフィンゴミエリナーゼあり、この場合、基質3が持つ認識配列10はスフィンゴミエリナーゼが特異的に加水分解するスフィンゴミエリンであり、基質3は認識配列10を含んだ脂肪酸であり固相面4に固定化されている。なお、リパーゼ15はスフィンゴミエリナーゼ以外であっても、脂肪酸の特定の構造を認識し切断する活性を持つものであれば、認識配列10として特定の脂肪酸を持つ基質3を用いることで同様の検知ができる。また、基質3を固相面4に固定化する方法としては、例えば実施の形態1に示した方法などがあり、また、リパーゼ15を固相面4に接触させる方法としては、例えば実施の形態1に記した方法があり、また、固相面4上に残った基質3を検知する手段としては、例えば実施の形態1に記した方法がある。
【0082】
上記構成において、リパーゼ15であるスフィンゴミエリナーゼによって基質3のもつ認識配列10が選択的に加水分解され、スフィンゴミエリナーゼの存在量に反比例して固相面4上の基質3である糖鎖が減少する。そして、固相面4上に残った基質3の量を検知し、あらかじめ存在量のわかっているスフィンゴミエリナーゼを用いて検知した固相面4上に残った基質3の量と比較することで、存在量のわからないスフィンゴミエリナーゼの存在量を検知することができる。このようにして基質3を分解するリパーゼ15を特異的に検知することができる。
【0083】
図7c)に示すように、リパーゼ15とリパーゼ阻害物質16を混合し、加水分解される基質3が固定化された固相面4に接触させ、図5d)に示すように、固相面4上に残った基質3の量を検知することで、リパーゼ阻害物質16を検知する。
【0084】
図7において、リパーゼ阻害物質16とは、例えばスフィンゴミエリナーゼに加水分解されるスフィンゴミエリンであり、この場合、共存させるリパーゼ15とは例えばスフィンゴミエリナーゼである。この場合、基質3はスフィンゴミエリナーゼによって特異的に切断されるスフィンゴミエリンを持った認識配列10を持っており固相面4に固定化されている。ここで、リパーゼ阻害物質16と認識配列10は同じ脂肪酸を含んであり、リパーゼ阻害物質16が存在することでリパーゼ15が認識配列10を切断する活性を競合的に阻害する。なお、リパーゼ15とリパーゼ阻害物質16の組み合わせは上記以外のものであっても、特異的な配列を認識して切断するリパーゼ15であれば、リパーゼ阻害物質16と同じ脂肪酸を持った認識配列10を用いることで同様の検知ができる。また、基質3を固相面4に固定化する方法としては、例えば実施の形態1に示した方法などがあり、また、リパーゼ阻害物質16を固相面4に接触させる方法としては、例えば実施の形態1に記した方法があり、また、固相面4上に残った基質3を検知する手段としては、例えば実施の形態1に記した方法がある。
【0085】
上記構成において、リパーゼ阻害物質16であるスフィンゴミエリンによって阻害されるリパーゼ15が、リパーゼ阻害物質16の存在量に反比例して固相面4上の認識配列10を持った基質3を特異的に切断し、固相面4上に残った基質3はリパーゼ阻害物質16の存在量に比例して多くなる。そして、固相面4上に残った基質3の量を検知し、あらかじめ存在量のわかっているスフィンゴミエリンを用いて検知した固相面4上に残った基質3の量と比較することで、存在量のわかっていないスフィンゴミエリンの存在量を検知することができる。このようにして基質3を分解するリパーゼ15に対して阻害活性を持ったリパーゼ阻害物質16の量を特異的に検知することができる。
【0086】
上記構成の検知方法を用いることでウルシュ菌のもつα毒素などリパーゼ活性を持った酵素を抗体の使用なしに特異的に簡単に検知することができる。
【0087】
(実施の形態8)
図8には、酵素の認識配列10を含んだ基質3を固定化した固相面4と認識配列10を含まない基質3を固定化した固相面4に被検知物質(A)1を反応させ、両固相面4に残った基質3量の差を比較することで被検知物質(A)1を検知する方法を示した。
【0088】
実施の形態1〜7に示した様に被検知物質を検知する際、図8のa)に示したように、被検知物質(A)1を、認識配列10を含んだ基質3を固定化した固相面4と認識配列10を含まない基質3を固定化した固相面4に接触させ、図8のb)に示したように、認識配列10を含んだ基質3のみ加水分解させ、認識配列10を含まない基質3は加水分解されない状況をつくる。そして両固相面4上に残った基質3の量を比較し、認識配列10を含んだ基質3の方が認識配列10を含まない基質3よりも減っていた場合は認識配列10を特異的に加水分解する被検知物質(A)1が存在していると判断される。ここで、認識配列10を含んだ基質3と認識配列10を含まない基質3が同等に減っていた場合は、認識配列に特異的でない加水分解活性を持った被検知物質(A)1が存在していると判断される。ここで、例えばヌクレアーゼ11である制限酵素SmaIを被検知物質(A)1とした場合、認識配列10として−CCCGGG−で示される塩基配列があり、−CCCGGG−塩基配列を持ったDNAと−CCCGGG−塩基配列を持たないDNAをそれぞれ固相面4に固定化する。固定化手段と固相面は例えば実施の形態1に示した方法がある。また、固相面4上に残った基質3を検知する方法としては例えば実施の形態1に示した方法がある。
【0089】
すなわち図8c)のフローチャートに示したように、被検知物質(A)1を含んだ検体を固相面4に反応させ基質3を切断させる工程、認識配列10を含んだ基質3の残量と認識配列10を含まない基質3の残量を検知する工程、両基質3の残量を比較判断し、認識配列10を含んだ基質3特異的に減った量を検知する工程、認識配列10を含んだ基質3特異的に減った基質3量を元に加水分解活性を検知し、被検知物質(A)1量に換算する工程を含む。
【0090】
なお、ここでは認識配列10が1種類の場合において認識配列10を持つ基質3の残量と持たない基質3の残量を比較する場合を示したが、複数の認識配列10を別々の固相面4に固定化することで、加水分解活性を持つ複数の被検知物質を同時に検知することができるようになる。
【0091】
上記構成において、被検知物質(A)1の存在量に依存して認識配列10を含んだ基質3が加水分解され、認識配列10に特異的な加水分解活性を指標に被検知物質(A)1を検知することができる。そして、あらかじめ存在量のわかっている被検知物質(A)1を用いて検知した固相面4上に残った基質3の量と比較することで、存在量のわからない被検知物質(A)1の存在量を検知することができる。このようにして認識配列10に対して特異的な加水分解活性をもった被検知物質(A)1を簡単に検知することができる。
【0092】
(実施の形態9)
図9には、加水分解活性を持つ酵素が認識する配列をもつ基質3が複数の固相面4に異なる濃度で固定化させ、被検知物質(A)1を反応させた後固相面4上に残った基質量の基質濃度依存性を指標に被検知物質(A)1を検知する方法を示した。
【0093】
実施の形態1〜7に示した被検知物質を検知する際、図9a)に示したように、被検知物質(A)1を、認識配列10を含んだ基質3を異なる濃度で固定化した固相面4に接触させ、図9b)に示したように、認識配列10を持った基質3の濃度に依存して被検知物質(A)1が基質を加水分解する状況をつくる。そして、これら異なる濃度の認識配列10を持つ基質3が固定化された固相面に残った基質量を検知し比較することで、加水分解活性の異なる基質濃度に対する分解速度を知ることができる。異なる基質濃度に対する分解速度をプロットすることで、被検知物質(A)1を特徴付ける酵素活性の反応速度論的な解釈、即ち、加水分解される基質の生成速度から個々の加水分解酵素特有の加水分解速度を推測することができる。図9c)に示したようなプロット図から、酵素活性のVmaxを知ることができ、被検知物質(A)1の酵素活性がどの程度特異性を持っているか知ることができ、また、酵素は特有の分解速度を有していることから、被検知物質(A)1を特定することも可能となる。
【0094】
上記構成において、被検知物質(A)1を検知することができ、また、異なる濃度の認識配列10を持った基質3に対する分解速度を知ることができ、被検知物質(A)1の加水分解活性の反応速度論的解釈が可能となる。
【0095】
また、上記記載の方法を利用して、被検知物質(A)1の酵素活性に影響する物質で、例えばウイルスの治療薬などをスクリーニングすることも可能となる。
【0096】
(実施の形態10)
図10に、被検知物質(A)1を含んだ検体17を固相面4上に接して流れるように反応させることを特徴とし、被検知物質を連続的に検知する方法を示した。
【0097】
実施の形態1〜7に示した様に被検知物質を検知する際、図10a)〜c)に示したように、被検知物質(A)1を含む検体17を固相面4上に接する要に連続的に流す。連続的に流す手段としては、例えば固相面4上に溶液の流れる流路を設け、流路に被検知物質(A)1を含んだ検体をポンプなど用いて流入させる方法がある。また、図10a)に示したように、検体17中に被検知物質(A)1以外の混合物質18が多数含まれており、被検知物質(A)1が含まれていない時は、被検知物質(A)1によって特異的に加水分解される認識配列10を持った基質3は分解されない。図10b)に示したように、被検知物質(A)1が含まれた検体17が固相面4上に流れてきたさい、被検知物質(A)1によって固相面4上の基質3が認識配列10で加水分解される。固相面4上の基質量を連続的にモニタリングすることで、基質3が加水分解されるタイミングを知ることができる、検体17中に被検知物質(A)1が混入されたタイミングを知ることができる。
【0098】
上記構成において、認識配列10に対して特異的は酵素活性を持った被検知物質(A)1を連続的にモニタリングすることができる。
【0099】
(実施の形態11)
図11に、基質を検知しやすくするための信号物質19を基質3に結合させた検知方法を示した。
【0100】
実施の形態1〜7に示した様に被検知物質(A)1を検知する際、固相面4上に残った基質3の量を検知する必要がある。固相面4上に固定化されたタンパク質やDNAなどの高分子を検知しやすくするための信号物質19として、例えばFITCなどの蛍光物質やGFPなどの蛍光タンパク質、あるいは、磁化特性や酸化還元力を持った希土類などを利用することで、信号物質の量を蛍光強度あるいは磁力あるいは酸化還元電流を検知し、基質量を検知することができるようになる。また、信号物質19を基質3である高分子に結合させる手段として、例えばグルタルアルデヒドなどの架橋試薬を用いる方法があり、あるいはGFPやHRPなどの酵素を結合させる方法としては、基質3であるタンパク質もしくはペプチドと融合タンパク質として合成する方法がある。なお、信号物質19を重量のある大きな高分子とする場合は固相面4に金を用い、表面プラズモンを利用して検知することもできる。
【0101】
上記構成において、基質3単独では検知しにくい場合であっても、信号物質19を結合することで基質3量を簡単に検知することができるようになり、被検知物質(A)1を簡単に検知することができるようになる。
【0102】
(実施の形態12)
図12に信号物質を蛍光色素20とした検知方法を示す。
【0103】
実施の形態1〜7に示した様に被検知物質(A)1を検知する際、図12a)b)に示したように蛍光色素20を結合させた基質3を固相面4に固定化させ、蛍光検知手段21を用いて蛍光色素20を検知する。蛍光色素20としては、例えばFITCなどがあり、蛍光色素20を基質3に結合させる手段としてはグルタルアルデヒドを用いて架橋する方法があるが、その他の蛍光色素20を他の架橋手段を用いて基質3に結合させてもかまわない。なお、蛍光色素20としてGFPなどの蛍光タンパク質を用いる場合は、基質3であるタンパク質と融合タンパク質として合成してもかまわない。また、蛍光検知手段21としては発光素子としてLEDを用い、受光素子としてフォトダイオードなどを利用した光センサなどを用いて蛍光強度を検知する方法がある。
【0104】
また、図12a)に示すような被検知物質(A)1を反応させる前の蛍光強度と図12b)に示すような被検知物質(A)1を反応させた後の蛍光強度を比較することで、被検知物質によって特異的に加水分解された基質3の量を知ることができる。
【0105】
上記構成において、蛍光色素20による蛍光強度を蛍光検知手段21で検知することで簡単に固相面4上の基質3を検知することができるようになり、被検知物質(A)1を簡単に高感度に検知することができるようになる。
【0106】
(実施の形態13)
図13に、信号物質として、酸化還元電位を発生させる物質22を利用した検知方法を示す。
【0107】
実施の形態1〜7に示した様に被検知物質(A)1を検知する際、図13a)b)に示したように酸化還元電位を発生させる物質22を結合させた基質3を固相面4に固定化させ、電流検知手段23を用いて酸化還元電流を検知する。酸化還元電位を発生させる物質22としては、例えばHRPなどの酸化還元酵素があり、この場合電流検知手段23としてはHRPによって過酸化水素が酸化される際に放出される電子をFMAなどのメディエーターを通じて金電極を用いて電流知として検知する方法がある。なお、基質3をDNAとした場合、へキストなどのインターカレーターをDNAに結合させ、ヘキストによる酸化電流を検知する方法でもかまわない。なお、希土類などを酸化還元電位を発生させる物質22として使用することもできる。
【0108】
また、図13a)に示すような被検知物質(A)1を反応させる前の電流量と図13b)に示すような被検知物質(A)1を反応させる後の電流量を比較することで、被検知物質(A)1によって特異的に加水分解された基質3の量を知ることができる。
【0109】
上記構成において、酸化還元電位を発生させる物質22により発生する酸化還元電流を電流検知手段23で検知することで、被検知物質(A)1を簡単に検知することができるようになる。
【0110】
(実施の形態14)
図14に、信号物質として、磁化特性をもった磁化物質24を利用した検知方法を示す。
【0111】
実施の形態1〜7に示した様に被検知物質(A)1を検知する際、図14a)b)に示したように磁化物質24を結合させた基質3を固相面4に固定化させ、磁気検知手段25を用いて磁気を検知する。磁化物質24としては、例えば希土類などの硬質磁性材料があり、この場合磁気検知手段25としては可飽和コイルなどを用いた磁気センサーを用いて検知する方法がある。なお、上記記載以外のものであっても、磁化特性を有する材料であれば同様に磁気センサーを用いて検知することが可能となる。
【0112】
また、図14a)に示すような被検知物質(A)1を反応させる前の磁気量と図14b)に示すような被検知物質(A)1を反応させる後の磁気量を比較することで、被検知物質(A)1によって特異的に加水分解された基質3の量を知ることができる。
【0113】
上記構成において、磁化物質24の磁化特性を磁気検知手段25で検知することで、被検知物質(A)1を簡単に検知することができるようになる。
【0114】
(実施の形態15)
図15に、信号物質として、可視できる色素26を利用した検知方法を示す。
【0115】
実施の形態1〜7に示した様に被検知物質(A)1を検知する際、図15a)b)に示したように色素26を結合させた基質3を固相面4に固定化させ、肉眼で基質量を確認する。色素26としては、例えばルテニウムなどの金属錯体があり、その他、可視光に吸収ピークのある色素であれば同様に用いることができる。図14a)に示すような被検知物質(A)1を反応させる前の色素量と図14b)に示すような被検知物質(A)1を反応させる後の色素量を比較することで、被検知物質(A)1によって特異的に加水分解された基質3の量を知ることができる。
【0116】
上記構成において、色素26を用いることで、被検知物質(A)1を特別な検知手段を必要とせず簡単に検知することができるようになる。
【0117】
(実施の形態16)
図16に、電極27を固相面とし、電極27に基質3を固定化し、電極27上の基質3の分子量に基づく電極27の電極活性を指標にして、電気化学測定法にて基質量を検知する方法を示す。ここで電極活性とは、電極界面の電子の移動しやすさのことである。
【0118】
実施の形態1〜7に示した様に被検知物質(A)1を検知する際、図16a)b)に示した様に固相面を電極27とし、電極27上に基質3を固定化してある。固定化された基質量は、基質3の分子量に応じて電極27の電極活性が変化することを利用して検知される。電極としては、白金、金、グラッシーカーボン、グラファイトや酸化スズに代表される導電性酸化物などで構成されており、電極27の電極活性を検知する手段としては、例えば水などの電解質を介し基質3を固定化した電極と基質3を固定化していない電極間を流れる電流を測定する方法があり、電極27上に固定化された基質3の分子量に応じて電極間を流れる電流が阻害されるため、流れる電流量から基質3の量を見積もることができる。なお電気化学的に電極の特性を測定する方法であればいずれの場合であっても同様の検知方法ができる。また、図15a)に示すような被検知物質(A)1を反応させる前の基質量と図15b)に示すような被検知物質(A)1を反応させる後の基質量を比較することで、被検知物質(A)1によって特異的に加水分解された基質3の量を知ることができる。
【0119】
上記構成において、特別な信号物質を基質3に導入することなく電極活性の変化を利用することで基質量を検知することができ、簡単な構成の固相面を用いて被検知物質(A)1を検知することができるようになる。
【産業上の利用可能性】
【0120】
本発明の被検知物質検知方法を用いて、加水分解活性に関与する様々な化学物質を選択的に検知することができ、且つ抗体の特性に依存しないバイオセンサーをつくることができる。本発明の検知方法を利用したバイオセンサーを用いることで、食品中に混入したボツリヌス毒素に代表されるプロテアーゼ活性を有した毒素を容易に検知することができ、また、血液中の前立腺特異的抗原(PSA)に代表される様々な疾患マーカーを容易に検知することができ、また、ノイラミンデース活性を有したインフルエンザウイルスやプロテアーゼ活性を有したダニアレルゲンなど空気中を浮遊し人体の健康に悪影響を及ぼす化学物質を検知することにも応用できる。また、加水分解活性を有した酵素やその阻害物質等のスクリーニング、活性測定などの研究用途にも利用することができる。
【図面の簡単な説明】
【0121】
【図1】本発明の実施の形態1の被検知物質検知方法を示す図
【図2】本発明の実施の形態2の被検知物質検知方法を示す図
【図3】本発明の実施の形態3の被検知物質検知方法を示す図
【図4】本発明の実施の形態4の被検知物質検知方法を示す図
【図5】本発明の実施の形態5の被検知物質検知方法を示す図
【図6】本発明の実施の形態6の被検知物質検知方法を示す図
【図7】本発明の実施の形態7の被検知物質検知方法を示す図
【図8】本発明の実施の形態8の被検知物質検知方法を示す図
【図9】本発明の実施の形態9の被検知物質検知方法を示す図
【図10】本発明の実施の形態10の被検知物質検知方法を示す図
【図11】本発明の実施の形態11の被検知物質検知方法を示す図
【図12】本発明の実施の形態12の被検知物質検知方法を示す図
【図13】本発明の実施の形態13の被検知物質検知方法を示す図
【図14】本発明の実施の形態14の被検知物質検知方法を示す図
【図15】本発明の実施の形態15の被検知物質検知方法を示す図
【図16】本発明の実施の形態16の被検知物質検知方法を示す図
【図17】従来の被検知方法を示す図
【符号の説明】
【0122】
1 被検知物質(A)
2 被検知物質(B)
3 基質
4 固相面
5 加水分解活性を有した物質
6 加水分解酵素
7 阻害物質
8 プロテアーゼ
9 プロテアーゼ阻害物質
10 認識配列
11 ヌクレアーゼ
12 ヌクレアーゼ阻害物質
13 グリコシダーゼ
14 グリコシダーゼ阻害物質
15 リパーゼ
16 リパーゼ阻害物質
17 検体
18 混合物質
19 信号物質
20 蛍光色素
21 蛍光検知手段
22 酸化還元電位を発生させる物質
23 電流検知手段
24 磁化物質
25 磁気検知手段
26 色素
27 電極
101 被検知物質
102 切断部位
103 基質
104 酵素
105 抗体
106 反応基質
107 生成物
【特許請求の範囲】
【請求項1】
基質を加水分解する酵素活性を利用した被検知物質検知方法であって、被検知物質は加水分解活性を有するかあるいは他の加水分解酵素活性を増減させる性質をもっており、加水分解される基質が固定化された固相面を利用し、前記被検知物質を含んだ検体と前記固相面を接触させ、加水分解されずに前記固相面上に残った基質を検知することで検体の加水分解活性を検知し、検体中の被検知物質を検知することを特徴とした被検知物質の検知方法。
【請求項2】
被検知物質が加水分解活性を持つ酵素であり、被検知物質によって固相面上の基質が加水分解され、被検知物質量によって固相面上に残る基質量が変化することを特徴とした請求項1記載の被検知物質の検知方法。
【請求項3】
被検知物質が加水分解活性を持つ酵素に対する阻害物質であり、検体は当該被検知物質が阻害する酵素活性を含んでおり、検体の加水分解活性によって固相面上の基質が加水分解され、被検知物質量によって固相面上に残る基質量が変化することを特徴とした請求項1に記載の被検知物質の検知方法。
【請求項4】
被検知物質がプロテアーゼもしくはプロテアーゼの阻害物質であり、固相面上の基質が当該プロテアーゼもしくは当該プロテアーゼの阻害物質が阻害するプロテアーゼの認識するアミノ酸配列を含んだポリペプチドからなることを特徴とした請求項1〜3のいずれかに記載の被検知物質の検知方法。
【請求項5】
被検知物質がヌクレアーゼもしくはヌクレアーゼの阻害物質であり、固相面上の基質が当該ヌクレアーゼもしくは当該ヌクレアーゼの阻害物質が阻害するヌクレアーゼの認識する塩基配列を含んだ核酸からなることを特徴とした請求項1〜3のいずれかに記載の被検知物質の検知方法。
【請求項6】
被検知物質がグリコシダーゼもしくはグリコシダーゼの阻害物質であり、固相面上の基質が当該グリコシダーゼもしくは当該グリコシダーゼの阻害物質が阻害するグリコシダーゼの認識する糖鎖構造を含んだ糖鎖からなることを特徴とした請求項1〜3のいずれかに記載の被検知物質の検知方法。
【請求項7】
被検知物質がリパーゼもしくはリパーゼの阻害物質であり、固相面上の基質が当該リパーゼもしくは当該リパーゼの阻害物質が阻害するリパーゼの認識する脂肪酸を含んだ有機酸からなることを特徴とした請求項1〜3のいずれかに記載の被検知物質の検知方法。
【請求項8】
加水分解活性を持つ酵素が認識する認識配列をもつ基質を固定化した固相面と、加水分解活性を持つ酵素が認識する認識配列を持たない基質を固定化した固相面に、被検知物質を含んだ検体を接触させ、認識配列をもつ基質を固定化した前記固相面上に残った基質量と認識配列を持たない基質を固定化した前記固相面上に残った基質量の差を比較することで被検知物質を検知することを特徴とした請求項4〜7のいずれかに記載の被検知物質の検知方法。
【請求項9】
加水分解活性を持つ酵素が認識する配列をもつ基質が複数の固相面に異なる濃度で固定化されていることを特徴とし、前記記載の複数の固相面に被検知物質を含んだ検体を接触させ、固相面上に残った基質量の基質濃度依存性を指標に検体中の被検知物質を検知することを特徴とした請求項4〜7のいずれかに記載の被検知物質の検知方法。
【請求項10】
被検知物質を含んだ検体を固相面上に接して流れるように反応させることを特徴とし、被検知物質を連続的に検知する請求項1〜9のいずれかに記載の被検知物質の検知方法。
【請求項11】
固相面上の基質を検知し易くするための信号物質を基質に結合してあることを特徴とし、信号物質の減少量を指標にして固相面上に残った基質量を検知する請求項1〜10のいずれかに記載の被検知物質の検知方法。
【請求項12】
基質に結合した信号物質が蛍光色素であり、固相面上に残った基質量を蛍光強度の減少量によって測定することを特徴とした請求項11に記載の被検知物質の検知方法。
【請求項13】
信号物質が酸化還元電位を発生させる物質であることを特徴とし、固相面上に残っている基質の量を酸化還元電流の減少量によって測定する請求項11に記載の被検知物質の検知方法。
【請求項14】
信号物質が磁化特性をもつことを特徴とし、固相面上に残っている基質の量を磁化特性の変化量によって測定する請求項11に記載の被検知物質の検知方法。
【請求項15】
信号物質が色素化合物であることを特徴とし、固相面上に残っている基質の量を色素の減少量によって測定する請求項11に記載の被検知物質の検知方法。
【請求項16】
基質が固定化された固相面が電極であることを特徴とし、固相面上の基質の分子量に基づく電極活性の変化を指標にして固相面上に残った基質量を検知する請求項1〜10のいずれかに記載の被検知物質の検知方法。
【請求項1】
基質を加水分解する酵素活性を利用した被検知物質検知方法であって、被検知物質は加水分解活性を有するかあるいは他の加水分解酵素活性を増減させる性質をもっており、加水分解される基質が固定化された固相面を利用し、前記被検知物質を含んだ検体と前記固相面を接触させ、加水分解されずに前記固相面上に残った基質を検知することで検体の加水分解活性を検知し、検体中の被検知物質を検知することを特徴とした被検知物質の検知方法。
【請求項2】
被検知物質が加水分解活性を持つ酵素であり、被検知物質によって固相面上の基質が加水分解され、被検知物質量によって固相面上に残る基質量が変化することを特徴とした請求項1記載の被検知物質の検知方法。
【請求項3】
被検知物質が加水分解活性を持つ酵素に対する阻害物質であり、検体は当該被検知物質が阻害する酵素活性を含んでおり、検体の加水分解活性によって固相面上の基質が加水分解され、被検知物質量によって固相面上に残る基質量が変化することを特徴とした請求項1に記載の被検知物質の検知方法。
【請求項4】
被検知物質がプロテアーゼもしくはプロテアーゼの阻害物質であり、固相面上の基質が当該プロテアーゼもしくは当該プロテアーゼの阻害物質が阻害するプロテアーゼの認識するアミノ酸配列を含んだポリペプチドからなることを特徴とした請求項1〜3のいずれかに記載の被検知物質の検知方法。
【請求項5】
被検知物質がヌクレアーゼもしくはヌクレアーゼの阻害物質であり、固相面上の基質が当該ヌクレアーゼもしくは当該ヌクレアーゼの阻害物質が阻害するヌクレアーゼの認識する塩基配列を含んだ核酸からなることを特徴とした請求項1〜3のいずれかに記載の被検知物質の検知方法。
【請求項6】
被検知物質がグリコシダーゼもしくはグリコシダーゼの阻害物質であり、固相面上の基質が当該グリコシダーゼもしくは当該グリコシダーゼの阻害物質が阻害するグリコシダーゼの認識する糖鎖構造を含んだ糖鎖からなることを特徴とした請求項1〜3のいずれかに記載の被検知物質の検知方法。
【請求項7】
被検知物質がリパーゼもしくはリパーゼの阻害物質であり、固相面上の基質が当該リパーゼもしくは当該リパーゼの阻害物質が阻害するリパーゼの認識する脂肪酸を含んだ有機酸からなることを特徴とした請求項1〜3のいずれかに記載の被検知物質の検知方法。
【請求項8】
加水分解活性を持つ酵素が認識する認識配列をもつ基質を固定化した固相面と、加水分解活性を持つ酵素が認識する認識配列を持たない基質を固定化した固相面に、被検知物質を含んだ検体を接触させ、認識配列をもつ基質を固定化した前記固相面上に残った基質量と認識配列を持たない基質を固定化した前記固相面上に残った基質量の差を比較することで被検知物質を検知することを特徴とした請求項4〜7のいずれかに記載の被検知物質の検知方法。
【請求項9】
加水分解活性を持つ酵素が認識する配列をもつ基質が複数の固相面に異なる濃度で固定化されていることを特徴とし、前記記載の複数の固相面に被検知物質を含んだ検体を接触させ、固相面上に残った基質量の基質濃度依存性を指標に検体中の被検知物質を検知することを特徴とした請求項4〜7のいずれかに記載の被検知物質の検知方法。
【請求項10】
被検知物質を含んだ検体を固相面上に接して流れるように反応させることを特徴とし、被検知物質を連続的に検知する請求項1〜9のいずれかに記載の被検知物質の検知方法。
【請求項11】
固相面上の基質を検知し易くするための信号物質を基質に結合してあることを特徴とし、信号物質の減少量を指標にして固相面上に残った基質量を検知する請求項1〜10のいずれかに記載の被検知物質の検知方法。
【請求項12】
基質に結合した信号物質が蛍光色素であり、固相面上に残った基質量を蛍光強度の減少量によって測定することを特徴とした請求項11に記載の被検知物質の検知方法。
【請求項13】
信号物質が酸化還元電位を発生させる物質であることを特徴とし、固相面上に残っている基質の量を酸化還元電流の減少量によって測定する請求項11に記載の被検知物質の検知方法。
【請求項14】
信号物質が磁化特性をもつことを特徴とし、固相面上に残っている基質の量を磁化特性の変化量によって測定する請求項11に記載の被検知物質の検知方法。
【請求項15】
信号物質が色素化合物であることを特徴とし、固相面上に残っている基質の量を色素の減少量によって測定する請求項11に記載の被検知物質の検知方法。
【請求項16】
基質が固定化された固相面が電極であることを特徴とし、固相面上の基質の分子量に基づく電極活性の変化を指標にして固相面上に残った基質量を検知する請求項1〜10のいずれかに記載の被検知物質の検知方法。
【図1】


【図2】


【図3】


【図4】


【図5】


【図6】


【図7】


【図8】


【図9】


【図10】


【図11】


【図12】


【図13】


【図14】


【図15】


【図16】


【図17】




【図2】


【図3】


【図4】


【図5】


【図6】


【図7】


【図8】


【図9】


【図10】


【図11】


【図12】


【図13】


【図14】


【図15】


【図16】


【図17】


【公開番号】特開2006−87303(P2006−87303A)
【公開日】平成18年4月6日(2006.4.6)
【国際特許分類】
【出願番号】特願2004−272855(P2004−272855)
【出願日】平成16年9月21日(2004.9.21)
【出願人】(000005821)松下電器産業株式会社 (73,050)
【Fターム(参考)】
【公開日】平成18年4月6日(2006.4.6)
【国際特許分類】
【出願日】平成16年9月21日(2004.9.21)
【出願人】(000005821)松下電器産業株式会社 (73,050)
【Fターム(参考)】
[ Back to top ]

