被浄化物質分解活性評価方法
【課題】被浄化物質の浄化工法に適用される微生物の分解活性の評価方法において、高感度で容易に測定でき、微生物を添加した直後でまだ被浄化物質の分解が起こっていない、または微生物と被浄化物質が接触していないために被浄化物質の分解が起こっていない時点でも、被浄化物質に対する分解の可能性を推測し、その活性を容易に評価することができる評価方法の提供を目的とする。
【解決手段】新規クロストリジウム・スピーシーズ(KD13)と糖類を含む栄養源13を共に被浄化物質8が含まれる土壌、地下水、ガスまたは工場廃液中に添加して、新規クロストリジウム・スピーシーズ(KD13)による糖類の代謝物濃度を測定することで、被浄化物質8の濃度を測定することなく、被浄化物質8の分解能力、分解活性を評価することができる。
【解決手段】新規クロストリジウム・スピーシーズ(KD13)と糖類を含む栄養源13を共に被浄化物質8が含まれる土壌、地下水、ガスまたは工場廃液中に添加して、新規クロストリジウム・スピーシーズ(KD13)による糖類の代謝物濃度を測定することで、被浄化物質8の濃度を測定することなく、被浄化物質8の分解能力、分解活性を評価することができる。
【発明の詳細な説明】
【技術分野】
【0001】
本発明は、例えば、汚染土壌、汚染地下水、汚染ガスあるいは工場廃液などの汚染物質を、新規クロストリジウム・スピーシーズKD13(clostridium sp.KD13 特許生物寄託センター受領番号:FERM AP−21115)などの微生物を用いて浄化する際の、浄化対象の汚染物質である被浄化物質の分解活性の評価方法などに関する。
【背景技術】
【0002】
微生物を用いた被浄化物質の浄化は例えば、揮発性有機化合物や芳香族炭化水素等の被浄化物質により汚染された土壌、地下水、ガスまたは工場廃液中に微生物を添加して、微生物と被浄化物質を接触させることにより、汚染物質である被浄化物質を分解して浄化・無害化するものが知られている。この浄化を実施する際、必要に応じて測定した被浄化物質の残留濃度と被浄化物質の初期濃度とを比較して、どの程度微生物による被浄化物質の分解が行われたか、またはどの程度被浄化物質が残留しているかといった情報を把握する必要がある。
【0003】
それは、被浄化物質を含む土壌や地下水、ガスまたは工場廃液中に添加した微生物により被浄化物質の分解が行われているのかという確認や、またはこの浄化作業はいつ完了しても良いのかといった予測を得るために必要な情報であり、効率の良い浄化作業を遂行するためには重要である。
【0004】
従来、この種の微生物による被浄化物質の分解速度のモニタリングは採取した被浄化物質を含む土壌や地下水、ガスまたは工場廃液中の被浄化物質の濃度をガスクロマトグラフィーを用いて測定するという手法が知られている。
【0005】
また、特許文献1に示された方法は、土壌や地下水汚染における主な被浄化物質の一つである油が好気性微生物によって好気的に生物分解されると、その分解過程で二酸化炭素が生成される点に着目し、土壌中の二酸化炭素濃度を測定することによって、好気性微生物による被浄化物質の分解活性を評価し、土壌浄化の進捗状況を推定する手法である。
【特許文献1】特開2006−275940号公報
【発明の開示】
【発明が解決しようとする課題】
【0006】
このような従来の被浄化物質の分解活性の評価方法では、必要に応じて被浄化物質濃度の減少または分解生成物濃度の増加を計測したが、微生物の被浄化物質分解活性はあるにもかかわらず、被浄化物質の分解に至っていない状態、つまり被浄化物質を含む土壌や地下水、ガスまたは工場廃液に微生物を添加した直後でまだ菌数が低いために被浄化物質分解が起こらない状態や被浄化物質が完全に分解されてこれ以上分解が行われない状態、または微生物を添加したが被浄化物質と微生物の接触が起こらないため被浄化物質が分解されない状態において、添加した微生物の活性に関する情報を知ることが不可能であった。すなわち、添加した微生物の被浄化物質分解活性を推測することは不可能であった。
【0007】
また、被浄化物質は土壌や地下水、ガスまたは工場廃液などに混入することで希釈されるため低濃度汚染が広がる場合が多い。特に、水より重い揮発性有機化合物は工場等から土壌中に遺漏すると、地下水にまで達して広範囲な汚染が発生する事例も多い。このような場合、被浄化物質の濃度は希釈効果により下がり、被浄化物質の濃度を測定するためには被浄化物質とそれ以外の成分を分離可能なカラムを装備し、かつ被浄化物質を検出可能な検出器を装備したガスクロマトグラフィーを用いて、高感度な計測を行う必要があった。
【0008】
また、被浄化物質の分解生成物の生成量を測定して分解活性を評価する場合、特許文献1のような好気微生物による油の好気分解では二酸化炭素が発生するという公知の知見がある場合は良いが、それ以外の場合では分解生成物が容易に推測できない場合も多い。分解生成物を特定する方法の一つに、ガスクロマトグラフィー質量分析法による定性分析が挙げられるが、サンプル中には被浄化物質に加えて様々な未知の成分が含まれているため特定は困難である。このような場合、被浄化物質の分解生成物を指標として被浄化物質の分解活性を評価することは困難である。
【0009】
本発明は、このような従来の課題を解決するものであり、被浄化物質を含む土壌や地下水、ガスまたは工場廃液に添加した微生物による、被浄化物質の分解が起こっていない状態においても、被浄化物質の分解活性を高感度で評価できる手法を提供することを目的としている。
【課題を解決するための手段】
【0010】
本発明は上記目的を達成するために、浄化対象の被浄化物質に新規クロストリジウム・スピーシーズKD13(clostridium sp.KD13 特許生物寄託センター受領番号:FERM AP−21115)とその栄養源を添加し、栄養源の代謝物濃度を測定することにより、汚染物質である前記被浄化物質の分解活性の評価を行うものである。
【0011】
この手段により、汚染物質である被浄化物質を含む土壌や地下水、ガスまたは工場廃液中に添加した新規クロストリジウム・スピーシーズKD13(clostridium sp.KD13 特許生物寄託センター受領番号:FERM AP−21115)の被浄化物質分解活性を容易に評価することが可能であり、汚染物質である被浄化物質が分解に至っていない状態、つまり添加した直後でまだ菌数が低いために被浄化物質分解が起こらない状態や被浄化物質が完全に分解されてこれ以上分解が行われない状態、または被浄化物質に汚染された現場に添加したのにもかかわらず被浄化物質と接触することができず、被浄化物質分解が起こらない状態における、揮発性有機化合物分解菌である新規クロストリジウム・スピーシーズKD13(clostridium sp.KD13 特許生物寄託センター受領番号:FERM AP−21115)の汚染物質、すなわち被浄化物質の分解活性を評価することが可能となる。
【0012】
また、他の手段として、被浄化物質が土壌、地下水、ガスあるいは工場廃液に含まれることを特徴としたものである。
【0013】
また、他の手段として、栄養源が糖類であることを特徴としたものである。
【0014】
また、他の手段として、糖類がグルコースであることを特徴としたものである。
【0015】
また、他の手段として、糖類がスクロースであることを特徴としたものである。
【0016】
また、他の手段として、糖類がフルクトースであることを特徴としたものである。
【0017】
また、他の手段として、糖類がグルコース、スクロース、フルクトースのうちいずれか2種類以上であることを特徴としたものである。
【0018】
また、他の手段として、アセトン濃度を測定することを特徴としたものである。
【0019】
また、他の手段として、ブタノール濃度を測定することを特徴としたものである。
【0020】
また、他の手段として、エタノール濃度を測定することを特徴としたものである。
【0021】
また、他の手段として、イソプロピルアルコール濃度を測定することを特徴としたものである。
【0022】
また、他の手段として、酢酸濃度を測定することを特徴としたものである。
【0023】
また、他の手段として、酪酸濃度を測定することを特徴としたものである。
【0024】
また、他の手段として、アセトン、ブタノール、エタノール、イソプロピルアルコール、酢酸あるいは酪酸のうちいずれか2種類以上の濃度を測定することを特徴としたものである。
【0025】
また、他の手段として、新規クロストリジウム・スピーシーズKD13(clostridium sp.KD13 特許生物寄託センター受領番号:FERM AP−21115)に変えて、アセトン・ブタノール発酵菌としたことを特徴としたものである。
【発明の効果】
【0026】
本発明の、新規クロストリジウム・スピーシーズKD13(clostridium sp.KD13 特許生物寄託センター受領番号:FERM AP−21115)が糖類を資化して生成する代謝物の濃度を測定することによって、被浄化物質の分解に至っていない状態でも、被浄化物質に対する分解能力、分解の可能性を推測し、その分解活性を容易に評価できるという効果が得られる。
【0027】
つまり、被浄化物質を含む土壌や地下水、ガスまたは工場廃液中に新規クロストリジウム・スピーシーズKD13(clostridium sp.KD13 特許生物寄託センター受領番号:FERM AP−21115)を添加した直後でまだ菌数が低いために被浄化物質分解が起こらない状態や被浄化物質が完全に分解されてこれ以上分解が行われない状態、または新規クロストリジウム・スピーシーズKD13(clostridium sp.KD13 特許生物寄託センター受領番号:FERM AP−21115)を添加したのにもかかわらず、被浄化物質に接触することができず、被浄化物質分解が起こらないといった状態における、新規クロストリジウム・スピーシーズKD13(clostridium sp.KD13 特許生物寄託センター受領番号:FERM AP−21115)の被浄化物質に対する分解能力、分解の可能性を推測し、その分解活性、浄化能力を容易に評価することが可能となる。
【発明を実施するための最良の形態】
【0028】
本発明の請求項1記載の発明は、浄化対象の汚染物質である被浄化物質に、新規クロストリジウム・スピーシーズKD13(clostridium sp.KD13 特許生物寄託センター受領番号:FERM AP−21115)と栄養源を同時に添加することにより、新規クロストリジウム・スピーシーズKD13(clostridium sp.KD13 特許生物寄託センター受領番号:FERM AP−21115)が栄養源を資化して代謝物を生成するが、その栄養源を資化して生成する代謝物の濃度を測定することによって、被浄化物質が分解に至っていない状態でも、被浄化物質に対する分解能力、分解の可能性をを推測することができ、その分解活性、浄化能力を容易に評価できるという作用を有する。
【0029】
また、本発明の請求項2記載の発明は、浄化対象の汚染物質である被浄化物質を含む土壌、地下水、ガスまたは工場廃液中に、新規クロストリジウム・スピーシーズKD13(clostridium sp.KD13 特許生物寄託センター受領番号:FERM AP−21115)と栄養源を同時に添加することにより、新規クロストリジウム・スピーシーズKD13(clostridium sp.KD13 特許生物寄託センター受領番号:FERM AP−21115)が栄養源を資化して代謝物を生成するが、その栄養源を資化して生成する代謝物の濃度を測定することによって、被浄化物質が分解に至っていない状態でも、被浄化物質に対する分解能力、分解の可能性を推測することができ、被浄化物質を含む土壌、地下水、ガスまたは工場廃液中での分解活性、浄化能力を容易に評価できるという作用を有する。
【0030】
また、請求項3〜7記載の発明は、新規クロストリジウム・スピーシーズKD13(clostridium sp.KD13 特許生物寄託センター受領番号:FERM AP−21115)と同時に添加する栄養源がグルコース、スクロース、フルクトースといった糖類であることを特徴としており、新規クロストリジウム・スピーシーズKD13(clostridium sp.KD13 特許生物寄託センター受領番号:FERM AP−21115)に含まれる酵素の働きにより糖類が資化されて代謝物を生成され、その代謝物の濃度を測定することによって、被浄化物質が分解に至っていない状態でも、被浄化物質に対する分解能力、分解の可能性を推測することができ、被浄化物質の分解活性、浄化能力を容易に評価できるという作用を有する。
【0031】
また、請求項8〜14記載の発明は、新規クロストリジウム・スピーシーズKD13(clostridium sp.KD13 特許生物寄託センター受領番号:FERM AP−21115)に含まれるhydrogenase、phosphotorans acetylase、acetate kinaseといった酵素によりグルコースから酢酸が生成されるというように、新規クロストリジウム・スピーシーズKD13(clostridium sp.KD13 特許生物寄託センター受領番号:FERM AP−21115)に含まれる各酵素の働きによって嫌気的な発酵が起った結果、アセトン、ブタノール、エタノール、イソプロピルアルコール、酢酸、酪酸といった代謝物が生成され、その代謝物の濃度を測定することによって、被浄化物質が分解に至っていない状態でも、被浄化物質に対する分解能力、分解の可能性を推測することができ、被浄化物質の分解活性、浄化能力を容易に評価できるという作用を有する。
【0032】
また、請求項15記載の発明は、新規クロストリジウム・スピーシーズKD13(clostridium sp.KD13 特許生物寄託センター受領番号:FERM AP−21115)に変えて、アセトン・ブタノール発酵菌としたものであり、アセトン・ブタノール発酵菌による浄化対象の汚染物質である被浄化物質の分解能力、分解の可能性を推測することができ、被浄化物質の分解活性、浄化能力を容易に評価できるという作用を有する。
【0033】
以下、新規クロストリジウム・スピーシーズKD13(clostridium sp.KD13 特許生物寄託センター受領番号:FERM AP−21115)を以下、KD13株と略し、本発明の実施の形態について図面を参照しながら説明する。
【0034】
(実施の形態1)
KD13株の性質と培養条件を以下に述べる。本菌KD13株の性質および培養条件を以下に示す。テトラクロロエチエン、トリクロロエチレン、cis−1,2ジクロロエチレン、ビニルクロライド複合汚染地下水から単離した揮発性有機化合物分解菌KD13株を以下の組成の液体培地を用いて培養した。
【0035】
このとき、気相は二酸化炭素で置換して嫌気培養を行った。なお、培養は25℃のインキュベーター内で静置条件で行った。
K2HPO4 0.3%
KH2PO4 0.08%
MgSO4・7H2O 0.02%
L−アスパラギン一水和物 0.5%
L−システイン塩酸塩一水和物 0.05%
D−グルコース 1.0%
(pH6.8)
培養温度は25℃に限定されるものではなく、37℃以下であれば良い。また、気相を置換するガスは二酸化炭素に限定されるものではなく、窒素や水素を成分とするものでも良い。本菌KD13は微量に酸素が含まれる状況でも増殖可能であるため、絶対嫌気性菌ではないことから、気相を置換するガス中に微量の酸素が含まれていても増殖また被浄化物質の分解に影響は無い。
【0036】
培養後の本菌KD13株から抽出したゲノムDNAを鋳型として、PCRにより16SribosomalRNA遺伝子(以後16SrDNAとする)のうち、5’末端側約500bpの領域を増幅した。その後、増幅された塩基配列をシーケンシングし、16SrDNA部分塩基配列を得た。得られた16SrDNAの部分塩基配列を用いて国際塩基配列データベースに対し相同性検索を行ったところ、クロストリジウム・ベイエリンキイ(Clostridium beijerinckii)と16SrDNAの部分塩基配列の相同率が98%であることが判明した。また、本菌KD13株と相同性の高かったクロストリジウム・ブチリカム(Clostridium butyricum)とクロストリジウム・アセトブチリカム(Clostridium acetobutilicum)はアセトン・ブタノール発酵菌として報告されている。本菌KD13株を上記の液体培地で培養した後、ヘッドスペースのガス組成をガスクロマトグラフィー質量分析装置によって定性分析した結果、図1に示すクロマトグラムが得られた。
【0037】
また、培養後の上記の液体培地をガスクロマトグラフィー質量分析装置によって定性分析した結果、図2に示すクロマトグラムが得られた。図1に示す通り、ヘッドスペースにはエタノールのピーク1、アセトンのピーク2、イソプロピルアルコールのピーク3、ブタノールのピーク4といった主要なピークが検出され、図2に示す通り、液相にはそれらに加えて酪酸のピーク6、酢酸のピーク5といったピークが検出された。したがって、本菌KD13株は、汚染物質、すなわち被浄化物質であるテトラクロロエチレン、トリクロロエチレン、cis−1,2ジクロロエチレンといった揮発性有機化合物の分解菌であると同時に、糖類を資化してアセトンやブタノールといった代謝物を生成する特性を持つことから、本発明は本菌KD13株のみならず、いわゆるアセトン・ブタノール発酵菌群にも適用可能である。
【0038】
すなわち、これらの代謝物の生成濃度を測定することで、テトラクロロエチレン、トリクロロエチレン、cis−1,2ジクロロエチレンなどの被浄化物質を含む土壌、地下水、ガスまたは工場廃液に被浄化物質を分解可能なアセトン・ブタノール発酵菌と糖類を含む栄養源を同時に添加して被浄化物質の分解、無害化を図る工法において、まだ被浄化物質の分解に至っていない場合であっても、被浄化物質を分解可能なアセトン・ブタノール発酵菌の被浄化物質分解活性を評価することが可能となる。
【0039】
浄化対象の汚染物質であるテトラクロロエチレン、トリクロロエチレン、cis−1,2ジクロロエチレンなどの被浄化物質に新規クロストリジウム・スピーシーズKD13(clostridium sp.KD13 特許生物寄託センター受領番号:FERM AP−21115)とその栄養源を添加し、栄養源の代謝物濃度を測定することにより、被浄化物質の分解能力、分解活性の評価を行うことができ、測定した代謝物濃度を指標として、汚染物質である被浄化物質の分解能力、分解活性を推測することができる。
【0040】
テトラクロロエチレン、トリクロロエチレン、cis−1,2ジクロロエチレンなどの被浄化物質に汚染された現場に被浄化物質を分解可能なアセトン・ブタノール発酵菌を添加した直後でまだ菌数が低いために被浄化物質分解が起こらない状態や被浄化物質が完全に分解されてこれ以上分解が行われない状態、または被浄化物質に汚染された現場に被浄化物質を分解可能なアセトン・ブタノール発酵菌を添加したが被浄化物質と接触することができず、被浄化物質分解が起こらない状態であっても、被浄化物質を分解可能なアセトン・ブタノール発酵菌の被浄化物質分解活性を評価することが可能となる。
【0041】
また、アセトン・ブタノール発酵菌群の増殖状態は、糖類の代謝生成物でアセトン、ブタノール、エタノールの生成量が多い場合は定常期、酢酸、酪酸の生成量が多い場合は対数増殖期といった公知の知見があることから、本菌KD13株のような被浄化物質分解菌であり、かつアセトン・ブタノール発酵菌であるような微生物が糖類を資化することによって生成する代謝物濃度を測定することで、そのような微生物の増殖期も推測することができる。測定した代謝物濃度を指標として、汚染物質である被浄化物質の分解能力、分解活性を推測するものである。
【0042】
例えば、テトラクロロエチレン、トリクロロエチレン、cis−1,2ジクロロエチレンなどの被浄化物質を含む土壌に本菌KD13株のような被浄化物質分解菌であり、かつアセトン・ブタノール発酵菌であるような微生物と糖類を含む栄養源を添加した後、糖類由来の代謝物の定性、定量分析を行って、添加した微生物の増殖が定常期に入っていると考えられた場合には、更にさらに微生物を汚染土壌に添加するといった対策を講じることができる。また、糖類由来の代謝物の定性、定量分析により微生物の増殖が対数増殖期に入っていると考えられた場合には、微生物による被浄化物質の分解にはしばらく微生物の増殖を待つ必要があると判断することができる。
【0043】
また、本発明によれば本菌KD13株のような被浄化物質分解菌であり、かつアセトン・ブタノール発酵菌であるような微生物と糖類を含む栄養源を同時に添加して被浄化物質の分解を測るため、微生物の増殖速度を高め、結果的に汚染の浄化速度も高め、汚染土壌、汚染地下水などの有害物質で汚染された環境の環境浄化を図ることができる。また、菌数が増えることで、アセトン、ブタノール、エタノール、イソプロピルアルコール、酢酸、酪酸といった糖類の代謝生成物が被浄化物質よりも比較的高濃度で生成されるため、定量しやすくかつ、少量のサンプリング量で代謝物濃度を測定し、被浄化物質の分解活性、浄化能力を評価することができる。
【0044】
(実施の形態2)
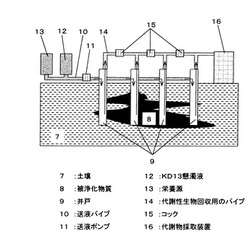
KD13株を用いた土壌汚染浄化工法における分解活性の評価方法を以下に述べる。本菌KD13株を用いた土壌汚染浄化工法について図3を用いて説明する。
【0045】
図3に本菌KD13と糖類を含む栄養源を用いた土壌汚染浄化工法を示す。図3に示す通り、地表から遺漏したテトラクロロエチレン、トリクロロエチレン、cis−1,2ジクロロエチレンなどの汚染物質である被浄化物質8は地下水に達していない場合、土壌7の間隙中へ拡散される。また降雨などにより被浄化物質8のプルームは巨大化し、広域的な土壌汚染が発生する。
【0046】
このような場合、本菌KD13による効率的な汚染浄化を図るためには、汚染区域に複数の井戸9を掘削し、それぞれの井戸9に送液パイプ10と送液ポンプ11を用いて本菌KD13懸濁液12と栄養源13を注入する工法が有効である。各井戸9それぞれから糖類由来の代謝性生物を採取するために代謝性生物回収用のパイプ14の途中にコック15を装備するのが好ましい。
【0047】
ここで、複数の井戸9の上部に糖類由来の代謝性生物回収用のパイプ14を装備し、代謝性生物採取装置16へ結合させる。井戸9は例えば、ボーリング等で掘削するのが一般的であるが、この方法に限定されず、本菌KD13株が土壌中で糖類を資化して生成される代謝物が検出できる深さまで達していれば良い。また、送液パイプ10と代謝性生物回収用のパイプ14を設置できる大きさであれば良い。また、代謝性生物回収用のパイプ14は地表または地中で劣化しにくく、かつ中を通過する代謝性生物の吸着が少ない素材のものを用いるのが望ましい。
【0048】
各井戸9に本菌KD13株と糖類を含んだ栄養源を注入すると、本菌KD13株に含まれる酵素の働きにより糖類が資化されて、アセトンやブタノールといった代謝物が生成される。各井戸9それぞれに対して、この代謝物の生成濃度をガス検知管やガスクロマトグラフィーを用いて測定することで、注入した本菌KD13の活性を評価することが可能であるため、被浄化物質の分解活性を評価することが可能である。
【0049】
すなわち、これらの代謝物の生成濃度を計測することで、本菌KD13株と糖類を含む栄養源を添加したにもかかわらず、まだ被浄化物質の分解に至っていない状態、つまり被浄化物質に汚染された土壌に本菌KD13株と糖類を含む栄養源を添加した直後でまだ菌数が低いために被浄化物質分解が起こらない状態や被浄化物質が完全に分解されてこれ以上分解が行われない状態、または被浄化物質に汚染された現場に本菌KD13株を添加したが被浄化物質と接触することができずに被浄化物質分解が起こらない状態においても本菌KD13株の被浄化物質の分解活性、浄化能力を評価することが可能となる。
【0050】
また、本菌KD13株が糖類を資化することによって生成される代謝物について定性、定量分析を行うことで、本菌KD13株の汚染土壌中での増殖期も推測することができる。よって、例えば被浄化物質に汚染された土壌に本菌KD13株と糖類を含む栄養源を添加した後、糖類由来の代謝物の定性、定量分析を行って、添加した微生物の増殖が定常期に入っていると考えられた場合には、更にさらに本菌KD13株を汚染土壌に添加するといった対策を打つことができる。また、糖類由来の代謝物の分析により本菌KD13株の増殖が対数増殖期に入っていると考えられた場合には、本菌KD13株による被浄化物質の分解にはしばらく本菌KD13株の増殖を待つ必要があると判断することができる。
【0051】
ここで、分解活性を評価する指標となる代謝物は最も早く生成するもの、または最も生成量が多いものを選択するのが好ましい。その上、汚染土壌の浄化現場で他の要因により発生するガスと異なる種類のものが好ましい。また、代謝物濃度をガス検知管を用いて測定する場合は、各現場で他の要因により発生するガスが検知管の発色に干渉しない代謝物を選択するのが好ましい。
【0052】
上記の土壌汚染浄化工法における分解活性の評価方法は、被浄化物質が揮発性有機化合物である場合に限定されず、本菌KD13株やアセトン・ブタノール発酵菌群が分解可能な物質であれば良い。
【0053】
本発明の被浄化物質の分解活性評価により、浄化が全く開始されない場合や分解活性が低い場合、また浄化開始初期に比べて分解活性が低下した場合等には、栄養源13のみを送液ポンプ11を用いて井戸9に追加で添加して、高い栄養状態をつくることにより対応することができる。また、本菌KD13株の懸濁液12のみを送液ポンプ11を用いて井戸9に追加で添加して、高菌密度状態をつくることにより対応することができる。また、二酸化炭素、窒素または水素を送液ポンプ11を用いて井戸9から追加で添加して、土壌中の嫌気度を高めることができる。また、アルカリ側のpHに調整した栄養源13を送液ポンプ11を用いて井戸9に追加で添加することができる。一般的に、アセトン・ブタノール発酵菌群は酸性側のpH耐性が低いという公知の知見がある。また、クロストリジウム属の微生物は生育条件が悪い場合、芽胞を形成するという公知の知見がある。よって、土壌中で糖類を資化することによって生成した酢酸や酪酸といった酸性物質が土壌を酸性条件に変化させることにより芽胞となった本菌KD13株に対してはこの方法で対応するのが望ましい。このような事態が予想された場合は、分解活性を評価する指標となる代謝生成物として、酢酸または酪酸を選択するのが望ましい。また、浄化対象の土壌のpHが酸性の場合も分解活性を評価する指標となる代謝生成物として酢酸または酪酸を選択するのが望ましい。
【0054】
(実施の形態3)
KD13を用いた地下水汚染浄化工法における分解活性の評価方法を以下に述べる。
【0055】
本菌KD13株を用いた地下水汚染浄化工法について図4を用いて説明する。図4に本菌KD13と糖類を含む栄養源を同時に添加する地下水の浄化工法を示す。
【0056】
図4に示す通り、地表から遺漏したテトラクロロエチレン、トリクロロエチレン、cis−1,2ジクロロエチレンなどの汚染物質である被浄化物質8が土壌7を浸透し地下水17まで達した場合、地下水流れによって輸送され、広域的な地下水汚染が発生する。このような場合、本菌KD13による効率的な汚染浄化を図るためには、汚染区域の片端に注入井18を掘削し、送液パイプ10と送液ポンプ11を用いて本菌KD13懸濁液12と栄養源13を注入する工法が有効である。注入された本菌KD13と栄養源は地下水の流れに乗って輸送され、汚染プルーム内を通過することにより、本菌KD13による被浄化物質8の分解が開始される。
【0057】
汚染プルームを通過した本菌KD13と栄養源は注出井19により回収される。注入井18と注出井19の間の汚染プルーム上に複数の代謝物採取井戸20を掘削し、各井戸上部に設置した代謝性生物回収用のパイプ14を代謝物採取装置16へ結合させる。各井戸それぞれに対して代謝生成物を採取するために、代謝性生物回収用のパイプ14の途中にコック15を装備するのが好ましい。注入井18または注出井19は例えば、ボーリング等で掘削するのが一般的であるが、この方法に限定されず、本菌KD13株が地下水中で糖類を資化して生成される代謝物が検出できる深さまで達していれば良い。また、送液パイプ10と代謝性生物回収用のパイプ14を設置できる大きさであれば良い。また、代謝物回収パイプ代謝性生物回収用のパイプ14は地表または土壌、地下水中で劣化しにくく、かつ中を通過する代謝物の吸着が少ない素材のものを用いるのが望ましい。
【0058】
注入井18から本菌KD13株と糖類を含んだ栄養源を注入すると、本菌KD13株に含まれる酵素の働きにより糖類が資化されて、アセトンやブタノールといった代謝物が生成される。各代謝物採取井戸20それぞれから採取された代謝物の濃度を、ガス検知管やガスクロマトグラフィーを用いて測定することで、注入した本菌KD13の活性を評価することが可能であるため、各代謝物採取井戸20設置地点での被浄化物質の分解活性を評価することが可能となる。
【0059】
すなわち、これらの代謝物の生成濃度をモニタリングすることで、本菌KD13株と糖類を含む栄養源を添加したにもかかわらず、まだ被浄化物質の分解に至っていない状態、つまり被浄化物質に汚染された地下水に本菌KD13株と糖類を含む栄養源を添加した直後でまだ菌数が低いために被浄化物質分解が起こらない状態や被浄化物質が完全に分解されてこれ以上分解が行われない状態、または被浄化物質に汚染された現場に本菌KD13株を添加したが被浄化物質と接触することができず被浄化物質分解が起こらない状態においても本菌KD13株の被浄化物質の分解活性、浄化能力を評価することが可能となる。
【0060】
また、本菌KD13株が糖類を資化することによって生成される代謝物について定性、定量分析を行うことで、本菌KD13株の汚染地下水中での増殖期も推測することができる。よって、例えば被浄化物質に汚染された地下水に本菌KD13株と糖類を含む栄養源を添加した後、糖類由来の代謝物の定性、定量分析を行い、添加した微生物の増殖が定常期に入っていると考えられた場合には、更にさらに本菌KD13株を汚染地下水に添加するといった対策を講じることができる。また、糖類由来の代謝物の分析により本菌KD13株の増殖が対数増殖期に入っていると考えられた場合には、本菌KD13株による被浄化物質の分解にはしばらく本菌KD13株の増殖を待つ必要があると判断することができる。
【0061】
ここで、分解活性評価の指標となる代謝物は、最も早く生成するもの、または最も生成量が多いものを選択するのが好ましい。その上、汚染地下水の浄化現場で他の要因により発生するガスと異なる種類のものが好ましい。また、代謝物濃度をガス検知管を用いて測定する場合は、各現場で他の要因により発生するガスが検知管の発色に干渉しない代謝物を選択するのが好ましい。
【0062】
注入井18から添加された本菌KD13株は地下水内を吸着、脱着を繰り返しながら地下水流れの方向に輸送される。また、注入井18から添加された糖類を含む栄養源は移流、分散により地下水流れの方向に輸送されるため、本菌KD13株よりも輸送速度は速い。よって、浄化開始初期に微生物が地下水流れに乗ってどこまで輸送されているのかといった現象も、各ガス回収井戸のから回収される代謝物濃度を測定することにより推測することが可能である。ここで、評価する代謝物は最も早く生成するもの、または最も生成量が多いものを選択するのが好ましい。その上、各現場で他の要因により発生するガスと異なる種類のものが好ましい。また、代謝物濃度をガス検知管を用いて測定する場合は、各現場で他の要因により発生するガスが検知管の発色に干渉しない代謝物を選択するのが好ましい。
【0063】
上記の地下水汚染の浄化工法における分解活性の評価方法は、被浄化物質が揮発性有機化合物である場合に限定されず、本菌KD13株を含むアセトン・ブタノール発酵菌群が分解可能な物質であれば良い。
【0064】
本発明の被浄化物質の分解活性評価により、浄化が全く開始されない場合や分解活性が低い場合、また浄化開始初期に比べて分解活性が低下した場合等には、栄養源13のみを送液ポンプ11を用いて注入井18に追加で添加して高い栄養状態をつくることにより対応することができる。また、本菌のKD13懸濁液12のみを送液ポンプ11を用いて注入井18に追加で添加して高菌密度状態をつくることにより対応することができる。また、二酸化炭素、窒素または水素を送液ポンプ11を用いて注入井18から追加で注入して地下水の嫌気度を高めることにより対応することができる。
【0065】
また、水酸化ナトリウムや水酸化カリウム等を用いてアルカリ側のpHに調整した栄養源13を送液ポンプ11を用いて注入井18に追加で注入することにより対応することができる。本菌KD13株を含むアセトン・ブタノール発酵菌群は酸性側のpH耐性が低いという公知の知見がある。また、クロストリジウム属の微生物は生育条件が悪い場合、芽胞を形成するという公知の知見がある。よって、地下水中で糖類を資化することによって生成した酢酸や酪酸といった酸性物質が地下水を酸性条件に変化させることにより芽胞となった本菌KD13株のようなアセトン・ブタノール発酵菌群はこの方法で対応するのが望ましい。このような事態が予想された場合は、分解活性評価の指標となる代謝物は酢酸または酪酸を選択するのが望ましい。また、浄化対象の地下水のpHが酸性の場合も分解活性評価の指標となる代謝物は酢酸または酪酸を選択するのが望ましい。
【0066】
(実施の形態4)
KD13を用いた空気浄化における分解活性の評価方法を以下に述べる。本菌KD13株を用いたガスの浄化方法について図5を用いて説明する。
【0067】
図5に示すように、カラム21内には本菌KD13株を担持させた担体22が充填されている。カラム21は2ヶ所の開口部を有し、排出口23には吸引ポンプ24が装着され、流入口25から被浄化物質含有ガスを吸引することができる。流入口25から吸引されたガスは担体22の空隙を通過し排出口23まで到達する。排出口23の上部にはサンプリング口26が供えられており、そこから排出ガスを採取することができる。
【0068】
糖類を含む栄養源13から送液ポンプ11、送液パイプ10を通じて栄養源をカラム21下部に備えられた供給口27によりカラム21内部に散布し、担体22上の微生物の活性を高める。このとき、カラム内部に隅々まで液体の栄養源を行き渡らせるため、栄養源の液体を微粒子化して散布するのが望ましい。また、カラム21に充填する本菌KD13を付着させた担体22は浄化実施中にKD13が剥離しにくいものであれば良い。また、サンプリング口26はカラム21上部に限定されるわけではなく、カラム21のどの位置に設置しても良い。
【0069】
この方法で、ガスの浄化を行う場合、本菌KD13と糖類を含んだ栄養源によりカラム21内にアセトンやブタノールといった代謝物が生成される。サンプリング口26から採取されるガス中の代謝物濃度を測定することにより、カラム21内の担体22上に生息する本菌KD13の活性を評価することが可能である。この方法を用いると、本菌KD13による被浄化物質分解活性の低下を容易に検知することができる。ここで、分解活性の評価の指標となる代謝物は最も早く生成するもの、または最も生成量が多いもの、また気体上のものを選択するのが好ましい。その上、浄化対象のガス成分と異なる種類のものが好ましい。また、代謝物濃度をガス検知管を用いて測定する場合は、浄化対象のガス成分が検知管の発色に干渉しない代謝物を選択するのが好ましい。
【0070】
本発明の被浄化物質の分解活性評価方法により、被浄化物質の分解が全く開始されない場合や分解活性が低い場合、また浄化開始初期に比べて分解活性が低下した場合等には、栄養源13のみを供給口27よりカラム21内に追加で添加して栄養条件を高めることにより対応できる。また、二酸化炭素、窒素または水素を供給口27よりカラム21内に供給して、カラム21内の嫌気度を上げることにより対応できる。アセトン・ブタノール発酵菌群は酸性側のpH耐性が低いという公知の知見がある。
【0071】
また、クロストリジウム属の微生物は生育条件が悪い場合、芽胞を形成するという公知の知見がある。このような場合、アルカリ側のpHに調整した栄養源13を供給口27よりカラム21内に追加で添加することにより対応できる。カラム21内で糖類を資化することによって生成した酢酸や酪酸といった酸性物質がカラム21内を酸性条件に変化させることにより本菌KD13株が芽胞を形成した場合はこの方法で対応するのが望ましい。
【0072】
このような事態になった場合は、分解活性を評価する指標となる代謝生成物として酢酸または酪酸を選択するのが望ましい。また、浄化対象のガスのpHが酸性の場合も分解活性を評価する指標となる代謝生成物として酢酸または酪酸を選択するのが望ましい。
【産業上の利用可能性】
【0073】
新規クロストリジウム・スピーシーズKD13(clostridium sp.KD13)などの汚染物資の分解、浄化を行う菌などを、糖類を含む栄養源を共に添加し、栄養源の代謝物濃度を測定することで、汚染物質である被浄化物質の分解能力、分解の可能性を推測でき、被浄化物質の分解能力、分解活性を容易に評価できることとなり、本評価方法を用いて、土壌、地下水、ガスあるいは工場廃液などの汚染物質の浄化などにも適用できる。
【図面の簡単な説明】
【0074】
【図1】本発明の実施の形態1における、新規クロストリジウム・スピーシーズKD13培養後に発生するガスのクロマトグラフィーを示す図
【図2】本発明の実施の形態1における、新規クロストリジウム・スピーシーズKD13培養後に発生する溶存成分のクロマトグラフィーを示す図
【図3】本発明の実施の形態2における、新規クロストリジウム・スピーシーズKD13と糖類を含む栄養源を同時に添加する土壌汚染の浄化工法を示す図
【図4】本発明の実施の形態3における、新規クロストリジウム・スピーシーズKD13と糖類を含む栄養源を同時に添加する地下水汚染の浄化工法を示す図
【図5】本発明の実施の形態4における、新規クロストリジウム・スピーシーズKD13と糖類を含む栄養源を同時に添加する空気浄化工法を示す図
【符号の説明】
【0075】
1 エタノールのピーク
2 アセトンのピーク
3 イソプロピルアルコールのピーク
4 ブタノールのピーク
5 酢酸のピーク
6 酪酸のピーク
7 土壌
8 被浄化物質
9 井戸
10 送液パイプ
11 送液ポンプ
12 KD13懸濁液
13 栄養源
14 代謝性生物回収用のパイプ
15 コック
16 代謝物採取装置
17 地下水
18 注入井
19 注出井
20 代謝物採取井戸
21 カラム
22 担体
23 排出口
24 吸引ポンプ
25 流入口
26 サンプリング口
27 供給口
【技術分野】
【0001】
本発明は、例えば、汚染土壌、汚染地下水、汚染ガスあるいは工場廃液などの汚染物質を、新規クロストリジウム・スピーシーズKD13(clostridium sp.KD13 特許生物寄託センター受領番号:FERM AP−21115)などの微生物を用いて浄化する際の、浄化対象の汚染物質である被浄化物質の分解活性の評価方法などに関する。
【背景技術】
【0002】
微生物を用いた被浄化物質の浄化は例えば、揮発性有機化合物や芳香族炭化水素等の被浄化物質により汚染された土壌、地下水、ガスまたは工場廃液中に微生物を添加して、微生物と被浄化物質を接触させることにより、汚染物質である被浄化物質を分解して浄化・無害化するものが知られている。この浄化を実施する際、必要に応じて測定した被浄化物質の残留濃度と被浄化物質の初期濃度とを比較して、どの程度微生物による被浄化物質の分解が行われたか、またはどの程度被浄化物質が残留しているかといった情報を把握する必要がある。
【0003】
それは、被浄化物質を含む土壌や地下水、ガスまたは工場廃液中に添加した微生物により被浄化物質の分解が行われているのかという確認や、またはこの浄化作業はいつ完了しても良いのかといった予測を得るために必要な情報であり、効率の良い浄化作業を遂行するためには重要である。
【0004】
従来、この種の微生物による被浄化物質の分解速度のモニタリングは採取した被浄化物質を含む土壌や地下水、ガスまたは工場廃液中の被浄化物質の濃度をガスクロマトグラフィーを用いて測定するという手法が知られている。
【0005】
また、特許文献1に示された方法は、土壌や地下水汚染における主な被浄化物質の一つである油が好気性微生物によって好気的に生物分解されると、その分解過程で二酸化炭素が生成される点に着目し、土壌中の二酸化炭素濃度を測定することによって、好気性微生物による被浄化物質の分解活性を評価し、土壌浄化の進捗状況を推定する手法である。
【特許文献1】特開2006−275940号公報
【発明の開示】
【発明が解決しようとする課題】
【0006】
このような従来の被浄化物質の分解活性の評価方法では、必要に応じて被浄化物質濃度の減少または分解生成物濃度の増加を計測したが、微生物の被浄化物質分解活性はあるにもかかわらず、被浄化物質の分解に至っていない状態、つまり被浄化物質を含む土壌や地下水、ガスまたは工場廃液に微生物を添加した直後でまだ菌数が低いために被浄化物質分解が起こらない状態や被浄化物質が完全に分解されてこれ以上分解が行われない状態、または微生物を添加したが被浄化物質と微生物の接触が起こらないため被浄化物質が分解されない状態において、添加した微生物の活性に関する情報を知ることが不可能であった。すなわち、添加した微生物の被浄化物質分解活性を推測することは不可能であった。
【0007】
また、被浄化物質は土壌や地下水、ガスまたは工場廃液などに混入することで希釈されるため低濃度汚染が広がる場合が多い。特に、水より重い揮発性有機化合物は工場等から土壌中に遺漏すると、地下水にまで達して広範囲な汚染が発生する事例も多い。このような場合、被浄化物質の濃度は希釈効果により下がり、被浄化物質の濃度を測定するためには被浄化物質とそれ以外の成分を分離可能なカラムを装備し、かつ被浄化物質を検出可能な検出器を装備したガスクロマトグラフィーを用いて、高感度な計測を行う必要があった。
【0008】
また、被浄化物質の分解生成物の生成量を測定して分解活性を評価する場合、特許文献1のような好気微生物による油の好気分解では二酸化炭素が発生するという公知の知見がある場合は良いが、それ以外の場合では分解生成物が容易に推測できない場合も多い。分解生成物を特定する方法の一つに、ガスクロマトグラフィー質量分析法による定性分析が挙げられるが、サンプル中には被浄化物質に加えて様々な未知の成分が含まれているため特定は困難である。このような場合、被浄化物質の分解生成物を指標として被浄化物質の分解活性を評価することは困難である。
【0009】
本発明は、このような従来の課題を解決するものであり、被浄化物質を含む土壌や地下水、ガスまたは工場廃液に添加した微生物による、被浄化物質の分解が起こっていない状態においても、被浄化物質の分解活性を高感度で評価できる手法を提供することを目的としている。
【課題を解決するための手段】
【0010】
本発明は上記目的を達成するために、浄化対象の被浄化物質に新規クロストリジウム・スピーシーズKD13(clostridium sp.KD13 特許生物寄託センター受領番号:FERM AP−21115)とその栄養源を添加し、栄養源の代謝物濃度を測定することにより、汚染物質である前記被浄化物質の分解活性の評価を行うものである。
【0011】
この手段により、汚染物質である被浄化物質を含む土壌や地下水、ガスまたは工場廃液中に添加した新規クロストリジウム・スピーシーズKD13(clostridium sp.KD13 特許生物寄託センター受領番号:FERM AP−21115)の被浄化物質分解活性を容易に評価することが可能であり、汚染物質である被浄化物質が分解に至っていない状態、つまり添加した直後でまだ菌数が低いために被浄化物質分解が起こらない状態や被浄化物質が完全に分解されてこれ以上分解が行われない状態、または被浄化物質に汚染された現場に添加したのにもかかわらず被浄化物質と接触することができず、被浄化物質分解が起こらない状態における、揮発性有機化合物分解菌である新規クロストリジウム・スピーシーズKD13(clostridium sp.KD13 特許生物寄託センター受領番号:FERM AP−21115)の汚染物質、すなわち被浄化物質の分解活性を評価することが可能となる。
【0012】
また、他の手段として、被浄化物質が土壌、地下水、ガスあるいは工場廃液に含まれることを特徴としたものである。
【0013】
また、他の手段として、栄養源が糖類であることを特徴としたものである。
【0014】
また、他の手段として、糖類がグルコースであることを特徴としたものである。
【0015】
また、他の手段として、糖類がスクロースであることを特徴としたものである。
【0016】
また、他の手段として、糖類がフルクトースであることを特徴としたものである。
【0017】
また、他の手段として、糖類がグルコース、スクロース、フルクトースのうちいずれか2種類以上であることを特徴としたものである。
【0018】
また、他の手段として、アセトン濃度を測定することを特徴としたものである。
【0019】
また、他の手段として、ブタノール濃度を測定することを特徴としたものである。
【0020】
また、他の手段として、エタノール濃度を測定することを特徴としたものである。
【0021】
また、他の手段として、イソプロピルアルコール濃度を測定することを特徴としたものである。
【0022】
また、他の手段として、酢酸濃度を測定することを特徴としたものである。
【0023】
また、他の手段として、酪酸濃度を測定することを特徴としたものである。
【0024】
また、他の手段として、アセトン、ブタノール、エタノール、イソプロピルアルコール、酢酸あるいは酪酸のうちいずれか2種類以上の濃度を測定することを特徴としたものである。
【0025】
また、他の手段として、新規クロストリジウム・スピーシーズKD13(clostridium sp.KD13 特許生物寄託センター受領番号:FERM AP−21115)に変えて、アセトン・ブタノール発酵菌としたことを特徴としたものである。
【発明の効果】
【0026】
本発明の、新規クロストリジウム・スピーシーズKD13(clostridium sp.KD13 特許生物寄託センター受領番号:FERM AP−21115)が糖類を資化して生成する代謝物の濃度を測定することによって、被浄化物質の分解に至っていない状態でも、被浄化物質に対する分解能力、分解の可能性を推測し、その分解活性を容易に評価できるという効果が得られる。
【0027】
つまり、被浄化物質を含む土壌や地下水、ガスまたは工場廃液中に新規クロストリジウム・スピーシーズKD13(clostridium sp.KD13 特許生物寄託センター受領番号:FERM AP−21115)を添加した直後でまだ菌数が低いために被浄化物質分解が起こらない状態や被浄化物質が完全に分解されてこれ以上分解が行われない状態、または新規クロストリジウム・スピーシーズKD13(clostridium sp.KD13 特許生物寄託センター受領番号:FERM AP−21115)を添加したのにもかかわらず、被浄化物質に接触することができず、被浄化物質分解が起こらないといった状態における、新規クロストリジウム・スピーシーズKD13(clostridium sp.KD13 特許生物寄託センター受領番号:FERM AP−21115)の被浄化物質に対する分解能力、分解の可能性を推測し、その分解活性、浄化能力を容易に評価することが可能となる。
【発明を実施するための最良の形態】
【0028】
本発明の請求項1記載の発明は、浄化対象の汚染物質である被浄化物質に、新規クロストリジウム・スピーシーズKD13(clostridium sp.KD13 特許生物寄託センター受領番号:FERM AP−21115)と栄養源を同時に添加することにより、新規クロストリジウム・スピーシーズKD13(clostridium sp.KD13 特許生物寄託センター受領番号:FERM AP−21115)が栄養源を資化して代謝物を生成するが、その栄養源を資化して生成する代謝物の濃度を測定することによって、被浄化物質が分解に至っていない状態でも、被浄化物質に対する分解能力、分解の可能性をを推測することができ、その分解活性、浄化能力を容易に評価できるという作用を有する。
【0029】
また、本発明の請求項2記載の発明は、浄化対象の汚染物質である被浄化物質を含む土壌、地下水、ガスまたは工場廃液中に、新規クロストリジウム・スピーシーズKD13(clostridium sp.KD13 特許生物寄託センター受領番号:FERM AP−21115)と栄養源を同時に添加することにより、新規クロストリジウム・スピーシーズKD13(clostridium sp.KD13 特許生物寄託センター受領番号:FERM AP−21115)が栄養源を資化して代謝物を生成するが、その栄養源を資化して生成する代謝物の濃度を測定することによって、被浄化物質が分解に至っていない状態でも、被浄化物質に対する分解能力、分解の可能性を推測することができ、被浄化物質を含む土壌、地下水、ガスまたは工場廃液中での分解活性、浄化能力を容易に評価できるという作用を有する。
【0030】
また、請求項3〜7記載の発明は、新規クロストリジウム・スピーシーズKD13(clostridium sp.KD13 特許生物寄託センター受領番号:FERM AP−21115)と同時に添加する栄養源がグルコース、スクロース、フルクトースといった糖類であることを特徴としており、新規クロストリジウム・スピーシーズKD13(clostridium sp.KD13 特許生物寄託センター受領番号:FERM AP−21115)に含まれる酵素の働きにより糖類が資化されて代謝物を生成され、その代謝物の濃度を測定することによって、被浄化物質が分解に至っていない状態でも、被浄化物質に対する分解能力、分解の可能性を推測することができ、被浄化物質の分解活性、浄化能力を容易に評価できるという作用を有する。
【0031】
また、請求項8〜14記載の発明は、新規クロストリジウム・スピーシーズKD13(clostridium sp.KD13 特許生物寄託センター受領番号:FERM AP−21115)に含まれるhydrogenase、phosphotorans acetylase、acetate kinaseといった酵素によりグルコースから酢酸が生成されるというように、新規クロストリジウム・スピーシーズKD13(clostridium sp.KD13 特許生物寄託センター受領番号:FERM AP−21115)に含まれる各酵素の働きによって嫌気的な発酵が起った結果、アセトン、ブタノール、エタノール、イソプロピルアルコール、酢酸、酪酸といった代謝物が生成され、その代謝物の濃度を測定することによって、被浄化物質が分解に至っていない状態でも、被浄化物質に対する分解能力、分解の可能性を推測することができ、被浄化物質の分解活性、浄化能力を容易に評価できるという作用を有する。
【0032】
また、請求項15記載の発明は、新規クロストリジウム・スピーシーズKD13(clostridium sp.KD13 特許生物寄託センター受領番号:FERM AP−21115)に変えて、アセトン・ブタノール発酵菌としたものであり、アセトン・ブタノール発酵菌による浄化対象の汚染物質である被浄化物質の分解能力、分解の可能性を推測することができ、被浄化物質の分解活性、浄化能力を容易に評価できるという作用を有する。
【0033】
以下、新規クロストリジウム・スピーシーズKD13(clostridium sp.KD13 特許生物寄託センター受領番号:FERM AP−21115)を以下、KD13株と略し、本発明の実施の形態について図面を参照しながら説明する。
【0034】
(実施の形態1)
KD13株の性質と培養条件を以下に述べる。本菌KD13株の性質および培養条件を以下に示す。テトラクロロエチエン、トリクロロエチレン、cis−1,2ジクロロエチレン、ビニルクロライド複合汚染地下水から単離した揮発性有機化合物分解菌KD13株を以下の組成の液体培地を用いて培養した。
【0035】
このとき、気相は二酸化炭素で置換して嫌気培養を行った。なお、培養は25℃のインキュベーター内で静置条件で行った。
K2HPO4 0.3%
KH2PO4 0.08%
MgSO4・7H2O 0.02%
L−アスパラギン一水和物 0.5%
L−システイン塩酸塩一水和物 0.05%
D−グルコース 1.0%
(pH6.8)
培養温度は25℃に限定されるものではなく、37℃以下であれば良い。また、気相を置換するガスは二酸化炭素に限定されるものではなく、窒素や水素を成分とするものでも良い。本菌KD13は微量に酸素が含まれる状況でも増殖可能であるため、絶対嫌気性菌ではないことから、気相を置換するガス中に微量の酸素が含まれていても増殖また被浄化物質の分解に影響は無い。
【0036】
培養後の本菌KD13株から抽出したゲノムDNAを鋳型として、PCRにより16SribosomalRNA遺伝子(以後16SrDNAとする)のうち、5’末端側約500bpの領域を増幅した。その後、増幅された塩基配列をシーケンシングし、16SrDNA部分塩基配列を得た。得られた16SrDNAの部分塩基配列を用いて国際塩基配列データベースに対し相同性検索を行ったところ、クロストリジウム・ベイエリンキイ(Clostridium beijerinckii)と16SrDNAの部分塩基配列の相同率が98%であることが判明した。また、本菌KD13株と相同性の高かったクロストリジウム・ブチリカム(Clostridium butyricum)とクロストリジウム・アセトブチリカム(Clostridium acetobutilicum)はアセトン・ブタノール発酵菌として報告されている。本菌KD13株を上記の液体培地で培養した後、ヘッドスペースのガス組成をガスクロマトグラフィー質量分析装置によって定性分析した結果、図1に示すクロマトグラムが得られた。
【0037】
また、培養後の上記の液体培地をガスクロマトグラフィー質量分析装置によって定性分析した結果、図2に示すクロマトグラムが得られた。図1に示す通り、ヘッドスペースにはエタノールのピーク1、アセトンのピーク2、イソプロピルアルコールのピーク3、ブタノールのピーク4といった主要なピークが検出され、図2に示す通り、液相にはそれらに加えて酪酸のピーク6、酢酸のピーク5といったピークが検出された。したがって、本菌KD13株は、汚染物質、すなわち被浄化物質であるテトラクロロエチレン、トリクロロエチレン、cis−1,2ジクロロエチレンといった揮発性有機化合物の分解菌であると同時に、糖類を資化してアセトンやブタノールといった代謝物を生成する特性を持つことから、本発明は本菌KD13株のみならず、いわゆるアセトン・ブタノール発酵菌群にも適用可能である。
【0038】
すなわち、これらの代謝物の生成濃度を測定することで、テトラクロロエチレン、トリクロロエチレン、cis−1,2ジクロロエチレンなどの被浄化物質を含む土壌、地下水、ガスまたは工場廃液に被浄化物質を分解可能なアセトン・ブタノール発酵菌と糖類を含む栄養源を同時に添加して被浄化物質の分解、無害化を図る工法において、まだ被浄化物質の分解に至っていない場合であっても、被浄化物質を分解可能なアセトン・ブタノール発酵菌の被浄化物質分解活性を評価することが可能となる。
【0039】
浄化対象の汚染物質であるテトラクロロエチレン、トリクロロエチレン、cis−1,2ジクロロエチレンなどの被浄化物質に新規クロストリジウム・スピーシーズKD13(clostridium sp.KD13 特許生物寄託センター受領番号:FERM AP−21115)とその栄養源を添加し、栄養源の代謝物濃度を測定することにより、被浄化物質の分解能力、分解活性の評価を行うことができ、測定した代謝物濃度を指標として、汚染物質である被浄化物質の分解能力、分解活性を推測することができる。
【0040】
テトラクロロエチレン、トリクロロエチレン、cis−1,2ジクロロエチレンなどの被浄化物質に汚染された現場に被浄化物質を分解可能なアセトン・ブタノール発酵菌を添加した直後でまだ菌数が低いために被浄化物質分解が起こらない状態や被浄化物質が完全に分解されてこれ以上分解が行われない状態、または被浄化物質に汚染された現場に被浄化物質を分解可能なアセトン・ブタノール発酵菌を添加したが被浄化物質と接触することができず、被浄化物質分解が起こらない状態であっても、被浄化物質を分解可能なアセトン・ブタノール発酵菌の被浄化物質分解活性を評価することが可能となる。
【0041】
また、アセトン・ブタノール発酵菌群の増殖状態は、糖類の代謝生成物でアセトン、ブタノール、エタノールの生成量が多い場合は定常期、酢酸、酪酸の生成量が多い場合は対数増殖期といった公知の知見があることから、本菌KD13株のような被浄化物質分解菌であり、かつアセトン・ブタノール発酵菌であるような微生物が糖類を資化することによって生成する代謝物濃度を測定することで、そのような微生物の増殖期も推測することができる。測定した代謝物濃度を指標として、汚染物質である被浄化物質の分解能力、分解活性を推測するものである。
【0042】
例えば、テトラクロロエチレン、トリクロロエチレン、cis−1,2ジクロロエチレンなどの被浄化物質を含む土壌に本菌KD13株のような被浄化物質分解菌であり、かつアセトン・ブタノール発酵菌であるような微生物と糖類を含む栄養源を添加した後、糖類由来の代謝物の定性、定量分析を行って、添加した微生物の増殖が定常期に入っていると考えられた場合には、更にさらに微生物を汚染土壌に添加するといった対策を講じることができる。また、糖類由来の代謝物の定性、定量分析により微生物の増殖が対数増殖期に入っていると考えられた場合には、微生物による被浄化物質の分解にはしばらく微生物の増殖を待つ必要があると判断することができる。
【0043】
また、本発明によれば本菌KD13株のような被浄化物質分解菌であり、かつアセトン・ブタノール発酵菌であるような微生物と糖類を含む栄養源を同時に添加して被浄化物質の分解を測るため、微生物の増殖速度を高め、結果的に汚染の浄化速度も高め、汚染土壌、汚染地下水などの有害物質で汚染された環境の環境浄化を図ることができる。また、菌数が増えることで、アセトン、ブタノール、エタノール、イソプロピルアルコール、酢酸、酪酸といった糖類の代謝生成物が被浄化物質よりも比較的高濃度で生成されるため、定量しやすくかつ、少量のサンプリング量で代謝物濃度を測定し、被浄化物質の分解活性、浄化能力を評価することができる。
【0044】
(実施の形態2)
KD13株を用いた土壌汚染浄化工法における分解活性の評価方法を以下に述べる。本菌KD13株を用いた土壌汚染浄化工法について図3を用いて説明する。
【0045】
図3に本菌KD13と糖類を含む栄養源を用いた土壌汚染浄化工法を示す。図3に示す通り、地表から遺漏したテトラクロロエチレン、トリクロロエチレン、cis−1,2ジクロロエチレンなどの汚染物質である被浄化物質8は地下水に達していない場合、土壌7の間隙中へ拡散される。また降雨などにより被浄化物質8のプルームは巨大化し、広域的な土壌汚染が発生する。
【0046】
このような場合、本菌KD13による効率的な汚染浄化を図るためには、汚染区域に複数の井戸9を掘削し、それぞれの井戸9に送液パイプ10と送液ポンプ11を用いて本菌KD13懸濁液12と栄養源13を注入する工法が有効である。各井戸9それぞれから糖類由来の代謝性生物を採取するために代謝性生物回収用のパイプ14の途中にコック15を装備するのが好ましい。
【0047】
ここで、複数の井戸9の上部に糖類由来の代謝性生物回収用のパイプ14を装備し、代謝性生物採取装置16へ結合させる。井戸9は例えば、ボーリング等で掘削するのが一般的であるが、この方法に限定されず、本菌KD13株が土壌中で糖類を資化して生成される代謝物が検出できる深さまで達していれば良い。また、送液パイプ10と代謝性生物回収用のパイプ14を設置できる大きさであれば良い。また、代謝性生物回収用のパイプ14は地表または地中で劣化しにくく、かつ中を通過する代謝性生物の吸着が少ない素材のものを用いるのが望ましい。
【0048】
各井戸9に本菌KD13株と糖類を含んだ栄養源を注入すると、本菌KD13株に含まれる酵素の働きにより糖類が資化されて、アセトンやブタノールといった代謝物が生成される。各井戸9それぞれに対して、この代謝物の生成濃度をガス検知管やガスクロマトグラフィーを用いて測定することで、注入した本菌KD13の活性を評価することが可能であるため、被浄化物質の分解活性を評価することが可能である。
【0049】
すなわち、これらの代謝物の生成濃度を計測することで、本菌KD13株と糖類を含む栄養源を添加したにもかかわらず、まだ被浄化物質の分解に至っていない状態、つまり被浄化物質に汚染された土壌に本菌KD13株と糖類を含む栄養源を添加した直後でまだ菌数が低いために被浄化物質分解が起こらない状態や被浄化物質が完全に分解されてこれ以上分解が行われない状態、または被浄化物質に汚染された現場に本菌KD13株を添加したが被浄化物質と接触することができずに被浄化物質分解が起こらない状態においても本菌KD13株の被浄化物質の分解活性、浄化能力を評価することが可能となる。
【0050】
また、本菌KD13株が糖類を資化することによって生成される代謝物について定性、定量分析を行うことで、本菌KD13株の汚染土壌中での増殖期も推測することができる。よって、例えば被浄化物質に汚染された土壌に本菌KD13株と糖類を含む栄養源を添加した後、糖類由来の代謝物の定性、定量分析を行って、添加した微生物の増殖が定常期に入っていると考えられた場合には、更にさらに本菌KD13株を汚染土壌に添加するといった対策を打つことができる。また、糖類由来の代謝物の分析により本菌KD13株の増殖が対数増殖期に入っていると考えられた場合には、本菌KD13株による被浄化物質の分解にはしばらく本菌KD13株の増殖を待つ必要があると判断することができる。
【0051】
ここで、分解活性を評価する指標となる代謝物は最も早く生成するもの、または最も生成量が多いものを選択するのが好ましい。その上、汚染土壌の浄化現場で他の要因により発生するガスと異なる種類のものが好ましい。また、代謝物濃度をガス検知管を用いて測定する場合は、各現場で他の要因により発生するガスが検知管の発色に干渉しない代謝物を選択するのが好ましい。
【0052】
上記の土壌汚染浄化工法における分解活性の評価方法は、被浄化物質が揮発性有機化合物である場合に限定されず、本菌KD13株やアセトン・ブタノール発酵菌群が分解可能な物質であれば良い。
【0053】
本発明の被浄化物質の分解活性評価により、浄化が全く開始されない場合や分解活性が低い場合、また浄化開始初期に比べて分解活性が低下した場合等には、栄養源13のみを送液ポンプ11を用いて井戸9に追加で添加して、高い栄養状態をつくることにより対応することができる。また、本菌KD13株の懸濁液12のみを送液ポンプ11を用いて井戸9に追加で添加して、高菌密度状態をつくることにより対応することができる。また、二酸化炭素、窒素または水素を送液ポンプ11を用いて井戸9から追加で添加して、土壌中の嫌気度を高めることができる。また、アルカリ側のpHに調整した栄養源13を送液ポンプ11を用いて井戸9に追加で添加することができる。一般的に、アセトン・ブタノール発酵菌群は酸性側のpH耐性が低いという公知の知見がある。また、クロストリジウム属の微生物は生育条件が悪い場合、芽胞を形成するという公知の知見がある。よって、土壌中で糖類を資化することによって生成した酢酸や酪酸といった酸性物質が土壌を酸性条件に変化させることにより芽胞となった本菌KD13株に対してはこの方法で対応するのが望ましい。このような事態が予想された場合は、分解活性を評価する指標となる代謝生成物として、酢酸または酪酸を選択するのが望ましい。また、浄化対象の土壌のpHが酸性の場合も分解活性を評価する指標となる代謝生成物として酢酸または酪酸を選択するのが望ましい。
【0054】
(実施の形態3)
KD13を用いた地下水汚染浄化工法における分解活性の評価方法を以下に述べる。
【0055】
本菌KD13株を用いた地下水汚染浄化工法について図4を用いて説明する。図4に本菌KD13と糖類を含む栄養源を同時に添加する地下水の浄化工法を示す。
【0056】
図4に示す通り、地表から遺漏したテトラクロロエチレン、トリクロロエチレン、cis−1,2ジクロロエチレンなどの汚染物質である被浄化物質8が土壌7を浸透し地下水17まで達した場合、地下水流れによって輸送され、広域的な地下水汚染が発生する。このような場合、本菌KD13による効率的な汚染浄化を図るためには、汚染区域の片端に注入井18を掘削し、送液パイプ10と送液ポンプ11を用いて本菌KD13懸濁液12と栄養源13を注入する工法が有効である。注入された本菌KD13と栄養源は地下水の流れに乗って輸送され、汚染プルーム内を通過することにより、本菌KD13による被浄化物質8の分解が開始される。
【0057】
汚染プルームを通過した本菌KD13と栄養源は注出井19により回収される。注入井18と注出井19の間の汚染プルーム上に複数の代謝物採取井戸20を掘削し、各井戸上部に設置した代謝性生物回収用のパイプ14を代謝物採取装置16へ結合させる。各井戸それぞれに対して代謝生成物を採取するために、代謝性生物回収用のパイプ14の途中にコック15を装備するのが好ましい。注入井18または注出井19は例えば、ボーリング等で掘削するのが一般的であるが、この方法に限定されず、本菌KD13株が地下水中で糖類を資化して生成される代謝物が検出できる深さまで達していれば良い。また、送液パイプ10と代謝性生物回収用のパイプ14を設置できる大きさであれば良い。また、代謝物回収パイプ代謝性生物回収用のパイプ14は地表または土壌、地下水中で劣化しにくく、かつ中を通過する代謝物の吸着が少ない素材のものを用いるのが望ましい。
【0058】
注入井18から本菌KD13株と糖類を含んだ栄養源を注入すると、本菌KD13株に含まれる酵素の働きにより糖類が資化されて、アセトンやブタノールといった代謝物が生成される。各代謝物採取井戸20それぞれから採取された代謝物の濃度を、ガス検知管やガスクロマトグラフィーを用いて測定することで、注入した本菌KD13の活性を評価することが可能であるため、各代謝物採取井戸20設置地点での被浄化物質の分解活性を評価することが可能となる。
【0059】
すなわち、これらの代謝物の生成濃度をモニタリングすることで、本菌KD13株と糖類を含む栄養源を添加したにもかかわらず、まだ被浄化物質の分解に至っていない状態、つまり被浄化物質に汚染された地下水に本菌KD13株と糖類を含む栄養源を添加した直後でまだ菌数が低いために被浄化物質分解が起こらない状態や被浄化物質が完全に分解されてこれ以上分解が行われない状態、または被浄化物質に汚染された現場に本菌KD13株を添加したが被浄化物質と接触することができず被浄化物質分解が起こらない状態においても本菌KD13株の被浄化物質の分解活性、浄化能力を評価することが可能となる。
【0060】
また、本菌KD13株が糖類を資化することによって生成される代謝物について定性、定量分析を行うことで、本菌KD13株の汚染地下水中での増殖期も推測することができる。よって、例えば被浄化物質に汚染された地下水に本菌KD13株と糖類を含む栄養源を添加した後、糖類由来の代謝物の定性、定量分析を行い、添加した微生物の増殖が定常期に入っていると考えられた場合には、更にさらに本菌KD13株を汚染地下水に添加するといった対策を講じることができる。また、糖類由来の代謝物の分析により本菌KD13株の増殖が対数増殖期に入っていると考えられた場合には、本菌KD13株による被浄化物質の分解にはしばらく本菌KD13株の増殖を待つ必要があると判断することができる。
【0061】
ここで、分解活性評価の指標となる代謝物は、最も早く生成するもの、または最も生成量が多いものを選択するのが好ましい。その上、汚染地下水の浄化現場で他の要因により発生するガスと異なる種類のものが好ましい。また、代謝物濃度をガス検知管を用いて測定する場合は、各現場で他の要因により発生するガスが検知管の発色に干渉しない代謝物を選択するのが好ましい。
【0062】
注入井18から添加された本菌KD13株は地下水内を吸着、脱着を繰り返しながら地下水流れの方向に輸送される。また、注入井18から添加された糖類を含む栄養源は移流、分散により地下水流れの方向に輸送されるため、本菌KD13株よりも輸送速度は速い。よって、浄化開始初期に微生物が地下水流れに乗ってどこまで輸送されているのかといった現象も、各ガス回収井戸のから回収される代謝物濃度を測定することにより推測することが可能である。ここで、評価する代謝物は最も早く生成するもの、または最も生成量が多いものを選択するのが好ましい。その上、各現場で他の要因により発生するガスと異なる種類のものが好ましい。また、代謝物濃度をガス検知管を用いて測定する場合は、各現場で他の要因により発生するガスが検知管の発色に干渉しない代謝物を選択するのが好ましい。
【0063】
上記の地下水汚染の浄化工法における分解活性の評価方法は、被浄化物質が揮発性有機化合物である場合に限定されず、本菌KD13株を含むアセトン・ブタノール発酵菌群が分解可能な物質であれば良い。
【0064】
本発明の被浄化物質の分解活性評価により、浄化が全く開始されない場合や分解活性が低い場合、また浄化開始初期に比べて分解活性が低下した場合等には、栄養源13のみを送液ポンプ11を用いて注入井18に追加で添加して高い栄養状態をつくることにより対応することができる。また、本菌のKD13懸濁液12のみを送液ポンプ11を用いて注入井18に追加で添加して高菌密度状態をつくることにより対応することができる。また、二酸化炭素、窒素または水素を送液ポンプ11を用いて注入井18から追加で注入して地下水の嫌気度を高めることにより対応することができる。
【0065】
また、水酸化ナトリウムや水酸化カリウム等を用いてアルカリ側のpHに調整した栄養源13を送液ポンプ11を用いて注入井18に追加で注入することにより対応することができる。本菌KD13株を含むアセトン・ブタノール発酵菌群は酸性側のpH耐性が低いという公知の知見がある。また、クロストリジウム属の微生物は生育条件が悪い場合、芽胞を形成するという公知の知見がある。よって、地下水中で糖類を資化することによって生成した酢酸や酪酸といった酸性物質が地下水を酸性条件に変化させることにより芽胞となった本菌KD13株のようなアセトン・ブタノール発酵菌群はこの方法で対応するのが望ましい。このような事態が予想された場合は、分解活性評価の指標となる代謝物は酢酸または酪酸を選択するのが望ましい。また、浄化対象の地下水のpHが酸性の場合も分解活性評価の指標となる代謝物は酢酸または酪酸を選択するのが望ましい。
【0066】
(実施の形態4)
KD13を用いた空気浄化における分解活性の評価方法を以下に述べる。本菌KD13株を用いたガスの浄化方法について図5を用いて説明する。
【0067】
図5に示すように、カラム21内には本菌KD13株を担持させた担体22が充填されている。カラム21は2ヶ所の開口部を有し、排出口23には吸引ポンプ24が装着され、流入口25から被浄化物質含有ガスを吸引することができる。流入口25から吸引されたガスは担体22の空隙を通過し排出口23まで到達する。排出口23の上部にはサンプリング口26が供えられており、そこから排出ガスを採取することができる。
【0068】
糖類を含む栄養源13から送液ポンプ11、送液パイプ10を通じて栄養源をカラム21下部に備えられた供給口27によりカラム21内部に散布し、担体22上の微生物の活性を高める。このとき、カラム内部に隅々まで液体の栄養源を行き渡らせるため、栄養源の液体を微粒子化して散布するのが望ましい。また、カラム21に充填する本菌KD13を付着させた担体22は浄化実施中にKD13が剥離しにくいものであれば良い。また、サンプリング口26はカラム21上部に限定されるわけではなく、カラム21のどの位置に設置しても良い。
【0069】
この方法で、ガスの浄化を行う場合、本菌KD13と糖類を含んだ栄養源によりカラム21内にアセトンやブタノールといった代謝物が生成される。サンプリング口26から採取されるガス中の代謝物濃度を測定することにより、カラム21内の担体22上に生息する本菌KD13の活性を評価することが可能である。この方法を用いると、本菌KD13による被浄化物質分解活性の低下を容易に検知することができる。ここで、分解活性の評価の指標となる代謝物は最も早く生成するもの、または最も生成量が多いもの、また気体上のものを選択するのが好ましい。その上、浄化対象のガス成分と異なる種類のものが好ましい。また、代謝物濃度をガス検知管を用いて測定する場合は、浄化対象のガス成分が検知管の発色に干渉しない代謝物を選択するのが好ましい。
【0070】
本発明の被浄化物質の分解活性評価方法により、被浄化物質の分解が全く開始されない場合や分解活性が低い場合、また浄化開始初期に比べて分解活性が低下した場合等には、栄養源13のみを供給口27よりカラム21内に追加で添加して栄養条件を高めることにより対応できる。また、二酸化炭素、窒素または水素を供給口27よりカラム21内に供給して、カラム21内の嫌気度を上げることにより対応できる。アセトン・ブタノール発酵菌群は酸性側のpH耐性が低いという公知の知見がある。
【0071】
また、クロストリジウム属の微生物は生育条件が悪い場合、芽胞を形成するという公知の知見がある。このような場合、アルカリ側のpHに調整した栄養源13を供給口27よりカラム21内に追加で添加することにより対応できる。カラム21内で糖類を資化することによって生成した酢酸や酪酸といった酸性物質がカラム21内を酸性条件に変化させることにより本菌KD13株が芽胞を形成した場合はこの方法で対応するのが望ましい。
【0072】
このような事態になった場合は、分解活性を評価する指標となる代謝生成物として酢酸または酪酸を選択するのが望ましい。また、浄化対象のガスのpHが酸性の場合も分解活性を評価する指標となる代謝生成物として酢酸または酪酸を選択するのが望ましい。
【産業上の利用可能性】
【0073】
新規クロストリジウム・スピーシーズKD13(clostridium sp.KD13)などの汚染物資の分解、浄化を行う菌などを、糖類を含む栄養源を共に添加し、栄養源の代謝物濃度を測定することで、汚染物質である被浄化物質の分解能力、分解の可能性を推測でき、被浄化物質の分解能力、分解活性を容易に評価できることとなり、本評価方法を用いて、土壌、地下水、ガスあるいは工場廃液などの汚染物質の浄化などにも適用できる。
【図面の簡単な説明】
【0074】
【図1】本発明の実施の形態1における、新規クロストリジウム・スピーシーズKD13培養後に発生するガスのクロマトグラフィーを示す図
【図2】本発明の実施の形態1における、新規クロストリジウム・スピーシーズKD13培養後に発生する溶存成分のクロマトグラフィーを示す図
【図3】本発明の実施の形態2における、新規クロストリジウム・スピーシーズKD13と糖類を含む栄養源を同時に添加する土壌汚染の浄化工法を示す図
【図4】本発明の実施の形態3における、新規クロストリジウム・スピーシーズKD13と糖類を含む栄養源を同時に添加する地下水汚染の浄化工法を示す図
【図5】本発明の実施の形態4における、新規クロストリジウム・スピーシーズKD13と糖類を含む栄養源を同時に添加する空気浄化工法を示す図
【符号の説明】
【0075】
1 エタノールのピーク
2 アセトンのピーク
3 イソプロピルアルコールのピーク
4 ブタノールのピーク
5 酢酸のピーク
6 酪酸のピーク
7 土壌
8 被浄化物質
9 井戸
10 送液パイプ
11 送液ポンプ
12 KD13懸濁液
13 栄養源
14 代謝性生物回収用のパイプ
15 コック
16 代謝物採取装置
17 地下水
18 注入井
19 注出井
20 代謝物採取井戸
21 カラム
22 担体
23 排出口
24 吸引ポンプ
25 流入口
26 サンプリング口
27 供給口
【特許請求の範囲】
【請求項1】
浄化対象の被浄化物質に新規クロストリジウム・スピーシーズKD13(clostridium sp.KD13 特許生物寄託センター受領番号:FERM AP−21115)とその栄養源を添加し、栄養源の代謝物濃度を測定することにより、前記被浄化物質の分解活性の評価を行うことを特徴とする被浄化物質分解活性評価方法。
【請求項2】
被浄化物質が土壌、地下水、ガスあるいは工場廃液に含まれることを特徴とする請求項1記載の被浄化物質分解活性評価方法。
【請求項3】
栄養源が糖類であることを特徴とする請求項1または2記載の被浄化物質分解活性評価方法。
【請求項4】
糖類がグルコースであることを特徴とする請求項1〜3のいずれかに記載の被浄化物質分解活性評価方法。
【請求項5】
糖類がスクロースであることを特徴とする請求項1〜3のいずれかに記載の被浄化物質分解活性評価方法。
【請求項6】
糖類がフルクトースであることを特徴とする請求項1〜3のいずれかに記載の被浄化物質分解活性評価方法。
【請求項7】
糖類がグルコース、スクロース、フルクトースのうちいずれか2種類以上であることを特徴とする請求項1〜3のいずれかに記載の被浄化物質分解活性評価方法。
【請求項8】
アセトン濃度を測定することを特徴とする請求項1〜3のいずれかに記載の被浄化物質分解活性評価方法。
【請求項9】
ブタノール濃度を測定することを特徴とする請求項1〜3のいずれかに記載の被浄化物質分解活性評価方法。
【請求項10】
エタノール濃度を測定することを特徴とする請求項1〜3のいずれかに記載の被浄化物質分解活性評価方法。
【請求項11】
イソプロピルアルコール濃度を測定することを特徴とする請求項1〜3のいずれかに記載の被浄化物質分解活性評価方法。
【請求項12】
酢酸濃度を測定することを特徴とする請求項1〜3のいずれかに記載の被浄化物質分解活性評価方法。
【請求項13】
酪酸濃度を測定することを特徴とする請求項1〜3のいずれかに記載の被浄化物質分解活性評価方法。
【請求項14】
アセトン、ブタノール、エタノール、イソプロピルアルコール、酢酸あるいは酪酸のうちいずれか2種類以上の濃度を測定することを特徴とする請求項1〜3のいずれかに記載の被浄化物質分解活性評価方法。
【請求項15】
新規クロストリジウム・スピーシーズKD13(clostridium sp.KD13 特許生物寄託センター受領番号:FERM AP−21115)に変えて、アセトン・ブタノール発酵菌としたことを特徴とする請求項1〜14のいずれかに記載の被浄化物質分解活性評価方法。
【請求項1】
浄化対象の被浄化物質に新規クロストリジウム・スピーシーズKD13(clostridium sp.KD13 特許生物寄託センター受領番号:FERM AP−21115)とその栄養源を添加し、栄養源の代謝物濃度を測定することにより、前記被浄化物質の分解活性の評価を行うことを特徴とする被浄化物質分解活性評価方法。
【請求項2】
被浄化物質が土壌、地下水、ガスあるいは工場廃液に含まれることを特徴とする請求項1記載の被浄化物質分解活性評価方法。
【請求項3】
栄養源が糖類であることを特徴とする請求項1または2記載の被浄化物質分解活性評価方法。
【請求項4】
糖類がグルコースであることを特徴とする請求項1〜3のいずれかに記載の被浄化物質分解活性評価方法。
【請求項5】
糖類がスクロースであることを特徴とする請求項1〜3のいずれかに記載の被浄化物質分解活性評価方法。
【請求項6】
糖類がフルクトースであることを特徴とする請求項1〜3のいずれかに記載の被浄化物質分解活性評価方法。
【請求項7】
糖類がグルコース、スクロース、フルクトースのうちいずれか2種類以上であることを特徴とする請求項1〜3のいずれかに記載の被浄化物質分解活性評価方法。
【請求項8】
アセトン濃度を測定することを特徴とする請求項1〜3のいずれかに記載の被浄化物質分解活性評価方法。
【請求項9】
ブタノール濃度を測定することを特徴とする請求項1〜3のいずれかに記載の被浄化物質分解活性評価方法。
【請求項10】
エタノール濃度を測定することを特徴とする請求項1〜3のいずれかに記載の被浄化物質分解活性評価方法。
【請求項11】
イソプロピルアルコール濃度を測定することを特徴とする請求項1〜3のいずれかに記載の被浄化物質分解活性評価方法。
【請求項12】
酢酸濃度を測定することを特徴とする請求項1〜3のいずれかに記載の被浄化物質分解活性評価方法。
【請求項13】
酪酸濃度を測定することを特徴とする請求項1〜3のいずれかに記載の被浄化物質分解活性評価方法。
【請求項14】
アセトン、ブタノール、エタノール、イソプロピルアルコール、酢酸あるいは酪酸のうちいずれか2種類以上の濃度を測定することを特徴とする請求項1〜3のいずれかに記載の被浄化物質分解活性評価方法。
【請求項15】
新規クロストリジウム・スピーシーズKD13(clostridium sp.KD13 特許生物寄託センター受領番号:FERM AP−21115)に変えて、アセトン・ブタノール発酵菌としたことを特徴とする請求項1〜14のいずれかに記載の被浄化物質分解活性評価方法。
【図1】


【図2】


【図3】


【図4】


【図5】




【図2】


【図3】


【図4】


【図5】


【公開番号】特開2008−161118(P2008−161118A)
【公開日】平成20年7月17日(2008.7.17)
【国際特許分類】
【出願番号】特願2006−354286(P2006−354286)
【出願日】平成18年12月28日(2006.12.28)
【出願人】(000005821)松下電器産業株式会社 (73,050)
【Fターム(参考)】
【公開日】平成20年7月17日(2008.7.17)
【国際特許分類】
【出願日】平成18年12月28日(2006.12.28)
【出願人】(000005821)松下電器産業株式会社 (73,050)
【Fターム(参考)】
[ Back to top ]

