被覆錠剤製剤
【課題】活性成分の表面特性が改質されている、マレイン酸ネラチニブ製剤を提供すること。
【解決手段】本発明は、マレイン酸ネラチニブを含む被覆錠剤製剤、およびそのような被覆錠剤を製造する改善された方法を提供する。
【解決手段】本発明は、マレイン酸ネラチニブを含む被覆錠剤製剤、およびそのような被覆錠剤を製造する改善された方法を提供する。
【発明の詳細な説明】
【技術分野】
【0001】
本出願は、2009年11月9日出願の米国特許出願第61/259,403号の特典を主張するものであり、その全体を参照により本明細書の一部とする。
【0002】
本発明は、流動層造粒または湿式造粒によって調製された被覆錠剤の形態で提供されるネラチニブの経口医薬製剤、およびこれらの被覆錠剤を製造する改善された方法に関する。
【背景技術】
【0003】
プロテインキナーゼは、細胞複製を開始する生化学的シグナルの伝達において重要である。プロテインキナーゼは、ATPからタンパク質上のチロシン、セリン、スレオニン、またはヒスチジンなどのアミノ酸残基へのリン酸基の転移を触媒する酵素である。これらのプロテインキナーゼの調節は、増殖および移動を含む多種多様な細胞事象の制御に必須である。特定のプロテインキナーゼは、癌[Traxler,P.M.、Exp.Opin.Ther.Patents、8、1599(1998);Bridges,A.J.、Emerging Drugs、3、279(1998)]、再狭窄[Mattsson,E.、Trends Cardiovas.Med.5、200(1995);Shaw、Trends Pharmacol.Sci.16、401(1995)]、アテローム性動脈硬化症[Raines,E.W.、Bioessays、18、271(1996)]、血管新生[Shawver,L.K.、Drug Discovery Today、2、50(1997);Folkman,J.、Nature Medicine、1、27(1995)]、および骨粗鬆症[Boyce、J.Clin.Invest.、90、1622(1992)]を含む有害な状態に関係があるとされている。受容体チロシンキナーゼの活性を阻害することのできる化合物は、それに限定されるものではないが、たとえば哺乳動物の非小細胞肺癌(NSCLC)、乳癌を含む癌、多発性嚢胞腎、結腸ポリープ、および卒中発作の治療に有用であることが知られている。特定のキナーゼ阻害剤は、ネラチニブとしても知られる、(E)−N−(4−(3−クロロ−4−(ピリジン−2−イルメトキシ)フェニルアミノ)−3−シアノ−7−エトキシキノリン−6−イル)−4−(ジメチルアミノ)ブタ−2−エナミドである。ネラチニブは、低いバイオアベイラビリティ、ならびに水およびアルコールの両方において低い溶解性を有する弱塩基である。
【0004】
マレイン酸ネラチニブ粒子は、非常に高い表面自由エネルギーを示す(凝集仕事=45.62mN/m)。この特性は、B.JanczukおよびT.Bialopiotrowicz、「Surface Free−Energy Components of Liquids and Low Energy Solids and Contact Angles」、J.Colloid Interf.Sci.127(1989)、189〜204頁;W.R.Good、「A Comparison of Contact Angle Interpretations」、J.Colloid Interf.Sci.44(1973)、63頁;M.D.Lechner(Ed.)、Landolt Bornstein、New Series、Vol.IV/16、「Surface Tension of Pure Liquids and Binary Liquid Mixture」、Springer Verlag、1998;ならびにJ.J.Jasper、「The Surface Tension of Pure Liquid Compounds」、J.Phys.Chem.Ref.Data、Vol.1、No.4、1972、859頁に記載のとおり、一次粒子を非常に凝集性のあるものにし、集合しやすくする。凝集性である結果として、マレイン酸ネラチニブ粉末は、特に組成物において高い比率を占めるとき、混合、流動、または流動化などの製薬操作に適していない。これらの制限のため、直接圧縮またはローラー圧密工程を首尾よく用いる、より強度なカプセル剤または錠剤を含むマレイン酸ネラチニブ製剤の開発は不可能であった。通常の湿式造粒法を用いる製剤は、化学的分解および安定性の問題を引き起こした。
【先行技術文献】
【特許文献】
【0005】
【特許文献1】米国特許出願第61/259,403号
【特許文献2】米国特許第6,002,008号
【特許文献3】米国特許第6,288,082号
【特許文献4】米国特許第6,297,258号
【特許文献5】米国特許第6,384,051号
【特許文献6】米国特許第7,399,865号
【非特許文献】
【0006】
【非特許文献1】Traxler,P.M.、Exp.Opin.Ther.Patents、8、1599(1998)
【非特許文献2】Bridges,A.J.、Emerging Drugs、3、279(1998)
【非特許文献3】Mattsson,E.、Trends Cardiovas.Med.5、200(1995)
【非特許文献4】Shaw、Trends Pharmacol.Sci.16、401(1995)
【非特許文献5】Raines,E.W.、Bioessays、18、271(1996)
【非特許文献6】Shawver,L.K.、Drug Discovery Today、2、50(1997)
【非特許文献7】Folkman,J.、Nature Medicine、1、27(1995)
【非特許文献8】Boyce、J.Clin.Invest.、90、1622(1992)
【非特許文献9】B.JanczukおよびT.Bialopiotrowicz、「Surface Free−Energy Components of Liquids and Low Energy Solids and Contact Angles」、J.Colloid Interf.Sci.127(1989)、189〜204頁
【非特許文献10】W.R.Good、「A Comparison of Contact Angle Interpretations」、J.Colloid Interf.Sci.44(1973)、63頁
【非特許文献11】M.D.Lechner(Ed.)、Landolt Bornstein、New Series、Vol.IV/16、「Surface Tension of Pure Liquids and Binary Liquid Mixture」、Springer Verlag、1998
【非特許文献12】J.J.Jasper、「The Surface Tension of Pure Liquid Compounds」、J.Phys.Chem.Ref.Data、Vol.1、No.4、1972、859頁
【非特許文献13】Handbook of Pharmaceutical Granulation Technology、1997、Dilip Parikh、Marcel Dekker,Inc.ISBN 0−8247−9882−1、338〜368頁
【発明の概要】
【発明が解決しようとする課題】
【0007】
マレイン酸ネラチニブ粒子の表面に、低表面エネルギー(たとえば約38mN/m)の物質、たとえばポビドンのようなポリマーを噴霧または他の方法で適用することによって、活性成分の表面特性が改質されている、マレイン酸ネラチニブ製剤を提供することが望ましい。
【課題を解決するための手段】
【0008】
本発明は、活性成分マレイン酸ネラチニブを含む、経口投与に適した薬学的に許容できる固体組成物を提供する。ある種の実施形態において、そのような固体組成物は、流動層造粒によって調製された被覆錠剤の形態で提供される。いくつかの実施形態において、本発明は、マレイン酸ネラチニブを含む単位投与形態を提供する。
【0009】
本発明は、顆粒内成分(a)マレイン酸ネラチニブ10〜70重量パーセント、(b)1種または複数の賦形剤15〜65重量パーセント、(c)1種または複数の崩壊剤0〜8または0.5〜8重量パーセント、および(d)1種または複数の流動促進剤0.2〜8重量パーセント、ある種の実施形態では0.2〜6重量パーセント、および(e)1種または複数の表面改質剤5〜15重量パーセントを含む顆粒を含む薬学的に許容できる組成物を提供する。この顆粒を、顆粒外成分(f)1種または複数の賦形剤1〜25または4〜25重量パーセント、(g)1種または複数の崩壊剤1〜8または0〜8重量パーセント、および(h)1種または複数の滑沢剤0.1〜3または0.5〜3重量パーセントと合わせ、次いで錠剤に圧縮するか、またはカプセルに乾燥充填する。
【0010】
本発明は、顆粒内成分(a)マレイン酸ネラチニブ10〜70重量パーセント、(b)マンニトールおよび微結晶性セルロース15〜65重量パーセント、(c)クロスポビドンまたはクロスカルメロースナトリウム0.5〜8重量パーセント、および(d)コロイド状二酸化ケイ素0.2〜8重量パーセント、ある種の実施形態では0.2〜6重量パーセント、および(e)ポビドン5〜15重量パーセントを含む顆粒を含む薬学的に許容できる組成物を提供する。この顆粒を、顆粒外成分(f)微結晶性セルロース1〜25または4〜25重量パーセント、(g)クロスポビドンまたはクロスカルメロースナトリウム0〜8または1〜8重量パーセント、および(h)ステアリン酸マグネシウム0.1〜3または0.5〜3重量パーセントと合わせ、次いで錠剤に圧縮するか、またはカプセルに乾燥充填する。
【0011】
本発明はまた、許容できる薬物動態特性を維持しながら、改善された加工特性を可能にする、上記および本明細書に記載の成分を含む、経口投与用の安定な薬学的に許容できるマレイン酸ネラチニブ製剤を調製する方法を提供する。
【図面の簡単な説明】
【0012】
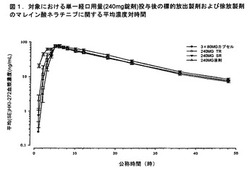
【図1】様々な溶解速度を有するネラチニブの即放性錠剤製剤の投与後のマレイン酸ネラチニブに関する平均薬物動態パラメータ対時間を要約する図である。TRは迅速に溶解する錠剤を指し、SRは比較的ゆっくりと溶解する。提示したデータは、対象における単一経口用量(240mg錠剤)投与後の血漿濃度レベルを示す。
【発明を実施するための形態】
【0013】
1.定義
本明細書では、化合物または薬学的に許容できる組成物の「有効量」は、所望の治療および/または予防効果を達成することができる。いくつかの実施形態において、「有効量」は、タンパク質チロシンキナーゼの調節に関連する障害または状態の1つまたは複数の症状を治療するのに十分な化合物、または化合物を含有する組成物の少なくとも最少量である。ある種の実施形態において、化合物、または化合物を含有する組成物の「有効量」は、異常なチロシンキナーゼ受容体に関連する疾患(たとえば、悪性および良性腫瘍増殖を含む癌)に関連する症状を治療するのに十分である。
【0014】
本明細書では、用語「対象」は、哺乳動物を意味し、ヒト対象、および家畜(たとえば、ウマ、イヌ、ネコなど)などの動物対象を含む。
【0015】
本明細書では、用語「罹患する(suffer)」または「罹患(suffering)」は、患者が診断を受けたか、または有することが疑われる1つまたは複数の状態を指す。
【0016】
本明細書では、用語「治療する(treat)」または「治療(treating)」は、障害もしくは状態、またはその障害もしくは状態の1つもしくは複数の症状を、部分的または完全に緩和する、抑制する、その発症を遅延する、予防する、改善する、および/または軽減することを指す。
【0017】
「治療活性剤」または「活性剤」は、予防的および治療的処置を含む療法(たとえば、ヒト療法、獣医学的療法)に有用である、生物学的に活性な物質を含む物質を指す。治療活性剤には、薬物化合物、ペプチド、タンパク質、炭水化物、単糖類、オリゴ糖、多糖類、核タンパク質、ムコタンパク質、リポタンパク質、合成ポリペプチドまたはタンパク質、タンパク質に結合した小分子、糖タンパク質、ステロイド、核酸、DNA、RNA、ヌクレオチド、ヌクレオシド、オリゴヌクレオチド、アンチセンスオリゴヌクレオチド、脂質、ホルモン、およびビタミンである有機分子が含まれる。治療活性剤には、疾患、状態、または障害を治療、予防、遅延、軽減、または改善する薬として用いられる任意の物質が含まれる。本発明の製剤において有用な治療活性剤には、オピオイド受容体アンタゴニスト化合物、オピオイド鎮痛薬化合物などがある。治療活性剤として有用な化合物のさらに詳細な説明は以下に記載する。治療活性剤には、たとえば第2化合物の効力を高めるか、またはその有害作用を低減することによって、第2化合物の作用または有効性を増大する化合物が含まれる。
【0018】
本明細書では、「単位投与形態」は、治療される対象に適した本発明の製剤の物理的に分離した単位を指す。しかし、本発明の組成物の1日当たりの総使用量は、正しい医学的判断の範囲内で担当医によって決定されることが理解されるであろう。任意の特定の対象または有機体に対する具体的な有効用量レベルは、治療される障害、およびその障害の重篤度、用いられる具体的な活性剤の活性、用いられる具体的な組成物、対象の年齢、体重、全身の健康状態、性別、および食事、投与時間、および用いられる具体的な活性剤の排出速度、処置期間、用いられる具体的な化合物(複数可)と組み合わせてまたは同時に使用される薬物および/または追加療法、ならびに医薬分野で周知の同様の要因を含む様々な要因によって決まることになる。
【0019】
乾式造粒(スラギングまたはローラー圧密)では、顆粒内材料を混合して、スラグまたはローラー圧密物を調製する。材料を粉砕し、顆粒外材料と混合し、その後、カプセルに充填するか、または錠剤に圧縮する。湿式造粒は、顆粒内材料を混合することを伴う。結合剤を用いてまたは用いずに、水とのブレンドを湿式造粒し(高剪断、低剪断造粒機を使用)、乾燥する(100℃までの温度を使用)。材料を粉砕し、顆粒外材料と混合し、その後、カプセルに充填するか、または錠剤に圧縮する。Handbook of Pharmaceutical Granulation Technology、1997、Dilip Parikh、Marcel Dekker,Inc.ISBN 0−8247−9882−1、338〜368頁を参照されたい。
【0020】
2.薬学的に許容できる組成物および製剤
ある種の実施形態において、本発明は、マレイン酸ネラチニブを含む、静脈内投与用の薬学的に許容できる組成物を提供する。ネラチニブおよび他の4−アミノ−3−シアノキノリン化合物は、米国特許第6,002,008号、第6,288,082号、第6,297,258号、第6,384,051号、および第7,399,865号に開示されている。ネラチニブは、下記の化学構造を有し、
【0021】
【化1】

遊離塩基として単離されるか、またはマレイン酸塩などの薬学的に許容できる塩として調製される。ネラチニブは、固有の低い水溶解性を有する弱塩基である。
【0022】
ある種の実施形態において、マレイン酸ネラチニブの薬学的に許容できる固体組成物は、流動層造粒によって調製された錠剤の形態で提供される。粒子の表面エネルギーを低減するために、活性成分、すなわちマレイン酸ネラチニブ、1種または複数の賦形剤、崩壊剤、および流動促進剤を含む顆粒内粒子状成分に、ポビドンなどの表面改質剤を噴霧するか、または他の方法で全体的もしくは部分的に被覆する。流動層工程を用いて、水が直ちに乾燥し、工程中にどのような多形変化または化学変化も起こらないように、粒子状活性成分の表面挙動を有効に改質する。活性成分の表面特性は、顆粒内粒子の表面に、低表面エネルギー(たとえば約38mN/m)を有するポリマー、たとえばポビドンを噴霧することによって改質される。表面特性の改質後、顆粒内粒子はもはや凝集性でないか、または著しく凝集性が低く、すべての製薬操作に容易に供される。表面改質顆粒内粒子はその後、典型的には、賦形剤、崩壊剤、および滑沢剤を典型的に含む顆粒外成分と合わせることによってさらに加工し、経口投与用の乾燥充填カプセルまたは錠剤にさらに加工する。表面改質顆粒内成分は、たとえば乾燥充填カプセルに関して、顆粒外成分と組み合わせることなく、投与形態を製造するために直接用いることもできる。
【0023】
ある種の実施形態において、マレイン酸ネラチニブの薬学的に許容できる固体組成物は、湿式造粒によって調製された錠剤の形態で提供される。流動促進剤および滑沢剤のレベルを増大することによって、臨床試験で用いられた湿式造粒マレイン酸ネラチニブ製剤と比較して、顆粒が凝集することなく流動する改善されたマレイン酸ネラチニブ製剤が提供された。流動促進剤を、予混合材料の流動性を改善するために、0.5%から2.0%に増加した。圧縮中に観察されたピッキングおよび付着の問題は、滑沢剤のレベルを0.5%から3.0%に、ある種の実施形態では0.5%から2.0%に増加することによって排除された。ある種の実施形態において、必要とされるステアリン酸マグネシウムなどの滑沢剤の量は、0.2%またはさらに0.1%程度の低量である。流動促進剤および滑沢剤の量の増大は、製剤に添加する賦形剤の量を相応に低減することによって相殺された。
【0024】
いくつかの実施形態において、活性成分は、ネラチニブ、特にマレイン酸ネラチニブなどの4−アミノ−3−シアノキノリン化合物、または薬学的に許容できるその塩を含む。4−アミノ−3−シアノキノリン化合物の適切な例は、米国特許第6,002,008号、第6,288,082号、第6,297,258号、第6,384,051号、および第7,399,865号に開示されている。一実施形態によれば、マレイン酸ネラチニブが活性成分である。活性成分は、製剤の総重量に対して、約10重量%から約70重量%を占め、20〜50重量%、および約35重量%、または41重量%が包含される。
【0025】
一実施形態によれば、顆粒外成分と共にさらに加工する前に、粒子状顆粒内成分に表面改質剤を噴霧する。適切な表面改質剤には、それに限定されるものではないが、たとえばポビドン、ゼラチン、デンプン、ヒドロキシプロピルメチルセルロース、およびヒドロキシプロピルセルロースが含まれる。一実施形態において、ポビドンが表面改質剤である。表面改質剤は、製剤の総重量に対して、約1重量%から約15重量%を占め、3〜12重量%、および約5〜10重量%が包含される。
【0026】
適切な賦形剤(「希釈剤」とも称される)は当分野で知られている。たとえば、適切な賦形剤には、それに限定されるものではないが、デンプン、デキストリン、スクロース、ソルビトール、サッカリンナトリウム、アセスルファームカリウム、キシリトール、アスパルテーム、マンニトール、デンプン、PVP(ポリビニルピロリドン)、低分子量HPC(ヒドロキシプロピルセルロース)、微結晶性セルロース(MCC)、低分子量HPMC(ヒドロキシプロピルメチルセルロース)、低分子量カルボキシメチルセルロース、エチルセルロース、第2リン酸カルシウム、ケイ酸化微結晶性セルロース、アルギン酸塩、ゼラチン、ポリエチレンオキシド、アカシア、デキストリン、スクロース、ケイ酸アルミニウムマグネシウム、およびポリメタクリラートが含まれる。賦形剤には、微結晶性セルロース、デンプン、ラクチトール、ラクトース、適切な無機カルシウム塩、スクロース、グルコース、マンニトール、ケイ酸、またはそれらの組合せからなる群から選択された作用剤が含まれる。賦形剤は、顆粒内成分として、製剤の総重量に対して、約15重量%から約65重量%を占める。一実施形態において、顆粒内賦形剤は、マンニトールと微結晶性セルロースの組合せである。賦形剤は、顆粒外成分として、製剤の総重量に対して、約4重量%から約25重量%を占める。一実施形態において、顆粒外賦形剤は、微結晶性セルロースである。
【0027】
適切な崩壊剤は当分野で知られており、それに限定されるものではないが、寒天、炭酸カルシウム、ジャガイモまたはタピオカデンプン、アルギン酸、ある種のケイ酸塩、炭酸ナトリウム、クロスポビドン(架橋PVP)、カルボキシメチルデンプンナトリウム(ナトリウムデンプングリコラート)、架橋カルボキシメチルセルロースナトリウム(クロスカルメロース)、アルファ化デンプン(starch1500)、微結晶性デンプン、水不溶性デンプン、ナトリウムデンプングリコラート、ポラクリリンカリウム、アルギン酸ナトリウム、カルボキシメチルセルロースカルシウム、ケイ酸アルミニウムマグネシウム(Veegum)、またはそれらの組合せが含まれる。いくつかの実施形態において、崩壊剤はクロスポビドンである。崩壊剤は、顆粒内成分として、製剤の総重量に対して、約0または0.5重量%から約8重量%を占め、0または0.5〜6重量%、および0または0.5〜5重量%が包含される。崩壊剤は、顆粒外成分として、製剤の総重量に対して、約0または1重量%から約8重量%を占める。
【0028】
流動促進剤は、製剤の顆粒内成分として用いられる。適切な流動促進剤には、非限定的に、コロイド状二酸化ケイ素、タルク、炭酸マグネシウム、ケイ酸カルシウム、ヒュームド二酸化ケイ素、およびそれらの組合せが含まれる。いくつかの実施形態において、流動促進剤はコロイド状二酸化ケイ素である。用いられる流動促進剤の量は、製剤の総重量に対して、0.2〜8重量パーセント、または0.2〜5重量パーセントであり、0.5〜2重量%が包含される。
【0029】
滑沢剤は、製剤の顆粒外成分として用いられる。適切な滑沢剤または流動促進剤には、たとえばステアリン酸塩、ステアリルフマル酸ナトリウム、マグネシウム塩、およびステアリン酸マグネシウムが含まれる。いくつかの実施形態において、滑沢剤はステアリン酸マグネシウムである。用いられる滑沢剤の量は、製剤の総重量に対して、0.2〜4重量パーセント、ある種の実施形態では0.5〜3重量%である。
【0030】
提供される組成物は、単位投与形態に製剤化することができる。そのような製剤は、当業者によく知られている。ある種の実施形態において、本発明は、錠剤として固体投与形態を含む製剤を提供する。他の実施形態において、本発明は、経口投与用の液剤を提供する。いくつかの実施形態において、単位投与形態は、ネラチニブ5、10、20、25、40、50mg、75mg、100mg、125mg、150mg、175mg、200mg、225mg、250mg、275mg、300mg、325mg、350mg、375mg、400mg、425mg、450mg、475mg、または500mg、525mg、550mg、575mg、600mg、625mg、650mg、675mg、700mg、725mg、750mg、775mg、800mg、825mg、850mg、875mg、900mg、925mg、950mg、975mg、1000mg、1025mg、1050mg、1075mg、1100mg、1125mg、1150mg、1175mg、1200mg、1225mg、1250mg、1275mg、1300mg、1325mg、1350mg、1375mg、1400mg、1425mg、1450mg、1475mg、1500mgを含有する。いくつかの実施形態において、単位投与形態は、ネラチニブ5mgから500mg(両端を含む)、または10mgから450mg(両端を含む)を含有する。いくつかの実施形態において、単位投与形態は、40mg、80mg、100mg、120mg、240mg、360mg、または480mgを含有する。いくつかの実施形態において、単位投与形態は、ネラチニブ500mg超を含有する。
【0031】
いくつかの実施形態において、本発明の化合物が、場合により1日2回から4回の分割用量、または持続放出形態で与えられる、日用量約0.5から約1000mg/体重kgで投与されるとき、良好な結果が得られる。総日用量は、約1から1000mg、好ましくは約2から500mgであることが見込まれる。内服に適した投与形態は、薬学的に許容できる固体または液体担体と緊密に混合した、活性化合物約0.5から1000mgを含む。この投与レジメンは、最適な治療反応を提供するために調節することができる。たとえば、1日数回の分割用量を投与することができ、または治療状況の緊急性による適応どおりに用量を比例的に低減することができる。
【0032】
癌の治療の場合、本発明の製剤は、他の抗腫瘍物質または放射線療法と組み合わせて投与できる。これらの他の物質または放射線治療は、本発明の化合物と同時または別に投与することができる。これらの併用療法は、相乗作用をもたらし、有効性を向上させる可能性がある。たとえば、本発明の化合物は、タキソールまたはビンブラスチンなどの有糸分裂阻害剤、シスプラチンまたはシクロホスファミドなどのアルキル化剤、5−フルオロウラシルまたはヒドロキシウレアなどの代謝拮抗剤、アドリアマイシンまたはブレオマイシンなどのDNAインターカレータ、エトポシドまたはカンプトテシンなどのトポイソメラーゼ阻害剤、アンギオスタチンなどの抗血管新生剤、およびタモキシフェンなどの抗エストロゲンと組み合わせて用いることができる。
【0033】
米国特許第6,297,258号にネラチニブおよび他の4−アミノ−3−シアノキノリン化合物に関して開示されている結果に基づいて、本発明の製剤は、新生物の治療、増殖抑制、または根絶に有用である、有意な有効性を有する有用な抗新生物剤である。具体的には、本発明の化合物は、erbB2(Her2)癌遺伝子によって産生される受容体タンパク質を発現する新生物の治療、増殖抑制、または根絶に有用である。
【0034】
3.併用製品および併用投与
ある種の実施形態において、本発明の組成物およびその製剤は、本明細書に記載の1つまたは複数の障害を治療するために単独で投与することができ、または本明細書に記載の1つまたは複数の障害を治療するのに有用な1種または複数の他の活性剤と組み合わせて(同時にまたは連続して)投与することができる。したがって、本発明の組成物またはその製剤は、1種または複数の活性剤と同時に、その前に、またはその後に投与することができる。
【0035】
ある種の実施形態において、本発明の組成物は、ネラチニブに加えて、ネラチニブでない1種または複数の他の活性剤を含む。いくつかの実施形態において、本発明の製剤は、別の抗癌化合物とネラチニブの両方を含む。
【0036】
本発明の併用組成物に存在する追加活性剤(複数可)の量は、典型的にその活性剤を唯一の治療剤として含む組成物において通常投与される量を超えない量となる。本発明のある種の実施形態において、追加活性剤の量は、その化合物を唯一の治療剤として含む組成物に通常存在する量の約50%から100%の範囲となる。
【0037】
4.本発明の組成物の使用およびキット
提供される組成物およびその製剤は、癌を含む状態の治療においても有用である。
【0038】
さらなる実施形態において、本発明の組成物およびその製剤の使用の獣医学的適用(たとえば、家畜、たとえばウマ、イヌ、ネコなどの治療)が提供される。したがって、ヒト対象に関して上で論じたものと類似した獣医学的適用における提供される製剤の使用が企図される。
【0039】
本発明の組成物およびその製剤は、併用療法において使用でき、すなわち、本発明の組成物またはその製剤は、1種または複数の他の所望の治療薬または医学的手技と同時に、その前に、またはその後に投与できることも理解される。併用レジメンに用いる特定の併用療法(治療薬または手技)には、所望の治療薬および/または手技と達成されるべき所望の治療効果との適合性が考慮される。用いられる療法は、同じ障害に関して所望の効果を達成してもよく(たとえば、製剤を同じ障害を治療するために用いられる別の化合物と同時に投与することができる)、または異なる効果(たとえば、任意の有害作用の制御)を達成してもよいことが理解される。本明細書において、特定の疾患または状態を治療または予防するために通常投与される追加治療化合物は、「治療される疾患または状態に適している」ものとして知られている。
【0040】
他の実施形態において、本発明の組成物、およびその製剤、および単位投与形態は、それに限定されるものではないが、癌の治療に有用な薬剤を含む薬剤の調製に有用である。
【0041】
本発明には、本発明の組成物およびその製剤、ならびに容器(たとえば、ホイルもしくはプラスチック製パッケージ、または他の適切な容器)を含む医薬パックおよび/またはキットがさらに包含される。そのようなキットには、使用説明書が追加的に提供されていてもよい。
【0042】
本明細書に記載の発明がより十分に理解されるように、以下の実施例を示す。これらの実施例は単に例示を目的とし、どのような方法においても本発明を限定するものとして解釈されないことが理解されるべきである。
【0043】
本発明のそれぞれの態様のすべての特徴は、必要な変更を加えて、他のすべての態様に適用される。
【実施例1】
【0044】
流動層湿式造粒法によるマレイン酸ネラチニブ製剤の被覆錠剤の調製
マレイン酸ネラチニブの薬学的に許容できる製剤を調製する:顆粒内成分(a)マレイン酸ネラチニブ10〜70重量パーセント、(b)マンニトールおよび微結晶性セルロース15〜65重量パーセント、(c)クロスポビドンまたはクロスカルメロースナトリウム0.5〜8重量パーセント、(d)コロイド状二酸化ケイ素0.2〜8重量パーセント、および(e)ポビドン5〜15重量パーセントを含む顆粒。この顆粒を、顆粒外成分(f)微結晶性セルロース4〜25重量パーセント、(g)クロスポビドン1〜8重量パーセント、および(h)ステアリン酸マグネシウム0.5〜3重量パーセントと合わせ、次いで錠剤に圧縮するか、またはカプセルに乾燥充填する。この材料の範囲およびいくつかの好ましい範囲を下記の表1に示す。
【0045】
【表1】

【0046】
以下の手順に従って製剤を調製した。
1.マレイン酸ネラチニブ、マンニトール、微結晶性セルロース、およびクロスポビドン、および二酸化ケイ素を混合した。任意の拡散または対流ミキサを用いることができる。
2.ポビドンを精製水に溶解した。
3.適切な流動層造粒機および乾燥器において、ステップ1の粉末ブレンドを流動化し、それにステップ2で調製した溶液を噴霧した。
4.顆粒を乾燥した。
5.顆粒を粉砕した。
6.微結晶性セルロースおよびクロスポビドンをステップ5の顆粒に添加し、混合した。
7.ステアリン酸マグネシウムをステップ6の混合物に添加し、混合した。
8.ステップ7のブレンドを所望の強度の錠剤に圧縮した。
9.所望の色のOpadry IIを用いて、圧縮錠剤にフィルムコートを適用した。
10.別法として、粉末ブレンドをカプセルのシェルに充填できる。
【実施例2】
【0047】
例示的なマレイン酸ネラチニブ製剤の単位投与形態
実施例1に記載の流動層法を用いて、表2に要約したとおり、例示的な製剤からマレイン酸ネラチニブの種々の単位投与を調製した。
【0048】
【表2】

【実施例3】
【0049】
流動層において顆粒内成分にポビドンを噴霧することによって製造された標的放出マレイン酸ネラチニブの被覆錠剤
例示的な標的放出(TR)マレイン酸ネラチニブ製剤を表3に要約する。
【0050】
【表3】

【実施例4】
【0051】
流動層において顆粒内成分にポビドンを噴霧することによって製造された徐放マレイン酸ネラチニブの被覆錠剤
例示的な徐放(SR)マレイン酸ネラチニブ製剤を表4Aおよび4Bに要約する。
【0052】
【表4】

【0053】
【表5】

【実施例5】
【0054】
薬物放出データ
表5に要約したとおり、実施例3および4のマレイン酸ネラチニブ製剤に関して、薬物放出データを要約する。錠剤の溶解は、USP溶解装置2において、37±0.5℃、パドル速度50±1rpmで、溶解媒質として0.1N HCl900mlを用いて行った。一定の時点でサンプルを採り、UV分光計によって266nmで分析した。
【0055】
【表6】

【0056】
対象における単一経口用量(240mg錠剤)投与後の標的放出製剤および徐放製剤のマレイン酸ネラチニブに関する平均薬物動態パラメータを評価し、表6に要約した。標的放出製剤および徐放製剤の平均濃度対時間プロファイルを図1に要約する。
【0057】
【表7】

【技術分野】
【0001】
本出願は、2009年11月9日出願の米国特許出願第61/259,403号の特典を主張するものであり、その全体を参照により本明細書の一部とする。
【0002】
本発明は、流動層造粒または湿式造粒によって調製された被覆錠剤の形態で提供されるネラチニブの経口医薬製剤、およびこれらの被覆錠剤を製造する改善された方法に関する。
【背景技術】
【0003】
プロテインキナーゼは、細胞複製を開始する生化学的シグナルの伝達において重要である。プロテインキナーゼは、ATPからタンパク質上のチロシン、セリン、スレオニン、またはヒスチジンなどのアミノ酸残基へのリン酸基の転移を触媒する酵素である。これらのプロテインキナーゼの調節は、増殖および移動を含む多種多様な細胞事象の制御に必須である。特定のプロテインキナーゼは、癌[Traxler,P.M.、Exp.Opin.Ther.Patents、8、1599(1998);Bridges,A.J.、Emerging Drugs、3、279(1998)]、再狭窄[Mattsson,E.、Trends Cardiovas.Med.5、200(1995);Shaw、Trends Pharmacol.Sci.16、401(1995)]、アテローム性動脈硬化症[Raines,E.W.、Bioessays、18、271(1996)]、血管新生[Shawver,L.K.、Drug Discovery Today、2、50(1997);Folkman,J.、Nature Medicine、1、27(1995)]、および骨粗鬆症[Boyce、J.Clin.Invest.、90、1622(1992)]を含む有害な状態に関係があるとされている。受容体チロシンキナーゼの活性を阻害することのできる化合物は、それに限定されるものではないが、たとえば哺乳動物の非小細胞肺癌(NSCLC)、乳癌を含む癌、多発性嚢胞腎、結腸ポリープ、および卒中発作の治療に有用であることが知られている。特定のキナーゼ阻害剤は、ネラチニブとしても知られる、(E)−N−(4−(3−クロロ−4−(ピリジン−2−イルメトキシ)フェニルアミノ)−3−シアノ−7−エトキシキノリン−6−イル)−4−(ジメチルアミノ)ブタ−2−エナミドである。ネラチニブは、低いバイオアベイラビリティ、ならびに水およびアルコールの両方において低い溶解性を有する弱塩基である。
【0004】
マレイン酸ネラチニブ粒子は、非常に高い表面自由エネルギーを示す(凝集仕事=45.62mN/m)。この特性は、B.JanczukおよびT.Bialopiotrowicz、「Surface Free−Energy Components of Liquids and Low Energy Solids and Contact Angles」、J.Colloid Interf.Sci.127(1989)、189〜204頁;W.R.Good、「A Comparison of Contact Angle Interpretations」、J.Colloid Interf.Sci.44(1973)、63頁;M.D.Lechner(Ed.)、Landolt Bornstein、New Series、Vol.IV/16、「Surface Tension of Pure Liquids and Binary Liquid Mixture」、Springer Verlag、1998;ならびにJ.J.Jasper、「The Surface Tension of Pure Liquid Compounds」、J.Phys.Chem.Ref.Data、Vol.1、No.4、1972、859頁に記載のとおり、一次粒子を非常に凝集性のあるものにし、集合しやすくする。凝集性である結果として、マレイン酸ネラチニブ粉末は、特に組成物において高い比率を占めるとき、混合、流動、または流動化などの製薬操作に適していない。これらの制限のため、直接圧縮またはローラー圧密工程を首尾よく用いる、より強度なカプセル剤または錠剤を含むマレイン酸ネラチニブ製剤の開発は不可能であった。通常の湿式造粒法を用いる製剤は、化学的分解および安定性の問題を引き起こした。
【先行技術文献】
【特許文献】
【0005】
【特許文献1】米国特許出願第61/259,403号
【特許文献2】米国特許第6,002,008号
【特許文献3】米国特許第6,288,082号
【特許文献4】米国特許第6,297,258号
【特許文献5】米国特許第6,384,051号
【特許文献6】米国特許第7,399,865号
【非特許文献】
【0006】
【非特許文献1】Traxler,P.M.、Exp.Opin.Ther.Patents、8、1599(1998)
【非特許文献2】Bridges,A.J.、Emerging Drugs、3、279(1998)
【非特許文献3】Mattsson,E.、Trends Cardiovas.Med.5、200(1995)
【非特許文献4】Shaw、Trends Pharmacol.Sci.16、401(1995)
【非特許文献5】Raines,E.W.、Bioessays、18、271(1996)
【非特許文献6】Shawver,L.K.、Drug Discovery Today、2、50(1997)
【非特許文献7】Folkman,J.、Nature Medicine、1、27(1995)
【非特許文献8】Boyce、J.Clin.Invest.、90、1622(1992)
【非特許文献9】B.JanczukおよびT.Bialopiotrowicz、「Surface Free−Energy Components of Liquids and Low Energy Solids and Contact Angles」、J.Colloid Interf.Sci.127(1989)、189〜204頁
【非特許文献10】W.R.Good、「A Comparison of Contact Angle Interpretations」、J.Colloid Interf.Sci.44(1973)、63頁
【非特許文献11】M.D.Lechner(Ed.)、Landolt Bornstein、New Series、Vol.IV/16、「Surface Tension of Pure Liquids and Binary Liquid Mixture」、Springer Verlag、1998
【非特許文献12】J.J.Jasper、「The Surface Tension of Pure Liquid Compounds」、J.Phys.Chem.Ref.Data、Vol.1、No.4、1972、859頁
【非特許文献13】Handbook of Pharmaceutical Granulation Technology、1997、Dilip Parikh、Marcel Dekker,Inc.ISBN 0−8247−9882−1、338〜368頁
【発明の概要】
【発明が解決しようとする課題】
【0007】
マレイン酸ネラチニブ粒子の表面に、低表面エネルギー(たとえば約38mN/m)の物質、たとえばポビドンのようなポリマーを噴霧または他の方法で適用することによって、活性成分の表面特性が改質されている、マレイン酸ネラチニブ製剤を提供することが望ましい。
【課題を解決するための手段】
【0008】
本発明は、活性成分マレイン酸ネラチニブを含む、経口投与に適した薬学的に許容できる固体組成物を提供する。ある種の実施形態において、そのような固体組成物は、流動層造粒によって調製された被覆錠剤の形態で提供される。いくつかの実施形態において、本発明は、マレイン酸ネラチニブを含む単位投与形態を提供する。
【0009】
本発明は、顆粒内成分(a)マレイン酸ネラチニブ10〜70重量パーセント、(b)1種または複数の賦形剤15〜65重量パーセント、(c)1種または複数の崩壊剤0〜8または0.5〜8重量パーセント、および(d)1種または複数の流動促進剤0.2〜8重量パーセント、ある種の実施形態では0.2〜6重量パーセント、および(e)1種または複数の表面改質剤5〜15重量パーセントを含む顆粒を含む薬学的に許容できる組成物を提供する。この顆粒を、顆粒外成分(f)1種または複数の賦形剤1〜25または4〜25重量パーセント、(g)1種または複数の崩壊剤1〜8または0〜8重量パーセント、および(h)1種または複数の滑沢剤0.1〜3または0.5〜3重量パーセントと合わせ、次いで錠剤に圧縮するか、またはカプセルに乾燥充填する。
【0010】
本発明は、顆粒内成分(a)マレイン酸ネラチニブ10〜70重量パーセント、(b)マンニトールおよび微結晶性セルロース15〜65重量パーセント、(c)クロスポビドンまたはクロスカルメロースナトリウム0.5〜8重量パーセント、および(d)コロイド状二酸化ケイ素0.2〜8重量パーセント、ある種の実施形態では0.2〜6重量パーセント、および(e)ポビドン5〜15重量パーセントを含む顆粒を含む薬学的に許容できる組成物を提供する。この顆粒を、顆粒外成分(f)微結晶性セルロース1〜25または4〜25重量パーセント、(g)クロスポビドンまたはクロスカルメロースナトリウム0〜8または1〜8重量パーセント、および(h)ステアリン酸マグネシウム0.1〜3または0.5〜3重量パーセントと合わせ、次いで錠剤に圧縮するか、またはカプセルに乾燥充填する。
【0011】
本発明はまた、許容できる薬物動態特性を維持しながら、改善された加工特性を可能にする、上記および本明細書に記載の成分を含む、経口投与用の安定な薬学的に許容できるマレイン酸ネラチニブ製剤を調製する方法を提供する。
【図面の簡単な説明】
【0012】
【図1】様々な溶解速度を有するネラチニブの即放性錠剤製剤の投与後のマレイン酸ネラチニブに関する平均薬物動態パラメータ対時間を要約する図である。TRは迅速に溶解する錠剤を指し、SRは比較的ゆっくりと溶解する。提示したデータは、対象における単一経口用量(240mg錠剤)投与後の血漿濃度レベルを示す。
【発明を実施するための形態】
【0013】
1.定義
本明細書では、化合物または薬学的に許容できる組成物の「有効量」は、所望の治療および/または予防効果を達成することができる。いくつかの実施形態において、「有効量」は、タンパク質チロシンキナーゼの調節に関連する障害または状態の1つまたは複数の症状を治療するのに十分な化合物、または化合物を含有する組成物の少なくとも最少量である。ある種の実施形態において、化合物、または化合物を含有する組成物の「有効量」は、異常なチロシンキナーゼ受容体に関連する疾患(たとえば、悪性および良性腫瘍増殖を含む癌)に関連する症状を治療するのに十分である。
【0014】
本明細書では、用語「対象」は、哺乳動物を意味し、ヒト対象、および家畜(たとえば、ウマ、イヌ、ネコなど)などの動物対象を含む。
【0015】
本明細書では、用語「罹患する(suffer)」または「罹患(suffering)」は、患者が診断を受けたか、または有することが疑われる1つまたは複数の状態を指す。
【0016】
本明細書では、用語「治療する(treat)」または「治療(treating)」は、障害もしくは状態、またはその障害もしくは状態の1つもしくは複数の症状を、部分的または完全に緩和する、抑制する、その発症を遅延する、予防する、改善する、および/または軽減することを指す。
【0017】
「治療活性剤」または「活性剤」は、予防的および治療的処置を含む療法(たとえば、ヒト療法、獣医学的療法)に有用である、生物学的に活性な物質を含む物質を指す。治療活性剤には、薬物化合物、ペプチド、タンパク質、炭水化物、単糖類、オリゴ糖、多糖類、核タンパク質、ムコタンパク質、リポタンパク質、合成ポリペプチドまたはタンパク質、タンパク質に結合した小分子、糖タンパク質、ステロイド、核酸、DNA、RNA、ヌクレオチド、ヌクレオシド、オリゴヌクレオチド、アンチセンスオリゴヌクレオチド、脂質、ホルモン、およびビタミンである有機分子が含まれる。治療活性剤には、疾患、状態、または障害を治療、予防、遅延、軽減、または改善する薬として用いられる任意の物質が含まれる。本発明の製剤において有用な治療活性剤には、オピオイド受容体アンタゴニスト化合物、オピオイド鎮痛薬化合物などがある。治療活性剤として有用な化合物のさらに詳細な説明は以下に記載する。治療活性剤には、たとえば第2化合物の効力を高めるか、またはその有害作用を低減することによって、第2化合物の作用または有効性を増大する化合物が含まれる。
【0018】
本明細書では、「単位投与形態」は、治療される対象に適した本発明の製剤の物理的に分離した単位を指す。しかし、本発明の組成物の1日当たりの総使用量は、正しい医学的判断の範囲内で担当医によって決定されることが理解されるであろう。任意の特定の対象または有機体に対する具体的な有効用量レベルは、治療される障害、およびその障害の重篤度、用いられる具体的な活性剤の活性、用いられる具体的な組成物、対象の年齢、体重、全身の健康状態、性別、および食事、投与時間、および用いられる具体的な活性剤の排出速度、処置期間、用いられる具体的な化合物(複数可)と組み合わせてまたは同時に使用される薬物および/または追加療法、ならびに医薬分野で周知の同様の要因を含む様々な要因によって決まることになる。
【0019】
乾式造粒(スラギングまたはローラー圧密)では、顆粒内材料を混合して、スラグまたはローラー圧密物を調製する。材料を粉砕し、顆粒外材料と混合し、その後、カプセルに充填するか、または錠剤に圧縮する。湿式造粒は、顆粒内材料を混合することを伴う。結合剤を用いてまたは用いずに、水とのブレンドを湿式造粒し(高剪断、低剪断造粒機を使用)、乾燥する(100℃までの温度を使用)。材料を粉砕し、顆粒外材料と混合し、その後、カプセルに充填するか、または錠剤に圧縮する。Handbook of Pharmaceutical Granulation Technology、1997、Dilip Parikh、Marcel Dekker,Inc.ISBN 0−8247−9882−1、338〜368頁を参照されたい。
【0020】
2.薬学的に許容できる組成物および製剤
ある種の実施形態において、本発明は、マレイン酸ネラチニブを含む、静脈内投与用の薬学的に許容できる組成物を提供する。ネラチニブおよび他の4−アミノ−3−シアノキノリン化合物は、米国特許第6,002,008号、第6,288,082号、第6,297,258号、第6,384,051号、および第7,399,865号に開示されている。ネラチニブは、下記の化学構造を有し、
【0021】
【化1】

遊離塩基として単離されるか、またはマレイン酸塩などの薬学的に許容できる塩として調製される。ネラチニブは、固有の低い水溶解性を有する弱塩基である。
【0022】
ある種の実施形態において、マレイン酸ネラチニブの薬学的に許容できる固体組成物は、流動層造粒によって調製された錠剤の形態で提供される。粒子の表面エネルギーを低減するために、活性成分、すなわちマレイン酸ネラチニブ、1種または複数の賦形剤、崩壊剤、および流動促進剤を含む顆粒内粒子状成分に、ポビドンなどの表面改質剤を噴霧するか、または他の方法で全体的もしくは部分的に被覆する。流動層工程を用いて、水が直ちに乾燥し、工程中にどのような多形変化または化学変化も起こらないように、粒子状活性成分の表面挙動を有効に改質する。活性成分の表面特性は、顆粒内粒子の表面に、低表面エネルギー(たとえば約38mN/m)を有するポリマー、たとえばポビドンを噴霧することによって改質される。表面特性の改質後、顆粒内粒子はもはや凝集性でないか、または著しく凝集性が低く、すべての製薬操作に容易に供される。表面改質顆粒内粒子はその後、典型的には、賦形剤、崩壊剤、および滑沢剤を典型的に含む顆粒外成分と合わせることによってさらに加工し、経口投与用の乾燥充填カプセルまたは錠剤にさらに加工する。表面改質顆粒内成分は、たとえば乾燥充填カプセルに関して、顆粒外成分と組み合わせることなく、投与形態を製造するために直接用いることもできる。
【0023】
ある種の実施形態において、マレイン酸ネラチニブの薬学的に許容できる固体組成物は、湿式造粒によって調製された錠剤の形態で提供される。流動促進剤および滑沢剤のレベルを増大することによって、臨床試験で用いられた湿式造粒マレイン酸ネラチニブ製剤と比較して、顆粒が凝集することなく流動する改善されたマレイン酸ネラチニブ製剤が提供された。流動促進剤を、予混合材料の流動性を改善するために、0.5%から2.0%に増加した。圧縮中に観察されたピッキングおよび付着の問題は、滑沢剤のレベルを0.5%から3.0%に、ある種の実施形態では0.5%から2.0%に増加することによって排除された。ある種の実施形態において、必要とされるステアリン酸マグネシウムなどの滑沢剤の量は、0.2%またはさらに0.1%程度の低量である。流動促進剤および滑沢剤の量の増大は、製剤に添加する賦形剤の量を相応に低減することによって相殺された。
【0024】
いくつかの実施形態において、活性成分は、ネラチニブ、特にマレイン酸ネラチニブなどの4−アミノ−3−シアノキノリン化合物、または薬学的に許容できるその塩を含む。4−アミノ−3−シアノキノリン化合物の適切な例は、米国特許第6,002,008号、第6,288,082号、第6,297,258号、第6,384,051号、および第7,399,865号に開示されている。一実施形態によれば、マレイン酸ネラチニブが活性成分である。活性成分は、製剤の総重量に対して、約10重量%から約70重量%を占め、20〜50重量%、および約35重量%、または41重量%が包含される。
【0025】
一実施形態によれば、顆粒外成分と共にさらに加工する前に、粒子状顆粒内成分に表面改質剤を噴霧する。適切な表面改質剤には、それに限定されるものではないが、たとえばポビドン、ゼラチン、デンプン、ヒドロキシプロピルメチルセルロース、およびヒドロキシプロピルセルロースが含まれる。一実施形態において、ポビドンが表面改質剤である。表面改質剤は、製剤の総重量に対して、約1重量%から約15重量%を占め、3〜12重量%、および約5〜10重量%が包含される。
【0026】
適切な賦形剤(「希釈剤」とも称される)は当分野で知られている。たとえば、適切な賦形剤には、それに限定されるものではないが、デンプン、デキストリン、スクロース、ソルビトール、サッカリンナトリウム、アセスルファームカリウム、キシリトール、アスパルテーム、マンニトール、デンプン、PVP(ポリビニルピロリドン)、低分子量HPC(ヒドロキシプロピルセルロース)、微結晶性セルロース(MCC)、低分子量HPMC(ヒドロキシプロピルメチルセルロース)、低分子量カルボキシメチルセルロース、エチルセルロース、第2リン酸カルシウム、ケイ酸化微結晶性セルロース、アルギン酸塩、ゼラチン、ポリエチレンオキシド、アカシア、デキストリン、スクロース、ケイ酸アルミニウムマグネシウム、およびポリメタクリラートが含まれる。賦形剤には、微結晶性セルロース、デンプン、ラクチトール、ラクトース、適切な無機カルシウム塩、スクロース、グルコース、マンニトール、ケイ酸、またはそれらの組合せからなる群から選択された作用剤が含まれる。賦形剤は、顆粒内成分として、製剤の総重量に対して、約15重量%から約65重量%を占める。一実施形態において、顆粒内賦形剤は、マンニトールと微結晶性セルロースの組合せである。賦形剤は、顆粒外成分として、製剤の総重量に対して、約4重量%から約25重量%を占める。一実施形態において、顆粒外賦形剤は、微結晶性セルロースである。
【0027】
適切な崩壊剤は当分野で知られており、それに限定されるものではないが、寒天、炭酸カルシウム、ジャガイモまたはタピオカデンプン、アルギン酸、ある種のケイ酸塩、炭酸ナトリウム、クロスポビドン(架橋PVP)、カルボキシメチルデンプンナトリウム(ナトリウムデンプングリコラート)、架橋カルボキシメチルセルロースナトリウム(クロスカルメロース)、アルファ化デンプン(starch1500)、微結晶性デンプン、水不溶性デンプン、ナトリウムデンプングリコラート、ポラクリリンカリウム、アルギン酸ナトリウム、カルボキシメチルセルロースカルシウム、ケイ酸アルミニウムマグネシウム(Veegum)、またはそれらの組合せが含まれる。いくつかの実施形態において、崩壊剤はクロスポビドンである。崩壊剤は、顆粒内成分として、製剤の総重量に対して、約0または0.5重量%から約8重量%を占め、0または0.5〜6重量%、および0または0.5〜5重量%が包含される。崩壊剤は、顆粒外成分として、製剤の総重量に対して、約0または1重量%から約8重量%を占める。
【0028】
流動促進剤は、製剤の顆粒内成分として用いられる。適切な流動促進剤には、非限定的に、コロイド状二酸化ケイ素、タルク、炭酸マグネシウム、ケイ酸カルシウム、ヒュームド二酸化ケイ素、およびそれらの組合せが含まれる。いくつかの実施形態において、流動促進剤はコロイド状二酸化ケイ素である。用いられる流動促進剤の量は、製剤の総重量に対して、0.2〜8重量パーセント、または0.2〜5重量パーセントであり、0.5〜2重量%が包含される。
【0029】
滑沢剤は、製剤の顆粒外成分として用いられる。適切な滑沢剤または流動促進剤には、たとえばステアリン酸塩、ステアリルフマル酸ナトリウム、マグネシウム塩、およびステアリン酸マグネシウムが含まれる。いくつかの実施形態において、滑沢剤はステアリン酸マグネシウムである。用いられる滑沢剤の量は、製剤の総重量に対して、0.2〜4重量パーセント、ある種の実施形態では0.5〜3重量%である。
【0030】
提供される組成物は、単位投与形態に製剤化することができる。そのような製剤は、当業者によく知られている。ある種の実施形態において、本発明は、錠剤として固体投与形態を含む製剤を提供する。他の実施形態において、本発明は、経口投与用の液剤を提供する。いくつかの実施形態において、単位投与形態は、ネラチニブ5、10、20、25、40、50mg、75mg、100mg、125mg、150mg、175mg、200mg、225mg、250mg、275mg、300mg、325mg、350mg、375mg、400mg、425mg、450mg、475mg、または500mg、525mg、550mg、575mg、600mg、625mg、650mg、675mg、700mg、725mg、750mg、775mg、800mg、825mg、850mg、875mg、900mg、925mg、950mg、975mg、1000mg、1025mg、1050mg、1075mg、1100mg、1125mg、1150mg、1175mg、1200mg、1225mg、1250mg、1275mg、1300mg、1325mg、1350mg、1375mg、1400mg、1425mg、1450mg、1475mg、1500mgを含有する。いくつかの実施形態において、単位投与形態は、ネラチニブ5mgから500mg(両端を含む)、または10mgから450mg(両端を含む)を含有する。いくつかの実施形態において、単位投与形態は、40mg、80mg、100mg、120mg、240mg、360mg、または480mgを含有する。いくつかの実施形態において、単位投与形態は、ネラチニブ500mg超を含有する。
【0031】
いくつかの実施形態において、本発明の化合物が、場合により1日2回から4回の分割用量、または持続放出形態で与えられる、日用量約0.5から約1000mg/体重kgで投与されるとき、良好な結果が得られる。総日用量は、約1から1000mg、好ましくは約2から500mgであることが見込まれる。内服に適した投与形態は、薬学的に許容できる固体または液体担体と緊密に混合した、活性化合物約0.5から1000mgを含む。この投与レジメンは、最適な治療反応を提供するために調節することができる。たとえば、1日数回の分割用量を投与することができ、または治療状況の緊急性による適応どおりに用量を比例的に低減することができる。
【0032】
癌の治療の場合、本発明の製剤は、他の抗腫瘍物質または放射線療法と組み合わせて投与できる。これらの他の物質または放射線治療は、本発明の化合物と同時または別に投与することができる。これらの併用療法は、相乗作用をもたらし、有効性を向上させる可能性がある。たとえば、本発明の化合物は、タキソールまたはビンブラスチンなどの有糸分裂阻害剤、シスプラチンまたはシクロホスファミドなどのアルキル化剤、5−フルオロウラシルまたはヒドロキシウレアなどの代謝拮抗剤、アドリアマイシンまたはブレオマイシンなどのDNAインターカレータ、エトポシドまたはカンプトテシンなどのトポイソメラーゼ阻害剤、アンギオスタチンなどの抗血管新生剤、およびタモキシフェンなどの抗エストロゲンと組み合わせて用いることができる。
【0033】
米国特許第6,297,258号にネラチニブおよび他の4−アミノ−3−シアノキノリン化合物に関して開示されている結果に基づいて、本発明の製剤は、新生物の治療、増殖抑制、または根絶に有用である、有意な有効性を有する有用な抗新生物剤である。具体的には、本発明の化合物は、erbB2(Her2)癌遺伝子によって産生される受容体タンパク質を発現する新生物の治療、増殖抑制、または根絶に有用である。
【0034】
3.併用製品および併用投与
ある種の実施形態において、本発明の組成物およびその製剤は、本明細書に記載の1つまたは複数の障害を治療するために単独で投与することができ、または本明細書に記載の1つまたは複数の障害を治療するのに有用な1種または複数の他の活性剤と組み合わせて(同時にまたは連続して)投与することができる。したがって、本発明の組成物またはその製剤は、1種または複数の活性剤と同時に、その前に、またはその後に投与することができる。
【0035】
ある種の実施形態において、本発明の組成物は、ネラチニブに加えて、ネラチニブでない1種または複数の他の活性剤を含む。いくつかの実施形態において、本発明の製剤は、別の抗癌化合物とネラチニブの両方を含む。
【0036】
本発明の併用組成物に存在する追加活性剤(複数可)の量は、典型的にその活性剤を唯一の治療剤として含む組成物において通常投与される量を超えない量となる。本発明のある種の実施形態において、追加活性剤の量は、その化合物を唯一の治療剤として含む組成物に通常存在する量の約50%から100%の範囲となる。
【0037】
4.本発明の組成物の使用およびキット
提供される組成物およびその製剤は、癌を含む状態の治療においても有用である。
【0038】
さらなる実施形態において、本発明の組成物およびその製剤の使用の獣医学的適用(たとえば、家畜、たとえばウマ、イヌ、ネコなどの治療)が提供される。したがって、ヒト対象に関して上で論じたものと類似した獣医学的適用における提供される製剤の使用が企図される。
【0039】
本発明の組成物およびその製剤は、併用療法において使用でき、すなわち、本発明の組成物またはその製剤は、1種または複数の他の所望の治療薬または医学的手技と同時に、その前に、またはその後に投与できることも理解される。併用レジメンに用いる特定の併用療法(治療薬または手技)には、所望の治療薬および/または手技と達成されるべき所望の治療効果との適合性が考慮される。用いられる療法は、同じ障害に関して所望の効果を達成してもよく(たとえば、製剤を同じ障害を治療するために用いられる別の化合物と同時に投与することができる)、または異なる効果(たとえば、任意の有害作用の制御)を達成してもよいことが理解される。本明細書において、特定の疾患または状態を治療または予防するために通常投与される追加治療化合物は、「治療される疾患または状態に適している」ものとして知られている。
【0040】
他の実施形態において、本発明の組成物、およびその製剤、および単位投与形態は、それに限定されるものではないが、癌の治療に有用な薬剤を含む薬剤の調製に有用である。
【0041】
本発明には、本発明の組成物およびその製剤、ならびに容器(たとえば、ホイルもしくはプラスチック製パッケージ、または他の適切な容器)を含む医薬パックおよび/またはキットがさらに包含される。そのようなキットには、使用説明書が追加的に提供されていてもよい。
【0042】
本明細書に記載の発明がより十分に理解されるように、以下の実施例を示す。これらの実施例は単に例示を目的とし、どのような方法においても本発明を限定するものとして解釈されないことが理解されるべきである。
【0043】
本発明のそれぞれの態様のすべての特徴は、必要な変更を加えて、他のすべての態様に適用される。
【実施例1】
【0044】
流動層湿式造粒法によるマレイン酸ネラチニブ製剤の被覆錠剤の調製
マレイン酸ネラチニブの薬学的に許容できる製剤を調製する:顆粒内成分(a)マレイン酸ネラチニブ10〜70重量パーセント、(b)マンニトールおよび微結晶性セルロース15〜65重量パーセント、(c)クロスポビドンまたはクロスカルメロースナトリウム0.5〜8重量パーセント、(d)コロイド状二酸化ケイ素0.2〜8重量パーセント、および(e)ポビドン5〜15重量パーセントを含む顆粒。この顆粒を、顆粒外成分(f)微結晶性セルロース4〜25重量パーセント、(g)クロスポビドン1〜8重量パーセント、および(h)ステアリン酸マグネシウム0.5〜3重量パーセントと合わせ、次いで錠剤に圧縮するか、またはカプセルに乾燥充填する。この材料の範囲およびいくつかの好ましい範囲を下記の表1に示す。
【0045】
【表1】

【0046】
以下の手順に従って製剤を調製した。
1.マレイン酸ネラチニブ、マンニトール、微結晶性セルロース、およびクロスポビドン、および二酸化ケイ素を混合した。任意の拡散または対流ミキサを用いることができる。
2.ポビドンを精製水に溶解した。
3.適切な流動層造粒機および乾燥器において、ステップ1の粉末ブレンドを流動化し、それにステップ2で調製した溶液を噴霧した。
4.顆粒を乾燥した。
5.顆粒を粉砕した。
6.微結晶性セルロースおよびクロスポビドンをステップ5の顆粒に添加し、混合した。
7.ステアリン酸マグネシウムをステップ6の混合物に添加し、混合した。
8.ステップ7のブレンドを所望の強度の錠剤に圧縮した。
9.所望の色のOpadry IIを用いて、圧縮錠剤にフィルムコートを適用した。
10.別法として、粉末ブレンドをカプセルのシェルに充填できる。
【実施例2】
【0047】
例示的なマレイン酸ネラチニブ製剤の単位投与形態
実施例1に記載の流動層法を用いて、表2に要約したとおり、例示的な製剤からマレイン酸ネラチニブの種々の単位投与を調製した。
【0048】
【表2】

【実施例3】
【0049】
流動層において顆粒内成分にポビドンを噴霧することによって製造された標的放出マレイン酸ネラチニブの被覆錠剤
例示的な標的放出(TR)マレイン酸ネラチニブ製剤を表3に要約する。
【0050】
【表3】

【実施例4】
【0051】
流動層において顆粒内成分にポビドンを噴霧することによって製造された徐放マレイン酸ネラチニブの被覆錠剤
例示的な徐放(SR)マレイン酸ネラチニブ製剤を表4Aおよび4Bに要約する。
【0052】
【表4】

【0053】
【表5】

【実施例5】
【0054】
薬物放出データ
表5に要約したとおり、実施例3および4のマレイン酸ネラチニブ製剤に関して、薬物放出データを要約する。錠剤の溶解は、USP溶解装置2において、37±0.5℃、パドル速度50±1rpmで、溶解媒質として0.1N HCl900mlを用いて行った。一定の時点でサンプルを採り、UV分光計によって266nmで分析した。
【0055】
【表6】

【0056】
対象における単一経口用量(240mg錠剤)投与後の標的放出製剤および徐放製剤のマレイン酸ネラチニブに関する平均薬物動態パラメータを評価し、表6に要約した。標的放出製剤および徐放製剤の平均濃度対時間プロファイルを図1に要約する。
【0057】
【表7】

【特許請求の範囲】
【請求項1】
顆粒内成分(a)マレイン酸ネラチニブ10〜70重量パーセント、(b)1種または複数の賦形剤15〜65重量パーセント、(c)1種または複数の崩壊剤0〜8重量パーセント、および(d)1種または複数の流動促進剤0.2〜8重量パーセント、および(e)1種または複数の表面改質剤5〜15重量パーセントを含む顆粒を含み、顆粒を、顆粒外成分(f)1種または複数の賦形剤1〜25重量パーセント、(g)1種または複数の崩壊剤0〜8重量パーセント、および(h)1種または複数の滑沢剤0.1〜3重量パーセントと合わせる、薬学的に許容できる組成物。
【請求項2】
マレイン酸ネラチニブ10〜70重量パーセント、およびポビドン5〜15重量パーセントを含む、薬学的に許容できる組成物。
【請求項3】
顆粒内成分のマレイン酸ネラチニブ10〜70重量パーセントおよびポビドン5〜15重量パーセント、ならびに顆粒外成分の微結晶性セルロース、クロスポビドン、およびステアリン酸マグネシウムを含む、薬学的に許容できる組成物。
【請求項4】
顆粒内成分(a)マレイン酸ネラチニブ10〜70重量パーセント、(b)マンニトール、微結晶性セルロース、または両方の組合せ15〜65重量パーセント、(c)クロスポビドン、クロスカルメロースナトリウム、または両方の組合せ0.5〜8重量パーセント、(d)コロイド状二酸化ケイ素0.2〜8重量パーセント、および(e)ポビドン5〜15重量パーセント、ならびに顆粒外成分(f)微結晶性セルロース4〜25重量パーセント、(g)クロスポビドン1〜8重量パーセント、および(h)ステアリン酸マグネシウム0.5〜3重量パーセントを含む、薬学的に許容できる組成物。
【請求項5】
請求項4の組成物を含む錠剤。
【請求項6】
請求項4の組成物を含む乾燥充填カプセル。
【請求項7】
マレイン酸ネラチニブの量が約41重量パーセントである、請求項4に記載の組成物。
【請求項8】
顆粒内成分として、マンニトールおよび微結晶性セルロースの量が約50重量パーセントである、請求項4に記載の組成物。
【請求項9】
顆粒内成分として、クロスポビドンの量が約3重量パーセントである、請求項4に記載の組成物。
【請求項10】
顆粒内成分として、ポビドンの量が約5重量パーセントである、請求項4に記載の組成物。
【請求項11】
40mg、80mg、または240mgの経口投与形態である、請求項4に記載の組成物。
【請求項12】
1種または複数の表面改質剤5〜15重量パーセントを顆粒の顆粒内成分に噴霧するステップを含み、前記顆粒内成分が(a)マレイン酸ネラチニブ10〜70重量パーセント、(b)1種または複数の賦形剤15〜65重量パーセント、(c)1種または複数の崩壊剤0〜8重量パーセント、および(d)1種または複数の流動促進剤0.2〜8重量パーセントを含む、薬学的に許容できる組成物を調製する方法。
【請求項13】
(1)1種または複数の表面改質剤5〜15重量パーセントを顆粒の顆粒内成分に噴霧するステップであって、前記顆粒内成分が(a)マレイン酸ネラチニブ10〜70重量パーセント、(b)1種または複数の賦形剤15〜65重量パーセント、(c)1種または複数の崩壊剤0〜8重量パーセント、および(d)1種または複数の流動促進剤0.2〜8重量パーセントを含むステップ、ならびに(2)前記被覆顆粒内成分を顆粒の顆粒外成分と合わせるステップであって、前記顆粒外成分が(e)1種または複数の賦形剤1〜25重量パーセント、(f)1種または複数の崩壊剤0〜8重量パーセント、および(g)1種または複数の滑沢剤0.1〜3重量パーセントを含むステップを含む、薬学的に許容できる組成物を調製する方法。
【請求項14】
表面改質剤がポビドンである、請求項12または13に記載の方法。
【請求項15】
有効量の請求項1に記載の組成物を投与することを含む、癌を治療する方法。
【請求項1】
顆粒内成分(a)マレイン酸ネラチニブ10〜70重量パーセント、(b)1種または複数の賦形剤15〜65重量パーセント、(c)1種または複数の崩壊剤0〜8重量パーセント、および(d)1種または複数の流動促進剤0.2〜8重量パーセント、および(e)1種または複数の表面改質剤5〜15重量パーセントを含む顆粒を含み、顆粒を、顆粒外成分(f)1種または複数の賦形剤1〜25重量パーセント、(g)1種または複数の崩壊剤0〜8重量パーセント、および(h)1種または複数の滑沢剤0.1〜3重量パーセントと合わせる、薬学的に許容できる組成物。
【請求項2】
マレイン酸ネラチニブ10〜70重量パーセント、およびポビドン5〜15重量パーセントを含む、薬学的に許容できる組成物。
【請求項3】
顆粒内成分のマレイン酸ネラチニブ10〜70重量パーセントおよびポビドン5〜15重量パーセント、ならびに顆粒外成分の微結晶性セルロース、クロスポビドン、およびステアリン酸マグネシウムを含む、薬学的に許容できる組成物。
【請求項4】
顆粒内成分(a)マレイン酸ネラチニブ10〜70重量パーセント、(b)マンニトール、微結晶性セルロース、または両方の組合せ15〜65重量パーセント、(c)クロスポビドン、クロスカルメロースナトリウム、または両方の組合せ0.5〜8重量パーセント、(d)コロイド状二酸化ケイ素0.2〜8重量パーセント、および(e)ポビドン5〜15重量パーセント、ならびに顆粒外成分(f)微結晶性セルロース4〜25重量パーセント、(g)クロスポビドン1〜8重量パーセント、および(h)ステアリン酸マグネシウム0.5〜3重量パーセントを含む、薬学的に許容できる組成物。
【請求項5】
請求項4の組成物を含む錠剤。
【請求項6】
請求項4の組成物を含む乾燥充填カプセル。
【請求項7】
マレイン酸ネラチニブの量が約41重量パーセントである、請求項4に記載の組成物。
【請求項8】
顆粒内成分として、マンニトールおよび微結晶性セルロースの量が約50重量パーセントである、請求項4に記載の組成物。
【請求項9】
顆粒内成分として、クロスポビドンの量が約3重量パーセントである、請求項4に記載の組成物。
【請求項10】
顆粒内成分として、ポビドンの量が約5重量パーセントである、請求項4に記載の組成物。
【請求項11】
40mg、80mg、または240mgの経口投与形態である、請求項4に記載の組成物。
【請求項12】
1種または複数の表面改質剤5〜15重量パーセントを顆粒の顆粒内成分に噴霧するステップを含み、前記顆粒内成分が(a)マレイン酸ネラチニブ10〜70重量パーセント、(b)1種または複数の賦形剤15〜65重量パーセント、(c)1種または複数の崩壊剤0〜8重量パーセント、および(d)1種または複数の流動促進剤0.2〜8重量パーセントを含む、薬学的に許容できる組成物を調製する方法。
【請求項13】
(1)1種または複数の表面改質剤5〜15重量パーセントを顆粒の顆粒内成分に噴霧するステップであって、前記顆粒内成分が(a)マレイン酸ネラチニブ10〜70重量パーセント、(b)1種または複数の賦形剤15〜65重量パーセント、(c)1種または複数の崩壊剤0〜8重量パーセント、および(d)1種または複数の流動促進剤0.2〜8重量パーセントを含むステップ、ならびに(2)前記被覆顆粒内成分を顆粒の顆粒外成分と合わせるステップであって、前記顆粒外成分が(e)1種または複数の賦形剤1〜25重量パーセント、(f)1種または複数の崩壊剤0〜8重量パーセント、および(g)1種または複数の滑沢剤0.1〜3重量パーセントを含むステップを含む、薬学的に許容できる組成物を調製する方法。
【請求項14】
表面改質剤がポビドンである、請求項12または13に記載の方法。
【請求項15】
有効量の請求項1に記載の組成物を投与することを含む、癌を治療する方法。
【図1】




【公開番号】特開2011−98964(P2011−98964A)
【公開日】平成23年5月19日(2011.5.19)
【国際特許分類】
【外国語出願】
【出願番号】特願2010−249385(P2010−249385)
【出願日】平成22年11月8日(2010.11.8)
【出願人】(309040701)ワイス・エルエルシー (181)
【Fターム(参考)】
【公開日】平成23年5月19日(2011.5.19)
【国際特許分類】
【出願番号】特願2010−249385(P2010−249385)
【出願日】平成22年11月8日(2010.11.8)
【出願人】(309040701)ワイス・エルエルシー (181)
【Fターム(参考)】
[ Back to top ]

