複フッ化物及び複フッ化物蛍光体の製造方法
【解決手段】A2MF6(MはSi、Ti、Zr、Hf、Ge及びSnから選ばれる1種以上、AはLi、Na、K、Rb及びCsから選ばれる1種以上)で表される複フッ化物を、Mのフッ化物を含む第1溶液、及びAのフッ化物、フッ化水素塩、硝酸塩、硫酸塩、硫酸水素塩、炭酸塩、炭酸水素塩及び水酸化物から選ばれる化合物を含む第2溶液及び/又はAの化合物の固体の各々を準備し、第1溶液と第2溶液及び/又は固体とを混合してMのフッ化物とAの化合物とを反応させ、固体生成物を固液分離して回収することにより製造する。
【効果】0〜100℃の低温において、溶液の混合による固体生成物の生成と、それに引き続く固液分離によって、複フッ化物及び複フッ化物蛍光体を製造することができ、この製造方法は、安全衛生上の問題も生じにくく、生産性も高い。また、得られる蛍光体の粒子径、粒子形状も揃っており、発光特性も良好である。
【効果】0〜100℃の低温において、溶液の混合による固体生成物の生成と、それに引き続く固液分離によって、複フッ化物及び複フッ化物蛍光体を製造することができ、この製造方法は、安全衛生上の問題も生じにくく、生産性も高い。また、得られる蛍光体の粒子径、粒子形状も揃っており、発光特性も良好である。
【発明の詳細な説明】
【技術分野】
【0001】
本発明は、高い安全性、かつ高い生産性で複フッ化物を製造する方法、特に、良好な発光特性を有する複フッ化物蛍光体を製造する方法に関する。
【背景技術】
【0002】
白色LEDの発光色に赤みを加えて、暖かい感じを出すために、近紫外から青色のLEDに相当する光で励起されて赤色に発光する蛍光体が必要とされ、研究が進められている。この中で、国際公開第2007/100824号パンフレット(特許文献1)には、A2MF6(AはNa,K,Rbなど、MはSi,Ge,Tiなど)などの式で表される複フッ化物にMnを添加したものが有用であることが記載されている。
【0003】
しかし、国際公開第2007/100824号パンフレット(特許文献1)に記載されている製造方法は、各原料をフッ化水素酸に溶解又は分散させ、加熱して蒸発乾固させるというものであり、フッ化水素酸を高濃度で含む溶液を、相当の高温に加熱する必要があり、人体に有害なフッ化水素を多く揮発させるため、工業的な実施は難しいものである。また、得られる蛍光体の純度、粒子形状及び発光特性も十分ではなく、改良の余地があった。
【0004】
一方、国際公開第2009/119486号パンフレット(特許文献2)には、ケイ素などの単体金属に、フッ化水素酸と過マンガン酸カリウムの混合溶液を作用させることで、同様の蛍光体を得る方法が記載されている。しかし、この方法も、反応速度が遅く工業的に実施するには生産性が低い。
【0005】
また、特開平5−306115号公報(特許文献3)に記載されているように、高純度で、粒の揃った雲母の製造の原料に、K2SiF6を用いることが知られている。K2SiF6の製造方法としては、共立出版株式会社発行、化学大辞典編集委員会編、化学大辞典、第8巻、縮刷版、1964年発行、278ページ(非特許文献1)に記載されているように、ヘキサフルオロ珪酸の水溶液に塩化カリウムを加える方法が知られている。
【0006】
しかし、この方法を適用して蛍光体を製造することを試みた場合、反応液にMnを加えても、Mnイオンの価数変化に起因すると思われる好ましくない変化が起きてしまい、発光特性が得られず、蛍光体として使用できるものは得られない。
【先行技術文献】
【特許文献】
【0007】
【特許文献1】国際公開第2007/100824号パンフレット
【特許文献2】国際公開第2009/119486号パンフレット
【特許文献3】特開平5−306115号公報
【非特許文献】
【0008】
【非特許文献1】共立出版株式会社発行、化学大辞典編集委員会編、化学大辞典、第8巻、縮刷版、1964年発行、278ページ
【非特許文献2】丸善株式会社発行、日本化学会編、新実験化学講座8「無機化合物の合成III」、1977年発行、1166ページ
【発明の概要】
【発明が解決しようとする課題】
【0009】
本発明は、上記問題を解決するためになされたものであり、高い安全性、かつ高い生産性で複フッ化物、特に、良好な発光特性を有する複フッ化物蛍光体を製造する方法を提供することを目的とする。
【課題を解決するための手段】
【0010】
本発明者は、上記課題を解決するために鋭意検討を重ねた結果、
4価元素M(MはSi、Ti、Zr、Hf、Ge及びSnから選ばれる1種又は2種以上である)のフッ化物を含む第1の溶液と、
アルカリ金属A(AはLi、Na、K、Rb及びCsから選ばれる1種又は2種以上である)のフッ化物、フッ化水素塩、硝酸塩、硫酸塩、硫酸水素塩、炭酸塩、炭酸水素塩及び水酸化物から選ばれる化合物を含む第2の溶液及び/又は該アルカリ金属Aの化合物の固体
とを混合して反応させることにより、下記式(1)
A2MF6 (1)
(式中、M及びAは、各々上記と同じである)
で表される複フッ化物を製造できることを見出した。
【0011】
また、上記第1の溶液と上記第2の溶液及び/又は固体との、少なくとも一方に、Na2MnF6又はK2MnF6で表されるマンガン化合物の少なくとも一方を添加して、第1の溶液と第2の溶液及び/又は固体とを混合して反応させることにより、下記式(2)
A12MF6:Mn (2)
(式中、Mは上記と同じであり、A1はLi、Na、K、Rb及びCsから選ばれ、かつ少なくともNa及び/又はKを含む1種、2種又は3種以上のアルカリ金属である)
で表される複フッ化物蛍光体を製造できることを見出した。
【0012】
そして、いずれの方法においても、反応生成物が固体で析出し、これを固液分離して回収することができ、例えば、0〜100℃の低温で、高い安全性、かつ高い生産性で複フッ化物及び複フッ化物蛍光体を製造できること、特に、後者の方法により、粒子径、粒子形状の揃った発光特性が良好な複フッ化物蛍光体を製造できることを見出し、本発明をなすに至った。
【0013】
従って、本発明は、下記の複フッ化物及び複フッ化物蛍光体の製造方法を提供する。
請求項1:
下記式(1)
A2MF6 (1)
(式中、MはSi、Ti、Zr、Hf、Ge及びSnから選ばれる1種又は2種以上の4価元素、AはLi、Na、K、Rb及びCsから選ばれる1種又は2種以上のアルカリ金属である)
で表される複フッ化物を製造する方法であって、
上記4価元素Mのフッ化物を含む第1の溶液、及び
上記アルカリ金属Aのフッ化物、フッ化水素塩、硝酸塩、硫酸塩、硫酸水素塩、炭酸塩、炭酸水素塩及び水酸化物から選ばれる化合物を含む第2の溶液及び/又は該アルカリ金属Aの化合物の固体
の各々を準備する工程、
上記第1の溶液と上記第2の溶液及び/又は固体とを混合して、上記4価元素Mのフッ化物と上記アルカリ金属Aの化合物とを反応させる工程、及び
反応により生じた固体生成物を固液分離して回収する工程
を含むことを特徴とする複フッ化物の製造方法。
請求項2:
上記4価元素MがSi及び/又はTiであり、上記アルカリ金属AがNa及び/又はKであることを特徴とする請求項1記載の複フッ化物の製造方法。
請求項3:
下記式(2)
A12MF6:Mn (2)
(式中、MはSi、Ti、Zr、Hf、Ge及びSnから選ばれる1種又は2種以上の4価元素、A1はLi、Na、K、Rb及びCsから選ばれ、かつ少なくともNa及び/又はKを含む1種、2種又は3種以上のアルカリ金属である)
で表される複フッ化物蛍光体を製造する方法であって、
上記4価元素Mのフッ化物を含む第1の溶液、及び
アルカリ金属A(AはLi、Na、K、Rb及びCsから選ばれる1種又は2種以上)のフッ化物、フッ化水素塩、硝酸塩、硫酸塩、硫酸水素塩、炭酸塩、炭酸水素塩及び水酸化物から選ばれる化合物を含む第2の溶液及び/又は該アルカリ金属Aの化合物の固体
の各々を、上記第1の溶液と上記第2の溶液及び/又は固体との、少なくとも一方に、Na2MnF6又はK2MnF6で表されるマンガン化合物の少なくとも一方を添加して、準備する工程、
上記第1の溶液と上記第2の溶液及び/又は固体とを混合して、上記4価元素Mのフッ化物と上記アルカリ金属Aの化合物と上記マンガン化合物とを反応させる工程、及び
反応により生じた固体生成物を固液分離して回収する工程
を含むことを特徴とする複フッ化物蛍光体の製造方法。
請求項4:
上記4価元素MがSi及び/又はTiであり、上記アルカリ金属AがNa及び/又はKであることを特徴とする請求項3記載の複フッ化物蛍光体の製造方法。
請求項5:
上記第2の溶液及び/又は固体が、フッ化アルカリAF(式中、AはLi、Na、K、Rb及びCsから選ばれる1種又は2種以上のアルカリ金属である)を含む溶液及び/又は該フッ化アルカリAFの固体であることを特徴とする請求項3又は4記載の複フッ化物蛍光体の製造方法。
【発明の効果】
【0014】
本発明によれば、例えば、0〜100℃の低温において、溶液の混合による固体生成物の生成と、それに引き続く固液分離によって、複フッ化物及び複フッ化物蛍光体を製造することができ、この製造方法は、安全衛生上の問題も生じにくく、生産性も高い。また、得られる蛍光体の粒子径、粒子形状も揃っており、発光特性も良好である。
【図面の簡単な説明】
【0015】
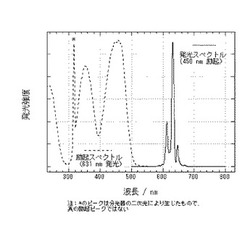
【図1】実施例1で得た蛍光体の発光スペクトル及び励起スペクトルを示す図である。
【図2】実施例1で得た蛍光体の走査型電子顕微鏡写真である。
【図3】実施例2で得た蛍光体の走査型電子顕微鏡写真である。
【図4】実施例4で得た蛍光体の発光スペクトル及び励起スペクトルを示す図である。
【図5】実施例4で得た蛍光体の走査型電子顕微鏡写真である。
【図6】実施例7で得た蛍光体の発光スペクトル及び励起スペクトルを示す図である。
【図7】比較例1で得た蛍光体の走査型電子顕微鏡写真である。
【図8】比較例2で得た蛍光体の走査型電子顕微鏡写真である。
【発明を実施するための形態】
【0016】
以下、本発明について詳細に説明する。
本発明においては、下記式(1)
A2MF6 (1)
(式中、MはSi、Ti、Zr、Hf、Ge及びSnから選ばれる1種又は2種以上の4価元素、好ましくはSi及び/又はTiであり、AはLi、Na、K、Rb及びCsから選ばれる1種又は2種以上のアルカリ金属、好ましくはNa及び/又はKである)
で表される複フッ化物を製造する。
【0017】
また、本発明においては、下記式(2)
A12MF6:Mn (2)
(式中、MはSi、Ti、Zr、Hf、Ge及びSnから選ばれる1種又は2種以上の4価元素、好ましくはSi及び/又はTiであり、A1はLi、Na、K、Rb及びCsから選ばれ、かつ少なくともNa及び/又はKを含む1種、2種又は3種以上のアルカリ金属、好ましくはNa及び/又はKである)
で表される複フッ化物蛍光体を製造する。この蛍光体は、A12MF6で表される複フッ化物の構成元素の一部がMnで置換された構造を有し、このような蛍光体は一般にMn賦活蛍光体と呼ばれ、この場合、Mn賦活複フッ化物蛍光体と呼ぶことができる。
【0018】
上記(2)で表されるMn賦活複フッ化物蛍光体において、賦活元素のMnは、特に限定するものではないが、A12MF6で表される複フッ化物の、Mで表される4価元素のサイトにMnが置換したもの(4価のマンガン(Mn4+)として置換したもの)が好適であり、4価のマンガン(Mn4+)を含むものが好ましい。この場合、通常、A12MF6:Mn4+と表記される。
【0019】
本発明の複フッ化物蛍光体は、紫外線から青色光の範囲の波長の光、例えば、波長250〜500nmの範囲の光の吸収が良好であり、特に、波長320〜390nmの紫外線、好ましくは波長360〜390nmの近紫外線、波長390〜420nmの紫色光、又は波長420〜490nmの青色光により励起されて、波長660〜710nmの範囲内に発光ピーク、特に、最大発光ピークを有する赤色の光を発光する。
【0020】
次に、本発明の複フッ化物及び複フッ化物蛍光体の製造方法について詳述する。
上記式(1)で表される複フッ化物は、例えば、以下のような方法で製造することができる。まず、4価元素M(MはSi、Ti、Zr、Hf、Ge及びSnから選ばれる1種又は2種以上、好ましくはSi及び/又はTiである)のフッ化物を含む第1の溶液と、アルカリ金属A(AはLi、Na、K、Rb及びCsから選ばれる1種又は2種以上のアルカリ金属、好ましくはNa及び/又はKである)のフッ化物、フッ化水素塩、硝酸塩、硫酸塩、硫酸水素塩、炭酸塩、炭酸水素塩及び水酸化物から選ばれる化合物を含む第2の溶液及び/又はアルカリ金属Aの化合物の固体の各々を、適宜調製して、準備する。
【0021】
第1の溶液は、通常、水溶液で調製され、4価元素Mのフッ化物を、必要に応じてフッ化水素(フッ化水素酸水溶液)と共に水に溶解させて水溶液として調製することができる。また、4価元素Mの酸化物、水酸化物、炭酸塩などを、フッ化水素(フッ化水素酸水溶液)と共に水に溶解させて水溶液として調製することもできる。この水溶液は、実質的に、4価元素Mのフッ化物又はポリフルオロ酸塩(例えば、ヘキサフルオロケイ酸塩)を含む水溶液となっている。
【0022】
この第1の溶液中の4価元素Mのフッ化物の濃度は0.1〜3モル/リットル、特に0.2〜1.5モル/リットルとすることが好ましい。また、フッ化水素(フッ化水素酸水溶液)は0〜30モル/リットル、特に0.1〜27モル/リットルの範囲で、4価元素Mに対するフッ素のモル比が6以上、好ましくは8以上になるように添加することが好ましい。この4価元素Mに対するフッ素のモル比の上限は、特に限定されるものではないが、通常100以下である。第1の溶液を調製する際、必要に応じて、例えば、0〜100℃、特に20〜80℃の温度で冷却又は加熱してもよい。
【0023】
一方、第2の溶液は、アルカリ金属A(AはLi、Na、K、Rb及びCsから選ばれる1種又は2種以上、好ましくはNa及び/又はKである)のフッ化物AF、フッ化水素塩AHF2、硝酸塩ANO3、硫酸塩A2SO4、硫酸水素塩AHSO4、炭酸塩A2CO3、炭酸水素塩AHCO3及び水酸化物AOHから選ばれる化合物を、必要に応じてフッ化水素(フッ化水素酸水溶液)と共に水に溶解させて水溶液として調製することができる。一方、固体(第2の溶液に対応する固体)の場合は、フッ化物AF、フッ化水素塩AHF2、硝酸塩ANO3、硫酸塩A2SO4、硫酸水素塩AHSO4、炭酸塩A2CO3、炭酸水素塩AHCO3及び水酸化物AOHから選ばれる化合物を、固体として準備すればよい。
【0024】
この第2の溶液中のアルカリ金属Aの化合物の濃度は、アルカリ金属Aの濃度として、0.02モル/リットル以上、特に0.05モル/リットル以上とすることが好ましい。このアルカリ金属Aの濃度の上限は、特に限定されるものではないが、通常10モル/リットル以下である。第2の溶液を調製する際、必要に応じて、室温(例えば、20℃)から100℃以下、特に20〜80℃の温度で加熱してもよい。
【0025】
この場合、第1の溶液中の4価元素Mと、第2の溶液及び/又は固体中のアルカリ金属Aとの比は、A/M=2.0〜10.0(モル比)、特に2.0〜5.0(モル比)とすることが好ましい。
【0026】
次に、第1の溶液と第2の溶液及び/又は固体とを混合して、4価元素Mのフッ化物とアルカリ金属Aの化合物とを反応させる。両者の混合は、発熱を伴うことがあるため、注意しながら徐々に混合することが好ましい。反応温度は、通常−20〜100℃であり、0〜80℃とすることが好ましい。反応時間は、通常10秒間〜1時間である。第1の溶液と第2の溶液及び/又は固体とを混合し、反応させることにより、固体の生成物(沈殿)が生成する。第1の溶液と第2の溶液及び/又は固体とは、反応後の固体生成物の濃度(固形分濃度)が1〜20質量%となるようにすることが好適である。
【0027】
生成物は、ろ別、遠心分離、デカンテーションなどの方法により固液分離し、本発明の複フッ化物を固体生成物として得ることができる。この場合、反応液の濃縮の工程を必要としない。なお、固液分離後の固体生成物は、必要に応じて、洗浄、溶媒置換などの処理を実施することができ、また、真空乾燥などによって乾燥することができる。
【0028】
一方、上記式(2)で表される複フッ化物蛍光体は、例えば、以下のような方法で製造することができる。上記式(2)で表される複フッ化物蛍光体を製造する場合は、上記式(1)で表される複フッ化物の製造における第1の溶液と第2の溶液及び/又は固体との、少なくとも一方(即ち、いずれか又は双方)に、Na2MnF6又はK2MnF6で表されるマンガン化合物の少なくとも一方(即ち、いずれか又は双方)を添加して、適宜調製して、準備する。この場合、上記式(2)中、A1で表されるアルカリ金属においてNa及び/又はKが必須成分となる。
【0029】
マンガン化合物の添加量は、原料中(即ち、第1の溶液と第2の溶液及び/又は固体とを合わせた全体中)、4価元素MとMnとが、M+Mn=100モル%として、70モル%≦M<100モル%、特に85モル%≦M≦99.9モル%、0モル%<Mn≦30モル%、特に0.1モル%≦Mn≦15モル%、とりわけ0.5モル%≦Mn≦10モル%となる量であることが好ましい。この比率は、得られた複フッ化物蛍光体におけるMで表される4価元素とMnとの比率に相関する。
【0030】
この場合、第1の溶液中の4価元素M、及び添加したマンガン化合物中のMnと、第2の溶液及び/又は固体中のアルカリ金属Aとの比は、A/(M+Mn)=2.0〜10.0(モル比)、特に2.0〜5.0(モル比)とすることが好ましい。
【0031】
次に、第1の溶液と第2の溶液及び/又は固体とを混合して、4価元素Mのフッ化物とアルカリ金属Aの化合物とマンガン化合物とを反応させる。両者の混合は、発熱を伴うことがあるため、注意しながら徐々に混合することが好ましい。反応温度は、通常−20〜100℃であり、0〜80℃とすることが好ましい。反応時間は、通常10秒間〜1時間である。第1の溶液と第2の溶液及び/又は固体とを混合し、反応させることにより、固体の生成物(沈殿)が生成する。第1の溶液と第2の溶液及び/又は固体とは、反応後の固体生成物の濃度(固形分濃度)が1〜20質量%となるようにすることが好適である。
【0032】
生成物は、ろ別、遠心分離、デカンテーションなどの方法により固液分離し、本発明の複フッ化物蛍光体を固体生成物として得ることができる。この場合、反応液の濃縮の工程を必要としない。なお、固液分離後の固体生成物は、必要に応じて、洗浄、溶媒置換などの処理を実施することができ、また、真空乾燥などによって乾燥することができる。
【実施例】
【0033】
以下、調製例、実施例及び比較例を示して本発明を具体的に説明するが、本発明は下記の実施例に制限されるものではない。なお、以下の例において用いた原料は、和光純薬工業(株)製の試薬特級品を使用した。
【0034】
[調製例1]K2MnF6の調製
丸善株式会社発行、日本化学会編、新実験化学講座8「無機化合物の合成III」、1977年発行、1166ページ(非特許文献2)に記載されている方法に準拠し、以下の方法で調製した。
【0035】
塩化ビニル樹脂製の反応槽の中央にフッ素樹脂系イオン交換膜の仕切り(隔膜)を設け、イオン交換膜を挟む2室の各々に、いずれも白金板からなる陽極と陰極を設置した。反応槽の陽極側に、フッ化マンガン(II)を溶解させたフッ化水素酸水溶液、陰極側にフッ化水素酸水溶液を入れた。両極を電源につなぎ、電圧3V、電流0.75Aで電解を行った。電解を終えた後、陽極側の反応液に、フッ化水素酸水溶液に飽和させたフッ化カリウムの溶液を過剰に加えた。生成した黄色の固体生成物をろ別、回収し、K2MnF6を得た。
【0036】
[実施例1]
4.8gの二酸化ケイ素を100cm3の48質量%フッ化水素酸水溶液に溶解させ、室温まで放冷し、フッ化ケイ素を含む水溶液を調製した。このフッ化ケイ素を含む水溶液に、調製例1で調製したK2MnF6粉末を1.19g加えて撹拌して溶解させ、フッ化ケイ素とK2MnF6を含む水溶液(第1溶液)を調製した。また、13.95gのフッ化カリウムを40cm3の48質量%フッ化水素酸水溶液に溶解させ、室温まで放冷し、フッ化カリウムを含む水溶液(第2溶液)を調製した。次に、撹拌した第1溶液に、第2溶液を約3分間かけて少しずつ加え、10分間程度撹拌し、淡橙色の固体が生成した。この固体生成物をろ別し、少量の20質量%フッ化水素酸水溶液、次いでエタノールで洗浄し、真空乾燥し、15.64gの反応生成物が得られた。
【0037】
粉末X線回折により、得られた生成物がK2SiF6に対応する結晶構造を有することが確認された。この生成物は、紫外線又は青色光の励起で、赤色の蛍光を示したことから、K2SiF6:Mnで表される蛍光体が得られていることが確認された。
【0038】
得られた蛍光体の発光スペクトル及び励起スペクトルを、蛍光光度計FP6500(日本分光(株)製)で測定した結果を図1に示す。また、量子効率測定装置QE1100(大塚電子(株)製)で測定した励起波長450nmでの吸収率と量子効率を表1に示す。吸収率は0.701、内部量子効率は0.717、外部量子効率(=(吸収率)×(内部量子効率)、以下同じ)は0.503であった。
【0039】
更に、蛍光体の走査型電子顕微鏡写真を図2に示す。蛍光体は、主に約30〜40μm程度の大きさの揃った角型粒子からなっていた。
【0040】
[実施例2]
4.8gの二酸化ケイ素を100cm3の48質量%フッ化水素酸水溶液に溶解させ、室温まで放冷し、フッ化ケイ素を含む水溶液を調製した。このフッ化ケイ素を含む水溶液に、調製例1で調製したK2MnF6粉末を1.19g加えて撹拌して溶解させ、フッ化ケイ素とK2MnF6を含む水溶液(第1溶液)を調製した。また、23.24gのフッ化カリウムを25cm3の水に溶解させ、室温まで放冷し、フッ化カリウムを含む水溶液(第2溶液)を調製した。次に、撹拌した第1溶液に、第2溶液を少しずつ加え、淡橙色の固体が生成した。この固体生成物をろ別し、少量の20質量%フッ化水素酸水溶液、次いでエタノールで洗浄し、真空乾燥し、16.79gの反応生成物が得られた。
【0041】
粉末X線回折により、得られた生成物がK2SiF6に対応する結晶構造を有することが確認された。この生成物は、紫外線又は青色光の励起で、赤色の蛍光を示したことから、K2SiF6:Mnで表される蛍光体が得られていることが確認された。
【0042】
得られた蛍光体の発光スペクトル及び励起スペクトルを実施例1と同様に測定したところ、実施例1と同等のスペクトルが得られた。また、実施例1と同様に測定した励起波長450nmでの吸収率と量子効率を表1に示す。吸収率は0.471、内部量子効率は0.451、外部量子効率は0.212であった。
【0043】
更に、蛍光体の走査型電子顕微鏡写真を図3に示す。蛍光体は、主に約2〜3μm程度の大きさの揃った角型粒子からなっていた。
【0044】
[実施例3]
4.8gの二酸化ケイ素を100cm3の48質量%フッ化水素酸水溶液に溶解させ、室温まで放冷し、フッ化ケイ素を含む水溶液を調製し、これをふた付きの樹脂容器に入れ、70℃に保った水浴中で1時間以上保持し、加温した。このフッ化ケイ素を含む水溶液に、調製例1で調製したK2MnF6粉末を1.19g加えて撹拌して溶解させ、フッ化ケイ素とK2MnF6を含む水溶液(第1溶液)を調製した。また、13.95gのフッ化カリウムを40cm3の48質量%フッ化水素酸水溶液に溶解させ、室温まで放冷し、フッ化カリウムを含む水溶液(第2溶液)を調製した。次に、撹拌した第1溶液に、第2溶液を約2.5分間かけて少しずつ加え、10分間程度撹拌し、淡橙色の固体が生成した。この固体生成物をろ別し、少量の20質量%フッ化水素酸水溶液、次いでエタノールで洗浄し、真空乾燥し、15.18gの反応生成物が得られた。
【0045】
粉末X線回折により、得られた生成物がK2SiF6に対応する結晶構造を有することが確認された。この生成物は、紫外線又は青色光の励起で、赤色の蛍光を示したことから、K2SiF6:Mnで表される蛍光体が得られていることが確認された。
【0046】
得られた蛍光体の発光スペクトル及び励起スペクトルを実施例1と同様に測定したところ、実施例1と同等のスペクトルが得られた。また、実施例1と同様に測定した励起波長450nmでの吸収率と量子効率を表1に示す。吸収率は0.716、内部量子効率は0.801、外部量子効率は0.574であった。
【0047】
更に、蛍光体の走査型電子顕微鏡像を確認した。蛍光体は、主に約20〜50μm程度の角型粒子からなっていた。
【0048】
[実施例4]
二酸化チタン6.39gを30cm3の48質量%フッ化水素酸水溶液と共に、密閉容器に入れ、容器ごと95℃に加熱し18時間保持した後、放冷し、フッ化チタンを含む水溶液を調製した。この水溶液は、完全に透明な溶液になっていた。このフッ化チタンを含む水溶液に、48質量%フッ化水素酸水溶液10cm3を加え、更に、調製例1で調製したK2MnF6粉末を1.19g加えて撹拌して溶解させ、フッ化チタンとK2MnF6を含む水溶液(第1溶液)を調製した。また、13.95gのフッ化カリウムを9cm3の48質量%フッ化水素酸水溶液と40cm3の水とに溶解させ、フッ化カリウムを含む水溶液(第2溶液)を調製した。次に、撹拌した第1溶液に、第2溶液を約1分間かけて少しずつ加え、しばらく撹拌し、淡橙色の固体が生成した。この固体生成物をろ別し、少量の20質量%フッ化水素酸水溶液、次いでエタノールで洗浄し、真空乾燥し、17.04gの反応生成物が得られた。
【0049】
粉末X線回折により、得られた生成物がK2TiF6に対応する結晶構造を有することが確認された。この生成物は、紫外線又は青色光の励起で、赤色の蛍光を示したことから、K2TiF6:Mnで表される蛍光体が得られていることが確認された。
【0050】
得られた蛍光体の発光スペクトル及び励起スペクトルを実施例1と同様に測定した結果を図4に示す。また、実施例1と同様に測定した励起波長450nmでの吸収率と量子効率を表1に示す。吸収率は0.701、内部量子効率は0.320、外部量子効率は0.224であった。
【0051】
更に、蛍光体の走査型電子顕微鏡写真を図5に示す。蛍光体は、主に約50〜70μm程度の大きさの揃った板状粒子からなっていた。
【0052】
[実施例5]
4.8gの二酸化ケイ素を100cm3の48質量%フッ化水素酸水溶液に溶解させ、室温まで放冷し、フッ化ケイ素を含む水溶液を調製した。このフッ化ケイ素を含む水溶液に、調製例1で調製したK2MnF6粉末を1.19g加えて撹拌して溶解させ、フッ化ケイ素とK2MnF6を含む水溶液(第1溶液)を調製した。次に、撹拌した第1溶液に、24.27gの硝酸カリウム(KNO3)の固体を少しずつ加えたところ、淡橙色の固体が生成した。5分間撹拌を続けた後、この固体生成物をろ別し、少量の20質量%フッ化水素酸水溶液、次いでエタノールで洗浄し、真空乾燥し、17.61gの反応生成物が得られた。
【0053】
粉末X線回折により、得られた生成物がK2SiF6に対応する結晶構造を有することが確認された。この生成物は、紫外線又は青色光の励起で、赤色の蛍光を示したことから、K2SiF6:Mnで表される蛍光体が得られていることが確認された。
【0054】
得られた蛍光体の発光スペクトル及び励起スペクトルを実施例1と同様に測定したところ、実施例1と同等のスペクトルが得られた。また、実施例1と同様に測定した励起波長450nmでの吸収率と量子効率を表1に示す。吸収率は0.499、内部量子効率は0.555、外部量子効率は0.277であった。
【0055】
更に、蛍光体の走査型電子顕微鏡像を確認した。蛍光体は、主に約10μm程度の大きさの角型粒子からなっていた。
【0056】
[実施例6]
実施例5と同じ原料を用い、同様の操作により、フッ化ケイ素とK2MnF6を含む水溶液(第1溶液)を調製した。また、13.46gの水酸化カリウム(KOH)を30cm3の水に溶解させ、カリウムを含む水溶液(第2溶液)を調製した。次に、撹拌した第1溶液に、第2溶液を約1分間かけて少しずつ加え、しばらく撹拌し、淡橙色の固体が生成した。この固体生成物をろ別し、少量の20質量%フッ化水素酸水溶液、次いでエタノールで洗浄し、真空乾燥し、16.72gの反応生成物が得られた。
【0057】
粉末X線回折により、得られた生成物がK2SiF6に対応する結晶構造を有することが確認された。この生成物は、紫外線又は青色光の励起で、赤色の蛍光を示したことから、K2SiF6:Mnで表される蛍光体が得られていることが確認された。
【0058】
得られた蛍光体の発光スペクトル及び励起スペクトルを実施例1と同様に測定したところ、実施例1と同等のスペクトルが得られた。また、実施例1と同様に測定した励起波長450nmでの吸収率と量子効率を表1に示す。吸収率は0.494、内部量子効率は0.493、外部量子効率は0.243であった。
【0059】
更に、蛍光体の走査型電子顕微鏡像を確認した。蛍光体は、主に約10μm程度の大きさの角型粒子からなっていた。
【0060】
[実施例7]
実施例5と同じ原料を用い、同様の操作により、フッ化ケイ素とK2MnF6を含む水溶液(第1溶液)を調製した。次に、撹拌した第1溶液に、17.04gの硫酸ナトリウム(Na2SO4)の固体を少しずつ加えたところ、淡橙色の固体が生成した。5分間撹拌を続けた後、この固体生成物をろ別し、少量の20質量%フッ化水素酸水溶液、次いでエタノールで洗浄し、真空乾燥し、15.17gの反応生成物が得られた。
【0061】
粉末X線回折により、得られた生成物がNa2SiF6に対応する結晶構造を有することが確認された。この生成物は、紫外線又は青色光の励起で、赤色の蛍光を示したことから、Na2SiF6:Mnで表される蛍光体が得られていることが確認された。
【0062】
得られた蛍光体の発光スペクトル及び励起スペクトルを実施例1と同様に測定した結果を図6に示す。また、実施例1と同様に測定した励起波長450nmでの吸収率と量子効率を表1に示す。吸収率は0.431、内部量子効率は0.675、外部量子効率は0.291であった。
【0063】
更に、蛍光体の走査型電子顕微鏡像を確認した。蛍光体は、主に約10〜20μm程度の大きさの角型粒子からなっていた。
【0064】
[実施例8]
実施例5と同じ原料を用い、同様の操作により、フッ化ケイ素とK2MnF6を含む水溶液(第1溶液)を調製した。次に、撹拌した第1溶液に、12.72gの炭酸ナトリウム(Na2CO3)の固体を、発泡に気をつけながら約2分間かけて少しずつ加えたところ、淡橙色の固体が生成し、発熱により温度が約50℃に上昇した。5分間撹拌を続けた後、この固体生成物をろ別し、少量の20質量%フッ化水素酸水溶液、次いでエタノールで洗浄し、真空乾燥し、15.02gの反応生成物が得られた。
【0065】
粉末X線回折により、得られた生成物がNa2SiF6に対応する結晶構造を有することが確認された。この生成物は、紫外線又は青色光の励起で、赤色の蛍光を示したことから、Na2SiF6:Mnで表される蛍光体が得られていることが確認された。
【0066】
得られた蛍光体の発光スペクトル及び励起スペクトルを実施例1と同様に測定したところ、実施例7と同等のスペクトルが得られた。また、実施例1と同様に測定した励起波長450nmでの吸収率と量子効率を表1に示す。吸収率は0.243、内部量子効率は0.650、外部量子効率は0.158であった。
【0067】
更に、蛍光体の走査型電子顕微鏡像を確認した。蛍光体は、主に約10〜20μm程度の大きさの角型粒子からなっていた。
【0068】
[比較例1]
二酸化チタン40.0gを、100cm3の48質量%フッ化水素酸水溶液及び50cm3の水と共に、フッ素樹脂で内張りされた容器に入れ、95℃で10時間加熱して溶解させて水溶液とした。得られた水溶液に、56.1gの水酸化カリウムを100cm3の水に溶解させた液を加えたところ、固体が生成した。この固体生成物をろ別、乾燥した。粉末X線回折により、得られた生成物がK2TiF6の結晶構造を有することが確認され、K2TiF6が得られていることが確認された。
【0069】
次に、得られたK2TiF6を15.43gと、調製例1で調製したK2MnF6粉末1.27gとを、135cm3の48質量%フッ化水素酸水溶液と27cm3の水とを加えて溶解させたところ、橙色の水溶液が得られた。この水溶液をフッ素樹脂製の蒸発皿に入れ、ドラフト内で、水浴で加熱して濃縮した。5時間加熱したところ、液は濃い赤褐色に変わり、液の表面がうっすら濁ったところで加熱をやめ、一夜放冷したところ、淡黄色の結晶が析出した。この固体生成物をろ別し、少量の20質量%フッ化水素酸水溶液、次いでエタノールで洗浄し、真空乾燥し、9.75gの反応生成物が得られた。
【0070】
粉末X線回折により、得られた生成物がK2TiF6に対応する結晶構造を有することが確認された。この生成物は、紫外線又は青色光の励起で、赤色の蛍光を示したことから、K2TiF6:Mnで表される蛍光体が得られていることが確認された。
【0071】
得られた蛍光体の発光スペクトル及び励起スペクトルを実施例1と同様に測定したところ、実施例4に類似するプロファイルのスペクトルが得られた。また、実施例1と同様に測定した励起波長450nmでの吸収率と量子効率を表1に示す。吸収率は0.828、内部量子効率は0.254、外部量子効率は0.210であった。
【0072】
更に、蛍光体の走査型電子顕微鏡写真を図7に示す。蛍光体は、小さいものは1μm程度から大きいものは100μmを超える不定形の粒子からなっていた。
【0073】
[比較例2]
33質量%ヘキサフルオロケイ酸水溶液45.9gに、11.8gの水酸化カリウムを加えた。この時点で液全体は白く濁っていたが、200cm3の48質量%フッ化水素酸水溶液と40cm3の水を加えたところ透明な水溶液になった。
【0074】
次に、得られた水溶液に、調製例1で調製したK2MnF6粉末を1.27g加えて溶解させたところ、橙色の水溶液が得られた。この水溶液を比較例1と同様に加熱、濃縮し、液の表面がうっすら濁ったところで加熱をやめ、一夜放冷したところ、淡黄色の結晶が析出した。この固体生成物をろ別し、少量の20質量%フッ化水素酸水溶液、次いでエタノールで洗浄し、真空乾燥し、19.32gの反応生成物が得られた。
【0075】
粉末X線回折により、得られた生成物がK2SiF6に対応する結晶構造を有することが確認された。この生成物は、紫外線又は青色光の励起で、赤色の蛍光を示したことから、K2SiF6:Mnで表される蛍光体が得られていることが確認された。
【0076】
得られた蛍光体の発光スペクトル及び励起スペクトルを実施例1と同様に測定したところ、実施例1に類似するプロファイルのスペクトルが得られた。また、実施例1と同様に測定した励起波長450nmでの吸収率と量子効率を表1に示す。吸収率は0.300、内部量子効率は0.450、外部量子効率は0.135であった。
【0077】
更に、蛍光体の走査型電子顕微鏡写真を図8に示す。蛍光体は、小さいものは1μm程度から大きいものは50μm程度までの不定形の粒子からなっていた。
【0078】
[比較例3]
実施例2と同様にして第1溶液を調製した。また、フッ化カリウムに代えて、17.89gの塩化カリウムを用いた以外は実施例2と同様にして、塩化カリウムを含む水溶液(第2溶液)を調製した。次に、撹拌した第1溶液に、第2溶液を少しずつ加えたところ、第2溶液を加えるにつれて、液の色が赤褐色を経て小豆色へと変化し、ほぼ白色の固体が生成した。この固体生成物をろ別し、少量の20質量%フッ化水素酸水溶液、次いでエタノールで洗浄し、真空乾燥し、16.12gの反応生成物が得られた。
【0079】
粉末X線回折により、得られた生成物がK2SiF6に対応する結晶構造を有することが確認された。この生成物は、紫外線又は青色光の励起で、ほとんど蛍光を示さなかった。そこで、電子線マイクロアナライザーによってMnを分析したところ、Mnの含有量は極わずかであることが確認された。
【0080】
【表1】

【技術分野】
【0001】
本発明は、高い安全性、かつ高い生産性で複フッ化物を製造する方法、特に、良好な発光特性を有する複フッ化物蛍光体を製造する方法に関する。
【背景技術】
【0002】
白色LEDの発光色に赤みを加えて、暖かい感じを出すために、近紫外から青色のLEDに相当する光で励起されて赤色に発光する蛍光体が必要とされ、研究が進められている。この中で、国際公開第2007/100824号パンフレット(特許文献1)には、A2MF6(AはNa,K,Rbなど、MはSi,Ge,Tiなど)などの式で表される複フッ化物にMnを添加したものが有用であることが記載されている。
【0003】
しかし、国際公開第2007/100824号パンフレット(特許文献1)に記載されている製造方法は、各原料をフッ化水素酸に溶解又は分散させ、加熱して蒸発乾固させるというものであり、フッ化水素酸を高濃度で含む溶液を、相当の高温に加熱する必要があり、人体に有害なフッ化水素を多く揮発させるため、工業的な実施は難しいものである。また、得られる蛍光体の純度、粒子形状及び発光特性も十分ではなく、改良の余地があった。
【0004】
一方、国際公開第2009/119486号パンフレット(特許文献2)には、ケイ素などの単体金属に、フッ化水素酸と過マンガン酸カリウムの混合溶液を作用させることで、同様の蛍光体を得る方法が記載されている。しかし、この方法も、反応速度が遅く工業的に実施するには生産性が低い。
【0005】
また、特開平5−306115号公報(特許文献3)に記載されているように、高純度で、粒の揃った雲母の製造の原料に、K2SiF6を用いることが知られている。K2SiF6の製造方法としては、共立出版株式会社発行、化学大辞典編集委員会編、化学大辞典、第8巻、縮刷版、1964年発行、278ページ(非特許文献1)に記載されているように、ヘキサフルオロ珪酸の水溶液に塩化カリウムを加える方法が知られている。
【0006】
しかし、この方法を適用して蛍光体を製造することを試みた場合、反応液にMnを加えても、Mnイオンの価数変化に起因すると思われる好ましくない変化が起きてしまい、発光特性が得られず、蛍光体として使用できるものは得られない。
【先行技術文献】
【特許文献】
【0007】
【特許文献1】国際公開第2007/100824号パンフレット
【特許文献2】国際公開第2009/119486号パンフレット
【特許文献3】特開平5−306115号公報
【非特許文献】
【0008】
【非特許文献1】共立出版株式会社発行、化学大辞典編集委員会編、化学大辞典、第8巻、縮刷版、1964年発行、278ページ
【非特許文献2】丸善株式会社発行、日本化学会編、新実験化学講座8「無機化合物の合成III」、1977年発行、1166ページ
【発明の概要】
【発明が解決しようとする課題】
【0009】
本発明は、上記問題を解決するためになされたものであり、高い安全性、かつ高い生産性で複フッ化物、特に、良好な発光特性を有する複フッ化物蛍光体を製造する方法を提供することを目的とする。
【課題を解決するための手段】
【0010】
本発明者は、上記課題を解決するために鋭意検討を重ねた結果、
4価元素M(MはSi、Ti、Zr、Hf、Ge及びSnから選ばれる1種又は2種以上である)のフッ化物を含む第1の溶液と、
アルカリ金属A(AはLi、Na、K、Rb及びCsから選ばれる1種又は2種以上である)のフッ化物、フッ化水素塩、硝酸塩、硫酸塩、硫酸水素塩、炭酸塩、炭酸水素塩及び水酸化物から選ばれる化合物を含む第2の溶液及び/又は該アルカリ金属Aの化合物の固体
とを混合して反応させることにより、下記式(1)
A2MF6 (1)
(式中、M及びAは、各々上記と同じである)
で表される複フッ化物を製造できることを見出した。
【0011】
また、上記第1の溶液と上記第2の溶液及び/又は固体との、少なくとも一方に、Na2MnF6又はK2MnF6で表されるマンガン化合物の少なくとも一方を添加して、第1の溶液と第2の溶液及び/又は固体とを混合して反応させることにより、下記式(2)
A12MF6:Mn (2)
(式中、Mは上記と同じであり、A1はLi、Na、K、Rb及びCsから選ばれ、かつ少なくともNa及び/又はKを含む1種、2種又は3種以上のアルカリ金属である)
で表される複フッ化物蛍光体を製造できることを見出した。
【0012】
そして、いずれの方法においても、反応生成物が固体で析出し、これを固液分離して回収することができ、例えば、0〜100℃の低温で、高い安全性、かつ高い生産性で複フッ化物及び複フッ化物蛍光体を製造できること、特に、後者の方法により、粒子径、粒子形状の揃った発光特性が良好な複フッ化物蛍光体を製造できることを見出し、本発明をなすに至った。
【0013】
従って、本発明は、下記の複フッ化物及び複フッ化物蛍光体の製造方法を提供する。
請求項1:
下記式(1)
A2MF6 (1)
(式中、MはSi、Ti、Zr、Hf、Ge及びSnから選ばれる1種又は2種以上の4価元素、AはLi、Na、K、Rb及びCsから選ばれる1種又は2種以上のアルカリ金属である)
で表される複フッ化物を製造する方法であって、
上記4価元素Mのフッ化物を含む第1の溶液、及び
上記アルカリ金属Aのフッ化物、フッ化水素塩、硝酸塩、硫酸塩、硫酸水素塩、炭酸塩、炭酸水素塩及び水酸化物から選ばれる化合物を含む第2の溶液及び/又は該アルカリ金属Aの化合物の固体
の各々を準備する工程、
上記第1の溶液と上記第2の溶液及び/又は固体とを混合して、上記4価元素Mのフッ化物と上記アルカリ金属Aの化合物とを反応させる工程、及び
反応により生じた固体生成物を固液分離して回収する工程
を含むことを特徴とする複フッ化物の製造方法。
請求項2:
上記4価元素MがSi及び/又はTiであり、上記アルカリ金属AがNa及び/又はKであることを特徴とする請求項1記載の複フッ化物の製造方法。
請求項3:
下記式(2)
A12MF6:Mn (2)
(式中、MはSi、Ti、Zr、Hf、Ge及びSnから選ばれる1種又は2種以上の4価元素、A1はLi、Na、K、Rb及びCsから選ばれ、かつ少なくともNa及び/又はKを含む1種、2種又は3種以上のアルカリ金属である)
で表される複フッ化物蛍光体を製造する方法であって、
上記4価元素Mのフッ化物を含む第1の溶液、及び
アルカリ金属A(AはLi、Na、K、Rb及びCsから選ばれる1種又は2種以上)のフッ化物、フッ化水素塩、硝酸塩、硫酸塩、硫酸水素塩、炭酸塩、炭酸水素塩及び水酸化物から選ばれる化合物を含む第2の溶液及び/又は該アルカリ金属Aの化合物の固体
の各々を、上記第1の溶液と上記第2の溶液及び/又は固体との、少なくとも一方に、Na2MnF6又はK2MnF6で表されるマンガン化合物の少なくとも一方を添加して、準備する工程、
上記第1の溶液と上記第2の溶液及び/又は固体とを混合して、上記4価元素Mのフッ化物と上記アルカリ金属Aの化合物と上記マンガン化合物とを反応させる工程、及び
反応により生じた固体生成物を固液分離して回収する工程
を含むことを特徴とする複フッ化物蛍光体の製造方法。
請求項4:
上記4価元素MがSi及び/又はTiであり、上記アルカリ金属AがNa及び/又はKであることを特徴とする請求項3記載の複フッ化物蛍光体の製造方法。
請求項5:
上記第2の溶液及び/又は固体が、フッ化アルカリAF(式中、AはLi、Na、K、Rb及びCsから選ばれる1種又は2種以上のアルカリ金属である)を含む溶液及び/又は該フッ化アルカリAFの固体であることを特徴とする請求項3又は4記載の複フッ化物蛍光体の製造方法。
【発明の効果】
【0014】
本発明によれば、例えば、0〜100℃の低温において、溶液の混合による固体生成物の生成と、それに引き続く固液分離によって、複フッ化物及び複フッ化物蛍光体を製造することができ、この製造方法は、安全衛生上の問題も生じにくく、生産性も高い。また、得られる蛍光体の粒子径、粒子形状も揃っており、発光特性も良好である。
【図面の簡単な説明】
【0015】
【図1】実施例1で得た蛍光体の発光スペクトル及び励起スペクトルを示す図である。
【図2】実施例1で得た蛍光体の走査型電子顕微鏡写真である。
【図3】実施例2で得た蛍光体の走査型電子顕微鏡写真である。
【図4】実施例4で得た蛍光体の発光スペクトル及び励起スペクトルを示す図である。
【図5】実施例4で得た蛍光体の走査型電子顕微鏡写真である。
【図6】実施例7で得た蛍光体の発光スペクトル及び励起スペクトルを示す図である。
【図7】比較例1で得た蛍光体の走査型電子顕微鏡写真である。
【図8】比較例2で得た蛍光体の走査型電子顕微鏡写真である。
【発明を実施するための形態】
【0016】
以下、本発明について詳細に説明する。
本発明においては、下記式(1)
A2MF6 (1)
(式中、MはSi、Ti、Zr、Hf、Ge及びSnから選ばれる1種又は2種以上の4価元素、好ましくはSi及び/又はTiであり、AはLi、Na、K、Rb及びCsから選ばれる1種又は2種以上のアルカリ金属、好ましくはNa及び/又はKである)
で表される複フッ化物を製造する。
【0017】
また、本発明においては、下記式(2)
A12MF6:Mn (2)
(式中、MはSi、Ti、Zr、Hf、Ge及びSnから選ばれる1種又は2種以上の4価元素、好ましくはSi及び/又はTiであり、A1はLi、Na、K、Rb及びCsから選ばれ、かつ少なくともNa及び/又はKを含む1種、2種又は3種以上のアルカリ金属、好ましくはNa及び/又はKである)
で表される複フッ化物蛍光体を製造する。この蛍光体は、A12MF6で表される複フッ化物の構成元素の一部がMnで置換された構造を有し、このような蛍光体は一般にMn賦活蛍光体と呼ばれ、この場合、Mn賦活複フッ化物蛍光体と呼ぶことができる。
【0018】
上記(2)で表されるMn賦活複フッ化物蛍光体において、賦活元素のMnは、特に限定するものではないが、A12MF6で表される複フッ化物の、Mで表される4価元素のサイトにMnが置換したもの(4価のマンガン(Mn4+)として置換したもの)が好適であり、4価のマンガン(Mn4+)を含むものが好ましい。この場合、通常、A12MF6:Mn4+と表記される。
【0019】
本発明の複フッ化物蛍光体は、紫外線から青色光の範囲の波長の光、例えば、波長250〜500nmの範囲の光の吸収が良好であり、特に、波長320〜390nmの紫外線、好ましくは波長360〜390nmの近紫外線、波長390〜420nmの紫色光、又は波長420〜490nmの青色光により励起されて、波長660〜710nmの範囲内に発光ピーク、特に、最大発光ピークを有する赤色の光を発光する。
【0020】
次に、本発明の複フッ化物及び複フッ化物蛍光体の製造方法について詳述する。
上記式(1)で表される複フッ化物は、例えば、以下のような方法で製造することができる。まず、4価元素M(MはSi、Ti、Zr、Hf、Ge及びSnから選ばれる1種又は2種以上、好ましくはSi及び/又はTiである)のフッ化物を含む第1の溶液と、アルカリ金属A(AはLi、Na、K、Rb及びCsから選ばれる1種又は2種以上のアルカリ金属、好ましくはNa及び/又はKである)のフッ化物、フッ化水素塩、硝酸塩、硫酸塩、硫酸水素塩、炭酸塩、炭酸水素塩及び水酸化物から選ばれる化合物を含む第2の溶液及び/又はアルカリ金属Aの化合物の固体の各々を、適宜調製して、準備する。
【0021】
第1の溶液は、通常、水溶液で調製され、4価元素Mのフッ化物を、必要に応じてフッ化水素(フッ化水素酸水溶液)と共に水に溶解させて水溶液として調製することができる。また、4価元素Mの酸化物、水酸化物、炭酸塩などを、フッ化水素(フッ化水素酸水溶液)と共に水に溶解させて水溶液として調製することもできる。この水溶液は、実質的に、4価元素Mのフッ化物又はポリフルオロ酸塩(例えば、ヘキサフルオロケイ酸塩)を含む水溶液となっている。
【0022】
この第1の溶液中の4価元素Mのフッ化物の濃度は0.1〜3モル/リットル、特に0.2〜1.5モル/リットルとすることが好ましい。また、フッ化水素(フッ化水素酸水溶液)は0〜30モル/リットル、特に0.1〜27モル/リットルの範囲で、4価元素Mに対するフッ素のモル比が6以上、好ましくは8以上になるように添加することが好ましい。この4価元素Mに対するフッ素のモル比の上限は、特に限定されるものではないが、通常100以下である。第1の溶液を調製する際、必要に応じて、例えば、0〜100℃、特に20〜80℃の温度で冷却又は加熱してもよい。
【0023】
一方、第2の溶液は、アルカリ金属A(AはLi、Na、K、Rb及びCsから選ばれる1種又は2種以上、好ましくはNa及び/又はKである)のフッ化物AF、フッ化水素塩AHF2、硝酸塩ANO3、硫酸塩A2SO4、硫酸水素塩AHSO4、炭酸塩A2CO3、炭酸水素塩AHCO3及び水酸化物AOHから選ばれる化合物を、必要に応じてフッ化水素(フッ化水素酸水溶液)と共に水に溶解させて水溶液として調製することができる。一方、固体(第2の溶液に対応する固体)の場合は、フッ化物AF、フッ化水素塩AHF2、硝酸塩ANO3、硫酸塩A2SO4、硫酸水素塩AHSO4、炭酸塩A2CO3、炭酸水素塩AHCO3及び水酸化物AOHから選ばれる化合物を、固体として準備すればよい。
【0024】
この第2の溶液中のアルカリ金属Aの化合物の濃度は、アルカリ金属Aの濃度として、0.02モル/リットル以上、特に0.05モル/リットル以上とすることが好ましい。このアルカリ金属Aの濃度の上限は、特に限定されるものではないが、通常10モル/リットル以下である。第2の溶液を調製する際、必要に応じて、室温(例えば、20℃)から100℃以下、特に20〜80℃の温度で加熱してもよい。
【0025】
この場合、第1の溶液中の4価元素Mと、第2の溶液及び/又は固体中のアルカリ金属Aとの比は、A/M=2.0〜10.0(モル比)、特に2.0〜5.0(モル比)とすることが好ましい。
【0026】
次に、第1の溶液と第2の溶液及び/又は固体とを混合して、4価元素Mのフッ化物とアルカリ金属Aの化合物とを反応させる。両者の混合は、発熱を伴うことがあるため、注意しながら徐々に混合することが好ましい。反応温度は、通常−20〜100℃であり、0〜80℃とすることが好ましい。反応時間は、通常10秒間〜1時間である。第1の溶液と第2の溶液及び/又は固体とを混合し、反応させることにより、固体の生成物(沈殿)が生成する。第1の溶液と第2の溶液及び/又は固体とは、反応後の固体生成物の濃度(固形分濃度)が1〜20質量%となるようにすることが好適である。
【0027】
生成物は、ろ別、遠心分離、デカンテーションなどの方法により固液分離し、本発明の複フッ化物を固体生成物として得ることができる。この場合、反応液の濃縮の工程を必要としない。なお、固液分離後の固体生成物は、必要に応じて、洗浄、溶媒置換などの処理を実施することができ、また、真空乾燥などによって乾燥することができる。
【0028】
一方、上記式(2)で表される複フッ化物蛍光体は、例えば、以下のような方法で製造することができる。上記式(2)で表される複フッ化物蛍光体を製造する場合は、上記式(1)で表される複フッ化物の製造における第1の溶液と第2の溶液及び/又は固体との、少なくとも一方(即ち、いずれか又は双方)に、Na2MnF6又はK2MnF6で表されるマンガン化合物の少なくとも一方(即ち、いずれか又は双方)を添加して、適宜調製して、準備する。この場合、上記式(2)中、A1で表されるアルカリ金属においてNa及び/又はKが必須成分となる。
【0029】
マンガン化合物の添加量は、原料中(即ち、第1の溶液と第2の溶液及び/又は固体とを合わせた全体中)、4価元素MとMnとが、M+Mn=100モル%として、70モル%≦M<100モル%、特に85モル%≦M≦99.9モル%、0モル%<Mn≦30モル%、特に0.1モル%≦Mn≦15モル%、とりわけ0.5モル%≦Mn≦10モル%となる量であることが好ましい。この比率は、得られた複フッ化物蛍光体におけるMで表される4価元素とMnとの比率に相関する。
【0030】
この場合、第1の溶液中の4価元素M、及び添加したマンガン化合物中のMnと、第2の溶液及び/又は固体中のアルカリ金属Aとの比は、A/(M+Mn)=2.0〜10.0(モル比)、特に2.0〜5.0(モル比)とすることが好ましい。
【0031】
次に、第1の溶液と第2の溶液及び/又は固体とを混合して、4価元素Mのフッ化物とアルカリ金属Aの化合物とマンガン化合物とを反応させる。両者の混合は、発熱を伴うことがあるため、注意しながら徐々に混合することが好ましい。反応温度は、通常−20〜100℃であり、0〜80℃とすることが好ましい。反応時間は、通常10秒間〜1時間である。第1の溶液と第2の溶液及び/又は固体とを混合し、反応させることにより、固体の生成物(沈殿)が生成する。第1の溶液と第2の溶液及び/又は固体とは、反応後の固体生成物の濃度(固形分濃度)が1〜20質量%となるようにすることが好適である。
【0032】
生成物は、ろ別、遠心分離、デカンテーションなどの方法により固液分離し、本発明の複フッ化物蛍光体を固体生成物として得ることができる。この場合、反応液の濃縮の工程を必要としない。なお、固液分離後の固体生成物は、必要に応じて、洗浄、溶媒置換などの処理を実施することができ、また、真空乾燥などによって乾燥することができる。
【実施例】
【0033】
以下、調製例、実施例及び比較例を示して本発明を具体的に説明するが、本発明は下記の実施例に制限されるものではない。なお、以下の例において用いた原料は、和光純薬工業(株)製の試薬特級品を使用した。
【0034】
[調製例1]K2MnF6の調製
丸善株式会社発行、日本化学会編、新実験化学講座8「無機化合物の合成III」、1977年発行、1166ページ(非特許文献2)に記載されている方法に準拠し、以下の方法で調製した。
【0035】
塩化ビニル樹脂製の反応槽の中央にフッ素樹脂系イオン交換膜の仕切り(隔膜)を設け、イオン交換膜を挟む2室の各々に、いずれも白金板からなる陽極と陰極を設置した。反応槽の陽極側に、フッ化マンガン(II)を溶解させたフッ化水素酸水溶液、陰極側にフッ化水素酸水溶液を入れた。両極を電源につなぎ、電圧3V、電流0.75Aで電解を行った。電解を終えた後、陽極側の反応液に、フッ化水素酸水溶液に飽和させたフッ化カリウムの溶液を過剰に加えた。生成した黄色の固体生成物をろ別、回収し、K2MnF6を得た。
【0036】
[実施例1]
4.8gの二酸化ケイ素を100cm3の48質量%フッ化水素酸水溶液に溶解させ、室温まで放冷し、フッ化ケイ素を含む水溶液を調製した。このフッ化ケイ素を含む水溶液に、調製例1で調製したK2MnF6粉末を1.19g加えて撹拌して溶解させ、フッ化ケイ素とK2MnF6を含む水溶液(第1溶液)を調製した。また、13.95gのフッ化カリウムを40cm3の48質量%フッ化水素酸水溶液に溶解させ、室温まで放冷し、フッ化カリウムを含む水溶液(第2溶液)を調製した。次に、撹拌した第1溶液に、第2溶液を約3分間かけて少しずつ加え、10分間程度撹拌し、淡橙色の固体が生成した。この固体生成物をろ別し、少量の20質量%フッ化水素酸水溶液、次いでエタノールで洗浄し、真空乾燥し、15.64gの反応生成物が得られた。
【0037】
粉末X線回折により、得られた生成物がK2SiF6に対応する結晶構造を有することが確認された。この生成物は、紫外線又は青色光の励起で、赤色の蛍光を示したことから、K2SiF6:Mnで表される蛍光体が得られていることが確認された。
【0038】
得られた蛍光体の発光スペクトル及び励起スペクトルを、蛍光光度計FP6500(日本分光(株)製)で測定した結果を図1に示す。また、量子効率測定装置QE1100(大塚電子(株)製)で測定した励起波長450nmでの吸収率と量子効率を表1に示す。吸収率は0.701、内部量子効率は0.717、外部量子効率(=(吸収率)×(内部量子効率)、以下同じ)は0.503であった。
【0039】
更に、蛍光体の走査型電子顕微鏡写真を図2に示す。蛍光体は、主に約30〜40μm程度の大きさの揃った角型粒子からなっていた。
【0040】
[実施例2]
4.8gの二酸化ケイ素を100cm3の48質量%フッ化水素酸水溶液に溶解させ、室温まで放冷し、フッ化ケイ素を含む水溶液を調製した。このフッ化ケイ素を含む水溶液に、調製例1で調製したK2MnF6粉末を1.19g加えて撹拌して溶解させ、フッ化ケイ素とK2MnF6を含む水溶液(第1溶液)を調製した。また、23.24gのフッ化カリウムを25cm3の水に溶解させ、室温まで放冷し、フッ化カリウムを含む水溶液(第2溶液)を調製した。次に、撹拌した第1溶液に、第2溶液を少しずつ加え、淡橙色の固体が生成した。この固体生成物をろ別し、少量の20質量%フッ化水素酸水溶液、次いでエタノールで洗浄し、真空乾燥し、16.79gの反応生成物が得られた。
【0041】
粉末X線回折により、得られた生成物がK2SiF6に対応する結晶構造を有することが確認された。この生成物は、紫外線又は青色光の励起で、赤色の蛍光を示したことから、K2SiF6:Mnで表される蛍光体が得られていることが確認された。
【0042】
得られた蛍光体の発光スペクトル及び励起スペクトルを実施例1と同様に測定したところ、実施例1と同等のスペクトルが得られた。また、実施例1と同様に測定した励起波長450nmでの吸収率と量子効率を表1に示す。吸収率は0.471、内部量子効率は0.451、外部量子効率は0.212であった。
【0043】
更に、蛍光体の走査型電子顕微鏡写真を図3に示す。蛍光体は、主に約2〜3μm程度の大きさの揃った角型粒子からなっていた。
【0044】
[実施例3]
4.8gの二酸化ケイ素を100cm3の48質量%フッ化水素酸水溶液に溶解させ、室温まで放冷し、フッ化ケイ素を含む水溶液を調製し、これをふた付きの樹脂容器に入れ、70℃に保った水浴中で1時間以上保持し、加温した。このフッ化ケイ素を含む水溶液に、調製例1で調製したK2MnF6粉末を1.19g加えて撹拌して溶解させ、フッ化ケイ素とK2MnF6を含む水溶液(第1溶液)を調製した。また、13.95gのフッ化カリウムを40cm3の48質量%フッ化水素酸水溶液に溶解させ、室温まで放冷し、フッ化カリウムを含む水溶液(第2溶液)を調製した。次に、撹拌した第1溶液に、第2溶液を約2.5分間かけて少しずつ加え、10分間程度撹拌し、淡橙色の固体が生成した。この固体生成物をろ別し、少量の20質量%フッ化水素酸水溶液、次いでエタノールで洗浄し、真空乾燥し、15.18gの反応生成物が得られた。
【0045】
粉末X線回折により、得られた生成物がK2SiF6に対応する結晶構造を有することが確認された。この生成物は、紫外線又は青色光の励起で、赤色の蛍光を示したことから、K2SiF6:Mnで表される蛍光体が得られていることが確認された。
【0046】
得られた蛍光体の発光スペクトル及び励起スペクトルを実施例1と同様に測定したところ、実施例1と同等のスペクトルが得られた。また、実施例1と同様に測定した励起波長450nmでの吸収率と量子効率を表1に示す。吸収率は0.716、内部量子効率は0.801、外部量子効率は0.574であった。
【0047】
更に、蛍光体の走査型電子顕微鏡像を確認した。蛍光体は、主に約20〜50μm程度の角型粒子からなっていた。
【0048】
[実施例4]
二酸化チタン6.39gを30cm3の48質量%フッ化水素酸水溶液と共に、密閉容器に入れ、容器ごと95℃に加熱し18時間保持した後、放冷し、フッ化チタンを含む水溶液を調製した。この水溶液は、完全に透明な溶液になっていた。このフッ化チタンを含む水溶液に、48質量%フッ化水素酸水溶液10cm3を加え、更に、調製例1で調製したK2MnF6粉末を1.19g加えて撹拌して溶解させ、フッ化チタンとK2MnF6を含む水溶液(第1溶液)を調製した。また、13.95gのフッ化カリウムを9cm3の48質量%フッ化水素酸水溶液と40cm3の水とに溶解させ、フッ化カリウムを含む水溶液(第2溶液)を調製した。次に、撹拌した第1溶液に、第2溶液を約1分間かけて少しずつ加え、しばらく撹拌し、淡橙色の固体が生成した。この固体生成物をろ別し、少量の20質量%フッ化水素酸水溶液、次いでエタノールで洗浄し、真空乾燥し、17.04gの反応生成物が得られた。
【0049】
粉末X線回折により、得られた生成物がK2TiF6に対応する結晶構造を有することが確認された。この生成物は、紫外線又は青色光の励起で、赤色の蛍光を示したことから、K2TiF6:Mnで表される蛍光体が得られていることが確認された。
【0050】
得られた蛍光体の発光スペクトル及び励起スペクトルを実施例1と同様に測定した結果を図4に示す。また、実施例1と同様に測定した励起波長450nmでの吸収率と量子効率を表1に示す。吸収率は0.701、内部量子効率は0.320、外部量子効率は0.224であった。
【0051】
更に、蛍光体の走査型電子顕微鏡写真を図5に示す。蛍光体は、主に約50〜70μm程度の大きさの揃った板状粒子からなっていた。
【0052】
[実施例5]
4.8gの二酸化ケイ素を100cm3の48質量%フッ化水素酸水溶液に溶解させ、室温まで放冷し、フッ化ケイ素を含む水溶液を調製した。このフッ化ケイ素を含む水溶液に、調製例1で調製したK2MnF6粉末を1.19g加えて撹拌して溶解させ、フッ化ケイ素とK2MnF6を含む水溶液(第1溶液)を調製した。次に、撹拌した第1溶液に、24.27gの硝酸カリウム(KNO3)の固体を少しずつ加えたところ、淡橙色の固体が生成した。5分間撹拌を続けた後、この固体生成物をろ別し、少量の20質量%フッ化水素酸水溶液、次いでエタノールで洗浄し、真空乾燥し、17.61gの反応生成物が得られた。
【0053】
粉末X線回折により、得られた生成物がK2SiF6に対応する結晶構造を有することが確認された。この生成物は、紫外線又は青色光の励起で、赤色の蛍光を示したことから、K2SiF6:Mnで表される蛍光体が得られていることが確認された。
【0054】
得られた蛍光体の発光スペクトル及び励起スペクトルを実施例1と同様に測定したところ、実施例1と同等のスペクトルが得られた。また、実施例1と同様に測定した励起波長450nmでの吸収率と量子効率を表1に示す。吸収率は0.499、内部量子効率は0.555、外部量子効率は0.277であった。
【0055】
更に、蛍光体の走査型電子顕微鏡像を確認した。蛍光体は、主に約10μm程度の大きさの角型粒子からなっていた。
【0056】
[実施例6]
実施例5と同じ原料を用い、同様の操作により、フッ化ケイ素とK2MnF6を含む水溶液(第1溶液)を調製した。また、13.46gの水酸化カリウム(KOH)を30cm3の水に溶解させ、カリウムを含む水溶液(第2溶液)を調製した。次に、撹拌した第1溶液に、第2溶液を約1分間かけて少しずつ加え、しばらく撹拌し、淡橙色の固体が生成した。この固体生成物をろ別し、少量の20質量%フッ化水素酸水溶液、次いでエタノールで洗浄し、真空乾燥し、16.72gの反応生成物が得られた。
【0057】
粉末X線回折により、得られた生成物がK2SiF6に対応する結晶構造を有することが確認された。この生成物は、紫外線又は青色光の励起で、赤色の蛍光を示したことから、K2SiF6:Mnで表される蛍光体が得られていることが確認された。
【0058】
得られた蛍光体の発光スペクトル及び励起スペクトルを実施例1と同様に測定したところ、実施例1と同等のスペクトルが得られた。また、実施例1と同様に測定した励起波長450nmでの吸収率と量子効率を表1に示す。吸収率は0.494、内部量子効率は0.493、外部量子効率は0.243であった。
【0059】
更に、蛍光体の走査型電子顕微鏡像を確認した。蛍光体は、主に約10μm程度の大きさの角型粒子からなっていた。
【0060】
[実施例7]
実施例5と同じ原料を用い、同様の操作により、フッ化ケイ素とK2MnF6を含む水溶液(第1溶液)を調製した。次に、撹拌した第1溶液に、17.04gの硫酸ナトリウム(Na2SO4)の固体を少しずつ加えたところ、淡橙色の固体が生成した。5分間撹拌を続けた後、この固体生成物をろ別し、少量の20質量%フッ化水素酸水溶液、次いでエタノールで洗浄し、真空乾燥し、15.17gの反応生成物が得られた。
【0061】
粉末X線回折により、得られた生成物がNa2SiF6に対応する結晶構造を有することが確認された。この生成物は、紫外線又は青色光の励起で、赤色の蛍光を示したことから、Na2SiF6:Mnで表される蛍光体が得られていることが確認された。
【0062】
得られた蛍光体の発光スペクトル及び励起スペクトルを実施例1と同様に測定した結果を図6に示す。また、実施例1と同様に測定した励起波長450nmでの吸収率と量子効率を表1に示す。吸収率は0.431、内部量子効率は0.675、外部量子効率は0.291であった。
【0063】
更に、蛍光体の走査型電子顕微鏡像を確認した。蛍光体は、主に約10〜20μm程度の大きさの角型粒子からなっていた。
【0064】
[実施例8]
実施例5と同じ原料を用い、同様の操作により、フッ化ケイ素とK2MnF6を含む水溶液(第1溶液)を調製した。次に、撹拌した第1溶液に、12.72gの炭酸ナトリウム(Na2CO3)の固体を、発泡に気をつけながら約2分間かけて少しずつ加えたところ、淡橙色の固体が生成し、発熱により温度が約50℃に上昇した。5分間撹拌を続けた後、この固体生成物をろ別し、少量の20質量%フッ化水素酸水溶液、次いでエタノールで洗浄し、真空乾燥し、15.02gの反応生成物が得られた。
【0065】
粉末X線回折により、得られた生成物がNa2SiF6に対応する結晶構造を有することが確認された。この生成物は、紫外線又は青色光の励起で、赤色の蛍光を示したことから、Na2SiF6:Mnで表される蛍光体が得られていることが確認された。
【0066】
得られた蛍光体の発光スペクトル及び励起スペクトルを実施例1と同様に測定したところ、実施例7と同等のスペクトルが得られた。また、実施例1と同様に測定した励起波長450nmでの吸収率と量子効率を表1に示す。吸収率は0.243、内部量子効率は0.650、外部量子効率は0.158であった。
【0067】
更に、蛍光体の走査型電子顕微鏡像を確認した。蛍光体は、主に約10〜20μm程度の大きさの角型粒子からなっていた。
【0068】
[比較例1]
二酸化チタン40.0gを、100cm3の48質量%フッ化水素酸水溶液及び50cm3の水と共に、フッ素樹脂で内張りされた容器に入れ、95℃で10時間加熱して溶解させて水溶液とした。得られた水溶液に、56.1gの水酸化カリウムを100cm3の水に溶解させた液を加えたところ、固体が生成した。この固体生成物をろ別、乾燥した。粉末X線回折により、得られた生成物がK2TiF6の結晶構造を有することが確認され、K2TiF6が得られていることが確認された。
【0069】
次に、得られたK2TiF6を15.43gと、調製例1で調製したK2MnF6粉末1.27gとを、135cm3の48質量%フッ化水素酸水溶液と27cm3の水とを加えて溶解させたところ、橙色の水溶液が得られた。この水溶液をフッ素樹脂製の蒸発皿に入れ、ドラフト内で、水浴で加熱して濃縮した。5時間加熱したところ、液は濃い赤褐色に変わり、液の表面がうっすら濁ったところで加熱をやめ、一夜放冷したところ、淡黄色の結晶が析出した。この固体生成物をろ別し、少量の20質量%フッ化水素酸水溶液、次いでエタノールで洗浄し、真空乾燥し、9.75gの反応生成物が得られた。
【0070】
粉末X線回折により、得られた生成物がK2TiF6に対応する結晶構造を有することが確認された。この生成物は、紫外線又は青色光の励起で、赤色の蛍光を示したことから、K2TiF6:Mnで表される蛍光体が得られていることが確認された。
【0071】
得られた蛍光体の発光スペクトル及び励起スペクトルを実施例1と同様に測定したところ、実施例4に類似するプロファイルのスペクトルが得られた。また、実施例1と同様に測定した励起波長450nmでの吸収率と量子効率を表1に示す。吸収率は0.828、内部量子効率は0.254、外部量子効率は0.210であった。
【0072】
更に、蛍光体の走査型電子顕微鏡写真を図7に示す。蛍光体は、小さいものは1μm程度から大きいものは100μmを超える不定形の粒子からなっていた。
【0073】
[比較例2]
33質量%ヘキサフルオロケイ酸水溶液45.9gに、11.8gの水酸化カリウムを加えた。この時点で液全体は白く濁っていたが、200cm3の48質量%フッ化水素酸水溶液と40cm3の水を加えたところ透明な水溶液になった。
【0074】
次に、得られた水溶液に、調製例1で調製したK2MnF6粉末を1.27g加えて溶解させたところ、橙色の水溶液が得られた。この水溶液を比較例1と同様に加熱、濃縮し、液の表面がうっすら濁ったところで加熱をやめ、一夜放冷したところ、淡黄色の結晶が析出した。この固体生成物をろ別し、少量の20質量%フッ化水素酸水溶液、次いでエタノールで洗浄し、真空乾燥し、19.32gの反応生成物が得られた。
【0075】
粉末X線回折により、得られた生成物がK2SiF6に対応する結晶構造を有することが確認された。この生成物は、紫外線又は青色光の励起で、赤色の蛍光を示したことから、K2SiF6:Mnで表される蛍光体が得られていることが確認された。
【0076】
得られた蛍光体の発光スペクトル及び励起スペクトルを実施例1と同様に測定したところ、実施例1に類似するプロファイルのスペクトルが得られた。また、実施例1と同様に測定した励起波長450nmでの吸収率と量子効率を表1に示す。吸収率は0.300、内部量子効率は0.450、外部量子効率は0.135であった。
【0077】
更に、蛍光体の走査型電子顕微鏡写真を図8に示す。蛍光体は、小さいものは1μm程度から大きいものは50μm程度までの不定形の粒子からなっていた。
【0078】
[比較例3]
実施例2と同様にして第1溶液を調製した。また、フッ化カリウムに代えて、17.89gの塩化カリウムを用いた以外は実施例2と同様にして、塩化カリウムを含む水溶液(第2溶液)を調製した。次に、撹拌した第1溶液に、第2溶液を少しずつ加えたところ、第2溶液を加えるにつれて、液の色が赤褐色を経て小豆色へと変化し、ほぼ白色の固体が生成した。この固体生成物をろ別し、少量の20質量%フッ化水素酸水溶液、次いでエタノールで洗浄し、真空乾燥し、16.12gの反応生成物が得られた。
【0079】
粉末X線回折により、得られた生成物がK2SiF6に対応する結晶構造を有することが確認された。この生成物は、紫外線又は青色光の励起で、ほとんど蛍光を示さなかった。そこで、電子線マイクロアナライザーによってMnを分析したところ、Mnの含有量は極わずかであることが確認された。
【0080】
【表1】

【特許請求の範囲】
【請求項1】
下記式(1)
A2MF6 (1)
(式中、MはSi、Ti、Zr、Hf、Ge及びSnから選ばれる1種又は2種以上の4価元素、AはLi、Na、K、Rb及びCsから選ばれる1種又は2種以上のアルカリ金属である)
で表される複フッ化物を製造する方法であって、
上記4価元素Mのフッ化物を含む第1の溶液、及び
上記アルカリ金属Aのフッ化物、フッ化水素塩、硝酸塩、硫酸塩、硫酸水素塩、炭酸塩、炭酸水素塩及び水酸化物から選ばれる化合物を含む第2の溶液及び/又は該アルカリ金属Aの化合物の固体
の各々を準備する工程、
上記第1の溶液と上記第2の溶液及び/又は固体とを混合して、上記4価元素Mのフッ化物と上記アルカリ金属Aの化合物とを反応させる工程、及び
反応により生じた固体生成物を固液分離して回収する工程
を含むことを特徴とする複フッ化物の製造方法。
【請求項2】
上記4価元素MがSi及び/又はTiであり、上記アルカリ金属AがNa及び/又はKであることを特徴とする請求項1記載の複フッ化物の製造方法。
【請求項3】
下記式(2)
A12MF6:Mn (2)
(式中、MはSi、Ti、Zr、Hf、Ge及びSnから選ばれる1種又は2種以上の4価元素、A1はLi、Na、K、Rb及びCsから選ばれ、かつ少なくともNa及び/又はKを含む1種、2種又は3種以上のアルカリ金属である)
で表される複フッ化物蛍光体を製造する方法であって、
上記4価元素Mのフッ化物を含む第1の溶液、及び
アルカリ金属A(AはLi、Na、K、Rb及びCsから選ばれる1種又は2種以上)のフッ化物、フッ化水素塩、硝酸塩、硫酸塩、硫酸水素塩、炭酸塩、炭酸水素塩及び水酸化物から選ばれる化合物を含む第2の溶液及び/又は該アルカリ金属Aの化合物の固体
の各々を、上記第1の溶液と上記第2の溶液及び/又は固体との、少なくとも一方に、Na2MnF6又はK2MnF6で表されるマンガン化合物の少なくとも一方を添加して、準備する工程、
上記第1の溶液と上記第2の溶液及び/又は固体とを混合して、上記4価元素Mのフッ化物と上記アルカリ金属Aの化合物と上記マンガン化合物とを反応させる工程、及び
反応により生じた固体生成物を固液分離して回収する工程
を含むことを特徴とする複フッ化物蛍光体の製造方法。
【請求項4】
上記4価元素MがSi及び/又はTiであり、上記アルカリ金属AがNa及び/又はKであることを特徴とする請求項3記載の複フッ化物蛍光体の製造方法。
【請求項5】
上記第2の溶液及び/又は固体が、フッ化アルカリAF(式中、AはLi、Na、K、Rb及びCsから選ばれる1種又は2種以上のアルカリ金属である)を含む溶液及び/又は該フッ化アルカリAFの固体であることを特徴とする請求項3又は4記載の複フッ化物蛍光体の製造方法。
【請求項1】
下記式(1)
A2MF6 (1)
(式中、MはSi、Ti、Zr、Hf、Ge及びSnから選ばれる1種又は2種以上の4価元素、AはLi、Na、K、Rb及びCsから選ばれる1種又は2種以上のアルカリ金属である)
で表される複フッ化物を製造する方法であって、
上記4価元素Mのフッ化物を含む第1の溶液、及び
上記アルカリ金属Aのフッ化物、フッ化水素塩、硝酸塩、硫酸塩、硫酸水素塩、炭酸塩、炭酸水素塩及び水酸化物から選ばれる化合物を含む第2の溶液及び/又は該アルカリ金属Aの化合物の固体
の各々を準備する工程、
上記第1の溶液と上記第2の溶液及び/又は固体とを混合して、上記4価元素Mのフッ化物と上記アルカリ金属Aの化合物とを反応させる工程、及び
反応により生じた固体生成物を固液分離して回収する工程
を含むことを特徴とする複フッ化物の製造方法。
【請求項2】
上記4価元素MがSi及び/又はTiであり、上記アルカリ金属AがNa及び/又はKであることを特徴とする請求項1記載の複フッ化物の製造方法。
【請求項3】
下記式(2)
A12MF6:Mn (2)
(式中、MはSi、Ti、Zr、Hf、Ge及びSnから選ばれる1種又は2種以上の4価元素、A1はLi、Na、K、Rb及びCsから選ばれ、かつ少なくともNa及び/又はKを含む1種、2種又は3種以上のアルカリ金属である)
で表される複フッ化物蛍光体を製造する方法であって、
上記4価元素Mのフッ化物を含む第1の溶液、及び
アルカリ金属A(AはLi、Na、K、Rb及びCsから選ばれる1種又は2種以上)のフッ化物、フッ化水素塩、硝酸塩、硫酸塩、硫酸水素塩、炭酸塩、炭酸水素塩及び水酸化物から選ばれる化合物を含む第2の溶液及び/又は該アルカリ金属Aの化合物の固体
の各々を、上記第1の溶液と上記第2の溶液及び/又は固体との、少なくとも一方に、Na2MnF6又はK2MnF6で表されるマンガン化合物の少なくとも一方を添加して、準備する工程、
上記第1の溶液と上記第2の溶液及び/又は固体とを混合して、上記4価元素Mのフッ化物と上記アルカリ金属Aの化合物と上記マンガン化合物とを反応させる工程、及び
反応により生じた固体生成物を固液分離して回収する工程
を含むことを特徴とする複フッ化物蛍光体の製造方法。
【請求項4】
上記4価元素MがSi及び/又はTiであり、上記アルカリ金属AがNa及び/又はKであることを特徴とする請求項3記載の複フッ化物蛍光体の製造方法。
【請求項5】
上記第2の溶液及び/又は固体が、フッ化アルカリAF(式中、AはLi、Na、K、Rb及びCsから選ばれる1種又は2種以上のアルカリ金属である)を含む溶液及び/又は該フッ化アルカリAFの固体であることを特徴とする請求項3又は4記載の複フッ化物蛍光体の製造方法。
【図1】


【図4】


【図6】


【図2】


【図3】


【図5】


【図7】


【図8】




【図4】


【図6】


【図2】


【図3】


【図5】


【図7】


【図8】


【公開番号】特開2012−224536(P2012−224536A)
【公開日】平成24年11月15日(2012.11.15)
【国際特許分類】
【出願番号】特願2012−73305(P2012−73305)
【出願日】平成24年3月28日(2012.3.28)
【出願人】(000002060)信越化学工業株式会社 (3,361)
【Fターム(参考)】
【公開日】平成24年11月15日(2012.11.15)
【国際特許分類】
【出願日】平成24年3月28日(2012.3.28)
【出願人】(000002060)信越化学工業株式会社 (3,361)
【Fターム(参考)】
[ Back to top ]

