複合ナノ粒子およびその製造方法、釉薬ならびに金属ナノ粒子の製造方法
【課題】反応性の高い金属を用いた場合であっても、当該金属を安定な状態に保つことができ、しかも、容易に製造することができる複合ナノ粒子及びその製造方法並びに低火度や中火度での酸化焼成であっても赤色に発色させることができる釉薬を提供する。
【解決手段】金属に結合する官能基およびシリカに結合する官能基を有する化合物12からなる分散剤と溶媒と金属イオン供与体とを含む液体中において、金属イオン供与体に由来する金属イオンの活量を制御しながら金属イオンを生じさせ、さらに還元させて金属ナノ粒子11を析出させる。つぎに、縮重合によってシリカネットワークを形成するシリカ前駆体化合物を用いて金属ナノ粒子11上にシリカを形成させ、複合ナノ粒子1a又は複合ナノ粒子。釉薬の色材として、複合ナノ粒子1a又は複合ナノ粒子を用いる。
【解決手段】金属に結合する官能基およびシリカに結合する官能基を有する化合物12からなる分散剤と溶媒と金属イオン供与体とを含む液体中において、金属イオン供与体に由来する金属イオンの活量を制御しながら金属イオンを生じさせ、さらに還元させて金属ナノ粒子11を析出させる。つぎに、縮重合によってシリカネットワークを形成するシリカ前駆体化合物を用いて金属ナノ粒子11上にシリカを形成させ、複合ナノ粒子1a又は複合ナノ粒子。釉薬の色材として、複合ナノ粒子1a又は複合ナノ粒子を用いる。
【発明の詳細な説明】
【技術分野】
【0001】
本発明は、複合ナノ粒子およびその製造方法、釉薬ならびに金属ナノ粒子の製造方法に関する。
【背景技術】
【0002】
陶磁器に用いられている釉薬の1つとして、赤色を呈する辰砂釉が知られている。前記辰砂釉は、酸化第二銅を含有している。前記辰砂釉を1250℃付近の高火度で、還元焼成すると、前記辰砂釉に含まれる酸化第二銅が還元され、金属銅が生じる。これにより、辰砂釉は、赤色を呈する。
しかしながら、還元焼成は、一酸化炭素ガスを含む還元雰囲気下に高火度で行なわれることから、細心の注意を要する。
【0003】
ところで、金属ナノ粒子は、当該金属ナノ粒子を構成する金属の種類によって、金属のバルク材料とは異なる物性を示す。したがって、金属ナノ粒子は、触媒、紫外線遮蔽剤、電子部品、光学部品、発光材料、塗料、磁性材料などの材料として種々の工業分野での利用が期待されている。
【0004】
金属ナノ粒子を製造する方法として、液相還元法(例えば、特許文献1などを参照)が提案されている。かかる液相還元法は、液相中で還元剤によって金属イオンを還元する方法である。
【0005】
ところが、金属ナノ粒子は、表面積が大きいため、一般的に凝集しやすい傾向にあるため、分離した状態で単離することが困難である。そこで、金属ナノ粒子同士の凝集を抑制し、保護剤によって金属ナノ粒子の表面を被覆して、金属ナノ粒子同士の凝集を抑制する方法が提案されている。
【先行技術文献】
【特許文献】
【0006】
【特許文献1】特開2010−31354号公報
【発明の概要】
【発明が解決しようとする課題】
【0007】
しかしながら、銅や銀などのように酸素などの外部環境要因との反応性の高い金属の場合、金属ナノ粒子の表面に酸化物が生じやすく、保護剤による被覆が困難である。そのため、このような金属を含むナノ粒子の製造には、複雑な操作を要する。また、反応性の高い金属の場合、長期間にわたって金属ナノ粒子を安定な状態に保つことが困難である。
したがって、反応性の高い金属を用いた場合であっても、当該金属を安定な状態に保つことができ、しかも、容易に製造することができる複合ナノ粒子が望まれている。
【0008】
本発明は、このような事情に鑑みてなされたものであり、反応性の高い金属を用いた場合であっても、当該金属を安定な状態に保つことができ、しかも、容易に製造することができる複合ナノ粒子およびその製造方法、低火度や中火度での酸化焼成であっても赤色に発色させることができる釉薬ならびに簡便な操作で、金属ナノ粒子を容易に製造することができる金属ナノ粒子の製造方法を提供することを目的とする。
【課題を解決するための手段】
【0009】
本発明の複合ナノ粒子の製造方法は、金属ナノ粒子と当該金属ナノ粒子上に形成されたシリカとを含み、前記金属ナノ粒子がシリカで覆われている複合ナノ粒子を製造する方法であって、
(I)金属に結合する官能基およびシリカに結合する官能基を有する化合物からなる分散剤と溶媒と金属イオン供与体とを含む液体中において、前記金属イオン供与体に由来する金属イオンの活量を制御しながら前記金属イオンを生じさせ、当該金属イオンを還元させて金属ナノ粒子を析出させ、金属ナノ粒子を含む分散液を得る工程、および
(II)前記工程(I)で得られた分散液に、縮重合によってシリカネットワークを形成するシリカ前駆体化合物を添加し、前記金属ナノ粒子上にシリカを形成させる工程
を含むことを特徴としている。
【0010】
本発明の複合ナノ粒子の製造方法では、前記液体中で金属イオンの活量を制御しながら当該金属イオンを生じさせるとともに還元させ、析出させた金属ナノ粒子を含む分散液にシリカ前駆体化合物を添加することにより、金属ナノ粒子上にシリカを形成させている。これにより、金属ナノ粒子の大きさを容易に制御することができ、かつ金属ナノ粒子を、迅速かつ簡便な操作で、シリカで覆うことができる。したがって、反応性の高い金属を用いた場合であっても、当該金属を安定な状態に保つことができ、しかも、容易に製造することができる。
【0011】
本発明の複合ナノ粒子の製造方法では、前記分散剤は、ゼラチン、ポリビニルアルコール、オレイン酸およびポリエチレングリコールからなる群より選ばれた少なくとも1種の化合物からなることが好ましい。これにより、析出させた金属ナノ粒子同士の凝集を効果的に抑制することができる。金属ナノ粒子同士の凝集を抑制し、かつ金属ナノ粒子上におけるシリカの形成を効率よく行なう観点から、ゼラチンからなることがより好ましい。
【0012】
本発明の複合ナノ粒子の製造方法では、前記工程(I)および前記工程(II)を、不活性ガス通気条件下で実施してもよい。これにより、例えば、金属ナノ粒子が酸化しやすい金属からなるナノ粒子である場合であっても、当該金属を安定な状態に保つことができ、複合ナノ粒子を容易に製造することができる。
【0013】
本発明の複合ナノ粒子の製造方法では、前記金属イオン供与体として、前記溶媒に難溶性で、かつ前記溶媒のpHとは異なるpH条件下で金属イオンを徐放する金属化合物を用い、前記工程(I)において、pH調整剤によって前記液体のpHを前記溶媒のpHとは異なるpHに調整して金属イオンの活量を制御しながら前記金属イオンを生成させることができる。これにより、析出させる金属ナノ粒子の大きさを容易に制御することができ、効率よく金属ナノ粒子を得ることができる。
【0014】
本発明の複合ナノ粒子の製造方法では、前記金属化合物が、アルカリ性条件下で金属イオンを徐放する金属化合物であってもよく、前記pH調整剤が、前記金属イオンに対応する金属との錯体を形成しないアルカリであってもよい。これにより、金属ナノ粒子が複数個のシリカナノ粒子によって覆われた複合ナノ粒子を得ることができる。
この場合、球状の小さなシリカナノ粒子を形成させる観点から、前記pH調整剤がアルカリ金属水酸化物またはアルカリ土類金属水酸化物であることが好ましい。
【0015】
本発明の複合ナノ粒子の製造方法では、前記溶媒として、水、前記金属イオン供与体として、酸化第二銅および前記pH調整剤として、水酸化ナトリウムを用いてもよい。これにより、酸化しやすい銅ナノ粒子が複数個のシリカナノ粒子によって覆われた複合ナノ粒子を容易に得ることができる。
【0016】
本発明の複合ナノ粒子の製造方法では、前記金属イオン供与体として、前記溶媒のpHとは異なるpH条件下で金属イオンを徐放する金属錯体を用い、前記工程(I)において、pH調整剤によって前記液体のpHを前記溶媒のpHとは異なるpHに調整して金属イオンの活量を制御しながら前記金属イオンを生成させることができる。これにより、金属ナノ粒子がシリカからなる層によって覆われた複合ナノ粒子を得ることができる。
この場合、前記金属イオン供与体として、銅錯体を用い、かつ前記pH調整剤として、アンモニア水溶液を用いてもよい。これにより、酸化しやすい銅ナノ粒子がシリカからなる層によって覆われた複合ナノ粒子を容易に得ることができる。
【0017】
また、本発明の複合ナノ粒子の製造方法では、前記工程(I)において、分散剤および溶媒の存在下に、金属と、当該金属と錯体を形成するpH調整剤とを当該pH調整剤が前記金属に対して過剰量となるように混合することにより、金属錯体を生成させるとともに、前記金属錯体に由来する金属イオンの活量を制御しながら前記金属イオンを生成させてもよい。これにより、金属ナノ粒子がシリカからなる層によって覆われた複合ナノ粒子を得ることができる。
この場合、前記金属は、銅であってもよい。これにより、酸化しやすい銅ナノ粒子がシリカからなる層によって覆われた複合ナノ粒子を容易に得ることができる。
【0018】
本発明の複合ナノ粒子は、1つの側面では、前述した方法を行なうことにより得られる複合ナノ粒子である。
また、本発明の複合ナノ粒子は、他の側面では、金属ナノ粒子と、当該金属ナノ粒子上に形成されたシリカとを含む複合ナノ粒子であって、前記金属ナノ粒子が複数個のシリカナノ粒子によって覆われていることを特徴とする複合ナノ粒子である。前記金属ナノ粒子は、銅ナノ粒子であってもよい。
【0019】
本発明の複合ナノ粒子は、前記金属ナノ粒子が前記シリカによって覆われて外部環境から保護されているため、前記金属ナノ粒子が反応性の高い金属からなるナノ粒子であったとしても、安定な状態に保つことができる。
【0020】
本発明の釉薬は、焼成により赤色を呈する釉薬であって、前述した複合ナノ粒子のうち金属ナノ粒子が銅ナノ粒子である複合ナノ粒子と、金属ケイ素または酒石酸ナトリウムカリウムとを含有することを特徴としている。
【0021】
本発明の釉薬は、前記複合ナノ粒子と金属ケイ素または酒石酸ナトリウムカリウムとを含有するため、低火度や中火度での酸化焼成であっても赤色に発色させることができる。したがって、本発明の釉薬は、例えば、従来の赤色釉薬である辰砂釉のように、高火度での還元焼成を行なわなくてもよいため、取り扱いやすい。
【0022】
本発明の金属ナノ粒子の製造方法は、分散剤と溶媒と金属錯体とを含む溶液中において、金属錯体に由来する金属イオンの活量を制御しながら前記金属イオンを生じさせた後、前記金属イオンを還元させて金属ナノ粒子を析出させることを特徴としている。
本発明の金属ナノ粒子の製造方法では、分散剤および溶媒の存在下に、金属と、当該金属と錯体を形成するアルカリとを当該アルカリが前記金属に対して過剰量となるように混合することにより、金属錯体を形成させるとともに、前記金属錯体に由来する金属イオンの活量を制御しながら前記金属イオンを生じさせた後、前記金属イオンを還元させて金属ナノ粒子を析出させてもよい。
【0023】
本発明の金属ナノ粒子の製造方法では、前記液体中で金属イオンの活量を制御しながら当該金属イオンを生じさせるとともに還元させ、金属ナノ粒子を析出させている。したがって、簡便な操作で、金属ナノ粒子を製造することができ、しかも、金属ナノ粒子の大きさを容易に制御することができる。
【発明の効果】
【0024】
本発明の複合ナノ粒子およびその製造方法は、反応性の高い金属を用いた場合であっても、当該金属を安定な状態に保つことができ、しかも、容易に製造することができるという優れた効果を奏する。また、本発明の釉薬は、低火度や中火度での酸化焼成であっても赤色に発色させることができるという優れた効果を奏する。また、本発明の金属ナノ粒子の製造方法は、簡便な操作で、金属ナノ粒子を製造することができるという優れた効果を奏する。
【図面の簡単な説明】
【0025】
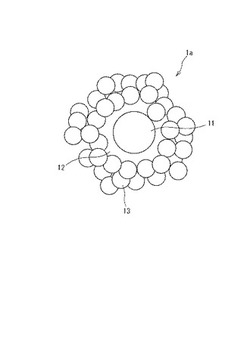
【図1】本発明の一実施形態に係る複合ナノ粒子(第1実施形態)の構造を示す概略説明図である。
【図2】本発明の他の実施形態に係る複合ナノ粒子(第2実施形態)の構造を示す概略説明図である。
【図3】本発明に係る複合ナノ粒子の製造方法の処理手順を示す工程図である。
【図4】本発明の一実施形態に係る複合ナノ粒子の製造方法(第1の方法)の処理手順を示す工程図である。
【図5】本発明の一実施形態に係る複合ナノ粒子の製造方法(第1の方法)における分散液調製工程の処理手順の一部を示す工程図である。
【図6】本発明の一実施形態に係る複合ナノ粒子の製造方法(第1の方法)における分散液調製工程の処理手順の一部を示す工程図である。
【図7】本発明の一実施形態に係る複合ナノ粒子の製造方法(第1の方法)における金属ナノ粒子析出工程を示す概略説明図である。
【図8】本発明の他の実施形態に係る複合ナノ粒子の製造方法(第2の方法)の処理手順を示す工程図である。
【図9】本発明の他の実施形態に係る複合ナノ粒子の製造方法(第2の方法)における金属錯体含有溶液調製工程の処理手順の一部を示す工程図である。
【図10】本発明の他の実施形態に係る複合ナノ粒子の製造方法(第2の方法)における金属錯体含有溶液調製工程の処理手順の一部を示す工程図である。
【図11】実施例1において、得られた産物のX線回折パターンを調べた結果を示すグラフである。
【図12】(a)は実施例1(1)において、得られた産物の沈殿物を走査型電子顕微鏡で観察した結果を示す図面代用写真、(b)は実施例1(1)において、得られた産物の上澄みを走査型電子顕微鏡で観察した結果を示す図面代用写真である。
【図13】実施例1(1)において、得られた産物の可視光吸収スペクトルを測定した結果を示すグラフである。
【図14】実施例1(2)において、得られた産物のX線回折パターンを調べた結果を示すグラフである。
【図15】(a)および(b)は、実施例1(2)において、得られた産物に含まれる粒子を透過型電子顕微鏡で観察した結果を示す図面代用写真である。
【図16】試験例1において、実施例1で得られた複合ナノ粒子(下段のパターン)および比較例1で得られた銅ナノ粒子(上段のパターン)それぞれのX線回折パターンを調べた結果を示すグラフである。
【図17】試験例3において、実施例3で得られた釉薬を施釉し、焼成したテストピースのX線回折パターンを調べた結果を示すグラフである。
【図18】試験例3において、実施例3で得られた釉薬を施釉し、焼成したテストピースの反射スペクトルを調べた結果を示すグラフである。
【図19】試験例4において、実施例4および5ならびに比較例5〜8で得られた各釉薬を施釉し、焼成したテストピースの表面の釉薬のL*a*b*表色系色度を調べた結果を示すグラフである。
【図20】実施例15において、得られた産物に含まれる粒子を透過型電子顕微鏡で観察した結果を示す図面代用写真である。
【図21】試験例7において、実施例16〜18で得られた各釉薬を施釉し、焼成したテストピースの表面の釉薬のL*a*b*表色系色度を調べた結果を示すグラフである。
【発明を実施するための形態】
【0026】
[複合ナノ粒子]
(1)第1実施形態
本発明の一実施形態に係る複合ナノ粒子は、1つの側面では金属ナノ粒子と、当該金属ナノ粒子上に形成されたシリカとを含む複合ナノ粒子であって、前記金属ナノ粒子が複数個のシリカナノ粒子によって覆われていることを特徴とする複合ナノ粒子である。
【0027】
図1は、本発明の一実施形態に係る複合ナノ粒子(第1実施形態)の構造を示す概略説明図である。
図1に示される複合ナノ粒子1aは、金属ナノ粒子11と、複数個のシリカナノ粒子13とを含有している。複合ナノ粒子1aにおいて、金属ナノ粒子11上には、金属ナノ粒子11を覆うように複数個のシリカナノ粒子13が形成されている。これより、金属ナノ粒子11は、当該金属ナノ粒子11の周囲に存在するシリカナノ粒子13によって、外部環境から保護された状態となっている。したがって、複合ナノ粒子1aでは、金属ナノ粒子11が反応性の高い金属からなるナノ粒子であったとしても当該金属ナノ粒子11が安定な状態に保たれる。
【0028】
なお、本明細書において、「金属」の概念には、いわゆる合金も包含される。
【0029】
金属ナノ粒子11を構成する金属としては、例えば、銅、銀、ニッケル、金、白金、コバルトなどが挙げられるが、本発明は、かかる例示のみに限定されるものではない。例えば、金属ナノ粒子11を構成する金属として、銅が用いられた複合ナノ粒子(すなわち、金属ナノ粒子11が、銅ナノ粒子である複合ナノ粒子)は、赤色を呈する釉薬の色材などとして用いることができる点で有用である。
【0030】
金属ナノ粒子11の粒子径は、複合ナノ粒子1aの用途などによって異なるので、かかる用途などに応じて決定されることが望ましい。前記粒子径は、通常、5nm〜500nmである。
【0031】
複合ナノ粒子1a中において、シリカナノ粒子13の量は、金属ナノ粒子11の種類や粒子径、複合ナノ粒子1aの用途などによって異なるので、かかる用途などに応じて決定されることが望ましい。通常、金属ナノ粒子1molあたりのシリカナノ粒子13の量が、1mol〜25molである。
なお、本明細書において、「複数個のシリカナノ粒子」は、複合ナノ粒子1aにおいて、金属ナノ粒子1molあたりの量が1mol〜25molとなる個数のシリカナノ粒子であればよい。
【0032】
シリカナノ粒子13の粒子径は、複合ナノ粒子1aの用途などによって異なるので、かかる用途などに応じて決定されることが望ましい。前記粒子径は、通常、金属ナノ粒子の粒子径よりも小さい粒子径である。
【0033】
かかる複合ナノ粒子1aにおいては、図1に示されるように、シリカナノ粒子13は、後述の複合ナノ粒子の製造方法において分散剤として用いられる化合物(金属に結合する官能基とシリカに結合する官能基とを有する化合物12)を介して金属ナノ粒子11上に形成されていてもよい。
前記化合物12における金属に結合する官能基としては、例えば、チオール基、水酸基、アミノ基などが挙げられるが、本発明は、かかる例示のみに限定されるものではない。
また、前記化合物12におけるシリカに結合する官能基としては、例えば、水酸基などが挙げられるが、本発明は、かかる例示のみに限定されるものではない。
前記化合物12としては、例えば、ゼラチン、ポリビニルアルコール、オレイン酸、ポリエチレングリコール、メチルセルロース、カルボキシメチルセルロースなどが挙げられるが、本発明は、かかる例示のみに限定されるものではない。金属ナノ粒子およびシリカナノ粒子それぞれに効果的に結合することができることから、ゼラチン、ポリビニルアルコール、オレイン酸およびポリエチレングリコールからなる群より選ばれた少なくとも1種が好ましく、ゼラチンがより好ましい。
【0034】
第1実施形態に係る複合ナノ粒子は、他の側面では、後述の複合ナノ粒子の製造方法(第1の方法)により得られるものであってもよい。
【0035】
以上のように、第1実施形態に係る複合ナノ粒子は、金属ナノ粒子が複数個のシリカナノ粒子によって覆われている構造を有することから、金属ナノ粒子が外部環境要因から保護された状態となっている。したがって、本発明の複合ナノ粒子は、金属ナノ粒子の機能などを安定な状態に保つことができるので、例えば、触媒、紫外線遮蔽剤、電子部品、光学部品、発光材料、塗料、磁性材料などの種々の分野に有用である。なお、本発明の複合ナノ粒子の用途は、かかる例示のみに限定されるものではない。
【0036】
(2)第2実施形態
本発明の他の実施形態に係る複合ナノ粒子は、1つの側面では、金属ナノ粒子と、当該金属ナノ粒子上に形成されたシリカとを含む複合ナノ粒子であって、前記金属ナノ粒子がシリカからなるシリカ層によって覆われていることを特徴とする複合ナノ粒子である。
図2は、本発明の一実施形態に係る複合ナノ粒子(第2実施形態)の構造を示す概略説明図である。
図2に示される複合ナノ粒子1bは、金属ナノ粒子11と、当該金属ナノ粒子11を覆うように金属ナノ粒子11上に形成されたシリカ(シリカ層14)とを含む。これより、複合ナノ粒子1b中の金属ナノ粒子11は、当該金属ナノ粒子11の周囲に存在するシリカからなるシリカ層14によって、複合ナノ粒子1aの金属ナノ粒子11と比べて、より確実に外部環境から保護された状態となっている。したがって、複合ナノ粒子1bは、金属ナノ粒子11が反応性の高い金属からなるナノ粒子である場合に有利である。
かかる反応性の高い金属としては、例えば、銅、銀、鉄、コバルト、ニッケル、スズなどが挙げられる。
【0037】
複合ナノ粒子1bにおける金属ナノ粒子11を構成する金属の種類および金属ナノ粒子11の粒子径は、前記複合ナノ粒子1aにおける金属ナノ粒子11を構成する金属の種類および金属ナノ粒子11の粒子径と同様である。
【0038】
シリカ層14の厚さは、複合ナノ粒子1bの用途などによって異なるので、一概には決定することができない。したがって、シリカ層14の厚さは、かかる用途などに応じて決定されることが望ましい。
【0039】
かかる複合ナノ粒子1bにおいては、図2に示されるように、シリカ層14は、後述の複合ナノ粒子の製造方法(第2の方法)において分散剤として用いられる化合物(金属に結合する官能基とシリカに結合する官能基とを有する化合物12)を介して金属ナノ粒子11上に形成されていてもよい。複合ナノ粒子1bにおける化合物12中の金属に結合する官能基およびシリカに結合する官能基ならびに化合物12の種類は、前記複合ナノ粒子1aにおける化合物12中の金属に結合する官能基およびシリカに結合する官能基ならびに化合物12の種類と同様である。
【0040】
以上のように、第2実施形態に係る複合ナノ粒子は、金属ナノ粒子がシリカ層によって覆われている構造を有することから、第1実施形態に係る複合ナノ粒子と比べて、金属ナノ粒子が外部環境要因から一層保護された状態となっている。したがって、第2実施形態に係る複合ナノ粒子は、金属ナノ粒子の機能などを安定な状態に保つことができるので、前記第1実施形態に係る複合ナノ粒子の用途に加え、金属ナノ粒子の機能などをより安定な状態に保つことが望まれる用途に有用である。
【0041】
[複合ナノ粒子の製造方法]
本発明の複合ナノ粒子の製造方法は、金属ナノ粒子と当該金属ナノ粒子上に形成されたシリカとを含み、前記金属ナノ粒子がシリカで覆われている複合ナノ粒子を製造する方法であって、
(I)金属に結合する官能基およびシリカに結合する官能基を有する化合物からなる分散剤と溶媒と金属イオン供与体とを含む液体中において、前記金属イオン供与体に由来する金属イオンの活量を制御しながら前記金属イオンを生じさせ、当該金属イオンを還元させて金属ナノ粒子を析出させ、金属ナノ粒子を含む分散液を得る工程、および
(II)前記工程(I)で得られた分散液に、縮重合によってシリカネットワークを形成するシリカ前駆体化合物を添加し、前記金属ナノ粒子上にシリカを形成させる工程
を含むことを特徴としている。
【0042】
図3は、本発明に係る複合ナノ粒子の製造方法の処理手順を示す工程図である。
本発明の複合ナノ粒子の製造方法では、まず、不活性ガス通気条件下に、金属に結合する官能基およびシリカに結合する官能基を有する化合物からなる分散剤と溶媒と金属イオン供与体10とを含む液体を調製する〔金属イオン供与体配合液調製工程、図3(a)参照〕。
つぎに、前記液体中で金属イオンの活量を制御しながら前記金属イオンを生じさせるとともに、当該金属イオンを還元させることにより、金属ナノ粒子11を析出させる〔金属ナノ粒子析出工程、図3(b)参照〕。これにより、析出させる金属ナノ粒子の大きさを容易に制御することができる。
その後、析出させた金属ナノ粒子を含む分散液にシリカ前駆体化合物を添加し、金属ナノ粒子上にシリカを形成させる〔シリカ形成工程、図3(c)参照〕。これにより、金属ナノ粒子を、迅速かつ簡便な操作で、シリカで覆うことができる。
【0043】
なお、本明細書において、「金属イオンの活量」とは、還元可能な状態の金属イオンの量をいう。
【0044】
本発明の複合ナノ粒子の製造方法は、液体中における金属イオンの活量の制御の仕方に基づき、大きく2つの方法に大別される。第1の方法は、溶媒に難溶性で、かつ前記溶媒のpHとは異なるpH条件下で金属イオンを徐放する金属化合物により、液体中における金属イオンの活量を制御する方法である。また、第2の方法は、前記溶媒のpHとは異なるpH条件下で金属イオンを徐放する金属錯体により、液体中における金属イオンの活量を制御する方法である。
【0045】
(1)第1の方法
まず、添付の図面に基づき、本発明の一実施形態に係る複合ナノ粒子の製造方法(第1の方法)を説明する。
図4は、本発明の一実施形態に係る複合ナノ粒子の製造方法(第1の方法)の処理手順を示す工程図である。なお、本実施形態では、金属ナノ粒子を構成する金属が酸素などの外部環境要因と反応しやすい金属である場合を例に挙げて説明するが、本発明は、かかる例示のみに限定されるものではない。
【0046】
第1の方法では、溶媒に難溶性で、かつ前記溶媒のpHとは異なるpH条件下で金属イオンを徐放する金属化合物を用いることにより、液体中に放出される還元可能な金属イオンの量を、ナノスケールの粒子を析出させるのに適した量となるように制御する点に1つの大きな特徴がある。
【0047】
第1の方法では、まず、複合ナノ粒子1a中の金属ナノ粒子11を構成する金属から得られる金属イオン供与体としての金属化合物10aの粉体の分散液を調製する〔分散液調製工程、図4(a)参照〕。
前記分散液は、例えば、金属化合物10aおよび分散剤を含む溶液Aと、還元剤および分散剤を含む溶液Bとを混合することにより得られるが、本発明は、かかる調製法のみに限定されるものではない。前記溶液Aは、例えば、図5に示される工程を行なうことにより調製することができるが、本発明は、かかる調製法のみに限定されるものではない。また、前記溶液Bは、例えば、図6に示される工程を行なうことにより調製することができるが、本発明は、かかる調製法のみに限定されるものではない。
【0048】
図5に示される溶液Aの調製に際しては、まず、溶媒に金属化合物10aの粉体を添加する〔金属化合物添加工程、図5(a)参照〕。
金属化合物10aは、金属ナノ粒子11を構成する金属を含み、前記溶媒に難溶性で、かつ前記溶媒のpHとは異なるpH条件下で金属イオンを徐放する化合物である。
なお、本明細書において、「溶媒に難溶性である」とは、溶媒に対する20℃での溶解度が10−16以下であることをいう。この場合、前記溶解度が小さいほど、溶媒中に存在する金属イオンの量が少なくなるので、析出する金属ナノ粒子の粒子径が小さくなる。また、本明細書において、「徐放」とは、金属ナノ粒子を析出させるに適した微量の金属イオンを生じることをいう。
金属化合物10aは、金属ナノ粒子11を構成する金属の種類により異なる。金属ナノ粒子11を構成する金属が銅である場合、金属化合物10aとしては、例えば、酸化第二銅などが挙げられるが、本発明は、かかる例示のみに限定されるものではない。また、金属ナノ粒子11を構成する金属がニッケルである場合、金属化合物10aとしては、例えば、酸化ニッケル、水酸化ニッケルなどが挙げられるが、本発明は、かかる例示のみに限定されるものではない。金属ナノ粒子11を構成する金属がコバルトである場合、金属化合物10aとしては、例えば、酸化コバルト、水酸化コバルトなどが挙げられるが、本発明は、かかる例示のみに限定されるものではない。
前記溶媒に添加する金属化合物10aの粉体の量は、最終生成物である金属ナノ粒子の量に応じて、適宜設定することができる。通常、溶媒100mlあたりの粉体の量が、4gであることが望ましい。
前記溶媒としては、例えば、水、エチレングリコール、プロピレングリコール、テトラヒドロフランなどが挙げられるが、本発明は、かかる例示のみに限定されるものではない。かかる溶媒は、金属ナノ粒子11を構成する金属の種類などに応じて適宜選択することができる。
つぎに、得られた産物に分散剤を添加する工程〔分散剤添加工程、図5(b)参照〕。
分散剤は、前記金属に結合する官能基とシリカに結合する官能基とを有する化合物12からなる。
前記産物に添加する分散剤の量は、金属化合物10aの粉体の量、生成させる金属ナノ粒子の粒子径などに応じて、適宜設定することができる。通常、金属化合物10a 100質量部あたりの分散剤の量が、1〜20質量部であることが望ましい。
つぎに、得られた混合物のpHを調整する〔pH調整工程、図5(c)参照〕。
混合物のpHは、当該混合物にpH調整剤を添加することにより調整することができる。
前記pH調整剤は、前記金属イオンに対応する金属との錯体を形成せず、かつシリカネットワークを修飾する化合物(以下、「シリカネットワークに対する修飾剤」ともいう)からなるのが好ましい。例えば、前記金属化合物10aがアルカリ性条件下で金属イオンを徐放する金属化合物である場合、かかるpH調整剤として、前記金属イオンに対応する金属との錯体を形成しないアルカリを用いることができる。前記シリカネットワークに対する修飾剤としては、例えば、水酸化ナトリウム、水酸化カリウムなどのアルカリ金属水酸化物;水酸化カルシウムなどのアルカリ土類金属水酸化物;リチウム酸化物などが挙げられるが、本発明は、かかる例示のみに限定されるものではない。これらのなかでは、シリカネットワークの形成時に、縮重合を適度に阻害して、球状の小さなシリカナノ粒子を容易に形成させることができることから、アルカリ金属水酸化物またはアルカリ土類金属水酸化物が好ましく、アルカリ金属水酸化物がより好ましい。アルカリ金属水酸化物のなかでは、シリカネットワークの形成時に、縮重合を適度に阻害して、球状の小さなシリカナノ粒子を容易に形成させることができることから、水酸化ナトリウムおよび水酸化カリウムが好ましく、水酸化ナトリウムがより好ましい。
前記混合物のpHは、金属化合物10aの種類、pH調整剤の種類、複合ナノ粒子の用途などによって異なるため、一概には決定することができない。したがって、前記溶液のpHは、金属化合物10aの種類、pH調整剤の種類、複合ナノ粒子の用途などに応じて適宜決定することが望ましい。通常、前記混合物のpHは、後述の金属ナノ粒子析出工程での還元反応を良好に進行させる観点から、好ましくは6〜14、より好ましくは7.5〜14である。溶液のpHをかかる範囲内で高くするほど、還元力が大きくなるので、還元反応の初期段階で生成する金属ナノ粒子の粒子径が小さくなる傾向がある。一方、溶液のpHを前記範囲内で低くするほど、還元力が小さくなるので、還元反応の初期段階で生成する金属ナノ粒子の粒子径が大きくなる傾向がある。
なお、金属化合物10aとして酸化第二銅を用いる場合、酸化第二銅は、水に難溶性であるが、当該水をアルカリ性(pH10〜14)に調整した場合には、わずかながら溶解する。そこで、金属化合物10aとして酸化第二銅を用いる場合には、溶媒として、水を用い、前記混合物のpHを10以上とすることにより、金属化合物10aより対応する金属イオンを微量に生じさせることができる。
その後、得られた溶液Aに不活性ガスを通気し脱気する〔脱気工程、図5(d)参照〕。
これにより、溶液A中の溶存酸素を除去することができる。
不活性ガスとしては、例えば、窒素ガス、アルゴンガスなどが挙げられる。
不活性ガスの流量は、溶液A中の溶存酸素を除去するのに十分な流量であればよい。また、脱気時間は、溶液A中の溶存酸素を除去するのに十分な時間であればよい。
【0049】
一方、図6に示される溶液Bの調製に際しては、まず、溶媒に還元剤を添加する〔還元剤添加工程、図6(a)参照〕。
前記溶媒は、前記溶液Aの調製に用いられる溶媒と同様である。
還元剤は、金属化合物10aから生じる金属イオンを還元する化合物であればよい。前記還元剤としては、特に限定されないが、例えば、ヒドラジン、次亜リン酸、水素化ホウ素、ジメチルアミンボラン(DMAB)、シュウ酸、水素化アルミニウムリチウムなどが挙げられるが、本発明は、かかる例示のみに限定されるものではない。これらのなかでは、高純度の複合ナノ粒子を得ることができる観点から、好ましくはヒドラジンである。前記還元剤は、本発明の目的を阻害しない範囲内であれば、塩を形成していてもよい。
前記溶媒に添加する還元剤の量は、金属イオンを還元するのに十分な量であればよく、金属イオンの量、生成させる金属ナノ粒子の量、還元剤の種類などに応じて、適宜設定することができる。
つぎに、得られた産物に分散剤を添加する工程〔分散剤添加工程、図6(b)参照〕。
分散剤および前記産物に添加する分散剤の量は、前記溶液Aの調製に用いられる分散剤および産物に添加する分散剤の量と同様である。
つぎに、得られた混合物のpHを調整する〔pH調整工程、図6(c)参照〕。
混合物のpHは、前記溶液Aの調製における混合物のpHの調整と同様の操作を行なうことにより調整することができる。また、混合物のpHは、前記溶液Aの調製における混合物のpHと同様である。
その後、得られた溶液Bに不活性ガスを通気し脱気する〔脱気工程、図6(d)参照〕。これにより、溶液B中の溶存酸素を除去することができる。したがって、例えば、金属が酸化しやすい金属である場合であっても、当該金属を安定な状態に保つことができ、複合ナノ粒子を容易に製造することができる。
不活性ガスの種類および不活性ガスの流量は、前記溶液Aの調製に用いられる不活性ガスの種類および不活性ガスの流量と同様である。
【0050】
分散液調製工程では、溶液Aと溶液Bとを、還元剤が金属イオンを還元するのに十分な量となるように混合することが望ましい。例えば、還元剤がヒドラジンである場合、金属化合物10a 1molに対して、ヒドラジンの量が10mol以上となるように、溶液Aと溶液Bとを混合することが望ましい。
【0051】
つぎに、前記分散液に不活性ガスを通気して脱気しながら、当該分散液中において、金属化合物10aから生じる金属イオンを還元させて金属ナノ粒子11を析出させる〔金属ナノ粒子析出工程、図4(b)参照〕。これにより、金属ナノ粒子11を含む液体が得られる。
金属イオンの還元および金属ナノ粒子11の析出は、前記分散液調製工程において、溶液Aと溶液Bとを混合すると同時に開始される。
金属ナノ粒子析出工程では、図7に示されるように、金属化合物10aがわずかに溶解することで生じた金属イオン10b(図7中、「Xn+」)が、還元剤の酸化に伴って生じた電子を受けとることによって還元され、金属ナノ粒子が析出される。かかる工程では、反応系(分散液)中において、金属イオン10bの量が略一定に保たれながら、常に定常状態で供給され、すぐに還元される。
本実施形態においては、金属イオン10bが還元されて析出する速度を制御することで、金属ナノ粒子11の粒子径を制御することができる。
前記速度は、反応系(分散液)中における還元剤の濃度を調整して還元反応の速度を制御することにより、制御することができる。
【0052】
本実施形態では、金属ナノ粒子11を構成する金属が酸素などの外部環境要因と反応しやすいことから、図7に示されるように、分散液に不活性ガスを通気しながら、金属イオン10bの還元および金属ナノ粒子11の析出を行なっている。これにより、酸素などの外部環境要因と金属ナノ粒子11を構成する金属との反応を抑制することができる。
【0053】
本金属ナノ粒子析出工程では、析出した金属ナノ粒子11を含む分散液を遠心沈降に供し、上澄みを分離してもよい。これにより、より小さな金属ナノ粒子11を得ることができる。
【0054】
その後、前記金属ナノ粒子析出工程で得られた液体に不活性ガスを通気して脱気しながら、当該液体に、縮重合によってシリカネットワークを形成するシリカ前駆体化合物(以下、単に、「シリカ前駆体化合物」という)を添加し、前記シリカネットワークに対する修飾剤の存在下においてシリカ前駆体化合物を縮重合させて、前記金属ナノ粒子を覆うように当該金属ナノ粒子11上に複数個のシリカナノ粒子13を形成させる〔シリカナノ粒子析出工程、図4(c)参照〕。
シリカ前駆体化合物としては、例えば、アルコキシ基の炭素数が1〜3であるテトラアルコキシシランなどが挙げられるが、本発明は、かかる例示のみに限定されるものではない。これらのなかでは、金属ナノ粒子上でのシリカナノ粒子の形成を良好に行なう観点から、テトラエトキシシランが好ましい。
シリカネットワークに対する修飾剤としては、前記と同様のものが挙げられる。
【0055】
前記液体に添加するシリカ前駆体化合物の量は、複合ナノ粒子の用途、複合ナノ粒子の形状などによって異なることから、複合ナノ粒子の用途、複合ナノ粒子の形状などに応じて、適宜設定することが望ましい。
シリカナノ粒子形成工程における金属ナノ粒子とシリカ前駆体化合物との体積比、pH、温度などにより、金属ナノ粒子を覆うシリカナノ粒子の量を制御することができると考えられる。
【0056】
なお、金属ナノ粒子11を構成する金属が、酸素などの外部環境要因との反応性が低い金属(例えば、金、白金など)である場合、前記分散液調製工程、金属ナノ粒子析出工程およびシリカナノ粒子形成工程における不活性ガスの通気による脱気を行なわなくてもよい。
【0057】
金属ナノ粒子11を構成する金属が、例えば、銅である場合、製造時における銅の酸化を抑制して効率よく複合ナノ粒子を製造する観点から、前記工程(I)において、溶媒として、水、金属化合物10aとして、酸化第二銅および前記pH調整剤として、水酸化ナトリウムとを用いることが好ましい。この場合、前記分散液調製工程、金属ナノ粒子析出工程およびシリカナノ粒子形成工程を、前述のように、不活性ガスを通気させながら行なうことにより、製造時における銅の酸化をより効果的に抑制して効率よく複合ナノ粒子を製造することができる。
【0058】
(2)第2の方法
つぎに、添付の図面に基づき、本発明の他の実施形態に係る複合ナノ粒子の製造方法(第2の方法)を説明する。
図8は、本発明の他の実施形態に係る複合ナノ粒子の製造方法(第2の方法)の処理手順を示す工程図である。なお、本実施形態では、金属ナノ粒子を構成する金属が酸素などの外部環境要因と反応しやすい金属である場合を例に挙げて説明するが、本発明は、かかる例示のみに限定されるものではない。
【0059】
第2の方法では、前記溶媒のpHとは異なるpH条件下で金属イオンを徐放する金属錯体を用いることにより、液体中に放出される還元可能な金属イオンの量を、ナノスケールの粒子を析出させるのに適した量となるように制御する点に1つの大きな特徴がある。
【0060】
本実施形態に係る複合ナノ粒子の製造方法では、まず、複合ナノ粒子1b中の金属ナノ粒子11を構成する金属の錯体(金属錯体)を含有する溶液を調製する〔金属錯体含有溶液調製工程、図8(a)参照〕。
前記金属錯体含有溶液は、例えば、金属粉体と、金属との錯体を形成するpH調整剤とが溶媒に配合された溶液Cと、還元剤と分散剤と前記pH調整剤とを含む溶液Dとを混合することにより得られるが、本発明は、かかる調製法のみに限定されるものではない。前記溶液Cは、例えば、図9に示される工程を行なうことにより調製することができるが、本発明は、かかる調製法のみに限定されるものではない。また、前記溶液Dは、例えば、図10に示される工程を行なうことにより調製することができるが、本発明は、かかる調製法のみに限定されるものではない。
【0061】
図9に示される溶液Cの調製に際しては、まず、溶媒に金属粉体を添加する〔金属粉体添加工程、図9(a)参照〕。
金属粉体は、金属ナノ粒子11を構成する金属からなる。かかる金属としては、銅、ニッケル、コバルト、銀、鉄、スズなどが挙げられるが、本発明は、かかる例示のみに限定されるものではない。
前記溶媒に添加する金属粉体の量は、析出させる金属ナノ粒子の量などによって異なるため、一概には決定することができない。したがって、前記溶媒に添加する金属粉体の量は、析出させる金属ナノ粒子の量などに応じて適宜決定することが望ましい。
前記溶媒は、前記溶液Aの調製に用いられる溶媒と同様である。
つぎに、得られた産物に分散剤を添加する工程〔分散剤添加工程、図9(b)参照〕。
分散剤および前記産物に添加する分散剤の量は、前記溶液Aの調製に用いられる分散剤および分散剤の量と同様であればよい。
つぎに、得られた混合物に、金属との錯体を形成するpH調整剤を添加して錯体を形成させるとともに溶液のpHを調整する〔錯体形成およびpH調整工程、図9(c)参照〕。
前記pH調整剤は、金属との錯体を形成するものであればよい。前記pH調整剤としては、例えば、アンモニア水溶液、シアン化合物、ハロゲン化合物などに代表される金属と錯体を形成する物質などが挙げられるが、本発明は、かかる例示のみに限定されるものではない。
前記溶液のpHは、当該溶液にpH調整剤を添加することにより調整することができる。前記溶液のpHは、金属の種類、pH調整剤の種類、形成させる錯体の種類、複合ナノ粒子の用途などによって異なるため、一概には決定することができない。したがって、前記溶液のpHは、金属の種類、pH調整剤の種類、形成させる錯体の種類、複合ナノ粒子の用途などに応じて適宜決定することが望ましい。通常、かかる溶液のpHは、後述の金属ナノ粒子析出工程での還元反応を良好に進行させる観点から、好ましくは6〜14、より好ましくは7.5〜14である。例えば、金属が銅であり、pH調整剤がアンモニア水溶液である場合、混合物のpHは、好ましくは6〜14、より好ましくは7.5〜14、さらに好ましくは13〜14である。第2の方法においても、溶液のpHをかかる範囲内で高くするほど、還元力が大きくなるので、還元反応の初期段階で生成する金属ナノ粒子の粒子径が小さくなる傾向がある。一方、溶液のpHを前記範囲内で低くするほど、還元力が小さくなるので、還元反応の初期段階で生成する金属ナノ粒子の粒子径が大きくなる傾向がある。
その後、得られた溶液Cに不活性ガスを通気し脱気する〔脱気工程、図9(d)参照〕。これにより、溶液C中の溶存酸素を除去することができる。
不活性ガスの種類および不活性ガスの流量は、前記溶液Aの調製に用いられる不活性ガスの種類および不活性ガスの流量と同様であればよい。
【0062】
一方、図10に示される溶液Dの調製に際しては、まず、溶媒に還元剤を添加する〔還元剤添加工程、図10(a)参照〕。
前記溶媒は、前記溶液Cの調製に用いられる溶媒と同様である。
前記還元剤の種類および前記溶媒に添加する還元剤の量は、前記溶液Bの調製に用いられる還元剤の種類および還元剤の量と同様であればよい。
つぎに、得られた産物に分散剤を添加する工程〔分散剤添加工程、図10(b)参照〕。
分散剤および前記産物に添加する分散剤の量は、前記溶液Cの調製に用いられる分散剤および産物に添加する分散剤の量と同様である。
つぎに、得られた混合物のpHを調整する〔pH調整工程、図10(c)参照〕。
混合物のpHは、当該混合物にpH調整剤を添加することにより調整することができる。前記pH調整剤は、前記溶液Cの調製に用いられるpH調整剤と同様である。かかる混合物のpHは、前記溶液Cの調製の際のpHと同様であり、後述の金属ナノ粒子析出工程での還元反応を良好に進行させる観点から、好ましくは6〜14、より好ましくは7.5〜14である。第2の方法においても、溶液のpHをかかる範囲内で高くするほど、還元力が大きくなるので、還元反応の初期段階で生成する金属ナノ粒子の粒子径が小さくなる傾向がある。一方、溶液のpHを前記範囲内で低くするほど、還元力が小さくなるので、還元反応の初期段階で生成する金属ナノ粒子の粒子径が大きくなる傾向がある。
その後、得られた溶液Dに不活性ガスを通気し脱気する〔脱気工程、図10(d)参照〕。これにより、溶液D中の溶存酸素を除去することができる。
【0063】
金属錯体含有溶液調製工程では、溶液Cと溶液Dとを、還元剤が金属イオンを還元するのに十分な量となるように混合することが望ましい。
【0064】
つぎに、前記金属錯体含有溶液に不活性ガスを通気して脱気しながら、当該金属錯体含有溶液中において、金属錯体から生じる金属イオンを還元させて金属ナノ粒子11を析出させる〔金属ナノ粒子析出工程、図8(b)参照〕。これにより、金属ナノ粒子11を含む液体が得られる。
金属イオンの還元および金属ナノ粒子11の析出は、前記分散液調製工程において、溶液Cと溶液Dとを混合すると同時に開始される。
【0065】
本金属ナノ粒子析出工程では、析出した金属ナノ粒子を含む分散液を遠心沈降に供し、沈殿を除去して上澄みを分離してもよい。これにより、より小さな金属ナノ粒子を得ることができる。
【0066】
その後、前記金属ナノ粒子析出工程で得られた液体に不活性ガスを通気して脱気しながら、当該液体に、シリカ前駆体化合物を添加し、シリカ前駆体化合物を縮重合させて、前記金属ナノ粒子を覆うように当該金属ナノ粒子上にシリカからなるシリカ層を形成させる〔シリカ形成工程、図8(c)参照〕。
前記シリカ前駆体化合物の種類および前記液体に添加するシリカ前駆体化合物の量は、前記第1の方法に用いられるシリカ前駆体化合物の種類およびシリカ前駆体化合物の量と同様である。
第2の方法においても、第1の方法と同様に、シリカナノ粒子形成工程における金属ナノ粒子とシリカ前駆体化合物との体積比、pH、温度などにより、金属ナノ粒子を覆うシリカナノ粒子の量を制御することができると考えられる。
【0067】
なお、金属ナノ粒子11を構成する金属が、酸素などの外部環境要因との反応性が低い金属(例えば、金、白金など)である場合、前記分散液調製工程、金属ナノ粒子析出工程およびシリカナノ粒子形成工程における不活性ガスの通気による脱気を行なわなくてもよい。
【0068】
また、金属錯体含有溶液調製工程において、金属粉体および金属と錯体を形成するアルカリを用いて、金属錯体を形成させる代わりに、前記溶媒のpHとは異なるpH条件下で金属イオンを徐放する金属錯体を直接用いてもよい。かかる金属錯体としては、例えば、テトラアンミン銅(II)、ジアンミン銀(I)、ヘキサシアノ鉄(II)、ヘキサシアノ鉄(III)テトラクロロ鉄(III)などが挙げられるが、本発明は、かかる例示のみに限定されるものではない。
【0069】
さらに、金属ナノ粒子11を構成する金属が、例えば、銅である場合、製造時における銅の酸化を抑制して効率よく複合ナノ粒子を製造する観点から、前記工程(I)において、前記pH調整剤として、アンモニア水溶液を用いることが好ましい。なお、この場合、溶媒は、アンモニア水溶液に含まれる水である。アンモニア水溶液に含まれるアンモニアは、揮発しやすいため、シリカ形成工程後に得られる複合ナノ粒子を含む分散液から容易に除去することができる。したがって、アンモニア水溶液は、複合ナノ粒子の高純度化を図ることができる点で有利である。
金属ナノ粒子11を構成する金属が、銅である場合、前記分散液調製工程、金属ナノ粒子析出工程およびシリカ形成工程を、前述のように、不活性ガスを通気させながら行なうことにより、製造時における銅の酸化をより効果的に抑制して効率よく複合ナノ粒子を製造することができる。
【0070】
以上のように、本発明の複合ナノ粒子の製造方法では、金属ナノ粒子がシリカナノ粒子またはシリカ層によって覆われている複合ナノ粒子を容易に製造することができる。これにより、金属ナノ粒子の表面をコーティング剤で被覆する場合と比べて、簡便な操作で、金属ナノ粒子を外部環境要因から保護することができる。したがって、本発明の複合ナノ粒子の製造方法は、例えば、触媒、紫外線遮蔽剤、電子部品、光学部品、発光材料、塗料、磁性材料などの製造に有用である。
【0071】
[複合ナノ粒子の用途]
(1)赤色釉薬
銅ナノ粒子は、金属銅の状態が保たれている場合には、赤色釉薬の1つとして知られている辰砂釉によく似た赤色を呈している。ところが、銅は酸化されやすいことから、前記銅ナノ粒子は、銅イオンとなり、緑色を呈するようになる。
しかしながら、前述のように、本発明の複合ナノ粒子では、当該複合ナノ粒子中の金属ナノ粒子が外部環境要因から保護されている。そのため、例えば、金属ナノ粒子が、酸化しやすい銅からなるナノ粒子(銅ナノ粒子)である複合ナノ粒子では、当該銅ナノ粒子の酸化が抑制され、赤色が維持される。したがって、釉薬の色材として、金属ナノ粒子が銅ナノ粒子である本発明の複合ナノ粒子を用いることにより、低火度や中火度での酸化焼成を行なった場合にも辰砂釉によく似た赤色を呈する釉薬が得られる。かかる釉薬も本発明の複合ナノ粒子の用途の1つである。
【0072】
本発明の釉薬は、焼成により赤色を呈する釉薬であって、前述した複合ナノ粒子のうち金属ナノ粒子が銅ナノ粒子である複合ナノ粒子と、金属ケイ素または酒石酸ナトリウムカリウムとを含有していることを特徴としている。
【0073】
釉薬中における複合ナノ粒子の含有量は、赤色の発色に十分な量であればよい。通常、辰砂釉によく似た赤色を発色させる観点から、1〜4質量%、好ましくは2〜3質量%である。
【0074】
釉薬中において、複合ナノ粒子に対する金属ケイ素または酒石酸ナトリウムカリウムの量は、銅ナノ粒子の酸化をより一層抑制し、より辰砂釉によく似た赤色を発色させる観点から、例えば、複合ナノ粒子100質量部あたり25〜100質量部、好ましくは25〜50質量部である。金属ケイ素および酒石酸ナトリウムカリウムのなかでは、より辰砂釉によく似た赤色を発色させる観点から、金属ケイ素が好ましい。
【0075】
本発明の釉薬には、通常用いられるフリット、ふのり、にがり、水などをさらに配合することができる。前記フリットの組成は、釉薬の用途に応じて適宜選択することが望ましい。前記フリットとしては、例えば、二酸化ケイ素60.0〜66.0モル%、酸化アルミニウム2.0〜4.0モル%、酸化ホウ素12.0〜26.0モル%、酸化リチウム0.0〜10.0モル%、酸化ナトリウム1.5〜5.0モル%、酸化カリウム2.5〜5.0モル%、酸化バリウム0.0〜2.5モル%、酸化亜鉛1.0〜8.0モル%、酸化カルシウム0.0〜1.0モル%、酸化マグネシウム0.0〜1.0モル%および酸化ストロンチウム0.0〜1.0モル%を含有するフリットなどが挙げられる。
【0076】
(2)磁性材料
本発明の複合ナノ粒子は、金属ナノ粒子がシリカナノ粒子によって外部環境要因から保護されているので、高い温度条件下でも互いに凝集しにくい性質を有する。そのため、金属ナノ粒子が鉄−白金などの磁性金属からなる粒子である場合、加熱することによって、互いに凝集させることなく、規則化を行なうことができる。
したがって、金属ナノ粒子が磁性金属からなるナノ粒子である本発明の複合ナノ粒子は、磁性材料として有用である。
【0077】
[金属ナノ粒子の製造方法]
本発明の金属ナノ粒子の製造方法は、分散剤と溶媒と金属錯体とを含む溶液中において、金属錯体に由来する金属イオンの活量を制御しながら前記金属イオンを生じさせた後、前記金属イオンを還元させて金属ナノ粒子を析出させることを特徴としている。
【0078】
本発明の金属ナノ粒子の製造方法では、分散剤および溶媒の存在下に、金属と、当該金属と錯体を形成するアルカリとを当該アルカリが前記金属に対して過剰量となるように混合することにより、金属錯体を形成させるとともに、前記金属錯体に由来する金属イオンの活量を制御しながら前記金属イオンを生じさせた後、前記金属イオンを還元させて金属ナノ粒子を析出させてもよい。
【0079】
本発明の金属ナノ粒子の製造方法は、前述した複合ナノ粒子の製造方法における工程(I)と同様の操作を行なうことによって実施することができる〔例えば、第1の方法における分散液調製工程および金属ナノ粒子析出工程、第2の方法における金属錯体含有溶液調製工程および金属ナノ粒子析出工程などを参照〕。
【実施例】
【0080】
以下、実施例などにより、本発明を詳細に説明するが、本発明は、かかる実施例により限定されるものではない。なお、以下の実施例において、平均粒子径は、粒子を含む試料のSEM像から、粒子を無作為に複数個選び、選ばれた個々の粒子の粒子径を測定し、選ばれた粒子の粒子径の平均を算出することにより得られた値である。
【0081】
(製造例1)
酸化第二銅(CuO)の粉末〔純正化学(株)製、商品名:酸化銅(II)(微粉末)、平均粒子径:1μm〕0.06molを、イオン交換水36mLに分散させ、銅分散液を得た。つぎに、前記銅分散液に、分散剤であるゼラチン〔ゼライス社製、商品名:写真用ゼラチンP459〕の水溶液〔ゼラチン濃度:10質量%、以下、「10質量%ゼラチン水溶液」という〕18mLを添加して混合物を得た。その後、前記混合物に、そのpHが12になるように、1.5mol/dm3水酸化ナトリウム水溶液を添加して溶液Aを得た。
【0082】
(製造例2)
ヒドラジン0.06molを、イオン交換水36mLに添加し、ヒドラジン水溶液を得た。得られたヒドラジン水溶液に、10質量%ゼラチン水溶液18mLを添加し、混合物を得た。その後、前記混合物に、そのpHが12になるように、1.5mol/dm3水酸化ナトリウム水溶液を添加して溶液Bを得た。
【0083】
(実施例1)
(1)銅ナノ粒子の調製
製造例1で得られた溶液Aおよび製造例2で得られた溶液Bを、それぞれの温度が80℃になるように維持しながら、窒素ガスで30分間脱気した。その後、溶液Aと溶液Bとを混合し、得られた混合物を、その温度が80℃になるように維持し、かつ窒素ガスで脱気しながら、マグネティックスターラーを用いて500rpmで2時間撹拌した。これにより、酸化第二銅から微量に生じる銅イオンを徐々に還元させ、粒子を含む分散液を得た。
【0084】
得られた産物のX線回折パターンを、X線回折装置〔(株)リガク製、商品名:RINT2500(Mo Kα)〕を用いて測定し、化学種を同定した。実施例1において、得られた産物のX線回折パターンを調べた結果を図11に示す。
【0085】
図11に示された結果から、銅に特有のピークが見られることがわかる。したがって、かかる結果から、前記産物に含まれる固体成分は、銅からなることがわかる。
【0086】
さらに、前記産物に、窒素ガスバブリング(0.1dm3/min)で30分間脱気されたイオン交換水(以下、「脱気イオン交換水」という)を添加した。つぎに、得られた混合物に、周波数38kHz、出力55Wの超音波を照射した。その後、前記混合物を、4000rpmで15分間の遠心沈降に供し、上澄みを除去した。得られた沈降物に、脱気イオン交換水を添加し、混合物を得た。つぎに、得られた混合物に対する超音波の照射および前記混合物の遠心沈降を、前記と同様に行ない、液体成分中に遊離しているナトリウムイオンおよびゼラチンを除去した。その後、得られた産物に、純水を添加した。得られた混合物を遠心分離に供し、沈殿物および上澄みを得た。
【0087】
得られた沈殿物および上澄みを、それぞれ、走査型電子顕微鏡(以下、「SEM」ともいう)の真鍮製の試料台に滴下した。前記試料台上の沈殿物および上澄みをデシケーター内で真空乾燥させ、SEM観察用試料を得た。得られた各SEM観察用試料を、走査型電子顕微鏡〔日本電子(株)製、商品名:JSM−6500F〕を用いて観察した。実施例1(1)において、得られた産物の沈殿物を走査型電子顕微鏡で観察した結果を図12(a)に、実施例1(1)において、得られた産物の上澄みを走査型電子顕微鏡で観察した結果を図12(b)に示す。図12(a)中、スケールバーは、300nmを示す。また、図12(b)中、スケールバーは、100nmを示す。
【0088】
図12(a)および図12(b)に示された結果から、沈殿物中には、平均粒子径が約20〜500nmのナノ粒子が存在しているのに対し、上澄み中には、平均粒子径が約30nm以下のナノ粒子のみが存在していることがわかる。かかる結果から、遠心分離を行なうことにより、平均粒子径が約30nm以下の粒子を得ることができることがわかる。
【0089】
さらに、表面プラズモン吸収による赤色発色の有無を確認するために、分光光度計を用いて、前記産物の可視光吸収スペクトルを測定した。実施例1(1)において、得られた産物の可視光吸収スペクトルを測定した結果を図13に示す。
【0090】
図13に示された結果から、625nm以下の波長域での吸収が見られるとともに、波長580nm付近での吸収ピークが見られることがわかる。かかる結果から、前記産物は、表面プラズモン吸収により、赤色を呈していることが示唆される。したがって、これらの結果から、前記産物は、銅ナノ粒子を含むことがわかる。
【0091】
(2)複合ナノ粒子の調製
前記(1)で得られた分散液10mLに、テトラエトキシシラン10mLを添加した。なお、前記テトラエトキシシランは、予め、窒素ガスバブリング(0.1dm3/min)で30分間脱気されたものである。得られた混合物を、500rpmで撹拌しながら70℃で20時間維持した。
【0092】
得られた産物を粉砕し、測定用試料を得た。得られた測定用試料のX線回折パターンを、前記X線回折装置を用いて測定し、化学種を同定した。実施例1(2)において、得られた産物のX線回折パターンを調べた結果を図14に示す。
【0093】
図14に示された結果から、銅に特有のピークが見られることがわかる。したがって、かかる結果から、前記産物中に銅が存在していることが示唆される。
【0094】
つぎに、前記産物に含まれる粒子を、透過型電子顕微鏡〔日本電子(株)製、商品名:JEM−2010〕で観察した。実施例1(2)において、得られた産物に含まれる粒子を透過型電子顕微鏡で観察した結果を図15(a)および図15(b)に示す。図15(a)中、スケールバーは、100nmを示す。また、図15(b)中、スケールバーは、50nmを示す。
【0095】
図15に示された結果から、銅ナノ粒子の周囲にシリカからなる平均粒子径約10nmのシリカ粒子が形成されていることがわかる。したがって、前記産物は、銅ナノ粒子とシリカ粒子とを含み、前記銅ナノ粒子の表面が前記シリカ粒子で覆われた複合ナノ粒子であることがわかる。
【0096】
銅とシリカとは、通常、複合体化(または会合)しにくいと考えられる。しかしながら、前記複合ナノ粒子では、銅ナノ粒子とシリカ粒子とが複合体化または会合していると考えられる。したがって、かかる複合ナノ粒子においては、銅ナノ粒子とシリカ粒子とは、側鎖に親水性基と疎水性基とが表出しているゼラチンを介して複合体化(または会合)していることが考えられる。
【0097】
(比較例1)
実施例1(1)と同様の操作を行ない、銅ナノ粒子を得た。
【0098】
(試験例1)
実施例1で得られた複合ナノ粒子を、大気中において、室温で200日間放置した。その後、実施例1で得られた複合ナノ粒子のX線回折パターンを、前記X線回折装置を用いて測定し、化学種を同定した。
【0099】
一方、比較例1で得られた銅ナノ粒子を、大気中において、室温で1日間放置した。その後、比較例1で得られた銅ナノ粒子のX線回折パターンを、前記X線回折装置を用いて測定し、化学種を同定した。
【0100】
試験例1において、実施例1で得られた複合ナノ粒子(下段のパターン)および比較例1で得られた銅ナノ粒子(上段のパターン)それぞれのX線回折パターンを調べた結果を図16に示す。図中、丸は銅に特有のピークを示し、三角は酸化第二銅に特有のピークを示す。
【0101】
図16に示された結果から、実施例1で得られた複合ナノ粒子のX線回折パターンには、銅に特有のピークのみが見られることがわかる。かかる結果から、実施例1で得られた複合ナノ粒子中の銅ナノ粒子は、当該複合ナノ粒子が200日間大気中で放置されているにもかかわらず、酸化されていないことがわかる。一方、比較例1で得られた複合ナノ粒子のX線回折パターンには、銅に特有のピークに加え、酸化第二銅に特有のピークがみられることがわかる。かかる結果から、比較例1で得られた銅ナノ粒子は、酸化されていることがわかる。
【0102】
以上の結果から、実施例1で得られた複合ナノ粒子のように、金属ナノ粒子をシリカからなる粒子で覆うことにより、複合ナノ粒子の外部環境要因による金属ナノ粒子への影響を低減させることができ、金属ナノ粒子の状態の変化(例えば、酸化など)を抑制することができることがわかる。
【0103】
(実施例2および3)
辰砂釉は、色材として酸化第二銅を含む釉薬である。かかる辰砂釉は、一酸化炭素ガスを含む還元雰囲気中において、1200℃前後の高火度で焼成させることにより、酸化第二銅が金属銅となり赤色を呈する。しかしながら、還元焼成には、有害な一酸化炭素ガスを用いる必要があることから、焼成を行なうために十分な注意を要する。実施例1で得られた複合ナノ粒子は、赤色を呈していることから、当該複合ナノ粒子中の銅ナノ粒子を酸化させずに焼成させることができれば、辰砂釉と同様の赤色を呈することができると考えられる。そこで、実施例1で得られた複合ナノ粒子を用い、低火度(800℃前後)での酸化焼成であっても辰砂釉の赤色と同様の色を呈する釉薬の調製を試みた。
【0104】
実施例1で得られた複合ナノ粒子0.02gと低火度無鉛楽用フリット〔京都市産業技術研究所製、融点:約680℃、組成:二酸化ケイ素60.9モル%、酸化アルミニウム2.8モル%、酸化ホウ素12.6モル%、酸化リチウム9.2モル%、酸化ナトリウム4.5モル%、酸化カリウム3.1モル%、酸化亜鉛6.9モル%〕1.0gとをイオン交換水0.6mLに添加し、メノー乳鉢で粉砕した。得られた混合物に、助剤である平均粒子径:80μmの金属ケイ素粉末0.01g(実施例2)または0.02g(実施例3)を添加し、混合して釉薬を得た。
【0105】
(比較例2および3)
比較例1で得られた銅ナノ粒子0.02gと低火度無鉛楽用フリット1.0gとをイオン交換水0.6mLに添加し、メノー乳鉢で粉砕した。得られた混合物に、助剤である平均粒子径:80μmの金属ケイ素粉末0.01g(比較例2)または0.02g(比較例3)を添加し、混合して釉薬を得た。
【0106】
(比較例4)
実施例1で得られた複合ナノ粒子0.02gと、低火度無鉛楽用フリット〔京都市産業技術研究所製、融点:約680℃〕1.0gとをイオン交換水0.6mLに添加し、メノー乳鉢で粉砕して釉薬を得た。
【0107】
(製造例3)
磁器土を成形し、直径30mmの円板状の小片を得た。得られた小片を800℃で素焼きした。素焼き後の小片に一号石灰釉を施釉した。つぎに、前記小片を1250℃で還元焼成し、テストピースを得た。
【0108】
(試験例2)
製造例3で得られたテストピースの表面に、実施例2および3ならびに比較例2〜4で得られた各釉薬を施釉した。その後、テストピースを乾燥させた。
【0109】
つぎに、テストピースを大気雰囲気で焼成した(酸化焼成)。なお、焼成条件は、室温から800℃までの昇温時間が5時間および800℃での保持時間が5分間である。その後、テストピースの表面の釉薬における赤色の発色の有無を肉眼で観察した。その結果を表1に示す。
【0110】
【表1】

【0111】
表1に示された結果から、実施例1で得られた複合ナノ粒子と金属ケイ素粉末とを含む釉薬(実施例2および3)は、酸化焼成で赤色を呈することがわかる。
【0112】
一方、比較例1で得られた銅ナノ粒子と金属ケイ素粉末とを含む釉薬(比較例2および3)は、赤色を呈しないことがわかる。また、実施例1で得られた銅ナノ粒子を含むが、金属ケイ素粉末を含まない釉薬(比較例4)も、赤色を呈しないことがわかる。
【0113】
これらの結果から、色材である実施例1で得られた複合ナノ粒子と、助剤である金属ケイ素を含む釉薬は、低火度(800℃前後)での酸化焼成であっても、赤色を呈することがわかる。
【0114】
(試験例3)
製造例3で得られたテストピースの表面に、実施例3で得られた釉薬を施釉した。その後、テストピースを乾燥させた。つぎに、テストピースを大気(酸化雰囲気)中で焼成した(酸化焼成)。焼成条件は、試験例1における焼成条件と同じである。
【0115】
焼成後のテストピースのX線回折パターンを、前記X線回折装置を用いて測定し、化学種を同定した。試験例3において、実施例3で得られた釉薬を施釉し、焼成したテストピースのX線回折パターンを調べた結果を図17に示す。図中、丸は二酸化ケイ素に特有のピーク、四角は金属ケイ素に特有のピークおよび三角は銅に特有のピークを示す。
【0116】
また、受光型分光光度計〔(株)日立ハイテクフィールディング製、商品名:U−3500〕を用い、焼成後のテストピースの反射スペクトルを測定した。試験例3において、実施例3で得られた釉薬を施釉し、焼成したテストピースの反射スペクトルを調べた結果を図18に示す。
【0117】
図17に示された結果から、銅に特有のピークが見られることがわかる。かかる結果から、テストピースの表面の釉薬中に銅が存在していることがわかる。また、図18に示された結果から、波長600nm以上の範囲でピークが見られることがわかる。かかる結果から、前記テストピースの表面の釉薬は、赤色を呈していることがわかる。
【0118】
これらの結果からも、低火度(800℃前後)での酸化焼成を行なった場合であっても、色材である実施例1で得られた複合ナノ粒子と、助剤である金属ケイ素とを含む釉薬は、低火度(800℃前後)での酸化焼成であっても、辰砂釉の赤色と同様の色を呈することがわかる。
【0119】
(実施例4および5)
実施例1で得られた複合ナノ粒子0.02gと、助剤である平均粒子径:40μmの金属ケイ素粉末0.005g(実施例4)または0.01g(実施例5)とをイオン交換水0.3mLに添加し、メノー乳鉢で粉砕した。得られた混合物に、低火度無鉛楽用フリット1.0gを添加し、混合して釉薬を得た。
【0120】
(比較例5および6)
平均粒子径:3μmの酸化第一銅粉末0.005gと、助剤としての平均粒子径:40μmの金属ケイ素粉末0.002g(比較例5)または0.005g(比較例6)とをイオン交換水0.3mLに添加し、メノー乳鉢で粉砕した。得られた混合物に、低火度無鉛楽用フリット1.0gを添加し、混合して釉薬を得た。
【0121】
(比較例7)
平均粒子径:13μmの酸化第二銅粉末0.005gと、助剤としての平均粒子径:40μmの金属ケイ素粉末0.005g(比較例7)とをイオン交換水0.3mLに添加し、メノー乳鉢で粉砕した。得られた混合物に、低火度無鉛楽用フリット1.0gを添加し、混合して釉薬を得た。
【0122】
(試験例4)
製造例3で得られたテストピースの表面に、実施例4および5ならびに比較例5〜7で得られた各釉薬を施釉した。その後、テストピースを乾燥させた。
【0123】
つぎに、テストピースを大気雰囲気で焼成した(酸化焼成)。なお、焼成条件は、試験例1における焼成条件と同じである。
【0124】
その後、分光色差計〔日本電色工業(株)製、商品名:NF333〕を用い、テストピースの表面の釉薬の測定径4mmの範囲のL*a*b*表色系色度を測定して色彩を評価した。試験例4において、実施例4および5ならびに比較例5〜8で得られた各釉薬を施釉し、焼成したテストピースの表面の釉薬のL*a*b*表色系色度を調べた結果を図19に示す。
【0125】
図19に示された結果から、色材として実施例1で得られた複合ナノ粒子を含む釉薬(実施例4および5)は、低火度(800℃前後)での酸化焼成を行なった場合であっても、色材として酸化第一銅粉末または酸化第二銅粉末を含む釉薬(比較例5〜7)と比べて、辰砂釉の赤色により近い色を呈することがわかる。
【0126】
(実施例6)
実施例2において、平均粒子径:80μmの金属ケイ素粉末0.01gの代わりに酒石酸ナトリウムカリウム0.08gを用いたことを除き、実施例2と同様の操作を行ない、釉薬を得た。
【0127】
(実施例7)
実施例2において、平均粒子径:80μmの金属ケイ素粉末0.01gの代わりに酒石酸ナトリウムカリウム0.08gを用いたことおよび低火度無鉛楽用フリットの代わりに京無鉛和絵具〔二酸化ケイ素64.3モル%、酸化アルミニウム3.0モル%、酸化ホウ素21.5モル%、酸化リチウム2.9モル%、酸化ナトリウム2.0モル%、酸化カリウム3.0モル%、酸化バリウム1.2モル%、酸化亜鉛2.2モル%〕を用いたことを除き、実施例2と同様の操作を行ない、釉薬を得た。
【0128】
(試験例5)
実施例6および7で得られた各釉薬を、製造例3で得られたテストピースの表面に施釉した。その後、テストピースを乾燥させた。
【0129】
つぎに、テストピースを大気雰囲気で焼成した(酸化焼成)。なお、焼成条件は、試験例1における焼成条件と同じである。その後、テストピースの表面の釉薬における赤色の発色の有無を肉眼で観察した。
【0130】
その結果、実施例6および7で得られた各釉薬は、酸化焼成を行なうことにより、赤色を呈していた。なかでも、実施例7で得られた釉薬は、実施例6で得られた釉薬よりも、より良好に発色していた。
【0131】
(実施例8)
実施例1において、ゼラチンの代わりにポリビニルアルコールを用いることを除き、実施例1と同様の操作を行ない、複合ナノ粒子を得る。得られた複合ナノ粒子においては、実施例1で得られた複合ナノ粒子と同様に、外部環境要因による金属ナノ粒子への影響が低減され、金属ナノ粒子の状態の変化(例えば、酸化など)が抑制される。
【0132】
(実施例9〜11)
実施例1において、テトラエトキシシランの代わりにテトラメトキシシラン(実施例9)、テトラプロポキシシラン(実施例10)またはテトラブトキシシラン(実施例11)を用いることを除き、実施例1と同様の操作を行ない、複合ナノ粒子を得る。得られた複合ナノ粒子は、実施例1で得られた複合ナノ粒子と同様に、複合ナノ粒子の外部環境要因による金属ナノ粒子への影響を低減させることができ、金属ナノ粒子の状態の変化(例えば、酸化など)を抑制することができる。
【0133】
(実施例12〜14)
実施例1において、水酸化ナトリウムの代わりに水酸化カリウム(実施例12)、水酸化マグネシウム(実施例13)または水酸化カルシウム(実施例14)を用いることを除き、実施例1と同様の操作を行ない、複合ナノ粒子を得る。得られた複合ナノ粒子は、実施例1で得られた複合ナノ粒子と同様に、複合ナノ粒子の外部環境要因による金属ナノ粒子への影響を低減させることができ、金属ナノ粒子の状態の変化(例えば、酸化など)を抑制することができる。
【0134】
(製造例4)
銅粉末〔福田金属箔粉工業(株)製、商品名:Cu−HWQ(微粉末)、平均粒子径:1.5μm〕0.003mol(0.2g)を、14.8Mアンモニア水溶液20mLに添加してテトラアンミン銅(II)を形成させ、テトラアンミン銅(II)水溶液を得た。得られたテトラアンミン銅(II)水溶液に、ゼラチン0.1gを添加して、溶液Cを得た。なお、溶液CのpHは、pHメータの測定限界であったことから、13.5以上であると考えられる。
【0135】
(製造例5)
ヒドラジン0.06molを、14.8Mアンモニア水溶液20mLに添加し、ヒドラジン水溶液を得た。得られたヒドラジン水溶液に、ゼラチン0.1gを添加し、溶液Dを得た。なお、溶液DのpHは、pHメータの測定限界であったことから、13.5以上であると考えられる。
【0136】
(実施例15)
(1)銅ナノ粒子の調製
製造例4で得られた溶液Cおよび製造例5で得られた溶液Dを、それぞれの温度が50℃になるように維持しながら、窒素ガスで30分間脱気した。その後、溶液Cと溶液Dとを混合し、得られた混合物を、その温度が50℃になるように維持し、かつ窒素ガスで脱気しながら、マグネティックスターラーを用いて500rpmで2時間撹拌した。これにより、テトラアンミン銅(II)から微量に生じる銅イオンを徐々に還元させ、銅ナノ粒子を含む分散液を得た。
【0137】
(2)複合ナノ粒子の調製
前記(1)で得られた銅ナノ粒子を含む分散液10mLに、テトラエトキシシラン10mLを添加した。なお、前記テトラエトキシシランは、予め、窒素ガスバブリング(0.1dm3/min)で30分間脱気されたものである。得られた混合物を、500rpmで撹拌しながら70℃で20時間維持した。
【0138】
つぎに、得られた産物に含まれる粒子を、透過型電子顕微鏡〔日本電子(株)製、商品名:JEM−2010〕で観察した。実施例15において、得られた産物に含まれる粒子を透過型電子顕微鏡で観察した結果を図20に示す。図中、スケールバーは、100nmを示す。
【0139】
図20に示された結果から、銅ナノ粒子の周囲にシリカからなる層が形成されていることがわかる。したがって、前記産物は、銅ナノ粒子の表面がシリカで覆われた複合ナノ粒子であることがわかる。
【0140】
(試験例6)
試験例1において、実施例1で得られた複合ナノ粒子を室温で200日間放置する代わりに実施例15で得られた複合ナノ粒子を室温で200日間以上放置することを除き、試験例1と同様の操作を行ない、複合ナノ粒子のX線回折パターンを測定し、化学種を同定する。その結果、実施例15で得られた複合ナノ粒子は、実施例1で得られた複合ナノ粒子よりも長期間放置しても銅に特有のピークのみが検出される場合、実施例15のように複合ナノ粒子を製造することによって複合ナノ粒子中の金属ナノ粒子をより安定に保持できることが示される。
【0141】
(実施例16〜18)
実施例15で得られた複合ナノ粒子0.02gと低火度無鉛楽用フリット〔京都市産業技術研究所製、融点:約680℃、組成:二酸化ケイ素60.9モル%、酸化アルミニウム2.8モル%、酸化ホウ素12.6モル%、酸化リチウム9.2モル%、酸化ナトリウム4.5モル%、酸化カリウム3.1モル%、酸化亜鉛6.9モル%〕1.0gとをイオン交換水0.6mLに添加し、メノー乳鉢で粉砕した。得られた混合物に、助剤である平均粒子径:80μmの金属ケイ素粉末0.003g(実施例16)、0.004g(実施例17)または0.005g(実施例18)を添加し、混合して釉薬を得た。
【0142】
(試験例7)
製造例3で得られたテストピースの表面に、実施例16〜18で得られた各釉薬を施釉した。その後、テストピースを乾燥させた。
【0143】
つぎに、テストピースを大気雰囲気で焼成した(酸化焼成)。なお、焼成条件は、試験例1における焼成条件と同じである。
【0144】
その後、分光色差計〔日本電色工業(株)製、商品名:NF333〕を用い、テストピースの表面の釉薬の測定径4mmの範囲のL*a*b*表色系色度を測定して色彩を評価した。試験例7において、実施例16〜18で得られた各釉薬を施釉し、焼成したテストピースの表面の釉薬のL*a*b*表色系色度を調べた結果を図21に示す。
【0145】
図21に示された結果から、色材として実施例15で得られた複合ナノ粒子を含む釉薬も、色材として実施例1で得られた複合ナノ粒子を含む釉薬と同様に、低火度(800℃前後)での酸化焼成を行なった場合であっても、辰砂釉の赤色に近い色を呈することがわかる。
【符号の説明】
【0146】
1 複合ナノ粒子
1a,1b 複合ナノ粒子
10 金属イオン供与体
10a 金属化合物
10b 金属イオン
11 金属ナノ粒子
12 化合物
13 シリカナノ粒子
14 シリカ層
【技術分野】
【0001】
本発明は、複合ナノ粒子およびその製造方法、釉薬ならびに金属ナノ粒子の製造方法に関する。
【背景技術】
【0002】
陶磁器に用いられている釉薬の1つとして、赤色を呈する辰砂釉が知られている。前記辰砂釉は、酸化第二銅を含有している。前記辰砂釉を1250℃付近の高火度で、還元焼成すると、前記辰砂釉に含まれる酸化第二銅が還元され、金属銅が生じる。これにより、辰砂釉は、赤色を呈する。
しかしながら、還元焼成は、一酸化炭素ガスを含む還元雰囲気下に高火度で行なわれることから、細心の注意を要する。
【0003】
ところで、金属ナノ粒子は、当該金属ナノ粒子を構成する金属の種類によって、金属のバルク材料とは異なる物性を示す。したがって、金属ナノ粒子は、触媒、紫外線遮蔽剤、電子部品、光学部品、発光材料、塗料、磁性材料などの材料として種々の工業分野での利用が期待されている。
【0004】
金属ナノ粒子を製造する方法として、液相還元法(例えば、特許文献1などを参照)が提案されている。かかる液相還元法は、液相中で還元剤によって金属イオンを還元する方法である。
【0005】
ところが、金属ナノ粒子は、表面積が大きいため、一般的に凝集しやすい傾向にあるため、分離した状態で単離することが困難である。そこで、金属ナノ粒子同士の凝集を抑制し、保護剤によって金属ナノ粒子の表面を被覆して、金属ナノ粒子同士の凝集を抑制する方法が提案されている。
【先行技術文献】
【特許文献】
【0006】
【特許文献1】特開2010−31354号公報
【発明の概要】
【発明が解決しようとする課題】
【0007】
しかしながら、銅や銀などのように酸素などの外部環境要因との反応性の高い金属の場合、金属ナノ粒子の表面に酸化物が生じやすく、保護剤による被覆が困難である。そのため、このような金属を含むナノ粒子の製造には、複雑な操作を要する。また、反応性の高い金属の場合、長期間にわたって金属ナノ粒子を安定な状態に保つことが困難である。
したがって、反応性の高い金属を用いた場合であっても、当該金属を安定な状態に保つことができ、しかも、容易に製造することができる複合ナノ粒子が望まれている。
【0008】
本発明は、このような事情に鑑みてなされたものであり、反応性の高い金属を用いた場合であっても、当該金属を安定な状態に保つことができ、しかも、容易に製造することができる複合ナノ粒子およびその製造方法、低火度や中火度での酸化焼成であっても赤色に発色させることができる釉薬ならびに簡便な操作で、金属ナノ粒子を容易に製造することができる金属ナノ粒子の製造方法を提供することを目的とする。
【課題を解決するための手段】
【0009】
本発明の複合ナノ粒子の製造方法は、金属ナノ粒子と当該金属ナノ粒子上に形成されたシリカとを含み、前記金属ナノ粒子がシリカで覆われている複合ナノ粒子を製造する方法であって、
(I)金属に結合する官能基およびシリカに結合する官能基を有する化合物からなる分散剤と溶媒と金属イオン供与体とを含む液体中において、前記金属イオン供与体に由来する金属イオンの活量を制御しながら前記金属イオンを生じさせ、当該金属イオンを還元させて金属ナノ粒子を析出させ、金属ナノ粒子を含む分散液を得る工程、および
(II)前記工程(I)で得られた分散液に、縮重合によってシリカネットワークを形成するシリカ前駆体化合物を添加し、前記金属ナノ粒子上にシリカを形成させる工程
を含むことを特徴としている。
【0010】
本発明の複合ナノ粒子の製造方法では、前記液体中で金属イオンの活量を制御しながら当該金属イオンを生じさせるとともに還元させ、析出させた金属ナノ粒子を含む分散液にシリカ前駆体化合物を添加することにより、金属ナノ粒子上にシリカを形成させている。これにより、金属ナノ粒子の大きさを容易に制御することができ、かつ金属ナノ粒子を、迅速かつ簡便な操作で、シリカで覆うことができる。したがって、反応性の高い金属を用いた場合であっても、当該金属を安定な状態に保つことができ、しかも、容易に製造することができる。
【0011】
本発明の複合ナノ粒子の製造方法では、前記分散剤は、ゼラチン、ポリビニルアルコール、オレイン酸およびポリエチレングリコールからなる群より選ばれた少なくとも1種の化合物からなることが好ましい。これにより、析出させた金属ナノ粒子同士の凝集を効果的に抑制することができる。金属ナノ粒子同士の凝集を抑制し、かつ金属ナノ粒子上におけるシリカの形成を効率よく行なう観点から、ゼラチンからなることがより好ましい。
【0012】
本発明の複合ナノ粒子の製造方法では、前記工程(I)および前記工程(II)を、不活性ガス通気条件下で実施してもよい。これにより、例えば、金属ナノ粒子が酸化しやすい金属からなるナノ粒子である場合であっても、当該金属を安定な状態に保つことができ、複合ナノ粒子を容易に製造することができる。
【0013】
本発明の複合ナノ粒子の製造方法では、前記金属イオン供与体として、前記溶媒に難溶性で、かつ前記溶媒のpHとは異なるpH条件下で金属イオンを徐放する金属化合物を用い、前記工程(I)において、pH調整剤によって前記液体のpHを前記溶媒のpHとは異なるpHに調整して金属イオンの活量を制御しながら前記金属イオンを生成させることができる。これにより、析出させる金属ナノ粒子の大きさを容易に制御することができ、効率よく金属ナノ粒子を得ることができる。
【0014】
本発明の複合ナノ粒子の製造方法では、前記金属化合物が、アルカリ性条件下で金属イオンを徐放する金属化合物であってもよく、前記pH調整剤が、前記金属イオンに対応する金属との錯体を形成しないアルカリであってもよい。これにより、金属ナノ粒子が複数個のシリカナノ粒子によって覆われた複合ナノ粒子を得ることができる。
この場合、球状の小さなシリカナノ粒子を形成させる観点から、前記pH調整剤がアルカリ金属水酸化物またはアルカリ土類金属水酸化物であることが好ましい。
【0015】
本発明の複合ナノ粒子の製造方法では、前記溶媒として、水、前記金属イオン供与体として、酸化第二銅および前記pH調整剤として、水酸化ナトリウムを用いてもよい。これにより、酸化しやすい銅ナノ粒子が複数個のシリカナノ粒子によって覆われた複合ナノ粒子を容易に得ることができる。
【0016】
本発明の複合ナノ粒子の製造方法では、前記金属イオン供与体として、前記溶媒のpHとは異なるpH条件下で金属イオンを徐放する金属錯体を用い、前記工程(I)において、pH調整剤によって前記液体のpHを前記溶媒のpHとは異なるpHに調整して金属イオンの活量を制御しながら前記金属イオンを生成させることができる。これにより、金属ナノ粒子がシリカからなる層によって覆われた複合ナノ粒子を得ることができる。
この場合、前記金属イオン供与体として、銅錯体を用い、かつ前記pH調整剤として、アンモニア水溶液を用いてもよい。これにより、酸化しやすい銅ナノ粒子がシリカからなる層によって覆われた複合ナノ粒子を容易に得ることができる。
【0017】
また、本発明の複合ナノ粒子の製造方法では、前記工程(I)において、分散剤および溶媒の存在下に、金属と、当該金属と錯体を形成するpH調整剤とを当該pH調整剤が前記金属に対して過剰量となるように混合することにより、金属錯体を生成させるとともに、前記金属錯体に由来する金属イオンの活量を制御しながら前記金属イオンを生成させてもよい。これにより、金属ナノ粒子がシリカからなる層によって覆われた複合ナノ粒子を得ることができる。
この場合、前記金属は、銅であってもよい。これにより、酸化しやすい銅ナノ粒子がシリカからなる層によって覆われた複合ナノ粒子を容易に得ることができる。
【0018】
本発明の複合ナノ粒子は、1つの側面では、前述した方法を行なうことにより得られる複合ナノ粒子である。
また、本発明の複合ナノ粒子は、他の側面では、金属ナノ粒子と、当該金属ナノ粒子上に形成されたシリカとを含む複合ナノ粒子であって、前記金属ナノ粒子が複数個のシリカナノ粒子によって覆われていることを特徴とする複合ナノ粒子である。前記金属ナノ粒子は、銅ナノ粒子であってもよい。
【0019】
本発明の複合ナノ粒子は、前記金属ナノ粒子が前記シリカによって覆われて外部環境から保護されているため、前記金属ナノ粒子が反応性の高い金属からなるナノ粒子であったとしても、安定な状態に保つことができる。
【0020】
本発明の釉薬は、焼成により赤色を呈する釉薬であって、前述した複合ナノ粒子のうち金属ナノ粒子が銅ナノ粒子である複合ナノ粒子と、金属ケイ素または酒石酸ナトリウムカリウムとを含有することを特徴としている。
【0021】
本発明の釉薬は、前記複合ナノ粒子と金属ケイ素または酒石酸ナトリウムカリウムとを含有するため、低火度や中火度での酸化焼成であっても赤色に発色させることができる。したがって、本発明の釉薬は、例えば、従来の赤色釉薬である辰砂釉のように、高火度での還元焼成を行なわなくてもよいため、取り扱いやすい。
【0022】
本発明の金属ナノ粒子の製造方法は、分散剤と溶媒と金属錯体とを含む溶液中において、金属錯体に由来する金属イオンの活量を制御しながら前記金属イオンを生じさせた後、前記金属イオンを還元させて金属ナノ粒子を析出させることを特徴としている。
本発明の金属ナノ粒子の製造方法では、分散剤および溶媒の存在下に、金属と、当該金属と錯体を形成するアルカリとを当該アルカリが前記金属に対して過剰量となるように混合することにより、金属錯体を形成させるとともに、前記金属錯体に由来する金属イオンの活量を制御しながら前記金属イオンを生じさせた後、前記金属イオンを還元させて金属ナノ粒子を析出させてもよい。
【0023】
本発明の金属ナノ粒子の製造方法では、前記液体中で金属イオンの活量を制御しながら当該金属イオンを生じさせるとともに還元させ、金属ナノ粒子を析出させている。したがって、簡便な操作で、金属ナノ粒子を製造することができ、しかも、金属ナノ粒子の大きさを容易に制御することができる。
【発明の効果】
【0024】
本発明の複合ナノ粒子およびその製造方法は、反応性の高い金属を用いた場合であっても、当該金属を安定な状態に保つことができ、しかも、容易に製造することができるという優れた効果を奏する。また、本発明の釉薬は、低火度や中火度での酸化焼成であっても赤色に発色させることができるという優れた効果を奏する。また、本発明の金属ナノ粒子の製造方法は、簡便な操作で、金属ナノ粒子を製造することができるという優れた効果を奏する。
【図面の簡単な説明】
【0025】
【図1】本発明の一実施形態に係る複合ナノ粒子(第1実施形態)の構造を示す概略説明図である。
【図2】本発明の他の実施形態に係る複合ナノ粒子(第2実施形態)の構造を示す概略説明図である。
【図3】本発明に係る複合ナノ粒子の製造方法の処理手順を示す工程図である。
【図4】本発明の一実施形態に係る複合ナノ粒子の製造方法(第1の方法)の処理手順を示す工程図である。
【図5】本発明の一実施形態に係る複合ナノ粒子の製造方法(第1の方法)における分散液調製工程の処理手順の一部を示す工程図である。
【図6】本発明の一実施形態に係る複合ナノ粒子の製造方法(第1の方法)における分散液調製工程の処理手順の一部を示す工程図である。
【図7】本発明の一実施形態に係る複合ナノ粒子の製造方法(第1の方法)における金属ナノ粒子析出工程を示す概略説明図である。
【図8】本発明の他の実施形態に係る複合ナノ粒子の製造方法(第2の方法)の処理手順を示す工程図である。
【図9】本発明の他の実施形態に係る複合ナノ粒子の製造方法(第2の方法)における金属錯体含有溶液調製工程の処理手順の一部を示す工程図である。
【図10】本発明の他の実施形態に係る複合ナノ粒子の製造方法(第2の方法)における金属錯体含有溶液調製工程の処理手順の一部を示す工程図である。
【図11】実施例1において、得られた産物のX線回折パターンを調べた結果を示すグラフである。
【図12】(a)は実施例1(1)において、得られた産物の沈殿物を走査型電子顕微鏡で観察した結果を示す図面代用写真、(b)は実施例1(1)において、得られた産物の上澄みを走査型電子顕微鏡で観察した結果を示す図面代用写真である。
【図13】実施例1(1)において、得られた産物の可視光吸収スペクトルを測定した結果を示すグラフである。
【図14】実施例1(2)において、得られた産物のX線回折パターンを調べた結果を示すグラフである。
【図15】(a)および(b)は、実施例1(2)において、得られた産物に含まれる粒子を透過型電子顕微鏡で観察した結果を示す図面代用写真である。
【図16】試験例1において、実施例1で得られた複合ナノ粒子(下段のパターン)および比較例1で得られた銅ナノ粒子(上段のパターン)それぞれのX線回折パターンを調べた結果を示すグラフである。
【図17】試験例3において、実施例3で得られた釉薬を施釉し、焼成したテストピースのX線回折パターンを調べた結果を示すグラフである。
【図18】試験例3において、実施例3で得られた釉薬を施釉し、焼成したテストピースの反射スペクトルを調べた結果を示すグラフである。
【図19】試験例4において、実施例4および5ならびに比較例5〜8で得られた各釉薬を施釉し、焼成したテストピースの表面の釉薬のL*a*b*表色系色度を調べた結果を示すグラフである。
【図20】実施例15において、得られた産物に含まれる粒子を透過型電子顕微鏡で観察した結果を示す図面代用写真である。
【図21】試験例7において、実施例16〜18で得られた各釉薬を施釉し、焼成したテストピースの表面の釉薬のL*a*b*表色系色度を調べた結果を示すグラフである。
【発明を実施するための形態】
【0026】
[複合ナノ粒子]
(1)第1実施形態
本発明の一実施形態に係る複合ナノ粒子は、1つの側面では金属ナノ粒子と、当該金属ナノ粒子上に形成されたシリカとを含む複合ナノ粒子であって、前記金属ナノ粒子が複数個のシリカナノ粒子によって覆われていることを特徴とする複合ナノ粒子である。
【0027】
図1は、本発明の一実施形態に係る複合ナノ粒子(第1実施形態)の構造を示す概略説明図である。
図1に示される複合ナノ粒子1aは、金属ナノ粒子11と、複数個のシリカナノ粒子13とを含有している。複合ナノ粒子1aにおいて、金属ナノ粒子11上には、金属ナノ粒子11を覆うように複数個のシリカナノ粒子13が形成されている。これより、金属ナノ粒子11は、当該金属ナノ粒子11の周囲に存在するシリカナノ粒子13によって、外部環境から保護された状態となっている。したがって、複合ナノ粒子1aでは、金属ナノ粒子11が反応性の高い金属からなるナノ粒子であったとしても当該金属ナノ粒子11が安定な状態に保たれる。
【0028】
なお、本明細書において、「金属」の概念には、いわゆる合金も包含される。
【0029】
金属ナノ粒子11を構成する金属としては、例えば、銅、銀、ニッケル、金、白金、コバルトなどが挙げられるが、本発明は、かかる例示のみに限定されるものではない。例えば、金属ナノ粒子11を構成する金属として、銅が用いられた複合ナノ粒子(すなわち、金属ナノ粒子11が、銅ナノ粒子である複合ナノ粒子)は、赤色を呈する釉薬の色材などとして用いることができる点で有用である。
【0030】
金属ナノ粒子11の粒子径は、複合ナノ粒子1aの用途などによって異なるので、かかる用途などに応じて決定されることが望ましい。前記粒子径は、通常、5nm〜500nmである。
【0031】
複合ナノ粒子1a中において、シリカナノ粒子13の量は、金属ナノ粒子11の種類や粒子径、複合ナノ粒子1aの用途などによって異なるので、かかる用途などに応じて決定されることが望ましい。通常、金属ナノ粒子1molあたりのシリカナノ粒子13の量が、1mol〜25molである。
なお、本明細書において、「複数個のシリカナノ粒子」は、複合ナノ粒子1aにおいて、金属ナノ粒子1molあたりの量が1mol〜25molとなる個数のシリカナノ粒子であればよい。
【0032】
シリカナノ粒子13の粒子径は、複合ナノ粒子1aの用途などによって異なるので、かかる用途などに応じて決定されることが望ましい。前記粒子径は、通常、金属ナノ粒子の粒子径よりも小さい粒子径である。
【0033】
かかる複合ナノ粒子1aにおいては、図1に示されるように、シリカナノ粒子13は、後述の複合ナノ粒子の製造方法において分散剤として用いられる化合物(金属に結合する官能基とシリカに結合する官能基とを有する化合物12)を介して金属ナノ粒子11上に形成されていてもよい。
前記化合物12における金属に結合する官能基としては、例えば、チオール基、水酸基、アミノ基などが挙げられるが、本発明は、かかる例示のみに限定されるものではない。
また、前記化合物12におけるシリカに結合する官能基としては、例えば、水酸基などが挙げられるが、本発明は、かかる例示のみに限定されるものではない。
前記化合物12としては、例えば、ゼラチン、ポリビニルアルコール、オレイン酸、ポリエチレングリコール、メチルセルロース、カルボキシメチルセルロースなどが挙げられるが、本発明は、かかる例示のみに限定されるものではない。金属ナノ粒子およびシリカナノ粒子それぞれに効果的に結合することができることから、ゼラチン、ポリビニルアルコール、オレイン酸およびポリエチレングリコールからなる群より選ばれた少なくとも1種が好ましく、ゼラチンがより好ましい。
【0034】
第1実施形態に係る複合ナノ粒子は、他の側面では、後述の複合ナノ粒子の製造方法(第1の方法)により得られるものであってもよい。
【0035】
以上のように、第1実施形態に係る複合ナノ粒子は、金属ナノ粒子が複数個のシリカナノ粒子によって覆われている構造を有することから、金属ナノ粒子が外部環境要因から保護された状態となっている。したがって、本発明の複合ナノ粒子は、金属ナノ粒子の機能などを安定な状態に保つことができるので、例えば、触媒、紫外線遮蔽剤、電子部品、光学部品、発光材料、塗料、磁性材料などの種々の分野に有用である。なお、本発明の複合ナノ粒子の用途は、かかる例示のみに限定されるものではない。
【0036】
(2)第2実施形態
本発明の他の実施形態に係る複合ナノ粒子は、1つの側面では、金属ナノ粒子と、当該金属ナノ粒子上に形成されたシリカとを含む複合ナノ粒子であって、前記金属ナノ粒子がシリカからなるシリカ層によって覆われていることを特徴とする複合ナノ粒子である。
図2は、本発明の一実施形態に係る複合ナノ粒子(第2実施形態)の構造を示す概略説明図である。
図2に示される複合ナノ粒子1bは、金属ナノ粒子11と、当該金属ナノ粒子11を覆うように金属ナノ粒子11上に形成されたシリカ(シリカ層14)とを含む。これより、複合ナノ粒子1b中の金属ナノ粒子11は、当該金属ナノ粒子11の周囲に存在するシリカからなるシリカ層14によって、複合ナノ粒子1aの金属ナノ粒子11と比べて、より確実に外部環境から保護された状態となっている。したがって、複合ナノ粒子1bは、金属ナノ粒子11が反応性の高い金属からなるナノ粒子である場合に有利である。
かかる反応性の高い金属としては、例えば、銅、銀、鉄、コバルト、ニッケル、スズなどが挙げられる。
【0037】
複合ナノ粒子1bにおける金属ナノ粒子11を構成する金属の種類および金属ナノ粒子11の粒子径は、前記複合ナノ粒子1aにおける金属ナノ粒子11を構成する金属の種類および金属ナノ粒子11の粒子径と同様である。
【0038】
シリカ層14の厚さは、複合ナノ粒子1bの用途などによって異なるので、一概には決定することができない。したがって、シリカ層14の厚さは、かかる用途などに応じて決定されることが望ましい。
【0039】
かかる複合ナノ粒子1bにおいては、図2に示されるように、シリカ層14は、後述の複合ナノ粒子の製造方法(第2の方法)において分散剤として用いられる化合物(金属に結合する官能基とシリカに結合する官能基とを有する化合物12)を介して金属ナノ粒子11上に形成されていてもよい。複合ナノ粒子1bにおける化合物12中の金属に結合する官能基およびシリカに結合する官能基ならびに化合物12の種類は、前記複合ナノ粒子1aにおける化合物12中の金属に結合する官能基およびシリカに結合する官能基ならびに化合物12の種類と同様である。
【0040】
以上のように、第2実施形態に係る複合ナノ粒子は、金属ナノ粒子がシリカ層によって覆われている構造を有することから、第1実施形態に係る複合ナノ粒子と比べて、金属ナノ粒子が外部環境要因から一層保護された状態となっている。したがって、第2実施形態に係る複合ナノ粒子は、金属ナノ粒子の機能などを安定な状態に保つことができるので、前記第1実施形態に係る複合ナノ粒子の用途に加え、金属ナノ粒子の機能などをより安定な状態に保つことが望まれる用途に有用である。
【0041】
[複合ナノ粒子の製造方法]
本発明の複合ナノ粒子の製造方法は、金属ナノ粒子と当該金属ナノ粒子上に形成されたシリカとを含み、前記金属ナノ粒子がシリカで覆われている複合ナノ粒子を製造する方法であって、
(I)金属に結合する官能基およびシリカに結合する官能基を有する化合物からなる分散剤と溶媒と金属イオン供与体とを含む液体中において、前記金属イオン供与体に由来する金属イオンの活量を制御しながら前記金属イオンを生じさせ、当該金属イオンを還元させて金属ナノ粒子を析出させ、金属ナノ粒子を含む分散液を得る工程、および
(II)前記工程(I)で得られた分散液に、縮重合によってシリカネットワークを形成するシリカ前駆体化合物を添加し、前記金属ナノ粒子上にシリカを形成させる工程
を含むことを特徴としている。
【0042】
図3は、本発明に係る複合ナノ粒子の製造方法の処理手順を示す工程図である。
本発明の複合ナノ粒子の製造方法では、まず、不活性ガス通気条件下に、金属に結合する官能基およびシリカに結合する官能基を有する化合物からなる分散剤と溶媒と金属イオン供与体10とを含む液体を調製する〔金属イオン供与体配合液調製工程、図3(a)参照〕。
つぎに、前記液体中で金属イオンの活量を制御しながら前記金属イオンを生じさせるとともに、当該金属イオンを還元させることにより、金属ナノ粒子11を析出させる〔金属ナノ粒子析出工程、図3(b)参照〕。これにより、析出させる金属ナノ粒子の大きさを容易に制御することができる。
その後、析出させた金属ナノ粒子を含む分散液にシリカ前駆体化合物を添加し、金属ナノ粒子上にシリカを形成させる〔シリカ形成工程、図3(c)参照〕。これにより、金属ナノ粒子を、迅速かつ簡便な操作で、シリカで覆うことができる。
【0043】
なお、本明細書において、「金属イオンの活量」とは、還元可能な状態の金属イオンの量をいう。
【0044】
本発明の複合ナノ粒子の製造方法は、液体中における金属イオンの活量の制御の仕方に基づき、大きく2つの方法に大別される。第1の方法は、溶媒に難溶性で、かつ前記溶媒のpHとは異なるpH条件下で金属イオンを徐放する金属化合物により、液体中における金属イオンの活量を制御する方法である。また、第2の方法は、前記溶媒のpHとは異なるpH条件下で金属イオンを徐放する金属錯体により、液体中における金属イオンの活量を制御する方法である。
【0045】
(1)第1の方法
まず、添付の図面に基づき、本発明の一実施形態に係る複合ナノ粒子の製造方法(第1の方法)を説明する。
図4は、本発明の一実施形態に係る複合ナノ粒子の製造方法(第1の方法)の処理手順を示す工程図である。なお、本実施形態では、金属ナノ粒子を構成する金属が酸素などの外部環境要因と反応しやすい金属である場合を例に挙げて説明するが、本発明は、かかる例示のみに限定されるものではない。
【0046】
第1の方法では、溶媒に難溶性で、かつ前記溶媒のpHとは異なるpH条件下で金属イオンを徐放する金属化合物を用いることにより、液体中に放出される還元可能な金属イオンの量を、ナノスケールの粒子を析出させるのに適した量となるように制御する点に1つの大きな特徴がある。
【0047】
第1の方法では、まず、複合ナノ粒子1a中の金属ナノ粒子11を構成する金属から得られる金属イオン供与体としての金属化合物10aの粉体の分散液を調製する〔分散液調製工程、図4(a)参照〕。
前記分散液は、例えば、金属化合物10aおよび分散剤を含む溶液Aと、還元剤および分散剤を含む溶液Bとを混合することにより得られるが、本発明は、かかる調製法のみに限定されるものではない。前記溶液Aは、例えば、図5に示される工程を行なうことにより調製することができるが、本発明は、かかる調製法のみに限定されるものではない。また、前記溶液Bは、例えば、図6に示される工程を行なうことにより調製することができるが、本発明は、かかる調製法のみに限定されるものではない。
【0048】
図5に示される溶液Aの調製に際しては、まず、溶媒に金属化合物10aの粉体を添加する〔金属化合物添加工程、図5(a)参照〕。
金属化合物10aは、金属ナノ粒子11を構成する金属を含み、前記溶媒に難溶性で、かつ前記溶媒のpHとは異なるpH条件下で金属イオンを徐放する化合物である。
なお、本明細書において、「溶媒に難溶性である」とは、溶媒に対する20℃での溶解度が10−16以下であることをいう。この場合、前記溶解度が小さいほど、溶媒中に存在する金属イオンの量が少なくなるので、析出する金属ナノ粒子の粒子径が小さくなる。また、本明細書において、「徐放」とは、金属ナノ粒子を析出させるに適した微量の金属イオンを生じることをいう。
金属化合物10aは、金属ナノ粒子11を構成する金属の種類により異なる。金属ナノ粒子11を構成する金属が銅である場合、金属化合物10aとしては、例えば、酸化第二銅などが挙げられるが、本発明は、かかる例示のみに限定されるものではない。また、金属ナノ粒子11を構成する金属がニッケルである場合、金属化合物10aとしては、例えば、酸化ニッケル、水酸化ニッケルなどが挙げられるが、本発明は、かかる例示のみに限定されるものではない。金属ナノ粒子11を構成する金属がコバルトである場合、金属化合物10aとしては、例えば、酸化コバルト、水酸化コバルトなどが挙げられるが、本発明は、かかる例示のみに限定されるものではない。
前記溶媒に添加する金属化合物10aの粉体の量は、最終生成物である金属ナノ粒子の量に応じて、適宜設定することができる。通常、溶媒100mlあたりの粉体の量が、4gであることが望ましい。
前記溶媒としては、例えば、水、エチレングリコール、プロピレングリコール、テトラヒドロフランなどが挙げられるが、本発明は、かかる例示のみに限定されるものではない。かかる溶媒は、金属ナノ粒子11を構成する金属の種類などに応じて適宜選択することができる。
つぎに、得られた産物に分散剤を添加する工程〔分散剤添加工程、図5(b)参照〕。
分散剤は、前記金属に結合する官能基とシリカに結合する官能基とを有する化合物12からなる。
前記産物に添加する分散剤の量は、金属化合物10aの粉体の量、生成させる金属ナノ粒子の粒子径などに応じて、適宜設定することができる。通常、金属化合物10a 100質量部あたりの分散剤の量が、1〜20質量部であることが望ましい。
つぎに、得られた混合物のpHを調整する〔pH調整工程、図5(c)参照〕。
混合物のpHは、当該混合物にpH調整剤を添加することにより調整することができる。
前記pH調整剤は、前記金属イオンに対応する金属との錯体を形成せず、かつシリカネットワークを修飾する化合物(以下、「シリカネットワークに対する修飾剤」ともいう)からなるのが好ましい。例えば、前記金属化合物10aがアルカリ性条件下で金属イオンを徐放する金属化合物である場合、かかるpH調整剤として、前記金属イオンに対応する金属との錯体を形成しないアルカリを用いることができる。前記シリカネットワークに対する修飾剤としては、例えば、水酸化ナトリウム、水酸化カリウムなどのアルカリ金属水酸化物;水酸化カルシウムなどのアルカリ土類金属水酸化物;リチウム酸化物などが挙げられるが、本発明は、かかる例示のみに限定されるものではない。これらのなかでは、シリカネットワークの形成時に、縮重合を適度に阻害して、球状の小さなシリカナノ粒子を容易に形成させることができることから、アルカリ金属水酸化物またはアルカリ土類金属水酸化物が好ましく、アルカリ金属水酸化物がより好ましい。アルカリ金属水酸化物のなかでは、シリカネットワークの形成時に、縮重合を適度に阻害して、球状の小さなシリカナノ粒子を容易に形成させることができることから、水酸化ナトリウムおよび水酸化カリウムが好ましく、水酸化ナトリウムがより好ましい。
前記混合物のpHは、金属化合物10aの種類、pH調整剤の種類、複合ナノ粒子の用途などによって異なるため、一概には決定することができない。したがって、前記溶液のpHは、金属化合物10aの種類、pH調整剤の種類、複合ナノ粒子の用途などに応じて適宜決定することが望ましい。通常、前記混合物のpHは、後述の金属ナノ粒子析出工程での還元反応を良好に進行させる観点から、好ましくは6〜14、より好ましくは7.5〜14である。溶液のpHをかかる範囲内で高くするほど、還元力が大きくなるので、還元反応の初期段階で生成する金属ナノ粒子の粒子径が小さくなる傾向がある。一方、溶液のpHを前記範囲内で低くするほど、還元力が小さくなるので、還元反応の初期段階で生成する金属ナノ粒子の粒子径が大きくなる傾向がある。
なお、金属化合物10aとして酸化第二銅を用いる場合、酸化第二銅は、水に難溶性であるが、当該水をアルカリ性(pH10〜14)に調整した場合には、わずかながら溶解する。そこで、金属化合物10aとして酸化第二銅を用いる場合には、溶媒として、水を用い、前記混合物のpHを10以上とすることにより、金属化合物10aより対応する金属イオンを微量に生じさせることができる。
その後、得られた溶液Aに不活性ガスを通気し脱気する〔脱気工程、図5(d)参照〕。
これにより、溶液A中の溶存酸素を除去することができる。
不活性ガスとしては、例えば、窒素ガス、アルゴンガスなどが挙げられる。
不活性ガスの流量は、溶液A中の溶存酸素を除去するのに十分な流量であればよい。また、脱気時間は、溶液A中の溶存酸素を除去するのに十分な時間であればよい。
【0049】
一方、図6に示される溶液Bの調製に際しては、まず、溶媒に還元剤を添加する〔還元剤添加工程、図6(a)参照〕。
前記溶媒は、前記溶液Aの調製に用いられる溶媒と同様である。
還元剤は、金属化合物10aから生じる金属イオンを還元する化合物であればよい。前記還元剤としては、特に限定されないが、例えば、ヒドラジン、次亜リン酸、水素化ホウ素、ジメチルアミンボラン(DMAB)、シュウ酸、水素化アルミニウムリチウムなどが挙げられるが、本発明は、かかる例示のみに限定されるものではない。これらのなかでは、高純度の複合ナノ粒子を得ることができる観点から、好ましくはヒドラジンである。前記還元剤は、本発明の目的を阻害しない範囲内であれば、塩を形成していてもよい。
前記溶媒に添加する還元剤の量は、金属イオンを還元するのに十分な量であればよく、金属イオンの量、生成させる金属ナノ粒子の量、還元剤の種類などに応じて、適宜設定することができる。
つぎに、得られた産物に分散剤を添加する工程〔分散剤添加工程、図6(b)参照〕。
分散剤および前記産物に添加する分散剤の量は、前記溶液Aの調製に用いられる分散剤および産物に添加する分散剤の量と同様である。
つぎに、得られた混合物のpHを調整する〔pH調整工程、図6(c)参照〕。
混合物のpHは、前記溶液Aの調製における混合物のpHの調整と同様の操作を行なうことにより調整することができる。また、混合物のpHは、前記溶液Aの調製における混合物のpHと同様である。
その後、得られた溶液Bに不活性ガスを通気し脱気する〔脱気工程、図6(d)参照〕。これにより、溶液B中の溶存酸素を除去することができる。したがって、例えば、金属が酸化しやすい金属である場合であっても、当該金属を安定な状態に保つことができ、複合ナノ粒子を容易に製造することができる。
不活性ガスの種類および不活性ガスの流量は、前記溶液Aの調製に用いられる不活性ガスの種類および不活性ガスの流量と同様である。
【0050】
分散液調製工程では、溶液Aと溶液Bとを、還元剤が金属イオンを還元するのに十分な量となるように混合することが望ましい。例えば、還元剤がヒドラジンである場合、金属化合物10a 1molに対して、ヒドラジンの量が10mol以上となるように、溶液Aと溶液Bとを混合することが望ましい。
【0051】
つぎに、前記分散液に不活性ガスを通気して脱気しながら、当該分散液中において、金属化合物10aから生じる金属イオンを還元させて金属ナノ粒子11を析出させる〔金属ナノ粒子析出工程、図4(b)参照〕。これにより、金属ナノ粒子11を含む液体が得られる。
金属イオンの還元および金属ナノ粒子11の析出は、前記分散液調製工程において、溶液Aと溶液Bとを混合すると同時に開始される。
金属ナノ粒子析出工程では、図7に示されるように、金属化合物10aがわずかに溶解することで生じた金属イオン10b(図7中、「Xn+」)が、還元剤の酸化に伴って生じた電子を受けとることによって還元され、金属ナノ粒子が析出される。かかる工程では、反応系(分散液)中において、金属イオン10bの量が略一定に保たれながら、常に定常状態で供給され、すぐに還元される。
本実施形態においては、金属イオン10bが還元されて析出する速度を制御することで、金属ナノ粒子11の粒子径を制御することができる。
前記速度は、反応系(分散液)中における還元剤の濃度を調整して還元反応の速度を制御することにより、制御することができる。
【0052】
本実施形態では、金属ナノ粒子11を構成する金属が酸素などの外部環境要因と反応しやすいことから、図7に示されるように、分散液に不活性ガスを通気しながら、金属イオン10bの還元および金属ナノ粒子11の析出を行なっている。これにより、酸素などの外部環境要因と金属ナノ粒子11を構成する金属との反応を抑制することができる。
【0053】
本金属ナノ粒子析出工程では、析出した金属ナノ粒子11を含む分散液を遠心沈降に供し、上澄みを分離してもよい。これにより、より小さな金属ナノ粒子11を得ることができる。
【0054】
その後、前記金属ナノ粒子析出工程で得られた液体に不活性ガスを通気して脱気しながら、当該液体に、縮重合によってシリカネットワークを形成するシリカ前駆体化合物(以下、単に、「シリカ前駆体化合物」という)を添加し、前記シリカネットワークに対する修飾剤の存在下においてシリカ前駆体化合物を縮重合させて、前記金属ナノ粒子を覆うように当該金属ナノ粒子11上に複数個のシリカナノ粒子13を形成させる〔シリカナノ粒子析出工程、図4(c)参照〕。
シリカ前駆体化合物としては、例えば、アルコキシ基の炭素数が1〜3であるテトラアルコキシシランなどが挙げられるが、本発明は、かかる例示のみに限定されるものではない。これらのなかでは、金属ナノ粒子上でのシリカナノ粒子の形成を良好に行なう観点から、テトラエトキシシランが好ましい。
シリカネットワークに対する修飾剤としては、前記と同様のものが挙げられる。
【0055】
前記液体に添加するシリカ前駆体化合物の量は、複合ナノ粒子の用途、複合ナノ粒子の形状などによって異なることから、複合ナノ粒子の用途、複合ナノ粒子の形状などに応じて、適宜設定することが望ましい。
シリカナノ粒子形成工程における金属ナノ粒子とシリカ前駆体化合物との体積比、pH、温度などにより、金属ナノ粒子を覆うシリカナノ粒子の量を制御することができると考えられる。
【0056】
なお、金属ナノ粒子11を構成する金属が、酸素などの外部環境要因との反応性が低い金属(例えば、金、白金など)である場合、前記分散液調製工程、金属ナノ粒子析出工程およびシリカナノ粒子形成工程における不活性ガスの通気による脱気を行なわなくてもよい。
【0057】
金属ナノ粒子11を構成する金属が、例えば、銅である場合、製造時における銅の酸化を抑制して効率よく複合ナノ粒子を製造する観点から、前記工程(I)において、溶媒として、水、金属化合物10aとして、酸化第二銅および前記pH調整剤として、水酸化ナトリウムとを用いることが好ましい。この場合、前記分散液調製工程、金属ナノ粒子析出工程およびシリカナノ粒子形成工程を、前述のように、不活性ガスを通気させながら行なうことにより、製造時における銅の酸化をより効果的に抑制して効率よく複合ナノ粒子を製造することができる。
【0058】
(2)第2の方法
つぎに、添付の図面に基づき、本発明の他の実施形態に係る複合ナノ粒子の製造方法(第2の方法)を説明する。
図8は、本発明の他の実施形態に係る複合ナノ粒子の製造方法(第2の方法)の処理手順を示す工程図である。なお、本実施形態では、金属ナノ粒子を構成する金属が酸素などの外部環境要因と反応しやすい金属である場合を例に挙げて説明するが、本発明は、かかる例示のみに限定されるものではない。
【0059】
第2の方法では、前記溶媒のpHとは異なるpH条件下で金属イオンを徐放する金属錯体を用いることにより、液体中に放出される還元可能な金属イオンの量を、ナノスケールの粒子を析出させるのに適した量となるように制御する点に1つの大きな特徴がある。
【0060】
本実施形態に係る複合ナノ粒子の製造方法では、まず、複合ナノ粒子1b中の金属ナノ粒子11を構成する金属の錯体(金属錯体)を含有する溶液を調製する〔金属錯体含有溶液調製工程、図8(a)参照〕。
前記金属錯体含有溶液は、例えば、金属粉体と、金属との錯体を形成するpH調整剤とが溶媒に配合された溶液Cと、還元剤と分散剤と前記pH調整剤とを含む溶液Dとを混合することにより得られるが、本発明は、かかる調製法のみに限定されるものではない。前記溶液Cは、例えば、図9に示される工程を行なうことにより調製することができるが、本発明は、かかる調製法のみに限定されるものではない。また、前記溶液Dは、例えば、図10に示される工程を行なうことにより調製することができるが、本発明は、かかる調製法のみに限定されるものではない。
【0061】
図9に示される溶液Cの調製に際しては、まず、溶媒に金属粉体を添加する〔金属粉体添加工程、図9(a)参照〕。
金属粉体は、金属ナノ粒子11を構成する金属からなる。かかる金属としては、銅、ニッケル、コバルト、銀、鉄、スズなどが挙げられるが、本発明は、かかる例示のみに限定されるものではない。
前記溶媒に添加する金属粉体の量は、析出させる金属ナノ粒子の量などによって異なるため、一概には決定することができない。したがって、前記溶媒に添加する金属粉体の量は、析出させる金属ナノ粒子の量などに応じて適宜決定することが望ましい。
前記溶媒は、前記溶液Aの調製に用いられる溶媒と同様である。
つぎに、得られた産物に分散剤を添加する工程〔分散剤添加工程、図9(b)参照〕。
分散剤および前記産物に添加する分散剤の量は、前記溶液Aの調製に用いられる分散剤および分散剤の量と同様であればよい。
つぎに、得られた混合物に、金属との錯体を形成するpH調整剤を添加して錯体を形成させるとともに溶液のpHを調整する〔錯体形成およびpH調整工程、図9(c)参照〕。
前記pH調整剤は、金属との錯体を形成するものであればよい。前記pH調整剤としては、例えば、アンモニア水溶液、シアン化合物、ハロゲン化合物などに代表される金属と錯体を形成する物質などが挙げられるが、本発明は、かかる例示のみに限定されるものではない。
前記溶液のpHは、当該溶液にpH調整剤を添加することにより調整することができる。前記溶液のpHは、金属の種類、pH調整剤の種類、形成させる錯体の種類、複合ナノ粒子の用途などによって異なるため、一概には決定することができない。したがって、前記溶液のpHは、金属の種類、pH調整剤の種類、形成させる錯体の種類、複合ナノ粒子の用途などに応じて適宜決定することが望ましい。通常、かかる溶液のpHは、後述の金属ナノ粒子析出工程での還元反応を良好に進行させる観点から、好ましくは6〜14、より好ましくは7.5〜14である。例えば、金属が銅であり、pH調整剤がアンモニア水溶液である場合、混合物のpHは、好ましくは6〜14、より好ましくは7.5〜14、さらに好ましくは13〜14である。第2の方法においても、溶液のpHをかかる範囲内で高くするほど、還元力が大きくなるので、還元反応の初期段階で生成する金属ナノ粒子の粒子径が小さくなる傾向がある。一方、溶液のpHを前記範囲内で低くするほど、還元力が小さくなるので、還元反応の初期段階で生成する金属ナノ粒子の粒子径が大きくなる傾向がある。
その後、得られた溶液Cに不活性ガスを通気し脱気する〔脱気工程、図9(d)参照〕。これにより、溶液C中の溶存酸素を除去することができる。
不活性ガスの種類および不活性ガスの流量は、前記溶液Aの調製に用いられる不活性ガスの種類および不活性ガスの流量と同様であればよい。
【0062】
一方、図10に示される溶液Dの調製に際しては、まず、溶媒に還元剤を添加する〔還元剤添加工程、図10(a)参照〕。
前記溶媒は、前記溶液Cの調製に用いられる溶媒と同様である。
前記還元剤の種類および前記溶媒に添加する還元剤の量は、前記溶液Bの調製に用いられる還元剤の種類および還元剤の量と同様であればよい。
つぎに、得られた産物に分散剤を添加する工程〔分散剤添加工程、図10(b)参照〕。
分散剤および前記産物に添加する分散剤の量は、前記溶液Cの調製に用いられる分散剤および産物に添加する分散剤の量と同様である。
つぎに、得られた混合物のpHを調整する〔pH調整工程、図10(c)参照〕。
混合物のpHは、当該混合物にpH調整剤を添加することにより調整することができる。前記pH調整剤は、前記溶液Cの調製に用いられるpH調整剤と同様である。かかる混合物のpHは、前記溶液Cの調製の際のpHと同様であり、後述の金属ナノ粒子析出工程での還元反応を良好に進行させる観点から、好ましくは6〜14、より好ましくは7.5〜14である。第2の方法においても、溶液のpHをかかる範囲内で高くするほど、還元力が大きくなるので、還元反応の初期段階で生成する金属ナノ粒子の粒子径が小さくなる傾向がある。一方、溶液のpHを前記範囲内で低くするほど、還元力が小さくなるので、還元反応の初期段階で生成する金属ナノ粒子の粒子径が大きくなる傾向がある。
その後、得られた溶液Dに不活性ガスを通気し脱気する〔脱気工程、図10(d)参照〕。これにより、溶液D中の溶存酸素を除去することができる。
【0063】
金属錯体含有溶液調製工程では、溶液Cと溶液Dとを、還元剤が金属イオンを還元するのに十分な量となるように混合することが望ましい。
【0064】
つぎに、前記金属錯体含有溶液に不活性ガスを通気して脱気しながら、当該金属錯体含有溶液中において、金属錯体から生じる金属イオンを還元させて金属ナノ粒子11を析出させる〔金属ナノ粒子析出工程、図8(b)参照〕。これにより、金属ナノ粒子11を含む液体が得られる。
金属イオンの還元および金属ナノ粒子11の析出は、前記分散液調製工程において、溶液Cと溶液Dとを混合すると同時に開始される。
【0065】
本金属ナノ粒子析出工程では、析出した金属ナノ粒子を含む分散液を遠心沈降に供し、沈殿を除去して上澄みを分離してもよい。これにより、より小さな金属ナノ粒子を得ることができる。
【0066】
その後、前記金属ナノ粒子析出工程で得られた液体に不活性ガスを通気して脱気しながら、当該液体に、シリカ前駆体化合物を添加し、シリカ前駆体化合物を縮重合させて、前記金属ナノ粒子を覆うように当該金属ナノ粒子上にシリカからなるシリカ層を形成させる〔シリカ形成工程、図8(c)参照〕。
前記シリカ前駆体化合物の種類および前記液体に添加するシリカ前駆体化合物の量は、前記第1の方法に用いられるシリカ前駆体化合物の種類およびシリカ前駆体化合物の量と同様である。
第2の方法においても、第1の方法と同様に、シリカナノ粒子形成工程における金属ナノ粒子とシリカ前駆体化合物との体積比、pH、温度などにより、金属ナノ粒子を覆うシリカナノ粒子の量を制御することができると考えられる。
【0067】
なお、金属ナノ粒子11を構成する金属が、酸素などの外部環境要因との反応性が低い金属(例えば、金、白金など)である場合、前記分散液調製工程、金属ナノ粒子析出工程およびシリカナノ粒子形成工程における不活性ガスの通気による脱気を行なわなくてもよい。
【0068】
また、金属錯体含有溶液調製工程において、金属粉体および金属と錯体を形成するアルカリを用いて、金属錯体を形成させる代わりに、前記溶媒のpHとは異なるpH条件下で金属イオンを徐放する金属錯体を直接用いてもよい。かかる金属錯体としては、例えば、テトラアンミン銅(II)、ジアンミン銀(I)、ヘキサシアノ鉄(II)、ヘキサシアノ鉄(III)テトラクロロ鉄(III)などが挙げられるが、本発明は、かかる例示のみに限定されるものではない。
【0069】
さらに、金属ナノ粒子11を構成する金属が、例えば、銅である場合、製造時における銅の酸化を抑制して効率よく複合ナノ粒子を製造する観点から、前記工程(I)において、前記pH調整剤として、アンモニア水溶液を用いることが好ましい。なお、この場合、溶媒は、アンモニア水溶液に含まれる水である。アンモニア水溶液に含まれるアンモニアは、揮発しやすいため、シリカ形成工程後に得られる複合ナノ粒子を含む分散液から容易に除去することができる。したがって、アンモニア水溶液は、複合ナノ粒子の高純度化を図ることができる点で有利である。
金属ナノ粒子11を構成する金属が、銅である場合、前記分散液調製工程、金属ナノ粒子析出工程およびシリカ形成工程を、前述のように、不活性ガスを通気させながら行なうことにより、製造時における銅の酸化をより効果的に抑制して効率よく複合ナノ粒子を製造することができる。
【0070】
以上のように、本発明の複合ナノ粒子の製造方法では、金属ナノ粒子がシリカナノ粒子またはシリカ層によって覆われている複合ナノ粒子を容易に製造することができる。これにより、金属ナノ粒子の表面をコーティング剤で被覆する場合と比べて、簡便な操作で、金属ナノ粒子を外部環境要因から保護することができる。したがって、本発明の複合ナノ粒子の製造方法は、例えば、触媒、紫外線遮蔽剤、電子部品、光学部品、発光材料、塗料、磁性材料などの製造に有用である。
【0071】
[複合ナノ粒子の用途]
(1)赤色釉薬
銅ナノ粒子は、金属銅の状態が保たれている場合には、赤色釉薬の1つとして知られている辰砂釉によく似た赤色を呈している。ところが、銅は酸化されやすいことから、前記銅ナノ粒子は、銅イオンとなり、緑色を呈するようになる。
しかしながら、前述のように、本発明の複合ナノ粒子では、当該複合ナノ粒子中の金属ナノ粒子が外部環境要因から保護されている。そのため、例えば、金属ナノ粒子が、酸化しやすい銅からなるナノ粒子(銅ナノ粒子)である複合ナノ粒子では、当該銅ナノ粒子の酸化が抑制され、赤色が維持される。したがって、釉薬の色材として、金属ナノ粒子が銅ナノ粒子である本発明の複合ナノ粒子を用いることにより、低火度や中火度での酸化焼成を行なった場合にも辰砂釉によく似た赤色を呈する釉薬が得られる。かかる釉薬も本発明の複合ナノ粒子の用途の1つである。
【0072】
本発明の釉薬は、焼成により赤色を呈する釉薬であって、前述した複合ナノ粒子のうち金属ナノ粒子が銅ナノ粒子である複合ナノ粒子と、金属ケイ素または酒石酸ナトリウムカリウムとを含有していることを特徴としている。
【0073】
釉薬中における複合ナノ粒子の含有量は、赤色の発色に十分な量であればよい。通常、辰砂釉によく似た赤色を発色させる観点から、1〜4質量%、好ましくは2〜3質量%である。
【0074】
釉薬中において、複合ナノ粒子に対する金属ケイ素または酒石酸ナトリウムカリウムの量は、銅ナノ粒子の酸化をより一層抑制し、より辰砂釉によく似た赤色を発色させる観点から、例えば、複合ナノ粒子100質量部あたり25〜100質量部、好ましくは25〜50質量部である。金属ケイ素および酒石酸ナトリウムカリウムのなかでは、より辰砂釉によく似た赤色を発色させる観点から、金属ケイ素が好ましい。
【0075】
本発明の釉薬には、通常用いられるフリット、ふのり、にがり、水などをさらに配合することができる。前記フリットの組成は、釉薬の用途に応じて適宜選択することが望ましい。前記フリットとしては、例えば、二酸化ケイ素60.0〜66.0モル%、酸化アルミニウム2.0〜4.0モル%、酸化ホウ素12.0〜26.0モル%、酸化リチウム0.0〜10.0モル%、酸化ナトリウム1.5〜5.0モル%、酸化カリウム2.5〜5.0モル%、酸化バリウム0.0〜2.5モル%、酸化亜鉛1.0〜8.0モル%、酸化カルシウム0.0〜1.0モル%、酸化マグネシウム0.0〜1.0モル%および酸化ストロンチウム0.0〜1.0モル%を含有するフリットなどが挙げられる。
【0076】
(2)磁性材料
本発明の複合ナノ粒子は、金属ナノ粒子がシリカナノ粒子によって外部環境要因から保護されているので、高い温度条件下でも互いに凝集しにくい性質を有する。そのため、金属ナノ粒子が鉄−白金などの磁性金属からなる粒子である場合、加熱することによって、互いに凝集させることなく、規則化を行なうことができる。
したがって、金属ナノ粒子が磁性金属からなるナノ粒子である本発明の複合ナノ粒子は、磁性材料として有用である。
【0077】
[金属ナノ粒子の製造方法]
本発明の金属ナノ粒子の製造方法は、分散剤と溶媒と金属錯体とを含む溶液中において、金属錯体に由来する金属イオンの活量を制御しながら前記金属イオンを生じさせた後、前記金属イオンを還元させて金属ナノ粒子を析出させることを特徴としている。
【0078】
本発明の金属ナノ粒子の製造方法では、分散剤および溶媒の存在下に、金属と、当該金属と錯体を形成するアルカリとを当該アルカリが前記金属に対して過剰量となるように混合することにより、金属錯体を形成させるとともに、前記金属錯体に由来する金属イオンの活量を制御しながら前記金属イオンを生じさせた後、前記金属イオンを還元させて金属ナノ粒子を析出させてもよい。
【0079】
本発明の金属ナノ粒子の製造方法は、前述した複合ナノ粒子の製造方法における工程(I)と同様の操作を行なうことによって実施することができる〔例えば、第1の方法における分散液調製工程および金属ナノ粒子析出工程、第2の方法における金属錯体含有溶液調製工程および金属ナノ粒子析出工程などを参照〕。
【実施例】
【0080】
以下、実施例などにより、本発明を詳細に説明するが、本発明は、かかる実施例により限定されるものではない。なお、以下の実施例において、平均粒子径は、粒子を含む試料のSEM像から、粒子を無作為に複数個選び、選ばれた個々の粒子の粒子径を測定し、選ばれた粒子の粒子径の平均を算出することにより得られた値である。
【0081】
(製造例1)
酸化第二銅(CuO)の粉末〔純正化学(株)製、商品名:酸化銅(II)(微粉末)、平均粒子径:1μm〕0.06molを、イオン交換水36mLに分散させ、銅分散液を得た。つぎに、前記銅分散液に、分散剤であるゼラチン〔ゼライス社製、商品名:写真用ゼラチンP459〕の水溶液〔ゼラチン濃度:10質量%、以下、「10質量%ゼラチン水溶液」という〕18mLを添加して混合物を得た。その後、前記混合物に、そのpHが12になるように、1.5mol/dm3水酸化ナトリウム水溶液を添加して溶液Aを得た。
【0082】
(製造例2)
ヒドラジン0.06molを、イオン交換水36mLに添加し、ヒドラジン水溶液を得た。得られたヒドラジン水溶液に、10質量%ゼラチン水溶液18mLを添加し、混合物を得た。その後、前記混合物に、そのpHが12になるように、1.5mol/dm3水酸化ナトリウム水溶液を添加して溶液Bを得た。
【0083】
(実施例1)
(1)銅ナノ粒子の調製
製造例1で得られた溶液Aおよび製造例2で得られた溶液Bを、それぞれの温度が80℃になるように維持しながら、窒素ガスで30分間脱気した。その後、溶液Aと溶液Bとを混合し、得られた混合物を、その温度が80℃になるように維持し、かつ窒素ガスで脱気しながら、マグネティックスターラーを用いて500rpmで2時間撹拌した。これにより、酸化第二銅から微量に生じる銅イオンを徐々に還元させ、粒子を含む分散液を得た。
【0084】
得られた産物のX線回折パターンを、X線回折装置〔(株)リガク製、商品名:RINT2500(Mo Kα)〕を用いて測定し、化学種を同定した。実施例1において、得られた産物のX線回折パターンを調べた結果を図11に示す。
【0085】
図11に示された結果から、銅に特有のピークが見られることがわかる。したがって、かかる結果から、前記産物に含まれる固体成分は、銅からなることがわかる。
【0086】
さらに、前記産物に、窒素ガスバブリング(0.1dm3/min)で30分間脱気されたイオン交換水(以下、「脱気イオン交換水」という)を添加した。つぎに、得られた混合物に、周波数38kHz、出力55Wの超音波を照射した。その後、前記混合物を、4000rpmで15分間の遠心沈降に供し、上澄みを除去した。得られた沈降物に、脱気イオン交換水を添加し、混合物を得た。つぎに、得られた混合物に対する超音波の照射および前記混合物の遠心沈降を、前記と同様に行ない、液体成分中に遊離しているナトリウムイオンおよびゼラチンを除去した。その後、得られた産物に、純水を添加した。得られた混合物を遠心分離に供し、沈殿物および上澄みを得た。
【0087】
得られた沈殿物および上澄みを、それぞれ、走査型電子顕微鏡(以下、「SEM」ともいう)の真鍮製の試料台に滴下した。前記試料台上の沈殿物および上澄みをデシケーター内で真空乾燥させ、SEM観察用試料を得た。得られた各SEM観察用試料を、走査型電子顕微鏡〔日本電子(株)製、商品名:JSM−6500F〕を用いて観察した。実施例1(1)において、得られた産物の沈殿物を走査型電子顕微鏡で観察した結果を図12(a)に、実施例1(1)において、得られた産物の上澄みを走査型電子顕微鏡で観察した結果を図12(b)に示す。図12(a)中、スケールバーは、300nmを示す。また、図12(b)中、スケールバーは、100nmを示す。
【0088】
図12(a)および図12(b)に示された結果から、沈殿物中には、平均粒子径が約20〜500nmのナノ粒子が存在しているのに対し、上澄み中には、平均粒子径が約30nm以下のナノ粒子のみが存在していることがわかる。かかる結果から、遠心分離を行なうことにより、平均粒子径が約30nm以下の粒子を得ることができることがわかる。
【0089】
さらに、表面プラズモン吸収による赤色発色の有無を確認するために、分光光度計を用いて、前記産物の可視光吸収スペクトルを測定した。実施例1(1)において、得られた産物の可視光吸収スペクトルを測定した結果を図13に示す。
【0090】
図13に示された結果から、625nm以下の波長域での吸収が見られるとともに、波長580nm付近での吸収ピークが見られることがわかる。かかる結果から、前記産物は、表面プラズモン吸収により、赤色を呈していることが示唆される。したがって、これらの結果から、前記産物は、銅ナノ粒子を含むことがわかる。
【0091】
(2)複合ナノ粒子の調製
前記(1)で得られた分散液10mLに、テトラエトキシシラン10mLを添加した。なお、前記テトラエトキシシランは、予め、窒素ガスバブリング(0.1dm3/min)で30分間脱気されたものである。得られた混合物を、500rpmで撹拌しながら70℃で20時間維持した。
【0092】
得られた産物を粉砕し、測定用試料を得た。得られた測定用試料のX線回折パターンを、前記X線回折装置を用いて測定し、化学種を同定した。実施例1(2)において、得られた産物のX線回折パターンを調べた結果を図14に示す。
【0093】
図14に示された結果から、銅に特有のピークが見られることがわかる。したがって、かかる結果から、前記産物中に銅が存在していることが示唆される。
【0094】
つぎに、前記産物に含まれる粒子を、透過型電子顕微鏡〔日本電子(株)製、商品名:JEM−2010〕で観察した。実施例1(2)において、得られた産物に含まれる粒子を透過型電子顕微鏡で観察した結果を図15(a)および図15(b)に示す。図15(a)中、スケールバーは、100nmを示す。また、図15(b)中、スケールバーは、50nmを示す。
【0095】
図15に示された結果から、銅ナノ粒子の周囲にシリカからなる平均粒子径約10nmのシリカ粒子が形成されていることがわかる。したがって、前記産物は、銅ナノ粒子とシリカ粒子とを含み、前記銅ナノ粒子の表面が前記シリカ粒子で覆われた複合ナノ粒子であることがわかる。
【0096】
銅とシリカとは、通常、複合体化(または会合)しにくいと考えられる。しかしながら、前記複合ナノ粒子では、銅ナノ粒子とシリカ粒子とが複合体化または会合していると考えられる。したがって、かかる複合ナノ粒子においては、銅ナノ粒子とシリカ粒子とは、側鎖に親水性基と疎水性基とが表出しているゼラチンを介して複合体化(または会合)していることが考えられる。
【0097】
(比較例1)
実施例1(1)と同様の操作を行ない、銅ナノ粒子を得た。
【0098】
(試験例1)
実施例1で得られた複合ナノ粒子を、大気中において、室温で200日間放置した。その後、実施例1で得られた複合ナノ粒子のX線回折パターンを、前記X線回折装置を用いて測定し、化学種を同定した。
【0099】
一方、比較例1で得られた銅ナノ粒子を、大気中において、室温で1日間放置した。その後、比較例1で得られた銅ナノ粒子のX線回折パターンを、前記X線回折装置を用いて測定し、化学種を同定した。
【0100】
試験例1において、実施例1で得られた複合ナノ粒子(下段のパターン)および比較例1で得られた銅ナノ粒子(上段のパターン)それぞれのX線回折パターンを調べた結果を図16に示す。図中、丸は銅に特有のピークを示し、三角は酸化第二銅に特有のピークを示す。
【0101】
図16に示された結果から、実施例1で得られた複合ナノ粒子のX線回折パターンには、銅に特有のピークのみが見られることがわかる。かかる結果から、実施例1で得られた複合ナノ粒子中の銅ナノ粒子は、当該複合ナノ粒子が200日間大気中で放置されているにもかかわらず、酸化されていないことがわかる。一方、比較例1で得られた複合ナノ粒子のX線回折パターンには、銅に特有のピークに加え、酸化第二銅に特有のピークがみられることがわかる。かかる結果から、比較例1で得られた銅ナノ粒子は、酸化されていることがわかる。
【0102】
以上の結果から、実施例1で得られた複合ナノ粒子のように、金属ナノ粒子をシリカからなる粒子で覆うことにより、複合ナノ粒子の外部環境要因による金属ナノ粒子への影響を低減させることができ、金属ナノ粒子の状態の変化(例えば、酸化など)を抑制することができることがわかる。
【0103】
(実施例2および3)
辰砂釉は、色材として酸化第二銅を含む釉薬である。かかる辰砂釉は、一酸化炭素ガスを含む還元雰囲気中において、1200℃前後の高火度で焼成させることにより、酸化第二銅が金属銅となり赤色を呈する。しかしながら、還元焼成には、有害な一酸化炭素ガスを用いる必要があることから、焼成を行なうために十分な注意を要する。実施例1で得られた複合ナノ粒子は、赤色を呈していることから、当該複合ナノ粒子中の銅ナノ粒子を酸化させずに焼成させることができれば、辰砂釉と同様の赤色を呈することができると考えられる。そこで、実施例1で得られた複合ナノ粒子を用い、低火度(800℃前後)での酸化焼成であっても辰砂釉の赤色と同様の色を呈する釉薬の調製を試みた。
【0104】
実施例1で得られた複合ナノ粒子0.02gと低火度無鉛楽用フリット〔京都市産業技術研究所製、融点:約680℃、組成:二酸化ケイ素60.9モル%、酸化アルミニウム2.8モル%、酸化ホウ素12.6モル%、酸化リチウム9.2モル%、酸化ナトリウム4.5モル%、酸化カリウム3.1モル%、酸化亜鉛6.9モル%〕1.0gとをイオン交換水0.6mLに添加し、メノー乳鉢で粉砕した。得られた混合物に、助剤である平均粒子径:80μmの金属ケイ素粉末0.01g(実施例2)または0.02g(実施例3)を添加し、混合して釉薬を得た。
【0105】
(比較例2および3)
比較例1で得られた銅ナノ粒子0.02gと低火度無鉛楽用フリット1.0gとをイオン交換水0.6mLに添加し、メノー乳鉢で粉砕した。得られた混合物に、助剤である平均粒子径:80μmの金属ケイ素粉末0.01g(比較例2)または0.02g(比較例3)を添加し、混合して釉薬を得た。
【0106】
(比較例4)
実施例1で得られた複合ナノ粒子0.02gと、低火度無鉛楽用フリット〔京都市産業技術研究所製、融点:約680℃〕1.0gとをイオン交換水0.6mLに添加し、メノー乳鉢で粉砕して釉薬を得た。
【0107】
(製造例3)
磁器土を成形し、直径30mmの円板状の小片を得た。得られた小片を800℃で素焼きした。素焼き後の小片に一号石灰釉を施釉した。つぎに、前記小片を1250℃で還元焼成し、テストピースを得た。
【0108】
(試験例2)
製造例3で得られたテストピースの表面に、実施例2および3ならびに比較例2〜4で得られた各釉薬を施釉した。その後、テストピースを乾燥させた。
【0109】
つぎに、テストピースを大気雰囲気で焼成した(酸化焼成)。なお、焼成条件は、室温から800℃までの昇温時間が5時間および800℃での保持時間が5分間である。その後、テストピースの表面の釉薬における赤色の発色の有無を肉眼で観察した。その結果を表1に示す。
【0110】
【表1】

【0111】
表1に示された結果から、実施例1で得られた複合ナノ粒子と金属ケイ素粉末とを含む釉薬(実施例2および3)は、酸化焼成で赤色を呈することがわかる。
【0112】
一方、比較例1で得られた銅ナノ粒子と金属ケイ素粉末とを含む釉薬(比較例2および3)は、赤色を呈しないことがわかる。また、実施例1で得られた銅ナノ粒子を含むが、金属ケイ素粉末を含まない釉薬(比較例4)も、赤色を呈しないことがわかる。
【0113】
これらの結果から、色材である実施例1で得られた複合ナノ粒子と、助剤である金属ケイ素を含む釉薬は、低火度(800℃前後)での酸化焼成であっても、赤色を呈することがわかる。
【0114】
(試験例3)
製造例3で得られたテストピースの表面に、実施例3で得られた釉薬を施釉した。その後、テストピースを乾燥させた。つぎに、テストピースを大気(酸化雰囲気)中で焼成した(酸化焼成)。焼成条件は、試験例1における焼成条件と同じである。
【0115】
焼成後のテストピースのX線回折パターンを、前記X線回折装置を用いて測定し、化学種を同定した。試験例3において、実施例3で得られた釉薬を施釉し、焼成したテストピースのX線回折パターンを調べた結果を図17に示す。図中、丸は二酸化ケイ素に特有のピーク、四角は金属ケイ素に特有のピークおよび三角は銅に特有のピークを示す。
【0116】
また、受光型分光光度計〔(株)日立ハイテクフィールディング製、商品名:U−3500〕を用い、焼成後のテストピースの反射スペクトルを測定した。試験例3において、実施例3で得られた釉薬を施釉し、焼成したテストピースの反射スペクトルを調べた結果を図18に示す。
【0117】
図17に示された結果から、銅に特有のピークが見られることがわかる。かかる結果から、テストピースの表面の釉薬中に銅が存在していることがわかる。また、図18に示された結果から、波長600nm以上の範囲でピークが見られることがわかる。かかる結果から、前記テストピースの表面の釉薬は、赤色を呈していることがわかる。
【0118】
これらの結果からも、低火度(800℃前後)での酸化焼成を行なった場合であっても、色材である実施例1で得られた複合ナノ粒子と、助剤である金属ケイ素とを含む釉薬は、低火度(800℃前後)での酸化焼成であっても、辰砂釉の赤色と同様の色を呈することがわかる。
【0119】
(実施例4および5)
実施例1で得られた複合ナノ粒子0.02gと、助剤である平均粒子径:40μmの金属ケイ素粉末0.005g(実施例4)または0.01g(実施例5)とをイオン交換水0.3mLに添加し、メノー乳鉢で粉砕した。得られた混合物に、低火度無鉛楽用フリット1.0gを添加し、混合して釉薬を得た。
【0120】
(比較例5および6)
平均粒子径:3μmの酸化第一銅粉末0.005gと、助剤としての平均粒子径:40μmの金属ケイ素粉末0.002g(比較例5)または0.005g(比較例6)とをイオン交換水0.3mLに添加し、メノー乳鉢で粉砕した。得られた混合物に、低火度無鉛楽用フリット1.0gを添加し、混合して釉薬を得た。
【0121】
(比較例7)
平均粒子径:13μmの酸化第二銅粉末0.005gと、助剤としての平均粒子径:40μmの金属ケイ素粉末0.005g(比較例7)とをイオン交換水0.3mLに添加し、メノー乳鉢で粉砕した。得られた混合物に、低火度無鉛楽用フリット1.0gを添加し、混合して釉薬を得た。
【0122】
(試験例4)
製造例3で得られたテストピースの表面に、実施例4および5ならびに比較例5〜7で得られた各釉薬を施釉した。その後、テストピースを乾燥させた。
【0123】
つぎに、テストピースを大気雰囲気で焼成した(酸化焼成)。なお、焼成条件は、試験例1における焼成条件と同じである。
【0124】
その後、分光色差計〔日本電色工業(株)製、商品名:NF333〕を用い、テストピースの表面の釉薬の測定径4mmの範囲のL*a*b*表色系色度を測定して色彩を評価した。試験例4において、実施例4および5ならびに比較例5〜8で得られた各釉薬を施釉し、焼成したテストピースの表面の釉薬のL*a*b*表色系色度を調べた結果を図19に示す。
【0125】
図19に示された結果から、色材として実施例1で得られた複合ナノ粒子を含む釉薬(実施例4および5)は、低火度(800℃前後)での酸化焼成を行なった場合であっても、色材として酸化第一銅粉末または酸化第二銅粉末を含む釉薬(比較例5〜7)と比べて、辰砂釉の赤色により近い色を呈することがわかる。
【0126】
(実施例6)
実施例2において、平均粒子径:80μmの金属ケイ素粉末0.01gの代わりに酒石酸ナトリウムカリウム0.08gを用いたことを除き、実施例2と同様の操作を行ない、釉薬を得た。
【0127】
(実施例7)
実施例2において、平均粒子径:80μmの金属ケイ素粉末0.01gの代わりに酒石酸ナトリウムカリウム0.08gを用いたことおよび低火度無鉛楽用フリットの代わりに京無鉛和絵具〔二酸化ケイ素64.3モル%、酸化アルミニウム3.0モル%、酸化ホウ素21.5モル%、酸化リチウム2.9モル%、酸化ナトリウム2.0モル%、酸化カリウム3.0モル%、酸化バリウム1.2モル%、酸化亜鉛2.2モル%〕を用いたことを除き、実施例2と同様の操作を行ない、釉薬を得た。
【0128】
(試験例5)
実施例6および7で得られた各釉薬を、製造例3で得られたテストピースの表面に施釉した。その後、テストピースを乾燥させた。
【0129】
つぎに、テストピースを大気雰囲気で焼成した(酸化焼成)。なお、焼成条件は、試験例1における焼成条件と同じである。その後、テストピースの表面の釉薬における赤色の発色の有無を肉眼で観察した。
【0130】
その結果、実施例6および7で得られた各釉薬は、酸化焼成を行なうことにより、赤色を呈していた。なかでも、実施例7で得られた釉薬は、実施例6で得られた釉薬よりも、より良好に発色していた。
【0131】
(実施例8)
実施例1において、ゼラチンの代わりにポリビニルアルコールを用いることを除き、実施例1と同様の操作を行ない、複合ナノ粒子を得る。得られた複合ナノ粒子においては、実施例1で得られた複合ナノ粒子と同様に、外部環境要因による金属ナノ粒子への影響が低減され、金属ナノ粒子の状態の変化(例えば、酸化など)が抑制される。
【0132】
(実施例9〜11)
実施例1において、テトラエトキシシランの代わりにテトラメトキシシラン(実施例9)、テトラプロポキシシラン(実施例10)またはテトラブトキシシラン(実施例11)を用いることを除き、実施例1と同様の操作を行ない、複合ナノ粒子を得る。得られた複合ナノ粒子は、実施例1で得られた複合ナノ粒子と同様に、複合ナノ粒子の外部環境要因による金属ナノ粒子への影響を低減させることができ、金属ナノ粒子の状態の変化(例えば、酸化など)を抑制することができる。
【0133】
(実施例12〜14)
実施例1において、水酸化ナトリウムの代わりに水酸化カリウム(実施例12)、水酸化マグネシウム(実施例13)または水酸化カルシウム(実施例14)を用いることを除き、実施例1と同様の操作を行ない、複合ナノ粒子を得る。得られた複合ナノ粒子は、実施例1で得られた複合ナノ粒子と同様に、複合ナノ粒子の外部環境要因による金属ナノ粒子への影響を低減させることができ、金属ナノ粒子の状態の変化(例えば、酸化など)を抑制することができる。
【0134】
(製造例4)
銅粉末〔福田金属箔粉工業(株)製、商品名:Cu−HWQ(微粉末)、平均粒子径:1.5μm〕0.003mol(0.2g)を、14.8Mアンモニア水溶液20mLに添加してテトラアンミン銅(II)を形成させ、テトラアンミン銅(II)水溶液を得た。得られたテトラアンミン銅(II)水溶液に、ゼラチン0.1gを添加して、溶液Cを得た。なお、溶液CのpHは、pHメータの測定限界であったことから、13.5以上であると考えられる。
【0135】
(製造例5)
ヒドラジン0.06molを、14.8Mアンモニア水溶液20mLに添加し、ヒドラジン水溶液を得た。得られたヒドラジン水溶液に、ゼラチン0.1gを添加し、溶液Dを得た。なお、溶液DのpHは、pHメータの測定限界であったことから、13.5以上であると考えられる。
【0136】
(実施例15)
(1)銅ナノ粒子の調製
製造例4で得られた溶液Cおよび製造例5で得られた溶液Dを、それぞれの温度が50℃になるように維持しながら、窒素ガスで30分間脱気した。その後、溶液Cと溶液Dとを混合し、得られた混合物を、その温度が50℃になるように維持し、かつ窒素ガスで脱気しながら、マグネティックスターラーを用いて500rpmで2時間撹拌した。これにより、テトラアンミン銅(II)から微量に生じる銅イオンを徐々に還元させ、銅ナノ粒子を含む分散液を得た。
【0137】
(2)複合ナノ粒子の調製
前記(1)で得られた銅ナノ粒子を含む分散液10mLに、テトラエトキシシラン10mLを添加した。なお、前記テトラエトキシシランは、予め、窒素ガスバブリング(0.1dm3/min)で30分間脱気されたものである。得られた混合物を、500rpmで撹拌しながら70℃で20時間維持した。
【0138】
つぎに、得られた産物に含まれる粒子を、透過型電子顕微鏡〔日本電子(株)製、商品名:JEM−2010〕で観察した。実施例15において、得られた産物に含まれる粒子を透過型電子顕微鏡で観察した結果を図20に示す。図中、スケールバーは、100nmを示す。
【0139】
図20に示された結果から、銅ナノ粒子の周囲にシリカからなる層が形成されていることがわかる。したがって、前記産物は、銅ナノ粒子の表面がシリカで覆われた複合ナノ粒子であることがわかる。
【0140】
(試験例6)
試験例1において、実施例1で得られた複合ナノ粒子を室温で200日間放置する代わりに実施例15で得られた複合ナノ粒子を室温で200日間以上放置することを除き、試験例1と同様の操作を行ない、複合ナノ粒子のX線回折パターンを測定し、化学種を同定する。その結果、実施例15で得られた複合ナノ粒子は、実施例1で得られた複合ナノ粒子よりも長期間放置しても銅に特有のピークのみが検出される場合、実施例15のように複合ナノ粒子を製造することによって複合ナノ粒子中の金属ナノ粒子をより安定に保持できることが示される。
【0141】
(実施例16〜18)
実施例15で得られた複合ナノ粒子0.02gと低火度無鉛楽用フリット〔京都市産業技術研究所製、融点:約680℃、組成:二酸化ケイ素60.9モル%、酸化アルミニウム2.8モル%、酸化ホウ素12.6モル%、酸化リチウム9.2モル%、酸化ナトリウム4.5モル%、酸化カリウム3.1モル%、酸化亜鉛6.9モル%〕1.0gとをイオン交換水0.6mLに添加し、メノー乳鉢で粉砕した。得られた混合物に、助剤である平均粒子径:80μmの金属ケイ素粉末0.003g(実施例16)、0.004g(実施例17)または0.005g(実施例18)を添加し、混合して釉薬を得た。
【0142】
(試験例7)
製造例3で得られたテストピースの表面に、実施例16〜18で得られた各釉薬を施釉した。その後、テストピースを乾燥させた。
【0143】
つぎに、テストピースを大気雰囲気で焼成した(酸化焼成)。なお、焼成条件は、試験例1における焼成条件と同じである。
【0144】
その後、分光色差計〔日本電色工業(株)製、商品名:NF333〕を用い、テストピースの表面の釉薬の測定径4mmの範囲のL*a*b*表色系色度を測定して色彩を評価した。試験例7において、実施例16〜18で得られた各釉薬を施釉し、焼成したテストピースの表面の釉薬のL*a*b*表色系色度を調べた結果を図21に示す。
【0145】
図21に示された結果から、色材として実施例15で得られた複合ナノ粒子を含む釉薬も、色材として実施例1で得られた複合ナノ粒子を含む釉薬と同様に、低火度(800℃前後)での酸化焼成を行なった場合であっても、辰砂釉の赤色に近い色を呈することがわかる。
【符号の説明】
【0146】
1 複合ナノ粒子
1a,1b 複合ナノ粒子
10 金属イオン供与体
10a 金属化合物
10b 金属イオン
11 金属ナノ粒子
12 化合物
13 シリカナノ粒子
14 シリカ層
【特許請求の範囲】
【請求項1】
金属ナノ粒子と当該金属ナノ粒子上に形成されたシリカとを含み、前記金属ナノ粒子がシリカで覆われている複合ナノ粒子を製造する方法であって、
(I)金属に結合する官能基およびシリカに結合する官能基を有する化合物からなる分散剤と溶媒と金属イオン供与体とを含む液体中において、前記金属イオン供与体に由来する金属イオンの活量を制御しながら前記金属イオンを生じさせ、当該金属イオンを還元させて金属ナノ粒子を析出させ、金属ナノ粒子を含む分散液を得る工程、および
(II)前記工程(I)で得られた分散液に、縮重合によってシリカネットワークを形成するシリカ前駆体化合物を添加し、前記金属ナノ粒子上にシリカを形成させる工程
を含むことを特徴とする複合ナノ粒子の製造方法。
【請求項2】
前記分散剤が、ゼラチン、ポリビニルアルコール、オレイン酸およびポリエチレングリコールからなる群より選ばれた少なくとも1種の化合物からなる、請求項1に記載の方法。
【請求項3】
前記分散剤が、ゼラチンからなる、請求項2に記載の方法。
【請求項4】
前記工程(I)および前記工程(II)を、不活性ガス通気条件下に実施する、請求項1〜3のいずれかに記載の方法。
【請求項5】
前記金属イオン供与体として、前記溶媒に難溶性で、かつ前記溶媒のpHとは異なるpH条件下で金属イオンを徐放する金属化合物を用い、前記工程(I)において、pH調整剤によって前記液体のpHを前記溶媒のpHとは異なるpHに調整して金属イオンの活量を制御しながら前記金属イオンを生成させる、請求項1〜4のいずれかに記載の方法。
【請求項6】
前記金属化合物が、アルカリ性条件下で金属イオンを徐放する金属化合物であり、前記pH調整剤が、前記金属イオンに対応する金属との錯体を形成しないアルカリである、請求項5に記載の方法。
【請求項7】
前記pH調整剤がアルカリ金属水酸化物またはアルカリ土類金属水酸化物である、請求項6に記載の方法。
【請求項8】
前記溶媒として、水、前記金属イオン供与体として、酸化第二銅および前記pH調整剤として、水酸化ナトリウムを用いる、請求項5〜7のいずれかに記載の方法。
【請求項9】
前記金属イオン供与体として、前記溶媒のpHとは異なるpH条件下で金属イオンを徐放する金属錯体を用い、前記工程(I)において、pH調整剤によって前記液体のpHを前記溶媒のpHとは異なるpHに調整して金属イオンの活量を制御しながら前記金属イオンを生成させる、請求項1〜4のいずれかに記載の方法。
【請求項10】
前記金属イオン供与体として、銅錯体を用い、かつ前記pH調整剤として、アンモニア水溶液を用いる、請求項9に記載の方法。
【請求項11】
前記工程(I)において、分散剤および溶媒の存在下に、金属と、当該金属と錯体を形成するpH調整剤とを当該pH調整剤が前記金属に対して過剰量となるように混合することにより、金属錯体を生成させるとともに、前記金属錯体に由来する金属イオンの活量を制御しながら前記金属イオンを生成させる、請求項9に記載の方法。
【請求項12】
前記金属が、銅である、請求項11に記載の方法。
【請求項13】
請求項1〜12のいずれかに記載の方法を行なうことにより得られる複合ナノ粒子。
【請求項14】
金属ナノ粒子と、当該金属ナノ粒子上に形成されたシリカとを含む複合ナノ粒子であって、
前記金属ナノ粒子が複数個のシリカナノ粒子によって覆われていることを特徴とする複合ナノ粒子。
【請求項15】
前記金属ナノ粒子が、銅ナノ粒子である請求項14に記載の複合ナノ粒子。
【請求項16】
焼成により赤色を呈する釉薬であって、
請求項8、10または12に記載の方法を行なうことにより得られる複合ナノ粒子または請求項15に記載の複合ナノ粒子と、金属ケイ素または酒石酸ナトリウムカリウムとを含有していることを特徴とする釉薬。
【請求項17】
分散剤と溶媒と金属錯体とを含む溶液中において、金属錯体に由来する金属イオンの活量を制御しながら前記金属イオンを生じさせた後、前記金属イオンを還元させて金属ナノ粒子を析出させることを特徴とする、金属ナノ粒子の製造方法。
【請求項18】
分散剤および溶媒の存在下に、金属と、当該金属と錯体を形成するアルカリとを当該アルカリが前記金属に対して過剰量となるように混合することにより、金属錯体を形成させるとともに、前記金属錯体に由来する金属イオンの活量を制御しながら前記金属イオンを生じさせた後、前記金属イオンを還元させて金属ナノ粒子を析出させる、請求項17に記載の方法。
【請求項1】
金属ナノ粒子と当該金属ナノ粒子上に形成されたシリカとを含み、前記金属ナノ粒子がシリカで覆われている複合ナノ粒子を製造する方法であって、
(I)金属に結合する官能基およびシリカに結合する官能基を有する化合物からなる分散剤と溶媒と金属イオン供与体とを含む液体中において、前記金属イオン供与体に由来する金属イオンの活量を制御しながら前記金属イオンを生じさせ、当該金属イオンを還元させて金属ナノ粒子を析出させ、金属ナノ粒子を含む分散液を得る工程、および
(II)前記工程(I)で得られた分散液に、縮重合によってシリカネットワークを形成するシリカ前駆体化合物を添加し、前記金属ナノ粒子上にシリカを形成させる工程
を含むことを特徴とする複合ナノ粒子の製造方法。
【請求項2】
前記分散剤が、ゼラチン、ポリビニルアルコール、オレイン酸およびポリエチレングリコールからなる群より選ばれた少なくとも1種の化合物からなる、請求項1に記載の方法。
【請求項3】
前記分散剤が、ゼラチンからなる、請求項2に記載の方法。
【請求項4】
前記工程(I)および前記工程(II)を、不活性ガス通気条件下に実施する、請求項1〜3のいずれかに記載の方法。
【請求項5】
前記金属イオン供与体として、前記溶媒に難溶性で、かつ前記溶媒のpHとは異なるpH条件下で金属イオンを徐放する金属化合物を用い、前記工程(I)において、pH調整剤によって前記液体のpHを前記溶媒のpHとは異なるpHに調整して金属イオンの活量を制御しながら前記金属イオンを生成させる、請求項1〜4のいずれかに記載の方法。
【請求項6】
前記金属化合物が、アルカリ性条件下で金属イオンを徐放する金属化合物であり、前記pH調整剤が、前記金属イオンに対応する金属との錯体を形成しないアルカリである、請求項5に記載の方法。
【請求項7】
前記pH調整剤がアルカリ金属水酸化物またはアルカリ土類金属水酸化物である、請求項6に記載の方法。
【請求項8】
前記溶媒として、水、前記金属イオン供与体として、酸化第二銅および前記pH調整剤として、水酸化ナトリウムを用いる、請求項5〜7のいずれかに記載の方法。
【請求項9】
前記金属イオン供与体として、前記溶媒のpHとは異なるpH条件下で金属イオンを徐放する金属錯体を用い、前記工程(I)において、pH調整剤によって前記液体のpHを前記溶媒のpHとは異なるpHに調整して金属イオンの活量を制御しながら前記金属イオンを生成させる、請求項1〜4のいずれかに記載の方法。
【請求項10】
前記金属イオン供与体として、銅錯体を用い、かつ前記pH調整剤として、アンモニア水溶液を用いる、請求項9に記載の方法。
【請求項11】
前記工程(I)において、分散剤および溶媒の存在下に、金属と、当該金属と錯体を形成するpH調整剤とを当該pH調整剤が前記金属に対して過剰量となるように混合することにより、金属錯体を生成させるとともに、前記金属錯体に由来する金属イオンの活量を制御しながら前記金属イオンを生成させる、請求項9に記載の方法。
【請求項12】
前記金属が、銅である、請求項11に記載の方法。
【請求項13】
請求項1〜12のいずれかに記載の方法を行なうことにより得られる複合ナノ粒子。
【請求項14】
金属ナノ粒子と、当該金属ナノ粒子上に形成されたシリカとを含む複合ナノ粒子であって、
前記金属ナノ粒子が複数個のシリカナノ粒子によって覆われていることを特徴とする複合ナノ粒子。
【請求項15】
前記金属ナノ粒子が、銅ナノ粒子である請求項14に記載の複合ナノ粒子。
【請求項16】
焼成により赤色を呈する釉薬であって、
請求項8、10または12に記載の方法を行なうことにより得られる複合ナノ粒子または請求項15に記載の複合ナノ粒子と、金属ケイ素または酒石酸ナトリウムカリウムとを含有していることを特徴とする釉薬。
【請求項17】
分散剤と溶媒と金属錯体とを含む溶液中において、金属錯体に由来する金属イオンの活量を制御しながら前記金属イオンを生じさせた後、前記金属イオンを還元させて金属ナノ粒子を析出させることを特徴とする、金属ナノ粒子の製造方法。
【請求項18】
分散剤および溶媒の存在下に、金属と、当該金属と錯体を形成するアルカリとを当該アルカリが前記金属に対して過剰量となるように混合することにより、金属錯体を形成させるとともに、前記金属錯体に由来する金属イオンの活量を制御しながら前記金属イオンを生じさせた後、前記金属イオンを還元させて金属ナノ粒子を析出させる、請求項17に記載の方法。
【図1】


【図2】


【図3】


【図4】


【図5】


【図6】


【図7】


【図8】


【図9】


【図10】


【図21】


【図11】


【図12】


【図13】


【図14】


【図15】


【図16】


【図17】


【図18】


【図19】


【図20】




【図2】


【図3】


【図4】


【図5】


【図6】


【図7】


【図8】


【図9】


【図10】


【図21】


【図11】


【図12】


【図13】


【図14】


【図15】


【図16】


【図17】


【図18】


【図19】


【図20】


【公開番号】特開2013−23735(P2013−23735A)
【公開日】平成25年2月4日(2013.2.4)
【国際特許分類】
【出願番号】特願2011−160145(P2011−160145)
【出願日】平成23年7月21日(2011.7.21)
【出願人】(504132272)国立大学法人京都大学 (1,269)
【出願人】(596053068)京都市 (26)
【Fターム(参考)】
【公開日】平成25年2月4日(2013.2.4)
【国際特許分類】
【出願日】平成23年7月21日(2011.7.21)
【出願人】(504132272)国立大学法人京都大学 (1,269)
【出願人】(596053068)京都市 (26)
【Fターム(参考)】
[ Back to top ]

