複合体、及びそれを用いた光イメージング用造影剤
【課題】内包したICGの漏出を抑制することができるゼラチンICG複合体を提供すること。
【解決手段】リン脂質とゼラチンとが共有結合したゼラチン誘導体及びコレステロールとゼラチンとが共有結合したゼラチン誘導体のうち少なくとも一方と、インドシアニングリーンとを有することを特徴とする複合体。
【解決手段】リン脂質とゼラチンとが共有結合したゼラチン誘導体及びコレステロールとゼラチンとが共有結合したゼラチン誘導体のうち少なくとも一方と、インドシアニングリーンとを有することを特徴とする複合体。
【発明の詳細な説明】
【技術分野】
【0001】
本発明は、インドシアニングリーンとゼラチン誘導体からなる複合体、及びそれを用いた光イメージング用造影剤、及び前記複合体の製造方法に関するものである。
【背景技術】
【0002】
生体内部の情報を可視化する装置の1つとして、光音響トモグラフィー(Photoacoustic tomography、以下PATと略すことがある)装置が知られている。PAT装置を用いる測定においては、被測定体に光を照射したときに被測定体内部で光を吸収した物質(光吸収体)が発する光音響信号の強度と発生時刻を測定することにより、被測定体内部の物質分布を演算して層画像を得ることができる。
【0003】
ここで、光吸収体としては、生体内で光を吸収して音響波を発するものであればいかなるものをも用いることができる。例えば人体内の血管や悪性腫瘍などを光吸収体とすることが可能である。その他にも、インドシアニングリーン(Indocyanine Green、以下ICGと略すことがある)などの分子プローブを体内に導入し、造影剤として利用することもできる。ICGは体内への摂取が認可されている安全な物質であり、また人体に照射した際の影響が少なくかつ生体での透過性が高い近赤外波長領域の光をよく吸収することから、PATにおける造影剤として好適に用いることができる。
【0004】
また、ICGは近赤外波長領域の光により励起され、蛍光を発するという特徴も有している。この特徴を利用して、ICGを蛍光イメージング用造影剤としても使用することもできる。
【0005】
一方で、ICGは水と反応して分解しやすいという性質を持つため、造影剤として摂取する際に測定部位に集積させることが難しいという問題がある。
【0006】
この問題を解決するための方法として、ICGを粒子の中に高濃度で封入する技術が開発されている。非特許文献1には、ポリビニルアルコール(PVA)を界面活性剤として用い、エマルジョン溶媒拡散法によって得た、ICGを含有する乳酸−グリコール酸共重合体(poly(lactide-co-glycolide)、以下PLGAと略すことがある)粒子が開示されている。また、特許文献1には、ICGとゼラチンとを含有したリポソームが開示されている。
【先行技術文献】
【非特許文献】
【0007】
【非特許文献1】Journal of Photochemistry and Photobiology B:Biology,74(2004)29−38
【特許文献】
【0008】
【特許文献1】米国特許出願公開第2009/087479号明細書
【発明の概要】
【発明が解決しようとする課題】
【0009】
しかし、非特許文献1に開示されたICG含有PLGA粒子及び特許文献1に開示されたリポソームのいずれも、実際の使用においては、モル吸光係数が経時的に減少し、吸光の安定性に欠けるという問題があった。
【0010】
これは、非特許文献1のICG含有PLGA粒子では、ICGは水溶性であるため、水中に分散した粒子内から周囲の水中にICGが漏出して粒子が褪色するために生じると考えられる。また、特許文献1のリポソームでは、リポソーム内の水に溶解したICGが非常に速く分解され、さらには、リポソームからICGが漏出してリポソームそのものが褪色するためであると考えられる。
【0011】
本発明はこのような背景技術に鑑みてなされたものであり、内包したICGの漏出と粒子の褪色が抑制され、モル吸光係数の大きなゼラチンICG複合体の提供が本発明の目的である。
【課題を解決するための手段】
【0012】
第一の本発明に係る複合体は、リン脂質とゼラチンとが共有結合したゼラチン誘導体、コレステロールとゼラチンとが共有結合したゼラチン誘導体のうち、少なくともいずれか一方と、インドシアニングリーンとを有することを特徴とする。
第二の本発明に係る複合体の製造方法は、第二の本発明に係る複合体の製造方法は、リン脂質とゼラチンとが共有結合したゼラチン誘導体、コレステロールとゼラチンとが共有結合したゼラチン誘導体のうち、少なくともいずれか一方を用意する工程と、前記少なくともいずれか一方のゼラチン誘導体とインドシアニングリーンとを混合することにより複合体を得る工程を有することを特徴とする。
【発明の効果】
【0013】
本発明のゼラチンICG複合体は、ゼラチンに共有結合したリン脂質又はコレステロールとICGとの相互作用により、複合体からICGの漏出を抑制することができる。
【図面の簡単な説明】
【0014】
【図1】本発明の実施形態に係るゼラチンICG複合体及びそれを製造する工程を示す図である。
【図2】ゼラチンICG複合体1、ゼラチンICG複合体3、及びICGの吸収スペクトルを示すグラフである。
【図3】ゼラチンICG複合体1、ゼラチンICG複合体3、及びICGの780nmにおける吸光度を比較したグラフである。
【図4】各種ゼラチン誘導体で形成したICG複合体、及びICGの780nmにおける吸光度を比較したグラフである。
【図5】ゼラチンICG複合体1、ゼラチンICG複合体2、混合物1、混合物2、及びICGの吸収スペクトルを示すグラフである。
【図6】ゼラチンICG複合体1、ゼラチンICG複合体3、及びICGの780nmにおける光音響信号強度を比較したグラフである。
【図7】各種ゼラチン誘導体で形成したICG複合体、及びICGの780nmにおける光音響信号強度を比較したグラフである。
【図8】各種ゼラチン誘導体で形成したICG複合体、及びICGの780nmにおける吸光度と光音響信号強度の関係を示したグラフである。
【図9】(a)はPBS中におけるゼラチンICG複合体1の吸収スペクトルの経時変化であり、(b)はアルブミンを含むPBS中におけるゼラチンICG複合体1の吸収スペクトルの経時変化である。
【図10】(a)はPBS中におけるICGの吸収スペクトルの経時変化であり、(b)はアルブミンを含むPBS中におけるICGの吸収スペクトルの経時変化である。
【図11】(a)はPBS中におけるゼラチンICG複合体2の吸収スペクトルの経時変化であり、(b)はアルブミンを含むPBS中におけるゼラチンICG複合体2の吸収スペクトルの経時変化である。
【図12】PBS中アルブミン添加有無の条件下におけるゼラチンICG複合体1、ゼラチンICG複合体2、及びICGの吸光度(λmax)の経時変化を比較したグラフである。
【図13】(a)はPBS中におけるゼラチンICG複合体3の吸収スペクトルの経時変化であり、(b)はアルブミンを含むPBS中におけるゼラチンICG複合体3の吸収スペクトルの経時変化である。
【図14】(a)はPBS中におけるゼラチンICG複合体4の吸収スペクトルの経時変化であり、(b)アルブミンを含むPBS中におけるゼラチンICG複合体4の吸収スペクトルの経時変化である。
【図15】PBS中アルブミン添加有無の条件下におけるゼラチンICG複合体3、ゼラチンICG複合体4、及びICGの吸光度(λmax)の経時変化を比較したグラフである。
【図16】ゼラチンICG複合体1、ゼラチンICG複合体3、非特許文献1、及びICG(特許文献1)の水中における吸光度(λmax)の経時変化を比較したグラフである。
【図17(a)】ゼラチンICG複合体1と担がんマウスを用いた蛍光イメージングの経時変化である。
【図17(b)】がん組織の蛍光強度の経時変化を示したグラフである。
【図18】ゼラチンICG複合体7と担がんマウスを用いた蛍光イメージングの経時変化である。
【図19】ICG、及び、ゼラチンとICGの混合物(ゼラチンICG混合体)の吸収スペクトルを示した図である。
【図20】ゼラチンICG複合体(ゼラチン:DSPE=1:1)の平均粒径とゼラチンの分子量の関係を示したグラフである。
【図21】ゼラチンICG複合体(ゼラチン:DSPE=1:1.5)の平均粒径とゼラチンの分子量の関係を示したグラフである。
【図22】ゼラチンICG複合体と担がんマウスを用いた同位体トレーサー実験における各臓器の放射活性の経時変化を示したグラフである。
【発明を実施するための形態】
【0015】
以下、本発明の実施形態について説明する。
【0016】
(複合体)
本実施形態に係る複合体は、ゼラチンにリン脂質又はコレステロールが共有結合したゼラチン誘導体と、インドシアニングリーン(ICG)とを有する。ICGは、ゼラチン誘導体の周辺、特にリン脂質又はコレステロールの周辺に存在する。また、ICGは、ゼラチン誘導体に覆われた状態で存在する場合もある。本実施形態に係る複合体は、具体的には、リン脂質又はコレステロールと、インドシアニングリーン(ICG)とが、非共有結合によって結合して、一体となったものである。ここで、非共有結合とは、疎水性相互作用、水素結合、分子間力、イオン結合などを含む。本実施形態に係る複合体は、ゼラチンが粒子表面に存在し、リン脂質又はコレステロール及びICGが粒子内部に存在した、粒子状であると考えられる。しかし、本実施形態に係る複合体は粒子状に限られず、平面状であってもよいし、線状であってもよい。本実施形態に係る複合体は、リン脂質とゼラチンとが共有結合したゼラチン誘導体と、コレステロールとゼラチンとが共有結合したゼラチン誘導体のうち、少なくともいずれか一方を有していればよく、これらを両方有していてもよい。本実施形態に係る複合体を、以下、ゼラチンICG複合体と呼ぶことがある。
【0017】
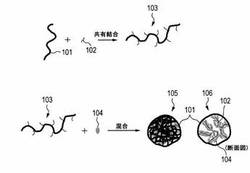
ゼラチンICG複合体について図1を用いてより詳細に説明する。本実施形態において、ICGゼラチン複合体105は、リン脂質又はコレステロール102をゼラチン101に共有結合させることでゼラチン誘導体103を調製し、ゼラチン誘導体103とICG104を混合することで調製できる。なお、106はゼラチン複合体105の断面図である。
【0018】
ここで、リン脂質又はコレステロール102は疎水性の高い部位(アルキル基など)を有する。一方、ICG104についても、スルホン酸基を除く部位は疎水性である。そのため、ICG104と、リン脂質又はコレステロール102とは、疎水性相互作用等の非共有結合によって結合するため、図1の106で示すように、ICG104はゼラチン誘導体103のリン脂質又はコレステロール102周辺に集まりやすい。そのため、ICG104はゼラチンICG複合体から離脱しにくいと考えられる。
【0019】
また、本実施形態に係るゼラチンICG複合体は、水中において、図1の105、106で示すように粒子状になっていると考えられる。すなわち、ゼラチン101は親水性であり、リン脂質又はコレステロール102は疎水性の高い部位(アルキル基など)を有するため、図1の106のように、表面部にゼラチン101が、内部にリン脂質又はコレステロール102が存在する、粒子状となっていると考えられる。前述のように、ICG104はリン脂質又はコレステロール102と非共有結合していると考えられるため、図1の106のようにICG104も粒子内部に存在し、ゼラチン101に覆われた状態となっていると考えられる。そのため、ICG104は粒子状のゼラチンICG複合体の内部から漏出しにくいと考えられる。なお、ICG104の一部は、粒子の表面部に存在していてもよい。
このように、本実施形態に係るゼラチンICG複合体は、ICGが漏出しにくいため、光イメージング用造影剤として好適に使用することができる。
また、本実施形態に係るゼラチンICG複合体は、生体透過性の優れた600nm以以上900nm以下の近赤外波長領域の光に対して吸収を持つことが好ましい。
【0020】
本実施形態においてゼラチン誘導体は、ゼラチンと、リン脂質またはコレステロールとが共有結合してできたものであり、結合する際にとれる原子は含まれない。例えば、リン脂質がカルボキシル基を有し、ゼラチンがアミノ基を有している場合、両者はアミド結合することでゼラチン誘導体となるが、アミド結合の際にとれるカルボキシル基のOHと、アミノ基のHは、本実施形態におけるゼラチン誘導体には含まれない。他の結合についても同様である。
【0021】
(粒径)
また、本実施形態に係るゼラチンICG複合体は、目的とする用途に応じて平均粒径を制御することが可能であり、その平均粒径は10nm以上1000nm以下であることが好ましい。これは、この範囲の平均粒径を有する粒子であればEPR(Enhanced Permeation and Retention)効果があると考えられるからである。腫瘍組織では、正常組織に比べ血管透過性が高いため、粒子などが血管から流出しやすい。さらに、この流出した粒子は腫瘍組織に到達して蓄積する。腫瘍組織の持つこのような特性をEPR効果という。
【0022】
なお、平均粒径を求める方法としては、動的光散乱法を用いて求める方法や、透過型電顕微鏡(Transmission Electron Microscope、以下TEMと略すことがある)の画像を取得して、その画像から粒径を測定することにより求める方法などがある。動的光散乱法によって平均粒径を求める方法として例えば、動的光散乱解析装置(大塚電子(株)製、DLS−8000)を用いる方法が挙げられる。
【0023】
複合体を形成するためには、ゼラチン誘導体とICGとの混合比(重量比)は、(ゼラチン誘導体):(ICG)=20:1〜2:1の範囲であることが好ましい。
【0024】
本実施形態に係るゼラチンICG複合体は、ゼラチンに共有結合したリン脂質又はコレステロールとICGとの相互作用により、複合体からのICGの漏出と、漏出によってICGが水と反応することによるICGの褪色とを、抑制することができる。本実施形態において、相互作用とは、ICGがリン脂質又はコレステロールと疎水性相互作用若しくはイオン結合等の非共有結合していることを意味し、特に疎水性相互作用によりICGがリン脂質又はコレステロールに集まっていることを意味する。
【0025】
本実施形態に係るゼラチンICG複合体は、上記のように、表面部にゼラチンが、内部にリン脂質又はコレステロールが存在する粒子状の構造を有すると考えられるため、粒子内部には水が存在しにくく、ICGが粒子内部で水と反応して分解することを防ぐことができる。なお、このとき、疎水性のリン脂質又はコレステロールはすべてがゼラチンの内部に存在している必要はなく、その一部が粒子の外側に存在してもよい。
【0026】
また、低分子物質であるリン脂質のみをICGと相互作用させ、ICGの溶解性を変化させる試みはあるが、この場合、ICGとリン脂質との間の相互作用が弱いため、両者の解離が生じるおそれがある。これに対して、本実施形態においては、ICGとリン脂質の相互作用の点は同じであるが、それに加えて、ゼラチン分子が存在していることから、ICGとリン脂質の解離の問題を解決することができる。
【0027】
(ゼラチン)
本実施形態におけるゼラチンは、食品分野、医療分野で広く知られている水溶性のタンパク質である。ゼラチンの組成は、牛骨、牛皮、豚皮など、由来する物質によって異なるため一意的には決まらないが、全アミノ酸のうち、おおよそ、グリシンが三分の一、イミノ酸(プロリン、オキシプロリン)が九分の二を占める。また、アミノ酸配列において、グリシンは3個に1個の繰り返しで存在している。ゼラチンの平均分子量は好適には1000以上100000以下であり、更に好適には3000以上である。なお、ゼラチンはコラーゲンの熱変性物質であり、コラーゲンの部分構造を有する。また、ゼラチンはコラーゲンの加水分解によってできる。
【0028】
本実施形態においては、ゼラチンの種類、採取する動物若しくは採取組織部位、コラーゲンからの変性処理法(アルカリ処理、酸処理、酵素処理など)によらず、いかなるゼラチンでも利用することができる。また、ヒト遺伝子組み換え型などのゼラチンも利用可能である。このようなゼラチンの例としては、等電点約5のアルカリ処理ゼラチン、等電点約9の酸処理ゼラチン等が挙げられる。
【0029】
また、本実施形態におけるコラーゲンとしては、例えば、グリシン約35%、プロリン及び4−ヒドロキシプロリン約21%、アラニン約11%を有するタンパク質を用いることができる。
【0030】
ゼラチンは、以前より食用や医療用に使用されており、体内に摂取しても人体に害を与えることがない。また、ゼラチンは生体に吸収されやすく、生体内においてICGを安定的に保持するという役割を果たした後に、生体内で分散消失される性質をもつため、使用後に生体内から除去する必要がないという利点を有する。
【0031】
(リン脂質)
本実施形態においてリン脂質とは、構造中にリン酸エステル部位をもつ脂質である。また、親水性の高い部位であるリン酸部位と疎水性の高い部位であるアルキル基などの部位をもつため、両親媒性である。本実施形態におけるリン脂質として、ゼラチンと容易に共有結合させることのできる、アミノ基、カルボキシル基、又はN−ヒドロキシスクシンイミド基(以下、NHS基と略すことがある)等を有するリン脂質であることが好ましい。特に、NHS基を有するリン脂質は、アミノ基と結合しやすく、アミノ基を有するゼラチンに結合しやすいため好ましい。
【0032】
また、本実施形態におけるリン脂質は、ホスファチジル系リン脂質であることが好ましい。
【0033】
本実施形態におけるリン脂質として例えば、
1,2-Distearoyl-sn-glycero-3-phosphoethanolamine、1,2-Dipalmitoyl-sn-glycero-3-phosphoethanolamine、1,2-Dimyristoyl-sn-glycero-3-phosphoethanolamine、1,2-Dilauroyl-sn-glycero-3-phosphoethanolamine、1,2-Dioleoyl-sn-glycero-3-phosphoethanolamine、1,2-Dilinoleoyl-sn-glycero-3-phosphoethanolamine、1,2-Dierucoyl-sn-glycero-3-phosphoethanolamine、1,2-Distearoyl-sn-glycero-3-phospho-L-serine、1,2-Dipalmitoyl-sn-glycero-3-phospho-L-serine、1,2-Dimyristoyl-sn-glycero-3-phospho-L-serine、1,2-Dioleoyl-sn-glycero-3-phospho-L-serine、Dimyristoyl N-(Succinimidyloxy-glutaryl)-L-α-phosphatidylethanolamine、Dipalmitoyl N-(Succinimidyloxy-glutaryl)-L-α-phosphatidylethanolamine、Distearoyl N-(Succinimidyloxy-glutaryl)-L-α-phosphatidylethanolamine、1-Palmitoyl-2-oleoyl N-(Succinimidyloxy-glutaryl)-L-α-phosphatidylethanolamine、Dioleoyl N-(Succinimidyloxy-glutaryl)-L-α-phosphatidylethanolamine等を挙げることができる。これらのリン脂質は単独で使用してもよいし、又は複数を組み合わせて用いてもよい。
【0034】
なお、上記のNHS基とは下記の化学式1で示される官能基を意味する。
【化1】

【0035】
本実施形態におけるリン脂質としては、下記の化学式2で表される、NHS基を有するDSPE(Distearoyl N-(Succinimidyloxy-glutaryl)-L-α-phosphatidylethanolamine、以下DSPE−NHSと略すことがある)が好ましい。
【化2】

(ただし、化学式2においてR1及びR2はCH3(CH2)16−である)
【0036】
(ICG)
ICG(インドシアニングリーン)は下記の化学式3で示される構造、及び、下記の構造において対イオンがNa+の代わりにH+あるいはK+であるものを指す。
【化3】

【0037】
(ゼラチンICG誘導体の製造方法)
本実施形態におけるゼラチンICG複合体の製造方法について説明する。
ゼラチンICG複合体を製造する工程を図1に示す。具体的には、以下の(1)と(2)の工程を経てゼラチンICG複合体105を得ることができる。
(1)ゼラチン101にリン脂質又はコレステロール102が共有結合したゼラチン誘導体103を得る工程。
(2)前記ゼラチン誘導体103とICG104とを混合することによりゼラチンICG複合体105を得る工程。
【0038】
本実施形態において、ゼラチン101と、リン脂質又はコレステロール102を共有結合させてゼラチン誘導体103を得る工程と、前記ゼラチン誘導体103とICG104とを混合することにより複合体105を得る工程を有することが好ましい。なぜなら、リン脂質又はコレステロール102とICG104を混合した後に、リン脂質又はコレステロール102とゼラチン101とを共有結合させようとすると、ICG104が、リン脂質又はコレステロール102とゼラチン101との結合を妨げるおそれがあるからである。
【0039】
また、上記の(1)の工程は、リン脂質とゼラチンとが共有結合したゼラチン誘導体、コレステロールとゼラチンとが共有結合したゼラチン誘導体のうち、少なくともいずれか一方を用意する工程であればよく、両方を用意する工程であってもよい。リン脂質とゼラチンとが共有結合したゼラチン誘導体を用意する工程は、リン脂質とゼラチンとを共有結合させてゼラチン誘導体を得る工程でもよく、リン脂質とゼラチンとが共有結合した市販のゼラチン誘導体を用意する工程でもよい。コレステロールとゼラチンとが共有結合したゼラチン誘導体を用意する工程についても同様に、コレステロールとゼラチンとを共有結合させてゼラチン誘導体を得る工程でもよく、コレステロールとゼラチンとが共有結合した市販のゼラチン誘導体を用意する工程でもよい。
【0040】
(ゼラチン誘導体)
ゼラチン誘導体の調製方法は特に限定されず、ゼラチンとリン脂質又はコレステロールとの間で共有結合が生じればよい。例えば、ゼラチンの脱水ジメチルスルホキシド溶液に、NHS基を有するリン脂質又はヒドロキシル基を活性化したコレステロールを加えて室温下で18時間反応させた後、反応溶液を水に対して透析し、水可溶化成分を凍結乾燥することにより、リン脂質又はコレステロールが共有結合したゼラチン誘導体を得ることができる。ここで、リン脂質のうち、NHS基を有するリン脂質は、アミノ基と結合しやすく、アミノ基を有するゼラチンに結合しやすい。したがって、NHS基を有するリン脂質を用いることで本実施形態に係る複合体の製造が容易となるため好ましい。特には、上記の化学式2で表される、DSPE−NHSを用いることが好ましい。
【0041】
このようにして得たゼラチン誘導体とICGとを混合することにより、リン脂質又はコレステロールが有する高い疎水性を示す炭素鎖部位とICGとの間で相互作用が生じ、本実施形態に係るゼラチンICG複合体を得ることができる。
【0042】
<光イメージング用造影剤>
本実施形態に係る光イメージング用造影剤は、本実施形態に係る複合体と、前記複合体が分散された分散媒とを有する。本実施形態において光イメージングとは、光を照射することで、イメージング(画像化)することを意味する。すなわち、本実施形態に係る光イメージング用造影剤はICGを有するため、ICGに光が照射されることで、音響波や蛍光などを発する。発せられた音響波を検出することで光音響イメージングをすることができ、発せられた蛍光を検出することで蛍光イメージングをすることができる。なお、光音響イメージングは、光音響トモグラフィー(断層撮影法)を含む概念である。 上記の分散媒は、本実施形態に係る複合体を分散させるための液状の物質であり、例えば生理食塩水、注射用蒸留水、リン酸緩衝生理食塩水(Phosphate buffered saline、以下PBSと略すことがある)などが挙げられる。また本実施形態に係る光イメージング用造影剤は、必要に応じて本実施形態に係る複合体の他に薬理上許容できる添加物を有していても良い。
【0043】
本実施形態に係る光イメージング用造影剤は、上記本実施形態に係る粒子をこの分散媒に予め分散させておいてもよいし、本実施形態に係る粒子と分散媒とをキットにしておき、生体内に投与する前に粒子を分散媒に分散させて使用してもよい。
【0044】
このように、本実施形態に係る光イメージング用造影剤は、光音響イメージング用造影剤や、蛍光イメージング用造影剤として利用することができる。
【0045】
本実施形態に係るゼラチンICG複合体は、EPR(Enhanced Permeability and Retention)効果を利用することで、生体内に投与したときに、生体内の正常部位に比べて腫瘍部位により多く集積させることができる。その結果、複合体を生体内に投与した後、生体に光を照射して、生体からの音響波や蛍光を検出するときに、腫瘍部位から発せられる音響波や蛍光を正常部位から発せられる音響波や蛍光よりも大きくすることができる。従って、本実施形態に係る複合体は腫瘍部位を特異的に検出する光イメージング用造影剤として用いることができる。
【0046】
ここで、ゼラチンは化学修飾可能な化学官能基をもっているため、例えば、ゼラチンICG複合体のゼラチン分子表面に腫瘍細胞認識リガンドを化学結合させることにより、複合体の腫瘍へのターゲティングが可能となる。リガンドとしては、細胞表面の構造を認識できる抗体、アプタマー、レクチン、トランスフェリン、及びレセプターに対するアゴニストあるいはアンタゴニストあるいは葉酸などの腫瘍細胞に特異的に取り込まれるような物質などが挙げられる。これらの物質は単独で使用してもよいし、あるいは複数を組み合わせて用いてもよい。
【0047】
生体内に投与して利用することを考えると、本実施形態に係るゼラチンICG複合体の吸収スペクトルのピークは近赤外波長領域にあることが好ましい。これは、近赤外波長領域の光が生体に照射したときに安全で、かつ、生体に対して比較的高い透過性をもつからである。本実施形態に係るゼラチンICG複合体は特に、600nmから900nmの波長領域において高い吸光度を有する。
【0048】
(造影方法)
生体内に投与された本実施形態に係る複合体を、PAT装置を用いて検出する方法について説明する。本実施形態に係る複合体を検出する方法は以下の工程を有する。
(a)本実施形態に係る複合体を生体内に投与する工程。
(b)生体に光を照射し、生体内に存在する本実施形態に係る複合体から発せられる光音響信号を検出する工程。
【0049】
なお、上記(a)の工程において、本実施形態に係る複合体を生体内に投与する方法は特に限定されない。また、上記(b)の工程において、生体に照射する光を発生させる装置、複合体から発せられる光音響信号を検出する装置は特に限定されない。例えば、生体に照射する光を発生させる装置として、レーザーパルス光を照射する装置を用いることができる。レーザーパルス光を照射する装置として例えば、チタンサファイアレーザー(LT−2211−PC、Lotis社製))、OPOレーザー(LT−2214 OPO、Lotis社製)、アレキサンドライトレーザーなどが挙げられる。
【0050】
次に、生体内に投与された本実施形態に係る複合体を、蛍光装置を用いて検出する方法について説明する。本実施形態に係る複合体を検出する方法は以下の工程を有する。
(c)本実施形態に係る複合体を生体内に投与する工程。
(d)生体に光を照射し、生体内に存在する本実施形態に係る複合体から発せられる蛍光を検出する工程。
【0051】
なお、上記(a)の工程において、本実施形態に係る複合体を生体内に投与する方法は特に限定されない。また、上記(d)の工程において、生体に照射する光を発生させる装置、複合体から発せられる蛍光を検出する装置は特に限定されない。
【実施例】
【0052】
以下、実施例を用いて更に詳細に本発明を説明するが、本発明は、これらの実施例に限定されるものではなく、材料、組成条件及び反応条件等は、同様の機能、効果を有する複合体が得られる範囲で変更することができる。
【0053】
<実施例1>
(ゼラチンICG複合体1)
牛骨由来、等電点5.0のゼラチン(1000mg、分子量10000、新田ゼラチン株式会社製)の脱水ジメチルスルホキシド(30ml、ナカライテスク株式会社製)溶液に、上記の化学式2で示されるDSPE−NHS(日油株式会社製)133mgを加え、モル比1:1.5で室温下18時間反応させた。得られた反応溶液を水に対して透析し、水可溶化成分を凍結乾燥することにより、ゼラチンにDSPEが共有結合したゼラチン誘導体1を得た。ゼラチンへのDSPEの導入量は、フルオレスカミン法にて測定し、ゼラチンに対してDSPEが67%導入されていることが確認された。
【0054】
次に、ICG(シグマ製)を溶解した水溶液(最終濃度:0.5mg/ml)とDSPEが共有結合したゼラチン誘導体1(最終濃度:40mg/ml)とを混合して、ゼラチンICG複合体1を得た。得られたゼラチンICG複合体1の粒径を動的光散乱解析装置(大塚電子株式会社製)で分析したところ、ゼラチンICG複合体1の平均粒径は540nmであった。
【0055】
分光光度計(ベックマンコールター社製)を用いて、得られたゼラチンICG複合体1の吸収スペクトルを測定した。
【0056】
ゼラチンICG複合体1の吸収スペクトルと780nmにおける吸光度をそれぞれ図2と図3に示した。比較例としてICGの吸収スペクトルと780nmにおける吸光度をそれぞれ図2と図3に示した。
【0057】
ICGの吸収スペクトルは2峰性であり、低波長側(700nm)がICGの会合体による吸収、長波長側(780nm)が単量体による吸収を示すことが知られている。
【0058】
図2から、最終濃度0.5mg/mlのICGでは、会合体が多く形成されている為、長波長側の吸光度が低くなったと考えられる。一方、ゼラチンICG複合体1では、長波長側の吸光度がICG単独よりも高く、複合体中でICGの会合が抑制され、ICGとリン脂質とが相互作用していることが示唆された。
【0059】
図3から、ゼラチンICG複合体1は同じ濃度(0.5mg/ml)のICGと比べて、約3.3倍の吸光度を有することが確認された。
【0060】
また、平均粒径と吸光度からモル吸光係数(780nm)を算出したところ、ゼラチンICG複合体1のモル吸光係数は1.1×1011 M-1cm-1であり、従来から知られている金ナノロッドのモル吸光係数(8.6×109M-1cm-1)より極めて大きいことが確認された。
【0061】
<実施例2>
(ゼラチンICG複合体2)
DSPEとゼラチンのモル比を1:1で反応させた以外は実施例1と同様の操作によって、DSPEが共有結合したゼラチン誘導体2を得た。フルオレスカミン法による測定により、ゼラチンに対してDSPEが30%導入されていることが確認された。
【0062】
ICGを溶解した水溶液(最終濃度:0.5mg/ml)とDSPEが共有結合したゼラチン誘導体2(最終濃度:40mg/ml)を混合して、ゼラチンICG複合体2を得た。実施例1と同様に平均粒径及びモル吸光係数を求めたところ、ゼラチンICG複合体2の平均粒径は500nmであった。また、ゼラチンICG複合体2の780nmにおけるモル吸光係数は5.2×1010 M-1cm-1であり、大きなモル吸光係数であることが確認された。
【0063】
<実施例3>
(ゼラチンICG複合体3)
コレステロール(38.6mg、和光純薬工業製、特級)のピリジン(和光純薬工業製)溶液へ、縮合剤のN,N'-Disuccinimidyl Carbonate(77mg、ナカライテスク製)、続いて反応触媒の4-Dimethylaminopyridine(ナカライテスク製)を加え、コレステロールのヒドロシル基を活性化した。
【0064】
上記活性化コレステロールのピリジン溶液へゼラチン(1000mg)の脱水ジメチルスルホキシド(30ml)溶液を加え、モル比1:1で室温下18時間反応させた。得られた反応溶液を水に対して透析し、水可溶化成分を凍結乾燥することにより、ゼラチンにコレステロールが共有結合したゼラチン誘導体3を得た。フルオレスカミン法による測定により、ゼラチンに対してコレステロールが41%導入されていることが確認された。
【0065】
次に、ICGを溶解した水溶液(最終濃度:0.5mg/ml)とコレステロールが共有結合したゼラチン誘導体3と(最終濃度:40mg/ml)を混合して、ゼラチンICG複合体3を得た。実施例1と同様に平均粒径を求めたところ、ゼラチンICG複合体3の平均粒径は200nmであった。
【0066】
実施例1と同様に求めたゼラチンICG複合体3の吸収スペクトルと780nmにおける吸光度をそれぞれ図2と図3に示す。
【0067】
図2から、ゼラチンICG複合体3はICGと比べて700nm付近の会合体の吸収が減少し、780nm付近の単量体の吸収が増加していることが確認された。ただし、DSPEが共有結合したゼラチン誘導体からなるゼラチンICG複合体1よりも700nm付近での吸光度が高く、780nm付近での吸光度が低かったため、複合体中での会合が抑制される度合いはゼラチン誘導体の種類に依存すると考えられた。
【0068】
図3から、ゼラチンICG複合体3は同じ濃度(0.5mg/ml)のICGと比べて、約1.5倍の吸光度を有することが確認された。
【0069】
また、平均粒径と吸光度からモル吸光係数(780nm)を算出したところ、ゼラチンICG複合体3のモル吸光係数は2.4×109 M-1cm-1であり、大きなモル吸光係数であることが確認された。
【0070】
<実施例4>
(ゼラチンICG複合体4)
ゼラチンとコレステロールのモル比を1:1.5で反応させた以外は実施例3と同様の操作によって、コレステロールが共有結合したゼラチン誘導体4を得た。フルオレスカミン法による測定により、ゼラチンに対してコレステロールが71%導入されていることが確認された。
【0071】
ICGを溶解した水溶液(最終濃度:0.5mg/ml)とコレステロールが共有結合したゼラチン誘導体4(最終濃度:40mg/ml)を混合して、ゼラチンICG複合体4を得た。実施例1と同様に平均粒径及びモル吸光係数を求めたところ、ゼラチンICG複合体4の平均粒径は150nmであった。また、ゼラチンICG複合体4の780nmにおけるモル吸光係数は1.7×109M-1cm-1であり、大きなモル吸光係数であることが確認された。
【0072】
<実施例5>
(吸光度比較)
実施例1と同様の操作によって、ゼラチン(分子量5000)にDSPEを75%導入したゼラチン誘導体5を合成した。
【0073】
実施例3と同様の操作によって、ゼラチン(分子量10000)にコレステロールを83%導入したゼラチン誘導体6を合成した。
【0074】
ゼラチンICG複合体1、3、4、5、6(最終濃度:40、100mg/ml)のそれぞれとICG水溶液(最終濃度:0.5mg/ml)とを混合して、ゼラチンICG複合体を得た。これらの複合体とICGの780nmにおける吸光度を比較した結果を図4に示す。
【0075】
図4から、ICGの同濃度の条件下においてゼラチンICG複合体はいずれもICGに比べて吸光度が大きく、更に、コレステロールよりもDSPEが共有結合したゼラチンからなる複合体の方が吸光度の増加が大きいことが確認された。
【0076】
<実施例6>
(ゼラチン誘導体の効果)
前記ゼラチンICG複合体1、2と同じ組成量の混合物を混合物1、2とし、それぞれの吸収スペクトルを比較したグラフを図5に示した。
【0077】
なお、複合体と混合物は、ICGとゼラチンの最終濃度がそれぞれ0.5mg/ml、40mg/mlとなるように調製した。
【0078】
図5の混合物1、2とゼラチンICG複合体1、2を比較すると、混合物1、2では780nm付近の長波長側の吸収が非常に低いことからゼラチンICG複合体は殆ど形成されず、また、700nm付近の短波長側の吸収が高いことからICGの会合体が数多く形成されていることが示唆された。
【0079】
一方、同様にして前記ゼラチンICG複合体3、4と同じ組成量の混合物の吸収スペクトルを求めようとしたが、コレステロールは水に対して不溶であり、ゼラチンICG複合体3、4と同じ組成量の混合物を得ることはできなかった。
【0080】
以上の検討結果から、DSPE又はコレステロールが共有結合したゼラチン誘導体でICGを複合化することが、モル吸光係数の大きな複合体を得る上で極めて有効であることを確認した。
【0081】
<実施例7>
(光音響信号評価1)
光音響信号測定装置(試作品、照射波長:780nm、照射エネルギー:50mJ)を用いて、ゼラチンICG複合体1、ゼラチンICG複合体3、及びICG(比較例)を用いて光音響信号を評価し、その結果を図6に示した。なお、図6は各サンプルの780nmにおける光音響信号強度を比較したものである。
【0082】
図6から、ゼラチンICG複合体1は同濃度(0.5mg/ml)のICGと比べて、光音響信号強度が6桁程大きいことが確認された。
【0083】
一方、ゼラチンICG複合体3は同濃度(0.5mg/ml)のICGと比べて、光音響信号強度が5桁程大きいことが確認された。
【0084】
以上から、ICGはゼラチン誘導体で複合体化することによって光音響信号が増強されることが確認された。
【0085】
<実施例8>
(光音響信号評価2)
ゼラチンICG複合体1(最終濃度:10、40、100mg/ml)、ゼラチン誘導体3、6(最終濃度:40、100mg/ml)とICG水溶液(最終濃度:0.1、0.5、1、5mg/ml)とをそれぞれ混合して得られたゼラチンICG複合体、及びICG(比較例)を用いて光音響信号を評価し、その結果を図7に示した。なお、図7は各サンプルの780nmにおける光音響信号強度を比較したものである。
【0086】
図7から、ゼラチンICG複合体はいずれもICG単独に比べて光音響信号が高く、ICGはゼラチン誘導体で複合体化することによって光音響信号が増強されることが確認された。
【0087】
<実施例9>
(光音響信号評価3)
ゼラチンICG複合体1、6(最終濃度:40、100mg/ml)とICG水溶液(最終濃度:0.5mg/ml)とをそれぞれ混合して得られたゼラチンICG複合体、及びICG(比較例)を用いて光音響信号を評価し、780nmにおける吸光度と光音響信号強度の関係を図8に示した。
【0088】
図8から、吸光度と光音響信号強度には正の相関があることが確認された。
【0089】
<実施例10>
(ゼラチンICG複合体1の安定性評価)
ゼラチンICG複合体1の安定性を評価する為に、ゼラチンICG複合体1をPBS(リン酸緩衝生理食塩水)又はアルブミン(40mg/ml)を含むPBS中に37℃で静置して、経時的に吸収スペクトルを測定した。
【0090】
ゼラチンICG複合体1のPBS中、及びアルブミンを含むPBS中での吸収スペクトルの経時変化をそれぞれ図9(a)と(b)に示した。
【0091】
また、比較例として、ICGのPBS中、及びアルブミンを含むPBS中での吸収スペクトルの経時変化を図10(a)と(b)に示した。
【0092】
また、上記条件下のゼラチンICG複合体1とICGの吸光度(λmax)の経時変化を比較したグラフを図12に示した。
【0093】
図9(a)と(b)、及び図12から、ゼラチンICG複合体1はアルブミンの添加の有無に関わらず、吸光度の減少が抑制さていることが確認され、少なくとも1週間、吸収スペクトルが変化しなかった。これはゼラチン誘導体中のリン脂質とICGとが相互作用して、複合体からのICGの漏出と褪色が抑制された為と考えられ、複合体が安定であることを確認した。
【0094】
一方、図10(a)と図12から、アルブミン無添加のICGでは吸収スペクトルの経時変化は非常に大きく、ICGが褪色していることが確認された。
【0095】
また、図10(b)と図12から、アルブミン添加のICGの吸収スペクトルはアルブミン無添加のICGより経時変化が抑制されてはいるが、アルブミン添加のゼラチンICG複合体1と比較すると安定性に若干劣ることが確認された。
【0096】
<実施例11>
(ゼラチンICG複合体2の安定性評価)
実施例10と同様にして、ゼラチンICG複合体2のPBS中、及びアルブミンを含むPBS中での吸収スペクトルの経時変化を測定し、その結果を図11(a)と(b)に示した。
【0097】
また、上記条件下のゼラチンICG複合体2とICGの吸光度(λmax)の経時変化を比較したグラフを図12に示した。
【0098】
図11(a)と(b)、及び図12から、ゼラチンICG複合体2はアルブミンの添加の有無に関わらず、吸光度の減少が抑制さていることが確認され、少なくとも1週間、吸収スペクトルが変化しなかった。これはゼラチン誘導体中のリン脂質とICGとが相互作用して、複合体からのICGの漏出と褪色が抑制された為と考えられ、複合体が安定であることを確認した。
【0099】
<実施例12>
(ゼラチンICG複合体3の安定性評価)
実施例10と同様にして、ゼラチンICG複合体3のPBS中、及びアルブミンを含むPBS中での吸収スペクトルの経時変化を測定し、その結果を図13(a)と(b)に示した。
【0100】
また、上記条件下のゼラチンICG複合体3とICGの吸光度(λmax)の経時変化を比較したグラフを図15に示した。
【0101】
図13(a)と図15から、アルブミン無添加のゼラチンICG複合体3はアルブミン無添加のICGと比べて、吸光度の減少が抑制されていることが確認された。
【0102】
また、図13(b)と図15から、アルブミン添加のゼラチンICG複合体3は、吸光度の減少が更に抑制されることが確認された。
【0103】
<実施例13>
(ゼラチンICG複合体4の安定性評価)
実施例10と同様にして、ゼラチンICG複合体4のPBS中、及びアルブミンを含むPBS中での吸収スペクトルの経時変化を測定し、その結果を図14(a)と(b)に示した。
【0104】
また、上記条件下のゼラチンICG複合体4とICGの吸光度(λmax)の経時変化を比較したグラフを図15に示した。
【0105】
図14(a)と(b)、及び図15から、アルブミンの添加の有無に関わらず、吸光度の減少が抑制さていることが確認された。
【0106】
<実施例14>
(ゼラチンICG複合体と先行技術の安定性比較)
ゼラチンICG複合体1、ゼラチンICG複合体3、非特許文献1、及びICG(特許文献1)の水中における吸光度(λmax)の経時変化を比較したグラフを図16に示した。
【0107】
図16から、前記ゼラチンICG複合体1、及びゼラチンICG複合体3は、非特許文献1、及びICG(特許文献1)と比べて、ICGの漏出による褪色が抑制されていることが確認された。
【0108】
非特許文献1のICG含有PLGA粒子では、ICGの漏出による褪色が非常に速かった。また、ICG水溶液(特許文献1)では、ICGは水中で分解し、褪色が極めて速かった。
【0109】
これは、非特許文献1のICG含有PLGA粒子では、PLGAとリン脂質(ゼラチンICG複合体1)あるいはコレステロール(ゼラチンICG複合体3)とでは、後者のほうが疎水性部位の疎水性が高いため、ICGと相互作用しやすいからと考えられる。また、特許文献1のリポソームでは、リポソーム内部の水中でICGが分解してしまい、また、リン脂質の二重膜中に存在するICGは粒子の外部に近い位置に存在するため、漏出しやすいためと考えられる。
【0110】
<実施例15>
(ゼラチンICG複合体の体内動態評価1)
左後肢にがん部位を有する担がんマウスの尾静脈よりゼラチンICG複合体1を投与した後、蛍光イメージング装置(GEヘルスケア社製)を用いて経時的に撮像し、ゼラチンICG複合体1の体内動態を評価した。
【0111】
また、比較例として、同濃度(0.5mg/ml)のICG単独を担がんマウスに静脈内投与して同様に評価した。蛍光イメージングの経時変化を図17(a)に、がん組織の蛍光強度の経時変化を図17(b)に示した。
【0112】
図17(a)と(b)から、ICG単独を投与した場合、一時的にがん組織へ分布するが、時間と共に消失する動態を示した。一方、ゼラチンICG複合体1を投与した場合、ICG単独の場合と同様にがん組織への一時的な分布が一度消失するものの、時間と共にがん組織へ再度高濃度で集積することが確認された。これは、ゼラチン誘導体による複合体化によりICGの血中安定性が向上され、いわゆるEPR効果によりがん組織へ集積したものと考えられる。
【0113】
<実施例16>
(ゼラチンICG複合体の体内動態評価2)
Cy5.5で蛍光標識したゼラチン誘導体7(DSPE67%導入)とICGからなるゼラチンICG複合体7を調製し、実施例15と同様にして担がんマウスに投与してゼラチン誘導体7自身の体内動態を評価した。その蛍光イメージングの経時変化を図18に示した。
【0114】
図18から、Cy5.5で蛍光標識したゼラチン誘導体7もまたゼラチンICG複合体1と同様の体内動態を示していることから、ゼラチンICG複合体は解離することなくがん組織へ集積していることが確認された。
【0115】
<参考例>
(ゼラチンICG)
ICG水溶液(最終濃度:0.1mg/ml)とゼラチン(重量平均分子量:10000、最終濃度:100mg/ml)とを混合して、ゼラチンとICGの混合物(ゼラチンICG混合体)を得た。分光光度計を用いて、得られたゼラチンICG混合体の吸収スペクトルを測定した。その結果を図19に示す。ゼラチンICG混合体はICG単独とほぼ同じ吸収スペクトルが得られた。このことから、ゼラチンに、リン脂質又はコレステロールが共有結合していない場合、ゼラチンとICGとは複合体を形成していないものと考えられる。
【0116】
<実施例17>
(ゼラチンICG複合体8乃至13)
3種類のゼラチン(分子量5000、10000、20000、いずれも新田ゼラチン株式会社製)にDSPEを仕込みモル比(ゼラチン:DSPE)1:1または1:1.5で導入したゼラチン誘導体をミリQ水で80mg/mlに調製し、0.22μmのフィルターで処理した後、ICG水溶液(1mg/ml)と同体積で混合して、ゼラチンICG複合体8乃至13を調製した。このとき用いたDSPEは実施例1と同様、上記の化学式2で示されるDSPE−NHS(日油株式会社製)である。各複合体の平均粒径、モル吸光係数、および光音響信号強度を表1に示した。
【0117】
【表1】

【0118】
ゼラチンの分子量やDSPEの仕込みモル比を変えることによって、平均粒径が164から855nmまでの種々のゼラチンICG複合体を得ることができた。
また、ゼラチンICG複合体11では、平均粒径が293nmで、1.6×1010 M-1cm-1の大きなモル吸光係数と2.9×1011 VJ-1M-1の大きな光音響信号が確認された。
【0119】
<実施例18>
(ゼラチンICG複合体14乃至17)
ゼラチン(分子量10000)にDSPEを4条件の仕込みモル比(1:0.5、1:1、1:1.5、1:3)で導入したゼラチン誘導体を実施例17と同様にして、ゼラチンICG複合体14乃至17を調製した。それらの平均粒径を表2に示した。
【0120】
【表2】

【0121】
DSPEの仕込みモル比を変えることによって、平均粒径が147から200nmまでの種々のゼラチンICG複合体を得ることができた。
【0122】
<実施例19>
(ゼラチンICG複合体の平均粒径とゼラチンの分子量の関係1)
4種類のゼラチン(分子量4000、5000、10000、20000)にDSPEを仕込みモル比1:1で導入したゼラチン誘導体を実施例17と同様にして、ゼラチンICG複合体を調製した。それらの平均粒径とゼラチンの分子量の関係を図20に示した。図20から、ゼラチンICG複合体の平均粒径は、ゼラチンの分子量が5000から10000の間で最小値になることが示唆された。
【0123】
<実施例20>
(ゼラチンICG複合体の平均粒径とゼラチンの分子量の関係2)
3種類のゼラチン(分子量5000、10000、20000)にDSPEを仕込みモル比1:1.5で導入したゼラチン誘導体を実施例17と同様にして、ゼラチンICG複合体を調製した。それらの平均粒径とゼラチンの分子量の関係を図21に示した。
図21から、ゼラチンICG複合体の平均粒径は、ゼラチンの分子量が10000あたりで、最小値になることが示唆された。
【0124】
<実施例21>
(ゼラチンICG複合体の体内動態評価3)
マウスの大腿部にcolon26細胞(マウス 大腸がん)を植え付けた後、20日間飼育することにより担がんマウスを作製した。
ICGはクロラミンT法により、125Iでラベル化した。125I−ICG(0.5mg/ml)単独、もしくはDSPEを導入したゼラチン(ゼラチンの分子量10000、仕込みモル比1:1、40mg/ml)と125I−ICGからなるゼラチンICG複合体18を上記の担がんマウスに尾静脈投与し(100μl)、一定時間ごとに眼窩採血を行った。また、投与1時間後と3時間後に各臓器を摘出し、放射活性を測定した。その結果を図22に示した。
【0125】
図22から、投与3時間後よりも1時間後の方が、がん組織への集積が高かった。また、投与1時間後のがん組織への集積に関して、ゼラチンICG複合体18の方がICG単独よりも高いことが確認された。これは、ゼラチン誘導体による複合体化によりICGの血中安定性が向上され、EPR効果によりがん組織へ集積したものと考えられる。
【符号の説明】
【0126】
101 ゼラチン
102 リン脂質又はコレステロール
103 ゼラチン誘導体
104 インドシアニングリーン(ICG)
105 ゼラチン複合体
【技術分野】
【0001】
本発明は、インドシアニングリーンとゼラチン誘導体からなる複合体、及びそれを用いた光イメージング用造影剤、及び前記複合体の製造方法に関するものである。
【背景技術】
【0002】
生体内部の情報を可視化する装置の1つとして、光音響トモグラフィー(Photoacoustic tomography、以下PATと略すことがある)装置が知られている。PAT装置を用いる測定においては、被測定体に光を照射したときに被測定体内部で光を吸収した物質(光吸収体)が発する光音響信号の強度と発生時刻を測定することにより、被測定体内部の物質分布を演算して層画像を得ることができる。
【0003】
ここで、光吸収体としては、生体内で光を吸収して音響波を発するものであればいかなるものをも用いることができる。例えば人体内の血管や悪性腫瘍などを光吸収体とすることが可能である。その他にも、インドシアニングリーン(Indocyanine Green、以下ICGと略すことがある)などの分子プローブを体内に導入し、造影剤として利用することもできる。ICGは体内への摂取が認可されている安全な物質であり、また人体に照射した際の影響が少なくかつ生体での透過性が高い近赤外波長領域の光をよく吸収することから、PATにおける造影剤として好適に用いることができる。
【0004】
また、ICGは近赤外波長領域の光により励起され、蛍光を発するという特徴も有している。この特徴を利用して、ICGを蛍光イメージング用造影剤としても使用することもできる。
【0005】
一方で、ICGは水と反応して分解しやすいという性質を持つため、造影剤として摂取する際に測定部位に集積させることが難しいという問題がある。
【0006】
この問題を解決するための方法として、ICGを粒子の中に高濃度で封入する技術が開発されている。非特許文献1には、ポリビニルアルコール(PVA)を界面活性剤として用い、エマルジョン溶媒拡散法によって得た、ICGを含有する乳酸−グリコール酸共重合体(poly(lactide-co-glycolide)、以下PLGAと略すことがある)粒子が開示されている。また、特許文献1には、ICGとゼラチンとを含有したリポソームが開示されている。
【先行技術文献】
【非特許文献】
【0007】
【非特許文献1】Journal of Photochemistry and Photobiology B:Biology,74(2004)29−38
【特許文献】
【0008】
【特許文献1】米国特許出願公開第2009/087479号明細書
【発明の概要】
【発明が解決しようとする課題】
【0009】
しかし、非特許文献1に開示されたICG含有PLGA粒子及び特許文献1に開示されたリポソームのいずれも、実際の使用においては、モル吸光係数が経時的に減少し、吸光の安定性に欠けるという問題があった。
【0010】
これは、非特許文献1のICG含有PLGA粒子では、ICGは水溶性であるため、水中に分散した粒子内から周囲の水中にICGが漏出して粒子が褪色するために生じると考えられる。また、特許文献1のリポソームでは、リポソーム内の水に溶解したICGが非常に速く分解され、さらには、リポソームからICGが漏出してリポソームそのものが褪色するためであると考えられる。
【0011】
本発明はこのような背景技術に鑑みてなされたものであり、内包したICGの漏出と粒子の褪色が抑制され、モル吸光係数の大きなゼラチンICG複合体の提供が本発明の目的である。
【課題を解決するための手段】
【0012】
第一の本発明に係る複合体は、リン脂質とゼラチンとが共有結合したゼラチン誘導体、コレステロールとゼラチンとが共有結合したゼラチン誘導体のうち、少なくともいずれか一方と、インドシアニングリーンとを有することを特徴とする。
第二の本発明に係る複合体の製造方法は、第二の本発明に係る複合体の製造方法は、リン脂質とゼラチンとが共有結合したゼラチン誘導体、コレステロールとゼラチンとが共有結合したゼラチン誘導体のうち、少なくともいずれか一方を用意する工程と、前記少なくともいずれか一方のゼラチン誘導体とインドシアニングリーンとを混合することにより複合体を得る工程を有することを特徴とする。
【発明の効果】
【0013】
本発明のゼラチンICG複合体は、ゼラチンに共有結合したリン脂質又はコレステロールとICGとの相互作用により、複合体からICGの漏出を抑制することができる。
【図面の簡単な説明】
【0014】
【図1】本発明の実施形態に係るゼラチンICG複合体及びそれを製造する工程を示す図である。
【図2】ゼラチンICG複合体1、ゼラチンICG複合体3、及びICGの吸収スペクトルを示すグラフである。
【図3】ゼラチンICG複合体1、ゼラチンICG複合体3、及びICGの780nmにおける吸光度を比較したグラフである。
【図4】各種ゼラチン誘導体で形成したICG複合体、及びICGの780nmにおける吸光度を比較したグラフである。
【図5】ゼラチンICG複合体1、ゼラチンICG複合体2、混合物1、混合物2、及びICGの吸収スペクトルを示すグラフである。
【図6】ゼラチンICG複合体1、ゼラチンICG複合体3、及びICGの780nmにおける光音響信号強度を比較したグラフである。
【図7】各種ゼラチン誘導体で形成したICG複合体、及びICGの780nmにおける光音響信号強度を比較したグラフである。
【図8】各種ゼラチン誘導体で形成したICG複合体、及びICGの780nmにおける吸光度と光音響信号強度の関係を示したグラフである。
【図9】(a)はPBS中におけるゼラチンICG複合体1の吸収スペクトルの経時変化であり、(b)はアルブミンを含むPBS中におけるゼラチンICG複合体1の吸収スペクトルの経時変化である。
【図10】(a)はPBS中におけるICGの吸収スペクトルの経時変化であり、(b)はアルブミンを含むPBS中におけるICGの吸収スペクトルの経時変化である。
【図11】(a)はPBS中におけるゼラチンICG複合体2の吸収スペクトルの経時変化であり、(b)はアルブミンを含むPBS中におけるゼラチンICG複合体2の吸収スペクトルの経時変化である。
【図12】PBS中アルブミン添加有無の条件下におけるゼラチンICG複合体1、ゼラチンICG複合体2、及びICGの吸光度(λmax)の経時変化を比較したグラフである。
【図13】(a)はPBS中におけるゼラチンICG複合体3の吸収スペクトルの経時変化であり、(b)はアルブミンを含むPBS中におけるゼラチンICG複合体3の吸収スペクトルの経時変化である。
【図14】(a)はPBS中におけるゼラチンICG複合体4の吸収スペクトルの経時変化であり、(b)アルブミンを含むPBS中におけるゼラチンICG複合体4の吸収スペクトルの経時変化である。
【図15】PBS中アルブミン添加有無の条件下におけるゼラチンICG複合体3、ゼラチンICG複合体4、及びICGの吸光度(λmax)の経時変化を比較したグラフである。
【図16】ゼラチンICG複合体1、ゼラチンICG複合体3、非特許文献1、及びICG(特許文献1)の水中における吸光度(λmax)の経時変化を比較したグラフである。
【図17(a)】ゼラチンICG複合体1と担がんマウスを用いた蛍光イメージングの経時変化である。
【図17(b)】がん組織の蛍光強度の経時変化を示したグラフである。
【図18】ゼラチンICG複合体7と担がんマウスを用いた蛍光イメージングの経時変化である。
【図19】ICG、及び、ゼラチンとICGの混合物(ゼラチンICG混合体)の吸収スペクトルを示した図である。
【図20】ゼラチンICG複合体(ゼラチン:DSPE=1:1)の平均粒径とゼラチンの分子量の関係を示したグラフである。
【図21】ゼラチンICG複合体(ゼラチン:DSPE=1:1.5)の平均粒径とゼラチンの分子量の関係を示したグラフである。
【図22】ゼラチンICG複合体と担がんマウスを用いた同位体トレーサー実験における各臓器の放射活性の経時変化を示したグラフである。
【発明を実施するための形態】
【0015】
以下、本発明の実施形態について説明する。
【0016】
(複合体)
本実施形態に係る複合体は、ゼラチンにリン脂質又はコレステロールが共有結合したゼラチン誘導体と、インドシアニングリーン(ICG)とを有する。ICGは、ゼラチン誘導体の周辺、特にリン脂質又はコレステロールの周辺に存在する。また、ICGは、ゼラチン誘導体に覆われた状態で存在する場合もある。本実施形態に係る複合体は、具体的には、リン脂質又はコレステロールと、インドシアニングリーン(ICG)とが、非共有結合によって結合して、一体となったものである。ここで、非共有結合とは、疎水性相互作用、水素結合、分子間力、イオン結合などを含む。本実施形態に係る複合体は、ゼラチンが粒子表面に存在し、リン脂質又はコレステロール及びICGが粒子内部に存在した、粒子状であると考えられる。しかし、本実施形態に係る複合体は粒子状に限られず、平面状であってもよいし、線状であってもよい。本実施形態に係る複合体は、リン脂質とゼラチンとが共有結合したゼラチン誘導体と、コレステロールとゼラチンとが共有結合したゼラチン誘導体のうち、少なくともいずれか一方を有していればよく、これらを両方有していてもよい。本実施形態に係る複合体を、以下、ゼラチンICG複合体と呼ぶことがある。
【0017】
ゼラチンICG複合体について図1を用いてより詳細に説明する。本実施形態において、ICGゼラチン複合体105は、リン脂質又はコレステロール102をゼラチン101に共有結合させることでゼラチン誘導体103を調製し、ゼラチン誘導体103とICG104を混合することで調製できる。なお、106はゼラチン複合体105の断面図である。
【0018】
ここで、リン脂質又はコレステロール102は疎水性の高い部位(アルキル基など)を有する。一方、ICG104についても、スルホン酸基を除く部位は疎水性である。そのため、ICG104と、リン脂質又はコレステロール102とは、疎水性相互作用等の非共有結合によって結合するため、図1の106で示すように、ICG104はゼラチン誘導体103のリン脂質又はコレステロール102周辺に集まりやすい。そのため、ICG104はゼラチンICG複合体から離脱しにくいと考えられる。
【0019】
また、本実施形態に係るゼラチンICG複合体は、水中において、図1の105、106で示すように粒子状になっていると考えられる。すなわち、ゼラチン101は親水性であり、リン脂質又はコレステロール102は疎水性の高い部位(アルキル基など)を有するため、図1の106のように、表面部にゼラチン101が、内部にリン脂質又はコレステロール102が存在する、粒子状となっていると考えられる。前述のように、ICG104はリン脂質又はコレステロール102と非共有結合していると考えられるため、図1の106のようにICG104も粒子内部に存在し、ゼラチン101に覆われた状態となっていると考えられる。そのため、ICG104は粒子状のゼラチンICG複合体の内部から漏出しにくいと考えられる。なお、ICG104の一部は、粒子の表面部に存在していてもよい。
このように、本実施形態に係るゼラチンICG複合体は、ICGが漏出しにくいため、光イメージング用造影剤として好適に使用することができる。
また、本実施形態に係るゼラチンICG複合体は、生体透過性の優れた600nm以以上900nm以下の近赤外波長領域の光に対して吸収を持つことが好ましい。
【0020】
本実施形態においてゼラチン誘導体は、ゼラチンと、リン脂質またはコレステロールとが共有結合してできたものであり、結合する際にとれる原子は含まれない。例えば、リン脂質がカルボキシル基を有し、ゼラチンがアミノ基を有している場合、両者はアミド結合することでゼラチン誘導体となるが、アミド結合の際にとれるカルボキシル基のOHと、アミノ基のHは、本実施形態におけるゼラチン誘導体には含まれない。他の結合についても同様である。
【0021】
(粒径)
また、本実施形態に係るゼラチンICG複合体は、目的とする用途に応じて平均粒径を制御することが可能であり、その平均粒径は10nm以上1000nm以下であることが好ましい。これは、この範囲の平均粒径を有する粒子であればEPR(Enhanced Permeation and Retention)効果があると考えられるからである。腫瘍組織では、正常組織に比べ血管透過性が高いため、粒子などが血管から流出しやすい。さらに、この流出した粒子は腫瘍組織に到達して蓄積する。腫瘍組織の持つこのような特性をEPR効果という。
【0022】
なお、平均粒径を求める方法としては、動的光散乱法を用いて求める方法や、透過型電顕微鏡(Transmission Electron Microscope、以下TEMと略すことがある)の画像を取得して、その画像から粒径を測定することにより求める方法などがある。動的光散乱法によって平均粒径を求める方法として例えば、動的光散乱解析装置(大塚電子(株)製、DLS−8000)を用いる方法が挙げられる。
【0023】
複合体を形成するためには、ゼラチン誘導体とICGとの混合比(重量比)は、(ゼラチン誘導体):(ICG)=20:1〜2:1の範囲であることが好ましい。
【0024】
本実施形態に係るゼラチンICG複合体は、ゼラチンに共有結合したリン脂質又はコレステロールとICGとの相互作用により、複合体からのICGの漏出と、漏出によってICGが水と反応することによるICGの褪色とを、抑制することができる。本実施形態において、相互作用とは、ICGがリン脂質又はコレステロールと疎水性相互作用若しくはイオン結合等の非共有結合していることを意味し、特に疎水性相互作用によりICGがリン脂質又はコレステロールに集まっていることを意味する。
【0025】
本実施形態に係るゼラチンICG複合体は、上記のように、表面部にゼラチンが、内部にリン脂質又はコレステロールが存在する粒子状の構造を有すると考えられるため、粒子内部には水が存在しにくく、ICGが粒子内部で水と反応して分解することを防ぐことができる。なお、このとき、疎水性のリン脂質又はコレステロールはすべてがゼラチンの内部に存在している必要はなく、その一部が粒子の外側に存在してもよい。
【0026】
また、低分子物質であるリン脂質のみをICGと相互作用させ、ICGの溶解性を変化させる試みはあるが、この場合、ICGとリン脂質との間の相互作用が弱いため、両者の解離が生じるおそれがある。これに対して、本実施形態においては、ICGとリン脂質の相互作用の点は同じであるが、それに加えて、ゼラチン分子が存在していることから、ICGとリン脂質の解離の問題を解決することができる。
【0027】
(ゼラチン)
本実施形態におけるゼラチンは、食品分野、医療分野で広く知られている水溶性のタンパク質である。ゼラチンの組成は、牛骨、牛皮、豚皮など、由来する物質によって異なるため一意的には決まらないが、全アミノ酸のうち、おおよそ、グリシンが三分の一、イミノ酸(プロリン、オキシプロリン)が九分の二を占める。また、アミノ酸配列において、グリシンは3個に1個の繰り返しで存在している。ゼラチンの平均分子量は好適には1000以上100000以下であり、更に好適には3000以上である。なお、ゼラチンはコラーゲンの熱変性物質であり、コラーゲンの部分構造を有する。また、ゼラチンはコラーゲンの加水分解によってできる。
【0028】
本実施形態においては、ゼラチンの種類、採取する動物若しくは採取組織部位、コラーゲンからの変性処理法(アルカリ処理、酸処理、酵素処理など)によらず、いかなるゼラチンでも利用することができる。また、ヒト遺伝子組み換え型などのゼラチンも利用可能である。このようなゼラチンの例としては、等電点約5のアルカリ処理ゼラチン、等電点約9の酸処理ゼラチン等が挙げられる。
【0029】
また、本実施形態におけるコラーゲンとしては、例えば、グリシン約35%、プロリン及び4−ヒドロキシプロリン約21%、アラニン約11%を有するタンパク質を用いることができる。
【0030】
ゼラチンは、以前より食用や医療用に使用されており、体内に摂取しても人体に害を与えることがない。また、ゼラチンは生体に吸収されやすく、生体内においてICGを安定的に保持するという役割を果たした後に、生体内で分散消失される性質をもつため、使用後に生体内から除去する必要がないという利点を有する。
【0031】
(リン脂質)
本実施形態においてリン脂質とは、構造中にリン酸エステル部位をもつ脂質である。また、親水性の高い部位であるリン酸部位と疎水性の高い部位であるアルキル基などの部位をもつため、両親媒性である。本実施形態におけるリン脂質として、ゼラチンと容易に共有結合させることのできる、アミノ基、カルボキシル基、又はN−ヒドロキシスクシンイミド基(以下、NHS基と略すことがある)等を有するリン脂質であることが好ましい。特に、NHS基を有するリン脂質は、アミノ基と結合しやすく、アミノ基を有するゼラチンに結合しやすいため好ましい。
【0032】
また、本実施形態におけるリン脂質は、ホスファチジル系リン脂質であることが好ましい。
【0033】
本実施形態におけるリン脂質として例えば、
1,2-Distearoyl-sn-glycero-3-phosphoethanolamine、1,2-Dipalmitoyl-sn-glycero-3-phosphoethanolamine、1,2-Dimyristoyl-sn-glycero-3-phosphoethanolamine、1,2-Dilauroyl-sn-glycero-3-phosphoethanolamine、1,2-Dioleoyl-sn-glycero-3-phosphoethanolamine、1,2-Dilinoleoyl-sn-glycero-3-phosphoethanolamine、1,2-Dierucoyl-sn-glycero-3-phosphoethanolamine、1,2-Distearoyl-sn-glycero-3-phospho-L-serine、1,2-Dipalmitoyl-sn-glycero-3-phospho-L-serine、1,2-Dimyristoyl-sn-glycero-3-phospho-L-serine、1,2-Dioleoyl-sn-glycero-3-phospho-L-serine、Dimyristoyl N-(Succinimidyloxy-glutaryl)-L-α-phosphatidylethanolamine、Dipalmitoyl N-(Succinimidyloxy-glutaryl)-L-α-phosphatidylethanolamine、Distearoyl N-(Succinimidyloxy-glutaryl)-L-α-phosphatidylethanolamine、1-Palmitoyl-2-oleoyl N-(Succinimidyloxy-glutaryl)-L-α-phosphatidylethanolamine、Dioleoyl N-(Succinimidyloxy-glutaryl)-L-α-phosphatidylethanolamine等を挙げることができる。これらのリン脂質は単独で使用してもよいし、又は複数を組み合わせて用いてもよい。
【0034】
なお、上記のNHS基とは下記の化学式1で示される官能基を意味する。
【化1】

【0035】
本実施形態におけるリン脂質としては、下記の化学式2で表される、NHS基を有するDSPE(Distearoyl N-(Succinimidyloxy-glutaryl)-L-α-phosphatidylethanolamine、以下DSPE−NHSと略すことがある)が好ましい。
【化2】

(ただし、化学式2においてR1及びR2はCH3(CH2)16−である)
【0036】
(ICG)
ICG(インドシアニングリーン)は下記の化学式3で示される構造、及び、下記の構造において対イオンがNa+の代わりにH+あるいはK+であるものを指す。
【化3】

【0037】
(ゼラチンICG誘導体の製造方法)
本実施形態におけるゼラチンICG複合体の製造方法について説明する。
ゼラチンICG複合体を製造する工程を図1に示す。具体的には、以下の(1)と(2)の工程を経てゼラチンICG複合体105を得ることができる。
(1)ゼラチン101にリン脂質又はコレステロール102が共有結合したゼラチン誘導体103を得る工程。
(2)前記ゼラチン誘導体103とICG104とを混合することによりゼラチンICG複合体105を得る工程。
【0038】
本実施形態において、ゼラチン101と、リン脂質又はコレステロール102を共有結合させてゼラチン誘導体103を得る工程と、前記ゼラチン誘導体103とICG104とを混合することにより複合体105を得る工程を有することが好ましい。なぜなら、リン脂質又はコレステロール102とICG104を混合した後に、リン脂質又はコレステロール102とゼラチン101とを共有結合させようとすると、ICG104が、リン脂質又はコレステロール102とゼラチン101との結合を妨げるおそれがあるからである。
【0039】
また、上記の(1)の工程は、リン脂質とゼラチンとが共有結合したゼラチン誘導体、コレステロールとゼラチンとが共有結合したゼラチン誘導体のうち、少なくともいずれか一方を用意する工程であればよく、両方を用意する工程であってもよい。リン脂質とゼラチンとが共有結合したゼラチン誘導体を用意する工程は、リン脂質とゼラチンとを共有結合させてゼラチン誘導体を得る工程でもよく、リン脂質とゼラチンとが共有結合した市販のゼラチン誘導体を用意する工程でもよい。コレステロールとゼラチンとが共有結合したゼラチン誘導体を用意する工程についても同様に、コレステロールとゼラチンとを共有結合させてゼラチン誘導体を得る工程でもよく、コレステロールとゼラチンとが共有結合した市販のゼラチン誘導体を用意する工程でもよい。
【0040】
(ゼラチン誘導体)
ゼラチン誘導体の調製方法は特に限定されず、ゼラチンとリン脂質又はコレステロールとの間で共有結合が生じればよい。例えば、ゼラチンの脱水ジメチルスルホキシド溶液に、NHS基を有するリン脂質又はヒドロキシル基を活性化したコレステロールを加えて室温下で18時間反応させた後、反応溶液を水に対して透析し、水可溶化成分を凍結乾燥することにより、リン脂質又はコレステロールが共有結合したゼラチン誘導体を得ることができる。ここで、リン脂質のうち、NHS基を有するリン脂質は、アミノ基と結合しやすく、アミノ基を有するゼラチンに結合しやすい。したがって、NHS基を有するリン脂質を用いることで本実施形態に係る複合体の製造が容易となるため好ましい。特には、上記の化学式2で表される、DSPE−NHSを用いることが好ましい。
【0041】
このようにして得たゼラチン誘導体とICGとを混合することにより、リン脂質又はコレステロールが有する高い疎水性を示す炭素鎖部位とICGとの間で相互作用が生じ、本実施形態に係るゼラチンICG複合体を得ることができる。
【0042】
<光イメージング用造影剤>
本実施形態に係る光イメージング用造影剤は、本実施形態に係る複合体と、前記複合体が分散された分散媒とを有する。本実施形態において光イメージングとは、光を照射することで、イメージング(画像化)することを意味する。すなわち、本実施形態に係る光イメージング用造影剤はICGを有するため、ICGに光が照射されることで、音響波や蛍光などを発する。発せられた音響波を検出することで光音響イメージングをすることができ、発せられた蛍光を検出することで蛍光イメージングをすることができる。なお、光音響イメージングは、光音響トモグラフィー(断層撮影法)を含む概念である。 上記の分散媒は、本実施形態に係る複合体を分散させるための液状の物質であり、例えば生理食塩水、注射用蒸留水、リン酸緩衝生理食塩水(Phosphate buffered saline、以下PBSと略すことがある)などが挙げられる。また本実施形態に係る光イメージング用造影剤は、必要に応じて本実施形態に係る複合体の他に薬理上許容できる添加物を有していても良い。
【0043】
本実施形態に係る光イメージング用造影剤は、上記本実施形態に係る粒子をこの分散媒に予め分散させておいてもよいし、本実施形態に係る粒子と分散媒とをキットにしておき、生体内に投与する前に粒子を分散媒に分散させて使用してもよい。
【0044】
このように、本実施形態に係る光イメージング用造影剤は、光音響イメージング用造影剤や、蛍光イメージング用造影剤として利用することができる。
【0045】
本実施形態に係るゼラチンICG複合体は、EPR(Enhanced Permeability and Retention)効果を利用することで、生体内に投与したときに、生体内の正常部位に比べて腫瘍部位により多く集積させることができる。その結果、複合体を生体内に投与した後、生体に光を照射して、生体からの音響波や蛍光を検出するときに、腫瘍部位から発せられる音響波や蛍光を正常部位から発せられる音響波や蛍光よりも大きくすることができる。従って、本実施形態に係る複合体は腫瘍部位を特異的に検出する光イメージング用造影剤として用いることができる。
【0046】
ここで、ゼラチンは化学修飾可能な化学官能基をもっているため、例えば、ゼラチンICG複合体のゼラチン分子表面に腫瘍細胞認識リガンドを化学結合させることにより、複合体の腫瘍へのターゲティングが可能となる。リガンドとしては、細胞表面の構造を認識できる抗体、アプタマー、レクチン、トランスフェリン、及びレセプターに対するアゴニストあるいはアンタゴニストあるいは葉酸などの腫瘍細胞に特異的に取り込まれるような物質などが挙げられる。これらの物質は単独で使用してもよいし、あるいは複数を組み合わせて用いてもよい。
【0047】
生体内に投与して利用することを考えると、本実施形態に係るゼラチンICG複合体の吸収スペクトルのピークは近赤外波長領域にあることが好ましい。これは、近赤外波長領域の光が生体に照射したときに安全で、かつ、生体に対して比較的高い透過性をもつからである。本実施形態に係るゼラチンICG複合体は特に、600nmから900nmの波長領域において高い吸光度を有する。
【0048】
(造影方法)
生体内に投与された本実施形態に係る複合体を、PAT装置を用いて検出する方法について説明する。本実施形態に係る複合体を検出する方法は以下の工程を有する。
(a)本実施形態に係る複合体を生体内に投与する工程。
(b)生体に光を照射し、生体内に存在する本実施形態に係る複合体から発せられる光音響信号を検出する工程。
【0049】
なお、上記(a)の工程において、本実施形態に係る複合体を生体内に投与する方法は特に限定されない。また、上記(b)の工程において、生体に照射する光を発生させる装置、複合体から発せられる光音響信号を検出する装置は特に限定されない。例えば、生体に照射する光を発生させる装置として、レーザーパルス光を照射する装置を用いることができる。レーザーパルス光を照射する装置として例えば、チタンサファイアレーザー(LT−2211−PC、Lotis社製))、OPOレーザー(LT−2214 OPO、Lotis社製)、アレキサンドライトレーザーなどが挙げられる。
【0050】
次に、生体内に投与された本実施形態に係る複合体を、蛍光装置を用いて検出する方法について説明する。本実施形態に係る複合体を検出する方法は以下の工程を有する。
(c)本実施形態に係る複合体を生体内に投与する工程。
(d)生体に光を照射し、生体内に存在する本実施形態に係る複合体から発せられる蛍光を検出する工程。
【0051】
なお、上記(a)の工程において、本実施形態に係る複合体を生体内に投与する方法は特に限定されない。また、上記(d)の工程において、生体に照射する光を発生させる装置、複合体から発せられる蛍光を検出する装置は特に限定されない。
【実施例】
【0052】
以下、実施例を用いて更に詳細に本発明を説明するが、本発明は、これらの実施例に限定されるものではなく、材料、組成条件及び反応条件等は、同様の機能、効果を有する複合体が得られる範囲で変更することができる。
【0053】
<実施例1>
(ゼラチンICG複合体1)
牛骨由来、等電点5.0のゼラチン(1000mg、分子量10000、新田ゼラチン株式会社製)の脱水ジメチルスルホキシド(30ml、ナカライテスク株式会社製)溶液に、上記の化学式2で示されるDSPE−NHS(日油株式会社製)133mgを加え、モル比1:1.5で室温下18時間反応させた。得られた反応溶液を水に対して透析し、水可溶化成分を凍結乾燥することにより、ゼラチンにDSPEが共有結合したゼラチン誘導体1を得た。ゼラチンへのDSPEの導入量は、フルオレスカミン法にて測定し、ゼラチンに対してDSPEが67%導入されていることが確認された。
【0054】
次に、ICG(シグマ製)を溶解した水溶液(最終濃度:0.5mg/ml)とDSPEが共有結合したゼラチン誘導体1(最終濃度:40mg/ml)とを混合して、ゼラチンICG複合体1を得た。得られたゼラチンICG複合体1の粒径を動的光散乱解析装置(大塚電子株式会社製)で分析したところ、ゼラチンICG複合体1の平均粒径は540nmであった。
【0055】
分光光度計(ベックマンコールター社製)を用いて、得られたゼラチンICG複合体1の吸収スペクトルを測定した。
【0056】
ゼラチンICG複合体1の吸収スペクトルと780nmにおける吸光度をそれぞれ図2と図3に示した。比較例としてICGの吸収スペクトルと780nmにおける吸光度をそれぞれ図2と図3に示した。
【0057】
ICGの吸収スペクトルは2峰性であり、低波長側(700nm)がICGの会合体による吸収、長波長側(780nm)が単量体による吸収を示すことが知られている。
【0058】
図2から、最終濃度0.5mg/mlのICGでは、会合体が多く形成されている為、長波長側の吸光度が低くなったと考えられる。一方、ゼラチンICG複合体1では、長波長側の吸光度がICG単独よりも高く、複合体中でICGの会合が抑制され、ICGとリン脂質とが相互作用していることが示唆された。
【0059】
図3から、ゼラチンICG複合体1は同じ濃度(0.5mg/ml)のICGと比べて、約3.3倍の吸光度を有することが確認された。
【0060】
また、平均粒径と吸光度からモル吸光係数(780nm)を算出したところ、ゼラチンICG複合体1のモル吸光係数は1.1×1011 M-1cm-1であり、従来から知られている金ナノロッドのモル吸光係数(8.6×109M-1cm-1)より極めて大きいことが確認された。
【0061】
<実施例2>
(ゼラチンICG複合体2)
DSPEとゼラチンのモル比を1:1で反応させた以外は実施例1と同様の操作によって、DSPEが共有結合したゼラチン誘導体2を得た。フルオレスカミン法による測定により、ゼラチンに対してDSPEが30%導入されていることが確認された。
【0062】
ICGを溶解した水溶液(最終濃度:0.5mg/ml)とDSPEが共有結合したゼラチン誘導体2(最終濃度:40mg/ml)を混合して、ゼラチンICG複合体2を得た。実施例1と同様に平均粒径及びモル吸光係数を求めたところ、ゼラチンICG複合体2の平均粒径は500nmであった。また、ゼラチンICG複合体2の780nmにおけるモル吸光係数は5.2×1010 M-1cm-1であり、大きなモル吸光係数であることが確認された。
【0063】
<実施例3>
(ゼラチンICG複合体3)
コレステロール(38.6mg、和光純薬工業製、特級)のピリジン(和光純薬工業製)溶液へ、縮合剤のN,N'-Disuccinimidyl Carbonate(77mg、ナカライテスク製)、続いて反応触媒の4-Dimethylaminopyridine(ナカライテスク製)を加え、コレステロールのヒドロシル基を活性化した。
【0064】
上記活性化コレステロールのピリジン溶液へゼラチン(1000mg)の脱水ジメチルスルホキシド(30ml)溶液を加え、モル比1:1で室温下18時間反応させた。得られた反応溶液を水に対して透析し、水可溶化成分を凍結乾燥することにより、ゼラチンにコレステロールが共有結合したゼラチン誘導体3を得た。フルオレスカミン法による測定により、ゼラチンに対してコレステロールが41%導入されていることが確認された。
【0065】
次に、ICGを溶解した水溶液(最終濃度:0.5mg/ml)とコレステロールが共有結合したゼラチン誘導体3と(最終濃度:40mg/ml)を混合して、ゼラチンICG複合体3を得た。実施例1と同様に平均粒径を求めたところ、ゼラチンICG複合体3の平均粒径は200nmであった。
【0066】
実施例1と同様に求めたゼラチンICG複合体3の吸収スペクトルと780nmにおける吸光度をそれぞれ図2と図3に示す。
【0067】
図2から、ゼラチンICG複合体3はICGと比べて700nm付近の会合体の吸収が減少し、780nm付近の単量体の吸収が増加していることが確認された。ただし、DSPEが共有結合したゼラチン誘導体からなるゼラチンICG複合体1よりも700nm付近での吸光度が高く、780nm付近での吸光度が低かったため、複合体中での会合が抑制される度合いはゼラチン誘導体の種類に依存すると考えられた。
【0068】
図3から、ゼラチンICG複合体3は同じ濃度(0.5mg/ml)のICGと比べて、約1.5倍の吸光度を有することが確認された。
【0069】
また、平均粒径と吸光度からモル吸光係数(780nm)を算出したところ、ゼラチンICG複合体3のモル吸光係数は2.4×109 M-1cm-1であり、大きなモル吸光係数であることが確認された。
【0070】
<実施例4>
(ゼラチンICG複合体4)
ゼラチンとコレステロールのモル比を1:1.5で反応させた以外は実施例3と同様の操作によって、コレステロールが共有結合したゼラチン誘導体4を得た。フルオレスカミン法による測定により、ゼラチンに対してコレステロールが71%導入されていることが確認された。
【0071】
ICGを溶解した水溶液(最終濃度:0.5mg/ml)とコレステロールが共有結合したゼラチン誘導体4(最終濃度:40mg/ml)を混合して、ゼラチンICG複合体4を得た。実施例1と同様に平均粒径及びモル吸光係数を求めたところ、ゼラチンICG複合体4の平均粒径は150nmであった。また、ゼラチンICG複合体4の780nmにおけるモル吸光係数は1.7×109M-1cm-1であり、大きなモル吸光係数であることが確認された。
【0072】
<実施例5>
(吸光度比較)
実施例1と同様の操作によって、ゼラチン(分子量5000)にDSPEを75%導入したゼラチン誘導体5を合成した。
【0073】
実施例3と同様の操作によって、ゼラチン(分子量10000)にコレステロールを83%導入したゼラチン誘導体6を合成した。
【0074】
ゼラチンICG複合体1、3、4、5、6(最終濃度:40、100mg/ml)のそれぞれとICG水溶液(最終濃度:0.5mg/ml)とを混合して、ゼラチンICG複合体を得た。これらの複合体とICGの780nmにおける吸光度を比較した結果を図4に示す。
【0075】
図4から、ICGの同濃度の条件下においてゼラチンICG複合体はいずれもICGに比べて吸光度が大きく、更に、コレステロールよりもDSPEが共有結合したゼラチンからなる複合体の方が吸光度の増加が大きいことが確認された。
【0076】
<実施例6>
(ゼラチン誘導体の効果)
前記ゼラチンICG複合体1、2と同じ組成量の混合物を混合物1、2とし、それぞれの吸収スペクトルを比較したグラフを図5に示した。
【0077】
なお、複合体と混合物は、ICGとゼラチンの最終濃度がそれぞれ0.5mg/ml、40mg/mlとなるように調製した。
【0078】
図5の混合物1、2とゼラチンICG複合体1、2を比較すると、混合物1、2では780nm付近の長波長側の吸収が非常に低いことからゼラチンICG複合体は殆ど形成されず、また、700nm付近の短波長側の吸収が高いことからICGの会合体が数多く形成されていることが示唆された。
【0079】
一方、同様にして前記ゼラチンICG複合体3、4と同じ組成量の混合物の吸収スペクトルを求めようとしたが、コレステロールは水に対して不溶であり、ゼラチンICG複合体3、4と同じ組成量の混合物を得ることはできなかった。
【0080】
以上の検討結果から、DSPE又はコレステロールが共有結合したゼラチン誘導体でICGを複合化することが、モル吸光係数の大きな複合体を得る上で極めて有効であることを確認した。
【0081】
<実施例7>
(光音響信号評価1)
光音響信号測定装置(試作品、照射波長:780nm、照射エネルギー:50mJ)を用いて、ゼラチンICG複合体1、ゼラチンICG複合体3、及びICG(比較例)を用いて光音響信号を評価し、その結果を図6に示した。なお、図6は各サンプルの780nmにおける光音響信号強度を比較したものである。
【0082】
図6から、ゼラチンICG複合体1は同濃度(0.5mg/ml)のICGと比べて、光音響信号強度が6桁程大きいことが確認された。
【0083】
一方、ゼラチンICG複合体3は同濃度(0.5mg/ml)のICGと比べて、光音響信号強度が5桁程大きいことが確認された。
【0084】
以上から、ICGはゼラチン誘導体で複合体化することによって光音響信号が増強されることが確認された。
【0085】
<実施例8>
(光音響信号評価2)
ゼラチンICG複合体1(最終濃度:10、40、100mg/ml)、ゼラチン誘導体3、6(最終濃度:40、100mg/ml)とICG水溶液(最終濃度:0.1、0.5、1、5mg/ml)とをそれぞれ混合して得られたゼラチンICG複合体、及びICG(比較例)を用いて光音響信号を評価し、その結果を図7に示した。なお、図7は各サンプルの780nmにおける光音響信号強度を比較したものである。
【0086】
図7から、ゼラチンICG複合体はいずれもICG単独に比べて光音響信号が高く、ICGはゼラチン誘導体で複合体化することによって光音響信号が増強されることが確認された。
【0087】
<実施例9>
(光音響信号評価3)
ゼラチンICG複合体1、6(最終濃度:40、100mg/ml)とICG水溶液(最終濃度:0.5mg/ml)とをそれぞれ混合して得られたゼラチンICG複合体、及びICG(比較例)を用いて光音響信号を評価し、780nmにおける吸光度と光音響信号強度の関係を図8に示した。
【0088】
図8から、吸光度と光音響信号強度には正の相関があることが確認された。
【0089】
<実施例10>
(ゼラチンICG複合体1の安定性評価)
ゼラチンICG複合体1の安定性を評価する為に、ゼラチンICG複合体1をPBS(リン酸緩衝生理食塩水)又はアルブミン(40mg/ml)を含むPBS中に37℃で静置して、経時的に吸収スペクトルを測定した。
【0090】
ゼラチンICG複合体1のPBS中、及びアルブミンを含むPBS中での吸収スペクトルの経時変化をそれぞれ図9(a)と(b)に示した。
【0091】
また、比較例として、ICGのPBS中、及びアルブミンを含むPBS中での吸収スペクトルの経時変化を図10(a)と(b)に示した。
【0092】
また、上記条件下のゼラチンICG複合体1とICGの吸光度(λmax)の経時変化を比較したグラフを図12に示した。
【0093】
図9(a)と(b)、及び図12から、ゼラチンICG複合体1はアルブミンの添加の有無に関わらず、吸光度の減少が抑制さていることが確認され、少なくとも1週間、吸収スペクトルが変化しなかった。これはゼラチン誘導体中のリン脂質とICGとが相互作用して、複合体からのICGの漏出と褪色が抑制された為と考えられ、複合体が安定であることを確認した。
【0094】
一方、図10(a)と図12から、アルブミン無添加のICGでは吸収スペクトルの経時変化は非常に大きく、ICGが褪色していることが確認された。
【0095】
また、図10(b)と図12から、アルブミン添加のICGの吸収スペクトルはアルブミン無添加のICGより経時変化が抑制されてはいるが、アルブミン添加のゼラチンICG複合体1と比較すると安定性に若干劣ることが確認された。
【0096】
<実施例11>
(ゼラチンICG複合体2の安定性評価)
実施例10と同様にして、ゼラチンICG複合体2のPBS中、及びアルブミンを含むPBS中での吸収スペクトルの経時変化を測定し、その結果を図11(a)と(b)に示した。
【0097】
また、上記条件下のゼラチンICG複合体2とICGの吸光度(λmax)の経時変化を比較したグラフを図12に示した。
【0098】
図11(a)と(b)、及び図12から、ゼラチンICG複合体2はアルブミンの添加の有無に関わらず、吸光度の減少が抑制さていることが確認され、少なくとも1週間、吸収スペクトルが変化しなかった。これはゼラチン誘導体中のリン脂質とICGとが相互作用して、複合体からのICGの漏出と褪色が抑制された為と考えられ、複合体が安定であることを確認した。
【0099】
<実施例12>
(ゼラチンICG複合体3の安定性評価)
実施例10と同様にして、ゼラチンICG複合体3のPBS中、及びアルブミンを含むPBS中での吸収スペクトルの経時変化を測定し、その結果を図13(a)と(b)に示した。
【0100】
また、上記条件下のゼラチンICG複合体3とICGの吸光度(λmax)の経時変化を比較したグラフを図15に示した。
【0101】
図13(a)と図15から、アルブミン無添加のゼラチンICG複合体3はアルブミン無添加のICGと比べて、吸光度の減少が抑制されていることが確認された。
【0102】
また、図13(b)と図15から、アルブミン添加のゼラチンICG複合体3は、吸光度の減少が更に抑制されることが確認された。
【0103】
<実施例13>
(ゼラチンICG複合体4の安定性評価)
実施例10と同様にして、ゼラチンICG複合体4のPBS中、及びアルブミンを含むPBS中での吸収スペクトルの経時変化を測定し、その結果を図14(a)と(b)に示した。
【0104】
また、上記条件下のゼラチンICG複合体4とICGの吸光度(λmax)の経時変化を比較したグラフを図15に示した。
【0105】
図14(a)と(b)、及び図15から、アルブミンの添加の有無に関わらず、吸光度の減少が抑制さていることが確認された。
【0106】
<実施例14>
(ゼラチンICG複合体と先行技術の安定性比較)
ゼラチンICG複合体1、ゼラチンICG複合体3、非特許文献1、及びICG(特許文献1)の水中における吸光度(λmax)の経時変化を比較したグラフを図16に示した。
【0107】
図16から、前記ゼラチンICG複合体1、及びゼラチンICG複合体3は、非特許文献1、及びICG(特許文献1)と比べて、ICGの漏出による褪色が抑制されていることが確認された。
【0108】
非特許文献1のICG含有PLGA粒子では、ICGの漏出による褪色が非常に速かった。また、ICG水溶液(特許文献1)では、ICGは水中で分解し、褪色が極めて速かった。
【0109】
これは、非特許文献1のICG含有PLGA粒子では、PLGAとリン脂質(ゼラチンICG複合体1)あるいはコレステロール(ゼラチンICG複合体3)とでは、後者のほうが疎水性部位の疎水性が高いため、ICGと相互作用しやすいからと考えられる。また、特許文献1のリポソームでは、リポソーム内部の水中でICGが分解してしまい、また、リン脂質の二重膜中に存在するICGは粒子の外部に近い位置に存在するため、漏出しやすいためと考えられる。
【0110】
<実施例15>
(ゼラチンICG複合体の体内動態評価1)
左後肢にがん部位を有する担がんマウスの尾静脈よりゼラチンICG複合体1を投与した後、蛍光イメージング装置(GEヘルスケア社製)を用いて経時的に撮像し、ゼラチンICG複合体1の体内動態を評価した。
【0111】
また、比較例として、同濃度(0.5mg/ml)のICG単独を担がんマウスに静脈内投与して同様に評価した。蛍光イメージングの経時変化を図17(a)に、がん組織の蛍光強度の経時変化を図17(b)に示した。
【0112】
図17(a)と(b)から、ICG単独を投与した場合、一時的にがん組織へ分布するが、時間と共に消失する動態を示した。一方、ゼラチンICG複合体1を投与した場合、ICG単独の場合と同様にがん組織への一時的な分布が一度消失するものの、時間と共にがん組織へ再度高濃度で集積することが確認された。これは、ゼラチン誘導体による複合体化によりICGの血中安定性が向上され、いわゆるEPR効果によりがん組織へ集積したものと考えられる。
【0113】
<実施例16>
(ゼラチンICG複合体の体内動態評価2)
Cy5.5で蛍光標識したゼラチン誘導体7(DSPE67%導入)とICGからなるゼラチンICG複合体7を調製し、実施例15と同様にして担がんマウスに投与してゼラチン誘導体7自身の体内動態を評価した。その蛍光イメージングの経時変化を図18に示した。
【0114】
図18から、Cy5.5で蛍光標識したゼラチン誘導体7もまたゼラチンICG複合体1と同様の体内動態を示していることから、ゼラチンICG複合体は解離することなくがん組織へ集積していることが確認された。
【0115】
<参考例>
(ゼラチンICG)
ICG水溶液(最終濃度:0.1mg/ml)とゼラチン(重量平均分子量:10000、最終濃度:100mg/ml)とを混合して、ゼラチンとICGの混合物(ゼラチンICG混合体)を得た。分光光度計を用いて、得られたゼラチンICG混合体の吸収スペクトルを測定した。その結果を図19に示す。ゼラチンICG混合体はICG単独とほぼ同じ吸収スペクトルが得られた。このことから、ゼラチンに、リン脂質又はコレステロールが共有結合していない場合、ゼラチンとICGとは複合体を形成していないものと考えられる。
【0116】
<実施例17>
(ゼラチンICG複合体8乃至13)
3種類のゼラチン(分子量5000、10000、20000、いずれも新田ゼラチン株式会社製)にDSPEを仕込みモル比(ゼラチン:DSPE)1:1または1:1.5で導入したゼラチン誘導体をミリQ水で80mg/mlに調製し、0.22μmのフィルターで処理した後、ICG水溶液(1mg/ml)と同体積で混合して、ゼラチンICG複合体8乃至13を調製した。このとき用いたDSPEは実施例1と同様、上記の化学式2で示されるDSPE−NHS(日油株式会社製)である。各複合体の平均粒径、モル吸光係数、および光音響信号強度を表1に示した。
【0117】
【表1】

【0118】
ゼラチンの分子量やDSPEの仕込みモル比を変えることによって、平均粒径が164から855nmまでの種々のゼラチンICG複合体を得ることができた。
また、ゼラチンICG複合体11では、平均粒径が293nmで、1.6×1010 M-1cm-1の大きなモル吸光係数と2.9×1011 VJ-1M-1の大きな光音響信号が確認された。
【0119】
<実施例18>
(ゼラチンICG複合体14乃至17)
ゼラチン(分子量10000)にDSPEを4条件の仕込みモル比(1:0.5、1:1、1:1.5、1:3)で導入したゼラチン誘導体を実施例17と同様にして、ゼラチンICG複合体14乃至17を調製した。それらの平均粒径を表2に示した。
【0120】
【表2】

【0121】
DSPEの仕込みモル比を変えることによって、平均粒径が147から200nmまでの種々のゼラチンICG複合体を得ることができた。
【0122】
<実施例19>
(ゼラチンICG複合体の平均粒径とゼラチンの分子量の関係1)
4種類のゼラチン(分子量4000、5000、10000、20000)にDSPEを仕込みモル比1:1で導入したゼラチン誘導体を実施例17と同様にして、ゼラチンICG複合体を調製した。それらの平均粒径とゼラチンの分子量の関係を図20に示した。図20から、ゼラチンICG複合体の平均粒径は、ゼラチンの分子量が5000から10000の間で最小値になることが示唆された。
【0123】
<実施例20>
(ゼラチンICG複合体の平均粒径とゼラチンの分子量の関係2)
3種類のゼラチン(分子量5000、10000、20000)にDSPEを仕込みモル比1:1.5で導入したゼラチン誘導体を実施例17と同様にして、ゼラチンICG複合体を調製した。それらの平均粒径とゼラチンの分子量の関係を図21に示した。
図21から、ゼラチンICG複合体の平均粒径は、ゼラチンの分子量が10000あたりで、最小値になることが示唆された。
【0124】
<実施例21>
(ゼラチンICG複合体の体内動態評価3)
マウスの大腿部にcolon26細胞(マウス 大腸がん)を植え付けた後、20日間飼育することにより担がんマウスを作製した。
ICGはクロラミンT法により、125Iでラベル化した。125I−ICG(0.5mg/ml)単独、もしくはDSPEを導入したゼラチン(ゼラチンの分子量10000、仕込みモル比1:1、40mg/ml)と125I−ICGからなるゼラチンICG複合体18を上記の担がんマウスに尾静脈投与し(100μl)、一定時間ごとに眼窩採血を行った。また、投与1時間後と3時間後に各臓器を摘出し、放射活性を測定した。その結果を図22に示した。
【0125】
図22から、投与3時間後よりも1時間後の方が、がん組織への集積が高かった。また、投与1時間後のがん組織への集積に関して、ゼラチンICG複合体18の方がICG単独よりも高いことが確認された。これは、ゼラチン誘導体による複合体化によりICGの血中安定性が向上され、EPR効果によりがん組織へ集積したものと考えられる。
【符号の説明】
【0126】
101 ゼラチン
102 リン脂質又はコレステロール
103 ゼラチン誘導体
104 インドシアニングリーン(ICG)
105 ゼラチン複合体
【特許請求の範囲】
【請求項1】
リン脂質とゼラチンとが共有結合したゼラチン誘導体及びコレステロールとゼラチンとが共有結合したゼラチン誘導体のうち少なくとも一方と、インドシアニングリーンとを有することを特徴とする複合体。
【請求項2】
前記リン脂質がN−ヒドロキシスクシンイミド基を有するリン脂質であることを特徴とする請求項1に記載の複合体。
【請求項3】
前記リン脂質が下記の化学式2で表されるリン脂質であることを特徴とする請求項1に記載の複合体。
【化1】

(ただし、化学式2においてR1及びR2はCH3(CH2)16−である)
【請求項4】
前記複合体の平均粒径が10nm以上1000nm以下であることを特徴とする請求項1に記載の複合体。
【請求項5】
請求項1に記載の複合体と、前記複合体が分散された分散媒とを有することを特徴とする光イメージング用造影剤。
【請求項6】
リン脂質とゼラチンとが共有結合したゼラチン誘導体及びコレステロールとゼラチンとが共有結合したゼラチン誘導体のうち少なくとも一方を用意する工程と、前記少なくとも一方のゼラチン誘導体とインドシアニングリーンとを混合することにより複合体を得る工程を有することを特徴とする複合体の製造方法。
【請求項7】
前記リン脂質がN−ヒドロキシスクシンイミド基を有するリン脂質であることを特徴とする請求項5に記載の複合体の製造方法。
【請求項8】
前記リン脂質が下記の化学式2で表されるリン脂質であることを特徴とする請求項5に記載の複合体の製造方法。
【化2】

(ただし、化学式2においてR1及びR2はCH3(CH2)16−である)
【請求項1】
リン脂質とゼラチンとが共有結合したゼラチン誘導体及びコレステロールとゼラチンとが共有結合したゼラチン誘導体のうち少なくとも一方と、インドシアニングリーンとを有することを特徴とする複合体。
【請求項2】
前記リン脂質がN−ヒドロキシスクシンイミド基を有するリン脂質であることを特徴とする請求項1に記載の複合体。
【請求項3】
前記リン脂質が下記の化学式2で表されるリン脂質であることを特徴とする請求項1に記載の複合体。
【化1】

(ただし、化学式2においてR1及びR2はCH3(CH2)16−である)
【請求項4】
前記複合体の平均粒径が10nm以上1000nm以下であることを特徴とする請求項1に記載の複合体。
【請求項5】
請求項1に記載の複合体と、前記複合体が分散された分散媒とを有することを特徴とする光イメージング用造影剤。
【請求項6】
リン脂質とゼラチンとが共有結合したゼラチン誘導体及びコレステロールとゼラチンとが共有結合したゼラチン誘導体のうち少なくとも一方を用意する工程と、前記少なくとも一方のゼラチン誘導体とインドシアニングリーンとを混合することにより複合体を得る工程を有することを特徴とする複合体の製造方法。
【請求項7】
前記リン脂質がN−ヒドロキシスクシンイミド基を有するリン脂質であることを特徴とする請求項5に記載の複合体の製造方法。
【請求項8】
前記リン脂質が下記の化学式2で表されるリン脂質であることを特徴とする請求項5に記載の複合体の製造方法。
【化2】

(ただし、化学式2においてR1及びR2はCH3(CH2)16−である)
【図2】


【図3】


【図4】


【図5】


【図6】


【図7】


【図8】


【図9】


【図10】


【図11】


【図13】


【図14】


【図16】


【図17(b)】


【図19】


【図20】


【図21】


【図1】


【図12】


【図15】


【図17(a)】


【図18】


【図22】




【図3】


【図4】


【図5】


【図6】


【図7】


【図8】


【図9】


【図10】


【図11】


【図13】


【図14】


【図16】


【図17(b)】


【図19】


【図20】


【図21】


【図1】


【図12】


【図15】


【図17(a)】


【図18】


【図22】


【公開番号】特開2012−67295(P2012−67295A)
【公開日】平成24年4月5日(2012.4.5)
【国際特許分類】
【出願番号】特願2011−182967(P2011−182967)
【出願日】平成23年8月24日(2011.8.24)
【国等の委託研究の成果に係る記載事項】(出願人による申告)平成18年度、文部科学省、「先端融合領域イノベーション創出拠点の形成(高次生体イメージング先端テクノハブ)」に係わる委託研究、産業技術力強化法第19条の適用を受ける特許出願
【出願人】(000001007)キヤノン株式会社 (59,756)
【Fターム(参考)】
【公開日】平成24年4月5日(2012.4.5)
【国際特許分類】
【出願日】平成23年8月24日(2011.8.24)
【国等の委託研究の成果に係る記載事項】(出願人による申告)平成18年度、文部科学省、「先端融合領域イノベーション創出拠点の形成(高次生体イメージング先端テクノハブ)」に係わる委託研究、産業技術力強化法第19条の適用を受ける特許出願
【出願人】(000001007)キヤノン株式会社 (59,756)
【Fターム(参考)】
[ Back to top ]

