複合材料、発光素子、発光装置、電子機器、及び照明装置
【課題】有機化合物と無機化合物とを複合した複合材料であって、キャリア輸送性の高い複合材料を提供する。また、有機化合物へのキャリア注入性の高い複合材料を提供する。また、電荷移動相互作用による吸収が生じにくい複合材料を提供する。また、該複合材料を発光素子に適用することにより、発光効率の高い発光素子を提供する。また、駆動電圧の低い発光素子を提供する。また、長寿命の発光素子を提供する。
【解決手段】ジベンゾチオフェン骨格又はジベンゾフラン骨格を有する複素環化合物と、該複素環化合物に対して電子受容性を示す無機化合物とを含む複合材料を提供する。また、一対の電極間に発光物質を含む層を有し、該発光物質を含む層は、該複合材料を含む層を有する発光素子を提供する。
【解決手段】ジベンゾチオフェン骨格又はジベンゾフラン骨格を有する複素環化合物と、該複素環化合物に対して電子受容性を示す無機化合物とを含む複合材料を提供する。また、一対の電極間に発光物質を含む層を有し、該発光物質を含む層は、該複合材料を含む層を有する発光素子を提供する。
【発明の詳細な説明】
【技術分野】
【0001】
本発明は、有機化合物と無機化合物とを複合した複合材料、発光素子、発光装置、電子機器、及び照明装置に関する。
【背景技術】
【0002】
近年、有機エレクトロルミネッセンス(EL:Electroluminescence)を利用した発光素子の研究開発が盛んに行われている。これら発光素子の基本的な構成は、一対の電極間に発光性の有機化合物を含む層を挟んだものである。この素子に電圧を印加することにより、発光性の有機化合物からの発光を得ることができる。
【0003】
このような発光素子は自発光型であるため、液晶ディスプレイに比べ画素の視認性が高く、バックライトが不要である等の利点があり、フラットパネルディスプレイ素子として好適であると考えられている。また、このような発光素子は、薄型軽量に作製できることも大きな利点である。さらに非常に応答速度が速いことも特徴の一つである。
【0004】
また、これらの発光素子は膜状に形成することが可能であるため、大面積の素子を容易に形成することができる。このことは、白熱電球やLEDに代表される点光源、あるいは蛍光灯に代表される線光源では得難い特色であるため、照明等に応用できる面光源としての利用価値も高い。
【0005】
このように、有機ELを用いた発光素子は、発光装置や照明などへの応用が期待されている。一方で、有機ELを用いた発光素子には課題も多い。その課題の一つとして、消費電力の低減が挙げられる。消費電力を低減するためには、発光素子の駆動電圧を低減することが重要である。そして、有機ELを用いた発光素子は流れる電流量によって発光強度が決まるため、駆動電圧を低減するためには、低い電圧で多くの電流を流すことが必要となってくる。
【0006】
これまでに、駆動電圧を低減させるための手法として、バッファー層を電極と発光性の有機化合物を含む層との間に設けるという試みがなされている。例えば、カンファースルホン酸をドープしたポリアニリン(PANI)からなるバッファー層をインジウム錫酸化物(ITO:indium tin oxide)と発光層との間に設けることにより、駆動電圧を低減できることが知られている(例えば、非特許文献1参照)。これは、PANIの発光層へのキャリア注入性が優れているためと説明されている。なお、非特許文献1では、バッファー層であるPANIも電極の一部と見なしている。
【0007】
しかしながら、非特許文献1に記載してある通り、PANIは膜厚を厚くすると透過率が悪くなるという問題点がある。具体的には、250nm程度の膜厚で、透過率は70%を切ると報告されている。すなわち、バッファー層に用いている材料自体の透明性に問題があるため、素子内部で発生した光を効率良く取り出すことができない。
【0008】
また、特許文献1によれば、発光素子(特許文献1では発光ユニットと記載されている)を直列に接続することにより、ある電流密度当たりの輝度、すなわち電流効率を高めようという試みがなされている。特許文献1においては、発光素子を直列に接続する際の接続部分に、有機化合物と金属酸化物(具体的には酸化バナジウムおよび酸化レニウム)とを混合した層を適用しており、この層はホール(正孔)や電子を発光ユニットへ注入できるとされている。
【0009】
しかしながら、特許文献1で開示されている有機化合物と金属酸化物との混合層は、実施例を見てもわかる通り、赤外領域だけでなく可視光領域(500nm付近)にも大きな吸収ピークが見られ、やはり透明性に問題が生じている。これは、電荷移動相互作用により発生する吸収バンドの影響である。したがって、やはり素子内部で発生した光を効率良く取り出すことができず、素子の発光効率が低下する。
【先行技術文献】
【特許文献】
【0010】
【特許文献1】特開2003−272860号公報
【非特許文献】
【0011】
【非特許文献1】Y.Yang、他1名、アプライド フィジクス レターズ、Vol.64(10)、1245−1247(1994)
【発明の概要】
【発明が解決しようとする課題】
【0012】
そこで、本発明の一態様では、有機化合物と無機化合物とを複合した複合材料であって、キャリア輸送性の高い複合材料を提供することを課題の一とする。また、有機化合物へのキャリア注入性の高い複合材料を提供することを課題の一とする。また、電荷移動相互作用による光吸収が生じにくい複合材料を提供することを課題の一とする。
【0013】
また、本発明の一態様は、該複合材料を発光素子に適用することにより、発光効率の高い発光素子を提供することを課題の一とする。また、駆動電圧の低い発光素子を提供することを課題の一とする。また、長寿命の発光素子を提供することを課題の一とする。また、該発光素子を用いた発光装置、該発光装置を用いた電子機器、又は照明装置を提供することを課題の一とする。
【0014】
なお、以下に開示する発明は、上記課題の少なくともいずれか一つを解決することを目的とする。
【課題を解決するための手段】
【0015】
本発明の一態様は、ジベンゾチオフェン骨格又はジベンゾフラン骨格を有する複素環化合物と、該複素環化合物に対して電子受容性を示す無機化合物とを含む複合材料である。
【0016】
チオフェン及びフランは、π過剰系ヘテロ芳香環であるため、いずれもホール輸送性を示す。よって、上記複合材料は、キャリア輸送性が高い。
【0017】
また、上記複合材料は、有機化合物へのキャリア注入性が高い。また、電荷移動相互作用による光吸収が生じにくい。また、可視光に対する透光性(以下、透光性と記載する)が高い。
【0018】
また、本発明の一態様は、ジベンゾチオフェン骨格又はジベンゾフラン骨格の4位に炭素数6以上70以下の置換基が結合した複素環化合物と、該複素環化合物に対して電子受容性を示す無機化合物とを含む複合材料である。
【0019】
ジベンゾチオフェン骨格又はジベンゾフラン骨格の4位に置換基を有する複素環化合物を複合材料に用いることで、電荷移動相互作用に基づく光吸収の発生を抑制することができるため、好ましい。また、複合材料の膜質が安定化するため好ましい。
【0020】
上記複合材料において、該置換基が有する環は、ベンゼン環、ナフタレン環、フェナントレン環、トリフェニレン環、フルオレン環、ジベンゾチオフェン環、ジベンゾフラン環から選ばれる一種又は複数種であることが好ましい。これによって、電荷移動相互作用に基づく光吸収の発生を抑制するだけでなく、複素環化合物自体の吸収ピークが可視光領域(380nm〜760nm)よりも短波長側に生じるよう制御できるため、透光性が特に高い複合材料を得ることができる。
【0021】
特に、置換基が有する環は、ベンゼン環、フルオレン環、ジベンゾチオフェン環、ジベンゾフラン環から選ばれる一種又は複数種であることが好ましい。これによって、該無機化合物との間に、電荷移動相互作用に基づく光吸収がほとんど生じなくなる。
【0022】
また、本発明の一態様は、ジベンゾチオフェン骨格又はジベンゾフラン骨格の4位にフェニル基が結合し、フェニル基が1以上の置換基を有し、フェニル基及び1以上の置換基の炭素数の総和が12以上70以下である複素環化合物と、該複素環化合物に対して電子受容性を示す無機化合物とを含む複合材料である。
【0023】
ジベンゾチオフェン骨格又はジベンゾフラン骨格の4位に共役が小さいフェニル基が結合した複素環化合物を複合材料に用いることで、電荷移動相互作用に基づく光吸収の発生を抑制することができるため、好ましい。また、複合材料の膜質が安定化するため好ましい。また、共役が広がりにくくなるため、透光性向上の観点でも有効である。
【0024】
上記複合材料において、該1以上の置換基が有する環は、それぞれ独立に、ベンゼン環、ナフタレン環、フェナントレン環、トリフェニレン環、フルオレン環、ジベンゾチオフェン環、ジベンゾフラン環から選ばれる一種又は複数種であることが好ましい。これによって、電荷移動相互作用に基づく光吸収の発生を抑制するだけでなく、複素環化合物自体の吸収ピークが可視光領域よりも短波長側に生じるように制御できるため、特に透光性の高い複合材料を得ることができる。
【0025】
特に、該1以上の置換基が有する環は、それぞれ独立に、ベンゼン環、フルオレン環、ジベンゾチオフェン環、ジベンゾフラン環から選ばれる一種又は複数種であることが好ましい。これによって、該無機化合物との間に、電荷移動相互作用に基づく光吸収がほとんど生じなくなる。
【0026】
また、本発明の一態様は、一般式(G1)で表される複素環化合物と、該複素環化合物に対して電子受容性を示す無機化合物とを含む複合材料である。
【0027】
【化1】

【0028】
式中、Aは酸素又は硫黄を表し、R1〜R7は、それぞれ独立に、水素、炭素数1〜4のアルキル基、又は環を構成する炭素数が6〜25のアリール基を表し、R8〜R12は、それぞれ独立に、水素、置換もしくは無置換のフェニル基、置換もしくは無置換のナフチル基、置換もしくは無置換のフェナントリル基、置換もしくは無置換のトリフェニレニル基、置換もしくは無置換のフルオレニル基、置換もしくは無置換のジベンゾチオフェニル基、又は置換もしくは無置換のジベンゾフラニル基を表す。ただし、R8〜R12のうち、少なくとも1つは、置換もしくは無置換のフェニル基、置換もしくは無置換のナフチル基、置換もしくは無置換のフェナントリル基、置換もしくは無置換のトリフェニレニル基、置換もしくは無置換のフルオレニル基、置換もしくは無置換のジベンゾチオフェニル基、又は置換もしくは無置換のジベンゾフラニル基を表す。
【0029】
特に、R8〜R12は、それぞれ独立に、水素、置換もしくは無置換のフェニル基、置換もしくは無置換のフルオレニル基、置換もしくは無置換のジベンゾチオフェニル基、又は置換もしくは無置換のジベンゾフラニル基を表すことが好ましい。ただし、R8〜R12のうち、少なくとも1つは、置換もしくは無置換のフェニル基、置換もしくは無置換のフルオレニル基、置換もしくは無置換のジベンゾチオフェニル基、又は置換もしくは無置換のジベンゾフラニル基を表す。
【0030】
また、本発明の一態様は、ジベンゾチオフェン骨格又はジベンゾフラン骨格を有する複素環化合物と、遷移金属酸化物とを含む複合材料である。
【0031】
上記複合材料は、キャリア輸送性が高い。また、有機化合物へのキャリア注入性が高い。また、電荷移動相互作用による光吸収が生じにくい。また、透光性が高い。
【0032】
また、本発明の一態様は、ジベンゾチオフェン骨格又はジベンゾフラン骨格の4位に炭素数6以上70以下の置換基が結合した複素環化合物と、遷移金属酸化物とを含む複合材料である。
【0033】
ジベンゾチオフェン骨格又はジベンゾフラン骨格の4位に置換基を有する複素環化合物を複合材料に用いることで、電荷移動相互作用に基づく光吸収の発生を抑制することができるため、好ましい。また、複合材料の膜質が安定化するため好ましい。
【0034】
上記複合材料において、該置換基が有する環は、ベンゼン環、ナフタレン環、フェナントレン環、トリフェニレン環、フルオレン環、ジベンゾチオフェン環、ジベンゾフラン環から選ばれる一種又は複数種であることが好ましい。これによって、電荷移動相互作用に基づく光吸収の発生を抑制するだけでなく、複素環化合物自体の吸収ピークが可視光領域よりも短波長側に生じるよう制御できるため、特に透光性の高い複合材料を得ることができる。
【0035】
特に、該置換基が有する環は、ベンゼン環、フルオレン環、ジベンゾチオフェン環、ジベンゾフラン環から選ばれる一種又は複数種であることが好ましい。これによって、該遷移金属酸化物との間に、電荷移動相互作用に基づく光吸収がほとんど生じなくなる。
【0036】
また、本発明の一態様は、ジベンゾチオフェン骨格又はジベンゾフラン骨格の4位にフェニル基が結合し、フェニル基が1以上の置換基を有し、フェニル基及び1以上の置換基の炭素数の総和が12以上70以下である複素環化合物と、遷移金属酸化物とを含む複合材料である。
【0037】
ジベンゾチオフェン骨格又はジベンゾフラン骨格の4位に共役が小さいフェニル基が結合した複素環化合物を複合材料に用いることで、電荷移動相互作用に基づく光吸収の発生を抑制することができるため好ましい。また、複合材料の膜質が安定化するため好ましい。また、共役が広がりにくくなるため、透光性向上の観点でも有効である。
【0038】
上記複合材料において、該1以上の置換基が有する環は、それぞれ独立に、ベンゼン環、ナフタレン環、フェナントレン環、トリフェニレン環、フルオレン環、ジベンゾチオフェン環、ジベンゾフラン環から選ばれる一種又は複数種であることが好ましい。これによって、電荷移動相互作用に基づく光吸収の発生を抑制するだけでなく、複素環化合物自体の吸収ピークが可視光領域よりも短波長側に生じるよう制御できるため、特に透光性の高い複合材料を得ることができる。
【0039】
特に、該1以上の置換基が有する環は、それぞれ独立に、ベンゼン環、フルオレン環、ジベンゾチオフェン環、ジベンゾフラン環から選ばれる一種又は複数種であることが好ましい。これによって、該遷移金属酸化物との間に、電荷移動相互作用に基づく光吸収がほとんど生じなくなる。
【0040】
また、本発明の一態様は、一般式(G1)で表される複素環化合物と、遷移金属酸化物とを含む複合材料である。
【0041】
【化2】

【0042】
式中、Aは酸素又は硫黄を表し、R1〜R7は、それぞれ独立に、水素、炭素数1〜4のアルキル基、又は環を構成する炭素数が6〜25のアリール基を表し、R8〜R12は、それぞれ独立に、水素、置換もしくは無置換のフェニル基、置換もしくは無置換のナフチル基、置換もしくは無置換のフェナントリル基、置換もしくは無置換のトリフェニレニル基、置換もしくは無置換のフルオレニル基、置換もしくは無置換のジベンゾチオフェニル基、又は置換もしくは無置換のジベンゾフラニル基を表す。ただし、R8〜R12のうち、少なくとも1つは、置換もしくは無置換のフェニル基、置換もしくは無置換のナフチル基、置換もしくは無置換のフェナントリル基、置換もしくは無置換のトリフェニレニル基、置換もしくは無置換のフルオレニル基、置換もしくは無置換のジベンゾチオフェニル基、又は置換もしくは無置換のジベンゾフラニル基を表す。
【0043】
特に、R8〜R12は、それぞれ独立に、水素、置換もしくは無置換のフェニル基、置換もしくは無置換のフルオレニル基、置換もしくは無置換のジベンゾチオフェニル基、又は置換もしくは無置換のジベンゾフラニル基を表すことが好ましい。ただし、R8〜R12のうち、少なくとも1つは、置換もしくは無置換のフェニル基、置換もしくは無置換のフルオレニル基、置換もしくは無置換のジベンゾチオフェニル基、又は置換もしくは無置換のジベンゾフラニル基を表す。
【0044】
また、上記複合材料に含まれる遷移金属酸化物としては、チタン酸化物、バナジウム酸化物、モリブデン酸化物、タングステン酸化物、レニウム酸化物、ルテニウム酸化物、クロム酸化物、ジルコニウム酸化物、ハフニウム酸化物、タンタル酸化物、銀酸化物から選ばれる一種又は複数種であることが好ましい。
【0045】
上記複合材料に用いる複素環化合物の最高被占有軌道準位(HOMO準位)は、光電子分光法での測定値が−5.7eV以下であることが好ましい。
【0046】
また、本発明の一態様は、一対の電極間に発光物質を含む層(以下、EL層とも記す)を有し、発光物質を含む層は、上記複合材料を含む層を有する発光素子である。
【0047】
上記発光素子において、複合材料を含む層は、一対の電極のうち、陽極として機能する電極と接することが好ましい。また、複合材料を含む層は、一対の電極のうち、陰極として機能する電極と接することが好ましい。
【0048】
また、上記発光素子は、複合材料を含む層を2層有していても良く、該複合材料を含む層のうち、一方の層は、一対の電極のうち陽極として機能する電極と接し、他方の層は、陰極として機能する電極と接することが好ましい。
【0049】
また、本発明の一態様は、一対の電極間に発光物質を含む層を複数有し、複数の発光物質を含む層の間に、上記複合材料を含む層を有する発光素子である。すなわち、複数の発光ユニットを積層した構成の有機EL発光素子(タンデム型の有機EL発光素子)における中間層(電荷発生層とも記す)に、上記複合材料を用いることができる。
【0050】
また、本発明の一態様は、上記発光素子を有する発光装置である。また、該発光装置を表示部に有する電子機器である。また、該発光素子を発光部に有する照明装置である。
【発明の効果】
【0051】
本発明の一態様によれば、有機化合物と無機化合物とを複合した複合材料であって、キャリア輸送性の高い複合材料を提供することができる。また、有機化合物へのキャリア注入性の高い複合材料を提供することができる。また、電荷移動相互作用による光吸収が生じにくい複合材料を提供することができる。
【0052】
また、本発明の一態様によれば、該複合材料を発光素子に適用することにより、発光効率の高い発光素子を提供することができる。また、駆動電圧の低い発光素子を提供することができる。また、長寿命の発光素子を提供することができる。また、該発光素子を用いた発光装置、該発光装置を用いた電子機器、又は照明装置を提供することができる。
【図面の簡単な説明】
【0053】
【図1】本発明の一態様の発光素子を示す図。
【図2】本発明の一態様の発光素子を示す図。
【図3】本発明の一態様の発光装置を示す図。
【図4】本発明の一態様の発光装置を示す図。
【図5】本発明の一態様の電子機器を示す図。
【図6】本発明の一態様の照明装置を示す図。
【図7】本発明の一態様の複合材料の吸光度を示す図。
【図8】本発明の一態様の複合材料の吸光度を示す図。
【図9】本発明の一態様の複合材料の吸光度を示す図。
【図10】本発明の一態様の複合材料の吸光度を示す図。
【図11】本発明の一態様の複合材料の吸光度を示す図。
【図12】本発明の一態様の複合材料の吸光度を示す図。
【図13】本発明の一態様の複合材料の吸光度を示す図。
【図14】本発明の一態様の複合材料の吸光度を示す図。
【図15】本発明の一態様の複合材料の吸光度を示す図。
【図16】実施例の発光素子を示す図。
【図17】実施例2の発光素子の電圧−輝度特性を示す図。
【図18】実施例2の発光素子の輝度−電流効率特性を示す図。
【図19】実施例2の発光素子の信頼性試験の結果を示す図。
【図20】実施例3の発光素子の電圧−輝度特性を示す図。
【図21】実施例3の発光素子の輝度−電流効率特性を示す図。
【図22】実施例3の発光素子の信頼性試験の結果を示す図。
【図23】実施例4の発光素子の電圧−輝度特性を示す図。
【図24】実施例4の発光素子の輝度−電流効率特性を示す図。
【図25】本発明の一態様の複合材料の吸光度を示す図。
【図26】本発明の一態様の複合材料の吸光度を示す図。
【図27】本発明の一態様の複合材料の吸光度を示す図。
【図28】本発明の一態様の複合材料の吸光度を示す図。
【図29】本発明の一態様の複合材料の吸光度を示す図。
【図30】実施例6の発光素子の電圧−輝度特性を示す図。
【図31】実施例6の発光素子の輝度−電流効率特性を示す図。
【図32】実施例6の発光素子の信頼性試験の結果を示す図。
【図33】実施例7の発光素子の電圧−輝度特性を示す図。
【図34】実施例7の発光素子の輝度−電流効率特性を示す図。
【図35】実施例8の発光素子の電圧−輝度特性を示す図。
【図36】実施例8の発光素子の輝度−電流効率特性を示す図。
【図37】実施例9の発光素子の電圧−輝度特性を示す図。
【図38】実施例9の発光素子の輝度−電流効率特性を示す図。
【図39】PCzPAと、その複合材料の吸光度を示す図。
【図40】NPBと、その複合材料の吸光度を示す図。
【図41】実施例10のESR測定の結果に係る図。
【図42】実施例10のESR測定の結果に係る図。
【発明を実施するための形態】
【0054】
実施の形態について、図面を用いて詳細に説明する。但し、本発明は以下の説明に限定されず、本発明の趣旨及びその範囲から逸脱することなくその形態及び詳細を様々に変更し得ることは当業者であれば容易に理解される。従って、本発明は以下に示す実施の形態の記載内容に限定して解釈されるものではない。なお、以下に説明する発明の構成において、同一部分又は同様な機能を有する部分には同一の符号を異なる図面間で共通して用い、その繰り返しの説明は省略する。
【0055】
まず、本発明の背景となる技術と本発明との相違について、概要を説明する。特許文献1で示されているように、芳香族アミンと電子受容性の無機化合物が混合された複合材料は、電子受容性の無機化合物が芳香族アミンから電子を奪うことにより、芳香族アミンにホールが、無機化合物に電子が発生すると解釈されている。換言すれば、このような複合材料は、芳香族アミンと電子受容性の無機化合物とが電荷移動錯体を形成していると解釈される。そして、このような現象を利用して、これまでにキャリア輸送性、キャリア注入性に優れた複合材料がいくつか報告されている。
【0056】
しかしながらこのような場合、一般的には、電荷移動相互作用に基づく吸収バンドが発生することが知られている。この吸収バンドは深赤色〜近赤外領域に発生すると言われているが、実際には、多くの場合、可視光領域にも吸収バンドが生じる。例えば、4,4’−ビス[N−(1−ナフチル)−N−フェニルアミノ]ビフェニル(略称:NPB又はα−NPD)と酸化バナジウム、又はNPBと酸化モリブデンを混合した複合材料は、1300nm付近の吸収バンド以外に、500nm付近にも吸収バンドが生じる。このことは、発光素子のような光学デバイスにとっては大きなデメリットとなる。
【0057】
本発明者らは、ジベンゾフラン骨格もしくはジベンゾチオフェン骨格を含む複素環化合物と電子受容性を示す無機化合物、又は、該複素環化合物と遷移金属酸化物とを複合させることにより、電荷移動相互作用に基づく光吸収が確認できない(ほとんど発生しない)にも関わらず、優れたキャリア輸送性やキャリア注入性を発現できることを見出した。従来、電荷移動相互作用によって発生するホールおよび電子が、キャリア輸送性・キャリア注入性発現の要素と考えられていたわけであるから、電荷移動相互作用による光吸収が明確に観察されないにも関わらず優れたキャリア輸送性やキャリア注入性を発現できる本発明は、その一般論とは矛盾しており、予測不可能の驚くべき機能であると言える。
【0058】
さらに、ジベンゾチオフェンやジベンゾフランは、それ自体のエネルギーギャップが大きい。したがって、ジベンゾフラン骨格もしくはジベンゾチオフェン骨格を含むことで、該複素環化合物自体が可視光領域に吸収ピークを持たない化合物となるよう設計できる。したがって、透光性向上の観点で大きなメリットがある。
【0059】
また、ジベンゾチオフェンやジベンゾフランは、サイクリックボルタンメトリ(CV)測定によると、HOMO準位が−6eV以下と非常に低い。したがって、ジベンゾフラン骨格またはジベンゾチオフェン骨格を含む複素環化合物単体は、他の有機化合物への正孔注入性には優れていると考えられるが、AlやITOに代表されるような導電材料(仕事関数が3〜5eV程度)から正孔を受け取ることは困難であると考えられる。しかしながら、本発明の一態様のような複合材料を形成することにより、他の有機化合物への優れた正孔注入性を保ちつつ、電極からの正孔注入性の問題点を克服することができる。このような複合材料の性質は、発光素子に用いた際に、駆動電圧の低減に寄与する。また、透光性が高いことから、発光効率を高めることができる。さらには、深いHOMO準位により発光素子中にキャリアの蓄積を防止できると考えられるため、長寿命化を達成できる。
【0060】
以下では、本発明の態様について、具体例を列挙しながら説明する。
【0061】
(実施の形態1)
本実施の形態では、本発明の一態様の複合材料について説明する。
【0062】
本発明の一態様の複合材料は特定の骨格を有する有機化合物と無機化合物との複合材料である。本発明の一態様の複合材料の作製方法に限定は無く、例えば、当該有機化合物と無機化合物を同時に蒸着する共蒸着法により形成することができる。本発明の一態様の複合材料において、有機化合物と無機化合物の混合比は質量比で8:1〜1:2(=有機化合物:無機化合物)程度が好ましく、さらに望ましくは4:1〜1:1(=有機化合物:無機化合物)である。混合比は複合材料を共蒸着法によって形成する場合は、有機化合物と無機化合物の蒸着レートをそれぞれ調節することによって制御することができる。
【0063】
まず、本発明の一態様の複合材料に用いることが可能な有機化合物は、ジベンゾチオフェン骨格又はジベンゾフラン骨格を有する複素環化合物である。
【0064】
該複素環化合物を複合材料に用いることで、キャリア輸送性が高い材料とすることができる。また、有機化合物へのキャリア注入性が高い材料とすることができる。また、無機化合物との電荷移動相互作用による光吸収が生じにくい材料とすることができる。また、該複素環化合物を複合材料に用いることで、透光性が高い材料とすることができる。
【0065】
特に、ジベンゾチオフェン骨格又はジベンゾフラン骨格の4位に炭素数6以上70以下の置換基が結合した複素環化合物を用いることが好ましい。ジベンゾチオフェン骨格又はジベンゾフラン骨格の4位に置換基を有する複素環化合物を複合材料に用いることで、電荷移動相互作用に基づく光吸収の発生を抑制することができるためである。また、ジベンゾチオフェンやジベンゾフランが、4位にバルキーな(嵩高い)置換基(例えば炭素数が6以上)を有する場合、ジベンゾチオフェンやジベンゾフランと該置換基との立体障害により、分子全体が立体的な骨格となる。このことにより、複合材料の膜質が安定化する。また、該複合材料を作製する際には、該複素環化合物と無機化合物とを共蒸着することが好ましいが、この場合は該複素環化合物が気化しやすいことが望まれる。したがって、分子量の観点から、該置換基の炭素数は70以下であることが好ましい。なお、該複素環化合物の分子量としては、1200以下程度が好ましい。
【0066】
なお、本発明者らがこれまで実験及び検討を行ってきた結果では、芳香族炭化水素化合物(例えばアントラセン化合物)と、無機化合物とを混合した際、芳香族炭化水素化合物と無機化合物の混合比における無機化合物の比率が低い場合には、混合により形成される複合材料は結晶化しやすい。逆に、無機化合物の比率が高い場合には、結晶化は抑制できるものの、芳香族炭化水素化合物が有する骨格(例えばアントラセン骨格)と無機化合物との電荷移動相互作用に由来するわずかな吸収ピークが可視光領域で増大する。一方で、本発明の一態様に示すように、ジベンゾチオフェン骨格又はジベンゾフラン骨格の4位に置換基が結合した複素環化合物を用いる場合は、例えば該置換基にアントラセン骨格を含み、かつ無機化合物の比率が低い場合においても、複合材料の結晶化は抑制され、複合材料の膜質が安定化する。したがって、本発明の一態様の複合材料の場合には、複素環化合物がアントラセン骨格を含んでいたとしても、結晶化を抑制する目的で無機化合物の比率を高くする必要がなく、電荷移動相互作用に由来する吸収ピークが可視光領域に観測されることを防ぐことができる。
【0067】
また、本発明者らがこれまで実験及び検討を行ってきた結果では、アリールカルバゾール化合物と、無機化合物とを混合した際も、アリールカルバゾール化合物と無機化合物の混合比における無機化合物の比率が低い場合には、混合により形成される複合材料は結晶化しやすい。逆に、無機化合物の比率が高い場合には、結晶化は抑制できるものの、アリールカルバゾール骨格と無機化合物との電荷移動相互作用に由来するわずかな吸収ピークが可視光領域で増大する。一方で、本発明の一態様に示すように、ジベンゾチオフェン骨格又はジベンゾフラン骨格の4位に置換基が結合した複素環化合物を用いる場合は、例えば該置換基にアリールカルバゾール骨格を含み、かつ無機化合物の比率が低い場合においても、複合材料の結晶化は抑制され、複合材料の膜質が安定化する。したがって、本発明の一態様の複合材料の場合には、複素環化合物がアリールカルバゾール骨格を含んでいたとしても、結晶化を抑制する目的で無機化合物の比率を高くする必要がなく、電荷移動相互作用に由来する吸収ピークが可視光領域に観測されることを防ぐことができる。
【0068】
上記置換基が有する環は、ベンゼン環、ナフタレン環、フェナントレン環、トリフェニレン環、フルオレン環、ジベンゾチオフェン環、ジベンゾフラン環から選ばれる一種又は複数種であることが好ましい。これらの環は、いずれもキャリア輸送性(特に正孔輸送性)を発現するのに重要な共役環であるが、それと同時に、エネルギーギャップの広い共役環でもある。したがって、上記置換基が有する環がこれらの環のみであることで、電荷移動相互作用に基づく光吸収の発生を抑制するだけでなく、複素環化合物の吸収ピークが可視光領域よりも短波長側に生じるよう制御できるため、該複素環化合物を用いることで、透光性の高い複合材料を得ることができる。
【0069】
特に、上記置換基が有する環は、ベンゼン環、フルオレン環、ジベンゾチオフェン環、ジベンゾフラン環から選ばれる一種又は複数種であることが好ましい。これによって、無機化合物との間に、電荷移動相互作用に基づく光吸収がほとんど生じなくなることを本発明者らは見いだした。特に、複素環化合物と無機化合物の混合比において、無機化合物の比率を上げても、電荷移動相互作用による光吸収はほとんど生じない。具体的には、複素環化合物と無機化合物の混合比が質量比で4:1〜1:1(=複素環化合物:無機化合物)であっても、電荷移動相互作用に基づく光吸収がほとんど生じない。なお、無機化合物の濃度が高いと、複合材料の導電性が高くなるため好ましい。また、本発明者らは、電荷移動相互作用による光吸収がほとんど生じないにも関わらず、発光素子に用いた際には、良好なキャリア輸送性・キャリア注入性、信頼性を発現できることを見いだした。
【0070】
さらに、ジベンゾチオフェン骨格又はジベンゾフラン骨格の4位にフェニル基が結合し、フェニル基が1以上の置換基を有し、フェニル基及び1以上の置換基の炭素数の総和が12以上70以下である複素環化合物を用いることが好ましい。ジベンゾチオフェン骨格又はジベンゾフラン骨格の4位に共役が小さいフェニル基が結合した複素環化合物を複合材料に用いることで、電荷移動相互作用に基づく光吸収の発生を抑制することができるためである。また、フェニル基は共役が小さいため、フェニル基にさらに置換基を結合させて分子量を増大させたとしても、広いエネルギーギャップを保つことができ、透光性向上の観点でも有効である。さらに、ジベンゾチオフェンやジベンゾフランが、4位にバルキーな部位(例えば、上記のフェニル基を含めて炭素数の総和が12以上の骨格)を有する場合、ジベンゾチオフェンやジベンゾフランと該バルキーな部位との立体障害により、分子全体が立体的な骨格となる。このことにより、複合材料の膜質が安定化する。また、該複合材料を作製する際には、該複素環化合物と無機化合物とを共蒸着することが好ましいが、この場合は該複素環化合物が気化しやすいことが望まれる。したがって、分子量の観点から、該バルキーな部位は炭素数の総和が70以下であることが好ましい。なお、該複素環化合物の分子量としては、1200以下程度が好ましい。
【0071】
該1以上の置換基が有する環は、それぞれ独立に、ベンゼン環、ナフタレン環、フェナントレン環、トリフェニレン環、フルオレン環、ジベンゾチオフェン環、ジベンゾフラン環から選ばれる一種又は複数種であることが好ましい。これらの環は、いずれもキャリア輸送性(特に正孔輸送性)を発現するのに重要な共役環であるが、それに加えて、エネルギーギャップの広い共役環でもある。したがって、置換基が有する環がこれらの環のみであることで、電荷移動相互作用に基づく光吸収の発生を抑制するだけでなく、複素環化合物の吸収ピークが可視光領域よりも短波長側に生じるように制御できるため、該複素環化合物を用いることで、透光性の高い複合材料を得ることができる。
【0072】
特に、上記1以上の置換基が有する環は、それぞれ独立に、ベンゼン環、フルオレン環、ジベンゾチオフェン環、ジベンゾフラン環から選ばれる一種又は複数種であることが好ましい。これによって、無機化合物との間に、電荷移動相互作用に基づく光吸収がほとんど生じなくなることを、本発明者らは見出した。特に、複素環化合物と無機化合物の混合比において、無機化合物の比率を上げても、電荷移動相互作用による光吸収はほとんど生じない。具体的には、複素環化合物と無機化合物の混合比が質量比で4:1〜1:1(=複素環化合物:無機化合物)であっても、電荷移動相互作用に基づく光吸収がほとんど生じない。なお、無機化合物の濃度が高いと、複合材料の導電性が高くなるため好ましい。また、本発明者らは、電荷移動相互作用による光吸収がほとんど生じないにも関わらず、発光素子に用いた際には、良好なキャリア輸送性・キャリア注入性、信頼性を発現できることを見いだした。
【0073】
また、本発明の一態様の複合材料に用いることができる有機化合物は、一般式(G1)で表される複素環化合物である。
【0074】
【化3】

【0075】
一般式(G1)中、Aは酸素又は硫黄を表し、R1〜R7は、それぞれ独立に、水素、炭素数1〜4のアルキル基、又は環を構成する炭素数が6〜25のアリール基を表し、R8〜R12は、それぞれ独立に、水素、置換もしくは無置換のフェニル基、置換もしくは無置換のナフチル基、置換もしくは無置換のフェナントリル基、置換もしくは無置換のトリフェニレニル基、置換もしくは無置換のフルオレニル基、置換もしくは無置換のジベンゾチオフェニル基、又は置換もしくは無置換のジベンゾフラニル基を表す。ただし、R8〜R12のうち、少なくとも1つは、置換もしくは無置換のフェニル基、置換もしくは無置換のナフチル基、置換もしくは無置換のフェナントリル基、置換もしくは無置換のトリフェニレニル基、置換もしくは無置換のフルオレニル基、置換もしくは無置換のジベンゾチオフェニル基、又は置換もしくは無置換のジベンゾフラニル基を表す。
【0076】
特に、R8〜R12は、それぞれ独立に、水素、置換もしくは無置換のフェニル基、置換もしくは無置換のフルオレニル基、置換もしくは無置換のジベンゾチオフェニル基、又は置換もしくは無置換のジベンゾフラニル基を表すことが好ましい。ただし、R8〜R12のうち、少なくとも1つは、置換もしくは無置換のフェニル基、置換もしくは無置換のフルオレニル基、置換もしくは無置換のジベンゾチオフェニル基、又は置換もしくは無置換のジベンゾフラニル基を表す。
【0077】
以下の構造式(100)〜(128)に本発明の一態様の複合材料に用いることが可能な有機化合物の一例を示す。
【0078】
【化4】

【0079】
【化5】

【0080】
【化6】

【0081】
【化7】

【0082】
続いて、本発明の一態様の複合材料に用いることが可能な無機化合物について説明する。
【0083】
本発明の一態様の複合材料に用いる複素環化合物に対して電子受容性を示す無機化合物を用いることができる。例えば、塩化鉄(III)や塩化アルミニウムなどは、電子受容性が高い無機化合物の一例である。
【0084】
または、本発明の一態様の複合材料には、無機化合物として遷移金属酸化物を用いることができる。好ましくは元素周期表における4〜8族に属する金属の酸化物が望ましい。特にチタン酸化物、バナジウム酸化物、タンタル酸化物、モリブデン酸化物、タングステン酸化物、レニウム酸化物、ルテニウム酸化物、クロム酸化物、ジルコニウム酸化物、ハフニウム酸化物、銀酸化物が好ましい。この中でもモリブデン酸化物は蒸着がしやすく、吸湿性が低く、安定であることから特に扱いやすい材料である。
【0085】
遷移金属酸化物は、上述した塩化鉄(III)等の強力なルイス酸に比べれば、電子受容性はそれほど高くない(反応性は低い)と考えられる。また、上述した通り、本発明の一態様である複合材料においては、電荷移動相互作用に基づく光吸収の発生が抑制される(あるいはほとんど発生しない)。これらのことから、本発明において、遷移金属酸化物は一般的な意味合いでの電子受容体として作用しているという証明はし難い。しかしながら一方で、実施例で後述するように、実験的には、電界を印加した際には複素環化合物単体では流せないほどの電流を流せる事実がある。したがって、本発明の一態様である複合材料において遷移金属酸化物を用いた場合、少なくとも電界印加のアシストにより容易にキャリアが発生しているものと考えられる。したがって本明細書では、少なくとも電界印加のアシストによりキャリアが発生していれば、複合材料中の無機化合物(上述のような遷移金属酸化物など)は電子受容性を有するものとして扱う。
【0086】
以上に述べた本発明の一態様の複合材料に含まれる複素環化合物のHOMO準位は、光電子分光法での測定値が−5.7eV以下であることが好ましい。上述したとおり、ジベンゾチオフェンやジベンゾフランは、CV測定によると、HOMO準位が−6eV以下と非常に低い。したがって、ジベンゾフラン骨格またはジベンゾチオフェン骨格を含む複素環化合物単体も、HOMO準位を−5.7eV以下という低い値をとることが容易である。
【0087】
複素環化合物が低いHOMO準位を有する場合、他の有機化合物への正孔注入性には優れていると考えられるが、AlやITOに代表されるような導電材料(仕事関数が3〜5eV程度)から正孔を受け取ることは困難であると考えられる。しかしながら、本発明の一態様のような複合材料を形成することにより、他の有機化合物への優れた正孔注入性を保ちつつ、電極からの正孔注入性の問題点を克服することができる。このような複合材料の性質は、発光素子に用いた際に、駆動電圧の低減に寄与する。また、透光性が高いことから、発光効率を高めることができる。さらには、深いHOMO準位によりキャリアの蓄積を防止できるため、長寿命化を達成できる。
【0088】
以上で述べたように、本発明の一態様の複合材料は、HOMO準位が低く、キャリア輸送性が高い材料である。また、本発明の一態様の複合材料は、有機化合物へのキャリア注入性に優れた材料である。また、本発明の一態様の複合材料は、電荷移動相互作用に基づく光吸収が生じにくい材料である。
【0089】
したがって、本発明の一態様の複合材料は、発光素子や、光電変換素子、トランジスタ等の半導体素子に用いることが可能である。
【0090】
また、本発明の一態様の複合材料は、キャリア輸送性および有機化合物へのキャリア注入性に優れることから、発光素子等に用いることで、駆動電圧を低下させることができる。
【0091】
また、本発明の一態様の複合材料が透光性を有することから、発光素子等に用いることで、高い発光効率を実現できる。
【0092】
また、本発明の一態様の複合材料は電荷の蓄積を抑制することから、発光素子等に用いることで、長寿命の素子を作製することができる。
【0093】
なお、本実施の形態は、他の実施の形態と適宜組み合わせることが可能である。
【0094】
(実施の形態2)
本実施の形態では、本発明の一態様の発光素子について図1を用いて説明する。
【0095】
本実施の形態の発光素子は、一対の電極間にEL層(発光物質を含む層)を挟持して形成される。EL層は、少なくとも、実施の形態1で示した本発明の一態様の複合材料を含む層と、発光層とを有する。さらに、EL層は、そのほかの層を有していても良い。例えば、電極から離れたところに発光領域が形成されるように、つまり電極から離れた部位でキャリアの再結合が行われるように、キャリア注入性の高い物質やキャリア輸送性の高い物質からなる層を備えていても良い。本明細書では、キャリア注入性の高い物質やキャリア輸送性の高い物質からなる層をキャリアの注入、輸送などの機能を有する、機能層ともよぶ。機能層としては、正孔注入層、正孔輸送層、電子注入層、電子輸送層などを用いることができる。なお、本実施の形態において、本発明の一態様の複合材料を含む層は、正孔注入層として用いる。
【0096】
また、本発明の一態様の複合材料を含む層と、発光層との間に、一層以上の層(正孔輸送層など)を設ける事が好ましい。そのことで、発光層で生じた励起エネルギーが、該複合材料を含む層へ伝わることでの消光(効率低下)を抑制でき、より高効率な素子を得ることができる。
【0097】
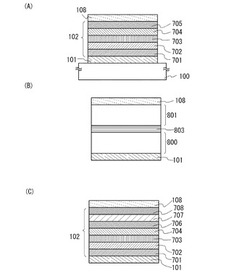
図1に示す発光素子は、第1の電極101及び第2の電極108の一対の電極間にEL層102が設けられている。EL層102は、第1の電極101上に正孔注入層701、正孔輸送層702、発光層703、電子輸送層704、電子注入層705の順で積層されている。なお、本実施の形態に示す発光素子において、第1の電極101は陽極として機能し、第2の電極108は陰極として機能する。
【0098】
発光素子の支持体(図1(A)の基板100参照)としては、例えばガラス基板、石英基板、又はプラスチック基板などを用いることができる。また可撓性基板を用いてもよい。可撓性基板とは、曲げることができる(フレキシブル)基板のことであり、例えば、ポリカーボネート、ポリアリレート、ポリエーテルスルフォンからなるプラスチック基板等が挙げられる。また、フィルム(ポリプロピレン、ポリエステル、ビニル、ポリフッ化ビニル、塩化ビニル等からなる)、無機蒸着フィルムなどを用いることもできる。なお、発光素子の支持体として機能するものであれば、これら以外のものでもよい。
【0099】
第1の電極101としては、様々な金属、合金、導電性化合物、及びこれらの混合物などを用いることができる。例えば、酸化インジウム−酸化スズ(ITO:Indium Tin Oxide)、珪素若しくは酸化珪素を含有した酸化インジウム−酸化スズ、酸化インジウム−酸化亜鉛(Indium Zinc Oxide)、酸化タングステン及び酸化亜鉛を含有した酸化インジウム(IWZO)等が挙げられる。これらの導電性金属酸化物膜は、通常スパッタにより成膜されるが、ゾル−ゲル法などを応用して作製しても構わない。例えば、酸化インジウム−酸化亜鉛膜は、酸化インジウムに対し1〜20wt%の酸化亜鉛を加えたターゲットを用いてスパッタリング法により形成することができる。また、IWZO膜は、酸化インジウムに対し酸化タングステンを0.5〜5wt%、酸化亜鉛を0.1〜1wt%含有したターゲットを用いてスパッタリング法により形成することができる。この他、金、白金、ニッケル、タングステン、クロム、モリブデン、鉄、コバルト、銅、パラジウム、又は金属材料の窒化物(例えば、窒化チタン)等が挙げられる。
【0100】
第1の電極101の材料としては、仕事関数の大きい(仕事関数が4.0eV以上)材料を用いることが好ましい。なお、第1の電極101と、本発明の一態様の複合材料を含む層とが接する構成の発光素子については、第1の電極101に用いる材料は、仕事関数の大きい材料に限定されず、仕事関数の小さい材料を用いることもできる。例えば、アルミニウム、銀、アルミニウムを含む合金(例えば、Al−Si)等を用いることもできる。
【0101】
正孔注入層701は、本発明の一態様の複合材料を含む層である。
【0102】
本発明の一態様の複合材料に用いる複素環化合物(実施の形態1参照)はHOMO準位が低く、正孔輸送層702及び発光層703への正孔注入性が良好である。一方、第1の電極101との間に注入障壁が生じ、第1の電極101から正孔が注入されにくい。
【0103】
しかし、本発明の一態様の発光素子は、正孔注入層701に、本発明の一態様の複合材料(該複素環化合物と、該複素環化合物に対して電子受容性を示す無機化合物とを含む材料)を用いるため、第1の電極101と正孔注入層701との間の注入障壁を緩和することができる。したがって、第1の電極101から発光層703までの注入障壁が小さく、キャリア注入性の高い素子の実現が可能となり、駆動電圧の低い発光素子を提供することができる。
【0104】
さらに、本発明の一態様の複合材料はキャリアの発生効率が高く、キャリア輸送性が高い。そのため、本発明の一態様の複合材料を用いることで、発光効率の高い発光素子を実現することができる。
【0105】
また、該複素環化合物は、可視光領域に大きな吸収ピークが生じない。さらに、該複素環化合物は、HOMO準位が低く、該無機化合物との間に、電荷移動相互作用に基づく光吸収が生じにくい。したがって、本発明の一態様の複合材料は、可視光領域に吸収ピークが生じにくく、高い透光性を有する。よって、このことからも、本発明の一態様の複合材料を用いることで、発光効率の高い発光素子を実現することができると言える。
【0106】
また、本発明の一態様の複合材料は、電荷の蓄積を抑制できるため、長寿命の発光素子を提供することができる。
【0107】
正孔輸送層702は、正孔輸送性の高い物質を含む層である。正孔輸送層702の材料として、本発明の一態様の複合材料に用いる複素環化合物を用いても良い。そのほか、正孔輸送性の高い物質としては、例えば、4,4’−ビス[N−(1−ナフチル)−N−フェニルアミノ]ビフェニル(略称:NPB又はα−NPD)、N,N’−ビス(3−メチルフェニル)−N,N’−ジフェニル−[1,1’−ビフェニル]−4,4’−ジアミン(略称:TPD)、4−フェニル−4’−(9−フェニルフルオレン−9−イル)トリフェニルアミン(略称:BPAFLP)、4,4’−ビス[N−(9,9−ジメチルフルオレン−2−イル)−N−フェニルアミノ]ビフェニル(略称:DFLDPBi)、4,4’−ビス[N−(スピロ−9,9’−ビフルオレン−2−イル)−N―フェニルアミノ]ビフェニル(略称:BSPB)等の芳香族アミン化合物を用いることができる。ここに述べた物質は、主に10−6cm2/Vs以上の正孔移動度を有する物質である。但し、電子よりも正孔の輸送性の高い物質であれば、これら以外のものを用いてもよい。なお、正孔輸送性の高い物質を含む層は、単層のものだけでなく、上記物質からなる層が二層以上積層したものとしてもよい。
【0108】
また、正孔輸送層702には、4,4’−ジ(N−カルバゾリル)ビフェニル(略称:CBP)、9−[4−(10−フェニル−9−アントリル)フェニル]−9H−カルバゾール(略称:CzPA)、9−フェニル−3−[4−(10−フェニル−9−アントリル)フェニル]−9H−カルバゾール(略称:PCzPA)のようなカルバゾール誘導体や、2−tert−ブチル−9,10−ジ(2−ナフチル)アントラセン(略称:t−BuDNA)、9,10−ジ(2−ナフチル)アントラセン(略称:DNA)、9,10−ジフェニルアントラセン(略称:DPAnth)のようなアントラセン誘導体を用いても良い。
【0109】
特に、本発明の一態様である複合材料における複素環化合物は、低いHOMO準位を有するため、正孔輸送層にも低いHOMO準位を有する材料を適用することができる。このような構成とすることにより、発光層と正孔輸送層との界面における電荷の蓄積を防ぐことができ、発光素子を長寿命化できる。具体的には、正孔輸送層のHOMO準位は−5.6eV以下であることが好ましい。また、このような観点から、正孔輸送層に用いる化合物としては、カルバゾール誘導体、ジベンゾチオフェン誘導体、ジベンゾフラン誘導体、アントラセン誘導体などが好ましい。
【0110】
なお、正孔輸送層702には、ポリ(N−ビニルカルバゾール)(略称:PVK)、ポリ(4−ビニルトリフェニルアミン)(略称:PVTPA)、ポリ[N−(4−{N’−[4−(4−ジフェニルアミノ)フェニル]フェニル−N’−フェニルアミノ}フェニル)メタクリルアミド](略称:PTPDMA)、ポリ[N,N’−ビス(4−ブチルフェニル)−N,N’−ビス(フェニル)ベンジジン](略称:Poly−TPD)などの高分子化合物を用いることもできる。
【0111】
発光層703は、発光性の有機化合物を含む層である。発光性の有機化合物としては、例えば、蛍光を発光する蛍光性化合物や燐光を発光する燐光性化合物を用いることができる。
【0112】
発光層703に用いることができる蛍光性化合物としては、例えば、青色系の発光材料として、N,N’−ビス[4−(9H−カルバゾール−9−イル)フェニル]−N,N’−ジフェニルスチルベン−4,4’−ジアミン(略称:YGA2S)、4−(9H−カルバゾール−9−イル)−4’−(10−フェニル−9−アントリル)トリフェニルアミン(略称:YGAPA)、4−(10−フェニル−9−アントリル)−4’−(9−フェニル−9H−カルバゾール−3−イル)トリフェニルアミン(略称:PCBAPA)などが挙げられる。また、緑色系の発光材料として、N−(9,10−ジフェニル−2−アントリル)−N,9−ジフェニル−9H−カルバゾール−3−アミン(略称:2PCAPA)、N−[9,10−ビス(1,1’−ビフェニル−2−イル)−2−アントリル]−N,9−ジフェニル−9H−カルバゾール−3−アミン(略称:2PCABPhA)、N−(9,10−ジフェニル−2−アントリル)−N,N’,N’−トリフェニル−1,4−フェニレンジアミン(略称:2DPAPA)、N−[9,10−ビス(1,1’−ビフェニル−2−イル)−2−アントリル]−N,N’,N’−トリフェニル−1,4−フェニレンジアミン(略称:2DPABPhA)、N−[9,10−ビス(1,1’−ビフェニル−2−イル)]−N−[4−(9H−カルバゾール−9−イル)フェニル]−N−フェニルアントラセン−2−アミン(略称:2YGABPhA)、N,N,9−トリフェニルアントラセン−9−アミン(略称:DPhAPhA)などが挙げられる。また、黄色系の発光材料として、ルブレン、5,12−ビス(1,1’−ビフェニル−4−イル)−6,11−ジフェニルテトラセン(略称:BPT)などが挙げられる。また、赤色系の発光材料として、N,N,N’,N’−テトラキス(4−メチルフェニル)テトラセン−5,11−ジアミン(略称:p−mPhTD)、7,14−ジフェニル−N,N,N’,N’−テトラキス(4−メチルフェニル)アセナフト[1,2−a]フルオランテン−3,10−ジアミン(略称:p−mPhAFD)などが挙げられる。
【0113】
また、発光層703に用いることができる燐光性化合物としては、例えば、青色系の発光材料として、ビス[2−(4’,6’−ジフルオロフェニル)ピリジナト−N,C2’]イリジウム(III)テトラキス(1−ピラゾリル)ボラート(略称:FIr6)、ビス[2−(4’,6’−ジフルオロフェニル)ピリジナト−N,C2’]イリジウム(III)ピコリナート(略称:FIrpic)、ビス{2−[3’,5’−ビス(トリフルオロメチル)フェニル]ピリジナト−N,C2’}イリジウム(III)ピコリナート(略称:Ir(CF3ppy)2(pic))、ビス[2−(4’,6’−ジフルオロフェニル)ピリジナト−N,C2’]イリジウム(III)アセチルアセトナート(略称:FIr(acac))などが挙げられる。また、緑色系の発光材料として、トリス(2−フェニルピリジナト−N,C2’)イリジウム(III)(略称:Ir(ppy)3)、ビス(2−フェニルピリジナト−N,C2’)イリジウム(III)アセチルアセトナート(略称:Ir(ppy)2(acac))、ビス(1,2−ジフェニル−1H−ベンゾイミダゾラト)イリジウム(III)アセチルアセトナート(略称:Ir(pbi)2(acac))、ビス(ベンゾ[h]キノリナト)イリジウム(III)アセチルアセトナート(略称:Ir(bzq)2(acac))、トリス(ベンゾ[h]キノリナト)イリジウム(III)(略称:Ir(bzq)3)などが挙げられる。また、黄色系の発光材料として、ビス(2,4−ジフェニル−1,3−オキサゾラト−N,C2’)イリジウム(III)アセチルアセトナート(略称:Ir(dpo)2(acac))、ビス[2−(4’−パーフルオロフェニルフェニル)ピリジナト]イリジウム(III)アセチルアセトナート(略称:Ir(p−PF−ph)2(acac))、ビス(2−フェニルベンゾチアゾラト−N,C2’)イリジウム(III)アセチルアセトナート(略称:Ir(bt)2(acac))、(アセチルアセトナト)ビス[2,3−ビス(4−フルオロフェニル)−5−メチルピラジナト]イリジウム(III)(略称:Ir(Fdppr−Me)2(acac))、(アセチルアセトナト)ビス{2−(4−メトキシフェニル)−3,5−ジメチルピラジナト}イリジウム(III)(略称:Ir(dmmoppr)2(acac))などが挙げられる。また、橙色系の発光材料として、トリス(2−フェニルキノリナト−N,C2’)イリジウム(III)(略称:Ir(pq)3)、ビス(2−フェニルキノリナト−N,C2’)イリジウム(III)アセチルアセトナート(略称:Ir(pq)2(acac))、(アセチルアセトナト)ビス(3,5−ジメチル−2−フェニルピラジナト)イリジウム(III)(略称:Ir(mppr−Me)2(acac))、(アセチルアセトナト)ビス(5−イソプロピル−3−メチル−2−フェニルピラジナト)イリジウム(III)(略称:Ir(mppr−iPr)2(acac))などが挙げられる。また、赤色系の発光材料として、ビス[2−(2’−ベンゾ[4,5−α]チエニル)ピリジナト−N,C3’]イリジウム(III)アセチルアセトナート(略称:Ir(btp)2(acac))、ビス(1−フェニルイソキノリナト−N,C2’)イリジウム(III)アセチルアセトナート(略称:Ir(piq)2(acac))、(アセチルアセトナト)ビス[2,3−ビス(4−フルオロフェニル)キノキサリナト]イリジウム(III)(略称:Ir(Fdpq)2(acac))、(アセチルアセトナト)ビス(2,3,5−トリフェニルピラジナト)イリジウム(III)(略称:Ir(tppr)2(acac))、(ジピバロイルメタナト)ビス(2,3,5−トリフェニルピラジナト)イリジウム(III)(略称:Ir(tppr)2(dpm))、2,3,7,8,12,13,17,18−オクタエチル−21H,23H−ポルフィリン白金(II)(略称:PtOEP)等の有機金属錯体が挙げられる。また、トリス(アセチルアセトナト)(モノフェナントロリン)テルビウム(III)(略称:Tb(acac)3(Phen))、トリス(1,3−ジフェニル−1,3−プロパンジオナト)(モノフェナントロリン)ユーロピウム(III)(略称:Eu(DBM)3(Phen))、トリス[1−(2−テノイル)−3,3,3−トリフルオロアセトナト](モノフェナントロリン)ユーロピウム(III)(略称:Eu(TTA)3(Phen))等の希土類金属錯体は、希土類金属イオンからの発光(異なる多重度間の電子遷移)であるため、燐光性化合物として用いることができる。
【0114】
なお、発光層703としては、上述した発光性の有機化合物(ゲスト材料)を他の物質(ホスト材料)に分散させた構成としてもよい。ホスト材料としては、各種のものを用いることができ、発光性の物質よりも最低空軌道準位(LUMO準位)が高く、HOMO準位が低い物質を用いることが好ましい。
【0115】
ホスト材料としては、具体的には、トリス(8−キノリノラト)アルミニウム(III)(略称:Alq)、トリス(4−メチル−8−キノリノラト)アルミニウム(III)(略称:Almq3)、ビス(10−ヒドロキシベンゾ[h]キノリナト)ベリリウム(II)(略称:BeBq2)、ビス(2−メチル−8−キノリノラト)(4−フェニルフェノラト)アルミニウム(III)(略称:BAlq)、ビス(8−キノリノラト)亜鉛(II)(略称:Znq)、ビス[2−(2−ベンゾオキサゾリル)フェノラト]亜鉛(II)(略称:ZnPBO)、ビス[2−(2−ベンゾチアゾリル)フェノラト]亜鉛(II)(略称:ZnBTZ)などの金属錯体、2−(4−ビフェニリル)−5−(4−tert−ブチルフェニル)−1,3,4−オキサジアゾール(略称:PBD)、1,3−ビス[5−(p−tert−ブチルフェニル)−1,3,4−オキサジアゾール−2−イル]ベンゼン(略称:OXD−7)、3−(4−ビフェニリル)−4−フェニル−5−(4−tert−ブチルフェニル)−1,2,4−トリアゾール(略称:TAZ)、2,2’,2’’−(1,3,5−ベンゼントリイル)トリス(1−フェニル−1H−ベンゾイミダゾール)(略称:TPBI)、バソフェナントロリン(略称:BPhen)、バソキュプロイン(略称:BCP)などの複素環化合物や、9−[4−(10−フェニル−9−アントリル)フェニル]−9H−カルバゾール(略称:CzPA)、3,6−ジフェニル−9−[4−(10−フェニル−9−アントリル)フェニル]−9H−カルバゾール(略称:DPCzPA)、9,10−ビス(3,5−ジフェニルフェニル)アントラセン(略称:DPPA)、9,10−ジ(2−ナフチル)アントラセン(略称:DNA)、2−tert−ブチル−9,10−ジ(2−ナフチル)アントラセン(略称:t−BuDNA)、9,9’−ビアントリル(略称:BANT)、9,9’−(スチルベン−3,3’−ジイル)ジフェナントレン(略称:DPNS)、9,9’−(スチルベン−4,4’−ジイル)ジフェナントレン(略称:DPNS2)、3,3’,3’’−(ベンゼン−1,3,5−トリイル)トリピレン(略称:TPB3)、9,10−ジフェニルアントラセン(略称:DPAnth)、6,12−ジメトキシ−5,11−ジフェニルクリセンなどの縮合芳香族化合物、N,N−ジフェニル−9−[4−(10−フェニル−9−アントリル)フェニル]−9H−カルバゾール−3−アミン(略称:CzA1PA)、4−(10−フェニル−9−アントリル)トリフェニルアミン(略称:DPhPA)、N,9−ジフェニル−N−[4−(10−フェニル−9−アントリル)フェニル]−9H−カルバゾール−3−アミン(略称:PCAPA)、N,9−ジフェニル−N−{4−[4−(10−フェニル−9−アントリル)フェニル]フェニル}−9H−カルバゾール−3−アミン(略称:PCAPBA)、N−(9,10−ジフェニル−2−アントリル)−N,9−ジフェニル−9H−カルバゾール−3−アミン(略称:2PCAPA)、NPB(又はα−NPD)、TPD、DFLDPBi、BSPBなどの芳香族アミン化合物などを用いることができる。
【0116】
また、ホスト材料は複数種用いることができる。例えば、結晶化を抑制するためにルブレン等の結晶化を抑制する物質をさらに添加してもよい。また、ゲスト材料へのエネルギー移動をより効率良く行うためにNPB、あるいはAlq等をさらに添加してもよい。
【0117】
ゲスト材料をホスト材料に分散させた構成とすることにより、発光層703の結晶化を抑制することができる。また、ゲスト材料の濃度が高いことによる濃度消光を抑制することができる。
【0118】
また、発光層703として高分子化合物を用いることができる。具体的には、青色系の発光材料として、ポリ(9,9−ジオクチルフルオレン−2,7−ジイル)(略称:PFO)、ポリ[(9,9−ジオクチルフルオレン−2,7−ジイル)−co−(2,5−ジメトキシベンゼン−1,4−ジイル)](略称:PF−DMOP)、ポリ{(9,9−ジオクチルフルオレン−2,7−ジイル)−co−[N,N’−ジ−(p−ブチルフェニル)−1,4−ジアミノベンゼン]}(略称:TAB−PFH)などが挙げられる。また、緑色系の発光材料として、ポリ(p−フェニレンビニレン)(略称:PPV)、ポリ[(9,9−ジヘキシルフルオレン−2,7−ジイル)−alt−co−(ベンゾ[2,1,3]チアジアゾール−4,7−ジイル)](略称:PFBT)、ポリ[(9,9−ジオクチル−2,7−ジビニレンフルオレニレン)−alt−co−(2−メトキシ−5−(2−エチルヘキシロキシ)−1,4−フェニレン)]などが挙げられる。また、橙色〜赤色系の発光材料として、ポリ[2−メトキシ−5−(2’−エチルヘキソキシ)−1,4−フェニレンビニレン](略称:MEH−PPV)、ポリ(3−ブチルチオフェン−2,5−ジイル)(略称:R4−PAT)、ポリ{[9,9−ジヘキシル−2,7−ビス(1−シアノビニレン)フルオレニレン]−alt−co−[2,5−ビス(N,N’−ジフェニルアミノ)−1,4−フェニレン]}、ポリ{[2−メトキシ−5−(2−エチルヘキシロキシ)−1,4−ビス(1−シアノビニレンフェニレン)]−alt−co−[2,5−ビス(N,N’−ジフェニルアミノ)−1,4−フェニレン]}(略称:CN−PPV−DPD)などが挙げられる。
【0119】
また、複数の発光層を設け、それぞれの発光層の発光色を異なるものにすることで、発光素子全体として、所望の色の発光を得ることができる。例えば、2つの発光層を有する発光素子において、第1の発光層の発光色と第2の発光層の発光色を補色の関係になるようにすることで、発光素子全体として白色発光する発光素子を得ることも可能である。なお、補色とは、混合すると無彩色になる色同士の関係をいう。つまり、補色の関係にある色を発光する物質から得られた光を混合すると、白色発光を得ることができる。また、3つ以上の発光層を有する発光素子の場合でも同様である。
【0120】
電子輸送層704は、電子輸送性の高い物質を含む層である。電子輸送性の高い物質としては、例えば、トリス(8−キノリノラト)アルミニウム(略称:Alq)、トリス(4−メチル−8−キノリノラト)アルミニウム(略称:Almq3)、ビス(10−ヒドロキシベンゾ[h]キノリナト)ベリリウム(略称:BeBq2)、ビス(2−メチル−8−キノリノラト)(4−フェニルフェノラト)アルミニウム(略称:BAlq)など、キノリン骨格又はベンゾキノリン骨格を有する金属錯体等が挙げられる。また、この他ビス[2−(2−ヒドロキシフェニル)ベンゾオキサゾラト]亜鉛(略称:Zn(BOX)2)、ビス[2−(2−ヒドロキシフェニル)ベンゾチアゾラト]亜鉛(略称:Zn(BTZ)2)などのオキサゾール系、チアゾール系配位子を有する金属錯体なども用いることができる。さらに、金属錯体以外にも、2−(4−ビフェニリル)−5−(4−tert−ブチルフェニル)−1,3,4−オキサジアゾール(略称:PBD)や、1,3−ビス[5−(p−tert−ブチルフェニル)−1,3,4−オキサジアゾール−2−イル]ベンゼン(略称:OXD−7)、3−(4−ビフェニリル)−4−フェニル−5−(4−tert−ブチルフェニル)−1,2,4−トリアゾール(略称:TAZ)、バソフェナントロリン(略称:BPhen)、バソキュプロイン(略称:BCP)なども用いることができる。ここに述べた物質は、主に10−6cm2/Vs以上の電子移動度を有する物質である。また、電子輸送層は、単層のものだけでなく、上記物質からなる層が二層以上積層したものとしてもよい。
【0121】
電子注入層705は、電子注入性の高い物質を含む層である。電子注入層705には、リチウム、セシウム、カルシウム、フッ化リチウム、フッ化セシウム、フッ化カルシウム、リチウム酸化物等のようなアルカリ金属、アルカリ土類金属、又はそれらの化合物を用いることができる。また、フッ化エルビウムのような希土類金属化合物を用いることができる。また、上述した電子輸送層704を構成する物質を用いることもできる。
【0122】
なお、上述した正孔注入層701、正孔輸送層702、発光層703、電子輸送層704、電子注入層705は、それぞれ、蒸着法(真空蒸着法を含む)、インクジェット法、塗布法等の方法で形成することができる。
【0123】
図2(A)に示す発光素子は、基板100上において、第1の電極101及び第2の電極108の一対の電極間に、EL層102が設けられている。EL層102は、正孔注入層701、正孔輸送層702、発光層703、電子輸送層704、電子注入層705を有している。図2(A)における発光素子は、基板100上に、陰極として機能する第2の電極108と、第2の電極108上に順に積層した電子注入層705、電子輸送層704、発光層703、正孔輸送層702、正孔注入層701と、さらにその上に設けられた陽極として機能する第1の電極101から構成されている。
【0124】
また、それぞれのEL層の発光色を異なるものにすることで、発光素子全体として、所望の色の発光を得ることができる。例えば、2つのEL層を有する発光素子において、第1のEL層の発光色と第2のEL層の発光色を補色の関係になるようにすることで、発光素子全体として白色発光する発光素子を得ることも可能である。また、3つ以上のEL層を有する発光素子の場合でも同様である。
【0125】
EL層は、図1(B)に示すように、第1の電極101と第2の電極108との間に複数積層されていても良い。この場合、積層された第1のEL層800と第2のEL層801との間には、電荷発生層803を設けることが好ましい。電荷発生層803は本発明の一態様の複合材料を用いて形成することができる。本発明の一態様の複合材料は、電圧印加時におけるキャリアの発生効率が高く、正孔輸送性が高い。そのため、本発明の一態様の複合材料を用いることで、駆動電圧の低い発光素子を実現することができる。また、発光効率の高い発光素子を実現することができる。
【0126】
また、該複素環化合物は、吸収ピークが可視光領域に生じにくい。また、該複素環化合物はHOMO準位が低く、該無機化合物との間に、電荷移動相互作用に基づく光吸収が生じにくい、したがって、本発明の一態様の複合材料は、可視光領域に吸収ピークが生じにくく、高い透光性を有する。よって、このことからも、本発明の一態様の複合材料を用いることで、発光効率の高い発光素子を実現することができると言える。
【0127】
また、電荷発生層803は本発明の一態様の複合材料からなる層と他の材料からなる層との積層構造でもよい。この場合、他の材料からなる層としては、電子供与性物質と電子輸送性の高い物質とを含む層や、透明導電膜からなる層などを用いることができる。このような構成を有する発光素子は、エネルギーの移動や消光などの問題が起こり難く、材料の選択の幅が広がることで高い発光効率と長い寿命とを併せ持つ発光素子とすることが容易である。また、一方のEL層で燐光発光、他方で蛍光発光を得ることも容易である。この構造は上述のEL層の構造と組み合わせて用いることができる。
【0128】
同様に、図2(B)に示すように、3つ以上のEL層802を積層した発光素子も適用することが可能である。本実施の形態に係る発光素子のように、一対の電極間に、電荷発生層を挟んで複数のEL層を配置することで、電流密度を低く保ったまま、高輝度で発光する長寿命素子を実現できる。
【0129】
EL層は、図1(C)に示すように、第1の電極101と第2の電極108との間に、正孔注入層701、正孔輸送層702、発光層703、電子輸送層704、電子注入バッファー層706、電子リレー層707、及び第2の電極108と接する複合材料層708を有していても良い。
【0130】
第2の電極108と接する複合材料層708を設けることで、特にスパッタリング法を用いて第2の電極108を形成する際に、EL層102が受けるダメージを低減することができるため、好ましい。複合材料層708は、本発明の一態様の複合材料を用いることができる。
【0131】
さらに、電子注入バッファー層706を設けることで、複合材料層708と電子輸送層704との間の注入障壁を緩和することができるため、複合材料層708で生じた電子を電子輸送層704に容易に注入することができる。
【0132】
電子注入バッファー層706には、アルカリ金属、アルカリ土類金属、希土類金属、およびこれらの化合物(アルカリ金属化合物(酸化リチウム等の酸化物、ハロゲン化物、炭酸リチウムや炭酸セシウム等の炭酸塩を含む)、アルカリ土類金属化合物(酸化物、ハロゲン化物、炭酸塩を含む)、又は希土類金属の化合物(酸化物、ハロゲン化物、炭酸塩を含む))等の電子注入性の高い物質を用いることが可能である。
【0133】
また、電子注入バッファー層706が、電子輸送性の高い物質とドナー性物質を含んで形成される場合には、電子輸送性の高い物質に対して質量比で、0.001以上0.1以下の比率でドナー性物質を添加することが好ましい。なお、ドナー性物質としては、アルカリ金属、アルカリ土類金属、希土類金属、およびこれらの化合物(アルカリ金属化合物(酸化リチウム等の酸化物、ハロゲン化物、炭酸リチウムや炭酸セシウム等の炭酸塩を含む)、アルカリ土類金属化合物(酸化物、ハロゲン化物、炭酸塩を含む)、又は希土類金属の化合物(酸化物、ハロゲン化物、炭酸塩を含む))の他、テトラチアナフタセン(略称:TTN)、ニッケロセン、デカメチルニッケロセン等の有機化合物を用いることもできる。なお、電子輸送性の高い物質としては、先に説明した電子輸送層704の材料と同様の材料を用いて形成することができる。
【0134】
さらに、電子注入バッファー層706と複合材料層708との間に、電子リレー層707を形成することが好ましい。電子リレー層707は、必ずしも設ける必要は無いが、電子輸送性の高い電子リレー層707を設けることで、電子注入バッファー層706へ電子を速やかに送ることが可能となる。
【0135】
複合材料層708と電子注入バッファー層706との間に電子リレー層707が挟まれた構造は、複合材料層708に含まれるアクセプター性物質と、電子注入バッファー層706に含まれるドナー性物質とが相互作用を受けにくく、互いの機能を阻害しにくい構造である。したがって、駆動電圧の上昇を抑制することができる。
【0136】
電子リレー層707は、電子輸送性の高い物質を含み、該電子輸送性の高い物質のLUMO準位は、複合材料層708に含まれるアクセプター性物質のLUMO準位と、電子輸送層704に含まれる電子輸送性の高い物質のLUMO準位との間となるように形成する。また、電子リレー層707がドナー性物質を含む場合には、当該ドナー性物質のドナー準位も複合材料層708に含まれるアクセプター性物質のLUMO準位と、電子輸送層704に含まれる電子輸送性の高い物質のLUMO準位との間となるようにする。具体的なエネルギー準位の数値としては、電子リレー層707に含まれる電子輸送性の高い物質のLUMO準位は−5.0eV以上、好ましくは−5.0eV以上−3.0eV以下とするとよい。
【0137】
電子リレー層707に含まれる電子輸送性の高い物質としてはフタロシアニン系の材料又は金属−酸素結合と芳香族配位子を有する金属錯体を用いることが好ましい。
【0138】
電子リレー層707に含まれるフタロシアニン系材料としては、CuPc、SnPc(Phthalocyanine tin(II) complex)、ZnPc(Phthalocyanine zinc complex)、CoPc(Cobalt(II)phthalocyanine, β−form)、FePc(Phthalocyanine Iron)及びPhO−VOPc(Vanadyl 2,9,16,23−tetraphenoxy−29H,31H−phthalocyanine)のいずれかを用いることが好ましい。
【0139】
電子リレー層707に含まれる金属−酸素結合と芳香族配位子を有する金属錯体としては、金属−酸素の二重結合を有する金属錯体を用いることが好ましい。金属−酸素の二重結合はアクセプター性(電子を受容しやすい性質)を有するため、電子の移動(授受)がより容易になる。また、金属−酸素の二重結合を有する金属錯体は安定であると考えられる。したがって、金属−酸素の二重結合を有する金属錯体を用いることにより発光素子を低電圧でより安定に駆動することが可能になる。
【0140】
金属−酸素結合と芳香族配位子を有する金属錯体としてはフタロシアニン系材料が好ましい。具体的には、VOPc(Vanadyl phthalocyanine)、SnOPc(Phthalocyanine tin(IV) oxide complex)及びTiOPc(Phthalocyanine titanium oxide complex)のいずれかは、分子構造的に金属−酸素の二重結合が他の分子に対して作用しやすく、アクセプター性が高いため好ましい。
【0141】
なお、上述したフタロシアニン系材料としては、フェノキシ基を有するものが好ましい。具体的にはPhO−VOPcのような、フェノキシ基を有するフタロシアニン誘導体が好ましい。フェノキシ基を有するフタロシアニン誘導体は、溶媒に可溶である。そのため、発光素子を形成する上で扱いやすいという利点を有する。また、溶媒に可溶であるため、成膜に用いる装置のメンテナンスが容易になるという利点を有する。
【0142】
電子リレー層707はさらにドナー性物質を含んでいても良い。ドナー性物質としては、アルカリ金属、アルカリ土類金属、希土類金属及びこれらの化合物(アルカリ金属化合物(酸化リチウムなどの酸化物、ハロゲン化物、炭酸リチウムや炭酸セシウムなどの炭酸塩を含む)、アルカリ土類金属化合物(酸化物、ハロゲン化物、炭酸塩を含む)、又は希土類金属の化合物(酸化物、ハロゲン化物、炭酸塩を含む))の他、テトラチアナフタセン(略称:TTN)、ニッケロセン、デカメチルニッケロセンなどの有機化合物を用いることができる。電子リレー層707にこれらドナー性物質を含ませることによって、電子の移動が容易となり、発光素子をより低電圧で駆動することが可能になる。
【0143】
電子リレー層707にドナー性物質を含ませる場合、電子輸送性の高い物質としては上記した材料の他、複合材料層708に含まれるアクセプター性物質のアクセプター準位より高いLUMO準位を有する物質を用いることができる。具体的なエネルギー準位としては、−5.0eV以上、好ましくは−5.0eV以上−3.0eV以下の範囲にLUMO準位を有する物質を用いることが好ましい。このような物質としては例えば、ペリレン誘導体や、含窒素縮合芳香族化合物などが挙げられる。なお、含窒素縮合芳香族化合物は、安定であるため、電子リレー層707を形成する為に用いる材料として、好ましい材料である。
【0144】
ペリレン誘導体の具体例としては、3,4,9,10−ペリレンテトラカルボン酸二無水物(略称:PTCDA)、3,4,9,10−ペリレンテトラカルボキシリックビスベンゾイミダゾール(略称:PTCBI)、N,N’−ジオクチル−3,4,9,10−ペリレンテトラカルボン酸ジイミド(略称:PTCDI−C8H)、N,N’−ジヘキシル−3,4,9,10−ペリレンテトラカルボン酸ジイミド(略称:Hex PTC)等が挙げられる。
【0145】
また、含窒素縮合芳香族化合物の具体例としては、ピラジノ[2,3−f][1,10]フェナントロリン−2,3−ジカルボニトリル(略称:PPDN)、2,3,6,7,10,11−ヘキサシアノ−1,4,5,8,9,12−ヘキサアザトリフェニレン(略称:HAT(CN)6)、2,3−ジフェニルピリド[2,3−b]ピラジン(略称:2PYPR)、2,3−ビス(4−フルオロフェニル)ピリド[2,3−b]ピラジン(略称:F2PYPR)等が挙げられる。
【0146】
その他にも、7,7,8,8−テトラシアノキノジメタン(略称:TCNQ)、1,4,5,8−ナフタレンテトラカルボン酸二無水物(略称:NTCDA)、パーフルオロペンタセン、銅ヘキサデカフルオロフタロシアニン(略称:F16CuPc)、N,N’−ビス(2,2,3,3,4,4,5,5,6,6,7,7,8,8,8−ペンタデカフルオロオクチル)−1,4,5,8−ナフタレンテトラカルボン酸ジイミド(略称:NTCDI−C8F)、3’,4’−ジブチル−5,5’’−ビス(ジシアノメチレン)−5,5’’−ジヒドロ−2,2’:5’,2’’−テルチオフェン)(略称:DCMT)、メタノフラーレン(例えば、[6,6]−フェニルC61酪酸メチルエステル)等を用いることができる。
【0147】
なお、電子リレー層707にドナー性物質を含ませる場合、電子輸送性の高い物質とドナー性物質との共蒸着などの方法によって電子リレー層707を形成すれば良い。
【0148】
正孔注入層701、正孔輸送層702、発光層703、及び電子輸送層704は前述の材料を用いてそれぞれ形成すれば良い。
【0149】
なお、本実施の形態は、他の実施の形態と適宜組み合わせることが可能である。
【0150】
(実施の形態3)
本実施の形態では、本発明の一態様の、発光素子を有する発光装置について図3を用いて説明する。なお、図3(A)は、発光装置を示す上面図、図3(B)は図3(A)をA−B及びC−Dで切断した断面図である。
【0151】
図3(A)において、点線で示された401は駆動回路部(ソース側駆動回路)、402は画素部、403は駆動回路部(ゲート側駆動回路)である。また、404は封止基板、405はシール材であり、シール材405で囲まれた内側は、空間になっている。
【0152】
なお、引き回し配線408はソース側駆動回路401及びゲート側駆動回路403に入力される信号を伝送するための配線であり、外部入力端子となるFPC(フレキシブルプリントサーキット)409からビデオ信号、クロック信号、スタート信号、リセット信号等を受け取る。なお、ここではFPCしか図示されていないが、このFPCにはプリント配線基板(PWB)が取り付けられていても良い。本明細書における発光装置には、発光装置本体だけでなく、それにFPC又はPWBが取り付けられた状態をも含むものとする。
【0153】
次に、断面構造について図3(B)を用いて説明する。素子基板410上には駆動回路部及び画素部が形成されているが、ここでは、駆動回路部であるソース側駆動回路401と、画素部402中の一つの画素が示されている。
【0154】
なお、ソース側駆動回路401はnチャネル型TFT423とpチャネル型TFT424とを組み合わせたCMOS回路が形成される。また、駆動回路は、TFTで形成される種々のCMOS回路、PMOS回路又はNMOS回路で形成しても良い。また、本実施の形態では、基板上に駆動回路を形成したドライバ一体型を示すが、必ずしもその必要はなく、駆動回路を基板上ではなく外部に形成することもできる。
【0155】
また、画素部402はスイッチング用TFT411と、電流制御用TFT412とそのドレインに電気的に接続された第1の電極413とを含む複数の画素により形成される。なお、第1の電極413の端部を覆って絶縁物414が形成されている。ここでは、ポジ型の感光性アクリル樹脂膜を用いることにより形成する。
【0156】
また、被覆性を良好なものとするため、絶縁物414の上端部又は下端部に曲率を有する曲面が形成されるようにする。例えば、絶縁物414の材料としてポジ型の感光性アクリルを用いた場合、絶縁物414の上端部のみに曲率半径(0.2μm〜3μm)を有する曲面を持たせることが好ましい。また、絶縁物414として、光の照射によってエッチャントに不溶解性となるネガ型、或いは光の照射によってエッチャントに溶解性となるポジ型のいずれも使用することができる。
【0157】
第1の電極413上には、EL層416、及び第2の電極417がそれぞれ形成されている。ここで、陽極として機能する第1の電極413に用いる材料としては、仕事関数の大きい材料を用いることが望ましい。例えば、ITO膜、又は珪素を含有したインジウム錫酸化物膜、2〜20wt%の酸化亜鉛を含む酸化インジウム膜、窒化チタン膜、クロム膜、タングステン膜、Zn膜、Pt膜などの単層膜の他、窒化チタン膜とアルミニウムを主成分とする膜との積層、窒化チタン膜とアルミニウムを主成分とする膜と窒化チタン膜との3層構造等を用いることができる。なお、積層構造とすると、配線としての抵抗も低く、良好なオーミックコンタクトがとれる。
【0158】
また、EL層416は、蒸着マスクを用いた蒸着法、インクジェット法などの液滴吐出法、印刷法、スピンコート法等の種々の方法によって形成される。EL層416は、実施の形態1で示した複合材料を含んでいる。また、EL層416を構成する他の材料としては、低分子材料、オリゴマー、デンドリマー、又は高分子材料であっても良い。
【0159】
さらに、EL層416上に形成され、陰極として機能する第2の電極417に用いる材料としては、仕事関数の小さい材料(Al、Mg、Li、Ca、又はこれらの合金や化合物、Mg−Ag、Mg−In、Al−Li等)を用いることが好ましい。なお、EL層416で生じた光が第2の電極417を透過するためには、第2の電極417として、膜厚を薄くした金属薄膜と、透明導電膜(ITO、2〜20wt%の酸化亜鉛を含む酸化インジウム、珪素若しくは酸化珪素を含有した酸化インジウム−酸化スズ、酸化亜鉛等)との積層を用いるのが良い。
【0160】
さらにシール材405で封止基板404を素子基板410と貼り合わせることにより、素子基板410、封止基板404、及びシール材405で囲まれた空間407に発光素子418が備えられた構造になっている。なお、空間407には、充填材が充填されており、不活性気体(窒素やアルゴン等)が充填される場合の他、シール材405で充填される場合もある。
【0161】
なお、シール材405にはエポキシ系樹脂を用いるのが好ましい。また、これらの材料はできるだけ水分や酸素を透過しない材料であることが望ましい。また、封止基板404に用いる材料としてガラス基板や石英基板の他、FRP(Fiberglass−Reinforced Plastics)、PVF(ポリビニルフロライド)、ポリエステル又はアクリル等からなるプラスチック基板を用いることができる。
【0162】
以上のようにして、本発明の一態様の発光素子を有するアクティブマトリクス型の発光装置を得ることができる。
【0163】
また、本発明の発光素子は、上述したアクティブマトリクス型の発光装置のみならずパッシブマトリクス型の発光装置に用いることもできる。図4に本発明の発光素子を用いたパッシブマトリクス型の発光装置の斜視図及び断面図を示す。なお、図4(A)は、発光装置を示す斜視図、図4(B)は図4(A)をX−Yで切断した断面図である。
【0164】
図4において、基板501上の第1の電極502と第2の電極503との間にはEL層504が設けられている。第1の電極502の端部は絶縁層505で覆われている。そして、絶縁層505上には隔壁層506が設けられている。隔壁層506の側壁は、基板面に近くなるに伴って、一方の側壁と他方の側壁との間隔が狭くなるような傾斜を有する。つまり、隔壁層506の短辺方向の断面は、台形状であり、底辺(絶縁層505と接する辺)の方が上辺(絶縁層505と接しない辺)よりも短い。このように、隔壁層506を設けることで、クロストーク等に起因した発光素子の不良を防ぐことができる。
【0165】
以上により、本発明の一態様の発光素子を有するパッシブマトリクス型の発光装置を得ることができる。
【0166】
なお、本実施の形態で示した発光装置(アクティブマトリクス型、パッシブマトリクス型)は、いずれも本発明の一態様の発光素子を用いて形成されることから、消費電力の低い発光装置を得ることができる。
【0167】
なお、本実施の形態は、他の実施の形態と適宜組み合わせることが可能である。
【0168】
(実施の形態4)
本実施の形態では、本発明を適用した一態様である発光装置を用いて完成させた様々な電子機器および照明器具の一例について、図5、図6を用いて説明する。
【0169】
発光装置を適用した電子機器として、例えば、テレビジョン装置(テレビ、又はテレビジョン受信機ともいう)、コンピュータ用などのモニタ、デジタルカメラ、デジタルビデオカメラ、デジタルフォトフレーム、携帯電話機(携帯電話、携帯電話装置ともいう)、携帯型ゲーム機、携帯情報端末、音響再生装置、パチンコ機などの大型ゲーム機などが挙げられる。これらの電子機器および照明器具の具体例を図5に示す。
【0170】
図5(A)は、テレビジョン装置の一例を示している。テレビジョン装置7100は、筐体7101に表示部7103が組み込まれている。表示部7103により、映像を表示することが可能であり、発光装置を表示部7103に用いることができる。また、ここでは、スタンド7105により筐体7101を支持した構成を示している。
【0171】
テレビジョン装置7100の操作は、筐体7101が備える操作スイッチや、別体のリモコン操作機7110により行うことができる。リモコン操作機7110が備える操作キー7109により、チャンネルや音量の操作を行うことができ、表示部7103に表示される映像を操作することができる。また、リモコン操作機7110に、当該リモコン操作機7110から出力する情報を表示する表示部7107を設ける構成としてもよい。
【0172】
なお、テレビジョン装置7100は、受信機やモデムなどを備えた構成とする。受信機により一般のテレビ放送の受信を行うことができ、さらにモデムを介して有線又は無線による通信ネットワークに接続することにより、一方向(送信者から受信者)又は双方向(送信者と受信者間、あるいは受信者間同士など)の情報通信を行うことも可能である。
【0173】
図5(B)はコンピュータであり、本体7201、筐体7202、表示部7203、キーボード7204、外部接続ポート7205、ポインティングデバイス7206等を含む。なお、コンピュータは、発光装置をその表示部7203に用いることにより作製される。
【0174】
図5(C)は携帯型遊技機であり、筐体7301と筐体7302の2つの筐体で構成されており、連結部7303により、開閉可能に連結されている。筐体7301には表示部7304が組み込まれ、筐体7302には表示部7305が組み込まれている。また、図5(C)に示す携帯型遊技機は、その他、スピーカ部7306、記録媒体挿入部7307、LEDランプ7308、入力手段(操作キー7309、接続端子7310、センサ7311(力、変位、位置、速度、加速度、角速度、回転数、距離、光、液、磁気、温度、化学物質、音声、時間、硬度、電場、電流、電圧、電力、放射線、流量、湿度、傾度、振動、におい又は赤外線を測定する機能を含むもの)、マイクロフォン7312)等を備えている。もちろん、携帯型遊技機の構成は上述のものに限定されず、少なくとも表示部7304および表示部7305の両方、又は一方に発光装置を用いていればよく、その他付属設備が適宜設けられた構成とすることができる。図5(C)に示す携帯型遊技機は、記録媒体に記録されているプログラム又はデータを読み出して表示部に表示する機能や、他の携帯型遊技機と無線通信を行って情報を共有する機能を有する。なお、図5(C)に示す携帯型遊技機が有する機能はこれに限定されず、様々な機能を有することができる。
【0175】
図5(D)は、携帯電話機の一例を示している。携帯電話機7400は、筐体7401に組み込まれた表示部7402の他、操作ボタン7403、外部接続ポート7404、スピーカ7405、マイク7406などを備えている。なお、携帯電話機7400は、発光装置を表示部7402に用いることにより作製される。
【0176】
図5(D)に示す携帯電話機7400は、表示部7402を指などで触れることで、情報を入力することができる。また、電話を掛ける、或いはメールを作成するなどの操作は、表示部7402を指などで触れることにより行うことができる。
【0177】
表示部7402の画面は主として3つのモードがある。第1は、画像の表示を主とする表示モードであり、第2は、文字等の情報の入力を主とする入力モードである。第3は表示モードと入力モードの2つのモードが混合した表示+入力モードである。
【0178】
例えば、電話を掛ける、或いはメールを作成する場合は、表示部7402を文字の入力を主とする文字入力モードとし、画面に表示させた文字の入力操作を行えばよい。この場合、表示部7402の画面のほとんどにキーボード又は番号ボタンを表示させることが好ましい。
【0179】
また、携帯電話機7400内部に、ジャイロ、加速度センサ等の傾きを検出するセンサを有する検出装置を設けることで、携帯電話機7400の向き(縦か横か)を判断して、表示部7402の画面表示を自動的に切り替えるようにすることができる。
【0180】
また、画面モードの切り替えは、表示部7402を触れること、又は筐体7401の操作ボタン7403の操作により行われる。また、表示部7402に表示される画像の種類によって切り替えるようにすることもできる。例えば、表示部に表示する画像信号が動画のデータであれば表示モード、テキストデータであれば入力モードに切り替える。
【0181】
また、入力モードにおいて、表示部7402の光センサで検出される信号を検知し、表示部7402のタッチ操作による入力が一定期間ない場合には、画面のモードを入力モードから表示モードに切り替えるように制御してもよい。
【0182】
表示部7402は、イメージセンサとして機能させることもできる。例えば、表示部7402に掌や指で触れ、掌紋、指紋等を撮像することで、本人認証を行うことができる。また、表示部に近赤外光を発光するバックライト又は近赤外光を発光するセンシング用光源を用いれば、指静脈、掌静脈などを撮像することもできる。
【0183】
図5(E)は卓上照明器具であり、照明部7501、傘7502、可変アーム7503、支柱7504、台7505、電源7506を含む。なお、卓上照明器具は、発光装置を照明部7501に用いることにより作製される。なお、照明器具には天井固定型の照明器具又は壁掛け型の照明器具なども含まれる。
【0184】
図6は、発光装置を、室内の照明装置811として用いた例である。発光装置は大面積化も可能であるため、大面積の照明装置として用いることができる。その他、ロール型の照明装置812として用いることもできる。なお、図6に示すように、室内の照明装置811を備えた部屋で、図5(E)で説明した卓上照明器具813を併用してもよい。
【0185】
以上のようにして、発光装置を適用して電子機器や照明器具を得ることができる。発光装置の適用範囲は極めて広く、あらゆる分野の電子機器に適用することが可能である。
【0186】
なお、本実施の形態に示す構成は、実施の形態1乃至実施の形態3に示した構成を適宜組み合わせて用いることができる。
【実施例1】
【0187】
本実施例では、本発明の一態様の複合材料の具体例を例示する。本発明の一態様の複合材料は、ジベンゾチオフェン骨格又はジベンゾフラン骨格を有する複素環化合物と、該複素環化合物に対して電子受容性を示す無機化合物とを含む。本実施例の構成例1〜9に用いた複素環化合物、及び該複素環化合物のHOMO準位(光電子分光法での測定値)を表1に示す。また、該複素環化合物の構造式を以下に示す。
【0188】
【表1】

【0189】
【化8】

【0190】
また、構成例1〜9において、無機化合物としては、酸化モリブデンを用いた。
【0191】
本発明の一態様の複合材料の作製方法について、構成例1を例に挙げて説明する。構成例2〜9は、構成例1と同様に作製したため、説明を省略する。
【0192】
(構成例1)
まず、ガラス基板を真空蒸着装置内の基板ホルダーに固定する。そして、4−[4−(9−フェニル−9H−フルオレン−9−イル)フェニル]−6−フェニルジベンゾチオフェン(略称:DBTFLP−IV)と酸化モリブデン(VI)とをそれぞれ別の抵抗加熱式の蒸発源に入れ、真空に引いた状態で、共蒸着法によりDBTFLP−IVと酸化モリブデンとを含む膜を形成した。この時、DBTFLP−IVと酸化モリブデン(VI)の比率が質量比で4:2(=DBTFLP−IV:酸化モリブデン)、4:1、4:0.5となるようにそれぞれ共蒸着した。なお、膜厚は50nmとした。
【0193】
このようにして成膜したDBTFLP−IVと酸化モリブデンの複合膜(構成例1)の吸収スペクトルを測定した結果を、図7に示す。また、比較のため、DBTFLP−IVのみの膜(膜厚50nm)の吸収スペクトルも合わせて図示する。なお、構成例2〜9も、それぞれの構成例で用いた複素環化合物のみの膜の吸収スペクトルを比較として示す。
【0194】
同様に、1,3,5−トリ(ジベンゾチオフェン−4−イル)−ベンゼン(略称:DBT3P−II)と酸化モリブデンの複合膜(構成例2)の吸収スペクトルを測定した結果を図8に示す。なお、膜厚はすべて50nmとした。
【0195】
また、4,4’−(ビフェニル−2,2’−ジイル)−ビス−ジベンゾチオフェン(略称:oDBTBP−II)と酸化モリブデンの複合膜(構成例3)の吸収スペクトルを測定した結果を図9に示す。なお、oDBTBP−IIと酸化モリブデン(VI)の比率が質量比で4:1(=oDBTBP−II:酸化モリブデン)の膜のみ、膜厚は47nmであった。そのほかの膜の膜厚は50nmとした。
【0196】
また、2,8−ジフェニル−4−[4−(9−フェニル−9H−フルオレン−9−イル)フェニル]ジベンゾチオフェン(略称:DBTFLP−III)と酸化モリブデンの複合膜(構成例4)の吸収スペクトルを測定した結果を図10に示す。なお、膜厚はすべて50nmとした。
【0197】
また、4−[3−(トリフェニレン−2−イル)フェニル]ジベンゾチオフェン(略称:mDBTPTp−II)と酸化モリブデンの複合膜(構成例5)の吸収スペクトルを測定した結果を図11に示す。なお、膜厚はすべて50nmとした。
【0198】
また、3,6−ジ−(ジベンゾチオフェン−4−イル)−9−フェニル−9H−カルバゾール(略称:DBT2PC−II)と酸化モリブデンの複合膜(構成例6)の吸収スペクトルを測定した結果を図12に示す。なお、膜厚はすべて50nmとした。
【0199】
また、4−[3−(9,10−ジフェニル−2−アントリル)フェニル]ジベンゾチオフェン(略称:2mDBTPPA−II)と酸化モリブデンの複合膜(構成例7)の吸収スペクトルを測定した結果を図13に示す。なお、膜厚はすべて50nmとした。
【0200】
また、4−[3−(9,10−ジフェニル−2−アントリル)フェニル]ジベンゾフラン(略称:2mDBFPPA−II)と酸化モリブデンの複合膜(構成例8)の吸収スペクトルを測定した結果を図14に示す。なお、膜厚はすべて50nmとした。
【0201】
そして、4−[4−(9−フェニルアントラセン−10−イル)フェニル]ジベンゾチオフェン(略称:mDBTPA−II)と酸化モリブデンの複合膜(構成例9)の吸収スペクトルを測定した結果を図15に示す。なお、膜厚はすべて50nmとした。
【0202】
図7乃至図15において、横軸は波長(nm)を、縦軸は吸光度(単位なし)を表す。
【0203】
図7乃至図15より、構成例1〜9に示す本発明の一態様の複合材料は、可視光領域に顕著な吸収ピークがほとんど見られず、透光性の高い材料であることが分かった。構成例7〜9は、アントラセン骨格を有する。本発明の一態様の複合材料は、アントラセン骨格、テトラセン骨格、ペリレン骨格などを含む複素環化合物を用いると、厚膜化した際に、これらの骨格に由来するわずかな吸収ピークが可視光領域に観測される。一方、構成例1〜6は、波長が360nm以上の領域に顕著な吸収ピークが見られず、特に透光性の高い材料であることが分かった。
【0204】
また、構成例1〜9に示す本発明の一態様の複合材料は、赤外領域(波長が700nm以上の領域)においても、顕著な吸収ピークがほとんど見られなかった。
【0205】
また、複素環化合物と酸化モリブデンからなる本発明の一態様の複合材料の吸収スペクトルは、該複素環化合物の吸収スペクトルとはほとんど同じ形状を有しており、酸化モリブデンの濃度が高い膜(具体的には、各構成例において、複素環化合物と酸化モリブデンの比率が質量比で4:2の膜)においても、可視光領域から赤外領域までに顕著な吸収ピークがほとんど見られなかった。このことから、本発明の一態様の複合材料は、電荷移動相互作用による光吸収が生じにくいことが示唆された。
【実施例2】
【0206】
本実施例では、本発明の一態様の発光素子について、図16(A)を用いて説明する。本実施例で用いた材料の構造式を以下に示す。
【0207】
【化9】

【0208】
以下に、本実施例の発光素子1、比較発光素子2、及び比較発光素子3の作製方法を示す。
【0209】
(発光素子1)
まず、ガラス基板1100上に、酸化珪素を含むインジウム錫酸化物(ITSO)をスパッタリング法にて成膜し、陽極として機能する第1の電極1101を形成した。なお、その膜厚は110nmとし、電極面積は2mm×2mmとした。
【0210】
次に、基板1100上に発光素子を形成するための前処理として、基板表面を水で洗浄し、200℃で1時間焼成した後、UVオゾン処理を370秒行った。
【0211】
その後、10−4Pa程度まで内部が減圧された真空蒸着装置に基板を導入し、真空蒸着装置内の加熱室において、170℃で30分間の真空焼成を行った後、基板1100を30分程度放冷した。
【0212】
次に、第1の電極1101が形成された面が下方となるように、第1の電極1101が形成された基板1100を真空蒸着装置内に設けられた基板ホルダーに固定し、10−4Pa程度まで減圧した後、第1の電極1101上に、4−[4−(9−フェニル−9H−フルオレン−9−イル)フェニル]−6−フェニルジベンゾチオフェン(略称:DBTFLP−IV)と酸化モリブデン(VI)を共蒸着することで、正孔注入層1111を形成した。その膜厚は、50nmとし、DBTFLP−IVと酸化モリブデン(VI)の比率は、質量比で4:2(=DBTFLP−IV:酸化モリブデン)となるように調節した。なお、共蒸着法とは、一つの処理室内で、複数の蒸発源から同時に蒸着を行う蒸着法である。
【0213】
次に、正孔注入層1111上に、3−[4−(9−フェナントリル)−フェニル]−9−フェニル−9H−カルバゾール(略称:PCPPn)を10nmの膜厚となるように成膜し、正孔輸送層1112を形成した。
【0214】
さらに、9−[4−(N−カルバゾリル)]フェニル−10−フェニルアントラセン(略称:CzPA)、及びN,N’−ビス〔4−(9−フェニル−9H−フルオレン−9−イル)フェニル〕−N,N’−ジフェニルピレン−1,6−ジアミン(略称:1,6FLPAPrn)を共蒸着し、正孔輸送層1112上に発光層1113を形成した。ここで、CzPA、及び1,6FLPAPrnの質量比は、1:0.05(=CzPA:1,6FLPAPrn)となるように調節した。また、発光層1113の膜厚は30nmとした。
【0215】
次に、発光層1113上に、CzPAを膜厚10nmとなるように成膜し、第1の電子輸送層1114aを形成した。
【0216】
その後、第1の電子輸送層1114a上にバソフェナントロリン(略称:BPhen)を膜厚15nmとなるように成膜し、第2の電子輸送層1114bを形成した。
【0217】
さらに、第2の電子輸送層1114b上に、フッ化リチウム(LiF)を1nmの膜厚で蒸着し、電子注入層1115を形成した。
【0218】
最後に、陰極として機能する第2の電極1103として、アルミニウムを200nmの膜厚となるように蒸着することで、本実施例の発光素子1を作製した。
【0219】
なお、上述した蒸着過程において、蒸着は全て抵抗加熱法を用いた。
【0220】
(比較発光素子2)
比較発光素子2の正孔注入層1111は、9−フェニル−3−[4−(10−フェニル−9−アントリル)フェニル]−9H−カルバゾール(略称:PCzPA)及び酸化モリブデン(VI)を共蒸着することで形成した。その膜厚は、50nmとし、PCzPAと酸化モリブデン(VI)の比率は、質量比で4:2(=PCzPA:酸化モリブデン)となるように調節した。正孔注入層1111以外は、発光素子1と同様に作製した。
【0221】
(比較発光素子3)
比較発光素子3の正孔注入層1111は、4−フェニル−4’−(9−フェニルフルオレン−9−イル)トリフェニルアミン(略称:BPAFLP)及び酸化モリブデン(VI)を共蒸着することで形成した。その膜厚は、50nmとし、BPAFLPと酸化モリブデン(VI)の比率は、質量比で4:2(=BPAFLP:酸化モリブデン)となるように調節した。正孔注入層1111以外は、発光素子1と同様に作製した。
【0222】
以上により得られた発光素子1、比較発光素子2及び比較発光素子3の素子構造を表2に示す。
【0223】
【表2】

【0224】
これらの発光素子を、窒素雰囲気のグローブボックス内において、発光素子が大気に曝されないように封止する作業を行った後、これらの発光素子の動作特性について測定を行った。なお、測定は室温(25℃に保たれた雰囲気)で行った。
【0225】
なお、上記3つの発光素子は、同一基板上に形成した。また、上記3つの発光素子の第1の電極、正孔輸送層〜第2の電極、封止は、同時に形成及び操作を行っている。
【0226】
発光素子1、比較発光素子2及び比較発光素子3の電圧−輝度特性を図17に示す。図17において、横軸は電圧(V)を、縦軸は輝度(cd/m2)を表す。また、輝度−電流効率特性を図18に示す。図18において、横軸は輝度(cd/m2)を、縦軸は電流効率(cd/A)を表す。また、各発光素子における輝度1000cd/m2のときの電圧(V)、CIE色度座標(x、y)、電流効率(cd/A)、外部量子効率(%)を表3に示す。
【0227】
【表3】

【0228】
表3に示す通り、それぞれ1000cd/m2の輝度の時の発光素子1のCIE色度座標は(x,y)=(0.15,0.23)であり、比較発光素子2のCIE色度座標は(x,y)=(0.15,0.22)であり、比較発光素子3のCIE色度座標は(x、y)=(0.15,0.22)であった。これらの結果から、発光素子1、比較発光素子2及び比較発光素子3は、1,6FLPAPrnに由来する青色発光が得られたことがわかった。
【0229】
図17からわかるように、同じ電圧において、発光素子1は比較発光素子3に比べて高い輝度が得られ、比較発光素子2と同等の輝度が得られている。また、図18及び表3からわかるように、発光素子1は、比較発光素子2及び比較発光素子3よりも高い電流効率、外部量子効率を得られている。
【0230】
次に、発光素子1、比較発光素子2及び比較発光素子3の信頼性試験を行った。信頼性試験の結果を図19に示す。図19において、縦軸は初期輝度を100%とした時の規格化輝度(%)を示し、横軸は素子の駆動時間(h)を示す。
【0231】
信頼性試験は、初期輝度を5000cd/m2に設定し、電流密度一定の条件で本実施例の発光素子を駆動した。
【0232】
図19から、発光素子1の260時間後の輝度は、初期輝度の54%を保っていた。一方、比較発光素子2の200時間後の輝度は、初期輝度の50%以下であった。また、比較発光素子3の62時間後の輝度は、初期輝度の50%以下であった。
【0233】
本発明の一態様を適用した発光素子1は、比較発光素子2及び比較発光素子3に比べて、長寿命であることが明らかとなった。
【0234】
以上の結果から、本発明の一態様の複合材料を、発光素子の正孔注入層として用いることで、高い発光効率の素子を実現できることが示された。また、本発明の一態様の複合材料を、発光素子の正孔注入層として用いることで、駆動電圧の低い発光素子を提供できることが示された。また、本発明の一態様の複合材料を正孔注入層として用いることで、長寿命な発光素子を作製できることが示された。
【実施例3】
【0235】
本実施例では、本発明の一態様の発光素子について、図16(A)を用いて説明する。本実施例で用いた材料の構造式を以下に示す。なお、既に示した材料については省略する。
【0236】
【化10】

【0237】
以下に、本実施例の発光素子4の作製方法を示す。
【0238】
(発光素子4)
発光素子4の正孔注入層1111は、1,3,5−トリ(ジベンゾチオフェン−4−イル)−ベンゼン(略称:DBT3P−II)及び酸化モリブデン(VI)を共蒸着することで形成した。その膜厚は、50nmとし、DBT3P−IIと酸化モリブデン(VI)の比率は、質量比で4:2(=DBT3P−II:酸化モリブデン)となるように調節した。正孔注入層1111以外は、実施例2に示した発光素子1と同様に作製した。
【0239】
以上により得られた発光素子4の素子構造を表4に示す。
【0240】
【表4】

【0241】
発光素子4を、窒素雰囲気のグローブボックス内において、発光素子4が大気に曝されないように封止する作業を行った後、発光素子4の動作特性について測定を行った。なお、測定は室温(25℃に保たれた雰囲気)で行った。
【0242】
発光素子4の電圧−輝度特性を図20に示す。図20において、横軸は電圧(V)を、縦軸は輝度(cd/m2)を表す。また、輝度−電流効率特性を図21に示す。図21において、横軸は輝度(cd/m2)を、縦軸は電流効率(cd/A)を表す。また、発光素子4における輝度1000cd/m2のときの電圧(V)、CIE色度座標(x、y)、電流効率(cd/A)、外部量子効率(%)を表5に示す。
【0243】
【表5】

【0244】
表5に示す通り、1000cd/m2の輝度の時の発光素子4のCIE色度座標は(x,y)=(0.15,0.22)であった。この結果から、発光素子4は、1,6FLPAPrnに由来する青色発光が得られたことがわかった。
【0245】
図20、図21及び表5からわかるように、発光素子4は、高い発光効率を示している。また、発光素子4は、駆動電圧が低い発光素子であることがわかる。
【0246】
次に、発光素子4の信頼性試験を行った。信頼性試験の結果を図22に示す。図22において、縦軸は初期輝度を100%とした時の規格化輝度(%)を示し、横軸は素子の駆動時間(h)を示す。
【0247】
信頼性試験は、初期輝度を5000cd/m2に設定し、電流密度一定の条件で本実施例の発光素子を駆動した。
【0248】
図22から、発光素子4の310時間後の輝度は、初期輝度の55%を保っていた。
【0249】
以上の結果から、本発明の一態様の複合材料を用いることで、発光効率の高い発光素子を実現できることが示された。また、本発明の一態様の複合材料を用いることで、駆動電圧の低い発光素子を作製できることが示された。また、本発明の一態様の複合材料を用いることで、長寿命の発光素子を提供できることが示された。
【実施例4】
【0250】
本実施例では、本発明の一態様の発光素子について、図16(A)を用いて説明する。本実施例で用いた材料の構造式を以下に示す。なお、既に示した材料については省略する。
【0251】
【化11】

【0252】
以下に、本実施例の発光素子5の作製方法を示す。
【0253】
(発光素子5)
発光素子5の正孔注入層1111は、2,8−ジフェニル−4−[4−(9−フェニル−9H−フルオレン−9−イル)フェニル]ジベンゾチオフェン(略称:DBTFLP−III)及び酸化モリブデン(VI)を共蒸着することで形成した。その膜厚は、50nmとし、DBTFLP−IIIと酸化モリブデン(VI)の比率は、質量比で4:2(=DBTFLP−III:酸化モリブデン)となるように調節した。正孔注入層1111以外は、実施例2に示した発光素子1と同様に作製した。
【0254】
以上により得られた発光素子5の素子構造を表6に示す。
【0255】
【表6】

【0256】
発光素子5を、窒素雰囲気のグローブボックス内において、発光素子5が大気に曝されないように封止する作業を行った後、発光素子5の動作特性について測定を行った。なお、測定は室温(25℃に保たれた雰囲気)で行った。
【0257】
発光素子5の電圧−輝度特性を図23に示す。図23において、横軸は電圧(V)を、縦軸は輝度(cd/m2)を表す。また、輝度−電流効率特性を図24に示す。図24において、横軸は輝度(cd/m2)を、縦軸は電流効率(cd/A)を表す。また、発光素子5における輝度1000cd/m2のときの電圧(V)、CIE色度座標(x、y)、電流効率(cd/A)、外部量子効率(%)を表7に示す。
【0258】
【表7】

【0259】
表7に示す通り、1000cd/m2の輝度の時の発光素子5のCIE色度座標は(x,y)=(0.15,0.23)であった。この結果から、発光素子5は、1,6FLPAPrnに由来する青色発光が得られたことがわかった。
【0260】
図23、図24及び表7からわかるように、発光素子5は、高い発光効率を示している。また、発光素子5は、駆動電圧が低い発光素子であることがわかる。
【0261】
以上の結果から、本発明の一態様の複合材料を用いることで、発光効率の高い発光素子を実現できることが示された。また、本発明の一態様の複合材料を用いることで、駆動電圧の低い発光素子を作製できることが示された。
【実施例5】
【0262】
本実施例では、本発明の一態様の複合材料の具体例を例示する。本発明の一態様の複合材料は、ジベンゾチオフェン骨格又はジベンゾフラン骨格を有する複素環化合物と、該複素環化合物に対して電子受容性を示す無機化合物とを含む。本実施例の構成例10〜14に用いた複素環化合物、及び構成例10〜13に用いた複素環化合物のHOMO準位(光電子分光法での測定値)を表8に示す。また、本実施例で用いた複素環化合物の構造式を以下に示す。
【0263】
【表8】

【0264】
【化12】

【0265】
また、構成例10〜14において、無機化合物としては、酸化モリブデンを用いた。
【0266】
本発明の一態様の複合材料の作製方法について、構成例10を例に挙げて説明する。構成例11〜14は、構成例10と同様に作製したため、説明を省略する。
【0267】
(構成例10)
まず、ガラス基板を真空蒸着装置内の基板ホルダーに固定する。そして、3−〔4−(ジベンゾチオフェン−4−イル)−フェニル〕−9−フェニル−9H−カルバゾール(略称:DBTPPC−II)と酸化モリブデン(VI)とをそれぞれ別の抵抗加熱式の蒸発源に入れ、真空に引いた状態で、共蒸着法によりDBTPPC−IIと酸化モリブデンとを含む膜を形成した。この時、DBTPPC−IIと酸化モリブデン(VI)の比率が質量比で4:2(=DBTPPC−II:酸化モリブデン)、4:1、4:0.5となるようにそれぞれ共蒸着した。なお、膜厚は50nmとした。
【0268】
このようにして成膜したDBTPPC−IIと酸化モリブデンの複合膜(構成例10)の吸収スペクトルを測定した結果を、図25に示す。また、比較のため、DBTPPC−IIのみの膜(膜厚50nm)の吸収スペクトルも合わせて図示する。なお、構成例11、12、14も、それぞれの構成例で用いた複素環化合物のみの膜の吸収スペクトルを比較として示す。
【0269】
同様に、3−〔3−(ジベンゾチオフェン−4−イル)−フェニル〕−9−フェニル−9H−カルバゾール(略称:mDBTPPC−II)と酸化モリブデンの複合膜(構成例11)の吸収スペクトルを測定した結果を図26に示す。なお、膜厚はすべて50nmとした。
【0270】
また、4−[4−(9−フェナントリル)フェニル]ジベンゾチオフェン(略称:DBTPPn−II)と酸化モリブデンの複合膜(構成例12)の吸収スペクトルを測定した結果を図27に示す。なお、構成例12で示す複合膜は、DBTPPn−IIと酸化モリブデン(VI)の比率が質量比で4:2(=DBTPPn−II:酸化モリブデン)の膜のみである。また、該複合膜、及びDBTPPn−IIのみの膜の膜厚は、どちらも50nmとした。
【0271】
また、4,4’−{(1,1’:2’,1’’:2’’,1’’’)−クアテルフェニル−3,3’’’−イル}−ビスジベンゾチオフェン(略称:mZ−DBT2−II)と酸化モリブデンの複合膜(構成例13)の吸収スペクトルを測定した結果を図28に示す。なお、構成例13では、mZ−DBT2−IIと酸化モリブデンの比率が質量比で4:2(=mZ−DBT2−II:酸化モリブデン)の膜のみを示す(膜厚50nm)。
【0272】
そして、4−{3−[3−(9−フェニル−9H−フルオレン−9−イル)フェニル]フェニル}ジベンゾフラン(略称:mmDBFFLBi−II)と酸化モリブデンの複合膜(構成例14)の吸収スペクトルを測定した結果を図29に示す。なお、膜厚はすべて50nmとした。
【0273】
図25乃至図29において、横軸は波長(nm)を、縦軸は吸光度(単位なし)を表す。
【0274】
図25乃至図29より、構成例10〜14に示す本発明の一態様の複合材料は、可視光領域に顕著な吸収ピークがほとんど見られず、透光性の高い材料であることが分かった。また、構成例10〜14に示す本発明の一態様の複合材料は、赤外領域(波長が700nm以上の領域)においても、顕著な吸収ピークがほとんど見られなかった。
【0275】
また、複素環化合物と酸化モリブデンからなる本発明の一態様の複合材料の吸収スペクトルは、該複素環化合物の吸収スペクトルとはほとんど同じ形状を有しており、酸化モリブデンの濃度が高い膜(具体的には、各構成例において、複素環化合物と酸化モリブデンの比率が質量比で4:2の膜)においても、可視光領域から赤外領域までに顕著な吸収ピークがほとんど見られなかった。このことから、本発明の一態様の複合材料は、電荷移動相互作用による光吸収が生じにくいことが示唆された。
【実施例6】
【0276】
本実施例では、本発明の一態様の発光素子について、図16(A)を用いて説明する。本実施例で用いた材料の構造式を以下に示す。なお、既に示した材料については省略する。
【0277】
【化13】

【0278】
以下に、本実施例の発光素子6の作製方法を示す。
【0279】
(発光素子6)
まず、実施例2に示した発光素子1と同様に、ガラス基板1100上にITSOを成膜することで、第1の電極1101を形成した。
【0280】
次に、第1の電極1101が形成された面が下方となるように、第1の電極1101が形成された基板1100を真空蒸着装置内に設けられた基板ホルダーに固定し、10−4Pa程度まで減圧した後、第1の電極1101上に、4,4’−{(1,1’:2’,1’’:2’’,1’’’)−クアテルフェニル−3,3’’’−イル}−ビスジベンゾチオフェン(略称:mZ−DBT2−II)と酸化モリブデン(VI)を共蒸着することで、正孔注入層1111を形成した。その膜厚は、50nmとし、mZ−DBT2−IIと酸化モリブデン(VI)の比率は、質量比で4:2(=mZ−DBT2−II:酸化モリブデン)となるように調節した。
【0281】
次に、正孔注入層1111上に、3−[4−(1−ナフチル)−フェニル]−9−フェニル−9H−カルバゾール(略称:PCPN)を10nmの膜厚となるように成膜し、正孔輸送層1112を形成した。
【0282】
さらに、CzPA、及びN,N’−ビス(3−メチルフェニル)−N,N’−ビス〔3−(9−フェニル−9H−フルオレン−9−イル)フェニル〕−ピレン−1,6−ジアミン(略称:1,6mMemFLPAPrn)を共蒸着し、正孔輸送層1112上に発光層1113を形成した。ここで、CzPA、及び1,6mMemFLPAPrnの質量比は、1:0.04(=CzPA:1,6mMemFLPAPrn)となるように調節した。また、発光層1113の膜厚は30nmとした。
【0283】
次に、発光層1113上に、CzPAを膜厚10nmとなるように成膜し、第1の電子輸送層1114aを形成した。
【0284】
その後、第1の電子輸送層1114a上にBPhenを膜厚15nmとなるように成膜し、第2の電子輸送層1114bを形成した。
【0285】
さらに、第2の電子輸送層1114b上に、LiFを1nmの膜厚で蒸着し、電子注入層1115を形成した。
【0286】
最後に、陰極として機能する第2の電極1103として、アルミニウムを200nmの膜厚となるように蒸着することで、本実施例の発光素子6を作製した。
【0287】
なお、上述した蒸着過程において、蒸着は全て抵抗加熱法を用いた。
【0288】
以上により得られた発光素子6の素子構造を表9に示す。
【0289】
【表9】

【0290】
発光素子6を、窒素雰囲気のグローブボックス内において、発光素子が大気に曝されないように封止する作業を行った後、発光素子6の動作特性について測定を行った。なお、測定は室温(25℃に保たれた雰囲気)で行った。
【0291】
発光素子6の電圧−輝度特性を図30に示す。図30において、横軸は電圧(V)を、縦軸は輝度(cd/m2)を表す。また、輝度−電流効率特性を図31に示す。図31において、横軸は輝度(cd/m2)を、縦軸は電流効率(cd/A)を表す。また、発光素子6における輝度1000cd/m2のときの電圧(V)、CIE色度座標(x、y)、電流効率(cd/A)、外部量子効率(%)を表10に示す。
【0292】
【表10】

【0293】
表10に示す通り、1000cd/m2の輝度の時の発光素子6のCIE色度座標は(x,y)=(0.14,0.16)であった。この結果から、発光素子6は、1,6mMemFLPAPrnに由来する青色発光が得られたことがわかった。
【0294】
図30、図31及び表10からわかるように、発光素子6は、高い発光効率を示している。また、発光素子6は、駆動電圧が低い発光素子であることがわかる。
【0295】
次に、発光素子6の信頼性試験を行った。信頼性試験の結果を図32に示す。図32において、縦軸は初期輝度を100%とした時の規格化輝度(%)を示し、横軸は素子の駆動時間(h)を示す。
【0296】
信頼性試験は、初期輝度を5000cd/m2に設定し、電流密度一定の条件で発光素子6を駆動した。
【0297】
図32から、発光素子6の280時間後の輝度は、初期輝度の54%を保っていた。
【0298】
以上の結果から、本発明の一態様の複合材料を、発光素子の正孔注入層として用いることで、高い発光効率の素子を実現できることが示された。また、本発明の一態様の複合材料を、発光素子の正孔注入層として用いることで、駆動電圧の低い発光素子を提供できることが示された。また、本発明の一態様の複合材料を正孔注入層として用いることで、長寿命な発光素子を作製できることが示された。
【実施例7】
【0299】
本実施例では、本発明の一態様の発光素子について、図16(A)を用いて説明する。本実施例で用いた材料の構造式を以下に示す。なお、既に示した材料については省略する。
【0300】
【化14】

【0301】
以下に、本実施例の発光素子7の作製方法を示す。
【0302】
(発光素子7)
発光素子7の正孔注入層1111は、4−{3−[3−(9−フェニル−9H−フルオレン−9−イル)フェニル]−フェニル}ジベンゾフラン(略称:mmDBFFLBi−II)及び酸化モリブデン(VI)を共蒸着することで形成した。その膜厚は、50nmとし、mmDBFFLBi−IIと酸化モリブデン(VI)の比率は、質量比で4:2(=mmDBFFLBi−II:酸化モリブデン)となるように調節した。
【0303】
発光素子7の正孔輸送層1112は、mmDBFFLBi−IIを10nmの膜厚で成膜することで形成した。正孔注入層1111及び正孔輸送層1112以外は、実施例6に示した発光素子6と同様に作製した。
【0304】
以上により得られた発光素子7の素子構造を表11に示す。
【0305】
【表11】

【0306】
発光素子7を、窒素雰囲気のグローブボックス内において、発光素子が大気に曝されないように封止する作業を行った後、発光素子7の動作特性について測定を行った。なお、測定は室温(25℃に保たれた雰囲気)で行った。
【0307】
発光素子7の電圧−輝度特性を図33に示す。図33において、横軸は電圧(V)を、縦軸は輝度(cd/m2)を表す。また、輝度−電流効率特性を図34に示す。図34において、横軸は輝度(cd/m2)を、縦軸は電流効率(cd/A)を表す。また、発光素子7における輝度1000cd/m2のときの電圧(V)、CIE色度座標(x、y)、電流効率(cd/A)、外部量子効率(%)を表12に示す。
【0308】
【表12】

【0309】
表12に示す通り、1000cd/m2の輝度の時の発光素子7のCIE色度座標は(x,y)=(0.14,0.16)であった。この結果から、発光素子7は、1,6mMemFLPAPrnに由来する青色発光が得られたことがわかった。
【0310】
図32、図33及び表12からわかるように、発光素子7は、高い発光効率を示している。また、発光素子7は、駆動電圧が低い発光素子であることがわかる。
【0311】
以上の結果から、本発明の一態様の複合材料を、発光素子の正孔注入層として用いることで、高い発光効率の素子を実現できることが示された。また、本発明の一態様の複合材料を、発光素子の正孔注入層として用いることで、駆動電圧の低い発光素子を提供できることが示された。
【実施例8】
【0312】
本実施例では、本発明の一態様の発光素子について、図16(A)を用いて説明する。本実施例で用いた材料は先の実施例で用いた材料であるため、化学式は省略する。
【0313】
以下に、本実施例の発光素子8の作製方法を示す。
【0314】
(発光素子8)
発光素子8の正孔注入層1111は、mmDBFFLBi−II及び酸化モリブデン(VI)を共蒸着することで形成した。その膜厚は、50nmとし、mmDBFFLBi−IIと酸化モリブデン(VI)の比率は、質量比で4:2(=mmDBFFLBi−II:酸化モリブデン)となるように調節した。
【0315】
発光素子8の正孔輸送層1112は、PCzPAを10nmの膜厚で成膜することで形成した。正孔注入層1111及び正孔輸送層1112以外は、実施例6に示した発光素子6と同様に作製した。
【0316】
以上により得られた発光素子8の素子構造を表13に示す。
【0317】
【表13】

【0318】
発光素子8を、窒素雰囲気のグローブボックス内において、発光素子が大気に曝されないように封止する作業を行った後、発光素子8の動作特性について測定を行った。なお、測定は室温(25℃に保たれた雰囲気)で行った。
【0319】
発光素子8の電圧−輝度特性を図35に示す。図35において、横軸は電圧(V)を、縦軸は輝度(cd/m2)を表す。また、輝度−電流効率特性を図36に示す。図36において、横軸は輝度(cd/m2)を、縦軸は電流効率(cd/A)を表す。また、発光素子8における輝度1000cd/m2のときの電圧(V)、CIE色度座標(x、y)、電流効率(cd/A)、外部量子効率(%)を表14に示す。
【0320】
【表14】

【0321】
表14に示す通り、1000cd/m2の輝度の時の発光素子8のCIE色度座標は(x,y)=(0.14,0.18)であった。この結果から、発光素子8は、1,6mMemFLPAPrnに由来する青色発光が得られたことがわかった。
【0322】
図34、図35及び表14からわかるように、発光素子8は、高い発光効率を示している。また、発光素子8は、駆動電圧が低い発光素子であることがわかる。
【0323】
以上の結果から、本発明の一態様の複合材料を、発光素子の正孔注入層として用いることで、高い発光効率の素子を実現できることが示された。また、本発明の一態様の複合材料を、発光素子の正孔注入層として用いることで、駆動電圧の低い発光素子を提供できることが示された。
【実施例9】
【0324】
本実施例では、本発明の一態様の発光素子について、図16(B)を用いて説明する。本実施例で用いた材料の構造式を以下に示す。なお、先の実施例で用いた材料の構造式は省略する。
【0325】
【化15】

【0326】
以下に、本実施例の発光素子9、比較発光素子10の作製方法を示す。
【0327】
(発光素子9)
まず、ガラス基板1100上に、ITSO膜をスパッタリング法にて成膜し、陽極として機能する第1の電極1101を形成した。なお、その膜厚は110nmとし、電極面積は2mm×2mmとした。
【0328】
基板1100上に発光素子を形成するための前処理としては、基板表面を水で洗浄し、200℃で1時間焼成した後、UVオゾン処理を370秒行った。
【0329】
その後、10−4Pa程度まで内部が減圧された真空蒸着装置に基板を導入し、真空蒸着装置内の加熱室において、170℃で30分間の真空焼成を行った後、基板1100を30分程度放冷した。
【0330】
次に、第1の電極1101が形成された面が下方となるように、第1の電極1101が形成された基板1100を真空蒸着装置内に設けられた基板ホルダーに固定し、10−4Pa程度まで減圧した後、第1の電極1101上に、DBT3P−IIと酸化モリブデン(VI)を共蒸着することで、第1の正孔注入層1111aを形成した。その膜厚は、50nmとし、DBT3P−IIと酸化モリブデン(VI)の比率は、質量比で4:2(=DBT3P−II:酸化モリブデン)となるように調節した。
【0331】
次に、第1の正孔注入層1111a上に、PCPNを10nmの膜厚となるように成膜し、第1の正孔輸送層1112aを形成した。
【0332】
さらに、CzPA、及び1,6FLPAPrnを共蒸着し、第1の正孔輸送層1112a上に第1の発光層1113aを形成した。ここで、CzPA、及び1,6FLPAPrnの質量比は、1:0.05(=CzPA:1,6FLPAPrn)となるように調節した。また、第1の発光層1113aの膜厚は30nmとした。
【0333】
次に、第1の発光層1113a上に、CzPAを膜厚10nm、BPhenを膜厚15nmとなるように成膜し、第1の電子輸送層1114aを形成した。
【0334】
さらに、第1の電子輸送層1114a上に、酸化リチウム(Li2O)を0.1nmの膜厚で蒸着し、第1の電子注入層1115aを形成した。
【0335】
その後、第1の電子注入層1115a上に、銅フタロシアニン(略称CuPc)を膜厚2nmで蒸着し、電子リレー層1116を形成した。
【0336】
次に、電子リレー層1116上に、DBT3P−IIと酸化モリブデン(VI)を共蒸着することで、第2の正孔注入層1111bを形成した。その膜厚は50nmとし、DBT3P−IIと酸化モリブデン(VI)の比率は、質量比で4:2(=DBT3P−II:酸化モリブデン)となるように調節した。なお、本実施例の第2の正孔注入層1111bは、先の実施の形態で説明した電荷発生層として機能する。
【0337】
次に、第2の正孔注入層1111b上に、PCPNを10nmの膜厚となるように成膜し、第2の正孔輸送層1112bを形成した。
【0338】
さらに、CzPA、及び1,6FLPAPrnを共蒸着し、第2の正孔輸送層1112b上に第2の発光層1113bを形成した。ここで、CzPA、及び1,6FLPAPrnの質量比は、1:0.05(=CzPA:1,6FLPAPrn)となるように調節した。また、第2の発光層1113bの膜厚は30nmとした。
【0339】
次に、第2の発光層1113b上に、CzPAを膜厚10nm、BPhenを膜厚15nmとなるように成膜し、第2の電子輸送層1114bを形成した。
【0340】
さらに、第2の電子輸送層1114b上に、LiFを1nmの膜厚で蒸着し、第2の電子注入層1115bを形成した。
【0341】
最後に、陰極として機能する第2の電極1103として、アルミニウムを200nmの膜厚となるように蒸着することで、本実施例の発光素子9を作製した。
【0342】
(比較発光素子10)
比較発光素子10の第1の正孔注入層1111aは、PCzPA及び酸化モリブデン(VI)を共蒸着することで形成した。その膜厚は、50nmとし、PCzPAと酸化モリブデン(VI)の比率は、質量比で4:2(=PCzPA:酸化モリブデン)となるように調節した。
【0343】
比較発光素子10の第2の正孔注入層1111bは、PCzPA及び酸化モリブデン(VI)を共蒸着することで形成した。その膜厚は、60nmとし、PCzPAと酸化モリブデン(VI)の比率は、質量比で4:2(=PCzPA:酸化モリブデン)となるように調節した。第1の正孔注入層1111a及び第2の正孔注入層1111b以外は、発光素子9と同様に作製した。
【0344】
なお、上述した蒸着過程において、蒸着は全て抵抗加熱法を用いた。
【0345】
以上により得られた発光素子9、比較発光素子10の素子構造を表15に示す。なお、発光素子9は、表15における物質XがDBT3P−IIであり、膜厚Yが50nmである。そして、比較発光素子10は、表15における物質XがPCzPAであり、膜厚Yが60nmである。
【0346】
【表15】

【0347】
これらの発光素子を、窒素雰囲気のグローブボックス内において、発光素子が大気に曝されないように封止する作業を行った後、これらの発光素子の動作特性について測定を行った。なお、測定は室温(25℃に保たれた雰囲気)で行った。
【0348】
なお、上記2つの発光素子は、同一基板上に形成した。また、上記2つの発光素子の第1の電極、第1の正孔輸送層〜電子リレー層、第2の正孔輸送層〜第2の電極、封止は、同時に形成及び操作を行っている。
【0349】
発光素子9及び比較発光素子10の電圧−輝度特性を図37に示す。図37において、横軸は電圧(V)を表し、縦軸は輝度(cd/m2)を表す。また、輝度−電流効率特性を図38に示す。図38において、横軸は輝度(cd/m2)を、縦軸は電流効率(cd/A)を表す。また、発光素子9及び比較発光素子10における輝度1000cd/m2のときの電圧(V)、CIE色度座標(x、y)、電流効率(cd/A)、パワー効率(lm/W)、外部量子効率(%)を表16に示す。
【0350】
【表16】

【0351】
表16に示す通り、1000cd/m2の輝度の時の発光素子9及び比較発光素子10のCIE色度座標はどちらも(x,y)=(0.14,0.20)であった。
【0352】
図38、表16からわかるように、発光素子9は比較発光素子10に比べて高い電流効率、パワー効率、外部量子効率を得られている。
【0353】
ここで、比較発光素子10に用いたPCzPAと酸化モリブデンとを含む複合材料に関して、吸収スペクトルを測定し、発光素子9に用いたDBT3P−IIと酸化モリブデンとを含む複合材料(図8)と比較した。
【0354】
PCzPAと酸化モリブデン(VI)とを50nmの膜厚になるように共蒸着して形成した膜(質量比で4:2、4:1、4:0.5(=PCzPA:酸化モリブデン))の吸収スペクトルを図39に示す。なお、図39において、横軸は波長(nm)を、縦軸は吸光度(単位なし)を表す。
【0355】
図39に示すように、PCzPAと酸化モリブデンとを含む複合材料は、可視光領域に吸収ピークを有する。一方、実施例1で示した通り、DBT3P−IIと酸化モリブデンとを含む複合材料は、可視光領域に顕著な吸収ピークがほとんど見られない(図8)。
【0356】
このことから、DBT3P−IIと酸化モリブデンとを含む複合材料は、PCzPAと酸化モリブデンとを含む複合材料に比べて可視光領域における透過性が高いため、発光素子9は、比較発光素子10に比べて、高い電流効率が得られたと考えられる。
【0357】
以上の結果から、本発明の一態様の複合材料を、タンデム型の発光素子の正孔注入層、電荷発生層に用いることで、高い発光効率の素子を実現できることが示された。また、本発明の一態様の複合材料を、タンデム型の発光素子の正孔注入層、電荷発生層に用いることで、駆動電圧の低い発光素子を提供できることが示された。また、本発明の一態様の複合材料は、電荷移動相互作用による光吸収が観察されないにも関わらず、タンデム型の発光素子の電荷発生層として極めて有効に機能することがわかった。
【実施例10】
【0358】
本実施例では、本発明の一態様の複合材料について、電子スピン共鳴(ESR:Electron Spin Resonance)法を用いて評価した結果を説明する。本実施例では、DBT3P−IIと酸化モリブデンとを含む本発明の一態様の複合材料と、4,4’−ビス[N−(1−ナフチル)−N−フェニルアミノ]ビフェニル(略称:NPB)と酸化モリブデンとを含む従来の複合材料との比較を行う。NPBの構造式を以下に示す。
【0359】
【化16】

【0360】
<複合材料の吸収スペクトルに関する比較>
まず、NPBと酸化モリブデンとを含む従来の複合材料に関して、吸収スペクトルを測定し、DBT3P−IIと酸化モリブデンとを含む本発明の一態様の複合材料(図8)と比較した。
【0361】
NPBと酸化モリブデン(VI)とを50nmの膜厚となるように共蒸着して形成した膜(質量比で4:2、4:1、4:0.5(=NPB:酸化モリブデン)の吸収スペクトルを図40に示す。なお、図40において、横軸は波長(nm)を、縦軸は吸光度(単位なし)を表す。
【0362】
図40と図8とを比較するとわかるように、NPBを複合材料に用いると、500nm付近および1300nm付近に電荷移動相互作用に基づく大きな光吸収が生じてしまう(しかも、酸化モリブデンの濃度を増やすとピーク強度が大きくなる)が、DBT3P−IIを用いるとその問題点が解消されることがわかる。なお、NPBのHOMO準位(光電子分光法での測定値)は−5.4eVであり、DBT3P−IIのHOMO準位は−5.9eVである。このことからも、NPBはDBT3P−IIに比べて電荷移動相互作用を起こしやすい傾向にあることが示唆される。
【0363】
このように、吸収スペクトルから電荷移動相互作用の有無に関する傾向は得られるが、本実施例では、さらにESR測定による定性的かつ定量的な評価を行い、本発明の一態様の複合材料と従来の複合材料との違いを考察した。以下にその内容を示す。
【0364】
<ESR測定用試料>
本実施例の試料1乃至6、及び比較試料1乃至13について説明する。
【0365】
本発明の一態様を適用した試料1乃至6は、DBT3P−IIと酸化モリブデンとの複合材料を含む複合膜である。比較試料1乃至13は、NPBと酸化モリブデンとの複合材料を含む複合膜である。
【0366】
全ての試料は、石英基板上に、有機化合物(DBT3P−II又はNPB)及び酸化モリブデン(VI)を共蒸着させることで形成した。石英基板のサイズは、2.8mm×20mm(比較試料1〜3は、3.0mm×20mm)とした。
【0367】
具体的には、まず、複合材料の蒸着される面が下方となるように、石英基板を真空蒸着装置内に設けられたホルダーに固定した。そして、真空装置内を10−4Paに減圧した後、有機化合物(DBT3P−II又はNPB)と、酸化モリブデン(VI)とを共蒸着することにより、石英基板上に有機化合物(DBT3P−II又はNPB)及び酸化モリブデンとの複合材料を含む複合膜を形成した。上記複合膜の膜厚は、全ての試料において50nmとなるように調整した。
【0368】
各試料における有機化合物と酸化モリブデン(VI)のモル比は、蒸着レートによって調節した。表17に、各試料における有機化合物と酸化モリブデン(VI)の質量比及びモル比を示す。なお、各試料は4つずつ(比較試料3は、8つ)用意し、ESR測定では4つ(比較試料3は、8つ)を重ねて測定を行った。さらに、表17には、各試料のg値も示す。
【0369】
【表17】

【0370】
<ESR測定>
測定は、電子スピン共鳴測定装置 JES−FA200(日本電子製)を使用し、共振周波数約9.4GHz、変調周波数100kHz、変調幅0.6mT、時定数0.1sec、掃引時間4min、測定温度は室温、の条件で行った。そして、Mn2+第3及び第4シグナルの位置により磁場補正を行った。測定により得られる電子スピン共鳴(ESR)スペクトルの強度は、不対電子の数を反映しており、その強度を比較することにより有機化合物と酸化モリブデンの間における電荷移動相互作用の生じやすさを間接的に把握することができる。なお、ESRスペクトルのピークから算出されたg値は、2.001〜2.006の範囲であり、自由電子のg値(2.0023)近傍の数値を示していた。
【0371】
<測定結果>
図41に、試料6及び比較試料11のESRスペクトルを示す。図41において、横軸は磁場(単位:mT)を、縦軸は強度を表す。
【0372】
図41からわかる通り、試料6は、比較試料11に比べて、磁場336〜340mT付近の強度が極めて低い。該強度が低いほど、複合材料内において、電荷移動相互作用により発生する不対電子の数が少ない。つまり、試料6は、比較試料11に比べて、複合材料内において、電荷移動相互作用が生じにくいと言える。
【0373】
この結果から、本発明の一態様の複合材料である、DBT3P−IIと酸化モリブデンとを含む複合材料は、NPBと酸化モリブデンとを含む複合材料に比べて、電荷移動相互作用が生じにくく、該電荷移動相互作用に基づく光吸収の発生を抑制することができると示唆された。
【0374】
図42は、各試料における有機化合物に対する酸化モリブデン(VI)のモル比と、各試料のESRスペクトルにおける正のピークの値(A)及び負のピークの値(B)の比の値(A/B)との関係を示すグラフである。例として、図41では、比較試料11におけるA及びBを示した。図42(A)(B)において、横軸は、各試料における有機化合物及び酸化モリブデン(VI)のモル比(1:X(=有機化合物:酸化モリブデン))のXの値を表し、縦軸は、各試料におけるA/Bの値を示す。
【0375】
図42(A)は、有機化合物としてDBT3P−IIを用いた試料1乃至6について、図42(B)は、有機化合物としてNPBを用いた比較試料1乃至13について示している。
【0376】
図42(A)(B)からわかる通り、試料1乃至6の多くは、A/Bの値が1.0付近にあり、比較試料1乃至13の多くは、A/Bの値が、1.1〜1.2付近にあった。つまり、本発明の一態様の複合材料である、DBT3P−IIと酸化モリブデンとを含む複合材料は、ESRスペクトルの正のピークと負のピークの形状が対称的であるのに対し、NPBと酸化モリブデンとを含む複合材料はその形状が非対称であると言える。
【0377】
ESRスペクトルにおいて、正のピークと負のピークの形状が対称的である場合は、複合材料内において不対電子が局在化しており、非対称である場合は、不対電子があたかも半導体のように非局在化していると考えられる。
【0378】
ここで、表17より、試料1乃至6のg値は、2.005〜2.006であり、比較試料1乃至13のg値は、2.001〜2.003であることがわかる。g値は不対電子近傍の原子のスピン軌道相互作用の影響を受けるため、重原子が近傍にあれば大きな値を示す。このことから、試料1乃至6において、不対電子は、DBT3P−IIにおける硫黄原子(S)の影響を強く受けており、一方、比較試料1乃至13において、不対電子は、NPBにおける窒素原子(N)や炭素原子(C)の影響を受けていると示唆される。
【0379】
<考察>
以上で得られたESRスペクトルの強度、ピークの対称性、及びg値から、以下のように考察を行った。
【0380】
まず、NPBを用いた複合材料は、ESRスペクトルの強度が高いため、電荷移動相互作用が生じやすいことを示している。また、比較試料1乃至13では、酸化モリブデンがNPBから電子を奪うことにより、主として窒素原子に不対電子が生じ、該不対電子は窒素原子や周辺の炭素原子に非局在化していると考えられる。なぜならば、g値が比較的小さく、また、ESRスペクトルの正のピークと負のピークの形状が非対称であるためである。
【0381】
ここで、該不対電子が存在している軌道には、電子の抜けた穴、すなわちホールが生じているため、そのホールも非局在化していることになる。したがって、窒素原子からベンゼン環にかけて広がる共役系を、ホールが移動しやすくなっており、分子間を移動することも容易となっていると推察される(芳香族アミンが優れたホール輸送性を示す所以である)。つまり、NPB上に生じたホールは、そのまま伝導に寄与するキャリアとなっていると考えられる。
【0382】
以上のことから、NPBは窒素原子を介して、電荷移動相互作用が生じやすく、該電荷移動相互作用によって発生するNPB上のホールが、そのままキャリア輸送性・キャリア注入性に寄与していると示唆される。
【0383】
一方、DBT3P−IIを用いた複合材料は、ESRスペクトルの強度が極めて低いため、電荷移動相互作用がほとんど生じていないことを示している。また、試料1乃至6では、極わずかにではあるが、酸化モリブデンがDBT3P−IIから電子を奪うことにより硫黄原子上に不対電子が生じていると考えられるが、該不対電子は硫黄原子に局在化していると考えられる。なぜならば、g値が比較的大きく、またESRスペクトルの正のピークと負のピークが対称形状であるためである。
【0384】
ここで、該不対電子が存在している軌道には、電子の抜けた穴、すなわちホールが生じているため、そのホールも局在化していることになる。したがって、硫黄原子上に生じたわずかなホールも、硫黄原子上にとどまってしまい、伝導に寄与するキャリアにはなりにくい。以上のことから、DBT3P−IIは電荷移動相互作用が生じにくく、また、仮にDBT3P−II上にホールが生成したとしても、キャリアにはなりにくいことが示唆される。
【0385】
しかし、DBT3P−IIを用いた複合材料は、電圧を印加することでホールを注入・輸送することができる。このことは、以下のように説明できる。つまり、試料1乃至6のような複合材料は、電圧を印加することで、酸化モリブデンがDBT3P−IIからさらに電子を奪うことにより、今度は硫黄原子ではなく、炭素原子上に不対電子ができる(すなわちホールができる)と考えられる。このホールは、炭素原子同士のπ結合により非局在化し、ジベンゾチオフェン環(又はベンゼン環)に広がる共役系を移動すると考えられる。よって、電荷移動相互作用が生じにくいにも関わらず、優れたキャリア輸送性・キャリア注入性を発現することができると示唆される。実際に、先の実施例で示した通り、本発明の一態様の複合材料を用いた発光素子は高い発光効率を示している。
【0386】
以上、本実施例から、本発明の一態様の複合材料は、電荷移動相互作用が生じにくく、該電荷移動相互作用に基づく光吸収の発生を抑制することができると示唆された。また、電荷移動相互作用が生じにくいにも関わらず、優れたキャリア注入性・輸送性を示す機構が示唆された。
【0387】
(参考例1)
上記実施例で用いた4−[4−(9−フェニル−9H−フルオレン−9−イル)フェニル]−6−フェニルジベンゾチオフェン(略称:DBTFLP−IV)の合成方法について説明する。DBTFLP−IVの構造を以下に示す。
【0388】
【化17】

【0389】
100mL三口フラスコに9−(4−ブロモフェニル)−9−フェニル−9H−フルオレンを1.6g(4.0mmol)、4−フェニルジベンゾチオフェン−6−ボロン酸を1.2g(4.0mmol)、酢酸パラジウム(II)を4.0mg(20μmol)、トリ(オルト−トリル)ホスフィンを12mg(40μmol)、トルエン30mL、エタノール3mL、2mol/L炭酸カリウム水溶液3mLを加えた。この混合物を、減圧下で攪拌しながら脱気した後、窒素雰囲気下、90℃で6時間加熱撹拌し、反応させた。
【0390】
反応後、この反応混合液にトルエン150mLを加えた後、この有機層をフロリジール(和光純薬工業株式会社、カタログ番号:540−00135)、アルミナ(メルク、中性)、セライト(和光純薬工業株式会社、カタログ番号:531−16855)の順で濾過して濾液を得た。得られた濾物をシリカゲルカラムクロマトグラフィー(展開溶媒 トルエン:ヘキサン=1:3)による精製を行った。得られたフラクションを濃縮し、アセトンとメタノールを加えて超音波をかけたのち、再結晶化したところ、目的物の白色粉末を収量1.6g、収率73%で得た。また、上記合成法の反応スキームを下記(A−1)に示す。
【0391】
【化18】

【0392】
シリカゲル薄層クロマトグラフィー(TLC)でのRf値(展開溶媒 酢酸エチル:ヘキサン=1:10)は、目的物では0.40、9−(4−ブロモフェニル)−9−フェニル−9H−フルオレンでは0.48だった。
【0393】
核磁気共鳴法(NMR)によって、この化合物が目的物であるDBTFLP−IVであることを確認した。
【0394】
得られた化合物の1H NMRデータを以下に示す。
1H NMR(CDCl3,300MHz):7.16−7.59(m,22H),7.69−7.71(m,2H),7.79(d,J=7.5Hz,2H),8.14−8.18(m,2H)。
【0395】
(参考例2)
上記実施例で用いた4,4’−(ビフェニル−2,2’−ジイル)−ビス−ジベンゾチオフェン(略称:oDBTBP−II)の合成方法について説明する。oDBTBP−IIの構造を以下に示す。
【0396】
【化19】

【0397】
100mL三口フラスコに2,2’−ジブロモビフェニルを1.6g(5.0mmol)、ジベンゾチオフェン−4−ボロン酸を3.2g(11mmol)、酢酸パラジウム(II)を44mg(0.2mmol)、トリ(オルト−トリル)ホスフィンを120mg(0.4mmol)、トルエン30mL、エタノール3mL、2mol/L炭酸カリウム水溶液20mLを加えた。この混合物を、減圧下で攪拌しながら脱気した後、窒素雰囲気下、90℃で10時間加熱撹拌し、反応させた。
【0398】
反応後、この反応混合液にトルエン150mLを加えた後、この有機層をフロリジール、セライトの順で濾過して濾液を得た。得られた濾物をシリカゲルカラムクロマトグラフィー(展開溶媒 トルエン:ヘキサン=1:3)による精製を行った。得られたフラクションを濃縮し、アセトンとメタノールを加えて超音波をかけたのち、再結晶化したところ、目的物であるoDBTBP−IIの白色粉末を収量1.8g、収率69%で得た。また、上記合成法の反応スキームを下記(B−1)に示す。
【0399】
【化20】

【0400】
シリカゲル薄層クロマトグラフィー(TLC)でのRf値(展開溶媒 酢酸エチル:ヘキサン=1:10)は、oDBTBP−IIでは0.56、2,2’−ジブロモビフェニルでは0.77だった。
【0401】
(参考例3)
上記実施例で用いた2,8−ジフェニル−4−[4−(9−フェニル−9H−フルオレン−9−イル)フェニル]ジベンゾチオフェン(略称:DBTFLP−III)の合成方法について説明する。DBTFLP−IIIの構造を以下に示す。
【0402】
【化21】

【0403】
100mL三口フラスコに9−(4−ブロモフェニル)−9−フェニル−9H−フルオレンを1.6g(4.0mmol)、2,8−ジフェニルジベンゾチオフェン−4−ボロン酸を1.7g(4.4mmol)、酢酸パラジウム(II)を11mg(0.1mmol)、トリ(オルト−トリル)ホスフィンを30mg(0.1mmol)、トルエン30mL、エタノール3mL、2mol/L炭酸カリウム水溶液5mLを加えた。この混合物を、減圧下で攪拌しながら脱気した後、窒素雰囲気下、90℃で6.5時間加熱撹拌し、反応させた。
【0404】
反応後、この反応混合液にトルエン150mLを加えた後、この有機層をフロリジール、アルミナ、セライトの順で濾過して濾液を得た。得られた濾物をシリカゲルカラムクロマトグラフィー(展開溶媒 トルエン:ヘキサン=1:3)による精製を行った。得られたフラクションを濃縮し、アセトンとメタノールを加えて超音波をかけたのち、再結晶化したところ、目的物の白色粉末を収量2.3g、収率90%で得た。また、上記合成法の反応スキームを下記(C−1)に示す。
【0405】
【化22】

【0406】
シリカゲル薄層クロマトグラフィー(TLC)でのRf値(展開溶媒 酢酸エチル:ヘキサン=1:10)は、目的物では0.33、9−(4−ブロモフェニル)−9−フェニル−9H−フルオレンでは0.60だった。
【0407】
核磁気共鳴法(NMR)によって、この化合物が目的物であるDBTFLP−IIIであることを確認した。
【0408】
得られた化合物の1H NMRデータを以下に示す。
1H NMR(CDCl3,300MHz):7.23−7.52(m,20H),7.65−7.76(m,8H),7.81(d,J=6.9Hz,1H),7.88(d,J=8.1Hz,1H),8.40(dd,J=11.7Hz,1.5Hz,2H)。
【0409】
(参考例4)
上記実施例で用いた3,6−ジ−(ジベンゾチオフェン−4−イル)−9−フェニル−9H−カルバゾール(略称:DBT2PC−II)の合成方法について説明する。DBT2PC−IIの構造を以下に示す。
【0410】
【化23】

【0411】
200mL三口フラスコに3,6−ジブロモ−9−フェニル−9H−カルバゾールを2.0g(5.0mmol)、ジベンゾチオフェン−4−ボロン酸を3.2g(11mmol)、酢酸パラジウム(II)を10mg(0.1mmol)、トリ(オルト−トリル)ホスフィンを30mg(0.1mmol)、トルエン50mL、エタノール5mL及び2mol/L炭酸カリウム水溶液7.5mLを加え、この混合物を減圧下で攪拌しながら脱気した後、窒素雰囲気下、90℃で6時間加熱撹拌し、反応させた。反応後、この反応混合液を室温まで冷ました後、水、エタノール、トルエン、ヘキサンの順で洗浄しながら、濾過して濾物を得た。得られた濾物をシリカゲルカラムクロマトグラフィー(展開溶媒 トルエン:ヘキサン=1:3)によって精製を行った。これにより得られたフラクションを濃縮し、アセトンとエタノールを加えて超音波をかけたのち、再結晶化したところ、白色粉末を収量1.4g、収率47%で得た。また、上記合成法の反応スキームを下記(D−1)に示す。
【0412】
【化24】

【0413】
得られた白色粉末を核磁気共鳴法(NMR)により測定した。以下に測定データを示す。
1H NMR(CDCl3,300MHz):δ(ppm)=7.44−7.70(m、15H)、7.82−7.86(m、4H)、8.15−8.22(m、4H)、8.57(d、J=1.5Hz、2H)
【0414】
(参考例5)
上記実施例で用いた4−[3−(9,10−ジフェニル−2−アントリル)フェニル]ジベンゾチオフェン(略称:2mDBTPPA−II)の合成方法について説明する。2mDBTPPA−IIの構造を以下に示す。
【0415】
【化25】

【0416】
2mDBTPPA−IIの合成方法を合成スキーム(E−1)に示すと共に、その反応に関し以下において詳述する。
【0417】
【化26】

【0418】
2−ブロモ−9,10−ジフェニルアントラセン1.6g(4.0mmol)、3−(ジベンゾチオフェン−4−イル)フェニルボロン酸1.2g(4.0mmol)、トリ(オルト−トリル)ホスフィン0.30g(1.0mmol)を、100mL三口フラスコに入れ、フラスコ内を窒素置換した。この混合物に、トルエン25mL、エタノール5.0mL、2.0mol/L炭酸カリウム水溶液5.0mLを加えた。この混合物を減圧しながら攪拌することで脱気した。
【0419】
この混合物に酢酸パラジウム(II)45mg(0.20mmol)を加え、窒素気流下、80℃で5時間攪拌した。攪拌後、この混合物の水層をトルエンで抽出し、抽出溶液と有機層を合わせて、飽和食塩水で洗浄した。有機層を硫酸マグネシウムにより乾燥し、乾燥後この混合物を自然濾過した。得られた濾液を濃縮して、油状物を得た。得られた油状物を、シリカゲルカラムクロマトグラフィーにより精製した。クロマトグラフィーは、ヘキサン:トルエン=5:1の混合溶媒を展開溶媒として用いて行った。得られた固体をトルエンとヘキサンの混合溶媒により再結晶化したところ、目的物の黄色粉末を1.6g、収率70%で得た。
【0420】
得られた黄色粉末状固体1.6gをトレインサブリメーション法により昇華精製した。昇華精製条件は、圧力3.0Pa、アルゴンガスを流量4.0mL/minで流しながら、290℃で黄色粉末状固体を加熱した。昇華精製後、目的物の黄色固体を1.4g、収率87%で得た。
【0421】
核磁気共鳴法(NMR)によって、この化合物が目的物である4−[3−(9,10−ジフェニル−2−アントリル)フェニル]ジベンゾチオフェン(略称:2mDBTPPA−II)であることを確認した。
【0422】
得られた物質の1H NMRデータを以下に示す。
1H NMR(CDCl3,300MHz):δ=7.33(q,J1=3.3Hz,2H),7.46−7.73(m,20H),7.80−7.87(m,2H),7.99(st,J1=1.8Hz,1H),8.03(sd,J1=1.5Hz,1H),8.14−8.20(m,2H)
【0423】
(参考例6)
上記実施例で用いた4−[3−(9,10−ジフェニル−2−アントリル)フェニル]ジベンゾフラン(略称:2mDBFPPA−II)の合成方法について説明する。2mDBFPPA−IIの構造を以下に示す。
【0424】
【化27】

【0425】
2mDBFPPA−IIの合成方法を合成スキーム(F−1)に示すと共に、その反応に関し以下において詳述する。
【0426】
【化28】

【0427】
2−ブロモ−9,10−ジフェニルアントラセン1.2g(3.0mmol)、3−(ジベンゾフラン−4−イル)フェニルボロン酸0.87g(3.0mmol)、トリ(オルト−トリル)ホスフィン0.23g(0.75mmol)を、100mL三口フラスコに入れ、フラスコ内を窒素置換した。この混合物に、トルエン15mL、エタノール5.0mL、2.0mol/L炭酸カリウム水溶液3.0mLを加えた。この混合物を減圧しながら攪拌することで脱気した。
【0428】
この混合物に酢酸パラジウム(II)34mg(0.15mmol)を加え、窒素気流下、80℃で4時間攪拌した。攪拌後、この混合物の水層を酢酸エチルで抽出し、抽出溶液と有機層を合わせて、飽和食塩水で洗浄した。有機層を硫酸マグネシウムにより乾燥し、乾燥後この混合物を自然濾過した。得られた濾液を濃縮して得た固体をシリカゲルカラムクロマトグラフィーにより精製した。クロマトグラフィーは、ヘキサン:トルエン=5:1の混合溶媒を展開溶媒に用いて行った。得られた固体をトルエンとヘキサンの混合溶媒により再結晶化したところ、目的物の黄色粉末を1.4g、収率79%で得た。
【0429】
得られた黄色粉末状固体1.4gをトレインサブリメーション法により昇華精製した。昇華精製条件は、圧力3.0Pa、アルゴンガスを流量4.0mL/minで流しながら、270℃で黄色粉末状固体を加熱した。昇華精製後、目的物の黄色固体を1.1g、収率81%で得た。
【0430】
核磁気共鳴法(NMR)によって、この化合物が目的物である4−[3−(9,10−ジフェニル−2−アントリル)フェニル]ジベンゾフラン(略称:2mDBFPPA−II)であることを確認した。
【0431】
得られた物質の1H NMRデータを以下に示す。
1H NMR(CDCl3,300MHz):δ=7.31−7.67(m,19H),7.69−7.73(m,3H),7.80−7.86(m,2H),7.95(dd,J1=0.90Hz,J2=1.8Hz,1H),7.98−8.01(m,2H),8.07(s,1H)
【0432】
(参考例7)
上記実施例で用いた4−フェニル−4’−(9−フェニルフルオレン−9−イル)トリフェニルアミン(略称:BPAFLP)の合成方法について具体的に説明する。BPAFLPの構造を以下に示す。
【0433】
【化29】

【0434】
<ステップ1:9−(4−ブロモフェニル)−9−フェニルフルオレンの合成法>
100mL三口フラスコにて、マグネシウムを1.2g(50mmol)減圧下で30分加熱撹拌し、マグネシウムを活性化させた。これを室温にまで冷まして窒素雰囲気にした後、ジブロモエタン数滴を加えて発泡、発熱するのを確認した。ここにジエチルエーテル10mL中に溶かした2−ブロモビフェニルを12g(50mmol)ゆっくり滴下した後、2.5時間加熱還流撹拌してグリニヤール試薬とした。
【0435】
4−ブロモベンゾフェノンを10g(40mmol)、ジエチルエーテルを100mL、を500mL三口フラスコに入れた。ここに先に合成したグリニヤール試薬をゆっくり滴下した後、9時間加熱還流撹拌した。
【0436】
反応後、この混合液を濾過して濾物を得た。得られた濾物を酢酸エチル150mLに溶かし、ここに1N−塩酸を酸性になるまで加えて2時間撹拌した。この液体の有機層の部分を水で洗浄し、硫酸マグネシウムを加えて水分を取り除いた。この懸濁液を濾過し、得られた濾液を濃縮し粘性の高い物質を得た。
【0437】
500mLなすフラスコに、この粘性の高い物質と、氷酢酸50mLと、塩酸1.0mLとを入れ、窒素雰囲気下、130℃で1.5時間加熱撹拌し、反応させた。
【0438】
反応後、この反応混合液を濾過して濾物を得た。得られた濾物を水、水酸化ナトリウム水溶液、水、メタノールの順で洗浄したのち乾燥させ、目的物の白色粉末を収量11g、収率69%で得た。また、上記合成法の反応スキームを下記(G−1)に示す。
【0439】
【化30】

【0440】
<ステップ2:4−フェニル−4’−(9−フェニルフルオレン−9−イル)トリフェニルアミン(略称:BPAFLP)の合成法>
100mL三口フラスコへ、9−(4−ブロモフェニル)−9−フェニルフルオレンを3.2g(8.0mmol)、4−フェニル−ジフェニルアミンを2.0g(8.0mmol)、ナトリウム tert−ブトキシドを1.0g(10mmol)、ビス(ジベンジリデンアセトン)パラジウム(0)を23mg(0.04mmol)加え、フラスコ内の雰囲気を窒素置換した。この混合物へ、脱水キシレン20mLを加えた。この混合物を、減圧下で攪拌しながら脱気した後、トリ(tert−ブチル)ホスフィン(10wt%ヘキサン溶液)0.2mL(0.1mmol)を加えた。この混合物を、窒素雰囲気下、110℃で2時間加熱撹拌し、反応させた。
【0441】
反応後、この反応混合液にトルエン200mLを加え、この懸濁液をフロリジール、セライトを通して濾過した。得られた濾液を濃縮し、シリカゲルカラムクロマトグラフィー(展開溶媒 トルエン:ヘキサン=1:4)による精製を行った。得られたフラクションを濃縮し、アセトンとメタノールを加えて超音波をかけたのち、再結晶化したところ、目的物の白色粉末を収量4.1g、収率92%で得た。また、上記合成法の反応スキームを下記(G−2)に示す。
【0442】
【化31】

【0443】
シリカゲル薄層クロマトグラフィー(TLC)でのRf値(展開溶媒 酢酸エチル:ヘキサン=1:10)は、目的物は0.41、9−(4−ブロモフェニル)−9−フェニルフルオレンは0.51、4−フェニル−ジフェニルアミンは0.27だった。
【0444】
上記ステップ2で得られた化合物を核磁気共鳴法(NMR)により測定した。以下に測定データを示す。測定結果から、フルオレン誘導体であるBPAFLP(略称)が得られたことがわかった。
【0445】
1H NMR(CDCl3,300MHz):δ(ppm)=6.63−7.02(m、3H)、7.06−7.11(m、6H)、7.19−7.45(m、18H)、7.53−7.55(m、2H)、7.75(d、J=6.9Hz、2H)。
【0446】
(参考例8)
上記実施例で用いたN,N’−ビス〔4−(9−フェニル−9H−フルオレン−9−イル)フェニル〕−N,N’−ジフェニルピレン−1,6−ジアミン(略称:1,6FLPAPrn)の合成方法について具体的に説明する。1,6FLPAPrnの構造を以下に示す。
【0447】
【化32】

【0448】
1,6−ジブロモピレン3.0g(8.3mmol)、4−(9−フェニル−9H−フルオレン−9−イル)ジフェニルアミン(略称:FLPA)6.8g(17mmol)を300mLの三口フラスコへ入れ、フラスコ内を窒素置換した。この混合物へ、100mLのトルエンと、トリ(tert−ブチル)ホスフィンの10wt%ヘキサン溶液0.10mLと、ナトリウム tert−ブトキシド2.4g(25mmol)を加えた。この混合物を、減圧下で攪拌しながら脱気した。この混合物を80℃で加熱して原料が溶けるのを確認してから、ビス(ジベンジリデンアセトン)パラジウム(0)48mg(0.083mmol)を加えた。この混合物を、80℃で1.5時間攪拌した。攪拌後、析出した黄色固体を、混合物を冷まさずに吸引濾過により回収した。得られた固体を3Lのトルエンに懸濁し、110℃で加熱した。この懸濁液を110℃のままアルミナ、セライト、フロリジールを通して吸引濾過し、さらに110℃に熱した200mLのトルエンを流した。得られた濾液を約300mLまで濃縮して再結晶化したところ、目的物を5.7g、収率67%で得た。
【0449】
得られた黄色固体3.56gをトレインサブリメーション法により昇華精製した。昇華精製条件は、圧力5.0Pa、アルゴンガスを流量5.0mL/minで流しながら、353℃で加熱した。昇華精製後、目的物の黄色固体2.54g、収率71%で得た。上記合成例の合成スキームを下記(H−1)に示す。
【0450】
【化33】

【0451】
核磁気共鳴法(NMR)及びMSスペクトルによって、合成例によって得られた化合物が目的物であるN,N’−ビス〔4−(9−フェニル−9H−フルオレン−9−イル)フェニル〕−N,N’−ジフェニルピレン−1,6−ジアミン(略称:1,6FLPAPrn)であることを確認した。
【0452】
上記合成例で得られた化合物の1H NMRデータを以下に示す。
1H NMR(CDCl3,300MHz):δ=6.88−6.91(m,6H),7.00−7.03(m,8H),7.13−7.40(m,26H),7.73−7.80(m,6H),7.87(d,J=9.0Hz,2H),8.06−8.09(m,4H)
【0453】
(参考例9)
上記実施例で用いた3−[4−(9−フェナントリル)−フェニル]−9−フェニル−9H−カルバゾール(略称:PCPPn)の合成方法について具体的に説明する。PCPPnの構造を以下に示す。
【0454】
【化34】

【0455】
<ステップ1:4−(9−フェニル−9H−カルバゾール−3−イル)フェニルボロン酸の合成法>
300mL三口フラスコに、3−(4−ブロモフェニル)−9−フェニル−9H−カルバゾールを8.0g(20mmol)入れ、フラスコ内の雰囲気を窒素置換したのち、脱水テトラヒドロフラン(略称:THF)100mLを加えて−78℃にした。この混合液に1.65mol/Lのn−ブチルリチウムヘキサン溶液15mL(24mmol)を滴下し、2時間撹拌した。この混合物にホウ酸トリメチル3.4mL(30mmol)を加え、−78℃で2時間、室温で18時間撹拌した。反応後、この反応溶液に1M希塩酸を酸性になるまで加えて7時間撹拌した。これを酢酸エチルで抽出し、得られた有機層を飽和食塩水で洗浄した。洗浄後、有機層に硫酸マグネシウムを加えて水分を吸着させた。この懸濁液を濾過し、得られた濾液を濃縮し、ヘキサンを加え超音波をかけたのち、再結晶したところ、目的の白色粉末を収量6.4g、収率88%で得た。上記ステップ1の反応スキームを下記(I−1)に示す。
【0456】
【化35】

【0457】
シリカゲル薄層クロマトグラフィー(TLC)でのRf値(展開溶媒 酢酸エチル:ヘキサン=1:10)は、目的物は0(原点)であり、3−(4−ブロモフェニル)−9−フェニル−9H−カルバゾールは0.53だった。また、展開溶媒に酢酸エチルを用いたシリカゲル薄層クロマトグラフィー(TLC)でのRf値は、目的物は0.72で、3−(4−ブロモフェニル)−9−フェニル−9H−カルバゾールは0.93だった。
【0458】
<ステップ2:3−[4−(9−フェナントリル)−フェニル]−9−フェニル−9H−カルバゾール(略称:PCPPn)の合成法>
200mL三口フラスコへ9−フェニル−9H−カルバゾール−3−イル−フェニル−4−ボロン酸を1.5g(5.0mmol)、9−ブロモフェナントレンを3.2g(11mmol)、酢酸パラジウム(II)を11mg(0.1mmol)、トリ(オルト−トリル)ホスフィンを30mg(0.1mmol)、トルエン30mL、エタノール3mL、2mol/L炭酸カリウム水溶液5mLの混合物を、減圧下で攪拌しながら脱気した後、窒素雰囲気下、90℃で6時間加熱撹拌し、反応させた。
【0459】
反応後、この反応混合液にトルエン200mLを加え、この混合液の有機層をフロリジール、アルミナ、セライトを通して濾過した。得られた濾液を水で洗浄し、硫酸マグネシウムを加えて水分を吸着させた。この懸濁液を濾過して濾液を得た。得られた濾液を濃縮し、シリカゲルカラムクロマトグラフィーによる精製を行った。このとき、クロマトグラフィーの展開溶媒として、トルエンとヘキサンの混合溶媒(トルエン:ヘキサン=1:4)を用いた。得られたフラクションを濃縮し、アセトンとメタノールを加えて超音波をかけたのち、再結晶したところ、目的物の白色粉末を収量2.2g、収率75%で得た。ステップ2の反応スキームを下記(I−2)に示す。
【0460】
【化36】

【0461】
シリカゲル薄層クロマトグラフィー(TLC)でのRf値(展開溶媒 酢酸エチル:ヘキサン=1:10)は、目的物は0.33、9−ブロモフェナントレンは0.70だった。
【0462】
また、得られた化合物を核磁気共鳴法(NMR)により測定した。以下に測定データを示す。
1H NMR(CDCl3,300MHz):δ(ppm)=7.30−7.35(m,11H),7.43−7.78(m,16H),7.86−7.93(m,3H),8.01(dd,J=0.9Hz,7.8Hz,1H),8.23(d,J=7.8Hz,1H),8.47(d,J=1.5Hz,1H),8.74(d,J=8.1Hz,1H),8.80(d,J=7.8Hz,1H)。
【0463】
(参考例10)
上記実施例で用いた3−〔4−(ジベンゾチオフェン−4−イル)−フェニル〕−9−フェニル−9H−カルバゾール(略称:DBTPPC−II)の合成方法について具体的に説明する。DBTPPC−IIの構造を以下に示す。
【0464】
【化37】

【0465】
100mL三口フラスコにて、3−(4−ブロモフェニル)−9−フェニル−9H−カルバゾール2.4g(6.0mmol)、ジベンゾチオフェン−4−ボロン酸1.7g(6.0mmol)、酢酸パラジウム(II)13mg(0.1mmol)、トリ(オルト−トリル)ホスフィン36mg(0.1mmol)、トルエン20mL、エタノール3mL、2mol/L炭酸カリウム水溶液5mLの混合物を、減圧下で攪拌しながら脱気した後、窒素雰囲気下、90℃で4時間加熱しながら撹拌し、反応させた。
【0466】
反応後、この反応混合液にトルエン200mLを加え、この混合液の有機層をフロリジール(和光純薬工業株式会社、カタログ番号:540−00135)、アルミナ(メルク、中性)、セライト(和光純薬工業株式会社、カタログ番号:531−16855)を通して濾過した。得られた濾液を水で洗浄した後、硫酸マグネシウムを加えて水分を吸着させた。この懸濁液を濾過して濾液を得た。得られた濾液を濃縮し、シリカゲルカラムクロマトグラフィーによる精製を行った。クロマトグラフィーの展開溶媒としては、トルエンとヘキサンの混合溶媒(トルエン:ヘキサン=1:4)を用いた。得られたフラクションを濃縮し、アセトンとメタノールを加えて超音波をかけたのち、再結晶したところ、白色粉末を収量2.3g、収率77%で得た。また、上記合成法の反応スキームを下記(J−1)に示す。
【0467】
【化38】

【0468】
シリカゲル薄層クロマトグラフィー(TLC)でのRf値(展開溶媒 酢酸エチル:ヘキサン=1:10)は、上記反応で得られた白色粉末は0.40、3−(4−ブロモフェニル)−9−フェニル−9H−カルバゾールは0.60だった。
【0469】
上記反応で得られた白色粉末を核磁気共鳴法(NMR)により測定した。以下に測定データを示す。測定結果から、上記反応で得られた白色粉末が目的物であるDBTPPC−IIであることを確認した。
【0470】
1H NMR(CDCl3,300MHz):δ(ppm)=7.30−7.36(m,1H),7.44−7.52(m,6H),7.55−7.67(m,6H),7.75(dd,J=8.7Hz,1.5Hz,1H),7.85−7.88(m,5H),8.16−8.24(m,3H),8.46(d,J=1.5Hz,1H)。
【0471】
(参考例11)
上記実施例で用いた3−〔3−(ジベンゾチオフェン−4−イル)−フェニル〕−9−フェニル−9H−カルバゾール(略称:mDBTPPC−II)の合成方法について具体的に説明する。mDBTPPC−IIの構造を以下に示す。
【0472】
【化39】

【0473】
100mL三口フラスコにて3−(3−ブロモフェニル)−9−フェニル−9H−カルバゾール2.4g(6.0mmol)、ジベンゾチオフェン−4−ボロン酸1.7g(6.0mmol)、酢酸パラジウム(II)13mg(0.1mmol)、トリ(オルト−トリル)ホスフィン36mg(0.1mmol)、トルエン20mL、エタノール3mL、2mol/L炭酸カリウム水溶液5mLの混合物を、減圧下で攪拌しながら脱気した後、窒素雰囲気下、90℃で6時間加熱しながら撹拌し、反応させた。
【0474】
反応後、この反応混合液にトルエン200mLを加え、この混合液の有機層をフロリジール(和光純薬工業株式会社、カタログ番号:540−00135)、アルミナ(メルク、中性)、セライト(和光純薬工業株式会社、カタログ番号:531−16855)を通して濾過した。得られた濾液を水で洗浄した後、硫酸マグネシウムを加えて水分を吸着させた。この懸濁液を濾過して濾液を得た。得られた濾液を濃縮し、シリカゲルカラムクロマトグラフィーによる精製を行った。クロマトグラフィーの展開溶媒は、トルエンとヘキサンの混合溶媒(トルエン:ヘキサン=1:4)を用いた。得られたフラクションを濃縮し、アセトンとヘキサンを加えて超音波をかけたのち、再結晶したところ、白色粉末を収量2.6g、収率87%で得た。また、上記合成法の反応スキームを下記(K−1)に示す。
【0475】
【化40】

【0476】
シリカゲル薄層クロマトグラフィー(TLC)でのRf値(展開溶媒 酢酸エチル:ヘキサン=1:10)は、上記反応で得られた白色粉末は0.38、3−(3−ブロモフェニル)−9−フェニル−9H−カルバゾールは0.54だった。
【0477】
上記反応で得られた白色粉末を核磁気共鳴法(NMR)により測定した。以下に測定データを示す。測定結果から、上記反応で得られた白色粉末はmDBTPPC−IIがであることを確認した。
【0478】
1H NMR(CDCl3,300MHz):δ(ppm)=7.27−7.33(m,1H),7.41−7.51(m,6H),7.58−7.65(m,7H),7.70−7.86(m,4H),8.12(t,J=1.5Hz,1H),8.17−8.22(m,3H),8.44(d,J=1.8Hz,1H)。
【0479】
(参考例12)
上記実施例で用いた4−[4−(9−フェナントリル)フェニル]ジベンゾチオフェン(略称:DBTPPn−II)の合成方法について具体的に説明する。DBTPPn−IIの構造を以下に示す。
【0480】
【化41】

【0481】
1.2g(3.6mmol)の9−(4−ブロモフェニル)フェナントレンと、0.8g(3.5mmol)のジベンゾチオフェン−4−ボロン酸と、53mg(0.2mmol)のトリ(オルト−トリル)ホスフィンを50mLの三口フラスコに入れ、フラスコ内を窒素置換した。この混合物に3.5mLの2.0M炭酸カリウム水溶液と、13mLのトルエンと、4.0mLのエタノールを加え、減圧下で攪拌することにより脱気した。この混合物に8.0mg(36μmol)の酢酸パラジウム(II)を加え、窒素気流下、80℃で7時間攪拌した。所定時間経過後、得られた混合物の水層から有機物をトルエンで抽出した。
【0482】
得られた抽出溶液と有機層を合わせ、飽和食塩水で洗浄後、硫酸マグネシウムで乾燥した。この混合物を自然濾過により濾別し、濾液を濃縮して油状物を得た。この油状物をシリカゲルカラムクロマトグラフィーにより精製した。カラムクロマトグラフィーはヘキサン:トルエン=20:1を展開溶媒として用いることにより行った。得られたフラクションを濃縮して油状物を得た。この油状物をトルエンとヘキサンの混合溶媒で再結晶したところ、目的物である白色粉末を収量0.8g、収率53%で得た。
【0483】
得られた白色粉末0.8gをトレインサブリメーション法により昇華精製した。昇華精製は、圧力2.4Pa、アルゴン流量5mL/minの条件で、白色粉末を240℃で加熱して行った。昇華精製後、白色粉末を収量0.7g、収率88%で得た。上述の合成スキームを下記(L−1)に示す。
【0484】
【化42】

【0485】
核磁気共鳴法(NMR)によって、この化合物が目的物である4−[4−(9−フェナントリル)フェニル]ジベンゾチオフェン(略称:DBTPPn−II)であることを確認した。
【0486】
得られた化合物の1H NMRデータを以下に示す。
1H NMR(CDCl3,300MHz):δ(ppm)=7.46−7.53(m,2H),7.58−7.73(m,8H),7.80(s,1H),7.87−7.96(m,4H),8.07(d,J=8.1Hz,1H),8.18−8.24(m,2H),8.76(d,J=8.1Hz,1H),8.82(d,J=7.8Hz,1H)。
【0487】
(参考例13)
上記実施例で用いた4,4’−{(1,1’:2’,1’’:2’’,1’’’)−クアテルフェニル−3,3’’’−イル}−ビスジベンゾチオフェン(略称:mZ−DBT2−II)の合成方法について説明する。
【0488】
【化43】

【0489】
200ml三口フラスコにて、2,2’−ジブロモビフェニル1.0g(3.2mmol)、3−(ジベンゾチオフェン−4−イル)−フェニルボロン酸2.1g(6.7mmol)、テトラキス(トリフェニルホスフィン)パラジウム(0)47mg(40μmol)、トルエン20mL、エタノール2mL、2mol/L炭酸カリウム水溶液7mLの混合物を、減圧下で攪拌しながら脱気した後、窒素雰囲気下、85℃で6時間加熱撹拌し、その後、100℃で6時間加熱撹拌し、反応させた。さらに、テトラキス(トリフェニルホスフィン)パラジウム(0)47mg(40μmol)を混合物に加え、窒素雰囲気下、100℃で2時間加熱撹拌し、反応させた。
【0490】
反応後、この反応混合液にトルエン300mLを加え、この混合液の有機層をフロリジール(和光純薬工業株式会社、カタログ番号:540−00135)、アルミナ(メルク、中性)、セライト(和光純薬工業株式会社、カタログ番号:531−16855)を通して濾過した。得られた濾液を水で洗浄し、硫酸マグネシウムを加えて水分を吸着させた。この懸濁液を濾過して濾液を得た。得られた濾液を濃縮し、シリカゲルカラムクロマトグラフィーによる精製を行った。このとき、クロマトグラフィーの展開溶媒として、トルエンとヘキサンの混合溶媒(トルエン:ヘキサン=1:5)を用いた。得られたフラクションを濃縮し、ヘキサンを加えて超音波をかけたのち、再結晶したところ、目的物の白色粉末を収量2.2g、収率51%で得た。また、上記合成法の反応スキームを下記(M−1)に示す。
【0491】
【化44】

【0492】
シリカゲル薄層クロマトグラフィー(TLC)でのRf値(展開溶媒 酢酸エチル:ヘキサン=1:10)は、目的物は0.25だった。
【0493】
核磁気共鳴法(NMR)によって、この化合物が目的物であるmZ−DBT2−IIであることを確認した。
【0494】
得られた化合物の1H NMRデータを以下に示す。
1H NMR(CDCl3,300MHz):δ(ppm)=6.73(td,J=0.98Hz,1.95Hz,7.4Hz,2H)、7.01−7.06(m,4H)7.34−7.39(m,4H)、7.41−7.47(m,11H)、7.53−7.59(m,3H)7.69−7.72(m,2H)7.98(dd,J=1.5Hz,6.8Hz,2H)、8.08−8.11(m,2H)。
【0495】
(参考例14)
上記実施例で用いた4−{3−[3−(9−フェニル−9H−フルオレン−9−イル)フェニル]フェニル}ジベンゾフラン(略称:mmDBFFLBi−II)の合成方法について説明する。
【0496】
【化45】

【0497】
200mL三口フラスコにて、9−(3−ブロモフェニル)−9−フェニルフルオレン3.5g(8.9mmol)、3−(ジベンゾフラン−4−イル)フェニルボロン酸2.8g(9.8mmol)、酢酸パラジウム(II)22mg(0.1mmol)、トリ(オルト−トリル)ホスフィン89.5mg(0.3mmol)、トルエン38ml、エタノール3.8ml、2mol/L炭酸カリウム水溶液12.7mlの混合物を、減圧下で撹拌しながら脱気した後、窒素雰囲気下、80℃で15.5時間加熱撹拌し、反応させた。
【0498】
反応後、この反応混合液にトルエンを300mL加え、この混合液の有機層をアルミナ(メルク、中性)、セライト(和光純薬工業株式会社、カタログ番号:531−16855)を通して濾過した。得られた濾液を水で洗浄し、硫酸マグネシウムを加えて水分を吸着させた。この懸濁液をろ過して濾液を得た。得られた濾液を濃縮し、シリカゲルカラムクロマトグラフィーによる精製を行った。このとき、クロマトグラフィーの展開溶媒として、トルエンとヘキサンの混合溶媒(トルエン:ヘキサン=2:5)を用いた。得られたフラクションを濃縮し、メタノールを加えて超音波をかけた後、再結晶をしたところ、目的物の白色粉末を収量3.0g、収率60%で得た。また、上記合成法の反応スキームを下記(N−1)に示す。
【0499】
【化46】

【0500】
シリカゲル薄層クロマトグラフィー(TLC)でのRf値(展開溶媒 酢酸エチル:ヘキサン=1:10)は、目的物は0.33であった。
【0501】
核磁気共鳴法(NMR)によって、この化合物が目的物であるmmDBFFLBi−IIであることを確認した。
【0502】
得られた化合物の1H NMRデータを以下に示す。
1H NMR(CDCl3、300MHz):δ(ppm)=7.18−7.60(m,22H)、7.78(d,J=6.4Hz,2H)、7.85(td,J=1.5Hz,7.3Hz,1H)、7.96(dd,J=1.47Hz,7.81Hz,1H)、7.99−8.00(m,2H)。
【0503】
(参考例15)
上記実施例で用いた3−[4−(1−ナフチル)−フェニル]−9−フェニル−9H−カルバゾール(略称:PCPN)を製造する合成例を示す。
【0504】
【化47】

【0505】
PCPNの合成スキームを(o−1)に示す。
【0506】
【化48】

【0507】
200mL三口フラスコにて、3−ブロモ−9−フェニル−9H−カルバゾール5.0g(15.5mmol)、4−(1−ナフチル)フェニルボロン酸4.2g(17.1mmol)、酢酸パラジウム(II)38.4mg(0.2mmol)、トリ(オルト−トリル)ホスフィン104mg(0.3mmol)、トルエン50mL、エタノール5mL、2mol/L炭酸カリウム水溶液30mLの混合物を、減圧下で攪拌しながら脱気した後、窒素雰囲気下、85℃で9時間加熱撹拌し、反応させた。
【0508】
反応後、この反応混合液にトルエン500mLを加え、この混合液の有機層をフロリジール(和光純薬工業株式会社、カタログ番号:540−00135)、アルミナ、セライト(和光純薬工業株式会社、カタログ番号:531−16855)を通して濾過した。得られた濾液を水で洗浄し、硫酸マグネシウムを加えて水分を吸着させた。この懸濁液を濾過して濾液を得た。得られた濾液を濃縮し、シリカゲルカラムクロマトグラフィーによる精製を行った。このとき、クロマトグラフィーの展開溶媒として、トルエンとヘキサンの混合溶媒(トルエン:ヘキサン=1:4)を用いた。得られたフラクションを濃縮し、メタノールを加えて超音波をかけたのち、再結晶化したところ、目的物の白色粉末を収量6.24g、収率90%で得た。
【0509】
核磁気共鳴分光法(1H−NMR)によって、この化合物が目的物である3−[4−(1−ナフチル)−フェニル]−9−フェニル−9H−カルバゾール(略称:PCPN)であることを確認した。
【0510】
得られた物質の1H NMRデータを以下に示す。
1H NMR(CDCl3,300MHz):δ(ppm)=7.30−7.35(m,1H),7.44−7.67(m,14H),7.76(dd,J=8.7Hz,1.8Hz,1H),7.84−7.95(m,4H),8.04(d,J=7.8,1H),8.23(d,J=7.8,1H),8.46(d,J=1.5,1H)。
【符号の説明】
【0511】
100 基板
101 第1の電極
102 EL層
108 第2の電極
401 ソース側駆動回路
402 画素部
403 ゲート側駆動回路
404 封止基板
405 シール材
407 空間
408 配線
409 FPC(フレキシブルプリントサーキット)
410 素子基板
411 スイッチング用TFT
412 電流制御用TFT
413 第1の電極
414 絶縁物
416 EL層
417 第2の電極
418 発光素子
423 nチャネル型TFT
424 pチャネル型TFT
501 基板
502 第1の電極
503 第2の電極
504 EL層
505 絶縁層
506 隔壁層
701 正孔注入層
702 正孔輸送層
703 発光層
704 電子輸送層
705 電子注入層
706 電子注入バッファー層
707 電子リレー層
708 複合材料層
800 EL層
801 EL層
802 EL層
803 電荷発生層
811 照明装置
812 照明装置
813 卓上照明器具
1100 基板
1101 第1の電極
1103 第2の電極
1111 正孔注入層
1111a 第1の正孔注入層
1111b 第2の正孔注入層
1112 正孔輸送層
1112a 第1の正孔輸送層
1112b 第2の正孔輸送層
1113 発光層
1113a 第1の発光層
1113b 第2の発光層
1114a 第1の電子輸送層
1114b 第2の電子輸送層
1115 電子注入層
1115a 第1の電子注入層
1115b 第2の電子注入層
1116 電子リレー層
7100 テレビジョン装置
7101 筐体
7103 表示部
7105 スタンド
7107 表示部
7109 操作キー
7110 リモコン操作機
7201 本体
7202 筐体
7203 表示部
7204 キーボード
7205 外部接続ポート
7206 ポインティングデバイス
7301 筐体
7302 筐体
7303 連結部
7304 表示部
7305 表示部
7306 スピーカ部
7307 記録媒体挿入部
7308 LEDランプ
7309 操作キー
7310 接続端子
7311 センサ
7312 マイクロフォン
7400 携帯電話機
7401 筐体
7402 表示部
7403 操作ボタン
7404 外部接続ポート
7405 スピーカ
7406 マイク
7501 照明部
7502 傘
7503 可変アーム
7504 支柱
7505 台
7506 電源
【技術分野】
【0001】
本発明は、有機化合物と無機化合物とを複合した複合材料、発光素子、発光装置、電子機器、及び照明装置に関する。
【背景技術】
【0002】
近年、有機エレクトロルミネッセンス(EL:Electroluminescence)を利用した発光素子の研究開発が盛んに行われている。これら発光素子の基本的な構成は、一対の電極間に発光性の有機化合物を含む層を挟んだものである。この素子に電圧を印加することにより、発光性の有機化合物からの発光を得ることができる。
【0003】
このような発光素子は自発光型であるため、液晶ディスプレイに比べ画素の視認性が高く、バックライトが不要である等の利点があり、フラットパネルディスプレイ素子として好適であると考えられている。また、このような発光素子は、薄型軽量に作製できることも大きな利点である。さらに非常に応答速度が速いことも特徴の一つである。
【0004】
また、これらの発光素子は膜状に形成することが可能であるため、大面積の素子を容易に形成することができる。このことは、白熱電球やLEDに代表される点光源、あるいは蛍光灯に代表される線光源では得難い特色であるため、照明等に応用できる面光源としての利用価値も高い。
【0005】
このように、有機ELを用いた発光素子は、発光装置や照明などへの応用が期待されている。一方で、有機ELを用いた発光素子には課題も多い。その課題の一つとして、消費電力の低減が挙げられる。消費電力を低減するためには、発光素子の駆動電圧を低減することが重要である。そして、有機ELを用いた発光素子は流れる電流量によって発光強度が決まるため、駆動電圧を低減するためには、低い電圧で多くの電流を流すことが必要となってくる。
【0006】
これまでに、駆動電圧を低減させるための手法として、バッファー層を電極と発光性の有機化合物を含む層との間に設けるという試みがなされている。例えば、カンファースルホン酸をドープしたポリアニリン(PANI)からなるバッファー層をインジウム錫酸化物(ITO:indium tin oxide)と発光層との間に設けることにより、駆動電圧を低減できることが知られている(例えば、非特許文献1参照)。これは、PANIの発光層へのキャリア注入性が優れているためと説明されている。なお、非特許文献1では、バッファー層であるPANIも電極の一部と見なしている。
【0007】
しかしながら、非特許文献1に記載してある通り、PANIは膜厚を厚くすると透過率が悪くなるという問題点がある。具体的には、250nm程度の膜厚で、透過率は70%を切ると報告されている。すなわち、バッファー層に用いている材料自体の透明性に問題があるため、素子内部で発生した光を効率良く取り出すことができない。
【0008】
また、特許文献1によれば、発光素子(特許文献1では発光ユニットと記載されている)を直列に接続することにより、ある電流密度当たりの輝度、すなわち電流効率を高めようという試みがなされている。特許文献1においては、発光素子を直列に接続する際の接続部分に、有機化合物と金属酸化物(具体的には酸化バナジウムおよび酸化レニウム)とを混合した層を適用しており、この層はホール(正孔)や電子を発光ユニットへ注入できるとされている。
【0009】
しかしながら、特許文献1で開示されている有機化合物と金属酸化物との混合層は、実施例を見てもわかる通り、赤外領域だけでなく可視光領域(500nm付近)にも大きな吸収ピークが見られ、やはり透明性に問題が生じている。これは、電荷移動相互作用により発生する吸収バンドの影響である。したがって、やはり素子内部で発生した光を効率良く取り出すことができず、素子の発光効率が低下する。
【先行技術文献】
【特許文献】
【0010】
【特許文献1】特開2003−272860号公報
【非特許文献】
【0011】
【非特許文献1】Y.Yang、他1名、アプライド フィジクス レターズ、Vol.64(10)、1245−1247(1994)
【発明の概要】
【発明が解決しようとする課題】
【0012】
そこで、本発明の一態様では、有機化合物と無機化合物とを複合した複合材料であって、キャリア輸送性の高い複合材料を提供することを課題の一とする。また、有機化合物へのキャリア注入性の高い複合材料を提供することを課題の一とする。また、電荷移動相互作用による光吸収が生じにくい複合材料を提供することを課題の一とする。
【0013】
また、本発明の一態様は、該複合材料を発光素子に適用することにより、発光効率の高い発光素子を提供することを課題の一とする。また、駆動電圧の低い発光素子を提供することを課題の一とする。また、長寿命の発光素子を提供することを課題の一とする。また、該発光素子を用いた発光装置、該発光装置を用いた電子機器、又は照明装置を提供することを課題の一とする。
【0014】
なお、以下に開示する発明は、上記課題の少なくともいずれか一つを解決することを目的とする。
【課題を解決するための手段】
【0015】
本発明の一態様は、ジベンゾチオフェン骨格又はジベンゾフラン骨格を有する複素環化合物と、該複素環化合物に対して電子受容性を示す無機化合物とを含む複合材料である。
【0016】
チオフェン及びフランは、π過剰系ヘテロ芳香環であるため、いずれもホール輸送性を示す。よって、上記複合材料は、キャリア輸送性が高い。
【0017】
また、上記複合材料は、有機化合物へのキャリア注入性が高い。また、電荷移動相互作用による光吸収が生じにくい。また、可視光に対する透光性(以下、透光性と記載する)が高い。
【0018】
また、本発明の一態様は、ジベンゾチオフェン骨格又はジベンゾフラン骨格の4位に炭素数6以上70以下の置換基が結合した複素環化合物と、該複素環化合物に対して電子受容性を示す無機化合物とを含む複合材料である。
【0019】
ジベンゾチオフェン骨格又はジベンゾフラン骨格の4位に置換基を有する複素環化合物を複合材料に用いることで、電荷移動相互作用に基づく光吸収の発生を抑制することができるため、好ましい。また、複合材料の膜質が安定化するため好ましい。
【0020】
上記複合材料において、該置換基が有する環は、ベンゼン環、ナフタレン環、フェナントレン環、トリフェニレン環、フルオレン環、ジベンゾチオフェン環、ジベンゾフラン環から選ばれる一種又は複数種であることが好ましい。これによって、電荷移動相互作用に基づく光吸収の発生を抑制するだけでなく、複素環化合物自体の吸収ピークが可視光領域(380nm〜760nm)よりも短波長側に生じるよう制御できるため、透光性が特に高い複合材料を得ることができる。
【0021】
特に、置換基が有する環は、ベンゼン環、フルオレン環、ジベンゾチオフェン環、ジベンゾフラン環から選ばれる一種又は複数種であることが好ましい。これによって、該無機化合物との間に、電荷移動相互作用に基づく光吸収がほとんど生じなくなる。
【0022】
また、本発明の一態様は、ジベンゾチオフェン骨格又はジベンゾフラン骨格の4位にフェニル基が結合し、フェニル基が1以上の置換基を有し、フェニル基及び1以上の置換基の炭素数の総和が12以上70以下である複素環化合物と、該複素環化合物に対して電子受容性を示す無機化合物とを含む複合材料である。
【0023】
ジベンゾチオフェン骨格又はジベンゾフラン骨格の4位に共役が小さいフェニル基が結合した複素環化合物を複合材料に用いることで、電荷移動相互作用に基づく光吸収の発生を抑制することができるため、好ましい。また、複合材料の膜質が安定化するため好ましい。また、共役が広がりにくくなるため、透光性向上の観点でも有効である。
【0024】
上記複合材料において、該1以上の置換基が有する環は、それぞれ独立に、ベンゼン環、ナフタレン環、フェナントレン環、トリフェニレン環、フルオレン環、ジベンゾチオフェン環、ジベンゾフラン環から選ばれる一種又は複数種であることが好ましい。これによって、電荷移動相互作用に基づく光吸収の発生を抑制するだけでなく、複素環化合物自体の吸収ピークが可視光領域よりも短波長側に生じるように制御できるため、特に透光性の高い複合材料を得ることができる。
【0025】
特に、該1以上の置換基が有する環は、それぞれ独立に、ベンゼン環、フルオレン環、ジベンゾチオフェン環、ジベンゾフラン環から選ばれる一種又は複数種であることが好ましい。これによって、該無機化合物との間に、電荷移動相互作用に基づく光吸収がほとんど生じなくなる。
【0026】
また、本発明の一態様は、一般式(G1)で表される複素環化合物と、該複素環化合物に対して電子受容性を示す無機化合物とを含む複合材料である。
【0027】
【化1】

【0028】
式中、Aは酸素又は硫黄を表し、R1〜R7は、それぞれ独立に、水素、炭素数1〜4のアルキル基、又は環を構成する炭素数が6〜25のアリール基を表し、R8〜R12は、それぞれ独立に、水素、置換もしくは無置換のフェニル基、置換もしくは無置換のナフチル基、置換もしくは無置換のフェナントリル基、置換もしくは無置換のトリフェニレニル基、置換もしくは無置換のフルオレニル基、置換もしくは無置換のジベンゾチオフェニル基、又は置換もしくは無置換のジベンゾフラニル基を表す。ただし、R8〜R12のうち、少なくとも1つは、置換もしくは無置換のフェニル基、置換もしくは無置換のナフチル基、置換もしくは無置換のフェナントリル基、置換もしくは無置換のトリフェニレニル基、置換もしくは無置換のフルオレニル基、置換もしくは無置換のジベンゾチオフェニル基、又は置換もしくは無置換のジベンゾフラニル基を表す。
【0029】
特に、R8〜R12は、それぞれ独立に、水素、置換もしくは無置換のフェニル基、置換もしくは無置換のフルオレニル基、置換もしくは無置換のジベンゾチオフェニル基、又は置換もしくは無置換のジベンゾフラニル基を表すことが好ましい。ただし、R8〜R12のうち、少なくとも1つは、置換もしくは無置換のフェニル基、置換もしくは無置換のフルオレニル基、置換もしくは無置換のジベンゾチオフェニル基、又は置換もしくは無置換のジベンゾフラニル基を表す。
【0030】
また、本発明の一態様は、ジベンゾチオフェン骨格又はジベンゾフラン骨格を有する複素環化合物と、遷移金属酸化物とを含む複合材料である。
【0031】
上記複合材料は、キャリア輸送性が高い。また、有機化合物へのキャリア注入性が高い。また、電荷移動相互作用による光吸収が生じにくい。また、透光性が高い。
【0032】
また、本発明の一態様は、ジベンゾチオフェン骨格又はジベンゾフラン骨格の4位に炭素数6以上70以下の置換基が結合した複素環化合物と、遷移金属酸化物とを含む複合材料である。
【0033】
ジベンゾチオフェン骨格又はジベンゾフラン骨格の4位に置換基を有する複素環化合物を複合材料に用いることで、電荷移動相互作用に基づく光吸収の発生を抑制することができるため、好ましい。また、複合材料の膜質が安定化するため好ましい。
【0034】
上記複合材料において、該置換基が有する環は、ベンゼン環、ナフタレン環、フェナントレン環、トリフェニレン環、フルオレン環、ジベンゾチオフェン環、ジベンゾフラン環から選ばれる一種又は複数種であることが好ましい。これによって、電荷移動相互作用に基づく光吸収の発生を抑制するだけでなく、複素環化合物自体の吸収ピークが可視光領域よりも短波長側に生じるよう制御できるため、特に透光性の高い複合材料を得ることができる。
【0035】
特に、該置換基が有する環は、ベンゼン環、フルオレン環、ジベンゾチオフェン環、ジベンゾフラン環から選ばれる一種又は複数種であることが好ましい。これによって、該遷移金属酸化物との間に、電荷移動相互作用に基づく光吸収がほとんど生じなくなる。
【0036】
また、本発明の一態様は、ジベンゾチオフェン骨格又はジベンゾフラン骨格の4位にフェニル基が結合し、フェニル基が1以上の置換基を有し、フェニル基及び1以上の置換基の炭素数の総和が12以上70以下である複素環化合物と、遷移金属酸化物とを含む複合材料である。
【0037】
ジベンゾチオフェン骨格又はジベンゾフラン骨格の4位に共役が小さいフェニル基が結合した複素環化合物を複合材料に用いることで、電荷移動相互作用に基づく光吸収の発生を抑制することができるため好ましい。また、複合材料の膜質が安定化するため好ましい。また、共役が広がりにくくなるため、透光性向上の観点でも有効である。
【0038】
上記複合材料において、該1以上の置換基が有する環は、それぞれ独立に、ベンゼン環、ナフタレン環、フェナントレン環、トリフェニレン環、フルオレン環、ジベンゾチオフェン環、ジベンゾフラン環から選ばれる一種又は複数種であることが好ましい。これによって、電荷移動相互作用に基づく光吸収の発生を抑制するだけでなく、複素環化合物自体の吸収ピークが可視光領域よりも短波長側に生じるよう制御できるため、特に透光性の高い複合材料を得ることができる。
【0039】
特に、該1以上の置換基が有する環は、それぞれ独立に、ベンゼン環、フルオレン環、ジベンゾチオフェン環、ジベンゾフラン環から選ばれる一種又は複数種であることが好ましい。これによって、該遷移金属酸化物との間に、電荷移動相互作用に基づく光吸収がほとんど生じなくなる。
【0040】
また、本発明の一態様は、一般式(G1)で表される複素環化合物と、遷移金属酸化物とを含む複合材料である。
【0041】
【化2】

【0042】
式中、Aは酸素又は硫黄を表し、R1〜R7は、それぞれ独立に、水素、炭素数1〜4のアルキル基、又は環を構成する炭素数が6〜25のアリール基を表し、R8〜R12は、それぞれ独立に、水素、置換もしくは無置換のフェニル基、置換もしくは無置換のナフチル基、置換もしくは無置換のフェナントリル基、置換もしくは無置換のトリフェニレニル基、置換もしくは無置換のフルオレニル基、置換もしくは無置換のジベンゾチオフェニル基、又は置換もしくは無置換のジベンゾフラニル基を表す。ただし、R8〜R12のうち、少なくとも1つは、置換もしくは無置換のフェニル基、置換もしくは無置換のナフチル基、置換もしくは無置換のフェナントリル基、置換もしくは無置換のトリフェニレニル基、置換もしくは無置換のフルオレニル基、置換もしくは無置換のジベンゾチオフェニル基、又は置換もしくは無置換のジベンゾフラニル基を表す。
【0043】
特に、R8〜R12は、それぞれ独立に、水素、置換もしくは無置換のフェニル基、置換もしくは無置換のフルオレニル基、置換もしくは無置換のジベンゾチオフェニル基、又は置換もしくは無置換のジベンゾフラニル基を表すことが好ましい。ただし、R8〜R12のうち、少なくとも1つは、置換もしくは無置換のフェニル基、置換もしくは無置換のフルオレニル基、置換もしくは無置換のジベンゾチオフェニル基、又は置換もしくは無置換のジベンゾフラニル基を表す。
【0044】
また、上記複合材料に含まれる遷移金属酸化物としては、チタン酸化物、バナジウム酸化物、モリブデン酸化物、タングステン酸化物、レニウム酸化物、ルテニウム酸化物、クロム酸化物、ジルコニウム酸化物、ハフニウム酸化物、タンタル酸化物、銀酸化物から選ばれる一種又は複数種であることが好ましい。
【0045】
上記複合材料に用いる複素環化合物の最高被占有軌道準位(HOMO準位)は、光電子分光法での測定値が−5.7eV以下であることが好ましい。
【0046】
また、本発明の一態様は、一対の電極間に発光物質を含む層(以下、EL層とも記す)を有し、発光物質を含む層は、上記複合材料を含む層を有する発光素子である。
【0047】
上記発光素子において、複合材料を含む層は、一対の電極のうち、陽極として機能する電極と接することが好ましい。また、複合材料を含む層は、一対の電極のうち、陰極として機能する電極と接することが好ましい。
【0048】
また、上記発光素子は、複合材料を含む層を2層有していても良く、該複合材料を含む層のうち、一方の層は、一対の電極のうち陽極として機能する電極と接し、他方の層は、陰極として機能する電極と接することが好ましい。
【0049】
また、本発明の一態様は、一対の電極間に発光物質を含む層を複数有し、複数の発光物質を含む層の間に、上記複合材料を含む層を有する発光素子である。すなわち、複数の発光ユニットを積層した構成の有機EL発光素子(タンデム型の有機EL発光素子)における中間層(電荷発生層とも記す)に、上記複合材料を用いることができる。
【0050】
また、本発明の一態様は、上記発光素子を有する発光装置である。また、該発光装置を表示部に有する電子機器である。また、該発光素子を発光部に有する照明装置である。
【発明の効果】
【0051】
本発明の一態様によれば、有機化合物と無機化合物とを複合した複合材料であって、キャリア輸送性の高い複合材料を提供することができる。また、有機化合物へのキャリア注入性の高い複合材料を提供することができる。また、電荷移動相互作用による光吸収が生じにくい複合材料を提供することができる。
【0052】
また、本発明の一態様によれば、該複合材料を発光素子に適用することにより、発光効率の高い発光素子を提供することができる。また、駆動電圧の低い発光素子を提供することができる。また、長寿命の発光素子を提供することができる。また、該発光素子を用いた発光装置、該発光装置を用いた電子機器、又は照明装置を提供することができる。
【図面の簡単な説明】
【0053】
【図1】本発明の一態様の発光素子を示す図。
【図2】本発明の一態様の発光素子を示す図。
【図3】本発明の一態様の発光装置を示す図。
【図4】本発明の一態様の発光装置を示す図。
【図5】本発明の一態様の電子機器を示す図。
【図6】本発明の一態様の照明装置を示す図。
【図7】本発明の一態様の複合材料の吸光度を示す図。
【図8】本発明の一態様の複合材料の吸光度を示す図。
【図9】本発明の一態様の複合材料の吸光度を示す図。
【図10】本発明の一態様の複合材料の吸光度を示す図。
【図11】本発明の一態様の複合材料の吸光度を示す図。
【図12】本発明の一態様の複合材料の吸光度を示す図。
【図13】本発明の一態様の複合材料の吸光度を示す図。
【図14】本発明の一態様の複合材料の吸光度を示す図。
【図15】本発明の一態様の複合材料の吸光度を示す図。
【図16】実施例の発光素子を示す図。
【図17】実施例2の発光素子の電圧−輝度特性を示す図。
【図18】実施例2の発光素子の輝度−電流効率特性を示す図。
【図19】実施例2の発光素子の信頼性試験の結果を示す図。
【図20】実施例3の発光素子の電圧−輝度特性を示す図。
【図21】実施例3の発光素子の輝度−電流効率特性を示す図。
【図22】実施例3の発光素子の信頼性試験の結果を示す図。
【図23】実施例4の発光素子の電圧−輝度特性を示す図。
【図24】実施例4の発光素子の輝度−電流効率特性を示す図。
【図25】本発明の一態様の複合材料の吸光度を示す図。
【図26】本発明の一態様の複合材料の吸光度を示す図。
【図27】本発明の一態様の複合材料の吸光度を示す図。
【図28】本発明の一態様の複合材料の吸光度を示す図。
【図29】本発明の一態様の複合材料の吸光度を示す図。
【図30】実施例6の発光素子の電圧−輝度特性を示す図。
【図31】実施例6の発光素子の輝度−電流効率特性を示す図。
【図32】実施例6の発光素子の信頼性試験の結果を示す図。
【図33】実施例7の発光素子の電圧−輝度特性を示す図。
【図34】実施例7の発光素子の輝度−電流効率特性を示す図。
【図35】実施例8の発光素子の電圧−輝度特性を示す図。
【図36】実施例8の発光素子の輝度−電流効率特性を示す図。
【図37】実施例9の発光素子の電圧−輝度特性を示す図。
【図38】実施例9の発光素子の輝度−電流効率特性を示す図。
【図39】PCzPAと、その複合材料の吸光度を示す図。
【図40】NPBと、その複合材料の吸光度を示す図。
【図41】実施例10のESR測定の結果に係る図。
【図42】実施例10のESR測定の結果に係る図。
【発明を実施するための形態】
【0054】
実施の形態について、図面を用いて詳細に説明する。但し、本発明は以下の説明に限定されず、本発明の趣旨及びその範囲から逸脱することなくその形態及び詳細を様々に変更し得ることは当業者であれば容易に理解される。従って、本発明は以下に示す実施の形態の記載内容に限定して解釈されるものではない。なお、以下に説明する発明の構成において、同一部分又は同様な機能を有する部分には同一の符号を異なる図面間で共通して用い、その繰り返しの説明は省略する。
【0055】
まず、本発明の背景となる技術と本発明との相違について、概要を説明する。特許文献1で示されているように、芳香族アミンと電子受容性の無機化合物が混合された複合材料は、電子受容性の無機化合物が芳香族アミンから電子を奪うことにより、芳香族アミンにホールが、無機化合物に電子が発生すると解釈されている。換言すれば、このような複合材料は、芳香族アミンと電子受容性の無機化合物とが電荷移動錯体を形成していると解釈される。そして、このような現象を利用して、これまでにキャリア輸送性、キャリア注入性に優れた複合材料がいくつか報告されている。
【0056】
しかしながらこのような場合、一般的には、電荷移動相互作用に基づく吸収バンドが発生することが知られている。この吸収バンドは深赤色〜近赤外領域に発生すると言われているが、実際には、多くの場合、可視光領域にも吸収バンドが生じる。例えば、4,4’−ビス[N−(1−ナフチル)−N−フェニルアミノ]ビフェニル(略称:NPB又はα−NPD)と酸化バナジウム、又はNPBと酸化モリブデンを混合した複合材料は、1300nm付近の吸収バンド以外に、500nm付近にも吸収バンドが生じる。このことは、発光素子のような光学デバイスにとっては大きなデメリットとなる。
【0057】
本発明者らは、ジベンゾフラン骨格もしくはジベンゾチオフェン骨格を含む複素環化合物と電子受容性を示す無機化合物、又は、該複素環化合物と遷移金属酸化物とを複合させることにより、電荷移動相互作用に基づく光吸収が確認できない(ほとんど発生しない)にも関わらず、優れたキャリア輸送性やキャリア注入性を発現できることを見出した。従来、電荷移動相互作用によって発生するホールおよび電子が、キャリア輸送性・キャリア注入性発現の要素と考えられていたわけであるから、電荷移動相互作用による光吸収が明確に観察されないにも関わらず優れたキャリア輸送性やキャリア注入性を発現できる本発明は、その一般論とは矛盾しており、予測不可能の驚くべき機能であると言える。
【0058】
さらに、ジベンゾチオフェンやジベンゾフランは、それ自体のエネルギーギャップが大きい。したがって、ジベンゾフラン骨格もしくはジベンゾチオフェン骨格を含むことで、該複素環化合物自体が可視光領域に吸収ピークを持たない化合物となるよう設計できる。したがって、透光性向上の観点で大きなメリットがある。
【0059】
また、ジベンゾチオフェンやジベンゾフランは、サイクリックボルタンメトリ(CV)測定によると、HOMO準位が−6eV以下と非常に低い。したがって、ジベンゾフラン骨格またはジベンゾチオフェン骨格を含む複素環化合物単体は、他の有機化合物への正孔注入性には優れていると考えられるが、AlやITOに代表されるような導電材料(仕事関数が3〜5eV程度)から正孔を受け取ることは困難であると考えられる。しかしながら、本発明の一態様のような複合材料を形成することにより、他の有機化合物への優れた正孔注入性を保ちつつ、電極からの正孔注入性の問題点を克服することができる。このような複合材料の性質は、発光素子に用いた際に、駆動電圧の低減に寄与する。また、透光性が高いことから、発光効率を高めることができる。さらには、深いHOMO準位により発光素子中にキャリアの蓄積を防止できると考えられるため、長寿命化を達成できる。
【0060】
以下では、本発明の態様について、具体例を列挙しながら説明する。
【0061】
(実施の形態1)
本実施の形態では、本発明の一態様の複合材料について説明する。
【0062】
本発明の一態様の複合材料は特定の骨格を有する有機化合物と無機化合物との複合材料である。本発明の一態様の複合材料の作製方法に限定は無く、例えば、当該有機化合物と無機化合物を同時に蒸着する共蒸着法により形成することができる。本発明の一態様の複合材料において、有機化合物と無機化合物の混合比は質量比で8:1〜1:2(=有機化合物:無機化合物)程度が好ましく、さらに望ましくは4:1〜1:1(=有機化合物:無機化合物)である。混合比は複合材料を共蒸着法によって形成する場合は、有機化合物と無機化合物の蒸着レートをそれぞれ調節することによって制御することができる。
【0063】
まず、本発明の一態様の複合材料に用いることが可能な有機化合物は、ジベンゾチオフェン骨格又はジベンゾフラン骨格を有する複素環化合物である。
【0064】
該複素環化合物を複合材料に用いることで、キャリア輸送性が高い材料とすることができる。また、有機化合物へのキャリア注入性が高い材料とすることができる。また、無機化合物との電荷移動相互作用による光吸収が生じにくい材料とすることができる。また、該複素環化合物を複合材料に用いることで、透光性が高い材料とすることができる。
【0065】
特に、ジベンゾチオフェン骨格又はジベンゾフラン骨格の4位に炭素数6以上70以下の置換基が結合した複素環化合物を用いることが好ましい。ジベンゾチオフェン骨格又はジベンゾフラン骨格の4位に置換基を有する複素環化合物を複合材料に用いることで、電荷移動相互作用に基づく光吸収の発生を抑制することができるためである。また、ジベンゾチオフェンやジベンゾフランが、4位にバルキーな(嵩高い)置換基(例えば炭素数が6以上)を有する場合、ジベンゾチオフェンやジベンゾフランと該置換基との立体障害により、分子全体が立体的な骨格となる。このことにより、複合材料の膜質が安定化する。また、該複合材料を作製する際には、該複素環化合物と無機化合物とを共蒸着することが好ましいが、この場合は該複素環化合物が気化しやすいことが望まれる。したがって、分子量の観点から、該置換基の炭素数は70以下であることが好ましい。なお、該複素環化合物の分子量としては、1200以下程度が好ましい。
【0066】
なお、本発明者らがこれまで実験及び検討を行ってきた結果では、芳香族炭化水素化合物(例えばアントラセン化合物)と、無機化合物とを混合した際、芳香族炭化水素化合物と無機化合物の混合比における無機化合物の比率が低い場合には、混合により形成される複合材料は結晶化しやすい。逆に、無機化合物の比率が高い場合には、結晶化は抑制できるものの、芳香族炭化水素化合物が有する骨格(例えばアントラセン骨格)と無機化合物との電荷移動相互作用に由来するわずかな吸収ピークが可視光領域で増大する。一方で、本発明の一態様に示すように、ジベンゾチオフェン骨格又はジベンゾフラン骨格の4位に置換基が結合した複素環化合物を用いる場合は、例えば該置換基にアントラセン骨格を含み、かつ無機化合物の比率が低い場合においても、複合材料の結晶化は抑制され、複合材料の膜質が安定化する。したがって、本発明の一態様の複合材料の場合には、複素環化合物がアントラセン骨格を含んでいたとしても、結晶化を抑制する目的で無機化合物の比率を高くする必要がなく、電荷移動相互作用に由来する吸収ピークが可視光領域に観測されることを防ぐことができる。
【0067】
また、本発明者らがこれまで実験及び検討を行ってきた結果では、アリールカルバゾール化合物と、無機化合物とを混合した際も、アリールカルバゾール化合物と無機化合物の混合比における無機化合物の比率が低い場合には、混合により形成される複合材料は結晶化しやすい。逆に、無機化合物の比率が高い場合には、結晶化は抑制できるものの、アリールカルバゾール骨格と無機化合物との電荷移動相互作用に由来するわずかな吸収ピークが可視光領域で増大する。一方で、本発明の一態様に示すように、ジベンゾチオフェン骨格又はジベンゾフラン骨格の4位に置換基が結合した複素環化合物を用いる場合は、例えば該置換基にアリールカルバゾール骨格を含み、かつ無機化合物の比率が低い場合においても、複合材料の結晶化は抑制され、複合材料の膜質が安定化する。したがって、本発明の一態様の複合材料の場合には、複素環化合物がアリールカルバゾール骨格を含んでいたとしても、結晶化を抑制する目的で無機化合物の比率を高くする必要がなく、電荷移動相互作用に由来する吸収ピークが可視光領域に観測されることを防ぐことができる。
【0068】
上記置換基が有する環は、ベンゼン環、ナフタレン環、フェナントレン環、トリフェニレン環、フルオレン環、ジベンゾチオフェン環、ジベンゾフラン環から選ばれる一種又は複数種であることが好ましい。これらの環は、いずれもキャリア輸送性(特に正孔輸送性)を発現するのに重要な共役環であるが、それと同時に、エネルギーギャップの広い共役環でもある。したがって、上記置換基が有する環がこれらの環のみであることで、電荷移動相互作用に基づく光吸収の発生を抑制するだけでなく、複素環化合物の吸収ピークが可視光領域よりも短波長側に生じるよう制御できるため、該複素環化合物を用いることで、透光性の高い複合材料を得ることができる。
【0069】
特に、上記置換基が有する環は、ベンゼン環、フルオレン環、ジベンゾチオフェン環、ジベンゾフラン環から選ばれる一種又は複数種であることが好ましい。これによって、無機化合物との間に、電荷移動相互作用に基づく光吸収がほとんど生じなくなることを本発明者らは見いだした。特に、複素環化合物と無機化合物の混合比において、無機化合物の比率を上げても、電荷移動相互作用による光吸収はほとんど生じない。具体的には、複素環化合物と無機化合物の混合比が質量比で4:1〜1:1(=複素環化合物:無機化合物)であっても、電荷移動相互作用に基づく光吸収がほとんど生じない。なお、無機化合物の濃度が高いと、複合材料の導電性が高くなるため好ましい。また、本発明者らは、電荷移動相互作用による光吸収がほとんど生じないにも関わらず、発光素子に用いた際には、良好なキャリア輸送性・キャリア注入性、信頼性を発現できることを見いだした。
【0070】
さらに、ジベンゾチオフェン骨格又はジベンゾフラン骨格の4位にフェニル基が結合し、フェニル基が1以上の置換基を有し、フェニル基及び1以上の置換基の炭素数の総和が12以上70以下である複素環化合物を用いることが好ましい。ジベンゾチオフェン骨格又はジベンゾフラン骨格の4位に共役が小さいフェニル基が結合した複素環化合物を複合材料に用いることで、電荷移動相互作用に基づく光吸収の発生を抑制することができるためである。また、フェニル基は共役が小さいため、フェニル基にさらに置換基を結合させて分子量を増大させたとしても、広いエネルギーギャップを保つことができ、透光性向上の観点でも有効である。さらに、ジベンゾチオフェンやジベンゾフランが、4位にバルキーな部位(例えば、上記のフェニル基を含めて炭素数の総和が12以上の骨格)を有する場合、ジベンゾチオフェンやジベンゾフランと該バルキーな部位との立体障害により、分子全体が立体的な骨格となる。このことにより、複合材料の膜質が安定化する。また、該複合材料を作製する際には、該複素環化合物と無機化合物とを共蒸着することが好ましいが、この場合は該複素環化合物が気化しやすいことが望まれる。したがって、分子量の観点から、該バルキーな部位は炭素数の総和が70以下であることが好ましい。なお、該複素環化合物の分子量としては、1200以下程度が好ましい。
【0071】
該1以上の置換基が有する環は、それぞれ独立に、ベンゼン環、ナフタレン環、フェナントレン環、トリフェニレン環、フルオレン環、ジベンゾチオフェン環、ジベンゾフラン環から選ばれる一種又は複数種であることが好ましい。これらの環は、いずれもキャリア輸送性(特に正孔輸送性)を発現するのに重要な共役環であるが、それに加えて、エネルギーギャップの広い共役環でもある。したがって、置換基が有する環がこれらの環のみであることで、電荷移動相互作用に基づく光吸収の発生を抑制するだけでなく、複素環化合物の吸収ピークが可視光領域よりも短波長側に生じるように制御できるため、該複素環化合物を用いることで、透光性の高い複合材料を得ることができる。
【0072】
特に、上記1以上の置換基が有する環は、それぞれ独立に、ベンゼン環、フルオレン環、ジベンゾチオフェン環、ジベンゾフラン環から選ばれる一種又は複数種であることが好ましい。これによって、無機化合物との間に、電荷移動相互作用に基づく光吸収がほとんど生じなくなることを、本発明者らは見出した。特に、複素環化合物と無機化合物の混合比において、無機化合物の比率を上げても、電荷移動相互作用による光吸収はほとんど生じない。具体的には、複素環化合物と無機化合物の混合比が質量比で4:1〜1:1(=複素環化合物:無機化合物)であっても、電荷移動相互作用に基づく光吸収がほとんど生じない。なお、無機化合物の濃度が高いと、複合材料の導電性が高くなるため好ましい。また、本発明者らは、電荷移動相互作用による光吸収がほとんど生じないにも関わらず、発光素子に用いた際には、良好なキャリア輸送性・キャリア注入性、信頼性を発現できることを見いだした。
【0073】
また、本発明の一態様の複合材料に用いることができる有機化合物は、一般式(G1)で表される複素環化合物である。
【0074】
【化3】

【0075】
一般式(G1)中、Aは酸素又は硫黄を表し、R1〜R7は、それぞれ独立に、水素、炭素数1〜4のアルキル基、又は環を構成する炭素数が6〜25のアリール基を表し、R8〜R12は、それぞれ独立に、水素、置換もしくは無置換のフェニル基、置換もしくは無置換のナフチル基、置換もしくは無置換のフェナントリル基、置換もしくは無置換のトリフェニレニル基、置換もしくは無置換のフルオレニル基、置換もしくは無置換のジベンゾチオフェニル基、又は置換もしくは無置換のジベンゾフラニル基を表す。ただし、R8〜R12のうち、少なくとも1つは、置換もしくは無置換のフェニル基、置換もしくは無置換のナフチル基、置換もしくは無置換のフェナントリル基、置換もしくは無置換のトリフェニレニル基、置換もしくは無置換のフルオレニル基、置換もしくは無置換のジベンゾチオフェニル基、又は置換もしくは無置換のジベンゾフラニル基を表す。
【0076】
特に、R8〜R12は、それぞれ独立に、水素、置換もしくは無置換のフェニル基、置換もしくは無置換のフルオレニル基、置換もしくは無置換のジベンゾチオフェニル基、又は置換もしくは無置換のジベンゾフラニル基を表すことが好ましい。ただし、R8〜R12のうち、少なくとも1つは、置換もしくは無置換のフェニル基、置換もしくは無置換のフルオレニル基、置換もしくは無置換のジベンゾチオフェニル基、又は置換もしくは無置換のジベンゾフラニル基を表す。
【0077】
以下の構造式(100)〜(128)に本発明の一態様の複合材料に用いることが可能な有機化合物の一例を示す。
【0078】
【化4】

【0079】
【化5】

【0080】
【化6】

【0081】
【化7】

【0082】
続いて、本発明の一態様の複合材料に用いることが可能な無機化合物について説明する。
【0083】
本発明の一態様の複合材料に用いる複素環化合物に対して電子受容性を示す無機化合物を用いることができる。例えば、塩化鉄(III)や塩化アルミニウムなどは、電子受容性が高い無機化合物の一例である。
【0084】
または、本発明の一態様の複合材料には、無機化合物として遷移金属酸化物を用いることができる。好ましくは元素周期表における4〜8族に属する金属の酸化物が望ましい。特にチタン酸化物、バナジウム酸化物、タンタル酸化物、モリブデン酸化物、タングステン酸化物、レニウム酸化物、ルテニウム酸化物、クロム酸化物、ジルコニウム酸化物、ハフニウム酸化物、銀酸化物が好ましい。この中でもモリブデン酸化物は蒸着がしやすく、吸湿性が低く、安定であることから特に扱いやすい材料である。
【0085】
遷移金属酸化物は、上述した塩化鉄(III)等の強力なルイス酸に比べれば、電子受容性はそれほど高くない(反応性は低い)と考えられる。また、上述した通り、本発明の一態様である複合材料においては、電荷移動相互作用に基づく光吸収の発生が抑制される(あるいはほとんど発生しない)。これらのことから、本発明において、遷移金属酸化物は一般的な意味合いでの電子受容体として作用しているという証明はし難い。しかしながら一方で、実施例で後述するように、実験的には、電界を印加した際には複素環化合物単体では流せないほどの電流を流せる事実がある。したがって、本発明の一態様である複合材料において遷移金属酸化物を用いた場合、少なくとも電界印加のアシストにより容易にキャリアが発生しているものと考えられる。したがって本明細書では、少なくとも電界印加のアシストによりキャリアが発生していれば、複合材料中の無機化合物(上述のような遷移金属酸化物など)は電子受容性を有するものとして扱う。
【0086】
以上に述べた本発明の一態様の複合材料に含まれる複素環化合物のHOMO準位は、光電子分光法での測定値が−5.7eV以下であることが好ましい。上述したとおり、ジベンゾチオフェンやジベンゾフランは、CV測定によると、HOMO準位が−6eV以下と非常に低い。したがって、ジベンゾフラン骨格またはジベンゾチオフェン骨格を含む複素環化合物単体も、HOMO準位を−5.7eV以下という低い値をとることが容易である。
【0087】
複素環化合物が低いHOMO準位を有する場合、他の有機化合物への正孔注入性には優れていると考えられるが、AlやITOに代表されるような導電材料(仕事関数が3〜5eV程度)から正孔を受け取ることは困難であると考えられる。しかしながら、本発明の一態様のような複合材料を形成することにより、他の有機化合物への優れた正孔注入性を保ちつつ、電極からの正孔注入性の問題点を克服することができる。このような複合材料の性質は、発光素子に用いた際に、駆動電圧の低減に寄与する。また、透光性が高いことから、発光効率を高めることができる。さらには、深いHOMO準位によりキャリアの蓄積を防止できるため、長寿命化を達成できる。
【0088】
以上で述べたように、本発明の一態様の複合材料は、HOMO準位が低く、キャリア輸送性が高い材料である。また、本発明の一態様の複合材料は、有機化合物へのキャリア注入性に優れた材料である。また、本発明の一態様の複合材料は、電荷移動相互作用に基づく光吸収が生じにくい材料である。
【0089】
したがって、本発明の一態様の複合材料は、発光素子や、光電変換素子、トランジスタ等の半導体素子に用いることが可能である。
【0090】
また、本発明の一態様の複合材料は、キャリア輸送性および有機化合物へのキャリア注入性に優れることから、発光素子等に用いることで、駆動電圧を低下させることができる。
【0091】
また、本発明の一態様の複合材料が透光性を有することから、発光素子等に用いることで、高い発光効率を実現できる。
【0092】
また、本発明の一態様の複合材料は電荷の蓄積を抑制することから、発光素子等に用いることで、長寿命の素子を作製することができる。
【0093】
なお、本実施の形態は、他の実施の形態と適宜組み合わせることが可能である。
【0094】
(実施の形態2)
本実施の形態では、本発明の一態様の発光素子について図1を用いて説明する。
【0095】
本実施の形態の発光素子は、一対の電極間にEL層(発光物質を含む層)を挟持して形成される。EL層は、少なくとも、実施の形態1で示した本発明の一態様の複合材料を含む層と、発光層とを有する。さらに、EL層は、そのほかの層を有していても良い。例えば、電極から離れたところに発光領域が形成されるように、つまり電極から離れた部位でキャリアの再結合が行われるように、キャリア注入性の高い物質やキャリア輸送性の高い物質からなる層を備えていても良い。本明細書では、キャリア注入性の高い物質やキャリア輸送性の高い物質からなる層をキャリアの注入、輸送などの機能を有する、機能層ともよぶ。機能層としては、正孔注入層、正孔輸送層、電子注入層、電子輸送層などを用いることができる。なお、本実施の形態において、本発明の一態様の複合材料を含む層は、正孔注入層として用いる。
【0096】
また、本発明の一態様の複合材料を含む層と、発光層との間に、一層以上の層(正孔輸送層など)を設ける事が好ましい。そのことで、発光層で生じた励起エネルギーが、該複合材料を含む層へ伝わることでの消光(効率低下)を抑制でき、より高効率な素子を得ることができる。
【0097】
図1に示す発光素子は、第1の電極101及び第2の電極108の一対の電極間にEL層102が設けられている。EL層102は、第1の電極101上に正孔注入層701、正孔輸送層702、発光層703、電子輸送層704、電子注入層705の順で積層されている。なお、本実施の形態に示す発光素子において、第1の電極101は陽極として機能し、第2の電極108は陰極として機能する。
【0098】
発光素子の支持体(図1(A)の基板100参照)としては、例えばガラス基板、石英基板、又はプラスチック基板などを用いることができる。また可撓性基板を用いてもよい。可撓性基板とは、曲げることができる(フレキシブル)基板のことであり、例えば、ポリカーボネート、ポリアリレート、ポリエーテルスルフォンからなるプラスチック基板等が挙げられる。また、フィルム(ポリプロピレン、ポリエステル、ビニル、ポリフッ化ビニル、塩化ビニル等からなる)、無機蒸着フィルムなどを用いることもできる。なお、発光素子の支持体として機能するものであれば、これら以外のものでもよい。
【0099】
第1の電極101としては、様々な金属、合金、導電性化合物、及びこれらの混合物などを用いることができる。例えば、酸化インジウム−酸化スズ(ITO:Indium Tin Oxide)、珪素若しくは酸化珪素を含有した酸化インジウム−酸化スズ、酸化インジウム−酸化亜鉛(Indium Zinc Oxide)、酸化タングステン及び酸化亜鉛を含有した酸化インジウム(IWZO)等が挙げられる。これらの導電性金属酸化物膜は、通常スパッタにより成膜されるが、ゾル−ゲル法などを応用して作製しても構わない。例えば、酸化インジウム−酸化亜鉛膜は、酸化インジウムに対し1〜20wt%の酸化亜鉛を加えたターゲットを用いてスパッタリング法により形成することができる。また、IWZO膜は、酸化インジウムに対し酸化タングステンを0.5〜5wt%、酸化亜鉛を0.1〜1wt%含有したターゲットを用いてスパッタリング法により形成することができる。この他、金、白金、ニッケル、タングステン、クロム、モリブデン、鉄、コバルト、銅、パラジウム、又は金属材料の窒化物(例えば、窒化チタン)等が挙げられる。
【0100】
第1の電極101の材料としては、仕事関数の大きい(仕事関数が4.0eV以上)材料を用いることが好ましい。なお、第1の電極101と、本発明の一態様の複合材料を含む層とが接する構成の発光素子については、第1の電極101に用いる材料は、仕事関数の大きい材料に限定されず、仕事関数の小さい材料を用いることもできる。例えば、アルミニウム、銀、アルミニウムを含む合金(例えば、Al−Si)等を用いることもできる。
【0101】
正孔注入層701は、本発明の一態様の複合材料を含む層である。
【0102】
本発明の一態様の複合材料に用いる複素環化合物(実施の形態1参照)はHOMO準位が低く、正孔輸送層702及び発光層703への正孔注入性が良好である。一方、第1の電極101との間に注入障壁が生じ、第1の電極101から正孔が注入されにくい。
【0103】
しかし、本発明の一態様の発光素子は、正孔注入層701に、本発明の一態様の複合材料(該複素環化合物と、該複素環化合物に対して電子受容性を示す無機化合物とを含む材料)を用いるため、第1の電極101と正孔注入層701との間の注入障壁を緩和することができる。したがって、第1の電極101から発光層703までの注入障壁が小さく、キャリア注入性の高い素子の実現が可能となり、駆動電圧の低い発光素子を提供することができる。
【0104】
さらに、本発明の一態様の複合材料はキャリアの発生効率が高く、キャリア輸送性が高い。そのため、本発明の一態様の複合材料を用いることで、発光効率の高い発光素子を実現することができる。
【0105】
また、該複素環化合物は、可視光領域に大きな吸収ピークが生じない。さらに、該複素環化合物は、HOMO準位が低く、該無機化合物との間に、電荷移動相互作用に基づく光吸収が生じにくい。したがって、本発明の一態様の複合材料は、可視光領域に吸収ピークが生じにくく、高い透光性を有する。よって、このことからも、本発明の一態様の複合材料を用いることで、発光効率の高い発光素子を実現することができると言える。
【0106】
また、本発明の一態様の複合材料は、電荷の蓄積を抑制できるため、長寿命の発光素子を提供することができる。
【0107】
正孔輸送層702は、正孔輸送性の高い物質を含む層である。正孔輸送層702の材料として、本発明の一態様の複合材料に用いる複素環化合物を用いても良い。そのほか、正孔輸送性の高い物質としては、例えば、4,4’−ビス[N−(1−ナフチル)−N−フェニルアミノ]ビフェニル(略称:NPB又はα−NPD)、N,N’−ビス(3−メチルフェニル)−N,N’−ジフェニル−[1,1’−ビフェニル]−4,4’−ジアミン(略称:TPD)、4−フェニル−4’−(9−フェニルフルオレン−9−イル)トリフェニルアミン(略称:BPAFLP)、4,4’−ビス[N−(9,9−ジメチルフルオレン−2−イル)−N−フェニルアミノ]ビフェニル(略称:DFLDPBi)、4,4’−ビス[N−(スピロ−9,9’−ビフルオレン−2−イル)−N―フェニルアミノ]ビフェニル(略称:BSPB)等の芳香族アミン化合物を用いることができる。ここに述べた物質は、主に10−6cm2/Vs以上の正孔移動度を有する物質である。但し、電子よりも正孔の輸送性の高い物質であれば、これら以外のものを用いてもよい。なお、正孔輸送性の高い物質を含む層は、単層のものだけでなく、上記物質からなる層が二層以上積層したものとしてもよい。
【0108】
また、正孔輸送層702には、4,4’−ジ(N−カルバゾリル)ビフェニル(略称:CBP)、9−[4−(10−フェニル−9−アントリル)フェニル]−9H−カルバゾール(略称:CzPA)、9−フェニル−3−[4−(10−フェニル−9−アントリル)フェニル]−9H−カルバゾール(略称:PCzPA)のようなカルバゾール誘導体や、2−tert−ブチル−9,10−ジ(2−ナフチル)アントラセン(略称:t−BuDNA)、9,10−ジ(2−ナフチル)アントラセン(略称:DNA)、9,10−ジフェニルアントラセン(略称:DPAnth)のようなアントラセン誘導体を用いても良い。
【0109】
特に、本発明の一態様である複合材料における複素環化合物は、低いHOMO準位を有するため、正孔輸送層にも低いHOMO準位を有する材料を適用することができる。このような構成とすることにより、発光層と正孔輸送層との界面における電荷の蓄積を防ぐことができ、発光素子を長寿命化できる。具体的には、正孔輸送層のHOMO準位は−5.6eV以下であることが好ましい。また、このような観点から、正孔輸送層に用いる化合物としては、カルバゾール誘導体、ジベンゾチオフェン誘導体、ジベンゾフラン誘導体、アントラセン誘導体などが好ましい。
【0110】
なお、正孔輸送層702には、ポリ(N−ビニルカルバゾール)(略称:PVK)、ポリ(4−ビニルトリフェニルアミン)(略称:PVTPA)、ポリ[N−(4−{N’−[4−(4−ジフェニルアミノ)フェニル]フェニル−N’−フェニルアミノ}フェニル)メタクリルアミド](略称:PTPDMA)、ポリ[N,N’−ビス(4−ブチルフェニル)−N,N’−ビス(フェニル)ベンジジン](略称:Poly−TPD)などの高分子化合物を用いることもできる。
【0111】
発光層703は、発光性の有機化合物を含む層である。発光性の有機化合物としては、例えば、蛍光を発光する蛍光性化合物や燐光を発光する燐光性化合物を用いることができる。
【0112】
発光層703に用いることができる蛍光性化合物としては、例えば、青色系の発光材料として、N,N’−ビス[4−(9H−カルバゾール−9−イル)フェニル]−N,N’−ジフェニルスチルベン−4,4’−ジアミン(略称:YGA2S)、4−(9H−カルバゾール−9−イル)−4’−(10−フェニル−9−アントリル)トリフェニルアミン(略称:YGAPA)、4−(10−フェニル−9−アントリル)−4’−(9−フェニル−9H−カルバゾール−3−イル)トリフェニルアミン(略称:PCBAPA)などが挙げられる。また、緑色系の発光材料として、N−(9,10−ジフェニル−2−アントリル)−N,9−ジフェニル−9H−カルバゾール−3−アミン(略称:2PCAPA)、N−[9,10−ビス(1,1’−ビフェニル−2−イル)−2−アントリル]−N,9−ジフェニル−9H−カルバゾール−3−アミン(略称:2PCABPhA)、N−(9,10−ジフェニル−2−アントリル)−N,N’,N’−トリフェニル−1,4−フェニレンジアミン(略称:2DPAPA)、N−[9,10−ビス(1,1’−ビフェニル−2−イル)−2−アントリル]−N,N’,N’−トリフェニル−1,4−フェニレンジアミン(略称:2DPABPhA)、N−[9,10−ビス(1,1’−ビフェニル−2−イル)]−N−[4−(9H−カルバゾール−9−イル)フェニル]−N−フェニルアントラセン−2−アミン(略称:2YGABPhA)、N,N,9−トリフェニルアントラセン−9−アミン(略称:DPhAPhA)などが挙げられる。また、黄色系の発光材料として、ルブレン、5,12−ビス(1,1’−ビフェニル−4−イル)−6,11−ジフェニルテトラセン(略称:BPT)などが挙げられる。また、赤色系の発光材料として、N,N,N’,N’−テトラキス(4−メチルフェニル)テトラセン−5,11−ジアミン(略称:p−mPhTD)、7,14−ジフェニル−N,N,N’,N’−テトラキス(4−メチルフェニル)アセナフト[1,2−a]フルオランテン−3,10−ジアミン(略称:p−mPhAFD)などが挙げられる。
【0113】
また、発光層703に用いることができる燐光性化合物としては、例えば、青色系の発光材料として、ビス[2−(4’,6’−ジフルオロフェニル)ピリジナト−N,C2’]イリジウム(III)テトラキス(1−ピラゾリル)ボラート(略称:FIr6)、ビス[2−(4’,6’−ジフルオロフェニル)ピリジナト−N,C2’]イリジウム(III)ピコリナート(略称:FIrpic)、ビス{2−[3’,5’−ビス(トリフルオロメチル)フェニル]ピリジナト−N,C2’}イリジウム(III)ピコリナート(略称:Ir(CF3ppy)2(pic))、ビス[2−(4’,6’−ジフルオロフェニル)ピリジナト−N,C2’]イリジウム(III)アセチルアセトナート(略称:FIr(acac))などが挙げられる。また、緑色系の発光材料として、トリス(2−フェニルピリジナト−N,C2’)イリジウム(III)(略称:Ir(ppy)3)、ビス(2−フェニルピリジナト−N,C2’)イリジウム(III)アセチルアセトナート(略称:Ir(ppy)2(acac))、ビス(1,2−ジフェニル−1H−ベンゾイミダゾラト)イリジウム(III)アセチルアセトナート(略称:Ir(pbi)2(acac))、ビス(ベンゾ[h]キノリナト)イリジウム(III)アセチルアセトナート(略称:Ir(bzq)2(acac))、トリス(ベンゾ[h]キノリナト)イリジウム(III)(略称:Ir(bzq)3)などが挙げられる。また、黄色系の発光材料として、ビス(2,4−ジフェニル−1,3−オキサゾラト−N,C2’)イリジウム(III)アセチルアセトナート(略称:Ir(dpo)2(acac))、ビス[2−(4’−パーフルオロフェニルフェニル)ピリジナト]イリジウム(III)アセチルアセトナート(略称:Ir(p−PF−ph)2(acac))、ビス(2−フェニルベンゾチアゾラト−N,C2’)イリジウム(III)アセチルアセトナート(略称:Ir(bt)2(acac))、(アセチルアセトナト)ビス[2,3−ビス(4−フルオロフェニル)−5−メチルピラジナト]イリジウム(III)(略称:Ir(Fdppr−Me)2(acac))、(アセチルアセトナト)ビス{2−(4−メトキシフェニル)−3,5−ジメチルピラジナト}イリジウム(III)(略称:Ir(dmmoppr)2(acac))などが挙げられる。また、橙色系の発光材料として、トリス(2−フェニルキノリナト−N,C2’)イリジウム(III)(略称:Ir(pq)3)、ビス(2−フェニルキノリナト−N,C2’)イリジウム(III)アセチルアセトナート(略称:Ir(pq)2(acac))、(アセチルアセトナト)ビス(3,5−ジメチル−2−フェニルピラジナト)イリジウム(III)(略称:Ir(mppr−Me)2(acac))、(アセチルアセトナト)ビス(5−イソプロピル−3−メチル−2−フェニルピラジナト)イリジウム(III)(略称:Ir(mppr−iPr)2(acac))などが挙げられる。また、赤色系の発光材料として、ビス[2−(2’−ベンゾ[4,5−α]チエニル)ピリジナト−N,C3’]イリジウム(III)アセチルアセトナート(略称:Ir(btp)2(acac))、ビス(1−フェニルイソキノリナト−N,C2’)イリジウム(III)アセチルアセトナート(略称:Ir(piq)2(acac))、(アセチルアセトナト)ビス[2,3−ビス(4−フルオロフェニル)キノキサリナト]イリジウム(III)(略称:Ir(Fdpq)2(acac))、(アセチルアセトナト)ビス(2,3,5−トリフェニルピラジナト)イリジウム(III)(略称:Ir(tppr)2(acac))、(ジピバロイルメタナト)ビス(2,3,5−トリフェニルピラジナト)イリジウム(III)(略称:Ir(tppr)2(dpm))、2,3,7,8,12,13,17,18−オクタエチル−21H,23H−ポルフィリン白金(II)(略称:PtOEP)等の有機金属錯体が挙げられる。また、トリス(アセチルアセトナト)(モノフェナントロリン)テルビウム(III)(略称:Tb(acac)3(Phen))、トリス(1,3−ジフェニル−1,3−プロパンジオナト)(モノフェナントロリン)ユーロピウム(III)(略称:Eu(DBM)3(Phen))、トリス[1−(2−テノイル)−3,3,3−トリフルオロアセトナト](モノフェナントロリン)ユーロピウム(III)(略称:Eu(TTA)3(Phen))等の希土類金属錯体は、希土類金属イオンからの発光(異なる多重度間の電子遷移)であるため、燐光性化合物として用いることができる。
【0114】
なお、発光層703としては、上述した発光性の有機化合物(ゲスト材料)を他の物質(ホスト材料)に分散させた構成としてもよい。ホスト材料としては、各種のものを用いることができ、発光性の物質よりも最低空軌道準位(LUMO準位)が高く、HOMO準位が低い物質を用いることが好ましい。
【0115】
ホスト材料としては、具体的には、トリス(8−キノリノラト)アルミニウム(III)(略称:Alq)、トリス(4−メチル−8−キノリノラト)アルミニウム(III)(略称:Almq3)、ビス(10−ヒドロキシベンゾ[h]キノリナト)ベリリウム(II)(略称:BeBq2)、ビス(2−メチル−8−キノリノラト)(4−フェニルフェノラト)アルミニウム(III)(略称:BAlq)、ビス(8−キノリノラト)亜鉛(II)(略称:Znq)、ビス[2−(2−ベンゾオキサゾリル)フェノラト]亜鉛(II)(略称:ZnPBO)、ビス[2−(2−ベンゾチアゾリル)フェノラト]亜鉛(II)(略称:ZnBTZ)などの金属錯体、2−(4−ビフェニリル)−5−(4−tert−ブチルフェニル)−1,3,4−オキサジアゾール(略称:PBD)、1,3−ビス[5−(p−tert−ブチルフェニル)−1,3,4−オキサジアゾール−2−イル]ベンゼン(略称:OXD−7)、3−(4−ビフェニリル)−4−フェニル−5−(4−tert−ブチルフェニル)−1,2,4−トリアゾール(略称:TAZ)、2,2’,2’’−(1,3,5−ベンゼントリイル)トリス(1−フェニル−1H−ベンゾイミダゾール)(略称:TPBI)、バソフェナントロリン(略称:BPhen)、バソキュプロイン(略称:BCP)などの複素環化合物や、9−[4−(10−フェニル−9−アントリル)フェニル]−9H−カルバゾール(略称:CzPA)、3,6−ジフェニル−9−[4−(10−フェニル−9−アントリル)フェニル]−9H−カルバゾール(略称:DPCzPA)、9,10−ビス(3,5−ジフェニルフェニル)アントラセン(略称:DPPA)、9,10−ジ(2−ナフチル)アントラセン(略称:DNA)、2−tert−ブチル−9,10−ジ(2−ナフチル)アントラセン(略称:t−BuDNA)、9,9’−ビアントリル(略称:BANT)、9,9’−(スチルベン−3,3’−ジイル)ジフェナントレン(略称:DPNS)、9,9’−(スチルベン−4,4’−ジイル)ジフェナントレン(略称:DPNS2)、3,3’,3’’−(ベンゼン−1,3,5−トリイル)トリピレン(略称:TPB3)、9,10−ジフェニルアントラセン(略称:DPAnth)、6,12−ジメトキシ−5,11−ジフェニルクリセンなどの縮合芳香族化合物、N,N−ジフェニル−9−[4−(10−フェニル−9−アントリル)フェニル]−9H−カルバゾール−3−アミン(略称:CzA1PA)、4−(10−フェニル−9−アントリル)トリフェニルアミン(略称:DPhPA)、N,9−ジフェニル−N−[4−(10−フェニル−9−アントリル)フェニル]−9H−カルバゾール−3−アミン(略称:PCAPA)、N,9−ジフェニル−N−{4−[4−(10−フェニル−9−アントリル)フェニル]フェニル}−9H−カルバゾール−3−アミン(略称:PCAPBA)、N−(9,10−ジフェニル−2−アントリル)−N,9−ジフェニル−9H−カルバゾール−3−アミン(略称:2PCAPA)、NPB(又はα−NPD)、TPD、DFLDPBi、BSPBなどの芳香族アミン化合物などを用いることができる。
【0116】
また、ホスト材料は複数種用いることができる。例えば、結晶化を抑制するためにルブレン等の結晶化を抑制する物質をさらに添加してもよい。また、ゲスト材料へのエネルギー移動をより効率良く行うためにNPB、あるいはAlq等をさらに添加してもよい。
【0117】
ゲスト材料をホスト材料に分散させた構成とすることにより、発光層703の結晶化を抑制することができる。また、ゲスト材料の濃度が高いことによる濃度消光を抑制することができる。
【0118】
また、発光層703として高分子化合物を用いることができる。具体的には、青色系の発光材料として、ポリ(9,9−ジオクチルフルオレン−2,7−ジイル)(略称:PFO)、ポリ[(9,9−ジオクチルフルオレン−2,7−ジイル)−co−(2,5−ジメトキシベンゼン−1,4−ジイル)](略称:PF−DMOP)、ポリ{(9,9−ジオクチルフルオレン−2,7−ジイル)−co−[N,N’−ジ−(p−ブチルフェニル)−1,4−ジアミノベンゼン]}(略称:TAB−PFH)などが挙げられる。また、緑色系の発光材料として、ポリ(p−フェニレンビニレン)(略称:PPV)、ポリ[(9,9−ジヘキシルフルオレン−2,7−ジイル)−alt−co−(ベンゾ[2,1,3]チアジアゾール−4,7−ジイル)](略称:PFBT)、ポリ[(9,9−ジオクチル−2,7−ジビニレンフルオレニレン)−alt−co−(2−メトキシ−5−(2−エチルヘキシロキシ)−1,4−フェニレン)]などが挙げられる。また、橙色〜赤色系の発光材料として、ポリ[2−メトキシ−5−(2’−エチルヘキソキシ)−1,4−フェニレンビニレン](略称:MEH−PPV)、ポリ(3−ブチルチオフェン−2,5−ジイル)(略称:R4−PAT)、ポリ{[9,9−ジヘキシル−2,7−ビス(1−シアノビニレン)フルオレニレン]−alt−co−[2,5−ビス(N,N’−ジフェニルアミノ)−1,4−フェニレン]}、ポリ{[2−メトキシ−5−(2−エチルヘキシロキシ)−1,4−ビス(1−シアノビニレンフェニレン)]−alt−co−[2,5−ビス(N,N’−ジフェニルアミノ)−1,4−フェニレン]}(略称:CN−PPV−DPD)などが挙げられる。
【0119】
また、複数の発光層を設け、それぞれの発光層の発光色を異なるものにすることで、発光素子全体として、所望の色の発光を得ることができる。例えば、2つの発光層を有する発光素子において、第1の発光層の発光色と第2の発光層の発光色を補色の関係になるようにすることで、発光素子全体として白色発光する発光素子を得ることも可能である。なお、補色とは、混合すると無彩色になる色同士の関係をいう。つまり、補色の関係にある色を発光する物質から得られた光を混合すると、白色発光を得ることができる。また、3つ以上の発光層を有する発光素子の場合でも同様である。
【0120】
電子輸送層704は、電子輸送性の高い物質を含む層である。電子輸送性の高い物質としては、例えば、トリス(8−キノリノラト)アルミニウム(略称:Alq)、トリス(4−メチル−8−キノリノラト)アルミニウム(略称:Almq3)、ビス(10−ヒドロキシベンゾ[h]キノリナト)ベリリウム(略称:BeBq2)、ビス(2−メチル−8−キノリノラト)(4−フェニルフェノラト)アルミニウム(略称:BAlq)など、キノリン骨格又はベンゾキノリン骨格を有する金属錯体等が挙げられる。また、この他ビス[2−(2−ヒドロキシフェニル)ベンゾオキサゾラト]亜鉛(略称:Zn(BOX)2)、ビス[2−(2−ヒドロキシフェニル)ベンゾチアゾラト]亜鉛(略称:Zn(BTZ)2)などのオキサゾール系、チアゾール系配位子を有する金属錯体なども用いることができる。さらに、金属錯体以外にも、2−(4−ビフェニリル)−5−(4−tert−ブチルフェニル)−1,3,4−オキサジアゾール(略称:PBD)や、1,3−ビス[5−(p−tert−ブチルフェニル)−1,3,4−オキサジアゾール−2−イル]ベンゼン(略称:OXD−7)、3−(4−ビフェニリル)−4−フェニル−5−(4−tert−ブチルフェニル)−1,2,4−トリアゾール(略称:TAZ)、バソフェナントロリン(略称:BPhen)、バソキュプロイン(略称:BCP)なども用いることができる。ここに述べた物質は、主に10−6cm2/Vs以上の電子移動度を有する物質である。また、電子輸送層は、単層のものだけでなく、上記物質からなる層が二層以上積層したものとしてもよい。
【0121】
電子注入層705は、電子注入性の高い物質を含む層である。電子注入層705には、リチウム、セシウム、カルシウム、フッ化リチウム、フッ化セシウム、フッ化カルシウム、リチウム酸化物等のようなアルカリ金属、アルカリ土類金属、又はそれらの化合物を用いることができる。また、フッ化エルビウムのような希土類金属化合物を用いることができる。また、上述した電子輸送層704を構成する物質を用いることもできる。
【0122】
なお、上述した正孔注入層701、正孔輸送層702、発光層703、電子輸送層704、電子注入層705は、それぞれ、蒸着法(真空蒸着法を含む)、インクジェット法、塗布法等の方法で形成することができる。
【0123】
図2(A)に示す発光素子は、基板100上において、第1の電極101及び第2の電極108の一対の電極間に、EL層102が設けられている。EL層102は、正孔注入層701、正孔輸送層702、発光層703、電子輸送層704、電子注入層705を有している。図2(A)における発光素子は、基板100上に、陰極として機能する第2の電極108と、第2の電極108上に順に積層した電子注入層705、電子輸送層704、発光層703、正孔輸送層702、正孔注入層701と、さらにその上に設けられた陽極として機能する第1の電極101から構成されている。
【0124】
また、それぞれのEL層の発光色を異なるものにすることで、発光素子全体として、所望の色の発光を得ることができる。例えば、2つのEL層を有する発光素子において、第1のEL層の発光色と第2のEL層の発光色を補色の関係になるようにすることで、発光素子全体として白色発光する発光素子を得ることも可能である。また、3つ以上のEL層を有する発光素子の場合でも同様である。
【0125】
EL層は、図1(B)に示すように、第1の電極101と第2の電極108との間に複数積層されていても良い。この場合、積層された第1のEL層800と第2のEL層801との間には、電荷発生層803を設けることが好ましい。電荷発生層803は本発明の一態様の複合材料を用いて形成することができる。本発明の一態様の複合材料は、電圧印加時におけるキャリアの発生効率が高く、正孔輸送性が高い。そのため、本発明の一態様の複合材料を用いることで、駆動電圧の低い発光素子を実現することができる。また、発光効率の高い発光素子を実現することができる。
【0126】
また、該複素環化合物は、吸収ピークが可視光領域に生じにくい。また、該複素環化合物はHOMO準位が低く、該無機化合物との間に、電荷移動相互作用に基づく光吸収が生じにくい、したがって、本発明の一態様の複合材料は、可視光領域に吸収ピークが生じにくく、高い透光性を有する。よって、このことからも、本発明の一態様の複合材料を用いることで、発光効率の高い発光素子を実現することができると言える。
【0127】
また、電荷発生層803は本発明の一態様の複合材料からなる層と他の材料からなる層との積層構造でもよい。この場合、他の材料からなる層としては、電子供与性物質と電子輸送性の高い物質とを含む層や、透明導電膜からなる層などを用いることができる。このような構成を有する発光素子は、エネルギーの移動や消光などの問題が起こり難く、材料の選択の幅が広がることで高い発光効率と長い寿命とを併せ持つ発光素子とすることが容易である。また、一方のEL層で燐光発光、他方で蛍光発光を得ることも容易である。この構造は上述のEL層の構造と組み合わせて用いることができる。
【0128】
同様に、図2(B)に示すように、3つ以上のEL層802を積層した発光素子も適用することが可能である。本実施の形態に係る発光素子のように、一対の電極間に、電荷発生層を挟んで複数のEL層を配置することで、電流密度を低く保ったまま、高輝度で発光する長寿命素子を実現できる。
【0129】
EL層は、図1(C)に示すように、第1の電極101と第2の電極108との間に、正孔注入層701、正孔輸送層702、発光層703、電子輸送層704、電子注入バッファー層706、電子リレー層707、及び第2の電極108と接する複合材料層708を有していても良い。
【0130】
第2の電極108と接する複合材料層708を設けることで、特にスパッタリング法を用いて第2の電極108を形成する際に、EL層102が受けるダメージを低減することができるため、好ましい。複合材料層708は、本発明の一態様の複合材料を用いることができる。
【0131】
さらに、電子注入バッファー層706を設けることで、複合材料層708と電子輸送層704との間の注入障壁を緩和することができるため、複合材料層708で生じた電子を電子輸送層704に容易に注入することができる。
【0132】
電子注入バッファー層706には、アルカリ金属、アルカリ土類金属、希土類金属、およびこれらの化合物(アルカリ金属化合物(酸化リチウム等の酸化物、ハロゲン化物、炭酸リチウムや炭酸セシウム等の炭酸塩を含む)、アルカリ土類金属化合物(酸化物、ハロゲン化物、炭酸塩を含む)、又は希土類金属の化合物(酸化物、ハロゲン化物、炭酸塩を含む))等の電子注入性の高い物質を用いることが可能である。
【0133】
また、電子注入バッファー層706が、電子輸送性の高い物質とドナー性物質を含んで形成される場合には、電子輸送性の高い物質に対して質量比で、0.001以上0.1以下の比率でドナー性物質を添加することが好ましい。なお、ドナー性物質としては、アルカリ金属、アルカリ土類金属、希土類金属、およびこれらの化合物(アルカリ金属化合物(酸化リチウム等の酸化物、ハロゲン化物、炭酸リチウムや炭酸セシウム等の炭酸塩を含む)、アルカリ土類金属化合物(酸化物、ハロゲン化物、炭酸塩を含む)、又は希土類金属の化合物(酸化物、ハロゲン化物、炭酸塩を含む))の他、テトラチアナフタセン(略称:TTN)、ニッケロセン、デカメチルニッケロセン等の有機化合物を用いることもできる。なお、電子輸送性の高い物質としては、先に説明した電子輸送層704の材料と同様の材料を用いて形成することができる。
【0134】
さらに、電子注入バッファー層706と複合材料層708との間に、電子リレー層707を形成することが好ましい。電子リレー層707は、必ずしも設ける必要は無いが、電子輸送性の高い電子リレー層707を設けることで、電子注入バッファー層706へ電子を速やかに送ることが可能となる。
【0135】
複合材料層708と電子注入バッファー層706との間に電子リレー層707が挟まれた構造は、複合材料層708に含まれるアクセプター性物質と、電子注入バッファー層706に含まれるドナー性物質とが相互作用を受けにくく、互いの機能を阻害しにくい構造である。したがって、駆動電圧の上昇を抑制することができる。
【0136】
電子リレー層707は、電子輸送性の高い物質を含み、該電子輸送性の高い物質のLUMO準位は、複合材料層708に含まれるアクセプター性物質のLUMO準位と、電子輸送層704に含まれる電子輸送性の高い物質のLUMO準位との間となるように形成する。また、電子リレー層707がドナー性物質を含む場合には、当該ドナー性物質のドナー準位も複合材料層708に含まれるアクセプター性物質のLUMO準位と、電子輸送層704に含まれる電子輸送性の高い物質のLUMO準位との間となるようにする。具体的なエネルギー準位の数値としては、電子リレー層707に含まれる電子輸送性の高い物質のLUMO準位は−5.0eV以上、好ましくは−5.0eV以上−3.0eV以下とするとよい。
【0137】
電子リレー層707に含まれる電子輸送性の高い物質としてはフタロシアニン系の材料又は金属−酸素結合と芳香族配位子を有する金属錯体を用いることが好ましい。
【0138】
電子リレー層707に含まれるフタロシアニン系材料としては、CuPc、SnPc(Phthalocyanine tin(II) complex)、ZnPc(Phthalocyanine zinc complex)、CoPc(Cobalt(II)phthalocyanine, β−form)、FePc(Phthalocyanine Iron)及びPhO−VOPc(Vanadyl 2,9,16,23−tetraphenoxy−29H,31H−phthalocyanine)のいずれかを用いることが好ましい。
【0139】
電子リレー層707に含まれる金属−酸素結合と芳香族配位子を有する金属錯体としては、金属−酸素の二重結合を有する金属錯体を用いることが好ましい。金属−酸素の二重結合はアクセプター性(電子を受容しやすい性質)を有するため、電子の移動(授受)がより容易になる。また、金属−酸素の二重結合を有する金属錯体は安定であると考えられる。したがって、金属−酸素の二重結合を有する金属錯体を用いることにより発光素子を低電圧でより安定に駆動することが可能になる。
【0140】
金属−酸素結合と芳香族配位子を有する金属錯体としてはフタロシアニン系材料が好ましい。具体的には、VOPc(Vanadyl phthalocyanine)、SnOPc(Phthalocyanine tin(IV) oxide complex)及びTiOPc(Phthalocyanine titanium oxide complex)のいずれかは、分子構造的に金属−酸素の二重結合が他の分子に対して作用しやすく、アクセプター性が高いため好ましい。
【0141】
なお、上述したフタロシアニン系材料としては、フェノキシ基を有するものが好ましい。具体的にはPhO−VOPcのような、フェノキシ基を有するフタロシアニン誘導体が好ましい。フェノキシ基を有するフタロシアニン誘導体は、溶媒に可溶である。そのため、発光素子を形成する上で扱いやすいという利点を有する。また、溶媒に可溶であるため、成膜に用いる装置のメンテナンスが容易になるという利点を有する。
【0142】
電子リレー層707はさらにドナー性物質を含んでいても良い。ドナー性物質としては、アルカリ金属、アルカリ土類金属、希土類金属及びこれらの化合物(アルカリ金属化合物(酸化リチウムなどの酸化物、ハロゲン化物、炭酸リチウムや炭酸セシウムなどの炭酸塩を含む)、アルカリ土類金属化合物(酸化物、ハロゲン化物、炭酸塩を含む)、又は希土類金属の化合物(酸化物、ハロゲン化物、炭酸塩を含む))の他、テトラチアナフタセン(略称:TTN)、ニッケロセン、デカメチルニッケロセンなどの有機化合物を用いることができる。電子リレー層707にこれらドナー性物質を含ませることによって、電子の移動が容易となり、発光素子をより低電圧で駆動することが可能になる。
【0143】
電子リレー層707にドナー性物質を含ませる場合、電子輸送性の高い物質としては上記した材料の他、複合材料層708に含まれるアクセプター性物質のアクセプター準位より高いLUMO準位を有する物質を用いることができる。具体的なエネルギー準位としては、−5.0eV以上、好ましくは−5.0eV以上−3.0eV以下の範囲にLUMO準位を有する物質を用いることが好ましい。このような物質としては例えば、ペリレン誘導体や、含窒素縮合芳香族化合物などが挙げられる。なお、含窒素縮合芳香族化合物は、安定であるため、電子リレー層707を形成する為に用いる材料として、好ましい材料である。
【0144】
ペリレン誘導体の具体例としては、3,4,9,10−ペリレンテトラカルボン酸二無水物(略称:PTCDA)、3,4,9,10−ペリレンテトラカルボキシリックビスベンゾイミダゾール(略称:PTCBI)、N,N’−ジオクチル−3,4,9,10−ペリレンテトラカルボン酸ジイミド(略称:PTCDI−C8H)、N,N’−ジヘキシル−3,4,9,10−ペリレンテトラカルボン酸ジイミド(略称:Hex PTC)等が挙げられる。
【0145】
また、含窒素縮合芳香族化合物の具体例としては、ピラジノ[2,3−f][1,10]フェナントロリン−2,3−ジカルボニトリル(略称:PPDN)、2,3,6,7,10,11−ヘキサシアノ−1,4,5,8,9,12−ヘキサアザトリフェニレン(略称:HAT(CN)6)、2,3−ジフェニルピリド[2,3−b]ピラジン(略称:2PYPR)、2,3−ビス(4−フルオロフェニル)ピリド[2,3−b]ピラジン(略称:F2PYPR)等が挙げられる。
【0146】
その他にも、7,7,8,8−テトラシアノキノジメタン(略称:TCNQ)、1,4,5,8−ナフタレンテトラカルボン酸二無水物(略称:NTCDA)、パーフルオロペンタセン、銅ヘキサデカフルオロフタロシアニン(略称:F16CuPc)、N,N’−ビス(2,2,3,3,4,4,5,5,6,6,7,7,8,8,8−ペンタデカフルオロオクチル)−1,4,5,8−ナフタレンテトラカルボン酸ジイミド(略称:NTCDI−C8F)、3’,4’−ジブチル−5,5’’−ビス(ジシアノメチレン)−5,5’’−ジヒドロ−2,2’:5’,2’’−テルチオフェン)(略称:DCMT)、メタノフラーレン(例えば、[6,6]−フェニルC61酪酸メチルエステル)等を用いることができる。
【0147】
なお、電子リレー層707にドナー性物質を含ませる場合、電子輸送性の高い物質とドナー性物質との共蒸着などの方法によって電子リレー層707を形成すれば良い。
【0148】
正孔注入層701、正孔輸送層702、発光層703、及び電子輸送層704は前述の材料を用いてそれぞれ形成すれば良い。
【0149】
なお、本実施の形態は、他の実施の形態と適宜組み合わせることが可能である。
【0150】
(実施の形態3)
本実施の形態では、本発明の一態様の、発光素子を有する発光装置について図3を用いて説明する。なお、図3(A)は、発光装置を示す上面図、図3(B)は図3(A)をA−B及びC−Dで切断した断面図である。
【0151】
図3(A)において、点線で示された401は駆動回路部(ソース側駆動回路)、402は画素部、403は駆動回路部(ゲート側駆動回路)である。また、404は封止基板、405はシール材であり、シール材405で囲まれた内側は、空間になっている。
【0152】
なお、引き回し配線408はソース側駆動回路401及びゲート側駆動回路403に入力される信号を伝送するための配線であり、外部入力端子となるFPC(フレキシブルプリントサーキット)409からビデオ信号、クロック信号、スタート信号、リセット信号等を受け取る。なお、ここではFPCしか図示されていないが、このFPCにはプリント配線基板(PWB)が取り付けられていても良い。本明細書における発光装置には、発光装置本体だけでなく、それにFPC又はPWBが取り付けられた状態をも含むものとする。
【0153】
次に、断面構造について図3(B)を用いて説明する。素子基板410上には駆動回路部及び画素部が形成されているが、ここでは、駆動回路部であるソース側駆動回路401と、画素部402中の一つの画素が示されている。
【0154】
なお、ソース側駆動回路401はnチャネル型TFT423とpチャネル型TFT424とを組み合わせたCMOS回路が形成される。また、駆動回路は、TFTで形成される種々のCMOS回路、PMOS回路又はNMOS回路で形成しても良い。また、本実施の形態では、基板上に駆動回路を形成したドライバ一体型を示すが、必ずしもその必要はなく、駆動回路を基板上ではなく外部に形成することもできる。
【0155】
また、画素部402はスイッチング用TFT411と、電流制御用TFT412とそのドレインに電気的に接続された第1の電極413とを含む複数の画素により形成される。なお、第1の電極413の端部を覆って絶縁物414が形成されている。ここでは、ポジ型の感光性アクリル樹脂膜を用いることにより形成する。
【0156】
また、被覆性を良好なものとするため、絶縁物414の上端部又は下端部に曲率を有する曲面が形成されるようにする。例えば、絶縁物414の材料としてポジ型の感光性アクリルを用いた場合、絶縁物414の上端部のみに曲率半径(0.2μm〜3μm)を有する曲面を持たせることが好ましい。また、絶縁物414として、光の照射によってエッチャントに不溶解性となるネガ型、或いは光の照射によってエッチャントに溶解性となるポジ型のいずれも使用することができる。
【0157】
第1の電極413上には、EL層416、及び第2の電極417がそれぞれ形成されている。ここで、陽極として機能する第1の電極413に用いる材料としては、仕事関数の大きい材料を用いることが望ましい。例えば、ITO膜、又は珪素を含有したインジウム錫酸化物膜、2〜20wt%の酸化亜鉛を含む酸化インジウム膜、窒化チタン膜、クロム膜、タングステン膜、Zn膜、Pt膜などの単層膜の他、窒化チタン膜とアルミニウムを主成分とする膜との積層、窒化チタン膜とアルミニウムを主成分とする膜と窒化チタン膜との3層構造等を用いることができる。なお、積層構造とすると、配線としての抵抗も低く、良好なオーミックコンタクトがとれる。
【0158】
また、EL層416は、蒸着マスクを用いた蒸着法、インクジェット法などの液滴吐出法、印刷法、スピンコート法等の種々の方法によって形成される。EL層416は、実施の形態1で示した複合材料を含んでいる。また、EL層416を構成する他の材料としては、低分子材料、オリゴマー、デンドリマー、又は高分子材料であっても良い。
【0159】
さらに、EL層416上に形成され、陰極として機能する第2の電極417に用いる材料としては、仕事関数の小さい材料(Al、Mg、Li、Ca、又はこれらの合金や化合物、Mg−Ag、Mg−In、Al−Li等)を用いることが好ましい。なお、EL層416で生じた光が第2の電極417を透過するためには、第2の電極417として、膜厚を薄くした金属薄膜と、透明導電膜(ITO、2〜20wt%の酸化亜鉛を含む酸化インジウム、珪素若しくは酸化珪素を含有した酸化インジウム−酸化スズ、酸化亜鉛等)との積層を用いるのが良い。
【0160】
さらにシール材405で封止基板404を素子基板410と貼り合わせることにより、素子基板410、封止基板404、及びシール材405で囲まれた空間407に発光素子418が備えられた構造になっている。なお、空間407には、充填材が充填されており、不活性気体(窒素やアルゴン等)が充填される場合の他、シール材405で充填される場合もある。
【0161】
なお、シール材405にはエポキシ系樹脂を用いるのが好ましい。また、これらの材料はできるだけ水分や酸素を透過しない材料であることが望ましい。また、封止基板404に用いる材料としてガラス基板や石英基板の他、FRP(Fiberglass−Reinforced Plastics)、PVF(ポリビニルフロライド)、ポリエステル又はアクリル等からなるプラスチック基板を用いることができる。
【0162】
以上のようにして、本発明の一態様の発光素子を有するアクティブマトリクス型の発光装置を得ることができる。
【0163】
また、本発明の発光素子は、上述したアクティブマトリクス型の発光装置のみならずパッシブマトリクス型の発光装置に用いることもできる。図4に本発明の発光素子を用いたパッシブマトリクス型の発光装置の斜視図及び断面図を示す。なお、図4(A)は、発光装置を示す斜視図、図4(B)は図4(A)をX−Yで切断した断面図である。
【0164】
図4において、基板501上の第1の電極502と第2の電極503との間にはEL層504が設けられている。第1の電極502の端部は絶縁層505で覆われている。そして、絶縁層505上には隔壁層506が設けられている。隔壁層506の側壁は、基板面に近くなるに伴って、一方の側壁と他方の側壁との間隔が狭くなるような傾斜を有する。つまり、隔壁層506の短辺方向の断面は、台形状であり、底辺(絶縁層505と接する辺)の方が上辺(絶縁層505と接しない辺)よりも短い。このように、隔壁層506を設けることで、クロストーク等に起因した発光素子の不良を防ぐことができる。
【0165】
以上により、本発明の一態様の発光素子を有するパッシブマトリクス型の発光装置を得ることができる。
【0166】
なお、本実施の形態で示した発光装置(アクティブマトリクス型、パッシブマトリクス型)は、いずれも本発明の一態様の発光素子を用いて形成されることから、消費電力の低い発光装置を得ることができる。
【0167】
なお、本実施の形態は、他の実施の形態と適宜組み合わせることが可能である。
【0168】
(実施の形態4)
本実施の形態では、本発明を適用した一態様である発光装置を用いて完成させた様々な電子機器および照明器具の一例について、図5、図6を用いて説明する。
【0169】
発光装置を適用した電子機器として、例えば、テレビジョン装置(テレビ、又はテレビジョン受信機ともいう)、コンピュータ用などのモニタ、デジタルカメラ、デジタルビデオカメラ、デジタルフォトフレーム、携帯電話機(携帯電話、携帯電話装置ともいう)、携帯型ゲーム機、携帯情報端末、音響再生装置、パチンコ機などの大型ゲーム機などが挙げられる。これらの電子機器および照明器具の具体例を図5に示す。
【0170】
図5(A)は、テレビジョン装置の一例を示している。テレビジョン装置7100は、筐体7101に表示部7103が組み込まれている。表示部7103により、映像を表示することが可能であり、発光装置を表示部7103に用いることができる。また、ここでは、スタンド7105により筐体7101を支持した構成を示している。
【0171】
テレビジョン装置7100の操作は、筐体7101が備える操作スイッチや、別体のリモコン操作機7110により行うことができる。リモコン操作機7110が備える操作キー7109により、チャンネルや音量の操作を行うことができ、表示部7103に表示される映像を操作することができる。また、リモコン操作機7110に、当該リモコン操作機7110から出力する情報を表示する表示部7107を設ける構成としてもよい。
【0172】
なお、テレビジョン装置7100は、受信機やモデムなどを備えた構成とする。受信機により一般のテレビ放送の受信を行うことができ、さらにモデムを介して有線又は無線による通信ネットワークに接続することにより、一方向(送信者から受信者)又は双方向(送信者と受信者間、あるいは受信者間同士など)の情報通信を行うことも可能である。
【0173】
図5(B)はコンピュータであり、本体7201、筐体7202、表示部7203、キーボード7204、外部接続ポート7205、ポインティングデバイス7206等を含む。なお、コンピュータは、発光装置をその表示部7203に用いることにより作製される。
【0174】
図5(C)は携帯型遊技機であり、筐体7301と筐体7302の2つの筐体で構成されており、連結部7303により、開閉可能に連結されている。筐体7301には表示部7304が組み込まれ、筐体7302には表示部7305が組み込まれている。また、図5(C)に示す携帯型遊技機は、その他、スピーカ部7306、記録媒体挿入部7307、LEDランプ7308、入力手段(操作キー7309、接続端子7310、センサ7311(力、変位、位置、速度、加速度、角速度、回転数、距離、光、液、磁気、温度、化学物質、音声、時間、硬度、電場、電流、電圧、電力、放射線、流量、湿度、傾度、振動、におい又は赤外線を測定する機能を含むもの)、マイクロフォン7312)等を備えている。もちろん、携帯型遊技機の構成は上述のものに限定されず、少なくとも表示部7304および表示部7305の両方、又は一方に発光装置を用いていればよく、その他付属設備が適宜設けられた構成とすることができる。図5(C)に示す携帯型遊技機は、記録媒体に記録されているプログラム又はデータを読み出して表示部に表示する機能や、他の携帯型遊技機と無線通信を行って情報を共有する機能を有する。なお、図5(C)に示す携帯型遊技機が有する機能はこれに限定されず、様々な機能を有することができる。
【0175】
図5(D)は、携帯電話機の一例を示している。携帯電話機7400は、筐体7401に組み込まれた表示部7402の他、操作ボタン7403、外部接続ポート7404、スピーカ7405、マイク7406などを備えている。なお、携帯電話機7400は、発光装置を表示部7402に用いることにより作製される。
【0176】
図5(D)に示す携帯電話機7400は、表示部7402を指などで触れることで、情報を入力することができる。また、電話を掛ける、或いはメールを作成するなどの操作は、表示部7402を指などで触れることにより行うことができる。
【0177】
表示部7402の画面は主として3つのモードがある。第1は、画像の表示を主とする表示モードであり、第2は、文字等の情報の入力を主とする入力モードである。第3は表示モードと入力モードの2つのモードが混合した表示+入力モードである。
【0178】
例えば、電話を掛ける、或いはメールを作成する場合は、表示部7402を文字の入力を主とする文字入力モードとし、画面に表示させた文字の入力操作を行えばよい。この場合、表示部7402の画面のほとんどにキーボード又は番号ボタンを表示させることが好ましい。
【0179】
また、携帯電話機7400内部に、ジャイロ、加速度センサ等の傾きを検出するセンサを有する検出装置を設けることで、携帯電話機7400の向き(縦か横か)を判断して、表示部7402の画面表示を自動的に切り替えるようにすることができる。
【0180】
また、画面モードの切り替えは、表示部7402を触れること、又は筐体7401の操作ボタン7403の操作により行われる。また、表示部7402に表示される画像の種類によって切り替えるようにすることもできる。例えば、表示部に表示する画像信号が動画のデータであれば表示モード、テキストデータであれば入力モードに切り替える。
【0181】
また、入力モードにおいて、表示部7402の光センサで検出される信号を検知し、表示部7402のタッチ操作による入力が一定期間ない場合には、画面のモードを入力モードから表示モードに切り替えるように制御してもよい。
【0182】
表示部7402は、イメージセンサとして機能させることもできる。例えば、表示部7402に掌や指で触れ、掌紋、指紋等を撮像することで、本人認証を行うことができる。また、表示部に近赤外光を発光するバックライト又は近赤外光を発光するセンシング用光源を用いれば、指静脈、掌静脈などを撮像することもできる。
【0183】
図5(E)は卓上照明器具であり、照明部7501、傘7502、可変アーム7503、支柱7504、台7505、電源7506を含む。なお、卓上照明器具は、発光装置を照明部7501に用いることにより作製される。なお、照明器具には天井固定型の照明器具又は壁掛け型の照明器具なども含まれる。
【0184】
図6は、発光装置を、室内の照明装置811として用いた例である。発光装置は大面積化も可能であるため、大面積の照明装置として用いることができる。その他、ロール型の照明装置812として用いることもできる。なお、図6に示すように、室内の照明装置811を備えた部屋で、図5(E)で説明した卓上照明器具813を併用してもよい。
【0185】
以上のようにして、発光装置を適用して電子機器や照明器具を得ることができる。発光装置の適用範囲は極めて広く、あらゆる分野の電子機器に適用することが可能である。
【0186】
なお、本実施の形態に示す構成は、実施の形態1乃至実施の形態3に示した構成を適宜組み合わせて用いることができる。
【実施例1】
【0187】
本実施例では、本発明の一態様の複合材料の具体例を例示する。本発明の一態様の複合材料は、ジベンゾチオフェン骨格又はジベンゾフラン骨格を有する複素環化合物と、該複素環化合物に対して電子受容性を示す無機化合物とを含む。本実施例の構成例1〜9に用いた複素環化合物、及び該複素環化合物のHOMO準位(光電子分光法での測定値)を表1に示す。また、該複素環化合物の構造式を以下に示す。
【0188】
【表1】

【0189】
【化8】

【0190】
また、構成例1〜9において、無機化合物としては、酸化モリブデンを用いた。
【0191】
本発明の一態様の複合材料の作製方法について、構成例1を例に挙げて説明する。構成例2〜9は、構成例1と同様に作製したため、説明を省略する。
【0192】
(構成例1)
まず、ガラス基板を真空蒸着装置内の基板ホルダーに固定する。そして、4−[4−(9−フェニル−9H−フルオレン−9−イル)フェニル]−6−フェニルジベンゾチオフェン(略称:DBTFLP−IV)と酸化モリブデン(VI)とをそれぞれ別の抵抗加熱式の蒸発源に入れ、真空に引いた状態で、共蒸着法によりDBTFLP−IVと酸化モリブデンとを含む膜を形成した。この時、DBTFLP−IVと酸化モリブデン(VI)の比率が質量比で4:2(=DBTFLP−IV:酸化モリブデン)、4:1、4:0.5となるようにそれぞれ共蒸着した。なお、膜厚は50nmとした。
【0193】
このようにして成膜したDBTFLP−IVと酸化モリブデンの複合膜(構成例1)の吸収スペクトルを測定した結果を、図7に示す。また、比較のため、DBTFLP−IVのみの膜(膜厚50nm)の吸収スペクトルも合わせて図示する。なお、構成例2〜9も、それぞれの構成例で用いた複素環化合物のみの膜の吸収スペクトルを比較として示す。
【0194】
同様に、1,3,5−トリ(ジベンゾチオフェン−4−イル)−ベンゼン(略称:DBT3P−II)と酸化モリブデンの複合膜(構成例2)の吸収スペクトルを測定した結果を図8に示す。なお、膜厚はすべて50nmとした。
【0195】
また、4,4’−(ビフェニル−2,2’−ジイル)−ビス−ジベンゾチオフェン(略称:oDBTBP−II)と酸化モリブデンの複合膜(構成例3)の吸収スペクトルを測定した結果を図9に示す。なお、oDBTBP−IIと酸化モリブデン(VI)の比率が質量比で4:1(=oDBTBP−II:酸化モリブデン)の膜のみ、膜厚は47nmであった。そのほかの膜の膜厚は50nmとした。
【0196】
また、2,8−ジフェニル−4−[4−(9−フェニル−9H−フルオレン−9−イル)フェニル]ジベンゾチオフェン(略称:DBTFLP−III)と酸化モリブデンの複合膜(構成例4)の吸収スペクトルを測定した結果を図10に示す。なお、膜厚はすべて50nmとした。
【0197】
また、4−[3−(トリフェニレン−2−イル)フェニル]ジベンゾチオフェン(略称:mDBTPTp−II)と酸化モリブデンの複合膜(構成例5)の吸収スペクトルを測定した結果を図11に示す。なお、膜厚はすべて50nmとした。
【0198】
また、3,6−ジ−(ジベンゾチオフェン−4−イル)−9−フェニル−9H−カルバゾール(略称:DBT2PC−II)と酸化モリブデンの複合膜(構成例6)の吸収スペクトルを測定した結果を図12に示す。なお、膜厚はすべて50nmとした。
【0199】
また、4−[3−(9,10−ジフェニル−2−アントリル)フェニル]ジベンゾチオフェン(略称:2mDBTPPA−II)と酸化モリブデンの複合膜(構成例7)の吸収スペクトルを測定した結果を図13に示す。なお、膜厚はすべて50nmとした。
【0200】
また、4−[3−(9,10−ジフェニル−2−アントリル)フェニル]ジベンゾフラン(略称:2mDBFPPA−II)と酸化モリブデンの複合膜(構成例8)の吸収スペクトルを測定した結果を図14に示す。なお、膜厚はすべて50nmとした。
【0201】
そして、4−[4−(9−フェニルアントラセン−10−イル)フェニル]ジベンゾチオフェン(略称:mDBTPA−II)と酸化モリブデンの複合膜(構成例9)の吸収スペクトルを測定した結果を図15に示す。なお、膜厚はすべて50nmとした。
【0202】
図7乃至図15において、横軸は波長(nm)を、縦軸は吸光度(単位なし)を表す。
【0203】
図7乃至図15より、構成例1〜9に示す本発明の一態様の複合材料は、可視光領域に顕著な吸収ピークがほとんど見られず、透光性の高い材料であることが分かった。構成例7〜9は、アントラセン骨格を有する。本発明の一態様の複合材料は、アントラセン骨格、テトラセン骨格、ペリレン骨格などを含む複素環化合物を用いると、厚膜化した際に、これらの骨格に由来するわずかな吸収ピークが可視光領域に観測される。一方、構成例1〜6は、波長が360nm以上の領域に顕著な吸収ピークが見られず、特に透光性の高い材料であることが分かった。
【0204】
また、構成例1〜9に示す本発明の一態様の複合材料は、赤外領域(波長が700nm以上の領域)においても、顕著な吸収ピークがほとんど見られなかった。
【0205】
また、複素環化合物と酸化モリブデンからなる本発明の一態様の複合材料の吸収スペクトルは、該複素環化合物の吸収スペクトルとはほとんど同じ形状を有しており、酸化モリブデンの濃度が高い膜(具体的には、各構成例において、複素環化合物と酸化モリブデンの比率が質量比で4:2の膜)においても、可視光領域から赤外領域までに顕著な吸収ピークがほとんど見られなかった。このことから、本発明の一態様の複合材料は、電荷移動相互作用による光吸収が生じにくいことが示唆された。
【実施例2】
【0206】
本実施例では、本発明の一態様の発光素子について、図16(A)を用いて説明する。本実施例で用いた材料の構造式を以下に示す。
【0207】
【化9】

【0208】
以下に、本実施例の発光素子1、比較発光素子2、及び比較発光素子3の作製方法を示す。
【0209】
(発光素子1)
まず、ガラス基板1100上に、酸化珪素を含むインジウム錫酸化物(ITSO)をスパッタリング法にて成膜し、陽極として機能する第1の電極1101を形成した。なお、その膜厚は110nmとし、電極面積は2mm×2mmとした。
【0210】
次に、基板1100上に発光素子を形成するための前処理として、基板表面を水で洗浄し、200℃で1時間焼成した後、UVオゾン処理を370秒行った。
【0211】
その後、10−4Pa程度まで内部が減圧された真空蒸着装置に基板を導入し、真空蒸着装置内の加熱室において、170℃で30分間の真空焼成を行った後、基板1100を30分程度放冷した。
【0212】
次に、第1の電極1101が形成された面が下方となるように、第1の電極1101が形成された基板1100を真空蒸着装置内に設けられた基板ホルダーに固定し、10−4Pa程度まで減圧した後、第1の電極1101上に、4−[4−(9−フェニル−9H−フルオレン−9−イル)フェニル]−6−フェニルジベンゾチオフェン(略称:DBTFLP−IV)と酸化モリブデン(VI)を共蒸着することで、正孔注入層1111を形成した。その膜厚は、50nmとし、DBTFLP−IVと酸化モリブデン(VI)の比率は、質量比で4:2(=DBTFLP−IV:酸化モリブデン)となるように調節した。なお、共蒸着法とは、一つの処理室内で、複数の蒸発源から同時に蒸着を行う蒸着法である。
【0213】
次に、正孔注入層1111上に、3−[4−(9−フェナントリル)−フェニル]−9−フェニル−9H−カルバゾール(略称:PCPPn)を10nmの膜厚となるように成膜し、正孔輸送層1112を形成した。
【0214】
さらに、9−[4−(N−カルバゾリル)]フェニル−10−フェニルアントラセン(略称:CzPA)、及びN,N’−ビス〔4−(9−フェニル−9H−フルオレン−9−イル)フェニル〕−N,N’−ジフェニルピレン−1,6−ジアミン(略称:1,6FLPAPrn)を共蒸着し、正孔輸送層1112上に発光層1113を形成した。ここで、CzPA、及び1,6FLPAPrnの質量比は、1:0.05(=CzPA:1,6FLPAPrn)となるように調節した。また、発光層1113の膜厚は30nmとした。
【0215】
次に、発光層1113上に、CzPAを膜厚10nmとなるように成膜し、第1の電子輸送層1114aを形成した。
【0216】
その後、第1の電子輸送層1114a上にバソフェナントロリン(略称:BPhen)を膜厚15nmとなるように成膜し、第2の電子輸送層1114bを形成した。
【0217】
さらに、第2の電子輸送層1114b上に、フッ化リチウム(LiF)を1nmの膜厚で蒸着し、電子注入層1115を形成した。
【0218】
最後に、陰極として機能する第2の電極1103として、アルミニウムを200nmの膜厚となるように蒸着することで、本実施例の発光素子1を作製した。
【0219】
なお、上述した蒸着過程において、蒸着は全て抵抗加熱法を用いた。
【0220】
(比較発光素子2)
比較発光素子2の正孔注入層1111は、9−フェニル−3−[4−(10−フェニル−9−アントリル)フェニル]−9H−カルバゾール(略称:PCzPA)及び酸化モリブデン(VI)を共蒸着することで形成した。その膜厚は、50nmとし、PCzPAと酸化モリブデン(VI)の比率は、質量比で4:2(=PCzPA:酸化モリブデン)となるように調節した。正孔注入層1111以外は、発光素子1と同様に作製した。
【0221】
(比較発光素子3)
比較発光素子3の正孔注入層1111は、4−フェニル−4’−(9−フェニルフルオレン−9−イル)トリフェニルアミン(略称:BPAFLP)及び酸化モリブデン(VI)を共蒸着することで形成した。その膜厚は、50nmとし、BPAFLPと酸化モリブデン(VI)の比率は、質量比で4:2(=BPAFLP:酸化モリブデン)となるように調節した。正孔注入層1111以外は、発光素子1と同様に作製した。
【0222】
以上により得られた発光素子1、比較発光素子2及び比較発光素子3の素子構造を表2に示す。
【0223】
【表2】

【0224】
これらの発光素子を、窒素雰囲気のグローブボックス内において、発光素子が大気に曝されないように封止する作業を行った後、これらの発光素子の動作特性について測定を行った。なお、測定は室温(25℃に保たれた雰囲気)で行った。
【0225】
なお、上記3つの発光素子は、同一基板上に形成した。また、上記3つの発光素子の第1の電極、正孔輸送層〜第2の電極、封止は、同時に形成及び操作を行っている。
【0226】
発光素子1、比較発光素子2及び比較発光素子3の電圧−輝度特性を図17に示す。図17において、横軸は電圧(V)を、縦軸は輝度(cd/m2)を表す。また、輝度−電流効率特性を図18に示す。図18において、横軸は輝度(cd/m2)を、縦軸は電流効率(cd/A)を表す。また、各発光素子における輝度1000cd/m2のときの電圧(V)、CIE色度座標(x、y)、電流効率(cd/A)、外部量子効率(%)を表3に示す。
【0227】
【表3】

【0228】
表3に示す通り、それぞれ1000cd/m2の輝度の時の発光素子1のCIE色度座標は(x,y)=(0.15,0.23)であり、比較発光素子2のCIE色度座標は(x,y)=(0.15,0.22)であり、比較発光素子3のCIE色度座標は(x、y)=(0.15,0.22)であった。これらの結果から、発光素子1、比較発光素子2及び比較発光素子3は、1,6FLPAPrnに由来する青色発光が得られたことがわかった。
【0229】
図17からわかるように、同じ電圧において、発光素子1は比較発光素子3に比べて高い輝度が得られ、比較発光素子2と同等の輝度が得られている。また、図18及び表3からわかるように、発光素子1は、比較発光素子2及び比較発光素子3よりも高い電流効率、外部量子効率を得られている。
【0230】
次に、発光素子1、比較発光素子2及び比較発光素子3の信頼性試験を行った。信頼性試験の結果を図19に示す。図19において、縦軸は初期輝度を100%とした時の規格化輝度(%)を示し、横軸は素子の駆動時間(h)を示す。
【0231】
信頼性試験は、初期輝度を5000cd/m2に設定し、電流密度一定の条件で本実施例の発光素子を駆動した。
【0232】
図19から、発光素子1の260時間後の輝度は、初期輝度の54%を保っていた。一方、比較発光素子2の200時間後の輝度は、初期輝度の50%以下であった。また、比較発光素子3の62時間後の輝度は、初期輝度の50%以下であった。
【0233】
本発明の一態様を適用した発光素子1は、比較発光素子2及び比較発光素子3に比べて、長寿命であることが明らかとなった。
【0234】
以上の結果から、本発明の一態様の複合材料を、発光素子の正孔注入層として用いることで、高い発光効率の素子を実現できることが示された。また、本発明の一態様の複合材料を、発光素子の正孔注入層として用いることで、駆動電圧の低い発光素子を提供できることが示された。また、本発明の一態様の複合材料を正孔注入層として用いることで、長寿命な発光素子を作製できることが示された。
【実施例3】
【0235】
本実施例では、本発明の一態様の発光素子について、図16(A)を用いて説明する。本実施例で用いた材料の構造式を以下に示す。なお、既に示した材料については省略する。
【0236】
【化10】

【0237】
以下に、本実施例の発光素子4の作製方法を示す。
【0238】
(発光素子4)
発光素子4の正孔注入層1111は、1,3,5−トリ(ジベンゾチオフェン−4−イル)−ベンゼン(略称:DBT3P−II)及び酸化モリブデン(VI)を共蒸着することで形成した。その膜厚は、50nmとし、DBT3P−IIと酸化モリブデン(VI)の比率は、質量比で4:2(=DBT3P−II:酸化モリブデン)となるように調節した。正孔注入層1111以外は、実施例2に示した発光素子1と同様に作製した。
【0239】
以上により得られた発光素子4の素子構造を表4に示す。
【0240】
【表4】

【0241】
発光素子4を、窒素雰囲気のグローブボックス内において、発光素子4が大気に曝されないように封止する作業を行った後、発光素子4の動作特性について測定を行った。なお、測定は室温(25℃に保たれた雰囲気)で行った。
【0242】
発光素子4の電圧−輝度特性を図20に示す。図20において、横軸は電圧(V)を、縦軸は輝度(cd/m2)を表す。また、輝度−電流効率特性を図21に示す。図21において、横軸は輝度(cd/m2)を、縦軸は電流効率(cd/A)を表す。また、発光素子4における輝度1000cd/m2のときの電圧(V)、CIE色度座標(x、y)、電流効率(cd/A)、外部量子効率(%)を表5に示す。
【0243】
【表5】

【0244】
表5に示す通り、1000cd/m2の輝度の時の発光素子4のCIE色度座標は(x,y)=(0.15,0.22)であった。この結果から、発光素子4は、1,6FLPAPrnに由来する青色発光が得られたことがわかった。
【0245】
図20、図21及び表5からわかるように、発光素子4は、高い発光効率を示している。また、発光素子4は、駆動電圧が低い発光素子であることがわかる。
【0246】
次に、発光素子4の信頼性試験を行った。信頼性試験の結果を図22に示す。図22において、縦軸は初期輝度を100%とした時の規格化輝度(%)を示し、横軸は素子の駆動時間(h)を示す。
【0247】
信頼性試験は、初期輝度を5000cd/m2に設定し、電流密度一定の条件で本実施例の発光素子を駆動した。
【0248】
図22から、発光素子4の310時間後の輝度は、初期輝度の55%を保っていた。
【0249】
以上の結果から、本発明の一態様の複合材料を用いることで、発光効率の高い発光素子を実現できることが示された。また、本発明の一態様の複合材料を用いることで、駆動電圧の低い発光素子を作製できることが示された。また、本発明の一態様の複合材料を用いることで、長寿命の発光素子を提供できることが示された。
【実施例4】
【0250】
本実施例では、本発明の一態様の発光素子について、図16(A)を用いて説明する。本実施例で用いた材料の構造式を以下に示す。なお、既に示した材料については省略する。
【0251】
【化11】

【0252】
以下に、本実施例の発光素子5の作製方法を示す。
【0253】
(発光素子5)
発光素子5の正孔注入層1111は、2,8−ジフェニル−4−[4−(9−フェニル−9H−フルオレン−9−イル)フェニル]ジベンゾチオフェン(略称:DBTFLP−III)及び酸化モリブデン(VI)を共蒸着することで形成した。その膜厚は、50nmとし、DBTFLP−IIIと酸化モリブデン(VI)の比率は、質量比で4:2(=DBTFLP−III:酸化モリブデン)となるように調節した。正孔注入層1111以外は、実施例2に示した発光素子1と同様に作製した。
【0254】
以上により得られた発光素子5の素子構造を表6に示す。
【0255】
【表6】

【0256】
発光素子5を、窒素雰囲気のグローブボックス内において、発光素子5が大気に曝されないように封止する作業を行った後、発光素子5の動作特性について測定を行った。なお、測定は室温(25℃に保たれた雰囲気)で行った。
【0257】
発光素子5の電圧−輝度特性を図23に示す。図23において、横軸は電圧(V)を、縦軸は輝度(cd/m2)を表す。また、輝度−電流効率特性を図24に示す。図24において、横軸は輝度(cd/m2)を、縦軸は電流効率(cd/A)を表す。また、発光素子5における輝度1000cd/m2のときの電圧(V)、CIE色度座標(x、y)、電流効率(cd/A)、外部量子効率(%)を表7に示す。
【0258】
【表7】

【0259】
表7に示す通り、1000cd/m2の輝度の時の発光素子5のCIE色度座標は(x,y)=(0.15,0.23)であった。この結果から、発光素子5は、1,6FLPAPrnに由来する青色発光が得られたことがわかった。
【0260】
図23、図24及び表7からわかるように、発光素子5は、高い発光効率を示している。また、発光素子5は、駆動電圧が低い発光素子であることがわかる。
【0261】
以上の結果から、本発明の一態様の複合材料を用いることで、発光効率の高い発光素子を実現できることが示された。また、本発明の一態様の複合材料を用いることで、駆動電圧の低い発光素子を作製できることが示された。
【実施例5】
【0262】
本実施例では、本発明の一態様の複合材料の具体例を例示する。本発明の一態様の複合材料は、ジベンゾチオフェン骨格又はジベンゾフラン骨格を有する複素環化合物と、該複素環化合物に対して電子受容性を示す無機化合物とを含む。本実施例の構成例10〜14に用いた複素環化合物、及び構成例10〜13に用いた複素環化合物のHOMO準位(光電子分光法での測定値)を表8に示す。また、本実施例で用いた複素環化合物の構造式を以下に示す。
【0263】
【表8】

【0264】
【化12】

【0265】
また、構成例10〜14において、無機化合物としては、酸化モリブデンを用いた。
【0266】
本発明の一態様の複合材料の作製方法について、構成例10を例に挙げて説明する。構成例11〜14は、構成例10と同様に作製したため、説明を省略する。
【0267】
(構成例10)
まず、ガラス基板を真空蒸着装置内の基板ホルダーに固定する。そして、3−〔4−(ジベンゾチオフェン−4−イル)−フェニル〕−9−フェニル−9H−カルバゾール(略称:DBTPPC−II)と酸化モリブデン(VI)とをそれぞれ別の抵抗加熱式の蒸発源に入れ、真空に引いた状態で、共蒸着法によりDBTPPC−IIと酸化モリブデンとを含む膜を形成した。この時、DBTPPC−IIと酸化モリブデン(VI)の比率が質量比で4:2(=DBTPPC−II:酸化モリブデン)、4:1、4:0.5となるようにそれぞれ共蒸着した。なお、膜厚は50nmとした。
【0268】
このようにして成膜したDBTPPC−IIと酸化モリブデンの複合膜(構成例10)の吸収スペクトルを測定した結果を、図25に示す。また、比較のため、DBTPPC−IIのみの膜(膜厚50nm)の吸収スペクトルも合わせて図示する。なお、構成例11、12、14も、それぞれの構成例で用いた複素環化合物のみの膜の吸収スペクトルを比較として示す。
【0269】
同様に、3−〔3−(ジベンゾチオフェン−4−イル)−フェニル〕−9−フェニル−9H−カルバゾール(略称:mDBTPPC−II)と酸化モリブデンの複合膜(構成例11)の吸収スペクトルを測定した結果を図26に示す。なお、膜厚はすべて50nmとした。
【0270】
また、4−[4−(9−フェナントリル)フェニル]ジベンゾチオフェン(略称:DBTPPn−II)と酸化モリブデンの複合膜(構成例12)の吸収スペクトルを測定した結果を図27に示す。なお、構成例12で示す複合膜は、DBTPPn−IIと酸化モリブデン(VI)の比率が質量比で4:2(=DBTPPn−II:酸化モリブデン)の膜のみである。また、該複合膜、及びDBTPPn−IIのみの膜の膜厚は、どちらも50nmとした。
【0271】
また、4,4’−{(1,1’:2’,1’’:2’’,1’’’)−クアテルフェニル−3,3’’’−イル}−ビスジベンゾチオフェン(略称:mZ−DBT2−II)と酸化モリブデンの複合膜(構成例13)の吸収スペクトルを測定した結果を図28に示す。なお、構成例13では、mZ−DBT2−IIと酸化モリブデンの比率が質量比で4:2(=mZ−DBT2−II:酸化モリブデン)の膜のみを示す(膜厚50nm)。
【0272】
そして、4−{3−[3−(9−フェニル−9H−フルオレン−9−イル)フェニル]フェニル}ジベンゾフラン(略称:mmDBFFLBi−II)と酸化モリブデンの複合膜(構成例14)の吸収スペクトルを測定した結果を図29に示す。なお、膜厚はすべて50nmとした。
【0273】
図25乃至図29において、横軸は波長(nm)を、縦軸は吸光度(単位なし)を表す。
【0274】
図25乃至図29より、構成例10〜14に示す本発明の一態様の複合材料は、可視光領域に顕著な吸収ピークがほとんど見られず、透光性の高い材料であることが分かった。また、構成例10〜14に示す本発明の一態様の複合材料は、赤外領域(波長が700nm以上の領域)においても、顕著な吸収ピークがほとんど見られなかった。
【0275】
また、複素環化合物と酸化モリブデンからなる本発明の一態様の複合材料の吸収スペクトルは、該複素環化合物の吸収スペクトルとはほとんど同じ形状を有しており、酸化モリブデンの濃度が高い膜(具体的には、各構成例において、複素環化合物と酸化モリブデンの比率が質量比で4:2の膜)においても、可視光領域から赤外領域までに顕著な吸収ピークがほとんど見られなかった。このことから、本発明の一態様の複合材料は、電荷移動相互作用による光吸収が生じにくいことが示唆された。
【実施例6】
【0276】
本実施例では、本発明の一態様の発光素子について、図16(A)を用いて説明する。本実施例で用いた材料の構造式を以下に示す。なお、既に示した材料については省略する。
【0277】
【化13】

【0278】
以下に、本実施例の発光素子6の作製方法を示す。
【0279】
(発光素子6)
まず、実施例2に示した発光素子1と同様に、ガラス基板1100上にITSOを成膜することで、第1の電極1101を形成した。
【0280】
次に、第1の電極1101が形成された面が下方となるように、第1の電極1101が形成された基板1100を真空蒸着装置内に設けられた基板ホルダーに固定し、10−4Pa程度まで減圧した後、第1の電極1101上に、4,4’−{(1,1’:2’,1’’:2’’,1’’’)−クアテルフェニル−3,3’’’−イル}−ビスジベンゾチオフェン(略称:mZ−DBT2−II)と酸化モリブデン(VI)を共蒸着することで、正孔注入層1111を形成した。その膜厚は、50nmとし、mZ−DBT2−IIと酸化モリブデン(VI)の比率は、質量比で4:2(=mZ−DBT2−II:酸化モリブデン)となるように調節した。
【0281】
次に、正孔注入層1111上に、3−[4−(1−ナフチル)−フェニル]−9−フェニル−9H−カルバゾール(略称:PCPN)を10nmの膜厚となるように成膜し、正孔輸送層1112を形成した。
【0282】
さらに、CzPA、及びN,N’−ビス(3−メチルフェニル)−N,N’−ビス〔3−(9−フェニル−9H−フルオレン−9−イル)フェニル〕−ピレン−1,6−ジアミン(略称:1,6mMemFLPAPrn)を共蒸着し、正孔輸送層1112上に発光層1113を形成した。ここで、CzPA、及び1,6mMemFLPAPrnの質量比は、1:0.04(=CzPA:1,6mMemFLPAPrn)となるように調節した。また、発光層1113の膜厚は30nmとした。
【0283】
次に、発光層1113上に、CzPAを膜厚10nmとなるように成膜し、第1の電子輸送層1114aを形成した。
【0284】
その後、第1の電子輸送層1114a上にBPhenを膜厚15nmとなるように成膜し、第2の電子輸送層1114bを形成した。
【0285】
さらに、第2の電子輸送層1114b上に、LiFを1nmの膜厚で蒸着し、電子注入層1115を形成した。
【0286】
最後に、陰極として機能する第2の電極1103として、アルミニウムを200nmの膜厚となるように蒸着することで、本実施例の発光素子6を作製した。
【0287】
なお、上述した蒸着過程において、蒸着は全て抵抗加熱法を用いた。
【0288】
以上により得られた発光素子6の素子構造を表9に示す。
【0289】
【表9】

【0290】
発光素子6を、窒素雰囲気のグローブボックス内において、発光素子が大気に曝されないように封止する作業を行った後、発光素子6の動作特性について測定を行った。なお、測定は室温(25℃に保たれた雰囲気)で行った。
【0291】
発光素子6の電圧−輝度特性を図30に示す。図30において、横軸は電圧(V)を、縦軸は輝度(cd/m2)を表す。また、輝度−電流効率特性を図31に示す。図31において、横軸は輝度(cd/m2)を、縦軸は電流効率(cd/A)を表す。また、発光素子6における輝度1000cd/m2のときの電圧(V)、CIE色度座標(x、y)、電流効率(cd/A)、外部量子効率(%)を表10に示す。
【0292】
【表10】

【0293】
表10に示す通り、1000cd/m2の輝度の時の発光素子6のCIE色度座標は(x,y)=(0.14,0.16)であった。この結果から、発光素子6は、1,6mMemFLPAPrnに由来する青色発光が得られたことがわかった。
【0294】
図30、図31及び表10からわかるように、発光素子6は、高い発光効率を示している。また、発光素子6は、駆動電圧が低い発光素子であることがわかる。
【0295】
次に、発光素子6の信頼性試験を行った。信頼性試験の結果を図32に示す。図32において、縦軸は初期輝度を100%とした時の規格化輝度(%)を示し、横軸は素子の駆動時間(h)を示す。
【0296】
信頼性試験は、初期輝度を5000cd/m2に設定し、電流密度一定の条件で発光素子6を駆動した。
【0297】
図32から、発光素子6の280時間後の輝度は、初期輝度の54%を保っていた。
【0298】
以上の結果から、本発明の一態様の複合材料を、発光素子の正孔注入層として用いることで、高い発光効率の素子を実現できることが示された。また、本発明の一態様の複合材料を、発光素子の正孔注入層として用いることで、駆動電圧の低い発光素子を提供できることが示された。また、本発明の一態様の複合材料を正孔注入層として用いることで、長寿命な発光素子を作製できることが示された。
【実施例7】
【0299】
本実施例では、本発明の一態様の発光素子について、図16(A)を用いて説明する。本実施例で用いた材料の構造式を以下に示す。なお、既に示した材料については省略する。
【0300】
【化14】

【0301】
以下に、本実施例の発光素子7の作製方法を示す。
【0302】
(発光素子7)
発光素子7の正孔注入層1111は、4−{3−[3−(9−フェニル−9H−フルオレン−9−イル)フェニル]−フェニル}ジベンゾフラン(略称:mmDBFFLBi−II)及び酸化モリブデン(VI)を共蒸着することで形成した。その膜厚は、50nmとし、mmDBFFLBi−IIと酸化モリブデン(VI)の比率は、質量比で4:2(=mmDBFFLBi−II:酸化モリブデン)となるように調節した。
【0303】
発光素子7の正孔輸送層1112は、mmDBFFLBi−IIを10nmの膜厚で成膜することで形成した。正孔注入層1111及び正孔輸送層1112以外は、実施例6に示した発光素子6と同様に作製した。
【0304】
以上により得られた発光素子7の素子構造を表11に示す。
【0305】
【表11】

【0306】
発光素子7を、窒素雰囲気のグローブボックス内において、発光素子が大気に曝されないように封止する作業を行った後、発光素子7の動作特性について測定を行った。なお、測定は室温(25℃に保たれた雰囲気)で行った。
【0307】
発光素子7の電圧−輝度特性を図33に示す。図33において、横軸は電圧(V)を、縦軸は輝度(cd/m2)を表す。また、輝度−電流効率特性を図34に示す。図34において、横軸は輝度(cd/m2)を、縦軸は電流効率(cd/A)を表す。また、発光素子7における輝度1000cd/m2のときの電圧(V)、CIE色度座標(x、y)、電流効率(cd/A)、外部量子効率(%)を表12に示す。
【0308】
【表12】

【0309】
表12に示す通り、1000cd/m2の輝度の時の発光素子7のCIE色度座標は(x,y)=(0.14,0.16)であった。この結果から、発光素子7は、1,6mMemFLPAPrnに由来する青色発光が得られたことがわかった。
【0310】
図32、図33及び表12からわかるように、発光素子7は、高い発光効率を示している。また、発光素子7は、駆動電圧が低い発光素子であることがわかる。
【0311】
以上の結果から、本発明の一態様の複合材料を、発光素子の正孔注入層として用いることで、高い発光効率の素子を実現できることが示された。また、本発明の一態様の複合材料を、発光素子の正孔注入層として用いることで、駆動電圧の低い発光素子を提供できることが示された。
【実施例8】
【0312】
本実施例では、本発明の一態様の発光素子について、図16(A)を用いて説明する。本実施例で用いた材料は先の実施例で用いた材料であるため、化学式は省略する。
【0313】
以下に、本実施例の発光素子8の作製方法を示す。
【0314】
(発光素子8)
発光素子8の正孔注入層1111は、mmDBFFLBi−II及び酸化モリブデン(VI)を共蒸着することで形成した。その膜厚は、50nmとし、mmDBFFLBi−IIと酸化モリブデン(VI)の比率は、質量比で4:2(=mmDBFFLBi−II:酸化モリブデン)となるように調節した。
【0315】
発光素子8の正孔輸送層1112は、PCzPAを10nmの膜厚で成膜することで形成した。正孔注入層1111及び正孔輸送層1112以外は、実施例6に示した発光素子6と同様に作製した。
【0316】
以上により得られた発光素子8の素子構造を表13に示す。
【0317】
【表13】

【0318】
発光素子8を、窒素雰囲気のグローブボックス内において、発光素子が大気に曝されないように封止する作業を行った後、発光素子8の動作特性について測定を行った。なお、測定は室温(25℃に保たれた雰囲気)で行った。
【0319】
発光素子8の電圧−輝度特性を図35に示す。図35において、横軸は電圧(V)を、縦軸は輝度(cd/m2)を表す。また、輝度−電流効率特性を図36に示す。図36において、横軸は輝度(cd/m2)を、縦軸は電流効率(cd/A)を表す。また、発光素子8における輝度1000cd/m2のときの電圧(V)、CIE色度座標(x、y)、電流効率(cd/A)、外部量子効率(%)を表14に示す。
【0320】
【表14】

【0321】
表14に示す通り、1000cd/m2の輝度の時の発光素子8のCIE色度座標は(x,y)=(0.14,0.18)であった。この結果から、発光素子8は、1,6mMemFLPAPrnに由来する青色発光が得られたことがわかった。
【0322】
図34、図35及び表14からわかるように、発光素子8は、高い発光効率を示している。また、発光素子8は、駆動電圧が低い発光素子であることがわかる。
【0323】
以上の結果から、本発明の一態様の複合材料を、発光素子の正孔注入層として用いることで、高い発光効率の素子を実現できることが示された。また、本発明の一態様の複合材料を、発光素子の正孔注入層として用いることで、駆動電圧の低い発光素子を提供できることが示された。
【実施例9】
【0324】
本実施例では、本発明の一態様の発光素子について、図16(B)を用いて説明する。本実施例で用いた材料の構造式を以下に示す。なお、先の実施例で用いた材料の構造式は省略する。
【0325】
【化15】

【0326】
以下に、本実施例の発光素子9、比較発光素子10の作製方法を示す。
【0327】
(発光素子9)
まず、ガラス基板1100上に、ITSO膜をスパッタリング法にて成膜し、陽極として機能する第1の電極1101を形成した。なお、その膜厚は110nmとし、電極面積は2mm×2mmとした。
【0328】
基板1100上に発光素子を形成するための前処理としては、基板表面を水で洗浄し、200℃で1時間焼成した後、UVオゾン処理を370秒行った。
【0329】
その後、10−4Pa程度まで内部が減圧された真空蒸着装置に基板を導入し、真空蒸着装置内の加熱室において、170℃で30分間の真空焼成を行った後、基板1100を30分程度放冷した。
【0330】
次に、第1の電極1101が形成された面が下方となるように、第1の電極1101が形成された基板1100を真空蒸着装置内に設けられた基板ホルダーに固定し、10−4Pa程度まで減圧した後、第1の電極1101上に、DBT3P−IIと酸化モリブデン(VI)を共蒸着することで、第1の正孔注入層1111aを形成した。その膜厚は、50nmとし、DBT3P−IIと酸化モリブデン(VI)の比率は、質量比で4:2(=DBT3P−II:酸化モリブデン)となるように調節した。
【0331】
次に、第1の正孔注入層1111a上に、PCPNを10nmの膜厚となるように成膜し、第1の正孔輸送層1112aを形成した。
【0332】
さらに、CzPA、及び1,6FLPAPrnを共蒸着し、第1の正孔輸送層1112a上に第1の発光層1113aを形成した。ここで、CzPA、及び1,6FLPAPrnの質量比は、1:0.05(=CzPA:1,6FLPAPrn)となるように調節した。また、第1の発光層1113aの膜厚は30nmとした。
【0333】
次に、第1の発光層1113a上に、CzPAを膜厚10nm、BPhenを膜厚15nmとなるように成膜し、第1の電子輸送層1114aを形成した。
【0334】
さらに、第1の電子輸送層1114a上に、酸化リチウム(Li2O)を0.1nmの膜厚で蒸着し、第1の電子注入層1115aを形成した。
【0335】
その後、第1の電子注入層1115a上に、銅フタロシアニン(略称CuPc)を膜厚2nmで蒸着し、電子リレー層1116を形成した。
【0336】
次に、電子リレー層1116上に、DBT3P−IIと酸化モリブデン(VI)を共蒸着することで、第2の正孔注入層1111bを形成した。その膜厚は50nmとし、DBT3P−IIと酸化モリブデン(VI)の比率は、質量比で4:2(=DBT3P−II:酸化モリブデン)となるように調節した。なお、本実施例の第2の正孔注入層1111bは、先の実施の形態で説明した電荷発生層として機能する。
【0337】
次に、第2の正孔注入層1111b上に、PCPNを10nmの膜厚となるように成膜し、第2の正孔輸送層1112bを形成した。
【0338】
さらに、CzPA、及び1,6FLPAPrnを共蒸着し、第2の正孔輸送層1112b上に第2の発光層1113bを形成した。ここで、CzPA、及び1,6FLPAPrnの質量比は、1:0.05(=CzPA:1,6FLPAPrn)となるように調節した。また、第2の発光層1113bの膜厚は30nmとした。
【0339】
次に、第2の発光層1113b上に、CzPAを膜厚10nm、BPhenを膜厚15nmとなるように成膜し、第2の電子輸送層1114bを形成した。
【0340】
さらに、第2の電子輸送層1114b上に、LiFを1nmの膜厚で蒸着し、第2の電子注入層1115bを形成した。
【0341】
最後に、陰極として機能する第2の電極1103として、アルミニウムを200nmの膜厚となるように蒸着することで、本実施例の発光素子9を作製した。
【0342】
(比較発光素子10)
比較発光素子10の第1の正孔注入層1111aは、PCzPA及び酸化モリブデン(VI)を共蒸着することで形成した。その膜厚は、50nmとし、PCzPAと酸化モリブデン(VI)の比率は、質量比で4:2(=PCzPA:酸化モリブデン)となるように調節した。
【0343】
比較発光素子10の第2の正孔注入層1111bは、PCzPA及び酸化モリブデン(VI)を共蒸着することで形成した。その膜厚は、60nmとし、PCzPAと酸化モリブデン(VI)の比率は、質量比で4:2(=PCzPA:酸化モリブデン)となるように調節した。第1の正孔注入層1111a及び第2の正孔注入層1111b以外は、発光素子9と同様に作製した。
【0344】
なお、上述した蒸着過程において、蒸着は全て抵抗加熱法を用いた。
【0345】
以上により得られた発光素子9、比較発光素子10の素子構造を表15に示す。なお、発光素子9は、表15における物質XがDBT3P−IIであり、膜厚Yが50nmである。そして、比較発光素子10は、表15における物質XがPCzPAであり、膜厚Yが60nmである。
【0346】
【表15】

【0347】
これらの発光素子を、窒素雰囲気のグローブボックス内において、発光素子が大気に曝されないように封止する作業を行った後、これらの発光素子の動作特性について測定を行った。なお、測定は室温(25℃に保たれた雰囲気)で行った。
【0348】
なお、上記2つの発光素子は、同一基板上に形成した。また、上記2つの発光素子の第1の電極、第1の正孔輸送層〜電子リレー層、第2の正孔輸送層〜第2の電極、封止は、同時に形成及び操作を行っている。
【0349】
発光素子9及び比較発光素子10の電圧−輝度特性を図37に示す。図37において、横軸は電圧(V)を表し、縦軸は輝度(cd/m2)を表す。また、輝度−電流効率特性を図38に示す。図38において、横軸は輝度(cd/m2)を、縦軸は電流効率(cd/A)を表す。また、発光素子9及び比較発光素子10における輝度1000cd/m2のときの電圧(V)、CIE色度座標(x、y)、電流効率(cd/A)、パワー効率(lm/W)、外部量子効率(%)を表16に示す。
【0350】
【表16】

【0351】
表16に示す通り、1000cd/m2の輝度の時の発光素子9及び比較発光素子10のCIE色度座標はどちらも(x,y)=(0.14,0.20)であった。
【0352】
図38、表16からわかるように、発光素子9は比較発光素子10に比べて高い電流効率、パワー効率、外部量子効率を得られている。
【0353】
ここで、比較発光素子10に用いたPCzPAと酸化モリブデンとを含む複合材料に関して、吸収スペクトルを測定し、発光素子9に用いたDBT3P−IIと酸化モリブデンとを含む複合材料(図8)と比較した。
【0354】
PCzPAと酸化モリブデン(VI)とを50nmの膜厚になるように共蒸着して形成した膜(質量比で4:2、4:1、4:0.5(=PCzPA:酸化モリブデン))の吸収スペクトルを図39に示す。なお、図39において、横軸は波長(nm)を、縦軸は吸光度(単位なし)を表す。
【0355】
図39に示すように、PCzPAと酸化モリブデンとを含む複合材料は、可視光領域に吸収ピークを有する。一方、実施例1で示した通り、DBT3P−IIと酸化モリブデンとを含む複合材料は、可視光領域に顕著な吸収ピークがほとんど見られない(図8)。
【0356】
このことから、DBT3P−IIと酸化モリブデンとを含む複合材料は、PCzPAと酸化モリブデンとを含む複合材料に比べて可視光領域における透過性が高いため、発光素子9は、比較発光素子10に比べて、高い電流効率が得られたと考えられる。
【0357】
以上の結果から、本発明の一態様の複合材料を、タンデム型の発光素子の正孔注入層、電荷発生層に用いることで、高い発光効率の素子を実現できることが示された。また、本発明の一態様の複合材料を、タンデム型の発光素子の正孔注入層、電荷発生層に用いることで、駆動電圧の低い発光素子を提供できることが示された。また、本発明の一態様の複合材料は、電荷移動相互作用による光吸収が観察されないにも関わらず、タンデム型の発光素子の電荷発生層として極めて有効に機能することがわかった。
【実施例10】
【0358】
本実施例では、本発明の一態様の複合材料について、電子スピン共鳴(ESR:Electron Spin Resonance)法を用いて評価した結果を説明する。本実施例では、DBT3P−IIと酸化モリブデンとを含む本発明の一態様の複合材料と、4,4’−ビス[N−(1−ナフチル)−N−フェニルアミノ]ビフェニル(略称:NPB)と酸化モリブデンとを含む従来の複合材料との比較を行う。NPBの構造式を以下に示す。
【0359】
【化16】

【0360】
<複合材料の吸収スペクトルに関する比較>
まず、NPBと酸化モリブデンとを含む従来の複合材料に関して、吸収スペクトルを測定し、DBT3P−IIと酸化モリブデンとを含む本発明の一態様の複合材料(図8)と比較した。
【0361】
NPBと酸化モリブデン(VI)とを50nmの膜厚となるように共蒸着して形成した膜(質量比で4:2、4:1、4:0.5(=NPB:酸化モリブデン)の吸収スペクトルを図40に示す。なお、図40において、横軸は波長(nm)を、縦軸は吸光度(単位なし)を表す。
【0362】
図40と図8とを比較するとわかるように、NPBを複合材料に用いると、500nm付近および1300nm付近に電荷移動相互作用に基づく大きな光吸収が生じてしまう(しかも、酸化モリブデンの濃度を増やすとピーク強度が大きくなる)が、DBT3P−IIを用いるとその問題点が解消されることがわかる。なお、NPBのHOMO準位(光電子分光法での測定値)は−5.4eVであり、DBT3P−IIのHOMO準位は−5.9eVである。このことからも、NPBはDBT3P−IIに比べて電荷移動相互作用を起こしやすい傾向にあることが示唆される。
【0363】
このように、吸収スペクトルから電荷移動相互作用の有無に関する傾向は得られるが、本実施例では、さらにESR測定による定性的かつ定量的な評価を行い、本発明の一態様の複合材料と従来の複合材料との違いを考察した。以下にその内容を示す。
【0364】
<ESR測定用試料>
本実施例の試料1乃至6、及び比較試料1乃至13について説明する。
【0365】
本発明の一態様を適用した試料1乃至6は、DBT3P−IIと酸化モリブデンとの複合材料を含む複合膜である。比較試料1乃至13は、NPBと酸化モリブデンとの複合材料を含む複合膜である。
【0366】
全ての試料は、石英基板上に、有機化合物(DBT3P−II又はNPB)及び酸化モリブデン(VI)を共蒸着させることで形成した。石英基板のサイズは、2.8mm×20mm(比較試料1〜3は、3.0mm×20mm)とした。
【0367】
具体的には、まず、複合材料の蒸着される面が下方となるように、石英基板を真空蒸着装置内に設けられたホルダーに固定した。そして、真空装置内を10−4Paに減圧した後、有機化合物(DBT3P−II又はNPB)と、酸化モリブデン(VI)とを共蒸着することにより、石英基板上に有機化合物(DBT3P−II又はNPB)及び酸化モリブデンとの複合材料を含む複合膜を形成した。上記複合膜の膜厚は、全ての試料において50nmとなるように調整した。
【0368】
各試料における有機化合物と酸化モリブデン(VI)のモル比は、蒸着レートによって調節した。表17に、各試料における有機化合物と酸化モリブデン(VI)の質量比及びモル比を示す。なお、各試料は4つずつ(比較試料3は、8つ)用意し、ESR測定では4つ(比較試料3は、8つ)を重ねて測定を行った。さらに、表17には、各試料のg値も示す。
【0369】
【表17】

【0370】
<ESR測定>
測定は、電子スピン共鳴測定装置 JES−FA200(日本電子製)を使用し、共振周波数約9.4GHz、変調周波数100kHz、変調幅0.6mT、時定数0.1sec、掃引時間4min、測定温度は室温、の条件で行った。そして、Mn2+第3及び第4シグナルの位置により磁場補正を行った。測定により得られる電子スピン共鳴(ESR)スペクトルの強度は、不対電子の数を反映しており、その強度を比較することにより有機化合物と酸化モリブデンの間における電荷移動相互作用の生じやすさを間接的に把握することができる。なお、ESRスペクトルのピークから算出されたg値は、2.001〜2.006の範囲であり、自由電子のg値(2.0023)近傍の数値を示していた。
【0371】
<測定結果>
図41に、試料6及び比較試料11のESRスペクトルを示す。図41において、横軸は磁場(単位:mT)を、縦軸は強度を表す。
【0372】
図41からわかる通り、試料6は、比較試料11に比べて、磁場336〜340mT付近の強度が極めて低い。該強度が低いほど、複合材料内において、電荷移動相互作用により発生する不対電子の数が少ない。つまり、試料6は、比較試料11に比べて、複合材料内において、電荷移動相互作用が生じにくいと言える。
【0373】
この結果から、本発明の一態様の複合材料である、DBT3P−IIと酸化モリブデンとを含む複合材料は、NPBと酸化モリブデンとを含む複合材料に比べて、電荷移動相互作用が生じにくく、該電荷移動相互作用に基づく光吸収の発生を抑制することができると示唆された。
【0374】
図42は、各試料における有機化合物に対する酸化モリブデン(VI)のモル比と、各試料のESRスペクトルにおける正のピークの値(A)及び負のピークの値(B)の比の値(A/B)との関係を示すグラフである。例として、図41では、比較試料11におけるA及びBを示した。図42(A)(B)において、横軸は、各試料における有機化合物及び酸化モリブデン(VI)のモル比(1:X(=有機化合物:酸化モリブデン))のXの値を表し、縦軸は、各試料におけるA/Bの値を示す。
【0375】
図42(A)は、有機化合物としてDBT3P−IIを用いた試料1乃至6について、図42(B)は、有機化合物としてNPBを用いた比較試料1乃至13について示している。
【0376】
図42(A)(B)からわかる通り、試料1乃至6の多くは、A/Bの値が1.0付近にあり、比較試料1乃至13の多くは、A/Bの値が、1.1〜1.2付近にあった。つまり、本発明の一態様の複合材料である、DBT3P−IIと酸化モリブデンとを含む複合材料は、ESRスペクトルの正のピークと負のピークの形状が対称的であるのに対し、NPBと酸化モリブデンとを含む複合材料はその形状が非対称であると言える。
【0377】
ESRスペクトルにおいて、正のピークと負のピークの形状が対称的である場合は、複合材料内において不対電子が局在化しており、非対称である場合は、不対電子があたかも半導体のように非局在化していると考えられる。
【0378】
ここで、表17より、試料1乃至6のg値は、2.005〜2.006であり、比較試料1乃至13のg値は、2.001〜2.003であることがわかる。g値は不対電子近傍の原子のスピン軌道相互作用の影響を受けるため、重原子が近傍にあれば大きな値を示す。このことから、試料1乃至6において、不対電子は、DBT3P−IIにおける硫黄原子(S)の影響を強く受けており、一方、比較試料1乃至13において、不対電子は、NPBにおける窒素原子(N)や炭素原子(C)の影響を受けていると示唆される。
【0379】
<考察>
以上で得られたESRスペクトルの強度、ピークの対称性、及びg値から、以下のように考察を行った。
【0380】
まず、NPBを用いた複合材料は、ESRスペクトルの強度が高いため、電荷移動相互作用が生じやすいことを示している。また、比較試料1乃至13では、酸化モリブデンがNPBから電子を奪うことにより、主として窒素原子に不対電子が生じ、該不対電子は窒素原子や周辺の炭素原子に非局在化していると考えられる。なぜならば、g値が比較的小さく、また、ESRスペクトルの正のピークと負のピークの形状が非対称であるためである。
【0381】
ここで、該不対電子が存在している軌道には、電子の抜けた穴、すなわちホールが生じているため、そのホールも非局在化していることになる。したがって、窒素原子からベンゼン環にかけて広がる共役系を、ホールが移動しやすくなっており、分子間を移動することも容易となっていると推察される(芳香族アミンが優れたホール輸送性を示す所以である)。つまり、NPB上に生じたホールは、そのまま伝導に寄与するキャリアとなっていると考えられる。
【0382】
以上のことから、NPBは窒素原子を介して、電荷移動相互作用が生じやすく、該電荷移動相互作用によって発生するNPB上のホールが、そのままキャリア輸送性・キャリア注入性に寄与していると示唆される。
【0383】
一方、DBT3P−IIを用いた複合材料は、ESRスペクトルの強度が極めて低いため、電荷移動相互作用がほとんど生じていないことを示している。また、試料1乃至6では、極わずかにではあるが、酸化モリブデンがDBT3P−IIから電子を奪うことにより硫黄原子上に不対電子が生じていると考えられるが、該不対電子は硫黄原子に局在化していると考えられる。なぜならば、g値が比較的大きく、またESRスペクトルの正のピークと負のピークが対称形状であるためである。
【0384】
ここで、該不対電子が存在している軌道には、電子の抜けた穴、すなわちホールが生じているため、そのホールも局在化していることになる。したがって、硫黄原子上に生じたわずかなホールも、硫黄原子上にとどまってしまい、伝導に寄与するキャリアにはなりにくい。以上のことから、DBT3P−IIは電荷移動相互作用が生じにくく、また、仮にDBT3P−II上にホールが生成したとしても、キャリアにはなりにくいことが示唆される。
【0385】
しかし、DBT3P−IIを用いた複合材料は、電圧を印加することでホールを注入・輸送することができる。このことは、以下のように説明できる。つまり、試料1乃至6のような複合材料は、電圧を印加することで、酸化モリブデンがDBT3P−IIからさらに電子を奪うことにより、今度は硫黄原子ではなく、炭素原子上に不対電子ができる(すなわちホールができる)と考えられる。このホールは、炭素原子同士のπ結合により非局在化し、ジベンゾチオフェン環(又はベンゼン環)に広がる共役系を移動すると考えられる。よって、電荷移動相互作用が生じにくいにも関わらず、優れたキャリア輸送性・キャリア注入性を発現することができると示唆される。実際に、先の実施例で示した通り、本発明の一態様の複合材料を用いた発光素子は高い発光効率を示している。
【0386】
以上、本実施例から、本発明の一態様の複合材料は、電荷移動相互作用が生じにくく、該電荷移動相互作用に基づく光吸収の発生を抑制することができると示唆された。また、電荷移動相互作用が生じにくいにも関わらず、優れたキャリア注入性・輸送性を示す機構が示唆された。
【0387】
(参考例1)
上記実施例で用いた4−[4−(9−フェニル−9H−フルオレン−9−イル)フェニル]−6−フェニルジベンゾチオフェン(略称:DBTFLP−IV)の合成方法について説明する。DBTFLP−IVの構造を以下に示す。
【0388】
【化17】

【0389】
100mL三口フラスコに9−(4−ブロモフェニル)−9−フェニル−9H−フルオレンを1.6g(4.0mmol)、4−フェニルジベンゾチオフェン−6−ボロン酸を1.2g(4.0mmol)、酢酸パラジウム(II)を4.0mg(20μmol)、トリ(オルト−トリル)ホスフィンを12mg(40μmol)、トルエン30mL、エタノール3mL、2mol/L炭酸カリウム水溶液3mLを加えた。この混合物を、減圧下で攪拌しながら脱気した後、窒素雰囲気下、90℃で6時間加熱撹拌し、反応させた。
【0390】
反応後、この反応混合液にトルエン150mLを加えた後、この有機層をフロリジール(和光純薬工業株式会社、カタログ番号:540−00135)、アルミナ(メルク、中性)、セライト(和光純薬工業株式会社、カタログ番号:531−16855)の順で濾過して濾液を得た。得られた濾物をシリカゲルカラムクロマトグラフィー(展開溶媒 トルエン:ヘキサン=1:3)による精製を行った。得られたフラクションを濃縮し、アセトンとメタノールを加えて超音波をかけたのち、再結晶化したところ、目的物の白色粉末を収量1.6g、収率73%で得た。また、上記合成法の反応スキームを下記(A−1)に示す。
【0391】
【化18】

【0392】
シリカゲル薄層クロマトグラフィー(TLC)でのRf値(展開溶媒 酢酸エチル:ヘキサン=1:10)は、目的物では0.40、9−(4−ブロモフェニル)−9−フェニル−9H−フルオレンでは0.48だった。
【0393】
核磁気共鳴法(NMR)によって、この化合物が目的物であるDBTFLP−IVであることを確認した。
【0394】
得られた化合物の1H NMRデータを以下に示す。
1H NMR(CDCl3,300MHz):7.16−7.59(m,22H),7.69−7.71(m,2H),7.79(d,J=7.5Hz,2H),8.14−8.18(m,2H)。
【0395】
(参考例2)
上記実施例で用いた4,4’−(ビフェニル−2,2’−ジイル)−ビス−ジベンゾチオフェン(略称:oDBTBP−II)の合成方法について説明する。oDBTBP−IIの構造を以下に示す。
【0396】
【化19】

【0397】
100mL三口フラスコに2,2’−ジブロモビフェニルを1.6g(5.0mmol)、ジベンゾチオフェン−4−ボロン酸を3.2g(11mmol)、酢酸パラジウム(II)を44mg(0.2mmol)、トリ(オルト−トリル)ホスフィンを120mg(0.4mmol)、トルエン30mL、エタノール3mL、2mol/L炭酸カリウム水溶液20mLを加えた。この混合物を、減圧下で攪拌しながら脱気した後、窒素雰囲気下、90℃で10時間加熱撹拌し、反応させた。
【0398】
反応後、この反応混合液にトルエン150mLを加えた後、この有機層をフロリジール、セライトの順で濾過して濾液を得た。得られた濾物をシリカゲルカラムクロマトグラフィー(展開溶媒 トルエン:ヘキサン=1:3)による精製を行った。得られたフラクションを濃縮し、アセトンとメタノールを加えて超音波をかけたのち、再結晶化したところ、目的物であるoDBTBP−IIの白色粉末を収量1.8g、収率69%で得た。また、上記合成法の反応スキームを下記(B−1)に示す。
【0399】
【化20】

【0400】
シリカゲル薄層クロマトグラフィー(TLC)でのRf値(展開溶媒 酢酸エチル:ヘキサン=1:10)は、oDBTBP−IIでは0.56、2,2’−ジブロモビフェニルでは0.77だった。
【0401】
(参考例3)
上記実施例で用いた2,8−ジフェニル−4−[4−(9−フェニル−9H−フルオレン−9−イル)フェニル]ジベンゾチオフェン(略称:DBTFLP−III)の合成方法について説明する。DBTFLP−IIIの構造を以下に示す。
【0402】
【化21】

【0403】
100mL三口フラスコに9−(4−ブロモフェニル)−9−フェニル−9H−フルオレンを1.6g(4.0mmol)、2,8−ジフェニルジベンゾチオフェン−4−ボロン酸を1.7g(4.4mmol)、酢酸パラジウム(II)を11mg(0.1mmol)、トリ(オルト−トリル)ホスフィンを30mg(0.1mmol)、トルエン30mL、エタノール3mL、2mol/L炭酸カリウム水溶液5mLを加えた。この混合物を、減圧下で攪拌しながら脱気した後、窒素雰囲気下、90℃で6.5時間加熱撹拌し、反応させた。
【0404】
反応後、この反応混合液にトルエン150mLを加えた後、この有機層をフロリジール、アルミナ、セライトの順で濾過して濾液を得た。得られた濾物をシリカゲルカラムクロマトグラフィー(展開溶媒 トルエン:ヘキサン=1:3)による精製を行った。得られたフラクションを濃縮し、アセトンとメタノールを加えて超音波をかけたのち、再結晶化したところ、目的物の白色粉末を収量2.3g、収率90%で得た。また、上記合成法の反応スキームを下記(C−1)に示す。
【0405】
【化22】

【0406】
シリカゲル薄層クロマトグラフィー(TLC)でのRf値(展開溶媒 酢酸エチル:ヘキサン=1:10)は、目的物では0.33、9−(4−ブロモフェニル)−9−フェニル−9H−フルオレンでは0.60だった。
【0407】
核磁気共鳴法(NMR)によって、この化合物が目的物であるDBTFLP−IIIであることを確認した。
【0408】
得られた化合物の1H NMRデータを以下に示す。
1H NMR(CDCl3,300MHz):7.23−7.52(m,20H),7.65−7.76(m,8H),7.81(d,J=6.9Hz,1H),7.88(d,J=8.1Hz,1H),8.40(dd,J=11.7Hz,1.5Hz,2H)。
【0409】
(参考例4)
上記実施例で用いた3,6−ジ−(ジベンゾチオフェン−4−イル)−9−フェニル−9H−カルバゾール(略称:DBT2PC−II)の合成方法について説明する。DBT2PC−IIの構造を以下に示す。
【0410】
【化23】

【0411】
200mL三口フラスコに3,6−ジブロモ−9−フェニル−9H−カルバゾールを2.0g(5.0mmol)、ジベンゾチオフェン−4−ボロン酸を3.2g(11mmol)、酢酸パラジウム(II)を10mg(0.1mmol)、トリ(オルト−トリル)ホスフィンを30mg(0.1mmol)、トルエン50mL、エタノール5mL及び2mol/L炭酸カリウム水溶液7.5mLを加え、この混合物を減圧下で攪拌しながら脱気した後、窒素雰囲気下、90℃で6時間加熱撹拌し、反応させた。反応後、この反応混合液を室温まで冷ました後、水、エタノール、トルエン、ヘキサンの順で洗浄しながら、濾過して濾物を得た。得られた濾物をシリカゲルカラムクロマトグラフィー(展開溶媒 トルエン:ヘキサン=1:3)によって精製を行った。これにより得られたフラクションを濃縮し、アセトンとエタノールを加えて超音波をかけたのち、再結晶化したところ、白色粉末を収量1.4g、収率47%で得た。また、上記合成法の反応スキームを下記(D−1)に示す。
【0412】
【化24】

【0413】
得られた白色粉末を核磁気共鳴法(NMR)により測定した。以下に測定データを示す。
1H NMR(CDCl3,300MHz):δ(ppm)=7.44−7.70(m、15H)、7.82−7.86(m、4H)、8.15−8.22(m、4H)、8.57(d、J=1.5Hz、2H)
【0414】
(参考例5)
上記実施例で用いた4−[3−(9,10−ジフェニル−2−アントリル)フェニル]ジベンゾチオフェン(略称:2mDBTPPA−II)の合成方法について説明する。2mDBTPPA−IIの構造を以下に示す。
【0415】
【化25】

【0416】
2mDBTPPA−IIの合成方法を合成スキーム(E−1)に示すと共に、その反応に関し以下において詳述する。
【0417】
【化26】

【0418】
2−ブロモ−9,10−ジフェニルアントラセン1.6g(4.0mmol)、3−(ジベンゾチオフェン−4−イル)フェニルボロン酸1.2g(4.0mmol)、トリ(オルト−トリル)ホスフィン0.30g(1.0mmol)を、100mL三口フラスコに入れ、フラスコ内を窒素置換した。この混合物に、トルエン25mL、エタノール5.0mL、2.0mol/L炭酸カリウム水溶液5.0mLを加えた。この混合物を減圧しながら攪拌することで脱気した。
【0419】
この混合物に酢酸パラジウム(II)45mg(0.20mmol)を加え、窒素気流下、80℃で5時間攪拌した。攪拌後、この混合物の水層をトルエンで抽出し、抽出溶液と有機層を合わせて、飽和食塩水で洗浄した。有機層を硫酸マグネシウムにより乾燥し、乾燥後この混合物を自然濾過した。得られた濾液を濃縮して、油状物を得た。得られた油状物を、シリカゲルカラムクロマトグラフィーにより精製した。クロマトグラフィーは、ヘキサン:トルエン=5:1の混合溶媒を展開溶媒として用いて行った。得られた固体をトルエンとヘキサンの混合溶媒により再結晶化したところ、目的物の黄色粉末を1.6g、収率70%で得た。
【0420】
得られた黄色粉末状固体1.6gをトレインサブリメーション法により昇華精製した。昇華精製条件は、圧力3.0Pa、アルゴンガスを流量4.0mL/minで流しながら、290℃で黄色粉末状固体を加熱した。昇華精製後、目的物の黄色固体を1.4g、収率87%で得た。
【0421】
核磁気共鳴法(NMR)によって、この化合物が目的物である4−[3−(9,10−ジフェニル−2−アントリル)フェニル]ジベンゾチオフェン(略称:2mDBTPPA−II)であることを確認した。
【0422】
得られた物質の1H NMRデータを以下に示す。
1H NMR(CDCl3,300MHz):δ=7.33(q,J1=3.3Hz,2H),7.46−7.73(m,20H),7.80−7.87(m,2H),7.99(st,J1=1.8Hz,1H),8.03(sd,J1=1.5Hz,1H),8.14−8.20(m,2H)
【0423】
(参考例6)
上記実施例で用いた4−[3−(9,10−ジフェニル−2−アントリル)フェニル]ジベンゾフラン(略称:2mDBFPPA−II)の合成方法について説明する。2mDBFPPA−IIの構造を以下に示す。
【0424】
【化27】

【0425】
2mDBFPPA−IIの合成方法を合成スキーム(F−1)に示すと共に、その反応に関し以下において詳述する。
【0426】
【化28】

【0427】
2−ブロモ−9,10−ジフェニルアントラセン1.2g(3.0mmol)、3−(ジベンゾフラン−4−イル)フェニルボロン酸0.87g(3.0mmol)、トリ(オルト−トリル)ホスフィン0.23g(0.75mmol)を、100mL三口フラスコに入れ、フラスコ内を窒素置換した。この混合物に、トルエン15mL、エタノール5.0mL、2.0mol/L炭酸カリウム水溶液3.0mLを加えた。この混合物を減圧しながら攪拌することで脱気した。
【0428】
この混合物に酢酸パラジウム(II)34mg(0.15mmol)を加え、窒素気流下、80℃で4時間攪拌した。攪拌後、この混合物の水層を酢酸エチルで抽出し、抽出溶液と有機層を合わせて、飽和食塩水で洗浄した。有機層を硫酸マグネシウムにより乾燥し、乾燥後この混合物を自然濾過した。得られた濾液を濃縮して得た固体をシリカゲルカラムクロマトグラフィーにより精製した。クロマトグラフィーは、ヘキサン:トルエン=5:1の混合溶媒を展開溶媒に用いて行った。得られた固体をトルエンとヘキサンの混合溶媒により再結晶化したところ、目的物の黄色粉末を1.4g、収率79%で得た。
【0429】
得られた黄色粉末状固体1.4gをトレインサブリメーション法により昇華精製した。昇華精製条件は、圧力3.0Pa、アルゴンガスを流量4.0mL/minで流しながら、270℃で黄色粉末状固体を加熱した。昇華精製後、目的物の黄色固体を1.1g、収率81%で得た。
【0430】
核磁気共鳴法(NMR)によって、この化合物が目的物である4−[3−(9,10−ジフェニル−2−アントリル)フェニル]ジベンゾフラン(略称:2mDBFPPA−II)であることを確認した。
【0431】
得られた物質の1H NMRデータを以下に示す。
1H NMR(CDCl3,300MHz):δ=7.31−7.67(m,19H),7.69−7.73(m,3H),7.80−7.86(m,2H),7.95(dd,J1=0.90Hz,J2=1.8Hz,1H),7.98−8.01(m,2H),8.07(s,1H)
【0432】
(参考例7)
上記実施例で用いた4−フェニル−4’−(9−フェニルフルオレン−9−イル)トリフェニルアミン(略称:BPAFLP)の合成方法について具体的に説明する。BPAFLPの構造を以下に示す。
【0433】
【化29】

【0434】
<ステップ1:9−(4−ブロモフェニル)−9−フェニルフルオレンの合成法>
100mL三口フラスコにて、マグネシウムを1.2g(50mmol)減圧下で30分加熱撹拌し、マグネシウムを活性化させた。これを室温にまで冷まして窒素雰囲気にした後、ジブロモエタン数滴を加えて発泡、発熱するのを確認した。ここにジエチルエーテル10mL中に溶かした2−ブロモビフェニルを12g(50mmol)ゆっくり滴下した後、2.5時間加熱還流撹拌してグリニヤール試薬とした。
【0435】
4−ブロモベンゾフェノンを10g(40mmol)、ジエチルエーテルを100mL、を500mL三口フラスコに入れた。ここに先に合成したグリニヤール試薬をゆっくり滴下した後、9時間加熱還流撹拌した。
【0436】
反応後、この混合液を濾過して濾物を得た。得られた濾物を酢酸エチル150mLに溶かし、ここに1N−塩酸を酸性になるまで加えて2時間撹拌した。この液体の有機層の部分を水で洗浄し、硫酸マグネシウムを加えて水分を取り除いた。この懸濁液を濾過し、得られた濾液を濃縮し粘性の高い物質を得た。
【0437】
500mLなすフラスコに、この粘性の高い物質と、氷酢酸50mLと、塩酸1.0mLとを入れ、窒素雰囲気下、130℃で1.5時間加熱撹拌し、反応させた。
【0438】
反応後、この反応混合液を濾過して濾物を得た。得られた濾物を水、水酸化ナトリウム水溶液、水、メタノールの順で洗浄したのち乾燥させ、目的物の白色粉末を収量11g、収率69%で得た。また、上記合成法の反応スキームを下記(G−1)に示す。
【0439】
【化30】

【0440】
<ステップ2:4−フェニル−4’−(9−フェニルフルオレン−9−イル)トリフェニルアミン(略称:BPAFLP)の合成法>
100mL三口フラスコへ、9−(4−ブロモフェニル)−9−フェニルフルオレンを3.2g(8.0mmol)、4−フェニル−ジフェニルアミンを2.0g(8.0mmol)、ナトリウム tert−ブトキシドを1.0g(10mmol)、ビス(ジベンジリデンアセトン)パラジウム(0)を23mg(0.04mmol)加え、フラスコ内の雰囲気を窒素置換した。この混合物へ、脱水キシレン20mLを加えた。この混合物を、減圧下で攪拌しながら脱気した後、トリ(tert−ブチル)ホスフィン(10wt%ヘキサン溶液)0.2mL(0.1mmol)を加えた。この混合物を、窒素雰囲気下、110℃で2時間加熱撹拌し、反応させた。
【0441】
反応後、この反応混合液にトルエン200mLを加え、この懸濁液をフロリジール、セライトを通して濾過した。得られた濾液を濃縮し、シリカゲルカラムクロマトグラフィー(展開溶媒 トルエン:ヘキサン=1:4)による精製を行った。得られたフラクションを濃縮し、アセトンとメタノールを加えて超音波をかけたのち、再結晶化したところ、目的物の白色粉末を収量4.1g、収率92%で得た。また、上記合成法の反応スキームを下記(G−2)に示す。
【0442】
【化31】

【0443】
シリカゲル薄層クロマトグラフィー(TLC)でのRf値(展開溶媒 酢酸エチル:ヘキサン=1:10)は、目的物は0.41、9−(4−ブロモフェニル)−9−フェニルフルオレンは0.51、4−フェニル−ジフェニルアミンは0.27だった。
【0444】
上記ステップ2で得られた化合物を核磁気共鳴法(NMR)により測定した。以下に測定データを示す。測定結果から、フルオレン誘導体であるBPAFLP(略称)が得られたことがわかった。
【0445】
1H NMR(CDCl3,300MHz):δ(ppm)=6.63−7.02(m、3H)、7.06−7.11(m、6H)、7.19−7.45(m、18H)、7.53−7.55(m、2H)、7.75(d、J=6.9Hz、2H)。
【0446】
(参考例8)
上記実施例で用いたN,N’−ビス〔4−(9−フェニル−9H−フルオレン−9−イル)フェニル〕−N,N’−ジフェニルピレン−1,6−ジアミン(略称:1,6FLPAPrn)の合成方法について具体的に説明する。1,6FLPAPrnの構造を以下に示す。
【0447】
【化32】

【0448】
1,6−ジブロモピレン3.0g(8.3mmol)、4−(9−フェニル−9H−フルオレン−9−イル)ジフェニルアミン(略称:FLPA)6.8g(17mmol)を300mLの三口フラスコへ入れ、フラスコ内を窒素置換した。この混合物へ、100mLのトルエンと、トリ(tert−ブチル)ホスフィンの10wt%ヘキサン溶液0.10mLと、ナトリウム tert−ブトキシド2.4g(25mmol)を加えた。この混合物を、減圧下で攪拌しながら脱気した。この混合物を80℃で加熱して原料が溶けるのを確認してから、ビス(ジベンジリデンアセトン)パラジウム(0)48mg(0.083mmol)を加えた。この混合物を、80℃で1.5時間攪拌した。攪拌後、析出した黄色固体を、混合物を冷まさずに吸引濾過により回収した。得られた固体を3Lのトルエンに懸濁し、110℃で加熱した。この懸濁液を110℃のままアルミナ、セライト、フロリジールを通して吸引濾過し、さらに110℃に熱した200mLのトルエンを流した。得られた濾液を約300mLまで濃縮して再結晶化したところ、目的物を5.7g、収率67%で得た。
【0449】
得られた黄色固体3.56gをトレインサブリメーション法により昇華精製した。昇華精製条件は、圧力5.0Pa、アルゴンガスを流量5.0mL/minで流しながら、353℃で加熱した。昇華精製後、目的物の黄色固体2.54g、収率71%で得た。上記合成例の合成スキームを下記(H−1)に示す。
【0450】
【化33】

【0451】
核磁気共鳴法(NMR)及びMSスペクトルによって、合成例によって得られた化合物が目的物であるN,N’−ビス〔4−(9−フェニル−9H−フルオレン−9−イル)フェニル〕−N,N’−ジフェニルピレン−1,6−ジアミン(略称:1,6FLPAPrn)であることを確認した。
【0452】
上記合成例で得られた化合物の1H NMRデータを以下に示す。
1H NMR(CDCl3,300MHz):δ=6.88−6.91(m,6H),7.00−7.03(m,8H),7.13−7.40(m,26H),7.73−7.80(m,6H),7.87(d,J=9.0Hz,2H),8.06−8.09(m,4H)
【0453】
(参考例9)
上記実施例で用いた3−[4−(9−フェナントリル)−フェニル]−9−フェニル−9H−カルバゾール(略称:PCPPn)の合成方法について具体的に説明する。PCPPnの構造を以下に示す。
【0454】
【化34】

【0455】
<ステップ1:4−(9−フェニル−9H−カルバゾール−3−イル)フェニルボロン酸の合成法>
300mL三口フラスコに、3−(4−ブロモフェニル)−9−フェニル−9H−カルバゾールを8.0g(20mmol)入れ、フラスコ内の雰囲気を窒素置換したのち、脱水テトラヒドロフラン(略称:THF)100mLを加えて−78℃にした。この混合液に1.65mol/Lのn−ブチルリチウムヘキサン溶液15mL(24mmol)を滴下し、2時間撹拌した。この混合物にホウ酸トリメチル3.4mL(30mmol)を加え、−78℃で2時間、室温で18時間撹拌した。反応後、この反応溶液に1M希塩酸を酸性になるまで加えて7時間撹拌した。これを酢酸エチルで抽出し、得られた有機層を飽和食塩水で洗浄した。洗浄後、有機層に硫酸マグネシウムを加えて水分を吸着させた。この懸濁液を濾過し、得られた濾液を濃縮し、ヘキサンを加え超音波をかけたのち、再結晶したところ、目的の白色粉末を収量6.4g、収率88%で得た。上記ステップ1の反応スキームを下記(I−1)に示す。
【0456】
【化35】

【0457】
シリカゲル薄層クロマトグラフィー(TLC)でのRf値(展開溶媒 酢酸エチル:ヘキサン=1:10)は、目的物は0(原点)であり、3−(4−ブロモフェニル)−9−フェニル−9H−カルバゾールは0.53だった。また、展開溶媒に酢酸エチルを用いたシリカゲル薄層クロマトグラフィー(TLC)でのRf値は、目的物は0.72で、3−(4−ブロモフェニル)−9−フェニル−9H−カルバゾールは0.93だった。
【0458】
<ステップ2:3−[4−(9−フェナントリル)−フェニル]−9−フェニル−9H−カルバゾール(略称:PCPPn)の合成法>
200mL三口フラスコへ9−フェニル−9H−カルバゾール−3−イル−フェニル−4−ボロン酸を1.5g(5.0mmol)、9−ブロモフェナントレンを3.2g(11mmol)、酢酸パラジウム(II)を11mg(0.1mmol)、トリ(オルト−トリル)ホスフィンを30mg(0.1mmol)、トルエン30mL、エタノール3mL、2mol/L炭酸カリウム水溶液5mLの混合物を、減圧下で攪拌しながら脱気した後、窒素雰囲気下、90℃で6時間加熱撹拌し、反応させた。
【0459】
反応後、この反応混合液にトルエン200mLを加え、この混合液の有機層をフロリジール、アルミナ、セライトを通して濾過した。得られた濾液を水で洗浄し、硫酸マグネシウムを加えて水分を吸着させた。この懸濁液を濾過して濾液を得た。得られた濾液を濃縮し、シリカゲルカラムクロマトグラフィーによる精製を行った。このとき、クロマトグラフィーの展開溶媒として、トルエンとヘキサンの混合溶媒(トルエン:ヘキサン=1:4)を用いた。得られたフラクションを濃縮し、アセトンとメタノールを加えて超音波をかけたのち、再結晶したところ、目的物の白色粉末を収量2.2g、収率75%で得た。ステップ2の反応スキームを下記(I−2)に示す。
【0460】
【化36】

【0461】
シリカゲル薄層クロマトグラフィー(TLC)でのRf値(展開溶媒 酢酸エチル:ヘキサン=1:10)は、目的物は0.33、9−ブロモフェナントレンは0.70だった。
【0462】
また、得られた化合物を核磁気共鳴法(NMR)により測定した。以下に測定データを示す。
1H NMR(CDCl3,300MHz):δ(ppm)=7.30−7.35(m,11H),7.43−7.78(m,16H),7.86−7.93(m,3H),8.01(dd,J=0.9Hz,7.8Hz,1H),8.23(d,J=7.8Hz,1H),8.47(d,J=1.5Hz,1H),8.74(d,J=8.1Hz,1H),8.80(d,J=7.8Hz,1H)。
【0463】
(参考例10)
上記実施例で用いた3−〔4−(ジベンゾチオフェン−4−イル)−フェニル〕−9−フェニル−9H−カルバゾール(略称:DBTPPC−II)の合成方法について具体的に説明する。DBTPPC−IIの構造を以下に示す。
【0464】
【化37】

【0465】
100mL三口フラスコにて、3−(4−ブロモフェニル)−9−フェニル−9H−カルバゾール2.4g(6.0mmol)、ジベンゾチオフェン−4−ボロン酸1.7g(6.0mmol)、酢酸パラジウム(II)13mg(0.1mmol)、トリ(オルト−トリル)ホスフィン36mg(0.1mmol)、トルエン20mL、エタノール3mL、2mol/L炭酸カリウム水溶液5mLの混合物を、減圧下で攪拌しながら脱気した後、窒素雰囲気下、90℃で4時間加熱しながら撹拌し、反応させた。
【0466】
反応後、この反応混合液にトルエン200mLを加え、この混合液の有機層をフロリジール(和光純薬工業株式会社、カタログ番号:540−00135)、アルミナ(メルク、中性)、セライト(和光純薬工業株式会社、カタログ番号:531−16855)を通して濾過した。得られた濾液を水で洗浄した後、硫酸マグネシウムを加えて水分を吸着させた。この懸濁液を濾過して濾液を得た。得られた濾液を濃縮し、シリカゲルカラムクロマトグラフィーによる精製を行った。クロマトグラフィーの展開溶媒としては、トルエンとヘキサンの混合溶媒(トルエン:ヘキサン=1:4)を用いた。得られたフラクションを濃縮し、アセトンとメタノールを加えて超音波をかけたのち、再結晶したところ、白色粉末を収量2.3g、収率77%で得た。また、上記合成法の反応スキームを下記(J−1)に示す。
【0467】
【化38】

【0468】
シリカゲル薄層クロマトグラフィー(TLC)でのRf値(展開溶媒 酢酸エチル:ヘキサン=1:10)は、上記反応で得られた白色粉末は0.40、3−(4−ブロモフェニル)−9−フェニル−9H−カルバゾールは0.60だった。
【0469】
上記反応で得られた白色粉末を核磁気共鳴法(NMR)により測定した。以下に測定データを示す。測定結果から、上記反応で得られた白色粉末が目的物であるDBTPPC−IIであることを確認した。
【0470】
1H NMR(CDCl3,300MHz):δ(ppm)=7.30−7.36(m,1H),7.44−7.52(m,6H),7.55−7.67(m,6H),7.75(dd,J=8.7Hz,1.5Hz,1H),7.85−7.88(m,5H),8.16−8.24(m,3H),8.46(d,J=1.5Hz,1H)。
【0471】
(参考例11)
上記実施例で用いた3−〔3−(ジベンゾチオフェン−4−イル)−フェニル〕−9−フェニル−9H−カルバゾール(略称:mDBTPPC−II)の合成方法について具体的に説明する。mDBTPPC−IIの構造を以下に示す。
【0472】
【化39】

【0473】
100mL三口フラスコにて3−(3−ブロモフェニル)−9−フェニル−9H−カルバゾール2.4g(6.0mmol)、ジベンゾチオフェン−4−ボロン酸1.7g(6.0mmol)、酢酸パラジウム(II)13mg(0.1mmol)、トリ(オルト−トリル)ホスフィン36mg(0.1mmol)、トルエン20mL、エタノール3mL、2mol/L炭酸カリウム水溶液5mLの混合物を、減圧下で攪拌しながら脱気した後、窒素雰囲気下、90℃で6時間加熱しながら撹拌し、反応させた。
【0474】
反応後、この反応混合液にトルエン200mLを加え、この混合液の有機層をフロリジール(和光純薬工業株式会社、カタログ番号:540−00135)、アルミナ(メルク、中性)、セライト(和光純薬工業株式会社、カタログ番号:531−16855)を通して濾過した。得られた濾液を水で洗浄した後、硫酸マグネシウムを加えて水分を吸着させた。この懸濁液を濾過して濾液を得た。得られた濾液を濃縮し、シリカゲルカラムクロマトグラフィーによる精製を行った。クロマトグラフィーの展開溶媒は、トルエンとヘキサンの混合溶媒(トルエン:ヘキサン=1:4)を用いた。得られたフラクションを濃縮し、アセトンとヘキサンを加えて超音波をかけたのち、再結晶したところ、白色粉末を収量2.6g、収率87%で得た。また、上記合成法の反応スキームを下記(K−1)に示す。
【0475】
【化40】

【0476】
シリカゲル薄層クロマトグラフィー(TLC)でのRf値(展開溶媒 酢酸エチル:ヘキサン=1:10)は、上記反応で得られた白色粉末は0.38、3−(3−ブロモフェニル)−9−フェニル−9H−カルバゾールは0.54だった。
【0477】
上記反応で得られた白色粉末を核磁気共鳴法(NMR)により測定した。以下に測定データを示す。測定結果から、上記反応で得られた白色粉末はmDBTPPC−IIがであることを確認した。
【0478】
1H NMR(CDCl3,300MHz):δ(ppm)=7.27−7.33(m,1H),7.41−7.51(m,6H),7.58−7.65(m,7H),7.70−7.86(m,4H),8.12(t,J=1.5Hz,1H),8.17−8.22(m,3H),8.44(d,J=1.8Hz,1H)。
【0479】
(参考例12)
上記実施例で用いた4−[4−(9−フェナントリル)フェニル]ジベンゾチオフェン(略称:DBTPPn−II)の合成方法について具体的に説明する。DBTPPn−IIの構造を以下に示す。
【0480】
【化41】

【0481】
1.2g(3.6mmol)の9−(4−ブロモフェニル)フェナントレンと、0.8g(3.5mmol)のジベンゾチオフェン−4−ボロン酸と、53mg(0.2mmol)のトリ(オルト−トリル)ホスフィンを50mLの三口フラスコに入れ、フラスコ内を窒素置換した。この混合物に3.5mLの2.0M炭酸カリウム水溶液と、13mLのトルエンと、4.0mLのエタノールを加え、減圧下で攪拌することにより脱気した。この混合物に8.0mg(36μmol)の酢酸パラジウム(II)を加え、窒素気流下、80℃で7時間攪拌した。所定時間経過後、得られた混合物の水層から有機物をトルエンで抽出した。
【0482】
得られた抽出溶液と有機層を合わせ、飽和食塩水で洗浄後、硫酸マグネシウムで乾燥した。この混合物を自然濾過により濾別し、濾液を濃縮して油状物を得た。この油状物をシリカゲルカラムクロマトグラフィーにより精製した。カラムクロマトグラフィーはヘキサン:トルエン=20:1を展開溶媒として用いることにより行った。得られたフラクションを濃縮して油状物を得た。この油状物をトルエンとヘキサンの混合溶媒で再結晶したところ、目的物である白色粉末を収量0.8g、収率53%で得た。
【0483】
得られた白色粉末0.8gをトレインサブリメーション法により昇華精製した。昇華精製は、圧力2.4Pa、アルゴン流量5mL/minの条件で、白色粉末を240℃で加熱して行った。昇華精製後、白色粉末を収量0.7g、収率88%で得た。上述の合成スキームを下記(L−1)に示す。
【0484】
【化42】

【0485】
核磁気共鳴法(NMR)によって、この化合物が目的物である4−[4−(9−フェナントリル)フェニル]ジベンゾチオフェン(略称:DBTPPn−II)であることを確認した。
【0486】
得られた化合物の1H NMRデータを以下に示す。
1H NMR(CDCl3,300MHz):δ(ppm)=7.46−7.53(m,2H),7.58−7.73(m,8H),7.80(s,1H),7.87−7.96(m,4H),8.07(d,J=8.1Hz,1H),8.18−8.24(m,2H),8.76(d,J=8.1Hz,1H),8.82(d,J=7.8Hz,1H)。
【0487】
(参考例13)
上記実施例で用いた4,4’−{(1,1’:2’,1’’:2’’,1’’’)−クアテルフェニル−3,3’’’−イル}−ビスジベンゾチオフェン(略称:mZ−DBT2−II)の合成方法について説明する。
【0488】
【化43】

【0489】
200ml三口フラスコにて、2,2’−ジブロモビフェニル1.0g(3.2mmol)、3−(ジベンゾチオフェン−4−イル)−フェニルボロン酸2.1g(6.7mmol)、テトラキス(トリフェニルホスフィン)パラジウム(0)47mg(40μmol)、トルエン20mL、エタノール2mL、2mol/L炭酸カリウム水溶液7mLの混合物を、減圧下で攪拌しながら脱気した後、窒素雰囲気下、85℃で6時間加熱撹拌し、その後、100℃で6時間加熱撹拌し、反応させた。さらに、テトラキス(トリフェニルホスフィン)パラジウム(0)47mg(40μmol)を混合物に加え、窒素雰囲気下、100℃で2時間加熱撹拌し、反応させた。
【0490】
反応後、この反応混合液にトルエン300mLを加え、この混合液の有機層をフロリジール(和光純薬工業株式会社、カタログ番号:540−00135)、アルミナ(メルク、中性)、セライト(和光純薬工業株式会社、カタログ番号:531−16855)を通して濾過した。得られた濾液を水で洗浄し、硫酸マグネシウムを加えて水分を吸着させた。この懸濁液を濾過して濾液を得た。得られた濾液を濃縮し、シリカゲルカラムクロマトグラフィーによる精製を行った。このとき、クロマトグラフィーの展開溶媒として、トルエンとヘキサンの混合溶媒(トルエン:ヘキサン=1:5)を用いた。得られたフラクションを濃縮し、ヘキサンを加えて超音波をかけたのち、再結晶したところ、目的物の白色粉末を収量2.2g、収率51%で得た。また、上記合成法の反応スキームを下記(M−1)に示す。
【0491】
【化44】

【0492】
シリカゲル薄層クロマトグラフィー(TLC)でのRf値(展開溶媒 酢酸エチル:ヘキサン=1:10)は、目的物は0.25だった。
【0493】
核磁気共鳴法(NMR)によって、この化合物が目的物であるmZ−DBT2−IIであることを確認した。
【0494】
得られた化合物の1H NMRデータを以下に示す。
1H NMR(CDCl3,300MHz):δ(ppm)=6.73(td,J=0.98Hz,1.95Hz,7.4Hz,2H)、7.01−7.06(m,4H)7.34−7.39(m,4H)、7.41−7.47(m,11H)、7.53−7.59(m,3H)7.69−7.72(m,2H)7.98(dd,J=1.5Hz,6.8Hz,2H)、8.08−8.11(m,2H)。
【0495】
(参考例14)
上記実施例で用いた4−{3−[3−(9−フェニル−9H−フルオレン−9−イル)フェニル]フェニル}ジベンゾフラン(略称:mmDBFFLBi−II)の合成方法について説明する。
【0496】
【化45】

【0497】
200mL三口フラスコにて、9−(3−ブロモフェニル)−9−フェニルフルオレン3.5g(8.9mmol)、3−(ジベンゾフラン−4−イル)フェニルボロン酸2.8g(9.8mmol)、酢酸パラジウム(II)22mg(0.1mmol)、トリ(オルト−トリル)ホスフィン89.5mg(0.3mmol)、トルエン38ml、エタノール3.8ml、2mol/L炭酸カリウム水溶液12.7mlの混合物を、減圧下で撹拌しながら脱気した後、窒素雰囲気下、80℃で15.5時間加熱撹拌し、反応させた。
【0498】
反応後、この反応混合液にトルエンを300mL加え、この混合液の有機層をアルミナ(メルク、中性)、セライト(和光純薬工業株式会社、カタログ番号:531−16855)を通して濾過した。得られた濾液を水で洗浄し、硫酸マグネシウムを加えて水分を吸着させた。この懸濁液をろ過して濾液を得た。得られた濾液を濃縮し、シリカゲルカラムクロマトグラフィーによる精製を行った。このとき、クロマトグラフィーの展開溶媒として、トルエンとヘキサンの混合溶媒(トルエン:ヘキサン=2:5)を用いた。得られたフラクションを濃縮し、メタノールを加えて超音波をかけた後、再結晶をしたところ、目的物の白色粉末を収量3.0g、収率60%で得た。また、上記合成法の反応スキームを下記(N−1)に示す。
【0499】
【化46】

【0500】
シリカゲル薄層クロマトグラフィー(TLC)でのRf値(展開溶媒 酢酸エチル:ヘキサン=1:10)は、目的物は0.33であった。
【0501】
核磁気共鳴法(NMR)によって、この化合物が目的物であるmmDBFFLBi−IIであることを確認した。
【0502】
得られた化合物の1H NMRデータを以下に示す。
1H NMR(CDCl3、300MHz):δ(ppm)=7.18−7.60(m,22H)、7.78(d,J=6.4Hz,2H)、7.85(td,J=1.5Hz,7.3Hz,1H)、7.96(dd,J=1.47Hz,7.81Hz,1H)、7.99−8.00(m,2H)。
【0503】
(参考例15)
上記実施例で用いた3−[4−(1−ナフチル)−フェニル]−9−フェニル−9H−カルバゾール(略称:PCPN)を製造する合成例を示す。
【0504】
【化47】

【0505】
PCPNの合成スキームを(o−1)に示す。
【0506】
【化48】

【0507】
200mL三口フラスコにて、3−ブロモ−9−フェニル−9H−カルバゾール5.0g(15.5mmol)、4−(1−ナフチル)フェニルボロン酸4.2g(17.1mmol)、酢酸パラジウム(II)38.4mg(0.2mmol)、トリ(オルト−トリル)ホスフィン104mg(0.3mmol)、トルエン50mL、エタノール5mL、2mol/L炭酸カリウム水溶液30mLの混合物を、減圧下で攪拌しながら脱気した後、窒素雰囲気下、85℃で9時間加熱撹拌し、反応させた。
【0508】
反応後、この反応混合液にトルエン500mLを加え、この混合液の有機層をフロリジール(和光純薬工業株式会社、カタログ番号:540−00135)、アルミナ、セライト(和光純薬工業株式会社、カタログ番号:531−16855)を通して濾過した。得られた濾液を水で洗浄し、硫酸マグネシウムを加えて水分を吸着させた。この懸濁液を濾過して濾液を得た。得られた濾液を濃縮し、シリカゲルカラムクロマトグラフィーによる精製を行った。このとき、クロマトグラフィーの展開溶媒として、トルエンとヘキサンの混合溶媒(トルエン:ヘキサン=1:4)を用いた。得られたフラクションを濃縮し、メタノールを加えて超音波をかけたのち、再結晶化したところ、目的物の白色粉末を収量6.24g、収率90%で得た。
【0509】
核磁気共鳴分光法(1H−NMR)によって、この化合物が目的物である3−[4−(1−ナフチル)−フェニル]−9−フェニル−9H−カルバゾール(略称:PCPN)であることを確認した。
【0510】
得られた物質の1H NMRデータを以下に示す。
1H NMR(CDCl3,300MHz):δ(ppm)=7.30−7.35(m,1H),7.44−7.67(m,14H),7.76(dd,J=8.7Hz,1.8Hz,1H),7.84−7.95(m,4H),8.04(d,J=7.8,1H),8.23(d,J=7.8,1H),8.46(d,J=1.5,1H)。
【符号の説明】
【0511】
100 基板
101 第1の電極
102 EL層
108 第2の電極
401 ソース側駆動回路
402 画素部
403 ゲート側駆動回路
404 封止基板
405 シール材
407 空間
408 配線
409 FPC(フレキシブルプリントサーキット)
410 素子基板
411 スイッチング用TFT
412 電流制御用TFT
413 第1の電極
414 絶縁物
416 EL層
417 第2の電極
418 発光素子
423 nチャネル型TFT
424 pチャネル型TFT
501 基板
502 第1の電極
503 第2の電極
504 EL層
505 絶縁層
506 隔壁層
701 正孔注入層
702 正孔輸送層
703 発光層
704 電子輸送層
705 電子注入層
706 電子注入バッファー層
707 電子リレー層
708 複合材料層
800 EL層
801 EL層
802 EL層
803 電荷発生層
811 照明装置
812 照明装置
813 卓上照明器具
1100 基板
1101 第1の電極
1103 第2の電極
1111 正孔注入層
1111a 第1の正孔注入層
1111b 第2の正孔注入層
1112 正孔輸送層
1112a 第1の正孔輸送層
1112b 第2の正孔輸送層
1113 発光層
1113a 第1の発光層
1113b 第2の発光層
1114a 第1の電子輸送層
1114b 第2の電子輸送層
1115 電子注入層
1115a 第1の電子注入層
1115b 第2の電子注入層
1116 電子リレー層
7100 テレビジョン装置
7101 筐体
7103 表示部
7105 スタンド
7107 表示部
7109 操作キー
7110 リモコン操作機
7201 本体
7202 筐体
7203 表示部
7204 キーボード
7205 外部接続ポート
7206 ポインティングデバイス
7301 筐体
7302 筐体
7303 連結部
7304 表示部
7305 表示部
7306 スピーカ部
7307 記録媒体挿入部
7308 LEDランプ
7309 操作キー
7310 接続端子
7311 センサ
7312 マイクロフォン
7400 携帯電話機
7401 筐体
7402 表示部
7403 操作ボタン
7404 外部接続ポート
7405 スピーカ
7406 マイク
7501 照明部
7502 傘
7503 可変アーム
7504 支柱
7505 台
7506 電源
【特許請求の範囲】
【請求項1】
ジベンゾチオフェン骨格又はジベンゾフラン骨格を有する複素環化合物と、前記複素環化合物に対して電子受容性を示す無機化合物とを含む複合材料。
【請求項2】
ジベンゾチオフェン骨格又はジベンゾフラン骨格の4位に炭素数6以上70以下の置換基が結合した複素環化合物と、前記複素環化合物に対して電子受容性を示す無機化合物とを含む複合材料。
【請求項3】
ジベンゾチオフェン骨格又はジベンゾフラン骨格の4位にフェニル基が結合し、前記フェニル基が1以上の置換基を有し、前記フェニル基及び前記1以上の置換基の炭素数の総和が12以上70以下である複素環化合物と、前記複素環化合物に対して電子受容性を示す無機化合物とを含む複合材料。
【請求項4】
請求項2又は請求項3において、
前記置換基が有する環は、それぞれ独立に、ベンゼン環、ナフタレン環、フェナントレン環、トリフェニレン環、フルオレン環、ジベンゾチオフェン環、ジベンゾフラン環から選ばれる一種又は複数種である複合材料。
【請求項5】
一般式(G1)で表される複素環化合物と、前記複素環化合物に対して電子受容性を示す無機化合物とを含む複合材料。
【化1】

(式中、Aは酸素又は硫黄を表し、R1〜R7は、それぞれ独立に、水素、炭素数1〜4のアルキル基、又は環を構成する炭素数が6〜25のアリール基を表し、R8〜R12は、それぞれ独立に、水素、置換もしくは無置換のフェニル基、置換もしくは無置換のナフチル基、置換もしくは無置換のフェナントリル基、置換もしくは無置換のトリフェニレニル基、置換もしくは無置換のフルオレニル基、置換もしくは無置換のジベンゾチオフェニル基、又は置換もしくは無置換のジベンゾフラニル基を表す。ただし、R8〜R12のうち、少なくとも1つは、置換もしくは無置換のフェニル基、置換もしくは無置換のナフチル基、置換もしくは無置換のフェナントリル基、置換もしくは無置換のトリフェニレニル基、置換もしくは無置換のフルオレニル基、置換もしくは無置換のジベンゾチオフェニル基、又は置換もしくは無置換のジベンゾフラニル基を表す。)
【請求項6】
一般式(G1)で表される複素環化合物と、前記複素環化合物に対して電子受容性を示す無機化合物とを含む複合材料。
【化2】

(式中、Aは酸素又は硫黄を表し、R1〜R7は、それぞれ独立に、水素、炭素数1〜4のアルキル基、又は環を構成する炭素数が6〜25のアリール基を表し、R8〜R12は、それぞれ独立に、水素、置換もしくは無置換のフェニル基、置換もしくは無置換のフルオレニル基、置換もしくは無置換のジベンゾチオフェニル基、又は置換もしくは無置換のジベンゾフラニル基を表す。ただし、R8〜R12のうち、少なくとも1つは、置換もしくは無置換のフェニル基、置換もしくは無置換のフルオレニル基、置換もしくは無置換のジベンゾチオフェニル基、又は置換もしくは無置換のジベンゾフラニル基を表す。)
【請求項7】
ジベンゾチオフェン骨格又はジベンゾフラン骨格を有する複素環化合物と、遷移金属酸化物とを含む複合材料。
【請求項8】
ジベンゾチオフェン骨格又はジベンゾフラン骨格の4位に炭素数6以上70以下の置換基が結合した複素環化合物と、遷移金属酸化物とを含む複合材料。
【請求項9】
ジベンゾチオフェン骨格又はジベンゾフラン骨格の4位にフェニル基が結合し、前記フェニル基が1以上の置換基を有し、前記フェニル基及び前記1以上の置換基の炭素数の総和が12以上70以下である複素環化合物と、遷移金属酸化物とを含む複合材料。
【請求項10】
請求項8又は請求項9において、
前記置換基が有する環は、それぞれ独立に、ベンゼン環、ナフタレン環、フェナントレン環、トリフェニレン環、フルオレン環、ジベンゾチオフェン環、ジベンゾフラン環から選ばれる一種又は複数種である複合材料。
【請求項11】
一般式(G1)で表される複素環化合物と、遷移金属酸化物とを含む複合材料。
【化3】

(式中、Aは酸素又は硫黄を表し、R1〜R7は、それぞれ独立に、水素、炭素数1〜4のアルキル基、又は環を構成する炭素数が6〜25のアリール基を表し、R8〜R12は、それぞれ独立に、水素、置換もしくは無置換のフェニル基、置換もしくは無置換のナフチル基、置換もしくは無置換のフェナントリル基、置換もしくは無置換のトリフェニレニル基、置換もしくは無置換のフルオレニル基、置換もしくは無置換のジベンゾチオフェニル基、又は置換もしくは無置換のジベンゾフラニル基を表す。ただし、R8〜R12のうち、少なくとも1つは、置換もしくは無置換のフェニル基、置換もしくは無置換のナフチル基、置換もしくは無置換のフェナントリル基、置換もしくは無置換のトリフェニレニル基、置換もしくは無置換のフルオレニル基、置換もしくは無置換のジベンゾチオフェニル基、又は置換もしくは無置換のジベンゾフラニル基を表す。)
【請求項12】
一般式(G1)で表される複素環化合物と、遷移金属酸化物とを含む複合材料。
【化4】

(式中、Aは酸素又は硫黄を表し、R1〜R7は、それぞれ独立に、水素、炭素数1〜4のアルキル基、又は環を構成する炭素数が6〜25のアリール基を表し、R8〜R12は、それぞれ独立に、水素、置換もしくは無置換のフェニル基、置換もしくは無置換のフルオレニル基、置換もしくは無置換のジベンゾチオフェニル基、又は置換もしくは無置換のジベンゾフラニル基を表す。ただし、R8〜R12のうち、少なくとも1つは、置換もしくは無置換のフェニル基、置換もしくは無置換のフルオレニル基、置換もしくは無置換のジベンゾチオフェニル基、又は置換もしくは無置換のジベンゾフラニル基を表す。)
【請求項13】
請求項7乃至請求項12のいずれか一項において、
前記遷移金属酸化物は、チタン酸化物、バナジウム酸化物、タンタル酸化物、モリブデン酸化物、タングステン酸化物、レニウム酸化物、ルテニウム酸化物、クロム酸化物、ジルコニウム酸化物、ハフニウム酸化物、銀酸化物から選ばれる一種又は複数種である複合材料。
【請求項14】
請求項1乃至請求項13のいずれか一項において、
前記複素環化合物の最高被占有軌道準位は、光電子分光法での測定値が−5.7eV以下である複合材料。
【請求項15】
一対の電極間に発光物質を含む層を有し、
前記発光物質を含む層は、請求項1乃至請求項14のいずれか一項に記載の複合材料を含む層を有する発光素子。
【請求項16】
請求項15において、
前記複合材料を含む層が、前記一対の電極のうち陽極として機能する電極と接する発光素子。
【請求項17】
請求項15において、
前記複合材料を含む層が、前記一対の電極のうち陰極として機能する電極と接する発光素子。
【請求項18】
請求項15において、
前記複合材料を含む層を2層有し、一方の層は、前記一対の電極のうち陽極として機能する電極と接し、他方の層は、前記一対の電極のうち陰極として機能する電極と接する発光素子。
【請求項19】
一対の電極間に発光物質を含む層を複数有し、
複数の前記発光物質を含む層の間に、請求項1乃至請求項14のいずれか一項に記載の複合材料を含む層を有する発光素子。
【請求項20】
請求項15乃至請求項19のいずれか一項に記載の発光素子を有する発光装置。
【請求項21】
請求項20に記載の発光装置を表示部に有する電子機器。
【請求項22】
請求項20に記載の発光装置を発光部に有する照明装置。
【請求項1】
ジベンゾチオフェン骨格又はジベンゾフラン骨格を有する複素環化合物と、前記複素環化合物に対して電子受容性を示す無機化合物とを含む複合材料。
【請求項2】
ジベンゾチオフェン骨格又はジベンゾフラン骨格の4位に炭素数6以上70以下の置換基が結合した複素環化合物と、前記複素環化合物に対して電子受容性を示す無機化合物とを含む複合材料。
【請求項3】
ジベンゾチオフェン骨格又はジベンゾフラン骨格の4位にフェニル基が結合し、前記フェニル基が1以上の置換基を有し、前記フェニル基及び前記1以上の置換基の炭素数の総和が12以上70以下である複素環化合物と、前記複素環化合物に対して電子受容性を示す無機化合物とを含む複合材料。
【請求項4】
請求項2又は請求項3において、
前記置換基が有する環は、それぞれ独立に、ベンゼン環、ナフタレン環、フェナントレン環、トリフェニレン環、フルオレン環、ジベンゾチオフェン環、ジベンゾフラン環から選ばれる一種又は複数種である複合材料。
【請求項5】
一般式(G1)で表される複素環化合物と、前記複素環化合物に対して電子受容性を示す無機化合物とを含む複合材料。
【化1】

(式中、Aは酸素又は硫黄を表し、R1〜R7は、それぞれ独立に、水素、炭素数1〜4のアルキル基、又は環を構成する炭素数が6〜25のアリール基を表し、R8〜R12は、それぞれ独立に、水素、置換もしくは無置換のフェニル基、置換もしくは無置換のナフチル基、置換もしくは無置換のフェナントリル基、置換もしくは無置換のトリフェニレニル基、置換もしくは無置換のフルオレニル基、置換もしくは無置換のジベンゾチオフェニル基、又は置換もしくは無置換のジベンゾフラニル基を表す。ただし、R8〜R12のうち、少なくとも1つは、置換もしくは無置換のフェニル基、置換もしくは無置換のナフチル基、置換もしくは無置換のフェナントリル基、置換もしくは無置換のトリフェニレニル基、置換もしくは無置換のフルオレニル基、置換もしくは無置換のジベンゾチオフェニル基、又は置換もしくは無置換のジベンゾフラニル基を表す。)
【請求項6】
一般式(G1)で表される複素環化合物と、前記複素環化合物に対して電子受容性を示す無機化合物とを含む複合材料。
【化2】

(式中、Aは酸素又は硫黄を表し、R1〜R7は、それぞれ独立に、水素、炭素数1〜4のアルキル基、又は環を構成する炭素数が6〜25のアリール基を表し、R8〜R12は、それぞれ独立に、水素、置換もしくは無置換のフェニル基、置換もしくは無置換のフルオレニル基、置換もしくは無置換のジベンゾチオフェニル基、又は置換もしくは無置換のジベンゾフラニル基を表す。ただし、R8〜R12のうち、少なくとも1つは、置換もしくは無置換のフェニル基、置換もしくは無置換のフルオレニル基、置換もしくは無置換のジベンゾチオフェニル基、又は置換もしくは無置換のジベンゾフラニル基を表す。)
【請求項7】
ジベンゾチオフェン骨格又はジベンゾフラン骨格を有する複素環化合物と、遷移金属酸化物とを含む複合材料。
【請求項8】
ジベンゾチオフェン骨格又はジベンゾフラン骨格の4位に炭素数6以上70以下の置換基が結合した複素環化合物と、遷移金属酸化物とを含む複合材料。
【請求項9】
ジベンゾチオフェン骨格又はジベンゾフラン骨格の4位にフェニル基が結合し、前記フェニル基が1以上の置換基を有し、前記フェニル基及び前記1以上の置換基の炭素数の総和が12以上70以下である複素環化合物と、遷移金属酸化物とを含む複合材料。
【請求項10】
請求項8又は請求項9において、
前記置換基が有する環は、それぞれ独立に、ベンゼン環、ナフタレン環、フェナントレン環、トリフェニレン環、フルオレン環、ジベンゾチオフェン環、ジベンゾフラン環から選ばれる一種又は複数種である複合材料。
【請求項11】
一般式(G1)で表される複素環化合物と、遷移金属酸化物とを含む複合材料。
【化3】

(式中、Aは酸素又は硫黄を表し、R1〜R7は、それぞれ独立に、水素、炭素数1〜4のアルキル基、又は環を構成する炭素数が6〜25のアリール基を表し、R8〜R12は、それぞれ独立に、水素、置換もしくは無置換のフェニル基、置換もしくは無置換のナフチル基、置換もしくは無置換のフェナントリル基、置換もしくは無置換のトリフェニレニル基、置換もしくは無置換のフルオレニル基、置換もしくは無置換のジベンゾチオフェニル基、又は置換もしくは無置換のジベンゾフラニル基を表す。ただし、R8〜R12のうち、少なくとも1つは、置換もしくは無置換のフェニル基、置換もしくは無置換のナフチル基、置換もしくは無置換のフェナントリル基、置換もしくは無置換のトリフェニレニル基、置換もしくは無置換のフルオレニル基、置換もしくは無置換のジベンゾチオフェニル基、又は置換もしくは無置換のジベンゾフラニル基を表す。)
【請求項12】
一般式(G1)で表される複素環化合物と、遷移金属酸化物とを含む複合材料。
【化4】

(式中、Aは酸素又は硫黄を表し、R1〜R7は、それぞれ独立に、水素、炭素数1〜4のアルキル基、又は環を構成する炭素数が6〜25のアリール基を表し、R8〜R12は、それぞれ独立に、水素、置換もしくは無置換のフェニル基、置換もしくは無置換のフルオレニル基、置換もしくは無置換のジベンゾチオフェニル基、又は置換もしくは無置換のジベンゾフラニル基を表す。ただし、R8〜R12のうち、少なくとも1つは、置換もしくは無置換のフェニル基、置換もしくは無置換のフルオレニル基、置換もしくは無置換のジベンゾチオフェニル基、又は置換もしくは無置換のジベンゾフラニル基を表す。)
【請求項13】
請求項7乃至請求項12のいずれか一項において、
前記遷移金属酸化物は、チタン酸化物、バナジウム酸化物、タンタル酸化物、モリブデン酸化物、タングステン酸化物、レニウム酸化物、ルテニウム酸化物、クロム酸化物、ジルコニウム酸化物、ハフニウム酸化物、銀酸化物から選ばれる一種又は複数種である複合材料。
【請求項14】
請求項1乃至請求項13のいずれか一項において、
前記複素環化合物の最高被占有軌道準位は、光電子分光法での測定値が−5.7eV以下である複合材料。
【請求項15】
一対の電極間に発光物質を含む層を有し、
前記発光物質を含む層は、請求項1乃至請求項14のいずれか一項に記載の複合材料を含む層を有する発光素子。
【請求項16】
請求項15において、
前記複合材料を含む層が、前記一対の電極のうち陽極として機能する電極と接する発光素子。
【請求項17】
請求項15において、
前記複合材料を含む層が、前記一対の電極のうち陰極として機能する電極と接する発光素子。
【請求項18】
請求項15において、
前記複合材料を含む層を2層有し、一方の層は、前記一対の電極のうち陽極として機能する電極と接し、他方の層は、前記一対の電極のうち陰極として機能する電極と接する発光素子。
【請求項19】
一対の電極間に発光物質を含む層を複数有し、
複数の前記発光物質を含む層の間に、請求項1乃至請求項14のいずれか一項に記載の複合材料を含む層を有する発光素子。
【請求項20】
請求項15乃至請求項19のいずれか一項に記載の発光素子を有する発光装置。
【請求項21】
請求項20に記載の発光装置を表示部に有する電子機器。
【請求項22】
請求項20に記載の発光装置を発光部に有する照明装置。
【図1】


【図2】


【図3】


【図4】


【図5】


【図6】


【図7】


【図8】


【図9】


【図10】


【図11】


【図12】


【図13】


【図14】


【図15】


【図16】


【図17】


【図18】


【図19】


【図20】


【図21】


【図22】


【図23】


【図24】


【図25】


【図26】


【図27】


【図28】


【図29】


【図30】


【図31】


【図32】


【図33】


【図34】


【図35】


【図36】


【図37】


【図38】


【図39】


【図40】


【図41】


【図42】




【図2】


【図3】


【図4】


【図5】


【図6】


【図7】


【図8】


【図9】


【図10】


【図11】


【図12】


【図13】


【図14】


【図15】


【図16】


【図17】


【図18】


【図19】


【図20】


【図21】


【図22】


【図23】


【図24】


【図25】


【図26】


【図27】


【図28】


【図29】


【図30】


【図31】


【図32】


【図33】


【図34】


【図35】


【図36】


【図37】


【図38】


【図39】


【図40】


【図41】


【図42】


【公開番号】特開2013−12698(P2013−12698A)
【公開日】平成25年1月17日(2013.1.17)
【国際特許分類】
【出願番号】特願2011−219738(P2011−219738)
【出願日】平成23年10月4日(2011.10.4)
【出願人】(000153878)株式会社半導体エネルギー研究所 (5,264)
【Fターム(参考)】
【公開日】平成25年1月17日(2013.1.17)
【国際特許分類】
【出願日】平成23年10月4日(2011.10.4)
【出願人】(000153878)株式会社半導体エネルギー研究所 (5,264)
【Fターム(参考)】
[ Back to top ]

