複製欠損アデノウイルスTNFベクター
【課題】構築と使用においてより大きな柔軟性を有し、かつ腫瘍又は癌の治療におけるより大きな効果を期待できる複製欠損TNFアデノウイルスベクターを提供する。
【解決手段】(a)アデノウイルスゲノムのE4領域12において欠損しているアデノウイルスゲノム、(b)TNFをコードする核酸配列15、及び(c)TNFをコードする核酸配列15と作動可能に連結している放射線誘導性プロモーター14、を含むアデノウイルスベクター。また、前記アデノウイルスゲノムにおいて、E4領域12中の少なくとも15塩基対のスペーサーエレメント18、を含むアデノウイルスベクター。前記アデノウイルスベクターの製造方法、並びに、宿主の腫瘍又は癌の治療方法において、前記アデノウイルスベクターの抗癌又は抗腫瘍有効量を投与することを含む方法。
【解決手段】(a)アデノウイルスゲノムのE4領域12において欠損しているアデノウイルスゲノム、(b)TNFをコードする核酸配列15、及び(c)TNFをコードする核酸配列15と作動可能に連結している放射線誘導性プロモーター14、を含むアデノウイルスベクター。また、前記アデノウイルスゲノムにおいて、E4領域12中の少なくとも15塩基対のスペーサーエレメント18、を含むアデノウイルスベクター。前記アデノウイルスベクターの製造方法、並びに、宿主の腫瘍又は癌の治療方法において、前記アデノウイルスベクターの抗癌又は抗腫瘍有効量を投与することを含む方法。
【発明の詳細な説明】
【技術分野】
【0001】
発明の技術分野
本発明は、腫瘍壊死因子(TNF)をコードする核酸配列を含む複製欠損(replication deficient)アデノウイルスベクター、並びにこのようなベクターの構築及び使用方法に関する。
【背景技術】
【0002】
発明の背景
腫瘍壊死因子(TNF)、特に、TNF−αは、その抗腫瘍効果及び放射線治療と相乗的に作用する能力について周知である。例えば、TNF−α遺伝子を含むある複製欠損アデノウイルスベクターは、動物における腫瘍を治療するために放射線治療と組み合わせて使用されており、ある程度は成功している(例えば、Hallahan ら, Nat. Med., 1, 786-91 (1995))。しかし、抗癌/抗腫瘍剤としてのTNFの使用は、その重篤な全身的効果によって制限されている。
【発明の概要】
【発明が解決しようとする課題】
【0003】
構築と使用においてより大きな柔軟性を有し、かつ腫瘍又は癌の治療におけるより大きな成功を提供しうる複製欠損TNFアデノウイルスベクターが依然として必要性とされている。本発明は、このようなベクター、並びにこのようなベクターの構築方法、及びこのようなベクターの使用を含む治療方法を提供する。
【課題を解決するための手段】
【0004】
発明の簡単な概要
本発明は、(a)アデノウイルスゲノムの初期増殖−4(E4)領域において欠損しているアデノウイルスゲノム、(b)TNFをコードする核酸配列、及び(c)TNFをコードする核酸配列と作動可能に連結している放射線誘導性プロモーター、を含むアデノウイルスベクターを提供する。本発明はまた、(a)アデノウイルスゲノムのE4領域において欠損しているアデノウイルスゲノム、(b)TNFをコードする核酸配列、及び(c)アデノウイルスゲノムのE4領域中の少なくとも15塩基対のスペーサーエレメント、を含むアデノウイルスベクターを提供する。
【0005】
アデノウイルスベクターの製造方法はまた、(a)アデノウイルスゲノムのE4領域において欠損しているアデノウイルスゲノムを提供すること、(b)TNFをコードする核酸配列をアデノウイルスゲノムに挿入すること、及び(c)TNFをコードする核酸配列に作動可能に連結するように、放射線誘導性プロモーターをアデノウイルスゲノムに挿入すること、を含む本発明によって提供される。本発明は更に、宿主の腫瘍又は癌の治療方法であって、本発明のアデノウイルスベクターの抗癌又は抗腫瘍有効量をその必要のある宿主に投与することを含む方法を提供する。
本発明は、付属の図面及び以下の好適な実施態様の詳細な説明を参照することにより最も良く理解され得る。
【図面の簡単な説明】
【0006】
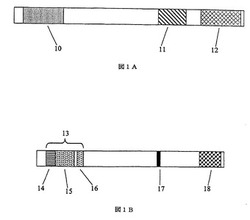
【図1】図1Aは、改変していないアデノウイルスゲノムを含むベクターの模式図である。図1Bは、本発明の改変アデノウイルスゲノムと遺伝子エレメントを含むベクターの模式図である。
【図2】本発明のアデノウイルスベクターでの処置を含む、種々の方法で処置された腫瘍についての、時間に対する腫瘍容積のプロットである。
【図3】本発明のアデノウイルスベクターでの処置を含む、種々の方法で処置された腫瘍についての、時間に対する腫瘍容積の第2のプロットである。
【図4】本発明のアデノウイルスベクターでの処置を含む、種々の方法で処置された腫瘍についての、時間に対する腫瘍容積の第3のプロットである。
【発明を実施するための形態】
【0007】
発明の詳細な説明
本発明は、(a)アデノウイルスゲノムのE4領域において欠損しているアデノウイルスゲノム、(b)TNFをコードする核酸配列、及び(c)TNFをコードする核酸配列と作動可能に連結している放射線誘導性プロモーター、を含むアデノウイルスベクターを提供する。本発明はまた、(a)アデノウイルスゲノムのE4領域において欠損しているアデノウイルスゲノム、(b)TNFをコードする核酸配列、及び(c)アデノウイルスゲノムのE4領域中の少なくとも15塩基対のスペーサーエレメント、を含むアデノウイルスベクターを提供する。
【0008】
アデノウイルスゲノム
任意のサブタイプ、サブタイプの混合物、又はキメラアデノウイルスが、本発明と関連したアデノウイルスベクターの製造のためのウイルスゲノムの源として使用できる。好ましくは、2型(Ad2)又は5型(Ad5)アデノウイルスゲノムなどのヒト血清型アデノウイルスのゲノムが使用される。任意の適切なアデノウイルスゲノムが本発明に関連して使用できるが、Ad5アデノウイルスゲノムが最適であり、本発明は、Ad5血清型に関して本明細書中で更に説明する。
【0009】
本発明に関連して使用されるアデノウイルスゲノムは望ましくは、複製欠損である。本明細書で使用される場合、遺伝子、遺伝子機能、又は遺伝子若しくはゲノム領域の欠損とは、全体として又は部分的に核酸配列が欠失している遺伝子の機能を損ない又は消失させ、かつウイルスゲノムに対して外来である核酸配列の挿入のためにウイルスゲノムにスペース又は容量を提供するように、ウイルスゲノムの遺伝物質が十分に欠失していることとして定義される。このような欠損は、非補完性細胞宿主中でのアデノウイルスベクターの増殖に必須又は非必須の遺伝子又はゲノム領域に存在しうる。このような増殖に必須のアデノウイルスゲノム領域(例えば、初期領域1(E1)、初期領域2A(E2A)、初期領域2B(E2B)、初期領域4(E4)、後期領域1(L1)、後期領域2(L2)、後期領域3(L3)、後期領域4(L4)、及び後期領域5(L5))における欠損は、アデノウイルスゲノムベースのアデノウイルスベクターを複製欠損にする。
【0010】
本発明のアデノウイルスベクターは望ましくは、多重複製欠損(multiply replication deficient)である。即ち、それは、非補完細胞宿主中でのウイルス増殖(即ち、インビトロでのウイルス複製)に必要な少なくとも2つのゲノム領域において欠損する。このような領域としては、E1、E2、E4、又はL1〜L5領域が挙げられる。E1領域は、初期領域1A(E1A)及び初期領域1B(E1B)からなるとみなすことができるが、E1A及び/又はE1B領域のいずれか一方又は両方の欠失は、本発明の文脈において単一の欠損とみなす。更に、このようなベクターは、ウイルス増殖に必要ではない1つ以上の領域において欠損しうる。例えば、ベクターは、初期領域3(E3)において更に欠損しうる。
【0011】
本発明のアデノウイルスベクターは望ましくは、E1とE4領域において欠損があり、好ましくは、アデノウイルスベクターからE4領域のコード領域全体が欠失したものである。本発明の文脈において、コード領域とは、蛋白質産物をコードするゲノム領域の部分(単数又は複数)(例えば、E4領域のオープン・リーディング・フレーム(ORF))をいう。即ち、アデノウイルスゲノムのE4領域のコード領域全体が欠失したベクターは、その領域の全てのORFを欠く。本発明のアデノウイルスベクターのE4領域は好ましくは、天然E4プロモーター、ポリアデニル化配列、及び/又は右側の逆末端反復(inverted terminal repeat: ITR)を保持する。
【0012】
本発明のアデノウイルスベクターはまた、ウイルス増殖に必要な1つ以上の更なる領域(特に、ウイルス複製に必要な他の初期領域(例えば、E2A及び/又はE2B領域))において欠損しうる。より好ましくは、アデノウイルスゲノムのE3領域もまた除去される。このように、本発明のアデノウイルスベクターの好適な形状は、(a)E1-E4-、(b)E1-E2A-E4-、及び(c)E2A-E4-アデノウイルスベクターを含み、そのいずれもがまた、E3-でありうる。
【0013】
図1Aは、Ad5ゲノムの模式図を提供する。図1Bは、例示的なアデノウイルスベクターの模式図である。この図は、図1Aで表される改変されていないAd5アデノウイルスゲノムと比較すると、(i)E1領域(10)が、放射線誘導性プロモーター(14)、TNFをコードする核酸配列(15)及びポリアデニル化配列(16)で置換され、(ii)E3領域(11)が欠失し(17)、及び(iii)E4領域(12)のコード領域がスペーサーエレメント(18)によって置換され、E1、E3及びE4領域において欠損のあるベクターが作出されていることを示す。
【0014】
本発明のアデノウイルスベクターがE2A領域において欠損する場合、ベクターは好ましくは、E2A欠損領域においてアデノウイルスゲノムのE2A領域の一部(長さで約230塩基対未満)を更に含む。一般的に、アデノウイルスのE2A領域は、DNA複製に必要なポリペプチドであるDBP(DNA結合蛋白質)をコードする。DBPは、ウイルス血清型に依存して、473〜529アミノ酸からなる。DBPは、伸長したNtドメインを有する球状Ctからなる偏長の楕円体として存在する非対称蛋白質であると考えられている。研究により、Ctドメインは、DBPが核酸と結合し、亜鉛と結合し、DNA鎖伸張のレベルでDNA合成において機能する能力を担うということが示されている。しかし、Ntドメインは、転写と転写後レベルの両方で後期遺伝子発現において機能すると考えられ、該蛋白質の効率的な核局在を担い、また、それ自身の発現の増大に関与しうる。アミノ酸2〜38のNtドメインにおける欠失は、この領域がDBP機能に重要であることを示した(Brough ら, Virology, 196, 269-281 (1993))。DBPのCt領域をコードするE2A領域における欠失は、ウイルス増殖に対する効果を有しないが、DBPのNtドメインのアミノ酸2〜38をコードするE2A領域における欠失は、ウイルス増殖を損なう。それ故、好ましくは、任意の多重複製欠損アデノウイルスベクターは、アデノウイルスゲノムのE2A領域のこの部分を含む。
【0015】
特に、例えば、保持されるべきE2A領域の所望の部分は、E2A領域の5’末端で規定されるアデノウイルスゲノムのE2A領域のその部分、特に、血清型Ad5のアデノウイルスゲノムのE2A領域の位置Ad5(23816)〜Ad5(24032)である。アデノウイルスゲノムのこの部分は望ましくは、アデノウイルスベクターに含まれる。なぜなら、それは、現在のE2A細胞株では補われず、その非存在下、ウイルス増殖とファイバー発現の必要なレベルは、補完性細胞株で得ることができないからである。
【0016】
本発明は、ゲノムの初期領域においてのみ遺伝子機能に欠損のあるアデノウイルスベクターに限定されない。また、ゲノムの初期及び後期領域において欠損しているアデノウイルスベクター、並びに、本質的にゲノム全体が除去されたベクター(その場合、少なくとも、ウイルスITR及びプロモーターの幾つか、又はウイルスITR及びパッケージングシグナルがインタクトなままであるのが好ましい)も含まれる。除去されるアデノウイルスゲノムの領域が大きい程、ゲノム中に挿入できる外因性核酸配列の断片が大きいことを当業者は理解しよう。例えば、アデノウイルスゲノムが36kbであるならば、ウイルスITR及び幾つかのプロモーターをインタクトのままにすると、アデノウイルスの収容能力は約35kbである。あるいは、ITRとパッケージングシグナルのみを含む多重欠損アデノウイルスベクターを製造できよう。次いで、これは、このベクターから37〜38kbの外来核酸配列を発現させることを効率的に可能としうるであろう。勿論、欠損アデノウイルス領域のいずれか又は全てにスペーサーエレメントを含めると、スペーサーエレメント配列のサイズに応じて、サイズにおけるアデノウイルスベクターの収容能力が減少するであろう。
【0017】
TNFをコードする核酸配列
好ましくは、ベクターは、TNFをコードする核酸配列を含む(contain)(即ち、含む(comprise))少なくとも1つの発現カセットを含む。TNFをコードする核酸配列は、TNFファミリーの蛋白質の任意のメンバーをコードする核酸配列を含む。本発明のアデノウイルスベクターは好ましくは、TNF−αをコードする核酸配列を含む。TNFをコードする核酸配列は、米国特許第4,879,226号に詳細に記載されている。
【0018】
TNFをコードする核酸配列は好ましくは、アデノウイルスゲノムのE1領域に存在する(例えば、E1領域を全体的又は部分的に、好ましくは全体的に置換する)。例えば、E1領域は、TNFをコードする核酸配列を含むプロモーター可変(promoter variable)発現カセットによって置換されうる。本明細書で使用する「発現カセット」という用語は、アデノウイルスゲノムに挿入されて、外来遺伝子産物を産生しうる任意の核酸配列をいう。例えば、図1A及び1Bに示すように、E1領域(10)は、放射線誘導性プロモーター(14)、TNFをコードする核酸配列(15)及びポリアデニル化配列(16)を含む発現カセット(13)により置換されうる。TNFをコードする核酸配列を含む発現カセットの他に、ベクターは、他の産物をコードする核酸配列を含む他の発現カセットを含み得る(そのカセットは、アデノウイルスゲノムの任意の欠失領域を置換しうる)。アデノウイルスゲノム(例えば、ゲノムのE1領域)中への発現カセットの挿入は、公知の方法によって、例えば、アデノウイルスゲノムの所定の位置に特有の制限部位を導入することによって、容易にされうる。
【0019】
好ましくは、TNFをコードする核酸配列は、TNFをコードする領域の3’に存在するポリアデニル化配列などの転写終結領域を更に含む。合成最適化配列、並びにBGH(ウシ成長ホルモン)、ポリオーマウイルス、TK(チミジンキナーゼ)、EBV(エプスタイン−バー・ウイルス)、及びヒトパピローマウイルスとBPV(ウシパピローマウイルス)を含むパピローマウイルスのポリアデニル化配列を含む任意の適切なポリアデニル化配列を使用できる。好適なポリアデニル化配列は、SV40(ヒト肉腫ウイルス−40)ポリアデニル化配列である。
【0020】
好ましくは、TNFをコードする核酸配列は、1つ以上のプロモーター及び/又はエンハンサーエレメントに、例えば、プロモーター可変発現カセットの部分として作動可能に連結される(即ち、1つ以上のプロモーター及び/又はエンハンサーエレメントの転写制御下におかれる)。配列を作動可能に一緒に連結するための技術は、当該分野で周知である。任意の適切なプロモーター又はエンハンサー配列が、本発明に関連して使用できる。適切なプロモーター又はエンハンサー配列は一般的には当該分野で公知である。本発明の好適なベクターは、TNFをコードする核酸配列に作動可能に連結した放射線誘導性プロモーターを含む。放射線誘導性プロモーターの使用は、例えば、アデノウイルスベクターを含む細胞又は宿主への放射線の投与により、外来遺伝子産物の転写に対する制御を提供する。任意の適切な放射線誘導性プロモーターが、本発明に関連して使用できる。適切な放射線誘導性プロモーターは一般的に当該分野で公知である。本発明に関連する使用のための好適な放射線誘導性プロモーターは、初期増殖領域−1(Egr−1)プロモーター、特に、Egr−1プロモーターのCArGドメインである。Egr−1プロモーターは、米国特許第5,206,152号及び国際特許出願WO 94/06916に詳細に記載されている。プロモーターは、当該分野で公知の方法によって、例えば、ゲノムの所定領域に特有の制限部位を導入することによって、外来ゲノム中に導入されうる。あるいは、プロモーターは、TNFをコードする核酸配列を含む発現カセットの部分として挿入されうる。
【0021】
本発明のアデノウイルスベクターはまた、TNFをコードする核酸配列の他に、発現されるべき他の核酸配列を含みうる。更なる核酸配列は、TNFの発現を制御する同じプロモーター/エンハンサー配列の転写制御下にありうるか、又は、他のプロモーター/エンハンサー配列の転写制御下にありうる。本発明により使用できる他の核酸配列としては、他のサイトカイン、アポトーシス因子、細胞増殖抑制剤、及びTNFと共に有利に発現されうる他の分子(例えば、TNF存在下で相乗効果を有する分子)をコードする核酸配列が挙げられるが、それらに限定されない。このような他のサイトカイン、アポトーシス因子、細胞増殖抑制剤及びそれらをコードする核酸は当該分野で公知であり、それらとしては、例えば、p53、Fas、Fasリガンド、デスドメインを有するFas関連蛋白質(FADD)、カスパーゼ−3、カスパーゼ−8(FLICE)、カスパーゼ−10、Apo2L、腫瘍壊死因子(TNF)−R1、IκB、ΔIκB、デスドメインを有する、レセプター相互作用蛋白質(RIP)関連ICH−1/CED−3−相同蛋白質(RAIDD)、TNF関連アポトーシス誘導リガンド(TRAIL)、DR4、DR5、N末端欠失を含むBcl−2の細胞死誘導コード配列、N末端欠失を含むBcl−xの細胞死誘導コード配列、Bax、Bak、Bid、Bad、Bik、Bif−2、c−myc、Ras、Raf、PCKキナーゼ、AKTキナーゼ、Akt/PI(3)−キナーゼ、PITSLRE、デス関連蛋白質(DAP)キナーゼ、RIP、JNK/SAPK、Daxx、NIK、MEKK1、ASK1、PKR、及びそれらの変異体 (例えば、それらのドミナントネガティブ変異体及びそれらのドミナントポジティブ変異体)、及びそれらのフラグメント(例えば、それらの活性ドメイン)、並びにそれらの組合せが挙げられる。アポトーシス、細胞毒性、及び細胞増殖抑制の転写因子は、本発明と関連して使用でき、それらとしては、例えば、E2F転写因子及びその合成細胞周期非依存性形態、AP1転写因子、AP2転写因子、SP転写因子(例えば、SP1転写因子)、ヘリックス−ループ−ヘリックス転写因子、DP転写因子(例えば、DP1、DP2及びDP3)、及びそれらの変異体 (例えば、それらのドミナントネガティブ変異体及びそれらのドミナントポジティブ変異体)、及びそれらのフラグメント(例えば、それらの活性ドメイン)、並びにそれらの組合せが挙げられる。アポトーシス、細胞毒性、及び細胞増殖抑制のウイルス蛋白質としては、例えば、アデノウイルスE1A産物、アデノウイルスE4/ORF6/7産物、アデノウイルスE4/ORF4産物、サイトメガロウイルス(CMV)産物(例えば、CMV−チミジンキナーゼ(CMV−TK)、単純ヘルペスウイルス(HSV)産物(例えば、HSV−TK)、ヒトパピローマウイルス(HPV)産物(例えば、HPVX)、及びそれらの変異体 (例えば、それらのドミナントネガティブ変異体及びそれらのドミナントポジティブ変異体)、及びそれらのフラグメント(例えば、それらの活性ドメイン)、並びにそれらの組合せが挙げられる。
【0022】
スペーサーエレメント
本発明のアデノウイルスベクターは、多重複製欠損の場合、好ましくは、単一複製欠損アデノウイルスベクター、特に、単一複製欠損E1-アデノウイルスベクターによって達成されるウイルス増殖と同様の補完性細胞株でのウイルス増殖を提供するためにスペーサーエレメントを含む。スペーサーの非存在下、多重複製欠損アデノウイルスベクターのファイバー蛋白質の産生及び/又はウイルス増殖は、単一複製欠損アデノウイルスベクターのそれと比較して減少している。しかし、欠損アデノウイルス領域の少なくとも1つ、好ましくは、図1B(18)に示されるE4領域にスペーサーを含めると、増殖及びファイバー発現におけるこの欠陥が中和される。
【0023】
L5ファイバー領域が保持されている、本発明の好適なE4-アデノウイルスベクターにおいて、スペーサーは望ましくは、L5ファイバー領域と右側ITRの間に存在する。より好ましくは、このようなアデノウイルスベクターにおいて、E4ポリアデニル化配列は、単独で又は最も好ましくは別の配列との組合せにおいて、保持されたL5ファイバー領域が右側ITRから十分に分離されるようにL5ファイバー領域と右側ITRの間に存在し、その結果、このようなベクターのウイルス産生が、単一複製欠損アデノウイルスベクター、特に、単一複製欠損E1-アデノウイルスベクターのウイルス産生に近づく。アデノウイルスベクターにおけるスペーサーの使用は、米国特許第5,851,806号に記載されている。
【0024】
ゲノムの複製欠損領域の機能は、補完性細胞株によって提供されうるので、スペーサーエレメントは欠損機能を提供する必要はなく、任意の配列でありうる。即ち、スペーサーエレメントは、ベクターが収容するインサートのサイズのみによって限定される。スペーサーエレメントは、任意の適切なサイズ、望ましくは、少なくとも約15塩基対(例えば、約15〜約12,000塩基対)、好ましくは、約100〜約10,000塩基対、より好ましくは、約500〜約8,000塩基対、より一層好ましくは、約1,500〜約6,000塩基対、最も好ましくは、約2,000〜約3,000塩基対でありうる。
【0025】
スペーサーエレメントは、所望の長さの任意の配列(単数又は複数)を含みうる。スペーサーエレメント配列は、コード又は非コードでありえ、また、アデノウイルスゲノムに関し天然又は非天然でありえるが、欠損領域に複製機能を回復させない。スペーサーエレメントはまた、プロモーター可変発現カセットを含みうる。より好ましくは、スペーサーエレメントは、更なるポリアデニル化配列及び/又は外来遺伝子を含む。好ましくは、E4を欠損する領域中に挿入されるスペーサーエレメントの場合、E4ポリアデニル化配列及びアデノウイルスゲノムのE4プロモーター又は任意の他の(細胞若しくはウイルス)プロモーターは、ベクター中にとどまる。このような実施態様において、スペーサーエレメントは、E4ポリアデニル化部位とE4プロモーターとの間に存在するか、あるいはE4プロモーターがベクターに存在しなければ、スペーサーエレメントは右側ITRに近位である。
【0026】
スペーサーエレメントは、任意の適切なポリアデニル化配列を含みうる。適切なポリアデニル化配列の例としては、合成最適化配列、並びにBGH(ウシ成長ホルモン)、ポリオーマウイルス、TK(チミジンキナーゼ)、EBV(エプスタイン−バー・ウイルス)、及びヒトパピローマウイルスとBPV(ウシパピローマウイルス)を含むパピローマウイルスのポリアデニル化配列が挙げられる。好ましくは、特に、E4欠損領域において、スペーサーエレメントは、SV40(ヒト肉腫ウイルス−40)ポリアデニル化配列を含む。SV40ポリアデニル化配列は、多重複製欠損アデノウイルスベクターのより高いウイルス産生レベルを可能とする。
【0027】
外来遺伝子(例えば、コード領域)はまた、アデノウイルスゲノムのE4欠損領域におけるスペーサーエレメントとして機能しうる。外来遺伝子は、ベクターが収容できるフラグメントのサイズによってのみ限定され、任意の適切な遺伝子でありうる。適切な外来遺伝子の例としては、pGUS、分泌性アルカリホスファターゼ、ルシフェラーゼ、B−ガラクトシダーゼ、及びヒト抗−トリプシンなどのマーカー遺伝子配列;治療遺伝子;B3−19K、E3−14.7、ICP47、fasリガンド遺伝子、及びCTLA4遺伝子などの可能性ある免疫調節因子;生物不活性配列(例えば、産物を産生するようには転写されないであろう配列、又は欠陥のある若しくは生物学的に不活性な産物をコードする配列)、並びにグルクロニダーゼ遺伝子などの他の無害の配列が挙げられる。トランス活性化因子をコードする遺伝子も、E4領域におけるスペーサーエレメントとして使用できる。好ましくは、トランス作用因子をコードする遺伝子は、アデノウイルス由来ではない。アデノウイルス由来ではないトランス作用因子の例としては、pTP、HSV ICP0、CMV UL84、VZV-ORF61、PRV-EP0、CMV-IE1、CMV-IE2、CMV-IE86、HIV-tat、HTLV-tax、HBV-X、AAV-Rep 78、HSV ICP0のように機能する U20S骨肉腫細胞株由来の細胞性因子、並びに神経成長因子によって誘導されるPC12 細胞における細胞性因子が挙げられる。アデノウイルス由来ではない好適なトランス作用因子は、HSV ICP0である。トランス作用因子をコードする遺伝子としては好ましくは、アデノウイルスE4プロモーターが挙げられる。
【0028】
ベクター構築
本発明は、(a)アデノウイルスゲノムのE4領域において欠損しているアデノウイルスゲノムを提供すること、(b)TNFをコードする核酸配列をアデノウイルスゲノムに挿入すること、及び(c)TNFをコードする核酸配列に作動可能に連結されるように、放射線誘導性プロモーターをアデノウイルスゲノムに挿入すること、を含むアデノウイルスベクターの製造方法を提供する。本発明はまた、(a)アデノウイルスゲノムのE4領域において欠損しているアデノウイルスゲノムを提供すること、(b)TNFをコードする核酸配列をアデノウイルスゲノムに挿入すること、及び(c)アデノウイルスゲノムのE4領域にスペーサーエレメントを挿入すること、を含むアデノウイルスベクターの製造方法を提供する。当業者が理解するように、本発明によって提供される方法は、アデノウイルスベクターを提供するために使用されるアデノウイルスゲノム中への他の核酸配列の挿入、又は該アデノウイルスゲノムからのこのような配列の欠失などの他の工程又は構成要素を含みうる。更に、本発明の方法の種々の局面(例えば、アデノウイルスゲノム、TNFをコードする核酸配列、放射線誘導性プロモーター、スペーサーエレメントなど)は、本発明のアデノウイルスベクターに関し本明細書で上記したとおりである。
【0029】
アデノウイルスベクターの本発明の製造方法は、当業者に公知の技術を用いて行うことができる。一般的に、ウイルスベクター構築は、細胞内のアデノウイルス核酸配列間の高レベルの組換えに依存する。配列間で類似性を有する(又は重複する)領域を含み、かつゲノムの完全長を構成する2又は3の別々のアデノウイルス核酸配列(例えば、DNAフラグメント)を細胞にトランスフェクトする。宿主細胞の組換えマシーナリーは、上記配列の組換えを行なうことによって、完全長ウイルスベクターゲノムを構築する。種々の単一領域中に改変を含むウイルスの構築のための他の適切な方法は、以前に記載されており(Berkner ら, Nucleic Acids Res., 12, 925-941 (1984); Berkner ら, Nucleic Acids Res., 11, 6003-6020 (1983); Brough ら, Virol., 190, 624-634 (1992))、そして多重欠損ウイルスを構築するために使用できる。更に他の適切な方法としては、例えば、インビトロ組換え及び連結、並びに米国特許第5,965,358号及び国際特許出願WO 98/56937, WO 99/15686, 及び WO 99/54441で開示される方法が挙げられる。
【0030】
本発明のアデノウイルスベクターの好適な構築方法は、初めに、アデノウイルスゲノムの特定の領域の必要な欠失又は改変(欠失領域へのスペーサーエレメントの付加など)を構築することを含む。このような改変は、例えば、標準的分子生物学技術を用いて、プラスミドカセットで行うことができる。次いで、変更された核酸配列(欠失又は改変を含む)は、アデノウイルスゲノムの1/2までを含むずっと大きなプラスミドに移され、改変されたアデノウイルスゲノムを含むベースプラスミドが提供される。次の工程は、改変されたアデノウイルスゲノムの所望の領域内に発現カセットを挿入することである。発現カセットは、当該分野で公知の標準的方法によって、例えば、プラスミドからカセットを単離することによって、提供されうる。次いで、単離されたカセットは、プラスミドDNA(改変アデノウイルスゲノムを含む)と共にレシピエント細胞内にトランスフェクトされうる。プラスミドは必要に応じて、アデノウイルスゲノム内の所望の位置での発現カセットの挿入を容易にするために、トランスフェクション前に、適切な制限酵素による消化によって線状化される。適切な制限酵素の選択は、当業者の技術内に十分ある。DNAの2断片が組換えられ、改変アデノウイルスゲノムと発現カセットを含むプラスミドが形成される。プラスミドは宿主細胞から単離され、組換えられたウイルスゲノムの失われたウイルス機能を補うレシピエント細胞に導入され、改変ウイルスゲノムと発現カセットを含むアデノウイルスベクターが産生される。ベクターは、ITR及び/又はパッケージングシグナルの変更によって更に改変されうる。
【0031】
補完性細胞株
本発明の複製欠損アデノウイルスベクターの増殖又は成長のための補完性細胞株は、公知であり、米国特許第5,851,806号, WO 95/34671, 及びBrough ら, Virol., 70, 6497-6501 (1996)に詳細に記載されている。好適な細胞株は、アデノウイルスベクターから失われたウイルス複製に必須の遺伝子のうちの少なくとも1つの遺伝子機能、好ましくは、少なくとも2つの遺伝子機能(例えば、アデノウイルスゲノムのE1、E2及びE4領域を含む遺伝子機能)を補うことにより特徴付けられる。他の細胞株としては、後期領域を含む遺伝子機能から少なくとも1つの遺伝子機能を欠損するアデノウイルスベクターを補うもの、初期及び後期遺伝子機能の組合せを補うもの、並びに全てのアデノウイルス機能を補うものが挙げられる。選択される細胞株は、問題の組換え複製欠損アデノウイルスベクターから失われた機能を特異的に補い、かつ標準的な分子生物学技術を用いて産生されるものであることを当業者は理解しよう。細胞株は更に、非重複様式で、補完性遺伝子(complementing gene)を含むことにより特徴付けられ、このことは、ベクターゲノムが細胞DNAと組換えする可能性を最小にし、かつ実質的に除去する。従って、複製能のあるアデノウイルスは、ベクターストックに存在せず、それ故、特定の治療の目的、特に、遺伝子治療の目的に適切である。これはまた、非補完性細胞でのアデノウイルスの複製を回避する。
【0032】
補完性細胞株は、組換えアデノウイルスベクターの高力価ストックを作製するために、欠損アデノウイルス遺伝子機能の産物を、それらの産物について適切なレベルで発現できるものでなければならない。例えば、アデノウイルスDNA複製については、化学量論的レベルで、即ち、比較的高レベルで、E2A産物であるDBPを発現することが必要とされるが、アデノウイルスDNA複製については、E2B産物であるAd polは、ほんの触媒レベルで、即ち、比較的低レベルで必要とされる。組換えアデノウイルスベクターの高力価ストックを確保するためには、産物のレベルが適切でなければならないのみでなく、産物の一時的発現が、細胞の通常のウイルス感染で見られるものと一致しなければならない。例えば、ウイルスDNA複製に必要な成分は、ビリオンアッセンブリー(virion
assembly)に必要な成分の前に発現されねばならない。ウイルス産物の高レベル発現にしばしば付随する細胞毒性を避けるために、並びに産物の一時的発現を制御するために、誘導性プロモーター系が使用される。例えば、ヒツジメタロチオナイン誘導性プロモーター系が、完全なE4領域、E4領域のオープン・リーディング・フレーム6、及びE2A領域を発現させるために使用されうる。適切な誘導性プロモーター系の他の例としては、細菌lacオペロン、テトラサイクリンオペロン、T7ポリメラーゼ系、並びに真核生物及び原核生物の転写因子の組合せ及びキメラ構築物、リプレッサー、並びに他の成分が挙げられるが、それらに限定されない。発現されるウイルス産物が非常に毒性である場合、インデューサーがウイルスベクターに運ばれ、誘導産物が補完性細胞株のクロマチン内に運ばれるという2段階からなる誘導系を使用することが望ましい。テトラサイクリン発現系及びlac発現系などの抑制性/誘導性発現系もまた使用できる。
【0033】
使用方法
本発明は、宿主の腫瘍又は癌の治療方法であって、本発明のアデノウイルスベクターの抗癌又は抗腫瘍有効量をその必要のある宿主に投与することを含む方法を提供する。
治療又は予防目的(例えば、遺伝子治療、ワクチン接種など)のために、動物に本発明の複製欠損アデノウイルスベクターを投与する適切な方法(例えば、Rosenfeld ら, Science, 252, 431-434 (1991), Jaffe ら, Clin. Res., 39(2), 302A (1991), Rosenfeld ら, Clin. Res., 39(2), 311A (1991), Berkner, BioTechniques, 6, 616-629 (1988)参照)が利用でき、そしてベクターを投与するために2以上の経路が使用できるが、別の経路よりも特定の経路がより迅速かつより効果的な反応を提供しうることを当業者は理解しよう。例えば、アデノウイルスベクターは、例えば、腫瘍内に又は腫瘍部位近傍に直接的に注射することによって、宿主の特定の組織に直接的に投与できる。あるいは、アデノウイルスベクターは、静脈投与などによって宿主に全身的に投与できる。
【0034】
本発明は、本発明のアデノウイルスベクター、及び担体、特に、医薬として許容できる(例えば、生理的又は薬理的に許容できる)担体(例えば、賦形剤又は希釈剤)を含む医薬組成物を提供する。医薬として許容できる担体は、当業者周知であり、容易に利用できる。担体の選択は、部分的には、医薬組成物を投与するのに使用される特定の方法によって決定されよう。それ故、本発明の医薬組成物の種々の適切な製剤がある。以下の製剤及び方法は単に例示であって、決して限定的ではない。しかし、経口製剤、注射製剤及びエアロゾル製剤が好適である。
【0035】
経口投与に適した製剤は、(a)水、生理食塩水、又はオレンジジュースなどの希釈剤に溶解した有効量の化合物などの液体溶液;(b)カプセル、サッシェ又は錠剤(各々は、固体又は顆粒として所定量の活性成分を含む);(c)適当な液体中の懸濁液;及び(d)適切なエマルション;からなりうる。錠剤形態は、ラクトース、マンニトール、トウモロコシデンプン、ジャガイモデンプン、結晶性セルロース、アカシア、ゼラチン、コロイド性二酸化ケイ素、クロスカルメロースナトリウム、タルク、ステアリン酸マグネシウム、ステアリン酸、並びに他の賦形剤、着色剤、希釈剤、緩衝剤、湿潤剤、保存剤、フレーバー剤、及び薬理的に適合性のある賦形剤のうちの1つ以上を含む。ロゼンジ形態は、フレーバー中に、通常は、スクロース及びアカシア又はトラガカント中に活性成分を含むことができ、そして香錠は、ゼラチンやグリセリン又はスクロースやアカシアなどの不活性基剤中に活性成分を含み、エマルジョン、ゲルなどは、活性成分の他に、当該分野で公知の賦形剤を含む。
【0036】
本発明のベクターは、単独で又は他の適切な成分と組合せて、吸入により投与されるエアロゾル製剤に製造されうる。これらのエアロゾル製剤は、ジクロロジフルオロメタン、プロパン、窒素などの加圧された許容できる噴射剤中に入れられうる。それらはまた、ネブライザー又はアトマイザーなどの非加圧製剤用の医薬として製剤化できる。
【0037】
非経口投与に適した製剤は、水溶性及び非水溶性で等張性の滅菌注射溶液(該溶液は、抗酸化剤、緩衝剤、静菌剤、及び製剤を意図されたレシピエントの血液と等張にする溶質を含みうる)、並びに懸濁剤、溶解剤、増粘剤、安定化剤、及び保存剤を含みうる水溶性及び非水溶性の滅菌懸濁液を含む。製剤は、単位投与量又は複数回投与量の密封容器(例えば、アンプルやバイアル)で提出され得、そして使用直前に、注射用滅菌液体賦形剤(例えば、水)の添加のみを必要とする凍結乾燥(凍結乾燥)状態で保存できる。即時調合注射溶液及び懸濁剤は、滅菌粉末、顆粒、及び上記種類の錠剤から製造できる。適切な製剤は、例えば、WO 00/34444及び米国特許第6,225,289号に記載されている。
【0038】
更に、本発明で使用されるベクターは、乳化基剤や水溶性基剤などの種々の基剤と混合することによって坐剤として製造されうる。膣投与に適した製剤は、活性成分の他に、適切であるということが当該分野で公知の担体などを含む、ペッサリー、タンポン、クリーム、ゲル、ペースト、フォーム(foam)又はスプレー製剤として提供されうる。
【0039】
本発明の文脈では、動物(特に、ヒト)に投与される投与量は、特定のアデノウイルスベクター、アデノウイルスベクターを含む組成物、投与方法、及び治療される特定の部位や生物に応じて変動しよう。投与量は、所望の時間枠内で、所望の応答(例えば、治療又は予防応答)を生じるのに十分であるべきである。典型的な投与量は、ベクターに関して、少なくとも約1×105粒子単位 (pu) (例えば、少なくとも約1×106 pu)、好ましくは少なくとも約1×107 pu (例えば、少なくとも約1×108 pu)を含むであろう。より大きい投与量も使用できる。例えば、少なくとも約1×109 pu(例えば、少なくとも約1×1010 pu)、又は少なくとも約1×1011 puさえも(例えば、少なくとも約1×1012 pu)、あるいは少なくとも約1×1013 pu(例えば、少なくとも約1×1014 pu)のような一層大きい投与量である。一般的に、投与量は、約1×105〜1×1014 pu (例えば、1×107〜1×1013 pu)、好ましくは 1×108〜1×1012 pu(例えば 1×109〜1×1011 pu)であろう。
【0040】
宿主における腫瘍又は癌を治療する本発明の方法は、その有効性を改変(例えば、増大)するために、他の治療及び/又は薬剤の投与(即ち、前投与、共投与、及び/又は後投与)を更に含みうる。例えば、本発明のアデノウイルスベクター、特に、放射線誘導性プロモーターと作動可能に連結しているTNFをコードする核酸配列を含むベクターは、放射線投与と一緒に投与されうる。放射線は、任意の適切な方法で、例えば、放射線(例えば、赤外線)の外部源に曝すことによって、又は放射線の内部源の使用によって(例えば、放射線源の化学的又は手術的投与によって)投与されうる。例えば、本発明のアデノウイルスベクターは、近接照射療法(放射線活性源を腫瘍内又は腫瘍近傍に配置(移植)し、局在化された高投与量の放射線を送達する)と一緒に使用できる。放射線は望ましくは、宿主で治療レベルのTNFの産生を誘導するのに十分な投与量で投与される。
【0041】
本発明の方法は、放射線投与に加えて又は放射線投与の代わりに、インビボでのTNF効果を局所的又は全身的に変化(即ち、減少又は増大)させる他の物質の投与を更に含みうる。例えば、宿主で発現する全身的毒性のレベルを制御するために、TNFの全身的効果を減少させる物質を使用できる。同様に、宿主で予防又は治療効果を生じさせるために必要なTNFのレベルを減少させるために、TNFの局所効果を増大させる物質を使用できる。このような物質としては、TNFアンタゴニスト(例えば、可溶性TNFレセプター又は抗TNF抗体)及びTNFアゴニストが挙げられる。TNFの効果を変化させる他の適切なアンタゴニスト、アゴニスト、及び他の物質が利用でき、そして一般的に当該分野で公知である。
【0042】
本発明の複製欠損アデノウイルスベクターはまた、インビトロで有用性を有する。例えば、それらは、アデノウイルス遺伝子機能及びアッセンブリー、TNFの産生、又は適切な標的細胞での他の外来核酸配列の発現を研究するために使用されうる。当業者は、アデノウイルスベクターをトランスフェクトし、それによって挿入されたアデノウイルス核酸配列相補物の発現が生じる細胞を選択することによって、適切な標的細胞を同定できる。好ましくは、細胞へのアデノウイルスの結合と侵入のためのレセプターを有する適切な標的細胞が選択される。このような細胞としては、任意の哺乳動物を起源として単離されたものを含むが、それに限定されない。一旦、適切な標的細胞が選択されると、標的細胞を本発明のアデノウイルスベクターと接触させることによって、それぞれトランスフェクション又は感染が起こる。次いで、標的細胞での発現、毒性、及びTNFをコードする核酸配列又は他の外来核酸配列の挿入及び活性に関する他のパラメーターが、当該分野で周知の従来の方法を用いて測定される。例えば、本発明のアデノウイルスベクターは、他の細胞分子に対するTNFの相互作用とターゲティングを研究するために使用されうる。このようにすることにより、研究者は、アデノウイルス感染に関する現象論、並びに種々の生物から外植され、かつ組織培養で研究される種々の細胞型において、アデノウイルスベクターによって導入される種々の外来核酸配列の発現の効力及び効果を学び、解明することができる。
【0043】
更に、本発明の文脈において、遺伝子治療によって適切に治療される疾患を有する患者から外植された又は取り出された細胞は、インビトロで有用に操作される。例えば、このような個体由来のインビトロで培養された細胞は、トランスフェクションを生じる適切な条件下(当業者によって容易に決定される)、本発明のアデノウイルスベクターとの接触下に置かれる。このような接触により適切に、培養細胞へのベクターのトランスフェクションが生じ、トランスフェクトされた細胞は、適切なマーカー及び選択的培養条件を用いて選択される。このようにすることにより、細胞の生命力を試験し(即ち、毒性を測定し)、かつ本発明のベクターの外来核酸配列の遺伝子産物の存在を試験する(即ち、発現を測定する)標準的方法を用いて、個体の細胞は、本発明のベクターとの適合性、該ベクターでの発現、及び該ベクターの毒性について試験され、それによって、そのように試験されるベクター系による個体の治療の適切性及び効力に関する情報が提供される。このように外植かつトランスフェクトされた細胞はまた、所定の遺伝子治療レジメンの潜在的効力/毒性を試験するのに役立つことに加えて、個体体内のインビボ位置に戻されうる。個体にそのように戻されるこのような細胞は、そのインビトロトランスフェクションを除いて、未変化のありのまま戻され得るか、又は個体身体の他の組織及び細胞からそれらを分離させておくマトリックスに包まれ得るか、若しくは該マトリックス中に包埋され得る。このようなマトリックスは、コラーゲン、セルロースなどを含む任意の適切な生体適合性材料でありうる。勿論、あるいは又はさらに、好ましくは、インビトロ試験への陽性応答後、本明細書中で先に詳述された投与手段によって、トランスフェクションがインビボで実施されうる。
【0044】
本発明の更なる局面
当業者が理解するように、本発明によって提供されるアデノウイルスベクター及びアデノウイルスベクターに関する方法は、本明細書記載のエレメントの組合せ又は置換を含みうる。このような好適な形状のエレメントを有するベクターは、図1Bによって模式的に表される。更に、このような形状のエレメントを有するベクターは、配列番号1の核酸配列を含むベクター、該核酸配列から本質的になるベクター、又は該核酸配列からなるベクターによって提供される。しかし、本発明では、例示的な核酸配列の多くの改変及びバリエーションが可能である。例えば、遺伝暗号の縮重は、コードされたポリペプチドのコード配列を変化させることなく、ポリペプチドコード領域にわたる、並びに翻訳停止シグナルでのヌクレオチドの置換を可能とする。このような置換可能な配列は、所定の遺伝子の公知のアミノ酸配列又は核酸配列から推定され得、そして通常の合成又は部位特異的変異誘発方法によって構築され得る。合成DNA方法は、Itakuraら, Science, 198, 1056-1063 (1977年), 及びCreaら, Proc. Natl. Acad. Sci. USA, 75, 5765-5769 (1978年)の方法に実質的に従って行われ得る。部位特異的変異誘発方法は、Maniatisら, Molecular Cloning: A Laboratory Manual, Cold Spring Harbor, NY (第2版, 1989年)に記載されている。それ故、本発明は、本明細書中で特に例示された核酸配列に決して限定されるものではない。例示されたベクターは腫瘍及び/又は癌の遺伝子治療用であり、それ故、TNF遺伝子を含みかつ発現する。しかし、記載されたベクターはまた、他の同様の又は異なる疾患及び/又は病気を治療するために使用される遺伝子を含みうる。このような疾患及び/又は病気としては、他の慢性肺疾患(例えば、肺気腫、喘息、成人呼吸促進症候群、及び慢性気管支炎)、並びに冠動脈性心疾患、及び遺伝子治療、ワクチン接種などによって適切に治療又は予防される他の病気が挙げられるが、それらに限定されない。それ故、任意の遺伝子又は核酸配列が、アデノウイルスTNFベクターに挿入されうる。
【0045】
アデノウイルスベクターは、本発明の範囲及び思想を逸脱することなく他の様式に改変されうる。例えば、本発明のアデノウイルスベクターのコート蛋白質は、可能性ある宿主細胞上のウイルスレセプターに対するウイルスの結合特異性又は認識を変化させるように操作されうる。このような操作としては、ファイバー、ペントン又はヘキソンの領域の欠失、コート蛋白質部分への種々の天然又は非天然リガンドの挿入などを挙げることができる。コート蛋白質の操作は、ウイルスベクターが感染する細胞の範囲を拡張しうるか、又は特定の細胞型へのウイルスベクターのターゲティングを可能としうる。
【0046】
例えば、ベクターは、好ましくは、アミノ末端又はカルボキシル末端での又はその近傍での、非天然アミノ酸配列の導入によって、野生型(即ち、天然)コート蛋白質とは異なるキメラコート蛋白質(例えば、ファイバー(カルボキシル末端、HIループ、又は他のループ)、ヘキソン、pIX、pIIIa、又はペントン蛋白質)を含みうる。好ましくは、非天然アミノ酸配列が、内部コート蛋白質配列中に、又は該配列の代わりに挿入される。結果として得られるキメラウイルスコート蛋白質は、好ましくは、キメラウイルスコート蛋白質ではなく野生型ウイルスコート蛋白質を含むことを除き同一であるアデノウイルスベクターの細胞内への侵入よりも効率的に、コート蛋白質を含むアデノウイルスベクターの細胞内への侵入を指向し得る。キメラウイルスコート蛋白質は望ましくは、細胞表面に存在する新規な内因性結合部位と結合する。侵入効率のこの増大は、アデノウイルスが、選択された細胞型(野生型コート蛋白質を含むウイルスが典型的には侵入できないか、又はほんの低効率でしか侵入できないもの)に結合し、かつ侵入し得るという結果につながる。
【0047】
本発明の好適なベクターは、リジン及び/又はアルギニン残基からなる非天然ポリアミノ酸配列を含むファイバー蛋白質を含む。ポリアミノ酸配列は一般的には、3〜30アミノ酸残基、好ましくは5〜20アミノ酸残基、より好ましくは5〜10アミノ酸残基を含む。より好ましくは、非天然ポリアミノ酸配列は、ファイバー蛋白質のHIループに、又はファイバー蛋白質のカルボキシル末端に存在する。ポリアミノ酸配列が、ファイバー蛋白質のカルボキシル末端に存在するとき、ファイバー蛋白質は更に、野生型ファイバー配列のカルボキシル末端に、少なくとも5アミノ酸(例えば、約5〜15アミノ酸)、より好ましくは少なくとも約7アミノ酸(例えば、約7〜10アミノ酸)のスペーサーエレメントを含むことが好ましい。典型的なスペーサーとしては、交互のグリシン及びセリン残基、リジン残基の繰り返し、又はそれらの混合物が挙げられる。
【0048】
あるいは、本発明のアデノウイルスベクターは、真核細胞の特定型に選択的ではないキメラウイルスコート蛋白質を含みうる。このようなキメラコート蛋白質は、内部コート蛋白質配列中に又は該配列の代わりに、非天然アミノ酸配列が挿入されていることによって野生型コート蛋白質とは異なる。非選択的キメラコート蛋白質を含むベクターにおいて、ウイルスコートは、国際特許出願WO 97/20051に記載されるように、野生型ウイルスコートよりも広い範囲の真核細胞に効率的に結合する。
【0049】
所定の細胞へのアデノウイルスの結合特異性もまた、米国特許第5,962,311号で考察されるように、短いシャフトのアデノウイルスファイバー遺伝子を含むアデノウイルスの使用によって調節されうる。短いシャフトのアデノウイルスファイバー遺伝子を含むアデノウイルスの使用は、アデノウイルスファイバーの細胞表面レセプターへのアデノウイルスファイバー結合のレベル又は効率を減少させ、かつアデノウイルスペントンベースの細胞表面レセプターへのアデノウイルスペントンベース結合を増大させ、それによって、所定の細胞へのアデノウイルスの結合特異性を増大させる。あるいは、短いシャフトのファイバーを含むアデノウイルスの使用は、ペントンベース又はファイバーノブへの非天然アミノ酸配列の導入によって、所望の細胞表面レセプターへのアデノウイルスのターゲティングを可能とする。
【0050】
更に、ウイルスベクターが可能性ある宿主細胞を認識する能力は、コート蛋白質を遺伝子操作することなく調節されうる。例えば、ペントンベース結合ドメインと特定の細胞表面結合部位を選択的に結合するドメインとを含む2重特異的分子と、アデノウイルスを複合体化することにより、当業者による特定の細胞型へのベクターの標的化が可能となる。
【0051】
ウイルスベクター、特にアデノウイルスベクターに対する多くの改変は、当該分野で公知である。アデノウイルスベクターについての適切な改変としては、米国特許第5,559,099号; 同第5,731,190号; 同第5,712,136号; 同第5,770,442号; 同第5,846,782号; 同第5,926,311号; 同第5,965,541号; 同第6,057,155号; 同第6,127,525号; 同第6,153,435号; 並びに国際特許出願WO 96/07734, WO 96/26281, WO 97/20051, WO 98/07865, WO 98/07877, WO 98/54346, 及びWO 00/15823に記載されている改変が挙げられる。
【0052】
以下の実施例は、本発明を更に説明するが、勿論、その範囲を制限するものとは解釈すべきではない。実施例で言及される酵素は、異なるように記載していなければ、Bethesda Research Laboratories (BRL), Gaithersburg, Maryland, New England Biolabs Inc. (NEB), Beverly, Massachusetts, 又は Boehringer Mannheim Biochemicals (BMB), Indianapolis, Indianaから入手でき、製造業者の推奨に実質的に従って使用される。本明細書中で使用される技術の多くは、当業者周知である。分子生物学技術は、適切な実験室マニュアル、例えば、Maniatisら, Molecular Cloning: A Laboratory Manual, Cold Spring Harbor, NY (第2版, 1989年), 及びCurrent Protocols in Molecular Biology (Ausubelら(編)(1987年))に詳細に記載されている。
【実施例】
【0053】
実施例1
以下の実施例は、本発明に従ってのアデノウイルスベクターの製造を示す。E1、E3及びE4領域に欠損を有する5型アデノウイルスゲノム(E3領域は完全欠失であり、E4領域はSV40ポリアデニル化配列を含んでいた)を含む第1プラスミド(ベースプラスミド)を製造した。TNF−αをコードする核酸配列に作動可能に連結したEgr−1放射線誘導性プロモーターを有する発現カセットを含む第2プラスミド(ドナープラスミド)を製造した。ドナープラスミドを、Drd−I制限エンドヌクレアーゼで消化し、Egr−I/TNF−α発現カセットを含む約6.5kbpの核酸セグメントをゲル電気泳動で単離した。ベースプラスミドを、Swa−I制限エンドヌクレアーゼを用い消化し、線状化プラスミドを脱リン酸化した。6.5kbp(約)ドナープラスミドフラグメント50ngと、線状化ベースプラスミド50ngで、コンピテントE.coli BJIq細胞を形質転換した。形質転換細胞を、カナマイシン50μg/μlとテトラサイクリン50μg/μlを含むルリア/SOCブロスプレートに播いた。得られたコロニーを組換え体につきスクリーニングし、陽性組換え体をルリアブロス/カナマイシンプレートで増殖させた。
【0054】
形質転換されたE.coli BJIq細胞から、標準的技術によって、組換えプラスミドDNAを単離した。標準的方法を用いて、単離したプラスミドDNAを、Pac−I制限エンドヌクレアーゼによる消化によって線状化し、線状化プラスミドDNAを、293−ORF6細胞(293ヒト胎児腎細胞由来)(E1及びE4欠損を補う)にトランスフェクトし、配列番号1の配列を有するアデノウイルスEgr−I/TNF−αE1-,E3-,E4-ベクターを産生した。
【0055】
実施例2
以下の実施例は、宿主における腫瘍の治療又は予防のための、本発明に従って製造されたアデノウイルスベクターの使用を示す。
放射線耐性ヒト扁平上皮(squameous)腫瘍細胞株(SQ−20B)異種移植腫瘍を有する8匹のヌードマウスを各々含む3つの治療群を確立した。第1治療群は、0、4、7、11日目に、5つの部位(各腫瘍の周辺に注射を4回及び各腫瘍の中心に注射を1回)で腫瘍組織中に直接的に注射することによって、実施例1のアデノウイルス粒子を5×1010粒子単位(PU)の投与量(ウイルス緩衝液を含めると総容積32μl)で受けた。第2治療群は、0〜4、7〜9日目に、投与されたアデノウイルスベクターの同じ投与量を受けるとともに、腫瘍が赤外線5Gy(合計40Gyの放射線)に曝された。第3治療群は赤外線のみを受けた。
【0056】
第1治療群では、顕著な腫瘍退縮が4日目までに観察されたが、第2治療群では、11日まで退縮は観察されなかった。11日目に、第1治療群の1匹の動物と、第2治療群の3匹の動物は目視可能な腫瘍を有さなかった。62日後、第2治療群の8匹全てのマウスは治癒し(即ち、目視可能な腫瘍は存在しなかった)、一方、第1群の6匹のマウスは治癒し、第3群(ベクター無し)の1匹のみ治癒した。
本実施例の結果は、本発明のアデノウイルスベクターが、宿主の腫瘍を治療するために首尾良く使用されうることを示す。
【0057】
実施例3
以下の実施例は、宿主における腫瘍の治療又は予防のための、本発明に従って製造されたアデノウイルスベクターの使用を示す。
ヌードマウスに、5×106のSQ−20B細胞を皮下注射した。動物の腫瘍が平均容積478.2mm3に達したとき、動物を8〜10匹の動物からなる6治療群に分け、群1〜6と命名した。治療群1〜6は各々、以下のように異なる治療を受けた。(1)緩衝液のみ、(2)放射線のみ、(3)実施例1のアデノウイルスベクター(本明細書中以降、「ベクター」という)4 x 108 pu、(4)4 x 108 puベクター+放射線、(5)4 x 109 puベクター、及び(6)4 x 109 puベクター+放射線。緩衝液又はベクターを、0、3、7、10日目に腫瘍内に注射した。放射線治療は、合計放射線量50Gyとなるように、0〜4日目及び7〜11日目に、腫瘍を担持する右後脚に5Gyを照射することからなっていた。
各実験群のマウスは、無作為化後、研究剤の1回目の接種の前、及びその後は1週毎に体重を計測した。動物は、研究過程中に全く死亡せず、その後も何ら毒性の兆候を示さなかった。どの時点でも、動物の体重において群間で有意な差はなかった。
【0058】
研究の間、血漿及び腫瘍中のTNFレベルを評価するために、各治療群から3匹のマウスを屠殺した。ヌードマウス中で増殖しているSQ−20B腫瘍にベクター又は緩衝液を単回腫瘍内投与した後、血漿中のTNFの循環レベルを評価した。選択された群はまた、ベクター注射3時間後を起点として3日間に渡って与えられた15Gyの放射線を受けた。最後の放射線治療1日後に、ヒトTNFの血漿レベルを酵素結合免疫吸着アッセイ(ELISA)で評価した(検出下限<4.4pg/ml)。結果を表1に示す。血漿レベルは、放射線とベクター投与の両方で増加した。
【0059】
【表1】

【0060】
TNF測定のために、血漿を集めた同じ時点に、マウスを安楽死させ、腫瘍を切除し、抽出した。次いで、ELISAによって、抽出物におけるTNF発現を定量した。腫瘍で発現したTNF量を表2に示す。
【0061】
【表2】

【0062】
ベクターを注射しなかった腫瘍では、ごくわずかのTNFが検出された。TNFは、投与量依存様式で、放射線無しのベクターの注射を受けた腫瘍で産生された。ベクターの接種後、3回の5Gyフラクションの放射線を腫瘍に与えたとき、ベクターの両方の投与量群で、TNF発現は2倍超であった。更に、ベクター4 x 108 puを注射した腫瘍と比べて、ベクター4 x 109 puを注射した腫瘍では、TNF発現は1.7倍大きかった。
【0063】
残りの動物を60日間追跡し、次いで屠殺した。結果を図2に示す。図2では、菱形データ点は治療群1を表し、黒四角データ点は治療群2を表し、白三角データ点は治療群3を表し、黒三角データ点は群4を表し、白四角データ点は治療群5を表し、円データ点は治療群6を表す。治療に対する腫瘍応答を解析すると、他の全ての群と比較して、ベクター4 x 109 pu投与量+放射線群で腫瘍容積がより大きく減少するという傾向が示された。この差異は、研究の終点(50〜60日目)で統計学的に有意であった。緩衝液対照群で、この研究で異常な出来事があった。6匹のマウスのうち2匹のマウスで、60日目までに腫瘍が完全に退縮した。これは、おそらく、初期の大きな腫瘍容積及びこれらの腫瘍の嚢状性質によるものであったかもしれない。なぜなら、これらの腫瘍は、サイズが増大すると容易に破裂するからである。しかし、ベクター4 x 109 pu投与量+放射線群における7匹のマウスのうち6匹のマウス(86%)は、60日目で腫瘍の形跡を有さなかった。
これらの結果は、腫瘍の治療のために、本発明のベクターを使用して、インビボでTNFを発現させうることを示す。
【0064】
実施例4
以下の実施例は、宿主における腫瘍の治療又は予防のための、本発明に従って製造されたアデノウイルスベクターの使用を示す。
患者サンプル由来の放射線耐性ヒト食道腫瘍細胞を、5×106細胞の単回投与量でヌードマウスの右後脚に注射し、マウスを4つの治療群に無作為に分けた。群1は、緩衝溶液(0日目と3日目に、腫瘍内への直接的な注射によって投与された)でのみ治療された。群2は、0、1、3、4日目に投与される放射線4Gy投与量からなる(合計IR投与量16Gy)赤外線治療を受けた。群3は、実施例1のアデノウイルスベクター(4×108PU)(0日と3日目に、腫瘍内への直接的な注射によって投与された)で治療された。群4は、アデノウイルスベクター治療と赤外線治療を受けた。
【0065】
腫瘍容積と動物の体重を48日間に渡って測定した。腫瘍容積を時間に対しプロットし、図3で示される腫瘍容積曲線を得た。図3では、菱形データ点(υ)は群1のデータを表し、円形データ点(λ)は群2のデータを表し、三角データ点(σ)は群3のデータを表し、四角データ点(ν)は群4のデータを表す。全ての動物は健康のままであり、有害な効果は、研究中観察されなかった。しかし、群1と2の動物を、大きな腫瘍負荷(体重の10%超)のために36日目に屠殺した。
【0066】
腫瘍容積曲線は、放射線のみ(群2)又はベクターのみ(群3)で治療された動物と比較して、ベクターと放射線(群4)で治療された動物において、実質的により小さな腫瘍増殖を示す。このデータは、本発明のアデノウイルスベクターが宿主における腫瘍の治療のために首尾よく使用されうることを示す。
【0067】
実施例5
以下の実施例は、宿主における腫瘍の治療又は予防のための、本発明に従って製造されたアデノウイルスベクターの使用を示す。
患者サンプル由来の放射線耐性食道腫瘍細胞を、5×106細胞の単回投与量でヌードマウスの右後脚に注射し、マウスを4つの治療群に無作為に分けた。群1は、緩衝溶液(0、3、7、10日目に、腫瘍内への直接的な注射によって投与された)でのみ治療された。群2は、0、1、3、4、7、8、10、11日目に投与される放射線3Gy投与量からなる(合計IR投与量24Gy)赤外線治療を受けた。群3は、実施例1のアデノウイルスベクター(4×108PU)(0、3、7、10日目に、腫瘍内への直接的な注射によって投与された)で治療された。群4は、アデノウイルスベクター治療と赤外線治療を受けた。
【0068】
腫瘍容積と動物の体重を22日間に渡って測定した。腫瘍容積を時間に対しプロットし、図4で示される腫瘍容積曲線を得た。図4では、菱形データ点(υ)は群1のデータを表し、円形データ点(λ)は群2のデータを表し、三角データ点(σ)は群3のデータを表し、四角データ点(ν)は群4のデータを表す。全ての動物は健康のままであり、有害な効果は観察されなかった。しかし、群1と2の動物を、大きな腫瘍負荷(体重の10%超)のために15日目に屠殺した。
【0069】
腫瘍容積曲線は、放射線のみ(群2)又はベクターのみ(群3)で治療された動物と比較して、ベクターと放射線(群4)で治療された動物において実質的により小さな腫瘍増殖を示す。このデータは、本発明のアデノウイルスベクターが宿主における腫瘍の治療のために首尾よく使用されうることを示す。
【0070】
特許、特許出願、及び刊行物を含む、本明細書で引用された全ての参考文献は、引用により内容の全てが本明細書に含まれるものとする。
好適な実施態様を強調して、本発明を記載したが、好適な実施態様のバリエーションを使用でき、そして本明細書で特に記載した以外にも本発明が実施できることが意図されていることは、当業者に明白であろう。それ故、本発明は、上記の特許請求の範囲により定められる本発明の思想と範囲内に包含される全ての改変を含む。
【技術分野】
【0001】
発明の技術分野
本発明は、腫瘍壊死因子(TNF)をコードする核酸配列を含む複製欠損(replication deficient)アデノウイルスベクター、並びにこのようなベクターの構築及び使用方法に関する。
【背景技術】
【0002】
発明の背景
腫瘍壊死因子(TNF)、特に、TNF−αは、その抗腫瘍効果及び放射線治療と相乗的に作用する能力について周知である。例えば、TNF−α遺伝子を含むある複製欠損アデノウイルスベクターは、動物における腫瘍を治療するために放射線治療と組み合わせて使用されており、ある程度は成功している(例えば、Hallahan ら, Nat. Med., 1, 786-91 (1995))。しかし、抗癌/抗腫瘍剤としてのTNFの使用は、その重篤な全身的効果によって制限されている。
【発明の概要】
【発明が解決しようとする課題】
【0003】
構築と使用においてより大きな柔軟性を有し、かつ腫瘍又は癌の治療におけるより大きな成功を提供しうる複製欠損TNFアデノウイルスベクターが依然として必要性とされている。本発明は、このようなベクター、並びにこのようなベクターの構築方法、及びこのようなベクターの使用を含む治療方法を提供する。
【課題を解決するための手段】
【0004】
発明の簡単な概要
本発明は、(a)アデノウイルスゲノムの初期増殖−4(E4)領域において欠損しているアデノウイルスゲノム、(b)TNFをコードする核酸配列、及び(c)TNFをコードする核酸配列と作動可能に連結している放射線誘導性プロモーター、を含むアデノウイルスベクターを提供する。本発明はまた、(a)アデノウイルスゲノムのE4領域において欠損しているアデノウイルスゲノム、(b)TNFをコードする核酸配列、及び(c)アデノウイルスゲノムのE4領域中の少なくとも15塩基対のスペーサーエレメント、を含むアデノウイルスベクターを提供する。
【0005】
アデノウイルスベクターの製造方法はまた、(a)アデノウイルスゲノムのE4領域において欠損しているアデノウイルスゲノムを提供すること、(b)TNFをコードする核酸配列をアデノウイルスゲノムに挿入すること、及び(c)TNFをコードする核酸配列に作動可能に連結するように、放射線誘導性プロモーターをアデノウイルスゲノムに挿入すること、を含む本発明によって提供される。本発明は更に、宿主の腫瘍又は癌の治療方法であって、本発明のアデノウイルスベクターの抗癌又は抗腫瘍有効量をその必要のある宿主に投与することを含む方法を提供する。
本発明は、付属の図面及び以下の好適な実施態様の詳細な説明を参照することにより最も良く理解され得る。
【図面の簡単な説明】
【0006】
【図1】図1Aは、改変していないアデノウイルスゲノムを含むベクターの模式図である。図1Bは、本発明の改変アデノウイルスゲノムと遺伝子エレメントを含むベクターの模式図である。
【図2】本発明のアデノウイルスベクターでの処置を含む、種々の方法で処置された腫瘍についての、時間に対する腫瘍容積のプロットである。
【図3】本発明のアデノウイルスベクターでの処置を含む、種々の方法で処置された腫瘍についての、時間に対する腫瘍容積の第2のプロットである。
【図4】本発明のアデノウイルスベクターでの処置を含む、種々の方法で処置された腫瘍についての、時間に対する腫瘍容積の第3のプロットである。
【発明を実施するための形態】
【0007】
発明の詳細な説明
本発明は、(a)アデノウイルスゲノムのE4領域において欠損しているアデノウイルスゲノム、(b)TNFをコードする核酸配列、及び(c)TNFをコードする核酸配列と作動可能に連結している放射線誘導性プロモーター、を含むアデノウイルスベクターを提供する。本発明はまた、(a)アデノウイルスゲノムのE4領域において欠損しているアデノウイルスゲノム、(b)TNFをコードする核酸配列、及び(c)アデノウイルスゲノムのE4領域中の少なくとも15塩基対のスペーサーエレメント、を含むアデノウイルスベクターを提供する。
【0008】
アデノウイルスゲノム
任意のサブタイプ、サブタイプの混合物、又はキメラアデノウイルスが、本発明と関連したアデノウイルスベクターの製造のためのウイルスゲノムの源として使用できる。好ましくは、2型(Ad2)又は5型(Ad5)アデノウイルスゲノムなどのヒト血清型アデノウイルスのゲノムが使用される。任意の適切なアデノウイルスゲノムが本発明に関連して使用できるが、Ad5アデノウイルスゲノムが最適であり、本発明は、Ad5血清型に関して本明細書中で更に説明する。
【0009】
本発明に関連して使用されるアデノウイルスゲノムは望ましくは、複製欠損である。本明細書で使用される場合、遺伝子、遺伝子機能、又は遺伝子若しくはゲノム領域の欠損とは、全体として又は部分的に核酸配列が欠失している遺伝子の機能を損ない又は消失させ、かつウイルスゲノムに対して外来である核酸配列の挿入のためにウイルスゲノムにスペース又は容量を提供するように、ウイルスゲノムの遺伝物質が十分に欠失していることとして定義される。このような欠損は、非補完性細胞宿主中でのアデノウイルスベクターの増殖に必須又は非必須の遺伝子又はゲノム領域に存在しうる。このような増殖に必須のアデノウイルスゲノム領域(例えば、初期領域1(E1)、初期領域2A(E2A)、初期領域2B(E2B)、初期領域4(E4)、後期領域1(L1)、後期領域2(L2)、後期領域3(L3)、後期領域4(L4)、及び後期領域5(L5))における欠損は、アデノウイルスゲノムベースのアデノウイルスベクターを複製欠損にする。
【0010】
本発明のアデノウイルスベクターは望ましくは、多重複製欠損(multiply replication deficient)である。即ち、それは、非補完細胞宿主中でのウイルス増殖(即ち、インビトロでのウイルス複製)に必要な少なくとも2つのゲノム領域において欠損する。このような領域としては、E1、E2、E4、又はL1〜L5領域が挙げられる。E1領域は、初期領域1A(E1A)及び初期領域1B(E1B)からなるとみなすことができるが、E1A及び/又はE1B領域のいずれか一方又は両方の欠失は、本発明の文脈において単一の欠損とみなす。更に、このようなベクターは、ウイルス増殖に必要ではない1つ以上の領域において欠損しうる。例えば、ベクターは、初期領域3(E3)において更に欠損しうる。
【0011】
本発明のアデノウイルスベクターは望ましくは、E1とE4領域において欠損があり、好ましくは、アデノウイルスベクターからE4領域のコード領域全体が欠失したものである。本発明の文脈において、コード領域とは、蛋白質産物をコードするゲノム領域の部分(単数又は複数)(例えば、E4領域のオープン・リーディング・フレーム(ORF))をいう。即ち、アデノウイルスゲノムのE4領域のコード領域全体が欠失したベクターは、その領域の全てのORFを欠く。本発明のアデノウイルスベクターのE4領域は好ましくは、天然E4プロモーター、ポリアデニル化配列、及び/又は右側の逆末端反復(inverted terminal repeat: ITR)を保持する。
【0012】
本発明のアデノウイルスベクターはまた、ウイルス増殖に必要な1つ以上の更なる領域(特に、ウイルス複製に必要な他の初期領域(例えば、E2A及び/又はE2B領域))において欠損しうる。より好ましくは、アデノウイルスゲノムのE3領域もまた除去される。このように、本発明のアデノウイルスベクターの好適な形状は、(a)E1-E4-、(b)E1-E2A-E4-、及び(c)E2A-E4-アデノウイルスベクターを含み、そのいずれもがまた、E3-でありうる。
【0013】
図1Aは、Ad5ゲノムの模式図を提供する。図1Bは、例示的なアデノウイルスベクターの模式図である。この図は、図1Aで表される改変されていないAd5アデノウイルスゲノムと比較すると、(i)E1領域(10)が、放射線誘導性プロモーター(14)、TNFをコードする核酸配列(15)及びポリアデニル化配列(16)で置換され、(ii)E3領域(11)が欠失し(17)、及び(iii)E4領域(12)のコード領域がスペーサーエレメント(18)によって置換され、E1、E3及びE4領域において欠損のあるベクターが作出されていることを示す。
【0014】
本発明のアデノウイルスベクターがE2A領域において欠損する場合、ベクターは好ましくは、E2A欠損領域においてアデノウイルスゲノムのE2A領域の一部(長さで約230塩基対未満)を更に含む。一般的に、アデノウイルスのE2A領域は、DNA複製に必要なポリペプチドであるDBP(DNA結合蛋白質)をコードする。DBPは、ウイルス血清型に依存して、473〜529アミノ酸からなる。DBPは、伸長したNtドメインを有する球状Ctからなる偏長の楕円体として存在する非対称蛋白質であると考えられている。研究により、Ctドメインは、DBPが核酸と結合し、亜鉛と結合し、DNA鎖伸張のレベルでDNA合成において機能する能力を担うということが示されている。しかし、Ntドメインは、転写と転写後レベルの両方で後期遺伝子発現において機能すると考えられ、該蛋白質の効率的な核局在を担い、また、それ自身の発現の増大に関与しうる。アミノ酸2〜38のNtドメインにおける欠失は、この領域がDBP機能に重要であることを示した(Brough ら, Virology, 196, 269-281 (1993))。DBPのCt領域をコードするE2A領域における欠失は、ウイルス増殖に対する効果を有しないが、DBPのNtドメインのアミノ酸2〜38をコードするE2A領域における欠失は、ウイルス増殖を損なう。それ故、好ましくは、任意の多重複製欠損アデノウイルスベクターは、アデノウイルスゲノムのE2A領域のこの部分を含む。
【0015】
特に、例えば、保持されるべきE2A領域の所望の部分は、E2A領域の5’末端で規定されるアデノウイルスゲノムのE2A領域のその部分、特に、血清型Ad5のアデノウイルスゲノムのE2A領域の位置Ad5(23816)〜Ad5(24032)である。アデノウイルスゲノムのこの部分は望ましくは、アデノウイルスベクターに含まれる。なぜなら、それは、現在のE2A細胞株では補われず、その非存在下、ウイルス増殖とファイバー発現の必要なレベルは、補完性細胞株で得ることができないからである。
【0016】
本発明は、ゲノムの初期領域においてのみ遺伝子機能に欠損のあるアデノウイルスベクターに限定されない。また、ゲノムの初期及び後期領域において欠損しているアデノウイルスベクター、並びに、本質的にゲノム全体が除去されたベクター(その場合、少なくとも、ウイルスITR及びプロモーターの幾つか、又はウイルスITR及びパッケージングシグナルがインタクトなままであるのが好ましい)も含まれる。除去されるアデノウイルスゲノムの領域が大きい程、ゲノム中に挿入できる外因性核酸配列の断片が大きいことを当業者は理解しよう。例えば、アデノウイルスゲノムが36kbであるならば、ウイルスITR及び幾つかのプロモーターをインタクトのままにすると、アデノウイルスの収容能力は約35kbである。あるいは、ITRとパッケージングシグナルのみを含む多重欠損アデノウイルスベクターを製造できよう。次いで、これは、このベクターから37〜38kbの外来核酸配列を発現させることを効率的に可能としうるであろう。勿論、欠損アデノウイルス領域のいずれか又は全てにスペーサーエレメントを含めると、スペーサーエレメント配列のサイズに応じて、サイズにおけるアデノウイルスベクターの収容能力が減少するであろう。
【0017】
TNFをコードする核酸配列
好ましくは、ベクターは、TNFをコードする核酸配列を含む(contain)(即ち、含む(comprise))少なくとも1つの発現カセットを含む。TNFをコードする核酸配列は、TNFファミリーの蛋白質の任意のメンバーをコードする核酸配列を含む。本発明のアデノウイルスベクターは好ましくは、TNF−αをコードする核酸配列を含む。TNFをコードする核酸配列は、米国特許第4,879,226号に詳細に記載されている。
【0018】
TNFをコードする核酸配列は好ましくは、アデノウイルスゲノムのE1領域に存在する(例えば、E1領域を全体的又は部分的に、好ましくは全体的に置換する)。例えば、E1領域は、TNFをコードする核酸配列を含むプロモーター可変(promoter variable)発現カセットによって置換されうる。本明細書で使用する「発現カセット」という用語は、アデノウイルスゲノムに挿入されて、外来遺伝子産物を産生しうる任意の核酸配列をいう。例えば、図1A及び1Bに示すように、E1領域(10)は、放射線誘導性プロモーター(14)、TNFをコードする核酸配列(15)及びポリアデニル化配列(16)を含む発現カセット(13)により置換されうる。TNFをコードする核酸配列を含む発現カセットの他に、ベクターは、他の産物をコードする核酸配列を含む他の発現カセットを含み得る(そのカセットは、アデノウイルスゲノムの任意の欠失領域を置換しうる)。アデノウイルスゲノム(例えば、ゲノムのE1領域)中への発現カセットの挿入は、公知の方法によって、例えば、アデノウイルスゲノムの所定の位置に特有の制限部位を導入することによって、容易にされうる。
【0019】
好ましくは、TNFをコードする核酸配列は、TNFをコードする領域の3’に存在するポリアデニル化配列などの転写終結領域を更に含む。合成最適化配列、並びにBGH(ウシ成長ホルモン)、ポリオーマウイルス、TK(チミジンキナーゼ)、EBV(エプスタイン−バー・ウイルス)、及びヒトパピローマウイルスとBPV(ウシパピローマウイルス)を含むパピローマウイルスのポリアデニル化配列を含む任意の適切なポリアデニル化配列を使用できる。好適なポリアデニル化配列は、SV40(ヒト肉腫ウイルス−40)ポリアデニル化配列である。
【0020】
好ましくは、TNFをコードする核酸配列は、1つ以上のプロモーター及び/又はエンハンサーエレメントに、例えば、プロモーター可変発現カセットの部分として作動可能に連結される(即ち、1つ以上のプロモーター及び/又はエンハンサーエレメントの転写制御下におかれる)。配列を作動可能に一緒に連結するための技術は、当該分野で周知である。任意の適切なプロモーター又はエンハンサー配列が、本発明に関連して使用できる。適切なプロモーター又はエンハンサー配列は一般的には当該分野で公知である。本発明の好適なベクターは、TNFをコードする核酸配列に作動可能に連結した放射線誘導性プロモーターを含む。放射線誘導性プロモーターの使用は、例えば、アデノウイルスベクターを含む細胞又は宿主への放射線の投与により、外来遺伝子産物の転写に対する制御を提供する。任意の適切な放射線誘導性プロモーターが、本発明に関連して使用できる。適切な放射線誘導性プロモーターは一般的に当該分野で公知である。本発明に関連する使用のための好適な放射線誘導性プロモーターは、初期増殖領域−1(Egr−1)プロモーター、特に、Egr−1プロモーターのCArGドメインである。Egr−1プロモーターは、米国特許第5,206,152号及び国際特許出願WO 94/06916に詳細に記載されている。プロモーターは、当該分野で公知の方法によって、例えば、ゲノムの所定領域に特有の制限部位を導入することによって、外来ゲノム中に導入されうる。あるいは、プロモーターは、TNFをコードする核酸配列を含む発現カセットの部分として挿入されうる。
【0021】
本発明のアデノウイルスベクターはまた、TNFをコードする核酸配列の他に、発現されるべき他の核酸配列を含みうる。更なる核酸配列は、TNFの発現を制御する同じプロモーター/エンハンサー配列の転写制御下にありうるか、又は、他のプロモーター/エンハンサー配列の転写制御下にありうる。本発明により使用できる他の核酸配列としては、他のサイトカイン、アポトーシス因子、細胞増殖抑制剤、及びTNFと共に有利に発現されうる他の分子(例えば、TNF存在下で相乗効果を有する分子)をコードする核酸配列が挙げられるが、それらに限定されない。このような他のサイトカイン、アポトーシス因子、細胞増殖抑制剤及びそれらをコードする核酸は当該分野で公知であり、それらとしては、例えば、p53、Fas、Fasリガンド、デスドメインを有するFas関連蛋白質(FADD)、カスパーゼ−3、カスパーゼ−8(FLICE)、カスパーゼ−10、Apo2L、腫瘍壊死因子(TNF)−R1、IκB、ΔIκB、デスドメインを有する、レセプター相互作用蛋白質(RIP)関連ICH−1/CED−3−相同蛋白質(RAIDD)、TNF関連アポトーシス誘導リガンド(TRAIL)、DR4、DR5、N末端欠失を含むBcl−2の細胞死誘導コード配列、N末端欠失を含むBcl−xの細胞死誘導コード配列、Bax、Bak、Bid、Bad、Bik、Bif−2、c−myc、Ras、Raf、PCKキナーゼ、AKTキナーゼ、Akt/PI(3)−キナーゼ、PITSLRE、デス関連蛋白質(DAP)キナーゼ、RIP、JNK/SAPK、Daxx、NIK、MEKK1、ASK1、PKR、及びそれらの変異体 (例えば、それらのドミナントネガティブ変異体及びそれらのドミナントポジティブ変異体)、及びそれらのフラグメント(例えば、それらの活性ドメイン)、並びにそれらの組合せが挙げられる。アポトーシス、細胞毒性、及び細胞増殖抑制の転写因子は、本発明と関連して使用でき、それらとしては、例えば、E2F転写因子及びその合成細胞周期非依存性形態、AP1転写因子、AP2転写因子、SP転写因子(例えば、SP1転写因子)、ヘリックス−ループ−ヘリックス転写因子、DP転写因子(例えば、DP1、DP2及びDP3)、及びそれらの変異体 (例えば、それらのドミナントネガティブ変異体及びそれらのドミナントポジティブ変異体)、及びそれらのフラグメント(例えば、それらの活性ドメイン)、並びにそれらの組合せが挙げられる。アポトーシス、細胞毒性、及び細胞増殖抑制のウイルス蛋白質としては、例えば、アデノウイルスE1A産物、アデノウイルスE4/ORF6/7産物、アデノウイルスE4/ORF4産物、サイトメガロウイルス(CMV)産物(例えば、CMV−チミジンキナーゼ(CMV−TK)、単純ヘルペスウイルス(HSV)産物(例えば、HSV−TK)、ヒトパピローマウイルス(HPV)産物(例えば、HPVX)、及びそれらの変異体 (例えば、それらのドミナントネガティブ変異体及びそれらのドミナントポジティブ変異体)、及びそれらのフラグメント(例えば、それらの活性ドメイン)、並びにそれらの組合せが挙げられる。
【0022】
スペーサーエレメント
本発明のアデノウイルスベクターは、多重複製欠損の場合、好ましくは、単一複製欠損アデノウイルスベクター、特に、単一複製欠損E1-アデノウイルスベクターによって達成されるウイルス増殖と同様の補完性細胞株でのウイルス増殖を提供するためにスペーサーエレメントを含む。スペーサーの非存在下、多重複製欠損アデノウイルスベクターのファイバー蛋白質の産生及び/又はウイルス増殖は、単一複製欠損アデノウイルスベクターのそれと比較して減少している。しかし、欠損アデノウイルス領域の少なくとも1つ、好ましくは、図1B(18)に示されるE4領域にスペーサーを含めると、増殖及びファイバー発現におけるこの欠陥が中和される。
【0023】
L5ファイバー領域が保持されている、本発明の好適なE4-アデノウイルスベクターにおいて、スペーサーは望ましくは、L5ファイバー領域と右側ITRの間に存在する。より好ましくは、このようなアデノウイルスベクターにおいて、E4ポリアデニル化配列は、単独で又は最も好ましくは別の配列との組合せにおいて、保持されたL5ファイバー領域が右側ITRから十分に分離されるようにL5ファイバー領域と右側ITRの間に存在し、その結果、このようなベクターのウイルス産生が、単一複製欠損アデノウイルスベクター、特に、単一複製欠損E1-アデノウイルスベクターのウイルス産生に近づく。アデノウイルスベクターにおけるスペーサーの使用は、米国特許第5,851,806号に記載されている。
【0024】
ゲノムの複製欠損領域の機能は、補完性細胞株によって提供されうるので、スペーサーエレメントは欠損機能を提供する必要はなく、任意の配列でありうる。即ち、スペーサーエレメントは、ベクターが収容するインサートのサイズのみによって限定される。スペーサーエレメントは、任意の適切なサイズ、望ましくは、少なくとも約15塩基対(例えば、約15〜約12,000塩基対)、好ましくは、約100〜約10,000塩基対、より好ましくは、約500〜約8,000塩基対、より一層好ましくは、約1,500〜約6,000塩基対、最も好ましくは、約2,000〜約3,000塩基対でありうる。
【0025】
スペーサーエレメントは、所望の長さの任意の配列(単数又は複数)を含みうる。スペーサーエレメント配列は、コード又は非コードでありえ、また、アデノウイルスゲノムに関し天然又は非天然でありえるが、欠損領域に複製機能を回復させない。スペーサーエレメントはまた、プロモーター可変発現カセットを含みうる。より好ましくは、スペーサーエレメントは、更なるポリアデニル化配列及び/又は外来遺伝子を含む。好ましくは、E4を欠損する領域中に挿入されるスペーサーエレメントの場合、E4ポリアデニル化配列及びアデノウイルスゲノムのE4プロモーター又は任意の他の(細胞若しくはウイルス)プロモーターは、ベクター中にとどまる。このような実施態様において、スペーサーエレメントは、E4ポリアデニル化部位とE4プロモーターとの間に存在するか、あるいはE4プロモーターがベクターに存在しなければ、スペーサーエレメントは右側ITRに近位である。
【0026】
スペーサーエレメントは、任意の適切なポリアデニル化配列を含みうる。適切なポリアデニル化配列の例としては、合成最適化配列、並びにBGH(ウシ成長ホルモン)、ポリオーマウイルス、TK(チミジンキナーゼ)、EBV(エプスタイン−バー・ウイルス)、及びヒトパピローマウイルスとBPV(ウシパピローマウイルス)を含むパピローマウイルスのポリアデニル化配列が挙げられる。好ましくは、特に、E4欠損領域において、スペーサーエレメントは、SV40(ヒト肉腫ウイルス−40)ポリアデニル化配列を含む。SV40ポリアデニル化配列は、多重複製欠損アデノウイルスベクターのより高いウイルス産生レベルを可能とする。
【0027】
外来遺伝子(例えば、コード領域)はまた、アデノウイルスゲノムのE4欠損領域におけるスペーサーエレメントとして機能しうる。外来遺伝子は、ベクターが収容できるフラグメントのサイズによってのみ限定され、任意の適切な遺伝子でありうる。適切な外来遺伝子の例としては、pGUS、分泌性アルカリホスファターゼ、ルシフェラーゼ、B−ガラクトシダーゼ、及びヒト抗−トリプシンなどのマーカー遺伝子配列;治療遺伝子;B3−19K、E3−14.7、ICP47、fasリガンド遺伝子、及びCTLA4遺伝子などの可能性ある免疫調節因子;生物不活性配列(例えば、産物を産生するようには転写されないであろう配列、又は欠陥のある若しくは生物学的に不活性な産物をコードする配列)、並びにグルクロニダーゼ遺伝子などの他の無害の配列が挙げられる。トランス活性化因子をコードする遺伝子も、E4領域におけるスペーサーエレメントとして使用できる。好ましくは、トランス作用因子をコードする遺伝子は、アデノウイルス由来ではない。アデノウイルス由来ではないトランス作用因子の例としては、pTP、HSV ICP0、CMV UL84、VZV-ORF61、PRV-EP0、CMV-IE1、CMV-IE2、CMV-IE86、HIV-tat、HTLV-tax、HBV-X、AAV-Rep 78、HSV ICP0のように機能する U20S骨肉腫細胞株由来の細胞性因子、並びに神経成長因子によって誘導されるPC12 細胞における細胞性因子が挙げられる。アデノウイルス由来ではない好適なトランス作用因子は、HSV ICP0である。トランス作用因子をコードする遺伝子としては好ましくは、アデノウイルスE4プロモーターが挙げられる。
【0028】
ベクター構築
本発明は、(a)アデノウイルスゲノムのE4領域において欠損しているアデノウイルスゲノムを提供すること、(b)TNFをコードする核酸配列をアデノウイルスゲノムに挿入すること、及び(c)TNFをコードする核酸配列に作動可能に連結されるように、放射線誘導性プロモーターをアデノウイルスゲノムに挿入すること、を含むアデノウイルスベクターの製造方法を提供する。本発明はまた、(a)アデノウイルスゲノムのE4領域において欠損しているアデノウイルスゲノムを提供すること、(b)TNFをコードする核酸配列をアデノウイルスゲノムに挿入すること、及び(c)アデノウイルスゲノムのE4領域にスペーサーエレメントを挿入すること、を含むアデノウイルスベクターの製造方法を提供する。当業者が理解するように、本発明によって提供される方法は、アデノウイルスベクターを提供するために使用されるアデノウイルスゲノム中への他の核酸配列の挿入、又は該アデノウイルスゲノムからのこのような配列の欠失などの他の工程又は構成要素を含みうる。更に、本発明の方法の種々の局面(例えば、アデノウイルスゲノム、TNFをコードする核酸配列、放射線誘導性プロモーター、スペーサーエレメントなど)は、本発明のアデノウイルスベクターに関し本明細書で上記したとおりである。
【0029】
アデノウイルスベクターの本発明の製造方法は、当業者に公知の技術を用いて行うことができる。一般的に、ウイルスベクター構築は、細胞内のアデノウイルス核酸配列間の高レベルの組換えに依存する。配列間で類似性を有する(又は重複する)領域を含み、かつゲノムの完全長を構成する2又は3の別々のアデノウイルス核酸配列(例えば、DNAフラグメント)を細胞にトランスフェクトする。宿主細胞の組換えマシーナリーは、上記配列の組換えを行なうことによって、完全長ウイルスベクターゲノムを構築する。種々の単一領域中に改変を含むウイルスの構築のための他の適切な方法は、以前に記載されており(Berkner ら, Nucleic Acids Res., 12, 925-941 (1984); Berkner ら, Nucleic Acids Res., 11, 6003-6020 (1983); Brough ら, Virol., 190, 624-634 (1992))、そして多重欠損ウイルスを構築するために使用できる。更に他の適切な方法としては、例えば、インビトロ組換え及び連結、並びに米国特許第5,965,358号及び国際特許出願WO 98/56937, WO 99/15686, 及び WO 99/54441で開示される方法が挙げられる。
【0030】
本発明のアデノウイルスベクターの好適な構築方法は、初めに、アデノウイルスゲノムの特定の領域の必要な欠失又は改変(欠失領域へのスペーサーエレメントの付加など)を構築することを含む。このような改変は、例えば、標準的分子生物学技術を用いて、プラスミドカセットで行うことができる。次いで、変更された核酸配列(欠失又は改変を含む)は、アデノウイルスゲノムの1/2までを含むずっと大きなプラスミドに移され、改変されたアデノウイルスゲノムを含むベースプラスミドが提供される。次の工程は、改変されたアデノウイルスゲノムの所望の領域内に発現カセットを挿入することである。発現カセットは、当該分野で公知の標準的方法によって、例えば、プラスミドからカセットを単離することによって、提供されうる。次いで、単離されたカセットは、プラスミドDNA(改変アデノウイルスゲノムを含む)と共にレシピエント細胞内にトランスフェクトされうる。プラスミドは必要に応じて、アデノウイルスゲノム内の所望の位置での発現カセットの挿入を容易にするために、トランスフェクション前に、適切な制限酵素による消化によって線状化される。適切な制限酵素の選択は、当業者の技術内に十分ある。DNAの2断片が組換えられ、改変アデノウイルスゲノムと発現カセットを含むプラスミドが形成される。プラスミドは宿主細胞から単離され、組換えられたウイルスゲノムの失われたウイルス機能を補うレシピエント細胞に導入され、改変ウイルスゲノムと発現カセットを含むアデノウイルスベクターが産生される。ベクターは、ITR及び/又はパッケージングシグナルの変更によって更に改変されうる。
【0031】
補完性細胞株
本発明の複製欠損アデノウイルスベクターの増殖又は成長のための補完性細胞株は、公知であり、米国特許第5,851,806号, WO 95/34671, 及びBrough ら, Virol., 70, 6497-6501 (1996)に詳細に記載されている。好適な細胞株は、アデノウイルスベクターから失われたウイルス複製に必須の遺伝子のうちの少なくとも1つの遺伝子機能、好ましくは、少なくとも2つの遺伝子機能(例えば、アデノウイルスゲノムのE1、E2及びE4領域を含む遺伝子機能)を補うことにより特徴付けられる。他の細胞株としては、後期領域を含む遺伝子機能から少なくとも1つの遺伝子機能を欠損するアデノウイルスベクターを補うもの、初期及び後期遺伝子機能の組合せを補うもの、並びに全てのアデノウイルス機能を補うものが挙げられる。選択される細胞株は、問題の組換え複製欠損アデノウイルスベクターから失われた機能を特異的に補い、かつ標準的な分子生物学技術を用いて産生されるものであることを当業者は理解しよう。細胞株は更に、非重複様式で、補完性遺伝子(complementing gene)を含むことにより特徴付けられ、このことは、ベクターゲノムが細胞DNAと組換えする可能性を最小にし、かつ実質的に除去する。従って、複製能のあるアデノウイルスは、ベクターストックに存在せず、それ故、特定の治療の目的、特に、遺伝子治療の目的に適切である。これはまた、非補完性細胞でのアデノウイルスの複製を回避する。
【0032】
補完性細胞株は、組換えアデノウイルスベクターの高力価ストックを作製するために、欠損アデノウイルス遺伝子機能の産物を、それらの産物について適切なレベルで発現できるものでなければならない。例えば、アデノウイルスDNA複製については、化学量論的レベルで、即ち、比較的高レベルで、E2A産物であるDBPを発現することが必要とされるが、アデノウイルスDNA複製については、E2B産物であるAd polは、ほんの触媒レベルで、即ち、比較的低レベルで必要とされる。組換えアデノウイルスベクターの高力価ストックを確保するためには、産物のレベルが適切でなければならないのみでなく、産物の一時的発現が、細胞の通常のウイルス感染で見られるものと一致しなければならない。例えば、ウイルスDNA複製に必要な成分は、ビリオンアッセンブリー(virion
assembly)に必要な成分の前に発現されねばならない。ウイルス産物の高レベル発現にしばしば付随する細胞毒性を避けるために、並びに産物の一時的発現を制御するために、誘導性プロモーター系が使用される。例えば、ヒツジメタロチオナイン誘導性プロモーター系が、完全なE4領域、E4領域のオープン・リーディング・フレーム6、及びE2A領域を発現させるために使用されうる。適切な誘導性プロモーター系の他の例としては、細菌lacオペロン、テトラサイクリンオペロン、T7ポリメラーゼ系、並びに真核生物及び原核生物の転写因子の組合せ及びキメラ構築物、リプレッサー、並びに他の成分が挙げられるが、それらに限定されない。発現されるウイルス産物が非常に毒性である場合、インデューサーがウイルスベクターに運ばれ、誘導産物が補完性細胞株のクロマチン内に運ばれるという2段階からなる誘導系を使用することが望ましい。テトラサイクリン発現系及びlac発現系などの抑制性/誘導性発現系もまた使用できる。
【0033】
使用方法
本発明は、宿主の腫瘍又は癌の治療方法であって、本発明のアデノウイルスベクターの抗癌又は抗腫瘍有効量をその必要のある宿主に投与することを含む方法を提供する。
治療又は予防目的(例えば、遺伝子治療、ワクチン接種など)のために、動物に本発明の複製欠損アデノウイルスベクターを投与する適切な方法(例えば、Rosenfeld ら, Science, 252, 431-434 (1991), Jaffe ら, Clin. Res., 39(2), 302A (1991), Rosenfeld ら, Clin. Res., 39(2), 311A (1991), Berkner, BioTechniques, 6, 616-629 (1988)参照)が利用でき、そしてベクターを投与するために2以上の経路が使用できるが、別の経路よりも特定の経路がより迅速かつより効果的な反応を提供しうることを当業者は理解しよう。例えば、アデノウイルスベクターは、例えば、腫瘍内に又は腫瘍部位近傍に直接的に注射することによって、宿主の特定の組織に直接的に投与できる。あるいは、アデノウイルスベクターは、静脈投与などによって宿主に全身的に投与できる。
【0034】
本発明は、本発明のアデノウイルスベクター、及び担体、特に、医薬として許容できる(例えば、生理的又は薬理的に許容できる)担体(例えば、賦形剤又は希釈剤)を含む医薬組成物を提供する。医薬として許容できる担体は、当業者周知であり、容易に利用できる。担体の選択は、部分的には、医薬組成物を投与するのに使用される特定の方法によって決定されよう。それ故、本発明の医薬組成物の種々の適切な製剤がある。以下の製剤及び方法は単に例示であって、決して限定的ではない。しかし、経口製剤、注射製剤及びエアロゾル製剤が好適である。
【0035】
経口投与に適した製剤は、(a)水、生理食塩水、又はオレンジジュースなどの希釈剤に溶解した有効量の化合物などの液体溶液;(b)カプセル、サッシェ又は錠剤(各々は、固体又は顆粒として所定量の活性成分を含む);(c)適当な液体中の懸濁液;及び(d)適切なエマルション;からなりうる。錠剤形態は、ラクトース、マンニトール、トウモロコシデンプン、ジャガイモデンプン、結晶性セルロース、アカシア、ゼラチン、コロイド性二酸化ケイ素、クロスカルメロースナトリウム、タルク、ステアリン酸マグネシウム、ステアリン酸、並びに他の賦形剤、着色剤、希釈剤、緩衝剤、湿潤剤、保存剤、フレーバー剤、及び薬理的に適合性のある賦形剤のうちの1つ以上を含む。ロゼンジ形態は、フレーバー中に、通常は、スクロース及びアカシア又はトラガカント中に活性成分を含むことができ、そして香錠は、ゼラチンやグリセリン又はスクロースやアカシアなどの不活性基剤中に活性成分を含み、エマルジョン、ゲルなどは、活性成分の他に、当該分野で公知の賦形剤を含む。
【0036】
本発明のベクターは、単独で又は他の適切な成分と組合せて、吸入により投与されるエアロゾル製剤に製造されうる。これらのエアロゾル製剤は、ジクロロジフルオロメタン、プロパン、窒素などの加圧された許容できる噴射剤中に入れられうる。それらはまた、ネブライザー又はアトマイザーなどの非加圧製剤用の医薬として製剤化できる。
【0037】
非経口投与に適した製剤は、水溶性及び非水溶性で等張性の滅菌注射溶液(該溶液は、抗酸化剤、緩衝剤、静菌剤、及び製剤を意図されたレシピエントの血液と等張にする溶質を含みうる)、並びに懸濁剤、溶解剤、増粘剤、安定化剤、及び保存剤を含みうる水溶性及び非水溶性の滅菌懸濁液を含む。製剤は、単位投与量又は複数回投与量の密封容器(例えば、アンプルやバイアル)で提出され得、そして使用直前に、注射用滅菌液体賦形剤(例えば、水)の添加のみを必要とする凍結乾燥(凍結乾燥)状態で保存できる。即時調合注射溶液及び懸濁剤は、滅菌粉末、顆粒、及び上記種類の錠剤から製造できる。適切な製剤は、例えば、WO 00/34444及び米国特許第6,225,289号に記載されている。
【0038】
更に、本発明で使用されるベクターは、乳化基剤や水溶性基剤などの種々の基剤と混合することによって坐剤として製造されうる。膣投与に適した製剤は、活性成分の他に、適切であるということが当該分野で公知の担体などを含む、ペッサリー、タンポン、クリーム、ゲル、ペースト、フォーム(foam)又はスプレー製剤として提供されうる。
【0039】
本発明の文脈では、動物(特に、ヒト)に投与される投与量は、特定のアデノウイルスベクター、アデノウイルスベクターを含む組成物、投与方法、及び治療される特定の部位や生物に応じて変動しよう。投与量は、所望の時間枠内で、所望の応答(例えば、治療又は予防応答)を生じるのに十分であるべきである。典型的な投与量は、ベクターに関して、少なくとも約1×105粒子単位 (pu) (例えば、少なくとも約1×106 pu)、好ましくは少なくとも約1×107 pu (例えば、少なくとも約1×108 pu)を含むであろう。より大きい投与量も使用できる。例えば、少なくとも約1×109 pu(例えば、少なくとも約1×1010 pu)、又は少なくとも約1×1011 puさえも(例えば、少なくとも約1×1012 pu)、あるいは少なくとも約1×1013 pu(例えば、少なくとも約1×1014 pu)のような一層大きい投与量である。一般的に、投与量は、約1×105〜1×1014 pu (例えば、1×107〜1×1013 pu)、好ましくは 1×108〜1×1012 pu(例えば 1×109〜1×1011 pu)であろう。
【0040】
宿主における腫瘍又は癌を治療する本発明の方法は、その有効性を改変(例えば、増大)するために、他の治療及び/又は薬剤の投与(即ち、前投与、共投与、及び/又は後投与)を更に含みうる。例えば、本発明のアデノウイルスベクター、特に、放射線誘導性プロモーターと作動可能に連結しているTNFをコードする核酸配列を含むベクターは、放射線投与と一緒に投与されうる。放射線は、任意の適切な方法で、例えば、放射線(例えば、赤外線)の外部源に曝すことによって、又は放射線の内部源の使用によって(例えば、放射線源の化学的又は手術的投与によって)投与されうる。例えば、本発明のアデノウイルスベクターは、近接照射療法(放射線活性源を腫瘍内又は腫瘍近傍に配置(移植)し、局在化された高投与量の放射線を送達する)と一緒に使用できる。放射線は望ましくは、宿主で治療レベルのTNFの産生を誘導するのに十分な投与量で投与される。
【0041】
本発明の方法は、放射線投与に加えて又は放射線投与の代わりに、インビボでのTNF効果を局所的又は全身的に変化(即ち、減少又は増大)させる他の物質の投与を更に含みうる。例えば、宿主で発現する全身的毒性のレベルを制御するために、TNFの全身的効果を減少させる物質を使用できる。同様に、宿主で予防又は治療効果を生じさせるために必要なTNFのレベルを減少させるために、TNFの局所効果を増大させる物質を使用できる。このような物質としては、TNFアンタゴニスト(例えば、可溶性TNFレセプター又は抗TNF抗体)及びTNFアゴニストが挙げられる。TNFの効果を変化させる他の適切なアンタゴニスト、アゴニスト、及び他の物質が利用でき、そして一般的に当該分野で公知である。
【0042】
本発明の複製欠損アデノウイルスベクターはまた、インビトロで有用性を有する。例えば、それらは、アデノウイルス遺伝子機能及びアッセンブリー、TNFの産生、又は適切な標的細胞での他の外来核酸配列の発現を研究するために使用されうる。当業者は、アデノウイルスベクターをトランスフェクトし、それによって挿入されたアデノウイルス核酸配列相補物の発現が生じる細胞を選択することによって、適切な標的細胞を同定できる。好ましくは、細胞へのアデノウイルスの結合と侵入のためのレセプターを有する適切な標的細胞が選択される。このような細胞としては、任意の哺乳動物を起源として単離されたものを含むが、それに限定されない。一旦、適切な標的細胞が選択されると、標的細胞を本発明のアデノウイルスベクターと接触させることによって、それぞれトランスフェクション又は感染が起こる。次いで、標的細胞での発現、毒性、及びTNFをコードする核酸配列又は他の外来核酸配列の挿入及び活性に関する他のパラメーターが、当該分野で周知の従来の方法を用いて測定される。例えば、本発明のアデノウイルスベクターは、他の細胞分子に対するTNFの相互作用とターゲティングを研究するために使用されうる。このようにすることにより、研究者は、アデノウイルス感染に関する現象論、並びに種々の生物から外植され、かつ組織培養で研究される種々の細胞型において、アデノウイルスベクターによって導入される種々の外来核酸配列の発現の効力及び効果を学び、解明することができる。
【0043】
更に、本発明の文脈において、遺伝子治療によって適切に治療される疾患を有する患者から外植された又は取り出された細胞は、インビトロで有用に操作される。例えば、このような個体由来のインビトロで培養された細胞は、トランスフェクションを生じる適切な条件下(当業者によって容易に決定される)、本発明のアデノウイルスベクターとの接触下に置かれる。このような接触により適切に、培養細胞へのベクターのトランスフェクションが生じ、トランスフェクトされた細胞は、適切なマーカー及び選択的培養条件を用いて選択される。このようにすることにより、細胞の生命力を試験し(即ち、毒性を測定し)、かつ本発明のベクターの外来核酸配列の遺伝子産物の存在を試験する(即ち、発現を測定する)標準的方法を用いて、個体の細胞は、本発明のベクターとの適合性、該ベクターでの発現、及び該ベクターの毒性について試験され、それによって、そのように試験されるベクター系による個体の治療の適切性及び効力に関する情報が提供される。このように外植かつトランスフェクトされた細胞はまた、所定の遺伝子治療レジメンの潜在的効力/毒性を試験するのに役立つことに加えて、個体体内のインビボ位置に戻されうる。個体にそのように戻されるこのような細胞は、そのインビトロトランスフェクションを除いて、未変化のありのまま戻され得るか、又は個体身体の他の組織及び細胞からそれらを分離させておくマトリックスに包まれ得るか、若しくは該マトリックス中に包埋され得る。このようなマトリックスは、コラーゲン、セルロースなどを含む任意の適切な生体適合性材料でありうる。勿論、あるいは又はさらに、好ましくは、インビトロ試験への陽性応答後、本明細書中で先に詳述された投与手段によって、トランスフェクションがインビボで実施されうる。
【0044】
本発明の更なる局面
当業者が理解するように、本発明によって提供されるアデノウイルスベクター及びアデノウイルスベクターに関する方法は、本明細書記載のエレメントの組合せ又は置換を含みうる。このような好適な形状のエレメントを有するベクターは、図1Bによって模式的に表される。更に、このような形状のエレメントを有するベクターは、配列番号1の核酸配列を含むベクター、該核酸配列から本質的になるベクター、又は該核酸配列からなるベクターによって提供される。しかし、本発明では、例示的な核酸配列の多くの改変及びバリエーションが可能である。例えば、遺伝暗号の縮重は、コードされたポリペプチドのコード配列を変化させることなく、ポリペプチドコード領域にわたる、並びに翻訳停止シグナルでのヌクレオチドの置換を可能とする。このような置換可能な配列は、所定の遺伝子の公知のアミノ酸配列又は核酸配列から推定され得、そして通常の合成又は部位特異的変異誘発方法によって構築され得る。合成DNA方法は、Itakuraら, Science, 198, 1056-1063 (1977年), 及びCreaら, Proc. Natl. Acad. Sci. USA, 75, 5765-5769 (1978年)の方法に実質的に従って行われ得る。部位特異的変異誘発方法は、Maniatisら, Molecular Cloning: A Laboratory Manual, Cold Spring Harbor, NY (第2版, 1989年)に記載されている。それ故、本発明は、本明細書中で特に例示された核酸配列に決して限定されるものではない。例示されたベクターは腫瘍及び/又は癌の遺伝子治療用であり、それ故、TNF遺伝子を含みかつ発現する。しかし、記載されたベクターはまた、他の同様の又は異なる疾患及び/又は病気を治療するために使用される遺伝子を含みうる。このような疾患及び/又は病気としては、他の慢性肺疾患(例えば、肺気腫、喘息、成人呼吸促進症候群、及び慢性気管支炎)、並びに冠動脈性心疾患、及び遺伝子治療、ワクチン接種などによって適切に治療又は予防される他の病気が挙げられるが、それらに限定されない。それ故、任意の遺伝子又は核酸配列が、アデノウイルスTNFベクターに挿入されうる。
【0045】
アデノウイルスベクターは、本発明の範囲及び思想を逸脱することなく他の様式に改変されうる。例えば、本発明のアデノウイルスベクターのコート蛋白質は、可能性ある宿主細胞上のウイルスレセプターに対するウイルスの結合特異性又は認識を変化させるように操作されうる。このような操作としては、ファイバー、ペントン又はヘキソンの領域の欠失、コート蛋白質部分への種々の天然又は非天然リガンドの挿入などを挙げることができる。コート蛋白質の操作は、ウイルスベクターが感染する細胞の範囲を拡張しうるか、又は特定の細胞型へのウイルスベクターのターゲティングを可能としうる。
【0046】
例えば、ベクターは、好ましくは、アミノ末端又はカルボキシル末端での又はその近傍での、非天然アミノ酸配列の導入によって、野生型(即ち、天然)コート蛋白質とは異なるキメラコート蛋白質(例えば、ファイバー(カルボキシル末端、HIループ、又は他のループ)、ヘキソン、pIX、pIIIa、又はペントン蛋白質)を含みうる。好ましくは、非天然アミノ酸配列が、内部コート蛋白質配列中に、又は該配列の代わりに挿入される。結果として得られるキメラウイルスコート蛋白質は、好ましくは、キメラウイルスコート蛋白質ではなく野生型ウイルスコート蛋白質を含むことを除き同一であるアデノウイルスベクターの細胞内への侵入よりも効率的に、コート蛋白質を含むアデノウイルスベクターの細胞内への侵入を指向し得る。キメラウイルスコート蛋白質は望ましくは、細胞表面に存在する新規な内因性結合部位と結合する。侵入効率のこの増大は、アデノウイルスが、選択された細胞型(野生型コート蛋白質を含むウイルスが典型的には侵入できないか、又はほんの低効率でしか侵入できないもの)に結合し、かつ侵入し得るという結果につながる。
【0047】
本発明の好適なベクターは、リジン及び/又はアルギニン残基からなる非天然ポリアミノ酸配列を含むファイバー蛋白質を含む。ポリアミノ酸配列は一般的には、3〜30アミノ酸残基、好ましくは5〜20アミノ酸残基、より好ましくは5〜10アミノ酸残基を含む。より好ましくは、非天然ポリアミノ酸配列は、ファイバー蛋白質のHIループに、又はファイバー蛋白質のカルボキシル末端に存在する。ポリアミノ酸配列が、ファイバー蛋白質のカルボキシル末端に存在するとき、ファイバー蛋白質は更に、野生型ファイバー配列のカルボキシル末端に、少なくとも5アミノ酸(例えば、約5〜15アミノ酸)、より好ましくは少なくとも約7アミノ酸(例えば、約7〜10アミノ酸)のスペーサーエレメントを含むことが好ましい。典型的なスペーサーとしては、交互のグリシン及びセリン残基、リジン残基の繰り返し、又はそれらの混合物が挙げられる。
【0048】
あるいは、本発明のアデノウイルスベクターは、真核細胞の特定型に選択的ではないキメラウイルスコート蛋白質を含みうる。このようなキメラコート蛋白質は、内部コート蛋白質配列中に又は該配列の代わりに、非天然アミノ酸配列が挿入されていることによって野生型コート蛋白質とは異なる。非選択的キメラコート蛋白質を含むベクターにおいて、ウイルスコートは、国際特許出願WO 97/20051に記載されるように、野生型ウイルスコートよりも広い範囲の真核細胞に効率的に結合する。
【0049】
所定の細胞へのアデノウイルスの結合特異性もまた、米国特許第5,962,311号で考察されるように、短いシャフトのアデノウイルスファイバー遺伝子を含むアデノウイルスの使用によって調節されうる。短いシャフトのアデノウイルスファイバー遺伝子を含むアデノウイルスの使用は、アデノウイルスファイバーの細胞表面レセプターへのアデノウイルスファイバー結合のレベル又は効率を減少させ、かつアデノウイルスペントンベースの細胞表面レセプターへのアデノウイルスペントンベース結合を増大させ、それによって、所定の細胞へのアデノウイルスの結合特異性を増大させる。あるいは、短いシャフトのファイバーを含むアデノウイルスの使用は、ペントンベース又はファイバーノブへの非天然アミノ酸配列の導入によって、所望の細胞表面レセプターへのアデノウイルスのターゲティングを可能とする。
【0050】
更に、ウイルスベクターが可能性ある宿主細胞を認識する能力は、コート蛋白質を遺伝子操作することなく調節されうる。例えば、ペントンベース結合ドメインと特定の細胞表面結合部位を選択的に結合するドメインとを含む2重特異的分子と、アデノウイルスを複合体化することにより、当業者による特定の細胞型へのベクターの標的化が可能となる。
【0051】
ウイルスベクター、特にアデノウイルスベクターに対する多くの改変は、当該分野で公知である。アデノウイルスベクターについての適切な改変としては、米国特許第5,559,099号; 同第5,731,190号; 同第5,712,136号; 同第5,770,442号; 同第5,846,782号; 同第5,926,311号; 同第5,965,541号; 同第6,057,155号; 同第6,127,525号; 同第6,153,435号; 並びに国際特許出願WO 96/07734, WO 96/26281, WO 97/20051, WO 98/07865, WO 98/07877, WO 98/54346, 及びWO 00/15823に記載されている改変が挙げられる。
【0052】
以下の実施例は、本発明を更に説明するが、勿論、その範囲を制限するものとは解釈すべきではない。実施例で言及される酵素は、異なるように記載していなければ、Bethesda Research Laboratories (BRL), Gaithersburg, Maryland, New England Biolabs Inc. (NEB), Beverly, Massachusetts, 又は Boehringer Mannheim Biochemicals (BMB), Indianapolis, Indianaから入手でき、製造業者の推奨に実質的に従って使用される。本明細書中で使用される技術の多くは、当業者周知である。分子生物学技術は、適切な実験室マニュアル、例えば、Maniatisら, Molecular Cloning: A Laboratory Manual, Cold Spring Harbor, NY (第2版, 1989年), 及びCurrent Protocols in Molecular Biology (Ausubelら(編)(1987年))に詳細に記載されている。
【実施例】
【0053】
実施例1
以下の実施例は、本発明に従ってのアデノウイルスベクターの製造を示す。E1、E3及びE4領域に欠損を有する5型アデノウイルスゲノム(E3領域は完全欠失であり、E4領域はSV40ポリアデニル化配列を含んでいた)を含む第1プラスミド(ベースプラスミド)を製造した。TNF−αをコードする核酸配列に作動可能に連結したEgr−1放射線誘導性プロモーターを有する発現カセットを含む第2プラスミド(ドナープラスミド)を製造した。ドナープラスミドを、Drd−I制限エンドヌクレアーゼで消化し、Egr−I/TNF−α発現カセットを含む約6.5kbpの核酸セグメントをゲル電気泳動で単離した。ベースプラスミドを、Swa−I制限エンドヌクレアーゼを用い消化し、線状化プラスミドを脱リン酸化した。6.5kbp(約)ドナープラスミドフラグメント50ngと、線状化ベースプラスミド50ngで、コンピテントE.coli BJIq細胞を形質転換した。形質転換細胞を、カナマイシン50μg/μlとテトラサイクリン50μg/μlを含むルリア/SOCブロスプレートに播いた。得られたコロニーを組換え体につきスクリーニングし、陽性組換え体をルリアブロス/カナマイシンプレートで増殖させた。
【0054】
形質転換されたE.coli BJIq細胞から、標準的技術によって、組換えプラスミドDNAを単離した。標準的方法を用いて、単離したプラスミドDNAを、Pac−I制限エンドヌクレアーゼによる消化によって線状化し、線状化プラスミドDNAを、293−ORF6細胞(293ヒト胎児腎細胞由来)(E1及びE4欠損を補う)にトランスフェクトし、配列番号1の配列を有するアデノウイルスEgr−I/TNF−αE1-,E3-,E4-ベクターを産生した。
【0055】
実施例2
以下の実施例は、宿主における腫瘍の治療又は予防のための、本発明に従って製造されたアデノウイルスベクターの使用を示す。
放射線耐性ヒト扁平上皮(squameous)腫瘍細胞株(SQ−20B)異種移植腫瘍を有する8匹のヌードマウスを各々含む3つの治療群を確立した。第1治療群は、0、4、7、11日目に、5つの部位(各腫瘍の周辺に注射を4回及び各腫瘍の中心に注射を1回)で腫瘍組織中に直接的に注射することによって、実施例1のアデノウイルス粒子を5×1010粒子単位(PU)の投与量(ウイルス緩衝液を含めると総容積32μl)で受けた。第2治療群は、0〜4、7〜9日目に、投与されたアデノウイルスベクターの同じ投与量を受けるとともに、腫瘍が赤外線5Gy(合計40Gyの放射線)に曝された。第3治療群は赤外線のみを受けた。
【0056】
第1治療群では、顕著な腫瘍退縮が4日目までに観察されたが、第2治療群では、11日まで退縮は観察されなかった。11日目に、第1治療群の1匹の動物と、第2治療群の3匹の動物は目視可能な腫瘍を有さなかった。62日後、第2治療群の8匹全てのマウスは治癒し(即ち、目視可能な腫瘍は存在しなかった)、一方、第1群の6匹のマウスは治癒し、第3群(ベクター無し)の1匹のみ治癒した。
本実施例の結果は、本発明のアデノウイルスベクターが、宿主の腫瘍を治療するために首尾良く使用されうることを示す。
【0057】
実施例3
以下の実施例は、宿主における腫瘍の治療又は予防のための、本発明に従って製造されたアデノウイルスベクターの使用を示す。
ヌードマウスに、5×106のSQ−20B細胞を皮下注射した。動物の腫瘍が平均容積478.2mm3に達したとき、動物を8〜10匹の動物からなる6治療群に分け、群1〜6と命名した。治療群1〜6は各々、以下のように異なる治療を受けた。(1)緩衝液のみ、(2)放射線のみ、(3)実施例1のアデノウイルスベクター(本明細書中以降、「ベクター」という)4 x 108 pu、(4)4 x 108 puベクター+放射線、(5)4 x 109 puベクター、及び(6)4 x 109 puベクター+放射線。緩衝液又はベクターを、0、3、7、10日目に腫瘍内に注射した。放射線治療は、合計放射線量50Gyとなるように、0〜4日目及び7〜11日目に、腫瘍を担持する右後脚に5Gyを照射することからなっていた。
各実験群のマウスは、無作為化後、研究剤の1回目の接種の前、及びその後は1週毎に体重を計測した。動物は、研究過程中に全く死亡せず、その後も何ら毒性の兆候を示さなかった。どの時点でも、動物の体重において群間で有意な差はなかった。
【0058】
研究の間、血漿及び腫瘍中のTNFレベルを評価するために、各治療群から3匹のマウスを屠殺した。ヌードマウス中で増殖しているSQ−20B腫瘍にベクター又は緩衝液を単回腫瘍内投与した後、血漿中のTNFの循環レベルを評価した。選択された群はまた、ベクター注射3時間後を起点として3日間に渡って与えられた15Gyの放射線を受けた。最後の放射線治療1日後に、ヒトTNFの血漿レベルを酵素結合免疫吸着アッセイ(ELISA)で評価した(検出下限<4.4pg/ml)。結果を表1に示す。血漿レベルは、放射線とベクター投与の両方で増加した。
【0059】
【表1】

【0060】
TNF測定のために、血漿を集めた同じ時点に、マウスを安楽死させ、腫瘍を切除し、抽出した。次いで、ELISAによって、抽出物におけるTNF発現を定量した。腫瘍で発現したTNF量を表2に示す。
【0061】
【表2】

【0062】
ベクターを注射しなかった腫瘍では、ごくわずかのTNFが検出された。TNFは、投与量依存様式で、放射線無しのベクターの注射を受けた腫瘍で産生された。ベクターの接種後、3回の5Gyフラクションの放射線を腫瘍に与えたとき、ベクターの両方の投与量群で、TNF発現は2倍超であった。更に、ベクター4 x 108 puを注射した腫瘍と比べて、ベクター4 x 109 puを注射した腫瘍では、TNF発現は1.7倍大きかった。
【0063】
残りの動物を60日間追跡し、次いで屠殺した。結果を図2に示す。図2では、菱形データ点は治療群1を表し、黒四角データ点は治療群2を表し、白三角データ点は治療群3を表し、黒三角データ点は群4を表し、白四角データ点は治療群5を表し、円データ点は治療群6を表す。治療に対する腫瘍応答を解析すると、他の全ての群と比較して、ベクター4 x 109 pu投与量+放射線群で腫瘍容積がより大きく減少するという傾向が示された。この差異は、研究の終点(50〜60日目)で統計学的に有意であった。緩衝液対照群で、この研究で異常な出来事があった。6匹のマウスのうち2匹のマウスで、60日目までに腫瘍が完全に退縮した。これは、おそらく、初期の大きな腫瘍容積及びこれらの腫瘍の嚢状性質によるものであったかもしれない。なぜなら、これらの腫瘍は、サイズが増大すると容易に破裂するからである。しかし、ベクター4 x 109 pu投与量+放射線群における7匹のマウスのうち6匹のマウス(86%)は、60日目で腫瘍の形跡を有さなかった。
これらの結果は、腫瘍の治療のために、本発明のベクターを使用して、インビボでTNFを発現させうることを示す。
【0064】
実施例4
以下の実施例は、宿主における腫瘍の治療又は予防のための、本発明に従って製造されたアデノウイルスベクターの使用を示す。
患者サンプル由来の放射線耐性ヒト食道腫瘍細胞を、5×106細胞の単回投与量でヌードマウスの右後脚に注射し、マウスを4つの治療群に無作為に分けた。群1は、緩衝溶液(0日目と3日目に、腫瘍内への直接的な注射によって投与された)でのみ治療された。群2は、0、1、3、4日目に投与される放射線4Gy投与量からなる(合計IR投与量16Gy)赤外線治療を受けた。群3は、実施例1のアデノウイルスベクター(4×108PU)(0日と3日目に、腫瘍内への直接的な注射によって投与された)で治療された。群4は、アデノウイルスベクター治療と赤外線治療を受けた。
【0065】
腫瘍容積と動物の体重を48日間に渡って測定した。腫瘍容積を時間に対しプロットし、図3で示される腫瘍容積曲線を得た。図3では、菱形データ点(υ)は群1のデータを表し、円形データ点(λ)は群2のデータを表し、三角データ点(σ)は群3のデータを表し、四角データ点(ν)は群4のデータを表す。全ての動物は健康のままであり、有害な効果は、研究中観察されなかった。しかし、群1と2の動物を、大きな腫瘍負荷(体重の10%超)のために36日目に屠殺した。
【0066】
腫瘍容積曲線は、放射線のみ(群2)又はベクターのみ(群3)で治療された動物と比較して、ベクターと放射線(群4)で治療された動物において、実質的により小さな腫瘍増殖を示す。このデータは、本発明のアデノウイルスベクターが宿主における腫瘍の治療のために首尾よく使用されうることを示す。
【0067】
実施例5
以下の実施例は、宿主における腫瘍の治療又は予防のための、本発明に従って製造されたアデノウイルスベクターの使用を示す。
患者サンプル由来の放射線耐性食道腫瘍細胞を、5×106細胞の単回投与量でヌードマウスの右後脚に注射し、マウスを4つの治療群に無作為に分けた。群1は、緩衝溶液(0、3、7、10日目に、腫瘍内への直接的な注射によって投与された)でのみ治療された。群2は、0、1、3、4、7、8、10、11日目に投与される放射線3Gy投与量からなる(合計IR投与量24Gy)赤外線治療を受けた。群3は、実施例1のアデノウイルスベクター(4×108PU)(0、3、7、10日目に、腫瘍内への直接的な注射によって投与された)で治療された。群4は、アデノウイルスベクター治療と赤外線治療を受けた。
【0068】
腫瘍容積と動物の体重を22日間に渡って測定した。腫瘍容積を時間に対しプロットし、図4で示される腫瘍容積曲線を得た。図4では、菱形データ点(υ)は群1のデータを表し、円形データ点(λ)は群2のデータを表し、三角データ点(σ)は群3のデータを表し、四角データ点(ν)は群4のデータを表す。全ての動物は健康のままであり、有害な効果は観察されなかった。しかし、群1と2の動物を、大きな腫瘍負荷(体重の10%超)のために15日目に屠殺した。
【0069】
腫瘍容積曲線は、放射線のみ(群2)又はベクターのみ(群3)で治療された動物と比較して、ベクターと放射線(群4)で治療された動物において実質的により小さな腫瘍増殖を示す。このデータは、本発明のアデノウイルスベクターが宿主における腫瘍の治療のために首尾よく使用されうることを示す。
【0070】
特許、特許出願、及び刊行物を含む、本明細書で引用された全ての参考文献は、引用により内容の全てが本明細書に含まれるものとする。
好適な実施態様を強調して、本発明を記載したが、好適な実施態様のバリエーションを使用でき、そして本明細書で特に記載した以外にも本発明が実施できることが意図されていることは、当業者に明白であろう。それ故、本発明は、上記の特許請求の範囲により定められる本発明の思想と範囲内に包含される全ての改変を含む。
【特許請求の範囲】
【請求項1】
以下を含む、アデノウイルスベクター:
(a)アデノウイルスゲノムのE4領域において欠損しているアデノウイルスゲノム;
(b)TNFをコードする核酸配列;及び
(c)TNFをコードする核酸配列と作動可能に連結している放射線誘導性プロモーター。
【請求項2】
アデノウイルスゲノムがアデノウイルスゲノムのE1領域において欠損しているものである、請求項1記載のアデノウイルスベクター。
【請求項3】
TNFをコードする核酸配列がアデノウイルスゲノムのE1領域に存在する、請求項2記載のアデノウイルスベクター。
【請求項4】
TNFがTNF−αである、請求項3記載のアデノウイルスベクター。
【請求項5】
TNFをコードする核酸配列が転写終結領域を更に含む、請求項3又は4記載のアデノウイルスベクター。
【請求項6】
放射線誘導性プロモーターがEgr−1である、請求項1〜5のいずれか1項記載のアデノウイルスベクター。
【請求項7】
アデノウイルスがアデノウイルスゲノムのE3領域において欠損している、請求項1〜3のいずれか1項記載のアデノウイルスベクター。
【請求項8】
アデノウイルスゲノムがE3領域全体を欠損している、請求項7記載のアデノウイルスベクター。
【請求項9】
アデノウイルスゲノムがE4領域のコード領域全体を欠損している、請求項1〜8のいずれか1項記載のアデノウイルスベクター。
【請求項10】
アデノウイルスゲノムのE4領域のコード領域が少なくとも15塩基対を有するスペーサーエレメントで置換されている、請求項9記載のアデノウイルスベクター。
【請求項11】
スペーサーエレメントが転写不活性である、請求項10記載のアデノウイルスベクター。
【請求項12】
スペーサーエレメントがアデノウイルスゲノムのE4領域に対して非天然であるポリアデニル化配列を含む、請求項11記載のアデノウイルスベクター。
【請求項13】
スペーサーエレメントがSV40ポリアデニル化配列を含む、請求項12記載のアデノウイルスベクター。
【請求項14】
アデノウイルスベクターのウイルス産生レベルが、スペーサーエレメントの無いアデノウイルスベクターのウイルス産生レベルよりも大きい、請求項10〜13のいずれか1項記載のアデノウイルスベクター。
【請求項15】
アデノウイルスゲノムが血清型5アデノウイルスゲノムである、請求項1〜14のいずれか1項記載のアデノウイルスベクター。
【請求項16】
配列番号1の核酸配列を有する、請求項1〜15のいずれか1項記載のアデノウイルスベクター。
【請求項17】
アデノウイルスベクターが3〜30アミノ酸残基の非天然ポリアミノ酸配列を含むファイバー蛋白質を含み、アミノ酸残基がリジン、アルギニン又はそれらの混合物からなる群から選択される、請求項1〜15のいずれか1項記載のアデノウイルスベクター。
【請求項18】
請求項1〜17のいずれか1項記載のアデノウイルスベクターの、複製能のあるアデノウイルスを含まないストック。
【請求項19】
請求項1〜17のいずれか1項記載のアデノウイルスベクターを含む宿主細胞。
【請求項20】
以下を含む、アデノウイルスベクター:
(a)アデノウイルスゲノムのE4領域において欠損しているアデノウイルスゲノム;
(b)TNFをコードする核酸配列;及び
(c)アデノウイルスゲノムのE4領域中の少なくとも15塩基対のスペーサーエレメント。
【請求項21】
アデノウイルスゲノムがアデノウイルスゲノムのE1領域において欠損している、請求項20記載のアデノウイルスベクター。
【請求項22】
スペーサーエレメントが転写不活性である、請求項20又は21記載のアデノウイルスベクター。
【請求項23】
スペーサーエレメントがアデノウイルスゲノムのE4領域に対して非天然であるポリアデニル化配列を含む、請求項22記載のアデノウイルスベクター。
【請求項24】
スペーサーエレメントがSV40ポリアデニル化配列を含む、請求項23記載のアデノウイルスベクター。
【請求項25】
TNFをコードする核酸配列がアデノウイルスゲノムのE1領域に存在する、請求項21〜24のいずれか1項記載のアデノウイルスベクター。
【請求項26】
TNFがTNF−αである、請求項25記載のアデノウイルスベクター。
【請求項27】
TNFをコードする核酸配列が転写終結領域を更に含む、請求項24又は25記載のアデノウイルスベクター。
【請求項28】
アデノウイルスベクターがアデノウイルスゲノムのE3領域において欠損している、請求項20〜27のいずれか1項記載のアデノウイルスベクター。
【請求項29】
アデノウイルスゲノムがE3領域全体を欠損している、請求項28記載のアデノウイルスベクター。
【請求項30】
アデノウイルスゲノムがE4領域のコード領域全体を欠損している、請求項20〜29のいずれか1項記載のアデノウイルスベクター。
【請求項31】
アデノウイルスベクターのウイルス産生レベルが、スペーサーエレメントの無いアデノウイルスベクターのウイルス産生レベルよりも大きい、請求項20〜30のいずれか1項記載のアデノウイルスベクター。
【請求項32】
アデノウイルスゲノムが血清型5アデノウイルスゲノムである、請求項20〜31のいずれか1項記載のアデノウイルスベクター。
【請求項33】
アデノウイルスベクターが3〜30アミノ酸残基の非天然ポリアミノ酸配列を含むファイバー蛋白質を含み、アミノ酸残基がリジン、アルギニン又はそれらの混合物からなる群から選択される、請求項20〜32のいずれか1項記載のアデノウイルスベクター。
【請求項34】
請求項20〜33のいずれか1項記載のアデノウイルスベクターの、複製能のあるアデノウイルスを含まないストック。
【請求項35】
請求項20〜33のいずれか1項記載のアデノウイルスベクターを含む宿主細胞。
【請求項36】
宿主の腫瘍又は癌の治療方法であって、請求項1〜17又は20〜33のいずれか1項記載のアデノウイルスベクターの抗癌又は抗腫瘍有効量をその必要のある宿主に投与することを含む方法。
【請求項37】
宿主に放射線を投与することを更に含む、請求項36記載の方法。
【請求項38】
放射線がTNFをコードする核酸配列の発現を誘導し、宿主において治療レベルのTNFを産生する、請求項37記載の方法。
【請求項39】
以下を含む、アデノウイルスベクターの製造方法:
(a)アデノウイルスゲノムのE4領域において欠損しているアデノウイルスゲノムを提供すること、
(b)TNFをコードする核酸配列をアデノウイルスゲノムに挿入すること、
(c)TNFをコードする核酸配列に作動可能に連結するように、放射線誘導性プロモーターをアデノウイルスゲノムに挿入すること。
【請求項40】
アデノウイルスゲノムがアデノウイルスゲノムのE4領域において少なくとも15塩基対を有するスペーサーエレメントを含む、請求項39記載の方法。
【請求項41】
放射線誘導性プロモーターがEgr−1である、請求項39又は40記載の方法。
【請求項42】
アデノウイルスゲノムが3〜30アミノ酸残基の非天然ポリアミノ酸配列を含むファイバー蛋白質を更に含み、アミノ酸残基がリジン、アルギニン又はそれらの混合物からなる群から選択される、請求項39〜41のいずれか1項記載の方法。
【請求項1】
以下を含む、アデノウイルスベクター:
(a)アデノウイルスゲノムのE4領域において欠損しているアデノウイルスゲノム;
(b)TNFをコードする核酸配列;及び
(c)TNFをコードする核酸配列と作動可能に連結している放射線誘導性プロモーター。
【請求項2】
アデノウイルスゲノムがアデノウイルスゲノムのE1領域において欠損しているものである、請求項1記載のアデノウイルスベクター。
【請求項3】
TNFをコードする核酸配列がアデノウイルスゲノムのE1領域に存在する、請求項2記載のアデノウイルスベクター。
【請求項4】
TNFがTNF−αである、請求項3記載のアデノウイルスベクター。
【請求項5】
TNFをコードする核酸配列が転写終結領域を更に含む、請求項3又は4記載のアデノウイルスベクター。
【請求項6】
放射線誘導性プロモーターがEgr−1である、請求項1〜5のいずれか1項記載のアデノウイルスベクター。
【請求項7】
アデノウイルスがアデノウイルスゲノムのE3領域において欠損している、請求項1〜3のいずれか1項記載のアデノウイルスベクター。
【請求項8】
アデノウイルスゲノムがE3領域全体を欠損している、請求項7記載のアデノウイルスベクター。
【請求項9】
アデノウイルスゲノムがE4領域のコード領域全体を欠損している、請求項1〜8のいずれか1項記載のアデノウイルスベクター。
【請求項10】
アデノウイルスゲノムのE4領域のコード領域が少なくとも15塩基対を有するスペーサーエレメントで置換されている、請求項9記載のアデノウイルスベクター。
【請求項11】
スペーサーエレメントが転写不活性である、請求項10記載のアデノウイルスベクター。
【請求項12】
スペーサーエレメントがアデノウイルスゲノムのE4領域に対して非天然であるポリアデニル化配列を含む、請求項11記載のアデノウイルスベクター。
【請求項13】
スペーサーエレメントがSV40ポリアデニル化配列を含む、請求項12記載のアデノウイルスベクター。
【請求項14】
アデノウイルスベクターのウイルス産生レベルが、スペーサーエレメントの無いアデノウイルスベクターのウイルス産生レベルよりも大きい、請求項10〜13のいずれか1項記載のアデノウイルスベクター。
【請求項15】
アデノウイルスゲノムが血清型5アデノウイルスゲノムである、請求項1〜14のいずれか1項記載のアデノウイルスベクター。
【請求項16】
配列番号1の核酸配列を有する、請求項1〜15のいずれか1項記載のアデノウイルスベクター。
【請求項17】
アデノウイルスベクターが3〜30アミノ酸残基の非天然ポリアミノ酸配列を含むファイバー蛋白質を含み、アミノ酸残基がリジン、アルギニン又はそれらの混合物からなる群から選択される、請求項1〜15のいずれか1項記載のアデノウイルスベクター。
【請求項18】
請求項1〜17のいずれか1項記載のアデノウイルスベクターの、複製能のあるアデノウイルスを含まないストック。
【請求項19】
請求項1〜17のいずれか1項記載のアデノウイルスベクターを含む宿主細胞。
【請求項20】
以下を含む、アデノウイルスベクター:
(a)アデノウイルスゲノムのE4領域において欠損しているアデノウイルスゲノム;
(b)TNFをコードする核酸配列;及び
(c)アデノウイルスゲノムのE4領域中の少なくとも15塩基対のスペーサーエレメント。
【請求項21】
アデノウイルスゲノムがアデノウイルスゲノムのE1領域において欠損している、請求項20記載のアデノウイルスベクター。
【請求項22】
スペーサーエレメントが転写不活性である、請求項20又は21記載のアデノウイルスベクター。
【請求項23】
スペーサーエレメントがアデノウイルスゲノムのE4領域に対して非天然であるポリアデニル化配列を含む、請求項22記載のアデノウイルスベクター。
【請求項24】
スペーサーエレメントがSV40ポリアデニル化配列を含む、請求項23記載のアデノウイルスベクター。
【請求項25】
TNFをコードする核酸配列がアデノウイルスゲノムのE1領域に存在する、請求項21〜24のいずれか1項記載のアデノウイルスベクター。
【請求項26】
TNFがTNF−αである、請求項25記載のアデノウイルスベクター。
【請求項27】
TNFをコードする核酸配列が転写終結領域を更に含む、請求項24又は25記載のアデノウイルスベクター。
【請求項28】
アデノウイルスベクターがアデノウイルスゲノムのE3領域において欠損している、請求項20〜27のいずれか1項記載のアデノウイルスベクター。
【請求項29】
アデノウイルスゲノムがE3領域全体を欠損している、請求項28記載のアデノウイルスベクター。
【請求項30】
アデノウイルスゲノムがE4領域のコード領域全体を欠損している、請求項20〜29のいずれか1項記載のアデノウイルスベクター。
【請求項31】
アデノウイルスベクターのウイルス産生レベルが、スペーサーエレメントの無いアデノウイルスベクターのウイルス産生レベルよりも大きい、請求項20〜30のいずれか1項記載のアデノウイルスベクター。
【請求項32】
アデノウイルスゲノムが血清型5アデノウイルスゲノムである、請求項20〜31のいずれか1項記載のアデノウイルスベクター。
【請求項33】
アデノウイルスベクターが3〜30アミノ酸残基の非天然ポリアミノ酸配列を含むファイバー蛋白質を含み、アミノ酸残基がリジン、アルギニン又はそれらの混合物からなる群から選択される、請求項20〜32のいずれか1項記載のアデノウイルスベクター。
【請求項34】
請求項20〜33のいずれか1項記載のアデノウイルスベクターの、複製能のあるアデノウイルスを含まないストック。
【請求項35】
請求項20〜33のいずれか1項記載のアデノウイルスベクターを含む宿主細胞。
【請求項36】
宿主の腫瘍又は癌の治療方法であって、請求項1〜17又は20〜33のいずれか1項記載のアデノウイルスベクターの抗癌又は抗腫瘍有効量をその必要のある宿主に投与することを含む方法。
【請求項37】
宿主に放射線を投与することを更に含む、請求項36記載の方法。
【請求項38】
放射線がTNFをコードする核酸配列の発現を誘導し、宿主において治療レベルのTNFを産生する、請求項37記載の方法。
【請求項39】
以下を含む、アデノウイルスベクターの製造方法:
(a)アデノウイルスゲノムのE4領域において欠損しているアデノウイルスゲノムを提供すること、
(b)TNFをコードする核酸配列をアデノウイルスゲノムに挿入すること、
(c)TNFをコードする核酸配列に作動可能に連結するように、放射線誘導性プロモーターをアデノウイルスゲノムに挿入すること。
【請求項40】
アデノウイルスゲノムがアデノウイルスゲノムのE4領域において少なくとも15塩基対を有するスペーサーエレメントを含む、請求項39記載の方法。
【請求項41】
放射線誘導性プロモーターがEgr−1である、請求項39又は40記載の方法。
【請求項42】
アデノウイルスゲノムが3〜30アミノ酸残基の非天然ポリアミノ酸配列を含むファイバー蛋白質を更に含み、アミノ酸残基がリジン、アルギニン又はそれらの混合物からなる群から選択される、請求項39〜41のいずれか1項記載の方法。
【図1】


【図2】


【図3】


【図4】




【図2】


【図3】


【図4】


【公開番号】特開2012−139220(P2012−139220A)
【公開日】平成24年7月26日(2012.7.26)
【国際特許分類】
【外国語出願】
【出願番号】特願2012−22529(P2012−22529)
【出願日】平成24年2月3日(2012.2.3)
【分割の表示】特願2002−506221(P2002−506221)の分割
【原出願日】平成13年6月27日(2001.6.27)
【出願人】(500129085)ジェンベク、インコーポレイティッド (13)
【Fターム(参考)】
【公開日】平成24年7月26日(2012.7.26)
【国際特許分類】
【出願番号】特願2012−22529(P2012−22529)
【出願日】平成24年2月3日(2012.2.3)
【分割の表示】特願2002−506221(P2002−506221)の分割
【原出願日】平成13年6月27日(2001.6.27)
【出願人】(500129085)ジェンベク、インコーポレイティッド (13)
【Fターム(参考)】
[ Back to top ]

