視覚的サーボ制御光学顕微鏡
【課題】細胞種間の差異を知識ベースで発見および最適化するための方法および装置を提供する。特に視覚的サーボ制御光学顕微鏡および分析方法を提供する。
【解決手段】数百個の別々の生細胞を経時的に詳しくモニターする手段;多チャネルにおける動的生理学的反応の定量化;リアルタイムのデジタル画像分割および分析;インテリジェントなかつ繰り返しの、コンピュータ印加による細胞ストレスおよび細胞刺激;ならびに、長期的な研究および観察のための細胞が同じ視野に戻る能力を有するシステム。さらに、細胞の特定部分母集団(subpopulation)のために培養条件を最適化する手段を有するシステム。
【解決手段】数百個の別々の生細胞を経時的に詳しくモニターする手段;多チャネルにおける動的生理学的反応の定量化;リアルタイムのデジタル画像分割および分析;インテリジェントなかつ繰り返しの、コンピュータ印加による細胞ストレスおよび細胞刺激;ならびに、長期的な研究および観察のための細胞が同じ視野に戻る能力を有するシステム。さらに、細胞の特定部分母集団(subpopulation)のために培養条件を最適化する手段を有するシステム。
【発明の詳細な説明】
【技術分野】
【0001】
本発明の一部は、米国エネルギー省による政府支援を受けた(契約番号DE-AC03-76SF00098)。米国政府は本発明において一定の権利を有する。
【0002】
本出願は、2000年6月8日に出願された米国特許仮出願第60/210,543号、および2001年5月14日に出願された米国特許仮出願60/290,755号の恩典を主張するものである。
【0003】
発明の分野
本発明は、細胞種間の差異を知識ベースで発見および最適化するための方法および装置を提供する。特に本発明は、視覚的サーボ制御光学顕微鏡および分析方法を提供する。本発明はさらに、特定の細胞部分母集団用に培養条件を最適化する手段を提供する。
【背景技術】
【0004】
発明の背景
現在、テレプレゼンス(telepresence)研究においては、地理的に分散した場所に存在する専門家および施設を一つにまとめることが主流となっている(Hadida-Hassanら、J.Struct. Biol.、125:229-234 [1999](非特許文献1); Parvinら、「オンライン施設用視覚的サーボ制御(Visual Servoing forOn-Line Facilities)」、IEEE Computer Mag.、56-62頁[1997](非特許文献2); Potterら、UltraMicros.、77:153-161[1999](非特許文献3); Youngら、J. Supercomputer Appl. High Perf. Comput、pp. 170-181 [1996](非特許文献4);およびParvinら、「分散型鏡検のための協調的フレームワーク(ACollaborative Framework for Distributed Microscopy)」、IEEE Conf. onSuperComputing [1998](非特許文献5))。このシステムは、協調的フレームワーク(Parvinら、[1997]、前述(非特許文献2))とともに現場で広く使用されている。テレプレゼンス研究の焦点は、機器の遠隔機能性、ならびに、大規模なデータ収集および分析に必要な自動化に当てられてきた。カリフォルニア(California)大学バークレー(Berkley)校でのMASHプロジェクト(McCanne、IEEEInternet Comput.、3:33-44 [1999](非特許文献6))では、不均質な環境でMBoneツールを使用して、完全に分散したシステムで、協調的アプリケーション用の拡大縮小可能なマルチメディアアーキテクチャを開発している。NCSAのHaveneroプロジェクトでは、主としてJavaで記述されたコンピュータベースの集中システムにおける共有情報の円滑な管理と全クライアントへの同時配布とが実現されている。ラトガー(Rutger)大学のDISCIPLEは、共有バーチャル空間を実現するためのサービスベースの集中システムにおける分散アクセス用にCORBAフレームワークを使用している。サン・マイクロシステム社(SunMicrosystem)のJava共有開発ツールキット(Java Shared Development tool kit)には、通信セッションの参加者にデータを送信するための協調認識性の(collaborative-aware)Javaコードが用意されている。このコードは、TCP/IPソケット、軽量高信頼マルチキャスト、および遠隔呼び出し法という3種類の転送プロトコルをサポートしている。このフレームワークでは、全オブジェクトが管理可能であり、協調はチャネル、トークン、ブロブ、およびリスナーを含むセッション内で発生する。ミシガン(Michigan)大学のUpperAtmosphere Research Collaboratory(UARC)はウェブベースの分散システムであり、大部分がJavaで記述されている。このシステムは宇宙空間物理学研究用の40以上の観察プラットフォームからデータを収集し、同期協調および非同期協調の両方が可能である。このシステムでは、データ提供者はデータ散布サーバー上で各自のデータを発表する。次に、クライアントは所望の情報を受け取るためにシステムに加入する。
【0005】
テレプレゼンス法は物理科学に加えて生物科学においても使用されている。例えば、ポストゲノム配列決定の時代において、複雑な生物材料の定量的な画像化が重大な課題となっている。事実、種々の鏡検法で得られる逐次的な測定結果には、多次元反応(例えば時間および空間における反応)の詳細な分析が含まれていない。多細胞集合体の大きな母集団における複数のマーカーの空間的および時間的な同時挙動を定量化することは、方法が労働集約的であること、定量化ツールが存在しないこと、および情報のインデックス化ができないことにより困難となっている。理想的には、複数の標的タンパク質について、動態および量、細胞内の状況、ならびに形態学的特徴を大きな母集団を用いて三次元的に追跡できる方法が望ましい。
【0006】
例えば、細胞内の特定のタンパク質成分を識別できる数千の抗体およびその他の試薬が利用可能である。一部の抗体はさらに、リン酸化状態、タンパク質の配座、および複合体生成などの修飾により生じるタンパク質の機能的変異体を識別することができる。細胞内タンパク質の多くはシグナル伝達経路に関与している。電位事象が複雑であること、タンパク質の機能に影響する複数の修飾が存在する可能性があること、ならびに、信号伝達においてタンパク質が活性を示す場所および時点に関する情報が不足していることから、これらの信号伝達経路の詳細は現在のところ明らかになっていない。本来的に存在する生物学的なばらつきおよびゲノムの不安定性も、大きな母集団を対象とした分析の必要性を裏付ける要素である。このように、細胞シグナル伝達に関するより詳細な像を描くのに有用な鏡検法および画像分析法が求められている。このことは、疾患の診断および治療の方法の開発において特に当てはまる。
【0007】
今日では、種々の疾患が分子レベルおよび遺伝子レベルで理解されている。疾患に関係する分子の分析は疾患の診断および予後判定において重要である。しかし、癌などの疾患の研究には、現在のところ技術およびモデルシステムによる限界がある。組織試料は通常複数の細胞種(例:異常な細胞、上皮細胞、ストローマ細胞、内皮細胞、炎症細胞など)を含んでおり、この多様な細胞母集団が、タンパク質および/または核酸の発現に関する定性的または定量的な研究の妨げとなっている。関心対象の細胞(例:腫瘍細胞)は全細胞母集団中に占める割合が比較的小さいことが多いため、典型的な標本中のタンパク質または核酸の実質的な変性についてその有意性を解釈することは困難である。また、培養細胞の研究では、細胞間で生じる複雑な相互作用の詳細を明らかにできない。さらに、現在広く用いられている技術は、組織の固定、抗原抗体認識、および/または組織染色などの方法に依存しており、これらの方法では通常、試料の処理中に分析対象の細胞が死ぬことを避けられない。このことにより、標本中の細胞に関して得られる情報の量が制限される。
【0008】
細胞生理学の研究では、実験で観察された現象に関して理論的仮説を設定する必要性があり、蛍光プローブおよび共焦点顕微鏡などのツールの使用によって、種々の分子種および細胞内構造物の細胞内での空間的配置が三次元で分解できるようになった。しばしばこれらの仮説は次に数学モデルとして構築される。次に、これらのモデルは、実験結果とインビボで観察された現象とを相関させるため、シミュレーションに組み込まれる。
【0009】
しかし、既存の技術には欠点がある。一般的にこれらの欠点は細胞の表現に関する現在の限界に由来するものである。これらの方法において、細胞は、空間的に均一な挙動(すなわち生理学的特徴)と構造(すなわち解剖学的特徴)とを有する、理想的かつ単純な幾何学的形状として表現される。このことは、無傷の細胞を用いた実際の実験と容易に相関するシミュレーションにおいて、観察される生理学的な現象を実際に表現しようとする研究者にとって妨げとなる。したがって、モデルおよび仮説の検証がしばしば非常に困難になる。
【0010】
現在、細胞生理学のモデリングおよびシミュレーションにおける努力の多くは、個々の機序を対象にした非常に特異的なモデルか、またはより複雑な現象の抽象的な表現かのいずれかに向けられている。特異的モデルとしては、個々の分子の相互作用(例:イオンチャネルに関するもの)のモデルがある。抽象的モデルは、根底にある機序の単純化を適用するのが一般的であり、こうした機序は、限定されたクラスの生理学的問題および/または観察結果を説明することのみに適しているのが普通である。このように、リアルタイムの観察、観察された現象と疾患状態との相関付け、およびインサイチューで経時的に細胞を観察するための手段を容易にする方法および装置が必要とされている。
【0011】
さらに、いくつかの種類の癌(例:特定の白血病および精巣癌)では、化学療法が成功して患者に治癒をもたらしている。しかし、固形癌(例:乳癌)については治療法向上の進歩は非常に少ない。固形癌でみられる先天性または後天性の多剤耐性(MDR)は、化学療法による治癒を妨げている重要な障害物の一つである。薬物反応の評価および患者反応の予測のためのインビトロ化学感受性アッセイが40年以上にわたって開発されているものの、真に成功したインビトロ化学感受性試験はまだ確立されていない。したがって、信頼性がありかつ有意義なインビトロ化学感受性試験の必要性が依然として存在する。
【先行技術文献】
【非特許文献】
【0012】
【非特許文献1】Hadida-Hassanら、J.Struct. Biol.、125:229-234 [1999]
【非特許文献2】Parvinら、「オンライン施設用視覚的サーボ制御(Visual Servoing forOn-Line Facilities)」、IEEE Computer Mag.、56-62頁[1997]
【非特許文献3】Potterら、UltraMicros.、77:153-161[1999]
【非特許文献4】Youngら、J. Supercomputer Appl. High Perf. Comput、pp. 170-181 [1996]
【非特許文献5】Parvinら、「分散型鏡検のための協調的フレームワーク(ACollaborative Framework for Distributed Microscopy)」、IEEE Conf. onSuperComputing [1998]
【非特許文献6】McCanne、IEEEInternet Comput.、3:33-44 [1999]
【発明の概要】
【0013】
本発明は、細胞種間の差異を知識ベースで発見および最適化するための方法および装置を提供する。特に本発明は視覚的サーボ制御光学顕微鏡および分析方法を提供する。本発明は、数百の個々の生細胞を経時的に詳しくモニターする手段;多チャネルにおける動的生理学的反応の定量化;リアルタイムのデジタル画像分割および分析;インテリジェントなかつ繰り返しの、コンピュータ印加による細胞ストレスおよび細胞刺激;ならびに、長期的な研究および観察において同じ細胞視野に戻ることができる能力を提供する。本発明はさらに、特定の細胞部分母集団用に培養条件を最適化する手段を提供する。
【0014】
特に本発明は、細胞アレイに含まれる細胞の視野を自動的に検出および分割(segmentation)する方法、ならびに、特に母集団研究を目的として、種々の刺激に対する細胞の反応をコンピュータ制御および外的曝露の関数として計算する方法を提供する。外的曝露は、光学装置(例:顕微鏡)の近くに配置されたコンピュータ制御のシリンジ(またはその他適切な容器)に入った化合物の流れによって制御される。
【0015】
好ましい態様において、VSOMは、選択した各視野における各細胞の特定の副区画を構造的に描出する方法を提供する。視野はxyステージによってユーザーが位置決めする。さらに、VSOMは、視野内にある各細胞の特定の細胞内区画(subcellularcompartment)における反応を測定する手段を提供する。いくつかの態様において、細胞下レベルの反応は、a)プログラミングされた刺激周波数で、かつ、b)細胞アレイに注入された化合物に対する細胞曝露の関数として測定される。さらに本発明は、関心対象の細胞の曝露を反応の測定結果の関数として調整するためのサーボループの制御を提供する。本発明は最大限の柔軟性を提供する。例えば、いくつかの態様においては、視野内の関心対象の全細胞について細胞および/または細胞内区画の反応の平均がユーザー定義の閾値に達すると外的曝露が遮断される。別の態様においては、所望の割合の細胞および/または細胞内区画が、定義された閾値に達すると、外的曝露が遮断される。また別の態様においては、細胞の部分集合および/または細胞内区画の部分集合の反応の平均が特定のプロフィールに達すると外的曝露が遮断される。これらの各態様は、任意の組合せで所望の回数繰り返すことができる。
【0016】
本発明の開発以前は、顕微鏡下で多数の個々の生細胞のデジタル画像を得ることは技術的に困難であった。また、多数の個々の生細胞について、細胞を損傷することなく長期間にわたって細胞内の複数の生理学的反応を同時にモニターすることも困難であった。第一の制限は、主として、いかなる倍率においても視野が限られていることに由来するものであった。使用されるデジタルカメラの内部の固体デジタル撮像装置(すなわち、電荷結合素子;CCD)のサイズおよび分解能が限られていることも、視野をさらに制限していた。本発明では、X、Y、Z顕微鏡ステージのソフトウェア制御によって、複数の視野(すなわち、多数の細胞)を迅速に、自動的に、かつ繰り返しモニターすることを容易にし、これにより上述の制限を克服する。また本発明により、中央コンピュータによる複数の顕微鏡の同時遠隔制御が容易になる。事実、局所の顕微鏡周辺装置(例:走査ステージ、フィルタホイール、灌流ポンプ、ロボットアーム、シャッター、カメラ、等)を制御するために現在使用されているコンピュータ(すなわちクライアント)に関連する、メモリ、ソフトウェア、および処理資源の制限が本発明により克服される。本発明により、インターネットを使用した遠隔制御と、遠隔値のユーザーから地理的に離れた場所に設置されたより強力な中央コンピュータ(サーバー)とでVSOM観察を実施することが可能になる。サーバーは、より処理集約的なタスクを実行または分配し、かつ、現在および過去の細胞反応を記録した非常に大規模のデータベースの中央ロケーションとして機能する。このように、本発明のVSOMは、強力な中央サーバーへのネットワークアクセスの利点、および、単一細胞の反応に関する過去の観察結果と複数情報チャネル間の相関に関する過去の観察結果とが記録された大規模中央データベースの利点を活用するものである。特に好ましい態様においては、VSOMシステムは、細胞を繰り返し検出し、全チャネルについて観察されたすべての細胞反応を記録および分析し、現在の細胞反応を比較し、現在の各情報チャネルについて相関付けを行い、かつ、細胞反応に関する過去の観察結果および各情報チャネル間の相関に関する過去の観察結果が記録されたデータベースに対して問い合わせを行う。単一の実験過程において、次にシステムは、実施中の実験の目的を達成するため、実験パラメータをどのように調整するかに関して知識ベースで一連の決定を行う。
【0017】
したがって、本発明により、単一の比較的短い実験過程の間に複数の完全な実験サイクルを実施することが可能となる。このことは、異なる細胞種間の差異を検索、発見、および最適化するプロセスを大幅に加速させる。必要な細胞数は比較的少ない。また、個々の細胞の反応がモニターされるため、分析用の標本は異なる種類の細胞を含んでいてもよい。「細胞種」とは、ある群に含まれる各細胞が他群の細胞から識別されうる類似の特徴を有するような複数の群に一群の細胞を分けることができる任意の観察方法により達成される分類である。この分類は、個々の単一細胞レベルにおける比較的迅速な生理学的反応を繰り返し観察した結果(例:細胞内構成要素、形態学的変化、細胞分裂、細胞死、剥離などの観察)に基づいて行われるのが一般的である。しかし、この用語は、従来の組織学的基準(例:上皮細胞、腫瘍細胞、筋細胞、脂肪細胞、神経細胞など)に基づいて分類した種々の細胞種も含む。
【0018】
本発明の開発以前は、多数の細胞を対象とした場合に、実験過程中に実験パラメータをどのように変更するかに関する自動的かつ知識ベースの決定を迅速に行うことができなかった。本発明は、実験過程中に「試験/記憶/分析/学習/再設計/再試験」サイクルを多数回実行する能力を提供するものであり、この能力により、以前は実行不可能であった多くの実験および応用が可能となる。細胞が生存状態を維持し、かつ、実験が進行状態およびオンライン状態を維持する場合、刺激に対する過去の反応と未来の反応との相関は細胞単位で維持される。比較的少量の細胞試料を使用して、単一の実験中に多様かつ繰り返しのコンピュータ生成刺激を印加および反復することができる。このことは、細胞種間の差異を検索および最適化する際に大きな利点となる。「刺激」という用語は、単一の刺激、複数の刺激、または複数の刺激の組合せを単回、繰り返し、または連続的に与えることを意味する。生理学的な反応を引き起こす刺激には、機械的、物理的、化学的、および生物学的な実体が含まれる。したがって、本発明はいかなる刺激または刺激の種類にも限定されない。
【0019】
生細胞は移動することができ、または形態を変化させることができる。したがって、細胞の形態測定的特徴、テクスチャ、およびその他の特徴を分析するための手段を提供することが重要である。したがって、ある視野に戻る際、ソフトウェアは、焦点を調節し(z軸制御)、かつ視野を再取得および再登録するため横方向および縦方向にわずかな調整を行う(x,y軸制御)必要がある。さらに、細胞の位置および形状の変化を追跡するため、個々の細胞の外形を規定する元の輪郭を修正する必要がある。したがって、1つの態様では、本発明のVSOMは画像内容の分析結果に基づいて機器の制御に関する決定を行うための手段を提供する。事実、本発明は以下の手段を提供する:生細胞に刺激を繰り返しおよび/または連続的に印加するコンピュータ自動処理の手段;鏡検およびデジタル撮像を用いて、刺激に対する細胞または細胞レベル以下の1つまたは複数の生理学的反応を単一細胞レベルで繰り返しおよび/または連続的に検出およびモニターする手段;信頼性の高い細胞種同定に適した、および/または細胞種間の差異を最適化するための刺激の修正に適した基準を確立するために十分な数の個々の細胞の反応を迅速に観察する手段;細胞が観察および/または刺激に利用できる間に知識ベースの刺激制御を決定できるよう、現在の細胞反応と過去に保存された細胞反応(例:データベース情報)とを迅速に分析する手段;および、時間依存的に生じる事象間の相関を多チャネルにわたってモニターする手段。
【0020】
本発明はさらに、蛍光に加えて透過光を利用して生細胞の輪郭を規定するための手段を提供する。これにより、蛍光成分を含まない細胞の追跡が容易になる。さらに、これにより、細胞毒性を示し得る蛍光標識化合物の使用量を少なくでき、かつ、蛍光発光を生じさせるために必要な強力な蛍光励起照射を回避することができる。したがって、より長時間にわたる細胞の観察が可能となる。さらに、特異的な挙動を示す細胞を実験の最後に個別に回収して、プール(貯蔵)、細胞株の樹立、クローニング、特定の分化状態への誘導、分析などに供することができる。
【0021】
本発明の機器では、撮像を透過光撮像と種々の波長の蛍光撮像とで迅速に循環させることによって、異なる生理学的反応を異なるチャネルで実質的に同時に観察することができるため、本発明により、多数の細胞をモニターすることに加えて、単一の実験中に多数の生理学的反応を観察することが可能となる。
【0022】
マルチウェル蛍光プレートリーダーを使用すると、生細胞の全母集団が発する進行中の蛍光シグナルを検出することができるが、単一の細胞の反応を観測することはできない。しかし、本発明のVSOMの1つの態様においては、マルチウェルプレートリーダーに適した蛍光アッセイの発見および最適化が可能である。また、一般的な技術では、個々の生細胞が発する多チャネル蛍光シグナルをフローサイトメトリーを使用して瞬時に検出することができる。細胞を蛍光シグナルに応じてソーティングすることができ、かつ、回収することもできる。しかし、細胞は検出器を高速で通過し、得られる測定結果は単一のものである(もしくは多チャネルの可能性もある)。個々の細胞が一定の長さの時間にわたって追跡されることはなく、過去の反応と現在の反応とを相関させた同一細胞の繰り返し観察も不可能である。本発明はこれらの制限を克服するものであり、フローサイトメトリーおよび活性細胞ソーティングに適した蛍光アッセイの開発および最適化を容易にする。
【0023】
本発明は、任意の種類の細胞(例:動物細胞、植物細胞、微生物細胞など)に有用な細胞種特異的蛍光アッセイに用途を有する。したがって本発明は、いかなる種類の細胞にも、またはいかなる特定の蛍光もしくは他のアッセイシステムにも限定されるものではない。好ましい態様ではヒトの細胞を対象としているが、他の態様では他の哺乳類ならびに植物および微生物から取得された細胞も対象となる。例えば本発明は、組織から取得された正常細胞、前悪性細胞、悪性細胞、および/または多剤耐性癌細胞を検出および識別する手段を提供する。さらに本発明は、稀な細胞種(例:幹細胞または母体血液中の胎児細胞)を選択的に標識するプロトコルを設計するための手段を提供する。いくつかの態様においては、これらのプロトコルは放射性およびその他の標識システムとともに使用するよう修正される。本発明はまた、個々の患者および/または患者の個々の腫瘍に合わせた化学療法レジメン(薬剤の組合せも含めて)を確立するためのアッセイの設計および応用を容易にする。さらに本発明は、医薬品、農業、バイオテクノロジーなどにおける種々の使用について、候補となる多数の薬剤、殺虫剤、除草剤、およびその他の化合物を検索するうえで有用なアッセイを提供する。さらに本発明は、細胞増殖、細胞毒性、および/または分化における使用について、多数の候補薬剤を検索するうえで有用なアッセイを提供する。
【0024】
本発明はさらに、関心対象の細胞種を増殖上有利にすることによって、または、培養中に存在する他の細胞種に対して細胞毒性として作用する環境条件もしくはプロトコルを設計することによって、特定の細胞種の増殖をもたらす、インビトロの組織培養条件を設計する手段を提供する。したがって本発明は、インビトロでの増殖がしばしば困難である細胞を培養するための手段を提供する。さらに本発明は、細胞を特定の分化終点へと誘導するのに適した細胞培養条件をつくるための手段を提供する。例えば、本発明を用いて、幹細胞または胚性細胞を所望の最終終点へと誘導するために必要な条件を開発することができる。
【0025】
本発明はまた、種々の迅速インビトロ検査の開発および実施に用途を有する。例えば、ある患者に対して候補となる組織または骨髄ドナーが複数存在する場合は、種々のドナーの細胞を患者の免疫細胞と混合し、免疫拒絶反応を単一細胞レベルで観察する。したがって、その特定の患者に対する最適なドナーの同定が容易になる。さらに、これらの検査は、移植拒絶を抑制するよう設計された薬剤(または薬剤候補)の存在下で実施することができ、患者に対する最適なドナーの選択とあわせて、最適な抗拒絶薬の投与レジメン(すなわち、単剤使用または多剤併用)の選択が容易になる。
【0026】
本発明は、細胞または細胞の細胞内構成要素をモニターする検出装置から細胞画像データ(すなわち、細胞の生理学的特徴、形態学的特徴、および/またはその他の特徴に関する情報)を受け取る段階;細胞画像データを分析する段階;ならびに、分析された細胞画像データに応じて細胞または細胞内構成要素を刺激するよう適合させた複数の刺激装置を自動的に作動させる段階を含む方法を提供する。いくつかの態様においては、本発明はさらに、分析された細胞画像データに応じて細胞を刺激するため複数の刺激装置を自動的かつ独立的に作動させる段階を含む。また別の態様においては、細胞画像データを分析する段階は、細胞のサイズの分析、細胞の色の分析、および細胞の動きの分析のうち少なくとも1つを含む。いくつかの好ましい態様においては、検出装置は視覚的サーボ制御光学顕微鏡(VSOM)を含み、この場合、方法はVSOMを用いて細胞をモニターする段階をさらに含む。別の態様において、刺激装置はシリンジである。さらに別の態様において、方法は、細胞画像データを時間の関数として保存する段階をさらに含む。いくつかの特に好ましい態様において、細胞は生細胞であり、かつ、細胞内構成要素は生細胞内の構成要素である。別の態様において、方法は、前述の段階を所望の回数かつ所望の順序で繰り返す段階をさらに含む。
【0027】
本発明はまた、細胞アレイ;細胞アレイが発する光を検出し、かつ細胞アレイで生成された光に対応する第一の信号を、第一の信号を受け取り第一の信号を用いて、被刺激細胞アレイを得るための細胞アレイへの少なくとも1つの検査刺激の送達を制御するための第二の信号を生成するコンピュータに提供する光学システム;および、第二の信号を受け取りかつ検査刺激を送達するロボットシステムを含む、細胞アレイを分析するための方法およびシステムであって、非刺激細胞アレイが発する光を光学システムがさらに検出する方法およびシステムを提供する。いくつかの態様において、検査刺激は第一の信号に従って自動的に細胞アレイに与えられる。いくつかの好ましい態様において、ロボットシステムは少なくとも2つの微量液体チャネルを介して検査刺激を細胞アレイに送達する。さらに別の態様において、光学システムは少なくとも1つの顕微鏡を含む。いくつかの好ましい態様において顕微鏡は共焦点顕微鏡であり、別の態様において顕微鏡は蛍光顕微鏡である。いくつかの態様において、細胞アレイは少なくとも2つの細胞種を含む。さらに別の態様において、光学システムは細胞アレイを走査して、細胞アレイに含まれる細胞種の中の細胞内構成要素を検出する。いくつかの好ましい態様において、細胞内構成要素は、核、核小体、ミトコンドリア、リソソーム、ファゴリソソーム、および貯蔵小胞からなる群より選択される。いくつかの特に好ましい態様においては、少なくとも1つの細胞内構成要素が標識される。別の好ましい態様において、細胞内構成要素は検査刺激により標識される。いくつかの態様において、細胞内構成要素は、蛍光染料、放射性化合物、酵素、および生体染料からなる群より選択される少なくとも1つの化合物で標識される。別の態様において、光学システムは標識をデジタルデータに変換する。さらに別の態様において、ロボットシステムはデジタルデータを利用して細胞アレイへの生物活性成分の送達を自動的に調整する。別の態様において、本発明は、コンピュータシステムの遠隔操作の手段を提供する。さらに別の態様において、本発明は、細胞情報(例:結果のプロフィールにおける情報)を、過去に取得された細胞情報およびデータを含む基準データベースと比較する手段を提供する。
【0028】
本発明はまた、細胞または細胞内構成要素をモニターする検出装置から細胞画像データを受け取るためのコード;細胞画像データを分析するためのコード;および、分析された細胞画像データに応じて細胞または細胞内構成要素を刺激するよう適合された複数の刺激装置を自動的に調整するためのコードを含む、コンピュータ読み取り可能媒体を提供する。いくつかの好ましい態様において、コンピュータ読み取り可能媒体は、細胞をモニターする視覚的サーボ制御光学顕微鏡(VSOM)を制御するためのコードをさらに含む。さらに別の態様において、コンピュータ読み取り可能媒体はさらに、細胞のサイズを分析するためのコード、細胞の色を分析するためのコード、および細胞の動きを分析するためのコードのうち少なくとも1つをさらに含む。また別の態様において、コンピュータ読み取り可能媒体は、分析された細胞画像データに応じて細胞を刺激するための複数の刺激装置を自動的かつ独立的に作動させるためのコードをさらに含む。さらに別の態様において、刺激装置はシリンジである。いくつかの好ましい態様において、コンピュータ読み取り可能媒体は、細胞画像データを時間の関数として保存するためのコードをさらに含む。さらに別の好ましい態様において、細胞は生細胞であり、細胞内構成要素は生細胞内の構成要素である。
【0029】
発明の全体的な説明
本発明は、近年の大多数のネットワークコンピュータの処理能力、記憶能力および分析能力を、単一の生細胞の複雑かつ相互作用的な生物学的経路および生化学的経路または「回路構成」と結びつけるための手段を提供する。さらに、この過程は数百または数千の細胞について繰り返し行うことが可能であり、人間がこの連結的かつ自動的なシステムに携わることはない。コンピュータ印加の刺激および摂動によって呼掛けを受けた生細胞がコンピュータによる検出および分析が可能な様式で「反応」する際に、通信またはフィードバックループが確立される。コンピュータ印加によるこれらの複雑な刺激および摂動は、繰り返し印加することができ、かつ、細胞から受け取った複雑な「反応」に基づいて適切に変化させることができる。
【0030】
本発明のいくつかの態様は、異なる細胞「種」の正味の生理学的反応における微妙な差異、および/または、異なる生理学的状態にある同じ「種」の細胞間の微妙な差異を迅速に発見するという用途を有する。本発明は、観察される差異を特定の生化学経路、特定の遺伝子もしくは遺伝子セットの発現、または他の特異的な差異に分離または局限するよう設計された一連の追加的な試験または刺激を与えることによって、異なる細胞種の正味の反応の差異を迅速、自動的、かつ効率的に精密化または最適化する手段を提供する。この方式により、特定の差異が非常に精密な方式で同定および標的化されるため、生きている複雑な系(生細胞)の2つ以上の異なる母集団間における生物学的反応の微妙な差異を増幅することが可能となる。
【0031】
本発明は、細胞種間の差異を知識ベースで発見および最適化するための方法および装置を提供する。特に本発明は、生細胞の大きな定義済みアレイの自動生成およびそれに続く自動分析のための視覚的サーボ制御光学顕微鏡(VSOM)および分析方法を提供する。本発明はさらに、印加された刺激または刺激の組合せに対する細胞の反応の差異を検索、定量化、および最適化するための手段を提供する。本発明は、種々の目的を達成するため、自動化された様式で、細胞反応の既知の差異を利用することができ、かつ/または、細胞反応の新しい差異を検索および発見することができる。したがって、本発明により、細胞反応の所望の差異を得るための刺激または刺激の組合せを発見および印加することが可能である。
【0032】
さらに、本発明により、表面に付着されたまたはしっかり接着した多数の個々の細胞について、個々の細胞種の同定および個々の細胞の生理学的状態の同定が可能である。この個々の細胞の同定に付随して、多数の隣接細胞に対する相対的な細胞位置が特定される。この方式により、表面上に任意に置かれた生細胞の大きなアレイは、定義されたx,y,z位置に存在する同定済み細胞の大きなアレイに自動的な様式で変換される。次に、このようなアレイは、続いて行われるVSOM刺激、摂動、および呼掛けの実験の間モニターおよび追跡される。VSOM刺激、摂動、および呼掛けには、蛍光プローブの使用、化学的物質および生物学的物質の添加、および物理的刺激の印加が含まれる。種々の量、間隔および連続性で単独または組合せで印加されるこれらは、自動的に記録、分析、および最適化される。このような刺激、摂動、および呼掛けは、良性のものであってもよく、細胞にとって致死的なストレスとなるものであってもよく、または中間的なある程度の影響を細胞に及ぼすものであってもよい。本発明により、1つの実験過程の間に、自動的に印加された刺激、摂動、および呼掛けに対する生理学的反応の生物学的帰結を、細胞について細胞単位でかつ細胞小器官について細胞小器官単位で、長期間にわたって定量、モニター、および保存すること、ならびに他の反応と相関させることが可能である。
【0033】
印加された刺激、摂動、および呼掛けの履歴、ならびに、複数のチャネルで同時に観察した数百または数千の細胞の、相関付けされた複数の個々の細胞の反応の履歴は、遠隔または局所のデータベースに保存される。さらに、このような刺激の最終的な生物学的帰結が以後のVSOM実験用に収集される。このデータベースが増大するにつれて、VSOMアッセイおよびプロトコルはその予測能力が向上し、かつ、機器および処理の制御および最適化により有用なものとなる。
【0034】
本発明では、適用されたプローブ、刺激、摂動、および呼掛けに対する過去の細胞反応の知識に基づいて刺激、検索、最適化、およびVSOM機器制御が行われるよう、VSOM実験過程の間にリアルタイムで局所的または遠隔的にデータベースにアクセスすることが可能である。本発明により、細胞種および/または細胞の生理学的状態に特異的な種々のインビトロアッセイおよびインビボアッセイを開発することができる。本発明の方法およびシステムと保存された知識の蓄積と基づくアッセイの開発により、よく特徴付けされた大規模な生細胞アレイの自動生成に用いることができる、より迅速で、良性で、かつ特異的なアッセイが可能となる。これにより、最小限の刺激または摂動を受けた生細胞アレイを、迅速かつ自動的に生成し、かつ、その後細胞種間の際を利用する新しいまたは改善されたレシピ(recipe)およびプロトコルを検索するためのVSOMに使用することができる、有効なサイクルが提供される。次に、種々の目的を達成する目的で、このプロセスと、機器制御知識と、その結果得られるレシピおよびプロトコルであって細胞種特異的な生理学的反応および細胞種特異的な生物学的帰結を生成するレシピおよびプロトコルとを、VSOM環境および非VSOM環境で使用することができる。
【0035】
これらの目的には以下(i)〜(xiii)が含まれるがこれらに限定されることはない:(i)細胞の特定の部分母集団のみに有利なインビトロ培養条件およびプロトコルを迅速かつ自動的に最適化すること、(ii)非VSOMの機器または状況に適した、細胞種特異的なアッセイ、プロトコル、および診断キットを開発すること、(iii)VSOM機器のみに適した細胞種特異的なアッセイを開発すること、(iv)薬剤開発の標的となる、細胞種間の特異的な差異を発見すること、(v)幹細胞から種々の特定種の細胞を得る場合のように、所望の分化状態で細胞を得るためのインビトロの条件およびプロトコルを発見すること、(vi)生細胞の複雑かつ相互作用的な生化学ネットワークにおける特定の遺伝子または遺伝子セットの機能を発見すること、(vii)遺伝子または遺伝子セットの発現または非発現、およびその結果である細胞表現型の間の関係を発見すること、(viii)個々の生細胞の複雑かつ相互作用的な生化学ネットワークにおける薬剤またはその他の物質の影響を発見すること、(ix)薬剤またはプローブの細胞特異的な送達に適した物質およびプロトコルを発見すること、(x)個々の患者の腫瘍、特に多剤耐性を示す可能性のある腫瘍に合わせて設計された化学療法レジメンを発見すること、(xi)特定の個人に対する、物質の相対的な化学感受性または毒性を発見すること、(xii)特定の個人に対する特定の臓器ドナーの適合性を発見すること、ならびに、(xiii)生きているヒトにおける特定遺伝子の発現の3D撮像に適した放射線標識プローブを利用するものなどの、インビボアッセイを開発すること。本発明はさらに、各分析の間にインキュベーション期間が設けられる(すなわち、培養物が細胞培養インキュベータ内に置かれる)場合においても、培養中に存在する特定の細胞を複数回特異的に特定する手段を提供することにより、経時的に繰り返し細胞を分析する手段を提供する。
【0036】
VSOMアプローチの1つの態様においては、個々の分散した生細胞(または、細胞もしくは組織片の非常に小さな集塊)を含む溶液が滅菌容器内に置かれる(すなわち、インビトロ)。容器の壁に細胞を付着させる手段がない限り細胞は容器の底に沈降し、次に(条件が正しければ)容器の底に付着を始める。この過程の間、細胞は扁平化し、次に(条件が正しければ)成長、分裂、および増殖を始める。一部の場合においては、扁平化および表面付着の傾向をまったく示さない例えば円形の細胞が容器の底面に付着して液体の交換によって洗い流されなくなるよう、容器の底面を処理する必要がある。
【0037】
いくつかの好ましい態様において、本発明は、典型的には倒立顕微鏡である顕微鏡を、拡大レンズ(すなわち対物レンズ)が細胞溶液の入った容器の下に位置する状態で使用する。デジタル画像を自動的に取得できるようデジタルカメラが顕微鏡に取り付けられ、(一部の場合においては)標準的なハロゲン電球を光源とする標準的な白色光が細胞に照射される。次に、標準的な透過光技術(位相差法、微分干渉法、明視野法、暗視野法など)を用いて、デジタルカメラ撮像に適した細胞像を得る。一部の場合においては、水銀アークランプまたはキセノンアークランプなどを光源とする非常に明るい照射光を用いて追加の画像を連続的に高速で取得する。この照明光はコンピュータ制御の回転光学フィルタホイールに収容された1つまたは複数の光学フィルタを通過し、細胞にはフィルタリングされた紫、青、または黄色の照明光が照射され、一連のデジタル画像が連続的に取得される。表面蛍光鏡検法用に適切に装備された顕微鏡では、1つまたは複数の蛍光プローブを含む細胞は適切な色の蛍光励起光を照射すると特定の色の蛍光を発する。したがって、光学フィルタホイールの位置を変えて取得した連続デジタル画像では、細胞が発する青、緑、および赤の蛍光が別々の連続デジタル画像またはデジタル「チャネル」に写った画像が得られる。この方式により、細胞中の(例えば)青、緑、または赤の蛍光プローブの量および相対的分布を青、緑、または赤の蛍光発光のデジタル画像(青、緑、および赤のチャネル)でモニターすることができ、細胞の全体的な形状およびテクスチャは透過光デジタル画像(透過光チャネル)で観察することができる。
【0038】
異なる細胞内区画で観察される蛍光の相対的な強度および色によって、異なる蛍光プローブの取込みおよび保持の比率を表すことができ、細胞内でこの蛍光強度が分断および再配分される様子は、細胞に関する重要な生理学的、解剖学的、および形態学的情報を提供する。形態学的な情報は透過光デジタル画像でも得られる。時間または印加した刺激の関数としてこれらのいずれかまたはすべてのパラメータに生じた変化は、使用された蛍光プローブに対する、および、細胞またはその環境に印加された他の刺激または摂動に対する、細胞の「反応」として解釈することができる。さらに、1つの反応が赤のチャネルで、1つの反応が緑のチャネルで、1つの反応が青のチャネルで、および、1つの反応が透過光チャネルで観察できるよう、個別の反応を複数の別々のデジタルチャネルでモニターおよび追跡することができる。この方式により、コンピュータ印加の刺激、摂動、および呼掛けに対する生理学的な反応が連続デジタル画像中にコードされる。これらの反応は、デジタル画像をコンピュータに通過させる際に、各デジタル画像に含まれる情報を抽出しかつある意味コンピュータ印加刺激に対する「応答」である細胞の反応を検出するアルゴリズムによって、デコードされる。
【0039】
本発明の特に好ましい態様の1つでは、ストレス、刺激、抑制、または摂動の形でコンピュータにより印加される呼掛け(または「質問」)に対する細胞の反応または「応答」とは、実験過程中に迅速に(すなわち、「リアルタイム」で)デコードおよび解釈される。したがって、前の「応答」または細胞反応の解釈に基づいて追加の「質問」をすることができる。このプロセスは細胞とコンピュータとの間の通信ループを構成し、かつ、個々の生細胞の現在の生物学的状態および現在の生物学的「回路構成」(例:現在の生物学的および生化学的なプロセス)に関する情報を「読み出す」手段に相当する。
【0040】
コンピュータ制御の刺激、摂動、および呼掛けを印加する1つの手段は、コンピュータ制御のシリンジポンプを経由させることである。この方式により、種々の蛍光プローブ、ならびに化学物質および生物学的物質の溶液を、付着した生細胞に通過させることができ、かつ、物質およびプローブを細胞標本容器に添加する際または細胞標本容器から洗い流す際にこれらの物質に対する細胞の反応をモニターすることができる。このようなプロセスは、細胞の微小環境の変動または摂動として説明してもよい。細胞容器の温度を変化させる、細胞に強いUV光を照射する、または容器内の細胞に電場をかけるなど、細胞環境を摂動させる他の物理的手段も存在する。このような環境の物理的変動はコンピュータで制御してもよく、かつ、シリンジポンプを必要としない。特に好ましいいくつかの態様においては、ユーザーは、膨大な数に及ぶこのような刺激の過去の組合せ、ならびに、それらがどのように印加されたかおよび細胞の反応がどうであったか、を追跡できるコンピュータの能力を利用する。これは、実施中の実験をモニターすることだけでなく、過去の細胞の刺激と反応とが記録された、オンラインの非常に大規模なコンピュータデータベースを参照することによって実施してもよい。生細胞を用いたリアルタイム実験の過程でこのような大規模データベースにアクセスできる能力は、広く用いられている方法に対する大きな利点である。
【0041】
さらに、異なる種の生細胞を同定、識別、および分類する手段が、特別に変調した(コンピュータ制御の様式で生成した)細胞種特異的かつ時間変動的な動的生理学的反応により提供される。本発明は、このように特有の細胞種特異的な「生理学的フィンガープリント」を、生細胞に対して侵襲が最低限でありかつ比較的良性である点まで発見および精密化する手段を提供する。環境の良性な摂動に対する反応を定量化するために形態測定パラメータ(蛍光プローブ不在化で透過光チャネルで取得される)を使用することは、高度に精密化された同定アッセイの一例である。
【0042】
本発明の開発中に克服された課題の1つは、生細胞とその個々の細胞内区画との外形(輪郭)を描くための標準的なデジタル画像分析技術が、しばしば生細胞の研究には不十分であるという問題点である。これらのアルゴリズムでは多くの場合、細胞が物理的に離れていること(すなわち、細胞が接触または重複していないこと)が必要とされ、また、比較的明るい蛍光色素で非常に均一に標識されていることも必要とされる。染色が不均一である場合(すなわち、他の細胞より明るい細胞がある場合)、または、照明パターンが不均一である場合、これらのアルゴリズムは失敗する。多くの場合、これらのアルゴリズムを成功させるために必要な長時間の蛍光曝露は生細胞にとって毒性として作用する。
【0043】
適切なコンピュータアルゴリズムによりデジタル画像中の個々の細胞(および、理想的には特定の細胞内区画)の検出および輪郭取得が成功すると、コンピュータ印加の刺激に対して生じる蛍光プローブの量の変化(すなわち蛍光顕微鏡の場合)または形態学的な変化を、コンピュータにより定量化、記録、および分析することが可能となる。次にコンピュータはこれらの分析結果に基づいて、生細胞から追加の情報を引き出すことを目的として判断をおこなうことができ、かつ、シリンジポンプまたはコンピュータ制御されたその他の顕微鏡周辺装置に対して命令を送ることができる。この追加の情報および以後のサイクルで得られる以後のすべての情報は、単一の刺激の後に観察された、細胞種間の最初の小さな差異を最適化および増幅するうえで有用である。
【0044】
個々の生細胞間には(同種の細胞であっても)正常な不均質性および変動があるため、同時に多数の細胞を観察しない限り、生細胞の反応を解釈することは困難または不可能であることが多い。多数の細胞を観察する必要があること、および、それに付随して大量のデジタルデータを迅速に処理する必要があることも、本発明により解決される。局所のコンピュータは通常このような計算能力を備えておらず、備えている場合は機器の費用が大幅に増加する。したがって、本発明のいくつかの態様では、より強力な遠隔コンピュータによる機器の制御が提供される。さらに、必要数の細胞が単一のデジタル画像または単一の顕微鏡視野内で常に見えるとは限らない。したがって、本発明の別の態様では、ごく近傍で追加のデジタル画像を取得することによってより多くの細胞を観察できる能力が提供される。
【0045】
本発明はさらに、以下の方式により多数の細胞を観察することを可能にしている。印加された刺激に対する生物学的反応および生物学的帰結は常に迅速であるとは限らず、比較的遅いことが多い。刺激が制御化された遅い方式で印加される場合はとくにこれが当てはまる。したがって本発明では、異なる細胞群を連続的にデジタルカメラの視野内に入れることを可能としている。5つの細胞群をモニターする場合、コンピュータ制御の顕微鏡ステージは、実験を通じて一定の間隔で常に同じ5つの細胞母集団に戻りながら、標本容器の5つの異なる領域間を連続的に繰り返し動く。この精度は、精密なxyステージのみによってもたらされるものではなく、細胞の輪郭の検出と付着した細胞の特定母集団を表す同じランダム分布パターンの再取得とを行い、かつ、同じ特定の細胞群がデジタル撮像用に再度適切に位置決めされるまで必要に応じてxyステージに微調整を行うコンピュータアルゴリズムの能力によってももたらされる。
【0046】
上述の概念のいくつかの例を種々の図に略図で示した(例えば図4および図5を参照)。必要な設備およびプロトコルの例も本明細書に詳述している。
【0047】
図5に略図で示すように、多視野(MF)VSOM実験により本発明の多くの局面を実証することができる。コンピュータ制御された4つのシリンジポンプ(A、B、C、D)が、生細胞と1つまたは複数の環境センサーとが入った円形の微小環境チャンバに種々の溶液を注入する。溶液は、物理的に離れた2つの細胞のパッチが置かれた細胞チャンバに入る。インラインの流量センサーIおよびIIは注入された溶液の組成をモニターし、センサーIIIおよびIVはチャンバ内の環境条件をモニターする。この略図において、左側の細胞は、乳癌の生検標本の場合に(この単純化したモデルにおいて)予測されるような、正常細胞(斜線入りの円)と癌細胞(白抜きの円)とを含む不均質な混合物を表す。右側の細胞(斜線入りの円)は正常組織(例えば反対側の乳房)から得られた生検標本を表す。同じ細胞セット(1、2、3、および4)が繰り返し撮像されるよう、VSOM制御されたxyステージが顕微鏡の対物レンズ(チャンバの下に位置する)の上方で細胞チャンバを繰り返し再位置決めする。種々の摂動が印加されると同時にこれら生細胞の反応が連続的に定量化される。これらの摂動には、種々の組成の溶液の注入、および、溶液として投与することができないその他の摂動の制御とが含まれる。これらの摂動には、ガス、温度の変動、照射、電場または磁場、またはVSOMアルゴリズムまたはレシピで印加されるその他の物理的摂動が含まれ得る。この図において、環境チャンバからの流出もインラインの流量センサーV、VI、VII、およびVIIIでモニターされる。細胞の反応は蛍光発光および透過光の両方の様式を用いてリアルタイムで分析される。特定の実験目標を達成するため、摂動と環境変化とに対する個々の反応について実行中のVSOM分析に基づいて、適切なシリンジと適切な環境条件とがVSOMにより制御される。本図に示した事例では、特定の細胞の近傍または中に微小毛管を置くことも可能である。
【0048】
図4は、VSOM実験の1つの態様を示した略図である。実験開始時(時点1)、細胞種AおよびBは表面上にランダムに配置され、不均一なアレイ中の未同定の細胞として存在する。この最初の時点では、各細胞は識別できないため「a」「b」および「?」と呼ばれる。VSOMシステムは、細胞種Aを蛍光色素で選択的に標識する(本図ではこれが時点5で生じたことが示されている)プロトコルを検索しながら、一連の溶液を(シリンジi〜vから)添加し、かつ、一連の物理的刺激を印加する。時点5(図中にチェックマークで示す)で、2つの細胞種と成功プロトコルとが同定され、細胞反応がデータベースに記録される。一部の場合では、細胞種Bの存在下で細胞種Aを選択的に標識するための新しいプロトコルが発見された時点5の時点で実験が終了される。次に、成功プロトコルが、時点3と時点5との間に実施された各段階として同定される。
【0049】
続く実験では、種類Aと種類Bの全細胞の同定と各細胞のアレイ内での位置の記録とが時点6の時点で完了しているよう、時点3〜時点6間の各段階のみが、場合によっては最適化された方式で、細胞に対して実施され、かつ、蛍光色素が洗い流される。この方式により(場合によっては標識プロトコルをさらに精密化した後に)、受けた摂動が最小限であり、かつ、異物の化合物またはマーカーを含まない、同定済みの細胞のアレイが得られる。次に、VSOMで生成されたこの同定済み生細胞のアレイを用いて、次のVSOM実験を開始してもよい。
【0050】
図4パネルAに示した一連の事象は大量の実験情報と結果とを含んでおり、これらはさらに詳細に説明することが可能である。例えば、時点1〜時点2間で、細胞に物理的摂動(温度の低下など;図中、「物理的刺激」と書かれた上側の時間軸の上に白抜きの矢印で示されている)を与え、次に、シリンジ(i)内の溶液を注入する。溶液注入については、本図の「ポンプ動作」と書かれたグラフに、ポンプ(i)が一定の時間(時間軸上の斜線の入った長方形の幅で示す)、一定の流量(斜線の入った長方形の高さ)で作動したことが示されている。時点2で形態学的な変化が生じ、これは画像分析技術を用いて各細胞について継続的に定量化されている。しかし、この細胞反応は両細胞種で同じである。したがって、この時点では細胞種間の識別は行われておらず、引き続き自動検索が行われる。時点2〜時点3間で、シリンジ(iii)内の溶液が注入され、続いて物理的刺激(UV光照射など)が行われる。時点3の時点でも両細胞種は依然として類似の挙動を示しており、したがって実験が継続される。時点3〜時点4間でシリンジ(v)から溶液が注入されて、その結果両細胞種が蛍光色素で標識され(灰色の影で示す)、続いて物理的刺激(電場をかけるなど)が与えられ、これとともに(概ね)時点4〜時点5間にシリンジ(ivおよびii)の溶液が添加される。この結果、細胞種Bは細胞種Aより早く蛍光色素を失い、したがって時点5では細胞種Aのみが標識された状態となる。時点5〜時点6間で、いずれの細胞も蛍光色素をまったく含まなくなるまで(時点6)、シリンジ(ii)からより大きな流量で溶液が注入される。この方式により、生細胞のアレイ全体が同定され、かつ、いずれの細胞も異物である化合物または蛍光プローブを含まない。以後の同定アッセイでは細胞の曝露および刺激の履歴を最小限にすることができる。
【0051】
デジタル画像の分割および分析によりコンピュータで検出された細胞種AおよびBの時間依存的反応は、次に、図4パネルBのように表示されてもよい。この図では、細胞の略図が、透過光チャネル(y軸が、細胞の形状またはテクスチャを表す形態測定値を表す)および単色の蛍光チャネル(y軸が、細胞蛍光強度の平均値を表す)でコンピュータにより検出され定量化された反応に置換されている。細胞種Aの反応は実線、細胞種Bの反応は点線で示されている。図4パネルBは、本発明の重要な1つの概念、すなわち、コンピュータが反応情報の各チャネル間の相関付けを行う能力を有するという事実を示している。このような一例は図4パネルBの時点4付近にみられる。すなわちこの付近では、例えば細胞膜のテクスチャの変化が、細胞からの蛍光染料の損失と相関付けされうる形態測定的反応を示している可能性がある。この現象が確認された後のアッセイでは、細胞反応の検出に蛍光染料の存在を必要としなくなる。細胞反応は、細胞の形態測定的反応のプロフィールで同定可能となる。
【0052】
このように、本発明は、細胞種間の差異を知識ベースで発見および最適化するための方法および装置を提供する。特に本発明は前述の視覚的サーボ制御光学顕微鏡および分析方法を提供する。本発明は、数百の個々の生細胞を経時的に詳しくモニターする手段;多チャネルにおける動的生理学的反応の定量化;リアルタイムのデジタル画像分割および分析;インテリジェントなかつ繰り返しの、コンピュータ印加による細胞ストレスおよび細胞刺激;ならびに、長期的な研究および観察において同じ細胞視野に戻ることができる能力を提供する。本発明はさらに、特定の細胞部分母集団用に培養条件を最適化する手段を提供する。
【0053】
本発明の開発以前は、顕微鏡下で多数の個々の生細胞のデジタル画像を得ることは技術的に困難であった。また、多数の個々の生細胞について、細胞を損傷することなく長期間にわたって細胞内の複数の生理学的反応を同時にモニターすることも困難であった。第一の制限は、主として、いかなる倍率においても視野が限られていることに由来するものであった。使用されるデジタルカメラの内部の固体デジタル撮像装置(すなわち、電荷結合素子;CCD)のサイズおよび分解能が限られていることも、視野をさらに制限していた。本発明では、x,y,z顕微鏡ステージのソフトウェア制御によって、複数の視野(すなわち、多数の細胞)を迅速に、自動的に、かつ繰り返しモニターすることを容易にし、これにより上述の制限を克服する。また本発明により、中央コンピュータによる複数の顕微鏡の同時遠隔制御が容易になる。事実、局所の顕微鏡周辺装置(例:走査ステージ、フィルタホイール、灌流ポンプ、ロボットアーム、シャッター、カメラ、等)を制御するために現在使用されているコンピュータ(すなわちクライアント)に関連する、メモリ、ソフトウェア、および処理資源の制限が本発明により克服される。本発明により、インターネットを使用した遠隔制御と、遠隔値のユーザーから地理的に離れた場所に設置されたより強力な中央コンピュータ(サーバー)とでVSOM観察を実施することが可能になる。サーバーは、より処理集約的なタスクを実行または分配し、かつ、現在および過去の細胞反応を記録した非常に大規模のデータベースの中央ロケーションとして機能する。このように、本発明のVSOMは、強力な中央サーバーへのネットワークアクセスの利点、および、単一細胞の反応に関する過去の観察結果と複数情報チャネル間の相関に関する過去の観察結果とが記録された大規模中央データベースの利点を活用するものである。特に好ましい態様においては、VSOMシステムは、細胞を繰り返し検出し、全チャネルについて観察されたすべての細胞反応を記録および分析し、現在の細胞反応を比較し、現在の各情報チャネルについて相関付けを行い、かつ、細胞反応に関する過去の観察結果および各情報チャネル間の相関に関する過去の観察結果が記録されたデータベースに対して問い合わせを行う。単一の実験過程において、次にシステムは、実施中の実験の目的を達成するため、実験パラメータをどのように調整するかに関して知識ベースで一連の決定を行う。
【0054】
したがって、本発明により、単一の比較的短い実験過程の間に複数の完全な実験サイクルを実施することが可能となる。このことは、異なる細胞種間の差異を検索、発見、および最適化するプロセスを大幅に加速させる。必要な細胞数は比較的少ない。また、個々の細胞の反応がモニターされるため、分析用の標本は異なる種類の細胞を含んでいてもよい。「細胞種」とは、ある群に含まれる各細胞が他群の細胞から識別されうる類似の特徴を有するような複数の群に一群の細胞を分けることができる任意の観察方法により達成される分類である。この分類は、個々の単一細胞レベルにおける比較的迅速な生理学的反応を繰り返し観察した結果(例:細胞内構成要素、形態学的変化、細胞分裂、細胞死、剥離などの観察)に基づいて行われるのが一般的である。しかし、この用語は、従来の組織学的基準(例:上皮細胞、腫瘍細胞、筋細胞、脂肪細胞、神経細胞など)に基づいて分類した種々の細胞種も含む。
【0055】
本発明の開発以前は、多数の細胞を対象とした場合に、実験過程中に実験パラメータをどのように変更するかに関する自動的かつ知識ベースの決定を迅速に行うことができなかった。本発明は、実験過程中に「試験/記憶/分析/学習/再設計/再試験」サイクルを多数回実行する能力を提供するものであり、この能力により、以前は実行不可能であった多くの実験および応用が可能となる。細胞が生存状態を維持し、かつ、実験が進行状態およびオンライン状態を維持する場合、刺激に対する過去の反応と未来の反応との相関は細胞単位で維持される。比較的少量の細胞試料を使用して、単一の実験中に多様かつ繰り返しのコンピュータ生成刺激を印加および反復することができる。このことは、細胞種間の差異を検索および最適化する際に大きな利点となる。「刺激」という用語は、単一の刺激、複数の刺激、または複数の刺激の組合せを単回、繰り返し、または連続的に与えることを意味する。生理学的な反応を引き起こす刺激には、機械的、物理的、化学的、および生物学的な実体が含まれる。したがって、本発明はいかなる刺激または刺激の種類にも限定されない。
【0056】
生細胞は移動することができる、または形態を変化させることができる。したがって、ある視野に戻る際、ソフトウェアは、焦点を調節し(z軸制御)、かつ視野を再取得および再登録するため横方向および縦方向にわずかな調整を行う(x,y軸制御)必要がある。さらに、細胞の位置および形状の変化を追跡するため、個々の細胞の外形を規定する元の輪郭を修正する必要がある。したがって、1つの態様では、本発明のVSOMは画像内容の分析結果に基づいて機器の制御に関する決定を行うための手段を提供する。事実、本発明は以下の手段を提供する:生細胞に刺激を繰り返しおよび/または連続的に印加するコンピュータ自動処理の手段;鏡検およびデジタル撮像を用いて、刺激に対する細胞または細胞以下レベルの1つまたは複数の生理学的反応を単一細胞レベルで繰り返しおよび/または連続的に検出およびモニターする手段;信頼性の高い細胞種同定に適した、および/または細胞種間の差異を最適化するための刺激の修正に適した基準を確立するために十分な数の個々の細胞の反応を迅速に観察する手段;細胞が観察および/または刺激に利用できる間に知識ベースの刺激制御を決定できるよう、現在の細胞反応と過去に保存された細胞反応(例:データベース情報)とを迅速に分析する手段;および、時間依存的に生じる事象間の相関を多チャネルにわたってモニターする手段。
【0057】
本発明はさらに、蛍光に加えて透過光を利用して生細胞の輪郭を規定するための手段を提供する。これにより、蛍光成分を含まない細胞の追跡が容易になる。さらに、これにより、細胞毒性を示し得る蛍光標識化合物の使用量を少なくでき、かつ、蛍光発光を生じさせるために必要な強力な蛍光励起照射を回避することができる。したがって、より長時間にわたる細胞の観察が可能となる。さらに、特異的な挙動を示す細胞を実験の最後に個別に回収して、プール(貯蔵)、細胞株の樹立、クローニング、特定の分化状態への誘導、分析などに供することができる。
【0058】
本発明の機器では、撮像を透過光撮像と種々の波長の蛍光撮像とで迅速に循環させることによって、異なる生理学的反応を異なるチャネルで実質的に同時に観察することができるため、本発明により、多数の細胞をモニターすることに加えて、単一の実験中に多数の生理学的反応を観察することが可能となる。
【0059】
マルチウェル蛍光プレートリーダーを使用すると、生細胞の全母集団が発する進行中の蛍光シグナルを検出することができるが、単一の細胞の反応を観測することはできない。しかし、本発明のVSOMの1つの態様においては、マルチウェルプレートリーダーに適した蛍光アッセイの発見および最適化が可能である。また、一般的な技術では、個々の生細胞が発する多チャネル蛍光シグナルをフローサイトメトリーを使用して瞬時に検出することができる。細胞は蛍光シグナルに応じてソーティングすることができ、かつ、回収することもできる。しかし、細胞は検出器を高速で通過し、得られる測定結果は単一のものである(もしくは多チャネルの可能性もある)。個々の細胞が一定の長さの時間にわたって追跡されることはなく、過去の反応と現在の反応とを相関させた同一細胞の繰り返し観察も不可能である。本発明はこれらの制限を克服するものであり、フローサイトメトリーおよび活性細胞ソーティングに適した蛍光アッセイの開発および最適化を容易にする。
【0060】
本発明は、任意の種類の細胞(例:動物細胞、植物細胞、微生物細胞など)に有用な細胞種特異的蛍光アッセイに用途を有する。したがって本発明は、いかなる種類の細胞にも、またはいかなる特定の蛍光もしくは他のアッセイシステムにも限定されるものではない。好ましい態様ではヒトの細胞を対象としているが、他の態様では他の哺乳類ならびに植物および微生物から取得された細胞も対象となる。例えば本発明は、組織から取得された正常細胞、前悪性細胞、悪性細胞、および/または多剤耐性癌細胞を検出および識別する手段を提供する。さらに本発明は、稀な細胞種(例:幹細胞または母体血液中の胎児細胞)を選択的に標識するプロトコルを設計するための手段を提供する。いくつかの態様においては、これらのプロトコルは放射性およびその他の標識システムとともに使用するよう修正される。本発明はまた、個々の患者および/または患者の個々の腫瘍に合わせた化学療法レジメン(薬剤の組合せも含めて)を確立するためのアッセイの設計および応用を容易にする。さらに本発明は、医薬品、農業、バイオテクノロジーなどにおける種々の使用について、候補となる多数の薬剤、殺虫剤、除草剤、およびその他の化合物を検索するうえで有用なアッセイを提供する。さらに本発明は、細胞増殖、細胞毒性、および/または分化における使用について、多数の候補薬剤を検索するうえで有用なアッセイを提供する。
【0061】
本発明はさらに、関心対象の細胞種を増殖上有利にすることによって、または、培養中に存在する他の細胞種に対して細胞毒性として作用する環境条件もしくはプロトコルを設計することによって、特定の細胞種の増殖をもたらす、インビトロの組織培養条件を設計する手段を提供する。したがって本発明は、インビトロでの増殖がしばしば困難である細胞を培養するための手段を提供する。さらに本発明は、細胞を特定の分化終点へと誘導するのに適した細胞培養条件をつくるための手段を提供する。例えば、本発明を用いて、幹細胞または胚性細胞を所望の最終終点へと誘導するために必要な条件を開発することができる。
【0062】
本発明はまた、種々の迅速インビトロ検査の開発および実施に用途を有する。例えば、ある患者に対して候補となる組織または骨髄ドナーが複数存在する場合は、種々のドナーの細胞を患者の免疫細胞と混合し、免疫拒絶反応を単一細胞レベルで観察する。したがって、その特定の患者に対する最適なドナーの同定が容易になる。さらに、これらの検査は、移植拒絶を抑制するよう設計された薬剤(または薬剤候補)の存在下で実施することができ、患者に対する最適なドナーの選択とあわせて、最適な抗拒絶薬の投与レジメン(すなわち、単剤使用または多剤併用)の選択が容易になる。
【図面の簡単な説明】
【0063】
【図1】本発明のマイクロプロセッサ/コンピュータ、ロボット、および光学システム、ならびにシステムのその他の構成要素間の関係を示す図である。
【図2】本発明の代替的態様を示す別の図である。
【図3】Blob ManagerおよびInstrument Managerの主要なオブジェクトの関係を示す図である。追加の機器はそれぞれControlSourceおよびBlobSource用のプラグインを必要とする。ControlSourceおよびBlobSourceの詳細はIDLレベルで隠されている。
【図4A】VSOM実験の1つの態様を示す略図である。
【図4B】VSOM実験の1つの態様を示す略図である。
【図5】多視野(MF)VSOM実験の1つの態様を示す略図である。
【図6】2つのデータモデルを提供する。パネルAはバイオインフォマティクスシステム用の完全データモデルであり、パネルBはインビボ処置用の詳細な内訳(breakdown)である。
【図7】分割の過程を示す。パネルAは、組織および細胞培養物から個々の核を抽出するためのプロトコルを提供する。パネルBは、隣接する2つの核を用いた重心の変換の様子を示す。
【図8】元の細胞を示す写真である。
【図9】DAPIにおける分割の結果を示す。
【図10】本発明の知識ベースのVSOMの1つの態様における種々の構成要素の相互作用を示す図である。この図において、イタリック体の項目は全体のシステムアーキテクチャ(architecture)で定義されるサービスを指す。
【図11】本明細書に記載されたVSOM実験(実施例5を参照)のいくつかで使用される、シリンジ、シリンジ内の溶液中の組成物、流速、および灌流間隔に関する詳細情報の図である。両方の実行(run)においてポンプスケジュールを用いた。2回の実行を(同じ日に続けて)行った後、コンピュータ画面に表示されたプロット図を保存した。図の下部の黒いウィンドウは、実行1および実行2のプロット図である。各場合における赤い線は全視野中のすべての細胞反応の平均を表す。MCF-7WTC(DS、実行1)およびMCF-7(MDR、実行2)について記録されたこれら2つのプロット図中で示されているように、DS細胞(上方のプロット)のカルセイン蓄積量(240±82、N=336)はMDR細胞の蓄積量(103±80、N=161)より多かった。このことは、多数の細胞での平均を表すマルチウェルプレート実験で同じDS細胞およびMDR細胞について観察されるカルセイン蓄積量の相対的差異と一致する。
【図12】実施例4の実行1における各DS細胞の個々の細胞反応を示したグラフである。全細胞の反応の平均±標準偏差を黒色で重ねて示す。個々の反応は本グラフ中の個々のラインで示す。VSOM実験中、各細胞の細胞蛍光の平均値をモニターし、母集団平均からの偏差を検出した。例えば、矢印は、生存率および原形質膜完全性を失い始めた複数の細胞を示している。このような細胞はカルセインを保持することができず、蛍光信号が減少する。
【図13】実行2(実施例4)で選択した4つの細胞について個々の細胞反応の測定結果を示す。これは、フローサイトメトリーおよびマルチウェルプレートアッセイでは得られない種類の詳細な生理学的情報の典型であり、本発明のVSOM技術が望ましい能力を有していることを示す。示されているように、カルセインの蓄積および保持に関する詳細な比率情報は、VSOM実験全体にわたって入手可能である。
【図14】本発明の1つの態様の図である。パネルAはDeepView Bioinformaticsシステムの機能アーキテクチャの図である。パネルBはポンプログ(pumplog)の例を示し、パネルCはXMLレシピファイルの例を提供し、パネルDはICSイメージヘッダーを提供する。
【図15】インビボ実験およびインビトロ実験のフローチャートである。
【図16】細胞の各区画について計算した構造および機能の特徴(feature)ベースの階層保存を示す略図である。各実験は、微速度ビデオ撮影および、必要とされる灌流ポンプの操作とで構成される(図には示していない)。画像は最下層レベルに保存される。次のレベルには、細胞内の解剖学的組織の構造および機能が属性グラフとして保存される。第三のレベルでは、特定の位置に対応する反応曲線および、化合物の予想軌跡とが構成される。第四の層は、実験間の相互相関試験とともに推移確率を構築するための機構を提供する。
【図17】培養皿中の細胞局在性の基準となるフレームを確立するための、エッチングを施した培養皿の使用を示した、拡大(close-up)略図である。
【発明を実施するための形態】
【0064】
発明の詳細な説明
本発明は、細胞種間の差異を知識ベースで発見および最適化するための方法および装置を提供する。特に本発明は視覚的サーボ制御光学顕微鏡(VSOM)および分析方法を提供する。本発明は、数百の個々の生細胞を経時的に詳しくモニターする手段;多チャネルにおける動的生理学的反応の定量化;リアルタイムのデジタル画像分割および分析;インテリジェントなかつ繰り返しの、コンピュータ印加による細胞ストレスおよび細胞刺激;ならびに、長期的な研究および観察において同じ細胞視野に戻ることができる能力を提供する。
【0065】
図1および図2は、本発明の好ましい態様の主要な3つの構成要素を示した略図である。これらは(i)細胞チャンバ内の生細胞をデジタル撮像するための光学プラットフォーム、(ii)多くの場合光学プラットフォームにまたは光学プラットフォーム付近に物理的に取り付けられ、「ロボット構成要素」と呼ばれる、種々のコンピュータ制御周辺装置、および(iii)ロボット周辺装置の局所命令用に使用される局所ホストコンピュータ(「クライアント」)からなる。別の態様において、本発明は、VSOM機器の遠隔制御用のソフトウェアを有しかつインターネット上で処理を行う遠隔コンピュータ(すなわち「サーバー」)をさらに提供する。
【0066】
A.光学プラットフォーム、ロボット構成要素、および制御電子機器
本発明の1つの態様において、VSOM光学プラットフォームは、顕微鏡ステージの中央に取り付けられた標本に対して透過光照明と表面蛍光照明との両方を実施するよう構成された倒立光学顕微鏡である。画像生成用および拡大用に、顕微鏡ステージの下に複数の対物レンズが取り付けられる。1つの態様においては4つのロボット構成要素(すなわち、コンピュータ制御された顕微鏡周辺装置)も顕微鏡ステージ付近に配置される。特に好ましい態様においては、内部カメラシャッターを有するデジタルカメラが顕微鏡上の上部カメラポートの1つに取り付けられる。顕微鏡ステージはコンピュータ化されたXY走査ステージであり、かつ、上部シャッターが透過光照明を制御し内部の後部シャッターが表面蛍光照明を制御する2つのコンピュータ制御のシャッターの位置が含まれる。内部シャッターに加えて、定義されたスペクトル成分の光で標本を照明および蛍光励起させることができる、コンピュータ制御の6位置回転光学フィルタを有する。
【0067】
別の態様では、第二のカメラが使用される(例えばカメラポート基部に取り付けられる)。ただし、VSOMには2つのカメラは必要ない。xy走査ステージの調整に加えて、顕微鏡の対物レンズのz軸位置の粗調整に使用されるステップモーターのハウジングと、コンピュータ制御されたXYZ微小毛管ポジショナまたは「ロボットアーム」とが存在する。多くの態様において、顕微鏡の対物レンズは顕微鏡の「ステージプレート」(または標本ホルダー)の下方に直接配置される。実験で使用するチャンバまたは容器に応じて、種々の取り外し可能なステージプレートをxy走査ステージに挿入することができる。多数の標本ホルダーまたは「ステージプレート」が本発明とともに使用できる。いくつかの態様においては非環境制御型の標本容器が使用される。チャンバ状にしたカバーガラス、組織培養フラスコ、細胞培養皿、およびマルチウェルプレートのためのステージプレートも本発明とともに使用できる。本発明のいくつかの態様では、単純に細胞インキュベータから種々の無菌標本容器を取り出し、適切なステージプレートを用いて顕微鏡に載せ、かつ、透過光のみを使用してVSOMシステムで容器内の細胞数を計数することもできる。この状況下で、個々の細胞を検出しかつデジタル画像内で分割するという細胞ごとの形態学的測定も可能であるため、形状、面積、テクスチャ、および核-細胞質比など細胞の形態学的な特徴をモニターすることもできる。
【0068】
いくつかの場合においては、微小環境制御した細胞チャンバが物理的にステージに取り付けられるかまたはステージプレートを介して接続される。事実、任意の適切な細胞チャンバ(すなわち、分析および/または観察の対象とする細胞を入れるためのレセプタクル(receptacle))である。様々な種類の市販の環境制御型細胞チャンバが利用可能であり、かつ、xy走査ステージとともに使用するのに適している。いくつかの態様では、蠕動ポンプまたは他のポンプにより余分の液体が標本容器から除去される。他の態様では、細胞チャンバ(または標本容器)の温度がモニターされる。これらの態様において、温度プローブは典型的に、チャンバ内の液体の温度またはチャンバ自体の温度を制御する制御装置に接続される。好ましい態様において、この非コンピュータ制御の独立した温度制御ユニットはコンピュータ制御可能なユニットに置換される。
【0069】
細胞チャンバの1つの追加的特徴として、定義された酸素成分のガスの流れを、細胞チャンバ内に置かれた標本容器の上方に層状に重ねる能力がある。この方式により、標本容器および溶液内で既知の酸素張力条件をつくること、または、標本容器上方を流れるガスに含まれるCO2量を変化させることによって重炭酸塩緩衝剤を含む溶液のpHを制御することができる。
【0070】
いくつかの態様においては、4つの独立制御可能なシリンジを有する、コンピュータ制御された2つのポンプが光学プラットフォームに隣接して配置される。2つの各ポンプユニットには、デイジーチェーン接続された電子制御装置が組み込まれる。この様式で最大約99のポンプユニットが接続可能であり、かつ、各ポンプの2つのシリンジはそれぞれ独立に制御できる。
【0071】
図1および図2に示すように、周辺装置の多くは、ホストコンピュータとロボット周辺装置自体との間のインターフェースとして機能する制御ユニットを有する。ホストコンピュータで実行されるカスタムソフトウェアに顕微鏡周辺装置の制御を組み込むことができるよう、基本的なソフトウェアコマンドはこれら周辺装置の製造業者によって提供される。ホストコンピュータはリモートコンピュータで実行されるソフトウェアで制御することができる。例えば、Z軸焦点粗調整モーター、xy走査ステージ、2つの照明シャッター、デジタルカメラ(およびその内部シャッター)、ならびに光学フィルタホイールは、いずれもこのソフトウェアを用いて制御することができる。いくつかの態様では、顕微鏡の対物タレットに螺入する圧電ポジショナによって顕微鏡の焦点の微調整制御が行われる。
【0072】
1.マイクロアレイフォーマット
本発明は、特定の物質、処理、または処理セットに対する細胞/個々の細胞の生理学的反応性をより完全に評価するため、高スループットのスクリーンを介して、種々の細胞種に対して連続的な処理を行うことによって多数の化合物(例えば、薬剤または所望の生物学的活性を有する可能性がある化合物)を迅速にスクリーニングする能力を提供する。既存の方法を用いた薬剤-細胞相互作用の操作および分析では、一定の時間内に分析できるバイオアッセイの数が少なく、化合物送達に必要な方法が煩雑であり、かつ、しばしば大量の化合物が試験に必要とされるため、高スループットかつ生物学的に高含量のスクリーニングを行うことができない。したがって、本発明の好ましい態様では、高スループットのスクリーニングをマイクロアレイフォーマットで可能にする。
【0073】
本発明の好ましい態様では、個々の細胞が発する光学画像信号を細胞種に応じて検出および処理する。したがって、複数の細胞種を支持体またはプレートに置き、個々の細胞の光学画像に応じてその細胞種を同定し、かつ、印加された環境刺激に対する個々の細胞または細胞種の反応性を追跡することによって、不均一なマイクロアレイをつくることができる。前述の均一または不均一なマイクロアレイ上の単一の細胞からの光の検出と分析とを可能にするため、このような細胞種を適切な低い細胞密度で固定してもよい。本発明の他の態様では、同じ処理を行った複数の細胞からの集合的な光信号を検出および測定する。
【0074】
好ましい態様において、細胞は支持体に固定状態で付着される。マイクロパターンアレイ内に細胞を付着させるのに適した方法は周知であり、例えば光化学レジストフォトリソグラフィ(photochemicalresist-photolithograpy)(MrksichおよびWhitesides、Ann. Rev. Biophys. Biomol. Struct.25:55-78、1996)などがある。このフォトレジスト法では、ガラス板をフォトレジストで均一にコーティングし、フォトマスクをフォトレジストコーティング上に置いて所望の「アレイ」またはパターンを規定する。露光により、マスクされていない領域のフォトレジストが除去される。露出したガラスの領域とフォトレジストで覆われた領域との両方に結合する有機シランなどの疎水性物質で、フォトリソグラフで規定した表面全体を均一にコーティングする。次にフォトレジストをガラス表面から剥離し、露出したガラスのスポットのアレイを露出させる。次に、アミノ基など親水性または化学反応性を有する基を末端に有する有機シランでガラス板を洗浄する。露出したガラスのスポットに疎水性の有機シランが結合し、その結果、疎水性表面上に、(元のフォトレジストの領域に配置された)親水性または反応性のスポットのアレイを有するガラス板が得られる。親水基のスポットのアレイにより、ニューロン由来のものも含めた特定の細胞を非特異的かつ非共有結合的に結合させるための基質が得られる(Kleinfeldら、J.Neurosci. 8:4098-4120、1988)。同様に、シリコンウェーハ表面に対する反応性イオンエッチングも、2つの異なる種類のテクスチャでパターン形成した表面を得るために用いられている(Craigheadら、Appl.Phys. Lett. 37:653、1980; Craigheadら、J. Vac. Sci. Technol. 20:316、1982; および、Suhら、Proc.SPIE 382:199、1983)。
【0075】
細胞の均一なマイクロアレイを作製する別の方法は、特異的であるが非共有結合的な相互作用に基づくものであり、タンパク質吸着性アルカンチオールでコーティングされた金表面を得るためにフォトレジストスタンプ法が用いられている(Singhviら、Science264:696-698、1994)。次に、末端にポリエチレンを有する、タンパク質吸着に抵抗性のアルカンチオールで金の裸面をコーティングする。表面全体を、細胞外マトリックス中に発見される細胞結合タンパク質であるラミニンに曝露すると、生きた肝細胞がラミニンでコーティングされた島に均一に付着しかつこの島の上で増殖できるようになる(Singhviら、1994)。特定タンパク質のパターンによる金表面のコーティングには、強力なしかし非共有結合的な金属キレート化を利用した加工が用いられている(Sigalら、Anal.Chem. 68:490-497、1996)。この場合は、ニトリロ酢酸を末端に有するアルカンチオールで金表面にパターンを形成する。タンパク質吸着を低減させるため、金の裸領域がトリ(エチレングリコール)でコーティングされる。Ni2+を添加すると、ヒスチジン標識した5つのタンパク質の特異的吸着が動力学的に安定するのが観察される。
【0076】
より特異的な均一の細胞結合は、パターン形成した基質上の反応部位にタンパク質などの特定分子を化学架橋することによって得られる(AplinおよびHughes、Analyt.Biochem. 113:144-148、1981)。基質パターン形成の別の加工法では、読み取り可能スポットのアレイが作製される。ガラスに化学吸着してガラスをコーティングする有機シランでガラス板を洗浄する。アレイのパターンを規定する光学マスクを通して有機シランコーティングに遠紫外光を照射する。照射によりSi--C結合が開裂して反応性のSiラジカルが生じる。Siラジカルは水との反応により有極性のシラノール基を生じる。参照として本明細書に組み入れられる米国特許第5,324,591号に記載のように、有極性のシラノール基はアレイ状のスポットを構成し、さらに修飾を受けて他の反応性分子をスポットに結合させる。例えば、自由アミノ成分などの生物学的機能基を含むシランをシラノール基と反応させることが可能である。次に、自由アミノ基を、タンパク質、核酸、炭水化物、および脂質などの生物分子との共有結合性付着部位として使用することができる。細胞表面と相互作用することが知られているレクチンを、反応性のアミノ基を介して、パターン形成せずにガラス基質に共有結合的に付着させる方法が示されている(AplinおよびHughes、1981)。支持体上に細胞の均一なアレイを作成する光学的方法は、フォトレジスト法と比較して必要な段階が少なくかつ高速であるが、高額な光源による強力な紫外光を必要とする。
【0077】
別の態様においては、細胞アレイと試験刺激の印加とは、参照として本明細書に完全に組み込まれる米国特許第6,103,479号に記載の方法と構成内容とに基づく。米国特許第6,103,479号は、関心対象の化合物(例えば、薬物およびその他の生物学的活性化合物)の送達が可能な小型化した細胞アレイを提供する好ましい手段を開示している。米国特許第6,103,479号は、生物学的活性化合物に対する細胞の生理学的反応を高スループットかつ高含量でスクリーニングする手段および方法を開示している。細胞の不均一マイクロパターンアレイとは、細胞が支持体表面上の単一の均一なコーティング内に分布されるのではなく、支持体上の各「ウェル」またはウェルの群が細胞結合選択性の面で固有であってもよいような不均一な様式で分布される、ベース上の細胞のアレイを指す。アレイ化する細胞種に特異的に結合できる分子がマイクロパターン化学アレイ内に存在する限り、細胞の不均一マイクロパターンアレイ上には任意の細胞種をアレイ化できる。細胞の不均一マイクロパターンアレイ用として好ましい細胞種としては、リンパ球、癌細胞、ニューロン、真菌、細菌、ならびにその他の原核生物および真核生物が含まれる。
【0078】
米国特許第6,103,479号の細胞の不均一マイクロパターンアレイを作製する方法は、マイクロパターン化学アレイを準備する段階、マイクロパターン化学アレイを不均一に化学修飾する段階、および、ベース上で不均一修飾マイクロ化学パターンアレイに細胞を結合させる段階を含む。ベースは、従来の光学顕微鏡用カバーガラスなどのように、ガラス、プラスチック、またはシリコンウェーハであってよいが、ベースの提供に適した他の任意の材料で作製してもよい。本明細書に記載のように、「ウェル」という用語はベース上の特定のスポットを説明するために用いられ、特定の深さである必要はない。このようなアレイを作製する方法は米国特許第6,103,479号に記載されている。特許の明細書に記載のとおり、好ましい態様において、修飾マイクロパターン化学アレイは組合せ様式で作製される。その結果得られるウェルは不均一である(すなわち、各ウェルまたはウェルの群が細胞結合選択性の面で固有であってもよい)。組合せ(combinatorial)とは、ウェルが変動的に処理されることを意味する。
【0079】
2.マイクロ流体工学フォーマット
固体の基体に付着した細胞のマイクロアレイに対する効率的な溶液送達は、マイクロ流体工学のシステムにより容易になる。少量液体試料の精密な取り扱いの方法および装置は、インク送達(米国特許第5,233,369号;米国特許第5,486,855号; 米国特許第5,502,467号、これらはすべて参照として本明細書に組み入れられる)、生物試料の吸引(米国特許第4,982,739号、参照として本明細書に組み入れられる)、試薬の保管および送達(米国特許第5,031,797号、参照として本明細書に組み入れられる)、ならびに、臨床診断および化学合成用の超小型電子工学的かつ流体工学的な区分装置アレイ(米国特許第5,585,069号、参照として本明細書に組み入れられる)に関して開示されている。さらに、少量液体試料を表面に沿って誘導するために使用できる、固体基体中に微小チャネルを形成するための方法および装置が開示されている(米国特許第5,571,410号;米国特許第5,500,071号; 米国特許第4,344,816号、これらはすべて参照として本明細書に組み入れられる)。閉鎖された光学チャンバ内で固体基体上に不均一なアレイとしてマイクロパターン形成された生細胞に溶液を送達するための方法は米国特許第6,103,479号に開示されており、特許も参照として本明細書に組み入れられる。
【0080】
細胞の不均一マイクロパターンアレイの好ましい態様は上記に開示したとおりである。液体送達システムの好ましい態様では、チャンバが、細胞の不均一マイクロパターンアレイを含む基体と接続する。チャンバの材料は好ましくはガラス、プラスチック、またはシリコンであるが、基体を提供できる他の任意の適切な材料であってよい。チャンバの1つの態様は、細胞の不均一マイクロパターンアレイ内のウェルと一致するエッチングされた領域のアレイを有する。さらに、エッチングされた領域に液体を供給するため、マイクロ流体工学チャネルがエッチングされる。エッチングされた領域から余分の液体を除去するための一連の「廃棄物」チャネルもウェルに接続されていてよい。チャンバと細胞のマイクロパターンアレイとはともにカセットを構成する。
【0081】
「液体」とは、特定の薬剤、タンパク質、リガンド、または細胞の表面発現成分と結合するもしくは細胞に取り込まれるその他の物質の溶液を含むが、これらに限定されることはない。細胞の不均一マイクロパターンアレイと反応させるための溶液は、薬剤を封入したリポソームも含んでいてよい。1つの態様では、露光により薬剤を放出する光反応生合成ポリマーなどの光化学材料でこのようなリポソームを形成する(WillnerおよびRubin、Chem.Int. Ed. Engl. 35:367-385、1996に概説)。薬剤はすべてのチャネル14で同時に放出させてもよく、または、個々のチャネルもしくはチャネルの列を照明して逐次的に放出させてもよい。このような薬剤の制御放出を動力学研究および生細胞研究に用いてもよい。液体送達の制御は、毛管現象の当業者に既知のマイクロバルブおよびマイクロポンプの組合せにより可能である(米国特許第5,567,294号;米国特許第5,527,673号; および米国特許第5,585,069号、これらはすべて参照として本明細書に組み入れられる)。
【0082】
好ましい態様では、薬剤または他の物質は以下のように送達される。アレイの細胞との相互作用の試験対象とする物質の溶液は、96ウェルのマイクロタイタープレートから微小毛管チューブのアレイに装填できる。微小毛管チューブのアレイはチャンバのマイクロ流体工学チャネルに1対1対応し、これにより、微小毛管チューブからチャネルへと溶液を流出させるまたはポンプ排出させることが可能となる。液体が充填されたエッチング領域にウェルが浸漬するように、細胞の不均一マイクロパターンアレイを反転させる。液体と細胞の不均一マイクロパターンアレイとの相互作用が生じたら、細胞の不均一マイクロパターンアレイが発する光を、直接測定すること、ならびに、細胞のアレイの配置、除去、および処理をロボットにより自動的に誘導するための光入力に変換することができる。
【0083】
3.蛍光フォーマット
本明細書に記載のように、特に好ましい態様は細胞の蛍光撮像を含む。顕微鏡で蛍光細胞を撮像し、かつこれらの細胞で生じている空間分布および経時変化に関する情報を抽出するための種々の方法が開発されている。これらの方法およびその応用の多くは最近開示されたものである(Taylorら、Am.Scientist 80:322-335、1992; 米国特許第6,103,479号も参照)。これらの方法は、細胞内の蛍光レポーター分子の分布、量、および生化学環境を高い空間分解能および時間分解能で画像測定することを目的として少数の標本を作製するために設計および最適化されたものである。
【0084】
染料と蛍光試薬とによる細胞の処理および細胞の撮像(Wangら、「細胞生物学における方法(In Methods in Cell Biology)」、NewYork、Alan R. Liss、29:1-12、1989)、ならびに、レポーター分子として修飾緑色蛍光タンパク質(GFP)などの蛍光タンパク質を生成させるための細胞の遺伝子操作は有用な検出方法である。クラゲの一種であるエクオレア・ビクトリア(AequoreaVictoria)の緑色蛍光タンパク質(GFP)は395 nmに最大励起波長、510 nmに最大発光波長を有し、かつ、外因性因子を必要としない。GFPを使用した遺伝子発現およびタンパク質位置測定はチャルフィー(Chalfie)ら、Science263:802-805、1994に記載されている。野生型GFPのいくつかの特性はモリセ(Morise)ら(Biochemistry 13:2656-2662、1974)およびワード(Ward)ら(Photochem.Photobiol. 31:611-615、1980)によって開示されている。リッツト(Rizzuto)ら(Nature 358:325-327、1992)による論文では、細胞小器官を可視化するためのツールとしての野生型GFPの使用が検討されている。カエサー(Kaether)およびゲルデス(Gerdes)(FEBSLetters 369:267-271、1995)は、分泌系路上のタンパク質輸送の野生型GFPを用いた可視化について報告している。植物細胞におけるGFPの発現についてはフー(Hu)およびチェン(Cheng)(FEBSLetters 369:331-334、1995)が、ショウジョウバエ(Drosophila)の胚におけるGFP発現についてはデービス(Davis)ら(Dev.Biology 170:726-729、1995)が報告している。参照として本明細書に組み入れられる米国特許第5,491,084号では、他の関心対象のタンパク質と融合させたレポーター分子としてのエクオレア・ビクトリア(AequoreaVictoria)由来GFPの発現が開示されている。参照として本明細書に組み入れられるPCT/DK96/00052は、細胞内プロセスに影響を与える細胞学的活性物質を、プロテインキナーゼ活性化部位を有するGFP構造を利用して検出する方法に関する。生物学的システムにおけるGFPタンパク質に関する文献は多数ある。例えば、参照として本明細書に組み入れられるPCT/US95/10165は、GFP様タンパク質の発現を利用して関心対象の細胞を分離するシステムを開示している。参照として本明細書に組み入れられるPCT/GB96/00481は、植物におけるGFPの発現を開示している。参照として本明細書に組み入れられるPCT/US95/01425は、突然変異生成を検出するための、形質転換生物における修飾GFPタンパク質の発現を開示している。GFP突然変異体は複数の生物学的システムで作製および使用されている(Hasselhoffら、Proc.Natl. Acad. Sci. 94:2122-2127、1997; Brejcら、Proc. Natl. Acad Sci. 94:2306-2311、1997;Chengら、Nature Biotech. 14:606-609、1996; HeimおよびTsien、Curr. Biol. 6:178-192、1996;ならびに、Ehrigら、FEBS Letters 367:163-166、1995)。いずれも参照として本明細書に組み入れられる米国特許第5,436,128号および第5,401,629号には、細胞表面受容体の活性に対して反応性を示す転写制御要素を含む受容体遺伝子構造を含みかつ細胞表面受容体を発現する組換え細胞を用いて、細胞外シグナルの細胞内変換を検出および評価するためのアッセイおよび構成を示した方法が開示されている。
【0085】
BioDx社(米国特許出願第08/810983号)により開発されたArrayScan(商標)システムは、特定の生物学的活性について多数の化合物を検索するために、発光的に標識したレポーター分子の細胞内における分布、環境、または活性を決定する光学システムである。ArrayScan(商標)システムは、発光レポーター分子を含む細胞を均一な位置のアレイに提供する段階と、各位置にある多数の細胞を蛍光顕微鏡で走査する段階とを含み、走査の段階では、光学情報がデジタルデータに変換され、かつ、細胞内の発光標識したレポーター分子の分布、環境、または活性がデジタルデータを利用して決定される。現在使用されている均一な位置のアレイは、業界標準の96ウェルまたは384ウェルのマイクロタイタープレートである。ArrayScan(商標)システムは、データを処理、表示、および保存するための装置とコンピュータ化された方法とを含み、したがって細胞に基づく高含量の検索を大規模のマイクロタイタープレートフォーマットで提供することによって薬剤の発見を増大させる。
【0086】
前述の態様を組み合わせて、均一なまたは不均一なマイクロパターンアレイで多色発光読取、マイクロ流体送達、および生細胞の自動環境制御を実施するための方法および装置を提供することも可能である。
【0087】
1つの態様では、本発明は細胞の不均一マイクロパターンアレイとアレイを作製する方法とを含む。アレイは、別の化合物の組合せで処理されてもよい同一の細胞種を含んでいてもよく、または、1つまたは複数の化合物で処理されてもよい細胞種の組合せを含んでいてもよい。「組合せ(combinatorial)」という用語は、ウェルまたはウェルの群が変動的に処理されることを意味する。本発明の別の局面は、細胞の不均一マイクロパターンアレイであって細胞が少なくとも1つの発光レポーター分子を含むアレイと細胞の不均一マイクロパターンアレイに試薬の組合せを送達させるための液体送達システムとを組み合わせて使用することによって細胞を分析する方法、ならびに、発光レポーター分子が発する発光信号を検出、記録、および分析する手段、を含む。本発明の別の局面では、細胞の不均一マイクロパターンアレイ内の発光レポーター分子が発する発光信号を検出するための発光読取機器と、発光読取機器からデータを受け取るためのデジタル検出器と、光検出器から送られたデジタルデータを受信および処理するためのコンピュータ手段とを含む細胞検索システムが開示される。
【0088】
別の態様では、細胞は細胞の化学特性または分子特性を表す蛍光インジケータで修飾され、不均一マイクロパターン化学アレイに播種され、かつ、生きた状態で分析される。このようなインジケータの例は、ギウイラノ(Giuilano)ら、Ann.Rev. Biophys. Biomol. Struct. 24:405-434、1995; ハルーツニアン(Harootunian)ら、Mol. Biol.Cell 4:993-1002、1993; ポスト(Post)ら、Mol. Biol. Cell 6:1755-1768、1995; ゴンザレス(Gonzalez)およびチエン(Tsien)、Biophys.J. 69:1272-1280、1995; スワミナサン(Swaminathan)ら、Biophys. J. 72:1900-1907、1997; ならびに、チャルフィー(Chalfie)ら、Science263:802-805、1994に記載されている。インジケータは、細胞をアレイに播種する前または播種した後に、種々の物理的方法の1つまたは組合せにより細胞に導入してよく、このような物理的方法としては、例えば、細胞膜を介した拡散(Haugland、「蛍光プローブと研究用化学物質のハンドブック(Handbookof fluorescent probes and research chemicals)」、別冊6、Molecular Probes社編、Eugene、1996に概説)、細胞膜の機械的摂動(McNeilら、J.Cell Biology 98:1556-1564、1984; ClarkeおよびMcNeil、J. Cell Science 102:533-541、1992;Clarkeら、BioTechniques 17:1118-1125、1994)、または規定された条件下において細胞内でインジケータが発現するような遺伝子操作(Chalfieら、1994)があるが、これらに限定されることはない。好ましい態様において、細胞は発光レポーター遺伝子を含むが、化学発光タンパク質をコードしている遺伝子を含めて他の種類のレポーター遺伝子も適している。生きた細胞の研究により、生活環中の発光または薬剤もしくはその他の反応性物質と接触した際の発光に基づいて、細胞の生理学的状態を分析することが可能になる。
【0089】
本発明の別の態様では、細胞の不均一マイクロパターンアレイであって細胞が少なくとも1つの発光レポーター分子を含むアレイを作製する段階と、細胞の不均一マイクロパターンアレイに試薬を送達させることを可能にするため細胞の不均一マイクロパターンアレイを液体送達システムに接触させる段階と、細胞の個々の画像を取得できるよう適切な倍率で個々の細胞の発光画像を取得することにより高スループットの検索を実施する段階とを含む、個々の細胞を分析する方法が提供される。次に、異なる生理学的特性およびスペクトル特性を有する発光試薬のセットを使用する段階と、細胞内の発光レポーター分子が発する発光信号を取得するため個々の細胞のアレイを走査する段階と、発光信号をデジタルデータに変換する段階と、デジタルデータを利用して個々の細胞内の発光レポーター分子の分布、環境、または活性を決定する段階とにより、反応したウェル内で高含量の検出が行われる。
【0090】
個々の細胞の不均一マイクロパターンアレイとチャンバとを含むカセットがVSOM光学読取機器に挿入される。光学読取機器は、カセットの取り扱いと、環境(例えば、生細胞にとって重要である温度)の制御と、溶液のウェルへの送達の制御と、1度に1つまたは複数の細胞について細胞のアレイから放出される発光の分析とを行う光学機械装置である。機器は、個々の細胞が発する光信号とアルゴリズムとに基づいて、溶液の添加を自動的に制御する。好ましい態様において、光学読取機器は、読取装置としての蛍光顕微鏡とカセットを走査するためのマイクロロボットとを使用した集積回路検査ステーションを含む。カセットは保管区画に保持され、コンピュータ制御されたロボットアームによって保管区画から回収される。ロボットアームはカセットを発光読取機器に挿入する。別のロボットアームがカセットを発光読取機器から取り出し、第二の保管区画に配置する。
【0091】
環境制御、マイクロロボット、および光学読取機器を統合したシステムはカールツァイス(Carl Zeiss)[Jena、GmbH] などの企業により製造されている。ロボットによる取り扱い、液体の送達、および高速かつ精密な走査が容易になっていることに加えて、高含量および高スループットの2つの読取モードが用意されている。高含量の読取は、ArrayScanリーダー(米国特許出願第08/810983号)による読取と本質的に同じである。高含量モードでは、細胞の不均一マイクロパターンアレイの各位置が倍率5倍〜40倍以上で撮像され、所望の統計学的分解能の測定を行うのに十分な数の視野が記録される。
【0092】
1つの態様において、光学読取機器は、コンピュータ制御のx,y,zステージを有する正立または倒立の蛍光顕微鏡である光学機械設計と、低倍率(例えば0.5倍)の対物レンズおよび1つまたは複数のより高倍率の対物レンズを保持するコンピュータ制御の回転ノーズピースと、励起フィルタホイールを有する白色光源と、発光フィルタを有するダイクロイックフィルタシステムと、検出器(例えば冷却電荷結合素子)とを含む。別の態様において、光学読取機器は、共焦点または標準の照明モードで走査レーザービームを利用してもよい。スペクトルは、カールツァイス(CarlZeiss)(Jena、GmbH、ドイツ)が製造しているようにまたはDenkら(Science 248:73、1990)が報告しているように、複数のレーザーラインかまたは個別のレーザーダイオードの群かに基づいて選択される。高スループットの検索モードの別の態様では、発光励振器のアレイ(1×8、1×12など)と発光放射検出器とを有する低分解能のシステムであって細胞の不均一マイクロパターンアレイのウェルの部分集合を走査するシステムが使用される。このシステムは、好ましい態様では光ファイバー束を有するが、発光励起光を誘導しかつ同じウェルが発する発光放射光を収集するシステムであれば任意のシステムであってよい。
【0093】
B.局所のホストコンピュータ(またはクライアント)
コンピュータ制御の周辺装置は局所コンピュータによって独立に制御してもよく、または、遠隔コンピュータが発行する命令のためのコンジットとして局所コンピュータを機能させてもよい。一般的な「機器」もしくは顕微鏡の遠隔制御、またはインターネット上のVSOMシステムは、後述のように複数の利点を有する。例えば、中央コンピュータは、より高い処理能力およびアーカイビング能力、ならびにより高度なデータベースおよびその他のソフトウェアパッケージを有していてもよく、これにより、これらの長所を、個々の光学プラットフォームの近くに配置された多数の局所コンピュータ上で多額の費用をかけて重複させる必要がなくなる。
【0094】
C.VSOM制御用の遠隔コンピュータ、ネットワークソフトウェア、データベース、インフォマティクス、および分析アルゴリズム
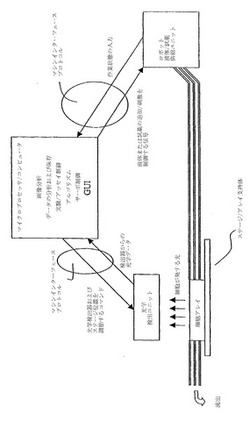
コンピュータ科学の見地から、本発明には種々の構成要素を必要とした。特に好ましい態様では以下の構成要素が含まれる:(1)顕微鏡周辺装置のコンピュータ制御、(2)単一または複数のチャネルで撮像された細胞のセグメント化、(3)特定の実験で使用されるレシピの解題、(4)印加された刺激の関数としての細胞反応の自動分析、(5)2つの細胞種間の差異をアッセイの関数として比較するオフラインの相関技術、クラスター化技術、および学習技術、ならびに、(6)2つ以上の異なる細胞種から直接の反応を導出するためのポリシー(すなわちプロトコルまたはレシピ)を動的に制御および推測するオンラインの学習技術。種々のシステム構成要素間の相互作用を図1および図2に示す。特に好ましい態様において、全システム構成要素の完全な統合には、専用に設計されたグラフィカルユーザーインターフェース(GUI)、オンライン画像分析ソフトウェア、オフライン分析用のデータベース統合、モデルシステム内での細胞反応の効果的な可視化、ならびに、オフラインおよびオンラインの学習技術(例えばアルゴリズム)が含まれる。
【0095】
さらに、別の態様において、本発明は視覚的サーボ制御光学顕微鏡観察用の画像バイオインフォマティクスシステム(すなわち「BioSig」)を提供する。本発明のこれらの態様により、VSOM実験用の特定の条件および刺激の関数として細胞反応をカタログ化する基礎が提供される。本発明は、システムアーキテクチャ、実験プロトコルを表すための機能データモデル、画像分析用の新規的アルゴリズム、および統計学的分析を提供する。アーキテクチャは、少なくとも1つのVSOM機器の遠隔共有操作を提供し、かつ、機器操作を画像の取得および解題と連結させる。好ましい態様において、情報は、オブジェクトおよびその関連を永続的に保存できるオブジェクト指向データベースに保存される。特に好ましい態様では、アルゴリズムは個々の細胞から細胞下レベルで生理学的情報を抽出し、それを細胞反応および最終的な生物学的帰結にマッピングする。
【0096】
VSOMシステムはいくつかの好ましい態様において、定期的に画像を取得し、それらの画像をセグメント化し、数百の細胞を含む視野について細胞反応を測定し、かつ、それらの反応をアーカイブシステムに記録する、ワークフローモデルを使用する。これらの反応により、個々の細胞反応の有向測定および追跡が可能になる。次に、ウェブベースのインターフェースを介してアーカイブシステムを閲覧することおよびアーカイブに問合せすることができる。生データ、セグメント化の結果、およぼ対応するメタデータ(例えば、2.5時間にわたる反応の計算結果)の閲覧の例。
【0097】
本発明によって克服された重大な課題の1つは、生物学的実験では大きな母集団による試験が必要であり、かつ、離れた特徴と解題データとを相関させる必要があるという事実に関するものである。本発明は、複数の標的に関する位置および発現の情報を位置参照および形態学的特徴とともに記録するデータベースを作成するための、統合された画像取得、解題、および階層的画像抽出用の画像バイオインフォマティクスシステムを提供する。統計ツールおよび可視化ツールが統合され、仮説検証およびデータマイニングを可能にする。これは、遠隔鏡検法(telemicroscopy)開発用のインフラストラクチャを強化および拡張することにより実現される(例えば、Parvinら、「考察:分散鏡検法およびインフォマティクス用のチャネル(DeepView: A Channel for Distributed Microscopy and Informatics)」、IEEE高性能コンピューティングとネットワーキング会議(IEEEConf. on High Performance Computing and Networking)[1999]、および、Parvinら、「分散機器用の宣言的フロー制御(DeclarativeFlow Control for Distributed Instrumentation)」、IEEEグリッド・クラスターコンピューティングの国際シンポジウム(IEEEInt. Symposium on the Grid and Cluster Computing)、2001年5月を参照)。本発明は、種々の新規的な構成要素を提供し、構成要素には以下のものが含まれるがこれらに限定されることはない:画像取得用の分散アーキテクチャ、細胞下レベルで構造および機能を特徴付けるための新規的アルゴリズム、特定の刺激に対する各細胞の反応のアーカイビング、ならびに、機器を特定の状態に駆動するための反応計算結果の使用。
【0098】
D.インフォマティクス
特に好ましい態様において、インフォマティクスシステムは、データモデル、プレゼンテーションマネージャ、およびクエリーマネージャを含む。開発、試験、および保守を容易にするためこれらのサブシステムは切り離される。データモデル構成要素の目的は、必要な解題データを取得し、かつ、それらを仮説の信号および反応の経路を表す計算された画像表現と連結させることである。モデルはオブジェクト指向であり、解題と測定された特徴データとの二方向追跡が可能である。プレゼンテーションマネージャは、基礎となるデータモデルの変化に関わらずユーザーインターフェースの配線が回避され、かつ実行時に構成されるインターフェースがより柔軟となるよう、データモデルとユーザーフェースとの間のマッピングを含む少なくとも2つの個別の特徴を提供する。さらに、テキストまたはグラフィックによる特定のクエリーの表示機能が提供される。クエリーマネージャは、高レベルのユーザークエリーを、データモデルを実行するJavaオブジェクトにマッピングする。したがって、好ましい態様において、本発明は、データベースの詳細な操作を単純化しかつエンドユーザーから隠蔽する。
【0099】
1.データモデル
図6パネルAに示す態様のデータモデルはオブジェクト指向であり、特定のプロジェクトを、画像の集合から計算された特徴にリンクする。リンクは二方向性であり、任意のエンドポイントから情報を追跡することが可能である。各プロジェクトは、試験にリンクされた各自のデータベースを有する。
【0100】
2.プレゼンテーションマネージャ
プレゼンテーションマネージャは、データベースの閲覧とクエリー機能の結果の可視化という2つの主たる特徴を有する。データベースの閲覧は、解題データ、画像、および対応する特徴を取得するあらかじめ定義されたスキーマに対して実施される。図6パネルAに示すデータモデルはXSD(XMLスキーム)で表現され、プレゼンテーションマネージャがこの表現と対応するスタイルシート(XSL)とを用いて閲覧および更新用にデータベース内にビューを構成する。この態様においては、より柔軟でかつ動的に生成されたユーザーインターフェースに有利となるようGUIの配線はバイパスされる。一般的には、このようなマッピングにより複雑な実行上の問題が生じる可能性がある。しかし本発明は、プレゼンテーションシステムを単純化することによって、1つの層の閲覧と更新とを同時に行うことを可能にしている。「層」とは、関連(association)、集合(aggregation)、および継承(inheritance)によってリンクされたオブジェクトと他のオブジェクトとの間のナビゲーションを指す。
【0101】
1つの態様において、各科学実験は、特定の時点における細胞の母集団に対応する数までの画像を含んでいてもよい。多くの場合、各時点において、そのセットの平均的な挙動を特徴付けるいくつか(2〜3)の画像を用いて画像の集合を可視化することが必要である。平均的な挙動は特定の特徴の観点で表現されることが多い。本発明により、ある時点の画像の集合の代表物に各画像が対応する、一連の画像を構成することが可能である。さらに、プレゼンテーションマネージャはクエリー機能の結果をテキストまたはグラフィックで表示することができる。グラフィックスには、化合物の特徴を独立変数の関数として表示する用量反応プロット図および散布図が含まれる。
【0102】
3.クエリーマネージャ
クエリーマネージャは、可視化および仮説検証を補助するためのあらかじめ定義されたオペレータのセットを提供する。これらのオペレータは、計算された特徴とそれに対応する解題データとの間のコントラストの描写を補助し、かつ、分散分析および主成分分析(PCA)など種々の統計学的方法を実行する。いくつかの態様では、これらのオペレータにより細胞反応を最終的なモデル再構成用に解読することが可能である。オブジェクト指向データベースでは、計算される特徴がそれぞれそのソース(例えば細胞培養物または動物)にマッピングされる必要があるため、分散分析などの測定が単純化される。このような高レベルのオペレータの1例としては、独立変数に対する、計算された特定の特徴の相関付けがある。本発明は、データベース操作へのユーザークエリーのマッピング、結果の計算、および計算結果のディスプレイマネージャへの転送を行うための視覚クエリーインターフェースを提供する。いくつかの態様において、実際の計算には、ディスプレイを目的とした分散分析(例えば、特定の測定結果を複数の独立した試料に関連付けるため)またはPCA(例えば、計算された特徴ベクトルの低次元化)が含まれる。
【0103】
4.核の抽出
細胞の副区画の自動描写は、印加された刺激に対する細胞の反応をモニターする上で重要な段階である。一部の場合では、関心対象の細胞が互いに接触または重複し、したがってセグメント化が困難なことがある。本発明の開発過程で利用した従来のアプローチでは(例えば、CongおよびParvin、Patt.Recog.、33:1383-1393 [2000]; ならびに、Parvinら、「Biosig:細胞内シグナルの機構研究のためのバイオインフォマティクスシステム(Biosig:A Bioinformatic System for Studying the Mechanism of Inter-Cell Signalling)」、IEEEInter. Sympos. Bio-Informatics Biomed. Engineer.、pages 281-288 [2000]を参照)、大域的に一貫性のある方法で核の集塊を仕切るため、ステップエッジとルーフエッジの両方を使用した。ステップエッジは核と背景との間の境界に対応し、ルーフエッジは隣接する核との境界に対応する。このシステムに固有な特徴の1つは、各仮説の超二次関数的表現と、大域一貫性のためにこの表現を用いたこととにあった。大域一貫性は、動的プログラミングで最小化した費用関数によって得た。本発明は、より単純かつより強力なアプローチを提供する。以前のアプローチにおける主たる難点は、しわ境界の検出およびグループ化によりシステムの複雑性が増し、その結果信頼性が低下したことであった。画像空間におけるそれぞれの核の投影が二次関数的であると仮定している点においては本発明もモデルベースである。しかし、本発明のいくつかの好ましい態様においては、ステップエッジとルーフエッジとをグループ化する代わりに、画像のゼロ交差に対応する表現から開始する。次に、ゼロ交差画像を幾何学的制約条件および照明制約条件でフィルタリングして、核の二値化集塊を生成する。次に、「重心変換」とよばれる過程により核集塊を複数の核に仕切る。計算プロトコルの各段階を図7パネルAに示す。重心変換は、本質的に、局所化された質量中心に輪郭上の各点を投影する。図7パネルBに示すように、輪郭上のノイズおよびその他のアーチファクトを除去するため、解の正規化が行われる。
【0104】
a.エッジ検出
エッジの局所化は局所座標系のゼロ交差を基礎としている。以下に詳細に説明するように、これらのエッジは上限の最小化に対応する。
【0105】
円滑化のための正規化技術の大多数は、∫R|∇f|2などの積分の最小化を基礎としている。しかし、この式はfの局所的性質をまったく制御できない。換言すれば、|∇f|の大局的平均が小さくてもfが局所的に急に変化する場合があり得る。この課題を克服する1つの方法は全点において|∇f|を最小にすることであり、これによって|∇f|の上限が最小化される。したがって、汎関数H(f)=supR |∇f| は、一連の次式の汎関数(式1)の「限界」であるとみなすことができる。
(数1)

汎関数 HN(f) を最小にするオイラーの方程式は次式(式2)で表される。
(数2)

式中、下付き文字は例えば次式のような導関数を表す。
(数3)

第一の係数を消去し、かつN→∞とすることにより、式3が得られる。
(数4)

式(3)は無限ラプラス方程式(ILE)と呼ばれるもので、広く研究されている(例えば、Aronsson、Arikv. Matematik、6:551-561[1966]; Aronsson、Arikv. Matematik、7:133-151 [1967]; Aronsson、Manuscripta Math.、41:133-151[1981]; ならびに、Evans、Electron. J. Different. Equat.、[http://ejde.math.swt.edu/Volumes/1993/03-Evans/abstr.html]3:1-9 [1993]を参照)。式(2)のいくつかの重要な特性は、少なくとも1つの解が存在すること、および、妥当に弱い意味で「解」が再定義されるならばC1の連続解が存在することである。さらに、fの勾配の軌跡は凸曲線または直線であり、かつ、Rには停留点|∇f|=0が存在しない。局所座標系が∇fで定義される局所座標系において、式(3)がゼロ交差(fxx+fyy=0)と等価であることは興味深い。
【0106】
式(3)を生データに適用すると、ラプラス形式より安定な(すなわち、前景と背景との間の漏れがない)ゼロ交差マップが得られる。このゼロ交差マップは、強度制限条件およびサイズ制限条件で容易にフィルタリング可能な誤領域を有する閉鎖輪郭をもつ。フィルタリングされたセグメント画像は次に重心変換に使用される。
【0107】
b.テンソルベースの特徴解析
ベクトル場解析は、数学および物理学などの古典的分野とともにコンピュータの視覚およびパターン認識においてもよく研究されている技術である。運動ベースの用途向けに多数の概念およびツールが開発されている。本発明は、現在の最新技術を科学画像のセグメント化および解釈に拡張する。強度画像f0(x,y)が与えられたとき、強度画像から導出される自然ベクトル場が存在し、これはπ/2の回転をもつ傾斜場に相当する:
(数5)

ここでの問題点は、ベクトル場「v」にノイズが多く何らかの種類の正規化を導入する必要があることである。これは次式で表される:
(数6)

式中、uは正規化されたベクトル場である。次に、反復法により楕円PDEの解が得られる。次式の単純な線形(ガウス)目盛空間モデルにより一次近似を求めることができる(Lindeberg、J.Appl. Stat、pages 225-270 [1994]):
(数7)

式中、
(数8)

は標準偏差が
(数9)

であるガウス核である。
【0108】
次に、ベクトル場の特異点は、密なベクトル表現のコンパクトな抽象を与える。これらの特異点は点特徴または線形特徴により特徴付けることができる。点特徴には速度および鞍点が含まれる。これらのパターンが検出された後は、対応するオブジェクトの抽出が可能となる。RaoおよびJain(IEEETrans. Patt. Anal. Mach. Intell.、pages 225-270 [1994])は、基礎となるベクトル場からの特徴抽出に局所ヤコビアンを用いることによって特異点を検出した。しかし、本発明のアプローチはより強力であり、かつ、渦のサイズ計測も可能である。渦サイズは、凸ブロブが互いに接続または接触している場合であっても凸ブロブの位置特定を補完する。これは、基礎となるベクトル場における特異点の位置を特定するジョルダンインデックス(Index)に基づく。F=(u,v)をベクトル場とし、Jを臨界点をもたないジョルダン曲線とする。Jのインデックスは次式により定義される:
(数10)

各点PにおいてP周囲の半径Rの小円(JRPによって表される)が選択され、Index(JRP)が計算される。次に、以下のように流れ場(u,v)を分類することができる:
1.渦のインデックスが+1 に等しい(すなわち、ベクトル場中の特異点は前述のRaoおよびJainによって与えられる)場合、および
2.鞍点のインデックスが -1 に等しい場合。
次式のように、ベクトル場のダイバージェンスは全点においてゼロであるから、ベクトル場に節は存在しない:
(数11)

次に、単純な検索技術により渦のサイズが推定される。点a(x,y)が渦であるならば、そのサイズR*(x,y)は次式で定義される:
(数12)

換言すると、R*(x,y)は、JR(x, y) のインデックスが1であり続けるような最大のRである。一次偏導関数の積分であるジョルダンインデックスは、ある意味において、強度画像の関数である。これとは対照的に、他の技術は、より多くのノイズが生じやすい高次の導関数を基礎としている。合成画像、蛍光染料で標識した核、および透過光で観察した細胞における渦および領域セグメント化の結果を種々の図に示した。
【0109】
図41パネルCおよびDは、蛍光染料Hoechst 33342で標識した、生細胞および溶解した細胞の核による結果を示す。図41パネルEおよびFは、20倍の位相差対物レンズと透過光とを用いて撮像した、生細胞による結果を示す。個々の細胞を位置特定する従来の技術は蛍光撮影に限られており、蛍光撮影は動的実験の設計の複雑さを増加させるため、後者の結果は重要である。本明細書に示すデジタル画像のうち、図41パネルEおよびFのみは、10×NA0.5 Zeiss Fluar対物レンズを用いずに撮影したものである。画像はすべて1024×1024であり、カメラ内のCCDチップのピクセルは6.8×6.8μであった。したがって、10倍で撮影したすべての画像において、視野はおよそ高さ700μ、幅700μである。
【0110】
c.正規化した重心変換
I(x,y)を元の画像とする。各点(x0,y0)において、等高の輪郭は次式(式4)で定義される:
(数13)
I(x,y)=I(x0,y0)。
テイラー級数を用いて上式の拡張および打切りを行うと次式(式5)が得られる:
(数14)

上式においてu=x-x0かつv=y-y0であり、または、
(数15)

がヘッセの行列である次式の標準形(式6)
(数16)

において
(数17)

は強度の勾配であり、かつ、w=(u, v)Tは局所座標系における重心である。式(6)で定義される二次曲線の重心が次式(式7)の線形制限条件を満たすことは周知である:
(数18)
Aw+b=0。
Aが特異点でないならば、重心は直接求めることができる(すなわち、次式(式8)):
(数19)
w=-A-1b。
しかし、これは必ずしも真ではなく、一般的に次式(式9)で定義されるゼロ集合
(数20)

は非自明である。さらに、これは以下の2つのカテゴリーに分類することができる。
1.強度の勾配がゼロである領域に対応する、均一な領域。二値画像の場合、情報は輪郭上のみに存在する;および、
2.グレーレベル画像中の楕円形状に対応する、不均一な領域。
【0111】
これらの点の重心は十分に定義されない。さらに、計算の安定性の観点からは、特異点のためこれらの近い点を高い信頼度で計算することができない。これらの難点に対処するためには問題を正規化する必要がある。(x,y)の重心を(u(x,y),v(x,y))Tで表すと、正規化モデルは以下の式10または式11で表すことができる:
(数21)

または
(数22)

式中、第1項および第2項は見積誤差、第3項は制限条件の平滑度であり、α(> 0)は重さである。この問題の解は「正規化重心変換」(RCT)と呼ばれる。変分問題である式11のオイラー-ラグランジュ方程式は次式(式12)である:
(数23)

【0112】
偏導関数の差分近似を上述の差分方程式に代入すると、次式(式13)が得られる。
(数24)

上式は次式(式14)に書き直すことができる。
(数25)

式中、(式15)
(数26)

である。
これらの係数はすべて偏導関数の関数であり、かつ、(u(x,y), v(x,y))の近傍である。行列式(式16):
(数27)
Δ=ad-bc > 16α2
は常に正であり、かつ、式(14)の解は次式(式17)となる。
(数28)

したがって、推定された偏導関数および前の推定値(un,vn)から得られた推定値の新しい集合(un+1,vn+1)は次式(式18)となる。
(数29)

【0113】
e.表現および分類
生細胞の撮像、および一般的に蛍光顕微鏡撮像は、構造情報と機能情報とを分離するために多スペクトルであることが多い。いくつかの態様においては、試料を蛍光染料で標識し、360nmでの撮像により核の情報(例えば、形状および構成)を得る。反応は他の励起波長(例えば、490 nmおよび570 nm)で撮像される。本発明のいくつかの態様においては、それぞれの核は楕円および超二次関数で表現され、その反応は他のチャネルで直接読み取られる。
【0114】
楕円のフィッティングは、4ac-b2=1の制約条件を受ける多項式F(a,x)=ax2+bxy+cy2+dx+ey+fのパラメータの推定に基づいて行われる(Fitzgibbonら、Proc.Intl. Conf. Patt. Recogn.、253-257 [1996])。
【0115】
2Dの超二次関数(Hanson、Comp. Vision Graph. Image Proc.、44:191-210 [1988]; および、Kumarら、IEEETrans. Patt. Anal. Mach. Intell.、17:1079-1083 [1995])は、次式(式19)で定義される閉曲線である。
(数30)

γi > 0であることから(Roskelleyら、Curr. Opin. Cell Biol.、7:736-747 [1995])、次式(式20)が得られる。
(数31)

上式は各iの平行線セグメントの対に対応する。これらの線セグメントは、その中に超二次関数が制限される凸ポリトープを(大きいγについて)定義する。この表現は、対称でなくてもよい幅広い形状について有効である。パラメータAiおよびBiは結合線の傾斜を決定し、これら2つの間の距離γiとCiとは形状の「直角度」を決定する。
【0116】
フィッティング問題は以下のとおりである。n個のセグメント
(数32)

のm個のデータ点Pj=(xj, yj)、j=1, 2, . . . , mが与えられたとする。費用関数は次式(式21)で定義される:
(数33)

式中、
(数34)

∇は勾配オペレータ、λは正規化パラメータ、Qiは制約条件項である(Kumarら、IEEE Trans. Patt. Anal.Mach. Intell.、17:1079-1083 [1995])。パラメータAi、Bi、Ci、およびγiは、レベンバーグ-マーカー(Levenberg-Marquar)の非線形最適化法(Pressら、「Cにおける数値レシピ(NumericalRecipes in C)」、Cambridge University Press [1992])を用いて、適切な初期推測値からεを最小化することによって計算される(Kumarら、IEEETrans. Patt. Anal. Mach. Intell.、17:1079-1083 [1995])。画像中のそれぞれの核はルーメン中の位置によってさらに分類される。図8に、画像中の核の楕円フィッティングおよび分類の例を示す。
【0117】
f.正規化した重心変換の解析
本発明の1つの態様において、画面内の核の抽出は周知の形態学的オペレータと異なる。1つの具体的な技術は、画像を三次元構造として捉える分水界変換である(例えば、NajmanおよびSchmidt、IEEETrans. Patt. Anal. Mach. Intell.、18:1163-1173 [1996]を参照)。画像をその局所極小からフラッドさせ、かつ異なる局所極小に由来する領域の併合を抑止することによって、画像は、流域(catchment)および盆地(basin)、ならびに分水界線(wathershedline)に分割される。別の態様では、このような分割は、各エッジ点から局所極小への下流経路を発見することによってエッジから開始される。分水界変換は、隣接領域を併合するために複雑な形態学的オペレーションを必要とする過剰セグメント化につながる。対照的に、本発明の好ましい態様では、二値化した画像から開始し、続いて、核に属する境界点をつぶして単一の点にする。ただし、自然の分割を明らかにするために境界点を局所盆地に移動させるという観点からは、分水界変換および重心変換も同じ発想である。この方法を用いると、距離変換に対応するエネルギーランドスケープは多数の局所極小を示す。対照的に、正規化重心変換は、単一の局所極小をもつ滑らかなエネルギーランドスケープを有する。
【0118】
重心変換は本質的に、二値ブロブを、各凸領域が核または他の副区画に対応するような別個の凸領域に分割する。分割は進化的であり、かつ、自然境界に沿って生じる。対照的に、本発明の開発過程で実施された早期の研究では(例えば、CongおよびParvin、Patt.Recog.、33:1383-1393 [2000]を参照)、このような分割は必ずしも対象の自然境界に沿って生じなかった。
【0119】
したがって、本発明は、生物学的反応(例えば生物学的機能)を惹起する種々の刺激(例えば外因的に印加された刺激)の結果として細胞間に発生するシグナルのより詳細な像を得るのに有用な、鏡検法および画像分析に対するバイオインフォマティクスアプローチのための方法を提供する。これらの方法は後により詳細に説明する。
【0120】
重要な点として、本発明のVSOMは、本発明者らの以前の研究でより詳細に報告されている分散型の鏡検法とインフォマティクスとのためのチャネルであるDeepViewとのインターフェースに適している。Deep Viewは、任意の機器をそのフレームワークに追加するための拡大縮小可能なインターフェースである。DeepViewはまた、ワイドエリアネットワーク上でデータを転送および閲覧するための手段も提供する。システムは、その特性の広告(advertisement)を介して標的の機器と相互作用する総称GUIを有する。VSOMの場合、関係する特性はコンピュータ制御のシリンジ、シャッター、およびXYステージ、Z軸フォーカスモーター、フィルタホイール、ならびにカメラ制御パラメータである。この、機器の広告性能(機能性)の概念は、より一様なインターフェースをもたらし、かつ、ソフトウェアが再使用可能であることにより維持管理費用を低減させる。
【0121】
E.セグメント化
前述のように、核および細胞質の自動描写は、細胞反応を特定の細胞区画にマッピングする上で重要な段階である。この計算構成要素はVSOMシステムと相互作用して1つまたは複数のチャネルから画像データを取得する(例えば、フィルタホイールを回転させるまたはシャッターを開閉させることによって)。単一のチャネルから取得した画像のセグメント化は前述のとおりである。以下に、多チャネルのセグメント化の概要を説明する。
【0122】
多チャネル画像の分析では、長時間を要する種類の、別のデータ収集が発生する。このシナリオでは、細胞の異なる構成要素を強調するため、異なる蛍光プローブを用いかつ異なる励起フィルタを使用して細胞が撮像される。この場合、システムは、複数のデータのチャネルの同時分析、特定の細胞内要素の選択、および繰り返し測定が可能でなければならない。ベイズフレームワークに基づいた融像のための効率的なアプローチが開発されている。本発明の開発中に行われた研究で示されているように(Parvinら、AAAISymp. Appln. Comp. Vis. Med. Imaging [1995]を参照)、このアプローチは(共焦点鏡検法を用いた)3Dにも拡張可能である。データ融合の目的は、セグメント化および標識のための異なる様式を補完的に処理することである。この見地から、セグメント化手順によりデータ領域中の各ピクセルが相応に標識される必要がある。しかし、標識処理を複雑化しうる曖昧さが多数存在する。これらの曖昧さは、局所処理のみから、および、高レベルのフィードバックの不在により、生じる可能性がある。
【0123】
曖昧さの発生源には、ノイズによるデータの破損、局所特徴を抽出するアルゴリズムの性能の限界、および、標識タスクを妨げる不必要な特徴の存在が含まれる。領域セグメント化の1つの局面では、ヒストグラムの分析により達成される、各領域の平均強度の推定が行われる。いくつかの態様において、ヒストグラムのピークの最初の位置が近似され、次に最小二乗近似により精密化される。計算過程の次の段階では、これらのピークをクラスター中心として使用して画像空間内の局所一貫性を高める。このとき、多チャネル情報に基づいて画像を標識するためにベイズフレームワークが使用される。具体的には、本発明は3つのレベルをもつベイズ階層モデルを使用する。第一レベルは基本的な分類Zのモデルである。理想的な条件下では、M個の異なる様式(例えば、青、緑、および赤の蛍光発光にそれぞれ対応する3つの蛍光画像)でZを観察することにより、画像システム中の種々のノイズにより破損されるデータの理想的な表現Xiが特定される。階層の第三レベルはデータYiの実際の観察結果に対応する。第一レベルは、マルコフランダム場(MRF)を事前確率密度関数とともに、正のパラメータをもつイジング模型の形式で使用する。このパラメータは近傍ピクセル間の協力を促進する。ベイズフレームワークにおいて、画面の内容に関する事前の無知性(ignorance)があるという仮定を設定してもよい。第二レベルは、Zが与えられたときの条件的な従属変数としてXをモデル化する(すなわち、P(X1,...,XMZ)=P(X1Z) ... P(XMZ)。ある分類が細胞質としてラベル付けされるのであれば、緑チャネル(すなわち細胞質)および青チャネル(すなわち核)の理想的反応は互いに影響しないので、これは妥当である。階層の第三レベルであるYiはガウス分布としてモデル化される。その結果、YiはXiの局所的にぼやけた表現となる。完全なモデルは次式(式22)として表される:
(数35)
P(Z, Xi Yi)=P(Yi Z) P(Xi Z) P(Z)。
最大事後確率(MAP)推定を用いてXiおよびZを得る。ただし、MAP計算は本来的に実行不可能であるため、反復条件モード(iterativeconditioning modes; ICM)に基づく数値近似を用いて局所最適条件を発見する(Besag、J. Roy. Stat. Soc. B、48:259-302[1986]を参照)。
【0124】
F.ソフトウェア
本明細書に詳細に説明しているように、本明細書に記載の実験で使用したVSOMの機能アーキテクチャは、画像取得モジュール、画像分析モジュール、サーボ制御、およびアーカイブで構成される。画像取得モジュールは、6つの励起フィルタを用いて、微速度撮影の高分解能ビデオ鏡検法の手段を提供する。このモジュールは、種々の時間周波数および励起周波数の、手動の画像取得またはあらかじめプログラムされた画像取得を可能にするレシピマネージャを有する。レシピは、意味的な相互運用性を提供するXML表記法で表現される。分析モジュールは、サイズ、位置、反応、および境界輪郭に基づいた画像の特徴ベース要約を提供する固有のセグメント化アルゴリズムを統合する。したがって、分析モジュールは、属性付けされたグラフモデルに基づいて画像の特徴ベース要約を提供する固有のセグメント化アルゴリズムのプールを有する。その結果、グラフ中の各節は画像中の同質の領域(例えば、核、細胞質など)に対応する。
【0125】
各節の属性には、境界輪郭、超二次関数を用いたこの輪郭のパラメトリック表現、派生する複数の特徴、および観察下における細胞内区画の反応が含まれる。グラフ中のリンクは種々の節の間の隣接関係をコードする。属性付けされたグラフモデルは、各細胞およびその近隣の構造的定義を完全に表現する。サーボ制御モジュールは、顕微鏡付近に位置する4つのシリンジのうち任意のシリンジの流れを制御することによって組織培養容器中の種々の化合物の濃度を制御する。サーボ制御は3つの操作モードを提供し、各モードはレシピマネージャで連続的に登録される。これらのモードには以下が含まれる:(1)各化合物の流量、その開始時点、および持続時間が特定される、静的レシピ;(2)観察下における細胞の特定の反応の関数として流量および持続時間を変化させる、動的レシピモード;ならびに、(3)指定された周波数で流れをオンおよびオフにするプログラムにより制御される、変調レシピ。アーカイブシステムは、画像、その計算されたグラフモデル、および解題データをフラットファイル環境に保存する。本発明の主要な特徴の1つは、複数の位置から遠隔的に操作できることである。この固有の特徴により、研究者らは地理的に離れた位置に物理的に位置していても、与えられた実験を協力して行うことができる。
【0126】
本発明により、ユーザーが利用できる柔軟性が最大限となる。例えばユーザーは、細胞チャンバへの灌流速度の制御、カメラ露出時間の設定、光学フィルタホイールの位置の選択、およびデータ収集のサンプリングレートの設定を可能にする、特定の実験のためのレシピを入力することができる。本明細書において、画像の取得および制御のための操作可能VSOMソフトウェアパッケージの好ましい態様の1つを「VX5」と呼び、別の好ましい態様の1つを「ADR」と呼ぶ。VX5はシステムの静的レシピ制御用に設計されたものであり、ADRは動的レシピの視覚サーボ制御実験を局所的にまたはネットワーク上で実行するために設計されたものである。図14に、DeepViewの機能的アーキテクチャの略図(パネルA)、VX5実行用のXMLレシピファイルのサンプル(図14パネルC)、ポンプログ中のデータの例(図14パネルB)、および、ICSデジタル画像ヘッダの例(図14パネルD)を示す。
【0127】
G.特徴ベースの画像の保存
現在、保存モデルは一般的にフラットファイル上に構築されており、フラットファイルは検索および維持が困難である。本発明は、保存取り扱いに必要なスキーマを構築するためのアクティブバイオインフォマティクスプログラムを活用する手段を提供する。1つのスキーマの設計を図15に示す。この設計は、VSOMに適応させるため、および、印加された刺激に対してどの特定の細胞内区画がどの程度「反応」したかというモデルを構築するうえで有用な、特徴ベースの空間-時間データベースをつくるために拡張されたものである。図16に示す多次元データベースは、各細胞内区画の反応曲線を含む細胞反応と、1つの区画から次の区画への蛍光プローブの移動との表現を提供する。
【0128】
好ましい態様の使用中、各実験は、標本容器(例えばぺトリ皿)中の特定の物理的位置に対応する標的フレーム(すなわち画像)を含む。細胞内の構造はセグメント化され、属性グラフとして解題データとともに保存される。次に、コンピュータ制御下で生細胞に刺激を印加しながら経時的に収集した一連のデジタル画像として、標的フレームが観察される。各区画の反応が記録され、かつ、細胞内へまたは細胞内区画間を移動する蛍光プローブの動きが追跡される。
【0129】
保存されたデータの機能的ビューは階層的である。最下レベルには、生の画像および画像の対応する物理的解題が保存される。次のレベルには、属性付けされたグラフモデル(すなわち構造)、対応する反応(すなわち機能)、および環境条件の動的解題(例えば、刺激の種類、流量、濃度など)が保存される。次のレベルには、化合物が種々の細胞内区画の中で再配分する際の化合物の軌跡とともに、細胞内の各区画の時間的発現が反応カーブとして要約される。これらの反応は観察中の全細胞について類似していなくてもよい。しかし、これらの反応は、特定の種類の細胞群または類似の生理学的状態にある細胞群に各クラスターが対応するようなクラスターを生成することが予測される。これらのクラスターは次の相関研究のために同定されなければならない。各クラスターは時系列事象に対応し、時系列事象は細胞の特定の細胞内区画に対応する。各クラスターにおけるこれら反応の平均的な挙動は単値分解により表現される。正式には、観察される反応は次式(式28)で定義される多値関数である:
(数36)
ft(Channel, CellType, Compartment, Dye)=f([Dye], f/t,Flowci / t, T)
式中、fは時点tにおいて特定の区画で観察される平均蛍光強度、[Dye]は染料の濃度、Channelは励起フィルタの位置、Tは温度であり、Flowは注入される化合物の流れの変化に対応する。以後の知識発見用に観察結果をデータベースに保存するため、この経時変化する情報を取得するためのスキーマが開発される。各実験サイクルは観察した各細胞についてフィンガープリントを生成する。これらの個々の反応から、画像空間内の細胞内活動のコンパクトな表現が得られ、これは細胞ごと、細胞母集団ごと、細胞種ごとなどに可視化することができる、
【0130】
H.細胞反応からの学習
本発明の学習技術は細胞種間の細胞特異的な差異を最適化および発見するために使用される。この文脈において、計算された反応とその組織構造および軌跡とは、最適化された細胞種識別を検索するためのその後の段階的な検索を容易にするためのモデルの開発を補助する。いずれの学習アプローチにおいても、その基礎には、ポリシーと、報酬と、価値と、環境のモデルとがある。モデル再構成の目的の1つは、種々のポリシーおよび報酬関数を評価することである。モデルはある細胞種と別の細胞種とで異なることが予測される。これらのばらつきはそれ自体のメリットについて重要であり、かつ、定量化すれば貴重な妥当性確認として利用できる。データベース内容は、類似性測度の評価、精密化、および局在化の根拠を提供する。類似性は状態および動作に基づいてクラスターを分析することにより測定される。これらのクラスターは、同値類を確率するための、種々の反応に関する共起統計の計算を補助する。または、細胞反応およびその対応属性(動的解題)によりあるシーケンス中の表現が生成される。この表現は次に、そのシーケンス中の共起統計を推移確率とともに構築するのに利用される。共起統計は、代表的な特徴の集合の二値木分類の仮説設定を補助する。この方法は、ひとつには、相関するシーケンスの検出および分類に有用である。さらに、一旦モデルが確立されれば、異常値を発見する手段が共起統計により得られる。推移確率は環境の知識を提供し、環境の知識は次に強化学習に使用することができる。さらに、細胞反応を、経時変化する線形系としてモデル化する手段が提供される。線形系は、系の挙動を特徴付けるための単純かつ強力な方法である。この文脈において、可変メモリ(遅れ)を有するシステムの状態空間表現が構築され、かつ、関連する行列のパラメータが推定および検証される。
【0131】
I.強化学習
この相では、どのように蛍光プローブの取込みを変動させるか、および、系統的な方法で細胞内の取込みを最適化するかを学習するための開始点として既知の知識が使用される。これは通常「強化学習」と呼ばれ、かつ、いくつかの態様においてはマルコフ決定過程(MDP)としてモデル化される。特定のMDPは、その状態(すなわち観察された反応)と、蛍光プローブの細胞内濃度の変更(例えば、生物学的阻害剤を注入する、生理学的に重要なイオンの培地内の濃度を変更する、など)を含む動作との集合によって定義される。このような系における報酬は、計算された反応の変化またはそのエピソード的勾配の変化によって測定可能である。さらに、いくつかの態様においては、次に、データベース中の同じアッセイで得られた観察結果をもとに(MDPの)推移確率が計算される。これらの推移確率は最適ポリシー(すなわちスケジュール)を可能にする技術を提供する。このようなポリシーは一般的に、動的プログラミング、モンテカルロ法、および時間差分学習(TD学習)として表現可能である。動的プログラミングは細胞反応のモデルを必要とする。このようなモデルはデータベースから仮説設定される。さらに、データベースが拡張するにつれてモデルへのアクセシビリティが向上する。モンテカルロ法はモデルを必要としないが、ステップ-バイ-ステップの増分計算に適していない。一方、時間差分学習はモデルを必要とせず、かつ、完全に増分的である。しかし、これら3つの方法はすべて本発明の態様に適用可能である。例えば、サンプルの推移確率(完全ではないもの)が存在するならば、1つの増分ステップ(すなわち1つのエピソード)においてモンテカルロ法が使用可能である。また、時間差分法はモンテカルロ法と動的プログラミングとの組合せである(すなわち、モデルなしで生の経験から直接学習し、次に、学習した推定に一部基づいて推定を更新する。)
【0132】
J.悪性および非悪性の乳房上皮細胞を識別する生理学的特徴を迅速に発見する方法
原発乳房腫瘍細胞のインビトロ増殖における近年の進歩により、細針吸引(FNA)で採取した比較的少数の腫瘍細胞を培養により継代および増殖することが可能になっている(Liら、Canc.Res.、58:5271-5274 [1998])。事実、悪性ヒト乳房上皮細胞(BEC)の初代培養は大きく進歩している(Bandら、Canc. Res.、50:7351-7357[1990]; Ethierら、Canc. Res.、53:627-635 [1993]; Dairkeeら、Canc. Res.、57:1590-1596[1995]; TomidaおよびTsuruo、Anti-Canc. Drug Des.、14:169-177 [1999]; ならびに、BrownおよびGiaccia、Canc.Res.、58:1408-1416 [1998])。
【0133】
悪性細胞に関連したインビボ環境は、少ない酸素(すなわち低酸素)、低いpH、低レベルのグルコースレベル、および高レベルの代謝廃棄物の領域で構成されていると考えられている。培養中でこれらの条件をシミュレートすると、非悪性細胞はこれらの厳しいインビトロ環境条件で生存できないため、原発乳癌細胞の比較的純粋な母集団が分離できることが示されている(Dairkeeら、前述)。悪性のBCEは非悪性細胞より速く増殖すると広く考えられているがこれは誤解である。したがって、厳しい環境で悪性細胞の培養を提供することのもう1つの利点は、増殖速度が速い非悪性の上皮細胞が存在せずかつ腫瘍細胞を凌駕して増殖できないこことである。また、腫瘍細胞の薬剤耐性は厳しい微小環境のストレスに依存するものである可能性があり、かつ、厳しい微小環境のストレスの結果である可能性がある(TomidaおよびTsuruo、前述)。この理由から、薬剤耐性を正確に測定するには適切な微小環境で細胞に対するアッセイを行わなけらばならない可能性があると予測されていた。事実、最も成功したインビトロの化学感受性試験のいくつかでは、両端をシールし14日間インキュベートした小さな毛管で培養した細胞が使用された。その結果得られた毛管内の微小環境は、サンドイッチ状態のカバーガラス法で一般的に得られるものよりさらに厳しい可能性が高い(前述のDairkeeらの文献を参照)。
【0134】
さらに、培養においては、得られる細胞(最大107個)は元の腫瘍とよく類似しており、かつ、軟寒天での増殖も含め1つまたは複数の腫瘍表現型を示す。事実、乳癌中には最適以下の栄養枯渇環境が存在する(Dairkeeら、前述、TomidaおよびTsuruo前述、ならびに、BrownおよびGiaccia、前述)本発明は原発乳癌標本の培養を向上させる手段を提供する。例えば、腫瘍細胞と正常細胞とは、インキュベータのCO2レベルの関数として、大きく異なるpH挙動を呈すると予測される。また、各細胞腫が耐性を示すpHレンジも異なる可能性が高い。正味の効果としては、単一のインキュベータ内で(別々のフラスコ内で、各細胞腫が好む培地中で)これら異なる細胞種が同時に増殖できるような共通のCO2レベルは存在しないことになる。事実、正常細胞が耐性を示すpHレンジは癌細胞のそれよりはるかに狭いと予測される。低pH環境(<7.1)を好む正常細胞株は見つかっていない。
【0135】
したがって、ヒト乳癌上皮細胞の増殖成功には pH < 7.0が必要であるということが正しいならば、これまでのインビトロ化学感受性アッセイが成功しなかった理由も明らかである。ほとんどの培地および細胞インキュベーション条件はpH> 7.0となるよう設計されてきた。したがって、ヒト腫瘍生検標本をこれらの条件下で培養すれば、付着および増殖するのは癌細胞ではなく正常細胞である。結果として、それとは知らずに癌細胞ではなく正常細胞に対して化学感受性試験を行うことになる。これまで、臨床試験でこれらのアッセイが失敗したのはこれが理由である可能性がある。ただし、本発明を使用するには機序の理解は必要ではなく、かつ、本発明はいかなる特定の機序にも限定されない。しかし、本発明は、正常細胞および異常細胞の形態学的形質転換をpHおよびその他の微小環境の局面の関数として(例えば、透過光中の細胞をセグメント化する能力を有するVSOMシステムによって)モニター、分析、および定量化する手段を提供する。
【0136】
K.細胞の特定視野の繰り返し観察および分析
本発明はさらに、マルチウェルプレートについて本明細書に説明したのと同様の方式で、閉鎖した組織培養フラスコ内の細胞の多数の視野を繰り返し観察および撮像する手段を提供する。透過光中で細胞をセグメント化できる能力を有することは、フラスコが顕微鏡ステージに戻されたときにVSOMシステムが細胞の同じ視野に戻り、新しい画像を取得し、かつ形態学的変化を定量化するよう、細胞の形状、位置、および相対的位置を保存できることを意味する。これは、細胞の数、相対位置、および形状に変化があった場合でもシステムが細胞の同じ視野を再度位置特定するような、視覚的サーボ制御のより機械的な用途の例である。
【0137】
したがって、本発明のいくつかの態様において、システムは、ガラス切り用の微細仕上げホイールを使用して滅菌培養皿に軽くエッチングされた、極めて精密なグリッド(「+」)に対する相対的な位置の手段を提供する。培養皿は次に除去し、インキュベータに戻すかまたは適切な条件下で保管してもよい。細胞を再撮像するときには、培養皿上の「+」を基準にしてシステムが較正され、座標(0,0)が「+」の中心に設定される。ユーザーは、最初の位置合わせ用に、透過光下でエッチングを容易に見ることができる。図52の略図に、培養皿内の細胞位置の基準となるフレームを確立する目的で、エッチングされた培養皿を使用する様子を詳しく示した。このように、各細胞の反応を、培養皿中のその細胞の物理的位置において解題するという目的が達成される。さらに、刺激などに対する細胞の反応を経時的にモニターするために細胞の同一視野を数時間後または数日後に観察することもエッチングにより容易になる。
【0138】
これらの実験で使用されるシステムは、ガラス切り用の微細仕上げホイールを使用して滅菌培養皿に軽くエッチングされた、極めて精密なグリッド(「+」)に対して相対的にその位置を参照する。培養皿は次に除去し、インキュベータに戻すかまたは適切な条件下で保管してもよい。細胞を再撮像するときには、培養皿上の「+」を基準にしてシステムが較正され、座標(0,0)が「+」の中心に設定される。ユーザーは、最初の位置合わせ用に、透過光下でエッチングを容易に見ることができる。図52の略図に、培養皿内の細胞位置の基準となるフレームを確立する目的で、エッチングされた培養皿を使用する様子を詳しく示した。このように、各細胞の反応を、培養皿中のその細胞の物理的位置において解題するという目的が達成される。さらに、刺激などに対する細胞の反応を経時的にモニターするために細胞の同一視野を数時間後または数日後に観察することもエッチングにより容易になる。
【0139】
したがって本発明は、他の細胞(すなわち正常な乳腺上皮細胞)を増殖上不利にしながら特定の細胞(すなわち原発乳癌細胞)を増殖上有利にするために細胞種間の差異を同定および活用する方法およびシステムを提供するだけでなく、生細胞の増殖率を細胞ごとに定量できるVSOM蛍光アッセイも提供する。
【0140】
L.インビトロの薬剤試験および化学感受性試験の向上
本発明は、悪性細胞の増殖および分析する手段を向上させることに加えて、癌患者(例えば乳癌患者)の臨床成績を向上させるための患者志向型の治療法を容易にする、インビトロの薬剤試験および化学感受性アッセイも大幅に向上させる。
【0141】
次の名称集を用いて臨床的相関の要約を作成することができる:TP(真陽性、細胞がインビトロで感受性を示しかつ化学療法に反応する患者)、TN(真陰性、細胞がインビトロで耐性を示しかつ化学療法に反応しない患者)、FP(偽陽性、細胞がインビトロでは耐性を示すが臨床的には耐性を示す患者)、FN(偽陰性、細胞がインビトロでは耐性を示すが臨床的には反応を示す患者)、PPA(陽性予測精度)=TP/(TP-FP)、試験システムで感受性を示しかつ治療に反応した患者のパーセンテージ、および、NPA(陰性予測精度)=TN/(TN+FN)、試験システムで感受性を示しかつ治療に反応しなかった患者のパーセンテージ。
【0142】
インビトロの試験結果と患者の反応とのこれまでの相関データでは、総合的なPPAは72%、NPAは90%となっている。これは、感度(すなわち、臨床的に反応性の患者を検出する能力)85%、および特異度(すなわち、非反応性の患者を検出する能力)89%に相当する。これらの数値は4263名の患者を対象とした研究における7種類のアッセイの平均であり、結果は複数の個別の研究からプールされたものである(DeVita、「癌:腫瘍学の原理と実践(Cancer:Principles and Practice of Oncology)」、Lippincott-Raven、Philadelphia [1997])。これらのアッセイが患者の反応よりも患者の薬剤耐性を予測するのに優れていることから、これらの著者らは、これらのアッセイを「化学療法」アッセイではなく「薬剤反応性」アッセイと呼ぶことを提唱している。
【0143】
ロボット視覚技術である「視覚サーボ制御(VS)」として結合された、デジタル撮像蛍光鏡検法、デジタル画像のリアルタイム分析、およびバイオインフォマティクスデータベースは、デジタル画像の内容の分析に基づいた実験パラメータの動的操作を意味する。さらに、VSOMは複数の視野を進んでおよび戻って走査する能力を有し、かつ、これにより生細胞の非常に多数の母集団をモニターする能力を有する。
【0144】
前述のとおり、VSOMは、細胞単位で変化をモニターするために、関心対象の細胞の同一視野に繰り返し戻る能力をさらに提供する。この能力により、細胞で観察される早期の生理学的反応を、増殖かアポトーシスかまたはある細胞周期段階での停止かという細胞の将来の生物学的状態または最終運命と相関させることが容易になる。事実、本発明の1つの態様は最も望ましい予測アッセイを提供する。重要な点として、これらのアッセイは動的かつ適応的である。
【0145】
1つの態様において、適応的VSOM蛍光アッセイでは、インテリジェント的に選択されたコンピュータ制御の刺激に対する細胞の早期の生理学的反応が観察される。いくつかの好ましい態様において、これらの刺激および摂動は可逆的であり、かつ、細胞を特定の生物学的経路に永続的に付すことはない。例えば、細胞外の培地のpHを低下させながら、観察されるストレス反応に基づいて細胞の特定の部分母集団を同定する。システムのインテリジェント反応の1つとしては、関心対象の細胞が同定されるまで培地のpHを低下させ、次に、細胞に不可逆的な損傷が生じる前に細胞を高いpHに戻すことが考えられる。次に、関心対象の細胞が細胞単位で同定され、システムは、低pHの環境に対するこの差分反応を最適化および/または利用するための追加の試験を実施するために使用される。
【0146】
本発明はまた、抗癌剤または薬剤の組合せによって利用できる生理学的特徴を探索するため細胞を繰り返しプロービングできる能力を提供する。したがって、本発明のVSOM蛍光アッセイは、好ましい態様において、細胞の複雑な混合物を用いて細胞を迅速に同定する手段であって、蛍光プローブが細胞に対して非毒性であり、印加された刺激または摂動に対する特徴的な生理学的反応に基づいて細胞が特定され、かつ、刺激または摂動が細胞に対して不可逆的影響をもたない手段を提供する。事実、特に好ましい態様において、本発明の予測アッセイは、インテリジェント的に選択されたコンピュータ制御の刺激に対する一連の早期の生理学的反応を観察することを含む動的かつ適応的なVSOM蛍光アッセイである。このアプローチは、このような刺激および摂動が可逆的でありかつ細胞を特定の生物学的経路に永続的に付さない場合はさらに強力である。比較的無害の刺激および摂動を生細胞に繰り返し印加できる能力により、抗癌剤または抗癌剤の組合せによって利用できる生理学的特徴を探索するため細胞を繰り返しプロービングすることが可能となる。本発明のVSOM蛍光アッセイは細胞の将来の挙動および/または最終運命を良好に予測できる。例えば本発明は、細胞が増殖できるよう十分に刺激されたか、または、アポトーシスが必然となる点までストレスを受けたかを決定する手段を提供する。この能力は、細胞で観察される早期の生理学的反応と、細胞の将来の生物学的状態または最終的な生物学的運命(すなわち、増殖、アポトーシス、特定の細胞周期段階での停止など)とを相関付けるのに役立つ。
【0147】
本発明はさらに、以前に観察された生理学的な細胞反応の記録を含むオブジェクト指向データベースを提供する。このデータベースは、VSOMアッセイの知識ベース制御を実施するうえで非常に有用な資源を提供する。このデータベースに遠隔的に(すなわち、任意のVS使用可能顕微鏡を介して)アクセスできることにより、これらの機器のインターネット上での制御が可能となり、かつ、これらの機器およびそれを操作するために必要なコンピュータの性能にかかる費用を大幅に削減しながらこれらの機器の機能性を大幅に高めることができる。
【0148】
少なくとも3つのプロスペクティブ臨床試験において、癌患者の化学療法に対する反応と生存率とを向上させるためにインビトロ化学感受性試験を使用する試みがなされている。しかし、これらの試験では、インビトロ化学感受性試験の結果に基づいて化学療法を受けた患者の生存率向上は認められなかった。しかし、それぞれの患者は他のどの患者とも少なくともわずかに異なる。例えば、1人の患者がある薬剤に対して有害反応を示し、別の患者が副作用をまったく経験しないということもあり得る。患者が薬剤に対して有害反応を示す場合または患者の腫瘍が薬剤に反応しない場合、医師は、効果のある薬剤を同定するため、薬剤および/または治療レジメンを変更する。乳癌の場合、医師は幅広い可能性の中から薬剤(または2つ以上の薬剤)を選択肢、かつ、個々の患者の腫瘍に対して最も有効でありかつ個々の患者における副作用が最小である組合せを見つけなければならない。多くの場合、医師は各患者について一連の薬剤を試さざるを得ない(すなわち、これらは最適の治療レジメンを決定するためのインビボ薬剤反応試験である)。インビトロの薬剤反応試験には、適切な治療法を見つけるための一連の衰弱を招く試行錯誤を患者に対して行うことなしにより幅広い薬剤をより短時間で試験できるという利点が期待できる。したがって、40年以上にわたって、患者の体から腫瘍細胞を取り出しそれをインビトロで試験するという試みが行われてきた。
【0149】
成功しなかったこれらの方法で使用された2つのインビトロ化学感受性アッセイは、HTCA(ヒト腫瘍クローニングアッセイ)およびDiSC(分染細胞毒性アッセイ)である。これらのアッセイで使用されるインビトロの細胞培養および細胞増殖の技術、ならびに測定される生物学的エンドポイントは著しく異なる。HTCAでは、細切した腫瘍組織を非常に小さい毛管に入れ両端を密封し14日間インキュベートした培養物が必要である。悪性細胞と非悪性細胞とを含むこの混合物(細胞数0.2〜1.0×105個)を毛管内に密封する前に、ヒトの血漿で観察されるピーク濃度の10分の1に相当する濃度に調整した標準的な抗癌剤に細胞を1時間曝露する。次に細胞を0.3%寒天に懸濁し、100μlの毛管に密封した状態で37℃かつ7%CO2の環境に14日間おく。14日後に細胞を毛管から抽出し、顕微鏡を用いて手作業でコロニー数を決定する。最初に必要な腫瘍細胞数が少なくてすみ、かつ、有意数の細胞を有するコロニーの発生が改善されたことから、この毛管クローニングシステムが使用されていた。
【0150】
DiSCアッセイは、試験に利用できる細胞数を増幅するために小さいポリプロピレンチューブ内で液体培地を用いて腫瘍細胞を4〜6日間培養するという非クローニング的なアッセイである。薬剤への曝露時間は薬剤により異なり、1時間〜4日間である。一般的に、薬剤濃度は経験的に決定され、HTCAで使用される濃度より高い。例えば、HTCAでは0.04μg/mlのドキソルビシンで1時間細胞を処理するが、DiSCでは1.2 μ/mlで1時間である。DiSCアッセイでは、ファストグリーンを含む懸濁液中で死細胞を染色することによって細胞膜の完全性を評価する。アセトアルデヒドで固定したカモ赤血球(DRBC)を内部標準として培養物に添加し、混合物全体を細胞遠心分離(cytocentrifuge)すると、生細胞は無色、死細胞およびDRBCは緑色に染色された状態で顕微鏡スライド上に収集される。次に、生細胞を染色するためHE(ヘマトキシリン-エオシン)でスライドを対比染色する。次に、熟練技術者が顕微鏡的に細胞を腫瘍細胞または正常細胞として同定する。次に、DRBCに対する生細胞の比が決定される。
【0151】
上述の試験で得られるデータについて共通の一群の問題点が指摘されている。両アッセイとも手作業で労働集約的であり、定量化を人の判断に依存しており、かつ、これらのインビトロシステムでは一部の患者の腫瘍細胞が良好に増殖しないためしばしば結果が得られないことがある。このような理由のため、これらのアッセイに対する臨床医の認知度および受容度は低い。したがって患者および標本の集積が困難となっている。しかし、患者の腫瘍細胞に効果を示さない薬剤の同定に優れた「第二世代」の試験がこれらの試験に置き換わりつつある。このようにいくつかの薬剤を除くことによって、医師は患者でインビボの薬剤反応試験を行う際にこれらの薬剤を考慮に入れる必要がなくなる。これらの試験は、労働集約的であるものの長年利用可能となっている技術を基礎にしている。しかし、これらの試験は労働集約的であり、かつ、人為的ミスが生じる可能性を有する。
【0152】
これまでのこうした研究が患者の反応および/または生存率に劇的な向上をもたらせなかったのは種々の要因の結果である可能性があり、こうした要因としては、微小環境(例えば、腫瘍細胞が好む微小環境がインビトロで適切にシミュレートされていなかった)、個々の細胞の生理学的反応がアッセイ中に詳しくモニターされなかった、ならびに/または、薬剤の濃度、組合せ、および曝露時間が制限されておりかつ科学的に最適化されていなかった、などがある。
【0153】
しかし、本発明(すなわち「第三世代」の試験の1つ)の開発中に、より進んだ細胞培養技術と、ロボット視覚およびデジタル撮像蛍光鏡検法の分野に由来する革新的な技術とが検討された。本発明の視覚サーボ制御光学顕微鏡(VSOM)は、悪性細胞と非悪性細胞(例えば乳房上皮細胞(BEC))とを識別する重要な生理学的特徴の迅速な発見などに有用である。前述のとおり、VSOMは、関心対象の細胞(例えば腫瘍細胞)の増殖に有利に働くインビトロの微小環境を迅速かつ自動的に生成すること、および、印加されたストレスに対する早期の生理学的反応に基づいて細胞の挙動を予測するインビトロの蛍光アッセイを生成することができる。したがって、本発明は前述の臨床試験に関連する問題点を克服する手段を提供し、このような問題点としては、インビトロで腫瘍細胞を増殖させるうえでの困難、アッセイの過程で間隔をおいて細胞を観察する能力に限界があること、1回のアッセイで観察できる生物学的エンドポイントの数に限界があること、および、オートメーションの欠如が含まれる。本発明はまた、原発乳癌細胞(例えばヒト細胞)のインビトロ増殖と化学感受性試験とに適した微小環境条件を迅速に発見および最適化する手段を提供する。さらに本発明は、この目的を腫瘍ごとに達成する手段を提供する。
【0154】
M.微小環境パラメータのモニタリング
本発明は、VSOM実験に有用である重要な微小環境パラメータのオンラインモニタリングに必要なバイオセンサーおよび関連電子機器を使用する手段を提供する。これらの実験で使用されるセンサーは灌流ラインへの直列接続に適したZABSフロースルーセンサーであると予測される。したがって、細胞に到達する直前の培地について複数の重要な特性を連続的にモニターおよび記録することが可能である。本発明のいくつかの態様においては、大きな透過光集光装置、温度プローブ、および真空吸引装置が存在するため、実際の細胞灌流チャンバ内にこれらのセンサーのすべてを設置するための空間が十分にない。したがって、培地をマイクロインキュベーションチャンバ内に連続的に灌流させながら、培地のpH、L-乳酸またはグルコース、細胞外カルシウム、およびpO2をモニターする。
【0155】
いくつかの態様において、VSOM法では、コンピュータ制御された4つのシリンジ灌流ポンプが使用される。さらに、コンピュータ制御のXY走査ステージにしっかり取り付けられるようマイクロインキュベーションチャンバを改修した。真空駆動吸引装置が余分の液体を排除し、温度プローブが温度制御用のフィードバックを提供する。
【0156】
種々の態様において、電子機器パッケージが本発明とともに使用される。例えば、電子機器パッケージ「PLUGSYS」がこれらの実験で使用される。PLUGSYSはモジュール設計であり、その基本システムケースは、pH、L-乳酸またはグルコース、細胞外カルシウム、およびpO2等の測定に必要な種々の増幅モジュールを保持するためのスロットを十分に有する。PLUGSYSケースはまた、使用されるデータ取得用ハードウェアとの互換性も有し、このようなハードウェアとしてはPC用のPCIA/D変換基板が含まれる。この装置は、VSOMシステム制御用の重要なリアルタイムデータを提供し、かつ、VSOM実験の実施および解釈に重要な微小環境パラメータと、VSOM実験中に使用される重要な微小環境パラメータのオンラインモニタリングに必要な関連電子機器との連続的なモニタリングおよび記録を可能にする。
【0157】
実験
以下の実施例は、本発明の特定の好ましい態様および局面を説明しかつさらに例証することを目的として提供されるものであり、したがって本発明の範囲を限定すると解釈されるべきではない。
【0158】
以下の実験の開示では次の略語を使用する:VS(視覚的サーボ制御);VSOM(視覚的サーボ制御光学顕微鏡/鏡検法);℃(度、摂氏);rpm(毎分回転数);BSA(ウシ血清アルブミン);H2O(水);aa(アミノ酸);bp(塩基対);kb(キロ塩基対);kD(キロダルトン);gm(グラム);μg(マイクログラム);mg(ミリグラム);ng(ナノグラム);μl(マイクロリットル);ml(ミリリットル);mm(ミリメートル);nm(ナノメートル);μm(マイクロメートル);M(モル);mM(ミリモル);μM(マイクロモル);U(単位);V(ボルト);MW(分子量);sおよびsec(秒);min(s)(分);hr(s)(時間);MgCl2(塩化マグネシウム);NaCl(塩化ナトリウム);OD280(280nmでの光学濃度);OD600(600 nmでの光学濃度);[Ca+2]in(細胞内カルシウム濃度);[Ca+2]ex(細胞外カルシウム濃度);DOX(ドキソルビシン);BEC(乳房上皮細胞);HMEC(ヒト乳腺上皮細胞);MCF-7(ヒト乳癌細胞株の1つ);MCF-7WTC(MCF-7 野生型、Cowan);HTCA(ヒト腫瘍クローニングアッセイ);DiSC(分染細胞毒性);CAM(カルセイン-AM);DRBC(カモ赤血球);DS(薬剤感受性);MDR(多剤耐性);EH(エチジウムホモ二量体);MEBM(乳腺上皮細胞基本培地);MEGM(乳腺上皮細胞増殖培地);PBS(リン酸緩衝生理食塩水);D_PBS(ダルベッコのPBS);FN(偽陰性);TN(真陰性);FP(偽陽性);TP(真陽性);NPA(陰性予測精度);PPA(陽性予測精度);PMA(ホルボール12-ミリステート13-アセテート);TRME(テトラメチルローダミンエチルエステル);TG(タプシガルギン);FURA-2-PE3(カルシウム感受性の蛍光染料の1つ);H42(Hoechst(ヘキスト)33342);LT-R(Lysotracker-Red);FNA(細針吸引);PAGE(ポリアクリルアミドゲル電気泳動);PBS(リン酸緩衝生理食塩水[150 mM NaCl、10 mM リン酸ナトリウム緩衝液、pH 7.2]);PCR(ポリメラーゼ連鎖反応);PEG(ポリエチレングリコール);SDS(硫酸ドデシルナトリウム);Tris(トリス(ヒドロキシメチル)アミノメタン);DMSO(ジメチルスルホキシド);w/v(質量体積比);v/v(体積体積比);Amersham(AmershamLife Science, Inc.、イリノイ州Arlington Heights);ICN(ICN Pharmaceuticals, Inc.、カリフォルニア州CostaMesa);ATCC(American Type Culture Collection、メリーランド州Rockville);Becton Dickinson(BectonDickinson Labware、ニュージャージー州Lincoln Park);BioRad(BioRad、カリフォルニア州Richmond);Clonetics(Clonetics、SanDiego);Clontech(CLONTECH Laboratories、カリフォルニア州Palo Alto);Molecular Probes(MolecularProbes、オレゴン州Eugene);GIBCO BRLまたはGibco BRL(Life Technologies, Inc.、メリーランド州Gaithersburg);Invitrogen(InvitrogenCorp.、カリフォルニア州San Diego);New England Biolabs(New England Biolabs, Inc.、マサチューセッツ州Beverly);Novagen(Novagen,Inc.、ウィスコンシン州Madison);Pharmacia(Pharmacia, Inc.、ニュージャージー州Piscataway);Sigma(SigmaChemical Co.、ミズーリ州St. Louis);Stratagene(Stratagene Cloning Systems、カリフォルニア州LaJolla);Creative Scientific Methods(Creative Scientific Methods, Inc.、www.cre8ive-sci.com);および、Zeiss(CarlZeiss, Inc.、ニューヨーク州Thornwood)。
【実施例】
【0159】
実施例1
同じ細胞セットに繰り返し戻るための撮像プロトコル
これらの実験では、培養中の同じ細胞セットに繰り返し戻るための方法を説明する。これらの方法を用いることにより、可動顕微鏡ステージ上に置かれた細胞培養皿中の生細胞の1つまたは複数のセットを観察することが可能となる。重要な点として、これにより、培養皿をステージから除去し、細胞を増殖させるためなどの目的でインキュベーに入れることが可能となる。次に培養皿を顕微鏡ステージに載せ、同じ細胞セットを自動的に観察に供することが可能である。これらの段階は所望のまたは必要な回数繰り返すことができる。
【0160】
これらの実験では、種々の化合物を培養皿に灌流させながら細胞セット(倍率10Xで細胞500〜1000個)の反応をモニターすることができる。指定された数のチャネルからなる画像のスタックが、指定された長さの時間にわたって指定された間隔で1回以上取得される。編集可能な(テキストの)レシピファイルにより、使用される実験レシピが指定される。「スナップショット」用には1画像のみのスタックが取得され、「微速度撮影」実験用には画像の完全なスタックを規則的な間隔で取得することができる。連続微速度撮影実験では実験と実験との間にユーザーがステージまたは培養皿を動かさないことが好ましいため、本発明により、培養皿を動かす前に同じ細胞セットに対して連続的に複数の微速度撮影実験を行うことを容易にする。所望の分析を行った後、培養皿は顕微鏡ステージから取り除かれ、必要に応じて数時間または数日間インキュベータ内に置かれる。培養皿を顕微鏡ステージに戻したとき、細胞は生きていてもまたは死んでいても(例えば、固定または染色された細胞であっても)よい。無論、死細胞を使用する場合は微速度撮影実験は行われない。ただし、これらの実験においては、繰り返しモニターされる単一の細胞セットが周囲の多くの細胞セットを代表していることを確認する目的で、細胞周囲の視野も「スナップショット」画像スタックを取得することによって撮像される。
【0161】
これらの実験では、ファイル名の中の_0、_1、_2、_3、_4、_5、および_Xによって「チャネル指示子」が指定される。これらの数字は光学フィルタホイールの特定の位置を示し、_Xは透過光画像を示す。フィルタホイールの各位置の光学フィルタの識別は、波長に応じて各画像のヘッダーに記述される。使用する透過光の種類は指定されない。例えば「dc122999dc2.0001.1_0ics」とはフィルタホイールの位置「0」で画像が取得されたことを表す。画像ヘッダーに基づくと、この位置のフィルタは360nmの蛍光励起フィルタである。チャネル指示子「dc122999dc2.0001.1_X.ics」とは透過光シャッターを開放した状態で画像が取得されたことを示す。この画像は位相差像、DIC、明視野像などであってもよい。これらの実験で使用されるフィルタホイールの各位置の光学フィルタの最大波長の識別は、後に詳述する編集可能なconfigテキストファイルに記述される。
【0162】
「細胞セット」とは、特定の倍率でデジタル画像中の特定の視野内に見えるすべての細胞を指す。数時間および数日間の過程を通じて、単独の生細胞が大きくなり分裂して2つになる、細胞が崩壊する、細胞が死んで浮流する、および個々の細胞が移動するなどの可能性がある。細胞セットの最初の位置は、培養皿(例えばぺトリ皿)表面に物理的にエッチングされた「+」(十字線)記号である(0,0)点に対する相対的な位置として特定される(図52参照)。
【0163】
「画像スタック」とは、単一の時点における指定された全チャネルの集合である。例えば、画像スタックの微速度撮影系列中の7番目のスタックは以下のようになりうる:

【0164】
「レシピファイル」とは、使用するプロトコルを指定するテキストファイルである。例えば、レシピファイルは以下のものを含む:
どの蛍光チャネルが完全画像スタックに含まれるか;
各チャネルの露出時間;
画像チャネルが取得される順序;
微速度撮影実験で取得される画像スタックの間隔;
取得するスタックの数;
フィルタホイールの各位置の励起フィルタの識別。
【0165】
方法の実施中、複数回の反復が可能である。例えば、「初回の反復」ではこれまで撮影されていない細胞の培養皿が使用される。細胞の入った培養皿にエッチングされた十字線を使用して、コンピュータ画面上で(0,0)マークが設定される。ユーザーは観察する細胞セットを探す。この段階において、種々のシャッターが開閉され、フィルタホイールが種々の位置に動かされ、かつ、プログラムは(0,0)マークに対してユーザーが培養皿をどこに移動したかを追跡し続けなければならない。次にユーザーは関心対象の細胞セットに焦点を合わせる。次に、レシピファイルの情報に基づいて実験が行われる。この初回の実験は、典型的に、生細胞の微速度撮影アッセイとして行われる。
【0166】
しかし、他の態様では、固定または染色された細胞の一連の「スナップショット」が使用される。次に、細胞またはステージを動かすことなく(焦点を再度合わせるのは許容される)レシピファイルが再編集され、1つまたは複数の微速度撮影実験が行われる。次に、細胞の入った培養皿が取り除かれ、必要時までインキュベータ(または他の保管場所)内に置かれる。「スナップショット」を使用するいくつかの態様では、他の細胞セットを観察するためユーザーが培養皿を動かし、追加のスナップショットが撮影される。
【0167】
「2回目の反復」では細胞セットが再度観察される。この細胞セットはすでに撮影され、かつ、その位置に関する情報が保存されている。まず、分析する細胞の入った培養皿が顕微鏡ステージに置かれる。十字線マークの最初の透過光画像が取得される。ユーザーは画面上の(0,0)マークを「クリック」し、どの細胞セットを観察するかをプログラムに指示する。プログラムは視野を(0,0)マークに移動させ、次に適切な細胞視野に移動させる。ユーザーは細胞に焦点を合わせ、編集されたレシピファイルの情報に基づいて実験を行う。この段階において、ユーザーは焦点を合わせるためにシャッターを開きかつフィルタホイールを動かす。細胞またはステージを動かすことなく(焦点を再度合わせるのは許容される)レシピファイルが再編集され、1つまたは複数の追加の微速度撮影実験が行われる。スナップショット実験では、所望に応じて視野が変更され、かつ、所望の数の追加のスナップショットが取得される。実験プロトコルの最後として、細胞の培養皿がステージから取り除かれかつ保管場所(例えばインキュベータ)に戻される。「n回目の反復」について、生細胞のセットが繰り返し撮像されかつ細胞位置に関する情報が保存される。事象の順序は2回目の反復と同様である。
【0168】
実施例2
VSOMの使用
本実施例では、本発明のVSOMの装置およびその他の局面について説明する。
【0169】
A.VSOMシステム光学プラットフォーム
一般的に、顕微鏡が倒立型(すなわち対物レンズが上向き)の形状であるほうが細胞チャンバおよび細胞容器の設計が容易であるため、大多数の態様において、VSOMシステムは倒立型の蛍光顕微鏡を中心に構成される。しかし、正立顕微鏡(対物レンズが下向きの顕微鏡)で使用できる細胞チャンバも存在する。本発明のVSOMシステムはこのような光学プラットフォームとともに使用するのに適している。カメラおよび顕微鏡周辺装置を顕微鏡に取り付けても安定するだけの十分な重量をもった、生物学研究に適した等級の蛍光顕微鏡が好ましい。いくつかのVSOM実験には標準的な10倍対物レンズで十分である。研究用等級の顕微鏡、対物レンズ、および種々の周辺装置は、カール・ツアイス(CarlZeiss, Inc.、ニューヨーク州Thornwood)およびニコンUSA(Nikon USA、ニューヨーク州Melville)など種々の製造業者により製造されている。環境制御細胞チャンバは、ツアイス、ハーバード・アパラタス(HarvardApparatus、マサチューセッツ州Holliston)およびバイオプテクス(Bioptechs, Inc.(Biological OpticalTechnologies)ペンシルベニア州Butler)など種々の種々の製造業者により製造されている。
【0170】
B.VSOM周辺装置
本発明の好ましい態様に使用できるデジタルカメラとしては、低照度蛍光鏡検法の用途向けに設計されたもの(例えば、ローパー・サイエンティフィック(RoperScientific Inc.、アリゾナ州Tucson)およびクウォンティテイティブ・イメージング(Quantitative Imaging Corp.、カナダ、Burnaby)などの企業により製造されているもの)が含まれる。このようなカメラは、12ビットデジタル化能力を有する科学等級のCCDを有しており、かつ、約7μm×7 μmのサイズである合計約100万ピクセルを有する。このようなカメラは、C++ソースコードおよびソフトウェア開発キットを含むソフトウェア開発キット、または、ホストPC上でカメラ操作をソフトウェア、光学素子、電気素子、および機械素子(すなわち顕微鏡周辺装置)と統合するソフトウェアを記述するのに使用できるホスト接続キットとともに入手可能である。これらのカメラは、ホストコンピュータを介してカメラの機能をプログラムできるよう、PCIコンピュータインターフェースカードまたは直接接続の「ファイアワイア」(IEEE1394)ケーブル接続など、種々の業界標準のコンピュータインターフェースとともに提供されている。
【0171】
デジタルカメラに加えて他の周辺装置も本発明とともに使用でき、このような周辺装置としてはXY走査ステージ、光学フィルタホイール、Z軸焦点粗調整モーター、ならびに、透過光シャッターおよび表面蛍光シャッターが含まれる(例えば、LUDLエレクトロニクス・プロダクツ(LUDLElectronics Products, Ltd.、ニューヨーク州Hawthorne)などの製造業者から入手可能な周辺装置)。種々の製造業者が他の装置を提供している。例えば、シャッター・インスツルメント(SutterInstrument Co.、カリフォルニア州Novato)は光学フィルタホイールおよびロボットマイクロマニピュレータを製造しており、シリンジポンプはハーバード・アパラタス(HarvardApparatus、マサチューセッツ州Holliston)から、顕微鏡対物レンズナノポジショナ(圧電ポジショナ)はフィジック・インツルメンテ(PhysikIntrumente、ドイツ、Waldbronn)からそれぞれ入手可能である。これらの企業は、それぞれの周辺装置用に適切なプログラマブルコントローラも販売している。ハーバード・アパラタスは、種々の環境センサー(酸素、乳酸、グルコース、pHなど)を操作およびホストコンピュータとインターフェースするための、PLUGSYSならびに同様の測定および制御装置も販売している。
【0172】
C.生物学的試薬
生物学的試薬および蛍光標識などは多数の製造業者から入手可能である。例えば、生細胞用の蛍光プローブはモレキュラー・プローブズ(Molecular Probes、オレゴン州Eugene)から入手可能である。他の細胞培養培地、細胞増殖用の装置および供給品、ならびに関連する装置および供給品は、標準的な供給業者(例えばシグマ(Sigma)、フィッシャー(Fisher)など)から入手可能である。
【0173】
D.VSOMホストコンピュータ
本発明の好ましい態様では、1つまたは複数の使用可能なPCIスロット(デジタルカメラがホストコンピュータとのインターフェースにPCIスロットを必要とするか否かによる)と、標準的なシリアルポートおよびパラレルポートと、OHCI互換IEEE1394ポート(ファイアワイア対応デジタルカメラが必要とする場合)と、256 MBのRAMと、1つまたは複数の18 Gbyteハードドライブと、テープバックアップユニットと、イーサネットアダプタと、32ビットカラービデオカードと、高解像度モニター(好ましくは1280×1024ピクセル)とを有し、かつ、あるバージョンのLINUXまたはMicrosoftWindowsを実行する、450 MHz Pentium IIIクラスの業界標準のPCを必要とする。オンラインの画像セグメント化および分析を行うために、デジタルカメラおよび種々の顕微鏡周辺装置の作動を前述のソフトウェアおよびアルゴリズムと統合させるため、標準的なC++コンピュータプログラミングの技術が必要である。したがって、標準的なC++プログラミングソフトウェア、およびMicrosoftVisual Studio C++などの統合ソフトウェア開発パッケージが必要である。さらに、標準的なデジタル画像取得、周辺装置の制御およびオートメーション、ならびに標準的な画像処理、プロッティング、および表示操作のためのC++ライブラリを含むソフトウェアパッケージが望ましい。このようなパッケージとしては、「SCILImage」(TNO、オランダ、Delft)、「MetaFluor」および「Metamorph」(ユニバーサル・イメージング・コーポレーション(UniversalImaging Corporation、ペンシルベニア州Downingtown))、ならびに、「Component Works++」(ナショナル・インスツルメンツ(NationalInstruments、テキサス州Austin))などがある。さらに、場合によっては、顕微鏡周辺装置の数およびVSOMシステムで制御される環境センサーの数が増加するにしたがって、ナショナル・インスツメンツが製造しているものなどの標準的なアナログ-デジタルインターフェースカードが必要となる。
【0174】
E.VSOMの実施
光学プラットフォームに加えて、VSOMの最小限の実施には以下のそれぞれが少なくとも1つ必要である:温度制御された細胞チャンバ、コンピュータ制御されたシリンジポンプ、照明シャッター、および、光学フィルタホイール。最小限で実施される実験には透過光を扱える能力は必要ではなく、蛍光鏡検法のみが必要となる。必要である唯一の微小環境制御装置は、標本容器に挿入できる温度プローブを有する、温度を37℃に維持できる温度制御ユニットである。最小限で実施される実験では、光学プラットフォームが比較的安定であり振動がないという前提において、対物レンズのZ軸調整は必要でない。観察の必要があるのは単一の細胞視野のみ(多視野ではない)であるため、XY位置決めステージも必要でない。しかし、本発明がこの特定の設計形式に限定されることはない。
【0175】
1つの態様において、細胞は、標準的な細胞インキュベータ内で標準的なプラスチック性のペトリ皿の中で標準的な技術を用いて実験前に増殖される。いくつかの態様において、細胞は、生細胞に適した核染色法により実験前に標識される。例えば、生細胞の核を染色するため、Hoechst33342(H42)が以下の方法で使用される。適切なサイズの標本容器(例えば丸型の35 mm細胞培養皿)に24時間付着させた細胞を、細胞インキュベータ内で1.0μg/mLのH42に約90分間曝露する。この曝露の後、H42および細胞増殖培地中に存在するフェノールレッド指示薬を洗い流し、フェノールレッドまたは過量のウシ胎仔血清を含まない、新鮮な培地に交換する。標本容器が細胞チャンバ内に置かれ、オペレータは適切な細胞視野に焦点を合わせ、次に画像出力をデジタルカメラに送る。コンピュータ制御のシリンジの1つには蛍光プローブを含まない適切な溶液(血清またはフェノールレッドを含まない、細胞培地など)が充填され、他のシリンジには同じ溶液と生細胞に適した蛍光プローブとが充填される。たとえば、カルセイン-AM(CAM)は細胞株中の多剤耐性(MDR)の存在を示すことができる適切なプローブである。最小限のVSOM実施可能コンピュータ制御MDRアッセイでは、約1.0μMのCAM溶液が1分あたり約0.5 mLの流量で細胞チャンバ内に灌流される。この化合物は生細胞の膜を通過し、次に代謝され、蛍光性となり、かつ、細胞内に保持される。当業者には周知であるように、細胞が1つまたは複数のMDRタンパク質を有するならば、その細胞はCAMを細胞外に搬出する能力を有する。これらの場合、CAMの存在下において細胞が化合物を取り込む速度は低下し、かつ、CAMがチャンバから洗い流された後に細胞が保持するCAMの量は少なくなる。
【0176】
VSOMシステムはCAM溶液の灌流を開始し、かつ、核内のH42の青い核蛍光信号を用いて生細胞の視野を連続的にセグメント化する。このように、核を描く輪郭が青チャネルで取得される。核領域におけるCAMの平均蛍光強度を計算するため、これらの同じ輪郭が緑チャネルでも使用される。CAMは細胞全体に均一に分布することが多いため、核領域に加えて細胞質領域を検出する必要はない。適切な間隔(例えば60秒ごと)で画像が取得されると同時に、このように緑チャネルにおける平均細胞内蛍光強度(MI)が各細胞の核領域について観察される。
【0177】
次に、下記のような方法で細胞チャンバ内のCAM量を調整するため、コンピュータアルゴリズムが以下のサーボループオペレーションを実行する。各画像取得点について全細胞の平均MI(前述に定義のとおり)がモニターされ、次に以下が実行される:
a)視野内の全細胞の平均MIがユーザー定義の閾値に達すると、CAMの入ったシリンジが遮断され、かつ、CAMの入っていないシリンジがオンになる;または、
b)視野内の全細胞の平均MIが、(a)で達した最大平均MIからユーザー定義のパーセンテージ分減少すると、CAMの入っていないシリンジが遮断される;
c)実験終了。
【0178】
このような最小限の実験において、CAMの取込みおよび保持の個々の率が細胞ごとに取得される。システムは次に、実験の最後に、視野内においてMDRを示した細胞の数(またはパーセンテージ)を報告することができる。さらに、このような細胞はこれによって同定され、かつ、MDRを変化させる化合物を試験する次の試験に供することができる。しかし、本発明がこの特定のシステム、形式、細胞などに限定されることはない。事実、本発明は実験デザインの面においてユーザーに最大限の柔軟性を提供する。
【0179】
実施例3
VSOM実験
本実施例では、実施例2の説明に以下に記載の変更点を加えて実施したVSOM実験について説明する。
【0180】
使用した光学プラットフォームは、透過光鏡検法(位相差法およびDIC法)および多色蛍光鏡検法用の装備を有するTV倒立顕微鏡、Zeiss Axiovert135 H/DICである。顕微鏡には、コンピュータ制御のXY走査ステージ、Z軸ステップモーター、および6位置フィルタホイール(LUDLエレクトロニック・プロダクツ(LUDLElectronic Products, Ltd.、ニューヨーク州Hawthorne))を装備した。これらの研究では、Kodak KAF-1400 CCDチップ(1317×1035ピクセル、7×7ミクロンピクセルサイズ)を有する12ビットのXillixCCDカメラ(キシリックス・テクノロジーズ(Xillix Technologies、ブリティッシュコロンビア州Vancouver))を使用した。このカメラは8MHz(すなわち、1セットあたりフルサイズ画像約4枚)の読み出し速度を有する。ホストコンピュータはマルチタスクUNIXワークステーションであるSparcstationUltra 1とし、コンピュータカメラから出力された画像をホストコンピュータに直接読み取らせた。
【0181】
さらに、ペルティエ温度制御マイクロ灌流チャンバ(TC-202二極式温度制御装置を有するPDMI-2開放チャンバ、ハーバード・アパラタス/メディカル・システムズ・リサーチ・プロダクツ(HarvardApparatus/Medical Systems Research Products、マサチューセッツ州Holliston))およびデュアルシリンジポンプ(Pump-33、ハーバード・アパラタス)を使用した。これらのシリンジは、同じサイズである必要はなく、かつ、灌流速度が独立に制御できるよう各シリンジがそれぞれコンピュータ制御のブロックを有する。「浴槽」タイプのサーミスタ(BSC-T3、計36Kオーム)をPDMI-2とともに使用した。
【0182】
いくつかの好ましい態様において顕微鏡の設計が倒立式であることによって、生細胞の灌流が可能となり、不動化された細胞が下から撮像された。本発明のいくつかの態様では油浸対物レンズが使用できる。また、細胞は、いくつかの態様では35mmペトリ皿の中で、他の態様では円形のカバーガラス上で増殖され、下から観察される。この倒立顕微鏡の構成により、ユーザーは蛍光から透過光検出(位相差またはDIC)に切り替えることができ、かつ、細胞の位置および形態を確認することができる。これはコンピュータ制御の透過光シャッターにより実現される。フィルタホイールにあるコンピュータ制御の表面蛍光シャッターも使用可能である(LUDL)。これらの実験において、システムの自動視覚サーボ制御オペレーション(すなわち、ポンプ、照明シャッター、フィルタホイール、およびXillixカメラの制御)はプログラム「ADR」で実施した。あらかじめプログラムされたレシピを使用して実施したVSOM実験ではプログラム「VX5」を使用した。
【0183】
A.ADR視覚サーボ制御実験
MCF-7 WTC細胞を35 mm細胞培養皿で増殖させ、H42で前染色した。H42とともに約1時間プレインキュベーションした後、細胞をDPBSGPですすぎ、温めた顕微鏡チャンバに入れた。ADRプログラムは以下の要領で問題なく動作した。この実験中、指定した一定の間隔で3枚のデジタル画像(360nm励起、490 nm励起、および透過光、明視野)が取得され、かつ、次の撮像間隔より前に、H42で染色されたすべての核が検出およびセグメント化された。青チャネルで描出された各核の輪郭を用いて、平均細胞蛍光強度の値が緑チャネルから算出された(MI)。DBPSGP溶液のみ(シリンジ#1)による最初の灌流を1.0mL/分で8.3分間実施し(ユーザーの指定による)、次にシリンジ#1が停止された。次に、1 μMのCAMを含むDBPSGP溶液(シリンジ#2)の灌流を0.5mL/分で開始した。全細胞の平均MIが指定の閾値に達したときに、正常な視覚サーボ制御によりシリンジ#2が停止された。細胞が十分量のCAMを蓄積しかつシステムが十分量の細胞内CAMを(核領域で)検出し、システムが正常にシリンジ#2を停止させかつシリンジ#1を再始動させるまでに、13.9分を要した。11.4分後(ユーザーの指定による)に、システムは再度シリンジ#1を停止させた。システムは引き続きチャンバ内の細胞をモニターし(ユーザーの指定による)、流れがない状態でさらに24.9分間が経過した。次に、実験終了時にシステムは画像取得を停止した。
【0184】
実施例4
MDRアッセイ-試験キットおよびVSOM実験
本明細書に記載のとおり、VSOM実験においてMDRアッセイβ試験キットの試験も行った。図11にこのVSOM実験の略図を示す。各ポンプは、あらかじめプログラムされたレシピに従って、または個々の細胞反応のリアルタイム分析に基づいて、指定された流量でオンおよびオフになる。使用したCAM、V、MKの濃度を図中に示した。CAMへの3回の曝露はそれぞれ900秒間(20分間)であり、したがってCAMへの総曝露時間は60分間であった。本図の下部の黒い窓は視野内の全細胞の反応の平均を示す。この平均反応プロットはVSOM実験中コンピュータ画面に表示され、かつ、1つまたは複数のチャネルのデジタルイメージも画面に表示される(通常、表示されるチャネルの1つは透過光である)。
【0185】
実験中、プロットおよび画像は継続的に再描画および更新される。MCF-7(DS、実行(run)#1)およびMCF-7 ADR(MDR、実行#2)について記録された2つのプロットにおいて、DS細胞のカルセインの蓄積量(240± 82、N=336)はMDR細胞の蓄積量(103 ± 80、N=161)より多いことが見出された。このことは、多数の細胞の平均を表すマルチウェルプレート実験で観察される、DS細胞とMDR細胞とのカルセイン蓄積の相対的な差異と一致する(前述の表1参照:1658/4822=0.34、1965/6598=0.30、VSOM:103/240=0.43)。しかし、VSOM実験では各細胞の平均細胞蛍光がモニターされ、かつ、平均値からの逸脱の検出が容易であった。例えば、複数の細胞が生存率および原形質膜完全性を失い始めた。このような細胞はカルセインを保持することができず、カルセインが漏出してその結果蛍光信号が低下する。これは、前述のDMSOの毒性に関連した影響である可能性がある。しかし、本発明を使用する上で機序の理解は必要ではなく、かつ、本発明が特定の機序に限定されることはない。それでもなお、単一の細胞の死がみとめられた時点で容易に曝露/灌流を終了させる能力を現在のVSOMシステムが有することは注意を要する。
【0186】
図13は、本実施例の実行#2の結果から、選択した4つの細胞の細胞反応を示したものである。これらの反応曲線はβ試験キットの基礎をなす原理を示すよい例である。反応曲線のうち2つでは(図13)、シリンジ#5の作動中に(図11)ベラパミル(V)に曝露されるまで細胞はカルセインを蓄積しない。PgpポンプはMK-571(MK)で阻害されないことから、これらの細胞はPgpポンプのみを発現していると解釈することができる。DS細胞の母集団中にこれらの細胞のいずれも存在しないことは明らかである(図12)。さらに、CAM+V曝露後、1つの細胞は、その平均細胞蛍光が、DS細胞で観察される平均細胞反応の一方の標準偏差の範囲内に達するまで急速にカルセインを蓄積した(図12)。他のすべての要因が同じであると仮定すると、第二の細胞はPgp分子の含有量が少ないと予測できる。残る2つの曲線(図13)は、CAM(のみ)およびCAM+MKの曝露中に別の反応を示しており、これはさらなる分析を要する。観察された曲線は、内在化したカルセインを排出する能力をもたない2種類のポンプのみの存在または不在の観点からは説明できない。しかし、本発明を使用する上で機序の理解は必要ではなく、かつ、本発明が特定の機序に限定されることはない。これは、フローサイトメトリーアッセイおよびマルチウェルプレートアッセイでは得られない種類の詳細な生理学的情報である。対照的に、本明細書に示したVSOM技術はこれらの能力を有している。
【0187】
例えば、カルセインの蓄積および保持に関する詳細な率の情報がVSOM実験全体を通して利用可能である。いくつかの反応曲線について、3回のCAM灌流中のカルセイン蓄積率を計算することができる。さらに、BUFF灌流中のカルセイン保持率も計算することができる。カルセイン蓄積は1500秒、3500秒、および5500秒の時点で生じたことが見出され、かつ、良好なカルセイン保持に対応するプラトーは2500秒、4500秒、および6500秒のインターバルで観察された。前述のとおり、いくつかのMDRポンプはカルセインが細胞内に内在化された後にこれを排出する能力をもっている。内在化されたカルセインを排出するDS細胞の能力は、BUFF灌流に対応する2500秒の期間中に顕著である(図12参照)。しかし、2つのMDR細胞(図13)はこの能力をもたない。
【0188】
さらに、前述の教示を使用すると、コンピュータが判断を行うあらかじめプログラムされたマニピュレーションは視覚的サーボ制御オペレーションに適している。
【0189】
実施例5
修飾試薬を用いたデジタル撮像蛍光法
VSOMを使用して、デジタル撮像蛍光顕微鏡を自動化することができる。例えば、修飾試薬MK-571(10 μM)またはベラパミル(50 μM)を含むカルセイン-AM(CAM、0.25μM)をマイクロ灌流チャンバに灌流させることができる。MK-571は膜貫通タンパク質MRPに対する特異的な阻害剤であり、一方、ベラパミルはMRPを阻害するとともに膜貫通タンパク質PgPも阻害する。これらの膜貫通タンパク質はいずれも外来性の化合物を排出し、これらタンパク質は多剤耐性に関与していると考えられている。これら2つの異なるタンパク質をコードしているのは別々の遺伝子である。これらタンパク質の薬剤交差耐性プロフィール(スペクトル)は、重複するものの完全に同じではない。さらに、前述のとおり、これらタンパク質は種々の阻害剤に対して異なる感受性を有する。
【0190】
Hoechst 33342で標識したMCF-7ADR細胞を35℃で観察し、細胞ごとの平均蛍光強度(MI、カルセイン)を求めた。細胞ごとの平均蛍光強度(MI、カルセイン)はリアルタイムで計算され、シリンジポンプのソフトウェアオペレーションはこれらの計算結果に基づいて実行される(すなわち視覚的サーボ制御)。これらの実験で使用されるプロトコルは、前述のMDRベータ試験キット(モレキュラー・プローブズ)を基礎にしている。画像は以下の3つの灌流インターバル中に取得される:(1)0〜2100秒、CAM;(2)8600〜11,000秒、CAM+MK-751;および(3)14,000〜16,000秒、CAM+ベラパミル。典型的には、3番目の灌流インターバルまでにすべての細胞が反応する。MRPおよび/またはPgPを発現している部分母集団は、以下のように、MI> 200となる反応に基づいて推論される:(a)1で反応(PgPおよびMK-571のいずれも発現なし)、(b)2まで反応しない(MRP)、および(c)1または2、のいずれでも反応しない(PgPのみ)。インターバル1の間はPgPおよびMK-571のいずれの発現も観察されなかったが、インターバル2ではMRPの発現が観察された。MK-571によるMRP阻害のため、30個の細胞においてカルセイン蓄積によるMIの増加が200を上回った。3枚のデジタル画像(各チャネルは60秒ごとに取得された)。例えば、細胞#10のMIは、この2400秒の灌流インターバル中に30から760に増加した。
【0191】
実施例6
生細胞用のBrdU増殖アッセイ
本実施例では、生細胞用のBrdU増殖アッセイシステムについて説明する。特定の細胞反応を特定の生物学的エンドポイントに相関付けできるならば、任意のVSOM予測アッセイの予測力が向上する。アポトーシス用の蛍光アッセイは複数存在するが、DNA合成または細胞増殖の定量化に使用できるBrdU取込みなどの重要なパラメータを測定できる生細胞用の蛍光アッセイはほとんどない。これらの実験において、BrdU取込み量を定量化することによって生細胞の増殖状態を検出するための画像比演算技術が開発された。このアッセイのためのプロトコルは、発表されているDr.Paul Yaswen(Stampferら、Exp. Cell Res.、208:175-188 [1993])のプロトコルをもとに適合させたものである。細胞株および培地は同じものを用いた。しかし、DNA合成アッセイ用として、[3H]-チミジンの代わりに5-ブロモ-2'-デオキシ-ウリジン(BrdU)を使用した。これらの実験は、5-ブロモ-2'-デオキシ-ウリジン標識および検出キット(No.1296736、ベーリンガー・マンハイム(Boehringer Mannheim))を使用して行った。VSOM実験の後、細胞を固定し、かつ、従来の間接免疫蛍光アッセイを用いてデジタル画像比演算に基づいてVSOMの結果を確認した。
【0192】
増殖するよう刺激を与えた細胞は、細胞分裂の準備においてDNAの相補鎖を通常の2倍合成する。活発に増殖するこれらの細胞は、細胞外の培地からA、T、C、およびGのヌクレオチドを取り込み、これらをDNAの合成に使うことができる。しかし、BrdUの存在下ではTの代わりにBudUがDNA合成に使われる。したがって、細胞の母集団を短時間(例えば1時間)BrdUに曝露すると、その1時間の曝露中にDNAを合成した細胞の部分母集団ではほとんどのBrdUがその核のDNAに組み込まれる。これは「パルスラベル」実験と呼ばれる。この実験は、Hoechst33342(H42)およびSyto 16(S16)の蛍光発光強度の比が、BrdU取込み量を細胞単位で決定する上で有用か否かを決定することを目的に実施した。
【0193】
H42およびS16は生細胞のまたは固定された細胞の核を染色する。H42の蛍光発光はDNAにBrdUが組み込まれていると消失(減少)する。しかし、S16の蛍光発光は組み込まれたBrdUの存在による影響を受けない。したがって、H42/S16蛍光強度の比(デジタル画像を用いてピクセルごとに計算される)は、各細胞のDNAに組み込まれたBrdUの量に比例すると考えられる。
【0194】
これを決定するため、これらの実験では184B5細胞の3つの培養皿を使用した。最初の48時間、2つの培養皿には無血清のMEBM(乳腺上皮細胞基本培地、CC-3151、クロンティックス(Clonetics))を使用し、3番目の培養皿には無血清のMEGM(乳腺上皮細胞増殖培地、MEGM、CC-3051、クロンティックス(Clonetics))を使用した。MEGMはウシ下垂体抽出物(BPE)、ヒドロコルチゾン、ヒト上皮成長因子(EGF)、およびインシュリンを含むが、MEBMはこれらを含まない。したがって、最初の48時間、培養皿3には増殖に一般的に必要な因子がすべて存在したが、培養皿1および2にはこれらが存在しなかった。MEBMは細胞を基礎代謝レベルで支持するのみであり、細胞の付着または増殖を支持するよう意図されたものではない。48時間後、培養皿2にはMEGMを添加し(この2段階処理を「MEBM+EGF」と呼ぶ)、培養皿3にもMEGMを添加したが、培養皿1にはMEGM-hEGF(BPE、ヒドロコルチゾン、およびインシュリンは存在)を添加した。培養皿1の処理を「MEBM-EGF」と呼ぶ。
【0195】
Stampferらの図4で示されているように、184B5細胞では供給から約18時間後にDNA合成がピークに達し、DNA合成量はMEGM細胞が最大となり、MEBM+EGF細胞ではそれより少なかった。MEBM-EGFに維持した細胞ではDNA合成がほとんど認められなかった。これらの結果は[3H]-チミジンを用いて得られたものである。本発明の開発中に実施した実験では、BrdUによるパルスラベルを1時間行い、次に生細胞をH42およびS16で二重染色した。細胞のデジタル画像を360nm励起(H42信号)で1枚取得し、かつ、490 nm励起(S16信号)で第二の画像を取得した。これらの画像を処理し、ピクセルごとに比を計算した。次に、分析の便宜のため、得られた比の値をカラーコード化した。これらの結果は、従来の[3H]-チミジン組込みアッセイで得られたものと一致していた。BrdU組込みの程度はMEGM細胞(培養皿3)が最も大きく、次に大きかったのがMEBM+EGF細胞(培養皿2)であり、MEBM-EGF細胞(培養皿1)ではBrdU組込みがほとんどみとめられなかった。
【0196】
これらの観察結果をさらに確認するため、70%エタノールおよび50 mMグリシンで、pH 2.0、-30℃で細胞を固定し、間接免疫蛍光染色を行った。この染色後、抗BrdU抗体で標識された固定細胞にBrdU消失を示すH42蛍光の低下もみとめられるか否かを決定するため、H42およびS16で細胞を再染色した。実際にこの影響を示す証拠がいくつか存在した。MEGM細胞が最大量のBrdU染色を示した。同細胞を青チャネルで調べたところ、BudUで染色される細胞はH42蛍光信号が低いという一般的な傾向がみとめられた。BrdU取込みを定量化する方法は2つある。第一は抗BrdU抗体検出であり、これは赤色の蛍光の強度で表される。第二は、青色の核蛍光強度(H42)を緑色の核蛍光強度(S16)で除した比を細胞ごとに計算するものである(すなわち画像比演算)。BudU取込みによってH42は消光するがS16は消光しないため、赤色を示す核は青チャネルにおいてH42蛍光の低下を示すと考えられる。
【0197】
実施例7
mRNA転写の画像化
本実施例では、VSOM実験の長所を示す実験について説明する。このような実験は、アンチセンス化合物、送達システム、および信号増幅法の開発の補助として、組織培養中のmRNA転写をリアルタイムで画像化する手段を提供すると予測される。リアルタイム医用画像技術に適した放射線標識アンチセンス化合物を提供する実験についても説明する。
【0198】
これらのVSOM実験では、bcl-2タンパク質をコードしているmRNAとともに、モデル系としてヒト乳癌細胞株BT-474が使用される。個々の細胞内の蛍光標識したアンチセンス化合物が追跡され、細胞内の適切な標的mRNAに誘導され、かつ、個々の細胞が予測された方式で影響されているか否かが決定される。デジタル画像蛍光鏡検法、新規性のある計算技術、およびバイオインフォマティクスツールの使用により1つのチャネルで蛍光アンチセンス化合物が追跡され、別のチャネルでは他の細胞反応(例えばアポトーシス)がモニターされる。bcl-2のmRNAレベルでの発現が、時間、細胞外ストレス、およびアンチセンス化合物の構造の関数として画像化される。これらの観察結果は各細胞内のbcl-2タンパク質レベルおよび各細胞の最終運命と相関付けられる。したがって、これらの実験は、PETで遺伝子発現を画像化するためのアンチセンス化合物のインテリジェント設計に有用な、特定のアンチセンス化合物の生物物理学的特性に関する詳細な情報を提供する。事実、本発明のインビトロ技術により、インビボ研究(例えば、異種腫瘍細胞株BT-474を移植したヌードマウスにおける研究)の場合よりも多くの化合物修飾を試験することが可能となる。
【0199】
いくつかの態様において、VSOM実験とインビボPET撮影試験の両方が可能となるよう、同じ配列だが5'末端を修飾したAS-ODN化合物を使用した。VSOM実験では蛍光色素を使用し、PET撮影試験では2つのフッ化放射性成分の1つを使用した。いずれの場合も、蛍光色素および放射性標識の付着を容易にするため5'末端にヘキシルアミンリンカーを結合させた。追加の実験では、送達ビークルとしてリポソームおよびイムノリポソームを用いた。いくつかの実験では、放射線標識試験で使用したフッ化成分の非蛍光、非放射性のバージョンを生物学的エンドポイントの基礎とした。この方式により、AS-ODNの5'末端における種々の置換基の結果を決定した。さらに、β-ガラクトシダーゼプロトコルで得られる信号増幅の量を本発明とともに使用することができる。他の態様ではペプチド核酸が使用される。ペプチド核酸(PNA)は、デオキシリボース骨格全体がポリアミド(ペプチド)鎖で置換された、修飾オリゴヌクレオチドである(Gewirtzら、Blood92:36 [1998]; ならびに、TemsamaniおよびGuinot、Biotechnol. Appl. Biochem.、26:65-71[1997])。
【0200】
1つの態様では以下のASD-ODN配列を使用した。

【0201】
bcl-2のオープンリーディングフレームの最初の6コドンに対するアンチセンス配列を有する、配列番号:1に示した18-merの完全なホスホロチオエートは、重症免疫不全マウスに移植したDoHH2リンパ腫に対する有効性が認められている(Raynaudら、[1997])。15-merの2つのPNA-ODN(配列番号:2および3)は無細胞系でのインビトロ評価が行われている(Mologniら、[1999])。特に興味深いのは、mRNA転写が完全に阻害されるのは両方のPNA-ODNが同時に存在する場合のみであるということである。
【0202】
蛍光標識したPT-G3139、PNA-1、およびPNA-4を市販の供給源から入手した(例えばGenset、http://www.gensetoligos.com)。これらAS-ODNの修飾物であり骨格がPD、PT、MP、またはPNAの骨格結合で完全に構成されるもの、ならびに、骨格結合に種々の置換および混合を有する化合物も使用した。
【0203】
最初の実験を行い、一連の単一細胞の反応としてデータベースに記録した。前述のように骨格結合に種々の修飾を有する、蛍光標識したAS-ODNのセットを使用した。ベースラインとなるVSOM実行のセットを行った。これらの実行において、細胞は顕微鏡カバーグラス上で増殖させ、かつ、細胞観察用に63×NA1.3油浸対物レンズを使用した。細胞を温度管理した微小灌流チャンバに入れた。細胞質区画、核質区画、およびミトコンドリア区画の最初のセグメント化を以下の要領で行った。
【0204】
カルシウム、マグネシウム、グルコース、およびピルビン酸塩を含むダルベッコのリン酸緩衝生理食塩水(D-PBS)に溶解した蛍光化合物TMRE(テトラメチル・ローダミン・エチルエステル;モレキュラー・プローブズ)をコンピュータ制御のシリンジポンプにより細胞チャンバに注入する。化合物TMREは、Nerstの式(Farkasら、前述)によってミトコンドリアの膜電位を決定するために使用される、再配分型のカチオン染料である。ミトコンドリア染料であるローダミン123と異なり、TMREは迅速かつ可逆的にミトコンドリア内で平衡し、かつ、程度はより少ないものの細胞質でも平衡する。核質区画はTMREで染色されない。
【0205】
次に、緩衝液のみが入ったコンピュータ制御のシリンジを使用して細胞からTMREを洗い流す。TMREは細胞から容易に洗い流すことができる。次に、別のコンピュータ制御シリンジを使用して、蛍光標識AS-ODNを微小灌流チャンバに注入する。AS-ODNが発する蛍光信号が可視状態になるときの濃度が記録され、かつ、AS-ODNの灌流が自動的に停止される。これがVSOM実行の前半の終了である。
【0206】
VSOMオペレーションを確認するための再生ができるよう、すべてのデジタル画像がデータベースに追加される。このように、多チャネルデジタル画像、実験パラメータ、および、コンピュータ制御の化合物灌流に対する単一細胞の反応(63×で細胞5〜10個)がデータベースの一部となる。
【0207】
最初のVSOM実行の後半では、蛍光標識AS-ODNの蛍光分布パターンと、細胞小器官特異的蛍光染料(モレキュラー・プローブズ)を用いて同じ細胞種について以前に取得された蛍光分布パターンまたは蛍光AS-ODNと細胞小器官特異的蛍光染料とで二重染色した現在観察中の細胞について別の蛍光チャネルで取得した現在の蛍光パターンとの比較が行われる。VSOMは、細胞内のAS-ODNの位置を決定し終えると、適切なシリンジから適切な化合物を添加して細胞内のAS-ODN分布に対する影響を観察する。
【0208】
蛍光標識AS-ODNのリソソーム隔離が生じる場合は、リソソームを選択的に透過化することが知られている化合物が、コンピュータ制御の灌流シリンジにより制御された流量でチャンバ内に灌流される。モネンシンプロトンイオノフォアナトリウムなど複数の化合物が、ヒト乳癌細胞の酸性小胞内に捕捉された蛍光化合物を解放することが明らかになっている(Schindlerら、[1996]を参照)。蛍光標識AS-ODNを解放するのに必要な(例えば)モネンシンの量がデータベースに記録される。隣接区画(例えば核)への再分布に要した時間およびその結果生じた核内の染色パターンも記録される。
【0209】
核からAS-ODNを除去するためのVSOM摂動は、当業者には周知である「クランピング」技術を使用して実施される。これらの技術により、ユーザーは、単純に周囲の細胞外培地のイオン(例えばカリウム)の濃度を変化させることにより細胞内のカリウム濃度を変化させることができる(Negulescuら、前述)。これと同じ方法を使用することによって細胞内のカルシウムレベルを変化させることができる。VSOMシステムは、核の塩基性タンパク質に対するAS-ODNの結合に干渉するため、細胞内のこのようなイオンの濃度を漸増させる。この場合も、核環境から化合物を解放させるのに必要な濃度およびその他の環境条件が記録される。この方法が成功しない場合は、オンラインの低張細胞溶解が実行され、かつ、以後の実験ではより厳しい環境条件が使用される。
【0210】
いくつかの態様において、VSOMは、細胞膜に結合したAS-ODNを解放するため、非生理学的なpHの緩衝液によるすすぎまたはトリプシン含有緩衝液によるすすぎによって摂動を与える。この場合も、蛍光標識AS-ODNの解放に必要な摂動の大きさに関する定量的データが細胞ごとに記録され、かつ、現在使用中のAS-ODNの化学構造と相関付けられる。
【0211】
好ましい態様において、(蛍光性および非蛍光性の)AS-ODNの生理学的影響が複数の方法で評価される。多くの場合はアポトーシス誘発性細胞外ストレス(例えば、紫外光、抗癌剤、カルシウムイオノフォアなど)が印加される。AS-ODNによるBT-474細胞中のbcl-2タンパク質量の低減が成功した場合は、bcl-2タンパク質の減少およびこれらの細胞のアポトーシスに対する抵抗能力が観察される。最も直接的な方法では、VSOM実験の後に細胞が固定され、bcl-2タンパク質に対する抗体を使用した間接免疫蛍光分析が行われ、続いて、同じ細胞視野に戻ってbcl-2タンパク質の定量が行われる(これは、細胞ごとに観察される蛍光信号と比例する)。しかし、本発明が特定の段階のセットに限定されることはなく、当業者には他の方法も本発明との関連で使用するのに適していることが理解されるものと思われる。
【0212】
当業者に周知の他の多くのアポトーシスマーカーも本発明とともに使用可能である。これらの方法には形態学的アッセイシステムおよび蛍光アッセイシステムが含まれる。例えば、VSOM実験で収集されるチャネルの1つは透過光チャネルであり、このチャネルを介して膜のブレブを観察することができる。また、アポトーシスに特徴的な核断片化を明らかにできる、種々の抗タンパク質(例えばアネキシンV)抗体およびDNA染料も存在する。さらに、すでに詳述したように、細胞膜完全性(例えば細胞の生存率)を示すカルセイン-AMなどの染料も、VSOM実験中に蛍光チャネルの1つで使用するのに適している。さらに、LDS-751で染色した185b5細胞についてすでに詳述したように、アポトーシスの早期に生じるミトコンドリアの膜電位の消失もアポトーシスの指標として有用である。
【0213】
以上より、本発明が細胞種間の差異に関する知識ベースの発見および最適化のための改良された方法およびシステムを提供することは明らかであると思われる。特に本発明は視覚的サーボ制御光学顕微鏡および分析方法を提供する。本発明は、数百の個々の生細胞を経時的に詳しくモニターする手段;多チャネルにおける動的生理学的反応の定量化;リアルタイムのデジタル画像セグメント化および分析;インテリジェントなかつ繰り返しの、コンピュータ印加による細胞ストレスおよび細胞刺激;ならびに、長期的な研究および観察において同じ細胞視野に戻ることができる能力を提供する。本発明はさらに、特定の細胞部分母集団用に培養条件を最適化する手段を提供する。
【0214】
本明細書で言及した発表物および特許はすべて参照として本明細書に組み入れられる。当業者には、本発明の範囲および精神から逸脱することなく、本明細書に記載された本発明の方法およびシステムに種々の改変および変形を行い得ることが明らかであると思われる。特定の好ましい態様に関して本発明を説明したが、特許請求の範囲で請求されている本発明がこのような特定の態様に不当に限定されることはないと理解されるべきである。事実、本発明を実行するための本明細書に記載の方式に対する、当業者に明白である種々の改変は、本明細書に記載の特許請求の範囲に含まれるものと意図される。
【技術分野】
【0001】
本発明の一部は、米国エネルギー省による政府支援を受けた(契約番号DE-AC03-76SF00098)。米国政府は本発明において一定の権利を有する。
【0002】
本出願は、2000年6月8日に出願された米国特許仮出願第60/210,543号、および2001年5月14日に出願された米国特許仮出願60/290,755号の恩典を主張するものである。
【0003】
発明の分野
本発明は、細胞種間の差異を知識ベースで発見および最適化するための方法および装置を提供する。特に本発明は、視覚的サーボ制御光学顕微鏡および分析方法を提供する。本発明はさらに、特定の細胞部分母集団用に培養条件を最適化する手段を提供する。
【背景技術】
【0004】
発明の背景
現在、テレプレゼンス(telepresence)研究においては、地理的に分散した場所に存在する専門家および施設を一つにまとめることが主流となっている(Hadida-Hassanら、J.Struct. Biol.、125:229-234 [1999](非特許文献1); Parvinら、「オンライン施設用視覚的サーボ制御(Visual Servoing forOn-Line Facilities)」、IEEE Computer Mag.、56-62頁[1997](非特許文献2); Potterら、UltraMicros.、77:153-161[1999](非特許文献3); Youngら、J. Supercomputer Appl. High Perf. Comput、pp. 170-181 [1996](非特許文献4);およびParvinら、「分散型鏡検のための協調的フレームワーク(ACollaborative Framework for Distributed Microscopy)」、IEEE Conf. onSuperComputing [1998](非特許文献5))。このシステムは、協調的フレームワーク(Parvinら、[1997]、前述(非特許文献2))とともに現場で広く使用されている。テレプレゼンス研究の焦点は、機器の遠隔機能性、ならびに、大規模なデータ収集および分析に必要な自動化に当てられてきた。カリフォルニア(California)大学バークレー(Berkley)校でのMASHプロジェクト(McCanne、IEEEInternet Comput.、3:33-44 [1999](非特許文献6))では、不均質な環境でMBoneツールを使用して、完全に分散したシステムで、協調的アプリケーション用の拡大縮小可能なマルチメディアアーキテクチャを開発している。NCSAのHaveneroプロジェクトでは、主としてJavaで記述されたコンピュータベースの集中システムにおける共有情報の円滑な管理と全クライアントへの同時配布とが実現されている。ラトガー(Rutger)大学のDISCIPLEは、共有バーチャル空間を実現するためのサービスベースの集中システムにおける分散アクセス用にCORBAフレームワークを使用している。サン・マイクロシステム社(SunMicrosystem)のJava共有開発ツールキット(Java Shared Development tool kit)には、通信セッションの参加者にデータを送信するための協調認識性の(collaborative-aware)Javaコードが用意されている。このコードは、TCP/IPソケット、軽量高信頼マルチキャスト、および遠隔呼び出し法という3種類の転送プロトコルをサポートしている。このフレームワークでは、全オブジェクトが管理可能であり、協調はチャネル、トークン、ブロブ、およびリスナーを含むセッション内で発生する。ミシガン(Michigan)大学のUpperAtmosphere Research Collaboratory(UARC)はウェブベースの分散システムであり、大部分がJavaで記述されている。このシステムは宇宙空間物理学研究用の40以上の観察プラットフォームからデータを収集し、同期協調および非同期協調の両方が可能である。このシステムでは、データ提供者はデータ散布サーバー上で各自のデータを発表する。次に、クライアントは所望の情報を受け取るためにシステムに加入する。
【0005】
テレプレゼンス法は物理科学に加えて生物科学においても使用されている。例えば、ポストゲノム配列決定の時代において、複雑な生物材料の定量的な画像化が重大な課題となっている。事実、種々の鏡検法で得られる逐次的な測定結果には、多次元反応(例えば時間および空間における反応)の詳細な分析が含まれていない。多細胞集合体の大きな母集団における複数のマーカーの空間的および時間的な同時挙動を定量化することは、方法が労働集約的であること、定量化ツールが存在しないこと、および情報のインデックス化ができないことにより困難となっている。理想的には、複数の標的タンパク質について、動態および量、細胞内の状況、ならびに形態学的特徴を大きな母集団を用いて三次元的に追跡できる方法が望ましい。
【0006】
例えば、細胞内の特定のタンパク質成分を識別できる数千の抗体およびその他の試薬が利用可能である。一部の抗体はさらに、リン酸化状態、タンパク質の配座、および複合体生成などの修飾により生じるタンパク質の機能的変異体を識別することができる。細胞内タンパク質の多くはシグナル伝達経路に関与している。電位事象が複雑であること、タンパク質の機能に影響する複数の修飾が存在する可能性があること、ならびに、信号伝達においてタンパク質が活性を示す場所および時点に関する情報が不足していることから、これらの信号伝達経路の詳細は現在のところ明らかになっていない。本来的に存在する生物学的なばらつきおよびゲノムの不安定性も、大きな母集団を対象とした分析の必要性を裏付ける要素である。このように、細胞シグナル伝達に関するより詳細な像を描くのに有用な鏡検法および画像分析法が求められている。このことは、疾患の診断および治療の方法の開発において特に当てはまる。
【0007】
今日では、種々の疾患が分子レベルおよび遺伝子レベルで理解されている。疾患に関係する分子の分析は疾患の診断および予後判定において重要である。しかし、癌などの疾患の研究には、現在のところ技術およびモデルシステムによる限界がある。組織試料は通常複数の細胞種(例:異常な細胞、上皮細胞、ストローマ細胞、内皮細胞、炎症細胞など)を含んでおり、この多様な細胞母集団が、タンパク質および/または核酸の発現に関する定性的または定量的な研究の妨げとなっている。関心対象の細胞(例:腫瘍細胞)は全細胞母集団中に占める割合が比較的小さいことが多いため、典型的な標本中のタンパク質または核酸の実質的な変性についてその有意性を解釈することは困難である。また、培養細胞の研究では、細胞間で生じる複雑な相互作用の詳細を明らかにできない。さらに、現在広く用いられている技術は、組織の固定、抗原抗体認識、および/または組織染色などの方法に依存しており、これらの方法では通常、試料の処理中に分析対象の細胞が死ぬことを避けられない。このことにより、標本中の細胞に関して得られる情報の量が制限される。
【0008】
細胞生理学の研究では、実験で観察された現象に関して理論的仮説を設定する必要性があり、蛍光プローブおよび共焦点顕微鏡などのツールの使用によって、種々の分子種および細胞内構造物の細胞内での空間的配置が三次元で分解できるようになった。しばしばこれらの仮説は次に数学モデルとして構築される。次に、これらのモデルは、実験結果とインビボで観察された現象とを相関させるため、シミュレーションに組み込まれる。
【0009】
しかし、既存の技術には欠点がある。一般的にこれらの欠点は細胞の表現に関する現在の限界に由来するものである。これらの方法において、細胞は、空間的に均一な挙動(すなわち生理学的特徴)と構造(すなわち解剖学的特徴)とを有する、理想的かつ単純な幾何学的形状として表現される。このことは、無傷の細胞を用いた実際の実験と容易に相関するシミュレーションにおいて、観察される生理学的な現象を実際に表現しようとする研究者にとって妨げとなる。したがって、モデルおよび仮説の検証がしばしば非常に困難になる。
【0010】
現在、細胞生理学のモデリングおよびシミュレーションにおける努力の多くは、個々の機序を対象にした非常に特異的なモデルか、またはより複雑な現象の抽象的な表現かのいずれかに向けられている。特異的モデルとしては、個々の分子の相互作用(例:イオンチャネルに関するもの)のモデルがある。抽象的モデルは、根底にある機序の単純化を適用するのが一般的であり、こうした機序は、限定されたクラスの生理学的問題および/または観察結果を説明することのみに適しているのが普通である。このように、リアルタイムの観察、観察された現象と疾患状態との相関付け、およびインサイチューで経時的に細胞を観察するための手段を容易にする方法および装置が必要とされている。
【0011】
さらに、いくつかの種類の癌(例:特定の白血病および精巣癌)では、化学療法が成功して患者に治癒をもたらしている。しかし、固形癌(例:乳癌)については治療法向上の進歩は非常に少ない。固形癌でみられる先天性または後天性の多剤耐性(MDR)は、化学療法による治癒を妨げている重要な障害物の一つである。薬物反応の評価および患者反応の予測のためのインビトロ化学感受性アッセイが40年以上にわたって開発されているものの、真に成功したインビトロ化学感受性試験はまだ確立されていない。したがって、信頼性がありかつ有意義なインビトロ化学感受性試験の必要性が依然として存在する。
【先行技術文献】
【非特許文献】
【0012】
【非特許文献1】Hadida-Hassanら、J.Struct. Biol.、125:229-234 [1999]
【非特許文献2】Parvinら、「オンライン施設用視覚的サーボ制御(Visual Servoing forOn-Line Facilities)」、IEEE Computer Mag.、56-62頁[1997]
【非特許文献3】Potterら、UltraMicros.、77:153-161[1999]
【非特許文献4】Youngら、J. Supercomputer Appl. High Perf. Comput、pp. 170-181 [1996]
【非特許文献5】Parvinら、「分散型鏡検のための協調的フレームワーク(ACollaborative Framework for Distributed Microscopy)」、IEEE Conf. onSuperComputing [1998]
【非特許文献6】McCanne、IEEEInternet Comput.、3:33-44 [1999]
【発明の概要】
【0013】
本発明は、細胞種間の差異を知識ベースで発見および最適化するための方法および装置を提供する。特に本発明は視覚的サーボ制御光学顕微鏡および分析方法を提供する。本発明は、数百の個々の生細胞を経時的に詳しくモニターする手段;多チャネルにおける動的生理学的反応の定量化;リアルタイムのデジタル画像分割および分析;インテリジェントなかつ繰り返しの、コンピュータ印加による細胞ストレスおよび細胞刺激;ならびに、長期的な研究および観察において同じ細胞視野に戻ることができる能力を提供する。本発明はさらに、特定の細胞部分母集団用に培養条件を最適化する手段を提供する。
【0014】
特に本発明は、細胞アレイに含まれる細胞の視野を自動的に検出および分割(segmentation)する方法、ならびに、特に母集団研究を目的として、種々の刺激に対する細胞の反応をコンピュータ制御および外的曝露の関数として計算する方法を提供する。外的曝露は、光学装置(例:顕微鏡)の近くに配置されたコンピュータ制御のシリンジ(またはその他適切な容器)に入った化合物の流れによって制御される。
【0015】
好ましい態様において、VSOMは、選択した各視野における各細胞の特定の副区画を構造的に描出する方法を提供する。視野はxyステージによってユーザーが位置決めする。さらに、VSOMは、視野内にある各細胞の特定の細胞内区画(subcellularcompartment)における反応を測定する手段を提供する。いくつかの態様において、細胞下レベルの反応は、a)プログラミングされた刺激周波数で、かつ、b)細胞アレイに注入された化合物に対する細胞曝露の関数として測定される。さらに本発明は、関心対象の細胞の曝露を反応の測定結果の関数として調整するためのサーボループの制御を提供する。本発明は最大限の柔軟性を提供する。例えば、いくつかの態様においては、視野内の関心対象の全細胞について細胞および/または細胞内区画の反応の平均がユーザー定義の閾値に達すると外的曝露が遮断される。別の態様においては、所望の割合の細胞および/または細胞内区画が、定義された閾値に達すると、外的曝露が遮断される。また別の態様においては、細胞の部分集合および/または細胞内区画の部分集合の反応の平均が特定のプロフィールに達すると外的曝露が遮断される。これらの各態様は、任意の組合せで所望の回数繰り返すことができる。
【0016】
本発明の開発以前は、顕微鏡下で多数の個々の生細胞のデジタル画像を得ることは技術的に困難であった。また、多数の個々の生細胞について、細胞を損傷することなく長期間にわたって細胞内の複数の生理学的反応を同時にモニターすることも困難であった。第一の制限は、主として、いかなる倍率においても視野が限られていることに由来するものであった。使用されるデジタルカメラの内部の固体デジタル撮像装置(すなわち、電荷結合素子;CCD)のサイズおよび分解能が限られていることも、視野をさらに制限していた。本発明では、X、Y、Z顕微鏡ステージのソフトウェア制御によって、複数の視野(すなわち、多数の細胞)を迅速に、自動的に、かつ繰り返しモニターすることを容易にし、これにより上述の制限を克服する。また本発明により、中央コンピュータによる複数の顕微鏡の同時遠隔制御が容易になる。事実、局所の顕微鏡周辺装置(例:走査ステージ、フィルタホイール、灌流ポンプ、ロボットアーム、シャッター、カメラ、等)を制御するために現在使用されているコンピュータ(すなわちクライアント)に関連する、メモリ、ソフトウェア、および処理資源の制限が本発明により克服される。本発明により、インターネットを使用した遠隔制御と、遠隔値のユーザーから地理的に離れた場所に設置されたより強力な中央コンピュータ(サーバー)とでVSOM観察を実施することが可能になる。サーバーは、より処理集約的なタスクを実行または分配し、かつ、現在および過去の細胞反応を記録した非常に大規模のデータベースの中央ロケーションとして機能する。このように、本発明のVSOMは、強力な中央サーバーへのネットワークアクセスの利点、および、単一細胞の反応に関する過去の観察結果と複数情報チャネル間の相関に関する過去の観察結果とが記録された大規模中央データベースの利点を活用するものである。特に好ましい態様においては、VSOMシステムは、細胞を繰り返し検出し、全チャネルについて観察されたすべての細胞反応を記録および分析し、現在の細胞反応を比較し、現在の各情報チャネルについて相関付けを行い、かつ、細胞反応に関する過去の観察結果および各情報チャネル間の相関に関する過去の観察結果が記録されたデータベースに対して問い合わせを行う。単一の実験過程において、次にシステムは、実施中の実験の目的を達成するため、実験パラメータをどのように調整するかに関して知識ベースで一連の決定を行う。
【0017】
したがって、本発明により、単一の比較的短い実験過程の間に複数の完全な実験サイクルを実施することが可能となる。このことは、異なる細胞種間の差異を検索、発見、および最適化するプロセスを大幅に加速させる。必要な細胞数は比較的少ない。また、個々の細胞の反応がモニターされるため、分析用の標本は異なる種類の細胞を含んでいてもよい。「細胞種」とは、ある群に含まれる各細胞が他群の細胞から識別されうる類似の特徴を有するような複数の群に一群の細胞を分けることができる任意の観察方法により達成される分類である。この分類は、個々の単一細胞レベルにおける比較的迅速な生理学的反応を繰り返し観察した結果(例:細胞内構成要素、形態学的変化、細胞分裂、細胞死、剥離などの観察)に基づいて行われるのが一般的である。しかし、この用語は、従来の組織学的基準(例:上皮細胞、腫瘍細胞、筋細胞、脂肪細胞、神経細胞など)に基づいて分類した種々の細胞種も含む。
【0018】
本発明の開発以前は、多数の細胞を対象とした場合に、実験過程中に実験パラメータをどのように変更するかに関する自動的かつ知識ベースの決定を迅速に行うことができなかった。本発明は、実験過程中に「試験/記憶/分析/学習/再設計/再試験」サイクルを多数回実行する能力を提供するものであり、この能力により、以前は実行不可能であった多くの実験および応用が可能となる。細胞が生存状態を維持し、かつ、実験が進行状態およびオンライン状態を維持する場合、刺激に対する過去の反応と未来の反応との相関は細胞単位で維持される。比較的少量の細胞試料を使用して、単一の実験中に多様かつ繰り返しのコンピュータ生成刺激を印加および反復することができる。このことは、細胞種間の差異を検索および最適化する際に大きな利点となる。「刺激」という用語は、単一の刺激、複数の刺激、または複数の刺激の組合せを単回、繰り返し、または連続的に与えることを意味する。生理学的な反応を引き起こす刺激には、機械的、物理的、化学的、および生物学的な実体が含まれる。したがって、本発明はいかなる刺激または刺激の種類にも限定されない。
【0019】
生細胞は移動することができ、または形態を変化させることができる。したがって、細胞の形態測定的特徴、テクスチャ、およびその他の特徴を分析するための手段を提供することが重要である。したがって、ある視野に戻る際、ソフトウェアは、焦点を調節し(z軸制御)、かつ視野を再取得および再登録するため横方向および縦方向にわずかな調整を行う(x,y軸制御)必要がある。さらに、細胞の位置および形状の変化を追跡するため、個々の細胞の外形を規定する元の輪郭を修正する必要がある。したがって、1つの態様では、本発明のVSOMは画像内容の分析結果に基づいて機器の制御に関する決定を行うための手段を提供する。事実、本発明は以下の手段を提供する:生細胞に刺激を繰り返しおよび/または連続的に印加するコンピュータ自動処理の手段;鏡検およびデジタル撮像を用いて、刺激に対する細胞または細胞レベル以下の1つまたは複数の生理学的反応を単一細胞レベルで繰り返しおよび/または連続的に検出およびモニターする手段;信頼性の高い細胞種同定に適した、および/または細胞種間の差異を最適化するための刺激の修正に適した基準を確立するために十分な数の個々の細胞の反応を迅速に観察する手段;細胞が観察および/または刺激に利用できる間に知識ベースの刺激制御を決定できるよう、現在の細胞反応と過去に保存された細胞反応(例:データベース情報)とを迅速に分析する手段;および、時間依存的に生じる事象間の相関を多チャネルにわたってモニターする手段。
【0020】
本発明はさらに、蛍光に加えて透過光を利用して生細胞の輪郭を規定するための手段を提供する。これにより、蛍光成分を含まない細胞の追跡が容易になる。さらに、これにより、細胞毒性を示し得る蛍光標識化合物の使用量を少なくでき、かつ、蛍光発光を生じさせるために必要な強力な蛍光励起照射を回避することができる。したがって、より長時間にわたる細胞の観察が可能となる。さらに、特異的な挙動を示す細胞を実験の最後に個別に回収して、プール(貯蔵)、細胞株の樹立、クローニング、特定の分化状態への誘導、分析などに供することができる。
【0021】
本発明の機器では、撮像を透過光撮像と種々の波長の蛍光撮像とで迅速に循環させることによって、異なる生理学的反応を異なるチャネルで実質的に同時に観察することができるため、本発明により、多数の細胞をモニターすることに加えて、単一の実験中に多数の生理学的反応を観察することが可能となる。
【0022】
マルチウェル蛍光プレートリーダーを使用すると、生細胞の全母集団が発する進行中の蛍光シグナルを検出することができるが、単一の細胞の反応を観測することはできない。しかし、本発明のVSOMの1つの態様においては、マルチウェルプレートリーダーに適した蛍光アッセイの発見および最適化が可能である。また、一般的な技術では、個々の生細胞が発する多チャネル蛍光シグナルをフローサイトメトリーを使用して瞬時に検出することができる。細胞を蛍光シグナルに応じてソーティングすることができ、かつ、回収することもできる。しかし、細胞は検出器を高速で通過し、得られる測定結果は単一のものである(もしくは多チャネルの可能性もある)。個々の細胞が一定の長さの時間にわたって追跡されることはなく、過去の反応と現在の反応とを相関させた同一細胞の繰り返し観察も不可能である。本発明はこれらの制限を克服するものであり、フローサイトメトリーおよび活性細胞ソーティングに適した蛍光アッセイの開発および最適化を容易にする。
【0023】
本発明は、任意の種類の細胞(例:動物細胞、植物細胞、微生物細胞など)に有用な細胞種特異的蛍光アッセイに用途を有する。したがって本発明は、いかなる種類の細胞にも、またはいかなる特定の蛍光もしくは他のアッセイシステムにも限定されるものではない。好ましい態様ではヒトの細胞を対象としているが、他の態様では他の哺乳類ならびに植物および微生物から取得された細胞も対象となる。例えば本発明は、組織から取得された正常細胞、前悪性細胞、悪性細胞、および/または多剤耐性癌細胞を検出および識別する手段を提供する。さらに本発明は、稀な細胞種(例:幹細胞または母体血液中の胎児細胞)を選択的に標識するプロトコルを設計するための手段を提供する。いくつかの態様においては、これらのプロトコルは放射性およびその他の標識システムとともに使用するよう修正される。本発明はまた、個々の患者および/または患者の個々の腫瘍に合わせた化学療法レジメン(薬剤の組合せも含めて)を確立するためのアッセイの設計および応用を容易にする。さらに本発明は、医薬品、農業、バイオテクノロジーなどにおける種々の使用について、候補となる多数の薬剤、殺虫剤、除草剤、およびその他の化合物を検索するうえで有用なアッセイを提供する。さらに本発明は、細胞増殖、細胞毒性、および/または分化における使用について、多数の候補薬剤を検索するうえで有用なアッセイを提供する。
【0024】
本発明はさらに、関心対象の細胞種を増殖上有利にすることによって、または、培養中に存在する他の細胞種に対して細胞毒性として作用する環境条件もしくはプロトコルを設計することによって、特定の細胞種の増殖をもたらす、インビトロの組織培養条件を設計する手段を提供する。したがって本発明は、インビトロでの増殖がしばしば困難である細胞を培養するための手段を提供する。さらに本発明は、細胞を特定の分化終点へと誘導するのに適した細胞培養条件をつくるための手段を提供する。例えば、本発明を用いて、幹細胞または胚性細胞を所望の最終終点へと誘導するために必要な条件を開発することができる。
【0025】
本発明はまた、種々の迅速インビトロ検査の開発および実施に用途を有する。例えば、ある患者に対して候補となる組織または骨髄ドナーが複数存在する場合は、種々のドナーの細胞を患者の免疫細胞と混合し、免疫拒絶反応を単一細胞レベルで観察する。したがって、その特定の患者に対する最適なドナーの同定が容易になる。さらに、これらの検査は、移植拒絶を抑制するよう設計された薬剤(または薬剤候補)の存在下で実施することができ、患者に対する最適なドナーの選択とあわせて、最適な抗拒絶薬の投与レジメン(すなわち、単剤使用または多剤併用)の選択が容易になる。
【0026】
本発明は、細胞または細胞の細胞内構成要素をモニターする検出装置から細胞画像データ(すなわち、細胞の生理学的特徴、形態学的特徴、および/またはその他の特徴に関する情報)を受け取る段階;細胞画像データを分析する段階;ならびに、分析された細胞画像データに応じて細胞または細胞内構成要素を刺激するよう適合させた複数の刺激装置を自動的に作動させる段階を含む方法を提供する。いくつかの態様においては、本発明はさらに、分析された細胞画像データに応じて細胞を刺激するため複数の刺激装置を自動的かつ独立的に作動させる段階を含む。また別の態様においては、細胞画像データを分析する段階は、細胞のサイズの分析、細胞の色の分析、および細胞の動きの分析のうち少なくとも1つを含む。いくつかの好ましい態様においては、検出装置は視覚的サーボ制御光学顕微鏡(VSOM)を含み、この場合、方法はVSOMを用いて細胞をモニターする段階をさらに含む。別の態様において、刺激装置はシリンジである。さらに別の態様において、方法は、細胞画像データを時間の関数として保存する段階をさらに含む。いくつかの特に好ましい態様において、細胞は生細胞であり、かつ、細胞内構成要素は生細胞内の構成要素である。別の態様において、方法は、前述の段階を所望の回数かつ所望の順序で繰り返す段階をさらに含む。
【0027】
本発明はまた、細胞アレイ;細胞アレイが発する光を検出し、かつ細胞アレイで生成された光に対応する第一の信号を、第一の信号を受け取り第一の信号を用いて、被刺激細胞アレイを得るための細胞アレイへの少なくとも1つの検査刺激の送達を制御するための第二の信号を生成するコンピュータに提供する光学システム;および、第二の信号を受け取りかつ検査刺激を送達するロボットシステムを含む、細胞アレイを分析するための方法およびシステムであって、非刺激細胞アレイが発する光を光学システムがさらに検出する方法およびシステムを提供する。いくつかの態様において、検査刺激は第一の信号に従って自動的に細胞アレイに与えられる。いくつかの好ましい態様において、ロボットシステムは少なくとも2つの微量液体チャネルを介して検査刺激を細胞アレイに送達する。さらに別の態様において、光学システムは少なくとも1つの顕微鏡を含む。いくつかの好ましい態様において顕微鏡は共焦点顕微鏡であり、別の態様において顕微鏡は蛍光顕微鏡である。いくつかの態様において、細胞アレイは少なくとも2つの細胞種を含む。さらに別の態様において、光学システムは細胞アレイを走査して、細胞アレイに含まれる細胞種の中の細胞内構成要素を検出する。いくつかの好ましい態様において、細胞内構成要素は、核、核小体、ミトコンドリア、リソソーム、ファゴリソソーム、および貯蔵小胞からなる群より選択される。いくつかの特に好ましい態様においては、少なくとも1つの細胞内構成要素が標識される。別の好ましい態様において、細胞内構成要素は検査刺激により標識される。いくつかの態様において、細胞内構成要素は、蛍光染料、放射性化合物、酵素、および生体染料からなる群より選択される少なくとも1つの化合物で標識される。別の態様において、光学システムは標識をデジタルデータに変換する。さらに別の態様において、ロボットシステムはデジタルデータを利用して細胞アレイへの生物活性成分の送達を自動的に調整する。別の態様において、本発明は、コンピュータシステムの遠隔操作の手段を提供する。さらに別の態様において、本発明は、細胞情報(例:結果のプロフィールにおける情報)を、過去に取得された細胞情報およびデータを含む基準データベースと比較する手段を提供する。
【0028】
本発明はまた、細胞または細胞内構成要素をモニターする検出装置から細胞画像データを受け取るためのコード;細胞画像データを分析するためのコード;および、分析された細胞画像データに応じて細胞または細胞内構成要素を刺激するよう適合された複数の刺激装置を自動的に調整するためのコードを含む、コンピュータ読み取り可能媒体を提供する。いくつかの好ましい態様において、コンピュータ読み取り可能媒体は、細胞をモニターする視覚的サーボ制御光学顕微鏡(VSOM)を制御するためのコードをさらに含む。さらに別の態様において、コンピュータ読み取り可能媒体はさらに、細胞のサイズを分析するためのコード、細胞の色を分析するためのコード、および細胞の動きを分析するためのコードのうち少なくとも1つをさらに含む。また別の態様において、コンピュータ読み取り可能媒体は、分析された細胞画像データに応じて細胞を刺激するための複数の刺激装置を自動的かつ独立的に作動させるためのコードをさらに含む。さらに別の態様において、刺激装置はシリンジである。いくつかの好ましい態様において、コンピュータ読み取り可能媒体は、細胞画像データを時間の関数として保存するためのコードをさらに含む。さらに別の好ましい態様において、細胞は生細胞であり、細胞内構成要素は生細胞内の構成要素である。
【0029】
発明の全体的な説明
本発明は、近年の大多数のネットワークコンピュータの処理能力、記憶能力および分析能力を、単一の生細胞の複雑かつ相互作用的な生物学的経路および生化学的経路または「回路構成」と結びつけるための手段を提供する。さらに、この過程は数百または数千の細胞について繰り返し行うことが可能であり、人間がこの連結的かつ自動的なシステムに携わることはない。コンピュータ印加の刺激および摂動によって呼掛けを受けた生細胞がコンピュータによる検出および分析が可能な様式で「反応」する際に、通信またはフィードバックループが確立される。コンピュータ印加によるこれらの複雑な刺激および摂動は、繰り返し印加することができ、かつ、細胞から受け取った複雑な「反応」に基づいて適切に変化させることができる。
【0030】
本発明のいくつかの態様は、異なる細胞「種」の正味の生理学的反応における微妙な差異、および/または、異なる生理学的状態にある同じ「種」の細胞間の微妙な差異を迅速に発見するという用途を有する。本発明は、観察される差異を特定の生化学経路、特定の遺伝子もしくは遺伝子セットの発現、または他の特異的な差異に分離または局限するよう設計された一連の追加的な試験または刺激を与えることによって、異なる細胞種の正味の反応の差異を迅速、自動的、かつ効率的に精密化または最適化する手段を提供する。この方式により、特定の差異が非常に精密な方式で同定および標的化されるため、生きている複雑な系(生細胞)の2つ以上の異なる母集団間における生物学的反応の微妙な差異を増幅することが可能となる。
【0031】
本発明は、細胞種間の差異を知識ベースで発見および最適化するための方法および装置を提供する。特に本発明は、生細胞の大きな定義済みアレイの自動生成およびそれに続く自動分析のための視覚的サーボ制御光学顕微鏡(VSOM)および分析方法を提供する。本発明はさらに、印加された刺激または刺激の組合せに対する細胞の反応の差異を検索、定量化、および最適化するための手段を提供する。本発明は、種々の目的を達成するため、自動化された様式で、細胞反応の既知の差異を利用することができ、かつ/または、細胞反応の新しい差異を検索および発見することができる。したがって、本発明により、細胞反応の所望の差異を得るための刺激または刺激の組合せを発見および印加することが可能である。
【0032】
さらに、本発明により、表面に付着されたまたはしっかり接着した多数の個々の細胞について、個々の細胞種の同定および個々の細胞の生理学的状態の同定が可能である。この個々の細胞の同定に付随して、多数の隣接細胞に対する相対的な細胞位置が特定される。この方式により、表面上に任意に置かれた生細胞の大きなアレイは、定義されたx,y,z位置に存在する同定済み細胞の大きなアレイに自動的な様式で変換される。次に、このようなアレイは、続いて行われるVSOM刺激、摂動、および呼掛けの実験の間モニターおよび追跡される。VSOM刺激、摂動、および呼掛けには、蛍光プローブの使用、化学的物質および生物学的物質の添加、および物理的刺激の印加が含まれる。種々の量、間隔および連続性で単独または組合せで印加されるこれらは、自動的に記録、分析、および最適化される。このような刺激、摂動、および呼掛けは、良性のものであってもよく、細胞にとって致死的なストレスとなるものであってもよく、または中間的なある程度の影響を細胞に及ぼすものであってもよい。本発明により、1つの実験過程の間に、自動的に印加された刺激、摂動、および呼掛けに対する生理学的反応の生物学的帰結を、細胞について細胞単位でかつ細胞小器官について細胞小器官単位で、長期間にわたって定量、モニター、および保存すること、ならびに他の反応と相関させることが可能である。
【0033】
印加された刺激、摂動、および呼掛けの履歴、ならびに、複数のチャネルで同時に観察した数百または数千の細胞の、相関付けされた複数の個々の細胞の反応の履歴は、遠隔または局所のデータベースに保存される。さらに、このような刺激の最終的な生物学的帰結が以後のVSOM実験用に収集される。このデータベースが増大するにつれて、VSOMアッセイおよびプロトコルはその予測能力が向上し、かつ、機器および処理の制御および最適化により有用なものとなる。
【0034】
本発明では、適用されたプローブ、刺激、摂動、および呼掛けに対する過去の細胞反応の知識に基づいて刺激、検索、最適化、およびVSOM機器制御が行われるよう、VSOM実験過程の間にリアルタイムで局所的または遠隔的にデータベースにアクセスすることが可能である。本発明により、細胞種および/または細胞の生理学的状態に特異的な種々のインビトロアッセイおよびインビボアッセイを開発することができる。本発明の方法およびシステムと保存された知識の蓄積と基づくアッセイの開発により、よく特徴付けされた大規模な生細胞アレイの自動生成に用いることができる、より迅速で、良性で、かつ特異的なアッセイが可能となる。これにより、最小限の刺激または摂動を受けた生細胞アレイを、迅速かつ自動的に生成し、かつ、その後細胞種間の際を利用する新しいまたは改善されたレシピ(recipe)およびプロトコルを検索するためのVSOMに使用することができる、有効なサイクルが提供される。次に、種々の目的を達成する目的で、このプロセスと、機器制御知識と、その結果得られるレシピおよびプロトコルであって細胞種特異的な生理学的反応および細胞種特異的な生物学的帰結を生成するレシピおよびプロトコルとを、VSOM環境および非VSOM環境で使用することができる。
【0035】
これらの目的には以下(i)〜(xiii)が含まれるがこれらに限定されることはない:(i)細胞の特定の部分母集団のみに有利なインビトロ培養条件およびプロトコルを迅速かつ自動的に最適化すること、(ii)非VSOMの機器または状況に適した、細胞種特異的なアッセイ、プロトコル、および診断キットを開発すること、(iii)VSOM機器のみに適した細胞種特異的なアッセイを開発すること、(iv)薬剤開発の標的となる、細胞種間の特異的な差異を発見すること、(v)幹細胞から種々の特定種の細胞を得る場合のように、所望の分化状態で細胞を得るためのインビトロの条件およびプロトコルを発見すること、(vi)生細胞の複雑かつ相互作用的な生化学ネットワークにおける特定の遺伝子または遺伝子セットの機能を発見すること、(vii)遺伝子または遺伝子セットの発現または非発現、およびその結果である細胞表現型の間の関係を発見すること、(viii)個々の生細胞の複雑かつ相互作用的な生化学ネットワークにおける薬剤またはその他の物質の影響を発見すること、(ix)薬剤またはプローブの細胞特異的な送達に適した物質およびプロトコルを発見すること、(x)個々の患者の腫瘍、特に多剤耐性を示す可能性のある腫瘍に合わせて設計された化学療法レジメンを発見すること、(xi)特定の個人に対する、物質の相対的な化学感受性または毒性を発見すること、(xii)特定の個人に対する特定の臓器ドナーの適合性を発見すること、ならびに、(xiii)生きているヒトにおける特定遺伝子の発現の3D撮像に適した放射線標識プローブを利用するものなどの、インビボアッセイを開発すること。本発明はさらに、各分析の間にインキュベーション期間が設けられる(すなわち、培養物が細胞培養インキュベータ内に置かれる)場合においても、培養中に存在する特定の細胞を複数回特異的に特定する手段を提供することにより、経時的に繰り返し細胞を分析する手段を提供する。
【0036】
VSOMアプローチの1つの態様においては、個々の分散した生細胞(または、細胞もしくは組織片の非常に小さな集塊)を含む溶液が滅菌容器内に置かれる(すなわち、インビトロ)。容器の壁に細胞を付着させる手段がない限り細胞は容器の底に沈降し、次に(条件が正しければ)容器の底に付着を始める。この過程の間、細胞は扁平化し、次に(条件が正しければ)成長、分裂、および増殖を始める。一部の場合においては、扁平化および表面付着の傾向をまったく示さない例えば円形の細胞が容器の底面に付着して液体の交換によって洗い流されなくなるよう、容器の底面を処理する必要がある。
【0037】
いくつかの好ましい態様において、本発明は、典型的には倒立顕微鏡である顕微鏡を、拡大レンズ(すなわち対物レンズ)が細胞溶液の入った容器の下に位置する状態で使用する。デジタル画像を自動的に取得できるようデジタルカメラが顕微鏡に取り付けられ、(一部の場合においては)標準的なハロゲン電球を光源とする標準的な白色光が細胞に照射される。次に、標準的な透過光技術(位相差法、微分干渉法、明視野法、暗視野法など)を用いて、デジタルカメラ撮像に適した細胞像を得る。一部の場合においては、水銀アークランプまたはキセノンアークランプなどを光源とする非常に明るい照射光を用いて追加の画像を連続的に高速で取得する。この照明光はコンピュータ制御の回転光学フィルタホイールに収容された1つまたは複数の光学フィルタを通過し、細胞にはフィルタリングされた紫、青、または黄色の照明光が照射され、一連のデジタル画像が連続的に取得される。表面蛍光鏡検法用に適切に装備された顕微鏡では、1つまたは複数の蛍光プローブを含む細胞は適切な色の蛍光励起光を照射すると特定の色の蛍光を発する。したがって、光学フィルタホイールの位置を変えて取得した連続デジタル画像では、細胞が発する青、緑、および赤の蛍光が別々の連続デジタル画像またはデジタル「チャネル」に写った画像が得られる。この方式により、細胞中の(例えば)青、緑、または赤の蛍光プローブの量および相対的分布を青、緑、または赤の蛍光発光のデジタル画像(青、緑、および赤のチャネル)でモニターすることができ、細胞の全体的な形状およびテクスチャは透過光デジタル画像(透過光チャネル)で観察することができる。
【0038】
異なる細胞内区画で観察される蛍光の相対的な強度および色によって、異なる蛍光プローブの取込みおよび保持の比率を表すことができ、細胞内でこの蛍光強度が分断および再配分される様子は、細胞に関する重要な生理学的、解剖学的、および形態学的情報を提供する。形態学的な情報は透過光デジタル画像でも得られる。時間または印加した刺激の関数としてこれらのいずれかまたはすべてのパラメータに生じた変化は、使用された蛍光プローブに対する、および、細胞またはその環境に印加された他の刺激または摂動に対する、細胞の「反応」として解釈することができる。さらに、1つの反応が赤のチャネルで、1つの反応が緑のチャネルで、1つの反応が青のチャネルで、および、1つの反応が透過光チャネルで観察できるよう、個別の反応を複数の別々のデジタルチャネルでモニターおよび追跡することができる。この方式により、コンピュータ印加の刺激、摂動、および呼掛けに対する生理学的な反応が連続デジタル画像中にコードされる。これらの反応は、デジタル画像をコンピュータに通過させる際に、各デジタル画像に含まれる情報を抽出しかつある意味コンピュータ印加刺激に対する「応答」である細胞の反応を検出するアルゴリズムによって、デコードされる。
【0039】
本発明の特に好ましい態様の1つでは、ストレス、刺激、抑制、または摂動の形でコンピュータにより印加される呼掛け(または「質問」)に対する細胞の反応または「応答」とは、実験過程中に迅速に(すなわち、「リアルタイム」で)デコードおよび解釈される。したがって、前の「応答」または細胞反応の解釈に基づいて追加の「質問」をすることができる。このプロセスは細胞とコンピュータとの間の通信ループを構成し、かつ、個々の生細胞の現在の生物学的状態および現在の生物学的「回路構成」(例:現在の生物学的および生化学的なプロセス)に関する情報を「読み出す」手段に相当する。
【0040】
コンピュータ制御の刺激、摂動、および呼掛けを印加する1つの手段は、コンピュータ制御のシリンジポンプを経由させることである。この方式により、種々の蛍光プローブ、ならびに化学物質および生物学的物質の溶液を、付着した生細胞に通過させることができ、かつ、物質およびプローブを細胞標本容器に添加する際または細胞標本容器から洗い流す際にこれらの物質に対する細胞の反応をモニターすることができる。このようなプロセスは、細胞の微小環境の変動または摂動として説明してもよい。細胞容器の温度を変化させる、細胞に強いUV光を照射する、または容器内の細胞に電場をかけるなど、細胞環境を摂動させる他の物理的手段も存在する。このような環境の物理的変動はコンピュータで制御してもよく、かつ、シリンジポンプを必要としない。特に好ましいいくつかの態様においては、ユーザーは、膨大な数に及ぶこのような刺激の過去の組合せ、ならびに、それらがどのように印加されたかおよび細胞の反応がどうであったか、を追跡できるコンピュータの能力を利用する。これは、実施中の実験をモニターすることだけでなく、過去の細胞の刺激と反応とが記録された、オンラインの非常に大規模なコンピュータデータベースを参照することによって実施してもよい。生細胞を用いたリアルタイム実験の過程でこのような大規模データベースにアクセスできる能力は、広く用いられている方法に対する大きな利点である。
【0041】
さらに、異なる種の生細胞を同定、識別、および分類する手段が、特別に変調した(コンピュータ制御の様式で生成した)細胞種特異的かつ時間変動的な動的生理学的反応により提供される。本発明は、このように特有の細胞種特異的な「生理学的フィンガープリント」を、生細胞に対して侵襲が最低限でありかつ比較的良性である点まで発見および精密化する手段を提供する。環境の良性な摂動に対する反応を定量化するために形態測定パラメータ(蛍光プローブ不在化で透過光チャネルで取得される)を使用することは、高度に精密化された同定アッセイの一例である。
【0042】
本発明の開発中に克服された課題の1つは、生細胞とその個々の細胞内区画との外形(輪郭)を描くための標準的なデジタル画像分析技術が、しばしば生細胞の研究には不十分であるという問題点である。これらのアルゴリズムでは多くの場合、細胞が物理的に離れていること(すなわち、細胞が接触または重複していないこと)が必要とされ、また、比較的明るい蛍光色素で非常に均一に標識されていることも必要とされる。染色が不均一である場合(すなわち、他の細胞より明るい細胞がある場合)、または、照明パターンが不均一である場合、これらのアルゴリズムは失敗する。多くの場合、これらのアルゴリズムを成功させるために必要な長時間の蛍光曝露は生細胞にとって毒性として作用する。
【0043】
適切なコンピュータアルゴリズムによりデジタル画像中の個々の細胞(および、理想的には特定の細胞内区画)の検出および輪郭取得が成功すると、コンピュータ印加の刺激に対して生じる蛍光プローブの量の変化(すなわち蛍光顕微鏡の場合)または形態学的な変化を、コンピュータにより定量化、記録、および分析することが可能となる。次にコンピュータはこれらの分析結果に基づいて、生細胞から追加の情報を引き出すことを目的として判断をおこなうことができ、かつ、シリンジポンプまたはコンピュータ制御されたその他の顕微鏡周辺装置に対して命令を送ることができる。この追加の情報および以後のサイクルで得られる以後のすべての情報は、単一の刺激の後に観察された、細胞種間の最初の小さな差異を最適化および増幅するうえで有用である。
【0044】
個々の生細胞間には(同種の細胞であっても)正常な不均質性および変動があるため、同時に多数の細胞を観察しない限り、生細胞の反応を解釈することは困難または不可能であることが多い。多数の細胞を観察する必要があること、および、それに付随して大量のデジタルデータを迅速に処理する必要があることも、本発明により解決される。局所のコンピュータは通常このような計算能力を備えておらず、備えている場合は機器の費用が大幅に増加する。したがって、本発明のいくつかの態様では、より強力な遠隔コンピュータによる機器の制御が提供される。さらに、必要数の細胞が単一のデジタル画像または単一の顕微鏡視野内で常に見えるとは限らない。したがって、本発明の別の態様では、ごく近傍で追加のデジタル画像を取得することによってより多くの細胞を観察できる能力が提供される。
【0045】
本発明はさらに、以下の方式により多数の細胞を観察することを可能にしている。印加された刺激に対する生物学的反応および生物学的帰結は常に迅速であるとは限らず、比較的遅いことが多い。刺激が制御化された遅い方式で印加される場合はとくにこれが当てはまる。したがって本発明では、異なる細胞群を連続的にデジタルカメラの視野内に入れることを可能としている。5つの細胞群をモニターする場合、コンピュータ制御の顕微鏡ステージは、実験を通じて一定の間隔で常に同じ5つの細胞母集団に戻りながら、標本容器の5つの異なる領域間を連続的に繰り返し動く。この精度は、精密なxyステージのみによってもたらされるものではなく、細胞の輪郭の検出と付着した細胞の特定母集団を表す同じランダム分布パターンの再取得とを行い、かつ、同じ特定の細胞群がデジタル撮像用に再度適切に位置決めされるまで必要に応じてxyステージに微調整を行うコンピュータアルゴリズムの能力によってももたらされる。
【0046】
上述の概念のいくつかの例を種々の図に略図で示した(例えば図4および図5を参照)。必要な設備およびプロトコルの例も本明細書に詳述している。
【0047】
図5に略図で示すように、多視野(MF)VSOM実験により本発明の多くの局面を実証することができる。コンピュータ制御された4つのシリンジポンプ(A、B、C、D)が、生細胞と1つまたは複数の環境センサーとが入った円形の微小環境チャンバに種々の溶液を注入する。溶液は、物理的に離れた2つの細胞のパッチが置かれた細胞チャンバに入る。インラインの流量センサーIおよびIIは注入された溶液の組成をモニターし、センサーIIIおよびIVはチャンバ内の環境条件をモニターする。この略図において、左側の細胞は、乳癌の生検標本の場合に(この単純化したモデルにおいて)予測されるような、正常細胞(斜線入りの円)と癌細胞(白抜きの円)とを含む不均質な混合物を表す。右側の細胞(斜線入りの円)は正常組織(例えば反対側の乳房)から得られた生検標本を表す。同じ細胞セット(1、2、3、および4)が繰り返し撮像されるよう、VSOM制御されたxyステージが顕微鏡の対物レンズ(チャンバの下に位置する)の上方で細胞チャンバを繰り返し再位置決めする。種々の摂動が印加されると同時にこれら生細胞の反応が連続的に定量化される。これらの摂動には、種々の組成の溶液の注入、および、溶液として投与することができないその他の摂動の制御とが含まれる。これらの摂動には、ガス、温度の変動、照射、電場または磁場、またはVSOMアルゴリズムまたはレシピで印加されるその他の物理的摂動が含まれ得る。この図において、環境チャンバからの流出もインラインの流量センサーV、VI、VII、およびVIIIでモニターされる。細胞の反応は蛍光発光および透過光の両方の様式を用いてリアルタイムで分析される。特定の実験目標を達成するため、摂動と環境変化とに対する個々の反応について実行中のVSOM分析に基づいて、適切なシリンジと適切な環境条件とがVSOMにより制御される。本図に示した事例では、特定の細胞の近傍または中に微小毛管を置くことも可能である。
【0048】
図4は、VSOM実験の1つの態様を示した略図である。実験開始時(時点1)、細胞種AおよびBは表面上にランダムに配置され、不均一なアレイ中の未同定の細胞として存在する。この最初の時点では、各細胞は識別できないため「a」「b」および「?」と呼ばれる。VSOMシステムは、細胞種Aを蛍光色素で選択的に標識する(本図ではこれが時点5で生じたことが示されている)プロトコルを検索しながら、一連の溶液を(シリンジi〜vから)添加し、かつ、一連の物理的刺激を印加する。時点5(図中にチェックマークで示す)で、2つの細胞種と成功プロトコルとが同定され、細胞反応がデータベースに記録される。一部の場合では、細胞種Bの存在下で細胞種Aを選択的に標識するための新しいプロトコルが発見された時点5の時点で実験が終了される。次に、成功プロトコルが、時点3と時点5との間に実施された各段階として同定される。
【0049】
続く実験では、種類Aと種類Bの全細胞の同定と各細胞のアレイ内での位置の記録とが時点6の時点で完了しているよう、時点3〜時点6間の各段階のみが、場合によっては最適化された方式で、細胞に対して実施され、かつ、蛍光色素が洗い流される。この方式により(場合によっては標識プロトコルをさらに精密化した後に)、受けた摂動が最小限であり、かつ、異物の化合物またはマーカーを含まない、同定済みの細胞のアレイが得られる。次に、VSOMで生成されたこの同定済み生細胞のアレイを用いて、次のVSOM実験を開始してもよい。
【0050】
図4パネルAに示した一連の事象は大量の実験情報と結果とを含んでおり、これらはさらに詳細に説明することが可能である。例えば、時点1〜時点2間で、細胞に物理的摂動(温度の低下など;図中、「物理的刺激」と書かれた上側の時間軸の上に白抜きの矢印で示されている)を与え、次に、シリンジ(i)内の溶液を注入する。溶液注入については、本図の「ポンプ動作」と書かれたグラフに、ポンプ(i)が一定の時間(時間軸上の斜線の入った長方形の幅で示す)、一定の流量(斜線の入った長方形の高さ)で作動したことが示されている。時点2で形態学的な変化が生じ、これは画像分析技術を用いて各細胞について継続的に定量化されている。しかし、この細胞反応は両細胞種で同じである。したがって、この時点では細胞種間の識別は行われておらず、引き続き自動検索が行われる。時点2〜時点3間で、シリンジ(iii)内の溶液が注入され、続いて物理的刺激(UV光照射など)が行われる。時点3の時点でも両細胞種は依然として類似の挙動を示しており、したがって実験が継続される。時点3〜時点4間でシリンジ(v)から溶液が注入されて、その結果両細胞種が蛍光色素で標識され(灰色の影で示す)、続いて物理的刺激(電場をかけるなど)が与えられ、これとともに(概ね)時点4〜時点5間にシリンジ(ivおよびii)の溶液が添加される。この結果、細胞種Bは細胞種Aより早く蛍光色素を失い、したがって時点5では細胞種Aのみが標識された状態となる。時点5〜時点6間で、いずれの細胞も蛍光色素をまったく含まなくなるまで(時点6)、シリンジ(ii)からより大きな流量で溶液が注入される。この方式により、生細胞のアレイ全体が同定され、かつ、いずれの細胞も異物である化合物または蛍光プローブを含まない。以後の同定アッセイでは細胞の曝露および刺激の履歴を最小限にすることができる。
【0051】
デジタル画像の分割および分析によりコンピュータで検出された細胞種AおよびBの時間依存的反応は、次に、図4パネルBのように表示されてもよい。この図では、細胞の略図が、透過光チャネル(y軸が、細胞の形状またはテクスチャを表す形態測定値を表す)および単色の蛍光チャネル(y軸が、細胞蛍光強度の平均値を表す)でコンピュータにより検出され定量化された反応に置換されている。細胞種Aの反応は実線、細胞種Bの反応は点線で示されている。図4パネルBは、本発明の重要な1つの概念、すなわち、コンピュータが反応情報の各チャネル間の相関付けを行う能力を有するという事実を示している。このような一例は図4パネルBの時点4付近にみられる。すなわちこの付近では、例えば細胞膜のテクスチャの変化が、細胞からの蛍光染料の損失と相関付けされうる形態測定的反応を示している可能性がある。この現象が確認された後のアッセイでは、細胞反応の検出に蛍光染料の存在を必要としなくなる。細胞反応は、細胞の形態測定的反応のプロフィールで同定可能となる。
【0052】
このように、本発明は、細胞種間の差異を知識ベースで発見および最適化するための方法および装置を提供する。特に本発明は前述の視覚的サーボ制御光学顕微鏡および分析方法を提供する。本発明は、数百の個々の生細胞を経時的に詳しくモニターする手段;多チャネルにおける動的生理学的反応の定量化;リアルタイムのデジタル画像分割および分析;インテリジェントなかつ繰り返しの、コンピュータ印加による細胞ストレスおよび細胞刺激;ならびに、長期的な研究および観察において同じ細胞視野に戻ることができる能力を提供する。本発明はさらに、特定の細胞部分母集団用に培養条件を最適化する手段を提供する。
【0053】
本発明の開発以前は、顕微鏡下で多数の個々の生細胞のデジタル画像を得ることは技術的に困難であった。また、多数の個々の生細胞について、細胞を損傷することなく長期間にわたって細胞内の複数の生理学的反応を同時にモニターすることも困難であった。第一の制限は、主として、いかなる倍率においても視野が限られていることに由来するものであった。使用されるデジタルカメラの内部の固体デジタル撮像装置(すなわち、電荷結合素子;CCD)のサイズおよび分解能が限られていることも、視野をさらに制限していた。本発明では、x,y,z顕微鏡ステージのソフトウェア制御によって、複数の視野(すなわち、多数の細胞)を迅速に、自動的に、かつ繰り返しモニターすることを容易にし、これにより上述の制限を克服する。また本発明により、中央コンピュータによる複数の顕微鏡の同時遠隔制御が容易になる。事実、局所の顕微鏡周辺装置(例:走査ステージ、フィルタホイール、灌流ポンプ、ロボットアーム、シャッター、カメラ、等)を制御するために現在使用されているコンピュータ(すなわちクライアント)に関連する、メモリ、ソフトウェア、および処理資源の制限が本発明により克服される。本発明により、インターネットを使用した遠隔制御と、遠隔値のユーザーから地理的に離れた場所に設置されたより強力な中央コンピュータ(サーバー)とでVSOM観察を実施することが可能になる。サーバーは、より処理集約的なタスクを実行または分配し、かつ、現在および過去の細胞反応を記録した非常に大規模のデータベースの中央ロケーションとして機能する。このように、本発明のVSOMは、強力な中央サーバーへのネットワークアクセスの利点、および、単一細胞の反応に関する過去の観察結果と複数情報チャネル間の相関に関する過去の観察結果とが記録された大規模中央データベースの利点を活用するものである。特に好ましい態様においては、VSOMシステムは、細胞を繰り返し検出し、全チャネルについて観察されたすべての細胞反応を記録および分析し、現在の細胞反応を比較し、現在の各情報チャネルについて相関付けを行い、かつ、細胞反応に関する過去の観察結果および各情報チャネル間の相関に関する過去の観察結果が記録されたデータベースに対して問い合わせを行う。単一の実験過程において、次にシステムは、実施中の実験の目的を達成するため、実験パラメータをどのように調整するかに関して知識ベースで一連の決定を行う。
【0054】
したがって、本発明により、単一の比較的短い実験過程の間に複数の完全な実験サイクルを実施することが可能となる。このことは、異なる細胞種間の差異を検索、発見、および最適化するプロセスを大幅に加速させる。必要な細胞数は比較的少ない。また、個々の細胞の反応がモニターされるため、分析用の標本は異なる種類の細胞を含んでいてもよい。「細胞種」とは、ある群に含まれる各細胞が他群の細胞から識別されうる類似の特徴を有するような複数の群に一群の細胞を分けることができる任意の観察方法により達成される分類である。この分類は、個々の単一細胞レベルにおける比較的迅速な生理学的反応を繰り返し観察した結果(例:細胞内構成要素、形態学的変化、細胞分裂、細胞死、剥離などの観察)に基づいて行われるのが一般的である。しかし、この用語は、従来の組織学的基準(例:上皮細胞、腫瘍細胞、筋細胞、脂肪細胞、神経細胞など)に基づいて分類した種々の細胞種も含む。
【0055】
本発明の開発以前は、多数の細胞を対象とした場合に、実験過程中に実験パラメータをどのように変更するかに関する自動的かつ知識ベースの決定を迅速に行うことができなかった。本発明は、実験過程中に「試験/記憶/分析/学習/再設計/再試験」サイクルを多数回実行する能力を提供するものであり、この能力により、以前は実行不可能であった多くの実験および応用が可能となる。細胞が生存状態を維持し、かつ、実験が進行状態およびオンライン状態を維持する場合、刺激に対する過去の反応と未来の反応との相関は細胞単位で維持される。比較的少量の細胞試料を使用して、単一の実験中に多様かつ繰り返しのコンピュータ生成刺激を印加および反復することができる。このことは、細胞種間の差異を検索および最適化する際に大きな利点となる。「刺激」という用語は、単一の刺激、複数の刺激、または複数の刺激の組合せを単回、繰り返し、または連続的に与えることを意味する。生理学的な反応を引き起こす刺激には、機械的、物理的、化学的、および生物学的な実体が含まれる。したがって、本発明はいかなる刺激または刺激の種類にも限定されない。
【0056】
生細胞は移動することができる、または形態を変化させることができる。したがって、ある視野に戻る際、ソフトウェアは、焦点を調節し(z軸制御)、かつ視野を再取得および再登録するため横方向および縦方向にわずかな調整を行う(x,y軸制御)必要がある。さらに、細胞の位置および形状の変化を追跡するため、個々の細胞の外形を規定する元の輪郭を修正する必要がある。したがって、1つの態様では、本発明のVSOMは画像内容の分析結果に基づいて機器の制御に関する決定を行うための手段を提供する。事実、本発明は以下の手段を提供する:生細胞に刺激を繰り返しおよび/または連続的に印加するコンピュータ自動処理の手段;鏡検およびデジタル撮像を用いて、刺激に対する細胞または細胞以下レベルの1つまたは複数の生理学的反応を単一細胞レベルで繰り返しおよび/または連続的に検出およびモニターする手段;信頼性の高い細胞種同定に適した、および/または細胞種間の差異を最適化するための刺激の修正に適した基準を確立するために十分な数の個々の細胞の反応を迅速に観察する手段;細胞が観察および/または刺激に利用できる間に知識ベースの刺激制御を決定できるよう、現在の細胞反応と過去に保存された細胞反応(例:データベース情報)とを迅速に分析する手段;および、時間依存的に生じる事象間の相関を多チャネルにわたってモニターする手段。
【0057】
本発明はさらに、蛍光に加えて透過光を利用して生細胞の輪郭を規定するための手段を提供する。これにより、蛍光成分を含まない細胞の追跡が容易になる。さらに、これにより、細胞毒性を示し得る蛍光標識化合物の使用量を少なくでき、かつ、蛍光発光を生じさせるために必要な強力な蛍光励起照射を回避することができる。したがって、より長時間にわたる細胞の観察が可能となる。さらに、特異的な挙動を示す細胞を実験の最後に個別に回収して、プール(貯蔵)、細胞株の樹立、クローニング、特定の分化状態への誘導、分析などに供することができる。
【0058】
本発明の機器では、撮像を透過光撮像と種々の波長の蛍光撮像とで迅速に循環させることによって、異なる生理学的反応を異なるチャネルで実質的に同時に観察することができるため、本発明により、多数の細胞をモニターすることに加えて、単一の実験中に多数の生理学的反応を観察することが可能となる。
【0059】
マルチウェル蛍光プレートリーダーを使用すると、生細胞の全母集団が発する進行中の蛍光シグナルを検出することができるが、単一の細胞の反応を観測することはできない。しかし、本発明のVSOMの1つの態様においては、マルチウェルプレートリーダーに適した蛍光アッセイの発見および最適化が可能である。また、一般的な技術では、個々の生細胞が発する多チャネル蛍光シグナルをフローサイトメトリーを使用して瞬時に検出することができる。細胞は蛍光シグナルに応じてソーティングすることができ、かつ、回収することもできる。しかし、細胞は検出器を高速で通過し、得られる測定結果は単一のものである(もしくは多チャネルの可能性もある)。個々の細胞が一定の長さの時間にわたって追跡されることはなく、過去の反応と現在の反応とを相関させた同一細胞の繰り返し観察も不可能である。本発明はこれらの制限を克服するものであり、フローサイトメトリーおよび活性細胞ソーティングに適した蛍光アッセイの開発および最適化を容易にする。
【0060】
本発明は、任意の種類の細胞(例:動物細胞、植物細胞、微生物細胞など)に有用な細胞種特異的蛍光アッセイに用途を有する。したがって本発明は、いかなる種類の細胞にも、またはいかなる特定の蛍光もしくは他のアッセイシステムにも限定されるものではない。好ましい態様ではヒトの細胞を対象としているが、他の態様では他の哺乳類ならびに植物および微生物から取得された細胞も対象となる。例えば本発明は、組織から取得された正常細胞、前悪性細胞、悪性細胞、および/または多剤耐性癌細胞を検出および識別する手段を提供する。さらに本発明は、稀な細胞種(例:幹細胞または母体血液中の胎児細胞)を選択的に標識するプロトコルを設計するための手段を提供する。いくつかの態様においては、これらのプロトコルは放射性およびその他の標識システムとともに使用するよう修正される。本発明はまた、個々の患者および/または患者の個々の腫瘍に合わせた化学療法レジメン(薬剤の組合せも含めて)を確立するためのアッセイの設計および応用を容易にする。さらに本発明は、医薬品、農業、バイオテクノロジーなどにおける種々の使用について、候補となる多数の薬剤、殺虫剤、除草剤、およびその他の化合物を検索するうえで有用なアッセイを提供する。さらに本発明は、細胞増殖、細胞毒性、および/または分化における使用について、多数の候補薬剤を検索するうえで有用なアッセイを提供する。
【0061】
本発明はさらに、関心対象の細胞種を増殖上有利にすることによって、または、培養中に存在する他の細胞種に対して細胞毒性として作用する環境条件もしくはプロトコルを設計することによって、特定の細胞種の増殖をもたらす、インビトロの組織培養条件を設計する手段を提供する。したがって本発明は、インビトロでの増殖がしばしば困難である細胞を培養するための手段を提供する。さらに本発明は、細胞を特定の分化終点へと誘導するのに適した細胞培養条件をつくるための手段を提供する。例えば、本発明を用いて、幹細胞または胚性細胞を所望の最終終点へと誘導するために必要な条件を開発することができる。
【0062】
本発明はまた、種々の迅速インビトロ検査の開発および実施に用途を有する。例えば、ある患者に対して候補となる組織または骨髄ドナーが複数存在する場合は、種々のドナーの細胞を患者の免疫細胞と混合し、免疫拒絶反応を単一細胞レベルで観察する。したがって、その特定の患者に対する最適なドナーの同定が容易になる。さらに、これらの検査は、移植拒絶を抑制するよう設計された薬剤(または薬剤候補)の存在下で実施することができ、患者に対する最適なドナーの選択とあわせて、最適な抗拒絶薬の投与レジメン(すなわち、単剤使用または多剤併用)の選択が容易になる。
【図面の簡単な説明】
【0063】
【図1】本発明のマイクロプロセッサ/コンピュータ、ロボット、および光学システム、ならびにシステムのその他の構成要素間の関係を示す図である。
【図2】本発明の代替的態様を示す別の図である。
【図3】Blob ManagerおよびInstrument Managerの主要なオブジェクトの関係を示す図である。追加の機器はそれぞれControlSourceおよびBlobSource用のプラグインを必要とする。ControlSourceおよびBlobSourceの詳細はIDLレベルで隠されている。
【図4A】VSOM実験の1つの態様を示す略図である。
【図4B】VSOM実験の1つの態様を示す略図である。
【図5】多視野(MF)VSOM実験の1つの態様を示す略図である。
【図6】2つのデータモデルを提供する。パネルAはバイオインフォマティクスシステム用の完全データモデルであり、パネルBはインビボ処置用の詳細な内訳(breakdown)である。
【図7】分割の過程を示す。パネルAは、組織および細胞培養物から個々の核を抽出するためのプロトコルを提供する。パネルBは、隣接する2つの核を用いた重心の変換の様子を示す。
【図8】元の細胞を示す写真である。
【図9】DAPIにおける分割の結果を示す。
【図10】本発明の知識ベースのVSOMの1つの態様における種々の構成要素の相互作用を示す図である。この図において、イタリック体の項目は全体のシステムアーキテクチャ(architecture)で定義されるサービスを指す。
【図11】本明細書に記載されたVSOM実験(実施例5を参照)のいくつかで使用される、シリンジ、シリンジ内の溶液中の組成物、流速、および灌流間隔に関する詳細情報の図である。両方の実行(run)においてポンプスケジュールを用いた。2回の実行を(同じ日に続けて)行った後、コンピュータ画面に表示されたプロット図を保存した。図の下部の黒いウィンドウは、実行1および実行2のプロット図である。各場合における赤い線は全視野中のすべての細胞反応の平均を表す。MCF-7WTC(DS、実行1)およびMCF-7(MDR、実行2)について記録されたこれら2つのプロット図中で示されているように、DS細胞(上方のプロット)のカルセイン蓄積量(240±82、N=336)はMDR細胞の蓄積量(103±80、N=161)より多かった。このことは、多数の細胞での平均を表すマルチウェルプレート実験で同じDS細胞およびMDR細胞について観察されるカルセイン蓄積量の相対的差異と一致する。
【図12】実施例4の実行1における各DS細胞の個々の細胞反応を示したグラフである。全細胞の反応の平均±標準偏差を黒色で重ねて示す。個々の反応は本グラフ中の個々のラインで示す。VSOM実験中、各細胞の細胞蛍光の平均値をモニターし、母集団平均からの偏差を検出した。例えば、矢印は、生存率および原形質膜完全性を失い始めた複数の細胞を示している。このような細胞はカルセインを保持することができず、蛍光信号が減少する。
【図13】実行2(実施例4)で選択した4つの細胞について個々の細胞反応の測定結果を示す。これは、フローサイトメトリーおよびマルチウェルプレートアッセイでは得られない種類の詳細な生理学的情報の典型であり、本発明のVSOM技術が望ましい能力を有していることを示す。示されているように、カルセインの蓄積および保持に関する詳細な比率情報は、VSOM実験全体にわたって入手可能である。
【図14】本発明の1つの態様の図である。パネルAはDeepView Bioinformaticsシステムの機能アーキテクチャの図である。パネルBはポンプログ(pumplog)の例を示し、パネルCはXMLレシピファイルの例を提供し、パネルDはICSイメージヘッダーを提供する。
【図15】インビボ実験およびインビトロ実験のフローチャートである。
【図16】細胞の各区画について計算した構造および機能の特徴(feature)ベースの階層保存を示す略図である。各実験は、微速度ビデオ撮影および、必要とされる灌流ポンプの操作とで構成される(図には示していない)。画像は最下層レベルに保存される。次のレベルには、細胞内の解剖学的組織の構造および機能が属性グラフとして保存される。第三のレベルでは、特定の位置に対応する反応曲線および、化合物の予想軌跡とが構成される。第四の層は、実験間の相互相関試験とともに推移確率を構築するための機構を提供する。
【図17】培養皿中の細胞局在性の基準となるフレームを確立するための、エッチングを施した培養皿の使用を示した、拡大(close-up)略図である。
【発明を実施するための形態】
【0064】
発明の詳細な説明
本発明は、細胞種間の差異を知識ベースで発見および最適化するための方法および装置を提供する。特に本発明は視覚的サーボ制御光学顕微鏡(VSOM)および分析方法を提供する。本発明は、数百の個々の生細胞を経時的に詳しくモニターする手段;多チャネルにおける動的生理学的反応の定量化;リアルタイムのデジタル画像分割および分析;インテリジェントなかつ繰り返しの、コンピュータ印加による細胞ストレスおよび細胞刺激;ならびに、長期的な研究および観察において同じ細胞視野に戻ることができる能力を提供する。
【0065】
図1および図2は、本発明の好ましい態様の主要な3つの構成要素を示した略図である。これらは(i)細胞チャンバ内の生細胞をデジタル撮像するための光学プラットフォーム、(ii)多くの場合光学プラットフォームにまたは光学プラットフォーム付近に物理的に取り付けられ、「ロボット構成要素」と呼ばれる、種々のコンピュータ制御周辺装置、および(iii)ロボット周辺装置の局所命令用に使用される局所ホストコンピュータ(「クライアント」)からなる。別の態様において、本発明は、VSOM機器の遠隔制御用のソフトウェアを有しかつインターネット上で処理を行う遠隔コンピュータ(すなわち「サーバー」)をさらに提供する。
【0066】
A.光学プラットフォーム、ロボット構成要素、および制御電子機器
本発明の1つの態様において、VSOM光学プラットフォームは、顕微鏡ステージの中央に取り付けられた標本に対して透過光照明と表面蛍光照明との両方を実施するよう構成された倒立光学顕微鏡である。画像生成用および拡大用に、顕微鏡ステージの下に複数の対物レンズが取り付けられる。1つの態様においては4つのロボット構成要素(すなわち、コンピュータ制御された顕微鏡周辺装置)も顕微鏡ステージ付近に配置される。特に好ましい態様においては、内部カメラシャッターを有するデジタルカメラが顕微鏡上の上部カメラポートの1つに取り付けられる。顕微鏡ステージはコンピュータ化されたXY走査ステージであり、かつ、上部シャッターが透過光照明を制御し内部の後部シャッターが表面蛍光照明を制御する2つのコンピュータ制御のシャッターの位置が含まれる。内部シャッターに加えて、定義されたスペクトル成分の光で標本を照明および蛍光励起させることができる、コンピュータ制御の6位置回転光学フィルタを有する。
【0067】
別の態様では、第二のカメラが使用される(例えばカメラポート基部に取り付けられる)。ただし、VSOMには2つのカメラは必要ない。xy走査ステージの調整に加えて、顕微鏡の対物レンズのz軸位置の粗調整に使用されるステップモーターのハウジングと、コンピュータ制御されたXYZ微小毛管ポジショナまたは「ロボットアーム」とが存在する。多くの態様において、顕微鏡の対物レンズは顕微鏡の「ステージプレート」(または標本ホルダー)の下方に直接配置される。実験で使用するチャンバまたは容器に応じて、種々の取り外し可能なステージプレートをxy走査ステージに挿入することができる。多数の標本ホルダーまたは「ステージプレート」が本発明とともに使用できる。いくつかの態様においては非環境制御型の標本容器が使用される。チャンバ状にしたカバーガラス、組織培養フラスコ、細胞培養皿、およびマルチウェルプレートのためのステージプレートも本発明とともに使用できる。本発明のいくつかの態様では、単純に細胞インキュベータから種々の無菌標本容器を取り出し、適切なステージプレートを用いて顕微鏡に載せ、かつ、透過光のみを使用してVSOMシステムで容器内の細胞数を計数することもできる。この状況下で、個々の細胞を検出しかつデジタル画像内で分割するという細胞ごとの形態学的測定も可能であるため、形状、面積、テクスチャ、および核-細胞質比など細胞の形態学的な特徴をモニターすることもできる。
【0068】
いくつかの場合においては、微小環境制御した細胞チャンバが物理的にステージに取り付けられるかまたはステージプレートを介して接続される。事実、任意の適切な細胞チャンバ(すなわち、分析および/または観察の対象とする細胞を入れるためのレセプタクル(receptacle))である。様々な種類の市販の環境制御型細胞チャンバが利用可能であり、かつ、xy走査ステージとともに使用するのに適している。いくつかの態様では、蠕動ポンプまたは他のポンプにより余分の液体が標本容器から除去される。他の態様では、細胞チャンバ(または標本容器)の温度がモニターされる。これらの態様において、温度プローブは典型的に、チャンバ内の液体の温度またはチャンバ自体の温度を制御する制御装置に接続される。好ましい態様において、この非コンピュータ制御の独立した温度制御ユニットはコンピュータ制御可能なユニットに置換される。
【0069】
細胞チャンバの1つの追加的特徴として、定義された酸素成分のガスの流れを、細胞チャンバ内に置かれた標本容器の上方に層状に重ねる能力がある。この方式により、標本容器および溶液内で既知の酸素張力条件をつくること、または、標本容器上方を流れるガスに含まれるCO2量を変化させることによって重炭酸塩緩衝剤を含む溶液のpHを制御することができる。
【0070】
いくつかの態様においては、4つの独立制御可能なシリンジを有する、コンピュータ制御された2つのポンプが光学プラットフォームに隣接して配置される。2つの各ポンプユニットには、デイジーチェーン接続された電子制御装置が組み込まれる。この様式で最大約99のポンプユニットが接続可能であり、かつ、各ポンプの2つのシリンジはそれぞれ独立に制御できる。
【0071】
図1および図2に示すように、周辺装置の多くは、ホストコンピュータとロボット周辺装置自体との間のインターフェースとして機能する制御ユニットを有する。ホストコンピュータで実行されるカスタムソフトウェアに顕微鏡周辺装置の制御を組み込むことができるよう、基本的なソフトウェアコマンドはこれら周辺装置の製造業者によって提供される。ホストコンピュータはリモートコンピュータで実行されるソフトウェアで制御することができる。例えば、Z軸焦点粗調整モーター、xy走査ステージ、2つの照明シャッター、デジタルカメラ(およびその内部シャッター)、ならびに光学フィルタホイールは、いずれもこのソフトウェアを用いて制御することができる。いくつかの態様では、顕微鏡の対物タレットに螺入する圧電ポジショナによって顕微鏡の焦点の微調整制御が行われる。
【0072】
1.マイクロアレイフォーマット
本発明は、特定の物質、処理、または処理セットに対する細胞/個々の細胞の生理学的反応性をより完全に評価するため、高スループットのスクリーンを介して、種々の細胞種に対して連続的な処理を行うことによって多数の化合物(例えば、薬剤または所望の生物学的活性を有する可能性がある化合物)を迅速にスクリーニングする能力を提供する。既存の方法を用いた薬剤-細胞相互作用の操作および分析では、一定の時間内に分析できるバイオアッセイの数が少なく、化合物送達に必要な方法が煩雑であり、かつ、しばしば大量の化合物が試験に必要とされるため、高スループットかつ生物学的に高含量のスクリーニングを行うことができない。したがって、本発明の好ましい態様では、高スループットのスクリーニングをマイクロアレイフォーマットで可能にする。
【0073】
本発明の好ましい態様では、個々の細胞が発する光学画像信号を細胞種に応じて検出および処理する。したがって、複数の細胞種を支持体またはプレートに置き、個々の細胞の光学画像に応じてその細胞種を同定し、かつ、印加された環境刺激に対する個々の細胞または細胞種の反応性を追跡することによって、不均一なマイクロアレイをつくることができる。前述の均一または不均一なマイクロアレイ上の単一の細胞からの光の検出と分析とを可能にするため、このような細胞種を適切な低い細胞密度で固定してもよい。本発明の他の態様では、同じ処理を行った複数の細胞からの集合的な光信号を検出および測定する。
【0074】
好ましい態様において、細胞は支持体に固定状態で付着される。マイクロパターンアレイ内に細胞を付着させるのに適した方法は周知であり、例えば光化学レジストフォトリソグラフィ(photochemicalresist-photolithograpy)(MrksichおよびWhitesides、Ann. Rev. Biophys. Biomol. Struct.25:55-78、1996)などがある。このフォトレジスト法では、ガラス板をフォトレジストで均一にコーティングし、フォトマスクをフォトレジストコーティング上に置いて所望の「アレイ」またはパターンを規定する。露光により、マスクされていない領域のフォトレジストが除去される。露出したガラスの領域とフォトレジストで覆われた領域との両方に結合する有機シランなどの疎水性物質で、フォトリソグラフで規定した表面全体を均一にコーティングする。次にフォトレジストをガラス表面から剥離し、露出したガラスのスポットのアレイを露出させる。次に、アミノ基など親水性または化学反応性を有する基を末端に有する有機シランでガラス板を洗浄する。露出したガラスのスポットに疎水性の有機シランが結合し、その結果、疎水性表面上に、(元のフォトレジストの領域に配置された)親水性または反応性のスポットのアレイを有するガラス板が得られる。親水基のスポットのアレイにより、ニューロン由来のものも含めた特定の細胞を非特異的かつ非共有結合的に結合させるための基質が得られる(Kleinfeldら、J.Neurosci. 8:4098-4120、1988)。同様に、シリコンウェーハ表面に対する反応性イオンエッチングも、2つの異なる種類のテクスチャでパターン形成した表面を得るために用いられている(Craigheadら、Appl.Phys. Lett. 37:653、1980; Craigheadら、J. Vac. Sci. Technol. 20:316、1982; および、Suhら、Proc.SPIE 382:199、1983)。
【0075】
細胞の均一なマイクロアレイを作製する別の方法は、特異的であるが非共有結合的な相互作用に基づくものであり、タンパク質吸着性アルカンチオールでコーティングされた金表面を得るためにフォトレジストスタンプ法が用いられている(Singhviら、Science264:696-698、1994)。次に、末端にポリエチレンを有する、タンパク質吸着に抵抗性のアルカンチオールで金の裸面をコーティングする。表面全体を、細胞外マトリックス中に発見される細胞結合タンパク質であるラミニンに曝露すると、生きた肝細胞がラミニンでコーティングされた島に均一に付着しかつこの島の上で増殖できるようになる(Singhviら、1994)。特定タンパク質のパターンによる金表面のコーティングには、強力なしかし非共有結合的な金属キレート化を利用した加工が用いられている(Sigalら、Anal.Chem. 68:490-497、1996)。この場合は、ニトリロ酢酸を末端に有するアルカンチオールで金表面にパターンを形成する。タンパク質吸着を低減させるため、金の裸領域がトリ(エチレングリコール)でコーティングされる。Ni2+を添加すると、ヒスチジン標識した5つのタンパク質の特異的吸着が動力学的に安定するのが観察される。
【0076】
より特異的な均一の細胞結合は、パターン形成した基質上の反応部位にタンパク質などの特定分子を化学架橋することによって得られる(AplinおよびHughes、Analyt.Biochem. 113:144-148、1981)。基質パターン形成の別の加工法では、読み取り可能スポットのアレイが作製される。ガラスに化学吸着してガラスをコーティングする有機シランでガラス板を洗浄する。アレイのパターンを規定する光学マスクを通して有機シランコーティングに遠紫外光を照射する。照射によりSi--C結合が開裂して反応性のSiラジカルが生じる。Siラジカルは水との反応により有極性のシラノール基を生じる。参照として本明細書に組み入れられる米国特許第5,324,591号に記載のように、有極性のシラノール基はアレイ状のスポットを構成し、さらに修飾を受けて他の反応性分子をスポットに結合させる。例えば、自由アミノ成分などの生物学的機能基を含むシランをシラノール基と反応させることが可能である。次に、自由アミノ基を、タンパク質、核酸、炭水化物、および脂質などの生物分子との共有結合性付着部位として使用することができる。細胞表面と相互作用することが知られているレクチンを、反応性のアミノ基を介して、パターン形成せずにガラス基質に共有結合的に付着させる方法が示されている(AplinおよびHughes、1981)。支持体上に細胞の均一なアレイを作成する光学的方法は、フォトレジスト法と比較して必要な段階が少なくかつ高速であるが、高額な光源による強力な紫外光を必要とする。
【0077】
別の態様においては、細胞アレイと試験刺激の印加とは、参照として本明細書に完全に組み込まれる米国特許第6,103,479号に記載の方法と構成内容とに基づく。米国特許第6,103,479号は、関心対象の化合物(例えば、薬物およびその他の生物学的活性化合物)の送達が可能な小型化した細胞アレイを提供する好ましい手段を開示している。米国特許第6,103,479号は、生物学的活性化合物に対する細胞の生理学的反応を高スループットかつ高含量でスクリーニングする手段および方法を開示している。細胞の不均一マイクロパターンアレイとは、細胞が支持体表面上の単一の均一なコーティング内に分布されるのではなく、支持体上の各「ウェル」またはウェルの群が細胞結合選択性の面で固有であってもよいような不均一な様式で分布される、ベース上の細胞のアレイを指す。アレイ化する細胞種に特異的に結合できる分子がマイクロパターン化学アレイ内に存在する限り、細胞の不均一マイクロパターンアレイ上には任意の細胞種をアレイ化できる。細胞の不均一マイクロパターンアレイ用として好ましい細胞種としては、リンパ球、癌細胞、ニューロン、真菌、細菌、ならびにその他の原核生物および真核生物が含まれる。
【0078】
米国特許第6,103,479号の細胞の不均一マイクロパターンアレイを作製する方法は、マイクロパターン化学アレイを準備する段階、マイクロパターン化学アレイを不均一に化学修飾する段階、および、ベース上で不均一修飾マイクロ化学パターンアレイに細胞を結合させる段階を含む。ベースは、従来の光学顕微鏡用カバーガラスなどのように、ガラス、プラスチック、またはシリコンウェーハであってよいが、ベースの提供に適した他の任意の材料で作製してもよい。本明細書に記載のように、「ウェル」という用語はベース上の特定のスポットを説明するために用いられ、特定の深さである必要はない。このようなアレイを作製する方法は米国特許第6,103,479号に記載されている。特許の明細書に記載のとおり、好ましい態様において、修飾マイクロパターン化学アレイは組合せ様式で作製される。その結果得られるウェルは不均一である(すなわち、各ウェルまたはウェルの群が細胞結合選択性の面で固有であってもよい)。組合せ(combinatorial)とは、ウェルが変動的に処理されることを意味する。
【0079】
2.マイクロ流体工学フォーマット
固体の基体に付着した細胞のマイクロアレイに対する効率的な溶液送達は、マイクロ流体工学のシステムにより容易になる。少量液体試料の精密な取り扱いの方法および装置は、インク送達(米国特許第5,233,369号;米国特許第5,486,855号; 米国特許第5,502,467号、これらはすべて参照として本明細書に組み入れられる)、生物試料の吸引(米国特許第4,982,739号、参照として本明細書に組み入れられる)、試薬の保管および送達(米国特許第5,031,797号、参照として本明細書に組み入れられる)、ならびに、臨床診断および化学合成用の超小型電子工学的かつ流体工学的な区分装置アレイ(米国特許第5,585,069号、参照として本明細書に組み入れられる)に関して開示されている。さらに、少量液体試料を表面に沿って誘導するために使用できる、固体基体中に微小チャネルを形成するための方法および装置が開示されている(米国特許第5,571,410号;米国特許第5,500,071号; 米国特許第4,344,816号、これらはすべて参照として本明細書に組み入れられる)。閉鎖された光学チャンバ内で固体基体上に不均一なアレイとしてマイクロパターン形成された生細胞に溶液を送達するための方法は米国特許第6,103,479号に開示されており、特許も参照として本明細書に組み入れられる。
【0080】
細胞の不均一マイクロパターンアレイの好ましい態様は上記に開示したとおりである。液体送達システムの好ましい態様では、チャンバが、細胞の不均一マイクロパターンアレイを含む基体と接続する。チャンバの材料は好ましくはガラス、プラスチック、またはシリコンであるが、基体を提供できる他の任意の適切な材料であってよい。チャンバの1つの態様は、細胞の不均一マイクロパターンアレイ内のウェルと一致するエッチングされた領域のアレイを有する。さらに、エッチングされた領域に液体を供給するため、マイクロ流体工学チャネルがエッチングされる。エッチングされた領域から余分の液体を除去するための一連の「廃棄物」チャネルもウェルに接続されていてよい。チャンバと細胞のマイクロパターンアレイとはともにカセットを構成する。
【0081】
「液体」とは、特定の薬剤、タンパク質、リガンド、または細胞の表面発現成分と結合するもしくは細胞に取り込まれるその他の物質の溶液を含むが、これらに限定されることはない。細胞の不均一マイクロパターンアレイと反応させるための溶液は、薬剤を封入したリポソームも含んでいてよい。1つの態様では、露光により薬剤を放出する光反応生合成ポリマーなどの光化学材料でこのようなリポソームを形成する(WillnerおよびRubin、Chem.Int. Ed. Engl. 35:367-385、1996に概説)。薬剤はすべてのチャネル14で同時に放出させてもよく、または、個々のチャネルもしくはチャネルの列を照明して逐次的に放出させてもよい。このような薬剤の制御放出を動力学研究および生細胞研究に用いてもよい。液体送達の制御は、毛管現象の当業者に既知のマイクロバルブおよびマイクロポンプの組合せにより可能である(米国特許第5,567,294号;米国特許第5,527,673号; および米国特許第5,585,069号、これらはすべて参照として本明細書に組み入れられる)。
【0082】
好ましい態様では、薬剤または他の物質は以下のように送達される。アレイの細胞との相互作用の試験対象とする物質の溶液は、96ウェルのマイクロタイタープレートから微小毛管チューブのアレイに装填できる。微小毛管チューブのアレイはチャンバのマイクロ流体工学チャネルに1対1対応し、これにより、微小毛管チューブからチャネルへと溶液を流出させるまたはポンプ排出させることが可能となる。液体が充填されたエッチング領域にウェルが浸漬するように、細胞の不均一マイクロパターンアレイを反転させる。液体と細胞の不均一マイクロパターンアレイとの相互作用が生じたら、細胞の不均一マイクロパターンアレイが発する光を、直接測定すること、ならびに、細胞のアレイの配置、除去、および処理をロボットにより自動的に誘導するための光入力に変換することができる。
【0083】
3.蛍光フォーマット
本明細書に記載のように、特に好ましい態様は細胞の蛍光撮像を含む。顕微鏡で蛍光細胞を撮像し、かつこれらの細胞で生じている空間分布および経時変化に関する情報を抽出するための種々の方法が開発されている。これらの方法およびその応用の多くは最近開示されたものである(Taylorら、Am.Scientist 80:322-335、1992; 米国特許第6,103,479号も参照)。これらの方法は、細胞内の蛍光レポーター分子の分布、量、および生化学環境を高い空間分解能および時間分解能で画像測定することを目的として少数の標本を作製するために設計および最適化されたものである。
【0084】
染料と蛍光試薬とによる細胞の処理および細胞の撮像(Wangら、「細胞生物学における方法(In Methods in Cell Biology)」、NewYork、Alan R. Liss、29:1-12、1989)、ならびに、レポーター分子として修飾緑色蛍光タンパク質(GFP)などの蛍光タンパク質を生成させるための細胞の遺伝子操作は有用な検出方法である。クラゲの一種であるエクオレア・ビクトリア(AequoreaVictoria)の緑色蛍光タンパク質(GFP)は395 nmに最大励起波長、510 nmに最大発光波長を有し、かつ、外因性因子を必要としない。GFPを使用した遺伝子発現およびタンパク質位置測定はチャルフィー(Chalfie)ら、Science263:802-805、1994に記載されている。野生型GFPのいくつかの特性はモリセ(Morise)ら(Biochemistry 13:2656-2662、1974)およびワード(Ward)ら(Photochem.Photobiol. 31:611-615、1980)によって開示されている。リッツト(Rizzuto)ら(Nature 358:325-327、1992)による論文では、細胞小器官を可視化するためのツールとしての野生型GFPの使用が検討されている。カエサー(Kaether)およびゲルデス(Gerdes)(FEBSLetters 369:267-271、1995)は、分泌系路上のタンパク質輸送の野生型GFPを用いた可視化について報告している。植物細胞におけるGFPの発現についてはフー(Hu)およびチェン(Cheng)(FEBSLetters 369:331-334、1995)が、ショウジョウバエ(Drosophila)の胚におけるGFP発現についてはデービス(Davis)ら(Dev.Biology 170:726-729、1995)が報告している。参照として本明細書に組み入れられる米国特許第5,491,084号では、他の関心対象のタンパク質と融合させたレポーター分子としてのエクオレア・ビクトリア(AequoreaVictoria)由来GFPの発現が開示されている。参照として本明細書に組み入れられるPCT/DK96/00052は、細胞内プロセスに影響を与える細胞学的活性物質を、プロテインキナーゼ活性化部位を有するGFP構造を利用して検出する方法に関する。生物学的システムにおけるGFPタンパク質に関する文献は多数ある。例えば、参照として本明細書に組み入れられるPCT/US95/10165は、GFP様タンパク質の発現を利用して関心対象の細胞を分離するシステムを開示している。参照として本明細書に組み入れられるPCT/GB96/00481は、植物におけるGFPの発現を開示している。参照として本明細書に組み入れられるPCT/US95/01425は、突然変異生成を検出するための、形質転換生物における修飾GFPタンパク質の発現を開示している。GFP突然変異体は複数の生物学的システムで作製および使用されている(Hasselhoffら、Proc.Natl. Acad. Sci. 94:2122-2127、1997; Brejcら、Proc. Natl. Acad Sci. 94:2306-2311、1997;Chengら、Nature Biotech. 14:606-609、1996; HeimおよびTsien、Curr. Biol. 6:178-192、1996;ならびに、Ehrigら、FEBS Letters 367:163-166、1995)。いずれも参照として本明細書に組み入れられる米国特許第5,436,128号および第5,401,629号には、細胞表面受容体の活性に対して反応性を示す転写制御要素を含む受容体遺伝子構造を含みかつ細胞表面受容体を発現する組換え細胞を用いて、細胞外シグナルの細胞内変換を検出および評価するためのアッセイおよび構成を示した方法が開示されている。
【0085】
BioDx社(米国特許出願第08/810983号)により開発されたArrayScan(商標)システムは、特定の生物学的活性について多数の化合物を検索するために、発光的に標識したレポーター分子の細胞内における分布、環境、または活性を決定する光学システムである。ArrayScan(商標)システムは、発光レポーター分子を含む細胞を均一な位置のアレイに提供する段階と、各位置にある多数の細胞を蛍光顕微鏡で走査する段階とを含み、走査の段階では、光学情報がデジタルデータに変換され、かつ、細胞内の発光標識したレポーター分子の分布、環境、または活性がデジタルデータを利用して決定される。現在使用されている均一な位置のアレイは、業界標準の96ウェルまたは384ウェルのマイクロタイタープレートである。ArrayScan(商標)システムは、データを処理、表示、および保存するための装置とコンピュータ化された方法とを含み、したがって細胞に基づく高含量の検索を大規模のマイクロタイタープレートフォーマットで提供することによって薬剤の発見を増大させる。
【0086】
前述の態様を組み合わせて、均一なまたは不均一なマイクロパターンアレイで多色発光読取、マイクロ流体送達、および生細胞の自動環境制御を実施するための方法および装置を提供することも可能である。
【0087】
1つの態様では、本発明は細胞の不均一マイクロパターンアレイとアレイを作製する方法とを含む。アレイは、別の化合物の組合せで処理されてもよい同一の細胞種を含んでいてもよく、または、1つまたは複数の化合物で処理されてもよい細胞種の組合せを含んでいてもよい。「組合せ(combinatorial)」という用語は、ウェルまたはウェルの群が変動的に処理されることを意味する。本発明の別の局面は、細胞の不均一マイクロパターンアレイであって細胞が少なくとも1つの発光レポーター分子を含むアレイと細胞の不均一マイクロパターンアレイに試薬の組合せを送達させるための液体送達システムとを組み合わせて使用することによって細胞を分析する方法、ならびに、発光レポーター分子が発する発光信号を検出、記録、および分析する手段、を含む。本発明の別の局面では、細胞の不均一マイクロパターンアレイ内の発光レポーター分子が発する発光信号を検出するための発光読取機器と、発光読取機器からデータを受け取るためのデジタル検出器と、光検出器から送られたデジタルデータを受信および処理するためのコンピュータ手段とを含む細胞検索システムが開示される。
【0088】
別の態様では、細胞は細胞の化学特性または分子特性を表す蛍光インジケータで修飾され、不均一マイクロパターン化学アレイに播種され、かつ、生きた状態で分析される。このようなインジケータの例は、ギウイラノ(Giuilano)ら、Ann.Rev. Biophys. Biomol. Struct. 24:405-434、1995; ハルーツニアン(Harootunian)ら、Mol. Biol.Cell 4:993-1002、1993; ポスト(Post)ら、Mol. Biol. Cell 6:1755-1768、1995; ゴンザレス(Gonzalez)およびチエン(Tsien)、Biophys.J. 69:1272-1280、1995; スワミナサン(Swaminathan)ら、Biophys. J. 72:1900-1907、1997; ならびに、チャルフィー(Chalfie)ら、Science263:802-805、1994に記載されている。インジケータは、細胞をアレイに播種する前または播種した後に、種々の物理的方法の1つまたは組合せにより細胞に導入してよく、このような物理的方法としては、例えば、細胞膜を介した拡散(Haugland、「蛍光プローブと研究用化学物質のハンドブック(Handbookof fluorescent probes and research chemicals)」、別冊6、Molecular Probes社編、Eugene、1996に概説)、細胞膜の機械的摂動(McNeilら、J.Cell Biology 98:1556-1564、1984; ClarkeおよびMcNeil、J. Cell Science 102:533-541、1992;Clarkeら、BioTechniques 17:1118-1125、1994)、または規定された条件下において細胞内でインジケータが発現するような遺伝子操作(Chalfieら、1994)があるが、これらに限定されることはない。好ましい態様において、細胞は発光レポーター遺伝子を含むが、化学発光タンパク質をコードしている遺伝子を含めて他の種類のレポーター遺伝子も適している。生きた細胞の研究により、生活環中の発光または薬剤もしくはその他の反応性物質と接触した際の発光に基づいて、細胞の生理学的状態を分析することが可能になる。
【0089】
本発明の別の態様では、細胞の不均一マイクロパターンアレイであって細胞が少なくとも1つの発光レポーター分子を含むアレイを作製する段階と、細胞の不均一マイクロパターンアレイに試薬を送達させることを可能にするため細胞の不均一マイクロパターンアレイを液体送達システムに接触させる段階と、細胞の個々の画像を取得できるよう適切な倍率で個々の細胞の発光画像を取得することにより高スループットの検索を実施する段階とを含む、個々の細胞を分析する方法が提供される。次に、異なる生理学的特性およびスペクトル特性を有する発光試薬のセットを使用する段階と、細胞内の発光レポーター分子が発する発光信号を取得するため個々の細胞のアレイを走査する段階と、発光信号をデジタルデータに変換する段階と、デジタルデータを利用して個々の細胞内の発光レポーター分子の分布、環境、または活性を決定する段階とにより、反応したウェル内で高含量の検出が行われる。
【0090】
個々の細胞の不均一マイクロパターンアレイとチャンバとを含むカセットがVSOM光学読取機器に挿入される。光学読取機器は、カセットの取り扱いと、環境(例えば、生細胞にとって重要である温度)の制御と、溶液のウェルへの送達の制御と、1度に1つまたは複数の細胞について細胞のアレイから放出される発光の分析とを行う光学機械装置である。機器は、個々の細胞が発する光信号とアルゴリズムとに基づいて、溶液の添加を自動的に制御する。好ましい態様において、光学読取機器は、読取装置としての蛍光顕微鏡とカセットを走査するためのマイクロロボットとを使用した集積回路検査ステーションを含む。カセットは保管区画に保持され、コンピュータ制御されたロボットアームによって保管区画から回収される。ロボットアームはカセットを発光読取機器に挿入する。別のロボットアームがカセットを発光読取機器から取り出し、第二の保管区画に配置する。
【0091】
環境制御、マイクロロボット、および光学読取機器を統合したシステムはカールツァイス(Carl Zeiss)[Jena、GmbH] などの企業により製造されている。ロボットによる取り扱い、液体の送達、および高速かつ精密な走査が容易になっていることに加えて、高含量および高スループットの2つの読取モードが用意されている。高含量の読取は、ArrayScanリーダー(米国特許出願第08/810983号)による読取と本質的に同じである。高含量モードでは、細胞の不均一マイクロパターンアレイの各位置が倍率5倍〜40倍以上で撮像され、所望の統計学的分解能の測定を行うのに十分な数の視野が記録される。
【0092】
1つの態様において、光学読取機器は、コンピュータ制御のx,y,zステージを有する正立または倒立の蛍光顕微鏡である光学機械設計と、低倍率(例えば0.5倍)の対物レンズおよび1つまたは複数のより高倍率の対物レンズを保持するコンピュータ制御の回転ノーズピースと、励起フィルタホイールを有する白色光源と、発光フィルタを有するダイクロイックフィルタシステムと、検出器(例えば冷却電荷結合素子)とを含む。別の態様において、光学読取機器は、共焦点または標準の照明モードで走査レーザービームを利用してもよい。スペクトルは、カールツァイス(CarlZeiss)(Jena、GmbH、ドイツ)が製造しているようにまたはDenkら(Science 248:73、1990)が報告しているように、複数のレーザーラインかまたは個別のレーザーダイオードの群かに基づいて選択される。高スループットの検索モードの別の態様では、発光励振器のアレイ(1×8、1×12など)と発光放射検出器とを有する低分解能のシステムであって細胞の不均一マイクロパターンアレイのウェルの部分集合を走査するシステムが使用される。このシステムは、好ましい態様では光ファイバー束を有するが、発光励起光を誘導しかつ同じウェルが発する発光放射光を収集するシステムであれば任意のシステムであってよい。
【0093】
B.局所のホストコンピュータ(またはクライアント)
コンピュータ制御の周辺装置は局所コンピュータによって独立に制御してもよく、または、遠隔コンピュータが発行する命令のためのコンジットとして局所コンピュータを機能させてもよい。一般的な「機器」もしくは顕微鏡の遠隔制御、またはインターネット上のVSOMシステムは、後述のように複数の利点を有する。例えば、中央コンピュータは、より高い処理能力およびアーカイビング能力、ならびにより高度なデータベースおよびその他のソフトウェアパッケージを有していてもよく、これにより、これらの長所を、個々の光学プラットフォームの近くに配置された多数の局所コンピュータ上で多額の費用をかけて重複させる必要がなくなる。
【0094】
C.VSOM制御用の遠隔コンピュータ、ネットワークソフトウェア、データベース、インフォマティクス、および分析アルゴリズム
コンピュータ科学の見地から、本発明には種々の構成要素を必要とした。特に好ましい態様では以下の構成要素が含まれる:(1)顕微鏡周辺装置のコンピュータ制御、(2)単一または複数のチャネルで撮像された細胞のセグメント化、(3)特定の実験で使用されるレシピの解題、(4)印加された刺激の関数としての細胞反応の自動分析、(5)2つの細胞種間の差異をアッセイの関数として比較するオフラインの相関技術、クラスター化技術、および学習技術、ならびに、(6)2つ以上の異なる細胞種から直接の反応を導出するためのポリシー(すなわちプロトコルまたはレシピ)を動的に制御および推測するオンラインの学習技術。種々のシステム構成要素間の相互作用を図1および図2に示す。特に好ましい態様において、全システム構成要素の完全な統合には、専用に設計されたグラフィカルユーザーインターフェース(GUI)、オンライン画像分析ソフトウェア、オフライン分析用のデータベース統合、モデルシステム内での細胞反応の効果的な可視化、ならびに、オフラインおよびオンラインの学習技術(例えばアルゴリズム)が含まれる。
【0095】
さらに、別の態様において、本発明は視覚的サーボ制御光学顕微鏡観察用の画像バイオインフォマティクスシステム(すなわち「BioSig」)を提供する。本発明のこれらの態様により、VSOM実験用の特定の条件および刺激の関数として細胞反応をカタログ化する基礎が提供される。本発明は、システムアーキテクチャ、実験プロトコルを表すための機能データモデル、画像分析用の新規的アルゴリズム、および統計学的分析を提供する。アーキテクチャは、少なくとも1つのVSOM機器の遠隔共有操作を提供し、かつ、機器操作を画像の取得および解題と連結させる。好ましい態様において、情報は、オブジェクトおよびその関連を永続的に保存できるオブジェクト指向データベースに保存される。特に好ましい態様では、アルゴリズムは個々の細胞から細胞下レベルで生理学的情報を抽出し、それを細胞反応および最終的な生物学的帰結にマッピングする。
【0096】
VSOMシステムはいくつかの好ましい態様において、定期的に画像を取得し、それらの画像をセグメント化し、数百の細胞を含む視野について細胞反応を測定し、かつ、それらの反応をアーカイブシステムに記録する、ワークフローモデルを使用する。これらの反応により、個々の細胞反応の有向測定および追跡が可能になる。次に、ウェブベースのインターフェースを介してアーカイブシステムを閲覧することおよびアーカイブに問合せすることができる。生データ、セグメント化の結果、およぼ対応するメタデータ(例えば、2.5時間にわたる反応の計算結果)の閲覧の例。
【0097】
本発明によって克服された重大な課題の1つは、生物学的実験では大きな母集団による試験が必要であり、かつ、離れた特徴と解題データとを相関させる必要があるという事実に関するものである。本発明は、複数の標的に関する位置および発現の情報を位置参照および形態学的特徴とともに記録するデータベースを作成するための、統合された画像取得、解題、および階層的画像抽出用の画像バイオインフォマティクスシステムを提供する。統計ツールおよび可視化ツールが統合され、仮説検証およびデータマイニングを可能にする。これは、遠隔鏡検法(telemicroscopy)開発用のインフラストラクチャを強化および拡張することにより実現される(例えば、Parvinら、「考察:分散鏡検法およびインフォマティクス用のチャネル(DeepView: A Channel for Distributed Microscopy and Informatics)」、IEEE高性能コンピューティングとネットワーキング会議(IEEEConf. on High Performance Computing and Networking)[1999]、および、Parvinら、「分散機器用の宣言的フロー制御(DeclarativeFlow Control for Distributed Instrumentation)」、IEEEグリッド・クラスターコンピューティングの国際シンポジウム(IEEEInt. Symposium on the Grid and Cluster Computing)、2001年5月を参照)。本発明は、種々の新規的な構成要素を提供し、構成要素には以下のものが含まれるがこれらに限定されることはない:画像取得用の分散アーキテクチャ、細胞下レベルで構造および機能を特徴付けるための新規的アルゴリズム、特定の刺激に対する各細胞の反応のアーカイビング、ならびに、機器を特定の状態に駆動するための反応計算結果の使用。
【0098】
D.インフォマティクス
特に好ましい態様において、インフォマティクスシステムは、データモデル、プレゼンテーションマネージャ、およびクエリーマネージャを含む。開発、試験、および保守を容易にするためこれらのサブシステムは切り離される。データモデル構成要素の目的は、必要な解題データを取得し、かつ、それらを仮説の信号および反応の経路を表す計算された画像表現と連結させることである。モデルはオブジェクト指向であり、解題と測定された特徴データとの二方向追跡が可能である。プレゼンテーションマネージャは、基礎となるデータモデルの変化に関わらずユーザーインターフェースの配線が回避され、かつ実行時に構成されるインターフェースがより柔軟となるよう、データモデルとユーザーフェースとの間のマッピングを含む少なくとも2つの個別の特徴を提供する。さらに、テキストまたはグラフィックによる特定のクエリーの表示機能が提供される。クエリーマネージャは、高レベルのユーザークエリーを、データモデルを実行するJavaオブジェクトにマッピングする。したがって、好ましい態様において、本発明は、データベースの詳細な操作を単純化しかつエンドユーザーから隠蔽する。
【0099】
1.データモデル
図6パネルAに示す態様のデータモデルはオブジェクト指向であり、特定のプロジェクトを、画像の集合から計算された特徴にリンクする。リンクは二方向性であり、任意のエンドポイントから情報を追跡することが可能である。各プロジェクトは、試験にリンクされた各自のデータベースを有する。
【0100】
2.プレゼンテーションマネージャ
プレゼンテーションマネージャは、データベースの閲覧とクエリー機能の結果の可視化という2つの主たる特徴を有する。データベースの閲覧は、解題データ、画像、および対応する特徴を取得するあらかじめ定義されたスキーマに対して実施される。図6パネルAに示すデータモデルはXSD(XMLスキーム)で表現され、プレゼンテーションマネージャがこの表現と対応するスタイルシート(XSL)とを用いて閲覧および更新用にデータベース内にビューを構成する。この態様においては、より柔軟でかつ動的に生成されたユーザーインターフェースに有利となるようGUIの配線はバイパスされる。一般的には、このようなマッピングにより複雑な実行上の問題が生じる可能性がある。しかし本発明は、プレゼンテーションシステムを単純化することによって、1つの層の閲覧と更新とを同時に行うことを可能にしている。「層」とは、関連(association)、集合(aggregation)、および継承(inheritance)によってリンクされたオブジェクトと他のオブジェクトとの間のナビゲーションを指す。
【0101】
1つの態様において、各科学実験は、特定の時点における細胞の母集団に対応する数までの画像を含んでいてもよい。多くの場合、各時点において、そのセットの平均的な挙動を特徴付けるいくつか(2〜3)の画像を用いて画像の集合を可視化することが必要である。平均的な挙動は特定の特徴の観点で表現されることが多い。本発明により、ある時点の画像の集合の代表物に各画像が対応する、一連の画像を構成することが可能である。さらに、プレゼンテーションマネージャはクエリー機能の結果をテキストまたはグラフィックで表示することができる。グラフィックスには、化合物の特徴を独立変数の関数として表示する用量反応プロット図および散布図が含まれる。
【0102】
3.クエリーマネージャ
クエリーマネージャは、可視化および仮説検証を補助するためのあらかじめ定義されたオペレータのセットを提供する。これらのオペレータは、計算された特徴とそれに対応する解題データとの間のコントラストの描写を補助し、かつ、分散分析および主成分分析(PCA)など種々の統計学的方法を実行する。いくつかの態様では、これらのオペレータにより細胞反応を最終的なモデル再構成用に解読することが可能である。オブジェクト指向データベースでは、計算される特徴がそれぞれそのソース(例えば細胞培養物または動物)にマッピングされる必要があるため、分散分析などの測定が単純化される。このような高レベルのオペレータの1例としては、独立変数に対する、計算された特定の特徴の相関付けがある。本発明は、データベース操作へのユーザークエリーのマッピング、結果の計算、および計算結果のディスプレイマネージャへの転送を行うための視覚クエリーインターフェースを提供する。いくつかの態様において、実際の計算には、ディスプレイを目的とした分散分析(例えば、特定の測定結果を複数の独立した試料に関連付けるため)またはPCA(例えば、計算された特徴ベクトルの低次元化)が含まれる。
【0103】
4.核の抽出
細胞の副区画の自動描写は、印加された刺激に対する細胞の反応をモニターする上で重要な段階である。一部の場合では、関心対象の細胞が互いに接触または重複し、したがってセグメント化が困難なことがある。本発明の開発過程で利用した従来のアプローチでは(例えば、CongおよびParvin、Patt.Recog.、33:1383-1393 [2000]; ならびに、Parvinら、「Biosig:細胞内シグナルの機構研究のためのバイオインフォマティクスシステム(Biosig:A Bioinformatic System for Studying the Mechanism of Inter-Cell Signalling)」、IEEEInter. Sympos. Bio-Informatics Biomed. Engineer.、pages 281-288 [2000]を参照)、大域的に一貫性のある方法で核の集塊を仕切るため、ステップエッジとルーフエッジの両方を使用した。ステップエッジは核と背景との間の境界に対応し、ルーフエッジは隣接する核との境界に対応する。このシステムに固有な特徴の1つは、各仮説の超二次関数的表現と、大域一貫性のためにこの表現を用いたこととにあった。大域一貫性は、動的プログラミングで最小化した費用関数によって得た。本発明は、より単純かつより強力なアプローチを提供する。以前のアプローチにおける主たる難点は、しわ境界の検出およびグループ化によりシステムの複雑性が増し、その結果信頼性が低下したことであった。画像空間におけるそれぞれの核の投影が二次関数的であると仮定している点においては本発明もモデルベースである。しかし、本発明のいくつかの好ましい態様においては、ステップエッジとルーフエッジとをグループ化する代わりに、画像のゼロ交差に対応する表現から開始する。次に、ゼロ交差画像を幾何学的制約条件および照明制約条件でフィルタリングして、核の二値化集塊を生成する。次に、「重心変換」とよばれる過程により核集塊を複数の核に仕切る。計算プロトコルの各段階を図7パネルAに示す。重心変換は、本質的に、局所化された質量中心に輪郭上の各点を投影する。図7パネルBに示すように、輪郭上のノイズおよびその他のアーチファクトを除去するため、解の正規化が行われる。
【0104】
a.エッジ検出
エッジの局所化は局所座標系のゼロ交差を基礎としている。以下に詳細に説明するように、これらのエッジは上限の最小化に対応する。
【0105】
円滑化のための正規化技術の大多数は、∫R|∇f|2などの積分の最小化を基礎としている。しかし、この式はfの局所的性質をまったく制御できない。換言すれば、|∇f|の大局的平均が小さくてもfが局所的に急に変化する場合があり得る。この課題を克服する1つの方法は全点において|∇f|を最小にすることであり、これによって|∇f|の上限が最小化される。したがって、汎関数H(f)=supR |∇f| は、一連の次式の汎関数(式1)の「限界」であるとみなすことができる。
(数1)

汎関数 HN(f) を最小にするオイラーの方程式は次式(式2)で表される。
(数2)

式中、下付き文字は例えば次式のような導関数を表す。
(数3)

第一の係数を消去し、かつN→∞とすることにより、式3が得られる。
(数4)

式(3)は無限ラプラス方程式(ILE)と呼ばれるもので、広く研究されている(例えば、Aronsson、Arikv. Matematik、6:551-561[1966]; Aronsson、Arikv. Matematik、7:133-151 [1967]; Aronsson、Manuscripta Math.、41:133-151[1981]; ならびに、Evans、Electron. J. Different. Equat.、[http://ejde.math.swt.edu/Volumes/1993/03-Evans/abstr.html]3:1-9 [1993]を参照)。式(2)のいくつかの重要な特性は、少なくとも1つの解が存在すること、および、妥当に弱い意味で「解」が再定義されるならばC1の連続解が存在することである。さらに、fの勾配の軌跡は凸曲線または直線であり、かつ、Rには停留点|∇f|=0が存在しない。局所座標系が∇fで定義される局所座標系において、式(3)がゼロ交差(fxx+fyy=0)と等価であることは興味深い。
【0106】
式(3)を生データに適用すると、ラプラス形式より安定な(すなわち、前景と背景との間の漏れがない)ゼロ交差マップが得られる。このゼロ交差マップは、強度制限条件およびサイズ制限条件で容易にフィルタリング可能な誤領域を有する閉鎖輪郭をもつ。フィルタリングされたセグメント画像は次に重心変換に使用される。
【0107】
b.テンソルベースの特徴解析
ベクトル場解析は、数学および物理学などの古典的分野とともにコンピュータの視覚およびパターン認識においてもよく研究されている技術である。運動ベースの用途向けに多数の概念およびツールが開発されている。本発明は、現在の最新技術を科学画像のセグメント化および解釈に拡張する。強度画像f0(x,y)が与えられたとき、強度画像から導出される自然ベクトル場が存在し、これはπ/2の回転をもつ傾斜場に相当する:
(数5)

ここでの問題点は、ベクトル場「v」にノイズが多く何らかの種類の正規化を導入する必要があることである。これは次式で表される:
(数6)

式中、uは正規化されたベクトル場である。次に、反復法により楕円PDEの解が得られる。次式の単純な線形(ガウス)目盛空間モデルにより一次近似を求めることができる(Lindeberg、J.Appl. Stat、pages 225-270 [1994]):
(数7)

式中、
(数8)

は標準偏差が
(数9)

であるガウス核である。
【0108】
次に、ベクトル場の特異点は、密なベクトル表現のコンパクトな抽象を与える。これらの特異点は点特徴または線形特徴により特徴付けることができる。点特徴には速度および鞍点が含まれる。これらのパターンが検出された後は、対応するオブジェクトの抽出が可能となる。RaoおよびJain(IEEETrans. Patt. Anal. Mach. Intell.、pages 225-270 [1994])は、基礎となるベクトル場からの特徴抽出に局所ヤコビアンを用いることによって特異点を検出した。しかし、本発明のアプローチはより強力であり、かつ、渦のサイズ計測も可能である。渦サイズは、凸ブロブが互いに接続または接触している場合であっても凸ブロブの位置特定を補完する。これは、基礎となるベクトル場における特異点の位置を特定するジョルダンインデックス(Index)に基づく。F=(u,v)をベクトル場とし、Jを臨界点をもたないジョルダン曲線とする。Jのインデックスは次式により定義される:
(数10)

各点PにおいてP周囲の半径Rの小円(JRPによって表される)が選択され、Index(JRP)が計算される。次に、以下のように流れ場(u,v)を分類することができる:
1.渦のインデックスが+1 に等しい(すなわち、ベクトル場中の特異点は前述のRaoおよびJainによって与えられる)場合、および
2.鞍点のインデックスが -1 に等しい場合。
次式のように、ベクトル場のダイバージェンスは全点においてゼロであるから、ベクトル場に節は存在しない:
(数11)

次に、単純な検索技術により渦のサイズが推定される。点a(x,y)が渦であるならば、そのサイズR*(x,y)は次式で定義される:
(数12)

換言すると、R*(x,y)は、JR(x, y) のインデックスが1であり続けるような最大のRである。一次偏導関数の積分であるジョルダンインデックスは、ある意味において、強度画像の関数である。これとは対照的に、他の技術は、より多くのノイズが生じやすい高次の導関数を基礎としている。合成画像、蛍光染料で標識した核、および透過光で観察した細胞における渦および領域セグメント化の結果を種々の図に示した。
【0109】
図41パネルCおよびDは、蛍光染料Hoechst 33342で標識した、生細胞および溶解した細胞の核による結果を示す。図41パネルEおよびFは、20倍の位相差対物レンズと透過光とを用いて撮像した、生細胞による結果を示す。個々の細胞を位置特定する従来の技術は蛍光撮影に限られており、蛍光撮影は動的実験の設計の複雑さを増加させるため、後者の結果は重要である。本明細書に示すデジタル画像のうち、図41パネルEおよびFのみは、10×NA0.5 Zeiss Fluar対物レンズを用いずに撮影したものである。画像はすべて1024×1024であり、カメラ内のCCDチップのピクセルは6.8×6.8μであった。したがって、10倍で撮影したすべての画像において、視野はおよそ高さ700μ、幅700μである。
【0110】
c.正規化した重心変換
I(x,y)を元の画像とする。各点(x0,y0)において、等高の輪郭は次式(式4)で定義される:
(数13)
I(x,y)=I(x0,y0)。
テイラー級数を用いて上式の拡張および打切りを行うと次式(式5)が得られる:
(数14)

上式においてu=x-x0かつv=y-y0であり、または、
(数15)

がヘッセの行列である次式の標準形(式6)
(数16)

において
(数17)

は強度の勾配であり、かつ、w=(u, v)Tは局所座標系における重心である。式(6)で定義される二次曲線の重心が次式(式7)の線形制限条件を満たすことは周知である:
(数18)
Aw+b=0。
Aが特異点でないならば、重心は直接求めることができる(すなわち、次式(式8)):
(数19)
w=-A-1b。
しかし、これは必ずしも真ではなく、一般的に次式(式9)で定義されるゼロ集合
(数20)

は非自明である。さらに、これは以下の2つのカテゴリーに分類することができる。
1.強度の勾配がゼロである領域に対応する、均一な領域。二値画像の場合、情報は輪郭上のみに存在する;および、
2.グレーレベル画像中の楕円形状に対応する、不均一な領域。
【0111】
これらの点の重心は十分に定義されない。さらに、計算の安定性の観点からは、特異点のためこれらの近い点を高い信頼度で計算することができない。これらの難点に対処するためには問題を正規化する必要がある。(x,y)の重心を(u(x,y),v(x,y))Tで表すと、正規化モデルは以下の式10または式11で表すことができる:
(数21)

または
(数22)

式中、第1項および第2項は見積誤差、第3項は制限条件の平滑度であり、α(> 0)は重さである。この問題の解は「正規化重心変換」(RCT)と呼ばれる。変分問題である式11のオイラー-ラグランジュ方程式は次式(式12)である:
(数23)

【0112】
偏導関数の差分近似を上述の差分方程式に代入すると、次式(式13)が得られる。
(数24)

上式は次式(式14)に書き直すことができる。
(数25)

式中、(式15)
(数26)

である。
これらの係数はすべて偏導関数の関数であり、かつ、(u(x,y), v(x,y))の近傍である。行列式(式16):
(数27)
Δ=ad-bc > 16α2
は常に正であり、かつ、式(14)の解は次式(式17)となる。
(数28)

したがって、推定された偏導関数および前の推定値(un,vn)から得られた推定値の新しい集合(un+1,vn+1)は次式(式18)となる。
(数29)

【0113】
e.表現および分類
生細胞の撮像、および一般的に蛍光顕微鏡撮像は、構造情報と機能情報とを分離するために多スペクトルであることが多い。いくつかの態様においては、試料を蛍光染料で標識し、360nmでの撮像により核の情報(例えば、形状および構成)を得る。反応は他の励起波長(例えば、490 nmおよび570 nm)で撮像される。本発明のいくつかの態様においては、それぞれの核は楕円および超二次関数で表現され、その反応は他のチャネルで直接読み取られる。
【0114】
楕円のフィッティングは、4ac-b2=1の制約条件を受ける多項式F(a,x)=ax2+bxy+cy2+dx+ey+fのパラメータの推定に基づいて行われる(Fitzgibbonら、Proc.Intl. Conf. Patt. Recogn.、253-257 [1996])。
【0115】
2Dの超二次関数(Hanson、Comp. Vision Graph. Image Proc.、44:191-210 [1988]; および、Kumarら、IEEETrans. Patt. Anal. Mach. Intell.、17:1079-1083 [1995])は、次式(式19)で定義される閉曲線である。
(数30)

γi > 0であることから(Roskelleyら、Curr. Opin. Cell Biol.、7:736-747 [1995])、次式(式20)が得られる。
(数31)

上式は各iの平行線セグメントの対に対応する。これらの線セグメントは、その中に超二次関数が制限される凸ポリトープを(大きいγについて)定義する。この表現は、対称でなくてもよい幅広い形状について有効である。パラメータAiおよびBiは結合線の傾斜を決定し、これら2つの間の距離γiとCiとは形状の「直角度」を決定する。
【0116】
フィッティング問題は以下のとおりである。n個のセグメント
(数32)

のm個のデータ点Pj=(xj, yj)、j=1, 2, . . . , mが与えられたとする。費用関数は次式(式21)で定義される:
(数33)

式中、
(数34)

∇は勾配オペレータ、λは正規化パラメータ、Qiは制約条件項である(Kumarら、IEEE Trans. Patt. Anal.Mach. Intell.、17:1079-1083 [1995])。パラメータAi、Bi、Ci、およびγiは、レベンバーグ-マーカー(Levenberg-Marquar)の非線形最適化法(Pressら、「Cにおける数値レシピ(NumericalRecipes in C)」、Cambridge University Press [1992])を用いて、適切な初期推測値からεを最小化することによって計算される(Kumarら、IEEETrans. Patt. Anal. Mach. Intell.、17:1079-1083 [1995])。画像中のそれぞれの核はルーメン中の位置によってさらに分類される。図8に、画像中の核の楕円フィッティングおよび分類の例を示す。
【0117】
f.正規化した重心変換の解析
本発明の1つの態様において、画面内の核の抽出は周知の形態学的オペレータと異なる。1つの具体的な技術は、画像を三次元構造として捉える分水界変換である(例えば、NajmanおよびSchmidt、IEEETrans. Patt. Anal. Mach. Intell.、18:1163-1173 [1996]を参照)。画像をその局所極小からフラッドさせ、かつ異なる局所極小に由来する領域の併合を抑止することによって、画像は、流域(catchment)および盆地(basin)、ならびに分水界線(wathershedline)に分割される。別の態様では、このような分割は、各エッジ点から局所極小への下流経路を発見することによってエッジから開始される。分水界変換は、隣接領域を併合するために複雑な形態学的オペレーションを必要とする過剰セグメント化につながる。対照的に、本発明の好ましい態様では、二値化した画像から開始し、続いて、核に属する境界点をつぶして単一の点にする。ただし、自然の分割を明らかにするために境界点を局所盆地に移動させるという観点からは、分水界変換および重心変換も同じ発想である。この方法を用いると、距離変換に対応するエネルギーランドスケープは多数の局所極小を示す。対照的に、正規化重心変換は、単一の局所極小をもつ滑らかなエネルギーランドスケープを有する。
【0118】
重心変換は本質的に、二値ブロブを、各凸領域が核または他の副区画に対応するような別個の凸領域に分割する。分割は進化的であり、かつ、自然境界に沿って生じる。対照的に、本発明の開発過程で実施された早期の研究では(例えば、CongおよびParvin、Patt.Recog.、33:1383-1393 [2000]を参照)、このような分割は必ずしも対象の自然境界に沿って生じなかった。
【0119】
したがって、本発明は、生物学的反応(例えば生物学的機能)を惹起する種々の刺激(例えば外因的に印加された刺激)の結果として細胞間に発生するシグナルのより詳細な像を得るのに有用な、鏡検法および画像分析に対するバイオインフォマティクスアプローチのための方法を提供する。これらの方法は後により詳細に説明する。
【0120】
重要な点として、本発明のVSOMは、本発明者らの以前の研究でより詳細に報告されている分散型の鏡検法とインフォマティクスとのためのチャネルであるDeepViewとのインターフェースに適している。Deep Viewは、任意の機器をそのフレームワークに追加するための拡大縮小可能なインターフェースである。DeepViewはまた、ワイドエリアネットワーク上でデータを転送および閲覧するための手段も提供する。システムは、その特性の広告(advertisement)を介して標的の機器と相互作用する総称GUIを有する。VSOMの場合、関係する特性はコンピュータ制御のシリンジ、シャッター、およびXYステージ、Z軸フォーカスモーター、フィルタホイール、ならびにカメラ制御パラメータである。この、機器の広告性能(機能性)の概念は、より一様なインターフェースをもたらし、かつ、ソフトウェアが再使用可能であることにより維持管理費用を低減させる。
【0121】
E.セグメント化
前述のように、核および細胞質の自動描写は、細胞反応を特定の細胞区画にマッピングする上で重要な段階である。この計算構成要素はVSOMシステムと相互作用して1つまたは複数のチャネルから画像データを取得する(例えば、フィルタホイールを回転させるまたはシャッターを開閉させることによって)。単一のチャネルから取得した画像のセグメント化は前述のとおりである。以下に、多チャネルのセグメント化の概要を説明する。
【0122】
多チャネル画像の分析では、長時間を要する種類の、別のデータ収集が発生する。このシナリオでは、細胞の異なる構成要素を強調するため、異なる蛍光プローブを用いかつ異なる励起フィルタを使用して細胞が撮像される。この場合、システムは、複数のデータのチャネルの同時分析、特定の細胞内要素の選択、および繰り返し測定が可能でなければならない。ベイズフレームワークに基づいた融像のための効率的なアプローチが開発されている。本発明の開発中に行われた研究で示されているように(Parvinら、AAAISymp. Appln. Comp. Vis. Med. Imaging [1995]を参照)、このアプローチは(共焦点鏡検法を用いた)3Dにも拡張可能である。データ融合の目的は、セグメント化および標識のための異なる様式を補完的に処理することである。この見地から、セグメント化手順によりデータ領域中の各ピクセルが相応に標識される必要がある。しかし、標識処理を複雑化しうる曖昧さが多数存在する。これらの曖昧さは、局所処理のみから、および、高レベルのフィードバックの不在により、生じる可能性がある。
【0123】
曖昧さの発生源には、ノイズによるデータの破損、局所特徴を抽出するアルゴリズムの性能の限界、および、標識タスクを妨げる不必要な特徴の存在が含まれる。領域セグメント化の1つの局面では、ヒストグラムの分析により達成される、各領域の平均強度の推定が行われる。いくつかの態様において、ヒストグラムのピークの最初の位置が近似され、次に最小二乗近似により精密化される。計算過程の次の段階では、これらのピークをクラスター中心として使用して画像空間内の局所一貫性を高める。このとき、多チャネル情報に基づいて画像を標識するためにベイズフレームワークが使用される。具体的には、本発明は3つのレベルをもつベイズ階層モデルを使用する。第一レベルは基本的な分類Zのモデルである。理想的な条件下では、M個の異なる様式(例えば、青、緑、および赤の蛍光発光にそれぞれ対応する3つの蛍光画像)でZを観察することにより、画像システム中の種々のノイズにより破損されるデータの理想的な表現Xiが特定される。階層の第三レベルはデータYiの実際の観察結果に対応する。第一レベルは、マルコフランダム場(MRF)を事前確率密度関数とともに、正のパラメータをもつイジング模型の形式で使用する。このパラメータは近傍ピクセル間の協力を促進する。ベイズフレームワークにおいて、画面の内容に関する事前の無知性(ignorance)があるという仮定を設定してもよい。第二レベルは、Zが与えられたときの条件的な従属変数としてXをモデル化する(すなわち、P(X1,...,XMZ)=P(X1Z) ... P(XMZ)。ある分類が細胞質としてラベル付けされるのであれば、緑チャネル(すなわち細胞質)および青チャネル(すなわち核)の理想的反応は互いに影響しないので、これは妥当である。階層の第三レベルであるYiはガウス分布としてモデル化される。その結果、YiはXiの局所的にぼやけた表現となる。完全なモデルは次式(式22)として表される:
(数35)
P(Z, Xi Yi)=P(Yi Z) P(Xi Z) P(Z)。
最大事後確率(MAP)推定を用いてXiおよびZを得る。ただし、MAP計算は本来的に実行不可能であるため、反復条件モード(iterativeconditioning modes; ICM)に基づく数値近似を用いて局所最適条件を発見する(Besag、J. Roy. Stat. Soc. B、48:259-302[1986]を参照)。
【0124】
F.ソフトウェア
本明細書に詳細に説明しているように、本明細書に記載の実験で使用したVSOMの機能アーキテクチャは、画像取得モジュール、画像分析モジュール、サーボ制御、およびアーカイブで構成される。画像取得モジュールは、6つの励起フィルタを用いて、微速度撮影の高分解能ビデオ鏡検法の手段を提供する。このモジュールは、種々の時間周波数および励起周波数の、手動の画像取得またはあらかじめプログラムされた画像取得を可能にするレシピマネージャを有する。レシピは、意味的な相互運用性を提供するXML表記法で表現される。分析モジュールは、サイズ、位置、反応、および境界輪郭に基づいた画像の特徴ベース要約を提供する固有のセグメント化アルゴリズムを統合する。したがって、分析モジュールは、属性付けされたグラフモデルに基づいて画像の特徴ベース要約を提供する固有のセグメント化アルゴリズムのプールを有する。その結果、グラフ中の各節は画像中の同質の領域(例えば、核、細胞質など)に対応する。
【0125】
各節の属性には、境界輪郭、超二次関数を用いたこの輪郭のパラメトリック表現、派生する複数の特徴、および観察下における細胞内区画の反応が含まれる。グラフ中のリンクは種々の節の間の隣接関係をコードする。属性付けされたグラフモデルは、各細胞およびその近隣の構造的定義を完全に表現する。サーボ制御モジュールは、顕微鏡付近に位置する4つのシリンジのうち任意のシリンジの流れを制御することによって組織培養容器中の種々の化合物の濃度を制御する。サーボ制御は3つの操作モードを提供し、各モードはレシピマネージャで連続的に登録される。これらのモードには以下が含まれる:(1)各化合物の流量、その開始時点、および持続時間が特定される、静的レシピ;(2)観察下における細胞の特定の反応の関数として流量および持続時間を変化させる、動的レシピモード;ならびに、(3)指定された周波数で流れをオンおよびオフにするプログラムにより制御される、変調レシピ。アーカイブシステムは、画像、その計算されたグラフモデル、および解題データをフラットファイル環境に保存する。本発明の主要な特徴の1つは、複数の位置から遠隔的に操作できることである。この固有の特徴により、研究者らは地理的に離れた位置に物理的に位置していても、与えられた実験を協力して行うことができる。
【0126】
本発明により、ユーザーが利用できる柔軟性が最大限となる。例えばユーザーは、細胞チャンバへの灌流速度の制御、カメラ露出時間の設定、光学フィルタホイールの位置の選択、およびデータ収集のサンプリングレートの設定を可能にする、特定の実験のためのレシピを入力することができる。本明細書において、画像の取得および制御のための操作可能VSOMソフトウェアパッケージの好ましい態様の1つを「VX5」と呼び、別の好ましい態様の1つを「ADR」と呼ぶ。VX5はシステムの静的レシピ制御用に設計されたものであり、ADRは動的レシピの視覚サーボ制御実験を局所的にまたはネットワーク上で実行するために設計されたものである。図14に、DeepViewの機能的アーキテクチャの略図(パネルA)、VX5実行用のXMLレシピファイルのサンプル(図14パネルC)、ポンプログ中のデータの例(図14パネルB)、および、ICSデジタル画像ヘッダの例(図14パネルD)を示す。
【0127】
G.特徴ベースの画像の保存
現在、保存モデルは一般的にフラットファイル上に構築されており、フラットファイルは検索および維持が困難である。本発明は、保存取り扱いに必要なスキーマを構築するためのアクティブバイオインフォマティクスプログラムを活用する手段を提供する。1つのスキーマの設計を図15に示す。この設計は、VSOMに適応させるため、および、印加された刺激に対してどの特定の細胞内区画がどの程度「反応」したかというモデルを構築するうえで有用な、特徴ベースの空間-時間データベースをつくるために拡張されたものである。図16に示す多次元データベースは、各細胞内区画の反応曲線を含む細胞反応と、1つの区画から次の区画への蛍光プローブの移動との表現を提供する。
【0128】
好ましい態様の使用中、各実験は、標本容器(例えばぺトリ皿)中の特定の物理的位置に対応する標的フレーム(すなわち画像)を含む。細胞内の構造はセグメント化され、属性グラフとして解題データとともに保存される。次に、コンピュータ制御下で生細胞に刺激を印加しながら経時的に収集した一連のデジタル画像として、標的フレームが観察される。各区画の反応が記録され、かつ、細胞内へまたは細胞内区画間を移動する蛍光プローブの動きが追跡される。
【0129】
保存されたデータの機能的ビューは階層的である。最下レベルには、生の画像および画像の対応する物理的解題が保存される。次のレベルには、属性付けされたグラフモデル(すなわち構造)、対応する反応(すなわち機能)、および環境条件の動的解題(例えば、刺激の種類、流量、濃度など)が保存される。次のレベルには、化合物が種々の細胞内区画の中で再配分する際の化合物の軌跡とともに、細胞内の各区画の時間的発現が反応カーブとして要約される。これらの反応は観察中の全細胞について類似していなくてもよい。しかし、これらの反応は、特定の種類の細胞群または類似の生理学的状態にある細胞群に各クラスターが対応するようなクラスターを生成することが予測される。これらのクラスターは次の相関研究のために同定されなければならない。各クラスターは時系列事象に対応し、時系列事象は細胞の特定の細胞内区画に対応する。各クラスターにおけるこれら反応の平均的な挙動は単値分解により表現される。正式には、観察される反応は次式(式28)で定義される多値関数である:
(数36)
ft(Channel, CellType, Compartment, Dye)=f([Dye], f/t,Flowci / t, T)
式中、fは時点tにおいて特定の区画で観察される平均蛍光強度、[Dye]は染料の濃度、Channelは励起フィルタの位置、Tは温度であり、Flowは注入される化合物の流れの変化に対応する。以後の知識発見用に観察結果をデータベースに保存するため、この経時変化する情報を取得するためのスキーマが開発される。各実験サイクルは観察した各細胞についてフィンガープリントを生成する。これらの個々の反応から、画像空間内の細胞内活動のコンパクトな表現が得られ、これは細胞ごと、細胞母集団ごと、細胞種ごとなどに可視化することができる、
【0130】
H.細胞反応からの学習
本発明の学習技術は細胞種間の細胞特異的な差異を最適化および発見するために使用される。この文脈において、計算された反応とその組織構造および軌跡とは、最適化された細胞種識別を検索するためのその後の段階的な検索を容易にするためのモデルの開発を補助する。いずれの学習アプローチにおいても、その基礎には、ポリシーと、報酬と、価値と、環境のモデルとがある。モデル再構成の目的の1つは、種々のポリシーおよび報酬関数を評価することである。モデルはある細胞種と別の細胞種とで異なることが予測される。これらのばらつきはそれ自体のメリットについて重要であり、かつ、定量化すれば貴重な妥当性確認として利用できる。データベース内容は、類似性測度の評価、精密化、および局在化の根拠を提供する。類似性は状態および動作に基づいてクラスターを分析することにより測定される。これらのクラスターは、同値類を確率するための、種々の反応に関する共起統計の計算を補助する。または、細胞反応およびその対応属性(動的解題)によりあるシーケンス中の表現が生成される。この表現は次に、そのシーケンス中の共起統計を推移確率とともに構築するのに利用される。共起統計は、代表的な特徴の集合の二値木分類の仮説設定を補助する。この方法は、ひとつには、相関するシーケンスの検出および分類に有用である。さらに、一旦モデルが確立されれば、異常値を発見する手段が共起統計により得られる。推移確率は環境の知識を提供し、環境の知識は次に強化学習に使用することができる。さらに、細胞反応を、経時変化する線形系としてモデル化する手段が提供される。線形系は、系の挙動を特徴付けるための単純かつ強力な方法である。この文脈において、可変メモリ(遅れ)を有するシステムの状態空間表現が構築され、かつ、関連する行列のパラメータが推定および検証される。
【0131】
I.強化学習
この相では、どのように蛍光プローブの取込みを変動させるか、および、系統的な方法で細胞内の取込みを最適化するかを学習するための開始点として既知の知識が使用される。これは通常「強化学習」と呼ばれ、かつ、いくつかの態様においてはマルコフ決定過程(MDP)としてモデル化される。特定のMDPは、その状態(すなわち観察された反応)と、蛍光プローブの細胞内濃度の変更(例えば、生物学的阻害剤を注入する、生理学的に重要なイオンの培地内の濃度を変更する、など)を含む動作との集合によって定義される。このような系における報酬は、計算された反応の変化またはそのエピソード的勾配の変化によって測定可能である。さらに、いくつかの態様においては、次に、データベース中の同じアッセイで得られた観察結果をもとに(MDPの)推移確率が計算される。これらの推移確率は最適ポリシー(すなわちスケジュール)を可能にする技術を提供する。このようなポリシーは一般的に、動的プログラミング、モンテカルロ法、および時間差分学習(TD学習)として表現可能である。動的プログラミングは細胞反応のモデルを必要とする。このようなモデルはデータベースから仮説設定される。さらに、データベースが拡張するにつれてモデルへのアクセシビリティが向上する。モンテカルロ法はモデルを必要としないが、ステップ-バイ-ステップの増分計算に適していない。一方、時間差分学習はモデルを必要とせず、かつ、完全に増分的である。しかし、これら3つの方法はすべて本発明の態様に適用可能である。例えば、サンプルの推移確率(完全ではないもの)が存在するならば、1つの増分ステップ(すなわち1つのエピソード)においてモンテカルロ法が使用可能である。また、時間差分法はモンテカルロ法と動的プログラミングとの組合せである(すなわち、モデルなしで生の経験から直接学習し、次に、学習した推定に一部基づいて推定を更新する。)
【0132】
J.悪性および非悪性の乳房上皮細胞を識別する生理学的特徴を迅速に発見する方法
原発乳房腫瘍細胞のインビトロ増殖における近年の進歩により、細針吸引(FNA)で採取した比較的少数の腫瘍細胞を培養により継代および増殖することが可能になっている(Liら、Canc.Res.、58:5271-5274 [1998])。事実、悪性ヒト乳房上皮細胞(BEC)の初代培養は大きく進歩している(Bandら、Canc. Res.、50:7351-7357[1990]; Ethierら、Canc. Res.、53:627-635 [1993]; Dairkeeら、Canc. Res.、57:1590-1596[1995]; TomidaおよびTsuruo、Anti-Canc. Drug Des.、14:169-177 [1999]; ならびに、BrownおよびGiaccia、Canc.Res.、58:1408-1416 [1998])。
【0133】
悪性細胞に関連したインビボ環境は、少ない酸素(すなわち低酸素)、低いpH、低レベルのグルコースレベル、および高レベルの代謝廃棄物の領域で構成されていると考えられている。培養中でこれらの条件をシミュレートすると、非悪性細胞はこれらの厳しいインビトロ環境条件で生存できないため、原発乳癌細胞の比較的純粋な母集団が分離できることが示されている(Dairkeeら、前述)。悪性のBCEは非悪性細胞より速く増殖すると広く考えられているがこれは誤解である。したがって、厳しい環境で悪性細胞の培養を提供することのもう1つの利点は、増殖速度が速い非悪性の上皮細胞が存在せずかつ腫瘍細胞を凌駕して増殖できないこことである。また、腫瘍細胞の薬剤耐性は厳しい微小環境のストレスに依存するものである可能性があり、かつ、厳しい微小環境のストレスの結果である可能性がある(TomidaおよびTsuruo、前述)。この理由から、薬剤耐性を正確に測定するには適切な微小環境で細胞に対するアッセイを行わなけらばならない可能性があると予測されていた。事実、最も成功したインビトロの化学感受性試験のいくつかでは、両端をシールし14日間インキュベートした小さな毛管で培養した細胞が使用された。その結果得られた毛管内の微小環境は、サンドイッチ状態のカバーガラス法で一般的に得られるものよりさらに厳しい可能性が高い(前述のDairkeeらの文献を参照)。
【0134】
さらに、培養においては、得られる細胞(最大107個)は元の腫瘍とよく類似しており、かつ、軟寒天での増殖も含め1つまたは複数の腫瘍表現型を示す。事実、乳癌中には最適以下の栄養枯渇環境が存在する(Dairkeeら、前述、TomidaおよびTsuruo前述、ならびに、BrownおよびGiaccia、前述)本発明は原発乳癌標本の培養を向上させる手段を提供する。例えば、腫瘍細胞と正常細胞とは、インキュベータのCO2レベルの関数として、大きく異なるpH挙動を呈すると予測される。また、各細胞腫が耐性を示すpHレンジも異なる可能性が高い。正味の効果としては、単一のインキュベータ内で(別々のフラスコ内で、各細胞腫が好む培地中で)これら異なる細胞種が同時に増殖できるような共通のCO2レベルは存在しないことになる。事実、正常細胞が耐性を示すpHレンジは癌細胞のそれよりはるかに狭いと予測される。低pH環境(<7.1)を好む正常細胞株は見つかっていない。
【0135】
したがって、ヒト乳癌上皮細胞の増殖成功には pH < 7.0が必要であるということが正しいならば、これまでのインビトロ化学感受性アッセイが成功しなかった理由も明らかである。ほとんどの培地および細胞インキュベーション条件はpH> 7.0となるよう設計されてきた。したがって、ヒト腫瘍生検標本をこれらの条件下で培養すれば、付着および増殖するのは癌細胞ではなく正常細胞である。結果として、それとは知らずに癌細胞ではなく正常細胞に対して化学感受性試験を行うことになる。これまで、臨床試験でこれらのアッセイが失敗したのはこれが理由である可能性がある。ただし、本発明を使用するには機序の理解は必要ではなく、かつ、本発明はいかなる特定の機序にも限定されない。しかし、本発明は、正常細胞および異常細胞の形態学的形質転換をpHおよびその他の微小環境の局面の関数として(例えば、透過光中の細胞をセグメント化する能力を有するVSOMシステムによって)モニター、分析、および定量化する手段を提供する。
【0136】
K.細胞の特定視野の繰り返し観察および分析
本発明はさらに、マルチウェルプレートについて本明細書に説明したのと同様の方式で、閉鎖した組織培養フラスコ内の細胞の多数の視野を繰り返し観察および撮像する手段を提供する。透過光中で細胞をセグメント化できる能力を有することは、フラスコが顕微鏡ステージに戻されたときにVSOMシステムが細胞の同じ視野に戻り、新しい画像を取得し、かつ形態学的変化を定量化するよう、細胞の形状、位置、および相対的位置を保存できることを意味する。これは、細胞の数、相対位置、および形状に変化があった場合でもシステムが細胞の同じ視野を再度位置特定するような、視覚的サーボ制御のより機械的な用途の例である。
【0137】
したがって、本発明のいくつかの態様において、システムは、ガラス切り用の微細仕上げホイールを使用して滅菌培養皿に軽くエッチングされた、極めて精密なグリッド(「+」)に対する相対的な位置の手段を提供する。培養皿は次に除去し、インキュベータに戻すかまたは適切な条件下で保管してもよい。細胞を再撮像するときには、培養皿上の「+」を基準にしてシステムが較正され、座標(0,0)が「+」の中心に設定される。ユーザーは、最初の位置合わせ用に、透過光下でエッチングを容易に見ることができる。図52の略図に、培養皿内の細胞位置の基準となるフレームを確立する目的で、エッチングされた培養皿を使用する様子を詳しく示した。このように、各細胞の反応を、培養皿中のその細胞の物理的位置において解題するという目的が達成される。さらに、刺激などに対する細胞の反応を経時的にモニターするために細胞の同一視野を数時間後または数日後に観察することもエッチングにより容易になる。
【0138】
これらの実験で使用されるシステムは、ガラス切り用の微細仕上げホイールを使用して滅菌培養皿に軽くエッチングされた、極めて精密なグリッド(「+」)に対して相対的にその位置を参照する。培養皿は次に除去し、インキュベータに戻すかまたは適切な条件下で保管してもよい。細胞を再撮像するときには、培養皿上の「+」を基準にしてシステムが較正され、座標(0,0)が「+」の中心に設定される。ユーザーは、最初の位置合わせ用に、透過光下でエッチングを容易に見ることができる。図52の略図に、培養皿内の細胞位置の基準となるフレームを確立する目的で、エッチングされた培養皿を使用する様子を詳しく示した。このように、各細胞の反応を、培養皿中のその細胞の物理的位置において解題するという目的が達成される。さらに、刺激などに対する細胞の反応を経時的にモニターするために細胞の同一視野を数時間後または数日後に観察することもエッチングにより容易になる。
【0139】
したがって本発明は、他の細胞(すなわち正常な乳腺上皮細胞)を増殖上不利にしながら特定の細胞(すなわち原発乳癌細胞)を増殖上有利にするために細胞種間の差異を同定および活用する方法およびシステムを提供するだけでなく、生細胞の増殖率を細胞ごとに定量できるVSOM蛍光アッセイも提供する。
【0140】
L.インビトロの薬剤試験および化学感受性試験の向上
本発明は、悪性細胞の増殖および分析する手段を向上させることに加えて、癌患者(例えば乳癌患者)の臨床成績を向上させるための患者志向型の治療法を容易にする、インビトロの薬剤試験および化学感受性アッセイも大幅に向上させる。
【0141】
次の名称集を用いて臨床的相関の要約を作成することができる:TP(真陽性、細胞がインビトロで感受性を示しかつ化学療法に反応する患者)、TN(真陰性、細胞がインビトロで耐性を示しかつ化学療法に反応しない患者)、FP(偽陽性、細胞がインビトロでは耐性を示すが臨床的には耐性を示す患者)、FN(偽陰性、細胞がインビトロでは耐性を示すが臨床的には反応を示す患者)、PPA(陽性予測精度)=TP/(TP-FP)、試験システムで感受性を示しかつ治療に反応した患者のパーセンテージ、および、NPA(陰性予測精度)=TN/(TN+FN)、試験システムで感受性を示しかつ治療に反応しなかった患者のパーセンテージ。
【0142】
インビトロの試験結果と患者の反応とのこれまでの相関データでは、総合的なPPAは72%、NPAは90%となっている。これは、感度(すなわち、臨床的に反応性の患者を検出する能力)85%、および特異度(すなわち、非反応性の患者を検出する能力)89%に相当する。これらの数値は4263名の患者を対象とした研究における7種類のアッセイの平均であり、結果は複数の個別の研究からプールされたものである(DeVita、「癌:腫瘍学の原理と実践(Cancer:Principles and Practice of Oncology)」、Lippincott-Raven、Philadelphia [1997])。これらのアッセイが患者の反応よりも患者の薬剤耐性を予測するのに優れていることから、これらの著者らは、これらのアッセイを「化学療法」アッセイではなく「薬剤反応性」アッセイと呼ぶことを提唱している。
【0143】
ロボット視覚技術である「視覚サーボ制御(VS)」として結合された、デジタル撮像蛍光鏡検法、デジタル画像のリアルタイム分析、およびバイオインフォマティクスデータベースは、デジタル画像の内容の分析に基づいた実験パラメータの動的操作を意味する。さらに、VSOMは複数の視野を進んでおよび戻って走査する能力を有し、かつ、これにより生細胞の非常に多数の母集団をモニターする能力を有する。
【0144】
前述のとおり、VSOMは、細胞単位で変化をモニターするために、関心対象の細胞の同一視野に繰り返し戻る能力をさらに提供する。この能力により、細胞で観察される早期の生理学的反応を、増殖かアポトーシスかまたはある細胞周期段階での停止かという細胞の将来の生物学的状態または最終運命と相関させることが容易になる。事実、本発明の1つの態様は最も望ましい予測アッセイを提供する。重要な点として、これらのアッセイは動的かつ適応的である。
【0145】
1つの態様において、適応的VSOM蛍光アッセイでは、インテリジェント的に選択されたコンピュータ制御の刺激に対する細胞の早期の生理学的反応が観察される。いくつかの好ましい態様において、これらの刺激および摂動は可逆的であり、かつ、細胞を特定の生物学的経路に永続的に付すことはない。例えば、細胞外の培地のpHを低下させながら、観察されるストレス反応に基づいて細胞の特定の部分母集団を同定する。システムのインテリジェント反応の1つとしては、関心対象の細胞が同定されるまで培地のpHを低下させ、次に、細胞に不可逆的な損傷が生じる前に細胞を高いpHに戻すことが考えられる。次に、関心対象の細胞が細胞単位で同定され、システムは、低pHの環境に対するこの差分反応を最適化および/または利用するための追加の試験を実施するために使用される。
【0146】
本発明はまた、抗癌剤または薬剤の組合せによって利用できる生理学的特徴を探索するため細胞を繰り返しプロービングできる能力を提供する。したがって、本発明のVSOM蛍光アッセイは、好ましい態様において、細胞の複雑な混合物を用いて細胞を迅速に同定する手段であって、蛍光プローブが細胞に対して非毒性であり、印加された刺激または摂動に対する特徴的な生理学的反応に基づいて細胞が特定され、かつ、刺激または摂動が細胞に対して不可逆的影響をもたない手段を提供する。事実、特に好ましい態様において、本発明の予測アッセイは、インテリジェント的に選択されたコンピュータ制御の刺激に対する一連の早期の生理学的反応を観察することを含む動的かつ適応的なVSOM蛍光アッセイである。このアプローチは、このような刺激および摂動が可逆的でありかつ細胞を特定の生物学的経路に永続的に付さない場合はさらに強力である。比較的無害の刺激および摂動を生細胞に繰り返し印加できる能力により、抗癌剤または抗癌剤の組合せによって利用できる生理学的特徴を探索するため細胞を繰り返しプロービングすることが可能となる。本発明のVSOM蛍光アッセイは細胞の将来の挙動および/または最終運命を良好に予測できる。例えば本発明は、細胞が増殖できるよう十分に刺激されたか、または、アポトーシスが必然となる点までストレスを受けたかを決定する手段を提供する。この能力は、細胞で観察される早期の生理学的反応と、細胞の将来の生物学的状態または最終的な生物学的運命(すなわち、増殖、アポトーシス、特定の細胞周期段階での停止など)とを相関付けるのに役立つ。
【0147】
本発明はさらに、以前に観察された生理学的な細胞反応の記録を含むオブジェクト指向データベースを提供する。このデータベースは、VSOMアッセイの知識ベース制御を実施するうえで非常に有用な資源を提供する。このデータベースに遠隔的に(すなわち、任意のVS使用可能顕微鏡を介して)アクセスできることにより、これらの機器のインターネット上での制御が可能となり、かつ、これらの機器およびそれを操作するために必要なコンピュータの性能にかかる費用を大幅に削減しながらこれらの機器の機能性を大幅に高めることができる。
【0148】
少なくとも3つのプロスペクティブ臨床試験において、癌患者の化学療法に対する反応と生存率とを向上させるためにインビトロ化学感受性試験を使用する試みがなされている。しかし、これらの試験では、インビトロ化学感受性試験の結果に基づいて化学療法を受けた患者の生存率向上は認められなかった。しかし、それぞれの患者は他のどの患者とも少なくともわずかに異なる。例えば、1人の患者がある薬剤に対して有害反応を示し、別の患者が副作用をまったく経験しないということもあり得る。患者が薬剤に対して有害反応を示す場合または患者の腫瘍が薬剤に反応しない場合、医師は、効果のある薬剤を同定するため、薬剤および/または治療レジメンを変更する。乳癌の場合、医師は幅広い可能性の中から薬剤(または2つ以上の薬剤)を選択肢、かつ、個々の患者の腫瘍に対して最も有効でありかつ個々の患者における副作用が最小である組合せを見つけなければならない。多くの場合、医師は各患者について一連の薬剤を試さざるを得ない(すなわち、これらは最適の治療レジメンを決定するためのインビボ薬剤反応試験である)。インビトロの薬剤反応試験には、適切な治療法を見つけるための一連の衰弱を招く試行錯誤を患者に対して行うことなしにより幅広い薬剤をより短時間で試験できるという利点が期待できる。したがって、40年以上にわたって、患者の体から腫瘍細胞を取り出しそれをインビトロで試験するという試みが行われてきた。
【0149】
成功しなかったこれらの方法で使用された2つのインビトロ化学感受性アッセイは、HTCA(ヒト腫瘍クローニングアッセイ)およびDiSC(分染細胞毒性アッセイ)である。これらのアッセイで使用されるインビトロの細胞培養および細胞増殖の技術、ならびに測定される生物学的エンドポイントは著しく異なる。HTCAでは、細切した腫瘍組織を非常に小さい毛管に入れ両端を密封し14日間インキュベートした培養物が必要である。悪性細胞と非悪性細胞とを含むこの混合物(細胞数0.2〜1.0×105個)を毛管内に密封する前に、ヒトの血漿で観察されるピーク濃度の10分の1に相当する濃度に調整した標準的な抗癌剤に細胞を1時間曝露する。次に細胞を0.3%寒天に懸濁し、100μlの毛管に密封した状態で37℃かつ7%CO2の環境に14日間おく。14日後に細胞を毛管から抽出し、顕微鏡を用いて手作業でコロニー数を決定する。最初に必要な腫瘍細胞数が少なくてすみ、かつ、有意数の細胞を有するコロニーの発生が改善されたことから、この毛管クローニングシステムが使用されていた。
【0150】
DiSCアッセイは、試験に利用できる細胞数を増幅するために小さいポリプロピレンチューブ内で液体培地を用いて腫瘍細胞を4〜6日間培養するという非クローニング的なアッセイである。薬剤への曝露時間は薬剤により異なり、1時間〜4日間である。一般的に、薬剤濃度は経験的に決定され、HTCAで使用される濃度より高い。例えば、HTCAでは0.04μg/mlのドキソルビシンで1時間細胞を処理するが、DiSCでは1.2 μ/mlで1時間である。DiSCアッセイでは、ファストグリーンを含む懸濁液中で死細胞を染色することによって細胞膜の完全性を評価する。アセトアルデヒドで固定したカモ赤血球(DRBC)を内部標準として培養物に添加し、混合物全体を細胞遠心分離(cytocentrifuge)すると、生細胞は無色、死細胞およびDRBCは緑色に染色された状態で顕微鏡スライド上に収集される。次に、生細胞を染色するためHE(ヘマトキシリン-エオシン)でスライドを対比染色する。次に、熟練技術者が顕微鏡的に細胞を腫瘍細胞または正常細胞として同定する。次に、DRBCに対する生細胞の比が決定される。
【0151】
上述の試験で得られるデータについて共通の一群の問題点が指摘されている。両アッセイとも手作業で労働集約的であり、定量化を人の判断に依存しており、かつ、これらのインビトロシステムでは一部の患者の腫瘍細胞が良好に増殖しないためしばしば結果が得られないことがある。このような理由のため、これらのアッセイに対する臨床医の認知度および受容度は低い。したがって患者および標本の集積が困難となっている。しかし、患者の腫瘍細胞に効果を示さない薬剤の同定に優れた「第二世代」の試験がこれらの試験に置き換わりつつある。このようにいくつかの薬剤を除くことによって、医師は患者でインビボの薬剤反応試験を行う際にこれらの薬剤を考慮に入れる必要がなくなる。これらの試験は、労働集約的であるものの長年利用可能となっている技術を基礎にしている。しかし、これらの試験は労働集約的であり、かつ、人為的ミスが生じる可能性を有する。
【0152】
これまでのこうした研究が患者の反応および/または生存率に劇的な向上をもたらせなかったのは種々の要因の結果である可能性があり、こうした要因としては、微小環境(例えば、腫瘍細胞が好む微小環境がインビトロで適切にシミュレートされていなかった)、個々の細胞の生理学的反応がアッセイ中に詳しくモニターされなかった、ならびに/または、薬剤の濃度、組合せ、および曝露時間が制限されておりかつ科学的に最適化されていなかった、などがある。
【0153】
しかし、本発明(すなわち「第三世代」の試験の1つ)の開発中に、より進んだ細胞培養技術と、ロボット視覚およびデジタル撮像蛍光鏡検法の分野に由来する革新的な技術とが検討された。本発明の視覚サーボ制御光学顕微鏡(VSOM)は、悪性細胞と非悪性細胞(例えば乳房上皮細胞(BEC))とを識別する重要な生理学的特徴の迅速な発見などに有用である。前述のとおり、VSOMは、関心対象の細胞(例えば腫瘍細胞)の増殖に有利に働くインビトロの微小環境を迅速かつ自動的に生成すること、および、印加されたストレスに対する早期の生理学的反応に基づいて細胞の挙動を予測するインビトロの蛍光アッセイを生成することができる。したがって、本発明は前述の臨床試験に関連する問題点を克服する手段を提供し、このような問題点としては、インビトロで腫瘍細胞を増殖させるうえでの困難、アッセイの過程で間隔をおいて細胞を観察する能力に限界があること、1回のアッセイで観察できる生物学的エンドポイントの数に限界があること、および、オートメーションの欠如が含まれる。本発明はまた、原発乳癌細胞(例えばヒト細胞)のインビトロ増殖と化学感受性試験とに適した微小環境条件を迅速に発見および最適化する手段を提供する。さらに本発明は、この目的を腫瘍ごとに達成する手段を提供する。
【0154】
M.微小環境パラメータのモニタリング
本発明は、VSOM実験に有用である重要な微小環境パラメータのオンラインモニタリングに必要なバイオセンサーおよび関連電子機器を使用する手段を提供する。これらの実験で使用されるセンサーは灌流ラインへの直列接続に適したZABSフロースルーセンサーであると予測される。したがって、細胞に到達する直前の培地について複数の重要な特性を連続的にモニターおよび記録することが可能である。本発明のいくつかの態様においては、大きな透過光集光装置、温度プローブ、および真空吸引装置が存在するため、実際の細胞灌流チャンバ内にこれらのセンサーのすべてを設置するための空間が十分にない。したがって、培地をマイクロインキュベーションチャンバ内に連続的に灌流させながら、培地のpH、L-乳酸またはグルコース、細胞外カルシウム、およびpO2をモニターする。
【0155】
いくつかの態様において、VSOM法では、コンピュータ制御された4つのシリンジ灌流ポンプが使用される。さらに、コンピュータ制御のXY走査ステージにしっかり取り付けられるようマイクロインキュベーションチャンバを改修した。真空駆動吸引装置が余分の液体を排除し、温度プローブが温度制御用のフィードバックを提供する。
【0156】
種々の態様において、電子機器パッケージが本発明とともに使用される。例えば、電子機器パッケージ「PLUGSYS」がこれらの実験で使用される。PLUGSYSはモジュール設計であり、その基本システムケースは、pH、L-乳酸またはグルコース、細胞外カルシウム、およびpO2等の測定に必要な種々の増幅モジュールを保持するためのスロットを十分に有する。PLUGSYSケースはまた、使用されるデータ取得用ハードウェアとの互換性も有し、このようなハードウェアとしてはPC用のPCIA/D変換基板が含まれる。この装置は、VSOMシステム制御用の重要なリアルタイムデータを提供し、かつ、VSOM実験の実施および解釈に重要な微小環境パラメータと、VSOM実験中に使用される重要な微小環境パラメータのオンラインモニタリングに必要な関連電子機器との連続的なモニタリングおよび記録を可能にする。
【0157】
実験
以下の実施例は、本発明の特定の好ましい態様および局面を説明しかつさらに例証することを目的として提供されるものであり、したがって本発明の範囲を限定すると解釈されるべきではない。
【0158】
以下の実験の開示では次の略語を使用する:VS(視覚的サーボ制御);VSOM(視覚的サーボ制御光学顕微鏡/鏡検法);℃(度、摂氏);rpm(毎分回転数);BSA(ウシ血清アルブミン);H2O(水);aa(アミノ酸);bp(塩基対);kb(キロ塩基対);kD(キロダルトン);gm(グラム);μg(マイクログラム);mg(ミリグラム);ng(ナノグラム);μl(マイクロリットル);ml(ミリリットル);mm(ミリメートル);nm(ナノメートル);μm(マイクロメートル);M(モル);mM(ミリモル);μM(マイクロモル);U(単位);V(ボルト);MW(分子量);sおよびsec(秒);min(s)(分);hr(s)(時間);MgCl2(塩化マグネシウム);NaCl(塩化ナトリウム);OD280(280nmでの光学濃度);OD600(600 nmでの光学濃度);[Ca+2]in(細胞内カルシウム濃度);[Ca+2]ex(細胞外カルシウム濃度);DOX(ドキソルビシン);BEC(乳房上皮細胞);HMEC(ヒト乳腺上皮細胞);MCF-7(ヒト乳癌細胞株の1つ);MCF-7WTC(MCF-7 野生型、Cowan);HTCA(ヒト腫瘍クローニングアッセイ);DiSC(分染細胞毒性);CAM(カルセイン-AM);DRBC(カモ赤血球);DS(薬剤感受性);MDR(多剤耐性);EH(エチジウムホモ二量体);MEBM(乳腺上皮細胞基本培地);MEGM(乳腺上皮細胞増殖培地);PBS(リン酸緩衝生理食塩水);D_PBS(ダルベッコのPBS);FN(偽陰性);TN(真陰性);FP(偽陽性);TP(真陽性);NPA(陰性予測精度);PPA(陽性予測精度);PMA(ホルボール12-ミリステート13-アセテート);TRME(テトラメチルローダミンエチルエステル);TG(タプシガルギン);FURA-2-PE3(カルシウム感受性の蛍光染料の1つ);H42(Hoechst(ヘキスト)33342);LT-R(Lysotracker-Red);FNA(細針吸引);PAGE(ポリアクリルアミドゲル電気泳動);PBS(リン酸緩衝生理食塩水[150 mM NaCl、10 mM リン酸ナトリウム緩衝液、pH 7.2]);PCR(ポリメラーゼ連鎖反応);PEG(ポリエチレングリコール);SDS(硫酸ドデシルナトリウム);Tris(トリス(ヒドロキシメチル)アミノメタン);DMSO(ジメチルスルホキシド);w/v(質量体積比);v/v(体積体積比);Amersham(AmershamLife Science, Inc.、イリノイ州Arlington Heights);ICN(ICN Pharmaceuticals, Inc.、カリフォルニア州CostaMesa);ATCC(American Type Culture Collection、メリーランド州Rockville);Becton Dickinson(BectonDickinson Labware、ニュージャージー州Lincoln Park);BioRad(BioRad、カリフォルニア州Richmond);Clonetics(Clonetics、SanDiego);Clontech(CLONTECH Laboratories、カリフォルニア州Palo Alto);Molecular Probes(MolecularProbes、オレゴン州Eugene);GIBCO BRLまたはGibco BRL(Life Technologies, Inc.、メリーランド州Gaithersburg);Invitrogen(InvitrogenCorp.、カリフォルニア州San Diego);New England Biolabs(New England Biolabs, Inc.、マサチューセッツ州Beverly);Novagen(Novagen,Inc.、ウィスコンシン州Madison);Pharmacia(Pharmacia, Inc.、ニュージャージー州Piscataway);Sigma(SigmaChemical Co.、ミズーリ州St. Louis);Stratagene(Stratagene Cloning Systems、カリフォルニア州LaJolla);Creative Scientific Methods(Creative Scientific Methods, Inc.、www.cre8ive-sci.com);および、Zeiss(CarlZeiss, Inc.、ニューヨーク州Thornwood)。
【実施例】
【0159】
実施例1
同じ細胞セットに繰り返し戻るための撮像プロトコル
これらの実験では、培養中の同じ細胞セットに繰り返し戻るための方法を説明する。これらの方法を用いることにより、可動顕微鏡ステージ上に置かれた細胞培養皿中の生細胞の1つまたは複数のセットを観察することが可能となる。重要な点として、これにより、培養皿をステージから除去し、細胞を増殖させるためなどの目的でインキュベーに入れることが可能となる。次に培養皿を顕微鏡ステージに載せ、同じ細胞セットを自動的に観察に供することが可能である。これらの段階は所望のまたは必要な回数繰り返すことができる。
【0160】
これらの実験では、種々の化合物を培養皿に灌流させながら細胞セット(倍率10Xで細胞500〜1000個)の反応をモニターすることができる。指定された数のチャネルからなる画像のスタックが、指定された長さの時間にわたって指定された間隔で1回以上取得される。編集可能な(テキストの)レシピファイルにより、使用される実験レシピが指定される。「スナップショット」用には1画像のみのスタックが取得され、「微速度撮影」実験用には画像の完全なスタックを規則的な間隔で取得することができる。連続微速度撮影実験では実験と実験との間にユーザーがステージまたは培養皿を動かさないことが好ましいため、本発明により、培養皿を動かす前に同じ細胞セットに対して連続的に複数の微速度撮影実験を行うことを容易にする。所望の分析を行った後、培養皿は顕微鏡ステージから取り除かれ、必要に応じて数時間または数日間インキュベータ内に置かれる。培養皿を顕微鏡ステージに戻したとき、細胞は生きていてもまたは死んでいても(例えば、固定または染色された細胞であっても)よい。無論、死細胞を使用する場合は微速度撮影実験は行われない。ただし、これらの実験においては、繰り返しモニターされる単一の細胞セットが周囲の多くの細胞セットを代表していることを確認する目的で、細胞周囲の視野も「スナップショット」画像スタックを取得することによって撮像される。
【0161】
これらの実験では、ファイル名の中の_0、_1、_2、_3、_4、_5、および_Xによって「チャネル指示子」が指定される。これらの数字は光学フィルタホイールの特定の位置を示し、_Xは透過光画像を示す。フィルタホイールの各位置の光学フィルタの識別は、波長に応じて各画像のヘッダーに記述される。使用する透過光の種類は指定されない。例えば「dc122999dc2.0001.1_0ics」とはフィルタホイールの位置「0」で画像が取得されたことを表す。画像ヘッダーに基づくと、この位置のフィルタは360nmの蛍光励起フィルタである。チャネル指示子「dc122999dc2.0001.1_X.ics」とは透過光シャッターを開放した状態で画像が取得されたことを示す。この画像は位相差像、DIC、明視野像などであってもよい。これらの実験で使用されるフィルタホイールの各位置の光学フィルタの最大波長の識別は、後に詳述する編集可能なconfigテキストファイルに記述される。
【0162】
「細胞セット」とは、特定の倍率でデジタル画像中の特定の視野内に見えるすべての細胞を指す。数時間および数日間の過程を通じて、単独の生細胞が大きくなり分裂して2つになる、細胞が崩壊する、細胞が死んで浮流する、および個々の細胞が移動するなどの可能性がある。細胞セットの最初の位置は、培養皿(例えばぺトリ皿)表面に物理的にエッチングされた「+」(十字線)記号である(0,0)点に対する相対的な位置として特定される(図52参照)。
【0163】
「画像スタック」とは、単一の時点における指定された全チャネルの集合である。例えば、画像スタックの微速度撮影系列中の7番目のスタックは以下のようになりうる:

【0164】
「レシピファイル」とは、使用するプロトコルを指定するテキストファイルである。例えば、レシピファイルは以下のものを含む:
どの蛍光チャネルが完全画像スタックに含まれるか;
各チャネルの露出時間;
画像チャネルが取得される順序;
微速度撮影実験で取得される画像スタックの間隔;
取得するスタックの数;
フィルタホイールの各位置の励起フィルタの識別。
【0165】
方法の実施中、複数回の反復が可能である。例えば、「初回の反復」ではこれまで撮影されていない細胞の培養皿が使用される。細胞の入った培養皿にエッチングされた十字線を使用して、コンピュータ画面上で(0,0)マークが設定される。ユーザーは観察する細胞セットを探す。この段階において、種々のシャッターが開閉され、フィルタホイールが種々の位置に動かされ、かつ、プログラムは(0,0)マークに対してユーザーが培養皿をどこに移動したかを追跡し続けなければならない。次にユーザーは関心対象の細胞セットに焦点を合わせる。次に、レシピファイルの情報に基づいて実験が行われる。この初回の実験は、典型的に、生細胞の微速度撮影アッセイとして行われる。
【0166】
しかし、他の態様では、固定または染色された細胞の一連の「スナップショット」が使用される。次に、細胞またはステージを動かすことなく(焦点を再度合わせるのは許容される)レシピファイルが再編集され、1つまたは複数の微速度撮影実験が行われる。次に、細胞の入った培養皿が取り除かれ、必要時までインキュベータ(または他の保管場所)内に置かれる。「スナップショット」を使用するいくつかの態様では、他の細胞セットを観察するためユーザーが培養皿を動かし、追加のスナップショットが撮影される。
【0167】
「2回目の反復」では細胞セットが再度観察される。この細胞セットはすでに撮影され、かつ、その位置に関する情報が保存されている。まず、分析する細胞の入った培養皿が顕微鏡ステージに置かれる。十字線マークの最初の透過光画像が取得される。ユーザーは画面上の(0,0)マークを「クリック」し、どの細胞セットを観察するかをプログラムに指示する。プログラムは視野を(0,0)マークに移動させ、次に適切な細胞視野に移動させる。ユーザーは細胞に焦点を合わせ、編集されたレシピファイルの情報に基づいて実験を行う。この段階において、ユーザーは焦点を合わせるためにシャッターを開きかつフィルタホイールを動かす。細胞またはステージを動かすことなく(焦点を再度合わせるのは許容される)レシピファイルが再編集され、1つまたは複数の追加の微速度撮影実験が行われる。スナップショット実験では、所望に応じて視野が変更され、かつ、所望の数の追加のスナップショットが取得される。実験プロトコルの最後として、細胞の培養皿がステージから取り除かれかつ保管場所(例えばインキュベータ)に戻される。「n回目の反復」について、生細胞のセットが繰り返し撮像されかつ細胞位置に関する情報が保存される。事象の順序は2回目の反復と同様である。
【0168】
実施例2
VSOMの使用
本実施例では、本発明のVSOMの装置およびその他の局面について説明する。
【0169】
A.VSOMシステム光学プラットフォーム
一般的に、顕微鏡が倒立型(すなわち対物レンズが上向き)の形状であるほうが細胞チャンバおよび細胞容器の設計が容易であるため、大多数の態様において、VSOMシステムは倒立型の蛍光顕微鏡を中心に構成される。しかし、正立顕微鏡(対物レンズが下向きの顕微鏡)で使用できる細胞チャンバも存在する。本発明のVSOMシステムはこのような光学プラットフォームとともに使用するのに適している。カメラおよび顕微鏡周辺装置を顕微鏡に取り付けても安定するだけの十分な重量をもった、生物学研究に適した等級の蛍光顕微鏡が好ましい。いくつかのVSOM実験には標準的な10倍対物レンズで十分である。研究用等級の顕微鏡、対物レンズ、および種々の周辺装置は、カール・ツアイス(CarlZeiss, Inc.、ニューヨーク州Thornwood)およびニコンUSA(Nikon USA、ニューヨーク州Melville)など種々の製造業者により製造されている。環境制御細胞チャンバは、ツアイス、ハーバード・アパラタス(HarvardApparatus、マサチューセッツ州Holliston)およびバイオプテクス(Bioptechs, Inc.(Biological OpticalTechnologies)ペンシルベニア州Butler)など種々の種々の製造業者により製造されている。
【0170】
B.VSOM周辺装置
本発明の好ましい態様に使用できるデジタルカメラとしては、低照度蛍光鏡検法の用途向けに設計されたもの(例えば、ローパー・サイエンティフィック(RoperScientific Inc.、アリゾナ州Tucson)およびクウォンティテイティブ・イメージング(Quantitative Imaging Corp.、カナダ、Burnaby)などの企業により製造されているもの)が含まれる。このようなカメラは、12ビットデジタル化能力を有する科学等級のCCDを有しており、かつ、約7μm×7 μmのサイズである合計約100万ピクセルを有する。このようなカメラは、C++ソースコードおよびソフトウェア開発キットを含むソフトウェア開発キット、または、ホストPC上でカメラ操作をソフトウェア、光学素子、電気素子、および機械素子(すなわち顕微鏡周辺装置)と統合するソフトウェアを記述するのに使用できるホスト接続キットとともに入手可能である。これらのカメラは、ホストコンピュータを介してカメラの機能をプログラムできるよう、PCIコンピュータインターフェースカードまたは直接接続の「ファイアワイア」(IEEE1394)ケーブル接続など、種々の業界標準のコンピュータインターフェースとともに提供されている。
【0171】
デジタルカメラに加えて他の周辺装置も本発明とともに使用でき、このような周辺装置としてはXY走査ステージ、光学フィルタホイール、Z軸焦点粗調整モーター、ならびに、透過光シャッターおよび表面蛍光シャッターが含まれる(例えば、LUDLエレクトロニクス・プロダクツ(LUDLElectronics Products, Ltd.、ニューヨーク州Hawthorne)などの製造業者から入手可能な周辺装置)。種々の製造業者が他の装置を提供している。例えば、シャッター・インスツルメント(SutterInstrument Co.、カリフォルニア州Novato)は光学フィルタホイールおよびロボットマイクロマニピュレータを製造しており、シリンジポンプはハーバード・アパラタス(HarvardApparatus、マサチューセッツ州Holliston)から、顕微鏡対物レンズナノポジショナ(圧電ポジショナ)はフィジック・インツルメンテ(PhysikIntrumente、ドイツ、Waldbronn)からそれぞれ入手可能である。これらの企業は、それぞれの周辺装置用に適切なプログラマブルコントローラも販売している。ハーバード・アパラタスは、種々の環境センサー(酸素、乳酸、グルコース、pHなど)を操作およびホストコンピュータとインターフェースするための、PLUGSYSならびに同様の測定および制御装置も販売している。
【0172】
C.生物学的試薬
生物学的試薬および蛍光標識などは多数の製造業者から入手可能である。例えば、生細胞用の蛍光プローブはモレキュラー・プローブズ(Molecular Probes、オレゴン州Eugene)から入手可能である。他の細胞培養培地、細胞増殖用の装置および供給品、ならびに関連する装置および供給品は、標準的な供給業者(例えばシグマ(Sigma)、フィッシャー(Fisher)など)から入手可能である。
【0173】
D.VSOMホストコンピュータ
本発明の好ましい態様では、1つまたは複数の使用可能なPCIスロット(デジタルカメラがホストコンピュータとのインターフェースにPCIスロットを必要とするか否かによる)と、標準的なシリアルポートおよびパラレルポートと、OHCI互換IEEE1394ポート(ファイアワイア対応デジタルカメラが必要とする場合)と、256 MBのRAMと、1つまたは複数の18 Gbyteハードドライブと、テープバックアップユニットと、イーサネットアダプタと、32ビットカラービデオカードと、高解像度モニター(好ましくは1280×1024ピクセル)とを有し、かつ、あるバージョンのLINUXまたはMicrosoftWindowsを実行する、450 MHz Pentium IIIクラスの業界標準のPCを必要とする。オンラインの画像セグメント化および分析を行うために、デジタルカメラおよび種々の顕微鏡周辺装置の作動を前述のソフトウェアおよびアルゴリズムと統合させるため、標準的なC++コンピュータプログラミングの技術が必要である。したがって、標準的なC++プログラミングソフトウェア、およびMicrosoftVisual Studio C++などの統合ソフトウェア開発パッケージが必要である。さらに、標準的なデジタル画像取得、周辺装置の制御およびオートメーション、ならびに標準的な画像処理、プロッティング、および表示操作のためのC++ライブラリを含むソフトウェアパッケージが望ましい。このようなパッケージとしては、「SCILImage」(TNO、オランダ、Delft)、「MetaFluor」および「Metamorph」(ユニバーサル・イメージング・コーポレーション(UniversalImaging Corporation、ペンシルベニア州Downingtown))、ならびに、「Component Works++」(ナショナル・インスツルメンツ(NationalInstruments、テキサス州Austin))などがある。さらに、場合によっては、顕微鏡周辺装置の数およびVSOMシステムで制御される環境センサーの数が増加するにしたがって、ナショナル・インスツメンツが製造しているものなどの標準的なアナログ-デジタルインターフェースカードが必要となる。
【0174】
E.VSOMの実施
光学プラットフォームに加えて、VSOMの最小限の実施には以下のそれぞれが少なくとも1つ必要である:温度制御された細胞チャンバ、コンピュータ制御されたシリンジポンプ、照明シャッター、および、光学フィルタホイール。最小限で実施される実験には透過光を扱える能力は必要ではなく、蛍光鏡検法のみが必要となる。必要である唯一の微小環境制御装置は、標本容器に挿入できる温度プローブを有する、温度を37℃に維持できる温度制御ユニットである。最小限で実施される実験では、光学プラットフォームが比較的安定であり振動がないという前提において、対物レンズのZ軸調整は必要でない。観察の必要があるのは単一の細胞視野のみ(多視野ではない)であるため、XY位置決めステージも必要でない。しかし、本発明がこの特定の設計形式に限定されることはない。
【0175】
1つの態様において、細胞は、標準的な細胞インキュベータ内で標準的なプラスチック性のペトリ皿の中で標準的な技術を用いて実験前に増殖される。いくつかの態様において、細胞は、生細胞に適した核染色法により実験前に標識される。例えば、生細胞の核を染色するため、Hoechst33342(H42)が以下の方法で使用される。適切なサイズの標本容器(例えば丸型の35 mm細胞培養皿)に24時間付着させた細胞を、細胞インキュベータ内で1.0μg/mLのH42に約90分間曝露する。この曝露の後、H42および細胞増殖培地中に存在するフェノールレッド指示薬を洗い流し、フェノールレッドまたは過量のウシ胎仔血清を含まない、新鮮な培地に交換する。標本容器が細胞チャンバ内に置かれ、オペレータは適切な細胞視野に焦点を合わせ、次に画像出力をデジタルカメラに送る。コンピュータ制御のシリンジの1つには蛍光プローブを含まない適切な溶液(血清またはフェノールレッドを含まない、細胞培地など)が充填され、他のシリンジには同じ溶液と生細胞に適した蛍光プローブとが充填される。たとえば、カルセイン-AM(CAM)は細胞株中の多剤耐性(MDR)の存在を示すことができる適切なプローブである。最小限のVSOM実施可能コンピュータ制御MDRアッセイでは、約1.0μMのCAM溶液が1分あたり約0.5 mLの流量で細胞チャンバ内に灌流される。この化合物は生細胞の膜を通過し、次に代謝され、蛍光性となり、かつ、細胞内に保持される。当業者には周知であるように、細胞が1つまたは複数のMDRタンパク質を有するならば、その細胞はCAMを細胞外に搬出する能力を有する。これらの場合、CAMの存在下において細胞が化合物を取り込む速度は低下し、かつ、CAMがチャンバから洗い流された後に細胞が保持するCAMの量は少なくなる。
【0176】
VSOMシステムはCAM溶液の灌流を開始し、かつ、核内のH42の青い核蛍光信号を用いて生細胞の視野を連続的にセグメント化する。このように、核を描く輪郭が青チャネルで取得される。核領域におけるCAMの平均蛍光強度を計算するため、これらの同じ輪郭が緑チャネルでも使用される。CAMは細胞全体に均一に分布することが多いため、核領域に加えて細胞質領域を検出する必要はない。適切な間隔(例えば60秒ごと)で画像が取得されると同時に、このように緑チャネルにおける平均細胞内蛍光強度(MI)が各細胞の核領域について観察される。
【0177】
次に、下記のような方法で細胞チャンバ内のCAM量を調整するため、コンピュータアルゴリズムが以下のサーボループオペレーションを実行する。各画像取得点について全細胞の平均MI(前述に定義のとおり)がモニターされ、次に以下が実行される:
a)視野内の全細胞の平均MIがユーザー定義の閾値に達すると、CAMの入ったシリンジが遮断され、かつ、CAMの入っていないシリンジがオンになる;または、
b)視野内の全細胞の平均MIが、(a)で達した最大平均MIからユーザー定義のパーセンテージ分減少すると、CAMの入っていないシリンジが遮断される;
c)実験終了。
【0178】
このような最小限の実験において、CAMの取込みおよび保持の個々の率が細胞ごとに取得される。システムは次に、実験の最後に、視野内においてMDRを示した細胞の数(またはパーセンテージ)を報告することができる。さらに、このような細胞はこれによって同定され、かつ、MDRを変化させる化合物を試験する次の試験に供することができる。しかし、本発明がこの特定のシステム、形式、細胞などに限定されることはない。事実、本発明は実験デザインの面においてユーザーに最大限の柔軟性を提供する。
【0179】
実施例3
VSOM実験
本実施例では、実施例2の説明に以下に記載の変更点を加えて実施したVSOM実験について説明する。
【0180】
使用した光学プラットフォームは、透過光鏡検法(位相差法およびDIC法)および多色蛍光鏡検法用の装備を有するTV倒立顕微鏡、Zeiss Axiovert135 H/DICである。顕微鏡には、コンピュータ制御のXY走査ステージ、Z軸ステップモーター、および6位置フィルタホイール(LUDLエレクトロニック・プロダクツ(LUDLElectronic Products, Ltd.、ニューヨーク州Hawthorne))を装備した。これらの研究では、Kodak KAF-1400 CCDチップ(1317×1035ピクセル、7×7ミクロンピクセルサイズ)を有する12ビットのXillixCCDカメラ(キシリックス・テクノロジーズ(Xillix Technologies、ブリティッシュコロンビア州Vancouver))を使用した。このカメラは8MHz(すなわち、1セットあたりフルサイズ画像約4枚)の読み出し速度を有する。ホストコンピュータはマルチタスクUNIXワークステーションであるSparcstationUltra 1とし、コンピュータカメラから出力された画像をホストコンピュータに直接読み取らせた。
【0181】
さらに、ペルティエ温度制御マイクロ灌流チャンバ(TC-202二極式温度制御装置を有するPDMI-2開放チャンバ、ハーバード・アパラタス/メディカル・システムズ・リサーチ・プロダクツ(HarvardApparatus/Medical Systems Research Products、マサチューセッツ州Holliston))およびデュアルシリンジポンプ(Pump-33、ハーバード・アパラタス)を使用した。これらのシリンジは、同じサイズである必要はなく、かつ、灌流速度が独立に制御できるよう各シリンジがそれぞれコンピュータ制御のブロックを有する。「浴槽」タイプのサーミスタ(BSC-T3、計36Kオーム)をPDMI-2とともに使用した。
【0182】
いくつかの好ましい態様において顕微鏡の設計が倒立式であることによって、生細胞の灌流が可能となり、不動化された細胞が下から撮像された。本発明のいくつかの態様では油浸対物レンズが使用できる。また、細胞は、いくつかの態様では35mmペトリ皿の中で、他の態様では円形のカバーガラス上で増殖され、下から観察される。この倒立顕微鏡の構成により、ユーザーは蛍光から透過光検出(位相差またはDIC)に切り替えることができ、かつ、細胞の位置および形態を確認することができる。これはコンピュータ制御の透過光シャッターにより実現される。フィルタホイールにあるコンピュータ制御の表面蛍光シャッターも使用可能である(LUDL)。これらの実験において、システムの自動視覚サーボ制御オペレーション(すなわち、ポンプ、照明シャッター、フィルタホイール、およびXillixカメラの制御)はプログラム「ADR」で実施した。あらかじめプログラムされたレシピを使用して実施したVSOM実験ではプログラム「VX5」を使用した。
【0183】
A.ADR視覚サーボ制御実験
MCF-7 WTC細胞を35 mm細胞培養皿で増殖させ、H42で前染色した。H42とともに約1時間プレインキュベーションした後、細胞をDPBSGPですすぎ、温めた顕微鏡チャンバに入れた。ADRプログラムは以下の要領で問題なく動作した。この実験中、指定した一定の間隔で3枚のデジタル画像(360nm励起、490 nm励起、および透過光、明視野)が取得され、かつ、次の撮像間隔より前に、H42で染色されたすべての核が検出およびセグメント化された。青チャネルで描出された各核の輪郭を用いて、平均細胞蛍光強度の値が緑チャネルから算出された(MI)。DBPSGP溶液のみ(シリンジ#1)による最初の灌流を1.0mL/分で8.3分間実施し(ユーザーの指定による)、次にシリンジ#1が停止された。次に、1 μMのCAMを含むDBPSGP溶液(シリンジ#2)の灌流を0.5mL/分で開始した。全細胞の平均MIが指定の閾値に達したときに、正常な視覚サーボ制御によりシリンジ#2が停止された。細胞が十分量のCAMを蓄積しかつシステムが十分量の細胞内CAMを(核領域で)検出し、システムが正常にシリンジ#2を停止させかつシリンジ#1を再始動させるまでに、13.9分を要した。11.4分後(ユーザーの指定による)に、システムは再度シリンジ#1を停止させた。システムは引き続きチャンバ内の細胞をモニターし(ユーザーの指定による)、流れがない状態でさらに24.9分間が経過した。次に、実験終了時にシステムは画像取得を停止した。
【0184】
実施例4
MDRアッセイ-試験キットおよびVSOM実験
本明細書に記載のとおり、VSOM実験においてMDRアッセイβ試験キットの試験も行った。図11にこのVSOM実験の略図を示す。各ポンプは、あらかじめプログラムされたレシピに従って、または個々の細胞反応のリアルタイム分析に基づいて、指定された流量でオンおよびオフになる。使用したCAM、V、MKの濃度を図中に示した。CAMへの3回の曝露はそれぞれ900秒間(20分間)であり、したがってCAMへの総曝露時間は60分間であった。本図の下部の黒い窓は視野内の全細胞の反応の平均を示す。この平均反応プロットはVSOM実験中コンピュータ画面に表示され、かつ、1つまたは複数のチャネルのデジタルイメージも画面に表示される(通常、表示されるチャネルの1つは透過光である)。
【0185】
実験中、プロットおよび画像は継続的に再描画および更新される。MCF-7(DS、実行(run)#1)およびMCF-7 ADR(MDR、実行#2)について記録された2つのプロットにおいて、DS細胞のカルセインの蓄積量(240± 82、N=336)はMDR細胞の蓄積量(103 ± 80、N=161)より多いことが見出された。このことは、多数の細胞の平均を表すマルチウェルプレート実験で観察される、DS細胞とMDR細胞とのカルセイン蓄積の相対的な差異と一致する(前述の表1参照:1658/4822=0.34、1965/6598=0.30、VSOM:103/240=0.43)。しかし、VSOM実験では各細胞の平均細胞蛍光がモニターされ、かつ、平均値からの逸脱の検出が容易であった。例えば、複数の細胞が生存率および原形質膜完全性を失い始めた。このような細胞はカルセインを保持することができず、カルセインが漏出してその結果蛍光信号が低下する。これは、前述のDMSOの毒性に関連した影響である可能性がある。しかし、本発明を使用する上で機序の理解は必要ではなく、かつ、本発明が特定の機序に限定されることはない。それでもなお、単一の細胞の死がみとめられた時点で容易に曝露/灌流を終了させる能力を現在のVSOMシステムが有することは注意を要する。
【0186】
図13は、本実施例の実行#2の結果から、選択した4つの細胞の細胞反応を示したものである。これらの反応曲線はβ試験キットの基礎をなす原理を示すよい例である。反応曲線のうち2つでは(図13)、シリンジ#5の作動中に(図11)ベラパミル(V)に曝露されるまで細胞はカルセインを蓄積しない。PgpポンプはMK-571(MK)で阻害されないことから、これらの細胞はPgpポンプのみを発現していると解釈することができる。DS細胞の母集団中にこれらの細胞のいずれも存在しないことは明らかである(図12)。さらに、CAM+V曝露後、1つの細胞は、その平均細胞蛍光が、DS細胞で観察される平均細胞反応の一方の標準偏差の範囲内に達するまで急速にカルセインを蓄積した(図12)。他のすべての要因が同じであると仮定すると、第二の細胞はPgp分子の含有量が少ないと予測できる。残る2つの曲線(図13)は、CAM(のみ)およびCAM+MKの曝露中に別の反応を示しており、これはさらなる分析を要する。観察された曲線は、内在化したカルセインを排出する能力をもたない2種類のポンプのみの存在または不在の観点からは説明できない。しかし、本発明を使用する上で機序の理解は必要ではなく、かつ、本発明が特定の機序に限定されることはない。これは、フローサイトメトリーアッセイおよびマルチウェルプレートアッセイでは得られない種類の詳細な生理学的情報である。対照的に、本明細書に示したVSOM技術はこれらの能力を有している。
【0187】
例えば、カルセインの蓄積および保持に関する詳細な率の情報がVSOM実験全体を通して利用可能である。いくつかの反応曲線について、3回のCAM灌流中のカルセイン蓄積率を計算することができる。さらに、BUFF灌流中のカルセイン保持率も計算することができる。カルセイン蓄積は1500秒、3500秒、および5500秒の時点で生じたことが見出され、かつ、良好なカルセイン保持に対応するプラトーは2500秒、4500秒、および6500秒のインターバルで観察された。前述のとおり、いくつかのMDRポンプはカルセインが細胞内に内在化された後にこれを排出する能力をもっている。内在化されたカルセインを排出するDS細胞の能力は、BUFF灌流に対応する2500秒の期間中に顕著である(図12参照)。しかし、2つのMDR細胞(図13)はこの能力をもたない。
【0188】
さらに、前述の教示を使用すると、コンピュータが判断を行うあらかじめプログラムされたマニピュレーションは視覚的サーボ制御オペレーションに適している。
【0189】
実施例5
修飾試薬を用いたデジタル撮像蛍光法
VSOMを使用して、デジタル撮像蛍光顕微鏡を自動化することができる。例えば、修飾試薬MK-571(10 μM)またはベラパミル(50 μM)を含むカルセイン-AM(CAM、0.25μM)をマイクロ灌流チャンバに灌流させることができる。MK-571は膜貫通タンパク質MRPに対する特異的な阻害剤であり、一方、ベラパミルはMRPを阻害するとともに膜貫通タンパク質PgPも阻害する。これらの膜貫通タンパク質はいずれも外来性の化合物を排出し、これらタンパク質は多剤耐性に関与していると考えられている。これら2つの異なるタンパク質をコードしているのは別々の遺伝子である。これらタンパク質の薬剤交差耐性プロフィール(スペクトル)は、重複するものの完全に同じではない。さらに、前述のとおり、これらタンパク質は種々の阻害剤に対して異なる感受性を有する。
【0190】
Hoechst 33342で標識したMCF-7ADR細胞を35℃で観察し、細胞ごとの平均蛍光強度(MI、カルセイン)を求めた。細胞ごとの平均蛍光強度(MI、カルセイン)はリアルタイムで計算され、シリンジポンプのソフトウェアオペレーションはこれらの計算結果に基づいて実行される(すなわち視覚的サーボ制御)。これらの実験で使用されるプロトコルは、前述のMDRベータ試験キット(モレキュラー・プローブズ)を基礎にしている。画像は以下の3つの灌流インターバル中に取得される:(1)0〜2100秒、CAM;(2)8600〜11,000秒、CAM+MK-751;および(3)14,000〜16,000秒、CAM+ベラパミル。典型的には、3番目の灌流インターバルまでにすべての細胞が反応する。MRPおよび/またはPgPを発現している部分母集団は、以下のように、MI> 200となる反応に基づいて推論される:(a)1で反応(PgPおよびMK-571のいずれも発現なし)、(b)2まで反応しない(MRP)、および(c)1または2、のいずれでも反応しない(PgPのみ)。インターバル1の間はPgPおよびMK-571のいずれの発現も観察されなかったが、インターバル2ではMRPの発現が観察された。MK-571によるMRP阻害のため、30個の細胞においてカルセイン蓄積によるMIの増加が200を上回った。3枚のデジタル画像(各チャネルは60秒ごとに取得された)。例えば、細胞#10のMIは、この2400秒の灌流インターバル中に30から760に増加した。
【0191】
実施例6
生細胞用のBrdU増殖アッセイ
本実施例では、生細胞用のBrdU増殖アッセイシステムについて説明する。特定の細胞反応を特定の生物学的エンドポイントに相関付けできるならば、任意のVSOM予測アッセイの予測力が向上する。アポトーシス用の蛍光アッセイは複数存在するが、DNA合成または細胞増殖の定量化に使用できるBrdU取込みなどの重要なパラメータを測定できる生細胞用の蛍光アッセイはほとんどない。これらの実験において、BrdU取込み量を定量化することによって生細胞の増殖状態を検出するための画像比演算技術が開発された。このアッセイのためのプロトコルは、発表されているDr.Paul Yaswen(Stampferら、Exp. Cell Res.、208:175-188 [1993])のプロトコルをもとに適合させたものである。細胞株および培地は同じものを用いた。しかし、DNA合成アッセイ用として、[3H]-チミジンの代わりに5-ブロモ-2'-デオキシ-ウリジン(BrdU)を使用した。これらの実験は、5-ブロモ-2'-デオキシ-ウリジン標識および検出キット(No.1296736、ベーリンガー・マンハイム(Boehringer Mannheim))を使用して行った。VSOM実験の後、細胞を固定し、かつ、従来の間接免疫蛍光アッセイを用いてデジタル画像比演算に基づいてVSOMの結果を確認した。
【0192】
増殖するよう刺激を与えた細胞は、細胞分裂の準備においてDNAの相補鎖を通常の2倍合成する。活発に増殖するこれらの細胞は、細胞外の培地からA、T、C、およびGのヌクレオチドを取り込み、これらをDNAの合成に使うことができる。しかし、BrdUの存在下ではTの代わりにBudUがDNA合成に使われる。したがって、細胞の母集団を短時間(例えば1時間)BrdUに曝露すると、その1時間の曝露中にDNAを合成した細胞の部分母集団ではほとんどのBrdUがその核のDNAに組み込まれる。これは「パルスラベル」実験と呼ばれる。この実験は、Hoechst33342(H42)およびSyto 16(S16)の蛍光発光強度の比が、BrdU取込み量を細胞単位で決定する上で有用か否かを決定することを目的に実施した。
【0193】
H42およびS16は生細胞のまたは固定された細胞の核を染色する。H42の蛍光発光はDNAにBrdUが組み込まれていると消失(減少)する。しかし、S16の蛍光発光は組み込まれたBrdUの存在による影響を受けない。したがって、H42/S16蛍光強度の比(デジタル画像を用いてピクセルごとに計算される)は、各細胞のDNAに組み込まれたBrdUの量に比例すると考えられる。
【0194】
これを決定するため、これらの実験では184B5細胞の3つの培養皿を使用した。最初の48時間、2つの培養皿には無血清のMEBM(乳腺上皮細胞基本培地、CC-3151、クロンティックス(Clonetics))を使用し、3番目の培養皿には無血清のMEGM(乳腺上皮細胞増殖培地、MEGM、CC-3051、クロンティックス(Clonetics))を使用した。MEGMはウシ下垂体抽出物(BPE)、ヒドロコルチゾン、ヒト上皮成長因子(EGF)、およびインシュリンを含むが、MEBMはこれらを含まない。したがって、最初の48時間、培養皿3には増殖に一般的に必要な因子がすべて存在したが、培養皿1および2にはこれらが存在しなかった。MEBMは細胞を基礎代謝レベルで支持するのみであり、細胞の付着または増殖を支持するよう意図されたものではない。48時間後、培養皿2にはMEGMを添加し(この2段階処理を「MEBM+EGF」と呼ぶ)、培養皿3にもMEGMを添加したが、培養皿1にはMEGM-hEGF(BPE、ヒドロコルチゾン、およびインシュリンは存在)を添加した。培養皿1の処理を「MEBM-EGF」と呼ぶ。
【0195】
Stampferらの図4で示されているように、184B5細胞では供給から約18時間後にDNA合成がピークに達し、DNA合成量はMEGM細胞が最大となり、MEBM+EGF細胞ではそれより少なかった。MEBM-EGFに維持した細胞ではDNA合成がほとんど認められなかった。これらの結果は[3H]-チミジンを用いて得られたものである。本発明の開発中に実施した実験では、BrdUによるパルスラベルを1時間行い、次に生細胞をH42およびS16で二重染色した。細胞のデジタル画像を360nm励起(H42信号)で1枚取得し、かつ、490 nm励起(S16信号)で第二の画像を取得した。これらの画像を処理し、ピクセルごとに比を計算した。次に、分析の便宜のため、得られた比の値をカラーコード化した。これらの結果は、従来の[3H]-チミジン組込みアッセイで得られたものと一致していた。BrdU組込みの程度はMEGM細胞(培養皿3)が最も大きく、次に大きかったのがMEBM+EGF細胞(培養皿2)であり、MEBM-EGF細胞(培養皿1)ではBrdU組込みがほとんどみとめられなかった。
【0196】
これらの観察結果をさらに確認するため、70%エタノールおよび50 mMグリシンで、pH 2.0、-30℃で細胞を固定し、間接免疫蛍光染色を行った。この染色後、抗BrdU抗体で標識された固定細胞にBrdU消失を示すH42蛍光の低下もみとめられるか否かを決定するため、H42およびS16で細胞を再染色した。実際にこの影響を示す証拠がいくつか存在した。MEGM細胞が最大量のBrdU染色を示した。同細胞を青チャネルで調べたところ、BudUで染色される細胞はH42蛍光信号が低いという一般的な傾向がみとめられた。BrdU取込みを定量化する方法は2つある。第一は抗BrdU抗体検出であり、これは赤色の蛍光の強度で表される。第二は、青色の核蛍光強度(H42)を緑色の核蛍光強度(S16)で除した比を細胞ごとに計算するものである(すなわち画像比演算)。BudU取込みによってH42は消光するがS16は消光しないため、赤色を示す核は青チャネルにおいてH42蛍光の低下を示すと考えられる。
【0197】
実施例7
mRNA転写の画像化
本実施例では、VSOM実験の長所を示す実験について説明する。このような実験は、アンチセンス化合物、送達システム、および信号増幅法の開発の補助として、組織培養中のmRNA転写をリアルタイムで画像化する手段を提供すると予測される。リアルタイム医用画像技術に適した放射線標識アンチセンス化合物を提供する実験についても説明する。
【0198】
これらのVSOM実験では、bcl-2タンパク質をコードしているmRNAとともに、モデル系としてヒト乳癌細胞株BT-474が使用される。個々の細胞内の蛍光標識したアンチセンス化合物が追跡され、細胞内の適切な標的mRNAに誘導され、かつ、個々の細胞が予測された方式で影響されているか否かが決定される。デジタル画像蛍光鏡検法、新規性のある計算技術、およびバイオインフォマティクスツールの使用により1つのチャネルで蛍光アンチセンス化合物が追跡され、別のチャネルでは他の細胞反応(例えばアポトーシス)がモニターされる。bcl-2のmRNAレベルでの発現が、時間、細胞外ストレス、およびアンチセンス化合物の構造の関数として画像化される。これらの観察結果は各細胞内のbcl-2タンパク質レベルおよび各細胞の最終運命と相関付けられる。したがって、これらの実験は、PETで遺伝子発現を画像化するためのアンチセンス化合物のインテリジェント設計に有用な、特定のアンチセンス化合物の生物物理学的特性に関する詳細な情報を提供する。事実、本発明のインビトロ技術により、インビボ研究(例えば、異種腫瘍細胞株BT-474を移植したヌードマウスにおける研究)の場合よりも多くの化合物修飾を試験することが可能となる。
【0199】
いくつかの態様において、VSOM実験とインビボPET撮影試験の両方が可能となるよう、同じ配列だが5'末端を修飾したAS-ODN化合物を使用した。VSOM実験では蛍光色素を使用し、PET撮影試験では2つのフッ化放射性成分の1つを使用した。いずれの場合も、蛍光色素および放射性標識の付着を容易にするため5'末端にヘキシルアミンリンカーを結合させた。追加の実験では、送達ビークルとしてリポソームおよびイムノリポソームを用いた。いくつかの実験では、放射線標識試験で使用したフッ化成分の非蛍光、非放射性のバージョンを生物学的エンドポイントの基礎とした。この方式により、AS-ODNの5'末端における種々の置換基の結果を決定した。さらに、β-ガラクトシダーゼプロトコルで得られる信号増幅の量を本発明とともに使用することができる。他の態様ではペプチド核酸が使用される。ペプチド核酸(PNA)は、デオキシリボース骨格全体がポリアミド(ペプチド)鎖で置換された、修飾オリゴヌクレオチドである(Gewirtzら、Blood92:36 [1998]; ならびに、TemsamaniおよびGuinot、Biotechnol. Appl. Biochem.、26:65-71[1997])。
【0200】
1つの態様では以下のASD-ODN配列を使用した。

【0201】
bcl-2のオープンリーディングフレームの最初の6コドンに対するアンチセンス配列を有する、配列番号:1に示した18-merの完全なホスホロチオエートは、重症免疫不全マウスに移植したDoHH2リンパ腫に対する有効性が認められている(Raynaudら、[1997])。15-merの2つのPNA-ODN(配列番号:2および3)は無細胞系でのインビトロ評価が行われている(Mologniら、[1999])。特に興味深いのは、mRNA転写が完全に阻害されるのは両方のPNA-ODNが同時に存在する場合のみであるということである。
【0202】
蛍光標識したPT-G3139、PNA-1、およびPNA-4を市販の供給源から入手した(例えばGenset、http://www.gensetoligos.com)。これらAS-ODNの修飾物であり骨格がPD、PT、MP、またはPNAの骨格結合で完全に構成されるもの、ならびに、骨格結合に種々の置換および混合を有する化合物も使用した。
【0203】
最初の実験を行い、一連の単一細胞の反応としてデータベースに記録した。前述のように骨格結合に種々の修飾を有する、蛍光標識したAS-ODNのセットを使用した。ベースラインとなるVSOM実行のセットを行った。これらの実行において、細胞は顕微鏡カバーグラス上で増殖させ、かつ、細胞観察用に63×NA1.3油浸対物レンズを使用した。細胞を温度管理した微小灌流チャンバに入れた。細胞質区画、核質区画、およびミトコンドリア区画の最初のセグメント化を以下の要領で行った。
【0204】
カルシウム、マグネシウム、グルコース、およびピルビン酸塩を含むダルベッコのリン酸緩衝生理食塩水(D-PBS)に溶解した蛍光化合物TMRE(テトラメチル・ローダミン・エチルエステル;モレキュラー・プローブズ)をコンピュータ制御のシリンジポンプにより細胞チャンバに注入する。化合物TMREは、Nerstの式(Farkasら、前述)によってミトコンドリアの膜電位を決定するために使用される、再配分型のカチオン染料である。ミトコンドリア染料であるローダミン123と異なり、TMREは迅速かつ可逆的にミトコンドリア内で平衡し、かつ、程度はより少ないものの細胞質でも平衡する。核質区画はTMREで染色されない。
【0205】
次に、緩衝液のみが入ったコンピュータ制御のシリンジを使用して細胞からTMREを洗い流す。TMREは細胞から容易に洗い流すことができる。次に、別のコンピュータ制御シリンジを使用して、蛍光標識AS-ODNを微小灌流チャンバに注入する。AS-ODNが発する蛍光信号が可視状態になるときの濃度が記録され、かつ、AS-ODNの灌流が自動的に停止される。これがVSOM実行の前半の終了である。
【0206】
VSOMオペレーションを確認するための再生ができるよう、すべてのデジタル画像がデータベースに追加される。このように、多チャネルデジタル画像、実験パラメータ、および、コンピュータ制御の化合物灌流に対する単一細胞の反応(63×で細胞5〜10個)がデータベースの一部となる。
【0207】
最初のVSOM実行の後半では、蛍光標識AS-ODNの蛍光分布パターンと、細胞小器官特異的蛍光染料(モレキュラー・プローブズ)を用いて同じ細胞種について以前に取得された蛍光分布パターンまたは蛍光AS-ODNと細胞小器官特異的蛍光染料とで二重染色した現在観察中の細胞について別の蛍光チャネルで取得した現在の蛍光パターンとの比較が行われる。VSOMは、細胞内のAS-ODNの位置を決定し終えると、適切なシリンジから適切な化合物を添加して細胞内のAS-ODN分布に対する影響を観察する。
【0208】
蛍光標識AS-ODNのリソソーム隔離が生じる場合は、リソソームを選択的に透過化することが知られている化合物が、コンピュータ制御の灌流シリンジにより制御された流量でチャンバ内に灌流される。モネンシンプロトンイオノフォアナトリウムなど複数の化合物が、ヒト乳癌細胞の酸性小胞内に捕捉された蛍光化合物を解放することが明らかになっている(Schindlerら、[1996]を参照)。蛍光標識AS-ODNを解放するのに必要な(例えば)モネンシンの量がデータベースに記録される。隣接区画(例えば核)への再分布に要した時間およびその結果生じた核内の染色パターンも記録される。
【0209】
核からAS-ODNを除去するためのVSOM摂動は、当業者には周知である「クランピング」技術を使用して実施される。これらの技術により、ユーザーは、単純に周囲の細胞外培地のイオン(例えばカリウム)の濃度を変化させることにより細胞内のカリウム濃度を変化させることができる(Negulescuら、前述)。これと同じ方法を使用することによって細胞内のカルシウムレベルを変化させることができる。VSOMシステムは、核の塩基性タンパク質に対するAS-ODNの結合に干渉するため、細胞内のこのようなイオンの濃度を漸増させる。この場合も、核環境から化合物を解放させるのに必要な濃度およびその他の環境条件が記録される。この方法が成功しない場合は、オンラインの低張細胞溶解が実行され、かつ、以後の実験ではより厳しい環境条件が使用される。
【0210】
いくつかの態様において、VSOMは、細胞膜に結合したAS-ODNを解放するため、非生理学的なpHの緩衝液によるすすぎまたはトリプシン含有緩衝液によるすすぎによって摂動を与える。この場合も、蛍光標識AS-ODNの解放に必要な摂動の大きさに関する定量的データが細胞ごとに記録され、かつ、現在使用中のAS-ODNの化学構造と相関付けられる。
【0211】
好ましい態様において、(蛍光性および非蛍光性の)AS-ODNの生理学的影響が複数の方法で評価される。多くの場合はアポトーシス誘発性細胞外ストレス(例えば、紫外光、抗癌剤、カルシウムイオノフォアなど)が印加される。AS-ODNによるBT-474細胞中のbcl-2タンパク質量の低減が成功した場合は、bcl-2タンパク質の減少およびこれらの細胞のアポトーシスに対する抵抗能力が観察される。最も直接的な方法では、VSOM実験の後に細胞が固定され、bcl-2タンパク質に対する抗体を使用した間接免疫蛍光分析が行われ、続いて、同じ細胞視野に戻ってbcl-2タンパク質の定量が行われる(これは、細胞ごとに観察される蛍光信号と比例する)。しかし、本発明が特定の段階のセットに限定されることはなく、当業者には他の方法も本発明との関連で使用するのに適していることが理解されるものと思われる。
【0212】
当業者に周知の他の多くのアポトーシスマーカーも本発明とともに使用可能である。これらの方法には形態学的アッセイシステムおよび蛍光アッセイシステムが含まれる。例えば、VSOM実験で収集されるチャネルの1つは透過光チャネルであり、このチャネルを介して膜のブレブを観察することができる。また、アポトーシスに特徴的な核断片化を明らかにできる、種々の抗タンパク質(例えばアネキシンV)抗体およびDNA染料も存在する。さらに、すでに詳述したように、細胞膜完全性(例えば細胞の生存率)を示すカルセイン-AMなどの染料も、VSOM実験中に蛍光チャネルの1つで使用するのに適している。さらに、LDS-751で染色した185b5細胞についてすでに詳述したように、アポトーシスの早期に生じるミトコンドリアの膜電位の消失もアポトーシスの指標として有用である。
【0213】
以上より、本発明が細胞種間の差異に関する知識ベースの発見および最適化のための改良された方法およびシステムを提供することは明らかであると思われる。特に本発明は視覚的サーボ制御光学顕微鏡および分析方法を提供する。本発明は、数百の個々の生細胞を経時的に詳しくモニターする手段;多チャネルにおける動的生理学的反応の定量化;リアルタイムのデジタル画像セグメント化および分析;インテリジェントなかつ繰り返しの、コンピュータ印加による細胞ストレスおよび細胞刺激;ならびに、長期的な研究および観察において同じ細胞視野に戻ることができる能力を提供する。本発明はさらに、特定の細胞部分母集団用に培養条件を最適化する手段を提供する。
【0214】
本明細書で言及した発表物および特許はすべて参照として本明細書に組み入れられる。当業者には、本発明の範囲および精神から逸脱することなく、本明細書に記載された本発明の方法およびシステムに種々の改変および変形を行い得ることが明らかであると思われる。特定の好ましい態様に関して本発明を説明したが、特許請求の範囲で請求されている本発明がこのような特定の態様に不当に限定されることはないと理解されるべきである。事実、本発明を実行するための本明細書に記載の方式に対する、当業者に明白である種々の改変は、本明細書に記載の特許請求の範囲に含まれるものと意図される。
【特許請求の範囲】
【請求項1】
以下の段階を含む方法:
(a)細胞または細胞の細胞内構成要素をモニターする検出装置から細胞画像データを受け取る段階;
(b)細胞画像データを分析する段階;および
(c)分析された細胞画像データに応じて細胞または細胞内構成要素を刺激するよう適合された複数の刺激装置を自動的に作動させる段階。
【請求項2】
(c)が、分析された細胞画像データに応じて細胞を刺激するための複数の刺激装置を自動的かつ独立的に作動させる段階を含む、請求項1記載の方法。
【請求項3】
細胞画像データを分析する段階が、細胞の形態測定結果の分析、細胞の色の分析、および細胞の動きの分析からなる群より選択される少なくとも1つの分析を含む、請求項1記載の方法。
【請求項4】
細胞画像データが細胞情報の基準データベースと比較される、請求項1記載の方法。
【請求項5】
細胞画像データが細胞情報の遠隔(remote)基準データベースと比較される、請求項1記載の方法。
【請求項6】
検出装置が顕微鏡を含む、請求項1記載の方法であり、以下の段階を更に含む方法:
VSOMを使用して細胞をモニターする段階。
【請求項7】
刺激装置がシリンジである、請求項1記載の方法。
【請求項8】
以下の段階をさらに含む、請求項1記載の方法:
(d)細胞画像データを時間の関数として保存する段階。
【請求項9】
細胞が生存しており、かつ、細胞内構成要素が生細胞内に存在する、請求項1記載の方法。
【請求項10】
以下の段階をさらに含む、請求項1記載の方法:
(d)段階(a)から(c)までを繰り返す段階。
【請求項11】
細胞アレイを分析する方法であり、以下の段階を含む方法:
a)i)細胞アレイ、ii)光学システム、iii)計算手段、iv)少なくとも1つの試験刺激、およびv)ロボットシステムを提供する段階;
b)第一の信号を提供するため、細胞アレイが発する光を光学システムを用いて検出する段階;
c)細胞アレイが発する光に対応する第一の信号を計算手段に提供する段階;
d)第二の信号を生成するために第一の信号を使用する段階であって、刺激された細胞アレイを提供するための、細胞アレイに対する少なくとも1つの試験刺激の送達を、第二の信号が制御する段階;ならびに
e)試験刺激を送達する段階であって、刺激された細胞アレイが発する光を光学システムがさらに検出する段階。
【請求項12】
試験刺激が第一の信号に従って自動的に細胞アレイに印加される、請求項11記載の方法。
【請求項13】
ロボットシステムが少なくとも2つの微量液体チャネルを介して試験刺激を細胞アレイに送達する、請求項11記載の方法。
【請求項14】
光学システムが少なくとも1つの顕微鏡を含む、請求項11記載の方法。
【請求項15】
顕微鏡が、共焦点顕微鏡および蛍光顕微鏡からなる群より選択される、請求項14記載の方法。
【請求項16】
細胞アレイが少なくとも2つの細胞種を含む、請求項11記載の方法。
【請求項17】
光学システムが、細胞アレイに含まれる細胞種の中の細胞内構成要素を検出するために細胞アレイを走査する、請求項16記載の方法。
【請求項18】
細胞内構成要素が、核、核小体、ミトコンドリア、リソソーム、ファゴリソソーム、および貯蔵小胞からなる群より選択される、請求項17記載の方法。
【請求項19】
少なくとも1つの細胞内構成要素が標識される、請求項17記載の方法。
【請求項20】
細胞内構成要素が試験刺激により標識される、請求項18記載の方法。
【請求項21】
細胞内構成要素が、蛍光染料、放射性化合物、酵素、および生体染料(vital dye)からなる群より選択される少なくとも1つの化合物で標識される、請求項17記載の方法。
【請求項22】
光学システムが標識をデジタルデータに変換する、請求項11記載の方法。
【請求項23】
ロボットシステムが、生物学的活性成分の細胞アレイへの送達を自動的に調整するためにデジタルデータを利用する、請求項11記載の方法。
【請求項24】
細胞情報プロフィールを作製するために、刺激された細胞アレイが発する光を分析する段階をさらに含む、請求項11記載の方法。
【請求項25】
細胞情報プロフィールを細胞情報の基準データベースと比較する段階をさらに含む、請求項24記載の方法。
【請求項26】
細胞アレイを分析するためのシステムであって、以下を含むシステム:
少なくとも1つの細胞アレイ、細胞アレイが発する光を検出するための光検出手段を有する光学システム、ロボットシステム、ならびに、光学システムからの入力を受け取る手段を有する第一のプログラム環境およびロボットシステムへの出力を提供する手段を有する第二のプログラム環境を含むコンピュータシステム。
【請求項27】
ロボットシステムが少なくとも2つの試験刺激源をさらに含む、請求項26記載のシステム。
【請求項28】
少なくとも2つの試験刺激源が生物学的活性組成物を含む、請求項26記載のシステム。
【請求項29】
少なくとも2つの試験刺激源が少なくとも1つの細胞アレイと流体接触状態(in fluidic communication)にある、請求項26記載のシステム。
【請求項30】
細胞アレイが少なくとも2つの細胞種を含む、請求項26記載のシステム。
【請求項31】
コンピュータシステムを遠隔操作する手段をさらに含む、請求項26記載のシステム。
【請求項32】
光学システムが顕微鏡を含む、請求項26記載のシステム。
【請求項33】
以下を含む、コンピュータ読み取り可能媒体:
(a)細胞または細胞内構成要素をモニターする検出装置から細胞画像データを受け取るためのコード(code);
(b)細胞画像データを分析するためのコード;および
(c)分析された細胞画像データに応じて細胞または細胞内構成要素を刺激するよう適合された複数の刺激装置を自動的に調整するためのコード。
【請求項34】
以下をさらに含む、請求項33記載のコンピュータ読み取り可能媒体。
(d)細胞をモニターする視覚的サーボ制御光学顕微鏡(VSOM)を制御するためのコード。
【請求項35】
以下のうち少なくとも1つをさらに含む、請求項33記載のコンピュータ読み取り可能媒体:
(d)細胞のサイズを分析するためのコード、細胞の色を分析するためのコード、および細胞の動きを分析するためのコード。
【請求項36】
以下をさらに含む、請求項33記載のコンピュータ読み取り可能媒体。
(d)分析された細胞画像データに応じて細胞を刺激するための複数の刺激装置を自動的かつ独立的に作動させるためのコード。
【請求項37】
刺激装置がシリンジである、請求項33記載のコンピュータ読み取り可能媒体。
【請求項38】
細胞画像データを時間の関数として保存するためのコードをさらに含む、請求項33記載のコンピュータ読み取り可能媒体。
【請求項39】
細胞が生存しており、かつ、細胞内構成要素が生細胞内に存在する、請求項33記載のコンピュータ読み取り可能媒体。
【請求項1】
以下の段階を含む方法:
(a)細胞または細胞の細胞内構成要素をモニターする検出装置から細胞画像データを受け取る段階;
(b)細胞画像データを分析する段階;および
(c)分析された細胞画像データに応じて細胞または細胞内構成要素を刺激するよう適合された複数の刺激装置を自動的に作動させる段階。
【請求項2】
(c)が、分析された細胞画像データに応じて細胞を刺激するための複数の刺激装置を自動的かつ独立的に作動させる段階を含む、請求項1記載の方法。
【請求項3】
細胞画像データを分析する段階が、細胞の形態測定結果の分析、細胞の色の分析、および細胞の動きの分析からなる群より選択される少なくとも1つの分析を含む、請求項1記載の方法。
【請求項4】
細胞画像データが細胞情報の基準データベースと比較される、請求項1記載の方法。
【請求項5】
細胞画像データが細胞情報の遠隔(remote)基準データベースと比較される、請求項1記載の方法。
【請求項6】
検出装置が顕微鏡を含む、請求項1記載の方法であり、以下の段階を更に含む方法:
VSOMを使用して細胞をモニターする段階。
【請求項7】
刺激装置がシリンジである、請求項1記載の方法。
【請求項8】
以下の段階をさらに含む、請求項1記載の方法:
(d)細胞画像データを時間の関数として保存する段階。
【請求項9】
細胞が生存しており、かつ、細胞内構成要素が生細胞内に存在する、請求項1記載の方法。
【請求項10】
以下の段階をさらに含む、請求項1記載の方法:
(d)段階(a)から(c)までを繰り返す段階。
【請求項11】
細胞アレイを分析する方法であり、以下の段階を含む方法:
a)i)細胞アレイ、ii)光学システム、iii)計算手段、iv)少なくとも1つの試験刺激、およびv)ロボットシステムを提供する段階;
b)第一の信号を提供するため、細胞アレイが発する光を光学システムを用いて検出する段階;
c)細胞アレイが発する光に対応する第一の信号を計算手段に提供する段階;
d)第二の信号を生成するために第一の信号を使用する段階であって、刺激された細胞アレイを提供するための、細胞アレイに対する少なくとも1つの試験刺激の送達を、第二の信号が制御する段階;ならびに
e)試験刺激を送達する段階であって、刺激された細胞アレイが発する光を光学システムがさらに検出する段階。
【請求項12】
試験刺激が第一の信号に従って自動的に細胞アレイに印加される、請求項11記載の方法。
【請求項13】
ロボットシステムが少なくとも2つの微量液体チャネルを介して試験刺激を細胞アレイに送達する、請求項11記載の方法。
【請求項14】
光学システムが少なくとも1つの顕微鏡を含む、請求項11記載の方法。
【請求項15】
顕微鏡が、共焦点顕微鏡および蛍光顕微鏡からなる群より選択される、請求項14記載の方法。
【請求項16】
細胞アレイが少なくとも2つの細胞種を含む、請求項11記載の方法。
【請求項17】
光学システムが、細胞アレイに含まれる細胞種の中の細胞内構成要素を検出するために細胞アレイを走査する、請求項16記載の方法。
【請求項18】
細胞内構成要素が、核、核小体、ミトコンドリア、リソソーム、ファゴリソソーム、および貯蔵小胞からなる群より選択される、請求項17記載の方法。
【請求項19】
少なくとも1つの細胞内構成要素が標識される、請求項17記載の方法。
【請求項20】
細胞内構成要素が試験刺激により標識される、請求項18記載の方法。
【請求項21】
細胞内構成要素が、蛍光染料、放射性化合物、酵素、および生体染料(vital dye)からなる群より選択される少なくとも1つの化合物で標識される、請求項17記載の方法。
【請求項22】
光学システムが標識をデジタルデータに変換する、請求項11記載の方法。
【請求項23】
ロボットシステムが、生物学的活性成分の細胞アレイへの送達を自動的に調整するためにデジタルデータを利用する、請求項11記載の方法。
【請求項24】
細胞情報プロフィールを作製するために、刺激された細胞アレイが発する光を分析する段階をさらに含む、請求項11記載の方法。
【請求項25】
細胞情報プロフィールを細胞情報の基準データベースと比較する段階をさらに含む、請求項24記載の方法。
【請求項26】
細胞アレイを分析するためのシステムであって、以下を含むシステム:
少なくとも1つの細胞アレイ、細胞アレイが発する光を検出するための光検出手段を有する光学システム、ロボットシステム、ならびに、光学システムからの入力を受け取る手段を有する第一のプログラム環境およびロボットシステムへの出力を提供する手段を有する第二のプログラム環境を含むコンピュータシステム。
【請求項27】
ロボットシステムが少なくとも2つの試験刺激源をさらに含む、請求項26記載のシステム。
【請求項28】
少なくとも2つの試験刺激源が生物学的活性組成物を含む、請求項26記載のシステム。
【請求項29】
少なくとも2つの試験刺激源が少なくとも1つの細胞アレイと流体接触状態(in fluidic communication)にある、請求項26記載のシステム。
【請求項30】
細胞アレイが少なくとも2つの細胞種を含む、請求項26記載のシステム。
【請求項31】
コンピュータシステムを遠隔操作する手段をさらに含む、請求項26記載のシステム。
【請求項32】
光学システムが顕微鏡を含む、請求項26記載のシステム。
【請求項33】
以下を含む、コンピュータ読み取り可能媒体:
(a)細胞または細胞内構成要素をモニターする検出装置から細胞画像データを受け取るためのコード(code);
(b)細胞画像データを分析するためのコード;および
(c)分析された細胞画像データに応じて細胞または細胞内構成要素を刺激するよう適合された複数の刺激装置を自動的に調整するためのコード。
【請求項34】
以下をさらに含む、請求項33記載のコンピュータ読み取り可能媒体。
(d)細胞をモニターする視覚的サーボ制御光学顕微鏡(VSOM)を制御するためのコード。
【請求項35】
以下のうち少なくとも1つをさらに含む、請求項33記載のコンピュータ読み取り可能媒体:
(d)細胞のサイズを分析するためのコード、細胞の色を分析するためのコード、および細胞の動きを分析するためのコード。
【請求項36】
以下をさらに含む、請求項33記載のコンピュータ読み取り可能媒体。
(d)分析された細胞画像データに応じて細胞を刺激するための複数の刺激装置を自動的かつ独立的に作動させるためのコード。
【請求項37】
刺激装置がシリンジである、請求項33記載のコンピュータ読み取り可能媒体。
【請求項38】
細胞画像データを時間の関数として保存するためのコードをさらに含む、請求項33記載のコンピュータ読み取り可能媒体。
【請求項39】
細胞が生存しており、かつ、細胞内構成要素が生細胞内に存在する、請求項33記載のコンピュータ読み取り可能媒体。
【図1】


【図2】


【図3】


【図4A】


【図4B】


【図5】


【図6】


【図7】


【図8】


【図9】


【図10】


【図11】


【図12】


【図13】


【図14】


【図15】


【図16】


【図17】




【図2】


【図3】


【図4A】


【図4B】


【図5】


【図6】


【図7】


【図8】


【図9】


【図10】


【図11】


【図12】


【図13】


【図14】


【図15】


【図16】


【図17】


【公開番号】特開2013−27392(P2013−27392A)
【公開日】平成25年2月7日(2013.2.7)
【国際特許分類】
【出願番号】特願2012−171722(P2012−171722)
【出願日】平成24年8月2日(2012.8.2)
【分割の表示】特願2002−502071(P2002−502071)の分割
【原出願日】平成13年6月7日(2001.6.7)
【公序良俗違反の表示】
(特許庁注:以下のものは登録商標)
1.JAVA
2.イーサネット
3.Linux
4.PENTIUM
5.UNIX
【出願人】(506115514)ザ リージェンツ オブ ザ ユニバーシティ オブ カリフォルニア (87)
【Fターム(参考)】
【公開日】平成25年2月7日(2013.2.7)
【国際特許分類】
【出願日】平成24年8月2日(2012.8.2)
【分割の表示】特願2002−502071(P2002−502071)の分割
【原出願日】平成13年6月7日(2001.6.7)
【公序良俗違反の表示】
(特許庁注:以下のものは登録商標)
1.JAVA
2.イーサネット
3.Linux
4.PENTIUM
5.UNIX
【出願人】(506115514)ザ リージェンツ オブ ザ ユニバーシティ オブ カリフォルニア (87)
【Fターム(参考)】
[ Back to top ]

