親和性可変抗体
【課題】カルシウム濃度変化などの温和な条件変化により抗原に対する親和性が変化する改変された抗体を提供する。
【解決手段】抗体VH領域−カルモジュリン−M13ペプチド−抗体VL領域よりなる融合蛋白質をコードするポリヌクレオチドを作成し、このポリヌクレオチドを含む発現プラスミドで大腸菌を形質転換して得た、融合蛋白質。当該融合蛋白質はカルシウム非存在下で抗原に対して高い親和性を示すが、1μM以上のカルシウムイオンの添加で親和性を大きく低下させる。
【解決手段】抗体VH領域−カルモジュリン−M13ペプチド−抗体VL領域よりなる融合蛋白質をコードするポリヌクレオチドを作成し、このポリヌクレオチドを含む発現プラスミドで大腸菌を形質転換して得た、融合蛋白質。当該融合蛋白質はカルシウム非存在下で抗原に対して高い親和性を示すが、1μM以上のカルシウムイオンの添加で親和性を大きく低下させる。
【発明の詳細な説明】
【技術分野】
【0001】
本発明は医薬品、臨床検査薬、バイオセンサー、アフィニティーリガンド(分離剤)などの用途に使用可能な、外部環境の変化、特にカルシウム濃度の変化に応答して、抗原との親和性が変化する改変型抗体に関する。
【背景技術】
【0002】
抗体は、特定の物質に特異的に結合するという性質を利用して、疾病診断検査、抗体医薬、環境モニタリング、食品品質管理、検体からの抗原の除去、蛋白質のアフィニティー精製、細胞やウィルスの回収などへの応用が試みられてきた。現在では蛋白質をはじめとして、あらゆる物質に結合する抗体の作成方法が確立されている。すなわち抗体を利用した検出/精製ができない物質は存在しないといえる状況にある。さらに近年では遺伝子工学の発展に伴い、抗体遺伝子の取得が容易となったことから抗体工学が急速に発展した。このことにより、抗体遺伝子を動物細胞だけでなく、酵母(特許文献1)や大腸菌(非特許文献1)に導入して発現させることが可能になり、抗体の大量生産も容易となった。
【0003】
抗体は一般的に重鎖(H鎖)2本および軽鎖(L鎖)2本よりなる四量体蛋白質であるが、遺伝子組換えにより抗体を作成する場合には必ずしもその全体を発現させる必要はなく、例えば抗原との結合能のみが必要な場合には可変領域を含むFab部分やFv部分のみを発現させればよく、細胞障害性や補体活性化能のみが必要な場合にはFc部分のみを発現させればよい。
【0004】
また、FabやFvは2本のポリペプチドより形成されるため、両遺伝子を均等に発現、かつ会合させることに問題があったが、両ポリペプチドをリンカーと呼ばれるアミノ酸数残基よりなる人工のポリペプチドで連結することによりscFvと呼ばれる1つのポリペプチドとして機能させる方法も開発されている(特許文献2)。さらにはこの抗体断片に生理活性のあるポリペプチドや低分子化合物を結合させて医薬品を特定の組織や細胞のみに作用させるような試みも行なわれている(特許文献3)。
【0005】
FvはVHとVL断片の2本のポリペプチドで構成されるが、これらは各々が抗原に結合する能力を有しており、抗体機能を有する最小単位のポリペプチドである。VHとVLをそれぞれ調製して混合すると、両ポリペプチドはそれぞれ単量体として存在するが、抗原が介在するとThree−Hybridを形成することが知られており、これを利用したオープンサンドイッチ免疫測定法が報告されている(非特許文献2)。この方法により、従来サンドイッチ法では測定できなかった低分子化合物を高感度に測定できる可能性がでてきた。
【0006】
さらにこの性質を利用し、VHおよびVLにそれぞれDNA結合蛋白質または転写活性調節因子を結合した二つの融合蛋白質を用いて、抗原が存在する場合に両融合蛋白質がVH領域およびVL領域を介して複合体を形成させ、この複合体をDNA結合蛋白質に応答するプロモーターを用いた遺伝子発現ベクターに作用させることで遺伝子発現を促進、または抑制する等の用途も考案されている(特許文献4)。
【0007】
抗体の用途の一つとして、蛋白質、ウィルスまたは細胞を培養液等から特異的に回収する用途がある。本用途では抗原に対する高い選択性を利用し、抗体を担持した担体に蛋白質などの目的物を吸着させ、吸着しない夾雑物を担体から洗い流して除去した後、酸性緩衝液や蛋白質変成剤を担体に通過させて抗体と目的物を解離させて溶出回収する。この方法は一段階の単純な操作で高純度の目的物を回収できるので非常に効果的な精製法である。しかしながら、抗体と目的物の結合力がきわめて強いため、解離させるためにはpH3付近の強酸性条件や非常に高濃度の蛋白質変性剤が必要となる。このため目的物が失活してしまうことが多く、安定性の高い目的物にしか使用できないという欠点があった。また、固定化した抗体自身も徐々に失活していくため、繰返し使用できる回数に制限があるという欠点があった。すなわち、目的物の吸着時には高い選択性と強い結合力を持ち、溶出時にはより温和な条件変化で結合力が低下する抗体が求められていた。
【0008】
さらには、例えば抗原とは異なる何らかの化合物が抗体に作用することによって抗原との親和性が低下する抗体が提供されれば、センサーや診断試薬としての新たな用途展開が可能となる。例えばレポーターとなる任意の物質に対する抗体に改変を施して、重金属の結合によりそのレポーター物質に対する親和性が低下するような抗体を創製し、この改変抗体とレポーター分子の複合体により重金属の検出を行なう用途が考えられる。このような抗体が創製されれば、重金属の作用により複合体からのレポーター分子の遊離を検出することで簡易なバイオセンサーを提供することができる。
【先行技術文献】
【特許文献】
【0009】
【特許文献1】特開平6−030778号公報
【特許文献2】特開平9−220092号公報
【特許文献3】特開平6−087898号公報
【特許文献4】特開2009−201504号公報
【非特許文献】
【0010】
【非特許文献1】Itoh, et al.,(1993)J.Biol.Chem.,268,16639−16647
【非特許文献2】Ueda,et al.,(1996)Nature Biotechnol.,14,1714−1718
【非特許文献3】Kaihara et al.,(2008)Anal. Sci.,24,1704−1408
【非特許文献4】Wada, et al.,(2003)J.Am.Chem.Soc.,125,16228−16234
【非特許文献5】D.M.Hoover et al.,(2002)Nucleic Acid Res.30,e43
【非特許文献6】Gang Wu et al.,(2006)Protein Expr Purif.、47、441−445
【非特許文献7】T.Kajino et al.,(2000)Appl.Environ.Microbiol.,66,638−642
【発明の概要】
【発明が解決しようとする課題】
【0011】
本発明は、医薬品、臨床検査薬、バイオセンサー、アフィニティーリガンド(分離剤)などの用途に使用可能な、外部環境の変化、特にカルシウム濃度の変化に応答して、抗原との親和性が変化する改変型抗体を提供することにある。
【課題を解決するための手段】
【0012】
本願発明者らは上記課題に対して鋭意検討した結果、低分子物質の結合により立体構造が変化する蛋白質、例えばカルシウムイオンの結合により立体構造が変化するカルモジュリンと抗体を融合することで、目的の蛋白質、細胞またはウィルスが失活しない程度の条件変化で抗体の親和性を低下させうることを見出し本願発明の完成に至った。
【0013】
すなわち本発明は、以下の発明を包含する。
(1)一般式、X−Y−Zで示される融合蛋白質であり、Xが抗体のVH領域またはVL領域を含むペプチド断片であり、Yが特定の低分子量化合物の結合により当該低分子化合物が存在しない場合と異なる立体構造をとるペプチド断片であり、Zが抗体のVH領域またはVL領域のうちXとは異なる方を含むペプチド断片であり、前記低分子化合物の結合により、XとZにより形成される抗体に対する特異的な抗原との親和性が増強または低下する融合蛋白質。
(2)前記Yが一般式Y1−Y2で示される融合蛋白質であり、Y1がカルモジュリンであり、Y2がカルモジュリン結合ペプチドであり、特定の低分子化合物がカルシウムイオンである(1)に記載の融合蛋白質。
(3)前記Y2がミオシン軽鎖キナーゼの部分構造である(2)に記載の融合蛋白質。
(4)前記Y2がミオシン軽鎖キナーゼのカルシウム結合ドメイン由来のペプチドM13である(2)または(3)に記載の融合蛋白質。
(5)前記Y1とY2がGly−Glyリンカーで結合された(2)から(4)に記載の融合蛋白質。
(6)前記Xが抗体のVH領域を含むペプチド断片であり、Zが抗体VL領域を含むペプチド断片である(1)から(5)に記載の融合蛋白質。
(7)前記VH領域が配列番号6に示されるアミノ酸配列、または当該配列において1若しくは数個のアミノ酸が置換、欠失若しくは付加されたアミノ酸配列からなる抗リゾチーム抗体のVH領域であり、VL領域が配列番号9に示されるアミノ酸配列、または当該配列において1若しくは数個のアミノ酸が置換、欠失若しくは付加されたアミノ酸配列からなる抗リゾチーム抗体のVL領域であり、1μM以上のカルシウムイオンを添加することによりリゾチーム結合能が、カルシウム非存在下より低下する(1)から(6)に記載の融合蛋白質。
【発明の効果】
【0014】
本発明の融合蛋白質は、特定の低分子化合物、例えばカルシウムイオンなどの濃度の変化により、当該融合蛋白質の目的物に対する結合性を変化させることができる。特定の低分子化合物の濃度変化は、通常抗体に結合した抗原を遊離させるために必要とされる変性条件に比較して温和な条件であり、目的物の失活を回避することが可能となる。
【図面の簡単な説明】
【0015】
【図1】本融合蛋白質の発現ベクターpET−trx−His−VH−CaM−gly−gly−M13−VL作成の工程のうち、中間ベクターpBS−CaM−gly−gly−M13−VLまでの工程図である。
【図2】本融合蛋白質の発現ベクターpET−trx−His−VH−CaM−gly−gly−M13−VL作成の工程のうち、中間ベクターpBS−CaM−gly−gly−M13−VL以降の工程図である。
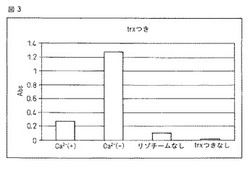
【図3】本融合蛋白質のリゾチームへの結合能に対するカルシウムイオンの影響をELISA法で検定した結果を示す。図中、「Ca2+(+)」は10mMのカルシウムイオン存在下での、「Ca2+(−)」はカルシウム非存在下でのELISAの結果を示す。また、「リゾチームなし」は固相にリゾチームを結合させなかった場合、「trxつきなし」は本融合蛋白質を添加しなかった場合を、それぞれブランク試験として実施した結果を示す。
【図4】本融合蛋白質のリゾチームへの結合能のカルシウム濃度依存性を示す図である。
【発明を実施するための形態】
【0016】
以下、本発明について詳細に説明する。
本発明に用いる低分子化合物濃度変化により立体構造を変化させる蛋白質として、配列番号1に示すカルモジュリン(非特許文献3)や、マルトースの結合により立体構造が変化するマルトース結合蛋白やグルタミンの結合によるグルタミン結合蛋白などを使用することができる(非特許文献4)。これらの中でも、カルモジュリンは分子量が約17kDaと比較的小さく、立体構造変化の原因となる因子が安価で安定性の高いカルシウムであるため、より好適に用いることができる。カルモジュリンは分子内に4箇所のカルシウムイオン結合サイトをもち、このサイトへのカルシウムの結合によりカルモジュリンの立体構造が大きく変化する。(非特許文献3)
【0017】
本発明ではカルモジュリン遺伝子の5’末端側に抗体のH鎖の全体もしくはVH領域を含む一部分をコードする遺伝子断片、またはL鎖の全体もしくはVL領域を含む一部分をコードする遺伝子断片を付加する。一方3’末端には、ミオシン軽鎖キナーゼのカルシウム結合ドメイン由来のペプチドM13(配列番号13)と、抗体のL鎖の全体もしくはVL領域を含む一部分をコードする遺伝子断片、またはH鎖の全体もしくはVH領域を含む一部分をコードする遺伝子断片のうちカルモジュリン遺伝子の5’末端側に付加した遺伝子断片とは異なる方(例えば5’末端側に抗体のH鎖の全体またはVH領域を含む一部分をコードする遺伝子断片を付加した場合は、抗体のL鎖の全体またはVL領域を含む一部分をコードする遺伝子断片)を付加した遺伝子を任意の発現ベクターを用いて、任意の細胞に導入し、その細胞を培養することで目的の融合蛋白質を作製する。
【0018】
作製する際、カルモジュリン遺伝子は配列番号1の配列のうち、コードするアミノ酸が変化しない範囲で任意の塩基配列に変更して用いることが可能であり、特に目的の融合蛋白質を発現する細胞のコドンの使用頻度に合わせて変更することができる。かかるコドンの変更は大腸菌や枯草菌などの原核細胞を用いて遺伝子発現を行なう場合に、発現量を飛躍的に向上させる場合がある。コドンの使用頻度の情報は例えば公的データベース(http://www.kazusa.or.jp/codon/)から得ることができる。
【0019】
塩基配列の変換はSite−directed mutagenesis法など公知の変異導入法を利用することができ、また、合成オリゴヌクレオチドとPCRを組合わせたDNAWorks法(非特許文献5)やSynthetic Gene Designer法(非特許文献6)を用いることができる。上記方法では、ポリペプチドをコードするアミノ酸配列を基にして、数十塩基からなるオリゴヌクレオチド群を合成し、PCR法により合成オリゴヌクレオチドをアッセンブリーさせることによって完全長の遺伝子を作製することができる。
【0020】
さらにはカルシウムの結合により立体構造が変化する性質を失わない範囲で、その一部または全部を別のアミノ酸に置換、または一部を削除して利用することもできる。このような改変を行なうことには、構造変化のために必要なカルシウム濃度を増加、または低減することやカルモジュリンの安定性を向上する効果が期待できる。また、蛋白質精製に本融合蛋白質を利用する場合には、担体への結合量を増加させる意味から融合蛋白質の分子量は小さいことが好ましく、そのための融合蛋白質の低分子化の効果も得られる。
【0021】
なお、カルモジュリンのC末端側に付加するM13遺伝子(配列番号13)についても同様に前述したコドン変換、遺伝子改変を行なってもよい。
【0022】
同様の目的で融合に用いる抗体遺伝子も、目的の化合物への結合能を失わない範囲で構成するアミノ酸の一部を置換、削除及び/又は付加するような改変を行なうことができる。抗体遺伝子としてはH鎖およびL鎖の全長を用いることもできるが、低分子量化する意味では機能を失わない範囲で小型化されていることが好ましく、より好適な形態としてVH領域およびVL領域をあげることができ、さらには機能を失わない範囲でVHおよびVLのN末端またはC末端の数残基を削除して利用することも可能である。
【0023】
ここで、利用する抗体は、遺伝子が調製されている物であれば、その目的にあわせて制限なく用いることができる。一例としてリゾチームの回収に利用する場合には配列番号6および配列番号9に示した抗体を用いることができるが、これに限定されるものではない。配列番号6は抗リゾチーム抗体のVL領域が、配列番号9には同じくVH領域が示されている。この他、例えばインシュリンの精製には抗インシュリン抗体の配列番号6および9に相当する部分、さらにインターフェロンの精製には抗インターフェロン抗体の配列番号6および9に相当する部分を用いることが可能である。
【0024】
本融合蛋白質の遺伝子の作成に当たり、抗体部分とカルモジュリン部分またはM13部分とは直接結合させることができるが、アミノ酸数残基をコードするリンカー配列を介して結合することも可能である。前記リンカー配列の例として、Gly−Gly、Gly−Ser、Gly−Gly−Ser、またはこれらを2から3回繰返した配列をあげることができる。
【0025】
また、本融合蛋白質の精製を容易にするために、タグ(tag)となるペプチドをコードするオリゴヌクレオチドを付加させてもよい。タグペプチドとしてはポリヒスチジンタグ(His−tag)、ミックタグ(C−myc tag)等を例示することができる。これらのタグペプチドは、上述のポリペプチドの生物活性を損なわない限りにおいて、N末端側、C末端側、または融合蛋白質分子の中央部分の任意の場所に付加することができる。本発明の蛋白質をコードするオリゴヌクレオチドへのタグペプチドをコードするオリゴヌクレオチドの付加は、当業者に周知の方法にて遺伝子工学的に行うことが可能である。
【0026】
さらには本融合蛋白質の細胞内での発現を容易にするために、任意のポリペプチドを付加することもできる。例えば、大腸菌で発現する場合はチオレドキシン(配列番号12)やグルタチオン−S−トランスフェラーゼなどを付加することで生産性が改善されることが知られている。また、蛋白質の分泌発現能が高いことで知られるバチルス属細菌を用いた発現系では、一例としてBrevibacillus choshinensisを宿主として用いた場合に、糸状菌由来のプロテインジスルフィドイソメラーゼ(PDI)との融合によりIgGのL鎖や超好熱菌由来のゲラニルゲラニル2リン酸合成酵素の生産性を改善した例が知られている(非特許文献7)。発現させる細胞の種類にあわせて、これらの任意的ポリペプチドを選択して用いることが可能である。これらの任意的ポリペプチドは、通常融合蛋白質のN末端側に付加される。
【0027】
細胞外に分泌生産させるためにシグナルペプチドを付加することも可能である。シグナルペプチドとは、細胞質内で発現した蛋白質が細胞膜を通過し、細胞膜外に分泌するためのポリペプチドであり、通常、当該蛋白質のN末端側に存在しており、細胞膜通過後、特定のプロテアーゼ酵素によって切断される。
【0028】
遺伝子発現に利用する細胞に制限はなく、任意の細胞を利用することが可能であり、例えば大腸菌としてはK12株やその誘導株のJMシリーズ株、BL21株などのB株誘導株があげられ、枯草菌としてはM168株やその誘導株のMT−2株やDB104株、DB117株などがあげられ、その他、枯草菌の近縁のBrevibacillus choshinensis、出芽酵母であるSaccharomyces cerevisiae、分裂酵母であるSchizosaccharomyces pombe、メタノール資化酵母のPichia pastoris、Aspergillus orizaeなどの麹菌、動物細胞、昆虫細胞などがあげられ、さらには小麦胚芽などの抽出液を利用した無細胞蛋白質発現系を利用することもできる。
【0029】
細胞への遺伝子導入に利用するベクターは用いる細胞に好適なベクターを任意に選択して細胞に導入することができる。そのようなベクターとして、例えば遺伝子発現に大腸菌を利用する場合にはpBR系、pUC系やpET系等のベクターを利用できる。また枯草菌を用いる場合はpUB110等を、Brevibacillus属の細菌を用いる場合はpNCMO2やpNY326(タカラバイオ社)等を、Saccharomyces属の酵母を利用する場合はpAUT101、pAUR123(タカラバイオ社)やpTEF1/Bsd(インビトロジェン社製)等を、Pichia属の酵母を用いる場合はpPHIL−D2、pAO815やpPICZ(インビトロジェン社)等を、麹菌を用いる場合はpUNAやpUSA等を、それぞれ利用できる。
【0030】
本発明の形質転換体を培養する方法についても特に限定はなく、通常の液体培地やそれを寒天で固めた固体培地を用いればよい。固体培地の形状にも限定はなく、斜面培地であってもよいし平板培地であってもよい。培地の組成としては、本発明の形質転換体が増殖し、かつ融合蛋白質を発現し得るものであればよい。炭素源としては、糖蜜、グルコース、フルクトース、マルトース、ショ糖、デンプン、乳糖、グリセロール、酢酸などが用いられる。窒素源としては、酢酸アンモニウム、塩化アンモニウム、硫酸アンモニウム、ペプトン、コーンスティープリカー、酵母エキスなどが用いられる。無機塩としては、リン酸二水素ナトリウム、リン酸水素二ナトリウム、リン酸二水素カリウム、リン酸水素二カリウムなどのリン酸塩、塩化ナトリウムなどが用いられる。金属イオンとしては、塩化マグネシウム、硫酸マグネシウム、硫酸鉄(II)、硫酸鉄(III)、塩化鉄(II)、塩化鉄(III)、クエン酸鉄、硫酸アンモニウム鉄、塩化カルシウム・二水和物、硫酸カルシウム、硫酸亜鉛、塩化亜鉛、硫酸銅、塩化銅、硫酸マンガン、塩化マンガンなどが用いられる。ビタミン類としては、酵母エキス、ビオチン、ニコチン酸、チアミン、リボフラビン、イノシトール、ピリドキシンなどが用いられる。なお、固体培地を用いる場合には上記の組成の培地に寒天やジェランガムといった固形化剤を加熱溶解させた後に、培養に用いる試験管やシャーレに分注し、さらに目的の温度まで冷却して固形化することで得られる。
【0031】
培養温度は発現に用いる細胞によるが、通常、大腸菌を用いる場合は15℃から40℃が好ましく、pHは6から8が好ましい。また、培養時間は任意に設定できるが、本融合蛋白質が十分に生産される時間であることが好ましく、大腸菌を用いる場合は通常は数時間から200時間の間に設定すればよい。
【0032】
本発明の製造方法で得られた融合蛋白質の分析方法は、培養液から安定的にかつ効率的に定量できる方法であれば特に限定はなく、ELISA法(酵素結合免疫吸着法)やウェスタンブロット法があげられる。
【0033】
本発明の製造方法で得られた融合蛋白質は培養液の状態のまま使用することも可能であり、高度に精製したものを使用することも可能であり、またその中間の純度の様々な精製度合いで使用することも可能である。融合蛋白質の精製は、遠心分離、限外ろ過、硫酸アンモニウム沈殿分画、カラムクロマトグラフィーなど様々な方法を組合わせて、目的の純度に達するまで行なえばよい。なお、本発明のポリヌクレオチドにHisタグ配列やc−myc抗原配列といったタグ配列をコードするポリヌクレオチドが含まれている場合、本発明の形質転換体によって発現した融合蛋白質にはそのN末端側またはC末端側に前記タグ配列が付加されているため、前記タグ配列を特異的に認識するアフィニティークロマトグラフィーを用いて簡便に精製することができる。
【0034】
本発明の製造方法で得られた融合蛋白質は、バイオ医薬や細胞、ウィルスを精製するためのアフィニティーリガンド(分離剤)に用いることができる他、医薬品、臨床検査薬、バイオセンサーといった様々な用途に用いることができる。
【0035】
カルモジュリンと抗体の可変領域を融合することで、カルシウム濃度に依存して抗原との親和性が変化する改変型抗体を提供する。本融合蛋白質は医薬品、臨床検査薬、バイオセンサー、またはアフィニティーリガンド(分離剤)といった様々な用途に用いることができる。特にアフィニティーリガンドへの利用において、通常の抗体を利用する場合は目的物の回収において強酸性条件や蛋白質変成剤を用いるため目的物の失活が問題となるのに対し、本融合蛋白質を利用した場合はカルシウムイオン濃度の変化という温和な条件で回収ができるため、目的物の失活を回避することが可能となる。
【0036】
以下に実施例をあげて本発明を説明するが、本発明はこれら実施例のみに限定されるものではなく、発明の要旨を逸脱しない範囲で、任意に変更が可能であることはいうまでもない。
【実施例】
【0037】
実施例1 融合蛋白質発現プラスミドの調製
(1)配列番号1に記載のポリヌクレオチドを鋳型とし、配列番号2および配列番号3のオリゴヌクレオチドをプライマーとしたPCR反応を行ない、増幅産物を得た。この増幅産物を制限酵素SpeIおよびBamHIで処理した。
(2)市販ベクターであるpBluescript II SK(+)(ストラタジン社)を制限酵素SpeIおよびBamHIで切断した後、アルカリフォスファターゼ処理により脱リン酸化した。
(3)(1)の増幅産物と(2)のベクターをT4DNAリガーゼにより結合させプラスミドpBS−CaMを得た。
(4)上記pBS−CaMを制限酵素NcoIで切断し、次いで配列番号4および5の合成オリゴヌクレオチドを連結してプラスミドpBS−CaM−(NcoI)−M13を調製した。
(5)上記pBS−CaM−(NcoI)−M13をMung Bean nucleaseで処理した後、セルフライゲーションを行なうことでプラスミドpBS−CaM−gly−gly−M13を得た。
(6)上記pBS−CaM−gly−gly−M13を制限酵素BamHIおよびNotIで処理し、さらにアルカリフォスファターゼ処理して脱リン酸化した。
(7)配列番号6の抗リゾチーム抗体VL領域を配列番号7および配列番号8のオリゴヌクレオチドをプライマーとしてPCR反応により増幅し、制限酵素BamHIおよびNotIで処理した後に、予め制限酵素BamHIおよびNotIで切断しさらに脱リン酸化しておいたプラスミドpBluescript II SK(+)に連結し、プラスミドpBS−VLを得た。
(8)(7)のプラスミドpBS−VLを制限酵素BamHIおよびNotIで処理してVL領域断片を回収し、(6)で調製したベクターにT4DNAリガーゼで結合することによりプラスミドpBS−CaM−gly−gly−M13−VLを得た。
(9)上記pBS−CaM−gly−gly−M13−VLを制限酵素KpnIおよびXbaIで切断した後に脱リン酸化した。
(10)配列番号9の抗リゾチーム抗体VH領域を配列番号10および配列番号11のオリゴヌクレオチドをプライマーとしてPCR反応により増幅し、制限酵素KpnIおよびXbaIで処理した後に、予め制限酵素KpnIおよびXbaIで切断しさらに脱リン酸化しておいたプラスミドpBluescript II SK(+)に連結し、プラスミドpBS−VHを得た。
(11)上記pBS−VHを制限酵素KpnIおよびXbaIで切断してVH領域を回収し、(9)のプラスミドにT4DNAリガーゼで結合させてプラスミドpBS−VH−CaM−gly−gly−M13−VLを得た。
(12)上記プラスミドを制限酵素NcoIおよびNotIで処理してVH領域からVL領域までの融合蛋白質をコードするDNA断片を得た。
(13)市販ベクターpET32c(ノバジェン社)を制限酵素NcoIおよびNotIで処理したのち、脱リン酸化処理を行なった。ここに(12)で得たDNA断片を結合して5’末端にチオレドキシンおよびHis−tag遺伝子を付加した融合蛋白質遺伝子がクローニングされた発現ベクターpET−trx−His−VH−CaM−gly−gly−M13−VLを調製した。以上の工程を図1および図2に示した。
【0038】
実施例2 大腸菌への形質転換と融合蛋白質の調製
(1)市販の大腸菌BL21(DE3)株のコンピテントセル(タカラバイオ社)を実施例1で作成した発現ベクターにより形質転換した。この組換え株をLB培地に植菌し、37℃で2時間培養したのちイソプロピルチオガラクトシルピラノシド(IPTG、終濃度1 mM)を添加してさらに25℃で一晩培養した。
(2)培養終了後、遠心分離により菌体を回収し、100mM KClを含む10mM MOPS緩衝液(pH7.4)に懸濁した。この懸濁液を超音波処理することで菌体を破砕したのち、遠心分離により可溶性画分を回収した。
(3)予め100mM KClを含む10mM MOPS緩衝液で平衡化したHis−Select Nickel Affinity Gel(SIGMA社)を充填したカラムに(2)で得た可溶性画分を通過させて融合蛋白質を吸着させ、平衡化緩衝液で洗浄した後に、200mM イミダゾールを含む100mM KClを含む10mM MOPS緩衝液で溶出することにより融合蛋白質の精製品を得た。
【0039】
実施例3 カルシウム存在下での融合蛋白質の親和性
(1)実施例2で調製した融合蛋白質溶液を10mM EGTAおよび100mM KClを含む10mM MOPS緩衝液に対して1時間透析し、さらに2.5mM EGTAおよび100mM KClを含む10mM MOPS緩衝液に対して1時間、100mM KClを含む10mM MOPS緩衝液に対して1時間、次いで同緩衝液に対して終夜の透析を行ない、60.0μg/mLの融合蛋白質溶液を調製した。
(2)(1)の溶液200μLを96穴タイタープレートのウェルにアプライし、37℃で1.5時間保温して固相化した。
(3)(2)のウェルを0.01% Tween20と100mM KClを含む10mM MOPS緩衝液で3回洗浄し、ついでBlock Ace(DSファーマバイオメディカル社)300μLをアプライし、37℃で1時間ブロッキングを行った。
(4)リゾチームを終濃度200μg/Lになるように10mM CaCl2および100mM KClを含む10mM MOPS緩衝液に溶解した。
(5)(3)のウェルを0.01% Tween20と100mM KClを含む10mM MOPS緩衝液で3回洗浄したのち、(4)のリゾチーム溶液200μLを加え、37℃で1.5時間保温し、固相の融合蛋白質にリゾチームを結合させた。
(6)0.01%Tween20と100mM KClを含む10mM MOPS緩衝液で3回洗浄したのち、市販のHRP標識anti−lysozyme polyclonal antibody(GeneTex社)を10000倍希釈して加え、37℃で1.5時間保温し、固相のリゾチームに結合させた。
(7)0.01% Tween20と100mM KClを含む10mM MOPS緩衝液で2回、100mM KClを含む10mM MOPS緩衝液で1回洗浄したのち、TMB基質溶液(KPL社)100μLを加えて1分間反応させた。
(8)1M硫酸を100μL加えて反応を停止させ、450nmの吸光度を測定した。この際の吸光度は0.25だった。結果を図3に示した。
【0040】
実施例4 カルシウム非存在下での融合蛋白質の親和性
実施例3に示す工程のうち、(4)においてCaCl2を含まない緩衝液を用いたことを除き、同様の操作を行なったところ、(8)における吸光度は1.25だった(図3)。本結果よりカルシウムの非存在下において本発明の融合蛋白質は、10mMのカルシウム存在下より多量のリゾチームを結合することを示す。すなわち本発明の融合蛋白質のリゾチームとの親和性は10mMのカルシウムを添加することで大きく低下することが確認された。
【0041】
比較例1 ブランク試験
実施例3に示す工程のうち、(5)においてリゾチーム溶液の代わりに100mM KClを含む10mM MOPS緩衝液を用いたことを除いて同様の操作を行なったところ、(8)における吸光度は0.1だった。(図3)
【0042】
また、同工程のうち(2)において(1)の融合蛋白質溶液の代わりに100mM KClを含む10mM MOPS緩衝液を用いたことを除いて同様の操作を行なったところ、(8)における吸光度は0.02だった。(図3)
本結果は実施例3および実施例4における吸光度は本融合蛋白質とリゾチームの結合によるものであり、非特異的反応によるものではないことが確認された。
【0043】
実施例5 カルシウム濃度依存性
実施例3における工程(4)において、緩衝液のカルシウム濃度を0、10、100、1000または10000μMとした他、同様の操作を行なった。その結果、(8)における吸光度はカルシウム濃度0μMでは1.15だったのに対し、10μMでは0.35に低下し、さらにそれ以上の濃度では濃度依存的に吸光度が低下することが確認された。この結果を図4に示した。この結果から本融合蛋白質はカルシウム濃度0μMでリゾチームに対して高い親和性を示すが、10μM以下のカルシウムを添加することで大きく低下することが確認された。
【技術分野】
【0001】
本発明は医薬品、臨床検査薬、バイオセンサー、アフィニティーリガンド(分離剤)などの用途に使用可能な、外部環境の変化、特にカルシウム濃度の変化に応答して、抗原との親和性が変化する改変型抗体に関する。
【背景技術】
【0002】
抗体は、特定の物質に特異的に結合するという性質を利用して、疾病診断検査、抗体医薬、環境モニタリング、食品品質管理、検体からの抗原の除去、蛋白質のアフィニティー精製、細胞やウィルスの回収などへの応用が試みられてきた。現在では蛋白質をはじめとして、あらゆる物質に結合する抗体の作成方法が確立されている。すなわち抗体を利用した検出/精製ができない物質は存在しないといえる状況にある。さらに近年では遺伝子工学の発展に伴い、抗体遺伝子の取得が容易となったことから抗体工学が急速に発展した。このことにより、抗体遺伝子を動物細胞だけでなく、酵母(特許文献1)や大腸菌(非特許文献1)に導入して発現させることが可能になり、抗体の大量生産も容易となった。
【0003】
抗体は一般的に重鎖(H鎖)2本および軽鎖(L鎖)2本よりなる四量体蛋白質であるが、遺伝子組換えにより抗体を作成する場合には必ずしもその全体を発現させる必要はなく、例えば抗原との結合能のみが必要な場合には可変領域を含むFab部分やFv部分のみを発現させればよく、細胞障害性や補体活性化能のみが必要な場合にはFc部分のみを発現させればよい。
【0004】
また、FabやFvは2本のポリペプチドより形成されるため、両遺伝子を均等に発現、かつ会合させることに問題があったが、両ポリペプチドをリンカーと呼ばれるアミノ酸数残基よりなる人工のポリペプチドで連結することによりscFvと呼ばれる1つのポリペプチドとして機能させる方法も開発されている(特許文献2)。さらにはこの抗体断片に生理活性のあるポリペプチドや低分子化合物を結合させて医薬品を特定の組織や細胞のみに作用させるような試みも行なわれている(特許文献3)。
【0005】
FvはVHとVL断片の2本のポリペプチドで構成されるが、これらは各々が抗原に結合する能力を有しており、抗体機能を有する最小単位のポリペプチドである。VHとVLをそれぞれ調製して混合すると、両ポリペプチドはそれぞれ単量体として存在するが、抗原が介在するとThree−Hybridを形成することが知られており、これを利用したオープンサンドイッチ免疫測定法が報告されている(非特許文献2)。この方法により、従来サンドイッチ法では測定できなかった低分子化合物を高感度に測定できる可能性がでてきた。
【0006】
さらにこの性質を利用し、VHおよびVLにそれぞれDNA結合蛋白質または転写活性調節因子を結合した二つの融合蛋白質を用いて、抗原が存在する場合に両融合蛋白質がVH領域およびVL領域を介して複合体を形成させ、この複合体をDNA結合蛋白質に応答するプロモーターを用いた遺伝子発現ベクターに作用させることで遺伝子発現を促進、または抑制する等の用途も考案されている(特許文献4)。
【0007】
抗体の用途の一つとして、蛋白質、ウィルスまたは細胞を培養液等から特異的に回収する用途がある。本用途では抗原に対する高い選択性を利用し、抗体を担持した担体に蛋白質などの目的物を吸着させ、吸着しない夾雑物を担体から洗い流して除去した後、酸性緩衝液や蛋白質変成剤を担体に通過させて抗体と目的物を解離させて溶出回収する。この方法は一段階の単純な操作で高純度の目的物を回収できるので非常に効果的な精製法である。しかしながら、抗体と目的物の結合力がきわめて強いため、解離させるためにはpH3付近の強酸性条件や非常に高濃度の蛋白質変性剤が必要となる。このため目的物が失活してしまうことが多く、安定性の高い目的物にしか使用できないという欠点があった。また、固定化した抗体自身も徐々に失活していくため、繰返し使用できる回数に制限があるという欠点があった。すなわち、目的物の吸着時には高い選択性と強い結合力を持ち、溶出時にはより温和な条件変化で結合力が低下する抗体が求められていた。
【0008】
さらには、例えば抗原とは異なる何らかの化合物が抗体に作用することによって抗原との親和性が低下する抗体が提供されれば、センサーや診断試薬としての新たな用途展開が可能となる。例えばレポーターとなる任意の物質に対する抗体に改変を施して、重金属の結合によりそのレポーター物質に対する親和性が低下するような抗体を創製し、この改変抗体とレポーター分子の複合体により重金属の検出を行なう用途が考えられる。このような抗体が創製されれば、重金属の作用により複合体からのレポーター分子の遊離を検出することで簡易なバイオセンサーを提供することができる。
【先行技術文献】
【特許文献】
【0009】
【特許文献1】特開平6−030778号公報
【特許文献2】特開平9−220092号公報
【特許文献3】特開平6−087898号公報
【特許文献4】特開2009−201504号公報
【非特許文献】
【0010】
【非特許文献1】Itoh, et al.,(1993)J.Biol.Chem.,268,16639−16647
【非特許文献2】Ueda,et al.,(1996)Nature Biotechnol.,14,1714−1718
【非特許文献3】Kaihara et al.,(2008)Anal. Sci.,24,1704−1408
【非特許文献4】Wada, et al.,(2003)J.Am.Chem.Soc.,125,16228−16234
【非特許文献5】D.M.Hoover et al.,(2002)Nucleic Acid Res.30,e43
【非特許文献6】Gang Wu et al.,(2006)Protein Expr Purif.、47、441−445
【非特許文献7】T.Kajino et al.,(2000)Appl.Environ.Microbiol.,66,638−642
【発明の概要】
【発明が解決しようとする課題】
【0011】
本発明は、医薬品、臨床検査薬、バイオセンサー、アフィニティーリガンド(分離剤)などの用途に使用可能な、外部環境の変化、特にカルシウム濃度の変化に応答して、抗原との親和性が変化する改変型抗体を提供することにある。
【課題を解決するための手段】
【0012】
本願発明者らは上記課題に対して鋭意検討した結果、低分子物質の結合により立体構造が変化する蛋白質、例えばカルシウムイオンの結合により立体構造が変化するカルモジュリンと抗体を融合することで、目的の蛋白質、細胞またはウィルスが失活しない程度の条件変化で抗体の親和性を低下させうることを見出し本願発明の完成に至った。
【0013】
すなわち本発明は、以下の発明を包含する。
(1)一般式、X−Y−Zで示される融合蛋白質であり、Xが抗体のVH領域またはVL領域を含むペプチド断片であり、Yが特定の低分子量化合物の結合により当該低分子化合物が存在しない場合と異なる立体構造をとるペプチド断片であり、Zが抗体のVH領域またはVL領域のうちXとは異なる方を含むペプチド断片であり、前記低分子化合物の結合により、XとZにより形成される抗体に対する特異的な抗原との親和性が増強または低下する融合蛋白質。
(2)前記Yが一般式Y1−Y2で示される融合蛋白質であり、Y1がカルモジュリンであり、Y2がカルモジュリン結合ペプチドであり、特定の低分子化合物がカルシウムイオンである(1)に記載の融合蛋白質。
(3)前記Y2がミオシン軽鎖キナーゼの部分構造である(2)に記載の融合蛋白質。
(4)前記Y2がミオシン軽鎖キナーゼのカルシウム結合ドメイン由来のペプチドM13である(2)または(3)に記載の融合蛋白質。
(5)前記Y1とY2がGly−Glyリンカーで結合された(2)から(4)に記載の融合蛋白質。
(6)前記Xが抗体のVH領域を含むペプチド断片であり、Zが抗体VL領域を含むペプチド断片である(1)から(5)に記載の融合蛋白質。
(7)前記VH領域が配列番号6に示されるアミノ酸配列、または当該配列において1若しくは数個のアミノ酸が置換、欠失若しくは付加されたアミノ酸配列からなる抗リゾチーム抗体のVH領域であり、VL領域が配列番号9に示されるアミノ酸配列、または当該配列において1若しくは数個のアミノ酸が置換、欠失若しくは付加されたアミノ酸配列からなる抗リゾチーム抗体のVL領域であり、1μM以上のカルシウムイオンを添加することによりリゾチーム結合能が、カルシウム非存在下より低下する(1)から(6)に記載の融合蛋白質。
【発明の効果】
【0014】
本発明の融合蛋白質は、特定の低分子化合物、例えばカルシウムイオンなどの濃度の変化により、当該融合蛋白質の目的物に対する結合性を変化させることができる。特定の低分子化合物の濃度変化は、通常抗体に結合した抗原を遊離させるために必要とされる変性条件に比較して温和な条件であり、目的物の失活を回避することが可能となる。
【図面の簡単な説明】
【0015】
【図1】本融合蛋白質の発現ベクターpET−trx−His−VH−CaM−gly−gly−M13−VL作成の工程のうち、中間ベクターpBS−CaM−gly−gly−M13−VLまでの工程図である。
【図2】本融合蛋白質の発現ベクターpET−trx−His−VH−CaM−gly−gly−M13−VL作成の工程のうち、中間ベクターpBS−CaM−gly−gly−M13−VL以降の工程図である。
【図3】本融合蛋白質のリゾチームへの結合能に対するカルシウムイオンの影響をELISA法で検定した結果を示す。図中、「Ca2+(+)」は10mMのカルシウムイオン存在下での、「Ca2+(−)」はカルシウム非存在下でのELISAの結果を示す。また、「リゾチームなし」は固相にリゾチームを結合させなかった場合、「trxつきなし」は本融合蛋白質を添加しなかった場合を、それぞれブランク試験として実施した結果を示す。
【図4】本融合蛋白質のリゾチームへの結合能のカルシウム濃度依存性を示す図である。
【発明を実施するための形態】
【0016】
以下、本発明について詳細に説明する。
本発明に用いる低分子化合物濃度変化により立体構造を変化させる蛋白質として、配列番号1に示すカルモジュリン(非特許文献3)や、マルトースの結合により立体構造が変化するマルトース結合蛋白やグルタミンの結合によるグルタミン結合蛋白などを使用することができる(非特許文献4)。これらの中でも、カルモジュリンは分子量が約17kDaと比較的小さく、立体構造変化の原因となる因子が安価で安定性の高いカルシウムであるため、より好適に用いることができる。カルモジュリンは分子内に4箇所のカルシウムイオン結合サイトをもち、このサイトへのカルシウムの結合によりカルモジュリンの立体構造が大きく変化する。(非特許文献3)
【0017】
本発明ではカルモジュリン遺伝子の5’末端側に抗体のH鎖の全体もしくはVH領域を含む一部分をコードする遺伝子断片、またはL鎖の全体もしくはVL領域を含む一部分をコードする遺伝子断片を付加する。一方3’末端には、ミオシン軽鎖キナーゼのカルシウム結合ドメイン由来のペプチドM13(配列番号13)と、抗体のL鎖の全体もしくはVL領域を含む一部分をコードする遺伝子断片、またはH鎖の全体もしくはVH領域を含む一部分をコードする遺伝子断片のうちカルモジュリン遺伝子の5’末端側に付加した遺伝子断片とは異なる方(例えば5’末端側に抗体のH鎖の全体またはVH領域を含む一部分をコードする遺伝子断片を付加した場合は、抗体のL鎖の全体またはVL領域を含む一部分をコードする遺伝子断片)を付加した遺伝子を任意の発現ベクターを用いて、任意の細胞に導入し、その細胞を培養することで目的の融合蛋白質を作製する。
【0018】
作製する際、カルモジュリン遺伝子は配列番号1の配列のうち、コードするアミノ酸が変化しない範囲で任意の塩基配列に変更して用いることが可能であり、特に目的の融合蛋白質を発現する細胞のコドンの使用頻度に合わせて変更することができる。かかるコドンの変更は大腸菌や枯草菌などの原核細胞を用いて遺伝子発現を行なう場合に、発現量を飛躍的に向上させる場合がある。コドンの使用頻度の情報は例えば公的データベース(http://www.kazusa.or.jp/codon/)から得ることができる。
【0019】
塩基配列の変換はSite−directed mutagenesis法など公知の変異導入法を利用することができ、また、合成オリゴヌクレオチドとPCRを組合わせたDNAWorks法(非特許文献5)やSynthetic Gene Designer法(非特許文献6)を用いることができる。上記方法では、ポリペプチドをコードするアミノ酸配列を基にして、数十塩基からなるオリゴヌクレオチド群を合成し、PCR法により合成オリゴヌクレオチドをアッセンブリーさせることによって完全長の遺伝子を作製することができる。
【0020】
さらにはカルシウムの結合により立体構造が変化する性質を失わない範囲で、その一部または全部を別のアミノ酸に置換、または一部を削除して利用することもできる。このような改変を行なうことには、構造変化のために必要なカルシウム濃度を増加、または低減することやカルモジュリンの安定性を向上する効果が期待できる。また、蛋白質精製に本融合蛋白質を利用する場合には、担体への結合量を増加させる意味から融合蛋白質の分子量は小さいことが好ましく、そのための融合蛋白質の低分子化の効果も得られる。
【0021】
なお、カルモジュリンのC末端側に付加するM13遺伝子(配列番号13)についても同様に前述したコドン変換、遺伝子改変を行なってもよい。
【0022】
同様の目的で融合に用いる抗体遺伝子も、目的の化合物への結合能を失わない範囲で構成するアミノ酸の一部を置換、削除及び/又は付加するような改変を行なうことができる。抗体遺伝子としてはH鎖およびL鎖の全長を用いることもできるが、低分子量化する意味では機能を失わない範囲で小型化されていることが好ましく、より好適な形態としてVH領域およびVL領域をあげることができ、さらには機能を失わない範囲でVHおよびVLのN末端またはC末端の数残基を削除して利用することも可能である。
【0023】
ここで、利用する抗体は、遺伝子が調製されている物であれば、その目的にあわせて制限なく用いることができる。一例としてリゾチームの回収に利用する場合には配列番号6および配列番号9に示した抗体を用いることができるが、これに限定されるものではない。配列番号6は抗リゾチーム抗体のVL領域が、配列番号9には同じくVH領域が示されている。この他、例えばインシュリンの精製には抗インシュリン抗体の配列番号6および9に相当する部分、さらにインターフェロンの精製には抗インターフェロン抗体の配列番号6および9に相当する部分を用いることが可能である。
【0024】
本融合蛋白質の遺伝子の作成に当たり、抗体部分とカルモジュリン部分またはM13部分とは直接結合させることができるが、アミノ酸数残基をコードするリンカー配列を介して結合することも可能である。前記リンカー配列の例として、Gly−Gly、Gly−Ser、Gly−Gly−Ser、またはこれらを2から3回繰返した配列をあげることができる。
【0025】
また、本融合蛋白質の精製を容易にするために、タグ(tag)となるペプチドをコードするオリゴヌクレオチドを付加させてもよい。タグペプチドとしてはポリヒスチジンタグ(His−tag)、ミックタグ(C−myc tag)等を例示することができる。これらのタグペプチドは、上述のポリペプチドの生物活性を損なわない限りにおいて、N末端側、C末端側、または融合蛋白質分子の中央部分の任意の場所に付加することができる。本発明の蛋白質をコードするオリゴヌクレオチドへのタグペプチドをコードするオリゴヌクレオチドの付加は、当業者に周知の方法にて遺伝子工学的に行うことが可能である。
【0026】
さらには本融合蛋白質の細胞内での発現を容易にするために、任意のポリペプチドを付加することもできる。例えば、大腸菌で発現する場合はチオレドキシン(配列番号12)やグルタチオン−S−トランスフェラーゼなどを付加することで生産性が改善されることが知られている。また、蛋白質の分泌発現能が高いことで知られるバチルス属細菌を用いた発現系では、一例としてBrevibacillus choshinensisを宿主として用いた場合に、糸状菌由来のプロテインジスルフィドイソメラーゼ(PDI)との融合によりIgGのL鎖や超好熱菌由来のゲラニルゲラニル2リン酸合成酵素の生産性を改善した例が知られている(非特許文献7)。発現させる細胞の種類にあわせて、これらの任意的ポリペプチドを選択して用いることが可能である。これらの任意的ポリペプチドは、通常融合蛋白質のN末端側に付加される。
【0027】
細胞外に分泌生産させるためにシグナルペプチドを付加することも可能である。シグナルペプチドとは、細胞質内で発現した蛋白質が細胞膜を通過し、細胞膜外に分泌するためのポリペプチドであり、通常、当該蛋白質のN末端側に存在しており、細胞膜通過後、特定のプロテアーゼ酵素によって切断される。
【0028】
遺伝子発現に利用する細胞に制限はなく、任意の細胞を利用することが可能であり、例えば大腸菌としてはK12株やその誘導株のJMシリーズ株、BL21株などのB株誘導株があげられ、枯草菌としてはM168株やその誘導株のMT−2株やDB104株、DB117株などがあげられ、その他、枯草菌の近縁のBrevibacillus choshinensis、出芽酵母であるSaccharomyces cerevisiae、分裂酵母であるSchizosaccharomyces pombe、メタノール資化酵母のPichia pastoris、Aspergillus orizaeなどの麹菌、動物細胞、昆虫細胞などがあげられ、さらには小麦胚芽などの抽出液を利用した無細胞蛋白質発現系を利用することもできる。
【0029】
細胞への遺伝子導入に利用するベクターは用いる細胞に好適なベクターを任意に選択して細胞に導入することができる。そのようなベクターとして、例えば遺伝子発現に大腸菌を利用する場合にはpBR系、pUC系やpET系等のベクターを利用できる。また枯草菌を用いる場合はpUB110等を、Brevibacillus属の細菌を用いる場合はpNCMO2やpNY326(タカラバイオ社)等を、Saccharomyces属の酵母を利用する場合はpAUT101、pAUR123(タカラバイオ社)やpTEF1/Bsd(インビトロジェン社製)等を、Pichia属の酵母を用いる場合はpPHIL−D2、pAO815やpPICZ(インビトロジェン社)等を、麹菌を用いる場合はpUNAやpUSA等を、それぞれ利用できる。
【0030】
本発明の形質転換体を培養する方法についても特に限定はなく、通常の液体培地やそれを寒天で固めた固体培地を用いればよい。固体培地の形状にも限定はなく、斜面培地であってもよいし平板培地であってもよい。培地の組成としては、本発明の形質転換体が増殖し、かつ融合蛋白質を発現し得るものであればよい。炭素源としては、糖蜜、グルコース、フルクトース、マルトース、ショ糖、デンプン、乳糖、グリセロール、酢酸などが用いられる。窒素源としては、酢酸アンモニウム、塩化アンモニウム、硫酸アンモニウム、ペプトン、コーンスティープリカー、酵母エキスなどが用いられる。無機塩としては、リン酸二水素ナトリウム、リン酸水素二ナトリウム、リン酸二水素カリウム、リン酸水素二カリウムなどのリン酸塩、塩化ナトリウムなどが用いられる。金属イオンとしては、塩化マグネシウム、硫酸マグネシウム、硫酸鉄(II)、硫酸鉄(III)、塩化鉄(II)、塩化鉄(III)、クエン酸鉄、硫酸アンモニウム鉄、塩化カルシウム・二水和物、硫酸カルシウム、硫酸亜鉛、塩化亜鉛、硫酸銅、塩化銅、硫酸マンガン、塩化マンガンなどが用いられる。ビタミン類としては、酵母エキス、ビオチン、ニコチン酸、チアミン、リボフラビン、イノシトール、ピリドキシンなどが用いられる。なお、固体培地を用いる場合には上記の組成の培地に寒天やジェランガムといった固形化剤を加熱溶解させた後に、培養に用いる試験管やシャーレに分注し、さらに目的の温度まで冷却して固形化することで得られる。
【0031】
培養温度は発現に用いる細胞によるが、通常、大腸菌を用いる場合は15℃から40℃が好ましく、pHは6から8が好ましい。また、培養時間は任意に設定できるが、本融合蛋白質が十分に生産される時間であることが好ましく、大腸菌を用いる場合は通常は数時間から200時間の間に設定すればよい。
【0032】
本発明の製造方法で得られた融合蛋白質の分析方法は、培養液から安定的にかつ効率的に定量できる方法であれば特に限定はなく、ELISA法(酵素結合免疫吸着法)やウェスタンブロット法があげられる。
【0033】
本発明の製造方法で得られた融合蛋白質は培養液の状態のまま使用することも可能であり、高度に精製したものを使用することも可能であり、またその中間の純度の様々な精製度合いで使用することも可能である。融合蛋白質の精製は、遠心分離、限外ろ過、硫酸アンモニウム沈殿分画、カラムクロマトグラフィーなど様々な方法を組合わせて、目的の純度に達するまで行なえばよい。なお、本発明のポリヌクレオチドにHisタグ配列やc−myc抗原配列といったタグ配列をコードするポリヌクレオチドが含まれている場合、本発明の形質転換体によって発現した融合蛋白質にはそのN末端側またはC末端側に前記タグ配列が付加されているため、前記タグ配列を特異的に認識するアフィニティークロマトグラフィーを用いて簡便に精製することができる。
【0034】
本発明の製造方法で得られた融合蛋白質は、バイオ医薬や細胞、ウィルスを精製するためのアフィニティーリガンド(分離剤)に用いることができる他、医薬品、臨床検査薬、バイオセンサーといった様々な用途に用いることができる。
【0035】
カルモジュリンと抗体の可変領域を融合することで、カルシウム濃度に依存して抗原との親和性が変化する改変型抗体を提供する。本融合蛋白質は医薬品、臨床検査薬、バイオセンサー、またはアフィニティーリガンド(分離剤)といった様々な用途に用いることができる。特にアフィニティーリガンドへの利用において、通常の抗体を利用する場合は目的物の回収において強酸性条件や蛋白質変成剤を用いるため目的物の失活が問題となるのに対し、本融合蛋白質を利用した場合はカルシウムイオン濃度の変化という温和な条件で回収ができるため、目的物の失活を回避することが可能となる。
【0036】
以下に実施例をあげて本発明を説明するが、本発明はこれら実施例のみに限定されるものではなく、発明の要旨を逸脱しない範囲で、任意に変更が可能であることはいうまでもない。
【実施例】
【0037】
実施例1 融合蛋白質発現プラスミドの調製
(1)配列番号1に記載のポリヌクレオチドを鋳型とし、配列番号2および配列番号3のオリゴヌクレオチドをプライマーとしたPCR反応を行ない、増幅産物を得た。この増幅産物を制限酵素SpeIおよびBamHIで処理した。
(2)市販ベクターであるpBluescript II SK(+)(ストラタジン社)を制限酵素SpeIおよびBamHIで切断した後、アルカリフォスファターゼ処理により脱リン酸化した。
(3)(1)の増幅産物と(2)のベクターをT4DNAリガーゼにより結合させプラスミドpBS−CaMを得た。
(4)上記pBS−CaMを制限酵素NcoIで切断し、次いで配列番号4および5の合成オリゴヌクレオチドを連結してプラスミドpBS−CaM−(NcoI)−M13を調製した。
(5)上記pBS−CaM−(NcoI)−M13をMung Bean nucleaseで処理した後、セルフライゲーションを行なうことでプラスミドpBS−CaM−gly−gly−M13を得た。
(6)上記pBS−CaM−gly−gly−M13を制限酵素BamHIおよびNotIで処理し、さらにアルカリフォスファターゼ処理して脱リン酸化した。
(7)配列番号6の抗リゾチーム抗体VL領域を配列番号7および配列番号8のオリゴヌクレオチドをプライマーとしてPCR反応により増幅し、制限酵素BamHIおよびNotIで処理した後に、予め制限酵素BamHIおよびNotIで切断しさらに脱リン酸化しておいたプラスミドpBluescript II SK(+)に連結し、プラスミドpBS−VLを得た。
(8)(7)のプラスミドpBS−VLを制限酵素BamHIおよびNotIで処理してVL領域断片を回収し、(6)で調製したベクターにT4DNAリガーゼで結合することによりプラスミドpBS−CaM−gly−gly−M13−VLを得た。
(9)上記pBS−CaM−gly−gly−M13−VLを制限酵素KpnIおよびXbaIで切断した後に脱リン酸化した。
(10)配列番号9の抗リゾチーム抗体VH領域を配列番号10および配列番号11のオリゴヌクレオチドをプライマーとしてPCR反応により増幅し、制限酵素KpnIおよびXbaIで処理した後に、予め制限酵素KpnIおよびXbaIで切断しさらに脱リン酸化しておいたプラスミドpBluescript II SK(+)に連結し、プラスミドpBS−VHを得た。
(11)上記pBS−VHを制限酵素KpnIおよびXbaIで切断してVH領域を回収し、(9)のプラスミドにT4DNAリガーゼで結合させてプラスミドpBS−VH−CaM−gly−gly−M13−VLを得た。
(12)上記プラスミドを制限酵素NcoIおよびNotIで処理してVH領域からVL領域までの融合蛋白質をコードするDNA断片を得た。
(13)市販ベクターpET32c(ノバジェン社)を制限酵素NcoIおよびNotIで処理したのち、脱リン酸化処理を行なった。ここに(12)で得たDNA断片を結合して5’末端にチオレドキシンおよびHis−tag遺伝子を付加した融合蛋白質遺伝子がクローニングされた発現ベクターpET−trx−His−VH−CaM−gly−gly−M13−VLを調製した。以上の工程を図1および図2に示した。
【0038】
実施例2 大腸菌への形質転換と融合蛋白質の調製
(1)市販の大腸菌BL21(DE3)株のコンピテントセル(タカラバイオ社)を実施例1で作成した発現ベクターにより形質転換した。この組換え株をLB培地に植菌し、37℃で2時間培養したのちイソプロピルチオガラクトシルピラノシド(IPTG、終濃度1 mM)を添加してさらに25℃で一晩培養した。
(2)培養終了後、遠心分離により菌体を回収し、100mM KClを含む10mM MOPS緩衝液(pH7.4)に懸濁した。この懸濁液を超音波処理することで菌体を破砕したのち、遠心分離により可溶性画分を回収した。
(3)予め100mM KClを含む10mM MOPS緩衝液で平衡化したHis−Select Nickel Affinity Gel(SIGMA社)を充填したカラムに(2)で得た可溶性画分を通過させて融合蛋白質を吸着させ、平衡化緩衝液で洗浄した後に、200mM イミダゾールを含む100mM KClを含む10mM MOPS緩衝液で溶出することにより融合蛋白質の精製品を得た。
【0039】
実施例3 カルシウム存在下での融合蛋白質の親和性
(1)実施例2で調製した融合蛋白質溶液を10mM EGTAおよび100mM KClを含む10mM MOPS緩衝液に対して1時間透析し、さらに2.5mM EGTAおよび100mM KClを含む10mM MOPS緩衝液に対して1時間、100mM KClを含む10mM MOPS緩衝液に対して1時間、次いで同緩衝液に対して終夜の透析を行ない、60.0μg/mLの融合蛋白質溶液を調製した。
(2)(1)の溶液200μLを96穴タイタープレートのウェルにアプライし、37℃で1.5時間保温して固相化した。
(3)(2)のウェルを0.01% Tween20と100mM KClを含む10mM MOPS緩衝液で3回洗浄し、ついでBlock Ace(DSファーマバイオメディカル社)300μLをアプライし、37℃で1時間ブロッキングを行った。
(4)リゾチームを終濃度200μg/Lになるように10mM CaCl2および100mM KClを含む10mM MOPS緩衝液に溶解した。
(5)(3)のウェルを0.01% Tween20と100mM KClを含む10mM MOPS緩衝液で3回洗浄したのち、(4)のリゾチーム溶液200μLを加え、37℃で1.5時間保温し、固相の融合蛋白質にリゾチームを結合させた。
(6)0.01%Tween20と100mM KClを含む10mM MOPS緩衝液で3回洗浄したのち、市販のHRP標識anti−lysozyme polyclonal antibody(GeneTex社)を10000倍希釈して加え、37℃で1.5時間保温し、固相のリゾチームに結合させた。
(7)0.01% Tween20と100mM KClを含む10mM MOPS緩衝液で2回、100mM KClを含む10mM MOPS緩衝液で1回洗浄したのち、TMB基質溶液(KPL社)100μLを加えて1分間反応させた。
(8)1M硫酸を100μL加えて反応を停止させ、450nmの吸光度を測定した。この際の吸光度は0.25だった。結果を図3に示した。
【0040】
実施例4 カルシウム非存在下での融合蛋白質の親和性
実施例3に示す工程のうち、(4)においてCaCl2を含まない緩衝液を用いたことを除き、同様の操作を行なったところ、(8)における吸光度は1.25だった(図3)。本結果よりカルシウムの非存在下において本発明の融合蛋白質は、10mMのカルシウム存在下より多量のリゾチームを結合することを示す。すなわち本発明の融合蛋白質のリゾチームとの親和性は10mMのカルシウムを添加することで大きく低下することが確認された。
【0041】
比較例1 ブランク試験
実施例3に示す工程のうち、(5)においてリゾチーム溶液の代わりに100mM KClを含む10mM MOPS緩衝液を用いたことを除いて同様の操作を行なったところ、(8)における吸光度は0.1だった。(図3)
【0042】
また、同工程のうち(2)において(1)の融合蛋白質溶液の代わりに100mM KClを含む10mM MOPS緩衝液を用いたことを除いて同様の操作を行なったところ、(8)における吸光度は0.02だった。(図3)
本結果は実施例3および実施例4における吸光度は本融合蛋白質とリゾチームの結合によるものであり、非特異的反応によるものではないことが確認された。
【0043】
実施例5 カルシウム濃度依存性
実施例3における工程(4)において、緩衝液のカルシウム濃度を0、10、100、1000または10000μMとした他、同様の操作を行なった。その結果、(8)における吸光度はカルシウム濃度0μMでは1.15だったのに対し、10μMでは0.35に低下し、さらにそれ以上の濃度では濃度依存的に吸光度が低下することが確認された。この結果を図4に示した。この結果から本融合蛋白質はカルシウム濃度0μMでリゾチームに対して高い親和性を示すが、10μM以下のカルシウムを添加することで大きく低下することが確認された。
【特許請求の範囲】
【請求項1】
一般式、X−Y−Zで示される融合蛋白質であって、X及びZが抗体のVH領域またはVL領域を含むペプチド断片であり、ただし、XがVH領域である場合にZがVL領域であり、XがVL領域である場合にZがVH領域であり、Yが低分子量化合物との結合により当該低分子化合物の非存在下とは異なる立体構造をとるペプチド断片であり、前記低分子化合物の結合により、XとZにより形成される抗体に対する特異的抗原との親和性が増強または低下する融合蛋白質。
【請求項2】
前記Yが一般式Y1−Y2で示される融合蛋白質であり、Y1がカルモジュリンであり、Y2がカルモジュリン結合ペプチドであり、特定の低分子化合物がカルシウムイオンである請求項1に記載の融合蛋白質。
【請求項3】
前記Y2がミオシン軽鎖キナーゼの部分構造である請求項2に記載の融合蛋白質。
【請求項4】
前記Y2がミオシン軽鎖キナーゼのカルシウム結合ドメイン由来のペプチドM13である請求項2または3に記載の融合蛋白質。
【請求項5】
前記Y1とY2がGly−Glyリンカーで結合された請求項2から4のいずれか一項に記載の融合蛋白質。
【請求項6】
前記Xが抗体のVH領域を含むペプチド断片であり、Zが抗体VL領域を含むペプチド断片である請求項1から5のいずれか一項に記載の融合蛋白質。
【請求項7】
前記VH領域が配列番号6に示されるアミノ酸配列、または当該アミノ酸配列において1若しくは数個のアミノ酸が置換、欠失若しくは付加されたアミノ酸配列からなり、前記VL領域が配列番号9に示されるアミノ酸配列、または当該アミノ酸配列において1若しくは数個のアミノ酸が置換、欠失若しくは付加されたアミノ酸配列からなり、抗リゾチーム抗体の結合能を有する、請求項1から6のいずれか一項に記載の融合蛋白質。
【請求項8】
前記リゾチーム結合能が、1μM以上のカルシウムイオンを添加することによりカルシウム非存在下より低下する、請求項7に記載の融合蛋白質。
【請求項1】
一般式、X−Y−Zで示される融合蛋白質であって、X及びZが抗体のVH領域またはVL領域を含むペプチド断片であり、ただし、XがVH領域である場合にZがVL領域であり、XがVL領域である場合にZがVH領域であり、Yが低分子量化合物との結合により当該低分子化合物の非存在下とは異なる立体構造をとるペプチド断片であり、前記低分子化合物の結合により、XとZにより形成される抗体に対する特異的抗原との親和性が増強または低下する融合蛋白質。
【請求項2】
前記Yが一般式Y1−Y2で示される融合蛋白質であり、Y1がカルモジュリンであり、Y2がカルモジュリン結合ペプチドであり、特定の低分子化合物がカルシウムイオンである請求項1に記載の融合蛋白質。
【請求項3】
前記Y2がミオシン軽鎖キナーゼの部分構造である請求項2に記載の融合蛋白質。
【請求項4】
前記Y2がミオシン軽鎖キナーゼのカルシウム結合ドメイン由来のペプチドM13である請求項2または3に記載の融合蛋白質。
【請求項5】
前記Y1とY2がGly−Glyリンカーで結合された請求項2から4のいずれか一項に記載の融合蛋白質。
【請求項6】
前記Xが抗体のVH領域を含むペプチド断片であり、Zが抗体VL領域を含むペプチド断片である請求項1から5のいずれか一項に記載の融合蛋白質。
【請求項7】
前記VH領域が配列番号6に示されるアミノ酸配列、または当該アミノ酸配列において1若しくは数個のアミノ酸が置換、欠失若しくは付加されたアミノ酸配列からなり、前記VL領域が配列番号9に示されるアミノ酸配列、または当該アミノ酸配列において1若しくは数個のアミノ酸が置換、欠失若しくは付加されたアミノ酸配列からなり、抗リゾチーム抗体の結合能を有する、請求項1から6のいずれか一項に記載の融合蛋白質。
【請求項8】
前記リゾチーム結合能が、1μM以上のカルシウムイオンを添加することによりカルシウム非存在下より低下する、請求項7に記載の融合蛋白質。
【図1】


【図2】


【図3】


【図4】




【図2】


【図3】


【図4】


【公開番号】特開2011−184418(P2011−184418A)
【公開日】平成23年9月22日(2011.9.22)
【国際特許分類】
【出願番号】特願2010−54576(P2010−54576)
【出願日】平成22年3月11日(2010.3.11)
【出願人】(304021417)国立大学法人東京工業大学 (1,821)
【出願人】(000003300)東ソー株式会社 (1,901)
【Fターム(参考)】
【公開日】平成23年9月22日(2011.9.22)
【国際特許分類】
【出願日】平成22年3月11日(2010.3.11)
【出願人】(304021417)国立大学法人東京工業大学 (1,821)
【出願人】(000003300)東ソー株式会社 (1,901)
【Fターム(参考)】
[ Back to top ]

