親水性多孔質膜及びその製造方法、並びに、医療用癒着防止膜及び細胞増殖用基材
【課題】生分解性を有するとともに濡れ表面に対する密着性に優れた親水性多孔質膜を提供する。
【解決手段】ポリ乳酸とポリカプロラクトンとのマルチブロック共重合体を含んでなり、アルカリ加水分解処理されたことによる空隙を有する、親水性多孔質膜、或いは、ポリ乳酸とポリカプロラクトンとのマルチブロック共重合体を含んでなり、膜表面から膜裏面にかけて連通する空隙を有する、親水性多孔質膜とする。
【解決手段】ポリ乳酸とポリカプロラクトンとのマルチブロック共重合体を含んでなり、アルカリ加水分解処理されたことによる空隙を有する、親水性多孔質膜、或いは、ポリ乳酸とポリカプロラクトンとのマルチブロック共重合体を含んでなり、膜表面から膜裏面にかけて連通する空隙を有する、親水性多孔質膜とする。
【発明の詳細な説明】
【技術分野】
【0001】
本発明は、医療分野等において好適に利用可能な親水性多孔質膜に関する。
【背景技術】
【0002】
ポリ乳酸等に代表される生分解性高分子は、止血用材料、接着・癒着防止用材料、再生工学用材料等の医療分野への応用が期待されている。
【0003】
しかしながら、ポリ乳酸自体は硬い材料であり、そのままでは医療分野への応用が制限される。医療分野に広く応用可能な材料とするためには、例えば、ポリ乳酸をその他の高分子との共重合体とするとよい。具体的には、ポリ乳酸とポリグリコール酸との共重合体が、抜糸不要な手術用の糸として実用化されている。或いは、特許文献1に開示されているように、ポリ乳酸とポリカプロラクトンとのマルチブロック共重合体は、優れた機械的性質等を有し、医療用マトリックス及び傷被覆材等の医療用素材として好適な素材である。
【先行技術文献】
【特許文献】
【0004】
【特許文献1】特許第3526856号
【発明の概要】
【発明が解決しようとする課題】
【0005】
しかしながら、本発明者らが鋭意研究を進めたところ、ポリ乳酸とポリカプロラクトンとのマルチブロック共重合体自体は疎水性であり,そのままでは医療用用途に向いておらず、また、これに鑑みてマルチブロック共重合体の成形体(膜など)の表面を親水化したとしても、単に親水化しただけでは,実験動物(ラット)体内で成形体が容易にズレ動いてしまうことを知見した。すなわち、濡れ表面に対する密着性が十分ではなかった。例えば、当該マルチブロック共重合体を癒着防止膜として生体内の患部に設置したとしても、時間の経過とともに当該癒着防止膜が患部からズレ動き、患部が癒着してしまうことを知見した。また、特許文献1に開示された方法にあっては、ポリ乳酸とポリカプロラクトンとのマルチブロック共重合体を再現性よく合成することが困難であることも併せて知見した。
【0006】
そこで本発明は、生分解性を有するとともに濡れ表面に対する密着性に優れた親水性多孔質膜を提供することを課題とする。
【課題を解決するための手段】
【0007】
本発明者らが鋭意研究したところ、以下の知見を得た。
(1)ポリ乳酸とポリカプロラクトンとのマルチブロック共重合体を成膜し、当該膜をアルカリ加水分解に供した場合、膜に対して、表面から裏面に連通する空隙を生じさせることができる。すなわち、多孔質な膜とすることができる。
(2)アルカリ加水分解により形成された空隙は、その内部壁表面も親水化されたものとなる。すなわち、表面から裏面に連通する空隙によって、膜の表面だけでなく内部まで親水化することができる。このような膜は水を浸み込ませることができる。また、膜の表面から裏面にかけて空隙を連通させることにより、表面から裏面にかけて水を透過させることができる。
(3)内部まで親水化された多孔質膜は、濡れ表面に対する密着性に優れる。すなわち、生体内において患部表面に物理的に密着し、容易にズレ動くことがない。
(4)ポリ乳酸とポリカプロラクトンとのマルチブロック共重合体から作製された多孔質膜は、生体内において容易に分解される。
(5)ポリ乳酸とポリカプロラクトンとのマルチブロック共重合体から作製された多孔質膜上では細胞培養が可能で、細胞は膜の内部まで入り込む。
(6)ポリ乳酸とポリカプロラクトンとのマルチブロック共重合体を効率的に生成させるには、まず、ポリ乳酸とポリカプロラクトンとのジブロック共重合体(オリゴマー)を合成し、その後、当該ジブロック共重合体を自己重合によりマルチブロック共重合体とするとよい。
【0008】
本発明は上記知見に基づいてなされたものである。すなわち、
第1の本発明は、ポリ乳酸とポリカプロラクトンとのマルチブロック共重合体を含んでなり、アルカリ加水分解処理されたことによる空隙を有する、親水性多孔質膜である。
【0009】
第1の本発明において、膜の厚みが5μm以上100μm以下であることが好ましい。これより薄い膜では膜強度が十分でなく、単独での使用が困難となる。ただし、本発明による膜を重ねて使用することは可能であり、数枚重ねることで100〜1000μm、或いはそれ以上の厚みの膜にすることができる。
【0010】
第2の本発明は、ポリ乳酸とポリカプロラクトンとのマルチブロック共重合体を含んでなり、膜表面から膜裏面にかけて連通する空隙を有する、親水性多孔質膜である。
【0011】
第2の本発明において、アルカリ加水分解処理されたことにより上記の空隙を有するものであることが好ましい。このような膜において特に、膜表面に水滴を加えた場合に当該水滴が膜に浸み込んでいく現象が顕著に観察される。
アルカリ加水分解処理によって「膜表面から膜裏面にかけて連通する空隙」を生じさせるためには、例えば、水との接触角20〜30°と表面が親水化された膜に対して、さらにアルカリ加水分解処理を施すことにより、膜表面から膜裏面まで空隙を連通させることができる。
【0012】
膜表面から膜裏面にかけて空隙が連通しているかどうかは、膜の断面を電子顕微鏡などで観察することで判断することができる。或いは、膜表面に水滴をのせ、これが浸み込んでいくかどうかを確認することによっても、簡易的に判断できる。
【0013】
第2の本発明において、膜の厚みが5μm以上100μm以下であることが好ましい。これより薄い膜では膜強度が十分でなく、単独での使用が困難となる。ただし、本発明による膜を重ねて使用することは可能であり、数枚重ねることで100〜1000μm、或いはそれ以上の厚みの膜にすることができる。
【0014】
第3の本発明は、第1の本発明又は第2の本発明に係る親水性多孔質膜を用いてなる医療用癒着防止膜である。
【0015】
第4の本発明は、第1の本発明又は第2の本発明に係る親水性多孔質膜を用いてなる細胞増殖用基材である。
【0016】
第5の本発明は、ポリ乳酸とポリカプロラクトンとのマルチブロック共重合体を得る工程と、得られたマルチブロック共重合体を膜状に成形する工程と、成形した膜に対してアルカリ加水分解処理することにより当該膜に空隙を生じさせる工程とを備える親水性多孔質膜の製造方法である。
【0017】
第5の本発明において、pH12 以上のアルカリによりアルカリ加水分解処理をすることが好ましい。
【0018】
第5の本発明において、膜の厚みが5μm以上100μm以下であることが好ましい。
【0019】
第5の本発明において、アルカリ加水分解処理が、膜の表面から裏面にかけて空隙が連通するまでの間行われることが好ましい。
【0020】
第5の本発明に係るマルチブロック共重合体を得る工程において、ポリ乳酸とポリカプロラクトンとのジブロック共重合体を合成し、当該ジブロック共重合体を後重合に供することによりマルチブロック共重合体を得るものとするとよい。
【0021】
本発明において、「親水性多孔質膜」とは、膜表面から膜裏面にかけて水が浸透・透過し得る膜であることを意味する。親油性多孔質膜である場合は、仮に多孔質膜であったとしても、膜表面に水が止まり、膜表面から膜裏面にかけて水が浸透・透過し得るものとはならない。
尚、ポリ乳酸−ポリカプロラクトンマルチブロック共重合体からなる成形体は、親水化処理をしない場合にあっては水に対する接触角が70°程度となる表面を有するところ、アルカリ加水分解処理によって表面が親水化されるため、水に対する接触角が40°以下、好ましくは30°以下、より好ましくは25°以下となる表面を有するものとなる。この状態からさらに加水分解処理を進め、適切な時間で処理をやめると、膜表面から膜裏面にかけて連通する空隙を形成でき、水が浸透する親水性多孔質膜となる。尚、長時間処理すると水の透過性は向上するが、長すぎると膜の強度が低下する。膜表面の水に対する接触角を所望範囲とする方法は上記に限定されず、例えばオゾン処理などで親水化してもよい。
【発明の効果】
【0022】
本発明によれば、ポリ乳酸とポリカプロラクトンとのマルチブロック共重合体を用いて、表面から裏面にかけて水が吸収・透過可能な親水性多孔質膜が得られる。当該親水性多孔質膜は、生分解性を有するとともに濡れ表面に対する密着性に優れる。例えば、生体内でズレ動くことがなく、所定の位置に長期間保持可能で、且つ、生体内で適切に分解される。
【図面の簡単な説明】
【0023】
【図1】ポリ乳酸−ポリカプロラクトンマルチブロック共重合体の合成経路について説明するための図である。
【図2】実施例にて使用した評価膜の表面状態を示すSEM画像図である。
【図3】親水性多孔質膜をラットの肝臓の患部表面に設置した場合において、6日経過後の状態を示す写真図である。
【図4】(A)が親水性多孔質膜上で細胞培養を行った後の細胞の状態のみを示した写真図、(B)が膜と細胞との双方の状態を示した合成写真図である。
【発明を実施するための形態】
【0024】
<親水性多孔質膜>
(1.第1実施形態)
第1実施形態に係る本発明の親水性多孔質膜は、ポリ乳酸とポリカプロラクトンとのマルチブロック共重合体を含んでなり、アルカリ加水分解処理されたことによる空隙を有する、親水性多孔質膜である。
【0025】
(1.1.ポリ乳酸とポリカプロラクトンとのマルチブロック共重合体)
本発明において、ポリ乳酸とポリカプロラクトンとのマルチブロック共重合体としては、例えば、下記一般式(1)で示されるマルチブロック共重合体を用いることができる。尚、ポリ乳酸とは、ポリ−L−乳酸、ポリ−D−乳酸、ポリ−DL−乳酸のいずれであってもよいが、医療用途への応用を考えた場合、特に、ポリ−L−乳酸が好ましい。
【0026】
【化1】

【0027】
上記一般式(1)において、mは5〜100、好ましくは10〜50、より好ましくは15〜30の整数、nは5〜100、好ましくは10〜50、より好ましくは15〜30の整数、xは2〜500、好ましくは5〜200、より好ましくは10〜100の整数である。
【0028】
上記のマルチブロック共重合体は、例えば図1に示すように、一端に保護基(ベンジル基等)を有するポリカプロラクトン(PCL)の他端に、触媒存在下、乳酸(ラクチド)(LA)を重合して、ポリ乳酸(PLA)−ポリカプロラクトンジブロック共重合体(オリゴマー)を合成し、脱保護の後、自己重縮合させることにより容易に得ることができる。
尚、特許第3526856号に開示された方法よりも、上記の方法のほうが再現性が高く簡便でな方法である。ポリ乳酸セグメント長(n)、ポリカプロラクトンセグメント長(m)がそれぞれ容易に制御可能である。
【0029】
尚、上記したマルチブロック共重合体はあくまでも例示であり、上記形態に限定されるものではない。例えば、末端のOHやHを他の官能基に置換することができ、或いは、上記したマルチブロック共重合体に連なるように、他の種類のモノマーが重合していてもよい。すなわち、本発明においては、ポリ乳酸ブロックとポリカプロラクトンブロックとがマルチに連なった構造を一部にでも有していれば、下記のようなアルカリ加水分解による空隙形成が可能である。
【0030】
(1.2.マルチブロック共重合体の成膜)
本発明において、上記のようにして得られたマルチブロック共重合体は、種々の方法により成膜される。例えば、上記マルチブロック共重合体をクロロホルム等の溶媒に溶解させた後、ガラス等の基材上にキャストして乾燥させることで、基材上にマルチブロック共重合体の薄膜を形成することができる。この場合に得られる薄膜の厚みは5μm〜100μm、好ましくは10μm〜50μmである。或いは、上記のキャスト法のほか、マルチブロック共重合体を溶融し、押出成形やプレス成形等を行うことによって薄膜を得ることもできる。
【0031】
(1.3.薄膜のアルカリ加水分解処理)
第1実施形態に係る本発明において、上記のようにして得られた薄膜は、アルカリ加水分解処理に供され、親水化される。ここで、本発明者らは、アルカリ加水分解処理の条件によって、水が浸み込む薄膜が得られることを知見した。すなわち、アルカリ加水分解処理によって薄膜に空隙を生じさせることができ、時間の経過とともに当該空隙が薄膜の表面から裏面まで連通する。このことにより、薄膜の表面から内部まで親水化することができる。このような現象は、ポリ乳酸のみからなる薄膜においては確認されず、上記のマルチブロック共重合体を用いた場合に見られる特有の現象である。
【0032】
アルカリ加水分解処理に用いるアルカリとしては、pHが好ましくは12以上、より好ましくは13以上のものを用いる。pHが低過ぎると、薄膜のアルカリ加水分解が進行せず、所望の空隙を得ることができない。用いるアルカリの種類については上記のpHを実現できるものであれば特に限定されるものではなく、水酸化ナトリウム、水酸化カリウム、水酸化カルシウム等を用いることができる。
【0033】
アルカリ加水分解処理の処理時間については、得られた薄膜の厚みによって調整することができる。例えば、20μm程度の薄膜が得られた場合は、1M水酸化ナトリウム水溶液中に24時間程度浸漬すれば、表面から裏面にかけて連通する空隙を有する親水性多孔質膜を得ることができる。
【0034】
このように、アルカリ加水分解処理により薄膜は親水性多孔質膜とされる。得られる親水性多孔質膜が膜表面から膜裏面にかけて連通する空隙を有するか否かについては、上記のpHやアルカリ加水分解処理時間によって判断できるほか、膜の断面の状態を電子顕微鏡などで観察することで直接判断することもできる。或いは、空隙が連通しているかどうかは、膜表面に水滴をのせ、これが浸み込んでいくかどうかを観察することによっても、簡易的に判断できる。
【0035】
尚、「親水性多孔質膜」とは、膜表面から膜裏面にかけて水が浸透し得る膜、或いは水が透過し得る膜であることを意味する。仮に多孔質膜であったとしても、親油性多孔質膜である場合は、膜表面に水が止まり、膜表面から膜裏面にかけて水が浸透・透過し得るものとはならない。特に、ポリ乳酸−ポリカプロラクトンマルチブロック共重合体をアルカリ加水分解処理することにより、その表面は親水化され、水に対する接触角が40°以下、好ましくは30°以下、より好ましくは25°以下となる表面を有するものとなり、さらには空隙を有することで水が浸透し得る膜となる。参考までに、親水化処理していないポリ乳酸−ポリカプロラクトンマルチブロック共重合体の表面においては、水に対する接触角が70°程度となる。
【0036】
(2.第2実施形態)
第2実施形態に係る本発明の親水性多孔質膜は、ポリ乳酸とポリカプロラクトンとのマルチブロック共重合体を含んでなり、膜表面から膜裏面にかけて連通する空隙を有する、親水性多孔質膜である。
【0037】
上述の第1実施形態と、本第2実施形態とでは、親水性多孔質膜であること、ポリ乳酸とポリカプロラクトンとのマルチブロック共重合体を含んでなること、空隙を有することにおいて共通している。しかしながら、第2実施形態に係る親水性多孔質膜においては、空隙をアルカリ加水分解処理に依らずに形成しても良い趣旨である。すなわち、マルチブロック共重合体の薄膜を得た後、空隙を形成し、その後、当該空隙を有する薄膜に対してアルカリ加水分解等の親水化処理を施すことによっても本発明に係る親水性多孔質膜を得ることができる。或いは、空隙を形成するための鋳型を含ませつつ薄膜を形成し、当該鋳型を除去することによって空隙を有する多孔質膜を得て、その後、当該多孔質膜に対してアルカリ加水分解等の親水化処理を施す形態であってもよい。
ただし、第1実施形態に記載したように、アルカリ加水分解処理によれば、ポリ乳酸−ポリカプロラクトンマルチブロック共重合体の親水化処理と空隙の形成とを同時に行うことができるため、簡便で好ましい。
【0038】
このように本発明に係る親水性多孔質膜は、ポリ乳酸−ポリカプロラクトンマルチブロック共重合体を含んでなるため、優れた機械的強度を有するとともに、柔軟性を有し、且つ、生分解性に優れている。また、表面だけでなく内部まで親水化された多孔質膜であるため、濡れ表面に対する密着性が高い。すなわち、生体内でズレ動くことがなく、所定の位置に長期間保持可能で、且つ、生体内で適切に分解される。
【0039】
<医療用癒着防止膜>
上述の通り、本発明に係る親水性多孔質膜は、生体内でズレ動くことがなく、所定の位置に長期間保持可能で、且つ、生体内で適切に分解される。そのため、生体内において傷付いた臓器の癒着等を防ぐための癒着防止膜として好適に利用することができる。
【0040】
癒着防止膜として用いる場合、親水性多孔質膜を複数積層したものを用いてもよい。すなわち、複層とすることによって親水性多孔質膜の厚みを厚くすることができ、これにより、生体内において膜が完全に生分解するまでの時間を適宜調整することができる。
【0041】
<細胞増殖用基材>
本発明に係る親水性多孔質膜は、その特性を利用して細胞増殖用の基材として用いることもできる。すなわち、本発明に係る親水性多孔質膜は内部まで親水化されており、膜表面だけでなく、内部にまで細胞のアシが伸びて細胞増殖を進行させることができる。また、上述の通り、生分解性であるため生体に対して用いることも容易である。さらに、十分な透水性をもっているため、多層化した細胞培養が可能となる。例えば、親水性多孔質膜において培養した細胞(人工皮膚等)をそのまま生体に移植可能となる。
【0042】
<親水性多孔質膜の製造方法>
本発明に係る親水性多孔質膜(特に、第1実施形態に係る本発明の親水性多孔質膜)は、ポリ乳酸とポリカプロラクトンとのマルチブロック共重合体を得る工程と、得られたマルチブロック共重合体を膜状に成形する工程と、成形した膜に対してアルカリ加水分解処理することにより当該膜に空隙を生じさせる工程とによって容易に製造することができる。各工程の詳細については上述した通りであり、ここでは説明を省略する。
【実施例】
【0043】
以下、実施例により、本発明に係る親水性多孔質膜についてさらに詳述するが、本発明は以下の実施例に記載された具体的な形態に限定されるものではない。
【0044】
<癒着防止膜への適用実験>
(1.評価膜の作成)
(実施例)
ポリ乳酸−ポリカプロラクトンマルチブロック共重合体をクロロホルムに0.03〜0.04g/mLの濃度で溶解し、ガラス板にキャストした。キャスト後、室温、大気圧下で2時間乾燥させた後、さらに室温、真空下で12時間乾燥させた。その後、水に浸けて薄膜をガラス板から剥がし、50℃、真空下で2時間乾燥した。得られた薄膜の膜厚は16〜26μmであった。当該薄膜を1Mの水酸化ナトリウム水溶液に24時間浸漬し、実施例に係る評価膜を作成した。
【0045】
(参考例)
薄膜を1Mの水酸化ナトリウム水溶液に12時間浸漬した以外は実施例と同様にして、参考例に係る評価膜を作成した。
【0046】
(比較例)
マルチブロック共重合体を用いず、ポリ乳酸を用いた以外は実施例と同様にして、比較例に係る評価膜を作成した。
【0047】
(2.膜の評価)
(2.1.SEM観察結果)
図2(A)に実施例に係る評価膜の表面状態を示すSEM画像図を、図2(B)に参考例に係る評価膜の表面状態を示すSEM画像図をそれぞれ示す。図2から明らかなように、実施例に係る評価膜は、表面に口径10μm程度の空隙が不均一に複数形成されていた。一方、参考例に係る評価膜では、膜表面に小さな空孔が形成されていた。尚、比較例に係る膜については空隙・空孔が確認できなかった。すなわち、アルカリ加水分解処理による空隙の形成については、マルチブロック共重合体特有の現象であることが分かった。以下、実施例、参考例に係る評価膜について、親水性評価等を行った。
【0048】
(2.2.親水性評価)
実施例に係る評価膜、参考例に係る評価膜それぞれについて、水を滴下して接触角を測定し親水性評価を行ったところ、実施例に係る評価膜にあっては、滴下した水が膜内部にまで浸透し、接触角を図ることができなかった。一方で、参考例に係る評価膜にあっては、滴下した水が表面に留まり、その接触角は25°であった。参考までに、アルカリ加水分解していないポリ乳酸−ポリカプロラクトンマルチブロック共重合体の薄膜表面について、水に対する接触角を測定したところ、70°であった。
【0049】
(2.3.癒着防止膜としての性能評価)
実施例に係る評価膜、参考例に係る評価膜をそれぞれ20×20mmに切り取り、ガス滅菌し、ラットの腹腔内の肝臓患部表面に密着させるように設置した。本実験では、1体のラットの肝臓に対して、実施例に係る評価膜、参考例に係る評価膜をそれぞれ別々の箇所に設置した。一定期間後、ラットの腹部を再開腹し、癒着の状態を観察した。その後、肝臓を摘出し、肝臓表面の組織状態について、顕微鏡を用いて観察した。結果を下記表1及び図3に示す。
【0050】
【表1】

【0051】
表1に示したように、参考例に係る評価膜を癒着防止膜として用いた場合、生体内において所定の位置に止めることが困難であり、6日後に再開腹して観察すると、すべての膜が元の位置からズレていた。一部については患部から完全に外れるまでズレており、強い癒着が確認された。また、評価膜の分解はほとんど確認できなかった。一方、実施例に係る評価膜を癒着防止膜として用いた場合、6日後であっても元の位置からズレることなく密着していた。尚、一部について癒着が見られたが、当該癒着部分を軽く引っ張ると剥がれる程度の極めて小さなものであった。実施例に係る評価膜にあっては、膜の分解が確認でき、膜は薄く残存するのみであった。
さらに、2週間後、再開腹して状態を観察したところ、参考例に係る評価膜にあっては6日後と同様に膜の分解はほとんど確認できなかった。一方、実施例に係る評価膜にあっては、膜が完全に分解されていた。
【0052】
図3は、実施例に係る評価膜を設置して6日後の肝臓表面の状態を示す観察図である。図3から明らかなように、膜は肝臓表面に密着したまま分解が進行しており、膜の内部にまで細胞の核が入り込んでいた。
【0053】
以上のように、実施例に係る評価膜は、適切に生分解可能であるとともに濡れ表面に対する密着性に優れており、癒着防止膜として好適に利用可能なことが立証された。
【0054】
<細胞増殖用基材としての適用実験>
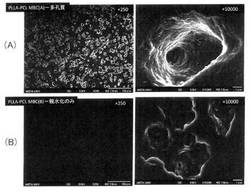
ポリ乳酸−ポリカプロラクトンマルチブロック共重合体薄膜をアルカリ加水分解処理によって親水性多孔質膜とし、得られた親水性多孔質膜の上で細胞(HeLa細胞)の培養を試みた。図4(A)に細胞培養後の膜中の細胞の状態を、図4(B)に細胞と膜との合成写真を示す。図4から明らかなように、細胞は膜の空隙を介して内部にまで入り込んで成長していた。すなわち、本発明に係る親水性多孔質膜は細胞増殖用基材としても適用可能であることがわかった。
【0055】
<アルカリpHと空隙形成との関係>
厚さ30μmのポリ乳酸−ポリカプロラクトンマルチブロック共重合体薄膜を得た。得られた薄膜をpH11〜13の水酸化ナトリウム水溶液に浸漬し、アルカリ加水分解が進行するか否かについて、pHの臨界点を特定した。実験により、アルカリ加水分解が適切に進行し、薄膜に上記の空隙を適切に形成可能なpHは12以上であることがわかった。
【0056】
以上、現時点において、最も実践的であり、且つ、好ましいと思われる実施形態に関連して本発明を説明したが、本発明は、本願明細書中に開示された実施形態に限定されるものではなく、特許請求の範囲及び明細書全体から読み取れる発明の要旨あるいは思想に反しない範囲で適宜変更可能であり、そのような変更を伴う親水性多孔質膜及びその製造方法、医療用癒着防止膜、細胞増殖用基材もまた本発明の技術範囲に包含されるものとして理解されなければならない。
【産業上の利用可能性】
【0057】
本発明に係る親水性多孔質膜は、生分解性を有するとともに濡れ表面に対する密着性に優れる。例えば、生体内でズレ動くことがなく、所定の位置に長期間保持可能で、且つ、生体内で適切に分解される。このような特性から、癒着防止膜や細胞増殖用基材等、医療分野において広く利用可能である。
【技術分野】
【0001】
本発明は、医療分野等において好適に利用可能な親水性多孔質膜に関する。
【背景技術】
【0002】
ポリ乳酸等に代表される生分解性高分子は、止血用材料、接着・癒着防止用材料、再生工学用材料等の医療分野への応用が期待されている。
【0003】
しかしながら、ポリ乳酸自体は硬い材料であり、そのままでは医療分野への応用が制限される。医療分野に広く応用可能な材料とするためには、例えば、ポリ乳酸をその他の高分子との共重合体とするとよい。具体的には、ポリ乳酸とポリグリコール酸との共重合体が、抜糸不要な手術用の糸として実用化されている。或いは、特許文献1に開示されているように、ポリ乳酸とポリカプロラクトンとのマルチブロック共重合体は、優れた機械的性質等を有し、医療用マトリックス及び傷被覆材等の医療用素材として好適な素材である。
【先行技術文献】
【特許文献】
【0004】
【特許文献1】特許第3526856号
【発明の概要】
【発明が解決しようとする課題】
【0005】
しかしながら、本発明者らが鋭意研究を進めたところ、ポリ乳酸とポリカプロラクトンとのマルチブロック共重合体自体は疎水性であり,そのままでは医療用用途に向いておらず、また、これに鑑みてマルチブロック共重合体の成形体(膜など)の表面を親水化したとしても、単に親水化しただけでは,実験動物(ラット)体内で成形体が容易にズレ動いてしまうことを知見した。すなわち、濡れ表面に対する密着性が十分ではなかった。例えば、当該マルチブロック共重合体を癒着防止膜として生体内の患部に設置したとしても、時間の経過とともに当該癒着防止膜が患部からズレ動き、患部が癒着してしまうことを知見した。また、特許文献1に開示された方法にあっては、ポリ乳酸とポリカプロラクトンとのマルチブロック共重合体を再現性よく合成することが困難であることも併せて知見した。
【0006】
そこで本発明は、生分解性を有するとともに濡れ表面に対する密着性に優れた親水性多孔質膜を提供することを課題とする。
【課題を解決するための手段】
【0007】
本発明者らが鋭意研究したところ、以下の知見を得た。
(1)ポリ乳酸とポリカプロラクトンとのマルチブロック共重合体を成膜し、当該膜をアルカリ加水分解に供した場合、膜に対して、表面から裏面に連通する空隙を生じさせることができる。すなわち、多孔質な膜とすることができる。
(2)アルカリ加水分解により形成された空隙は、その内部壁表面も親水化されたものとなる。すなわち、表面から裏面に連通する空隙によって、膜の表面だけでなく内部まで親水化することができる。このような膜は水を浸み込ませることができる。また、膜の表面から裏面にかけて空隙を連通させることにより、表面から裏面にかけて水を透過させることができる。
(3)内部まで親水化された多孔質膜は、濡れ表面に対する密着性に優れる。すなわち、生体内において患部表面に物理的に密着し、容易にズレ動くことがない。
(4)ポリ乳酸とポリカプロラクトンとのマルチブロック共重合体から作製された多孔質膜は、生体内において容易に分解される。
(5)ポリ乳酸とポリカプロラクトンとのマルチブロック共重合体から作製された多孔質膜上では細胞培養が可能で、細胞は膜の内部まで入り込む。
(6)ポリ乳酸とポリカプロラクトンとのマルチブロック共重合体を効率的に生成させるには、まず、ポリ乳酸とポリカプロラクトンとのジブロック共重合体(オリゴマー)を合成し、その後、当該ジブロック共重合体を自己重合によりマルチブロック共重合体とするとよい。
【0008】
本発明は上記知見に基づいてなされたものである。すなわち、
第1の本発明は、ポリ乳酸とポリカプロラクトンとのマルチブロック共重合体を含んでなり、アルカリ加水分解処理されたことによる空隙を有する、親水性多孔質膜である。
【0009】
第1の本発明において、膜の厚みが5μm以上100μm以下であることが好ましい。これより薄い膜では膜強度が十分でなく、単独での使用が困難となる。ただし、本発明による膜を重ねて使用することは可能であり、数枚重ねることで100〜1000μm、或いはそれ以上の厚みの膜にすることができる。
【0010】
第2の本発明は、ポリ乳酸とポリカプロラクトンとのマルチブロック共重合体を含んでなり、膜表面から膜裏面にかけて連通する空隙を有する、親水性多孔質膜である。
【0011】
第2の本発明において、アルカリ加水分解処理されたことにより上記の空隙を有するものであることが好ましい。このような膜において特に、膜表面に水滴を加えた場合に当該水滴が膜に浸み込んでいく現象が顕著に観察される。
アルカリ加水分解処理によって「膜表面から膜裏面にかけて連通する空隙」を生じさせるためには、例えば、水との接触角20〜30°と表面が親水化された膜に対して、さらにアルカリ加水分解処理を施すことにより、膜表面から膜裏面まで空隙を連通させることができる。
【0012】
膜表面から膜裏面にかけて空隙が連通しているかどうかは、膜の断面を電子顕微鏡などで観察することで判断することができる。或いは、膜表面に水滴をのせ、これが浸み込んでいくかどうかを確認することによっても、簡易的に判断できる。
【0013】
第2の本発明において、膜の厚みが5μm以上100μm以下であることが好ましい。これより薄い膜では膜強度が十分でなく、単独での使用が困難となる。ただし、本発明による膜を重ねて使用することは可能であり、数枚重ねることで100〜1000μm、或いはそれ以上の厚みの膜にすることができる。
【0014】
第3の本発明は、第1の本発明又は第2の本発明に係る親水性多孔質膜を用いてなる医療用癒着防止膜である。
【0015】
第4の本発明は、第1の本発明又は第2の本発明に係る親水性多孔質膜を用いてなる細胞増殖用基材である。
【0016】
第5の本発明は、ポリ乳酸とポリカプロラクトンとのマルチブロック共重合体を得る工程と、得られたマルチブロック共重合体を膜状に成形する工程と、成形した膜に対してアルカリ加水分解処理することにより当該膜に空隙を生じさせる工程とを備える親水性多孔質膜の製造方法である。
【0017】
第5の本発明において、pH12 以上のアルカリによりアルカリ加水分解処理をすることが好ましい。
【0018】
第5の本発明において、膜の厚みが5μm以上100μm以下であることが好ましい。
【0019】
第5の本発明において、アルカリ加水分解処理が、膜の表面から裏面にかけて空隙が連通するまでの間行われることが好ましい。
【0020】
第5の本発明に係るマルチブロック共重合体を得る工程において、ポリ乳酸とポリカプロラクトンとのジブロック共重合体を合成し、当該ジブロック共重合体を後重合に供することによりマルチブロック共重合体を得るものとするとよい。
【0021】
本発明において、「親水性多孔質膜」とは、膜表面から膜裏面にかけて水が浸透・透過し得る膜であることを意味する。親油性多孔質膜である場合は、仮に多孔質膜であったとしても、膜表面に水が止まり、膜表面から膜裏面にかけて水が浸透・透過し得るものとはならない。
尚、ポリ乳酸−ポリカプロラクトンマルチブロック共重合体からなる成形体は、親水化処理をしない場合にあっては水に対する接触角が70°程度となる表面を有するところ、アルカリ加水分解処理によって表面が親水化されるため、水に対する接触角が40°以下、好ましくは30°以下、より好ましくは25°以下となる表面を有するものとなる。この状態からさらに加水分解処理を進め、適切な時間で処理をやめると、膜表面から膜裏面にかけて連通する空隙を形成でき、水が浸透する親水性多孔質膜となる。尚、長時間処理すると水の透過性は向上するが、長すぎると膜の強度が低下する。膜表面の水に対する接触角を所望範囲とする方法は上記に限定されず、例えばオゾン処理などで親水化してもよい。
【発明の効果】
【0022】
本発明によれば、ポリ乳酸とポリカプロラクトンとのマルチブロック共重合体を用いて、表面から裏面にかけて水が吸収・透過可能な親水性多孔質膜が得られる。当該親水性多孔質膜は、生分解性を有するとともに濡れ表面に対する密着性に優れる。例えば、生体内でズレ動くことがなく、所定の位置に長期間保持可能で、且つ、生体内で適切に分解される。
【図面の簡単な説明】
【0023】
【図1】ポリ乳酸−ポリカプロラクトンマルチブロック共重合体の合成経路について説明するための図である。
【図2】実施例にて使用した評価膜の表面状態を示すSEM画像図である。
【図3】親水性多孔質膜をラットの肝臓の患部表面に設置した場合において、6日経過後の状態を示す写真図である。
【図4】(A)が親水性多孔質膜上で細胞培養を行った後の細胞の状態のみを示した写真図、(B)が膜と細胞との双方の状態を示した合成写真図である。
【発明を実施するための形態】
【0024】
<親水性多孔質膜>
(1.第1実施形態)
第1実施形態に係る本発明の親水性多孔質膜は、ポリ乳酸とポリカプロラクトンとのマルチブロック共重合体を含んでなり、アルカリ加水分解処理されたことによる空隙を有する、親水性多孔質膜である。
【0025】
(1.1.ポリ乳酸とポリカプロラクトンとのマルチブロック共重合体)
本発明において、ポリ乳酸とポリカプロラクトンとのマルチブロック共重合体としては、例えば、下記一般式(1)で示されるマルチブロック共重合体を用いることができる。尚、ポリ乳酸とは、ポリ−L−乳酸、ポリ−D−乳酸、ポリ−DL−乳酸のいずれであってもよいが、医療用途への応用を考えた場合、特に、ポリ−L−乳酸が好ましい。
【0026】
【化1】

【0027】
上記一般式(1)において、mは5〜100、好ましくは10〜50、より好ましくは15〜30の整数、nは5〜100、好ましくは10〜50、より好ましくは15〜30の整数、xは2〜500、好ましくは5〜200、より好ましくは10〜100の整数である。
【0028】
上記のマルチブロック共重合体は、例えば図1に示すように、一端に保護基(ベンジル基等)を有するポリカプロラクトン(PCL)の他端に、触媒存在下、乳酸(ラクチド)(LA)を重合して、ポリ乳酸(PLA)−ポリカプロラクトンジブロック共重合体(オリゴマー)を合成し、脱保護の後、自己重縮合させることにより容易に得ることができる。
尚、特許第3526856号に開示された方法よりも、上記の方法のほうが再現性が高く簡便でな方法である。ポリ乳酸セグメント長(n)、ポリカプロラクトンセグメント長(m)がそれぞれ容易に制御可能である。
【0029】
尚、上記したマルチブロック共重合体はあくまでも例示であり、上記形態に限定されるものではない。例えば、末端のOHやHを他の官能基に置換することができ、或いは、上記したマルチブロック共重合体に連なるように、他の種類のモノマーが重合していてもよい。すなわち、本発明においては、ポリ乳酸ブロックとポリカプロラクトンブロックとがマルチに連なった構造を一部にでも有していれば、下記のようなアルカリ加水分解による空隙形成が可能である。
【0030】
(1.2.マルチブロック共重合体の成膜)
本発明において、上記のようにして得られたマルチブロック共重合体は、種々の方法により成膜される。例えば、上記マルチブロック共重合体をクロロホルム等の溶媒に溶解させた後、ガラス等の基材上にキャストして乾燥させることで、基材上にマルチブロック共重合体の薄膜を形成することができる。この場合に得られる薄膜の厚みは5μm〜100μm、好ましくは10μm〜50μmである。或いは、上記のキャスト法のほか、マルチブロック共重合体を溶融し、押出成形やプレス成形等を行うことによって薄膜を得ることもできる。
【0031】
(1.3.薄膜のアルカリ加水分解処理)
第1実施形態に係る本発明において、上記のようにして得られた薄膜は、アルカリ加水分解処理に供され、親水化される。ここで、本発明者らは、アルカリ加水分解処理の条件によって、水が浸み込む薄膜が得られることを知見した。すなわち、アルカリ加水分解処理によって薄膜に空隙を生じさせることができ、時間の経過とともに当該空隙が薄膜の表面から裏面まで連通する。このことにより、薄膜の表面から内部まで親水化することができる。このような現象は、ポリ乳酸のみからなる薄膜においては確認されず、上記のマルチブロック共重合体を用いた場合に見られる特有の現象である。
【0032】
アルカリ加水分解処理に用いるアルカリとしては、pHが好ましくは12以上、より好ましくは13以上のものを用いる。pHが低過ぎると、薄膜のアルカリ加水分解が進行せず、所望の空隙を得ることができない。用いるアルカリの種類については上記のpHを実現できるものであれば特に限定されるものではなく、水酸化ナトリウム、水酸化カリウム、水酸化カルシウム等を用いることができる。
【0033】
アルカリ加水分解処理の処理時間については、得られた薄膜の厚みによって調整することができる。例えば、20μm程度の薄膜が得られた場合は、1M水酸化ナトリウム水溶液中に24時間程度浸漬すれば、表面から裏面にかけて連通する空隙を有する親水性多孔質膜を得ることができる。
【0034】
このように、アルカリ加水分解処理により薄膜は親水性多孔質膜とされる。得られる親水性多孔質膜が膜表面から膜裏面にかけて連通する空隙を有するか否かについては、上記のpHやアルカリ加水分解処理時間によって判断できるほか、膜の断面の状態を電子顕微鏡などで観察することで直接判断することもできる。或いは、空隙が連通しているかどうかは、膜表面に水滴をのせ、これが浸み込んでいくかどうかを観察することによっても、簡易的に判断できる。
【0035】
尚、「親水性多孔質膜」とは、膜表面から膜裏面にかけて水が浸透し得る膜、或いは水が透過し得る膜であることを意味する。仮に多孔質膜であったとしても、親油性多孔質膜である場合は、膜表面に水が止まり、膜表面から膜裏面にかけて水が浸透・透過し得るものとはならない。特に、ポリ乳酸−ポリカプロラクトンマルチブロック共重合体をアルカリ加水分解処理することにより、その表面は親水化され、水に対する接触角が40°以下、好ましくは30°以下、より好ましくは25°以下となる表面を有するものとなり、さらには空隙を有することで水が浸透し得る膜となる。参考までに、親水化処理していないポリ乳酸−ポリカプロラクトンマルチブロック共重合体の表面においては、水に対する接触角が70°程度となる。
【0036】
(2.第2実施形態)
第2実施形態に係る本発明の親水性多孔質膜は、ポリ乳酸とポリカプロラクトンとのマルチブロック共重合体を含んでなり、膜表面から膜裏面にかけて連通する空隙を有する、親水性多孔質膜である。
【0037】
上述の第1実施形態と、本第2実施形態とでは、親水性多孔質膜であること、ポリ乳酸とポリカプロラクトンとのマルチブロック共重合体を含んでなること、空隙を有することにおいて共通している。しかしながら、第2実施形態に係る親水性多孔質膜においては、空隙をアルカリ加水分解処理に依らずに形成しても良い趣旨である。すなわち、マルチブロック共重合体の薄膜を得た後、空隙を形成し、その後、当該空隙を有する薄膜に対してアルカリ加水分解等の親水化処理を施すことによっても本発明に係る親水性多孔質膜を得ることができる。或いは、空隙を形成するための鋳型を含ませつつ薄膜を形成し、当該鋳型を除去することによって空隙を有する多孔質膜を得て、その後、当該多孔質膜に対してアルカリ加水分解等の親水化処理を施す形態であってもよい。
ただし、第1実施形態に記載したように、アルカリ加水分解処理によれば、ポリ乳酸−ポリカプロラクトンマルチブロック共重合体の親水化処理と空隙の形成とを同時に行うことができるため、簡便で好ましい。
【0038】
このように本発明に係る親水性多孔質膜は、ポリ乳酸−ポリカプロラクトンマルチブロック共重合体を含んでなるため、優れた機械的強度を有するとともに、柔軟性を有し、且つ、生分解性に優れている。また、表面だけでなく内部まで親水化された多孔質膜であるため、濡れ表面に対する密着性が高い。すなわち、生体内でズレ動くことがなく、所定の位置に長期間保持可能で、且つ、生体内で適切に分解される。
【0039】
<医療用癒着防止膜>
上述の通り、本発明に係る親水性多孔質膜は、生体内でズレ動くことがなく、所定の位置に長期間保持可能で、且つ、生体内で適切に分解される。そのため、生体内において傷付いた臓器の癒着等を防ぐための癒着防止膜として好適に利用することができる。
【0040】
癒着防止膜として用いる場合、親水性多孔質膜を複数積層したものを用いてもよい。すなわち、複層とすることによって親水性多孔質膜の厚みを厚くすることができ、これにより、生体内において膜が完全に生分解するまでの時間を適宜調整することができる。
【0041】
<細胞増殖用基材>
本発明に係る親水性多孔質膜は、その特性を利用して細胞増殖用の基材として用いることもできる。すなわち、本発明に係る親水性多孔質膜は内部まで親水化されており、膜表面だけでなく、内部にまで細胞のアシが伸びて細胞増殖を進行させることができる。また、上述の通り、生分解性であるため生体に対して用いることも容易である。さらに、十分な透水性をもっているため、多層化した細胞培養が可能となる。例えば、親水性多孔質膜において培養した細胞(人工皮膚等)をそのまま生体に移植可能となる。
【0042】
<親水性多孔質膜の製造方法>
本発明に係る親水性多孔質膜(特に、第1実施形態に係る本発明の親水性多孔質膜)は、ポリ乳酸とポリカプロラクトンとのマルチブロック共重合体を得る工程と、得られたマルチブロック共重合体を膜状に成形する工程と、成形した膜に対してアルカリ加水分解処理することにより当該膜に空隙を生じさせる工程とによって容易に製造することができる。各工程の詳細については上述した通りであり、ここでは説明を省略する。
【実施例】
【0043】
以下、実施例により、本発明に係る親水性多孔質膜についてさらに詳述するが、本発明は以下の実施例に記載された具体的な形態に限定されるものではない。
【0044】
<癒着防止膜への適用実験>
(1.評価膜の作成)
(実施例)
ポリ乳酸−ポリカプロラクトンマルチブロック共重合体をクロロホルムに0.03〜0.04g/mLの濃度で溶解し、ガラス板にキャストした。キャスト後、室温、大気圧下で2時間乾燥させた後、さらに室温、真空下で12時間乾燥させた。その後、水に浸けて薄膜をガラス板から剥がし、50℃、真空下で2時間乾燥した。得られた薄膜の膜厚は16〜26μmであった。当該薄膜を1Mの水酸化ナトリウム水溶液に24時間浸漬し、実施例に係る評価膜を作成した。
【0045】
(参考例)
薄膜を1Mの水酸化ナトリウム水溶液に12時間浸漬した以外は実施例と同様にして、参考例に係る評価膜を作成した。
【0046】
(比較例)
マルチブロック共重合体を用いず、ポリ乳酸を用いた以外は実施例と同様にして、比較例に係る評価膜を作成した。
【0047】
(2.膜の評価)
(2.1.SEM観察結果)
図2(A)に実施例に係る評価膜の表面状態を示すSEM画像図を、図2(B)に参考例に係る評価膜の表面状態を示すSEM画像図をそれぞれ示す。図2から明らかなように、実施例に係る評価膜は、表面に口径10μm程度の空隙が不均一に複数形成されていた。一方、参考例に係る評価膜では、膜表面に小さな空孔が形成されていた。尚、比較例に係る膜については空隙・空孔が確認できなかった。すなわち、アルカリ加水分解処理による空隙の形成については、マルチブロック共重合体特有の現象であることが分かった。以下、実施例、参考例に係る評価膜について、親水性評価等を行った。
【0048】
(2.2.親水性評価)
実施例に係る評価膜、参考例に係る評価膜それぞれについて、水を滴下して接触角を測定し親水性評価を行ったところ、実施例に係る評価膜にあっては、滴下した水が膜内部にまで浸透し、接触角を図ることができなかった。一方で、参考例に係る評価膜にあっては、滴下した水が表面に留まり、その接触角は25°であった。参考までに、アルカリ加水分解していないポリ乳酸−ポリカプロラクトンマルチブロック共重合体の薄膜表面について、水に対する接触角を測定したところ、70°であった。
【0049】
(2.3.癒着防止膜としての性能評価)
実施例に係る評価膜、参考例に係る評価膜をそれぞれ20×20mmに切り取り、ガス滅菌し、ラットの腹腔内の肝臓患部表面に密着させるように設置した。本実験では、1体のラットの肝臓に対して、実施例に係る評価膜、参考例に係る評価膜をそれぞれ別々の箇所に設置した。一定期間後、ラットの腹部を再開腹し、癒着の状態を観察した。その後、肝臓を摘出し、肝臓表面の組織状態について、顕微鏡を用いて観察した。結果を下記表1及び図3に示す。
【0050】
【表1】

【0051】
表1に示したように、参考例に係る評価膜を癒着防止膜として用いた場合、生体内において所定の位置に止めることが困難であり、6日後に再開腹して観察すると、すべての膜が元の位置からズレていた。一部については患部から完全に外れるまでズレており、強い癒着が確認された。また、評価膜の分解はほとんど確認できなかった。一方、実施例に係る評価膜を癒着防止膜として用いた場合、6日後であっても元の位置からズレることなく密着していた。尚、一部について癒着が見られたが、当該癒着部分を軽く引っ張ると剥がれる程度の極めて小さなものであった。実施例に係る評価膜にあっては、膜の分解が確認でき、膜は薄く残存するのみであった。
さらに、2週間後、再開腹して状態を観察したところ、参考例に係る評価膜にあっては6日後と同様に膜の分解はほとんど確認できなかった。一方、実施例に係る評価膜にあっては、膜が完全に分解されていた。
【0052】
図3は、実施例に係る評価膜を設置して6日後の肝臓表面の状態を示す観察図である。図3から明らかなように、膜は肝臓表面に密着したまま分解が進行しており、膜の内部にまで細胞の核が入り込んでいた。
【0053】
以上のように、実施例に係る評価膜は、適切に生分解可能であるとともに濡れ表面に対する密着性に優れており、癒着防止膜として好適に利用可能なことが立証された。
【0054】
<細胞増殖用基材としての適用実験>
ポリ乳酸−ポリカプロラクトンマルチブロック共重合体薄膜をアルカリ加水分解処理によって親水性多孔質膜とし、得られた親水性多孔質膜の上で細胞(HeLa細胞)の培養を試みた。図4(A)に細胞培養後の膜中の細胞の状態を、図4(B)に細胞と膜との合成写真を示す。図4から明らかなように、細胞は膜の空隙を介して内部にまで入り込んで成長していた。すなわち、本発明に係る親水性多孔質膜は細胞増殖用基材としても適用可能であることがわかった。
【0055】
<アルカリpHと空隙形成との関係>
厚さ30μmのポリ乳酸−ポリカプロラクトンマルチブロック共重合体薄膜を得た。得られた薄膜をpH11〜13の水酸化ナトリウム水溶液に浸漬し、アルカリ加水分解が進行するか否かについて、pHの臨界点を特定した。実験により、アルカリ加水分解が適切に進行し、薄膜に上記の空隙を適切に形成可能なpHは12以上であることがわかった。
【0056】
以上、現時点において、最も実践的であり、且つ、好ましいと思われる実施形態に関連して本発明を説明したが、本発明は、本願明細書中に開示された実施形態に限定されるものではなく、特許請求の範囲及び明細書全体から読み取れる発明の要旨あるいは思想に反しない範囲で適宜変更可能であり、そのような変更を伴う親水性多孔質膜及びその製造方法、医療用癒着防止膜、細胞増殖用基材もまた本発明の技術範囲に包含されるものとして理解されなければならない。
【産業上の利用可能性】
【0057】
本発明に係る親水性多孔質膜は、生分解性を有するとともに濡れ表面に対する密着性に優れる。例えば、生体内でズレ動くことがなく、所定の位置に長期間保持可能で、且つ、生体内で適切に分解される。このような特性から、癒着防止膜や細胞増殖用基材等、医療分野において広く利用可能である。
【特許請求の範囲】
【請求項1】
ポリ乳酸とポリカプロラクトンとのマルチブロック共重合体を含んでなり、
アルカリ加水分解処理されたことによる空隙を有する、親水性多孔質膜。
【請求項2】
厚みが5μm以上100μm以下である、請求項1に記載の親水性多孔質膜。
【請求項3】
ポリ乳酸とポリカプロラクトンとのマルチブロック共重合体を含んでなり、
膜表面から膜裏面にかけて連通する空隙を有する、
親水性多孔質膜。
【請求項4】
アルカリ加水分解処理されたことにより前記空隙を有する、請求項3に記載の親水性多孔質膜。
【請求項5】
厚みが5μm以上100μm以下である、請求項3又は4に記載の親水性多孔質膜。
【請求項6】
請求項1〜5のいずれかに記載の親水性多孔質膜を用いてなる医療用癒着防止膜。
【請求項7】
請求項1〜5のいずれかに記載の親水性多孔質膜を用いてなる細胞増殖用基材。
【請求項8】
ポリ乳酸とポリカプロラクトンとのマルチブロック共重合体を得る工程と、
得られた前記マルチブロック共重合体を膜状に成形する工程と、
成形した前記膜に対してアルカリ加水分解処理することにより該膜に空隙を生じさせる工程と、
を備える親水性多孔質膜の製造方法。
【請求項9】
pH12以上のアルカリにより前記アルカリ加水分解処理をする、請求項8に記載の親水性多孔質膜の製造方法。
【請求項10】
厚みが5μm以上100μm以下である、請求項8又は9に記載の親水性多孔質膜の製造方法。
【請求項11】
前記アルカリ加水分解処理が、前記膜の表面から裏面にかけて前記空隙が連通するまでの間行われる、請求項8〜10のいずれかに記載の親水性多孔質膜の製造方法。
【請求項12】
前記マルチブロック共重合体を得る工程において、前記ポリ乳酸と前記ポリカプロラクトンとのジブロック共重合体を合成し、該ジブロック共重合体を後重合に供することにより、前記マルチブロック共重合体を得る、請求項8〜11のいずれかに記載の親水性多孔質膜の製造方法。
【請求項1】
ポリ乳酸とポリカプロラクトンとのマルチブロック共重合体を含んでなり、
アルカリ加水分解処理されたことによる空隙を有する、親水性多孔質膜。
【請求項2】
厚みが5μm以上100μm以下である、請求項1に記載の親水性多孔質膜。
【請求項3】
ポリ乳酸とポリカプロラクトンとのマルチブロック共重合体を含んでなり、
膜表面から膜裏面にかけて連通する空隙を有する、
親水性多孔質膜。
【請求項4】
アルカリ加水分解処理されたことにより前記空隙を有する、請求項3に記載の親水性多孔質膜。
【請求項5】
厚みが5μm以上100μm以下である、請求項3又は4に記載の親水性多孔質膜。
【請求項6】
請求項1〜5のいずれかに記載の親水性多孔質膜を用いてなる医療用癒着防止膜。
【請求項7】
請求項1〜5のいずれかに記載の親水性多孔質膜を用いてなる細胞増殖用基材。
【請求項8】
ポリ乳酸とポリカプロラクトンとのマルチブロック共重合体を得る工程と、
得られた前記マルチブロック共重合体を膜状に成形する工程と、
成形した前記膜に対してアルカリ加水分解処理することにより該膜に空隙を生じさせる工程と、
を備える親水性多孔質膜の製造方法。
【請求項9】
pH12以上のアルカリにより前記アルカリ加水分解処理をする、請求項8に記載の親水性多孔質膜の製造方法。
【請求項10】
厚みが5μm以上100μm以下である、請求項8又は9に記載の親水性多孔質膜の製造方法。
【請求項11】
前記アルカリ加水分解処理が、前記膜の表面から裏面にかけて前記空隙が連通するまでの間行われる、請求項8〜10のいずれかに記載の親水性多孔質膜の製造方法。
【請求項12】
前記マルチブロック共重合体を得る工程において、前記ポリ乳酸と前記ポリカプロラクトンとのジブロック共重合体を合成し、該ジブロック共重合体を後重合に供することにより、前記マルチブロック共重合体を得る、請求項8〜11のいずれかに記載の親水性多孔質膜の製造方法。
【図1】


【図2】


【図3】


【図4】




【図2】


【図3】


【図4】


【公開番号】特開2013−60499(P2013−60499A)
【公開日】平成25年4月4日(2013.4.4)
【国際特許分類】
【出願番号】特願2011−198550(P2011−198550)
【出願日】平成23年9月12日(2011.9.12)
【出願人】(504409543)国立大学法人秋田大学 (210)
【Fターム(参考)】
【公開日】平成25年4月4日(2013.4.4)
【国際特許分類】
【出願日】平成23年9月12日(2011.9.12)
【出願人】(504409543)国立大学法人秋田大学 (210)
【Fターム(参考)】
[ Back to top ]

