観察装置
【課題】高解像度画像を観察することができる観察装置を提供すること。
【解決手段】観察装置100は、サンプルPを保持するサンプルホルダー8と、サンプルPを切断し、順次新たな切断面を形成するブレード7と、第1の対物レンズ11及び第2の対物レンズ12を有する光学系3と、サンプルPの切断面を撮像する電子カメラ2とを有する。メインコントローラ16は、電子カメラ2に、第1の対物レンズ11を介して、切断面の一部に相当する部分画像を撮像させる。メインコントローラは、XYステージを移動させることで、サンプルPと、光学系3とのXY平面内の相対的な位置を変化させ、複数の部分画像を取得する。画像処理部は、切断面毎に、部分画像を合成した合成画像データを生成し、表示部に表示させる。これにより、ユーザは、高解像度画像を観察することができる。
【解決手段】観察装置100は、サンプルPを保持するサンプルホルダー8と、サンプルPを切断し、順次新たな切断面を形成するブレード7と、第1の対物レンズ11及び第2の対物レンズ12を有する光学系3と、サンプルPの切断面を撮像する電子カメラ2とを有する。メインコントローラ16は、電子カメラ2に、第1の対物レンズ11を介して、切断面の一部に相当する部分画像を撮像させる。メインコントローラは、XYステージを移動させることで、サンプルPと、光学系3とのXY平面内の相対的な位置を変化させ、複数の部分画像を取得する。画像処理部は、切断面毎に、部分画像を合成した合成画像データを生成し、表示部に表示させる。これにより、ユーザは、高解像度画像を観察することができる。
【発明の詳細な説明】
【技術分野】
【0001】
本発明は、生体サンプルなどのサンプルの内部構造を観察するための観察装置に関する。
【背景技術】
【0002】
従来から、病理サンプルなどのサンプルの詳細解析を行う方法として、サンプルをミクロトームを用いて連続的にスライスし、その結果生じた切片をスライドガラス上に付着させることで、プレパラートを形成し、切片を観察ないし撮像していく方法が知られている。
【0003】
近年では、デジタルパソロジーと呼ばれる分野も注目を集めるようになった。これは、上記した方法で、プレパラートを形成した後に、高解像度画像を切片全体にわたって撮像し、コンピュータに記憶する方法である。
他方、プレパラートを作成せずに、サンプルの内部構造を観察することができる試料観察装置も知られている(例えば、特許文献1参照)。
【0004】
特許文献1に記載の観察装置は、保持筒に保持された試料を可動ステージにより上方へ所定量、上昇させることで、保持筒の上端から試料を所定量、突出させる。そして、観察装置は、回転板を回転させて、試料の突出部分を切断刃により切断し、切断面を形成する。切断刃により、順次新たに形成される切断面は、カメラにより撮像され、切断面の画像データに基づき、表示部に3次元画像がモニターに表示される。
【先行技術文献】
【特許文献】
【0005】
【特許文献1】特開平10−206296号公報(段落[0036]〜[0039]、図10)
【発明の概要】
【発明が解決しようとする課題】
【0006】
ところで、例えば、病理サンプルなどのサンプルが観察される場合、高解像度画像が要求される場合が多い。
【0007】
しかしながら、上述の特許文献1では、1つの切断面に対して、1つの画像データを取得することしかできない。したがって、特許文献1に記載の観察装置では、ユーザは、高解像度の画像を観察することができない。
【0008】
以上のような事情に鑑み、本発明の目的は、高解像度画像を観察することができる観察装置を提供することにある。
【課題を解決するための手段】
【0009】
上記目的を達成するため、本発明の一形態に係る観察装置は、保持部と、切断部と、撮像機構と、走査機構と、制御手段とを具備する。
前記保持部は、サンプル、または前記サンプルを含む固形物を保持する。
前記切断部は、前記保持された前記サンプルまたは前記固形物を切断し、順次新たな切断面を形成する。
前記撮像機構は、前記切断面よりも小さい撮像範囲内の画像であって、前記切断面の一部を含む画像である部分画像を撮像する。
前記走査機構は、前記撮像範囲を前記切断面に沿って走査させる。
前記制御手段は、前記走査機構を駆動させ、前記撮像機構により前記撮像範囲ごとに前記部分画像を撮像させることで、前記切断面毎に、前記複数の部分画像が合成された画像である、前記切断面の合成画像情報を生成する。
【0010】
本発明では、撮像部は、切断面よりも小さい範囲の撮像範囲内の画像を撮像することができるので、高解像度の部分画像を取得することができる。この高解像度の部分画像は、切断面毎に、合成され、合成画像の情報が生成される。観察装置は、この合成画像情報に基づいて、サンプルの平面画像や立体画像などの表示画像を表示させればよい。これにより、ユーザは、高解像度画像を観察することができる。
【0011】
上記観察装置において、前記制御手段は、前記切断面が新たに形成される毎に、前記合成画像情報に基づき、撮像範囲が走査される走査領域を設定してもよい。
本発明では、切断面が新たに形成される毎に、新たに形成される切断面に適した大きさの走査領域を設定することができる。これにより、余計な領域が走査されることを防止することができるので、高速な処理が可能となる。
【0012】
上記観察装置において、前記制御手段は、過去の前記切断面の合成画像情報に基づいて、前記新たに形成された前記切断面に応じた前記走査領域を設定してもよい。
これにより、余計な領域が走査されることを防止することができるので、高速な処理が可能となる。
【0013】
上記観察装置において、前記制御手段は、過去の前記切断面の合成画像から前記サンプルに相当する画像のエッジ検出を実行し、前記検出されたエッジの情報に基づいて前記走査領域を設定してもよい。
【0014】
上記観察装置において、前記制御手段は、前記検出されたエッジで囲まれる画像領域を変化させ、前記変化後の画像領域のエッジを包括する領域を、前記走査領域として設定してもよい。
これにより、余計な領域が走査されることを防止することができるので、高速な処理が可能となる。
【0015】
上記観察装置において、前記撮像機構は、少なくとも前記サンプルの前記切断面全体を包括する範囲内の画像である全体画像を撮像し、
前記制御手段は、前記切断面が新たに形成される毎に、前記全体画像情報に基づいて、前記切断面に応じた前記走査領域を設定してもよい。
本発明では、切断面が新たに形成される毎に、新たに形成される切断面に適した大きさの走査領域を設定することができる。これにより、余計な領域が走査されることを防止することができるので、高速な処理が可能となる。
【0016】
上記観察装置において、前記制御手段は、前記サンプルが前記切断部により切断される間隔を可変に制御してもよい。
本発明では、サンプルが切断される間隔が可変に制御される。このサンプルが切断される間隔は、画像データのZ分解能に相当する。すなわち、画像データのZ分解能が可変に制御されることになる。これにより、例えば、高いZ分解能が要求されない範囲は、上記間隔を大きくすることで、高速な処理が可能となる。一方、高いZ分解能が要求される範囲は、上記間隔を小さくすることで、さらに高解像度の画像データを取得することができる。
【0017】
上記観察装置において、前記制御手段は、前記合成画像情報に基づき、前記サンプルの画像中の特徴量を抽出し、前記抽出された特徴量に応じて、前記間隔を可変に制御してもよい。
本発明は、サンプルの画像中の特徴量に応じて、間隔を可変とすることができるので、例えば、生体サンプル内のがん細胞を特徴量として、上記間隔(Z分解能)を可変に制御することができる。
【0018】
上記観察装置において、前記制御手段は、前記特徴量が増加するに従って、前記間隔を小さくするように、前記間隔を制御してもよい。
これにより、例えば、特徴量が生体サンプル内のがん細胞である場合、がん細胞が増加するに従って、上記間隔を小さくすることができ、Z分解能を高くすることができる。
【発明の効果】
【0019】
以上のように、本発明によれば、高解像度画像を観察することができる観察装置を提供することができる。
【図面の簡単な説明】
【0020】
【図1】本発明の一実施形態に係る観察装置を示す模式図である。
【図2】本発明の一実施形態に係る観察装置の動作を示すフローチャートである。
【図3】図2に示す動作を説明するための模式図である。
【図4】本発明の他の実施形態に係る観察装置の動作を示すフローチャートである。
【図5】図4に示す動作を説明するため模式図である。
【図6】本発明のさらに別の実施形態に係る観察装置の動作を示すフローチャートである。
【図7】光学系の他の形態を示す模式図である。
【発明を実施するための形態】
【0021】
以下、図面を参照しながら、本発明の実施形態を説明する。
<第1実施形態>
(観察装置の全体構成)
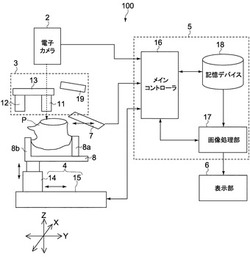
図1は、本発明の第1実施形態に係る観察装置100を示す模式図である。
図1に示すように、観察装置100は、サンプルホルダー8と、ブレード7と、光学系3と、電子カメラ2と、制御系5とを備える。
【0022】
サンプルホルダー8は、測部に水平方向(XY方向)に移動可能な可動部8aを有し、この可動部8aと、可動部の反対側の側部8bとの間で、サンプルPを挟み込んで固定する。サンプルホルダー8は、XYZステージ4に接続されている。XYZステージ4は、例えば、サンプルホルダー8に接続され、サンプルホルダー8を昇降させる昇降機構14と、この昇降機構14をX軸方向及びY軸方向に移動させるXYステージ15を有する。
【0023】
ブレード7は、図示しない回転機構により、回転され、サンプルホルダー8に保持されたサンプルPをXY平面で切断するように構成されている。ブレード7は、観察装置100に対して、固定された位置で、回転機構により回転される。ブレード7は、水平移動により、サンプルPを切断するように構成されていても構わない。ブレード7は、サンプルPをXY平面で切断するような構成であれば、どのような形態であってもよい。
【0024】
昇降機構14、XYステージ15及び回転機構などの駆動機構は、例えばラックアンドピニオン、ベルト、チェーン、リニアモータ、ボールネジ、流体圧シリンダ等の駆動機構により実現される。
【0025】
光学系3は、照明用の光源19と、2つの対物レンズ11、12と、この2つの対物レンズ11、12を切り替えるレボルバー13とを有する。レボルバー13は、図示しない回転機構により回転されることで、2つの対物レンズ11、12を切り替える。
【0026】
光源19は、例えば、発光ダイオードや、キセノンランプなどが用いられる。光源19からの光が例えば、図示しないミラーにより反射され、対物レンズに入射し、サンプルPを照明するようにしてもよい。
【0027】
第1の対物レンズ11は、例えば、40倍〜60倍程度の倍率のレンズが用いられる。第2の対物レンズ12は、第1の対物レンズ11よりも低倍率な広角レンズが用いられる。第2の対物レンズ12としては、数倍から数十倍の倍率のレンズが用いられる。なお、上記各レンズの倍率は、上記した範囲に限られない。
【0028】
光学系3は、フィルタや、ダイクロックミラーなどを有していてもよい。これにより、蛍光画像や、マルチカラー画像などを取得することができるように構成することができる。
電子カメラ2は、例えば、CCD(Charge Coupled Device)や、CMOS(Complementary Metal Oxide Semiconductor)などの撮像デバイスを備えている。
【0029】
制御系5は、メインコントローラ16と、画像処理部17と、記憶デバイス18とを有する。
メインコントローラ16は、観察装置100の全体を統括的に制御する。メインコントローラ16は、例えば、XYZステージ4、ブレード7の回転機構、及びレボルバー13の回転機構の駆動を制御したり、電子カメラ2により得られた画像データを記憶デバイス18に出力したりする。また、メインコントローラ16は、XYZステージ4によるサンプルホルダー8の位置、すなわち、サンプルPの3次元内の位置情報を、XYZステージ4から取得する。
【0030】
記憶デバイス18は、メインコントローラ16から出力された画像データを、XYZステージ4の位置情報とともにテーブル化して記憶し、保持する。
画像処理部17は、記憶デバイス18に記憶された、画像データ及び位置情報を抽出し、抽出された画像データ及び位置情報に基づき、所定の画像処理を実行する。
【0031】
観察装置100は、例えば液晶や有機EL等の表示部6を備えている。画像処理部17は、メインコントローラ16に制御に応じて、画像処理により生成された画像を表示部6に出力して表示させる。観察装置100は、表示部6に加えて、あるいは、表示部6の代わりにプリンタなどの印刷装置を備えていてもよい。
【0032】
メインコントローラ16及び画像処理部17を実現するためのハードウェアとして、例えばCPU(Central Processing Unit)、DSP(Digital Signal Processor)、FPGA(Field Programmable Gate Array)、ASIC(Application Specific Integrated Circuit)、これらに類するもの、または、これらの組み合わせが用いられる。
【0033】
画像処理部17は、ソフトウェア及びハードウェアの両方で実現されてもよい。画像処理部17がソフトウェア及びハードウェアの両方で実現される場合、そのハードウェアは、ソフトウェアのプログラムを格納する記憶装置(例えばROM、その他の記憶装置)を少なくとも含む。メインコントローラ16についても同様である。
記憶デバイス18は、磁気ディスク、光ディスク等のディスク状の記憶媒体のほか、固体(半導体、誘電体または磁気抵抗)メモリ等の記憶媒体でもよい。
【0034】
サンプルPとしては、例えば、病理サンプルや、人以外の動物、植物などの生体組織サンプルPが用いられる。サンプルPの種類は、特に限定されず、医療分野、薬品分野、食品分野、農業分野等から適宜選択されたサンプルPが用いられればよい。
【0035】
サンプルPは、例えば、樹脂や、パラフィンなどの包埋材に包埋され、サンプルPを含む固形物としてサンプルホルダー8に保持されてもよい。サンプルPは、凍結包埋によるサンプルPとして、サンプルホルダー8により保持されてもよい。サンプルPが凍結包埋される場合、サンプルホルダー8は、図示しない冷却部を有していてもよい。あるいは、サンプルP自体が硬い物体である場合は、サンプルP自体がサンプルホルダー8に保持されても構わない。
【0036】
サンプルPは、撮像が実行される前に、染色が施されていてもよい。染色の種類としては、ヘマトキシリン・エオシン染色(HE染色)など染色液を用いた明視野での染色のほか、IHC(immunohisto chemistry)や、FISH(Fluorescent in situ hybridization)法による染色などが挙げられる。また、DAPI(4',6-diamino-2-phenylindole)による核酸蛍光染色など、蛍光物質を用いた染色法、抗体や核酸プローブなどを用いた染色法などが挙げられる。
【0037】
サンプルPが染色される場合、whole mount法が用いられることで、サンプルPの切断面を染色された状態とすることができる。
【0038】
(動作説明)
図2は、観察装置100の動作を示すフローチャートである。図3は、図2に示す動作を説明するための模式図である。
【0039】
まず、メインコントローラ16は、ブレード7に設けられた回転機構を駆動させ、ブレード7により、サンプルPの上端部を切断する(ステップ101)。サンプルPが切断されると、サンプルPのn層目の切断面が形成される。
【0040】
サンプルPのn層目の切断面が形成されると、メインコントローラ16は、第2の対物レンズ12を介して、サンプルPのn層目の切断面を撮像するように、電子カメラ2を制御する(ステップ102)。このとき、第2の対物レンズ12を介して撮像される画像は、少なくともサンプルPのn層目の切断面全体を包括する範囲内の画像である。
【0041】
メインコントローラ16は、n層目の切断面全体を包括する全体画像データを取得すると、この全体画像データに基づいて、走査領域1Aを設定する(ステップ103)。ここで、走査領域1Aとは、電子カメラ2により、第1の対物レンズ11を介して撮像される撮像範囲2Aが走査される領域を指す(図3(C)参照)。
【0042】
メインコントローラ16は、典型的には、ステップ103において、全体画像データに基づき、n層目の切断面のエッジ検出を実行し(図3(B)参照)、このエッジの内部を包括する領域を走査領域1Aとして設定する(図3(C)参照)。エッジ検出は、例えば、全体画像の輝度情報の閾値判定により実行されればよい。
【0043】
走査領域1Aが設定されると、メインコントローラ16は、レボルバー13の回転機構を駆動させ、第2の対物レンズ12から第1の対物レンズ11へと切り替える(ステップ104)。
【0044】
次に、メインコントローラ16は、設定された走査領域1Aの情報に基づいて、XYステージ15を駆動させることで、サンプルホルダー8をX軸方向及びY軸方向へ移動させる(ステップ105)。
【0045】
サンプルホルダー8が所定の位置まで移動されると、例えば、近赤外線などを利用したアクティブ型の測距方式により、第1の対物レンズ11からサンプルPのn層目の切断面との距離が測定される。メインコントローラ16は、測定された距離に応じて、昇降機構14を昇降させ、フォーカスを調整する(ステップ106)。なお、測距方式は、アクティブ型の測距方式に限られず、例えば、TTL(Through the Lens)方式などのパッシブ型の測距方式が用いられてもよく、測距方式は、特に限定されない。
【0046】
フォーカスが調整されると、メインコントローラ16は、電子カメラ2を制御し、第1の対物レンズ11を介して、n層目の切断面の一部に相当する部分画像を撮像させる(ステップ107)。なお、以降の説明では、電子カメラ2が第1の対物レンズ11を介して、撮像可能な範囲を撮像範囲2Aとして説明する(図3(C)参照)。
【0047】
n層目の切断面の部分画像が撮像されると、メインコントローラ16は、サンプルPの3次元内の位置情報を、XYZステージ4から取得し、部分画像データとともに記憶デバイス18に出力する。記憶デバイス18は、メインコントローラ16から出力された部分画像データと、XYZステージ4の位置情報とをテーブル化して記憶し、保持する(ステップ108)。
【0048】
次に、メインコントローラ16は、走査領域1A内の部分画像データが全て取得されたか否かを判定する(ステップ109)。走査領域1A内の画像が全て取得されていない場合(ステップ109NO)、メインコントローラ16は、XYステージ15を所定の距離だけ移動させる(ステップ105)。この場合、電子カメラ2が、第1の対物レンズ11を介して撮像可能な撮像範囲2Aは、サンプルPの切断面に沿って、走査されるように移動されることになる。
【0049】
以降、走査領域1A内の画像が全て取得されるまで、ステップ105〜ステップ109に示す処理が繰り返される。
【0050】
走査領域1A内の画像が全て取得された場合(ステップ109のYES)、メインコントローラ16は、昇降機構14を上昇させ、サンプルPを上昇させる(ステップ110)。このとき、サンプルPが上昇される距離は、例えば、50μm〜100μmとされるが、この範囲に限られない。サンプルPが上昇される距離は、取得される画像データのZ分解能に相当する。
【0051】
昇降機構14が所定の距離だけ上昇されると、メインコントローラ16は、ブレード7を回転させる。これにより、サンプルPが上昇された距離だけ、サンプルPが切断され、サンプルPのn+1層目の切断面が形成される。
以降、ステップ101〜110に示す処理が、サンプルP全体が切断されるまで実行される。
【0052】
画像処理部17は、部分画像データと、XYZステージ4の位置情報とを記憶デバイス18から取得し、位置情報に基づいて、部分画像データを合成することで、切断面毎の合成画像データを生成する。画像処理部17は、この合成画像データに基づいて、サンプルPの平面画像や、立体画像などの表示画像を表示させる。
【0053】
画像処理部17は、部分画像データを合成する際に、位置の調整や、色調、明るさの補正などの処理を実行してもよい。画像処理部17は、部分画像データに基づいて、任意の断面で切断された立体画像を擬似的に作成し、この立体画像を表示部6に表示させるようにしてもよい。
【0054】
メインコントローラ16は、平面画像や立体画像などの表示画像を、そのまま表示するのではなく、各種の画像解析を実行してもよい。例えば、メインコントローラ16は、特定細胞や特定組織の識別、病変部に特異的な画像的特徴の有無の検出および特徴的な領域の識別、特定遺伝子の発現の有無の検出その空間的分布の解析などの処理を実行してもよい。
【0055】
本実施形態では、上記したように、高倍率な第1の対物レンズ11を介して撮像されたサンプルPの部分画像データを取得し、この部分画像データを合成することで、平面画像データ及び立体画像データを生成している。これにより、ユーザは、高解像度の画像を観察することができる。
【0056】
さらに、本発明では、第2の対物レンズ12を介して撮像された全体画像データに基づいて、走査領域1Aが設定されているため、切断面が新たに形成される毎に、新たに形成される切断面に適した大きさの走査領域1Aを設定することができる。これにより、余計な領域が走査されることを防止することができるので、高速な処理が可能となる。
【0057】
さらに、本実施実施形態では、XYZステージ4の位置情報を部分画像データとともに記録するため、複数の部分画像データから得られる、切断面毎の合成画像データの位置合わせを、記録された位置情報に元に行うことができる。これは、スライドガラス画像を用いたデジタルパソロジーによる立体画像構築と比較して、はるかに簡便であり、高速である。
【0058】
特に、サンプルPが病理サンプルPの場合、高解像度な画像及び高速な処理が要求されることが多い。従って、本実施形態に係る観察装置100は、病理サンプルPを観察する際に、特に大きな効果を奏する。
【0059】
本実施形態の説明では、ステップ104において、検出されたエッジの内部を包括する領域を走査領域1Aとして設定する、として説明した。すなわち、走査領域1Aは、エッジを全て包括する、エッジよりも大きい領域であるとして説明した。しかし、これに限られず、走査領域1Aは、エッジよりも小さい領域であっても構わない。例えば、サンプルPの切断面の中心部分に観察したい領域があるような場合、走査領域1Aをエッジよりも小さい領域として設定するように、メインコントローラ16に制御させても構わない。これにより、ユーザは、サンプルPの必要部分の表示画像を観察することができる。また、このような処理によれば、高速な処理も可能となる。
【0060】
<第2実施形態>
次に、本発明の第2実施系形態について説明する。
【0061】
第2実施形態では、上述の第1実施形態と、走査領域1Aが設定される方法が異なるため、その点を中心に説明する。なお、以降の説明では、上述の第1実施形態と、同様の構成及び機能を有するものについては、同一符号を付し、説明を簡略化、または省略する。
図4は、第2実施形態に係る観察装置100の動作を示すフローチャートである。図5は、図4に示す動作を説明するため模式図である。
【0062】
まず、メインコントローラ16は、ブレード7を駆動させ、ブレード7により、サンプルPの上端部を切断する(ステップ201)。サンプルPが切断されると、サンプルPのn層目の切断面が形成される。
【0063】
サンプルPのn層目の切断面が形成されると、メインコントローラ16は、サンプルPのn−1層目の(前の)切断面の全体画像データが記憶デバイス18に記憶されているか否かを判定する(ステップ202)。ここで、ステップ202において、判定されるn−1層目の切断面の全体画像データは、部分画像データが合成されて形成された、合成画像データであってもよく、第2の対物レンズ12を介して取得された切断面の全体画像データであってもよい。
【0064】
n−1層目の切断面の全体画像データが記憶されていない場合、メインコントローラ16は、走査領域1Aの最大領域である最大走査領域を走査領域1Aとして設定する(ステップ203)。
【0065】
そして、メインコントローラ16は、撮像範囲2Aを最大走査領域内で走査させる(ステップ204〜ステップ207)。この場合、最大走査領域内で、XYステージ15の移動(ステップ204)→フォーカシング(ステップ205)→撮像(第1の対物レンズ11)(ステップ206)→データ保存(ステップ207)→判定(ステップ208)の処理が繰り返される。最大走査領域内で撮像範囲2Aを走査し終えた場合、再びステップ201へ戻る。
【0066】
ステップ202において、n−1層目の切断面の全体画像データが記憶されている場合、メインコントローラ16は、n−1層目の切断面の全体画像データに基づき、n層目の切断面の走査領域1Aを設定する(ステップ209)。典型的には、メインコントローラ16は、n−1層目の画像データのエッジ検出を実行する(図5(A)参照)。そして、メインコントローラ16は、検出されたエッジで囲まれる領域を一定量膨張させた領域(以下、変化領域)を形成する(図5(B)参照)。次に、メインコントローラ16は、変化領域を包括する領域を走査領域1Aとして設定する(図5(C)参照)。
【0067】
走査領域1Aが設定されると、メインコントローラ16は、ステップ204〜ステップ210に示す処理を実行する。
【0068】
本実施形態では、前回の切断面の画像データに基づいて、新たな切断面の走査領域1Aを設定することができるので、余計な領域の走査を省くことができる。これにより、高速な処理が実現される。
【0069】
ステップ202において、メインコントローラ16は、n−1層目の切断面の全体画像データが存在しない場合、第2の対物レンズ12を介して、n層目の切断面の全体画像データを取得してもよい。この場合、メインコントローラ16は、取得されたn層目の全体画像データに基づいて、走査領域1Aを設定し、撮像範囲2Aを走査領域1A内で走査させる。すなわち、メインコントローラ16は、n−1層目の切断面の全体画像データが存在しない場合、図2のステップ102〜109に示す処理を実行しても構わない。
【0070】
上述の説明では、変化領域は、エッジで囲まれる領域が膨張されて形成される、として説明した。しかし、これに限られず、変化領域は、エッジで囲まれる領域が縮小されて形成されてもよい。
【0071】
<第3実施形態>
次に、本発明の第3実施形態について説明する。
【0072】
第3実施形態では、ブレード7により、サンプルPが切断される間隔が可変に制御される点が、上述の各実施形態と異なっている。従って、その点を中心に説明する。
図6は、第3実施形態に係る観察装置100の動作を示すフローチャートである。
【0073】
図6に示すように、まず、メインコントローラ16は、ブレード7を回転させ、サンプルPの端部を切断し、サンプルPのn層目の切断面を形成する(ステップ301)。
【0074】
メインコントローラ16は、サンプルPのn層目の切断面を形成すると、ステップ302〜ステップ306において、図2のステップ105〜109に示した処理と同様の処理を実行する。なお、ステップ301〜306までの処理については、上述の図2に示したステップ101〜109と同様の処理を実行させてもよく、図4に示したステップ201〜208と同様の処理を実行させてもよい。また、上述の各実施形態で示した変形例は、本実施形態に全て適用することができる。
【0075】
サンプルPのn層目の切断面が形成されると、メインコントローラ16は、ステップ302〜306の処理により得られた部分画像データを合成し、合成画像データを生成する。そして、メインコントローラ16は、この合成画像データに基づき、画像解析により画像特徴量を抽出する(ステップ306)。画像特徴量は、例えば、合成画像データの輝度情報などに基づいて判定される。抽出される画像特徴量としては、さまざまなものを指標とすることができるが、本実施形態では、がん細胞の画像パターンを指標とするとして説明する。がん細胞の画像パターンを指標とする場合、がん細胞の大きさを指標としてもよく、切断面の大きさに対するがん細胞の大きさの割合を指標としてもよい。
【0076】
がん細胞の画像パターンを指標として、画像特徴量が判定されると、メインコントローラ16は、がん細胞の大きさに応じた距離分、昇降機構14を上昇させることで、サンプルPを上昇させる(ステップ307)。この場合、サンプルPが上昇される距離は、がん細胞が大きくなるに従って、小さくなるように設定されている。なお、サンプルPが上昇される距離は、上述のように、画像データのZ分解能に相当する。従って、画像データのZ分解能は、がん細胞が大きくなるに従って、上昇する。
【0077】
サンプルPが上昇される距離は、がん細胞が大きくなるに従って、段階的に小さくなってもよく、一次関数的に小さくなってもよい。あるいは、指数関数的に小さくなっても構わない。
【0078】
ところで、癌組織の術中迅速診断を行う場合などにおいては、得られた生体サンプルP中に癌細胞が存在しているか否かを短時間に判定することが求められる場合がある。この場合において、本実施形態では、癌細胞の存在の疑いが高い領域においてのみZ分解能を向上させることができるので、作業時間を短縮することができる。
【0079】
画像特徴量の他の例としては、例えば合成画像データ中に占めるサンプルPの切断面の面積が挙げられる。この場合も、画像特徴量が大きくなるに従って、サンプルPが上昇される距離が小さくなるように設定される。サンプルPが樹脂などの包埋材に包埋・固定化されている場合において、撮影したいサンプルPの切断面に出現してくるまでの間の時間を短縮させることができので、作業効率を向上させることができる。
【0080】
本実施形態では、画像特徴量が大きくなるに従って、サンプルPが上昇される距離が小さくなる場合について説明した。しかし、画像特徴量が大きくなるに従って、サンプルPが上昇される距離が大きくされる形態も考えられる。
【0081】
ここで、使用する画像特徴量、およびそれに応じたZ分解能は、観察したい対象物の性質によって異なる。そこで、あらかじめこれらのパラメータをコンピュータ上に用意しておき、実験を行う際に実験に用いるパラメータをユーザが選択できる機構を取り付けることによって、ユーザの作業効率を向上させることができる。
【0082】
<各種変形例>
上述の各実施形態では、サンプルPがXY方向に移動され、光学系3及び電子カメラ2が固定される形態について説明した。しかし、これに限られず、サンプルPがXY方向で固定され、光学系3及び電子カメラ2がXY方向に移動されるように構成されてもよい。あるいは、サンプルPと、光学系3及び電子カメラ2との両方がXY方向に移動されるように構成されてもよい。すなわち、サンプルPと、光学系3及び電子カメラ2とのXY方向での相対的な位置を変化させることができる形態であれば、どのような形態であってもよい。
【0083】
また、上述の各実施形態では、Z方向への移動は、サンプルPが、光学系3及び電子カメラ2側に移動する形態について説明した。しかし、これに限られず、光学系3及び電子カメラ2が、サンプルP側に移動されても構わない。この場合、光学系3及び電子カメラ2の移動に応じてブレード7もサンプルP側に移動される。
【0084】
上述の各実施形態では、サンプルPの染色は、前処理として、行われるとして説明した。しかし、これに限られず、サンプルPの切断面が形成される毎に、新たに形成された切断面に、染色用薬品を塗布する方法が用いられてもよい。この場合、サンプルPの切断面に対向する位置に、染色用薬品を塗布する塗布機構が配置されればよい。
【0085】
図7は、光学系の他の形態を示す模式図である。
図7に示すように、光学系20は、光源21と、ポラライザ22と、ビームスプリッタ23と、ウェラストンプリズム24と、対物レンズ25と、アナライザ26とで構成される。
【0086】
光源21からの光は、ポラライザ22に入射し、所定の振動方向の直線偏光となる。ポラライザ22からの直線偏光は、ビームスプリッタ23で反射されてウェラストンプリズム24に入射し、振動方向が互いに直行する2つの直線偏光に分離される。この2つの直線偏光は、対物レンズ25を介してほぼ平行な集光光となり、サンプルPの切断面上の異なる位置に垂直に照明される。
【0087】
異なる2つの位置で反射した光は、再び対物レンズ25を介してウェラストンプリズム24に入射し、合成されて同一光路を進む。ウェラストンプリズム24からの2束光は、ビームスプリッタ23を介して、アナライザ26に入射し、同一の振動方向の成分が取り出されて偏光干渉する。その後、偏光干渉した光が電子カメラ2の像面に導かれ、微分干渉像が形成される。
【符号の説明】
【0088】
P…サンプル
1A…走査領域
2A…撮像範囲
2…電子カメラ
3…光学系
4…XYZステージ
5…制御系
6…表示部
7…ブレード
8…サンプルホルダー
11…第1の対物レンズ
12…第2の対物レンズ
13…レボルバー
14…昇降機構
15…XYステージ
16…メインコントローラ
17…画像処理部
18…記憶デバイス
100…観察装置
【技術分野】
【0001】
本発明は、生体サンプルなどのサンプルの内部構造を観察するための観察装置に関する。
【背景技術】
【0002】
従来から、病理サンプルなどのサンプルの詳細解析を行う方法として、サンプルをミクロトームを用いて連続的にスライスし、その結果生じた切片をスライドガラス上に付着させることで、プレパラートを形成し、切片を観察ないし撮像していく方法が知られている。
【0003】
近年では、デジタルパソロジーと呼ばれる分野も注目を集めるようになった。これは、上記した方法で、プレパラートを形成した後に、高解像度画像を切片全体にわたって撮像し、コンピュータに記憶する方法である。
他方、プレパラートを作成せずに、サンプルの内部構造を観察することができる試料観察装置も知られている(例えば、特許文献1参照)。
【0004】
特許文献1に記載の観察装置は、保持筒に保持された試料を可動ステージにより上方へ所定量、上昇させることで、保持筒の上端から試料を所定量、突出させる。そして、観察装置は、回転板を回転させて、試料の突出部分を切断刃により切断し、切断面を形成する。切断刃により、順次新たに形成される切断面は、カメラにより撮像され、切断面の画像データに基づき、表示部に3次元画像がモニターに表示される。
【先行技術文献】
【特許文献】
【0005】
【特許文献1】特開平10−206296号公報(段落[0036]〜[0039]、図10)
【発明の概要】
【発明が解決しようとする課題】
【0006】
ところで、例えば、病理サンプルなどのサンプルが観察される場合、高解像度画像が要求される場合が多い。
【0007】
しかしながら、上述の特許文献1では、1つの切断面に対して、1つの画像データを取得することしかできない。したがって、特許文献1に記載の観察装置では、ユーザは、高解像度の画像を観察することができない。
【0008】
以上のような事情に鑑み、本発明の目的は、高解像度画像を観察することができる観察装置を提供することにある。
【課題を解決するための手段】
【0009】
上記目的を達成するため、本発明の一形態に係る観察装置は、保持部と、切断部と、撮像機構と、走査機構と、制御手段とを具備する。
前記保持部は、サンプル、または前記サンプルを含む固形物を保持する。
前記切断部は、前記保持された前記サンプルまたは前記固形物を切断し、順次新たな切断面を形成する。
前記撮像機構は、前記切断面よりも小さい撮像範囲内の画像であって、前記切断面の一部を含む画像である部分画像を撮像する。
前記走査機構は、前記撮像範囲を前記切断面に沿って走査させる。
前記制御手段は、前記走査機構を駆動させ、前記撮像機構により前記撮像範囲ごとに前記部分画像を撮像させることで、前記切断面毎に、前記複数の部分画像が合成された画像である、前記切断面の合成画像情報を生成する。
【0010】
本発明では、撮像部は、切断面よりも小さい範囲の撮像範囲内の画像を撮像することができるので、高解像度の部分画像を取得することができる。この高解像度の部分画像は、切断面毎に、合成され、合成画像の情報が生成される。観察装置は、この合成画像情報に基づいて、サンプルの平面画像や立体画像などの表示画像を表示させればよい。これにより、ユーザは、高解像度画像を観察することができる。
【0011】
上記観察装置において、前記制御手段は、前記切断面が新たに形成される毎に、前記合成画像情報に基づき、撮像範囲が走査される走査領域を設定してもよい。
本発明では、切断面が新たに形成される毎に、新たに形成される切断面に適した大きさの走査領域を設定することができる。これにより、余計な領域が走査されることを防止することができるので、高速な処理が可能となる。
【0012】
上記観察装置において、前記制御手段は、過去の前記切断面の合成画像情報に基づいて、前記新たに形成された前記切断面に応じた前記走査領域を設定してもよい。
これにより、余計な領域が走査されることを防止することができるので、高速な処理が可能となる。
【0013】
上記観察装置において、前記制御手段は、過去の前記切断面の合成画像から前記サンプルに相当する画像のエッジ検出を実行し、前記検出されたエッジの情報に基づいて前記走査領域を設定してもよい。
【0014】
上記観察装置において、前記制御手段は、前記検出されたエッジで囲まれる画像領域を変化させ、前記変化後の画像領域のエッジを包括する領域を、前記走査領域として設定してもよい。
これにより、余計な領域が走査されることを防止することができるので、高速な処理が可能となる。
【0015】
上記観察装置において、前記撮像機構は、少なくとも前記サンプルの前記切断面全体を包括する範囲内の画像である全体画像を撮像し、
前記制御手段は、前記切断面が新たに形成される毎に、前記全体画像情報に基づいて、前記切断面に応じた前記走査領域を設定してもよい。
本発明では、切断面が新たに形成される毎に、新たに形成される切断面に適した大きさの走査領域を設定することができる。これにより、余計な領域が走査されることを防止することができるので、高速な処理が可能となる。
【0016】
上記観察装置において、前記制御手段は、前記サンプルが前記切断部により切断される間隔を可変に制御してもよい。
本発明では、サンプルが切断される間隔が可変に制御される。このサンプルが切断される間隔は、画像データのZ分解能に相当する。すなわち、画像データのZ分解能が可変に制御されることになる。これにより、例えば、高いZ分解能が要求されない範囲は、上記間隔を大きくすることで、高速な処理が可能となる。一方、高いZ分解能が要求される範囲は、上記間隔を小さくすることで、さらに高解像度の画像データを取得することができる。
【0017】
上記観察装置において、前記制御手段は、前記合成画像情報に基づき、前記サンプルの画像中の特徴量を抽出し、前記抽出された特徴量に応じて、前記間隔を可変に制御してもよい。
本発明は、サンプルの画像中の特徴量に応じて、間隔を可変とすることができるので、例えば、生体サンプル内のがん細胞を特徴量として、上記間隔(Z分解能)を可変に制御することができる。
【0018】
上記観察装置において、前記制御手段は、前記特徴量が増加するに従って、前記間隔を小さくするように、前記間隔を制御してもよい。
これにより、例えば、特徴量が生体サンプル内のがん細胞である場合、がん細胞が増加するに従って、上記間隔を小さくすることができ、Z分解能を高くすることができる。
【発明の効果】
【0019】
以上のように、本発明によれば、高解像度画像を観察することができる観察装置を提供することができる。
【図面の簡単な説明】
【0020】
【図1】本発明の一実施形態に係る観察装置を示す模式図である。
【図2】本発明の一実施形態に係る観察装置の動作を示すフローチャートである。
【図3】図2に示す動作を説明するための模式図である。
【図4】本発明の他の実施形態に係る観察装置の動作を示すフローチャートである。
【図5】図4に示す動作を説明するため模式図である。
【図6】本発明のさらに別の実施形態に係る観察装置の動作を示すフローチャートである。
【図7】光学系の他の形態を示す模式図である。
【発明を実施するための形態】
【0021】
以下、図面を参照しながら、本発明の実施形態を説明する。
<第1実施形態>
(観察装置の全体構成)
図1は、本発明の第1実施形態に係る観察装置100を示す模式図である。
図1に示すように、観察装置100は、サンプルホルダー8と、ブレード7と、光学系3と、電子カメラ2と、制御系5とを備える。
【0022】
サンプルホルダー8は、測部に水平方向(XY方向)に移動可能な可動部8aを有し、この可動部8aと、可動部の反対側の側部8bとの間で、サンプルPを挟み込んで固定する。サンプルホルダー8は、XYZステージ4に接続されている。XYZステージ4は、例えば、サンプルホルダー8に接続され、サンプルホルダー8を昇降させる昇降機構14と、この昇降機構14をX軸方向及びY軸方向に移動させるXYステージ15を有する。
【0023】
ブレード7は、図示しない回転機構により、回転され、サンプルホルダー8に保持されたサンプルPをXY平面で切断するように構成されている。ブレード7は、観察装置100に対して、固定された位置で、回転機構により回転される。ブレード7は、水平移動により、サンプルPを切断するように構成されていても構わない。ブレード7は、サンプルPをXY平面で切断するような構成であれば、どのような形態であってもよい。
【0024】
昇降機構14、XYステージ15及び回転機構などの駆動機構は、例えばラックアンドピニオン、ベルト、チェーン、リニアモータ、ボールネジ、流体圧シリンダ等の駆動機構により実現される。
【0025】
光学系3は、照明用の光源19と、2つの対物レンズ11、12と、この2つの対物レンズ11、12を切り替えるレボルバー13とを有する。レボルバー13は、図示しない回転機構により回転されることで、2つの対物レンズ11、12を切り替える。
【0026】
光源19は、例えば、発光ダイオードや、キセノンランプなどが用いられる。光源19からの光が例えば、図示しないミラーにより反射され、対物レンズに入射し、サンプルPを照明するようにしてもよい。
【0027】
第1の対物レンズ11は、例えば、40倍〜60倍程度の倍率のレンズが用いられる。第2の対物レンズ12は、第1の対物レンズ11よりも低倍率な広角レンズが用いられる。第2の対物レンズ12としては、数倍から数十倍の倍率のレンズが用いられる。なお、上記各レンズの倍率は、上記した範囲に限られない。
【0028】
光学系3は、フィルタや、ダイクロックミラーなどを有していてもよい。これにより、蛍光画像や、マルチカラー画像などを取得することができるように構成することができる。
電子カメラ2は、例えば、CCD(Charge Coupled Device)や、CMOS(Complementary Metal Oxide Semiconductor)などの撮像デバイスを備えている。
【0029】
制御系5は、メインコントローラ16と、画像処理部17と、記憶デバイス18とを有する。
メインコントローラ16は、観察装置100の全体を統括的に制御する。メインコントローラ16は、例えば、XYZステージ4、ブレード7の回転機構、及びレボルバー13の回転機構の駆動を制御したり、電子カメラ2により得られた画像データを記憶デバイス18に出力したりする。また、メインコントローラ16は、XYZステージ4によるサンプルホルダー8の位置、すなわち、サンプルPの3次元内の位置情報を、XYZステージ4から取得する。
【0030】
記憶デバイス18は、メインコントローラ16から出力された画像データを、XYZステージ4の位置情報とともにテーブル化して記憶し、保持する。
画像処理部17は、記憶デバイス18に記憶された、画像データ及び位置情報を抽出し、抽出された画像データ及び位置情報に基づき、所定の画像処理を実行する。
【0031】
観察装置100は、例えば液晶や有機EL等の表示部6を備えている。画像処理部17は、メインコントローラ16に制御に応じて、画像処理により生成された画像を表示部6に出力して表示させる。観察装置100は、表示部6に加えて、あるいは、表示部6の代わりにプリンタなどの印刷装置を備えていてもよい。
【0032】
メインコントローラ16及び画像処理部17を実現するためのハードウェアとして、例えばCPU(Central Processing Unit)、DSP(Digital Signal Processor)、FPGA(Field Programmable Gate Array)、ASIC(Application Specific Integrated Circuit)、これらに類するもの、または、これらの組み合わせが用いられる。
【0033】
画像処理部17は、ソフトウェア及びハードウェアの両方で実現されてもよい。画像処理部17がソフトウェア及びハードウェアの両方で実現される場合、そのハードウェアは、ソフトウェアのプログラムを格納する記憶装置(例えばROM、その他の記憶装置)を少なくとも含む。メインコントローラ16についても同様である。
記憶デバイス18は、磁気ディスク、光ディスク等のディスク状の記憶媒体のほか、固体(半導体、誘電体または磁気抵抗)メモリ等の記憶媒体でもよい。
【0034】
サンプルPとしては、例えば、病理サンプルや、人以外の動物、植物などの生体組織サンプルPが用いられる。サンプルPの種類は、特に限定されず、医療分野、薬品分野、食品分野、農業分野等から適宜選択されたサンプルPが用いられればよい。
【0035】
サンプルPは、例えば、樹脂や、パラフィンなどの包埋材に包埋され、サンプルPを含む固形物としてサンプルホルダー8に保持されてもよい。サンプルPは、凍結包埋によるサンプルPとして、サンプルホルダー8により保持されてもよい。サンプルPが凍結包埋される場合、サンプルホルダー8は、図示しない冷却部を有していてもよい。あるいは、サンプルP自体が硬い物体である場合は、サンプルP自体がサンプルホルダー8に保持されても構わない。
【0036】
サンプルPは、撮像が実行される前に、染色が施されていてもよい。染色の種類としては、ヘマトキシリン・エオシン染色(HE染色)など染色液を用いた明視野での染色のほか、IHC(immunohisto chemistry)や、FISH(Fluorescent in situ hybridization)法による染色などが挙げられる。また、DAPI(4',6-diamino-2-phenylindole)による核酸蛍光染色など、蛍光物質を用いた染色法、抗体や核酸プローブなどを用いた染色法などが挙げられる。
【0037】
サンプルPが染色される場合、whole mount法が用いられることで、サンプルPの切断面を染色された状態とすることができる。
【0038】
(動作説明)
図2は、観察装置100の動作を示すフローチャートである。図3は、図2に示す動作を説明するための模式図である。
【0039】
まず、メインコントローラ16は、ブレード7に設けられた回転機構を駆動させ、ブレード7により、サンプルPの上端部を切断する(ステップ101)。サンプルPが切断されると、サンプルPのn層目の切断面が形成される。
【0040】
サンプルPのn層目の切断面が形成されると、メインコントローラ16は、第2の対物レンズ12を介して、サンプルPのn層目の切断面を撮像するように、電子カメラ2を制御する(ステップ102)。このとき、第2の対物レンズ12を介して撮像される画像は、少なくともサンプルPのn層目の切断面全体を包括する範囲内の画像である。
【0041】
メインコントローラ16は、n層目の切断面全体を包括する全体画像データを取得すると、この全体画像データに基づいて、走査領域1Aを設定する(ステップ103)。ここで、走査領域1Aとは、電子カメラ2により、第1の対物レンズ11を介して撮像される撮像範囲2Aが走査される領域を指す(図3(C)参照)。
【0042】
メインコントローラ16は、典型的には、ステップ103において、全体画像データに基づき、n層目の切断面のエッジ検出を実行し(図3(B)参照)、このエッジの内部を包括する領域を走査領域1Aとして設定する(図3(C)参照)。エッジ検出は、例えば、全体画像の輝度情報の閾値判定により実行されればよい。
【0043】
走査領域1Aが設定されると、メインコントローラ16は、レボルバー13の回転機構を駆動させ、第2の対物レンズ12から第1の対物レンズ11へと切り替える(ステップ104)。
【0044】
次に、メインコントローラ16は、設定された走査領域1Aの情報に基づいて、XYステージ15を駆動させることで、サンプルホルダー8をX軸方向及びY軸方向へ移動させる(ステップ105)。
【0045】
サンプルホルダー8が所定の位置まで移動されると、例えば、近赤外線などを利用したアクティブ型の測距方式により、第1の対物レンズ11からサンプルPのn層目の切断面との距離が測定される。メインコントローラ16は、測定された距離に応じて、昇降機構14を昇降させ、フォーカスを調整する(ステップ106)。なお、測距方式は、アクティブ型の測距方式に限られず、例えば、TTL(Through the Lens)方式などのパッシブ型の測距方式が用いられてもよく、測距方式は、特に限定されない。
【0046】
フォーカスが調整されると、メインコントローラ16は、電子カメラ2を制御し、第1の対物レンズ11を介して、n層目の切断面の一部に相当する部分画像を撮像させる(ステップ107)。なお、以降の説明では、電子カメラ2が第1の対物レンズ11を介して、撮像可能な範囲を撮像範囲2Aとして説明する(図3(C)参照)。
【0047】
n層目の切断面の部分画像が撮像されると、メインコントローラ16は、サンプルPの3次元内の位置情報を、XYZステージ4から取得し、部分画像データとともに記憶デバイス18に出力する。記憶デバイス18は、メインコントローラ16から出力された部分画像データと、XYZステージ4の位置情報とをテーブル化して記憶し、保持する(ステップ108)。
【0048】
次に、メインコントローラ16は、走査領域1A内の部分画像データが全て取得されたか否かを判定する(ステップ109)。走査領域1A内の画像が全て取得されていない場合(ステップ109NO)、メインコントローラ16は、XYステージ15を所定の距離だけ移動させる(ステップ105)。この場合、電子カメラ2が、第1の対物レンズ11を介して撮像可能な撮像範囲2Aは、サンプルPの切断面に沿って、走査されるように移動されることになる。
【0049】
以降、走査領域1A内の画像が全て取得されるまで、ステップ105〜ステップ109に示す処理が繰り返される。
【0050】
走査領域1A内の画像が全て取得された場合(ステップ109のYES)、メインコントローラ16は、昇降機構14を上昇させ、サンプルPを上昇させる(ステップ110)。このとき、サンプルPが上昇される距離は、例えば、50μm〜100μmとされるが、この範囲に限られない。サンプルPが上昇される距離は、取得される画像データのZ分解能に相当する。
【0051】
昇降機構14が所定の距離だけ上昇されると、メインコントローラ16は、ブレード7を回転させる。これにより、サンプルPが上昇された距離だけ、サンプルPが切断され、サンプルPのn+1層目の切断面が形成される。
以降、ステップ101〜110に示す処理が、サンプルP全体が切断されるまで実行される。
【0052】
画像処理部17は、部分画像データと、XYZステージ4の位置情報とを記憶デバイス18から取得し、位置情報に基づいて、部分画像データを合成することで、切断面毎の合成画像データを生成する。画像処理部17は、この合成画像データに基づいて、サンプルPの平面画像や、立体画像などの表示画像を表示させる。
【0053】
画像処理部17は、部分画像データを合成する際に、位置の調整や、色調、明るさの補正などの処理を実行してもよい。画像処理部17は、部分画像データに基づいて、任意の断面で切断された立体画像を擬似的に作成し、この立体画像を表示部6に表示させるようにしてもよい。
【0054】
メインコントローラ16は、平面画像や立体画像などの表示画像を、そのまま表示するのではなく、各種の画像解析を実行してもよい。例えば、メインコントローラ16は、特定細胞や特定組織の識別、病変部に特異的な画像的特徴の有無の検出および特徴的な領域の識別、特定遺伝子の発現の有無の検出その空間的分布の解析などの処理を実行してもよい。
【0055】
本実施形態では、上記したように、高倍率な第1の対物レンズ11を介して撮像されたサンプルPの部分画像データを取得し、この部分画像データを合成することで、平面画像データ及び立体画像データを生成している。これにより、ユーザは、高解像度の画像を観察することができる。
【0056】
さらに、本発明では、第2の対物レンズ12を介して撮像された全体画像データに基づいて、走査領域1Aが設定されているため、切断面が新たに形成される毎に、新たに形成される切断面に適した大きさの走査領域1Aを設定することができる。これにより、余計な領域が走査されることを防止することができるので、高速な処理が可能となる。
【0057】
さらに、本実施実施形態では、XYZステージ4の位置情報を部分画像データとともに記録するため、複数の部分画像データから得られる、切断面毎の合成画像データの位置合わせを、記録された位置情報に元に行うことができる。これは、スライドガラス画像を用いたデジタルパソロジーによる立体画像構築と比較して、はるかに簡便であり、高速である。
【0058】
特に、サンプルPが病理サンプルPの場合、高解像度な画像及び高速な処理が要求されることが多い。従って、本実施形態に係る観察装置100は、病理サンプルPを観察する際に、特に大きな効果を奏する。
【0059】
本実施形態の説明では、ステップ104において、検出されたエッジの内部を包括する領域を走査領域1Aとして設定する、として説明した。すなわち、走査領域1Aは、エッジを全て包括する、エッジよりも大きい領域であるとして説明した。しかし、これに限られず、走査領域1Aは、エッジよりも小さい領域であっても構わない。例えば、サンプルPの切断面の中心部分に観察したい領域があるような場合、走査領域1Aをエッジよりも小さい領域として設定するように、メインコントローラ16に制御させても構わない。これにより、ユーザは、サンプルPの必要部分の表示画像を観察することができる。また、このような処理によれば、高速な処理も可能となる。
【0060】
<第2実施形態>
次に、本発明の第2実施系形態について説明する。
【0061】
第2実施形態では、上述の第1実施形態と、走査領域1Aが設定される方法が異なるため、その点を中心に説明する。なお、以降の説明では、上述の第1実施形態と、同様の構成及び機能を有するものについては、同一符号を付し、説明を簡略化、または省略する。
図4は、第2実施形態に係る観察装置100の動作を示すフローチャートである。図5は、図4に示す動作を説明するため模式図である。
【0062】
まず、メインコントローラ16は、ブレード7を駆動させ、ブレード7により、サンプルPの上端部を切断する(ステップ201)。サンプルPが切断されると、サンプルPのn層目の切断面が形成される。
【0063】
サンプルPのn層目の切断面が形成されると、メインコントローラ16は、サンプルPのn−1層目の(前の)切断面の全体画像データが記憶デバイス18に記憶されているか否かを判定する(ステップ202)。ここで、ステップ202において、判定されるn−1層目の切断面の全体画像データは、部分画像データが合成されて形成された、合成画像データであってもよく、第2の対物レンズ12を介して取得された切断面の全体画像データであってもよい。
【0064】
n−1層目の切断面の全体画像データが記憶されていない場合、メインコントローラ16は、走査領域1Aの最大領域である最大走査領域を走査領域1Aとして設定する(ステップ203)。
【0065】
そして、メインコントローラ16は、撮像範囲2Aを最大走査領域内で走査させる(ステップ204〜ステップ207)。この場合、最大走査領域内で、XYステージ15の移動(ステップ204)→フォーカシング(ステップ205)→撮像(第1の対物レンズ11)(ステップ206)→データ保存(ステップ207)→判定(ステップ208)の処理が繰り返される。最大走査領域内で撮像範囲2Aを走査し終えた場合、再びステップ201へ戻る。
【0066】
ステップ202において、n−1層目の切断面の全体画像データが記憶されている場合、メインコントローラ16は、n−1層目の切断面の全体画像データに基づき、n層目の切断面の走査領域1Aを設定する(ステップ209)。典型的には、メインコントローラ16は、n−1層目の画像データのエッジ検出を実行する(図5(A)参照)。そして、メインコントローラ16は、検出されたエッジで囲まれる領域を一定量膨張させた領域(以下、変化領域)を形成する(図5(B)参照)。次に、メインコントローラ16は、変化領域を包括する領域を走査領域1Aとして設定する(図5(C)参照)。
【0067】
走査領域1Aが設定されると、メインコントローラ16は、ステップ204〜ステップ210に示す処理を実行する。
【0068】
本実施形態では、前回の切断面の画像データに基づいて、新たな切断面の走査領域1Aを設定することができるので、余計な領域の走査を省くことができる。これにより、高速な処理が実現される。
【0069】
ステップ202において、メインコントローラ16は、n−1層目の切断面の全体画像データが存在しない場合、第2の対物レンズ12を介して、n層目の切断面の全体画像データを取得してもよい。この場合、メインコントローラ16は、取得されたn層目の全体画像データに基づいて、走査領域1Aを設定し、撮像範囲2Aを走査領域1A内で走査させる。すなわち、メインコントローラ16は、n−1層目の切断面の全体画像データが存在しない場合、図2のステップ102〜109に示す処理を実行しても構わない。
【0070】
上述の説明では、変化領域は、エッジで囲まれる領域が膨張されて形成される、として説明した。しかし、これに限られず、変化領域は、エッジで囲まれる領域が縮小されて形成されてもよい。
【0071】
<第3実施形態>
次に、本発明の第3実施形態について説明する。
【0072】
第3実施形態では、ブレード7により、サンプルPが切断される間隔が可変に制御される点が、上述の各実施形態と異なっている。従って、その点を中心に説明する。
図6は、第3実施形態に係る観察装置100の動作を示すフローチャートである。
【0073】
図6に示すように、まず、メインコントローラ16は、ブレード7を回転させ、サンプルPの端部を切断し、サンプルPのn層目の切断面を形成する(ステップ301)。
【0074】
メインコントローラ16は、サンプルPのn層目の切断面を形成すると、ステップ302〜ステップ306において、図2のステップ105〜109に示した処理と同様の処理を実行する。なお、ステップ301〜306までの処理については、上述の図2に示したステップ101〜109と同様の処理を実行させてもよく、図4に示したステップ201〜208と同様の処理を実行させてもよい。また、上述の各実施形態で示した変形例は、本実施形態に全て適用することができる。
【0075】
サンプルPのn層目の切断面が形成されると、メインコントローラ16は、ステップ302〜306の処理により得られた部分画像データを合成し、合成画像データを生成する。そして、メインコントローラ16は、この合成画像データに基づき、画像解析により画像特徴量を抽出する(ステップ306)。画像特徴量は、例えば、合成画像データの輝度情報などに基づいて判定される。抽出される画像特徴量としては、さまざまなものを指標とすることができるが、本実施形態では、がん細胞の画像パターンを指標とするとして説明する。がん細胞の画像パターンを指標とする場合、がん細胞の大きさを指標としてもよく、切断面の大きさに対するがん細胞の大きさの割合を指標としてもよい。
【0076】
がん細胞の画像パターンを指標として、画像特徴量が判定されると、メインコントローラ16は、がん細胞の大きさに応じた距離分、昇降機構14を上昇させることで、サンプルPを上昇させる(ステップ307)。この場合、サンプルPが上昇される距離は、がん細胞が大きくなるに従って、小さくなるように設定されている。なお、サンプルPが上昇される距離は、上述のように、画像データのZ分解能に相当する。従って、画像データのZ分解能は、がん細胞が大きくなるに従って、上昇する。
【0077】
サンプルPが上昇される距離は、がん細胞が大きくなるに従って、段階的に小さくなってもよく、一次関数的に小さくなってもよい。あるいは、指数関数的に小さくなっても構わない。
【0078】
ところで、癌組織の術中迅速診断を行う場合などにおいては、得られた生体サンプルP中に癌細胞が存在しているか否かを短時間に判定することが求められる場合がある。この場合において、本実施形態では、癌細胞の存在の疑いが高い領域においてのみZ分解能を向上させることができるので、作業時間を短縮することができる。
【0079】
画像特徴量の他の例としては、例えば合成画像データ中に占めるサンプルPの切断面の面積が挙げられる。この場合も、画像特徴量が大きくなるに従って、サンプルPが上昇される距離が小さくなるように設定される。サンプルPが樹脂などの包埋材に包埋・固定化されている場合において、撮影したいサンプルPの切断面に出現してくるまでの間の時間を短縮させることができので、作業効率を向上させることができる。
【0080】
本実施形態では、画像特徴量が大きくなるに従って、サンプルPが上昇される距離が小さくなる場合について説明した。しかし、画像特徴量が大きくなるに従って、サンプルPが上昇される距離が大きくされる形態も考えられる。
【0081】
ここで、使用する画像特徴量、およびそれに応じたZ分解能は、観察したい対象物の性質によって異なる。そこで、あらかじめこれらのパラメータをコンピュータ上に用意しておき、実験を行う際に実験に用いるパラメータをユーザが選択できる機構を取り付けることによって、ユーザの作業効率を向上させることができる。
【0082】
<各種変形例>
上述の各実施形態では、サンプルPがXY方向に移動され、光学系3及び電子カメラ2が固定される形態について説明した。しかし、これに限られず、サンプルPがXY方向で固定され、光学系3及び電子カメラ2がXY方向に移動されるように構成されてもよい。あるいは、サンプルPと、光学系3及び電子カメラ2との両方がXY方向に移動されるように構成されてもよい。すなわち、サンプルPと、光学系3及び電子カメラ2とのXY方向での相対的な位置を変化させることができる形態であれば、どのような形態であってもよい。
【0083】
また、上述の各実施形態では、Z方向への移動は、サンプルPが、光学系3及び電子カメラ2側に移動する形態について説明した。しかし、これに限られず、光学系3及び電子カメラ2が、サンプルP側に移動されても構わない。この場合、光学系3及び電子カメラ2の移動に応じてブレード7もサンプルP側に移動される。
【0084】
上述の各実施形態では、サンプルPの染色は、前処理として、行われるとして説明した。しかし、これに限られず、サンプルPの切断面が形成される毎に、新たに形成された切断面に、染色用薬品を塗布する方法が用いられてもよい。この場合、サンプルPの切断面に対向する位置に、染色用薬品を塗布する塗布機構が配置されればよい。
【0085】
図7は、光学系の他の形態を示す模式図である。
図7に示すように、光学系20は、光源21と、ポラライザ22と、ビームスプリッタ23と、ウェラストンプリズム24と、対物レンズ25と、アナライザ26とで構成される。
【0086】
光源21からの光は、ポラライザ22に入射し、所定の振動方向の直線偏光となる。ポラライザ22からの直線偏光は、ビームスプリッタ23で反射されてウェラストンプリズム24に入射し、振動方向が互いに直行する2つの直線偏光に分離される。この2つの直線偏光は、対物レンズ25を介してほぼ平行な集光光となり、サンプルPの切断面上の異なる位置に垂直に照明される。
【0087】
異なる2つの位置で反射した光は、再び対物レンズ25を介してウェラストンプリズム24に入射し、合成されて同一光路を進む。ウェラストンプリズム24からの2束光は、ビームスプリッタ23を介して、アナライザ26に入射し、同一の振動方向の成分が取り出されて偏光干渉する。その後、偏光干渉した光が電子カメラ2の像面に導かれ、微分干渉像が形成される。
【符号の説明】
【0088】
P…サンプル
1A…走査領域
2A…撮像範囲
2…電子カメラ
3…光学系
4…XYZステージ
5…制御系
6…表示部
7…ブレード
8…サンプルホルダー
11…第1の対物レンズ
12…第2の対物レンズ
13…レボルバー
14…昇降機構
15…XYステージ
16…メインコントローラ
17…画像処理部
18…記憶デバイス
100…観察装置
【特許請求の範囲】
【請求項1】
サンプル、または前記サンプルを含む固形物を保持する保持部と、
前記保持された前記サンプルまたは前記固形物を切断し、順次新たな切断面を形成する切断部と、
前記切断面よりも小さい撮像範囲内の画像であって、前記切断面の一部を含む画像である部分画像を撮像する撮像機構と、
前記撮像範囲を前記切断面に沿って走査させる走査機構と、
前記走査機構を駆動させ、前記撮像機構により前記撮像範囲ごとに前記部分画像を撮像させることで、前記切断面毎に、前記複数の部分画像が合成された画像である、前記切断面の合成画像情報を生成する制御手段と
を具備する観察装置。
【請求項2】
請求項1に記載の観察装置であって、
前記制御手段は、前記切断面が新たに形成される毎に、前記合成画像情報に基づき、撮像範囲が走査される走査領域を設定する
観察装置。
【請求項3】
請求項2に記載の観察装置であって、
前記制御手段は、過去の前記切断面の合成画像情報に基づいて、前記新たに形成された前記切断面に応じた前記走査領域を設定する
観察装置。
【請求項4】
請求項3に記載の観察装置であって、
前記制御手段は、過去の前記切断面の合成画像から前記サンプルに相当する画像のエッジ検出を実行し、前記検出されたエッジの情報に基づいて前記走査領域を設定する
観察装置。
【請求項5】
請求項4に記載の観察装置であって、
前記制御手段は、前記検出されたエッジで囲まれる画像領域を変化させ、前記変化後の画像領域のエッジを包括する領域を、前記走査領域として設定する
観察装置。
【請求項6】
請求項1に記載の観察装置であって、
前記撮像機構は、少なくとも前記サンプルの前記切断面全体を包括する範囲内の画像である全体画像を撮像し、
前記制御手段は、前記切断面が新たに形成される毎に、前記全体画像情報に基づいて、前記切断面に応じた前記走査領域を設定する
観察装置。
【請求項7】
請求項1に記載の観察装置であって、
前記制御手段は、前記サンプルが前記切断部により切断される間隔を可変に制御する
観察装置。
【請求項8】
請求項7に記載の観察装置であって、
前記制御手段は、前記合成画像情報に基づき、前記サンプルの画像中の特徴量を抽出し、前記抽出された特徴量に応じて、前記間隔を可変に制御する
観察装置。
【請求項9】
請求項8に記載の観察装置であって、
前記制御手段は、前記特徴量が増加するに従って、前記間隔を小さくするように、前記間隔を制御する
観察装置。
【請求項1】
サンプル、または前記サンプルを含む固形物を保持する保持部と、
前記保持された前記サンプルまたは前記固形物を切断し、順次新たな切断面を形成する切断部と、
前記切断面よりも小さい撮像範囲内の画像であって、前記切断面の一部を含む画像である部分画像を撮像する撮像機構と、
前記撮像範囲を前記切断面に沿って走査させる走査機構と、
前記走査機構を駆動させ、前記撮像機構により前記撮像範囲ごとに前記部分画像を撮像させることで、前記切断面毎に、前記複数の部分画像が合成された画像である、前記切断面の合成画像情報を生成する制御手段と
を具備する観察装置。
【請求項2】
請求項1に記載の観察装置であって、
前記制御手段は、前記切断面が新たに形成される毎に、前記合成画像情報に基づき、撮像範囲が走査される走査領域を設定する
観察装置。
【請求項3】
請求項2に記載の観察装置であって、
前記制御手段は、過去の前記切断面の合成画像情報に基づいて、前記新たに形成された前記切断面に応じた前記走査領域を設定する
観察装置。
【請求項4】
請求項3に記載の観察装置であって、
前記制御手段は、過去の前記切断面の合成画像から前記サンプルに相当する画像のエッジ検出を実行し、前記検出されたエッジの情報に基づいて前記走査領域を設定する
観察装置。
【請求項5】
請求項4に記載の観察装置であって、
前記制御手段は、前記検出されたエッジで囲まれる画像領域を変化させ、前記変化後の画像領域のエッジを包括する領域を、前記走査領域として設定する
観察装置。
【請求項6】
請求項1に記載の観察装置であって、
前記撮像機構は、少なくとも前記サンプルの前記切断面全体を包括する範囲内の画像である全体画像を撮像し、
前記制御手段は、前記切断面が新たに形成される毎に、前記全体画像情報に基づいて、前記切断面に応じた前記走査領域を設定する
観察装置。
【請求項7】
請求項1に記載の観察装置であって、
前記制御手段は、前記サンプルが前記切断部により切断される間隔を可変に制御する
観察装置。
【請求項8】
請求項7に記載の観察装置であって、
前記制御手段は、前記合成画像情報に基づき、前記サンプルの画像中の特徴量を抽出し、前記抽出された特徴量に応じて、前記間隔を可変に制御する
観察装置。
【請求項9】
請求項8に記載の観察装置であって、
前記制御手段は、前記特徴量が増加するに従って、前記間隔を小さくするように、前記間隔を制御する
観察装置。
【図1】


【図2】


【図4】


【図5】


【図6】


【図7】


【図3】




【図2】


【図4】


【図5】


【図6】


【図7】


【図3】


【公開番号】特開2010−230495(P2010−230495A)
【公開日】平成22年10月14日(2010.10.14)
【国際特許分類】
【出願番号】特願2009−78578(P2009−78578)
【出願日】平成21年3月27日(2009.3.27)
【出願人】(000002185)ソニー株式会社 (34,172)
【Fターム(参考)】
【公開日】平成22年10月14日(2010.10.14)
【国際特許分類】
【出願日】平成21年3月27日(2009.3.27)
【出願人】(000002185)ソニー株式会社 (34,172)
【Fターム(参考)】
[ Back to top ]

