解析用容器及び生化学的解析方法
【課題】微量な検体を対象とし、複数種類の生化学的解析に適用できる解析用容器を提供する。
【解決手段】プレート表面に、平坦な底面12aを有するウェル12が形成され、前記ウェルの底面12a及び側面12bが同じ材質からなり、前記ウェルの底面12aにおける厚みが0.12〜0.29mmであり、前記ウェルの底面12aの面積が2mm2以下であり、4〜120℃において耐熱性を有する材質からなる解析用容器1;かかる解析用容器1を使用して、細胞イメージング、核酸増幅及び蛍光検出を含む一種以上の解析を行う生化学的解析方法。
【解決手段】プレート表面に、平坦な底面12aを有するウェル12が形成され、前記ウェルの底面12a及び側面12bが同じ材質からなり、前記ウェルの底面12aにおける厚みが0.12〜0.29mmであり、前記ウェルの底面12aの面積が2mm2以下であり、4〜120℃において耐熱性を有する材質からなる解析用容器1;かかる解析用容器1を使用して、細胞イメージング、核酸増幅及び蛍光検出を含む一種以上の解析を行う生化学的解析方法。
【発明の詳細な説明】
【技術分野】
【0001】
本発明は、生化学分野で使用する解析用容器及び該解析用容器を使用する生化学的解析方法に関する。
【背景技術】
【0002】
ヒトゲノムの解読は、1980年代後半にその計画の議論が始まり、1990年頃から国際協力の下に進められてきた。そして2003年には、最初のゴールである全ゲノムの構造決定がほぼ終わり、本格的なゲノム研究時代に突入した。ゲノム研究時代を迎え、タンパク質や糖の構造・機能解析や、疾患と関連したSNPs解析等の研究の促進がはかられている。
【0003】
そして近年は、核酸の抽出、増幅反応、検出反応、あるいはタンパク質の検出反応などを、微量な検体を用いて小容量の容器中で行うμ−Total Analysis System技術やLab−on Chip技術についての研究が盛んに行われている。
小容量の容器としては、スライドガラス上にプローブDNAを配置し、これに検体を作用させて目的のDNAの検出するようにしたもの(特許文献1参照) や、ガラスや樹脂などのプレートにウェルと呼ばれる微小な凹部を形成し、ウェル内で検出反応を行うようにしたものなどが知られている。ウェルが形成された容器としては、例えば、検出反応を行うためのウェルだけでなく、核酸増幅を行うためのウェル、さらにはこれらとは異なる目的で液体を収容するためのウェルを備えたものが開示されている(特許文献2参照)。ここでは、例えば、検出反応を行うウェルであれば、低自家蛍光性及び高光透過性等の光学特性を有するなど、各ウェルが、それぞれの用途に適した特性の材質で、適切な形状に成型されている。
【0004】
一方、近年は、ゲノム、タンパク質、糖鎖などについて、それぞれの構造及び機能を別々に解析することの限界が議論されており、システムバイオロジーの必要性が強調されている。そのような中で、個々の細胞の機能や形状の違いを、個々の細胞における遺伝子やタンパク質の発現に関する時間的空間的挙動の解析等に基づいて、一細胞レベルで抱括的にとらえようとする試みがなされている。
上記技術分野では、これまでに様々な解析技術が提供されてきており、具体的には、細胞内の画像解析を3次元的に行う共焦点光学顕微鏡を使用する解析方法、一細胞ないし細胞数個レベル等、微量な細胞で遺伝子解析を行うPCRデバイスを使用した解析方法、微量溶液中の核酸やタンパク質等の生体分子間の相互作用解析を可能とする蛍光相関分光法を使用した解析方法等が例示できる。
【先行技術文献】
【特許文献】
【0005】
【特許文献1】特表平11−512293号公報
【特許文献2】特開2006−349559号公報
【発明の概要】
【発明が解決しようとする課題】
【0006】
しかしながら、これらの解析技術に使用する解析用容器は、それぞれ目的に応じて形状に制約があるだけでなく、必要とされる光学特性、耐熱性等に応じて材質にも制約があり、共通の容器を使用して複数種類の解析を連続的に行うことが困難であるという問題点があった。さらに、その結果として、複数種類の高度な機能を複合化した解析技術や装置の開発が進展しないという問題点があった。
【0007】
本発明は上記事情に鑑みてなされたものであり、微量な検体を対象とし、複数種類の生化学的解析に適用できる解析用容器を提供することを課題とする。
【課題を解決するための手段】
【0008】
上記課題を解決するため、
請求項1に記載の発明は、プレート表面に、平坦な底面を有するウェルが形成された解析用容器であって、前記ウェルの底面及び側面が同じ材質からなり、前記ウェルの底面における厚みが0.12〜0.29mmであり、前記ウェルの底面の面積が2mm2以下であり、4〜120℃において耐熱性を有する材質からなることを特徴とする解析用容器である。
請求項2に記載の発明は、前記ウェルが複数形成されていることを特徴とする請求項1に記載の解析用容器である。
請求項3に記載の発明は、隣り合う前記ウェルの底面中心間の距離が、2.25mmの整数倍であることを特徴とする請求項2に記載の解析用容器である。
請求項4に記載の発明は、マイクロタイタープレートに関するSBS規格(ANSI/SBS 1)又はスライドガラスに関するJIS規格(JIS R 3703)に対して同等以下の大きさを有することを特徴とする請求項1〜3のいずれか一項に記載の解析用容器である。
請求項5に記載の発明は、シクロオレフィン系樹脂又はメチルペンテン系樹脂からなることを特徴とする請求項1〜4のいずれか一項に記載の解析用容器である。
請求項6に記載の発明は、無色透明な材質からなることを特徴とする請求項1〜5のいずれか一項に記載の解析用容器である。
請求項7に記載の発明は、請求項1〜6のいずれ一項に記載の解析用容器を使用して、細胞イメージング、核酸増幅及び蛍光検出を含む一種以上の解析を行うことを特徴とする生化学的解析方法である。
【発明の効果】
【0009】
本発明によれば、微量な検体を使用する複数種類の生化学的解析を共通の容器で行うことができる。したがって、解析工程を簡略化でき、低コストで解析できる。また、複数種類の種々の解析を複合化して行うことができるので、従来よりも高度な解析が可能となる。
【図面の簡単な説明】
【0010】
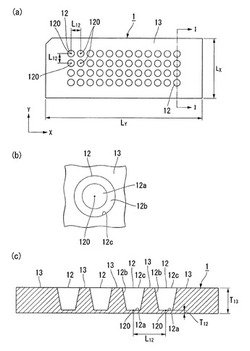
【図1】本発明の第一の実施形態に係る解析用容器を例示する図であり、(a)は平面図、(b)はウェルの拡大平面図、(c)は(a)のI−I線における断面図である。
【図2】本発明の第一の実施形態に係る解析用容器をアダプターに装着した状態を例示する概略図である。
【図3】本発明の第二の実施形態に係る容器を例示する図であり、(a)はウェルの拡大平面図、(b)は断面図である。
【図4】本発明の第三の実施形態に係る容器を例示する図であり、(a)はウェルの拡大平面図、(b)は断面図である。
【図5】本発明の第四の実施形態に係る容器を例示する拡大断面図である。
【図6】実施例1における倒立顕微鏡での観察画像の撮像データであり、(a)はエンテロウィルスを接種していないもの、(b)はエンテロウィルスを接種したものの撮像データである。
【図7】実施例1におけるPCR時のカイネティックコンピュータによる各反応領域の蛍光強度の算出結果を示すグラフである。
【発明を実施するための形態】
【0011】
以下、図面を参照しながら、本発明について詳しく説明する。
本発明に係る解析用容器(以下、「容器」と略記することがある)は、プレート表面に、平坦な底面を有するウェルが形成された解析用容器であって、前記ウェルの底面及び側面が同じ材質からなり、前記ウェルの底面における厚みが0.12〜0.29mmであり、前記ウェルの底面の面積が2mm2以下であり、4〜120℃において耐熱性を有する材質からなることを特徴とする。
【0012】
(第一の実施形態)
図1は本発明の第一の実施形態に係る容器を例示する図であり、(a)は平面図、(b)はウェルの拡大平面図、(c)は(a)のI−I線における断面図である。
容器1は、プレートの表面に凹状のウェル12が12個ずつ4列に合計48個並設されたものである。
ウェル12は略円錐台形状であり、直径D12の略円形状である底面12aから開口部12cへ向けて漸次内径が拡大されている。そして、底面12aと開口部12cの開口面とは同心状となっている。また、底面12aは平坦になっており、容器の裏面側から光を照射した時も、光シグナルを高精度に検出でき、光学的な解析を高精度に行うことができるようになっている。
【0013】
容器1のうち、ウェル12の底面12aにおける厚みはT12、ウェル12が設けられていない平坦面13における厚みはT13である。
隣り合うウェル12同士は、図示するX軸方向及びY軸方向のいずれにおいても、底面12aの中心120間の距離が一様にL12となるように配置されている。
【0014】
容器1の材質は、4〜120℃において耐熱性を有するものである。前記温度範囲は、想定される容器1の用途の中でも、最も広範な温度変化を伴うと考えられる核酸増幅反応時の設定温度を包含する。ここで「耐熱性を有する」とは、加熱により変形、割れやひび等の形状劣化、あるいは成分の変質又は漏出等を生じないことを指す。また「核酸増幅反応」とは、例えば、PCR(Polymerase Chain Reaction、ポリメラーゼ連鎖反応)法等、公知のすべての手法を指す。さらに「核酸」とは、DNA、RNA、その他のオリゴヌクレオチド又はポリヌクレオチド等を指す。
細胞イメージングや蛍光検出を伴う光学的な解析を行う場合には、容器は通常、4℃〜室温程度で安定であれば十分であるが、上記のような耐熱性を併せ持つことにより、容器1は光学的な解析と核酸増幅反応のいずれにも適用できる。なお、本発明において、「光学的な解析」とは、測光操作を伴う解析のことを指し、例えば、細胞の画像解析、蛍光相関分析、その他の蛍光検出を伴う解析等が挙げられ、公知のすべての解析が対象となる。
【0015】
容器1の材質は、なかでも精密加工・成型性、光透過性、低複屈折性及び低吸湿性のすべての特性を有するものが好ましい。
精密加工・成型性を有する材質を使用すれば、微量な検体の取り扱いに好適な容器を容易に作製できる。特に、1mm以下のサイズで加工及び成型が容易な材質が好ましい。
また、光透過性及び低複屈折性を有する材質を使用すれば、細胞イメージングや蛍光検出を伴う光学的な解析を高精度に行うことができる。特に、無色透明な材質が好ましく、透明ガラスと同程度の光透過性を有する材質がより好ましい。無色透明な材質を使用することで、ノイズを低減できると共に、容器の表面及び裏面のいずれから光を照射しても解析を行うことができる。さらに、低複屈折性を有することにより、例えば、蛍光画像の結像性が向上し、その結果、細胞変性効果(CPE)が確認し易くなるなど、検体中のウィルスの有無の確認や種類の特定を一層高精度に行うことができる。
また、低吸湿性を有する材質を使用すれば、容器の変形を抑制できる共に、ウェル中の検体を安定して保持できるので、高精度な解析が可能となる。
【0016】
通常、生化学分野で汎用される解析用容器は、ポリカーボネート、ポリプロピレン、フッ素系樹脂、シリコン樹脂等の材質からなる。しかしこれら材質は、上記特性をすべて有するものではない。
これに対し、上記特性をすべて有し、容器1の材質として好ましいものとしては、シクロオレフィン系樹脂(例えば、日本ゼオン株式会社製のゼオネックス(登録商標)、ゼオノア(登録商標))、ポリメチルペンテン等のメチルペンテン系樹脂(例えば、三井化学株式会社製のTPX(登録商標))が例示できる。
【0017】
ここに示すように、容器1は全体が同じ材質からなる。これにより、底面12aと側面12bとは熱膨張係数が同じなので、ウェル12に温度変化が生じても、応力の発生が抑制され、変形や、割れやひび等の形状劣化が抑制される。また、容器1を容易に製造できる。
なお、本発明において、容器は必ずしも全体が同じ材質からなるものでなくても良く、少なくともウェルの底面及び側面が同じ材質からなるものであれば良い。
このように、少なくともウェルの底面12a及び側面12bが同じ材質からなることで、容器1は、光学的な解析だけでなく、広範な温度変化を伴う核酸増幅反応にも適用できる。
これに対し、主に光学特性を重視した従来の容器(例えば、オリンパス株式会社製のガラスボトムプレート)は、細胞イメージングや蛍光検出等の光学的な解析には好適だが、ウェルの底面及び側面の材質が異なるため、変形や、割れやひび等の形状劣化が生じ易い。したがって、材質が耐熱性を有していても、結果的に容器としての耐熱性が不十分である。
【0018】
容器1において、前記厚みT12は、0.12〜0.29mmである。このような範囲とすることにより、容器の光学特性が向上する。特に、T12の上限を0.29mmとすることで、従来の容器よりも、光透過性及び低複屈折性等の光学特性が向上する。その結果、このような光学特性を有する材質を使用した場合と同様の効果が得られる。
そして、前記厚みT12は、光学特性及び取り扱い性を考慮すると、市販品のカバーガラス(例えば、松浪硝子工業株式会社製のマイクロカバーガラス等)の厚みと同等であることが好ましく、市販品の共焦点画像解析装置(例えば、オリンパス株式会社製のMF20(商品名)等)やハイコンテンツスクリーニング装置で使用されるガラスボトムプレート(例えば、オリンパス株式会社製、ワットマンジャパン株式会社製のガラスボトムプレート)の厚みと同等であることが好ましい。このような条件を満たすためには、例えば、T12を0.15〜0.19mmとすれば良い。
このように、厚みT12が上記範囲に設定された容器1は、光学的な解析と核酸増幅反応のいずれにも適用できる。
これに対し、ウェル底面における厚みが0.3mm以上である従来の容器(例えば、特開2007−175003号公報参照)は、細胞培養や核酸増幅反応に使用するのには好適である。しかし、細胞の画像解析装置や蛍光相互解析装置等、カバーガラスと同等の厚みの基材を介して光学的な解析を行う装置に対して使用するのには適していない。
【0019】
また、容器1において、前記厚みT13は特に限定されるものではなく、目的に応じて適宜設定し得る。ただし、熱伝導率と取り扱い性を考慮すると、0.5〜10mmであることが好ましく、1〜3mmであることがより好ましい。このような範囲とすることで、容器1は、優れた熱伝導率と十分な強度とを兼ね備えたものになるので、解析精度及び取り扱い性が一層向上する。
【0020】
容器1において、前記L12は、例えば、SBS規格等の規格に準拠した従来のマイクロタイタープレートにおける、隣り合うウェル底面の中心間距離と略同等であることが好ましい。そのためには、L12を2.25mmの整数倍とすることがより好ましい。例えば、従来の1536穴のマイクロタイタープレートにおける前記中心間距離は約2.25mmであり、384穴の場合の前記中心間距離は約4.5mm、96穴の場合の前記中心間距離は約9.0mmである。
前記L12をこのように設定することで、複数の液体試料を同時に分注するために通常使用される自動分注機(例えば、テカンジャパン株式会社製の小型自動分注機MSP2950(商品名))、多連型マイクロピペット(例えば、Eppendorf社製のリサーチマルチチャネル(商品名))を、容器1に対してもそのまま使用できる。これにより、多数の検体も効率良く分注でき、作業の簡略化と時間短縮が可能となる。その結果、作業ミスが低減でき、低コストで解析できる。
【0021】
容器の厚みが薄い部位では、その部位の表面積が大きいほど、成型時や解析時の温度変化に伴って歪みが生じ、変形し易い。特に厚みが0.29mm以下という小さい値の場合には、容器の温度変化時における熱膨張や熱収縮に伴い、大きな歪みが生じ易い。このような歪みは、容器の中でも特にウェルの底面で発生すると、解析に支障をきたし、容器が実用に適さないものとなってしまう。
そこで本発明においては、ウェル12の底面12aの面積を2mm2以下としている。このようにすることで、厚みT12が0.29mm以下でも、温度変化時における底面12aの変形が抑制される。このように底面12aの平面性を維持することで、複屈折のばらつきが抑制され、光学特性が安定し、光学的な解析を高精度に行うことができる。また、容器1は、加熱を伴う解析にも好適なので、PCR法等の核酸増幅法も適用できる。その結果、例えば、検体が微量でもウィルス等の種類の特定が容易になる。また、ウェル12への溶液の充填量が少なくて済むので、微量な検体の解析に好適である。
本発明は、容器のウェル底面における厚みが薄い場合でも、ウェル底面の面積を所定の範囲に設定することで、温度変化に伴うウェル底面の変形を抑制できることを見出して、なされたものである。そして、ウェル底面における厚み及びウェル底面の面積を、それぞれ特定の範囲に設定して組み合わせることで、ウェル底面の変形を効果的に抑制するものである。
【0022】
容器1において、開口部12cの開口面積は特に限定されず、例えば、容器1の大きさや、ウェル12の数等を考慮して適宜調整すれば良い。
【0023】
容器1の大きさ、すなわちX軸方向の長さLX及びY軸方向の長さLYは、特に限定されない。従来のマイクロタイタープレートで採用されているSBS規格(ANSI/SBS 1)や、スライドガラスで採用されているJIS規格(JIS R 3703)等のいずれかの規格に準拠して設定することが好ましい。既存の解析装置は、上記のような規格に準拠した容器の使用を前提として、容器保持部や駆動部が設計されているものが多い。そこで、大きさをこれら規格に準拠して設定することで、容器1を従来の解析装置にそのまま設置して使用できるようになる。
【0024】
また、これら規格よりも小さい大きさの容器1であれば、例えば、アダプターを装着して従来の解析装置に設置するようにしても良い。アダプターとしては、前記SBS規格やJIS規格等のいずれかの規格に準拠した大きさであり、容器1を保持する手段を有していれば良い。このようなアダプターに装着した状態の容器1の概略図を図2に例示する。
図2中、アダプター9は、略四角形状のプレートの4辺のうち3辺の周縁部を残すように切欠部90を設けた、角型の略C字状プレートである。表面9A及び裏面9Bは平坦である。そして、一端から他端へ向けて、内周上に溝91が延設されている。容器1は、図の矢印方向から、対向する第一周縁部1A及び第二周縁部1Bをそれぞれ、アダプター9の第一短腕部92及び第二短腕部93の前記溝91に係合させつつアダプター9に挿入し、第三周縁部1Cをアダプター9の長腕部94の前記溝91により係止させることで、アダプター9に装着される。
【0025】
溝91の幅W1は、容器1の前記厚みT13と同等か、又はT13よりもやや大きい値に設定すれば良い。
そして、溝91の深さW2は、容器1の前記LX及びLYを考慮して設定すれば良く、少なくとも第一短腕部92及び第二短腕部93の溝91の底面間距離Z1を、容器1のLXと同等か、又はLXよりもやや大きい値に設定すれば良い。そして、長腕部94の溝91の底面からこれに対して垂直な方向に第一短腕部92又は第二短腕部93の先端部までの距離Z2を、容器1のLYと同等か、又はLYよりも大きい値に設定することが好ましい。
アダプター9の大きさ、すなわち、長腕部94の長手方向の長さ、及び第一短腕部92又は第二短腕部93の長手方向の長さは、前記SBS規格やJIS規格等の各種規格に準拠して設定すれば良い。また、アダプター9の厚みT9は、各種解析装置への設置のし易さ等を考慮して、適宜調製すれば良い。
【0026】
アダプター9の材質は特に限定されないが、容器1に適用し得る材質であることが好ましく、組み合わせる容器1と同じ材質であることがより好ましい。また、核酸増幅反応等、広範な温度変化を伴う解析に使用することを考慮すると、熱伝導率が高い材質が好ましく、このようなものとして具体的には、ステンレス、アルミニウム等の各種金属又は合金が例示できる。
【0027】
アダプター9には切欠部90が設けられているので、容器1をアダプター9に装着してもウェル12が露出され、アダプター9の表面9A側及び裏面9B側のどちら側からでも、ウェル12に光を照射できる。したがって、アダプター9に装着した容器1は、前記SBS規格やJIS規格等のいずれかの規格に準拠した容器と同様に、従来の解析装置に設置できるので、解析も容易に行うことができる。
【0028】
なお、容器1を装着するアダプターとしては、図2に例示するものに限定されず、本発明の効果を損なわない範囲内で、一部構成の変更、追加又は省略が適宜可能であることは言うまでもない。例えば、切欠部を有していれば、アダプターの形状は略C字状に限定されず、例えば、略四角形状のプレートの4辺の周縁部をすべて残すように切欠部を設けた、角型の略O字状プレートでも良い。また、ここでは、内周上に設けた溝に容器周縁部を係合させることで容器を保持する形態のアダプターについて説明したが、容器を保持する形態もこれに限定されるものではない。例えば、溝が設けられていないこと以外は上記と同様のプレート表面に、弾性を有する材質からなる爪状の止め具を複数個設け、これら止め具を使用して容器平面をプレート表面に押圧することで容器を保持するようにしても良い。
【0029】
(第二の実施形態)
図3は、本発明の第二の実施形態に係る容器を例示する図であり、(a)はウェルの拡大平面図、(b)は断面図である。
ここに示す容器2は、ウェル22の側面22bと、ウェル22が設けられていない平坦面23に沿って、その厚みが第一の実施形態よりも薄くされたものである。そして、ウェル22の形状及び大きさは、第一の実施形態と同様である。
【0030】
容器22のうち、ウェル22の底面22aにおける厚みT22aは、第一の実施形態におけるとT12と同様である。
また、前記平坦面23における厚みT23及び側面22bにおける厚みT22bは、いずれも特に限定されるものではなく、目的に応じて適宜設定すれば良い。ただし、容器2の強度及び取り扱い性を考慮すると、T23及びT22bは、前記T22aよりもやや厚めに設定することが好ましく、0.3〜1mmであることが好ましく、0.4〜0.7mmであることがより好ましい。T23及びT22bは必ずしも同じである必要性はないが、同じである方が容器2を容易に製造できる点で好ましい。
また、容器2は、T23が薄いため、第一の実施形態における容器1よりも熱伝導性に優れる。したがって、平坦面23と、ウェル22の底面側外表面24との間の距離(すなわち、容器2の平坦面23における高さ)H23は、主に取り扱い性を考慮して設定すれば良く、0.5〜12mmであることが好ましく、2〜5mmであることがより好ましい。このような範囲とすることにより、解析精度及び取り扱い性が一層向上する。
【0031】
上記の点以外は、容器2は、第一の実施形態と同様である。
【0032】
(第三の実施形態)
図4は、本発明の第三の実施形態に係る容器を例示する図であり、(a)はウェルの拡大平面図、(b)は断面図である。
ここに示す容器3は、プレートの表面に凹状のウェル32が並設され、ウェル32が設けられていない面が平坦面33とされている点は第一の実施形態と同様であるが、ウェル32の形状が第一の実施形態と異なる。ウェル32は、略円錐台形状の凹部が二つ積重ねられた形状であり、平坦面33側のウェル上部321は、これよりも下側のウェル下部322よりも内径が大きくなっている。また、ウェル上部321及びウェル下部322は同心状となっている。そして、ウェル上部321の底面321a内に、ウェル下部322の開口部322cが配置されており、ウェル上部321の側面321bは、前記底面321aを介してウェル下部322の側面322bに連接されている。
ウェル上部321では、底面321aから開口部321cへ向けて漸次内径が拡大されている。同様に、ウェル下部322では、底面322aから開口部322cへ向けて漸次内径が拡大されている。そして、前記底面321aの直径D321aは、前記開口部322cの開口径D322cよりも大きくなっている。
【0033】
ウェル下部322の底面322aの大きさ及び形状は、第一の実施形態における底面12aと同様で良い。
また、容器3のうち、前記底面322aにおける厚みT32は、第一の実施形態におけるT12と同様である。さらに、平坦面33における厚みT33は、第一の実施形態におけるT11と同様である。
ウェル上部321の高さH321と、ウェル下部322の高さH322との比は、特に限定されず、目的に応じて適宜選択すれば良い。
ウェル上部321及びウェル下部322は互いに相似形でも良いし、異なる形状でも良い。
このように、ウェルを、略円錐台形状の凹部が二つ積重ねられた形状とすることで、ウェルへ充填するサンプルの量を幅広く設定することが可能となる。例えば、ウェル上部を設け、その開口部の面積を拡大することで、第一の実施形態のウェルよりも、充填可能なサンプル量を増量できる。一方、ウェル下部を設け、その底面の面積を縮小することで、第一の実施形態のウェルよりも、充填可能なサンプル量が少なくなるが、微量なサンプルを局所的に集液することで、解析を容易に行うことができる。
【0034】
上記の点以外は、容器3は、第一の実施形態と同様である。
【0035】
(第四の実施形態)
図5は、本発明の第三の実施形態に係る容器を例示する拡大断面図である。
ここに示す容器4は、ウェル42の側面421b、422b、底面421aと、ウェル42が設けられていない平坦面43に沿って、その厚みが第三の実施形態よりも薄くされたものである。そして、ウェル42の形状及び大きさは、第三の実施形態と同様である。
容器4のうち、ウェル下部422の底面422aにおける厚みT422aは、第一の実施形態におけるとT12と同様である。
また、前記平坦面43における厚みT43、ウェル上部421の側面421bにおける厚みT421b、底面421aにおける厚みT421a、ウェル下部422の側面422bにおける厚みT422bは、いずれも特に限定されるものではなく、目的に応じて適宜設定すれば良い。ただし、容器4の強度及び取り扱い性を考慮すると、前記T422aよりもやや厚めに設定することが好ましく、第二の実施形態におけるT23等と同様であることが好ましい。また、前記T421a、T421b及びT422bは、必ずしもすべて同じである必要性はないが、すべて同じである方が容器4を容易に製造できる点で好ましい。
容器4は、T43が薄いため、第三の実施形態における容器3よりも熱伝導性に優れる。したがって、平坦面43と、ウェル42の底面側外表面44との間の距離(すなわち、容器4の平坦面43における高さ)H43は、第二の実施形態におけるH23と同様であることが好ましい。このような範囲とすることにより、解析精度及び取り扱い性が一層向上する。
【0036】
本発明の容器は、上記第一〜第四の実施形態として示したいずれかの容器に限定されるものではなく、本発明の効果を損なわない範囲内で、一部構成の変更、追加又は省略が適宜可能であることは言うまでもない。
例えば、ウェルの形状は略円錐台形状以外でも良く、さらに、底面から開口部へ向けて漸次内径が拡大されていなくても良い。ただし、底面の面積は開口部の面積に対して同等以下であることが好ましい。また、ウェルの底面と開口部の開口面とは必ずしも同心状でなくても良い。
また、隣り合うウェル同士は、前記X軸方向及びY軸方向において、底面の中心部間の距離がすべて同じでなくても良い。
また、第三及び第四の実施形態のように、ウェルが上部及び下部の二つの部位に分けられる場合には、上部及び下部は必ずしも同心状でなくても良い。
そして、ウェルの数は目的に応じて設定すれば良く、一つ以上であればいずれでも良い。例えば、一列あたりのウェルの数や、一容器あたりのウェルを並設した列の数も、適宜調整すれば良い。ただし、効率的に解析を行うために、ウェルの数は多いほど好ましい。ウェルの数を増やすことで、ハイコンテンツスクリーニング(HCS)のような、多数の検体の解析も容易に行うことができる。
【0037】
本発明の容器は、射出成型法、インサート成形法等、公知の方法で所望の形状に成型することで得られる。また、例えば、特に第二及び第四の実施形態のように、全体の厚みが薄い容器の場合には、上記方法に加え、所定の型の上に加熱して軟化させたシート状の材料を載置し、型とシートとの間を減圧することでシートを型に圧着させて成型する、所謂真空法によっても好適に得られる。なかでも本発明においては、インサート成形法が特に好ましい方法として挙げられる。
一方、本発明の容器を装着するアダプターは、容器の形状を考慮して設計し、例えば、射出成型等、公知の方法で成型した部材同士を接着したり、所定の成型品に対して適宜打ち抜き、切削等、公知の手法で加工を行うなど、種々の方法で作製できる。
【0038】
本発明の解析用容器は、そのウェル内に充填した液体の蒸発を防止する手段を適用するのにも好適である。蒸発を防止する手段は特に限定されないが、ウェルの開口部をシールで封止したり、ウェル内の液体の露出面をオイルで被覆する方法が好ましい。
シールやオイルは、目的に応じて適宜選択すれば良い。例えば、ポリメラーゼ連鎖反応(PCR)法をはじめとする核酸増幅反応等、加熱操作を必要とする場合には、耐熱性を有するものを使用することが好ましい。また、細胞イメージングや蛍光検出等の光学的な解析を容器の表面側から行う場合には、低自家蛍光で透明なものを使用することが好ましい。このように蒸発を防止することで、一層高精度に解析できる。
さらにシールは、ウェルの開口部を封止する部位において、ウェル側の面とその反対側の面の両面がともに平坦である部位を有することが好ましく、該平坦部位の面積が広いほど好ましい。このようにすることで、容器の表面側からの光学的解析を、一層高精度に行うことができる。
透明でかつ前記平坦部位を有するシールとしては、好ましい市販品として、アブソリュートQPCRシール(ABgene社製)、リアルタイムPCR用プレートシール(株式会社ベックス製)等が例示できる。
【0039】
本発明によれば、微量な検体を対象に、測光操作を伴う光学的な解析と、核酸増幅等の大きな温度変化を伴う解析とを、各解析間で検体の移液操作や分注操作を行うことなく、同一ウェル中で連続的に行うことができる。そして本発明は、例えば、細胞イメージング、核酸増幅及び蛍光検出を必須の工程として含む一種以上の解析を行うのに特に好適である。これは、容器のウェル底面における厚み及びウェル底面の面積として、特に最適な範囲の組み合わせを見出し、さらに、容器の材質、ウェルの底面及び側面の材質を限定することで達成されたものである。
このように、複数種類の解析を、同一ウェル中で連続的に行うことで、解析工程を簡略化できる。また、複数種類の種々の解析を複合化して行うことができるので、従来よりも高度な解析が可能となる。
また、容器を透明な材質からなるものとすれば、アダプターの装着の有無によらず、容器の表面及び裏面のいずれからも光シグナルを検出でき、光学的な解析が可能となる。
【実施例】
【0040】
以下、具体的実施例により、本発明についてさらに詳しく説明する。ただし、本発明は、以下に示す実施例に何ら限定されるものではない。
(実施例1)
図1に示す本発明の容器1を使用して、以下の手順に従って解析を行った。なお、容器1としては、大きさが75.6mm×25mm、厚みT13が3mm、ウェル2底面の面積が0.8mm2、ウェル2底面における厚みT12が0.19mm、材質がシクロオレフィン系樹脂(ゼオネックス(登録商標)、日本ゼオン株式会社製)であるものを使用した。
【0041】
(I)細胞変性効果(CPE)の確認
(1)本発明の容器のウェル中でGNK細胞を成育させ、次いでGNK細胞にエンテロウィルス(Echo9)を接種して33℃で培養を行ったものと、エンテロウィルス(Echo9)を接種せずに33℃で培養を行ったものをそれぞれ調製した。
(2)培養後の前記容器をそれぞれ倒立顕微鏡に設置して、容器の裏面側からCPEを確認した。
その結果、図6に示す通り、前記エンテロウィルスを接種したものとしていないものとでGNK細胞の形状が異なり、CPEを明確に確認できた。なお、図6はこの時の倒立顕微鏡での観察画像の撮像データであり、(a)はエンテロウィルスを接種していないもの、(b)はエンテロウィルスを接種したものの撮像データである。
【0042】
(II)核酸増幅反応及び蛍光強度の検出
Applied Biosystems社製のTaq Man Gene Expression Cell−to Ct Kit(商品名)と、前記(I)でCPEを確認したGNK細胞を使用して、以下の手順に従ってリアルタイムPCR解析を行った。なお、ここでは、CPEが確認された細胞が存在しなかったサンプル、CPEが確認された細胞数の少ないサンプル、CPEが確認された細胞数の多いサンプルをそれぞれ使用して解析を行った。
(1)ウェルにPBSを5μl分注して洗浄し、その後PBSを除去して細胞を洗浄した。
(2)洗浄後、ウェルにLysis Solutionを5μl加えてピペッティングを5回行い、次いで、蒸発防止用のオイルを2μl分注して、室温で5分間インキュベートを行い、細胞を溶解させた。
(3)溶解後、ウェルにStop Solutionを0.5μl加えてピペッティングを5回行い、次いで室温で2分間インキュベートを行って細胞の溶解を停止させた。
(4)溶解停止後、ライセートを4.5μl抜き取ってウェル中に分注し、分注したウェルに、以下に示す組成の逆転写用のPre−Mixtureを4μl加えた。
(Pre−Mixture)
2×RT Buffer:2.50μl
20×RT Enzyme Mix:0.25μl
Nuclease−free Water:1.25μl
計:4.00μl
(5)(4)で調製した液と、以下の温度条件をプログラムした装置を使用して逆転写反応を行い、cDNAを得た。
(温度条件)
37℃/60分→95℃/5分→4℃/終了
(6)逆転写反応後のcDNAを含む液を3μl抜き取ってウェル中に分注し、分注したウェルに、以下に示す組成のPCR Cocktailを8μl加えた(「Taq Man gene Expression Assay」は別途準備した)。
(PCR Cocktail)
Taq Man gene Expression Master Mix:5.0μl
Taq Man gene Expression Assay:0.5μl
Nuclease free Water:2.5μl
計:8.0μl
(7)アブソリュートQPCRシール(ABgene社製)でウェルの開口部を封止し、(6)で調製した液の蒸発を防止して、以下の温度条件をプログラムした装置を使用して、PCRを行った。
50℃/2分→95℃/10分→(95℃/15秒→60℃/1分)×50サイクル
(8)PCR中の各サイクル60℃の工程において、容器の表面側から励起光を照射して、CCDカメラにて撮像を行った。
(9)カイネティックコンピュータを使用して、(8)で得られた撮像データにおける各反応領域の蛍光強度を算出した。なお、蛍光試薬はTaq Man gene Expression Assayに含まれていたものである。算出結果を図7に示す。図7中、縦軸は蛍光強度(ΔRn)、横軸はサイクルを示す。
【0043】
PCR中、本発明の容器において変形や剥離は生じず、図7に示すデータが取得できた。
図7から明らかなように、CPEが確認された細胞が存在しなかったサンプル(図6中の「CPEなし」)では、蛍光強度の増幅が見られなかった。また、CPEが確認された細胞数の少ないサンプル(図6中の「CPE少量」)に比べ、CPEが確認された細胞数の多いサンプル(図6中の「CPE多量」)は、蛍光強度増幅の立ち上がりが早かった。すなわち、エンテロウィルスの量と核酸増幅速度とは比例関係にあることが確認された。
【0044】
(比較例1)
本発明の容器の代わりに、ウェルの底面が平坦であり、ウェルの底面及び側面の材質が異なり、ウェルの底面における厚みが175μm±20μm、ウェルの底面の面積が10.24mm2であるガラスボトムプレート(オリンパス株式会社製)を使用したこと以外は、実施例1と同様に、CPEの確認、核酸増幅反応及び蛍光強度の検出をそれぞれ試みた。
その結果、実施例1と同様に、エンテロウィルスを接種したものとしていないものとでGNK細胞の形状が異なり、CPEを明確に確認できた。
しかし、PCR中にウェルの底面と側面との接着面が剥離し、反応試薬が漏れ出した。したがって、蛍光強度の検出を行うことができなかった。
【0045】
(比較例2)
本発明の容器の代わりに、ウェルの底面及び側面の材質が同じであり、ウェルの底面における厚みが0.3mm以上(約0.5mm)であり、該底面が曲面であるPCR用プレート(ABgene社製)を使用したこと以外は、実施例1と同様に、CPEの確認を試みた。
しかし、PCR用プレートは底面の厚みが厚い上に底面が平面ではないため、エンテロウィルスによるCPEの確認だけでなく、エンテロウィルスを接種していないGNK細胞の確認も行うことができなかった。
【0046】
以上の結果より、ガラスボトムプレートは耐熱性が低いため、PCRへの使用には不適であること、PCR用プレートは細胞観察等のイメージングには不適であることがそれぞれ確認できた。一方、本発明の容器は、細胞イメージング、蛍光強度検出等の光学的解析で必要とされる光学特性と、PCRで必要とされる耐熱性とを兼ね備えていることが確認できた。
【0047】
(実施例2)
実施例1と同様の容器を使用して以下の手順に従い、蛍光相関分析を行った。
(I)測定方法
(1)本発明の容器に、濃度が1nM(1×10−9mol/L)であるTAMRA(蛍光色素)の溶液を分注し、プレートシールにより蒸発を防止した。
(2)蛍光相関分析装置MF20(オリンパス株式会社製)を使用して、以下の条件により、容器の裏面側から蛍光を検出して測定を行った。
メソッド:FCS
レーザー波長:543nm
出力:250μW
測定時間:10秒×10回
【0048】
測定結果を表1に示す。表1中、「Diff.Time」は、1fL(1×10−15L)の溶液中を横切る分子の並進拡散時間を、「CPP」は分子1個辺りの輝度を、「Particle」は1fL中の分子数を、そして「Count rate」は総輝度(すなわち、「CPP」×「Particle」)をそれぞれ表す。
【0049】
(比較例3)
本発明の容器の代わりに、蛍光相関分析装置MF20専用の容器で、比較例1と同様のガラスボトムプレートを使用したこと以外は、実施例2と同様に、蛍光相関分析を試みた。測定結果を表1に示す。
【0050】
(比較例4)
本発明の容器の代わりに比較例2と同様のPCR用プレートを使用したこと以外は、実施例2と同様に、蛍光相関分析を試みた。測定結果を表1に示す。
【0051】
表1から明らかな通り、実施例2及び比較例3では、同等の分析結果が得られ、本発明の容器が、従来の蛍光相関分析装置や蛍光相関相互分析装置を使用する分析にも好適に使用できること、さらに前記装置専用の容器と同等の光学特性を併せ持っていることが確認できた。一方、PCR用プレートは底面が厚いだけでなく光学特性にも劣るため、蛍光相関分析を行うことができなかった。
【0052】
【表1】

【産業上の利用可能性】
【0053】
本発明は、細胞レベルでゲノム、タンパク質、糖鎖等に関して包括的に解析するシステムバイオロジーの研究に利用可能である。
【符号の説明】
【0054】
1,2,3,4・・・解析用容器,12,22,32,42・・・ウェル、12a,22a・・・ウェル底面、12b,22b・・・ウェル側面、120・・・ウェル底面の中心、321,421・・・ウェル上部、321a,421a・・・ウェル上部の底面、321b,421b・・・ウェル上部の側面、322,422・・・ウェル下部、322a,422a・・・ウェル下部の底面、322b,422b・・・ウェル下部の側面
【技術分野】
【0001】
本発明は、生化学分野で使用する解析用容器及び該解析用容器を使用する生化学的解析方法に関する。
【背景技術】
【0002】
ヒトゲノムの解読は、1980年代後半にその計画の議論が始まり、1990年頃から国際協力の下に進められてきた。そして2003年には、最初のゴールである全ゲノムの構造決定がほぼ終わり、本格的なゲノム研究時代に突入した。ゲノム研究時代を迎え、タンパク質や糖の構造・機能解析や、疾患と関連したSNPs解析等の研究の促進がはかられている。
【0003】
そして近年は、核酸の抽出、増幅反応、検出反応、あるいはタンパク質の検出反応などを、微量な検体を用いて小容量の容器中で行うμ−Total Analysis System技術やLab−on Chip技術についての研究が盛んに行われている。
小容量の容器としては、スライドガラス上にプローブDNAを配置し、これに検体を作用させて目的のDNAの検出するようにしたもの(特許文献1参照) や、ガラスや樹脂などのプレートにウェルと呼ばれる微小な凹部を形成し、ウェル内で検出反応を行うようにしたものなどが知られている。ウェルが形成された容器としては、例えば、検出反応を行うためのウェルだけでなく、核酸増幅を行うためのウェル、さらにはこれらとは異なる目的で液体を収容するためのウェルを備えたものが開示されている(特許文献2参照)。ここでは、例えば、検出反応を行うウェルであれば、低自家蛍光性及び高光透過性等の光学特性を有するなど、各ウェルが、それぞれの用途に適した特性の材質で、適切な形状に成型されている。
【0004】
一方、近年は、ゲノム、タンパク質、糖鎖などについて、それぞれの構造及び機能を別々に解析することの限界が議論されており、システムバイオロジーの必要性が強調されている。そのような中で、個々の細胞の機能や形状の違いを、個々の細胞における遺伝子やタンパク質の発現に関する時間的空間的挙動の解析等に基づいて、一細胞レベルで抱括的にとらえようとする試みがなされている。
上記技術分野では、これまでに様々な解析技術が提供されてきており、具体的には、細胞内の画像解析を3次元的に行う共焦点光学顕微鏡を使用する解析方法、一細胞ないし細胞数個レベル等、微量な細胞で遺伝子解析を行うPCRデバイスを使用した解析方法、微量溶液中の核酸やタンパク質等の生体分子間の相互作用解析を可能とする蛍光相関分光法を使用した解析方法等が例示できる。
【先行技術文献】
【特許文献】
【0005】
【特許文献1】特表平11−512293号公報
【特許文献2】特開2006−349559号公報
【発明の概要】
【発明が解決しようとする課題】
【0006】
しかしながら、これらの解析技術に使用する解析用容器は、それぞれ目的に応じて形状に制約があるだけでなく、必要とされる光学特性、耐熱性等に応じて材質にも制約があり、共通の容器を使用して複数種類の解析を連続的に行うことが困難であるという問題点があった。さらに、その結果として、複数種類の高度な機能を複合化した解析技術や装置の開発が進展しないという問題点があった。
【0007】
本発明は上記事情に鑑みてなされたものであり、微量な検体を対象とし、複数種類の生化学的解析に適用できる解析用容器を提供することを課題とする。
【課題を解決するための手段】
【0008】
上記課題を解決するため、
請求項1に記載の発明は、プレート表面に、平坦な底面を有するウェルが形成された解析用容器であって、前記ウェルの底面及び側面が同じ材質からなり、前記ウェルの底面における厚みが0.12〜0.29mmであり、前記ウェルの底面の面積が2mm2以下であり、4〜120℃において耐熱性を有する材質からなることを特徴とする解析用容器である。
請求項2に記載の発明は、前記ウェルが複数形成されていることを特徴とする請求項1に記載の解析用容器である。
請求項3に記載の発明は、隣り合う前記ウェルの底面中心間の距離が、2.25mmの整数倍であることを特徴とする請求項2に記載の解析用容器である。
請求項4に記載の発明は、マイクロタイタープレートに関するSBS規格(ANSI/SBS 1)又はスライドガラスに関するJIS規格(JIS R 3703)に対して同等以下の大きさを有することを特徴とする請求項1〜3のいずれか一項に記載の解析用容器である。
請求項5に記載の発明は、シクロオレフィン系樹脂又はメチルペンテン系樹脂からなることを特徴とする請求項1〜4のいずれか一項に記載の解析用容器である。
請求項6に記載の発明は、無色透明な材質からなることを特徴とする請求項1〜5のいずれか一項に記載の解析用容器である。
請求項7に記載の発明は、請求項1〜6のいずれ一項に記載の解析用容器を使用して、細胞イメージング、核酸増幅及び蛍光検出を含む一種以上の解析を行うことを特徴とする生化学的解析方法である。
【発明の効果】
【0009】
本発明によれば、微量な検体を使用する複数種類の生化学的解析を共通の容器で行うことができる。したがって、解析工程を簡略化でき、低コストで解析できる。また、複数種類の種々の解析を複合化して行うことができるので、従来よりも高度な解析が可能となる。
【図面の簡単な説明】
【0010】
【図1】本発明の第一の実施形態に係る解析用容器を例示する図であり、(a)は平面図、(b)はウェルの拡大平面図、(c)は(a)のI−I線における断面図である。
【図2】本発明の第一の実施形態に係る解析用容器をアダプターに装着した状態を例示する概略図である。
【図3】本発明の第二の実施形態に係る容器を例示する図であり、(a)はウェルの拡大平面図、(b)は断面図である。
【図4】本発明の第三の実施形態に係る容器を例示する図であり、(a)はウェルの拡大平面図、(b)は断面図である。
【図5】本発明の第四の実施形態に係る容器を例示する拡大断面図である。
【図6】実施例1における倒立顕微鏡での観察画像の撮像データであり、(a)はエンテロウィルスを接種していないもの、(b)はエンテロウィルスを接種したものの撮像データである。
【図7】実施例1におけるPCR時のカイネティックコンピュータによる各反応領域の蛍光強度の算出結果を示すグラフである。
【発明を実施するための形態】
【0011】
以下、図面を参照しながら、本発明について詳しく説明する。
本発明に係る解析用容器(以下、「容器」と略記することがある)は、プレート表面に、平坦な底面を有するウェルが形成された解析用容器であって、前記ウェルの底面及び側面が同じ材質からなり、前記ウェルの底面における厚みが0.12〜0.29mmであり、前記ウェルの底面の面積が2mm2以下であり、4〜120℃において耐熱性を有する材質からなることを特徴とする。
【0012】
(第一の実施形態)
図1は本発明の第一の実施形態に係る容器を例示する図であり、(a)は平面図、(b)はウェルの拡大平面図、(c)は(a)のI−I線における断面図である。
容器1は、プレートの表面に凹状のウェル12が12個ずつ4列に合計48個並設されたものである。
ウェル12は略円錐台形状であり、直径D12の略円形状である底面12aから開口部12cへ向けて漸次内径が拡大されている。そして、底面12aと開口部12cの開口面とは同心状となっている。また、底面12aは平坦になっており、容器の裏面側から光を照射した時も、光シグナルを高精度に検出でき、光学的な解析を高精度に行うことができるようになっている。
【0013】
容器1のうち、ウェル12の底面12aにおける厚みはT12、ウェル12が設けられていない平坦面13における厚みはT13である。
隣り合うウェル12同士は、図示するX軸方向及びY軸方向のいずれにおいても、底面12aの中心120間の距離が一様にL12となるように配置されている。
【0014】
容器1の材質は、4〜120℃において耐熱性を有するものである。前記温度範囲は、想定される容器1の用途の中でも、最も広範な温度変化を伴うと考えられる核酸増幅反応時の設定温度を包含する。ここで「耐熱性を有する」とは、加熱により変形、割れやひび等の形状劣化、あるいは成分の変質又は漏出等を生じないことを指す。また「核酸増幅反応」とは、例えば、PCR(Polymerase Chain Reaction、ポリメラーゼ連鎖反応)法等、公知のすべての手法を指す。さらに「核酸」とは、DNA、RNA、その他のオリゴヌクレオチド又はポリヌクレオチド等を指す。
細胞イメージングや蛍光検出を伴う光学的な解析を行う場合には、容器は通常、4℃〜室温程度で安定であれば十分であるが、上記のような耐熱性を併せ持つことにより、容器1は光学的な解析と核酸増幅反応のいずれにも適用できる。なお、本発明において、「光学的な解析」とは、測光操作を伴う解析のことを指し、例えば、細胞の画像解析、蛍光相関分析、その他の蛍光検出を伴う解析等が挙げられ、公知のすべての解析が対象となる。
【0015】
容器1の材質は、なかでも精密加工・成型性、光透過性、低複屈折性及び低吸湿性のすべての特性を有するものが好ましい。
精密加工・成型性を有する材質を使用すれば、微量な検体の取り扱いに好適な容器を容易に作製できる。特に、1mm以下のサイズで加工及び成型が容易な材質が好ましい。
また、光透過性及び低複屈折性を有する材質を使用すれば、細胞イメージングや蛍光検出を伴う光学的な解析を高精度に行うことができる。特に、無色透明な材質が好ましく、透明ガラスと同程度の光透過性を有する材質がより好ましい。無色透明な材質を使用することで、ノイズを低減できると共に、容器の表面及び裏面のいずれから光を照射しても解析を行うことができる。さらに、低複屈折性を有することにより、例えば、蛍光画像の結像性が向上し、その結果、細胞変性効果(CPE)が確認し易くなるなど、検体中のウィルスの有無の確認や種類の特定を一層高精度に行うことができる。
また、低吸湿性を有する材質を使用すれば、容器の変形を抑制できる共に、ウェル中の検体を安定して保持できるので、高精度な解析が可能となる。
【0016】
通常、生化学分野で汎用される解析用容器は、ポリカーボネート、ポリプロピレン、フッ素系樹脂、シリコン樹脂等の材質からなる。しかしこれら材質は、上記特性をすべて有するものではない。
これに対し、上記特性をすべて有し、容器1の材質として好ましいものとしては、シクロオレフィン系樹脂(例えば、日本ゼオン株式会社製のゼオネックス(登録商標)、ゼオノア(登録商標))、ポリメチルペンテン等のメチルペンテン系樹脂(例えば、三井化学株式会社製のTPX(登録商標))が例示できる。
【0017】
ここに示すように、容器1は全体が同じ材質からなる。これにより、底面12aと側面12bとは熱膨張係数が同じなので、ウェル12に温度変化が生じても、応力の発生が抑制され、変形や、割れやひび等の形状劣化が抑制される。また、容器1を容易に製造できる。
なお、本発明において、容器は必ずしも全体が同じ材質からなるものでなくても良く、少なくともウェルの底面及び側面が同じ材質からなるものであれば良い。
このように、少なくともウェルの底面12a及び側面12bが同じ材質からなることで、容器1は、光学的な解析だけでなく、広範な温度変化を伴う核酸増幅反応にも適用できる。
これに対し、主に光学特性を重視した従来の容器(例えば、オリンパス株式会社製のガラスボトムプレート)は、細胞イメージングや蛍光検出等の光学的な解析には好適だが、ウェルの底面及び側面の材質が異なるため、変形や、割れやひび等の形状劣化が生じ易い。したがって、材質が耐熱性を有していても、結果的に容器としての耐熱性が不十分である。
【0018】
容器1において、前記厚みT12は、0.12〜0.29mmである。このような範囲とすることにより、容器の光学特性が向上する。特に、T12の上限を0.29mmとすることで、従来の容器よりも、光透過性及び低複屈折性等の光学特性が向上する。その結果、このような光学特性を有する材質を使用した場合と同様の効果が得られる。
そして、前記厚みT12は、光学特性及び取り扱い性を考慮すると、市販品のカバーガラス(例えば、松浪硝子工業株式会社製のマイクロカバーガラス等)の厚みと同等であることが好ましく、市販品の共焦点画像解析装置(例えば、オリンパス株式会社製のMF20(商品名)等)やハイコンテンツスクリーニング装置で使用されるガラスボトムプレート(例えば、オリンパス株式会社製、ワットマンジャパン株式会社製のガラスボトムプレート)の厚みと同等であることが好ましい。このような条件を満たすためには、例えば、T12を0.15〜0.19mmとすれば良い。
このように、厚みT12が上記範囲に設定された容器1は、光学的な解析と核酸増幅反応のいずれにも適用できる。
これに対し、ウェル底面における厚みが0.3mm以上である従来の容器(例えば、特開2007−175003号公報参照)は、細胞培養や核酸増幅反応に使用するのには好適である。しかし、細胞の画像解析装置や蛍光相互解析装置等、カバーガラスと同等の厚みの基材を介して光学的な解析を行う装置に対して使用するのには適していない。
【0019】
また、容器1において、前記厚みT13は特に限定されるものではなく、目的に応じて適宜設定し得る。ただし、熱伝導率と取り扱い性を考慮すると、0.5〜10mmであることが好ましく、1〜3mmであることがより好ましい。このような範囲とすることで、容器1は、優れた熱伝導率と十分な強度とを兼ね備えたものになるので、解析精度及び取り扱い性が一層向上する。
【0020】
容器1において、前記L12は、例えば、SBS規格等の規格に準拠した従来のマイクロタイタープレートにおける、隣り合うウェル底面の中心間距離と略同等であることが好ましい。そのためには、L12を2.25mmの整数倍とすることがより好ましい。例えば、従来の1536穴のマイクロタイタープレートにおける前記中心間距離は約2.25mmであり、384穴の場合の前記中心間距離は約4.5mm、96穴の場合の前記中心間距離は約9.0mmである。
前記L12をこのように設定することで、複数の液体試料を同時に分注するために通常使用される自動分注機(例えば、テカンジャパン株式会社製の小型自動分注機MSP2950(商品名))、多連型マイクロピペット(例えば、Eppendorf社製のリサーチマルチチャネル(商品名))を、容器1に対してもそのまま使用できる。これにより、多数の検体も効率良く分注でき、作業の簡略化と時間短縮が可能となる。その結果、作業ミスが低減でき、低コストで解析できる。
【0021】
容器の厚みが薄い部位では、その部位の表面積が大きいほど、成型時や解析時の温度変化に伴って歪みが生じ、変形し易い。特に厚みが0.29mm以下という小さい値の場合には、容器の温度変化時における熱膨張や熱収縮に伴い、大きな歪みが生じ易い。このような歪みは、容器の中でも特にウェルの底面で発生すると、解析に支障をきたし、容器が実用に適さないものとなってしまう。
そこで本発明においては、ウェル12の底面12aの面積を2mm2以下としている。このようにすることで、厚みT12が0.29mm以下でも、温度変化時における底面12aの変形が抑制される。このように底面12aの平面性を維持することで、複屈折のばらつきが抑制され、光学特性が安定し、光学的な解析を高精度に行うことができる。また、容器1は、加熱を伴う解析にも好適なので、PCR法等の核酸増幅法も適用できる。その結果、例えば、検体が微量でもウィルス等の種類の特定が容易になる。また、ウェル12への溶液の充填量が少なくて済むので、微量な検体の解析に好適である。
本発明は、容器のウェル底面における厚みが薄い場合でも、ウェル底面の面積を所定の範囲に設定することで、温度変化に伴うウェル底面の変形を抑制できることを見出して、なされたものである。そして、ウェル底面における厚み及びウェル底面の面積を、それぞれ特定の範囲に設定して組み合わせることで、ウェル底面の変形を効果的に抑制するものである。
【0022】
容器1において、開口部12cの開口面積は特に限定されず、例えば、容器1の大きさや、ウェル12の数等を考慮して適宜調整すれば良い。
【0023】
容器1の大きさ、すなわちX軸方向の長さLX及びY軸方向の長さLYは、特に限定されない。従来のマイクロタイタープレートで採用されているSBS規格(ANSI/SBS 1)や、スライドガラスで採用されているJIS規格(JIS R 3703)等のいずれかの規格に準拠して設定することが好ましい。既存の解析装置は、上記のような規格に準拠した容器の使用を前提として、容器保持部や駆動部が設計されているものが多い。そこで、大きさをこれら規格に準拠して設定することで、容器1を従来の解析装置にそのまま設置して使用できるようになる。
【0024】
また、これら規格よりも小さい大きさの容器1であれば、例えば、アダプターを装着して従来の解析装置に設置するようにしても良い。アダプターとしては、前記SBS規格やJIS規格等のいずれかの規格に準拠した大きさであり、容器1を保持する手段を有していれば良い。このようなアダプターに装着した状態の容器1の概略図を図2に例示する。
図2中、アダプター9は、略四角形状のプレートの4辺のうち3辺の周縁部を残すように切欠部90を設けた、角型の略C字状プレートである。表面9A及び裏面9Bは平坦である。そして、一端から他端へ向けて、内周上に溝91が延設されている。容器1は、図の矢印方向から、対向する第一周縁部1A及び第二周縁部1Bをそれぞれ、アダプター9の第一短腕部92及び第二短腕部93の前記溝91に係合させつつアダプター9に挿入し、第三周縁部1Cをアダプター9の長腕部94の前記溝91により係止させることで、アダプター9に装着される。
【0025】
溝91の幅W1は、容器1の前記厚みT13と同等か、又はT13よりもやや大きい値に設定すれば良い。
そして、溝91の深さW2は、容器1の前記LX及びLYを考慮して設定すれば良く、少なくとも第一短腕部92及び第二短腕部93の溝91の底面間距離Z1を、容器1のLXと同等か、又はLXよりもやや大きい値に設定すれば良い。そして、長腕部94の溝91の底面からこれに対して垂直な方向に第一短腕部92又は第二短腕部93の先端部までの距離Z2を、容器1のLYと同等か、又はLYよりも大きい値に設定することが好ましい。
アダプター9の大きさ、すなわち、長腕部94の長手方向の長さ、及び第一短腕部92又は第二短腕部93の長手方向の長さは、前記SBS規格やJIS規格等の各種規格に準拠して設定すれば良い。また、アダプター9の厚みT9は、各種解析装置への設置のし易さ等を考慮して、適宜調製すれば良い。
【0026】
アダプター9の材質は特に限定されないが、容器1に適用し得る材質であることが好ましく、組み合わせる容器1と同じ材質であることがより好ましい。また、核酸増幅反応等、広範な温度変化を伴う解析に使用することを考慮すると、熱伝導率が高い材質が好ましく、このようなものとして具体的には、ステンレス、アルミニウム等の各種金属又は合金が例示できる。
【0027】
アダプター9には切欠部90が設けられているので、容器1をアダプター9に装着してもウェル12が露出され、アダプター9の表面9A側及び裏面9B側のどちら側からでも、ウェル12に光を照射できる。したがって、アダプター9に装着した容器1は、前記SBS規格やJIS規格等のいずれかの規格に準拠した容器と同様に、従来の解析装置に設置できるので、解析も容易に行うことができる。
【0028】
なお、容器1を装着するアダプターとしては、図2に例示するものに限定されず、本発明の効果を損なわない範囲内で、一部構成の変更、追加又は省略が適宜可能であることは言うまでもない。例えば、切欠部を有していれば、アダプターの形状は略C字状に限定されず、例えば、略四角形状のプレートの4辺の周縁部をすべて残すように切欠部を設けた、角型の略O字状プレートでも良い。また、ここでは、内周上に設けた溝に容器周縁部を係合させることで容器を保持する形態のアダプターについて説明したが、容器を保持する形態もこれに限定されるものではない。例えば、溝が設けられていないこと以外は上記と同様のプレート表面に、弾性を有する材質からなる爪状の止め具を複数個設け、これら止め具を使用して容器平面をプレート表面に押圧することで容器を保持するようにしても良い。
【0029】
(第二の実施形態)
図3は、本発明の第二の実施形態に係る容器を例示する図であり、(a)はウェルの拡大平面図、(b)は断面図である。
ここに示す容器2は、ウェル22の側面22bと、ウェル22が設けられていない平坦面23に沿って、その厚みが第一の実施形態よりも薄くされたものである。そして、ウェル22の形状及び大きさは、第一の実施形態と同様である。
【0030】
容器22のうち、ウェル22の底面22aにおける厚みT22aは、第一の実施形態におけるとT12と同様である。
また、前記平坦面23における厚みT23及び側面22bにおける厚みT22bは、いずれも特に限定されるものではなく、目的に応じて適宜設定すれば良い。ただし、容器2の強度及び取り扱い性を考慮すると、T23及びT22bは、前記T22aよりもやや厚めに設定することが好ましく、0.3〜1mmであることが好ましく、0.4〜0.7mmであることがより好ましい。T23及びT22bは必ずしも同じである必要性はないが、同じである方が容器2を容易に製造できる点で好ましい。
また、容器2は、T23が薄いため、第一の実施形態における容器1よりも熱伝導性に優れる。したがって、平坦面23と、ウェル22の底面側外表面24との間の距離(すなわち、容器2の平坦面23における高さ)H23は、主に取り扱い性を考慮して設定すれば良く、0.5〜12mmであることが好ましく、2〜5mmであることがより好ましい。このような範囲とすることにより、解析精度及び取り扱い性が一層向上する。
【0031】
上記の点以外は、容器2は、第一の実施形態と同様である。
【0032】
(第三の実施形態)
図4は、本発明の第三の実施形態に係る容器を例示する図であり、(a)はウェルの拡大平面図、(b)は断面図である。
ここに示す容器3は、プレートの表面に凹状のウェル32が並設され、ウェル32が設けられていない面が平坦面33とされている点は第一の実施形態と同様であるが、ウェル32の形状が第一の実施形態と異なる。ウェル32は、略円錐台形状の凹部が二つ積重ねられた形状であり、平坦面33側のウェル上部321は、これよりも下側のウェル下部322よりも内径が大きくなっている。また、ウェル上部321及びウェル下部322は同心状となっている。そして、ウェル上部321の底面321a内に、ウェル下部322の開口部322cが配置されており、ウェル上部321の側面321bは、前記底面321aを介してウェル下部322の側面322bに連接されている。
ウェル上部321では、底面321aから開口部321cへ向けて漸次内径が拡大されている。同様に、ウェル下部322では、底面322aから開口部322cへ向けて漸次内径が拡大されている。そして、前記底面321aの直径D321aは、前記開口部322cの開口径D322cよりも大きくなっている。
【0033】
ウェル下部322の底面322aの大きさ及び形状は、第一の実施形態における底面12aと同様で良い。
また、容器3のうち、前記底面322aにおける厚みT32は、第一の実施形態におけるT12と同様である。さらに、平坦面33における厚みT33は、第一の実施形態におけるT11と同様である。
ウェル上部321の高さH321と、ウェル下部322の高さH322との比は、特に限定されず、目的に応じて適宜選択すれば良い。
ウェル上部321及びウェル下部322は互いに相似形でも良いし、異なる形状でも良い。
このように、ウェルを、略円錐台形状の凹部が二つ積重ねられた形状とすることで、ウェルへ充填するサンプルの量を幅広く設定することが可能となる。例えば、ウェル上部を設け、その開口部の面積を拡大することで、第一の実施形態のウェルよりも、充填可能なサンプル量を増量できる。一方、ウェル下部を設け、その底面の面積を縮小することで、第一の実施形態のウェルよりも、充填可能なサンプル量が少なくなるが、微量なサンプルを局所的に集液することで、解析を容易に行うことができる。
【0034】
上記の点以外は、容器3は、第一の実施形態と同様である。
【0035】
(第四の実施形態)
図5は、本発明の第三の実施形態に係る容器を例示する拡大断面図である。
ここに示す容器4は、ウェル42の側面421b、422b、底面421aと、ウェル42が設けられていない平坦面43に沿って、その厚みが第三の実施形態よりも薄くされたものである。そして、ウェル42の形状及び大きさは、第三の実施形態と同様である。
容器4のうち、ウェル下部422の底面422aにおける厚みT422aは、第一の実施形態におけるとT12と同様である。
また、前記平坦面43における厚みT43、ウェル上部421の側面421bにおける厚みT421b、底面421aにおける厚みT421a、ウェル下部422の側面422bにおける厚みT422bは、いずれも特に限定されるものではなく、目的に応じて適宜設定すれば良い。ただし、容器4の強度及び取り扱い性を考慮すると、前記T422aよりもやや厚めに設定することが好ましく、第二の実施形態におけるT23等と同様であることが好ましい。また、前記T421a、T421b及びT422bは、必ずしもすべて同じである必要性はないが、すべて同じである方が容器4を容易に製造できる点で好ましい。
容器4は、T43が薄いため、第三の実施形態における容器3よりも熱伝導性に優れる。したがって、平坦面43と、ウェル42の底面側外表面44との間の距離(すなわち、容器4の平坦面43における高さ)H43は、第二の実施形態におけるH23と同様であることが好ましい。このような範囲とすることにより、解析精度及び取り扱い性が一層向上する。
【0036】
本発明の容器は、上記第一〜第四の実施形態として示したいずれかの容器に限定されるものではなく、本発明の効果を損なわない範囲内で、一部構成の変更、追加又は省略が適宜可能であることは言うまでもない。
例えば、ウェルの形状は略円錐台形状以外でも良く、さらに、底面から開口部へ向けて漸次内径が拡大されていなくても良い。ただし、底面の面積は開口部の面積に対して同等以下であることが好ましい。また、ウェルの底面と開口部の開口面とは必ずしも同心状でなくても良い。
また、隣り合うウェル同士は、前記X軸方向及びY軸方向において、底面の中心部間の距離がすべて同じでなくても良い。
また、第三及び第四の実施形態のように、ウェルが上部及び下部の二つの部位に分けられる場合には、上部及び下部は必ずしも同心状でなくても良い。
そして、ウェルの数は目的に応じて設定すれば良く、一つ以上であればいずれでも良い。例えば、一列あたりのウェルの数や、一容器あたりのウェルを並設した列の数も、適宜調整すれば良い。ただし、効率的に解析を行うために、ウェルの数は多いほど好ましい。ウェルの数を増やすことで、ハイコンテンツスクリーニング(HCS)のような、多数の検体の解析も容易に行うことができる。
【0037】
本発明の容器は、射出成型法、インサート成形法等、公知の方法で所望の形状に成型することで得られる。また、例えば、特に第二及び第四の実施形態のように、全体の厚みが薄い容器の場合には、上記方法に加え、所定の型の上に加熱して軟化させたシート状の材料を載置し、型とシートとの間を減圧することでシートを型に圧着させて成型する、所謂真空法によっても好適に得られる。なかでも本発明においては、インサート成形法が特に好ましい方法として挙げられる。
一方、本発明の容器を装着するアダプターは、容器の形状を考慮して設計し、例えば、射出成型等、公知の方法で成型した部材同士を接着したり、所定の成型品に対して適宜打ち抜き、切削等、公知の手法で加工を行うなど、種々の方法で作製できる。
【0038】
本発明の解析用容器は、そのウェル内に充填した液体の蒸発を防止する手段を適用するのにも好適である。蒸発を防止する手段は特に限定されないが、ウェルの開口部をシールで封止したり、ウェル内の液体の露出面をオイルで被覆する方法が好ましい。
シールやオイルは、目的に応じて適宜選択すれば良い。例えば、ポリメラーゼ連鎖反応(PCR)法をはじめとする核酸増幅反応等、加熱操作を必要とする場合には、耐熱性を有するものを使用することが好ましい。また、細胞イメージングや蛍光検出等の光学的な解析を容器の表面側から行う場合には、低自家蛍光で透明なものを使用することが好ましい。このように蒸発を防止することで、一層高精度に解析できる。
さらにシールは、ウェルの開口部を封止する部位において、ウェル側の面とその反対側の面の両面がともに平坦である部位を有することが好ましく、該平坦部位の面積が広いほど好ましい。このようにすることで、容器の表面側からの光学的解析を、一層高精度に行うことができる。
透明でかつ前記平坦部位を有するシールとしては、好ましい市販品として、アブソリュートQPCRシール(ABgene社製)、リアルタイムPCR用プレートシール(株式会社ベックス製)等が例示できる。
【0039】
本発明によれば、微量な検体を対象に、測光操作を伴う光学的な解析と、核酸増幅等の大きな温度変化を伴う解析とを、各解析間で検体の移液操作や分注操作を行うことなく、同一ウェル中で連続的に行うことができる。そして本発明は、例えば、細胞イメージング、核酸増幅及び蛍光検出を必須の工程として含む一種以上の解析を行うのに特に好適である。これは、容器のウェル底面における厚み及びウェル底面の面積として、特に最適な範囲の組み合わせを見出し、さらに、容器の材質、ウェルの底面及び側面の材質を限定することで達成されたものである。
このように、複数種類の解析を、同一ウェル中で連続的に行うことで、解析工程を簡略化できる。また、複数種類の種々の解析を複合化して行うことができるので、従来よりも高度な解析が可能となる。
また、容器を透明な材質からなるものとすれば、アダプターの装着の有無によらず、容器の表面及び裏面のいずれからも光シグナルを検出でき、光学的な解析が可能となる。
【実施例】
【0040】
以下、具体的実施例により、本発明についてさらに詳しく説明する。ただし、本発明は、以下に示す実施例に何ら限定されるものではない。
(実施例1)
図1に示す本発明の容器1を使用して、以下の手順に従って解析を行った。なお、容器1としては、大きさが75.6mm×25mm、厚みT13が3mm、ウェル2底面の面積が0.8mm2、ウェル2底面における厚みT12が0.19mm、材質がシクロオレフィン系樹脂(ゼオネックス(登録商標)、日本ゼオン株式会社製)であるものを使用した。
【0041】
(I)細胞変性効果(CPE)の確認
(1)本発明の容器のウェル中でGNK細胞を成育させ、次いでGNK細胞にエンテロウィルス(Echo9)を接種して33℃で培養を行ったものと、エンテロウィルス(Echo9)を接種せずに33℃で培養を行ったものをそれぞれ調製した。
(2)培養後の前記容器をそれぞれ倒立顕微鏡に設置して、容器の裏面側からCPEを確認した。
その結果、図6に示す通り、前記エンテロウィルスを接種したものとしていないものとでGNK細胞の形状が異なり、CPEを明確に確認できた。なお、図6はこの時の倒立顕微鏡での観察画像の撮像データであり、(a)はエンテロウィルスを接種していないもの、(b)はエンテロウィルスを接種したものの撮像データである。
【0042】
(II)核酸増幅反応及び蛍光強度の検出
Applied Biosystems社製のTaq Man Gene Expression Cell−to Ct Kit(商品名)と、前記(I)でCPEを確認したGNK細胞を使用して、以下の手順に従ってリアルタイムPCR解析を行った。なお、ここでは、CPEが確認された細胞が存在しなかったサンプル、CPEが確認された細胞数の少ないサンプル、CPEが確認された細胞数の多いサンプルをそれぞれ使用して解析を行った。
(1)ウェルにPBSを5μl分注して洗浄し、その後PBSを除去して細胞を洗浄した。
(2)洗浄後、ウェルにLysis Solutionを5μl加えてピペッティングを5回行い、次いで、蒸発防止用のオイルを2μl分注して、室温で5分間インキュベートを行い、細胞を溶解させた。
(3)溶解後、ウェルにStop Solutionを0.5μl加えてピペッティングを5回行い、次いで室温で2分間インキュベートを行って細胞の溶解を停止させた。
(4)溶解停止後、ライセートを4.5μl抜き取ってウェル中に分注し、分注したウェルに、以下に示す組成の逆転写用のPre−Mixtureを4μl加えた。
(Pre−Mixture)
2×RT Buffer:2.50μl
20×RT Enzyme Mix:0.25μl
Nuclease−free Water:1.25μl
計:4.00μl
(5)(4)で調製した液と、以下の温度条件をプログラムした装置を使用して逆転写反応を行い、cDNAを得た。
(温度条件)
37℃/60分→95℃/5分→4℃/終了
(6)逆転写反応後のcDNAを含む液を3μl抜き取ってウェル中に分注し、分注したウェルに、以下に示す組成のPCR Cocktailを8μl加えた(「Taq Man gene Expression Assay」は別途準備した)。
(PCR Cocktail)
Taq Man gene Expression Master Mix:5.0μl
Taq Man gene Expression Assay:0.5μl
Nuclease free Water:2.5μl
計:8.0μl
(7)アブソリュートQPCRシール(ABgene社製)でウェルの開口部を封止し、(6)で調製した液の蒸発を防止して、以下の温度条件をプログラムした装置を使用して、PCRを行った。
50℃/2分→95℃/10分→(95℃/15秒→60℃/1分)×50サイクル
(8)PCR中の各サイクル60℃の工程において、容器の表面側から励起光を照射して、CCDカメラにて撮像を行った。
(9)カイネティックコンピュータを使用して、(8)で得られた撮像データにおける各反応領域の蛍光強度を算出した。なお、蛍光試薬はTaq Man gene Expression Assayに含まれていたものである。算出結果を図7に示す。図7中、縦軸は蛍光強度(ΔRn)、横軸はサイクルを示す。
【0043】
PCR中、本発明の容器において変形や剥離は生じず、図7に示すデータが取得できた。
図7から明らかなように、CPEが確認された細胞が存在しなかったサンプル(図6中の「CPEなし」)では、蛍光強度の増幅が見られなかった。また、CPEが確認された細胞数の少ないサンプル(図6中の「CPE少量」)に比べ、CPEが確認された細胞数の多いサンプル(図6中の「CPE多量」)は、蛍光強度増幅の立ち上がりが早かった。すなわち、エンテロウィルスの量と核酸増幅速度とは比例関係にあることが確認された。
【0044】
(比較例1)
本発明の容器の代わりに、ウェルの底面が平坦であり、ウェルの底面及び側面の材質が異なり、ウェルの底面における厚みが175μm±20μm、ウェルの底面の面積が10.24mm2であるガラスボトムプレート(オリンパス株式会社製)を使用したこと以外は、実施例1と同様に、CPEの確認、核酸増幅反応及び蛍光強度の検出をそれぞれ試みた。
その結果、実施例1と同様に、エンテロウィルスを接種したものとしていないものとでGNK細胞の形状が異なり、CPEを明確に確認できた。
しかし、PCR中にウェルの底面と側面との接着面が剥離し、反応試薬が漏れ出した。したがって、蛍光強度の検出を行うことができなかった。
【0045】
(比較例2)
本発明の容器の代わりに、ウェルの底面及び側面の材質が同じであり、ウェルの底面における厚みが0.3mm以上(約0.5mm)であり、該底面が曲面であるPCR用プレート(ABgene社製)を使用したこと以外は、実施例1と同様に、CPEの確認を試みた。
しかし、PCR用プレートは底面の厚みが厚い上に底面が平面ではないため、エンテロウィルスによるCPEの確認だけでなく、エンテロウィルスを接種していないGNK細胞の確認も行うことができなかった。
【0046】
以上の結果より、ガラスボトムプレートは耐熱性が低いため、PCRへの使用には不適であること、PCR用プレートは細胞観察等のイメージングには不適であることがそれぞれ確認できた。一方、本発明の容器は、細胞イメージング、蛍光強度検出等の光学的解析で必要とされる光学特性と、PCRで必要とされる耐熱性とを兼ね備えていることが確認できた。
【0047】
(実施例2)
実施例1と同様の容器を使用して以下の手順に従い、蛍光相関分析を行った。
(I)測定方法
(1)本発明の容器に、濃度が1nM(1×10−9mol/L)であるTAMRA(蛍光色素)の溶液を分注し、プレートシールにより蒸発を防止した。
(2)蛍光相関分析装置MF20(オリンパス株式会社製)を使用して、以下の条件により、容器の裏面側から蛍光を検出して測定を行った。
メソッド:FCS
レーザー波長:543nm
出力:250μW
測定時間:10秒×10回
【0048】
測定結果を表1に示す。表1中、「Diff.Time」は、1fL(1×10−15L)の溶液中を横切る分子の並進拡散時間を、「CPP」は分子1個辺りの輝度を、「Particle」は1fL中の分子数を、そして「Count rate」は総輝度(すなわち、「CPP」×「Particle」)をそれぞれ表す。
【0049】
(比較例3)
本発明の容器の代わりに、蛍光相関分析装置MF20専用の容器で、比較例1と同様のガラスボトムプレートを使用したこと以外は、実施例2と同様に、蛍光相関分析を試みた。測定結果を表1に示す。
【0050】
(比較例4)
本発明の容器の代わりに比較例2と同様のPCR用プレートを使用したこと以外は、実施例2と同様に、蛍光相関分析を試みた。測定結果を表1に示す。
【0051】
表1から明らかな通り、実施例2及び比較例3では、同等の分析結果が得られ、本発明の容器が、従来の蛍光相関分析装置や蛍光相関相互分析装置を使用する分析にも好適に使用できること、さらに前記装置専用の容器と同等の光学特性を併せ持っていることが確認できた。一方、PCR用プレートは底面が厚いだけでなく光学特性にも劣るため、蛍光相関分析を行うことができなかった。
【0052】
【表1】

【産業上の利用可能性】
【0053】
本発明は、細胞レベルでゲノム、タンパク質、糖鎖等に関して包括的に解析するシステムバイオロジーの研究に利用可能である。
【符号の説明】
【0054】
1,2,3,4・・・解析用容器,12,22,32,42・・・ウェル、12a,22a・・・ウェル底面、12b,22b・・・ウェル側面、120・・・ウェル底面の中心、321,421・・・ウェル上部、321a,421a・・・ウェル上部の底面、321b,421b・・・ウェル上部の側面、322,422・・・ウェル下部、322a,422a・・・ウェル下部の底面、322b,422b・・・ウェル下部の側面
【特許請求の範囲】
【請求項1】
プレート表面に、平坦な底面を有するウェルが形成された解析用容器であって、
前記ウェルの底面及び側面が同じ材質からなり、
前記ウェルの底面における厚みが0.12〜0.29mmであり、
前記ウェルの底面の面積が2mm2以下であり、
4〜120℃において耐熱性を有する材質からなることを特徴とする解析用容器。
【請求項2】
前記ウェルが複数形成されていることを特徴とする請求項1に記載の解析用容器。
【請求項3】
隣り合う前記ウェルの底面中心間の距離が、2.25mmの整数倍であることを特徴とする請求項2に記載の解析用容器。
【請求項4】
マイクロタイタープレートに関するSBS規格(ANSI/SBS 1)又はスライドガラスに関するJIS規格(JIS R 3703)に対して同等以下の大きさを有することを特徴とする請求項1〜3のいずれか一項に記載の解析用容器。
【請求項5】
シクロオレフィン系樹脂又はメチルペンテン系樹脂からなることを特徴とする請求項1〜4のいずれか一項に記載の解析用容器。
【請求項6】
無色透明な材質からなることを特徴とする請求項1〜5のいずれか一項に記載の解析用容器。
【請求項7】
請求項1〜6のいずれ一項に記載の解析用容器を使用して、細胞イメージング、核酸増幅及び蛍光検出を含む一種以上の解析を行うことを特徴とする生化学的解析方法。
【請求項1】
プレート表面に、平坦な底面を有するウェルが形成された解析用容器であって、
前記ウェルの底面及び側面が同じ材質からなり、
前記ウェルの底面における厚みが0.12〜0.29mmであり、
前記ウェルの底面の面積が2mm2以下であり、
4〜120℃において耐熱性を有する材質からなることを特徴とする解析用容器。
【請求項2】
前記ウェルが複数形成されていることを特徴とする請求項1に記載の解析用容器。
【請求項3】
隣り合う前記ウェルの底面中心間の距離が、2.25mmの整数倍であることを特徴とする請求項2に記載の解析用容器。
【請求項4】
マイクロタイタープレートに関するSBS規格(ANSI/SBS 1)又はスライドガラスに関するJIS規格(JIS R 3703)に対して同等以下の大きさを有することを特徴とする請求項1〜3のいずれか一項に記載の解析用容器。
【請求項5】
シクロオレフィン系樹脂又はメチルペンテン系樹脂からなることを特徴とする請求項1〜4のいずれか一項に記載の解析用容器。
【請求項6】
無色透明な材質からなることを特徴とする請求項1〜5のいずれか一項に記載の解析用容器。
【請求項7】
請求項1〜6のいずれ一項に記載の解析用容器を使用して、細胞イメージング、核酸増幅及び蛍光検出を含む一種以上の解析を行うことを特徴とする生化学的解析方法。
【図1】


【図2】


【図3】


【図4】


【図5】


【図6】


【図7】




【図2】


【図3】


【図4】


【図5】


【図6】


【図7】


【公開番号】特開2010−32487(P2010−32487A)
【公開日】平成22年2月12日(2010.2.12)
【国際特許分類】
【出願番号】特願2009−15600(P2009−15600)
【出願日】平成21年1月27日(2009.1.27)
【出願人】(000000376)オリンパス株式会社 (11,466)
【Fターム(参考)】
【公開日】平成22年2月12日(2010.2.12)
【国際特許分類】
【出願日】平成21年1月27日(2009.1.27)
【出願人】(000000376)オリンパス株式会社 (11,466)
【Fターム(参考)】
[ Back to top ]

