試料中の動的細胞追跡法
本発明は、試料中の細胞を動的に追跡する方法であって、試料の連続する2つの時間経過画像中の細胞間の対応尺度を生成する段階と、前記対応尺度を評価して、これらの2つの画像中の個々の細胞を関連付ける事象を生成する段階であり、それらの事象が、グループ:不変、細胞除去、細胞移動、細胞衝突及び細胞分裂の中から選択される段階と、これらの2つの画像中の個々の細胞を関連付ける事象の追跡出力を提供する段階とを含む方法を提供する。本発明では、関連付ける事象を確定する前記段階が、生成された細胞衝突事象及び細胞分裂事象の正当性を、このような事象毎に適応閾値を計算し、それらの閾値を事象パラメーターと比較することによって検証することを含む。試料中の細胞を動的に追跡するシステムも提供される。
【発明の詳細な説明】
【技術分野】
【0001】
本発明は、生体物質の位置を決定するシステム及び方法に関する。
【背景技術】
【0002】
この10年の間に、生物学的プロセスに関して実施されたデータ測定の量は爆発的に増大した。この爆発は主に、技術の向上、特にコンピューター技術の向上によるものと考えることができる。しかし、データ量は増えたが、それらのデータの分析はデータ量増大のペースに追いついていない。したがって、データの自動分析がますます求められている。
【0003】
生物学的データの最も基本的な観察の1つは、細胞の挙動を経時的に測定することである。細胞の数及び構造は時間経過とともに変化する。具体的には、増殖、構造、細胞分裂、細胞死などの細胞事象に関する測定量の一連の推移が、加えられた刺激と細胞の挙動との間の因果関係を暗示し、演繹することが報告されている。具体的な例を挙げると、ハイスループットアッセイでは、臨床治療での薬物の効能を判定する際に、ウェルへのその薬物の添加、細胞の構造及び数の変化の大きさ、並びに構造及び数の変化速度が重要である。さらに、細胞寿命のどの点で点滴注入が効果を現わすのかも興味深い。例えば、細胞癌に対する治療が細胞分裂を抑制することがある。細胞を追跡する必要がある大部分の研究は、訓練された生物学者の専門的技術を必要とする。ハイスループットスクリーニングのための追跡の費用は極端に高い。後に、ハイスループットアッセイに適した細胞追跡法を示す。
【0004】
細胞を追跡するためには一般に、コンピューターを使用して、複数の細胞のうちの単一の細胞を染料で標識し、その細胞が1つのフレームから別のフレームへ移動したときにその細胞を追跡する必要があるであろう。たとえその1つの細胞が標識されていたとしても、1つのフレームから別のフレームに移るときに存在する複数の細胞の中からその細胞を識別できるとは限らないため、標識された細胞の移動を追跡するこのプロセスはエラーを生じやすく、時間もかかる。さらに、細胞を標識するために利用する染料が、細胞の正常な機能を妨げる可能性もあり、そのため、細胞が1つのフレームから別のフレームへ移動するときに細胞がどのように機能するかを示す真の画像は得られないであろう。
【0005】
細胞を追跡するためにコンピューターが利用するアルゴリズムは、カルマンフィルター、粒子フィルターなどいくつかある。カルマンフィルターは、動的な系の状態を、不完全で雑音の多い一連の測定から推定する効率的な再帰型フィルターである。カルマンフィルターは、細胞などの物体の1つの点から別の点への移動を追跡するために、2次統計量に基づく追跡法を使用する。カルマンフィルターは、動的測定モデルがガウス雑音と線形関係にあると仮定する追跡法を使用する。しかし、細胞画像列では、多くの干渉因子、例えば背景クラッタが存在し、細胞境界の鮮明な画像を生成することが難しく、このことがしばしば、カルマンフィルター追跡が失敗に終わるなる原因となる。
【0006】
逐次モンテカルロ法の一形態である粒子フィルタリングは、ランダムサンプリングに基づく精巧なモデル推定技法を使用する。粒子フィルターは、ガウス分布の仮定を必要とせず、動的測定モデルは非線形モデルでもよい。粒子フィルターには、カルマンフィルターの欠点が1つもない。しかし、速度が遅いという欠点がある。しかし、そうは言われているものの、粒子フィルターは遅くはない。
【0007】
粒子フィルターとカルマンフィルターの基本的な違いは、それらのフィルターが状態を表す方法にある。カルマンフィルターは、パラメーター毎に1つの値を記憶し、それぞれのパラメーター間の対応する分散及び相関を、共分散行列の形で記憶する。粒子フィルターは、それぞれの粒子が、状態ベクトルとその対応する重みとを含む対に対応する「粒子」の集合を維持する。追跡対象の物体の全体的挙動は、粒子の集合の統計量から導き出すことができる。数十、数百又は数千の粒子を使用して単一の物体を追跡することができる。
【0008】
複数の時間経過画像をまたぐ細胞の追跡では、連続する2つの画像が一度に関与する。これらの2つの画像間では、一方の画像(前のフレーム)がもう一方の画像(現在のフレーム)よりも早く取得される。粒子フィルターの基本的着想は、逐次重点サンプリングの概念を使用した関連した確率分布の近似、及び関連した重みを有する一組の離散的ランダムサンプルを使用した確率分布の近似である。粒子フィルターアルゴリズムの目的は、現在のフレームと前のフレームとを関連付ける事象を識別することであり、複数の時点画像中の細胞の非線形移動に対して効率的であることが証明されている。粒子フィルターアルゴリズムでは、画像のそれぞれの細胞を、状態ベクトル/特徴ベクトルと呼ばれる一組の尺度によって表現する必要がある。このシナリオでは、特徴ベクトルが、X座標、Y座標及びフォームファクターを尺度として含み、これら尺度は、経時的に細胞を追跡するための1次入力である。
【0009】
粒子フィルターの使用の一例がWO2008/100704に開示されている。この文献の開示は、その全体が参照によって本明細書に組み込まれる。
【0010】
特徴ベクトルは、分割された画像から生成される。したがって、分割をより適切に実施することがこの追跡アルゴリズムの要諦である。粒子フィルターは、それぞれの細胞の周囲に粒子の雲(cloud)を生成する。この雲は、フレーム内のある1つの細胞につきまとい、次のフレームでその細胞を追跡するために使用される。粒子フィルターにおける追跡は、連続する2つのフレーム間の細胞の対応尺度によって達成される。対応は、(前のフレームの細胞につきまとう)それぞれの雲と(現在のフレーム内のある1つの細胞を表す)それぞれの特徴ベクトルとの間のエントロピーを計算することによって得られる。対応尺度は、2つのマトリックスの形態で提示され、1つのマトリックスは、前のフレームから現在のフレームへの対応を表し(以下、Cloud_to_Measureという。)、別のマトリックスは、現在のフレームから前のフレームへの対応を表す(以下、Measure_to_Cloudという。)。ある粒子フィルター用途では、この対応尺度を評価して、連続する2つの画像中の個々の細胞を関連付ける事象を生成し、この事象は、親子関係によって、グループ:不変、細胞除去、細胞移動、細胞衝突及び細胞分裂の中から選択される。しかし、時に、細胞の対応が誤った事象の生成につながり、細胞の対応を検証することが必要となる。
【先行技術文献】
【非特許文献】
【0011】
【非特許文献1】Kang et al,”Online Tracking of Migrating and Proliferating Cells Imaged with Phase−Contrast Microscopy”,Conference on Computer Vision and Pattern Recognition,20060617,ISBN 978−0−7695−2646−1;Abstract,Section 1.1,2
【発明の概要】
【0012】
本発明の目的は、試料中の細胞を動的に追跡する新しい方法及びシステムであって、先行技術の1つ以上の欠点を克服した方法及びシステムを提供することにある。この目的は、独立請求項に記載された方法及びシステムによって達成される。
【0013】
本発明に基づく方法及びシステムの1つの利点は、粒子フィルターによって生成された事象の正当性を検証する自動意思決定システムであって、既存の細胞追跡アルゴリズムに比べて、細胞追跡の正確さを最高30%向上させることができる自動意思決定システムを提供することである。
【0014】
一態様によれば、試料中の細胞を動的に追跡する方法であって、
・試料の連続する2つの時間経過画像中の細胞間の対応尺度を生成する段階と、
・前記対応尺度を評価して、それらの2つの画像中の個々の細胞を関連付ける事象を生成する段階であり、その事象が、グループ:不変、細胞除去、細胞移動、細胞衝突及び細胞分裂の中から選択される段階と、
・それらの2つの画像中の個々の細胞を関連付ける事象の追跡出力を提供する段階と
を含み、
・関連付ける事象を確定する前記段階が、生成された細胞衝突事象及び細胞分裂事象の正当性を、このような事象毎に適応閾値を計算し、その閾値を事象パラメーターと比較することによって検証することを含む方法が提供される。
【0015】
他の態様によれば、適応閾値が、生成された事象に関与した細胞のうちの1つ以上の細胞のサイズから計算される。さらに、適応閾値を、生成された事象に関与した最も小さな細胞の半径に比例させることができる。より具体的には、適応閾値を、前記最も小さな細胞の半径に、試料中の細胞の運動に応じた変数を乗じることによって計算することができ、一実施形態では、この変数が、5乃至20、好ましくは7.5乃至15の範囲のユーザ定義パラメーターである。
【0016】
一態様によれば、生成された細胞衝突事象については、前記事象パラメーターが、前の画像中の関連付けられた細胞間の空間関係であり、生成された細胞分裂事象については、前記事象パラメーターが、後の画像中の関連付けられた細胞間の空間関係である。より具体的には、生成された細胞衝突事象については、前記事象パラメーターを、前の画像中の関連付けられた細胞間の距離とすることができ、生成された細胞分裂事象については、前記事象パラメーターを、後の画像中の関連付けられた細胞間の距離とすることができる。
【0017】
一態様によれば、対応尺度を生成する前記段階が粒子フィルターアルゴリズムを含む。
【0018】
一態様によれば、この方法はさらに、
・被追跡細胞毎に、生成された追跡出力から親及び子カウントを計算する段落であり、
・親カウント>1のときに、親細胞を子細胞に関連付ける衝突事象が生成され、
・子カウント>1のときに、子細胞を親細胞に関連付ける分裂事象が生成される
段階と、
・生成された細胞衝突事象及び細胞分裂事象の正当性を、このような事象毎に適応閾値を計算し、その閾値を事象パラメーターと比較することによって検証する段階と
・追跡出力を更新する段階と
を含む。
【0019】
さらに別の態様によれば、試料中の細胞を動的に追跡するシステムであって、試料の連続する時間経過画像を提供するように配置された撮像システムと、請求項1乃至請求項9のいずれか1項記載の方法に従って試料中の細胞を追跡するように配置された画像受信装置とを備えるシステムが提供される。
【0020】
本発明の実施形態は従属請求項に記載されている。
【0021】
本発明のこれらの利点及びその他の利点は、添付図面を参照して以下の説明を読むことによってより明白となる。
【図面の簡単な説明】
【0022】
【図1】本発明に基づく一般的な撮像システムのブロック図である。
【図2】本発明に基づく図1の画像受信装置の概略図である。
【図3】本発明に基づく粒子フィルターアルゴリズムグラフィカルユーザインタフェースのコンピュータースクリーンショットを示す図である。
【図4】本発明に基づく粒子フィルターアルゴリズムの流れ図である。
【図5】細胞の対応を処理する本発明に基づく新規の方法の他の流れ図である。
【図6】本発明に基づく新規の閾値論理を適用した後の、前の画像及び現在の画像の図である。
【図7】本発明に基づく粒子フィルターによって検出された細胞分裂を示す、前の画像及び現在の画像の図である。
【図8】本発明に基づく粒子フィルターによって検出された細胞衝突を示す、前の画像及び現在の画像の図である。
【発明を実施するための形態】
【0023】
現時点における本発明の好ましい実施形態を図面を参照して説明する。それらの図面では、同様の構成要素が同じ符号によって識別される。好ましい実施形態の以下の説明は例示が目的であり、それらの実施形態が本発明の範囲を限定することは意図されていない。
【0024】
図1は、一般的なディジタル顕微鏡システムの主要な構成要素のブロック図を示す。この自動ディジタル顕微鏡システム100は以下の構成要素を含む:光源101、コリメータ102、任意選択の非球面光学部品104、ビームフォールディング光学部品105、対物レンズ107、試料109、試料ホルダー111、ステージ113、チューブレンズ115、光学検出器117、任意選択の通信リンク119及び任意選択のコンピューター121。
【0025】
光源101は、ランプ、レーザー、複数のレーザー、発光ダイオード(LED)、複数のLED、又は光ビーム101aを発生させる当業者に知られている任意のタイプの光源とすることができる。光ビーム101aは、光源101、コリメータ102、任意選択の非球面光学部品104、ビームフォールディング光学部品105及び対物レンズ107によって送達されて試料109を照らす。試料109は、生きた生体物質/生物、生物細胞、非生物試料などである。非球面光学部品104は一般的なパウエルレンズである。ビームフォールディング光学部品105は、一般的なスキャニングミラー又はダイクロイックミラーである。試料109から放射された光は対物レンズ107によって集められ、次いで、一般的なチューブレンズ115によって光学検出器117上に試料109の像が形成される。光学検出器117は、電荷結合素子(CCD)、相補型金属酸化物半導体(CMOS)像検出器、又は当業者によって利用されている任意の2−Dアレイ光学検出器とすることができる。光学検出器117は適宜、通信リンク119によって、電気的に又は無線でコンピューター121に接続される。他の実施形態では、光学検出器117の代わりに、対物レンズ107と協力して中間像をさらに拡大し、標本の詳細を観察できるようにする一般的な顕微鏡接眼レンズ又は接眼鏡が使用される。さらに、光学検出器117の代わりに、2つ、3つ又は4つ以上の光学検出器117を利用することもできる。試料109は試料ホルダー111上に取り付けられ、試料ホルダー111は、一般的なマイクロタイタープレート、顕微鏡スライド、チップ、ガラスプレート、ペトリ皿又は任意のタイプの試料ホルダーと呼ばれることがある。
【0026】
他の実施形態では、顕微鏡システム100が適宜、通信リンク119によって従来のコンピューター121に電気的に又は無線で接続される。通信リンク119は、ローカルエリアネットワーク(LAN)、無線ローカルネットワーク、ワイドエリアネットワーク(WAN)、ユニバーサルシリアルバス(USB)、Ethernet(登録商標)リンク、光ファイバなど、自動顕微鏡システム100とコンピューター121の間のデータ転送を容易にすることができる任意のネットワークとすることができる。
【0027】
顕微鏡システム100は、光学検出器117又は一般的な顕微鏡接眼レンズを利用することによって物体ステージ113上に置かれた試料109又は任意のタイプの物体の画像を捕捉する能力を有する画像送信装置、撮像装置又は撮像システムと呼ばれることがある。さらに、顕微鏡システム100を例えば、GE Healthcare社(米ニュージャージー州ピスカタウェイ)製のIN Cell Analyzer 1000又はIN Cell Analyzer 3000とすることもできる。顕微鏡システム100は、一般的な共焦点顕微鏡、蛍光顕微鏡、落射蛍光顕微鏡、位相差顕微鏡、微分干渉コントラスト顕微鏡、又は当業者に知られている任意のタイプの顕微鏡とすることができる。他の実施形態では、顕微鏡システム100が、生物などの画像を検出し、分析し、提供することができる一般的なハイスループット、ハイコンテント細胞内(subcellular)撮像分析装置である。さらに、顕微鏡システム100を、自動細胞撮像システム又は自動細胞内(subcellular)撮像システムとすることもできる。
【0028】
試料からの反射光又は蛍光を受け取る光学検出器117は、光電子増倍管、電荷結合素子(CCD)、相補型金属酸化物半導体(CMOS)像検出器、又は当業者によって利用されている任意の光学検出器とすることができる。光学検出器117は、通信リンク119によってコンピューター103に電気的に又は無線で接続される。他の実施形態では、光学検出器117の代わりに、対物レンズ107と協力して中間像をさらに拡大し、標本の詳細を観察できるようにする一般的な顕微鏡接眼レンズ又は接眼鏡が使用される。
【0029】
コンピューター121は、画像受信装置121又は画像検出装置121と呼ばれることがある。本発明の他の実施形態では、画像受信装置121が画像送信装置100内に位置する。画像受信装置121は、試料115の画像を光学検出器107から受信する能力を有する一般的なコンピューターの働きをし、次いで、画像受信装置103は、標準画像処理ソフトウェアプログラム、アルゴリズム又は式を利用することによって、その画像を表示し、保存し、又は処理することができる。さらに、コンピューター103を、パーソナルディジタルアシスタント(PDA)、ラップトップコンピューター、ノートブックコンピューター、携帯電話、ハードドライブベースの装置、又は通信リンク119を介して情報を受信し、送信し、記憶することができる任意の装置とすることもできる。本発明では1台のコンピューターが利用されるが、コンピューター121の代わりに複数のコンピューターを利用することもできる。
【0030】
図2は、図1の細胞追跡システムの画像受信装置の概略図を示す。画像受信装置若しくは撮像受信装置121又は画像受信装置203は、従来のコンピューターに関連した一般的な構成要素を含む。画像受信装置203を、画像送信システム100上に収容することもできる。画像受信装置203は、プロセッサー203a、入力/出力(I/O)コントローラ203b、大容量記憶装置203c、メモリー203d、ビデオアダプター203e、接続インタフェース203f、及び上記のシステム構成要素をプロセッサー203aに電気的に又は無線で動作可能に結合するシステムバス203gを含む。システムバス203gはさらに、一般的なコンピューターシステム構成要素をプロセッサー203aに電気的に又は無線で動作可能に結合する。プロセッサー203aは、処理ユニット、中央処理ユニット(CPU)、複数の処理ユニット又は並列処理ユニットと呼ばれることがある。システムバス203gは、従来のコンピューターに関連した一般的なバスとすることができる。メモリー203dは、リードオンリーメモリー(ROM)及びランダムアクセスメモリー(RAM)を含む。ROMは、起動時のコンピューターの構成要素間の情報転送を支援する基本ルーチンを含む一般的な入力/出力システムを含む。
【0031】
入力/出力コントローラ203bはバス203gによってプロセッサー203aに接続され、そこで入力/出力コントローラ203bは、粒子フィルターグラフィカルユーザインタフェース(GUI)及びキーボード、ポインティングデバイスなどの入力装置204を介して、ユーザが、コマンド及び情報をコンピューターに入力することを可能にするインタフェースの働きをする。利用される一般的なポインティングデバイスは、ジョイスティック、マウス、ゲームパッドなどである。システムバス203gには、ビデオアダプター203eによって、表示装置206が電気的に又は無線で接続される。表示装置206は、一般的なコンピューターモニター、プラズマテレビジョン、液晶ディスプレイ(LCD)、又はコンピューター203によって生成された文字及び/若しくは静止画像を表示する能力を有する任意の装置とすることができる。コンピューター203のビデオアダプター203eのとなりには接続インタフェース203fがある。接続インタフェース203fは、前述のとおり通信リンク119によって光学検出器117に接続されたネットワークインタフェースと呼ばれることがある。さらに、画像受信装置203は、画像受信装置203を別のコンピューターに結合することを可能にするネットワークアダプター又はモデムを含むことができる。
【0032】
メモリー203dの上には大容量記憶装置203cがあり、大容量記憶装置203cには、1.ハードディスクから読み取り、ハードディスクへ書き込むためのハードディスクドライブ構成要素(図示せず)及びハードディスクドライブインタフェース(図示せず)、2.磁気ディスクドライブ(図示せず)及びハードディスクドライブインタフェース(図示せず)、並びに3.CD−ROM、他の光学式媒体などの取外し可能な光ディスクから読み取り、光ディスクに書き込むための光ディスクドライブ(図示せず)及び光ディスクドライブインタフェース(図示せず)が含まれる。上記のドライブ及びそれらの関連コンピューター可読媒体は、コンピューター可読命令、データ構造、プログラムモジュール及び他のデータの不揮発性記憶をコンピューター103に提供する。さらに、上記のドライブは、図4及び5の流れ図で説明する、生体物質の位置を決定し、又は細胞の移動を追跡するための本発明のアルゴリズム、ソフトウェア又は式を有する技術的な効果を含む。
【0033】
このソフトウェアは、生体物質ロケータグラフィカルユーザインタフェース(GUI)を有する。生体物質ロケータGUIは、コンピューターユーザがコンピューター203と容易に対話することを可能にするように設計されたソフトウェアプログラムである一般的なGUIと同じ機能のうちの一部の機能を有する特別にプログラムされたGUIである。生体物質ロケータGUIは、1.追跡ターゲット、2.粒子の数、及び3.閾値ファクターを表示する図3に示されているようなスクリーンショットを含む。
粒子フィルター
前述のとおり、WO2008/100704は、本発明に基づく事象の検証を利用することができる粒子フィルターの一実施形態を詳細に開示している。
【0034】
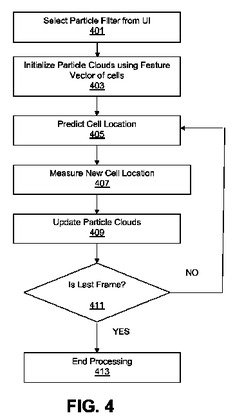
粒子フィルター(すなわち細胞追跡)のための最初の処理段階は画像の分割である。分割後すぐに、画像のそれぞれの細胞に固有の識別番号(細胞ID)を割り当てる。粒子フィルターの実際の追跡アルゴリズムは、連続する2つのフレームの細胞ID間の対応を見つける。このアルゴリズムは主に、予測、観察/測定及び更新と呼ばれる3つの段階を実行する(図4)。
【0035】
図4は、細胞追跡ソフトウェアアプリケーションで粒子フィルターアルゴリズムが使用される方法の一例の流れ図を概略的に示す。
【0036】
ブロック401で、ユーザが、あるプロトコルで記憶された細胞粒子フィルターアルゴリズムを、プロセッサー203a上で開始する。それによって、ユーザは例えば、生体物質ロケータGUI又は細胞追跡GUIを操作して、図3のコンピュータースクリーンショット上の生体物質GUIのドロップダウンリストの中の粒子フィルターアルゴリズムを選択する。
【0037】
次に、ブロック403で、粒子フィルターアルゴリズムを初期化する。粒子フィルターを追跡アルゴリズムとして起動する時間経過画像スタックに対する分析を選択した後、最初の段階は、最初の画像フレームのそれぞれの細胞の周囲の粒子雲を更新する/生成する段階である。粒子雲は、最初の画像フレーム内のそれぞれの細胞に対して生成された特徴ベクトルの助けを借りて更新される。
【0038】
ブロック405で、生体物質又は細胞の位置を予測する。この予測段階は、それぞれの試料に、細胞につきまとう雲の小さなランダムな摂動を追加する。これは、ある細胞が次のフレームにあるか否かの予測である。
【0039】
次に、ブロック407で、新たな細胞位置を追跡し、確定する。この段階では、細胞間の対応を評価する手段として、現在時刻に実際に観察された細胞の反応(特徴ベクトル)を、それぞれの粒子の予測と比較する。この段階は、中核をなす論理を使用して、前の画像フレームと現在の画像フレームとの間の複数の細胞間の対応を見つけ出す。この段階は、現在のフレームの細胞を前のフレームの細胞に関連付けることによって、関連付けられた事象を生成する。この新たな細胞位置の追跡407ついては、後に、図5の流れ図でより詳細に説明する。
【0040】
ブロック409で、粒子雲を更新する。雲は、現在のフレームの測定(特徴ベクトル)に対して更新され、最終的に次のフレームの細胞に対して使用される。次に、ブロック411で、そのフレームが最後のフレームであるか否かを判定する。そのフレームが最後のフレームでない場合、処理は、細胞位置の予測に戻る。そのフレームが最後のフレームである場合、ブロック413で、この処理は終了する。
【0041】
この実施形態では、それぞれの雲及び特徴ベクトルに対するエントロピー値を使用して生成された2つの対応マトリックスを介して、連続する2つの画像フレームの細胞間の対応にアクセスする。本明細書ではCloud_to_Measureと呼ぶ一方の対応マトリックスは、現在のフレームの1つ又は多くの細胞IDに対応する前のフレームの細胞IDを捕捉する。これは子カウントを表す。本明細書ではMeasure_to_Cloudと呼ぶもう一方の対応マトリックスは、親カウントを表す前のフレームの1つ又は多くの細胞IDに対応する現在のフレームの細胞IDを捕捉する。粒子フィルターアルゴリズムの目的は、現在(現在のフレーム)を過去(現在のフレームよりも早く処理された任意のフレーム;通常は単純に1つ前のフレーム)に関連付ける事象を識別することである。関連付けの結果は、事象、例えば不変(標準の追跡)、細胞除去、細胞移動、細胞衝突及び細胞分裂の形で提示される。
【0042】
対応マトリックスのそれぞれの要素は、細胞IDを含まないか、単一の細胞IDを含むか、又は多くの細胞IDを含むかのいずれかである。それぞれの要素は、事象が生成されたときに、標準の追跡に対応する細胞間の1対1の対合を生成し、1対多又は多対1の対合に従う。生物領域に対して識別されるこれらのさまざまな事象は、衝突、分裂、新たな細胞の移動及び細胞の除去と呼ばれる。下表1は、さまざまなケースの図表現及び粒子フィルターによって生成されるそれらの対応尺度を示す。表中の破線の円は存在する細胞を表し、点線の円は存在しない細胞を表す。対応マトリックスを解釈する手がかりを以下に示す。
【0043】
1.Cloud_to_Measure[A]=B又はMeasure_to_Cloud[B]
これは、前のフレームの細胞ID Aが現在のフレームの細胞ID Bに関連付けられたときの標準の追跡(不変)を表す。
【0044】
2.Cloud_to_Measure[A]=NULL
これは、現在のフレームの特徴が前のフレームの細胞ID Aに関連付けられないときの細胞除去を表す。
【0045】
3.Cloud_to_Measure[A]=B,C
これは、前のフレームの細胞ID Aが現在のフレームの細胞ID B及びCに関連付けられたときの細胞分裂を表す。
【0046】
4.Measure_to_Cloud[B]=NULL
これは、現在のフレームの細胞IDが前のフレームの細胞と一切関連を持たないときの細胞移動又は新たな細胞を表す。
【0047】
5.Measure_to_Cloud[B]=E,F
これは、現在のフレームの単一の細胞ID Bが前のフレームの細胞ID E及びFに関連付けられたときの細胞衝突を表す。
【0048】
粒子フィルターによって生成される追跡出力は完全に、上で論じた対応マトリックスに基づく。
【0049】
【表1】


この表は、以下の3つの部分に分けられる:1.前のフレームから現在のフレームへの以前の生体物質(細胞)の移動のそれぞれの発生、2.前のフレームから現在のフレームへの移動に対する対応尺度、及び3.事象のタイプ。対応尺度は、前のフレームから現在のフレームへ細胞が移動したときに、その細胞に起こったことをユーザに知らせる。事象は、前のフレームから現在のフレームへ細胞が移動したときに、細胞の衝突、分裂、移動、除去などのうちのどの種類の事象が起こったのかを記述する。この表は、前のフレームから現在のフレームへ細胞が移動するときに細胞に起こることの異なる10の例を含む。
【0050】
第1の例では、前のフレームに細胞ID 9があり、細胞ID 9が、現在のフレームの細胞ID 11になる。この対応尺度は、前のフレームの細胞ID 9が現在のフレームの細胞ID 11に関連付けられたとき、及び現在のフレームの細胞ID 11が前のフレームの細胞ID 9に関連付けられたときの標準の追跡(不変事象)を表す単純なClouds_to_measure[9]=11及びMeasure_to_Cloud[11]=9である。この第1の例に対応する事象は、細胞ID 9が、細胞ID 11として新たな位置へ完全に移動した標準の追跡である。第2の例では、前のフレームに細胞ID 9があり、現在のフレームを見たときに細胞ID 9が消失している。この対応尺度は、現在のフレームの特徴が前のフレームの細胞ID 9に関連付けられないときの細胞除去を表すCloud_to_Measure[9]=Nullである。この例に対応する事象は細胞除去である。
【0051】
第3の例では、前のフレームに2つの細胞ID 9及び10がある。現在のフレームへ移動したときに、前のフレームの細胞ID 9は変化しており、細胞除去事象を指示するCloud_to_Measure[9]=Nullがある。細胞ID 10については、対応尺度Cloud_to_Measure[10]=11が不変追跡事象を指示している。しかし、対応尺度Measure_to_Cloud[11]=9,10は、前のフレームに細胞ID 9があり、次いで細胞ID 9が移動して、現在の現在のフレームで細胞ID 10と結合して細胞ID 11を形成した細胞衝突事象があることを指示している。この図に示されているように、細胞ID 9と10の間の距離は比較的に大きく、したがって、9と10の間の細胞間距離が、後により詳細に論じる閾値よりも大きいため、細胞ID 9は除去されたはずである。
【0052】
第4の例では、前のフレームには細胞IDがないが、現在のフレームには新たな細胞ID 11がある。この例に対する対応尺度は、Measure_to_Cloud[11]=Nullである。この事象は、現在のフレームの細胞IDが前のフレームの細胞と一切関連を持たないときの細胞移動又は新たな細胞と呼ばれる。第5の例では、前のフレームには細胞ID 9だけしかないが、現在のフレームには細胞ID 10及び11がある。対応尺度Cloud_to_Measure[9]=10,11は細胞ID 9の細胞分裂を指示しているが、対応尺度Measure_to_Cloud[10]=9及びMeasure_to_Cloud[11]=Nullは、細胞ID 9が現在のフレーム内の細胞ID 10を表す不変事象、及び細胞ID 11に対する細胞移動事象を指示している。この図に示されているとおり、細胞ID 10と11の間の距離は比較的に大きく、したがって、10と11の間の細胞間距離が、後により詳細に論じる閾値よりも大きいため、細胞ID 11は新たな(移動した)細胞と考えるべきである。
【0053】
細胞ID 9及び細胞ID 10を含む第6の例では、細胞ID 9が、前のフレームから現在のフレームへ移動して細胞ID 11を生成している。対応尺度Cloud_to_Measure[9]=11及びCloud_to_Measure[10]=Nullは、細胞ID 9が現在のフレーム内の細胞ID 11を表す不変事象、及び細胞ID 10に対する細胞除去事象を指示しているが、対応尺度Measure_to_Cloud[11]=9,10は、細胞ID 9と10の細胞衝突を指示している。この図に示されているように、細胞ID 9と10の間の距離は比較的に小さく、したがって、細胞ID 9と10の間の細胞間距離が、後により詳細に論じる閾値よりも小さいため、この事象は細胞衝突と考えるべきである。
【0054】
第7の例では、前のフレーム内の細胞ID 9及び10が現在のフレームへ移動し、そこでそれらの細胞IDが衝突して細胞ID 11を形成する。この対応尺度は、Cloud_to_Measure[9]=11及びMeasure_to_Cloud[11]=10である。この図から、この事象が明確な細胞衝突であることが分かるが、両方の尺度が1対1の尺度であり、そのためこの事象は粒子フィルターによって衝突と認識されないため、粒子フィルターによって生成された対応尺度はいずれも衝突を認識しないことに留意すべきである。第8の例では、前のフレームの細胞ID 9が、現在のフレームの細胞ID 10と細胞ID 11に分割される。対応尺度Cloud_to_Measure[9]=10,11は細胞ID 9の細胞分裂を指示するが、対応尺度Measure_to_Cloud[10]=9及びMeasure_to_Cloud[11]=Nullは、細胞ID 9が現在のフレーム内の細胞ID 10を表す不変事象、及び細胞ID 11に対する細胞移動事象を指示している。この図に示されているように、細胞ID 10と11の間の距離は比較的に小さく、10と11の間の細胞間距離が、後により詳細に論じる閾値よりも小さいため、この事象は、細胞ID 9の細胞分裂と考えるべきである。
【0055】
第9の例では、前のフレームの細胞ID 9が、現在のフレームに2つの細胞ID 10及び11を生成している。対応尺度は、Cloud_to_Measure[9]=10及びMeasure_to_Cloud[11]=9である。しかし、この図から分かるとおり、この事象は明確な細胞分裂事象であるが、全ての尺度が1対1の尺度であり、そのためこの事象は粒子フィルターによって衝突と認識されないため、粒子フィルターによって生成される対応尺度はいずれも分裂を認識しないことに留意すべきである。最後の例では、前のフレームに2つの細胞ID 9及び12がある。前のフレームの細胞ID 9は細胞ID 10及び11を生成しており、これは、対応尺度Cloud_to_Measure[9]=10,11、Cloud_to_Measure[12]=10、Measure_to_Cloud[10]=9及びMeasure_to_Cloud[11]=9を有する。これは不明確な事象を表し、したがって標準の追跡事象とみなすべきである。
【0056】
図5は、新たな細胞位置を測定するブロック407の下に位置する、細胞の対応を処理する新規の方法の流れ図を示す。ブロック501で、新たな細胞位置を測定するこの処理段階は一般に、連続する2つの画像フレームの細胞を関連付けるための中核をなす対応尺度を、上で論じたとおりに生成する。これらの尺度の要素は、それらの尺度に関連した1つ又は複数の細胞ID事象を含みうる。ブロック503で、それらの対応尺度を評価して、不変事象、細胞除去事象、細胞移動事象(表1の例1、2及び4)など、追加の検証又は解釈を必要としない明確な単一のID事象を識別し、そのデータを直接に使用して、ブロック505によって指示された標準の追跡を介して、ブロック513で追跡出力を生成する。本明細書では、追跡出力を生成すること513が一般に、連続する2つの画像フレームの細胞IDを関連付けることを意味する。しかし、ブロック503で、ある要素が複数の細胞IDに関連すると識別された場合、これは、追跡事象として処理されなければならない。追跡事象に遭遇したときには、ブロック507から511で、その事象の正当性を、局所閾値の助けを借りて検証する。事象の自動検証及び局所閾値の計算については後に説明する。事象の正当性を検証する間に、検証された事象を表す新たな対応尺度が生成され、最終的にブロック513で追跡出力を生成する。
【0057】
ブロック513での追跡出力の生成に続いて、ブロック515で、「親子関係」に基づいて追跡出力の訂正を実行することができる。訂正ブロック515は、それまでに識別されていない衝突事象又は分裂事象を捕捉し、複数の事象に関連付ける同じ細胞IDの複製を追跡出力が含むことを防ぐのに役立つ。ブロック515において、親カウントは、現在のフレームの単一の細胞に関連付けられた前のフレームの細胞の数を表す。親カウントが1よりも大きな値を有するとき、その事象は衝突として確定される。同様に、子カウントは、前のフレームの単一の細胞に関連付けられた現在のフレームの細胞の数を表す。子カウントが1よりも大きい値を有するとき、その事象は分裂として確定される。したがって、親子関係に基づくこの処理は正当な追加の事象を捕捉するが、追跡出力が生成されるまではそれらの事象は捕捉されない。その後、ブロック517で、最終的な追跡出力を保存する。
【0058】
一実施形態によれば、ブロック503で複数の細胞IDに関連すると識別された追跡事象は、ブロック507及び508で、以下の手順に基づく検証を受ける。
【0059】
1.衝突に関して前のフレームの細胞IDを識別する。前のフレームの細胞X、Yを現在のフレームの細胞Zに関連付ける(すなわちMeasure_to_Cloud=[Z]=X,Y)。
【0060】
2.Cloud_to_Measureマトリックスにおいて、ID X又はYが複数のIDに関連付けられているか否かを判定する。Cloud_to_Measureマトリックスが、前のいずれかの細胞に関して複数の対応を示さない場合、これは真の衝突とみなされ、Cloud_to_Measureマトリックスが前のいずれかの細胞に関して複数の対応を示す場合、その事象は不明確な事象とみなされる。例えばCloud_to_Measure[X]=Z,Aであるとき、これは不明確なケースである。
【0061】
3.明確な事象に関しては、実行時に生成された閾値に基づいて、前の画像の細胞がグループ分けされる。前のフレームの細胞ID間の事象パラメーターが閾値よりも大きい場合、一方のグループが除去された細胞とみなされ、標準的に追跡された細胞は、マトリックスCloud_to_Measureの助けを借りて識別される。
【0062】
4.不明確なケースは、不明確な細胞以外の細胞の標準の追跡又は分割を表す。実際に分割を受ける細胞は、Measure_to_Cloudマトリックスとして捕捉された細胞の対応によって評価される。
【0063】
5.細胞分裂に遭遇したときには、段階1から4で説明したのと同様の論理を繰り返す。これは、2つの異なるマトリックス及び現在のフレーム又は前のフレームを入れ替えるだけである。
【0064】
ブロック507で、その事象が真の事象であるか否かを検証するために、それぞれの事象に対する適応閾値を計算する。一実施形態によれば、以前の画像(1つ以上)及び/又は現在の画像から取得可能な空間情報に基づいて、適応閾値を計算する。より具体的には、生成された事象に関与した細胞に関する空間情報から、この閾値を計算することができる。細胞の運動学的挙動は少なくとも部分的に細胞のサイズに関係するため、この閾値は例えば、関与した細胞のうちの1つ以上の細胞のサイズに基づいて計算することができる。それに加えて、又はその代わりに、この閾値が、2つ以上の以前の画像から測定された運動学的パラメーターに基づいてもよい。
【0065】
適応閾値を計算するプロセスの一例は以下の段階を含む。
【0066】
1.事象を生成する細胞のグループの領域を、このアルゴリズムに対する入力として使用する段階
2.事象を生成すると仮定される細胞の中で最も小さな領域を見つける段階
3.その事象に対する閾値(T)を、最も小さな細胞の半径のある倍数として計算する段階
この例の乗数は、ユーザ定義のパラメーター(すなわち図1の閾値ファクター)として設計される。この乗数の値は、高速で非常にランダムな細胞の移動に対してはより大きくする。しかし、複数の時間経過画像をまたいで低速で安定した細胞の移動に対しては、この乗数値を小さくすべきである。この乗数の一般的な範囲は7.5乃至15と定義される。
【0067】
最大事象はある値で正当とみなされ、これを超える事象は誤りである。適応閾値は、それを超えると粒子フィルターが余分な事象を捕捉しない飽和値を有する。
【0068】
この閾値は局所閾値であり、それぞれの事象に対して新たな閾値が計算されること、及びこの閾値は標準の追跡に影響を及ぼさないこと、すなわち、この閾値に対する小さな変更はあまりに異なる出力を生成しないことに留意すべきである。
【0069】
ブロック509で、この適応閾値を前記事象に対する事象パラメーターと比較することにより、正当性検証の対象である事象の正当性を検証する。適応閾値と同様に、この事象パラメーターも、例えば、以前の画像(1つ以上)及び/又は現在の画像から取得可能な、生成された事象に関与した細胞に関する空間情報に基づくことができる。生成された細胞衝突事象については、この事象パラメーターを例えば、前の画像中の関連付けられた細胞間の空間関係とすることができ、生成された細胞分裂事象については、この事象パラメーターを、後の画像中の関連付けられた細胞間の空間関係とすることができる。より具体的には、この事象パラメーターを、その事象に関与した関連付けられた細胞間の距離とすることができる。
【0070】
前述のとおり、ブロック515で、追跡出力は親子関係に基づいて訂正される。表1に示した例7及び9はそれぞれ、衝突及び分裂の非常に特別なケースを表す。これは、前の現在のフレームの細胞IDと現在のフレームの細胞IDの間の可能な1対1関係を例示し、したがって、標準の追跡シナリオを指示する。一実施形態によれば、追跡出力から親及び子カウントを得ることにより親子関係を考慮することによって、この不明確性を訂正することができる。親カウントは、現在のフレーム内の唯一の細胞に接続する前のフレームの細胞の数を表す。また、子カウントは、前のフレーム内の唯一の細胞に接続する現在のフレームの細胞の数を表し、以下の段階を含むことができる。
【0071】
1.既に生成された追跡出力から親及び子供カウントを計算する段階
2.親カウント>1であるか、又は子カウント>1であるかに応じて、前のフレームの細胞IDと現在のフレーム細胞IDとの間の細胞対応を生成する段階。すなわち、親カウント>1は衝突に対応し、子カウント>1は分裂に対応する。
【0072】
3.自動的に生成された閾値Tを使用して、対応/事象を検証する段階
4.生成された新たな事象に基づいて追跡出力を更新する段階
標準的に追跡された細胞につきまとう雲の連続する更新は、その細胞を事実上新たな位置へ移動させることがありえる。したがって、雲の集合は、現在のフレームからの細胞尺度(特徴ベクトル)を使用して更新される。
粒子フィルターの性能を示す例
図6a及び6bは、事象の検証によって粒子アルゴリズムの改良の導入が実現された一例を示す。図6aは前のフレームを示し、図6bは現在のフレームを示す。粒子フィルタリングによって画像6a及び6bを評価したとき、細胞ID 12に対する追跡出力は、Cloud_to_Measure[12]=13,14であった。この追跡出力により、この事象は細胞分裂事象として捕捉される。しかし、この細胞分裂事象の正当性を検証した後、この事象は、1つの新たな細胞の移動と、前のフレーム内の2つの細胞の不変事象とを表すものと訂正された。すなわちCloud_to_Measure[12]=13及びMeasure_to_Cloud[14]=NULLである。
【0073】
図7a及び7bは、粒子フィルタリングによる評価が、この事象を、1対多関係を有する細胞分裂事象として、すなわちCloud_to_Measure[12]=13,14、Measure_to_Cloud[13]=12及びMeasure_to_Cloud[14]=12として捕捉する他の例を示す。このケースでは、細胞分裂事象の正当性の検証が、その事象が真の細胞分裂であることを明らかにする。同様に、図8a及び8bは、粒子フィルタリングによる評価が、この事象を、多対1関係を有する細胞衝突事象として、すなわちCloud_to_Measure[12]=14、Cloud_to_Measure[13]=14及びMeasure_to_Cloud[14]=12,13として捕捉する例を示し、この事象の正当性の検証は、その事象が真の細胞衝突であることを明らかにする。
【0074】
粒子フィルターと近接(proximity)との性能比較では、粒子フィルターの追跡機能の性能の方が約30%高いことが示されている。粒子フィルターのUIは、図3に示すように、粒子の数を入力するオプションを設けている。粒子フィルターの性能は粒子数に依存する。常に、粒子数が多いほど追跡の正確さは向上する。細胞が密集して存在するときには、粒子数をより大きくすべきである。InCellによって取得した時間経過画像スタックに対する実験中に、本発明の発明者らは以下の知見を見出した。
【0075】
細胞の密度が低いときには、粒子数=25が適当である。
【0076】
細胞の密度が中程度であるときには、粒子数=50が適当である。
【0077】
細胞の密度が高いときには、粒子数=100から150が適当である。
【0078】
改良されたこの粒子フィルターアルゴリズムの正確さを、既存の追跡アルゴリズム(すなわち近接)に対して評価する。この評価は、2つの別個の画像スタック、すなわちcell track−3及び171006−cell tracking−22hrs−2.xdceに対して実施する。画像スタック毎に、両方の追跡アルゴリズムに対して単一の分割技法を適用した。適当なパラメーターを使用して近接の効率を捕捉する(すなわち両方の画像スタックに対して相対閾値=2.5及び異常値検出=4.0)。しかし、粒子フィルターは、異なる粒子数値及び異なる閾値ファクター値を用いて評価した。分析結果は下表2に表示されている。
【0079】
【表2】

本発明は、ユーザが物体の移動を追跡することができる自動システム及び方法、例えば、ユーザが、複数の細胞の中の1つ以上の細胞がどのように機能するかを判定するために、その1つ以上の細胞が時間経過とともに1つの点から別の点へ移動するときに、その1つ以上の細胞の移動を追跡することができる自動システム及び方法を提供する。ユーザは、その1つ以上の細胞の移動を追跡し、その1つ以上の細胞が細胞分裂を経ているか否か、又は2つ以上の細胞が合体したか否かなど、その1つ以上の細胞の構造が変化したか否かを判定することができる。このユーザは、その1つ以上の細胞を最適に追跡して、その1つ以上の細胞が時間及び距離に関して移動するときに、その1つ以上の細胞のおおよその位置を見つけることができる。したがって、本発明は、細胞機能を研究するために細胞の移動を追跡する手段をユーザに提供する。
【0080】
特定の実施形態に関して本発明を説明したが、当業者には明らかなとおり、以下の特許請求の範囲に記載された本発明の趣旨及び範囲から逸脱することなく、本発明の多くの変更及び変形を実施することができる。
【符号の説明】
【0081】
100 自動ディジタル顕微鏡システム
101 光源
101a 光ビーム
102 コリメータ
104 非球面光学部品
105 ビームフォールディング光学部品
107 対物レンズ
109 試料
111 試料ホルダー
113 ステージ
115 チューブレンズ
117 光学検出器
119 通信リンク
121 コンピューター
203 画像受信装置
203a プロセッサー
203b 入力/出力(I/O)コントローラ
203c 大容量記憶装置
203d メモリー
203e ビデオアダプター
203f 接続インタフェース
203g システムバス
204 入力装置
206 表示装置
【技術分野】
【0001】
本発明は、生体物質の位置を決定するシステム及び方法に関する。
【背景技術】
【0002】
この10年の間に、生物学的プロセスに関して実施されたデータ測定の量は爆発的に増大した。この爆発は主に、技術の向上、特にコンピューター技術の向上によるものと考えることができる。しかし、データ量は増えたが、それらのデータの分析はデータ量増大のペースに追いついていない。したがって、データの自動分析がますます求められている。
【0003】
生物学的データの最も基本的な観察の1つは、細胞の挙動を経時的に測定することである。細胞の数及び構造は時間経過とともに変化する。具体的には、増殖、構造、細胞分裂、細胞死などの細胞事象に関する測定量の一連の推移が、加えられた刺激と細胞の挙動との間の因果関係を暗示し、演繹することが報告されている。具体的な例を挙げると、ハイスループットアッセイでは、臨床治療での薬物の効能を判定する際に、ウェルへのその薬物の添加、細胞の構造及び数の変化の大きさ、並びに構造及び数の変化速度が重要である。さらに、細胞寿命のどの点で点滴注入が効果を現わすのかも興味深い。例えば、細胞癌に対する治療が細胞分裂を抑制することがある。細胞を追跡する必要がある大部分の研究は、訓練された生物学者の専門的技術を必要とする。ハイスループットスクリーニングのための追跡の費用は極端に高い。後に、ハイスループットアッセイに適した細胞追跡法を示す。
【0004】
細胞を追跡するためには一般に、コンピューターを使用して、複数の細胞のうちの単一の細胞を染料で標識し、その細胞が1つのフレームから別のフレームへ移動したときにその細胞を追跡する必要があるであろう。たとえその1つの細胞が標識されていたとしても、1つのフレームから別のフレームに移るときに存在する複数の細胞の中からその細胞を識別できるとは限らないため、標識された細胞の移動を追跡するこのプロセスはエラーを生じやすく、時間もかかる。さらに、細胞を標識するために利用する染料が、細胞の正常な機能を妨げる可能性もあり、そのため、細胞が1つのフレームから別のフレームへ移動するときに細胞がどのように機能するかを示す真の画像は得られないであろう。
【0005】
細胞を追跡するためにコンピューターが利用するアルゴリズムは、カルマンフィルター、粒子フィルターなどいくつかある。カルマンフィルターは、動的な系の状態を、不完全で雑音の多い一連の測定から推定する効率的な再帰型フィルターである。カルマンフィルターは、細胞などの物体の1つの点から別の点への移動を追跡するために、2次統計量に基づく追跡法を使用する。カルマンフィルターは、動的測定モデルがガウス雑音と線形関係にあると仮定する追跡法を使用する。しかし、細胞画像列では、多くの干渉因子、例えば背景クラッタが存在し、細胞境界の鮮明な画像を生成することが難しく、このことがしばしば、カルマンフィルター追跡が失敗に終わるなる原因となる。
【0006】
逐次モンテカルロ法の一形態である粒子フィルタリングは、ランダムサンプリングに基づく精巧なモデル推定技法を使用する。粒子フィルターは、ガウス分布の仮定を必要とせず、動的測定モデルは非線形モデルでもよい。粒子フィルターには、カルマンフィルターの欠点が1つもない。しかし、速度が遅いという欠点がある。しかし、そうは言われているものの、粒子フィルターは遅くはない。
【0007】
粒子フィルターとカルマンフィルターの基本的な違いは、それらのフィルターが状態を表す方法にある。カルマンフィルターは、パラメーター毎に1つの値を記憶し、それぞれのパラメーター間の対応する分散及び相関を、共分散行列の形で記憶する。粒子フィルターは、それぞれの粒子が、状態ベクトルとその対応する重みとを含む対に対応する「粒子」の集合を維持する。追跡対象の物体の全体的挙動は、粒子の集合の統計量から導き出すことができる。数十、数百又は数千の粒子を使用して単一の物体を追跡することができる。
【0008】
複数の時間経過画像をまたぐ細胞の追跡では、連続する2つの画像が一度に関与する。これらの2つの画像間では、一方の画像(前のフレーム)がもう一方の画像(現在のフレーム)よりも早く取得される。粒子フィルターの基本的着想は、逐次重点サンプリングの概念を使用した関連した確率分布の近似、及び関連した重みを有する一組の離散的ランダムサンプルを使用した確率分布の近似である。粒子フィルターアルゴリズムの目的は、現在のフレームと前のフレームとを関連付ける事象を識別することであり、複数の時点画像中の細胞の非線形移動に対して効率的であることが証明されている。粒子フィルターアルゴリズムでは、画像のそれぞれの細胞を、状態ベクトル/特徴ベクトルと呼ばれる一組の尺度によって表現する必要がある。このシナリオでは、特徴ベクトルが、X座標、Y座標及びフォームファクターを尺度として含み、これら尺度は、経時的に細胞を追跡するための1次入力である。
【0009】
粒子フィルターの使用の一例がWO2008/100704に開示されている。この文献の開示は、その全体が参照によって本明細書に組み込まれる。
【0010】
特徴ベクトルは、分割された画像から生成される。したがって、分割をより適切に実施することがこの追跡アルゴリズムの要諦である。粒子フィルターは、それぞれの細胞の周囲に粒子の雲(cloud)を生成する。この雲は、フレーム内のある1つの細胞につきまとい、次のフレームでその細胞を追跡するために使用される。粒子フィルターにおける追跡は、連続する2つのフレーム間の細胞の対応尺度によって達成される。対応は、(前のフレームの細胞につきまとう)それぞれの雲と(現在のフレーム内のある1つの細胞を表す)それぞれの特徴ベクトルとの間のエントロピーを計算することによって得られる。対応尺度は、2つのマトリックスの形態で提示され、1つのマトリックスは、前のフレームから現在のフレームへの対応を表し(以下、Cloud_to_Measureという。)、別のマトリックスは、現在のフレームから前のフレームへの対応を表す(以下、Measure_to_Cloudという。)。ある粒子フィルター用途では、この対応尺度を評価して、連続する2つの画像中の個々の細胞を関連付ける事象を生成し、この事象は、親子関係によって、グループ:不変、細胞除去、細胞移動、細胞衝突及び細胞分裂の中から選択される。しかし、時に、細胞の対応が誤った事象の生成につながり、細胞の対応を検証することが必要となる。
【先行技術文献】
【非特許文献】
【0011】
【非特許文献1】Kang et al,”Online Tracking of Migrating and Proliferating Cells Imaged with Phase−Contrast Microscopy”,Conference on Computer Vision and Pattern Recognition,20060617,ISBN 978−0−7695−2646−1;Abstract,Section 1.1,2
【発明の概要】
【0012】
本発明の目的は、試料中の細胞を動的に追跡する新しい方法及びシステムであって、先行技術の1つ以上の欠点を克服した方法及びシステムを提供することにある。この目的は、独立請求項に記載された方法及びシステムによって達成される。
【0013】
本発明に基づく方法及びシステムの1つの利点は、粒子フィルターによって生成された事象の正当性を検証する自動意思決定システムであって、既存の細胞追跡アルゴリズムに比べて、細胞追跡の正確さを最高30%向上させることができる自動意思決定システムを提供することである。
【0014】
一態様によれば、試料中の細胞を動的に追跡する方法であって、
・試料の連続する2つの時間経過画像中の細胞間の対応尺度を生成する段階と、
・前記対応尺度を評価して、それらの2つの画像中の個々の細胞を関連付ける事象を生成する段階であり、その事象が、グループ:不変、細胞除去、細胞移動、細胞衝突及び細胞分裂の中から選択される段階と、
・それらの2つの画像中の個々の細胞を関連付ける事象の追跡出力を提供する段階と
を含み、
・関連付ける事象を確定する前記段階が、生成された細胞衝突事象及び細胞分裂事象の正当性を、このような事象毎に適応閾値を計算し、その閾値を事象パラメーターと比較することによって検証することを含む方法が提供される。
【0015】
他の態様によれば、適応閾値が、生成された事象に関与した細胞のうちの1つ以上の細胞のサイズから計算される。さらに、適応閾値を、生成された事象に関与した最も小さな細胞の半径に比例させることができる。より具体的には、適応閾値を、前記最も小さな細胞の半径に、試料中の細胞の運動に応じた変数を乗じることによって計算することができ、一実施形態では、この変数が、5乃至20、好ましくは7.5乃至15の範囲のユーザ定義パラメーターである。
【0016】
一態様によれば、生成された細胞衝突事象については、前記事象パラメーターが、前の画像中の関連付けられた細胞間の空間関係であり、生成された細胞分裂事象については、前記事象パラメーターが、後の画像中の関連付けられた細胞間の空間関係である。より具体的には、生成された細胞衝突事象については、前記事象パラメーターを、前の画像中の関連付けられた細胞間の距離とすることができ、生成された細胞分裂事象については、前記事象パラメーターを、後の画像中の関連付けられた細胞間の距離とすることができる。
【0017】
一態様によれば、対応尺度を生成する前記段階が粒子フィルターアルゴリズムを含む。
【0018】
一態様によれば、この方法はさらに、
・被追跡細胞毎に、生成された追跡出力から親及び子カウントを計算する段落であり、
・親カウント>1のときに、親細胞を子細胞に関連付ける衝突事象が生成され、
・子カウント>1のときに、子細胞を親細胞に関連付ける分裂事象が生成される
段階と、
・生成された細胞衝突事象及び細胞分裂事象の正当性を、このような事象毎に適応閾値を計算し、その閾値を事象パラメーターと比較することによって検証する段階と
・追跡出力を更新する段階と
を含む。
【0019】
さらに別の態様によれば、試料中の細胞を動的に追跡するシステムであって、試料の連続する時間経過画像を提供するように配置された撮像システムと、請求項1乃至請求項9のいずれか1項記載の方法に従って試料中の細胞を追跡するように配置された画像受信装置とを備えるシステムが提供される。
【0020】
本発明の実施形態は従属請求項に記載されている。
【0021】
本発明のこれらの利点及びその他の利点は、添付図面を参照して以下の説明を読むことによってより明白となる。
【図面の簡単な説明】
【0022】
【図1】本発明に基づく一般的な撮像システムのブロック図である。
【図2】本発明に基づく図1の画像受信装置の概略図である。
【図3】本発明に基づく粒子フィルターアルゴリズムグラフィカルユーザインタフェースのコンピュータースクリーンショットを示す図である。
【図4】本発明に基づく粒子フィルターアルゴリズムの流れ図である。
【図5】細胞の対応を処理する本発明に基づく新規の方法の他の流れ図である。
【図6】本発明に基づく新規の閾値論理を適用した後の、前の画像及び現在の画像の図である。
【図7】本発明に基づく粒子フィルターによって検出された細胞分裂を示す、前の画像及び現在の画像の図である。
【図8】本発明に基づく粒子フィルターによって検出された細胞衝突を示す、前の画像及び現在の画像の図である。
【発明を実施するための形態】
【0023】
現時点における本発明の好ましい実施形態を図面を参照して説明する。それらの図面では、同様の構成要素が同じ符号によって識別される。好ましい実施形態の以下の説明は例示が目的であり、それらの実施形態が本発明の範囲を限定することは意図されていない。
【0024】
図1は、一般的なディジタル顕微鏡システムの主要な構成要素のブロック図を示す。この自動ディジタル顕微鏡システム100は以下の構成要素を含む:光源101、コリメータ102、任意選択の非球面光学部品104、ビームフォールディング光学部品105、対物レンズ107、試料109、試料ホルダー111、ステージ113、チューブレンズ115、光学検出器117、任意選択の通信リンク119及び任意選択のコンピューター121。
【0025】
光源101は、ランプ、レーザー、複数のレーザー、発光ダイオード(LED)、複数のLED、又は光ビーム101aを発生させる当業者に知られている任意のタイプの光源とすることができる。光ビーム101aは、光源101、コリメータ102、任意選択の非球面光学部品104、ビームフォールディング光学部品105及び対物レンズ107によって送達されて試料109を照らす。試料109は、生きた生体物質/生物、生物細胞、非生物試料などである。非球面光学部品104は一般的なパウエルレンズである。ビームフォールディング光学部品105は、一般的なスキャニングミラー又はダイクロイックミラーである。試料109から放射された光は対物レンズ107によって集められ、次いで、一般的なチューブレンズ115によって光学検出器117上に試料109の像が形成される。光学検出器117は、電荷結合素子(CCD)、相補型金属酸化物半導体(CMOS)像検出器、又は当業者によって利用されている任意の2−Dアレイ光学検出器とすることができる。光学検出器117は適宜、通信リンク119によって、電気的に又は無線でコンピューター121に接続される。他の実施形態では、光学検出器117の代わりに、対物レンズ107と協力して中間像をさらに拡大し、標本の詳細を観察できるようにする一般的な顕微鏡接眼レンズ又は接眼鏡が使用される。さらに、光学検出器117の代わりに、2つ、3つ又は4つ以上の光学検出器117を利用することもできる。試料109は試料ホルダー111上に取り付けられ、試料ホルダー111は、一般的なマイクロタイタープレート、顕微鏡スライド、チップ、ガラスプレート、ペトリ皿又は任意のタイプの試料ホルダーと呼ばれることがある。
【0026】
他の実施形態では、顕微鏡システム100が適宜、通信リンク119によって従来のコンピューター121に電気的に又は無線で接続される。通信リンク119は、ローカルエリアネットワーク(LAN)、無線ローカルネットワーク、ワイドエリアネットワーク(WAN)、ユニバーサルシリアルバス(USB)、Ethernet(登録商標)リンク、光ファイバなど、自動顕微鏡システム100とコンピューター121の間のデータ転送を容易にすることができる任意のネットワークとすることができる。
【0027】
顕微鏡システム100は、光学検出器117又は一般的な顕微鏡接眼レンズを利用することによって物体ステージ113上に置かれた試料109又は任意のタイプの物体の画像を捕捉する能力を有する画像送信装置、撮像装置又は撮像システムと呼ばれることがある。さらに、顕微鏡システム100を例えば、GE Healthcare社(米ニュージャージー州ピスカタウェイ)製のIN Cell Analyzer 1000又はIN Cell Analyzer 3000とすることもできる。顕微鏡システム100は、一般的な共焦点顕微鏡、蛍光顕微鏡、落射蛍光顕微鏡、位相差顕微鏡、微分干渉コントラスト顕微鏡、又は当業者に知られている任意のタイプの顕微鏡とすることができる。他の実施形態では、顕微鏡システム100が、生物などの画像を検出し、分析し、提供することができる一般的なハイスループット、ハイコンテント細胞内(subcellular)撮像分析装置である。さらに、顕微鏡システム100を、自動細胞撮像システム又は自動細胞内(subcellular)撮像システムとすることもできる。
【0028】
試料からの反射光又は蛍光を受け取る光学検出器117は、光電子増倍管、電荷結合素子(CCD)、相補型金属酸化物半導体(CMOS)像検出器、又は当業者によって利用されている任意の光学検出器とすることができる。光学検出器117は、通信リンク119によってコンピューター103に電気的に又は無線で接続される。他の実施形態では、光学検出器117の代わりに、対物レンズ107と協力して中間像をさらに拡大し、標本の詳細を観察できるようにする一般的な顕微鏡接眼レンズ又は接眼鏡が使用される。
【0029】
コンピューター121は、画像受信装置121又は画像検出装置121と呼ばれることがある。本発明の他の実施形態では、画像受信装置121が画像送信装置100内に位置する。画像受信装置121は、試料115の画像を光学検出器107から受信する能力を有する一般的なコンピューターの働きをし、次いで、画像受信装置103は、標準画像処理ソフトウェアプログラム、アルゴリズム又は式を利用することによって、その画像を表示し、保存し、又は処理することができる。さらに、コンピューター103を、パーソナルディジタルアシスタント(PDA)、ラップトップコンピューター、ノートブックコンピューター、携帯電話、ハードドライブベースの装置、又は通信リンク119を介して情報を受信し、送信し、記憶することができる任意の装置とすることもできる。本発明では1台のコンピューターが利用されるが、コンピューター121の代わりに複数のコンピューターを利用することもできる。
【0030】
図2は、図1の細胞追跡システムの画像受信装置の概略図を示す。画像受信装置若しくは撮像受信装置121又は画像受信装置203は、従来のコンピューターに関連した一般的な構成要素を含む。画像受信装置203を、画像送信システム100上に収容することもできる。画像受信装置203は、プロセッサー203a、入力/出力(I/O)コントローラ203b、大容量記憶装置203c、メモリー203d、ビデオアダプター203e、接続インタフェース203f、及び上記のシステム構成要素をプロセッサー203aに電気的に又は無線で動作可能に結合するシステムバス203gを含む。システムバス203gはさらに、一般的なコンピューターシステム構成要素をプロセッサー203aに電気的に又は無線で動作可能に結合する。プロセッサー203aは、処理ユニット、中央処理ユニット(CPU)、複数の処理ユニット又は並列処理ユニットと呼ばれることがある。システムバス203gは、従来のコンピューターに関連した一般的なバスとすることができる。メモリー203dは、リードオンリーメモリー(ROM)及びランダムアクセスメモリー(RAM)を含む。ROMは、起動時のコンピューターの構成要素間の情報転送を支援する基本ルーチンを含む一般的な入力/出力システムを含む。
【0031】
入力/出力コントローラ203bはバス203gによってプロセッサー203aに接続され、そこで入力/出力コントローラ203bは、粒子フィルターグラフィカルユーザインタフェース(GUI)及びキーボード、ポインティングデバイスなどの入力装置204を介して、ユーザが、コマンド及び情報をコンピューターに入力することを可能にするインタフェースの働きをする。利用される一般的なポインティングデバイスは、ジョイスティック、マウス、ゲームパッドなどである。システムバス203gには、ビデオアダプター203eによって、表示装置206が電気的に又は無線で接続される。表示装置206は、一般的なコンピューターモニター、プラズマテレビジョン、液晶ディスプレイ(LCD)、又はコンピューター203によって生成された文字及び/若しくは静止画像を表示する能力を有する任意の装置とすることができる。コンピューター203のビデオアダプター203eのとなりには接続インタフェース203fがある。接続インタフェース203fは、前述のとおり通信リンク119によって光学検出器117に接続されたネットワークインタフェースと呼ばれることがある。さらに、画像受信装置203は、画像受信装置203を別のコンピューターに結合することを可能にするネットワークアダプター又はモデムを含むことができる。
【0032】
メモリー203dの上には大容量記憶装置203cがあり、大容量記憶装置203cには、1.ハードディスクから読み取り、ハードディスクへ書き込むためのハードディスクドライブ構成要素(図示せず)及びハードディスクドライブインタフェース(図示せず)、2.磁気ディスクドライブ(図示せず)及びハードディスクドライブインタフェース(図示せず)、並びに3.CD−ROM、他の光学式媒体などの取外し可能な光ディスクから読み取り、光ディスクに書き込むための光ディスクドライブ(図示せず)及び光ディスクドライブインタフェース(図示せず)が含まれる。上記のドライブ及びそれらの関連コンピューター可読媒体は、コンピューター可読命令、データ構造、プログラムモジュール及び他のデータの不揮発性記憶をコンピューター103に提供する。さらに、上記のドライブは、図4及び5の流れ図で説明する、生体物質の位置を決定し、又は細胞の移動を追跡するための本発明のアルゴリズム、ソフトウェア又は式を有する技術的な効果を含む。
【0033】
このソフトウェアは、生体物質ロケータグラフィカルユーザインタフェース(GUI)を有する。生体物質ロケータGUIは、コンピューターユーザがコンピューター203と容易に対話することを可能にするように設計されたソフトウェアプログラムである一般的なGUIと同じ機能のうちの一部の機能を有する特別にプログラムされたGUIである。生体物質ロケータGUIは、1.追跡ターゲット、2.粒子の数、及び3.閾値ファクターを表示する図3に示されているようなスクリーンショットを含む。
粒子フィルター
前述のとおり、WO2008/100704は、本発明に基づく事象の検証を利用することができる粒子フィルターの一実施形態を詳細に開示している。
【0034】
粒子フィルター(すなわち細胞追跡)のための最初の処理段階は画像の分割である。分割後すぐに、画像のそれぞれの細胞に固有の識別番号(細胞ID)を割り当てる。粒子フィルターの実際の追跡アルゴリズムは、連続する2つのフレームの細胞ID間の対応を見つける。このアルゴリズムは主に、予測、観察/測定及び更新と呼ばれる3つの段階を実行する(図4)。
【0035】
図4は、細胞追跡ソフトウェアアプリケーションで粒子フィルターアルゴリズムが使用される方法の一例の流れ図を概略的に示す。
【0036】
ブロック401で、ユーザが、あるプロトコルで記憶された細胞粒子フィルターアルゴリズムを、プロセッサー203a上で開始する。それによって、ユーザは例えば、生体物質ロケータGUI又は細胞追跡GUIを操作して、図3のコンピュータースクリーンショット上の生体物質GUIのドロップダウンリストの中の粒子フィルターアルゴリズムを選択する。
【0037】
次に、ブロック403で、粒子フィルターアルゴリズムを初期化する。粒子フィルターを追跡アルゴリズムとして起動する時間経過画像スタックに対する分析を選択した後、最初の段階は、最初の画像フレームのそれぞれの細胞の周囲の粒子雲を更新する/生成する段階である。粒子雲は、最初の画像フレーム内のそれぞれの細胞に対して生成された特徴ベクトルの助けを借りて更新される。
【0038】
ブロック405で、生体物質又は細胞の位置を予測する。この予測段階は、それぞれの試料に、細胞につきまとう雲の小さなランダムな摂動を追加する。これは、ある細胞が次のフレームにあるか否かの予測である。
【0039】
次に、ブロック407で、新たな細胞位置を追跡し、確定する。この段階では、細胞間の対応を評価する手段として、現在時刻に実際に観察された細胞の反応(特徴ベクトル)を、それぞれの粒子の予測と比較する。この段階は、中核をなす論理を使用して、前の画像フレームと現在の画像フレームとの間の複数の細胞間の対応を見つけ出す。この段階は、現在のフレームの細胞を前のフレームの細胞に関連付けることによって、関連付けられた事象を生成する。この新たな細胞位置の追跡407ついては、後に、図5の流れ図でより詳細に説明する。
【0040】
ブロック409で、粒子雲を更新する。雲は、現在のフレームの測定(特徴ベクトル)に対して更新され、最終的に次のフレームの細胞に対して使用される。次に、ブロック411で、そのフレームが最後のフレームであるか否かを判定する。そのフレームが最後のフレームでない場合、処理は、細胞位置の予測に戻る。そのフレームが最後のフレームである場合、ブロック413で、この処理は終了する。
【0041】
この実施形態では、それぞれの雲及び特徴ベクトルに対するエントロピー値を使用して生成された2つの対応マトリックスを介して、連続する2つの画像フレームの細胞間の対応にアクセスする。本明細書ではCloud_to_Measureと呼ぶ一方の対応マトリックスは、現在のフレームの1つ又は多くの細胞IDに対応する前のフレームの細胞IDを捕捉する。これは子カウントを表す。本明細書ではMeasure_to_Cloudと呼ぶもう一方の対応マトリックスは、親カウントを表す前のフレームの1つ又は多くの細胞IDに対応する現在のフレームの細胞IDを捕捉する。粒子フィルターアルゴリズムの目的は、現在(現在のフレーム)を過去(現在のフレームよりも早く処理された任意のフレーム;通常は単純に1つ前のフレーム)に関連付ける事象を識別することである。関連付けの結果は、事象、例えば不変(標準の追跡)、細胞除去、細胞移動、細胞衝突及び細胞分裂の形で提示される。
【0042】
対応マトリックスのそれぞれの要素は、細胞IDを含まないか、単一の細胞IDを含むか、又は多くの細胞IDを含むかのいずれかである。それぞれの要素は、事象が生成されたときに、標準の追跡に対応する細胞間の1対1の対合を生成し、1対多又は多対1の対合に従う。生物領域に対して識別されるこれらのさまざまな事象は、衝突、分裂、新たな細胞の移動及び細胞の除去と呼ばれる。下表1は、さまざまなケースの図表現及び粒子フィルターによって生成されるそれらの対応尺度を示す。表中の破線の円は存在する細胞を表し、点線の円は存在しない細胞を表す。対応マトリックスを解釈する手がかりを以下に示す。
【0043】
1.Cloud_to_Measure[A]=B又はMeasure_to_Cloud[B]
これは、前のフレームの細胞ID Aが現在のフレームの細胞ID Bに関連付けられたときの標準の追跡(不変)を表す。
【0044】
2.Cloud_to_Measure[A]=NULL
これは、現在のフレームの特徴が前のフレームの細胞ID Aに関連付けられないときの細胞除去を表す。
【0045】
3.Cloud_to_Measure[A]=B,C
これは、前のフレームの細胞ID Aが現在のフレームの細胞ID B及びCに関連付けられたときの細胞分裂を表す。
【0046】
4.Measure_to_Cloud[B]=NULL
これは、現在のフレームの細胞IDが前のフレームの細胞と一切関連を持たないときの細胞移動又は新たな細胞を表す。
【0047】
5.Measure_to_Cloud[B]=E,F
これは、現在のフレームの単一の細胞ID Bが前のフレームの細胞ID E及びFに関連付けられたときの細胞衝突を表す。
【0048】
粒子フィルターによって生成される追跡出力は完全に、上で論じた対応マトリックスに基づく。
【0049】
【表1】


この表は、以下の3つの部分に分けられる:1.前のフレームから現在のフレームへの以前の生体物質(細胞)の移動のそれぞれの発生、2.前のフレームから現在のフレームへの移動に対する対応尺度、及び3.事象のタイプ。対応尺度は、前のフレームから現在のフレームへ細胞が移動したときに、その細胞に起こったことをユーザに知らせる。事象は、前のフレームから現在のフレームへ細胞が移動したときに、細胞の衝突、分裂、移動、除去などのうちのどの種類の事象が起こったのかを記述する。この表は、前のフレームから現在のフレームへ細胞が移動するときに細胞に起こることの異なる10の例を含む。
【0050】
第1の例では、前のフレームに細胞ID 9があり、細胞ID 9が、現在のフレームの細胞ID 11になる。この対応尺度は、前のフレームの細胞ID 9が現在のフレームの細胞ID 11に関連付けられたとき、及び現在のフレームの細胞ID 11が前のフレームの細胞ID 9に関連付けられたときの標準の追跡(不変事象)を表す単純なClouds_to_measure[9]=11及びMeasure_to_Cloud[11]=9である。この第1の例に対応する事象は、細胞ID 9が、細胞ID 11として新たな位置へ完全に移動した標準の追跡である。第2の例では、前のフレームに細胞ID 9があり、現在のフレームを見たときに細胞ID 9が消失している。この対応尺度は、現在のフレームの特徴が前のフレームの細胞ID 9に関連付けられないときの細胞除去を表すCloud_to_Measure[9]=Nullである。この例に対応する事象は細胞除去である。
【0051】
第3の例では、前のフレームに2つの細胞ID 9及び10がある。現在のフレームへ移動したときに、前のフレームの細胞ID 9は変化しており、細胞除去事象を指示するCloud_to_Measure[9]=Nullがある。細胞ID 10については、対応尺度Cloud_to_Measure[10]=11が不変追跡事象を指示している。しかし、対応尺度Measure_to_Cloud[11]=9,10は、前のフレームに細胞ID 9があり、次いで細胞ID 9が移動して、現在の現在のフレームで細胞ID 10と結合して細胞ID 11を形成した細胞衝突事象があることを指示している。この図に示されているように、細胞ID 9と10の間の距離は比較的に大きく、したがって、9と10の間の細胞間距離が、後により詳細に論じる閾値よりも大きいため、細胞ID 9は除去されたはずである。
【0052】
第4の例では、前のフレームには細胞IDがないが、現在のフレームには新たな細胞ID 11がある。この例に対する対応尺度は、Measure_to_Cloud[11]=Nullである。この事象は、現在のフレームの細胞IDが前のフレームの細胞と一切関連を持たないときの細胞移動又は新たな細胞と呼ばれる。第5の例では、前のフレームには細胞ID 9だけしかないが、現在のフレームには細胞ID 10及び11がある。対応尺度Cloud_to_Measure[9]=10,11は細胞ID 9の細胞分裂を指示しているが、対応尺度Measure_to_Cloud[10]=9及びMeasure_to_Cloud[11]=Nullは、細胞ID 9が現在のフレーム内の細胞ID 10を表す不変事象、及び細胞ID 11に対する細胞移動事象を指示している。この図に示されているとおり、細胞ID 10と11の間の距離は比較的に大きく、したがって、10と11の間の細胞間距離が、後により詳細に論じる閾値よりも大きいため、細胞ID 11は新たな(移動した)細胞と考えるべきである。
【0053】
細胞ID 9及び細胞ID 10を含む第6の例では、細胞ID 9が、前のフレームから現在のフレームへ移動して細胞ID 11を生成している。対応尺度Cloud_to_Measure[9]=11及びCloud_to_Measure[10]=Nullは、細胞ID 9が現在のフレーム内の細胞ID 11を表す不変事象、及び細胞ID 10に対する細胞除去事象を指示しているが、対応尺度Measure_to_Cloud[11]=9,10は、細胞ID 9と10の細胞衝突を指示している。この図に示されているように、細胞ID 9と10の間の距離は比較的に小さく、したがって、細胞ID 9と10の間の細胞間距離が、後により詳細に論じる閾値よりも小さいため、この事象は細胞衝突と考えるべきである。
【0054】
第7の例では、前のフレーム内の細胞ID 9及び10が現在のフレームへ移動し、そこでそれらの細胞IDが衝突して細胞ID 11を形成する。この対応尺度は、Cloud_to_Measure[9]=11及びMeasure_to_Cloud[11]=10である。この図から、この事象が明確な細胞衝突であることが分かるが、両方の尺度が1対1の尺度であり、そのためこの事象は粒子フィルターによって衝突と認識されないため、粒子フィルターによって生成された対応尺度はいずれも衝突を認識しないことに留意すべきである。第8の例では、前のフレームの細胞ID 9が、現在のフレームの細胞ID 10と細胞ID 11に分割される。対応尺度Cloud_to_Measure[9]=10,11は細胞ID 9の細胞分裂を指示するが、対応尺度Measure_to_Cloud[10]=9及びMeasure_to_Cloud[11]=Nullは、細胞ID 9が現在のフレーム内の細胞ID 10を表す不変事象、及び細胞ID 11に対する細胞移動事象を指示している。この図に示されているように、細胞ID 10と11の間の距離は比較的に小さく、10と11の間の細胞間距離が、後により詳細に論じる閾値よりも小さいため、この事象は、細胞ID 9の細胞分裂と考えるべきである。
【0055】
第9の例では、前のフレームの細胞ID 9が、現在のフレームに2つの細胞ID 10及び11を生成している。対応尺度は、Cloud_to_Measure[9]=10及びMeasure_to_Cloud[11]=9である。しかし、この図から分かるとおり、この事象は明確な細胞分裂事象であるが、全ての尺度が1対1の尺度であり、そのためこの事象は粒子フィルターによって衝突と認識されないため、粒子フィルターによって生成される対応尺度はいずれも分裂を認識しないことに留意すべきである。最後の例では、前のフレームに2つの細胞ID 9及び12がある。前のフレームの細胞ID 9は細胞ID 10及び11を生成しており、これは、対応尺度Cloud_to_Measure[9]=10,11、Cloud_to_Measure[12]=10、Measure_to_Cloud[10]=9及びMeasure_to_Cloud[11]=9を有する。これは不明確な事象を表し、したがって標準の追跡事象とみなすべきである。
【0056】
図5は、新たな細胞位置を測定するブロック407の下に位置する、細胞の対応を処理する新規の方法の流れ図を示す。ブロック501で、新たな細胞位置を測定するこの処理段階は一般に、連続する2つの画像フレームの細胞を関連付けるための中核をなす対応尺度を、上で論じたとおりに生成する。これらの尺度の要素は、それらの尺度に関連した1つ又は複数の細胞ID事象を含みうる。ブロック503で、それらの対応尺度を評価して、不変事象、細胞除去事象、細胞移動事象(表1の例1、2及び4)など、追加の検証又は解釈を必要としない明確な単一のID事象を識別し、そのデータを直接に使用して、ブロック505によって指示された標準の追跡を介して、ブロック513で追跡出力を生成する。本明細書では、追跡出力を生成すること513が一般に、連続する2つの画像フレームの細胞IDを関連付けることを意味する。しかし、ブロック503で、ある要素が複数の細胞IDに関連すると識別された場合、これは、追跡事象として処理されなければならない。追跡事象に遭遇したときには、ブロック507から511で、その事象の正当性を、局所閾値の助けを借りて検証する。事象の自動検証及び局所閾値の計算については後に説明する。事象の正当性を検証する間に、検証された事象を表す新たな対応尺度が生成され、最終的にブロック513で追跡出力を生成する。
【0057】
ブロック513での追跡出力の生成に続いて、ブロック515で、「親子関係」に基づいて追跡出力の訂正を実行することができる。訂正ブロック515は、それまでに識別されていない衝突事象又は分裂事象を捕捉し、複数の事象に関連付ける同じ細胞IDの複製を追跡出力が含むことを防ぐのに役立つ。ブロック515において、親カウントは、現在のフレームの単一の細胞に関連付けられた前のフレームの細胞の数を表す。親カウントが1よりも大きな値を有するとき、その事象は衝突として確定される。同様に、子カウントは、前のフレームの単一の細胞に関連付けられた現在のフレームの細胞の数を表す。子カウントが1よりも大きい値を有するとき、その事象は分裂として確定される。したがって、親子関係に基づくこの処理は正当な追加の事象を捕捉するが、追跡出力が生成されるまではそれらの事象は捕捉されない。その後、ブロック517で、最終的な追跡出力を保存する。
【0058】
一実施形態によれば、ブロック503で複数の細胞IDに関連すると識別された追跡事象は、ブロック507及び508で、以下の手順に基づく検証を受ける。
【0059】
1.衝突に関して前のフレームの細胞IDを識別する。前のフレームの細胞X、Yを現在のフレームの細胞Zに関連付ける(すなわちMeasure_to_Cloud=[Z]=X,Y)。
【0060】
2.Cloud_to_Measureマトリックスにおいて、ID X又はYが複数のIDに関連付けられているか否かを判定する。Cloud_to_Measureマトリックスが、前のいずれかの細胞に関して複数の対応を示さない場合、これは真の衝突とみなされ、Cloud_to_Measureマトリックスが前のいずれかの細胞に関して複数の対応を示す場合、その事象は不明確な事象とみなされる。例えばCloud_to_Measure[X]=Z,Aであるとき、これは不明確なケースである。
【0061】
3.明確な事象に関しては、実行時に生成された閾値に基づいて、前の画像の細胞がグループ分けされる。前のフレームの細胞ID間の事象パラメーターが閾値よりも大きい場合、一方のグループが除去された細胞とみなされ、標準的に追跡された細胞は、マトリックスCloud_to_Measureの助けを借りて識別される。
【0062】
4.不明確なケースは、不明確な細胞以外の細胞の標準の追跡又は分割を表す。実際に分割を受ける細胞は、Measure_to_Cloudマトリックスとして捕捉された細胞の対応によって評価される。
【0063】
5.細胞分裂に遭遇したときには、段階1から4で説明したのと同様の論理を繰り返す。これは、2つの異なるマトリックス及び現在のフレーム又は前のフレームを入れ替えるだけである。
【0064】
ブロック507で、その事象が真の事象であるか否かを検証するために、それぞれの事象に対する適応閾値を計算する。一実施形態によれば、以前の画像(1つ以上)及び/又は現在の画像から取得可能な空間情報に基づいて、適応閾値を計算する。より具体的には、生成された事象に関与した細胞に関する空間情報から、この閾値を計算することができる。細胞の運動学的挙動は少なくとも部分的に細胞のサイズに関係するため、この閾値は例えば、関与した細胞のうちの1つ以上の細胞のサイズに基づいて計算することができる。それに加えて、又はその代わりに、この閾値が、2つ以上の以前の画像から測定された運動学的パラメーターに基づいてもよい。
【0065】
適応閾値を計算するプロセスの一例は以下の段階を含む。
【0066】
1.事象を生成する細胞のグループの領域を、このアルゴリズムに対する入力として使用する段階
2.事象を生成すると仮定される細胞の中で最も小さな領域を見つける段階
3.その事象に対する閾値(T)を、最も小さな細胞の半径のある倍数として計算する段階
この例の乗数は、ユーザ定義のパラメーター(すなわち図1の閾値ファクター)として設計される。この乗数の値は、高速で非常にランダムな細胞の移動に対してはより大きくする。しかし、複数の時間経過画像をまたいで低速で安定した細胞の移動に対しては、この乗数値を小さくすべきである。この乗数の一般的な範囲は7.5乃至15と定義される。
【0067】
最大事象はある値で正当とみなされ、これを超える事象は誤りである。適応閾値は、それを超えると粒子フィルターが余分な事象を捕捉しない飽和値を有する。
【0068】
この閾値は局所閾値であり、それぞれの事象に対して新たな閾値が計算されること、及びこの閾値は標準の追跡に影響を及ぼさないこと、すなわち、この閾値に対する小さな変更はあまりに異なる出力を生成しないことに留意すべきである。
【0069】
ブロック509で、この適応閾値を前記事象に対する事象パラメーターと比較することにより、正当性検証の対象である事象の正当性を検証する。適応閾値と同様に、この事象パラメーターも、例えば、以前の画像(1つ以上)及び/又は現在の画像から取得可能な、生成された事象に関与した細胞に関する空間情報に基づくことができる。生成された細胞衝突事象については、この事象パラメーターを例えば、前の画像中の関連付けられた細胞間の空間関係とすることができ、生成された細胞分裂事象については、この事象パラメーターを、後の画像中の関連付けられた細胞間の空間関係とすることができる。より具体的には、この事象パラメーターを、その事象に関与した関連付けられた細胞間の距離とすることができる。
【0070】
前述のとおり、ブロック515で、追跡出力は親子関係に基づいて訂正される。表1に示した例7及び9はそれぞれ、衝突及び分裂の非常に特別なケースを表す。これは、前の現在のフレームの細胞IDと現在のフレームの細胞IDの間の可能な1対1関係を例示し、したがって、標準の追跡シナリオを指示する。一実施形態によれば、追跡出力から親及び子カウントを得ることにより親子関係を考慮することによって、この不明確性を訂正することができる。親カウントは、現在のフレーム内の唯一の細胞に接続する前のフレームの細胞の数を表す。また、子カウントは、前のフレーム内の唯一の細胞に接続する現在のフレームの細胞の数を表し、以下の段階を含むことができる。
【0071】
1.既に生成された追跡出力から親及び子供カウントを計算する段階
2.親カウント>1であるか、又は子カウント>1であるかに応じて、前のフレームの細胞IDと現在のフレーム細胞IDとの間の細胞対応を生成する段階。すなわち、親カウント>1は衝突に対応し、子カウント>1は分裂に対応する。
【0072】
3.自動的に生成された閾値Tを使用して、対応/事象を検証する段階
4.生成された新たな事象に基づいて追跡出力を更新する段階
標準的に追跡された細胞につきまとう雲の連続する更新は、その細胞を事実上新たな位置へ移動させることがありえる。したがって、雲の集合は、現在のフレームからの細胞尺度(特徴ベクトル)を使用して更新される。
粒子フィルターの性能を示す例
図6a及び6bは、事象の検証によって粒子アルゴリズムの改良の導入が実現された一例を示す。図6aは前のフレームを示し、図6bは現在のフレームを示す。粒子フィルタリングによって画像6a及び6bを評価したとき、細胞ID 12に対する追跡出力は、Cloud_to_Measure[12]=13,14であった。この追跡出力により、この事象は細胞分裂事象として捕捉される。しかし、この細胞分裂事象の正当性を検証した後、この事象は、1つの新たな細胞の移動と、前のフレーム内の2つの細胞の不変事象とを表すものと訂正された。すなわちCloud_to_Measure[12]=13及びMeasure_to_Cloud[14]=NULLである。
【0073】
図7a及び7bは、粒子フィルタリングによる評価が、この事象を、1対多関係を有する細胞分裂事象として、すなわちCloud_to_Measure[12]=13,14、Measure_to_Cloud[13]=12及びMeasure_to_Cloud[14]=12として捕捉する他の例を示す。このケースでは、細胞分裂事象の正当性の検証が、その事象が真の細胞分裂であることを明らかにする。同様に、図8a及び8bは、粒子フィルタリングによる評価が、この事象を、多対1関係を有する細胞衝突事象として、すなわちCloud_to_Measure[12]=14、Cloud_to_Measure[13]=14及びMeasure_to_Cloud[14]=12,13として捕捉する例を示し、この事象の正当性の検証は、その事象が真の細胞衝突であることを明らかにする。
【0074】
粒子フィルターと近接(proximity)との性能比較では、粒子フィルターの追跡機能の性能の方が約30%高いことが示されている。粒子フィルターのUIは、図3に示すように、粒子の数を入力するオプションを設けている。粒子フィルターの性能は粒子数に依存する。常に、粒子数が多いほど追跡の正確さは向上する。細胞が密集して存在するときには、粒子数をより大きくすべきである。InCellによって取得した時間経過画像スタックに対する実験中に、本発明の発明者らは以下の知見を見出した。
【0075】
細胞の密度が低いときには、粒子数=25が適当である。
【0076】
細胞の密度が中程度であるときには、粒子数=50が適当である。
【0077】
細胞の密度が高いときには、粒子数=100から150が適当である。
【0078】
改良されたこの粒子フィルターアルゴリズムの正確さを、既存の追跡アルゴリズム(すなわち近接)に対して評価する。この評価は、2つの別個の画像スタック、すなわちcell track−3及び171006−cell tracking−22hrs−2.xdceに対して実施する。画像スタック毎に、両方の追跡アルゴリズムに対して単一の分割技法を適用した。適当なパラメーターを使用して近接の効率を捕捉する(すなわち両方の画像スタックに対して相対閾値=2.5及び異常値検出=4.0)。しかし、粒子フィルターは、異なる粒子数値及び異なる閾値ファクター値を用いて評価した。分析結果は下表2に表示されている。
【0079】
【表2】

本発明は、ユーザが物体の移動を追跡することができる自動システム及び方法、例えば、ユーザが、複数の細胞の中の1つ以上の細胞がどのように機能するかを判定するために、その1つ以上の細胞が時間経過とともに1つの点から別の点へ移動するときに、その1つ以上の細胞の移動を追跡することができる自動システム及び方法を提供する。ユーザは、その1つ以上の細胞の移動を追跡し、その1つ以上の細胞が細胞分裂を経ているか否か、又は2つ以上の細胞が合体したか否かなど、その1つ以上の細胞の構造が変化したか否かを判定することができる。このユーザは、その1つ以上の細胞を最適に追跡して、その1つ以上の細胞が時間及び距離に関して移動するときに、その1つ以上の細胞のおおよその位置を見つけることができる。したがって、本発明は、細胞機能を研究するために細胞の移動を追跡する手段をユーザに提供する。
【0080】
特定の実施形態に関して本発明を説明したが、当業者には明らかなとおり、以下の特許請求の範囲に記載された本発明の趣旨及び範囲から逸脱することなく、本発明の多くの変更及び変形を実施することができる。
【符号の説明】
【0081】
100 自動ディジタル顕微鏡システム
101 光源
101a 光ビーム
102 コリメータ
104 非球面光学部品
105 ビームフォールディング光学部品
107 対物レンズ
109 試料
111 試料ホルダー
113 ステージ
115 チューブレンズ
117 光学検出器
119 通信リンク
121 コンピューター
203 画像受信装置
203a プロセッサー
203b 入力/出力(I/O)コントローラ
203c 大容量記憶装置
203d メモリー
203e ビデオアダプター
203f 接続インタフェース
203g システムバス
204 入力装置
206 表示装置
【特許請求の範囲】
【請求項1】
試料中の細胞を動的に追跡する方法であって、
・試料の連続する2つの時間経過画像中の細胞間の対応尺度を生成する段階と、
・前記対応尺度を評価して、前記2つの画像中の個々の細胞を関連付ける事象を生成する段階であり、前記事象が、グループ:不変、細胞除去、細胞移動、細胞衝突及び細胞分裂の中から選択される段階と、
・前記2つの画像中の個々の細胞を関連付ける事象の追跡出力を提供する段階と
を含み、
・関連付ける事象を確定する前記段階が、生成された細胞衝突事象及び細胞分裂事象の正当性を、このような事象毎に適応閾値を計算し、前記閾値を事象パラメーターと比較することによって検証すること
を含む方法。
【請求項2】
前記適応閾値が、前記生成された事象に関与した細胞のうちの1つ以上の細胞のサイズから計算される、請求項1記載の方法。
【請求項3】
前記適応閾値が、前記生成された事象に関与した最も小さな細胞の半径に比例する、請求項2記載の方法。
【請求項4】
前記適応閾値が、前記最も小さな細胞の半径に、試料中の細胞の運動に応じた変数を乗じることによって計算される、請求項3記載の方法。
【請求項5】
前記適応閾値が、前記最も小さな細胞の半径に、5乃至20、好ましくは7.5乃至15の範囲のユーザ定義パラメーターを乗じることによって計算される、請求項3記載の方法。
【請求項6】
・生成された細胞衝突事象については、前記事象パラメーターが、前の画像中の関連付けられた細胞間の空間関係であり、
・生成された細胞分裂事象については、前記事象パラメーターが、後の画像中の関連付けられた細胞間の空間関係である、
請求項1乃至請求項5のいずれか1項記載の方法。
【請求項7】
・生成された細胞衝突事象については、前記事象パラメーターが、前の画像中の関連付けられた細胞間の距離であり、
・生成された細胞分裂事象については、前記事象パラメーターが、後の画像中の関連付けられた細胞間の距離である、
請求項5記載の方法。
【請求項8】
対応尺度を生成する前記段階が粒子フィルターアルゴリズムを含む、請求項1乃至請求項7のいずれか1項記載の方法。
【請求項9】
・被追跡細胞毎に、生成された前記追跡出力から親及び子カウントを計算する段落であり、
親カウント>1のときに、親細胞を子細胞に関連付ける衝突事象が生成され、
子カウント>1のときに、子細胞を親細胞に関連付ける分裂事象が生成される
段階と、
・生成された細胞衝突事象及び細胞分裂事象の正当性を、このような事象毎に適応閾値を計算し、前記閾値を事象パラメーターと比較することによって検証する段階と
・前記追跡出力を更新する段階と
をさらに含む、請求項1乃至請求項8のいずれか1項記載の方法。
【請求項10】
試料中の細胞を動的に追跡するシステムであって、前記試料の連続する時間経過画像を提供するように配置された撮像システムと、請求項1乃至請求項9のいずれか1項記載の方法に従って試料中の細胞を追跡するように配置された画像受信装置とを備えるシステム。
【請求項1】
試料中の細胞を動的に追跡する方法であって、
・試料の連続する2つの時間経過画像中の細胞間の対応尺度を生成する段階と、
・前記対応尺度を評価して、前記2つの画像中の個々の細胞を関連付ける事象を生成する段階であり、前記事象が、グループ:不変、細胞除去、細胞移動、細胞衝突及び細胞分裂の中から選択される段階と、
・前記2つの画像中の個々の細胞を関連付ける事象の追跡出力を提供する段階と
を含み、
・関連付ける事象を確定する前記段階が、生成された細胞衝突事象及び細胞分裂事象の正当性を、このような事象毎に適応閾値を計算し、前記閾値を事象パラメーターと比較することによって検証すること
を含む方法。
【請求項2】
前記適応閾値が、前記生成された事象に関与した細胞のうちの1つ以上の細胞のサイズから計算される、請求項1記載の方法。
【請求項3】
前記適応閾値が、前記生成された事象に関与した最も小さな細胞の半径に比例する、請求項2記載の方法。
【請求項4】
前記適応閾値が、前記最も小さな細胞の半径に、試料中の細胞の運動に応じた変数を乗じることによって計算される、請求項3記載の方法。
【請求項5】
前記適応閾値が、前記最も小さな細胞の半径に、5乃至20、好ましくは7.5乃至15の範囲のユーザ定義パラメーターを乗じることによって計算される、請求項3記載の方法。
【請求項6】
・生成された細胞衝突事象については、前記事象パラメーターが、前の画像中の関連付けられた細胞間の空間関係であり、
・生成された細胞分裂事象については、前記事象パラメーターが、後の画像中の関連付けられた細胞間の空間関係である、
請求項1乃至請求項5のいずれか1項記載の方法。
【請求項7】
・生成された細胞衝突事象については、前記事象パラメーターが、前の画像中の関連付けられた細胞間の距離であり、
・生成された細胞分裂事象については、前記事象パラメーターが、後の画像中の関連付けられた細胞間の距離である、
請求項5記載の方法。
【請求項8】
対応尺度を生成する前記段階が粒子フィルターアルゴリズムを含む、請求項1乃至請求項7のいずれか1項記載の方法。
【請求項9】
・被追跡細胞毎に、生成された前記追跡出力から親及び子カウントを計算する段落であり、
親カウント>1のときに、親細胞を子細胞に関連付ける衝突事象が生成され、
子カウント>1のときに、子細胞を親細胞に関連付ける分裂事象が生成される
段階と、
・生成された細胞衝突事象及び細胞分裂事象の正当性を、このような事象毎に適応閾値を計算し、前記閾値を事象パラメーターと比較することによって検証する段階と
・前記追跡出力を更新する段階と
をさらに含む、請求項1乃至請求項8のいずれか1項記載の方法。
【請求項10】
試料中の細胞を動的に追跡するシステムであって、前記試料の連続する時間経過画像を提供するように配置された撮像システムと、請求項1乃至請求項9のいずれか1項記載の方法に従って試料中の細胞を追跡するように配置された画像受信装置とを備えるシステム。
【図1】


【図2】


【図3】


【図4】


【図5】


【図6】


【図7】


【図8】




【図2】


【図3】


【図4】


【図5】


【図6】


【図7】


【図8】


【公表番号】特表2012−527236(P2012−527236A)
【公表日】平成24年11月8日(2012.11.8)
【国際特許分類】
【出願番号】特願2012−511788(P2012−511788)
【出願日】平成22年5月17日(2010.5.17)
【国際出願番号】PCT/SE2010/050530
【国際公開番号】WO2010/134875
【国際公開日】平成22年11月25日(2010.11.25)
【出願人】(597064713)ジーイー・ヘルスケア・バイオサイエンス・アクチボラグ (109)
【Fターム(参考)】
【公表日】平成24年11月8日(2012.11.8)
【国際特許分類】
【出願日】平成22年5月17日(2010.5.17)
【国際出願番号】PCT/SE2010/050530
【国際公開番号】WO2010/134875
【国際公開日】平成22年11月25日(2010.11.25)
【出願人】(597064713)ジーイー・ヘルスケア・バイオサイエンス・アクチボラグ (109)
【Fターム(参考)】
[ Back to top ]

