試料捕捉合金、質量分析装置、質量分析方法、試料捕捉方法、試料捕捉合金、試料捕捉合金製造方法
【課題】 試料を高い効率で捕捉できる試料捕捉合金などを提供する。
【解決手段】 本発明のあるの側面は、表面が修飾され、Fe、Pt及びCuを含有し、
試料を捕捉することを特徴とする試料捕捉合金にある。本構成によれば、試料を高い効率で捕捉できる試料捕捉合金が得られる。本発明の他の側面は、表面が修飾されることで電荷が付与されていることを特徴とする請求項1記載の試料捕捉合金にある。本構成によれば、電荷により試料をより高い効率で捕捉できる試料捕捉合金が得られる。本発明のさらに他の側面は、チオール基で表面修飾されていることを特徴とする請求項1記載の試料捕捉合金
にある。本構成によれば、チオール基で表面修飾されていることからさらに他の置換基の導入が容易な試料捕捉合金が得られる。
【解決手段】 本発明のあるの側面は、表面が修飾され、Fe、Pt及びCuを含有し、
試料を捕捉することを特徴とする試料捕捉合金にある。本構成によれば、試料を高い効率で捕捉できる試料捕捉合金が得られる。本発明の他の側面は、表面が修飾されることで電荷が付与されていることを特徴とする請求項1記載の試料捕捉合金にある。本構成によれば、電荷により試料をより高い効率で捕捉できる試料捕捉合金が得られる。本発明のさらに他の側面は、チオール基で表面修飾されていることを特徴とする請求項1記載の試料捕捉合金
にある。本構成によれば、チオール基で表面修飾されていることからさらに他の置換基の導入が容易な試料捕捉合金が得られる。
【発明の詳細な説明】
【技術分野】
【0001】
本発明は、試料捕捉合金、質量分析装置、質量分析方法、試料捕捉方法、試料捕捉合金、試料捕捉合金製造方法に関する。
【背景技術】
【0002】
質量分析法は、試料の質量電荷比(質量を電荷の数で割った値)を求めるときに使用される手法である。質量分析法では、測定対象をイオン化し、その質量電荷比(m/z)の違いによってイオンを分離し、検出する。
【0003】
物質にレーザー光を照射すると、物質が光を吸収して光電子移動が進行し、イオン化される。この直接的なレーザー照射によるイオン化法をレーザー脱離イオン化法(Laser Desorption / Ionization、LDI)という。しかし、LDIでは物質の種類によっては効率的な電子移動が行われず、試料がレーザーでダメージを受けてしまうという欠点があった。
【0004】
そこで、測定試料にイオン化補助剤(マトリックス剤)を混合して、レーザー光(例えば波長:337nm)を当てることにより、マトリックス剤が光を吸収し、照射箇所で急激な温度上昇が生じ、試料分子を分解せずにイオン化(ソフトイオン化)する手法がこれまで広く検討されてきた。この手法は、マトリック支援レーザー脱離イオン化質量分析法(MALDI(Matrix Assisted Laser Desorption / Ionization)-MS)と呼ばれる技術である。
【0005】
[MALDI-MS]
【0006】
田中らおよびHillenkampらが開発したマトリックス支援レーザー脱離イオン化法(非特許文献1、2参照)は、熱に不安定な物質や高分子量物質のソフトなイオン化が可能であり、生体高分子・合成高分子・金属錯体などの物質の分子量測定に用いられてきた(非特許文献3、4、5、6参照)。MALDI測定では、マトリックスと呼ばれるUVレーザー光を吸収する低分子量の有機分子と目的試料の混合結晶をプレート上に作成する必要がある。MALDIでは対象のサンプルに対して適切なマトリックスを選択することが重要となる。使用するレーザー光を高効率で吸収するもの、塩基性化合物にはプロトンドナーとして、酸性化合物にはプロトンアクセプターとして作用するものが選ばれる。低分子量サンプルのとき、マトリックス由来のピークとサンプル由来のピークが重ならないようにする。以上のことなどを考慮してマトリックスを選択する必要がある。
【0007】
また、MALDIでは、マトリックスの分子イオンおよびそのクラスターイオンがスペクトル中の低分子量領域に強い強度で観測されるため、低分子量の試料測定ではこれらのイオンが妨害になって、解析が困難になる場合がある。また、対象化合物が混合物のときには、対象化合物以外の試料による妨害やイオン化の抑制が起こり、検出が困難となる場合がある(イオンサプレッション)。このような背景から、近年、有機マトリックスを用いないLDI-MSが注目されている。
【0008】
[SALDI-MS]
【0009】
安定な無機ナノ粒子を利用したレーザー脱離イオン化法は、
Tanakaら(非特許文献7参照)によって初めて報告された。30 nmのコバルトナノ粒子と液体マトリックスであるグリセロール溶液とを混合することによって、タンパク質リゾチームの質量分析に成功した。続いて、Sunnerら(非特許文献8参照)は、グリセロールと混ぜた2−150 μmグラファイト粒子をマトリックスとして用いたレーザー脱離イオン化法を提案し、それを表面支援レーザー脱離イオン化法(surface-assisted laser desorption/ionization: SALDI)と名付けた。Kinumiらは、様々な無機微粒子を用いたSALDI−MSを報告している(非特許文献9参照)。無機微粒子を用いたレーザー脱離イオン化の機構は十分明らかではないが、一つのモデルとして「急速加熱条件で高温に到達させる」ことが試料を分解せずに昇化させるのに重要であると、提案されている(非特許文献7、10、11参照)。
【0010】
近年、カーボンナノチューブ(非特許文献12、13参照)、シリコンナノ粒子(非特許文献14参照)、及び金ナノ粒子(非特許文献15-22参照)などのナノ粒子を担持した基板を用いたSALDIが注目されている。これらは、液体マトリックスであるグリセロールを用いないのが特徴であり、Dry-SALDI-MSとも呼ばれている。
【0011】
McLeanらは2-10 nm程度の金ナノ粒子を利用して、ペプチド(substance P)試料を壊さないでイオン化している(非特許文献15参照)。これは、金ナノ粒子にパルスレーザー(N2レーザー337 nm)が照射され、局所的に温度が急速上昇し、ペプチドなどの試料分子が分解されずにソフトイオン化されるものである。試料のイオン化効率は金ナノ粒子の粒子サイズに依存し、10-20nm程度の粒子がよいとされている。金ナノ粒子との特異相互作用を利用したターゲット分子の選択的イオン化や(非特許文献16、17参照)、尿中のグルコースの定量分析の研究がある(非特許文献18参照)。また、金ナノ粒子表面に吸着した有機物質が優先的にイオン化されることから、ナノ粒子表面の吸着物質の分析にSALDI-MSが利用されている(非特許文献19、20参照)。このように金ナノ粒子を用いたSALDI-MS(Au-SALDI-MS)は、簡便性、粒子当たりの高いイオン化効率、及び粒子表面吸着物の選択的イオン化が可能などの利点がある。しかし、Au-SALDIには幾つかの課題も残されている。例えば、ナノサイズ効果によって金ナノ粒子の融点が減少するために、レーザー照射によって生じる金クラスターイオンが妨害イオンピークとして低分子量域に出現する。また、Au-SALDIでは、一般的に、金コロイドを滴下乾燥させた基板をイオン化基板として用いるが、その乾燥過程で金ナノ粒子が凝集し、その凝集状態が試料のイオン化効率や再現性に影響を与えることがある。このような観点から、Au-SALDIで塗布する金コロイドの濃度や塗布方法がイオン化効率に及ぼす影響について検討されている(非特許文献21参照)。
【0012】
白金(Pt)ナノ粒子を利用したSALDI-MSも検討されている。Au金属に比べ、Pt金属は融点が2045 Kと大きくかつ熱伝導度が小さいので、レーザー照射によって局所的に温度が最も高くなる。そのために脱離イオン化が促進されると期待できる。Yonezawaらは、白金ならではの特徴を生かした上に、花びら状の突起を表面に有した白金ナノ粒子 (ナノフラワーと呼ぶ) を新規に合成した。そして、白金ナノフラワーのSALDI-MSへの展開を行っている(非特許文献23参照)。白金ナノフラワーを利用した4つの典型的なペプチドサンプルのイオン化を行い、いずれの場合も、高感度で検出している。また、白金ナノフラワーを利用して分子量10,000以上のcytochrome Cのソフトイオン化にも成功している。白金ナノフラワーを用いたSALDIは、通常の球状白金ナノ粒子や蒸着白金基板に較べて、感度が極めて向上し、高分子量のペプチドまで検出できる。これは、白金ナノフラワーの花びら状の突起形状が、ペプチドの高感度、高分子量検出に作用していることを示す。これは、ナノ粒子のSALDIへの応用では、粒子の形態制御も試料のイオン化効率を上げるのに有効であることを示す。
【0013】
[ナノ粒子のアフィニティを利用したLDI-MS]
【0014】
生体分子混合溶液の中から特定の試料を分離・抽出・除去する目的で、磁性粒子(Magnetic Beads)による磁気分離が利用されている。Chenらは、磁性ナノ粒子の磁性分離をSALDI-MSへ展開している(非特許文献24、25参照)。酸化鉄ナノ粒子表面にゾル−ゲル反応によりチタニア薄膜コートしたFe3O4/TiO2ナノ粒子を合成し、SALD-MSへの有効性を実証した。生物分析化学領域では、タンパク質を酵素分解して得られるリン酸化ペプチドを選択的に濃縮することが重要な研究課題となっている。β-カゼイン消化物からのペプチド混合物試料溶液と、このナノ粒子を試験管の中で混合し、試験管の外壁に磁石を接して、ナノ粒子表面上に吸着したリン酸化ペプチドを磁性分離している。この磁性ナノ粒子を、そのままSALD-MSへ利用することにより、ペプチド混合物中のリン酸化ペプチドを高感度に検出している。本手法では、チタニア薄膜とリン酸化ペプチド間のケモアフイニティを利用して、試料をナノ粒子表面に濃縮し、それを“直接”SALDI-MSで高感度に検出できる。これにより、通常の溶媒抽出などの煩雑な分離操作を行うことなく、粒子表面に吸着した物質を直接、検出できる利点を持つ。一方、ゾル−ゲル反応などのカップリング剤による表面修飾では、チオール表面修飾に比べ、単一分子層の均一な修飾が困難なことや、導入できる官能基の種類が少ない。
【0015】
尿や血清中に含まれる生体由来の物質で、生体内の生物学的変化を定量的に把握するための指標となるものはバイオマーカーと呼ばれる。バイオマーカーは、ある特定の疾病や体の状態に相関して量的に変化するために、その量を測定することで疾病の診断や効率的な治療法の確立等が可能となる。ただし、ヒトの生態の複雑さと疾病の多因子性のため、単一のバイオマーカーだけに基づいて疾病を予測することは難しい。そこで、複数のバイオマーカーを同時にスクリーニングできる多重免疫測定の開発が急がれている。Wangらは、抗体を結合させた磁性ナノ粒子を用いて、血清中のバイオマーカーを濃縮し、MALDI-TOF
MSによる同定と定量を行う多重免疫検定を行っている(非特許文献26参照)。
【0016】
【非特許文献1】P. Pelagatti, M. Carcelli, F. Calbiani,C. Cassi, L. Elviri, C. Pelizzi, U. Rizzotti, D. Rogolino. Transfer Hydrogenation ofAcetophenone Catalyzed by Half-Sandwich Ruthenium(II) Complexes ContainingAmino Amide Ligands. Detection of the Catalytic Intermediates by ElectrosprayIonization Mass Spectrometry. Organometallics., 2005; 24: 5836-5844.
【非特許文献2】L. A. Paim, D. V. Augusti, D. Ilza, T.M. A. Alves. R. Augusti, H. G. L. Siebald. Electrospray ionization and tandemmass spectrometry characterization of novel heterotrimetallic Ru(η5-C5H5)(dppf)SnX3 complexes andtheir heterobimetallic Ru(η5-C5H5)(dppf)X precursors. Polyhedron.,2005; 24: 1153-1159.
【非特許文献3】G. Bhaskar, M. A. Chary, M. K. Kumar, K. Syamasundar, M. Vairamani,S. Prabhakar. Electrosprayionization studies of transition-metal complexes of2-acetylbenzimidazolethiosemicarbazone using collision-induced dissociation andion-molecule reactions. Rapid Commun. Mass Spectrometry., 2005; 19:1536-1544.
【非特許文献4】G. Maerkl, K. Gschwendner, I. Roetzer, P.Kreitmeier. Tetrakis(diethyl phosphonate), tetrakis(ethyl phenylphosphinate)-,tetrakis(diphenylphosphine oxide)- substituted phthalocyanines. HelveticaChimica Acta., 2004; 87: 825-844.
【非特許文献5】H. Takeda, A. Kawasaki, M. Takahashi, A. Yamada,T. Koike. Matrix-assisted laser desorption/ionization time-of-flight massspectrometry of phosphorylated compounds using a novel phosphate capturemolecule. Rapid Commun. Mass Spectrometry., 2003; 17: 2075-2081.
【非特許文献6】J. E. Ham, B. Durham, J. R. Scott. Comparison ofLaser Desorption and Matrix-Assisted Laser Desorption/Ionization for Rutheniumand Osmium Trisbipyridine Complexes Using Fourier Transform Mass Spectrometry. J.Am. Soc. Mass Spectrom., 2003; 14: 393-400.
【非特許文献7】K. Tanaka, H. Waki, Y. Ido, S. Akita, Y. Yoshida,T. Yoshida: Rapid Commun. Mass Spectrom., 2, 151 (1988).
【非特許文献8】D.S. Peterson: Mass Spectrom. Rev., 26, 19(2007).
【非特許文献9】T. Kinumi, T. Saisu, M. Takayama, H. Niwa: J.Mass Spectrom., 35,417 (2000).
【非特許文献10】M. Schu1renberg, K. Dreisewerd, F. Hillenkamp: Anal.Chem., 71, 221(1999).
【非特許文献11】島津製作所 田中耕一記念 質量分析研究所、”MADI-MS Technical Reports“ ,Rev.:29/Jun/2007.
【非特許文献12】S.Y. Xu, Y. F. Zou, J. S. Qiu, Z. Guo, B. C.Guo: Anal. Chem., 75,6191 (2003).
【非特許文献13】M.V. Ugarov, T. Egan, D.V. Khabashesku, J. A.Schultz, H. Peng, V. N. Khabashesku, H. Furutani, K. S. Prather, H. W. J. Wang,S. N. Jackson , A. S. Woods: Anal. Chem., 76, 6734 (2004).
【非特許文献14】X. Wen, S. Dagan, V. H. Wysocki: Anal. Chem.,79, 434 (2007).
【非特許文献15】J. A. McLean, A. A. Stumpo, D. H. Russell: J.Am. Chem. Soc., 127, 5304 (2005).
【非特許文献16】Y. F. Huang, H. T. Chang: Anal. Chem., 78, 1485 (2006).
【非特許文献17】Y. F. Huang, H. T. Chang: Anal. Chem., 79, 4852 (2007).
【非特許文献18】C. L. Su, W. L. Tseng: Anal. Chem., 79, 1626 (2007).
【非特許文献19】H. Kawasaki, T. Yonezawa, K. Nishimura, R.Arakawa: Chem. Lett., 36, 1038 (2007).
【非特許文献20】H. Kawasaki, M. Uota, T. Yoshimura, D. Fujikawa,G. Sakai, R. Arakawa, T. Kijima:Langmuir, 23, 11540(2007).
【非特許文献21】H-P. Wu, C-L. Su, H-C. Chang, W-L. Tseng: Anal. Chem., 79, 6215 (2007).
【非特許文献22】A. Tarui, H. Kawasaki, T. Taiko, T. Watanabe, T.Yonezawa, R. Arakawa: Journal of Nanoscience and Nanotechnology, inpress(2008).
【非特許文献23】H. Kawasaki, T. Yonezawa, T. Watanabe, R. Arakawa:J. Phys. Chem. C, 11,16278 (2007).
【非特許文献24】C-T. Chen, Y-C. Chen: Anal. Chem., 77, 5912 (2005).
【非特許文献25】W-Y. Chen, Y-C. Chen: Anal. Bioanal. Chem.,386, 699 (2006).
【非特許文献26】Kai-Yi Wang, Szu-An Chuang, Po-Chiao Lin, Li-ShingHuang, Shu-Hua Chen, Saib Ouarda, Wen-Harn Pan, X Ping-Ying Lee, O Chun-ChengLin, Yu-Ju Chen: Anal. Chem., 80, 6159-6167 (2008)
【発明の概要】
【発明が解決しようとする課題】
【0017】
本発明は、上述の背景技術に鑑みてなされたものであり、試料を高い効率で捕捉できる試料捕捉合金などを提供することを目的とする。
【課題を解決するための手段】
【0018】
この発明によれば、上述の目的を達成するために、特許請求の範囲に記載のとおりの構成を採用している。以下、この発明を詳細に説明する。
【0019】
本発明の第1の側面は、
表面が修飾され、
Fe、Pt及びCuを含有し、
試料を捕捉することを特徴とする試料捕捉合金
にある。
【0020】
本構成によれば、試料を高い効率で捕捉できる試料捕捉合金が得られる。
【0021】
なお、表面修飾には、スルホン酸による表面修飾のほか、アミン、カルボン酸、芳香族、炭化水素、炭化フッ素による方法を例として挙げることができる。また、表面修飾はチオール基を介する場合のほか、アミノ基、ホスフィン基、カルボキシル基などを介する方法を例として挙げることができる。これらの点は、下記のFePtCu合金だけでなく、FePt合金でも同様である。
【0022】
本発明の第2の側面は、
表面が修飾されることで電荷が付与されていることを特徴とする請求項1記載の試料捕捉合金
にある。
【0023】
本構成によれば、電荷により試料をより高い効率で捕捉できる試料捕捉合金が得られる。
【0024】
本発明の第3の側面は、
チオール基を結合しており、前記チオール基を介して表面が修飾されていることを特徴とする請求項1記載の試料捕捉合金
にある。
【0025】
本構成によれば、チオール基で表面修飾されていることからさらに他の置換基の導入が容易な試料捕捉合金が得られる。
【0026】
本発明の第4の側面は、
スルホン酸で表面が修飾されていることを特徴とする請求項1記載の試料捕捉合金
にある。
【0027】
本構成によれば、高い選択性を有する試料捕捉合金が得られる。
本発明の第5の側面は、
レーザーを照射することで捕捉した試料のイオン化を支援することを特徴とする請求項1記載の試料捕捉合金
にある。
【0028】
本構成によれば、試料を効率よく捕捉でき、イオン化までの効率も高くできる。
【0029】
本発明の第6の側面は、
表面支援レーザー脱離イオン化法で捕捉した試料のイオン化を支援することを特徴とする請求項5記載の試料捕捉合金
にある。
【0030】
本構成によれば、低分子量の試料のイオン化にも適する試料捕捉合金が得られる。
【0031】
本発明の第7の側面は、
請求項1から請求項6までのいずれかに記載の前記試料捕捉合金を装着したことを特徴とする質量分析装置
にある。
【0032】
本発明の第8の側面は、
請求項1から請求項6までのいずれかに記載の試料捕捉合金により補足した試料の質量分析を行うことを特徴とする質量分析方法
にある。
【0033】
本発明の第9の側面は、
表面が修飾され、Fe、Pt及びCuを含有する合金によって試料を捕捉することを特徴とする試料捉方法
にある。
【0034】
本構成によれば、試料を高い効率で捕捉できる方法が得られる。
【0035】
本発明の第10の側面は、Fe、Pt及びCuを含有し、チオール基を介してSO3-基が表面に結合しており、試料を捕捉することを特徴とする試料捕捉合金にある。
【0036】
本構成によれば、高い効率で試料を捕捉することができる試料捕捉合金が得られる。
【0037】
本発明の第11の側面は、Fe、Pt及びCuを含有する合金にチオール基を介して表面修飾を行うことを特徴とする試料捕捉合金製造方法にある。
【0038】
本構成によれば、シンプルな方法で、高い効率で試料を捕捉することができる試料捕捉合金が得られる。
【0039】
本発明の第12の側面は、Fe及びPtから実質的になり、試料を捕捉することを特徴とする試料捕捉合金にある。
【0040】
本構成によれば、優れた捕捉能力を持つ試料捕捉合金が得られる。
【0041】
ここで、実質的とは、Cuなどの他の元素をその合金の物性に大きな影響を与えるほど含まないことをいう。
【0042】
本発明の第13の側面は、
表面が修飾されていることを特徴とする請求項12記載の試料捕捉合金
にある。
【0043】
本構成によれば、試料をより高い効率で捕捉できる試料捕捉合金が得られる。
【0044】
本発明の第14の側面は、
Fe及びPtから実質的になり、
チオール基を介してSO3-基が表面に結合しており、
試料を捕捉することを特徴とする試料捕捉合金
にある。
【0045】
本構成によれば、高い効率で試料を捕捉することができる試料捕捉合金が得られる。
【0046】
なお、本明細書において、イオン化支援とは、レーザーが照射されることによって捕捉対象となる試料の脱離(気化)とイオン化の両方を支援することをいい、その目的を達するものであれば粒径などの大きさを問わない。合金には、例えば、微細粉、微粒子、後述するナノ粒子などが含まれる。微細粉の1次粒子のサイズ(直径)は、例えば、1 nm以上1μm以下、望ましくは5 nm以上600 nm以下、さらに望ましくは5 nm以上300 nm以下とするのが好ましい。また、2次凝集しているものも含まれる。さらに、微細粉よりも大きな構造体のうち、上述の大きさの突起部分を有する構造体でもよい。例えば、突起物が3nm以上300 nm以下、望ましくは5nm以上200 nm以下の大きさのものをもつ構造体が考えられる。
【発明の効果】
【0047】
本構成によれば、試料を高い効率で捕捉できる試料捕捉合金などが得られる。
【0048】
本発明のさらに他の目的、特徴又は利点は、後述する本発明の実施の形態や添付する図面に基づく詳細な説明によって明らかになるであろう。
【図面の簡単な説明】
【0049】
【図1】薬物試料の化学構造、分子量、酸解離定数を示す図である。
【図2】オリゴペプチド試料の化学構造、分子量、等電点を示す図である。
【図3】Gly-Gly-His、およびノナフルオロブタンスルホン酸の化学構造、分子量を示す図である。
【図4】FePtCu-SO3-ナノ粒子を用いた標的分子の捕捉・抽出手順の概略を示す図である。
【図5】保護剤SDSの存在下で合成されたFePtCuナノ粒子のFE-SEM写真(25000倍)を示す図である。
【図6】保護剤SDSの存在下で合成されたFePtCuナノ粒子の構成元素((X) の拡大範囲(25、000倍) におけるEDXスペクトル)を示す図である。
【図7】保護剤SDSの存在下で合成されたFePtCuナノ粒子の元素分布((X) の拡大範囲(25、000倍) における(a) Fe、(b) Pt、(c) Cu の元素分布)を示す図である。
【図8】保護剤の非存在下で合成されたFePtCuナノ粒子のFE-SEM写真((a) 25000倍、(b) (a)の左側大きな粒子付近、50000倍、(c) (a)の中央部の小さな粒子付近、50000倍)を示す図である。
【図9】保護剤の非存在下で合成されたFePtCuナノ粒子のTEM写真(100000倍)を示す図である。
【図10】保護剤の非存在下で合成されたFePtCuナノ粒子の構成元素((X) の拡大範囲(25000倍) における(a) EDXスペクトルと(b) 定量分析)を示す図である。
【図11】保護剤の非存在下で合成されたFePtCuナノ粒子の元素分布((X) の拡大範囲(25000倍) における(a) Fe、(b) Pt、(c) Cu の元素分布(d) Fe、(e) Pt、(f) Cuの元素質量分布)を示す図である。
【図12】FT-IR (ATR) スペクトル((a) 表面修飾前のFePtCuナノ粒子、(b) HSCH2CH2SO3Na表面修飾後のFePtCuナノ粒子、(c) HSCH2CH2SO3Na粉末)を示す図である。
【図13】アンギオテンシンI(10 fmol) のSALDIマススペクトルを示す図である。
【図14】インスリンヒト(5 pmol) のSALDIマススペクトルを示す図である。
【図15】チトクロームC (5 pmol) のSALDIマススペクトルを示す図である。
【図16】カフェイン(100 pmol) のマススペクトルを示す図である。
【図17】GGH (100 pmol) のSALDIマススペクトルを示す図である。
【図18】アミトリプチリン塩酸塩(1 pmol) のマススペクトルを示す図である。
【図19】デキストロメトルファン臭化水素酸塩(1 pmol) のマススペクトルを示す図である。
【図20】オリゴペプチドGGYR (1 μM ) の捕捉・抽出操作後に回収したFePtCu-SO3-ナノ粒子のSALDIマススペクトルを示す図である。
【図21】任意のpHにおけるFePtCu- SO3-ナノ粒子とオリゴペプチドGGYRの電荷状態、およびオリゴペプチドGGYRの捕捉・抽出結果を示す図である。
【図22】オリゴペプチドGGYR (1 μM ) の捕捉・抽出操作後に回収した上清のSALDIマススペクトルを示す図である。
【図23】3種混合オリゴペプチド(10 μM ) の捕捉・抽出操作後に回収したFePtCu-SO3-ナノ粒子のSALDIマススペクトルを示す図である。
【図24】任意のpHにおけるFePtCu- SO3-ナノ粒子とオリゴペプチドの電荷状態、およびオリゴペプチド3種の捕捉・抽出結果を示す図である。
【図25】血清中に添加した卵白リゾチーム(100 μM) のMALDIマススペクトルを示す図である。
【図26】血清中に添加した卵白リゾチーム(10 μM) のMALDIマススペクトルを示す図である。
【図27】FePtナノ粒子を用いたAng I のSALDIマススペクトルとFePtCuナノ粒子を用いたAng I のSALDIマススペクトルとを示す図である。
【図28】FePtナノ粒子を用いたAng I のSALDIマススペクトルとFePtCuナノ粒子を用いたAng I のSALDIマススペクトルとを示す図である。
【発明を実施するための形態】
【0050】
以下、本発明の実施の形態について図面を参照しながら詳細に説明する。
【0051】
[概要]
【0052】
本発明者らは、アフィニティ機能を有する無機マトリックスとしてFePtCuナノ粒子 (鉄・白金・銅から構成される合金ナノ粒子)などを合成し、ナノ粒子のアフィニテイ分離を利用した SALDI-MSの開発・研究を行った。このFePtCuナノ粒子などは、合金化により、単独の金属ナノ粒子と比較して高いイオン化効率を有し、さらに、チオール基などによる表面修飾により、標的分子と相互作用する様々な官能基を導入することができる。混合物中から粒子表面に標的分子を捕捉し、FePtCuナノ粒子などの持つ磁性、あるいは簡易遠心を利用した分離・抽出することが可能となる。さらに、粒子表面に捕捉した標的分子をSALDI-MSで同定することができる。これらの特徴を活かすため、FePtCuナノ粒子などを強電解質であるチオールスルホン酸で表面修飾し、pHに依存しない負の表面電荷を付与した (例えばFePtCu- SO3-ナノ粒子)。また、正電荷を持つ低分子量のオリゴペプチドや高分子量のタンパク質を静電的に捕捉・抽出し、それらをSALDI/MALDI-MSなどで検出できることを実証した。
【0053】
[本発明に至る経緯、背景]
【0054】
本発明者らは、合金化したFePtCuナノ粒子を用いることで、単独の金属ナノ粒子と比較して高いイオン化効率の実現を図ることを目標としていた(下記の非特許文献参照)。
【0055】
【非特許文献27】第56回質量分析総合討論会(2008)講演要旨集246-247
【0056】
本発明者らは、さらなる進歩を実現するため、FePtCuナノ粒子などをチオールによって表面修飾し、チオール末端と相互作用する標的分子の捕捉・抽出を試みた。先行研究として、Benjaminらは、カルボキシル基を末端に持つアルカンチオールで金ナノ粒子を表面修飾することで負に帯電させた金ナノ粒子を用いて、正の電荷を持つペプチドを粒子表面に捕捉・抽出し、MALDI-MSでその捕捉したペプチドを検出している(下記の非特許文献参照)。
【0057】
【非特許文献28】Benjamin N. Y. Vanderpuije, Gang Han, Vincent M.Rotello, Richard W. Vachet: Anal. Chem.78 (2006) 5491-5496
【0058】
しかしながら、pH 6以下の条件においては、カルボキシル基はほとんど解離しないため、その負電荷は失われ、静電的なアフィニティを利用することが困難になるという使用できるpHの制限がある。また、MALDI法を用いているために、マトリックスの影響で医薬品などの低分子化合物の測定は困難である。
【0059】
そこで、本研究では、FePtCu-SO3-ナノ粒子のアフィニティを利用したLDI-MSの開発・研究を行った。FePtCuナノ粒子などを新規に合成し、強電解質であるチオールスルホン酸で表面修飾を行い、pHに依存しない負の表面電荷を付与した (例えばFePtCu- SO3-ナノ粒子)。このFePtCu- SO3-ナノ粒子をSALDIの無機マトリックスとして用いることにより、混合試料から正の電荷を持つ低分子量オリゴペプチドを静電的に捕捉・抽出し、それらをSALDI-MSのサンプルとして検出することを目標とした。また、多くの夾雑物を含む血清中から塩基性タンパク質をFePtCu- SO3-ナノ粒子で捕捉し、それをMALDI-MSで検出することも検討した。
【0060】
次に、実際に行った実験について説明する。
【0061】
[試薬]
【0062】
塩化鉄(II) (FeCl2・4H2O)、塩化白金(IV)酸 (H2PtCl6・H2O)、硫酸銅五水和物(II) (CuSO4・5H2O)、ヒドラジン一水和物 (N2H4・H2O)、0.1 M 塩酸 (容量分析用)、25 %アンモニア水、クエン酸 (無水)、ノナフルオロブタンスルホン酸
(NFA)、トリフルオロ酢酸 (TFA)、ドデシル硫酸ナトリウム (CH3(CH2)11OSO3Na, SDS)、アンギオテンシンI、インスリンヒト (組み替え体)、カフェイン (無水)、デキストロメトルファン臭化水素酸塩一水和物、リゾチーム塩酸塩 (ニワトリ卵白由来) 、エタノール
(EtOH、99.5%、特級)、メタノール (MeOH、HPLC用)、アセトニトリル (MeCN、特級)、アセトン (特級)、テトラヒドロフラン (THF、有機合成用、安定剤含有) は和光純薬工業から購入した。蒸留水 (LC-MS用) は関東化学から購入した。また、蒸留水は蒸留水製造装置 (RFD250NB,
ADVANTEC) から得た。チトクロームC (ウマ心臓由来)
はCalbiochemから購入した。Gly-Gly-Tyr-Arg
(GGYR) 、Gly-Gly-His (GGH) はペプチド研究所から購入した。クエン酸二アンモニウムはFlukaから購入した。2-メルカプトエタンスルホン酸ナトリウム (HSCH2CH2SO3Na)、Gly-Gly-Gly-Gly (GGGG)は東京化成工業から購入した。α-シアノ-4-ヒドロキシ桂皮酸 (CHCA)、Asp-Asp-Asp-Asp (DDDD)、アミトリプチリン塩酸塩はSigma Aldrichから購入した。ヒト血清はCHEMICON
Internationalから購入した。
【0063】
図1は、薬物試料の化学構造、分子量、酸解離定数を示す図である。カフェイン、アミトリプチリン塩酸塩、デキストロメトルファン臭化水素酸塩の化学構造、分子量、酸解離定数を示す。
図2は、オリゴペプチド試料の化学構造、分子量、等電点を示す図である。Asp-Asp-Asp-Asp
(DDDD), Gly-Gly-Gly-Gly (GGGG), Gly-Gly-Tyr-Arg (GGYR) の化学構造, 分子量, 等電点 (pI) を示す。pI値は、http://mobyle.pasteur.fr/cgi-bin/MobylePortal/portal.py?form=pepstatsの計算プログラムを使用して得た。図3は、Gly-Gly-His(GGH)、およびノナフルオロブタンスルホン酸の化学構造、分子量を示す図である。
【0064】
[FePtCu合金ナノ粒子の合成]
<保護剤SDSの存在下におけるFePtCu合金ナノ粒子の合成>
【0065】
0.8 mmol FeCl2・4H2O、0.8 mmol H2PtCl6・H2O、0.192 mmol CuSO4・5H2O、および1.6 mmol SDSを蒸留水 (40
mL, 70 °C) に溶解し、それぞれ20 mM、20 mM、4.8 mM、40 mMの濃度とした(下記の非特許文献参照)。ここで生成したFeとSDSの錯体は、40 mM N2H4 (10 mL, 0.4 mmol N2H4・H2Oを蒸留水に溶解) を少量ずつ加えて溶解した。これに、390 mM N2H4 (40 mL, 70 °C, 15.6 mmol N2H4・H2Oを水に溶解)を激しく撹拌しながら (530〜 rpm, 磁石撹拌子を使用) 素早く加え、還元した。反応は数秒で進行し、その後は70 °Cで3時間還流・撹拌を続けた。自然冷却の後、遠心分離し (4000 rpm, 15 min, KUBOTA3200)、上清を廃棄した。なお、還元剤は、水素化ホウ素ナトリム、水素化ホウ素リチウムでもよい。
【0066】
【非特許文献29】P. Gibot, E. Tronc, C. Chaneac, J.P. Jolivet, D.Fiorani, A.M. Testa: J. Magn. Magn. Mater. 290-291 (2005) 555-558
【0067】
残ったFePtCuナノ粒子の沈殿にMeOH (〜8 mL) を加え、超音波を照射 (〜3 min) することで分散させた。撹拌 (〜3 min) と遠心分離 (4000
rpm, 15 min, KUBOTA3200) の後、上清を廃棄した。続いて、残ったFePtCuナノ粒子の沈殿に蒸留水 (〜8 mL) を加え、超音波を照射
(〜3 min) することで分散させた。撹拌 (〜3 min) と遠心分離 (4000 rpm、15 min、KUBOTA3200) の後、上清を廃棄した。以上の洗浄は5周行った。最後に、FePtCuナノ粒子を減圧乾燥して粉末とし、常温で保存した。
【0068】
<保護剤の非存在下におけるFePtCu合金ナノ粒子の合成>
2 mmol FeCl2・4H2O、2 mmol H2PtCl6・H2O、および0.48 mmol CuSO4・5H2Oを蒸留水 (100 mL, 70 °C) に溶解し、それぞれ20 mM、20 mM、4.8 mMの濃度とした。これに、400 mM N2H4 (100 mL, 70 °C, 40 mmol N2H4・H2Oを水に溶解) を激しく撹拌しながら (530〜 rpm, 磁石撹拌子を使用) 素早く加え、還元した。反応は数秒で進行し、その後は70 °Cで3時間還流・撹拌を続けた。自然冷却の後、上清を廃棄した。
【0069】
残ったFePtCuナノ粒子の沈殿にEtOH (〜8 mL) を加え、超音波を照射 (〜3 min) することで分散させた。撹拌 (〜3 min) と遠心分離 (4000
rpm, 5 min, KUBOTA3200) の後、上清を廃棄した。続いて、残ったFePtCuナノ粒子の沈殿に蒸留水 (〜8 mL) を加え、超音波を照射
(〜3 min) することで分散させた。撹拌 (〜3 min) と遠心分離 (4000 rpm、5 min、KUBOTA3200) の後、上清を廃棄した。以上の洗浄は3周行った。最後に、FePtCuナノ粒子を減圧乾燥して粉末とし、常温で保存した。
【0070】
[FePtCu合金ナノ粒子の構造評価]
【0071】
FePtCuナノ粒子は、電界放射型走査電子顕微鏡 (Field Emission Scanning
Electron Microscope, FE-SEM)、および透過型電子顕微鏡 (Transmission
Electron Microscope, TEM, JEOL) によりサイズと形状を確認し、エネルギー分散型X線分光 (Energy Dispersive X-ray Spectroscopy, EDX) により構成元素を確認した (FE-SEMおよびEDXは東京大学大学院 米澤徹先生に測定を依頼した)。
【0072】
[チオールスルホン酸によるFePtCu合金ナノ粒子の表面修飾]
【0073】
保護剤の非存在下で合成したFePtCuナノ粒子 (100 mg) にEtOH (〜8
mL) を加え、超音波を照射 (〜3 min) することで分散させた。撹拌 (〜3 min) と遠心分離 (4000
rpm, 5 min, KUBOTA3200) の後、上清を廃棄した。続いて、残ったFePtCuナノ粒子の沈殿に蒸留水 (〜8 mL) を加え、超音波を照射
(〜3 min) することで分散させた。撹拌 (〜3 min) と遠心分離 (4000 rpm、5 min、KUBOTA3200) の後、上清を廃棄した。以上の洗浄は5周行い、最後に廃棄した上清の電気伝導度が25 mS/m以下となることを確認した (CM-30G, DKK・TOA)。
【0074】
洗浄したFePtCuナノ粒子にEtOH (50 mL) を加え、超音波を照射 (5 min, US-3R, AS
ONE) することで分散させた。これに、1M HS(CH2)2SO3Na (5.6 mL, 5.6 mmol, 水に溶解)を撹拌しながら (500-770 rpm, LT400, yamato scientific) 素早く加えた。その後は、25 °Cで24時間撹拌を続けた(下記の非特許文献参照)。途中、HS(CH2)2SO3Naの析出が見られたため、蒸留水 (〜10 mL) を加えてこれを溶解した。反応の後、上清を廃棄した。
【0075】
【非特許文献30】Simard, J. M.,Briggs, C., Boal, A. K., Rotello, V. M.: Chem. Commun. 19 (2000)1943-1944
【非特許文献31】McIntosh, C. M.,Esposito, E. A., Boal, A. K., Simard, J. M., Martin, C. T.,& Rotello, V. M.J. Am. Chem. Soc. 123 (2001) 7626-7629
【0076】
残ったFePtCuナノ粒子の沈殿に蒸留水 (〜1.5 mL) を加えた。撹拌 (〜3 min) と遠心分離 (14000 rpm、5 min、centrifuge 5417R, eppendorf) の後、上清を廃棄した。以上の洗浄は5周行い、最後に廃棄した上清の電気伝導度が1 mS/m以下となることを確認した (CM-30G, DKK・TOA)。続いて、残ったFePtCuナノ粒子の沈殿にアセトン (〜8 mL) を加えた。撹拌 (〜3
min) と遠心分離 (4000 rpm、10 min、KUBOTA3200) の後、上清を廃棄した。以上の洗浄は2周行った。最後に、FePtCuナノ粒子を減圧乾燥して粉末とし、-30 °Cで保存した。
【0077】
以上の表面修飾処理を行ったFePtCuナノ粒子を、以下では、FePtCu-
SO3-ナノ粒子と表す。
【0078】
[FePtCu- SO3-ナノ粒子の表面修飾評価]
【0079】
FePtCu- SO3-ナノ粒子は、フーリエ変換型赤外分光 (Fourier Transform Infrared Spectroscopy,
FT-IR, FT/IR-4200, JASCO) の減衰全反射法 (Attenuated Total Reflection, ATR) により表面修飾を確認した。
【0080】
[試料調製、溶液調製]
<FePtCuナノ粒子 (表面修飾前) の水分散液の調製>
FePtCuナノ粒子 (表面修飾前) の粉末 (〜1 mg) をマイクロチューブにとり、蒸留水 (〜200 μL) を加えた。撹拌 (〜1 min) と超音波の照射 (15 min, US-3R, AS ONE)の操作を3、4回行い、ナノ粒子を分散させた。濃度は1.5 mg/mLとした。
【0081】
<FePtCu- SO3-ナノ粒子の水分散液の調製>
FePtCu- SO3-ナノ粒子の粉末 (〜6 mg) をガラス遠沈管にとり、これにTHF (〜8 mL) を加え、超音波を照射 (〜3 min) することで分散させた。撹拌 (〜3 min) と遠心分離 (4000
rpm, 5 min, KUBOTA3200) の後、上清を廃棄した。以上の洗浄は2周行った。続いて、残ったFePtCu-
SO3-ナノ粒子の沈殿に蒸留水 (〜8 mL) を加え、超音波を照射 (〜3 min) することで分散させた。撹拌 (〜3 min) と遠心分離 (4000
rpm、5 min、KUBOTA3200) の後、上清を廃棄した。以上の洗浄は2周行った。
【0082】
最後に、洗浄したFePtCu- SO3-ナノ粒子に蒸留水 (4 mL) を加え、超音波を照射
(〜3 min) することで分散させた。濃度は1.5
mg/mLとした。
【0083】
<カチオン化剤の調製>
カチオン化剤には、クエン酸緩衝液、TFA、NFAのいずれかを選択した。クエン酸緩衝液は、分子量が10,000以下の試料と用いる場合には10 mMaqクエン酸 / 5 mMクエン酸二アンモニウムaq=1/3 (v/v) の組成とし、分子量が10,000以上の試料と用いる場合にはチ23 mMaqクエン酸 / 20 mMaqクエン酸二アンモニウム=1.1/5 (v/v) の組成とした。TFA、およびNFAは蒸留水で希釈し、それぞれ0.1v%の濃度に調製した。
【0084】
<マトリックスの調製>
MALDI-MSで用いるマトリックス剤にはCHCAを選択した。蒸留水/MeCN=1/1 (v/v)を溶媒に用いて10 mg/mLの濃度に調製した。なお、有機マトリックスとして、ここでは、CHCAを使用したが、試料の分子量などに応じて、他にもシナピン酸(3,5-ジメトキシ-4-ヒドロキシケイ皮酸)、フェルラ酸(trans-4-ヒドロキシ-3-メトキシケイ皮酸)、ゲンチシン酸、DHBA(2,5-ジヒドロキシ安息香酸)、HPA(3-ヒドロキシピコリン酸)、ジスラノール(1,8-ジヒドロキシ-9,10-ジヒドロアントラセン-9-オン)などを使用してもよい。
【0085】
[FePtCu合金ナノ粒子/FePtCu- SO3-ナノ粒子を利用したSALDI-MS]
<FePtCuナノ粒子 (表面修飾前) を利用したSALDI-MS>
表面修飾を行う前のFePtCuナノ粒子のSALDI特性を検討した。
【0086】
試料には、アンギオテンシンI、インスリンヒト、チトクロームCを選択した。蒸留水を溶媒に用いてそれぞれ20 nM、10 μM、10 μMの濃度に調製した。
【0087】
384-well MALDIステンレスプレートにFePtCuナノ粒子 (表面修飾前) の水分散液を塗布し (0.5
μL)、自然乾燥した。続いて、その上に試料溶液およびカチオン化剤を塗布し (それぞれ0.5 μL)、乾燥した。カチオン化剤にはクエン酸緩衝液を選択した。
【0088】
<FePtCu- SO3-ナノ粒子を利用したSALDI-MS>
低分子医薬品化合物を試料とし、FePtCu- SO3-ナノ粒子を用いたSALDIマススペクトルと、MALDIマススペクトルとの比較を行った。
【0089】
試料には、カフェイン、アミトリプチリン塩酸塩、デキストロメトルファン臭化水素酸塩を選択した。蒸留水を溶媒に用いてそれぞれ100 μM、1 μM、1 μMの濃度に調製した。カフェインを試料とする場合、0.1v%NFAをカチオン化剤として選択した。アミトリプチリン塩酸塩、およびデキストロメトルファン臭化水素酸塩を試料とする場合、カチオン化剤は使用しなかった。
【0090】
384-well MALDIステンレスプレートにFePtCu- SO3-ナノ粒子の水分散液を塗布し (1 μL)、自然乾燥した。続いて、その上に試料溶液 (、およびカチオン化剤) を塗布し (1 μL)、乾燥した。
【0091】
{MALDI-MS}
384-well MALDIステンレスプレートにCHCA、試料溶液 (、およびカチオン化剤)を順に塗布し
(それぞれ1 μL)、乾燥した。
【0092】
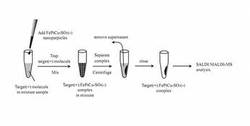
<FePtCu- SO3-ナノ粒子のアフィニティを利用した標的分子の捕捉実験とLDI-MS>
図4は、FePtCu- SO3-ナノ粒子を用いた標的分子の捕捉・抽出手順の概略を示す図である。ここでは、FePtCu- SO3-ナノ粒子表面の負電荷と、正電荷を持つペプチド・タンパク質との間に働
【0093】
く静電的なアフィニティを利用して、ペプチド・タンパク質を捕捉・抽出し、これをSALDI-MS/MALDI-MSで検出することを試みた。
【0094】
<単一オリゴペプチドの捕捉実験とSALDI-MS>
単一オリゴペプチドにはGGYRを選択した。蒸留水を溶媒に用いて50 μMの濃度に調製した (20 μL)。これを1×10-4 M塩酸、蒸留水、3×10-4 %アンモニア水、1×10-2 % アンモニア水のいずれか (980 μL) で1 μMの濃度に希釈し (1 mL)、それぞれpH 4, 6, 8, 10に調整した。
【0095】
これらにFePtCu- SO3-ナノ粒子の水分散液 (100 μL) を加え、撹拌
(10 min,
Thermomixer comfort, eppendorf)・一晩静置してGGYRの捕捉を行った。その後、簡易遠心分離し(6200 rpm, 5 min, MICRO SIX)、上清 (950 μL) を回収した。
【0096】
残ったFePtCu- SO3-ナノ粒子の沈殿に、捕捉時と同じpHを保持するように1×10-4 M塩酸、蒸留水、3×10-4 %アンモニア水、1×10-2 % アンモニア水のいずれか (1 mL) を加え、撹拌した (〜1 min)。簡易遠心分離 (6200
rpm, 5 min, MICRO SIX) の後、上清 (1 mL) を廃棄した。以上の洗浄はそれぞれ2回行った。
【0097】
洗浄後、100 μLの上清を残して超音波を照射し
(〜2 min,)、FePtCu- SO3-ナノ粒子を再分散させた。これらを384-well MALDIステンレスプレートに塗布し (1.0 μL)、自然乾燥した。続いて、その上にカチオン化剤を塗布し (1 μL)、乾燥した。カチオン化剤にはクエン酸緩衝液を選択した。
【0098】
{捕捉直後に回収した上清のSALDI-MS}
FePtCu- SO3-ナノ粒子の水分散液を384-well MALDIステンレスプレートに塗布し (1.0 μL)、自然乾燥した。続いてその上に回収した上清およびカチオン化剤を塗布し (それぞれ1 μL)、乾燥した。カチオン化剤にはクエン酸緩衝液を選択した。
【0099】
<混合オリゴペプチドの捕捉実験とSALDI-MS>
オリゴペプチドにはDDDD、GGGG、GGYRの3種類を選択した。蒸留水を溶媒に用いてそれぞれ300 μMの濃度に調製した。これらを等量ずつ混合し、100 μMの濃度に調製した (100 μL)。これを1×10-2.5 M塩酸、3×10-4 %アンモニア水、1×10-2 % アンモニア水のいずれか (900 μL) で10 μMの濃度に希釈し (1 mL)、それぞれpH 2.5、8、10に調整した。
【0100】
これらにFePtCu- SO3-ナノ粒子の水分散液 (100 μL) を加え、撹拌
(10 min, Thermomixer comfort, eppendorf)・一晩静置してオリゴペプチドの捕捉を行った。その後、簡易遠心分離し(6200 rpm, 5 min, MICRO SIX)、上清 (950 μL) を廃棄した。
【0101】
残ったFePtCu- SO3-ナノ粒子の沈殿に、捕捉時と同じpHを保持するように1×10-2.5 M塩酸、3×10-4 %アンモニア水、1×10-2 % アンモニア水のいずれか (1 mL) を加え、撹拌した (〜1 min)。簡易遠心分離 (6200
rpm, 5 min, MICRO SIX) の後、上清 (1 mL) を廃棄した。以上の洗浄はそれぞれ2回行った。
【0102】
洗浄後、〜100 μLの上清を残して超音波を照射し (〜2 min)、FePtCu- SO3-ナノ粒子を再分散させた。これらを384-well MALDIステンレスプレートに塗布し (1.0 μL)、自然乾燥した。続いて、その上にカチオン化剤を塗布し (1 μL)、乾燥した。カチオン化剤にはクエン酸緩衝液を選択した。
【0103】
<血清中のタンパク質の捕捉実験とMALDI-MS>
血清中に添加したタンパク質を標的分子とし、FePtCu- SO3-ナノ粒子を利用した捕捉・抽出の有無でMALDIマススペクトルの比較を行った。タンパク質には卵白リゾチームを選択した (M.W. 14306, pI=11.1)。リゾチームは、単球性白血病、腎臓病、髄膜炎において血清中濃度が増加する酵素タンパク質である(下記非特許文献による)。
【0104】
【非特許文献32】Levinson, S. S.;Elin, R. J.; Yam, L. Clin. Chem. 2002, 48, 1131-1132.
【非特許文献33】Harrison, J. F.;Lunt, G. S.; Scott, P.; Blainey, J. D. Lancet 1968, 1,371-375.
【非特許文献34】Klockars, M.; Reitamo, S.; Weber, T.; Kerttula,Y. Acta Med. Scand.1978, 203, 71-74.
【0105】
リゾチームは、蒸留水を溶媒に用いて5 mM, 500 μMのいずれかの濃度に調製した (20 μL) 。これをヒト血清 (980 μL, pH 8) で100 μM, 10 μMの濃度に希釈した (1 mL)。
【0106】
上の血清試料にFePtCu- SO3-ナノ粒子の水分散液 (200 μL) を加え、撹拌して (1 h, Thermomixer comfort, eppendorf) リゾチームの捕捉を行った。その後、簡易遠心分離し(6200 rpm, 5 min, MICRO SIX)、上清 (1.19 mL) を廃棄した。
【0107】
残ったFePtCu- SO3-ナノ粒子の沈殿に、蒸留水 (1.3 mL) を加え、撹拌した (〜1 min)。簡易遠心分離
(6200 rpm, 5 min, MICRO
SIX) の後、上清 (1.29 mL) を廃棄した。以上の洗浄は3回行った。
【0108】
洗浄後、100 μLの蒸留水を加えて超音波を照射し (〜2 min)、FePtCu- SO3-ナノ粒子を再分散させた。これを384-well MALDIステンレスプレートに塗布し (1.0 μL)、自然乾燥した。続いて、その上にCHCA、およびカチオン化剤を塗布し (それぞれ1 μL)、乾燥した。カチオン化剤にはクエン酸緩衝液を選択した。
【0109】
{前処理を行わないMALDI-MS}
384-well MALDIステンレスプレートに上の血清試料、CHCA、カチオン化剤を順に塗布し (それぞれ1 μL, 0.6 μL, 0.6 μL)、乾燥した。カチオン化剤にはクエン酸緩衝液を選択した。
【0110】
[SALDI/MALDI-MS測定条件]
【0111】
上記のようにサンプルを塗布した384-well MALDIステンレスプレートは、飛行時間型質量分析計 (AXIMA-CFR、またはAXIMA-CFR plus、窒素レーザー光波長337 nm, Shimadzu-Kratos) に導入し、リニア・正イオンモードでSALDI/MALDI-TOF-MS測定を行った。質量校正には、CHCAの[M+H]+イオン, アンギオテンシンIの[M+H]+イオン、インスリンヒトの[M+H]+イオン、リゾチームの[M+H]+イオン (それぞれm/z 190.05, 1296.69, 5806.65, 14303.83, Most
abundunt) を用いた。
【0112】
[FePtCu合金ナノ粒子の構造評価]
【0113】
保護剤SDSの存在下で合成されたFePtCuナノ粒子のFE-SEM画像、EDXスペクトル、および元素分布について説明する。図5は、保護剤SDSの存在下で合成されたFePtCuナノ粒子のFE-SEM写真(25000倍)を示す図である。図6は、保護剤SDSの存在下で合成されたFePtCuナノ粒子の構成元素((X) の拡大範囲(25、000倍) におけるEDXスペクトル)を示す図である。図7は、保護剤SDSの存在下で合成されたFePtCuナノ粒子の元素分布((X) の拡大範囲(25、000倍) における(a) Fe、(b) Pt、(c) Cu の元素分布)を示す図である。
【0114】
FE-SEM画像より、保護剤SDSの存在下で合成されたFePtCuナノ粒子は、直径が約10 nm の球形状であることがわかった (図5)。また、EDX解析より、鉄・白金・銅の合金であることが確認され (図6)、元素の分布にも差がなかった
(図7)。
【0115】
次に、保護剤の非存在下で合成されたFePtCuナノ粒子のFE-SEM画像、TEM画像、EDXスペクトル、および元素分布について説明する。図8は、保護剤の非存在下で合成されたFePtCuナノ粒子のFE-SEM写真((a) 25000倍、(b)
(a)の左側大きな粒子付近、50000倍、(c) (a)の中央部の小さな粒子付近、50000倍)を示す図である。図9は、保護剤の非存在下で合成されたFePtCuナノ粒子のTEM写真(100000倍)を示す図である。図10は、保護剤の非存在下で合成されたFePtCuナノ粒子の構成元素((X) の拡大範囲(25000倍) における(a) EDXスペクトルと(b) 定量分析)を示す図である。図11は、保護剤の非存在下で合成されたFePtCuナノ粒子の元素分布((X) の拡大範囲(25000倍) における(a) Fe、(b) Pt、(c) Cu の元素分布
(d) Fe、(e) Pt、(f) Cuの元素質量分布)を示す図である。図12は、FT-IR (ATR) スペクトル((a) 表面修飾前のFePtCuナノ粒子、(b) HSCH2CH2SO3Na表面修飾後のFePtCuナノ粒子、(c) HSCH2CH2SO3Na粉末)を示す図である。
【0116】
FE-SEM画像 (図8)、およびTEM画像 (図9) より、保護剤の非存在下で合成されたFePtCuナノ粒子は、10-20 nm程度のナノ粒子と100-200 nm程度の微粒子の混合物であることがわかった。また、EDX解析より、いずれも鉄・白金・銅の合金であることが確認されたが、前者は白金含量が多く(図11a, b)、後者は鉄含量が多くなっていた(図11d, e)。これらの偏りは、合成系に保護剤SDSが存在していた場合と比較して還元反応が不均一に進行したために生じたと考えられる。
【0117】
チオールスルホン酸による表面修飾を行ったFePtCuナノ粒子 (FePtCu-
SO3-ナノ粒子) のFT-IRスペクトルを図12に示す。チオールスルホン酸は、波長1200 nm付近に- SO3-に由来する強い2本のピークが特徴に見られる(図12c)。このピークに注目して表面修飾の前(図12a)と表面修飾の後(図12b)を比較すると、弱いピーク強度ではありながら、表面修飾の後 (図12b) においては波長1200
nm付近に- SO3-に由来すると考えられる2本のピークが新たに現れている。また、FePtCu-
SO3-ナノ粒子は、表面修飾を行う前のFePtCuナノ粒子と比較して水に容易に分散し、沈降速度も遅かったことから、チオールスルホン酸による表面修飾が行われたと考えられる。
【0118】
[FePtCu合金ナノ粒子/FePtCu- SO3-ナノ粒子を利用したSALDI-MS]
<FePtCu合金ナノ粒子を利用したSALDI-MS
>
表面修飾を行う前のFePtCuナノ粒子のSALDI特性を検討した。
【0119】
図13は、アンギオテンシンI(10
fmol) のSALDIマススペクトルを示す図である。カチオン化剤としてクエン酸緩衝液を使用した。FePtCu粒子の合成条件は(a) 保護剤非存在下、(b)保護剤SDS存在下であった
【0120】
保護剤SDSの存在/非存在下の合成条件の如何に関わらず、プロトンが付加した[M+H]+イオン (m/z 1297) を高いイオン強度と分解能をもって観測することができた。標準的な試料であるアンジオテンシンIにフェムトモルレベルの検出感度を有していることから、 FePtCuナノ粒子はSALDI-MSにおける無機マトリックスとして利用可能であることがわかった。ただし、保護剤SDSの存在下で合成されたFePtCuナノ粒子を用いた場合、m/z 400以下の範囲で残留したSDSに由来すると考えられるピーク群が併せて観測された。このことから、保護剤SDSの存在下で合成されたFePtCuナノ粒子は、低分子化合物のSALDI-MSへの使用にはやや劣ると考えられる。
【0121】
図14は、インスリンヒト(5 pmol) のSALDIマススペクトルを示す図である。ナノ粒子として(a) Ptナノ粒子、(b) 保護剤SDS存在下で合成されたFePtCuナノ粒子、カチオン化剤としてクエン酸緩衝液を使用した。白金単独の元素から構成されるPtナノ粒子を用いた場合、試料に由来するピークを観測することができなかった(下記の非特許文献参照)図14a)。一方、FePtCuナノ粒子 (保護剤SDSの存在下で合成) を用いた場合、[M+H]+イオン (m/z 5806) を観測することができ(図14b)、合金化によるイオン化効率の向上が示唆される。
【0122】
【非特許文献35】H. Kawasaki, T.Yonezawa, T. Watanabe, R. Arakawa: J. Phys. Chem C , 11, 16278-16283(2007)
【0123】
図15は、チトクロームC (5 pmol) のSALDIマススペクトルを示す図である。m/z 4000以下はblankである。保護剤SDS存在下で合成されたFePtCuナノ粒子、カチオン化剤としてクエン酸緩衝液を使用した。一価の[M+H]+イオン
(m/z 12360) および二価の[M+2H]2+イオン (m/z 6180) を観測することができたが、その強度と分解能は低かった。このことから、分子量が10,000以上の高分子化合物のイオン化については、他の金属ナノ粒子を用いたSALDIと同様にMALDIに劣ることがわかった。
【0124】
<FePtCu- SO3-ナノ粒子を利用したSALDI-MS>
塩基性の低分子医薬品化合物を試料とし、FePtCu- SO3-ナノ粒子を用いたSALDIマススペクトルと、MALDIマススペクトルとの比較を行った。
【0125】
図16は、カフェイン(100 pmol) のマススペクトル((a) CHCAを用いたMALDI、(b) FePtCu- SO3-ナノ粒子を用いたSALDI)を示す図である。カチオン化剤として0.1% NFAを使用した。MALDIマススペクトルでは、プロトンが付加した[M+H]+イオン (m/z 195) が観測されたが、CHCAマトリックス剤に由来するピークも近傍に観測され (m/z 190)、カフェインのイオン化は抑制されていた (図16a)。一方、SALDIマススペクトルでは、[M+H]+イオン (m/z 195) が支配的に観測され、妨害イオンピークはMALDIと比較して大幅に少なかった (図16b)。なお、m/z
345にみられるピークは、カチオン化剤に用いたNFAに由来するものである。
【0126】
図17は、GGH
(100 pmol) のSALDIマススペクトルを示す図である。FePtCu- SO3-ナノ粒子を使用した。カチオン化剤として(a) 0.1% TFA、(b) クエン酸緩衝液、(c) 0.1% NFAをそれぞれ使用した。FePtCu- SO3-ナノ粒子を用いたSALDIにおけるカチオン化剤の検討を行ったところ、NFAはクエン酸緩衝液やTFAと同様にカチオン化剤として用いることができ、カチオン化剤自体に由来するピークが少ないという特徴を持っていた (図17)。
【0127】
次に、図18は、アミトリプチリン塩酸塩(1 pmol) のマススペクトル((a) CHCAを用いたMALDI、(b) FePtCu- SO3-ナノ粒子を用いたSALDI)を示す図である。カチオン化剤は使用しなかった。ALDIマススペクトルでは、塩素が解離した[M-Cl]+イオン (m/z 278)が観測されたが、CHCAマトリックス剤に由来するピークに妨害され、帰属は困難であった (図18a)。一方、SALDIマススペクトルでは、[M-Cl]+イオン (m/z 278) に加えて、酸化体から塩素が脱離した[M-H2 -Cl]+イオン (m/z
276) も観測されたが、妨害イオンピークはMALDIと比較して大幅に少なかった (図18b)。
【0128】
最後に、図19は、デキストロメトルファン臭化水素酸塩(1 pmol) のマススペクトル((a) CHCAを用いたMALDI、(b) FePtCu- SO3-ナノ粒子を用いたSALDI)を示す図である。カチオン化剤は使用しなかった。MALDIマススペクトルでは、臭素が解離した[M-Br]+イオンと見られるピーク (m/z 272) が観測された。しかし、m/z 272は、CHCAマトリックス剤に由来するピークと考えることもでき、帰属は確定的ではない (図19a)。 一方、SALDIマススペクトルでは、[M-Br]+イオン (m/z 272) に加えて、酸化体から臭素が脱離した[M-H2 -Br]+イオン (m/z
270) も観測されたが、やはり妨害イオンピークはMALDIと比較して大幅に少なかった(図19b)。これらのことから、FePtCu- SO3-ナノ粒子を用いたSALDI-MSは、低分子医薬品化合物の検出に有効であることがわかった。
【0129】
[FePtCu- SO3-ナノ粒子のアフィニティを利用した標的分子の捕捉実験とLDI-MS]
<単一オリゴペプチドの捕捉実験とSALDI-MS>
図20は、異なるpH条件の下でGGYRの捕捉を試みたFePtCu- SO3-ナノ粒子のSALDI-MSスペクトルを示す図である。捕捉条件は(a) pH 4、(b) pH 6、(c)
pH 8、(d) pH 10であった。GGYR ([M+H]+
, m/z 452) は、pH 4, 6, 8の条件で検出することができたが (それぞれ図20a, 20b, 20c)、pH 10の条件では検出することができなかった(図20d)。
【0130】
図21は、任意のpHにおけるFePtCu- SO3-ナノ粒子とオリゴペプチドGGYRの電荷状態、およびオリゴペプチドGGYRの捕捉・抽出結果を示す図である。GGYR (pI=9.35) は、pI以下のpH 4, 6, 8では正電荷を持つことから、負帯電ナノ粒子に捕捉され、SALDI-MSで検出されたものと考えられる。一方、pI以上のpH 10ではGGYRは負電荷を持つため、負帯電ナノ粒子に捕捉されず、SALDI-MSでは検出できないと考えられる (図21)。
【0131】
{捕捉直後に回収した上清のSALDI-MS}
図22は、オリゴペプチドGGYR (1 μM ) の捕捉・抽出操作後に回収した上清のSALDIマススペクトルを示す図である。すなわち、上記のGGYRの捕捉を試みた直後に回収した上清のSALDI-MSスペクトルを示す。捕捉条件は(a) pH 4、(b) pH 6、(c) pH 8、(d)
pH 10であった。GGYR ([M+H]+, m/z 452) は、pH 4, 6, 8の条件では検出することができなかったが(それぞれ図22a, 22b, 22c)、pH 10の条件で検出することができた (図22d)。
【0132】
これらは、図20のスペクトルとは正反対の結果を示している。GGYRは、pI以上のpH 10では上清に残存し、pI以下のpH 4, 6, 8ではほぼ100
%が捕捉されたと考えられ、上記の考察を裏付けている。
【0133】
<混合オリゴペプチドの捕捉実験とSALDI-MS>
図23は、3種混合オリゴペプチド(10 μM ) の捕捉・抽出操作後に回収したFePtCu-
SO3-ナノ粒子のSALDIマススペクトルを示す図である。捕捉条件は(a) pH 2.5、(b) pH 8、(c)pH
10であった。pH 2.5では、DDDD、GGGG, およびGGYR (それぞれ[M+Na]+, [M+Na]+, [M+H]+, m/z
501, 269, 452) の全てが検出されたが、pH10では全く検出されなかった。一方、pH 8では、3種のオリゴペプチド混合物中から、GGYR (m/z 452) のみ検出されることがわかった。これは、DDDD
(pI=3.2)、GGGG (pI=6.1), GGYR (pI=9.4) の等電点 (pI) の違いにより説明される 。
【0134】
図24は、任意のpHにおけるFePtCu- SO3-ナノ粒子とオリゴペプチドの電荷状態、およびオリゴペプチド3種の捕捉・抽出結果を示す図である。つまり、pI以下のpH 2.5では3種のオリゴペプチドの全てが正電荷を持つことから、負帯電ナノ粒子に捕捉され、SALDI-MSで検出されたものと考えられる。pI以上のpH 10では全てのペプチドが負電荷を持つため、負帯電ナノ粒子に捕捉されず、SALDI-MSでは検出できないと考えられる。一方pH 8では、正電荷を持つGGYRのみが負帯電ナノ粒子に捕捉・抽出され、混合物中からGGYRのみが検出できたものと考えられる。
【0135】
<血清中のタンパク質の捕捉実験とMALDI-MS>
ヒト血清 (pH 8) に添加した卵白リゾチーム (pI=11) の捕捉実験で得られたMALDIマススペクトルについて説明する。図25は、血清中に添加した卵白リゾチーム(100 μM) のMALDIマススペクトルを示す図である。m/z 4500-15000以外はblankである。カチオン化剤としてクエン酸緩衝液を使用した。(a) 前処理なし、100 pmol (b) FePtCu- SO3-ナノ粒子を用いた捕捉・抽出後である。図26は、血清中に添加した卵白リゾチーム(10 μM) のMALDIマススペクトルを示す図である。m/z 4500-15000以外はblankである。カチオン化剤としてカチオン化剤としてクエン酸緩衝液を使用した。(a) 前処理なし、10 pmol (b) FePtCu- SO3-ナノ粒子を用いた捕捉・抽出後である。
【0136】
前処理を行わずに血清サンプルを直接塗布した場合、リゾチームはほとんど検出されなかった (図25a, 26a)。一方、FePtCu- SO3-ナノ粒子により血清中から卵白リゾチームの捕捉・抽出を行った場合、プロトンが付加した1価、2価、3価のイオン (それぞれ[M+H]+, [M+2H]2+, [M+3H]3+, m/z
14304, 7153, 4769) としてリゾチームを検出することに成功した (図25b, 26b)。血清中に多く含まれるアルブミン等の生体物質による非特異的吸着の影響を抑制しながら、リゾチームを検出できたことは、FePtCu-
SO3-ナノ粒子の高い捕捉・抽出選択能を示すものである。
【0137】
[FePtナノ粒子]
【0138】
FePtナノ粒子を用いたAng I のSALDI-MSとFePtCuナノ粒子を用いたAng I のSALDI-MSとを比較しながら説明する。
【0139】
試料としてAng I(アンジオテンシンI)を、カチオン化剤としてクエン酸/クエン酸アンモニウムを使用した。マトリックスとしてはFePtナノ粒子(又はFePtCuナノ粒子)をSDSなしで合成したものを使用した。FePtナノ粒子の場合は5.6mg/mLであり、FePtCuナノ粒子5mg/mLであった。
【0140】
プレートにAng(10 μM Ang I ×0.5 μL = 5 pmol)を滴下し、乾燥した。続いてFePtナノ粒子(又はFePtCuナノ粒子)(5 mg/mL× 0.5 μL)を滴下、乾燥した。
【0141】
図27及び図28は、FePtナノ粒子を用いたAng
I のSALDIマススペクトルとFePtCuナノ粒子を用いたAng I のSALDIマススペクトルとを示す図である。FePtナノ粒子を用いた場合とFePtCuナノ粒子を用いた場合とでは分子量1296.5に同等レベルのピーク強度が観察された。FePtナノ粒子を用いた場合のほうが、FePtCuナノ粒子を用いた場合よりも低分子量域の不純物ピークが大きいことがわかった。
【0142】
これらのことから、上述のFePtCu合金ナノ粒子と同様に、例えば、FePt- SO3-ナノ粒子としてチオール基を介してFePtナノ粒子の表面にスルホン酸を修飾すれば、正電荷を持つオリゴペプチドとリゾチームなどを混合試料中から選択的に捕捉・抽出し、SALDI/MALDI-MSで検出することが可能であると考えられる。
【0143】
また、上述のFePtCuに比べFePtのほうが、 FeとPt の化学組成が均一な粒子が合成できる点で優れている。同様に、表面修飾したFePtCuに比べ表面修飾したFePtのほうが、 Cuの酸化によってチオール表面修飾が困難となるという問題がないため、表面修飾がしやすい点で優れている。
【0144】
[用途]
【0145】
プロテオーム解析、メタボロミクス解析への応用が有望視される。特に、サンプルに含まれる低分子化合物を網羅的に解析し、ある条件下で生体内はどのような変化を起こすかを調べるメタボロミクス解析では、低分子領域で妨害イオンピークが少ない上述の技術が有効である。
【0146】
なお、SDS-PAGEや二次元電気泳動による分離操作と組み合わせて使用することも可能である。特にこのように分離したものをプレート上に塗布もしくは転写することで、分離された物質をマッピングすることができる。試料を効率よく捕捉でき、場所による感度の大きな違い(いわゆるスイートスポット)を抑えることができるため、こうした物質の位置を知ることのできるマッピング法にも有効である。大気圧下で測定を行うAP-LDIにも転用することも考えられる。
【0147】
[まとめ]
【0148】
本発明者らは、保護剤の存在下/非存在下の条件でFePtCu合金ナノ粒子を合成し、保護剤の非存在下の条件で合成したFePtCuナノ粒子などは、チオールスルホン酸で表面修飾することで負電荷を付与することができた (例えばFePtCu- SO3-ナノ粒子)。FePtCu- SO3-ナノ粒子などを用いて、正電荷を持つオリゴペプチドとリゾチームなどを混合試料中から選択的に捕捉・抽出し、SALDI/MALDI-MSで検出することができた。また、FePt合金ナノ粒子を同様に合成し、FePt合金ナノ粒子を表面修飾することによりSALDI/MALDI-MSで検出することができることを十分に裏付ける結果を得た。
【0149】
[権利解釈など]
【0150】
以上、特定の実施形態を参照しながら、本発明について説明してきた。しかしながら、本発明の要旨を逸脱しない範囲で当業者が実施形態の修正又は代用を成し得ることは自明である。すなわち、例示という形態で本発明を開示してきたのであり、本明細書の記載内容を限定的に解釈するべきではない。本発明の要旨を判断するためには、冒頭に記載した特許請求の範囲の欄を参酌すべきである。
【0151】
また、この発明の説明用の実施形態が上述の目的を達成することは明らかであるが、多くの変更や他の実施例を当業者が行うことができることも理解されるところである。特許請求の範囲、明細書、図面及び説明用の各実施形態のエレメント又はコンポーネントを他の1つまたは組み合わせとともに採用してもよい。特許請求の範囲は、かかる変更や他の実施形態をも範囲に含むことを意図されており、これらは、この発明の技術思想および技術的範囲に含まれる。
【技術分野】
【0001】
本発明は、試料捕捉合金、質量分析装置、質量分析方法、試料捕捉方法、試料捕捉合金、試料捕捉合金製造方法に関する。
【背景技術】
【0002】
質量分析法は、試料の質量電荷比(質量を電荷の数で割った値)を求めるときに使用される手法である。質量分析法では、測定対象をイオン化し、その質量電荷比(m/z)の違いによってイオンを分離し、検出する。
【0003】
物質にレーザー光を照射すると、物質が光を吸収して光電子移動が進行し、イオン化される。この直接的なレーザー照射によるイオン化法をレーザー脱離イオン化法(Laser Desorption / Ionization、LDI)という。しかし、LDIでは物質の種類によっては効率的な電子移動が行われず、試料がレーザーでダメージを受けてしまうという欠点があった。
【0004】
そこで、測定試料にイオン化補助剤(マトリックス剤)を混合して、レーザー光(例えば波長:337nm)を当てることにより、マトリックス剤が光を吸収し、照射箇所で急激な温度上昇が生じ、試料分子を分解せずにイオン化(ソフトイオン化)する手法がこれまで広く検討されてきた。この手法は、マトリック支援レーザー脱離イオン化質量分析法(MALDI(Matrix Assisted Laser Desorption / Ionization)-MS)と呼ばれる技術である。
【0005】
[MALDI-MS]
【0006】
田中らおよびHillenkampらが開発したマトリックス支援レーザー脱離イオン化法(非特許文献1、2参照)は、熱に不安定な物質や高分子量物質のソフトなイオン化が可能であり、生体高分子・合成高分子・金属錯体などの物質の分子量測定に用いられてきた(非特許文献3、4、5、6参照)。MALDI測定では、マトリックスと呼ばれるUVレーザー光を吸収する低分子量の有機分子と目的試料の混合結晶をプレート上に作成する必要がある。MALDIでは対象のサンプルに対して適切なマトリックスを選択することが重要となる。使用するレーザー光を高効率で吸収するもの、塩基性化合物にはプロトンドナーとして、酸性化合物にはプロトンアクセプターとして作用するものが選ばれる。低分子量サンプルのとき、マトリックス由来のピークとサンプル由来のピークが重ならないようにする。以上のことなどを考慮してマトリックスを選択する必要がある。
【0007】
また、MALDIでは、マトリックスの分子イオンおよびそのクラスターイオンがスペクトル中の低分子量領域に強い強度で観測されるため、低分子量の試料測定ではこれらのイオンが妨害になって、解析が困難になる場合がある。また、対象化合物が混合物のときには、対象化合物以外の試料による妨害やイオン化の抑制が起こり、検出が困難となる場合がある(イオンサプレッション)。このような背景から、近年、有機マトリックスを用いないLDI-MSが注目されている。
【0008】
[SALDI-MS]
【0009】
安定な無機ナノ粒子を利用したレーザー脱離イオン化法は、
Tanakaら(非特許文献7参照)によって初めて報告された。30 nmのコバルトナノ粒子と液体マトリックスであるグリセロール溶液とを混合することによって、タンパク質リゾチームの質量分析に成功した。続いて、Sunnerら(非特許文献8参照)は、グリセロールと混ぜた2−150 μmグラファイト粒子をマトリックスとして用いたレーザー脱離イオン化法を提案し、それを表面支援レーザー脱離イオン化法(surface-assisted laser desorption/ionization: SALDI)と名付けた。Kinumiらは、様々な無機微粒子を用いたSALDI−MSを報告している(非特許文献9参照)。無機微粒子を用いたレーザー脱離イオン化の機構は十分明らかではないが、一つのモデルとして「急速加熱条件で高温に到達させる」ことが試料を分解せずに昇化させるのに重要であると、提案されている(非特許文献7、10、11参照)。
【0010】
近年、カーボンナノチューブ(非特許文献12、13参照)、シリコンナノ粒子(非特許文献14参照)、及び金ナノ粒子(非特許文献15-22参照)などのナノ粒子を担持した基板を用いたSALDIが注目されている。これらは、液体マトリックスであるグリセロールを用いないのが特徴であり、Dry-SALDI-MSとも呼ばれている。
【0011】
McLeanらは2-10 nm程度の金ナノ粒子を利用して、ペプチド(substance P)試料を壊さないでイオン化している(非特許文献15参照)。これは、金ナノ粒子にパルスレーザー(N2レーザー337 nm)が照射され、局所的に温度が急速上昇し、ペプチドなどの試料分子が分解されずにソフトイオン化されるものである。試料のイオン化効率は金ナノ粒子の粒子サイズに依存し、10-20nm程度の粒子がよいとされている。金ナノ粒子との特異相互作用を利用したターゲット分子の選択的イオン化や(非特許文献16、17参照)、尿中のグルコースの定量分析の研究がある(非特許文献18参照)。また、金ナノ粒子表面に吸着した有機物質が優先的にイオン化されることから、ナノ粒子表面の吸着物質の分析にSALDI-MSが利用されている(非特許文献19、20参照)。このように金ナノ粒子を用いたSALDI-MS(Au-SALDI-MS)は、簡便性、粒子当たりの高いイオン化効率、及び粒子表面吸着物の選択的イオン化が可能などの利点がある。しかし、Au-SALDIには幾つかの課題も残されている。例えば、ナノサイズ効果によって金ナノ粒子の融点が減少するために、レーザー照射によって生じる金クラスターイオンが妨害イオンピークとして低分子量域に出現する。また、Au-SALDIでは、一般的に、金コロイドを滴下乾燥させた基板をイオン化基板として用いるが、その乾燥過程で金ナノ粒子が凝集し、その凝集状態が試料のイオン化効率や再現性に影響を与えることがある。このような観点から、Au-SALDIで塗布する金コロイドの濃度や塗布方法がイオン化効率に及ぼす影響について検討されている(非特許文献21参照)。
【0012】
白金(Pt)ナノ粒子を利用したSALDI-MSも検討されている。Au金属に比べ、Pt金属は融点が2045 Kと大きくかつ熱伝導度が小さいので、レーザー照射によって局所的に温度が最も高くなる。そのために脱離イオン化が促進されると期待できる。Yonezawaらは、白金ならではの特徴を生かした上に、花びら状の突起を表面に有した白金ナノ粒子 (ナノフラワーと呼ぶ) を新規に合成した。そして、白金ナノフラワーのSALDI-MSへの展開を行っている(非特許文献23参照)。白金ナノフラワーを利用した4つの典型的なペプチドサンプルのイオン化を行い、いずれの場合も、高感度で検出している。また、白金ナノフラワーを利用して分子量10,000以上のcytochrome Cのソフトイオン化にも成功している。白金ナノフラワーを用いたSALDIは、通常の球状白金ナノ粒子や蒸着白金基板に較べて、感度が極めて向上し、高分子量のペプチドまで検出できる。これは、白金ナノフラワーの花びら状の突起形状が、ペプチドの高感度、高分子量検出に作用していることを示す。これは、ナノ粒子のSALDIへの応用では、粒子の形態制御も試料のイオン化効率を上げるのに有効であることを示す。
【0013】
[ナノ粒子のアフィニティを利用したLDI-MS]
【0014】
生体分子混合溶液の中から特定の試料を分離・抽出・除去する目的で、磁性粒子(Magnetic Beads)による磁気分離が利用されている。Chenらは、磁性ナノ粒子の磁性分離をSALDI-MSへ展開している(非特許文献24、25参照)。酸化鉄ナノ粒子表面にゾル−ゲル反応によりチタニア薄膜コートしたFe3O4/TiO2ナノ粒子を合成し、SALD-MSへの有効性を実証した。生物分析化学領域では、タンパク質を酵素分解して得られるリン酸化ペプチドを選択的に濃縮することが重要な研究課題となっている。β-カゼイン消化物からのペプチド混合物試料溶液と、このナノ粒子を試験管の中で混合し、試験管の外壁に磁石を接して、ナノ粒子表面上に吸着したリン酸化ペプチドを磁性分離している。この磁性ナノ粒子を、そのままSALD-MSへ利用することにより、ペプチド混合物中のリン酸化ペプチドを高感度に検出している。本手法では、チタニア薄膜とリン酸化ペプチド間のケモアフイニティを利用して、試料をナノ粒子表面に濃縮し、それを“直接”SALDI-MSで高感度に検出できる。これにより、通常の溶媒抽出などの煩雑な分離操作を行うことなく、粒子表面に吸着した物質を直接、検出できる利点を持つ。一方、ゾル−ゲル反応などのカップリング剤による表面修飾では、チオール表面修飾に比べ、単一分子層の均一な修飾が困難なことや、導入できる官能基の種類が少ない。
【0015】
尿や血清中に含まれる生体由来の物質で、生体内の生物学的変化を定量的に把握するための指標となるものはバイオマーカーと呼ばれる。バイオマーカーは、ある特定の疾病や体の状態に相関して量的に変化するために、その量を測定することで疾病の診断や効率的な治療法の確立等が可能となる。ただし、ヒトの生態の複雑さと疾病の多因子性のため、単一のバイオマーカーだけに基づいて疾病を予測することは難しい。そこで、複数のバイオマーカーを同時にスクリーニングできる多重免疫測定の開発が急がれている。Wangらは、抗体を結合させた磁性ナノ粒子を用いて、血清中のバイオマーカーを濃縮し、MALDI-TOF
MSによる同定と定量を行う多重免疫検定を行っている(非特許文献26参照)。
【0016】
【非特許文献1】P. Pelagatti, M. Carcelli, F. Calbiani,C. Cassi, L. Elviri, C. Pelizzi, U. Rizzotti, D. Rogolino. Transfer Hydrogenation ofAcetophenone Catalyzed by Half-Sandwich Ruthenium(II) Complexes ContainingAmino Amide Ligands. Detection of the Catalytic Intermediates by ElectrosprayIonization Mass Spectrometry. Organometallics., 2005; 24: 5836-5844.
【非特許文献2】L. A. Paim, D. V. Augusti, D. Ilza, T.M. A. Alves. R. Augusti, H. G. L. Siebald. Electrospray ionization and tandemmass spectrometry characterization of novel heterotrimetallic Ru(η5-C5H5)(dppf)SnX3 complexes andtheir heterobimetallic Ru(η5-C5H5)(dppf)X precursors. Polyhedron.,2005; 24: 1153-1159.
【非特許文献3】G. Bhaskar, M. A. Chary, M. K. Kumar, K. Syamasundar, M. Vairamani,S. Prabhakar. Electrosprayionization studies of transition-metal complexes of2-acetylbenzimidazolethiosemicarbazone using collision-induced dissociation andion-molecule reactions. Rapid Commun. Mass Spectrometry., 2005; 19:1536-1544.
【非特許文献4】G. Maerkl, K. Gschwendner, I. Roetzer, P.Kreitmeier. Tetrakis(diethyl phosphonate), tetrakis(ethyl phenylphosphinate)-,tetrakis(diphenylphosphine oxide)- substituted phthalocyanines. HelveticaChimica Acta., 2004; 87: 825-844.
【非特許文献5】H. Takeda, A. Kawasaki, M. Takahashi, A. Yamada,T. Koike. Matrix-assisted laser desorption/ionization time-of-flight massspectrometry of phosphorylated compounds using a novel phosphate capturemolecule. Rapid Commun. Mass Spectrometry., 2003; 17: 2075-2081.
【非特許文献6】J. E. Ham, B. Durham, J. R. Scott. Comparison ofLaser Desorption and Matrix-Assisted Laser Desorption/Ionization for Rutheniumand Osmium Trisbipyridine Complexes Using Fourier Transform Mass Spectrometry. J.Am. Soc. Mass Spectrom., 2003; 14: 393-400.
【非特許文献7】K. Tanaka, H. Waki, Y. Ido, S. Akita, Y. Yoshida,T. Yoshida: Rapid Commun. Mass Spectrom., 2, 151 (1988).
【非特許文献8】D.S. Peterson: Mass Spectrom. Rev., 26, 19(2007).
【非特許文献9】T. Kinumi, T. Saisu, M. Takayama, H. Niwa: J.Mass Spectrom., 35,417 (2000).
【非特許文献10】M. Schu1renberg, K. Dreisewerd, F. Hillenkamp: Anal.Chem., 71, 221(1999).
【非特許文献11】島津製作所 田中耕一記念 質量分析研究所、”MADI-MS Technical Reports“ ,Rev.:29/Jun/2007.
【非特許文献12】S.Y. Xu, Y. F. Zou, J. S. Qiu, Z. Guo, B. C.Guo: Anal. Chem., 75,6191 (2003).
【非特許文献13】M.V. Ugarov, T. Egan, D.V. Khabashesku, J. A.Schultz, H. Peng, V. N. Khabashesku, H. Furutani, K. S. Prather, H. W. J. Wang,S. N. Jackson , A. S. Woods: Anal. Chem., 76, 6734 (2004).
【非特許文献14】X. Wen, S. Dagan, V. H. Wysocki: Anal. Chem.,79, 434 (2007).
【非特許文献15】J. A. McLean, A. A. Stumpo, D. H. Russell: J.Am. Chem. Soc., 127, 5304 (2005).
【非特許文献16】Y. F. Huang, H. T. Chang: Anal. Chem., 78, 1485 (2006).
【非特許文献17】Y. F. Huang, H. T. Chang: Anal. Chem., 79, 4852 (2007).
【非特許文献18】C. L. Su, W. L. Tseng: Anal. Chem., 79, 1626 (2007).
【非特許文献19】H. Kawasaki, T. Yonezawa, K. Nishimura, R.Arakawa: Chem. Lett., 36, 1038 (2007).
【非特許文献20】H. Kawasaki, M. Uota, T. Yoshimura, D. Fujikawa,G. Sakai, R. Arakawa, T. Kijima:Langmuir, 23, 11540(2007).
【非特許文献21】H-P. Wu, C-L. Su, H-C. Chang, W-L. Tseng: Anal. Chem., 79, 6215 (2007).
【非特許文献22】A. Tarui, H. Kawasaki, T. Taiko, T. Watanabe, T.Yonezawa, R. Arakawa: Journal of Nanoscience and Nanotechnology, inpress(2008).
【非特許文献23】H. Kawasaki, T. Yonezawa, T. Watanabe, R. Arakawa:J. Phys. Chem. C, 11,16278 (2007).
【非特許文献24】C-T. Chen, Y-C. Chen: Anal. Chem., 77, 5912 (2005).
【非特許文献25】W-Y. Chen, Y-C. Chen: Anal. Bioanal. Chem.,386, 699 (2006).
【非特許文献26】Kai-Yi Wang, Szu-An Chuang, Po-Chiao Lin, Li-ShingHuang, Shu-Hua Chen, Saib Ouarda, Wen-Harn Pan, X Ping-Ying Lee, O Chun-ChengLin, Yu-Ju Chen: Anal. Chem., 80, 6159-6167 (2008)
【発明の概要】
【発明が解決しようとする課題】
【0017】
本発明は、上述の背景技術に鑑みてなされたものであり、試料を高い効率で捕捉できる試料捕捉合金などを提供することを目的とする。
【課題を解決するための手段】
【0018】
この発明によれば、上述の目的を達成するために、特許請求の範囲に記載のとおりの構成を採用している。以下、この発明を詳細に説明する。
【0019】
本発明の第1の側面は、
表面が修飾され、
Fe、Pt及びCuを含有し、
試料を捕捉することを特徴とする試料捕捉合金
にある。
【0020】
本構成によれば、試料を高い効率で捕捉できる試料捕捉合金が得られる。
【0021】
なお、表面修飾には、スルホン酸による表面修飾のほか、アミン、カルボン酸、芳香族、炭化水素、炭化フッ素による方法を例として挙げることができる。また、表面修飾はチオール基を介する場合のほか、アミノ基、ホスフィン基、カルボキシル基などを介する方法を例として挙げることができる。これらの点は、下記のFePtCu合金だけでなく、FePt合金でも同様である。
【0022】
本発明の第2の側面は、
表面が修飾されることで電荷が付与されていることを特徴とする請求項1記載の試料捕捉合金
にある。
【0023】
本構成によれば、電荷により試料をより高い効率で捕捉できる試料捕捉合金が得られる。
【0024】
本発明の第3の側面は、
チオール基を結合しており、前記チオール基を介して表面が修飾されていることを特徴とする請求項1記載の試料捕捉合金
にある。
【0025】
本構成によれば、チオール基で表面修飾されていることからさらに他の置換基の導入が容易な試料捕捉合金が得られる。
【0026】
本発明の第4の側面は、
スルホン酸で表面が修飾されていることを特徴とする請求項1記載の試料捕捉合金
にある。
【0027】
本構成によれば、高い選択性を有する試料捕捉合金が得られる。
本発明の第5の側面は、
レーザーを照射することで捕捉した試料のイオン化を支援することを特徴とする請求項1記載の試料捕捉合金
にある。
【0028】
本構成によれば、試料を効率よく捕捉でき、イオン化までの効率も高くできる。
【0029】
本発明の第6の側面は、
表面支援レーザー脱離イオン化法で捕捉した試料のイオン化を支援することを特徴とする請求項5記載の試料捕捉合金
にある。
【0030】
本構成によれば、低分子量の試料のイオン化にも適する試料捕捉合金が得られる。
【0031】
本発明の第7の側面は、
請求項1から請求項6までのいずれかに記載の前記試料捕捉合金を装着したことを特徴とする質量分析装置
にある。
【0032】
本発明の第8の側面は、
請求項1から請求項6までのいずれかに記載の試料捕捉合金により補足した試料の質量分析を行うことを特徴とする質量分析方法
にある。
【0033】
本発明の第9の側面は、
表面が修飾され、Fe、Pt及びCuを含有する合金によって試料を捕捉することを特徴とする試料捉方法
にある。
【0034】
本構成によれば、試料を高い効率で捕捉できる方法が得られる。
【0035】
本発明の第10の側面は、Fe、Pt及びCuを含有し、チオール基を介してSO3-基が表面に結合しており、試料を捕捉することを特徴とする試料捕捉合金にある。
【0036】
本構成によれば、高い効率で試料を捕捉することができる試料捕捉合金が得られる。
【0037】
本発明の第11の側面は、Fe、Pt及びCuを含有する合金にチオール基を介して表面修飾を行うことを特徴とする試料捕捉合金製造方法にある。
【0038】
本構成によれば、シンプルな方法で、高い効率で試料を捕捉することができる試料捕捉合金が得られる。
【0039】
本発明の第12の側面は、Fe及びPtから実質的になり、試料を捕捉することを特徴とする試料捕捉合金にある。
【0040】
本構成によれば、優れた捕捉能力を持つ試料捕捉合金が得られる。
【0041】
ここで、実質的とは、Cuなどの他の元素をその合金の物性に大きな影響を与えるほど含まないことをいう。
【0042】
本発明の第13の側面は、
表面が修飾されていることを特徴とする請求項12記載の試料捕捉合金
にある。
【0043】
本構成によれば、試料をより高い効率で捕捉できる試料捕捉合金が得られる。
【0044】
本発明の第14の側面は、
Fe及びPtから実質的になり、
チオール基を介してSO3-基が表面に結合しており、
試料を捕捉することを特徴とする試料捕捉合金
にある。
【0045】
本構成によれば、高い効率で試料を捕捉することができる試料捕捉合金が得られる。
【0046】
なお、本明細書において、イオン化支援とは、レーザーが照射されることによって捕捉対象となる試料の脱離(気化)とイオン化の両方を支援することをいい、その目的を達するものであれば粒径などの大きさを問わない。合金には、例えば、微細粉、微粒子、後述するナノ粒子などが含まれる。微細粉の1次粒子のサイズ(直径)は、例えば、1 nm以上1μm以下、望ましくは5 nm以上600 nm以下、さらに望ましくは5 nm以上300 nm以下とするのが好ましい。また、2次凝集しているものも含まれる。さらに、微細粉よりも大きな構造体のうち、上述の大きさの突起部分を有する構造体でもよい。例えば、突起物が3nm以上300 nm以下、望ましくは5nm以上200 nm以下の大きさのものをもつ構造体が考えられる。
【発明の効果】
【0047】
本構成によれば、試料を高い効率で捕捉できる試料捕捉合金などが得られる。
【0048】
本発明のさらに他の目的、特徴又は利点は、後述する本発明の実施の形態や添付する図面に基づく詳細な説明によって明らかになるであろう。
【図面の簡単な説明】
【0049】
【図1】薬物試料の化学構造、分子量、酸解離定数を示す図である。
【図2】オリゴペプチド試料の化学構造、分子量、等電点を示す図である。
【図3】Gly-Gly-His、およびノナフルオロブタンスルホン酸の化学構造、分子量を示す図である。
【図4】FePtCu-SO3-ナノ粒子を用いた標的分子の捕捉・抽出手順の概略を示す図である。
【図5】保護剤SDSの存在下で合成されたFePtCuナノ粒子のFE-SEM写真(25000倍)を示す図である。
【図6】保護剤SDSの存在下で合成されたFePtCuナノ粒子の構成元素((X) の拡大範囲(25、000倍) におけるEDXスペクトル)を示す図である。
【図7】保護剤SDSの存在下で合成されたFePtCuナノ粒子の元素分布((X) の拡大範囲(25、000倍) における(a) Fe、(b) Pt、(c) Cu の元素分布)を示す図である。
【図8】保護剤の非存在下で合成されたFePtCuナノ粒子のFE-SEM写真((a) 25000倍、(b) (a)の左側大きな粒子付近、50000倍、(c) (a)の中央部の小さな粒子付近、50000倍)を示す図である。
【図9】保護剤の非存在下で合成されたFePtCuナノ粒子のTEM写真(100000倍)を示す図である。
【図10】保護剤の非存在下で合成されたFePtCuナノ粒子の構成元素((X) の拡大範囲(25000倍) における(a) EDXスペクトルと(b) 定量分析)を示す図である。
【図11】保護剤の非存在下で合成されたFePtCuナノ粒子の元素分布((X) の拡大範囲(25000倍) における(a) Fe、(b) Pt、(c) Cu の元素分布(d) Fe、(e) Pt、(f) Cuの元素質量分布)を示す図である。
【図12】FT-IR (ATR) スペクトル((a) 表面修飾前のFePtCuナノ粒子、(b) HSCH2CH2SO3Na表面修飾後のFePtCuナノ粒子、(c) HSCH2CH2SO3Na粉末)を示す図である。
【図13】アンギオテンシンI(10 fmol) のSALDIマススペクトルを示す図である。
【図14】インスリンヒト(5 pmol) のSALDIマススペクトルを示す図である。
【図15】チトクロームC (5 pmol) のSALDIマススペクトルを示す図である。
【図16】カフェイン(100 pmol) のマススペクトルを示す図である。
【図17】GGH (100 pmol) のSALDIマススペクトルを示す図である。
【図18】アミトリプチリン塩酸塩(1 pmol) のマススペクトルを示す図である。
【図19】デキストロメトルファン臭化水素酸塩(1 pmol) のマススペクトルを示す図である。
【図20】オリゴペプチドGGYR (1 μM ) の捕捉・抽出操作後に回収したFePtCu-SO3-ナノ粒子のSALDIマススペクトルを示す図である。
【図21】任意のpHにおけるFePtCu- SO3-ナノ粒子とオリゴペプチドGGYRの電荷状態、およびオリゴペプチドGGYRの捕捉・抽出結果を示す図である。
【図22】オリゴペプチドGGYR (1 μM ) の捕捉・抽出操作後に回収した上清のSALDIマススペクトルを示す図である。
【図23】3種混合オリゴペプチド(10 μM ) の捕捉・抽出操作後に回収したFePtCu-SO3-ナノ粒子のSALDIマススペクトルを示す図である。
【図24】任意のpHにおけるFePtCu- SO3-ナノ粒子とオリゴペプチドの電荷状態、およびオリゴペプチド3種の捕捉・抽出結果を示す図である。
【図25】血清中に添加した卵白リゾチーム(100 μM) のMALDIマススペクトルを示す図である。
【図26】血清中に添加した卵白リゾチーム(10 μM) のMALDIマススペクトルを示す図である。
【図27】FePtナノ粒子を用いたAng I のSALDIマススペクトルとFePtCuナノ粒子を用いたAng I のSALDIマススペクトルとを示す図である。
【図28】FePtナノ粒子を用いたAng I のSALDIマススペクトルとFePtCuナノ粒子を用いたAng I のSALDIマススペクトルとを示す図である。
【発明を実施するための形態】
【0050】
以下、本発明の実施の形態について図面を参照しながら詳細に説明する。
【0051】
[概要]
【0052】
本発明者らは、アフィニティ機能を有する無機マトリックスとしてFePtCuナノ粒子 (鉄・白金・銅から構成される合金ナノ粒子)などを合成し、ナノ粒子のアフィニテイ分離を利用した SALDI-MSの開発・研究を行った。このFePtCuナノ粒子などは、合金化により、単独の金属ナノ粒子と比較して高いイオン化効率を有し、さらに、チオール基などによる表面修飾により、標的分子と相互作用する様々な官能基を導入することができる。混合物中から粒子表面に標的分子を捕捉し、FePtCuナノ粒子などの持つ磁性、あるいは簡易遠心を利用した分離・抽出することが可能となる。さらに、粒子表面に捕捉した標的分子をSALDI-MSで同定することができる。これらの特徴を活かすため、FePtCuナノ粒子などを強電解質であるチオールスルホン酸で表面修飾し、pHに依存しない負の表面電荷を付与した (例えばFePtCu- SO3-ナノ粒子)。また、正電荷を持つ低分子量のオリゴペプチドや高分子量のタンパク質を静電的に捕捉・抽出し、それらをSALDI/MALDI-MSなどで検出できることを実証した。
【0053】
[本発明に至る経緯、背景]
【0054】
本発明者らは、合金化したFePtCuナノ粒子を用いることで、単独の金属ナノ粒子と比較して高いイオン化効率の実現を図ることを目標としていた(下記の非特許文献参照)。
【0055】
【非特許文献27】第56回質量分析総合討論会(2008)講演要旨集246-247
【0056】
本発明者らは、さらなる進歩を実現するため、FePtCuナノ粒子などをチオールによって表面修飾し、チオール末端と相互作用する標的分子の捕捉・抽出を試みた。先行研究として、Benjaminらは、カルボキシル基を末端に持つアルカンチオールで金ナノ粒子を表面修飾することで負に帯電させた金ナノ粒子を用いて、正の電荷を持つペプチドを粒子表面に捕捉・抽出し、MALDI-MSでその捕捉したペプチドを検出している(下記の非特許文献参照)。
【0057】
【非特許文献28】Benjamin N. Y. Vanderpuije, Gang Han, Vincent M.Rotello, Richard W. Vachet: Anal. Chem.78 (2006) 5491-5496
【0058】
しかしながら、pH 6以下の条件においては、カルボキシル基はほとんど解離しないため、その負電荷は失われ、静電的なアフィニティを利用することが困難になるという使用できるpHの制限がある。また、MALDI法を用いているために、マトリックスの影響で医薬品などの低分子化合物の測定は困難である。
【0059】
そこで、本研究では、FePtCu-SO3-ナノ粒子のアフィニティを利用したLDI-MSの開発・研究を行った。FePtCuナノ粒子などを新規に合成し、強電解質であるチオールスルホン酸で表面修飾を行い、pHに依存しない負の表面電荷を付与した (例えばFePtCu- SO3-ナノ粒子)。このFePtCu- SO3-ナノ粒子をSALDIの無機マトリックスとして用いることにより、混合試料から正の電荷を持つ低分子量オリゴペプチドを静電的に捕捉・抽出し、それらをSALDI-MSのサンプルとして検出することを目標とした。また、多くの夾雑物を含む血清中から塩基性タンパク質をFePtCu- SO3-ナノ粒子で捕捉し、それをMALDI-MSで検出することも検討した。
【0060】
次に、実際に行った実験について説明する。
【0061】
[試薬]
【0062】
塩化鉄(II) (FeCl2・4H2O)、塩化白金(IV)酸 (H2PtCl6・H2O)、硫酸銅五水和物(II) (CuSO4・5H2O)、ヒドラジン一水和物 (N2H4・H2O)、0.1 M 塩酸 (容量分析用)、25 %アンモニア水、クエン酸 (無水)、ノナフルオロブタンスルホン酸
(NFA)、トリフルオロ酢酸 (TFA)、ドデシル硫酸ナトリウム (CH3(CH2)11OSO3Na, SDS)、アンギオテンシンI、インスリンヒト (組み替え体)、カフェイン (無水)、デキストロメトルファン臭化水素酸塩一水和物、リゾチーム塩酸塩 (ニワトリ卵白由来) 、エタノール
(EtOH、99.5%、特級)、メタノール (MeOH、HPLC用)、アセトニトリル (MeCN、特級)、アセトン (特級)、テトラヒドロフラン (THF、有機合成用、安定剤含有) は和光純薬工業から購入した。蒸留水 (LC-MS用) は関東化学から購入した。また、蒸留水は蒸留水製造装置 (RFD250NB,
ADVANTEC) から得た。チトクロームC (ウマ心臓由来)
はCalbiochemから購入した。Gly-Gly-Tyr-Arg
(GGYR) 、Gly-Gly-His (GGH) はペプチド研究所から購入した。クエン酸二アンモニウムはFlukaから購入した。2-メルカプトエタンスルホン酸ナトリウム (HSCH2CH2SO3Na)、Gly-Gly-Gly-Gly (GGGG)は東京化成工業から購入した。α-シアノ-4-ヒドロキシ桂皮酸 (CHCA)、Asp-Asp-Asp-Asp (DDDD)、アミトリプチリン塩酸塩はSigma Aldrichから購入した。ヒト血清はCHEMICON
Internationalから購入した。
【0063】
図1は、薬物試料の化学構造、分子量、酸解離定数を示す図である。カフェイン、アミトリプチリン塩酸塩、デキストロメトルファン臭化水素酸塩の化学構造、分子量、酸解離定数を示す。
図2は、オリゴペプチド試料の化学構造、分子量、等電点を示す図である。Asp-Asp-Asp-Asp
(DDDD), Gly-Gly-Gly-Gly (GGGG), Gly-Gly-Tyr-Arg (GGYR) の化学構造, 分子量, 等電点 (pI) を示す。pI値は、http://mobyle.pasteur.fr/cgi-bin/MobylePortal/portal.py?form=pepstatsの計算プログラムを使用して得た。図3は、Gly-Gly-His(GGH)、およびノナフルオロブタンスルホン酸の化学構造、分子量を示す図である。
【0064】
[FePtCu合金ナノ粒子の合成]
<保護剤SDSの存在下におけるFePtCu合金ナノ粒子の合成>
【0065】
0.8 mmol FeCl2・4H2O、0.8 mmol H2PtCl6・H2O、0.192 mmol CuSO4・5H2O、および1.6 mmol SDSを蒸留水 (40
mL, 70 °C) に溶解し、それぞれ20 mM、20 mM、4.8 mM、40 mMの濃度とした(下記の非特許文献参照)。ここで生成したFeとSDSの錯体は、40 mM N2H4 (10 mL, 0.4 mmol N2H4・H2Oを蒸留水に溶解) を少量ずつ加えて溶解した。これに、390 mM N2H4 (40 mL, 70 °C, 15.6 mmol N2H4・H2Oを水に溶解)を激しく撹拌しながら (530〜 rpm, 磁石撹拌子を使用) 素早く加え、還元した。反応は数秒で進行し、その後は70 °Cで3時間還流・撹拌を続けた。自然冷却の後、遠心分離し (4000 rpm, 15 min, KUBOTA3200)、上清を廃棄した。なお、還元剤は、水素化ホウ素ナトリム、水素化ホウ素リチウムでもよい。
【0066】
【非特許文献29】P. Gibot, E. Tronc, C. Chaneac, J.P. Jolivet, D.Fiorani, A.M. Testa: J. Magn. Magn. Mater. 290-291 (2005) 555-558
【0067】
残ったFePtCuナノ粒子の沈殿にMeOH (〜8 mL) を加え、超音波を照射 (〜3 min) することで分散させた。撹拌 (〜3 min) と遠心分離 (4000
rpm, 15 min, KUBOTA3200) の後、上清を廃棄した。続いて、残ったFePtCuナノ粒子の沈殿に蒸留水 (〜8 mL) を加え、超音波を照射
(〜3 min) することで分散させた。撹拌 (〜3 min) と遠心分離 (4000 rpm、15 min、KUBOTA3200) の後、上清を廃棄した。以上の洗浄は5周行った。最後に、FePtCuナノ粒子を減圧乾燥して粉末とし、常温で保存した。
【0068】
<保護剤の非存在下におけるFePtCu合金ナノ粒子の合成>
2 mmol FeCl2・4H2O、2 mmol H2PtCl6・H2O、および0.48 mmol CuSO4・5H2Oを蒸留水 (100 mL, 70 °C) に溶解し、それぞれ20 mM、20 mM、4.8 mMの濃度とした。これに、400 mM N2H4 (100 mL, 70 °C, 40 mmol N2H4・H2Oを水に溶解) を激しく撹拌しながら (530〜 rpm, 磁石撹拌子を使用) 素早く加え、還元した。反応は数秒で進行し、その後は70 °Cで3時間還流・撹拌を続けた。自然冷却の後、上清を廃棄した。
【0069】
残ったFePtCuナノ粒子の沈殿にEtOH (〜8 mL) を加え、超音波を照射 (〜3 min) することで分散させた。撹拌 (〜3 min) と遠心分離 (4000
rpm, 5 min, KUBOTA3200) の後、上清を廃棄した。続いて、残ったFePtCuナノ粒子の沈殿に蒸留水 (〜8 mL) を加え、超音波を照射
(〜3 min) することで分散させた。撹拌 (〜3 min) と遠心分離 (4000 rpm、5 min、KUBOTA3200) の後、上清を廃棄した。以上の洗浄は3周行った。最後に、FePtCuナノ粒子を減圧乾燥して粉末とし、常温で保存した。
【0070】
[FePtCu合金ナノ粒子の構造評価]
【0071】
FePtCuナノ粒子は、電界放射型走査電子顕微鏡 (Field Emission Scanning
Electron Microscope, FE-SEM)、および透過型電子顕微鏡 (Transmission
Electron Microscope, TEM, JEOL) によりサイズと形状を確認し、エネルギー分散型X線分光 (Energy Dispersive X-ray Spectroscopy, EDX) により構成元素を確認した (FE-SEMおよびEDXは東京大学大学院 米澤徹先生に測定を依頼した)。
【0072】
[チオールスルホン酸によるFePtCu合金ナノ粒子の表面修飾]
【0073】
保護剤の非存在下で合成したFePtCuナノ粒子 (100 mg) にEtOH (〜8
mL) を加え、超音波を照射 (〜3 min) することで分散させた。撹拌 (〜3 min) と遠心分離 (4000
rpm, 5 min, KUBOTA3200) の後、上清を廃棄した。続いて、残ったFePtCuナノ粒子の沈殿に蒸留水 (〜8 mL) を加え、超音波を照射
(〜3 min) することで分散させた。撹拌 (〜3 min) と遠心分離 (4000 rpm、5 min、KUBOTA3200) の後、上清を廃棄した。以上の洗浄は5周行い、最後に廃棄した上清の電気伝導度が25 mS/m以下となることを確認した (CM-30G, DKK・TOA)。
【0074】
洗浄したFePtCuナノ粒子にEtOH (50 mL) を加え、超音波を照射 (5 min, US-3R, AS
ONE) することで分散させた。これに、1M HS(CH2)2SO3Na (5.6 mL, 5.6 mmol, 水に溶解)を撹拌しながら (500-770 rpm, LT400, yamato scientific) 素早く加えた。その後は、25 °Cで24時間撹拌を続けた(下記の非特許文献参照)。途中、HS(CH2)2SO3Naの析出が見られたため、蒸留水 (〜10 mL) を加えてこれを溶解した。反応の後、上清を廃棄した。
【0075】
【非特許文献30】Simard, J. M.,Briggs, C., Boal, A. K., Rotello, V. M.: Chem. Commun. 19 (2000)1943-1944
【非特許文献31】McIntosh, C. M.,Esposito, E. A., Boal, A. K., Simard, J. M., Martin, C. T.,& Rotello, V. M.J. Am. Chem. Soc. 123 (2001) 7626-7629
【0076】
残ったFePtCuナノ粒子の沈殿に蒸留水 (〜1.5 mL) を加えた。撹拌 (〜3 min) と遠心分離 (14000 rpm、5 min、centrifuge 5417R, eppendorf) の後、上清を廃棄した。以上の洗浄は5周行い、最後に廃棄した上清の電気伝導度が1 mS/m以下となることを確認した (CM-30G, DKK・TOA)。続いて、残ったFePtCuナノ粒子の沈殿にアセトン (〜8 mL) を加えた。撹拌 (〜3
min) と遠心分離 (4000 rpm、10 min、KUBOTA3200) の後、上清を廃棄した。以上の洗浄は2周行った。最後に、FePtCuナノ粒子を減圧乾燥して粉末とし、-30 °Cで保存した。
【0077】
以上の表面修飾処理を行ったFePtCuナノ粒子を、以下では、FePtCu-
SO3-ナノ粒子と表す。
【0078】
[FePtCu- SO3-ナノ粒子の表面修飾評価]
【0079】
FePtCu- SO3-ナノ粒子は、フーリエ変換型赤外分光 (Fourier Transform Infrared Spectroscopy,
FT-IR, FT/IR-4200, JASCO) の減衰全反射法 (Attenuated Total Reflection, ATR) により表面修飾を確認した。
【0080】
[試料調製、溶液調製]
<FePtCuナノ粒子 (表面修飾前) の水分散液の調製>
FePtCuナノ粒子 (表面修飾前) の粉末 (〜1 mg) をマイクロチューブにとり、蒸留水 (〜200 μL) を加えた。撹拌 (〜1 min) と超音波の照射 (15 min, US-3R, AS ONE)の操作を3、4回行い、ナノ粒子を分散させた。濃度は1.5 mg/mLとした。
【0081】
<FePtCu- SO3-ナノ粒子の水分散液の調製>
FePtCu- SO3-ナノ粒子の粉末 (〜6 mg) をガラス遠沈管にとり、これにTHF (〜8 mL) を加え、超音波を照射 (〜3 min) することで分散させた。撹拌 (〜3 min) と遠心分離 (4000
rpm, 5 min, KUBOTA3200) の後、上清を廃棄した。以上の洗浄は2周行った。続いて、残ったFePtCu-
SO3-ナノ粒子の沈殿に蒸留水 (〜8 mL) を加え、超音波を照射 (〜3 min) することで分散させた。撹拌 (〜3 min) と遠心分離 (4000
rpm、5 min、KUBOTA3200) の後、上清を廃棄した。以上の洗浄は2周行った。
【0082】
最後に、洗浄したFePtCu- SO3-ナノ粒子に蒸留水 (4 mL) を加え、超音波を照射
(〜3 min) することで分散させた。濃度は1.5
mg/mLとした。
【0083】
<カチオン化剤の調製>
カチオン化剤には、クエン酸緩衝液、TFA、NFAのいずれかを選択した。クエン酸緩衝液は、分子量が10,000以下の試料と用いる場合には10 mMaqクエン酸 / 5 mMクエン酸二アンモニウムaq=1/3 (v/v) の組成とし、分子量が10,000以上の試料と用いる場合にはチ23 mMaqクエン酸 / 20 mMaqクエン酸二アンモニウム=1.1/5 (v/v) の組成とした。TFA、およびNFAは蒸留水で希釈し、それぞれ0.1v%の濃度に調製した。
【0084】
<マトリックスの調製>
MALDI-MSで用いるマトリックス剤にはCHCAを選択した。蒸留水/MeCN=1/1 (v/v)を溶媒に用いて10 mg/mLの濃度に調製した。なお、有機マトリックスとして、ここでは、CHCAを使用したが、試料の分子量などに応じて、他にもシナピン酸(3,5-ジメトキシ-4-ヒドロキシケイ皮酸)、フェルラ酸(trans-4-ヒドロキシ-3-メトキシケイ皮酸)、ゲンチシン酸、DHBA(2,5-ジヒドロキシ安息香酸)、HPA(3-ヒドロキシピコリン酸)、ジスラノール(1,8-ジヒドロキシ-9,10-ジヒドロアントラセン-9-オン)などを使用してもよい。
【0085】
[FePtCu合金ナノ粒子/FePtCu- SO3-ナノ粒子を利用したSALDI-MS]
<FePtCuナノ粒子 (表面修飾前) を利用したSALDI-MS>
表面修飾を行う前のFePtCuナノ粒子のSALDI特性を検討した。
【0086】
試料には、アンギオテンシンI、インスリンヒト、チトクロームCを選択した。蒸留水を溶媒に用いてそれぞれ20 nM、10 μM、10 μMの濃度に調製した。
【0087】
384-well MALDIステンレスプレートにFePtCuナノ粒子 (表面修飾前) の水分散液を塗布し (0.5
μL)、自然乾燥した。続いて、その上に試料溶液およびカチオン化剤を塗布し (それぞれ0.5 μL)、乾燥した。カチオン化剤にはクエン酸緩衝液を選択した。
【0088】
<FePtCu- SO3-ナノ粒子を利用したSALDI-MS>
低分子医薬品化合物を試料とし、FePtCu- SO3-ナノ粒子を用いたSALDIマススペクトルと、MALDIマススペクトルとの比較を行った。
【0089】
試料には、カフェイン、アミトリプチリン塩酸塩、デキストロメトルファン臭化水素酸塩を選択した。蒸留水を溶媒に用いてそれぞれ100 μM、1 μM、1 μMの濃度に調製した。カフェインを試料とする場合、0.1v%NFAをカチオン化剤として選択した。アミトリプチリン塩酸塩、およびデキストロメトルファン臭化水素酸塩を試料とする場合、カチオン化剤は使用しなかった。
【0090】
384-well MALDIステンレスプレートにFePtCu- SO3-ナノ粒子の水分散液を塗布し (1 μL)、自然乾燥した。続いて、その上に試料溶液 (、およびカチオン化剤) を塗布し (1 μL)、乾燥した。
【0091】
{MALDI-MS}
384-well MALDIステンレスプレートにCHCA、試料溶液 (、およびカチオン化剤)を順に塗布し
(それぞれ1 μL)、乾燥した。
【0092】
<FePtCu- SO3-ナノ粒子のアフィニティを利用した標的分子の捕捉実験とLDI-MS>
図4は、FePtCu- SO3-ナノ粒子を用いた標的分子の捕捉・抽出手順の概略を示す図である。ここでは、FePtCu- SO3-ナノ粒子表面の負電荷と、正電荷を持つペプチド・タンパク質との間に働
【0093】
く静電的なアフィニティを利用して、ペプチド・タンパク質を捕捉・抽出し、これをSALDI-MS/MALDI-MSで検出することを試みた。
【0094】
<単一オリゴペプチドの捕捉実験とSALDI-MS>
単一オリゴペプチドにはGGYRを選択した。蒸留水を溶媒に用いて50 μMの濃度に調製した (20 μL)。これを1×10-4 M塩酸、蒸留水、3×10-4 %アンモニア水、1×10-2 % アンモニア水のいずれか (980 μL) で1 μMの濃度に希釈し (1 mL)、それぞれpH 4, 6, 8, 10に調整した。
【0095】
これらにFePtCu- SO3-ナノ粒子の水分散液 (100 μL) を加え、撹拌
(10 min,
Thermomixer comfort, eppendorf)・一晩静置してGGYRの捕捉を行った。その後、簡易遠心分離し(6200 rpm, 5 min, MICRO SIX)、上清 (950 μL) を回収した。
【0096】
残ったFePtCu- SO3-ナノ粒子の沈殿に、捕捉時と同じpHを保持するように1×10-4 M塩酸、蒸留水、3×10-4 %アンモニア水、1×10-2 % アンモニア水のいずれか (1 mL) を加え、撹拌した (〜1 min)。簡易遠心分離 (6200
rpm, 5 min, MICRO SIX) の後、上清 (1 mL) を廃棄した。以上の洗浄はそれぞれ2回行った。
【0097】
洗浄後、100 μLの上清を残して超音波を照射し
(〜2 min,)、FePtCu- SO3-ナノ粒子を再分散させた。これらを384-well MALDIステンレスプレートに塗布し (1.0 μL)、自然乾燥した。続いて、その上にカチオン化剤を塗布し (1 μL)、乾燥した。カチオン化剤にはクエン酸緩衝液を選択した。
【0098】
{捕捉直後に回収した上清のSALDI-MS}
FePtCu- SO3-ナノ粒子の水分散液を384-well MALDIステンレスプレートに塗布し (1.0 μL)、自然乾燥した。続いてその上に回収した上清およびカチオン化剤を塗布し (それぞれ1 μL)、乾燥した。カチオン化剤にはクエン酸緩衝液を選択した。
【0099】
<混合オリゴペプチドの捕捉実験とSALDI-MS>
オリゴペプチドにはDDDD、GGGG、GGYRの3種類を選択した。蒸留水を溶媒に用いてそれぞれ300 μMの濃度に調製した。これらを等量ずつ混合し、100 μMの濃度に調製した (100 μL)。これを1×10-2.5 M塩酸、3×10-4 %アンモニア水、1×10-2 % アンモニア水のいずれか (900 μL) で10 μMの濃度に希釈し (1 mL)、それぞれpH 2.5、8、10に調整した。
【0100】
これらにFePtCu- SO3-ナノ粒子の水分散液 (100 μL) を加え、撹拌
(10 min, Thermomixer comfort, eppendorf)・一晩静置してオリゴペプチドの捕捉を行った。その後、簡易遠心分離し(6200 rpm, 5 min, MICRO SIX)、上清 (950 μL) を廃棄した。
【0101】
残ったFePtCu- SO3-ナノ粒子の沈殿に、捕捉時と同じpHを保持するように1×10-2.5 M塩酸、3×10-4 %アンモニア水、1×10-2 % アンモニア水のいずれか (1 mL) を加え、撹拌した (〜1 min)。簡易遠心分離 (6200
rpm, 5 min, MICRO SIX) の後、上清 (1 mL) を廃棄した。以上の洗浄はそれぞれ2回行った。
【0102】
洗浄後、〜100 μLの上清を残して超音波を照射し (〜2 min)、FePtCu- SO3-ナノ粒子を再分散させた。これらを384-well MALDIステンレスプレートに塗布し (1.0 μL)、自然乾燥した。続いて、その上にカチオン化剤を塗布し (1 μL)、乾燥した。カチオン化剤にはクエン酸緩衝液を選択した。
【0103】
<血清中のタンパク質の捕捉実験とMALDI-MS>
血清中に添加したタンパク質を標的分子とし、FePtCu- SO3-ナノ粒子を利用した捕捉・抽出の有無でMALDIマススペクトルの比較を行った。タンパク質には卵白リゾチームを選択した (M.W. 14306, pI=11.1)。リゾチームは、単球性白血病、腎臓病、髄膜炎において血清中濃度が増加する酵素タンパク質である(下記非特許文献による)。
【0104】
【非特許文献32】Levinson, S. S.;Elin, R. J.; Yam, L. Clin. Chem. 2002, 48, 1131-1132.
【非特許文献33】Harrison, J. F.;Lunt, G. S.; Scott, P.; Blainey, J. D. Lancet 1968, 1,371-375.
【非特許文献34】Klockars, M.; Reitamo, S.; Weber, T.; Kerttula,Y. Acta Med. Scand.1978, 203, 71-74.
【0105】
リゾチームは、蒸留水を溶媒に用いて5 mM, 500 μMのいずれかの濃度に調製した (20 μL) 。これをヒト血清 (980 μL, pH 8) で100 μM, 10 μMの濃度に希釈した (1 mL)。
【0106】
上の血清試料にFePtCu- SO3-ナノ粒子の水分散液 (200 μL) を加え、撹拌して (1 h, Thermomixer comfort, eppendorf) リゾチームの捕捉を行った。その後、簡易遠心分離し(6200 rpm, 5 min, MICRO SIX)、上清 (1.19 mL) を廃棄した。
【0107】
残ったFePtCu- SO3-ナノ粒子の沈殿に、蒸留水 (1.3 mL) を加え、撹拌した (〜1 min)。簡易遠心分離
(6200 rpm, 5 min, MICRO
SIX) の後、上清 (1.29 mL) を廃棄した。以上の洗浄は3回行った。
【0108】
洗浄後、100 μLの蒸留水を加えて超音波を照射し (〜2 min)、FePtCu- SO3-ナノ粒子を再分散させた。これを384-well MALDIステンレスプレートに塗布し (1.0 μL)、自然乾燥した。続いて、その上にCHCA、およびカチオン化剤を塗布し (それぞれ1 μL)、乾燥した。カチオン化剤にはクエン酸緩衝液を選択した。
【0109】
{前処理を行わないMALDI-MS}
384-well MALDIステンレスプレートに上の血清試料、CHCA、カチオン化剤を順に塗布し (それぞれ1 μL, 0.6 μL, 0.6 μL)、乾燥した。カチオン化剤にはクエン酸緩衝液を選択した。
【0110】
[SALDI/MALDI-MS測定条件]
【0111】
上記のようにサンプルを塗布した384-well MALDIステンレスプレートは、飛行時間型質量分析計 (AXIMA-CFR、またはAXIMA-CFR plus、窒素レーザー光波長337 nm, Shimadzu-Kratos) に導入し、リニア・正イオンモードでSALDI/MALDI-TOF-MS測定を行った。質量校正には、CHCAの[M+H]+イオン, アンギオテンシンIの[M+H]+イオン、インスリンヒトの[M+H]+イオン、リゾチームの[M+H]+イオン (それぞれm/z 190.05, 1296.69, 5806.65, 14303.83, Most
abundunt) を用いた。
【0112】
[FePtCu合金ナノ粒子の構造評価]
【0113】
保護剤SDSの存在下で合成されたFePtCuナノ粒子のFE-SEM画像、EDXスペクトル、および元素分布について説明する。図5は、保護剤SDSの存在下で合成されたFePtCuナノ粒子のFE-SEM写真(25000倍)を示す図である。図6は、保護剤SDSの存在下で合成されたFePtCuナノ粒子の構成元素((X) の拡大範囲(25、000倍) におけるEDXスペクトル)を示す図である。図7は、保護剤SDSの存在下で合成されたFePtCuナノ粒子の元素分布((X) の拡大範囲(25、000倍) における(a) Fe、(b) Pt、(c) Cu の元素分布)を示す図である。
【0114】
FE-SEM画像より、保護剤SDSの存在下で合成されたFePtCuナノ粒子は、直径が約10 nm の球形状であることがわかった (図5)。また、EDX解析より、鉄・白金・銅の合金であることが確認され (図6)、元素の分布にも差がなかった
(図7)。
【0115】
次に、保護剤の非存在下で合成されたFePtCuナノ粒子のFE-SEM画像、TEM画像、EDXスペクトル、および元素分布について説明する。図8は、保護剤の非存在下で合成されたFePtCuナノ粒子のFE-SEM写真((a) 25000倍、(b)
(a)の左側大きな粒子付近、50000倍、(c) (a)の中央部の小さな粒子付近、50000倍)を示す図である。図9は、保護剤の非存在下で合成されたFePtCuナノ粒子のTEM写真(100000倍)を示す図である。図10は、保護剤の非存在下で合成されたFePtCuナノ粒子の構成元素((X) の拡大範囲(25000倍) における(a) EDXスペクトルと(b) 定量分析)を示す図である。図11は、保護剤の非存在下で合成されたFePtCuナノ粒子の元素分布((X) の拡大範囲(25000倍) における(a) Fe、(b) Pt、(c) Cu の元素分布
(d) Fe、(e) Pt、(f) Cuの元素質量分布)を示す図である。図12は、FT-IR (ATR) スペクトル((a) 表面修飾前のFePtCuナノ粒子、(b) HSCH2CH2SO3Na表面修飾後のFePtCuナノ粒子、(c) HSCH2CH2SO3Na粉末)を示す図である。
【0116】
FE-SEM画像 (図8)、およびTEM画像 (図9) より、保護剤の非存在下で合成されたFePtCuナノ粒子は、10-20 nm程度のナノ粒子と100-200 nm程度の微粒子の混合物であることがわかった。また、EDX解析より、いずれも鉄・白金・銅の合金であることが確認されたが、前者は白金含量が多く(図11a, b)、後者は鉄含量が多くなっていた(図11d, e)。これらの偏りは、合成系に保護剤SDSが存在していた場合と比較して還元反応が不均一に進行したために生じたと考えられる。
【0117】
チオールスルホン酸による表面修飾を行ったFePtCuナノ粒子 (FePtCu-
SO3-ナノ粒子) のFT-IRスペクトルを図12に示す。チオールスルホン酸は、波長1200 nm付近に- SO3-に由来する強い2本のピークが特徴に見られる(図12c)。このピークに注目して表面修飾の前(図12a)と表面修飾の後(図12b)を比較すると、弱いピーク強度ではありながら、表面修飾の後 (図12b) においては波長1200
nm付近に- SO3-に由来すると考えられる2本のピークが新たに現れている。また、FePtCu-
SO3-ナノ粒子は、表面修飾を行う前のFePtCuナノ粒子と比較して水に容易に分散し、沈降速度も遅かったことから、チオールスルホン酸による表面修飾が行われたと考えられる。
【0118】
[FePtCu合金ナノ粒子/FePtCu- SO3-ナノ粒子を利用したSALDI-MS]
<FePtCu合金ナノ粒子を利用したSALDI-MS
>
表面修飾を行う前のFePtCuナノ粒子のSALDI特性を検討した。
【0119】
図13は、アンギオテンシンI(10
fmol) のSALDIマススペクトルを示す図である。カチオン化剤としてクエン酸緩衝液を使用した。FePtCu粒子の合成条件は(a) 保護剤非存在下、(b)保護剤SDS存在下であった
【0120】
保護剤SDSの存在/非存在下の合成条件の如何に関わらず、プロトンが付加した[M+H]+イオン (m/z 1297) を高いイオン強度と分解能をもって観測することができた。標準的な試料であるアンジオテンシンIにフェムトモルレベルの検出感度を有していることから、 FePtCuナノ粒子はSALDI-MSにおける無機マトリックスとして利用可能であることがわかった。ただし、保護剤SDSの存在下で合成されたFePtCuナノ粒子を用いた場合、m/z 400以下の範囲で残留したSDSに由来すると考えられるピーク群が併せて観測された。このことから、保護剤SDSの存在下で合成されたFePtCuナノ粒子は、低分子化合物のSALDI-MSへの使用にはやや劣ると考えられる。
【0121】
図14は、インスリンヒト(5 pmol) のSALDIマススペクトルを示す図である。ナノ粒子として(a) Ptナノ粒子、(b) 保護剤SDS存在下で合成されたFePtCuナノ粒子、カチオン化剤としてクエン酸緩衝液を使用した。白金単独の元素から構成されるPtナノ粒子を用いた場合、試料に由来するピークを観測することができなかった(下記の非特許文献参照)図14a)。一方、FePtCuナノ粒子 (保護剤SDSの存在下で合成) を用いた場合、[M+H]+イオン (m/z 5806) を観測することができ(図14b)、合金化によるイオン化効率の向上が示唆される。
【0122】
【非特許文献35】H. Kawasaki, T.Yonezawa, T. Watanabe, R. Arakawa: J. Phys. Chem C , 11, 16278-16283(2007)
【0123】
図15は、チトクロームC (5 pmol) のSALDIマススペクトルを示す図である。m/z 4000以下はblankである。保護剤SDS存在下で合成されたFePtCuナノ粒子、カチオン化剤としてクエン酸緩衝液を使用した。一価の[M+H]+イオン
(m/z 12360) および二価の[M+2H]2+イオン (m/z 6180) を観測することができたが、その強度と分解能は低かった。このことから、分子量が10,000以上の高分子化合物のイオン化については、他の金属ナノ粒子を用いたSALDIと同様にMALDIに劣ることがわかった。
【0124】
<FePtCu- SO3-ナノ粒子を利用したSALDI-MS>
塩基性の低分子医薬品化合物を試料とし、FePtCu- SO3-ナノ粒子を用いたSALDIマススペクトルと、MALDIマススペクトルとの比較を行った。
【0125】
図16は、カフェイン(100 pmol) のマススペクトル((a) CHCAを用いたMALDI、(b) FePtCu- SO3-ナノ粒子を用いたSALDI)を示す図である。カチオン化剤として0.1% NFAを使用した。MALDIマススペクトルでは、プロトンが付加した[M+H]+イオン (m/z 195) が観測されたが、CHCAマトリックス剤に由来するピークも近傍に観測され (m/z 190)、カフェインのイオン化は抑制されていた (図16a)。一方、SALDIマススペクトルでは、[M+H]+イオン (m/z 195) が支配的に観測され、妨害イオンピークはMALDIと比較して大幅に少なかった (図16b)。なお、m/z
345にみられるピークは、カチオン化剤に用いたNFAに由来するものである。
【0126】
図17は、GGH
(100 pmol) のSALDIマススペクトルを示す図である。FePtCu- SO3-ナノ粒子を使用した。カチオン化剤として(a) 0.1% TFA、(b) クエン酸緩衝液、(c) 0.1% NFAをそれぞれ使用した。FePtCu- SO3-ナノ粒子を用いたSALDIにおけるカチオン化剤の検討を行ったところ、NFAはクエン酸緩衝液やTFAと同様にカチオン化剤として用いることができ、カチオン化剤自体に由来するピークが少ないという特徴を持っていた (図17)。
【0127】
次に、図18は、アミトリプチリン塩酸塩(1 pmol) のマススペクトル((a) CHCAを用いたMALDI、(b) FePtCu- SO3-ナノ粒子を用いたSALDI)を示す図である。カチオン化剤は使用しなかった。ALDIマススペクトルでは、塩素が解離した[M-Cl]+イオン (m/z 278)が観測されたが、CHCAマトリックス剤に由来するピークに妨害され、帰属は困難であった (図18a)。一方、SALDIマススペクトルでは、[M-Cl]+イオン (m/z 278) に加えて、酸化体から塩素が脱離した[M-H2 -Cl]+イオン (m/z
276) も観測されたが、妨害イオンピークはMALDIと比較して大幅に少なかった (図18b)。
【0128】
最後に、図19は、デキストロメトルファン臭化水素酸塩(1 pmol) のマススペクトル((a) CHCAを用いたMALDI、(b) FePtCu- SO3-ナノ粒子を用いたSALDI)を示す図である。カチオン化剤は使用しなかった。MALDIマススペクトルでは、臭素が解離した[M-Br]+イオンと見られるピーク (m/z 272) が観測された。しかし、m/z 272は、CHCAマトリックス剤に由来するピークと考えることもでき、帰属は確定的ではない (図19a)。 一方、SALDIマススペクトルでは、[M-Br]+イオン (m/z 272) に加えて、酸化体から臭素が脱離した[M-H2 -Br]+イオン (m/z
270) も観測されたが、やはり妨害イオンピークはMALDIと比較して大幅に少なかった(図19b)。これらのことから、FePtCu- SO3-ナノ粒子を用いたSALDI-MSは、低分子医薬品化合物の検出に有効であることがわかった。
【0129】
[FePtCu- SO3-ナノ粒子のアフィニティを利用した標的分子の捕捉実験とLDI-MS]
<単一オリゴペプチドの捕捉実験とSALDI-MS>
図20は、異なるpH条件の下でGGYRの捕捉を試みたFePtCu- SO3-ナノ粒子のSALDI-MSスペクトルを示す図である。捕捉条件は(a) pH 4、(b) pH 6、(c)
pH 8、(d) pH 10であった。GGYR ([M+H]+
, m/z 452) は、pH 4, 6, 8の条件で検出することができたが (それぞれ図20a, 20b, 20c)、pH 10の条件では検出することができなかった(図20d)。
【0130】
図21は、任意のpHにおけるFePtCu- SO3-ナノ粒子とオリゴペプチドGGYRの電荷状態、およびオリゴペプチドGGYRの捕捉・抽出結果を示す図である。GGYR (pI=9.35) は、pI以下のpH 4, 6, 8では正電荷を持つことから、負帯電ナノ粒子に捕捉され、SALDI-MSで検出されたものと考えられる。一方、pI以上のpH 10ではGGYRは負電荷を持つため、負帯電ナノ粒子に捕捉されず、SALDI-MSでは検出できないと考えられる (図21)。
【0131】
{捕捉直後に回収した上清のSALDI-MS}
図22は、オリゴペプチドGGYR (1 μM ) の捕捉・抽出操作後に回収した上清のSALDIマススペクトルを示す図である。すなわち、上記のGGYRの捕捉を試みた直後に回収した上清のSALDI-MSスペクトルを示す。捕捉条件は(a) pH 4、(b) pH 6、(c) pH 8、(d)
pH 10であった。GGYR ([M+H]+, m/z 452) は、pH 4, 6, 8の条件では検出することができなかったが(それぞれ図22a, 22b, 22c)、pH 10の条件で検出することができた (図22d)。
【0132】
これらは、図20のスペクトルとは正反対の結果を示している。GGYRは、pI以上のpH 10では上清に残存し、pI以下のpH 4, 6, 8ではほぼ100
%が捕捉されたと考えられ、上記の考察を裏付けている。
【0133】
<混合オリゴペプチドの捕捉実験とSALDI-MS>
図23は、3種混合オリゴペプチド(10 μM ) の捕捉・抽出操作後に回収したFePtCu-
SO3-ナノ粒子のSALDIマススペクトルを示す図である。捕捉条件は(a) pH 2.5、(b) pH 8、(c)pH
10であった。pH 2.5では、DDDD、GGGG, およびGGYR (それぞれ[M+Na]+, [M+Na]+, [M+H]+, m/z
501, 269, 452) の全てが検出されたが、pH10では全く検出されなかった。一方、pH 8では、3種のオリゴペプチド混合物中から、GGYR (m/z 452) のみ検出されることがわかった。これは、DDDD
(pI=3.2)、GGGG (pI=6.1), GGYR (pI=9.4) の等電点 (pI) の違いにより説明される 。
【0134】
図24は、任意のpHにおけるFePtCu- SO3-ナノ粒子とオリゴペプチドの電荷状態、およびオリゴペプチド3種の捕捉・抽出結果を示す図である。つまり、pI以下のpH 2.5では3種のオリゴペプチドの全てが正電荷を持つことから、負帯電ナノ粒子に捕捉され、SALDI-MSで検出されたものと考えられる。pI以上のpH 10では全てのペプチドが負電荷を持つため、負帯電ナノ粒子に捕捉されず、SALDI-MSでは検出できないと考えられる。一方pH 8では、正電荷を持つGGYRのみが負帯電ナノ粒子に捕捉・抽出され、混合物中からGGYRのみが検出できたものと考えられる。
【0135】
<血清中のタンパク質の捕捉実験とMALDI-MS>
ヒト血清 (pH 8) に添加した卵白リゾチーム (pI=11) の捕捉実験で得られたMALDIマススペクトルについて説明する。図25は、血清中に添加した卵白リゾチーム(100 μM) のMALDIマススペクトルを示す図である。m/z 4500-15000以外はblankである。カチオン化剤としてクエン酸緩衝液を使用した。(a) 前処理なし、100 pmol (b) FePtCu- SO3-ナノ粒子を用いた捕捉・抽出後である。図26は、血清中に添加した卵白リゾチーム(10 μM) のMALDIマススペクトルを示す図である。m/z 4500-15000以外はblankである。カチオン化剤としてカチオン化剤としてクエン酸緩衝液を使用した。(a) 前処理なし、10 pmol (b) FePtCu- SO3-ナノ粒子を用いた捕捉・抽出後である。
【0136】
前処理を行わずに血清サンプルを直接塗布した場合、リゾチームはほとんど検出されなかった (図25a, 26a)。一方、FePtCu- SO3-ナノ粒子により血清中から卵白リゾチームの捕捉・抽出を行った場合、プロトンが付加した1価、2価、3価のイオン (それぞれ[M+H]+, [M+2H]2+, [M+3H]3+, m/z
14304, 7153, 4769) としてリゾチームを検出することに成功した (図25b, 26b)。血清中に多く含まれるアルブミン等の生体物質による非特異的吸着の影響を抑制しながら、リゾチームを検出できたことは、FePtCu-
SO3-ナノ粒子の高い捕捉・抽出選択能を示すものである。
【0137】
[FePtナノ粒子]
【0138】
FePtナノ粒子を用いたAng I のSALDI-MSとFePtCuナノ粒子を用いたAng I のSALDI-MSとを比較しながら説明する。
【0139】
試料としてAng I(アンジオテンシンI)を、カチオン化剤としてクエン酸/クエン酸アンモニウムを使用した。マトリックスとしてはFePtナノ粒子(又はFePtCuナノ粒子)をSDSなしで合成したものを使用した。FePtナノ粒子の場合は5.6mg/mLであり、FePtCuナノ粒子5mg/mLであった。
【0140】
プレートにAng(10 μM Ang I ×0.5 μL = 5 pmol)を滴下し、乾燥した。続いてFePtナノ粒子(又はFePtCuナノ粒子)(5 mg/mL× 0.5 μL)を滴下、乾燥した。
【0141】
図27及び図28は、FePtナノ粒子を用いたAng
I のSALDIマススペクトルとFePtCuナノ粒子を用いたAng I のSALDIマススペクトルとを示す図である。FePtナノ粒子を用いた場合とFePtCuナノ粒子を用いた場合とでは分子量1296.5に同等レベルのピーク強度が観察された。FePtナノ粒子を用いた場合のほうが、FePtCuナノ粒子を用いた場合よりも低分子量域の不純物ピークが大きいことがわかった。
【0142】
これらのことから、上述のFePtCu合金ナノ粒子と同様に、例えば、FePt- SO3-ナノ粒子としてチオール基を介してFePtナノ粒子の表面にスルホン酸を修飾すれば、正電荷を持つオリゴペプチドとリゾチームなどを混合試料中から選択的に捕捉・抽出し、SALDI/MALDI-MSで検出することが可能であると考えられる。
【0143】
また、上述のFePtCuに比べFePtのほうが、 FeとPt の化学組成が均一な粒子が合成できる点で優れている。同様に、表面修飾したFePtCuに比べ表面修飾したFePtのほうが、 Cuの酸化によってチオール表面修飾が困難となるという問題がないため、表面修飾がしやすい点で優れている。
【0144】
[用途]
【0145】
プロテオーム解析、メタボロミクス解析への応用が有望視される。特に、サンプルに含まれる低分子化合物を網羅的に解析し、ある条件下で生体内はどのような変化を起こすかを調べるメタボロミクス解析では、低分子領域で妨害イオンピークが少ない上述の技術が有効である。
【0146】
なお、SDS-PAGEや二次元電気泳動による分離操作と組み合わせて使用することも可能である。特にこのように分離したものをプレート上に塗布もしくは転写することで、分離された物質をマッピングすることができる。試料を効率よく捕捉でき、場所による感度の大きな違い(いわゆるスイートスポット)を抑えることができるため、こうした物質の位置を知ることのできるマッピング法にも有効である。大気圧下で測定を行うAP-LDIにも転用することも考えられる。
【0147】
[まとめ]
【0148】
本発明者らは、保護剤の存在下/非存在下の条件でFePtCu合金ナノ粒子を合成し、保護剤の非存在下の条件で合成したFePtCuナノ粒子などは、チオールスルホン酸で表面修飾することで負電荷を付与することができた (例えばFePtCu- SO3-ナノ粒子)。FePtCu- SO3-ナノ粒子などを用いて、正電荷を持つオリゴペプチドとリゾチームなどを混合試料中から選択的に捕捉・抽出し、SALDI/MALDI-MSで検出することができた。また、FePt合金ナノ粒子を同様に合成し、FePt合金ナノ粒子を表面修飾することによりSALDI/MALDI-MSで検出することができることを十分に裏付ける結果を得た。
【0149】
[権利解釈など]
【0150】
以上、特定の実施形態を参照しながら、本発明について説明してきた。しかしながら、本発明の要旨を逸脱しない範囲で当業者が実施形態の修正又は代用を成し得ることは自明である。すなわち、例示という形態で本発明を開示してきたのであり、本明細書の記載内容を限定的に解釈するべきではない。本発明の要旨を判断するためには、冒頭に記載した特許請求の範囲の欄を参酌すべきである。
【0151】
また、この発明の説明用の実施形態が上述の目的を達成することは明らかであるが、多くの変更や他の実施例を当業者が行うことができることも理解されるところである。特許請求の範囲、明細書、図面及び説明用の各実施形態のエレメント又はコンポーネントを他の1つまたは組み合わせとともに採用してもよい。特許請求の範囲は、かかる変更や他の実施形態をも範囲に含むことを意図されており、これらは、この発明の技術思想および技術的範囲に含まれる。
【特許請求の範囲】
【請求項1】
表面が修飾され、
Fe、Pt及びCuを含有し、
試料を捕捉することを特徴とする試料捕捉合金。
【請求項2】
表面が修飾されることで電荷が付与されていることを特徴とする請求項1記載の試料捕捉合金。
【請求項3】
チオール基を結合しており、前記チオール基を介して表面が修飾されていることを特徴とする請求項1記載の試料捕捉合金。
【請求項4】
スルホン酸で表面が修飾されていることを特徴とする請求項1記載の試料捕捉合金。
【請求項5】
レーザーを照射することで捕捉した試料のイオン化を支援することを特徴とする請求項1記載の試料捕捉合金。
【請求項6】
表面支援レーザー脱離イオン化法で捕捉した試料のイオン化を支援することを特徴とする請求項5記載の試料捕捉合金。
【請求項7】
請求項1から請求項6までのいずれかに記載の試料捕捉合金を装着したことを特徴とする質量分析装置。
【請求項8】
請求項1から請求項6までのいずれかに記載の試料捕捉合金により補足した試料の質量分析を行うことを特徴とする質量分析方法。
【請求項9】
表面が修飾され、Fe、Pt及びCuを含有する合金によって試料を捕捉することを特徴とする試料捕捉方法。
【請求項10】
Fe、Pt及びCuを含有し、
チオール基を介してSO3-基が表面に結合しており、
試料を捕捉することを特徴とする試料捕捉合金。
【請求項11】
Fe、Pt及びCuを含有する合金にチオール基を介して表面修飾を行うことを特徴とする試料捕捉合金製造方法。
【請求項12】
Fe及びPtから実質的になり、
試料を捕捉することを特徴とする試料捕捉合金。
【請求項13】
表面が修飾されていることを特徴とする請求項12記載の試料捕捉合金。
【請求項14】
Fe及びPtから実質的になり、
チオール基を介してSO3-基が表面に結合しており、
試料を捕捉することを特徴とする試料捕捉合金。
【請求項1】
表面が修飾され、
Fe、Pt及びCuを含有し、
試料を捕捉することを特徴とする試料捕捉合金。
【請求項2】
表面が修飾されることで電荷が付与されていることを特徴とする請求項1記載の試料捕捉合金。
【請求項3】
チオール基を結合しており、前記チオール基を介して表面が修飾されていることを特徴とする請求項1記載の試料捕捉合金。
【請求項4】
スルホン酸で表面が修飾されていることを特徴とする請求項1記載の試料捕捉合金。
【請求項5】
レーザーを照射することで捕捉した試料のイオン化を支援することを特徴とする請求項1記載の試料捕捉合金。
【請求項6】
表面支援レーザー脱離イオン化法で捕捉した試料のイオン化を支援することを特徴とする請求項5記載の試料捕捉合金。
【請求項7】
請求項1から請求項6までのいずれかに記載の試料捕捉合金を装着したことを特徴とする質量分析装置。
【請求項8】
請求項1から請求項6までのいずれかに記載の試料捕捉合金により補足した試料の質量分析を行うことを特徴とする質量分析方法。
【請求項9】
表面が修飾され、Fe、Pt及びCuを含有する合金によって試料を捕捉することを特徴とする試料捕捉方法。
【請求項10】
Fe、Pt及びCuを含有し、
チオール基を介してSO3-基が表面に結合しており、
試料を捕捉することを特徴とする試料捕捉合金。
【請求項11】
Fe、Pt及びCuを含有する合金にチオール基を介して表面修飾を行うことを特徴とする試料捕捉合金製造方法。
【請求項12】
Fe及びPtから実質的になり、
試料を捕捉することを特徴とする試料捕捉合金。
【請求項13】
表面が修飾されていることを特徴とする請求項12記載の試料捕捉合金。
【請求項14】
Fe及びPtから実質的になり、
チオール基を介してSO3-基が表面に結合しており、
試料を捕捉することを特徴とする試料捕捉合金。
【図1】


【図2】


【図3】


【図4】


【図5】


【図6】


【図7】


【図8】


【図9】


【図10】


【図11】


【図12】


【図13】


【図14】


【図15】


【図16】


【図17】


【図18】


【図19】


【図20】


【図21】


【図22】


【図23】


【図24】


【図25】


【図26】


【図27】


【図28】




【図2】


【図3】


【図4】


【図5】


【図6】


【図7】


【図8】


【図9】


【図10】


【図11】


【図12】


【図13】


【図14】


【図15】


【図16】


【図17】


【図18】


【図19】


【図20】


【図21】


【図22】


【図23】


【図24】


【図25】


【図26】


【図27】


【図28】


【公開番号】特開2011−27477(P2011−27477A)
【公開日】平成23年2月10日(2011.2.10)
【国際特許分類】
【出願番号】特願2009−171507(P2009−171507)
【出願日】平成21年7月22日(2009.7.22)
【新規性喪失の例外の表示】特許法第30条第1項適用申請有り A.公開の事実 ▲1▼刊行物名 第57回質量分析総合討論会(2009)講演要旨集 ▲2▼発行日 平成21年5月13日 ▲3▼発行所 日本質量分析学会 ▲4▼該当ページ 第382ページ及び第383ページ ▲5▼公開者 川崎 英也、樽井 章、渡辺 健宏、荒川 隆一 ▲6▼公開のタイトル「表面修飾FePtCuナノ粒子による標的分子の捕捉・分離とLDI−MSによる直接検出」 B.公開の事実 ▲1▼研究集会名 修士論文発表会 ▲2▼主催者名 学校法人関西大学 ▲3▼公開場所 学校法人関西大学(大阪府吹田市山手町3丁目3番35号) ▲4▼公開日 平成21年2月19日 ▲5▼文書の種類 プレゼンテーションデータ ▲5▼公開者 樽井 章 ▲6▼公開のタイトル 「FePtCu合金ナノ粒子を利用したレーザー脱離イオン化質量分析法の開発」
【出願人】(399030060)学校法人 関西大学 (208)
【Fターム(参考)】
【公開日】平成23年2月10日(2011.2.10)
【国際特許分類】
【出願日】平成21年7月22日(2009.7.22)
【新規性喪失の例外の表示】特許法第30条第1項適用申請有り A.公開の事実 ▲1▼刊行物名 第57回質量分析総合討論会(2009)講演要旨集 ▲2▼発行日 平成21年5月13日 ▲3▼発行所 日本質量分析学会 ▲4▼該当ページ 第382ページ及び第383ページ ▲5▼公開者 川崎 英也、樽井 章、渡辺 健宏、荒川 隆一 ▲6▼公開のタイトル「表面修飾FePtCuナノ粒子による標的分子の捕捉・分離とLDI−MSによる直接検出」 B.公開の事実 ▲1▼研究集会名 修士論文発表会 ▲2▼主催者名 学校法人関西大学 ▲3▼公開場所 学校法人関西大学(大阪府吹田市山手町3丁目3番35号) ▲4▼公開日 平成21年2月19日 ▲5▼文書の種類 プレゼンテーションデータ ▲5▼公開者 樽井 章 ▲6▼公開のタイトル 「FePtCu合金ナノ粒子を利用したレーザー脱離イオン化質量分析法の開発」
【出願人】(399030060)学校法人 関西大学 (208)
【Fターム(参考)】
[ Back to top ]

