試料調製装置
【課題】測定試料中の凝集した分析対象物を自動で分離させることができる試料調製装置を提供する。
【解決手段】測定試料容器54内に収容された分析対象物を含む試料に超音波振動を付与する超音波振動部100と、超音波振動が付与された試料と所定の試薬とから測定試料を調製する試料調製部(反応部24)と、試料が収容された測定試料容器を超音波振動部100から試料調製部(反応部24)へ移送する容器移送部110とを備えている。
【解決手段】測定試料容器54内に収容された分析対象物を含む試料に超音波振動を付与する超音波振動部100と、超音波振動が付与された試料と所定の試薬とから測定試料を調製する試料調製部(反応部24)と、試料が収容された測定試料容器を超音波振動部100から試料調製部(反応部24)へ移送する容器移送部110とを備えている。
【発明の詳細な説明】
【技術分野】
【0001】
本発明は試料調製装置に関する。
【背景技術】
【0002】
従来、生体から採取された生体試料に含まれる細胞を分析する細胞分析装置として、被験者の子宮頸部から採取された試料に含まれる子宮頸部の上皮細胞をフローサイトメータで測定して、癌・異型細胞のスクリーニングを行う細胞分析装置が知られている(例えば、特許文献1参照)。
【0003】
この細胞分析装置では、癌・異型細胞を特異的に染色する蛍光マーカーを用いて癌・異型細胞を染色し、当該癌・異型細胞から生じた蛍光をフローサイトメータで測定している。
【先行技術文献】
【特許文献】
【0004】
【特許文献1】国際公開第2009/123000号パンフレット
【発明の概要】
【発明が解決しようとする課題】
【0005】
細胞を染色するときに染色対象の細胞同士が互いに凝集していると、癌・異型細胞のスクリーニングの精度が低下する場合がある。しかしながら、このような凝集した細胞を自動で分離させる技術は知られていなかった。
本発明は、このような事情に鑑みてなされたものであり、測定試料中の凝集した分析対象物を自動で分離させることができる試料調製装置を提供することを目的としている。
【課題を解決するための手段】
【0006】
本発明の第1の観点に係る試料調製装置は、測定試料容器内に収容された分析対象物を含む試料に超音波振動を付与する超音波振動部と、
超音波振動が付与された試料と所定の試薬とから測定試料を調製する試料調製部と、
試料が収容された測定試料容器を超音波振動部から試料調製部へ移送する容器移送部と
を備えたことを特徴としている。
【0007】
本発明の第1の観点に係る試料調製装置では、超音波振動部により測定試料容器中の試料に超音波振動を付与することで、当該試料中の凝集した分析対象物を分離させることができる。そして、容器移送部によって、分離された分析対象物を含む試料が収容された測定試料容器を超音波振動部から試料調製部へ移送するので、自動で測定試料を調製することができる。また、試料が収容された測定試料容器を超音波振動部から試料調製部へ移送するので、分析に供される分析対象物の損失を最小限にすることができる。
【0008】
前記超音波振動部は、液体を収容する液体収容部と、超音波振動を発生する超音波振動子とを備えており、
前記容器移送部は、前記測定試料容器を前記液体収容部に収容された液体に漬けた状態で保持可能であり、且つ、
前記超音波振動子は、前記液体を介して前記測定試料容器に収容された試料に超音波振動を付与するものとすることができる。
【0009】
前記液体収容部に収容された液体の液面の高さを調整する液面調整部をさらに備えているのが好ましい。
前記液面調整部は、前記液体収容部に液体を供給する液体供給部と、当該液体収容部から液体を排出する液体排出部とを備えたものとすることができる。
【0010】
前記液体排出部は前記液体収容部の周壁に形成された排出孔からなり、この排出孔は、前記液体の液面が当該液体に付与される超音波振動の波長に基づき定められる所定の高さにくる位置に形成されたものとすることができる。
【0011】
前記測定試料容器は、当該測定試料容器内の試料の液面が、液体収容部内の液体の液面よりも下方に位置するように当該液体に漬けられるのが好ましい。
前記測定試料容器は、液体収容部に収容される液体の音響インピーダンスとほぼ同じ音響インピーダンスを有する材料で作製されているのが好ましい。
【0012】
前記液体を水とし、且つ、前記測定試料容器を合成樹脂で作製することができる。
前記測定試料容器がポリプロピレンで作製されているのが好ましい。
前記測定試料容器の内面の算術平均粗さが1〜30μmの範囲であるのが好ましい。
【0013】
前記液体収容部が円筒体形状を呈しており、前記超音波振動子が円柱体形状を呈しており、且つ、液体収容部の内径が超音波振動子の径よりも大きいのが好ましい。
前記超音波振動部は、分析対象物に対して分析に影響するダメージを与えない所定の出力および時間で超音波振動を付与するのが好ましい。
前記超音波振動子の振動数が20〜75kHzの範囲であるのが好ましい。
【0014】
前記測定試料容器に付着した液体を除去する液体除去部をさらに備えており、
前記容器移送部は、前記測定試料容器を超音波振動部から前記液体除去部へ移送し、当該液体除去部から前記試料調製部へ移送するものとすることができる。
【0015】
前記液体除去部は、前記測定試料容器のうち少なくとも液体に漬けられた部分を収容可能な収容凹部を有する本体部と、前記収容凹部に収容された測定試料容器の外周面に気体を供給する給気部と、供給された気体を吸引する吸気部とを備えたものとすることができる。
前記給気部は、収容凹部の内周面において周方向に複数形成された給気口を有するものとすることができる。
【0016】
前記試料調製装置は、前記測定試料容器を載置する容器載置部をさらに備えており、
前記容器移送部は、前記測定試料容器を前記容器載置部から前記超音波振動部へ移送するものとすることができる。
前記試料調製装置は、前記測定試料容器に前記試料を分注する試料分注部をさらに備えているものとすることができる。
【0017】
前記試料分注部は、前記容器載置部に載置された測定試料容器に試料を分注し、
前記容器移送部は、前記試料を収容した測定試料容器を、前記容器載置部から前記超音波振動部へ移送するものとすることができる。
前記超音波振動部、前記試料調製部、及び前記容器載置部は同一円周上に配置されているのが好ましい。
【0018】
本発明の第2の観点に係る試料調製装置は、測定試料容器内に収容された分析対象物を含む試料に超音波振動を付与する超音波振動部と、
超音波振動が付与された試料と所定の試薬とから測定試料を調製する試料調製部と、
前記超音波振動部に配置された測定試料容器内の試料を超音波振動部から試料調製部へ移送する試料移送部と
を備えたことを特徴としている。
【発明の効果】
【0019】
本発明の試料調製装置によれば、測定試料中の凝集した分析対象物を自動で分離させることができる。
【図面の簡単な説明】
【0020】
【図1】本発明の一実施の形態に係る試料調製装置を備えた細胞分析装置の斜視図である。
【図2】測定装置の内部構成を示すブロック図である。
【図3】試料調製装置の内部構成を示すブロック図である。
【図4】試料調製装置の平面説明図である。
【図5】超音波振動部の断面説明図である。
【図6】液体除去部の断面説明図である。
【図7】液体除去部の開口部周縁の斜視説明図である。
【図8】データ処理装置の内部構成を示すブロック図である。
【図9】検出部を構成するフローサイトメータの機能ブロック図である。
【図10】フローサイトメータの光学系を示す側面図である。
【図11】調製デバイス部の流体回路図である。
【図12】調製デバイス部の流体回路図である。
【図13】置換容器の断面説明図である。
【図14】弁別・置換部における分析物の濃縮過程を示す模式図である。
【図15】細胞分析装置の各制御部が行う処理を示すフローチャートである。
【図16】細胞分析装置の各制御部が行う処理を示すフローチャートである。
【図17】弁別・置換処理を示すフローチャートである。
【図18】弁別・置換処理を示すフローチャートである。
【図19】超音波振動による凝集細胞の分離処理を示すフローチャートである。
【図20】本発明の別実施の形態に係る測定装置の内部構成を示すブロック図である。
【発明を実施するための形態】
【0021】
以下、添付図面を参照しつつ、本発明の試料調製装置の実施の形態を詳細に説明する。
本発明の試料調製装置は、患者から採取した細胞を分析する細胞分析装置に用いることができる。まず、かかる細胞分析装置について説明する。
【0022】
[細胞分析装置の全体構成]
図1は、本発明の一実施の形態に係る試料調製装置を備えた細胞分析装置1の斜視図である。
この細胞分析装置1は、患者から採取した細胞を含む測定試料をフローセルに流し、このフローセルを流れる測定試料にレーザ光を照射し、測定試料からの光(前方散乱光、側方蛍光など)を検出してその光信号を分析することで、細胞に癌細胞が含まれているか否かを判断するのに用いられる。
【0023】
より具体的には、本実施の形態の細胞分析装置1は、子宮頸部の上皮細胞を分析対象としており、子宮頸癌をスクリーニングするのに用いられるものである。
図1に示されるように、細胞分析装置1は、測定試料に対してレーザ光による光学的な測定を行う測定装置2と、被検者から採取された生体試料に洗浄や染色等の前処理を行って、測定装置2に供給する測定試料を作製する試料調製装置3と、測定装置2での測定結果の分析等を行うデータ処理装置4とを備えている。
【0024】
以下、細胞分析装置1の主要な構成要素について順次説明をする。
〔測定装置の内部構成〕
図2は、測定装置2の内部構成を示すブロック図である。
図2に示されるように、この測定装置2は、検出部6と、信号処理部7と、測定制御部8と、I/Oインタフェース9とを備えている。
【0025】
このうち、検出部6は、測定試料から測定対象細胞やその核の数及びサイズ等を検出するものであり、本実施の形態では、図9及び図10に示されるフローサイトメータ10が採用されている。
【0026】
信号処理部7は、検出部6からの出力信号に必要な信号処理を行う信号処理回路よりなる。また、測定制御部8は、マイクロプロセッサ11と記憶部12とを含んでおり、記憶部12は、ROM及びRAM等よりなる。
【0027】
記憶部12のROMには、検出部6や信号処理部7の動作制御を行う制御プログラムと、この制御プログラムの実行に必要なデータとが格納されており、マイクロプロセッサ11は、その制御プログラムをRAMにロードして、又は、ROMから直接実行することが可能である。
【0028】
測定制御部8のマイクロプロセッサ11は、I/Oインタフェース9を介して、データ処理装置4と後述する調製制御部16のマイクロプロセッサ19に繋がっており、これにより、自身が処理したデータや自身の処理に必要なデータを、データ処理装置4及び調製制御部16のマイクロプロセッサ19との間で送受信できるようになっている。
【0029】
〔試料調製装置の構成〕
図3は、試料調製装置3の内部構成を示すブロック図である。
図3に示されるように、この試料調製装置3は、調製制御部16と、I/Oインタフェース17と、生体試料に対する成分調整を自動的に行うための調製デバイス部18とを備えている。
【0030】
調製制御部16は、マイクロプロセッサ19と、記憶部20と、センサドライバ21と、駆動部ドライバ22とを含んでおり、記憶部20は、ROM及びRAM等よりなる。
本実施の形態の調製デバイス部18は、検体セット部150と、細胞分散部25と、検体ピペット部26と、検体定量部27と、試薬定量部28と、弁別・置換部29と、超音波振動部100と、容器移送部110と、液体除去部120と、反応部24とから構成されている。
【0031】
このうち、検体セット部150は、患者から採取された生体試料とメタノール主成分の保存液とを収容する複数の生体容器53(図11参照)をセットするためのものであり、 反応部24は、調製された液体試料を収容する測定試料容器54をセットするためのものである。
【0032】
細胞分散部25は、生体試料と保存液との混合液を攪拌して試料に含まれる細胞を強制的に分散させるものである。
【0033】
検体ピペット部(試料分注部)26は、細胞が分散された生体試料と保存液との混合液を生体容器53から取り出して調製デバイス部18の流体回路に導入したり、調製された液体試料を測定試料容器54に排出したり(図11参照)当該測定試料容器54から取り出したりするものである。検体定量部27は、流体回路に供給される生体試料と保存液との混合液を定量するものである。また、試薬定量部28は、生体試料に加える染色液等の試薬を定量するものである。
【0034】
弁別・置換部29は、保存液と希釈液とを置換するとともに、測定対象細胞とそれ以外の細胞(赤血球、白血球等)や細菌等とを弁別するためのものである。また、弁別・置換部29は、前記弁別・置換された測定対象細胞を含む液体試料から、測定対象細胞の濃度を高めた液体試料を得るためのものである。
【0035】
超音波振動部100は、弁別・置換部29において濃度が高められた測定試料に超音波振動を付与して、凝集している測定対象細胞を分離させるためのものである。
容器移送部110は、反応部24に設置されている測定試料容器54(図4参照)を把持して当該測定試料容器54を、反応部24、容器載置部130、超音波振動部110及び液体除去部120の間で移送するためのものである。
【0036】
液体除去部120は、超音波振動部100において液体中に漬けられた測定試料容器54の外周面に付着した液分を取り除くためのものである。液分を取り除くことにより、測定試料容器54を反応部24等に配置して長時間放置したとき等に当該測定試料容器54が反応部24等に固着するのを防止することができる。
なお、前記各部24〜29、100、110、120、150を有する調製デバイス部18の流体回路の構成(図11〜12)については、後述する。
【0037】
記憶部20のROMには、センサドライバ21及び駆動部ドライバ22の動作制御を行う制御プログラムと、この制御プログラムの実行に必要なデータとが格納され、マイクロプロセッサ19は、その制御プログラムをRAMにロードして、又は、ROMから直接実行することが可能である。
【0038】
調製制御部16のマイクロプロセッサ19は、I/Oインタフェース17を介して前記測定制御部8のマイクロプロセッサ11に繋がっており、これにより、自身が処理したデータや自身の処理に必要なデータを、測定処理部8のマイクロプロセッサ11との間で送受信できるようになっている。
【0039】
また、調製制御部16のマイクロプロセッサ19は、センサドライバ21と駆動部ドライバ22を介して、調製デバイス部18の各部24〜29、100、110、120、150のセンサ類や駆動部を構成する駆動モータと繋がっており、センサからの検知信号に基づいて制御プログラムを実行し、駆動部の動作を制御する。
【0040】
本実施の形態に係る試料調製装置3では、後述するようにして弁別・置換部29において濃縮された測定対象細胞を含む液体試料に超音波振動を付与して、当該液体試料中で凝集している測定対象細胞を分離させる処理を行っている。
【0041】
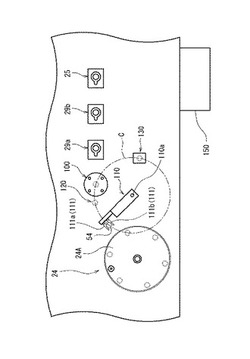
図4は、このような超音波処理に係る試料調製装置3の要素の平面説明図である。試料調製装置3は、かかる超音波処理のために、超音波振動部100、容器移送部110、液体除去部120、及び容器載置部130を備えている。超音波振動部100、液体除去部120及び容器載置部130は、同一円周上に配置されており、反応部24における6つの測定試料容器配置箇所のうちの1箇所は当該円周上に配置可能にされている。具体的には、前記超音波振動部100等は容器移送部110の回動中心を中心とする円周上に配置されている。したがって、容器移送部110を回動させることで測定試料容器54を、超音波振動部100、液体除去部120、容器載置部130、及び反応部24の間で移送することができる。
【0042】
超音波振動部100は、図5に示されるように、液体収容部101と、超音波振動子102とを備えている。液体収容部101は、円筒体形状を呈しており、水等の液体103を収容する凹部104を有している。この凹部104の開口には、測定試料容器54が挿通し得る大きさの円孔が形成された蓋105が設けられている。この蓋105により超音波振動による液体103の外部への飛散を防止することができる。
【0043】
超音波振動子102は円柱形状を呈しており、前記液体収容部101の下部に配置されている。このため、超音波振動子102に防水加工を施す必要がなく、構成を簡素化することができる。超音波振動子102としては、例えば部品の洗浄等に用いられている公知のものを利用することができる。
【0044】
液体収容部101の周壁の下部には、当該液体収容部101の凹部104内に、液体供給源106Aより液体103を供給する供給孔106が形成されており、一方、前記周壁の上部には、吸引源107Aによって凹部104から液体103を排出する排出孔107が形成されている。供給孔106と液体供給源106Aは管路160により接続されており、排出孔107とチャンバ108は管路161により接続されている。管路160の途中には流路切替バルブ162が配設されており、この流路切替バルブ162と前記チャンバ108は管路163により接続されている。液体供給源106A及び吸引源107Aの駆動は、前述の試料調製装置3の調製制御部16により制御される。
【0045】
液体収容部101の周壁であって前記排出孔107のさらに上部には、液体103が液体収容部101の凹部104からあふれるのを防止するためのオーバーフロー流路164が形成されている。このオーバーフロー流路164は装置外へつながっている。
チャンバ108には、前記吸引源107A、管路161及び管路163とともに、吸引源107Aによってチャンバ108内に導かれた液体103を装置外に排出する排出管165が接続されている。
【0046】
流路切替バルブ162は、液体収容部101の凹部104内に液体103を供給するときには、液体供給源106Aと当該凹部104とを連通させ、一方、液体収容部101の凹部104内から液体103を排出するときには、チャンバ108と当該凹部104とを連通させるように切り替えられる。
【0047】
超音波振動を効果的に発生させるために、超音波振動子102により発生する超音波の節が前記凹部104内に収容される液体103の水面の位置になるように深さd(測定試料容器54を漬けた状態での液体の深さ)が設定されている。
【0048】
そこで、本実施の形態では、液体収容部101の凹部104内の液体に測定試料容器54を漬けた後に前記供給孔106から所定量の液体を凹部104内に供給し、調製制御部16により吸引源を所定時間駆動させて、前記排出孔107から凹部104内の余分の液体103を排出する。排出孔107の下端の凹部104の底面からの高さは、超音波振動子102により発生する超音波の節が液体103の水面の位置になるように設定されているので、凹部104内の液体を所定時間吸引し続けると、液体103の水面の位置は超音波の節の位置になるように調整される。液体を吸引する「所定の時間」は、供給した液体の量及び吸引源の排出能力から算出される時間に数秒程度の時間を足した時間とすることができる。算出される時間よりも長めに吸引したとしても、排出孔107よりも下方の液体が排出されてしまうことはないので、液面の調整には支障がない。
【0049】
筒状の液体収容部101の内径D1は、円柱状の超音波振動子102の外径D2よりも数mm程度、例えば5〜6mm程度大きくされている。このように超音波が付与される液体部分の大きさを超音波振動子102よりも大きくすることで、超音波振動を効率よく液体に伝達することができる。
【0050】
測定試料容器54は、容器移送部110のはさみ状の把持部111に把持された状態で液体収容部101の液体中に漬けられる(図5参照)が、その際、当該測定試料容器54内の液体試料の液面が凹部104内の液体103の液面よりも下方に位置するように、前記容器移送部110の下降位置が設定されている。測定試料容器54内の液体試料の液面が凹部104内の液体103の液面よりも上方に位置すると、液体試料に効果的に超音波振動を伝達することができず、その結果、液体試料中の凝集した測定対象細胞を確実に分離させることができなくなる。本発明において特に限定されるものではないが、測定試料容器54内の液体試料の液面は、凹部104内の液体103の液面よりも1〜2mm程度下方に位置するのが好ましい。
【0051】
測定試料容器54は合成樹脂やステンレス等の金属で作製することができるが、凹部104内に収容される液体の音響インピーダンスと同程度の音響インピーダンスを有する材料で作製するのが好ましい。例えば、凹部104内に水を収容する場合、測定試料容器54はポリプロピレンやポリエチレンなどの合成樹脂で作製するのが好ましい。本実施の形態では、凹部104内の液体を介して間接的に液体試料に超音波振動を付与しているが、超音波振動を伝達する液体と測定試料容器54の特性(音響インピーダンス)を同程度のものにすることで、超音波振動の伝達効率を向上させることができる。
【0052】
また、測定試料容器54の内周面は、分散効果を向上させるという観点より、ある程度の粗さを有する面とするのが好ましく、具体的には、表面粗さを例えば1〜30μm程度にするのが好ましい。
超音波振動子102により付与される超音波振動の振動数は、本発明において特に限定されるものではないが、20kHz以上であることが好ましく、さらに、20〜75kHzであることが好ましい。
【0053】
容器移送部110は、図4に示されるように、その回動中心110aが、前記超音波振動部100、液体除去部120及び容器載置部130により形成される円Cの中心に位置するように配設されている。容器移送部110の先端部には、前記鋏状の把持部111が設けられている。鋏状の把持部111は、図5に示されるように、左右一対の把持片111a、111bからなっており、両把持片111a,111bはバネ112によって閉止方向に付勢されている。各把持片111a、111bの対向する面には、測定試料容器54の上端部に形成された環状の鍔部54a(図6参照)と係合する溝113が形成されている。
【0054】
図4に戻り、容器移送部110による測定試料容器54の移送は、以下のようにして行われる。
まず、容器移送部110を回動させて、前記把持部111の両把持片111a、111bと測定試料容器54の上端部に形成された環状の鍔部54aとを係合させる。このとき、前記把持部111は、バネ112の付勢力により測定試料容器54を把持している。
【0055】
ついで、容器移送部110を上昇させ、さらに測定試料容器54を移動させる位置まで回動させる。その後、容器移送部110を下降させ、把持部111の両把持片111a、111bをバネ112の付勢力に抗して開放させる。これにより、把持片111a、111bの溝112と測定試料容器54の鍔部54aとの係合が解除され、測定試料容器54は所定位置に配置される。
【0056】
液体除去部120は、図6に示されるように、本体部121と、給気部122と、吸気部123とを備えている。本体部121は、測定試料容器54のうち少なくとも前記凹部104内の液体に漬けられた部分を収容可能な収容凹部124を有している。この収容凹部124の水平断面は円形であり、その内径は測定試料容器54の外径よりも数mm程度大きくされており、当該収容凹部124内に挿入された測定試料容器54の外周面との間に若干のスペースを確保することができる。
【0057】
給気部122は本体部121の上部付近に設けられており、前記収容凹部124に収容された測定試料容器54の外周面に空気を供給する。給気口122は、給気源(陽圧付与源)122Aに接続されており、図7に示されるように、横給気路125、縦給気路126、環状給気路127、及び給気口129を備えている。給気口129は、収容凹部124の開口部の周縁に沿って立設された突出壁128に周方向に等間隔で6個形成されている。
一方、図6に示されるように、吸気部123は、収容凹部124の底部に設けられており、吸引源123Aに接続されている。
【0058】
給気源122Aから供給された空気は、図7に示されるように、横給気路125、縦給気路126、環状給気路127、及び給気口129を通って、収容凹部124内に収容されている測定試料容器54の外周面に吹き付けられる。そして、吹き付けられた空気によって、測定試料容器54の外周面に付着していた液体は当該外周面から吹き飛ばされ、前記空気とともに吸気部123から排出される。
【0059】
〔データ処理部の内部構成〕
図8は、データ処理装置4の内部構成を示すブロック図である。
図8に示されるように、本実施の形態のデータ処理装置4は、例えばノートPC(デスクトップ型でもよい。)等のパーソナルコンピュータよりなり、処理本体31と、表示部32と、入力部33とから主に構成されている。
【0060】
処理本体31は、CPU34と、ROM35と、RAM36と、ハードディスク37と、読出装置38と、I/Oインタフェース39と、画像出力インタフェース40とを備えており、これらの各部は内部バスによって通信可能に接続されている。
CPU34は、ROM35に記憶されているコンピュータプログラムやRAM36にロードされたコンピュータプログラムを実行することが可能である。
【0061】
ROM35は、マスクROM、PROM、EPROM、EEPROM等によって構成され、CPU34に実行されるコンピュータプログラム及びこれに用いるデータ等が格納されている。
【0062】
RAM36は、SRAM又はDRAM等で構成され、ROM35及びハードディスク37に記録されている各種のコンピュータプログラムの読み出しや、それらのコンピュータプログラムを実行するときのCPU34の作業領域として利用される。
【0063】
前記ハードディスク37には、オペレーティングシステム及びアプリケーションプログラム等、CPU34に実行させるための種々のコンピュータプログラム及びそのプログラムの実行に用いるデータがインストールされている。
【0064】
また、ハードディスク37には、例えば、米国マイクロソフト社が製造販売するWindows(登録商標)等のグラフィカルユーザインタフェース環境を提供する、オペレーティングシステムがインストールされている。
【0065】
更に、ハードディスク37には、測定制御部8及び調製制御部16への動作命令の送信、測定装置2で行った測定結果の受信及び分析処理、並びに、処理した分析結果の表示等を行う操作プログラム41がインストールされている。この操作プログラム41は、当該オペレーティングシステム上で動作する。
【0066】
読出装置38は、フレキシブルディスクドライブ、CD−ROMドライブ、又はDVD−ROMドライブ等で構成され、可搬型記録媒体に記録されたコンピュータプログラム又はデータを読み出すことができる。
【0067】
I/Oインタフェース39は、例えば、USB、IEEE1394、RS−232C等のシリアルインタフェース、SCSI、IDE、IEEE1284等のパラレルインタフェース、及びD/A変換器、A/D変換器等からなるアナログインタフェース等から構成されている。
【0068】
I/Oインタフェース39には、キーボード及びマウスからなる入力部33が接続され、これをユーザが操作することでコンピュータへのデータ入力が可能となっている。
また、I/Oインタフェース39は、測定装置2のI/Oインタフェース9とも接続されており、これにより、測定装置2とデータ処理装置4との間でデータの送受信を行うことができる。
【0069】
画像出力インタフェース40は、LCD又はCRT等よりなる前記表示部32に接続されており、CPU34からの画像データに応じた映像信号を当該表示部32に出力させるものである。
【0070】
〔検出部(フローサイトメータ)の構成〕
図9は、前記検出部6を構成するフローサイトメータ10の機能ブロック図であり、図10は、そのフローサイトメータ10の光学系を示す側面図である。
図9に示されるように、フローサイトメータ10のレンズ系43は、光源である半導体レーザ44からのレーザ光を、フローセル45を流れる測定試料に集光するものであり、集光レンズ46は、測定試料中の細胞の前方散乱光をフォトダイオード47よりなる散乱光検出器に集光するものである。
【0071】
図9では、レンズ系43を単一レンズで図示してあるが、具体的には、例えば図10に示されるような構成になっている。
すなわち、本実施の形態のレンズ系43は、半導体レーザ44側(図10の左側)から順に、コリメータレンズ43a、シリンダレンズ系(平凸シリンダレンズ43b+両凹シリンダレンズ43c)及びコンデンサレンズ系(コンデンサレンズ43d+コンデンサレンズ43e)から構成されている。
【0072】
図9に戻り、側方用の集光レンズ48は、測定対象細胞又はこの細胞中の核の側方散乱光と側方蛍光をダイクロイックミラー49に集光する。このダイクロイックミラー49は、側方散乱光を散乱光検出器であるフォトマルチプライヤ50へ反射させ、側方蛍光を蛍光検出器であるフォトマルチプライヤ51の方へ透過させる。これらの光は、測定試料中の細胞や核の特徴を反映したものとなっている。
【0073】
そして、フォトダイオード47及び各フォトマルチプライヤ50、51は、受光した光信号を電気信号に変換して、それぞれ、前方散乱光信号(FSC)、側方散乱光信号(SSC)及び側方蛍光信号(SFL)を出力する。これらの出力信号は図示しないプリアンプにより増幅され、測定装置2の信号処理部7(図2参照)に送られる。
【0074】
測定装置2の信号処理部7で処理された各信号FSC、SSC、SFLは、それぞれ、マイクロプロセッサ11によってI/Oインタフェース9からデータ処理装置4に送信される。
【0075】
データ処理装置4のCPU34は、前記操作プログラム41を実行することにより、各信号FSC、SSC、SFLから細胞や核を分析するためのスキャッタグラムを作成し、このスキャッタグラムに基づいて、測定試料中の細胞が異常であるか否か、具体的には癌化した細胞であるか否かを判定する。
【0076】
なお、フローサイトメータ10の光源としては、半導体レーザ44の代わりにガスレーザを用いることもできるが、低コスト、小型、且つ低消費電力である点より半導体レーザ44を採用するのが好ましく、かかる半導体レーザ44の採用によって製品コストを低減させるとともに、装置の小型化及び省電力化を図ることができる。
【0077】
また、本実施の形態では、ビームを狭く絞ることに有利な波長の短い青色半導体レーザを用いている。青色半導体レーザは、PI等の蛍光励起波長に対しても有効である。なお、半導体レーザのうち、低コスト且つ長寿命であり、メーカーからの供給が安定している赤色半導体レーザを用いてもよい。
【0078】
ところで、子宮頸部の上皮細胞の大きさは平均で約60μmであり、また核の大きさは5〜7μmである。この細胞が癌化すると細胞分裂の頻度が異常に多くなり、核は10〜15μmの大きさとなる。これにより、N/C比(核の大きさ/細胞の大きさ)が正常な細胞に比べて大きくなる。
【0079】
従って、細胞と核の大きさを検出することによって、細胞が癌化したか否かの判断指標とすることができる。
そこで、本実施の形態では、フローセル45を流れる測定試料からの散乱光をフォトダイオード47で検出するとともに、フローセル45を流れる測定試料からの蛍光をフォトマルチプライヤ51で検出する。
【0080】
測定装置2の信号処理部7(図2参照)は、フォトダイオード47から出力された散乱光信号から、測定対象細胞の大きさを反映した値である散乱光信号のパルス幅を取得するとともに、フォトマルチプライヤ51から出力された蛍光信号から、測定対象細胞の核の大きさを反映した値である蛍光信号のパルス幅を取得する。
【0081】
そして、前記信号処理部7で得た測定対象細胞の大きさを反映した値と、測定対象細胞の核の大きさを反映した値に基づいて、当該測定対象細胞が異常であるか否かを、分析部を構成するデータ処理装置4のCPU34が判定するようになっている。
具体的には、データ処理装置4のCPU34は、測定対象細胞のピーク、核径、面積の値が所定の閾値より大きい場合に、測定対象細胞が異常であると判定する。
【0082】
〔調製デバイス部の流体回路〕
図11は、調製デバイス部18の検体セット部150、細胞分散部25、検体ピペット部26、検体定量部27、試薬定量部28、超音波振動部100、液体除去部120、反応部24の流体回路図であり、図12は、調製デバイス部18の弁別・置換部29の流体回路図である。
【0083】
検体セット部150は、生体容器53を載置可能なラック151をセットするラックセット領域を備えており、ラック151にセットされた生体容器53内の生体試料と保存液との混合液を後述する第1ピペット26Aで吸引可能な位置まで搬送する機能を有している。
【0084】
細胞分散部25は、分散容器内の生体試料と保存液との混合液を攪拌する攪拌棒25Aと、これを回転駆動する駆動部25Bとを備えており、駆動部25Bは、DCモーターからなり、攪拌棒25Aを分散容器内に挿入して回転させる。これにより、後述する第1ピペット26Aによって分散容器内に排出された混合液が攪拌され、生体試料に含まれる細胞を分散させることができる。
【0085】
検体ピペット部26は、第1ピペット26Aと第2ピペット26Bとを備えている。第1ピペット26Aは、生体容器53内の生体試料と保存液との混合液を吸引し、細胞分散部25の分散容器に混合液を排出する。また、第1ピペット26Aは、分散処理後に分散済の混合液を吸引し、弁別・置換部29の置換容器57(図12参照)まで移動し、混合液を置換容器57内に排出する。置換容器57に排出された混合液は弁別・置換され、弁別・置換された測定対象細胞を含む液体試料から測定対象細胞の濃度を高めた液体試料が調製される。その後、第1ピペット26Aは、置換容器57から測定対象細胞の濃度を高めた液体試料を吸引し、容器載置部130(図4参照)に配置された測定試料容器54まで移動し、測定試料容器54内に液体試料を排出する。第2ピペット26Bは、試薬定量部28から供給される染色液等の試薬を測定試料容器54に排出する。
【0086】
検体定量部27は、定量シリンダ27Aと、このシリンダ27Aに挿通された定量ピストンを上下動させる、ステッピングモーターからなる駆動部27Bとを備えている。定量シリンダ27Aは、方向切替バルブV1を介して第1ピペット26Aと管路で繋がっている。
【0087】
弁別・置換部29は、図12に示されるように、上方開口状の置換容器57と、この置換容器57内で上下方向に移動可能なピストン58と、このピストン58を置換容器57内で上下動させる、ステッピングモーターからなる駆動部59とを備えている。
【0088】
置換容器57は、切替バルブV4、V5を介して洗浄液ユニット90と管路で繋がっており、洗浄液ユニット90から切替バルブV4、V5を介して置換容器57に洗浄液が供給される。また、切替バルブV6を介して希釈液ユニット55と管路で繋がっており、希釈液ユニット55から切替バルブV6を介して置換容器57に希釈液が供給される。
【0089】
ピストン58は、測定対象細胞(上皮細胞)は通過させず、且つ、それより小径の細胞(赤血球、白血球等)は通過させるフィルタ60を下部に備えた中空筒体よりなっている。このピストン58は、切替バルブV8を介して陽圧源71に管路で繋がっている。このため、切替バルブV8を開放することでピストン58の内部に陽圧を供給することができる。また、ピストン58は、切替バルブV9を介してピストン58の内部空間と外部とが接続されており、切替バルブV9を開放することで、ピストン58の内部空間を大気開放することができる。
【0090】
さらに、ピストン58は、切替バルブV10、V12を介して濾液の廃棄部61に管路で繋がっている。このため、ピストン58の内部から吸引された濾液は、切替バルブV10、V12を通じて外部に廃棄される。
【0091】
また、ピストン58は、切替バルブV7を介して洗浄液ユニット90と管路で繋がっており、洗浄液ユニット90から供給された洗浄液は、ピストン58及び置換容器57を洗浄するのに用いられる。そして、ピストン58及び置換容器57内を洗浄した洗浄液は、切替バルブV11、V13を介して廃棄部61に排出される。
【0092】
図11に戻り、試薬定量部28は、一対の定量シリンダ28A、28Bと、この各シリンダ28A、28Bにそれぞれ挿通された定量ピストンを上下動させる、ステッピングモーターからなる駆動部28Cを備えている。各定量シリンダ28A、28Bは、それぞれ供給切替バルブV2、V3を介して第2ピペット26Bと管路で繋がっており、各定量シリンダ28A、28Bで定量された試薬は、供給切替バルブV2、V3を介して第2ピペット26Bに供給され、測定試料容器54内に排出される。
【0093】
これにより、反応部24の測定試料容器54に収容されている測定対象細胞の濃度を高めた液体試料に対して、試薬定量部28が定量した複数種類の所定分量の試薬を混合できるようになっている。
【0094】
本実施の形態では、試薬定量部28の各定量シリンダ28A、28Bで定量される試薬は2種類ある。このうち、一方の定量シリンダ28Aで計量して生体試料に加える試薬は、PI染色を行うための染料液であり、他方の定量シリンダ28Bで計量して生体試料に加える試薬は、細胞にRNA処理を行うためのRNaseである。PI染色は、色素を含んでいる蛍光染色液であるヨウ化プロピジウム(PI)により行われる。PI染色では核に選択的に染色が施されるため、核からの蛍光が検出可能となる。また、RNA処理とは、細胞中のRNAを溶かすための処理である。染料液は、上皮細胞のRNAとDNAの両方を染色してしまうので、前記のRNA処理を行うことでRNAが溶け染料液によって染まらなくなるので、細胞核のDNAを正確に測定することが可能となる。
【0095】
反応部24は、円形の回転テーブル24Aと、これを回転駆動する駆動部24Bとを備えている。駆動部24Bはステッピングモーターからなる。回転テーブル24Aの外周縁部には、弁別・置換部29で調製された、測定対象細胞の濃度を高めた液体試料を収容する測定試料容器54をセット可能な保持部が設けられている。
【0096】
なお、図11及び図12で示される各部の駆動部や切替弁(電磁弁)V1〜V13に対する動作制御は、前記調製制御部16(マイクロプロセッサ19)からの制御指令に基づいて行われる。
【0097】
〔弁別・置換部の構成〕
本実施の形態における弁別・置換部29の構成について、図13を用いて説明する。図13は、本実施の形態における図12の弁別・置換部29における置換容器57の底部付近の断面説明図である。
図13に示されるように、本実施の形態の弁別・置換部29は、置換容器57と、前記置換容器57内で上下方向に移動可能な円筒体からなるピストン58と、円筒体からなるピストン58の下端面に配設された、測定対象細胞を選別するためのフィルタ60と、測定対象細胞を含む液体の液面を検知する液面検知センサ82と、を備えている。
【0098】
置換容器57は、分析対象となる分析物(測定対象細胞)を収容可能な収容室68と、この収容室に連通して配設された濃縮試料収容室80とを備えている。収容室68には、液体試料中に含まれる測定対象細胞を、収容室68から濃縮試料収容室80へ移動させる回転子72(回転部材)が収容されている。この回転子72は磁力で回転するように構成されており、収容室68の底部下方に、回転子72に磁力を与えるための磁石69と、この磁石69を回転させるための駆動モータ70とを備えている。
【0099】
回転子72は、円柱体形状を呈しており、三フッ化エチレン(PCTFE)等で作製される。回転子72の周面には、中心に向かう穴73が形成されており、この穴73に丸棒状の磁石75が収納される。
【0100】
ピストン58は、その底部に保持具65を介してフィルタ60が配設されている。ピストン58は、前記フィルタ60に液体を通過させることにより、測定対象細胞を主に含む第1液体と、測定対象細胞よりも小径の細胞を主に含む第2液体とに液体を分離する液体分離部として機能している。
【0101】
本実施の形態では、測定対象細胞として子宮頸部の上皮細胞を想定しており、この上皮細胞の大きさは概ね20〜80μm(平均は60μm程度)である。また、かかる測定対象細胞より小さい細胞である赤血球の大きさは、概ね7〜10μmであり、同じく測定対象細胞より小さい細胞である白血球の大きさは、概ね8〜15μmである。更に、細菌等の夾雑物の大きさは、概ね1〜数μm程度である。
【0102】
そこで、本実施の形態におけるフィルタ60は、置換容器57内の液体に圧力がかかった状態でも上皮細胞が前記フィルタ60の通孔を通過してピストン58内に移動しないように、20μmより小さい8〜20μmの径の通孔を有する金属製のCVD(Chemical Vapor Deposition:化学気相成長法)で作製されている。かかる金属製のCVDフィルタは、その他の樹脂製のフィルタや、金属製であってもメッシュ製のものに比べて通孔の変形が少なく、開口率を高められるという利点がある。
【0103】
また、フィルタ60の孔径を8〜20μmに設定したのは、8μm未満であれば、細胞や夾雑物が通孔に早期に詰まる現象が多く見られ、20μmを超えると、置換容器57内の液体に圧力がかかっている状態では上皮細胞が通孔を通過してしまうことが多くなるからである。なお、フィルタ60の孔径は、15μm前後がより好ましい。
【0104】
液面検知センサ82は、置換容器57の下部に、当該置換容器57内の第1液体の液面を検知するために配設されている。液面検知センサ82は、静電容量タイプのものであり、その先端部が、置換容器57の内面から2〜3mm程度内方に突出している。そして、突出した部分の先端にピン状のセンサ部82aが設けられている。
【0105】
液面検知センサ82は、測定対象細胞を含む第1液体の液面が前記フィルタ60のほぼ下面の位置に達したことを検知するために用いられる。
本実施の形態では、フィルタ60の下面よりも上方約2.0mmの位置にセンサ部82aを配設し、前記表面張力の影響及び第2液体の吸引速度をも考慮して、センサ部82aからの検知信号を受信していから所定時間経過後に、ピストン58内の第2液体の吸引を停止するようにしている。また、ピン状のセンサ部82aを斜め上方に配置することにより、液切れを良くして液面検知の精度を上げることができる。このとき、配置する角度としては、水平面に対して、概ね5〜90度の範囲である。
【0106】
本実施の形態では、置換容器57の底部に、収容室68と、該収容室68の周縁部に連通して配設された濃縮試料収容室80が配設されている。この濃縮試料収容室80は、収容室68に収容されている回転子72の回転により移動させた測定対象細胞を収集する役割を果たしている。後述する弁別操作によって測定対象細胞の一部がフィルタ60の下面に付着するが、この付着した測定対象細胞は、回転子72の回転によりフィルタ60の下面から引き剥がされ、更に、回転子72の回転に伴って発生する遠心力により、収容室68の周縁部に連通して配設された濃縮試料収容室80に収集される。
【0107】
ここで、本実施形態における、生体試料と保存液との混合液を弁別し、弁別した測定対象細胞を含む液体試料から測定対象細胞の濃度を高めた液体試料が調製されるまでについて、図14の模式図を用いて詳細に説明する。
まず図14(a)に示すように、フィルタ60が、置換容器57内の生体試料と保存液との混合液の液面上方から、その液中に向かって下方に移動するように、ピストン58を下降させる。
【0108】
すると、図14(b)に示すように、測定対象細胞(C1)を含む液体(第1液体)が、置換容器57内のフィルタ60の下方に残り、測定対象細胞より小径の細胞(C2)を含む液体(第2液体)が、フィルタ60の上方(ピストン58の内部)に残る。
その後、図14(c)に示すように、ピストン58の内部に残っている第2液体を外部に排出させる。このとき、ピストン58の内部に陰圧をかけて第2液体を吸引するため、第1液体中に含まれる測定対象細胞(C1)の一部は、フィルタ60の下方に付着する。
【0109】
そして、図14(d)に示すように、回転子72を回転させることにより、フィルタ60の下方に付着している測定対象細胞が引き剥がされるとともに、第1液体中に含まれる測定対象細胞が濃縮試料収容室に収容される。この濃縮試料収容室に収容された測定対象細胞を含む液体を取得することにより、測定対象細胞の濃度が高い測定試料を得ることができる。
【0110】
なお、図13に示されるように、濃縮試料収容室80は、その底部に、下方に向かって断面積が徐々に減少するテーパ部83が形成されている。濃縮試料収容室80に収容された液体試料は、液体取得部である前記第1ピペット26Aにより吸引されるが、その際、第1ピペット26Aの先端は前記テーパ部83の先端近傍まで下降し、この先端近傍から液体試料を吸引するように構成されている。これにより、濃縮試料収容室80内の液体試料をできるだけ多く吸引して無駄なく利用することが可能となる。
【0111】
〔処理動作〕
つぎに前述した細胞分析装置1の処理動作について説明する。
図15及び図16は、細胞分析装置1の各制御部8、16、31が行う処理を示すフローチャートである。
なお、図15では、データ処理装置4の制御部(処理本体)31が行う処理フローを右列に示し、測定装置2の制御部8が行う処理フローを左列に示している。また、図16では、試料調製装置3の制御部16が行う処理フローを一列に示しているが、この処理フローは、図示のA、B及びC点において図15の処理フローと繋がっている。以下、この図15及び図16を参照しつつ、細胞分析装置1が行う処理内容を説明する。
【0112】
まず、最初に、データ処理装置4の制御部31は、前記表示部32にメニュー画面を表示させる(ステップS1)。その後、このメニュー画面に従った測定開始指示を入力部33から受け付けると(ステップS2)、データ処理装置4の制御部31は、測定開始信号を測定装置2に送信する(ステップS3)。
測定装置2の制御部8は、前記測定開始信号を受信すると(ステップS4)、調製開始信号を試料調製装置3に送信する(ステップS5及びA点)。
【0113】
試料調製装置3の調製制御部16は、初期化処理において、液体収容部101の凹部104に液体供給源106Aより液体103を供給し、ついで、図16に示されるように、前記調製開始信号を受信すると(ステップS6)、測定試料の調製に用いられる試薬(染色液、RNase)を装置内の流路に吸引するとともに、生体容器53内に収容された生体試料とメタノール主成分の保存液との混合液を細胞分散部25の分散容器内に送る。ついで、混合液中の細胞を細胞分散部25で分散させる(ステップS7,S8,S9)。
【0114】
その後、試料調製装置3の調製制御部16は、分散済みの混合液を分散容器から所定量だけ吸引させて、弁別・置換部29の置換容器57に送り、その弁別・置換部29に、生体試料と保存液との混合液に対する弁別・置換処理を行わせる(ステップS10)。
【0115】
〔弁別・置換処理の内容〕
図17〜18は、前記弁別・置換処理(ステップS10)を示すフローチャートである。
図17に示されるように、まず、試料調製装置3の調製制御部16は、検体ピペット部26を細胞分散部25に移動させ(ステップT1)、第1ピペット26Aに分散済みの混合液を分散容器から所定量だけ吸引させる(ステップT2)。
【0116】
ついで、調製制御部16は、検体ピペット部26を置換容器57に移動させ(ステップT3)、第1ピペット26Aに、吸引した混合液を当該置換容器57内に排出させる(ステップT4)。
ついで、置換容器57内に希釈液ユニット55からバルブV6を通して希釈液(置換液)が投入される(ステップT5)。
【0117】
ついで、ピストン58が駆動部59によって所定のろ過高さまで下方に移動され(ステップT6)、置換容器57内の混合液が当該ピストン58内に吸引されてろ過される(ステップT7)。この吸引ろ過時には、リリーフバルブが接続されているバルブV10及びV12が用いられる。このとき、リリーフバルブは-5kpaに設定されている。これにより、吸引ろ過時には、ピストン58の下端部に配設されているフィルタ60に約-3kpaの圧力がかかる。このような弱い陰圧で液体を吸引ろ過することにより、測定対象細胞がフィルタ60を通過して廃棄部61に排出することなくろ過を行うことができる。
【0118】
ついで、ピストン58が駆動部59によってさらに下方に移動され(ステップT8)、前記ステップT7と同様にして置換容器57内の混合液が当該ピストン58内に吸引されてろ過される(ステップT9)。
【0119】
このようなピストン58の移動及び混合液の吸引ろ過が、所定回数繰り返されて、当該ピストン58が所定の最下死点に移動すると(ステップT10)、前記ステップT7と同様にして置換容器57内のサンプルが当該ピストン58内に吸引ろ過され(ステップT11)、収容容器57内に配置された静電容量タイプの液面検知センサ82のセンサ部82aが液面を検知すると(ステップT12)、所定時間経過後に吸引が停止される(ステップT13)。このとき、置換容器57の底部に配設された収容室68及び濃縮試料収容室80内に、測定対象細胞を含む液体試料が満たされた状態となっている。
【0120】
ついで、フィルタ60の通孔に詰まっている、又は、フィルタ60の下面に付着している細胞(分析対象物)を取り除いて、置換容器57(収容室68及び濃縮試料収容室80)内に戻すために、ピストン58内に陽圧を付与する(ステップT14)。
【0121】
ここで、試料調製装置3の調製制御部16は、ピストン58の最下死点への移動が2回目か否かを判定する(ステップT15)。
試料調製装置3の調製制御部16は、ピストン58の最下死点への移動が2回目でない場合には、置換スピッツへ希釈液の投入(ステップT5)から再度ろ過を繰り返し、2回目である場合には、ステップT16に進む。
【0122】
ステップT16では、駆動モータ70により磁石69を回転させることで回転子72を回転させ、フィルタ60の下面に付着している測定対象細胞を取り除くと共に、収容室68内の液体試料中に含まれる測定対象細胞を濃縮試料収容室80の方に移動させて、濃縮試料収容室80内に測定対象細胞を収容する(ステップT16)。
【0123】
この弁別・置換処理により、測定対象細胞(上皮細胞)を主に含み測定対象細胞以外の細胞の数が低減された液体(濃縮液)を取得することができる。また、前記弁別・置換処理により、生体容器53から置換容器57に供給された液体(生体試料と保存液との混合液)における保存液中のメタノールの濃度を、当該保存液の大部分を希釈液と置換することで薄めることができる。そのため、後述のDNA染色処理において、保存液の影響を低減させ、良好に測定対象細胞のDNAを染色することができる。
【0124】
また、この弁別・置換処理においては、細胞の弁別処理を行いながら、保存液と希釈液の置換処理を行うことができるので、これら2つの処理を別々に行う場合に比べて短時間で弁別処理と置換処理とを行うことができる。
【0125】
また、この弁別・置換処理においては、回転子72を回転させることにより、フィルタ60の下面に付着している測定対象細胞(上皮細胞)を剪断力で剥離してフィルタ60の下方の第1液体に浮遊させるとともに、フィルタ60の上方からフィルタ60の通孔に圧力を付与することにより、フィルタ60の通孔に詰まっている測定対象細胞(上皮細胞)を除去してフィルタ60の下方の第1液体に浮遊させることができる。そのため、フィルタに付着した測定対象細胞(上皮細胞)をロスすることなく効率的に回収することができる。
【0126】
さらに、本実施の形態では、収容室68の周縁部に濃縮試料収容室80を連通して配設しているので、前記スターラー72の回転により、収容室68内の液体試料中に含まれる測定対象細胞は、濃縮試料収容室80に収集される。これにより、収容室68内の液体試料中に含まれる測定対象細胞の濃度が低くなり、濃縮試料収容室80内の液体試料中に含まれる測定対象細胞の濃度が高くなる。したがって、かかる濃縮試料収容室80から液体試料を取得することにより、測定対象細胞の濃度を高めた測定試料を取得することができる。なお、この収集過程において、測定対象細胞の一部が濃縮されることにより互いに凝集することがあるが、かかる凝集した測定対象細胞は、後述する超音波振動付与操作によって分離される。
【0127】
〔測定試料の調製〕
図16に戻り、試料調製装置3の調製制御部16は、検体ピペット部26を置換容器57に移動させ、第1ピペット26Aに濃縮試料収容室80から濃縮液を吸引し、さらに検体ピペット部26を容器載置部130へ移動させ、容器移送部110によって予め反応部24から当該容器載置部130に移送されている測定試料容器54に前記濃縮液を供給する(ステップS11)。
【0128】
ついで、試料調製装置3の調製制御部16は、超音波振動部100に凝集細胞の分離処理を行わせる(ステップS12)。
〔凝集細胞の分離処理の内容〕
図19は、前記凝集細胞の分離処理(ステップS12)を示すフローチャートである。
図19に示されるように、まず、試料調製装置3の調製制御部16は、容器移送部110によって前記測定試料容器54を容器載置部130から超音波振動部100における所定の位置(図5に示される位置)まで移動させ、その一部(下部)を液体収容部101内の液体(水溶液)中に漬ける(ステップS121)。
【0129】
ついで、試料調製装置3の調製制御部16は、流路切替バルブ162を切り替えて液体供給源106Aと液体収容部101の凹部104とを連通させてから、所定量(液面が図5のdを超える量)の液体103を当該液体供給源106Aから液体収容部101の凹部104内に追加供給する(ステップS122)。
ついで、試料調製装置3の調製制御部16は、吸引源107Aを駆動させて所定時間だけ液体収容部101の凹部104から液体103を吸引し、当該液体103の深さd(測定試料容器54を漬けた状態での液体の深さ)になるように調整する(ステップS123)。こうすることで、超音波振動を効果的に発生させることができる。
【0130】
ついで、容器移送部110によって液体中に漬けられた状態で保持された測定試料容器54内の濃縮液に対し、超音波振動子102により超音波振動が付与され、当該濃縮液中で凝集している測定対象細胞が分離される(ステップS124)。
【0131】
本実施の形態では、この超音波処理において、超音波振動部100は、分析対象物である上皮細胞に対して分析に影響するダメージを与えない所定の出力及び時間で超音波振動を付与するように制御されている。
凝集細胞の分散効果を上げるためには、超音波振動の出力を上げる、及び/又は、超音波振動を付与する時間を長くすればよいが、測定試料容器54内の濃縮液に対し超音波振動を付与すると、濃縮液に含まれる凝集細胞が分散される一方において液体の振動に起因して濃縮液の温度が上昇する。
【0132】
表1は、ポリプロピレンからなる測定試料容器(キュベット)54と、ポリエチレンからなる測定試料容器54とについて、超音波振動の出力を14W、16W及び18Wと設定した場合における測定試料容器54の液温の上昇値を調べた結果を示している。超音波振動を付与する時間は5秒又は10秒とした。測定試料容器54内には、測定試料として約530μLの水を収容し、液温は熱電対で測定した。また、測定時の室温は24.1〜25.0℃であった。実験は各条件について3回行い、その平均値を求めた。
【0133】
【表1】

【0134】
表1より、超音波振動の出力が高くなるほど、また超音波の付与時間が長くなるほど測定試料容器54内の液温の温度上昇が大きくなることがわかる。また、測定試料容器54の材質の違いにより測定試料容器54内液温の上昇温度に違いがあり、ポリプロピレンとポリエチレンとでは、ポリプロピレンの方がポリエチレンよりも温度上昇が大きいことがわかる。例えば、超音波振動の出力が18Wで付与時間が10秒の条件で比較すると、ポリプロピレンの方がポリエチレンよりも約1℃測定試料容器54内の液温が高くなった。これは、ポリプロピレンの方がポリエチレンよりも測定試料容器54内の液体に超音波が伝わりやすく、その結果、測定試料容器54内の液温が高くなると考えられる。したがって、凝集細胞を効果的に分散させるという観点からは測定試料容器54内の材質としてポリプロピレンの方がポリエチレンよりも好ましいと考えられる。また、測定試料容器54の材質がポリプロピレンのとき、超音波の付与時間が10秒以内であれば、超音波出力14〜16Wにおいてキュベット内液温の温度はおよそ31℃(温度上昇はおよそ5〜6℃)に抑えることができることがわかる。
【0135】
図16に戻り、試料調製装置3の調製制御部16は、容器移送部110によって前記測定試料容器54を超音波振動部100から液体除去部120に移動させ、当該液体除去部120において測定試料容器54の外周面に付着している水分を空気の吹き付け及び吸引排出により除去する(ステップS13)。
【0136】
ついで、試料調製装置3の調製制御部16は、容器移送部110によって前記測定試料容器54を液体除去部120から反応部24に移動させる。そして、装置内に貯留されていた染色液とRNaseとを、試薬定量部28から第2ピペット26Bに送り、この第2ピペット26Bは、送られてきた染色液とRNaseとを測定試料容器54に供給し(ステップS14)、この測定試料容器54内においてRNA処理とDNA染色を行わせて測定試料を作製する(ステップS15)。
前記処理が終わると、得られた測定試料は第1ピペット26Aを介して、検体定量部27で定量され、定量後に測定装置2の検出部6に供給される(ステップS16及びB点)。
【0137】
なお、試料調製装置3の調製制御部16は、測定装置2からのシャットダウン信号を受信したか否かを常時判定しており(ステップS17及びC点)、その信号を受信していない場合には、調製開始信号の受信如何を判定するステップS6に戻り、その信号を受信した場合には、シャットダウンを実行して試料調製処理を終了する(ステップS18)。シャットダウン処理において、試料調製装置3の調製制御部16は、流路切替バルブ162を切り替えて液体収容部101の凹部104とチャンバ108とを連通させた後に、吸引源107Aを駆動させて当該凹部104から液体103を全て排出させる。
【0138】
〔測定装置による測定とそのデータ分析〕
図15に戻り、測定装置2の制御部8は、調製開始信号を送信したあと、試料調製装置3から測定試料の供給があるか否かを常時判定している(ステップS19)。
そこで、試料調製装置3から測定試料が送液されると(B点)、測定装置2の制御部8は、その測定試料を測定部14のフローセル45に送り、測定試料の細胞に対する前記測定を行い(ステップS20)、その測定データをデータ処理装置4に送信する(ステップS21)。
【0139】
一方、データ処理装置4の制御部31は、測定開始信号を送信したあと、測定装置2から測定データを受信したか否かを常時判定している(ステップS22)。
測定装置2から前記測定データを受信すると、データ処理装置4の制御部31は、その測定データを用いて細胞や核を分析し、測定試料中の細胞が癌化しているか否か等を判定する(ステップS23)。
【0140】
また、データ処理装置4の制御部31は、前記分析結果を表示部32に表示させ(ステップS24)、ユーザ入力によるシャットダウン指示があるか否かを判定する(ステップS25)。
前記シャットダウン指示がある場合には、データ処理装置4の制御部31は、測定装置2にシャットダウン信号を送信する(ステップS26)。
【0141】
測定装置2の制御部8は、データ処理装置4からの前記シャットダウン信号を受信したか否かを常時判定しており(ステップS27)、その信号を受信していない場合には、測定開始信号の受信如何を判定するステップS4に戻り、その信号を受信した場合には、試料調製装置3に前記シャットダウン信号を転送するとともに(ステップS28)、シャットダウンを実行して測定処理を終了する(ステップS29)。
【0142】
本発明では、超音波振動部100において、弁別・置換部29で濃縮された測定試料に超音波振動を付与して当該測定試料中の凝集した測定対象細胞を分離している。これにより、測定精度を向上させることができる。
表2は、超音波振動部による超音波処理を行わなかった場合(コントロール)、測定試料容器にポリプロピレンを用いて超音波処理を行った場合(実施例1)、及び測定試料容器にステンレスを用いて超音波処理を行った場合(比較例1)における、凝集上皮細胞率<凝集上皮細胞率=凝集上皮細胞数/(単一上皮細胞数+凝集上皮細胞数)>を表したものである。ここでは、液体収容部に収容されている液体として水を用いている。
【0143】
実施例1より、測定試料容器としてポリプロピレンを用いた場合、コントロールと比較して凝集上皮細胞の凝集の程度が1/6に減少していることがわかる。また、比較例1より、測定試料容器としてステンレスを用いた場合、超音波処理を施しても、測定対象細胞の凝集の程度はコントロールとほとんど変わらないことがわかる。
【0144】
【表2】

【0145】
前述したように、測定試料容器の材質としては、ポリプロピレン以外にポリエチレンなど他の合成樹脂を用いることができる。表3は、測定試料容器の材質としてポリプロピレンを用い、超音波振動部による超音波処理を行わなかった場合、測定試料容器の材質としてポリプロピレンを用いて超音波処理を行った場合(超音波振動の出力:15W、超音波振動付与時間:5秒)、測定試料容器の材質としてポリエチレンを用いて超音波処理を行った場合(超音波振動の出力:15W、超音波振動付与時間:5秒)における、凝集上皮細胞率<凝集上皮細胞率=凝集上皮細胞数/(単一上皮細胞数+凝集上皮細胞数)>を示している。ここでは、液体収容部に収容されている液体として水を用いている。
【0146】
【表3】

【0147】
表3より、測定試料容器の材質としてポリエチレンを用いた場合、測定試料容器の材質としてポリプロピレンを用いた場合と同様に、超音波処理を施すことで、測定対象細胞の凝集の程度を減少させ得ることがわかる。また、超音波振動の条件が同一である場合、ポリエチレンよりもポリプロピレンの方が、細胞を分散させる効果が高いことが推認される。
【0148】
〔その他の変形例〕
なお、以上開示された実施の形態は、本発明の例示であって制限的なものではない。本発明の範囲は、前記実施の形態ではなく特許請求の範囲によって示され、さらに特許請求の範囲の構成と均等なすべての変更が含まれる。
【0149】
例えば、前記実施の形態では、測定試料を収容した測定試料容器を容器移送部によって超音波振動部に移送し、超音波振動による凝集細胞の分離処理を行った測定試料容器を同じく容器移送部によって液体除去部に移送することで超音波処理の自動化を図っているが、ピペット等の試料移送手段(試料移送部)を用いて、超音波振動部に配設されている容器中に測定試料を移送し、超音波振動による凝集細胞の分離処理を行った測定試料を同じくピペット等の試料移送手段を用いて検体セット部に配置されている別の容器中に移送することもできる。この場合は、前記実施の形態に比べて測定試料のロスが多くなるが、容器移送部や液体除去部を省略することができ、装置の構成を簡素化することができる。
【0150】
また、前記実施の形態では、容器移送部によって測定試料を収容した測定試料容器を容器載置部から超音波振動部へ移送しているが、これに限らず、例えば、ピペット等の試料移送手段によって超音波振動部に配設されている測定試料容器内に測定試料を移送してもよく、また、ユーザーによって測定試料を収容した測定試料容器を超音波振動部に移送してもよい。
【0151】
また、前記実施の形態では、子宮頸部の上皮細胞を測定対象細胞としているが、口腔細胞、膀胱や咽頭など他の上皮細胞、さらには臓器の上皮細胞についても、癌化判定を行うことができる。
【0152】
また、前記実施の形態では、試料調製装置3で調製された測定試料をフローサイトメータで測定しているが、試料調製装置3で調製された測定試料をスライドガラスに塗抹して塗抹標本を作製する塗抹標本作製装置と、作製された塗抹標本を撮像して撮像画像中の上皮細胞を分析する細胞画像処理装置とを設けてもよい。スライドガラスには、測定対象細胞である上皮細胞の濃度が高められ且つ赤血球や白血球などの細胞の数が低減された測定試料が塗抹されるため、上皮細胞の分析を精度良く行うことができる。
【0153】
また、前記実施の形態では、測定装置と試料調製装置は別体となっているが、測定装置と試料調製装置を一体とすることもできる。図19は、測定装置と試料調製装置を一体としたときの測定装置200の内部構成を示すブロック図である。なお、前記実施の形態と同様の構成については、同一の符号を付して説明を省略する。
図19に示されるように、この測定装置200は、反応部24、細胞分散部25、検体ピペット部26、検体定量部27、試薬定量部28、弁別・置換部29、超音波分散部100、容器移送部110、液体除去部120、検体セット部150、検出部6、信号処理部7、制御部140、及びI/Oインターフェース160を備えている。
測定装置200の制御部150は、前記実施の形態に係る図2の測定制御部8と図3の調製制御部16との両方の機能を有している。また、制御部150は、I/Oインターフェース160を介して、データ処理装置4と繋がっており、制御部150が処理したデータや、制御部150の処理で必要なデータをデータ処理装置4との間で送受信することができる。
【符号の説明】
【0154】
1 細胞分析装置
2 測定装置
3 試料調製装置
4 データ処理装置
6 検出部
16 調製制御部
18 調製デバイス部
24 反応部
25 細胞分散部
26 検体ピペット部
27 検体定量部
28 試薬定量部
29 弁別・置換部
31 処理本体
32 表示部
53 生体容器
54 測定試料容器
57 置換容器
58 ピストン
59 駆動部
60 フィルタ
68 収容室
69 磁石
70 駆動モータ
72 回転子
75 磁石
80 濃縮試料収容室
82 液面検知センサ
100 超音波振動部
101 液体収容部
102 超音波振動子
103 液体
104 凹部
106 供給孔
107 排出孔
110 容器移送部
111 把持部
112 溝
120 液体除去部
121 本体部
122 給気口
123 吸気部
124 収容凹部
129 給気口
130 容器載置部
【技術分野】
【0001】
本発明は試料調製装置に関する。
【背景技術】
【0002】
従来、生体から採取された生体試料に含まれる細胞を分析する細胞分析装置として、被験者の子宮頸部から採取された試料に含まれる子宮頸部の上皮細胞をフローサイトメータで測定して、癌・異型細胞のスクリーニングを行う細胞分析装置が知られている(例えば、特許文献1参照)。
【0003】
この細胞分析装置では、癌・異型細胞を特異的に染色する蛍光マーカーを用いて癌・異型細胞を染色し、当該癌・異型細胞から生じた蛍光をフローサイトメータで測定している。
【先行技術文献】
【特許文献】
【0004】
【特許文献1】国際公開第2009/123000号パンフレット
【発明の概要】
【発明が解決しようとする課題】
【0005】
細胞を染色するときに染色対象の細胞同士が互いに凝集していると、癌・異型細胞のスクリーニングの精度が低下する場合がある。しかしながら、このような凝集した細胞を自動で分離させる技術は知られていなかった。
本発明は、このような事情に鑑みてなされたものであり、測定試料中の凝集した分析対象物を自動で分離させることができる試料調製装置を提供することを目的としている。
【課題を解決するための手段】
【0006】
本発明の第1の観点に係る試料調製装置は、測定試料容器内に収容された分析対象物を含む試料に超音波振動を付与する超音波振動部と、
超音波振動が付与された試料と所定の試薬とから測定試料を調製する試料調製部と、
試料が収容された測定試料容器を超音波振動部から試料調製部へ移送する容器移送部と
を備えたことを特徴としている。
【0007】
本発明の第1の観点に係る試料調製装置では、超音波振動部により測定試料容器中の試料に超音波振動を付与することで、当該試料中の凝集した分析対象物を分離させることができる。そして、容器移送部によって、分離された分析対象物を含む試料が収容された測定試料容器を超音波振動部から試料調製部へ移送するので、自動で測定試料を調製することができる。また、試料が収容された測定試料容器を超音波振動部から試料調製部へ移送するので、分析に供される分析対象物の損失を最小限にすることができる。
【0008】
前記超音波振動部は、液体を収容する液体収容部と、超音波振動を発生する超音波振動子とを備えており、
前記容器移送部は、前記測定試料容器を前記液体収容部に収容された液体に漬けた状態で保持可能であり、且つ、
前記超音波振動子は、前記液体を介して前記測定試料容器に収容された試料に超音波振動を付与するものとすることができる。
【0009】
前記液体収容部に収容された液体の液面の高さを調整する液面調整部をさらに備えているのが好ましい。
前記液面調整部は、前記液体収容部に液体を供給する液体供給部と、当該液体収容部から液体を排出する液体排出部とを備えたものとすることができる。
【0010】
前記液体排出部は前記液体収容部の周壁に形成された排出孔からなり、この排出孔は、前記液体の液面が当該液体に付与される超音波振動の波長に基づき定められる所定の高さにくる位置に形成されたものとすることができる。
【0011】
前記測定試料容器は、当該測定試料容器内の試料の液面が、液体収容部内の液体の液面よりも下方に位置するように当該液体に漬けられるのが好ましい。
前記測定試料容器は、液体収容部に収容される液体の音響インピーダンスとほぼ同じ音響インピーダンスを有する材料で作製されているのが好ましい。
【0012】
前記液体を水とし、且つ、前記測定試料容器を合成樹脂で作製することができる。
前記測定試料容器がポリプロピレンで作製されているのが好ましい。
前記測定試料容器の内面の算術平均粗さが1〜30μmの範囲であるのが好ましい。
【0013】
前記液体収容部が円筒体形状を呈しており、前記超音波振動子が円柱体形状を呈しており、且つ、液体収容部の内径が超音波振動子の径よりも大きいのが好ましい。
前記超音波振動部は、分析対象物に対して分析に影響するダメージを与えない所定の出力および時間で超音波振動を付与するのが好ましい。
前記超音波振動子の振動数が20〜75kHzの範囲であるのが好ましい。
【0014】
前記測定試料容器に付着した液体を除去する液体除去部をさらに備えており、
前記容器移送部は、前記測定試料容器を超音波振動部から前記液体除去部へ移送し、当該液体除去部から前記試料調製部へ移送するものとすることができる。
【0015】
前記液体除去部は、前記測定試料容器のうち少なくとも液体に漬けられた部分を収容可能な収容凹部を有する本体部と、前記収容凹部に収容された測定試料容器の外周面に気体を供給する給気部と、供給された気体を吸引する吸気部とを備えたものとすることができる。
前記給気部は、収容凹部の内周面において周方向に複数形成された給気口を有するものとすることができる。
【0016】
前記試料調製装置は、前記測定試料容器を載置する容器載置部をさらに備えており、
前記容器移送部は、前記測定試料容器を前記容器載置部から前記超音波振動部へ移送するものとすることができる。
前記試料調製装置は、前記測定試料容器に前記試料を分注する試料分注部をさらに備えているものとすることができる。
【0017】
前記試料分注部は、前記容器載置部に載置された測定試料容器に試料を分注し、
前記容器移送部は、前記試料を収容した測定試料容器を、前記容器載置部から前記超音波振動部へ移送するものとすることができる。
前記超音波振動部、前記試料調製部、及び前記容器載置部は同一円周上に配置されているのが好ましい。
【0018】
本発明の第2の観点に係る試料調製装置は、測定試料容器内に収容された分析対象物を含む試料に超音波振動を付与する超音波振動部と、
超音波振動が付与された試料と所定の試薬とから測定試料を調製する試料調製部と、
前記超音波振動部に配置された測定試料容器内の試料を超音波振動部から試料調製部へ移送する試料移送部と
を備えたことを特徴としている。
【発明の効果】
【0019】
本発明の試料調製装置によれば、測定試料中の凝集した分析対象物を自動で分離させることができる。
【図面の簡単な説明】
【0020】
【図1】本発明の一実施の形態に係る試料調製装置を備えた細胞分析装置の斜視図である。
【図2】測定装置の内部構成を示すブロック図である。
【図3】試料調製装置の内部構成を示すブロック図である。
【図4】試料調製装置の平面説明図である。
【図5】超音波振動部の断面説明図である。
【図6】液体除去部の断面説明図である。
【図7】液体除去部の開口部周縁の斜視説明図である。
【図8】データ処理装置の内部構成を示すブロック図である。
【図9】検出部を構成するフローサイトメータの機能ブロック図である。
【図10】フローサイトメータの光学系を示す側面図である。
【図11】調製デバイス部の流体回路図である。
【図12】調製デバイス部の流体回路図である。
【図13】置換容器の断面説明図である。
【図14】弁別・置換部における分析物の濃縮過程を示す模式図である。
【図15】細胞分析装置の各制御部が行う処理を示すフローチャートである。
【図16】細胞分析装置の各制御部が行う処理を示すフローチャートである。
【図17】弁別・置換処理を示すフローチャートである。
【図18】弁別・置換処理を示すフローチャートである。
【図19】超音波振動による凝集細胞の分離処理を示すフローチャートである。
【図20】本発明の別実施の形態に係る測定装置の内部構成を示すブロック図である。
【発明を実施するための形態】
【0021】
以下、添付図面を参照しつつ、本発明の試料調製装置の実施の形態を詳細に説明する。
本発明の試料調製装置は、患者から採取した細胞を分析する細胞分析装置に用いることができる。まず、かかる細胞分析装置について説明する。
【0022】
[細胞分析装置の全体構成]
図1は、本発明の一実施の形態に係る試料調製装置を備えた細胞分析装置1の斜視図である。
この細胞分析装置1は、患者から採取した細胞を含む測定試料をフローセルに流し、このフローセルを流れる測定試料にレーザ光を照射し、測定試料からの光(前方散乱光、側方蛍光など)を検出してその光信号を分析することで、細胞に癌細胞が含まれているか否かを判断するのに用いられる。
【0023】
より具体的には、本実施の形態の細胞分析装置1は、子宮頸部の上皮細胞を分析対象としており、子宮頸癌をスクリーニングするのに用いられるものである。
図1に示されるように、細胞分析装置1は、測定試料に対してレーザ光による光学的な測定を行う測定装置2と、被検者から採取された生体試料に洗浄や染色等の前処理を行って、測定装置2に供給する測定試料を作製する試料調製装置3と、測定装置2での測定結果の分析等を行うデータ処理装置4とを備えている。
【0024】
以下、細胞分析装置1の主要な構成要素について順次説明をする。
〔測定装置の内部構成〕
図2は、測定装置2の内部構成を示すブロック図である。
図2に示されるように、この測定装置2は、検出部6と、信号処理部7と、測定制御部8と、I/Oインタフェース9とを備えている。
【0025】
このうち、検出部6は、測定試料から測定対象細胞やその核の数及びサイズ等を検出するものであり、本実施の形態では、図9及び図10に示されるフローサイトメータ10が採用されている。
【0026】
信号処理部7は、検出部6からの出力信号に必要な信号処理を行う信号処理回路よりなる。また、測定制御部8は、マイクロプロセッサ11と記憶部12とを含んでおり、記憶部12は、ROM及びRAM等よりなる。
【0027】
記憶部12のROMには、検出部6や信号処理部7の動作制御を行う制御プログラムと、この制御プログラムの実行に必要なデータとが格納されており、マイクロプロセッサ11は、その制御プログラムをRAMにロードして、又は、ROMから直接実行することが可能である。
【0028】
測定制御部8のマイクロプロセッサ11は、I/Oインタフェース9を介して、データ処理装置4と後述する調製制御部16のマイクロプロセッサ19に繋がっており、これにより、自身が処理したデータや自身の処理に必要なデータを、データ処理装置4及び調製制御部16のマイクロプロセッサ19との間で送受信できるようになっている。
【0029】
〔試料調製装置の構成〕
図3は、試料調製装置3の内部構成を示すブロック図である。
図3に示されるように、この試料調製装置3は、調製制御部16と、I/Oインタフェース17と、生体試料に対する成分調整を自動的に行うための調製デバイス部18とを備えている。
【0030】
調製制御部16は、マイクロプロセッサ19と、記憶部20と、センサドライバ21と、駆動部ドライバ22とを含んでおり、記憶部20は、ROM及びRAM等よりなる。
本実施の形態の調製デバイス部18は、検体セット部150と、細胞分散部25と、検体ピペット部26と、検体定量部27と、試薬定量部28と、弁別・置換部29と、超音波振動部100と、容器移送部110と、液体除去部120と、反応部24とから構成されている。
【0031】
このうち、検体セット部150は、患者から採取された生体試料とメタノール主成分の保存液とを収容する複数の生体容器53(図11参照)をセットするためのものであり、 反応部24は、調製された液体試料を収容する測定試料容器54をセットするためのものである。
【0032】
細胞分散部25は、生体試料と保存液との混合液を攪拌して試料に含まれる細胞を強制的に分散させるものである。
【0033】
検体ピペット部(試料分注部)26は、細胞が分散された生体試料と保存液との混合液を生体容器53から取り出して調製デバイス部18の流体回路に導入したり、調製された液体試料を測定試料容器54に排出したり(図11参照)当該測定試料容器54から取り出したりするものである。検体定量部27は、流体回路に供給される生体試料と保存液との混合液を定量するものである。また、試薬定量部28は、生体試料に加える染色液等の試薬を定量するものである。
【0034】
弁別・置換部29は、保存液と希釈液とを置換するとともに、測定対象細胞とそれ以外の細胞(赤血球、白血球等)や細菌等とを弁別するためのものである。また、弁別・置換部29は、前記弁別・置換された測定対象細胞を含む液体試料から、測定対象細胞の濃度を高めた液体試料を得るためのものである。
【0035】
超音波振動部100は、弁別・置換部29において濃度が高められた測定試料に超音波振動を付与して、凝集している測定対象細胞を分離させるためのものである。
容器移送部110は、反応部24に設置されている測定試料容器54(図4参照)を把持して当該測定試料容器54を、反応部24、容器載置部130、超音波振動部110及び液体除去部120の間で移送するためのものである。
【0036】
液体除去部120は、超音波振動部100において液体中に漬けられた測定試料容器54の外周面に付着した液分を取り除くためのものである。液分を取り除くことにより、測定試料容器54を反応部24等に配置して長時間放置したとき等に当該測定試料容器54が反応部24等に固着するのを防止することができる。
なお、前記各部24〜29、100、110、120、150を有する調製デバイス部18の流体回路の構成(図11〜12)については、後述する。
【0037】
記憶部20のROMには、センサドライバ21及び駆動部ドライバ22の動作制御を行う制御プログラムと、この制御プログラムの実行に必要なデータとが格納され、マイクロプロセッサ19は、その制御プログラムをRAMにロードして、又は、ROMから直接実行することが可能である。
【0038】
調製制御部16のマイクロプロセッサ19は、I/Oインタフェース17を介して前記測定制御部8のマイクロプロセッサ11に繋がっており、これにより、自身が処理したデータや自身の処理に必要なデータを、測定処理部8のマイクロプロセッサ11との間で送受信できるようになっている。
【0039】
また、調製制御部16のマイクロプロセッサ19は、センサドライバ21と駆動部ドライバ22を介して、調製デバイス部18の各部24〜29、100、110、120、150のセンサ類や駆動部を構成する駆動モータと繋がっており、センサからの検知信号に基づいて制御プログラムを実行し、駆動部の動作を制御する。
【0040】
本実施の形態に係る試料調製装置3では、後述するようにして弁別・置換部29において濃縮された測定対象細胞を含む液体試料に超音波振動を付与して、当該液体試料中で凝集している測定対象細胞を分離させる処理を行っている。
【0041】
図4は、このような超音波処理に係る試料調製装置3の要素の平面説明図である。試料調製装置3は、かかる超音波処理のために、超音波振動部100、容器移送部110、液体除去部120、及び容器載置部130を備えている。超音波振動部100、液体除去部120及び容器載置部130は、同一円周上に配置されており、反応部24における6つの測定試料容器配置箇所のうちの1箇所は当該円周上に配置可能にされている。具体的には、前記超音波振動部100等は容器移送部110の回動中心を中心とする円周上に配置されている。したがって、容器移送部110を回動させることで測定試料容器54を、超音波振動部100、液体除去部120、容器載置部130、及び反応部24の間で移送することができる。
【0042】
超音波振動部100は、図5に示されるように、液体収容部101と、超音波振動子102とを備えている。液体収容部101は、円筒体形状を呈しており、水等の液体103を収容する凹部104を有している。この凹部104の開口には、測定試料容器54が挿通し得る大きさの円孔が形成された蓋105が設けられている。この蓋105により超音波振動による液体103の外部への飛散を防止することができる。
【0043】
超音波振動子102は円柱形状を呈しており、前記液体収容部101の下部に配置されている。このため、超音波振動子102に防水加工を施す必要がなく、構成を簡素化することができる。超音波振動子102としては、例えば部品の洗浄等に用いられている公知のものを利用することができる。
【0044】
液体収容部101の周壁の下部には、当該液体収容部101の凹部104内に、液体供給源106Aより液体103を供給する供給孔106が形成されており、一方、前記周壁の上部には、吸引源107Aによって凹部104から液体103を排出する排出孔107が形成されている。供給孔106と液体供給源106Aは管路160により接続されており、排出孔107とチャンバ108は管路161により接続されている。管路160の途中には流路切替バルブ162が配設されており、この流路切替バルブ162と前記チャンバ108は管路163により接続されている。液体供給源106A及び吸引源107Aの駆動は、前述の試料調製装置3の調製制御部16により制御される。
【0045】
液体収容部101の周壁であって前記排出孔107のさらに上部には、液体103が液体収容部101の凹部104からあふれるのを防止するためのオーバーフロー流路164が形成されている。このオーバーフロー流路164は装置外へつながっている。
チャンバ108には、前記吸引源107A、管路161及び管路163とともに、吸引源107Aによってチャンバ108内に導かれた液体103を装置外に排出する排出管165が接続されている。
【0046】
流路切替バルブ162は、液体収容部101の凹部104内に液体103を供給するときには、液体供給源106Aと当該凹部104とを連通させ、一方、液体収容部101の凹部104内から液体103を排出するときには、チャンバ108と当該凹部104とを連通させるように切り替えられる。
【0047】
超音波振動を効果的に発生させるために、超音波振動子102により発生する超音波の節が前記凹部104内に収容される液体103の水面の位置になるように深さd(測定試料容器54を漬けた状態での液体の深さ)が設定されている。
【0048】
そこで、本実施の形態では、液体収容部101の凹部104内の液体に測定試料容器54を漬けた後に前記供給孔106から所定量の液体を凹部104内に供給し、調製制御部16により吸引源を所定時間駆動させて、前記排出孔107から凹部104内の余分の液体103を排出する。排出孔107の下端の凹部104の底面からの高さは、超音波振動子102により発生する超音波の節が液体103の水面の位置になるように設定されているので、凹部104内の液体を所定時間吸引し続けると、液体103の水面の位置は超音波の節の位置になるように調整される。液体を吸引する「所定の時間」は、供給した液体の量及び吸引源の排出能力から算出される時間に数秒程度の時間を足した時間とすることができる。算出される時間よりも長めに吸引したとしても、排出孔107よりも下方の液体が排出されてしまうことはないので、液面の調整には支障がない。
【0049】
筒状の液体収容部101の内径D1は、円柱状の超音波振動子102の外径D2よりも数mm程度、例えば5〜6mm程度大きくされている。このように超音波が付与される液体部分の大きさを超音波振動子102よりも大きくすることで、超音波振動を効率よく液体に伝達することができる。
【0050】
測定試料容器54は、容器移送部110のはさみ状の把持部111に把持された状態で液体収容部101の液体中に漬けられる(図5参照)が、その際、当該測定試料容器54内の液体試料の液面が凹部104内の液体103の液面よりも下方に位置するように、前記容器移送部110の下降位置が設定されている。測定試料容器54内の液体試料の液面が凹部104内の液体103の液面よりも上方に位置すると、液体試料に効果的に超音波振動を伝達することができず、その結果、液体試料中の凝集した測定対象細胞を確実に分離させることができなくなる。本発明において特に限定されるものではないが、測定試料容器54内の液体試料の液面は、凹部104内の液体103の液面よりも1〜2mm程度下方に位置するのが好ましい。
【0051】
測定試料容器54は合成樹脂やステンレス等の金属で作製することができるが、凹部104内に収容される液体の音響インピーダンスと同程度の音響インピーダンスを有する材料で作製するのが好ましい。例えば、凹部104内に水を収容する場合、測定試料容器54はポリプロピレンやポリエチレンなどの合成樹脂で作製するのが好ましい。本実施の形態では、凹部104内の液体を介して間接的に液体試料に超音波振動を付与しているが、超音波振動を伝達する液体と測定試料容器54の特性(音響インピーダンス)を同程度のものにすることで、超音波振動の伝達効率を向上させることができる。
【0052】
また、測定試料容器54の内周面は、分散効果を向上させるという観点より、ある程度の粗さを有する面とするのが好ましく、具体的には、表面粗さを例えば1〜30μm程度にするのが好ましい。
超音波振動子102により付与される超音波振動の振動数は、本発明において特に限定されるものではないが、20kHz以上であることが好ましく、さらに、20〜75kHzであることが好ましい。
【0053】
容器移送部110は、図4に示されるように、その回動中心110aが、前記超音波振動部100、液体除去部120及び容器載置部130により形成される円Cの中心に位置するように配設されている。容器移送部110の先端部には、前記鋏状の把持部111が設けられている。鋏状の把持部111は、図5に示されるように、左右一対の把持片111a、111bからなっており、両把持片111a,111bはバネ112によって閉止方向に付勢されている。各把持片111a、111bの対向する面には、測定試料容器54の上端部に形成された環状の鍔部54a(図6参照)と係合する溝113が形成されている。
【0054】
図4に戻り、容器移送部110による測定試料容器54の移送は、以下のようにして行われる。
まず、容器移送部110を回動させて、前記把持部111の両把持片111a、111bと測定試料容器54の上端部に形成された環状の鍔部54aとを係合させる。このとき、前記把持部111は、バネ112の付勢力により測定試料容器54を把持している。
【0055】
ついで、容器移送部110を上昇させ、さらに測定試料容器54を移動させる位置まで回動させる。その後、容器移送部110を下降させ、把持部111の両把持片111a、111bをバネ112の付勢力に抗して開放させる。これにより、把持片111a、111bの溝112と測定試料容器54の鍔部54aとの係合が解除され、測定試料容器54は所定位置に配置される。
【0056】
液体除去部120は、図6に示されるように、本体部121と、給気部122と、吸気部123とを備えている。本体部121は、測定試料容器54のうち少なくとも前記凹部104内の液体に漬けられた部分を収容可能な収容凹部124を有している。この収容凹部124の水平断面は円形であり、その内径は測定試料容器54の外径よりも数mm程度大きくされており、当該収容凹部124内に挿入された測定試料容器54の外周面との間に若干のスペースを確保することができる。
【0057】
給気部122は本体部121の上部付近に設けられており、前記収容凹部124に収容された測定試料容器54の外周面に空気を供給する。給気口122は、給気源(陽圧付与源)122Aに接続されており、図7に示されるように、横給気路125、縦給気路126、環状給気路127、及び給気口129を備えている。給気口129は、収容凹部124の開口部の周縁に沿って立設された突出壁128に周方向に等間隔で6個形成されている。
一方、図6に示されるように、吸気部123は、収容凹部124の底部に設けられており、吸引源123Aに接続されている。
【0058】
給気源122Aから供給された空気は、図7に示されるように、横給気路125、縦給気路126、環状給気路127、及び給気口129を通って、収容凹部124内に収容されている測定試料容器54の外周面に吹き付けられる。そして、吹き付けられた空気によって、測定試料容器54の外周面に付着していた液体は当該外周面から吹き飛ばされ、前記空気とともに吸気部123から排出される。
【0059】
〔データ処理部の内部構成〕
図8は、データ処理装置4の内部構成を示すブロック図である。
図8に示されるように、本実施の形態のデータ処理装置4は、例えばノートPC(デスクトップ型でもよい。)等のパーソナルコンピュータよりなり、処理本体31と、表示部32と、入力部33とから主に構成されている。
【0060】
処理本体31は、CPU34と、ROM35と、RAM36と、ハードディスク37と、読出装置38と、I/Oインタフェース39と、画像出力インタフェース40とを備えており、これらの各部は内部バスによって通信可能に接続されている。
CPU34は、ROM35に記憶されているコンピュータプログラムやRAM36にロードされたコンピュータプログラムを実行することが可能である。
【0061】
ROM35は、マスクROM、PROM、EPROM、EEPROM等によって構成され、CPU34に実行されるコンピュータプログラム及びこれに用いるデータ等が格納されている。
【0062】
RAM36は、SRAM又はDRAM等で構成され、ROM35及びハードディスク37に記録されている各種のコンピュータプログラムの読み出しや、それらのコンピュータプログラムを実行するときのCPU34の作業領域として利用される。
【0063】
前記ハードディスク37には、オペレーティングシステム及びアプリケーションプログラム等、CPU34に実行させるための種々のコンピュータプログラム及びそのプログラムの実行に用いるデータがインストールされている。
【0064】
また、ハードディスク37には、例えば、米国マイクロソフト社が製造販売するWindows(登録商標)等のグラフィカルユーザインタフェース環境を提供する、オペレーティングシステムがインストールされている。
【0065】
更に、ハードディスク37には、測定制御部8及び調製制御部16への動作命令の送信、測定装置2で行った測定結果の受信及び分析処理、並びに、処理した分析結果の表示等を行う操作プログラム41がインストールされている。この操作プログラム41は、当該オペレーティングシステム上で動作する。
【0066】
読出装置38は、フレキシブルディスクドライブ、CD−ROMドライブ、又はDVD−ROMドライブ等で構成され、可搬型記録媒体に記録されたコンピュータプログラム又はデータを読み出すことができる。
【0067】
I/Oインタフェース39は、例えば、USB、IEEE1394、RS−232C等のシリアルインタフェース、SCSI、IDE、IEEE1284等のパラレルインタフェース、及びD/A変換器、A/D変換器等からなるアナログインタフェース等から構成されている。
【0068】
I/Oインタフェース39には、キーボード及びマウスからなる入力部33が接続され、これをユーザが操作することでコンピュータへのデータ入力が可能となっている。
また、I/Oインタフェース39は、測定装置2のI/Oインタフェース9とも接続されており、これにより、測定装置2とデータ処理装置4との間でデータの送受信を行うことができる。
【0069】
画像出力インタフェース40は、LCD又はCRT等よりなる前記表示部32に接続されており、CPU34からの画像データに応じた映像信号を当該表示部32に出力させるものである。
【0070】
〔検出部(フローサイトメータ)の構成〕
図9は、前記検出部6を構成するフローサイトメータ10の機能ブロック図であり、図10は、そのフローサイトメータ10の光学系を示す側面図である。
図9に示されるように、フローサイトメータ10のレンズ系43は、光源である半導体レーザ44からのレーザ光を、フローセル45を流れる測定試料に集光するものであり、集光レンズ46は、測定試料中の細胞の前方散乱光をフォトダイオード47よりなる散乱光検出器に集光するものである。
【0071】
図9では、レンズ系43を単一レンズで図示してあるが、具体的には、例えば図10に示されるような構成になっている。
すなわち、本実施の形態のレンズ系43は、半導体レーザ44側(図10の左側)から順に、コリメータレンズ43a、シリンダレンズ系(平凸シリンダレンズ43b+両凹シリンダレンズ43c)及びコンデンサレンズ系(コンデンサレンズ43d+コンデンサレンズ43e)から構成されている。
【0072】
図9に戻り、側方用の集光レンズ48は、測定対象細胞又はこの細胞中の核の側方散乱光と側方蛍光をダイクロイックミラー49に集光する。このダイクロイックミラー49は、側方散乱光を散乱光検出器であるフォトマルチプライヤ50へ反射させ、側方蛍光を蛍光検出器であるフォトマルチプライヤ51の方へ透過させる。これらの光は、測定試料中の細胞や核の特徴を反映したものとなっている。
【0073】
そして、フォトダイオード47及び各フォトマルチプライヤ50、51は、受光した光信号を電気信号に変換して、それぞれ、前方散乱光信号(FSC)、側方散乱光信号(SSC)及び側方蛍光信号(SFL)を出力する。これらの出力信号は図示しないプリアンプにより増幅され、測定装置2の信号処理部7(図2参照)に送られる。
【0074】
測定装置2の信号処理部7で処理された各信号FSC、SSC、SFLは、それぞれ、マイクロプロセッサ11によってI/Oインタフェース9からデータ処理装置4に送信される。
【0075】
データ処理装置4のCPU34は、前記操作プログラム41を実行することにより、各信号FSC、SSC、SFLから細胞や核を分析するためのスキャッタグラムを作成し、このスキャッタグラムに基づいて、測定試料中の細胞が異常であるか否か、具体的には癌化した細胞であるか否かを判定する。
【0076】
なお、フローサイトメータ10の光源としては、半導体レーザ44の代わりにガスレーザを用いることもできるが、低コスト、小型、且つ低消費電力である点より半導体レーザ44を採用するのが好ましく、かかる半導体レーザ44の採用によって製品コストを低減させるとともに、装置の小型化及び省電力化を図ることができる。
【0077】
また、本実施の形態では、ビームを狭く絞ることに有利な波長の短い青色半導体レーザを用いている。青色半導体レーザは、PI等の蛍光励起波長に対しても有効である。なお、半導体レーザのうち、低コスト且つ長寿命であり、メーカーからの供給が安定している赤色半導体レーザを用いてもよい。
【0078】
ところで、子宮頸部の上皮細胞の大きさは平均で約60μmであり、また核の大きさは5〜7μmである。この細胞が癌化すると細胞分裂の頻度が異常に多くなり、核は10〜15μmの大きさとなる。これにより、N/C比(核の大きさ/細胞の大きさ)が正常な細胞に比べて大きくなる。
【0079】
従って、細胞と核の大きさを検出することによって、細胞が癌化したか否かの判断指標とすることができる。
そこで、本実施の形態では、フローセル45を流れる測定試料からの散乱光をフォトダイオード47で検出するとともに、フローセル45を流れる測定試料からの蛍光をフォトマルチプライヤ51で検出する。
【0080】
測定装置2の信号処理部7(図2参照)は、フォトダイオード47から出力された散乱光信号から、測定対象細胞の大きさを反映した値である散乱光信号のパルス幅を取得するとともに、フォトマルチプライヤ51から出力された蛍光信号から、測定対象細胞の核の大きさを反映した値である蛍光信号のパルス幅を取得する。
【0081】
そして、前記信号処理部7で得た測定対象細胞の大きさを反映した値と、測定対象細胞の核の大きさを反映した値に基づいて、当該測定対象細胞が異常であるか否かを、分析部を構成するデータ処理装置4のCPU34が判定するようになっている。
具体的には、データ処理装置4のCPU34は、測定対象細胞のピーク、核径、面積の値が所定の閾値より大きい場合に、測定対象細胞が異常であると判定する。
【0082】
〔調製デバイス部の流体回路〕
図11は、調製デバイス部18の検体セット部150、細胞分散部25、検体ピペット部26、検体定量部27、試薬定量部28、超音波振動部100、液体除去部120、反応部24の流体回路図であり、図12は、調製デバイス部18の弁別・置換部29の流体回路図である。
【0083】
検体セット部150は、生体容器53を載置可能なラック151をセットするラックセット領域を備えており、ラック151にセットされた生体容器53内の生体試料と保存液との混合液を後述する第1ピペット26Aで吸引可能な位置まで搬送する機能を有している。
【0084】
細胞分散部25は、分散容器内の生体試料と保存液との混合液を攪拌する攪拌棒25Aと、これを回転駆動する駆動部25Bとを備えており、駆動部25Bは、DCモーターからなり、攪拌棒25Aを分散容器内に挿入して回転させる。これにより、後述する第1ピペット26Aによって分散容器内に排出された混合液が攪拌され、生体試料に含まれる細胞を分散させることができる。
【0085】
検体ピペット部26は、第1ピペット26Aと第2ピペット26Bとを備えている。第1ピペット26Aは、生体容器53内の生体試料と保存液との混合液を吸引し、細胞分散部25の分散容器に混合液を排出する。また、第1ピペット26Aは、分散処理後に分散済の混合液を吸引し、弁別・置換部29の置換容器57(図12参照)まで移動し、混合液を置換容器57内に排出する。置換容器57に排出された混合液は弁別・置換され、弁別・置換された測定対象細胞を含む液体試料から測定対象細胞の濃度を高めた液体試料が調製される。その後、第1ピペット26Aは、置換容器57から測定対象細胞の濃度を高めた液体試料を吸引し、容器載置部130(図4参照)に配置された測定試料容器54まで移動し、測定試料容器54内に液体試料を排出する。第2ピペット26Bは、試薬定量部28から供給される染色液等の試薬を測定試料容器54に排出する。
【0086】
検体定量部27は、定量シリンダ27Aと、このシリンダ27Aに挿通された定量ピストンを上下動させる、ステッピングモーターからなる駆動部27Bとを備えている。定量シリンダ27Aは、方向切替バルブV1を介して第1ピペット26Aと管路で繋がっている。
【0087】
弁別・置換部29は、図12に示されるように、上方開口状の置換容器57と、この置換容器57内で上下方向に移動可能なピストン58と、このピストン58を置換容器57内で上下動させる、ステッピングモーターからなる駆動部59とを備えている。
【0088】
置換容器57は、切替バルブV4、V5を介して洗浄液ユニット90と管路で繋がっており、洗浄液ユニット90から切替バルブV4、V5を介して置換容器57に洗浄液が供給される。また、切替バルブV6を介して希釈液ユニット55と管路で繋がっており、希釈液ユニット55から切替バルブV6を介して置換容器57に希釈液が供給される。
【0089】
ピストン58は、測定対象細胞(上皮細胞)は通過させず、且つ、それより小径の細胞(赤血球、白血球等)は通過させるフィルタ60を下部に備えた中空筒体よりなっている。このピストン58は、切替バルブV8を介して陽圧源71に管路で繋がっている。このため、切替バルブV8を開放することでピストン58の内部に陽圧を供給することができる。また、ピストン58は、切替バルブV9を介してピストン58の内部空間と外部とが接続されており、切替バルブV9を開放することで、ピストン58の内部空間を大気開放することができる。
【0090】
さらに、ピストン58は、切替バルブV10、V12を介して濾液の廃棄部61に管路で繋がっている。このため、ピストン58の内部から吸引された濾液は、切替バルブV10、V12を通じて外部に廃棄される。
【0091】
また、ピストン58は、切替バルブV7を介して洗浄液ユニット90と管路で繋がっており、洗浄液ユニット90から供給された洗浄液は、ピストン58及び置換容器57を洗浄するのに用いられる。そして、ピストン58及び置換容器57内を洗浄した洗浄液は、切替バルブV11、V13を介して廃棄部61に排出される。
【0092】
図11に戻り、試薬定量部28は、一対の定量シリンダ28A、28Bと、この各シリンダ28A、28Bにそれぞれ挿通された定量ピストンを上下動させる、ステッピングモーターからなる駆動部28Cを備えている。各定量シリンダ28A、28Bは、それぞれ供給切替バルブV2、V3を介して第2ピペット26Bと管路で繋がっており、各定量シリンダ28A、28Bで定量された試薬は、供給切替バルブV2、V3を介して第2ピペット26Bに供給され、測定試料容器54内に排出される。
【0093】
これにより、反応部24の測定試料容器54に収容されている測定対象細胞の濃度を高めた液体試料に対して、試薬定量部28が定量した複数種類の所定分量の試薬を混合できるようになっている。
【0094】
本実施の形態では、試薬定量部28の各定量シリンダ28A、28Bで定量される試薬は2種類ある。このうち、一方の定量シリンダ28Aで計量して生体試料に加える試薬は、PI染色を行うための染料液であり、他方の定量シリンダ28Bで計量して生体試料に加える試薬は、細胞にRNA処理を行うためのRNaseである。PI染色は、色素を含んでいる蛍光染色液であるヨウ化プロピジウム(PI)により行われる。PI染色では核に選択的に染色が施されるため、核からの蛍光が検出可能となる。また、RNA処理とは、細胞中のRNAを溶かすための処理である。染料液は、上皮細胞のRNAとDNAの両方を染色してしまうので、前記のRNA処理を行うことでRNAが溶け染料液によって染まらなくなるので、細胞核のDNAを正確に測定することが可能となる。
【0095】
反応部24は、円形の回転テーブル24Aと、これを回転駆動する駆動部24Bとを備えている。駆動部24Bはステッピングモーターからなる。回転テーブル24Aの外周縁部には、弁別・置換部29で調製された、測定対象細胞の濃度を高めた液体試料を収容する測定試料容器54をセット可能な保持部が設けられている。
【0096】
なお、図11及び図12で示される各部の駆動部や切替弁(電磁弁)V1〜V13に対する動作制御は、前記調製制御部16(マイクロプロセッサ19)からの制御指令に基づいて行われる。
【0097】
〔弁別・置換部の構成〕
本実施の形態における弁別・置換部29の構成について、図13を用いて説明する。図13は、本実施の形態における図12の弁別・置換部29における置換容器57の底部付近の断面説明図である。
図13に示されるように、本実施の形態の弁別・置換部29は、置換容器57と、前記置換容器57内で上下方向に移動可能な円筒体からなるピストン58と、円筒体からなるピストン58の下端面に配設された、測定対象細胞を選別するためのフィルタ60と、測定対象細胞を含む液体の液面を検知する液面検知センサ82と、を備えている。
【0098】
置換容器57は、分析対象となる分析物(測定対象細胞)を収容可能な収容室68と、この収容室に連通して配設された濃縮試料収容室80とを備えている。収容室68には、液体試料中に含まれる測定対象細胞を、収容室68から濃縮試料収容室80へ移動させる回転子72(回転部材)が収容されている。この回転子72は磁力で回転するように構成されており、収容室68の底部下方に、回転子72に磁力を与えるための磁石69と、この磁石69を回転させるための駆動モータ70とを備えている。
【0099】
回転子72は、円柱体形状を呈しており、三フッ化エチレン(PCTFE)等で作製される。回転子72の周面には、中心に向かう穴73が形成されており、この穴73に丸棒状の磁石75が収納される。
【0100】
ピストン58は、その底部に保持具65を介してフィルタ60が配設されている。ピストン58は、前記フィルタ60に液体を通過させることにより、測定対象細胞を主に含む第1液体と、測定対象細胞よりも小径の細胞を主に含む第2液体とに液体を分離する液体分離部として機能している。
【0101】
本実施の形態では、測定対象細胞として子宮頸部の上皮細胞を想定しており、この上皮細胞の大きさは概ね20〜80μm(平均は60μm程度)である。また、かかる測定対象細胞より小さい細胞である赤血球の大きさは、概ね7〜10μmであり、同じく測定対象細胞より小さい細胞である白血球の大きさは、概ね8〜15μmである。更に、細菌等の夾雑物の大きさは、概ね1〜数μm程度である。
【0102】
そこで、本実施の形態におけるフィルタ60は、置換容器57内の液体に圧力がかかった状態でも上皮細胞が前記フィルタ60の通孔を通過してピストン58内に移動しないように、20μmより小さい8〜20μmの径の通孔を有する金属製のCVD(Chemical Vapor Deposition:化学気相成長法)で作製されている。かかる金属製のCVDフィルタは、その他の樹脂製のフィルタや、金属製であってもメッシュ製のものに比べて通孔の変形が少なく、開口率を高められるという利点がある。
【0103】
また、フィルタ60の孔径を8〜20μmに設定したのは、8μm未満であれば、細胞や夾雑物が通孔に早期に詰まる現象が多く見られ、20μmを超えると、置換容器57内の液体に圧力がかかっている状態では上皮細胞が通孔を通過してしまうことが多くなるからである。なお、フィルタ60の孔径は、15μm前後がより好ましい。
【0104】
液面検知センサ82は、置換容器57の下部に、当該置換容器57内の第1液体の液面を検知するために配設されている。液面検知センサ82は、静電容量タイプのものであり、その先端部が、置換容器57の内面から2〜3mm程度内方に突出している。そして、突出した部分の先端にピン状のセンサ部82aが設けられている。
【0105】
液面検知センサ82は、測定対象細胞を含む第1液体の液面が前記フィルタ60のほぼ下面の位置に達したことを検知するために用いられる。
本実施の形態では、フィルタ60の下面よりも上方約2.0mmの位置にセンサ部82aを配設し、前記表面張力の影響及び第2液体の吸引速度をも考慮して、センサ部82aからの検知信号を受信していから所定時間経過後に、ピストン58内の第2液体の吸引を停止するようにしている。また、ピン状のセンサ部82aを斜め上方に配置することにより、液切れを良くして液面検知の精度を上げることができる。このとき、配置する角度としては、水平面に対して、概ね5〜90度の範囲である。
【0106】
本実施の形態では、置換容器57の底部に、収容室68と、該収容室68の周縁部に連通して配設された濃縮試料収容室80が配設されている。この濃縮試料収容室80は、収容室68に収容されている回転子72の回転により移動させた測定対象細胞を収集する役割を果たしている。後述する弁別操作によって測定対象細胞の一部がフィルタ60の下面に付着するが、この付着した測定対象細胞は、回転子72の回転によりフィルタ60の下面から引き剥がされ、更に、回転子72の回転に伴って発生する遠心力により、収容室68の周縁部に連通して配設された濃縮試料収容室80に収集される。
【0107】
ここで、本実施形態における、生体試料と保存液との混合液を弁別し、弁別した測定対象細胞を含む液体試料から測定対象細胞の濃度を高めた液体試料が調製されるまでについて、図14の模式図を用いて詳細に説明する。
まず図14(a)に示すように、フィルタ60が、置換容器57内の生体試料と保存液との混合液の液面上方から、その液中に向かって下方に移動するように、ピストン58を下降させる。
【0108】
すると、図14(b)に示すように、測定対象細胞(C1)を含む液体(第1液体)が、置換容器57内のフィルタ60の下方に残り、測定対象細胞より小径の細胞(C2)を含む液体(第2液体)が、フィルタ60の上方(ピストン58の内部)に残る。
その後、図14(c)に示すように、ピストン58の内部に残っている第2液体を外部に排出させる。このとき、ピストン58の内部に陰圧をかけて第2液体を吸引するため、第1液体中に含まれる測定対象細胞(C1)の一部は、フィルタ60の下方に付着する。
【0109】
そして、図14(d)に示すように、回転子72を回転させることにより、フィルタ60の下方に付着している測定対象細胞が引き剥がされるとともに、第1液体中に含まれる測定対象細胞が濃縮試料収容室に収容される。この濃縮試料収容室に収容された測定対象細胞を含む液体を取得することにより、測定対象細胞の濃度が高い測定試料を得ることができる。
【0110】
なお、図13に示されるように、濃縮試料収容室80は、その底部に、下方に向かって断面積が徐々に減少するテーパ部83が形成されている。濃縮試料収容室80に収容された液体試料は、液体取得部である前記第1ピペット26Aにより吸引されるが、その際、第1ピペット26Aの先端は前記テーパ部83の先端近傍まで下降し、この先端近傍から液体試料を吸引するように構成されている。これにより、濃縮試料収容室80内の液体試料をできるだけ多く吸引して無駄なく利用することが可能となる。
【0111】
〔処理動作〕
つぎに前述した細胞分析装置1の処理動作について説明する。
図15及び図16は、細胞分析装置1の各制御部8、16、31が行う処理を示すフローチャートである。
なお、図15では、データ処理装置4の制御部(処理本体)31が行う処理フローを右列に示し、測定装置2の制御部8が行う処理フローを左列に示している。また、図16では、試料調製装置3の制御部16が行う処理フローを一列に示しているが、この処理フローは、図示のA、B及びC点において図15の処理フローと繋がっている。以下、この図15及び図16を参照しつつ、細胞分析装置1が行う処理内容を説明する。
【0112】
まず、最初に、データ処理装置4の制御部31は、前記表示部32にメニュー画面を表示させる(ステップS1)。その後、このメニュー画面に従った測定開始指示を入力部33から受け付けると(ステップS2)、データ処理装置4の制御部31は、測定開始信号を測定装置2に送信する(ステップS3)。
測定装置2の制御部8は、前記測定開始信号を受信すると(ステップS4)、調製開始信号を試料調製装置3に送信する(ステップS5及びA点)。
【0113】
試料調製装置3の調製制御部16は、初期化処理において、液体収容部101の凹部104に液体供給源106Aより液体103を供給し、ついで、図16に示されるように、前記調製開始信号を受信すると(ステップS6)、測定試料の調製に用いられる試薬(染色液、RNase)を装置内の流路に吸引するとともに、生体容器53内に収容された生体試料とメタノール主成分の保存液との混合液を細胞分散部25の分散容器内に送る。ついで、混合液中の細胞を細胞分散部25で分散させる(ステップS7,S8,S9)。
【0114】
その後、試料調製装置3の調製制御部16は、分散済みの混合液を分散容器から所定量だけ吸引させて、弁別・置換部29の置換容器57に送り、その弁別・置換部29に、生体試料と保存液との混合液に対する弁別・置換処理を行わせる(ステップS10)。
【0115】
〔弁別・置換処理の内容〕
図17〜18は、前記弁別・置換処理(ステップS10)を示すフローチャートである。
図17に示されるように、まず、試料調製装置3の調製制御部16は、検体ピペット部26を細胞分散部25に移動させ(ステップT1)、第1ピペット26Aに分散済みの混合液を分散容器から所定量だけ吸引させる(ステップT2)。
【0116】
ついで、調製制御部16は、検体ピペット部26を置換容器57に移動させ(ステップT3)、第1ピペット26Aに、吸引した混合液を当該置換容器57内に排出させる(ステップT4)。
ついで、置換容器57内に希釈液ユニット55からバルブV6を通して希釈液(置換液)が投入される(ステップT5)。
【0117】
ついで、ピストン58が駆動部59によって所定のろ過高さまで下方に移動され(ステップT6)、置換容器57内の混合液が当該ピストン58内に吸引されてろ過される(ステップT7)。この吸引ろ過時には、リリーフバルブが接続されているバルブV10及びV12が用いられる。このとき、リリーフバルブは-5kpaに設定されている。これにより、吸引ろ過時には、ピストン58の下端部に配設されているフィルタ60に約-3kpaの圧力がかかる。このような弱い陰圧で液体を吸引ろ過することにより、測定対象細胞がフィルタ60を通過して廃棄部61に排出することなくろ過を行うことができる。
【0118】
ついで、ピストン58が駆動部59によってさらに下方に移動され(ステップT8)、前記ステップT7と同様にして置換容器57内の混合液が当該ピストン58内に吸引されてろ過される(ステップT9)。
【0119】
このようなピストン58の移動及び混合液の吸引ろ過が、所定回数繰り返されて、当該ピストン58が所定の最下死点に移動すると(ステップT10)、前記ステップT7と同様にして置換容器57内のサンプルが当該ピストン58内に吸引ろ過され(ステップT11)、収容容器57内に配置された静電容量タイプの液面検知センサ82のセンサ部82aが液面を検知すると(ステップT12)、所定時間経過後に吸引が停止される(ステップT13)。このとき、置換容器57の底部に配設された収容室68及び濃縮試料収容室80内に、測定対象細胞を含む液体試料が満たされた状態となっている。
【0120】
ついで、フィルタ60の通孔に詰まっている、又は、フィルタ60の下面に付着している細胞(分析対象物)を取り除いて、置換容器57(収容室68及び濃縮試料収容室80)内に戻すために、ピストン58内に陽圧を付与する(ステップT14)。
【0121】
ここで、試料調製装置3の調製制御部16は、ピストン58の最下死点への移動が2回目か否かを判定する(ステップT15)。
試料調製装置3の調製制御部16は、ピストン58の最下死点への移動が2回目でない場合には、置換スピッツへ希釈液の投入(ステップT5)から再度ろ過を繰り返し、2回目である場合には、ステップT16に進む。
【0122】
ステップT16では、駆動モータ70により磁石69を回転させることで回転子72を回転させ、フィルタ60の下面に付着している測定対象細胞を取り除くと共に、収容室68内の液体試料中に含まれる測定対象細胞を濃縮試料収容室80の方に移動させて、濃縮試料収容室80内に測定対象細胞を収容する(ステップT16)。
【0123】
この弁別・置換処理により、測定対象細胞(上皮細胞)を主に含み測定対象細胞以外の細胞の数が低減された液体(濃縮液)を取得することができる。また、前記弁別・置換処理により、生体容器53から置換容器57に供給された液体(生体試料と保存液との混合液)における保存液中のメタノールの濃度を、当該保存液の大部分を希釈液と置換することで薄めることができる。そのため、後述のDNA染色処理において、保存液の影響を低減させ、良好に測定対象細胞のDNAを染色することができる。
【0124】
また、この弁別・置換処理においては、細胞の弁別処理を行いながら、保存液と希釈液の置換処理を行うことができるので、これら2つの処理を別々に行う場合に比べて短時間で弁別処理と置換処理とを行うことができる。
【0125】
また、この弁別・置換処理においては、回転子72を回転させることにより、フィルタ60の下面に付着している測定対象細胞(上皮細胞)を剪断力で剥離してフィルタ60の下方の第1液体に浮遊させるとともに、フィルタ60の上方からフィルタ60の通孔に圧力を付与することにより、フィルタ60の通孔に詰まっている測定対象細胞(上皮細胞)を除去してフィルタ60の下方の第1液体に浮遊させることができる。そのため、フィルタに付着した測定対象細胞(上皮細胞)をロスすることなく効率的に回収することができる。
【0126】
さらに、本実施の形態では、収容室68の周縁部に濃縮試料収容室80を連通して配設しているので、前記スターラー72の回転により、収容室68内の液体試料中に含まれる測定対象細胞は、濃縮試料収容室80に収集される。これにより、収容室68内の液体試料中に含まれる測定対象細胞の濃度が低くなり、濃縮試料収容室80内の液体試料中に含まれる測定対象細胞の濃度が高くなる。したがって、かかる濃縮試料収容室80から液体試料を取得することにより、測定対象細胞の濃度を高めた測定試料を取得することができる。なお、この収集過程において、測定対象細胞の一部が濃縮されることにより互いに凝集することがあるが、かかる凝集した測定対象細胞は、後述する超音波振動付与操作によって分離される。
【0127】
〔測定試料の調製〕
図16に戻り、試料調製装置3の調製制御部16は、検体ピペット部26を置換容器57に移動させ、第1ピペット26Aに濃縮試料収容室80から濃縮液を吸引し、さらに検体ピペット部26を容器載置部130へ移動させ、容器移送部110によって予め反応部24から当該容器載置部130に移送されている測定試料容器54に前記濃縮液を供給する(ステップS11)。
【0128】
ついで、試料調製装置3の調製制御部16は、超音波振動部100に凝集細胞の分離処理を行わせる(ステップS12)。
〔凝集細胞の分離処理の内容〕
図19は、前記凝集細胞の分離処理(ステップS12)を示すフローチャートである。
図19に示されるように、まず、試料調製装置3の調製制御部16は、容器移送部110によって前記測定試料容器54を容器載置部130から超音波振動部100における所定の位置(図5に示される位置)まで移動させ、その一部(下部)を液体収容部101内の液体(水溶液)中に漬ける(ステップS121)。
【0129】
ついで、試料調製装置3の調製制御部16は、流路切替バルブ162を切り替えて液体供給源106Aと液体収容部101の凹部104とを連通させてから、所定量(液面が図5のdを超える量)の液体103を当該液体供給源106Aから液体収容部101の凹部104内に追加供給する(ステップS122)。
ついで、試料調製装置3の調製制御部16は、吸引源107Aを駆動させて所定時間だけ液体収容部101の凹部104から液体103を吸引し、当該液体103の深さd(測定試料容器54を漬けた状態での液体の深さ)になるように調整する(ステップS123)。こうすることで、超音波振動を効果的に発生させることができる。
【0130】
ついで、容器移送部110によって液体中に漬けられた状態で保持された測定試料容器54内の濃縮液に対し、超音波振動子102により超音波振動が付与され、当該濃縮液中で凝集している測定対象細胞が分離される(ステップS124)。
【0131】
本実施の形態では、この超音波処理において、超音波振動部100は、分析対象物である上皮細胞に対して分析に影響するダメージを与えない所定の出力及び時間で超音波振動を付与するように制御されている。
凝集細胞の分散効果を上げるためには、超音波振動の出力を上げる、及び/又は、超音波振動を付与する時間を長くすればよいが、測定試料容器54内の濃縮液に対し超音波振動を付与すると、濃縮液に含まれる凝集細胞が分散される一方において液体の振動に起因して濃縮液の温度が上昇する。
【0132】
表1は、ポリプロピレンからなる測定試料容器(キュベット)54と、ポリエチレンからなる測定試料容器54とについて、超音波振動の出力を14W、16W及び18Wと設定した場合における測定試料容器54の液温の上昇値を調べた結果を示している。超音波振動を付与する時間は5秒又は10秒とした。測定試料容器54内には、測定試料として約530μLの水を収容し、液温は熱電対で測定した。また、測定時の室温は24.1〜25.0℃であった。実験は各条件について3回行い、その平均値を求めた。
【0133】
【表1】

【0134】
表1より、超音波振動の出力が高くなるほど、また超音波の付与時間が長くなるほど測定試料容器54内の液温の温度上昇が大きくなることがわかる。また、測定試料容器54の材質の違いにより測定試料容器54内液温の上昇温度に違いがあり、ポリプロピレンとポリエチレンとでは、ポリプロピレンの方がポリエチレンよりも温度上昇が大きいことがわかる。例えば、超音波振動の出力が18Wで付与時間が10秒の条件で比較すると、ポリプロピレンの方がポリエチレンよりも約1℃測定試料容器54内の液温が高くなった。これは、ポリプロピレンの方がポリエチレンよりも測定試料容器54内の液体に超音波が伝わりやすく、その結果、測定試料容器54内の液温が高くなると考えられる。したがって、凝集細胞を効果的に分散させるという観点からは測定試料容器54内の材質としてポリプロピレンの方がポリエチレンよりも好ましいと考えられる。また、測定試料容器54の材質がポリプロピレンのとき、超音波の付与時間が10秒以内であれば、超音波出力14〜16Wにおいてキュベット内液温の温度はおよそ31℃(温度上昇はおよそ5〜6℃)に抑えることができることがわかる。
【0135】
図16に戻り、試料調製装置3の調製制御部16は、容器移送部110によって前記測定試料容器54を超音波振動部100から液体除去部120に移動させ、当該液体除去部120において測定試料容器54の外周面に付着している水分を空気の吹き付け及び吸引排出により除去する(ステップS13)。
【0136】
ついで、試料調製装置3の調製制御部16は、容器移送部110によって前記測定試料容器54を液体除去部120から反応部24に移動させる。そして、装置内に貯留されていた染色液とRNaseとを、試薬定量部28から第2ピペット26Bに送り、この第2ピペット26Bは、送られてきた染色液とRNaseとを測定試料容器54に供給し(ステップS14)、この測定試料容器54内においてRNA処理とDNA染色を行わせて測定試料を作製する(ステップS15)。
前記処理が終わると、得られた測定試料は第1ピペット26Aを介して、検体定量部27で定量され、定量後に測定装置2の検出部6に供給される(ステップS16及びB点)。
【0137】
なお、試料調製装置3の調製制御部16は、測定装置2からのシャットダウン信号を受信したか否かを常時判定しており(ステップS17及びC点)、その信号を受信していない場合には、調製開始信号の受信如何を判定するステップS6に戻り、その信号を受信した場合には、シャットダウンを実行して試料調製処理を終了する(ステップS18)。シャットダウン処理において、試料調製装置3の調製制御部16は、流路切替バルブ162を切り替えて液体収容部101の凹部104とチャンバ108とを連通させた後に、吸引源107Aを駆動させて当該凹部104から液体103を全て排出させる。
【0138】
〔測定装置による測定とそのデータ分析〕
図15に戻り、測定装置2の制御部8は、調製開始信号を送信したあと、試料調製装置3から測定試料の供給があるか否かを常時判定している(ステップS19)。
そこで、試料調製装置3から測定試料が送液されると(B点)、測定装置2の制御部8は、その測定試料を測定部14のフローセル45に送り、測定試料の細胞に対する前記測定を行い(ステップS20)、その測定データをデータ処理装置4に送信する(ステップS21)。
【0139】
一方、データ処理装置4の制御部31は、測定開始信号を送信したあと、測定装置2から測定データを受信したか否かを常時判定している(ステップS22)。
測定装置2から前記測定データを受信すると、データ処理装置4の制御部31は、その測定データを用いて細胞や核を分析し、測定試料中の細胞が癌化しているか否か等を判定する(ステップS23)。
【0140】
また、データ処理装置4の制御部31は、前記分析結果を表示部32に表示させ(ステップS24)、ユーザ入力によるシャットダウン指示があるか否かを判定する(ステップS25)。
前記シャットダウン指示がある場合には、データ処理装置4の制御部31は、測定装置2にシャットダウン信号を送信する(ステップS26)。
【0141】
測定装置2の制御部8は、データ処理装置4からの前記シャットダウン信号を受信したか否かを常時判定しており(ステップS27)、その信号を受信していない場合には、測定開始信号の受信如何を判定するステップS4に戻り、その信号を受信した場合には、試料調製装置3に前記シャットダウン信号を転送するとともに(ステップS28)、シャットダウンを実行して測定処理を終了する(ステップS29)。
【0142】
本発明では、超音波振動部100において、弁別・置換部29で濃縮された測定試料に超音波振動を付与して当該測定試料中の凝集した測定対象細胞を分離している。これにより、測定精度を向上させることができる。
表2は、超音波振動部による超音波処理を行わなかった場合(コントロール)、測定試料容器にポリプロピレンを用いて超音波処理を行った場合(実施例1)、及び測定試料容器にステンレスを用いて超音波処理を行った場合(比較例1)における、凝集上皮細胞率<凝集上皮細胞率=凝集上皮細胞数/(単一上皮細胞数+凝集上皮細胞数)>を表したものである。ここでは、液体収容部に収容されている液体として水を用いている。
【0143】
実施例1より、測定試料容器としてポリプロピレンを用いた場合、コントロールと比較して凝集上皮細胞の凝集の程度が1/6に減少していることがわかる。また、比較例1より、測定試料容器としてステンレスを用いた場合、超音波処理を施しても、測定対象細胞の凝集の程度はコントロールとほとんど変わらないことがわかる。
【0144】
【表2】

【0145】
前述したように、測定試料容器の材質としては、ポリプロピレン以外にポリエチレンなど他の合成樹脂を用いることができる。表3は、測定試料容器の材質としてポリプロピレンを用い、超音波振動部による超音波処理を行わなかった場合、測定試料容器の材質としてポリプロピレンを用いて超音波処理を行った場合(超音波振動の出力:15W、超音波振動付与時間:5秒)、測定試料容器の材質としてポリエチレンを用いて超音波処理を行った場合(超音波振動の出力:15W、超音波振動付与時間:5秒)における、凝集上皮細胞率<凝集上皮細胞率=凝集上皮細胞数/(単一上皮細胞数+凝集上皮細胞数)>を示している。ここでは、液体収容部に収容されている液体として水を用いている。
【0146】
【表3】

【0147】
表3より、測定試料容器の材質としてポリエチレンを用いた場合、測定試料容器の材質としてポリプロピレンを用いた場合と同様に、超音波処理を施すことで、測定対象細胞の凝集の程度を減少させ得ることがわかる。また、超音波振動の条件が同一である場合、ポリエチレンよりもポリプロピレンの方が、細胞を分散させる効果が高いことが推認される。
【0148】
〔その他の変形例〕
なお、以上開示された実施の形態は、本発明の例示であって制限的なものではない。本発明の範囲は、前記実施の形態ではなく特許請求の範囲によって示され、さらに特許請求の範囲の構成と均等なすべての変更が含まれる。
【0149】
例えば、前記実施の形態では、測定試料を収容した測定試料容器を容器移送部によって超音波振動部に移送し、超音波振動による凝集細胞の分離処理を行った測定試料容器を同じく容器移送部によって液体除去部に移送することで超音波処理の自動化を図っているが、ピペット等の試料移送手段(試料移送部)を用いて、超音波振動部に配設されている容器中に測定試料を移送し、超音波振動による凝集細胞の分離処理を行った測定試料を同じくピペット等の試料移送手段を用いて検体セット部に配置されている別の容器中に移送することもできる。この場合は、前記実施の形態に比べて測定試料のロスが多くなるが、容器移送部や液体除去部を省略することができ、装置の構成を簡素化することができる。
【0150】
また、前記実施の形態では、容器移送部によって測定試料を収容した測定試料容器を容器載置部から超音波振動部へ移送しているが、これに限らず、例えば、ピペット等の試料移送手段によって超音波振動部に配設されている測定試料容器内に測定試料を移送してもよく、また、ユーザーによって測定試料を収容した測定試料容器を超音波振動部に移送してもよい。
【0151】
また、前記実施の形態では、子宮頸部の上皮細胞を測定対象細胞としているが、口腔細胞、膀胱や咽頭など他の上皮細胞、さらには臓器の上皮細胞についても、癌化判定を行うことができる。
【0152】
また、前記実施の形態では、試料調製装置3で調製された測定試料をフローサイトメータで測定しているが、試料調製装置3で調製された測定試料をスライドガラスに塗抹して塗抹標本を作製する塗抹標本作製装置と、作製された塗抹標本を撮像して撮像画像中の上皮細胞を分析する細胞画像処理装置とを設けてもよい。スライドガラスには、測定対象細胞である上皮細胞の濃度が高められ且つ赤血球や白血球などの細胞の数が低減された測定試料が塗抹されるため、上皮細胞の分析を精度良く行うことができる。
【0153】
また、前記実施の形態では、測定装置と試料調製装置は別体となっているが、測定装置と試料調製装置を一体とすることもできる。図19は、測定装置と試料調製装置を一体としたときの測定装置200の内部構成を示すブロック図である。なお、前記実施の形態と同様の構成については、同一の符号を付して説明を省略する。
図19に示されるように、この測定装置200は、反応部24、細胞分散部25、検体ピペット部26、検体定量部27、試薬定量部28、弁別・置換部29、超音波分散部100、容器移送部110、液体除去部120、検体セット部150、検出部6、信号処理部7、制御部140、及びI/Oインターフェース160を備えている。
測定装置200の制御部150は、前記実施の形態に係る図2の測定制御部8と図3の調製制御部16との両方の機能を有している。また、制御部150は、I/Oインターフェース160を介して、データ処理装置4と繋がっており、制御部150が処理したデータや、制御部150の処理で必要なデータをデータ処理装置4との間で送受信することができる。
【符号の説明】
【0154】
1 細胞分析装置
2 測定装置
3 試料調製装置
4 データ処理装置
6 検出部
16 調製制御部
18 調製デバイス部
24 反応部
25 細胞分散部
26 検体ピペット部
27 検体定量部
28 試薬定量部
29 弁別・置換部
31 処理本体
32 表示部
53 生体容器
54 測定試料容器
57 置換容器
58 ピストン
59 駆動部
60 フィルタ
68 収容室
69 磁石
70 駆動モータ
72 回転子
75 磁石
80 濃縮試料収容室
82 液面検知センサ
100 超音波振動部
101 液体収容部
102 超音波振動子
103 液体
104 凹部
106 供給孔
107 排出孔
110 容器移送部
111 把持部
112 溝
120 液体除去部
121 本体部
122 給気口
123 吸気部
124 収容凹部
129 給気口
130 容器載置部
【特許請求の範囲】
【請求項1】
測定試料容器内に収容された分析対象物を含む試料に超音波振動を付与する超音波振動部と、
超音波振動が付与された試料と所定の試薬とから測定試料を調製する試料調製部と、
試料が収容された測定試料容器を超音波振動部から試料調製部へ移送する容器移送部と
を備えたことを特徴とする試料調製装置。
【請求項2】
前記超音波振動部は、液体を収容する液体収容部と、超音波振動を発生する超音波振動子とを備えており、
前記容器移送部は、前記測定試料容器を前記液体収容部に収容された液体に漬けた状態で保持可能であり、且つ、
前記超音波振動子は、前記液体を介して前記測定試料容器に収容された試料に超音波振動を付与する請求項1に記載の試料調製装置。
【請求項3】
前記液体収容部に収容された液体の液面の高さを調整する液面調整部をさらに備えている請求項2に記載の試料調製装置。
【請求項4】
前記液面調整部は、前記液体収容部に液体を供給する液体供給部と、当該液体収容部から液体を排出する液体排出部とを備えている請求項3に記載の試料調製装置。
【請求項5】
前記液体排出部は前記液体収容部の周壁に形成された排出孔からなり、この排出孔は、前記液体の液面が当該液体に付与される超音波振動の波長に基づき定められる所定の高さにくる位置に形成されている請求項4に記載の試料調製装置。
【請求項6】
前記測定試料容器は、当該測定試料容器内の試料の液面が、液体収容部内の液体の液面よりも下方に位置するように当該液体に漬けられる請求項2〜5のいずれかに記載の試料調製装置。
【請求項7】
前記測定試料容器は、液体収容部に収容される液体の音響インピーダンスとほぼ同じ音響インピーダンスを有する材料で作製されている請求項2〜6のいずれかに記載の試料調製装置。
【請求項8】
前記液体が水であり、且つ、前記測定試料容器が合成樹脂で作製されている請求項7に記載の試料調製装置。
【請求項9】
前記測定試料容器がポリプロピレンで作製されている請求項8に記載の試料調製装置。
【請求項10】
前記測定試料容器の内面の算術平均粗さが1〜30μmの範囲である請求項1〜9のいずれかに記載の試料調製装置。
【請求項11】
前記液体収容部が円筒体形状を呈しており、前記超音波振動子が円柱体形状を呈しており、且つ、液体収容部の内径が超音波振動子の径よりも大きい請求項1〜10のいずれかに記載の試料調製装置。
【請求項12】
前記超音波振動部は、分析対象物に対して分析に影響するダメージを与えない所定の出力および時間で超音波振動を付与する請求項1〜11のいずれかに記載の試料調製装置。
【請求項13】
前記超音波振動子の振動数が20〜75Hzの範囲である請求項2〜12のいずれかに記載の試料調製装置。
【請求項14】
前記測定試料容器に付着した液体を除去する液体除去部をさらに備えており、
前記容器移送部は、前記測定試料容器を超音波振動部から前記液体除去部へ移送し、当該液体除去部から前記試料調製部へ移送する請求項1〜13のいずれかに記載の試料調製装置。
【請求項15】
前記液体除去部は、前記測定試料容器のうち少なくとも液体に漬けられた部分を収容可能な収容凹部を有する本体部と、前記収容凹部に収容された測定試料容器の外周面に気体を供給する給気部と、供給された気体を吸引する吸気部とを備えている請求項14に記載の試料調製装置。
【請求項16】
前記給気部は、収容凹部の内周面において周方向に複数形成された給気口を有する請求項15に記載の試料調製装置。
【請求項17】
前記測定試料容器を載置する容器載置部をさらに備えており、
前記容器移送部は、前記測定試料容器を前記容器載置部から前記超音波振動部へ移送する請求項1〜16のいずれかに記載の試料調製装置。
【請求項18】
前記測定試料容器に前記試料を分注する試料分注部をさらに備えている請求項1〜17のいずれかに記載の試料調製装置。
【請求項19】
前記試料分注部は、前記容器載置部に載置された測定試料容器に試料を分注し、
前記容器移送部は、前記試料を収容した測定試料容器を、前記容器載置部から前記超音波振動部へ移送する請求項18に記載の試料調製装置。
【請求項20】
前記超音波振動部、前記試料調製部、及び前記容器載置部は同一円周上に配置されている請求項17〜19のいずれかに記載の試料調製装置。
【請求項21】
測定試料容器内に収容された分析対象物を含む試料に超音波振動を付与する超音波振動部と、
超音波振動が付与された試料と所定の試薬とから測定試料を調製する試料調製部と、
前記超音波振動部に配置された測定試料容器内の試料を超音波振動部から試料調製部へ移送する試料移送部と
を備えたことを特徴とする試料調製装置。
【請求項1】
測定試料容器内に収容された分析対象物を含む試料に超音波振動を付与する超音波振動部と、
超音波振動が付与された試料と所定の試薬とから測定試料を調製する試料調製部と、
試料が収容された測定試料容器を超音波振動部から試料調製部へ移送する容器移送部と
を備えたことを特徴とする試料調製装置。
【請求項2】
前記超音波振動部は、液体を収容する液体収容部と、超音波振動を発生する超音波振動子とを備えており、
前記容器移送部は、前記測定試料容器を前記液体収容部に収容された液体に漬けた状態で保持可能であり、且つ、
前記超音波振動子は、前記液体を介して前記測定試料容器に収容された試料に超音波振動を付与する請求項1に記載の試料調製装置。
【請求項3】
前記液体収容部に収容された液体の液面の高さを調整する液面調整部をさらに備えている請求項2に記載の試料調製装置。
【請求項4】
前記液面調整部は、前記液体収容部に液体を供給する液体供給部と、当該液体収容部から液体を排出する液体排出部とを備えている請求項3に記載の試料調製装置。
【請求項5】
前記液体排出部は前記液体収容部の周壁に形成された排出孔からなり、この排出孔は、前記液体の液面が当該液体に付与される超音波振動の波長に基づき定められる所定の高さにくる位置に形成されている請求項4に記載の試料調製装置。
【請求項6】
前記測定試料容器は、当該測定試料容器内の試料の液面が、液体収容部内の液体の液面よりも下方に位置するように当該液体に漬けられる請求項2〜5のいずれかに記載の試料調製装置。
【請求項7】
前記測定試料容器は、液体収容部に収容される液体の音響インピーダンスとほぼ同じ音響インピーダンスを有する材料で作製されている請求項2〜6のいずれかに記載の試料調製装置。
【請求項8】
前記液体が水であり、且つ、前記測定試料容器が合成樹脂で作製されている請求項7に記載の試料調製装置。
【請求項9】
前記測定試料容器がポリプロピレンで作製されている請求項8に記載の試料調製装置。
【請求項10】
前記測定試料容器の内面の算術平均粗さが1〜30μmの範囲である請求項1〜9のいずれかに記載の試料調製装置。
【請求項11】
前記液体収容部が円筒体形状を呈しており、前記超音波振動子が円柱体形状を呈しており、且つ、液体収容部の内径が超音波振動子の径よりも大きい請求項1〜10のいずれかに記載の試料調製装置。
【請求項12】
前記超音波振動部は、分析対象物に対して分析に影響するダメージを与えない所定の出力および時間で超音波振動を付与する請求項1〜11のいずれかに記載の試料調製装置。
【請求項13】
前記超音波振動子の振動数が20〜75Hzの範囲である請求項2〜12のいずれかに記載の試料調製装置。
【請求項14】
前記測定試料容器に付着した液体を除去する液体除去部をさらに備えており、
前記容器移送部は、前記測定試料容器を超音波振動部から前記液体除去部へ移送し、当該液体除去部から前記試料調製部へ移送する請求項1〜13のいずれかに記載の試料調製装置。
【請求項15】
前記液体除去部は、前記測定試料容器のうち少なくとも液体に漬けられた部分を収容可能な収容凹部を有する本体部と、前記収容凹部に収容された測定試料容器の外周面に気体を供給する給気部と、供給された気体を吸引する吸気部とを備えている請求項14に記載の試料調製装置。
【請求項16】
前記給気部は、収容凹部の内周面において周方向に複数形成された給気口を有する請求項15に記載の試料調製装置。
【請求項17】
前記測定試料容器を載置する容器載置部をさらに備えており、
前記容器移送部は、前記測定試料容器を前記容器載置部から前記超音波振動部へ移送する請求項1〜16のいずれかに記載の試料調製装置。
【請求項18】
前記測定試料容器に前記試料を分注する試料分注部をさらに備えている請求項1〜17のいずれかに記載の試料調製装置。
【請求項19】
前記試料分注部は、前記容器載置部に載置された測定試料容器に試料を分注し、
前記容器移送部は、前記試料を収容した測定試料容器を、前記容器載置部から前記超音波振動部へ移送する請求項18に記載の試料調製装置。
【請求項20】
前記超音波振動部、前記試料調製部、及び前記容器載置部は同一円周上に配置されている請求項17〜19のいずれかに記載の試料調製装置。
【請求項21】
測定試料容器内に収容された分析対象物を含む試料に超音波振動を付与する超音波振動部と、
超音波振動が付与された試料と所定の試薬とから測定試料を調製する試料調製部と、
前記超音波振動部に配置された測定試料容器内の試料を超音波振動部から試料調製部へ移送する試料移送部と
を備えたことを特徴とする試料調製装置。
【図1】


【図2】


【図3】


【図4】


【図5】


【図6】


【図7】


【図8】


【図9】


【図10】


【図11】


【図12】


【図13】


【図15】


【図16】


【図17】


【図18】


【図19】


【図20】


【図14】




【図2】


【図3】


【図4】


【図5】


【図6】


【図7】


【図8】


【図9】


【図10】


【図11】


【図12】


【図13】


【図15】


【図16】


【図17】


【図18】


【図19】


【図20】


【図14】


【公開番号】特開2011−169886(P2011−169886A)
【公開日】平成23年9月1日(2011.9.1)
【国際特許分類】
【出願番号】特願2010−243693(P2010−243693)
【出願日】平成22年10月29日(2010.10.29)
【出願人】(390014960)シスメックス株式会社 (810)
【Fターム(参考)】
【公開日】平成23年9月1日(2011.9.1)
【国際特許分類】
【出願日】平成22年10月29日(2010.10.29)
【出願人】(390014960)シスメックス株式会社 (810)
【Fターム(参考)】
[ Back to top ]

