試薬保持容器、その製造方法、および試薬保持容器を備えた検出装置
【課題】送液時の液残りを低減し、低コスト化を図ることができるとともに、送液の制御が容易な試薬保持容器、その製造方法、および試薬保持容器を用いた分析装置を提供する。
【解決手段】筒状部品の軸方向一端を閉じることにより形成される試薬保持容器10であって、筒状部品の一端は、軸方向と直交して延びる底壁を有し、この底壁は、筒状部品を平坦に接合した接合部により形成されている試薬保持容器。
【解決手段】筒状部品の軸方向一端を閉じることにより形成される試薬保持容器10であって、筒状部品の一端は、軸方向と直交して延びる底壁を有し、この底壁は、筒状部品を平坦に接合した接合部により形成されている試薬保持容器。
【発明の詳細な説明】
【技術分野】
【0001】
本発明の実施形態は、核酸、酵素等を含む試薬を保持し、検査時には内部の試薬が外部に送り込まれる構造の試薬保持容器、その製造方法、および試薬保持容器を用いる検出装置に関する。
【背景技術】
【0002】
近年の遺伝子工学の発展に伴い、医療分野では、遺伝子による病気の診断或いは予防が可能となりつつある。これは遺伝子診断と呼ばれ、病気の原因となるヒトの遺伝子欠陥、変化を検出することで病気の発症前もしくは極めて初期段階での病気の診断や予測をすることが出来る。また、ヒトゲノムの解読とともに、遺伝子型と疫病との関連に関する研究が進み、各個人の遺伝子型に合わせた治療(テーラーメイド医療)も現実化しつつある。従って、遺伝子の検出並びに遺伝子型の決定を簡便に行うことは非常に重要となっている。
【0003】
一方、1つのデバイス内において、複数の試薬が関わる複数の反応を順次行うことのできるμ−TASと呼ばれるデバイスが盛んに研究開発されている。これらは試薬保持領域、反応領域、センサー領域などから成り、それらをつなぐ流路を備えることが特徴である。これを応用し、核酸を検出するための検出装置も開発されている。核酸検出を行う場合、複数の試薬を使用し、複数の反応を行う必要がある。試薬として、一般に、核酸の増幅や検出のための試薬、例えばDNAプライマー、酵素、蛍光色素などの標識試薬、あるいは、バッファ等が用いられる。
【0004】
このような核酸検出装置における試薬保持容器に関して要求される点は主に以下の2項目が挙げられる。1つ目の項目は、容器の低コスト化である。試薬は、予め試薬保持容器内に注入されているが、試薬保持容器内にて試薬の化学反応を行う場合は、反応後、容器内部の試薬を検出装置内の別な領域に送液する。また、検出装置内の別な領域で化学反応を行う場合は、反応前に、容器内部の試薬を反応領域に送液する。DNAプライマーや酵素、蛍光色素等の試薬は高価であるため、上記のような送液の際、容器内の液残りを極力少なくすることが低コスト化のために要求される。
【0005】
2つ目の項目は、容器を制御する装置の構成が極力簡略化されることである。確実な制御ができる装置であっても、構成が複雑になると高コスト化、検査の信頼性低下につながる。より簡易な構成で試薬の送液や化学反応の制御ができることが要求される。
【0006】
例えば、特許文献3に開示されている形状の試薬保持容器では、試薬保持容器に把持部が形成されるため、内部の液残りが大きくなり、さらに装置構成も複雑となっている。
【先行技術文献】
【特許文献】
【0007】
【特許文献1】特許第4127679号公報
【特許文献2】特開2008−263959号公報
【特許文献3】特開2010−78508号公報
【発明の開示】
【発明が解決しようとする課題】
【0008】
上述したように、従来の試薬保持容器では、内部の試薬を試薬保持容器から検出装置内の別な領域へ送液する際に容器内に液残りがあり低コスト化の妨げとなる。また、従来の試薬保持容器では、この容器からの試薬の送液を制御する装置の構成が複雑となる。
【0009】
この発明は、上記事情に鑑みなされたもので、その目的は、送液時の液残りを低減し、低コスト化を図ることができるとともに、送液の制御が容易な試薬保持容器、その製造方法、および試薬保持容器を用いた検出装置を提供することにある。
【課題を解決するための手段】
【0010】
実施形態によれば、試薬保持容器は、筒状部品の軸方向一端を閉じることにより形成される試薬保持容器であって、前記一端は、筒状部品の軸方向と直交して延びる底壁を有し、この底壁は、筒状部品を平坦に接合した接合部により形成されている。
【0011】
実施態様によれば、検出装置は、検査器を装着可能な検査部、およびこの検査部を通って延び検体を流す微小流路を有する送液カセットと、送液カセットに接続され、微小流路に連通する前記試薬保持容器と、を備えている。
【図面の簡単な説明】
【0012】
【図1】図1は、第1の実施形態に係る試薬保持容器を示す斜視図。
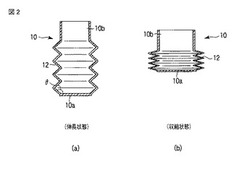
【図2】図2は、前記試薬保持容器の伸長状態および収縮状態を示す断面図。
【図3】図3は、検出装置に装着された前記試薬保持容器の伸長状態および収縮状態を示す断面図。
【図4】図4は、前記試薬保持容器の製造工程を示す断面図。
【図5】図5は、前記試薬保持容器の製造工程を示す断面図。
【図6】図6は、前記試薬保持容器の製造工程を示す断面図。
【図7】図7は、この発明の実施形態に係る検体検出装置の送液カセットおよび試薬保持容器を示す斜視図。
【図8】図8は、前記送液カセットの裏面側を示す斜視図。
【図9】図9は、前記検体検出装置の断面図。
【図10】図10は、加熱機構のヒータおよび試薬保持容器を示す斜視図。
【図11】図11は、前記検体検出装置による検体の検出結果を示すグラフ。
【図12】図12は、第2の実施形態に係る試薬保持容器を示す斜視図。
【図13】図13は、前記試薬保持容器の伸長状態および収縮状態を示す断面図。
【図14】図14は、前記試薬保持容器の製造工程を示す断面図。
【図15】図15は、前記試薬保持容器の製造工程を示す断面図。
【図16】図16は、前記試薬保持容器の製造工程を示す断面図。
【発明を実施するための形態】
【0013】
以下、図面を参照しながら、実施形態に係る試薬保持容器およびこれを備えた検体検出装置について詳細に説明する。
図1、図2、図3は、第1の実施形態に係る試薬保持容器を示している。図1および図2に示すように、試薬保持容器10は、下端が閉塞し、上端部10bが開口した円筒形状に形成され、その中途部に、伸縮可能な蛇腹構造部12を有している。保持容器10の下端は、継ぎ目のない平坦な底壁10aを形成している。底壁10aは、保持容器10の軸方向に対して直交して延びている。試薬保持容器10は、一般的な蛇腹付きストローなどの一部と類似した構造を有している。
【0014】
底壁10aは、蛇腹構造12の谷部、つまり、凹部に連続して形成されている。これにより、蛇腹構造部12は、底壁10aから徐々に拡径するように外側に傾斜している。これにより、底壁10aと蛇腹構造部12との成す角度θは、90度以上に形成されている。本実施形態において、保持容器10の底壁10aは円形に形成され、少なくとも平坦部分の直径は、蛇腹構造部12の凹部内径の60〜99%に形成されている。
【0015】
試薬保持容器10の材質は特に限定されないが、ポリプロピレンが好ましく、その他、ポリスチレン、ポリビニル、ポリエチレン、ポリカーボネート、ABS、ゴムなどを用いることができる。試薬保持容器10は、生体物質を検出するデバイスであるため、場合によっては滅菌処理が必要となる。滅菌の手法は限定されないが、ガンマ線滅菌、電子線滅菌、ガス滅菌、乾熱滅菌等が挙げられる。試薬保持容器10のガンマ線滅菌を行う場合、容器材料に耐ガンマ線添加剤が添加されていることが望ましい。
【0016】
本実施形態において、保持容器10に保持される試薬は、核酸あるいは酵素の少なくとも一方を含む試薬を保持対象としている。試薬として、加熱処理される試薬、例えば、核酸増幅反応を行う試薬は、100℃近い加熱処理が必要であるため、このような試薬を保持する保持容器10の材料は、例えば、120℃までの耐熱性を持つことが好ましい。また、プライマー等の核酸試薬や酵素試薬等は紫外光により分解されてしまう。そのため、これらの試薬を保持する場合、保持容器10は、入射光中の紫外光に対して90%以上の遮光率を持つ材質で形成されていることが好ましい。
【0017】
図2(a)は、試薬保持容器10の蛇腹構造部12が伸長した状態を示し、図2(b)は、蛇腹構造部12が収縮した状態を示している。収縮状態において、蛇腹構造部12の内面は、互いに重なりながら収縮している。蛇腹部12の伸長、収縮は可逆性がある。本実施形態において、試薬保持容器10は、押圧負荷を受けていない状態では、図2(a)に示す伸長状態となっている。そして、後述する駆動機構により、下端10aが上端側に向かって押されることにより、図2(b)に示すように、蛇腹構造部12が収縮する。押圧力が除かれると、蛇腹構造部12は自身の弾性により伸長状態に復帰する。
【0018】
図3は、上記のように構成された試薬保持容器10を、後述する検査装置のカセットに装着した状態を示している。保持容器10は、カセットに形成された円柱形状のボス部を容器内に挿入し、かつ、容器の上端部10bをボス部に嵌合することにより、カセットに装着される。図3(a)に示すように、伸長状態の保持容器10内に試薬が供給され、図3(b)に示すように、蛇腹構造部12が収縮することで、保持容器10内の試薬がカセットのカセット内の流路に押し出される。
【0019】
なお、試薬保持容器10は、上述した円筒形状に限らず、多角筒形状、楕円筒形状等、他の形状としてもよい。また、蛇腹構造部を備えている場合に限らず、試薬保持容器10の内面に複数の連続した凹凸を備えた構造としてもよい。
【0020】
次に、上記の構成を有する試薬保持容器10の製造方法について説明する。まず、図4(a)に示すように、中途部に蛇腹構造部12を有する円筒形状の部品11を用意する。また、ほぼ半球形状の凹所44aを有する成形治具44を用意する。部品11は、蛇腹構造の上側に伸びる円筒部と、下側に延びる円筒部10dとを有している。
【0021】
図4(b)に示すように、この部品11の下側の下端部10dを成形治具44の凹所44aに上から押し込むことにより、円筒部10dを内側に変形させる。その際、成形治具44を加熱する、或いは溶剤を用いることにより、円筒部10dを容易に変形させることができる。
【0022】
次に、図5(a)、図5(b)に示すように、変形した円筒部10dを部品11の軸方方向に沿って上下両方向から押圧して圧着することにより、継目の無い平坦な底壁10aを形成する。例えば、先端が平坦な円柱形状の押圧治具48を部品11に挿入し、また、変形した円筒部10dの外側に平坦な支持ブロック46を配置し、これら押圧治具48と支持ブロック46とで、内側に変形した円筒部10dを両側から押圧することにより、円筒部10dを平坦な底壁に変形させる。その際、超音波、熱、溶剤等を用いて圧着することにより、図6に示すように、内側に変形した部分が溶融し、かつ、押圧され、継目の無い平坦な底壁10aが形成される。底部からのはみ出し部分がないため、後述するジャバラ部分の伸縮や、加熱の際に均一に処理することができる。
【0023】
なお、図4(b)に示した一段階目の加工の時点で内側に変形させる部分の面積は、円筒形の底面積よりも大きいことが望ましい。底面積よりも小さい場合、図5に示す二段階目の加工で底部を閉塞できない可能性があり、仮に閉塞できた場合でも底壁が肉薄になってしまうためである。従って、図4(a)に示すように、変形される円筒部10dの寸法は、半径r、軸方向長さaとした場合、以下の式(1)を満たすことが望ましい。
a>r×(1/2))・・・(1)
以上により、継目の無い平坦な底壁10aを有する試薬保持容器10が形成される。保持容器10の底部に窪みがないことから、保持容器10内の試薬を流路に供給する際、薬液残りが低減される。この際、底壁10aの直径は蛇腹構造部12の凹部の内径と同程度であることが好ましく、それよりも小さいと平坦な領域が少なくなり、液残り低減効果が少なくなってしまう。
【0024】
次に、上述した試薬保持容器10を用いる検体検出装置について説明する。図7は、核酸検出用の検出装置における送液カセット20、この送液カセットに装着される複数の試薬保持容器、および検知器としてのDNAチップ40を示し、図8は、送液カセットの裏面側を示し、図9は、送液カセットを駆動機構に装填した状態を示している。
【0025】
図7、図8、および図9に示すように、検体検出装置は、送液カセット20と、この送液カセットを駆動する駆動機構30とを備え、送液カセット20は、駆動機構30に対して脱着自在に接続されている。
【0026】
送液カセット20は、例えば、矩形板状に形成された基材22を備えている。基材22の下面は、平坦な装着面を形成している。基材22の中央部には、基材22の下面側に開口した矩形状の凹所からなる検査部24が形成されている。この検査部24を覆うように、検査器、例えば、DNAチップ40が基材22の下面側に装着されている。
【0027】
基材22には、検査部24に気密に連通した微小流路28が形成されている。微小流路28の一端は、基材22の下面側に開口した流入口28aに連通し、他端は、基材22の下面側に開口した流出口28bに連通している。検査部24は、微小流路28の中途部に連通している。微小流路28は、例えば、0.3mm×0.3mmの径に形成されている。また、基材22には、基材の上面に開口した注入口21が形成されている。注入口21は、流入口28aと対向して位置しているとともに、脱着自在な封止栓23によって気密に閉じられている。
【0028】
また、基材22の下面側には、流入口28aと検査部24との間で、微小流路28にそれぞれ連通する複数、例えば、1つの出入口28c、および3つの出入口28dが形成されている。基材22の下面において、流入口28a、流出口28b、出入口28c、28dの位置には、下方に突出する円柱形状のボス25がそれぞれ形成されている。
【0029】
送液カセット20の流入口28a、流出口28b、出入口28c、28dには、抽出試薬保持容器32a、廃液容器32b、増幅試薬保持容器32c、ハイブリダイゼーション試薬保持容器32d、洗浄試薬保持容器32e、検出試薬保持容器32fがそれぞれ装着され、気密に接続されている。これらの容器は、前述した試薬保持容器10と同様に構成されている。すなわち、各容器は、蛇腹構造部12を有する円筒形状に形成され、その上端開口に送液カセット20のボス25が気密に嵌合された状態で、送液カセット20に取り付けられている。これらの容器は、送液カセット20内の微小流路28を通じて接続されている。
【0030】
各容器32a〜32fは、送液カセット20の下面に対して垂直な方向に伸縮自在に装着されている。これらの容器32a〜32fは、サンプル液量及び保持試薬量等によって内容積が互いに異なっている。また、検出する核酸の種類が多い場合は、増幅試薬保持容器32cを複数設け、複数種類の増幅用プライマーを用意することも可能である。
【0031】
容器32a〜32fは、それぞれ伸縮自在な蛇腹構造部12を有していることから、この容器を伸縮することにより内部容積が変化し、マイクロポンプとしても機能することができる。基材22の下面側の四隅には、基材22を支持する4本の支持脚26が立設されている。
【0032】
図9に示すように、検体検出装置の駆動機構30は、ベース32と、ベースに設けられ、それぞれ抽出試薬保持容器32a、廃液容器32b、増幅試薬保持容器32c、ハイブリダイゼーション試薬保持容器32d、洗浄試薬保持容器32e、検出試薬保持容器32fを収縮させる昇降自在なプランジャ34a、34b、34c、34dを有している。プランジャ34a、34b、34c、34dの先端部は平坦に形成されている。
【0033】
送液カセット20は、支持脚26により駆動機構30のベース32上に載置され、容器32a〜32fの底壁10aは、対応するプランジャ34a、34b、34c、34dの先端部に対向している。
【0034】
プランジャにより試薬保持容器を下から押すことにより蛇腹構造部12を収縮させることができ、マイクロポンプとしての機能を実現できるが、この際、試薬保持容器では溶着された底壁10a部分に凹凸やはみ出し部がないため、より均一に液残りなく試薬を押し出すことができる。
【0035】
また、駆動機構30は、容器内の試薬あるいは検査液を加熱処理するための加熱機構、および図示しない核酸検出機構を備えている。加熱機構は様々な形態が考えられるが、例えば、図9および図10に示すように、半円筒形の窪みを持つ一対のヒータ47を備え、これらのヒータ47によって試薬保持容器10を両側から挟むことにより、容器内の試薬を加熱することができる。この際、試薬保持容器10では溶着部(底壁10a)に凹凸やはみ出し部がないため、ヒータ47をより均一に保持容器10に接近させることができ、より均一に加熱することができる。
【0036】
次に、上記のように構成された検体検出装置を用いて核酸検出を行う手順について説明する。
まず、基材22の検査部24を覆うように、例えば、DNAチップ40を基材22の下面側に装着し、保持する。DNAチップには、所望の核酸プローブが形成されている。このような送液カセット20を駆動機構30上に載置する。抽出試薬保持容器32aは伸張した状態に維持され、他の容器32b〜32eは、対応するプランジャ34b〜34dにより収縮した状態としておく。
【0037】
続いて、封止栓23を取り外し、注入口21および流入口28aを通して、所定量のサンプル(検査液体)を抽出試薬保持容器32aに注入する。抽出試薬保持容器32aには予め抽出試薬が乾燥保持されている。これにより、注入されたサンプルと抽出試薬とが混合される。このとき、特許文献3記載の試薬保持容器形状の場合は底部の凹部に入り込んだサンプルは抽出試薬と混合されにくいが、本発明のような平坦な底部形状の場合は混合されやすい。次に駆動機構30の加熱機構によって抽出試薬保持容器32a内のサンプルおよび抽出試薬を煮沸し、抽出反応を行う。なお、抽出反応は送液カセット20外で予め行い、抽出済みのサンプルを送液カセットの試薬保持容器に注入しても構わない。
【0038】
続いて、プランジャ34aにより抽出試薬保持容器32aを下から押圧して収縮させる。これにより、抽出試薬保持容器32a内のサンプルを所定量、押し出し、微小流路28を通して増幅試薬保持容器32c内に移動させる。この際、微小流路28は密閉構造であり、流路内部の体積を一定とする必要がある。そのため、増幅試薬保持容器32cについては、駆動機構30のプランジャ34cを下降させる。増幅試薬保持容器32cは、抽出試薬保持容器32aの収縮動作に同期して、蛇腹構造部12が伸長する。これにより、抽出試薬保持容器32a、および増幅試薬保持容器32cの内部容積を含む、流路内部の体積を一定に維持する。
増幅試薬保持容器32c内には増幅反応用のプライマーセット、酵素、バッファが予め乾燥保持されており、送液されたサンプルと混合される。次いで、図示しない加熱機構によってサンプルを加熱し、核酸増幅反応を行う。核酸増幅反応は、特に限定されないが、PCR、LAMP、SMAP法などを用いる。
【0039】
続いて、プランジャ34cにより増幅試薬保持容器32cを下から押圧して収縮させるとともに、プランジャ34dを下降させてハイブリダイゼーション試薬保持容器32dを伸張させる。これにより、増幅試薬保持容器32c内のサンプルを所定量、押し出し、微小流路28を通してハイブリダイゼーション試薬保持容器32d内に移動させる。ハイブリダイゼーション試薬保持容器32d内にはハイブリダイゼーション反応用バッファが予め乾燥保持されており、送液されたサンプルと混合される。
【0040】
次に、プランジャ34dによりハイブリダイゼーション試薬保持容器32dを下から押圧して収縮させる。これにより、ハイブリダイゼーション試薬保持容器32d内のサンプルを所定量、押し出し、微小流路28を通して検査部24に送液し、DNAチップ40に供給する。核酸検出用のDNAチップ40には予め核酸検出用の核酸プローブが固定化されている。そして、加熱機構によってDNAチップ40を加熱することにより、サンプルとハイブリダイゼーション反応を行う。
【0041】
これに同期して、プランジャ34bを下降させることにより廃液容器32bを伸張させ、検査を行いながら、サンプルを、検査部24から微小流路28を通して廃液容器32bに移動させる。次に、プランジャにより洗浄試薬保持容器32eを押し上げて収縮させ、予め洗浄試薬保持容器32e内に収容されていた洗浄試薬を微小流路28を通してDNAチップ40上に移動させる。更に、加熱機構によってDNAチップ40を加熱することにより、非特異的に吸着したサンプルを洗浄試薬により除去する。
【0042】
続いて、プランジャ34bを下降させて廃液容器32bを伸張させ、DNAチップ40上の洗浄試薬を廃液容器32bに移動させる。更に、プランジャにより検出試薬保持容器32fを押し上げて収縮させ、予め洗浄試薬保持容器32e内に収容されていた検出試薬を微小流路28を通してDNAチップ40上に移動させる。DNAチップ40上のサンプルと検出試薬を反応させた後、検出試薬からの信号を検出することによってサンプル中に含まれる核酸の種類を特定することができる。核酸検出法は特に限定されないが、蛍光試薬を用いた蛍光検出法や、電気化学活性試薬を用いた電流検出法などである。
【0043】
検査終了後、送液カセット20を駆動機構30のベース32から取り外し、更に、DNAチップ40を基材22から取り外した後、必要であれば、送液カセット20を破棄する。
【0044】
(実施例1)
以下に、上記実施形態の送液カセットを用いた核酸検出の使用例を具体的に説明する。
1.検体検出装置の準備
1−1.試薬保持容器の準備
以下、5つの試薬保持容器にそれぞれ試薬を注入した。
1)抽出試薬保持容器:抽出用バッファ
2)増幅試薬保持容器:マウス2C39増幅用LAMPプライマー(配列A〜D)、酵素、増幅用バッファ
3)ハイブリダイゼーション試薬保持容器:SSC
4)洗浄試薬保持容器:SSC
5)検出試薬保持容器:ヘキスト33258
次に、上記1)、2)、3)については、真空乾燥処理を行い、容器の蛇腹構造部に試薬を乾燥固定させた。
【0045】
1−2.核酸検出用チップの準備
電流検出式の核酸検出用チップ上の各電極に、以下に示す3種類の核酸検出用プローブ(配列E〜G)を固定化した。
1)マウス2C39検出用(配列E)
2)マウス2C29検出用(配列F)
3)マウスNAT1検出用(配列G)
1−3.核酸検出用デバイスの組立
送液カセット20に対し、図7および図8に示すように、上記5つの試薬保持容器、廃液容器、核酸検出用チップを装着した。
【0046】
2.核酸検出用デバイスを用いた核酸検出
まず、粗抽出済みのマウス2C39配列を持つサンプルをサンプル注入口21から注入し、抽出試薬保持容器32a内で抽出用バッファと混合させたのち、95℃で5分保持することで抽出反応を行った。抽出済みサンプルを増幅試薬保持容器32cに送液し、増幅試薬と混合した後、63℃で40分保持することで増幅反応を行った。
【0047】
増幅済みサンプルを核酸検出用のDNAチップ40に送液し、45℃で10分保持することでチップ上の核酸検出用プローブとハイブリダイゼーション反応を行った。増幅済みサンプルを廃液容器32bに移動させた後、洗浄試薬保持容器32eから洗浄試薬を核酸検出用チップ上へ送液し、30℃で5分保持することで、非特異的に吸着した核酸を除去した。
【0048】
洗浄試薬を廃液容器32bに送液したのち、検出試薬保持容器32fから検出試薬を核DNAチップ40上に送液し、室温で3分保持することで検出試薬を核酸と反応させた。最後にDNAチップ40の各電極から得られる電流値を測定することによって核酸検出を行った。
【0049】
3.結果
各電極から得られた電流値を図11に示す。2C39検出用のプローブが固定化された電極からは、他の電極と比較して有意に大きな電流値が得られていることから、サンプル中の2C39配列が以下の通りに検出されたことがわかった。
【0050】
A:TCAAAACGATCCTGGAAAATAATGGACATTCATTCTGAGCTGTGC
B:GGAAAAACTAAATGAGAATGTCAAGGAGAAAAAACATTCTTGACTTC
C:TTCAGGCTCACCTTGTGA
D:CTGTGGCAATAAAGCACC
E:CTCCCCATGATTGCAGGTGA
F:GTCCAGAGATTCATCGACCTCCTC
G:CAGGTGACCATCAGTGACAGG
以上のように構成された試薬保持容器およびこれを用いる検出装置によれば、保持容器の底壁は窪みのない平坦な接合部によって形成されていることから、保持容器内から試薬等を供給する際、液残りを極力少なくすることができる。これにより、比較的高価な試薬を無駄なく使用することができ、結果として、低コスト化を図ることができる。
【0051】
保持容器の底壁は平坦に形成されているため、この保持容器の伸縮を制御する駆動機構は、保持容器を押上げるだけの簡単な構成とすることができる。XY軸、回転方向の位置合わせも厳密である必要がないことから、非常に簡易な駆動機構とすることができる。
【0052】
上記のように構成された検体検出装置によれば、試薬保持容器をマイクロポンプとして用いることができ、流路内の空気の膨張、収縮に影響されることなく、微小量の検査液体を安定して送液することができる。マイクロポンプの収縮量により送液量を決めることができ、正確な量の液体を安定して送ることが可能となる。
【0053】
送液カセットについては、使用目的にもよるが、使い捨てが望まれる場合が多い。そのため、流路部品の価格は可能な限り安価が望ましい。本実施形態によれば、マイクロポンプを動作させるための駆動機構や加熱機構は、流路部品の一部ではなく、容易に切り離すことを可能としている。
【0054】
以上のことから、送液時の液残りを低減し、制御装置の構成を簡略にすることが可能な試薬保持容器、その製造方法、および試薬保持容器を用いた検出装置が得られる。
【0055】
次に、第2の実施形態に係る試薬保持容器およびその製造方法について説明する。
図12、図13は、第2の実施形態に係る試薬保持容器を示している。試薬保持容器10は、下端が閉塞し、上端部10bが開口した円筒形状に形成され、その中途部に、伸縮可能な蛇腹構造部12を有している。保持容器10の下端は、継ぎ目のない平坦な底壁10aを形成し、周囲には下端部を接合した余剰部10cが存在している。底壁10aは、保持容器10の軸方向に対して直交して延び、同様に、余剰部10cは、保持容器10の下端から軸方向と直交する方向に延出している。試薬保持容器10は、一般的な蛇腹付きストローなどの一部と類似した構造を有している。
【0056】
底壁10aは、蛇腹構造12の谷部、つまり、凹部に連続して形成されている。これにより、蛇腹構造部12は、底壁10aから徐々に拡径するように外側に傾斜している。これにより、底壁10aと蛇腹構造部12との成す角度θは、90度以上に形成されている。本実施形態において、保持容器10の底壁10aは円形に形成され、少なくとも平坦部分の直径は、蛇腹構造部12の凹部内径の60〜99%に形成されている。
【0057】
試薬保持容器10の材質は特に限定されないが、ポリプロピレンが好ましく、その他、ポリスチレン、ポリビニル、ポリエチレン、ポリカーボネート、ABS、ゴムなどを用いることができる。試薬保持容器10は、生体物質を検出するデバイスであるため、場合によっては滅菌処理が必要となる。滅菌の手法は限定されないが、ガンマ線滅菌、電子線滅菌、ガス滅菌、乾熱滅菌等が挙げられる。試薬保持容器10のガンマ線滅菌を行う場合、容器材料に耐ガンマ線添加剤が添加されていることが望ましい。
【0058】
本実施形態において、保持容器10に保持される試薬は、核酸あるいは酵素の少なくとも一方を含む試薬を保持対象としている。試薬として、加熱処理される試薬、例えば、核酸増幅反応を行う試薬は、100℃近い加熱処理が必要であるため、このような試薬を保持する保持容器10の材料は、例えば、120℃までの耐熱性を持つことが好ましい。また、プライマー等の核酸試薬や酵素試薬等は紫外光により分解されてしまう。そのため、これらの試薬を保持する場合、保持容器10は、入射光中の紫外光に対して90%以上の遮光率を持つ材質で形成されていることが好ましい。
【0059】
図13(a)は、試薬保持容器10の蛇腹構造部12が伸長した状態を示し、図13(b)は、蛇腹構造部12が収縮した状態を示している。収縮状態において、蛇腹構造部12の内面は、互いに重なりながら収縮している。蛇腹部12の伸長、収縮は可逆性がある。本実施形態において、試薬保持容器10は、押圧負荷を受けていない状態では、図13(a)に示す伸長状態となっている。そして、前述した駆動機構により、下端10aが上端側に向かって押されることにより、図13(b)に示すように、蛇腹構造部12が収縮する。押圧力が除かれると、蛇腹構造部12は自身の弾性により伸長状態に復帰する。
【0060】
なお、試薬保持容器10は、上述した円筒形状に限らず、多角筒形状、楕円筒形状等、他の形状としてもよい。また、蛇腹構造部を備えている場合に限らず、試薬保持容器10の内面に複数の連続した凹凸を備えた構造としてもよい。
【0061】
次に、上記の構成を有する試薬保持容器10の製造方法について説明する。まず、図14(a)に示すように、中途部に蛇腹構造部12を有する円筒形状の部品11を用意する。この部品11の下端部を、円筒の軸方向と直交する2方向から挟み込むように押圧して圧着し、接合する。例えば、一対の矩形状のブロック50a、50bにより部品11の下端部を挟み込み、超音波、熱、溶剤を用いて圧着する。これにより、図14(b)に示すように、部品11の下端部は閉塞され、底壁10a、および円筒の軸方向に平坦な第1接合部14が形成される。
【0062】
続いて、図15(a)に示すように、第1接合部14をその根元から筒の軸に垂直な方向に折曲げ、底壁10aに重ねる。この状態で、図15(b)に示すように、底壁10aおよび第1接合部14を、筒の軸方向に沿って両方向から押圧して圧着することにより、継ぎ目がなく、均一な厚さの平坦な第2接合部15、ここでは、底壁10aを形成する。例えば、先端が平坦な円柱形状の芯部材52を部品11に挿入し、また、底壁10aの外側に平坦な支持ブロック54を配置し、これら芯部材52と支持ブロック54とで底壁10aおよび第1接合部14を両側から圧着する。その際、超音波、熱、溶剤等を用いて圧着することにより、図16に示すように、底壁10aおよび第1接合部14が溶融し、かつ、押圧され、継目の無い平坦な底壁10aが形成される。
【0063】
図14(b)に示す、第1接合部14を形成した状態、および図15(a)に示す、第1接合部14を折り曲げた状態では、いずれも、底壁10aに窪みが残っているが、図16に示すように、底壁10aおよび第1接合部14を、筒の軸方向に沿って両方向から押圧して圧着することにより、継ぎ目がなく、均一な厚さの平坦な底壁10aが得られる。これにより、試薬保持容器10が製造される。
【0064】
保持容器10の底部に窪みがないことから、保持容器内の試薬を流路に供給する際、薬液残りが低減される。この際、底壁10aの直径は蛇腹構造部12の凹部の内径と同程度であることが好ましい。
【0065】
以上のように構成された試薬保持容器によれば、保持容器の底壁は窪みのない平坦な接合部によって形成されていることから、保持容器内から試薬等を供給する際、液残りを極力少なくすることができる。これにより、比較的高価な試薬を無駄なく使用することができ、結果として、低コスト化を図ることができる。上記試薬保持容器を前述した検査装置に用いることにより、前述した第1の実施形態と同様の作用効果を得ることができる。
【0066】
この発明は上述した実施形態そのままに限定されるものではなく、実施段階ではその要旨を逸脱しない範囲で構成要素を変形して具体化可能である。また、上記実施形態に開示されている複数の構成要素の適宜な組み合わせにより、種々の発明を形成できる。例えば、実施形態に示される全構成要素から幾つかの構成要素を削除してもよい。さらに、異なる実施形態にわたる構成要素を適宜組み合わせてもよい。
検出装置の各構成部材の形状、寸法、材質等は、前述した実施形態に限定されることなく、必要に応じて、変更可能である。
【符号の説明】
【0067】
10…試薬保持容器、10a…底壁、10b…上端部、10c…余剰部、
12…蛇腹構造部、14…第1接合部、20…送液カセット、22…基材、
24…検査部、28…微小流路、21…注入口、28a…流入口、
28b…流出口、32a…抽出試薬保持容器、32b…廃液容器、
32c…増幅試薬保持容器、32d…ハイブリタイゼーション試薬保持容器、
30…駆動機構、32…ベース、34a、34b、34c、34d…プランジャ
【技術分野】
【0001】
本発明の実施形態は、核酸、酵素等を含む試薬を保持し、検査時には内部の試薬が外部に送り込まれる構造の試薬保持容器、その製造方法、および試薬保持容器を用いる検出装置に関する。
【背景技術】
【0002】
近年の遺伝子工学の発展に伴い、医療分野では、遺伝子による病気の診断或いは予防が可能となりつつある。これは遺伝子診断と呼ばれ、病気の原因となるヒトの遺伝子欠陥、変化を検出することで病気の発症前もしくは極めて初期段階での病気の診断や予測をすることが出来る。また、ヒトゲノムの解読とともに、遺伝子型と疫病との関連に関する研究が進み、各個人の遺伝子型に合わせた治療(テーラーメイド医療)も現実化しつつある。従って、遺伝子の検出並びに遺伝子型の決定を簡便に行うことは非常に重要となっている。
【0003】
一方、1つのデバイス内において、複数の試薬が関わる複数の反応を順次行うことのできるμ−TASと呼ばれるデバイスが盛んに研究開発されている。これらは試薬保持領域、反応領域、センサー領域などから成り、それらをつなぐ流路を備えることが特徴である。これを応用し、核酸を検出するための検出装置も開発されている。核酸検出を行う場合、複数の試薬を使用し、複数の反応を行う必要がある。試薬として、一般に、核酸の増幅や検出のための試薬、例えばDNAプライマー、酵素、蛍光色素などの標識試薬、あるいは、バッファ等が用いられる。
【0004】
このような核酸検出装置における試薬保持容器に関して要求される点は主に以下の2項目が挙げられる。1つ目の項目は、容器の低コスト化である。試薬は、予め試薬保持容器内に注入されているが、試薬保持容器内にて試薬の化学反応を行う場合は、反応後、容器内部の試薬を検出装置内の別な領域に送液する。また、検出装置内の別な領域で化学反応を行う場合は、反応前に、容器内部の試薬を反応領域に送液する。DNAプライマーや酵素、蛍光色素等の試薬は高価であるため、上記のような送液の際、容器内の液残りを極力少なくすることが低コスト化のために要求される。
【0005】
2つ目の項目は、容器を制御する装置の構成が極力簡略化されることである。確実な制御ができる装置であっても、構成が複雑になると高コスト化、検査の信頼性低下につながる。より簡易な構成で試薬の送液や化学反応の制御ができることが要求される。
【0006】
例えば、特許文献3に開示されている形状の試薬保持容器では、試薬保持容器に把持部が形成されるため、内部の液残りが大きくなり、さらに装置構成も複雑となっている。
【先行技術文献】
【特許文献】
【0007】
【特許文献1】特許第4127679号公報
【特許文献2】特開2008−263959号公報
【特許文献3】特開2010−78508号公報
【発明の開示】
【発明が解決しようとする課題】
【0008】
上述したように、従来の試薬保持容器では、内部の試薬を試薬保持容器から検出装置内の別な領域へ送液する際に容器内に液残りがあり低コスト化の妨げとなる。また、従来の試薬保持容器では、この容器からの試薬の送液を制御する装置の構成が複雑となる。
【0009】
この発明は、上記事情に鑑みなされたもので、その目的は、送液時の液残りを低減し、低コスト化を図ることができるとともに、送液の制御が容易な試薬保持容器、その製造方法、および試薬保持容器を用いた検出装置を提供することにある。
【課題を解決するための手段】
【0010】
実施形態によれば、試薬保持容器は、筒状部品の軸方向一端を閉じることにより形成される試薬保持容器であって、前記一端は、筒状部品の軸方向と直交して延びる底壁を有し、この底壁は、筒状部品を平坦に接合した接合部により形成されている。
【0011】
実施態様によれば、検出装置は、検査器を装着可能な検査部、およびこの検査部を通って延び検体を流す微小流路を有する送液カセットと、送液カセットに接続され、微小流路に連通する前記試薬保持容器と、を備えている。
【図面の簡単な説明】
【0012】
【図1】図1は、第1の実施形態に係る試薬保持容器を示す斜視図。
【図2】図2は、前記試薬保持容器の伸長状態および収縮状態を示す断面図。
【図3】図3は、検出装置に装着された前記試薬保持容器の伸長状態および収縮状態を示す断面図。
【図4】図4は、前記試薬保持容器の製造工程を示す断面図。
【図5】図5は、前記試薬保持容器の製造工程を示す断面図。
【図6】図6は、前記試薬保持容器の製造工程を示す断面図。
【図7】図7は、この発明の実施形態に係る検体検出装置の送液カセットおよび試薬保持容器を示す斜視図。
【図8】図8は、前記送液カセットの裏面側を示す斜視図。
【図9】図9は、前記検体検出装置の断面図。
【図10】図10は、加熱機構のヒータおよび試薬保持容器を示す斜視図。
【図11】図11は、前記検体検出装置による検体の検出結果を示すグラフ。
【図12】図12は、第2の実施形態に係る試薬保持容器を示す斜視図。
【図13】図13は、前記試薬保持容器の伸長状態および収縮状態を示す断面図。
【図14】図14は、前記試薬保持容器の製造工程を示す断面図。
【図15】図15は、前記試薬保持容器の製造工程を示す断面図。
【図16】図16は、前記試薬保持容器の製造工程を示す断面図。
【発明を実施するための形態】
【0013】
以下、図面を参照しながら、実施形態に係る試薬保持容器およびこれを備えた検体検出装置について詳細に説明する。
図1、図2、図3は、第1の実施形態に係る試薬保持容器を示している。図1および図2に示すように、試薬保持容器10は、下端が閉塞し、上端部10bが開口した円筒形状に形成され、その中途部に、伸縮可能な蛇腹構造部12を有している。保持容器10の下端は、継ぎ目のない平坦な底壁10aを形成している。底壁10aは、保持容器10の軸方向に対して直交して延びている。試薬保持容器10は、一般的な蛇腹付きストローなどの一部と類似した構造を有している。
【0014】
底壁10aは、蛇腹構造12の谷部、つまり、凹部に連続して形成されている。これにより、蛇腹構造部12は、底壁10aから徐々に拡径するように外側に傾斜している。これにより、底壁10aと蛇腹構造部12との成す角度θは、90度以上に形成されている。本実施形態において、保持容器10の底壁10aは円形に形成され、少なくとも平坦部分の直径は、蛇腹構造部12の凹部内径の60〜99%に形成されている。
【0015】
試薬保持容器10の材質は特に限定されないが、ポリプロピレンが好ましく、その他、ポリスチレン、ポリビニル、ポリエチレン、ポリカーボネート、ABS、ゴムなどを用いることができる。試薬保持容器10は、生体物質を検出するデバイスであるため、場合によっては滅菌処理が必要となる。滅菌の手法は限定されないが、ガンマ線滅菌、電子線滅菌、ガス滅菌、乾熱滅菌等が挙げられる。試薬保持容器10のガンマ線滅菌を行う場合、容器材料に耐ガンマ線添加剤が添加されていることが望ましい。
【0016】
本実施形態において、保持容器10に保持される試薬は、核酸あるいは酵素の少なくとも一方を含む試薬を保持対象としている。試薬として、加熱処理される試薬、例えば、核酸増幅反応を行う試薬は、100℃近い加熱処理が必要であるため、このような試薬を保持する保持容器10の材料は、例えば、120℃までの耐熱性を持つことが好ましい。また、プライマー等の核酸試薬や酵素試薬等は紫外光により分解されてしまう。そのため、これらの試薬を保持する場合、保持容器10は、入射光中の紫外光に対して90%以上の遮光率を持つ材質で形成されていることが好ましい。
【0017】
図2(a)は、試薬保持容器10の蛇腹構造部12が伸長した状態を示し、図2(b)は、蛇腹構造部12が収縮した状態を示している。収縮状態において、蛇腹構造部12の内面は、互いに重なりながら収縮している。蛇腹部12の伸長、収縮は可逆性がある。本実施形態において、試薬保持容器10は、押圧負荷を受けていない状態では、図2(a)に示す伸長状態となっている。そして、後述する駆動機構により、下端10aが上端側に向かって押されることにより、図2(b)に示すように、蛇腹構造部12が収縮する。押圧力が除かれると、蛇腹構造部12は自身の弾性により伸長状態に復帰する。
【0018】
図3は、上記のように構成された試薬保持容器10を、後述する検査装置のカセットに装着した状態を示している。保持容器10は、カセットに形成された円柱形状のボス部を容器内に挿入し、かつ、容器の上端部10bをボス部に嵌合することにより、カセットに装着される。図3(a)に示すように、伸長状態の保持容器10内に試薬が供給され、図3(b)に示すように、蛇腹構造部12が収縮することで、保持容器10内の試薬がカセットのカセット内の流路に押し出される。
【0019】
なお、試薬保持容器10は、上述した円筒形状に限らず、多角筒形状、楕円筒形状等、他の形状としてもよい。また、蛇腹構造部を備えている場合に限らず、試薬保持容器10の内面に複数の連続した凹凸を備えた構造としてもよい。
【0020】
次に、上記の構成を有する試薬保持容器10の製造方法について説明する。まず、図4(a)に示すように、中途部に蛇腹構造部12を有する円筒形状の部品11を用意する。また、ほぼ半球形状の凹所44aを有する成形治具44を用意する。部品11は、蛇腹構造の上側に伸びる円筒部と、下側に延びる円筒部10dとを有している。
【0021】
図4(b)に示すように、この部品11の下側の下端部10dを成形治具44の凹所44aに上から押し込むことにより、円筒部10dを内側に変形させる。その際、成形治具44を加熱する、或いは溶剤を用いることにより、円筒部10dを容易に変形させることができる。
【0022】
次に、図5(a)、図5(b)に示すように、変形した円筒部10dを部品11の軸方方向に沿って上下両方向から押圧して圧着することにより、継目の無い平坦な底壁10aを形成する。例えば、先端が平坦な円柱形状の押圧治具48を部品11に挿入し、また、変形した円筒部10dの外側に平坦な支持ブロック46を配置し、これら押圧治具48と支持ブロック46とで、内側に変形した円筒部10dを両側から押圧することにより、円筒部10dを平坦な底壁に変形させる。その際、超音波、熱、溶剤等を用いて圧着することにより、図6に示すように、内側に変形した部分が溶融し、かつ、押圧され、継目の無い平坦な底壁10aが形成される。底部からのはみ出し部分がないため、後述するジャバラ部分の伸縮や、加熱の際に均一に処理することができる。
【0023】
なお、図4(b)に示した一段階目の加工の時点で内側に変形させる部分の面積は、円筒形の底面積よりも大きいことが望ましい。底面積よりも小さい場合、図5に示す二段階目の加工で底部を閉塞できない可能性があり、仮に閉塞できた場合でも底壁が肉薄になってしまうためである。従って、図4(a)に示すように、変形される円筒部10dの寸法は、半径r、軸方向長さaとした場合、以下の式(1)を満たすことが望ましい。
a>r×(1/2))・・・(1)
以上により、継目の無い平坦な底壁10aを有する試薬保持容器10が形成される。保持容器10の底部に窪みがないことから、保持容器10内の試薬を流路に供給する際、薬液残りが低減される。この際、底壁10aの直径は蛇腹構造部12の凹部の内径と同程度であることが好ましく、それよりも小さいと平坦な領域が少なくなり、液残り低減効果が少なくなってしまう。
【0024】
次に、上述した試薬保持容器10を用いる検体検出装置について説明する。図7は、核酸検出用の検出装置における送液カセット20、この送液カセットに装着される複数の試薬保持容器、および検知器としてのDNAチップ40を示し、図8は、送液カセットの裏面側を示し、図9は、送液カセットを駆動機構に装填した状態を示している。
【0025】
図7、図8、および図9に示すように、検体検出装置は、送液カセット20と、この送液カセットを駆動する駆動機構30とを備え、送液カセット20は、駆動機構30に対して脱着自在に接続されている。
【0026】
送液カセット20は、例えば、矩形板状に形成された基材22を備えている。基材22の下面は、平坦な装着面を形成している。基材22の中央部には、基材22の下面側に開口した矩形状の凹所からなる検査部24が形成されている。この検査部24を覆うように、検査器、例えば、DNAチップ40が基材22の下面側に装着されている。
【0027】
基材22には、検査部24に気密に連通した微小流路28が形成されている。微小流路28の一端は、基材22の下面側に開口した流入口28aに連通し、他端は、基材22の下面側に開口した流出口28bに連通している。検査部24は、微小流路28の中途部に連通している。微小流路28は、例えば、0.3mm×0.3mmの径に形成されている。また、基材22には、基材の上面に開口した注入口21が形成されている。注入口21は、流入口28aと対向して位置しているとともに、脱着自在な封止栓23によって気密に閉じられている。
【0028】
また、基材22の下面側には、流入口28aと検査部24との間で、微小流路28にそれぞれ連通する複数、例えば、1つの出入口28c、および3つの出入口28dが形成されている。基材22の下面において、流入口28a、流出口28b、出入口28c、28dの位置には、下方に突出する円柱形状のボス25がそれぞれ形成されている。
【0029】
送液カセット20の流入口28a、流出口28b、出入口28c、28dには、抽出試薬保持容器32a、廃液容器32b、増幅試薬保持容器32c、ハイブリダイゼーション試薬保持容器32d、洗浄試薬保持容器32e、検出試薬保持容器32fがそれぞれ装着され、気密に接続されている。これらの容器は、前述した試薬保持容器10と同様に構成されている。すなわち、各容器は、蛇腹構造部12を有する円筒形状に形成され、その上端開口に送液カセット20のボス25が気密に嵌合された状態で、送液カセット20に取り付けられている。これらの容器は、送液カセット20内の微小流路28を通じて接続されている。
【0030】
各容器32a〜32fは、送液カセット20の下面に対して垂直な方向に伸縮自在に装着されている。これらの容器32a〜32fは、サンプル液量及び保持試薬量等によって内容積が互いに異なっている。また、検出する核酸の種類が多い場合は、増幅試薬保持容器32cを複数設け、複数種類の増幅用プライマーを用意することも可能である。
【0031】
容器32a〜32fは、それぞれ伸縮自在な蛇腹構造部12を有していることから、この容器を伸縮することにより内部容積が変化し、マイクロポンプとしても機能することができる。基材22の下面側の四隅には、基材22を支持する4本の支持脚26が立設されている。
【0032】
図9に示すように、検体検出装置の駆動機構30は、ベース32と、ベースに設けられ、それぞれ抽出試薬保持容器32a、廃液容器32b、増幅試薬保持容器32c、ハイブリダイゼーション試薬保持容器32d、洗浄試薬保持容器32e、検出試薬保持容器32fを収縮させる昇降自在なプランジャ34a、34b、34c、34dを有している。プランジャ34a、34b、34c、34dの先端部は平坦に形成されている。
【0033】
送液カセット20は、支持脚26により駆動機構30のベース32上に載置され、容器32a〜32fの底壁10aは、対応するプランジャ34a、34b、34c、34dの先端部に対向している。
【0034】
プランジャにより試薬保持容器を下から押すことにより蛇腹構造部12を収縮させることができ、マイクロポンプとしての機能を実現できるが、この際、試薬保持容器では溶着された底壁10a部分に凹凸やはみ出し部がないため、より均一に液残りなく試薬を押し出すことができる。
【0035】
また、駆動機構30は、容器内の試薬あるいは検査液を加熱処理するための加熱機構、および図示しない核酸検出機構を備えている。加熱機構は様々な形態が考えられるが、例えば、図9および図10に示すように、半円筒形の窪みを持つ一対のヒータ47を備え、これらのヒータ47によって試薬保持容器10を両側から挟むことにより、容器内の試薬を加熱することができる。この際、試薬保持容器10では溶着部(底壁10a)に凹凸やはみ出し部がないため、ヒータ47をより均一に保持容器10に接近させることができ、より均一に加熱することができる。
【0036】
次に、上記のように構成された検体検出装置を用いて核酸検出を行う手順について説明する。
まず、基材22の検査部24を覆うように、例えば、DNAチップ40を基材22の下面側に装着し、保持する。DNAチップには、所望の核酸プローブが形成されている。このような送液カセット20を駆動機構30上に載置する。抽出試薬保持容器32aは伸張した状態に維持され、他の容器32b〜32eは、対応するプランジャ34b〜34dにより収縮した状態としておく。
【0037】
続いて、封止栓23を取り外し、注入口21および流入口28aを通して、所定量のサンプル(検査液体)を抽出試薬保持容器32aに注入する。抽出試薬保持容器32aには予め抽出試薬が乾燥保持されている。これにより、注入されたサンプルと抽出試薬とが混合される。このとき、特許文献3記載の試薬保持容器形状の場合は底部の凹部に入り込んだサンプルは抽出試薬と混合されにくいが、本発明のような平坦な底部形状の場合は混合されやすい。次に駆動機構30の加熱機構によって抽出試薬保持容器32a内のサンプルおよび抽出試薬を煮沸し、抽出反応を行う。なお、抽出反応は送液カセット20外で予め行い、抽出済みのサンプルを送液カセットの試薬保持容器に注入しても構わない。
【0038】
続いて、プランジャ34aにより抽出試薬保持容器32aを下から押圧して収縮させる。これにより、抽出試薬保持容器32a内のサンプルを所定量、押し出し、微小流路28を通して増幅試薬保持容器32c内に移動させる。この際、微小流路28は密閉構造であり、流路内部の体積を一定とする必要がある。そのため、増幅試薬保持容器32cについては、駆動機構30のプランジャ34cを下降させる。増幅試薬保持容器32cは、抽出試薬保持容器32aの収縮動作に同期して、蛇腹構造部12が伸長する。これにより、抽出試薬保持容器32a、および増幅試薬保持容器32cの内部容積を含む、流路内部の体積を一定に維持する。
増幅試薬保持容器32c内には増幅反応用のプライマーセット、酵素、バッファが予め乾燥保持されており、送液されたサンプルと混合される。次いで、図示しない加熱機構によってサンプルを加熱し、核酸増幅反応を行う。核酸増幅反応は、特に限定されないが、PCR、LAMP、SMAP法などを用いる。
【0039】
続いて、プランジャ34cにより増幅試薬保持容器32cを下から押圧して収縮させるとともに、プランジャ34dを下降させてハイブリダイゼーション試薬保持容器32dを伸張させる。これにより、増幅試薬保持容器32c内のサンプルを所定量、押し出し、微小流路28を通してハイブリダイゼーション試薬保持容器32d内に移動させる。ハイブリダイゼーション試薬保持容器32d内にはハイブリダイゼーション反応用バッファが予め乾燥保持されており、送液されたサンプルと混合される。
【0040】
次に、プランジャ34dによりハイブリダイゼーション試薬保持容器32dを下から押圧して収縮させる。これにより、ハイブリダイゼーション試薬保持容器32d内のサンプルを所定量、押し出し、微小流路28を通して検査部24に送液し、DNAチップ40に供給する。核酸検出用のDNAチップ40には予め核酸検出用の核酸プローブが固定化されている。そして、加熱機構によってDNAチップ40を加熱することにより、サンプルとハイブリダイゼーション反応を行う。
【0041】
これに同期して、プランジャ34bを下降させることにより廃液容器32bを伸張させ、検査を行いながら、サンプルを、検査部24から微小流路28を通して廃液容器32bに移動させる。次に、プランジャにより洗浄試薬保持容器32eを押し上げて収縮させ、予め洗浄試薬保持容器32e内に収容されていた洗浄試薬を微小流路28を通してDNAチップ40上に移動させる。更に、加熱機構によってDNAチップ40を加熱することにより、非特異的に吸着したサンプルを洗浄試薬により除去する。
【0042】
続いて、プランジャ34bを下降させて廃液容器32bを伸張させ、DNAチップ40上の洗浄試薬を廃液容器32bに移動させる。更に、プランジャにより検出試薬保持容器32fを押し上げて収縮させ、予め洗浄試薬保持容器32e内に収容されていた検出試薬を微小流路28を通してDNAチップ40上に移動させる。DNAチップ40上のサンプルと検出試薬を反応させた後、検出試薬からの信号を検出することによってサンプル中に含まれる核酸の種類を特定することができる。核酸検出法は特に限定されないが、蛍光試薬を用いた蛍光検出法や、電気化学活性試薬を用いた電流検出法などである。
【0043】
検査終了後、送液カセット20を駆動機構30のベース32から取り外し、更に、DNAチップ40を基材22から取り外した後、必要であれば、送液カセット20を破棄する。
【0044】
(実施例1)
以下に、上記実施形態の送液カセットを用いた核酸検出の使用例を具体的に説明する。
1.検体検出装置の準備
1−1.試薬保持容器の準備
以下、5つの試薬保持容器にそれぞれ試薬を注入した。
1)抽出試薬保持容器:抽出用バッファ
2)増幅試薬保持容器:マウス2C39増幅用LAMPプライマー(配列A〜D)、酵素、増幅用バッファ
3)ハイブリダイゼーション試薬保持容器:SSC
4)洗浄試薬保持容器:SSC
5)検出試薬保持容器:ヘキスト33258
次に、上記1)、2)、3)については、真空乾燥処理を行い、容器の蛇腹構造部に試薬を乾燥固定させた。
【0045】
1−2.核酸検出用チップの準備
電流検出式の核酸検出用チップ上の各電極に、以下に示す3種類の核酸検出用プローブ(配列E〜G)を固定化した。
1)マウス2C39検出用(配列E)
2)マウス2C29検出用(配列F)
3)マウスNAT1検出用(配列G)
1−3.核酸検出用デバイスの組立
送液カセット20に対し、図7および図8に示すように、上記5つの試薬保持容器、廃液容器、核酸検出用チップを装着した。
【0046】
2.核酸検出用デバイスを用いた核酸検出
まず、粗抽出済みのマウス2C39配列を持つサンプルをサンプル注入口21から注入し、抽出試薬保持容器32a内で抽出用バッファと混合させたのち、95℃で5分保持することで抽出反応を行った。抽出済みサンプルを増幅試薬保持容器32cに送液し、増幅試薬と混合した後、63℃で40分保持することで増幅反応を行った。
【0047】
増幅済みサンプルを核酸検出用のDNAチップ40に送液し、45℃で10分保持することでチップ上の核酸検出用プローブとハイブリダイゼーション反応を行った。増幅済みサンプルを廃液容器32bに移動させた後、洗浄試薬保持容器32eから洗浄試薬を核酸検出用チップ上へ送液し、30℃で5分保持することで、非特異的に吸着した核酸を除去した。
【0048】
洗浄試薬を廃液容器32bに送液したのち、検出試薬保持容器32fから検出試薬を核DNAチップ40上に送液し、室温で3分保持することで検出試薬を核酸と反応させた。最後にDNAチップ40の各電極から得られる電流値を測定することによって核酸検出を行った。
【0049】
3.結果
各電極から得られた電流値を図11に示す。2C39検出用のプローブが固定化された電極からは、他の電極と比較して有意に大きな電流値が得られていることから、サンプル中の2C39配列が以下の通りに検出されたことがわかった。
【0050】
A:TCAAAACGATCCTGGAAAATAATGGACATTCATTCTGAGCTGTGC
B:GGAAAAACTAAATGAGAATGTCAAGGAGAAAAAACATTCTTGACTTC
C:TTCAGGCTCACCTTGTGA
D:CTGTGGCAATAAAGCACC
E:CTCCCCATGATTGCAGGTGA
F:GTCCAGAGATTCATCGACCTCCTC
G:CAGGTGACCATCAGTGACAGG
以上のように構成された試薬保持容器およびこれを用いる検出装置によれば、保持容器の底壁は窪みのない平坦な接合部によって形成されていることから、保持容器内から試薬等を供給する際、液残りを極力少なくすることができる。これにより、比較的高価な試薬を無駄なく使用することができ、結果として、低コスト化を図ることができる。
【0051】
保持容器の底壁は平坦に形成されているため、この保持容器の伸縮を制御する駆動機構は、保持容器を押上げるだけの簡単な構成とすることができる。XY軸、回転方向の位置合わせも厳密である必要がないことから、非常に簡易な駆動機構とすることができる。
【0052】
上記のように構成された検体検出装置によれば、試薬保持容器をマイクロポンプとして用いることができ、流路内の空気の膨張、収縮に影響されることなく、微小量の検査液体を安定して送液することができる。マイクロポンプの収縮量により送液量を決めることができ、正確な量の液体を安定して送ることが可能となる。
【0053】
送液カセットについては、使用目的にもよるが、使い捨てが望まれる場合が多い。そのため、流路部品の価格は可能な限り安価が望ましい。本実施形態によれば、マイクロポンプを動作させるための駆動機構や加熱機構は、流路部品の一部ではなく、容易に切り離すことを可能としている。
【0054】
以上のことから、送液時の液残りを低減し、制御装置の構成を簡略にすることが可能な試薬保持容器、その製造方法、および試薬保持容器を用いた検出装置が得られる。
【0055】
次に、第2の実施形態に係る試薬保持容器およびその製造方法について説明する。
図12、図13は、第2の実施形態に係る試薬保持容器を示している。試薬保持容器10は、下端が閉塞し、上端部10bが開口した円筒形状に形成され、その中途部に、伸縮可能な蛇腹構造部12を有している。保持容器10の下端は、継ぎ目のない平坦な底壁10aを形成し、周囲には下端部を接合した余剰部10cが存在している。底壁10aは、保持容器10の軸方向に対して直交して延び、同様に、余剰部10cは、保持容器10の下端から軸方向と直交する方向に延出している。試薬保持容器10は、一般的な蛇腹付きストローなどの一部と類似した構造を有している。
【0056】
底壁10aは、蛇腹構造12の谷部、つまり、凹部に連続して形成されている。これにより、蛇腹構造部12は、底壁10aから徐々に拡径するように外側に傾斜している。これにより、底壁10aと蛇腹構造部12との成す角度θは、90度以上に形成されている。本実施形態において、保持容器10の底壁10aは円形に形成され、少なくとも平坦部分の直径は、蛇腹構造部12の凹部内径の60〜99%に形成されている。
【0057】
試薬保持容器10の材質は特に限定されないが、ポリプロピレンが好ましく、その他、ポリスチレン、ポリビニル、ポリエチレン、ポリカーボネート、ABS、ゴムなどを用いることができる。試薬保持容器10は、生体物質を検出するデバイスであるため、場合によっては滅菌処理が必要となる。滅菌の手法は限定されないが、ガンマ線滅菌、電子線滅菌、ガス滅菌、乾熱滅菌等が挙げられる。試薬保持容器10のガンマ線滅菌を行う場合、容器材料に耐ガンマ線添加剤が添加されていることが望ましい。
【0058】
本実施形態において、保持容器10に保持される試薬は、核酸あるいは酵素の少なくとも一方を含む試薬を保持対象としている。試薬として、加熱処理される試薬、例えば、核酸増幅反応を行う試薬は、100℃近い加熱処理が必要であるため、このような試薬を保持する保持容器10の材料は、例えば、120℃までの耐熱性を持つことが好ましい。また、プライマー等の核酸試薬や酵素試薬等は紫外光により分解されてしまう。そのため、これらの試薬を保持する場合、保持容器10は、入射光中の紫外光に対して90%以上の遮光率を持つ材質で形成されていることが好ましい。
【0059】
図13(a)は、試薬保持容器10の蛇腹構造部12が伸長した状態を示し、図13(b)は、蛇腹構造部12が収縮した状態を示している。収縮状態において、蛇腹構造部12の内面は、互いに重なりながら収縮している。蛇腹部12の伸長、収縮は可逆性がある。本実施形態において、試薬保持容器10は、押圧負荷を受けていない状態では、図13(a)に示す伸長状態となっている。そして、前述した駆動機構により、下端10aが上端側に向かって押されることにより、図13(b)に示すように、蛇腹構造部12が収縮する。押圧力が除かれると、蛇腹構造部12は自身の弾性により伸長状態に復帰する。
【0060】
なお、試薬保持容器10は、上述した円筒形状に限らず、多角筒形状、楕円筒形状等、他の形状としてもよい。また、蛇腹構造部を備えている場合に限らず、試薬保持容器10の内面に複数の連続した凹凸を備えた構造としてもよい。
【0061】
次に、上記の構成を有する試薬保持容器10の製造方法について説明する。まず、図14(a)に示すように、中途部に蛇腹構造部12を有する円筒形状の部品11を用意する。この部品11の下端部を、円筒の軸方向と直交する2方向から挟み込むように押圧して圧着し、接合する。例えば、一対の矩形状のブロック50a、50bにより部品11の下端部を挟み込み、超音波、熱、溶剤を用いて圧着する。これにより、図14(b)に示すように、部品11の下端部は閉塞され、底壁10a、および円筒の軸方向に平坦な第1接合部14が形成される。
【0062】
続いて、図15(a)に示すように、第1接合部14をその根元から筒の軸に垂直な方向に折曲げ、底壁10aに重ねる。この状態で、図15(b)に示すように、底壁10aおよび第1接合部14を、筒の軸方向に沿って両方向から押圧して圧着することにより、継ぎ目がなく、均一な厚さの平坦な第2接合部15、ここでは、底壁10aを形成する。例えば、先端が平坦な円柱形状の芯部材52を部品11に挿入し、また、底壁10aの外側に平坦な支持ブロック54を配置し、これら芯部材52と支持ブロック54とで底壁10aおよび第1接合部14を両側から圧着する。その際、超音波、熱、溶剤等を用いて圧着することにより、図16に示すように、底壁10aおよび第1接合部14が溶融し、かつ、押圧され、継目の無い平坦な底壁10aが形成される。
【0063】
図14(b)に示す、第1接合部14を形成した状態、および図15(a)に示す、第1接合部14を折り曲げた状態では、いずれも、底壁10aに窪みが残っているが、図16に示すように、底壁10aおよび第1接合部14を、筒の軸方向に沿って両方向から押圧して圧着することにより、継ぎ目がなく、均一な厚さの平坦な底壁10aが得られる。これにより、試薬保持容器10が製造される。
【0064】
保持容器10の底部に窪みがないことから、保持容器内の試薬を流路に供給する際、薬液残りが低減される。この際、底壁10aの直径は蛇腹構造部12の凹部の内径と同程度であることが好ましい。
【0065】
以上のように構成された試薬保持容器によれば、保持容器の底壁は窪みのない平坦な接合部によって形成されていることから、保持容器内から試薬等を供給する際、液残りを極力少なくすることができる。これにより、比較的高価な試薬を無駄なく使用することができ、結果として、低コスト化を図ることができる。上記試薬保持容器を前述した検査装置に用いることにより、前述した第1の実施形態と同様の作用効果を得ることができる。
【0066】
この発明は上述した実施形態そのままに限定されるものではなく、実施段階ではその要旨を逸脱しない範囲で構成要素を変形して具体化可能である。また、上記実施形態に開示されている複数の構成要素の適宜な組み合わせにより、種々の発明を形成できる。例えば、実施形態に示される全構成要素から幾つかの構成要素を削除してもよい。さらに、異なる実施形態にわたる構成要素を適宜組み合わせてもよい。
検出装置の各構成部材の形状、寸法、材質等は、前述した実施形態に限定されることなく、必要に応じて、変更可能である。
【符号の説明】
【0067】
10…試薬保持容器、10a…底壁、10b…上端部、10c…余剰部、
12…蛇腹構造部、14…第1接合部、20…送液カセット、22…基材、
24…検査部、28…微小流路、21…注入口、28a…流入口、
28b…流出口、32a…抽出試薬保持容器、32b…廃液容器、
32c…増幅試薬保持容器、32d…ハイブリタイゼーション試薬保持容器、
30…駆動機構、32…ベース、34a、34b、34c、34d…プランジャ
【特許請求の範囲】
【請求項1】
筒状部品の軸方向一端を閉じることにより形成される試薬保持容器であって、
前記一端は、筒状部品の軸方向と直交して延びる底壁を有し、この底壁は、筒状部品を平坦に接合した接合部により形成されている試薬保持容器。
【請求項2】
前記筒状部品の軸方向中途部に形成された蛇腹構造部を有し、軸方向に沿って収縮可能な請求項1に記載の試薬保持容器。
【請求項3】
前記接合部は円形に形成され、その直径は前記蛇腹構造部の凹部内径の60〜99%に形成されている請求項2に記載の試薬保持容器。
【請求項4】
前記底壁と前記蛇腹構造部との成す角度は、90度以上に形成されている請求項2に記載の試薬保持容器。
【請求項5】
試薬保持容器の製造方法であって、
筒状部品の一端部を筒内側方向に変形させ、
前記変形された一端部を筒状部品の軸方向に沿って両方向から押圧して圧着し、平坦に接合された接合部を形成する試薬保持容器の製造方法。
【請求項6】
前記変形される筒部の端部の長さをa、筒部の半径をrとしたとき、
a>r×(1/2)を満たしている請求項5に記載の試薬保持容器の製造方法。
【請求項7】
半球状の凹所を有する成形治具の前記凹所に、前記筒状部品の一端部を押し当てて変形させる請求項5に記載の試薬保持容器の製造方法。
【請求項8】
前記筒状部品の一端部を熱、あるいは溶剤を用いて変形させる請求項5又は7に記載の試薬保持容器の製造方法。
【請求項9】
前記接合部は超音波、熱、あるいは溶剤を用いて圧着する請求項5に記載の試薬保持容器の製造方法。
【請求項10】
検査器を装着可能な検査部、およびこの検査部を通って延び検体を流す微小流路を有する送液カセットと、
前記送液カセットに接続され、前記微小流路に連通する請求項1ないし4のいずれか1項に記載の試薬保持容器と、
を備える検出装置。
【請求項11】
前記試薬保持容器を伸縮させ、液体を前記試薬保持容器内と前記微小流路との間で押し出しあるいは引き込みする駆動機構を備えている請求項10に記載の検出装置。
【請求項1】
筒状部品の軸方向一端を閉じることにより形成される試薬保持容器であって、
前記一端は、筒状部品の軸方向と直交して延びる底壁を有し、この底壁は、筒状部品を平坦に接合した接合部により形成されている試薬保持容器。
【請求項2】
前記筒状部品の軸方向中途部に形成された蛇腹構造部を有し、軸方向に沿って収縮可能な請求項1に記載の試薬保持容器。
【請求項3】
前記接合部は円形に形成され、その直径は前記蛇腹構造部の凹部内径の60〜99%に形成されている請求項2に記載の試薬保持容器。
【請求項4】
前記底壁と前記蛇腹構造部との成す角度は、90度以上に形成されている請求項2に記載の試薬保持容器。
【請求項5】
試薬保持容器の製造方法であって、
筒状部品の一端部を筒内側方向に変形させ、
前記変形された一端部を筒状部品の軸方向に沿って両方向から押圧して圧着し、平坦に接合された接合部を形成する試薬保持容器の製造方法。
【請求項6】
前記変形される筒部の端部の長さをa、筒部の半径をrとしたとき、
a>r×(1/2)を満たしている請求項5に記載の試薬保持容器の製造方法。
【請求項7】
半球状の凹所を有する成形治具の前記凹所に、前記筒状部品の一端部を押し当てて変形させる請求項5に記載の試薬保持容器の製造方法。
【請求項8】
前記筒状部品の一端部を熱、あるいは溶剤を用いて変形させる請求項5又は7に記載の試薬保持容器の製造方法。
【請求項9】
前記接合部は超音波、熱、あるいは溶剤を用いて圧着する請求項5に記載の試薬保持容器の製造方法。
【請求項10】
検査器を装着可能な検査部、およびこの検査部を通って延び検体を流す微小流路を有する送液カセットと、
前記送液カセットに接続され、前記微小流路に連通する請求項1ないし4のいずれか1項に記載の試薬保持容器と、
を備える検出装置。
【請求項11】
前記試薬保持容器を伸縮させ、液体を前記試薬保持容器内と前記微小流路との間で押し出しあるいは引き込みする駆動機構を備えている請求項10に記載の検出装置。
【図1】


【図2】


【図3】


【図4】


【図5】


【図6】


【図7】


【図8】


【図9】


【図10】


【図11】


【図12】


【図13】


【図14】


【図15】


【図16】




【図2】


【図3】


【図4】


【図5】


【図6】


【図7】


【図8】


【図9】


【図10】


【図11】


【図12】


【図13】


【図14】


【図15】


【図16】


【公開番号】特開2011−158463(P2011−158463A)
【公開日】平成23年8月18日(2011.8.18)
【国際特許分類】
【出願番号】特願2010−205993(P2010−205993)
【出願日】平成22年9月14日(2010.9.14)
【出願人】(000003078)株式会社東芝 (54,554)
【Fターム(参考)】
【公開日】平成23年8月18日(2011.8.18)
【国際特許分類】
【出願日】平成22年9月14日(2010.9.14)
【出願人】(000003078)株式会社東芝 (54,554)
【Fターム(参考)】
[ Back to top ]

