認知増強のための化合物と組成物、製造方法、および治療方法
オキサジアゾール誘導体、組成物、およびその調剤を含むムスカリンアゴニスト化合物を開示する。加えて、該オキサジアゾール化合物の合成方法を開示する。さらに、認知機能を増強するため、該ムスカリンアゴニストまたはその薬剤的に許容可能な形態で被験体を治療する方法を開示する。
Notice: Undefined index: DEJ in /mnt/www/gzt_disp.php on line 298
【特許請求の範囲】
【請求項1】
式Iの化合物:
【化1】

[式中、
R1は、−CR2R3R4、
【化2】

からなる群より選ばれ;
R2、R3、およびR4は、独立して、DまたはFから選ばれ;
R5、R6、R7、R8、R9、およびR10は、独立して、H、D、F、またはメチル基から選ばれ;
ただし、R5、R6、R7、R8、R9、およびR10のうち1つ以下はメチル基である。]
、および、その薬剤的に許容可能な塩または立体異性体。
【請求項2】
R1は次式である、請求項1に記載の化合物。
【化3】

【請求項3】
R1は次式である、請求項1に記載の化合物。
【化4】

【請求項4】
R2とR3は、両方ともDまたは両方ともFである、請求項3に記載の化合物。
【請求項5】
R5、R6、およびR7はそれぞれDまたはFである、請求項3に記載の化合物。
【請求項6】
R2、R3、R5、R6、R7はそれぞれDまたはHでよい、請求項3に記載の化合物。
【請求項7】
請求項3に記載の化合物であって、
A)R2、R3、R5、R6、R7はそれぞれDであり、前記化合物は式3−(エチル−d5)−5−(1,4,5,6−テトラヒドロピリミジン−5−イル)−1,2,4−オキサジアゾールである;
B)R2はHであり、R3、R5、R6、R7はそれぞれDであり、前記化合物は式3−(エチル−d4)−5−(1,4,5,6−テトラヒドロピリミジン−5−イル)−1,2,4−オキサジアゾールである;
C)R2、R3、R5、およびR6はそれぞれDであり、R7はHであり、前記化合物は式3−(エチル−d4)−5−(1,4,5,6−テトラヒドロピリミジン−5−イル)−1,2,4−オキサジアゾールである;
D)R2とR3はそれぞれHであり、R5、R6、R7はそれぞれDであり、前記化合物は式3−(エチル−d3)−5−(1,4,5,6−テトラヒドロピリミジン−5−イル)−1,2,4−オキサジアゾールである;
E)R2とR6はそれぞれHであり、R3、R5、およびR7はDであり、前記化合物は式3−(エチル−d3)−5−(1,4,5,6−テトラヒドロピリミジン−5−イル)−1,2,4−オキサジアゾールである;
F)R5とR6はそれぞれHであり、R2、R3、およびR7はDであり、前記化合物は式3−(エチル−d3)−5−(1,4,5,6−テトラヒドロピリミジン−5−イル)−1,2,4−オキサジアゾールである;
G)R5、R6、およびR7はそれぞれHであり、R2とR3はそれぞれDであり、前記化合物は式3−(エチル−d2)−5−(1,4,5,6−テトラヒドロピリミジン−5−イル)−1,2,4−オキサジアゾールである;
H)R2、R3、およびR5はそれぞれHであり、R6とR7はそれぞれDであり、前記化合物は式3−(エチル−d2)−5−(1,4,5,6−テトラヒドロピリミジン−5−イル)−1,2,4−オキサジアゾールである;
I)R2、R5、およびR6はそれぞれHであり、R3とR7はそれぞれDであり、前記化合物は式3−(エチル−d2)−5−(1,4,5,6−テトラヒドロピリミジン−5−イル)−1,2,4−オキサジアゾールである;
J)R2、R3、R5、およびR6はそれぞれHであり、R7はDであり、前記化合物は式3−(エチル−d1)−5−(1,4,5,6−テトラヒドロピリミジン−5−イル)−1,2,4−オキサジアゾールである;ならびに
K)R2、R5、R6、およびR7はそれぞれHであり、R3はDであり、前記化合物は式3−(エチル−d1)−5−(1,4,5,6−テトラヒドロピリミジン−5−イル)−1,2,4−オキサジアゾールである;
からなる群より選ばれる化合物。
【請求項8】
R2、R3、R5、R6、およびR7はそれぞれ・・・である、請求項3に記載の化合物。
【請求項9】
R1は次式である、請求項1に記載の化合物。
【化5】

【請求項10】
R8、R9、およびR10のいずれか1つはメチル基である、請求項9に記載の化合物。
【請求項11】
R9はメチル基であり、R8とR10は両方ともHである、請求項10に記載の化合物。
【請求項12】
R1は−CR2R3R4である、請求項1に記載の化合物。
【請求項13】
R2、R3、およびR4はすべてDまたはすべてFである、請求項12に記載の化合物。
【請求項14】
R2、R3、およびR4はすべてDである、請求項12に記載の化合物。
【請求項15】
以下の構造を有する、式I、IA、IB、X、XA、もしくはXBの化合物、またはI、IA、IB、X、XA、もしくはXBの立体異性体、またはその薬剤的に許容可能な塩。
【化6】

[式中、
XはOまたはSであり;
R1は、NH2またはメチルであり、任意で1〜3個の重水素原子で置換されてもよく;あるいは、XがSのとき、R1はHになることもでき;
R2は、H、F、置換または非置換C1−4アルキル基、OH、またはORであり、ここでRは置換または非置換C1−4アルキル基であり;
R3はHであり;
R4は、出現するごとにFであり;
nは0、1、または2であり;ここで、nが0のとき、ピロリドン環は、任意で4位において置換または非置換C1−6アルキルで置換されてもよく;
mは、1または2であり;
pは、0、1、または2である。]
【請求項16】
XはOである、請求項15に記載の化合物。
【請求項17】
XはSである、請求項15に記載の化合物。
【請求項18】
R1はCH3またはCD3である、請求項15〜17のいずれかに記載の化合物。
【請求項19】
R2はFである、請求項15〜18のいずれかに記載の化合物。
【請求項20】
式Iで表される、請求項15〜19のいずれかに記載の化合物。
【請求項21】
式IAで表される、請求項15〜19のいずれかに記載の化合物。
【請求項22】
式IBで表される、請求項15〜19のいずれかに記載の化合物。
【請求項23】
式IIで表される、請求項15〜19のいずれかに記載の化合物。
【請求項24】
式IIAで表される、請求項15〜19のいずれかに記載の化合物。
【請求項25】
式IIBで表される、請求項15〜19のいずれかに記載の化合物。
【請求項26】
請求項15に記載の化合物であって、3−(メチル)−5−(ピペリジン−3−イル)−1,2,4−オキサジアゾール、(R)−3−(メチル)−5−(ピペリジン−3−イル)−1,2,4−オキサジアゾール、(S)−3−(メチル)−5−(ピペリジン−3−イル)−1,2,4−オキサジアゾール、5−(3−アザビシクロ[3.1.0]ヘキサン−1−イル)−3−(メチル)−1,2,4−オキサジアゾール、5−((1S)−3−アザビシクロ[3.1.0]ヘキサン−1−イル)−3−(メチル)−1,2,4−オキサジアゾール、5−((1R)−3−アザビシクロ[3.1.0]ヘキサン−1−イル)−3−(メチル)−1,2,4−オキサジアゾール、5−(3−アザビシクロ[3.1.0]ヘプタン−1−イル)−3−(メチル)−1,2,4−オキサジアゾール、5−((1S)−3−アザビシクロ[3.1.0]ヘプタン−1−イル)−3−(メチル)−1,2,4−オキサジアゾール、5−((1R)−3−アザビシクロ[3.1.0]ヘプタン−1−イル)−3−(メチル)−1,2,4−オキサジアゾール、3−メチル−5−(4−メチルピロリジン−3−イル)−1,2,4−オキサジアゾール、3−メチル−5−((3S,4S)−4−メチルピロリジン−3−イル)−1,2,4−オキサジアゾール、3−メチル−5−((3R,4R)−4−メチルピロリジン−3−イル)−1,2,4−オキサジアゾール、3−メチル−5−(ピペリジン−3−イル)−1,2,4−オキサジアゾール、(S)−3−メチル−5−(ピペリジン−3−イル)−1,2,4−オキサジアゾール、(R)−3−メチル−5−(ピペリジン−3−イル)−1,2,4−オキサジアゾール、5−(3−フルオロピペリジン−3−イル)−3−メチル−1,2,4−オキサジアゾール、(R)−5−(3−フルオロピペリジン−3−イル)−3−メチル−1,2,4−オキサジアゾール、(S)−5−(3−フルオロピペリジン−3−イル)−3−メチル−1,2,4−オキサジアゾール、3−メチル−5−(ピペリジン−3−イル)−1,2,4−チアジアゾール、(S)−3−メチル−5−(ピペリジン−3−イル)−1,2,4−チアジアゾール、(R)−3−メチル−5−(ピペリジン−3−イル)−1,2,4−チアジアゾール、3−メチル−5−(ピロリジン−3−イル)−1,2,4−オキサジアゾール、(S)−3−メチル−5−(ピロリジン−3−イル)−1,2,4−オキサジアゾール、および(R)−3−メチル−5−(ピロリジン−3−イル)−1,2,4−オキサジアゾールからなる群より選ばれる化合物。
【請求項27】
請求項15に記載の化合物であって、3−(メチル−d3)−5−(ピペリジン−3−イル)−1,2,4−オキサジアゾール、(R)−3−(メチル−d3)−5−(ピペリジン−3−イル)−1,2,4−オキサジアゾール、(S)−3−(メチル−d3)−5−(ピペリジン−3−イル)−1,2,4−オキサジアゾール、5−(3−アザビシクロ[3.1.0]ヘキサン−1−イル)−3−(メチル−d3)−1,2,4−オキサジアゾール、5−((1S)−3−アザビシクロ[3.1.0]ヘキサン−1−イル)−3−(メチル−d3)−1,2,4−オキサジアゾール、5−((1R)−3−アザビシクロ[3.1.0]ヘキサン−1−イル)−3−(メチル−d3)−1,2,4−オキサジアゾール、5−(3−アザビシクロ[3.1.0]ヘプタン−1−イル)−3−(メチル−d3)−1,2,4−オキサジアゾール、5−((1S)−3−アザビシクロ[3.1.0]ヘプタン−1−イル)−3−(メチル−d3)−1,2,4−オキサジアゾール、5−((1R)−3−アザビシクロ[3.1.0]ヘプタン−1−イル)−3−(メチル−d3)−1,2,4−オキサジアゾール、3−(メチル−d3)−5−(4−メチルピロリジン−3−イル)−1,2,4−オキサジアゾール、3−(メチル−d3)−5−((3S,4S)−4−メチルピロリジン−3−イル)−1,2,4−オキサジアゾール、3−(メチル−d3)−5−((3R,4R)−4−メチルピロリジン−3−イル)−1,2,4−オキサジアゾール、3−(メチル−d3)−5−(ピペリジン−3−イル)−1,2,4−オキサジアゾール、(S)−3−(メチル−d3)−5−(ピペリジン−3−イル)−1,2,4−オキサジアゾール、(R)−3−(メチル−d3)−5−(ピペリジン−3−イル)−1,2,4−オキサジアゾール、5−(3−フルオロピペリジン−3−イル)−3−(メチル−d3)−1,2,4−オキサジアゾール、(R)−5−(3−フルオロピペリジン−3−イル)−3−(メチル−d3)−1,2,4−オキサジアゾール、(S)−5−(3−フルオロピペリジン−3−イル)−3−(メチル−d3)−1,2,4−オキサジアゾール、3−(メチル−d3)−5−(ピペリジン−3−イル)−1,2,4−チアジアゾール、(S)−3−(メチル−d3)−5−(ピペリジン−3−イル)−1,2,4−チアジアゾール、(R)−(メチル−d3)−5−(ピペリジン−3−イル)−1,2,4−チアジアゾール、(メチル−d3)−5−(ピロリジン−3−イル)−1,2,4−オキサジアゾール、(S)−3−(メチル−d3)−5−(ピロリジン−3−イル)−1,2,4−オキサジアゾール、および(R)−3−(メチル−d3)−5−(ピロリジン−3−イル)−1,2,4−オキサジアゾールからなる群より選ばれる化合物。
【請求項28】
請求項15に記載の化合物であって、3−(メチル−d2)−5−(ピペリジン−3−イル)−1,2,4−オキサジアゾール、(R)−3−(メチル−d2)−5−(ピペリジン−3−イル)−1,2,4−オキサジアゾール、(S)−3−(メチル−d2)−5−(ピペリジン−3−イル)−1,2,4−オキサジアゾール、5−(3−アザビシクロ[3.1.0]ヘキサン−1−イル)−3−(メチル−d2)−1,2,4−オキサジアゾール、5−((1S)−3−アザビシクロ[3.1.0]ヘキサン−1−イル)−3−(メチル−d2)−1,2,4−オキサジアゾール、5−((1R)−3−アザビシクロ[3.1.0]ヘキサン−1−イル)−3−(メチル−d2)−1,2,4−オキサジアゾール、5−(3−アザビシクロ[3.1.0]ヘプタン−1−イル)−3−(メチル−d2)−1,2,4−オキサジアゾール、5−((1S)−3−アザビシクロ[3.1.0]ヘプタン−1−イル)−3−(メチル−d2)−1,2,4−オキサジアゾール、5−((1R)−3−アザビシクロ[3.1.0]ヘプタン−1−イル)−3−(メチル−d2)−1,2,4−オキサジアゾール、3−(メチル−d2)−5−(4−メチルピロリジン−3−イル)−1,2,4−オキサジアゾール、3−(メチル−d2)−5−((3S,4S)−4−メチルピロリジン−3−イル)−1,2,4−オキサジアゾール、3−(メチル−d2)−5−((3R,4R)−4−メチルピロリジン−3−イル)−1,2,4−オキサジアゾール、3−(メチル−d2)−5−(ピペリジン−3−イル)−1,2,4−オキサジアゾール、(S)−3−(メチル−d2)−5−(ピペリジン−3−イル)−1,2,4−オキサジアゾール、(R)−3−(メチル−d2)−5−(ピペリジン−3−イル)−1,2,4−オキサジアゾール、5−(3−フルオロピペリジン−3−イル)−3−(メチル−d2)−1,2,4−オキサジアゾール、(R)−5−(3−フルオロピペリジン−3−イル)−3−(メチル−d2)−1,2,4−オキサジアゾール、(S)−5−(3−フルオロピペリジン−3−イル)−3−(メチル−d2)−1,2,4−オキサジアゾール、3−(メチル−d2)−5−(ピペリジン−3−イル)−1,2,4−チアジアゾール、(S)−3−(メチル−d2)−5−(ピペリジン−3−イル)−1,2,4−チアジアゾール、(R)−(メチル−d2)−5−(ピペリジン−3−イル)−1,2,4−チアジアゾール、(メチル−d2)−5−(ピロリジン−3−イル)−1,2,4−オキサジアゾール、(S)−3−(メチル−d2)−5−(ピロリジン−3−イル)−1,2,4−オキサジアゾール、および(R)−3−(メチル−d2)−5−(ピロリジン−3−イル)−1,2,4−オキサジアゾールからなる群より選ばれる化合物。
【請求項29】
請求項15に記載の化合物であって、3−(メチル−d1)−5−(ピペリジン−3−イル)−1,2,4−オキサジアゾール、(R)−3−(メチル−d1)−5−(ピペリジン−3−イル)−1,2,4−オキサジアゾール、(S)−3−(メチル−d1)−5−(ピペリジン−3−イル)−1,2,4−オキサジアゾール、5−(3−アザビシクロ[3.1.0]ヘキサン−1−イル)−3−(メチル−d1)−1,2,4−オキサジアゾール、5−((1S)−3−アザビシクロ[3.1.0]ヘキサン−1−イル)−3−(メチル−d1)−1,2,4−オキサジアゾール、5−((1R)−3−アザビシクロ[3.1.0]ヘキサン−1−イル)−3−(メチル−d1)−1,2,4−オキサジアゾール、5−(3−アザビシクロ[3.1.0]ヘプタン−1−イル)−3−(メチル−d1)−1,2,4−オキサジアゾール、5−((1S)−3−アザビシクロ[3.1.0]ヘプタン−1−イル)−3−(メチル−d1)−1,2,4−オキサジアゾール、5−((1R)−3−アザビシクロ[3.1.0]ヘプタン−1−イル)−3−(メチル−d1)−1,2,4−オキサジアゾール、3−(メチル−d1)−5−(4−メチルピロリジン−3−イル)−1,2,4−オキサジアゾール、3−(メチル−d1)−5−((3S,4S)−4−メチルピロリジン−3−イル)−1,2,4−オキサジアゾール、3−(メチル−d1)−5−((3R,4R)−4−メチルピロリジン−3−イル)−1,2,4−オキサジアゾール、3−(メチル−d1)−5−(ピペリジン−3−イル)−1,2,4−オキサジアゾール、(S)−3−(メチル−d1)−5−(ピペリジン−3−イル)−1,2,4−オキサジアゾール、(R)−3−(メチル−d1)−5−(ピペリジン−3−イル)−1,2,4−オキサジアゾール、5−(3−フルオロピペリジン−3−イル)−3−(メチル−d1)−1,2,4−オキサジアゾール、(R)−5−(3−フルオロピペリジン−3−イル)−3−(メチル−d1)−1,2,4−オキサジアゾール、(S)−5−(3−フルオロピペリジン−3−イル)−3−(メチル−d1)−1,2,4−オキサジアゾール、3−(メチル−d1)−5−(ピペリジン−3−イル)−1,2,4−チアジアゾール、(S)−3−(メチル−d1)−5−(ピペリジン−3−イル)−1,2,4−チアジアゾール、(R)−(メチル−d1)−5−(ピペリジン−3−イル)−1,2,4−チアジアゾール、(メチル−d1)−5−(ピロリジン−3−イル)−1,2,4−オキサジアゾール、(S)−3−(メチル−d1)−5−(ピロリジン−3−イル)−1,2,4−オキサジアゾール、および(R)−3−(メチル−d1)−5−(ピロリジン−3−イル)−1,2,4−オキサジアゾールからなる群より選ばれる化合物。
【請求項30】
請求項1〜29のいずれか一項に記載の化合物および薬剤的に許容可能な担体を含む、薬剤的に許容可能な組成物。
【請求項31】
請求項1〜30のいずれか一項に記載の化合物または組成物の有効量を、それを必要としている被験体に投与することを含む、方法。
【請求項32】
前記被験体は、初老期認知症、老年認知症、ハンチントン舞踏病、遅発性ジスキネジア、運動過剰症、躁病、およびトゥレット症候群、またはアルツハイマー病に罹患している、請求項31に記載の方法。
【請求項33】
式Iの化合物またはその塩を提供するため、式IIの化合物またはその塩を、ギ酸エステル等価体で処理することを含む、方法。
【化7】

【化8】

[式中、
R1は、−CR2R3R4、
【化9】

からなる群より選ばれ;
R2、R3、R4は、独立して、H、D、またはFから選ばれ;
R5、R6、R7、R8、R9、およびR10は、独立して、H、D、F、またはメチル基から選ばれる。ただし、R4、R5、R6、R7、R8、R9、およびR10のうち1つ以下はメチル基である。]
【請求項34】
前記ギ酸エステル等価体は、オルトギ酸トリエチル、オルトギ酸トリメチル、酢酸ジエトキシメチル、またはギ酸エチルから選ばれる、請求項33に記載の方法。
【請求項35】
式IIIの化合物から塩基に安定なN−保護基を実質的に除去することにより、式IIの化合物を調製することをさらに含む、請求項33または34に記載の方法。
【化10】

[式中、各PGは独立して、塩基に安定なN−保護基である。]
【請求項36】
前記塩基に安定なN−保護基は、t−ブチルオキシカルボニル、ベンジルオキシカルボニル、またはクロロベンジルオキシカルボニルから選ばれる、請求項35に記載の方法。
【請求項37】
各PGはt−ブチルオキシカルボニルであり、該t−ブチルオキシカルボニルを実質的にすべて除去するのに十分な量の酸に、前記式IIIの化合物を露出することにより各PGを除去する、請求項35または36に記載の方法。
【請求項38】
前記酸はHClまたはトリフルオロ酢酸である、請求項37に記載の方法。
【請求項39】
塩基の存在下で式IIIの化合物を得るため、式IVの化合物を、アミドオキシムVIIIで処理することを含む、方法。
【化11】

【化12】

【化13】

[式中、
Rはメチル基またはエチル基であり;
R1は、−CR2R3R4、
【化14】

からなる群より選ばれ;
R2、R3、R4は、独立して、H、D、またはFから選ばれ;
R5、R6、R7、R8、R9、およびR10は、独立して、H、D、F、またはメチル基から選ばれ;ただし、R4、R5、R6、R7、R8、R9、およびR10のうち1つ以下はメチル基であり;
各PGは独立して、塩基に安定なN−保護基である。]
【請求項40】
前記塩基は、NaH、KH、ナトリウムメトキシド、またはカリウムt−ブトキシドから選ばれる、請求項39に記載の方法。
【請求項41】
式Vの化合物またはその塩を、塩基に安定なN−保護基を該式Vの各アミノ基に結合する試薬で処理することにより、前記式IVの化合物を調製することをさらに含む、請求項39または40に記載の方法。
【化15】

[式V中、Rはメチル基またはエチル基である。]
【請求項42】
塩基に安定なN−保護基を結合するための前記試薬は、二炭酸ジ−t−ブチル、t−ブチルオキシクロロホルマート、ベンジルオキシクロロホルマート、クロロベンジルオキシクロロホルマートから選ばれる、請求項41に記載の方法。
【請求項43】
前記式IVの化合物の調製は塩基の存在下で行われる、請求項41または42に記載の方法。
【請求項44】
前記塩基は、アルカリ金属炭酸塩もしくは重炭酸塩、または第三級アミンである、請求項43に記載の方法。
【請求項45】
前記塩基は、重炭酸ナトリウム、重炭酸カリウム、炭酸ナトリウム、炭酸カリウム、または炭酸セシウムである、請求項44に記載の方法。
【請求項46】
前記塩基に安定なN−保護基は、t−ブチルオキシカルボニル、ベンジルオキシカルボニル、またはクロロベンジルオキシカルボニルから選ばれる、請求項39〜45のいずれか一項に記載の方法。
【請求項47】
式VIの化合物からR1基を除去することにより、前記式IIIの化合物を調製することをさらに含む、請求項39に記載の方法。
【化16】

[式中、Rはメチル基またはエチル基であり、各R1は独立して、置換または非置換ベンジル基である。]
【請求項48】
式VIIの化合物を、塩基の存在下で置換または非置換ベンジルアミンで処理することにより、前記式VIの化合物を調製することをさらに含む、請求項47に記載の方法。
【化17】

[式中、Rはメチル基またはエチル基であり、各LGは独立して脱離基である。]
【請求項49】
各LGはブロモ基である、請求項48に記載の方法。
【請求項50】
式IXの化合物またはその塩。
【化18】

[式中、
R1は、−CR2R3R4、
【化19】

からなる群より選ばれ;
R2、R3、R4は、独立して、H、D、またはFから選ばれ;
R5、R6、R7、R8、R9、およびR10は、独立して、H、D、F、またはメチル基から選ばれ;ただし、R4、R5、R6、R7、R8、R9、およびR10のうち1つ以下はメチル基であり;
各R12は、独立して、−H、置換もしくは非置換ベンジル基、または塩基に安定なN−保護基である。]
【請求項51】
請求項1〜30のいずれかに記載の化合物または組成物の有効量を被験体に投与することを含む、被験体の認知および/または記憶を増強する方法。
【請求項52】
前記被験体はアルツハイマー病に罹患しているヒトである、請求項51に記載の方法。
【請求項53】
被験体の認知障害を治療する方法であって、該方法は、請求項1〜30のいずれかに記載の化合物または組成物の有効量を被験体に投与することを含み、
前記被験体が罹患する認知障害は、認知機能障害、軽度認知機能障害、前頭側頭型認知症、レビー小体型認知症、初老期認知症、老年認知症、ダウン症候群、ハンチントン舞踏病、遅発性ジスキネジア、運動過剰症、躁病、およびトゥレット症候群、またはアルツハイマー病からなる群より選ばれる、
方法。
【請求項54】
前記被験体はアルツハイマー病に罹患しているヒトである、請求項53に記載の方法。
【請求項55】
請求項1〜30のいずれかに記載の化合物または組成物の有効量を被験体に投与することを含む、被験体の脳内のムスカリン受容体を刺激する方法。
【請求項56】
前記ムスカリン受容体の刺激は緊張性刺激を含む、請求項55に記載の方法。
【請求項57】
前記被験体の脳内イノシトールリン酸レベルを、投与前のレベルに対して相対的に増加させる、請求項55または56に記載の方法。
【請求項58】
ムスカリンM1受容体を発現するニューロンにおいて前記イノシトールリン酸レベルを増加させる、請求項57に記載の方法。
【請求項59】
前記被験体はアルツハイマー病に罹患しているヒトである、請求項55〜58のいずれかに記載の方法。
【請求項60】
精神病に罹患している被験体に対し、請求項1〜30のいずれかに記載の化合物または組成物の化合物の治療有効量を投与することを含む、被験体の精神病を治療する方法。
【請求項61】
前記精神病は統合失調症に付随または起因する、請求項60に記載の方法。
【請求項62】
前記精神病はアルツハイマー病に付随または起因する、請求項60に記載の方法。
【請求項63】
被験体のAβレベルを減少させる方法であって、該減少を必要としている被験体に対し、請求項1〜30のいずれかに記載の化合物または組成物の化合物の何らかの量を投与することを含む、方法。
【請求項64】
前記被験体はアルツハイマー病に罹患している、請求項63に記載の方法。
【請求項65】
ムスカリンM1受容体を発現するニューロンにおいて前記Aβレベルを減少させる、請求項64に記載の方法。
【請求項66】
コリン作動性活性の欠損を含む神経学的疾患を有する被験体を治療する方法であって、グリコーゲンシンテターゼ3β活性を阻害すること、プロテインキナーゼC活性を増加すること、イノシトールリン酸レベルを増加すること、sAPPαレベルを増加すること、Aβレベルを減少すること、およびM1ムスカリン受容体を発現するニューロン中のアポトーシスを阻害することからなる群より選ばれる、少なくとも1つの生物活性を該被験体に引き起こすため、請求項1〜30のいずれかに記載の化合物または組成物の有効量を該被験体に投与することを含む、方法。
【請求項67】
前記被験体はアルツハイマー病に罹患している、請求項66に記載の方法。
【請求項68】
前記化合物または組成物を前記被験体に少なくとも1ヶ月間投与する、請求項51〜67のいずれかに記載の方法。
【請求項69】
前記化合物または組成物を前記被験体に少なくとも1年間投与する、請求項51〜67のいずれかに記載の方法。
【請求項70】
前記化合物または組成物を前記被験体に無期限に投与する、請求項51〜67のいずれかに記載の方法。
【請求項71】
医薬組成物であって、該医薬組成物を必要としている被験体に投与するための医薬組成物であり、
(i)該医薬組成物は、前記被験体の認知増強効果を達成するのに十分な量の少なくとも1つのM1またはM1/M4選択的ムスカリンアゴニスト、またはその薬剤的に許容可能な形態を含み;
ここで、前記少なくとも1つのM1またはM1/M4選択的ムスカリンアゴニストの量は、前記被験体に少なくとも1つの中程度のコリン作動性副作用を引き起こすのに十分な量であり、該コリン作動性副作用は、発汗、唾液分泌過多、潮紅、消化管障害、胃酸増加、悪心、嘔吐と下痢、呼吸困難、頻拍、めまい、失神、頭痛、痙攣、傾眠、およびこれらの組み合わせからなる群より選ばれ、
(ii)該医薬組成物は、前記少なくとも1つのコリン作動性副作用を前記被験体に最大でも軽度に引き起こすのに十分な量の、少なくとも1つのムスカリンアンタゴニスト、またはその薬剤的に許容可能な形態を含む、
医薬組成物。
【請求項72】
前記少なくとも1つのM1またはM1/M4選択的ムスカリンアゴニストは、MCD−386、オキサジアゾール、チアジアゾール、または請求項1〜29に記載の化合物である、請求項71に記載の医薬組成物。
【請求項73】
前記少なくとも1つのM1またはM1/M4選択的ムスカリンアゴニストはMCD−386である、請求項71に記載の医薬組成物。
【請求項74】
前記組成物中の前記MCD−386の量は、少なくとも25〜30ng/ml、少なくとも30〜35ng/ml、少なくとも40〜45ng/ml、および少なくとも45〜50ng/mlからなる群から選ばれる範囲内の、ヒト被験体中の血清濃度または血漿濃度を生成するのに十分である、請求項73に記載の医薬組成物。
【請求項75】
前記少なくとも1つのM1またはM1/M4選択的ムスカリンアゴニストは、請求項1〜14のいずれかに記載の化合物である、請求項72に記載の医薬組成物。
【請求項76】
前記少なくとも1つのM1またはM1/M4選択的ムスカリンアゴニストは、請求項15〜29のいずれかに記載の化合物である、請求項72に記載の医薬組成物。
【請求項77】
請求項75または76のいずれかに記載の医薬組成物であって、前記少なくとも1つのM1またはM1/M4選択的ムスカリンアゴニストは、前記被験体の認知増強効果を達成するのに十分な血清または血漿の最小Cmaxを達成し、
前記少なくとも1つのM1またはM1/M4選択的ムスカリンアゴニストの量は、前記被験体に少なくとも1つの中程度のコリン作動性副作用を引き起こすのに十分な量であり、該コリン作動性副作用は、発汗、唾液分泌過多、潮紅、消化管障害、胃酸増加、悪心、嘔吐と下痢、呼吸困難、頻拍、めまい、失神、頭痛、痙攣、傾眠、およびこれらの組み合わせからなる群より選ばれる、医薬組成物。
【請求項78】
前記少なくとも1つのムスカリンアンタゴニストは、N−メチルアトロピン硝酸塩、フラボキサート塩酸塩、N−メチルスコポラミン塩酸塩、グリコピロレート臭化物、ダリフェナシン臭化水素酸塩、ソリフェナシンコハク酸塩、プロパンテリン臭化物、トロスピウム塩化物、トルテロジン酒石酸塩、フェソテロジンフマル酸塩、メタンテリン臭化物、およびこれらの組み合わせからなる群より選ばれる、請求項71〜77のいずれかに記載の医薬組成物。
【請求項79】
前記コリン作動性副作用は発汗、唾液分泌過多、潮紅、下痢からなる群より選ばれる、請求項71〜78のいずれかに記載の医薬組成物。
【請求項80】
前記M1またはM1/M4選択的ムスカリンアゴニストの薬剤的に許容可能な形態は、前記M1またはM1/M4選択的ムスカリンアゴニストの塩、水和物、包接化合物、溶媒和化合物、または多型を含み、かつ、前記ムスカリンアンタゴニストの薬剤的に許容可能な形態は、前記ムスカリンアンタゴニストの塩、水和物、包接化合物、溶媒和化合物、または多型を含む、請求項71〜79のいずれか一項に記載の医薬組成物。
【請求項81】
前記医薬組成物は、錠剤、丸剤、ゲル、固体、カプセル剤、多粒子(multi−particulate)、経皮貼付剤、イオントフォレーシス装置、浸透圧装置、静脈内投与に適合する製剤、点滴により投与する液体製剤、または注入ポンプからなる群より選ばれる剤形で提供される、請求項71〜80のいずれか一項に記載の医薬組成物。
【請求項82】
前記剤形はイオントフォレーシス装置を含む、請求項81に記載の医薬組成物。
【請求項83】
請求項71〜82のいずれかに記載に医薬組成物であって、前記組成物または剤形が、前記被験体の認知増強効果を達成するのに十分な、前記少なくとも1つの選択的M1またはM1/M4ムスカリンアゴニストの血漿濃度または血清濃度を、15、30、45、60、90、および120から選ばれる時間枠(単位:分)内に提供し、かつ
前記少なくとも1つのM1またはM1/M4選択的ムスカリンアゴニストの量は、ムスカリンアンタゴニストが存在しない場合に、前記被験体の少なくとも1つの少なくとも中程度のコリン作動性副作用を引き起こすのに十分である、医薬組成物。
【請求項84】
前記少なくとも1つの選択的M1またはM1/M4ムスカリンアゴニストおよび前記少なくとも1つのムスカリンアンタゴニストは、遅延放出性の剤形をなしている、請求項71〜83のいずれかに記載の医薬組成物。
【請求項85】
前記認知増強効果は、場所の記憶の改善;人々の記憶の改善;情報記憶の改善;事実の記憶の改善;道具の操作方法および使用方法の記憶の改善;情報分析能力の改善;推定または判断する能力の改善;結論をまとめる能力の改善;戦略的に思考する能力の改善;計画し意思決定する能力の改善;計画および決定を実行する能力の改善;日常生活の活動を遂行する能力の改善;雇用される能力の改善;効果的な記憶および認知に関与するニューロン機構の活動(ムスカリン機能を含む)の増強;記憶および認知機能の損失をもたらす病理機構の低減;認知および記憶機能の損失をもたらすニューロンまたはニューロン活動の損失の低減;ADAS−Cog、MMSE等の神経心理検査のスコア向上;ADCS−ADL等の日常生活活動の臨床的評価のスコア向上;被験体内のα−セクレターゼ活性の増加;被験体内のAβ生成の減少;被験体内のsAPPα生成の増加;および被験体内のタウ病理および/またはアポトーシスの減少からなる群より選ばれる、請求項71〜84のいずれかに記載の医薬組成物。
【請求項86】
認知障害を有する被験体を治療する方法であって、
該方法は、前記被験体に少なくとも1つのムスカリンアゴニストを投与することを含み;
ここで、前記少なくとも1つのムスカリンアゴニストはM1またはM1/M4選択的ムスカリンアゴニストであり、M1またはM1/M4選択的ムスカリンアゴニストの量は、ムスカリンアンタゴニストが存在しない場合に、発汗、唾液分泌過多、潮紅、消化管障害、胃酸増加、悪心、嘔吐と下痢、呼吸困難、頻拍、めまい、失神、頭痛、痙攣、傾眠、およびこれらの組み合わせからなる群より選ばれる少なくとも1つの中程度のコリン作動性副作用を、前記被験体に経験させるのに十分な濃度を前記被験体の血流内に達成する量であり、かつ
該方法は、前記被験体に少なくとも1つのムスカリンアンタゴニストを投与することを含み;
ここで、前記少なくとも1つのムスカリンアンタゴニストの量は、該アンタゴニストが前記血流中に存在する時間の少なくとも一部の時間中に、最大でも軽度または中程度のみのコリン作動性副作用を前記被験体に経験させるのに十分な濃度を前記被験体の血流内に達成する量である、
方法。
【請求項87】
前記アンタゴニストが前記血流に存在する時間の少なくとも一部の時間中に、前記被験体が最大でも軽度のみのコリン作動性副作用を経験する、請求項86に記載の方法。
【請求項88】
前記少なくとも1つのM1またはM1/M4選択的ムスカリンアゴニストは、MCD−386、オキサジアゾール、チアジアゾール、または請求項1〜29のいずれかに記載の化合物である、請求項86〜87のいずれか一項に記載の方法。
【請求項89】
前記少なくとも1つのM1/M4選択的ムスカリンアゴニストはMCD−386である、請求項88に記載の方法。
【請求項90】
前記少なくとも1つのM1/M4選択的ムスカリンアゴニストは、請求項1〜14のいずれかに記載の化合物である、請求項88に記載の方法。
【請求項91】
前記少なくとも1つのM1/M4選択的ムスカリンアゴニストは、請求項15〜29に記載の化合物である、請求項88に記載の方法。
【請求項92】
前記少なくとも1つのムスカリンアンタゴニストは、N−メチルアトロピン硝酸塩、フラボキサート塩酸塩、N−メチルスコポラミン塩酸塩、グリコピロレート臭化物、ダリフェナシン臭化水素酸塩、ソリフェナシンコハク酸塩、プロパンテリン臭化物、トロスピウム塩化物、トルテロジン酒石酸塩、フェソテロジンフマル酸塩、メタンテリン臭化物、およびこれらの組み合わせからなる群より選ばれる、請求項86〜91のいずれかに記載の方法。
【請求項93】
前記少なくとも1つのムスカリンアンタゴニストは、前記少なくとも1つのM1またはM1/M4選択的ムスカリンアゴニストと同時に、または実質的に同時に投与される、請求項86〜92のいずれか一項に記載の方法。
【請求項94】
前記少なくとも1つのムスカリンアンタゴニストは、N−メチルアトロピン、フラボキサート、N−メチルスコポラミン、グリコピロレート、ダリフェナシン、ソリフェナシン、プロパンテリン、トロスピウム、トルテロジン、フェソテロジン、メタンテリン、前記の塩類、およびこれらの組み合わせからなる群より選ばれる、請求項88〜93のいずれかに記載の方法。
【請求項95】
前記塩類は、硝酸塩、塩酸塩、臭化物、臭化水素酸塩、コハク酸塩、塩化物、酒石酸塩、およびフマル酸塩からなる群より独立して選ばれる、請求項94に記載の方法。
【請求項96】
前記少なくとも1つのムスカリンアンタゴニストは、N−メチルアトロピン硝酸塩、フラボキサート塩酸塩、N−メチルスコポラミン塩酸塩、グリコピロレート臭化物、ダリフェナシン臭化水素酸塩、ソリフェナシンコハク酸塩、プロパンテリン臭化物、トロスピウム塩化物、トルテロジン酒石酸塩、フェソテロジンフマル酸塩、メタンテリン臭化物、およびこれらの組み合わせからなる群より選ばれる、請求項94と95のいずれかに記載の方法。
【請求項97】
前記少なくとも1つのムスカリンアンタゴニストは、前記少なくとも1つのM1またはM1/M4選択的ムスカリンアゴニストの投与に次いで投与される、請求項86〜96のいずれか一項に記載の方法。
【請求項98】
前記少なくとも1つのムスカリンアンタゴニストは、前記少なくとも1つのM1またはM1/M4選択的ムスカリンアゴニストの120分以内に投与される、請求項93〜97のいずれかに記載の方法。
【請求項99】
前記少なくとも1つのムスカリンアンタゴニストは、前記少なくとも1つのM1またはM1/M4選択的ムスカリンアゴニストの60分以内に投与される、請求項93〜97のいずれかに記載の方法。
【請求項100】
前記少なくとも1つのムスカリンアンタゴニストは、前記少なくとも1つのM1またはM1/M4選択的ムスカリンアゴニストの10分以内に投与される、請求項93〜97のいずれかに記載の方法。
【請求項101】
被験体を試験して、前記少なくとも1つのアゴニストまたはアンタゴニストを代謝する該被験体の能力を測定するステップをさらに含む、請求項93〜100のいずれかに記載の方法。
【請求項102】
医薬組成物であって、該医薬組成物の投与を必要としているヒト被験体に投与するための医薬組成物であり、
(i)前記被験体の認知増強効果を達成するのに十分な量の、前記少なくとも1つの選択的ムスカリンアゴニスト、またはその薬剤的に許容可能な形態と、
(ii)ある一定量の少なくとも1つのムスカリンアンタゴニスト、またはその薬剤的に許容可能な形態と、を含み、
ヒト被験体に投与されたとき、最大でも軽度のコリン作動性副作用を引き起こす、医薬組成物。
【請求項103】
前記ムスカリンアンタゴニストはフェソテロジンまたはその塩である、請求項102に記載の医薬組成物。
【請求項104】
前記ムスカリンアンタゴニストはフェソテロジンフマル酸塩である、請求項103に記載の医薬組成物。
【請求項105】
前記ムスカリンアンタゴニストはフェソテロジンの塩化物塩である、請求項103に記載の医薬組成物。
【請求項106】
前記少なくとも1つの選択的ムスカリンアゴニストの量は、前記被験体に少なくとも1つの中程度のコリン作動性副作用を引き起こすのに十分な量であり、該コリン作動性副作用は、発汗、唾液分泌過多、潮紅、消化管障害、胃酸増加、悪心、嘔吐と下痢、呼吸困難、頻拍、めまい、失神、頭痛、痙攣、傾眠、およびこれらの組み合わせからなる群より選ばれる、請求項102〜5のいずれかに記載の医薬組成物。
【請求項107】
前記ムスカリンアンタゴニストはフェソテロジンまたはその塩である、請求項78〜85のいずれかに記載の医薬組成物。
【請求項108】
前記ムスカリンアンタゴニストはフェソテロジンフマル酸塩である、請求項107に記載の医薬組成物。
【請求項109】
前記ムスカリンアンタゴニストはフェソテロジンの塩化物塩である、請求項107に記載の医薬組成物。
【請求項110】
前記ムスカリンアンタゴニストはフェソテロジンまたはその塩である、請求項92〜101のいずれかに記載の医薬組成物。
【請求項111】
前記ムスカリンアンタゴニストはフェソテロジンフマル酸塩である、請求項110のいずれかに記載の医薬組成物。
【請求項112】
前記ムスカリンアンタゴニストはフェソテロジンの塩化物塩である、請求項110のいずれかに記載の医薬組成物。
【請求項1】
式Iの化合物:
【化1】

[式中、
R1は、−CR2R3R4、
【化2】

からなる群より選ばれ;
R2、R3、およびR4は、独立して、DまたはFから選ばれ;
R5、R6、R7、R8、R9、およびR10は、独立して、H、D、F、またはメチル基から選ばれ;
ただし、R5、R6、R7、R8、R9、およびR10のうち1つ以下はメチル基である。]
、および、その薬剤的に許容可能な塩または立体異性体。
【請求項2】
R1は次式である、請求項1に記載の化合物。
【化3】

【請求項3】
R1は次式である、請求項1に記載の化合物。
【化4】

【請求項4】
R2とR3は、両方ともDまたは両方ともFである、請求項3に記載の化合物。
【請求項5】
R5、R6、およびR7はそれぞれDまたはFである、請求項3に記載の化合物。
【請求項6】
R2、R3、R5、R6、R7はそれぞれDまたはHでよい、請求項3に記載の化合物。
【請求項7】
請求項3に記載の化合物であって、
A)R2、R3、R5、R6、R7はそれぞれDであり、前記化合物は式3−(エチル−d5)−5−(1,4,5,6−テトラヒドロピリミジン−5−イル)−1,2,4−オキサジアゾールである;
B)R2はHであり、R3、R5、R6、R7はそれぞれDであり、前記化合物は式3−(エチル−d4)−5−(1,4,5,6−テトラヒドロピリミジン−5−イル)−1,2,4−オキサジアゾールである;
C)R2、R3、R5、およびR6はそれぞれDであり、R7はHであり、前記化合物は式3−(エチル−d4)−5−(1,4,5,6−テトラヒドロピリミジン−5−イル)−1,2,4−オキサジアゾールである;
D)R2とR3はそれぞれHであり、R5、R6、R7はそれぞれDであり、前記化合物は式3−(エチル−d3)−5−(1,4,5,6−テトラヒドロピリミジン−5−イル)−1,2,4−オキサジアゾールである;
E)R2とR6はそれぞれHであり、R3、R5、およびR7はDであり、前記化合物は式3−(エチル−d3)−5−(1,4,5,6−テトラヒドロピリミジン−5−イル)−1,2,4−オキサジアゾールである;
F)R5とR6はそれぞれHであり、R2、R3、およびR7はDであり、前記化合物は式3−(エチル−d3)−5−(1,4,5,6−テトラヒドロピリミジン−5−イル)−1,2,4−オキサジアゾールである;
G)R5、R6、およびR7はそれぞれHであり、R2とR3はそれぞれDであり、前記化合物は式3−(エチル−d2)−5−(1,4,5,6−テトラヒドロピリミジン−5−イル)−1,2,4−オキサジアゾールである;
H)R2、R3、およびR5はそれぞれHであり、R6とR7はそれぞれDであり、前記化合物は式3−(エチル−d2)−5−(1,4,5,6−テトラヒドロピリミジン−5−イル)−1,2,4−オキサジアゾールである;
I)R2、R5、およびR6はそれぞれHであり、R3とR7はそれぞれDであり、前記化合物は式3−(エチル−d2)−5−(1,4,5,6−テトラヒドロピリミジン−5−イル)−1,2,4−オキサジアゾールである;
J)R2、R3、R5、およびR6はそれぞれHであり、R7はDであり、前記化合物は式3−(エチル−d1)−5−(1,4,5,6−テトラヒドロピリミジン−5−イル)−1,2,4−オキサジアゾールである;ならびに
K)R2、R5、R6、およびR7はそれぞれHであり、R3はDであり、前記化合物は式3−(エチル−d1)−5−(1,4,5,6−テトラヒドロピリミジン−5−イル)−1,2,4−オキサジアゾールである;
からなる群より選ばれる化合物。
【請求項8】
R2、R3、R5、R6、およびR7はそれぞれ・・・である、請求項3に記載の化合物。
【請求項9】
R1は次式である、請求項1に記載の化合物。
【化5】

【請求項10】
R8、R9、およびR10のいずれか1つはメチル基である、請求項9に記載の化合物。
【請求項11】
R9はメチル基であり、R8とR10は両方ともHである、請求項10に記載の化合物。
【請求項12】
R1は−CR2R3R4である、請求項1に記載の化合物。
【請求項13】
R2、R3、およびR4はすべてDまたはすべてFである、請求項12に記載の化合物。
【請求項14】
R2、R3、およびR4はすべてDである、請求項12に記載の化合物。
【請求項15】
以下の構造を有する、式I、IA、IB、X、XA、もしくはXBの化合物、またはI、IA、IB、X、XA、もしくはXBの立体異性体、またはその薬剤的に許容可能な塩。
【化6】

[式中、
XはOまたはSであり;
R1は、NH2またはメチルであり、任意で1〜3個の重水素原子で置換されてもよく;あるいは、XがSのとき、R1はHになることもでき;
R2は、H、F、置換または非置換C1−4アルキル基、OH、またはORであり、ここでRは置換または非置換C1−4アルキル基であり;
R3はHであり;
R4は、出現するごとにFであり;
nは0、1、または2であり;ここで、nが0のとき、ピロリドン環は、任意で4位において置換または非置換C1−6アルキルで置換されてもよく;
mは、1または2であり;
pは、0、1、または2である。]
【請求項16】
XはOである、請求項15に記載の化合物。
【請求項17】
XはSである、請求項15に記載の化合物。
【請求項18】
R1はCH3またはCD3である、請求項15〜17のいずれかに記載の化合物。
【請求項19】
R2はFである、請求項15〜18のいずれかに記載の化合物。
【請求項20】
式Iで表される、請求項15〜19のいずれかに記載の化合物。
【請求項21】
式IAで表される、請求項15〜19のいずれかに記載の化合物。
【請求項22】
式IBで表される、請求項15〜19のいずれかに記載の化合物。
【請求項23】
式IIで表される、請求項15〜19のいずれかに記載の化合物。
【請求項24】
式IIAで表される、請求項15〜19のいずれかに記載の化合物。
【請求項25】
式IIBで表される、請求項15〜19のいずれかに記載の化合物。
【請求項26】
請求項15に記載の化合物であって、3−(メチル)−5−(ピペリジン−3−イル)−1,2,4−オキサジアゾール、(R)−3−(メチル)−5−(ピペリジン−3−イル)−1,2,4−オキサジアゾール、(S)−3−(メチル)−5−(ピペリジン−3−イル)−1,2,4−オキサジアゾール、5−(3−アザビシクロ[3.1.0]ヘキサン−1−イル)−3−(メチル)−1,2,4−オキサジアゾール、5−((1S)−3−アザビシクロ[3.1.0]ヘキサン−1−イル)−3−(メチル)−1,2,4−オキサジアゾール、5−((1R)−3−アザビシクロ[3.1.0]ヘキサン−1−イル)−3−(メチル)−1,2,4−オキサジアゾール、5−(3−アザビシクロ[3.1.0]ヘプタン−1−イル)−3−(メチル)−1,2,4−オキサジアゾール、5−((1S)−3−アザビシクロ[3.1.0]ヘプタン−1−イル)−3−(メチル)−1,2,4−オキサジアゾール、5−((1R)−3−アザビシクロ[3.1.0]ヘプタン−1−イル)−3−(メチル)−1,2,4−オキサジアゾール、3−メチル−5−(4−メチルピロリジン−3−イル)−1,2,4−オキサジアゾール、3−メチル−5−((3S,4S)−4−メチルピロリジン−3−イル)−1,2,4−オキサジアゾール、3−メチル−5−((3R,4R)−4−メチルピロリジン−3−イル)−1,2,4−オキサジアゾール、3−メチル−5−(ピペリジン−3−イル)−1,2,4−オキサジアゾール、(S)−3−メチル−5−(ピペリジン−3−イル)−1,2,4−オキサジアゾール、(R)−3−メチル−5−(ピペリジン−3−イル)−1,2,4−オキサジアゾール、5−(3−フルオロピペリジン−3−イル)−3−メチル−1,2,4−オキサジアゾール、(R)−5−(3−フルオロピペリジン−3−イル)−3−メチル−1,2,4−オキサジアゾール、(S)−5−(3−フルオロピペリジン−3−イル)−3−メチル−1,2,4−オキサジアゾール、3−メチル−5−(ピペリジン−3−イル)−1,2,4−チアジアゾール、(S)−3−メチル−5−(ピペリジン−3−イル)−1,2,4−チアジアゾール、(R)−3−メチル−5−(ピペリジン−3−イル)−1,2,4−チアジアゾール、3−メチル−5−(ピロリジン−3−イル)−1,2,4−オキサジアゾール、(S)−3−メチル−5−(ピロリジン−3−イル)−1,2,4−オキサジアゾール、および(R)−3−メチル−5−(ピロリジン−3−イル)−1,2,4−オキサジアゾールからなる群より選ばれる化合物。
【請求項27】
請求項15に記載の化合物であって、3−(メチル−d3)−5−(ピペリジン−3−イル)−1,2,4−オキサジアゾール、(R)−3−(メチル−d3)−5−(ピペリジン−3−イル)−1,2,4−オキサジアゾール、(S)−3−(メチル−d3)−5−(ピペリジン−3−イル)−1,2,4−オキサジアゾール、5−(3−アザビシクロ[3.1.0]ヘキサン−1−イル)−3−(メチル−d3)−1,2,4−オキサジアゾール、5−((1S)−3−アザビシクロ[3.1.0]ヘキサン−1−イル)−3−(メチル−d3)−1,2,4−オキサジアゾール、5−((1R)−3−アザビシクロ[3.1.0]ヘキサン−1−イル)−3−(メチル−d3)−1,2,4−オキサジアゾール、5−(3−アザビシクロ[3.1.0]ヘプタン−1−イル)−3−(メチル−d3)−1,2,4−オキサジアゾール、5−((1S)−3−アザビシクロ[3.1.0]ヘプタン−1−イル)−3−(メチル−d3)−1,2,4−オキサジアゾール、5−((1R)−3−アザビシクロ[3.1.0]ヘプタン−1−イル)−3−(メチル−d3)−1,2,4−オキサジアゾール、3−(メチル−d3)−5−(4−メチルピロリジン−3−イル)−1,2,4−オキサジアゾール、3−(メチル−d3)−5−((3S,4S)−4−メチルピロリジン−3−イル)−1,2,4−オキサジアゾール、3−(メチル−d3)−5−((3R,4R)−4−メチルピロリジン−3−イル)−1,2,4−オキサジアゾール、3−(メチル−d3)−5−(ピペリジン−3−イル)−1,2,4−オキサジアゾール、(S)−3−(メチル−d3)−5−(ピペリジン−3−イル)−1,2,4−オキサジアゾール、(R)−3−(メチル−d3)−5−(ピペリジン−3−イル)−1,2,4−オキサジアゾール、5−(3−フルオロピペリジン−3−イル)−3−(メチル−d3)−1,2,4−オキサジアゾール、(R)−5−(3−フルオロピペリジン−3−イル)−3−(メチル−d3)−1,2,4−オキサジアゾール、(S)−5−(3−フルオロピペリジン−3−イル)−3−(メチル−d3)−1,2,4−オキサジアゾール、3−(メチル−d3)−5−(ピペリジン−3−イル)−1,2,4−チアジアゾール、(S)−3−(メチル−d3)−5−(ピペリジン−3−イル)−1,2,4−チアジアゾール、(R)−(メチル−d3)−5−(ピペリジン−3−イル)−1,2,4−チアジアゾール、(メチル−d3)−5−(ピロリジン−3−イル)−1,2,4−オキサジアゾール、(S)−3−(メチル−d3)−5−(ピロリジン−3−イル)−1,2,4−オキサジアゾール、および(R)−3−(メチル−d3)−5−(ピロリジン−3−イル)−1,2,4−オキサジアゾールからなる群より選ばれる化合物。
【請求項28】
請求項15に記載の化合物であって、3−(メチル−d2)−5−(ピペリジン−3−イル)−1,2,4−オキサジアゾール、(R)−3−(メチル−d2)−5−(ピペリジン−3−イル)−1,2,4−オキサジアゾール、(S)−3−(メチル−d2)−5−(ピペリジン−3−イル)−1,2,4−オキサジアゾール、5−(3−アザビシクロ[3.1.0]ヘキサン−1−イル)−3−(メチル−d2)−1,2,4−オキサジアゾール、5−((1S)−3−アザビシクロ[3.1.0]ヘキサン−1−イル)−3−(メチル−d2)−1,2,4−オキサジアゾール、5−((1R)−3−アザビシクロ[3.1.0]ヘキサン−1−イル)−3−(メチル−d2)−1,2,4−オキサジアゾール、5−(3−アザビシクロ[3.1.0]ヘプタン−1−イル)−3−(メチル−d2)−1,2,4−オキサジアゾール、5−((1S)−3−アザビシクロ[3.1.0]ヘプタン−1−イル)−3−(メチル−d2)−1,2,4−オキサジアゾール、5−((1R)−3−アザビシクロ[3.1.0]ヘプタン−1−イル)−3−(メチル−d2)−1,2,4−オキサジアゾール、3−(メチル−d2)−5−(4−メチルピロリジン−3−イル)−1,2,4−オキサジアゾール、3−(メチル−d2)−5−((3S,4S)−4−メチルピロリジン−3−イル)−1,2,4−オキサジアゾール、3−(メチル−d2)−5−((3R,4R)−4−メチルピロリジン−3−イル)−1,2,4−オキサジアゾール、3−(メチル−d2)−5−(ピペリジン−3−イル)−1,2,4−オキサジアゾール、(S)−3−(メチル−d2)−5−(ピペリジン−3−イル)−1,2,4−オキサジアゾール、(R)−3−(メチル−d2)−5−(ピペリジン−3−イル)−1,2,4−オキサジアゾール、5−(3−フルオロピペリジン−3−イル)−3−(メチル−d2)−1,2,4−オキサジアゾール、(R)−5−(3−フルオロピペリジン−3−イル)−3−(メチル−d2)−1,2,4−オキサジアゾール、(S)−5−(3−フルオロピペリジン−3−イル)−3−(メチル−d2)−1,2,4−オキサジアゾール、3−(メチル−d2)−5−(ピペリジン−3−イル)−1,2,4−チアジアゾール、(S)−3−(メチル−d2)−5−(ピペリジン−3−イル)−1,2,4−チアジアゾール、(R)−(メチル−d2)−5−(ピペリジン−3−イル)−1,2,4−チアジアゾール、(メチル−d2)−5−(ピロリジン−3−イル)−1,2,4−オキサジアゾール、(S)−3−(メチル−d2)−5−(ピロリジン−3−イル)−1,2,4−オキサジアゾール、および(R)−3−(メチル−d2)−5−(ピロリジン−3−イル)−1,2,4−オキサジアゾールからなる群より選ばれる化合物。
【請求項29】
請求項15に記載の化合物であって、3−(メチル−d1)−5−(ピペリジン−3−イル)−1,2,4−オキサジアゾール、(R)−3−(メチル−d1)−5−(ピペリジン−3−イル)−1,2,4−オキサジアゾール、(S)−3−(メチル−d1)−5−(ピペリジン−3−イル)−1,2,4−オキサジアゾール、5−(3−アザビシクロ[3.1.0]ヘキサン−1−イル)−3−(メチル−d1)−1,2,4−オキサジアゾール、5−((1S)−3−アザビシクロ[3.1.0]ヘキサン−1−イル)−3−(メチル−d1)−1,2,4−オキサジアゾール、5−((1R)−3−アザビシクロ[3.1.0]ヘキサン−1−イル)−3−(メチル−d1)−1,2,4−オキサジアゾール、5−(3−アザビシクロ[3.1.0]ヘプタン−1−イル)−3−(メチル−d1)−1,2,4−オキサジアゾール、5−((1S)−3−アザビシクロ[3.1.0]ヘプタン−1−イル)−3−(メチル−d1)−1,2,4−オキサジアゾール、5−((1R)−3−アザビシクロ[3.1.0]ヘプタン−1−イル)−3−(メチル−d1)−1,2,4−オキサジアゾール、3−(メチル−d1)−5−(4−メチルピロリジン−3−イル)−1,2,4−オキサジアゾール、3−(メチル−d1)−5−((3S,4S)−4−メチルピロリジン−3−イル)−1,2,4−オキサジアゾール、3−(メチル−d1)−5−((3R,4R)−4−メチルピロリジン−3−イル)−1,2,4−オキサジアゾール、3−(メチル−d1)−5−(ピペリジン−3−イル)−1,2,4−オキサジアゾール、(S)−3−(メチル−d1)−5−(ピペリジン−3−イル)−1,2,4−オキサジアゾール、(R)−3−(メチル−d1)−5−(ピペリジン−3−イル)−1,2,4−オキサジアゾール、5−(3−フルオロピペリジン−3−イル)−3−(メチル−d1)−1,2,4−オキサジアゾール、(R)−5−(3−フルオロピペリジン−3−イル)−3−(メチル−d1)−1,2,4−オキサジアゾール、(S)−5−(3−フルオロピペリジン−3−イル)−3−(メチル−d1)−1,2,4−オキサジアゾール、3−(メチル−d1)−5−(ピペリジン−3−イル)−1,2,4−チアジアゾール、(S)−3−(メチル−d1)−5−(ピペリジン−3−イル)−1,2,4−チアジアゾール、(R)−(メチル−d1)−5−(ピペリジン−3−イル)−1,2,4−チアジアゾール、(メチル−d1)−5−(ピロリジン−3−イル)−1,2,4−オキサジアゾール、(S)−3−(メチル−d1)−5−(ピロリジン−3−イル)−1,2,4−オキサジアゾール、および(R)−3−(メチル−d1)−5−(ピロリジン−3−イル)−1,2,4−オキサジアゾールからなる群より選ばれる化合物。
【請求項30】
請求項1〜29のいずれか一項に記載の化合物および薬剤的に許容可能な担体を含む、薬剤的に許容可能な組成物。
【請求項31】
請求項1〜30のいずれか一項に記載の化合物または組成物の有効量を、それを必要としている被験体に投与することを含む、方法。
【請求項32】
前記被験体は、初老期認知症、老年認知症、ハンチントン舞踏病、遅発性ジスキネジア、運動過剰症、躁病、およびトゥレット症候群、またはアルツハイマー病に罹患している、請求項31に記載の方法。
【請求項33】
式Iの化合物またはその塩を提供するため、式IIの化合物またはその塩を、ギ酸エステル等価体で処理することを含む、方法。
【化7】

【化8】

[式中、
R1は、−CR2R3R4、
【化9】

からなる群より選ばれ;
R2、R3、R4は、独立して、H、D、またはFから選ばれ;
R5、R6、R7、R8、R9、およびR10は、独立して、H、D、F、またはメチル基から選ばれる。ただし、R4、R5、R6、R7、R8、R9、およびR10のうち1つ以下はメチル基である。]
【請求項34】
前記ギ酸エステル等価体は、オルトギ酸トリエチル、オルトギ酸トリメチル、酢酸ジエトキシメチル、またはギ酸エチルから選ばれる、請求項33に記載の方法。
【請求項35】
式IIIの化合物から塩基に安定なN−保護基を実質的に除去することにより、式IIの化合物を調製することをさらに含む、請求項33または34に記載の方法。
【化10】

[式中、各PGは独立して、塩基に安定なN−保護基である。]
【請求項36】
前記塩基に安定なN−保護基は、t−ブチルオキシカルボニル、ベンジルオキシカルボニル、またはクロロベンジルオキシカルボニルから選ばれる、請求項35に記載の方法。
【請求項37】
各PGはt−ブチルオキシカルボニルであり、該t−ブチルオキシカルボニルを実質的にすべて除去するのに十分な量の酸に、前記式IIIの化合物を露出することにより各PGを除去する、請求項35または36に記載の方法。
【請求項38】
前記酸はHClまたはトリフルオロ酢酸である、請求項37に記載の方法。
【請求項39】
塩基の存在下で式IIIの化合物を得るため、式IVの化合物を、アミドオキシムVIIIで処理することを含む、方法。
【化11】

【化12】

【化13】

[式中、
Rはメチル基またはエチル基であり;
R1は、−CR2R3R4、
【化14】

からなる群より選ばれ;
R2、R3、R4は、独立して、H、D、またはFから選ばれ;
R5、R6、R7、R8、R9、およびR10は、独立して、H、D、F、またはメチル基から選ばれ;ただし、R4、R5、R6、R7、R8、R9、およびR10のうち1つ以下はメチル基であり;
各PGは独立して、塩基に安定なN−保護基である。]
【請求項40】
前記塩基は、NaH、KH、ナトリウムメトキシド、またはカリウムt−ブトキシドから選ばれる、請求項39に記載の方法。
【請求項41】
式Vの化合物またはその塩を、塩基に安定なN−保護基を該式Vの各アミノ基に結合する試薬で処理することにより、前記式IVの化合物を調製することをさらに含む、請求項39または40に記載の方法。
【化15】

[式V中、Rはメチル基またはエチル基である。]
【請求項42】
塩基に安定なN−保護基を結合するための前記試薬は、二炭酸ジ−t−ブチル、t−ブチルオキシクロロホルマート、ベンジルオキシクロロホルマート、クロロベンジルオキシクロロホルマートから選ばれる、請求項41に記載の方法。
【請求項43】
前記式IVの化合物の調製は塩基の存在下で行われる、請求項41または42に記載の方法。
【請求項44】
前記塩基は、アルカリ金属炭酸塩もしくは重炭酸塩、または第三級アミンである、請求項43に記載の方法。
【請求項45】
前記塩基は、重炭酸ナトリウム、重炭酸カリウム、炭酸ナトリウム、炭酸カリウム、または炭酸セシウムである、請求項44に記載の方法。
【請求項46】
前記塩基に安定なN−保護基は、t−ブチルオキシカルボニル、ベンジルオキシカルボニル、またはクロロベンジルオキシカルボニルから選ばれる、請求項39〜45のいずれか一項に記載の方法。
【請求項47】
式VIの化合物からR1基を除去することにより、前記式IIIの化合物を調製することをさらに含む、請求項39に記載の方法。
【化16】

[式中、Rはメチル基またはエチル基であり、各R1は独立して、置換または非置換ベンジル基である。]
【請求項48】
式VIIの化合物を、塩基の存在下で置換または非置換ベンジルアミンで処理することにより、前記式VIの化合物を調製することをさらに含む、請求項47に記載の方法。
【化17】

[式中、Rはメチル基またはエチル基であり、各LGは独立して脱離基である。]
【請求項49】
各LGはブロモ基である、請求項48に記載の方法。
【請求項50】
式IXの化合物またはその塩。
【化18】

[式中、
R1は、−CR2R3R4、
【化19】

からなる群より選ばれ;
R2、R3、R4は、独立して、H、D、またはFから選ばれ;
R5、R6、R7、R8、R9、およびR10は、独立して、H、D、F、またはメチル基から選ばれ;ただし、R4、R5、R6、R7、R8、R9、およびR10のうち1つ以下はメチル基であり;
各R12は、独立して、−H、置換もしくは非置換ベンジル基、または塩基に安定なN−保護基である。]
【請求項51】
請求項1〜30のいずれかに記載の化合物または組成物の有効量を被験体に投与することを含む、被験体の認知および/または記憶を増強する方法。
【請求項52】
前記被験体はアルツハイマー病に罹患しているヒトである、請求項51に記載の方法。
【請求項53】
被験体の認知障害を治療する方法であって、該方法は、請求項1〜30のいずれかに記載の化合物または組成物の有効量を被験体に投与することを含み、
前記被験体が罹患する認知障害は、認知機能障害、軽度認知機能障害、前頭側頭型認知症、レビー小体型認知症、初老期認知症、老年認知症、ダウン症候群、ハンチントン舞踏病、遅発性ジスキネジア、運動過剰症、躁病、およびトゥレット症候群、またはアルツハイマー病からなる群より選ばれる、
方法。
【請求項54】
前記被験体はアルツハイマー病に罹患しているヒトである、請求項53に記載の方法。
【請求項55】
請求項1〜30のいずれかに記載の化合物または組成物の有効量を被験体に投与することを含む、被験体の脳内のムスカリン受容体を刺激する方法。
【請求項56】
前記ムスカリン受容体の刺激は緊張性刺激を含む、請求項55に記載の方法。
【請求項57】
前記被験体の脳内イノシトールリン酸レベルを、投与前のレベルに対して相対的に増加させる、請求項55または56に記載の方法。
【請求項58】
ムスカリンM1受容体を発現するニューロンにおいて前記イノシトールリン酸レベルを増加させる、請求項57に記載の方法。
【請求項59】
前記被験体はアルツハイマー病に罹患しているヒトである、請求項55〜58のいずれかに記載の方法。
【請求項60】
精神病に罹患している被験体に対し、請求項1〜30のいずれかに記載の化合物または組成物の化合物の治療有効量を投与することを含む、被験体の精神病を治療する方法。
【請求項61】
前記精神病は統合失調症に付随または起因する、請求項60に記載の方法。
【請求項62】
前記精神病はアルツハイマー病に付随または起因する、請求項60に記載の方法。
【請求項63】
被験体のAβレベルを減少させる方法であって、該減少を必要としている被験体に対し、請求項1〜30のいずれかに記載の化合物または組成物の化合物の何らかの量を投与することを含む、方法。
【請求項64】
前記被験体はアルツハイマー病に罹患している、請求項63に記載の方法。
【請求項65】
ムスカリンM1受容体を発現するニューロンにおいて前記Aβレベルを減少させる、請求項64に記載の方法。
【請求項66】
コリン作動性活性の欠損を含む神経学的疾患を有する被験体を治療する方法であって、グリコーゲンシンテターゼ3β活性を阻害すること、プロテインキナーゼC活性を増加すること、イノシトールリン酸レベルを増加すること、sAPPαレベルを増加すること、Aβレベルを減少すること、およびM1ムスカリン受容体を発現するニューロン中のアポトーシスを阻害することからなる群より選ばれる、少なくとも1つの生物活性を該被験体に引き起こすため、請求項1〜30のいずれかに記載の化合物または組成物の有効量を該被験体に投与することを含む、方法。
【請求項67】
前記被験体はアルツハイマー病に罹患している、請求項66に記載の方法。
【請求項68】
前記化合物または組成物を前記被験体に少なくとも1ヶ月間投与する、請求項51〜67のいずれかに記載の方法。
【請求項69】
前記化合物または組成物を前記被験体に少なくとも1年間投与する、請求項51〜67のいずれかに記載の方法。
【請求項70】
前記化合物または組成物を前記被験体に無期限に投与する、請求項51〜67のいずれかに記載の方法。
【請求項71】
医薬組成物であって、該医薬組成物を必要としている被験体に投与するための医薬組成物であり、
(i)該医薬組成物は、前記被験体の認知増強効果を達成するのに十分な量の少なくとも1つのM1またはM1/M4選択的ムスカリンアゴニスト、またはその薬剤的に許容可能な形態を含み;
ここで、前記少なくとも1つのM1またはM1/M4選択的ムスカリンアゴニストの量は、前記被験体に少なくとも1つの中程度のコリン作動性副作用を引き起こすのに十分な量であり、該コリン作動性副作用は、発汗、唾液分泌過多、潮紅、消化管障害、胃酸増加、悪心、嘔吐と下痢、呼吸困難、頻拍、めまい、失神、頭痛、痙攣、傾眠、およびこれらの組み合わせからなる群より選ばれ、
(ii)該医薬組成物は、前記少なくとも1つのコリン作動性副作用を前記被験体に最大でも軽度に引き起こすのに十分な量の、少なくとも1つのムスカリンアンタゴニスト、またはその薬剤的に許容可能な形態を含む、
医薬組成物。
【請求項72】
前記少なくとも1つのM1またはM1/M4選択的ムスカリンアゴニストは、MCD−386、オキサジアゾール、チアジアゾール、または請求項1〜29に記載の化合物である、請求項71に記載の医薬組成物。
【請求項73】
前記少なくとも1つのM1またはM1/M4選択的ムスカリンアゴニストはMCD−386である、請求項71に記載の医薬組成物。
【請求項74】
前記組成物中の前記MCD−386の量は、少なくとも25〜30ng/ml、少なくとも30〜35ng/ml、少なくとも40〜45ng/ml、および少なくとも45〜50ng/mlからなる群から選ばれる範囲内の、ヒト被験体中の血清濃度または血漿濃度を生成するのに十分である、請求項73に記載の医薬組成物。
【請求項75】
前記少なくとも1つのM1またはM1/M4選択的ムスカリンアゴニストは、請求項1〜14のいずれかに記載の化合物である、請求項72に記載の医薬組成物。
【請求項76】
前記少なくとも1つのM1またはM1/M4選択的ムスカリンアゴニストは、請求項15〜29のいずれかに記載の化合物である、請求項72に記載の医薬組成物。
【請求項77】
請求項75または76のいずれかに記載の医薬組成物であって、前記少なくとも1つのM1またはM1/M4選択的ムスカリンアゴニストは、前記被験体の認知増強効果を達成するのに十分な血清または血漿の最小Cmaxを達成し、
前記少なくとも1つのM1またはM1/M4選択的ムスカリンアゴニストの量は、前記被験体に少なくとも1つの中程度のコリン作動性副作用を引き起こすのに十分な量であり、該コリン作動性副作用は、発汗、唾液分泌過多、潮紅、消化管障害、胃酸増加、悪心、嘔吐と下痢、呼吸困難、頻拍、めまい、失神、頭痛、痙攣、傾眠、およびこれらの組み合わせからなる群より選ばれる、医薬組成物。
【請求項78】
前記少なくとも1つのムスカリンアンタゴニストは、N−メチルアトロピン硝酸塩、フラボキサート塩酸塩、N−メチルスコポラミン塩酸塩、グリコピロレート臭化物、ダリフェナシン臭化水素酸塩、ソリフェナシンコハク酸塩、プロパンテリン臭化物、トロスピウム塩化物、トルテロジン酒石酸塩、フェソテロジンフマル酸塩、メタンテリン臭化物、およびこれらの組み合わせからなる群より選ばれる、請求項71〜77のいずれかに記載の医薬組成物。
【請求項79】
前記コリン作動性副作用は発汗、唾液分泌過多、潮紅、下痢からなる群より選ばれる、請求項71〜78のいずれかに記載の医薬組成物。
【請求項80】
前記M1またはM1/M4選択的ムスカリンアゴニストの薬剤的に許容可能な形態は、前記M1またはM1/M4選択的ムスカリンアゴニストの塩、水和物、包接化合物、溶媒和化合物、または多型を含み、かつ、前記ムスカリンアンタゴニストの薬剤的に許容可能な形態は、前記ムスカリンアンタゴニストの塩、水和物、包接化合物、溶媒和化合物、または多型を含む、請求項71〜79のいずれか一項に記載の医薬組成物。
【請求項81】
前記医薬組成物は、錠剤、丸剤、ゲル、固体、カプセル剤、多粒子(multi−particulate)、経皮貼付剤、イオントフォレーシス装置、浸透圧装置、静脈内投与に適合する製剤、点滴により投与する液体製剤、または注入ポンプからなる群より選ばれる剤形で提供される、請求項71〜80のいずれか一項に記載の医薬組成物。
【請求項82】
前記剤形はイオントフォレーシス装置を含む、請求項81に記載の医薬組成物。
【請求項83】
請求項71〜82のいずれかに記載に医薬組成物であって、前記組成物または剤形が、前記被験体の認知増強効果を達成するのに十分な、前記少なくとも1つの選択的M1またはM1/M4ムスカリンアゴニストの血漿濃度または血清濃度を、15、30、45、60、90、および120から選ばれる時間枠(単位:分)内に提供し、かつ
前記少なくとも1つのM1またはM1/M4選択的ムスカリンアゴニストの量は、ムスカリンアンタゴニストが存在しない場合に、前記被験体の少なくとも1つの少なくとも中程度のコリン作動性副作用を引き起こすのに十分である、医薬組成物。
【請求項84】
前記少なくとも1つの選択的M1またはM1/M4ムスカリンアゴニストおよび前記少なくとも1つのムスカリンアンタゴニストは、遅延放出性の剤形をなしている、請求項71〜83のいずれかに記載の医薬組成物。
【請求項85】
前記認知増強効果は、場所の記憶の改善;人々の記憶の改善;情報記憶の改善;事実の記憶の改善;道具の操作方法および使用方法の記憶の改善;情報分析能力の改善;推定または判断する能力の改善;結論をまとめる能力の改善;戦略的に思考する能力の改善;計画し意思決定する能力の改善;計画および決定を実行する能力の改善;日常生活の活動を遂行する能力の改善;雇用される能力の改善;効果的な記憶および認知に関与するニューロン機構の活動(ムスカリン機能を含む)の増強;記憶および認知機能の損失をもたらす病理機構の低減;認知および記憶機能の損失をもたらすニューロンまたはニューロン活動の損失の低減;ADAS−Cog、MMSE等の神経心理検査のスコア向上;ADCS−ADL等の日常生活活動の臨床的評価のスコア向上;被験体内のα−セクレターゼ活性の増加;被験体内のAβ生成の減少;被験体内のsAPPα生成の増加;および被験体内のタウ病理および/またはアポトーシスの減少からなる群より選ばれる、請求項71〜84のいずれかに記載の医薬組成物。
【請求項86】
認知障害を有する被験体を治療する方法であって、
該方法は、前記被験体に少なくとも1つのムスカリンアゴニストを投与することを含み;
ここで、前記少なくとも1つのムスカリンアゴニストはM1またはM1/M4選択的ムスカリンアゴニストであり、M1またはM1/M4選択的ムスカリンアゴニストの量は、ムスカリンアンタゴニストが存在しない場合に、発汗、唾液分泌過多、潮紅、消化管障害、胃酸増加、悪心、嘔吐と下痢、呼吸困難、頻拍、めまい、失神、頭痛、痙攣、傾眠、およびこれらの組み合わせからなる群より選ばれる少なくとも1つの中程度のコリン作動性副作用を、前記被験体に経験させるのに十分な濃度を前記被験体の血流内に達成する量であり、かつ
該方法は、前記被験体に少なくとも1つのムスカリンアンタゴニストを投与することを含み;
ここで、前記少なくとも1つのムスカリンアンタゴニストの量は、該アンタゴニストが前記血流中に存在する時間の少なくとも一部の時間中に、最大でも軽度または中程度のみのコリン作動性副作用を前記被験体に経験させるのに十分な濃度を前記被験体の血流内に達成する量である、
方法。
【請求項87】
前記アンタゴニストが前記血流に存在する時間の少なくとも一部の時間中に、前記被験体が最大でも軽度のみのコリン作動性副作用を経験する、請求項86に記載の方法。
【請求項88】
前記少なくとも1つのM1またはM1/M4選択的ムスカリンアゴニストは、MCD−386、オキサジアゾール、チアジアゾール、または請求項1〜29のいずれかに記載の化合物である、請求項86〜87のいずれか一項に記載の方法。
【請求項89】
前記少なくとも1つのM1/M4選択的ムスカリンアゴニストはMCD−386である、請求項88に記載の方法。
【請求項90】
前記少なくとも1つのM1/M4選択的ムスカリンアゴニストは、請求項1〜14のいずれかに記載の化合物である、請求項88に記載の方法。
【請求項91】
前記少なくとも1つのM1/M4選択的ムスカリンアゴニストは、請求項15〜29に記載の化合物である、請求項88に記載の方法。
【請求項92】
前記少なくとも1つのムスカリンアンタゴニストは、N−メチルアトロピン硝酸塩、フラボキサート塩酸塩、N−メチルスコポラミン塩酸塩、グリコピロレート臭化物、ダリフェナシン臭化水素酸塩、ソリフェナシンコハク酸塩、プロパンテリン臭化物、トロスピウム塩化物、トルテロジン酒石酸塩、フェソテロジンフマル酸塩、メタンテリン臭化物、およびこれらの組み合わせからなる群より選ばれる、請求項86〜91のいずれかに記載の方法。
【請求項93】
前記少なくとも1つのムスカリンアンタゴニストは、前記少なくとも1つのM1またはM1/M4選択的ムスカリンアゴニストと同時に、または実質的に同時に投与される、請求項86〜92のいずれか一項に記載の方法。
【請求項94】
前記少なくとも1つのムスカリンアンタゴニストは、N−メチルアトロピン、フラボキサート、N−メチルスコポラミン、グリコピロレート、ダリフェナシン、ソリフェナシン、プロパンテリン、トロスピウム、トルテロジン、フェソテロジン、メタンテリン、前記の塩類、およびこれらの組み合わせからなる群より選ばれる、請求項88〜93のいずれかに記載の方法。
【請求項95】
前記塩類は、硝酸塩、塩酸塩、臭化物、臭化水素酸塩、コハク酸塩、塩化物、酒石酸塩、およびフマル酸塩からなる群より独立して選ばれる、請求項94に記載の方法。
【請求項96】
前記少なくとも1つのムスカリンアンタゴニストは、N−メチルアトロピン硝酸塩、フラボキサート塩酸塩、N−メチルスコポラミン塩酸塩、グリコピロレート臭化物、ダリフェナシン臭化水素酸塩、ソリフェナシンコハク酸塩、プロパンテリン臭化物、トロスピウム塩化物、トルテロジン酒石酸塩、フェソテロジンフマル酸塩、メタンテリン臭化物、およびこれらの組み合わせからなる群より選ばれる、請求項94と95のいずれかに記載の方法。
【請求項97】
前記少なくとも1つのムスカリンアンタゴニストは、前記少なくとも1つのM1またはM1/M4選択的ムスカリンアゴニストの投与に次いで投与される、請求項86〜96のいずれか一項に記載の方法。
【請求項98】
前記少なくとも1つのムスカリンアンタゴニストは、前記少なくとも1つのM1またはM1/M4選択的ムスカリンアゴニストの120分以内に投与される、請求項93〜97のいずれかに記載の方法。
【請求項99】
前記少なくとも1つのムスカリンアンタゴニストは、前記少なくとも1つのM1またはM1/M4選択的ムスカリンアゴニストの60分以内に投与される、請求項93〜97のいずれかに記載の方法。
【請求項100】
前記少なくとも1つのムスカリンアンタゴニストは、前記少なくとも1つのM1またはM1/M4選択的ムスカリンアゴニストの10分以内に投与される、請求項93〜97のいずれかに記載の方法。
【請求項101】
被験体を試験して、前記少なくとも1つのアゴニストまたはアンタゴニストを代謝する該被験体の能力を測定するステップをさらに含む、請求項93〜100のいずれかに記載の方法。
【請求項102】
医薬組成物であって、該医薬組成物の投与を必要としているヒト被験体に投与するための医薬組成物であり、
(i)前記被験体の認知増強効果を達成するのに十分な量の、前記少なくとも1つの選択的ムスカリンアゴニスト、またはその薬剤的に許容可能な形態と、
(ii)ある一定量の少なくとも1つのムスカリンアンタゴニスト、またはその薬剤的に許容可能な形態と、を含み、
ヒト被験体に投与されたとき、最大でも軽度のコリン作動性副作用を引き起こす、医薬組成物。
【請求項103】
前記ムスカリンアンタゴニストはフェソテロジンまたはその塩である、請求項102に記載の医薬組成物。
【請求項104】
前記ムスカリンアンタゴニストはフェソテロジンフマル酸塩である、請求項103に記載の医薬組成物。
【請求項105】
前記ムスカリンアンタゴニストはフェソテロジンの塩化物塩である、請求項103に記載の医薬組成物。
【請求項106】
前記少なくとも1つの選択的ムスカリンアゴニストの量は、前記被験体に少なくとも1つの中程度のコリン作動性副作用を引き起こすのに十分な量であり、該コリン作動性副作用は、発汗、唾液分泌過多、潮紅、消化管障害、胃酸増加、悪心、嘔吐と下痢、呼吸困難、頻拍、めまい、失神、頭痛、痙攣、傾眠、およびこれらの組み合わせからなる群より選ばれる、請求項102〜5のいずれかに記載の医薬組成物。
【請求項107】
前記ムスカリンアンタゴニストはフェソテロジンまたはその塩である、請求項78〜85のいずれかに記載の医薬組成物。
【請求項108】
前記ムスカリンアンタゴニストはフェソテロジンフマル酸塩である、請求項107に記載の医薬組成物。
【請求項109】
前記ムスカリンアンタゴニストはフェソテロジンの塩化物塩である、請求項107に記載の医薬組成物。
【請求項110】
前記ムスカリンアンタゴニストはフェソテロジンまたはその塩である、請求項92〜101のいずれかに記載の医薬組成物。
【請求項111】
前記ムスカリンアンタゴニストはフェソテロジンフマル酸塩である、請求項110のいずれかに記載の医薬組成物。
【請求項112】
前記ムスカリンアンタゴニストはフェソテロジンの塩化物塩である、請求項110のいずれかに記載の医薬組成物。
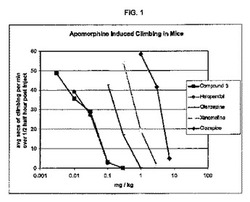
【図1】


【図2】


【図3】


【図4】


【図5】


【図6】


【図7】


【図8】


【図9】


【図10】


【図11】


【図12】


【図13】


【図14】




【図2】


【図3】


【図4】


【図5】


【図6】


【図7】


【図8】


【図9】


【図10】


【図11】


【図12】


【図13】


【図14】


【公表番号】特表2013−516497(P2013−516497A)
【公表日】平成25年5月13日(2013.5.13)
【国際特許分類】
【出願番号】特願2012−548237(P2012−548237)
【出願日】平成23年1月11日(2011.1.11)
【国際出願番号】PCT/US2011/020902
【国際公開番号】WO2011/085406
【国際公開日】平成23年7月14日(2011.7.14)
【出願人】(511212561)ミスリィディオン,インク. (2)
【氏名又は名称原語表記】MITHRIDION,INC.
【Fターム(参考)】
【公表日】平成25年5月13日(2013.5.13)
【国際特許分類】
【出願日】平成23年1月11日(2011.1.11)
【国際出願番号】PCT/US2011/020902
【国際公開番号】WO2011/085406
【国際公開日】平成23年7月14日(2011.7.14)
【出願人】(511212561)ミスリィディオン,インク. (2)
【氏名又は名称原語表記】MITHRIDION,INC.
【Fターム(参考)】
[ Back to top ]

