質量分析システム及び質量分析方法
【課題】 物質の構造に関する情報の取得効率を向上し、測定及び物質同定の時間を短縮し、同定精度を向上することのできる安価な質量分析システムを提供する。
【解決手段】 タンデム型質量分析装置を用いた質量分析システムにおいて、試料を所望の極性でイオン化し、イオンを解離して得られたフラグメントイオンを第一、あるいは、第二の質量分析部で測定し、その結果に基づき、第二の質量分析装置の極性を決定し、質量分析測定することを特徴とする質量分析システム、及び、質量分析方法を開示する。
【解決手段】 タンデム型質量分析装置を用いた質量分析システムにおいて、試料を所望の極性でイオン化し、イオンを解離して得られたフラグメントイオンを第一、あるいは、第二の質量分析部で測定し、その結果に基づき、第二の質量分析装置の極性を決定し、質量分析測定することを特徴とする質量分析システム、及び、質量分析方法を開示する。
【発明の詳細な説明】
【技術分野】
【0001】
質量分析法を用いた生体高分子の構造解析方法と装置に関する。
【背景技術】
【0002】
ヒトにはおよそ10万種のタンパク質が存在すると言われている。タンパク質の機能は、プロテアーゼによる切断、糖鎖やリン酸基などの付加による活性・相互作用調節、ミリスチル化やパルミチル化などのアシル化による膜への局在化など、様々の翻訳後修飾により巧妙な調節を受けている。特に真核生物においては、遺伝子配列をもとに合成されたタンパク質がそのままの状態で機能を発揮することはむしろまれで、リボソーム上での合成後にその場で、あるいは細胞内での最終的な局在が決まるまでの様々の段階で多種多様な修飾を受ける。時間空間的に変化するこれらの生体高分子はゲノム情報のみでは決定できず、タンパク質を直接解析して初めて決定できる。
【0003】
その構造解析手段の1つとして、質量分析法(mass spectrometry)がある。質量分析法を用いて、生体高分子を構成するアミノ酸がペプチド結合でつながったポリペプチド(ペプチドやタンパク質)の配列情報や翻訳後修飾情報を得ることができる。とくに高周波電場を用いたイオントラップやQマスフィルターを用いた質量分析法や、飛行時間型質量分析法(Time−of−Flight :TOF) は高速分析法のため、液体クロマトグラフィー装置などに代表される試料を分離する前処理手段との結合性がよい。そこで、多種類の試料を連続解析することが求められるプロテオーム解析などの目的に合致しており、幅広く使われている。
【0004】
一般に質量分析法では、試料分子をイオン化して真空中に導入し( または真空中でイオン化し) 、電磁場中におけるそのイオンの運動を測定することにより、対象とする分子イオンの電荷と質量の比(m/z)が測定される。得られる情報が質量と電荷の比という巨視的な量であるため、単に1度の質量分析操作では内部構造情報まで得ることは出来ない。そこで、タンデム質量分析法と呼ばれる方法が用いられる。すなわち、1回目の質量分析操作で試料分子イオンを選択し、単離する。このイオンをプリカーサーイオンとよぶ。つづいて、このプリカーサーイオンを何らかの手法で解離する。解離したイオンをフラグメントイオンと呼ぶ。そのフラグメントイオンをさらに質量分析することにより、フラグメントイオンの生成パターンの情報を得る。解離手法により、解離パターンの法則性があるので、プリカーサーイオンの配列構造を推察することが可能となる。とくに、アミノ酸を骨格とする生体分子の分析分野では、解離手法として衝突励起解離( Collision−Induced−Dissociation:CID)、赤外多光子吸収(Infra−Red−Multi−Photon−Dissociation:IRMPD) そして、電子捕獲解離(Electron−Capture−Dissociation:ECD)や電子移動解離(Electron−Transfer−Dissociation:ETD)が使われる。
【0005】
タンパク質解析分野において、現在もっとも広く使われている手法がCIDである。プリカーサーイオンに運動エネルギーを与えてガスと衝突させる。衝突により分子振動が励起されて、分子鎖の切れやすい部分で解離する。また、最近使われるようになった方法がIRMPDである。プリカーサーイオンに赤外レーザ光を照射して、多数の光子を吸収させる。分子振動が励起されて、分子鎖の切れやすい部位で解離する。解離部位は図12に示す。a,b,cはNH2末端側を含む分子、x,y,zはCOOH末端側を含む分子である。CIDやIRMPDで切れやすい部位は、アミノ酸配列からなる主鎖のうち、a − x、b − yで命名されている部位である。a− x、b − yの部位であっても、アミノ酸配列パターンによっては切れにくい場合があるために、CID やIRMPDのみでは完全な構造解析ができないことが知られている。そのために、酵素などを用いた前処理が必要になり、高速な分析を妨げている。また、翻訳後修飾を受けた生体高分子では、CID やIRMPDを用いると、翻訳後修飾されたポリペプチド側鎖が切れやすい傾向がある。側鎖が切れやすいため、失われた質量から修飾分子種と修飾されているかどうかの判定は可能である。ただし、どのアミノ酸部分で修飾されていたかという修飾部位に関する重要な情報は失われる。
【0006】
一方、ECDやETDは、アミノ酸配列に依存せず( ただし例外として環状構造であるプロリン残基は切断しない)、アミノ酸配列の主鎖上のc − z部位の1 箇所を切断する。そのために、タンパク質分子を質量分析的手法のみで完全解析出来る。また、側鎖を切断しにくいという特徴をもっていることから、翻訳後修飾の研究・解析の手段として適している。このために、近年特に注目を受けているのがこのECDやETDという解離手法である。
【0007】
ECDやETDはプラスに帯電した多価イオンに対してのみ解離可能である。ECDはプラスに帯電した分子にマイナスに帯電した電子を捕獲させることによって分子が解離する原理を利用している。そのため、マイナスに帯電している分子では解離できず、プラスの一価イオンでは、ニュートラルな分子になってしまうため、質量分析装置で検出できない。
【0008】
また、ECDの反応効率は電荷の二乗に比例すると言われているため、非常に高い価数になるタンパク質では効率よく解離できる。このため、最近ではトップダウンと呼ばれる解析が注目されている。トップダウン解析は、タンパク質を酵素消化し、ペプチド断片化する手法(ボトムアップ)と対照的であり、タンパク質を直接質量分析する手法である。ボトムアップ解析では、分析されたペプチドが生体内でタンパク質として存在していたのか、あるいは分解物として存在していたのかを特定することはできない。一方、トップダウン解析では、生体試料を直接分析するため、その特定も可能となる。
【0009】
現時点で、ECDはフーリエ変換型質量分析装置(FT−ICR)と高周波イオントラップで実現されている(非特許文献1)。FT−ICRでは、分解能800000程度、ppbの質量精度をもつが、超伝導磁石を用いて、平行強磁場(数テスラ以上)が必要となるため、高価かつ大型であり、1つのスペクトルを得るために、必要な測定時間は数秒から10秒かかり、スペクトルを得るために必要なフーリエ解析に10秒程度必要である。都合、数10秒必要となる。そのため、10秒程度で1つのピークが現れる液体クロマトグラフィーとの結合性は良いとは言えない。一方、高周波イオントラップはTOFと結合すると、FT−ICRには及ばないが、高分解能(15000程度)で高い質量精度(ppm)でデータ測定が可能である。さらに、小型、安価である上、高速測定が可能であるため、液体クロマトグラフィーとの結合性が良い(非特許文献2)。
【0010】
このように、質量分析装置や液体クロマトグラフィーの進化、さらにデータベースの充実によって大規模タンパク質解析が実現しつつある。しかし、それでも一度に分析できるタンパク質としては、せいぜい数千種類が限度である。そのため、すべてのタンパク質を対象にするのではなく、特定の集団だけを相手にするいわゆる「フォーカスド・プロテオーム」が昨今の主流になりつつある。
【0011】
例えば、代表的な翻訳後修飾であるリン酸にフォーカスした分析が盛んに行われている。リン酸化物を分析するには2つの課題がある。一つ目として、リン酸化物は非リン酸化物に比べ、数倍から数百倍イオン化効率が低くなることがある。2つめとして、CIDを解離手法とする場合、タンパク質のままでは解離が困難なため、酵素消化によって、ペプチド断片化する必要がある。分子量40000のタンパク質が酵素消化により400断片のペプチドに分解されたと仮定すると、全タンパク質のおよそ30%存在していたリン酸化物は、酵素消化により存在比は0.08%以下になると試算される(非特許文献3)。
【0012】
この2つの制限により、ペプチド断片化した生体試料サンプルをそのまま質量分析してもリン酸化ペプチドが同定できることはほとんどない。そこで、現在、リン酸化ペプチドを特異的に検出するために、CIDに特徴的である翻訳後修飾部位の脱離を利用した手法が使われている。CIDによるタンデム質量分析法では、リン酸化ペプチドからリン酸基だけが失われたフラグメントイオンと、リン酸基に由来するフラグメントイオンが生成する。リン酸基に注目してリン酸化ペプチドを探索する手法はプリカーサーイオンスキャン法と呼ばれる。
プリカーサーイオンスキャン法は、特定のフラグメントイオンを生成する全てのプリカーサーイオンをスキャンする測定方法である。1台目の質量分離部MS−1のスキャンで透過したイオンを、コリジョンセルでCIDを実施し、得られたフラグメントイオンの中で、特定のm/zのイオンのみを2台目の質量分離部MS−2で検出する。このようにして、MS−2で特定のフラグメントイオンが検出された時、MS−1を通過したプリカーサーイオンを特定する。リン酸基を特異的に検出する場合は、ネガティブモードで、m/z79(PO3−)イオンをMS−2で検出する(非特許文献4)。
【0013】
【非特許文献1】Takeshi Baba et al. Electron capture dissociation in a radio frequency ion trap.Anal Chem. 2004 Aug 1;76(15):4263−6.
【非特許文献2】Takeshi Baba et al :ASMS conference on Mass spectrometry(2006)WOB.
【非特許文献3】実験医学 Vol.23 No.19 2005,p2951−2956
【非特許文献4】プロテオミクス実験プロトコール(秀潤社)p156−168
【非特許文献5】Kisaburo Deguchi et al. Structural analysis of O−glycopeptides employing negative− and positive−ion multi−stage mass spectra obtained by collision−induced and electron−capture dissociations in linear ion trap time−of−flight mass spectrometry. RAPID COMMUNICATIONS IN MASS SPECTROMETRY 2007;21:691−698.
【発明の開示】
【発明が解決しようとする課題】
【0014】
タンパク質やペプチドの定性解析では、アミノ酸配列の同定だけでなく、翻訳後修飾の種類や修飾物の構造あるいは修飾部位の同定が求められる。サンプルは貴重であるため、効率よく最大限のアウトプットを獲得することが求められる。また、一連の解析をできるだけ短時間に行うこと、すなわち、高スループットが求められている。
【0015】
前述したように、代表的なフォーカスドプロテオームであるリン酸化をターゲットにした解析では、CIDを用いたプリカーサー・スキャン法によって、リン酸化ペプチドを特異的な探索を実施する。リン酸基はマイナスに帯電するため、ネガティブモードで測定する必要がある。探索の結果、リン酸化ペプチドが検出された場合、リン酸化ペプチドイオンを単離し、CIDによって定性解析を試みる。しかし、CIDによる解析では、リン酸基が解離し修飾箇所の特定には至らないケースが多々存在する。その場合、貴重なサンプルを用いて再分析する。再分析はポジティブモードでイオン化し、ECDやETDでのイオン解離によって定性解析される。
【0016】
重要な翻訳後修飾の1つである糖鎖をもつペプチドの解析においては、ポジティブモードで測定した場合、簡単にフコースやシアル酸などの単糖の解離が観察される。一方、ネガティブモードでは糖鎖の解離は観察されない。このため、まず、糖鎖ペプチドはネガティブモードでイオン化される。糖鎖ペプチドをCIDすると、糖鎖が優先的に解離し、糖鎖だけが解離したフラグメントイオンが観察される。これらにより、糖鎖構造解析が可能となる。しかし、CIDすることで糖鎖はポリペプチド側鎖から脱離してしまうため、どのアミノ酸に修飾していたかという情報は失われる。そこで、再分析が実施される。今度は一部糖鎖は脱離してしまうが、ポジティブモードでイオン化し、ECDやETDで解析することによってアミノ酸配列情報や修飾部位を同定する(RAPID COMMUNICATIONS IN MASS SPECTROMETRY 2007;21:691-698.)。
【0017】
また、最近注目されているトップダウン解析では、10価以上のプリカーサーイオンに対して、ECDやETDを実施しなければならない。その解析にはプリカーサーイオンの分子量やECDで解離した結果得られたフラグメントイオンの分子量が判明しなければ、構造解析することはできない。分子量(m)はイオンのm/z値と同位体ピーク間隔からzが判明し、mを算出する。多価になるほど、狭くなる同位体ピーク間隔を判別するためには、高分解能な装置が必要である。
【0018】
以上のように、イオン解離手法としては一般的に広く汎用されているCIDだけでなく、CIDと相補的なイオン解離手法であるECDを使用することで初めて解析可能となる生体高分子が多数存在する。また、糖鎖解析例のように、ポジティブ、ネガティブ両極性での測定ができないと定性解析が成立しないものも存在する。液体クロマトグラフと接続した場合、各イオンピークは10秒程度しか検出されない。その間に両極性での分析、あるいは、ECDとCIDなど相補的なイオン解離手段が使用できる高スループットな装置が重要視される。さらに、トップダウン解析に対応可能な高分解能な装置も合わせて求められる。
【0019】
イオン源、Qマスフィルター、イオントラップなどは数十ms程度で容易に極性を変換できるため、両極性測定可能な装置が製品化されている。また、ETDとCIDを同一装置内で利用できる装置も製品化されている。
【0020】
大きな課題は液体クロマトグラフでの分析が可能な高速で高分解能な装置である。前述したように超高分解能装置であるFT−ICRはスループットが低いため、液体クロマトグラムを用いた解析には向かない。しかし、最近、Orbitrapと呼ばれる磁場型の装置が市販された。この装置は高スループット(1スキャン/秒)で、高分解能(50000)な装置で、液体クロマトグラムとの接合性もよい。しかし、非常に高価である。安価で高分解能な装置を製作するにはTOFが最適である。しかし、TOFの極性切り替え制御はイオントラップのように容易にできるものではない。非常に大きな電圧が必要になり、高価な装置になってしまう。最近、0.1秒程度でTOFの極性変換が可能な装置が市販されたが、高価な装置である。
【課題を解決するための手段】
【0021】
本発明のタンデム型質量分析装置を用いた質量分析システムでは、試料をイオン化するイオン源と、イオンの軌道を偏向することでイオンの進行方向を決定するイオン偏向部と、イオン偏向部から排出されたイオンを質量分析するための第1の質量分析部と、第1の質量分析部とは極性の異なる第2の質量分析部と、少なくともイオン源及びイオン偏向部の極性の切り替えを行う制御部を有し、第1の質量分析部により得られた測定結果に基いて前記制御部は少なくともイオン源及びイオン偏向部の極性を切り替え、第2の質量分析部により質量分析が行われる。
【0022】
本発明の質量分析方法では、極性を切り替えて質量分析することが可能な質量分析システムにおいて、試料をイオン化するイオン源の前段に設けられた分離部によって試料を分離する工程と、分離された試料をイオン源により所望の極性でイオン化する工程と、生成された試料イオンを第1の解離手段によって解離する工程と、解離された試料イオンを質量分析部により第1の質量分析が行われる工程と、第1の質量分析により目的のイオンが検出された場合、第1の解離手段とは別の解離手段によって試料イオンの解離を行う工程と、質量分析部により第2の質量分析が行われる工程とを有し、第1の質量分析の結果に基いて、第2の質量分析における試料のイオン化極性が決定する。
【0023】
本発明の質量分析システム及び質量分析方法では、貴重なサンプルを無駄にすることなく、正負両極性での2つの質量分析部を用いた一連の相補的な解析を短時間で行うことができる。
【0024】
質量分析部として、安価で高分解能な装置にするため、TOFを用いる。ただし、分析中にTOFの極性を切り替えると大きな電圧やシステムが必要になり、高価な装置になるという問題がある。もう一方の質量分析部として、イオントラップを用いる。イオントラップは数十m秒程度で極性を切り替えることができ、安価である上、CIDによるMSn機能も有する。しかし、イオントラップ内で解離を実施した場合、低分子は共鳴振動し、イオントラップから排出されてしまう。そのため、リン酸基(98 m/z)などの低分子は検出できない。そのため、コリジョンセルを用いる。コリジョンセルはイオンの単離はできないが、低分子が排出されないという利点がある。その他、ECDを実施するためのECDセル、極性切り替え可能なイオン源と同じく極性切り替え可能なイオンを単離するためのQマスフィルターを用いる。また、他の解離手段としてETDを用いても良い。
【0025】
以上の装置構成から、TOFの極性を分析中に切り替えることなく両極性での測定が可能となり、安価な質量分析システムで高分解能・高スループットな質量分析が可能となる。
【0026】
また、本発明のタンデム型質量分析装置を用いた質量分析システムでは、試料分離して得られた特定物質をイオン化し、プリカーサーイオンの価数の判定を行う。価数を判定できた場合は、そのイオンに対し、ECDで解離して詳細分析を実行し、価数を判定できない場合は、そのプリカーサーイオンをCIDで解離し、フラグメントイオンの価数の判定を行い、価数判定できたフラグメントに対し、ECDで解離して詳細分析を実行することで、従来では分析できなかった分子量の大きなタンパク質に対して、構造解析が可能になる。
【発明の効果】
【0027】
本発明によると、両極性測定可能であり、相補的なCIDとECDでのイオン解離が実施可能である安価で高分解能な装置を提供できる。また、質量分析による物質の同定において、物質の構造に関する情報を取得する効率が向上し、測定及び物質同定の時間が短縮され、同定精度が向上する。
【発明を実施するための最良の形態】
【0028】
図1に、本発明に基づく質量分析システムの構成例を示す。分析対象の試料1は、ガスクロマトグラフ(GC)またはLC2の前処理により分離される。分離された試料は、イオン源3においてイオン化され、質量分析装置に導入される。導入されたイオンはQマスフィルター4で単離され、単離された特定のイオン(あるいは全イオン)はQディフレクター5から、LIT6、ECDセル8、あるいはコリジョンセル9に排出される。Qディフレクター5では、全方向へのイオンの移動が可能である。例えば、ECDセル8に導入されたイオンは、ECDで解離し、リニアイオントラップ(LIT)6、あるいは、コリジョンセル9に導かれる。LIT6、コリジョンセル9ではイオンをCIDで解離することが可能である。LIT6、コリジョンセル9から排出されたイオンはLIT検出器7またはTOF検出器11でイオンの質量電荷比m/zに応じて分離される。TOF検出器11の前段には高分解能であるTOFが存在する。また、LITはMSn機能をもつ。
【0029】
分離されたイオンは、イオン検出部7または11で検出され、イオン価数判定部16で決定された価数は各イオンのm/z値と共に全体処理部21でデータ整理・処理され、その分析結果である質量分析データはデータ表示部20にて表示される。この一連の質量分析過程、すなわち、試料の分離、イオン化、質量分析装置内のイオン輸送、及び、解離、質量分離、及び、イオン検出、データ処理の全体を全体情報処理部21で制御する。パラメータ入力部20からユーザの必要な情報であるイオンモード決定部15、解離方法決定部17、Qディフレクター方向決定部18、解離物イオン、ニュートラルロス決定部19を入力する。
【0030】
イオン源3、Qマスフィルター4、Qディフレクター5、LIT6、コリジョンセル9、TOF10は制御部12によって制御され、ポジティブ、ネガティブへの切り替えが可能である。
ただし、TOF部10の極性切り替え制御は短時間で実施できるものは高価な装置になるため、TOF部10の極性は、サンプル分析前に切り替え可能とした方が良い。
【0031】
以下に本発明の実施例を示す。
【実施例1】
【0032】
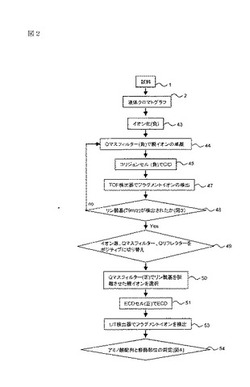
代表的な翻訳後修飾であるリン酸化にフォーカスしたプロテオーム解析の実施例を示す。多数存在する非リン酸化物からリン酸化物を探索し、定性解析を実施するまでのフローチャートを図2に示す。
【0033】
分析開始前の極性は、イオン源3、Qマスフィルター4、Qディフレクター5、コリジョンセル9、TOF10はネガティブ、LIT6はポジティブである。ECDセル8は原理上いつでもポジティブである。
【0034】
液体クロマトグラフ2で分離された試料1はネガティブモードでイオン化され43、Qマスフィルター、Qディフレクター、コリジョンセルを通過し、TOFでイオンを検出する(MS1)。次に、MS1で検出されたイオンの中から特定のプリカーサーイオンをQマスフィルターで選択する44。選択されたプリカーサーイオンはQディフレクターを通過し、コリジョンセルでCIDを実施する45。CIDによって生成したフラグメントイオンはTOF部で検出される47。LIT6でCIDを実施することは可能であるが、100m/z程度の小さなフラグメントイオンは高周波電圧の影響により共鳴振動し、LIT内に保持できないため検出できない。よってコリジョンセル9でCIDを実施する必要がある。
【0035】
Qマスフィルター4で選択したイオンの中にリン酸化物が含まれていた場合、CIDによって脱離したリン酸基(79m/z)が検出される。このCIDによるMS2解析結果は定性解析に重要な情報が含まれているが、不十分な情報であることが予想される。図3にリン酸化ペプチド33をCIDで解析した場合の模式的なスペクトルを示す。CIDではリン酸基を優先的に解離するため、リン酸化物イオン31とリン酸基のみを失ったペプチドのみであるニュートラルロス32が検出される。CIDでは、アミノ酸配列と修飾部位の特定が困難である。
【0036】
そこで、詳細な定性解析をECDで実施するため、リン酸基イオンが検出された場合48、ネガティブモードからポジティブモードに切り替える49。切り替える箇所はイオン源、Qマスフィルター、Qディフレクターである。
【0037】
次に、Qマスフィルターに導入されたイオンの中から、ネガティブモードで検出されたリン酸化物イオンの質量電荷比+2の位置に存在するイオンをQマスフィルターで選択する50。
【0038】
ポジティブモードでイオン化した場合、ネガティブモードで検出されたリン酸化物イオンは、通常質量電荷比が+2された位置でイオンが検出される。というのは、ネガティブモードでは、多くの場合、H+(プロトン)を失い、イオンになる。一方、ポジティブモードでは、プロトンが付加し、イオンとなる。分子量Mの物質がx価数でイオン化すると、ネガティブモードでは質量電荷比(M−xH)/xのイオンが検出される。一方、ポジティブモードでは、質量電荷比(M+xH)/xのイオンが検出される。両者の差は2Hとなる。水素の分子量は1であるため、差は2となる。
【0039】
Qマスフィルター4で単離されたイオンはQディフレクター5を介し、ECDセル8に導入さる。そこでECDを実施し51、フラグメントイオンは再びQディフレクター5を介し、LIT検出器7でフラグメントイオンを検出する53。図4にECDで解析した場合の模式的なスペクトルを示す。ECDではリン酸基を解離することなく、ペプチド結合のみを解離するため、アミノ酸配列と修飾部位の特定が可能である。
【0040】
ECDによって得られたフラグメント情報は、CIDによって得られたフラグメント情報とともに詳細に解析し、アミノ酸配列や修飾部位の特定を行う54。
【0041】
従来、リン酸化ポリペプチドの探索、CIDによる構造解析、ECDによる構造解析など、独立に分析を行っていたが、本装置構成、本方法により、短時間で分析結果を得ることが可能である。
【実施例2】
【0042】
糖鎖ポリペプチドにフォーカスしたプロテオーム解析の実施例を示す。ネガティブモードで糖鎖構造解析を実施し、ポジティブモードでアミノ酸配列と糖鎖修飾箇所を同定するまでのフローチャートを図5に示す。
【0043】
分析開始前の装置の極性は、イオン源3、Qマスフィルター4、Qディフレクター5、LIT6はネガティブ、コリジョンセル9、TOF10はポジティブである。ECDセル8は原理上いつでもポジティブである。
【0044】
液体クロマトグラフ2で分離された試料1はネガティブモードでイオン化され、Qマスフィルター4、Qディフレクター5、LIT6を通過し、LIT検出器7でイオンを検出する(MS1)。次に、MS1で検出されたイオンの中から糖鎖ポリペプチドのプリカーサーイオンをQマスフィルター4で単離する83。単離されたプリカーサーイオンはQディフレクター5を通過し、LIT6でCIDを実施する84。CIDによって生成したフラグメントイオンはLIT検出器7で検出される(MS2/CID)53。
【0045】
次に、ネガティブモードからポジティブモードに切り替える49。切り替える箇所はイオン源3、Qマスフィルター4、Qディフレクター5である。
【0046】
一般的に糖鎖ポリペプチドをポジティブモードでイオン化したり、イオンを単離したりすると糖鎖の一部が離脱することがあるが、イオントラップの代わりにQマスフィルター5を用いることにより、糖鎖の脱離は抑制されると考える。
【0047】
ポジティブモードでイオン化し88、ネガティブモードで分析した糖鎖ポリペプチドのイオンをQマスフィルター4で選択する89。このときで同じ価数のイオンを単離する場合、質量電荷比で+2の位置に検出される。
【0048】
Qマスフィルター4で選択されたイオンはQディフレクター5を介し、ECDセル8に導入される。そこでECDを実施し51、フラグメントイオンは再びQディフレクター5を介し、コリジョンセル9を通過し、TOF検出器11でフラグメントイオンを検出する(MS2/ECD)47。
【0049】
ネガティブモードでCIDすることによって得られたフラグメントイオンから糖鎖構造情報が得られる86。ポジティブモードでECDすることによって得られたフラグメントから、アミノ酸配列情報や修飾部位情報が得られる54。両者の情報から詳細な解析を行う。
【0050】
ここで、具体例を図6,7に示す。図6は糖鎖修飾ペプチド由来負イオン(脱プロトン化分子)のCID分析データである。このデータの前駆イオンは、m/z値が954.9の[M−2H]2−である。ここで、Mは糖鎖修飾ペプチド分子を、Hは水素原子を表し、このイオンは2個プロトンが失われた2価イオンである。この前駆イオンをCIDによりMS二/CID分析したデータが図6(B)に示されている。図6(B)の右上に糖鎖修飾部の模式図を示す。ここで、BやCはグリコシド結合の部位で解離したイオンを表す。波線はペプチドを表し、ひし形はNeu5Ac(Nアセチルノイラミン酸、分子量309.1)、黒丸はGal(ガラクトース、分子量180.05)、四角はGlcNAc(Nアセチルグルコサミン、分子量221.08)、三角はFuc(フコース、分子量164.06)を示す。また、破線は解離部位を示す。
【0051】
単糖同士のグリコシド結合は脱水反応であるため、糖鎖部分の分子量は各単糖の分子量の総和からグリコシド結合1つ当たり水の分子量18が失われた値となる。図6(B)で検出された質量電荷比819.3(1価、分子量820.3)は4つの単糖の分子量の合計は309.1+180.05+221.08+164.06=874.29から3つのグリコシド結合18×3=54を引いた値となる。つまり、分子量は874.29−54=820.29となる。C3と一致することが分かる。このイオンC3を前駆イオンに選択し、CIDによりMS3/CID分析を実施して得られたデータが図6(C)である。これにより、糖鎖構造が明らかできた。
【0052】
次に、同じ糖鎖ペプチドをポジティブモードでイオンし、ECDの結果得られたMS2/ECD分析データを図7に示す。ECDでは、ペプチド結合の特定の部位で解離し、cイオンやzイオンが検出される点が特徴的である。右上に、糖鎖修飾ペプチドの構造、及び、検出イオンを示す。水平方向に並んだアルファベットはアミノ酸配列を示す。このMS2/ECD分析データに対し、データベース検索を実施した結果、図に示されるように、アミノ酸配列情報が得られる多数のcイオンやzイオンが検出され、元のタンパク質が同定された。さらに、C末端から7つ目のセリン(S)に糖鎖が修飾されていることもデータベース検索の結果から明らかになった。このデータの前駆イオンはm/zが638.3の[M+3H]3+である。なお、ECDのMS2/ECD分析データでは、前駆イオンの電子捕獲再結合により、電荷数だけが低減したイオン([M+3H]2+、[M+3H]+)も検出される。
【0053】
このように、従来、独立に2回分析することによって得られていた、糖鎖構造、アミノ酸配列、修飾箇所が本発明により一度の分析で可能となる。さらにサンプル消費の低減にもつながる。
【実施例3】
【0054】
試料としてタンパク質を用いたプロテオーム解析の実施例のフローチャートを図8に示す。
【0055】
本実施例では装置の極性をすべてポジティブにするが、ポジティブとネガティブを混合させたり、ネガティブのみにしたり、分析途中で切り替えることも可能である。
【0056】
液体クロマトグラフ2で分離された試料1はポジティブモードでイオン化され、Qマスフィルター4、Qディフレクター5、コリジョンセル9を通過し、TOF検出器11でイオンを検出する(MS1)47。ここで、分析対象となるある一定強度以上のイオンの価数判定を実施する107。イオンを構成する分子には一定の割合で同位体元素が含まれるため、同位体を含む一連のイオンも同時に観察される。そのm/z軸における間隔は1/zとなることにより、イオンの価数を判定することが可能である。どの程度、価数判定できるかは装置性能、特に質量分解能に依存する。ここで価数判定可能なイオンとは、その装置で価数判定できる価数以下のイオンを指す。例えば、6価まで信頼性をもって価数判定可能な装置であれば、6価以下のイオンが存在するかを探索する。
【0057】
MS1の模式図を図9に示す。価数判定可能なイオンはQマスフィルターで単離される108。単離されたプリカーサーイオンはQディフレクター5を通過し、ECDセル8でECDを実施する51。ECDによって生成したフラグメントイオンは、再び、Qディフレクター5に排出され、TOF検出器11でイオンを検出する(MS2/ECD)109。
【0058】
MS1で価数判定できないタンパク質が検出された場合、Qマスフィルター5であるプリカーサーイオンを単離し114、Qリフレクター5を介し、LIT6でCIDを実施する115。フラグメント化したイオンはTOF検出器11でイオンを検出する110。
【0059】
ここで、ある一定強度以上のイオンに対して価数判定を実施する117。検出されたフラグメントイオンの中に価数判定可能なイオンが存在する場合(図10)、Qマスフィルター4でプリカーサーイオンを単離、LIT6でCIDを実施し、先ほど検出されたフラグメントイオンを単離する118。単離したイオンはQディフレクター5を介し、ECDセル8でECDを実施し70、再び、Qディフレクター5に排出し、TOF検出器11でイオンを検出する(MS3/ECD)119。
【0060】
MS2/CIDに価数判定できるイオンが存在しない場合は、さらにMS3/CIDを実施し、価数判定できるイオンが検出されるまで、MSnを繰り返す。あるいは、MS2/CIDで検出されたほかのイオンに対し、MS3/CIDを実施する。
【0061】
MS1で価数判定できたプリカーサーイオンは修飾物の種類や修飾部位の特定が期待できる。一方、価数判定できなかったプリカーサーイオンはCIDによって部分分解した結果得られた一部に対してのみ、ECDを実施しているため、タンパク質を完全に解析したことにはならないが、タンパク質を同定することは可能である。
【0062】
また、上記装置構成において、あるプリカーサーイオンに対し、CIDとECDを実施することで、多くの定性解析情報を得ることが可能である。
たとえば、CIDだけでは解離が不十分であると判断した場合、同じプリカーサーイオンに対し、ECDを実施する。あるいは、あるプリカーサーイオンに対してECDを実施し、情報が不十分だと判断した場合、CIDを実施する。
【0063】
このように、1つの解離方法では充分なフラグメントが得られない場合、もう1つの解離方法を実施することによって、分析精度の向上が期待できる。
【0064】
また、1つのペプチドに対して、両極性のデータを所得することも可能である。
【0065】
本発明により、従来では分析できなかった分子量の大きなタンパク質に対して、一部分であるが、構造解析が可能になる。
【図面の簡単な説明】
【0066】
【図1】本発明に基づく質量分析システムの装置構成例を示す図。
【図2】CIDによってリン酸化物を探索し、ECDで物質同定するフローの概略図。
【図3】リン酸化ペプチドをCIDで解離した結果得られた質量スペクトルの例。
【図4】リン酸化ペプチドをECDで解離した結果得られた質量スペクトルの例。
【図5】糖鎖ポリペプチドの物質同定フローの概略図。
【図6】ネガティブモードにおける糖鎖ペプチドの糖鎖構造解析例、(B)MS2(CID)、(C)MS3(CID)。
【図7】ポジティブモードでMS2(ECD)実施による糖鎖ペプチドのアミノ酸配列、及び、糖鎖修飾箇所の同定例。
【図8】試料としてタンパク質を用いた場合の物質同定フローの概略図。
【図9】MS1のイオン検出例。
【図10】MS2/CID実施後のイオン検出例。
【図11】ポリペプチドの解離パターン。
【符号の説明】
【0067】
1:試料導入、2:試料分離(LCまたはGC)、3:イオン化(ポジティブまたはネガティブ)、4:Qマスフィルター、5:Qディフレクター、6:リニアイオントラップ(LIT)、7:質量スペクトル検出器1、8:ECDセル、9:コリジョンセル、10:TOF部、11:質量スペクトル検出器2、12:質量分析装置制御部、13:全体処理部、14:解析手段決定部、15:イオンモード決定部、16:イオン価数判定部、17:解離方法決定部、18:Qリフレクター方向決定部、19:解離物イオン、及び、ニュートラルロス決定部、20:データ表示部/パラメーター入力部、31:リン酸基イオン、32:リン酸基だけが離脱したプリカーサーイオン、33:解離しなかったプリカーサーイオン、43:ネガティブでのイオン化、44:Qマスフィルターでプリカーサーイオンの単離、45:コリジョンセルでのCID、47:TOF検出器での検出、48:フラグメントイオンの中にリン酸基イオン(79m/z)が存在するかの判定、49:リン酸基イオンが検出された場合のみ、イオン源、Qマスフィルター、Qディフレクターのポジティブへの切り替え、50:Qマスフィルターにおけるポジティブイオン化したリン酸化ポリペプチドの単離、51:ECDセルでのECD、53:LIT検出器での検出、54:アミノ酸配列と修飾部位の同定、83:Qマスフルターで糖鎖ポリペプチドの単離、84:LIT内でのCID、86:ネガティブイオンモードでのCIDによる糖鎖の構造解析、88:ポジティブモードでのイオン化、89: LITでCIDを実施したプリカーサーイオンをQマスフィルターで再度単離、107:MS1のスペクトルの中に価数判定できるイオンが存在するか判定、108:価数判定できたプリカーサーイオンの単離、109:TOF検出器での検出(MS2/ECD)、110:TOF検出器での検出(MS2/CID)、114:LITでCID、117:CIDを実施した結果得られたスペクトルの中に価数判定できるフラグメントイオンが存在するか判定、119:TOF検出器での検出(MS3≦/ECD)123:CIDを実施し、価数判定できたフラグメントイオンに対し、ECDを実施し、アミノ酸配列を同定、124:CIDを実施した結果得られたスペクトルの中に価数判定できるフラグメントイオンが存在しない場合、その中のフラグメントイオンに対してさらにCIDを実施。
【技術分野】
【0001】
質量分析法を用いた生体高分子の構造解析方法と装置に関する。
【背景技術】
【0002】
ヒトにはおよそ10万種のタンパク質が存在すると言われている。タンパク質の機能は、プロテアーゼによる切断、糖鎖やリン酸基などの付加による活性・相互作用調節、ミリスチル化やパルミチル化などのアシル化による膜への局在化など、様々の翻訳後修飾により巧妙な調節を受けている。特に真核生物においては、遺伝子配列をもとに合成されたタンパク質がそのままの状態で機能を発揮することはむしろまれで、リボソーム上での合成後にその場で、あるいは細胞内での最終的な局在が決まるまでの様々の段階で多種多様な修飾を受ける。時間空間的に変化するこれらの生体高分子はゲノム情報のみでは決定できず、タンパク質を直接解析して初めて決定できる。
【0003】
その構造解析手段の1つとして、質量分析法(mass spectrometry)がある。質量分析法を用いて、生体高分子を構成するアミノ酸がペプチド結合でつながったポリペプチド(ペプチドやタンパク質)の配列情報や翻訳後修飾情報を得ることができる。とくに高周波電場を用いたイオントラップやQマスフィルターを用いた質量分析法や、飛行時間型質量分析法(Time−of−Flight :TOF) は高速分析法のため、液体クロマトグラフィー装置などに代表される試料を分離する前処理手段との結合性がよい。そこで、多種類の試料を連続解析することが求められるプロテオーム解析などの目的に合致しており、幅広く使われている。
【0004】
一般に質量分析法では、試料分子をイオン化して真空中に導入し( または真空中でイオン化し) 、電磁場中におけるそのイオンの運動を測定することにより、対象とする分子イオンの電荷と質量の比(m/z)が測定される。得られる情報が質量と電荷の比という巨視的な量であるため、単に1度の質量分析操作では内部構造情報まで得ることは出来ない。そこで、タンデム質量分析法と呼ばれる方法が用いられる。すなわち、1回目の質量分析操作で試料分子イオンを選択し、単離する。このイオンをプリカーサーイオンとよぶ。つづいて、このプリカーサーイオンを何らかの手法で解離する。解離したイオンをフラグメントイオンと呼ぶ。そのフラグメントイオンをさらに質量分析することにより、フラグメントイオンの生成パターンの情報を得る。解離手法により、解離パターンの法則性があるので、プリカーサーイオンの配列構造を推察することが可能となる。とくに、アミノ酸を骨格とする生体分子の分析分野では、解離手法として衝突励起解離( Collision−Induced−Dissociation:CID)、赤外多光子吸収(Infra−Red−Multi−Photon−Dissociation:IRMPD) そして、電子捕獲解離(Electron−Capture−Dissociation:ECD)や電子移動解離(Electron−Transfer−Dissociation:ETD)が使われる。
【0005】
タンパク質解析分野において、現在もっとも広く使われている手法がCIDである。プリカーサーイオンに運動エネルギーを与えてガスと衝突させる。衝突により分子振動が励起されて、分子鎖の切れやすい部分で解離する。また、最近使われるようになった方法がIRMPDである。プリカーサーイオンに赤外レーザ光を照射して、多数の光子を吸収させる。分子振動が励起されて、分子鎖の切れやすい部位で解離する。解離部位は図12に示す。a,b,cはNH2末端側を含む分子、x,y,zはCOOH末端側を含む分子である。CIDやIRMPDで切れやすい部位は、アミノ酸配列からなる主鎖のうち、a − x、b − yで命名されている部位である。a− x、b − yの部位であっても、アミノ酸配列パターンによっては切れにくい場合があるために、CID やIRMPDのみでは完全な構造解析ができないことが知られている。そのために、酵素などを用いた前処理が必要になり、高速な分析を妨げている。また、翻訳後修飾を受けた生体高分子では、CID やIRMPDを用いると、翻訳後修飾されたポリペプチド側鎖が切れやすい傾向がある。側鎖が切れやすいため、失われた質量から修飾分子種と修飾されているかどうかの判定は可能である。ただし、どのアミノ酸部分で修飾されていたかという修飾部位に関する重要な情報は失われる。
【0006】
一方、ECDやETDは、アミノ酸配列に依存せず( ただし例外として環状構造であるプロリン残基は切断しない)、アミノ酸配列の主鎖上のc − z部位の1 箇所を切断する。そのために、タンパク質分子を質量分析的手法のみで完全解析出来る。また、側鎖を切断しにくいという特徴をもっていることから、翻訳後修飾の研究・解析の手段として適している。このために、近年特に注目を受けているのがこのECDやETDという解離手法である。
【0007】
ECDやETDはプラスに帯電した多価イオンに対してのみ解離可能である。ECDはプラスに帯電した分子にマイナスに帯電した電子を捕獲させることによって分子が解離する原理を利用している。そのため、マイナスに帯電している分子では解離できず、プラスの一価イオンでは、ニュートラルな分子になってしまうため、質量分析装置で検出できない。
【0008】
また、ECDの反応効率は電荷の二乗に比例すると言われているため、非常に高い価数になるタンパク質では効率よく解離できる。このため、最近ではトップダウンと呼ばれる解析が注目されている。トップダウン解析は、タンパク質を酵素消化し、ペプチド断片化する手法(ボトムアップ)と対照的であり、タンパク質を直接質量分析する手法である。ボトムアップ解析では、分析されたペプチドが生体内でタンパク質として存在していたのか、あるいは分解物として存在していたのかを特定することはできない。一方、トップダウン解析では、生体試料を直接分析するため、その特定も可能となる。
【0009】
現時点で、ECDはフーリエ変換型質量分析装置(FT−ICR)と高周波イオントラップで実現されている(非特許文献1)。FT−ICRでは、分解能800000程度、ppbの質量精度をもつが、超伝導磁石を用いて、平行強磁場(数テスラ以上)が必要となるため、高価かつ大型であり、1つのスペクトルを得るために、必要な測定時間は数秒から10秒かかり、スペクトルを得るために必要なフーリエ解析に10秒程度必要である。都合、数10秒必要となる。そのため、10秒程度で1つのピークが現れる液体クロマトグラフィーとの結合性は良いとは言えない。一方、高周波イオントラップはTOFと結合すると、FT−ICRには及ばないが、高分解能(15000程度)で高い質量精度(ppm)でデータ測定が可能である。さらに、小型、安価である上、高速測定が可能であるため、液体クロマトグラフィーとの結合性が良い(非特許文献2)。
【0010】
このように、質量分析装置や液体クロマトグラフィーの進化、さらにデータベースの充実によって大規模タンパク質解析が実現しつつある。しかし、それでも一度に分析できるタンパク質としては、せいぜい数千種類が限度である。そのため、すべてのタンパク質を対象にするのではなく、特定の集団だけを相手にするいわゆる「フォーカスド・プロテオーム」が昨今の主流になりつつある。
【0011】
例えば、代表的な翻訳後修飾であるリン酸にフォーカスした分析が盛んに行われている。リン酸化物を分析するには2つの課題がある。一つ目として、リン酸化物は非リン酸化物に比べ、数倍から数百倍イオン化効率が低くなることがある。2つめとして、CIDを解離手法とする場合、タンパク質のままでは解離が困難なため、酵素消化によって、ペプチド断片化する必要がある。分子量40000のタンパク質が酵素消化により400断片のペプチドに分解されたと仮定すると、全タンパク質のおよそ30%存在していたリン酸化物は、酵素消化により存在比は0.08%以下になると試算される(非特許文献3)。
【0012】
この2つの制限により、ペプチド断片化した生体試料サンプルをそのまま質量分析してもリン酸化ペプチドが同定できることはほとんどない。そこで、現在、リン酸化ペプチドを特異的に検出するために、CIDに特徴的である翻訳後修飾部位の脱離を利用した手法が使われている。CIDによるタンデム質量分析法では、リン酸化ペプチドからリン酸基だけが失われたフラグメントイオンと、リン酸基に由来するフラグメントイオンが生成する。リン酸基に注目してリン酸化ペプチドを探索する手法はプリカーサーイオンスキャン法と呼ばれる。
プリカーサーイオンスキャン法は、特定のフラグメントイオンを生成する全てのプリカーサーイオンをスキャンする測定方法である。1台目の質量分離部MS−1のスキャンで透過したイオンを、コリジョンセルでCIDを実施し、得られたフラグメントイオンの中で、特定のm/zのイオンのみを2台目の質量分離部MS−2で検出する。このようにして、MS−2で特定のフラグメントイオンが検出された時、MS−1を通過したプリカーサーイオンを特定する。リン酸基を特異的に検出する場合は、ネガティブモードで、m/z79(PO3−)イオンをMS−2で検出する(非特許文献4)。
【0013】
【非特許文献1】Takeshi Baba et al. Electron capture dissociation in a radio frequency ion trap.Anal Chem. 2004 Aug 1;76(15):4263−6.
【非特許文献2】Takeshi Baba et al :ASMS conference on Mass spectrometry(2006)WOB.
【非特許文献3】実験医学 Vol.23 No.19 2005,p2951−2956
【非特許文献4】プロテオミクス実験プロトコール(秀潤社)p156−168
【非特許文献5】Kisaburo Deguchi et al. Structural analysis of O−glycopeptides employing negative− and positive−ion multi−stage mass spectra obtained by collision−induced and electron−capture dissociations in linear ion trap time−of−flight mass spectrometry. RAPID COMMUNICATIONS IN MASS SPECTROMETRY 2007;21:691−698.
【発明の開示】
【発明が解決しようとする課題】
【0014】
タンパク質やペプチドの定性解析では、アミノ酸配列の同定だけでなく、翻訳後修飾の種類や修飾物の構造あるいは修飾部位の同定が求められる。サンプルは貴重であるため、効率よく最大限のアウトプットを獲得することが求められる。また、一連の解析をできるだけ短時間に行うこと、すなわち、高スループットが求められている。
【0015】
前述したように、代表的なフォーカスドプロテオームであるリン酸化をターゲットにした解析では、CIDを用いたプリカーサー・スキャン法によって、リン酸化ペプチドを特異的な探索を実施する。リン酸基はマイナスに帯電するため、ネガティブモードで測定する必要がある。探索の結果、リン酸化ペプチドが検出された場合、リン酸化ペプチドイオンを単離し、CIDによって定性解析を試みる。しかし、CIDによる解析では、リン酸基が解離し修飾箇所の特定には至らないケースが多々存在する。その場合、貴重なサンプルを用いて再分析する。再分析はポジティブモードでイオン化し、ECDやETDでのイオン解離によって定性解析される。
【0016】
重要な翻訳後修飾の1つである糖鎖をもつペプチドの解析においては、ポジティブモードで測定した場合、簡単にフコースやシアル酸などの単糖の解離が観察される。一方、ネガティブモードでは糖鎖の解離は観察されない。このため、まず、糖鎖ペプチドはネガティブモードでイオン化される。糖鎖ペプチドをCIDすると、糖鎖が優先的に解離し、糖鎖だけが解離したフラグメントイオンが観察される。これらにより、糖鎖構造解析が可能となる。しかし、CIDすることで糖鎖はポリペプチド側鎖から脱離してしまうため、どのアミノ酸に修飾していたかという情報は失われる。そこで、再分析が実施される。今度は一部糖鎖は脱離してしまうが、ポジティブモードでイオン化し、ECDやETDで解析することによってアミノ酸配列情報や修飾部位を同定する(RAPID COMMUNICATIONS IN MASS SPECTROMETRY 2007;21:691-698.)。
【0017】
また、最近注目されているトップダウン解析では、10価以上のプリカーサーイオンに対して、ECDやETDを実施しなければならない。その解析にはプリカーサーイオンの分子量やECDで解離した結果得られたフラグメントイオンの分子量が判明しなければ、構造解析することはできない。分子量(m)はイオンのm/z値と同位体ピーク間隔からzが判明し、mを算出する。多価になるほど、狭くなる同位体ピーク間隔を判別するためには、高分解能な装置が必要である。
【0018】
以上のように、イオン解離手法としては一般的に広く汎用されているCIDだけでなく、CIDと相補的なイオン解離手法であるECDを使用することで初めて解析可能となる生体高分子が多数存在する。また、糖鎖解析例のように、ポジティブ、ネガティブ両極性での測定ができないと定性解析が成立しないものも存在する。液体クロマトグラフと接続した場合、各イオンピークは10秒程度しか検出されない。その間に両極性での分析、あるいは、ECDとCIDなど相補的なイオン解離手段が使用できる高スループットな装置が重要視される。さらに、トップダウン解析に対応可能な高分解能な装置も合わせて求められる。
【0019】
イオン源、Qマスフィルター、イオントラップなどは数十ms程度で容易に極性を変換できるため、両極性測定可能な装置が製品化されている。また、ETDとCIDを同一装置内で利用できる装置も製品化されている。
【0020】
大きな課題は液体クロマトグラフでの分析が可能な高速で高分解能な装置である。前述したように超高分解能装置であるFT−ICRはスループットが低いため、液体クロマトグラムを用いた解析には向かない。しかし、最近、Orbitrapと呼ばれる磁場型の装置が市販された。この装置は高スループット(1スキャン/秒)で、高分解能(50000)な装置で、液体クロマトグラムとの接合性もよい。しかし、非常に高価である。安価で高分解能な装置を製作するにはTOFが最適である。しかし、TOFの極性切り替え制御はイオントラップのように容易にできるものではない。非常に大きな電圧が必要になり、高価な装置になってしまう。最近、0.1秒程度でTOFの極性変換が可能な装置が市販されたが、高価な装置である。
【課題を解決するための手段】
【0021】
本発明のタンデム型質量分析装置を用いた質量分析システムでは、試料をイオン化するイオン源と、イオンの軌道を偏向することでイオンの進行方向を決定するイオン偏向部と、イオン偏向部から排出されたイオンを質量分析するための第1の質量分析部と、第1の質量分析部とは極性の異なる第2の質量分析部と、少なくともイオン源及びイオン偏向部の極性の切り替えを行う制御部を有し、第1の質量分析部により得られた測定結果に基いて前記制御部は少なくともイオン源及びイオン偏向部の極性を切り替え、第2の質量分析部により質量分析が行われる。
【0022】
本発明の質量分析方法では、極性を切り替えて質量分析することが可能な質量分析システムにおいて、試料をイオン化するイオン源の前段に設けられた分離部によって試料を分離する工程と、分離された試料をイオン源により所望の極性でイオン化する工程と、生成された試料イオンを第1の解離手段によって解離する工程と、解離された試料イオンを質量分析部により第1の質量分析が行われる工程と、第1の質量分析により目的のイオンが検出された場合、第1の解離手段とは別の解離手段によって試料イオンの解離を行う工程と、質量分析部により第2の質量分析が行われる工程とを有し、第1の質量分析の結果に基いて、第2の質量分析における試料のイオン化極性が決定する。
【0023】
本発明の質量分析システム及び質量分析方法では、貴重なサンプルを無駄にすることなく、正負両極性での2つの質量分析部を用いた一連の相補的な解析を短時間で行うことができる。
【0024】
質量分析部として、安価で高分解能な装置にするため、TOFを用いる。ただし、分析中にTOFの極性を切り替えると大きな電圧やシステムが必要になり、高価な装置になるという問題がある。もう一方の質量分析部として、イオントラップを用いる。イオントラップは数十m秒程度で極性を切り替えることができ、安価である上、CIDによるMSn機能も有する。しかし、イオントラップ内で解離を実施した場合、低分子は共鳴振動し、イオントラップから排出されてしまう。そのため、リン酸基(98 m/z)などの低分子は検出できない。そのため、コリジョンセルを用いる。コリジョンセルはイオンの単離はできないが、低分子が排出されないという利点がある。その他、ECDを実施するためのECDセル、極性切り替え可能なイオン源と同じく極性切り替え可能なイオンを単離するためのQマスフィルターを用いる。また、他の解離手段としてETDを用いても良い。
【0025】
以上の装置構成から、TOFの極性を分析中に切り替えることなく両極性での測定が可能となり、安価な質量分析システムで高分解能・高スループットな質量分析が可能となる。
【0026】
また、本発明のタンデム型質量分析装置を用いた質量分析システムでは、試料分離して得られた特定物質をイオン化し、プリカーサーイオンの価数の判定を行う。価数を判定できた場合は、そのイオンに対し、ECDで解離して詳細分析を実行し、価数を判定できない場合は、そのプリカーサーイオンをCIDで解離し、フラグメントイオンの価数の判定を行い、価数判定できたフラグメントに対し、ECDで解離して詳細分析を実行することで、従来では分析できなかった分子量の大きなタンパク質に対して、構造解析が可能になる。
【発明の効果】
【0027】
本発明によると、両極性測定可能であり、相補的なCIDとECDでのイオン解離が実施可能である安価で高分解能な装置を提供できる。また、質量分析による物質の同定において、物質の構造に関する情報を取得する効率が向上し、測定及び物質同定の時間が短縮され、同定精度が向上する。
【発明を実施するための最良の形態】
【0028】
図1に、本発明に基づく質量分析システムの構成例を示す。分析対象の試料1は、ガスクロマトグラフ(GC)またはLC2の前処理により分離される。分離された試料は、イオン源3においてイオン化され、質量分析装置に導入される。導入されたイオンはQマスフィルター4で単離され、単離された特定のイオン(あるいは全イオン)はQディフレクター5から、LIT6、ECDセル8、あるいはコリジョンセル9に排出される。Qディフレクター5では、全方向へのイオンの移動が可能である。例えば、ECDセル8に導入されたイオンは、ECDで解離し、リニアイオントラップ(LIT)6、あるいは、コリジョンセル9に導かれる。LIT6、コリジョンセル9ではイオンをCIDで解離することが可能である。LIT6、コリジョンセル9から排出されたイオンはLIT検出器7またはTOF検出器11でイオンの質量電荷比m/zに応じて分離される。TOF検出器11の前段には高分解能であるTOFが存在する。また、LITはMSn機能をもつ。
【0029】
分離されたイオンは、イオン検出部7または11で検出され、イオン価数判定部16で決定された価数は各イオンのm/z値と共に全体処理部21でデータ整理・処理され、その分析結果である質量分析データはデータ表示部20にて表示される。この一連の質量分析過程、すなわち、試料の分離、イオン化、質量分析装置内のイオン輸送、及び、解離、質量分離、及び、イオン検出、データ処理の全体を全体情報処理部21で制御する。パラメータ入力部20からユーザの必要な情報であるイオンモード決定部15、解離方法決定部17、Qディフレクター方向決定部18、解離物イオン、ニュートラルロス決定部19を入力する。
【0030】
イオン源3、Qマスフィルター4、Qディフレクター5、LIT6、コリジョンセル9、TOF10は制御部12によって制御され、ポジティブ、ネガティブへの切り替えが可能である。
ただし、TOF部10の極性切り替え制御は短時間で実施できるものは高価な装置になるため、TOF部10の極性は、サンプル分析前に切り替え可能とした方が良い。
【0031】
以下に本発明の実施例を示す。
【実施例1】
【0032】
代表的な翻訳後修飾であるリン酸化にフォーカスしたプロテオーム解析の実施例を示す。多数存在する非リン酸化物からリン酸化物を探索し、定性解析を実施するまでのフローチャートを図2に示す。
【0033】
分析開始前の極性は、イオン源3、Qマスフィルター4、Qディフレクター5、コリジョンセル9、TOF10はネガティブ、LIT6はポジティブである。ECDセル8は原理上いつでもポジティブである。
【0034】
液体クロマトグラフ2で分離された試料1はネガティブモードでイオン化され43、Qマスフィルター、Qディフレクター、コリジョンセルを通過し、TOFでイオンを検出する(MS1)。次に、MS1で検出されたイオンの中から特定のプリカーサーイオンをQマスフィルターで選択する44。選択されたプリカーサーイオンはQディフレクターを通過し、コリジョンセルでCIDを実施する45。CIDによって生成したフラグメントイオンはTOF部で検出される47。LIT6でCIDを実施することは可能であるが、100m/z程度の小さなフラグメントイオンは高周波電圧の影響により共鳴振動し、LIT内に保持できないため検出できない。よってコリジョンセル9でCIDを実施する必要がある。
【0035】
Qマスフィルター4で選択したイオンの中にリン酸化物が含まれていた場合、CIDによって脱離したリン酸基(79m/z)が検出される。このCIDによるMS2解析結果は定性解析に重要な情報が含まれているが、不十分な情報であることが予想される。図3にリン酸化ペプチド33をCIDで解析した場合の模式的なスペクトルを示す。CIDではリン酸基を優先的に解離するため、リン酸化物イオン31とリン酸基のみを失ったペプチドのみであるニュートラルロス32が検出される。CIDでは、アミノ酸配列と修飾部位の特定が困難である。
【0036】
そこで、詳細な定性解析をECDで実施するため、リン酸基イオンが検出された場合48、ネガティブモードからポジティブモードに切り替える49。切り替える箇所はイオン源、Qマスフィルター、Qディフレクターである。
【0037】
次に、Qマスフィルターに導入されたイオンの中から、ネガティブモードで検出されたリン酸化物イオンの質量電荷比+2の位置に存在するイオンをQマスフィルターで選択する50。
【0038】
ポジティブモードでイオン化した場合、ネガティブモードで検出されたリン酸化物イオンは、通常質量電荷比が+2された位置でイオンが検出される。というのは、ネガティブモードでは、多くの場合、H+(プロトン)を失い、イオンになる。一方、ポジティブモードでは、プロトンが付加し、イオンとなる。分子量Mの物質がx価数でイオン化すると、ネガティブモードでは質量電荷比(M−xH)/xのイオンが検出される。一方、ポジティブモードでは、質量電荷比(M+xH)/xのイオンが検出される。両者の差は2Hとなる。水素の分子量は1であるため、差は2となる。
【0039】
Qマスフィルター4で単離されたイオンはQディフレクター5を介し、ECDセル8に導入さる。そこでECDを実施し51、フラグメントイオンは再びQディフレクター5を介し、LIT検出器7でフラグメントイオンを検出する53。図4にECDで解析した場合の模式的なスペクトルを示す。ECDではリン酸基を解離することなく、ペプチド結合のみを解離するため、アミノ酸配列と修飾部位の特定が可能である。
【0040】
ECDによって得られたフラグメント情報は、CIDによって得られたフラグメント情報とともに詳細に解析し、アミノ酸配列や修飾部位の特定を行う54。
【0041】
従来、リン酸化ポリペプチドの探索、CIDによる構造解析、ECDによる構造解析など、独立に分析を行っていたが、本装置構成、本方法により、短時間で分析結果を得ることが可能である。
【実施例2】
【0042】
糖鎖ポリペプチドにフォーカスしたプロテオーム解析の実施例を示す。ネガティブモードで糖鎖構造解析を実施し、ポジティブモードでアミノ酸配列と糖鎖修飾箇所を同定するまでのフローチャートを図5に示す。
【0043】
分析開始前の装置の極性は、イオン源3、Qマスフィルター4、Qディフレクター5、LIT6はネガティブ、コリジョンセル9、TOF10はポジティブである。ECDセル8は原理上いつでもポジティブである。
【0044】
液体クロマトグラフ2で分離された試料1はネガティブモードでイオン化され、Qマスフィルター4、Qディフレクター5、LIT6を通過し、LIT検出器7でイオンを検出する(MS1)。次に、MS1で検出されたイオンの中から糖鎖ポリペプチドのプリカーサーイオンをQマスフィルター4で単離する83。単離されたプリカーサーイオンはQディフレクター5を通過し、LIT6でCIDを実施する84。CIDによって生成したフラグメントイオンはLIT検出器7で検出される(MS2/CID)53。
【0045】
次に、ネガティブモードからポジティブモードに切り替える49。切り替える箇所はイオン源3、Qマスフィルター4、Qディフレクター5である。
【0046】
一般的に糖鎖ポリペプチドをポジティブモードでイオン化したり、イオンを単離したりすると糖鎖の一部が離脱することがあるが、イオントラップの代わりにQマスフィルター5を用いることにより、糖鎖の脱離は抑制されると考える。
【0047】
ポジティブモードでイオン化し88、ネガティブモードで分析した糖鎖ポリペプチドのイオンをQマスフィルター4で選択する89。このときで同じ価数のイオンを単離する場合、質量電荷比で+2の位置に検出される。
【0048】
Qマスフィルター4で選択されたイオンはQディフレクター5を介し、ECDセル8に導入される。そこでECDを実施し51、フラグメントイオンは再びQディフレクター5を介し、コリジョンセル9を通過し、TOF検出器11でフラグメントイオンを検出する(MS2/ECD)47。
【0049】
ネガティブモードでCIDすることによって得られたフラグメントイオンから糖鎖構造情報が得られる86。ポジティブモードでECDすることによって得られたフラグメントから、アミノ酸配列情報や修飾部位情報が得られる54。両者の情報から詳細な解析を行う。
【0050】
ここで、具体例を図6,7に示す。図6は糖鎖修飾ペプチド由来負イオン(脱プロトン化分子)のCID分析データである。このデータの前駆イオンは、m/z値が954.9の[M−2H]2−である。ここで、Mは糖鎖修飾ペプチド分子を、Hは水素原子を表し、このイオンは2個プロトンが失われた2価イオンである。この前駆イオンをCIDによりMS二/CID分析したデータが図6(B)に示されている。図6(B)の右上に糖鎖修飾部の模式図を示す。ここで、BやCはグリコシド結合の部位で解離したイオンを表す。波線はペプチドを表し、ひし形はNeu5Ac(Nアセチルノイラミン酸、分子量309.1)、黒丸はGal(ガラクトース、分子量180.05)、四角はGlcNAc(Nアセチルグルコサミン、分子量221.08)、三角はFuc(フコース、分子量164.06)を示す。また、破線は解離部位を示す。
【0051】
単糖同士のグリコシド結合は脱水反応であるため、糖鎖部分の分子量は各単糖の分子量の総和からグリコシド結合1つ当たり水の分子量18が失われた値となる。図6(B)で検出された質量電荷比819.3(1価、分子量820.3)は4つの単糖の分子量の合計は309.1+180.05+221.08+164.06=874.29から3つのグリコシド結合18×3=54を引いた値となる。つまり、分子量は874.29−54=820.29となる。C3と一致することが分かる。このイオンC3を前駆イオンに選択し、CIDによりMS3/CID分析を実施して得られたデータが図6(C)である。これにより、糖鎖構造が明らかできた。
【0052】
次に、同じ糖鎖ペプチドをポジティブモードでイオンし、ECDの結果得られたMS2/ECD分析データを図7に示す。ECDでは、ペプチド結合の特定の部位で解離し、cイオンやzイオンが検出される点が特徴的である。右上に、糖鎖修飾ペプチドの構造、及び、検出イオンを示す。水平方向に並んだアルファベットはアミノ酸配列を示す。このMS2/ECD分析データに対し、データベース検索を実施した結果、図に示されるように、アミノ酸配列情報が得られる多数のcイオンやzイオンが検出され、元のタンパク質が同定された。さらに、C末端から7つ目のセリン(S)に糖鎖が修飾されていることもデータベース検索の結果から明らかになった。このデータの前駆イオンはm/zが638.3の[M+3H]3+である。なお、ECDのMS2/ECD分析データでは、前駆イオンの電子捕獲再結合により、電荷数だけが低減したイオン([M+3H]2+、[M+3H]+)も検出される。
【0053】
このように、従来、独立に2回分析することによって得られていた、糖鎖構造、アミノ酸配列、修飾箇所が本発明により一度の分析で可能となる。さらにサンプル消費の低減にもつながる。
【実施例3】
【0054】
試料としてタンパク質を用いたプロテオーム解析の実施例のフローチャートを図8に示す。
【0055】
本実施例では装置の極性をすべてポジティブにするが、ポジティブとネガティブを混合させたり、ネガティブのみにしたり、分析途中で切り替えることも可能である。
【0056】
液体クロマトグラフ2で分離された試料1はポジティブモードでイオン化され、Qマスフィルター4、Qディフレクター5、コリジョンセル9を通過し、TOF検出器11でイオンを検出する(MS1)47。ここで、分析対象となるある一定強度以上のイオンの価数判定を実施する107。イオンを構成する分子には一定の割合で同位体元素が含まれるため、同位体を含む一連のイオンも同時に観察される。そのm/z軸における間隔は1/zとなることにより、イオンの価数を判定することが可能である。どの程度、価数判定できるかは装置性能、特に質量分解能に依存する。ここで価数判定可能なイオンとは、その装置で価数判定できる価数以下のイオンを指す。例えば、6価まで信頼性をもって価数判定可能な装置であれば、6価以下のイオンが存在するかを探索する。
【0057】
MS1の模式図を図9に示す。価数判定可能なイオンはQマスフィルターで単離される108。単離されたプリカーサーイオンはQディフレクター5を通過し、ECDセル8でECDを実施する51。ECDによって生成したフラグメントイオンは、再び、Qディフレクター5に排出され、TOF検出器11でイオンを検出する(MS2/ECD)109。
【0058】
MS1で価数判定できないタンパク質が検出された場合、Qマスフィルター5であるプリカーサーイオンを単離し114、Qリフレクター5を介し、LIT6でCIDを実施する115。フラグメント化したイオンはTOF検出器11でイオンを検出する110。
【0059】
ここで、ある一定強度以上のイオンに対して価数判定を実施する117。検出されたフラグメントイオンの中に価数判定可能なイオンが存在する場合(図10)、Qマスフィルター4でプリカーサーイオンを単離、LIT6でCIDを実施し、先ほど検出されたフラグメントイオンを単離する118。単離したイオンはQディフレクター5を介し、ECDセル8でECDを実施し70、再び、Qディフレクター5に排出し、TOF検出器11でイオンを検出する(MS3/ECD)119。
【0060】
MS2/CIDに価数判定できるイオンが存在しない場合は、さらにMS3/CIDを実施し、価数判定できるイオンが検出されるまで、MSnを繰り返す。あるいは、MS2/CIDで検出されたほかのイオンに対し、MS3/CIDを実施する。
【0061】
MS1で価数判定できたプリカーサーイオンは修飾物の種類や修飾部位の特定が期待できる。一方、価数判定できなかったプリカーサーイオンはCIDによって部分分解した結果得られた一部に対してのみ、ECDを実施しているため、タンパク質を完全に解析したことにはならないが、タンパク質を同定することは可能である。
【0062】
また、上記装置構成において、あるプリカーサーイオンに対し、CIDとECDを実施することで、多くの定性解析情報を得ることが可能である。
たとえば、CIDだけでは解離が不十分であると判断した場合、同じプリカーサーイオンに対し、ECDを実施する。あるいは、あるプリカーサーイオンに対してECDを実施し、情報が不十分だと判断した場合、CIDを実施する。
【0063】
このように、1つの解離方法では充分なフラグメントが得られない場合、もう1つの解離方法を実施することによって、分析精度の向上が期待できる。
【0064】
また、1つのペプチドに対して、両極性のデータを所得することも可能である。
【0065】
本発明により、従来では分析できなかった分子量の大きなタンパク質に対して、一部分であるが、構造解析が可能になる。
【図面の簡単な説明】
【0066】
【図1】本発明に基づく質量分析システムの装置構成例を示す図。
【図2】CIDによってリン酸化物を探索し、ECDで物質同定するフローの概略図。
【図3】リン酸化ペプチドをCIDで解離した結果得られた質量スペクトルの例。
【図4】リン酸化ペプチドをECDで解離した結果得られた質量スペクトルの例。
【図5】糖鎖ポリペプチドの物質同定フローの概略図。
【図6】ネガティブモードにおける糖鎖ペプチドの糖鎖構造解析例、(B)MS2(CID)、(C)MS3(CID)。
【図7】ポジティブモードでMS2(ECD)実施による糖鎖ペプチドのアミノ酸配列、及び、糖鎖修飾箇所の同定例。
【図8】試料としてタンパク質を用いた場合の物質同定フローの概略図。
【図9】MS1のイオン検出例。
【図10】MS2/CID実施後のイオン検出例。
【図11】ポリペプチドの解離パターン。
【符号の説明】
【0067】
1:試料導入、2:試料分離(LCまたはGC)、3:イオン化(ポジティブまたはネガティブ)、4:Qマスフィルター、5:Qディフレクター、6:リニアイオントラップ(LIT)、7:質量スペクトル検出器1、8:ECDセル、9:コリジョンセル、10:TOF部、11:質量スペクトル検出器2、12:質量分析装置制御部、13:全体処理部、14:解析手段決定部、15:イオンモード決定部、16:イオン価数判定部、17:解離方法決定部、18:Qリフレクター方向決定部、19:解離物イオン、及び、ニュートラルロス決定部、20:データ表示部/パラメーター入力部、31:リン酸基イオン、32:リン酸基だけが離脱したプリカーサーイオン、33:解離しなかったプリカーサーイオン、43:ネガティブでのイオン化、44:Qマスフィルターでプリカーサーイオンの単離、45:コリジョンセルでのCID、47:TOF検出器での検出、48:フラグメントイオンの中にリン酸基イオン(79m/z)が存在するかの判定、49:リン酸基イオンが検出された場合のみ、イオン源、Qマスフィルター、Qディフレクターのポジティブへの切り替え、50:Qマスフィルターにおけるポジティブイオン化したリン酸化ポリペプチドの単離、51:ECDセルでのECD、53:LIT検出器での検出、54:アミノ酸配列と修飾部位の同定、83:Qマスフルターで糖鎖ポリペプチドの単離、84:LIT内でのCID、86:ネガティブイオンモードでのCIDによる糖鎖の構造解析、88:ポジティブモードでのイオン化、89: LITでCIDを実施したプリカーサーイオンをQマスフィルターで再度単離、107:MS1のスペクトルの中に価数判定できるイオンが存在するか判定、108:価数判定できたプリカーサーイオンの単離、109:TOF検出器での検出(MS2/ECD)、110:TOF検出器での検出(MS2/CID)、114:LITでCID、117:CIDを実施した結果得られたスペクトルの中に価数判定できるフラグメントイオンが存在するか判定、119:TOF検出器での検出(MS3≦/ECD)123:CIDを実施し、価数判定できたフラグメントイオンに対し、ECDを実施し、アミノ酸配列を同定、124:CIDを実施した結果得られたスペクトルの中に価数判定できるフラグメントイオンが存在しない場合、その中のフラグメントイオンに対してさらにCIDを実施。
【特許請求の範囲】
【請求項1】
試料をイオン化するイオン源と、
イオンの軌道を偏向することでイオンの進行方向を決定するイオン偏向部と、
前記イオン偏向部から排出されたイオンを質量分析するための第1の質量分析部と、
前記第1の質量分析部とは極性の異なるイオンを分析する第2の質量分析部と、
少なくとも前記イオン源及び前記イオン偏向部の極性の切り替えを行う制御部を有し、
前記第1の質量分析部により得られた測定結果に基いて前記制御部は少なくとも前記イオン源及び前記イオン偏向部の極性を切り替え、前記第2の質量分析部により質量分析が行われることを特徴とする質量分析システム。
【請求項2】
請求項1に記載の質量分析システムにおいて、
前記第1又は第2の質量分析部は、飛行時間型質量分析装置であることを特徴とする質量分析システム。
【請求項3】
請求項1に記載の質量分析システムにおいて、
前記第1又は第2の質量分析部は、イオントラップ型質量分析装置であることを特徴とする質量分析システム。
【請求項4】
請求項1に記載の質量分析システムにおいて、
衝突励起解離手段と電子捕獲解離手段、または、電子移動解離手段を有することを特徴とする質量分析システム。
【請求項5】
請求項4に記載の質量分析システムにおいて、
前記制御部によって、前記衝突励起解離手段の極性の切り替えが行われることを特徴とする質量分析システム。
【請求項6】
請求項5に記載の質量分析システムにおいて、
前記イオン源、前記イオン偏向部、前記第1又は第2の質量分析部及び前記衝突励起解離手段の極性の切り替えを、測定中に行うことができることを特徴とする質量分析システム。
【請求項7】
請求項4に記載の質量分析システムにおいて、
前記衝突励起解離手段として、イオントラップ及びコリジョンセルを有することを特徴とする質量分析システム。
【請求項8】
請求項1に記載の質量分析システムにおいて、
前記イオン源と前記イオン偏向部との間に、特定の質量電荷比を有するイオンの単離手段を有することを特徴とする質量分析システム。
【請求項9】
請求項8に記載の質量分析システムにおいて、
前記制御部によって、前記単離手段の極性の切り替えが行われることを特徴とする質量分析システム。
【請求項10】
請求項9に記載の質量分析システムにおいて、
前記単離手段の極性の切り替えを測定中に行うことができることを特徴とする質量分析システム。
【請求項11】
請求項8に記載の質量分析システムにおいて、
前記イオンの単離手段がQマスフィルターであることを特徴とする質量分析システム。
【請求項12】
請求項#に記載の質量分析システムにおいて、
試料をイオン化するイオン源の前段に、試料が分離される分離部を備えることを特徴とする質量分析装置。
【請求項13】
極性を切り替えて質量分析することが可能な質量分析システムにおいて、
試料をイオン化するイオン源の前段に設けられた分離部によって試料を分離する工程と、
分離された試料を前記イオン源により所望の極性でイオン化する工程と、
生成された試料イオンを解離手段によって解離する工程と、
解離された試料イオンを質量分析部により第1の質量分析が行われる工程と、
前記第1の質量分析により目的のイオンが検出された場合、前記解離手段とは別の解離手段によって試料イオンの解離を行う工程と、
前記質量分析部により第2の質量分析が行われる工程とを有し、
前記第1の質量分析の結果に基いて、前記第2の質量分析における試料のイオン化極性が決定されることを特徴とする質量分析方法。
【請求項14】
請求項13に記載の質量分析方法において、
前記質量分析部として、飛行時間型質量分析装置、イオントラップ型質量分析装置のどちらか一方又は両方を用いて質量分析が行われることを特徴とする質量分析方法。
【請求項15】
請求項13に記載の質量分析方法において、
試料を前記イオン源により所望の極性でイオン化する工程と、
生成された試料イオンを衝突励起解離手段により衝突励起解離する工程と、
衝突励起解離によって生成されたフラグメントイオンの質量分析が行われる工程と、
質量分析により目的のフラグメントイオンが検出された場合、試料のイオン化極性を正に設定する工程と、
正の極性でイオン化された試料イオンを電子捕獲解離手段により電子捕獲解離する工程と、
電子捕獲解離によって生成されたフラグメントイオンの質量分析が行われる工程とを有することを特徴とする質量分析方法。
【請求項16】
請求項15に記載の質量分析方法において、
前記衝突励起解離手段として、イオントラップ及びコリジョンセルを用いることを特徴とする質量分析方法。
【請求項17】
請求項15に記載の質量分析方法において、
イオンの軌道を偏向することでイオンの進行方向を決定するイオン偏向部により、イオンを前記質量分析部、前記衝突励起解離部又は前記電子捕獲解離部に導くことを特徴とする質量分析方法。
【請求項18】
請求項17に記載の質量分析方法において、
前記イオン源と前記イオン偏向部との間に、特定の質量電荷比を有するイオンの単離手段を備えることを特徴とする質量分析方法。
【請求項19】
試料をイオン化するイオン源の前段に設けられた分離部により分離された試料を、前記イオン源によりイオン化する工程と、
質量分析部により、生成された試料イオンの質量分析が行われる工程と、
前記質量分析部による質量分析結果から、目的の試料イオンの価数判定が行われる工程とを有し、
価数判定が可能なイオンは、特定の質量電荷比を有するイオンの単離手段により単離され、電子捕獲解離手段により電子捕獲解離され、前記質量分析部により質量分析が行われ、
価数判定ができないイオンは、価数判定が可能になるまで衝突励起解離手段により衝突励起解離が繰り返し行われることを特徴とする質量分析方法。
【請求項20】
請求項19に記載の質量分析方法において、
前記質量分析部は飛行時間型質量分析装置であることを特徴とする質量分析方法。
【請求項21】
請求項19に記載の質量分析方法において、
制御部によって、前記イオン源、前記質量分析部、前記イオンの単離手段及び前記衝突励起解離手段の極性の切り替えが行われることを特徴とする質量方法。
【請求項1】
試料をイオン化するイオン源と、
イオンの軌道を偏向することでイオンの進行方向を決定するイオン偏向部と、
前記イオン偏向部から排出されたイオンを質量分析するための第1の質量分析部と、
前記第1の質量分析部とは極性の異なるイオンを分析する第2の質量分析部と、
少なくとも前記イオン源及び前記イオン偏向部の極性の切り替えを行う制御部を有し、
前記第1の質量分析部により得られた測定結果に基いて前記制御部は少なくとも前記イオン源及び前記イオン偏向部の極性を切り替え、前記第2の質量分析部により質量分析が行われることを特徴とする質量分析システム。
【請求項2】
請求項1に記載の質量分析システムにおいて、
前記第1又は第2の質量分析部は、飛行時間型質量分析装置であることを特徴とする質量分析システム。
【請求項3】
請求項1に記載の質量分析システムにおいて、
前記第1又は第2の質量分析部は、イオントラップ型質量分析装置であることを特徴とする質量分析システム。
【請求項4】
請求項1に記載の質量分析システムにおいて、
衝突励起解離手段と電子捕獲解離手段、または、電子移動解離手段を有することを特徴とする質量分析システム。
【請求項5】
請求項4に記載の質量分析システムにおいて、
前記制御部によって、前記衝突励起解離手段の極性の切り替えが行われることを特徴とする質量分析システム。
【請求項6】
請求項5に記載の質量分析システムにおいて、
前記イオン源、前記イオン偏向部、前記第1又は第2の質量分析部及び前記衝突励起解離手段の極性の切り替えを、測定中に行うことができることを特徴とする質量分析システム。
【請求項7】
請求項4に記載の質量分析システムにおいて、
前記衝突励起解離手段として、イオントラップ及びコリジョンセルを有することを特徴とする質量分析システム。
【請求項8】
請求項1に記載の質量分析システムにおいて、
前記イオン源と前記イオン偏向部との間に、特定の質量電荷比を有するイオンの単離手段を有することを特徴とする質量分析システム。
【請求項9】
請求項8に記載の質量分析システムにおいて、
前記制御部によって、前記単離手段の極性の切り替えが行われることを特徴とする質量分析システム。
【請求項10】
請求項9に記載の質量分析システムにおいて、
前記単離手段の極性の切り替えを測定中に行うことができることを特徴とする質量分析システム。
【請求項11】
請求項8に記載の質量分析システムにおいて、
前記イオンの単離手段がQマスフィルターであることを特徴とする質量分析システム。
【請求項12】
請求項#に記載の質量分析システムにおいて、
試料をイオン化するイオン源の前段に、試料が分離される分離部を備えることを特徴とする質量分析装置。
【請求項13】
極性を切り替えて質量分析することが可能な質量分析システムにおいて、
試料をイオン化するイオン源の前段に設けられた分離部によって試料を分離する工程と、
分離された試料を前記イオン源により所望の極性でイオン化する工程と、
生成された試料イオンを解離手段によって解離する工程と、
解離された試料イオンを質量分析部により第1の質量分析が行われる工程と、
前記第1の質量分析により目的のイオンが検出された場合、前記解離手段とは別の解離手段によって試料イオンの解離を行う工程と、
前記質量分析部により第2の質量分析が行われる工程とを有し、
前記第1の質量分析の結果に基いて、前記第2の質量分析における試料のイオン化極性が決定されることを特徴とする質量分析方法。
【請求項14】
請求項13に記載の質量分析方法において、
前記質量分析部として、飛行時間型質量分析装置、イオントラップ型質量分析装置のどちらか一方又は両方を用いて質量分析が行われることを特徴とする質量分析方法。
【請求項15】
請求項13に記載の質量分析方法において、
試料を前記イオン源により所望の極性でイオン化する工程と、
生成された試料イオンを衝突励起解離手段により衝突励起解離する工程と、
衝突励起解離によって生成されたフラグメントイオンの質量分析が行われる工程と、
質量分析により目的のフラグメントイオンが検出された場合、試料のイオン化極性を正に設定する工程と、
正の極性でイオン化された試料イオンを電子捕獲解離手段により電子捕獲解離する工程と、
電子捕獲解離によって生成されたフラグメントイオンの質量分析が行われる工程とを有することを特徴とする質量分析方法。
【請求項16】
請求項15に記載の質量分析方法において、
前記衝突励起解離手段として、イオントラップ及びコリジョンセルを用いることを特徴とする質量分析方法。
【請求項17】
請求項15に記載の質量分析方法において、
イオンの軌道を偏向することでイオンの進行方向を決定するイオン偏向部により、イオンを前記質量分析部、前記衝突励起解離部又は前記電子捕獲解離部に導くことを特徴とする質量分析方法。
【請求項18】
請求項17に記載の質量分析方法において、
前記イオン源と前記イオン偏向部との間に、特定の質量電荷比を有するイオンの単離手段を備えることを特徴とする質量分析方法。
【請求項19】
試料をイオン化するイオン源の前段に設けられた分離部により分離された試料を、前記イオン源によりイオン化する工程と、
質量分析部により、生成された試料イオンの質量分析が行われる工程と、
前記質量分析部による質量分析結果から、目的の試料イオンの価数判定が行われる工程とを有し、
価数判定が可能なイオンは、特定の質量電荷比を有するイオンの単離手段により単離され、電子捕獲解離手段により電子捕獲解離され、前記質量分析部により質量分析が行われ、
価数判定ができないイオンは、価数判定が可能になるまで衝突励起解離手段により衝突励起解離が繰り返し行われることを特徴とする質量分析方法。
【請求項20】
請求項19に記載の質量分析方法において、
前記質量分析部は飛行時間型質量分析装置であることを特徴とする質量分析方法。
【請求項21】
請求項19に記載の質量分析方法において、
制御部によって、前記イオン源、前記質量分析部、前記イオンの単離手段及び前記衝突励起解離手段の極性の切り替えが行われることを特徴とする質量方法。
【図1】


【図2】


【図3】


【図4】


【図5】


【図6】


【図7】


【図8】


【図9】


【図10】


【図11】




【図2】


【図3】


【図4】


【図5】


【図6】


【図7】


【図8】


【図9】


【図10】


【図11】


【公開番号】特開2009−68981(P2009−68981A)
【公開日】平成21年4月2日(2009.4.2)
【国際特許分類】
【出願番号】特願2007−237389(P2007−237389)
【出願日】平成19年9月13日(2007.9.13)
【出願人】(501387839)株式会社日立ハイテクノロジーズ (4,325)
【Fターム(参考)】
【公開日】平成21年4月2日(2009.4.2)
【国際特許分類】
【出願日】平成19年9月13日(2007.9.13)
【出願人】(501387839)株式会社日立ハイテクノロジーズ (4,325)
【Fターム(参考)】
[ Back to top ]

