質量分析装置を用いたタンパク質定量のための評価用ペプチド、人工標準タンパク質、及びタンパク質の定量方法
【課題】質量分析計を用いたタンパク質の定量における前処理効率を評価するための、信頼性及び汎用性が高い評価用ペプチド、当該評価用ペプチドを含む人工標準タンパク質、当該人工標準タンパク質を用いたタンパク質の定量方法を提供すること。
【解決手段】天然に存在するタンパク質及びその変異体と一致せず、質量分析によって検出が可能であるアミノ酸配列からなり、かつタンパク質消化酵素によって認識されるアミノ酸を有するペプチドを選択し、当該ペプチドを、質量分析装置を用いたタンパク質定量のための評価用ペプチドとして使用する方法。
【解決手段】天然に存在するタンパク質及びその変異体と一致せず、質量分析によって検出が可能であるアミノ酸配列からなり、かつタンパク質消化酵素によって認識されるアミノ酸を有するペプチドを選択し、当該ペプチドを、質量分析装置を用いたタンパク質定量のための評価用ペプチドとして使用する方法。
【発明の詳細な説明】
【技術分野】
【0001】
本発明は、質量分析を用いたタンパク質の定量において実施される前処理の効率を評価するための評価用ペプチド、当該ペプチドを含む人工標準タンパク質、当該人工標準タンパク質を用いるタンパク質の定量方法に関する。人工標準タンパク質には、2種類以上の評価用ペプチドをそれぞれ2つ以上組み込むことが好ましく、さらに、システインを2つ以上組み込むことがより好ましい。
本発明のタンパク質の定量方法においては、本発明の人工標準タンパク質を前処理前のタンパク質試料に一定量添加し、その後、前処理を行い質量分析にて評価用ペプチドを定量し、その定量値から前処理効率を評価することができる。
【背景技術】
【0002】
近年、質量分析法(mass spectrometry)の進展が目覚しく、種々の生物学材料の検出や測定にこの方法が検討され、利用されてきた。質量分析計には、エレクトロスプレー・イオン化法(ESI:electrospray ionization)による質量分析計、液体クロマトグラフィーマススペクトロメトリー(LC−MS)をもつ質量分析計、質量分析計を2台結合した、MS/MSスペクトル(MS/MSspectrum)又はタンデムマススペクトル(tandem mass spectrum: tandem MS)質量分析計等、種々の機能をもつ質量分析計が開発されており、これらの機能を組み合わせたものが、生物学材料の検出や測定、定量に利用されている(特許文献1〜3)。
【0003】
質量分析計を用いてタンパク質を網羅的に解析する技術はプロテオミクスと呼ばれている。タンパク質は巨大分子であり立体構造を有しているために網羅的に液体クロマトグラフィーで分離し、質量分析計で解析するには適していない。そのため一般的に、タンパク質を変性、修飾、沈殿し、その後、トリプシンなどのタンパク質消化酵素を用いてタンパク質をペプチドに小分子化し、液体クロマトグラフィーで分離し、質量分析計で解析することが行われている。消化ペプチド断片を同定することによってタンパク質試料中に存在するタンパク質を同定し、さらに、消化ペプチド断片を定量することによってタンパク質試料中の標的タンパク質の発現量を定量することができる。
【0004】
発明者らは既に質量分析装置を用いて、膜タンパク質及び代謝酵素の絶対発現量を網羅的に一斉定量する方法を発明している(特許文献4,5)。従来の、同定を目的としたプロテオミクスでは、変性、修飾、沈殿、消化等の前処理の効率は、感度に作用するもののほとんど問題とはならなかった。しかし、発明者らの定量方法においては、標的とする消化ペプチドの定量値を標的タンパク質の定量値とするために、前処理が十分に行われていることが必須の条件となり、前処理の効率の良し悪しが定量値の正確性と信頼性に大きく影響する。従って、各試料毎に前処理効率を評価し、前処理が十分行われていることを確認することは、質量分析を用いたタンパク質の定量に必須である。
【0005】
従来、質量分析計を用いたタンパク質の定量において、定量するタンパク質と同一配列を有する安定同位体標識タンパク質を作製し、該安定同位体標識タンパク質を内部標準として用いる知見はあったが、前処理効率を評価する知見はなかった(非特許文献1)。前処理効率の評価には、自然界に既に存在する精製された特定のタンパク質を標準タンパク質として、その一つの消化ペプチド断片を評価用ペプチドとして用いる方法が行われていた。しかし当該方法では、評価用ペプチドと同一のアミノ酸配列を一部に持つタンパク質が測定試料に存在する場合、定量値に影響を与え、過大評価してしまう問題があった。さらに、一つの評価用ペプチドで評価する場合は、全体としては消化が十分に行われていなくても、評価用ペプチドが完全に切り出されてしまう可能性があり、前処理効率を過大評価してしまう問題があった。
【0006】
一方、それぞれのタンパク質の定量に用いる標的消化ペプチドを組み込んだ人工タンパク質を作成し、安定同位体標識されたアミノ酸を含む培地で大腸菌を培養することによって安定同位体標識された人工タンパク質を調製する方法がある。この安定同位体標識された人工タンパク質を被定量タンパク質試料に添加し、前処理を行い、質量分析計によって(非標識標的消化ペプチド/安定同位体標識標的消化ペプチド)のピークエリア比を計測し、そのピークエリア比から前処理効率を補正したそれぞれのタンパク質の発現の相対比率を計算する手法が報告されている(非特許文献2)。しかしこの手法は、定量する標的タンパク質が制限され、標的タンパク質を変更するたびに人工タンパク質を設計、精製し直さなければならず、汎用性に大きな課題があった。
【先行技術文献】
【特許文献】
【0007】
【特許文献1】特開2004−28993号公報
【特許文献2】特開2004−77276号公報
【特許文献3】特表2004−533610号公報
【特許文献4】国際公開公報WO07/055116号
【特許文献5】特願2008−251212号
【非特許文献】
【0008】
【非特許文献1】Dupius K et al., Proteomics 2008, 8, 4633-4636
【非特許文献2】Kito K et al., J Proteome Res 6: 792-800, 2007
【発明の概要】
【発明が解決しようとする課題】
【0009】
本発明の課題は、質量分析計を用いたタンパク質の定量における前処理効率を評価するための、信頼性及び汎用性が高い評価用ペプチド、当該評価用ペプチドを含む人工標準タンパク質、当該人工標準タンパク質を用いたタンパク質の定量方法を提供することにある。
【課題を解決するための手段】
【0010】
本発明者らは上記課題を解決すべく鋭意検討する中で、既知のタンパク質と同一のアミノ酸配列が存在せず、かつ質量分析計によって十分な感度をもつペプチドを評価用ペプチドとすることで、すべての種のタンパク質試料に汎用的に適応できるとの知見を得た。さらに、質量分析計による検出に好適なペプチドのアミノ酸残基数やアミノ酸種を見い出し、具体的なペプチドを検討し、上記の条件を満たす評価用ペプチドの4種類のアミノ酸配列を設計した。
また、2種類以上の評価ペプチドをそれぞれ2つ以上人工標準タンパク質に組み込むことで、タンパク質が完全にタンパク質消化酵素によって消化されたことを評価でき、加えて、タンパク質あたりの感度を増加させるとの知見を得た。さらに、人工標準タンパク質にシステインを2つ以上入れることによって、消化効率に大きく影響するS−S結合を解離させる修飾を評価可能であるとの知見を得た。本発明はこれら知見に基づき完成されるに至ったものである。
【0011】
すなわち本発明は、
[1]天然に存在するタンパク質及びその変異体と一致せず、質量分析によって検出が可能であるアミノ酸配列からなり、かつタンパク質消化酵素によって認識されるアミノ酸を含むペプチドを選択し、当該ペプチドを、質量分析装置を用いたタンパク質定量のための評価用ペプチドとして使用する方法や、
[2]天然に存在するタンパク質及びその変異体と一致しないアミノ酸配列が、既知のタンパク質と一致しないアミノ酸配列であることを特徴とする、前記[1]に記載の方法に関する。
【0012】
また本発明は、
[3]アミノ酸残基数が3〜20のペプチドであって、C末端にタンパク質消化酵素によって認識されるアミノ酸を有し、C末端以外には当該タンパク質消化酵素によって認識されるアミノ酸を有さず、天然に存在するタンパク質及びその変異体と一致しないアミノ酸配列からなる、質量分析装置を用いたタンパク質定量のための評価用ペプチドや、
[4]安定同位体標識可能なアミノ酸を有することを特徴とする、前記[3]に記載の評価用ペプチドや、
[5]アミノ酸残基数が8、10又は12であって、プロリン又はグリシンを含み、かつ、ヒスチジンを含まないことを特徴とする、前記[3]又は[4]に記載の評価用ペプチドや、
[6]1又は2のプロリンを含むことを特徴とする、前記[5]に記載の評価用ペプチドや、
[7]下記(1)〜(4)に示すアミノ酸配列のいずれかによって構成されることを特徴とする、質量分析装置を用いたタンパク質定量のための評価用ペプチドに関する。
(1)VGAPGVPALK(配列番号1)
(2)QIGDPTVPSGVK(配列番号2)
(3)DAPGSGLK(配列番号3)
(4)NVAPAGPTLK(配列番号4)
【0013】
さらに本発明は、
[8]前記[3]〜[7]のいずれかに記載の評価用ペプチドを、質量分析装置を用いたタンパク質定量のために使用する方法に関する。
【0014】
また本発明は、
[9]前記[3]〜[7]のいずれかに記載の評価用ペプチドのアミノ酸配列を2種類以上、かつ、1種類の配列について2箇所含むことを特徴とする、質量分析装置を用いたタンパク質定量のための人工標準タンパク質や、
[10]1分子中にシステインを2以上有することを特徴とする、前記[9]に記載の人工標準タンパク質に関する。
【0015】
さらに本発明は、
[11]前記[9]又は[10]に記載の人工標準タンパク質を、質量分析装置を用いたタンパク質定量のための人工標準タンパク質として使用する方法や、
[12]前記[9]又は[10]に記載の人工標準タンパク質を、質量分析装置を用いたタンパク質定量のための人工標準タンパク質として使用する、タンパク質の定量方法に関する。
【0016】
さらに本発明は、
[13]以下の(a)〜(c)の工程を順次備えたことを特徴とする、タンパク質の定量方法、
(a)定量対象タンパク質を含む試料中に、質量既知の人工標準タンパク質を添加し、さらにタンパク質消化酵素を添加して、定量対象タンパク質及び人工標準タンパク質を消化する工程。
(b)(a)工程により得られた試料中に、定量対象タンパク質及び人工標準タンパク質の消化物であるペプチドと同一配列であって、安定同位体標識されたペプチドを添加し、液体クロマトグラフ−タンデム質量分析(LC−MS/MS)測定を行う工程。
(c)(a)工程において添加した人工標準タンパク質の質量と、(b)工程の測定により得られた、人工標準タンパク質の消化物であるペプチドの質量との比率を算出することで、タンパク質消化酵素による処理効率を評価する工程。
[14]以下の(A)〜(C)を含むことを特徴とする、質量分析装置を用いたタンパク質定量用標準物質キットに関する。
(A)前記[9]又は[10]に記載の人工標準タンパク質
(B)タンパク質消化酵素
(C)前記人工標準タンパク質の前記タンパク質消化酵素による消化物であるペプチドと同一の配列であって、安定同位体標識されたペプチド
【発明の効果】
【0017】
本発明の評価用ペプチドは汎用性が高く、当該ペプチドを用いて任意の測定試料の前処理の効率を評価することが可能であり、タンパク質定量値の信頼性を確保できる。2種類以上の評価ペプチドをそれぞれ2つ以上人工標準タンパク質に組み込んだ人工標準タンパク質は、タンパク質消化酵素により完全に断片化された場合にすべての評価ペプチドの回収率が100%となるため、定量にきわめて重要な、消化の完全性を評価できる。また本発明の評価用ペプチドは、既知のタンパク質と同一のアミノ酸配列が存在せず、かつ質量分析計によって十分な感度をもつペプチドを評価用ペプチドであり、どのようなタンパク質試料にも適応できる高い汎用性を有する。
【図面の簡単な説明】
【0018】
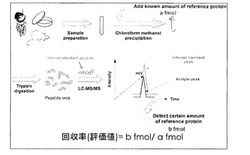
【図1】本発明のタンパク質定量における前処理評価の流れを模式的に示したものである。
【図2】本発明のタンパク質定量における前処理評価の方法を模式的に示したものである。
【図3】作成した人工標準タンパク質のアミノ酸配列とその模式図である。下線部分は挿入された評価用ペプチド、*は安定同位体標識されたアミノ酸を示している。
【図4】4種類の評価用ペプチドの、検量線10fmolにおけるクロマトグラムである。
【図5】実験操作に習熟しない者が前処理を行った場合の、前処理効率の評価結果である。4種の評価用ペプチドの評価値にはばらつきがあり、いずれも低い値を示している。
【図6】実験操作に熟練した者が前処理を行った場合の、前処理効率の評価結果である。4種の評価用ペプチドの評価値はばらつきが少なく、いずれも高い値を示している。
【図7】ペプチド83種類を、LC−MS/MSのMRM modeによって解析し、ピーク面積値の平均値をペプチド長に対してプロットしたものである。プロリン(P)が多いほど平均ピーク面積値が大きくなる、また、ヒスチジン(H)が存在すると平均ピーク面積値が低くなることを示している。
【図8】図7と同様に測定、プロットしたものである。グリシンが多いほど平均ピーク面積値が大きくなることを示している。
【発明を実施するための形態】
【0019】
(評価用ペプチド)
本発明としては、天然に存在するタンパク質及びその変異体と一致せず、質量分析によって検出が可能であるアミノ酸配列からなり、かつタンパク質消化酵素によって認識されるアミノ酸を含むペプチドを選択し、当該ペプチドを、質量分析装置を用いたタンパク質定量のための評価用ペプチドとして使用する方法であれば特に制限されず、上記天然に存在するタンパク質及びその変異体と一致しないアミノ酸配列としては、未知又は既知のタンパク質と一致しないアミノ酸配列を挙げることができるが、既知のタンパク質と一致しないアミノ酸配列であることがより好ましい。また、既知のタンパク質と一致しないアミノ酸配列として、好適にSwiss-Prot等のデータベースに対して相同性検索によって、同一のアミノ酸配列が存在しないことが確認されたアミノ酸配列を例示することができる。
上記天然に存在するタンパク質には、相同タンパク質(ホモログ)やSNPs由来の変異箇所を有するタンパク質が含まれ、天然に存在するタンパク質の変異体としては、例えば、天然型タンパク質のアミノ酸配列において1又は複数のアミノ酸が欠失、置換若しくは付加されたアミノ酸配列からなるタンパク質を挙げることができ、より具体的には1若しくは数個のアミノ酸が欠失、置換若しくは付加されたアミノ酸配列からなるタンパク質を挙げることができる。
【0020】
質量分析計で検出が可能であるアミノ酸配列としては、具体的には例えばLC−MS/MSによって検出が可能であるペプチドを構成するアミノ酸配列であり、さらに具体的には、LC−MS/MSによって10fmolが検出可能であるペプチドを構成するアミノ酸配列が好ましい。LC−MS/MSによって10fmolが検出可能とは、例えば、アプライドバイオシステムズ社製LC/MS/MSシステム「API5000(商品名)」、「4000Q TRAP(登録商標)」等を用いて10fmolが検出可能であることをいう。
【0021】
タンパク質消化酵素によって認識されるアミノ酸を含むとは、タンパク質消化酵素によって認識され、切断部位となるアミノ酸を含むことを意味し、タンパク質消化酵素としてはエンドペプチダーゼが好ましく、例えば、トリプシンが挙げられる。本願発明の評価用ペプチドのアミノ酸配列の中で、タンパク質消化酵素によって認識される箇所は、アミノ酸配列のC末端であることが好ましく、C末端以外には当該タンパク質消化酵素によって認識されるアミノ酸を有しないことが好ましい。例えばタンパク質消化酵素としてトリプシンを用いる場合、評価用ペプチドは、C末端にリジン(K)又はアルギニン(R)を有することが好ましい。
【0022】
また、評価用ペプチドは安定同位体標識可能なアミノ酸を有し、安定同位体標識可能なアミノ酸としては例えば、ロイシン(L)、バリン(V)等が挙げられる。1つの評価用ペプチド中に、安定同位体標識可能なアミノ酸は1箇所であってもよいし複数箇所であってもよい。また、安定同位体標識可能なアミノ酸は1種類であっても複数種類であってもよいが、実施時のコスト等の観点からは1種類であることが好ましい。
【0023】
評価用ペプチドのアミノ酸残基数は特に制限されるものではないが、4〜30であることが好ましく、5〜15であることがより好ましく、8〜12であることがさらに好ましい。とりわけ、評価用ペプチドのアミノ酸残基数が8、10又は12であって、プロリン(P)及び/又はグリシン(G)を含み、かつ、ヒスチジン(H)を含まないものが好ましく、なかでも、1又は2のプロリンを含むことが好ましい。
アミノ酸残基数が8、10又は12であって、プロリン及び/又はグリシンを含み、かつ、ヒスチジンを含まないペプチドは、質量分析において強いシグナルを与えるため、より少量の添加でその存在を検出することができ、評価用ペプチドとして好適である。
【0024】
本発明の評価用ペプチドは、上記の条件と公知のクライテリアとを組み合わせて、その配列を設計することができる。公知のクライテリアとしては例えば、質量分析計を用いたタンパク質の分析に好適なペプチドを選択するためのクライテリア(例えば、WO2007/055116号公報に記載のクライテリア)を組み合わせることができる。
具体的には例えば、
トリプシン分解酵素により得られるペプチドであること;
トリプトファン、チロシン、バリン、ロイシン、イソロイシン、フェニルアラニンからなる疎水性アミノ酸の含量及び配列条件として、疎水性アミノ酸の含量が80%以下、好ましくは50%以下であり、かつ前記疎水性アミノ酸が10アミノ酸以上連続しないペプチドであること;
特定アミノ酸配列条件として、アスパラギン−X−Y(配列中、Xはプロリン以外のアミノ酸を表し、Yはセリン、スレオニン又はシステインを表す。)の配列を含まないペプチドであること;
タンパク質分解酵素切断部が、アルギニン−アルギニン、アルギニン−リジン、リジン−アルギニン、リジン−リジンではないペプチドであること;
メチオニン、システインを含まないペプチドであること;
トリプトファン、グルタミン酸を含まないペプチドであること;
等のクライテリアの1又は2以上を用いることができる。また、これらのクライテリアの各々にスコアを設定し、スコア合計の高いペプチドを設計することもできる。
【0025】
評価用ペプチドとして具体的には、配列番号1〜4に示されるアミノ酸配列によって構成されるペプチドが挙げられる。
【0026】
(人工標準タンパク質)
前記の評価用ペプチドを用いて人工標準タンパク質を設計することができ、本発明はまた、前記の評価用ペプチドのアミノ酸配列を2種類以上、かつ、1種類のアミノ酸配列について2箇所以上含むことを特徴とする人工標準タンパク質に関する。なお、本明細書においては、人工標準タンパク質に組み込んだ各評価用ペプチドの数を「組み込み数」という。
【0027】
人工標準タンパク質において、複数種類の評価用ペプチド(例えば、A,B,C,D)は複数種類の非評価用ペプチド部分(X)と共にランダムに組み込まれていてもよいし(例えば、A−B−X−B−C−B−X−A−B−C−A−X)、順番に配列されていてもよいが(例えば、X−A−X−B−X−A−B−X−A−B−X−A−B)、好ましくは、4種類以上の評価用ペプチドを順番に並べ(A−B−C−D)、さらに繰り返すことによって設計する(A−B−C−D−X−A−B−X−C−D;組み込み数2)。なお、非評価用ペプチド部分(X)を用いる場合、そのC末端はタンパク質消化酵素によって認識されるアミノ酸とすることが、タンパク質消化酵素によって評価用ペプチドを分離する上で必要である。
また、人工標準タンパク質は1分子中に2種類以上、かつ、1種類の配列について2箇所以上の評価ペプチドを有するため、タンパク質が完全にタンパク質消化酵素によって消化されたことを評価でき、加えて、タンパク質あたりの感度が高い。このため、質量分析装置を用いたタンパク質定量のための人工標準タンパク質として好適に使用できる。
【0028】
また、人工標準タンパク質はシステイン(S)を2つ以上有していることがより好ましい。システイン(S)は、評価用ペプチドのアミノ酸配列中に組み込まれていても良いし、評価用ペプチド以外の部位に組み込まれていてもよいが、好ましくは評価用ペプチド以外の部位(上記非評価用ペプチド部分Xの部位)である。
また、人工標準タンパク質は、評価用ペプチドの部位以外の配列、例えば、輸送シグナル配列や精製のためのタグ配列等を有していてもよく、精製のためのタグ配列を含んでいることが好ましい。
【0029】
人工標準タンパク質は例えば、次の方法で製造できる。すなわち、上記人工標準タンパク質のアミノ酸配列からcDNA配列を設計し、核酸オリゴ合成及びPCR等によって、cDNAを合成する。さらに、cDNAを発現ベクターに組み込み大腸菌等によってタンパク質を合成する。得られた合成タンパク質は、タグ配列を利用した精製法等の公知の条件・方法によって精製することができる。精製した人工標準タンパク質は、アミノ酸分析によって正確な量(濃度)を算出することができる。
【0030】
(人工標準タンパク質を用いたタンパク質の前処理評価及び定量)
本発明の人工標準タンパク質を用いた前処理評価及び被定量タンパク質の定量には、予め、評価用ペプチドの絶対量の定量のため、評価用ペプチドと同一の配列である安定同位体標識ペプチドを合成しておく。内部標準として加えられる安定同位体標識ペプチドは、15N,13C,18O,2Hのうち少なくとも一つの安定同位元素により標識される。LC−MS/MS測定の際、非標識の評価用ペプチドと内部標準である安定同位体標識された評価用ペプチドとは、質量差によって分離されるため、LC−MS/MSで分離可能な質量差が必要である。好ましくは13Cで6箇所標識されたロイシン(L)を含むペプチドを用いる。安定同位体標識ペプチドは、少なくとも一つのアミノ酸が安定同位元素で標識されていることが必要であり、当該ペプチドは、当業者に公知の任意の方法で調製することができる。例えば、安定同位元素により標識されたアミノ酸を用いてF−moc法(Amblard M, Fehrentz JA, Martinez J, Subra G. Methods Mol Biol.298:3-24(2005))等の適当な手段で目的の安定同位体標識ペプチドを化学合成することができる。このようにして得られた安定同位体標識ペプチドと定量対象ペプチドとは、標識アミノ酸の質量が異なる点以外では化学的に同一であり、LC−MS/MS測定において同一の挙動を示し、分析物と標準物の損失の程度は等しくなる。
【0031】
本発明に係るタンパク質定量においては、前処理前の定量対象タンパク質を含むタンパク質試料に、既知量、好ましくは100−10,000fmolの人工標準タンパク質を加え、さらにタンパク質消化酵素を添加し、前処理を行う(工程(a))。前処理とは、タンパク質消化酵素を添加し、人工標準タンパク質及び定量対象タンパク質を消化して、ペプチドとする処理をいう。タンパク質分解酵素としては、前述のトリプシン等を用いることができる。前処理の温度及び時間は、タンパク質消化酵素の標準的な反応条件を用いることができ、例えば、温度35℃〜45℃において、1分〜20時間前処理を行うことができる。
【0032】
前処理後、前処理工程により得られた試料に、既知量の安定同位体標識評価用ペプチドを加える。加える安定同位体標識評価用ペプチドの量は、既知量であればよいが、(人工標準タンパク質[mol]×組み込み数)に相当する量[mol]であることが好ましい。
また同時に、定量対象タンパク質の定量のために、定量対象タンパク質のタンパク質消化酵素による消化物と同一配列の、安定同位体標識ペプチドも添加する。
この試料を液体クロマトグラフ−タンデム質量分析(LC−MS/MS)によって測定し、定量対象タンパク質の定量と同時に、各評価ペプチドの絶対量を公知の内部標準法(例えば、国際公開公報WO07/055116号に記載の方法)によって計測する(工程(b))。
【0033】
添加した人工標準タンパク質の量(A[mol])と各評価ペプチドの定量値(B[mol])から、前処理効率の評価値を計算する(工程(c))。
評価値は、次式;
評価値=B/(A×組み込み数)
によって得られる。
【0034】
各評価ペプチド間の評価値が一定値であって0.80以上、好ましくは0.90以上の時に前処理が十分行われていると評価し、定量対象タンパク質について信頼性のある定量値が得られていると判断することができる(図1及び図2参照)。
評価値が一定値とは、例えば、人工標準タンパク質に含まれる複数種の評価ペプチドの評価値の間にばらつきが少なく、もしくは無く、具体的には、平均値からのばらつきが0.10以内である場合が挙げられる。
評価値が0.80以上とは、例えば、人工標準タンパク質に含まれる複数種の評価用ペプチドの評価値の平均値が0.80以上である場合が挙げられる。
【0035】
さらに、前工程により得られた前処理効率の評価値を用いて、定量対象タンパク質の定量値を算出することもできる。また、評価値が0.80より低い場合には、前処理に問題があり、測定値を採用せず、再測定又は測定方法の変更等を検討することができる。
【0036】
本発明はまたタンパク質定量用キットに関し、本発明のキットには、以下の(A)〜(C)が含まれる。
(A)人工標準タンパク質
(B)タンパク質消化酵素
(C)前記人工標準タンパク質の前記タンパク質消化酵素による消化物であるペプチドと同一の配列であって、安定同位体標識されたペプチド
キットに含まれる人工標準タンパク質、タンパク質消化酵素、及び、人工標準タンパク質の前記タンパク質消化酵素による消化物であるペプチドと同一の配列であって、安定同位体標識されたペプチドは、前記に詳述したものと同様であり、本発明のキットには上記(A)〜(C)以外にも必要と目的に応じて、緩衝液、pH調整剤、反応容器等が含まれていてもよい。
【0037】
以下、実施例により本発明をより具体的に説明するが、本発明の技術的範囲はこれらの例示に限定されるものではない。
【実施例1】
【0038】
(評価用ペプチドを含む人工標準タンパク質の調製及び、評価用ペプチドの感度の確認)
評価用ペプチドとして、VGAPGVPALK(配列番号1)、QIGDPTVPSGVK(配列番号2)、DAPGSGLK(配列番号3)、NVAPAGPTLK(配列番号4)を選択し、これら4種類のペプチドをそれぞれ2箇所ずつ含む人工標準タンパク質(配列番号5)を調製した(図3参照)。人工標準タンパク質の調製は次の方法によった。
1.IPTG誘導
人工標準タンパク質cDNAを挿入したpET−vectorをトランスフォーメーションした大腸菌 (BL21−CodonPlus (DE3)−RIPL)を、カナマイシン及びクロラムフェニコールをそれぞれ30mg/L、50mg/Lで添加したLB培地において一晩振盪培養した後、LB培地に希釈し、OD600が0.4付近の値を示すまで培養を行い、最終濃度100mMでIPTGを添加し、さらに3時間のインキュベートを行うことで、タンパク質の発現誘導を行った。誘導を行った大腸菌は、8M Ureaの存在下で超音波破砕を行い、可溶性画分と不溶性画分を調製した後、SDS−PAGEによって分画し、CBB R−250による検出を行った。
2.人工標準タンパク質の精製
コバルトレジンを充填したスピンカラムに、大腸菌可溶性画分を添加し、10mM Imidazole溶液でカラムを洗浄後、50mM,150mM, 500mMのImidazole溶液で人工標準タンパク質の溶出を行った。
【0039】
(評価用ペプチドの感度の確認)
人工標準タンパク質に挿入した4種類の評価用ペプチドの全てについて、10fmolでピークが検出されることを確認した。確認は以下の方法によった。
4種類の評価用ペプチド{VGAPGVPALK(配列番号1)、QIGDPTVPSGVK(配列番号2)、DAPGSGLK(配列番号3)、NVAPAGPTLK(配列番号4)}を混合し、LC−MS/MSのMRMモードにより、以下の条件で定量を行った。
カラム: Agilent 300SB−C18 0.5 mm ID×150mm,5μm particles
HPLC: Agilent1100 system
質量分析機: API5000
グラジエント条件: 1−45% アセトニトリル/0.1% ギ酸, 50μL/min,50min
【0040】
結果を図4に示す。図4のとおり、4種類の評価用ペプチド{VGAPGVPALK(配列番号1)、QIGDPTVPSGVK(配列番号2)、DAPGSGLK(配列番号3)、NVAPAGPTLK(配列番号4)}について、顕著なピークが確認され、10fmolでも検出可能なことが示された。
【実施例2】
【0041】
(評価用ペプチドを用いた前処理効率の評価1)
実施例1の人工標準タンパク質を用いて、タンパク質定量における前処理効率の評価をおこなった。評価用試料の調製及び評価は次の方法でおこなった。なお、評価用試料の操作は、実験操作に習熟しない者がおこなった。
1.ペプチド試料の調製
マウスから単離した腎臓形質膜サンプル50μgに人工標準タンパク質を10000fmol、比較例として大腸菌由来Triose Phosphate Isomerase(TPI)2200fmolを添加した。その後、7M 塩酸グアニジン溶液(0.1M Tris−HCl、10mM EDTA pH8.5に溶解)で変性させ、システイン残基のSH基を保護するために、DTTによる還元処理とヨードアセトアミドによるカルバミドメチル化処理を行なった。 続いて、メタノールクロロホルム沈殿法により、脱塩濃縮し、1.2M Urea/10mM Tris−HClに再懸濁した。その後、タンパク質重量の1/100量のトリプシンを加え、37度で16時間酵素消化してペプチド試料を得た。
2.ペプチド試料の定量分析
上記ペプチド試料に、500fmolの13C6,15N標識ペプチドを加えてLC−MS/MSで測定した。測定後、定量対象ペプチドピークと13C6,15N標識ペプチドとのMSスペクトル面積比を算出し、検量線を用いて定量値を算出した。
3.検量線の作成
選定した定量対象ペプチドを用いて、検量線を作成した。具体的には、10fmol、50fmol、100fmol、500fmol、1000fmolの非標識ペプチドにそれぞれ500fmolの13C6,15N標識ペプチドを添加した後、LC−MS/MSにより測定し、MSスペクトル面積比(非標識ペプチド/13C6,15N標識ペプチド)を算出し、検量線を作成した。
【0042】
結果を図5に示す。図5より、評価用ペプチドの評価値は50〜71%であり、評価値にばらつきがあり、また、いずれも低い値を示しているため、本実験のタンパク質の前処理が適当に行われなかったと判断された。一方、比較例のTPIは評価値が84%であり、TPIのみでは前処理の妥当性が正しく判断できないことがわかる。
【実施例3】
【0043】
(評価用ペプチドを用いた前処理効率の評価2)
実施例2と同様の方法で前処理効率の評価をおこなった。但し、評価用試料の操作は、実験操作に熟練した者がおこなった。また、人工標準タンパク質の添加量を250fmol、大腸菌由来Triose Phosphate Isomerase(TPI)の添加量を700fmolとした。
結果を図6に示す。図6より、評価用ペプチドの評価値は90〜97%であり、評価値にばらつきが少なく、いずれも高い評価値を示している。また、前処理のコントロールとしてのTPIは回収率が99%であり、評価用ペプチドが高い評価値を示した本実験のタンパク質の前処理は適当に行われたと判断された。評価値が高い値を示した図6では、評価値の低い図5よりTPI回収率が高く(図6:99%、図5:84%)、評価値と回収率に相関関係が認められることから、評価用ペプチドを用いた前処理評価の有効性が示された。
【0044】
[参考例1]より好ましい評価ペプチドの選定
ペプチド83種類(各500fmol)を、LC−MS/MS(ABI 4000QTRAP)のMRM modeによって解析し、ピーク面積値の平均値をペプチド長に対してプロットした。その結果、図7に示すとおりプロリン(P)の残基が多いほど平均ピーク面積値が大きくなる。また、ヒスチジン(H)が存在すると平均ピーク面積値が低くなる。また、図8に示すとおり、グリシンの残基が多いほど平均ピーク面積値が大きくなる。
上記の結果からアミノ酸残基数が8、10又は12であって、プロリン又はグリシンを有し、かつ、ヒスチジンを有しない評価用ペプチドは、LC−MS/MSで好適に検出できることがわかった。
【技術分野】
【0001】
本発明は、質量分析を用いたタンパク質の定量において実施される前処理の効率を評価するための評価用ペプチド、当該ペプチドを含む人工標準タンパク質、当該人工標準タンパク質を用いるタンパク質の定量方法に関する。人工標準タンパク質には、2種類以上の評価用ペプチドをそれぞれ2つ以上組み込むことが好ましく、さらに、システインを2つ以上組み込むことがより好ましい。
本発明のタンパク質の定量方法においては、本発明の人工標準タンパク質を前処理前のタンパク質試料に一定量添加し、その後、前処理を行い質量分析にて評価用ペプチドを定量し、その定量値から前処理効率を評価することができる。
【背景技術】
【0002】
近年、質量分析法(mass spectrometry)の進展が目覚しく、種々の生物学材料の検出や測定にこの方法が検討され、利用されてきた。質量分析計には、エレクトロスプレー・イオン化法(ESI:electrospray ionization)による質量分析計、液体クロマトグラフィーマススペクトロメトリー(LC−MS)をもつ質量分析計、質量分析計を2台結合した、MS/MSスペクトル(MS/MSspectrum)又はタンデムマススペクトル(tandem mass spectrum: tandem MS)質量分析計等、種々の機能をもつ質量分析計が開発されており、これらの機能を組み合わせたものが、生物学材料の検出や測定、定量に利用されている(特許文献1〜3)。
【0003】
質量分析計を用いてタンパク質を網羅的に解析する技術はプロテオミクスと呼ばれている。タンパク質は巨大分子であり立体構造を有しているために網羅的に液体クロマトグラフィーで分離し、質量分析計で解析するには適していない。そのため一般的に、タンパク質を変性、修飾、沈殿し、その後、トリプシンなどのタンパク質消化酵素を用いてタンパク質をペプチドに小分子化し、液体クロマトグラフィーで分離し、質量分析計で解析することが行われている。消化ペプチド断片を同定することによってタンパク質試料中に存在するタンパク質を同定し、さらに、消化ペプチド断片を定量することによってタンパク質試料中の標的タンパク質の発現量を定量することができる。
【0004】
発明者らは既に質量分析装置を用いて、膜タンパク質及び代謝酵素の絶対発現量を網羅的に一斉定量する方法を発明している(特許文献4,5)。従来の、同定を目的としたプロテオミクスでは、変性、修飾、沈殿、消化等の前処理の効率は、感度に作用するもののほとんど問題とはならなかった。しかし、発明者らの定量方法においては、標的とする消化ペプチドの定量値を標的タンパク質の定量値とするために、前処理が十分に行われていることが必須の条件となり、前処理の効率の良し悪しが定量値の正確性と信頼性に大きく影響する。従って、各試料毎に前処理効率を評価し、前処理が十分行われていることを確認することは、質量分析を用いたタンパク質の定量に必須である。
【0005】
従来、質量分析計を用いたタンパク質の定量において、定量するタンパク質と同一配列を有する安定同位体標識タンパク質を作製し、該安定同位体標識タンパク質を内部標準として用いる知見はあったが、前処理効率を評価する知見はなかった(非特許文献1)。前処理効率の評価には、自然界に既に存在する精製された特定のタンパク質を標準タンパク質として、その一つの消化ペプチド断片を評価用ペプチドとして用いる方法が行われていた。しかし当該方法では、評価用ペプチドと同一のアミノ酸配列を一部に持つタンパク質が測定試料に存在する場合、定量値に影響を与え、過大評価してしまう問題があった。さらに、一つの評価用ペプチドで評価する場合は、全体としては消化が十分に行われていなくても、評価用ペプチドが完全に切り出されてしまう可能性があり、前処理効率を過大評価してしまう問題があった。
【0006】
一方、それぞれのタンパク質の定量に用いる標的消化ペプチドを組み込んだ人工タンパク質を作成し、安定同位体標識されたアミノ酸を含む培地で大腸菌を培養することによって安定同位体標識された人工タンパク質を調製する方法がある。この安定同位体標識された人工タンパク質を被定量タンパク質試料に添加し、前処理を行い、質量分析計によって(非標識標的消化ペプチド/安定同位体標識標的消化ペプチド)のピークエリア比を計測し、そのピークエリア比から前処理効率を補正したそれぞれのタンパク質の発現の相対比率を計算する手法が報告されている(非特許文献2)。しかしこの手法は、定量する標的タンパク質が制限され、標的タンパク質を変更するたびに人工タンパク質を設計、精製し直さなければならず、汎用性に大きな課題があった。
【先行技術文献】
【特許文献】
【0007】
【特許文献1】特開2004−28993号公報
【特許文献2】特開2004−77276号公報
【特許文献3】特表2004−533610号公報
【特許文献4】国際公開公報WO07/055116号
【特許文献5】特願2008−251212号
【非特許文献】
【0008】
【非特許文献1】Dupius K et al., Proteomics 2008, 8, 4633-4636
【非特許文献2】Kito K et al., J Proteome Res 6: 792-800, 2007
【発明の概要】
【発明が解決しようとする課題】
【0009】
本発明の課題は、質量分析計を用いたタンパク質の定量における前処理効率を評価するための、信頼性及び汎用性が高い評価用ペプチド、当該評価用ペプチドを含む人工標準タンパク質、当該人工標準タンパク質を用いたタンパク質の定量方法を提供することにある。
【課題を解決するための手段】
【0010】
本発明者らは上記課題を解決すべく鋭意検討する中で、既知のタンパク質と同一のアミノ酸配列が存在せず、かつ質量分析計によって十分な感度をもつペプチドを評価用ペプチドとすることで、すべての種のタンパク質試料に汎用的に適応できるとの知見を得た。さらに、質量分析計による検出に好適なペプチドのアミノ酸残基数やアミノ酸種を見い出し、具体的なペプチドを検討し、上記の条件を満たす評価用ペプチドの4種類のアミノ酸配列を設計した。
また、2種類以上の評価ペプチドをそれぞれ2つ以上人工標準タンパク質に組み込むことで、タンパク質が完全にタンパク質消化酵素によって消化されたことを評価でき、加えて、タンパク質あたりの感度を増加させるとの知見を得た。さらに、人工標準タンパク質にシステインを2つ以上入れることによって、消化効率に大きく影響するS−S結合を解離させる修飾を評価可能であるとの知見を得た。本発明はこれら知見に基づき完成されるに至ったものである。
【0011】
すなわち本発明は、
[1]天然に存在するタンパク質及びその変異体と一致せず、質量分析によって検出が可能であるアミノ酸配列からなり、かつタンパク質消化酵素によって認識されるアミノ酸を含むペプチドを選択し、当該ペプチドを、質量分析装置を用いたタンパク質定量のための評価用ペプチドとして使用する方法や、
[2]天然に存在するタンパク質及びその変異体と一致しないアミノ酸配列が、既知のタンパク質と一致しないアミノ酸配列であることを特徴とする、前記[1]に記載の方法に関する。
【0012】
また本発明は、
[3]アミノ酸残基数が3〜20のペプチドであって、C末端にタンパク質消化酵素によって認識されるアミノ酸を有し、C末端以外には当該タンパク質消化酵素によって認識されるアミノ酸を有さず、天然に存在するタンパク質及びその変異体と一致しないアミノ酸配列からなる、質量分析装置を用いたタンパク質定量のための評価用ペプチドや、
[4]安定同位体標識可能なアミノ酸を有することを特徴とする、前記[3]に記載の評価用ペプチドや、
[5]アミノ酸残基数が8、10又は12であって、プロリン又はグリシンを含み、かつ、ヒスチジンを含まないことを特徴とする、前記[3]又は[4]に記載の評価用ペプチドや、
[6]1又は2のプロリンを含むことを特徴とする、前記[5]に記載の評価用ペプチドや、
[7]下記(1)〜(4)に示すアミノ酸配列のいずれかによって構成されることを特徴とする、質量分析装置を用いたタンパク質定量のための評価用ペプチドに関する。
(1)VGAPGVPALK(配列番号1)
(2)QIGDPTVPSGVK(配列番号2)
(3)DAPGSGLK(配列番号3)
(4)NVAPAGPTLK(配列番号4)
【0013】
さらに本発明は、
[8]前記[3]〜[7]のいずれかに記載の評価用ペプチドを、質量分析装置を用いたタンパク質定量のために使用する方法に関する。
【0014】
また本発明は、
[9]前記[3]〜[7]のいずれかに記載の評価用ペプチドのアミノ酸配列を2種類以上、かつ、1種類の配列について2箇所含むことを特徴とする、質量分析装置を用いたタンパク質定量のための人工標準タンパク質や、
[10]1分子中にシステインを2以上有することを特徴とする、前記[9]に記載の人工標準タンパク質に関する。
【0015】
さらに本発明は、
[11]前記[9]又は[10]に記載の人工標準タンパク質を、質量分析装置を用いたタンパク質定量のための人工標準タンパク質として使用する方法や、
[12]前記[9]又は[10]に記載の人工標準タンパク質を、質量分析装置を用いたタンパク質定量のための人工標準タンパク質として使用する、タンパク質の定量方法に関する。
【0016】
さらに本発明は、
[13]以下の(a)〜(c)の工程を順次備えたことを特徴とする、タンパク質の定量方法、
(a)定量対象タンパク質を含む試料中に、質量既知の人工標準タンパク質を添加し、さらにタンパク質消化酵素を添加して、定量対象タンパク質及び人工標準タンパク質を消化する工程。
(b)(a)工程により得られた試料中に、定量対象タンパク質及び人工標準タンパク質の消化物であるペプチドと同一配列であって、安定同位体標識されたペプチドを添加し、液体クロマトグラフ−タンデム質量分析(LC−MS/MS)測定を行う工程。
(c)(a)工程において添加した人工標準タンパク質の質量と、(b)工程の測定により得られた、人工標準タンパク質の消化物であるペプチドの質量との比率を算出することで、タンパク質消化酵素による処理効率を評価する工程。
[14]以下の(A)〜(C)を含むことを特徴とする、質量分析装置を用いたタンパク質定量用標準物質キットに関する。
(A)前記[9]又は[10]に記載の人工標準タンパク質
(B)タンパク質消化酵素
(C)前記人工標準タンパク質の前記タンパク質消化酵素による消化物であるペプチドと同一の配列であって、安定同位体標識されたペプチド
【発明の効果】
【0017】
本発明の評価用ペプチドは汎用性が高く、当該ペプチドを用いて任意の測定試料の前処理の効率を評価することが可能であり、タンパク質定量値の信頼性を確保できる。2種類以上の評価ペプチドをそれぞれ2つ以上人工標準タンパク質に組み込んだ人工標準タンパク質は、タンパク質消化酵素により完全に断片化された場合にすべての評価ペプチドの回収率が100%となるため、定量にきわめて重要な、消化の完全性を評価できる。また本発明の評価用ペプチドは、既知のタンパク質と同一のアミノ酸配列が存在せず、かつ質量分析計によって十分な感度をもつペプチドを評価用ペプチドであり、どのようなタンパク質試料にも適応できる高い汎用性を有する。
【図面の簡単な説明】
【0018】
【図1】本発明のタンパク質定量における前処理評価の流れを模式的に示したものである。
【図2】本発明のタンパク質定量における前処理評価の方法を模式的に示したものである。
【図3】作成した人工標準タンパク質のアミノ酸配列とその模式図である。下線部分は挿入された評価用ペプチド、*は安定同位体標識されたアミノ酸を示している。
【図4】4種類の評価用ペプチドの、検量線10fmolにおけるクロマトグラムである。
【図5】実験操作に習熟しない者が前処理を行った場合の、前処理効率の評価結果である。4種の評価用ペプチドの評価値にはばらつきがあり、いずれも低い値を示している。
【図6】実験操作に熟練した者が前処理を行った場合の、前処理効率の評価結果である。4種の評価用ペプチドの評価値はばらつきが少なく、いずれも高い値を示している。
【図7】ペプチド83種類を、LC−MS/MSのMRM modeによって解析し、ピーク面積値の平均値をペプチド長に対してプロットしたものである。プロリン(P)が多いほど平均ピーク面積値が大きくなる、また、ヒスチジン(H)が存在すると平均ピーク面積値が低くなることを示している。
【図8】図7と同様に測定、プロットしたものである。グリシンが多いほど平均ピーク面積値が大きくなることを示している。
【発明を実施するための形態】
【0019】
(評価用ペプチド)
本発明としては、天然に存在するタンパク質及びその変異体と一致せず、質量分析によって検出が可能であるアミノ酸配列からなり、かつタンパク質消化酵素によって認識されるアミノ酸を含むペプチドを選択し、当該ペプチドを、質量分析装置を用いたタンパク質定量のための評価用ペプチドとして使用する方法であれば特に制限されず、上記天然に存在するタンパク質及びその変異体と一致しないアミノ酸配列としては、未知又は既知のタンパク質と一致しないアミノ酸配列を挙げることができるが、既知のタンパク質と一致しないアミノ酸配列であることがより好ましい。また、既知のタンパク質と一致しないアミノ酸配列として、好適にSwiss-Prot等のデータベースに対して相同性検索によって、同一のアミノ酸配列が存在しないことが確認されたアミノ酸配列を例示することができる。
上記天然に存在するタンパク質には、相同タンパク質(ホモログ)やSNPs由来の変異箇所を有するタンパク質が含まれ、天然に存在するタンパク質の変異体としては、例えば、天然型タンパク質のアミノ酸配列において1又は複数のアミノ酸が欠失、置換若しくは付加されたアミノ酸配列からなるタンパク質を挙げることができ、より具体的には1若しくは数個のアミノ酸が欠失、置換若しくは付加されたアミノ酸配列からなるタンパク質を挙げることができる。
【0020】
質量分析計で検出が可能であるアミノ酸配列としては、具体的には例えばLC−MS/MSによって検出が可能であるペプチドを構成するアミノ酸配列であり、さらに具体的には、LC−MS/MSによって10fmolが検出可能であるペプチドを構成するアミノ酸配列が好ましい。LC−MS/MSによって10fmolが検出可能とは、例えば、アプライドバイオシステムズ社製LC/MS/MSシステム「API5000(商品名)」、「4000Q TRAP(登録商標)」等を用いて10fmolが検出可能であることをいう。
【0021】
タンパク質消化酵素によって認識されるアミノ酸を含むとは、タンパク質消化酵素によって認識され、切断部位となるアミノ酸を含むことを意味し、タンパク質消化酵素としてはエンドペプチダーゼが好ましく、例えば、トリプシンが挙げられる。本願発明の評価用ペプチドのアミノ酸配列の中で、タンパク質消化酵素によって認識される箇所は、アミノ酸配列のC末端であることが好ましく、C末端以外には当該タンパク質消化酵素によって認識されるアミノ酸を有しないことが好ましい。例えばタンパク質消化酵素としてトリプシンを用いる場合、評価用ペプチドは、C末端にリジン(K)又はアルギニン(R)を有することが好ましい。
【0022】
また、評価用ペプチドは安定同位体標識可能なアミノ酸を有し、安定同位体標識可能なアミノ酸としては例えば、ロイシン(L)、バリン(V)等が挙げられる。1つの評価用ペプチド中に、安定同位体標識可能なアミノ酸は1箇所であってもよいし複数箇所であってもよい。また、安定同位体標識可能なアミノ酸は1種類であっても複数種類であってもよいが、実施時のコスト等の観点からは1種類であることが好ましい。
【0023】
評価用ペプチドのアミノ酸残基数は特に制限されるものではないが、4〜30であることが好ましく、5〜15であることがより好ましく、8〜12であることがさらに好ましい。とりわけ、評価用ペプチドのアミノ酸残基数が8、10又は12であって、プロリン(P)及び/又はグリシン(G)を含み、かつ、ヒスチジン(H)を含まないものが好ましく、なかでも、1又は2のプロリンを含むことが好ましい。
アミノ酸残基数が8、10又は12であって、プロリン及び/又はグリシンを含み、かつ、ヒスチジンを含まないペプチドは、質量分析において強いシグナルを与えるため、より少量の添加でその存在を検出することができ、評価用ペプチドとして好適である。
【0024】
本発明の評価用ペプチドは、上記の条件と公知のクライテリアとを組み合わせて、その配列を設計することができる。公知のクライテリアとしては例えば、質量分析計を用いたタンパク質の分析に好適なペプチドを選択するためのクライテリア(例えば、WO2007/055116号公報に記載のクライテリア)を組み合わせることができる。
具体的には例えば、
トリプシン分解酵素により得られるペプチドであること;
トリプトファン、チロシン、バリン、ロイシン、イソロイシン、フェニルアラニンからなる疎水性アミノ酸の含量及び配列条件として、疎水性アミノ酸の含量が80%以下、好ましくは50%以下であり、かつ前記疎水性アミノ酸が10アミノ酸以上連続しないペプチドであること;
特定アミノ酸配列条件として、アスパラギン−X−Y(配列中、Xはプロリン以外のアミノ酸を表し、Yはセリン、スレオニン又はシステインを表す。)の配列を含まないペプチドであること;
タンパク質分解酵素切断部が、アルギニン−アルギニン、アルギニン−リジン、リジン−アルギニン、リジン−リジンではないペプチドであること;
メチオニン、システインを含まないペプチドであること;
トリプトファン、グルタミン酸を含まないペプチドであること;
等のクライテリアの1又は2以上を用いることができる。また、これらのクライテリアの各々にスコアを設定し、スコア合計の高いペプチドを設計することもできる。
【0025】
評価用ペプチドとして具体的には、配列番号1〜4に示されるアミノ酸配列によって構成されるペプチドが挙げられる。
【0026】
(人工標準タンパク質)
前記の評価用ペプチドを用いて人工標準タンパク質を設計することができ、本発明はまた、前記の評価用ペプチドのアミノ酸配列を2種類以上、かつ、1種類のアミノ酸配列について2箇所以上含むことを特徴とする人工標準タンパク質に関する。なお、本明細書においては、人工標準タンパク質に組み込んだ各評価用ペプチドの数を「組み込み数」という。
【0027】
人工標準タンパク質において、複数種類の評価用ペプチド(例えば、A,B,C,D)は複数種類の非評価用ペプチド部分(X)と共にランダムに組み込まれていてもよいし(例えば、A−B−X−B−C−B−X−A−B−C−A−X)、順番に配列されていてもよいが(例えば、X−A−X−B−X−A−B−X−A−B−X−A−B)、好ましくは、4種類以上の評価用ペプチドを順番に並べ(A−B−C−D)、さらに繰り返すことによって設計する(A−B−C−D−X−A−B−X−C−D;組み込み数2)。なお、非評価用ペプチド部分(X)を用いる場合、そのC末端はタンパク質消化酵素によって認識されるアミノ酸とすることが、タンパク質消化酵素によって評価用ペプチドを分離する上で必要である。
また、人工標準タンパク質は1分子中に2種類以上、かつ、1種類の配列について2箇所以上の評価ペプチドを有するため、タンパク質が完全にタンパク質消化酵素によって消化されたことを評価でき、加えて、タンパク質あたりの感度が高い。このため、質量分析装置を用いたタンパク質定量のための人工標準タンパク質として好適に使用できる。
【0028】
また、人工標準タンパク質はシステイン(S)を2つ以上有していることがより好ましい。システイン(S)は、評価用ペプチドのアミノ酸配列中に組み込まれていても良いし、評価用ペプチド以外の部位に組み込まれていてもよいが、好ましくは評価用ペプチド以外の部位(上記非評価用ペプチド部分Xの部位)である。
また、人工標準タンパク質は、評価用ペプチドの部位以外の配列、例えば、輸送シグナル配列や精製のためのタグ配列等を有していてもよく、精製のためのタグ配列を含んでいることが好ましい。
【0029】
人工標準タンパク質は例えば、次の方法で製造できる。すなわち、上記人工標準タンパク質のアミノ酸配列からcDNA配列を設計し、核酸オリゴ合成及びPCR等によって、cDNAを合成する。さらに、cDNAを発現ベクターに組み込み大腸菌等によってタンパク質を合成する。得られた合成タンパク質は、タグ配列を利用した精製法等の公知の条件・方法によって精製することができる。精製した人工標準タンパク質は、アミノ酸分析によって正確な量(濃度)を算出することができる。
【0030】
(人工標準タンパク質を用いたタンパク質の前処理評価及び定量)
本発明の人工標準タンパク質を用いた前処理評価及び被定量タンパク質の定量には、予め、評価用ペプチドの絶対量の定量のため、評価用ペプチドと同一の配列である安定同位体標識ペプチドを合成しておく。内部標準として加えられる安定同位体標識ペプチドは、15N,13C,18O,2Hのうち少なくとも一つの安定同位元素により標識される。LC−MS/MS測定の際、非標識の評価用ペプチドと内部標準である安定同位体標識された評価用ペプチドとは、質量差によって分離されるため、LC−MS/MSで分離可能な質量差が必要である。好ましくは13Cで6箇所標識されたロイシン(L)を含むペプチドを用いる。安定同位体標識ペプチドは、少なくとも一つのアミノ酸が安定同位元素で標識されていることが必要であり、当該ペプチドは、当業者に公知の任意の方法で調製することができる。例えば、安定同位元素により標識されたアミノ酸を用いてF−moc法(Amblard M, Fehrentz JA, Martinez J, Subra G. Methods Mol Biol.298:3-24(2005))等の適当な手段で目的の安定同位体標識ペプチドを化学合成することができる。このようにして得られた安定同位体標識ペプチドと定量対象ペプチドとは、標識アミノ酸の質量が異なる点以外では化学的に同一であり、LC−MS/MS測定において同一の挙動を示し、分析物と標準物の損失の程度は等しくなる。
【0031】
本発明に係るタンパク質定量においては、前処理前の定量対象タンパク質を含むタンパク質試料に、既知量、好ましくは100−10,000fmolの人工標準タンパク質を加え、さらにタンパク質消化酵素を添加し、前処理を行う(工程(a))。前処理とは、タンパク質消化酵素を添加し、人工標準タンパク質及び定量対象タンパク質を消化して、ペプチドとする処理をいう。タンパク質分解酵素としては、前述のトリプシン等を用いることができる。前処理の温度及び時間は、タンパク質消化酵素の標準的な反応条件を用いることができ、例えば、温度35℃〜45℃において、1分〜20時間前処理を行うことができる。
【0032】
前処理後、前処理工程により得られた試料に、既知量の安定同位体標識評価用ペプチドを加える。加える安定同位体標識評価用ペプチドの量は、既知量であればよいが、(人工標準タンパク質[mol]×組み込み数)に相当する量[mol]であることが好ましい。
また同時に、定量対象タンパク質の定量のために、定量対象タンパク質のタンパク質消化酵素による消化物と同一配列の、安定同位体標識ペプチドも添加する。
この試料を液体クロマトグラフ−タンデム質量分析(LC−MS/MS)によって測定し、定量対象タンパク質の定量と同時に、各評価ペプチドの絶対量を公知の内部標準法(例えば、国際公開公報WO07/055116号に記載の方法)によって計測する(工程(b))。
【0033】
添加した人工標準タンパク質の量(A[mol])と各評価ペプチドの定量値(B[mol])から、前処理効率の評価値を計算する(工程(c))。
評価値は、次式;
評価値=B/(A×組み込み数)
によって得られる。
【0034】
各評価ペプチド間の評価値が一定値であって0.80以上、好ましくは0.90以上の時に前処理が十分行われていると評価し、定量対象タンパク質について信頼性のある定量値が得られていると判断することができる(図1及び図2参照)。
評価値が一定値とは、例えば、人工標準タンパク質に含まれる複数種の評価ペプチドの評価値の間にばらつきが少なく、もしくは無く、具体的には、平均値からのばらつきが0.10以内である場合が挙げられる。
評価値が0.80以上とは、例えば、人工標準タンパク質に含まれる複数種の評価用ペプチドの評価値の平均値が0.80以上である場合が挙げられる。
【0035】
さらに、前工程により得られた前処理効率の評価値を用いて、定量対象タンパク質の定量値を算出することもできる。また、評価値が0.80より低い場合には、前処理に問題があり、測定値を採用せず、再測定又は測定方法の変更等を検討することができる。
【0036】
本発明はまたタンパク質定量用キットに関し、本発明のキットには、以下の(A)〜(C)が含まれる。
(A)人工標準タンパク質
(B)タンパク質消化酵素
(C)前記人工標準タンパク質の前記タンパク質消化酵素による消化物であるペプチドと同一の配列であって、安定同位体標識されたペプチド
キットに含まれる人工標準タンパク質、タンパク質消化酵素、及び、人工標準タンパク質の前記タンパク質消化酵素による消化物であるペプチドと同一の配列であって、安定同位体標識されたペプチドは、前記に詳述したものと同様であり、本発明のキットには上記(A)〜(C)以外にも必要と目的に応じて、緩衝液、pH調整剤、反応容器等が含まれていてもよい。
【0037】
以下、実施例により本発明をより具体的に説明するが、本発明の技術的範囲はこれらの例示に限定されるものではない。
【実施例1】
【0038】
(評価用ペプチドを含む人工標準タンパク質の調製及び、評価用ペプチドの感度の確認)
評価用ペプチドとして、VGAPGVPALK(配列番号1)、QIGDPTVPSGVK(配列番号2)、DAPGSGLK(配列番号3)、NVAPAGPTLK(配列番号4)を選択し、これら4種類のペプチドをそれぞれ2箇所ずつ含む人工標準タンパク質(配列番号5)を調製した(図3参照)。人工標準タンパク質の調製は次の方法によった。
1.IPTG誘導
人工標準タンパク質cDNAを挿入したpET−vectorをトランスフォーメーションした大腸菌 (BL21−CodonPlus (DE3)−RIPL)を、カナマイシン及びクロラムフェニコールをそれぞれ30mg/L、50mg/Lで添加したLB培地において一晩振盪培養した後、LB培地に希釈し、OD600が0.4付近の値を示すまで培養を行い、最終濃度100mMでIPTGを添加し、さらに3時間のインキュベートを行うことで、タンパク質の発現誘導を行った。誘導を行った大腸菌は、8M Ureaの存在下で超音波破砕を行い、可溶性画分と不溶性画分を調製した後、SDS−PAGEによって分画し、CBB R−250による検出を行った。
2.人工標準タンパク質の精製
コバルトレジンを充填したスピンカラムに、大腸菌可溶性画分を添加し、10mM Imidazole溶液でカラムを洗浄後、50mM,150mM, 500mMのImidazole溶液で人工標準タンパク質の溶出を行った。
【0039】
(評価用ペプチドの感度の確認)
人工標準タンパク質に挿入した4種類の評価用ペプチドの全てについて、10fmolでピークが検出されることを確認した。確認は以下の方法によった。
4種類の評価用ペプチド{VGAPGVPALK(配列番号1)、QIGDPTVPSGVK(配列番号2)、DAPGSGLK(配列番号3)、NVAPAGPTLK(配列番号4)}を混合し、LC−MS/MSのMRMモードにより、以下の条件で定量を行った。
カラム: Agilent 300SB−C18 0.5 mm ID×150mm,5μm particles
HPLC: Agilent1100 system
質量分析機: API5000
グラジエント条件: 1−45% アセトニトリル/0.1% ギ酸, 50μL/min,50min
【0040】
結果を図4に示す。図4のとおり、4種類の評価用ペプチド{VGAPGVPALK(配列番号1)、QIGDPTVPSGVK(配列番号2)、DAPGSGLK(配列番号3)、NVAPAGPTLK(配列番号4)}について、顕著なピークが確認され、10fmolでも検出可能なことが示された。
【実施例2】
【0041】
(評価用ペプチドを用いた前処理効率の評価1)
実施例1の人工標準タンパク質を用いて、タンパク質定量における前処理効率の評価をおこなった。評価用試料の調製及び評価は次の方法でおこなった。なお、評価用試料の操作は、実験操作に習熟しない者がおこなった。
1.ペプチド試料の調製
マウスから単離した腎臓形質膜サンプル50μgに人工標準タンパク質を10000fmol、比較例として大腸菌由来Triose Phosphate Isomerase(TPI)2200fmolを添加した。その後、7M 塩酸グアニジン溶液(0.1M Tris−HCl、10mM EDTA pH8.5に溶解)で変性させ、システイン残基のSH基を保護するために、DTTによる還元処理とヨードアセトアミドによるカルバミドメチル化処理を行なった。 続いて、メタノールクロロホルム沈殿法により、脱塩濃縮し、1.2M Urea/10mM Tris−HClに再懸濁した。その後、タンパク質重量の1/100量のトリプシンを加え、37度で16時間酵素消化してペプチド試料を得た。
2.ペプチド試料の定量分析
上記ペプチド試料に、500fmolの13C6,15N標識ペプチドを加えてLC−MS/MSで測定した。測定後、定量対象ペプチドピークと13C6,15N標識ペプチドとのMSスペクトル面積比を算出し、検量線を用いて定量値を算出した。
3.検量線の作成
選定した定量対象ペプチドを用いて、検量線を作成した。具体的には、10fmol、50fmol、100fmol、500fmol、1000fmolの非標識ペプチドにそれぞれ500fmolの13C6,15N標識ペプチドを添加した後、LC−MS/MSにより測定し、MSスペクトル面積比(非標識ペプチド/13C6,15N標識ペプチド)を算出し、検量線を作成した。
【0042】
結果を図5に示す。図5より、評価用ペプチドの評価値は50〜71%であり、評価値にばらつきがあり、また、いずれも低い値を示しているため、本実験のタンパク質の前処理が適当に行われなかったと判断された。一方、比較例のTPIは評価値が84%であり、TPIのみでは前処理の妥当性が正しく判断できないことがわかる。
【実施例3】
【0043】
(評価用ペプチドを用いた前処理効率の評価2)
実施例2と同様の方法で前処理効率の評価をおこなった。但し、評価用試料の操作は、実験操作に熟練した者がおこなった。また、人工標準タンパク質の添加量を250fmol、大腸菌由来Triose Phosphate Isomerase(TPI)の添加量を700fmolとした。
結果を図6に示す。図6より、評価用ペプチドの評価値は90〜97%であり、評価値にばらつきが少なく、いずれも高い評価値を示している。また、前処理のコントロールとしてのTPIは回収率が99%であり、評価用ペプチドが高い評価値を示した本実験のタンパク質の前処理は適当に行われたと判断された。評価値が高い値を示した図6では、評価値の低い図5よりTPI回収率が高く(図6:99%、図5:84%)、評価値と回収率に相関関係が認められることから、評価用ペプチドを用いた前処理評価の有効性が示された。
【0044】
[参考例1]より好ましい評価ペプチドの選定
ペプチド83種類(各500fmol)を、LC−MS/MS(ABI 4000QTRAP)のMRM modeによって解析し、ピーク面積値の平均値をペプチド長に対してプロットした。その結果、図7に示すとおりプロリン(P)の残基が多いほど平均ピーク面積値が大きくなる。また、ヒスチジン(H)が存在すると平均ピーク面積値が低くなる。また、図8に示すとおり、グリシンの残基が多いほど平均ピーク面積値が大きくなる。
上記の結果からアミノ酸残基数が8、10又は12であって、プロリン又はグリシンを有し、かつ、ヒスチジンを有しない評価用ペプチドは、LC−MS/MSで好適に検出できることがわかった。
【特許請求の範囲】
【請求項1】
天然に存在するタンパク質及びその変異体と一致せず、質量分析によって検出が可能であるアミノ酸配列からなり、かつタンパク質消化酵素によって認識されるアミノ酸を含むペプチドを選択し、当該ペプチドを、質量分析装置を用いたタンパク質定量のための評価用ペプチドとして使用する方法。
【請求項2】
天然に存在するタンパク質及びその変異体と一致しないアミノ酸配列が、既知のタンパク質と一致しないアミノ酸配列であることを特徴とする、請求項1に記載の方法。
【請求項3】
アミノ酸残基数が3〜20のペプチドであって、C末端にタンパク質消化酵素によって認識されるアミノ酸を有し、C末端以外には当該タンパク質消化酵素によって認識されるアミノ酸を有さず、天然に存在するタンパク質及びその変異体と一致しないアミノ酸配列からなる、質量分析装置を用いたタンパク質定量のための評価用ペプチド。
【請求項4】
安定同位体標識可能なアミノ酸を有することを特徴とする、請求項3に記載の評価用ペプチド。
【請求項5】
アミノ酸残基数が8、10又は12であって、プロリン又はグリシンを含み、かつ、ヒスチジンを含まないことを特徴とする、請求項3又は4に記載の評価用ペプチド。
【請求項6】
1又は2のプロリンを含むことを特徴とする、請求項5に記載の評価用ペプチド。
【請求項7】
下記(1)〜(4)に示すアミノ酸配列のいずれかによって構成されることを特徴とする、質量分析装置を用いたタンパク質定量のための評価用ペプチド。
(1)VGAPGVPALK(配列番号1)
(2)QIGDPTVPSGVK(配列番号2)
(3)DAPGSGLK(配列番号3)
(4)NVAPAGPTLK(配列番号4)
【請求項8】
請求項3〜7のいずれかに記載の評価用ペプチドを、質量分析装置を用いたタンパク質定量のために使用する方法。
【請求項9】
請求項3〜7のいずれかに記載の評価用ペプチドのアミノ酸配列を2種類以上、かつ、1種類の配列について2箇所以上含むことを特徴とする、質量分析装置を用いたタンパク質定量のための人工標準タンパク質。
【請求項10】
1分子中にシステインを2以上有することを特徴とする、請求項9に記載の人工標準タンパク質。
【請求項11】
請求項9又は10に記載の人工標準タンパク質を、質量分析装置を用いたタンパク質定量のための人工標準タンパク質として使用する方法。
【請求項12】
請求項9又は10に記載の人工標準タンパク質を、質量分析装置を用いたタンパク質定量のための人工標準タンパク質として使用する、タンパク質の定量方法。
【請求項13】
以下の(a)〜(c)の工程を順次備えたことを特徴とする、タンパク質の定量方法。
(a)定量対象タンパク質を含む試料中に、質量既知の人工標準タンパク質を添加し、さらにタンパク質消化酵素を添加して、定量対象タンパク質及び人工標準タンパク質を消化する工程;
(b)(a)工程により得られた試料中に、定量対象タンパク質及び人工標準タンパク質の消化物であるペプチドと同一配列であって、安定同位体標識されたペプチドを添加し、液体クロマトグラフ−タンデム質量分析(LC−MS/MS)測定を行う工程;
(c)(a)工程において添加した人工標準タンパク質の質量と、(b)工程の測定により得られた、人工標準タンパク質の消化物であるペプチドの質量との比率を算出することで、タンパク質消化酵素による処理効率を評価する工程;
【請求項14】
以下の(A)〜(C)を含むことを特徴とする、質量分析装置を用いたタンパク質定量用標準物質キット。
(A)請求項9又は10に記載の人工標準タンパク質;
(B)タンパク質消化酵素;
(C)前記人工標準タンパク質の前記タンパク質消化酵素による消化物であるペプチドと同一の配列であって、安定同位体標識されたペプチド;
【請求項1】
天然に存在するタンパク質及びその変異体と一致せず、質量分析によって検出が可能であるアミノ酸配列からなり、かつタンパク質消化酵素によって認識されるアミノ酸を含むペプチドを選択し、当該ペプチドを、質量分析装置を用いたタンパク質定量のための評価用ペプチドとして使用する方法。
【請求項2】
天然に存在するタンパク質及びその変異体と一致しないアミノ酸配列が、既知のタンパク質と一致しないアミノ酸配列であることを特徴とする、請求項1に記載の方法。
【請求項3】
アミノ酸残基数が3〜20のペプチドであって、C末端にタンパク質消化酵素によって認識されるアミノ酸を有し、C末端以外には当該タンパク質消化酵素によって認識されるアミノ酸を有さず、天然に存在するタンパク質及びその変異体と一致しないアミノ酸配列からなる、質量分析装置を用いたタンパク質定量のための評価用ペプチド。
【請求項4】
安定同位体標識可能なアミノ酸を有することを特徴とする、請求項3に記載の評価用ペプチド。
【請求項5】
アミノ酸残基数が8、10又は12であって、プロリン又はグリシンを含み、かつ、ヒスチジンを含まないことを特徴とする、請求項3又は4に記載の評価用ペプチド。
【請求項6】
1又は2のプロリンを含むことを特徴とする、請求項5に記載の評価用ペプチド。
【請求項7】
下記(1)〜(4)に示すアミノ酸配列のいずれかによって構成されることを特徴とする、質量分析装置を用いたタンパク質定量のための評価用ペプチド。
(1)VGAPGVPALK(配列番号1)
(2)QIGDPTVPSGVK(配列番号2)
(3)DAPGSGLK(配列番号3)
(4)NVAPAGPTLK(配列番号4)
【請求項8】
請求項3〜7のいずれかに記載の評価用ペプチドを、質量分析装置を用いたタンパク質定量のために使用する方法。
【請求項9】
請求項3〜7のいずれかに記載の評価用ペプチドのアミノ酸配列を2種類以上、かつ、1種類の配列について2箇所以上含むことを特徴とする、質量分析装置を用いたタンパク質定量のための人工標準タンパク質。
【請求項10】
1分子中にシステインを2以上有することを特徴とする、請求項9に記載の人工標準タンパク質。
【請求項11】
請求項9又は10に記載の人工標準タンパク質を、質量分析装置を用いたタンパク質定量のための人工標準タンパク質として使用する方法。
【請求項12】
請求項9又は10に記載の人工標準タンパク質を、質量分析装置を用いたタンパク質定量のための人工標準タンパク質として使用する、タンパク質の定量方法。
【請求項13】
以下の(a)〜(c)の工程を順次備えたことを特徴とする、タンパク質の定量方法。
(a)定量対象タンパク質を含む試料中に、質量既知の人工標準タンパク質を添加し、さらにタンパク質消化酵素を添加して、定量対象タンパク質及び人工標準タンパク質を消化する工程;
(b)(a)工程により得られた試料中に、定量対象タンパク質及び人工標準タンパク質の消化物であるペプチドと同一配列であって、安定同位体標識されたペプチドを添加し、液体クロマトグラフ−タンデム質量分析(LC−MS/MS)測定を行う工程;
(c)(a)工程において添加した人工標準タンパク質の質量と、(b)工程の測定により得られた、人工標準タンパク質の消化物であるペプチドの質量との比率を算出することで、タンパク質消化酵素による処理効率を評価する工程;
【請求項14】
以下の(A)〜(C)を含むことを特徴とする、質量分析装置を用いたタンパク質定量用標準物質キット。
(A)請求項9又は10に記載の人工標準タンパク質;
(B)タンパク質消化酵素;
(C)前記人工標準タンパク質の前記タンパク質消化酵素による消化物であるペプチドと同一の配列であって、安定同位体標識されたペプチド;
【図1】


【図2】


【図3】


【図4】


【図5】


【図6】


【図7】


【図8】




【図2】


【図3】


【図4】


【図5】


【図6】


【図7】


【図8】


【公開番号】特開2010−197110(P2010−197110A)
【公開日】平成22年9月9日(2010.9.9)
【国際特許分類】
【出願番号】特願2009−39937(P2009−39937)
【出願日】平成21年2月23日(2009.2.23)
【出願人】(504157024)国立大学法人東北大学 (2,297)
【Fターム(参考)】
【公開日】平成22年9月9日(2010.9.9)
【国際特許分類】
【出願日】平成21年2月23日(2009.2.23)
【出願人】(504157024)国立大学法人東北大学 (2,297)
【Fターム(参考)】
[ Back to top ]

