質量標識体
【課題】本発明の目的は、ペプチドの選択的単離及び標識に基づく複雑なタンパク質試料を比較分析する改良した方法を提供することである。
【解決手段】質量標識体のグループを複数含む質量標識体セットであって、セット内の前記質量標識体は、それぞれ、切断可能なリンカーを介して質量正規化部に結合している質量マーカー部を有し、セット内の前記質量標識体は、互いに質量が同じであり、グループ内の前記質量標識体において、前記質量マーカー部の質量は同じであり、グループ間の前記質量標識体において、前記質量マーカー部の質量が異なり、前記質量マーカー部は、2つ以上のフラグメントにフラグメンテーション可能であり、グループ内の前記質量標識体間で、前記質量マーカー部の少なくとも1つの前記フラグメントの質量が異なることを特徴とする質量標識体セットの提供。
【解決手段】質量標識体のグループを複数含む質量標識体セットであって、セット内の前記質量標識体は、それぞれ、切断可能なリンカーを介して質量正規化部に結合している質量マーカー部を有し、セット内の前記質量標識体は、互いに質量が同じであり、グループ内の前記質量標識体において、前記質量マーカー部の質量は同じであり、グループ間の前記質量標識体において、前記質量マーカー部の質量が異なり、前記質量マーカー部は、2つ以上のフラグメントにフラグメンテーション可能であり、グループ内の前記質量標識体間で、前記質量マーカー部の少なくとも1つの前記フラグメントの質量が異なることを特徴とする質量標識体セットの提供。
【発明の詳細な説明】
【技術分野】
【0001】
本発明は、質量標識体、特に、質量標識体のセット及びアレイに関する。質量標識体は、核酸、ペプチド、タンパク質等の検体の標識及び質量分析に有用である。
【背景技術】
【0002】
放射性原子、蛍光色素、発光試薬、電子捕捉試薬、光吸収色素等を用いた、所望の分子を標識する様々な方法が当該技術分野において知られている。これらの標識系は、それぞれ、特定の用途には適しているが、他の用途には適さないという特徴を有する。安全性の点から、非放射性標識系への関心が高まり、特に遺伝分析のための蛍光標識法が商業的に広く開発されている。蛍光標識法によれば、比較的少数の分子の同時標識が可能で、通常4、最大で8の標識体を同時に使用できる。しかし、検出装置が高価であり、生じたシグナルの分析が困難であるため、蛍光検出法で同時に使用できる標識体数は制限される。
【0003】
ごく最近、所望の分子に切断可能に結合した標識体の検出方法が、質量分析法の分野において開発されている。分子生物学への応用において、多くの場合、所望の分子を分析前に分離することが必要であり、その分離する方法として一般的に液相分離法が用いられる。最近の質量分析法では、液相分離用インターフェースが多数開発されており、これにより質量分析法がこのような応用において検出方法として特に効果的なものとなっている。最近まで、液体クロマトグラフィー質量分析法が検体イオン又はフラグメントイオンを直接的に検出するために用いられていたが、核酸分析等多くの場合では、間接標識によって検体構造を決定することができる。これは、特に質量分析法の使用に対して有利であるが、その理由は、DNAのような複雑な生体分子は複雑な質量スペクトルを持つので、検出感度が比較的低くなるからである。間接検出とは、もとの検体の同定に標識体分子を用いることができることを意味し、その場合には、検出感度が高く及び質量スペクトルが単純になるようにその標識体を作製する。質量スペクトルが単純であることは、複数の検体の同時分析に複数の標識体を用いることが可能であることを意味する。
【0004】
特許文献1に記載されている核酸プローブアレイは、切断可能な標識体に共有結合し、その標識体は質量分析法で検出可能であり、共有結合した核酸プローブ配列を同定する。この出願の標識したプローブは、Nu−L−M構造を有し、式中、NuはLに共有結合した核酸、Lは質量標識体Mに共有結合した切断可能なリンカーである。この出願において好ましい切断可能なリンカーは、質量分析計のイオン源内で切断する。質量標識体は、置換ポリアリールエーテルであることが好ましい。この出願において、質量分析法により質量標識体を分析する具体的な方法として、様々なイオン化法と四重極質量分析計、TOF分析計及び磁場型装置による分析が開示される。
【0005】
特許文献2において、リガンド、具体的には質量タグ分子に切断可能に結合した核酸が開示されている。切断可能なリンカーは光切断可能であることが好ましい。この出願では、質量分析法により質量標識体を分析する具体的な方法として、MALDI(マトリックス支援レーザー脱離イオン化)‐TOF(飛行時間)質量分析法が開示されている。
【0006】
特許文献3において、放出可能な非揮発性の質量標識体分子が開示されている。好ましい実施形態では、質量標識体は高分子を含み、この高分子は通常、反応基又はリガンド、即ちプローブに切断可能に結合した生体高分子である。切断可能なリンカーは、化学的又は酵素的に切断可能であることが好ましいと考えられる。質量分析法により質量標識体を分析する具体的な方法として、MALDI‐TOF質量分析法が開示されている。
【0007】
特許文献4、特許文献5及び特許文献6において、リガンド、具体的には質量タグ分子に切断可能に結合した核酸が開示されている。切断可能なリンカーは化学的又は光切断可能であることが好ましいと考えられる。これらの出願において、質量分析法により質量標識体を分析する具体的な方法として、様々なイオン化法と四重極質量分析計、TOF分析計及び磁場型装置による分析が開示されている。
【0008】
非特許文献1において、「同位体コード化アフィニティータグ」を用いてタンパク質からペプチドを捕捉し、タンパク質の発現分析を可能とすることが開示されている。この論文において、チオール反応性のビオチンリンカーを、システインを有するペプチドを捕捉するために用いることが記載されている。1つの材料から得られたタンパク質の試料をビオチンリンカーと反応させ、エンドペプチダーゼにより切断する。ビオチン化システイン含有ペプチドをアビジンビーズで単離することにより、後続する質量分析法による分析が可能となる。1番目の試料をビオチンリンカーで標識し、2番目の試料を重水素化したビオチンリンカーで標識することで、これらの2つの試料を量的に比較することができる。そして、それらの試料における各ペプチドは、質量スペクトルにおいて一対のピークとして現れる。質量スペクトルの各タグに対応するピークを積分することにより、タグに結合したペプチドの相対発現量とすることができる。
【0009】
この「同位体コード化」法には多数の制限がある。第1はタンパク質中にチオールが存在するか否かに依存することである。すなわち、チオールを数個有するものもあるが、有さないタンパク質は多数ある。この方法の変形として他の側鎖、例えばアミンと反応するようにリンカーを設計してもよい。しかし、多くのタンパク質は、1個以上のリシン残基を含有するので、一般に、このアプローチで、タンパク質1個当たり複数のペプチドが単離されることになる。これは、質量分析法による分析の際の試料の複雑さを十分に減少させることにならない可能性がある。試料に含まれるペプチド種が多すぎると、「イオン抑制」を受ける可能性がある。このイオン抑制では、通常、それほど複雑でない試料の質量スペクトルに現われる他種に優先して特定種がイオン化する。
【0010】
このアプローチの第2の制限は、異なる試料のタンパク質の発現レベルを比較する際に使用する方法である。異なる同位体による別個のアフィニティータグで各試料を標識すると、各試料の各ペプチドの質量スペクトルに別のピークを生じる。これは、2つの試料を合わせて分析するとスペクトル中のピーク数は2倍になることを意味する。同様に、3つの試料を合わせて分析する場合、試料1個のみよりも3倍複雑になることを意味する。ピークの数が増加し続けると、質量スペクトル上で、2個の異なるペプチドのピークが重なる可能性が高まることになるため、このアプローチに限界があることは明らかである。
【0011】
上記論文の筆者らが報告している更なる制限は、タグに起因する移動度の変化である。重水素化ビオチンタグで標識したペプチドは重水素化していないタグで標識した同一のペプチドに少し遅れて溶出すると筆者らは報告している。
【0012】
検体材料に対して作成した質量スペクトルは、混入物に対する感度が非常に高い。基本的に、イオン化可能であれば質量分析計に導入されたどんな材料も質量スペクトルに現われる。これは、多くの分析にとって、質量分析計に導入する前に検体を入念に精製することが必要であることを意味する。質量標識体を使った検体の間接分析用高処理システムでは、不必要な試料調製工程を避けることが望ましい。即ち、混入材料の背景にある標識体を検出でき、検出ピークが事実上確実に標識体に相当していることが望ましい。質量分析法に基づく検出系で達成できるシグナル対ノイズ比が改善され、あるいは、質量標識体の存在によりスペクトル中の質量ピークが生じたことを確認できる方法又は組成が先行技術では開示されていない。
【0013】
液体クロマトグラフィー又は電気泳動分離の後の検体の検出では、使用する標識体の分離プロセスへの妨害が最少であるのが望ましい。前記標識体のアレイを使用する場合、アレイの各標識体の結合した検体への作用は、他の全ての標識体と同一であるのが望ましい。これは、質量に基づいて質量分析計中で分解可能な標識体アレイを生成しなければならない質量マーキングの意図とある程度矛盾する。上記の先行技術では、好ましくは質量標識体を4ダルトン毎に分解し、別の標識体のピークによるある標識体からの同位体ピークへの妨害を防ぐべきであると開示されている。これは、250個の異なる質量標識体の生成には、約1000ダルトン及び、おそらくはそれ以上の範囲を網羅する標識体が必要であることを意味する。その理由は、正確に4ダルトンで分離される大型標識体アレイを生成するのは簡単ではないからである。この範囲の質量は、ほぼ確実に、質量分析法による検出に先行する分離プロセスに対して別異の作用を呈する質量標識体を生じることになる。質量分析計がイオンを検出できる質量範囲が増加するにつれて装置コストが増加するという点で、それは装置の設計にも重要である。
【0014】
特許文献7及び特許文献8は、質量分析する検体の標識に適した質量標識体セットを開示する。質量標識体は、質量正規化部に切断可能なリンカーで結合する質量マーカー部を含む。質量標識体セットは、総質量が同じ質量標識体を多数含むが、質量マーカー部が異なる質量を有するため、質量分析法により互いに識別可能である。よって、そのようなセットのより高い質量の質量マーカー部を含む質量標識体は、より低い質量の質量正規化部を含み、逆もまた同様である。
【0015】
これらの質量標識体は、特に、タンデム質量分析法に適切である。第1工程において、特定の質量/電荷比のイオン化された質量標識体が選択される。第2工程において、選択された質量標識体が衝突誘起解離によりフラグメント化され、質量マーカー部が検出される。
【0016】
しかしながら、非常に多くの検体が標識、及び質量分析法で識別可能である質量標識体セットが更に必要である。特に、容易な方法で非常に多くの固有の標識体が作製できる質量標識体セットが必要である。
【0017】
【特許文献1】国際公開第98/31830号パンフレット
【特許文献2】国際公開第95/04160号パンフレット
【特許文献3】国際公開第98/26095号パンフレット
【特許文献4】国際公開第97/27327号パンフレット
【特許文献5】国際公開第97/27325号パンフレット
【特許文献6】国際公開第97/27331号パンフレット
【特許文献7】国際公開第01/68664号パンフレット
【特許文献8】国際公開第03/025576号パンフレット
【非特許文献1】ギギ(Gygi)ら、Nature Biotechnology 17:994−999、「同位体コードアフィニティータグを用いた複合タンパク混合物の定量分析」1999
【発明の開示】
【発明が解決しようとする課題】
【0018】
本発明の目的は、ペプチドの選択的単離及び標識に基づく複雑なタンパク質試料を比較分析する改良した方法を提供することである。
【課題を解決するための手段】
【0019】
従って、本発明は、質量標識体のグループを複数含む質量標識体セットであって、セット内の前記質量標識体は、それぞれ、切断可能なリンカーを介して質量正規化部に結合している質量マーカー部を有し、セット内の前記質量標識体は、互いに質量が同じであり、グループ内の前記質量標識体において、前記質量マーカー部の質量は同じであり、グループ間の前記質量標識体において、前記質量マーカー部の質量が異なり、前記質量マーカー部は、2つ以上のフラグメントにフラグメンテーション可能であり、グループ内の前記質量標識体間で、前記質量マーカー部の少なくとも1つの前記フラグメントの質量が異なる。
【0020】
更なる態様において、本発明は、上記に示す複数の質量標識体セットを含み、質量標識体の共通質量が各セットで異なる質量標識体アレイを提供する。
【0021】
本発明の質量標識体セットは、更にフラグメント化可能な質量マーカー部を使用することで質量標識に更なる特徴を提供する。本発明の質量標識体セット(同一の総質量を有する質量標識体を含む)は、同一質量を有する質量マーカー部を含む質量標識体グループを含むが、質量分析法で互いに識別可能である。これは、特許文献7及び特許文献8の質量標識体セットとは対照的であり、質量標識体の総質量、又は質量マーカー部の質量は、質量標識体が識別できるように異ならなければならない。
【0022】
本発明の質量標識体の質量マーカー及び質量正規化部は、同一質量を有する質量マーカー部が、特定の質量マーカー部から生じる対応するフラグメントの質量が異なることで、互いに識別できるように異なって標識され得る。
【0023】
好適な実施形態において、同一質量を有する質量マーカー部が同位体標識体によって互いに識別できるように作製され得る。1つ以上の同位体標識体が質量標識体に含まれ、質量標識体間で同位体標識体の位置が異なる。共通質量を有する質量マーカー部を含む質量標識体の全グループにおいて、1つ又は複数の同位体標識体が、特定の質量マーカー部(すなわち、特定の質量標識体)から生じる異なるフラグメントに含まれてもよい。
【0024】
同位体標識体は、2H、13C、15N、18O等の自然発生する低存在度の同位体を含む原子又は置換基を含んでもよい。同位体標識体の特性は、同位体標識体を含むフラグメントを、例えば、主に自然発生する同位体(すなわち、1H、12C、14N、又は16O)を含む同位体標識体を含まない対応するフラグメントと識別可能であるならば、特に限定されない。
【0025】
本発明のある実施形態の同位体標識体を使用することで、化学的に同一である(すなわち、同一の化学種であるが、特定の位置で同位体組成のみ異なる)質量標識体のグループ及びセットが作製できる。これは、各質量標識体の複雑で異なる化学的合成を必要としない、容易で効率的な方法で非常に多くの質量標識体を識別可能にする。
【0026】
先行技術は、質量標識体の質量を変える方法として同位体置換の使用を示唆しているが、本発明の実施形態は、質量マーカー部を含む質量標識体での同位体標識体の使用と質量正規化部とを組み合わせる。特許文献7及び特許文献8に開示される方法と比較して、本発明は、質量標識の追加的な特徴を可能にする。すなわち、固有の質量の質量マーカー部を含む各質量標識体が、質量マーカー部のフラグメントの質量が異なる複数の固有の質量標識体の作製に使用できる。
【0027】
上述のように、特許文献7及び特許文献8に開示の質量標識体は、タンデム質量分析法で識別可能である。共通質量を有する質量マーカー部を含む本発明の個別の質量標識体は、質量マーカー部がフラグメント化され、及びフラグメントが検出される追加的な質量分析工程により分解できる。よって、本発明の方法は、「トリプル」質量分析プロセスに関連すると考えてもよい。第一段階において、質量標識体が検体から分離され(例えば、質量分析器における衝突誘起解離による分離)、第二段階において、分析する質量標識体が選択される。第二段階において、質量標識体が質量分析器で解離され、質量正規化部から質量マーカー部を遊離され、第三段階での更なるフラグメント化及び分析する質量マーカー部が選択される。
【0028】
本発明により提供される追加的な標識の特徴は、所望でない複雑性を回避するために、以前は見落とされていた実験情報を解明するために実質的に使用できる。例えば、複数の実験条件の試料は、各試料の検体の量が定量化できるように、異なる質量マーカー部を含む質量標識体でそれぞれ標識されてもよい。一般的に、各実験条件は、再現性及び統計的有意性を確立するために何度繰り返してもよい。多数の異なる実験条件に関する複雑な実験プロトコルにおいて、(例えば、質量標識体の数が制限され、又は単に複雑性を低減するために)標識する前に各実験条件の繰り返しをプールしてもよい。
【0029】
しかしながら、本発明により、各実験条件の試料は、特定の質量を有する質量マーカー部を含む質量標識体で標識でき、各繰返しで生じる試料を質量マーカー部における同位体標識体の位置が異なる質量標識体で標識することで個別の繰返し間の差異が検出できる。よって、特定の実験条件の繰返しで生じる試料は、個別の質量標識体のグループの中から特定の質量標識体でそれぞれ標識され、グループ内の各質量標識体は、共通質量の質量マーカー部を有するが、質量マーカー部のフラグメントの質量が異なる。試料がこのように標識されると、二段階タンデム質量分析を行って各実験条件の結果をプールする。各条件に対する個別の繰返しの結果が必要とされれば、質量マーカー部がフラグメント化され、フラグメントが分析される更なる質量分析工程が行われる。
【0030】
本発明の質量標識体セットは、バックグラウンドに材料が混入されても検出及び同定できる。更に、本明細書で開示される標識体セット及びアレイは、標識体が分離プロセスを実質的に妨害しないように圧縮した質量範囲で分解でき、限定範囲の質量対電荷比でイオンを検出する質量分析計中で容易に検出できる。本発明の標識体セットは、生体分子に対するアッセイ、特にペプチド分析用に処理量、シグナル対ノイズ比及び感度を最大化する。
【0031】
本明細書中における質量マーカー部とは、質量分析法により検出する部分を意味し、本明細書中における質量正規化部とは、質量分析法により必ずしも検出されず、質量標識体が所望の総質量を有していることを確実にするために存在する部分を意味する。
【0032】
セットが複数の質量標識体を含んでいれば、セット内の質量標識体の数は特に限定されない。しかしながら、セットは2つ以上、3つ以上、4つ以上、又は5つ以上の質量標識体を含むのが好ましい。
【0033】
本発明は、また、1つのセットにおける各質量標識体の共通質量が、アレイ内の他のすべてのセットにおける各質量標識体の共通質量とは異なる上記の2つ以上の質量標識体を含む質量標識体アレイを提供する。
【0034】
本発明の好ましい実施形態において、グループ、セット又はアレイにおける質量標識体は全て化学的に同一である。グループ間の質量標識体の特性を変えるために、質量正規化部及び質量マーカー部の質量は好ましくは同位体置換によって変わるようにする。上記の同位体置換は、グループ内の質量マーカー部の特定のフラグメントの質量を変えるために使用することもできる。
【0035】
本発明の更に好ましい実施形態において、タグは増感基を含んでもよい。タグは好ましくは以下の構造を有する。
増感基−アミド結合−リンカー−反応性官能基
構造式中、増感基は、通常、質量マーカー部に結合し、質量分析計において質量マーカー部の検出感度を高めるものである。反応性官能基は増感基とは異なる部分に結合し存在するように示される。増感基は2つ以上の成分を含んでもよく、第1成分は、MS/MSイオン強度(一般的に、塩基性残基)を高め、第2成分は、MSイオン強度を高める。しかしながら、タグはこの様に限定される必要はなく、増感基を含むが、反応性官能基を有さない場合もある。他の実施形態において、増感基が反応性官能基と同じ部分に結合してもよい。
【0036】
本発明の一実施形態において、質量標識体はアフィニティー捕捉試薬を含む。アフィニティー捕捉リガンドは、ビオチンであることが好ましい。標識した検体と標識されていない検体とは、例えばアビジン固相において、アフィニティー捕捉リガンドにより捕捉することにより分離することができる。
【0037】
本発明の更なる態様において、生体分子又は生体分子の混合物を分析する方法を提供し、方法は、好ましくは下記工程を含む。
1.生体分子又は生体分子の混合物を本発明による質量標識体と反応させる。
2.標識した生体分子を電気泳動又はクロマトグラフィーにより任意に分離する。
3.標識した生体分子をイオン化する。
4.標識した生体分子の好ましいイオンの質量電荷比に対応する所定の質量電荷比を有するイオンを質量分析計で選択する。
5.衝突させることで選択されたイオンを誘起解離する。
6.質量マーカー部を含む衝突生成イオンを選択する。
7.質量マーカー部を含む衝突生成イオンを誘起解離する。
8.質量マーカー部から生じるフラグメントを検出する。
【0038】
本実施形態において、質量タグがアフィニティータグを含み、標識されていない生体分子から標識した生体分子を分離するために、アフィニティータグ付けした生体分子がカウンターリガンドにより捕捉されてもよい。この工程は、上記の任意の第2工程に先がけて行われることが好ましい。
【0039】
一実施形態において、所定の質量電荷比を有するイオンを選択する工程は、直列型分析器の最初の質量分析計で行われる。そして、本発明の第1態様の第5工程により、選択されたイオンはチャンネルを通して独立した衝突室に運ばれ、気体又は固体表面と衝突する。次に、衝突生成物は直列型分析器の更なる質量分析計に運ばれ、本発明の第1態様の第6工程により衝突生成物を検出する。質量マーカー部に対応するイオンが選択され、チャンネルを通して更なる衝突室に運ばれ、第7工程により解離される。第8工程の更なる質量分析計で質量マーカー部のフラグメントが検出される。
【0040】
通常用いられる直列型分析器として、トリプル四重極質量分析計、タンデムセクター型分析器、及び四重極飛行時間質量分析計等が挙げられる。
【0041】
他の実施形態において、所定の質量電荷比を有するイオンを選択する工程と、選択されたイオンを気体に衝突させる工程と、衝突生成物を検出する工程は、質量分析計の同じゾーンで行われる。例えば、イオントラップ型質量分析計やフーリエ変換イオンサイクロトロン共鳴型質量分析計において行われてもよい。
【0042】
他の好ましい態様において、本発明は下記構造の質量標識した分子のセット又はアレイを提供する。
検体−リンカー−標識体
構造式中、標識体は、本発明のセット又はアレイの質量マーカーであり、リンカーは、下記に示すリンカーであり、検体は、生体分子等の所望の検体であってもよい。本実施形態の1つの好適な態様は、セット又はアレイの検体(1、1を超える、又は、全ての検体)が、周知の質量又はクロマトグラフィーにおける所定の性質を有する標準的な検体である。このような標準的な検体を本発明の方法に用いて、例えばクロロマトグラフィーによる分離工程の結果を分析する際に、未知の検体と比較することができる。
【0043】
本発明は、ペプチド合成機で容易に作製される質量マーカーについて説明する。実に、本発明で使用される化合物は、ペプチド及び修飾ペプチドを含む。ペプチド合成は、自動で作製される選択された特性で広範囲のマーカーが可能である化学的多様性を提供する。
【0044】
質量分析計における「MS/MS」とは、イオンを選択し、選択したイオンを衝突誘起解離(CID)によりフラグメントイオンの更なる分析を行うことができる質量分析計を意味する。
【0045】
「直列型分析器」とは、質量分析計が直列に配置され、連結された質量分析計においてMS/MS処理の各工程が交互に行われるMS/MS可能な質量分析計を意味する。本発明は、特に連続する3つの分析工程を含む「MS/MS/MS」、「MS3」すなわち「トリプル」質量分析法に関する。通常用いられる直列型分析器として、トリプル四重極質量分析計、タンデムセクター型分析器、及び四重極飛行時間質量分析計が挙げられる。これらの機器は、トリプル質量分析法を可能にするために必要であれば変更される。
【発明を実施するための最良の形態】
【0046】
添付の図を参照しながら、本発明の更なる詳細について説明する。以下の説明は本発明の例示であり、本発明は以下の実施形態に限定されない。
【0047】
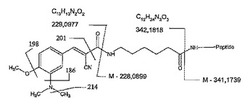
図1は、本発明での使用に適した標識した検体を示す。ペプチド(検体)は、質量マーカー部及び質量正規化部を含む質量標識体に結合する。質量標識体のイオンの質量電荷比、及び質量マーカー部のフラグメントを図1に示す。
【0048】
図2は、トリプル質量分析法により図1の質量標識体で標識されたモデル検体として水を分析して得た質量スペクトルを示す。第1工程において、質量標識体を含むイオンが質量分析器で選択される。これらのイオンは、質量正規化部から質量マーカー部を遊離させるために衝突誘起解離される。次に、質量マーカー部を含むイオンが選択され、更に衝突誘起解離工程が行われる。図2の質量スペクトルは、質量マーカー部から生じるフラグメントを示す。
【0049】
図3は、図2の質量スペクトルに示すピークを図1に示す質量標識体の構造と関連付ける図である。主なフラグメントは、186,198,201及び214に表れる主なピークに相当する。
【0050】
図4は、図1に示す質量標識体が、同位体標識体を異なる位置に含む質量標識体セットを作製する同位体標識方法を示す。質量標識体は、アスタリスク(*)が示す少なくとも1つ以上の好適な位置に1つ以上の同位体標識体を含んでもよい。質量マーカー部の同位体標識体が、図3に示すような異なるフラグメントに現れるように異なる位置に配置されることで質量マーカー部がフラグメント化する場合に、同じ質量を有する質量マーカー部が識別可能になる。このように同位体標識体は、例えば、耐フラグメント性を示すベンゼン環よりもむしろメトキシ基又はジメチルアミノ基等の置換基に位置する。アスタリスクが示す各位置において、1H,12C,14N及び16Oは、それぞれ2H,13C,15N及び18Oで置換されてもよい。
【0051】
質量マーカー部における同位体標識体の合計数は、質量標識体のグループ間で異なり、質量標識体の各グループは、同じ質量の質量マーカー部を含む。同位体標識体を質量正規化部へ加えることで、質量標識体の異なるグループ間の質量標識体の総質量のバランスを保つことができ、グループ間で質量マーカー部の同位体標識体の数が異なるにも関わらず、1つのセットにおける各質量標識体の総質量は同じである。
【0052】
これを本発明の1つの質量標識体セットで行う方法を図5に示す。質量標識体を図1に示すような検体に結合して示す。セット内の各質量標識体は共通質量を有し、構造は図1に示す質量標識体と化学的に同一である。各質量標識体は、アスタリスクが示す3つの同位体標識体を含む。同位体標識体は、15N原子(14N原子を置換)を含むグループ4における1つの質量標識体以外は、それぞれ13C原子(12C原子を置換)を含む。
【0053】
質量マーカー部(すなわち、質量正規化部でもある)における同位体標識体の数は、図5に示す質量標識体のグループ間で異なる。従って、グループ1の質量標識体は、質量正規化部に3つの同位体標識体を含み、且つ質量マーカー部に同位体標識体を含まない。グループ2の質量標識体は、それぞれ質量正規化部に2つの同位体標識体を含み、且つ質量マーカー部に1つの同位体標識体を含む。グループ3の質量標識体は、それぞれ質量正規化部に1つの同位体標識体を含み、且つ質量マーカー部に2つの同位体標識体を含む。グループ4の質量標識体は、それぞれ質量正規化部に同位体標識体を含まず、且つ質量マーカー部に3つの同位体標識体を含む。従って、質量マーカー部の質量/電荷比は、グループ間で異なる。
【0054】
図3は、質量/電荷比が186であるジメチルアミノ基がない(同位体置換なし)質量マーカー部のフラグメントを示す。図5に示す質量標識体セットにおいて、このフラグメントに存在する同位体標識体の数により特定のグループ内の質量標識体が識別可能である。従って、グループ2では、このフラグメントにおける同位体標識体の数は1又は0であり、このフラグメント(187又は186)の質量/電荷比のおかげでグループ2における2つの質量標識体が識別可能である。グループ3では、このフラグメントにおける同位体標識体の数は2、1又は0であり、異なる標識体から生じるフラグメントに対してそれぞれ質量/電荷比が188,187又は186である。グループ4では、このフラグメントにおける同位体標識体の数は3、2、1又は0であり、異なる標識体から生じるフラグメントに対してそれぞれ質量/電荷比が189,188,187又は186である。
【0055】
図5に示す質量標識体の構造を以下の表にまとめて示す。
【0056】
【表1】

【0057】
このように、図5に示す各質量標識体は、質量マーカー部の質量電荷比とフラグメントの質量電荷比との組合せに基づいて識別可能である。
【0058】
本発明に使用される質量標識体の一般構造体が、質量標識体が質量マーカー部及び質量正規化部を含むならば、例えば、国際公開第01/68664(特許文献7),03/025576(特許文献8),02/099435,03/087839及び2005/012914号パンフレットに記載の一般構造体に基づいてもよい。しかしながら、本明細書に記載の質量標識体セットは、上記の公開公報に記載の質量標識体セットとは異なる。なぜならば、本発明によると、質量標識体セットは、同じ質量の質量マーカー部を含む質量標識体を含み、質量マーカー部が質量分析器でフラグメント化される場合に、いずれにせよ、質量標識体は互いに識別できるからである。よって、上記公開公報の1つに開示される特定の質量標識体の質量マーカー部を(例えば、同位体標識体により)差別的に標識して、質量マーカー部をフラグメント化するだけで識別できる質量標識体のグループを作製することで、本発明で使用される質量標識体が作製できる。
【0059】
好適な一実施形態において、質量標識体セットは、国際公開第2005/012914号パンフレットに開示されるような増感質量タグの構造に基づく質量標識体を含むが、本発明のセットの新規の特徴も含む。本実施形態において、質量標識体セットは、好ましくは、マトリックス支援レーザー脱離イオン化(MALDI)質量分析法を使用して分析される。
【0060】
例えば、図5に示すような質量標識体セットの基礎を形成する質量標識体は、下記に示すプロトコルによって合成されてもよい。図5に示すようなペプチドに結合した標識体よりもむしろ末端2,5−ジオキソ−1−ピロリジニルエステルを含む標識体に対する合成を説明する。第1工程において、塩素化したリンカーが作製される。そして、塩素基は、シアン化物イオンで求核置換される。このシアノリンカーは、3−ジメチルアミノ4−ヒドロキシベンズアルデヒドで縮合され、遊離カルボキシル基を有する炭素鎖6のリンカーを有する桂皮酸誘導体を得る。前記遊離カルボキシル基は、活性化されて合成の最終工程においてNHSエステルを形成する。
【0061】
6−[2−シアン−3−(3−ジメチルアミノ−4−メトキシ−フェニル)アクリロイルアミノ]ヘキサン酸−(2,5−ジオキソ−1−ピロリジニル)エステルの合成
1. 6−(クロルアセトアミド)ヘキサン酸の合成
クロルアセチルクロリド18mL(221mMol)を、冷NaOH溶液(2N)80mLに溶解した6−アミノヘキサン酸20g(153mMol)に室温で滴下した。NaOH溶液(6N)を時々加えて溶液のpHを10〜11に保ちながら反応混合物を30分間撹拌した。そして、反応混合物のpHをHCl(2N)でpH5に変え、残留物がろ過された。次に、水のpHが中性になるまで残留物を水で洗浄した。生成物を五酸化リン上で乾燥し、クロロホルム300mlに再び溶解し、ろ過して、不溶解残留物を取り除いた。へプタンをろ液に加え、冷却しながら撹拌してシロップ剤を得た。生成物が、水からろ過、乾燥されて、結晶化された。
収量:20g(63%)
融点:82℃
【0062】
2. 6−(シアノアセトアミド)ヘキサン酸の合成
炭酸水素カリウム2.8g(20mMol)を、水25mlに溶解した6−(クロルアセトアミド)ヘキサン酸8.3g(40mMol)に加えた。シアン化カリウム3.2g(48mMol)を氷冷した澄明な液に加えた。反応混合物を17時間撹拌し、そして、HCl(2N)で酸性化した。抽出後の残留物をクロマトグラフィー(シリカゲル、溶媒:酢酸エチル)により精製した。
収量:6g(76%)
融点:80℃〜81℃
【0063】
3. 6−[2−シアン−3−(3−ジメチルアミノ−4−メトキシ−フェニル)アクリロイルアミノ]ヘキサン酸の合成
6−(2−シアン−アセチルアミノ)ヘキサン酸3.96g(20mMol)をピリジン27mlに溶解した。3−ジメチルアミノ−4−メトキシベンズアルデヒド3.64g(20mMol)及びピペリジン0.6mLを溶液に加え、反応混合物を20時間撹拌した。反応混合物の気化後、残留物を酢酸エチル150ml及び水150mlに溶解し、pHが純粋な酢酸で4.2に調製された。水相が酢酸エチルを用いて抽出された。回収された酢酸エチル相を、NaCl溶液で洗浄し、乾燥、蒸発させた。残留物を低圧で酢酸エチルを用いてSiO2クロマトグラフした。生成物を少量の酢酸エチルから結晶化した。
収量:4.6g(66%)
融点:130℃
【0064】
4. 6−[2−シアン−3−(3−ジメチルアミノ−4−メトキシ−フェニル)アクリロイルアミノ]ヘキサン酸−(2,5−ジオキソ−1−ピロリジニル)エステルの合成
N−ヒドロキシスクシンイミド0.78g(6.76mMol)及び6−[2−シアン−3−(3−ジメチルアミノ−4−メトキシ−フェニル)アクリロイルアミノ]ヘキサン酸2.43g(6.76mMol)をCH2Cl250mlに加えた。混合物を室温で20時間撹拌した。溶液をろ過し、蒸発した。残留物を、酢酸エチルを用いて、低圧下フロリジルでクロマトグラフした。結晶性生成物をジイソプロピルエーテルでペースト状にし、フィルターに回収した。
収量:1.9g(62%)
融点:104℃
【0065】
上記のプロトコルは、質量標識体の異なる位置に同位体標識体を取り込むために変えることができる。最終生成物において所定の位置に13C標識体を得るために、適切に13C標識した出発原料が使用できる。例えば、上記の工程1で使用されるクロルアセチルクロリド(又は、ブロモアセチルクロリド)の1つ又は両方の炭素原子が13Cで標識できる。13C標識クロルアセチルクロリド又はブロモアセチルクロリドは、例えば、13C標識クロル、又はブロモ酢酸(以下、試薬Aとする)から得てもよい。
【0066】
同様にして、工程1で使用される6−アミノヘキサン酸は、13C原子で様々な位置に標識されてもよい。13C標識6−アミノヘキサン酸は、例えば、13C標識酢酸(以下、試薬Bとする)を、Boc−4−アミノブチルブロミドとアルカリ性条件(リチウムジイソプロピルアミド)下で反応させて13C標識Boc−6−アミノヘキサン酸を形成し、HCl処理下でt−ブチルオキシカルボニル(Boc)保護基を取り除くことで得てもよい。
【0067】
図6は、上記の分子合成に基づく4つの質量標識体を示す。各質量標識体(a)〜(d)は、総質量が同一である。各質量標識体は、2つの13C同位体標識体を含む。質量標識体(a)〜(d)は、上記プロトコルの第1工程で使用する試薬を調製するために、下記の出発原料を使用して合成できる。
【0068】
【表2】

【0069】
フラグメントAは、図3に示す非同位体標識した質量標識体において質量電荷比が198の質量マーカー部のフラグメントである。フラグメントBは、図3に示す非同位体標識した質量標識体において質量電荷比が201の質量マーカー部のフラグメントである。
【0070】
質量標識体セットは上記の好適な実施形態に限定される必要はなく、上記に概略したように全ての標識体が質量分析法により識別可能であれば、例えば、複数の標識体を含んでもよい。
【0071】
セット内の各質量マーカー部が共通の基本構造を有し、セット内の各質量正規化部が共通の基本構造を有し、セット内の各質量標識体が1つ以上の質量調整部を含み、質量調整部が質量マーカー部の基本構造及び/又は質量正規化部の基本構造に結合し又はその中に位置することが好ましい。本実施形態において、質量マーカー部の質量調整部の数は標識体のグループ間で異なり、セット内の各質量標識体は同一総数の質量調整部を含む。
【0072】
共通の基本構造により、2つ以上の部分は実質同一の骨格構造、バックボーン又はコアを共有することを意味する。骨格構造、又はバックボーンは、例えば、1つ以上のアミノ酸を含んでもよい。骨格構造は、好ましくは、アミド結合で結合された複数のアミノ酸を含む。しかしながら、アリールエーテルユニット等の他のユニットもまた存在してもよい。共通の基本構造が変化しないように、骨格構造又はバックボーンは、ペンダント置換基、又は原子若しくは同位体で置換されてもよい。
【0073】
本発明は、複数の質量標識体セットのアレイも含む。本発明の質量標識体セットを複数含むものであれば、本発明の質量標識体のアレイは特に限定されない。アレイは、2つ以上、3つ以上、4つ以上又は5つ以上の質量標識体セットを含むのが好ましい。
【0074】
リンカー基
上述又は後述する説明において、所望の分子を本発明の質量標識体化合物に結合させるために使用するリンカー基について言及する。様々なリンカーが当該技術分野において公知であり、これらのリンカーは本発明の質量標識体とこれらに共有結合した検体との間に導入される。これらのリンカーのいくつかは切断可能であってもよい。オリゴ又はポリエチレングリコール又はこれらの誘導体をリンカーとして用いることができ、例えば、Maskos,U.&Southern,E.M. Nucleic Acids Research 20:1679−1684,1992に開示されたものを用いることができる。コハク酸系リンカーも広く用いられているが、一般に塩基に不安定であり、多数のオリゴヌクレオチド合成で使用されている塩基介在脱保護工程には不適合であるため、オリゴヌクレオチドの標識には好ましくない。
【0075】
プロパルギルアルコールは二官能リンカーであり、オリゴヌクレオチド合成の条件下で安定した結合を提供し、本発明でオリゴヌクレオチドを用いる場合に、好適に使用されるリンカーである。同様に、6−アミノヘキサノールは、適切に官能基を付与した分子の結合に有用な二官能試薬であり、好適なリンカーでもある。
【0076】
光切断可能なリンカーなどの多様な公知の切断可能なリンカー基を本発明の化合物と併用できる。オルソニトロベンジル基は、光切断可能なリンカーとして公知であり、特に、2−ニトロベンジルエステルや2−ニトロベンジルアミンは、ベンジルアミン結合で切断する。切断可能なリンカーの概要については、様々な光切断可能及び化学的切断可能なリンカーについて言及している、Lloyd−Williamsら、Tetrahedron 49,11065−11133,1993を参照されたい。
【0077】
国際公開第00/02895号パンフレットにおいて、切断可能なリンカーとしてビニルスルフォン化合物が開示されている。これらは本発明においても使用することができ、特にポリペプチド、ペプチド及びアミノ酸の標識に用いられる。この出願の内容を参照することにより本明細書に援用する。
【0078】
国際公開第00/02895号パンフレットにおいて、気相中で塩基により切断可能なリンカーであるシリコン化合物の使用が開示されている。これらのリンカーも本発明で使用することができ、特にオリゴヌクレオチドの標識に用いられる。この出願の内容を参照することにより本明細書に援用する。
【0079】
本発明の質量標識体は、検体への結合を助ける反応性官能基Reを含んでもよい。本発明の好適な実施形態において、Reは、反応性官能基、又は質量標識体を検体分子における適切な官能基に共有結合反応させる基である。検体分子は、ヌクレオチド、オリゴヌクレオチド、ポリヌクレオチド、アミノ酸、ペプチド、及びポリペプチド等が挙げられるが、これらに限定されない。反応性官能基はリンカーで質量標識体に結合してもよく、リンカーは切断可能であってもなくてもよい。本発明の質量標識体には、様々な反応性官能基を導入してもよい。
【0080】
下記表3に、生体分子の求核性官能基と反応して2つの物質間に共有結合を形成する反応性官能基をいくつか列挙する。オリゴヌクレオチドの合成における使用においては、第一級アミン又はチオールが分子の終端に頻繁に導入され、標識が可能となる。以下に列挙された官能基であれば、いずれも本発明の化合物に導入することができ、質量マーカーを所望の分子に結合させることができる。必要であれば、反応性官能基を用いて反応性官能基を更に有するリンカー基を更に導入することができる。なお、表3は全てを網羅したものではなく、本発明は列挙された官能基のみの使用に限定されない。
【0081】
【表3】

【0082】
ここで留意すべきことは、本発明の質量マーカーをオリゴヌクレオチドの標識に用いる場合に、上記の反応性官能基の一部又はそれらの生成結合基は、オリゴヌクレオチド合成機に導入する前に保護されなければならないことである。好ましくは、非保護エステル、チオエーテルとチオエステル、アミンとアミド結合は、オリゴヌクレオチド合成機中で、通常安定しないので避けるべきである。多様な保護基が当該技術分野において公知であり、それらを使用すれば結合を望ましくない副反応から保護することができる。
【0083】
以下の説明において、「電荷輸送官能基」及び可溶化基について言及する。これらの基は、イオン化と溶解度を促進するために、本発明の質量マーカー等の質量標識体に導入されてもよい。陽イオン検出又は陰イオン検出のどちらを用いるかによって、選択するマーカーは異なる。以下の表4は、陽イオン化又は陰イオン化を促進するために質量マーカーに導入されてもよい官能基をいくつか示す。表はこのような官能基の全てを網羅したものではなく、本発明は以下に列挙された官能基のみの使用に限定されない。
【0084】
【表4】

【0085】
国際公開第00/02893号パンフレットは、質量マーカーのイオン化の向上を図るため、クラウンエーテルやポルフィリン等の金属イオン結合部分の使用を開示する。これらの部分は、本発明の質量マーカーの使用に用いることもできる。
【0086】
本発明の質量マーカー部の構成要素は、衝突誘起解離(CID)により容易に壊れるような結合を行うことにより、マーカーのフラグメンテーション部を制御可能なようにフラグメント耐性を有することが好ましい。しかしながら、質量マーカー部が2つ以上のフラグメントにフラグメント化可能であることが重要である。アリールエーテルは、本発明で使用してもよい耐フラグメント化合物類の例である。また、これらの化合物は、化学的に不活性であり、熱的に安定している。国際公開第99/32501号パンフレットは、より詳細に質量分析法でのポリエーテルの使用について論じており、この出願の内容を参照することにより本明細書に援用する。
【0087】
過去に、アリールエーテル合成の一般的方法は、約200℃、銅粉末の存在下でのフェノールとのアリールブロマイドのウルマンカップリングに基づいていた(代表的参考文献:H.Stetter,G.Duve,Chemische Berichte 87(1954)1699)。さらに温和なアリールエーテル合成法は、異なる金属触媒を使って開発されているが、反応温度は、依然として100℃〜120℃である(M.Iyoda,M.Sakaitani,H.Otsuka,M.Oda,Tetrahedron Letters 26(1985)477)。これは、ポリエーテル質量標識体生成の好ましい経路である。以下の実施例に示すFT77の合成を参照されたい。最近発表された方法は、これまでの方法よりもはるかに温和な条件下で実施するので、ポリエーテル質量標識体の生成に最も好ましい経路である(D.E.Evans,J.L.Katz,T.R.West,Tetrahedron Lett.39(1998)2937)。
【0088】
本発明は、また、2つ以上のプローブからなるセットを提供し、セット内の各プローブが異なり、上記のように定義された質量標識体セット又はアレイの中から固有の質量標識体若しくは固有の質量標識体の組合せに結合する。
【0089】
更に、2つ以上のプローブセットを含むプローブアレイも提供し、いずれかのセット内の各プローブは、上述のように定義された質量標識体セットの中から固有の質量標識体又は固有の質量標識体の組合せに結合し、いずれかのセットにおけるプローブが同じ質量標識体セットの質量標識体に結合し、各プローブセットは、上述のように定義された質量標識体アレイの中から固有の質量標識体セットの質量標識体に結合する。
【0090】
一実施形態において、各プローブは固有の質量標識体の組合せに結合することが好ましく、質量標識体セットの各質量標識体の存在又は不在により、及び/又はプローブに結合した各質量標識体の量により各質量標識体の組合せを識別する。このことは、質量標識体の混合物にプローブが結合していてもよいことから、本発明における「混合モード」と示す。
【0091】
上記の態様において、プローブの性質は特に限定されないが、各プローブは生体分子を含むことが好ましい。どのような生体分子でも用いることができるが、DNA、RNA、オリゴヌクレオチド、核酸塩基、ペプチド、ポリペプチド、タンパク質及びアミノ酸から選択される生体分子であることが好ましい。
【0092】
好適な一実施形態において、本発明は、下記の構造のヌクレオチド、オリゴヌクレオチド及びポリヌクレオチド等の質量標識した検体のセット及びアレイを提供する。
検体−リンカー−標識体
構造式中、リンカーは上記に定義するリンカーであり、標識体は、上記に定義するセット及びアレイの質量標識体である。
【0093】
上記の態様において、検体の性質は特に限定されない。しかしながら、好ましくは、各検体は生体分子を含む。どのような生体分子でも用いることができるが、DNA、RNA、オリゴヌクレオチド、核酸塩基、ペプチド、ポリペプチド、タンパク質及びアミノ酸から選択される生体分子であることが好ましい。
【0094】
一実施形態において、各検体は固有の質量標識体の組合せに結合していることが好ましく、質量標識体セットの各質量標識体の存在又は不在により、及び/又はプローブに結合した各質量標識体の量により各質量標識体の組合せを識別する。上述したように、このことは、質量標識体の混合物にプローブが結合していてもよいことから、本発明における「混合モード」と示す。
【0095】
上述のように、本発明は、検体に固有の質量標識体又は質量標識体の組合せを質量分析法により同定して検体を検出する工程を含む分析方法を提供し、質量標識体は上述のように定義した質量標識体セット又はアレイの質量標識体である。本発明の質量標識体を用いて検体を同定することにより方法が有利になるのであれば、方法は特に限定されない。方法として、例えば、核酸塩基配列決定法や、試料のタンパク質の量を検出することで1つ以上の遺伝子発現をプロファイルする方法等が挙げられる。複数の生体分子を同時に分析するのに容易に用いることができるため、この方法は特に有効である。しかし、個々の検体の分析にも効果的な方法である。これは、本発明の質量標識体を用いると、従来のスペクトルよりもすっきりとした質量スペクトルが得られ、この方法の正確性及び感度が高まるためである。
【0096】
更に好ましい実施形態において、本発明は、下記工程を含む方法を提供する。
(a)1つ以上の検体をプローブセット又はプローブアレイに接触させる。セット内又はアレイ内の各プローブは少なくとも1つの検体に特異的なものであり、プローブは上記のように定義されたものである。
(b)検体に特異的なプローブを検出して生体分子を同定する。
【0097】
本実施形態において、質量分析法により質量標識体を検出する前に、プローブから質量標識体が切断することが好ましい。
【0098】
この特定の実施形態における方法の本質は特に限定されないが、方法は1つ以上の核酸をハイブリッド形成プローブセットに接触する工程を含むことが好ましい。ハイブリッド形成プローブセットは、通常、最大で256 4マーのセットを含み、セット内の各プローブは異なる核酸塩基の組合せを有する。この方法は、標的核酸の存在を同定するのに適していてもよく、又はプライマー伸長における1つ以上の核酸の鋳型の塩基配列決定の方法に段階的に用いることができる。
【0099】
主に多くの標識体を同時に識別することが可能であることから、本発明の質量標識体は二次元分析方法での使用に特に適している。このため、標識体は二次元ゲル電気泳動法又は二次元質量分析法に用いてもよい。
【0100】
質量変動アミノ酸
様々なアミノ酸が質量マーカー部及び質量正規化部に使用できる。例えば、本発明の第1及び第4実施形態において、アミノ酸1及びアミノ酸2を記した位置で、(イオン化を促進し、感度を高めるので)中性アミノ酸が質量正規化部に好ましく使用され、帯電アミノ酸が質量マーカー部に好ましく使用される。下記表5に、同位体によって質量変動された市販のアミノ酸を示す。この表に示した1、2、3又は4つ以上のアミノ酸の組合せはいずれも、本発明の各質量マーカー部又は質量正規化部に好ましく用いられる。また、本発明によると、質量マーカー部のフラグメントが、異なる質量標識体では質量を異なって有するように、質量マーカー部自体が、グループ内で異なる質量標識体に変動されることも重要である。これは、例えば、質量標識体のグループにおいて質量マーカー部を形成するアミノ酸の特定の組合せを差別的に同位体標識することで行うことができる。
【0101】
【表5】

【0102】
反応性官能基
既に説明したように、本発明のいくつかの態様において、本発明の質量タグは反応性官能基を含む。最も簡潔な実施形態において、これは、本発明のタグペプチドのC末端の活性化により導入されたN−ヒドロキシスクシンイミドエステルであってもよい。従来の合成において、ペプチド質量タグがペプチド質量タグ合成の原産物から精製された後で、活性化工程を行う必要がある。N−ヒドロキシスクシンイミド活性化質量タグは、ヒドラジンと反応して、ヒドラジド反応性官能基を生成することもできる。これは、例えば、過ヨウ素酸酸化糖部分の標識に用いることができる。アミノ基又はチオールを反応性官能基として用いることもでき、これらは、タグの結合後にリシン又はシステインを結合することで導入してもよい。リシンを用いて、タグを遊離カルボキシル官能基に結合することができる。この場合、カルボジイミドをカップリング剤として用いる。本発明のタグに他の反応性官能基を導入するにあたって、最初にリシンを用いることもできる。リシンεアミノ基を無水マレイン酸に反応させることにより、チオール反応性マレイミド官能基を導入することができる。様々なアルケニルスルフォン化合物を合成するにあたって、チオールとアミンに反応する有用なタンパク質標識試薬であるシステインチオール基を最初に用いることができる。アミノヘキサン酸等の化合物を用いて、質量マーカー部と質量正規化部との間に、スペーサーを設けることができる。
【0103】
アフィニティー捕捉リガンド
本発明の特定の実施形態の第1の態様において、質量マーカーはアフィニティー捕捉リガンドを含む。アフィニティー捕捉リガンドは、特異性の高い結合相手を有するリガンドである。これらの結合相手により、結合相手がリガンドでタグされた分子の選択的な捕捉が可能になる。結合相手により固相担体が誘導体化することが好ましく、それによりアフィニティーリガンドでタグされた分子は選択的に固相担体に捕捉される。好ましいアフィニティー捕捉リガンドはビオチンであり、当該技術分野において公知の標準的な方法により本発明のペプチド質量タグに導入することができる。特にリシン残基は、アミノ酸2の後に導入することができ、これを介してアミン反応性ビオチンがペプチド質量タグに結合できる(例えば、Geahlen R.L.ら、Anal Biochem 202(1):68−67「カルボキシ末端をビオチニル化したペプチドの一般的作製方法」1992;Sawutz D.G.ら、Peptides 12(5):1019−1012「[Lys]ブラディキニンのビオチニル化類似化合物の合成及び分子特性分析」 1991;Natarajan S.ら、Int J Pept Protein Res 40(6):567−567「部位特異的ビオチニル化。エンドセリン―1類似化合物及びPTH−1類似化合物の新規アプローチとその応用」、1992を参照)。また、イミノビオチンを用いることもできる。ビオチンに対する様々なアビジンカウンターリガンドを使用することができる。アビジンカウンターリガンドには単量体及び四量体アビジン及びストレプトアビジンがあり、これら全てを多くの固相担体に用いることができる。
【0104】
他のアフィニティー捕捉リガンドとして、ジゴキシゲニン、フルオレセイン、ニトロフェニル部分及びc−mycエピトープ等の様々なペプチドエピトープが挙げられ、それらに対してカウンターリガンドとして選択的モノクローナル抗体が存在する。容易にNi2+イオンに結合するヘキサヒスチジン等の金属イオン結合リガンドを用いることもできる。例えば、イミノ二酢酸キレート化Ni2+イオンのクロマトグラフィー樹脂が市販されている。これらの固定化ニッケルカラムは、ヒスチジンオリゴマーを含むペプチド質量タグを捕捉するのに用いられる。更に、他のアフィニティー捕捉リガンドとして、アフィニティー捕捉官能基が適切に誘導体化された固相担体と選択的に反応してもよい。例えば、ボロン酸は、隣接したシス−ジオール及びサリチルヒドロキサム酸等の化学的に類似したリガンドに選択的に反応することが知られている。ボロン酸を含む試薬は、サリチルヒドロキサム酸を導入した固相担体へのタンパク質捕捉のために開発されている(Stolowitz M.L.ら、Bioconjug Chem.12(2):229−239「フェニルボロン酸−サリチルヒドロキサム酸バイオ共役体1.タンパク質固定のための新規ボロン酸複合体」2001;Wiley J.P.ら、Biioconjug. Chem.12(2):240−250「フェニルボロン酸-サリチルヒドロキサム酸バイオ共役体2.アフィニティークロマトグラフィー用タンパク質リガンドの多価固定」2001、Prolinx Inc, Washington State,USA)。フェニルボロン酸官能基を本発明のペプチド質量タグに結合し、選択的化学反応によって捕捉できる捕捉試薬を生成するのは比較的簡単であろうと予想される。この種の化学の使用は、隣接するシス-ジオール含有糖を帯びた生体分子と直接適合するのではないと思われるが、この種の糖は、ボロン酸誘導ペプチド質量タグ試薬との反応に先行して、フェニルボロン酸又は関連試薬で封鎖できるはずである。
【0105】
質量スペクトル増感基及び質量識別法
本発明の好適な実施形態の態様において、ペプチド質量タグは増感基を含む。これらの増感基は、MSモードにおける強度、及びMS/MS又はMS/MS/MSモードにおける質量マーカー又は質量マーカーのフラグメントの強度を高める。適切な増感基が国際公開第02/099435、03/087839、及び2005/012914号パンフレットに開示される。グアニジノ基及び第三級アミノ基は、特に質量マーカーのMS/MS及びMS/MS/MS強度の向上に有用である。
【0106】
ペプチドを誘導体化する他の様々な方法が開発されており、第4級アンモニウム誘導体、第4級ホスホニウム誘導体及びピリジル誘導体を陽イオン質量分析法に使用する方法もある。特に、ハロゲン化芳香族化合物等のハロゲン化化合物が電気盆、即ち熱電子を非常に容易にピックアップするものとしてよく知られている。フッ素化芳香族化合物の様々な誘導体化試薬(Bian Nら、Rapid Commun Mass Spectrom 11(16):1781−1784「多重電気盆で標識したアルブミンのレーザー脱離及び質量分析法による検出」1997)は、電子捕捉検出用に開発されており、この電子捕捉検出は高感度のイオン化及び検出のプロセスであるため、陰イオン質量分析法に用いられる(Abdel−Baky S. & Giese R.W., Anal Chem 63(24):2986−2989「ゼプトモルレベルのガスクロマトグラフィー/電子捕捉陰イオン質量分析法」1991)。フッ素化芳香族基も増感基として使用することができる。陰イオン質量分析法において感度を向上させるため、芳香族スルフォン酸を用いることもできる。
【0107】
それぞれの増感基は異なる利点を有しており、用いられるイオン化法及び質量分析法によって異なる。感度が増大するメカニズムも各基によって異なってもよい。誘導体化は、塩基度を上昇させることによりプロトン化及び電荷局在化を促進する方法もあれば、タグされたペプチドの表面活性を増加して、マトリックス支援レーザー脱離イオン化法(MALDI)や高速原子衝撃イオン化法(FAB)等の表面脱離法において感度を増大させる方法もある。適切な増感基による方法が、国際公開第02/099435、03/087839、及び2005/012914号パンフレットに開示されるMSモードの感度をより高めるために選択されてもよい。陰イオン質量分析法ではバックグラウンドノイズがより少ないため、感度がより高い傾向にある。電荷誘導体化により、衝突誘起解離法において誘導体化ペプチドのフラグメンテーション生成物を変えることもできる。特に、ある誘導体化法ではフラグメンテーションパターンが単純になることから、非常に有利である。増感基は、用いる質量分析法によって選択される(Rothら、Mass Spectrometry Reviews 17:255−274「質量分析法による分析のためのペプチド誘導体化」1998を参照)。本発明の目的を鑑みると、全ての公知の誘導体化法を本発明のペプチド質量タグに用いることができる。固相ペプチド合成後、本発明のペプチド質量タグを誘導体化するために既に公開されたプロトコルを、改良を加えずに用いることができる。また、必要であれば、プロトコルを固相合成中に使用するようにすぐに導入することができる。
【0108】
質量分析法によるペプチド分析
質量分析計の本質的な特徴は以下の通りである。
導入系→イオン源→質量分析計→イオン検出器→データ捕捉システム
【0109】
ペプチド分析の目的によって、好ましい導入系、イオン源及び質量分析計がある。
【0110】
導入系
本発明の第2の態様において、質量分析法による分析前に試料の複雑性を軽減するために、クロマトグラフィー又は電気泳動法が好まれる。各種の質量分析法技術は、特にキャピラリーゾーン電気泳動法及びHPLC(高速液体クロマトグラフィー)等の分離技術と互換性がある。典型的な連結器は、オンラインHPLC−ESI、オフラインHPLC−MALDI等が挙げられる。
【0111】
イオン化技術
生物学的質量分析法としていわゆる「ソフト」イオン化技術を利用することが多い。これにより、タンパク質及び核酸等の大きな分子をほぼ損傷せずにイオン化することができる。多数の技術が本発明での使用に適しており、例えば、ESI−MS(エレクトロスプレーイオン化質量分析法)、FAB(高速原子衝撃イオン化質量分析法)、MALDI−MS(マトリックス支援レーザー脱離イオン化質量分析法)及びAPCI−MS(大気圧化学イオン化質量分析法)が挙げられるが、これらに限定されない。
【0112】
エレクトロスプレーイオン化法
エレクトロスプレーイオン化法において、検体生体分子の希釈溶液を質量分析計において「原子化する」、即ち、微細スプレーとして注入する必要がある。例えば、溶液を帯電した針の先端から乾燥窒素流及び静電場に噴霧する。イオン化のメカニズムは完全には明らかになっていないが、概して以下のように作用すると考えられている。溶媒が窒素流において蒸発し、小さな液滴となり、これが検体分子の濃縮につながる。ほとんどの生体分子は実効電荷を有していることから、溶解した分子の静電反発が高まる。蒸発するにつれ、この反発は液滴の表面張力よりも最終的に大きくなり、液滴が分解され、小さな液滴になる。これは、「クーロン爆発」とも呼ばれる。静電場により、更に、液滴の表面張力に打ち勝って、噴霧プロセスが容易となる。小さな液滴になっても蒸発が継続し、結果として、全ての溶媒のように、生体分子が基本的に気相となるまで繰り返し爆発が起こる。この技術は他の技術と比べ、イオン化の過程においてイオンに付加するエネルギーが比較的少量であり、そのエネルギーが比較的狭い範囲において分布することから、質量標識体の使用においてこの技術は特に重要である。適切に配置された電極による電場を使用することにより、イオンが加速しイオン化室から出てくる。電場の極性を変えて、陰又は陽イオンを抽出してもよい。電極間の電位差により、質量分析器に導入する陽又は陰イオン、及び質量分析計に導入するイオンの運動エネルギーが決定する。このことは、質量分析計におけるイオンのフラグメンテーションを考慮する際に重要である。イオンに付加するエネルギーが多いほど、検体分子とイオン源に存在する浴ガスの衝突により、フラグメンテーションが起こりやすくなる。イオン化室からのイオンの加速に用いられる電場を調整することにより、イオンのフラグメンテーションを制御することができる。標識した生体分子からタグを取り除く手段としてイオンのフラグメンテーションが用いられる場合、これは特に有利である。エレクトロスプレーイオン化法は、液体クロマトグラフィー質量分析法(LC−MS)と呼ばれる液体クロマトグラフィーとインラインで用いることができることから、特に有利である。
【0113】
マトリックス支援レーザー脱離イオン化法(MALDI)
MALDIでは、光励起「マトリックス」に過剰モル生体分子溶液を包埋させる必要がある。適切な周波数を有するレーザー光を用いることにより、マトリックスが励起され、マトリックスと共に包括された生体分子が急速に蒸発する。詳細なイオン化のメカニズムは完全に理解されてはいないが、特に飛行時間(TOF)質量分析法等の陽イオン質量分析法で検出できるプロトン化生体分子の数を増やすことができる。陰イオン質量分析法もMALDI−TOFによって行うことができる。この技術は、イオンに大量の並進エネルギーを与えることができるにも関わらず、余分なフラグメンテーションを生じない傾向がある。電圧を加速し、且つマトリックスを選択することでMALDIにおけるフラグメンテーションが制御可能である。
【0114】
高速原子衝撃法
高速原子衝撃法(FAB)を用いて、比較的不揮発性である分子の気化及びイオン化技術を説明する。これらの技術では、試料とキセノン原子又はセシウムイオンの高エネルギービームの衝突により、表面から試料が脱離する。試料は、通常、不揮発性材料(例えば、m−ニトロベンジルアルコール(NBA)又はグリセロール)である単純マトリックス表面上に塗布される。FAB技術も液相導入系に対応しており、キャピラリー電気泳動導入系又は高圧液体クロマトグラフィー系から溶出した液体はフリットを通過し、検体溶液でフリット表面を実質的に被覆し、フリット表面から検体溶液を原子衝撃によりイオン化する。
【0115】
質量分析器
衝突誘起解離によるペプチドのフラグメンテーションを本発明に用いることにより、タンパク質に結合したタグを同定する。様々な質量分析器を用いてペプチドをフラグメント化し、フラグメントの質量を決定してもよい。
【0116】
ペプチドのMS/MS及びMSn分析
タンデム型質量分析計において、CID(衝突誘起解離)により所定の質量電荷比を有するイオンを選択し、フラグメント化することが可能である。そして、フラグメントを検出し、選択したイオンの構造情報を得ることができる。タンデム型質量分析計でCIDによりペプチドを分析する場合、特徴的な切断パターンを観察して、ペプチド配列を決定することができる。一般に天然ペプチドはペプチドバックボーンのアミド結合において無作為にフラグメント化し、そのペプチドの特徴的なイオンシリーズが得られる。イオンの電荷がイオンのN末端フラグメントに保持される場合には、n番目のペプチド結合での切断に対するCIDフラグメントシリーズはan、bn、cn等と表される。同様に、電荷がイオンのC末端フラグメントに保持される場合にはフラグメントシリーズはxn、yn、zn、等と表される。
【0117】
通常用いられるタンデム質量分析計は、トリプル四重極型であり、四重極衝突室で分離された2つの四重極質量分析計を含む。この衝突四重極は2つの質量分析計の四重極間のイオンガイドとして機能する。ガスを衝突四重極に導入して、第1の質量分析器からのイオン気流と衝突させることができる。第1の質量分析計によりイオンはその質量/電荷比をもとにして選択され、通過する衝突セルでフラグメント化する。フラグメントイオンは第3の質量分析計で分離され、検出される。本発明で重要なのは、イオンは、質量/電荷比をもとに第3質量分析計で選択され、更に衝突セルに通してフラグメント化可能であり、フラグメントイオンが更なる質量分析計で分離され、検出されることである。
【0118】
本発明は、トリプル四重極装置を使用してマルチプルリアクションモニタリング(MRM)実験における非常に高感度な方法で公知の検体の検出が可能である。MRMは、標的化合物の検出に対して最大感度を得るように設計される。この種の質量分析実験は、製薬業界で薬物及び薬物代謝産物の検出、及び定量化に広く用いられる。標的分子の質量及び構造を知ることで、標的分子に対する前駆体質量荷電比、及びフラグメント質量荷電比(MRM遷移)を予測可能である。これらのMRM実験は、そのような検体のスクリーニングに使用できる。
【0119】
誘起切断はタンデム分析計以外のジオメトリーで行うことができる。トラップされたイオンが衝突するガスをトラップに導入する過程で、イオントラップ質量分析計によりフラグメンテーションが促進できる。一般的に、イオントラップにはヘリウム等の浴ガスが含まれる。同様に、トラップされたイオンをフォトン誘導フラグメント化することもできる。他の好ましいジオメトリーは四重極/直交飛行時間タンデム装置であり、MS/MSモードで四重極を介して静電的通路が高感度のリフレクトロンTOF質量分析器に結合してフラグメンテーション生成物を同定することができる。
【0120】
従来の「セクター」型装置は、タンデム質量分析法に通常用いる別のジオメトリーである。セクター型質量分析計は2つの別々の「セクター」を含み、電気セクターがイオンビームに焦点を合わせると、イオンビームがイオン源を出発し、電場により同じ運動エネルギーを持つイオン流となる。磁気セクターはイオンを質量に基づいて分離し、検出器でスペクトルが形成される。タンデム質量分析法では、このような2つのセクターを含む質量分析計を使用することができ、電気セクターが第1質量分析計を設け、磁気セクターが第2質量分析計を設け、2つのセクター間には衝突セルが設けられる。衝突セルで分離された2の完全セクターからなる質量分析器は、質量タグしたペプチドの分析にも使用することができる。
【0121】
イオントラップ質量分析計は四重極質量分析計に類似する。一般的に、イオントラップは3つの電極からなる構造をしている。これは、円筒状電極の各端の「キャップ」電極によって、空洞が形成される。円筒状電極に正弦波高周波電位を印加し、キャップ電極にはDC又はAC電位でバイアスをかける。空洞に注入したイオンは、円筒状電極の振動電場により安定した軌道に束縛される。しかし、特定のイオンは、所与振幅の振動電位に対して不安定な軌道をとり、トラップから放出される。振動高周波電位を変化することによって、質量電荷比に応じてトラップに注入したイオン試料がトラップから連続的に放出する。そして、放出されたイオンを検出することにより、質量スペクトルが得られる。
【0122】
イオントラップは、一般的に、イオントラップの空洞に存在する少量の「浴ガス」、例えばヘリウムを用いて動作する。これにより、装置の解像度と感度の両方が増加し、また、トラップに入ったイオンは、浴ガスとの衝突を経て浴ガスの周囲温度にまでほぼ冷却される。衝突すると、試料をトラップに導入した時のイオン化は増加するが、それと共にイオン軌道の振幅と速度は低下してイオン軌道はトラップの中央近傍に保持される。
【0123】
イオントラップは、タンデム質量分析計のジオメトリーを真似ることができ、実際に、多重質量分析計のジオメトリーを真似たものにして、トラップされたイオンの複雑な分析が可能となっている。試料由来の単一の質量種はトラップに保持できる。即ち、その他の種は全てトラップから放出させることができ、第一振動周波上に第二振動周波を超負荷することにより、保持した種を慎重に励起することができる。励起されたイオンは浴ガスと衝突し、十分に励起されるとフラグメント化する。このため、このフラグメントを更に分析することができる。フラグメントイオンを保持して他のイオンを放出し、フラグメントイオンを励起してフラグメント化することにより、更にフラグメントイオンを分析することも可能である。十分な試料が存在する限り、このプロセスを繰り返し行い、更なる分析をすることができる。留意すべき点として、これらの装置は一般的に誘導フラグメンテーション後のフラグメントイオンを高い割合で保持する。これらの装置とFTICR質量分析計(後述する)は、線形質量分析計に見られる空間分解タンデム質量分析法ではなく、一時的な分解タンデム質量分析法の形態を代表するものである。
【0124】
フーリエ変換イオンサイクロトロン共鳴質量分析法(FTICR MS)
FTICR質量分析計は、イオン試料が空洞内に保持されるという点でイオントラップと類似する特徴を有する。しかし、FTICR MSでは、交差電磁場により高真空室にイオンがトラップされる。箱の二つの側面を形成する一対の平板電極によって電場は形成される。この箱は超伝導磁石の磁場に収容される。この磁石は、トラッププレートである2枚の平板に連結しており、トラッププレート間にあってかつ印加した磁場に直交する円形軌道に注入イオンを束縛する。箱の他の対立側を形成する2枚の「送信板」に高周波パルスを印加すると、イオンはより大きな軌道に励起される。イオンのサイクロイド運動により、「受信板」を含む箱の残りの二つの対立側に、対応する電場が発生する。励起パルスによりイオンはより大きな軌道に励起されるが、衝突を経てイオンの固有運動が失われるのに従いこの軌道は崩壊する。受信板が検出した対応シグナルは、フーリエ変換(FT)分析により質量スペクトルに変換される。
【0125】
誘起フラグメンテーション実験において、これらの装置は、イオントラップと類似の方法を行うことができる。所望の単一種を除く全てのイオンをトラップから放出できる。衝突ガスをトラップに導入してフラグメンテーションを誘起することができる。そして、フラグメントイオンを分析することができる。「受信板」が検出したシグナルのFT分析によって分析する場合に、一般的に、フラグメンテーション生成物と浴ガスとが結合すると解像度が低くなる。しかし、フラグメントイオンを空洞から放出させ、例えばタンデム四重極型分析器で分析することができる。
【0126】
クロマトグラフィー又は電気泳動による標識されたペプチドの分離
本発明の一実施形態において、質量分析による分析前に標識された生体分子をクロマトグラフィーで分離する。HPLC(高速液体クロマトグラフィー)で分離することが好ましく、これを質量分析計に直接連結すれば、ペプチドをクロマトグラフィーカラムから溶出しながらペプチドをインライン分析することができる。HPLCによって多様な分離技術を実施できるが、質量分析前のペプチド分離には、逆相クロマトグラフィーが一般的である。キャピラリーゾーン電気泳動は別の分離方法であり、質量分析計に直接連結することにより溶出試料の自動分析ができる。これらの分析方法や他の分画技術を用いて、質量分析前の生体分子の混合物の複雑さを軽減してもよい。
【0127】
本発明の応用
ペプチド及びポリペプチドの標識及びLC−MS−MS−MSによる分析
本発明の好適な実施形態の第2の態様では、タグを使用してペプチド混合物を液体クロマトグラフィートリプル質量分析法(LC−MS−MS−MS)により分析する。本発明の質量標識体の使用について、ペプチド分析に関連付けて説明する。図示されたような質量標識体を用いて、ペプチドを標識してもよい。これらの化合物における反応性官能基が、N−ヒドロキシスクシンイミドエステルであるならば、タグがリシンのαアミノ基及びεアミノ基等の遊離アミノ基と反応する。
【0128】
タグを結合すると、標識したペプチドの質量はタグの質量だけ変動する。このペプチドの質量はもとのタンパク質の同定には十分であると推測される。この場合、タグのみを検出すればよく、以下に詳細に説明するトリプル四重極で選択した反応をモニタリングすることで検出できる。概述すると、所望のペプチドの質量に対応する質量荷電比を持ったイオンが通過できるようにトリプル四重極の第1四重極を設定し、質量マーカー部の質量に合うように調節する。次に、選択したイオンを第2四重極で衝突誘起解離(CID)する。ペプチド分析におけるこのような条件下で、イオンは、概ね、その分子のアミド結合でフラグメント化する。図1のマーカーは、アミド結合を有し、切断上のタグのN末端部を開放する。タグの質量は全て同じであるが、アミド結合端部に異なる置換基を有するため、標識体のグループ間で末端部分が異なる。そのため、質量標識体のグループは互いに識別可能である。特定の質量のイオンに関連したマーカーフラグメントの存在により、そのイオンはペプチドであり、かつ異なる試料に由来するタグのピークの相対的な高さから、試料中のペプチドの相対量に関する情報が得られることが確認される。試料中に同じ末端質量を有する末端ペプチドが多数あるか、ペプチドが未知である等、質量のみで十分にペプチドを同定できない場合、全CIDスペクトルを分析して配列情報を決定してもよい。ペプチドフラグメンテーションピークを使用してペプチドを同定することができ、質量標識体ピークからそのペプチドの相対量に関する情報が得られる。
【0129】
タンデム質量分析法によるタンパク質、特にペプチド混合物の分析は、スペクトルの「ノイズ」が入るので複雑になる。ペプチドを生物試料から単離すると、時折、緩衝剤、変性剤及び界面活性剤が混入して、質量スペクトル中にこれら全てのピークが現れる。その結果、ペプチドピーク以外のピークがスペクトルに現れてしまい、ペプチドに対応するピークを同定することが非常に困難となる。特に、試料タンパク質が小さく、単離が困難な場合に問題となる。したがって、各種方法を駆使してどのピークがペプチドに対応するかを決定してから、詳細なCID分析を行うことになる。トリプル四重極装置でプリカーサーイオンスキャンを行うことができる(Wilm M.ら、Anal Chem 68(3):527−33「未分離ペプチド混合物の親イオンスキャン」(1996)を参照)。単一反応モニタリングモードでトリプル四重極を動作すれば、第1四重極が全質量範囲を走査し、第2四重極においてゲートに入れられた各イオンに対してCIDを行う。そして、特定の1つのフラグメントイオンのみを検出するように第3四重極を設定する。このフラグメントイオンは、通常、ペプチドに由来するインモニウムイオン等の特徴的なフラグメントイオンである。このような技術を用いることにより、リン酸基の存在も検出することができる。
【0130】
プレカーサーイオンスキャン法に加えて、標的検体に対する最大感度を得るために選択反応モニタリング法(SRM)が使用できる。SRMは、MS/MSフラグメンテーションに対して化合物の親イオンの質量/電荷比を規定することで行われ、シングルフラグメントイオンを詳細にモニタリングする。上記の標識体と一緒に、質量マーカー部がフラグメントイオンとしてモニタリングされる1つのSRM実験で多くの試料を分析可能である。更に、MS/MS/MS工程により、質量マーカー部のフラグメントを介して試料アレイの定量化が可能になる。
【0131】
マルチプルリアクションモニタリング(MRM)は、同様の実験方法を使用するが、しかし、1つ以上の遷移が起こる。ハイブリッド四重極リニアイオントラップ装置を使用してプロダクトイオンスキャン(MS/MS)で追随して捕捉を誘発するために非常に高感度のSRM及びMRM実験が使用できる。そのような装置は、また、MS/MSに制限される従来のトリプル四重極装置とは対照的に、更にMS工程(MS/MS/MS又はMS3)が可能である。プロテオミクス用途において、これはペプチドの統計的検証又は多数の種のタンパク質定量に非常に有用である。記載のタグを非常に高感度のMRMスキャンと更にMS3スキャンとを組合せることで、1回で多数の種のデータの検証を提供する。
【0132】
本発明の質量標識体でペプチドを標識することにより、新しいプリカーサーイオンスキャンが予見できる。即ち、標識したペプチドのCIDを行った後の本発明の質量標識体に対応するフラグメントの存在により、ペプチドピークを同定してもよい。特に、各試料から本発明の方法により単離したペプチドを1つ以上の質量標識体で標識してもよい。全試料に使用する「プリカーサーイオンスキャン」用タグ及び試料に特異的なタグの等モル混合物を用いて、各試料のペプチドを標識してもよい。こうすれば、異なる試料においてペプチドレベルが変動しても、プリカーサーイオンスキャンによるペプチドピークの同定に悪影響はない。
【0133】
ペプチドイオンを同定し選択したら、CIDを行う。CIDスペクトルは時折極めて複雑となり、CIDスペクトルのどのピークが有意なペプチドフラグメントシリーズに対応するかを決定するのが、質量分析法でペプチド配列を決定する際に更に問題になる。Shevchenkoら、Rapid Commun. Mass Spec. 11:1015−1024(1997)には別の方法が記載されており、1:1 16O/18O水中で、分析するタンパク質をトリプシン処理している。その加水分解反応の結果、2つのペプチド集団が生じ、第1の集団の末端カルボキシルには16Oが、第2の集団の末端カルボキシルには18Oが含有される。試料中の各ペプチドに対して、強度の等しい二重ピークが存在し、その二重ピークは2ダルトン離れている。このピークはペプチド本来の同位体のピークと少し重なるが、CIDスペクトルにおいてこれを双極子として自動走査することができる。2つの異なるフラグメントにより双極子間の質量差を決定し、アミノ酸を同定することができる。この方法を本発明の方法に用いてもよい。
【0134】
タンパク質発現のプロファイリング
癌組織の変化を理解するには、例えば、その組織での分子的変化を全て理解し、理想的にはそれらの変化を正常組織に関連付けることが必要である。分子的変化を全て決定するには、遺伝子発現の変化、タンパク質発現及び最終的には代謝産物の変化を測定する能力が必要とされる。異なる組織試料間の多数の遺伝子の発現量は、マイクロアレイ技術を使用してメッセンジャーRNA(mRNA)量で同時に比較可能である(例えば、Iyer V.R.ら、Science 283(5398):83−87「ヒト繊維芽細胞の血清に対する応答の際の転写プログラム」1999参照)。しかし、mRNA量は組織中のタンパク質量に直接相関しない。組織についてタンパク質発現のプロファイルを決定するのにあたって、二次元ゲル電気泳動法が広く使用されている。残念ながら、この技術は極めて手間がかかり、再現性に難点があるため2つ以上の試料を2−Dゲル上で同時に比較することは困難である。上述のように、本発明の方法を使えば、ペプチドを効果的に分析することができる。本発明のタグをLC−MS−MSで使用すれば、試料が異なっても同じペプチドを同定することができる。更に、試料が異なっても同一のペプチドの相対量を決定することができる。多数の試料中のペプチドの同一性及び相対量を迅速かつ感度よく測定できるため、発現をプロファイルすることができる。したがって、本発明の目的は、ペプチドの選択的単離及び標識に基づく複雑なタンパク質試料を比較分析する改良した方法を提供することである。以下に、タンパク質発現を包括的に分析する2つの開示されたアプローチについて説明し、タンパク質の特定の状態、例えばリン酸化及び炭水化物修飾を分析するための様々な方法についても記載する。
【0135】
包括的タンパク質発現プロファイル用の末端ペプチド単離
N末端又はC末端のペプチドの単離については、タンパク質試料の包括的な発現プロファイルを決定する方法として説明してきた。末端ペプチドの単離により、1つのタンパク質において少なくとも1つのペプチド又は1つのペプチドのみが確実に単離され、その結果、複雑な分析試料における成分が最初の試料より確実に少なくなる。大きなポリペプチドを短いペプチドにすれば、質量分析法による試料の分析がより容易となる。ポリペプチド末端からペプチドを単離する方法は、国際出願番号PCT/GB98/00201明細書及び国際出願番号PCT/GB99/03258明細書に記載されている。
【図面の簡単な説明】
【0136】
【図1】図1は、本発明の使用に適した標識した検体を示す。
【図2】図2は、図1に示す質量マーカー部の衝突誘起解離により作製される質量スペクトルを示す。
【図3】図3は、図2に示す質量スペクトルの翻訳を示す。
【図4】図4は、図1に示す質量標識体の同位体標識に適した位置を示す。
【図5】図5は、本発明による質量標識体セットを示す。
【図6】図6は、異なる位置に13Cで標識した質量標識体セットを示す。
【技術分野】
【0001】
本発明は、質量標識体、特に、質量標識体のセット及びアレイに関する。質量標識体は、核酸、ペプチド、タンパク質等の検体の標識及び質量分析に有用である。
【背景技術】
【0002】
放射性原子、蛍光色素、発光試薬、電子捕捉試薬、光吸収色素等を用いた、所望の分子を標識する様々な方法が当該技術分野において知られている。これらの標識系は、それぞれ、特定の用途には適しているが、他の用途には適さないという特徴を有する。安全性の点から、非放射性標識系への関心が高まり、特に遺伝分析のための蛍光標識法が商業的に広く開発されている。蛍光標識法によれば、比較的少数の分子の同時標識が可能で、通常4、最大で8の標識体を同時に使用できる。しかし、検出装置が高価であり、生じたシグナルの分析が困難であるため、蛍光検出法で同時に使用できる標識体数は制限される。
【0003】
ごく最近、所望の分子に切断可能に結合した標識体の検出方法が、質量分析法の分野において開発されている。分子生物学への応用において、多くの場合、所望の分子を分析前に分離することが必要であり、その分離する方法として一般的に液相分離法が用いられる。最近の質量分析法では、液相分離用インターフェースが多数開発されており、これにより質量分析法がこのような応用において検出方法として特に効果的なものとなっている。最近まで、液体クロマトグラフィー質量分析法が検体イオン又はフラグメントイオンを直接的に検出するために用いられていたが、核酸分析等多くの場合では、間接標識によって検体構造を決定することができる。これは、特に質量分析法の使用に対して有利であるが、その理由は、DNAのような複雑な生体分子は複雑な質量スペクトルを持つので、検出感度が比較的低くなるからである。間接検出とは、もとの検体の同定に標識体分子を用いることができることを意味し、その場合には、検出感度が高く及び質量スペクトルが単純になるようにその標識体を作製する。質量スペクトルが単純であることは、複数の検体の同時分析に複数の標識体を用いることが可能であることを意味する。
【0004】
特許文献1に記載されている核酸プローブアレイは、切断可能な標識体に共有結合し、その標識体は質量分析法で検出可能であり、共有結合した核酸プローブ配列を同定する。この出願の標識したプローブは、Nu−L−M構造を有し、式中、NuはLに共有結合した核酸、Lは質量標識体Mに共有結合した切断可能なリンカーである。この出願において好ましい切断可能なリンカーは、質量分析計のイオン源内で切断する。質量標識体は、置換ポリアリールエーテルであることが好ましい。この出願において、質量分析法により質量標識体を分析する具体的な方法として、様々なイオン化法と四重極質量分析計、TOF分析計及び磁場型装置による分析が開示される。
【0005】
特許文献2において、リガンド、具体的には質量タグ分子に切断可能に結合した核酸が開示されている。切断可能なリンカーは光切断可能であることが好ましい。この出願では、質量分析法により質量標識体を分析する具体的な方法として、MALDI(マトリックス支援レーザー脱離イオン化)‐TOF(飛行時間)質量分析法が開示されている。
【0006】
特許文献3において、放出可能な非揮発性の質量標識体分子が開示されている。好ましい実施形態では、質量標識体は高分子を含み、この高分子は通常、反応基又はリガンド、即ちプローブに切断可能に結合した生体高分子である。切断可能なリンカーは、化学的又は酵素的に切断可能であることが好ましいと考えられる。質量分析法により質量標識体を分析する具体的な方法として、MALDI‐TOF質量分析法が開示されている。
【0007】
特許文献4、特許文献5及び特許文献6において、リガンド、具体的には質量タグ分子に切断可能に結合した核酸が開示されている。切断可能なリンカーは化学的又は光切断可能であることが好ましいと考えられる。これらの出願において、質量分析法により質量標識体を分析する具体的な方法として、様々なイオン化法と四重極質量分析計、TOF分析計及び磁場型装置による分析が開示されている。
【0008】
非特許文献1において、「同位体コード化アフィニティータグ」を用いてタンパク質からペプチドを捕捉し、タンパク質の発現分析を可能とすることが開示されている。この論文において、チオール反応性のビオチンリンカーを、システインを有するペプチドを捕捉するために用いることが記載されている。1つの材料から得られたタンパク質の試料をビオチンリンカーと反応させ、エンドペプチダーゼにより切断する。ビオチン化システイン含有ペプチドをアビジンビーズで単離することにより、後続する質量分析法による分析が可能となる。1番目の試料をビオチンリンカーで標識し、2番目の試料を重水素化したビオチンリンカーで標識することで、これらの2つの試料を量的に比較することができる。そして、それらの試料における各ペプチドは、質量スペクトルにおいて一対のピークとして現れる。質量スペクトルの各タグに対応するピークを積分することにより、タグに結合したペプチドの相対発現量とすることができる。
【0009】
この「同位体コード化」法には多数の制限がある。第1はタンパク質中にチオールが存在するか否かに依存することである。すなわち、チオールを数個有するものもあるが、有さないタンパク質は多数ある。この方法の変形として他の側鎖、例えばアミンと反応するようにリンカーを設計してもよい。しかし、多くのタンパク質は、1個以上のリシン残基を含有するので、一般に、このアプローチで、タンパク質1個当たり複数のペプチドが単離されることになる。これは、質量分析法による分析の際の試料の複雑さを十分に減少させることにならない可能性がある。試料に含まれるペプチド種が多すぎると、「イオン抑制」を受ける可能性がある。このイオン抑制では、通常、それほど複雑でない試料の質量スペクトルに現われる他種に優先して特定種がイオン化する。
【0010】
このアプローチの第2の制限は、異なる試料のタンパク質の発現レベルを比較する際に使用する方法である。異なる同位体による別個のアフィニティータグで各試料を標識すると、各試料の各ペプチドの質量スペクトルに別のピークを生じる。これは、2つの試料を合わせて分析するとスペクトル中のピーク数は2倍になることを意味する。同様に、3つの試料を合わせて分析する場合、試料1個のみよりも3倍複雑になることを意味する。ピークの数が増加し続けると、質量スペクトル上で、2個の異なるペプチドのピークが重なる可能性が高まることになるため、このアプローチに限界があることは明らかである。
【0011】
上記論文の筆者らが報告している更なる制限は、タグに起因する移動度の変化である。重水素化ビオチンタグで標識したペプチドは重水素化していないタグで標識した同一のペプチドに少し遅れて溶出すると筆者らは報告している。
【0012】
検体材料に対して作成した質量スペクトルは、混入物に対する感度が非常に高い。基本的に、イオン化可能であれば質量分析計に導入されたどんな材料も質量スペクトルに現われる。これは、多くの分析にとって、質量分析計に導入する前に検体を入念に精製することが必要であることを意味する。質量標識体を使った検体の間接分析用高処理システムでは、不必要な試料調製工程を避けることが望ましい。即ち、混入材料の背景にある標識体を検出でき、検出ピークが事実上確実に標識体に相当していることが望ましい。質量分析法に基づく検出系で達成できるシグナル対ノイズ比が改善され、あるいは、質量標識体の存在によりスペクトル中の質量ピークが生じたことを確認できる方法又は組成が先行技術では開示されていない。
【0013】
液体クロマトグラフィー又は電気泳動分離の後の検体の検出では、使用する標識体の分離プロセスへの妨害が最少であるのが望ましい。前記標識体のアレイを使用する場合、アレイの各標識体の結合した検体への作用は、他の全ての標識体と同一であるのが望ましい。これは、質量に基づいて質量分析計中で分解可能な標識体アレイを生成しなければならない質量マーキングの意図とある程度矛盾する。上記の先行技術では、好ましくは質量標識体を4ダルトン毎に分解し、別の標識体のピークによるある標識体からの同位体ピークへの妨害を防ぐべきであると開示されている。これは、250個の異なる質量標識体の生成には、約1000ダルトン及び、おそらくはそれ以上の範囲を網羅する標識体が必要であることを意味する。その理由は、正確に4ダルトンで分離される大型標識体アレイを生成するのは簡単ではないからである。この範囲の質量は、ほぼ確実に、質量分析法による検出に先行する分離プロセスに対して別異の作用を呈する質量標識体を生じることになる。質量分析計がイオンを検出できる質量範囲が増加するにつれて装置コストが増加するという点で、それは装置の設計にも重要である。
【0014】
特許文献7及び特許文献8は、質量分析する検体の標識に適した質量標識体セットを開示する。質量標識体は、質量正規化部に切断可能なリンカーで結合する質量マーカー部を含む。質量標識体セットは、総質量が同じ質量標識体を多数含むが、質量マーカー部が異なる質量を有するため、質量分析法により互いに識別可能である。よって、そのようなセットのより高い質量の質量マーカー部を含む質量標識体は、より低い質量の質量正規化部を含み、逆もまた同様である。
【0015】
これらの質量標識体は、特に、タンデム質量分析法に適切である。第1工程において、特定の質量/電荷比のイオン化された質量標識体が選択される。第2工程において、選択された質量標識体が衝突誘起解離によりフラグメント化され、質量マーカー部が検出される。
【0016】
しかしながら、非常に多くの検体が標識、及び質量分析法で識別可能である質量標識体セットが更に必要である。特に、容易な方法で非常に多くの固有の標識体が作製できる質量標識体セットが必要である。
【0017】
【特許文献1】国際公開第98/31830号パンフレット
【特許文献2】国際公開第95/04160号パンフレット
【特許文献3】国際公開第98/26095号パンフレット
【特許文献4】国際公開第97/27327号パンフレット
【特許文献5】国際公開第97/27325号パンフレット
【特許文献6】国際公開第97/27331号パンフレット
【特許文献7】国際公開第01/68664号パンフレット
【特許文献8】国際公開第03/025576号パンフレット
【非特許文献1】ギギ(Gygi)ら、Nature Biotechnology 17:994−999、「同位体コードアフィニティータグを用いた複合タンパク混合物の定量分析」1999
【発明の開示】
【発明が解決しようとする課題】
【0018】
本発明の目的は、ペプチドの選択的単離及び標識に基づく複雑なタンパク質試料を比較分析する改良した方法を提供することである。
【課題を解決するための手段】
【0019】
従って、本発明は、質量標識体のグループを複数含む質量標識体セットであって、セット内の前記質量標識体は、それぞれ、切断可能なリンカーを介して質量正規化部に結合している質量マーカー部を有し、セット内の前記質量標識体は、互いに質量が同じであり、グループ内の前記質量標識体において、前記質量マーカー部の質量は同じであり、グループ間の前記質量標識体において、前記質量マーカー部の質量が異なり、前記質量マーカー部は、2つ以上のフラグメントにフラグメンテーション可能であり、グループ内の前記質量標識体間で、前記質量マーカー部の少なくとも1つの前記フラグメントの質量が異なる。
【0020】
更なる態様において、本発明は、上記に示す複数の質量標識体セットを含み、質量標識体の共通質量が各セットで異なる質量標識体アレイを提供する。
【0021】
本発明の質量標識体セットは、更にフラグメント化可能な質量マーカー部を使用することで質量標識に更なる特徴を提供する。本発明の質量標識体セット(同一の総質量を有する質量標識体を含む)は、同一質量を有する質量マーカー部を含む質量標識体グループを含むが、質量分析法で互いに識別可能である。これは、特許文献7及び特許文献8の質量標識体セットとは対照的であり、質量標識体の総質量、又は質量マーカー部の質量は、質量標識体が識別できるように異ならなければならない。
【0022】
本発明の質量標識体の質量マーカー及び質量正規化部は、同一質量を有する質量マーカー部が、特定の質量マーカー部から生じる対応するフラグメントの質量が異なることで、互いに識別できるように異なって標識され得る。
【0023】
好適な実施形態において、同一質量を有する質量マーカー部が同位体標識体によって互いに識別できるように作製され得る。1つ以上の同位体標識体が質量標識体に含まれ、質量標識体間で同位体標識体の位置が異なる。共通質量を有する質量マーカー部を含む質量標識体の全グループにおいて、1つ又は複数の同位体標識体が、特定の質量マーカー部(すなわち、特定の質量標識体)から生じる異なるフラグメントに含まれてもよい。
【0024】
同位体標識体は、2H、13C、15N、18O等の自然発生する低存在度の同位体を含む原子又は置換基を含んでもよい。同位体標識体の特性は、同位体標識体を含むフラグメントを、例えば、主に自然発生する同位体(すなわち、1H、12C、14N、又は16O)を含む同位体標識体を含まない対応するフラグメントと識別可能であるならば、特に限定されない。
【0025】
本発明のある実施形態の同位体標識体を使用することで、化学的に同一である(すなわち、同一の化学種であるが、特定の位置で同位体組成のみ異なる)質量標識体のグループ及びセットが作製できる。これは、各質量標識体の複雑で異なる化学的合成を必要としない、容易で効率的な方法で非常に多くの質量標識体を識別可能にする。
【0026】
先行技術は、質量標識体の質量を変える方法として同位体置換の使用を示唆しているが、本発明の実施形態は、質量マーカー部を含む質量標識体での同位体標識体の使用と質量正規化部とを組み合わせる。特許文献7及び特許文献8に開示される方法と比較して、本発明は、質量標識の追加的な特徴を可能にする。すなわち、固有の質量の質量マーカー部を含む各質量標識体が、質量マーカー部のフラグメントの質量が異なる複数の固有の質量標識体の作製に使用できる。
【0027】
上述のように、特許文献7及び特許文献8に開示の質量標識体は、タンデム質量分析法で識別可能である。共通質量を有する質量マーカー部を含む本発明の個別の質量標識体は、質量マーカー部がフラグメント化され、及びフラグメントが検出される追加的な質量分析工程により分解できる。よって、本発明の方法は、「トリプル」質量分析プロセスに関連すると考えてもよい。第一段階において、質量標識体が検体から分離され(例えば、質量分析器における衝突誘起解離による分離)、第二段階において、分析する質量標識体が選択される。第二段階において、質量標識体が質量分析器で解離され、質量正規化部から質量マーカー部を遊離され、第三段階での更なるフラグメント化及び分析する質量マーカー部が選択される。
【0028】
本発明により提供される追加的な標識の特徴は、所望でない複雑性を回避するために、以前は見落とされていた実験情報を解明するために実質的に使用できる。例えば、複数の実験条件の試料は、各試料の検体の量が定量化できるように、異なる質量マーカー部を含む質量標識体でそれぞれ標識されてもよい。一般的に、各実験条件は、再現性及び統計的有意性を確立するために何度繰り返してもよい。多数の異なる実験条件に関する複雑な実験プロトコルにおいて、(例えば、質量標識体の数が制限され、又は単に複雑性を低減するために)標識する前に各実験条件の繰り返しをプールしてもよい。
【0029】
しかしながら、本発明により、各実験条件の試料は、特定の質量を有する質量マーカー部を含む質量標識体で標識でき、各繰返しで生じる試料を質量マーカー部における同位体標識体の位置が異なる質量標識体で標識することで個別の繰返し間の差異が検出できる。よって、特定の実験条件の繰返しで生じる試料は、個別の質量標識体のグループの中から特定の質量標識体でそれぞれ標識され、グループ内の各質量標識体は、共通質量の質量マーカー部を有するが、質量マーカー部のフラグメントの質量が異なる。試料がこのように標識されると、二段階タンデム質量分析を行って各実験条件の結果をプールする。各条件に対する個別の繰返しの結果が必要とされれば、質量マーカー部がフラグメント化され、フラグメントが分析される更なる質量分析工程が行われる。
【0030】
本発明の質量標識体セットは、バックグラウンドに材料が混入されても検出及び同定できる。更に、本明細書で開示される標識体セット及びアレイは、標識体が分離プロセスを実質的に妨害しないように圧縮した質量範囲で分解でき、限定範囲の質量対電荷比でイオンを検出する質量分析計中で容易に検出できる。本発明の標識体セットは、生体分子に対するアッセイ、特にペプチド分析用に処理量、シグナル対ノイズ比及び感度を最大化する。
【0031】
本明細書中における質量マーカー部とは、質量分析法により検出する部分を意味し、本明細書中における質量正規化部とは、質量分析法により必ずしも検出されず、質量標識体が所望の総質量を有していることを確実にするために存在する部分を意味する。
【0032】
セットが複数の質量標識体を含んでいれば、セット内の質量標識体の数は特に限定されない。しかしながら、セットは2つ以上、3つ以上、4つ以上、又は5つ以上の質量標識体を含むのが好ましい。
【0033】
本発明は、また、1つのセットにおける各質量標識体の共通質量が、アレイ内の他のすべてのセットにおける各質量標識体の共通質量とは異なる上記の2つ以上の質量標識体を含む質量標識体アレイを提供する。
【0034】
本発明の好ましい実施形態において、グループ、セット又はアレイにおける質量標識体は全て化学的に同一である。グループ間の質量標識体の特性を変えるために、質量正規化部及び質量マーカー部の質量は好ましくは同位体置換によって変わるようにする。上記の同位体置換は、グループ内の質量マーカー部の特定のフラグメントの質量を変えるために使用することもできる。
【0035】
本発明の更に好ましい実施形態において、タグは増感基を含んでもよい。タグは好ましくは以下の構造を有する。
増感基−アミド結合−リンカー−反応性官能基
構造式中、増感基は、通常、質量マーカー部に結合し、質量分析計において質量マーカー部の検出感度を高めるものである。反応性官能基は増感基とは異なる部分に結合し存在するように示される。増感基は2つ以上の成分を含んでもよく、第1成分は、MS/MSイオン強度(一般的に、塩基性残基)を高め、第2成分は、MSイオン強度を高める。しかしながら、タグはこの様に限定される必要はなく、増感基を含むが、反応性官能基を有さない場合もある。他の実施形態において、増感基が反応性官能基と同じ部分に結合してもよい。
【0036】
本発明の一実施形態において、質量標識体はアフィニティー捕捉試薬を含む。アフィニティー捕捉リガンドは、ビオチンであることが好ましい。標識した検体と標識されていない検体とは、例えばアビジン固相において、アフィニティー捕捉リガンドにより捕捉することにより分離することができる。
【0037】
本発明の更なる態様において、生体分子又は生体分子の混合物を分析する方法を提供し、方法は、好ましくは下記工程を含む。
1.生体分子又は生体分子の混合物を本発明による質量標識体と反応させる。
2.標識した生体分子を電気泳動又はクロマトグラフィーにより任意に分離する。
3.標識した生体分子をイオン化する。
4.標識した生体分子の好ましいイオンの質量電荷比に対応する所定の質量電荷比を有するイオンを質量分析計で選択する。
5.衝突させることで選択されたイオンを誘起解離する。
6.質量マーカー部を含む衝突生成イオンを選択する。
7.質量マーカー部を含む衝突生成イオンを誘起解離する。
8.質量マーカー部から生じるフラグメントを検出する。
【0038】
本実施形態において、質量タグがアフィニティータグを含み、標識されていない生体分子から標識した生体分子を分離するために、アフィニティータグ付けした生体分子がカウンターリガンドにより捕捉されてもよい。この工程は、上記の任意の第2工程に先がけて行われることが好ましい。
【0039】
一実施形態において、所定の質量電荷比を有するイオンを選択する工程は、直列型分析器の最初の質量分析計で行われる。そして、本発明の第1態様の第5工程により、選択されたイオンはチャンネルを通して独立した衝突室に運ばれ、気体又は固体表面と衝突する。次に、衝突生成物は直列型分析器の更なる質量分析計に運ばれ、本発明の第1態様の第6工程により衝突生成物を検出する。質量マーカー部に対応するイオンが選択され、チャンネルを通して更なる衝突室に運ばれ、第7工程により解離される。第8工程の更なる質量分析計で質量マーカー部のフラグメントが検出される。
【0040】
通常用いられる直列型分析器として、トリプル四重極質量分析計、タンデムセクター型分析器、及び四重極飛行時間質量分析計等が挙げられる。
【0041】
他の実施形態において、所定の質量電荷比を有するイオンを選択する工程と、選択されたイオンを気体に衝突させる工程と、衝突生成物を検出する工程は、質量分析計の同じゾーンで行われる。例えば、イオントラップ型質量分析計やフーリエ変換イオンサイクロトロン共鳴型質量分析計において行われてもよい。
【0042】
他の好ましい態様において、本発明は下記構造の質量標識した分子のセット又はアレイを提供する。
検体−リンカー−標識体
構造式中、標識体は、本発明のセット又はアレイの質量マーカーであり、リンカーは、下記に示すリンカーであり、検体は、生体分子等の所望の検体であってもよい。本実施形態の1つの好適な態様は、セット又はアレイの検体(1、1を超える、又は、全ての検体)が、周知の質量又はクロマトグラフィーにおける所定の性質を有する標準的な検体である。このような標準的な検体を本発明の方法に用いて、例えばクロロマトグラフィーによる分離工程の結果を分析する際に、未知の検体と比較することができる。
【0043】
本発明は、ペプチド合成機で容易に作製される質量マーカーについて説明する。実に、本発明で使用される化合物は、ペプチド及び修飾ペプチドを含む。ペプチド合成は、自動で作製される選択された特性で広範囲のマーカーが可能である化学的多様性を提供する。
【0044】
質量分析計における「MS/MS」とは、イオンを選択し、選択したイオンを衝突誘起解離(CID)によりフラグメントイオンの更なる分析を行うことができる質量分析計を意味する。
【0045】
「直列型分析器」とは、質量分析計が直列に配置され、連結された質量分析計においてMS/MS処理の各工程が交互に行われるMS/MS可能な質量分析計を意味する。本発明は、特に連続する3つの分析工程を含む「MS/MS/MS」、「MS3」すなわち「トリプル」質量分析法に関する。通常用いられる直列型分析器として、トリプル四重極質量分析計、タンデムセクター型分析器、及び四重極飛行時間質量分析計が挙げられる。これらの機器は、トリプル質量分析法を可能にするために必要であれば変更される。
【発明を実施するための最良の形態】
【0046】
添付の図を参照しながら、本発明の更なる詳細について説明する。以下の説明は本発明の例示であり、本発明は以下の実施形態に限定されない。
【0047】
図1は、本発明での使用に適した標識した検体を示す。ペプチド(検体)は、質量マーカー部及び質量正規化部を含む質量標識体に結合する。質量標識体のイオンの質量電荷比、及び質量マーカー部のフラグメントを図1に示す。
【0048】
図2は、トリプル質量分析法により図1の質量標識体で標識されたモデル検体として水を分析して得た質量スペクトルを示す。第1工程において、質量標識体を含むイオンが質量分析器で選択される。これらのイオンは、質量正規化部から質量マーカー部を遊離させるために衝突誘起解離される。次に、質量マーカー部を含むイオンが選択され、更に衝突誘起解離工程が行われる。図2の質量スペクトルは、質量マーカー部から生じるフラグメントを示す。
【0049】
図3は、図2の質量スペクトルに示すピークを図1に示す質量標識体の構造と関連付ける図である。主なフラグメントは、186,198,201及び214に表れる主なピークに相当する。
【0050】
図4は、図1に示す質量標識体が、同位体標識体を異なる位置に含む質量標識体セットを作製する同位体標識方法を示す。質量標識体は、アスタリスク(*)が示す少なくとも1つ以上の好適な位置に1つ以上の同位体標識体を含んでもよい。質量マーカー部の同位体標識体が、図3に示すような異なるフラグメントに現れるように異なる位置に配置されることで質量マーカー部がフラグメント化する場合に、同じ質量を有する質量マーカー部が識別可能になる。このように同位体標識体は、例えば、耐フラグメント性を示すベンゼン環よりもむしろメトキシ基又はジメチルアミノ基等の置換基に位置する。アスタリスクが示す各位置において、1H,12C,14N及び16Oは、それぞれ2H,13C,15N及び18Oで置換されてもよい。
【0051】
質量マーカー部における同位体標識体の合計数は、質量標識体のグループ間で異なり、質量標識体の各グループは、同じ質量の質量マーカー部を含む。同位体標識体を質量正規化部へ加えることで、質量標識体の異なるグループ間の質量標識体の総質量のバランスを保つことができ、グループ間で質量マーカー部の同位体標識体の数が異なるにも関わらず、1つのセットにおける各質量標識体の総質量は同じである。
【0052】
これを本発明の1つの質量標識体セットで行う方法を図5に示す。質量標識体を図1に示すような検体に結合して示す。セット内の各質量標識体は共通質量を有し、構造は図1に示す質量標識体と化学的に同一である。各質量標識体は、アスタリスクが示す3つの同位体標識体を含む。同位体標識体は、15N原子(14N原子を置換)を含むグループ4における1つの質量標識体以外は、それぞれ13C原子(12C原子を置換)を含む。
【0053】
質量マーカー部(すなわち、質量正規化部でもある)における同位体標識体の数は、図5に示す質量標識体のグループ間で異なる。従って、グループ1の質量標識体は、質量正規化部に3つの同位体標識体を含み、且つ質量マーカー部に同位体標識体を含まない。グループ2の質量標識体は、それぞれ質量正規化部に2つの同位体標識体を含み、且つ質量マーカー部に1つの同位体標識体を含む。グループ3の質量標識体は、それぞれ質量正規化部に1つの同位体標識体を含み、且つ質量マーカー部に2つの同位体標識体を含む。グループ4の質量標識体は、それぞれ質量正規化部に同位体標識体を含まず、且つ質量マーカー部に3つの同位体標識体を含む。従って、質量マーカー部の質量/電荷比は、グループ間で異なる。
【0054】
図3は、質量/電荷比が186であるジメチルアミノ基がない(同位体置換なし)質量マーカー部のフラグメントを示す。図5に示す質量標識体セットにおいて、このフラグメントに存在する同位体標識体の数により特定のグループ内の質量標識体が識別可能である。従って、グループ2では、このフラグメントにおける同位体標識体の数は1又は0であり、このフラグメント(187又は186)の質量/電荷比のおかげでグループ2における2つの質量標識体が識別可能である。グループ3では、このフラグメントにおける同位体標識体の数は2、1又は0であり、異なる標識体から生じるフラグメントに対してそれぞれ質量/電荷比が188,187又は186である。グループ4では、このフラグメントにおける同位体標識体の数は3、2、1又は0であり、異なる標識体から生じるフラグメントに対してそれぞれ質量/電荷比が189,188,187又は186である。
【0055】
図5に示す質量標識体の構造を以下の表にまとめて示す。
【0056】
【表1】

【0057】
このように、図5に示す各質量標識体は、質量マーカー部の質量電荷比とフラグメントの質量電荷比との組合せに基づいて識別可能である。
【0058】
本発明に使用される質量標識体の一般構造体が、質量標識体が質量マーカー部及び質量正規化部を含むならば、例えば、国際公開第01/68664(特許文献7),03/025576(特許文献8),02/099435,03/087839及び2005/012914号パンフレットに記載の一般構造体に基づいてもよい。しかしながら、本明細書に記載の質量標識体セットは、上記の公開公報に記載の質量標識体セットとは異なる。なぜならば、本発明によると、質量標識体セットは、同じ質量の質量マーカー部を含む質量標識体を含み、質量マーカー部が質量分析器でフラグメント化される場合に、いずれにせよ、質量標識体は互いに識別できるからである。よって、上記公開公報の1つに開示される特定の質量標識体の質量マーカー部を(例えば、同位体標識体により)差別的に標識して、質量マーカー部をフラグメント化するだけで識別できる質量標識体のグループを作製することで、本発明で使用される質量標識体が作製できる。
【0059】
好適な一実施形態において、質量標識体セットは、国際公開第2005/012914号パンフレットに開示されるような増感質量タグの構造に基づく質量標識体を含むが、本発明のセットの新規の特徴も含む。本実施形態において、質量標識体セットは、好ましくは、マトリックス支援レーザー脱離イオン化(MALDI)質量分析法を使用して分析される。
【0060】
例えば、図5に示すような質量標識体セットの基礎を形成する質量標識体は、下記に示すプロトコルによって合成されてもよい。図5に示すようなペプチドに結合した標識体よりもむしろ末端2,5−ジオキソ−1−ピロリジニルエステルを含む標識体に対する合成を説明する。第1工程において、塩素化したリンカーが作製される。そして、塩素基は、シアン化物イオンで求核置換される。このシアノリンカーは、3−ジメチルアミノ4−ヒドロキシベンズアルデヒドで縮合され、遊離カルボキシル基を有する炭素鎖6のリンカーを有する桂皮酸誘導体を得る。前記遊離カルボキシル基は、活性化されて合成の最終工程においてNHSエステルを形成する。
【0061】
6−[2−シアン−3−(3−ジメチルアミノ−4−メトキシ−フェニル)アクリロイルアミノ]ヘキサン酸−(2,5−ジオキソ−1−ピロリジニル)エステルの合成
1. 6−(クロルアセトアミド)ヘキサン酸の合成
クロルアセチルクロリド18mL(221mMol)を、冷NaOH溶液(2N)80mLに溶解した6−アミノヘキサン酸20g(153mMol)に室温で滴下した。NaOH溶液(6N)を時々加えて溶液のpHを10〜11に保ちながら反応混合物を30分間撹拌した。そして、反応混合物のpHをHCl(2N)でpH5に変え、残留物がろ過された。次に、水のpHが中性になるまで残留物を水で洗浄した。生成物を五酸化リン上で乾燥し、クロロホルム300mlに再び溶解し、ろ過して、不溶解残留物を取り除いた。へプタンをろ液に加え、冷却しながら撹拌してシロップ剤を得た。生成物が、水からろ過、乾燥されて、結晶化された。
収量:20g(63%)
融点:82℃
【0062】
2. 6−(シアノアセトアミド)ヘキサン酸の合成
炭酸水素カリウム2.8g(20mMol)を、水25mlに溶解した6−(クロルアセトアミド)ヘキサン酸8.3g(40mMol)に加えた。シアン化カリウム3.2g(48mMol)を氷冷した澄明な液に加えた。反応混合物を17時間撹拌し、そして、HCl(2N)で酸性化した。抽出後の残留物をクロマトグラフィー(シリカゲル、溶媒:酢酸エチル)により精製した。
収量:6g(76%)
融点:80℃〜81℃
【0063】
3. 6−[2−シアン−3−(3−ジメチルアミノ−4−メトキシ−フェニル)アクリロイルアミノ]ヘキサン酸の合成
6−(2−シアン−アセチルアミノ)ヘキサン酸3.96g(20mMol)をピリジン27mlに溶解した。3−ジメチルアミノ−4−メトキシベンズアルデヒド3.64g(20mMol)及びピペリジン0.6mLを溶液に加え、反応混合物を20時間撹拌した。反応混合物の気化後、残留物を酢酸エチル150ml及び水150mlに溶解し、pHが純粋な酢酸で4.2に調製された。水相が酢酸エチルを用いて抽出された。回収された酢酸エチル相を、NaCl溶液で洗浄し、乾燥、蒸発させた。残留物を低圧で酢酸エチルを用いてSiO2クロマトグラフした。生成物を少量の酢酸エチルから結晶化した。
収量:4.6g(66%)
融点:130℃
【0064】
4. 6−[2−シアン−3−(3−ジメチルアミノ−4−メトキシ−フェニル)アクリロイルアミノ]ヘキサン酸−(2,5−ジオキソ−1−ピロリジニル)エステルの合成
N−ヒドロキシスクシンイミド0.78g(6.76mMol)及び6−[2−シアン−3−(3−ジメチルアミノ−4−メトキシ−フェニル)アクリロイルアミノ]ヘキサン酸2.43g(6.76mMol)をCH2Cl250mlに加えた。混合物を室温で20時間撹拌した。溶液をろ過し、蒸発した。残留物を、酢酸エチルを用いて、低圧下フロリジルでクロマトグラフした。結晶性生成物をジイソプロピルエーテルでペースト状にし、フィルターに回収した。
収量:1.9g(62%)
融点:104℃
【0065】
上記のプロトコルは、質量標識体の異なる位置に同位体標識体を取り込むために変えることができる。最終生成物において所定の位置に13C標識体を得るために、適切に13C標識した出発原料が使用できる。例えば、上記の工程1で使用されるクロルアセチルクロリド(又は、ブロモアセチルクロリド)の1つ又は両方の炭素原子が13Cで標識できる。13C標識クロルアセチルクロリド又はブロモアセチルクロリドは、例えば、13C標識クロル、又はブロモ酢酸(以下、試薬Aとする)から得てもよい。
【0066】
同様にして、工程1で使用される6−アミノヘキサン酸は、13C原子で様々な位置に標識されてもよい。13C標識6−アミノヘキサン酸は、例えば、13C標識酢酸(以下、試薬Bとする)を、Boc−4−アミノブチルブロミドとアルカリ性条件(リチウムジイソプロピルアミド)下で反応させて13C標識Boc−6−アミノヘキサン酸を形成し、HCl処理下でt−ブチルオキシカルボニル(Boc)保護基を取り除くことで得てもよい。
【0067】
図6は、上記の分子合成に基づく4つの質量標識体を示す。各質量標識体(a)〜(d)は、総質量が同一である。各質量標識体は、2つの13C同位体標識体を含む。質量標識体(a)〜(d)は、上記プロトコルの第1工程で使用する試薬を調製するために、下記の出発原料を使用して合成できる。
【0068】
【表2】

【0069】
フラグメントAは、図3に示す非同位体標識した質量標識体において質量電荷比が198の質量マーカー部のフラグメントである。フラグメントBは、図3に示す非同位体標識した質量標識体において質量電荷比が201の質量マーカー部のフラグメントである。
【0070】
質量標識体セットは上記の好適な実施形態に限定される必要はなく、上記に概略したように全ての標識体が質量分析法により識別可能であれば、例えば、複数の標識体を含んでもよい。
【0071】
セット内の各質量マーカー部が共通の基本構造を有し、セット内の各質量正規化部が共通の基本構造を有し、セット内の各質量標識体が1つ以上の質量調整部を含み、質量調整部が質量マーカー部の基本構造及び/又は質量正規化部の基本構造に結合し又はその中に位置することが好ましい。本実施形態において、質量マーカー部の質量調整部の数は標識体のグループ間で異なり、セット内の各質量標識体は同一総数の質量調整部を含む。
【0072】
共通の基本構造により、2つ以上の部分は実質同一の骨格構造、バックボーン又はコアを共有することを意味する。骨格構造、又はバックボーンは、例えば、1つ以上のアミノ酸を含んでもよい。骨格構造は、好ましくは、アミド結合で結合された複数のアミノ酸を含む。しかしながら、アリールエーテルユニット等の他のユニットもまた存在してもよい。共通の基本構造が変化しないように、骨格構造又はバックボーンは、ペンダント置換基、又は原子若しくは同位体で置換されてもよい。
【0073】
本発明は、複数の質量標識体セットのアレイも含む。本発明の質量標識体セットを複数含むものであれば、本発明の質量標識体のアレイは特に限定されない。アレイは、2つ以上、3つ以上、4つ以上又は5つ以上の質量標識体セットを含むのが好ましい。
【0074】
リンカー基
上述又は後述する説明において、所望の分子を本発明の質量標識体化合物に結合させるために使用するリンカー基について言及する。様々なリンカーが当該技術分野において公知であり、これらのリンカーは本発明の質量標識体とこれらに共有結合した検体との間に導入される。これらのリンカーのいくつかは切断可能であってもよい。オリゴ又はポリエチレングリコール又はこれらの誘導体をリンカーとして用いることができ、例えば、Maskos,U.&Southern,E.M. Nucleic Acids Research 20:1679−1684,1992に開示されたものを用いることができる。コハク酸系リンカーも広く用いられているが、一般に塩基に不安定であり、多数のオリゴヌクレオチド合成で使用されている塩基介在脱保護工程には不適合であるため、オリゴヌクレオチドの標識には好ましくない。
【0075】
プロパルギルアルコールは二官能リンカーであり、オリゴヌクレオチド合成の条件下で安定した結合を提供し、本発明でオリゴヌクレオチドを用いる場合に、好適に使用されるリンカーである。同様に、6−アミノヘキサノールは、適切に官能基を付与した分子の結合に有用な二官能試薬であり、好適なリンカーでもある。
【0076】
光切断可能なリンカーなどの多様な公知の切断可能なリンカー基を本発明の化合物と併用できる。オルソニトロベンジル基は、光切断可能なリンカーとして公知であり、特に、2−ニトロベンジルエステルや2−ニトロベンジルアミンは、ベンジルアミン結合で切断する。切断可能なリンカーの概要については、様々な光切断可能及び化学的切断可能なリンカーについて言及している、Lloyd−Williamsら、Tetrahedron 49,11065−11133,1993を参照されたい。
【0077】
国際公開第00/02895号パンフレットにおいて、切断可能なリンカーとしてビニルスルフォン化合物が開示されている。これらは本発明においても使用することができ、特にポリペプチド、ペプチド及びアミノ酸の標識に用いられる。この出願の内容を参照することにより本明細書に援用する。
【0078】
国際公開第00/02895号パンフレットにおいて、気相中で塩基により切断可能なリンカーであるシリコン化合物の使用が開示されている。これらのリンカーも本発明で使用することができ、特にオリゴヌクレオチドの標識に用いられる。この出願の内容を参照することにより本明細書に援用する。
【0079】
本発明の質量標識体は、検体への結合を助ける反応性官能基Reを含んでもよい。本発明の好適な実施形態において、Reは、反応性官能基、又は質量標識体を検体分子における適切な官能基に共有結合反応させる基である。検体分子は、ヌクレオチド、オリゴヌクレオチド、ポリヌクレオチド、アミノ酸、ペプチド、及びポリペプチド等が挙げられるが、これらに限定されない。反応性官能基はリンカーで質量標識体に結合してもよく、リンカーは切断可能であってもなくてもよい。本発明の質量標識体には、様々な反応性官能基を導入してもよい。
【0080】
下記表3に、生体分子の求核性官能基と反応して2つの物質間に共有結合を形成する反応性官能基をいくつか列挙する。オリゴヌクレオチドの合成における使用においては、第一級アミン又はチオールが分子の終端に頻繁に導入され、標識が可能となる。以下に列挙された官能基であれば、いずれも本発明の化合物に導入することができ、質量マーカーを所望の分子に結合させることができる。必要であれば、反応性官能基を用いて反応性官能基を更に有するリンカー基を更に導入することができる。なお、表3は全てを網羅したものではなく、本発明は列挙された官能基のみの使用に限定されない。
【0081】
【表3】

【0082】
ここで留意すべきことは、本発明の質量マーカーをオリゴヌクレオチドの標識に用いる場合に、上記の反応性官能基の一部又はそれらの生成結合基は、オリゴヌクレオチド合成機に導入する前に保護されなければならないことである。好ましくは、非保護エステル、チオエーテルとチオエステル、アミンとアミド結合は、オリゴヌクレオチド合成機中で、通常安定しないので避けるべきである。多様な保護基が当該技術分野において公知であり、それらを使用すれば結合を望ましくない副反応から保護することができる。
【0083】
以下の説明において、「電荷輸送官能基」及び可溶化基について言及する。これらの基は、イオン化と溶解度を促進するために、本発明の質量マーカー等の質量標識体に導入されてもよい。陽イオン検出又は陰イオン検出のどちらを用いるかによって、選択するマーカーは異なる。以下の表4は、陽イオン化又は陰イオン化を促進するために質量マーカーに導入されてもよい官能基をいくつか示す。表はこのような官能基の全てを網羅したものではなく、本発明は以下に列挙された官能基のみの使用に限定されない。
【0084】
【表4】

【0085】
国際公開第00/02893号パンフレットは、質量マーカーのイオン化の向上を図るため、クラウンエーテルやポルフィリン等の金属イオン結合部分の使用を開示する。これらの部分は、本発明の質量マーカーの使用に用いることもできる。
【0086】
本発明の質量マーカー部の構成要素は、衝突誘起解離(CID)により容易に壊れるような結合を行うことにより、マーカーのフラグメンテーション部を制御可能なようにフラグメント耐性を有することが好ましい。しかしながら、質量マーカー部が2つ以上のフラグメントにフラグメント化可能であることが重要である。アリールエーテルは、本発明で使用してもよい耐フラグメント化合物類の例である。また、これらの化合物は、化学的に不活性であり、熱的に安定している。国際公開第99/32501号パンフレットは、より詳細に質量分析法でのポリエーテルの使用について論じており、この出願の内容を参照することにより本明細書に援用する。
【0087】
過去に、アリールエーテル合成の一般的方法は、約200℃、銅粉末の存在下でのフェノールとのアリールブロマイドのウルマンカップリングに基づいていた(代表的参考文献:H.Stetter,G.Duve,Chemische Berichte 87(1954)1699)。さらに温和なアリールエーテル合成法は、異なる金属触媒を使って開発されているが、反応温度は、依然として100℃〜120℃である(M.Iyoda,M.Sakaitani,H.Otsuka,M.Oda,Tetrahedron Letters 26(1985)477)。これは、ポリエーテル質量標識体生成の好ましい経路である。以下の実施例に示すFT77の合成を参照されたい。最近発表された方法は、これまでの方法よりもはるかに温和な条件下で実施するので、ポリエーテル質量標識体の生成に最も好ましい経路である(D.E.Evans,J.L.Katz,T.R.West,Tetrahedron Lett.39(1998)2937)。
【0088】
本発明は、また、2つ以上のプローブからなるセットを提供し、セット内の各プローブが異なり、上記のように定義された質量標識体セット又はアレイの中から固有の質量標識体若しくは固有の質量標識体の組合せに結合する。
【0089】
更に、2つ以上のプローブセットを含むプローブアレイも提供し、いずれかのセット内の各プローブは、上述のように定義された質量標識体セットの中から固有の質量標識体又は固有の質量標識体の組合せに結合し、いずれかのセットにおけるプローブが同じ質量標識体セットの質量標識体に結合し、各プローブセットは、上述のように定義された質量標識体アレイの中から固有の質量標識体セットの質量標識体に結合する。
【0090】
一実施形態において、各プローブは固有の質量標識体の組合せに結合することが好ましく、質量標識体セットの各質量標識体の存在又は不在により、及び/又はプローブに結合した各質量標識体の量により各質量標識体の組合せを識別する。このことは、質量標識体の混合物にプローブが結合していてもよいことから、本発明における「混合モード」と示す。
【0091】
上記の態様において、プローブの性質は特に限定されないが、各プローブは生体分子を含むことが好ましい。どのような生体分子でも用いることができるが、DNA、RNA、オリゴヌクレオチド、核酸塩基、ペプチド、ポリペプチド、タンパク質及びアミノ酸から選択される生体分子であることが好ましい。
【0092】
好適な一実施形態において、本発明は、下記の構造のヌクレオチド、オリゴヌクレオチド及びポリヌクレオチド等の質量標識した検体のセット及びアレイを提供する。
検体−リンカー−標識体
構造式中、リンカーは上記に定義するリンカーであり、標識体は、上記に定義するセット及びアレイの質量標識体である。
【0093】
上記の態様において、検体の性質は特に限定されない。しかしながら、好ましくは、各検体は生体分子を含む。どのような生体分子でも用いることができるが、DNA、RNA、オリゴヌクレオチド、核酸塩基、ペプチド、ポリペプチド、タンパク質及びアミノ酸から選択される生体分子であることが好ましい。
【0094】
一実施形態において、各検体は固有の質量標識体の組合せに結合していることが好ましく、質量標識体セットの各質量標識体の存在又は不在により、及び/又はプローブに結合した各質量標識体の量により各質量標識体の組合せを識別する。上述したように、このことは、質量標識体の混合物にプローブが結合していてもよいことから、本発明における「混合モード」と示す。
【0095】
上述のように、本発明は、検体に固有の質量標識体又は質量標識体の組合せを質量分析法により同定して検体を検出する工程を含む分析方法を提供し、質量標識体は上述のように定義した質量標識体セット又はアレイの質量標識体である。本発明の質量標識体を用いて検体を同定することにより方法が有利になるのであれば、方法は特に限定されない。方法として、例えば、核酸塩基配列決定法や、試料のタンパク質の量を検出することで1つ以上の遺伝子発現をプロファイルする方法等が挙げられる。複数の生体分子を同時に分析するのに容易に用いることができるため、この方法は特に有効である。しかし、個々の検体の分析にも効果的な方法である。これは、本発明の質量標識体を用いると、従来のスペクトルよりもすっきりとした質量スペクトルが得られ、この方法の正確性及び感度が高まるためである。
【0096】
更に好ましい実施形態において、本発明は、下記工程を含む方法を提供する。
(a)1つ以上の検体をプローブセット又はプローブアレイに接触させる。セット内又はアレイ内の各プローブは少なくとも1つの検体に特異的なものであり、プローブは上記のように定義されたものである。
(b)検体に特異的なプローブを検出して生体分子を同定する。
【0097】
本実施形態において、質量分析法により質量標識体を検出する前に、プローブから質量標識体が切断することが好ましい。
【0098】
この特定の実施形態における方法の本質は特に限定されないが、方法は1つ以上の核酸をハイブリッド形成プローブセットに接触する工程を含むことが好ましい。ハイブリッド形成プローブセットは、通常、最大で256 4マーのセットを含み、セット内の各プローブは異なる核酸塩基の組合せを有する。この方法は、標的核酸の存在を同定するのに適していてもよく、又はプライマー伸長における1つ以上の核酸の鋳型の塩基配列決定の方法に段階的に用いることができる。
【0099】
主に多くの標識体を同時に識別することが可能であることから、本発明の質量標識体は二次元分析方法での使用に特に適している。このため、標識体は二次元ゲル電気泳動法又は二次元質量分析法に用いてもよい。
【0100】
質量変動アミノ酸
様々なアミノ酸が質量マーカー部及び質量正規化部に使用できる。例えば、本発明の第1及び第4実施形態において、アミノ酸1及びアミノ酸2を記した位置で、(イオン化を促進し、感度を高めるので)中性アミノ酸が質量正規化部に好ましく使用され、帯電アミノ酸が質量マーカー部に好ましく使用される。下記表5に、同位体によって質量変動された市販のアミノ酸を示す。この表に示した1、2、3又は4つ以上のアミノ酸の組合せはいずれも、本発明の各質量マーカー部又は質量正規化部に好ましく用いられる。また、本発明によると、質量マーカー部のフラグメントが、異なる質量標識体では質量を異なって有するように、質量マーカー部自体が、グループ内で異なる質量標識体に変動されることも重要である。これは、例えば、質量標識体のグループにおいて質量マーカー部を形成するアミノ酸の特定の組合せを差別的に同位体標識することで行うことができる。
【0101】
【表5】

【0102】
反応性官能基
既に説明したように、本発明のいくつかの態様において、本発明の質量タグは反応性官能基を含む。最も簡潔な実施形態において、これは、本発明のタグペプチドのC末端の活性化により導入されたN−ヒドロキシスクシンイミドエステルであってもよい。従来の合成において、ペプチド質量タグがペプチド質量タグ合成の原産物から精製された後で、活性化工程を行う必要がある。N−ヒドロキシスクシンイミド活性化質量タグは、ヒドラジンと反応して、ヒドラジド反応性官能基を生成することもできる。これは、例えば、過ヨウ素酸酸化糖部分の標識に用いることができる。アミノ基又はチオールを反応性官能基として用いることもでき、これらは、タグの結合後にリシン又はシステインを結合することで導入してもよい。リシンを用いて、タグを遊離カルボキシル官能基に結合することができる。この場合、カルボジイミドをカップリング剤として用いる。本発明のタグに他の反応性官能基を導入するにあたって、最初にリシンを用いることもできる。リシンεアミノ基を無水マレイン酸に反応させることにより、チオール反応性マレイミド官能基を導入することができる。様々なアルケニルスルフォン化合物を合成するにあたって、チオールとアミンに反応する有用なタンパク質標識試薬であるシステインチオール基を最初に用いることができる。アミノヘキサン酸等の化合物を用いて、質量マーカー部と質量正規化部との間に、スペーサーを設けることができる。
【0103】
アフィニティー捕捉リガンド
本発明の特定の実施形態の第1の態様において、質量マーカーはアフィニティー捕捉リガンドを含む。アフィニティー捕捉リガンドは、特異性の高い結合相手を有するリガンドである。これらの結合相手により、結合相手がリガンドでタグされた分子の選択的な捕捉が可能になる。結合相手により固相担体が誘導体化することが好ましく、それによりアフィニティーリガンドでタグされた分子は選択的に固相担体に捕捉される。好ましいアフィニティー捕捉リガンドはビオチンであり、当該技術分野において公知の標準的な方法により本発明のペプチド質量タグに導入することができる。特にリシン残基は、アミノ酸2の後に導入することができ、これを介してアミン反応性ビオチンがペプチド質量タグに結合できる(例えば、Geahlen R.L.ら、Anal Biochem 202(1):68−67「カルボキシ末端をビオチニル化したペプチドの一般的作製方法」1992;Sawutz D.G.ら、Peptides 12(5):1019−1012「[Lys]ブラディキニンのビオチニル化類似化合物の合成及び分子特性分析」 1991;Natarajan S.ら、Int J Pept Protein Res 40(6):567−567「部位特異的ビオチニル化。エンドセリン―1類似化合物及びPTH−1類似化合物の新規アプローチとその応用」、1992を参照)。また、イミノビオチンを用いることもできる。ビオチンに対する様々なアビジンカウンターリガンドを使用することができる。アビジンカウンターリガンドには単量体及び四量体アビジン及びストレプトアビジンがあり、これら全てを多くの固相担体に用いることができる。
【0104】
他のアフィニティー捕捉リガンドとして、ジゴキシゲニン、フルオレセイン、ニトロフェニル部分及びc−mycエピトープ等の様々なペプチドエピトープが挙げられ、それらに対してカウンターリガンドとして選択的モノクローナル抗体が存在する。容易にNi2+イオンに結合するヘキサヒスチジン等の金属イオン結合リガンドを用いることもできる。例えば、イミノ二酢酸キレート化Ni2+イオンのクロマトグラフィー樹脂が市販されている。これらの固定化ニッケルカラムは、ヒスチジンオリゴマーを含むペプチド質量タグを捕捉するのに用いられる。更に、他のアフィニティー捕捉リガンドとして、アフィニティー捕捉官能基が適切に誘導体化された固相担体と選択的に反応してもよい。例えば、ボロン酸は、隣接したシス−ジオール及びサリチルヒドロキサム酸等の化学的に類似したリガンドに選択的に反応することが知られている。ボロン酸を含む試薬は、サリチルヒドロキサム酸を導入した固相担体へのタンパク質捕捉のために開発されている(Stolowitz M.L.ら、Bioconjug Chem.12(2):229−239「フェニルボロン酸−サリチルヒドロキサム酸バイオ共役体1.タンパク質固定のための新規ボロン酸複合体」2001;Wiley J.P.ら、Biioconjug. Chem.12(2):240−250「フェニルボロン酸-サリチルヒドロキサム酸バイオ共役体2.アフィニティークロマトグラフィー用タンパク質リガンドの多価固定」2001、Prolinx Inc, Washington State,USA)。フェニルボロン酸官能基を本発明のペプチド質量タグに結合し、選択的化学反応によって捕捉できる捕捉試薬を生成するのは比較的簡単であろうと予想される。この種の化学の使用は、隣接するシス-ジオール含有糖を帯びた生体分子と直接適合するのではないと思われるが、この種の糖は、ボロン酸誘導ペプチド質量タグ試薬との反応に先行して、フェニルボロン酸又は関連試薬で封鎖できるはずである。
【0105】
質量スペクトル増感基及び質量識別法
本発明の好適な実施形態の態様において、ペプチド質量タグは増感基を含む。これらの増感基は、MSモードにおける強度、及びMS/MS又はMS/MS/MSモードにおける質量マーカー又は質量マーカーのフラグメントの強度を高める。適切な増感基が国際公開第02/099435、03/087839、及び2005/012914号パンフレットに開示される。グアニジノ基及び第三級アミノ基は、特に質量マーカーのMS/MS及びMS/MS/MS強度の向上に有用である。
【0106】
ペプチドを誘導体化する他の様々な方法が開発されており、第4級アンモニウム誘導体、第4級ホスホニウム誘導体及びピリジル誘導体を陽イオン質量分析法に使用する方法もある。特に、ハロゲン化芳香族化合物等のハロゲン化化合物が電気盆、即ち熱電子を非常に容易にピックアップするものとしてよく知られている。フッ素化芳香族化合物の様々な誘導体化試薬(Bian Nら、Rapid Commun Mass Spectrom 11(16):1781−1784「多重電気盆で標識したアルブミンのレーザー脱離及び質量分析法による検出」1997)は、電子捕捉検出用に開発されており、この電子捕捉検出は高感度のイオン化及び検出のプロセスであるため、陰イオン質量分析法に用いられる(Abdel−Baky S. & Giese R.W., Anal Chem 63(24):2986−2989「ゼプトモルレベルのガスクロマトグラフィー/電子捕捉陰イオン質量分析法」1991)。フッ素化芳香族基も増感基として使用することができる。陰イオン質量分析法において感度を向上させるため、芳香族スルフォン酸を用いることもできる。
【0107】
それぞれの増感基は異なる利点を有しており、用いられるイオン化法及び質量分析法によって異なる。感度が増大するメカニズムも各基によって異なってもよい。誘導体化は、塩基度を上昇させることによりプロトン化及び電荷局在化を促進する方法もあれば、タグされたペプチドの表面活性を増加して、マトリックス支援レーザー脱離イオン化法(MALDI)や高速原子衝撃イオン化法(FAB)等の表面脱離法において感度を増大させる方法もある。適切な増感基による方法が、国際公開第02/099435、03/087839、及び2005/012914号パンフレットに開示されるMSモードの感度をより高めるために選択されてもよい。陰イオン質量分析法ではバックグラウンドノイズがより少ないため、感度がより高い傾向にある。電荷誘導体化により、衝突誘起解離法において誘導体化ペプチドのフラグメンテーション生成物を変えることもできる。特に、ある誘導体化法ではフラグメンテーションパターンが単純になることから、非常に有利である。増感基は、用いる質量分析法によって選択される(Rothら、Mass Spectrometry Reviews 17:255−274「質量分析法による分析のためのペプチド誘導体化」1998を参照)。本発明の目的を鑑みると、全ての公知の誘導体化法を本発明のペプチド質量タグに用いることができる。固相ペプチド合成後、本発明のペプチド質量タグを誘導体化するために既に公開されたプロトコルを、改良を加えずに用いることができる。また、必要であれば、プロトコルを固相合成中に使用するようにすぐに導入することができる。
【0108】
質量分析法によるペプチド分析
質量分析計の本質的な特徴は以下の通りである。
導入系→イオン源→質量分析計→イオン検出器→データ捕捉システム
【0109】
ペプチド分析の目的によって、好ましい導入系、イオン源及び質量分析計がある。
【0110】
導入系
本発明の第2の態様において、質量分析法による分析前に試料の複雑性を軽減するために、クロマトグラフィー又は電気泳動法が好まれる。各種の質量分析法技術は、特にキャピラリーゾーン電気泳動法及びHPLC(高速液体クロマトグラフィー)等の分離技術と互換性がある。典型的な連結器は、オンラインHPLC−ESI、オフラインHPLC−MALDI等が挙げられる。
【0111】
イオン化技術
生物学的質量分析法としていわゆる「ソフト」イオン化技術を利用することが多い。これにより、タンパク質及び核酸等の大きな分子をほぼ損傷せずにイオン化することができる。多数の技術が本発明での使用に適しており、例えば、ESI−MS(エレクトロスプレーイオン化質量分析法)、FAB(高速原子衝撃イオン化質量分析法)、MALDI−MS(マトリックス支援レーザー脱離イオン化質量分析法)及びAPCI−MS(大気圧化学イオン化質量分析法)が挙げられるが、これらに限定されない。
【0112】
エレクトロスプレーイオン化法
エレクトロスプレーイオン化法において、検体生体分子の希釈溶液を質量分析計において「原子化する」、即ち、微細スプレーとして注入する必要がある。例えば、溶液を帯電した針の先端から乾燥窒素流及び静電場に噴霧する。イオン化のメカニズムは完全には明らかになっていないが、概して以下のように作用すると考えられている。溶媒が窒素流において蒸発し、小さな液滴となり、これが検体分子の濃縮につながる。ほとんどの生体分子は実効電荷を有していることから、溶解した分子の静電反発が高まる。蒸発するにつれ、この反発は液滴の表面張力よりも最終的に大きくなり、液滴が分解され、小さな液滴になる。これは、「クーロン爆発」とも呼ばれる。静電場により、更に、液滴の表面張力に打ち勝って、噴霧プロセスが容易となる。小さな液滴になっても蒸発が継続し、結果として、全ての溶媒のように、生体分子が基本的に気相となるまで繰り返し爆発が起こる。この技術は他の技術と比べ、イオン化の過程においてイオンに付加するエネルギーが比較的少量であり、そのエネルギーが比較的狭い範囲において分布することから、質量標識体の使用においてこの技術は特に重要である。適切に配置された電極による電場を使用することにより、イオンが加速しイオン化室から出てくる。電場の極性を変えて、陰又は陽イオンを抽出してもよい。電極間の電位差により、質量分析器に導入する陽又は陰イオン、及び質量分析計に導入するイオンの運動エネルギーが決定する。このことは、質量分析計におけるイオンのフラグメンテーションを考慮する際に重要である。イオンに付加するエネルギーが多いほど、検体分子とイオン源に存在する浴ガスの衝突により、フラグメンテーションが起こりやすくなる。イオン化室からのイオンの加速に用いられる電場を調整することにより、イオンのフラグメンテーションを制御することができる。標識した生体分子からタグを取り除く手段としてイオンのフラグメンテーションが用いられる場合、これは特に有利である。エレクトロスプレーイオン化法は、液体クロマトグラフィー質量分析法(LC−MS)と呼ばれる液体クロマトグラフィーとインラインで用いることができることから、特に有利である。
【0113】
マトリックス支援レーザー脱離イオン化法(MALDI)
MALDIでは、光励起「マトリックス」に過剰モル生体分子溶液を包埋させる必要がある。適切な周波数を有するレーザー光を用いることにより、マトリックスが励起され、マトリックスと共に包括された生体分子が急速に蒸発する。詳細なイオン化のメカニズムは完全に理解されてはいないが、特に飛行時間(TOF)質量分析法等の陽イオン質量分析法で検出できるプロトン化生体分子の数を増やすことができる。陰イオン質量分析法もMALDI−TOFによって行うことができる。この技術は、イオンに大量の並進エネルギーを与えることができるにも関わらず、余分なフラグメンテーションを生じない傾向がある。電圧を加速し、且つマトリックスを選択することでMALDIにおけるフラグメンテーションが制御可能である。
【0114】
高速原子衝撃法
高速原子衝撃法(FAB)を用いて、比較的不揮発性である分子の気化及びイオン化技術を説明する。これらの技術では、試料とキセノン原子又はセシウムイオンの高エネルギービームの衝突により、表面から試料が脱離する。試料は、通常、不揮発性材料(例えば、m−ニトロベンジルアルコール(NBA)又はグリセロール)である単純マトリックス表面上に塗布される。FAB技術も液相導入系に対応しており、キャピラリー電気泳動導入系又は高圧液体クロマトグラフィー系から溶出した液体はフリットを通過し、検体溶液でフリット表面を実質的に被覆し、フリット表面から検体溶液を原子衝撃によりイオン化する。
【0115】
質量分析器
衝突誘起解離によるペプチドのフラグメンテーションを本発明に用いることにより、タンパク質に結合したタグを同定する。様々な質量分析器を用いてペプチドをフラグメント化し、フラグメントの質量を決定してもよい。
【0116】
ペプチドのMS/MS及びMSn分析
タンデム型質量分析計において、CID(衝突誘起解離)により所定の質量電荷比を有するイオンを選択し、フラグメント化することが可能である。そして、フラグメントを検出し、選択したイオンの構造情報を得ることができる。タンデム型質量分析計でCIDによりペプチドを分析する場合、特徴的な切断パターンを観察して、ペプチド配列を決定することができる。一般に天然ペプチドはペプチドバックボーンのアミド結合において無作為にフラグメント化し、そのペプチドの特徴的なイオンシリーズが得られる。イオンの電荷がイオンのN末端フラグメントに保持される場合には、n番目のペプチド結合での切断に対するCIDフラグメントシリーズはan、bn、cn等と表される。同様に、電荷がイオンのC末端フラグメントに保持される場合にはフラグメントシリーズはxn、yn、zn、等と表される。
【0117】
通常用いられるタンデム質量分析計は、トリプル四重極型であり、四重極衝突室で分離された2つの四重極質量分析計を含む。この衝突四重極は2つの質量分析計の四重極間のイオンガイドとして機能する。ガスを衝突四重極に導入して、第1の質量分析器からのイオン気流と衝突させることができる。第1の質量分析計によりイオンはその質量/電荷比をもとにして選択され、通過する衝突セルでフラグメント化する。フラグメントイオンは第3の質量分析計で分離され、検出される。本発明で重要なのは、イオンは、質量/電荷比をもとに第3質量分析計で選択され、更に衝突セルに通してフラグメント化可能であり、フラグメントイオンが更なる質量分析計で分離され、検出されることである。
【0118】
本発明は、トリプル四重極装置を使用してマルチプルリアクションモニタリング(MRM)実験における非常に高感度な方法で公知の検体の検出が可能である。MRMは、標的化合物の検出に対して最大感度を得るように設計される。この種の質量分析実験は、製薬業界で薬物及び薬物代謝産物の検出、及び定量化に広く用いられる。標的分子の質量及び構造を知ることで、標的分子に対する前駆体質量荷電比、及びフラグメント質量荷電比(MRM遷移)を予測可能である。これらのMRM実験は、そのような検体のスクリーニングに使用できる。
【0119】
誘起切断はタンデム分析計以外のジオメトリーで行うことができる。トラップされたイオンが衝突するガスをトラップに導入する過程で、イオントラップ質量分析計によりフラグメンテーションが促進できる。一般的に、イオントラップにはヘリウム等の浴ガスが含まれる。同様に、トラップされたイオンをフォトン誘導フラグメント化することもできる。他の好ましいジオメトリーは四重極/直交飛行時間タンデム装置であり、MS/MSモードで四重極を介して静電的通路が高感度のリフレクトロンTOF質量分析器に結合してフラグメンテーション生成物を同定することができる。
【0120】
従来の「セクター」型装置は、タンデム質量分析法に通常用いる別のジオメトリーである。セクター型質量分析計は2つの別々の「セクター」を含み、電気セクターがイオンビームに焦点を合わせると、イオンビームがイオン源を出発し、電場により同じ運動エネルギーを持つイオン流となる。磁気セクターはイオンを質量に基づいて分離し、検出器でスペクトルが形成される。タンデム質量分析法では、このような2つのセクターを含む質量分析計を使用することができ、電気セクターが第1質量分析計を設け、磁気セクターが第2質量分析計を設け、2つのセクター間には衝突セルが設けられる。衝突セルで分離された2の完全セクターからなる質量分析器は、質量タグしたペプチドの分析にも使用することができる。
【0121】
イオントラップ質量分析計は四重極質量分析計に類似する。一般的に、イオントラップは3つの電極からなる構造をしている。これは、円筒状電極の各端の「キャップ」電極によって、空洞が形成される。円筒状電極に正弦波高周波電位を印加し、キャップ電極にはDC又はAC電位でバイアスをかける。空洞に注入したイオンは、円筒状電極の振動電場により安定した軌道に束縛される。しかし、特定のイオンは、所与振幅の振動電位に対して不安定な軌道をとり、トラップから放出される。振動高周波電位を変化することによって、質量電荷比に応じてトラップに注入したイオン試料がトラップから連続的に放出する。そして、放出されたイオンを検出することにより、質量スペクトルが得られる。
【0122】
イオントラップは、一般的に、イオントラップの空洞に存在する少量の「浴ガス」、例えばヘリウムを用いて動作する。これにより、装置の解像度と感度の両方が増加し、また、トラップに入ったイオンは、浴ガスとの衝突を経て浴ガスの周囲温度にまでほぼ冷却される。衝突すると、試料をトラップに導入した時のイオン化は増加するが、それと共にイオン軌道の振幅と速度は低下してイオン軌道はトラップの中央近傍に保持される。
【0123】
イオントラップは、タンデム質量分析計のジオメトリーを真似ることができ、実際に、多重質量分析計のジオメトリーを真似たものにして、トラップされたイオンの複雑な分析が可能となっている。試料由来の単一の質量種はトラップに保持できる。即ち、その他の種は全てトラップから放出させることができ、第一振動周波上に第二振動周波を超負荷することにより、保持した種を慎重に励起することができる。励起されたイオンは浴ガスと衝突し、十分に励起されるとフラグメント化する。このため、このフラグメントを更に分析することができる。フラグメントイオンを保持して他のイオンを放出し、フラグメントイオンを励起してフラグメント化することにより、更にフラグメントイオンを分析することも可能である。十分な試料が存在する限り、このプロセスを繰り返し行い、更なる分析をすることができる。留意すべき点として、これらの装置は一般的に誘導フラグメンテーション後のフラグメントイオンを高い割合で保持する。これらの装置とFTICR質量分析計(後述する)は、線形質量分析計に見られる空間分解タンデム質量分析法ではなく、一時的な分解タンデム質量分析法の形態を代表するものである。
【0124】
フーリエ変換イオンサイクロトロン共鳴質量分析法(FTICR MS)
FTICR質量分析計は、イオン試料が空洞内に保持されるという点でイオントラップと類似する特徴を有する。しかし、FTICR MSでは、交差電磁場により高真空室にイオンがトラップされる。箱の二つの側面を形成する一対の平板電極によって電場は形成される。この箱は超伝導磁石の磁場に収容される。この磁石は、トラッププレートである2枚の平板に連結しており、トラッププレート間にあってかつ印加した磁場に直交する円形軌道に注入イオンを束縛する。箱の他の対立側を形成する2枚の「送信板」に高周波パルスを印加すると、イオンはより大きな軌道に励起される。イオンのサイクロイド運動により、「受信板」を含む箱の残りの二つの対立側に、対応する電場が発生する。励起パルスによりイオンはより大きな軌道に励起されるが、衝突を経てイオンの固有運動が失われるのに従いこの軌道は崩壊する。受信板が検出した対応シグナルは、フーリエ変換(FT)分析により質量スペクトルに変換される。
【0125】
誘起フラグメンテーション実験において、これらの装置は、イオントラップと類似の方法を行うことができる。所望の単一種を除く全てのイオンをトラップから放出できる。衝突ガスをトラップに導入してフラグメンテーションを誘起することができる。そして、フラグメントイオンを分析することができる。「受信板」が検出したシグナルのFT分析によって分析する場合に、一般的に、フラグメンテーション生成物と浴ガスとが結合すると解像度が低くなる。しかし、フラグメントイオンを空洞から放出させ、例えばタンデム四重極型分析器で分析することができる。
【0126】
クロマトグラフィー又は電気泳動による標識されたペプチドの分離
本発明の一実施形態において、質量分析による分析前に標識された生体分子をクロマトグラフィーで分離する。HPLC(高速液体クロマトグラフィー)で分離することが好ましく、これを質量分析計に直接連結すれば、ペプチドをクロマトグラフィーカラムから溶出しながらペプチドをインライン分析することができる。HPLCによって多様な分離技術を実施できるが、質量分析前のペプチド分離には、逆相クロマトグラフィーが一般的である。キャピラリーゾーン電気泳動は別の分離方法であり、質量分析計に直接連結することにより溶出試料の自動分析ができる。これらの分析方法や他の分画技術を用いて、質量分析前の生体分子の混合物の複雑さを軽減してもよい。
【0127】
本発明の応用
ペプチド及びポリペプチドの標識及びLC−MS−MS−MSによる分析
本発明の好適な実施形態の第2の態様では、タグを使用してペプチド混合物を液体クロマトグラフィートリプル質量分析法(LC−MS−MS−MS)により分析する。本発明の質量標識体の使用について、ペプチド分析に関連付けて説明する。図示されたような質量標識体を用いて、ペプチドを標識してもよい。これらの化合物における反応性官能基が、N−ヒドロキシスクシンイミドエステルであるならば、タグがリシンのαアミノ基及びεアミノ基等の遊離アミノ基と反応する。
【0128】
タグを結合すると、標識したペプチドの質量はタグの質量だけ変動する。このペプチドの質量はもとのタンパク質の同定には十分であると推測される。この場合、タグのみを検出すればよく、以下に詳細に説明するトリプル四重極で選択した反応をモニタリングすることで検出できる。概述すると、所望のペプチドの質量に対応する質量荷電比を持ったイオンが通過できるようにトリプル四重極の第1四重極を設定し、質量マーカー部の質量に合うように調節する。次に、選択したイオンを第2四重極で衝突誘起解離(CID)する。ペプチド分析におけるこのような条件下で、イオンは、概ね、その分子のアミド結合でフラグメント化する。図1のマーカーは、アミド結合を有し、切断上のタグのN末端部を開放する。タグの質量は全て同じであるが、アミド結合端部に異なる置換基を有するため、標識体のグループ間で末端部分が異なる。そのため、質量標識体のグループは互いに識別可能である。特定の質量のイオンに関連したマーカーフラグメントの存在により、そのイオンはペプチドであり、かつ異なる試料に由来するタグのピークの相対的な高さから、試料中のペプチドの相対量に関する情報が得られることが確認される。試料中に同じ末端質量を有する末端ペプチドが多数あるか、ペプチドが未知である等、質量のみで十分にペプチドを同定できない場合、全CIDスペクトルを分析して配列情報を決定してもよい。ペプチドフラグメンテーションピークを使用してペプチドを同定することができ、質量標識体ピークからそのペプチドの相対量に関する情報が得られる。
【0129】
タンデム質量分析法によるタンパク質、特にペプチド混合物の分析は、スペクトルの「ノイズ」が入るので複雑になる。ペプチドを生物試料から単離すると、時折、緩衝剤、変性剤及び界面活性剤が混入して、質量スペクトル中にこれら全てのピークが現れる。その結果、ペプチドピーク以外のピークがスペクトルに現れてしまい、ペプチドに対応するピークを同定することが非常に困難となる。特に、試料タンパク質が小さく、単離が困難な場合に問題となる。したがって、各種方法を駆使してどのピークがペプチドに対応するかを決定してから、詳細なCID分析を行うことになる。トリプル四重極装置でプリカーサーイオンスキャンを行うことができる(Wilm M.ら、Anal Chem 68(3):527−33「未分離ペプチド混合物の親イオンスキャン」(1996)を参照)。単一反応モニタリングモードでトリプル四重極を動作すれば、第1四重極が全質量範囲を走査し、第2四重極においてゲートに入れられた各イオンに対してCIDを行う。そして、特定の1つのフラグメントイオンのみを検出するように第3四重極を設定する。このフラグメントイオンは、通常、ペプチドに由来するインモニウムイオン等の特徴的なフラグメントイオンである。このような技術を用いることにより、リン酸基の存在も検出することができる。
【0130】
プレカーサーイオンスキャン法に加えて、標的検体に対する最大感度を得るために選択反応モニタリング法(SRM)が使用できる。SRMは、MS/MSフラグメンテーションに対して化合物の親イオンの質量/電荷比を規定することで行われ、シングルフラグメントイオンを詳細にモニタリングする。上記の標識体と一緒に、質量マーカー部がフラグメントイオンとしてモニタリングされる1つのSRM実験で多くの試料を分析可能である。更に、MS/MS/MS工程により、質量マーカー部のフラグメントを介して試料アレイの定量化が可能になる。
【0131】
マルチプルリアクションモニタリング(MRM)は、同様の実験方法を使用するが、しかし、1つ以上の遷移が起こる。ハイブリッド四重極リニアイオントラップ装置を使用してプロダクトイオンスキャン(MS/MS)で追随して捕捉を誘発するために非常に高感度のSRM及びMRM実験が使用できる。そのような装置は、また、MS/MSに制限される従来のトリプル四重極装置とは対照的に、更にMS工程(MS/MS/MS又はMS3)が可能である。プロテオミクス用途において、これはペプチドの統計的検証又は多数の種のタンパク質定量に非常に有用である。記載のタグを非常に高感度のMRMスキャンと更にMS3スキャンとを組合せることで、1回で多数の種のデータの検証を提供する。
【0132】
本発明の質量標識体でペプチドを標識することにより、新しいプリカーサーイオンスキャンが予見できる。即ち、標識したペプチドのCIDを行った後の本発明の質量標識体に対応するフラグメントの存在により、ペプチドピークを同定してもよい。特に、各試料から本発明の方法により単離したペプチドを1つ以上の質量標識体で標識してもよい。全試料に使用する「プリカーサーイオンスキャン」用タグ及び試料に特異的なタグの等モル混合物を用いて、各試料のペプチドを標識してもよい。こうすれば、異なる試料においてペプチドレベルが変動しても、プリカーサーイオンスキャンによるペプチドピークの同定に悪影響はない。
【0133】
ペプチドイオンを同定し選択したら、CIDを行う。CIDスペクトルは時折極めて複雑となり、CIDスペクトルのどのピークが有意なペプチドフラグメントシリーズに対応するかを決定するのが、質量分析法でペプチド配列を決定する際に更に問題になる。Shevchenkoら、Rapid Commun. Mass Spec. 11:1015−1024(1997)には別の方法が記載されており、1:1 16O/18O水中で、分析するタンパク質をトリプシン処理している。その加水分解反応の結果、2つのペプチド集団が生じ、第1の集団の末端カルボキシルには16Oが、第2の集団の末端カルボキシルには18Oが含有される。試料中の各ペプチドに対して、強度の等しい二重ピークが存在し、その二重ピークは2ダルトン離れている。このピークはペプチド本来の同位体のピークと少し重なるが、CIDスペクトルにおいてこれを双極子として自動走査することができる。2つの異なるフラグメントにより双極子間の質量差を決定し、アミノ酸を同定することができる。この方法を本発明の方法に用いてもよい。
【0134】
タンパク質発現のプロファイリング
癌組織の変化を理解するには、例えば、その組織での分子的変化を全て理解し、理想的にはそれらの変化を正常組織に関連付けることが必要である。分子的変化を全て決定するには、遺伝子発現の変化、タンパク質発現及び最終的には代謝産物の変化を測定する能力が必要とされる。異なる組織試料間の多数の遺伝子の発現量は、マイクロアレイ技術を使用してメッセンジャーRNA(mRNA)量で同時に比較可能である(例えば、Iyer V.R.ら、Science 283(5398):83−87「ヒト繊維芽細胞の血清に対する応答の際の転写プログラム」1999参照)。しかし、mRNA量は組織中のタンパク質量に直接相関しない。組織についてタンパク質発現のプロファイルを決定するのにあたって、二次元ゲル電気泳動法が広く使用されている。残念ながら、この技術は極めて手間がかかり、再現性に難点があるため2つ以上の試料を2−Dゲル上で同時に比較することは困難である。上述のように、本発明の方法を使えば、ペプチドを効果的に分析することができる。本発明のタグをLC−MS−MSで使用すれば、試料が異なっても同じペプチドを同定することができる。更に、試料が異なっても同一のペプチドの相対量を決定することができる。多数の試料中のペプチドの同一性及び相対量を迅速かつ感度よく測定できるため、発現をプロファイルすることができる。したがって、本発明の目的は、ペプチドの選択的単離及び標識に基づく複雑なタンパク質試料を比較分析する改良した方法を提供することである。以下に、タンパク質発現を包括的に分析する2つの開示されたアプローチについて説明し、タンパク質の特定の状態、例えばリン酸化及び炭水化物修飾を分析するための様々な方法についても記載する。
【0135】
包括的タンパク質発現プロファイル用の末端ペプチド単離
N末端又はC末端のペプチドの単離については、タンパク質試料の包括的な発現プロファイルを決定する方法として説明してきた。末端ペプチドの単離により、1つのタンパク質において少なくとも1つのペプチド又は1つのペプチドのみが確実に単離され、その結果、複雑な分析試料における成分が最初の試料より確実に少なくなる。大きなポリペプチドを短いペプチドにすれば、質量分析法による試料の分析がより容易となる。ポリペプチド末端からペプチドを単離する方法は、国際出願番号PCT/GB98/00201明細書及び国際出願番号PCT/GB99/03258明細書に記載されている。
【図面の簡単な説明】
【0136】
【図1】図1は、本発明の使用に適した標識した検体を示す。
【図2】図2は、図1に示す質量マーカー部の衝突誘起解離により作製される質量スペクトルを示す。
【図3】図3は、図2に示す質量スペクトルの翻訳を示す。
【図4】図4は、図1に示す質量標識体の同位体標識に適した位置を示す。
【図5】図5は、本発明による質量標識体セットを示す。
【図6】図6は、異なる位置に13Cで標識した質量標識体セットを示す。
【特許請求の範囲】
【請求項1】
質量標識体のグループを複数含む質量標識体セットであって、
セット内の前記質量標識体は、それぞれ、切断可能なリンカーを介して質量正規化部に結合している質量マーカー部を有し、
セット内の前記質量標識体は、互いに質量が同じであり、
グループ内の前記質量標識体において、前記質量マーカー部の質量は同じであり、
グループ間の前記質量標識体において、前記質量マーカー部の質量が異なり、
前記質量マーカー部は、2つ以上のフラグメントにフラグメンテーション可能であり、
グループ内の前記質量標識体間で、前記質量マーカー部の少なくとも1つの前記フラグメントの質量が異なることを特徴とする質量標識体セット。
【請求項2】
セット内の1つ以上の質量標識体が1つ以上の同位体標識体を含む請求項1に記載の質量標識体セット。
【請求項3】
セット内のそれぞれの質量標識体が同位体標識体を含み、セット内の質量標識体間で前記同位体標識体の位置が異なる請求項2に記載の質量標識体セット。
【請求項4】
セット内のそれぞれの質量標識体が2つ以上でかつ同数の同位体標識体を含み、セット内の質量標識体間で前記同位体標識体の位置が異なる請求項3に記載の質量標識体セット。
【請求項5】
グループ内の質量標識体において、それぞれの質量マーカー部に含まれる同位体標識体の数が同じである請求項2から4のいずれかに記載の質量標識体セット。
【請求項6】
グループ内の質量標識体において、それぞれの質量正規化部に含まれる同位体標識体の数が同じである請求項2から5のいずれかに記載の質量標識体セット。
【請求項7】
グループ内の質量標識体において、それぞれの質量標識体の質量マーカー部が少なくとも1つの同位体標識体を含み、
前記グループ内の質量標識体間で、少なくとも1つの前記同位体標識体の位置が異なる請求項2から6のいずれかに記載の質量標識体セット。
【請求項8】
グループ内のそれぞれの質量標識体が、質量マーカー部の異なる位置に同位体標識体を含み、
前記グループ内のそれぞれの質量標識体において、前記同位体標識体が異なるフラグメントに含まれる請求項2から7のいずれかに記載の質量標識体セット。
【請求項9】
グループ内のそれぞれの質量標識体において、2つ以上の同位体標識体を含み、
前記グループ内の質量標識体間で、少なくとも1つの前記同位体標識体の位置が異なり、
前記グループ内のそれぞれの質量標識体において、少なくとも1つの前記同位体標識体が質量マーカー部の異なるフラグメントに含まれる請求項2から8のいずれかに記載の質量標識体セット。
【請求項10】
グループ内のそれぞれの質量標識体が、同じ化学種である質量マーカー部を含み、
前記グループ内のそれぞれの質量標識体は、質量マーカー部の異なる位置に同位体マーカーを含む請求項2から8のいずれかに記載の質量標識体セット。
【請求項11】
セット内のそれぞれの質量標識体が、同じ化学種であり、
セット内のそれぞれの質量標識体が、2つ以上でかつ同数の同位体標識体を含み、
グループ内のそれぞれの質量標識体は、質量マーカー部に第1番号同位体マーカーを、質量正規化部に第2番号同位体マーカーを含み、
グループ間で、前記第1番号及び前記第2番号が異なる請求項9から10のいずれかに記載の質量標識体セット。
【請求項12】
同位体標識体が2H,13C,15N又は18Oを含む請求項2から11のいずれかに記載の質量標識体セット。
【請求項13】
グループ内の質量標識体において、質量正規化部の質量が同じであり、
グループ間の質量標識体において、質量正規化部の質量が異なる請求項2から12のいずれかに記載の質量標識体セット。
【請求項14】
質量マーカー部が衝突誘起解離によりフラグメント化可能である請求項1から13のいずれかに記載の質量標識体セット。
【請求項15】
請求項1から14のいずれかに記載の複数の質量標識体セットを含み、
セット間で、質量標識体の質量が異なることを特徴とする質量標識体アレイ。
【請求項16】
請求項1から15のいずれかに記載の質量標識体セット又はアレイとは異なる質量標識体に結合している検体、又は、請求項1から15のいずれかに記載の質量標識体セット又はアレイとは異なる組合せの質量標識体に結合している検体、をそれぞれ含むことを特徴とする標識した検体のセット。
【請求項17】
請求項1から15のいずれかに記載の質量標識体セット又はアレイを含む請求項16に記載の標識した検体のセット。
【請求項18】
セット内のそれぞれの検体が、異なるか、又は、異なる試料に由来する請求項16から17のいずれかに記載の標識した検体のセット。
【請求項19】
セットの各標識したプローブは、請求項1から15のいずれかに記載の質量標識体セット又はアレイとは異なる質量標識体に結合しているプローブ、又は、請求項1から15のいずれかに記載の質量標識体セット又はアレイとは異なる組合せの質量標識体に結合しているプローブを含むことを特徴とする2つ以上の標識したプローブのセット。
【請求項20】
それぞれの検体又はプローブが生体分子を含む請求項16から19のいずれかに記載の標識した検体又は標識したプローブのセット。
【請求項21】
生体分子が、DNA、RNA、オリゴヌクレオチド、核酸塩基、タンパク質、及び/又はアミノ酸から選択される請求項20に記載の検体又はプローブのセット。
【請求項22】
検体に関連付けられる質量標識体又は質量標識体の組合せを、質量分析法により同定することで検体を検出する工程を含む分析方法であって、
前記質量標識体が請求項1から15のいずれかに記載の質量標識体セット又はアレイの質量標識体であることを特徴とする分析方法。
【請求項23】
使用する質量標識体が、アフィニティー捕捉リガンドを含む標識体であり、
前記アフィニティー捕捉リガンドをカウンターリガンドで捕捉することにより、標識した検体を未標識検体から分離する請求項22に記載の分析方法。
【請求項24】
2つ以上の検体を、前記検体の質量標識体又は質量標識体の組合せを質量分析法で同時に同定することにより、検出する請求項22から23のいずれかに記載の分析方法。
【請求項25】
それぞれの検体を、質量標識体セット又はアレイの質量標識体の固有の組合せによって同定し、
それぞれの組合せを、セット又はアレイ中の各質量標識体の有無及び/又は各質量標識体の量によって識別する請求項22から24のいずれかに記載の分析方法。
【請求項26】
検体の質量標識体を質量分析法で検出する前に、前記検体を質量に応じて分離することにより、2つ以上の検体を同定する請求項22から25のいずれかに記載の分析方法。
【請求項27】
分離が、クロマトグラフィー法又は電気泳動法によって行われる請求項23から26のいずれかに記載の分析方法。
【請求項28】
質量標識体の検出に使用する質量分析器が、1つ以上の質量分析計を含み、
前記質量分析計が、特定の質量又は質量範囲のイオンを検出のために通過させることができる、及び/又は、イオンを解離させることができる請求項22から27のいずれかに記載の分析方法。
【請求項29】
1つ以上の公知の質量標識体に特異的な特定の質量又は質量範囲のイオンを、質量分析計によって選択し、選択したイオンを解離させ、解離生成物を検出して、選択した前記質量標識体を示すイオンパターンを同定する請求項28に記載の分析方法。
【請求項30】
質量分析器が、3つ以上の四重極質量分析計を含む請求項28から29のいずれかに記載の分析方法。
【請求項31】
質量分析器が、2つの四重極質量分析計及びイオントラップ質量分析計を含む請求項28から29のいずれかに記載の分析方法。
【請求項32】
第1質量分析計を使用して特定の質量又は質量範囲のイオンを選択し、第2質量分析計を使用して選択したイオンを解離させ、第3質量分析計を使用して得られたイオンを検出する請求項30から31のいずれかに記載の分析方法。
【請求項33】
(a)1つ以上の検体を、請求項19から21のいずれかに記載のプローブのセットと接触させ、
(b)検体を、前記検体に関連付け可能なプローブを検出することにより同定する、
請求項22から32のいずれかに記載の分析方法。
【請求項34】
質量標識体を質量分析計で検出する前に、前記質量標識体をプローブから切断させる請求項33に記載の分析方法。
【請求項35】
1つ以上の核酸をハイブリダイゼーションプローブセットと接触させる請求項33から34のいずれかに記載の分析方法。
【請求項36】
質量分析方法であって、
(a) 請求項1から15のいずれかに記載の質量標識体セットを質量分析器で検出し、
(b) 前記質量分析器で質量標識体を解離して、質量正規化部から質量マーカー部を遊離させ、
(c) 前記質量分析器で前記質量マーカー部を検出し、
(f) 前記質量分析器で前記質量マーカー部をフラグメント化して、それぞれの質量マーカー部から2つ以上のフラグメントを生成し、
(f) 前記フラグメントを検出する、
工程を含むことを特徴とする質量分析方法。
【請求項37】
質量標識体が、請求項16から18のいずれかに記載の標識した検体のセットに含まれる請求項36に記載の分析方法。
【請求項38】
マルチプルリアクションモニタリング実験を含む請求項22から37のいずれかに記載の分析方法。
【請求項1】
質量標識体のグループを複数含む質量標識体セットであって、
セット内の前記質量標識体は、それぞれ、切断可能なリンカーを介して質量正規化部に結合している質量マーカー部を有し、
セット内の前記質量標識体は、互いに質量が同じであり、
グループ内の前記質量標識体において、前記質量マーカー部の質量は同じであり、
グループ間の前記質量標識体において、前記質量マーカー部の質量が異なり、
前記質量マーカー部は、2つ以上のフラグメントにフラグメンテーション可能であり、
グループ内の前記質量標識体間で、前記質量マーカー部の少なくとも1つの前記フラグメントの質量が異なることを特徴とする質量標識体セット。
【請求項2】
セット内の1つ以上の質量標識体が1つ以上の同位体標識体を含む請求項1に記載の質量標識体セット。
【請求項3】
セット内のそれぞれの質量標識体が同位体標識体を含み、セット内の質量標識体間で前記同位体標識体の位置が異なる請求項2に記載の質量標識体セット。
【請求項4】
セット内のそれぞれの質量標識体が2つ以上でかつ同数の同位体標識体を含み、セット内の質量標識体間で前記同位体標識体の位置が異なる請求項3に記載の質量標識体セット。
【請求項5】
グループ内の質量標識体において、それぞれの質量マーカー部に含まれる同位体標識体の数が同じである請求項2から4のいずれかに記載の質量標識体セット。
【請求項6】
グループ内の質量標識体において、それぞれの質量正規化部に含まれる同位体標識体の数が同じである請求項2から5のいずれかに記載の質量標識体セット。
【請求項7】
グループ内の質量標識体において、それぞれの質量標識体の質量マーカー部が少なくとも1つの同位体標識体を含み、
前記グループ内の質量標識体間で、少なくとも1つの前記同位体標識体の位置が異なる請求項2から6のいずれかに記載の質量標識体セット。
【請求項8】
グループ内のそれぞれの質量標識体が、質量マーカー部の異なる位置に同位体標識体を含み、
前記グループ内のそれぞれの質量標識体において、前記同位体標識体が異なるフラグメントに含まれる請求項2から7のいずれかに記載の質量標識体セット。
【請求項9】
グループ内のそれぞれの質量標識体において、2つ以上の同位体標識体を含み、
前記グループ内の質量標識体間で、少なくとも1つの前記同位体標識体の位置が異なり、
前記グループ内のそれぞれの質量標識体において、少なくとも1つの前記同位体標識体が質量マーカー部の異なるフラグメントに含まれる請求項2から8のいずれかに記載の質量標識体セット。
【請求項10】
グループ内のそれぞれの質量標識体が、同じ化学種である質量マーカー部を含み、
前記グループ内のそれぞれの質量標識体は、質量マーカー部の異なる位置に同位体マーカーを含む請求項2から8のいずれかに記載の質量標識体セット。
【請求項11】
セット内のそれぞれの質量標識体が、同じ化学種であり、
セット内のそれぞれの質量標識体が、2つ以上でかつ同数の同位体標識体を含み、
グループ内のそれぞれの質量標識体は、質量マーカー部に第1番号同位体マーカーを、質量正規化部に第2番号同位体マーカーを含み、
グループ間で、前記第1番号及び前記第2番号が異なる請求項9から10のいずれかに記載の質量標識体セット。
【請求項12】
同位体標識体が2H,13C,15N又は18Oを含む請求項2から11のいずれかに記載の質量標識体セット。
【請求項13】
グループ内の質量標識体において、質量正規化部の質量が同じであり、
グループ間の質量標識体において、質量正規化部の質量が異なる請求項2から12のいずれかに記載の質量標識体セット。
【請求項14】
質量マーカー部が衝突誘起解離によりフラグメント化可能である請求項1から13のいずれかに記載の質量標識体セット。
【請求項15】
請求項1から14のいずれかに記載の複数の質量標識体セットを含み、
セット間で、質量標識体の質量が異なることを特徴とする質量標識体アレイ。
【請求項16】
請求項1から15のいずれかに記載の質量標識体セット又はアレイとは異なる質量標識体に結合している検体、又は、請求項1から15のいずれかに記載の質量標識体セット又はアレイとは異なる組合せの質量標識体に結合している検体、をそれぞれ含むことを特徴とする標識した検体のセット。
【請求項17】
請求項1から15のいずれかに記載の質量標識体セット又はアレイを含む請求項16に記載の標識した検体のセット。
【請求項18】
セット内のそれぞれの検体が、異なるか、又は、異なる試料に由来する請求項16から17のいずれかに記載の標識した検体のセット。
【請求項19】
セットの各標識したプローブは、請求項1から15のいずれかに記載の質量標識体セット又はアレイとは異なる質量標識体に結合しているプローブ、又は、請求項1から15のいずれかに記載の質量標識体セット又はアレイとは異なる組合せの質量標識体に結合しているプローブを含むことを特徴とする2つ以上の標識したプローブのセット。
【請求項20】
それぞれの検体又はプローブが生体分子を含む請求項16から19のいずれかに記載の標識した検体又は標識したプローブのセット。
【請求項21】
生体分子が、DNA、RNA、オリゴヌクレオチド、核酸塩基、タンパク質、及び/又はアミノ酸から選択される請求項20に記載の検体又はプローブのセット。
【請求項22】
検体に関連付けられる質量標識体又は質量標識体の組合せを、質量分析法により同定することで検体を検出する工程を含む分析方法であって、
前記質量標識体が請求項1から15のいずれかに記載の質量標識体セット又はアレイの質量標識体であることを特徴とする分析方法。
【請求項23】
使用する質量標識体が、アフィニティー捕捉リガンドを含む標識体であり、
前記アフィニティー捕捉リガンドをカウンターリガンドで捕捉することにより、標識した検体を未標識検体から分離する請求項22に記載の分析方法。
【請求項24】
2つ以上の検体を、前記検体の質量標識体又は質量標識体の組合せを質量分析法で同時に同定することにより、検出する請求項22から23のいずれかに記載の分析方法。
【請求項25】
それぞれの検体を、質量標識体セット又はアレイの質量標識体の固有の組合せによって同定し、
それぞれの組合せを、セット又はアレイ中の各質量標識体の有無及び/又は各質量標識体の量によって識別する請求項22から24のいずれかに記載の分析方法。
【請求項26】
検体の質量標識体を質量分析法で検出する前に、前記検体を質量に応じて分離することにより、2つ以上の検体を同定する請求項22から25のいずれかに記載の分析方法。
【請求項27】
分離が、クロマトグラフィー法又は電気泳動法によって行われる請求項23から26のいずれかに記載の分析方法。
【請求項28】
質量標識体の検出に使用する質量分析器が、1つ以上の質量分析計を含み、
前記質量分析計が、特定の質量又は質量範囲のイオンを検出のために通過させることができる、及び/又は、イオンを解離させることができる請求項22から27のいずれかに記載の分析方法。
【請求項29】
1つ以上の公知の質量標識体に特異的な特定の質量又は質量範囲のイオンを、質量分析計によって選択し、選択したイオンを解離させ、解離生成物を検出して、選択した前記質量標識体を示すイオンパターンを同定する請求項28に記載の分析方法。
【請求項30】
質量分析器が、3つ以上の四重極質量分析計を含む請求項28から29のいずれかに記載の分析方法。
【請求項31】
質量分析器が、2つの四重極質量分析計及びイオントラップ質量分析計を含む請求項28から29のいずれかに記載の分析方法。
【請求項32】
第1質量分析計を使用して特定の質量又は質量範囲のイオンを選択し、第2質量分析計を使用して選択したイオンを解離させ、第3質量分析計を使用して得られたイオンを検出する請求項30から31のいずれかに記載の分析方法。
【請求項33】
(a)1つ以上の検体を、請求項19から21のいずれかに記載のプローブのセットと接触させ、
(b)検体を、前記検体に関連付け可能なプローブを検出することにより同定する、
請求項22から32のいずれかに記載の分析方法。
【請求項34】
質量標識体を質量分析計で検出する前に、前記質量標識体をプローブから切断させる請求項33に記載の分析方法。
【請求項35】
1つ以上の核酸をハイブリダイゼーションプローブセットと接触させる請求項33から34のいずれかに記載の分析方法。
【請求項36】
質量分析方法であって、
(a) 請求項1から15のいずれかに記載の質量標識体セットを質量分析器で検出し、
(b) 前記質量分析器で質量標識体を解離して、質量正規化部から質量マーカー部を遊離させ、
(c) 前記質量分析器で前記質量マーカー部を検出し、
(f) 前記質量分析器で前記質量マーカー部をフラグメント化して、それぞれの質量マーカー部から2つ以上のフラグメントを生成し、
(f) 前記フラグメントを検出する、
工程を含むことを特徴とする質量分析方法。
【請求項37】
質量標識体が、請求項16から18のいずれかに記載の標識した検体のセットに含まれる請求項36に記載の分析方法。
【請求項38】
マルチプルリアクションモニタリング実験を含む請求項22から37のいずれかに記載の分析方法。
【図1】


【図2】


【図3】


【図4】


【図5】


【図6】




【図2】


【図3】


【図4】


【図5】


【図6】


【公表番号】特表2009−508135(P2009−508135A)
【公表日】平成21年2月26日(2009.2.26)
【国際特許分類】
【出願番号】特願2008−530598(P2008−530598)
【出願日】平成18年9月11日(2006.9.11)
【国際出願番号】PCT/GB2006/003341
【国際公開番号】WO2007/031717
【国際公開日】平成19年3月22日(2007.3.22)
【出願人】(505423678)エレクトロフォレティクス リミテッド (7)
【Fターム(参考)】
【公表日】平成21年2月26日(2009.2.26)
【国際特許分類】
【出願日】平成18年9月11日(2006.9.11)
【国際出願番号】PCT/GB2006/003341
【国際公開番号】WO2007/031717
【国際公開日】平成19年3月22日(2007.3.22)
【出願人】(505423678)エレクトロフォレティクス リミテッド (7)
【Fターム(参考)】
[ Back to top ]

