赤外吸収スペクトル測定法を用いた酸化物材料中の酸化マグネシウム含有量および酸化カルシウム含有量の測定方法
【課題】水和反応による体積膨張に起因して成型体中に亀裂の発生や粉化・破壊などを引き起こす原因となる酸化物材料中の酸化マグネシウムおよび酸化カルシウムの含有量を赤外吸収スペクトル測定法を用いて精度良く測定する方法を提供する。
【解決手段】予め前記酸化物材料の粉砕試料を重水(D2O)または重水酸化ナトリウム(NaOD)重水溶液中に浸漬し、該粉砕試料中の酸化マグネシウム(MgO)および酸化カルシウム(CaO)を、それぞれ重水酸化マグネシウム(Mg(OD)2)および重水酸化カルシウム(Ca(OD)2)とした後、赤外吸収スペクトルを測定し、該赤外吸収スペクトルにおける重水酸化マグネシウムおよび重水酸化カルシウムのそれぞれの重水酸基(O−D)に起因する吸収帯の赤外吸収ピークの面積あるいは高さを基に、前記酸化物材料の粉砕試料中の酸化マグネシウム含有量および酸化カルシウム含有量を求めることを特徴とする。
【解決手段】予め前記酸化物材料の粉砕試料を重水(D2O)または重水酸化ナトリウム(NaOD)重水溶液中に浸漬し、該粉砕試料中の酸化マグネシウム(MgO)および酸化カルシウム(CaO)を、それぞれ重水酸化マグネシウム(Mg(OD)2)および重水酸化カルシウム(Ca(OD)2)とした後、赤外吸収スペクトルを測定し、該赤外吸収スペクトルにおける重水酸化マグネシウムおよび重水酸化カルシウムのそれぞれの重水酸基(O−D)に起因する吸収帯の赤外吸収ピークの面積あるいは高さを基に、前記酸化物材料の粉砕試料中の酸化マグネシウム含有量および酸化カルシウム含有量を求めることを特徴とする。
【発明の詳細な説明】
【技術分野】
【0001】
本発明は、製鋼スラグ、不定形耐火物、セメントなどの酸化物材料中に含有するアルカリ土類金属酸化物を定量する方法に関し、特に、酸化物材料を成型体として利用する場合に水和反応による体積膨張に起因して、成型体中に亀裂の発生や粉化・破壊などを引き起こす原因となる酸化マグネシウムおよび酸化カルシウムの含有量を赤外吸収スペクトル測定法を利用して測定する方法に関する。
【背景技術】
【0002】
従来から製鉄プロセスで生成される製鋼スラグ、不定形耐火物、セメントなどの酸化物材料は、一般の土木・構造物材料や、加熱炉などの耐火物材料などの成型体材料として広く用いられている。しかし、これらの酸化物材料中に含有する酸化マグネシウム(MgO)および酸化カルシウム(CaO)は、成型体中で(1)式および(2)式に示される水との水和反応により水酸化マグネシウムMg(OH)2 や水酸化カルシウムCa(OH)2 となる際に体積が約2倍に膨張するため、成型体中に亀裂を発生し、粉化・破壊を招く原因となっていた。
MgO+H2O → Mg(OH)2 ・・・(1)
CaO+H2O → Ca(OH)2 ・・・(2)
例えば、製鉄プロセスで生成される製鋼スラグをセメントの代替材料として使用することが行なわれているが、この材料を道路路盤材等に利用した場合に、上記MgOやCaOの水和反応に起因する体積膨張により路盤に凹凸や亀裂を生じ、車両の走行に支障をきたすなどの問題が生ずる。このため、MgOやCaOを含む道路用製鋼スラグを使用する場合には、JIS A 5015「水浸膨張試験」(例えば非特許文献1、参照)に準じて測定される水浸膨張率が1.5%以下である条件を満足させることになっている。
【0003】
従来、体積膨張の原因となる製鋼スラグ中のMgO量やCaO量を低減する方法として、次のような方法が知られている。
(a) 自然エージング処理方法;所定粒度に破砕した製鋼スラグを、山積みし、大気中の水分、雨水等によって (1)式の水和反応を行わせることにより、MgOをMg(OH)2、CaOをCa(OH)2として安定化する方法。
(b) 水蒸気エージング処理方法;所定粒度に破砕した製鋼スラグを、山積みし、高温度で蒸気を吹き込み、大気中で48時間以上暴露することにより、MgOをMg(OH)2 、CaOをCa(OH)2として安定化する方法(例えば特許文献1、参照)。
(c) 温水エージング処理方法 ;所定粒度に破砕した製鋼スラグを、温水に浸漬することにより、MgOをMg(OH)2、CaOをCa(OH)2として安定化する方法で(例えば特許文献2、参照)。
(d) 赤泥添加処理方法;溶融状態の転炉スラグまたは電気炉スラグに赤泥を添加することにより、MgO及びCaOを消失させ、スラグの膨張性を安定化する方法(例えば特許文献3、参照)。
【0004】
しかし、製鋼スラグ中のMgOやCaOはスラグ塊の表面だけでなく、塊の内部に取り込まれているため、上記方法によりMgO及びCaOをMg(OH)2 及びCa(OH)2として安定化するための処理時間は、自然エージング処理法で通常1年以上、水蒸気エージング処理法や温水エージング処理法でも、48時間以上の長時間を要する。また、上記赤泥添加処理法は、溶融状態のスラグに赤泥を添加することから、スラグの塩基度が低下することに起因し、転炉等の耐火物を損耗させる原因になっていた。
【0005】
上記方法を用いてスラグ中のMgO、CaOを低減する際には、処理前後のスラグ中のMgO、CaOを精度良く定量化し、処理条件に反映することが重要な技術課題である。道路用製鋼スラグについては、上記JIS A 5015「水浸膨張試験」(例えば非特許文献1、参照)に規定される方法によって被測定物全体の水和による膨張率は測定できるものの、膨張の原因となる被測定物中の成分含有量を測定することはできない。また、スラグ中の成分によって水和反応の速度は異なるため、水浸膨張試験の処理時間は、水和速度が遅い成分に律速され、長時間となる。特にスラグの体積膨張を引き起こす成分中で、MgOの水和反応は、CaOなどの水和反応に比べて非常に遅く、水浸膨張試験によるMgO量の測定に非常に時間を要するという問題があった。
【0006】
その他のスラグ中のMgO、CaOの評価方法としては、スラグ構成成分の状態図を基にMgO及びCaOを推定する方法(例えば特許文献4、参照)、熱力学平衡計算手法であるThermocalcを用いてMgO及びCaOを推定する方法(例えば特許文献5、参照)、が知られている。しかし、これらの計算手法を用いてMgO及びCaOを推定する方法は、精度が悪いため、実用が困難である。
【0007】
また、スラグ中の成分をエチレングリコールまたはトリブロムフェノールで抽出し、溶出したMg量をもってMgO量、溶出したCa量をもってCaO量を求めるエチレングリコール抽出法、トリブロムフェノール抽出法(例えば非特許文献2〜4、参照)、が知られている。この方法では、エチレングリコールまたはトリブロムフェノールに溶出するMg量、Ca量は、MgO、CaOが溶出したものの他に、Mg(OH)2、Ca(OH)2から溶出したMg、Caや、MgCO3やCaCO3から溶出したMg、Caも一部含まれることから、正確にMgO量またはCaO量を測定することができないという問題があった。
【0008】
また、スラグ以外の材料の水和度評価方法としては、MgOを主成分とする方向性電磁鋼板用焼鈍分離剤の水和度の評価方法が知られている(例えば特許文献6、参照)。この方法は、Mg(OH)2を直接測定するものであるが、共存するMgOは測定できないという問題があった。
【0009】
【特許文献1】特開昭61-101441号公報
【特許文献2】特開平3-13517号公報
【特許文献3】特公昭57-2768号公報
【特許文献4】特開2001−64714号公報
【特許文献5】特開2002−68789号公報
【特許文献6】特開2002−90300号公報
【非特許文献1】JIS A 5015「水浸膨張試験」
【非特許文献2】鉄と鋼:Vol.63(1977)No.14 P50-59
【非特許文献3】鉄と鋼:Vol.64(1978)No.10 P68-77
【非特許文献4】鉄と鋼:Vol.68(1982)No.6 P97-104
【発明の開示】
【発明が解決しようとする課題】
【0010】
本発明は、上記従来技術の現状を鑑みて、酸化物材料を成型体として利用する場合に水和反応による体積膨張に起因して成型体中に亀裂の発生や粉化・破壊などを引き起こす原因となる酸化物材料中の酸化マグネシウム(MgO)および酸化カルシウム(CaO)の含有量を赤外吸収スペクトル測定法を用いて精度良く測定する方法を提供することを目的とする。
【課題を解決するための手段】
【0011】
本発明は上記課題を解決するためになされたものであり、その本発明の要旨とするところは、以下の通りである。
(1)赤外吸収スペクトル測定法を用いた酸化物材料中の酸化マグネシウム(MgO)含有量および酸化カルシウム(CaO)含有量の測定方法において、予め前記酸化物材料の粉砕試料を重水(D2O)または重水酸化ナトリウム(NaOD)重水溶液中に浸漬し、該粉砕試料中の酸化マグネシウム(MgO)および酸化カルシウム(CaO)を、それぞれ重水酸化マグネシウム(Mg(OD)2)および重水酸化カルシウム(Ca(OD)2)とした後、乾燥して赤外吸収スペクトルを測定し、該赤外吸収スペクトルにおける重水酸化マグネシウム(Mg(OD)2)および重水酸化カルシウム(Ca(OD)2)のそれぞれの重水酸基(O−D)に起因する吸収帯の赤外吸収ピークの面積あるいは高さを基に、前記酸化物材料の粉砕試料中の酸化マグネシウム(MgO)含有量および酸化カルシウム(CaO)含有量を求めることを特徴とする赤外吸収スペクトル測定法を用いた酸化物材料中の酸化マグネシウム含有量および酸化カルシウム含有量の測定方法。
【0012】
(2)前記赤外吸収スペクトルにおける重水酸化マグネシウム(Mg(OD)2)および重水酸化カルシウム(Ca(OD)2)のそれぞれの重水酸基(O−D)に起因する吸収帯の赤外吸収ピークの面積あるいは高さから、粉砕試料中の重水酸化マグネシウム(Mg(OD)2)含有量および重水酸化カルシウム(Ca(OD)2)含有量を求めた後、該含有量から前記重水(D2O)または重水酸化ナトリウム(NaOD)重水溶液中に浸漬する前の粉砕試料中の酸化マグネシウム(MgO)含有量および酸化カルシウム(CaO)含有量を求めることを特徴とする上記(1)記載の赤外吸収スペクトル測定法を用いた酸化物材料中の酸化マグネシウム含有量および酸化カルシウム含有量の測定方法。
【0013】
(3)前記赤外吸収スペクトルにおける重水酸化マグネシウム(Mg(OD)2)および重水酸化カルシウム(Ca(OD)2)のそれぞれの重水酸基(O−D)に起因する吸収帯は、前記重水(D2O)または重水酸化ナトリウム(NaOD)重水溶液中に浸漬する前の該粉砕試料中に含有していた酸化マグネシウム(Mg(OH)2)および水酸化カルシウム(Ca(OH)2)のそれぞれの水酸基(O−H)に起因する吸収帯とは異なる波数を有することを特徴とする上記(1)または(2)に記載の赤外吸収スペクトル測定法を用いた酸化物材料中の酸化マグネシウム含有量および酸化カルシウム含有量の測定方法。
【0014】
(4)前記重水酸化マグネシウム(Mg(OD)2)および重水酸化カルシウム(Ca(OD)2)のそれぞれの重水酸基(O−D)に起因する吸収帯の波数は、それぞれ約2724cm−1および約2685cm−1であることを特徴とする上記(1)〜(3)の何れかに記載の赤外吸収スペクトル測定法を用いた酸化物材料中の酸化マグネシウム含有量および酸化カルシウム含有量の測定方法。
【0015】
(5)前記水酸化マグネシウム(Mg(OH)2)および水酸化マグネシウム(Ca(OH)2)のそれぞれの水酸基(O−H)に起因する吸収帯の波数は、それぞれ約3697cm−1および約3643cm−1であることを特徴とする上記(3)または(4)に記載の赤外吸収スペクトル測定法を用いた酸化物材料中の酸化マグネシウム含有量および酸化カルシウム含有量の測定方法。
【0016】
(6)前記重水酸化ナトリウム(NaOD)重水溶液は、重水酸化ナトリウム(NaOD)の濃度が0.1mol/L以上である重水酸化ナトリウム重水溶液のあることを特徴とする上記(1)〜(5)の何れかに記載の赤外吸収スペクトル測定法を用いた酸化物材料中の酸化マグネシウム含有量および酸化カルシウム含有量の測定方法。
【0017】
(7)前記酸化物材料がスラグ、酸化マグネシウム含有不定形耐火物、セメントの何れかであることを特徴とする上記(1)〜(6)の何れかに記載の赤外吸収スペクトル測定法を用いた酸化物材料中の酸化マグネシウム含有量および酸化カルシウム含有量の測定方法。
【発明の効果】
【0018】
本発明によれば、製鉄プロセスで生成される製鋼スラグ、不定形耐火物、セメントなどの酸化物材料中に含有する酸化マグネシウム量(MgO)および酸化カルシウム量(CaO)を赤外吸収スペクトル測定法を利用して迅速かつ高精度に定量評価することが可能となる。本発明を土木分野、耐火物分野に適用することにより、道路路盤材、耐火物などの成型体材料として使用する酸化物材料中のMgO、CaOなどのアルカリ土類金属の定量化し、適切な条件でMgO、CaOなどを安定化処理することにより、これらの水和反応に起因する亀裂、粉化・破壊を抑制し、成型体の品質および耐久性を向上することができる。
【発明を実施するための最良の形態】
【0019】
以下に本発明の詳細を説明する。
一般に赤外分光分析法は、試料に赤外線を照射し、双極子能率の変化を起こす分子振動に起因する吸収スペクトルを測定する方法であり、この赤外吸収スペクトル測定方法は、有機化合物、高分子化合物や、一部無機化合物の分析に広く用いられている。
従来、MgOやCaOなどのアルカリ土類金属酸化物については、MgやCaなどの元素濃度を測定し、その濃度を酸化物に換算していた。一方、赤外吸収スペクトル測定方法は、分子振動に基づく光吸収を測定することから、Mg−OやCa−O、Mg(OH)2やCa(OH)2のO−Hなど化学構造に基づいた分析が可能である。ただし、Mg−OやCa−Oの吸収は、Si−O、Fe−Oなど他の酸化物の吸収に非常に近いこと、CaOは、容易に水和してCa(OH)2となるため、通常の赤外吸収スペクトル測定方法を用いて酸化物材料中のMgO、CaOを直接測定することができない。
【0020】
本発明者らは、上記赤外吸収スペクトル測定方法を酸化物材料中のMgO、CaOなどのアルカリ土類金属の定量化に適用することによるメリットを活かしつつ、酸化物材料中のMgO及びCaOの含有量を精度良く測定するための方法を鋭意検討した。
その結果、(1)酸化物材料を重水(D2O)水溶液中に浸漬する処理によって、酸化物材料中に含有するMgOおよびCaOは、重水酸化マグネシウム(Mg(OD)2)および重水酸化カルシウム(Ca(OD)2)に効率的に変えることができること、(2)前記処理後の酸化物材料の赤外吸収スペクトルで観測される、重水酸化マグネシウム(Mg(OD)2)および重水酸化カルシウム(Ca(OD)2)のそれぞれのO-D伸縮振動に起因する波数約2722cm-1の吸収帯および波数約2685cm-1の吸収帯は、前記処理前に酸化物材料中に含有する、水酸化マグネシウム(Mg(OH)2)および水酸化カルシウム(Ca(OH)2)のそれぞれのO-H伸縮振動に起因する波数約3698cm-1の吸収帯および波数約3643cm-1の吸収帯と分離し、それぞれ明確に区別できること、(3)前記処理後の酸化物材料の赤外吸収スペクトルで観測される、重水酸化マグネシウム(Mg(OD)2)および重水酸化カルシウム(Ca(OD)2)のそれぞれの赤外吸収ピークの面積あるいは高さから重水酸化マグネシウム(Mg(OD)2)および重水酸化カルシウム(Ca(OD)2)の含有量を求め、これらを酸化マグネシウム量に換算することで、前記処理前の酸化物材料中に存在する酸化マグネシウム(MgO)および酸化カルシウム(CaO)の含有量を精度良く測定できること、を知見した。本発明は、これらの知見を基になされたものである。
【0021】
以下に本発明の実施形態の一例を説明する。
固体試料の赤外線吸収スペクトル測定法としては、試料を粉砕して粉末とし、その粉末試料の一定量を赤外線に透明な臭化カリウムや塩化ナトリウム、塩化カリウムなどと混合して加圧・成型する錠剤法、測定する吸収帯に影響を与えない吸収スペクトルを持つ液体(例えば流動パラフィンなどの炭化水素)と試料を混合してペーストを作り、ペーストを赤外線透過窓材に塗付、あるいは2枚の赤外線透過窓材で挟んで測定する液膜法があるが、錠剤法が最も簡便で定量性も良い。
【0022】
一般的な錠剤法は、試料と赤外線に透明な純ハロゲン化アルカリを粉砕・混合して加圧・成型する方法であり、例えば、機器分析ハンドブック(1965年、技報堂、p.505)等の文献に記されているように、試料を乾燥した純ハロゲン化アルカリ(塩化カリウムまたは臭化カリウム)150〜250mgとよく混ぜて粉砕し、この混合物を室温で約0.1mmHg以下の減圧下で高圧をかけて錠剤を成型し、測定する方法である。試料とハロゲン化アルカリとの混合・粉砕は、メノウ乳鉢などで十分に行なうと透過率の高い錠剤を得ることができる。また、試料量とハロゲン化アルカリ量、およびその混合比率は、成型する錠剤の大きさ、試料中の被測定成分量、吸収帯のモル吸光係数などに応じて変えても良い。
【0023】
図1〜3は、MgO試薬(図1)、MgO試薬を重水(D2O)で重水和(Mg(OD) 2化)処理した試料(図2)、および、MgO試薬を水和(Mg(OH) 2化)処理した試料(図3)を測定した赤外吸収スペクトルである。なお、それぞれの試料は、錠剤法により、ハロゲン化アルカリとして臭化カリウム(KBr)を300mg用い、MgO試薬は1.0mg、重水および水和処理した試料は0.5mgを量り取って、減圧下で加圧成型して13mmφの大きさの錠剤とした。
【0024】
図1に示されるように、酸化マグネシウム(MgO)は、波数4000〜2000cm-1の赤外域には吸収帯は存在しないが、実際の酸化物材料中には、酸化マグネシウム(MgO)が水分と水和反応して生成した水酸化マグネシウム(Mg(OH)2)が含有され、これに起因する吸収帯が観測される。水酸化マグネシウム(Mg(OH)2)は、図3に示されるように、赤外線吸収スペクトルの波数約3697cm-1付近に水酸化マグネシウムのO-H伸縮振動に起因する、鋭い吸収帯が観測される。
【0025】
一方、本発明において酸化物材料を重水(D2O)水溶液中に浸漬し、酸化マグネシウム(MgO)を重水酸化マグネシウム(Mg(OD)2)とした場合のMg(OD)2のO-D伸縮振動に起因する吸収帯は、図2に示されるように、水酸化マグネシウム(Mg(OH)2)のO-H伸縮振動に起因する吸収帯の波数(約3697cm-1)に比べてより低波数側の波数約2724cm-1にシフトするため、Mg(OD)2とMg(OH)2のそれぞれの赤外吸収ピークは完全に分離し、両者は明確に区別できる。
【0026】
図4は、CaO試薬(図4)、CaO試薬を重水(D2O)で重水和(Ca (OD) 2化)処理した試料(図5)、および、CaO試薬を水和(Ca (OH) 2化)処理した試料(図6)を測定した赤外吸収スペクトルを示す。測定における試料調製は、図1〜3と同様の方法で行なったが、図4におけるCaOは、測定時に水和して強いO−Hの吸収が3643cm−1に観測されるため、試料量を図5、図6と同じく0.5mgとした。
図4に示されるように、酸化カルシウム(CaO)は、波数約3643cm-1付近に吸収帯が観測されるが、これは前述したように、CaOが測定時に水和してCa(OH)2を生成したためである。また、CaO試薬を保管中に、自然に水和したものも含まれている。
【0027】
水酸化カルシウム(Ca (OH)2)は、図6に示されるように、赤外線吸収スペクトルの水酸化カルシウムのO-H伸縮振動に起因する、鋭い吸収帯が観測される。一方、酸化物材料を重水(D2O)中に浸漬し、酸化カルシウム(CaO)を重水酸化カルシウム(Ca(OD)2)とした場合のCa(OD)2のO-D伸縮振動に起因する吸収帯は、図5に示されるように、水酸化カルシウム(Ca (OH)2)のO-H伸縮振動に起因する吸収帯の波数(約3643cm-1)に比べてより低波数側の波数約2685cm-1にシフトするため、Ca (OD)2とCa (OH)2のそれぞれの赤外吸収ピークは完全に分離し、両者は明確に区別できる。なお、図5において3643cm−1に吸収ピークが観測されるが、これはCaO試薬を保管中に自然に水和したものである。
【0028】
以上のように、本発明では、予め酸化物材料を重水(D2O)中に浸漬する処理によって、酸化物材料中のMgOおよびCaOを重水酸化マグネシウム(Mg(OD)2)および重水酸化カルシウム(Ca(OD)2)に効率的に変換させた後、赤外吸収スペクトルの測定を行うことにより、前記処理前に酸化物材料中に含有する水酸化マグネシウム(Mg(OH)2)および水酸化カルシウム(Ca(OH)2)の吸収帯の影響を受けずに、重水酸化マグネシウム(Mg(OD)2)および重水酸化カルシウム(Ca(OD)2)の赤外吸収ピークに基づき、高い精度で重水酸化マグネシウム(Mg(OD)2)量および重水酸化カルシウム(Ca(OD)2)量を測定することができる。
【0029】
なお、赤外吸収スペクトルの吸収帯の波数は測定時の波数分解能、ベースラインの傾きなどによって多少変動するが、一般的に固体や液体試料を測定するときの分解能は、4cm-1程度であるから、その波数の変動は±4cm-1以内であり、実測上は問題のない程度である。
【0030】
本発明において、酸化物材料中の重水酸化マグネシウム(Mg(OD)2)および重水酸化カルシウム(Ca(OD)2)の含有量は、前記重水(D2O)水溶液の浸漬処理をした酸化物材料の赤外吸収スペクトルにおける、重水酸化マグネシウム(Mg(OD)2)および重水酸化カルシウム(Ca(OD)2)の赤外吸収ピークの面積あるいは高さを基に(3)式(Lambert-Beerの法則)に従って求めることができる。
log(I0/I) =a×c×t ・・・ (3)
ここでI0は赤外線の照射(基準)光量、Iは赤外線の透過(試料透過)光量、log(I0/I)は吸光度、aはモル吸光係数(各吸収帯に固有(一定))、cは試料中の被測定成分の濃度、tは光路長(試料量に相当(一定))を示す。
【0031】
上記(3)式によれば、酸化物材料(試料)中の重水酸化マグネシウム(Mg(OD)2)および重水酸化カルシウム(Ca(OD)2)の含有量(濃度)は、重水酸化マグネシウム(Mg(OD)2)および重水酸化カルシウム(Ca(OD)2)の赤外線の吸収帯の強度(吸光度)と比例関係となる。このため、吸収帯の強度を吸光度で測定した、赤外吸収スペクトルにおける重水酸化マグネシウム(Mg(OD)2)および重水酸化カルシウム(Ca(OD)2)の赤外吸収ピークの面積あるいは高さの測定値を基に、酸化物材料の試料中の重水酸化マグネシウム(Mg(OD)2)および重水酸化カルシウム(Ca(OD)2)の含有量を求めることができる。
【0032】
赤外吸収ピークの吸収帯の強度(吸光度)から酸化物材料(試料)中の重水酸化マグネシウム(Mg(OD)2)および重水酸化カルシウム(Ca(OD)2)の含有量を求めるための具体的方法は、特に限定する必要はない。例えば、A.検量線法を用いる場合は、以下のようにして重水酸化マグネシウム(Mg(OD)2)および重水酸化カルシウム(Ca(OD)2)の含有量を求めることができる。
A.検量線法;
(1)予め合成した重水酸化マグネシウム(Mg(OD)2)および重水酸化カルシウム(Ca(OD)2)の純粋試料を用いて、それぞれ重水酸化マグネシウム(Mg(OD)2)量とそのO-Dに起因する吸収帯の強度(吸光度)の関係、および、重水酸化カルシウム(Ca(OD)2)量とそのO-Dに起因する吸収帯の強度(吸光度)の関係を求め、重水酸化マグネシウム(Mg(OD)2)および重水酸化カルシウム(Ca(OD)2)の検量線を作成する。
(2)次に一定量の酸化物材料(試料)を秤量し、この試料を重水(D2O)水溶液中に浸漬する処理をした後、その赤外線吸収スペクトルを測定し、試料中の重水酸化マグネシウム(Mg(OD)2)および重水酸化カルシウム(Ca(OD)2)のそれぞれのO-Dに起因する吸収帯の強度(吸光度)、つまり、それぞれの赤外吸収ピークの面積あるいは高さを測定する。
(3)前記(2)で測定した重水酸化マグネシウム(Mg(OD)2)および重水酸化カルシウム(Ca(OD)2)の吸収帯の強度(吸光度)から、前記(1)で予め作成した検量線を用いて重水酸化マグネシウム(Mg(OD)2)量および重水酸化カルシウム(Ca(OD)2)量を求める。
【0033】
本発明では、上記検量線法に替えて、B.重水酸化マグネシウム(Mg(OD)2)および重水酸化カルシウム(Ca(OD)2)に起因するO-D吸収帯と波数位置の異なる吸収帯を有する既知の物質を内部標準として一定量添加し、重水酸化マグネシウム(Mg(OD)2)および重水酸化カルシウム(Ca(OD)2)に起因するO-D吸収帯の強度(吸光度:吸収ピークの面積又は高さ)と、内部標準の強度(吸光度:吸収ピークの面積又は高さ)との比率から、重水酸化マグネシウム(Mg(OD)2)および重水酸化カルシウム(Ca(OD)2)を定量する「内部標準法方法」、を用いても良い。
【0034】
或いは、上記検量線法に替えて、C.酸化物材料(試料)中の構成成分で、重水酸化マグネシウム(Mg(OD)2)および重水酸化カルシウム(Ca(OD)2)に起因するO-D吸収帯と波数位置の異なる吸収帯を有する構成成分の強度(吸光度)利用し、その強度(吸光度:吸収ピークの面積又は高さ)と、重水酸化マグネシウム(Mg(OD)2)および重水酸化カルシウム(Ca(OD)2)のO-D吸収帯の強度(吸光度:吸収ピークの面積又は高さ)との比率を基に、重水酸化マグネシウム(Mg(OD)2)量および重水酸化カルシウム(Ca(OD)2)量を求める方法などが、用いられるが、上記A.検量線法が最も簡便で、精度が良いため好ましい。
【0035】
本発明では、検量線法により、重水(D2O)中に浸漬処理をした酸化物材料(試料)の赤外吸収スペクトルから重水酸化マグネシウム(Mg(OD)2)および重水酸化カルシウム(Ca(OD)2)の含有量を求めた後、これらを、酸化マグネシウム(MgO)量および酸化カルシウム(CaO)量に換算することにより、前記重水(D2O)水溶液中に浸漬する処理をする前の酸化物材料(試料)中に含有する酸化マグネシウム(MgO)量および酸化カルシウム(CaO)量(試料中の質量%)を算出した。
つまり、上記重水酸化マグネシウム(Mg(OD)2)量の測定値を基に、重水酸化マグネシウム(Mg(OD)2)の式量60.33と酸化マグネシウム(MgO)の式量40.30から前記処理により重水酸化マグネシウム(Mg(OD)2)となった酸化マグネシウム(MgO)量を算出することができる。同様に上記重水酸化カルシウム(Ca(OD)2)量の測定値を基に、重水酸化カルシウム(Ca(OD)2)の式量76.10と酸化カルシウム(Ca O)の式量56.08から重水酸化カルシウム(Ca (OD)2)となった酸化カルシウム(CaO)量を算出することができる。
【0036】
なお、前記重水(D2O)中に浸漬する処理をする前の酸化物材料(試料)中に含有する水酸化マグネシウム(Mg(OH)2)量および水酸化カルシウム(Ca(OH)2)量の測定も、上記重水酸化マグネシウム(Mg(OD)2)および重水酸化カルシウム(Ca(OD)2)と同様な方法で測定することができる。
【0037】
また、本発明において、前記重水(D2O)中に浸漬処理をする前の酸化物材料(試料)中に含有する水酸化マグネシウム(Mg(OH)2)は、当該処理により水酸基(OH)中の水素(H)が重水素(D)に置換されることは少ない。一方、前記重水(D2O)中に浸漬処理をする前の酸化物材料(試料)中に含有する水酸化カルシウム(Ca(OH)2)の場合は、重水(D2O)のpHが低い条件で、当該処理を行うと、水酸基(OH)中の水素(H)が重水素(D)に置換され、それにより、酸化カルシウム(CaO)の測定精度が多少低下する恐れがある。したがって、水酸化カルシウム(Ca(OH)2)の水酸基(OH)中の水素(H)と重水素(D)の置換を抑制するために、前記重水(D2O)水溶液中に重水酸化ナトリウム(NaOD)濃度が0.1mol/L以上となるように重水(D2O)中に重水酸化ナトリウム(NaOD)を含有させ、pHを高くすることが好ましい。0.1mol/L以上の濃度で重水酸化ナトリウム(NaOD)を含有した重水(D2O)水溶液(NaOD/D2O水溶液)のpHは20℃で約13.1であり、水酸化カルシウム(Ca(OH)2)飽和水溶液のpH(約12.6)よりも高いため、Ca(OH)2のHとDの交換を抑制できる。
【実施例】
【0038】
A、B、Cの3種類の製鋼スラグを用いてスラグ中のMg(OH)2、MgO、Ca(OH)2、CaOの測定を行なった。スラグ試料を0.1mol/LのNaOD/D2O溶液12時間浸漬し、その後ろ過してスラグを回収し、乾燥した後に赤外吸収スペクトルを測定した。それぞれの試料は錠剤法により、臭化カリウム(KBr)を300mg用い、製鋼スラグ試料は2.0mgを量り取って、減圧下で加圧成型して13mmφの大きさの錠剤を作成した。赤外吸収スペクトルで観測されるMg(OH)2、Mg(OD)2、Ca(OH)2、Ca(OD)2の吸収帯のピーク面積を求め、予め標準試料で作成した検量線より定量評価を行なった。表1にMg(OH)2、Mg(OD)2、Ca(OH)2、Ca(OD)2に相当する吸収帯のピーク面積、表2にピーク面積から求めたスラグ中の各々の量を示す。MgOおよびCaOを直接測定することは難しいが、重水酸化してMg(OD)2、Ca(OD)2とすることにより、容易にMgOおよびCaOを測定することができる。このMgOおよびCaOが、例えばスラグを路盤材等に用いた場合、施工後に膨れる原因となるものであり、事前にMgOおよびCaO量を評価することは、非常に有用である。
【0039】
【表1】

【0040】
【表2】

【0041】
比較例として、表3に通常の分析法、すなわち重水で処理することなく、そのまま赤外吸収スペクトルを測定し、観測されるMg(OH)2、Ca(OH)2の吸収帯のピーク強度から検量線によって各々定量評価を行なった結果を示す。重水で処理することなく、そのまま赤外吸収スペクトルを測定した場合には、MgOおよびCaOに関する情報は、全く得られない。また、比較例におけるMg(OH)2量は、実施例におけるMg(OH)2量とほぼ一致するが、Ca(OH)2についてはCaOを含む形となるため、過大評価となり、比較例のデータからスラグの膨張などを予測することは困難である。
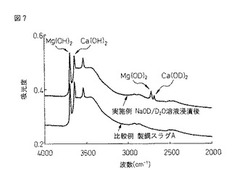
なお、図7は、製鋼スラグAのNaOD/D2O溶液浸漬前と浸漬後の赤外吸収スペクトルを示す。
【0042】
【表3】

【図面の簡単な説明】
【0043】
【図1】試薬のMgOの赤外吸収スペクトルである。
【図2】NaOD/D2O溶液に浸漬したMgOの赤外吸収スペクトルである。
【図3】試薬のMg(OH)2の赤外吸収スペクトルである。
【図4】試薬のCaOの赤外吸収スペクトルである。
【図5】NaOD/D2O溶液に浸漬したCaOの赤外吸収スペクトルである。
【図6】試薬のCa(OH)2の赤外吸収スペクトルである。
【図7】製鋼スラグAのNaOD/D2O溶液浸漬前と浸漬後の赤外吸収スペクトルである。
【技術分野】
【0001】
本発明は、製鋼スラグ、不定形耐火物、セメントなどの酸化物材料中に含有するアルカリ土類金属酸化物を定量する方法に関し、特に、酸化物材料を成型体として利用する場合に水和反応による体積膨張に起因して、成型体中に亀裂の発生や粉化・破壊などを引き起こす原因となる酸化マグネシウムおよび酸化カルシウムの含有量を赤外吸収スペクトル測定法を利用して測定する方法に関する。
【背景技術】
【0002】
従来から製鉄プロセスで生成される製鋼スラグ、不定形耐火物、セメントなどの酸化物材料は、一般の土木・構造物材料や、加熱炉などの耐火物材料などの成型体材料として広く用いられている。しかし、これらの酸化物材料中に含有する酸化マグネシウム(MgO)および酸化カルシウム(CaO)は、成型体中で(1)式および(2)式に示される水との水和反応により水酸化マグネシウムMg(OH)2 や水酸化カルシウムCa(OH)2 となる際に体積が約2倍に膨張するため、成型体中に亀裂を発生し、粉化・破壊を招く原因となっていた。
MgO+H2O → Mg(OH)2 ・・・(1)
CaO+H2O → Ca(OH)2 ・・・(2)
例えば、製鉄プロセスで生成される製鋼スラグをセメントの代替材料として使用することが行なわれているが、この材料を道路路盤材等に利用した場合に、上記MgOやCaOの水和反応に起因する体積膨張により路盤に凹凸や亀裂を生じ、車両の走行に支障をきたすなどの問題が生ずる。このため、MgOやCaOを含む道路用製鋼スラグを使用する場合には、JIS A 5015「水浸膨張試験」(例えば非特許文献1、参照)に準じて測定される水浸膨張率が1.5%以下である条件を満足させることになっている。
【0003】
従来、体積膨張の原因となる製鋼スラグ中のMgO量やCaO量を低減する方法として、次のような方法が知られている。
(a) 自然エージング処理方法;所定粒度に破砕した製鋼スラグを、山積みし、大気中の水分、雨水等によって (1)式の水和反応を行わせることにより、MgOをMg(OH)2、CaOをCa(OH)2として安定化する方法。
(b) 水蒸気エージング処理方法;所定粒度に破砕した製鋼スラグを、山積みし、高温度で蒸気を吹き込み、大気中で48時間以上暴露することにより、MgOをMg(OH)2 、CaOをCa(OH)2として安定化する方法(例えば特許文献1、参照)。
(c) 温水エージング処理方法 ;所定粒度に破砕した製鋼スラグを、温水に浸漬することにより、MgOをMg(OH)2、CaOをCa(OH)2として安定化する方法で(例えば特許文献2、参照)。
(d) 赤泥添加処理方法;溶融状態の転炉スラグまたは電気炉スラグに赤泥を添加することにより、MgO及びCaOを消失させ、スラグの膨張性を安定化する方法(例えば特許文献3、参照)。
【0004】
しかし、製鋼スラグ中のMgOやCaOはスラグ塊の表面だけでなく、塊の内部に取り込まれているため、上記方法によりMgO及びCaOをMg(OH)2 及びCa(OH)2として安定化するための処理時間は、自然エージング処理法で通常1年以上、水蒸気エージング処理法や温水エージング処理法でも、48時間以上の長時間を要する。また、上記赤泥添加処理法は、溶融状態のスラグに赤泥を添加することから、スラグの塩基度が低下することに起因し、転炉等の耐火物を損耗させる原因になっていた。
【0005】
上記方法を用いてスラグ中のMgO、CaOを低減する際には、処理前後のスラグ中のMgO、CaOを精度良く定量化し、処理条件に反映することが重要な技術課題である。道路用製鋼スラグについては、上記JIS A 5015「水浸膨張試験」(例えば非特許文献1、参照)に規定される方法によって被測定物全体の水和による膨張率は測定できるものの、膨張の原因となる被測定物中の成分含有量を測定することはできない。また、スラグ中の成分によって水和反応の速度は異なるため、水浸膨張試験の処理時間は、水和速度が遅い成分に律速され、長時間となる。特にスラグの体積膨張を引き起こす成分中で、MgOの水和反応は、CaOなどの水和反応に比べて非常に遅く、水浸膨張試験によるMgO量の測定に非常に時間を要するという問題があった。
【0006】
その他のスラグ中のMgO、CaOの評価方法としては、スラグ構成成分の状態図を基にMgO及びCaOを推定する方法(例えば特許文献4、参照)、熱力学平衡計算手法であるThermocalcを用いてMgO及びCaOを推定する方法(例えば特許文献5、参照)、が知られている。しかし、これらの計算手法を用いてMgO及びCaOを推定する方法は、精度が悪いため、実用が困難である。
【0007】
また、スラグ中の成分をエチレングリコールまたはトリブロムフェノールで抽出し、溶出したMg量をもってMgO量、溶出したCa量をもってCaO量を求めるエチレングリコール抽出法、トリブロムフェノール抽出法(例えば非特許文献2〜4、参照)、が知られている。この方法では、エチレングリコールまたはトリブロムフェノールに溶出するMg量、Ca量は、MgO、CaOが溶出したものの他に、Mg(OH)2、Ca(OH)2から溶出したMg、Caや、MgCO3やCaCO3から溶出したMg、Caも一部含まれることから、正確にMgO量またはCaO量を測定することができないという問題があった。
【0008】
また、スラグ以外の材料の水和度評価方法としては、MgOを主成分とする方向性電磁鋼板用焼鈍分離剤の水和度の評価方法が知られている(例えば特許文献6、参照)。この方法は、Mg(OH)2を直接測定するものであるが、共存するMgOは測定できないという問題があった。
【0009】
【特許文献1】特開昭61-101441号公報
【特許文献2】特開平3-13517号公報
【特許文献3】特公昭57-2768号公報
【特許文献4】特開2001−64714号公報
【特許文献5】特開2002−68789号公報
【特許文献6】特開2002−90300号公報
【非特許文献1】JIS A 5015「水浸膨張試験」
【非特許文献2】鉄と鋼:Vol.63(1977)No.14 P50-59
【非特許文献3】鉄と鋼:Vol.64(1978)No.10 P68-77
【非特許文献4】鉄と鋼:Vol.68(1982)No.6 P97-104
【発明の開示】
【発明が解決しようとする課題】
【0010】
本発明は、上記従来技術の現状を鑑みて、酸化物材料を成型体として利用する場合に水和反応による体積膨張に起因して成型体中に亀裂の発生や粉化・破壊などを引き起こす原因となる酸化物材料中の酸化マグネシウム(MgO)および酸化カルシウム(CaO)の含有量を赤外吸収スペクトル測定法を用いて精度良く測定する方法を提供することを目的とする。
【課題を解決するための手段】
【0011】
本発明は上記課題を解決するためになされたものであり、その本発明の要旨とするところは、以下の通りである。
(1)赤外吸収スペクトル測定法を用いた酸化物材料中の酸化マグネシウム(MgO)含有量および酸化カルシウム(CaO)含有量の測定方法において、予め前記酸化物材料の粉砕試料を重水(D2O)または重水酸化ナトリウム(NaOD)重水溶液中に浸漬し、該粉砕試料中の酸化マグネシウム(MgO)および酸化カルシウム(CaO)を、それぞれ重水酸化マグネシウム(Mg(OD)2)および重水酸化カルシウム(Ca(OD)2)とした後、乾燥して赤外吸収スペクトルを測定し、該赤外吸収スペクトルにおける重水酸化マグネシウム(Mg(OD)2)および重水酸化カルシウム(Ca(OD)2)のそれぞれの重水酸基(O−D)に起因する吸収帯の赤外吸収ピークの面積あるいは高さを基に、前記酸化物材料の粉砕試料中の酸化マグネシウム(MgO)含有量および酸化カルシウム(CaO)含有量を求めることを特徴とする赤外吸収スペクトル測定法を用いた酸化物材料中の酸化マグネシウム含有量および酸化カルシウム含有量の測定方法。
【0012】
(2)前記赤外吸収スペクトルにおける重水酸化マグネシウム(Mg(OD)2)および重水酸化カルシウム(Ca(OD)2)のそれぞれの重水酸基(O−D)に起因する吸収帯の赤外吸収ピークの面積あるいは高さから、粉砕試料中の重水酸化マグネシウム(Mg(OD)2)含有量および重水酸化カルシウム(Ca(OD)2)含有量を求めた後、該含有量から前記重水(D2O)または重水酸化ナトリウム(NaOD)重水溶液中に浸漬する前の粉砕試料中の酸化マグネシウム(MgO)含有量および酸化カルシウム(CaO)含有量を求めることを特徴とする上記(1)記載の赤外吸収スペクトル測定法を用いた酸化物材料中の酸化マグネシウム含有量および酸化カルシウム含有量の測定方法。
【0013】
(3)前記赤外吸収スペクトルにおける重水酸化マグネシウム(Mg(OD)2)および重水酸化カルシウム(Ca(OD)2)のそれぞれの重水酸基(O−D)に起因する吸収帯は、前記重水(D2O)または重水酸化ナトリウム(NaOD)重水溶液中に浸漬する前の該粉砕試料中に含有していた酸化マグネシウム(Mg(OH)2)および水酸化カルシウム(Ca(OH)2)のそれぞれの水酸基(O−H)に起因する吸収帯とは異なる波数を有することを特徴とする上記(1)または(2)に記載の赤外吸収スペクトル測定法を用いた酸化物材料中の酸化マグネシウム含有量および酸化カルシウム含有量の測定方法。
【0014】
(4)前記重水酸化マグネシウム(Mg(OD)2)および重水酸化カルシウム(Ca(OD)2)のそれぞれの重水酸基(O−D)に起因する吸収帯の波数は、それぞれ約2724cm−1および約2685cm−1であることを特徴とする上記(1)〜(3)の何れかに記載の赤外吸収スペクトル測定法を用いた酸化物材料中の酸化マグネシウム含有量および酸化カルシウム含有量の測定方法。
【0015】
(5)前記水酸化マグネシウム(Mg(OH)2)および水酸化マグネシウム(Ca(OH)2)のそれぞれの水酸基(O−H)に起因する吸収帯の波数は、それぞれ約3697cm−1および約3643cm−1であることを特徴とする上記(3)または(4)に記載の赤外吸収スペクトル測定法を用いた酸化物材料中の酸化マグネシウム含有量および酸化カルシウム含有量の測定方法。
【0016】
(6)前記重水酸化ナトリウム(NaOD)重水溶液は、重水酸化ナトリウム(NaOD)の濃度が0.1mol/L以上である重水酸化ナトリウム重水溶液のあることを特徴とする上記(1)〜(5)の何れかに記載の赤外吸収スペクトル測定法を用いた酸化物材料中の酸化マグネシウム含有量および酸化カルシウム含有量の測定方法。
【0017】
(7)前記酸化物材料がスラグ、酸化マグネシウム含有不定形耐火物、セメントの何れかであることを特徴とする上記(1)〜(6)の何れかに記載の赤外吸収スペクトル測定法を用いた酸化物材料中の酸化マグネシウム含有量および酸化カルシウム含有量の測定方法。
【発明の効果】
【0018】
本発明によれば、製鉄プロセスで生成される製鋼スラグ、不定形耐火物、セメントなどの酸化物材料中に含有する酸化マグネシウム量(MgO)および酸化カルシウム量(CaO)を赤外吸収スペクトル測定法を利用して迅速かつ高精度に定量評価することが可能となる。本発明を土木分野、耐火物分野に適用することにより、道路路盤材、耐火物などの成型体材料として使用する酸化物材料中のMgO、CaOなどのアルカリ土類金属の定量化し、適切な条件でMgO、CaOなどを安定化処理することにより、これらの水和反応に起因する亀裂、粉化・破壊を抑制し、成型体の品質および耐久性を向上することができる。
【発明を実施するための最良の形態】
【0019】
以下に本発明の詳細を説明する。
一般に赤外分光分析法は、試料に赤外線を照射し、双極子能率の変化を起こす分子振動に起因する吸収スペクトルを測定する方法であり、この赤外吸収スペクトル測定方法は、有機化合物、高分子化合物や、一部無機化合物の分析に広く用いられている。
従来、MgOやCaOなどのアルカリ土類金属酸化物については、MgやCaなどの元素濃度を測定し、その濃度を酸化物に換算していた。一方、赤外吸収スペクトル測定方法は、分子振動に基づく光吸収を測定することから、Mg−OやCa−O、Mg(OH)2やCa(OH)2のO−Hなど化学構造に基づいた分析が可能である。ただし、Mg−OやCa−Oの吸収は、Si−O、Fe−Oなど他の酸化物の吸収に非常に近いこと、CaOは、容易に水和してCa(OH)2となるため、通常の赤外吸収スペクトル測定方法を用いて酸化物材料中のMgO、CaOを直接測定することができない。
【0020】
本発明者らは、上記赤外吸収スペクトル測定方法を酸化物材料中のMgO、CaOなどのアルカリ土類金属の定量化に適用することによるメリットを活かしつつ、酸化物材料中のMgO及びCaOの含有量を精度良く測定するための方法を鋭意検討した。
その結果、(1)酸化物材料を重水(D2O)水溶液中に浸漬する処理によって、酸化物材料中に含有するMgOおよびCaOは、重水酸化マグネシウム(Mg(OD)2)および重水酸化カルシウム(Ca(OD)2)に効率的に変えることができること、(2)前記処理後の酸化物材料の赤外吸収スペクトルで観測される、重水酸化マグネシウム(Mg(OD)2)および重水酸化カルシウム(Ca(OD)2)のそれぞれのO-D伸縮振動に起因する波数約2722cm-1の吸収帯および波数約2685cm-1の吸収帯は、前記処理前に酸化物材料中に含有する、水酸化マグネシウム(Mg(OH)2)および水酸化カルシウム(Ca(OH)2)のそれぞれのO-H伸縮振動に起因する波数約3698cm-1の吸収帯および波数約3643cm-1の吸収帯と分離し、それぞれ明確に区別できること、(3)前記処理後の酸化物材料の赤外吸収スペクトルで観測される、重水酸化マグネシウム(Mg(OD)2)および重水酸化カルシウム(Ca(OD)2)のそれぞれの赤外吸収ピークの面積あるいは高さから重水酸化マグネシウム(Mg(OD)2)および重水酸化カルシウム(Ca(OD)2)の含有量を求め、これらを酸化マグネシウム量に換算することで、前記処理前の酸化物材料中に存在する酸化マグネシウム(MgO)および酸化カルシウム(CaO)の含有量を精度良く測定できること、を知見した。本発明は、これらの知見を基になされたものである。
【0021】
以下に本発明の実施形態の一例を説明する。
固体試料の赤外線吸収スペクトル測定法としては、試料を粉砕して粉末とし、その粉末試料の一定量を赤外線に透明な臭化カリウムや塩化ナトリウム、塩化カリウムなどと混合して加圧・成型する錠剤法、測定する吸収帯に影響を与えない吸収スペクトルを持つ液体(例えば流動パラフィンなどの炭化水素)と試料を混合してペーストを作り、ペーストを赤外線透過窓材に塗付、あるいは2枚の赤外線透過窓材で挟んで測定する液膜法があるが、錠剤法が最も簡便で定量性も良い。
【0022】
一般的な錠剤法は、試料と赤外線に透明な純ハロゲン化アルカリを粉砕・混合して加圧・成型する方法であり、例えば、機器分析ハンドブック(1965年、技報堂、p.505)等の文献に記されているように、試料を乾燥した純ハロゲン化アルカリ(塩化カリウムまたは臭化カリウム)150〜250mgとよく混ぜて粉砕し、この混合物を室温で約0.1mmHg以下の減圧下で高圧をかけて錠剤を成型し、測定する方法である。試料とハロゲン化アルカリとの混合・粉砕は、メノウ乳鉢などで十分に行なうと透過率の高い錠剤を得ることができる。また、試料量とハロゲン化アルカリ量、およびその混合比率は、成型する錠剤の大きさ、試料中の被測定成分量、吸収帯のモル吸光係数などに応じて変えても良い。
【0023】
図1〜3は、MgO試薬(図1)、MgO試薬を重水(D2O)で重水和(Mg(OD) 2化)処理した試料(図2)、および、MgO試薬を水和(Mg(OH) 2化)処理した試料(図3)を測定した赤外吸収スペクトルである。なお、それぞれの試料は、錠剤法により、ハロゲン化アルカリとして臭化カリウム(KBr)を300mg用い、MgO試薬は1.0mg、重水および水和処理した試料は0.5mgを量り取って、減圧下で加圧成型して13mmφの大きさの錠剤とした。
【0024】
図1に示されるように、酸化マグネシウム(MgO)は、波数4000〜2000cm-1の赤外域には吸収帯は存在しないが、実際の酸化物材料中には、酸化マグネシウム(MgO)が水分と水和反応して生成した水酸化マグネシウム(Mg(OH)2)が含有され、これに起因する吸収帯が観測される。水酸化マグネシウム(Mg(OH)2)は、図3に示されるように、赤外線吸収スペクトルの波数約3697cm-1付近に水酸化マグネシウムのO-H伸縮振動に起因する、鋭い吸収帯が観測される。
【0025】
一方、本発明において酸化物材料を重水(D2O)水溶液中に浸漬し、酸化マグネシウム(MgO)を重水酸化マグネシウム(Mg(OD)2)とした場合のMg(OD)2のO-D伸縮振動に起因する吸収帯は、図2に示されるように、水酸化マグネシウム(Mg(OH)2)のO-H伸縮振動に起因する吸収帯の波数(約3697cm-1)に比べてより低波数側の波数約2724cm-1にシフトするため、Mg(OD)2とMg(OH)2のそれぞれの赤外吸収ピークは完全に分離し、両者は明確に区別できる。
【0026】
図4は、CaO試薬(図4)、CaO試薬を重水(D2O)で重水和(Ca (OD) 2化)処理した試料(図5)、および、CaO試薬を水和(Ca (OH) 2化)処理した試料(図6)を測定した赤外吸収スペクトルを示す。測定における試料調製は、図1〜3と同様の方法で行なったが、図4におけるCaOは、測定時に水和して強いO−Hの吸収が3643cm−1に観測されるため、試料量を図5、図6と同じく0.5mgとした。
図4に示されるように、酸化カルシウム(CaO)は、波数約3643cm-1付近に吸収帯が観測されるが、これは前述したように、CaOが測定時に水和してCa(OH)2を生成したためである。また、CaO試薬を保管中に、自然に水和したものも含まれている。
【0027】
水酸化カルシウム(Ca (OH)2)は、図6に示されるように、赤外線吸収スペクトルの水酸化カルシウムのO-H伸縮振動に起因する、鋭い吸収帯が観測される。一方、酸化物材料を重水(D2O)中に浸漬し、酸化カルシウム(CaO)を重水酸化カルシウム(Ca(OD)2)とした場合のCa(OD)2のO-D伸縮振動に起因する吸収帯は、図5に示されるように、水酸化カルシウム(Ca (OH)2)のO-H伸縮振動に起因する吸収帯の波数(約3643cm-1)に比べてより低波数側の波数約2685cm-1にシフトするため、Ca (OD)2とCa (OH)2のそれぞれの赤外吸収ピークは完全に分離し、両者は明確に区別できる。なお、図5において3643cm−1に吸収ピークが観測されるが、これはCaO試薬を保管中に自然に水和したものである。
【0028】
以上のように、本発明では、予め酸化物材料を重水(D2O)中に浸漬する処理によって、酸化物材料中のMgOおよびCaOを重水酸化マグネシウム(Mg(OD)2)および重水酸化カルシウム(Ca(OD)2)に効率的に変換させた後、赤外吸収スペクトルの測定を行うことにより、前記処理前に酸化物材料中に含有する水酸化マグネシウム(Mg(OH)2)および水酸化カルシウム(Ca(OH)2)の吸収帯の影響を受けずに、重水酸化マグネシウム(Mg(OD)2)および重水酸化カルシウム(Ca(OD)2)の赤外吸収ピークに基づき、高い精度で重水酸化マグネシウム(Mg(OD)2)量および重水酸化カルシウム(Ca(OD)2)量を測定することができる。
【0029】
なお、赤外吸収スペクトルの吸収帯の波数は測定時の波数分解能、ベースラインの傾きなどによって多少変動するが、一般的に固体や液体試料を測定するときの分解能は、4cm-1程度であるから、その波数の変動は±4cm-1以内であり、実測上は問題のない程度である。
【0030】
本発明において、酸化物材料中の重水酸化マグネシウム(Mg(OD)2)および重水酸化カルシウム(Ca(OD)2)の含有量は、前記重水(D2O)水溶液の浸漬処理をした酸化物材料の赤外吸収スペクトルにおける、重水酸化マグネシウム(Mg(OD)2)および重水酸化カルシウム(Ca(OD)2)の赤外吸収ピークの面積あるいは高さを基に(3)式(Lambert-Beerの法則)に従って求めることができる。
log(I0/I) =a×c×t ・・・ (3)
ここでI0は赤外線の照射(基準)光量、Iは赤外線の透過(試料透過)光量、log(I0/I)は吸光度、aはモル吸光係数(各吸収帯に固有(一定))、cは試料中の被測定成分の濃度、tは光路長(試料量に相当(一定))を示す。
【0031】
上記(3)式によれば、酸化物材料(試料)中の重水酸化マグネシウム(Mg(OD)2)および重水酸化カルシウム(Ca(OD)2)の含有量(濃度)は、重水酸化マグネシウム(Mg(OD)2)および重水酸化カルシウム(Ca(OD)2)の赤外線の吸収帯の強度(吸光度)と比例関係となる。このため、吸収帯の強度を吸光度で測定した、赤外吸収スペクトルにおける重水酸化マグネシウム(Mg(OD)2)および重水酸化カルシウム(Ca(OD)2)の赤外吸収ピークの面積あるいは高さの測定値を基に、酸化物材料の試料中の重水酸化マグネシウム(Mg(OD)2)および重水酸化カルシウム(Ca(OD)2)の含有量を求めることができる。
【0032】
赤外吸収ピークの吸収帯の強度(吸光度)から酸化物材料(試料)中の重水酸化マグネシウム(Mg(OD)2)および重水酸化カルシウム(Ca(OD)2)の含有量を求めるための具体的方法は、特に限定する必要はない。例えば、A.検量線法を用いる場合は、以下のようにして重水酸化マグネシウム(Mg(OD)2)および重水酸化カルシウム(Ca(OD)2)の含有量を求めることができる。
A.検量線法;
(1)予め合成した重水酸化マグネシウム(Mg(OD)2)および重水酸化カルシウム(Ca(OD)2)の純粋試料を用いて、それぞれ重水酸化マグネシウム(Mg(OD)2)量とそのO-Dに起因する吸収帯の強度(吸光度)の関係、および、重水酸化カルシウム(Ca(OD)2)量とそのO-Dに起因する吸収帯の強度(吸光度)の関係を求め、重水酸化マグネシウム(Mg(OD)2)および重水酸化カルシウム(Ca(OD)2)の検量線を作成する。
(2)次に一定量の酸化物材料(試料)を秤量し、この試料を重水(D2O)水溶液中に浸漬する処理をした後、その赤外線吸収スペクトルを測定し、試料中の重水酸化マグネシウム(Mg(OD)2)および重水酸化カルシウム(Ca(OD)2)のそれぞれのO-Dに起因する吸収帯の強度(吸光度)、つまり、それぞれの赤外吸収ピークの面積あるいは高さを測定する。
(3)前記(2)で測定した重水酸化マグネシウム(Mg(OD)2)および重水酸化カルシウム(Ca(OD)2)の吸収帯の強度(吸光度)から、前記(1)で予め作成した検量線を用いて重水酸化マグネシウム(Mg(OD)2)量および重水酸化カルシウム(Ca(OD)2)量を求める。
【0033】
本発明では、上記検量線法に替えて、B.重水酸化マグネシウム(Mg(OD)2)および重水酸化カルシウム(Ca(OD)2)に起因するO-D吸収帯と波数位置の異なる吸収帯を有する既知の物質を内部標準として一定量添加し、重水酸化マグネシウム(Mg(OD)2)および重水酸化カルシウム(Ca(OD)2)に起因するO-D吸収帯の強度(吸光度:吸収ピークの面積又は高さ)と、内部標準の強度(吸光度:吸収ピークの面積又は高さ)との比率から、重水酸化マグネシウム(Mg(OD)2)および重水酸化カルシウム(Ca(OD)2)を定量する「内部標準法方法」、を用いても良い。
【0034】
或いは、上記検量線法に替えて、C.酸化物材料(試料)中の構成成分で、重水酸化マグネシウム(Mg(OD)2)および重水酸化カルシウム(Ca(OD)2)に起因するO-D吸収帯と波数位置の異なる吸収帯を有する構成成分の強度(吸光度)利用し、その強度(吸光度:吸収ピークの面積又は高さ)と、重水酸化マグネシウム(Mg(OD)2)および重水酸化カルシウム(Ca(OD)2)のO-D吸収帯の強度(吸光度:吸収ピークの面積又は高さ)との比率を基に、重水酸化マグネシウム(Mg(OD)2)量および重水酸化カルシウム(Ca(OD)2)量を求める方法などが、用いられるが、上記A.検量線法が最も簡便で、精度が良いため好ましい。
【0035】
本発明では、検量線法により、重水(D2O)中に浸漬処理をした酸化物材料(試料)の赤外吸収スペクトルから重水酸化マグネシウム(Mg(OD)2)および重水酸化カルシウム(Ca(OD)2)の含有量を求めた後、これらを、酸化マグネシウム(MgO)量および酸化カルシウム(CaO)量に換算することにより、前記重水(D2O)水溶液中に浸漬する処理をする前の酸化物材料(試料)中に含有する酸化マグネシウム(MgO)量および酸化カルシウム(CaO)量(試料中の質量%)を算出した。
つまり、上記重水酸化マグネシウム(Mg(OD)2)量の測定値を基に、重水酸化マグネシウム(Mg(OD)2)の式量60.33と酸化マグネシウム(MgO)の式量40.30から前記処理により重水酸化マグネシウム(Mg(OD)2)となった酸化マグネシウム(MgO)量を算出することができる。同様に上記重水酸化カルシウム(Ca(OD)2)量の測定値を基に、重水酸化カルシウム(Ca(OD)2)の式量76.10と酸化カルシウム(Ca O)の式量56.08から重水酸化カルシウム(Ca (OD)2)となった酸化カルシウム(CaO)量を算出することができる。
【0036】
なお、前記重水(D2O)中に浸漬する処理をする前の酸化物材料(試料)中に含有する水酸化マグネシウム(Mg(OH)2)量および水酸化カルシウム(Ca(OH)2)量の測定も、上記重水酸化マグネシウム(Mg(OD)2)および重水酸化カルシウム(Ca(OD)2)と同様な方法で測定することができる。
【0037】
また、本発明において、前記重水(D2O)中に浸漬処理をする前の酸化物材料(試料)中に含有する水酸化マグネシウム(Mg(OH)2)は、当該処理により水酸基(OH)中の水素(H)が重水素(D)に置換されることは少ない。一方、前記重水(D2O)中に浸漬処理をする前の酸化物材料(試料)中に含有する水酸化カルシウム(Ca(OH)2)の場合は、重水(D2O)のpHが低い条件で、当該処理を行うと、水酸基(OH)中の水素(H)が重水素(D)に置換され、それにより、酸化カルシウム(CaO)の測定精度が多少低下する恐れがある。したがって、水酸化カルシウム(Ca(OH)2)の水酸基(OH)中の水素(H)と重水素(D)の置換を抑制するために、前記重水(D2O)水溶液中に重水酸化ナトリウム(NaOD)濃度が0.1mol/L以上となるように重水(D2O)中に重水酸化ナトリウム(NaOD)を含有させ、pHを高くすることが好ましい。0.1mol/L以上の濃度で重水酸化ナトリウム(NaOD)を含有した重水(D2O)水溶液(NaOD/D2O水溶液)のpHは20℃で約13.1であり、水酸化カルシウム(Ca(OH)2)飽和水溶液のpH(約12.6)よりも高いため、Ca(OH)2のHとDの交換を抑制できる。
【実施例】
【0038】
A、B、Cの3種類の製鋼スラグを用いてスラグ中のMg(OH)2、MgO、Ca(OH)2、CaOの測定を行なった。スラグ試料を0.1mol/LのNaOD/D2O溶液12時間浸漬し、その後ろ過してスラグを回収し、乾燥した後に赤外吸収スペクトルを測定した。それぞれの試料は錠剤法により、臭化カリウム(KBr)を300mg用い、製鋼スラグ試料は2.0mgを量り取って、減圧下で加圧成型して13mmφの大きさの錠剤を作成した。赤外吸収スペクトルで観測されるMg(OH)2、Mg(OD)2、Ca(OH)2、Ca(OD)2の吸収帯のピーク面積を求め、予め標準試料で作成した検量線より定量評価を行なった。表1にMg(OH)2、Mg(OD)2、Ca(OH)2、Ca(OD)2に相当する吸収帯のピーク面積、表2にピーク面積から求めたスラグ中の各々の量を示す。MgOおよびCaOを直接測定することは難しいが、重水酸化してMg(OD)2、Ca(OD)2とすることにより、容易にMgOおよびCaOを測定することができる。このMgOおよびCaOが、例えばスラグを路盤材等に用いた場合、施工後に膨れる原因となるものであり、事前にMgOおよびCaO量を評価することは、非常に有用である。
【0039】
【表1】

【0040】
【表2】

【0041】
比較例として、表3に通常の分析法、すなわち重水で処理することなく、そのまま赤外吸収スペクトルを測定し、観測されるMg(OH)2、Ca(OH)2の吸収帯のピーク強度から検量線によって各々定量評価を行なった結果を示す。重水で処理することなく、そのまま赤外吸収スペクトルを測定した場合には、MgOおよびCaOに関する情報は、全く得られない。また、比較例におけるMg(OH)2量は、実施例におけるMg(OH)2量とほぼ一致するが、Ca(OH)2についてはCaOを含む形となるため、過大評価となり、比較例のデータからスラグの膨張などを予測することは困難である。
なお、図7は、製鋼スラグAのNaOD/D2O溶液浸漬前と浸漬後の赤外吸収スペクトルを示す。
【0042】
【表3】

【図面の簡単な説明】
【0043】
【図1】試薬のMgOの赤外吸収スペクトルである。
【図2】NaOD/D2O溶液に浸漬したMgOの赤外吸収スペクトルである。
【図3】試薬のMg(OH)2の赤外吸収スペクトルである。
【図4】試薬のCaOの赤外吸収スペクトルである。
【図5】NaOD/D2O溶液に浸漬したCaOの赤外吸収スペクトルである。
【図6】試薬のCa(OH)2の赤外吸収スペクトルである。
【図7】製鋼スラグAのNaOD/D2O溶液浸漬前と浸漬後の赤外吸収スペクトルである。
【特許請求の範囲】
【請求項1】
赤外吸収スペクトル測定法を用いた酸化物材料中の酸化マグネシウム含有量および酸化カルシウム含有量の測定方法において、予め前記酸化物材料の粉砕試料を重水または重水酸化ナトリウム重水溶液中に浸漬し、該粉砕試料中の酸化マグネシウムおよび酸化カルシウムを、それぞれ重水酸化マグネシウムおよび重水酸化カルシウムとした後、乾燥して赤外吸収スペクトルを測定し、該赤外吸収スペクトルにおける重水酸化マグネシウムおよび重水酸化カルシウムのそれぞれの重水酸基に起因する吸収帯の赤外吸収ピークの面積あるいは高さを基に、前記酸化物材料の粉砕試料中の酸化マグネシウム含有量および酸化カルシウム含有量を求めることを特徴とする赤外吸収スペクトル測定法を用いた酸化物材料中の酸化マグネシウム含有量および酸化カルシウム含有量の測定方法。
【請求項2】
前記赤外吸収スペクトルにおける重水酸化マグネシウムおよび重水酸化カルシウムのそれぞれの重水酸基に起因する吸収帯の赤外吸収ピークの面積あるいは高さから、粉砕試料中の重水酸化マグネシウム含有量および重水酸化カルシウム含有量を求めた後、該含有量から前記重水または重水酸化ナトリウム重水溶液中に浸漬する前の粉砕試料中の酸化マグネシウム含有量および酸化カルシウム含有量を求めることを特徴とする請求項1記載の赤外吸収スペクトル測定法を用いた酸化物材料中の酸化マグネシウム含有量および酸化カルシウム含有量の測定方法。
【請求項3】
前記赤外吸収スペクトルにおける重水酸化マグネシウムおよび重水酸化カルシウムのそれぞれの重水酸基に起因する吸収帯は、前記重水または重水酸化ナトリウム重水溶液中に浸漬する前の該粉砕試料中に含有していた水酸化マグネシウムおよび水酸化カルシウムのそれぞれの水酸基に起因する吸収帯とは異なる波数を有することを特徴とする請求項1または2に記載の赤外吸収スペクトル測定法を用いた酸化物材料中の酸化マグネシウム含有量および酸化カルシウム含有量の測定方法。
【請求項4】
前記重水酸化マグネシウムおよび重水酸化カルシウムのそれぞれの重水酸基に起因する吸収帯の波数は、それぞれ約2724cm−1および約2685cm−1であることを特徴とする請求項1〜3の何れかに記載の赤外吸収スペクトル測定法を用いた酸化物材料中の酸化マグネシウム含有量および酸化カルシウム含有量の測定方法。
【請求項5】
前記水酸化マグネシウムおよび水酸化カルシウムのそれぞれの水酸基に起因する吸収帯の波数は、それぞれ約3697cm−1および約3643cm−1であることを特徴とする請求項3または4に記載の赤外吸収スペクトル測定法を用いた酸化物材料中の酸化マグネシウム含有量および酸化カルシウム含有量の測定方法。
【請求項6】
前記重水酸化ナトリウム重水溶液は、重水酸化ナトリウムの濃度が0.1mol/L以上である重水酸化ナトリウム重水溶液であることを特徴とする請求項1〜5の何れかに記載の赤外吸収スペクトル測定法を用いた酸化物材料中の酸化マグネシウム含有量および酸化カルシウム含有量の測定方法。
【請求項7】
前記酸化物材料がスラグ、酸化マグネシウム含有不定形耐火物、セメントの何れかであることを特徴とする請求項1〜6の何れかに記載の赤外吸収スペクトル測定法を用いた酸化物材料中の酸化マグネシウム含有量および酸化カルシウム含有量の測定方法。
【請求項1】
赤外吸収スペクトル測定法を用いた酸化物材料中の酸化マグネシウム含有量および酸化カルシウム含有量の測定方法において、予め前記酸化物材料の粉砕試料を重水または重水酸化ナトリウム重水溶液中に浸漬し、該粉砕試料中の酸化マグネシウムおよび酸化カルシウムを、それぞれ重水酸化マグネシウムおよび重水酸化カルシウムとした後、乾燥して赤外吸収スペクトルを測定し、該赤外吸収スペクトルにおける重水酸化マグネシウムおよび重水酸化カルシウムのそれぞれの重水酸基に起因する吸収帯の赤外吸収ピークの面積あるいは高さを基に、前記酸化物材料の粉砕試料中の酸化マグネシウム含有量および酸化カルシウム含有量を求めることを特徴とする赤外吸収スペクトル測定法を用いた酸化物材料中の酸化マグネシウム含有量および酸化カルシウム含有量の測定方法。
【請求項2】
前記赤外吸収スペクトルにおける重水酸化マグネシウムおよび重水酸化カルシウムのそれぞれの重水酸基に起因する吸収帯の赤外吸収ピークの面積あるいは高さから、粉砕試料中の重水酸化マグネシウム含有量および重水酸化カルシウム含有量を求めた後、該含有量から前記重水または重水酸化ナトリウム重水溶液中に浸漬する前の粉砕試料中の酸化マグネシウム含有量および酸化カルシウム含有量を求めることを特徴とする請求項1記載の赤外吸収スペクトル測定法を用いた酸化物材料中の酸化マグネシウム含有量および酸化カルシウム含有量の測定方法。
【請求項3】
前記赤外吸収スペクトルにおける重水酸化マグネシウムおよび重水酸化カルシウムのそれぞれの重水酸基に起因する吸収帯は、前記重水または重水酸化ナトリウム重水溶液中に浸漬する前の該粉砕試料中に含有していた水酸化マグネシウムおよび水酸化カルシウムのそれぞれの水酸基に起因する吸収帯とは異なる波数を有することを特徴とする請求項1または2に記載の赤外吸収スペクトル測定法を用いた酸化物材料中の酸化マグネシウム含有量および酸化カルシウム含有量の測定方法。
【請求項4】
前記重水酸化マグネシウムおよび重水酸化カルシウムのそれぞれの重水酸基に起因する吸収帯の波数は、それぞれ約2724cm−1および約2685cm−1であることを特徴とする請求項1〜3の何れかに記載の赤外吸収スペクトル測定法を用いた酸化物材料中の酸化マグネシウム含有量および酸化カルシウム含有量の測定方法。
【請求項5】
前記水酸化マグネシウムおよび水酸化カルシウムのそれぞれの水酸基に起因する吸収帯の波数は、それぞれ約3697cm−1および約3643cm−1であることを特徴とする請求項3または4に記載の赤外吸収スペクトル測定法を用いた酸化物材料中の酸化マグネシウム含有量および酸化カルシウム含有量の測定方法。
【請求項6】
前記重水酸化ナトリウム重水溶液は、重水酸化ナトリウムの濃度が0.1mol/L以上である重水酸化ナトリウム重水溶液であることを特徴とする請求項1〜5の何れかに記載の赤外吸収スペクトル測定法を用いた酸化物材料中の酸化マグネシウム含有量および酸化カルシウム含有量の測定方法。
【請求項7】
前記酸化物材料がスラグ、酸化マグネシウム含有不定形耐火物、セメントの何れかであることを特徴とする請求項1〜6の何れかに記載の赤外吸収スペクトル測定法を用いた酸化物材料中の酸化マグネシウム含有量および酸化カルシウム含有量の測定方法。
【図1】


【図2】


【図3】


【図4】


【図5】


【図6】


【図7】




【図2】


【図3】


【図4】


【図5】


【図6】


【図7】


【公開番号】特開2007−198950(P2007−198950A)
【公開日】平成19年8月9日(2007.8.9)
【国際特許分類】
【出願番号】特願2006−18835(P2006−18835)
【出願日】平成18年1月27日(2006.1.27)
【出願人】(000006655)新日本製鐵株式会社 (6,474)
【Fターム(参考)】
【公開日】平成19年8月9日(2007.8.9)
【国際特許分類】
【出願日】平成18年1月27日(2006.1.27)
【出願人】(000006655)新日本製鐵株式会社 (6,474)
【Fターム(参考)】
[ Back to top ]

