赤外線(IR)に基づき生体分子を定量するためのデバイスおよび方法
【課題】IRに基づく技法を用いて、サンプル中の1つまたは複数の生体分子を定量する方法、そのような方法で用いられるサンプルホルダーデバイスならびにそのようなサンプルホルダーデバイスを製造する方法を提供する。
【解決手段】(a)サンプルを封じ込めるための、疎水性領域でとり囲まれた親水性領域を含む多孔膜を備えるサンプルホルダーを提供するステップ;(b)膜の親水性領域をサンプル体積と接触させるステップ;(c)膜上の前記サンプル体積を乾燥させるステップ;(d)膜上の前記サンプル体積を4000−400cm−1のスペクトル範囲内の1つの波長または前記スペクトル範囲の任意の部分を含む赤外線ビームに曝露するステップを含み、こうして赤外線吸収スペクトル内の1つまたは複数の吸収ピーク面積が、サンプル中の1つまたは複数の生体分子の量と相関性を有する前記赤外線吸収スペクトルを得る。
【解決手段】(a)サンプルを封じ込めるための、疎水性領域でとり囲まれた親水性領域を含む多孔膜を備えるサンプルホルダーを提供するステップ;(b)膜の親水性領域をサンプル体積と接触させるステップ;(c)膜上の前記サンプル体積を乾燥させるステップ;(d)膜上の前記サンプル体積を4000−400cm−1のスペクトル範囲内の1つの波長または前記スペクトル範囲の任意の部分を含む赤外線ビームに曝露するステップを含み、こうして赤外線吸収スペクトル内の1つまたは複数の吸収ピーク面積が、サンプル中の1つまたは複数の生体分子の量と相関性を有する前記赤外線吸収スペクトルを得る。
【発明の詳細な説明】
【技術分野】
【0001】
(関連出願の相互参照)
本出願は、2011年4月14日に出願された米国仮特許出願第61/475,434号の優先権の利益を主張し、その全記載内容をそのまま参照により本明細書に組み込む。
【0002】
本発明は、サンプル中の分析物を定量するための赤外線分光光度法および当該方法で用いられるデバイスの分野に関連する。
【背景技術】
【0003】
赤外線(IR)分光法は、サンプルを分析するために研究所で一般的に用いられる解析ツールである。電磁スペクトルのIR領域は、可視領域の下端(約14,300cm−1の波数)からマイクロ波領域(20cm−1近傍)まで延在する。通常、分子がIRを吸収する場合、分子内の振動または回転が分子の双極子モーメントに純変化を引き起こすはずである。照射光の電場を変化させると、分子の双極子モーメントに生じた変動と相互作用し、また照射光の周波数が分子の振動周波数と一致すると、照射光は吸収され、これにより分子振動の振幅に変化を生じせしめる。
【0004】
一般的に、生体分子、例えばタンパク質を定量的に分析する場合、最も一般的に用いられる方法は、比色技術(例えば、クマシーブルー分析法、ローリー法、BCA分析法およびPierce660タンパク質分析法)、およびUV分光技術(例えば、280nmにおける吸収)である。当技術分野において公知のほとんどの定量法の場合、ユーザーが定量を実施する毎に、ユーザーは、定量対象分析物と一般的に同一の分子である検量体を用いて、較正曲線を作成する必要がある。
【発明の概要】
【発明が解決しようとする課題】
【0005】
(発明の要旨)
本発明は、サンプル中の分析物、特に生体分子を定量するための改善した方法を提供し、同方法は、当技術分野において公知のほとんどの方法よりも短い実施時間、ならびに少ないサンプル体積を必要とし、またさらに当技術分野において公知のほとんどの方法が行うように、何らかの特別なサンプル調製ステップを必要としない。さらに、本発明による方法は、分析物が定量される毎に、ユーザーが較正曲線を作成する必要性もなくし、また検量体が、定量される分析物と同一の分子であることを必要としない。本発明は、本請求項に係る方法で用いられるデバイスも提供する。
【0006】
本発明による1つの態様では、サンプル中の1つまたは複数の生体分子を定量するIRに基づく方法が提供される。
【課題を解決するための手段】
【0007】
サンプル中の1つまたは複数の生体分子を定量する、本発明による1つの方法では、当該方法は、(a)サンプルを封じ込めるための、疎水性領域でとり囲まれた親水性領域を含む多孔膜を備えるサンプルホルダーを提供するステップ;(b)膜の親水性領域をサンプル体積と接触させるステップ;(c)膜上の前記サンプル体積を乾燥させるステップ;(d)膜上の前記サンプル体積を4000−400cm−1のスペクトル範囲内の1つの波長または前記スペクトル範囲の任意の部分を含む赤外線ビームに曝露するステップを含み、こうして赤外線吸収スペクトル内の1つまたは複数の吸収ピーク面積が、サンプル中の1つまたは複数の生体分子の量と相関性を有する前記赤外線吸収スペクトルを得る。
【0008】
サンプル中の1つまたは複数の生体分子を定量する、本発明による別の方法では、当該方法は、(a)サンプルを封じ込めるための、疎水性領域でとり囲まれた親水性領域を含む多孔膜を備えるサンプルホルダーを提供するステップ;(b)膜の親水性領域をサンプル体積と接触させるステップ;(c)膜上の前記サンプル体積を乾燥させるステップ;(d)ステップ(c)の後に、赤外線吸収によりサンプル体積中の水の存在を検出し、必要な場合には、水の存在が検出不能になるまでステップ(c)を反復するステップ;ならびに(e)膜上の乾燥されたサンプル体積を、4000−400cm−1のスペクトル範囲内の1つの波長または前記スペクトル範囲の任意の部分を含む赤外線ビームに曝露するステップを含み、こうして赤外線吸収スペクトル内の1つまたは複数の吸収ピーク面積が、サンプル中の1つまたは複数の生体分子の量と相関性を有する前記赤外線吸収スペクトルを得る。
【0009】
本請求項に係る方法によるいくつかの実施形態では、1つまたは複数の生体分子は、核酸、タンパク質、脂質、多糖類およびリポ多糖類からなる群より選択される。代表的なリポ多糖類はエンドトキシンである。
【0010】
様々な実施形態では、スペクトル内の1つまたは複数の吸収面積それぞれは、サンプル中の特定の生体分子の量と相関性を有する。
【0011】
いくつかの実施形態では、本請求項に係る発明による方法は、分析物が定量される毎に較正曲線を作成する必要がない。
【0012】
本発明によるいくつかの実施形態では、1つまたは複数の較正曲線は、用いられる装置に事前にロードされ、こうしてユーザーがサンプル中の分析物を定量したいと欲する毎に較正曲線を作成する必要をなくす。タンパク質およびペプチドを定量する場合には、定量は、ポリペプチド分子内に存在するアミド結合数またはアミド結合濃度に基づき、したがって定量は、分子のアミノ酸配列に依存しない。したがって、分析物(例えば、タンパク質またはペプチド)が定量される毎に較正曲線の作成を必要とし、また検量体が定量される分析物と同一の分子であることをさらに必要とする、当技術分野において公知であり、用いられているほとんどの方法とは異なり、請求項にかかわる発明による方法では、その後、用いられる装置に事前にロードされる較正曲線を作成するための検量体として、任意のタンパク質が利用可能である。
【0013】
同様に、その他の分析物、例えば、核酸、炭水化物等の場合、用いられる装置に事前にロードされる較正曲線を作成するのに任意の適する検量体が利用可能である。本発明による方法は、極少量のサンプル体積中の分析物を定量するのに利用可能である。本請求項に係る方法による様々な実施形態では、サンプル体積は、0.1から20μlの範囲である。特定の実施形態では、サンプル体積は約2から5μl以下または1μl未満である。
【0014】
いくつかの実施形態では、サンプルは、例えば血液、血漿、血清および尿等の生体液を含む。別の実施形態では、サンプルは環境サンプル、医薬品サンプルまたは食品サンプルである。なおも別の実施形態では、サンプルは燃料サンプルである。
【0015】
いくつかの実施形態では、サンプルは、細胞ライセートまたは組織ライセートを含む。
【0016】
様々な実施形態では、サンプルは粗製サンプルである。
【0017】
いくつかの実施形態では、多孔膜は、限外濾過膜である。別の実施形態では、多孔膜は微多孔性膜である。
【0018】
本請求項に係る発明の方法によるいくつかの実施形態では、多孔膜は、ポリフッ化ビニリデン(Polyvinylidene fluoride)、PTFE(ポリテトラフルオロエチレン)、親水性PTFEおよびポリエチレンからなる群より選択されるポリマー材料を含む。特定の実施形態では、多孔膜は親水性PTFEを含む。但し、任意の適するポリマー材料が、本請求項に係る発明による方法で利用可能であると考えられる。ポリマー材料/膜の選択は、主として定量される分析物に依存する。例えば、対象分析物と同一の波長で吸収する、および/または吸収測定を妨害するポリマー材料を使用するのは望ましくない。
【0019】
いくつかの実施形態では、サンプルがスポットされる多孔膜は、便宜上サンプルホルダーと呼ばれるデバイス内に収納される。特定の実施形態では、サンプルホルダーはカードの形態であり、便宜上サンプルホルダーカードと呼ばれる。
【0020】
本請求項に係る方法による様々な実施形態では、サンプルホルダーは、ある1つの領域を含む多孔膜を備え、サンプル体積が前記領域内に前記膜上で封じ込められる。いくつかの実施形態では、サンプルを封じ込めるための領域は、疎水性領域内に親水性領域を含み、ここではサンプル体積が当該親水性領域内に収納される。
【0021】
いくつかの実施形態では、疎水性領域は、親水性多孔膜をプラズマ処理することにより形成される。別の実施形態では、疎水性領域は、親水性多孔膜を熱処理することにより形成される。
【0022】
いくつかの実施形態では、親水性領域は、疎水性領域の1つもしくは複数のスポット、または1つもしくは複数の線を含む。
【0023】
サンプル体積が、親水性領域の直径に封じ込められることが重要である。親水性領域の直径は、用いられるIR測定装置のビーム直径に依存し、当該装置では当該ビームが、親水性領域内に封じ込められたサンプルを通過する。正確な定量を容易にするために、親水性領域の直径は、IRビームの直径以下であるのが望ましい。こうして、全サンプル体積がIRビームに対して可視的であること、および正確な定量が実現されることを保証する。
【0024】
いくつかの実施形態では、サンプルホルダーの親水性領域の直径は、2.0mmから9.2mmの範囲である。いくつかの実施形態では、親水性領域の直径は、3.0mmから6mmである。いくつかの実施形態では、膜上にスポットされるサンプル体積は、界面活性剤を含む。いくつかの実施形態では、界面活性剤は、サンプル体積が膜上にスポットされる前または後に膜上にスポットされる。
【図面の簡単な説明】
【0025】
【図1】将来用いるために作成された代表的な較正曲線を示す図である。BSAがある日の較正曲線を作成するのに用いられた(点線)。4mg/mlのBSAサンプルが後日作成され(例えば、この場合4日後)、そしてあらかじめ作成された較正曲線に対してチェックされた。
【図2】本請求項に係る発明による代表的なサンプルホルダーを示す概略図である。代表的なサンプルホルダーは、4つの異なる膜スポットを含むカードであり、それぞれは、ある体積のサンプル溶液を適用するための疎水性領域でとり囲まれた親水性領域を含む。サンプルスポット1、2および3と呼ぶスポットは、適するバッファー中に対象となる生体分子を含有するサンプル体積をスポットすることが意図されており、一方、スポットBは、ある体積のブランク溶液またはバッファーのみをスポットするのに用いられる。スポット1、2および/または3上にスポットされるサンプル体積は、同一のサンプル溶液を表し得るが、または異なるサンプル溶液を構成し得る。
【図3】赤外線吸収スペクトルを示す図であり、同一サンプル中のタンパク質および核酸を定量する代表的な実験の結果を表している。この実験で用いられたタンパク質はBSAであった。X軸はcm−lによる波数を表し、またY軸は吸収単位を表す。グラフは、本発明によるIRに基づく方法を用いて、DNAおよびタンパク質(すなわち、BSA)の両方が、同一サンプル中で定量可能であることを実証している。
【図4】赤外線吸収スペクトルを示す図であり、サンプル中のペプチドを定量する代表的な実験の結果を表している。この定量実験では、タンパク質の標準物質としてBSAが用いられた。X軸はcm−lによる波数を表し、またY軸は吸収単位を表す。
【図5】赤外線吸収スペクトルを示す図であり、水中のエンドトキシンであるリポ多糖類(LPS)を定量する実験の結果を表している。X軸はcm−lによる波数を表し、またY軸は吸収単位を表す。スペクトルは、水中のLPSの濃度が20μg/μlから0.2μg/μlに低下するに従い、スペクトル強度が低下することを実証している。さらに、LPSを用いた較正曲線は、この実験を用いて作成され、またその後のエンドトキシン定量に用いられる。
【図6】赤外線吸収スペクトルを示す図であり、サンプル中の水の存在をモニター/測定/検出する実験の結果を表している。X軸はcm−lによる波数を表し、またY軸は吸収単位を表す。スペクトルに示されるように、水がサンプル中に存在する場合には、水の−OH結合と関連した振動結合伸縮および屈曲に起因するスペクトル干渉が存在し、これはタンパク質のアミド結合の分解能を妨げる。しかし、サンプルが乾燥され、水が蒸発するにつれ、やはりスペクトルに示されるように、水と関連したスペクトル強度は低下する。
【図7】界面活性剤(例えば、SDS)をサンプルに添加した際の、サンプルのより均一な分布プロファイルおよび吸収プロファイルを示すグラフである。X軸はcm−lによる波数を表し、またY軸は吸収単位を表す。
【図8A】血漿ベースのサンプルを封じ込める際に用いられる固定具およびサンプルホルダーカードアセンブリに関する展開図および閉鎖図それぞれを示す図である。図8Aは、完全に組み立てられたサンプルホルダーカードおよび固定具の2つの側面からなる展開した形態を表す。
【図8B】血漿ベースのサンプルを封じ込める際に用いられる固定具およびサンプルホルダーカードアセンブリに関する展開図および閉鎖図それぞれを示す図である。図8Bは、真空プラズマ環境の内側で、サンプルホルダーカードおよび固定アセンブリを示す閉鎖した状態の断面概略図であり、この場合疎水的であるのが望ましいサンプルホルダーカード上の膜の領域が、プラズマ処理に曝露され、一方、サンプルがスポットされる親水性領域はプラズマ処理から保護されている。
【図9】プラズマ処理後のサンプルホルダーカードを示す概略図である。親水性領域は膜の保護された領域に該当し、この親水性領域はプラズマ処理に曝露された疎水性領域でとり囲まれている。
【図10A】サンプルホルダーカードの膜内にある疎水性領域および親水性領域の代表的な形状/パターンを示す図であり、これはエラストマーシールを好適に配置することにより(プラズマ処理法の場合)、または加熱された圧板の型により(熱処理法の場合)作成可能である。
【図10B】サンプルホルダーカードの膜内にある疎水性領域および親水性領域の代表的な形状/パターンを示す図であり、これはエラストマーシールを好適に配置することにより(プラズマ処理法の場合)、または加熱された圧板の型により(熱処理法の場合)作成可能である。
【図10C】サンプルホルダーカードの膜内にある疎水性領域および親水性領域の代表的な形状/パターンを示す図であり、これはエラストマーシールを好適に配置することにより(プラズマ処理法の場合)、または加熱された圧板の型により(熱処理法の場合)作成可能である。
【図10D】サンプルホルダーカードの膜内にある疎水性領域および親水性領域の代表的な形状/パターンを示す図であり、これはエラストマーシールを好適に配置することにより(プラズマ処理法の場合)、または加熱された圧板の型により(熱処理法の場合)作成可能である。
【図11】膜内に疎水性のサンプル封じ込め領域を形成するためのエンボス型固定具およびサンプルホルダーカードシステムを示す拡大図であり、加熱された圧板およびシリコーン基材を含む。
【図12A】サンプルカードホルダーがシステム内に配置された後の、エンボスヘッド/加熱された圧板システムを示す展開断面の図である。
【図12B】サンプルカードホルダーがシステム内に配置された後の、エンボスヘッド/加熱された圧板システムを示す閉鎖断面の図である。
【図13A】図13A(0秒)および図13B(30秒)に示すように、熱処理を受けなかった膜と比較して、図13C(0秒)および図13D(30秒)に示すように、熱処理後では、膜がサンプル封じ込め領域内にサンプル(例えば、水)を保持することを表す実験結果を示す図である。
【図13B】図13A(0秒)および図13B(30秒)に示すように、熱処理を受けなかった膜と比較して、図13C(0秒)および図13D(30秒)に示すように、熱処理後では、膜がサンプル封じ込め領域内にサンプル(例えば、水)を保持することを表す実験結果を示す図である。
【図13C】図13A(0秒)および図13B(30秒)に示すように、熱処理を受けなかった膜と比較して、図13C(0秒)および図13D(30秒)に示すように、熱処理後では、膜がサンプル封じ込め領域内にサンプル(例えば、水)を保持することを表す実験結果を示す図である。
【図13D】図13A(0秒)および図13B(30秒)に示すように、熱処理を受けなかった膜と比較して、図13C(0秒)および図13D(30秒)に示すように、熱処理後では、膜がサンプル封じ込め領域内にサンプル(例えば、水)を保持することを表す実験結果を示す図である。
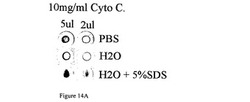
【図14A】化学的および物理的分解が、それぞれサンプルの「コーヒーリング」配置パターンに及ぼす影響を表す図である。図14Aは、洗剤(SDS)がサンプルに添加されたときに、化学的分解によりサンプルの均一な分布が向上したことを示す。水およびリン酸緩衝化された生理食塩水(PBS)の両方に溶解されたチトクロームC(l0mg/ml)が親水性PTFE膜上に配置され(2および5μL)、そして乾燥された。SDSをサンプルに添加すると、サンプルはより均一に分布する(PBS+SDSは図示せず)。
【図14B】化学的および物理的分解が、それぞれサンプルの「コーヒーリング」配置パターンに及ぼす影響を表す図である。図14Bは、物理的分解を行ったときのサンプルの分布を示し(疎水性バリアを変化させることにより)、その結果、複数の「コーヒーリング」が形成され、より多くのサンプルがサンプル領域の中央部に集まる。
【図15】SDSをサンプルに添加したときの効果を示す棒グラフである。SDS(1および5%)がチトクロームCサンプルに添加され、そして乾燥された。SDSを添加すると、その結果各ピーク面積が増加した。
【発明を実施するための形態】
【0026】
本発明は、赤外線分光法(IR)、ならびに本請求項に係る発明による方法で使用するデバイスを用いて、サンプル中の1つまたは複数の生体分子を定量するための改善した方法を提供する。
【0027】
本開示がより容易に理解可能となるように、しかるべき用語が最初に定義される。追加の定義は、詳細説明全体を通じて説明される。
【0028】
I.定義
用語「定量する」、「定量」、「定量化する」、「測定する」または「測定」は、本明細書において交換可能に用いられ、本請求項に係る発明による方法を用いて、サンプル中の分析物の量または濃度を測定することを意味する。用語「分析物」は、本明細書で用いる場合、本明細書に記載する方法を用いて定量化するのが望ましい任意の対象分子を意味する。様々な実施形態では、分析物は生体分子である。
【0029】
用語「生体分子」は、本明細書で用いる場合、本請求項に係る発明による方法を用いて定量化するのが望ましい任意の対象生体物質を意味する。代表的な生体分子は、タンパク質、ペプチド、DNAおよびRNAを含む核酸分子、脂質、炭水化物およびエンドトキシン(例えば、リポ多糖類)を含む。生体分子が電磁スペクトルの赤外線範囲内で吸収する能力を有する限り、任意の生体分子が、本請求項に係る発明による方法を用いて定量化可能であると考えられる。
【0030】
用語「サンプル」は、本明細書で用いる場合、本発明による方法を用いて定量化される分析物(例えば、生体分子)を含む任意の媒体を意味する。サンプルは、例えば食物(例えば家禽、新鮮な肉、ミルク、ヨーグルト、乳製品、ベーカリー製品、飲料物、ビール、レモネード、ジュース、チーズ、野菜類、果物、魚等)、水または汚水体(例えば池、湖、河川、海洋、下水路、飲用水道水等)、臨床試料(例えば血液、血漿、血清、喀痰、組織、尿、唾液、気道由来のサンプル/液)、土壌、ならびに化粧品および医薬品(例えばローション、クリーム、軟膏、溶液、薬剤、眼および耳の点滴薬等)を含み得るが、但し、これらに限定されない。特定の実施形態では、サンプルは、細胞ライセートまたは組織ライセートを含む。本請求項に係る発明の様々な実施形態では、サンプルは粗製サンプルを構成し得るが、すなわち、これは本請求項に係る方法で使用する前に何らかの調製または処理を必要としない。
【0031】
いくつかの実施形態では、少量のサンプル(例えば、0.1−20μl)が、サンプルホルダー(例えば、カードの形態)内に収納される膜の親水性領域上にピペット分取されまたはスポットされ、そしてその後乾燥され、IRに基づく分光法へのサンプルの曝露がこれに続く。カード上のサンプル体積は任意の適する方法を用いて乾燥可能である。例えば、サンプル体積は風乾可能、または対流加熱器または従来型のオーブン、または電子レンジであっても、これらを用いて乾燥可能である。いくつかの実施形態では、乾燥機構はIRシステムに組み込まれると考えられる。一般的に、水は正確な定量を行う障害となり得るので、定量前にサンプル体積中に痕跡量の水が存在しないのが望ましい。
【0032】
本請求項に係る方法のいくつかの実施形態では、サンプル体積がスポットされる膜は、乾燥ステップの対象となり、その後に水の存在を検出するために赤外線吸収が利用される。水が検知された場合には、膜は再度乾燥ステップの対象となり、この乾燥ステップは、水の存在が検出不能となるまで反復される。一般的に、乾燥ステップ後に吸収がさらに変化しなければ、それは水の存在が検出不能である、または換言すれば、サンプルはIR分析するのに十分に乾燥されていることを示している。
【0033】
本請求項に係る発明による方法およびデバイスは、極少量のサンプル体積を用いてもサンプル中の分析物を正確に定量することを可能にする。様々な実施形態では、サンプル体積は、約0.05μl、0.1μlまたは0.2μlまたは0.3μlまたは0.4μlまたは0.5μlまたは0.6μlまたは0.7μlまたは0.8μlまたは0.9μlまたは1.0μlまたは1.5μlまたは2μlまたは2.5μlまたは3μlまたは3.5μlまたは4μlまたは4.5μlまたは5μlまたは5.5μlまたは6μlまたは6.5μlまたは7μlまたは7.5μlまたは8μlまたは8.5μlまたは9μlまたは9.5μlまたは10μlまたは10.5μlまたは11μlまたは11.5μlまたは12μlまたは12.5μlまたは13μlまたは13.5μlまたは14μlまたは14.5μlまたは15μlまたは15.5または16μlまたは16.5μlまたは17μlまたは17.5μlまたは18μlまたは18.5μlまたは19μlまたは19.5μlまたは20μlであり、または20μlを上回る。本明細書に記載するデバイスおよび方法は、1つまたは複数の生体分子を定量するのに極少量の体積でも使用できるようにするが、本明細書に記載する方法を用いて検出および定量する際の下限を広げるために、複数のアリコットのサンプル体積がサンプルホルダーカードに、当該サンプル体積を当該アリコット毎に乾燥させながら適用可能である。例えば、非常に低レベルの分析物を含むサンプルの場合、本明細書に記載する方法を用いてこれを検出するのは困難または検出不能である場合があり、そうした場合、複数のアリコットのしかるべきサンプル体積(例えば、10−20μl)が、当該サンプル体積を異なるアリコット毎に乾燥させながらサンプルホルダーカード上にスポット可能である。したがって、10−20μlの極少量が、各適用に際しサンプルホルダーカード上にスポットされるが、50μlから100μlまたはこれより多くの総サンプル体積が、サンプル体積を複数回適用する際に、その適用毎に各サンプル体積を乾燥させながら、合算して適用される。
【0034】
いくつかの実施形態では、サンプル体積を20μlずつカードに適用し、当該カードを乾燥させることにより、100μl以上のサンプル体積がサンプルホルダーカードに適用される。サンプル体積が完全に乾燥したら、追加のサンプル体積20μlがサンプルホルダーカードに適用可能となり、当該カードは再度乾燥可能となる。このプロセスは、カード上に必要とされるサンプル体積をスポットするように、複数回反復可能である。この技術の長所として、同技術が分析物の検出/定量限界を拡張するという点が挙げられる。
【0035】
本明細書で用いる場合、用語「溶解する」、「溶解」または「溶解すること」とは、例えば細胞膜を傷つけることにより、細胞または組織が破壊されて開放され、またおそらくは細胞の内容物の放出を引き起こし得る任意の手段を指す。細胞または組織を溶解するのに利用可能な代表的な方法は、酵素的方法、超音波、機械的作用(例えば、剪断および衝突)および化学的方法を含むが、但し、これらに限定されない。
【0036】
本明細書で用いる場合、用語「核酸」または「核酸分子」は、互いに共有結合した2つ以上のヌクレオチド、ヌクレオシド、または核酸塩基(例えば、デオキシリボヌクレオチドまたはリボヌクレオチド)からなる任意の鎖状物を意味する。いくつかの実施形態では、本請求項に係る発明による方法を用いて定量化される生体分子は、核酸分子である。核酸分子は、ウイルスゲノムまたはそれらの一部分、DNAまたはRNAのいずれか、細菌性ゲノムまたはそれらの一部分、真菌、植物もしくは動物ゲノムまたはそれらの一部分、メッセンジャーRNA(mRNA)、リボソームRNA(rRNA)、転移RNA(tRNA)、プラスミドDNA、ミトコンドリアDNAまたは合成DNAまたはRNAを含むが、但し、これらに限定されない。核酸分子は、線形(例えば、mRNA)、円形(例えば、プラスミド)または分枝した形態、ならびに二本鎖または一本鎖の形態で提供され得る。核酸分子は、例えば追加のヌクレオチドが核酸に付加されるのを阻止するために、3’−末端ジデオキシヌクレオチドを付加したもの等の、核酸の機能または挙動を変更するために修飾された塩基を含み得る。
【0037】
用語「波長」は、波の1つのピークまたは頂上および次のピークまたは頂上の間の距離を一般的に意味する。これは、波のスピードをその周波数で割り算したもの、および波のスピードにその周期を掛け算したものに等しい。波長は、進行波および定常波の両波、ならびにその他の空間波パターンに固有である。波長は、ギリシャ文字ラムダ(λ)で一般的に表される。正弦波が一定の位相速度で移動すると仮定した場合、波長は波の周波数に対して逆比例する。したがって、波の周波数が高くなるほど短い波長を有し、また波の周波数が低くなるほど長い波長を有する。
【0038】
用語「波数」はその波長の逆数に比例する波の特性である。これは、cm−1の単位で一般的に測定され、また単位距離当たりの波長の数、すなわち1/λ(λは波長)として定義される。
【0039】
本明細書で用いる場合、用語「吸収ピーク面積」または「吸収ピーク面積(複数)」とは、本明細書に記載するように、サンプルをIR分光法に曝露した後に認められる赤外線吸収スペクトルの1つまたは複数の部分を意味する。本明細書に記載するIRに基づく方法を用いて赤外線吸収スペクトルが得られたら、ピークを横断するベースラインを描き、当該ピークに囲まれた面積を求めることにより、スペクトル内の1つまたは複数のピーク下面積が計算される。ベースラインは、下記に示されるように、スペクトル上のピークの始めと終わりのポイントを基準に一般的に描かれる。
【0040】
【化1】

【0041】
本請求項に係る方法によるいくつかの実施形態では、ピーク面積はサンプル中の分析物の濃度または量と相関性を有する。
【0042】
いくつかの実施形態では、サンプル中のタンパク質濃度は、下記のように測定される。第1ステップとして、既知濃度のタンパク質標準物質を含む検量体を用いて較正曲線が作成され、そして較正曲線がIR分光装置に事前ロードされる。その後同一の較正曲線が、当該装置がサンプル中のタンパク質を定量するために用いられる毎に、利用可能である。さらに、検量体が分析されるサンプル中に存在することは必要とされない、または換言すれば、サンプル以外の完全に異なる起源に由来し得る。例えば、特定の実施形態では、例えばBSA等のタンパク質標準物質の溶液が、様々な既知濃度でバッファー中に調製される。標準物質溶液は、カード形態のサンプルホルダー内にある膜の親水性領域に適用され、当該膜は乾燥され、そして吸収スペクトルが、IR測定装置、例えばBruker製IR測定装置を用いて測定される。理論に束縛されるものではないが、任意の適するIR測定装置が、本発明による方法で利用可能であると考えられる。
【0043】
最も近代的なIR吸収測定装置は、マイケルソン干渉計と共にフーリエ変換技術を利用する。本請求項に係る方法によるいくつかの実施形態では、IR吸収スペクトルを得るために、干渉計の1つの鏡が検出器に到達する照射光において干渉を生成するように移動する。すべての波長は干渉計を通過するので、インターフェログラムは複合パターンである。波数(cm−1)の関数である吸収スペクトルが、鏡の移動量(cm)の関数であるインターフェログラムのフーリエ変換から得られる。この設計は、分散装置の基準セルを有さないので、基準スペクトルが記録され、そしてサンプルスペクトルから減じるためにメモリー内に保管される。
【0044】
その他の代表的なIR吸収測定装置は、分散型IR吸収測定装置および単一波長IR測定装置を含む。分散型IR分光計は、異なる波長の光を分散するために、モノクロメータ内にある回折格子を使用する。一般的に、分散型IR分光計は、FTIR測定装置に置き換えられてきた。単一波長IR測定装置は、単一のIR波長をモニターして速い反応の反応速度を測定するのに利用可能である。
【0045】
本請求項に係る発明によるいくつかの実施形態では、FTIR測定装置が、1つまたは複数の生体分子の定量に用いられる。アミドIおよびアミドIIピーク(1800−1450cm−1)を含む曲線下面積が、装置内に組み込まれたソフトウェアにより計算される。例えば、Bruker製IR分光計は、Bruker製Opusソフトウェアを含む。次に、較正曲線が作成されるが、その場合、ピーク下面積をタンパク質標準物質の濃度に対してプロットする。既知濃度の標準物質により作成された較正曲線を用いて、サンプル中の分析物の濃度が、その後測定される。
【0046】
一般的に、較正曲線とは、分析物の量または濃度と、観察されたシグナルの期待値との間の関数的な関係を図示したものを意味する。一般的に、検量体の既知濃度をある範囲で含む標準物質が、較正曲線を作成するのに用いられる。サンプルを用いて得られたスペクトルは、次に、所望の分析物の濃度を得るために標準物質と比較される。
【0047】
本明細書に記載する方法によるいくつかの実施形態では、当該方法は、サンプル中の水による吸収をモニター/検出するステップをさらに含む。水は約3400および1600cm−1に吸収を有し、これにより多くの生体分子で得られたスペクトルと重なり合う。本発明によるいくつかの実施形態では、水による吸収に関連したスペクトル強度変化をモニターするための組み込み型ソフトウェアを備えるIR測定装置が用いられるが、当該強度は、サンプル中の水アリコットが低下するに従い低下する。したがって、水と関連したスペクトル強度をモニターすることにより、ユーザーはサンプルをさらに乾燥させる必要があるかどうか判断することができる。一般的に、水による吸収と関連したスペクトル強度は、2つまたは3つ以上連続した結果について同一のスペクトル強度が認められるまで、乾燥プロセス期間中数回測定され、こうして、サンプルが実際の定量用として乾燥していることを確認する。
【0048】
いくつかの実施形態では、界面活性剤が本発明の方法を用いて分析されるサンプル中に含まれる。界面活性剤は、膜上にスポットされるサンプルに含まれてもよく、またサンプルがスポットされる前または後に膜に添加されてもよい。例えばドデシル硫酸ナトリウム(SDS)もしくはツイーン20等の界面活性剤、または化学添加物、例えばグリセロールは、溶液の表面張力を低減し、こうして領域内にサンプルが均一に分布するのを可能にする。
【0049】
親水性PTFE基材上で、1つまたは複数の生体分子を含有する水性サンプルが乾燥される際には、サンプルが乾燥するにつれて濃度勾配が形成される。この配置パターンでは、最外周部において最高量の、またサンプル領域の中央部において最低量のサンプルが配置することとなる。このパターンは、多くの場合「コーヒーリング」または「ドーナッツ」パターンと呼ばれる。例えば界面活性剤を添加するなどして水性サンプルの表面張力が低下すると、サンプルの配置は、全サンプル領域にわたりより均一となる。サンプルがエネルギー源を用いて調査されるような場合には、界面活性剤を含めることで、エネルギー源に曝露される領域内のサンプルはより均一に分布する。
【0050】
代表的な界面活性剤は、ポリオキシエチレンベースの非イオン性界面活性剤(ツイーン20、ツイーン40、ツイーン60およびツイーン80)等を含むが、但し、これらに限定されない。陰イオン性界面活性剤として、例えばドデシル硫酸ナトリウム(SDS)、ラウリル硫酸アンモニウム、ラウリルエーテル硫酸ナトリウム(SLES)、ステアリン酸ナトリウム等が挙げられる。いくつかの実施形態では、界面活性剤の濃度は、約1%または約2%または約3%または約4%または約5%または約6%または約7%または約8%または約9%または約10%である。特定の実施形態では、界面活性剤の濃度は約5%である。
【0051】
代表的な化学添加物は、ポリオール、例えばグリセロール、エチレングリコール、プロピレングリコール、ジプロピレングリコール等を含むが、但し、これらに限定されない。いくつかの実施形態では、化学添加物の濃度は、約1%または約2%または約3%または約4%または約5%または約6%または約7%または約8%または約9%または約10%である。特定の実施形態では、化学添加物の濃度は約5%である。
【0052】
やはり本発明に含まれるものとして、IRに基づく方法を用いてサンプル中の1つまたは複数の生体分子を定量するのに用いられるデバイス、ならびにそのようなデバイスの作製方法が挙げられる。本発明によるいくつかの実施形態では、生体分子の定量に用いられるデバイスは、多孔膜(例えば、限外濾過膜または微多孔性膜)を含むカード形態のサンプルホルダーである。一般的に、限外濾過膜は、0.1μm未満のポアサイズを有するものと理解されている。
【0053】
いくつかの実施形態では、サンプルホルダーに収納された多孔膜は、疎水性領域でとり囲まれた親水性領域を含む。親水性領域は、水によって速やかに湿潤可能な膜の領域であり、またサンプルが、膜上に通常スポットされまたはピペット分取される領域である。また、IRビームに一般的に曝露される領域でもある。
【0054】
いくつかの実施形態では、膜の親水性領域は、水に濡れない疎水性領域でとり囲まれている。
【0055】
いくつかの実施形態では、サンプルを封じ込めるための領域は、親水性領域および疎水性領域からなる形状/パターン、例えば親水性領域内に形成された直線形状またはスポット形状の疎水性領域を含む。代表的な形状およびパターンを図8A−8Dに示す。そのような形状およびパターンも、界面活性剤または化学添加物を添加する場合とまったく同様に、IRビームに曝露される領域内でサンプルがより均一に分布するのを可能にする。
【0056】
赤外線分光分析で使用するサンプルホルダーカードは、当技術分野においてこれまで記載されてきたが、そのようなカードは、微多孔性膜、例えば参照により本明細書にそのまま組み込む米国特許第5,470,757号および同第5,764,355号で議論されている膜等を含む。しかし、本発明の場合のように、サンプルを封じ込めるために、疎水性領域でとり囲まれた親水性領域を含むサンプルホルダーカードの教示は存在しない。さらに、上記特許は、本明細書に記載する改善、例えばサンプル中の2つ以上の生体分子の定量、極少量のサンプル体積の使用および測定毎の較正曲線作成が不要等を実証するサンプルホルダーカードおよび方法について記載していない。
【0057】
カード形態のサンプルホルダーは、接着剤で膜基材にラミネートされた2層のペーパーカードストックから一般的に製造される。サンプルホルダーは、任意のその他の物質、例えば接着剤で接着可能なプラスチックからも作製され得る。さらに、サンプルホルダーは接着剤をまったく使用せずに形成され得るが、また熱に曝露されたときに、カードストックと接着する、カードストック上のコーティング物を介してラミネートされ得る。いくつかの実施形態では、サンプルホルダーは、およそ幅1.4インチ、長さ2.5インチのカードの形態であり、また少なくとも4つのサンプルを保持することができる。しかし、サンプルホルダーは、これが1個のサンプルから最大96個またはこれよりも多くのサンプルを収納可能なように設計可能である(例えば、96ウェルのプレートフォーマット)。特にサンプルホルダーがカード形態のとき、サンプルホルダーがIRビームに曝露されるIRシステムの担体に正しく挿入されることを検証するために、サンプルホルダーの方向をIRシステムの方向と一致させる、ノッチがサンプルホルダーの設計に盛り込み可能である。また、IRビームがサンプルを含有する親水性領域を通過するように、サンプルホルダーが正しい方向を向いていることも重要である。
【0058】
本明細書に記載するサンプルホルダーカードは、製造するのに容易であり、対費用効果が高く、また使い捨てである。
【0059】
本発明は、限定とみなされるべきでない下記の実施例によりさらに説明される。本出願全体を通じて引用されるすべての参考資料、特許および公表された特許出願の内容ならびに図は、参照により本明細書に組み込まれる。
【実施例】
【0060】
[実施例1]:将来のサンプル定量で用いる較正曲線の作成
本明細書に記載するサンプル中の1つまたは複数の生体分子を定量する方法は、定量実験が装置上で実施される毎に、較正曲線を作成する必要性をなくす。これは、定量分析が実施される毎に、ユーザーが新しい較正曲線または標準曲線を作成するように一般的に求められる当技術分野における現行分析法に比べて改善されている。
【0061】
本明細書に記載する方法では、ユーザーは、較正曲線または標準曲線を一度作成し、そして将来の分析のために使用することができる。1つの実験では、較正曲線が下記のように作成された。様々な濃度の分析物(BSA)の溶液がバッファー中に調製され、本明細書に記載するFTIRに基づく検出法を用いて分析された。図1のグラフは、分析物の濃度または量(X軸)に対するピーク面積またはピーク高さ(Y軸)を示している。ピーク面積が既知のとき、この較正の直線範囲が、未知のサンプルの濃度計算で用いられる。
【0062】
代表的な式はy=mx+c、式中c=Y軸の切片、m=直線の傾き;y=ピーク面積または高さ、およびx=分析物の濃度または量である。さらにユーザーは、定量の統計的妥当性を高めるために、当初の較正曲線にデータを付加することができる。
【0063】
図1は、ある日に、バッファー中の様々な既知濃度のBSAを用いて生成された較正曲線の例、および同一曲線と比較した数日後に定量された濃度が未知であるタンパク質の関連するサンプルである。
【0064】
[実施例2]:サンプル中の生体分子を定量するための一般プロトコール
代表的な実験では、1つまたは複数の生体分子(例えば、タンパク質、核酸、炭水化物、脂質等)を含有するサンプルが、脱イオン水または適するバッファー中で調製される。約0.2−10μlのブランク溶液(例えば、脱イオン水またはバッファー単独)が、例えばカードの形態のサンプルホルダー(本明細書ではサンプルホルダーカードと呼ぶ)内に収納された膜の親水性領域に適用される。同一体積の調製済みのサンプル溶液が、1つまたは複数のスポットに適用されるが、同スポットは、同一サンプルホルダーカード上に存在しても、また異なるが同形のサンプルホルダーカード上に存在してもよい。サンプルホルダーカードは、下記の方法のうち1つを用いてその後乾燥される:熱(40−60℃、0.5−2分);圧縮空気/窒素もしくは任意のその他の不活性気体(0.5−2分)、または電子レンジ。乾燥したサンプルホルダーカードは、IR測定装置のサンプルコンパートメント内にその後挿入される。ブランク溶液の透過/吸収スペクトルが、バックグランドに対応するスペクトルを得るために4000および400cm−1の間で測定され、これに同一波長範囲でのサンプル測定が続く。様々な濃度の標準物質を用いて作成され、システムに組み込まれた較正曲線を用いて、濃度未知のサンプルがその後測定される。
【0065】
図2は、ブランクを適用するための1つのスポット(Bと呼ぶ)および3サンプル用のスポット(1、2および3と呼ぶ)を示す、代表的なサンプルホルダーカードの画像を表している。しかし、上記で議論したように、サンプルホルダーカードは、サンプルを適用するための任意の数のスポットを有するように設計可能である。
【0066】
[実施例3]:IR分光法を用いたサンプル中のタンパク質および核酸の定量
代表的な実験では、サンプル中のタンパク質および核酸の両方が、本発明による方法を用いて、下記のように定量された。
【0067】
1つの実験では、ウシ血清アルブミン(BSA;SIGMA Cat#A−7030)およびデオキシリボ核酸(DNA;Ambion Cat#AM9680剪断されたサケ精子DNA)が、様々な割合(等比および逆比で10から1μg)で一緒に混合され、1×PBSバッファー内に溶解された。1μlのサンプルが、親水性PTFE膜サンプルホルダーカード上に、P10型Raininピペットを用いてピペット分取されたが、その場所は図2に示すサンプルホルダーカードの1、2および3の位置であった。上記サンプルが調製されたバッファーの同一の体積が、図2に示すように、サンプルホルダーカード上の位置Bにピペット分取された。
【0068】
バッファースポットおよびサンプルスポットの両方を備えるサンプルホルダーカードが、高圧空気を用いて乾燥された。サンプルホルダーカードがIR測定装置内に挿入され、バッファーの吸収/透過スペクトルが4000および400cm−1の間で最初に測定された。その後、サンプルのスペクトルが、バックグランドスペクトルとしてバッファースペクトルを用いて測定された。タンパク質および核酸の量は、タンパク質の場合、1700−1400cm−1、また核酸の場合、1740−1400および1120−940cm−1のスペクトル範囲を用いて測定される。1700−1400cm−1の波長範囲では、タンパク質および核酸の両方が吸収を有する点に留意する。したがって、核酸の濃度が求められたら、この濃度は、1700−1400cm−1の間のピーク面積を用いて得られるタンパク質+核酸の濃度から減じることができ、こうしてタンパク質単独の濃度が得られる。したがって、タンパク質および核酸の濃度が、一回の実験で測定可能である。この実験では、較正曲線は、バッファーまたは脱イオン水中に溶解したタンパク質およびDNAの純粋なサンプルを用いて、タンパク質およびDNAについて独立に作成された。1つのそのような実験の結果を図3に示す。
【0069】
[実施例4]:IRを用いたサンプル中のペプチドの定量
別の代表的な実験では、本発明による方法は、ペプチドを定量するのに利用され得ることが実証されている。1つの実験では、ペプチドサンプルが1mg/mlの濃度まで水に溶解された。2μlの体積のサンプルが、P2型Raininピペットを用いて、図2に示すように親水性PTFE膜を収納するサンプルホルダーカード上にピペット分取され、そして40℃のヒーター内で乾燥された。同一のサンプルホルダーカードは、ブランク(B)と呼ばれる位置も備え、ここには2μlの体積のサンプル溶解水がピペット分取された。カードはIR測定装置内に挿入され、水/バッファーブランクの吸収/透過スペクトルが測定され、これにバックグランドとして水/バッファースペクトルを用いたサンプル測定が続いた。ペプチドの量は、1700−1400cm−1のスペクトル範囲を用いて測定された。較正曲線は、検量体としてBSAの純粋サンプルを用いて、バッファー/水中で作成された。1つのそのような実験の結果を図4に示す。
【0070】
[実施例5]:IRを用いたサンプル中のリポ多糖類の定量
代表的な実験では、本発明による方法が、サンプル中のリポ多糖類を定量するのに用いられた。具体的には、エンドトキシン等のリポ多糖類(リポ多糖類(LPS);SIGMA製L2630)が、20mg/mlのストック溶液を得るために1×PBSバッファー中に溶解された。2μlの体積のサンプルが、P2型Raininピペットを用いて、図2の画像に示すように、親水性PTFE膜を収納するサンプルホルダーカード上にピペット分取され、そして40℃のヒーターを用いて乾燥された。同一のサンプルホルダーカードは、ブランク(B)と呼ばれる位置も備え、ここには2μ1の体積のサンプル溶解バッファーが適用される。サンプルホルダーカードはIR測定装置内に挿入され、サンプルのスペクトル測定を行う前にバッファーのスペクトルが最初に測定されたが、この場合ブランクバッファースペクトルをバックグランドスペクトルとみなす。LPS希釈物の滴定結果が、較正曲線を得るためにストック溶液の計算に基づき記録された。1つのそのような実験の結果を図5に示す。
【0071】
[実施例6]:IRを用いたサンプル中の水の存在のモニタリング
本明細書に記載する方法は、サンプル中の水の存在を検出するためにも利用可能である。水は、例えば特にタンパク質/ペプチドを定量する際には、生体分子の定量の正確性に影響を及ぼす可能性があるので、IRに基づく方法を用いて分析されるサンプル中に水を含むのは大部分は望ましくない。
【0072】
代表的な実験では、Milli Q水中に溶解された10mg/mlのBSA(Sigma Cat#A−7030)溶液、2μlが、例えばカードの形態のサンプルホルダー(本明細書ではサンプルホルダーカードと呼ばれる)に収納されている膜の親水性領域に適用された。
【0073】
濡れたサンプルが、次にIR分光計のIRビーム内に配置され、IR吸収スペクトルが測定された。吸収スペクトルは、シグナル強度、例えば水の蒸発に起因したシグナルプロファイル変化として記録される。
【0074】
吸収スペクトルに関するシグナル強度が、3回の連続した測定において一定に留まるとき、サンプルは乾燥しているとみなされ、ソフトウェア(例えば、Bruker製測定装置の場合Opusソフトウェア)は、4000−400cm−1の間でBSAの吸収スペクトルを収集し、そして組み込み済みの較正曲線を用いて、当該溶液中のBSA濃度を決定する。1つのそのような実験の結果を図6に示すが、この図は、サンプルが乾燥すると共に水と関連するシグナル強度が低下することを表している。
【0075】
[実施例7]:界面活性剤がサンプルの分布に与える影響
水溶液は、IRビームに曝露される膜の領域上で均一に乾燥させ、また均一な分布を得る際に、問題を有する可能性がある。
【0076】
この実験は、界面活性剤をサンプル溶液に添加すると、サンプルは、IRビームに曝露される領域上で均一に分布し、その結果より正確な定量を実現することを実証する。代表的な実験では、10mg/mlのチトクロームCタンパク質サンプル溶液、5μlが用いられ、これはPBSに溶解され、そして5%SDSを含む、また含まないで乾燥された。サンプルはサンプルホルダーカード上にスポットされ、そして全直径が4.5mmのIRビーム内に配置された。
【0077】
SDSを含まない場合、ほとんどのサンプルは、サンプル領域の外側1mm内に含まれたので、サンプルの約10%しかIRビームを吸収しないことが観察された。しかし、SDSが存在するサンプルでは、サンプルはより均一に分布し、その結果、サンプルはビームの最大照度(1/e2)内にあるので、より多くのIRを吸収した。積分して得られたアミド1および2のピーク面積(1725から1479cm−1)は、SDSを含まないサンプルの場合よりも約3倍大きかった。1つのそのような実験の結果を図7に示す。このIR吸収スペクトルでは、X軸は波数(cm−1)を表し、一方、Y軸は吸収単位を表している。
【0078】
[実施例8]:プラズマ処理を用いたサンプルを封じ込めるためのサンプルホルダーカードの製造
やはり本発明に含まれるものとして、本明細書に記載するように、サンプル中の1つまたは複数の生体分子を定量する方法で利用可能なサンプルホルダーが挙げられる。いくつかの実施形態では、サンプルホルダーはカードの形態であり、便宜上サンプルホルダーカードと呼ばれる。サンプルホルダーカードは、正確な吸収スペクトルを取得し、その結果、対象とする生体分子の1つまたは複数の定量を実現するために、IRビーム内にサンプルを収納可能であることが必須である。
【0079】
本発明による方法で使用されるサンプルホルダーカードを製造する1つの方法では、サンプルを封じ込める領域を作成するために真空プラズマ環境が用いられた。サンプルホルダーカードで用いられる出発膜は、親水性PTFE膜であったが、これはブランド名PoreflonでSumitomoから販売されている。この膜は、平均すると0.03μmのサイズの孔(HHPSW−005−30)を備え、水濡れ可能な表面を付与するように親水化処理剤でコーティングされている。Poreflon親水性膜を真空プラズマ環境に曝露すると、表面から処理剤が除去されて本来疎水性のPTFEが露出する。
【0080】
図8Aおよび8Bは、マスキング固定具の実験的に展開および閉鎖した図をそれぞれ表し、同固定具内には、プラズマに曝露させるように組み立て済みのサンプルホルダーカードが配置されている。膜は、各中央部に12.5mmの貫通孔を有する硬質接着剤がコーティングされた2枚のペーパーシートから構成されるカード内に組み込まれた。2枚のペーパーシートは、これらの間にサンドイッチされる住友の親水性膜と共に組み立てられ、こうすることで組み立て済みのペーパーカード内で貫通孔を覆う。組み立て済みカード(10)を、展開した構成の固定具(12)と共に図8Aに示す。図8Aおよび8Bに示すように、親水性膜(14)を収納する組み立て済みのカード(10)は、カードを中央部に配置するためのフレーム(16)を備えるマスキング固定具(12)内に配置された。エラストマーシール(18)が、中央部に配置され位置決定された膜カード(10)の反対側に存在した。エラストマーシール(18)を4つのホール(19)が取り巻き、同ホールは処理の対象とされる膜(14)にプラズマガスが接触するように流通を確保する。マスキング固定具(12)は、図8Bの断面図に示すようにエラストマーシール(18)がカード(10)内の膜(14)の反対側に対して押し付けられて気密となるようにその後閉鎖された。親水性膜(14)を収納するサンプルホルダーカード(10)上に固定具(12)を密着させるのに、例えばクランプによる力が用いられた。
【0081】
固定具(12)内に位置するカード(10)は、その後真空プラズマ環境内に配置され、その閉鎖した断面図を図8Bに示す。利用可能である代表的な真空プラズマシステムはHarrick真空プラズマシステムモデルPDC−001である。システム内部のチャンバー(20)は真空ポンプ(図示せず)を用いて脱気された。大気ガスがチャンバー(20)内に導入され、流速は約2−5cc/分に維持された。高周波発振器(図示せず)に電力が加えられ、10秒から7分の時間維持された。エラストマーシール(18)間にあるサンプルホルダーカード(10)の膜(15)の領域は、プラズマから保護されており、一方残りの外側はドットで示しているプラズマに曝露された。
【0082】
図8Aおよび8Bに記載する固定具を用いたプラズマ曝露実験は、処理時間が1分を超えれば、いずれの場合も親水性領域および疎水性領域が明確に規定され、エラストマーシール(18)の位置で鮮明な遷移端が生ずることを明らかにした。プラズマ処理時間が1分よりも短いと、移行端部が不鮮明となるか移行端部がまったく生ぜず、その結果、膜は親水性に留まり、サンプルは封じ込められなかった。
【0083】
図9は、この実施例に記載する方法を用いて作成された、疎水性領域(26)でとり囲まれた親水性領域(24)を有する膜を収納する代表的なサンプルホルダーカード(22)を示す。2つの領域の間の境界は遷移端または線(28)である。
【0084】
上記で議論したように、IRビーム内においてできる限り均一に分布したサンプルを有するのがさらに望ましい。均一な分布を実現する1つの方法は、上記で議論したように、界面活性剤をサンプルに添加することである。均一な分布を実現する別の方法は、本明細書で議論するように、膜上で親水性領域に散在する疎水性領域のパターン/形状を形成することである。
【0085】
乾燥する液滴は、コーヒーリング現象において一般的に認められるように、サンプルを乾燥する液滴の外端部に沿って優先的に配置するものと理解される。この乾燥パターンを最低限に抑えるために、親水性領域をとり囲む疎水性領域は、さらに改変され得る。これは、例えば、親水性領域内に疎水性のスポットまたは線からなる膜上のパターンが形成されるように、膜上にエラストマーシールを好適に配置することにより実現可能である。そのようなパターンは複数のより小さな液滴をもたらし、こうしてより小さな、またさらに小さな乾燥パターンを形成するものと期待される。これらのより小さな乾燥パターンは、サンプルをIRビーム内により均一な構成で配置する。膜上に構成することができる可能な形状/パターンは、線、ドット、星型の形態およびその他の一般的な形状であり得ると理解される。さらに、外側の疎水性領域も、例えば星型、四角形等の形状であり得る。固定具上にエラストマーシールを好適に配置することにより形成され得る代表的な疎水性/親水性パターンは、図10A−10Dに示されている。親水性領域は数字参照30で示され、また疎水性領域は数字参照32で示されている。
【0086】
[実施例9]:サンプルを封じ込めるための熱処理を用いたサンプルホルダーカードの製造
別の実験では、本発明によるIR法で用いられるサンプルホルダーカードは、カード内の膜上でサンプルの封じ込めを実現するための別の代替手段として熱処理を用いて下記のように製造された。
【0087】
代表的な実験では、親水性PTFE膜の表面の濡れ性は、サンプルを封じ込めるための領域を形成するために、加熱された圧板に曝露することにより変更される。用いられた親水性PTFE膜は、住友よりブランド名Poreflonで販売されており、平均すると0.05μm孔のポアサイズを有し(HHPSW−005−30)、また水濡れ可能な表面を付与するように親水化処理剤でコーティングされている。一般的に、この実施例に記載する方法を用いて、0.05μm−0.45μmの範囲のポアサイズ、および30μmから80μmの範囲の厚さを有する任意のPoreflon膜が、加熱された圧板を用いて改変可能である。
【0088】
実施例8の場合と同様に、親水性PTFE膜は、4つの10mm貫通孔を有する接着剤がコーティングされたペーパーシートから構成されるカード内に組み込まれる。2つのペーパーシートは、当該シート間にサンドイッチされる住友の親水性膜と共に組み立てられ、こうして、組み立てられたペーパーカード内で孔を覆う。親水性膜(36)を収納するこの組み立て済みのカード(34)は、図11に表すようにcal−rods(図示せず)および加熱された圧板(42)に取り付けられた空気圧シリンダー(図示せず)を備えたエンボス型固定具(38)内に配置された。シリンダーは、加熱された圧板(42)をサンプルホルダーカード(34)内の膜(36)の直上または上方に配置し、またネスト(40)上のエラストマーパッド(44)は、膜(36)の下面を支持する。加熱された圧板(42)は、飛び出した突起部(46)を備え、またネスト(40)は、飛び出した突起部(46)と整合するエラストマーパッド(44)を備え、サンプルホルダーカード(34)がこれらの間に配置されると、加熱された圧板(42)と直接接触した領域は疎水性となる。
【0089】
エンボス型固定具/カード/加熱された圧板アセンブリの展開断面図および閉鎖断面図を図12Aおよび12Bにそれぞれ示す。
【0090】
加熱された圧板(42)が、一定時間(例えば、5秒から5分)、膜(36)に曝露された後、シリンダー(図示せず)は、加熱された圧板(42)を膜カード(34)から遠ざけた。
【0091】
やはり実施例8の場合と同様に、封じ込まれる領域の形状は改変可能である。熱処理の場合、封じ込まれる領域の形状は、加熱された圧板の飛び出た突起部と接触する膜の部分が疎水的となり、一方、加熱された圧板と接触しない部分は親水性に留まるように、膜の直近にある飛び出た突起部およびエラストマーパッドの形状により制御可能である。
【0092】
実施例8記載するプラズマ処理法または本実施例に記載する熱処理法のいずれかを用いて生み出される疎水性領域が、サンプルの封じ込めに有効であることを確認するために、熱またはプラズマ処理された膜および未処理の膜の両方のサンプル封じ込め特性が、サンプルとして水を用いて調べられた。図13A−13Bは、熱処理またはプラズマ処理の対象とされなかった膜のサンプル封じ込め特性を示し、また図13Cおよび13Dは、熱処理またはプラズマ処理のいずれか一方の対象となった膜のサンプル封じ込め特性を示している。サンプルとして2μlの体積の水(50)が、サンプルホルダーカード(54)の親水性膜(52)上にスポットされた。図13Aは、時刻0の時の水のサンプル(50)を示し、図12Bは時刻30秒の時の水のサンプル(50)を示している。図13Bに示す通り、水のサンプルは、膜領域全体に展開し、その結果濡れた領域の直径はIRビームの直径よりも大きくなる。一方、熱処理された膜またはプラズマ処理された膜の場合、図13Cおよび13Dに示すように、時刻0(図13C)ならびに30秒(図13D)のいずれにおいても、水のサンプル(50)は、疎水性バリア領域(58)でとり囲まれた膜の親水性領域(56)内に封じ込められた。したがって、本明細書に記載するように、熱またはプラズマ処理は、外側の疎水性バリア領域(56)でとり囲まれた内側の親水性領域(56)を作成するのに利用可能である。
【0093】
[実施例10]:化学的または物理的分解によるサンプルの均一な分布
FTIR分析用に水性生体サンプルを乾燥させると、その結果、しばしばサンプル分布パターンが不均一となり、サンプル濃度はサンプル領域の外端部で最高となって、これにより不正確な定量を引き起こし得る、いわゆる「コーヒーリング」または「ドーナッツリング」パターンを形成することが認められている。
【0094】
本明細書に記載する代表的な実験では、図14Aに示すように、界面活性剤または洗剤を使用すると、その結果、サンプル封じ込め領域においてより均一なパターンでサンプルを乾燥せしめ、これによりサンプルはより均一に分布した。また、疎水性バリアパターン(例えば、「X」形の交差パターン)をサンプル領域に付加すると、図14Bに示すように、それはサンプルがサンプル領域の中央部に向かってより多く乾燥するようにせしめることができ、その結果、サンプルは界面活性添加物を用いた効果に類似した分布を示す。サンプルの分布または「コーヒーリング」の破壊は、濃度を高め、変動係数(%CV)の割合(%)を低減した。
【0095】
利用可能な界面活性剤の例は、ツイーン20およびドデシル硫酸ナトリウム(SAS)を含むが、但し、これらに限定されない。1つの実験では、乾燥させたチトクロームCサンプルのリングパターンは、サンプルが溶解される溶液(例えば、PBSとH2O)に応じて変化することが明らかにされた。IRビーム内でサンプル分布が変化すると、それはサンプルを通過するIRビームの透過量に影響を及ぼす可能性がある。リングパターンを破壊し、もってサンプルのより均一な分布を実現するために、洗剤または界面活性剤が、サンプルに添加可能であり、またはサンプルがスポットされ、乾燥される膜に直接添加可能である。
【0096】
下記の表1では、チトクロームCタンパク質のアミド1&2ピーク面積が、SDSが存在しない場合(H2Oのみ)およびSDSが存在する場合(1および5%)において計算された。SDSを添加した場合、その結果、計算により求められるサンプル面積が増加し、ならびに変動係数(%CV)の割合(%)は低下した(例えば、9.1から2.3%)。
【0097】
図15は下記の表1および2に示す作表データを棒グラフにした図を表す。SDSを添加するとサンプルの数値が増加し、また%CVが低下するのは、サンプルがより均一に分布すること(より多くのサンプルが全IRビーム内にある)、およびサンプル間のばらつきがより少ない(リング形成の場合差異が生ずるのに対してサンプルが均一に分布する)ことに起因する。
【0098】
表1および2のカラムBのアミド1および2ピーク面積は、OPUS6.5ソフトウェア(Bruker)を用いて計算された。平均値ならびに%CVが計算された。SDS(1および5%)がサンプルに添加され、ならびにピーク面積および%CVが再分析された。
【0099】
【表1】

【0100】
【表2】

【0101】
本出願全体を通じて引用されたすべての参考資料、特許および公表された特許出願の内容を参照により本明細書に組み込む。
【0102】
本明細書は、参照により本明細書に組み込まれる本明細書内で引用された参考資料の教示を踏まえることで、最も完全に理解される。本明細書内の実施形態は、本発明の実施形態について説明を提供するものであり、その範囲を限定するものとみなしてはならない。当業者は、多くのその他の実施形態が本発明により含まれることを容易に認識する。すべての公表文献および発明は参照によりそのまま組み込まれる。参照により組み込まれる資料が本明細書と矛盾する、または整合しない範囲で、本明細書はあらゆるそのような資料に優先する。本明細書におけるあらゆる参照資料の引用は、そのような参照資料が本発明に対する先行技術であると認めるものではない。
【0103】
別途明記しない限り、特許請求の範囲を含め、本明細書で用いられる成分、細胞培養物、処理条件等の量を表すすべての数値は、すべての事例において用語「約」により修飾されるものと理解される。したがって、別途異なって明記しない限り、数値パラメーターは近似であり、本発明により実現しようとする所望の特性に応じて変化し得る。別途明記しない限り、一連の要素に先行する用語「少なくとも」は、当該一連の要素すべてに係るものと理解される。当業者は、日常的な実験法を超える方法を用いなくても、本明細書に記載する本発明の具体的な実施形態と等価な物を多数認識する、または確認することができる。そのような等価物は、下記の特許請求の範囲に含まれるように意図されている。
【0104】
当業者にとって明白であるように、本発明の精神および範囲から逸脱せずに、多くの本発明の修正形態および変形形態が作成可能である。本明細書に記載する具体的な実施形態は、例としてのみ提供されており、決して限定するように意図するものではない。明細書および実施例は、例示に限定されるものとみなされることが意図されており、本発明の真の範囲および精神は下記の特許請求の範囲に明示されている。
【技術分野】
【0001】
(関連出願の相互参照)
本出願は、2011年4月14日に出願された米国仮特許出願第61/475,434号の優先権の利益を主張し、その全記載内容をそのまま参照により本明細書に組み込む。
【0002】
本発明は、サンプル中の分析物を定量するための赤外線分光光度法および当該方法で用いられるデバイスの分野に関連する。
【背景技術】
【0003】
赤外線(IR)分光法は、サンプルを分析するために研究所で一般的に用いられる解析ツールである。電磁スペクトルのIR領域は、可視領域の下端(約14,300cm−1の波数)からマイクロ波領域(20cm−1近傍)まで延在する。通常、分子がIRを吸収する場合、分子内の振動または回転が分子の双極子モーメントに純変化を引き起こすはずである。照射光の電場を変化させると、分子の双極子モーメントに生じた変動と相互作用し、また照射光の周波数が分子の振動周波数と一致すると、照射光は吸収され、これにより分子振動の振幅に変化を生じせしめる。
【0004】
一般的に、生体分子、例えばタンパク質を定量的に分析する場合、最も一般的に用いられる方法は、比色技術(例えば、クマシーブルー分析法、ローリー法、BCA分析法およびPierce660タンパク質分析法)、およびUV分光技術(例えば、280nmにおける吸収)である。当技術分野において公知のほとんどの定量法の場合、ユーザーが定量を実施する毎に、ユーザーは、定量対象分析物と一般的に同一の分子である検量体を用いて、較正曲線を作成する必要がある。
【発明の概要】
【発明が解決しようとする課題】
【0005】
(発明の要旨)
本発明は、サンプル中の分析物、特に生体分子を定量するための改善した方法を提供し、同方法は、当技術分野において公知のほとんどの方法よりも短い実施時間、ならびに少ないサンプル体積を必要とし、またさらに当技術分野において公知のほとんどの方法が行うように、何らかの特別なサンプル調製ステップを必要としない。さらに、本発明による方法は、分析物が定量される毎に、ユーザーが較正曲線を作成する必要性もなくし、また検量体が、定量される分析物と同一の分子であることを必要としない。本発明は、本請求項に係る方法で用いられるデバイスも提供する。
【0006】
本発明による1つの態様では、サンプル中の1つまたは複数の生体分子を定量するIRに基づく方法が提供される。
【課題を解決するための手段】
【0007】
サンプル中の1つまたは複数の生体分子を定量する、本発明による1つの方法では、当該方法は、(a)サンプルを封じ込めるための、疎水性領域でとり囲まれた親水性領域を含む多孔膜を備えるサンプルホルダーを提供するステップ;(b)膜の親水性領域をサンプル体積と接触させるステップ;(c)膜上の前記サンプル体積を乾燥させるステップ;(d)膜上の前記サンプル体積を4000−400cm−1のスペクトル範囲内の1つの波長または前記スペクトル範囲の任意の部分を含む赤外線ビームに曝露するステップを含み、こうして赤外線吸収スペクトル内の1つまたは複数の吸収ピーク面積が、サンプル中の1つまたは複数の生体分子の量と相関性を有する前記赤外線吸収スペクトルを得る。
【0008】
サンプル中の1つまたは複数の生体分子を定量する、本発明による別の方法では、当該方法は、(a)サンプルを封じ込めるための、疎水性領域でとり囲まれた親水性領域を含む多孔膜を備えるサンプルホルダーを提供するステップ;(b)膜の親水性領域をサンプル体積と接触させるステップ;(c)膜上の前記サンプル体積を乾燥させるステップ;(d)ステップ(c)の後に、赤外線吸収によりサンプル体積中の水の存在を検出し、必要な場合には、水の存在が検出不能になるまでステップ(c)を反復するステップ;ならびに(e)膜上の乾燥されたサンプル体積を、4000−400cm−1のスペクトル範囲内の1つの波長または前記スペクトル範囲の任意の部分を含む赤外線ビームに曝露するステップを含み、こうして赤外線吸収スペクトル内の1つまたは複数の吸収ピーク面積が、サンプル中の1つまたは複数の生体分子の量と相関性を有する前記赤外線吸収スペクトルを得る。
【0009】
本請求項に係る方法によるいくつかの実施形態では、1つまたは複数の生体分子は、核酸、タンパク質、脂質、多糖類およびリポ多糖類からなる群より選択される。代表的なリポ多糖類はエンドトキシンである。
【0010】
様々な実施形態では、スペクトル内の1つまたは複数の吸収面積それぞれは、サンプル中の特定の生体分子の量と相関性を有する。
【0011】
いくつかの実施形態では、本請求項に係る発明による方法は、分析物が定量される毎に較正曲線を作成する必要がない。
【0012】
本発明によるいくつかの実施形態では、1つまたは複数の較正曲線は、用いられる装置に事前にロードされ、こうしてユーザーがサンプル中の分析物を定量したいと欲する毎に較正曲線を作成する必要をなくす。タンパク質およびペプチドを定量する場合には、定量は、ポリペプチド分子内に存在するアミド結合数またはアミド結合濃度に基づき、したがって定量は、分子のアミノ酸配列に依存しない。したがって、分析物(例えば、タンパク質またはペプチド)が定量される毎に較正曲線の作成を必要とし、また検量体が定量される分析物と同一の分子であることをさらに必要とする、当技術分野において公知であり、用いられているほとんどの方法とは異なり、請求項にかかわる発明による方法では、その後、用いられる装置に事前にロードされる較正曲線を作成するための検量体として、任意のタンパク質が利用可能である。
【0013】
同様に、その他の分析物、例えば、核酸、炭水化物等の場合、用いられる装置に事前にロードされる較正曲線を作成するのに任意の適する検量体が利用可能である。本発明による方法は、極少量のサンプル体積中の分析物を定量するのに利用可能である。本請求項に係る方法による様々な実施形態では、サンプル体積は、0.1から20μlの範囲である。特定の実施形態では、サンプル体積は約2から5μl以下または1μl未満である。
【0014】
いくつかの実施形態では、サンプルは、例えば血液、血漿、血清および尿等の生体液を含む。別の実施形態では、サンプルは環境サンプル、医薬品サンプルまたは食品サンプルである。なおも別の実施形態では、サンプルは燃料サンプルである。
【0015】
いくつかの実施形態では、サンプルは、細胞ライセートまたは組織ライセートを含む。
【0016】
様々な実施形態では、サンプルは粗製サンプルである。
【0017】
いくつかの実施形態では、多孔膜は、限外濾過膜である。別の実施形態では、多孔膜は微多孔性膜である。
【0018】
本請求項に係る発明の方法によるいくつかの実施形態では、多孔膜は、ポリフッ化ビニリデン(Polyvinylidene fluoride)、PTFE(ポリテトラフルオロエチレン)、親水性PTFEおよびポリエチレンからなる群より選択されるポリマー材料を含む。特定の実施形態では、多孔膜は親水性PTFEを含む。但し、任意の適するポリマー材料が、本請求項に係る発明による方法で利用可能であると考えられる。ポリマー材料/膜の選択は、主として定量される分析物に依存する。例えば、対象分析物と同一の波長で吸収する、および/または吸収測定を妨害するポリマー材料を使用するのは望ましくない。
【0019】
いくつかの実施形態では、サンプルがスポットされる多孔膜は、便宜上サンプルホルダーと呼ばれるデバイス内に収納される。特定の実施形態では、サンプルホルダーはカードの形態であり、便宜上サンプルホルダーカードと呼ばれる。
【0020】
本請求項に係る方法による様々な実施形態では、サンプルホルダーは、ある1つの領域を含む多孔膜を備え、サンプル体積が前記領域内に前記膜上で封じ込められる。いくつかの実施形態では、サンプルを封じ込めるための領域は、疎水性領域内に親水性領域を含み、ここではサンプル体積が当該親水性領域内に収納される。
【0021】
いくつかの実施形態では、疎水性領域は、親水性多孔膜をプラズマ処理することにより形成される。別の実施形態では、疎水性領域は、親水性多孔膜を熱処理することにより形成される。
【0022】
いくつかの実施形態では、親水性領域は、疎水性領域の1つもしくは複数のスポット、または1つもしくは複数の線を含む。
【0023】
サンプル体積が、親水性領域の直径に封じ込められることが重要である。親水性領域の直径は、用いられるIR測定装置のビーム直径に依存し、当該装置では当該ビームが、親水性領域内に封じ込められたサンプルを通過する。正確な定量を容易にするために、親水性領域の直径は、IRビームの直径以下であるのが望ましい。こうして、全サンプル体積がIRビームに対して可視的であること、および正確な定量が実現されることを保証する。
【0024】
いくつかの実施形態では、サンプルホルダーの親水性領域の直径は、2.0mmから9.2mmの範囲である。いくつかの実施形態では、親水性領域の直径は、3.0mmから6mmである。いくつかの実施形態では、膜上にスポットされるサンプル体積は、界面活性剤を含む。いくつかの実施形態では、界面活性剤は、サンプル体積が膜上にスポットされる前または後に膜上にスポットされる。
【図面の簡単な説明】
【0025】
【図1】将来用いるために作成された代表的な較正曲線を示す図である。BSAがある日の較正曲線を作成するのに用いられた(点線)。4mg/mlのBSAサンプルが後日作成され(例えば、この場合4日後)、そしてあらかじめ作成された較正曲線に対してチェックされた。
【図2】本請求項に係る発明による代表的なサンプルホルダーを示す概略図である。代表的なサンプルホルダーは、4つの異なる膜スポットを含むカードであり、それぞれは、ある体積のサンプル溶液を適用するための疎水性領域でとり囲まれた親水性領域を含む。サンプルスポット1、2および3と呼ぶスポットは、適するバッファー中に対象となる生体分子を含有するサンプル体積をスポットすることが意図されており、一方、スポットBは、ある体積のブランク溶液またはバッファーのみをスポットするのに用いられる。スポット1、2および/または3上にスポットされるサンプル体積は、同一のサンプル溶液を表し得るが、または異なるサンプル溶液を構成し得る。
【図3】赤外線吸収スペクトルを示す図であり、同一サンプル中のタンパク質および核酸を定量する代表的な実験の結果を表している。この実験で用いられたタンパク質はBSAであった。X軸はcm−lによる波数を表し、またY軸は吸収単位を表す。グラフは、本発明によるIRに基づく方法を用いて、DNAおよびタンパク質(すなわち、BSA)の両方が、同一サンプル中で定量可能であることを実証している。
【図4】赤外線吸収スペクトルを示す図であり、サンプル中のペプチドを定量する代表的な実験の結果を表している。この定量実験では、タンパク質の標準物質としてBSAが用いられた。X軸はcm−lによる波数を表し、またY軸は吸収単位を表す。
【図5】赤外線吸収スペクトルを示す図であり、水中のエンドトキシンであるリポ多糖類(LPS)を定量する実験の結果を表している。X軸はcm−lによる波数を表し、またY軸は吸収単位を表す。スペクトルは、水中のLPSの濃度が20μg/μlから0.2μg/μlに低下するに従い、スペクトル強度が低下することを実証している。さらに、LPSを用いた較正曲線は、この実験を用いて作成され、またその後のエンドトキシン定量に用いられる。
【図6】赤外線吸収スペクトルを示す図であり、サンプル中の水の存在をモニター/測定/検出する実験の結果を表している。X軸はcm−lによる波数を表し、またY軸は吸収単位を表す。スペクトルに示されるように、水がサンプル中に存在する場合には、水の−OH結合と関連した振動結合伸縮および屈曲に起因するスペクトル干渉が存在し、これはタンパク質のアミド結合の分解能を妨げる。しかし、サンプルが乾燥され、水が蒸発するにつれ、やはりスペクトルに示されるように、水と関連したスペクトル強度は低下する。
【図7】界面活性剤(例えば、SDS)をサンプルに添加した際の、サンプルのより均一な分布プロファイルおよび吸収プロファイルを示すグラフである。X軸はcm−lによる波数を表し、またY軸は吸収単位を表す。
【図8A】血漿ベースのサンプルを封じ込める際に用いられる固定具およびサンプルホルダーカードアセンブリに関する展開図および閉鎖図それぞれを示す図である。図8Aは、完全に組み立てられたサンプルホルダーカードおよび固定具の2つの側面からなる展開した形態を表す。
【図8B】血漿ベースのサンプルを封じ込める際に用いられる固定具およびサンプルホルダーカードアセンブリに関する展開図および閉鎖図それぞれを示す図である。図8Bは、真空プラズマ環境の内側で、サンプルホルダーカードおよび固定アセンブリを示す閉鎖した状態の断面概略図であり、この場合疎水的であるのが望ましいサンプルホルダーカード上の膜の領域が、プラズマ処理に曝露され、一方、サンプルがスポットされる親水性領域はプラズマ処理から保護されている。
【図9】プラズマ処理後のサンプルホルダーカードを示す概略図である。親水性領域は膜の保護された領域に該当し、この親水性領域はプラズマ処理に曝露された疎水性領域でとり囲まれている。
【図10A】サンプルホルダーカードの膜内にある疎水性領域および親水性領域の代表的な形状/パターンを示す図であり、これはエラストマーシールを好適に配置することにより(プラズマ処理法の場合)、または加熱された圧板の型により(熱処理法の場合)作成可能である。
【図10B】サンプルホルダーカードの膜内にある疎水性領域および親水性領域の代表的な形状/パターンを示す図であり、これはエラストマーシールを好適に配置することにより(プラズマ処理法の場合)、または加熱された圧板の型により(熱処理法の場合)作成可能である。
【図10C】サンプルホルダーカードの膜内にある疎水性領域および親水性領域の代表的な形状/パターンを示す図であり、これはエラストマーシールを好適に配置することにより(プラズマ処理法の場合)、または加熱された圧板の型により(熱処理法の場合)作成可能である。
【図10D】サンプルホルダーカードの膜内にある疎水性領域および親水性領域の代表的な形状/パターンを示す図であり、これはエラストマーシールを好適に配置することにより(プラズマ処理法の場合)、または加熱された圧板の型により(熱処理法の場合)作成可能である。
【図11】膜内に疎水性のサンプル封じ込め領域を形成するためのエンボス型固定具およびサンプルホルダーカードシステムを示す拡大図であり、加熱された圧板およびシリコーン基材を含む。
【図12A】サンプルカードホルダーがシステム内に配置された後の、エンボスヘッド/加熱された圧板システムを示す展開断面の図である。
【図12B】サンプルカードホルダーがシステム内に配置された後の、エンボスヘッド/加熱された圧板システムを示す閉鎖断面の図である。
【図13A】図13A(0秒)および図13B(30秒)に示すように、熱処理を受けなかった膜と比較して、図13C(0秒)および図13D(30秒)に示すように、熱処理後では、膜がサンプル封じ込め領域内にサンプル(例えば、水)を保持することを表す実験結果を示す図である。
【図13B】図13A(0秒)および図13B(30秒)に示すように、熱処理を受けなかった膜と比較して、図13C(0秒)および図13D(30秒)に示すように、熱処理後では、膜がサンプル封じ込め領域内にサンプル(例えば、水)を保持することを表す実験結果を示す図である。
【図13C】図13A(0秒)および図13B(30秒)に示すように、熱処理を受けなかった膜と比較して、図13C(0秒)および図13D(30秒)に示すように、熱処理後では、膜がサンプル封じ込め領域内にサンプル(例えば、水)を保持することを表す実験結果を示す図である。
【図13D】図13A(0秒)および図13B(30秒)に示すように、熱処理を受けなかった膜と比較して、図13C(0秒)および図13D(30秒)に示すように、熱処理後では、膜がサンプル封じ込め領域内にサンプル(例えば、水)を保持することを表す実験結果を示す図である。
【図14A】化学的および物理的分解が、それぞれサンプルの「コーヒーリング」配置パターンに及ぼす影響を表す図である。図14Aは、洗剤(SDS)がサンプルに添加されたときに、化学的分解によりサンプルの均一な分布が向上したことを示す。水およびリン酸緩衝化された生理食塩水(PBS)の両方に溶解されたチトクロームC(l0mg/ml)が親水性PTFE膜上に配置され(2および5μL)、そして乾燥された。SDSをサンプルに添加すると、サンプルはより均一に分布する(PBS+SDSは図示せず)。
【図14B】化学的および物理的分解が、それぞれサンプルの「コーヒーリング」配置パターンに及ぼす影響を表す図である。図14Bは、物理的分解を行ったときのサンプルの分布を示し(疎水性バリアを変化させることにより)、その結果、複数の「コーヒーリング」が形成され、より多くのサンプルがサンプル領域の中央部に集まる。
【図15】SDSをサンプルに添加したときの効果を示す棒グラフである。SDS(1および5%)がチトクロームCサンプルに添加され、そして乾燥された。SDSを添加すると、その結果各ピーク面積が増加した。
【発明を実施するための形態】
【0026】
本発明は、赤外線分光法(IR)、ならびに本請求項に係る発明による方法で使用するデバイスを用いて、サンプル中の1つまたは複数の生体分子を定量するための改善した方法を提供する。
【0027】
本開示がより容易に理解可能となるように、しかるべき用語が最初に定義される。追加の定義は、詳細説明全体を通じて説明される。
【0028】
I.定義
用語「定量する」、「定量」、「定量化する」、「測定する」または「測定」は、本明細書において交換可能に用いられ、本請求項に係る発明による方法を用いて、サンプル中の分析物の量または濃度を測定することを意味する。用語「分析物」は、本明細書で用いる場合、本明細書に記載する方法を用いて定量化するのが望ましい任意の対象分子を意味する。様々な実施形態では、分析物は生体分子である。
【0029】
用語「生体分子」は、本明細書で用いる場合、本請求項に係る発明による方法を用いて定量化するのが望ましい任意の対象生体物質を意味する。代表的な生体分子は、タンパク質、ペプチド、DNAおよびRNAを含む核酸分子、脂質、炭水化物およびエンドトキシン(例えば、リポ多糖類)を含む。生体分子が電磁スペクトルの赤外線範囲内で吸収する能力を有する限り、任意の生体分子が、本請求項に係る発明による方法を用いて定量化可能であると考えられる。
【0030】
用語「サンプル」は、本明細書で用いる場合、本発明による方法を用いて定量化される分析物(例えば、生体分子)を含む任意の媒体を意味する。サンプルは、例えば食物(例えば家禽、新鮮な肉、ミルク、ヨーグルト、乳製品、ベーカリー製品、飲料物、ビール、レモネード、ジュース、チーズ、野菜類、果物、魚等)、水または汚水体(例えば池、湖、河川、海洋、下水路、飲用水道水等)、臨床試料(例えば血液、血漿、血清、喀痰、組織、尿、唾液、気道由来のサンプル/液)、土壌、ならびに化粧品および医薬品(例えばローション、クリーム、軟膏、溶液、薬剤、眼および耳の点滴薬等)を含み得るが、但し、これらに限定されない。特定の実施形態では、サンプルは、細胞ライセートまたは組織ライセートを含む。本請求項に係る発明の様々な実施形態では、サンプルは粗製サンプルを構成し得るが、すなわち、これは本請求項に係る方法で使用する前に何らかの調製または処理を必要としない。
【0031】
いくつかの実施形態では、少量のサンプル(例えば、0.1−20μl)が、サンプルホルダー(例えば、カードの形態)内に収納される膜の親水性領域上にピペット分取されまたはスポットされ、そしてその後乾燥され、IRに基づく分光法へのサンプルの曝露がこれに続く。カード上のサンプル体積は任意の適する方法を用いて乾燥可能である。例えば、サンプル体積は風乾可能、または対流加熱器または従来型のオーブン、または電子レンジであっても、これらを用いて乾燥可能である。いくつかの実施形態では、乾燥機構はIRシステムに組み込まれると考えられる。一般的に、水は正確な定量を行う障害となり得るので、定量前にサンプル体積中に痕跡量の水が存在しないのが望ましい。
【0032】
本請求項に係る方法のいくつかの実施形態では、サンプル体積がスポットされる膜は、乾燥ステップの対象となり、その後に水の存在を検出するために赤外線吸収が利用される。水が検知された場合には、膜は再度乾燥ステップの対象となり、この乾燥ステップは、水の存在が検出不能となるまで反復される。一般的に、乾燥ステップ後に吸収がさらに変化しなければ、それは水の存在が検出不能である、または換言すれば、サンプルはIR分析するのに十分に乾燥されていることを示している。
【0033】
本請求項に係る発明による方法およびデバイスは、極少量のサンプル体積を用いてもサンプル中の分析物を正確に定量することを可能にする。様々な実施形態では、サンプル体積は、約0.05μl、0.1μlまたは0.2μlまたは0.3μlまたは0.4μlまたは0.5μlまたは0.6μlまたは0.7μlまたは0.8μlまたは0.9μlまたは1.0μlまたは1.5μlまたは2μlまたは2.5μlまたは3μlまたは3.5μlまたは4μlまたは4.5μlまたは5μlまたは5.5μlまたは6μlまたは6.5μlまたは7μlまたは7.5μlまたは8μlまたは8.5μlまたは9μlまたは9.5μlまたは10μlまたは10.5μlまたは11μlまたは11.5μlまたは12μlまたは12.5μlまたは13μlまたは13.5μlまたは14μlまたは14.5μlまたは15μlまたは15.5または16μlまたは16.5μlまたは17μlまたは17.5μlまたは18μlまたは18.5μlまたは19μlまたは19.5μlまたは20μlであり、または20μlを上回る。本明細書に記載するデバイスおよび方法は、1つまたは複数の生体分子を定量するのに極少量の体積でも使用できるようにするが、本明細書に記載する方法を用いて検出および定量する際の下限を広げるために、複数のアリコットのサンプル体積がサンプルホルダーカードに、当該サンプル体積を当該アリコット毎に乾燥させながら適用可能である。例えば、非常に低レベルの分析物を含むサンプルの場合、本明細書に記載する方法を用いてこれを検出するのは困難または検出不能である場合があり、そうした場合、複数のアリコットのしかるべきサンプル体積(例えば、10−20μl)が、当該サンプル体積を異なるアリコット毎に乾燥させながらサンプルホルダーカード上にスポット可能である。したがって、10−20μlの極少量が、各適用に際しサンプルホルダーカード上にスポットされるが、50μlから100μlまたはこれより多くの総サンプル体積が、サンプル体積を複数回適用する際に、その適用毎に各サンプル体積を乾燥させながら、合算して適用される。
【0034】
いくつかの実施形態では、サンプル体積を20μlずつカードに適用し、当該カードを乾燥させることにより、100μl以上のサンプル体積がサンプルホルダーカードに適用される。サンプル体積が完全に乾燥したら、追加のサンプル体積20μlがサンプルホルダーカードに適用可能となり、当該カードは再度乾燥可能となる。このプロセスは、カード上に必要とされるサンプル体積をスポットするように、複数回反復可能である。この技術の長所として、同技術が分析物の検出/定量限界を拡張するという点が挙げられる。
【0035】
本明細書で用いる場合、用語「溶解する」、「溶解」または「溶解すること」とは、例えば細胞膜を傷つけることにより、細胞または組織が破壊されて開放され、またおそらくは細胞の内容物の放出を引き起こし得る任意の手段を指す。細胞または組織を溶解するのに利用可能な代表的な方法は、酵素的方法、超音波、機械的作用(例えば、剪断および衝突)および化学的方法を含むが、但し、これらに限定されない。
【0036】
本明細書で用いる場合、用語「核酸」または「核酸分子」は、互いに共有結合した2つ以上のヌクレオチド、ヌクレオシド、または核酸塩基(例えば、デオキシリボヌクレオチドまたはリボヌクレオチド)からなる任意の鎖状物を意味する。いくつかの実施形態では、本請求項に係る発明による方法を用いて定量化される生体分子は、核酸分子である。核酸分子は、ウイルスゲノムまたはそれらの一部分、DNAまたはRNAのいずれか、細菌性ゲノムまたはそれらの一部分、真菌、植物もしくは動物ゲノムまたはそれらの一部分、メッセンジャーRNA(mRNA)、リボソームRNA(rRNA)、転移RNA(tRNA)、プラスミドDNA、ミトコンドリアDNAまたは合成DNAまたはRNAを含むが、但し、これらに限定されない。核酸分子は、線形(例えば、mRNA)、円形(例えば、プラスミド)または分枝した形態、ならびに二本鎖または一本鎖の形態で提供され得る。核酸分子は、例えば追加のヌクレオチドが核酸に付加されるのを阻止するために、3’−末端ジデオキシヌクレオチドを付加したもの等の、核酸の機能または挙動を変更するために修飾された塩基を含み得る。
【0037】
用語「波長」は、波の1つのピークまたは頂上および次のピークまたは頂上の間の距離を一般的に意味する。これは、波のスピードをその周波数で割り算したもの、および波のスピードにその周期を掛け算したものに等しい。波長は、進行波および定常波の両波、ならびにその他の空間波パターンに固有である。波長は、ギリシャ文字ラムダ(λ)で一般的に表される。正弦波が一定の位相速度で移動すると仮定した場合、波長は波の周波数に対して逆比例する。したがって、波の周波数が高くなるほど短い波長を有し、また波の周波数が低くなるほど長い波長を有する。
【0038】
用語「波数」はその波長の逆数に比例する波の特性である。これは、cm−1の単位で一般的に測定され、また単位距離当たりの波長の数、すなわち1/λ(λは波長)として定義される。
【0039】
本明細書で用いる場合、用語「吸収ピーク面積」または「吸収ピーク面積(複数)」とは、本明細書に記載するように、サンプルをIR分光法に曝露した後に認められる赤外線吸収スペクトルの1つまたは複数の部分を意味する。本明細書に記載するIRに基づく方法を用いて赤外線吸収スペクトルが得られたら、ピークを横断するベースラインを描き、当該ピークに囲まれた面積を求めることにより、スペクトル内の1つまたは複数のピーク下面積が計算される。ベースラインは、下記に示されるように、スペクトル上のピークの始めと終わりのポイントを基準に一般的に描かれる。
【0040】
【化1】

【0041】
本請求項に係る方法によるいくつかの実施形態では、ピーク面積はサンプル中の分析物の濃度または量と相関性を有する。
【0042】
いくつかの実施形態では、サンプル中のタンパク質濃度は、下記のように測定される。第1ステップとして、既知濃度のタンパク質標準物質を含む検量体を用いて較正曲線が作成され、そして較正曲線がIR分光装置に事前ロードされる。その後同一の較正曲線が、当該装置がサンプル中のタンパク質を定量するために用いられる毎に、利用可能である。さらに、検量体が分析されるサンプル中に存在することは必要とされない、または換言すれば、サンプル以外の完全に異なる起源に由来し得る。例えば、特定の実施形態では、例えばBSA等のタンパク質標準物質の溶液が、様々な既知濃度でバッファー中に調製される。標準物質溶液は、カード形態のサンプルホルダー内にある膜の親水性領域に適用され、当該膜は乾燥され、そして吸収スペクトルが、IR測定装置、例えばBruker製IR測定装置を用いて測定される。理論に束縛されるものではないが、任意の適するIR測定装置が、本発明による方法で利用可能であると考えられる。
【0043】
最も近代的なIR吸収測定装置は、マイケルソン干渉計と共にフーリエ変換技術を利用する。本請求項に係る方法によるいくつかの実施形態では、IR吸収スペクトルを得るために、干渉計の1つの鏡が検出器に到達する照射光において干渉を生成するように移動する。すべての波長は干渉計を通過するので、インターフェログラムは複合パターンである。波数(cm−1)の関数である吸収スペクトルが、鏡の移動量(cm)の関数であるインターフェログラムのフーリエ変換から得られる。この設計は、分散装置の基準セルを有さないので、基準スペクトルが記録され、そしてサンプルスペクトルから減じるためにメモリー内に保管される。
【0044】
その他の代表的なIR吸収測定装置は、分散型IR吸収測定装置および単一波長IR測定装置を含む。分散型IR分光計は、異なる波長の光を分散するために、モノクロメータ内にある回折格子を使用する。一般的に、分散型IR分光計は、FTIR測定装置に置き換えられてきた。単一波長IR測定装置は、単一のIR波長をモニターして速い反応の反応速度を測定するのに利用可能である。
【0045】
本請求項に係る発明によるいくつかの実施形態では、FTIR測定装置が、1つまたは複数の生体分子の定量に用いられる。アミドIおよびアミドIIピーク(1800−1450cm−1)を含む曲線下面積が、装置内に組み込まれたソフトウェアにより計算される。例えば、Bruker製IR分光計は、Bruker製Opusソフトウェアを含む。次に、較正曲線が作成されるが、その場合、ピーク下面積をタンパク質標準物質の濃度に対してプロットする。既知濃度の標準物質により作成された較正曲線を用いて、サンプル中の分析物の濃度が、その後測定される。
【0046】
一般的に、較正曲線とは、分析物の量または濃度と、観察されたシグナルの期待値との間の関数的な関係を図示したものを意味する。一般的に、検量体の既知濃度をある範囲で含む標準物質が、較正曲線を作成するのに用いられる。サンプルを用いて得られたスペクトルは、次に、所望の分析物の濃度を得るために標準物質と比較される。
【0047】
本明細書に記載する方法によるいくつかの実施形態では、当該方法は、サンプル中の水による吸収をモニター/検出するステップをさらに含む。水は約3400および1600cm−1に吸収を有し、これにより多くの生体分子で得られたスペクトルと重なり合う。本発明によるいくつかの実施形態では、水による吸収に関連したスペクトル強度変化をモニターするための組み込み型ソフトウェアを備えるIR測定装置が用いられるが、当該強度は、サンプル中の水アリコットが低下するに従い低下する。したがって、水と関連したスペクトル強度をモニターすることにより、ユーザーはサンプルをさらに乾燥させる必要があるかどうか判断することができる。一般的に、水による吸収と関連したスペクトル強度は、2つまたは3つ以上連続した結果について同一のスペクトル強度が認められるまで、乾燥プロセス期間中数回測定され、こうして、サンプルが実際の定量用として乾燥していることを確認する。
【0048】
いくつかの実施形態では、界面活性剤が本発明の方法を用いて分析されるサンプル中に含まれる。界面活性剤は、膜上にスポットされるサンプルに含まれてもよく、またサンプルがスポットされる前または後に膜に添加されてもよい。例えばドデシル硫酸ナトリウム(SDS)もしくはツイーン20等の界面活性剤、または化学添加物、例えばグリセロールは、溶液の表面張力を低減し、こうして領域内にサンプルが均一に分布するのを可能にする。
【0049】
親水性PTFE基材上で、1つまたは複数の生体分子を含有する水性サンプルが乾燥される際には、サンプルが乾燥するにつれて濃度勾配が形成される。この配置パターンでは、最外周部において最高量の、またサンプル領域の中央部において最低量のサンプルが配置することとなる。このパターンは、多くの場合「コーヒーリング」または「ドーナッツ」パターンと呼ばれる。例えば界面活性剤を添加するなどして水性サンプルの表面張力が低下すると、サンプルの配置は、全サンプル領域にわたりより均一となる。サンプルがエネルギー源を用いて調査されるような場合には、界面活性剤を含めることで、エネルギー源に曝露される領域内のサンプルはより均一に分布する。
【0050】
代表的な界面活性剤は、ポリオキシエチレンベースの非イオン性界面活性剤(ツイーン20、ツイーン40、ツイーン60およびツイーン80)等を含むが、但し、これらに限定されない。陰イオン性界面活性剤として、例えばドデシル硫酸ナトリウム(SDS)、ラウリル硫酸アンモニウム、ラウリルエーテル硫酸ナトリウム(SLES)、ステアリン酸ナトリウム等が挙げられる。いくつかの実施形態では、界面活性剤の濃度は、約1%または約2%または約3%または約4%または約5%または約6%または約7%または約8%または約9%または約10%である。特定の実施形態では、界面活性剤の濃度は約5%である。
【0051】
代表的な化学添加物は、ポリオール、例えばグリセロール、エチレングリコール、プロピレングリコール、ジプロピレングリコール等を含むが、但し、これらに限定されない。いくつかの実施形態では、化学添加物の濃度は、約1%または約2%または約3%または約4%または約5%または約6%または約7%または約8%または約9%または約10%である。特定の実施形態では、化学添加物の濃度は約5%である。
【0052】
やはり本発明に含まれるものとして、IRに基づく方法を用いてサンプル中の1つまたは複数の生体分子を定量するのに用いられるデバイス、ならびにそのようなデバイスの作製方法が挙げられる。本発明によるいくつかの実施形態では、生体分子の定量に用いられるデバイスは、多孔膜(例えば、限外濾過膜または微多孔性膜)を含むカード形態のサンプルホルダーである。一般的に、限外濾過膜は、0.1μm未満のポアサイズを有するものと理解されている。
【0053】
いくつかの実施形態では、サンプルホルダーに収納された多孔膜は、疎水性領域でとり囲まれた親水性領域を含む。親水性領域は、水によって速やかに湿潤可能な膜の領域であり、またサンプルが、膜上に通常スポットされまたはピペット分取される領域である。また、IRビームに一般的に曝露される領域でもある。
【0054】
いくつかの実施形態では、膜の親水性領域は、水に濡れない疎水性領域でとり囲まれている。
【0055】
いくつかの実施形態では、サンプルを封じ込めるための領域は、親水性領域および疎水性領域からなる形状/パターン、例えば親水性領域内に形成された直線形状またはスポット形状の疎水性領域を含む。代表的な形状およびパターンを図8A−8Dに示す。そのような形状およびパターンも、界面活性剤または化学添加物を添加する場合とまったく同様に、IRビームに曝露される領域内でサンプルがより均一に分布するのを可能にする。
【0056】
赤外線分光分析で使用するサンプルホルダーカードは、当技術分野においてこれまで記載されてきたが、そのようなカードは、微多孔性膜、例えば参照により本明細書にそのまま組み込む米国特許第5,470,757号および同第5,764,355号で議論されている膜等を含む。しかし、本発明の場合のように、サンプルを封じ込めるために、疎水性領域でとり囲まれた親水性領域を含むサンプルホルダーカードの教示は存在しない。さらに、上記特許は、本明細書に記載する改善、例えばサンプル中の2つ以上の生体分子の定量、極少量のサンプル体積の使用および測定毎の較正曲線作成が不要等を実証するサンプルホルダーカードおよび方法について記載していない。
【0057】
カード形態のサンプルホルダーは、接着剤で膜基材にラミネートされた2層のペーパーカードストックから一般的に製造される。サンプルホルダーは、任意のその他の物質、例えば接着剤で接着可能なプラスチックからも作製され得る。さらに、サンプルホルダーは接着剤をまったく使用せずに形成され得るが、また熱に曝露されたときに、カードストックと接着する、カードストック上のコーティング物を介してラミネートされ得る。いくつかの実施形態では、サンプルホルダーは、およそ幅1.4インチ、長さ2.5インチのカードの形態であり、また少なくとも4つのサンプルを保持することができる。しかし、サンプルホルダーは、これが1個のサンプルから最大96個またはこれよりも多くのサンプルを収納可能なように設計可能である(例えば、96ウェルのプレートフォーマット)。特にサンプルホルダーがカード形態のとき、サンプルホルダーがIRビームに曝露されるIRシステムの担体に正しく挿入されることを検証するために、サンプルホルダーの方向をIRシステムの方向と一致させる、ノッチがサンプルホルダーの設計に盛り込み可能である。また、IRビームがサンプルを含有する親水性領域を通過するように、サンプルホルダーが正しい方向を向いていることも重要である。
【0058】
本明細書に記載するサンプルホルダーカードは、製造するのに容易であり、対費用効果が高く、また使い捨てである。
【0059】
本発明は、限定とみなされるべきでない下記の実施例によりさらに説明される。本出願全体を通じて引用されるすべての参考資料、特許および公表された特許出願の内容ならびに図は、参照により本明細書に組み込まれる。
【実施例】
【0060】
[実施例1]:将来のサンプル定量で用いる較正曲線の作成
本明細書に記載するサンプル中の1つまたは複数の生体分子を定量する方法は、定量実験が装置上で実施される毎に、較正曲線を作成する必要性をなくす。これは、定量分析が実施される毎に、ユーザーが新しい較正曲線または標準曲線を作成するように一般的に求められる当技術分野における現行分析法に比べて改善されている。
【0061】
本明細書に記載する方法では、ユーザーは、較正曲線または標準曲線を一度作成し、そして将来の分析のために使用することができる。1つの実験では、較正曲線が下記のように作成された。様々な濃度の分析物(BSA)の溶液がバッファー中に調製され、本明細書に記載するFTIRに基づく検出法を用いて分析された。図1のグラフは、分析物の濃度または量(X軸)に対するピーク面積またはピーク高さ(Y軸)を示している。ピーク面積が既知のとき、この較正の直線範囲が、未知のサンプルの濃度計算で用いられる。
【0062】
代表的な式はy=mx+c、式中c=Y軸の切片、m=直線の傾き;y=ピーク面積または高さ、およびx=分析物の濃度または量である。さらにユーザーは、定量の統計的妥当性を高めるために、当初の較正曲線にデータを付加することができる。
【0063】
図1は、ある日に、バッファー中の様々な既知濃度のBSAを用いて生成された較正曲線の例、および同一曲線と比較した数日後に定量された濃度が未知であるタンパク質の関連するサンプルである。
【0064】
[実施例2]:サンプル中の生体分子を定量するための一般プロトコール
代表的な実験では、1つまたは複数の生体分子(例えば、タンパク質、核酸、炭水化物、脂質等)を含有するサンプルが、脱イオン水または適するバッファー中で調製される。約0.2−10μlのブランク溶液(例えば、脱イオン水またはバッファー単独)が、例えばカードの形態のサンプルホルダー(本明細書ではサンプルホルダーカードと呼ぶ)内に収納された膜の親水性領域に適用される。同一体積の調製済みのサンプル溶液が、1つまたは複数のスポットに適用されるが、同スポットは、同一サンプルホルダーカード上に存在しても、また異なるが同形のサンプルホルダーカード上に存在してもよい。サンプルホルダーカードは、下記の方法のうち1つを用いてその後乾燥される:熱(40−60℃、0.5−2分);圧縮空気/窒素もしくは任意のその他の不活性気体(0.5−2分)、または電子レンジ。乾燥したサンプルホルダーカードは、IR測定装置のサンプルコンパートメント内にその後挿入される。ブランク溶液の透過/吸収スペクトルが、バックグランドに対応するスペクトルを得るために4000および400cm−1の間で測定され、これに同一波長範囲でのサンプル測定が続く。様々な濃度の標準物質を用いて作成され、システムに組み込まれた較正曲線を用いて、濃度未知のサンプルがその後測定される。
【0065】
図2は、ブランクを適用するための1つのスポット(Bと呼ぶ)および3サンプル用のスポット(1、2および3と呼ぶ)を示す、代表的なサンプルホルダーカードの画像を表している。しかし、上記で議論したように、サンプルホルダーカードは、サンプルを適用するための任意の数のスポットを有するように設計可能である。
【0066】
[実施例3]:IR分光法を用いたサンプル中のタンパク質および核酸の定量
代表的な実験では、サンプル中のタンパク質および核酸の両方が、本発明による方法を用いて、下記のように定量された。
【0067】
1つの実験では、ウシ血清アルブミン(BSA;SIGMA Cat#A−7030)およびデオキシリボ核酸(DNA;Ambion Cat#AM9680剪断されたサケ精子DNA)が、様々な割合(等比および逆比で10から1μg)で一緒に混合され、1×PBSバッファー内に溶解された。1μlのサンプルが、親水性PTFE膜サンプルホルダーカード上に、P10型Raininピペットを用いてピペット分取されたが、その場所は図2に示すサンプルホルダーカードの1、2および3の位置であった。上記サンプルが調製されたバッファーの同一の体積が、図2に示すように、サンプルホルダーカード上の位置Bにピペット分取された。
【0068】
バッファースポットおよびサンプルスポットの両方を備えるサンプルホルダーカードが、高圧空気を用いて乾燥された。サンプルホルダーカードがIR測定装置内に挿入され、バッファーの吸収/透過スペクトルが4000および400cm−1の間で最初に測定された。その後、サンプルのスペクトルが、バックグランドスペクトルとしてバッファースペクトルを用いて測定された。タンパク質および核酸の量は、タンパク質の場合、1700−1400cm−1、また核酸の場合、1740−1400および1120−940cm−1のスペクトル範囲を用いて測定される。1700−1400cm−1の波長範囲では、タンパク質および核酸の両方が吸収を有する点に留意する。したがって、核酸の濃度が求められたら、この濃度は、1700−1400cm−1の間のピーク面積を用いて得られるタンパク質+核酸の濃度から減じることができ、こうしてタンパク質単独の濃度が得られる。したがって、タンパク質および核酸の濃度が、一回の実験で測定可能である。この実験では、較正曲線は、バッファーまたは脱イオン水中に溶解したタンパク質およびDNAの純粋なサンプルを用いて、タンパク質およびDNAについて独立に作成された。1つのそのような実験の結果を図3に示す。
【0069】
[実施例4]:IRを用いたサンプル中のペプチドの定量
別の代表的な実験では、本発明による方法は、ペプチドを定量するのに利用され得ることが実証されている。1つの実験では、ペプチドサンプルが1mg/mlの濃度まで水に溶解された。2μlの体積のサンプルが、P2型Raininピペットを用いて、図2に示すように親水性PTFE膜を収納するサンプルホルダーカード上にピペット分取され、そして40℃のヒーター内で乾燥された。同一のサンプルホルダーカードは、ブランク(B)と呼ばれる位置も備え、ここには2μlの体積のサンプル溶解水がピペット分取された。カードはIR測定装置内に挿入され、水/バッファーブランクの吸収/透過スペクトルが測定され、これにバックグランドとして水/バッファースペクトルを用いたサンプル測定が続いた。ペプチドの量は、1700−1400cm−1のスペクトル範囲を用いて測定された。較正曲線は、検量体としてBSAの純粋サンプルを用いて、バッファー/水中で作成された。1つのそのような実験の結果を図4に示す。
【0070】
[実施例5]:IRを用いたサンプル中のリポ多糖類の定量
代表的な実験では、本発明による方法が、サンプル中のリポ多糖類を定量するのに用いられた。具体的には、エンドトキシン等のリポ多糖類(リポ多糖類(LPS);SIGMA製L2630)が、20mg/mlのストック溶液を得るために1×PBSバッファー中に溶解された。2μlの体積のサンプルが、P2型Raininピペットを用いて、図2の画像に示すように、親水性PTFE膜を収納するサンプルホルダーカード上にピペット分取され、そして40℃のヒーターを用いて乾燥された。同一のサンプルホルダーカードは、ブランク(B)と呼ばれる位置も備え、ここには2μ1の体積のサンプル溶解バッファーが適用される。サンプルホルダーカードはIR測定装置内に挿入され、サンプルのスペクトル測定を行う前にバッファーのスペクトルが最初に測定されたが、この場合ブランクバッファースペクトルをバックグランドスペクトルとみなす。LPS希釈物の滴定結果が、較正曲線を得るためにストック溶液の計算に基づき記録された。1つのそのような実験の結果を図5に示す。
【0071】
[実施例6]:IRを用いたサンプル中の水の存在のモニタリング
本明細書に記載する方法は、サンプル中の水の存在を検出するためにも利用可能である。水は、例えば特にタンパク質/ペプチドを定量する際には、生体分子の定量の正確性に影響を及ぼす可能性があるので、IRに基づく方法を用いて分析されるサンプル中に水を含むのは大部分は望ましくない。
【0072】
代表的な実験では、Milli Q水中に溶解された10mg/mlのBSA(Sigma Cat#A−7030)溶液、2μlが、例えばカードの形態のサンプルホルダー(本明細書ではサンプルホルダーカードと呼ばれる)に収納されている膜の親水性領域に適用された。
【0073】
濡れたサンプルが、次にIR分光計のIRビーム内に配置され、IR吸収スペクトルが測定された。吸収スペクトルは、シグナル強度、例えば水の蒸発に起因したシグナルプロファイル変化として記録される。
【0074】
吸収スペクトルに関するシグナル強度が、3回の連続した測定において一定に留まるとき、サンプルは乾燥しているとみなされ、ソフトウェア(例えば、Bruker製測定装置の場合Opusソフトウェア)は、4000−400cm−1の間でBSAの吸収スペクトルを収集し、そして組み込み済みの較正曲線を用いて、当該溶液中のBSA濃度を決定する。1つのそのような実験の結果を図6に示すが、この図は、サンプルが乾燥すると共に水と関連するシグナル強度が低下することを表している。
【0075】
[実施例7]:界面活性剤がサンプルの分布に与える影響
水溶液は、IRビームに曝露される膜の領域上で均一に乾燥させ、また均一な分布を得る際に、問題を有する可能性がある。
【0076】
この実験は、界面活性剤をサンプル溶液に添加すると、サンプルは、IRビームに曝露される領域上で均一に分布し、その結果より正確な定量を実現することを実証する。代表的な実験では、10mg/mlのチトクロームCタンパク質サンプル溶液、5μlが用いられ、これはPBSに溶解され、そして5%SDSを含む、また含まないで乾燥された。サンプルはサンプルホルダーカード上にスポットされ、そして全直径が4.5mmのIRビーム内に配置された。
【0077】
SDSを含まない場合、ほとんどのサンプルは、サンプル領域の外側1mm内に含まれたので、サンプルの約10%しかIRビームを吸収しないことが観察された。しかし、SDSが存在するサンプルでは、サンプルはより均一に分布し、その結果、サンプルはビームの最大照度(1/e2)内にあるので、より多くのIRを吸収した。積分して得られたアミド1および2のピーク面積(1725から1479cm−1)は、SDSを含まないサンプルの場合よりも約3倍大きかった。1つのそのような実験の結果を図7に示す。このIR吸収スペクトルでは、X軸は波数(cm−1)を表し、一方、Y軸は吸収単位を表している。
【0078】
[実施例8]:プラズマ処理を用いたサンプルを封じ込めるためのサンプルホルダーカードの製造
やはり本発明に含まれるものとして、本明細書に記載するように、サンプル中の1つまたは複数の生体分子を定量する方法で利用可能なサンプルホルダーが挙げられる。いくつかの実施形態では、サンプルホルダーはカードの形態であり、便宜上サンプルホルダーカードと呼ばれる。サンプルホルダーカードは、正確な吸収スペクトルを取得し、その結果、対象とする生体分子の1つまたは複数の定量を実現するために、IRビーム内にサンプルを収納可能であることが必須である。
【0079】
本発明による方法で使用されるサンプルホルダーカードを製造する1つの方法では、サンプルを封じ込める領域を作成するために真空プラズマ環境が用いられた。サンプルホルダーカードで用いられる出発膜は、親水性PTFE膜であったが、これはブランド名PoreflonでSumitomoから販売されている。この膜は、平均すると0.03μmのサイズの孔(HHPSW−005−30)を備え、水濡れ可能な表面を付与するように親水化処理剤でコーティングされている。Poreflon親水性膜を真空プラズマ環境に曝露すると、表面から処理剤が除去されて本来疎水性のPTFEが露出する。
【0080】
図8Aおよび8Bは、マスキング固定具の実験的に展開および閉鎖した図をそれぞれ表し、同固定具内には、プラズマに曝露させるように組み立て済みのサンプルホルダーカードが配置されている。膜は、各中央部に12.5mmの貫通孔を有する硬質接着剤がコーティングされた2枚のペーパーシートから構成されるカード内に組み込まれた。2枚のペーパーシートは、これらの間にサンドイッチされる住友の親水性膜と共に組み立てられ、こうすることで組み立て済みのペーパーカード内で貫通孔を覆う。組み立て済みカード(10)を、展開した構成の固定具(12)と共に図8Aに示す。図8Aおよび8Bに示すように、親水性膜(14)を収納する組み立て済みのカード(10)は、カードを中央部に配置するためのフレーム(16)を備えるマスキング固定具(12)内に配置された。エラストマーシール(18)が、中央部に配置され位置決定された膜カード(10)の反対側に存在した。エラストマーシール(18)を4つのホール(19)が取り巻き、同ホールは処理の対象とされる膜(14)にプラズマガスが接触するように流通を確保する。マスキング固定具(12)は、図8Bの断面図に示すようにエラストマーシール(18)がカード(10)内の膜(14)の反対側に対して押し付けられて気密となるようにその後閉鎖された。親水性膜(14)を収納するサンプルホルダーカード(10)上に固定具(12)を密着させるのに、例えばクランプによる力が用いられた。
【0081】
固定具(12)内に位置するカード(10)は、その後真空プラズマ環境内に配置され、その閉鎖した断面図を図8Bに示す。利用可能である代表的な真空プラズマシステムはHarrick真空プラズマシステムモデルPDC−001である。システム内部のチャンバー(20)は真空ポンプ(図示せず)を用いて脱気された。大気ガスがチャンバー(20)内に導入され、流速は約2−5cc/分に維持された。高周波発振器(図示せず)に電力が加えられ、10秒から7分の時間維持された。エラストマーシール(18)間にあるサンプルホルダーカード(10)の膜(15)の領域は、プラズマから保護されており、一方残りの外側はドットで示しているプラズマに曝露された。
【0082】
図8Aおよび8Bに記載する固定具を用いたプラズマ曝露実験は、処理時間が1分を超えれば、いずれの場合も親水性領域および疎水性領域が明確に規定され、エラストマーシール(18)の位置で鮮明な遷移端が生ずることを明らかにした。プラズマ処理時間が1分よりも短いと、移行端部が不鮮明となるか移行端部がまったく生ぜず、その結果、膜は親水性に留まり、サンプルは封じ込められなかった。
【0083】
図9は、この実施例に記載する方法を用いて作成された、疎水性領域(26)でとり囲まれた親水性領域(24)を有する膜を収納する代表的なサンプルホルダーカード(22)を示す。2つの領域の間の境界は遷移端または線(28)である。
【0084】
上記で議論したように、IRビーム内においてできる限り均一に分布したサンプルを有するのがさらに望ましい。均一な分布を実現する1つの方法は、上記で議論したように、界面活性剤をサンプルに添加することである。均一な分布を実現する別の方法は、本明細書で議論するように、膜上で親水性領域に散在する疎水性領域のパターン/形状を形成することである。
【0085】
乾燥する液滴は、コーヒーリング現象において一般的に認められるように、サンプルを乾燥する液滴の外端部に沿って優先的に配置するものと理解される。この乾燥パターンを最低限に抑えるために、親水性領域をとり囲む疎水性領域は、さらに改変され得る。これは、例えば、親水性領域内に疎水性のスポットまたは線からなる膜上のパターンが形成されるように、膜上にエラストマーシールを好適に配置することにより実現可能である。そのようなパターンは複数のより小さな液滴をもたらし、こうしてより小さな、またさらに小さな乾燥パターンを形成するものと期待される。これらのより小さな乾燥パターンは、サンプルをIRビーム内により均一な構成で配置する。膜上に構成することができる可能な形状/パターンは、線、ドット、星型の形態およびその他の一般的な形状であり得ると理解される。さらに、外側の疎水性領域も、例えば星型、四角形等の形状であり得る。固定具上にエラストマーシールを好適に配置することにより形成され得る代表的な疎水性/親水性パターンは、図10A−10Dに示されている。親水性領域は数字参照30で示され、また疎水性領域は数字参照32で示されている。
【0086】
[実施例9]:サンプルを封じ込めるための熱処理を用いたサンプルホルダーカードの製造
別の実験では、本発明によるIR法で用いられるサンプルホルダーカードは、カード内の膜上でサンプルの封じ込めを実現するための別の代替手段として熱処理を用いて下記のように製造された。
【0087】
代表的な実験では、親水性PTFE膜の表面の濡れ性は、サンプルを封じ込めるための領域を形成するために、加熱された圧板に曝露することにより変更される。用いられた親水性PTFE膜は、住友よりブランド名Poreflonで販売されており、平均すると0.05μm孔のポアサイズを有し(HHPSW−005−30)、また水濡れ可能な表面を付与するように親水化処理剤でコーティングされている。一般的に、この実施例に記載する方法を用いて、0.05μm−0.45μmの範囲のポアサイズ、および30μmから80μmの範囲の厚さを有する任意のPoreflon膜が、加熱された圧板を用いて改変可能である。
【0088】
実施例8の場合と同様に、親水性PTFE膜は、4つの10mm貫通孔を有する接着剤がコーティングされたペーパーシートから構成されるカード内に組み込まれる。2つのペーパーシートは、当該シート間にサンドイッチされる住友の親水性膜と共に組み立てられ、こうして、組み立てられたペーパーカード内で孔を覆う。親水性膜(36)を収納するこの組み立て済みのカード(34)は、図11に表すようにcal−rods(図示せず)および加熱された圧板(42)に取り付けられた空気圧シリンダー(図示せず)を備えたエンボス型固定具(38)内に配置された。シリンダーは、加熱された圧板(42)をサンプルホルダーカード(34)内の膜(36)の直上または上方に配置し、またネスト(40)上のエラストマーパッド(44)は、膜(36)の下面を支持する。加熱された圧板(42)は、飛び出した突起部(46)を備え、またネスト(40)は、飛び出した突起部(46)と整合するエラストマーパッド(44)を備え、サンプルホルダーカード(34)がこれらの間に配置されると、加熱された圧板(42)と直接接触した領域は疎水性となる。
【0089】
エンボス型固定具/カード/加熱された圧板アセンブリの展開断面図および閉鎖断面図を図12Aおよび12Bにそれぞれ示す。
【0090】
加熱された圧板(42)が、一定時間(例えば、5秒から5分)、膜(36)に曝露された後、シリンダー(図示せず)は、加熱された圧板(42)を膜カード(34)から遠ざけた。
【0091】
やはり実施例8の場合と同様に、封じ込まれる領域の形状は改変可能である。熱処理の場合、封じ込まれる領域の形状は、加熱された圧板の飛び出た突起部と接触する膜の部分が疎水的となり、一方、加熱された圧板と接触しない部分は親水性に留まるように、膜の直近にある飛び出た突起部およびエラストマーパッドの形状により制御可能である。
【0092】
実施例8記載するプラズマ処理法または本実施例に記載する熱処理法のいずれかを用いて生み出される疎水性領域が、サンプルの封じ込めに有効であることを確認するために、熱またはプラズマ処理された膜および未処理の膜の両方のサンプル封じ込め特性が、サンプルとして水を用いて調べられた。図13A−13Bは、熱処理またはプラズマ処理の対象とされなかった膜のサンプル封じ込め特性を示し、また図13Cおよび13Dは、熱処理またはプラズマ処理のいずれか一方の対象となった膜のサンプル封じ込め特性を示している。サンプルとして2μlの体積の水(50)が、サンプルホルダーカード(54)の親水性膜(52)上にスポットされた。図13Aは、時刻0の時の水のサンプル(50)を示し、図12Bは時刻30秒の時の水のサンプル(50)を示している。図13Bに示す通り、水のサンプルは、膜領域全体に展開し、その結果濡れた領域の直径はIRビームの直径よりも大きくなる。一方、熱処理された膜またはプラズマ処理された膜の場合、図13Cおよび13Dに示すように、時刻0(図13C)ならびに30秒(図13D)のいずれにおいても、水のサンプル(50)は、疎水性バリア領域(58)でとり囲まれた膜の親水性領域(56)内に封じ込められた。したがって、本明細書に記載するように、熱またはプラズマ処理は、外側の疎水性バリア領域(56)でとり囲まれた内側の親水性領域(56)を作成するのに利用可能である。
【0093】
[実施例10]:化学的または物理的分解によるサンプルの均一な分布
FTIR分析用に水性生体サンプルを乾燥させると、その結果、しばしばサンプル分布パターンが不均一となり、サンプル濃度はサンプル領域の外端部で最高となって、これにより不正確な定量を引き起こし得る、いわゆる「コーヒーリング」または「ドーナッツリング」パターンを形成することが認められている。
【0094】
本明細書に記載する代表的な実験では、図14Aに示すように、界面活性剤または洗剤を使用すると、その結果、サンプル封じ込め領域においてより均一なパターンでサンプルを乾燥せしめ、これによりサンプルはより均一に分布した。また、疎水性バリアパターン(例えば、「X」形の交差パターン)をサンプル領域に付加すると、図14Bに示すように、それはサンプルがサンプル領域の中央部に向かってより多く乾燥するようにせしめることができ、その結果、サンプルは界面活性添加物を用いた効果に類似した分布を示す。サンプルの分布または「コーヒーリング」の破壊は、濃度を高め、変動係数(%CV)の割合(%)を低減した。
【0095】
利用可能な界面活性剤の例は、ツイーン20およびドデシル硫酸ナトリウム(SAS)を含むが、但し、これらに限定されない。1つの実験では、乾燥させたチトクロームCサンプルのリングパターンは、サンプルが溶解される溶液(例えば、PBSとH2O)に応じて変化することが明らかにされた。IRビーム内でサンプル分布が変化すると、それはサンプルを通過するIRビームの透過量に影響を及ぼす可能性がある。リングパターンを破壊し、もってサンプルのより均一な分布を実現するために、洗剤または界面活性剤が、サンプルに添加可能であり、またはサンプルがスポットされ、乾燥される膜に直接添加可能である。
【0096】
下記の表1では、チトクロームCタンパク質のアミド1&2ピーク面積が、SDSが存在しない場合(H2Oのみ)およびSDSが存在する場合(1および5%)において計算された。SDSを添加した場合、その結果、計算により求められるサンプル面積が増加し、ならびに変動係数(%CV)の割合(%)は低下した(例えば、9.1から2.3%)。
【0097】
図15は下記の表1および2に示す作表データを棒グラフにした図を表す。SDSを添加するとサンプルの数値が増加し、また%CVが低下するのは、サンプルがより均一に分布すること(より多くのサンプルが全IRビーム内にある)、およびサンプル間のばらつきがより少ない(リング形成の場合差異が生ずるのに対してサンプルが均一に分布する)ことに起因する。
【0098】
表1および2のカラムBのアミド1および2ピーク面積は、OPUS6.5ソフトウェア(Bruker)を用いて計算された。平均値ならびに%CVが計算された。SDS(1および5%)がサンプルに添加され、ならびにピーク面積および%CVが再分析された。
【0099】
【表1】

【0100】
【表2】

【0101】
本出願全体を通じて引用されたすべての参考資料、特許および公表された特許出願の内容を参照により本明細書に組み込む。
【0102】
本明細書は、参照により本明細書に組み込まれる本明細書内で引用された参考資料の教示を踏まえることで、最も完全に理解される。本明細書内の実施形態は、本発明の実施形態について説明を提供するものであり、その範囲を限定するものとみなしてはならない。当業者は、多くのその他の実施形態が本発明により含まれることを容易に認識する。すべての公表文献および発明は参照によりそのまま組み込まれる。参照により組み込まれる資料が本明細書と矛盾する、または整合しない範囲で、本明細書はあらゆるそのような資料に優先する。本明細書におけるあらゆる参照資料の引用は、そのような参照資料が本発明に対する先行技術であると認めるものではない。
【0103】
別途明記しない限り、特許請求の範囲を含め、本明細書で用いられる成分、細胞培養物、処理条件等の量を表すすべての数値は、すべての事例において用語「約」により修飾されるものと理解される。したがって、別途異なって明記しない限り、数値パラメーターは近似であり、本発明により実現しようとする所望の特性に応じて変化し得る。別途明記しない限り、一連の要素に先行する用語「少なくとも」は、当該一連の要素すべてに係るものと理解される。当業者は、日常的な実験法を超える方法を用いなくても、本明細書に記載する本発明の具体的な実施形態と等価な物を多数認識する、または確認することができる。そのような等価物は、下記の特許請求の範囲に含まれるように意図されている。
【0104】
当業者にとって明白であるように、本発明の精神および範囲から逸脱せずに、多くの本発明の修正形態および変形形態が作成可能である。本明細書に記載する具体的な実施形態は、例としてのみ提供されており、決して限定するように意図するものではない。明細書および実施例は、例示に限定されるものとみなされることが意図されており、本発明の真の範囲および精神は下記の特許請求の範囲に明示されている。
【特許請求の範囲】
【請求項1】
サンプル中の1つまたは複数の生体分子を定量する方法であって、
(a)サンプルを封じ込めるための、疎水性領域でとり囲まれた親水性領域を含む多孔膜を備えるサンプルホルダーを提供するステップ;
(b)膜の親水性領域をサンプル体積と接触させるステップ;
(c)膜上のサンプル体積を乾燥させるステップ;
(d)膜上のサンプル体積を、4000−400cm−lのスペクトル範囲内または4000−400cm−lのスペクトル範囲の任意の部分内の波長を含む赤外線ビームに曝露させ、これにより赤外線吸収スペクトルを取得するステップを含み、
i)赤外線吸収スペクトル内の1つまたは複数の吸収ピーク面積が、サンプル中の1つまたは複数の生体分子の量と相関性を有する、
方法。
【請求項2】
1つまたは複数の生体分子が、核酸、タンパク質、脂質、多糖類およびリポ多糖類からなる群より選択される、請求項1に記載の方法。
【請求項3】
リポ多糖類が、エンドトキシンである、請求項2に記載の方法。
【請求項4】
1つまたは複数の生体分子を定量するためにサンプルが分析される毎に、ユーザーが較正曲線を作成する必要のない方法である、請求項1に記載の方法。
【請求項5】
サンプル体積が、0.1から20μlの範囲である、請求項1に記載の方法。
【請求項6】
サンプル体積が、1μl以下である、請求項5に記載の方法。
【請求項7】
多孔膜が、デバイス内に収納される、請求項1に記載の方法。
【請求項8】
デバイスが、サンプルホルダーカードである、請求項7に記載の方法。
【請求項9】
サンプルが、生体液を含む、請求項1に記載の方法。
【請求項10】
生体液が、血液、血漿、血清および尿からなる群より選択される、請求項9に記載の方法。
【請求項11】
サンプルが、細胞ライセートまたは組織ライセートを含む、請求項1に記載の方法。
【請求項12】
サンプルが、粗製サンプルである、請求項1に記載の方法。
【請求項13】
サンプルホルダーカードが、サンプルが膜上で封じ込められる領域を備える多孔膜を備える、請求項8に記載の方法。
【請求項14】
多孔膜が、限外濾過膜である、請求項1に記載の方法。
【請求項15】
多孔膜が、微多孔性膜である、請求項1に記載の方法。
【請求項16】
多孔膜が、ポリフッ化ビニリデン、ポリテトラフルオロエチレン、親水性ポリテトラフルオロエチレン、ポリエチレンおよびポリプロピレンからなる群より選択されるポリマー材料を含む、請求項1に記載の方法。
【請求項17】
膜上でサンプルを封じ込めるための領域が、疎水性領域でとり囲まれた親水性領域を含む、請求項13に記載の方法。
【請求項18】
疎水性領域が、親水性多孔膜のプラズマ処理により形成される、請求項17に記載の方法。
【請求項19】
サンプルが、親水性領域内に封じ込められる、請求項17に記載の方法。
【請求項20】
疎水性領域が、親水性多孔膜の熱処理により形成される、請求項17に記載の方法。
【請求項21】
サンプルホルダーカードは、疎水性領域でとり囲まれた親水性領域を備える多孔膜を備え、サンプルは、親水性領域の境界内に封じ込まれる、請求項1に記載の方法で用いられるサンプルホルダーカード。
【請求項22】
親水性領域の直径が、2.0mmから10mmの範囲である、請求項21に記載のサンプルホルダーカード。
【請求項23】
親水性領域の直径が、3.0mmから6mmの範囲である、請求項21に記載のサンプルホルダーカード。
【請求項24】
サンプル中の1つまたは複数の生体分子を定量する方法であって、
(a)サンプルを封じ込めるための、疎水性領域でとり囲まれた親水性領域を含む多孔膜を備えるサンプルホルダーカードを提供するステップ;
(b)膜の親水性領域をサンプル体積と接触させるステップ;
(c)膜上のサンプル体積を乾燥させるステップ;
(d)赤外線吸収を用いて膜上の水の存在を検出し、必要な場合には、水が検出されなくなるまでステップ(c)を反復するステップ;ならびに
(e)膜上のサンプル体積を、4000−400cm−lのスペクトル範囲内または前記スペクトル範囲の任意の部分内の波長を含む赤外線ビームに曝露させ、これにより赤外線吸収スペクトルを取得するステップを含み、
i)赤外線吸収スペクトル内の1つまたは複数の吸収ピーク面積が、サンプル中の1つまたは複数の生体分子の量と相関性を有する、
方法。
【請求項1】
サンプル中の1つまたは複数の生体分子を定量する方法であって、
(a)サンプルを封じ込めるための、疎水性領域でとり囲まれた親水性領域を含む多孔膜を備えるサンプルホルダーを提供するステップ;
(b)膜の親水性領域をサンプル体積と接触させるステップ;
(c)膜上のサンプル体積を乾燥させるステップ;
(d)膜上のサンプル体積を、4000−400cm−lのスペクトル範囲内または4000−400cm−lのスペクトル範囲の任意の部分内の波長を含む赤外線ビームに曝露させ、これにより赤外線吸収スペクトルを取得するステップを含み、
i)赤外線吸収スペクトル内の1つまたは複数の吸収ピーク面積が、サンプル中の1つまたは複数の生体分子の量と相関性を有する、
方法。
【請求項2】
1つまたは複数の生体分子が、核酸、タンパク質、脂質、多糖類およびリポ多糖類からなる群より選択される、請求項1に記載の方法。
【請求項3】
リポ多糖類が、エンドトキシンである、請求項2に記載の方法。
【請求項4】
1つまたは複数の生体分子を定量するためにサンプルが分析される毎に、ユーザーが較正曲線を作成する必要のない方法である、請求項1に記載の方法。
【請求項5】
サンプル体積が、0.1から20μlの範囲である、請求項1に記載の方法。
【請求項6】
サンプル体積が、1μl以下である、請求項5に記載の方法。
【請求項7】
多孔膜が、デバイス内に収納される、請求項1に記載の方法。
【請求項8】
デバイスが、サンプルホルダーカードである、請求項7に記載の方法。
【請求項9】
サンプルが、生体液を含む、請求項1に記載の方法。
【請求項10】
生体液が、血液、血漿、血清および尿からなる群より選択される、請求項9に記載の方法。
【請求項11】
サンプルが、細胞ライセートまたは組織ライセートを含む、請求項1に記載の方法。
【請求項12】
サンプルが、粗製サンプルである、請求項1に記載の方法。
【請求項13】
サンプルホルダーカードが、サンプルが膜上で封じ込められる領域を備える多孔膜を備える、請求項8に記載の方法。
【請求項14】
多孔膜が、限外濾過膜である、請求項1に記載の方法。
【請求項15】
多孔膜が、微多孔性膜である、請求項1に記載の方法。
【請求項16】
多孔膜が、ポリフッ化ビニリデン、ポリテトラフルオロエチレン、親水性ポリテトラフルオロエチレン、ポリエチレンおよびポリプロピレンからなる群より選択されるポリマー材料を含む、請求項1に記載の方法。
【請求項17】
膜上でサンプルを封じ込めるための領域が、疎水性領域でとり囲まれた親水性領域を含む、請求項13に記載の方法。
【請求項18】
疎水性領域が、親水性多孔膜のプラズマ処理により形成される、請求項17に記載の方法。
【請求項19】
サンプルが、親水性領域内に封じ込められる、請求項17に記載の方法。
【請求項20】
疎水性領域が、親水性多孔膜の熱処理により形成される、請求項17に記載の方法。
【請求項21】
サンプルホルダーカードは、疎水性領域でとり囲まれた親水性領域を備える多孔膜を備え、サンプルは、親水性領域の境界内に封じ込まれる、請求項1に記載の方法で用いられるサンプルホルダーカード。
【請求項22】
親水性領域の直径が、2.0mmから10mmの範囲である、請求項21に記載のサンプルホルダーカード。
【請求項23】
親水性領域の直径が、3.0mmから6mmの範囲である、請求項21に記載のサンプルホルダーカード。
【請求項24】
サンプル中の1つまたは複数の生体分子を定量する方法であって、
(a)サンプルを封じ込めるための、疎水性領域でとり囲まれた親水性領域を含む多孔膜を備えるサンプルホルダーカードを提供するステップ;
(b)膜の親水性領域をサンプル体積と接触させるステップ;
(c)膜上のサンプル体積を乾燥させるステップ;
(d)赤外線吸収を用いて膜上の水の存在を検出し、必要な場合には、水が検出されなくなるまでステップ(c)を反復するステップ;ならびに
(e)膜上のサンプル体積を、4000−400cm−lのスペクトル範囲内または前記スペクトル範囲の任意の部分内の波長を含む赤外線ビームに曝露させ、これにより赤外線吸収スペクトルを取得するステップを含み、
i)赤外線吸収スペクトル内の1つまたは複数の吸収ピーク面積が、サンプル中の1つまたは複数の生体分子の量と相関性を有する、
方法。
【図1】


【図2】


【図3】


【図4】


【図5】


【図6】


【図7】


【図8A】


【図8B】


【図9】


【図10A】


【図10B】


【図10C】


【図10D】


【図11】


【図12A】


【図12B】


【図13A】


【図13B】


【図13C】


【図13D】


【図14A】


【図14B】


【図15】




【図2】


【図3】


【図4】


【図5】


【図6】


【図7】


【図8A】


【図8B】


【図9】


【図10A】


【図10B】


【図10C】


【図10D】


【図11】


【図12A】


【図12B】


【図13A】


【図13B】


【図13C】


【図13D】


【図14A】


【図14B】


【図15】


【公開番号】特開2012−225910(P2012−225910A)
【公開日】平成24年11月15日(2012.11.15)
【国際特許分類】
【外国語出願】
【出願番号】特願2012−88118(P2012−88118)
【出願日】平成24年4月9日(2012.4.9)
【出願人】(504115013)イー・エム・デイー・ミリポア・コーポレイシヨン (33)
【Fターム(参考)】
【公開日】平成24年11月15日(2012.11.15)
【国際特許分類】
【出願番号】特願2012−88118(P2012−88118)
【出願日】平成24年4月9日(2012.4.9)
【出願人】(504115013)イー・エム・デイー・ミリポア・コーポレイシヨン (33)
【Fターム(参考)】
[ Back to top ]

