赤血球生成の強化に係わる化合物とその方法
本発明は、赤血球生成を強化する化合物と、その方法とに関する。化合物は、下記式(I)で表される化学構造を有し、式中、Rは、グリコシル基を示す。
【化1】

又、式(I)で表される化合物は、赤血球生成を強化する効果を有することに加え、エリトロポイエチン生成を強化し、腎機能と肝細胞増殖因子の発現を増強する。更に、本発明は、有効量の式(I)で表される化合物を、それを必要とする対象に投与することで、赤血球生成を強化する方法に関する。
【化1】

又、式(I)で表される化合物は、赤血球生成を強化する効果を有することに加え、エリトロポイエチン生成を強化し、腎機能と肝細胞増殖因子の発現を増強する。更に、本発明は、有効量の式(I)で表される化合物を、それを必要とする対象に投与することで、赤血球生成を強化する方法に関する。
【発明の詳細な説明】
【技術分野】
【0001】
本発明は、赤血球生成に係わるものであり、特に、赤血球生成の強化に関する。
【背景技術】
【0002】
近年、慢性進行性腎障害(Chronic Kidney Disease、以下CKDと略称する)は、世界規模の公衆衛生問題の一つであり、腎不全、心血管疾患及び早期死亡などの不利益を結果的にもたらすことが知られている(Levey、2005年)。CKD患者は、腎臓病の末期に進行する非常に高いリスクを抱え、生命を長く維持するためには、腎臓透析や腎臓移植などを行う必要がある。CKDの初期症状の一つとして貧血(Anemia)が挙げられるが、それは腎臓の内因性エリトロポイエチン(erythropoietin、以下Epoと略称する)の生産不足によることが報告されている(Zarzeckiら、2004年)。更に、CKDに加え、貧血は、例えば、ガン、急性及び慢性感染症、自己免疫症、炎症、そして臓器移植後の慢性拒絶反応などのその他の疾患をも伴うことが知られている(Weiss及びGoodnough、2005年)。
【0003】
Epoは、主として成人の腎臓と胎児の肝臓において生成される糖たんぱくホルモンであり、細胞表面のエリトロポイエチンレセプタ(以下Epoレセプタと略称する)と結合することによって、その効果を発揮するものである。細胞が相対的に低い酸素レベルを感じた場合(例えば、低酸素症)、Epoが生産・放出され、赤血球系細胞の増殖、分化、成熟、生存などを調整する(Moritzら、1997年。Fisher、2003年)。血流中におけるEpoレベルの異常は、恐らくは骨髄症及び腎臓病の指標であると言われている。相対的に低いEpoレベルを示すことが、CKD、原発性真性赤血球増加症及び化学療法誘発性貧血症の患者に見られ、又、相対的に高いEpoレベルを示すことが、続発性赤血球増加症及び腎臓ガンの患者に見られることが報告されている(EckardtとKurtz、2005年。Hodgesら、2007年)。
【0004】
腎臓と肝臓組織において生産される以外に、Epoとそのレセプタは、脳、目、心臓、肺臓、腸、膵臓、筋肉、子宮及び生殖腺を含む非赤血球系の組織及び器官中において発見されている(Eckardt及びKurtz、1992年)。Epo−Epoレセプタシグナル伝達は、創傷癒合反応、脈管形成、そして例えば神経保護、心臓血管保護、並びに組織虚血及び虚血/再潅流傷害などに係わる局所性組織保護機能に貢献することが知られている(Paschosら、2008年。Arcasoy、2008年)。又、Epoは、腎機能障害の程度を軽減し、シスプラチン誘発性急性腎不全からの回復を促進するという腎臓保護効果を有することが報告されている(Sepodesら、2006年。Arcasoy、2008年)。
【0005】
赤血球生成促進剤(Erythropoiesis-stimulating agents、以下ESAsと略称する)は、治療反応性の貧血を抱える患者におけるCKDの貧血に対する治療薬として、米国国立腎臓財団のガイドライン「Kidney Disease Outcomes Quality Initiative」により推奨されている。遺伝子組換えヒトEpo(Recombinant human Epo(rHuEpo))は、CKDの貧血症、化学療法を受けたガン患者の貧血症の治療、手術中の輸液需要の低減、及びヒト免疫不全ウイルスに感染したジドブジン治療患者の貧血症の治療のために使用されることが認められている。新規な赤血球生成刺激タンパク質(novel erythropoiesis-stimulating protein(NESP))は、比較的長いプラズマ半減期を有するEpoによりデザインされ、慢性腎不全の貧血症の治療のために使用されることが認められている(Fisher、2003年)。これらのESAsは、維持療法のために、週に1回以上静脈内(i.v.)又は皮下(s.c.)投薬することが推奨されているが、痛み、頻回注射の不便性、rHuEpoを伴う固有の抗原性による抗Epo抗体の発生などが大きな関心を呼んでいる(Bunn、2007年)。それのみならず、ESAsは、比較的高いヘモグロビンレベルの患者に安全上のリスクをもたらし、例えば、高血圧症、血栓塞栓症、鉄缺乏症、重度の赤芽球癆などの合併症の誘因となる可能性がある(Wish及びCoyne、2007年)。
【発明の概要】
【発明が解決しようとする課題】
【0006】
そこで、上述した欠陥や不備に対処するというこれまで対処されてこなかった必要性が、当技術分野に、特に赤血球生成と腎機能に関する技術分野において存在する。
【課題を解決するための手段】
【0007】
一つの態様において、本発明は、下記式(I)で表される化合物を用いて、エリトロポイエチンの生成を強化する薬剤の製造に使用することに関し、
【化1】

【0008】
[式中、Rは、グリコシル基を示す。]その使用法として、治療上有効な量の当該薬剤を投与することが含まれる。
【0009】
前記グリコシル基は、ジヒドロキシアセトン、グルコース、ガラクトース、グリセリンアルデヒド、トレオース、キシロース、マンノース、リボース、リブロース、キシルロース、タガトース、プシコース(アルロース)、フラクトース、ソルボース、ラムノース、エリトロース、エリトルロース、アラビノース、リキソース、アロース、アルトロース、グロース、イドース及びタロースからなる群より選ばれる一つのモノサッカリド(単糖)である。
【0010】
上記式(I)で表される化合物は、骨髄、肝臓、腎臓及びその任意の組合せからなる群より選ばれる組織及び/又は器官に、エリトロポイエチン生成を強化するために投与される。
【0011】
他の態様において、本発明は、上記式(I)で表される化合物を、エリトロポイエチン治療が有効な疾患及び/又は障害の治療に用いる薬剤の製造に使用することに関する。その使用法として、治療上有効な量の当該薬剤を、それを必要とする対象に投与することが含まれる。
【0012】
前記疾患及び/又は障害として、貧血症、腎不全及び赤血球生成欠損関連疾患からなる群より選ばれる少なくとも一つである。
【0013】
前記疾患及び/又は障害は、エリトロポイエチン関連保護効果が有効なものである。
【0014】
前記エリトロポイエチン関連保護効果としては、神経保護、心血管保護及び腎臓保護効果、並びに組織虚血及び虚血/再潅流障害からの保護からなる群より選ばれる少なくとも一つである。
【0015】
さらに他の態様において、本発明は、上記式(I)で表される化合物を、赤血球生成を強化する薬剤の製造に使用することに関する。その使用法として、治療上有効な量の当該薬剤を、それを必要とする対象に投与することが含まれる。
【0016】
さらに態様において、本発明は、上記式(I)で表される化合物を、腎機能を強化する薬剤の製造に使用することに関する。その使用法として、治療上有効な量の当該薬剤を、それを必要とする対象に投与することが含まれる。
【0017】
さらに他の態様において、本発明は、上記式(I)で表される化合物を、肝細胞増殖因子の発現を増強する薬剤の製造に使用することに関する。その使用法として、治療上有効な量の当該薬剤を、それを必要とする対象に投与することが含まれる。
【0018】
さらに他の態様において、本発明は、上記式(I)で表される化合物を、肝細胞増殖因子治療が有効な対象における疾患及び/又は障害を治療する薬剤の製造に使用することに関する。その使用法として、治療上有効な量の当該薬剤を、それを必要とする対象に投与することが含まれる。
【0019】
態様において、本発明は、上記式(I)で表される化合物を、肝細胞増殖因子の発現を調整することにより疾患及び/又は障害を治療する薬剤の製造に使用することに関する。その使用法として、治療上有効な量の当該薬剤を、それを必要とする対象に投与することが含まれる。
【0020】
前記疾患及び/又は障害としては、肝疾患、腎疾患、肺疾患、心血管疾患、消化器疾患、神経疾患、骨疾患、関節疾患、筋疾患、皮膚疾患、圧挫症候群、アレルギー性炎症及びこれらの任意の組合せからなる群より選ばれる少なくとも一つである。
【0021】
前記肝疾患としては、急性肝炎、肝硬変、劇症肝炎及び脂肪肝、並びに肝臓移植、局部切除及び虚血のための外科処置からなる群より選ばれる少なくとも一つである。
【0022】
前記腎疾患としては、腎線維症、急性腎不全、慢性腎不全及び糖尿病性ネフロパシー、並びに腎臓移植及び虚血のための外科処置からなる群より選ばれる少なくとも一つである。
【0023】
前記慢性腎不全としては、腎炎症候群及び閉塞性ネフロパシーより選ばれる少なくとも一つである。
【0024】
前記肺疾患としては、急性肺炎及び肺線維症、並びに肺臓移植、局所切除及び虚血のための外科処置からなる群より選ばれる少なくとも一つである。
【0025】
前記心血管疾患としては、炎症媒介性心臓疾患、狹心症、心筋梗塞症、心筋症及び閉塞性動脈硬化症からなる群より選ばれる少なくとも一つである。
【0026】
前記炎症媒介性心臓疾患としては、心臓同種移植片拒絶反応及び心筋炎が含まれる。
【0027】
前記消化器疾患としては、腸粘膜障害、炎症性腸疾患、胃潰瘍及び真性糖尿病からなる群より選ばれる少なくとも一つである。
【0028】
前記神経疾患としては、脳血管性疾患、神経変性疾患、脊髄障害、糖尿病性網膜障害、末梢神経障害、脊柱管挟窄症及び聴覚消失症(難聴)からなる群より選ばれる少なくとも一つである。
【0029】
前記脳血管性疾患としては、一過性脳虚血発作及び脳卒中の少なくとも一つである。
【0030】
前記神経変性疾患としては、筋萎縮性側索硬化症、アルツハイマー症及びパーキンソン症からなる群より選ばれる少なくとも一つである。
【0031】
前記骨疾患及び関節疾患としては、変形性関節症及び/又はリウマチ性関節炎が含まれる。
【0032】
前記筋疾患としては、筋ジストロフィー及び/又は筋萎縮症が挙げられる。
【0033】
前記皮膚疾患としては、皮膚潰瘍、熱傷及び強皮症からなる群より選ばれる少なくとも一つである。
【0034】
本発明の上記及びその他の態様は、添付図面を含む下記の好ましい実施形態の説明から更に明瞭となる。本発明の新規な概念の主旨と範囲から逸脱しないかぎり、更に種々の変更や修正を行うことができる。
【0035】
添付図面は、本発明の一つ又は一つ以上の実施形態を説明するものであり、そこに書かれた説明と共に本発明の原理を説明する。又、ある実施形態の同一または同様の構成要素を示すために、できる限り同じ参照番号を図面を通して使用する。
【図面の簡単な説明】
【0036】
【図1】図1は、化合物Aによる骨髄細胞中のヘモグロビンレベルの強化を示す。
【図2】図2は、骨髄細胞のバースト形成ユニット−赤血球(BFU−Eと略称する)分析を用いた、化合物Aによる赤血球前駆細胞増殖の活性化を示す。
【図3】図3は、腎臓組織内における化合物Aによるエリトロポイエチン(Epo)発現の増大を示す。
【図4】図4は、肝細胞内における化合物Aによるエリトロポイエチン(Epo)の発現の増大を示す。
【図5】図5は、シスプラチン誘発急性腎不全動物モデルにおける化合物Aによる赤血球数の増大を示す。
【図6】図6は、シスプラチン誘発急性腎不全動物モデルにおける化合物Aによる血液の尿素態窒素レベルの減少を示す。
【図7】図7は、シスプラチン誘発急性腎不全動物モデルの第23日目における化合物Aによる赤血球数の増大を示す。図面中、水平方向の矢印は、化合物A治療(mg/Kg/day)を示す。
【図8】図8は、シスプラチン誘発急性腎不全動物モデルの第23日目における化合物Aによる血液の尿素態窒素レベルの減少を示す。図面中、水平方向の矢印は、化合物A治療(mg/Kg/day)を示す。
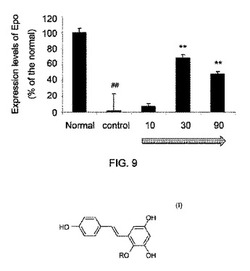
【図9】図9は、シスプラチン誘発急性腎不全動物モデルにおける化合物Aによるエリトロポイエチン(Epo)の発現の増大を示す。図面中、水平方向の矢印は、化合物A治療(mg/Kg/day)を示す。
【図10】図10は、シスプラチン誘発急性腎不全動物モデルにおける化合物Aによる肝組織内の肝細胞増殖因子(hepatocyte growth factor、以下、HGFと略称する)の発現の増大を示す。図面中、水平方向の矢印は、化合物A治療(mg/Kg/day)を示す。
【図11】図11は、シスプラチン誘発急性腎不全動物モデルにおける、骨髄細胞のバースト形成ユニット−赤血球(BFU−E)分析により測定した、化合物Aによる赤血球前駆細胞増殖の活性化を示す。図面中、水平方向の矢印は、化合物A治療(mg/Kg/day)を示す。
【発明を実施するための形態】
【0037】
[定義]
本明細書に使用された術語は、通常、本発明の明細書の文脈と、それぞれの術語が用いられた特殊な文脈とにおいて、本発明の技芸における一般的な語義を有する。本発明の説明に使用された若干の術語について、以下又は本明細書中の他の箇所において、当業者のために本発明の記述に係わる追加的な説明が行われる。便宜上、若干の術語は、例えばイタリック体及び/又は括弧を使用して強調することも有り得る。しかし、そのことはその術語の範囲や語義に何ら影響を与えるものではない、即ち、同様の文脈においては、強調の有無に関わらず、同様の範囲や語義を示すものである。同様のことが一つ以上の方法により表現され得ることが理解できるであろう。その結果、代替言語と同義語が、本発明において論述される任意の一つ又は多くの術語として使用され、そしてまた、ある術語が本明細書において詳述または論述されたかどうかに応じて特別な意味を付与されることもない。若干の術語について同義語が用意される。一つ又は一つ以上の同義語が多用されることは、他の同義語を用いることを排除することを意味しない。本明細書において論述される任意の術語の実例を含む本明細書の全ての実例は、例示的に用いられるものに過ぎず、本発明または任意の実例による術語の意義と範囲を限定するものではない。同様に、本発明は本明細書中に示された様々な実施形態に限定されない。
【0038】
特に定義されない限り、本明細書中に使用されるすべての科学的、技術的用語は、本発明が属する技術分野において、通常の知識を有する者によって一般的に理解されているものと同様の語義を示すものである。もし競合がある場合、与えられる語義については本明細書において統制される。
【0039】
本明細書において使用される「ぐらい」、「ほぼ」又は「おおよそ」の語義は、通常、示された値の20%範囲内、好ましくは10%範囲内、更に好ましくは、5%範囲内を表わすものである。本明細書中、特に説明のない限り、示される数値はおおよその値であり、その語義は上記の「ぐらい」、「ほぼ」又は「おおよそ」の値として推定すべき値を示す。
【実施例】
【0040】
以下、本発明の実施形態により模範的な器具、装置、方法及びそれに関連する結果を示すが、本発明はそれらに限定されるものではない。又、実施例において、読者のために便宜上、表題又は副題を記載しているが、これも本発明を制約するものではない。さらに、本発明においていくらかの理論を提議且つ開示しているが、それらが正しいか否かを問わず、本発明が特定の理論あるいは処置の仕組みを考慮せずに本発明の開示内容に従って実施されるかぎり、そうした理論は本発明の範囲を限定するものではない。
【0041】
実施例1
化合物Aの精製
乾燥したPolygonum multiflorumを2Kg用い、粉砕機で粉砕し、その粉砕物を2Lの85%(v/v)エタノールに一夜浸漬し、反応液を調製する。反応液を収集し、残渣に上記の操作に従って、更に別の2Lの85%(v/v)エタノールを加えて抽出を3回くり返す。これら反応液を収集し、ガス抽出器(ワットマン#1濾紙を使用)により、収集された溶液を濾過し、次に、ロータリーエバポレーター(Buchi社)を用い、40℃下、容積計6分之1迄濃縮する。濃縮した濾液を集め、n−ヘキサン/水=1:1を用いて5回分液する(総量5L)。水相を集め、酢酸エチル溶液(EtOAC/水=1.1)を用いて、更に6回分液して(総量6.5L)、酢酸エチル溶液層を得る。これら6回分の酢酸エチル層を合併し濃縮する。これにより得た濃縮物を凍結乾燥機(台湾Kingmech社)により乾燥して酢酸エチル抽出物を得る(以下、PoMuEPeと称する)。このPoMuEPeを、ダイヤイオンHP−200のカラム(4.8×60cm、日本三菱化学社)を用い、メタノール/水=50:50の溶媒系により、流速2ml/min下で、クロマトグラフィを行う。この分画液を集め、濃縮、乾燥、分析することにより、そのヘモグロビン生成強化能力を調べる。その活性を有する分画を集め、PoMuEPeD9と命名する。更に、PoMuEPeD9を、セファデクスTMLH20のカラム(2.6×100cm、GE Healthcare Life Science社)を用い、メタノール/水=100:0溶媒系により、1ml/minの流速下で、クロマトグラフィを行う。これらの分画を集め、濃縮、乾燥、分析し、ヘモグロビン生成強化能力を調べ、生物活性を示す分画を集め、PoMuEPeD9L11と命名した。
【0042】
上記PoMuEPeD9L11の主要成分について、核磁気共鳴(NMR)分光法(Bruker社)と液体クロマトグラフィ/質量分析法(LC/MS、Bruker社)によりその化学構造を決定した。上記主成分は、2,3,5,4'−テトラヒドロキシスチルベン2−O−β−D−グルコピラノシドであることが確認され、化合物Aと命名され、下記一般式(I)により表される。
【化2】

[式中、Rは、グルコシル基を示す。]
【0043】
実施例2
化合物Aはヘモグロビン生成を強化する
先ず、国立実験動物センター(NLAC、台湾)より試験用動物のC57BL/6JNarlマウス(8〜10週齢)を購入し、投与量100mg/kgで、フェニルヒドラジン塩酸塩(シグマアルドリッチ社)を含むリン酸緩衝生理食塩水(PBSと略称する)を単回の腹腔内(i.p.)注射で投与することにより急性溶血性の貧血症を誘発する。注射後6日目に、骨髄細胞をマウスより分離し、Worthingtonら(1987年)とRosenthalら(1987年)記載の方法を若干修正した方法により培養した。細胞懸濁液は、1%(v/v)ボビン血清アルブミン(BSA、シグマアルドリッチ社)、7.5μmの2−メルカプトエタノール(シグマアルドリッチ社)、1.4mMのL−グルタミン(シグマアルドリッチ社)、10μmの塩化鉄(FeCl3、シグマアルドリッチ社)及び50mU/mlのEPO(レコーモンエポエチン、ロシュ社)を含むMEMアルファ培地(α−MEM、ギブコ社)中、ほぼ6×105細胞/mlの濃度に調整される。この細胞を96穴プレート(コスター社)におおよそ1.5×105細胞/wellで播種し、5%炭酸ガスと95%空気を含む加湿した培養器中、37℃下で培養する。
【0044】
次の日に、異なる濃度の化合物A(0、0.1、0.5、2.5、12.5及び20μg/ml)を、前記細胞にそれぞれ添加し、更に4日間培養を続ける。次に、Kaiho及びMizuno(1985年)並びにWorthington(1987年)らの方法に若干の修正を加えた方法により、DAFベースヘモグロビン比色法を用いて、相対的なヘモグロビンレベルを測定した。簡潔に説明すると、細胞をPBSで洗淨し、ノニデットTMP40(NP−40、シグマアルドリッチ社)(0.01%(v/v)、50μl/well)で、溶解させる。その後、細胞を4,5−ジアミノフルオレスセイン(DAF、シグマアルドリッチ社)(100μg/ml、100μl/well)と、30%の過酸化水素(シグマアルドリッチ社)(6μl/well)と共に5〜10分間培養する。次に、ビクター2 1420マルチラベルカンター(ワラック、パーキンエルマー社)を用いて波長610nmの吸光度を測定した。その結果を相対指数±標準誤差(n=6)で表示した。統計学的有意性は、スチューデントテスト(**P<0.01vs対照群(0μg/ml))により評価した。この結果、化合物Aは、ほぼ0.1〜20μg/mlの濃度でヘモグロビン生成を著しく強化することが明らかに示された(図1を参照)。
【0045】
実施例3
化合物Aは細胞培養中の赤血球前駆細胞を活性化する
赤血球前駆細胞における化合物Aの効果を調べるために、Corazzaら(2004年)とJinら(2003年)の文献に記載の方法を若干修正して、バースト形成ユニット−赤血球(BFU−E)分析を行った。簡潔に説明すると、国立実験動物センター(NLAC、台湾)より試験用動物のC57BL/6JNarlマウス(6週齢)を購入し、このマウスより骨髄細胞を分離し、15%(v/v)FBS(牛胎児血清、ギブコ社)、1%(v/v)BSA(シグマアルドリッチ社)、0.8%(w/v)メチルセルロース(シグマアルドリッチ社)、10μMの2−メルカプトエタノール(シグマアルドリッチ社)、2U/mlEpo(レコーモンエポエチン、ロシュ社)及び10ng/mlIL−3(シグマアルドリッチ社)を含有するα−MEM中に、上記細胞を懸濁し、ほぼ8.3×104細胞/ml濃度の細胞懸濁液を調製する。この細胞を24穴プレート(Falcon社)におおよそ7.5×104細胞/wellで播種し、異なる濃度の化合物A(0、0.1、0.5、2.5、12.5μg/ml)をそれぞれ添加した後、5%炭酸ガス−95%空気中、加湿した培養器において、37℃下で9日間培養を続けた。コロニーは、3−(4,5−ジメチルチアゾル−2−イル)−2,5−ジフェニル−テトラゾリウムブロミド(50μg/50μl/well)(MTT;シグマアルドリッチ社)を用いて染色し、50個以上の細胞群のコロニーが計上された際に、プレートの写真をとり、その結果を平均値±標準誤差(n=3)で表示した。統計学的有意性は、スチューデントテスト(*P<0.05と**P<0.01vs対照群(即ち、濃度:0))により評価した。化合物Aは、0.5〜12.5μg/mlの濃度範囲内において著しく骨髄細胞のBFU−Eコロニー数を増加させることが明らかになった(図2を参照)。この結果は、化合物Aがヘモグロビン生成と赤血球前駆細胞を活性化することにより赤血球生成を強化することを示している。
【0046】
実施例4
化合物Aは腎臓のEpo発現を強化する
先ず、国立実験動物センター(NLAC、台湾)より試験用動物のC57BL/6JNarlマウス(8〜10週齢)を購入し、上記の方法を若干修正した方法(Parrishら、1995年。Obatomiら、1998年。De Kanterら、1999年)に基づき、マウスの腎スライスを準備する。簡潔に説明すると、マウスを頸椎脱臼により死亡させ、腎臓を摘出し、直ちに、20mM HEPES(USB社)、128mM塩化ナトリウム(シグマアルドリッチ社)、2.5mM塩化ポタシウム(シグマアルドリッチ社)、2.7mM塩化カルシウム(シグマアルドリッチ社)、1mM塩化マグネシウム(シグマアルドリッチ社)及び16mM D-グルコース(シグマアルドリッチ社)を含み且つ95%の酸素と5%の炭酸ガスを充気した氷冷の無菌のKrebs-HEPES緩衝液(pH7.4)中に保存する。この腎臓はその被膜を皮質乳頭軸に対して垂直に剥離し、芯を抜く。次に、95%の酸素と5%の炭酸ガスを充填した氷冷の無菌のKrebs−HEPES緩衝液で満たしたミクロスライサー(D.S.K、microslicer、DRK1000、Dosaka EM社)において、腎スライス(250μm)を調製する。この腎スライスを集め、ガス(95%の酸素と5%の炭酸ガス)を充填した氷冷の無菌のKrebs−HEPES緩衝液中に氷上で保存する。この腎スライスは、調製後10分間以内で実験に使用される。
【0047】
腎スライスは、15mM HEPES(USB社)、20mM炭酸水素ナトリウム(シグマアルドリッチ社)と5%(v/v)FBS(ギブコ社)を含むガス(95%の酸素と5%の炭酸ガス)を充填した新鮮な培地(DMEM/F12(ギブコ社/インビトロゲン社)を、1.0ml/well当り、24穴プレート(Falcon社)用いて、37℃下、95%の酸素と5%の炭酸ガスの雰囲気下の培養器中、90〜120分間前培養を行った。その後、腎スライスを、異なる濃度の化合物A(0、0.6、2.5、10、40及び100μg/ml)と共にそれぞれ37℃下、50%の酸素、5%の炭酸ガス及び45%の窒素ガス雰囲気下の培養器中で培養した。RNA−BeeTMRNA分離溶媒(テルテスト社)を用いて腎スライスのリボ核酸(RNA)を抽出し、総RNA(5μg)を、MMLV逆転写酵素(プロメガ社)を用いた相補的デオキシリボ核酸(cDNA)の調製に供した。上記の逆転写したcDNA試料を、ABI−プリズム7700の塩基配列検出システム(アプライドバイオシステム社)とSYBRグリーンマスターミックスキット(アプライドバイオシステム社)を用いて、リアルタイムPCRにより分析した。リアルタイムPCRのプライマーは、マウスβ−アクチン(SEQ ID NOs:1と2)とエリトロポイエチン(Epo)(SEQ ID NOs:3と4)を標的とするものを使用した(表1を参照)。リアルタイムPCRの条件は、95℃で10分間変性させ、次に、95℃で30秒間、58℃で35秒間、72℃で40秒間のサイクルを40回くり返すこと、とした。内部標準としてβ−アクチンの発現レベルを使用した。相対的な遺伝子発現レベルは、2−△△CTにより算出する。この結果を、対照群(即ち、0μg/ml)と比較し、相対指数で表示した。その結果、化合物Aは腎臓組織中のEpoの発現を増強することが明らかとなった(図3を参照)。
【表1】

【0048】
実施例5
化合物Aは肝細胞のEpo発現を強化する
先ず、国立実験動物センター(NLAC、台湾)よりC57BL/6JNarlマウス(8〜10週齢)を購入する。次に、先に説明した方法(Kreamerら、1986年)に修正を加え、これに基づいて肝細胞を分離した。簡潔に説明すると、マウスをアバチン(2%(w/v)2,2,2−トリブロモエタノール、i.p.、400mg/Kg体重)により麻酔し、0.5mMエチレングリコール−ビス(2−アミノエチルエーテル)−N,N,N',N'−テトラ酢酸(EGTA;シグマアルドリッチ社)を含むカルシウムフリーのハンクス液(HBSS)により下大静脈を通して肝臓に原位置潅流した。潅流液は、切断された門静脈を経由して1ml/minの流速で流出する。10分間潅流した後、0.05%(w/v)コラゲナーゼ(II、ワージントンバイオケミカル社)と1mM塩化カルシウム(シグマアルドリッチ社)を含むHBSSを潅流装置に導入し、上記の流速で、更に10分間継続して潅流を行う。部分的に消化された肝臓を移動させ、HBSSを含む60mmの培養皿(BDファルコン社)に放置し、緩やかに細かくきざんで、肝臓の被膜を切り開く。細かくきざんだ肝臓の懸濁液をナイロンメッシュ(孔サイズはほぼ300μm)により濾過し、50×gの遠心力で3分間遠心分離を行い細胞ペレットを得る。密度1.06g/mlのパーコール(GEヘルスケアー社)培地を調製する。上記の細胞ペレットをDMEM培地(ギブコ/インビトロゲン社)に懸濁し、先のパーコール培地と共に50×gで10分間4℃下で遠心分離を行い、次にDMEM培地で1回洗って、続いて50×gで2分間遠心分離を行い、肝細胞を得る。
【0049】
このようにして分離された肝細胞を、5%の炭酸ガスと95%の空気含む加湿した培養器内で37℃にて、10%FBS(ギブコ社)を含むDMEM培地(ギブコ/インビトローゲン社)中、おおよそ6×105細胞/well(2ml/well)当りの量を6穴プレート(コスター社)に播種培養する。3時間後、培地を除き、その細胞を異なる濃度の化合物A(0、0.1、0.5、2.5及び12.5μg/ml)と共にそれぞれ24時間培養する。肝細胞のRNAを、逆転写のため、RNA−BeeTMRNA分離液(テルテスト社)により抽出し、先の説明の通りPCRにより転写産物を分析する。この結果、化合物Aは肝細胞中のEpoの発現を強化することが明らかとなった(図4を参照)。
【0050】
実施例6
化合物Aはシスプラチン−誘発急性腎不全動物モデルにおける腎機能を強化する
シスプラチン−誘発急性腎不全動物モデルにおける化合物Aの治療効果を調べた。先ず、国立実験動物センター(NLAC、台湾)よりC57BL/6JNarlマウス(8週齢)を購入する。次に、シスプラチン(シス−ジアミンプラチナム(II)ジクロリド、シグマアルドリッチ社)を生理食塩水(0.9%(w/v)塩化ナトリウム、シグマアルドリッチ社)に溶解して1mg/ml濃度に調整し、以下のスケジュールに基づきマウスの腹腔内(i.p.)注射を行う。即ち、第1日目に7mg/kg;第5日目に6mg/kg;第9日目に6mg/kg量をそれぞれ投与する。シスプラチン未処置の正常マウス群には、平行して上記の量の生理食塩水を腹腔内に注射投与する。第13日目に血清の試料を集め、血液中の尿素窒素(BUN)含量を分析する。更に、100mg/dl以上のBUNレベルを示すシスプラチンを注射したマウスと、シスプラチン未処置の正常マウスを1群当り6匹、計5群に分けて2週間飼育した。この5群は、即ち、(1)正常群:生理食塩水を注射し、その後、標準飼料(LabDiet(登録商標))を与えて飼育したマウス群;(2)対照群:シスプラチンを注射し、その後、標準飼料を与えて飼育したマウス群;(3)化合物A10mg/kg/day投与群:シスプラチンを注射し、その後10mg/kg/day剤量の化合物Aを与えて飼育したマウス群;(4)化合物A30mg/kg/day投与群:シスプラチンを注射し、その後30mg/kg/day剤量の化合物Aを与えて飼育したマウス群;(5)化合物A90mg/kg/day投与群:シスプラチンを注射し、その後90mg/kg/day剤量の化合物Aを与えて飼育したマウス群。
【0051】
マウスの後眼窩洞より、第0、5、10、13、18、23及び28日目に血液試料を採集し、シスメクス(登録商標)Kx−21血液分析計を用いて、完全血液細胞計数により赤血球(Red blood cell、以下RBCと略称する)濃度を測定した。血液尿素窒素(BUN)レベルを、ウレアーゼGLDH法(ウレアFS、ダイヤシス社)により測定した。その結果を、平均値±標準誤差(n=5〜6)で表示した。統計学的有意性は、スチューデントテスト(##P<0.01vs正常群と**P<0.01vs対照群)により評価した。この結果、化合物A治療は、濃度が30〜90mg/kg/day範囲内において、赤血球(RBCs)数を増加させ、血清BUNレベルを低下させることが明らかとなった(図5を参照)。第23日目に、濃度が30〜90mg/kg/day範囲内にある化合物Aは、RBCs数を顕著に増加させ(図7を参照)、同時に血清BUNレベルを低下させる(図8を参照)。図7と図8において、水平方向の矢印は化合物A治療(mg/Kg/day)を示す。このデータから、シスプラチン誘発急性腎不全動物モデルにおいて、化合物A治療は、腎機能を強化し、貧血を減少させることが判った。この結果は、化合物Aが赤血球生成を強化する能力を有することと一致するものである。
【0052】
実施例7
化合物Aはシスプラチン誘発急性腎不全動物モデルにおける肝臓のEpoと肝細胞増殖因子の発現を増強する
実施例6において、最後に(即ち、第28日目)マウスを殺し、その腎臓と肝臓の組織を取り出し、骨髄細胞を分離する。次に、これらの組織と骨髄細胞よりRNA−BeeTMRNA分離溶液(テル−テスト社)を用いてRNAを抽出する。更に、MMLV逆転写酵素(プロメガ社)を用いて、総RNA(5μg)からcDNAを調製した。この逆転写cDNA試料は、ABIGeneAmpTMシステム2700(アプライドバイオシステム社)と、マウスグリセリンアルデヒド3−ホスフェイト脱水素酵素(GAPDH)(SEQ ID NOs:5と6を参照)、エリトロポイエチン(Epo)(SEQ ID NOs:3と4を参照)及び肝細胞増殖因子(HGF)(SEQ ID NOs:7と8を参照)(表1を参照)を標的としたプライマーを使用したSYBRグリーンマスターミックスキット(アプライドバイオシステム社)とを用いるPCRにより分析した。上記のリアルタイムPCRの条件は、95℃で10分間変性させ、次に、95℃で30秒間、58℃で35秒間及び72℃で40秒間のサイクルを40回繰り返すこと、とした。内部標準としてGAPDHの発現レベルを使用した。相対的な遺伝子発現レベルを2−△△CTにより算出する。この結果を、相対指数±標準誤差(n=5〜6)で表示した。統計学的有意性は、スチューデントテスト(##P<0.01vs正常群と*P<0.05、**P<0.01vs対照群)により評価した。
【0053】
その結果、30〜90mg/kg/day濃度において、化合物Aは、シスプラチン誘発急性腎不全動物モデルの肝臓のEpo発現を、未処置対照群と比較した場合、顕著に増大させることが明らかとなった(図9を参照)。肝臓と腎臓は、Epoを製造する二つの主要な器官である。化合物Aは、腎臓組織(図3を参照)、肝細胞(図4を参照)及び肝臓組織(図9を参照)におけるEpoの発現を強化することをも見出した。この結果は、化合物AがEpoの発現を強化する能力を有することと符合する。更に、化合物A(10〜90mg/kg/day)治療は、肝臓組織中のHGFの発現をも増強する(図10を参照)。図9と図10において、水平方向の矢印は、化合物A治療(mg/Kg/day)を示すものである。
【0054】
実施例8
化合物Aはシスプラチン誘発急性腎不全動物モデルにおける赤血球前駆細胞を活性化する
実施例7に基づいて、上述した通り、バースト形成ユニット−赤血球(BFU−E)分析を行うために、5%炭酸ガスと95%空気を含む加湿した培養器中、37℃下で、分離した骨髄細胞を12日間培養した。その結果を、相対指数±標準誤差(n=5〜6)で表わす。統計学的有意性は、スチューデントテスト(##P<0.01vs正常群と*P<0.05、**P<0.01vs対照群)により評価した。この結果、10〜90mg/kg/day濃度において、化合物Aは、骨髄細胞中のBFU−Eコロニー数を顕著に増大させることが見出された(図11を参照)。図11において、水平方向の矢印は、化合物A治療(mg/Kg/day)を示す。この結果より、化合物Aは、赤血球前駆細胞を活性化し、赤血球生成を強化することが明らかとなった。
【0055】
化合物2,3,5,4'−テトラヒドロキシスチルベン2−O−β−D−グルコピラノシド、即ち、化合物Aは、いくつかの植物で見出されている。文献によると、化合物Aは以下の薬物学的効果を有する。例えば、チロシナーゼを活性化してメラニン産生を促す(Guanら、2008年);脂質の過酸化作用を阻害する(Kimuraら、1983年);酸素と窒素のフリーラジカルレベルを軽減し、誘起される一酸化窒素合成酵素の発現を低く調整することにより、大腸炎、結腸炎に対する保護効果を発揮する(Wangら、2008年);リポタンパクの酸化に対する拮抗性効果、増殖及び冠状動脈平滑筋細胞の酸化窒素含量の低減によって、抗アテローム性動脈硬化症効果を発揮する(Liuら、2007年);シクロオキシゲナーゼ‐2の酵素活性と発現を阻害することに関連する抗炎症機能を有する(Zhangら、2007年)と、アルツハイマー症と認知障害に有益である(Wangら、2007年)などが報告されている。
【0056】
米国特許公開第20050042314号公報(標題:Polygonum multiflorum Thunb.の抽出物とその製造過程及びその用途)において、Polygonum multiflorum Thunb.からの抽出物は、肝細胞と骨髄細胞の増殖、生長及び/又は分化を増大させる生物学的活性を有することが開示されている。この羊毛花の根(Fleeceflower,即ちPolygonum multiflorum Thunb.,漢方薬の何首烏)には、多くの植物化学成分が含まれている。例えば、エモジン(emodin)、クリソファノール(chrysophanol)、フィシィオン(physcion)、レイン(rhein)、クリソファノールアントロン(chrysophanol anthrone)、レスベラトロール(resveratrol)、ピセイド(piceid)、2,3,5,4’−テトラヒドロキシスチルベン−2−O−β−D−グルコピラノシド、2,3,5,4’−テトラヒドロキシスチルベン−2−O−β−D−グルコピラノシド−2''−O−モノガロイルエステル、2,3,5,4’−テトラヒドロキシスチルベン−2−O−β−D−グルコピラノシド−3''−O−モノガロイルエステル、没食子酸(gallic acid)、カテキン(catechin)、エピカテキン(epicatechin)、3−O−ガロイル(−)−カテキン、3−O−ガロイル(−)−エピカテキン、3−O−ガロイル−プロシアニジンβ−2,3,3’−ジ−O−ガロイル−プロシアニジンB−2及びβ−シトステロール(β−sitosterol)が挙げられる。しかし、この米国特許公開第20050042314号公報においては、どの化学成分に活性があるかについては触れられていない。
【0057】
上記の通り、化合物Aについては、赤血球生成と腎機能を強化し、Epo産生を増大する生物学的活性を有することが立証された。化合物Aのグリコシル基は、例えば、ジヒドロキシアセトン、ガラクトース、グリセリンアルデヒド、トレオース、キシロース、マンノース、リボース、リブロース、キシルロース、タガトース、プシコース(アルロース)、フラクトース、ソルボース、ラムノース、エリトロース、エリトルロース、アラビノース、リキソース、アロース、アルトロース、グロース、イドース及びタロースからなる群より選ばれるモノサッカリドによって置換されても良い。
【0058】
Epoが赤血球生成を刺激し、赤血球生成にはEpoが必要であることは良く知られている(Moritzら、1997年)。更に、Epoは腎臓保護効果を有することが報告されている(Sepodesら、2006年。Arcasoy、2008年)。Epo産生の増大に加えて、化合物Aは赤血球生成と腎機能をも強化する。
【0059】
HGFは、多機能性のシトキン(cytokine)であり、細胞の生存、生長、運動性と、形態発生、組織再生、保護と修復に係わる。Epoレセプタからのシグナルの導入が、HGFにより活性化されることが報告されている(Iguchiら、1999年。Isobeら、2006年)。すでに、HGFは、アレルギー性炎症(Itoら、2008年)、変形性関節症、リウマチ性関節炎、筋ジストロフィー、筋萎縮症、皮膚潰瘍、熱傷、強皮症、挫傷症候群(Funakoshi及びNakamura、2003年)、又、例えば一過性虚血性発作及び血栓症といった脳血管性疾患、例えば筋萎縮性側索硬化症、アルツハイマー症、パーキンソン症、脊髄障害、糖尿病性網膜症、末梢性神経障害、脊柱管狭窄症、難聴などの神経変性疾患(Funakoshi及びNakamura、2003年。Takeoら、2007年)、更に、急性肝炎、肝硬変、激症肝炎及び脂肪肝、並びに、肝臓移植、局部切除及び虚血のための外科処置(Funakoshi及びNakamura、2003年。Mizuno及びNakamura、2007年)、腎臓腺維症、急性腎不全、例えば腎炎症候群及び閉塞性ネフロパシーといった慢性腎不全、腎臓移植及び虚血のための外科処置、糖尿病性ネフロパシー(Matsumoto及びNakamura、2001年。Funakoshi及びNakamura、2003年。Liu、2004年)、又、急性肺炎、肺腺維症、並びに肺臓移植、局部切除及び虚血のための外科処置(Funakoshi及びNakamura、2003年)、例えば心臓同種移植片拒絶及び心筋炎などの炎症媒介性心臓疾患、例えば狭心症、心筋梗塞症、心筋症及び閉塞性動脈硬化症などの心血管疾患(Funakoshi及びNakamura、2003年。Isobeら、2006年)、又、腸粘膜障害、炎症性腸疾患(Idoら、2005年)、更に、胃潰瘍及び真性糖尿病(Funakoshi及びNakamura、2003年)などを治療する潜在能力があると報告されている。
【0060】
化合物Aは、3,4’,5−トリヒドロキシ−トランス−スチルベンの基本化学構造を示し、酸化窒素依存性及び/又は抗酸化剤メカニズムを経由して腎臓保護機能を含む多くの生物学的活性を有する天然化学成分である(Sharmaら、2006年。Shankarら、2007年。Do Amaralら、2008年。Orallo、2008年)。又、化合物Aは、腎機能の強化と虚血の改善において、3,4’,5−トリヒドロキシ−トランス−スチルベンに比較して優れていることが知られている(データは提示されず)。
【0061】
ジドブジン(zidovudine)処置したヒト免疫不全ウイルスに感染された患者の貧血、化学治療を受けたガン患者の貧血、CKDの貧血の治療として、静脈内(i.v.)又は皮下(s.c.)注射により、rHuEpoとNESPが使用されたが(Fisher、2003年)、治療を維持するためには、週1回以上投薬することが好ましいとされている。そのコスト、頻回注射(非経口投与)による不便性、及びrHuEpoの固有の抗原性による抗Epo抗体の産生などすべてを考慮した場合、この治療剤の更なる改良が必要であることが判る。3,4’,5−トリヒドロキシ−トランス−スチルベン類似物の一つの化合物Aの経口投与は、Epo生成の増大、赤血球生成と腎機能の強化、及び貧血の低減を可能にする。
【0062】
酸化窒素依存及び/又は抗酸化剤メカニズム経由による腎臓保護効果を、3,4’,5−トリヒドロキシ−トランス−スチルベン化合物が保有することは、すでに報告されている。又、化合物Aが赤血球生成と腎機能を強化する能力は、3,4’,5−トリヒドロキシ−トランス−スチルベンより優れることも示されている。更に、化合物Aは、組み換えEpoには無い有益性を有する。例えば、化合物Aの経口投与は、組み換えEpoが有する固有の抗原性を招来せず、更に、rEpoの投与ルートは、頻回注射を要する不便性を有し、この点でも化合物Aの経口投与は有利性を示す。例えば、CKD、ガン、急性及び慢性感染症、自己免疫症、炎症、臓器移植後の慢性拒絶反応、化学療法が誘発する貧血症及び組織虚血症などの貧血関連疾患に対し、化合物Aは有用であろう。
【0063】
本発明における上述の実施形態は、本発明の説明と記述を目的とするに過ぎず、本発明を制約するものではない。更に多くの修正と変更の可能性が存在することは言うまでもない。
【0064】
実施形態と実施例は、本発明の原則と実際の応用を説明し、それによって本発明と異なる修正を伴う特別な意図を通した種々の実施形態などを、当業者が有効に利用できるようにするためになされた例示である。又、当業者は、本発明の主旨と範囲を逸脱しない限り、その他の実施形態を採用することができる。従って、本発明の具体的な保護請求の範囲は、上述の内容と実施例よりむしろ、特許請求の範囲に定義される。
【0065】
本発明では、特許、特許出願及び種々の刊行物を含む若干の文献を引用し、議論に用いたが、これら引用及び/又は議論に用いた文献は、単に本発明を明瞭に説明するためのものに過ぎず、本発明の「先行技術」とは見なされるものではない。又、本明細書において引用され、議論がなされたすべての文献は、各文献が個別に参考文献に組み込まれるのと同等の範囲でその文献全体が参考文献として本明細書に組み込まれる。
【0066】
参考文献のリスト

【技術分野】
【0001】
本発明は、赤血球生成に係わるものであり、特に、赤血球生成の強化に関する。
【背景技術】
【0002】
近年、慢性進行性腎障害(Chronic Kidney Disease、以下CKDと略称する)は、世界規模の公衆衛生問題の一つであり、腎不全、心血管疾患及び早期死亡などの不利益を結果的にもたらすことが知られている(Levey、2005年)。CKD患者は、腎臓病の末期に進行する非常に高いリスクを抱え、生命を長く維持するためには、腎臓透析や腎臓移植などを行う必要がある。CKDの初期症状の一つとして貧血(Anemia)が挙げられるが、それは腎臓の内因性エリトロポイエチン(erythropoietin、以下Epoと略称する)の生産不足によることが報告されている(Zarzeckiら、2004年)。更に、CKDに加え、貧血は、例えば、ガン、急性及び慢性感染症、自己免疫症、炎症、そして臓器移植後の慢性拒絶反応などのその他の疾患をも伴うことが知られている(Weiss及びGoodnough、2005年)。
【0003】
Epoは、主として成人の腎臓と胎児の肝臓において生成される糖たんぱくホルモンであり、細胞表面のエリトロポイエチンレセプタ(以下Epoレセプタと略称する)と結合することによって、その効果を発揮するものである。細胞が相対的に低い酸素レベルを感じた場合(例えば、低酸素症)、Epoが生産・放出され、赤血球系細胞の増殖、分化、成熟、生存などを調整する(Moritzら、1997年。Fisher、2003年)。血流中におけるEpoレベルの異常は、恐らくは骨髄症及び腎臓病の指標であると言われている。相対的に低いEpoレベルを示すことが、CKD、原発性真性赤血球増加症及び化学療法誘発性貧血症の患者に見られ、又、相対的に高いEpoレベルを示すことが、続発性赤血球増加症及び腎臓ガンの患者に見られることが報告されている(EckardtとKurtz、2005年。Hodgesら、2007年)。
【0004】
腎臓と肝臓組織において生産される以外に、Epoとそのレセプタは、脳、目、心臓、肺臓、腸、膵臓、筋肉、子宮及び生殖腺を含む非赤血球系の組織及び器官中において発見されている(Eckardt及びKurtz、1992年)。Epo−Epoレセプタシグナル伝達は、創傷癒合反応、脈管形成、そして例えば神経保護、心臓血管保護、並びに組織虚血及び虚血/再潅流傷害などに係わる局所性組織保護機能に貢献することが知られている(Paschosら、2008年。Arcasoy、2008年)。又、Epoは、腎機能障害の程度を軽減し、シスプラチン誘発性急性腎不全からの回復を促進するという腎臓保護効果を有することが報告されている(Sepodesら、2006年。Arcasoy、2008年)。
【0005】
赤血球生成促進剤(Erythropoiesis-stimulating agents、以下ESAsと略称する)は、治療反応性の貧血を抱える患者におけるCKDの貧血に対する治療薬として、米国国立腎臓財団のガイドライン「Kidney Disease Outcomes Quality Initiative」により推奨されている。遺伝子組換えヒトEpo(Recombinant human Epo(rHuEpo))は、CKDの貧血症、化学療法を受けたガン患者の貧血症の治療、手術中の輸液需要の低減、及びヒト免疫不全ウイルスに感染したジドブジン治療患者の貧血症の治療のために使用されることが認められている。新規な赤血球生成刺激タンパク質(novel erythropoiesis-stimulating protein(NESP))は、比較的長いプラズマ半減期を有するEpoによりデザインされ、慢性腎不全の貧血症の治療のために使用されることが認められている(Fisher、2003年)。これらのESAsは、維持療法のために、週に1回以上静脈内(i.v.)又は皮下(s.c.)投薬することが推奨されているが、痛み、頻回注射の不便性、rHuEpoを伴う固有の抗原性による抗Epo抗体の発生などが大きな関心を呼んでいる(Bunn、2007年)。それのみならず、ESAsは、比較的高いヘモグロビンレベルの患者に安全上のリスクをもたらし、例えば、高血圧症、血栓塞栓症、鉄缺乏症、重度の赤芽球癆などの合併症の誘因となる可能性がある(Wish及びCoyne、2007年)。
【発明の概要】
【発明が解決しようとする課題】
【0006】
そこで、上述した欠陥や不備に対処するというこれまで対処されてこなかった必要性が、当技術分野に、特に赤血球生成と腎機能に関する技術分野において存在する。
【課題を解決するための手段】
【0007】
一つの態様において、本発明は、下記式(I)で表される化合物を用いて、エリトロポイエチンの生成を強化する薬剤の製造に使用することに関し、
【化1】

【0008】
[式中、Rは、グリコシル基を示す。]その使用法として、治療上有効な量の当該薬剤を投与することが含まれる。
【0009】
前記グリコシル基は、ジヒドロキシアセトン、グルコース、ガラクトース、グリセリンアルデヒド、トレオース、キシロース、マンノース、リボース、リブロース、キシルロース、タガトース、プシコース(アルロース)、フラクトース、ソルボース、ラムノース、エリトロース、エリトルロース、アラビノース、リキソース、アロース、アルトロース、グロース、イドース及びタロースからなる群より選ばれる一つのモノサッカリド(単糖)である。
【0010】
上記式(I)で表される化合物は、骨髄、肝臓、腎臓及びその任意の組合せからなる群より選ばれる組織及び/又は器官に、エリトロポイエチン生成を強化するために投与される。
【0011】
他の態様において、本発明は、上記式(I)で表される化合物を、エリトロポイエチン治療が有効な疾患及び/又は障害の治療に用いる薬剤の製造に使用することに関する。その使用法として、治療上有効な量の当該薬剤を、それを必要とする対象に投与することが含まれる。
【0012】
前記疾患及び/又は障害として、貧血症、腎不全及び赤血球生成欠損関連疾患からなる群より選ばれる少なくとも一つである。
【0013】
前記疾患及び/又は障害は、エリトロポイエチン関連保護効果が有効なものである。
【0014】
前記エリトロポイエチン関連保護効果としては、神経保護、心血管保護及び腎臓保護効果、並びに組織虚血及び虚血/再潅流障害からの保護からなる群より選ばれる少なくとも一つである。
【0015】
さらに他の態様において、本発明は、上記式(I)で表される化合物を、赤血球生成を強化する薬剤の製造に使用することに関する。その使用法として、治療上有効な量の当該薬剤を、それを必要とする対象に投与することが含まれる。
【0016】
さらに態様において、本発明は、上記式(I)で表される化合物を、腎機能を強化する薬剤の製造に使用することに関する。その使用法として、治療上有効な量の当該薬剤を、それを必要とする対象に投与することが含まれる。
【0017】
さらに他の態様において、本発明は、上記式(I)で表される化合物を、肝細胞増殖因子の発現を増強する薬剤の製造に使用することに関する。その使用法として、治療上有効な量の当該薬剤を、それを必要とする対象に投与することが含まれる。
【0018】
さらに他の態様において、本発明は、上記式(I)で表される化合物を、肝細胞増殖因子治療が有効な対象における疾患及び/又は障害を治療する薬剤の製造に使用することに関する。その使用法として、治療上有効な量の当該薬剤を、それを必要とする対象に投与することが含まれる。
【0019】
態様において、本発明は、上記式(I)で表される化合物を、肝細胞増殖因子の発現を調整することにより疾患及び/又は障害を治療する薬剤の製造に使用することに関する。その使用法として、治療上有効な量の当該薬剤を、それを必要とする対象に投与することが含まれる。
【0020】
前記疾患及び/又は障害としては、肝疾患、腎疾患、肺疾患、心血管疾患、消化器疾患、神経疾患、骨疾患、関節疾患、筋疾患、皮膚疾患、圧挫症候群、アレルギー性炎症及びこれらの任意の組合せからなる群より選ばれる少なくとも一つである。
【0021】
前記肝疾患としては、急性肝炎、肝硬変、劇症肝炎及び脂肪肝、並びに肝臓移植、局部切除及び虚血のための外科処置からなる群より選ばれる少なくとも一つである。
【0022】
前記腎疾患としては、腎線維症、急性腎不全、慢性腎不全及び糖尿病性ネフロパシー、並びに腎臓移植及び虚血のための外科処置からなる群より選ばれる少なくとも一つである。
【0023】
前記慢性腎不全としては、腎炎症候群及び閉塞性ネフロパシーより選ばれる少なくとも一つである。
【0024】
前記肺疾患としては、急性肺炎及び肺線維症、並びに肺臓移植、局所切除及び虚血のための外科処置からなる群より選ばれる少なくとも一つである。
【0025】
前記心血管疾患としては、炎症媒介性心臓疾患、狹心症、心筋梗塞症、心筋症及び閉塞性動脈硬化症からなる群より選ばれる少なくとも一つである。
【0026】
前記炎症媒介性心臓疾患としては、心臓同種移植片拒絶反応及び心筋炎が含まれる。
【0027】
前記消化器疾患としては、腸粘膜障害、炎症性腸疾患、胃潰瘍及び真性糖尿病からなる群より選ばれる少なくとも一つである。
【0028】
前記神経疾患としては、脳血管性疾患、神経変性疾患、脊髄障害、糖尿病性網膜障害、末梢神経障害、脊柱管挟窄症及び聴覚消失症(難聴)からなる群より選ばれる少なくとも一つである。
【0029】
前記脳血管性疾患としては、一過性脳虚血発作及び脳卒中の少なくとも一つである。
【0030】
前記神経変性疾患としては、筋萎縮性側索硬化症、アルツハイマー症及びパーキンソン症からなる群より選ばれる少なくとも一つである。
【0031】
前記骨疾患及び関節疾患としては、変形性関節症及び/又はリウマチ性関節炎が含まれる。
【0032】
前記筋疾患としては、筋ジストロフィー及び/又は筋萎縮症が挙げられる。
【0033】
前記皮膚疾患としては、皮膚潰瘍、熱傷及び強皮症からなる群より選ばれる少なくとも一つである。
【0034】
本発明の上記及びその他の態様は、添付図面を含む下記の好ましい実施形態の説明から更に明瞭となる。本発明の新規な概念の主旨と範囲から逸脱しないかぎり、更に種々の変更や修正を行うことができる。
【0035】
添付図面は、本発明の一つ又は一つ以上の実施形態を説明するものであり、そこに書かれた説明と共に本発明の原理を説明する。又、ある実施形態の同一または同様の構成要素を示すために、できる限り同じ参照番号を図面を通して使用する。
【図面の簡単な説明】
【0036】
【図1】図1は、化合物Aによる骨髄細胞中のヘモグロビンレベルの強化を示す。
【図2】図2は、骨髄細胞のバースト形成ユニット−赤血球(BFU−Eと略称する)分析を用いた、化合物Aによる赤血球前駆細胞増殖の活性化を示す。
【図3】図3は、腎臓組織内における化合物Aによるエリトロポイエチン(Epo)発現の増大を示す。
【図4】図4は、肝細胞内における化合物Aによるエリトロポイエチン(Epo)の発現の増大を示す。
【図5】図5は、シスプラチン誘発急性腎不全動物モデルにおける化合物Aによる赤血球数の増大を示す。
【図6】図6は、シスプラチン誘発急性腎不全動物モデルにおける化合物Aによる血液の尿素態窒素レベルの減少を示す。
【図7】図7は、シスプラチン誘発急性腎不全動物モデルの第23日目における化合物Aによる赤血球数の増大を示す。図面中、水平方向の矢印は、化合物A治療(mg/Kg/day)を示す。
【図8】図8は、シスプラチン誘発急性腎不全動物モデルの第23日目における化合物Aによる血液の尿素態窒素レベルの減少を示す。図面中、水平方向の矢印は、化合物A治療(mg/Kg/day)を示す。
【図9】図9は、シスプラチン誘発急性腎不全動物モデルにおける化合物Aによるエリトロポイエチン(Epo)の発現の増大を示す。図面中、水平方向の矢印は、化合物A治療(mg/Kg/day)を示す。
【図10】図10は、シスプラチン誘発急性腎不全動物モデルにおける化合物Aによる肝組織内の肝細胞増殖因子(hepatocyte growth factor、以下、HGFと略称する)の発現の増大を示す。図面中、水平方向の矢印は、化合物A治療(mg/Kg/day)を示す。
【図11】図11は、シスプラチン誘発急性腎不全動物モデルにおける、骨髄細胞のバースト形成ユニット−赤血球(BFU−E)分析により測定した、化合物Aによる赤血球前駆細胞増殖の活性化を示す。図面中、水平方向の矢印は、化合物A治療(mg/Kg/day)を示す。
【発明を実施するための形態】
【0037】
[定義]
本明細書に使用された術語は、通常、本発明の明細書の文脈と、それぞれの術語が用いられた特殊な文脈とにおいて、本発明の技芸における一般的な語義を有する。本発明の説明に使用された若干の術語について、以下又は本明細書中の他の箇所において、当業者のために本発明の記述に係わる追加的な説明が行われる。便宜上、若干の術語は、例えばイタリック体及び/又は括弧を使用して強調することも有り得る。しかし、そのことはその術語の範囲や語義に何ら影響を与えるものではない、即ち、同様の文脈においては、強調の有無に関わらず、同様の範囲や語義を示すものである。同様のことが一つ以上の方法により表現され得ることが理解できるであろう。その結果、代替言語と同義語が、本発明において論述される任意の一つ又は多くの術語として使用され、そしてまた、ある術語が本明細書において詳述または論述されたかどうかに応じて特別な意味を付与されることもない。若干の術語について同義語が用意される。一つ又は一つ以上の同義語が多用されることは、他の同義語を用いることを排除することを意味しない。本明細書において論述される任意の術語の実例を含む本明細書の全ての実例は、例示的に用いられるものに過ぎず、本発明または任意の実例による術語の意義と範囲を限定するものではない。同様に、本発明は本明細書中に示された様々な実施形態に限定されない。
【0038】
特に定義されない限り、本明細書中に使用されるすべての科学的、技術的用語は、本発明が属する技術分野において、通常の知識を有する者によって一般的に理解されているものと同様の語義を示すものである。もし競合がある場合、与えられる語義については本明細書において統制される。
【0039】
本明細書において使用される「ぐらい」、「ほぼ」又は「おおよそ」の語義は、通常、示された値の20%範囲内、好ましくは10%範囲内、更に好ましくは、5%範囲内を表わすものである。本明細書中、特に説明のない限り、示される数値はおおよその値であり、その語義は上記の「ぐらい」、「ほぼ」又は「おおよそ」の値として推定すべき値を示す。
【実施例】
【0040】
以下、本発明の実施形態により模範的な器具、装置、方法及びそれに関連する結果を示すが、本発明はそれらに限定されるものではない。又、実施例において、読者のために便宜上、表題又は副題を記載しているが、これも本発明を制約するものではない。さらに、本発明においていくらかの理論を提議且つ開示しているが、それらが正しいか否かを問わず、本発明が特定の理論あるいは処置の仕組みを考慮せずに本発明の開示内容に従って実施されるかぎり、そうした理論は本発明の範囲を限定するものではない。
【0041】
実施例1
化合物Aの精製
乾燥したPolygonum multiflorumを2Kg用い、粉砕機で粉砕し、その粉砕物を2Lの85%(v/v)エタノールに一夜浸漬し、反応液を調製する。反応液を収集し、残渣に上記の操作に従って、更に別の2Lの85%(v/v)エタノールを加えて抽出を3回くり返す。これら反応液を収集し、ガス抽出器(ワットマン#1濾紙を使用)により、収集された溶液を濾過し、次に、ロータリーエバポレーター(Buchi社)を用い、40℃下、容積計6分之1迄濃縮する。濃縮した濾液を集め、n−ヘキサン/水=1:1を用いて5回分液する(総量5L)。水相を集め、酢酸エチル溶液(EtOAC/水=1.1)を用いて、更に6回分液して(総量6.5L)、酢酸エチル溶液層を得る。これら6回分の酢酸エチル層を合併し濃縮する。これにより得た濃縮物を凍結乾燥機(台湾Kingmech社)により乾燥して酢酸エチル抽出物を得る(以下、PoMuEPeと称する)。このPoMuEPeを、ダイヤイオンHP−200のカラム(4.8×60cm、日本三菱化学社)を用い、メタノール/水=50:50の溶媒系により、流速2ml/min下で、クロマトグラフィを行う。この分画液を集め、濃縮、乾燥、分析することにより、そのヘモグロビン生成強化能力を調べる。その活性を有する分画を集め、PoMuEPeD9と命名する。更に、PoMuEPeD9を、セファデクスTMLH20のカラム(2.6×100cm、GE Healthcare Life Science社)を用い、メタノール/水=100:0溶媒系により、1ml/minの流速下で、クロマトグラフィを行う。これらの分画を集め、濃縮、乾燥、分析し、ヘモグロビン生成強化能力を調べ、生物活性を示す分画を集め、PoMuEPeD9L11と命名した。
【0042】
上記PoMuEPeD9L11の主要成分について、核磁気共鳴(NMR)分光法(Bruker社)と液体クロマトグラフィ/質量分析法(LC/MS、Bruker社)によりその化学構造を決定した。上記主成分は、2,3,5,4'−テトラヒドロキシスチルベン2−O−β−D−グルコピラノシドであることが確認され、化合物Aと命名され、下記一般式(I)により表される。
【化2】

[式中、Rは、グルコシル基を示す。]
【0043】
実施例2
化合物Aはヘモグロビン生成を強化する
先ず、国立実験動物センター(NLAC、台湾)より試験用動物のC57BL/6JNarlマウス(8〜10週齢)を購入し、投与量100mg/kgで、フェニルヒドラジン塩酸塩(シグマアルドリッチ社)を含むリン酸緩衝生理食塩水(PBSと略称する)を単回の腹腔内(i.p.)注射で投与することにより急性溶血性の貧血症を誘発する。注射後6日目に、骨髄細胞をマウスより分離し、Worthingtonら(1987年)とRosenthalら(1987年)記載の方法を若干修正した方法により培養した。細胞懸濁液は、1%(v/v)ボビン血清アルブミン(BSA、シグマアルドリッチ社)、7.5μmの2−メルカプトエタノール(シグマアルドリッチ社)、1.4mMのL−グルタミン(シグマアルドリッチ社)、10μmの塩化鉄(FeCl3、シグマアルドリッチ社)及び50mU/mlのEPO(レコーモンエポエチン、ロシュ社)を含むMEMアルファ培地(α−MEM、ギブコ社)中、ほぼ6×105細胞/mlの濃度に調整される。この細胞を96穴プレート(コスター社)におおよそ1.5×105細胞/wellで播種し、5%炭酸ガスと95%空気を含む加湿した培養器中、37℃下で培養する。
【0044】
次の日に、異なる濃度の化合物A(0、0.1、0.5、2.5、12.5及び20μg/ml)を、前記細胞にそれぞれ添加し、更に4日間培養を続ける。次に、Kaiho及びMizuno(1985年)並びにWorthington(1987年)らの方法に若干の修正を加えた方法により、DAFベースヘモグロビン比色法を用いて、相対的なヘモグロビンレベルを測定した。簡潔に説明すると、細胞をPBSで洗淨し、ノニデットTMP40(NP−40、シグマアルドリッチ社)(0.01%(v/v)、50μl/well)で、溶解させる。その後、細胞を4,5−ジアミノフルオレスセイン(DAF、シグマアルドリッチ社)(100μg/ml、100μl/well)と、30%の過酸化水素(シグマアルドリッチ社)(6μl/well)と共に5〜10分間培養する。次に、ビクター2 1420マルチラベルカンター(ワラック、パーキンエルマー社)を用いて波長610nmの吸光度を測定した。その結果を相対指数±標準誤差(n=6)で表示した。統計学的有意性は、スチューデントテスト(**P<0.01vs対照群(0μg/ml))により評価した。この結果、化合物Aは、ほぼ0.1〜20μg/mlの濃度でヘモグロビン生成を著しく強化することが明らかに示された(図1を参照)。
【0045】
実施例3
化合物Aは細胞培養中の赤血球前駆細胞を活性化する
赤血球前駆細胞における化合物Aの効果を調べるために、Corazzaら(2004年)とJinら(2003年)の文献に記載の方法を若干修正して、バースト形成ユニット−赤血球(BFU−E)分析を行った。簡潔に説明すると、国立実験動物センター(NLAC、台湾)より試験用動物のC57BL/6JNarlマウス(6週齢)を購入し、このマウスより骨髄細胞を分離し、15%(v/v)FBS(牛胎児血清、ギブコ社)、1%(v/v)BSA(シグマアルドリッチ社)、0.8%(w/v)メチルセルロース(シグマアルドリッチ社)、10μMの2−メルカプトエタノール(シグマアルドリッチ社)、2U/mlEpo(レコーモンエポエチン、ロシュ社)及び10ng/mlIL−3(シグマアルドリッチ社)を含有するα−MEM中に、上記細胞を懸濁し、ほぼ8.3×104細胞/ml濃度の細胞懸濁液を調製する。この細胞を24穴プレート(Falcon社)におおよそ7.5×104細胞/wellで播種し、異なる濃度の化合物A(0、0.1、0.5、2.5、12.5μg/ml)をそれぞれ添加した後、5%炭酸ガス−95%空気中、加湿した培養器において、37℃下で9日間培養を続けた。コロニーは、3−(4,5−ジメチルチアゾル−2−イル)−2,5−ジフェニル−テトラゾリウムブロミド(50μg/50μl/well)(MTT;シグマアルドリッチ社)を用いて染色し、50個以上の細胞群のコロニーが計上された際に、プレートの写真をとり、その結果を平均値±標準誤差(n=3)で表示した。統計学的有意性は、スチューデントテスト(*P<0.05と**P<0.01vs対照群(即ち、濃度:0))により評価した。化合物Aは、0.5〜12.5μg/mlの濃度範囲内において著しく骨髄細胞のBFU−Eコロニー数を増加させることが明らかになった(図2を参照)。この結果は、化合物Aがヘモグロビン生成と赤血球前駆細胞を活性化することにより赤血球生成を強化することを示している。
【0046】
実施例4
化合物Aは腎臓のEpo発現を強化する
先ず、国立実験動物センター(NLAC、台湾)より試験用動物のC57BL/6JNarlマウス(8〜10週齢)を購入し、上記の方法を若干修正した方法(Parrishら、1995年。Obatomiら、1998年。De Kanterら、1999年)に基づき、マウスの腎スライスを準備する。簡潔に説明すると、マウスを頸椎脱臼により死亡させ、腎臓を摘出し、直ちに、20mM HEPES(USB社)、128mM塩化ナトリウム(シグマアルドリッチ社)、2.5mM塩化ポタシウム(シグマアルドリッチ社)、2.7mM塩化カルシウム(シグマアルドリッチ社)、1mM塩化マグネシウム(シグマアルドリッチ社)及び16mM D-グルコース(シグマアルドリッチ社)を含み且つ95%の酸素と5%の炭酸ガスを充気した氷冷の無菌のKrebs-HEPES緩衝液(pH7.4)中に保存する。この腎臓はその被膜を皮質乳頭軸に対して垂直に剥離し、芯を抜く。次に、95%の酸素と5%の炭酸ガスを充填した氷冷の無菌のKrebs−HEPES緩衝液で満たしたミクロスライサー(D.S.K、microslicer、DRK1000、Dosaka EM社)において、腎スライス(250μm)を調製する。この腎スライスを集め、ガス(95%の酸素と5%の炭酸ガス)を充填した氷冷の無菌のKrebs−HEPES緩衝液中に氷上で保存する。この腎スライスは、調製後10分間以内で実験に使用される。
【0047】
腎スライスは、15mM HEPES(USB社)、20mM炭酸水素ナトリウム(シグマアルドリッチ社)と5%(v/v)FBS(ギブコ社)を含むガス(95%の酸素と5%の炭酸ガス)を充填した新鮮な培地(DMEM/F12(ギブコ社/インビトロゲン社)を、1.0ml/well当り、24穴プレート(Falcon社)用いて、37℃下、95%の酸素と5%の炭酸ガスの雰囲気下の培養器中、90〜120分間前培養を行った。その後、腎スライスを、異なる濃度の化合物A(0、0.6、2.5、10、40及び100μg/ml)と共にそれぞれ37℃下、50%の酸素、5%の炭酸ガス及び45%の窒素ガス雰囲気下の培養器中で培養した。RNA−BeeTMRNA分離溶媒(テルテスト社)を用いて腎スライスのリボ核酸(RNA)を抽出し、総RNA(5μg)を、MMLV逆転写酵素(プロメガ社)を用いた相補的デオキシリボ核酸(cDNA)の調製に供した。上記の逆転写したcDNA試料を、ABI−プリズム7700の塩基配列検出システム(アプライドバイオシステム社)とSYBRグリーンマスターミックスキット(アプライドバイオシステム社)を用いて、リアルタイムPCRにより分析した。リアルタイムPCRのプライマーは、マウスβ−アクチン(SEQ ID NOs:1と2)とエリトロポイエチン(Epo)(SEQ ID NOs:3と4)を標的とするものを使用した(表1を参照)。リアルタイムPCRの条件は、95℃で10分間変性させ、次に、95℃で30秒間、58℃で35秒間、72℃で40秒間のサイクルを40回くり返すこと、とした。内部標準としてβ−アクチンの発現レベルを使用した。相対的な遺伝子発現レベルは、2−△△CTにより算出する。この結果を、対照群(即ち、0μg/ml)と比較し、相対指数で表示した。その結果、化合物Aは腎臓組織中のEpoの発現を増強することが明らかとなった(図3を参照)。
【表1】

【0048】
実施例5
化合物Aは肝細胞のEpo発現を強化する
先ず、国立実験動物センター(NLAC、台湾)よりC57BL/6JNarlマウス(8〜10週齢)を購入する。次に、先に説明した方法(Kreamerら、1986年)に修正を加え、これに基づいて肝細胞を分離した。簡潔に説明すると、マウスをアバチン(2%(w/v)2,2,2−トリブロモエタノール、i.p.、400mg/Kg体重)により麻酔し、0.5mMエチレングリコール−ビス(2−アミノエチルエーテル)−N,N,N',N'−テトラ酢酸(EGTA;シグマアルドリッチ社)を含むカルシウムフリーのハンクス液(HBSS)により下大静脈を通して肝臓に原位置潅流した。潅流液は、切断された門静脈を経由して1ml/minの流速で流出する。10分間潅流した後、0.05%(w/v)コラゲナーゼ(II、ワージントンバイオケミカル社)と1mM塩化カルシウム(シグマアルドリッチ社)を含むHBSSを潅流装置に導入し、上記の流速で、更に10分間継続して潅流を行う。部分的に消化された肝臓を移動させ、HBSSを含む60mmの培養皿(BDファルコン社)に放置し、緩やかに細かくきざんで、肝臓の被膜を切り開く。細かくきざんだ肝臓の懸濁液をナイロンメッシュ(孔サイズはほぼ300μm)により濾過し、50×gの遠心力で3分間遠心分離を行い細胞ペレットを得る。密度1.06g/mlのパーコール(GEヘルスケアー社)培地を調製する。上記の細胞ペレットをDMEM培地(ギブコ/インビトロゲン社)に懸濁し、先のパーコール培地と共に50×gで10分間4℃下で遠心分離を行い、次にDMEM培地で1回洗って、続いて50×gで2分間遠心分離を行い、肝細胞を得る。
【0049】
このようにして分離された肝細胞を、5%の炭酸ガスと95%の空気含む加湿した培養器内で37℃にて、10%FBS(ギブコ社)を含むDMEM培地(ギブコ/インビトローゲン社)中、おおよそ6×105細胞/well(2ml/well)当りの量を6穴プレート(コスター社)に播種培養する。3時間後、培地を除き、その細胞を異なる濃度の化合物A(0、0.1、0.5、2.5及び12.5μg/ml)と共にそれぞれ24時間培養する。肝細胞のRNAを、逆転写のため、RNA−BeeTMRNA分離液(テルテスト社)により抽出し、先の説明の通りPCRにより転写産物を分析する。この結果、化合物Aは肝細胞中のEpoの発現を強化することが明らかとなった(図4を参照)。
【0050】
実施例6
化合物Aはシスプラチン−誘発急性腎不全動物モデルにおける腎機能を強化する
シスプラチン−誘発急性腎不全動物モデルにおける化合物Aの治療効果を調べた。先ず、国立実験動物センター(NLAC、台湾)よりC57BL/6JNarlマウス(8週齢)を購入する。次に、シスプラチン(シス−ジアミンプラチナム(II)ジクロリド、シグマアルドリッチ社)を生理食塩水(0.9%(w/v)塩化ナトリウム、シグマアルドリッチ社)に溶解して1mg/ml濃度に調整し、以下のスケジュールに基づきマウスの腹腔内(i.p.)注射を行う。即ち、第1日目に7mg/kg;第5日目に6mg/kg;第9日目に6mg/kg量をそれぞれ投与する。シスプラチン未処置の正常マウス群には、平行して上記の量の生理食塩水を腹腔内に注射投与する。第13日目に血清の試料を集め、血液中の尿素窒素(BUN)含量を分析する。更に、100mg/dl以上のBUNレベルを示すシスプラチンを注射したマウスと、シスプラチン未処置の正常マウスを1群当り6匹、計5群に分けて2週間飼育した。この5群は、即ち、(1)正常群:生理食塩水を注射し、その後、標準飼料(LabDiet(登録商標))を与えて飼育したマウス群;(2)対照群:シスプラチンを注射し、その後、標準飼料を与えて飼育したマウス群;(3)化合物A10mg/kg/day投与群:シスプラチンを注射し、その後10mg/kg/day剤量の化合物Aを与えて飼育したマウス群;(4)化合物A30mg/kg/day投与群:シスプラチンを注射し、その後30mg/kg/day剤量の化合物Aを与えて飼育したマウス群;(5)化合物A90mg/kg/day投与群:シスプラチンを注射し、その後90mg/kg/day剤量の化合物Aを与えて飼育したマウス群。
【0051】
マウスの後眼窩洞より、第0、5、10、13、18、23及び28日目に血液試料を採集し、シスメクス(登録商標)Kx−21血液分析計を用いて、完全血液細胞計数により赤血球(Red blood cell、以下RBCと略称する)濃度を測定した。血液尿素窒素(BUN)レベルを、ウレアーゼGLDH法(ウレアFS、ダイヤシス社)により測定した。その結果を、平均値±標準誤差(n=5〜6)で表示した。統計学的有意性は、スチューデントテスト(##P<0.01vs正常群と**P<0.01vs対照群)により評価した。この結果、化合物A治療は、濃度が30〜90mg/kg/day範囲内において、赤血球(RBCs)数を増加させ、血清BUNレベルを低下させることが明らかとなった(図5を参照)。第23日目に、濃度が30〜90mg/kg/day範囲内にある化合物Aは、RBCs数を顕著に増加させ(図7を参照)、同時に血清BUNレベルを低下させる(図8を参照)。図7と図8において、水平方向の矢印は化合物A治療(mg/Kg/day)を示す。このデータから、シスプラチン誘発急性腎不全動物モデルにおいて、化合物A治療は、腎機能を強化し、貧血を減少させることが判った。この結果は、化合物Aが赤血球生成を強化する能力を有することと一致するものである。
【0052】
実施例7
化合物Aはシスプラチン誘発急性腎不全動物モデルにおける肝臓のEpoと肝細胞増殖因子の発現を増強する
実施例6において、最後に(即ち、第28日目)マウスを殺し、その腎臓と肝臓の組織を取り出し、骨髄細胞を分離する。次に、これらの組織と骨髄細胞よりRNA−BeeTMRNA分離溶液(テル−テスト社)を用いてRNAを抽出する。更に、MMLV逆転写酵素(プロメガ社)を用いて、総RNA(5μg)からcDNAを調製した。この逆転写cDNA試料は、ABIGeneAmpTMシステム2700(アプライドバイオシステム社)と、マウスグリセリンアルデヒド3−ホスフェイト脱水素酵素(GAPDH)(SEQ ID NOs:5と6を参照)、エリトロポイエチン(Epo)(SEQ ID NOs:3と4を参照)及び肝細胞増殖因子(HGF)(SEQ ID NOs:7と8を参照)(表1を参照)を標的としたプライマーを使用したSYBRグリーンマスターミックスキット(アプライドバイオシステム社)とを用いるPCRにより分析した。上記のリアルタイムPCRの条件は、95℃で10分間変性させ、次に、95℃で30秒間、58℃で35秒間及び72℃で40秒間のサイクルを40回繰り返すこと、とした。内部標準としてGAPDHの発現レベルを使用した。相対的な遺伝子発現レベルを2−△△CTにより算出する。この結果を、相対指数±標準誤差(n=5〜6)で表示した。統計学的有意性は、スチューデントテスト(##P<0.01vs正常群と*P<0.05、**P<0.01vs対照群)により評価した。
【0053】
その結果、30〜90mg/kg/day濃度において、化合物Aは、シスプラチン誘発急性腎不全動物モデルの肝臓のEpo発現を、未処置対照群と比較した場合、顕著に増大させることが明らかとなった(図9を参照)。肝臓と腎臓は、Epoを製造する二つの主要な器官である。化合物Aは、腎臓組織(図3を参照)、肝細胞(図4を参照)及び肝臓組織(図9を参照)におけるEpoの発現を強化することをも見出した。この結果は、化合物AがEpoの発現を強化する能力を有することと符合する。更に、化合物A(10〜90mg/kg/day)治療は、肝臓組織中のHGFの発現をも増強する(図10を参照)。図9と図10において、水平方向の矢印は、化合物A治療(mg/Kg/day)を示すものである。
【0054】
実施例8
化合物Aはシスプラチン誘発急性腎不全動物モデルにおける赤血球前駆細胞を活性化する
実施例7に基づいて、上述した通り、バースト形成ユニット−赤血球(BFU−E)分析を行うために、5%炭酸ガスと95%空気を含む加湿した培養器中、37℃下で、分離した骨髄細胞を12日間培養した。その結果を、相対指数±標準誤差(n=5〜6)で表わす。統計学的有意性は、スチューデントテスト(##P<0.01vs正常群と*P<0.05、**P<0.01vs対照群)により評価した。この結果、10〜90mg/kg/day濃度において、化合物Aは、骨髄細胞中のBFU−Eコロニー数を顕著に増大させることが見出された(図11を参照)。図11において、水平方向の矢印は、化合物A治療(mg/Kg/day)を示す。この結果より、化合物Aは、赤血球前駆細胞を活性化し、赤血球生成を強化することが明らかとなった。
【0055】
化合物2,3,5,4'−テトラヒドロキシスチルベン2−O−β−D−グルコピラノシド、即ち、化合物Aは、いくつかの植物で見出されている。文献によると、化合物Aは以下の薬物学的効果を有する。例えば、チロシナーゼを活性化してメラニン産生を促す(Guanら、2008年);脂質の過酸化作用を阻害する(Kimuraら、1983年);酸素と窒素のフリーラジカルレベルを軽減し、誘起される一酸化窒素合成酵素の発現を低く調整することにより、大腸炎、結腸炎に対する保護効果を発揮する(Wangら、2008年);リポタンパクの酸化に対する拮抗性効果、増殖及び冠状動脈平滑筋細胞の酸化窒素含量の低減によって、抗アテローム性動脈硬化症効果を発揮する(Liuら、2007年);シクロオキシゲナーゼ‐2の酵素活性と発現を阻害することに関連する抗炎症機能を有する(Zhangら、2007年)と、アルツハイマー症と認知障害に有益である(Wangら、2007年)などが報告されている。
【0056】
米国特許公開第20050042314号公報(標題:Polygonum multiflorum Thunb.の抽出物とその製造過程及びその用途)において、Polygonum multiflorum Thunb.からの抽出物は、肝細胞と骨髄細胞の増殖、生長及び/又は分化を増大させる生物学的活性を有することが開示されている。この羊毛花の根(Fleeceflower,即ちPolygonum multiflorum Thunb.,漢方薬の何首烏)には、多くの植物化学成分が含まれている。例えば、エモジン(emodin)、クリソファノール(chrysophanol)、フィシィオン(physcion)、レイン(rhein)、クリソファノールアントロン(chrysophanol anthrone)、レスベラトロール(resveratrol)、ピセイド(piceid)、2,3,5,4’−テトラヒドロキシスチルベン−2−O−β−D−グルコピラノシド、2,3,5,4’−テトラヒドロキシスチルベン−2−O−β−D−グルコピラノシド−2''−O−モノガロイルエステル、2,3,5,4’−テトラヒドロキシスチルベン−2−O−β−D−グルコピラノシド−3''−O−モノガロイルエステル、没食子酸(gallic acid)、カテキン(catechin)、エピカテキン(epicatechin)、3−O−ガロイル(−)−カテキン、3−O−ガロイル(−)−エピカテキン、3−O−ガロイル−プロシアニジンβ−2,3,3’−ジ−O−ガロイル−プロシアニジンB−2及びβ−シトステロール(β−sitosterol)が挙げられる。しかし、この米国特許公開第20050042314号公報においては、どの化学成分に活性があるかについては触れられていない。
【0057】
上記の通り、化合物Aについては、赤血球生成と腎機能を強化し、Epo産生を増大する生物学的活性を有することが立証された。化合物Aのグリコシル基は、例えば、ジヒドロキシアセトン、ガラクトース、グリセリンアルデヒド、トレオース、キシロース、マンノース、リボース、リブロース、キシルロース、タガトース、プシコース(アルロース)、フラクトース、ソルボース、ラムノース、エリトロース、エリトルロース、アラビノース、リキソース、アロース、アルトロース、グロース、イドース及びタロースからなる群より選ばれるモノサッカリドによって置換されても良い。
【0058】
Epoが赤血球生成を刺激し、赤血球生成にはEpoが必要であることは良く知られている(Moritzら、1997年)。更に、Epoは腎臓保護効果を有することが報告されている(Sepodesら、2006年。Arcasoy、2008年)。Epo産生の増大に加えて、化合物Aは赤血球生成と腎機能をも強化する。
【0059】
HGFは、多機能性のシトキン(cytokine)であり、細胞の生存、生長、運動性と、形態発生、組織再生、保護と修復に係わる。Epoレセプタからのシグナルの導入が、HGFにより活性化されることが報告されている(Iguchiら、1999年。Isobeら、2006年)。すでに、HGFは、アレルギー性炎症(Itoら、2008年)、変形性関節症、リウマチ性関節炎、筋ジストロフィー、筋萎縮症、皮膚潰瘍、熱傷、強皮症、挫傷症候群(Funakoshi及びNakamura、2003年)、又、例えば一過性虚血性発作及び血栓症といった脳血管性疾患、例えば筋萎縮性側索硬化症、アルツハイマー症、パーキンソン症、脊髄障害、糖尿病性網膜症、末梢性神経障害、脊柱管狭窄症、難聴などの神経変性疾患(Funakoshi及びNakamura、2003年。Takeoら、2007年)、更に、急性肝炎、肝硬変、激症肝炎及び脂肪肝、並びに、肝臓移植、局部切除及び虚血のための外科処置(Funakoshi及びNakamura、2003年。Mizuno及びNakamura、2007年)、腎臓腺維症、急性腎不全、例えば腎炎症候群及び閉塞性ネフロパシーといった慢性腎不全、腎臓移植及び虚血のための外科処置、糖尿病性ネフロパシー(Matsumoto及びNakamura、2001年。Funakoshi及びNakamura、2003年。Liu、2004年)、又、急性肺炎、肺腺維症、並びに肺臓移植、局部切除及び虚血のための外科処置(Funakoshi及びNakamura、2003年)、例えば心臓同種移植片拒絶及び心筋炎などの炎症媒介性心臓疾患、例えば狭心症、心筋梗塞症、心筋症及び閉塞性動脈硬化症などの心血管疾患(Funakoshi及びNakamura、2003年。Isobeら、2006年)、又、腸粘膜障害、炎症性腸疾患(Idoら、2005年)、更に、胃潰瘍及び真性糖尿病(Funakoshi及びNakamura、2003年)などを治療する潜在能力があると報告されている。
【0060】
化合物Aは、3,4’,5−トリヒドロキシ−トランス−スチルベンの基本化学構造を示し、酸化窒素依存性及び/又は抗酸化剤メカニズムを経由して腎臓保護機能を含む多くの生物学的活性を有する天然化学成分である(Sharmaら、2006年。Shankarら、2007年。Do Amaralら、2008年。Orallo、2008年)。又、化合物Aは、腎機能の強化と虚血の改善において、3,4’,5−トリヒドロキシ−トランス−スチルベンに比較して優れていることが知られている(データは提示されず)。
【0061】
ジドブジン(zidovudine)処置したヒト免疫不全ウイルスに感染された患者の貧血、化学治療を受けたガン患者の貧血、CKDの貧血の治療として、静脈内(i.v.)又は皮下(s.c.)注射により、rHuEpoとNESPが使用されたが(Fisher、2003年)、治療を維持するためには、週1回以上投薬することが好ましいとされている。そのコスト、頻回注射(非経口投与)による不便性、及びrHuEpoの固有の抗原性による抗Epo抗体の産生などすべてを考慮した場合、この治療剤の更なる改良が必要であることが判る。3,4’,5−トリヒドロキシ−トランス−スチルベン類似物の一つの化合物Aの経口投与は、Epo生成の増大、赤血球生成と腎機能の強化、及び貧血の低減を可能にする。
【0062】
酸化窒素依存及び/又は抗酸化剤メカニズム経由による腎臓保護効果を、3,4’,5−トリヒドロキシ−トランス−スチルベン化合物が保有することは、すでに報告されている。又、化合物Aが赤血球生成と腎機能を強化する能力は、3,4’,5−トリヒドロキシ−トランス−スチルベンより優れることも示されている。更に、化合物Aは、組み換えEpoには無い有益性を有する。例えば、化合物Aの経口投与は、組み換えEpoが有する固有の抗原性を招来せず、更に、rEpoの投与ルートは、頻回注射を要する不便性を有し、この点でも化合物Aの経口投与は有利性を示す。例えば、CKD、ガン、急性及び慢性感染症、自己免疫症、炎症、臓器移植後の慢性拒絶反応、化学療法が誘発する貧血症及び組織虚血症などの貧血関連疾患に対し、化合物Aは有用であろう。
【0063】
本発明における上述の実施形態は、本発明の説明と記述を目的とするに過ぎず、本発明を制約するものではない。更に多くの修正と変更の可能性が存在することは言うまでもない。
【0064】
実施形態と実施例は、本発明の原則と実際の応用を説明し、それによって本発明と異なる修正を伴う特別な意図を通した種々の実施形態などを、当業者が有効に利用できるようにするためになされた例示である。又、当業者は、本発明の主旨と範囲を逸脱しない限り、その他の実施形態を採用することができる。従って、本発明の具体的な保護請求の範囲は、上述の内容と実施例よりむしろ、特許請求の範囲に定義される。
【0065】
本発明では、特許、特許出願及び種々の刊行物を含む若干の文献を引用し、議論に用いたが、これら引用及び/又は議論に用いた文献は、単に本発明を明瞭に説明するためのものに過ぎず、本発明の「先行技術」とは見なされるものではない。又、本明細書において引用され、議論がなされたすべての文献は、各文献が個別に参考文献に組み込まれるのと同等の範囲でその文献全体が参考文献として本明細書に組み込まれる。
【0066】
参考文献のリスト

【特許請求の範囲】
【請求項1】
エリトロポイエチン生成を強化する薬剤の製造のための、下記式(I)、
【化1】

[式中、Rは、グリコシル基を示す。]
で表される化合物の使用であって、前記薬剤が、それを必要とする対象に治療上有効な量で投与されることを特徴とする使用。
【請求項2】
前記グリコシル基が、ジヒドロキシアセトン、グルコース、ガラクトース、グリセルアルデヒド、トレオース、キシロース、マンノース、リボース、リブロース、キシルロース、タガトース、プシコース(アルロース)、フラクトース、ソルボース、ラムノース、エリトロース、エリトルロース、アラビノース、リキソース、アロース、アルトロース、グロース、イドース及びタロースからなる群より選ばれるモノサッカライドである請求項1に記載の使用。
【請求項3】
前記式(I)で表される化合物が、骨髄、肝臓、腎臓及びその任意の組み合せからなる群より選ばれる組織及び/又は器官にエリトロポイエチン生成の強化のために投与される請求項1に記載の使用。
【請求項4】
エリトロポイエチン治療が有効な疾患及び/又は障害の治療に用いられる薬剤の製造のための、下記式(I)、
【化2】

[式中、Rは、グリコシル基を示す。]
で表される化合物の使用であって、前記薬剤が、治療上有効な量が投与されることを特徴とする使用。
【請求項5】
前記グリコシル基が、ジヒドロキシアセトン、グルコース、ガラクトース、グリセルアルデヒド、トレオース、キシロース、マンノース、リボース、リブロース、キシルロース、タガトース、プシコース(アルロース)、フラクトース、ソルボース、ラムノース、エリトロース、エリトルロース、アラビノース、リキソース、アロース、アルトロース、グロース、イドース及びタロースからなる群より選ばれるモノサッカリドである請求項4に記載の使用。
【請求項6】
前記疾患及び/又は障害が、貧血症、腎不全及び赤血球生成缺損関連疾患からなる群より選ばれる少なくとも一つである請求項4に記載の使用。
【請求項7】
前記疾患及び/又は障害が、エリトロポイエチン関連保護効果から利益を得る請求項4に記載の化合物の使用。
【請求項8】
前記エリトロポイエチン関連保護効果が、神経保護、心血管保護及び腎臓保護効果、並びに組織虚血及び虚血/再潅流障害からの保護からなる群より選ばれる少なくとも一つである請求項7に記載の使用。
【請求項9】
赤血球生成を強化する薬剤の製造のための、下記式(I)、
【化3】

[式中、Rは、グリコシル基を示す。]
で表される化合物の使用であって、前記薬剤が、それを必要とする対象に治療上有効な量が投与されることを特徴とする使用。
【請求項10】
前記グリコシル基が、ジヒドロキシアセトン、グルコース、ガラクトース、グリセルアルデヒド、トレオース、キシロース、マンノース、リボース、リブロース、キシルロース、タガトース、プシコース(アルロース)、フラクトース、ソルボース、ラムノース、エリトロース、エリトルロース、アラビノース、リキソース、アロース、アルトロース、グロース、イドース及びタロースからなる群より選ばれるモノサッカリドである請求項9に記載の使用。
【請求項11】
腎機能を強化する薬剤の製造のための、下記式(I)、
【化4】

[式中、Rは、グリコシル基を示す。]
で表される化合物の使用であって、前記薬剤が、それを必要とする対象に治療上有効な量が投与されることを特徴とする使用。
【請求項12】
前記グリコシル基としては、ジヒドロキシアセトン、グルコース、ガラクトース、グリセリンアルデヒド、トレオース、キシロース、マンノース、リボース、リブロース、キシルロース、タガトース、プシコース(アルロース)、フラクトース、ソルボース、ラムノース、エリトロース、エリトルロース、アラビノース、リキソース、アロース、アルトロース、グロース、イドース及びタロースからなる群より選ばれる一つのモノサッカリドである請求項11に記載の使用。
【請求項13】
肝細胞増殖因子の発現を強化する薬剤の製造ための、下記式(I)、
【化5】

[式中、Rは、グリコシル基を示す。]
で表される化合物の使用であって、前記薬剤が、それを必要とする対象に治療上有効な量が投与されることを特徴とする使用。
【請求項14】
前記グリコシル基が、ジヒドロキシアセトン、グルコース、ガラクトース、グリセルアルデヒド、トレオース、キシロース、マンノース、リボース、リブロース、キシルロース、タガトース、プシコース(アルロース)、フラクトース、ソルボース、ラムノース、エリトロース、エリトルロース、アラビノース、リキソース、アロース、アルトロース、グロース、イドース及びタロースからなる群より選ばれるモノサッカリドである請求項13に記載の使用。
【請求項15】
肝細胞増殖因子治療から利益が得られる患者における疾患及び/又は障害を治療する薬剤の製造のための、下記式(I)、
【化6】

[式中、Rはグリコシル基を示す。]
で表される化合物の使用であって、前記薬剤が、治療上有効な量が投与されることを特徴とする使用。
【請求項16】
前記グリコシル基が、ジヒドロキシアセトン、グルコース、ガラクトース、グリセルアルデヒド、トレオース、キシロース、マンノース、リボース、リブロース、キシルロース、タガトース、プシコース(アルロース)、フラクトース、ソルボース、ラムノース、エリトロース、エリトルロース、アラビノース、リキソース、アロース、アルトロース、グロース、イドース及びタロースからなる群より選ばれるモノサッカリドである請求項15に記載の使用。
【請求項17】
前記疾患及び/又は障害が、肝疾患、腎疾患、肺疾患、心血管疾患、消化器疾患、神経疾患、骨疾患、関節疾患、筋疾患、皮膚疾患、圧挫症候群、アレルギー性炎症及びこれらの任意の組み合せからなる群より選ばれる少なくとも一つである請求項15に記載の使用。
【請求項1】
エリトロポイエチン生成を強化する薬剤の製造のための、下記式(I)、
【化1】

[式中、Rは、グリコシル基を示す。]
で表される化合物の使用であって、前記薬剤が、それを必要とする対象に治療上有効な量で投与されることを特徴とする使用。
【請求項2】
前記グリコシル基が、ジヒドロキシアセトン、グルコース、ガラクトース、グリセルアルデヒド、トレオース、キシロース、マンノース、リボース、リブロース、キシルロース、タガトース、プシコース(アルロース)、フラクトース、ソルボース、ラムノース、エリトロース、エリトルロース、アラビノース、リキソース、アロース、アルトロース、グロース、イドース及びタロースからなる群より選ばれるモノサッカライドである請求項1に記載の使用。
【請求項3】
前記式(I)で表される化合物が、骨髄、肝臓、腎臓及びその任意の組み合せからなる群より選ばれる組織及び/又は器官にエリトロポイエチン生成の強化のために投与される請求項1に記載の使用。
【請求項4】
エリトロポイエチン治療が有効な疾患及び/又は障害の治療に用いられる薬剤の製造のための、下記式(I)、
【化2】

[式中、Rは、グリコシル基を示す。]
で表される化合物の使用であって、前記薬剤が、治療上有効な量が投与されることを特徴とする使用。
【請求項5】
前記グリコシル基が、ジヒドロキシアセトン、グルコース、ガラクトース、グリセルアルデヒド、トレオース、キシロース、マンノース、リボース、リブロース、キシルロース、タガトース、プシコース(アルロース)、フラクトース、ソルボース、ラムノース、エリトロース、エリトルロース、アラビノース、リキソース、アロース、アルトロース、グロース、イドース及びタロースからなる群より選ばれるモノサッカリドである請求項4に記載の使用。
【請求項6】
前記疾患及び/又は障害が、貧血症、腎不全及び赤血球生成缺損関連疾患からなる群より選ばれる少なくとも一つである請求項4に記載の使用。
【請求項7】
前記疾患及び/又は障害が、エリトロポイエチン関連保護効果から利益を得る請求項4に記載の化合物の使用。
【請求項8】
前記エリトロポイエチン関連保護効果が、神経保護、心血管保護及び腎臓保護効果、並びに組織虚血及び虚血/再潅流障害からの保護からなる群より選ばれる少なくとも一つである請求項7に記載の使用。
【請求項9】
赤血球生成を強化する薬剤の製造のための、下記式(I)、
【化3】

[式中、Rは、グリコシル基を示す。]
で表される化合物の使用であって、前記薬剤が、それを必要とする対象に治療上有効な量が投与されることを特徴とする使用。
【請求項10】
前記グリコシル基が、ジヒドロキシアセトン、グルコース、ガラクトース、グリセルアルデヒド、トレオース、キシロース、マンノース、リボース、リブロース、キシルロース、タガトース、プシコース(アルロース)、フラクトース、ソルボース、ラムノース、エリトロース、エリトルロース、アラビノース、リキソース、アロース、アルトロース、グロース、イドース及びタロースからなる群より選ばれるモノサッカリドである請求項9に記載の使用。
【請求項11】
腎機能を強化する薬剤の製造のための、下記式(I)、
【化4】

[式中、Rは、グリコシル基を示す。]
で表される化合物の使用であって、前記薬剤が、それを必要とする対象に治療上有効な量が投与されることを特徴とする使用。
【請求項12】
前記グリコシル基としては、ジヒドロキシアセトン、グルコース、ガラクトース、グリセリンアルデヒド、トレオース、キシロース、マンノース、リボース、リブロース、キシルロース、タガトース、プシコース(アルロース)、フラクトース、ソルボース、ラムノース、エリトロース、エリトルロース、アラビノース、リキソース、アロース、アルトロース、グロース、イドース及びタロースからなる群より選ばれる一つのモノサッカリドである請求項11に記載の使用。
【請求項13】
肝細胞増殖因子の発現を強化する薬剤の製造ための、下記式(I)、
【化5】

[式中、Rは、グリコシル基を示す。]
で表される化合物の使用であって、前記薬剤が、それを必要とする対象に治療上有効な量が投与されることを特徴とする使用。
【請求項14】
前記グリコシル基が、ジヒドロキシアセトン、グルコース、ガラクトース、グリセルアルデヒド、トレオース、キシロース、マンノース、リボース、リブロース、キシルロース、タガトース、プシコース(アルロース)、フラクトース、ソルボース、ラムノース、エリトロース、エリトルロース、アラビノース、リキソース、アロース、アルトロース、グロース、イドース及びタロースからなる群より選ばれるモノサッカリドである請求項13に記載の使用。
【請求項15】
肝細胞増殖因子治療から利益が得られる患者における疾患及び/又は障害を治療する薬剤の製造のための、下記式(I)、
【化6】

[式中、Rはグリコシル基を示す。]
で表される化合物の使用であって、前記薬剤が、治療上有効な量が投与されることを特徴とする使用。
【請求項16】
前記グリコシル基が、ジヒドロキシアセトン、グルコース、ガラクトース、グリセルアルデヒド、トレオース、キシロース、マンノース、リボース、リブロース、キシルロース、タガトース、プシコース(アルロース)、フラクトース、ソルボース、ラムノース、エリトロース、エリトルロース、アラビノース、リキソース、アロース、アルトロース、グロース、イドース及びタロースからなる群より選ばれるモノサッカリドである請求項15に記載の使用。
【請求項17】
前記疾患及び/又は障害が、肝疾患、腎疾患、肺疾患、心血管疾患、消化器疾患、神経疾患、骨疾患、関節疾患、筋疾患、皮膚疾患、圧挫症候群、アレルギー性炎症及びこれらの任意の組み合せからなる群より選ばれる少なくとも一つである請求項15に記載の使用。
【図1】


【図2】


【図3】


【図4】


【図5】


【図6】


【図7】


【図8】


【図9】


【図10】


【図11】




【図2】


【図3】


【図4】


【図5】


【図6】


【図7】


【図8】


【図9】


【図10】


【図11】


【公表番号】特表2012−514000(P2012−514000A)
【公表日】平成24年6月21日(2012.6.21)
【国際特許分類】
【出願番号】特願2011−543611(P2011−543611)
【出願日】平成21年12月21日(2009.12.21)
【国際出願番号】PCT/US2009/068957
【国際公開番号】WO2010/075263
【国際公開日】平成22年7月1日(2010.7.1)
【出願人】(510143354)
【出願人】(510143365)
【Fターム(参考)】
【公表日】平成24年6月21日(2012.6.21)
【国際特許分類】
【出願日】平成21年12月21日(2009.12.21)
【国際出願番号】PCT/US2009/068957
【国際公開番号】WO2010/075263
【国際公開日】平成22年7月1日(2010.7.1)
【出願人】(510143354)

【出願人】(510143365)

【Fターム(参考)】
[ Back to top ]

