超臨界二酸化炭素中における有機ニトリル化合物の水素化物の製造方法
【課題】超臨界二酸化炭素中における有機ニトリル化合物の水素化物の製造方法を提供する。
【解決手段】有機ニトリル化合物の水素化時に、超臨界二酸化炭素(scCO2)を使用して、添加剤も用いることなく、Pd/MCM−41触媒又はRh/Al2O3触媒を用いて、たとえば、ベンゾニトリルを高選択率(90.9%)でベンジルアミンに水素化し、アジポニトリルを高転化率及び高選択率(選択率100%)で、6−アミノカプロニトリルに水素化することを可能とする有機ニトリル化合物の水素化物を製造する。
【効果】CO2圧に依存して、たとえば、より低い圧力領域では、保護剤としてのCO2作用により、第一級アミンが生成され、より高い圧力では、第一級アミンの収率さらにはCO2中へのイミン中間体の溶解性が増大して、ジベンジルアミンの選択率が高くなる。
【解決手段】有機ニトリル化合物の水素化時に、超臨界二酸化炭素(scCO2)を使用して、添加剤も用いることなく、Pd/MCM−41触媒又はRh/Al2O3触媒を用いて、たとえば、ベンゾニトリルを高選択率(90.9%)でベンジルアミンに水素化し、アジポニトリルを高転化率及び高選択率(選択率100%)で、6−アミノカプロニトリルに水素化することを可能とする有機ニトリル化合物の水素化物を製造する。
【効果】CO2圧に依存して、たとえば、より低い圧力領域では、保護剤としてのCO2作用により、第一級アミンが生成され、より高い圧力では、第一級アミンの収率さらにはCO2中へのイミン中間体の溶解性が増大して、ジベンジルアミンの選択率が高くなる。
【発明の詳細な説明】
【技術分野】
【0001】
本発明は、超臨界二酸化炭素中における有機ニトリル化合物の水素化物の製造方法に関するものであり、さらに詳しくは、ベンゾニトリル、アジポニトリルなどの有機ニトリル化合物を、超臨界二酸化炭素(scCO2)を使用して、いかなる添加剤も用いることなく、Pd/MCM−41触媒又はRh/Al2O3触媒を用いて、たとえば、ベンゾニトリルを高選択率(90.9%)でベンジルアミンに水素化し、アジポニトリルを高転化率及び高選択率(選択率100%)で6−アミノカプロニトリルに水素化することを可能とする有機ニトリル化合物の水素化物の製造方法に関するものである。
【背景技術】
【0002】
超臨界二酸化炭素(scCO2)は、迅速かつ選択的な有機合成に供される有望な「グリーン」反応媒体であり、過去数年間にわたり、いくつかの不均一系触媒反応が超臨界二酸化炭素媒体中で行われ、好結果が得られている。その多くは、従来の有機溶媒中で行った場合と比較して、選択率が高いだけでなく、反応速度がより速く、かつ生成物分布が異なる例が報告されている[非特許文献1]。
【0003】
観測された高い選択率の原因は、CO2に関して報告された溶媒属性や、興味深い超分子相互作用についての理解の最近の進展に鑑みて、重要であり、それは、物質移動制限のような、従来の均一系及び不均一系の触媒に伴う問題点を克服する、大きな可能性を有する。そうした問題点は、気相中及び液相中の反応物間で頻繁に生じるが、CO2中における反応は、主に圧力及び温度により変化する。
【0004】
CO2と基質又は触媒との化学的相互作用は、選択率を制御することの可能性を提供する。たとえば、アミンは、CO2と反応してカルバミン酸又はアンモニウムカルバメートを生成することができる。したがって、アミン基を保護することにより、反応の選択率を改良したり、さらには、触媒の失活を防止したりする可能性を期待することができる。
【0005】
ニトリルからアミンへの水素化は、工業的に重要なプロセスであり、一般的には、高い水素圧を用いて、液相中で行われる[非特許文献2]。アミンは、医薬品工業、農薬工業、及びプラスチック工業で中間体として使用される。たとえば、ベンジルアミンは、ビタミンH(ビオチン)のようないくつかの薬剤で、アミド、イソシネート、写真材料用中間体[非特許文献3]、及びジベンジルアミン(腐食防止剤としても使用される)の製造で、ガソリン添加剤の製造で、医薬品工業で、SBRゴムの製造におけるゴム及びタイヤの配合で、利用される[非特許文献4〜6]。一方、アジポニトリルの水素化により得られる6−アミノカプロニトリルは、同様に周知の工業上魅力的なナイロン−6の製造に供されるモノマーである。
【0006】
ベンゾニトリルの水素化は、均一系触媒[非特許文献7]、及び不均一系触媒[非特許文献8]を用いて研究されてきた。均一系触媒の場合、第一級アミンへの選択率は高いが、触媒/生成物の分離の困難を伴う。均一系触媒と比較して、不均一系触媒は、第一級アミンへの不十分な選択率を呈する。したがって、第一級アミンの選択率を増大させるためにNH3を適用することは、不均一系触媒反応で最も多く使用される技術である[非特許文献9]。
【0007】
しかしながら、NH3は、加圧貯蔵のようないくつかの問題点を有し、しかも必要量が多いので、環境上及び経済上の問題を生じる。さらには、第一級アミンの高選択率を達成するために、HCl、CH3COOH、及び酸無水物のような、さまざまな酸が、Pd/C触媒又はラネーNi触媒とともに使用されて来た[非特許文献10]。そのほかに、高温の反応条件、及び過酷な反応条件、Ni、Co、Fe、Pt、Pd、Ru、及びRhのような、さまざまなタイプの金属の使用も、また、第一級アミンの選択率の増大の一翼を担っている[非特許文献11]。
【0008】
Volf及びPasek[非特許文献12]は、液相中におけるニトリルの水素化について検討し、Ni及びCoが、第一級アミンの製造に最良の選択肢であり、いくつかの添加剤を必要とすることを示した。最近、Hegeduesら[非特許文献13]も、また、ジクロロメタン/水中で、10%Pd/C触媒を用いて、酸性添加剤としてのNaH2PO4を使用して、ベンジルアミンの高選択率(95%)を達成した。
【0009】
言うまでもなく、選択率を増大させるために添加剤を用いると、廃棄物問題を生じ、添加剤がリサイクルされない場合、プロセス費用が増大し、生成物の分離が妨害され、特定の運転回数後の触媒効率が低下するので、工業規模で容易に実施することは困難である。液相水素化の代わりに、Xieらは、ベンゾニトリルの水素化のために不均一系触媒(NiCl2/NaBH4触媒の溶液)及び均一系触媒(RhH(P−i−Pr3)3)とともにCO2+エタノール(ガス膨張液体)媒体を使用し[非特許文献14]、CO2の保護的役割を説明した。
【0010】
ベンゾニトリルと同様に、アジポニトリルの水素化は、文献量が多いことからわかるように、非常に重要である[非特許文献15]。反応は、通常の有機溶媒中、高い水素圧で行われ、最も頻繁に用いられる触媒は、ラネーNiである。いくつかの問題点(脆弱、取扱い困難、環境上有害)が原因で、ラネーNi触媒は、Ni/MgO触媒、Rh/Al2O3触媒、及びNi/Al2O3触媒で置き換えられてきた。さらには、PVP中に包埋されたRhは、6−アミノカプロニトリルの形成に関して選択性の高い触媒であるが(85%)、転化率が低い(33%)ことが報告された。
【0011】
さらにまた、Maresら[非特許文献16]は、純NH3媒体中で、Rh/MgOが、6−アミノカプロニトリルの形成に関して選択性があることを見いだした(選択率94.1%、転化率70%)。アジポニトリルの水素化は、高選択率を達成すべく気相条件でも研究されているが、結果は不満足なものであった[非特許文献17]。これまで、scCO2中におけるアジポニトリルの水素化に関する文献は、見当たらない。
【先行技術文献】
【非特許文献】
【0012】
【非特許文献1】Baiker,Chem.Rev.,1999,99,453;A.Furstner,L.Ackermann,K.Beck,H.Hori,D.Koch,K.Langeman,M.Liebl,C.Six and W.Leitner,J.Am.Chem.Soc.,2001,123,9000;K.Wittmann,W.Wisniewski,R.Mynott,W.Leitner,C.L.Kranemann,T.Rische,P.Eilbracht,S.Kluwer,J.M.Ernsting and C.J.Elsevier,Chem.−Eur.J.,2001,7,4584
【非特許文献2】Ullmann’s Encyclopedia of Industrial Chemistry,fifth rev.ed.,Vol.A2,VCH Verlag,Weinheim,1985,p.1
【非特許文献3】A.Kleemann,J.Engel,B.Kutscher,D.Reichert,Pharmaceutical Substances:Syntheses,Patents,Applications,fourth ed.,Stuttgart Georg Verlag,New York,2001
【非特許文献4】B.Wanderott,Z.Metallkd.56(1965)63
【非特許文献5】S.Gomez,J.A.Peters,J.C.Van der Waal,W.Zhou,T.Maschmeyer,Catal.Lett.,84,2002,1−4
【非特許文献6】Buehler,D.R.,Keister,G.P.,Long,I.F.,Du Pont 1969 US Pat.3 461 167
【非特許文献7】Toti,A.;Frediani,P.;Salvini,A.;Rosi,L.;Giolli,C.;Giannelli,C.C.R.Chim.2004,7,769−778;Bianchini,C.;Dal Santo,V.;Meli,A.;Oberhauser,W.;Psaro,R.;Vizza,F.Organometallics 2000,19,2433−2444;Chin,C.S.;Lee,B.N.Catal.Lett.1992,14,135−140;Nishimura,S.Handbook of Heterogeneous Catalytic Hydrogenation for Organic Synthesis;John Wiley & Sons:New York,2001;Chapter 7,p 254−285;T.Li,I.Bergner,F.Nipa Haque,M.Zimmer De−Iuliis,D.Song,R.H.Morris,Organometallics,2007,26,5940−5949
【非特許文献8】Xie,X.;Liotta,C.L.;Eckert,C.A.Ind.Eng.Chem.Res.2004,43,7907−7911;Kukula,P.;Studer,M.;Blaser,H.−U.AdV.Synth.Catal.2004,346,1487−1493;Blaser,H.U.;Malan,C.;Pugin,B.;Spindler,F.;Steiner,H.;Studer,M.AdV.Synth.Catal.2003,345,103−151;Gomez,S.;Peters,J.A.;Maschmeyer,T.AdV.Synth.Catal.2002,344,1037
【非特許文献9】C.F.Winans,J.Am.Chem.Soc.1939,61,3566;A.M.C.F.Castelijns,P.J.D.Maas,EP Patent 0644177,1995;C.F.Winans,US Patent 2,217,630,1940
【非特許文献10】W.H.Hartung,J.Am.Chem.Soc.1928,50,3370;E.Miller,J.M.Sprague,L.W.Kissinger,L.F.McBurney,J.Am.Chem.Soc.1940,62,2099;W.H.Carothers,G.A.Jones,J.Am.Chem.Soc.1925,47,3051
【非特許文献11】C.V.Rode,M.Arai,M.Shirai,Y.Nishiyama,Appl.Catal.A general,1997,148,405−413
【非特許文献12】Volf,J.Pasek,in:L.Cerveny(Ed.),Catalytic Hydrogenation,Elsevier,Amsterdam,Stud.Surf.Sci.Catal.27(1986)105−144
【非特許文献13】L.Hegedus,T.Mathe,Appl.Catal.A:General,296,2005,209−215
【非特許文献14】X.Xie,C.L.Liotta,C.Eckert,Ind.Eng.Chem.Res.2004,43,7907−7911
【非特許文献15】F.Medina,P.Salagre,J.E.Sueiras and J.L.G.Fierro.J.Catal.142(1993),p.392;F.Medina,P.Salagre,J.E.Sueiras and J.L.G.Fierro.J.Mol.Catal.81(1993),p.363;F.Medina,P.Salagre,J.E.Sueiras and J.L.G.Fierro.J.Chem.Soc.,Faraday Trans.89 18(1993),p.3507;F.Medina,P.Salagre,J.E.Sueiras and J.L.G.Fierro.J.Chem.Soc.,Faraday Trans.89 21(1994),p.3981;X.Yu,H.Li and J.F.Deng.Appl.Catal.A:Gen.199(2000),P.191;H.Li,Y.Xu,H.Li and J.F.Deng.Appl.Catal.A:Gen.216(2001),p.51;H.Li,Y.Xu and J.F.Deng.New J.Chem.11(1999),p.1059
【非特許文献16】F.Mares,J.E.Galle,S.E.Diamond and F.J.Regina.J.Catal.112(1988),p.145
【非特許文献17】X.Yu,H.Li and J.Deng.Appl.Catal.A 199(2000),p.191;H.Li,Y.Xu,H.Li and J.F.Deng.Appl.Catal.A 216(2001),p.51;F.Medina,P.Salagre,J.E.Sueiras and J.L.Fierro.J.Chem.Soc.Faraday Trans.90(1994),p.1455;.Huang and W.M.H.Sachtler.Appl.Catal.A 182(1999),p.365
【非特許文献18】B.W.Hoffer,J.A.Moulijn,Appl.Catal.A:General,2009,352,193−201
【発明の概要】
【発明が解決しようとする課題】
【0013】
本願発明は、超臨界二酸化炭素(scCO2)中で、Pd触媒又はRh触媒を用いて、いかなる添加剤も、有機溶媒も用いることなく、ベンゾニトリル、アジポニトリルなどの有機ニトリル化合物の水素化物を製造する方法を提供することを目的とするものである。
【課題を解決するための手段】
【0014】
上記課題を解決するための本発明は、以下の技術手段から構成される。
(1)超臨界二酸化炭素を反応媒体として、Pd触媒又はRh触媒を用いて、有機ニトリル化合物を水素化してその水素化物を製造する方法。
(2)Pd/MCM−41触媒を用いて、ベンゾニトリルを高選択率で水素化してベンジルアミンを製造する、前記(1)に記載の方法。
(3)Rh/Al2O3触媒を用いて、アジポニトリルを水素化して、6−アミノカプロニトリルを製造する、前記(1)に記載の方法。
(4)CO2圧が、8〜10MPaの範囲である、前記(1)から(3)のいずれかに記載の方法。
(5)CO2圧を調整することにより、ベンジルアミン又はジベンジルアミンを製造する、前記(1)又は(2)に記載の方法。
(6)CO2圧のより低い圧力領域で、保護剤としてのCO2の作用により、第1級アミンを生成させ、より高い圧力領域で、CO2中へのイミン中間体の溶解性を増大させて、ジベンジルアミンを高選択率で生成させる、前記(1)又は(2)に記載の方法。
(7)H2圧が、1〜4MPaの範囲である、前記(1)から(6)のいずれかに記載の方法。
【0015】
次に、本発明について更に詳細に説明する。
本発明では、材料として、ベンゾニトリル、アジポニトリルなどの脂肪族および芳香族系ニトリルやジニトリル化合物、二酸化炭素が用いられ、また、触媒としては、Pd/C、Pd/Al2O3、Pt/SiO2、Rh/C、Rh/Al2O3、Pd/MCM−41、Pt/MCM−41、及びRh/MCM−41触媒が用いられる。ニトリル化合物は、一般式
【0016】
【化1】

【0017】
で表され、nは、1から20までの整数、mは1から4の整数を表す。Rは、CH2で代表されるメチレン鎖や、CH2−Ph−CH2で代表されるフェニル基を含むアルキル鎖、そしてフェニル基を表す。ここで表されるアルキル鎖やフェニル基は更に置換基を有しても構わない。例えば、アジポニトリルは、n=4、m=2で表される。
【0018】
触媒及び反応物を、反応器内に導入し、所要の温度に達した後、高圧液体ポンプを用いて、H2及びそれに続いてCO2を反応器内に仕込み、次に、所望の圧力に圧縮する。生成物の液体を単に濾過により触媒から分離して、NMR及びGC−MSにより同定し、続いて、キャピラリーカラムとフレームイオン化検出器とを備えたGC(HP6890)を用いて定量分析を行い、選択率は、以下により算出する。
選択率%=(生成物濃度/全生成物濃度)×100
【0019】
次に、有機ニトリル化合物として、ベンゾニトリル、アジポニトリルを代表例として説明するが、本発明は、有機ニトリル化合物であれば、適用可能であり、これらに限定されるものではない。サファイア窓を備えた10ml高圧可視化セル内で、ベンゾニトリル、アジポニトリルを反応させる。内容物を撹拌するために、マグネティックスターラー上にセルを配置し、そして、可視化セル内の圧力を調整するために、圧力コントローラーに接続する。それに加えて、ベンゾニトリル及びアジポニトリルに対して、それぞれ50℃及び80℃の所望の温度を保持するために、温度コントローラーをも使用する。7〜14MPaの間でCO2圧を変化させて、ベンゾニトリルの場合には、2MPa、及びアジポニトリルの場合には、4MPaの一定水素圧で、基質を可視化セル内に導入し、相挙動をモニターする。
【0020】
化2のスキーム1(a)及び1(b)は、scCO2中におけるベンゾニトリル及びアジポニトリルの水素化の予想反応経路を示している。ベンゾニトリル(BN)は、ベンジルアミン(BA)に水素化され、反応条件に依存して、それに続いて、ジベンジルアミン(DBA)を生成する。一方、アジポニトリルの水素化からは、生成物として6−アミノカプロニトリル(ACN)が生成する。
【0021】
【化2】

【0022】
活性金属イオンの性質及び触媒の支持体は、活性及び特定の反応の生成物分布を記述する最も重要なパラメーターである。したがって、最初に、さまざまな触媒を用いて、ベンゾニトリル及びアジポニトリルの水素化を行ったが、実験反応条件下では、Pd触媒が、他のいずれの触媒よりも、ベンゾニトリルの水素化に関して効率的である。
【0023】
Pt触媒及びRh触媒を用いたときのベンゾニトリルの転化率は低く、15〜30%の範囲内であり、一方、Pd触媒を用いたときの転化率は比較的高く、Pd/C触媒では、100%に達する。しかしながら、Pd/MCM−41を用いると、第一級アミンの顕著な選択率が得られ(90.9%)、Pd/C触媒を用いると、第二級アミンがもっぱら形成される。
【0024】
さまざまな貴金属触媒を用いて、アジポニトリルの水素化も行ったが、その生成物は、金属の性質に依存せずに、6−アミノカプロニトリルだけである。なかでも、Rh含有触媒は、転化率及び選択率が高いので、最も有望な触媒であると考えられる。Rh/Al2O3は、Rh/MCM−41と比較して、より良好な活性を示す。
【0025】
ベンゾニトリルの水素化の反応パラメーターを調べるために、50℃、かつ一定水素圧で、Pd/MCM−41触媒及びPd/C触媒を用いて、CO2圧の影響及びCO2なしの影響を調べると、CO2圧を8MPaから10MPaに増大させると、Pd/MCM−41を用いた場合、ベンゾニトリルの転化率は、64.9%から90.2%に増大し、第一級アミンの選択率は、64.9%から90.9%に増大する。
【0026】
圧力を14MPaまでさらに増大させると、転化率は、51.5%の有意な減少を示し、第一級アミンへの選択率は、30%に有意に減少する。
【0027】
基質、水素、及びCO2は、圧力が10MPa超に増大すると、気液相から単一の均一相に変化する。ベンゾニトリルの転化率の減少は、媒体の単なる希釈効果に起因する。一方、ジベンジルアミンの選択率の増大は、触媒表面上のベンゾニトリルの濃度の増大に関連する。
【0028】
ニトリルの水素化は、後記する化3のスキームに示される工程で行われる。この反応スキームによれば、第二級アミンは、第一級アミンへのイミンの求核付加ならびにそれに続くNH3の脱離及びCN基の水素化により生成される。より高いCO2圧での第二級アミンの生成は、scCO2中へのイミンの溶解性が高いことによる。
【0029】
イミンは、CO2中にかなり可溶であり、かつその溶解性は、CO2圧とともに増大する。したがって、イミンの溶解性が増大すると、イミンと第一級アミンとの間の縮合工程及びそれに続く第二級アミンの生成に有利である。縮合工程は、中間体イミンの脱着前に金属表面上で進行する。したがって、単にCO2圧を調整することにより、生成物分布を変化させることができる。
【0030】
Pd/C触媒は、ジベンジルアミンへの選択性がある。第一級アミンへの最高選択率(44.7%)は、8MPaで達成されるが、圧力が14MPaに増大すると、0.0%に減少する。CO2なしで、反応を行った場合、転化率(18%)の著しい減少は、おそらく物質移動制限に起因する。
【0031】
同一反応条件下でのPd/MCM−41触媒とPd/C触媒との間のこの活性差は、担体効果に由来する可能性がある。周知のごとく、C担体は、MCM−41と比較して、かなり酸性である。担体の酸性度は、ニトリルの水素化に関して議論の余地のある問題である。
【0032】
アジポニトリルを水素化すると、CO2圧に依存せずに6−アミノカプロニトリルだけが生成される。しかしながら、転化率は、圧力によって強く影響される。CO2圧を6MPaから8MPaに増大させると、アジポニトリルの転化率は、約46%から100%に変化し、圧力が8MPaを超えると、減少し始める。
【0033】
CO2圧の増大に伴う転化率の減少は、溶媒とニトリル基との相互作用(これは、化合物の反応性を決定付ける)、及び単なる希釈効果、に関連すると思われ、2個のニトリル基の共吸着は、起こりそうにない。したがって、ニトリル基の一方が、最初にアミンに選択的に水素化され、そして、類似の基が存在するために、同一の活性部位に対して、ジニトリルとアミノニトリルとの間の競合が増大される。
【0034】
周知のごとく、Ru金属は、表面上へのニトリル種の吸着を促進し、最も可能性の高い律速工程は、水素移動が起こると思われる脱着である。したがって、この特定の基質を水素化するために、基質の吸着と生成物の脱着との間の適正バランスにより、最大水素化速度を得ることが期待されるが、現状では、CO2圧の増大に伴う基質の溶解性の増大に起因して、触媒表面上へのアジポニトリルの吸着速度は、アミンの脱着速度よりも大きいので、転化率の減少を生じる。
【0035】
Pd/MCM−41触媒及びPd/C触媒を用いたベンゾニトリルの水素化に及ぼす水素圧変化の影響は、水素圧が1MPaから4MPaに増大すると、ベンゾニトリルの転化率は、Pd/MCM−41を用いた場合、44.2%から95%に増大されるが、ベンジルアミンの選択率は、60%に低減される。
【0036】
同様に、転化率は、また、Pd/C触媒の場合にも、水素圧とともに41.9%から100%に変化する。しかしながら、ベンジルアミンへの選択率は、1MPaから4MPaへの水素圧の増大に伴って、70%から0%に低減される。
【0037】
アジポニトリルの水素化の転化率プロファイルは、ベンゾニトリルと同一の傾向を示し、水素圧を1MPaから4MPaに増大させると媒体中の水素濃度が増大し、結果的に、転化率が28.4%から100%に増大される。しかしながら、6−アミノカプロニトリルからヘキサメチレンジアミンへのさらなる水素化は、観測されない。
【0038】
反応の生成物分布は、触媒系の使用条件及び触媒表面上での中間体種の安定性と密接に関連するが、反応時間は、反応の速度論に関する概念を提供しうる重要なパラメーターである。水素化速度は、Pd/MCM−41と比較して、Pd/Cを用いた方が速い。たとえば、Pd/Cは、2時間以内の反応で、74%の転化率を示すが、Pd/MCM−41では、44%の転化率が達成されたにすぎない。いずれの場合も、反応条件は同一であるので、これらの結果は、(i)担体の酸性度、(ii)金属粒子のサイズ、及び(iii)金属イオンの酸化状態、に関連すると思われる。C担体の酸性度は、MCM−41よりも大きく、ジベンジルアミンに至る反応の選択率に影響を及ぼす。
【0039】
金属粒子のサイズは、触媒のXRDパターンを用いた粒子サイズ分析(シェラー式の適用)から、Pd/Cは、約56nmのより大きい粒子を有し、一方、Pd/MCM−41は、約16nmのPd粒子を含有する。特に、反応がいくつかの隣接表面原子を必要とする場合、密に充填された平面の寄与は、粒子サイズの増大に伴って増大し、表面構造のこうした改質は、異なる反応性をもたらす可能性がある。
【0040】
したがって、本発明者らは、異なるPdサイズを有するPd/MCM−41を用いて、反応を行った。その結果は、図5に示される。検討した粒子サイズの範囲は狭いが(16〜25nm)、それにもかかわらず、ここで用いられた反応条件下で、触媒活性の差異により、ベンゾニトリルの水素化の構造敏感性が予想されることは明らかである。反応性のこうした変動は、表面Pd粒子の電子状態及び反応物の吸着特性の差異に起因する可能性がある。
【0041】
より大きい粒子の触媒活性は、反応物の吸着強度が高いより小さい粒子と比較してより大きいが、これらの2種の触媒を区別するもう1つのパラメーターは、Pdの酸化状態である。仮焼Pd/MCM−41のXRDパターンから、PdOの存在が示唆される。一方、Pd/Cは、Pd0を含有する。しかしながら、MCM−41に担持されたPdOは、水素の存在下で容易に還元されるので、Pd0に還元されたと思われる。したがって、Pd粒子サイズの差異は、Pd/C触媒を用いた方が、反応速度が速いことの理由になりうる。
【0042】
アジポニトリルの転化率は、反応時間とともに増大し、全転化は、4時間の反応時間内で達成可能である。しかしながら、6−アミノカプロニトリルが唯一の生成物である場合、生成物の選択率に及ぼす反応時間の影響は、まったく観測されない。
【0043】
アジポニトリルの液相水素化では、類似のRh/Al2O3触媒もまた、時間とともに転化率の増大を示すが、それに加えて、6−アミノカプロニトリルからヘキサメチレンジアミンへのさらなる水素化が起こる。ヘキサメチレンジアミンの生成を調べるために反応時間を24時間まで延長しても、6−アミノカプロニトリルの選択率は一定に保たれる。
【0044】
さらにまた、本方法は、類似の反応条件下でヘキサンニトリル(−CN基は1個だけ)及びテレフタロニトリルの水素化にも拡張され、前者は、ヘキサンアミンに水素化されるが、後者は、4−アミノメチルベンゾニトリルで停止する。これは、1個のニトリル基だけが触媒表面に吸着可能であり、ジニトリルとアミノニトリルとの競合が反応の選択率を決定付けることに起因する。
【0045】
Pd/MCM−41触媒及びPd/C触媒による、ベンゾニトリルの水素化に及ぼす温度の影響については、Pd/MCM−41を用いた場合、温度が35℃から70℃に変化するにつれて、反応速度が増大するとともに、ベンジルアミンへの選択率が91.6%から40%に減少する。Pd/Cでは、ベンゾニトリルの転化率、さらにはジベンジルアミンへの選択率も、また、温度とともに増大される。
【0046】
アジポニトリルの水素化に及ぼす温度のプラスの影響も、温度が低い場合(35℃)、転化率は非常に低い(5.2%)。反応系の温度を50℃から80℃に上昇させると、6−アミノカプロニトリルの生成速度は、52.5%から100%に有利に増大され、90℃まで一定に保たれる。しかしながら、生成物の選択率に及ぼす温度の影響は、まったくない。
【0047】
いずれの場合も、反応温度は、転化率に影響を及ぼすが、このことは、基質−水素−CO2の相挙動により説明可能である。scCO2中では、温度を変更すると、媒体の密度が変化するので、単一相が二相に分離する可能性がある。転化率の増大は、液相中、さらには気相中における反応速度の劇的な増大に起因し、これにより、相分離のマイナスの影響が補償される。
【0048】
不均一系触媒は、再利用のために、単に濾過により、それを分離し、リサイクルしたところ、両方のニトリルで、触媒の再利用が可能であることが示唆されるが、これは、ニトリルの水素化時における金属部位のブロッキングによる触媒失活の主な理由の1つであり、この事実は、イミン中間体が、scCO2中への高い溶解性を有することにより、立証される。
【0049】
本発明においては、scCO2は、ベンゾニトリル及びアジポニトリルから、それらの対応するアミンへの水素化を促進する有望な媒体であることが実証された。いかなる添加剤も用いることなく、Pd/MCM−41触媒を用いて、ベンゾニトリルの水素化から第一級アミンへの高い転化率(90.2%)及び選択率(91%)が達成される。ベンゾニトリルでは、CO2圧、粒子サイズ、及び担体の性質は、第一級アミンの選択率を決定する最も重要なパラメーターである。単にCO2圧の調整及び中性MCM−41から酸性Cへの担体の変更を行うだけで、もう1つの重要な化合物ジベンジルアミンが生成される。
【0050】
さらには、CO2圧は、また、アジポニトリルの転化率を増大させる効果的な役割も果たす。CO2圧及び温度に依存して、Rh/Al2O3触媒を用いて、アジポニトリルから6−アミノカプロニトリル(ナイロン66に非常に重要な化合物;100%)への完全転化が達成される。触媒は、両方とも、リサイクルして好結果を得ることが可能である。ここに提示された本発明の方法は、ベンゾニトリル、アジポニトリルなどの脂肪族および芳香族系ニトリルやジニトリル化合物などの有機ニトリル化合物を水素化するためのクリーンな化学プロセスのさらなる改良を行うのにきわめて好適なものとして有用である。
【発明の効果】
【0051】
本発明により、次のような効果が奏される。
(1)ベンゾニトリル及びアジポニトリルなどの有機ニトリル化合物の水素化時に、超臨界二酸化炭素(scCO2)を使用して、いかなる添加剤も用いることなく、Pd/MCM−41触媒又はRh/Al2O3触媒を用いて、たとえば、ベンゾニトリルを高選択率(90.9%)でベンジルアミンに水素化し、アジポニトリルを高転化率及び高選択率(選択率100%)で6−アミノカプロニトリルに水素化することができる。
(2)転化率に及ぼすCO2圧の強い影響が両方のニトリルで観測され、CO2圧が8MPaから10MPaに増大するにつれて転化率は増大し、8〜10Mpaの近傍で最大値に達した後、減少するが、このことは、アジポニトリルでより顕著である。
(3)さらには、単にCO2圧を調整することにより、ベンジルアミン又はジベンジルアミンを得ることが可能であり、たとえば、より低い圧力領域では、保護剤としてのCO2作用により、第一級アミンが生成され、より高い圧力では、第一級アミンの収率さらにはCO2中へのイミン中間体の溶解性が増大して、ジベンジルアミンの選択率が高くなる。
(4)この結果から、scCO2の存在がベンジルアミンの生成に不可欠であり、かつプロセスが構造敏感性である。
(5)アジポニトリルからの6−アミノカプロニトリルの選択率は、CO2圧にも、反応時間、H2圧の変化、温度のような他の反応パラメーターにも依存しない。
(6)溶媒とニトリル基との相互作用及び触媒の同一の活性部位に対するジニトリルとアミノニトリルとの改善された競合により、それぞれ、アミノニトリル生成物のより高い転化率及び選択率が得られる。
【図面の簡単な説明】
【0052】
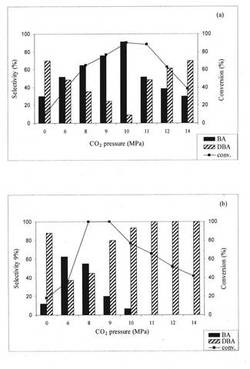
【図1】(a)Pd/MCM−41及び(b)Pd/Cを用いたベンゾニトリルの水素化の転化率及び選択率に及ぼすCO2圧の影響を示す。反応条件は、触媒=0.1g、基質=1.0g、温度=50℃、PH2=2MPa、及び反応時間=4時間である。
【図2】Rh/Al2O3触媒を用いたアジポニトリルの水素化の転化率に及ぼすCO2圧の影響を示す。反応条件は、触媒=0.1g、基質=1.0g、温度=80℃、PH2=4MPa、及び反応時間=4時間である。
【図3】(a)Pd/MCM−41及び(b)Pd/Cを用いたベンゾニトリルの水素化のH2圧の変化を示す。反応条件は、触媒=0.1g、基質=1.0g、温度=50℃、PCO2=10MPa、及び反応時間=4時間である。
【図4】(a)Pd/MCM−41及び(b)Pd/Cを用いたベンゾニトリルの水素化に及ぼす時間変化の影響を示す。反応条件は、触媒=0.1g、基質=1.0g、温度=50℃、PH2=2MPa、及びPCO2=10MPaである。
【図5】ベンゾニトリルの転化率に及ぼす粒子サイズの影響を示す。
【図6】時間変化させたアジポニトリルの水素化を示す。反応条件は、触媒=0.1g、基質=1.0g、温度=80℃、及びPH2=4MPaである。
【発明を実施するための形態】
【0053】
次に、実施例に基づいて本発明を具体的に説明するが、本発明は、以下の実施例によって何ら限定されるものではない。
【実施例1】
【0054】
1.実験方法
(1)材料
ベンゾニトリル(和光純薬)及びアジポニトリル(Aldrich)は、入手したままの状態で使用した。二酸化炭素(>99.99%)は、日本酸素株式会社により供給された二酸化炭素を用いた。1%Pd/C、5%Pd/Al2O3、1%Pt/SiO2、及び5%Rh/Cは、Aldrich製であり、5%Rh/Al2O3は、和光純薬製である。Pd/MCM−41、Pt/MCM−41、及びRh/MCM−41触媒は、本発明者らの研究室で合成したものである。
【0055】
(2)触媒活性
Pd−MCM−41触媒を用いて、50℃で、ベンゾニトリルの水素化について調べ、一方、80℃におけるアジポニトリルの水素化では、5%Rh/Al2O3触媒を使用した。熱風循環式オーブン内に配置された50mlステンレス鋼製バッチ反応器内で、すべての反応を行った。その方法については、簡潔に述べると次のとおりである。
【0056】
0.1gの触媒及び1.0gの反応物を、反応器内に導入した。所要の温度に達した後、高圧液体ポンプを用いて、H2及びそれに続いてCO2を反応器内に仕込み、次に、所望の圧力に圧縮した。生成物の液体を単に濾過により触媒から分離して、NMR及びGC−MSにより同定し、続いて、キャピラリーカラムとフレームイオン化検出器とを備えたGC(HP6890)を用いて定量分析を行った。本明細書に記載したすべての結果に関して、選択率は、以下のとおりである。
選択率%=(生成物濃度/全生成物濃度)×100
【0057】
(3)相挙動の検討
サファイア窓を備えた10ml高圧可視化セル内で、ベンゾニトリル及びアジポニトリルの相挙動を調べた。内容物を撹拌するために、マグネティックスターラー上にセルを配置し、そして、可視化セル内の圧力を調整するために、圧力コントローラーに接続した。それに加えて、ベンゾニトリル及びアジポニトリルに対して、それぞれ50℃及び80℃の所望の温度を保持するために、温度コントローラーを使用した。7〜14MPaの間でCO2圧を変化させて、ベンゾニトリルの場合には、2MPa、及びアジポニトリルの場合には、4MPaの一定水素圧で、基質を、可視化セル内に導入し、相挙動をモニターした。
【0058】
化2のスキーム(a)及び(b)は、scCO2中におけるベンゾニトリル及びアジポニトリルの水素化の予想反応経路を示している。ベンゾニトリル(BN)は、ベンジルアミン(BA)に水素化され、反応条件に依存して、それに続いて、ジベンジルアミン(DBA)を生成する。一方、アジポニトリルの水素化からは、生成物として、6−アミノカプロニトリル(ACN)のみが検出された。
【0059】
(4)触媒のスクリーニング
活性金属イオンの性質及び触媒の支持体は、活性及び特定の反応の生成物分布を記述する最も重要なパラメーターである。したがって、最初に、さまざまな触媒を用いて、ベンゾニトリル及びアジポニトリルの水素化を行った。その結果を表1に示す。これらの結果から明らかなように、実験反応条件下では、Pd触媒が、他のいずれの触媒よりも、ベンゾニトリルの水素化に関して効率的であった。
【0060】
【表1】

【0061】
Pt触媒及びRh触媒を用いたときのベンゾニトリルの転化率は低く、15〜30%の範囲内であり(項目4〜8)、一方、Pd触媒を用いたときの転化率は比較的高く、Pd/C触媒では、100%に達する。しかしながら、Pd/MCM−41を用いると、第一級アミンの顕著な選択率が得られ(90.9%)、Pd/C触媒を用いると、第二級アミンが形成される。したがって、本発明者らは、さらなる実験のために、Pd/MCM−41を選択し、その結果を、Pd/C触媒と比較した。
【0062】
種々の貴金属触媒を用いて、アジポニトリルの水素化を行った。その生成物は、金属の性質に依存せずに、6−アミノカプロニトリルだけであった。中でも、Rh含有触媒は、転化率及び選択率が高いので、最も有望な触媒であると考えられる。したがって、種々の反応パラメーターを調べるために、市販のRh/Al2O3(項目16、転化率=100%)を利用した。これは、Rh/MCM−41(項目17、転化率=78.3%)と比較して、より良好な活性を示す。
【0063】
(5)ベンゾニトリルの水素化に及ぼすCO2圧の影響
ベンゾニトリルの水素化の反応パラメーターを最適ないし好適化するために、50℃、かつ一定水素圧で、Pd/MCM−41触媒及びPd/C触媒を用いて、CO2圧の影響及びCO2なしの場合の影響を調べた[図1(a)及び1(b)]。その結果からわかるように、CO2圧を8MPaから10MPaに増大させると、Pd/MCM−41を用いた場合、ベンゾニトリルの転化率は、64.9%から90.2%に増大し、第一級アミンの選択率は、64.9%から90.9%に増大した。
【0064】
圧力を14MPaまでさらに増大させると、転化率は、51.5%の有意な減少を示し、第一級アミンへの選択率は、30%に有意に減少する。この過程は、可視化セルを介して、CO2及び反応物の相挙動を目視観測することにより説明可能である。
【0065】
本実験の結果、基質、水素、及びCO2は、圧力が10MPa超に増大すると、気液相から単一の均一相に変化することが示された。ベンゾニトリルの転化率の減少は、媒体の単なる希釈効果に起因する。一方、ジベンジルアミンの選択率の増大は、触媒表面上のベンゾニトリルの濃度の増大に関連すると思われる。
【0066】
ニトリルの水素化は、化3のスキームに示される工程で行われることが示された。この反応スキームによれば、第二級アミンは、第一級アミンへのイミンの求核付加ならびにそれに続くNH3の脱離及びCN基の水素化により生成される。より高いCO2圧での第二級アミンの生成は、scCO2中へのイミンの溶解性が高いことにより説明されると考えられる。
【0067】
【化3】

【0068】
イミンは、CO2中にかなり可溶であり、かつその溶解性は、CO2圧とともに増大することが確認されている。したがって、イミンの溶解性が増大すると、イミンと第一級アミンとの間の縮合工程及びそれに続く第二級アミンの生成に有利である。縮合工程は、中間体イミンの脱着前に金属表面上で進行する。したがって、単にCO2圧を調整することにより、生成物分布を変化させることが可能である。
【0069】
同様に、図1(b)から明らかなように、Pd/C触媒は、ジベンジルアミンへの選択性がある。第一級アミンへの最大の選択率(44.7%)は、8MPaで達成されたが、圧力が14MPaに増大すると、0.0%に減少する。その結果にしたがって、CO2なしで、反応を行ったところ[図1(b)]、転化率(18%)の著しい減少は、物質移動制限に起因することが明らかであった。
【0070】
同一反応条件下でのPd/MCM−41触媒とPd/C触媒との間のこの活性差は、担体の効果に由来する可能性がある。周知のごとく、C担体は、MCM−41と比較して、かなり酸性である。担体の酸性度は、ニトリルの水素化に関して議論の余地のある問題である。一部の著者らは、酸性度が第二級アミンの生成に有利であると主張しており、他の著者らは、選択率になんら影響しないと報告している。ここに提示された結果では、酸性の担体を用いた場合、第二級アミンの生成に関してCO2効果が顕著であることが示唆された。したがって、第一級アミンとイミンとの縮合を開始する酸性部位の役割は、無視できない。
【0071】
(6)アジポニトリルの水素化に及ぼすCO2圧の影響
アジポニトリルを水素化すると、CO2圧に依存せずに、6−アミノカプロニトリルだけが生成される。しかしながら、転化率は、圧力によって強く影響される。これは、図2に示される。その結果から明らかなように、CO2圧を6MPaから8MPaに増大させると、アジポニトリルの転化率は、約46%から100%に変化し、圧力が8MPaを超えると、減少し始めた。
【0072】
CO2圧の増大に伴う転化率の減少は、(i)溶媒とニトリル基との相互作用(これは、化合物の反応性を決定付ける)、及び(ii)単なる希釈効果、に関連すると思われる。2個のニトリル基の共吸着は、起こりそうにない。したがって、ニトリル基の一方が、最初にアミンに選択的に水素化され、そして、類似の基が存在するために、同一の活性部位に対して、ジニトリルとアミノニトリルとの間の競合が増大される[非特許文献18]。
【0073】
周知のごとく、Ru金属は、表面上へのニトリル種の吸着を促進し、最も可能性の高い律速工程は、水素移動が起こると思われる脱着である。したがって、この特定の基質を水素化するために、基質の吸着と生成物の脱着との間の適正バランスにより、最大水素化速度を得ることが期待される。しかしながら、現状では、CO2圧の増大に伴う基質の溶解性の増大に起因して、触媒表面上へのアジポニトリルの吸着速度は、アミンの脱着速度よりも大きいので、転化率の減少を生じる。
【0074】
(7)ベンゾニトリルの水素化に及ぼすH2圧の影響
図3(a)及び(b)は、それぞれ、Pd/MCM−41触媒及びPd/C触媒を用いたベンゾニトリルの水素化に及ぼす1MPaから4MPaへの水素圧変化の影響を示している。観測された最大の活性及び選択率に基づいて、温度(50℃)及びCO2圧(10MPa)を一定に保持した。水素圧が1MPaから4MPaに増大すると、ベンゾニトリルの転化率は、Pd/MCM−41を用いた場合、44.2%から95%に増大されたが、ベンジルアミンの選択率は、60%に低減された。
【0075】
同様に、転化率は、また、Pd/C触媒の場合にも、水素圧とともに41.9%から100%に変化する。しかしながら、ベンジルアミンへの選択率は、1MPaから4MPaへの水素圧の増大に伴って、70%から0%に低減された。したがって、ベンジルアミンの選択率に基づいて、ベンゾニトリルの水素化では、両触媒の圧力条件として、2MPaを選択した。
【0076】
(8)アジポニトリルの水素化に及ぼすH2圧の影響
アジポニトリルの水素化の転化率プロファイルは、ベンゾニトリルと同一の傾向を示す。水素圧を1MPaから4MPaに増大させると、媒体中の水素濃度が増大し、結果的に、転化率が28.4%から100%に増大された。しかしながら、6−アミノカプロニトリルからヘキサメチレンジアミンへのさらなる水素化は、まったく観測されなかった。
【0077】
(9)反応時間
周知のごとく、反応の生成物分布は、触媒系の使用条件及び触媒表面上での中間体種の安定性と密接に関連する。反応時間は、反応の速度論に関する概念を提供しうる重要なパラメーターである。Pd/MCM−41及びPd/Cを用いて、ベンゾニトリルの水素化に関して、反応時間の影響についても調べた。図4(a)及び(b)は、時間による触媒活性の変化を示している。
【0078】
観測によれば、水素化速度は、Pd/MCM−41と比較して、Pd/Cを用いた方が速い。たとえば、Pd/Cは、2時間以内の反応で、74%の転化率を示すが、Pd/MCM−41では、44%の転化率が達成されたにすぎない。いずれの場合も、反応条件は同一であるので、これらの結果は、(i)担体の酸性度、(ii)金属粒子のサイズ、及び(iii)金属イオンの酸化状態、に関連すると思われる。既に記載したように、C担体の酸性度は、MCM−41よりも大きく、ジベンジルアミンに至る反応の選択率に影響を及ぼす。
【0079】
次に考慮すべき点は、金属粒子のサイズである。それらの触媒のXRDパターンを用いた粒子サイズ分析(シェラー式の適用)から明らかなように、Pd/Cは、約56nmのより大きい粒子を有し、一方、Pd/MCM−41は、約16nmのPd粒子を含有する。Galvagnoらは、粒子サイズの変化に伴って、触媒性能が変化することを見いだし、金属粒子のサイズにより表面構造が異なることが原因であるとした。彼らの示唆したところによれば、特に、反応がいくつかの隣接表面原子を必要とする場合、密に充填された平面の寄与は、粒子サイズの増大に伴って増大し、表面構造のこうした改質は、異なる反応性をもたらす可能性がある。
【0080】
したがって、本発明者らは、異なるPdサイズを有するPd/MCM−41を用いて、反応を行った。その結果は、図5に示される。検討した粒子サイズの範囲は狭いが(16〜25nm)、それにもかかわらず、ここで用いられた反応条件下で、触媒活性の差異により、ベンゾニトリルの水素化の構造敏感性が予想されることは明らかである。反応性のこうした変動は、表面Pd粒子の電子状態及び反応物の吸着特性の差異に起因する可能性がある。
【0081】
より大きい粒子の触媒活性は、反応物の吸着強度が高いより小さい粒子と比較してより大きい。これらの2種の触媒を区別するもう1つのパラメーターは、Pdの酸化状態である。仮焼Pd/MCM−41のXRDパターン(図示せず)から、PdOの存在が示唆された。一方、Pd/Cは、Pd0を含有する。しかしながら、MCM−41に担持されたPdOは、水素の存在下で容易に還元されるので、Pd0に還元されたと思われる。したがって、Pd粒子サイズの差異は、Pd/C触媒を用いた方が、反応速度が速いことを説明する理由になりうる。
【0082】
アジポニトリルの水素化に関する実験は、また、反応時間を変化させることによっても行われ、その結果は、図6に示される。その結果によれば、アジポニトリルの転化率は、反応時間とともに増大し、全転化は、4時間の反応時間内で達成可能である。しかしながら、6−アミノカプロニトリルが唯一の生成物である場合、生成物の選択率に及ぼす反応時間の影響は、まったく観測されなかった。
【0083】
アジポニトリルの液相水素化では、類似のRh/Al2O3触媒もまた、時間とともに転化率の増大を示すが、それに加えて、6−アミノカプロニトリルからヘキサメチレンジアミンへのさらなる水素化が起こった。ヘキサメチレンジアミンの生成を調べるために、反応時間を24時間まで延長したが、6−アミノカプロニトリルの選択率は一定に保たれた。
【0084】
さらにまた、本方法は、類似の反応条件下で、ヘキサンニトリル(−CN基は1個だけ)及びテレフタロニトリルの水素化にも拡張され、前者は、ヘキサンアミンに水素化されたが、後者は、4−アミノメチルベンゾニトリルで停止した。この場合も、こうした結果は、1個のニトリル基だけが触媒表面に吸着可能であり、ジニトリルとアミノニトリルとの競合が反応の選択率を決定付けることに起因する。
【0085】
(10)温度の影響
水素圧及びCO2圧を、それぞれ一定の4MPa及び10MPaに保持して、35℃、50℃、及び70℃で、Pd/MCM−41触媒及びPd/C触媒を用いて、ベンゾニトリルの水素化に及ぼす温度の影響を調べた。Pd/MCM−41を用いた場合、温度が35℃から70℃に変化するにつれて、反応速度が増大するとともに、ベンジルアミンへの選択率が91.6%から40%に減少する。Pd/Cでは、ベンゾニトリルの転化率、さらにはジベンジルアミンへの選択率も、また、温度とともに増大された。
【0086】
アジポニトリルの水素化に及ぼす温度のプラスの影響も、また、明瞭に観測された。固定CO2圧(8MPa)で、35℃、50℃、70℃、80℃、及び90℃で、反応を行った。温度が低い場合(35℃)、転化率は非常に低い(5.2%)。系の温度を、50℃から80℃に上昇させると、6−アミノカプロニトリルの生成速度は、52.5%から100%に有利に増大され、90℃まで一定に保たれる。しかしながら、生成物の選択率に及ぼす温度の影響は、まったくなかった。
【0087】
いずれの場合も、反応温度は、転化率に影響を及ぼした。このことは、基質−水素−CO2の相挙動により説明可能である。scCO2中では、温度を変更すると、媒体の密度が変化するので、単一相が二相に分離する可能性がある。転化率の増大は、液相中、さらには気相中における反応速度の劇的な増大に起因しうる。これにより、相分離のマイナスの影響が補償される。
【0088】
(11)触媒のリサイクル
不均一系触媒は、リサイクルの利点を提供できるとされているので、本発明者らは、再利用のために、単に濾過により、それを分離した。5回目のリサイクルの後の結果を前述の表1(項目9、項目18)に示す。この結果から、両方のニトリルで、触媒の再利用が可能であることが示唆された。ニトリルの水素化時における金属部位のブロッキングによる触媒失活の主な理由の1つであるこの事実は、イミン中間体が、scCO2中への高い溶解性を有することを考慮することにより、立証されると思われる。
【0089】
結果として、scCO2は、ベンゾニトリル及びアジポニトリルから、それらの対応するアミンへの水素化を促進する有望な媒体であることが実証された。いかなる添加剤も用いることなく、Pd/MCM−41触媒を用いて、ベンゾニトリルの水素化から第一級アミンへの高い転化率(90.2%)及び選択率(91%)が達成された。ベンゾニトリルでは、CO2圧、粒子サイズ、及び担体の性質は、第一級アミンの選択率を決定する最も重要なパラメーターである。単にCO2圧の調整及び中性MCM−41から酸性Cへの担体の変更を行うだけで、もう1つの重要な化合物ジベンジルアミンが生成された。
【0090】
さらには、CO2圧は、また、アジポニトリルの転化率を増大させる効果的な役割も果たす。CO2圧及び温度に依存して、Rh/Al2O3触媒を用いてアジポニトリルから6−アミノカプロニトリル(ナイロン66に非常に重要な化合物;100%)への完全転化が達成された。触媒は、両方とも、リサイクルして好結果を得ることが可能である。ここに提示されたこの簡便な方法は、ニトリルを水素化するためのクリーンな化学プロセスのさらなる改良を行うのにきわめて適していると思われる。
【産業上の利用可能性】
【0091】
以上詳述したように、本発明は、超臨界二酸化炭素中における有機ニトリル化合物の水素化物の製造方法に係るものであり、本発明により、ベンゾニトリル及びアジポニトリルなどの有機ニトリル化合物の水素化時に、超臨界二酸化炭素(scCO2)を使用して、いかなる添加剤も用いることなく、Pd/MCM−41触媒又はRh/Al2O3触媒を用いて、たとえば、ベンゾニトリルを高選択率(90.9%)でベンジルアミンに水素化し、アジポニトリルを高転化率及び高選択率(選択率100%)で6−アミノカプロニトリルに水素化することを可能とする水素化物の製造方法が提供される。
【0092】
本発明では、単にCO2圧を調整することにより、ベンジルアミン又はジベンジルアミンを得ることが可能であり、たとえば、より低い圧力領域では、保護剤としてのCO2作用により、第一級アミンが生成されるが、より高い圧力では、第一級アミンの収率さらにはCO2中へのイミン中間体の溶解性が増大して、ジベンジルアミンの選択率が高くなる。本発明は、溶媒とニトリル基との相互作用及び触媒の同一の活性部位に対するジニトリルとアミノニトリルとの改善された競合により、それぞれ、アミノニトリル生成物のより高い転化率及び選択率が得られることを可能とする有機ニトリル化合物の水素化物の製造方法を提供するものとして有用である。
【技術分野】
【0001】
本発明は、超臨界二酸化炭素中における有機ニトリル化合物の水素化物の製造方法に関するものであり、さらに詳しくは、ベンゾニトリル、アジポニトリルなどの有機ニトリル化合物を、超臨界二酸化炭素(scCO2)を使用して、いかなる添加剤も用いることなく、Pd/MCM−41触媒又はRh/Al2O3触媒を用いて、たとえば、ベンゾニトリルを高選択率(90.9%)でベンジルアミンに水素化し、アジポニトリルを高転化率及び高選択率(選択率100%)で6−アミノカプロニトリルに水素化することを可能とする有機ニトリル化合物の水素化物の製造方法に関するものである。
【背景技術】
【0002】
超臨界二酸化炭素(scCO2)は、迅速かつ選択的な有機合成に供される有望な「グリーン」反応媒体であり、過去数年間にわたり、いくつかの不均一系触媒反応が超臨界二酸化炭素媒体中で行われ、好結果が得られている。その多くは、従来の有機溶媒中で行った場合と比較して、選択率が高いだけでなく、反応速度がより速く、かつ生成物分布が異なる例が報告されている[非特許文献1]。
【0003】
観測された高い選択率の原因は、CO2に関して報告された溶媒属性や、興味深い超分子相互作用についての理解の最近の進展に鑑みて、重要であり、それは、物質移動制限のような、従来の均一系及び不均一系の触媒に伴う問題点を克服する、大きな可能性を有する。そうした問題点は、気相中及び液相中の反応物間で頻繁に生じるが、CO2中における反応は、主に圧力及び温度により変化する。
【0004】
CO2と基質又は触媒との化学的相互作用は、選択率を制御することの可能性を提供する。たとえば、アミンは、CO2と反応してカルバミン酸又はアンモニウムカルバメートを生成することができる。したがって、アミン基を保護することにより、反応の選択率を改良したり、さらには、触媒の失活を防止したりする可能性を期待することができる。
【0005】
ニトリルからアミンへの水素化は、工業的に重要なプロセスであり、一般的には、高い水素圧を用いて、液相中で行われる[非特許文献2]。アミンは、医薬品工業、農薬工業、及びプラスチック工業で中間体として使用される。たとえば、ベンジルアミンは、ビタミンH(ビオチン)のようないくつかの薬剤で、アミド、イソシネート、写真材料用中間体[非特許文献3]、及びジベンジルアミン(腐食防止剤としても使用される)の製造で、ガソリン添加剤の製造で、医薬品工業で、SBRゴムの製造におけるゴム及びタイヤの配合で、利用される[非特許文献4〜6]。一方、アジポニトリルの水素化により得られる6−アミノカプロニトリルは、同様に周知の工業上魅力的なナイロン−6の製造に供されるモノマーである。
【0006】
ベンゾニトリルの水素化は、均一系触媒[非特許文献7]、及び不均一系触媒[非特許文献8]を用いて研究されてきた。均一系触媒の場合、第一級アミンへの選択率は高いが、触媒/生成物の分離の困難を伴う。均一系触媒と比較して、不均一系触媒は、第一級アミンへの不十分な選択率を呈する。したがって、第一級アミンの選択率を増大させるためにNH3を適用することは、不均一系触媒反応で最も多く使用される技術である[非特許文献9]。
【0007】
しかしながら、NH3は、加圧貯蔵のようないくつかの問題点を有し、しかも必要量が多いので、環境上及び経済上の問題を生じる。さらには、第一級アミンの高選択率を達成するために、HCl、CH3COOH、及び酸無水物のような、さまざまな酸が、Pd/C触媒又はラネーNi触媒とともに使用されて来た[非特許文献10]。そのほかに、高温の反応条件、及び過酷な反応条件、Ni、Co、Fe、Pt、Pd、Ru、及びRhのような、さまざまなタイプの金属の使用も、また、第一級アミンの選択率の増大の一翼を担っている[非特許文献11]。
【0008】
Volf及びPasek[非特許文献12]は、液相中におけるニトリルの水素化について検討し、Ni及びCoが、第一級アミンの製造に最良の選択肢であり、いくつかの添加剤を必要とすることを示した。最近、Hegeduesら[非特許文献13]も、また、ジクロロメタン/水中で、10%Pd/C触媒を用いて、酸性添加剤としてのNaH2PO4を使用して、ベンジルアミンの高選択率(95%)を達成した。
【0009】
言うまでもなく、選択率を増大させるために添加剤を用いると、廃棄物問題を生じ、添加剤がリサイクルされない場合、プロセス費用が増大し、生成物の分離が妨害され、特定の運転回数後の触媒効率が低下するので、工業規模で容易に実施することは困難である。液相水素化の代わりに、Xieらは、ベンゾニトリルの水素化のために不均一系触媒(NiCl2/NaBH4触媒の溶液)及び均一系触媒(RhH(P−i−Pr3)3)とともにCO2+エタノール(ガス膨張液体)媒体を使用し[非特許文献14]、CO2の保護的役割を説明した。
【0010】
ベンゾニトリルと同様に、アジポニトリルの水素化は、文献量が多いことからわかるように、非常に重要である[非特許文献15]。反応は、通常の有機溶媒中、高い水素圧で行われ、最も頻繁に用いられる触媒は、ラネーNiである。いくつかの問題点(脆弱、取扱い困難、環境上有害)が原因で、ラネーNi触媒は、Ni/MgO触媒、Rh/Al2O3触媒、及びNi/Al2O3触媒で置き換えられてきた。さらには、PVP中に包埋されたRhは、6−アミノカプロニトリルの形成に関して選択性の高い触媒であるが(85%)、転化率が低い(33%)ことが報告された。
【0011】
さらにまた、Maresら[非特許文献16]は、純NH3媒体中で、Rh/MgOが、6−アミノカプロニトリルの形成に関して選択性があることを見いだした(選択率94.1%、転化率70%)。アジポニトリルの水素化は、高選択率を達成すべく気相条件でも研究されているが、結果は不満足なものであった[非特許文献17]。これまで、scCO2中におけるアジポニトリルの水素化に関する文献は、見当たらない。
【先行技術文献】
【非特許文献】
【0012】
【非特許文献1】Baiker,Chem.Rev.,1999,99,453;A.Furstner,L.Ackermann,K.Beck,H.Hori,D.Koch,K.Langeman,M.Liebl,C.Six and W.Leitner,J.Am.Chem.Soc.,2001,123,9000;K.Wittmann,W.Wisniewski,R.Mynott,W.Leitner,C.L.Kranemann,T.Rische,P.Eilbracht,S.Kluwer,J.M.Ernsting and C.J.Elsevier,Chem.−Eur.J.,2001,7,4584
【非特許文献2】Ullmann’s Encyclopedia of Industrial Chemistry,fifth rev.ed.,Vol.A2,VCH Verlag,Weinheim,1985,p.1
【非特許文献3】A.Kleemann,J.Engel,B.Kutscher,D.Reichert,Pharmaceutical Substances:Syntheses,Patents,Applications,fourth ed.,Stuttgart Georg Verlag,New York,2001
【非特許文献4】B.Wanderott,Z.Metallkd.56(1965)63
【非特許文献5】S.Gomez,J.A.Peters,J.C.Van der Waal,W.Zhou,T.Maschmeyer,Catal.Lett.,84,2002,1−4
【非特許文献6】Buehler,D.R.,Keister,G.P.,Long,I.F.,Du Pont 1969 US Pat.3 461 167
【非特許文献7】Toti,A.;Frediani,P.;Salvini,A.;Rosi,L.;Giolli,C.;Giannelli,C.C.R.Chim.2004,7,769−778;Bianchini,C.;Dal Santo,V.;Meli,A.;Oberhauser,W.;Psaro,R.;Vizza,F.Organometallics 2000,19,2433−2444;Chin,C.S.;Lee,B.N.Catal.Lett.1992,14,135−140;Nishimura,S.Handbook of Heterogeneous Catalytic Hydrogenation for Organic Synthesis;John Wiley & Sons:New York,2001;Chapter 7,p 254−285;T.Li,I.Bergner,F.Nipa Haque,M.Zimmer De−Iuliis,D.Song,R.H.Morris,Organometallics,2007,26,5940−5949
【非特許文献8】Xie,X.;Liotta,C.L.;Eckert,C.A.Ind.Eng.Chem.Res.2004,43,7907−7911;Kukula,P.;Studer,M.;Blaser,H.−U.AdV.Synth.Catal.2004,346,1487−1493;Blaser,H.U.;Malan,C.;Pugin,B.;Spindler,F.;Steiner,H.;Studer,M.AdV.Synth.Catal.2003,345,103−151;Gomez,S.;Peters,J.A.;Maschmeyer,T.AdV.Synth.Catal.2002,344,1037
【非特許文献9】C.F.Winans,J.Am.Chem.Soc.1939,61,3566;A.M.C.F.Castelijns,P.J.D.Maas,EP Patent 0644177,1995;C.F.Winans,US Patent 2,217,630,1940
【非特許文献10】W.H.Hartung,J.Am.Chem.Soc.1928,50,3370;E.Miller,J.M.Sprague,L.W.Kissinger,L.F.McBurney,J.Am.Chem.Soc.1940,62,2099;W.H.Carothers,G.A.Jones,J.Am.Chem.Soc.1925,47,3051
【非特許文献11】C.V.Rode,M.Arai,M.Shirai,Y.Nishiyama,Appl.Catal.A general,1997,148,405−413
【非特許文献12】Volf,J.Pasek,in:L.Cerveny(Ed.),Catalytic Hydrogenation,Elsevier,Amsterdam,Stud.Surf.Sci.Catal.27(1986)105−144
【非特許文献13】L.Hegedus,T.Mathe,Appl.Catal.A:General,296,2005,209−215
【非特許文献14】X.Xie,C.L.Liotta,C.Eckert,Ind.Eng.Chem.Res.2004,43,7907−7911
【非特許文献15】F.Medina,P.Salagre,J.E.Sueiras and J.L.G.Fierro.J.Catal.142(1993),p.392;F.Medina,P.Salagre,J.E.Sueiras and J.L.G.Fierro.J.Mol.Catal.81(1993),p.363;F.Medina,P.Salagre,J.E.Sueiras and J.L.G.Fierro.J.Chem.Soc.,Faraday Trans.89 18(1993),p.3507;F.Medina,P.Salagre,J.E.Sueiras and J.L.G.Fierro.J.Chem.Soc.,Faraday Trans.89 21(1994),p.3981;X.Yu,H.Li and J.F.Deng.Appl.Catal.A:Gen.199(2000),P.191;H.Li,Y.Xu,H.Li and J.F.Deng.Appl.Catal.A:Gen.216(2001),p.51;H.Li,Y.Xu and J.F.Deng.New J.Chem.11(1999),p.1059
【非特許文献16】F.Mares,J.E.Galle,S.E.Diamond and F.J.Regina.J.Catal.112(1988),p.145
【非特許文献17】X.Yu,H.Li and J.Deng.Appl.Catal.A 199(2000),p.191;H.Li,Y.Xu,H.Li and J.F.Deng.Appl.Catal.A 216(2001),p.51;F.Medina,P.Salagre,J.E.Sueiras and J.L.Fierro.J.Chem.Soc.Faraday Trans.90(1994),p.1455;.Huang and W.M.H.Sachtler.Appl.Catal.A 182(1999),p.365
【非特許文献18】B.W.Hoffer,J.A.Moulijn,Appl.Catal.A:General,2009,352,193−201
【発明の概要】
【発明が解決しようとする課題】
【0013】
本願発明は、超臨界二酸化炭素(scCO2)中で、Pd触媒又はRh触媒を用いて、いかなる添加剤も、有機溶媒も用いることなく、ベンゾニトリル、アジポニトリルなどの有機ニトリル化合物の水素化物を製造する方法を提供することを目的とするものである。
【課題を解決するための手段】
【0014】
上記課題を解決するための本発明は、以下の技術手段から構成される。
(1)超臨界二酸化炭素を反応媒体として、Pd触媒又はRh触媒を用いて、有機ニトリル化合物を水素化してその水素化物を製造する方法。
(2)Pd/MCM−41触媒を用いて、ベンゾニトリルを高選択率で水素化してベンジルアミンを製造する、前記(1)に記載の方法。
(3)Rh/Al2O3触媒を用いて、アジポニトリルを水素化して、6−アミノカプロニトリルを製造する、前記(1)に記載の方法。
(4)CO2圧が、8〜10MPaの範囲である、前記(1)から(3)のいずれかに記載の方法。
(5)CO2圧を調整することにより、ベンジルアミン又はジベンジルアミンを製造する、前記(1)又は(2)に記載の方法。
(6)CO2圧のより低い圧力領域で、保護剤としてのCO2の作用により、第1級アミンを生成させ、より高い圧力領域で、CO2中へのイミン中間体の溶解性を増大させて、ジベンジルアミンを高選択率で生成させる、前記(1)又は(2)に記載の方法。
(7)H2圧が、1〜4MPaの範囲である、前記(1)から(6)のいずれかに記載の方法。
【0015】
次に、本発明について更に詳細に説明する。
本発明では、材料として、ベンゾニトリル、アジポニトリルなどの脂肪族および芳香族系ニトリルやジニトリル化合物、二酸化炭素が用いられ、また、触媒としては、Pd/C、Pd/Al2O3、Pt/SiO2、Rh/C、Rh/Al2O3、Pd/MCM−41、Pt/MCM−41、及びRh/MCM−41触媒が用いられる。ニトリル化合物は、一般式
【0016】
【化1】

【0017】
で表され、nは、1から20までの整数、mは1から4の整数を表す。Rは、CH2で代表されるメチレン鎖や、CH2−Ph−CH2で代表されるフェニル基を含むアルキル鎖、そしてフェニル基を表す。ここで表されるアルキル鎖やフェニル基は更に置換基を有しても構わない。例えば、アジポニトリルは、n=4、m=2で表される。
【0018】
触媒及び反応物を、反応器内に導入し、所要の温度に達した後、高圧液体ポンプを用いて、H2及びそれに続いてCO2を反応器内に仕込み、次に、所望の圧力に圧縮する。生成物の液体を単に濾過により触媒から分離して、NMR及びGC−MSにより同定し、続いて、キャピラリーカラムとフレームイオン化検出器とを備えたGC(HP6890)を用いて定量分析を行い、選択率は、以下により算出する。
選択率%=(生成物濃度/全生成物濃度)×100
【0019】
次に、有機ニトリル化合物として、ベンゾニトリル、アジポニトリルを代表例として説明するが、本発明は、有機ニトリル化合物であれば、適用可能であり、これらに限定されるものではない。サファイア窓を備えた10ml高圧可視化セル内で、ベンゾニトリル、アジポニトリルを反応させる。内容物を撹拌するために、マグネティックスターラー上にセルを配置し、そして、可視化セル内の圧力を調整するために、圧力コントローラーに接続する。それに加えて、ベンゾニトリル及びアジポニトリルに対して、それぞれ50℃及び80℃の所望の温度を保持するために、温度コントローラーをも使用する。7〜14MPaの間でCO2圧を変化させて、ベンゾニトリルの場合には、2MPa、及びアジポニトリルの場合には、4MPaの一定水素圧で、基質を可視化セル内に導入し、相挙動をモニターする。
【0020】
化2のスキーム1(a)及び1(b)は、scCO2中におけるベンゾニトリル及びアジポニトリルの水素化の予想反応経路を示している。ベンゾニトリル(BN)は、ベンジルアミン(BA)に水素化され、反応条件に依存して、それに続いて、ジベンジルアミン(DBA)を生成する。一方、アジポニトリルの水素化からは、生成物として6−アミノカプロニトリル(ACN)が生成する。
【0021】
【化2】

【0022】
活性金属イオンの性質及び触媒の支持体は、活性及び特定の反応の生成物分布を記述する最も重要なパラメーターである。したがって、最初に、さまざまな触媒を用いて、ベンゾニトリル及びアジポニトリルの水素化を行ったが、実験反応条件下では、Pd触媒が、他のいずれの触媒よりも、ベンゾニトリルの水素化に関して効率的である。
【0023】
Pt触媒及びRh触媒を用いたときのベンゾニトリルの転化率は低く、15〜30%の範囲内であり、一方、Pd触媒を用いたときの転化率は比較的高く、Pd/C触媒では、100%に達する。しかしながら、Pd/MCM−41を用いると、第一級アミンの顕著な選択率が得られ(90.9%)、Pd/C触媒を用いると、第二級アミンがもっぱら形成される。
【0024】
さまざまな貴金属触媒を用いて、アジポニトリルの水素化も行ったが、その生成物は、金属の性質に依存せずに、6−アミノカプロニトリルだけである。なかでも、Rh含有触媒は、転化率及び選択率が高いので、最も有望な触媒であると考えられる。Rh/Al2O3は、Rh/MCM−41と比較して、より良好な活性を示す。
【0025】
ベンゾニトリルの水素化の反応パラメーターを調べるために、50℃、かつ一定水素圧で、Pd/MCM−41触媒及びPd/C触媒を用いて、CO2圧の影響及びCO2なしの影響を調べると、CO2圧を8MPaから10MPaに増大させると、Pd/MCM−41を用いた場合、ベンゾニトリルの転化率は、64.9%から90.2%に増大し、第一級アミンの選択率は、64.9%から90.9%に増大する。
【0026】
圧力を14MPaまでさらに増大させると、転化率は、51.5%の有意な減少を示し、第一級アミンへの選択率は、30%に有意に減少する。
【0027】
基質、水素、及びCO2は、圧力が10MPa超に増大すると、気液相から単一の均一相に変化する。ベンゾニトリルの転化率の減少は、媒体の単なる希釈効果に起因する。一方、ジベンジルアミンの選択率の増大は、触媒表面上のベンゾニトリルの濃度の増大に関連する。
【0028】
ニトリルの水素化は、後記する化3のスキームに示される工程で行われる。この反応スキームによれば、第二級アミンは、第一級アミンへのイミンの求核付加ならびにそれに続くNH3の脱離及びCN基の水素化により生成される。より高いCO2圧での第二級アミンの生成は、scCO2中へのイミンの溶解性が高いことによる。
【0029】
イミンは、CO2中にかなり可溶であり、かつその溶解性は、CO2圧とともに増大する。したがって、イミンの溶解性が増大すると、イミンと第一級アミンとの間の縮合工程及びそれに続く第二級アミンの生成に有利である。縮合工程は、中間体イミンの脱着前に金属表面上で進行する。したがって、単にCO2圧を調整することにより、生成物分布を変化させることができる。
【0030】
Pd/C触媒は、ジベンジルアミンへの選択性がある。第一級アミンへの最高選択率(44.7%)は、8MPaで達成されるが、圧力が14MPaに増大すると、0.0%に減少する。CO2なしで、反応を行った場合、転化率(18%)の著しい減少は、おそらく物質移動制限に起因する。
【0031】
同一反応条件下でのPd/MCM−41触媒とPd/C触媒との間のこの活性差は、担体効果に由来する可能性がある。周知のごとく、C担体は、MCM−41と比較して、かなり酸性である。担体の酸性度は、ニトリルの水素化に関して議論の余地のある問題である。
【0032】
アジポニトリルを水素化すると、CO2圧に依存せずに6−アミノカプロニトリルだけが生成される。しかしながら、転化率は、圧力によって強く影響される。CO2圧を6MPaから8MPaに増大させると、アジポニトリルの転化率は、約46%から100%に変化し、圧力が8MPaを超えると、減少し始める。
【0033】
CO2圧の増大に伴う転化率の減少は、溶媒とニトリル基との相互作用(これは、化合物の反応性を決定付ける)、及び単なる希釈効果、に関連すると思われ、2個のニトリル基の共吸着は、起こりそうにない。したがって、ニトリル基の一方が、最初にアミンに選択的に水素化され、そして、類似の基が存在するために、同一の活性部位に対して、ジニトリルとアミノニトリルとの間の競合が増大される。
【0034】
周知のごとく、Ru金属は、表面上へのニトリル種の吸着を促進し、最も可能性の高い律速工程は、水素移動が起こると思われる脱着である。したがって、この特定の基質を水素化するために、基質の吸着と生成物の脱着との間の適正バランスにより、最大水素化速度を得ることが期待されるが、現状では、CO2圧の増大に伴う基質の溶解性の増大に起因して、触媒表面上へのアジポニトリルの吸着速度は、アミンの脱着速度よりも大きいので、転化率の減少を生じる。
【0035】
Pd/MCM−41触媒及びPd/C触媒を用いたベンゾニトリルの水素化に及ぼす水素圧変化の影響は、水素圧が1MPaから4MPaに増大すると、ベンゾニトリルの転化率は、Pd/MCM−41を用いた場合、44.2%から95%に増大されるが、ベンジルアミンの選択率は、60%に低減される。
【0036】
同様に、転化率は、また、Pd/C触媒の場合にも、水素圧とともに41.9%から100%に変化する。しかしながら、ベンジルアミンへの選択率は、1MPaから4MPaへの水素圧の増大に伴って、70%から0%に低減される。
【0037】
アジポニトリルの水素化の転化率プロファイルは、ベンゾニトリルと同一の傾向を示し、水素圧を1MPaから4MPaに増大させると媒体中の水素濃度が増大し、結果的に、転化率が28.4%から100%に増大される。しかしながら、6−アミノカプロニトリルからヘキサメチレンジアミンへのさらなる水素化は、観測されない。
【0038】
反応の生成物分布は、触媒系の使用条件及び触媒表面上での中間体種の安定性と密接に関連するが、反応時間は、反応の速度論に関する概念を提供しうる重要なパラメーターである。水素化速度は、Pd/MCM−41と比較して、Pd/Cを用いた方が速い。たとえば、Pd/Cは、2時間以内の反応で、74%の転化率を示すが、Pd/MCM−41では、44%の転化率が達成されたにすぎない。いずれの場合も、反応条件は同一であるので、これらの結果は、(i)担体の酸性度、(ii)金属粒子のサイズ、及び(iii)金属イオンの酸化状態、に関連すると思われる。C担体の酸性度は、MCM−41よりも大きく、ジベンジルアミンに至る反応の選択率に影響を及ぼす。
【0039】
金属粒子のサイズは、触媒のXRDパターンを用いた粒子サイズ分析(シェラー式の適用)から、Pd/Cは、約56nmのより大きい粒子を有し、一方、Pd/MCM−41は、約16nmのPd粒子を含有する。特に、反応がいくつかの隣接表面原子を必要とする場合、密に充填された平面の寄与は、粒子サイズの増大に伴って増大し、表面構造のこうした改質は、異なる反応性をもたらす可能性がある。
【0040】
したがって、本発明者らは、異なるPdサイズを有するPd/MCM−41を用いて、反応を行った。その結果は、図5に示される。検討した粒子サイズの範囲は狭いが(16〜25nm)、それにもかかわらず、ここで用いられた反応条件下で、触媒活性の差異により、ベンゾニトリルの水素化の構造敏感性が予想されることは明らかである。反応性のこうした変動は、表面Pd粒子の電子状態及び反応物の吸着特性の差異に起因する可能性がある。
【0041】
より大きい粒子の触媒活性は、反応物の吸着強度が高いより小さい粒子と比較してより大きいが、これらの2種の触媒を区別するもう1つのパラメーターは、Pdの酸化状態である。仮焼Pd/MCM−41のXRDパターンから、PdOの存在が示唆される。一方、Pd/Cは、Pd0を含有する。しかしながら、MCM−41に担持されたPdOは、水素の存在下で容易に還元されるので、Pd0に還元されたと思われる。したがって、Pd粒子サイズの差異は、Pd/C触媒を用いた方が、反応速度が速いことの理由になりうる。
【0042】
アジポニトリルの転化率は、反応時間とともに増大し、全転化は、4時間の反応時間内で達成可能である。しかしながら、6−アミノカプロニトリルが唯一の生成物である場合、生成物の選択率に及ぼす反応時間の影響は、まったく観測されない。
【0043】
アジポニトリルの液相水素化では、類似のRh/Al2O3触媒もまた、時間とともに転化率の増大を示すが、それに加えて、6−アミノカプロニトリルからヘキサメチレンジアミンへのさらなる水素化が起こる。ヘキサメチレンジアミンの生成を調べるために反応時間を24時間まで延長しても、6−アミノカプロニトリルの選択率は一定に保たれる。
【0044】
さらにまた、本方法は、類似の反応条件下でヘキサンニトリル(−CN基は1個だけ)及びテレフタロニトリルの水素化にも拡張され、前者は、ヘキサンアミンに水素化されるが、後者は、4−アミノメチルベンゾニトリルで停止する。これは、1個のニトリル基だけが触媒表面に吸着可能であり、ジニトリルとアミノニトリルとの競合が反応の選択率を決定付けることに起因する。
【0045】
Pd/MCM−41触媒及びPd/C触媒による、ベンゾニトリルの水素化に及ぼす温度の影響については、Pd/MCM−41を用いた場合、温度が35℃から70℃に変化するにつれて、反応速度が増大するとともに、ベンジルアミンへの選択率が91.6%から40%に減少する。Pd/Cでは、ベンゾニトリルの転化率、さらにはジベンジルアミンへの選択率も、また、温度とともに増大される。
【0046】
アジポニトリルの水素化に及ぼす温度のプラスの影響も、温度が低い場合(35℃)、転化率は非常に低い(5.2%)。反応系の温度を50℃から80℃に上昇させると、6−アミノカプロニトリルの生成速度は、52.5%から100%に有利に増大され、90℃まで一定に保たれる。しかしながら、生成物の選択率に及ぼす温度の影響は、まったくない。
【0047】
いずれの場合も、反応温度は、転化率に影響を及ぼすが、このことは、基質−水素−CO2の相挙動により説明可能である。scCO2中では、温度を変更すると、媒体の密度が変化するので、単一相が二相に分離する可能性がある。転化率の増大は、液相中、さらには気相中における反応速度の劇的な増大に起因し、これにより、相分離のマイナスの影響が補償される。
【0048】
不均一系触媒は、再利用のために、単に濾過により、それを分離し、リサイクルしたところ、両方のニトリルで、触媒の再利用が可能であることが示唆されるが、これは、ニトリルの水素化時における金属部位のブロッキングによる触媒失活の主な理由の1つであり、この事実は、イミン中間体が、scCO2中への高い溶解性を有することにより、立証される。
【0049】
本発明においては、scCO2は、ベンゾニトリル及びアジポニトリルから、それらの対応するアミンへの水素化を促進する有望な媒体であることが実証された。いかなる添加剤も用いることなく、Pd/MCM−41触媒を用いて、ベンゾニトリルの水素化から第一級アミンへの高い転化率(90.2%)及び選択率(91%)が達成される。ベンゾニトリルでは、CO2圧、粒子サイズ、及び担体の性質は、第一級アミンの選択率を決定する最も重要なパラメーターである。単にCO2圧の調整及び中性MCM−41から酸性Cへの担体の変更を行うだけで、もう1つの重要な化合物ジベンジルアミンが生成される。
【0050】
さらには、CO2圧は、また、アジポニトリルの転化率を増大させる効果的な役割も果たす。CO2圧及び温度に依存して、Rh/Al2O3触媒を用いて、アジポニトリルから6−アミノカプロニトリル(ナイロン66に非常に重要な化合物;100%)への完全転化が達成される。触媒は、両方とも、リサイクルして好結果を得ることが可能である。ここに提示された本発明の方法は、ベンゾニトリル、アジポニトリルなどの脂肪族および芳香族系ニトリルやジニトリル化合物などの有機ニトリル化合物を水素化するためのクリーンな化学プロセスのさらなる改良を行うのにきわめて好適なものとして有用である。
【発明の効果】
【0051】
本発明により、次のような効果が奏される。
(1)ベンゾニトリル及びアジポニトリルなどの有機ニトリル化合物の水素化時に、超臨界二酸化炭素(scCO2)を使用して、いかなる添加剤も用いることなく、Pd/MCM−41触媒又はRh/Al2O3触媒を用いて、たとえば、ベンゾニトリルを高選択率(90.9%)でベンジルアミンに水素化し、アジポニトリルを高転化率及び高選択率(選択率100%)で6−アミノカプロニトリルに水素化することができる。
(2)転化率に及ぼすCO2圧の強い影響が両方のニトリルで観測され、CO2圧が8MPaから10MPaに増大するにつれて転化率は増大し、8〜10Mpaの近傍で最大値に達した後、減少するが、このことは、アジポニトリルでより顕著である。
(3)さらには、単にCO2圧を調整することにより、ベンジルアミン又はジベンジルアミンを得ることが可能であり、たとえば、より低い圧力領域では、保護剤としてのCO2作用により、第一級アミンが生成され、より高い圧力では、第一級アミンの収率さらにはCO2中へのイミン中間体の溶解性が増大して、ジベンジルアミンの選択率が高くなる。
(4)この結果から、scCO2の存在がベンジルアミンの生成に不可欠であり、かつプロセスが構造敏感性である。
(5)アジポニトリルからの6−アミノカプロニトリルの選択率は、CO2圧にも、反応時間、H2圧の変化、温度のような他の反応パラメーターにも依存しない。
(6)溶媒とニトリル基との相互作用及び触媒の同一の活性部位に対するジニトリルとアミノニトリルとの改善された競合により、それぞれ、アミノニトリル生成物のより高い転化率及び選択率が得られる。
【図面の簡単な説明】
【0052】
【図1】(a)Pd/MCM−41及び(b)Pd/Cを用いたベンゾニトリルの水素化の転化率及び選択率に及ぼすCO2圧の影響を示す。反応条件は、触媒=0.1g、基質=1.0g、温度=50℃、PH2=2MPa、及び反応時間=4時間である。
【図2】Rh/Al2O3触媒を用いたアジポニトリルの水素化の転化率に及ぼすCO2圧の影響を示す。反応条件は、触媒=0.1g、基質=1.0g、温度=80℃、PH2=4MPa、及び反応時間=4時間である。
【図3】(a)Pd/MCM−41及び(b)Pd/Cを用いたベンゾニトリルの水素化のH2圧の変化を示す。反応条件は、触媒=0.1g、基質=1.0g、温度=50℃、PCO2=10MPa、及び反応時間=4時間である。
【図4】(a)Pd/MCM−41及び(b)Pd/Cを用いたベンゾニトリルの水素化に及ぼす時間変化の影響を示す。反応条件は、触媒=0.1g、基質=1.0g、温度=50℃、PH2=2MPa、及びPCO2=10MPaである。
【図5】ベンゾニトリルの転化率に及ぼす粒子サイズの影響を示す。
【図6】時間変化させたアジポニトリルの水素化を示す。反応条件は、触媒=0.1g、基質=1.0g、温度=80℃、及びPH2=4MPaである。
【発明を実施するための形態】
【0053】
次に、実施例に基づいて本発明を具体的に説明するが、本発明は、以下の実施例によって何ら限定されるものではない。
【実施例1】
【0054】
1.実験方法
(1)材料
ベンゾニトリル(和光純薬)及びアジポニトリル(Aldrich)は、入手したままの状態で使用した。二酸化炭素(>99.99%)は、日本酸素株式会社により供給された二酸化炭素を用いた。1%Pd/C、5%Pd/Al2O3、1%Pt/SiO2、及び5%Rh/Cは、Aldrich製であり、5%Rh/Al2O3は、和光純薬製である。Pd/MCM−41、Pt/MCM−41、及びRh/MCM−41触媒は、本発明者らの研究室で合成したものである。
【0055】
(2)触媒活性
Pd−MCM−41触媒を用いて、50℃で、ベンゾニトリルの水素化について調べ、一方、80℃におけるアジポニトリルの水素化では、5%Rh/Al2O3触媒を使用した。熱風循環式オーブン内に配置された50mlステンレス鋼製バッチ反応器内で、すべての反応を行った。その方法については、簡潔に述べると次のとおりである。
【0056】
0.1gの触媒及び1.0gの反応物を、反応器内に導入した。所要の温度に達した後、高圧液体ポンプを用いて、H2及びそれに続いてCO2を反応器内に仕込み、次に、所望の圧力に圧縮した。生成物の液体を単に濾過により触媒から分離して、NMR及びGC−MSにより同定し、続いて、キャピラリーカラムとフレームイオン化検出器とを備えたGC(HP6890)を用いて定量分析を行った。本明細書に記載したすべての結果に関して、選択率は、以下のとおりである。
選択率%=(生成物濃度/全生成物濃度)×100
【0057】
(3)相挙動の検討
サファイア窓を備えた10ml高圧可視化セル内で、ベンゾニトリル及びアジポニトリルの相挙動を調べた。内容物を撹拌するために、マグネティックスターラー上にセルを配置し、そして、可視化セル内の圧力を調整するために、圧力コントローラーに接続した。それに加えて、ベンゾニトリル及びアジポニトリルに対して、それぞれ50℃及び80℃の所望の温度を保持するために、温度コントローラーを使用した。7〜14MPaの間でCO2圧を変化させて、ベンゾニトリルの場合には、2MPa、及びアジポニトリルの場合には、4MPaの一定水素圧で、基質を、可視化セル内に導入し、相挙動をモニターした。
【0058】
化2のスキーム(a)及び(b)は、scCO2中におけるベンゾニトリル及びアジポニトリルの水素化の予想反応経路を示している。ベンゾニトリル(BN)は、ベンジルアミン(BA)に水素化され、反応条件に依存して、それに続いて、ジベンジルアミン(DBA)を生成する。一方、アジポニトリルの水素化からは、生成物として、6−アミノカプロニトリル(ACN)のみが検出された。
【0059】
(4)触媒のスクリーニング
活性金属イオンの性質及び触媒の支持体は、活性及び特定の反応の生成物分布を記述する最も重要なパラメーターである。したがって、最初に、さまざまな触媒を用いて、ベンゾニトリル及びアジポニトリルの水素化を行った。その結果を表1に示す。これらの結果から明らかなように、実験反応条件下では、Pd触媒が、他のいずれの触媒よりも、ベンゾニトリルの水素化に関して効率的であった。
【0060】
【表1】

【0061】
Pt触媒及びRh触媒を用いたときのベンゾニトリルの転化率は低く、15〜30%の範囲内であり(項目4〜8)、一方、Pd触媒を用いたときの転化率は比較的高く、Pd/C触媒では、100%に達する。しかしながら、Pd/MCM−41を用いると、第一級アミンの顕著な選択率が得られ(90.9%)、Pd/C触媒を用いると、第二級アミンが形成される。したがって、本発明者らは、さらなる実験のために、Pd/MCM−41を選択し、その結果を、Pd/C触媒と比較した。
【0062】
種々の貴金属触媒を用いて、アジポニトリルの水素化を行った。その生成物は、金属の性質に依存せずに、6−アミノカプロニトリルだけであった。中でも、Rh含有触媒は、転化率及び選択率が高いので、最も有望な触媒であると考えられる。したがって、種々の反応パラメーターを調べるために、市販のRh/Al2O3(項目16、転化率=100%)を利用した。これは、Rh/MCM−41(項目17、転化率=78.3%)と比較して、より良好な活性を示す。
【0063】
(5)ベンゾニトリルの水素化に及ぼすCO2圧の影響
ベンゾニトリルの水素化の反応パラメーターを最適ないし好適化するために、50℃、かつ一定水素圧で、Pd/MCM−41触媒及びPd/C触媒を用いて、CO2圧の影響及びCO2なしの場合の影響を調べた[図1(a)及び1(b)]。その結果からわかるように、CO2圧を8MPaから10MPaに増大させると、Pd/MCM−41を用いた場合、ベンゾニトリルの転化率は、64.9%から90.2%に増大し、第一級アミンの選択率は、64.9%から90.9%に増大した。
【0064】
圧力を14MPaまでさらに増大させると、転化率は、51.5%の有意な減少を示し、第一級アミンへの選択率は、30%に有意に減少する。この過程は、可視化セルを介して、CO2及び反応物の相挙動を目視観測することにより説明可能である。
【0065】
本実験の結果、基質、水素、及びCO2は、圧力が10MPa超に増大すると、気液相から単一の均一相に変化することが示された。ベンゾニトリルの転化率の減少は、媒体の単なる希釈効果に起因する。一方、ジベンジルアミンの選択率の増大は、触媒表面上のベンゾニトリルの濃度の増大に関連すると思われる。
【0066】
ニトリルの水素化は、化3のスキームに示される工程で行われることが示された。この反応スキームによれば、第二級アミンは、第一級アミンへのイミンの求核付加ならびにそれに続くNH3の脱離及びCN基の水素化により生成される。より高いCO2圧での第二級アミンの生成は、scCO2中へのイミンの溶解性が高いことにより説明されると考えられる。
【0067】
【化3】

【0068】
イミンは、CO2中にかなり可溶であり、かつその溶解性は、CO2圧とともに増大することが確認されている。したがって、イミンの溶解性が増大すると、イミンと第一級アミンとの間の縮合工程及びそれに続く第二級アミンの生成に有利である。縮合工程は、中間体イミンの脱着前に金属表面上で進行する。したがって、単にCO2圧を調整することにより、生成物分布を変化させることが可能である。
【0069】
同様に、図1(b)から明らかなように、Pd/C触媒は、ジベンジルアミンへの選択性がある。第一級アミンへの最大の選択率(44.7%)は、8MPaで達成されたが、圧力が14MPaに増大すると、0.0%に減少する。その結果にしたがって、CO2なしで、反応を行ったところ[図1(b)]、転化率(18%)の著しい減少は、物質移動制限に起因することが明らかであった。
【0070】
同一反応条件下でのPd/MCM−41触媒とPd/C触媒との間のこの活性差は、担体の効果に由来する可能性がある。周知のごとく、C担体は、MCM−41と比較して、かなり酸性である。担体の酸性度は、ニトリルの水素化に関して議論の余地のある問題である。一部の著者らは、酸性度が第二級アミンの生成に有利であると主張しており、他の著者らは、選択率になんら影響しないと報告している。ここに提示された結果では、酸性の担体を用いた場合、第二級アミンの生成に関してCO2効果が顕著であることが示唆された。したがって、第一級アミンとイミンとの縮合を開始する酸性部位の役割は、無視できない。
【0071】
(6)アジポニトリルの水素化に及ぼすCO2圧の影響
アジポニトリルを水素化すると、CO2圧に依存せずに、6−アミノカプロニトリルだけが生成される。しかしながら、転化率は、圧力によって強く影響される。これは、図2に示される。その結果から明らかなように、CO2圧を6MPaから8MPaに増大させると、アジポニトリルの転化率は、約46%から100%に変化し、圧力が8MPaを超えると、減少し始めた。
【0072】
CO2圧の増大に伴う転化率の減少は、(i)溶媒とニトリル基との相互作用(これは、化合物の反応性を決定付ける)、及び(ii)単なる希釈効果、に関連すると思われる。2個のニトリル基の共吸着は、起こりそうにない。したがって、ニトリル基の一方が、最初にアミンに選択的に水素化され、そして、類似の基が存在するために、同一の活性部位に対して、ジニトリルとアミノニトリルとの間の競合が増大される[非特許文献18]。
【0073】
周知のごとく、Ru金属は、表面上へのニトリル種の吸着を促進し、最も可能性の高い律速工程は、水素移動が起こると思われる脱着である。したがって、この特定の基質を水素化するために、基質の吸着と生成物の脱着との間の適正バランスにより、最大水素化速度を得ることが期待される。しかしながら、現状では、CO2圧の増大に伴う基質の溶解性の増大に起因して、触媒表面上へのアジポニトリルの吸着速度は、アミンの脱着速度よりも大きいので、転化率の減少を生じる。
【0074】
(7)ベンゾニトリルの水素化に及ぼすH2圧の影響
図3(a)及び(b)は、それぞれ、Pd/MCM−41触媒及びPd/C触媒を用いたベンゾニトリルの水素化に及ぼす1MPaから4MPaへの水素圧変化の影響を示している。観測された最大の活性及び選択率に基づいて、温度(50℃)及びCO2圧(10MPa)を一定に保持した。水素圧が1MPaから4MPaに増大すると、ベンゾニトリルの転化率は、Pd/MCM−41を用いた場合、44.2%から95%に増大されたが、ベンジルアミンの選択率は、60%に低減された。
【0075】
同様に、転化率は、また、Pd/C触媒の場合にも、水素圧とともに41.9%から100%に変化する。しかしながら、ベンジルアミンへの選択率は、1MPaから4MPaへの水素圧の増大に伴って、70%から0%に低減された。したがって、ベンジルアミンの選択率に基づいて、ベンゾニトリルの水素化では、両触媒の圧力条件として、2MPaを選択した。
【0076】
(8)アジポニトリルの水素化に及ぼすH2圧の影響
アジポニトリルの水素化の転化率プロファイルは、ベンゾニトリルと同一の傾向を示す。水素圧を1MPaから4MPaに増大させると、媒体中の水素濃度が増大し、結果的に、転化率が28.4%から100%に増大された。しかしながら、6−アミノカプロニトリルからヘキサメチレンジアミンへのさらなる水素化は、まったく観測されなかった。
【0077】
(9)反応時間
周知のごとく、反応の生成物分布は、触媒系の使用条件及び触媒表面上での中間体種の安定性と密接に関連する。反応時間は、反応の速度論に関する概念を提供しうる重要なパラメーターである。Pd/MCM−41及びPd/Cを用いて、ベンゾニトリルの水素化に関して、反応時間の影響についても調べた。図4(a)及び(b)は、時間による触媒活性の変化を示している。
【0078】
観測によれば、水素化速度は、Pd/MCM−41と比較して、Pd/Cを用いた方が速い。たとえば、Pd/Cは、2時間以内の反応で、74%の転化率を示すが、Pd/MCM−41では、44%の転化率が達成されたにすぎない。いずれの場合も、反応条件は同一であるので、これらの結果は、(i)担体の酸性度、(ii)金属粒子のサイズ、及び(iii)金属イオンの酸化状態、に関連すると思われる。既に記載したように、C担体の酸性度は、MCM−41よりも大きく、ジベンジルアミンに至る反応の選択率に影響を及ぼす。
【0079】
次に考慮すべき点は、金属粒子のサイズである。それらの触媒のXRDパターンを用いた粒子サイズ分析(シェラー式の適用)から明らかなように、Pd/Cは、約56nmのより大きい粒子を有し、一方、Pd/MCM−41は、約16nmのPd粒子を含有する。Galvagnoらは、粒子サイズの変化に伴って、触媒性能が変化することを見いだし、金属粒子のサイズにより表面構造が異なることが原因であるとした。彼らの示唆したところによれば、特に、反応がいくつかの隣接表面原子を必要とする場合、密に充填された平面の寄与は、粒子サイズの増大に伴って増大し、表面構造のこうした改質は、異なる反応性をもたらす可能性がある。
【0080】
したがって、本発明者らは、異なるPdサイズを有するPd/MCM−41を用いて、反応を行った。その結果は、図5に示される。検討した粒子サイズの範囲は狭いが(16〜25nm)、それにもかかわらず、ここで用いられた反応条件下で、触媒活性の差異により、ベンゾニトリルの水素化の構造敏感性が予想されることは明らかである。反応性のこうした変動は、表面Pd粒子の電子状態及び反応物の吸着特性の差異に起因する可能性がある。
【0081】
より大きい粒子の触媒活性は、反応物の吸着強度が高いより小さい粒子と比較してより大きい。これらの2種の触媒を区別するもう1つのパラメーターは、Pdの酸化状態である。仮焼Pd/MCM−41のXRDパターン(図示せず)から、PdOの存在が示唆された。一方、Pd/Cは、Pd0を含有する。しかしながら、MCM−41に担持されたPdOは、水素の存在下で容易に還元されるので、Pd0に還元されたと思われる。したがって、Pd粒子サイズの差異は、Pd/C触媒を用いた方が、反応速度が速いことを説明する理由になりうる。
【0082】
アジポニトリルの水素化に関する実験は、また、反応時間を変化させることによっても行われ、その結果は、図6に示される。その結果によれば、アジポニトリルの転化率は、反応時間とともに増大し、全転化は、4時間の反応時間内で達成可能である。しかしながら、6−アミノカプロニトリルが唯一の生成物である場合、生成物の選択率に及ぼす反応時間の影響は、まったく観測されなかった。
【0083】
アジポニトリルの液相水素化では、類似のRh/Al2O3触媒もまた、時間とともに転化率の増大を示すが、それに加えて、6−アミノカプロニトリルからヘキサメチレンジアミンへのさらなる水素化が起こった。ヘキサメチレンジアミンの生成を調べるために、反応時間を24時間まで延長したが、6−アミノカプロニトリルの選択率は一定に保たれた。
【0084】
さらにまた、本方法は、類似の反応条件下で、ヘキサンニトリル(−CN基は1個だけ)及びテレフタロニトリルの水素化にも拡張され、前者は、ヘキサンアミンに水素化されたが、後者は、4−アミノメチルベンゾニトリルで停止した。この場合も、こうした結果は、1個のニトリル基だけが触媒表面に吸着可能であり、ジニトリルとアミノニトリルとの競合が反応の選択率を決定付けることに起因する。
【0085】
(10)温度の影響
水素圧及びCO2圧を、それぞれ一定の4MPa及び10MPaに保持して、35℃、50℃、及び70℃で、Pd/MCM−41触媒及びPd/C触媒を用いて、ベンゾニトリルの水素化に及ぼす温度の影響を調べた。Pd/MCM−41を用いた場合、温度が35℃から70℃に変化するにつれて、反応速度が増大するとともに、ベンジルアミンへの選択率が91.6%から40%に減少する。Pd/Cでは、ベンゾニトリルの転化率、さらにはジベンジルアミンへの選択率も、また、温度とともに増大された。
【0086】
アジポニトリルの水素化に及ぼす温度のプラスの影響も、また、明瞭に観測された。固定CO2圧(8MPa)で、35℃、50℃、70℃、80℃、及び90℃で、反応を行った。温度が低い場合(35℃)、転化率は非常に低い(5.2%)。系の温度を、50℃から80℃に上昇させると、6−アミノカプロニトリルの生成速度は、52.5%から100%に有利に増大され、90℃まで一定に保たれる。しかしながら、生成物の選択率に及ぼす温度の影響は、まったくなかった。
【0087】
いずれの場合も、反応温度は、転化率に影響を及ぼした。このことは、基質−水素−CO2の相挙動により説明可能である。scCO2中では、温度を変更すると、媒体の密度が変化するので、単一相が二相に分離する可能性がある。転化率の増大は、液相中、さらには気相中における反応速度の劇的な増大に起因しうる。これにより、相分離のマイナスの影響が補償される。
【0088】
(11)触媒のリサイクル
不均一系触媒は、リサイクルの利点を提供できるとされているので、本発明者らは、再利用のために、単に濾過により、それを分離した。5回目のリサイクルの後の結果を前述の表1(項目9、項目18)に示す。この結果から、両方のニトリルで、触媒の再利用が可能であることが示唆された。ニトリルの水素化時における金属部位のブロッキングによる触媒失活の主な理由の1つであるこの事実は、イミン中間体が、scCO2中への高い溶解性を有することを考慮することにより、立証されると思われる。
【0089】
結果として、scCO2は、ベンゾニトリル及びアジポニトリルから、それらの対応するアミンへの水素化を促進する有望な媒体であることが実証された。いかなる添加剤も用いることなく、Pd/MCM−41触媒を用いて、ベンゾニトリルの水素化から第一級アミンへの高い転化率(90.2%)及び選択率(91%)が達成された。ベンゾニトリルでは、CO2圧、粒子サイズ、及び担体の性質は、第一級アミンの選択率を決定する最も重要なパラメーターである。単にCO2圧の調整及び中性MCM−41から酸性Cへの担体の変更を行うだけで、もう1つの重要な化合物ジベンジルアミンが生成された。
【0090】
さらには、CO2圧は、また、アジポニトリルの転化率を増大させる効果的な役割も果たす。CO2圧及び温度に依存して、Rh/Al2O3触媒を用いてアジポニトリルから6−アミノカプロニトリル(ナイロン66に非常に重要な化合物;100%)への完全転化が達成された。触媒は、両方とも、リサイクルして好結果を得ることが可能である。ここに提示されたこの簡便な方法は、ニトリルを水素化するためのクリーンな化学プロセスのさらなる改良を行うのにきわめて適していると思われる。
【産業上の利用可能性】
【0091】
以上詳述したように、本発明は、超臨界二酸化炭素中における有機ニトリル化合物の水素化物の製造方法に係るものであり、本発明により、ベンゾニトリル及びアジポニトリルなどの有機ニトリル化合物の水素化時に、超臨界二酸化炭素(scCO2)を使用して、いかなる添加剤も用いることなく、Pd/MCM−41触媒又はRh/Al2O3触媒を用いて、たとえば、ベンゾニトリルを高選択率(90.9%)でベンジルアミンに水素化し、アジポニトリルを高転化率及び高選択率(選択率100%)で6−アミノカプロニトリルに水素化することを可能とする水素化物の製造方法が提供される。
【0092】
本発明では、単にCO2圧を調整することにより、ベンジルアミン又はジベンジルアミンを得ることが可能であり、たとえば、より低い圧力領域では、保護剤としてのCO2作用により、第一級アミンが生成されるが、より高い圧力では、第一級アミンの収率さらにはCO2中へのイミン中間体の溶解性が増大して、ジベンジルアミンの選択率が高くなる。本発明は、溶媒とニトリル基との相互作用及び触媒の同一の活性部位に対するジニトリルとアミノニトリルとの改善された競合により、それぞれ、アミノニトリル生成物のより高い転化率及び選択率が得られることを可能とする有機ニトリル化合物の水素化物の製造方法を提供するものとして有用である。
【特許請求の範囲】
【請求項1】
超臨界二酸化炭素を反応媒体として、Pd触媒又はRh触媒を用いて、有機ニトリル化合物を水素化してその水素化物を製造する方法。
【請求項2】
Pd/MCM−41触媒を用いて、ベンゾニトリルを高選択率で水素化してベンジルアミンを製造する、請求項1に記載の方法。
【請求項3】
Rh/Al2O3触媒を用いて、アジポニトリルを水素化して、6−アミノカプロニトリルを製造する、請求項1に記載の方法。
【請求項4】
CO2圧が、8〜10MPaの範囲である、請求項1から3のいずれかに記載の方法。
【請求項5】
CO2圧を調整することにより、ベンジルアミン又はジベンジルアミンを製造する、請求項1又は2に記載の方法。
【請求項6】
CO2圧のより低い圧力領域で、保護剤としてのCO2の作用により、第1級アミンを生成させ、より高い圧力領域で、CO2中へのイミン中間体の溶解性を増大させて、ジベンジルアミンを高選択率で生成させる、請求項1又は2に記載の方法。
【請求項7】
H2圧が、1〜4MPaの範囲である、請求項1から6のいずれかに記載の方法。
【請求項1】
超臨界二酸化炭素を反応媒体として、Pd触媒又はRh触媒を用いて、有機ニトリル化合物を水素化してその水素化物を製造する方法。
【請求項2】
Pd/MCM−41触媒を用いて、ベンゾニトリルを高選択率で水素化してベンジルアミンを製造する、請求項1に記載の方法。
【請求項3】
Rh/Al2O3触媒を用いて、アジポニトリルを水素化して、6−アミノカプロニトリルを製造する、請求項1に記載の方法。
【請求項4】
CO2圧が、8〜10MPaの範囲である、請求項1から3のいずれかに記載の方法。
【請求項5】
CO2圧を調整することにより、ベンジルアミン又はジベンジルアミンを製造する、請求項1又は2に記載の方法。
【請求項6】
CO2圧のより低い圧力領域で、保護剤としてのCO2の作用により、第1級アミンを生成させ、より高い圧力領域で、CO2中へのイミン中間体の溶解性を増大させて、ジベンジルアミンを高選択率で生成させる、請求項1又は2に記載の方法。
【請求項7】
H2圧が、1〜4MPaの範囲である、請求項1から6のいずれかに記載の方法。
【図1】


【図2】


【図3】


【図4】


【図5】


【図6】




【図2】


【図3】


【図4】


【図5】


【図6】


【公開番号】特開2011−225502(P2011−225502A)
【公開日】平成23年11月10日(2011.11.10)
【国際特許分類】
【出願番号】特願2010−99198(P2010−99198)
【出願日】平成22年4月22日(2010.4.22)
【新規性喪失の例外の表示】特許法第30条第1項適用申請有り 平成21年10月23日 インターネットアドレス「http://www.rsc.org/greenchem」に発表
【出願人】(301021533)独立行政法人産業技術総合研究所 (6,529)
【Fターム(参考)】
【公開日】平成23年11月10日(2011.11.10)
【国際特許分類】
【出願日】平成22年4月22日(2010.4.22)
【新規性喪失の例外の表示】特許法第30条第1項適用申請有り 平成21年10月23日 インターネットアドレス「http://www.rsc.org/greenchem」に発表
【出願人】(301021533)独立行政法人産業技術総合研究所 (6,529)
【Fターム(参考)】
[ Back to top ]

