超音波癌治療促進剤
【課題】高い安全性を確保しながら、超音波による癌の治療効果を著しく向上できる超音
波癌治療促進剤の提供。
【解決手段】この超音波癌治療促進剤は、金属半導体粒子を含んでなり、超音波の照射に
より活性化して癌細胞を死滅ないし破壊することができる。
波癌治療促進剤の提供。
【解決手段】この超音波癌治療促進剤は、金属半導体粒子を含んでなり、超音波の照射に
より活性化して癌細胞を死滅ないし破壊することができる。
【発明の詳細な説明】
【発明の背景】
【0001】
発明の分野
本発明は、患部に超音波を照射することにより行われる超音波癌治療を促進するための、超音波癌治療促進剤に関するものである。
【0002】
背景技術
近年、癌治療において、治療効果と患者のQOL(生活の質)の両方の向上を図るために、非侵襲で効率的に患部を治療することができる音響化学療法が提案されている。これは、超音波の照射により、投与した薬剤(超音波併用剤)の抗腫瘍活性化を行い、腫瘍の治療を行なうというものである。超音波治療用併用剤として、フラーレンを用いる方法が知られている(例えば、特許文献1(特開2002−241307号公報)および特許文献2(国際公開第2002/66061号パンフレット)参照)。また、超音波治療用併用剤として、色素を用いる方法も知られている(特許文献3(特開2001−253836号公報)、特許文献4(国際公開第98/1131号パンフレット)、および特許文献5(特開2003−226654号公報)を参照)。このような方法にあっては、光によりラジカル種を発生する有機物またはフラーレンを超音波の効果により励起させることによって、治療が行われる。
【0003】
一方、酸化チタンの光触媒活性を癌治療に利用する提案もなされている。例えば、酸化チタンの医療用具としての利用や(特許文献6(特開平4−357941号公報)参照)、ドラッグデリバリーシステム(DDS)の担体としての利用が提案されている(特許文献7(特開2001−200050号公報)および特許文献8(米国特許第6677606号明細書)参照)。
【0004】
更に、酸化チタンに超音波照射を行い、ヒドロキシラジカルを発生させることにより有機物を分解させる技術も提案されている(例えば、特許文献9(特開2003−26406号公報)および特許文献10(特開2005−7392号公報)参照)。
【0005】
【特許文献1】特開2002−241307号公報
【特許文献2】国際公開第2002/66061号パンフレット
【特許文献3】特開2001−253836号公報
【特許文献4】国際公開第98/1131号パンフレット
【特許文献5】特開2003−226654号公報
【特許文献6】特開平4−357941号公報
【特許文献7】特開2001−200050号公報
【特許文献8】米国特許第6677606号明細書
【特許文献9】特開2003−26406号公報
【特許文献10】特開2005−7392号公報
【発明の概要】
【0006】
本発明者らは、今般、ある種の金属半導体粒子に超音波を照射することにより、高い安全性を確保しながら、超音波による癌の治療効果を著しく向上できるとの知見を得た。また、本発明者らは、上記金属半導体粒子を患者の体内に投与して癌細胞に到達させた上で超音波を患部に照射するといった、ドラッグデリバリーシステムの使用によって、癌の治療効果を更に向上できるとの知見も得た。
【0007】
したがって、本発明は、高い安全性を確保しながら、超音波による癌の治療効果を著しく向上できる超音波癌治療促進剤の提供をその目的としている。
【0008】
そして、本発明による、超音波癌治療促進剤は、金属半導体粒子を含んでなるものである。
【発明の具体的説明】
【0009】
本発明による超音波癌治療促進剤は、金属半導体粒子を含んでなるものである。本発明において使用可能な金属半導体粒子は、超音波の照射により活性化して癌細胞を死滅ないし破壊することができる金属半導体を含んでなる粒子であれば限定されず、種々の金属半導体粒子であることができる。ある種の金属半導体粒子が超音波の照射により活性化して細胞を死滅ないし破壊する機構の全容は定かではないが、少なくとも超音波照射によりラジカル種を生成可能な金属半導体粒子であれば上記効果が期待できる。
【0010】
すなわち、金属半導体粒子が与える生物的殺傷効果は、超音波照射によりラジカル種を生成させることにより得ることができる。すなわち、これらの半導体粒子が与える生物的殺傷効果はラジカル種の質的・量的な増加にあると考えられる。その理由は以下の通り推察されるが、以下の理由はあくまで仮説であって、本発明は何ら下記説明に限定されるものではない。すなわち、超音波照射のみでは系中には過酸化水素とヒドロキシルラジカルが発生するが、本発明者らの知見によれば、酸化チタンなどの半導体粒子の存在下では、過酸化水素及びヒドロキシルラジカルの生成が促進される。また、これら半導体粒子の存在下、特に酸化チタンの存在下では、スーパーオキサイドアニオンと一重項酸素の生成が促進されるように見受けられる。これらラジカル種の特異的生成は、ナノメートルオーダーの微粒子を用いた場合、超音波照射時に観察される現象である。このような効果が金属半導体微粒子存在下での超音波による特異的な現象であると考えられる。
【0011】
本発明の好ましい態様によれば、金属半導体粒子として光感応特性を有する金属半導体粒子を用いるのが好ましく、より好ましくは、光触媒活性を有する金属半導体粒子、および量子効果により発光を示す量子ドットである。ここで、光触媒活性を有する金属半導体粒子とは光エネルギーを受けて電荷分離を起こす光金属半導体の粒子である。また、量子ドットとは、電子キャリアのエネルギー分布が離散的なため室温等の熱的励起が存在するような状態にあってもキャリアの遷移が量子準位間で不連続に生じ、結果として鋭い発光を示す特徴をもつ構造である。このような粒子によれば、超音波の照射により十分に活性化して細胞を死滅させることができる。これらの金属半導体粒子の具体例としては、TiO2、ZnO、WO3、SnO2、Fe2O3、In2O3、BaTiO3、TiO3、SrTiO3、Nb2O5、Ta2O5等の金属酸化物;CdS、MoS2、ZnS等の金属硫化物;およびSiC、CdSe、InGaP等の複合金属半導体が挙げられる。これらの金属半導体粒子は光感応特性を有するが、フラーレンや色素等の光増感剤ではないため、患者に投与後の治療段階において光過敏症の問題を生じることがなく、安全性が極めて高い。
【0012】
本発明の好ましい態様によれば、金属半導体粒子として光触媒活性を有する金属半導体粒子を用いることができ、好ましい例として、TiO2、ZnO、SnO2、WO3、In2O3、SrTiO3、Nb2O5、Ta2O5が挙げられ、より好ましくはTiO2である。
【0013】
本発明の好ましい態様によれば、金属半導体粒子として量子ドットを用いることができ、好ましい例として、CdSe、Cds、CdTe、ZnS、ZnSe、InGaP、ZnTe、およびそれらの混合物が挙げられる。
【0014】
本発明の好ましい態様によれば、金属半導体粒子は20〜200nmの粒子径を有し、より好ましくは50〜200nmであり、さらに好ましくは50〜150nmである。この粒径範囲であると、腫瘍への到達を目的として患者の体内に投与されると、ドラッグデリバリーシステムのように、EPR効果により癌組織に効率的に到達して蓄積される。したがって、超音波の照射により高い効率で癌組織を死滅ないし破壊することができる。
【0015】
本発明の別の好ましい態様によれば、金属半導体粒子が50nm未満(例えば数nm)の粒子径を有する場合、金属半導体粒子同士を多官能リンカーで連結し、見かけ上のサイズを大きくしてEPR効果を得ることもできる。特に、この態様は、金属半導体粒子として量子ドットを使用する場合に有効である。すなわち、量子ドットは一般的に2nm〜10nmの粒径を有するが、50〜150nmの粒子径を有する二次粒子の形態を有するように複数個の量子ドットを凝集または結合されることで、EPR効果により高い癌治療効果を実現することができる。本発明の更に別の好ましい態様によれば、EPR効果を利用するため、リポソームのような薬剤封入体の中に、金属半導体粒子を包摂させることもできる。また、このようにして得られる複合粒子に更に抗体等の生体素子を付与すれば、EPR効果以上の、腫瘍へのターゲッティングも可能である。
【0016】
本発明に使用可能な金属半導体粒子は、単一種類の金属半導体粒子のみならず、複数種類の金属半導体粒子の混合物あるいは複合物も包含する。具体例としては、酸化チタンナノ粒子と酸化鉄ナノ粒子との複合物、酸化チタンナノ粒子と白金との複合物、およびシリカ被覆された酸化チタン等が挙げられる。
【0017】
本発明の好ましい態様によれば、金属半導体粒子の表面に、ポリマーまたは生体由来高分子が結合されてなるのが好ましい。これにより、もともと固体中性であるような半導体を用いる場合においても、半導体粒子を主成分とする超音波癌治療用促進剤の分散化が達成され、生体環境において、安全な投与を可能とすることができる。ここで、金属半導体粒子表面に結合するポリマーとしては、親水性高分子であればよい。半導体粒子とポリマーおよび/または生体由来高分子との結合形態としては、血中滞留性を確保する観点から、体内への投与後24〜72時間後に分散性が確保されている程度の結合形態であれば特に限定されないが、生理条件での分散安定性に優れ、かつ超音波照射後もポリマーの遊離が無く正常細胞へのダメージが少ない点で、共有結合が望ましい。
【0018】
本発明の好ましい態様によれば、金属半導体粒子表面に結合されるポリマーとして、カルボキシル基を有するポリマー、例えば、カルボキシメチルデンプン、カルボキシメチルデキストラン、カルボキシメチルセルロース、ポリカルボン酸類、およびカルボキシル基単位を有する共重合体(コポリマー)を用いるのが好ましく、より好ましくは、親水性高分子の加水分解性および溶解度の観点から、ポリアクリル酸、ポリマレイン酸等のポリカルボン酸類、およびアクリル酸/マレイン酸やアクリル酸/スルフォン酸系モノマーの共重合体(コポリマー)であり、さらに好ましくはポリアクリル酸である。カルボキシル基を有するポリマーが金属半導体粒子表面に結合すると、粒子が負に帯電するため、高度に分散するとともに、生体分子や薬剤を固定化させやすく、点滴等による全身投与にも適する。このため、ポリアクリル酸が表面に結合した金属半導体粒子は、臓器内部の癌の治療に適し、特定の細胞とのアフィニティが高い(生体)分子や薬剤を固定化した場合には、よりアフィニティの高い金属半導体粒子として患部へのターゲッティング療法へ用いることに特に適する。アニオン性ポリマーを固定した半導体粒子複合体の好ましいゼータ電位は、−50〜−20mVである。この範囲内であると、負電荷の反発により粒子の分散性を確保しやすくなり、凝集隗を形成しにくくなるため、投与後に血管の閉塞などの二次的弊害を招くおそれが無い。
【0019】
本発明の好ましい態様によれば、金属半導体粒子表面に結合されるポリマーとして、カチオン性ポリマー、例えば、重量平均分子量が1000〜100000の範囲にあるアミンを用いるのが好ましく、より好ましくは、ポリアミノ酸、ポリペプチド、ポリアミン類、およびアミン単位を有する共重合体(コポリマー)であり、さらに好ましくは、水溶性高分子の加水分解性および溶解度の観点から、ポリエチレンイミン、ポリビニルアミン、ポリアリルアミン等のポリアミン類であり、最も好ましくはポリエチレンイミンである。カチオン性ポリマーが金属半導体粒子表面に結合すると、粒子が正に帯電するため、高度に分散するとともに、急速に細胞内に吸着し取り込まれやすく、注射あるいは塗布による局所投与に適する。このため、ポリエチレンイミンが表面に結合した金属半導体粒子は、皮膚癌や初期癌等の表層の癌の治療に特に適する。カチオン性ポリマーを固定した半導体粒子複合体の好ましいゼータ電位は、+20〜+50mVである。この範囲内であると、正電荷の反発により粒子の分散性を確保しやすくなり、局所投与に好適に用いることができる。
【0020】
本発明の好ましい態様によれば、金属半導体粒子表面に結合されるポリマーとして、ノニオン性ポリマー、例えば、ポリエチレングリコール、ポリビニルアルコール、ポリエチレンオキシド、デキストランあるいはそれらのコポリマーを用いるのが好ましく、より好ましくはポリエチレングリコールである。ノニオン性ポリマーが金属半導体粒子表面に結合すると、粒子は帯電することなく水和により分散するため、体内(血中)で長期間安定し、癌組織へ集積させやすく、全身投与にも適する。このため、ポリエチレングリコールで被覆した金属半導体粒子は、表層から深部に至るまでの広範囲の癌の治療に特に適する。ノニオン性の親水性基を有するポリマーを固定した半導体粒子複合体の好ましいゼータ電位は、−20〜+20mVである。この範囲内であると、血中タンパク質が静電気的に吸着しにくくなるので、細網内皮系への取り込み、腎排泄、肝臓取り込み等を回避しやすくなり、目的部位(腫瘍)に到達できるに足る血中滞留性を確保することができる。
【0021】
本発明の好ましい態様によれば、金属半導体粒子が、溶媒に分散されてなるのが好ましい。これにより、金属半導体粒子を、点滴、注射、塗布等の種々の方法により、患者の体内に効率的に投与することができる。なお、安全性の観点から、分散液は、中性の液性を有するのが好ましく、より好ましくは生理食塩水である。半導体粒子は分散体に対して、0.001〜1質量%以下含有されることが好ましく、より好ましくは0.001〜0.1質量%である。この範囲内であれば、投与後、24〜72時間後に患部(腫瘍)に効果的に粒子を蓄積させることが可能となる。すなわち、患部(腫瘍)に粒子濃度が蓄積しやすくなるとともに、血中での粒子の分散性も確保されて凝集隗が形成しにくくなるため、投与後に血管の閉塞などの二次的弊害を招くおそれも無い。
【0022】
本発明の別の態様によれば、金属半導体粒子を含んでなり、超音波照射を受け、該照射により細胞毒となる、殺細胞剤が提供される。この殺細胞剤は、体内に投与され、超音波照射を受け、該照射により細胞毒となることで、細胞を破壊ないし死滅させることができるが、体内に限らず、試験管内においても殺対象である細胞を破壊ないし死滅させることができる。この態様において、殺対象は特に限定されないが、癌細胞であるのが好ましい。本態様において、細胞毒は、超音波照射により前記半導体粒子が発生するラジカル種により生じるものであるのが好ましい。
【0023】
本発明の超音波癌治療促進剤は、点滴、注射、塗布等の種々の方法により、患者の体内に投与することができる。そして、体内に投与された超音波癌治療促進剤は、ドラッグデリバリーシステムのように、癌組織に到達して蓄積される。そして、超音波癌治療促進剤が蓄積された癌組織に超音波処理が行われる。本発明の好ましい態様によれば、使用する超音波の周波数は、細胞を殺傷する効果および安全性の観点から、20kHz〜20MHzが好ましく、400kHz〜20MHzがより好ましく、さらに好ましくは600kHz〜10MHz、最も好ましくは1MHz〜10MHzである。超音波の照射時間は治療対象である癌組織の位置および大きさを考慮して適宜決定されるべきであり、特に限定されない。こうして、患者の癌組織を超音波により高い効率で死滅ないし破壊して、高い癌治療効果を実現することができる。超音波は生体内の深部に外部より到達させることが可能で、本発明の促進剤と併せて用いることにより、非侵襲の状態で生体内深部に存在するような患部やターゲット部位の治療が実現できる。さらに、患部やターゲット部位に本発明の促進剤が集積することにより、周辺の正常細胞に悪影響を及ぼさない程度の微弱な超音波で本発明の促進剤を集積させた局所のみに作用させることができる。
【0024】
本発明の好ましい態様によれば、金属半導体粒子としてより好ましくはTiO2であるが、該金属半導体粒子の光触媒活性を癌治療に利用する提案もなされている。この際、紫外線を用いた照射によって患部やターゲット部位の治療を行うことが可能であり、その照射到達深度は生体表層部より2mmである。一方で、超音波を用いた照射によって生体内の診断等を行う際は、生体表層部より2mm以上の内部においても可能である。従って超音波を用いることで、より生体内の深部に外部より到達させることが可能で、本発明の促進剤と併せて用いることにより、非侵襲の状態で生体内深部に存在するような患部やターゲット部位の治療が実現できる。
【0025】
本発明の好ましい態様によれば、好ましい適用部位として、切除術が困難な臓器が考えられ、具体的には膵臓癌、膀胱癌、肝臓癌、脳腫瘍があげられる。
【0026】
超音波照射部については特に限定されるべきではないが、本発明の好ましい態様によれば、より効果を得るためには超音波照射部を内視鏡やカテーテル等の患部やターゲット部位に到達可能な器具に設置し、直接的に照射することができる。また、切除術が困難な臓器に対して、あるいは患者のQOLの観点から体外より非侵襲の状態で照射することができる。具体的には消化器の表層癌に対して、腹部より超音波照射を行い患部に超音波を到達させ、癌組織を殺傷できる。
【実施例】
【0027】
例1:ポリアクリル酸結合型酸化チタン(TiO2/PAA)粒子の作製
チタンテトライソプロポキシド3.6gとイソプロパノール3.6gを混合し、氷冷下で60mlの超純水に滴下して加水分解を行った。滴下後に室温で30分間攪拌した。攪拌後、12N硝酸を1ml滴下して80℃で8時間攪拌を行い、ペプチゼーションした。ペプチゼーション終了後、0.45μmのフィルターで濾過し、脱塩カラム(PD10、アマシャム・ファルマシア・バイオサイエンス社)を用いて溶液交換して固形成分1%のアナターゼ型二酸化チタンゾルを調製した。この分散液を容量100mlのバイアル瓶に入れ、200Hzで30分間超音波処理を行った。超音波処理を行う前と後での平均分散粒経は、それぞれ、36.4nm、20.2nmであった。超音波処理後、溶液を濃縮して固形成分20%の二酸化チタンゾル(アナターゼ型)を調製した。
【0028】
得られた二酸化チタンゾル0.75mlを20mlのジメチルホルムアミド(DMF)に分散させ、ポリアクリル酸(平均分子量:5000、和光純薬)0.2gを溶解したDMFを10ml添加後、攪拌して混合した。水熱反応容器に溶液を移し変え、150℃で6時間水熱合成を行った。反応終了後、反応容器温度が50℃以下になるまで冷却し、溶液を取り出した後に水80mlを添加して攪拌混合した。エバポレータでDMFおよび水を除去した後に、再度、水20mlを添加してポリアクリル酸修飾二酸化チタン水溶液とした。2N塩酸1mlを添加して二酸化チタン粒子を沈殿させて、遠心後に上清を除去することにより未反応のポリアクリル酸を分離した。再度水を添加して洗浄を行い、遠心後に水を除去した。50mMリン酸緩衝液(pH7.0)を10ml添加後、200Hzで30分間超音波処理を行い、二酸化チタン粒子を分散させた。超音波処理後、0.45μmのフィルターで濾過し、固形成分1.5%のポリアクリル酸修飾二酸化チタンゾルを得た。作製したポリアクリル酸修飾二酸化チタン微粒子(アナターゼ型)の分散粒径をゼータサイザーナノZS(シスメックス社製)を用いて測定したところ、キュムラント法解析から平均分散粒径は45.5nmであった。この測定は、ゼータ電位測定セルにポリエチレンイミン結合二酸化チタン微粒子を含む分散液0.75mlを仕込み、溶媒の各種パラメーターを水と同値に設定し、25℃にて動的光散乱法により行った。
【0029】
例2:ポリエチレンイミン結合型酸化チタン(TiO2/PEI)粒子の作製
チタンテトライソプロポキシド3.6gとイソプロパノール3.6gを混合し、氷冷下で60mlの超純水に滴下して加水分解を行った。滴下後に室温で30分間攪拌した。攪拌後、12N硝酸1mlを滴下して80℃で8時間攪拌を行い、ペプチゼーションした。ペプチゼーション終了後、0.45μmのフィルターで濾過し、さらに脱塩カラム(PD−10、アマシャム・ファルマシア・バイオサイエンス社製)を用いて溶液交換して固形成分1%の酸性二酸化チタンゾルを調製した。この分散液を容量100mlのバイアル瓶に入れ、200Hzで30分間超音波処理を行った。超音波処理を行う前後の平均分散粒経は、それぞれ、36.4nm、20.2nmであった。超音波処理後、溶液を濃縮して固形成分20%の二酸化チタンゾルを調製した。
【0030】
得られた二酸化チタンゾル0.75mlを20mlのジメチルホルムアミド(DMF)に分散させ、ポリエチレンイミン(平均分子量:10000、和光純薬社製)450mgを溶解したDMF10mlを添加後、攪拌して混合した。水熱反応容器(HU−50、三愛科学社製)に溶液を移し変え、150℃で6時間合成を行った。反応終了後、反応容器温度が50℃以下になるまで冷却し、2倍量のイソプロパノールを添加し、ポリエチレンイミン結合二酸化チタン微粒子を沈殿させ、遠心後に上清を除去することにより未反応のポリエチレンイミンを分離した。70%エタノールを添加して洗浄を行い、遠心後にエタノールを除去した。蒸留水を10ml添加後、200Hzで30分間超音波処理を行い、ポリエチレンイミン結合二酸化チタン微粒子を分散させた。超音波処理後、0.45μmのフィルターで濾過して、固形成分1.5%のポリエチレンイミン結合二酸化チタン微粒子の分散液を得た。作製したポリエチレンイミン結合二酸化チタン微粒子の分散粒径を、ゼータサイザーナノZS(シスメックス社製)を用いて測定したところ、ポリエチレンイミン結合二酸化チタン微粒子の平均粒径は67.7nmであった。この測定は、ゼータ電位測定セルにポリエチレンイミン結合二酸化チタン微粒子の分散液0.75mlを仕込み、溶媒の各種パラメーターを水と同値に設定し、25℃にて動的光散乱法により行った。
【0031】
例3:ポリエチレングリコール結合型酸化チタン(TiO2/PEG)粒子の作製
チタンテトライソプロポキシド3.6gとイソプロパノール3.6gを混合し、氷冷下で60mlの超純水に滴下して加水分解を行った。滴下後に室温で30分間攪拌した。攪拌後、12N硝酸1mlを滴下して80℃で8時間攪拌を行い、ペプチゼーションした。ペプチゼーション終了後、0.45μmのフィルターで濾過し、さらに脱塩カラム(PD−10、アマシャム・バイオサイエンス社製)を用いて溶液交換して固形成分1%の酸性二酸化チタンゾルを調製した。この二酸化チタンゾルを100ml容のバイアル瓶に入れ、超音波発生器MIDSONIC200(カイジョー社製)を用いて200Hzで30分間超音波処理を行った。超音波処理を行った後の平均分散粒経は、12Nの硝酸で1000倍に希釈した後、ゼータサイザーナノZS(シスメックス社製)を用いて、石英測定セルに分散液0.1mlを仕込み、溶媒の各種パラメーターを水と同値に設定し、25℃にて動的光散乱法により測定した。その結果、分散粒径は20.2nmであった。この二酸化チタンゾルを蒸発皿を用いて、50℃下で溶液の濃縮を行い、最終的に固形成分20%の酸性二酸化チタンゾルを調整した。
【0032】
次に、ポリオキシエチレン−モノアリル−モノメチルエーテルと無水マレイン酸の共重合体(平均分子量;33,659−日本油脂製)1gに水5mlを添加して、加水分解後凍結乾燥を行った。反応終了後、ジメチルホルムアミド(DMF)溶液5mlに溶解させポリエチレングリコール溶液200mg/mlを調整した。得られたポリエチレングリコール溶液1.875mlを、27.725mlのDMFに溶液に加え、先に調整したアナタ−ゼ型二酸化チタンゾル0.9mlを添加後、攪拌して混合した。水熱反応容器のHU−50(三愛科学社製)に溶液を移し変え、150℃で5時間水熱合成を行った。反応終了後、反応容器温度が50 ℃以下になるまで冷却し、エバポレータでDMFを除去した後に、蒸留水10mlを添加してポリエチレングリコール結合二酸化チタン水溶液とした。さらに、下記の条件でHPLCに付したところ、素通り画分にUV吸収のピークが確認され、この画分を回収した。
HPLC:AKTA purifier、アマシャム・バイオサイエンス社製
カラム:HiPrep 16/60 Sephacryl S−300HR、アマシャム・バイオサイエンス社製
移動相:リン酸塩緩衝溶液(pH7.4)
流速:0.3ml/min
【0033】
この分散液を蒸留水で0.01%水溶液に希釈し、動的光散乱法による分散粒径およびゼータ電位の測定したところ、分散粒径は45.4nm、ゼータ電位は1.1mVであった。この測定は、ゼータサイザーナノZSを用いて、ゼータ電位測定セルにポリエチレングリコール結合二酸化チタン水溶液0.75mlを仕込み、溶媒の各種パラメーターを水と同値に設定することにより、25℃にて行った。
【0034】
例4:超音波照射による細胞殺傷試験
まず、以下の半導体粒子を用意した。
TiO2/PAA粒子(例1で作製されたもの)
SnO2粒子(シーアイ化成製、SNW15WT%-G02、中性分散体、分散粒径:39nm)
ZnO粒子(シーアイ化成製、Znミズ15WT%-G01、中性分散体、分散粒径:67nm)
CdSe粒子(Quantum Dot社製、Qdot655プロテインA標識、中性分散体、分散粒径:8nm)
ここで、上述した各種粒子の分散粒径は、例1で示した動的光散乱法により得られたものである。
【0035】
次に、上記半導体粒子を、PBS緩衝溶液(pH6.8)に分散させ、この溶液を、1×104cells/mlのJurkat細胞を含む、10%血清入りRPMI1640培地(Invitrogen社)に1/10量添加して、終濃度0.05%となるように試験溶液を調整した。
【0036】
また、比較例として、以下の金属半導体ではない粒子を用意して、上記同様に試験溶液を調製した。
SiO2粒子(シーアイ化成製、Siミズ10WT%−G360、Lot#050420−1、分散粒径:105nm)
Au粒子(ICN Biomedicals,Inc製、ProteinA 20nm、Gold conjugate、分散粒径:40nm)
ここで、上述した各種粒子の分散粒径は、例1で示した動的光散乱法により得られたものである。
【0037】
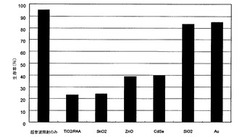
上記得られた各試験溶液に、超音波照射装置(オージー技研(株)製、ULTRASONIC APPARATUS ES−2:1MHz)により、0.5W/cm2で50%duty cycle運転で1分間超音波を照射して、細胞の殺傷試験を行なった。その結果は、図1に示される通りであった。図1に示されるように、金属半導体粒子を添加した溶液はいずれも細胞の殺傷率が高かったことから、超音波照射により細胞を殺傷できることが確認された。一方、比較例として使用したSiO2粒子やAu粒子にはこの細胞殺傷効果は確認されなかった。
【0038】
例5:金属半導体粒子濃度の依存性
金属半導体粒子として、例1で作製されたTiO2粒子(TiO2/PAA)を用いて、超音波照射による細胞殺傷濃度依存性試験を行なった。酸化チタン粒子を終濃度で、0.001%、0.01%、0.05%、および0.1%となるように、PBS緩衝溶液(pH6.8)で調整し、1×104cells/mlのJurkat細胞を含む、10%血清入りRPMI1640培地(Invitrogen社)に1/10量添加して試験溶液を調整した。この試験溶液に、超音波照射装置(オージー技研(株)製、ULTRASONIC APPARATUS ES−2:1MHz)により、0.5W/cm2で50%duty cycle運転で1分間超音波を照射して、細胞の殺傷試験を行ない、金属半導体粒子濃度の依存性を検討した。その結果は、図2に示される通りであった。酸化チタン粒子を添加した全ての溶液濃度において細胞の生存率が低下していることが確認された。特に、終濃度0.05%溶液において細胞の生存率が低下していることから、細胞殺傷効果の高い終濃度は0.05%であることが分かった。
【0039】
例6:超音波照射によるスーパーオキサイドアニオン生成能の評価
まず、以下の金属半導体粒子を用意した。
TiO2粒子(テイカ製、アナタース型酸化チタン、TKS−203、分散粒径120nm)
SnO2粒子(シーアイ化成製、SNW15WT%−G02、Lot#050526、分散粒径;39nm)
ZnO粒子(シーアイ化成製、Znミズ15WT%−G01、Lot#050523−01、分散粒径:67nm)
【0040】
次に、上記金属半導体粒子を、固形分が終濃度で0.1%となるようにPBS緩衝溶液(pH6.8)に分散させ、スーパーオキサイドアニオンの発生試薬である還元系発色試薬WST−1(同仁化学製)を0.5%溶液となるように水溶液に添加して、試験溶液を調整した。
【0041】
また、比較例として、金属半導体ではない粒子としてSiO2粒子(シーアイ化成製、Siミズ10WT%−G360、Lot#050420−1、分散粒径:105nm)を用意して、上記同様に試験溶液を調製した。
【0042】
上記得られた各試験溶液に、超音波照射装置(オージー技研(株)製、ULTRASONIC APPARATUS ES−2:1MHz)により、0.5W/cm2で50%duty cycle運転で5分間超音波を照射して、450nmにおける波長の吸収を紫外−可視光分光光度計により測定した。その結果は、図3に示される通りであった。図3に示されるように、金属半導体粒子である全ての粒子においてWST−1の分解に伴い黄色ホルマザンを生成することにより吸光度の上昇が認められた。すなわち、TiO2粒子、SnO2粒子、およびZnO粒子は超音波照射によりスーパーオキサイドアニオンを生成することが確認された。
【0043】
例7:超音波照射によるヒドロキシラジカル生成能の評価
まず、以下の金属半導体粒子を用意した。
TiO2粒子(テイカ製、アナタース型酸化チタン、TKS−203、分散粒径:120nm)
SnO2粒子(シーアイ化成製、SNW15WT%−G02、Lot#050526、分散粒径:39nm)
ZnO粒子(シーアイ化成製、Znミズ15WT%−G01、Lot#050523−01、分散粒径:67nm)、
【0044】
次に、上記金属半導体粒子を、固形分が終濃度で0.1%となるようにPBS緩衝溶液(pH6.8)で調整し、ヒドロキシラジカルの生成試薬として活性酸素検出用蛍光試薬ヒドロキシフェニルフルオレセイン(HPF、第一化学薬品製)を5μMとなるように先の金属酸化物粒子を含む溶液に添加して、試験溶液を調整した。
【0045】
また、比較例として、SiO2粒子(シーアイ化成製、Siミズ10WT%−G360、Lot#050420−1、分散粒径:105nm)を用意して、上記同様に試験溶液を調製した。
【0046】
上記得られた各試験溶液に、超音波照射装置(オージー技研(株)製、ULTRASONIC APPARATUS ES−2:1MHz)により、0.5W/cm2で50%duty cycle運転で5分間超音波を照射して、Ex=490nm、Em=515nmにおける波長を蛍光蛍光光度計により測定した。その結果は、図4に示される通りであった。図4に示されるように、金属半導体粒子である全ての粒子において、HPFが反応しフルオレセインを生成し蛍光強度の上昇が認められた。すなわち、TiO2粒子、SnO2粒子、ZnO粒子は超音波照射によってヒドロキシラジカルを生成することが確認された。
【0047】
例8:超音波照射による過酸化水素生成能の評価
まず、以下の金属半導体粒子を用意した。
TiO2粒子(テイカ製、アナタース型酸化チタン、TKS−203、分散粒径:120nm)
SnO2粒子(シーアイ化成製、SNW15WT%−G02、Lot#050526、分散粒径:39nm)
ZnO粒子(シーアイ化成製、Znミズ15WT%−G01、Lot#050523−01、分散粒径:67nm)
【0048】
次に、上記金属半導体粒子を、固形分が終濃度で0.1%となるようにPBS緩衝溶液(pH6.8)で調整し、過酸化水素測定用試薬TPM−PS(同仁化学製)を10μMとなるように水溶液に添加して、試験溶液を調整した。
【0049】
また、比較例として、SiO2粒子(シーアイ化成製、Siミズ10WT%−G360、Lot#050420−1、分散粒径105nm)を用意して、上記同様に試験溶液を調製した。
【0050】
上記得られた各試験溶液に、超音波照射装置(オージー技研(株)製、ULTRASONIC APPARATUS ES-2:1MHz)により、0.5W/cm2で50% duty cycle運転で5分間超音波を照射して、100μlを採取し、Amplex Red Hydrogen Peroxide/Peroxidase Assay Kit (Molecular Probes 社)のマニュアルに従い、同キットで測定を行った。その結果は、図5に示される通りであった。図5に示されるように、TiO2粒子は超音波照射により過酸化水素をより効率的に生成することが確認された。
【0051】
例9:超音波照射による一重項酸素生成能の評価
まず、以下の半導体粒子を用意した。
TiO2粒子(A)(石原産業製、アナターゼ型酸化チタン、STS-240、中性分散体、分散粒径:52nm)
SnO2粒子(シーアイ化成製、SNW15WT%-G02、中性分散体、分散粒径:39nm)
ZnO粒子(シーアイ化成製、Znミズ15WT%-G01、中性分散体、分散粒径:67nm)
TiO2/PAA(例1により作成したもの)
TiO2/PEG(例3により作成したもの)
【0052】
次に、上記半導体粒子を、固形分が終濃度で0.05%となるようにPBS緩衝溶液(pH6.8)で調整し試験溶液を調整した。
【0053】
また、比較例として、SiO2粒子(シーアイ化成製、Siミズ10WT%-G360、中性分散体、分散粒径105nm)を用意して、上記同様に試験溶液を調製した。
【0054】
上記得られた各試験溶液に、超音波照射装置(オージー技研(株)製、ULTRASONIC APPARATUS ES-2:1MHz)により、0.5W/cm2で50% duty cycle運転で5分間超音波を照射して、100μlを採取し、Singlet Oxygen Sensor Green Reagent(Molecular Probes社)のマニュアルに従い、同社のキットで、一重項酸素に起因する、Ex=488nm、Em=525nmにおける蛍光強度を蛍光光度計により測定した。その結果は、図6に示される通りであった。図6に示されるように、TiO2粒子は超音波照射により一重項酸素をより効率的に生成することが確認された。
【0055】
例10:周波数への依存性
2mlのマイクロチューブ中で、PBS緩衝液:850μl、還元系発色試薬WST-1(同仁化学製):50μl、0.1%酸化チタン粒子:100μlの組成の溶液を調製した。酸化チタン粒子としては、TiO2粒子(A)(石原産業製、アナターゼ型酸化チタン、STS-240、中性分散体、分散粒径:52nm)を用いた。
【0056】
得られたマイクロチューブを、水浴中、超音波振動子から3cmの距離で、多周波数超音波発生装置(MODEL4021{KAIJYO}、出力:200W)により超音波を同強度になるように照射した。照射後0、3、6分毎に200μlずつサンプリングを行い 例6と同様の測定方法でスーパーオキサイドアニオンを測定した。測定は、28、50、100、200、および600kHzの各照射周波数について行った。また、コントロールとして、酸化チタン粒子を添加しない場合についても上記同様の測定を行った。それらの結果は、図7に示される通りであった。図7に示されるように、スーパーオキサイドアニオンはチタンが存在することによって生産され、さらにその効果は、照射周波数が最も高い600kHzの場合において、顕著であった。
【0057】
例11:粒子の安定性
水、PBS緩衝液(pH 7.4)、および10%血清を含むRPMI1640培地のそれぞれに以下の粒子を最終濃度 が0.01% になるように分散して、サンプルを得た。
【0058】
酸化チタン(C)(P25粒子;日本エアロジル製をPBS緩衝溶液(pH6.8)で分散させたもの、分散粒径:500nm)
例1により作成したTiO2/PAA粒子
例3により作成したTiO2/PEG粒子
酸化チタン(A)(STS240、石原産業製、中性分散体、分散粒径:52nm)
酸化チタン(B)(TKS-203、テイカ製、アナターゼ型酸化チタン、中性分散体、分散粒径:120nm)
SnO2粒子(シーアイ化成製、SNW15WT%-G02、中性分散体、分散粒径:39nm)
ZnO粒子(シーアイ化成製、Znミズ15WT%-G01、中性分散体、分散粒径:67nm)
【0059】
各粒子の安定性の指標として、各分散液における平均分散粒子径の変化を測定した。この測定は、石英測定セルに分散液0.1mlを仕込み、溶媒の各種パラメーターを水と同値に設定し、ゼータサイザーナノZS(シスメックス社製)を用いて、1時間後と24時間後に25℃にて動的光散乱法により行った。
各分散液について測定された平均分散粒子径を表1に示す。表1に示されるように、中性分散体として市販されている酸化チタン(A)や酸化チタン(B)と比較して、本例で作成した TiO2/PAAおよびTiO2/PEGは平均分散粒子径の変化が少なく、それ故優れた安定性を有することが分かる。
【表1】

【0060】
例12:超音波照射による細胞殺傷試験
まず、TiO2/PAA粒子(例1で作製されたもの 中性分散体、分散粒径:45.5nm)をPBS緩衝溶液(pH6.8)に分散させ、この溶液を、1×104cells/mlのJurkat細胞を含む、10%血清入りRPMI1640培地(Invitrogen社)に1/10量添加して、TiO2/PAA粒子の終濃度0.01%および0.001%となるように試験溶液を調整した。
【0061】
また、比較例として、TiO2粒子(C)(P25粒子;日本エアロジル製をPBS緩衝溶液(pH6.8)で分散させたもの、分散粒径:500nm)を用意して、上記同様に試験溶液を調製した。ここで、上述した各種粒子の分散粒径は、例1で示した動的光散乱法により得られたものである。
【0062】
上記得られた各試験溶液に、超音波照射装置(オージー技研(株)製、ULTRASONIC APPARATUS ES-2:1MHz)により、0.5W/cm2で50%duty cycle運転で1分間超音波を照射して、細胞の殺傷試験を行なった。その結果は、図8に示される通りであった。図8に示されるように、分散粒径45.5nmのTiO2/PAA粒子を添加した溶液はいずれも腫瘍細胞殺傷効果が高いことが確認された。一方、比較例として使用した分散粒径500nmのTiO2粒子(C)においてはこの細胞殺傷効果は確認されなかった。
【0063】
例13:超音波照射によるヒドロキシラジカル生成能の評価
まず、以下の半導体粒子を用意した。
TiO2粒子(A)(石原産業製、アナターゼ型酸化チタン、STS-240、中性分散体、分散粒径:52nm)
TiO2粒子(D)(石原産業製、アナターゼ型酸化チタン、STS-230、中性分散体、分散粒径:15nm)
TiO2粒子(C)(P25粒子;日本エアロジル製をPBS緩衝溶液(pH6.8)で分散させたもの、分散粒径:500nm)
【0064】
次に、上記半導体粒子を、固形分が終濃度で0.05%となるようにPBS緩衝溶液(pH6.8)で調整し、ヒドロキシラジカルの生成試薬として活性酸素検出用蛍光試薬ヒドロキシフェニルフルオレセイン(HPF、第一化学薬品製)を5μMとなるように先の金属酸化物粒子を含む溶液に添加して、試験溶液を調整した。
【0065】
また、コントロールとしてPBS緩衝溶液(pH6.8)を用意して、上記同様に試験溶液を調製した。
【0066】
上記得られた各試験溶液に、超音波照射装置(オージー技研(株)製、ULTRASONIC APPARATUS ES-2:1MHz)により、0.5W/cm2で50% duty cycle運転で5分間超音波を照射して、ヒドロキシラジカルに起因する、Ex=490nm、Em=515nmにおける蛍光強度を蛍光光度計により測定した。その結果は、図9に示される通りであった。図9に示されるように、分散粒径52nmのTiO2粒子(A)および分散粒径の15nmのTiO2粒子(D)においてコントロールよりも顕著なヒドロキシラジカル生成が確認された。しかしながら、分散粒径500nmのTiO2粒子(C)においてはヒドロキシラジカル生成が確認されなかった。
【0067】
例14:粒子の安全性
まず、TiO2/PAA粒子(例1で作製されたもの 中性分散体、分散粒径:45.5nm)、TiO2/PEI粒子(例2で作製されたもの 中性分散体、分散粒径:67.7nm)、およびTiO2/PEG粒子(例3で作製されたもの 中性分散体、分散粒径:45.4nm)をPBS緩衝溶液(pH6.8)に分散させて、各種分散液を得た。これらの分散液を、1×104cells/mlのJurkat細胞を含む、10%血清入りRPMI1640培地(Invitrogen社)に1/10量添加して、TiO2系複合体粒子の終濃度が0.1、0.01、および0.001質量%となるように試料液を調整した。また、対照実験として、PBS緩衝液のみを同様に添加して対照試料液を調整した。調整後、CO2インキュベーターにて37℃で24時間培養し、CellTiterGro Kit(バイオラッド社製)により生細胞数を測定した。対照試料液の生存率を100%として各試験液を比較した結果を図10に示す。図10に示される通り、0.1〜0.001質量%の全試料液において、高い細胞生存率、すなわち高い安全性を示した。
【0068】
例15:ポリマーが結合されたTiO2粒子を用いた超音波照射による細胞殺傷試験
TiO2/PAA粒子(例1で作製されたもの)、TiO2/PEI粒子(例2で作製されたもの)およびTiO2/PEG粒子(例3で作製されたもの)を、PBS緩衝溶液(pH6.8)に分散させ、この溶液を、1×104cells/mlのJurkat細胞を含む、10%血清入りRPMI1640培地(Invitrogen社)に1/10量添加して、終濃度0.05%となるように試験溶液を調整した。
【0069】
上記得られた各試験溶液に、超音波照射装置(オージー技研(株)製、ULTRASONIC APPARATUS ES-2:1MHz)により、0.5W/cm2で50%duty cycle運転で1分間超音波を照射して、細胞の殺傷試験を行なった。その結果は、図11に示される通りであった。図11に示されるように、TiO2/PAA粒子、TiO2/PEI粒子およびTiO2/PEG粒子のいずれの粒子を添加した溶液も細胞生存率が低い、すなわち殺傷率が高かった。特に、TiO2/PEG粒子を添加した溶液は細胞生存率が極めて低かったことから、このTiO2/PEG粒子は超音波照射により細胞を殺傷できる効果が特に高いことが確認された。
【0070】
例16:超音波照射による細胞殺傷試験2
まず、TiO2/PAA粒子(例1で作製されたもの 中性分散体、分散粒径:45.5nm)をPBS緩衝溶液(pH6.8)に分散させ、この溶液を、5×104cells/mlのJurkat細胞を含む、10%血清入りRPMI1640培地(Invitrogen社)に1/10量添加して、TiO2/PAA粒子の終濃度0.05%となるように試験溶液を3ml調整した。
【0071】
また、コントロールとしてPBS緩衝溶液(pH6.8)を用意して、上記同様に試験溶液を調製した。
【0072】
上記得られた各試験溶液に、超音波照射装置(松下電工(株)製、EH2435:5MHz)により、最大出力で2分間超音波を連続照射して、細胞の殺傷試験を行なった。その結果は、図11に示される通りであった。PBS緩衝溶液を添加し、超音波照射を行わなかった生細胞の数を100%として生存率で示した。図11に示されるように、分散粒径45.5nmのTiO2/PAA粒子を添加した溶液は腫瘍細胞殺傷効果が高いことが確認された。
【0073】
例17:抗腫瘍効果試験
ヌードマウス Balb/c、雄、3週齢)にヒト膀胱癌由来株化細胞(T−24)を皮下接種し、腫瘍を形成させ、約0.63mm3程度の腫瘍を形成させた。実施例1で作成したPAA―TiO2をPBS緩衝液にて0.5 %に希釈し、腫瘍に100μl局所注射した。投与より24時間後に、時間1分 出力1W パルス50%で1MHzの超音波を超音波照射装置(オージー技研(株)製、ULTRASONIC APPARATUS ES-2:1MHz; プローブ径 10mm)を用いて照射した。照射は、水溶性高分子ゲルを皮膚に塗布し、その上にプローブ(超音波照射部)を密着させた後に行った。マウス数は1群あたり6匹とし、PBSのみ投与又は無処置動物を対照群とした。超音波照射後、各個体の腫瘍体積を測定し、各個体の超音波照射施工日(0日)におけるPAA−TiO2投与前のs腫瘍体積を1とした時の各測定時点の腫瘍体積(相対腫瘍増殖率)を求めた。
【0074】
結果を図13に示す。
図13に示されるとおり、酸化チタン+超音波照射の存在時のみ、腫瘍の大幅な増殖抑制効果が確認された。
【図面の簡単な説明】
【0075】
【図1】例4において各種粒子について測定された、超音波を1分間照射した際の細胞の殺傷率を示す図である。
【図2】例5において各種濃度のTiO2粒子(TiO2/PAA)含有試験溶液について測定された、細胞の生存率を示す図である。
【図3】例6において各種粒子について測定された、超音波の照射によるスーパーオキサイドアニオンの発生に起因する、還元系発色試薬を介した吸光度の上昇を示す図である。
【図4】例7において各種粒子について測定された、超音波の照射によるヒドロキシラジカルの発生に起因する、活性酸素検出用蛍光試薬を介した蛍光の強度を示す図である。
【図5】例8において各種粒子について測定された、超音波の照射による過酸化水素の発生に起因する、TPM-PSの酸化を介した吸光度の上昇を示す図である。
【図6】例9において各種粒子について測定された、超音波照射による一重項酸素の発生に起因する、一重項酸素検出用蛍光試薬を介した蛍光強度を示す図である。
【図7】例10においてTiO2(A)について測定された、超音波の照射によるスーパーオキサイドアニオンの発生に起因する、還元系発色試薬を介した吸光度の上昇を示す図である。
【図8】例12において各種粒子について測定された、超音波を1分間照射した際の細胞の生存率を示す図である。
【図9】例13において各種粒子について測定された、超音波の照射によるヒドロキシラジカルの発生に起因する、活性酸素検出用蛍光試薬を介した蛍光強度を示す図である。
【図10】例14において各種濃度のTiO2粒子含有試験溶液について測定された、細胞の生存率を示す図である。
【図11】例15において各種粒子について測定された、超音波を1分間照射した際の細胞の殺傷率を示す図である。
【図12】例16においてTiO2/PAA粒子およびPBS緩衝溶液について測定された、超音波を2分間照射した際(超音波あり)、および照射なし(超音波なし)の細胞の生存率を示す図である。
【図13】例17において測定された、マウスの相対腫瘍増殖率の経時変化を示す図である。
【発明の背景】
【0001】
発明の分野
本発明は、患部に超音波を照射することにより行われる超音波癌治療を促進するための、超音波癌治療促進剤に関するものである。
【0002】
背景技術
近年、癌治療において、治療効果と患者のQOL(生活の質)の両方の向上を図るために、非侵襲で効率的に患部を治療することができる音響化学療法が提案されている。これは、超音波の照射により、投与した薬剤(超音波併用剤)の抗腫瘍活性化を行い、腫瘍の治療を行なうというものである。超音波治療用併用剤として、フラーレンを用いる方法が知られている(例えば、特許文献1(特開2002−241307号公報)および特許文献2(国際公開第2002/66061号パンフレット)参照)。また、超音波治療用併用剤として、色素を用いる方法も知られている(特許文献3(特開2001−253836号公報)、特許文献4(国際公開第98/1131号パンフレット)、および特許文献5(特開2003−226654号公報)を参照)。このような方法にあっては、光によりラジカル種を発生する有機物またはフラーレンを超音波の効果により励起させることによって、治療が行われる。
【0003】
一方、酸化チタンの光触媒活性を癌治療に利用する提案もなされている。例えば、酸化チタンの医療用具としての利用や(特許文献6(特開平4−357941号公報)参照)、ドラッグデリバリーシステム(DDS)の担体としての利用が提案されている(特許文献7(特開2001−200050号公報)および特許文献8(米国特許第6677606号明細書)参照)。
【0004】
更に、酸化チタンに超音波照射を行い、ヒドロキシラジカルを発生させることにより有機物を分解させる技術も提案されている(例えば、特許文献9(特開2003−26406号公報)および特許文献10(特開2005−7392号公報)参照)。
【0005】
【特許文献1】特開2002−241307号公報
【特許文献2】国際公開第2002/66061号パンフレット
【特許文献3】特開2001−253836号公報
【特許文献4】国際公開第98/1131号パンフレット
【特許文献5】特開2003−226654号公報
【特許文献6】特開平4−357941号公報
【特許文献7】特開2001−200050号公報
【特許文献8】米国特許第6677606号明細書
【特許文献9】特開2003−26406号公報
【特許文献10】特開2005−7392号公報
【発明の概要】
【0006】
本発明者らは、今般、ある種の金属半導体粒子に超音波を照射することにより、高い安全性を確保しながら、超音波による癌の治療効果を著しく向上できるとの知見を得た。また、本発明者らは、上記金属半導体粒子を患者の体内に投与して癌細胞に到達させた上で超音波を患部に照射するといった、ドラッグデリバリーシステムの使用によって、癌の治療効果を更に向上できるとの知見も得た。
【0007】
したがって、本発明は、高い安全性を確保しながら、超音波による癌の治療効果を著しく向上できる超音波癌治療促進剤の提供をその目的としている。
【0008】
そして、本発明による、超音波癌治療促進剤は、金属半導体粒子を含んでなるものである。
【発明の具体的説明】
【0009】
本発明による超音波癌治療促進剤は、金属半導体粒子を含んでなるものである。本発明において使用可能な金属半導体粒子は、超音波の照射により活性化して癌細胞を死滅ないし破壊することができる金属半導体を含んでなる粒子であれば限定されず、種々の金属半導体粒子であることができる。ある種の金属半導体粒子が超音波の照射により活性化して細胞を死滅ないし破壊する機構の全容は定かではないが、少なくとも超音波照射によりラジカル種を生成可能な金属半導体粒子であれば上記効果が期待できる。
【0010】
すなわち、金属半導体粒子が与える生物的殺傷効果は、超音波照射によりラジカル種を生成させることにより得ることができる。すなわち、これらの半導体粒子が与える生物的殺傷効果はラジカル種の質的・量的な増加にあると考えられる。その理由は以下の通り推察されるが、以下の理由はあくまで仮説であって、本発明は何ら下記説明に限定されるものではない。すなわち、超音波照射のみでは系中には過酸化水素とヒドロキシルラジカルが発生するが、本発明者らの知見によれば、酸化チタンなどの半導体粒子の存在下では、過酸化水素及びヒドロキシルラジカルの生成が促進される。また、これら半導体粒子の存在下、特に酸化チタンの存在下では、スーパーオキサイドアニオンと一重項酸素の生成が促進されるように見受けられる。これらラジカル種の特異的生成は、ナノメートルオーダーの微粒子を用いた場合、超音波照射時に観察される現象である。このような効果が金属半導体微粒子存在下での超音波による特異的な現象であると考えられる。
【0011】
本発明の好ましい態様によれば、金属半導体粒子として光感応特性を有する金属半導体粒子を用いるのが好ましく、より好ましくは、光触媒活性を有する金属半導体粒子、および量子効果により発光を示す量子ドットである。ここで、光触媒活性を有する金属半導体粒子とは光エネルギーを受けて電荷分離を起こす光金属半導体の粒子である。また、量子ドットとは、電子キャリアのエネルギー分布が離散的なため室温等の熱的励起が存在するような状態にあってもキャリアの遷移が量子準位間で不連続に生じ、結果として鋭い発光を示す特徴をもつ構造である。このような粒子によれば、超音波の照射により十分に活性化して細胞を死滅させることができる。これらの金属半導体粒子の具体例としては、TiO2、ZnO、WO3、SnO2、Fe2O3、In2O3、BaTiO3、TiO3、SrTiO3、Nb2O5、Ta2O5等の金属酸化物;CdS、MoS2、ZnS等の金属硫化物;およびSiC、CdSe、InGaP等の複合金属半導体が挙げられる。これらの金属半導体粒子は光感応特性を有するが、フラーレンや色素等の光増感剤ではないため、患者に投与後の治療段階において光過敏症の問題を生じることがなく、安全性が極めて高い。
【0012】
本発明の好ましい態様によれば、金属半導体粒子として光触媒活性を有する金属半導体粒子を用いることができ、好ましい例として、TiO2、ZnO、SnO2、WO3、In2O3、SrTiO3、Nb2O5、Ta2O5が挙げられ、より好ましくはTiO2である。
【0013】
本発明の好ましい態様によれば、金属半導体粒子として量子ドットを用いることができ、好ましい例として、CdSe、Cds、CdTe、ZnS、ZnSe、InGaP、ZnTe、およびそれらの混合物が挙げられる。
【0014】
本発明の好ましい態様によれば、金属半導体粒子は20〜200nmの粒子径を有し、より好ましくは50〜200nmであり、さらに好ましくは50〜150nmである。この粒径範囲であると、腫瘍への到達を目的として患者の体内に投与されると、ドラッグデリバリーシステムのように、EPR効果により癌組織に効率的に到達して蓄積される。したがって、超音波の照射により高い効率で癌組織を死滅ないし破壊することができる。
【0015】
本発明の別の好ましい態様によれば、金属半導体粒子が50nm未満(例えば数nm)の粒子径を有する場合、金属半導体粒子同士を多官能リンカーで連結し、見かけ上のサイズを大きくしてEPR効果を得ることもできる。特に、この態様は、金属半導体粒子として量子ドットを使用する場合に有効である。すなわち、量子ドットは一般的に2nm〜10nmの粒径を有するが、50〜150nmの粒子径を有する二次粒子の形態を有するように複数個の量子ドットを凝集または結合されることで、EPR効果により高い癌治療効果を実現することができる。本発明の更に別の好ましい態様によれば、EPR効果を利用するため、リポソームのような薬剤封入体の中に、金属半導体粒子を包摂させることもできる。また、このようにして得られる複合粒子に更に抗体等の生体素子を付与すれば、EPR効果以上の、腫瘍へのターゲッティングも可能である。
【0016】
本発明に使用可能な金属半導体粒子は、単一種類の金属半導体粒子のみならず、複数種類の金属半導体粒子の混合物あるいは複合物も包含する。具体例としては、酸化チタンナノ粒子と酸化鉄ナノ粒子との複合物、酸化チタンナノ粒子と白金との複合物、およびシリカ被覆された酸化チタン等が挙げられる。
【0017】
本発明の好ましい態様によれば、金属半導体粒子の表面に、ポリマーまたは生体由来高分子が結合されてなるのが好ましい。これにより、もともと固体中性であるような半導体を用いる場合においても、半導体粒子を主成分とする超音波癌治療用促進剤の分散化が達成され、生体環境において、安全な投与を可能とすることができる。ここで、金属半導体粒子表面に結合するポリマーとしては、親水性高分子であればよい。半導体粒子とポリマーおよび/または生体由来高分子との結合形態としては、血中滞留性を確保する観点から、体内への投与後24〜72時間後に分散性が確保されている程度の結合形態であれば特に限定されないが、生理条件での分散安定性に優れ、かつ超音波照射後もポリマーの遊離が無く正常細胞へのダメージが少ない点で、共有結合が望ましい。
【0018】
本発明の好ましい態様によれば、金属半導体粒子表面に結合されるポリマーとして、カルボキシル基を有するポリマー、例えば、カルボキシメチルデンプン、カルボキシメチルデキストラン、カルボキシメチルセルロース、ポリカルボン酸類、およびカルボキシル基単位を有する共重合体(コポリマー)を用いるのが好ましく、より好ましくは、親水性高分子の加水分解性および溶解度の観点から、ポリアクリル酸、ポリマレイン酸等のポリカルボン酸類、およびアクリル酸/マレイン酸やアクリル酸/スルフォン酸系モノマーの共重合体(コポリマー)であり、さらに好ましくはポリアクリル酸である。カルボキシル基を有するポリマーが金属半導体粒子表面に結合すると、粒子が負に帯電するため、高度に分散するとともに、生体分子や薬剤を固定化させやすく、点滴等による全身投与にも適する。このため、ポリアクリル酸が表面に結合した金属半導体粒子は、臓器内部の癌の治療に適し、特定の細胞とのアフィニティが高い(生体)分子や薬剤を固定化した場合には、よりアフィニティの高い金属半導体粒子として患部へのターゲッティング療法へ用いることに特に適する。アニオン性ポリマーを固定した半導体粒子複合体の好ましいゼータ電位は、−50〜−20mVである。この範囲内であると、負電荷の反発により粒子の分散性を確保しやすくなり、凝集隗を形成しにくくなるため、投与後に血管の閉塞などの二次的弊害を招くおそれが無い。
【0019】
本発明の好ましい態様によれば、金属半導体粒子表面に結合されるポリマーとして、カチオン性ポリマー、例えば、重量平均分子量が1000〜100000の範囲にあるアミンを用いるのが好ましく、より好ましくは、ポリアミノ酸、ポリペプチド、ポリアミン類、およびアミン単位を有する共重合体(コポリマー)であり、さらに好ましくは、水溶性高分子の加水分解性および溶解度の観点から、ポリエチレンイミン、ポリビニルアミン、ポリアリルアミン等のポリアミン類であり、最も好ましくはポリエチレンイミンである。カチオン性ポリマーが金属半導体粒子表面に結合すると、粒子が正に帯電するため、高度に分散するとともに、急速に細胞内に吸着し取り込まれやすく、注射あるいは塗布による局所投与に適する。このため、ポリエチレンイミンが表面に結合した金属半導体粒子は、皮膚癌や初期癌等の表層の癌の治療に特に適する。カチオン性ポリマーを固定した半導体粒子複合体の好ましいゼータ電位は、+20〜+50mVである。この範囲内であると、正電荷の反発により粒子の分散性を確保しやすくなり、局所投与に好適に用いることができる。
【0020】
本発明の好ましい態様によれば、金属半導体粒子表面に結合されるポリマーとして、ノニオン性ポリマー、例えば、ポリエチレングリコール、ポリビニルアルコール、ポリエチレンオキシド、デキストランあるいはそれらのコポリマーを用いるのが好ましく、より好ましくはポリエチレングリコールである。ノニオン性ポリマーが金属半導体粒子表面に結合すると、粒子は帯電することなく水和により分散するため、体内(血中)で長期間安定し、癌組織へ集積させやすく、全身投与にも適する。このため、ポリエチレングリコールで被覆した金属半導体粒子は、表層から深部に至るまでの広範囲の癌の治療に特に適する。ノニオン性の親水性基を有するポリマーを固定した半導体粒子複合体の好ましいゼータ電位は、−20〜+20mVである。この範囲内であると、血中タンパク質が静電気的に吸着しにくくなるので、細網内皮系への取り込み、腎排泄、肝臓取り込み等を回避しやすくなり、目的部位(腫瘍)に到達できるに足る血中滞留性を確保することができる。
【0021】
本発明の好ましい態様によれば、金属半導体粒子が、溶媒に分散されてなるのが好ましい。これにより、金属半導体粒子を、点滴、注射、塗布等の種々の方法により、患者の体内に効率的に投与することができる。なお、安全性の観点から、分散液は、中性の液性を有するのが好ましく、より好ましくは生理食塩水である。半導体粒子は分散体に対して、0.001〜1質量%以下含有されることが好ましく、より好ましくは0.001〜0.1質量%である。この範囲内であれば、投与後、24〜72時間後に患部(腫瘍)に効果的に粒子を蓄積させることが可能となる。すなわち、患部(腫瘍)に粒子濃度が蓄積しやすくなるとともに、血中での粒子の分散性も確保されて凝集隗が形成しにくくなるため、投与後に血管の閉塞などの二次的弊害を招くおそれも無い。
【0022】
本発明の別の態様によれば、金属半導体粒子を含んでなり、超音波照射を受け、該照射により細胞毒となる、殺細胞剤が提供される。この殺細胞剤は、体内に投与され、超音波照射を受け、該照射により細胞毒となることで、細胞を破壊ないし死滅させることができるが、体内に限らず、試験管内においても殺対象である細胞を破壊ないし死滅させることができる。この態様において、殺対象は特に限定されないが、癌細胞であるのが好ましい。本態様において、細胞毒は、超音波照射により前記半導体粒子が発生するラジカル種により生じるものであるのが好ましい。
【0023】
本発明の超音波癌治療促進剤は、点滴、注射、塗布等の種々の方法により、患者の体内に投与することができる。そして、体内に投与された超音波癌治療促進剤は、ドラッグデリバリーシステムのように、癌組織に到達して蓄積される。そして、超音波癌治療促進剤が蓄積された癌組織に超音波処理が行われる。本発明の好ましい態様によれば、使用する超音波の周波数は、細胞を殺傷する効果および安全性の観点から、20kHz〜20MHzが好ましく、400kHz〜20MHzがより好ましく、さらに好ましくは600kHz〜10MHz、最も好ましくは1MHz〜10MHzである。超音波の照射時間は治療対象である癌組織の位置および大きさを考慮して適宜決定されるべきであり、特に限定されない。こうして、患者の癌組織を超音波により高い効率で死滅ないし破壊して、高い癌治療効果を実現することができる。超音波は生体内の深部に外部より到達させることが可能で、本発明の促進剤と併せて用いることにより、非侵襲の状態で生体内深部に存在するような患部やターゲット部位の治療が実現できる。さらに、患部やターゲット部位に本発明の促進剤が集積することにより、周辺の正常細胞に悪影響を及ぼさない程度の微弱な超音波で本発明の促進剤を集積させた局所のみに作用させることができる。
【0024】
本発明の好ましい態様によれば、金属半導体粒子としてより好ましくはTiO2であるが、該金属半導体粒子の光触媒活性を癌治療に利用する提案もなされている。この際、紫外線を用いた照射によって患部やターゲット部位の治療を行うことが可能であり、その照射到達深度は生体表層部より2mmである。一方で、超音波を用いた照射によって生体内の診断等を行う際は、生体表層部より2mm以上の内部においても可能である。従って超音波を用いることで、より生体内の深部に外部より到達させることが可能で、本発明の促進剤と併せて用いることにより、非侵襲の状態で生体内深部に存在するような患部やターゲット部位の治療が実現できる。
【0025】
本発明の好ましい態様によれば、好ましい適用部位として、切除術が困難な臓器が考えられ、具体的には膵臓癌、膀胱癌、肝臓癌、脳腫瘍があげられる。
【0026】
超音波照射部については特に限定されるべきではないが、本発明の好ましい態様によれば、より効果を得るためには超音波照射部を内視鏡やカテーテル等の患部やターゲット部位に到達可能な器具に設置し、直接的に照射することができる。また、切除術が困難な臓器に対して、あるいは患者のQOLの観点から体外より非侵襲の状態で照射することができる。具体的には消化器の表層癌に対して、腹部より超音波照射を行い患部に超音波を到達させ、癌組織を殺傷できる。
【実施例】
【0027】
例1:ポリアクリル酸結合型酸化チタン(TiO2/PAA)粒子の作製
チタンテトライソプロポキシド3.6gとイソプロパノール3.6gを混合し、氷冷下で60mlの超純水に滴下して加水分解を行った。滴下後に室温で30分間攪拌した。攪拌後、12N硝酸を1ml滴下して80℃で8時間攪拌を行い、ペプチゼーションした。ペプチゼーション終了後、0.45μmのフィルターで濾過し、脱塩カラム(PD10、アマシャム・ファルマシア・バイオサイエンス社)を用いて溶液交換して固形成分1%のアナターゼ型二酸化チタンゾルを調製した。この分散液を容量100mlのバイアル瓶に入れ、200Hzで30分間超音波処理を行った。超音波処理を行う前と後での平均分散粒経は、それぞれ、36.4nm、20.2nmであった。超音波処理後、溶液を濃縮して固形成分20%の二酸化チタンゾル(アナターゼ型)を調製した。
【0028】
得られた二酸化チタンゾル0.75mlを20mlのジメチルホルムアミド(DMF)に分散させ、ポリアクリル酸(平均分子量:5000、和光純薬)0.2gを溶解したDMFを10ml添加後、攪拌して混合した。水熱反応容器に溶液を移し変え、150℃で6時間水熱合成を行った。反応終了後、反応容器温度が50℃以下になるまで冷却し、溶液を取り出した後に水80mlを添加して攪拌混合した。エバポレータでDMFおよび水を除去した後に、再度、水20mlを添加してポリアクリル酸修飾二酸化チタン水溶液とした。2N塩酸1mlを添加して二酸化チタン粒子を沈殿させて、遠心後に上清を除去することにより未反応のポリアクリル酸を分離した。再度水を添加して洗浄を行い、遠心後に水を除去した。50mMリン酸緩衝液(pH7.0)を10ml添加後、200Hzで30分間超音波処理を行い、二酸化チタン粒子を分散させた。超音波処理後、0.45μmのフィルターで濾過し、固形成分1.5%のポリアクリル酸修飾二酸化チタンゾルを得た。作製したポリアクリル酸修飾二酸化チタン微粒子(アナターゼ型)の分散粒径をゼータサイザーナノZS(シスメックス社製)を用いて測定したところ、キュムラント法解析から平均分散粒径は45.5nmであった。この測定は、ゼータ電位測定セルにポリエチレンイミン結合二酸化チタン微粒子を含む分散液0.75mlを仕込み、溶媒の各種パラメーターを水と同値に設定し、25℃にて動的光散乱法により行った。
【0029】
例2:ポリエチレンイミン結合型酸化チタン(TiO2/PEI)粒子の作製
チタンテトライソプロポキシド3.6gとイソプロパノール3.6gを混合し、氷冷下で60mlの超純水に滴下して加水分解を行った。滴下後に室温で30分間攪拌した。攪拌後、12N硝酸1mlを滴下して80℃で8時間攪拌を行い、ペプチゼーションした。ペプチゼーション終了後、0.45μmのフィルターで濾過し、さらに脱塩カラム(PD−10、アマシャム・ファルマシア・バイオサイエンス社製)を用いて溶液交換して固形成分1%の酸性二酸化チタンゾルを調製した。この分散液を容量100mlのバイアル瓶に入れ、200Hzで30分間超音波処理を行った。超音波処理を行う前後の平均分散粒経は、それぞれ、36.4nm、20.2nmであった。超音波処理後、溶液を濃縮して固形成分20%の二酸化チタンゾルを調製した。
【0030】
得られた二酸化チタンゾル0.75mlを20mlのジメチルホルムアミド(DMF)に分散させ、ポリエチレンイミン(平均分子量:10000、和光純薬社製)450mgを溶解したDMF10mlを添加後、攪拌して混合した。水熱反応容器(HU−50、三愛科学社製)に溶液を移し変え、150℃で6時間合成を行った。反応終了後、反応容器温度が50℃以下になるまで冷却し、2倍量のイソプロパノールを添加し、ポリエチレンイミン結合二酸化チタン微粒子を沈殿させ、遠心後に上清を除去することにより未反応のポリエチレンイミンを分離した。70%エタノールを添加して洗浄を行い、遠心後にエタノールを除去した。蒸留水を10ml添加後、200Hzで30分間超音波処理を行い、ポリエチレンイミン結合二酸化チタン微粒子を分散させた。超音波処理後、0.45μmのフィルターで濾過して、固形成分1.5%のポリエチレンイミン結合二酸化チタン微粒子の分散液を得た。作製したポリエチレンイミン結合二酸化チタン微粒子の分散粒径を、ゼータサイザーナノZS(シスメックス社製)を用いて測定したところ、ポリエチレンイミン結合二酸化チタン微粒子の平均粒径は67.7nmであった。この測定は、ゼータ電位測定セルにポリエチレンイミン結合二酸化チタン微粒子の分散液0.75mlを仕込み、溶媒の各種パラメーターを水と同値に設定し、25℃にて動的光散乱法により行った。
【0031】
例3:ポリエチレングリコール結合型酸化チタン(TiO2/PEG)粒子の作製
チタンテトライソプロポキシド3.6gとイソプロパノール3.6gを混合し、氷冷下で60mlの超純水に滴下して加水分解を行った。滴下後に室温で30分間攪拌した。攪拌後、12N硝酸1mlを滴下して80℃で8時間攪拌を行い、ペプチゼーションした。ペプチゼーション終了後、0.45μmのフィルターで濾過し、さらに脱塩カラム(PD−10、アマシャム・バイオサイエンス社製)を用いて溶液交換して固形成分1%の酸性二酸化チタンゾルを調製した。この二酸化チタンゾルを100ml容のバイアル瓶に入れ、超音波発生器MIDSONIC200(カイジョー社製)を用いて200Hzで30分間超音波処理を行った。超音波処理を行った後の平均分散粒経は、12Nの硝酸で1000倍に希釈した後、ゼータサイザーナノZS(シスメックス社製)を用いて、石英測定セルに分散液0.1mlを仕込み、溶媒の各種パラメーターを水と同値に設定し、25℃にて動的光散乱法により測定した。その結果、分散粒径は20.2nmであった。この二酸化チタンゾルを蒸発皿を用いて、50℃下で溶液の濃縮を行い、最終的に固形成分20%の酸性二酸化チタンゾルを調整した。
【0032】
次に、ポリオキシエチレン−モノアリル−モノメチルエーテルと無水マレイン酸の共重合体(平均分子量;33,659−日本油脂製)1gに水5mlを添加して、加水分解後凍結乾燥を行った。反応終了後、ジメチルホルムアミド(DMF)溶液5mlに溶解させポリエチレングリコール溶液200mg/mlを調整した。得られたポリエチレングリコール溶液1.875mlを、27.725mlのDMFに溶液に加え、先に調整したアナタ−ゼ型二酸化チタンゾル0.9mlを添加後、攪拌して混合した。水熱反応容器のHU−50(三愛科学社製)に溶液を移し変え、150℃で5時間水熱合成を行った。反応終了後、反応容器温度が50 ℃以下になるまで冷却し、エバポレータでDMFを除去した後に、蒸留水10mlを添加してポリエチレングリコール結合二酸化チタン水溶液とした。さらに、下記の条件でHPLCに付したところ、素通り画分にUV吸収のピークが確認され、この画分を回収した。
HPLC:AKTA purifier、アマシャム・バイオサイエンス社製
カラム:HiPrep 16/60 Sephacryl S−300HR、アマシャム・バイオサイエンス社製
移動相:リン酸塩緩衝溶液(pH7.4)
流速:0.3ml/min
【0033】
この分散液を蒸留水で0.01%水溶液に希釈し、動的光散乱法による分散粒径およびゼータ電位の測定したところ、分散粒径は45.4nm、ゼータ電位は1.1mVであった。この測定は、ゼータサイザーナノZSを用いて、ゼータ電位測定セルにポリエチレングリコール結合二酸化チタン水溶液0.75mlを仕込み、溶媒の各種パラメーターを水と同値に設定することにより、25℃にて行った。
【0034】
例4:超音波照射による細胞殺傷試験
まず、以下の半導体粒子を用意した。
TiO2/PAA粒子(例1で作製されたもの)
SnO2粒子(シーアイ化成製、SNW15WT%-G02、中性分散体、分散粒径:39nm)
ZnO粒子(シーアイ化成製、Znミズ15WT%-G01、中性分散体、分散粒径:67nm)
CdSe粒子(Quantum Dot社製、Qdot655プロテインA標識、中性分散体、分散粒径:8nm)
ここで、上述した各種粒子の分散粒径は、例1で示した動的光散乱法により得られたものである。
【0035】
次に、上記半導体粒子を、PBS緩衝溶液(pH6.8)に分散させ、この溶液を、1×104cells/mlのJurkat細胞を含む、10%血清入りRPMI1640培地(Invitrogen社)に1/10量添加して、終濃度0.05%となるように試験溶液を調整した。
【0036】
また、比較例として、以下の金属半導体ではない粒子を用意して、上記同様に試験溶液を調製した。
SiO2粒子(シーアイ化成製、Siミズ10WT%−G360、Lot#050420−1、分散粒径:105nm)
Au粒子(ICN Biomedicals,Inc製、ProteinA 20nm、Gold conjugate、分散粒径:40nm)
ここで、上述した各種粒子の分散粒径は、例1で示した動的光散乱法により得られたものである。
【0037】
上記得られた各試験溶液に、超音波照射装置(オージー技研(株)製、ULTRASONIC APPARATUS ES−2:1MHz)により、0.5W/cm2で50%duty cycle運転で1分間超音波を照射して、細胞の殺傷試験を行なった。その結果は、図1に示される通りであった。図1に示されるように、金属半導体粒子を添加した溶液はいずれも細胞の殺傷率が高かったことから、超音波照射により細胞を殺傷できることが確認された。一方、比較例として使用したSiO2粒子やAu粒子にはこの細胞殺傷効果は確認されなかった。
【0038】
例5:金属半導体粒子濃度の依存性
金属半導体粒子として、例1で作製されたTiO2粒子(TiO2/PAA)を用いて、超音波照射による細胞殺傷濃度依存性試験を行なった。酸化チタン粒子を終濃度で、0.001%、0.01%、0.05%、および0.1%となるように、PBS緩衝溶液(pH6.8)で調整し、1×104cells/mlのJurkat細胞を含む、10%血清入りRPMI1640培地(Invitrogen社)に1/10量添加して試験溶液を調整した。この試験溶液に、超音波照射装置(オージー技研(株)製、ULTRASONIC APPARATUS ES−2:1MHz)により、0.5W/cm2で50%duty cycle運転で1分間超音波を照射して、細胞の殺傷試験を行ない、金属半導体粒子濃度の依存性を検討した。その結果は、図2に示される通りであった。酸化チタン粒子を添加した全ての溶液濃度において細胞の生存率が低下していることが確認された。特に、終濃度0.05%溶液において細胞の生存率が低下していることから、細胞殺傷効果の高い終濃度は0.05%であることが分かった。
【0039】
例6:超音波照射によるスーパーオキサイドアニオン生成能の評価
まず、以下の金属半導体粒子を用意した。
TiO2粒子(テイカ製、アナタース型酸化チタン、TKS−203、分散粒径120nm)
SnO2粒子(シーアイ化成製、SNW15WT%−G02、Lot#050526、分散粒径;39nm)
ZnO粒子(シーアイ化成製、Znミズ15WT%−G01、Lot#050523−01、分散粒径:67nm)
【0040】
次に、上記金属半導体粒子を、固形分が終濃度で0.1%となるようにPBS緩衝溶液(pH6.8)に分散させ、スーパーオキサイドアニオンの発生試薬である還元系発色試薬WST−1(同仁化学製)を0.5%溶液となるように水溶液に添加して、試験溶液を調整した。
【0041】
また、比較例として、金属半導体ではない粒子としてSiO2粒子(シーアイ化成製、Siミズ10WT%−G360、Lot#050420−1、分散粒径:105nm)を用意して、上記同様に試験溶液を調製した。
【0042】
上記得られた各試験溶液に、超音波照射装置(オージー技研(株)製、ULTRASONIC APPARATUS ES−2:1MHz)により、0.5W/cm2で50%duty cycle運転で5分間超音波を照射して、450nmにおける波長の吸収を紫外−可視光分光光度計により測定した。その結果は、図3に示される通りであった。図3に示されるように、金属半導体粒子である全ての粒子においてWST−1の分解に伴い黄色ホルマザンを生成することにより吸光度の上昇が認められた。すなわち、TiO2粒子、SnO2粒子、およびZnO粒子は超音波照射によりスーパーオキサイドアニオンを生成することが確認された。
【0043】
例7:超音波照射によるヒドロキシラジカル生成能の評価
まず、以下の金属半導体粒子を用意した。
TiO2粒子(テイカ製、アナタース型酸化チタン、TKS−203、分散粒径:120nm)
SnO2粒子(シーアイ化成製、SNW15WT%−G02、Lot#050526、分散粒径:39nm)
ZnO粒子(シーアイ化成製、Znミズ15WT%−G01、Lot#050523−01、分散粒径:67nm)、
【0044】
次に、上記金属半導体粒子を、固形分が終濃度で0.1%となるようにPBS緩衝溶液(pH6.8)で調整し、ヒドロキシラジカルの生成試薬として活性酸素検出用蛍光試薬ヒドロキシフェニルフルオレセイン(HPF、第一化学薬品製)を5μMとなるように先の金属酸化物粒子を含む溶液に添加して、試験溶液を調整した。
【0045】
また、比較例として、SiO2粒子(シーアイ化成製、Siミズ10WT%−G360、Lot#050420−1、分散粒径:105nm)を用意して、上記同様に試験溶液を調製した。
【0046】
上記得られた各試験溶液に、超音波照射装置(オージー技研(株)製、ULTRASONIC APPARATUS ES−2:1MHz)により、0.5W/cm2で50%duty cycle運転で5分間超音波を照射して、Ex=490nm、Em=515nmにおける波長を蛍光蛍光光度計により測定した。その結果は、図4に示される通りであった。図4に示されるように、金属半導体粒子である全ての粒子において、HPFが反応しフルオレセインを生成し蛍光強度の上昇が認められた。すなわち、TiO2粒子、SnO2粒子、ZnO粒子は超音波照射によってヒドロキシラジカルを生成することが確認された。
【0047】
例8:超音波照射による過酸化水素生成能の評価
まず、以下の金属半導体粒子を用意した。
TiO2粒子(テイカ製、アナタース型酸化チタン、TKS−203、分散粒径:120nm)
SnO2粒子(シーアイ化成製、SNW15WT%−G02、Lot#050526、分散粒径:39nm)
ZnO粒子(シーアイ化成製、Znミズ15WT%−G01、Lot#050523−01、分散粒径:67nm)
【0048】
次に、上記金属半導体粒子を、固形分が終濃度で0.1%となるようにPBS緩衝溶液(pH6.8)で調整し、過酸化水素測定用試薬TPM−PS(同仁化学製)を10μMとなるように水溶液に添加して、試験溶液を調整した。
【0049】
また、比較例として、SiO2粒子(シーアイ化成製、Siミズ10WT%−G360、Lot#050420−1、分散粒径105nm)を用意して、上記同様に試験溶液を調製した。
【0050】
上記得られた各試験溶液に、超音波照射装置(オージー技研(株)製、ULTRASONIC APPARATUS ES-2:1MHz)により、0.5W/cm2で50% duty cycle運転で5分間超音波を照射して、100μlを採取し、Amplex Red Hydrogen Peroxide/Peroxidase Assay Kit (Molecular Probes 社)のマニュアルに従い、同キットで測定を行った。その結果は、図5に示される通りであった。図5に示されるように、TiO2粒子は超音波照射により過酸化水素をより効率的に生成することが確認された。
【0051】
例9:超音波照射による一重項酸素生成能の評価
まず、以下の半導体粒子を用意した。
TiO2粒子(A)(石原産業製、アナターゼ型酸化チタン、STS-240、中性分散体、分散粒径:52nm)
SnO2粒子(シーアイ化成製、SNW15WT%-G02、中性分散体、分散粒径:39nm)
ZnO粒子(シーアイ化成製、Znミズ15WT%-G01、中性分散体、分散粒径:67nm)
TiO2/PAA(例1により作成したもの)
TiO2/PEG(例3により作成したもの)
【0052】
次に、上記半導体粒子を、固形分が終濃度で0.05%となるようにPBS緩衝溶液(pH6.8)で調整し試験溶液を調整した。
【0053】
また、比較例として、SiO2粒子(シーアイ化成製、Siミズ10WT%-G360、中性分散体、分散粒径105nm)を用意して、上記同様に試験溶液を調製した。
【0054】
上記得られた各試験溶液に、超音波照射装置(オージー技研(株)製、ULTRASONIC APPARATUS ES-2:1MHz)により、0.5W/cm2で50% duty cycle運転で5分間超音波を照射して、100μlを採取し、Singlet Oxygen Sensor Green Reagent(Molecular Probes社)のマニュアルに従い、同社のキットで、一重項酸素に起因する、Ex=488nm、Em=525nmにおける蛍光強度を蛍光光度計により測定した。その結果は、図6に示される通りであった。図6に示されるように、TiO2粒子は超音波照射により一重項酸素をより効率的に生成することが確認された。
【0055】
例10:周波数への依存性
2mlのマイクロチューブ中で、PBS緩衝液:850μl、還元系発色試薬WST-1(同仁化学製):50μl、0.1%酸化チタン粒子:100μlの組成の溶液を調製した。酸化チタン粒子としては、TiO2粒子(A)(石原産業製、アナターゼ型酸化チタン、STS-240、中性分散体、分散粒径:52nm)を用いた。
【0056】
得られたマイクロチューブを、水浴中、超音波振動子から3cmの距離で、多周波数超音波発生装置(MODEL4021{KAIJYO}、出力:200W)により超音波を同強度になるように照射した。照射後0、3、6分毎に200μlずつサンプリングを行い 例6と同様の測定方法でスーパーオキサイドアニオンを測定した。測定は、28、50、100、200、および600kHzの各照射周波数について行った。また、コントロールとして、酸化チタン粒子を添加しない場合についても上記同様の測定を行った。それらの結果は、図7に示される通りであった。図7に示されるように、スーパーオキサイドアニオンはチタンが存在することによって生産され、さらにその効果は、照射周波数が最も高い600kHzの場合において、顕著であった。
【0057】
例11:粒子の安定性
水、PBS緩衝液(pH 7.4)、および10%血清を含むRPMI1640培地のそれぞれに以下の粒子を最終濃度 が0.01% になるように分散して、サンプルを得た。
【0058】
酸化チタン(C)(P25粒子;日本エアロジル製をPBS緩衝溶液(pH6.8)で分散させたもの、分散粒径:500nm)
例1により作成したTiO2/PAA粒子
例3により作成したTiO2/PEG粒子
酸化チタン(A)(STS240、石原産業製、中性分散体、分散粒径:52nm)
酸化チタン(B)(TKS-203、テイカ製、アナターゼ型酸化チタン、中性分散体、分散粒径:120nm)
SnO2粒子(シーアイ化成製、SNW15WT%-G02、中性分散体、分散粒径:39nm)
ZnO粒子(シーアイ化成製、Znミズ15WT%-G01、中性分散体、分散粒径:67nm)
【0059】
各粒子の安定性の指標として、各分散液における平均分散粒子径の変化を測定した。この測定は、石英測定セルに分散液0.1mlを仕込み、溶媒の各種パラメーターを水と同値に設定し、ゼータサイザーナノZS(シスメックス社製)を用いて、1時間後と24時間後に25℃にて動的光散乱法により行った。
各分散液について測定された平均分散粒子径を表1に示す。表1に示されるように、中性分散体として市販されている酸化チタン(A)や酸化チタン(B)と比較して、本例で作成した TiO2/PAAおよびTiO2/PEGは平均分散粒子径の変化が少なく、それ故優れた安定性を有することが分かる。
【表1】

【0060】
例12:超音波照射による細胞殺傷試験
まず、TiO2/PAA粒子(例1で作製されたもの 中性分散体、分散粒径:45.5nm)をPBS緩衝溶液(pH6.8)に分散させ、この溶液を、1×104cells/mlのJurkat細胞を含む、10%血清入りRPMI1640培地(Invitrogen社)に1/10量添加して、TiO2/PAA粒子の終濃度0.01%および0.001%となるように試験溶液を調整した。
【0061】
また、比較例として、TiO2粒子(C)(P25粒子;日本エアロジル製をPBS緩衝溶液(pH6.8)で分散させたもの、分散粒径:500nm)を用意して、上記同様に試験溶液を調製した。ここで、上述した各種粒子の分散粒径は、例1で示した動的光散乱法により得られたものである。
【0062】
上記得られた各試験溶液に、超音波照射装置(オージー技研(株)製、ULTRASONIC APPARATUS ES-2:1MHz)により、0.5W/cm2で50%duty cycle運転で1分間超音波を照射して、細胞の殺傷試験を行なった。その結果は、図8に示される通りであった。図8に示されるように、分散粒径45.5nmのTiO2/PAA粒子を添加した溶液はいずれも腫瘍細胞殺傷効果が高いことが確認された。一方、比較例として使用した分散粒径500nmのTiO2粒子(C)においてはこの細胞殺傷効果は確認されなかった。
【0063】
例13:超音波照射によるヒドロキシラジカル生成能の評価
まず、以下の半導体粒子を用意した。
TiO2粒子(A)(石原産業製、アナターゼ型酸化チタン、STS-240、中性分散体、分散粒径:52nm)
TiO2粒子(D)(石原産業製、アナターゼ型酸化チタン、STS-230、中性分散体、分散粒径:15nm)
TiO2粒子(C)(P25粒子;日本エアロジル製をPBS緩衝溶液(pH6.8)で分散させたもの、分散粒径:500nm)
【0064】
次に、上記半導体粒子を、固形分が終濃度で0.05%となるようにPBS緩衝溶液(pH6.8)で調整し、ヒドロキシラジカルの生成試薬として活性酸素検出用蛍光試薬ヒドロキシフェニルフルオレセイン(HPF、第一化学薬品製)を5μMとなるように先の金属酸化物粒子を含む溶液に添加して、試験溶液を調整した。
【0065】
また、コントロールとしてPBS緩衝溶液(pH6.8)を用意して、上記同様に試験溶液を調製した。
【0066】
上記得られた各試験溶液に、超音波照射装置(オージー技研(株)製、ULTRASONIC APPARATUS ES-2:1MHz)により、0.5W/cm2で50% duty cycle運転で5分間超音波を照射して、ヒドロキシラジカルに起因する、Ex=490nm、Em=515nmにおける蛍光強度を蛍光光度計により測定した。その結果は、図9に示される通りであった。図9に示されるように、分散粒径52nmのTiO2粒子(A)および分散粒径の15nmのTiO2粒子(D)においてコントロールよりも顕著なヒドロキシラジカル生成が確認された。しかしながら、分散粒径500nmのTiO2粒子(C)においてはヒドロキシラジカル生成が確認されなかった。
【0067】
例14:粒子の安全性
まず、TiO2/PAA粒子(例1で作製されたもの 中性分散体、分散粒径:45.5nm)、TiO2/PEI粒子(例2で作製されたもの 中性分散体、分散粒径:67.7nm)、およびTiO2/PEG粒子(例3で作製されたもの 中性分散体、分散粒径:45.4nm)をPBS緩衝溶液(pH6.8)に分散させて、各種分散液を得た。これらの分散液を、1×104cells/mlのJurkat細胞を含む、10%血清入りRPMI1640培地(Invitrogen社)に1/10量添加して、TiO2系複合体粒子の終濃度が0.1、0.01、および0.001質量%となるように試料液を調整した。また、対照実験として、PBS緩衝液のみを同様に添加して対照試料液を調整した。調整後、CO2インキュベーターにて37℃で24時間培養し、CellTiterGro Kit(バイオラッド社製)により生細胞数を測定した。対照試料液の生存率を100%として各試験液を比較した結果を図10に示す。図10に示される通り、0.1〜0.001質量%の全試料液において、高い細胞生存率、すなわち高い安全性を示した。
【0068】
例15:ポリマーが結合されたTiO2粒子を用いた超音波照射による細胞殺傷試験
TiO2/PAA粒子(例1で作製されたもの)、TiO2/PEI粒子(例2で作製されたもの)およびTiO2/PEG粒子(例3で作製されたもの)を、PBS緩衝溶液(pH6.8)に分散させ、この溶液を、1×104cells/mlのJurkat細胞を含む、10%血清入りRPMI1640培地(Invitrogen社)に1/10量添加して、終濃度0.05%となるように試験溶液を調整した。
【0069】
上記得られた各試験溶液に、超音波照射装置(オージー技研(株)製、ULTRASONIC APPARATUS ES-2:1MHz)により、0.5W/cm2で50%duty cycle運転で1分間超音波を照射して、細胞の殺傷試験を行なった。その結果は、図11に示される通りであった。図11に示されるように、TiO2/PAA粒子、TiO2/PEI粒子およびTiO2/PEG粒子のいずれの粒子を添加した溶液も細胞生存率が低い、すなわち殺傷率が高かった。特に、TiO2/PEG粒子を添加した溶液は細胞生存率が極めて低かったことから、このTiO2/PEG粒子は超音波照射により細胞を殺傷できる効果が特に高いことが確認された。
【0070】
例16:超音波照射による細胞殺傷試験2
まず、TiO2/PAA粒子(例1で作製されたもの 中性分散体、分散粒径:45.5nm)をPBS緩衝溶液(pH6.8)に分散させ、この溶液を、5×104cells/mlのJurkat細胞を含む、10%血清入りRPMI1640培地(Invitrogen社)に1/10量添加して、TiO2/PAA粒子の終濃度0.05%となるように試験溶液を3ml調整した。
【0071】
また、コントロールとしてPBS緩衝溶液(pH6.8)を用意して、上記同様に試験溶液を調製した。
【0072】
上記得られた各試験溶液に、超音波照射装置(松下電工(株)製、EH2435:5MHz)により、最大出力で2分間超音波を連続照射して、細胞の殺傷試験を行なった。その結果は、図11に示される通りであった。PBS緩衝溶液を添加し、超音波照射を行わなかった生細胞の数を100%として生存率で示した。図11に示されるように、分散粒径45.5nmのTiO2/PAA粒子を添加した溶液は腫瘍細胞殺傷効果が高いことが確認された。
【0073】
例17:抗腫瘍効果試験
ヌードマウス Balb/c、雄、3週齢)にヒト膀胱癌由来株化細胞(T−24)を皮下接種し、腫瘍を形成させ、約0.63mm3程度の腫瘍を形成させた。実施例1で作成したPAA―TiO2をPBS緩衝液にて0.5 %に希釈し、腫瘍に100μl局所注射した。投与より24時間後に、時間1分 出力1W パルス50%で1MHzの超音波を超音波照射装置(オージー技研(株)製、ULTRASONIC APPARATUS ES-2:1MHz; プローブ径 10mm)を用いて照射した。照射は、水溶性高分子ゲルを皮膚に塗布し、その上にプローブ(超音波照射部)を密着させた後に行った。マウス数は1群あたり6匹とし、PBSのみ投与又は無処置動物を対照群とした。超音波照射後、各個体の腫瘍体積を測定し、各個体の超音波照射施工日(0日)におけるPAA−TiO2投与前のs腫瘍体積を1とした時の各測定時点の腫瘍体積(相対腫瘍増殖率)を求めた。
【0074】
結果を図13に示す。
図13に示されるとおり、酸化チタン+超音波照射の存在時のみ、腫瘍の大幅な増殖抑制効果が確認された。
【図面の簡単な説明】
【0075】
【図1】例4において各種粒子について測定された、超音波を1分間照射した際の細胞の殺傷率を示す図である。
【図2】例5において各種濃度のTiO2粒子(TiO2/PAA)含有試験溶液について測定された、細胞の生存率を示す図である。
【図3】例6において各種粒子について測定された、超音波の照射によるスーパーオキサイドアニオンの発生に起因する、還元系発色試薬を介した吸光度の上昇を示す図である。
【図4】例7において各種粒子について測定された、超音波の照射によるヒドロキシラジカルの発生に起因する、活性酸素検出用蛍光試薬を介した蛍光の強度を示す図である。
【図5】例8において各種粒子について測定された、超音波の照射による過酸化水素の発生に起因する、TPM-PSの酸化を介した吸光度の上昇を示す図である。
【図6】例9において各種粒子について測定された、超音波照射による一重項酸素の発生に起因する、一重項酸素検出用蛍光試薬を介した蛍光強度を示す図である。
【図7】例10においてTiO2(A)について測定された、超音波の照射によるスーパーオキサイドアニオンの発生に起因する、還元系発色試薬を介した吸光度の上昇を示す図である。
【図8】例12において各種粒子について測定された、超音波を1分間照射した際の細胞の生存率を示す図である。
【図9】例13において各種粒子について測定された、超音波の照射によるヒドロキシラジカルの発生に起因する、活性酸素検出用蛍光試薬を介した蛍光強度を示す図である。
【図10】例14において各種濃度のTiO2粒子含有試験溶液について測定された、細胞の生存率を示す図である。
【図11】例15において各種粒子について測定された、超音波を1分間照射した際の細胞の殺傷率を示す図である。
【図12】例16においてTiO2/PAA粒子およびPBS緩衝溶液について測定された、超音波を2分間照射した際(超音波あり)、および照射なし(超音波なし)の細胞の生存率を示す図である。
【図13】例17において測定された、マウスの相対腫瘍増殖率の経時変化を示す図である。
【特許請求の範囲】
【請求項1】
金属半導体粒子を含んでなる、超音波癌治療促進剤。
【請求項2】
前記金属半導体粒子が、超音波照射によりラジカル種を生成可能である、請求項1に記載の超音波癌治療促進剤。
【請求項3】
前記金属半導体粒子が、光感応特性を有する、請求項1または2に記載の超音波癌治療促進剤。
【請求項4】
前記金属半導体粒子が、光触媒活性を有する、請求項1〜3のいずれか一項に記載の超音波癌治療促進剤。
【請求項5】
前記光触媒活性を有する金属半導体粒子が、TiO2、ZnO、SnO2、WO3、In2O3、SrTiO3、Nb2O5、およびTa2O5からなる群から選択される、請求項4に記載の超音波癌治療促進剤。
【請求項6】
前記金属半導体粒子が、TiO2である、請求項1〜5のいずれか一項に記載の超音波癌治療促進剤。
【請求項7】
前記金属半導体粒子が、50〜200nmの粒子径を有する、請求項1〜6のいずれか一項に記載の超音波癌治療促進剤。
【請求項8】
前記金属半導体粒子が、量子ドットである、請求項1〜3のいずれか一項に記載の超音波癌治療促進剤。
【請求項9】
前記量子ドットが、CdSe、CdS、CdTe、ZnS、ZnSe、InGaPおよびZnTeからなる群から選択される少なくとも一種である、請求項8に記載の超音波癌治療促進剤。
【請求項10】
前記金属半導体粒子が、凝集または結合されてなる、50〜200nmの粒子径を有する二次粒子の形態を有する、請求項1〜6、8、および9のいずれか一項に記載の超音波癌治療促進剤。
【請求項11】
前記金属半導体粒子が、複数種類の金属半導体粒子の混合物または複合体である、請求項1〜10のいずれか一項に記載の超音波癌治療促進剤。
【請求項12】
前記金属半導体粒子の表面に、ポリマーまたは生体由来高分子が結合されてなる、請求項1〜11のいずれか一項に記載の超音波癌治療促進剤。
【請求項13】
前記ポリマーが、カルボキシル基を有するポリマーである、請求項12に記載の超音波癌治療促進剤。
【請求項14】
前記ポリマーが、カチオン性ポリマーである、請求項12に記載の超音波癌治療促進剤。
【請求項15】
前記ポリマーが、ノニオン性ポリマーである、請求項12に記載の超音波癌治療促進剤。
【請求項16】
前記金属半導体粒子が、溶媒に分散されてなる、請求項1〜15のいずれか一項に記載の超音波癌治療促進剤。
【請求項17】
前記分散液が中性の液性を有する、請求項16に記載の超音波癌治療促進剤。
【請求項18】
前記分散液が、生理食塩水である、請求項16または17に記載の超音波癌治療促進剤。
【請求項19】
金属半導体粒子を含んでなり、超音波照射を受け、該照射により細胞毒となる、殺細胞剤。
【請求項20】
体内に投与され、超音波照射を受け、該照射により細胞毒となる、請求項19に記載の殺細胞剤。
【請求項21】
殺対象が癌細胞である、請求項19または20に記載の殺細胞剤。
【請求項22】
前記細胞毒が、超音波照射により前記半導体粒子が発生するラジカル種により生じる、請求項19〜22のいずれか一項に記載の殺細胞剤。
【請求項1】
金属半導体粒子を含んでなる、超音波癌治療促進剤。
【請求項2】
前記金属半導体粒子が、超音波照射によりラジカル種を生成可能である、請求項1に記載の超音波癌治療促進剤。
【請求項3】
前記金属半導体粒子が、光感応特性を有する、請求項1または2に記載の超音波癌治療促進剤。
【請求項4】
前記金属半導体粒子が、光触媒活性を有する、請求項1〜3のいずれか一項に記載の超音波癌治療促進剤。
【請求項5】
前記光触媒活性を有する金属半導体粒子が、TiO2、ZnO、SnO2、WO3、In2O3、SrTiO3、Nb2O5、およびTa2O5からなる群から選択される、請求項4に記載の超音波癌治療促進剤。
【請求項6】
前記金属半導体粒子が、TiO2である、請求項1〜5のいずれか一項に記載の超音波癌治療促進剤。
【請求項7】
前記金属半導体粒子が、50〜200nmの粒子径を有する、請求項1〜6のいずれか一項に記載の超音波癌治療促進剤。
【請求項8】
前記金属半導体粒子が、量子ドットである、請求項1〜3のいずれか一項に記載の超音波癌治療促進剤。
【請求項9】
前記量子ドットが、CdSe、CdS、CdTe、ZnS、ZnSe、InGaPおよびZnTeからなる群から選択される少なくとも一種である、請求項8に記載の超音波癌治療促進剤。
【請求項10】
前記金属半導体粒子が、凝集または結合されてなる、50〜200nmの粒子径を有する二次粒子の形態を有する、請求項1〜6、8、および9のいずれか一項に記載の超音波癌治療促進剤。
【請求項11】
前記金属半導体粒子が、複数種類の金属半導体粒子の混合物または複合体である、請求項1〜10のいずれか一項に記載の超音波癌治療促進剤。
【請求項12】
前記金属半導体粒子の表面に、ポリマーまたは生体由来高分子が結合されてなる、請求項1〜11のいずれか一項に記載の超音波癌治療促進剤。
【請求項13】
前記ポリマーが、カルボキシル基を有するポリマーである、請求項12に記載の超音波癌治療促進剤。
【請求項14】
前記ポリマーが、カチオン性ポリマーである、請求項12に記載の超音波癌治療促進剤。
【請求項15】
前記ポリマーが、ノニオン性ポリマーである、請求項12に記載の超音波癌治療促進剤。
【請求項16】
前記金属半導体粒子が、溶媒に分散されてなる、請求項1〜15のいずれか一項に記載の超音波癌治療促進剤。
【請求項17】
前記分散液が中性の液性を有する、請求項16に記載の超音波癌治療促進剤。
【請求項18】
前記分散液が、生理食塩水である、請求項16または17に記載の超音波癌治療促進剤。
【請求項19】
金属半導体粒子を含んでなり、超音波照射を受け、該照射により細胞毒となる、殺細胞剤。
【請求項20】
体内に投与され、超音波照射を受け、該照射により細胞毒となる、請求項19に記載の殺細胞剤。
【請求項21】
殺対象が癌細胞である、請求項19または20に記載の殺細胞剤。
【請求項22】
前記細胞毒が、超音波照射により前記半導体粒子が発生するラジカル種により生じる、請求項19〜22のいずれか一項に記載の殺細胞剤。
【図1】


【図2】


【図3】


【図4】


【図5】


【図6】


【図7】


【図8】


【図9】


【図10】


【図11】


【図12】


【図13】




【図2】


【図3】


【図4】


【図5】


【図6】


【図7】


【図8】


【図9】


【図10】


【図11】


【図12】


【図13】


【公開番号】特開2008−94816(P2008−94816A)
【公開日】平成20年4月24日(2008.4.24)
【国際特許分類】
【出願番号】特願2006−291542(P2006−291542)
【出願日】平成18年10月26日(2006.10.26)
【出願人】(000010087)TOTO株式会社 (3,889)
【Fターム(参考)】
【公開日】平成20年4月24日(2008.4.24)
【国際特許分類】
【出願日】平成18年10月26日(2006.10.26)
【出願人】(000010087)TOTO株式会社 (3,889)
【Fターム(参考)】
[ Back to top ]

