超高速の核酸配列決定のための電界効果トランジスタ装置
【課題】DNAまたはRNAの個々の塩基を正確かつ有効に識別するためのシステムおよび方法を提供することである。
【解決手段】
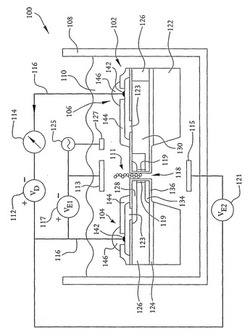
電界効果トランジスタ(FET)核酸配列決定装置(102)は、ソース(106)およびドレイン(104)領域ならびにゲート酸化物(136)を含む。ソース/ドレイン金属接点(123、142)に接続されたリード線(116)を介して電圧源(112)によってソースおよびドレインに電位が印加される。核酸鎖(111)がゲート電極領域となる開口部(118)を通過すると、核酸塩基(アデニン、チミン、グアニン、またはシトシン)を表す電荷が、チャネル(119)を介してソース(106)およびドレイン(104)間を流れる電流をその間の電界を変えることによって変え、電流計(114)によって測定される。
【解決手段】
電界効果トランジスタ(FET)核酸配列決定装置(102)は、ソース(106)およびドレイン(104)領域ならびにゲート酸化物(136)を含む。ソース/ドレイン金属接点(123、142)に接続されたリード線(116)を介して電圧源(112)によってソースおよびドレインに電位が印加される。核酸鎖(111)がゲート電極領域となる開口部(118)を通過すると、核酸塩基(アデニン、チミン、グアニン、またはシトシン)を表す電荷が、チャネル(119)を介してソース(106)およびドレイン(104)間を流れる電流をその間の電界を変えることによって変え、電流計(114)によって測定される。
【発明の詳細な説明】
【技術分野】
【0001】
本発明は、炭水化物、タンパク質のような長鎖ポリマーの個々の構成要素(mers)およびデオキシリボ核酸(DNA)またはリボ核酸(RNA)の個々の塩基を識別するための検出領域を有する半導体装置を使用するシステムおよび方法ならびに半導体装置を製作するための方法に関する。特に、本発明は、DNA/RNA鎖の塩基を識別し、これにより対象となる鎖の配列決定を可能にすることができる電界効果トランジスタ装置と同様の半導体装置を使用するシステムおよび方法に関する。
【背景技術】
【0002】
本出願は、米国特許法第119条(e)に基づき、「超高速の半導体に基づいた遺伝子配列決定(”Ultra-Fast, Semiconductor-Based Gene Sequencing”)」という名称のジョン R.ザウアー(Jon R. Sauer)らの米国特許仮出願、第60/199,130号、出願日2000年4月24日および「DNA配列決定用電荷検知および増幅装置(”Charge Sensing and Amplification Device for DNA Sequencing”)」という名称のバート ヴァン ゼーブロック(Bart Van Zeghbroeck)らの米国特許仮出願、第60/217,681号、出願日2000年7月12日の利益を主張し、米国特許法第120条に基づき、「超高速核酸配列決定装置ならびにそれを製作および使用するための方法(”An Ultra-Fast Nucleic Acid Sequencing Device and a Method for Making and Using the Same”)」という名称のジョン R.ザウアー(Jon R. Sauer)らの米国特許非仮出願(non-provisional application)、第09/653,543号、出願日2001年8月31日の利益を主張するものであり、上記仮出願および非仮出願の双方の全内容は参照により本明細書に援用されている。
【0003】
DNAは、共通の軸の周りを巻いている2つの非常に長いらせん状のポリヌクレオチド鎖からなる。二重らせんの2つの鎖は反対の向きになっている。2つの鎖は、アデニン(A)、チミン(T)、グアニン(G)およびシトシン(C)からなる対の塩基間の水素結合によってまとめられている。アデニンは常にチミンと対になり、グアニンは常にシトシンと対になる。それゆえ、二重らせんの一方の鎖はもう一方と相補的である。
【0004】
遺伝情報は、DNA鎖に沿った塩基の具体的な配列において暗号化される。通常の細胞においては、遺伝情報はDNAからRNAへ渡される。RNA分子の大部分は一本鎖であるが、大部分は、鎖がヘアピン状の構造に折れることから生じる広範囲の二重らせん領域を含む。
【0005】
DNA配列のマッピングは、ヒトゲノム計画によって具体化される新時代の遺伝子に基づく医療の一部を成している。この計画の尽力によって、いつか医者は個人の遺伝子の構成に基づいて治療をその人に合ったものにすることができるであろうし、出生前に遺伝子の欠陥を修正することさえできるかもしれない。しかしながら、この課題を達成するためには各個人のDNAを配列決定することが必要となる。ヒトゲノム配列の差異はおよそ0.1%であるが、この小さな差異が個人の種々の病気に対する素因を理解するのに重要である。近い将来には、医療が「DNA的に個人化(DNA personalized)」され、医師は今日のコレステロール検査を手配するのと全く同じくらい容易に、配列情報を手配するようになると考えられる。したがって、このような発展を日常生活において用いられるようにするために、より高速で経済的なDNA配列決定方法が求められる。
【0006】
DNA配列決定を行う1つの方法は、特許文献1に開示されており、その全内容は参照により本明細書に援用されている。この方法は、半導体基板のような基板上に形成されたテストサイトのモノリシックアレイを使用する。各テストサイトは、所定の標的分子構造と結合するようになっているプローブを含んでいる。テストサイトでのプローブへの分子構造の結合は、テストサイトの電気的、機械的および光学的特性を変化させる。したがって、テストサイトに信号が与えられると、各テストサイトの電気的、機械的および光学的特性を測定して、どのプローブがそれぞれの標的分子構造と結合したのかを決定することができる。しかしながら、テストサイトのアレイは製造するには複雑で、種々のタイプの標的分子構造を検出するための多数のプローブを用いなければならないため、この方法は不利である。
【0007】
配列決定の別の方法は、ゲル電気泳動として公知である。この技術では、DNAを分解して1つの鎖にして4つのヌクレオチドのうちの1つ、例えばAを破壊する化学物質に露出し、これにより、Aで終わり、反対側の一端で標識されたDNA断片のランダムな分布を有する鎖を生成する。他の3つの残りの塩基について同じ手続きを繰り返す。DNA断片は、ゲル電気泳動によって長さに応じて分けられる。長さは標識された端から既知の塩基への距離を示し、対象範囲にギャップがなければもとのDNA鎖断片の配列が決定される。
【0008】
このDNA配列決定方法は、それと関連する欠点を多く有している。この技術ではおよそ500の塩基の読取りしかできない。なぜなら、それより多くの塩基を含むDNA鎖だと「丸まって」しまい、正しく読取ることができないからである。また、鎖の長さが長くなると長さ決定の分解能が急激に低下し、このことも同様に鎖の解析を500塩基長までに制限する。加えて、ゲル電気泳動は非常に時間がかかり、複雑な有機体のゲノムの配列決定という課題に対しては有効な解決手段ではない。さらに、電気泳動の前の準備および後の解析は、本質的に費用および時間がかかるものである。したがって、より高速で、一定していて、より経済的なDNA配列決定のための方法が求められている。
【0009】
DNA配列決定への別のアプローチは、特許文献2および特許文献3に記載されており、それらの全内容は参照により本明細書に援用されている。この技術では、2つの液体がアルファヘモリシン(アルファ溶血素)孔(alpha hemolysinpores)を有する生体膜によって分離される。DNAが膜を通過すると、孔を通るイオン電流が遮断される。実験によって、孔を通るイオン電流が遮断される時間の長さはDNA断片の長さと比例することが示されている。さらに、遮断の量および速度は、どの塩基が孔の最も狭い部分にあるかに依存する。このため、これらの現象から塩基配列を決定できる可能性がある。
【0010】
この技術の問題には、これまでのところ個々のヌクレオチドを区別できないということがある。また、個々のヌクレオチドの空間的な向きを見分けることは困難である。さらに、電荷の流れを測定する電極が孔からかなり離れており、このことが測定の精度に悪影響を及ぼす。これは、大部分は、電流検知電極の特有の静電容量と、少量の電流の検知における統計的変動が大きいこととによるものである。さらに、特有のショットノイズなどのノイズ源が信号を歪ませ、さらなる誤差を招く。したがって、塩基がシーケンサを通過するときにそれらを区別する、より感度の高い検出システムが求められている。
【先行技術文献】
【特許文献】
【0011】
【特許文献1】米国特許第5,653,939号明細書
【特許文献2】米国特許第5,795,782号明細書
【特許文献3】米国特許第6,015,714号明細書
【発明の概要】
【発明が解決しようとする課題】
【0012】
本発明の目的は、DNAまたはRNAの個々の塩基を正確かつ有効に識別するためのシステムおよび方法を提供することである。
【0013】
本発明の別の目的は、DNAまたはRNAの個々の塩基を配列決定するための半導体装置を使用するシステムおよび方法を提供することである。
【0014】
本発明のさらなる目的は、半導体に基づいたDNAまたはRNA配列決定装置を製造するための方法を提供することである。
【0015】
本発明の別の目的は、正確かつ有効に、炭水化物またはタンパク質のような長鎖ポリマーの個々の構成要素を識別し、かつ長鎖ポリマーの長さを測定するためのシステムおよび方法を提供することである。
【0016】
本発明のさらに別の目的は、DNAまたはRNA分子がシーケンサにおいて開口部を通過する位置で電荷を測定することによってDNAまたはRNAの塩基を正確かつ有効に識別するための、中に開口部を有する半導体に基づいた装置を使用するシステムおよび方法を提供し、これにより、開口部を通るDNAまたはRNA分子のランダムな動きと関連するショットノイズなどのノイズ源の影響を排除または少なくとも最小化することである。
【課題を解決するための手段】
【0017】
ソース領域と、ドレイン領域と、前記ソース領域及び前記ドレイン領域間の検出領域と、を有し、前記ソース領域、前記ドレイン領域及び前記検出領域に延在する開口部は、1〜10nmの範囲の直径を有しており、前記ソース領域、前記ドレイン領域及び前記検出領域は、絶縁体により前記開口部から分離されている、半導体装置を備える、システムを提供する。
【0018】
核酸鎖を検出する方法であって、
ソース領域と、ドレイン領域と、前記ソース領域及び前記ドレイン領域間の検出領域と、を有し、前記ソース領域、前記ドレイン領域及び前記検出領域に延在する開口部が、1〜10nmの範囲の直径を有しており、前記ソース領域、前記ドレイン領域及び前記検出領域が、絶縁体により前記開口部から分離されている半導体装置を提供するステップを備える方法を提供する。
【図面の簡単な説明】
【0019】
【図1】本発明の実施形態に従って構成されたDNAまたはRNAシーケンサを含むDNAまたはRNA配列決定を行うためのシステムを図示する。
【図2】図1に示すDNAまたはRNAシーケンサの平面図を示す。
【図3】DNAまたはRNA配列のアデニン(A)、チミン(T)、グアニン(G)およびシトシン(C)塩基がDNAまたはRNAシーケンサを通過するときの、図1に示すシステムの電流検出器によって検出された電流を表す波形の例を示すグラフである。
【図4】本発明の実施形態に従って図1に示すようなDNAまたはRNAシーケンサを作製するシリコンオンインシュレータ(SOI)基板の断面図を示す。
【図5】シリコン層に形成された浅いn型領域および深いn型領域ならびに切り欠かれた基板の部分を有する図4に示すSOI基板の断面図を示す。
【図6】絶縁体の一部が切り欠かれ、別の浅いn型領域がシリコン層に形成された図5に示すSOI基板の断面図を示す。
【図7】エッチングで形成された開口部を有するSOI基板の断面図を示す。
【図8】図7に示すSOI基板の平面図を示す。
【図9】シリコン層上およびその中の開口部を形成する壁面上に形成された酸化層を有する図7に示すSOI基板の断面図を示す。
【図10】図9に示すSOI基板の平面図を示す。
【図11】シリコン層上およびその中の開口部を形成する壁面上に形成された酸化層を有する図9に示すSOI基板の詳細な断面図を示す。
【図12】図11に示すSOI基板の平面図を示す。
【図13】図7に示すSOI基板の開口部の構成例の詳細な断面図を示す。
【図14】図13に示す開口部の平面図を示す。
【図15】酸化層にエッチングされた穴および浅いn型領域と深いn型領域に接触するためにそれぞれ穴の上方に形成された金属コンタクトを有する図9に示すSOI基板の断面図を示す。
【図16】図4〜15に示す製造ステップに従って作製された図1に示すDNAまたはRNAシーケンサの断面図を示す。;
【図17】本発明の別の実施形態による複数のn型領域によって形成された複数の検出器を有するDNAまたはRNAシーケンサの平面図を示す。
【図18】本発明の別の実施形態によるDNAまたはRNAシーケンサの断面図を示す。
【図19】本発明のさらなる実施形態によるDNAまたはRNAシーケンサの断面図を示す。
【図20】本発明のさらなる実施形態によるDNAまたはRNAシーケンサの断面図を示す。
【図21】図20に示すDNAまたはRNAシーケンサの平面図を示す。
【発明を実施するための形態】
【0020】
図1および2は、DNAまたはRNA、タンパク質または炭水化物のようなポリマー、あるいは石油のような長鎖ポリマーの存在を検出するための、より好ましくはポリマーまたは長鎖ポリマーの個々の構成要素およびポリマーまたは長鎖ポリマーの長さを識別するためのシステム100を図示する。システム100は、好ましくは、本発明の実施形態によるDNAまたはRNA配列決定のような核酸の配列決定を行えるようになっている。したがって、この明細書において、核酸配列決定と関連してシステム100を説明する。
【0021】
システム100は、以下により詳細に説明するように、半導体装置である核酸配列決定装置102を含む。特に、核酸配列決定装置102は、2つのドープ領域つまりドレイン領域104およびソース領域106を含む点で、MOSFETのような電界効果トランジスタに似ている。しかしながら、MOSFETとは異なり、核酸配列決定装置は以下に述べる理由のためにゲート領域を含まない。
【0022】
核酸配列決定装置102は、水、ゲル、KCLなどの緩衝液、または他のあらゆる適切な溶液などの液体110を含む容器108の中に配置される。なお、溶液110は、油などの絶縁媒体または他のあらゆる適切な絶縁媒体であってもよい。さらに、容器108は液体のような媒体を含まなくてもよい。つまり、容器108は、核酸配列決定装置102が配置される真空をつくるために密封して排気することもできる。また、図1は例として容器108の中に1つの核酸配列決定装置102しか示していないが、容器は、並行して複数のDNA配列決定測定を行うための複数の核酸配列決定装置102を含むことができる。
【0023】
容器108内の液体110などの媒体または真空は、核酸配列決定装置102によって配列決定される核酸鎖または核酸鎖の部分111を含む。さらに図示するように、直流電圧源のような電圧源112が、それぞれドレインおよびソース領域104および106を介してリード線116によって電流計114に直列に結合されている。この例では、電圧源112の正のリード線はドレイン領域104に結合され、電圧源112の負のリード線は電流計114を介してソース領域106に結合されている。
【0024】
核酸配列決定装置102のドレインおよびソース領域104および106に印加される電位は、例えば約100mVと小さくてもよく、これは、核酸配列決定装置102の開口部118に核酸鎖を引き込むためにドレインおよびソース領域104および106に勾配をつくるのに十分である。つまり、核酸鎖111は、局部的な勾配によって開口部118を通って移動する。あるいはまたはさらに、液体はイオン溶液を含み得る。この場合、局部的な勾配によって溶液中のイオンが開口部118を通って流れ、このことがDNAまたはRNAのような核酸鎖111が同様に開口部118を通って移動する助けとなる。
【0025】
媒体110内に置かれてさらなる電圧源117および121に接続されたさらなる電極113および115があれば、開口部118に向かう核酸鎖の移動をさらに容易にする。すなわち、外部電極113および115は、媒体110内に電界を印加するために用いられる。この電界は、核酸鎖111などの全ての荷電した粒子が開口部118へ向けてか開口部118から離れてかのいずれかに流れる原因となる。このため、電極113および115は、核酸鎖111を開口部118の中へまたはその外へ向けるための手段として用いられる。電圧源112および117を核酸シーケンサ102に接続するために、金属コンタクト123が以下により詳細に説明するn型ドープ領域128および130に結合されている。電極113および115は、交流電圧源125によってDC電圧に重畳される高周波電圧を提供することもでき得る。メガヘルツ範囲(例えば10MHz)のような無線周波数範囲の周波数を有し得るこの高周波電圧によって、核酸鎖111およびイオンが振動する。この振動は、塩の粒がシェーカーの開口部を通過できるようにソルトシェーカーを振るのと同様の方法で、核酸鎖111がより円滑に開口部118を通るようにする。あるいは、音波発生装置のような装置127を液体110の中または他のあらゆる適切な位置に配置することができ、同様の機械的振とう機能を提供するために装置102を介して音波の振動を送るように制御される。
【0026】
当業者が十分に理解できるように、核酸鎖は、それぞれが特定の大きさおよび極性のイオン電荷を含有する塩基A、C、GおよびTの異なる組み合わせをそれぞれ含んでいる。このため、ドレインおよびソース領域104および106間またはそうでなければ開口部118の両端の電荷勾配は、荷電した核酸鎖に開口部118を通過させる。あるいは、開口部118と液体の間に電位差をつくるために別の電圧源(図示せず)を用いることができる。また、ソースおよびドレイン106および104間に印加される電圧と無関係にDNAの流れを制御するために開口部118の両端に圧力差を与えることができる。
【0027】
また、配列決定装置102は、電圧源112を基準として媒体110に正の電圧を印加することによって核酸鎖を開口部118に引き寄せることができる。さらに、ドレインおよびソース領域104および106の極性をそれぞれ反転することによって、媒体110中の核酸鎖を開口部118に押し込んだりそこから押し出したりし、複数回解析することもできる。
【0028】
以下により詳細に説明するように、開口部118は、ナノメートルの範囲内、例えば約1nmから約10nmの範囲内の直径を有するように構成される。したがって、常に1つのDNA鎖だけしか開口部118を通過することができない。DNA鎖が開口部118を通過すると、塩基の配列は、鏡像電荷を誘起する。この鏡像電荷は、開口部118が形成された装置の壁面に沿って垂直方向に延伸するチャネル119をドレインおよびソース領域104および106間に形成する。電圧源112によってソース領域106およびドレイン領域104間に電圧が印加されると、チャネル内のこれらの鏡像電荷はソースからドレインへと流れ、結果として電流計114によって検出することができる電流フローとなる。開口部118内に電荷がある限り電流がチャネル内に存在するので、電流計114によって検出される装置電流は、移動電荷と関連する電流よりもはるかに大きい。例えば、開口部118を通過する1つ1つの荷電イオンは、0.16pAのイオン電流および160nAの装置電流の原因となる。
【0029】
あるいは、塩基は、チャネル119内に電荷の変化を誘起し、電流計114によって検出されるような電流の+変化をもたらす。DNA鎖の存在による開口部を通るイオンの流れの変化が同様にチャネル119内の鏡像電荷の変化の原因となり、結果として電流計114によって検出される電流の変化となる。つまり、電流計114によって測定される装置電流は、DNA鎖111が開口部118を通過すると、例えば80μAから4μAに減少する。
【0030】
各タイプの塩基A、C、GおよびTのそれぞれは、それぞれの塩基のタイプと関連する特定の電荷を表す特定の大きさおよび波形を有する電流を誘起する。すなわち、Aタイプの塩基は、核酸配列決定装置102のドレインおよびソース領域間のチャネル内にAタイプの塩基であることを示す大きさおよび波形を有する電流を誘起する。同様に、C、TおよびG塩基は、それぞれ特定の大きさおよび波形を有する電流を誘起する。
【0031】
検出された電流の波形の例を図3に示す。この図は、A、C、GおよびT塩基の存在によって生成される予想信号の形、大きさおよび時間分解能を象徴的に図示している。電流の大きさは、一般的にマイクロアンペア(μA)の範囲にあり、これはピコアンペアの範囲にある開口部118を通って流れるイオン電流の106倍の大きさである。個々の塩基の静電位の計算は、水素結合をもたらす電荷の相補分布を示す。例えば、T−AおよびC−Gの対は、外から対にして見ると同様の分布を有するが、対ではない一本鎖DNAを解析する場合は、水素結合が起こる面が独特である。大きなAおよびG塩基は、水素結合面上でほぼ相補的(正と負が逆)であり、小さなTおよびC塩基についても同様である。
【0032】
したがって、DNA鎖が開口部118を通過すると、電流計114によって検出された誘起された電流の波形および大きさを解釈することによって、鎖の塩基の配列を検出し、それゆえ確認できる。したがって、システム100は、非常に正確で効率的な方法でDNA配列決定を行うことを可能にする。
【0033】
チャネル119内の電子の速度は開口部を通過するイオンの速度よりもはるかに大きいので、ドレイン電流もまた開口部118を通るイオン電流よりもはるかに大きい。イオンの速度1cm/秒および電子の速度106cm/秒の場合、100万倍の増幅が得られる。
【0034】
また、DNA分子の存在は、開口部118を通る電流IPを監視することによって検出できる。つまり、開口部を通る電流IPは、DNA分子が開口部を通過するとき80pAから4pAに減少する。これは、分子が開口部を通過する際の1マイクロ秒当たり25の電子の電荷に相当する。
【0035】
開口部を通る電流ではなく装置電流を測定することには以下の利点がある。装置電流は比較的大きいので測定しやすい。大きな電流は短時間での正確な測定を可能にし、それにより2つのn型領域の間に位置する1つのDNA塩基と関連する電荷の測定を可能にする。これに対して、開口部を通る電流の測定の帯域幅は、開口部118を通る電荷のランダムな動きと関連したショットノイズによって制限される。例えば、10MHzの帯域幅で1pAの電流を測定すると、1.8pAのノイズ電流が生じる。また、装置電流は、開口部118の両側の液体が電気的に絶縁されていなくても測定することができる。つまり、上述のように、配列決定装置102は単一の液体の容器に浸されている。このため、複数の電流測定を並行して行えるようにするために複数のシーケンサ102を単一の液体の容器に浸すことができる。さらに、以下により詳細に述べるように、ナノメートルサイズの開口部118の代わりにDNA分子を2つのn型領域に極めて接近させる他のあらゆる構造または方法を用いることができる。
【0036】
核酸配列決定装置102を作製する好適な方法を図4〜16を参照して説明する。図4に示すように、作製工程は、シリコン基板122、二酸化シリコン(SiO2)層124および薄いp型シリコン層126を含むシリコンオンインシュレータ(SOI)基板のようなウエハ120から始まる。この例では、シリコン基板122は約300μmから約600μmの範囲内の厚さを有し、二酸化シリコン層124は約200から6400nmの範囲内の厚さを有し、p型シリコン層126は約1μm以下(例えば約100nmから約1000nmの範囲内)の厚さを有する。
【0037】
図5に示すように、ヒ素、リンなどのようなn型ドーパントのイオン注入およびアニーリングまたは拡散によってドープn型領域128がp型シリコン層126につくられる。図示するように、n型領域128は、p型シリコン126を完全には貫通しない浅い領域である。図5に示すように深いn型領域130もまたp型シリコン126につくられる。深いn型領域130は、p型シリコン126を貫通して二酸化シリコン124に至り、n型領域128をつくるのに用いられるn型物質と同一または同様であり得るn型物質の拡散、あるいはイオン注入およびアニーリングのような公知の方法によってつくられる。図5にさらに示すように、シリコン基板122は、水酸化カリウム(KOH)中でのエッチングなどのような公知の方法によってその(111)平面に沿ってエッチングされる。基板122の背面はテフロンジグ(teflon jig)でエッチングすることもできる。図示するように、エッチング工程によりシリコン基板122の中央部分が二酸化シリコン124まで切り欠かれて、シリコン基板122に開口部132がつくられる。
【0038】
図6に示すように、開口部132に露出した二酸化シリコン124の部分が、フッ化水素酸中でのエッチング、反応性エッチングなどのような従来のエッチング方法によって切り欠かれる。n型領域128および130をつくるのに用いられるのと同一または同様のn型物質の注入または拡散のような公知の方法によって、開口部132で露出したp型シリコン126の場所に別の浅いn型領域134がつくられる。
【0039】
次いで開口部118(図1および2参照)が、例えば図7および8に示すようにフレオン(Freon)14(CF4)を用いる反応性イオンエッチング(RIE)、光学リソグラフィー、電子ビームリソグラフィーまたはその他の細線リソグラフィーによって、n型領域128、p型シリコン126および底部のn型領域134を貫いて形成され、約10nmの直径を有する開口部となる。図9に示すように、開口部の直径は、シリコンを酸化することでp型シリコン層126および開口部118を形成する壁面の上に二酸化シリコン層136を形成することによってさらに小さくすることができる。この酸化状態は、例えば1000℃の酸素雰囲気中でのシリコンの熱酸化により形成することができる。図11および12に詳細に示すように、結果としての酸化物は、酸化工程中に使われたシリコンよりも大きな体積を有しており、このことが開口部118の直径をさらに狭める。開口部118の直径が1nmほどの小ささであると望ましい。
【0040】
例示のために図1、2および3〜9は開口部118を円筒形の開口部であるように示しているが、例えば図13および14に示すように開口部118が漏斗形を有するのが好ましい。この漏斗形の開口部118は、水酸化カリウム(KOH)を用いて(100)p型シリコン層126のV字形溝エッチングを行うことによってつくられ、p型シリコン126の(111)平面138に沿って形成されたV字形の溝となる。図14に明示するように、V字形または漏斗形の開口部は、開口部118を通るDNA鎖の動きを容易にし、DNA鎖が丸まってしまうために開口部118を通過するのが困難になる可能性を最小にする。酸化およびV字形溝エッチングを組み合わせてさらに小さい開口部を生み出すことができる。さらに、上記のように、熱酸化の代わりに陽極酸化を用いることができる。陽極酸化は、最適な開口部サイズが得られると工程を中止できるように酸化の際に開口部サイズの監視を可能にするというさらなる利点を有する。
【0041】
特に、開口部118は、1度に1つのDNA鎖の分子だけを通過させるのに十分に小さくなければならない。電子ビームリソグラフィーでは10nmほどの小ささの開口部118を形成できるが、さらに小さな開口部が必要である。上記のようなシリコンの酸化およびV字形溝エッチングは、開口部をさらに小さくして1〜2nmという所望のサイズにするために用いることができる。シリコンの酸化によって酸化の際に消費されたシリコンの約2倍の体積を有する二酸化シリコンが得られることが公知である。小さな開口部118の酸化によって開口部サイズが徐々に小さくなり、それにより所望の開口部サイズが提供される。KOHを用いた(100)配向シリコンのV字形溝エッチングにより、(111)平面によって形成されたV字形溝が得られる。正方形のSiO2またはSi3N4マスクを介してのKOHエッチングにより、正方形の断面を有する漏斗形の開口部が得られる。薄いシリコン層のエッチングにより、極めて小さなサイズの開口部118がもう一方の側に得られる。
【0042】
酸化およびV字形溝エッチングを組み合わせてさらに小さな開口部118を形成することもできる。熱酸化の代わりに、酸化の際の開口部118のサイズの監視を可能にするというさらなる利点を有する陽極酸化を用いることができ、適切のサイズの開口部118が得られると酸化を中止することができる。
【0043】
ここで図15を参照すると、n型領域128およびn型領域130を露出させるために二酸化シリコン136に穴140がエッチングされる。次いで、各n型領域128および130に接触するために、金属コンタクト142が二酸化シリコン層136上および穴140内に堆積される。その後、図16に示すように金属コンタクト142の上に絶縁体144が堆積され、このようにして図1に示す装置102が得られる。
【0044】
図1にさらに示すように、リード線116がn型領域128および130に接触できるように絶縁体144の一部を取り除くことができ、このことによりこれらの領域はそれぞれドレイン領域104およびソース領域106を形成する。リード線116がn型領域128および130に接触するために延伸して通る開口部を密閉するために、さらなる絶縁体146が絶縁体144の上に堆積される。その結果、上述のようなDNA配列決定を行うために完成した装置102を作動させることができる。
【0045】
DNA分子の塩基を識別するためには、単一の電子の電荷を測定するのが望ましい。配列決定装置102が0.1×0.1μmの長さおよび幅を有すように製作され、二酸化シリコン層の厚さが開口部118の壁面に沿って0.1μmであると、0.35fFの静電容量、0.45mVの電圧の変化、1mSの装置の相互コンダクタンスおよび0.5nAの電流の変化が実現される。したがって、これらの寸法および特徴を有する配列決定装置102は、単一の電子の電荷を検出するのに用いることができる。配列決定装置102は、異なるヌクレオチドを区別するのに十分な特別の分解能を得るためにさらにサイズを小さくすることができる。
【0046】
装置102のさらなる実施形態もまた作製することができる。例えば、図17は、本発明の別の実施形態による核酸配列決定装置の平面図を示す。この実施形態では、最終的にドレインおよびソース領域を形成するn型領域を形成するために、図3から16に関して上述したステップが実行される。しかしながら、この実施形態では、例えば図5に示すn型領域128は、4つの別個のn型領域150として上記のp型シリコン層126と同様のp型シリコン層に形成される。二酸化シリコン層154は、中にn型領域150がつくられたp型シリコン層を覆っている。穴156は、二酸化シリコン層154上に置かれた金属コンタクト158がn型領域150に接触できるように、二酸化シリコン層154においてエッチングされる。n型領域150によって形成された4つのドレイン領域およびソース領域(図示せず)間を流れる電流を検出することによって、開口部152を通過するDNA鎖の塩基の空間的な向きを検出することができる。
【0047】
図18は、本発明の別の実施形態による核酸配列決定装置160の断面である。核酸配列決定装置102と同様に、核酸配列決定装置160は、シリコン基板162、二酸化シリコン層164、p型シリコン168に注入されたn型領域166およびp型シリコン168に注入された第2のn型領域170を含む。核酸配列決定装置160は、それを貫通する開口部172をさらに有する。開口部は円筒形でもよいし、上記のようなV字形または漏斗形の開口部でもよい。二酸化シリコン層174は、図示するようにp型シリコン層168、n型領域170およびn型領域166を覆っており、上記のようにして開口部172の直径を減少させる。リード線176をn型領域170に接合させるために二酸化シリコン層174に開口部がエッチングされている。別のリード線176もまたn型領域166の露出部分に接合されているので、電圧源178はn型領域170によって形成されたドレイン領域180およびn型領域166によって形成されたソース領域182の間に電位を印加することができる。このようにして、核酸配列決定装置160は、上記の方法でDNA鎖184の塩基を検出するのに用いることができる。
【0048】
図19は、本発明の別の実施形態によるDNA配列決定システム186を示す。システム186は、この例では互いの上部に積み重ねられた3つのMOSFET型装置を含む多層核酸配列決定装置188を含む。つまり、装置188は、上記のシリコン基板122と同様のシリコン基板190を含む。二酸化シリコン層192はシリコン基板190の上にある。装置188は、n型ドープシリコン領域194、p型二酸化シリコン領域196、n型ドープシリコン領域198、p型二酸化シリコン領域200、n型ドープシリコン領域202、p型二酸化シリコン領域204およびn型ドープシリコン領域206をさらに含む。領域194から206は、図19に明示するように互いの上部に積み重ねられている。しかしながら、当業者は十分に理解できるように、この実施形態および本明細書に記載のその他の全ての実施形態について層の極性を反転させることができる。つまり、装置188は、p型ドープシリコン領域194、n型二酸化シリコン領域196、p型ドープシリコン領域198などを含んでもよい。
【0049】
さらに、薄い二酸化シリコン層208が図示するように層の上に形成され、開口部118に関して上述した方法で開口部210の直径を減少させるために開口部210を形成する壁面上にも形成される。また、開口部210は、上記のように円筒形でもV字型の溝または漏斗形の溝でもあり得る。以下に説明するように電圧源214、216および218ならびに電流計220、222および224を装置188に結合するためにリード線212を領域194、198、202および206に接合できるように、二酸化シリコン層208に穴が形成される。上記のように、電圧源214、216および218ならびに電流計220、222および224は、それぞれ電圧源112および電流計114と同様である。
【0050】
特に、リード線212は、電圧源214および電流計220をn型ドープシリコン領域202およびn型ドープシリコン領域206に直列に結合する。したがって、電圧源214は、p型二酸化シリコン領域204によって分離された領域202および206の間に電圧を印加する。リード線212はまた、図示するように電圧源216および電流計222をn型ドープシリコン領域198およびn型ドープシリコン領域202に結合する。さらに、リード線212は、図示するように電圧源218および電流計224をn型ドープシリコン領域194およびn型ドープシリコン領域202に結合する。その結果、図19から十分に理解できるように、n型ドープシリコン領域198およびn型ドープシリコン領域194はそれぞれ第1のMOSFETのドレインおよびソース領域として作用し、n型ドープシリコン領域202およびn型ドープシリコン領域198はそれぞれ第2のMOSFETのドレインおよびソース領域として作用し、n型ドープシリコン領域206およびn型ドープシリコン領域202はそれぞれ第3のMOSFETのドレインおよびソース領域として作用する。これらの3つのMOSFET型装置は、開口部210を通過するDNA鎖の塩基によって誘起された電流を測定することができ、これにより、精度を高めるためにこれらの塩基の複数の測定を行うことができる。
【0051】
また、図20および21に示すように、上記の核酸配列決定装置は、DNA鎖が装置の開口部を通過することを必要とすることなく核酸鎖の塩基を検知するように構成することができる。つまり、上記の技術を用いて、図1に示す核酸配列決定装置102と同様の、表面に近接してドレインおよびソース領域を有する核酸配列決定装置226を作製することができる。なお、図1、20および21に示す同様の構成要素は、同様の参照番号で識別されている。しかしながら、開口部118の代わりに、ドレイン領域からソース領域へと延伸する表面に1つ以上の溝(groove)228を任意に形成することができる。あるいは、表面に溝は形成されないが、核酸鎖111を検出するための検出領域がドレインおよびソース領域間にある。電圧源117および121による電位の印加ならびに容器108内の圧力差の生成のような、上述したものと同様の技術は、核酸鎖111を装置の表面に沿って溝228の上を水平方向に移動させるために用いることができる。核酸鎖の塩基は、電流がドレインおよびソース領域間を流れられるようにする鏡像電荷チャネル230をドレインおよびソース領域間につくる。塩基によって核酸配列決定装置内に誘起された電流は、上記のものと同様の方法で測定することができる。
【0052】
さらに、装置226は、鏡像電荷を含むチャネル230が垂直ではなく水平である点で、図1、17および19に表すその他の実施形態と異なる。この構造は図1、17および19に示す装置102におけるような開口部118を含まないが、この実施形態は、チャネル230のすぐ上方に電荷検知領域を含む。図1と同様に、核酸鎖111を電荷検知領域の方へまたはそれから離れるように向ける電界を与えるために外部電極113および115が用いられる。つまり、核酸鎖111の動きは、ドープ領域130に印加される電圧を基準として外部電極113および115に電圧を印加することによって制御される。核酸鎖111を図20に示す平面に垂直に動かすために、さらなる電極(図示せず)を加えることもできる。
【0053】
装置の電荷検知領域は、チャネル230のすぐ上方かつ2つのドープ領域130の間に位置している。個々の塩基の識別には、2つのドープ領域間の距離が1つの塩基程度であり、各塩基が連続して電荷検知領域の上方にあるように核酸鎖111が動くことが必要である。この水平構成は、さらに並行的かつ連続的な核酸鎖111の解析を可能にし、小さな開口部の作製を必要としない。このアプローチをさらに高めるために、核酸鎖111を導く上述のような溝228の形成などのさらなる表面処理を用いることができる。
【0054】
図19および20に示す水平の実施形態はまた、多数の核酸鎖111の存在を検出するためにも有利である。例えば、媒体として電気泳動ゲルを用いて、種々の長さの核酸鎖111を電極113および115間に置くことから始める。ドープ領域130を基準として負の電圧を電極113および115に印加する。そうすると、核酸鎖111は電荷検知領域へ向けて移動する。小さな鎖は速く移動し、大きな鎖はゆっくり移動する。したがって、小さな鎖がまず電荷検知領域に到着し、その後に大きなものが続く。したがって、電荷検知領域に蓄積された電荷は、およびそれゆえにチャネル230の鏡像電荷もまた、時間とともに「階段状に」増加する。この結果として、電流計114によって測定される電流が階段状に増加または減少する。
【0055】
この処理は、1つのDNA/RNA鎖の個々の塩基の識別とはならないが、電気泳動測定によって行われるのと同等の鎖の長さの測定を提供する。標準の電気泳動に対する利点は、DNA/RNA鎖の位置のリアルタイムの測定が行われることである。また、標準の電気泳動がcmサイズではないとしてもmmサイズの泳動領域を用いるのに対して、ミクロンサイズの装置を容易に製作できるので寸法を大幅に低減することができる。このサイズの低減によって、単一の電荷の検知装置の費用も削減しながら、必要なDNA/RNA鎖がより少ない高速の測定がもたらされる。
【0056】
本発明のいくつかの実施例だけを上記に詳細に説明したが、当業者には、この発明の新規な教示および利点から著しく逸脱することなく、実施例において多くの変形が可能であることが容易に理解される。したがって、このような変形の全ては、以下の請求の範囲において規定されるような本発明の範囲内に含まれるものである。
【技術分野】
【0001】
本発明は、炭水化物、タンパク質のような長鎖ポリマーの個々の構成要素(mers)およびデオキシリボ核酸(DNA)またはリボ核酸(RNA)の個々の塩基を識別するための検出領域を有する半導体装置を使用するシステムおよび方法ならびに半導体装置を製作するための方法に関する。特に、本発明は、DNA/RNA鎖の塩基を識別し、これにより対象となる鎖の配列決定を可能にすることができる電界効果トランジスタ装置と同様の半導体装置を使用するシステムおよび方法に関する。
【背景技術】
【0002】
本出願は、米国特許法第119条(e)に基づき、「超高速の半導体に基づいた遺伝子配列決定(”Ultra-Fast, Semiconductor-Based Gene Sequencing”)」という名称のジョン R.ザウアー(Jon R. Sauer)らの米国特許仮出願、第60/199,130号、出願日2000年4月24日および「DNA配列決定用電荷検知および増幅装置(”Charge Sensing and Amplification Device for DNA Sequencing”)」という名称のバート ヴァン ゼーブロック(Bart Van Zeghbroeck)らの米国特許仮出願、第60/217,681号、出願日2000年7月12日の利益を主張し、米国特許法第120条に基づき、「超高速核酸配列決定装置ならびにそれを製作および使用するための方法(”An Ultra-Fast Nucleic Acid Sequencing Device and a Method for Making and Using the Same”)」という名称のジョン R.ザウアー(Jon R. Sauer)らの米国特許非仮出願(non-provisional application)、第09/653,543号、出願日2001年8月31日の利益を主張するものであり、上記仮出願および非仮出願の双方の全内容は参照により本明細書に援用されている。
【0003】
DNAは、共通の軸の周りを巻いている2つの非常に長いらせん状のポリヌクレオチド鎖からなる。二重らせんの2つの鎖は反対の向きになっている。2つの鎖は、アデニン(A)、チミン(T)、グアニン(G)およびシトシン(C)からなる対の塩基間の水素結合によってまとめられている。アデニンは常にチミンと対になり、グアニンは常にシトシンと対になる。それゆえ、二重らせんの一方の鎖はもう一方と相補的である。
【0004】
遺伝情報は、DNA鎖に沿った塩基の具体的な配列において暗号化される。通常の細胞においては、遺伝情報はDNAからRNAへ渡される。RNA分子の大部分は一本鎖であるが、大部分は、鎖がヘアピン状の構造に折れることから生じる広範囲の二重らせん領域を含む。
【0005】
DNA配列のマッピングは、ヒトゲノム計画によって具体化される新時代の遺伝子に基づく医療の一部を成している。この計画の尽力によって、いつか医者は個人の遺伝子の構成に基づいて治療をその人に合ったものにすることができるであろうし、出生前に遺伝子の欠陥を修正することさえできるかもしれない。しかしながら、この課題を達成するためには各個人のDNAを配列決定することが必要となる。ヒトゲノム配列の差異はおよそ0.1%であるが、この小さな差異が個人の種々の病気に対する素因を理解するのに重要である。近い将来には、医療が「DNA的に個人化(DNA personalized)」され、医師は今日のコレステロール検査を手配するのと全く同じくらい容易に、配列情報を手配するようになると考えられる。したがって、このような発展を日常生活において用いられるようにするために、より高速で経済的なDNA配列決定方法が求められる。
【0006】
DNA配列決定を行う1つの方法は、特許文献1に開示されており、その全内容は参照により本明細書に援用されている。この方法は、半導体基板のような基板上に形成されたテストサイトのモノリシックアレイを使用する。各テストサイトは、所定の標的分子構造と結合するようになっているプローブを含んでいる。テストサイトでのプローブへの分子構造の結合は、テストサイトの電気的、機械的および光学的特性を変化させる。したがって、テストサイトに信号が与えられると、各テストサイトの電気的、機械的および光学的特性を測定して、どのプローブがそれぞれの標的分子構造と結合したのかを決定することができる。しかしながら、テストサイトのアレイは製造するには複雑で、種々のタイプの標的分子構造を検出するための多数のプローブを用いなければならないため、この方法は不利である。
【0007】
配列決定の別の方法は、ゲル電気泳動として公知である。この技術では、DNAを分解して1つの鎖にして4つのヌクレオチドのうちの1つ、例えばAを破壊する化学物質に露出し、これにより、Aで終わり、反対側の一端で標識されたDNA断片のランダムな分布を有する鎖を生成する。他の3つの残りの塩基について同じ手続きを繰り返す。DNA断片は、ゲル電気泳動によって長さに応じて分けられる。長さは標識された端から既知の塩基への距離を示し、対象範囲にギャップがなければもとのDNA鎖断片の配列が決定される。
【0008】
このDNA配列決定方法は、それと関連する欠点を多く有している。この技術ではおよそ500の塩基の読取りしかできない。なぜなら、それより多くの塩基を含むDNA鎖だと「丸まって」しまい、正しく読取ることができないからである。また、鎖の長さが長くなると長さ決定の分解能が急激に低下し、このことも同様に鎖の解析を500塩基長までに制限する。加えて、ゲル電気泳動は非常に時間がかかり、複雑な有機体のゲノムの配列決定という課題に対しては有効な解決手段ではない。さらに、電気泳動の前の準備および後の解析は、本質的に費用および時間がかかるものである。したがって、より高速で、一定していて、より経済的なDNA配列決定のための方法が求められている。
【0009】
DNA配列決定への別のアプローチは、特許文献2および特許文献3に記載されており、それらの全内容は参照により本明細書に援用されている。この技術では、2つの液体がアルファヘモリシン(アルファ溶血素)孔(alpha hemolysinpores)を有する生体膜によって分離される。DNAが膜を通過すると、孔を通るイオン電流が遮断される。実験によって、孔を通るイオン電流が遮断される時間の長さはDNA断片の長さと比例することが示されている。さらに、遮断の量および速度は、どの塩基が孔の最も狭い部分にあるかに依存する。このため、これらの現象から塩基配列を決定できる可能性がある。
【0010】
この技術の問題には、これまでのところ個々のヌクレオチドを区別できないということがある。また、個々のヌクレオチドの空間的な向きを見分けることは困難である。さらに、電荷の流れを測定する電極が孔からかなり離れており、このことが測定の精度に悪影響を及ぼす。これは、大部分は、電流検知電極の特有の静電容量と、少量の電流の検知における統計的変動が大きいこととによるものである。さらに、特有のショットノイズなどのノイズ源が信号を歪ませ、さらなる誤差を招く。したがって、塩基がシーケンサを通過するときにそれらを区別する、より感度の高い検出システムが求められている。
【先行技術文献】
【特許文献】
【0011】
【特許文献1】米国特許第5,653,939号明細書
【特許文献2】米国特許第5,795,782号明細書
【特許文献3】米国特許第6,015,714号明細書
【発明の概要】
【発明が解決しようとする課題】
【0012】
本発明の目的は、DNAまたはRNAの個々の塩基を正確かつ有効に識別するためのシステムおよび方法を提供することである。
【0013】
本発明の別の目的は、DNAまたはRNAの個々の塩基を配列決定するための半導体装置を使用するシステムおよび方法を提供することである。
【0014】
本発明のさらなる目的は、半導体に基づいたDNAまたはRNA配列決定装置を製造するための方法を提供することである。
【0015】
本発明の別の目的は、正確かつ有効に、炭水化物またはタンパク質のような長鎖ポリマーの個々の構成要素を識別し、かつ長鎖ポリマーの長さを測定するためのシステムおよび方法を提供することである。
【0016】
本発明のさらに別の目的は、DNAまたはRNA分子がシーケンサにおいて開口部を通過する位置で電荷を測定することによってDNAまたはRNAの塩基を正確かつ有効に識別するための、中に開口部を有する半導体に基づいた装置を使用するシステムおよび方法を提供し、これにより、開口部を通るDNAまたはRNA分子のランダムな動きと関連するショットノイズなどのノイズ源の影響を排除または少なくとも最小化することである。
【課題を解決するための手段】
【0017】
ソース領域と、ドレイン領域と、前記ソース領域及び前記ドレイン領域間の検出領域と、を有し、前記ソース領域、前記ドレイン領域及び前記検出領域に延在する開口部は、1〜10nmの範囲の直径を有しており、前記ソース領域、前記ドレイン領域及び前記検出領域は、絶縁体により前記開口部から分離されている、半導体装置を備える、システムを提供する。
【0018】
核酸鎖を検出する方法であって、
ソース領域と、ドレイン領域と、前記ソース領域及び前記ドレイン領域間の検出領域と、を有し、前記ソース領域、前記ドレイン領域及び前記検出領域に延在する開口部が、1〜10nmの範囲の直径を有しており、前記ソース領域、前記ドレイン領域及び前記検出領域が、絶縁体により前記開口部から分離されている半導体装置を提供するステップを備える方法を提供する。
【図面の簡単な説明】
【0019】
【図1】本発明の実施形態に従って構成されたDNAまたはRNAシーケンサを含むDNAまたはRNA配列決定を行うためのシステムを図示する。
【図2】図1に示すDNAまたはRNAシーケンサの平面図を示す。
【図3】DNAまたはRNA配列のアデニン(A)、チミン(T)、グアニン(G)およびシトシン(C)塩基がDNAまたはRNAシーケンサを通過するときの、図1に示すシステムの電流検出器によって検出された電流を表す波形の例を示すグラフである。
【図4】本発明の実施形態に従って図1に示すようなDNAまたはRNAシーケンサを作製するシリコンオンインシュレータ(SOI)基板の断面図を示す。
【図5】シリコン層に形成された浅いn型領域および深いn型領域ならびに切り欠かれた基板の部分を有する図4に示すSOI基板の断面図を示す。
【図6】絶縁体の一部が切り欠かれ、別の浅いn型領域がシリコン層に形成された図5に示すSOI基板の断面図を示す。
【図7】エッチングで形成された開口部を有するSOI基板の断面図を示す。
【図8】図7に示すSOI基板の平面図を示す。
【図9】シリコン層上およびその中の開口部を形成する壁面上に形成された酸化層を有する図7に示すSOI基板の断面図を示す。
【図10】図9に示すSOI基板の平面図を示す。
【図11】シリコン層上およびその中の開口部を形成する壁面上に形成された酸化層を有する図9に示すSOI基板の詳細な断面図を示す。
【図12】図11に示すSOI基板の平面図を示す。
【図13】図7に示すSOI基板の開口部の構成例の詳細な断面図を示す。
【図14】図13に示す開口部の平面図を示す。
【図15】酸化層にエッチングされた穴および浅いn型領域と深いn型領域に接触するためにそれぞれ穴の上方に形成された金属コンタクトを有する図9に示すSOI基板の断面図を示す。
【図16】図4〜15に示す製造ステップに従って作製された図1に示すDNAまたはRNAシーケンサの断面図を示す。;
【図17】本発明の別の実施形態による複数のn型領域によって形成された複数の検出器を有するDNAまたはRNAシーケンサの平面図を示す。
【図18】本発明の別の実施形態によるDNAまたはRNAシーケンサの断面図を示す。
【図19】本発明のさらなる実施形態によるDNAまたはRNAシーケンサの断面図を示す。
【図20】本発明のさらなる実施形態によるDNAまたはRNAシーケンサの断面図を示す。
【図21】図20に示すDNAまたはRNAシーケンサの平面図を示す。
【発明を実施するための形態】
【0020】
図1および2は、DNAまたはRNA、タンパク質または炭水化物のようなポリマー、あるいは石油のような長鎖ポリマーの存在を検出するための、より好ましくはポリマーまたは長鎖ポリマーの個々の構成要素およびポリマーまたは長鎖ポリマーの長さを識別するためのシステム100を図示する。システム100は、好ましくは、本発明の実施形態によるDNAまたはRNA配列決定のような核酸の配列決定を行えるようになっている。したがって、この明細書において、核酸配列決定と関連してシステム100を説明する。
【0021】
システム100は、以下により詳細に説明するように、半導体装置である核酸配列決定装置102を含む。特に、核酸配列決定装置102は、2つのドープ領域つまりドレイン領域104およびソース領域106を含む点で、MOSFETのような電界効果トランジスタに似ている。しかしながら、MOSFETとは異なり、核酸配列決定装置は以下に述べる理由のためにゲート領域を含まない。
【0022】
核酸配列決定装置102は、水、ゲル、KCLなどの緩衝液、または他のあらゆる適切な溶液などの液体110を含む容器108の中に配置される。なお、溶液110は、油などの絶縁媒体または他のあらゆる適切な絶縁媒体であってもよい。さらに、容器108は液体のような媒体を含まなくてもよい。つまり、容器108は、核酸配列決定装置102が配置される真空をつくるために密封して排気することもできる。また、図1は例として容器108の中に1つの核酸配列決定装置102しか示していないが、容器は、並行して複数のDNA配列決定測定を行うための複数の核酸配列決定装置102を含むことができる。
【0023】
容器108内の液体110などの媒体または真空は、核酸配列決定装置102によって配列決定される核酸鎖または核酸鎖の部分111を含む。さらに図示するように、直流電圧源のような電圧源112が、それぞれドレインおよびソース領域104および106を介してリード線116によって電流計114に直列に結合されている。この例では、電圧源112の正のリード線はドレイン領域104に結合され、電圧源112の負のリード線は電流計114を介してソース領域106に結合されている。
【0024】
核酸配列決定装置102のドレインおよびソース領域104および106に印加される電位は、例えば約100mVと小さくてもよく、これは、核酸配列決定装置102の開口部118に核酸鎖を引き込むためにドレインおよびソース領域104および106に勾配をつくるのに十分である。つまり、核酸鎖111は、局部的な勾配によって開口部118を通って移動する。あるいはまたはさらに、液体はイオン溶液を含み得る。この場合、局部的な勾配によって溶液中のイオンが開口部118を通って流れ、このことがDNAまたはRNAのような核酸鎖111が同様に開口部118を通って移動する助けとなる。
【0025】
媒体110内に置かれてさらなる電圧源117および121に接続されたさらなる電極113および115があれば、開口部118に向かう核酸鎖の移動をさらに容易にする。すなわち、外部電極113および115は、媒体110内に電界を印加するために用いられる。この電界は、核酸鎖111などの全ての荷電した粒子が開口部118へ向けてか開口部118から離れてかのいずれかに流れる原因となる。このため、電極113および115は、核酸鎖111を開口部118の中へまたはその外へ向けるための手段として用いられる。電圧源112および117を核酸シーケンサ102に接続するために、金属コンタクト123が以下により詳細に説明するn型ドープ領域128および130に結合されている。電極113および115は、交流電圧源125によってDC電圧に重畳される高周波電圧を提供することもでき得る。メガヘルツ範囲(例えば10MHz)のような無線周波数範囲の周波数を有し得るこの高周波電圧によって、核酸鎖111およびイオンが振動する。この振動は、塩の粒がシェーカーの開口部を通過できるようにソルトシェーカーを振るのと同様の方法で、核酸鎖111がより円滑に開口部118を通るようにする。あるいは、音波発生装置のような装置127を液体110の中または他のあらゆる適切な位置に配置することができ、同様の機械的振とう機能を提供するために装置102を介して音波の振動を送るように制御される。
【0026】
当業者が十分に理解できるように、核酸鎖は、それぞれが特定の大きさおよび極性のイオン電荷を含有する塩基A、C、GおよびTの異なる組み合わせをそれぞれ含んでいる。このため、ドレインおよびソース領域104および106間またはそうでなければ開口部118の両端の電荷勾配は、荷電した核酸鎖に開口部118を通過させる。あるいは、開口部118と液体の間に電位差をつくるために別の電圧源(図示せず)を用いることができる。また、ソースおよびドレイン106および104間に印加される電圧と無関係にDNAの流れを制御するために開口部118の両端に圧力差を与えることができる。
【0027】
また、配列決定装置102は、電圧源112を基準として媒体110に正の電圧を印加することによって核酸鎖を開口部118に引き寄せることができる。さらに、ドレインおよびソース領域104および106の極性をそれぞれ反転することによって、媒体110中の核酸鎖を開口部118に押し込んだりそこから押し出したりし、複数回解析することもできる。
【0028】
以下により詳細に説明するように、開口部118は、ナノメートルの範囲内、例えば約1nmから約10nmの範囲内の直径を有するように構成される。したがって、常に1つのDNA鎖だけしか開口部118を通過することができない。DNA鎖が開口部118を通過すると、塩基の配列は、鏡像電荷を誘起する。この鏡像電荷は、開口部118が形成された装置の壁面に沿って垂直方向に延伸するチャネル119をドレインおよびソース領域104および106間に形成する。電圧源112によってソース領域106およびドレイン領域104間に電圧が印加されると、チャネル内のこれらの鏡像電荷はソースからドレインへと流れ、結果として電流計114によって検出することができる電流フローとなる。開口部118内に電荷がある限り電流がチャネル内に存在するので、電流計114によって検出される装置電流は、移動電荷と関連する電流よりもはるかに大きい。例えば、開口部118を通過する1つ1つの荷電イオンは、0.16pAのイオン電流および160nAの装置電流の原因となる。
【0029】
あるいは、塩基は、チャネル119内に電荷の変化を誘起し、電流計114によって検出されるような電流の+変化をもたらす。DNA鎖の存在による開口部を通るイオンの流れの変化が同様にチャネル119内の鏡像電荷の変化の原因となり、結果として電流計114によって検出される電流の変化となる。つまり、電流計114によって測定される装置電流は、DNA鎖111が開口部118を通過すると、例えば80μAから4μAに減少する。
【0030】
各タイプの塩基A、C、GおよびTのそれぞれは、それぞれの塩基のタイプと関連する特定の電荷を表す特定の大きさおよび波形を有する電流を誘起する。すなわち、Aタイプの塩基は、核酸配列決定装置102のドレインおよびソース領域間のチャネル内にAタイプの塩基であることを示す大きさおよび波形を有する電流を誘起する。同様に、C、TおよびG塩基は、それぞれ特定の大きさおよび波形を有する電流を誘起する。
【0031】
検出された電流の波形の例を図3に示す。この図は、A、C、GおよびT塩基の存在によって生成される予想信号の形、大きさおよび時間分解能を象徴的に図示している。電流の大きさは、一般的にマイクロアンペア(μA)の範囲にあり、これはピコアンペアの範囲にある開口部118を通って流れるイオン電流の106倍の大きさである。個々の塩基の静電位の計算は、水素結合をもたらす電荷の相補分布を示す。例えば、T−AおよびC−Gの対は、外から対にして見ると同様の分布を有するが、対ではない一本鎖DNAを解析する場合は、水素結合が起こる面が独特である。大きなAおよびG塩基は、水素結合面上でほぼ相補的(正と負が逆)であり、小さなTおよびC塩基についても同様である。
【0032】
したがって、DNA鎖が開口部118を通過すると、電流計114によって検出された誘起された電流の波形および大きさを解釈することによって、鎖の塩基の配列を検出し、それゆえ確認できる。したがって、システム100は、非常に正確で効率的な方法でDNA配列決定を行うことを可能にする。
【0033】
チャネル119内の電子の速度は開口部を通過するイオンの速度よりもはるかに大きいので、ドレイン電流もまた開口部118を通るイオン電流よりもはるかに大きい。イオンの速度1cm/秒および電子の速度106cm/秒の場合、100万倍の増幅が得られる。
【0034】
また、DNA分子の存在は、開口部118を通る電流IPを監視することによって検出できる。つまり、開口部を通る電流IPは、DNA分子が開口部を通過するとき80pAから4pAに減少する。これは、分子が開口部を通過する際の1マイクロ秒当たり25の電子の電荷に相当する。
【0035】
開口部を通る電流ではなく装置電流を測定することには以下の利点がある。装置電流は比較的大きいので測定しやすい。大きな電流は短時間での正確な測定を可能にし、それにより2つのn型領域の間に位置する1つのDNA塩基と関連する電荷の測定を可能にする。これに対して、開口部を通る電流の測定の帯域幅は、開口部118を通る電荷のランダムな動きと関連したショットノイズによって制限される。例えば、10MHzの帯域幅で1pAの電流を測定すると、1.8pAのノイズ電流が生じる。また、装置電流は、開口部118の両側の液体が電気的に絶縁されていなくても測定することができる。つまり、上述のように、配列決定装置102は単一の液体の容器に浸されている。このため、複数の電流測定を並行して行えるようにするために複数のシーケンサ102を単一の液体の容器に浸すことができる。さらに、以下により詳細に述べるように、ナノメートルサイズの開口部118の代わりにDNA分子を2つのn型領域に極めて接近させる他のあらゆる構造または方法を用いることができる。
【0036】
核酸配列決定装置102を作製する好適な方法を図4〜16を参照して説明する。図4に示すように、作製工程は、シリコン基板122、二酸化シリコン(SiO2)層124および薄いp型シリコン層126を含むシリコンオンインシュレータ(SOI)基板のようなウエハ120から始まる。この例では、シリコン基板122は約300μmから約600μmの範囲内の厚さを有し、二酸化シリコン層124は約200から6400nmの範囲内の厚さを有し、p型シリコン層126は約1μm以下(例えば約100nmから約1000nmの範囲内)の厚さを有する。
【0037】
図5に示すように、ヒ素、リンなどのようなn型ドーパントのイオン注入およびアニーリングまたは拡散によってドープn型領域128がp型シリコン層126につくられる。図示するように、n型領域128は、p型シリコン126を完全には貫通しない浅い領域である。図5に示すように深いn型領域130もまたp型シリコン126につくられる。深いn型領域130は、p型シリコン126を貫通して二酸化シリコン124に至り、n型領域128をつくるのに用いられるn型物質と同一または同様であり得るn型物質の拡散、あるいはイオン注入およびアニーリングのような公知の方法によってつくられる。図5にさらに示すように、シリコン基板122は、水酸化カリウム(KOH)中でのエッチングなどのような公知の方法によってその(111)平面に沿ってエッチングされる。基板122の背面はテフロンジグ(teflon jig)でエッチングすることもできる。図示するように、エッチング工程によりシリコン基板122の中央部分が二酸化シリコン124まで切り欠かれて、シリコン基板122に開口部132がつくられる。
【0038】
図6に示すように、開口部132に露出した二酸化シリコン124の部分が、フッ化水素酸中でのエッチング、反応性エッチングなどのような従来のエッチング方法によって切り欠かれる。n型領域128および130をつくるのに用いられるのと同一または同様のn型物質の注入または拡散のような公知の方法によって、開口部132で露出したp型シリコン126の場所に別の浅いn型領域134がつくられる。
【0039】
次いで開口部118(図1および2参照)が、例えば図7および8に示すようにフレオン(Freon)14(CF4)を用いる反応性イオンエッチング(RIE)、光学リソグラフィー、電子ビームリソグラフィーまたはその他の細線リソグラフィーによって、n型領域128、p型シリコン126および底部のn型領域134を貫いて形成され、約10nmの直径を有する開口部となる。図9に示すように、開口部の直径は、シリコンを酸化することでp型シリコン層126および開口部118を形成する壁面の上に二酸化シリコン層136を形成することによってさらに小さくすることができる。この酸化状態は、例えば1000℃の酸素雰囲気中でのシリコンの熱酸化により形成することができる。図11および12に詳細に示すように、結果としての酸化物は、酸化工程中に使われたシリコンよりも大きな体積を有しており、このことが開口部118の直径をさらに狭める。開口部118の直径が1nmほどの小ささであると望ましい。
【0040】
例示のために図1、2および3〜9は開口部118を円筒形の開口部であるように示しているが、例えば図13および14に示すように開口部118が漏斗形を有するのが好ましい。この漏斗形の開口部118は、水酸化カリウム(KOH)を用いて(100)p型シリコン層126のV字形溝エッチングを行うことによってつくられ、p型シリコン126の(111)平面138に沿って形成されたV字形の溝となる。図14に明示するように、V字形または漏斗形の開口部は、開口部118を通るDNA鎖の動きを容易にし、DNA鎖が丸まってしまうために開口部118を通過するのが困難になる可能性を最小にする。酸化およびV字形溝エッチングを組み合わせてさらに小さい開口部を生み出すことができる。さらに、上記のように、熱酸化の代わりに陽極酸化を用いることができる。陽極酸化は、最適な開口部サイズが得られると工程を中止できるように酸化の際に開口部サイズの監視を可能にするというさらなる利点を有する。
【0041】
特に、開口部118は、1度に1つのDNA鎖の分子だけを通過させるのに十分に小さくなければならない。電子ビームリソグラフィーでは10nmほどの小ささの開口部118を形成できるが、さらに小さな開口部が必要である。上記のようなシリコンの酸化およびV字形溝エッチングは、開口部をさらに小さくして1〜2nmという所望のサイズにするために用いることができる。シリコンの酸化によって酸化の際に消費されたシリコンの約2倍の体積を有する二酸化シリコンが得られることが公知である。小さな開口部118の酸化によって開口部サイズが徐々に小さくなり、それにより所望の開口部サイズが提供される。KOHを用いた(100)配向シリコンのV字形溝エッチングにより、(111)平面によって形成されたV字形溝が得られる。正方形のSiO2またはSi3N4マスクを介してのKOHエッチングにより、正方形の断面を有する漏斗形の開口部が得られる。薄いシリコン層のエッチングにより、極めて小さなサイズの開口部118がもう一方の側に得られる。
【0042】
酸化およびV字形溝エッチングを組み合わせてさらに小さな開口部118を形成することもできる。熱酸化の代わりに、酸化の際の開口部118のサイズの監視を可能にするというさらなる利点を有する陽極酸化を用いることができ、適切のサイズの開口部118が得られると酸化を中止することができる。
【0043】
ここで図15を参照すると、n型領域128およびn型領域130を露出させるために二酸化シリコン136に穴140がエッチングされる。次いで、各n型領域128および130に接触するために、金属コンタクト142が二酸化シリコン層136上および穴140内に堆積される。その後、図16に示すように金属コンタクト142の上に絶縁体144が堆積され、このようにして図1に示す装置102が得られる。
【0044】
図1にさらに示すように、リード線116がn型領域128および130に接触できるように絶縁体144の一部を取り除くことができ、このことによりこれらの領域はそれぞれドレイン領域104およびソース領域106を形成する。リード線116がn型領域128および130に接触するために延伸して通る開口部を密閉するために、さらなる絶縁体146が絶縁体144の上に堆積される。その結果、上述のようなDNA配列決定を行うために完成した装置102を作動させることができる。
【0045】
DNA分子の塩基を識別するためには、単一の電子の電荷を測定するのが望ましい。配列決定装置102が0.1×0.1μmの長さおよび幅を有すように製作され、二酸化シリコン層の厚さが開口部118の壁面に沿って0.1μmであると、0.35fFの静電容量、0.45mVの電圧の変化、1mSの装置の相互コンダクタンスおよび0.5nAの電流の変化が実現される。したがって、これらの寸法および特徴を有する配列決定装置102は、単一の電子の電荷を検出するのに用いることができる。配列決定装置102は、異なるヌクレオチドを区別するのに十分な特別の分解能を得るためにさらにサイズを小さくすることができる。
【0046】
装置102のさらなる実施形態もまた作製することができる。例えば、図17は、本発明の別の実施形態による核酸配列決定装置の平面図を示す。この実施形態では、最終的にドレインおよびソース領域を形成するn型領域を形成するために、図3から16に関して上述したステップが実行される。しかしながら、この実施形態では、例えば図5に示すn型領域128は、4つの別個のn型領域150として上記のp型シリコン層126と同様のp型シリコン層に形成される。二酸化シリコン層154は、中にn型領域150がつくられたp型シリコン層を覆っている。穴156は、二酸化シリコン層154上に置かれた金属コンタクト158がn型領域150に接触できるように、二酸化シリコン層154においてエッチングされる。n型領域150によって形成された4つのドレイン領域およびソース領域(図示せず)間を流れる電流を検出することによって、開口部152を通過するDNA鎖の塩基の空間的な向きを検出することができる。
【0047】
図18は、本発明の別の実施形態による核酸配列決定装置160の断面である。核酸配列決定装置102と同様に、核酸配列決定装置160は、シリコン基板162、二酸化シリコン層164、p型シリコン168に注入されたn型領域166およびp型シリコン168に注入された第2のn型領域170を含む。核酸配列決定装置160は、それを貫通する開口部172をさらに有する。開口部は円筒形でもよいし、上記のようなV字形または漏斗形の開口部でもよい。二酸化シリコン層174は、図示するようにp型シリコン層168、n型領域170およびn型領域166を覆っており、上記のようにして開口部172の直径を減少させる。リード線176をn型領域170に接合させるために二酸化シリコン層174に開口部がエッチングされている。別のリード線176もまたn型領域166の露出部分に接合されているので、電圧源178はn型領域170によって形成されたドレイン領域180およびn型領域166によって形成されたソース領域182の間に電位を印加することができる。このようにして、核酸配列決定装置160は、上記の方法でDNA鎖184の塩基を検出するのに用いることができる。
【0048】
図19は、本発明の別の実施形態によるDNA配列決定システム186を示す。システム186は、この例では互いの上部に積み重ねられた3つのMOSFET型装置を含む多層核酸配列決定装置188を含む。つまり、装置188は、上記のシリコン基板122と同様のシリコン基板190を含む。二酸化シリコン層192はシリコン基板190の上にある。装置188は、n型ドープシリコン領域194、p型二酸化シリコン領域196、n型ドープシリコン領域198、p型二酸化シリコン領域200、n型ドープシリコン領域202、p型二酸化シリコン領域204およびn型ドープシリコン領域206をさらに含む。領域194から206は、図19に明示するように互いの上部に積み重ねられている。しかしながら、当業者は十分に理解できるように、この実施形態および本明細書に記載のその他の全ての実施形態について層の極性を反転させることができる。つまり、装置188は、p型ドープシリコン領域194、n型二酸化シリコン領域196、p型ドープシリコン領域198などを含んでもよい。
【0049】
さらに、薄い二酸化シリコン層208が図示するように層の上に形成され、開口部118に関して上述した方法で開口部210の直径を減少させるために開口部210を形成する壁面上にも形成される。また、開口部210は、上記のように円筒形でもV字型の溝または漏斗形の溝でもあり得る。以下に説明するように電圧源214、216および218ならびに電流計220、222および224を装置188に結合するためにリード線212を領域194、198、202および206に接合できるように、二酸化シリコン層208に穴が形成される。上記のように、電圧源214、216および218ならびに電流計220、222および224は、それぞれ電圧源112および電流計114と同様である。
【0050】
特に、リード線212は、電圧源214および電流計220をn型ドープシリコン領域202およびn型ドープシリコン領域206に直列に結合する。したがって、電圧源214は、p型二酸化シリコン領域204によって分離された領域202および206の間に電圧を印加する。リード線212はまた、図示するように電圧源216および電流計222をn型ドープシリコン領域198およびn型ドープシリコン領域202に結合する。さらに、リード線212は、図示するように電圧源218および電流計224をn型ドープシリコン領域194およびn型ドープシリコン領域202に結合する。その結果、図19から十分に理解できるように、n型ドープシリコン領域198およびn型ドープシリコン領域194はそれぞれ第1のMOSFETのドレインおよびソース領域として作用し、n型ドープシリコン領域202およびn型ドープシリコン領域198はそれぞれ第2のMOSFETのドレインおよびソース領域として作用し、n型ドープシリコン領域206およびn型ドープシリコン領域202はそれぞれ第3のMOSFETのドレインおよびソース領域として作用する。これらの3つのMOSFET型装置は、開口部210を通過するDNA鎖の塩基によって誘起された電流を測定することができ、これにより、精度を高めるためにこれらの塩基の複数の測定を行うことができる。
【0051】
また、図20および21に示すように、上記の核酸配列決定装置は、DNA鎖が装置の開口部を通過することを必要とすることなく核酸鎖の塩基を検知するように構成することができる。つまり、上記の技術を用いて、図1に示す核酸配列決定装置102と同様の、表面に近接してドレインおよびソース領域を有する核酸配列決定装置226を作製することができる。なお、図1、20および21に示す同様の構成要素は、同様の参照番号で識別されている。しかしながら、開口部118の代わりに、ドレイン領域からソース領域へと延伸する表面に1つ以上の溝(groove)228を任意に形成することができる。あるいは、表面に溝は形成されないが、核酸鎖111を検出するための検出領域がドレインおよびソース領域間にある。電圧源117および121による電位の印加ならびに容器108内の圧力差の生成のような、上述したものと同様の技術は、核酸鎖111を装置の表面に沿って溝228の上を水平方向に移動させるために用いることができる。核酸鎖の塩基は、電流がドレインおよびソース領域間を流れられるようにする鏡像電荷チャネル230をドレインおよびソース領域間につくる。塩基によって核酸配列決定装置内に誘起された電流は、上記のものと同様の方法で測定することができる。
【0052】
さらに、装置226は、鏡像電荷を含むチャネル230が垂直ではなく水平である点で、図1、17および19に表すその他の実施形態と異なる。この構造は図1、17および19に示す装置102におけるような開口部118を含まないが、この実施形態は、チャネル230のすぐ上方に電荷検知領域を含む。図1と同様に、核酸鎖111を電荷検知領域の方へまたはそれから離れるように向ける電界を与えるために外部電極113および115が用いられる。つまり、核酸鎖111の動きは、ドープ領域130に印加される電圧を基準として外部電極113および115に電圧を印加することによって制御される。核酸鎖111を図20に示す平面に垂直に動かすために、さらなる電極(図示せず)を加えることもできる。
【0053】
装置の電荷検知領域は、チャネル230のすぐ上方かつ2つのドープ領域130の間に位置している。個々の塩基の識別には、2つのドープ領域間の距離が1つの塩基程度であり、各塩基が連続して電荷検知領域の上方にあるように核酸鎖111が動くことが必要である。この水平構成は、さらに並行的かつ連続的な核酸鎖111の解析を可能にし、小さな開口部の作製を必要としない。このアプローチをさらに高めるために、核酸鎖111を導く上述のような溝228の形成などのさらなる表面処理を用いることができる。
【0054】
図19および20に示す水平の実施形態はまた、多数の核酸鎖111の存在を検出するためにも有利である。例えば、媒体として電気泳動ゲルを用いて、種々の長さの核酸鎖111を電極113および115間に置くことから始める。ドープ領域130を基準として負の電圧を電極113および115に印加する。そうすると、核酸鎖111は電荷検知領域へ向けて移動する。小さな鎖は速く移動し、大きな鎖はゆっくり移動する。したがって、小さな鎖がまず電荷検知領域に到着し、その後に大きなものが続く。したがって、電荷検知領域に蓄積された電荷は、およびそれゆえにチャネル230の鏡像電荷もまた、時間とともに「階段状に」増加する。この結果として、電流計114によって測定される電流が階段状に増加または減少する。
【0055】
この処理は、1つのDNA/RNA鎖の個々の塩基の識別とはならないが、電気泳動測定によって行われるのと同等の鎖の長さの測定を提供する。標準の電気泳動に対する利点は、DNA/RNA鎖の位置のリアルタイムの測定が行われることである。また、標準の電気泳動がcmサイズではないとしてもmmサイズの泳動領域を用いるのに対して、ミクロンサイズの装置を容易に製作できるので寸法を大幅に低減することができる。このサイズの低減によって、単一の電荷の検知装置の費用も削減しながら、必要なDNA/RNA鎖がより少ない高速の測定がもたらされる。
【0056】
本発明のいくつかの実施例だけを上記に詳細に説明したが、当業者には、この発明の新規な教示および利点から著しく逸脱することなく、実施例において多くの変形が可能であることが容易に理解される。したがって、このような変形の全ては、以下の請求の範囲において規定されるような本発明の範囲内に含まれるものである。
【特許請求の範囲】
【請求項1】
細孔を通じてポリヌクレオチドポリマーを処理する方法であって、
ポリマー骨格に沿った複数のヌクレオチド塩基を有するポリヌクレオチドポリマーを溶液に入れるステップと、
前記溶液を第一部と第二部に分離し、前記ポリヌクレオチドポリマーを検出器の開口部に導くステップと、
第一電流を使用してポリヌクレオチドにバイアスを付加することにより前記開口部を通過するポリヌクレオチドの動きを誘起するステップと、
第二電流を使用してポリヌクレオチドにバイアスを付加することにより前記開口部を通過するポリヌクレオチドの動きを制御するステップと、
前記第一電流とは異なる極性を有する第三電流を使用してポリヌクレオチドに逆のバイアスを付加するステップと、
を含む、方法。
【請求項2】
ポリヌクレオチドに逆のバイアスを付加するステップでは、前記開口部を通過する流動方向を逆にする、請求項1に記載の方法。
【請求項3】
前記ポリヌクレオチドポリマーを検出器の開口部に導くステップでは、ポリヌクレオチドの動きを第一方向に誘起するステップを含む、請求項1に記載の方法。
【請求項4】
ポリヌクレオチドの動きを誘起するために、前記溶液内で電位勾配を使用するステップをさらに含む、請求項1に記載の方法。
【請求項5】
前記開口部は、基板内で形成されたチャネルを規定する、請求項1に記載の方法。
【請求項6】
前記開口部は、生体膜内のチャネルを規定する、請求項1に記載の方法。
【請求項7】
開口部の内外にポリヌクレオチドを導くことにより、ポリマー内で複数のヌクレオチドを解析するステップをさらに含む、請求項1に記載の方法。
【請求項8】
前記ポリヌクレオチドポリマーを検出器の開口部に導くステップにおいて、、開口部にわたってラテラルバイアスを供給するステップを含む、請求項1に記載のシステム。
【請求項9】
前記ポリヌクレオチドポリマーを検出器の開口部に導くステップにおいて、開口部を通過するようポリヌクレオチドを導くために、溶液内で局部的な勾配を形成するステップを含む、請求項1に記載の方法。
【請求項10】
交流電流を供給することにより開口部を通過する前記ポリヌクレオチドポリマーを振動させるステップをさらに含む、請求項1に記載の方法。
【請求項1】
細孔を通じてポリヌクレオチドポリマーを処理する方法であって、
ポリマー骨格に沿った複数のヌクレオチド塩基を有するポリヌクレオチドポリマーを溶液に入れるステップと、
前記溶液を第一部と第二部に分離し、前記ポリヌクレオチドポリマーを検出器の開口部に導くステップと、
第一電流を使用してポリヌクレオチドにバイアスを付加することにより前記開口部を通過するポリヌクレオチドの動きを誘起するステップと、
第二電流を使用してポリヌクレオチドにバイアスを付加することにより前記開口部を通過するポリヌクレオチドの動きを制御するステップと、
前記第一電流とは異なる極性を有する第三電流を使用してポリヌクレオチドに逆のバイアスを付加するステップと、
を含む、方法。
【請求項2】
ポリヌクレオチドに逆のバイアスを付加するステップでは、前記開口部を通過する流動方向を逆にする、請求項1に記載の方法。
【請求項3】
前記ポリヌクレオチドポリマーを検出器の開口部に導くステップでは、ポリヌクレオチドの動きを第一方向に誘起するステップを含む、請求項1に記載の方法。
【請求項4】
ポリヌクレオチドの動きを誘起するために、前記溶液内で電位勾配を使用するステップをさらに含む、請求項1に記載の方法。
【請求項5】
前記開口部は、基板内で形成されたチャネルを規定する、請求項1に記載の方法。
【請求項6】
前記開口部は、生体膜内のチャネルを規定する、請求項1に記載の方法。
【請求項7】
開口部の内外にポリヌクレオチドを導くことにより、ポリマー内で複数のヌクレオチドを解析するステップをさらに含む、請求項1に記載の方法。
【請求項8】
前記ポリヌクレオチドポリマーを検出器の開口部に導くステップにおいて、、開口部にわたってラテラルバイアスを供給するステップを含む、請求項1に記載のシステム。
【請求項9】
前記ポリヌクレオチドポリマーを検出器の開口部に導くステップにおいて、開口部を通過するようポリヌクレオチドを導くために、溶液内で局部的な勾配を形成するステップを含む、請求項1に記載の方法。
【請求項10】
交流電流を供給することにより開口部を通過する前記ポリヌクレオチドポリマーを振動させるステップをさらに含む、請求項1に記載の方法。
【図1】


【図2】


【図3】


【図4】


【図5】


【図6】


【図7】


【図8】


【図9】


【図10】


【図11】


【図12】


【図13】


【図14】


【図15】


【図16】


【図17】


【図18】


【図19】


【図20】


【図21】




【図2】


【図3】


【図4】


【図5】


【図6】


【図7】


【図8】


【図9】


【図10】


【図11】


【図12】


【図13】


【図14】


【図15】


【図16】


【図17】


【図18】


【図19】


【図20】


【図21】


【公開番号】特開2013−13413(P2013−13413A)
【公開日】平成25年1月24日(2013.1.24)
【国際特許分類】
【出願番号】特願2012−198375(P2012−198375)
【出願日】平成24年9月10日(2012.9.10)
【分割の表示】特願2011−82517(P2011−82517)の分割
【原出願日】平成13年4月24日(2001.4.24)
【公序良俗違反の表示】
(特許庁注:以下のものは登録商標)
1.テフロン
2.TEFLON
【出願人】(502221282)ライフ テクノロジーズ コーポレーション (113)
【Fターム(参考)】
【公開日】平成25年1月24日(2013.1.24)
【国際特許分類】
【出願日】平成24年9月10日(2012.9.10)
【分割の表示】特願2011−82517(P2011−82517)の分割
【原出願日】平成13年4月24日(2001.4.24)
【公序良俗違反の表示】
(特許庁注:以下のものは登録商標)
1.テフロン
2.TEFLON
【出願人】(502221282)ライフ テクノロジーズ コーポレーション (113)
【Fターム(参考)】
[ Back to top ]

