軟組織石灰化の回復、予防、遅延または安定化方法
本発明は、被験体の軟組織石灰化を治療する方法であって、有効量の有機第二鉄化合物、例えばクエン酸第二鉄を該被験体に投与するステップを含む方法を提供する。特許請求されている方法は、慢性腎疾患を有する被験体において軟組織石灰化を予防するか、回復させるか、遅延させるか、または安定化することができる。影響を受ける軟組織石灰化には、関節、皮膚、眼、心血管系、例えば心臓弁、心筋、冠動脈および細動脈、または内臓、例えば腎臓および肺の軟組織石灰化が含まれる。
【発明の詳細な説明】
【技術分野】
【0001】
本出願は、2006年1月30日出願の米国仮出願第60/763,253号および2006年8月18日出願のPCT/US2006/032585の優先権を主張する。前出願の内容および開示全体は、参照により本出願に組み入れられる。
【0002】
本出願の全体を通して、種々の参考文献または刊行物が引用される。これらの参考文献または刊行物の開示内容は、その全体が、本発明が属する分野の技術水準をより完全に説明するために、ここに参照により本出願に組み入れられる。
【背景技術】
【0003】
発明の背景
米国の9人に1人が慢性腎疾患(CKD)の何らかの兆候を有すると推定され、それは、正常な腎クリアランス/機能を有するタンパク尿から、透析または移植の形式の腎代償療法を必要とする進行した腎不全(一般に末期腎疾患(ESRD)と称される)に及ぶ。米国心臓協会(American Heart Association)は、最近、慢性腎疾患を有する個体が循環器疾患の最も高いリスクグループに算入されるべきであり、したがって循環器疾患の有病率および重症度を低減するための積極的な予防措置を受けるべきであろうことを支持する強力な証拠を詳しく述べるScientific Statementを発表した。
【0004】
循環器疾患による死亡は、透析によって処置される患者の主要死因であり、その死亡率は、性別、人種、および糖尿病の存在についての層別化にかかわらず、一般集団より10〜30倍高い。同様に、循環器疾患による死亡率は、機能性移植腎を有する患者において一般集団より2〜5倍高い。このことは、(1) 血液透析患者におけるアテローム性動脈硬化症、心不全、および左心室不全の極めて高い有病率(40%〜74%の偶発的透析患者において観察される)および(2) 急性心筋梗塞後の、または心不全の、高い症例死亡率(case mortality rate)、に起因すると思われる。
【0005】
冠動脈石灰化は、透析患者において非常に一般的である。調査対象の患者集団の年齢に応じて、一連の症例の透析患者の54%〜100%(平均83%)はある程度の冠動脈石灰化を有し、そのスコアは一般集団を顕著に上回る。冠動脈石灰化はまた、慢性腎疾患を有する未成年および若い成人にも存在する。透析患者において冠動脈石灰化が存在すると、ほとんどすべての研究においてそれは迅速に進行し、腎移植後には最小限にしか進行しないか、または進行しない。
【0006】
正常な生理条件下では、血清カルシウムおよび血清リンは厳密にコントロールされ、バランスが保たれている。しかし、腎疾患の患者の変性した腎臓は調節系に対して適切に応答せず、リン排泄が減少する。腎臓状態の悪化およびリンの蓄積に伴い、副甲状腺は副甲状腺ホルモン(PTH)の生産を継続的に増加させる。高PTHは骨から血清へのカルシウム放出を増加させる。その結果、腎不全を有する患者のほとんどが高い血清中のリン、カルシウムおよびPTHを有することが見出される。高リン酸血症、血清中のカルシウム・リン(CaxP)積の増加、副甲状腺機能亢進症およびカルシウム取込み増加は、循環器疾患罹患率および死亡率の重要な予測因子と考えられ、潜在的には、尿毒症における望ましくない石灰化の進行因子として作用している(Block and Port (2000), Re-evaluation of risks associated with hyperphosphatemia and hyperparathyroidism in dialysis patients: recommendations for a change in management. American Journal of Kidney Diseases, 35:1226-1237; Ketteler et al. (2005), Pathogenesis of vascular calcification in dialysis patients. Clin. Exp. 9:265-270)。
【0007】
リン(phosphorous)は、CaxPの変化に直接関与し、かつ、甲状腺機能亢進症の病因および進行に間接的に関与することによって、血管石灰化に関して負の影響をおよぼす。血清カルシウムおよびリンは通常環境下で準安定性であり、それは、それらの濃度が自然沈殿を生じさせるために十分ではないことを意味する。しかし、石灰化プロセスが一旦始まると、該濃度は、結晶増殖を支持するために十分である。
【0008】
異常に高いカルシウムおよびリン濃度は、体内のリン酸カルシウムのランダムな受動的沈殿に寄与すると考えられる。全体の作用機序は依然調査中であるが、最近の研究では、無機質代謝の障害(高リン酸血症および高カルシウム血症)が血管平滑筋細胞の遺伝的変化をさらに誘発し、また進行性石灰化に寄与する骨芽細胞様表現型に向けて細胞挙動を変化させると考えられる、より複雑かつ能動的な経路が発見されている(Ketteler et al. (2005), Pathogenesis of vascular calcification in dialysis patients. Clin. Exp. 9:265-270)。
【0009】
異常な軟組織石灰化の程度は、腎疾患の程度が増悪するにつれて進行し、例えば皮膚、関節、眼、心臓弁、心筋、冠動脈、細動脈、肺、腎臓等の器官において全身で生じうる。その中でも、眼球の石灰化は、血液透析患者において最も頻繁に観察されるものの1つであり、非常に一般的な軟組織石灰化である(Tilman Drueke and Isidro Salusky, The Spectrum of Renal Osteodystrophy. Oxford University Press. p345-357)。異所性石灰化は、ほとんどの場合、結膜および角膜上の、眼瞼間裂溝に露出している辺縁領域で生じ、微細な白色沈着物、粗粒状結晶、またはより扁平な(flatter)プラークとして現れる。うまく対処されないと、眼領域の石灰化は、視力の低下、刺激および眼球の不快感を生じさせ、無能力になる点まで悪化しうる。さらに、カルシウム沈着物は上皮性および持続性組織欠損を生じさせうる。
【0010】
最近の研究では、透析患者における眼の石灰化の重症度と血管石灰化の出現の間の関連性がさらに調査され、眼球の石灰化の程度と骨外性石灰化の状態の間の有意な相関が見出された。該研究では、骨外性石灰化、例えば軟組織石灰化または任意の他の器官の石灰化の状態を評価するためのツールとして眼球の石灰化の程度を使用することができると示唆された(Seyahi et al. (2005), Association of conjunctival and corneal calcification with vascular calcification in dialysis patients. American Journal of Kidney Disease 45:550-556)。
【0011】
心血管系における石灰化の発症は、多くの臨床的に重大な合併症、例えば心筋虚血、心筋梗塞、心筋機能障害、うっ血性心不全および心臓弁不全の発症を導きうる。循環器疾患、特に冠動脈疾患および慢性心不全の発症の促進は末期腎疾患患者の主要死因である。透析患者における、毎年の、原因を問わない死亡率は12%〜25%の範囲におよぶと報告されている。そのうち、この過剰死亡率の約50%は心血管系の原因よるものである(Ketteler et al., 2005)。
【0012】
石灰化はまた、腎疾患の患者以外にもおよび、年齢40歳を超える人は誰でも含まれうる。米国の主要死因は急性心筋梗塞および卒中であるが、高コレステロール血症はこのカテゴリーの死の15%にしか寄与せず、85%は心室の石灰化によって引き起こされる。
【発明の開示】
【発明が解決しようとする課題】
【0013】
したがって、血管石灰化、内臓石灰化または軟組織石灰化を発症する高いリスクを有する被験体において血清リン、カルシウム・リン積(CaxP)および副甲状腺ホルモン(PTH)レベルを管理または低減する方法に対するニーズが存在する。本発明は、そのニーズを満たす新規形態の有機第二鉄化合物の使用方法を提供する。
【課題を解決するための手段】
【0014】
発明の要旨
本発明の前記目的および他の目的にしたがって、本発明の簡単な要旨を示す。以下の要旨には、いくらかの簡略化および省略が施されている可能性があるが、それは本発明のいくつかの態様を強調および導入するためのものであり、その範囲を限定するためのものではない。当業者が本発明の概念を実施および使用することを可能にするために適切な好ましい典型的実施形態についての詳細な説明は後のセクションで示す。
【0015】
本発明は、被験体の軟組織石灰化を治療する方法であって、有効量の有機第二鉄化合物を該被験体に投与するステップを含む方法を提供する。一実施形態では、有機第二鉄化合物は少なくとも約2 mg/cm2/分の溶解速度を有する。
【0016】
一実施形態では、その有機第二鉄化合物は、以下のステップ: (a) 第二鉄塩を得るステップ; (b) 酸化ポリ鉄(polyiron oxide)を含む混合物を生成するのに有効な条件下で第二鉄塩に水酸化アルカリ金属を加えるステップ; (c) 混合物から沈殿を単離するステップ; (d) 沈殿に有機酸を加えるステップ; (e) 有機酸および沈殿を加熱することによって有機酸第二鉄溶液を形成させるステップ; および(f) 有機溶媒によって有機酸第二鉄溶液から有機第二鉄化合物を沈殿させるステップ、を含む方法にしたがって製造される。
【0017】
一般に、被験体はヒトまたは動物である。該被験体は慢性腎疾患または末期腎疾患を有してよく、腎臓透析または腎移植を受けている。有機第二鉄化合物は、経口でまたは、当技術分野において一般に公知の任意の他の適切な経路で投与してよい。当業者は、有機第二鉄化合物の有効量を容易に決定することができ、有機第二鉄化合物を当技術分野において一般に公知の多くの剤形に製剤化することができる。代表的な剤形には、非限定的に、錠剤、散剤、懸濁剤、乳剤、カプセル剤、ロゼンジ剤、顆粒剤、トローチ剤、丸剤、液剤、酒精剤、またはシロップ剤が含まれる。
【0018】
一実施形態では、有機第二鉄化合物での処置は、被験体の軟組織石灰化を予防するか、回復させる(reverse)か、遅延させるか、または安定化することができ、該軟組織には、非限定的に、皮膚、関節、眼、心臓弁、心筋、冠動脈、肺、腎臓等の軟組織が含まれる。
【0019】
本発明はまた、被験体の軟組織石灰化を治療するための治療計画であって、許容しうる担体および有効量の有機第二鉄化合物を含む医薬組成物を含み、該医薬組成物を一回または複数回投与計画で投与する、治療計画を提供する。一実施形態では、有機第二鉄化合物は少なくとも約2 mg/cm2/分の溶解速度を有する。有機第二鉄化合物の例はクエン酸第二鉄である。
【0020】
本発明はまた、被験体の軟組織石灰化を治療するための医薬組成物であって、少なくとも約2 mg/cm2/分の溶解速度を有する有効量の有機第二鉄化合物を含む医薬組成物を提供する。一般に、該医薬組成物は、錠剤、散剤、懸濁剤、乳剤、カプセル剤、ロゼンジ剤、顆粒剤、トローチ剤、丸剤、液剤、酒精剤、またはシロップ剤として製剤化することができる。
【0021】
本発明はまた、被験体の軟組織石灰化を治療するための医薬の製造における、有効量の有機第二鉄化合物を含む医薬組成物の使用を提供する。一実施形態では、有機第二鉄化合物(例えばクエン酸第二鉄)は少なくとも約2 mg/cm2/分の溶解速度を有する。
【0022】
本発明の他の利点および態様は、後述の実施例を読むことによって明らかになろう。
【発明を実施するための最良の形態】
【0023】
発明の詳細な説明
新規有機第二鉄化合物、例えばクエン酸第二鉄の製造方法は米国仮出願第60/763,253号、およびPCT/US2006/032585に開示されている。前記文献は参照によりその全体がここに組み入れられる。これらの第二鉄化合物は、市販の形態のクエン酸第二鉄化合物または複合体よりも広いpH範囲において、より可溶性である。さらにまた、本発明の有機第二鉄化合物は、市販の形態のクエン酸第二鉄化合物と比較して、より広い有効表面積を有する。これらの有機第二鉄化合物は、より可溶性であるため、それらを、有機第二鉄化合物、例えばクエン酸第二鉄での治療に対して応答性の病状に苦しむ患者に、より効果的に経口送達することができる。
【0024】
下記に示す結果は、本発明のクエン酸第二鉄での処置が、内臓石灰化、血管石灰化および/または軟組織石灰化、例えば角膜石灰化を遅延させるか、または改善しうることを示唆する。ゆえに、有効量のクエン酸第二鉄を使用して、被験体の内臓石灰化、血管石灰化および/または軟組織石灰化を回復させるか、予防するか、遅延させるか、または安定化することができる。
【0025】
本発明は、本明細書中で開示されるクエン酸第二鉄の使用に限定されない。本発明の方法での使用に好適な他のクエン酸第二鉄化合物、またはそれらの塩、誘導体、アナログ、代謝産物、または調製物は、本出願の教示内容にしたがうことによって当業者に自明である。さらにまた、本発明の方法はまた、本明細書中に記載の方法にしたがって合成される他の有機第二鉄化合物の使用を包含する。これらの有機第二鉄化合物は、好ましくは以下の特性を有するか、または含む:
リン(phosphorous)との結合についての高親和性;
広範囲のpHにわたる可溶性;
pHに依存しない高速結合性;
高溶解性;
身体全体にわたる低吸収性;
毒性なし;
経口投与可能; および/または
製造が安価。
【0026】
本明細書中に記載のデータを考慮して、当業者はまた、本発明が、本明細書中で開示される方法にしたがって製造された有機第二鉄化合物の使用に限定されないことを容易に理解する。ゆえに、本発明は、軟組織石灰化を治療するために有機第二鉄化合物を使用する方法であって、該有機第二鉄化合物が本明細書中に記載の特定の特性を有するものである方法を包含することが当業者に自明である。
【0027】
一実施形態では、本発明の方法は、有効量の有機第二鉄化合物および好適な担体を被験体に投与するステップを含む。本明細書中で使用される用語「好適な担体」には、非限定的に、当業者に公知の医薬化合物または医薬組成物を投与するための任意の好適な担体が含まれる。担体の種類は投与様式に応じて様々である。「許容しうる担体または好適な担体」には、非限定的に、液体、エアロゾル、カプセル、錠剤、丸剤、散剤、ゲル、軟膏、クリーム、顆粒、水、リン酸緩衝食塩水、リンゲル液、ブドウ糖液、血清含有液、ハンクス液、他の水性生理的平衡溶液、油、エステル、グリコール、生体適合ポリマー、ポリマーマトリックス、カプセル、マイクロカプセル、微粒子、ボーラス製剤、浸透性ポンプ、拡散デバイス、リポソーム、リポスフェア(lipospheres)、細胞または細胞膜も含まれうる。生分解性ミクロスフェア(例えば、ポリ乳酸、ポリグリコレート)を担体として使用することもできる。
【0028】
非経口投与(例えば皮下注射)用の化合物または組成物に関して、好適な担体という用語には、非限定的に、水、生理食塩水、アルコール、脂肪、ワックスまたはバッファーが含まれる。
【0029】
経口投与用の化合物または組成物に関して、好適な担体という用語には、非限定的に、任意の上記担体または固形担体、例えばマンニトール、ラクトース、デンプン、ステアリン酸マグネシウム、サッカリンナトリウム、タルク、セルロース、グルコース、ショ糖、および炭酸マグネシウムが含まれる。
【0030】
一実施形態では、本発明は、被験体の軟組織石灰化を治療するために有機第二鉄化合物を使用する方法を提供する。一般に、被験体はヒトまたは動物である。該被験体は、慢性腎疾患、または末期腎疾患を有してよく、または腎臓透析を受けている。有機第二鉄化合物は本明細書中に記載のようにして合成する。簡潔に言えば、該合成方法は以下のステップを含む: (a) 第二鉄塩(例えば塩化第二鉄六水和物)を得るステップ; (b) 酸化ポリ鉄を含む混合物を生成するのに有効な速度および温度で第二鉄塩に水酸化アルカリ金属(例えば水酸化ナトリウム)を加えるステップ; (c) 混合物から沈殿を単離するステップ; (d) 沈殿に有機酸を加えるステップ; (e) 有機酸および沈殿を加熱することによって有機酸第二鉄溶液を形成させるステップ; および(f) 有機溶媒によって有機酸第二鉄溶液から有機第二鉄化合物を沈殿させるステップ。
【0031】
本発明はまた、被験体における軟組織石灰化を治療する方法であって、有効量の有機第二鉄化合物を該被験体に投与するステップを含む方法を提供する。一般に、有機第二鉄化合物は、少なくとも約2 mg/cm2/分、例えば約2 mg/cm2/分〜約4 mg/cm2/分の溶解速度を有する。
【0032】
一実施形態では、有機第二鉄化合物は、以下のステップ: (a) 第二鉄塩を得るステップ; (b) 酸化ポリ鉄を含む混合物を生成するのに有効な条件下で第二鉄塩に水酸化アルカリ金属を加えるステップ; (c) 混合物から沈殿を単離するステップ; (d) 沈殿に有機酸を加えるステップ; (e) 有機酸および沈殿を加熱することによって有機酸第二鉄溶液を形成させるステップ; および(f) 有機溶媒によって有機酸第二鉄溶液から有機第二鉄化合物を沈殿させるステップ、を含む方法にしたがって製造される。
【0033】
一実施形態では、水酸化アルカリ金属を、20 ml/分未満、好ましくは約10 ml/分〜約20 ml/分の範囲の速度で加え、40℃未満、好ましくは約10℃〜約40℃の範囲の温度で水酸化アルカリ金属を第二鉄塩に加える。
【0034】
一実施形態では、有機酸および沈殿を約80℃〜約90℃の範囲の温度に加熱する。有機酸第二鉄溶液から、有機溶媒を該溶液に加えることによって、有機第二鉄化合物を沈殿させるステップは、有機溶媒を加える前に有機酸第二鉄溶液を30℃未満に冷却するステップを含み、好ましくは有機酸第二鉄溶液を約10℃〜約30℃の範囲の温度に冷却する。
【0035】
有機第二鉄化合物を合成する方法では、多数の有機酸、例えばクエン酸、酢酸、イソクエン酸、コハク酸、フマル酸、および酒石酸を使用することができ、多数の有機溶媒、例えばエタノール、メタノール、ブタノール、イソプロピルアルコール、アセトン、およびテトラヒドロフランを使用することができる。
【0036】
有機第二鉄化合物は、当業者によって決定される有効量で投与することができる。例えば、有機第二鉄化合物の有効量は、動物での滴定実験または適切なin vitroモデルによって決定することができる。有効量の例には、非限定的には、1日3回投与される2〜8 gm/日の有機第二鉄化合物、14日間または28日間にわたる6 gm/日が含まれ、または有機第二鉄化合物を1日3回均等に投与するか、または食事後10分以内に有機第二鉄化合物を投与する。
【0037】
異なる投与経路、例えば静脈内(i.v.)、腹腔内(i.p.)または皮内送達でも同様に機能し、または同様に有効でありうるが、好ましくは本発明の有機第二鉄化合物は経口投与する。一般に、有機第二鉄化合物は、錠剤、散剤、懸濁剤、乳剤、カプセル剤、ロゼンジ剤、顆粒剤、トローチ剤、丸剤、液剤、酒精剤、またはシロップ剤として製剤化することができる。
【0038】
一実施形態では、有機第二鉄化合物での処置が、被験体の軟組織石灰化を予防するか、回復させるか、遅延させるか、または安定化することができ、該軟組織には、非限定的に、皮膚、関節、眼、心臓弁、心筋、冠動脈、細動脈、または内臓、例えば肺および腎臓の軟組織が含まれる。
【0039】
本発明はまた、被験体の軟組織石灰化を治療するための治療計画であって、許容しうる担体および有効量の有機第二鉄化合物を含む医薬組成物を含み、該医薬組成物を一回または複数回投与計画で投与する、治療計画を提供する。一実施形態では、有機第二鉄化合物は少なくとも約2 mg/cm2/分の溶解速度を有する。有機第二鉄化合物の例はクエン酸第二鉄である。
【0040】
一般に、医薬組成物の少なくとも一部分を経口投与し、例えば有機第二鉄化合物を、錠剤、散剤、懸濁剤、乳剤、カプセル剤、ロゼンジ剤、顆粒剤、トローチ剤、丸剤、液剤、酒精剤、またはシロップ剤として製剤化することができる。該治療計画は慢性腎疾患または末期腎疾患を有する被験体の治療に有用である。一実施形態では、該治療計画での治療は、被験体の軟組織石灰化を予防するか、回復させるか、遅延させるか、または安定化することができ、該軟組織には、非限定的に、皮膚、関節、眼、心臓弁、心筋、冠動脈、細動脈、または内臓、例えば肺および腎臓の軟組織が含まれる。
【0041】
本発明はまた、被験体の軟組織石灰化を治療するための医薬組成物であって、少なくとも約2 mg/cm2/分、例えば約2 mg/cm2/分〜約4 mg/cm2/分の溶解速度を有する有効量の有機第二鉄化合物を含む医薬組成物を提供する。この医薬組成物は上記様々な剤形に製剤化することができ、上記軟組織石灰化の治療に有用である。
【0042】
本発明はまた、被験体の軟組織石灰化を治療するための医薬の製造における、有効量の有機第二鉄化合物を含む医薬組成物の使用を提供する。一実施形態では、有機第二鉄化合物(例えばクエン酸第二鉄)は少なくとも約2 mg/cm2/分の溶解速度を有する。得られた医薬は上記様々な剤形に製剤化することができ、上記軟組織石灰化の治療に有用である。
【0043】
一般的に記載されている本発明は、以下の実施例を参照することによって、さらに容易に理解される。該実施例は、単に、本発明の特定の態様および実施形態を説明するために含められ、本発明を限定するためのものではない。
【実施例1】
【0044】
実施例1
医薬品グレードの有機第二鉄化合物を合成するための一般的方法
有機第二鉄化合物を合成するための一般的方法は、PCT/US2006/032585、および米国仮出願第60/763,253号(該文献は参照により本出願に組み入れられる)に開示されている。代表的な有機第二鉄化合物には、非限定的に、クエン酸第二鉄が含まれる。
【0045】
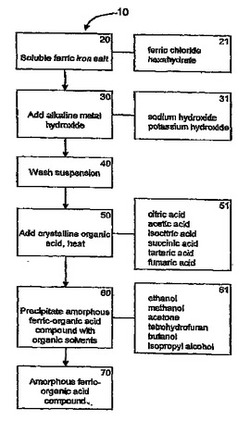
図1を参照すると、そのフローチャート10は、本発明で使用できる形態の有機第二鉄化合物またはクエン酸第二鉄化合物を合成するための一般的プロセスである。ボックス20に記載の出発材料は可溶性第二鉄塩を含む。可溶性第二鉄塩は、ボックス21に記載の塩化第二鉄六水和物(FeCl36H2O)、または任意の他の好適な可溶性第二鉄塩を含みうる。次いで、水酸化アルカリ金属(ボックス30)を特定の速度および温度で可溶性第二鉄塩に加える。特定の速度、好ましくは約10 ml/分〜約20 ml/分の範囲で、かつ特定の温度範囲、好ましくは40℃未満で水酸化アルカリ金属を加えると、均一なポリ鉄オキソコロイド懸濁液が形成される。水酸化アルカリ金属は、ボックス31に記載の水酸化ナトリウム、水酸化カリウム、または任意の他の好適な水酸化アルカリ金属を含みうる。
【0046】
コロイド懸濁液沈殿を回収し、蒸留水ですすいで(ボックス40)、すべての可溶性不純物を除去する。すすいだ後、沈殿を再懸濁し、ボックス50に記載のように、結晶性有機酸を沈殿に加え、特定の温度範囲、好ましくは約80℃〜約90℃の範囲に加熱する。該有機酸は任意の好適な有機酸を含みうる。ボックス51は、使用できるいくつかの有機酸候補を列挙しており、その有機酸候補には、非限定的に、クエン酸、酢酸、イソクエン酸、コハク酸、フマル酸、および酒石酸が含まれる。有機酸を加えると、該酸が溶液中の沈殿と複合体を形成することが可能になる。ボックス60では、有機溶媒を用いて有機第二鉄化合物を溶液から沈殿させ、新規形態の有機第二鉄化合物を形成させる(ボックス70)。種々の有機溶媒を使用することができ、その有機溶媒には、非限定的に、ボックス61に記載の溶媒、例えばエタノール、メタノール、ブタノール、アセトン、イソプロピルアルコール、テトラヒドロフラン、または任意の他の好適な有機溶媒が含まれる。
【0047】
クエン酸第二鉄の合成
本発明の一実施形態では、有機第二鉄化合物はクエン酸第二鉄である。クエン酸第二鉄を生成するための出発材料は、塩化第二鉄六水和物(FeCl36H2O)の1.85M溶液を含む。比1:3の第二鉄 対 水酸化物イオンを達成するために必要な5M水酸化ナトリウムの容量を、20 ml/分未満、好ましくは約10 ml/分〜約20 ml/分の範囲の速度で塩化第二鉄六水和物溶液に加える。該混合物の温度を40℃未満、好ましくは約10℃〜約40℃の範囲で維持しつつ、水酸化ナトリウムを加えて、水酸化第二鉄の酸化ポリ鉄コロイド懸濁液を形成させる。該懸濁液のpHを測定しながら、水酸化ナトリウムを加える。pHが7.0を超えたら、懸濁液を30℃未満、好ましくは約10℃〜約30℃の範囲になるまで冷却する。そして1 mm孔フィルターを通して該懸濁液をろ過して凝集物を分散させ、大きい粒子の水酸化第二鉄沈殿を除去する。そしてろ過した水酸化第二鉄懸濁液を遠心分離する。上清を廃棄し、沈殿させた水酸化第二鉄を再び遠心分離して、すべての残りの上清を除去する。そして水酸化第二鉄沈殿を蒸留水で再懸濁する。遠心分離-再懸濁ステップをさらに2回反復して、水酸化第二鉄沈殿を洗浄し、水溶性不純物を除去する。そして得られた水酸化第二鉄沈殿をホモジナイズする。
【0048】
比1:1の第二鉄 対 クエン酸を達成するために必要なクエン酸の量を沈殿に加える。混合物の色がオレンジ〜褐色から澄んだ黒色〜褐色に変化するまで、またはすべての水酸化第二鉄沈殿が溶解するまで、油浴中で混合物を約80℃〜約90℃の範囲に加熱する。反応物を30℃未満、好ましくは約10℃〜約30℃の範囲になるまで冷却し、pHを測定して、0.8〜1.5の範囲内であることを決定する。反応物を遠心分離し、上清を回収する。5倍容量の有機溶媒を加えることによって、上清からクエン酸第二鉄を沈殿させる。
【0049】
種々の有機溶媒を使用することができ、その有機溶媒には、エタノール、メタノール、ブタノール、アセトン、イソプロピルアルコール、またはテトラヒドロフランが含まれる。溶媒を加えたら、淡いベージュ色沈殿が形成されるまで混合物を攪拌する。懸濁液を遠心分離し、上清を廃棄する。沈殿を、さらに2回、溶媒で洗浄し遠心分離する。そして沈殿を、周囲温度で8〜16時間真空オーブンで乾燥するか、または任意の他の好適な工業プロセス、例えば流動床乾燥によって乾燥する。乾燥させた沈殿を乳鉢および乳棒で砕き、周囲温度でさらに8〜24時間乾燥する。微細な沈殿を再び粉砕することによって細かく砕き、45メッシュサイズ(35ミクロン)のふるいに通してふるい分けする。その新規形態のクエン酸第二鉄粉末を、真空オーブンで再び、または流動床乾燥で再び乾燥し、1時間の乾燥によって0.25%未満の重量減少に至るまで周囲温度で乾燥する。
【実施例2】
【0050】
実施例2
末期腎疾患(ESRD)患者における血清リン酸に対するクエン酸第二鉄の効果についての無作為化、二重盲検、プラセボ対照化、用量範囲決定(Dose-Ranging)研究
目的: (1) 末期腎疾患(ESRD)患者における血清リン酸(PO4)レベルに対する、28日間にわたり、TID (3回/日)で投与される、2、4および6 g/日の用量のクエン酸第二鉄の効果を決定すること。(2) ESRD患者において、28日間の、TID投与される、2、4、6 g/日の用量のクエン酸第二鉄の安全性を評価すること。
【0051】
研究薬物: 米国第11/206,981号およびWO 2004/07444に開示されているクエン酸第二鉄。
【0052】
研究デザイン: 血液透析を受けているESRD患者の血清リン酸濃度に対するクエン酸第二鉄の効果を評価するための、無作為化、二重盲検、プラセボ対照化、用量範囲決定研究。血清リン酸濃度によって測定される有効性に関して、研究14および28日目に患者を評価する。さらに、1以上の用量の研究薬物を投与された患者を安全性に関して評価する。
【0053】
研究期間: 8週間(スクリーニング期間、2週間の洗い出し、4週間の処置を含む)。
【0054】
結果は、0、2、4および6 gm/日(食事直後、すなわち10分以内にTIDで投与される)で、血清PO4およびCa×PO4の減少を示す。クエン酸第二鉄を経口投与し、3回/日で均等に与える。
【0055】
クエン酸第二鉄の、ESRD患者の血清リン酸レベルを低下させる能力が実証された。プラセボ、2、4、および6 gm/日に関して、28日間、血清カルシウムレベルの有意な変化は観察されなかった。しかし、Ca×PO4レベルは減少し、14および28日目の両時点で6 gm/日の用量に関して統計学的に有意であった。さらにこの結果は、クエン酸第二鉄での処置後に石灰化が回復するか、または安定化されうることも示す。以下の表に本研究のデータをまとめる。
【表1】

【0056】
【表2】

【0057】
【表3】

【0058】
【表4】

【0059】
【表5】

【0060】
図2および3に示されるように、医薬品グレードのクエン酸第二鉄を使用する処置は、ケミカルグレードのクエン酸第二鉄より優れたいくつかの利点を提供する。一般に、医薬品グレードのクエン酸第二鉄はケミカルグレードのクエン酸第二鉄と概ね等しい効力を示すが、医薬品グレードのクエン酸第二鉄はこの結果をケミカルグレードのクエン酸第二鉄より少ない有害副作用しか伴わずに達成する。
【0061】
図2はまた、医薬品グレードのクエン酸第二鉄の投与に伴う有害副作用が、プラセボに伴う有害副作用と統計学的に相違しなかったことを示す。この安全性プロファイルの利点は、個々の患者が、副作用について少ない懸念で、広範囲の用量にわたって滴定された医薬品グレードのクエン酸第二鉄の投薬を受けることができることである。このように、患者の個別の処置を、具体的なニーズおよび耐容性に合わせてオーダーメード化することができる。
【0062】
血清クレアチニンレベルの減少
糸球体ろ過量(GFR)レベルは構造的な腎臓損傷と相関し、したがって腎機能を測定するための黄金標準として使用される。GFRは、バイオマーカーである血清クレアチニンによって推定することができる。腎機能が悪化すると、腎臓は、クレアチニンを効率的に排泄するその機能を失い、その結果、体内にクレアチニンが保持される。したがって、血清クレアチニンの増加はGFRの低下を示し、それは腎臓悪化の重要な徴候である。
【0063】
第二相臨床研究: 「末期腎疾患(ESRD)患者の血清リン酸に対するクエン酸第二鉄の効果についての無作為化、二重盲検、プラセボ対照化、用量範囲決定研究」の非盲検拡張研究では、一部の患者に2〜6g/日のクエン酸第二鉄を投与し、血清クレアチニンレベルをモニターして、腎機能を評価した。6g/日のクエン酸第二鉄を投与された複数の患者が血清クレアチニンレベルの減少傾向を有するようであり、このことは、クエン酸第二鉄が慢性腎疾患の進行を改善し、遅延させ、阻止するか、または予防することを意味する。2人の患者から得られた結果を図4〜5に示す。
【実施例3】
【0064】
実施例3
角膜石灰化の測定方法
デジタルカメラ(NIKON E995)に連結された細隙灯顕微鏡を使用して眼の検査を行った。角膜の石灰化は角膜縁の鼻側および側頭側の近くで生じ、高カルシウム血症の帯状角膜症のように見える。観察者は、内側(鼻の近く)、外側(側頭の近く)を撮影するか、または石灰化が認められる角膜の全体像を撮った(図6)。したがって、各眼について撮影された1〜2枚の写真が存在し、その結果、1検査当たり患者1人につき2〜4枚の写真が収集された。
【0065】
「Image J」と称される画像解析ソフトウェアをデータ解析に使用した。この画像解析ソフトウェアは、8ビット、16ビットおよび32ビット画像を表示し、編集し、解析し、加工し、保存し、印刷するよう開発されている。このソフトウェアは、ユーザー定義の選択部分の面積およびピクセル値統計データを計算し、距離および角度を測定し、濃度ヒストグラムおよび線形プロファイルプロットを作成することができる。これは標準画像処理機能、例えばコントラスト操作、シャープニング、スムーシング、エッジ検出および中央値フィルタリングをサポートする。このソフトウェアは、米国国立衛生研究所(National Institutes of Health)(NIH)の1機関であるNational Institute of Mental HealthのResearch Services Branchで開発されている。このソフトウェアはNIHのウェブサイトからダウンロードすることができる。
【0066】
この画像解析ソフトウェアは、ユーザーによって主観的に定義される石灰化面積および総角膜面積を測定することができる。石灰化面積を見積もるために、観察者はまず、患者の眼の写真を画像ソフトウェアに読み込み、特定の石灰化領域を切り取り、そのソフトウェアによって、定義セクションをしかるべく測定する(該領域中に含まれるピクセル数として定義される)。写真は、角膜の一方の側に焦点を合わせて撮影されたために、通常、角膜の完全な画像をキャプチャーしていなかったことが留意されるべきであろう。角膜全体のサイズを見積もるために、観察者は、画像ソフトウェアを使用して、主観的に、写真上の利用可能な角膜領域上の90度の扇形領域を切り取り、そしてそのソフトウェアに、角膜全体の1/4に当たるこの扇形領域のサイズを計算させる。そして観察者は、該数値を4倍することによって、総角膜面積の推定値を得た。角膜石灰化の写真の例を図7に示す。
【0067】
石灰化が占める角膜表面のパーセンテージ、すなわち内側石灰化% + 外側石灰化%に基づいて、角膜石灰化の重症度を算出した。その際、内側または外側石灰化を、(内側または外側角膜の石灰化面積/総角膜面積)×100として算出する。図8を参照のこと。
【0068】
いくつかの要因が角膜の石灰化測定に影響しうる。
(1) 処置後の検査までの遅延期間が異なる結果、試験者によって定義される被験体間の変動が生じうる。
【0069】
(2) 写真撮影要因、例えば環境の明るさ、焦点距離、露出時間、輝度、光感度(ISO値)、分解能、画像コントラスト等を制御しなかった。これらの要因は、写真間の質に影響し、ゆえに、異なる写真間の石灰化領域の正確な定義に対する医師の判断に影響しうる。
【0070】
(3) 角膜領域の画像を標準化しなかった。ほとんどの写真は角膜の部分画像のみを含んでいた。角膜領域のサイズを見積もるために、観察者は、主観的に、90度の扇形領域を定義し、その値を4倍することによって角膜全体のサイズを外挿した。
【0071】
(4) いくつかの写真において異なるカメラを使用した。ベースライン角膜測定に使用されたカメラが偶然故障し、2回目の角膜測定の一部を行うために別のカメラを使用した。
【0072】
(5) 角膜の球状構造上の3次元の石灰化を見積もるために2次元の面積を使用する現行の方法は、完全に正確なわけではない。
【0073】
すべての上記要因が角膜石灰化測定の誤差に寄与する。しかし、全画像が単一の評価者によって測定され、各患者が自分自身の対照として機能し、かつ各患者内の相対的変化を検査したという事実によって、その誤差は最小化されている。
【実施例4】
【0074】
実施例4
クエン酸第二鉄は角膜石灰化を回復させる
上記第二相研究から得られた結果では、クエン酸第二鉄が用量依存的様式で血清CaxPを減少させることができ、最小限の副作用しか伴わないことが示される。眼球の石灰化は最も頻繁に観察される軟組織石灰化の1つであるため、第二相研究の終了後に、眼球の角膜石灰化に対するクエン酸第二鉄の効果および軟組織石灰化に対するその意義をさらに調査するために、クエン酸第二鉄での処置を、非盲検延長(OLE)として延長した。
【0075】
この研究では、クエン酸第二鉄処置の前および後に、患者を眼の検査のために眼科に診せた。すべての患者は、第二相試験の最初の投薬日の2、3日前または当日に1回目の眼の検査を受けた(角膜石灰化のベースライン値)。2回目の眼の検査の時期は様々であった。一部の患者は第二相研究の直後に検査を受け、別の患者はOLE期間中に検査を受けた。しかし、2回目の眼の検査を行った時期とは無関係に、角膜石灰化の変化に対するクエン酸第二鉄の効果を決定するための有効値としてみなすために、定義した連続日のクエン酸第二鉄投与後に結果を得る必要がある。
【0076】
クエン酸第二鉄の第二相臨床試験のすべての患者は、その後、種々の時間長にわたる薬を使わない期間を持ち、また一部の患者は非盲検延長処置期間に参加した。参加した各患者は、眼科医が実施する2回の眼の検査を受けた。1回目および2回目の眼の検査の日付および対応する薬物投与期間に応じて、参加したすべての患者から使用可能な情報が得られるわけではない。認められる患者は、少なくとも21日間の連続投薬を受けた患者であった。1回目および2回目の眼の検査の間の期間は少なくとも投薬期間と同じ長さであった。2回の眼の検査の間の実際の間隔はこの評価の目的では関連がなかった。その理由は、1回目および2回目の眼の検査の間の時間がより長いほど、角膜石灰化が発症する可能性が高く、その逆はないからである。したがって、角膜石灰化の変化の程度に対するクエン酸第二鉄の効果の見積りに関する以下の結果は、1回目および2回目の検査の間の間隔が薬物処置期間より長い場合には、実に保存的である。
【0077】
合計で12人の患者から評価にふさわしいデータが得られた。得られたデータを表6に列挙した。各患者の左眼および右眼を検査し、したがって24個の角膜石灰化の値が得られた。これらの12人の患者のうち、1人はプラセボを投与され、ネガティブコントロールとして機能した。他の11人の患者は種々の期間の連続有効処置(28〜57日間の範囲)を受け、22個の左眼および右眼の角膜石灰化の値が得られた。有効処置を受けた11人の患者のうち、2人の患者は用量レベル2g/日のクエン酸第二鉄を投与され、2人の患者は用量レベル4g/日のクエン酸第二鉄を投与され、7人の患者は6g/日の用量レベルのクエン酸第二鉄を投与された。この評価には、限られた数の患者しか参加していないために、本格的な統計データは必要でなく、本明細書中では概要の統計データを使用する。
【0078】
プラセボを投与された患者は、1回目および2回目の眼の検査の間の77日間の期間中に平均で+6.55%(+1.28%の右眼悪化および+11.81%の左眼悪化)悪化した角膜石灰化を示すことが見出された。
【0079】
有効処置を受けた11人の患者のうちでは、処置期間は平均33日間であり、28〜57日間の範囲におよんだ。1回目および2回目の検査の間の期間は平均で126日間であり、50〜217日間の範囲におよんだ。これらの11人の患者の中で、悪化した結果を示した眼の角膜石灰化の値は10個のみであった(平均+2.20%、範囲+0.08%〜+6.98%)。対照的に、1個の眼の角膜石灰化の値は不変のままであり、一方、11個の眼の角膜石灰化の値は改善を示した(平均-2.07%、-0.08%〜- 10.21%の範囲)。角膜石灰化の悪化または改善例を図9〜10に示す。
【0080】
上記データは極めて有望であった。クエン酸第二鉄は角膜石灰化病状を遅延させるか、または改善すると考えられる。その結果はまた、クエン酸第二鉄処置が軟組織石灰化の種々の病状を改善しうることを意味する。追加の臨床研究を実施して、すべての軟組織石灰化病状の治療に対するクエン酸第二鉄の効力を確認することができる。
【表6】

【図面の簡単な説明】
【0081】
【図1】図1は、本発明に係る新規形態の有機第二鉄化合物の製造方法を概説する模式図である。
【図2】図2は、ケミカルグレードおよび医薬品グレードのクエン酸第二鉄の安全性プロファイルの比較である。
【図3】図3は、ケミカルグレードおよび医薬品グレードのクエン酸第二鉄の効力プロファイルの比較である。
【図4】図4は、6g/日のクエン酸第二鉄で処置された患者(患者コード: 2-01-1-029)の血清クレアチニンレベルを示す。
【図5】図5は、6g/日のクエン酸第二鉄で処置された患者(患者コード: 2-01-1-032)の血清クレアチニンレベルを示す。
【図6】図6は、眼の検査に関する眼の様々な領域を示す。
【図7】図7は、角膜石灰化の写真例を示す。
【図8】図8は、眼の検査および角膜石灰化の算出の例を示す。
【図9】図9は、クエン酸第二鉄で処置されない患者における悪化した角膜石灰化の例を示す。患者ID: 2-01-001; 用量: プラセボ; 処置期間: 77日間。
【図10】図10は、クエン酸第二鉄での処置後の患者における改善した角膜石灰化の例を示す。患者ID: 2-01-1-012; 用量: クエン酸第二鉄2g/日; 処置期間: 28日間。
【技術分野】
【0001】
本出願は、2006年1月30日出願の米国仮出願第60/763,253号および2006年8月18日出願のPCT/US2006/032585の優先権を主張する。前出願の内容および開示全体は、参照により本出願に組み入れられる。
【0002】
本出願の全体を通して、種々の参考文献または刊行物が引用される。これらの参考文献または刊行物の開示内容は、その全体が、本発明が属する分野の技術水準をより完全に説明するために、ここに参照により本出願に組み入れられる。
【背景技術】
【0003】
発明の背景
米国の9人に1人が慢性腎疾患(CKD)の何らかの兆候を有すると推定され、それは、正常な腎クリアランス/機能を有するタンパク尿から、透析または移植の形式の腎代償療法を必要とする進行した腎不全(一般に末期腎疾患(ESRD)と称される)に及ぶ。米国心臓協会(American Heart Association)は、最近、慢性腎疾患を有する個体が循環器疾患の最も高いリスクグループに算入されるべきであり、したがって循環器疾患の有病率および重症度を低減するための積極的な予防措置を受けるべきであろうことを支持する強力な証拠を詳しく述べるScientific Statementを発表した。
【0004】
循環器疾患による死亡は、透析によって処置される患者の主要死因であり、その死亡率は、性別、人種、および糖尿病の存在についての層別化にかかわらず、一般集団より10〜30倍高い。同様に、循環器疾患による死亡率は、機能性移植腎を有する患者において一般集団より2〜5倍高い。このことは、(1) 血液透析患者におけるアテローム性動脈硬化症、心不全、および左心室不全の極めて高い有病率(40%〜74%の偶発的透析患者において観察される)および(2) 急性心筋梗塞後の、または心不全の、高い症例死亡率(case mortality rate)、に起因すると思われる。
【0005】
冠動脈石灰化は、透析患者において非常に一般的である。調査対象の患者集団の年齢に応じて、一連の症例の透析患者の54%〜100%(平均83%)はある程度の冠動脈石灰化を有し、そのスコアは一般集団を顕著に上回る。冠動脈石灰化はまた、慢性腎疾患を有する未成年および若い成人にも存在する。透析患者において冠動脈石灰化が存在すると、ほとんどすべての研究においてそれは迅速に進行し、腎移植後には最小限にしか進行しないか、または進行しない。
【0006】
正常な生理条件下では、血清カルシウムおよび血清リンは厳密にコントロールされ、バランスが保たれている。しかし、腎疾患の患者の変性した腎臓は調節系に対して適切に応答せず、リン排泄が減少する。腎臓状態の悪化およびリンの蓄積に伴い、副甲状腺は副甲状腺ホルモン(PTH)の生産を継続的に増加させる。高PTHは骨から血清へのカルシウム放出を増加させる。その結果、腎不全を有する患者のほとんどが高い血清中のリン、カルシウムおよびPTHを有することが見出される。高リン酸血症、血清中のカルシウム・リン(CaxP)積の増加、副甲状腺機能亢進症およびカルシウム取込み増加は、循環器疾患罹患率および死亡率の重要な予測因子と考えられ、潜在的には、尿毒症における望ましくない石灰化の進行因子として作用している(Block and Port (2000), Re-evaluation of risks associated with hyperphosphatemia and hyperparathyroidism in dialysis patients: recommendations for a change in management. American Journal of Kidney Diseases, 35:1226-1237; Ketteler et al. (2005), Pathogenesis of vascular calcification in dialysis patients. Clin. Exp. 9:265-270)。
【0007】
リン(phosphorous)は、CaxPの変化に直接関与し、かつ、甲状腺機能亢進症の病因および進行に間接的に関与することによって、血管石灰化に関して負の影響をおよぼす。血清カルシウムおよびリンは通常環境下で準安定性であり、それは、それらの濃度が自然沈殿を生じさせるために十分ではないことを意味する。しかし、石灰化プロセスが一旦始まると、該濃度は、結晶増殖を支持するために十分である。
【0008】
異常に高いカルシウムおよびリン濃度は、体内のリン酸カルシウムのランダムな受動的沈殿に寄与すると考えられる。全体の作用機序は依然調査中であるが、最近の研究では、無機質代謝の障害(高リン酸血症および高カルシウム血症)が血管平滑筋細胞の遺伝的変化をさらに誘発し、また進行性石灰化に寄与する骨芽細胞様表現型に向けて細胞挙動を変化させると考えられる、より複雑かつ能動的な経路が発見されている(Ketteler et al. (2005), Pathogenesis of vascular calcification in dialysis patients. Clin. Exp. 9:265-270)。
【0009】
異常な軟組織石灰化の程度は、腎疾患の程度が増悪するにつれて進行し、例えば皮膚、関節、眼、心臓弁、心筋、冠動脈、細動脈、肺、腎臓等の器官において全身で生じうる。その中でも、眼球の石灰化は、血液透析患者において最も頻繁に観察されるものの1つであり、非常に一般的な軟組織石灰化である(Tilman Drueke and Isidro Salusky, The Spectrum of Renal Osteodystrophy. Oxford University Press. p345-357)。異所性石灰化は、ほとんどの場合、結膜および角膜上の、眼瞼間裂溝に露出している辺縁領域で生じ、微細な白色沈着物、粗粒状結晶、またはより扁平な(flatter)プラークとして現れる。うまく対処されないと、眼領域の石灰化は、視力の低下、刺激および眼球の不快感を生じさせ、無能力になる点まで悪化しうる。さらに、カルシウム沈着物は上皮性および持続性組織欠損を生じさせうる。
【0010】
最近の研究では、透析患者における眼の石灰化の重症度と血管石灰化の出現の間の関連性がさらに調査され、眼球の石灰化の程度と骨外性石灰化の状態の間の有意な相関が見出された。該研究では、骨外性石灰化、例えば軟組織石灰化または任意の他の器官の石灰化の状態を評価するためのツールとして眼球の石灰化の程度を使用することができると示唆された(Seyahi et al. (2005), Association of conjunctival and corneal calcification with vascular calcification in dialysis patients. American Journal of Kidney Disease 45:550-556)。
【0011】
心血管系における石灰化の発症は、多くの臨床的に重大な合併症、例えば心筋虚血、心筋梗塞、心筋機能障害、うっ血性心不全および心臓弁不全の発症を導きうる。循環器疾患、特に冠動脈疾患および慢性心不全の発症の促進は末期腎疾患患者の主要死因である。透析患者における、毎年の、原因を問わない死亡率は12%〜25%の範囲におよぶと報告されている。そのうち、この過剰死亡率の約50%は心血管系の原因よるものである(Ketteler et al., 2005)。
【0012】
石灰化はまた、腎疾患の患者以外にもおよび、年齢40歳を超える人は誰でも含まれうる。米国の主要死因は急性心筋梗塞および卒中であるが、高コレステロール血症はこのカテゴリーの死の15%にしか寄与せず、85%は心室の石灰化によって引き起こされる。
【発明の開示】
【発明が解決しようとする課題】
【0013】
したがって、血管石灰化、内臓石灰化または軟組織石灰化を発症する高いリスクを有する被験体において血清リン、カルシウム・リン積(CaxP)および副甲状腺ホルモン(PTH)レベルを管理または低減する方法に対するニーズが存在する。本発明は、そのニーズを満たす新規形態の有機第二鉄化合物の使用方法を提供する。
【課題を解決するための手段】
【0014】
発明の要旨
本発明の前記目的および他の目的にしたがって、本発明の簡単な要旨を示す。以下の要旨には、いくらかの簡略化および省略が施されている可能性があるが、それは本発明のいくつかの態様を強調および導入するためのものであり、その範囲を限定するためのものではない。当業者が本発明の概念を実施および使用することを可能にするために適切な好ましい典型的実施形態についての詳細な説明は後のセクションで示す。
【0015】
本発明は、被験体の軟組織石灰化を治療する方法であって、有効量の有機第二鉄化合物を該被験体に投与するステップを含む方法を提供する。一実施形態では、有機第二鉄化合物は少なくとも約2 mg/cm2/分の溶解速度を有する。
【0016】
一実施形態では、その有機第二鉄化合物は、以下のステップ: (a) 第二鉄塩を得るステップ; (b) 酸化ポリ鉄(polyiron oxide)を含む混合物を生成するのに有効な条件下で第二鉄塩に水酸化アルカリ金属を加えるステップ; (c) 混合物から沈殿を単離するステップ; (d) 沈殿に有機酸を加えるステップ; (e) 有機酸および沈殿を加熱することによって有機酸第二鉄溶液を形成させるステップ; および(f) 有機溶媒によって有機酸第二鉄溶液から有機第二鉄化合物を沈殿させるステップ、を含む方法にしたがって製造される。
【0017】
一般に、被験体はヒトまたは動物である。該被験体は慢性腎疾患または末期腎疾患を有してよく、腎臓透析または腎移植を受けている。有機第二鉄化合物は、経口でまたは、当技術分野において一般に公知の任意の他の適切な経路で投与してよい。当業者は、有機第二鉄化合物の有効量を容易に決定することができ、有機第二鉄化合物を当技術分野において一般に公知の多くの剤形に製剤化することができる。代表的な剤形には、非限定的に、錠剤、散剤、懸濁剤、乳剤、カプセル剤、ロゼンジ剤、顆粒剤、トローチ剤、丸剤、液剤、酒精剤、またはシロップ剤が含まれる。
【0018】
一実施形態では、有機第二鉄化合物での処置は、被験体の軟組織石灰化を予防するか、回復させる(reverse)か、遅延させるか、または安定化することができ、該軟組織には、非限定的に、皮膚、関節、眼、心臓弁、心筋、冠動脈、肺、腎臓等の軟組織が含まれる。
【0019】
本発明はまた、被験体の軟組織石灰化を治療するための治療計画であって、許容しうる担体および有効量の有機第二鉄化合物を含む医薬組成物を含み、該医薬組成物を一回または複数回投与計画で投与する、治療計画を提供する。一実施形態では、有機第二鉄化合物は少なくとも約2 mg/cm2/分の溶解速度を有する。有機第二鉄化合物の例はクエン酸第二鉄である。
【0020】
本発明はまた、被験体の軟組織石灰化を治療するための医薬組成物であって、少なくとも約2 mg/cm2/分の溶解速度を有する有効量の有機第二鉄化合物を含む医薬組成物を提供する。一般に、該医薬組成物は、錠剤、散剤、懸濁剤、乳剤、カプセル剤、ロゼンジ剤、顆粒剤、トローチ剤、丸剤、液剤、酒精剤、またはシロップ剤として製剤化することができる。
【0021】
本発明はまた、被験体の軟組織石灰化を治療するための医薬の製造における、有効量の有機第二鉄化合物を含む医薬組成物の使用を提供する。一実施形態では、有機第二鉄化合物(例えばクエン酸第二鉄)は少なくとも約2 mg/cm2/分の溶解速度を有する。
【0022】
本発明の他の利点および態様は、後述の実施例を読むことによって明らかになろう。
【発明を実施するための最良の形態】
【0023】
発明の詳細な説明
新規有機第二鉄化合物、例えばクエン酸第二鉄の製造方法は米国仮出願第60/763,253号、およびPCT/US2006/032585に開示されている。前記文献は参照によりその全体がここに組み入れられる。これらの第二鉄化合物は、市販の形態のクエン酸第二鉄化合物または複合体よりも広いpH範囲において、より可溶性である。さらにまた、本発明の有機第二鉄化合物は、市販の形態のクエン酸第二鉄化合物と比較して、より広い有効表面積を有する。これらの有機第二鉄化合物は、より可溶性であるため、それらを、有機第二鉄化合物、例えばクエン酸第二鉄での治療に対して応答性の病状に苦しむ患者に、より効果的に経口送達することができる。
【0024】
下記に示す結果は、本発明のクエン酸第二鉄での処置が、内臓石灰化、血管石灰化および/または軟組織石灰化、例えば角膜石灰化を遅延させるか、または改善しうることを示唆する。ゆえに、有効量のクエン酸第二鉄を使用して、被験体の内臓石灰化、血管石灰化および/または軟組織石灰化を回復させるか、予防するか、遅延させるか、または安定化することができる。
【0025】
本発明は、本明細書中で開示されるクエン酸第二鉄の使用に限定されない。本発明の方法での使用に好適な他のクエン酸第二鉄化合物、またはそれらの塩、誘導体、アナログ、代謝産物、または調製物は、本出願の教示内容にしたがうことによって当業者に自明である。さらにまた、本発明の方法はまた、本明細書中に記載の方法にしたがって合成される他の有機第二鉄化合物の使用を包含する。これらの有機第二鉄化合物は、好ましくは以下の特性を有するか、または含む:
リン(phosphorous)との結合についての高親和性;
広範囲のpHにわたる可溶性;
pHに依存しない高速結合性;
高溶解性;
身体全体にわたる低吸収性;
毒性なし;
経口投与可能; および/または
製造が安価。
【0026】
本明細書中に記載のデータを考慮して、当業者はまた、本発明が、本明細書中で開示される方法にしたがって製造された有機第二鉄化合物の使用に限定されないことを容易に理解する。ゆえに、本発明は、軟組織石灰化を治療するために有機第二鉄化合物を使用する方法であって、該有機第二鉄化合物が本明細書中に記載の特定の特性を有するものである方法を包含することが当業者に自明である。
【0027】
一実施形態では、本発明の方法は、有効量の有機第二鉄化合物および好適な担体を被験体に投与するステップを含む。本明細書中で使用される用語「好適な担体」には、非限定的に、当業者に公知の医薬化合物または医薬組成物を投与するための任意の好適な担体が含まれる。担体の種類は投与様式に応じて様々である。「許容しうる担体または好適な担体」には、非限定的に、液体、エアロゾル、カプセル、錠剤、丸剤、散剤、ゲル、軟膏、クリーム、顆粒、水、リン酸緩衝食塩水、リンゲル液、ブドウ糖液、血清含有液、ハンクス液、他の水性生理的平衡溶液、油、エステル、グリコール、生体適合ポリマー、ポリマーマトリックス、カプセル、マイクロカプセル、微粒子、ボーラス製剤、浸透性ポンプ、拡散デバイス、リポソーム、リポスフェア(lipospheres)、細胞または細胞膜も含まれうる。生分解性ミクロスフェア(例えば、ポリ乳酸、ポリグリコレート)を担体として使用することもできる。
【0028】
非経口投与(例えば皮下注射)用の化合物または組成物に関して、好適な担体という用語には、非限定的に、水、生理食塩水、アルコール、脂肪、ワックスまたはバッファーが含まれる。
【0029】
経口投与用の化合物または組成物に関して、好適な担体という用語には、非限定的に、任意の上記担体または固形担体、例えばマンニトール、ラクトース、デンプン、ステアリン酸マグネシウム、サッカリンナトリウム、タルク、セルロース、グルコース、ショ糖、および炭酸マグネシウムが含まれる。
【0030】
一実施形態では、本発明は、被験体の軟組織石灰化を治療するために有機第二鉄化合物を使用する方法を提供する。一般に、被験体はヒトまたは動物である。該被験体は、慢性腎疾患、または末期腎疾患を有してよく、または腎臓透析を受けている。有機第二鉄化合物は本明細書中に記載のようにして合成する。簡潔に言えば、該合成方法は以下のステップを含む: (a) 第二鉄塩(例えば塩化第二鉄六水和物)を得るステップ; (b) 酸化ポリ鉄を含む混合物を生成するのに有効な速度および温度で第二鉄塩に水酸化アルカリ金属(例えば水酸化ナトリウム)を加えるステップ; (c) 混合物から沈殿を単離するステップ; (d) 沈殿に有機酸を加えるステップ; (e) 有機酸および沈殿を加熱することによって有機酸第二鉄溶液を形成させるステップ; および(f) 有機溶媒によって有機酸第二鉄溶液から有機第二鉄化合物を沈殿させるステップ。
【0031】
本発明はまた、被験体における軟組織石灰化を治療する方法であって、有効量の有機第二鉄化合物を該被験体に投与するステップを含む方法を提供する。一般に、有機第二鉄化合物は、少なくとも約2 mg/cm2/分、例えば約2 mg/cm2/分〜約4 mg/cm2/分の溶解速度を有する。
【0032】
一実施形態では、有機第二鉄化合物は、以下のステップ: (a) 第二鉄塩を得るステップ; (b) 酸化ポリ鉄を含む混合物を生成するのに有効な条件下で第二鉄塩に水酸化アルカリ金属を加えるステップ; (c) 混合物から沈殿を単離するステップ; (d) 沈殿に有機酸を加えるステップ; (e) 有機酸および沈殿を加熱することによって有機酸第二鉄溶液を形成させるステップ; および(f) 有機溶媒によって有機酸第二鉄溶液から有機第二鉄化合物を沈殿させるステップ、を含む方法にしたがって製造される。
【0033】
一実施形態では、水酸化アルカリ金属を、20 ml/分未満、好ましくは約10 ml/分〜約20 ml/分の範囲の速度で加え、40℃未満、好ましくは約10℃〜約40℃の範囲の温度で水酸化アルカリ金属を第二鉄塩に加える。
【0034】
一実施形態では、有機酸および沈殿を約80℃〜約90℃の範囲の温度に加熱する。有機酸第二鉄溶液から、有機溶媒を該溶液に加えることによって、有機第二鉄化合物を沈殿させるステップは、有機溶媒を加える前に有機酸第二鉄溶液を30℃未満に冷却するステップを含み、好ましくは有機酸第二鉄溶液を約10℃〜約30℃の範囲の温度に冷却する。
【0035】
有機第二鉄化合物を合成する方法では、多数の有機酸、例えばクエン酸、酢酸、イソクエン酸、コハク酸、フマル酸、および酒石酸を使用することができ、多数の有機溶媒、例えばエタノール、メタノール、ブタノール、イソプロピルアルコール、アセトン、およびテトラヒドロフランを使用することができる。
【0036】
有機第二鉄化合物は、当業者によって決定される有効量で投与することができる。例えば、有機第二鉄化合物の有効量は、動物での滴定実験または適切なin vitroモデルによって決定することができる。有効量の例には、非限定的には、1日3回投与される2〜8 gm/日の有機第二鉄化合物、14日間または28日間にわたる6 gm/日が含まれ、または有機第二鉄化合物を1日3回均等に投与するか、または食事後10分以内に有機第二鉄化合物を投与する。
【0037】
異なる投与経路、例えば静脈内(i.v.)、腹腔内(i.p.)または皮内送達でも同様に機能し、または同様に有効でありうるが、好ましくは本発明の有機第二鉄化合物は経口投与する。一般に、有機第二鉄化合物は、錠剤、散剤、懸濁剤、乳剤、カプセル剤、ロゼンジ剤、顆粒剤、トローチ剤、丸剤、液剤、酒精剤、またはシロップ剤として製剤化することができる。
【0038】
一実施形態では、有機第二鉄化合物での処置が、被験体の軟組織石灰化を予防するか、回復させるか、遅延させるか、または安定化することができ、該軟組織には、非限定的に、皮膚、関節、眼、心臓弁、心筋、冠動脈、細動脈、または内臓、例えば肺および腎臓の軟組織が含まれる。
【0039】
本発明はまた、被験体の軟組織石灰化を治療するための治療計画であって、許容しうる担体および有効量の有機第二鉄化合物を含む医薬組成物を含み、該医薬組成物を一回または複数回投与計画で投与する、治療計画を提供する。一実施形態では、有機第二鉄化合物は少なくとも約2 mg/cm2/分の溶解速度を有する。有機第二鉄化合物の例はクエン酸第二鉄である。
【0040】
一般に、医薬組成物の少なくとも一部分を経口投与し、例えば有機第二鉄化合物を、錠剤、散剤、懸濁剤、乳剤、カプセル剤、ロゼンジ剤、顆粒剤、トローチ剤、丸剤、液剤、酒精剤、またはシロップ剤として製剤化することができる。該治療計画は慢性腎疾患または末期腎疾患を有する被験体の治療に有用である。一実施形態では、該治療計画での治療は、被験体の軟組織石灰化を予防するか、回復させるか、遅延させるか、または安定化することができ、該軟組織には、非限定的に、皮膚、関節、眼、心臓弁、心筋、冠動脈、細動脈、または内臓、例えば肺および腎臓の軟組織が含まれる。
【0041】
本発明はまた、被験体の軟組織石灰化を治療するための医薬組成物であって、少なくとも約2 mg/cm2/分、例えば約2 mg/cm2/分〜約4 mg/cm2/分の溶解速度を有する有効量の有機第二鉄化合物を含む医薬組成物を提供する。この医薬組成物は上記様々な剤形に製剤化することができ、上記軟組織石灰化の治療に有用である。
【0042】
本発明はまた、被験体の軟組織石灰化を治療するための医薬の製造における、有効量の有機第二鉄化合物を含む医薬組成物の使用を提供する。一実施形態では、有機第二鉄化合物(例えばクエン酸第二鉄)は少なくとも約2 mg/cm2/分の溶解速度を有する。得られた医薬は上記様々な剤形に製剤化することができ、上記軟組織石灰化の治療に有用である。
【0043】
一般的に記載されている本発明は、以下の実施例を参照することによって、さらに容易に理解される。該実施例は、単に、本発明の特定の態様および実施形態を説明するために含められ、本発明を限定するためのものではない。
【実施例1】
【0044】
実施例1
医薬品グレードの有機第二鉄化合物を合成するための一般的方法
有機第二鉄化合物を合成するための一般的方法は、PCT/US2006/032585、および米国仮出願第60/763,253号(該文献は参照により本出願に組み入れられる)に開示されている。代表的な有機第二鉄化合物には、非限定的に、クエン酸第二鉄が含まれる。
【0045】
図1を参照すると、そのフローチャート10は、本発明で使用できる形態の有機第二鉄化合物またはクエン酸第二鉄化合物を合成するための一般的プロセスである。ボックス20に記載の出発材料は可溶性第二鉄塩を含む。可溶性第二鉄塩は、ボックス21に記載の塩化第二鉄六水和物(FeCl36H2O)、または任意の他の好適な可溶性第二鉄塩を含みうる。次いで、水酸化アルカリ金属(ボックス30)を特定の速度および温度で可溶性第二鉄塩に加える。特定の速度、好ましくは約10 ml/分〜約20 ml/分の範囲で、かつ特定の温度範囲、好ましくは40℃未満で水酸化アルカリ金属を加えると、均一なポリ鉄オキソコロイド懸濁液が形成される。水酸化アルカリ金属は、ボックス31に記載の水酸化ナトリウム、水酸化カリウム、または任意の他の好適な水酸化アルカリ金属を含みうる。
【0046】
コロイド懸濁液沈殿を回収し、蒸留水ですすいで(ボックス40)、すべての可溶性不純物を除去する。すすいだ後、沈殿を再懸濁し、ボックス50に記載のように、結晶性有機酸を沈殿に加え、特定の温度範囲、好ましくは約80℃〜約90℃の範囲に加熱する。該有機酸は任意の好適な有機酸を含みうる。ボックス51は、使用できるいくつかの有機酸候補を列挙しており、その有機酸候補には、非限定的に、クエン酸、酢酸、イソクエン酸、コハク酸、フマル酸、および酒石酸が含まれる。有機酸を加えると、該酸が溶液中の沈殿と複合体を形成することが可能になる。ボックス60では、有機溶媒を用いて有機第二鉄化合物を溶液から沈殿させ、新規形態の有機第二鉄化合物を形成させる(ボックス70)。種々の有機溶媒を使用することができ、その有機溶媒には、非限定的に、ボックス61に記載の溶媒、例えばエタノール、メタノール、ブタノール、アセトン、イソプロピルアルコール、テトラヒドロフラン、または任意の他の好適な有機溶媒が含まれる。
【0047】
クエン酸第二鉄の合成
本発明の一実施形態では、有機第二鉄化合物はクエン酸第二鉄である。クエン酸第二鉄を生成するための出発材料は、塩化第二鉄六水和物(FeCl36H2O)の1.85M溶液を含む。比1:3の第二鉄 対 水酸化物イオンを達成するために必要な5M水酸化ナトリウムの容量を、20 ml/分未満、好ましくは約10 ml/分〜約20 ml/分の範囲の速度で塩化第二鉄六水和物溶液に加える。該混合物の温度を40℃未満、好ましくは約10℃〜約40℃の範囲で維持しつつ、水酸化ナトリウムを加えて、水酸化第二鉄の酸化ポリ鉄コロイド懸濁液を形成させる。該懸濁液のpHを測定しながら、水酸化ナトリウムを加える。pHが7.0を超えたら、懸濁液を30℃未満、好ましくは約10℃〜約30℃の範囲になるまで冷却する。そして1 mm孔フィルターを通して該懸濁液をろ過して凝集物を分散させ、大きい粒子の水酸化第二鉄沈殿を除去する。そしてろ過した水酸化第二鉄懸濁液を遠心分離する。上清を廃棄し、沈殿させた水酸化第二鉄を再び遠心分離して、すべての残りの上清を除去する。そして水酸化第二鉄沈殿を蒸留水で再懸濁する。遠心分離-再懸濁ステップをさらに2回反復して、水酸化第二鉄沈殿を洗浄し、水溶性不純物を除去する。そして得られた水酸化第二鉄沈殿をホモジナイズする。
【0048】
比1:1の第二鉄 対 クエン酸を達成するために必要なクエン酸の量を沈殿に加える。混合物の色がオレンジ〜褐色から澄んだ黒色〜褐色に変化するまで、またはすべての水酸化第二鉄沈殿が溶解するまで、油浴中で混合物を約80℃〜約90℃の範囲に加熱する。反応物を30℃未満、好ましくは約10℃〜約30℃の範囲になるまで冷却し、pHを測定して、0.8〜1.5の範囲内であることを決定する。反応物を遠心分離し、上清を回収する。5倍容量の有機溶媒を加えることによって、上清からクエン酸第二鉄を沈殿させる。
【0049】
種々の有機溶媒を使用することができ、その有機溶媒には、エタノール、メタノール、ブタノール、アセトン、イソプロピルアルコール、またはテトラヒドロフランが含まれる。溶媒を加えたら、淡いベージュ色沈殿が形成されるまで混合物を攪拌する。懸濁液を遠心分離し、上清を廃棄する。沈殿を、さらに2回、溶媒で洗浄し遠心分離する。そして沈殿を、周囲温度で8〜16時間真空オーブンで乾燥するか、または任意の他の好適な工業プロセス、例えば流動床乾燥によって乾燥する。乾燥させた沈殿を乳鉢および乳棒で砕き、周囲温度でさらに8〜24時間乾燥する。微細な沈殿を再び粉砕することによって細かく砕き、45メッシュサイズ(35ミクロン)のふるいに通してふるい分けする。その新規形態のクエン酸第二鉄粉末を、真空オーブンで再び、または流動床乾燥で再び乾燥し、1時間の乾燥によって0.25%未満の重量減少に至るまで周囲温度で乾燥する。
【実施例2】
【0050】
実施例2
末期腎疾患(ESRD)患者における血清リン酸に対するクエン酸第二鉄の効果についての無作為化、二重盲検、プラセボ対照化、用量範囲決定(Dose-Ranging)研究
目的: (1) 末期腎疾患(ESRD)患者における血清リン酸(PO4)レベルに対する、28日間にわたり、TID (3回/日)で投与される、2、4および6 g/日の用量のクエン酸第二鉄の効果を決定すること。(2) ESRD患者において、28日間の、TID投与される、2、4、6 g/日の用量のクエン酸第二鉄の安全性を評価すること。
【0051】
研究薬物: 米国第11/206,981号およびWO 2004/07444に開示されているクエン酸第二鉄。
【0052】
研究デザイン: 血液透析を受けているESRD患者の血清リン酸濃度に対するクエン酸第二鉄の効果を評価するための、無作為化、二重盲検、プラセボ対照化、用量範囲決定研究。血清リン酸濃度によって測定される有効性に関して、研究14および28日目に患者を評価する。さらに、1以上の用量の研究薬物を投与された患者を安全性に関して評価する。
【0053】
研究期間: 8週間(スクリーニング期間、2週間の洗い出し、4週間の処置を含む)。
【0054】
結果は、0、2、4および6 gm/日(食事直後、すなわち10分以内にTIDで投与される)で、血清PO4およびCa×PO4の減少を示す。クエン酸第二鉄を経口投与し、3回/日で均等に与える。
【0055】
クエン酸第二鉄の、ESRD患者の血清リン酸レベルを低下させる能力が実証された。プラセボ、2、4、および6 gm/日に関して、28日間、血清カルシウムレベルの有意な変化は観察されなかった。しかし、Ca×PO4レベルは減少し、14および28日目の両時点で6 gm/日の用量に関して統計学的に有意であった。さらにこの結果は、クエン酸第二鉄での処置後に石灰化が回復するか、または安定化されうることも示す。以下の表に本研究のデータをまとめる。
【表1】

【0056】
【表2】

【0057】
【表3】

【0058】
【表4】

【0059】
【表5】

【0060】
図2および3に示されるように、医薬品グレードのクエン酸第二鉄を使用する処置は、ケミカルグレードのクエン酸第二鉄より優れたいくつかの利点を提供する。一般に、医薬品グレードのクエン酸第二鉄はケミカルグレードのクエン酸第二鉄と概ね等しい効力を示すが、医薬品グレードのクエン酸第二鉄はこの結果をケミカルグレードのクエン酸第二鉄より少ない有害副作用しか伴わずに達成する。
【0061】
図2はまた、医薬品グレードのクエン酸第二鉄の投与に伴う有害副作用が、プラセボに伴う有害副作用と統計学的に相違しなかったことを示す。この安全性プロファイルの利点は、個々の患者が、副作用について少ない懸念で、広範囲の用量にわたって滴定された医薬品グレードのクエン酸第二鉄の投薬を受けることができることである。このように、患者の個別の処置を、具体的なニーズおよび耐容性に合わせてオーダーメード化することができる。
【0062】
血清クレアチニンレベルの減少
糸球体ろ過量(GFR)レベルは構造的な腎臓損傷と相関し、したがって腎機能を測定するための黄金標準として使用される。GFRは、バイオマーカーである血清クレアチニンによって推定することができる。腎機能が悪化すると、腎臓は、クレアチニンを効率的に排泄するその機能を失い、その結果、体内にクレアチニンが保持される。したがって、血清クレアチニンの増加はGFRの低下を示し、それは腎臓悪化の重要な徴候である。
【0063】
第二相臨床研究: 「末期腎疾患(ESRD)患者の血清リン酸に対するクエン酸第二鉄の効果についての無作為化、二重盲検、プラセボ対照化、用量範囲決定研究」の非盲検拡張研究では、一部の患者に2〜6g/日のクエン酸第二鉄を投与し、血清クレアチニンレベルをモニターして、腎機能を評価した。6g/日のクエン酸第二鉄を投与された複数の患者が血清クレアチニンレベルの減少傾向を有するようであり、このことは、クエン酸第二鉄が慢性腎疾患の進行を改善し、遅延させ、阻止するか、または予防することを意味する。2人の患者から得られた結果を図4〜5に示す。
【実施例3】
【0064】
実施例3
角膜石灰化の測定方法
デジタルカメラ(NIKON E995)に連結された細隙灯顕微鏡を使用して眼の検査を行った。角膜の石灰化は角膜縁の鼻側および側頭側の近くで生じ、高カルシウム血症の帯状角膜症のように見える。観察者は、内側(鼻の近く)、外側(側頭の近く)を撮影するか、または石灰化が認められる角膜の全体像を撮った(図6)。したがって、各眼について撮影された1〜2枚の写真が存在し、その結果、1検査当たり患者1人につき2〜4枚の写真が収集された。
【0065】
「Image J」と称される画像解析ソフトウェアをデータ解析に使用した。この画像解析ソフトウェアは、8ビット、16ビットおよび32ビット画像を表示し、編集し、解析し、加工し、保存し、印刷するよう開発されている。このソフトウェアは、ユーザー定義の選択部分の面積およびピクセル値統計データを計算し、距離および角度を測定し、濃度ヒストグラムおよび線形プロファイルプロットを作成することができる。これは標準画像処理機能、例えばコントラスト操作、シャープニング、スムーシング、エッジ検出および中央値フィルタリングをサポートする。このソフトウェアは、米国国立衛生研究所(National Institutes of Health)(NIH)の1機関であるNational Institute of Mental HealthのResearch Services Branchで開発されている。このソフトウェアはNIHのウェブサイトからダウンロードすることができる。
【0066】
この画像解析ソフトウェアは、ユーザーによって主観的に定義される石灰化面積および総角膜面積を測定することができる。石灰化面積を見積もるために、観察者はまず、患者の眼の写真を画像ソフトウェアに読み込み、特定の石灰化領域を切り取り、そのソフトウェアによって、定義セクションをしかるべく測定する(該領域中に含まれるピクセル数として定義される)。写真は、角膜の一方の側に焦点を合わせて撮影されたために、通常、角膜の完全な画像をキャプチャーしていなかったことが留意されるべきであろう。角膜全体のサイズを見積もるために、観察者は、画像ソフトウェアを使用して、主観的に、写真上の利用可能な角膜領域上の90度の扇形領域を切り取り、そしてそのソフトウェアに、角膜全体の1/4に当たるこの扇形領域のサイズを計算させる。そして観察者は、該数値を4倍することによって、総角膜面積の推定値を得た。角膜石灰化の写真の例を図7に示す。
【0067】
石灰化が占める角膜表面のパーセンテージ、すなわち内側石灰化% + 外側石灰化%に基づいて、角膜石灰化の重症度を算出した。その際、内側または外側石灰化を、(内側または外側角膜の石灰化面積/総角膜面積)×100として算出する。図8を参照のこと。
【0068】
いくつかの要因が角膜の石灰化測定に影響しうる。
(1) 処置後の検査までの遅延期間が異なる結果、試験者によって定義される被験体間の変動が生じうる。
【0069】
(2) 写真撮影要因、例えば環境の明るさ、焦点距離、露出時間、輝度、光感度(ISO値)、分解能、画像コントラスト等を制御しなかった。これらの要因は、写真間の質に影響し、ゆえに、異なる写真間の石灰化領域の正確な定義に対する医師の判断に影響しうる。
【0070】
(3) 角膜領域の画像を標準化しなかった。ほとんどの写真は角膜の部分画像のみを含んでいた。角膜領域のサイズを見積もるために、観察者は、主観的に、90度の扇形領域を定義し、その値を4倍することによって角膜全体のサイズを外挿した。
【0071】
(4) いくつかの写真において異なるカメラを使用した。ベースライン角膜測定に使用されたカメラが偶然故障し、2回目の角膜測定の一部を行うために別のカメラを使用した。
【0072】
(5) 角膜の球状構造上の3次元の石灰化を見積もるために2次元の面積を使用する現行の方法は、完全に正確なわけではない。
【0073】
すべての上記要因が角膜石灰化測定の誤差に寄与する。しかし、全画像が単一の評価者によって測定され、各患者が自分自身の対照として機能し、かつ各患者内の相対的変化を検査したという事実によって、その誤差は最小化されている。
【実施例4】
【0074】
実施例4
クエン酸第二鉄は角膜石灰化を回復させる
上記第二相研究から得られた結果では、クエン酸第二鉄が用量依存的様式で血清CaxPを減少させることができ、最小限の副作用しか伴わないことが示される。眼球の石灰化は最も頻繁に観察される軟組織石灰化の1つであるため、第二相研究の終了後に、眼球の角膜石灰化に対するクエン酸第二鉄の効果および軟組織石灰化に対するその意義をさらに調査するために、クエン酸第二鉄での処置を、非盲検延長(OLE)として延長した。
【0075】
この研究では、クエン酸第二鉄処置の前および後に、患者を眼の検査のために眼科に診せた。すべての患者は、第二相試験の最初の投薬日の2、3日前または当日に1回目の眼の検査を受けた(角膜石灰化のベースライン値)。2回目の眼の検査の時期は様々であった。一部の患者は第二相研究の直後に検査を受け、別の患者はOLE期間中に検査を受けた。しかし、2回目の眼の検査を行った時期とは無関係に、角膜石灰化の変化に対するクエン酸第二鉄の効果を決定するための有効値としてみなすために、定義した連続日のクエン酸第二鉄投与後に結果を得る必要がある。
【0076】
クエン酸第二鉄の第二相臨床試験のすべての患者は、その後、種々の時間長にわたる薬を使わない期間を持ち、また一部の患者は非盲検延長処置期間に参加した。参加した各患者は、眼科医が実施する2回の眼の検査を受けた。1回目および2回目の眼の検査の日付および対応する薬物投与期間に応じて、参加したすべての患者から使用可能な情報が得られるわけではない。認められる患者は、少なくとも21日間の連続投薬を受けた患者であった。1回目および2回目の眼の検査の間の期間は少なくとも投薬期間と同じ長さであった。2回の眼の検査の間の実際の間隔はこの評価の目的では関連がなかった。その理由は、1回目および2回目の眼の検査の間の時間がより長いほど、角膜石灰化が発症する可能性が高く、その逆はないからである。したがって、角膜石灰化の変化の程度に対するクエン酸第二鉄の効果の見積りに関する以下の結果は、1回目および2回目の検査の間の間隔が薬物処置期間より長い場合には、実に保存的である。
【0077】
合計で12人の患者から評価にふさわしいデータが得られた。得られたデータを表6に列挙した。各患者の左眼および右眼を検査し、したがって24個の角膜石灰化の値が得られた。これらの12人の患者のうち、1人はプラセボを投与され、ネガティブコントロールとして機能した。他の11人の患者は種々の期間の連続有効処置(28〜57日間の範囲)を受け、22個の左眼および右眼の角膜石灰化の値が得られた。有効処置を受けた11人の患者のうち、2人の患者は用量レベル2g/日のクエン酸第二鉄を投与され、2人の患者は用量レベル4g/日のクエン酸第二鉄を投与され、7人の患者は6g/日の用量レベルのクエン酸第二鉄を投与された。この評価には、限られた数の患者しか参加していないために、本格的な統計データは必要でなく、本明細書中では概要の統計データを使用する。
【0078】
プラセボを投与された患者は、1回目および2回目の眼の検査の間の77日間の期間中に平均で+6.55%(+1.28%の右眼悪化および+11.81%の左眼悪化)悪化した角膜石灰化を示すことが見出された。
【0079】
有効処置を受けた11人の患者のうちでは、処置期間は平均33日間であり、28〜57日間の範囲におよんだ。1回目および2回目の検査の間の期間は平均で126日間であり、50〜217日間の範囲におよんだ。これらの11人の患者の中で、悪化した結果を示した眼の角膜石灰化の値は10個のみであった(平均+2.20%、範囲+0.08%〜+6.98%)。対照的に、1個の眼の角膜石灰化の値は不変のままであり、一方、11個の眼の角膜石灰化の値は改善を示した(平均-2.07%、-0.08%〜- 10.21%の範囲)。角膜石灰化の悪化または改善例を図9〜10に示す。
【0080】
上記データは極めて有望であった。クエン酸第二鉄は角膜石灰化病状を遅延させるか、または改善すると考えられる。その結果はまた、クエン酸第二鉄処置が軟組織石灰化の種々の病状を改善しうることを意味する。追加の臨床研究を実施して、すべての軟組織石灰化病状の治療に対するクエン酸第二鉄の効力を確認することができる。
【表6】

【図面の簡単な説明】
【0081】
【図1】図1は、本発明に係る新規形態の有機第二鉄化合物の製造方法を概説する模式図である。
【図2】図2は、ケミカルグレードおよび医薬品グレードのクエン酸第二鉄の安全性プロファイルの比較である。
【図3】図3は、ケミカルグレードおよび医薬品グレードのクエン酸第二鉄の効力プロファイルの比較である。
【図4】図4は、6g/日のクエン酸第二鉄で処置された患者(患者コード: 2-01-1-029)の血清クレアチニンレベルを示す。
【図5】図5は、6g/日のクエン酸第二鉄で処置された患者(患者コード: 2-01-1-032)の血清クレアチニンレベルを示す。
【図6】図6は、眼の検査に関する眼の様々な領域を示す。
【図7】図7は、角膜石灰化の写真例を示す。
【図8】図8は、眼の検査および角膜石灰化の算出の例を示す。
【図9】図9は、クエン酸第二鉄で処置されない患者における悪化した角膜石灰化の例を示す。患者ID: 2-01-001; 用量: プラセボ; 処置期間: 77日間。
【図10】図10は、クエン酸第二鉄での処置後の患者における改善した角膜石灰化の例を示す。患者ID: 2-01-1-012; 用量: クエン酸第二鉄2g/日; 処置期間: 28日間。
【特許請求の範囲】
【請求項1】
被験体の軟組織石灰化を治療する方法であって、有効量の有機第二鉄化合物を該被験体に投与するステップを含む方法。
【請求項2】
有機第二鉄化合物が少なくとも約2 mg/cm2/分の溶解速度を有する、請求項1に記載の方法。
【請求項3】
有機第二鉄化合物の溶解速度が約2 mg/cm2/分〜約4 mg/cm2/分である、請求項2に記載の方法。
【請求項4】
有機第二鉄化合物が、以下のステップ:
a) 第二鉄塩を得るステップ;
b) 酸化ポリ鉄(polyiron oxide)を含む混合物を生成するのに好適な条件下で水酸化アルカリ金属を第二鉄塩に加えるステップ;
c) 混合物から沈殿を単離するステップ;
d) 沈殿に有機酸を加えるステップ;
e) 有機酸および沈殿を加熱して、それにより有機酸第二鉄溶液を形成させるステップ; および
f) 有機溶媒によって有機酸第二鉄溶液から有機第二鉄化合物を沈殿させるステップ
を含む方法にしたがって製造される、請求項1〜3のいずれか一項に記載の方法。
【請求項5】
水酸化アルカリ金属が水酸化ナトリウムまたは水酸化カリウムである、請求項4に記載の方法。
【請求項6】
20 ml/分未満の速度で水酸化アルカリ金属を加え、40℃未満の温度で水酸化アルカリ金属を第二鉄塩に加える、請求項4または5に記載の方法。
【請求項7】
有機酸および沈殿を約80℃〜約90℃の温度に加熱し、かつ、有機溶媒によって有機酸第二鉄溶液から有機第二鉄化合物を沈殿させるステップが、有機溶媒を加える前に有機酸第二鉄溶液を30℃未満に冷却するステップを含む、請求項4〜6のいずれか一項に記載の方法。
【請求項8】
有機酸が結晶性形状である、請求項4〜7のいずれか一項に記載の方法。
【請求項9】
有機酸が、クエン酸、酢酸、イソクエン酸、コハク酸、フマル酸、および酒石酸からなる群から選択される、請求項4〜8のいずれか一項に記載の方法。
【請求項10】
有機溶媒が、エタノール、メタノール、ブタノール、イソプロピルアルコール、アセトン、およびテトラヒドロフランからなる群から選択される、請求項4〜9のいずれか一項に記載の方法。
【請求項11】
第二鉄塩が塩化第二鉄六水和物であり、水酸化アルカリ金属が水酸化ナトリウムであり、かつ有機酸が結晶性クエン酸である、請求項4に記載の方法。
【請求項12】
被験体がヒトまたは動物である、請求項1に記載の方法。
【請求項13】
被験体が慢性腎疾患または末期腎疾患を有している、請求項12に記載の方法。
【請求項14】
被験体が腎臓透析または腎移植を受けている、請求項13に記載の方法。
【請求項15】
被験体の軟組織石灰化が回復するか、予防されるか、遅延するか、または安定化される、請求項1〜14のいずれか一項に記載の方法。
【請求項16】
軟組織が、関節、皮膚、眼、心臓弁、心筋、冠動脈および細動脈、腎臓または肺の組織である、請求項15に記載の方法。
【請求項17】
有機第二鉄化合物が経口投与に好適な剤形である、請求項1に記載の方法。
【請求項18】
経口投与に好適な剤形が、錠剤、散剤、懸濁剤、乳剤、カプセル剤、ロゼンジ剤、顆粒剤、トローチ剤、丸剤、液剤、酒精剤、またはシロップ剤である、請求項17に記載の方法。
【請求項19】
有機第二鉄化合物がクエン酸第二鉄である、請求項1〜18のいずれか一項に記載の方法。
【請求項20】
被験体の軟組織石灰化を治療するための治療計画であって、許容しうる担体および有効量の有機第二鉄化合物を含む医薬組成物を含み、該医薬組成物を一回または複数回投与計画で投与する、治療計画。
【請求項21】
有機第二鉄化合物が少なくとも約2 mg/cm2/分の溶解速度を有する、請求項20に記載の治療計画。
【請求項22】
有機第二鉄化合物の溶解速度が約2 mg/cm2/分〜約4 mg/cm2/分である、請求項21に記載の治療計画。
【請求項23】
医薬組成物の少なくとも一部分を経口投与する、請求項20〜22のいずれか一項に記載の治療計画。
【請求項24】
有機第二鉄化合物を、錠剤、散剤、懸濁剤、乳剤、カプセル剤、ロゼンジ剤、顆粒剤、トローチ剤、丸剤、液剤、酒精剤、またはシロップ剤として製剤化する、請求項20〜23のいずれか一項に記載の治療計画。
【請求項25】
被験体が慢性腎疾患または末期腎疾患を有している、請求項20に記載の治療計画。
【請求項26】
被験体の軟組織石灰化が回復するか、予防されるか、遅延するか、または安定化される、請求項20〜25のいずれか一項に記載の治療計画。
【請求項27】
軟組織が、関節、皮膚、眼、心臓弁、心筋、冠動脈および細動脈、腎臓または肺の組織である、請求項26に記載の治療計画。
【請求項28】
腎臓透析または腹膜透析をさらに含む、請求項20〜27のいずれか一項に記載の治療計画。
【請求項29】
有機第二鉄化合物がクエン酸第二鉄である、請求項20〜28のいずれか一項に記載の治療計画。
【請求項30】
被験体の軟組織石灰化を治療するための医薬組成物であって、少なくとも約2 mg/cm2/分の溶解速度を有する有効量の有機第二鉄化合物を含む医薬組成物。
【請求項31】
有機第二鉄化合物の溶解速度が約2 mg/cm2/分〜約4 mg/cm2/分である、請求項30に記載の医薬組成物。
【請求項32】
経口投与に好適な剤形である、請求項30または31に記載の医薬組成物。
【請求項33】
経口投与に好適な剤形が、錠剤、散剤、懸濁剤、乳剤、カプセル剤、ロゼンジ剤、顆粒剤、トローチ剤、丸剤、液剤、酒精剤、またはシロップ剤である、請求項32に記載の医薬組成物。
【請求項34】
有機第二鉄化合物がクエン酸第二鉄である、請求項30〜33のいずれか一項に記載の医薬組成物。
【請求項35】
被験体の軟組織石灰化を治療するための医薬の製造における、有効量の有機第二鉄化合物を含む医薬組成物の使用。
【請求項36】
有機第二鉄化合物が少なくとも約2 mg/cm2/分の溶解速度を有する、請求項35に記載の使用。
【請求項37】
被験体が慢性腎疾患または末期腎疾患を有している、請求項35に記載の使用。
【請求項38】
被験体の軟組織石灰化を回復させるか、予防するか、遅延させるか、または安定化する、請求項35〜37のいずれか一項に記載の使用。
【請求項39】
軟組織が、関節、皮膚、眼、心臓弁、心筋、冠動脈および細動脈、腎臓または肺の組織である、請求項38に記載の使用。
【請求項40】
有機第二鉄化合物がクエン酸第二鉄である、請求項35〜39のいずれか一項に記載の使用。
【請求項1】
被験体の軟組織石灰化を治療する方法であって、有効量の有機第二鉄化合物を該被験体に投与するステップを含む方法。
【請求項2】
有機第二鉄化合物が少なくとも約2 mg/cm2/分の溶解速度を有する、請求項1に記載の方法。
【請求項3】
有機第二鉄化合物の溶解速度が約2 mg/cm2/分〜約4 mg/cm2/分である、請求項2に記載の方法。
【請求項4】
有機第二鉄化合物が、以下のステップ:
a) 第二鉄塩を得るステップ;
b) 酸化ポリ鉄(polyiron oxide)を含む混合物を生成するのに好適な条件下で水酸化アルカリ金属を第二鉄塩に加えるステップ;
c) 混合物から沈殿を単離するステップ;
d) 沈殿に有機酸を加えるステップ;
e) 有機酸および沈殿を加熱して、それにより有機酸第二鉄溶液を形成させるステップ; および
f) 有機溶媒によって有機酸第二鉄溶液から有機第二鉄化合物を沈殿させるステップ
を含む方法にしたがって製造される、請求項1〜3のいずれか一項に記載の方法。
【請求項5】
水酸化アルカリ金属が水酸化ナトリウムまたは水酸化カリウムである、請求項4に記載の方法。
【請求項6】
20 ml/分未満の速度で水酸化アルカリ金属を加え、40℃未満の温度で水酸化アルカリ金属を第二鉄塩に加える、請求項4または5に記載の方法。
【請求項7】
有機酸および沈殿を約80℃〜約90℃の温度に加熱し、かつ、有機溶媒によって有機酸第二鉄溶液から有機第二鉄化合物を沈殿させるステップが、有機溶媒を加える前に有機酸第二鉄溶液を30℃未満に冷却するステップを含む、請求項4〜6のいずれか一項に記載の方法。
【請求項8】
有機酸が結晶性形状である、請求項4〜7のいずれか一項に記載の方法。
【請求項9】
有機酸が、クエン酸、酢酸、イソクエン酸、コハク酸、フマル酸、および酒石酸からなる群から選択される、請求項4〜8のいずれか一項に記載の方法。
【請求項10】
有機溶媒が、エタノール、メタノール、ブタノール、イソプロピルアルコール、アセトン、およびテトラヒドロフランからなる群から選択される、請求項4〜9のいずれか一項に記載の方法。
【請求項11】
第二鉄塩が塩化第二鉄六水和物であり、水酸化アルカリ金属が水酸化ナトリウムであり、かつ有機酸が結晶性クエン酸である、請求項4に記載の方法。
【請求項12】
被験体がヒトまたは動物である、請求項1に記載の方法。
【請求項13】
被験体が慢性腎疾患または末期腎疾患を有している、請求項12に記載の方法。
【請求項14】
被験体が腎臓透析または腎移植を受けている、請求項13に記載の方法。
【請求項15】
被験体の軟組織石灰化が回復するか、予防されるか、遅延するか、または安定化される、請求項1〜14のいずれか一項に記載の方法。
【請求項16】
軟組織が、関節、皮膚、眼、心臓弁、心筋、冠動脈および細動脈、腎臓または肺の組織である、請求項15に記載の方法。
【請求項17】
有機第二鉄化合物が経口投与に好適な剤形である、請求項1に記載の方法。
【請求項18】
経口投与に好適な剤形が、錠剤、散剤、懸濁剤、乳剤、カプセル剤、ロゼンジ剤、顆粒剤、トローチ剤、丸剤、液剤、酒精剤、またはシロップ剤である、請求項17に記載の方法。
【請求項19】
有機第二鉄化合物がクエン酸第二鉄である、請求項1〜18のいずれか一項に記載の方法。
【請求項20】
被験体の軟組織石灰化を治療するための治療計画であって、許容しうる担体および有効量の有機第二鉄化合物を含む医薬組成物を含み、該医薬組成物を一回または複数回投与計画で投与する、治療計画。
【請求項21】
有機第二鉄化合物が少なくとも約2 mg/cm2/分の溶解速度を有する、請求項20に記載の治療計画。
【請求項22】
有機第二鉄化合物の溶解速度が約2 mg/cm2/分〜約4 mg/cm2/分である、請求項21に記載の治療計画。
【請求項23】
医薬組成物の少なくとも一部分を経口投与する、請求項20〜22のいずれか一項に記載の治療計画。
【請求項24】
有機第二鉄化合物を、錠剤、散剤、懸濁剤、乳剤、カプセル剤、ロゼンジ剤、顆粒剤、トローチ剤、丸剤、液剤、酒精剤、またはシロップ剤として製剤化する、請求項20〜23のいずれか一項に記載の治療計画。
【請求項25】
被験体が慢性腎疾患または末期腎疾患を有している、請求項20に記載の治療計画。
【請求項26】
被験体の軟組織石灰化が回復するか、予防されるか、遅延するか、または安定化される、請求項20〜25のいずれか一項に記載の治療計画。
【請求項27】
軟組織が、関節、皮膚、眼、心臓弁、心筋、冠動脈および細動脈、腎臓または肺の組織である、請求項26に記載の治療計画。
【請求項28】
腎臓透析または腹膜透析をさらに含む、請求項20〜27のいずれか一項に記載の治療計画。
【請求項29】
有機第二鉄化合物がクエン酸第二鉄である、請求項20〜28のいずれか一項に記載の治療計画。
【請求項30】
被験体の軟組織石灰化を治療するための医薬組成物であって、少なくとも約2 mg/cm2/分の溶解速度を有する有効量の有機第二鉄化合物を含む医薬組成物。
【請求項31】
有機第二鉄化合物の溶解速度が約2 mg/cm2/分〜約4 mg/cm2/分である、請求項30に記載の医薬組成物。
【請求項32】
経口投与に好適な剤形である、請求項30または31に記載の医薬組成物。
【請求項33】
経口投与に好適な剤形が、錠剤、散剤、懸濁剤、乳剤、カプセル剤、ロゼンジ剤、顆粒剤、トローチ剤、丸剤、液剤、酒精剤、またはシロップ剤である、請求項32に記載の医薬組成物。
【請求項34】
有機第二鉄化合物がクエン酸第二鉄である、請求項30〜33のいずれか一項に記載の医薬組成物。
【請求項35】
被験体の軟組織石灰化を治療するための医薬の製造における、有効量の有機第二鉄化合物を含む医薬組成物の使用。
【請求項36】
有機第二鉄化合物が少なくとも約2 mg/cm2/分の溶解速度を有する、請求項35に記載の使用。
【請求項37】
被験体が慢性腎疾患または末期腎疾患を有している、請求項35に記載の使用。
【請求項38】
被験体の軟組織石灰化を回復させるか、予防するか、遅延させるか、または安定化する、請求項35〜37のいずれか一項に記載の使用。
【請求項39】
軟組織が、関節、皮膚、眼、心臓弁、心筋、冠動脈および細動脈、腎臓または肺の組織である、請求項38に記載の使用。
【請求項40】
有機第二鉄化合物がクエン酸第二鉄である、請求項35〜39のいずれか一項に記載の使用。
【図1】


【図2】


【図3】


【図4】


【図5】


【図6】


【図7】


【図8】


【図9】


【図10】




【図2】


【図3】


【図4】


【図5】


【図6】


【図7】


【図8】


【図9】


【図10】


【公表番号】特表2009−525277(P2009−525277A)
【公表日】平成21年7月9日(2009.7.9)
【国際特許分類】
【出願番号】特願2008−552435(P2008−552435)
【出願日】平成19年1月26日(2007.1.26)
【国際出願番号】PCT/US2007/002157
【国際公開番号】WO2007/089577
【国際公開日】平成19年8月9日(2007.8.9)
【出願人】(505311733)グロボアジア エルエルシー (4)
【Fターム(参考)】
【公表日】平成21年7月9日(2009.7.9)
【国際特許分類】
【出願日】平成19年1月26日(2007.1.26)
【国際出願番号】PCT/US2007/002157
【国際公開番号】WO2007/089577
【国際公開日】平成19年8月9日(2007.8.9)
【出願人】(505311733)グロボアジア エルエルシー (4)
【Fターム(参考)】
[ Back to top ]

