近赤外蛍光色素、画像診断材料及び画像診断方法
【課題】従来知られているフルオレセインや逆U字型ナフトフルオレセイン(1)よりもさらに長波長側に蛍光波長を有する近赤外蛍光色素を提供し、併せて、そのような近赤外蛍光色素を含む画像診断材料と、そのような画像診断材料を用いて行う画像診断方法とを提供する。
【解決手段】フルオレセインのキサンテン骨格の両側にベンゼン環を1つずつ付加した構造のナフトフルオレセインのうち、2つのベンゼン環の縮合位置がキサンテンの[b、i]である直線型ナフトフルオレセイン(2)は、従来既知のフルオレセインや逆U字型ナフトフルオレセイン(1)よりもさらに長波長側に蛍光波長を有する。
【解決手段】フルオレセインのキサンテン骨格の両側にベンゼン環を1つずつ付加した構造のナフトフルオレセインのうち、2つのベンゼン環の縮合位置がキサンテンの[b、i]である直線型ナフトフルオレセイン(2)は、従来既知のフルオレセインや逆U字型ナフトフルオレセイン(1)よりもさらに長波長側に蛍光波長を有する。
【発明の詳細な説明】
【技術分野】
【0001】
本発明は、近赤外領域に蛍光波長を有する近赤外蛍光色素、画像診断材料及び画像診断方法に関する。より詳しくは、キサンテン様骨格を有する特定構造の化合物を含む近赤外蛍光色素、この近赤外蛍光色素を含む画像診断材料、及び、この画像診断材料を用いて行う画像診断方法に関する。
【背景技術】
【0002】
従来、キサンテン骨格を有する構造のフルオレセインやローダミン等は、蛍光色素として知られている。特にフルオレセインは、例えば非特許文献1に記載されているように、生体イメージングの画像診断ツールとして様々な誘導体が合成され、実用化されている。
【0003】
フルオレセインやローダミン等の励起波長及び蛍光波長は、水中で500nm前後である。例えばフルオレセインの励起波長及び蛍光波長は、λex;493nm(H2O)、λem;510nm(H2O)である。このような蛍光波長を有するフルオレセインを生体イメージングの画像診断ツールとして用いる場合、生体の自家蛍光との重なりによって使用が制限されるという不具合がある。つまり、蛍光色素の蛍光波長が、生体内に存在する細胞自身が有するポルフィリン等の生体内物質(蛍光性物質)の蛍光波長と重なり合い、状況によっては生体イメージングツールとして良好に使用できない場合がある。
【0004】
そこで、このような不具合に対処するために、より長波長領域で励起し発光する色素、すなわち近赤外蛍光色素を用いることが行われている。そのような、蛍光波長がより長波長側にシフトした近赤外蛍光色素においては、生体内物質自体が吸収を持たないので、自家蛍光との重なりの不具合が解消されて画像診断がより正確に行えるうえに、長波長の近赤外光が生体組織のより深い部位まで到達するので、可視化が困難な生体組織の深部の状態観察が可能となる。また、生体へのダメージが軽減するという利点もある。
【0005】
従来、フルオレセインよりも長波長側に発光を示す蛍光色素が種々知られている。それらのうちの代表的なものの1つに、下記構造式(1)で示されるように、フルオレセインのキサンテン骨格の両側にベンゼン環を1つずつ付加した構造の化合物が知られている。この化合物(1)は、2つのベンゼン環の縮合位置がキサンテンの[c、h]である逆U字型ナフトフルオレセインである(特許文献1参照)。この従来既知のナフトフルオレセイン(1)は、フルオレセインに比べて共役系が伸びた分だけ、蛍光波長が長波長側へシフトすることが予測される。事実、この化合物(1)の励起波長及び蛍光波長は、λex;600nm(H2O)、λem;656nm(H2O)である。フルオレセインの蛍光波長(λem;510nm)よりも146nm程度長波長側にシフトしている。しかしながら、バックグラウンドの蛍光強度に影響されない、精度のよい良好な生体イメージングを実行するためにはまだ十分とはいえず、蛍光を利用した生体内画像診断精度のさらなる向上のためには、なお一層の長波長側へのシフトが望まれているのが現状である。
【0006】
【化1】

【先行技術文献】
【非特許文献】
【0007】
【非特許文献1】生体イメージングを目指した近赤外蛍光プローブの開発研究 小島宏建/YAKUGAKU ZASSHI 128(11)1653−1663(2008)/The Pharmaceutical Society of Japan
【特許文献】
【0008】
【特許文献1】特許第3955638号公報(請求項7、第12頁)
【発明の概要】
【発明が解決しようとする課題】
【0009】
したがって、本発明の目的は、従来知られているフルオレセインや逆U字型ナフトフルオレセイン(1)よりもさらに長波長側に蛍光波長を有する近赤外蛍光色素を提供し、併せて、そのような近赤外蛍光色素を含む画像診断材料(すなわち画像診断ツールあるいは生体イメージングツール)と、そのような画像診断材料を用いて行う画像診断方法とを提供することである。
【課題を解決するための手段】
【0010】
本発明の一局面は、下記一般式(I)で示される化合物と、下記一般式(II)で示される化合物と、下記一般式(III)で示される化合物と、下記一般式(IV)で示される化合物と、下記一般式(V)で示される化合物とからなる群より選ばれる少なくとも1つの化合物を含む近赤外蛍光色素である。
【0011】
【化2】

【0012】
【化3】

【0013】
【化4】

【0014】
【化5】

【0015】
【化6】

【0016】
なお、式中、Xは、酸素原子又はケイ素原子であり;Yは、複数ある場合はそれぞれ独立して、OH、OR1又はNR2R3であり;Z1は、複数ある場合はそれぞれ独立して、水素原子、ハロゲン原子(F、Cl、BrもしくはI)、炭素数が1〜5の一部もしくは全部がNR2R3で置換されたもしくは無置換のアルキル基又は炭素数が1〜5の一部もしくは全部がOR4で置換されたもしくは無置換のアルキル基であり;Z2は、複数ある場合はそれぞれ独立して、水素原子又はハロゲン原子(F、Cl、BrもしくはI)であり;Z3、Z4は、それぞれ独立して、水素原子、NR2R3、OR4又は炭素数が1〜5の一部もしくは全部がハロゲン原子(F、Cl、BrもしくはI)で置換されたもしくは無置換のアルキル基である。また、前記において、R1は、複数ある場合はそれぞれ独立して、アシル基、糖残基又は芳香族化合物であり;R2、R3は、それぞれ独立して、水素原子又は炭素数が1〜5の一部もしくは全部が置換されたもしくは無置換のアルキル基であり;R4は、複数ある場合はそれぞれ独立して、水素原子又は炭素数が1〜5の一部もしくは全部が置換されたもしくは無置換のアルキル基である。
【0017】
前記一般式(I)及び(II)において、Xは酸素原子であり、YはそれぞれOHであり、Z1、Z2、Z3及びZ4はそれぞれ水素原子であることが好ましい。
【0018】
本発明の他の一局面は、前記近赤外蛍光色素を含む画像診断材料である。
【0019】
本発明のさらに他の一局面は、前記画像診断材料を用いて行う画像診断方法である。
【発明の効果】
【0020】
本発明によれば、近赤外領域に蛍光波長を有する新規な近赤外蛍光色素、この近赤外蛍光色素を含む画像診断材料、及び、この画像診断材料を用いて行う画像診断方法が提供される。
【図面の簡単な説明】
【0021】
【図1】本発明の実施形態に係る直線型ナフトフルオレセインの合成スキームである。
【図2】別の合成スキームである。
【図3】従来既知の逆U字型ナフトフルオレセインの呈色挙動の説明図である。
【図4】本発明の実施形態に係る直線型ナフトフルオレセインの呈色挙動の説明図である。
【図5】本発明の実施形態に係る直線型ナフトフルオレセインの発光挙動及び従来既知の逆U字型ナフトフルオレセインの発光挙動の説明図である。
【発明を実施するための形態】
【0022】
本発明者等は、フルオレセインのキサンテン骨格の両側にベンゼン環を1つずつ付加した構造のナフトフルオレセインのなかでも、下記構造式(2)で示されるように、2つのベンゼン環の縮合位置がキサンテンの[b、i]である直線型ナフトフルオレセイン(2)が、従来知られているフルオレセインや逆U字型ナフトフルオレセイン(1)よりもさらに長波長側に蛍光波長を有することを見出して本発明を完成した。
【0023】
【化7】

【0024】
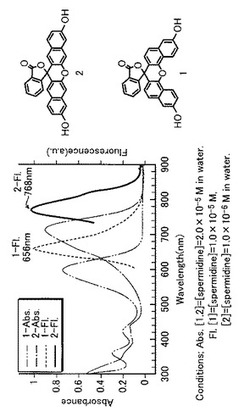
この直線型ナフトフルオレセイン(2)の励起波長及び蛍光波長は、後に詳しく述べるように、λex;714nm(H2O)、λem;768nm(H2O)である。フルオレセインの蛍光波長(λem;510nm)よりも258nm程度長波長側にシフトしている。また、従来既知の逆U字型ナフトフルオレセイン(1)の蛍光波長(λem;656nm)と比べても112nm程度長波長側にシフトしている。この直線型ナフトフルオレセイン(2)の蛍光波長(λem;768nm)は近赤外領域(λ;700nm〜2500nm)の中にある。また、この直線型ナフトフルオレセイン(2)は新規化合物である。
【0025】
一般に、近赤外光は、生体組織のより深い部位まで到達するので、前記直線型ナフトフルオレセイン(2)を含む画像診断材料(すなわち画像診断ツールあるいは生体イメージングツール)を用いれば、生体組織のより深い部位の状態観察が可能な画像診断検査(画像診断方法)が実現し得る。また、700nmを超える波長領域は、ポルフィリン等の生体内物質が発光しない波長領域であるから、生体の自家蛍光の影響を受けることが回避される。そのため、本実施形態に係る近赤外蛍光色素で標識された薬剤(画像診断材料)を被検者に投与し、特定の波長帯域を有する励起光を生体内に照射し、その際に生体内で近赤外蛍光色素で標識された薬剤が発する蛍光の像を撮り、この蛍光画像を観察することによって、生体内の正常部位及び病変部位を判別する蛍光観察(画像診断)が可能となる。
【0026】
この直線型ナフトフルオレセイン(2)を基本骨格とし、様々な直線型ナフトフルオレセイン誘導体あるいは直線型ナフトローダミン誘導体を合成して、現在用いられているフルオレセイン型プローブやローダミン型プローブに適応すれば、原理的に全てのフルオレセイン型プローブ及びローダミン型プローブの近赤外発光化が可能となる。
【0027】
以上のことから、本実施形態に係る近赤外蛍光色素は、下記一般式(I)で示される化合物と、下記一般式(II)で示される化合物と、下記一般式(III)で示される化合物と、下記一般式(IV)で示される化合物と、下記一般式(V)で示される化合物とからなる群より選ばれる少なくとも1つの化合物(キサンテン様骨格を有する特定構造の化合物)を含むものである。
【0028】
【化8】

【0029】
【化9】

【0030】
【化10】

【0031】
【化11】

【0032】
【化12】

【0033】
なお、式中、Xは、酸素原子又はケイ素原子であり;Yは、複数ある場合はそれぞれ独立して、OH、OR1又はNR2R3であり;Z1は、複数ある場合はそれぞれ独立して、水素原子、ハロゲン原子(F、Cl、BrもしくはI)、炭素数が1〜5の一部もしくは全部がNR2R3で置換されたもしくは無置換のアルキル基又は炭素数が1〜5の一部もしくは全部がOR4で置換されたもしくは無置換のアルキル基であり;Z2は、複数ある場合はそれぞれ独立して、水素原子又はハロゲン原子(F、Cl、BrもしくはI)であり;Z3、Z4は、それぞれ独立して、水素原子、NR2R3、OR4又は炭素数が1〜5の一部もしくは全部がハロゲン原子(F、Cl、BrもしくはI)で置換されたもしくは無置換のアルキル基である。また、前記において、R1は、複数ある場合はそれぞれ独立して、アシル基、糖残基又は芳香族化合物であり;R2、R3は、それぞれ独立して、水素原子又は炭素数が1〜5の一部もしくは全部が置換されたもしくは無置換のアルキル基であり;R4は、複数ある場合はそれぞれ独立して、水素原子又は炭素数が1〜5の一部もしくは全部が置換されたもしくは無置換のアルキル基である。
【0034】
前記一般式(I)〜(V)で示される化合物は、前記直線型ナフトフルオレセイン(2)を基本骨格としているため、蛍光波長が長波長側にシフトしている。その結果、本実施形態に係る近赤外蛍光色素は、前記一般式(I)〜(V)で示される化合物のうちの少なくとも1つの化合物を含むものであるから、従来知られているフルオレセインや逆U字型ナフトフルオレセイン(1)よりもさらに長波長側に蛍光波長を有する。本実施形態に係る近赤外蛍光色素は、適応範囲が極めて広く、広範な産業上の利用可能性が期待される。
【0035】
なお、一般式(I)の少なくとも一方のYがOHである場合は、一般式(I)で示される化合物は一般式(II)で示される化合物と互変異性の関係にある。この場合において、一般式(II)で示される化合物は、周辺の環境(pHや塩基等)に応じて、一般式(I)で示される化合物から変異し、長波長側にシフトした蛍光の発現に寄与するものと考えられる。また、一般式(I)の少なくとも一方のYがNR2R3である場合は、一般式(I)で示される化合物は一般式(IV)で示される化合物と互変異性の関係にある。この場合においても、一般式(IV)で示される化合物は、周辺の環境(pHや塩基等)に応じて、一般式(I)で示される化合物から変異し、長波長側にシフトした蛍光の発現に寄与するものと考えられる。一方、一般式(III)で示される化合物は、一般式(II)で示される化合物においてCOOHを水素原子に置換した、一般式(II)に類似構造の化合物である。また、一般式(V)で示される化合物は、一般式(IV)で示される化合物においてCOO−を水素原子に置換した、一般式(IV)に類似構造の化合物である。
【0036】
前記一般式(I)、(II)で示される化合物のうち、Xが酸素原子であり、YがそれぞれOHであり、Z1、Z2、Z3及びZ4がそれぞれ水素原子である化合物は、前記直線型ナフトフルオレセイン(2)である。
【0037】
前記一般式(I)、(IV)で示される化合物のうち、Xが酸素原子であり、YがそれぞれNR2R3であり、Z1、Z2、Z3及びZ4がそれぞれ水素原子である化合物は、直線型ナフトローダミン類である。
【0038】
前記一般式(I)〜(V)で示される化合物のうち、Xがケイ素原子である化合物は、蛍光波長がさらに長波長側にシフトする。
【0039】
前記一般式(I)〜(V)で示される化合物のうちの少なくとも1つの化合物を含む近赤外蛍光色素を含む画像診断材料は、生体の自家蛍光との重なりによって使用が制限されるという不具合が解消され、生体イメージングの画像診断ツールとして極めて有用である。
【0040】
前記一般式(I)〜(V)で示される化合物のうちの少なくとも1つの化合物を含む近赤外蛍光色素を含む画像診断材料を用いて行う画像診断方法は、生体組織のより深い部位の状態観察が可能となり、例えば、全身に適用し得る画像診断方法である。
【0041】
[合成スキーム]
本実施形態に係る直線型ナフトフルオレセイン(2)は、フルオレセインの合成と同様、図1に示すように、2,7−ジヒドロキシナフタレンと無水フタル酸とを酸性条件下(例えば反応触媒としてのスルホン酸や塩化亜鉛の存在下)で反応させることにより合成することができる。一例として、メタンスルホン酸中、100℃で反応を行ったところ、本実施形態に係る直線型の化合物(2)の他に、2つのベンゼン環の縮合位置がキサンテンの[a、j]であるU字型ナフトフルオレセイン(3)と、2つのベンゼン環の縮合位置がキサンテンの[a、i]であるL字型ナフトフルオレセイン(4)とが構造異性体として得られ、この混合物を順相及び逆相クロマトグラフィー及び分取用TLCを組み合わせて精製することにより3種類の化合物(2)、(3)、(4)を単離することができた。収率は、直線型(2)が1%、U字型(3)が5%、L字型(4)が3%であった。
【0042】
他の改善された合成スキームを説明する。図2に示すように、まず、2,7−ジヒドロキシナフタレンの3位への臭素化を行う。酢酸中、臭素を作用させることにより、ジブロモ体へと導き、その後、スズを添加して加温することにより、1位の臭素を選択的に脱離させることにより、3−ブロモナフタレン−2,7−ジオール(5)が83%の収率で得られる。次いで、2つのフェノール性水酸基をメトキシメチル(MOM)基で保護する。このとき、強塩基である水素化ナトリウム(NaH)を用いることにより、反応は速やかに進行し、中間化合物(6)が定量的に得られる。次いで、中間化合物(6)にn−ブチルリチウムを作用させることにより、3位をリチオ化した後、無水フタル酸と反応させ、塩酸によりラクトン骨格を構築することにより、中間化合物(7)が62%の収率で得られる。次いで、中間化合物(7)の4つのメトキシメチル(MOM)基を塩酸で脱保護することにより、テトラオール体(8)が73%の収率で得られる。そして、メタンスルホン酸を用いてテトラオール体(8)の分子内環化を行うことにより、目的物質である本実施形態に係る直線型ナフトフルオレセイン(2)が77%の収率で得られる。以上により、5工程、トータル収率29%で、本実施形態に係るキサンテン様骨格を有する特定構造の化合物(直線型ナフトフルオレセイン(2))が選択的に合成できる。
【0043】
[呈色挙動]
一般に、フルオレセインは、キサンテン骨格にフェノール部位を含んでいるため、塩基性条件でアニオン種が生成した際に呈色及び蛍光を発するという性質を有している。本実施形態に係る直線型ナフトフルオレセイン(2)と、従来既知の逆U字型ナフトフルオレセイン(1)とを、水系で、pHを塩基性側の8.6から13.5まで変化させたときの呈色挙動を調べるため、UV−VIS測定を行った。その結果、従来のもの(1)は、図3に示すように、pH10.0から12.8までは、600nm(H2O)に吸収を示した。一方、本実施形態のもの(2)は、図4に示すように、pH10.6において吸収強度が最大となり、その吸収最大波長(λmax)は714nm(H2O)であった。これは、従来のもの(1)(λmax:600nm)に比べて110nm以上も、またフルオレセイン(λmax:493nm)に比べて220nm以上も長波長側に最大吸収を示すことになる。
【0044】
[発光挙動]
次に、本実施形態に係る直線型ナフトフルオレセイン(2)と、従来既知の逆U字型ナフトフルオレセイン(1)とについて、蛍光測定を行った。その結果、本実施形態のもの(2)は、図5に示すように、アミン程度の塩基性条件下において、近赤外領域(λ;700nm〜2500nm)に達するほどの長波長側に蛍光を発することが明らかとなった。その発光波長(λem)は768nm(H2O)であった。これは、従来のもの(1)(λem:656nm)に比べて110nm以上も、また図示していないがフルオレセイン(λem:510nm)に比べて250nm以上も長波長側にシフトしており近赤外領域に達していた。
【0045】
以上のことから、本実施形態に係る直線型ナフトフルオレセイン(2)は、フルオレセインに類似の構造を有し、水系で塩基に発光及び呈色応答し、近赤外領域で発光する、近赤外蛍光色素として十分に使用し得るものである。このような近赤外領域に吸収、発光波長を持つ蛍光色素は、生体イメージングに用いる色素として優れた性質を具備することになる。
【0046】
[用途]
したがって、本実施形態に係る直線型ナフトフルオレセイン(2)の用途として次のようなことが考えられる。生物学への適用として、細胞生物学や免疫組織学における細胞の標識及び追跡に好ましく使用し得る。蛍光顕微鏡やフローサイトメトリーにも用いられ得る。生物学的に活性のある抗体等の分子に本実施形態に係る直線型ナフトフルオレセイン(2)を付加することも考えられる。細胞内の特定のタンパク質や微細構造の標識の用途で用いられ得る。本実施形態に係る直線型ナフトフルオレセイン(2)のフェノール性水酸基部位に糖を結合すると蛍光が失われる(蛍光off)。そして、その誘導体を生体に投与して生体内で糖加水分解酵素によって前記結合が切断されると蛍光が復活する(蛍光on)。これは、糖加水分解酵素活性の検出プローブとして有用である。本実施形態に係るナフトフルオレセイン誘導体は、蛍光法による糖加水分解酵素活性のイメージング検査技術に使用し得る。つまり、糖加水分解酵素は、糖のグリコシド結合を加水分解する反応を触媒する消化酵素である。この消化酵素で、前記結合が切断されると、蛍光が復活し、蛍光ONとなり、蛍光が観察される。よって、糖加水分解酵素活性の有無が診断される。
【0047】
従来、フルオレセインを誘導体化した様々な蛍光プローブが利用されている。これらの手法を本実施形態に係る直線型のナフトフルオレセイン(2)に適用すれば、蛍光波長が768nm程度というような長波長側で発光する新たな蛍光プローブが得られる。このような蛍光プローブは、長波長の近赤外光が生体の奥深い部位まで到達するので、生体の奥深い部位での発光が実現し、例えば、全身の画像診断検査(画像診断方法)に適用することが可能となる。また、768nmの近赤外領域で発光する自家蛍光もないので、この本実施形態の直線型ナフトフルオレセイン(2)を用いた蛍光プローブないし画像診断方法は精度の高いものとなる。
【0048】
つまり、本実施形態に係る化合物(2)は、フルオレセインよりも258nm、既知のナフトフルオレセイン(1)よりも112nm、長波長側の近赤外領域で発光する。これにより、本実施形態に係る化合物(2)を画像診断ツールとして生体に用いる際、自家蛍光との重なりによる制限を受けることが低減し、画像診断がより正確に行える。
【実施例】
【0049】
以下、実施例を通して、本発明をさらに詳しく説明するが、本発明はこの実施例により限定されるものではない。
【0050】
<実施例1>
前記構造式(2)で示される直線型ナフトフルオレセインを図2に示される合成スキームに従って合成した。励起波長及び蛍光波長は、λex;714nm(H2O)、λem;768nm(H2O)であった。
【0051】
化合物(2):light blue solid; decomposition at 290oC; IR (KBr) 3423, 1736, 1637, 1506, 1441, 1346, 1290, 1178, 1147, 876, 756, 708 cm-1; 1H-NMR (270 MHz, CD3OD) δ 8.10 (dd, J = 6.5 Hz, 1.4 Hz, 1H), 7.85-7.74 (m, 2H), 7.57 (s, 2H), 7.55 (d, J = 8.9 Hz, 2H), 7.37 (dd, J = 6.6 Hz, 1.4 Hz, 1H), 7.30 (s, 2H), 7.10 (d, J = 2.4 Hz, 2H), 6.95 (dd, J = 8.9 Hz, 2.4 Hz, 2H); 13C-NMR (400 MHz, CD3OD) δ 172.3, 159.2, 155.0, 152.1, 138.8, 137.6, 132.3, 131.9, 129.4, 128.5, 127.3, 127.2, 126.1, 120.6, 120.0, 112.6, 109.3, 86.1; MS (EI) m/z (rel. intensity) = 432 (M+, 10), 388 (52), 371 (15), 284 (23), 241 (23), 213 (21), 185 (27), 129 (55), 73 (100); HRMS (EI) Calcd for C28H16O5 (M+) 432.0998, Found 432.0996.
【0052】
<実施例2>
下記構造式(9)で示される直線型ナフトフルオレセイン誘導体(ジブロモ体)を下記合成スキーム1に従って合成した。励起波長及び蛍光波長は、λex;731nm(H2O)、λem;785nm(H2O)であった。
【0053】
【化13】

【0054】
【化14】

【0055】
直線型ナフトフルオレセイン(2)(16.6mg、0.0384mmol)をN,N−ジメチルホルムアミド(0.8mL)に溶解し、N−ブロモスクシンイミド(14.3mg、0.0806mmol)のN,N−ジメチルホルムアミド(0.4mL)溶液を滴下し室温で6時間撹拌した。反応液を酢酸エチルに注ぎ入れ、水3回、飽和食塩水で洗浄し、無水硫酸ナトリウムで乾燥した。乾燥剤を濾別後、溶媒を減圧留去した。残渣をカラムクロマトグラフィー(ヘキサン:酢酸エチル=3:1)にて精製し、ジブロモ体(9)(12.7mg、収率56%)を得た。
【0056】
化合物(9):1H-NMR (270 MHz, CD3OD) δ 8.13-8.09 (m, 1H), 8.09 (s, 2H), 7.75-7.66 (m, 2H), 7.53 (d, J = 8.9 Hz, 2H), 7.41 (s, 2H), 7.36 (d, J = 1.1 Hz, 2H), 7.30-7.27 (m, 1H), 7.09 (dd, J = 8.9 Hz, 1.1 Hz, 2H).
【0057】
<実施例3>
下記構造式(10)で示される直線型ナフトフルオレセイン誘導体を下記合成スキーム2に従って合成した。励起波長及び蛍光波長は、λex;714nm(H2O)、λem;780nm(H2O)であった。
【0058】
【化15】

【0059】
【化16】

【0060】
窒素雰囲気下、図2に示される中間化合物(6)(626.8mg、1.92mmol)を無水THF(6mL)に溶解し、−78℃に冷却し、n−ブチルリチウム(1.6M n−ヘキサン溶液、1.23mL、2.00mmol)を10分間かけて滴下した。−78℃で50分間攪拌した後、化合物(11)(180.0mg、0.833mmol)の無水THF溶液(3mL)を15分間かけて滴下した。4時間攪拌を続け、自然に昇温し、室温に戻した。1M塩酸水(8mL)を加え5時間攪拌した。反応液を酢酸エチルに注ぎいれ、水2回、飽和食塩水で順次洗浄し、無水硫酸ナトリウムで乾燥した。乾燥剤を濾別後、溶媒を減圧留去した。残渣をカラムクロマトグラフィー(ヘキサン:酢酸エチル=7:1)及び分取シリカHPLC(ヘキサン:酢酸エチル=4:1)にて精製し、中間化合物(12)(170.3mg、収率29%)を透明オイルとして得た。次いで、中間化合物(12)(75.0mg、0.108mmol)を1,4−ジオキサン(1mL)に溶解し、4M HCl/1,4−ジオキサン(0.5mL、2.16mmol)を加え、13時間攪拌した。反応液中の溶媒を減圧留去した。残渣をカラムクロマトグラフィー(ヘキサン:酢酸エチル=4:1)にて精製し、テトラオール体(13)(33.0mg、収率59%)を得た。次いで、テトラオール体(13)(30.0mg、0.0579mmol)にトルエン(0.5mL)、メタンスルホン酸(0.1mL)を加え、60℃で1.5時間攪拌した。反応液を室温に戻し、酢酸エチルに注ぎいれ、水2回、飽和食塩水で順次洗浄し、無水硫酸ナトリウムで乾燥した。乾燥剤を濾別後、溶媒を減圧留去した。残渣をカラムクロマトグラフィー(トルエン:酢酸エチル=3:1)にて精製し、目的化合物(10)(8.7mg、収率30%)を得た。
【0061】
化合物(10):1H-NMR (270 MHz, CD3OD) δ 8.40 (s, 1H), 8.05 (d, J= 8.6 Hz, 1H), 7.56 (d, J = 8.9 Hz, 2H), 7.53 (s, 2H), 7.49 (d, J= 8.6 Hz, 1H), 7.33 (s, 2H), 7.08 (d, J= 2.4 Hz, 2H), 6.93 (dd, J = 8.9 Hz, 2.4 Hz, 2H).
【0062】
<実施例4>
下記構造式(14)で示される直線型ナフトフルオレセイン誘導体(モルホリノメチル体)を下記合成スキーム3に従って合成した。
【0063】
【化17】

【0064】
【化18】

【0065】
直線型ナフトフルオレセイン(2)(16.9mg、0.0391mmol)を酢酸に溶解し、38%ホルマリン(49.4μL、0.625mmol)及びモルホリン(54.4mg、0.625mmol)を加え、80℃で4時間攪拌した。反応液を酢酸エチルに注ぎ入れ、飽和炭酸水素ナトリウム水溶液、水、飽和食塩水で順次洗浄し、無水硫酸ナトリウムで乾燥した。乾燥剤を濾別後、溶媒を減圧留去した。残渣をカラムクロマトグラフィー(ヘキサン:酢酸エチル=1:2)にて精製し、モルホリノメチル体(14)(15.2mg、収率47%)を得た。
【0066】
化合物(14):1H-NMR (270 MHz, CD3OD) δ 8.13-8.09 (m, 1H), 7.70-7.66 (m, 2H), 7.69 (s, 2H), 7.50 (d, J = 9.2 Hz, 2H), 7.36 (s, 2H), 7.28-7.24 (m, 1H), 6.96 (d, J = 9.2 Hz, 2H), 4.15 (s, 4H), 3.82 (brs, 8H), 2.71 (brs, 8H).
【0067】
<実施例5>
下記構造式(15)で示される直線型ナフトフルオレセイン誘導体(テトラアセチル体)を下記合成スキーム4に従って合成した。
【0068】
【化19】

【0069】
【化20】

【0070】
モルホリノメチル体(14)(10.2mg、0.0162mmol)に酢酸(0.1mL)、無水酢酸(1.5mL)を加え、1時間還流した。反応液を室温に戻し、酢酸エチルに注ぎ入れ、飽和炭酸水素ナトリウム水溶液、水、飽和食塩水で洗浄し、無水硫酸ナトリウムで乾燥した。乾燥剤を濾別後、溶媒を減圧留去した。残渣をカラムクロマトグラフィー(ヘキサン:酢酸エチル=2:1)にて精製し、テトラアセチル体(15)(1.8mg、収率17%)を得た。
【0071】
化合物(15):1H-NMR (270 MHz, CDCl3) δ 8.12-8.09 (m, 1H), 8.06 (s, 2H), 7.73 (d, J= 9.2 Hz, 2H), 7.66-7.63 (m, 2H), 7.60 (s, 2H), 7.24-7.20 (m, 1H), 7.14 (d, J = 9.2 Hz, 2H), 5.57 (ABq, Δν = 10.0 Hz, JAB=12.4 Hz, 4H), 2.41 (s, 6H), 2.11 (s, 6H).
【0072】
<実施例6>
下記構造式(16)で示される直線型ナフトフルオレセイン誘導体(ジアセチル体)を下記合成スキーム5に従って合成した。
【0073】
【化21】

【0074】
【化22】

【0075】
直線型ナフトフルオレセイン(2)(20.0mg、0.0463mmol)に酢酸(0.3mL)、無水酢酸(0.4mL)を加え、80〜90℃で21時間、さらに8時間還流した。反応液を室温に戻し、酢酸エチルに注ぎ入れ、飽和炭酸水素ナトリウム水溶液、水、飽和食塩水で洗浄し、無水硫酸ナトリウムで乾燥した。乾燥剤を濾別後、溶媒を減圧留去した。残渣をカラムクロマトグラフィー(ヘキサン:酢酸エチル=3:1)にて精製し、ジアセチル体(16)(23.4mg、収率98%)を得た。
【0076】
化合物(16):1H-NMR (270 MHz, CDCl3) δ8.11-8.07 (m, 1H), 7.73 (s, 2H), 7.70 (d, J = 9.0 Hz, 2H), 7.65-7.61 (m, 2H), 7.57 (s, 2H), 7.56 (d, J = 2.4 Hz, 2H), 7.24-7.22 (m, 1H), 7.12 (dd, J = 9.0 Hz, 2.4 Hz, 2H), 2.35 (s, 6H).
【0077】
<実施例7>
下記構造式(17)で示される直線型ナフトフルオレセイン誘導体を下記合成スキーム6に従って合成した。励起波長及び蛍光波長は、λex;732nm(H2O)、λem;784nm(H2O)であった。
【0078】
【化23】

【0079】
【化24】

【0080】
窒素雰囲気下、図2に示される中間化合物(6)(626.8mg、1.92mmol)を無水THF(6mL)に溶解し、−78℃に冷却し、n−ブチルリチウム(1.6M n−ヘキサン溶液、1.23mL、2.00mmol)を10分間かけて滴下した。−78℃で50分間攪拌した後、化合物(11)(180.0mg、0.833mmol)の無水THF溶液(3mL)を15分間かけて滴下した。4時間攪拌を続け、自然に昇温し、室温に戻した。1M塩酸水(8mL)を加え5時間攪拌した。反応液を酢酸エチルに注ぎいれ、水2回、飽和食塩水で順次洗浄し、無水硫酸ナトリウムで乾燥した。乾燥剤を濾別後、溶媒を減圧留去した。残渣をカラムクロマトグラフィー(ヘキサン:酢酸エチル=7:1)及び分取シリカHPLC(ヘキサン:酢酸エチル=4:1)にて精製し、中間化合物(18)(120.1mg、収率21%)を得た。次いで、中間化合物(18)(88.0mg、0.127mmol)を1,4−ジオキサン(1mL)に溶解し、4M HCl/1,4−ジオキサン(0.6mL、2.53mmol)を加え、17時間攪拌した。反応液中の溶媒を減圧留去した。残渣をカラムクロマトグラフィー(ヘキサン:酢酸エチル=1:1)にて精製し、テトラオール体(19)(32.0mg、収率49%)を得た。次いで、テトラオール体(19)(24.2mg、0.0467mmol)にトルエン(1mL)、メタンスルホン酸(0.2mL)を加え、60℃で1.5時間攪拌した。反応液を室温に戻し、酢酸エチルに注ぎいれ、水2回、飽和食塩水で順次洗浄し、無水硫酸ナトリウムで乾燥した。乾燥剤を濾別後、溶媒を減圧留去した。残渣をカラムクロマトグラフィー(トルエン:酢酸エチル=3:1)にて精製し、目的化合物(17)(17.6mg、収率76%)を得た。
【0081】
化合物(17):1H-NMR (270 MHz, CD3OD) δ 8.18 (d, J = 8.1 Hz, 1H), 7.96 (d, J = 8.1 Hz, 1H), 7.59 (s, 1H), 7.46 (d, J = 8.9 Hz, 2H), 7.45 (s, 2H), 7.23 (s, 2H), 6.98 (d, J = 2.1 Hz, 2H), 6.84 (dd, J = 8.9 Hz, 2.1 Hz, 2H).
【0082】
<実施例8>
下記構造式(20)で示される直線型ナフトローダミン類を合成した。
【0083】
【化25】

【0084】
<実施例9>
下記構造式(21)で示される直線型ナフトフルオレセイン誘導体を合成した。
【0085】
【化26】

【0086】
<実施例10>
下記構造式(22)で示される直線型ナフトフルオレセイン誘導体を合成した。
【0087】
【化27】

【0088】
<実施例11>
下記構造式(23)で示される化合物を合成した。
【0089】
【化28】

【0090】
<実施例12>
下記構造式(24)で示される化合物を合成した。
【0091】
【化29】

【0092】
<実施例13>
下記構造式(25)で示される化合物を合成した。
【0093】
【化30】

【符号の説明】
【0094】
1 逆U字型ナフトフルオレセイン
2 直線型ナフトフルオレセイン
3 U字型ナフトフルオレセイン
4 L字型ナフトフルオレセイン
【技術分野】
【0001】
本発明は、近赤外領域に蛍光波長を有する近赤外蛍光色素、画像診断材料及び画像診断方法に関する。より詳しくは、キサンテン様骨格を有する特定構造の化合物を含む近赤外蛍光色素、この近赤外蛍光色素を含む画像診断材料、及び、この画像診断材料を用いて行う画像診断方法に関する。
【背景技術】
【0002】
従来、キサンテン骨格を有する構造のフルオレセインやローダミン等は、蛍光色素として知られている。特にフルオレセインは、例えば非特許文献1に記載されているように、生体イメージングの画像診断ツールとして様々な誘導体が合成され、実用化されている。
【0003】
フルオレセインやローダミン等の励起波長及び蛍光波長は、水中で500nm前後である。例えばフルオレセインの励起波長及び蛍光波長は、λex;493nm(H2O)、λem;510nm(H2O)である。このような蛍光波長を有するフルオレセインを生体イメージングの画像診断ツールとして用いる場合、生体の自家蛍光との重なりによって使用が制限されるという不具合がある。つまり、蛍光色素の蛍光波長が、生体内に存在する細胞自身が有するポルフィリン等の生体内物質(蛍光性物質)の蛍光波長と重なり合い、状況によっては生体イメージングツールとして良好に使用できない場合がある。
【0004】
そこで、このような不具合に対処するために、より長波長領域で励起し発光する色素、すなわち近赤外蛍光色素を用いることが行われている。そのような、蛍光波長がより長波長側にシフトした近赤外蛍光色素においては、生体内物質自体が吸収を持たないので、自家蛍光との重なりの不具合が解消されて画像診断がより正確に行えるうえに、長波長の近赤外光が生体組織のより深い部位まで到達するので、可視化が困難な生体組織の深部の状態観察が可能となる。また、生体へのダメージが軽減するという利点もある。
【0005】
従来、フルオレセインよりも長波長側に発光を示す蛍光色素が種々知られている。それらのうちの代表的なものの1つに、下記構造式(1)で示されるように、フルオレセインのキサンテン骨格の両側にベンゼン環を1つずつ付加した構造の化合物が知られている。この化合物(1)は、2つのベンゼン環の縮合位置がキサンテンの[c、h]である逆U字型ナフトフルオレセインである(特許文献1参照)。この従来既知のナフトフルオレセイン(1)は、フルオレセインに比べて共役系が伸びた分だけ、蛍光波長が長波長側へシフトすることが予測される。事実、この化合物(1)の励起波長及び蛍光波長は、λex;600nm(H2O)、λem;656nm(H2O)である。フルオレセインの蛍光波長(λem;510nm)よりも146nm程度長波長側にシフトしている。しかしながら、バックグラウンドの蛍光強度に影響されない、精度のよい良好な生体イメージングを実行するためにはまだ十分とはいえず、蛍光を利用した生体内画像診断精度のさらなる向上のためには、なお一層の長波長側へのシフトが望まれているのが現状である。
【0006】
【化1】

【先行技術文献】
【非特許文献】
【0007】
【非特許文献1】生体イメージングを目指した近赤外蛍光プローブの開発研究 小島宏建/YAKUGAKU ZASSHI 128(11)1653−1663(2008)/The Pharmaceutical Society of Japan
【特許文献】
【0008】
【特許文献1】特許第3955638号公報(請求項7、第12頁)
【発明の概要】
【発明が解決しようとする課題】
【0009】
したがって、本発明の目的は、従来知られているフルオレセインや逆U字型ナフトフルオレセイン(1)よりもさらに長波長側に蛍光波長を有する近赤外蛍光色素を提供し、併せて、そのような近赤外蛍光色素を含む画像診断材料(すなわち画像診断ツールあるいは生体イメージングツール)と、そのような画像診断材料を用いて行う画像診断方法とを提供することである。
【課題を解決するための手段】
【0010】
本発明の一局面は、下記一般式(I)で示される化合物と、下記一般式(II)で示される化合物と、下記一般式(III)で示される化合物と、下記一般式(IV)で示される化合物と、下記一般式(V)で示される化合物とからなる群より選ばれる少なくとも1つの化合物を含む近赤外蛍光色素である。
【0011】
【化2】

【0012】
【化3】

【0013】
【化4】

【0014】
【化5】

【0015】
【化6】

【0016】
なお、式中、Xは、酸素原子又はケイ素原子であり;Yは、複数ある場合はそれぞれ独立して、OH、OR1又はNR2R3であり;Z1は、複数ある場合はそれぞれ独立して、水素原子、ハロゲン原子(F、Cl、BrもしくはI)、炭素数が1〜5の一部もしくは全部がNR2R3で置換されたもしくは無置換のアルキル基又は炭素数が1〜5の一部もしくは全部がOR4で置換されたもしくは無置換のアルキル基であり;Z2は、複数ある場合はそれぞれ独立して、水素原子又はハロゲン原子(F、Cl、BrもしくはI)であり;Z3、Z4は、それぞれ独立して、水素原子、NR2R3、OR4又は炭素数が1〜5の一部もしくは全部がハロゲン原子(F、Cl、BrもしくはI)で置換されたもしくは無置換のアルキル基である。また、前記において、R1は、複数ある場合はそれぞれ独立して、アシル基、糖残基又は芳香族化合物であり;R2、R3は、それぞれ独立して、水素原子又は炭素数が1〜5の一部もしくは全部が置換されたもしくは無置換のアルキル基であり;R4は、複数ある場合はそれぞれ独立して、水素原子又は炭素数が1〜5の一部もしくは全部が置換されたもしくは無置換のアルキル基である。
【0017】
前記一般式(I)及び(II)において、Xは酸素原子であり、YはそれぞれOHであり、Z1、Z2、Z3及びZ4はそれぞれ水素原子であることが好ましい。
【0018】
本発明の他の一局面は、前記近赤外蛍光色素を含む画像診断材料である。
【0019】
本発明のさらに他の一局面は、前記画像診断材料を用いて行う画像診断方法である。
【発明の効果】
【0020】
本発明によれば、近赤外領域に蛍光波長を有する新規な近赤外蛍光色素、この近赤外蛍光色素を含む画像診断材料、及び、この画像診断材料を用いて行う画像診断方法が提供される。
【図面の簡単な説明】
【0021】
【図1】本発明の実施形態に係る直線型ナフトフルオレセインの合成スキームである。
【図2】別の合成スキームである。
【図3】従来既知の逆U字型ナフトフルオレセインの呈色挙動の説明図である。
【図4】本発明の実施形態に係る直線型ナフトフルオレセインの呈色挙動の説明図である。
【図5】本発明の実施形態に係る直線型ナフトフルオレセインの発光挙動及び従来既知の逆U字型ナフトフルオレセインの発光挙動の説明図である。
【発明を実施するための形態】
【0022】
本発明者等は、フルオレセインのキサンテン骨格の両側にベンゼン環を1つずつ付加した構造のナフトフルオレセインのなかでも、下記構造式(2)で示されるように、2つのベンゼン環の縮合位置がキサンテンの[b、i]である直線型ナフトフルオレセイン(2)が、従来知られているフルオレセインや逆U字型ナフトフルオレセイン(1)よりもさらに長波長側に蛍光波長を有することを見出して本発明を完成した。
【0023】
【化7】

【0024】
この直線型ナフトフルオレセイン(2)の励起波長及び蛍光波長は、後に詳しく述べるように、λex;714nm(H2O)、λem;768nm(H2O)である。フルオレセインの蛍光波長(λem;510nm)よりも258nm程度長波長側にシフトしている。また、従来既知の逆U字型ナフトフルオレセイン(1)の蛍光波長(λem;656nm)と比べても112nm程度長波長側にシフトしている。この直線型ナフトフルオレセイン(2)の蛍光波長(λem;768nm)は近赤外領域(λ;700nm〜2500nm)の中にある。また、この直線型ナフトフルオレセイン(2)は新規化合物である。
【0025】
一般に、近赤外光は、生体組織のより深い部位まで到達するので、前記直線型ナフトフルオレセイン(2)を含む画像診断材料(すなわち画像診断ツールあるいは生体イメージングツール)を用いれば、生体組織のより深い部位の状態観察が可能な画像診断検査(画像診断方法)が実現し得る。また、700nmを超える波長領域は、ポルフィリン等の生体内物質が発光しない波長領域であるから、生体の自家蛍光の影響を受けることが回避される。そのため、本実施形態に係る近赤外蛍光色素で標識された薬剤(画像診断材料)を被検者に投与し、特定の波長帯域を有する励起光を生体内に照射し、その際に生体内で近赤外蛍光色素で標識された薬剤が発する蛍光の像を撮り、この蛍光画像を観察することによって、生体内の正常部位及び病変部位を判別する蛍光観察(画像診断)が可能となる。
【0026】
この直線型ナフトフルオレセイン(2)を基本骨格とし、様々な直線型ナフトフルオレセイン誘導体あるいは直線型ナフトローダミン誘導体を合成して、現在用いられているフルオレセイン型プローブやローダミン型プローブに適応すれば、原理的に全てのフルオレセイン型プローブ及びローダミン型プローブの近赤外発光化が可能となる。
【0027】
以上のことから、本実施形態に係る近赤外蛍光色素は、下記一般式(I)で示される化合物と、下記一般式(II)で示される化合物と、下記一般式(III)で示される化合物と、下記一般式(IV)で示される化合物と、下記一般式(V)で示される化合物とからなる群より選ばれる少なくとも1つの化合物(キサンテン様骨格を有する特定構造の化合物)を含むものである。
【0028】
【化8】

【0029】
【化9】

【0030】
【化10】

【0031】
【化11】

【0032】
【化12】

【0033】
なお、式中、Xは、酸素原子又はケイ素原子であり;Yは、複数ある場合はそれぞれ独立して、OH、OR1又はNR2R3であり;Z1は、複数ある場合はそれぞれ独立して、水素原子、ハロゲン原子(F、Cl、BrもしくはI)、炭素数が1〜5の一部もしくは全部がNR2R3で置換されたもしくは無置換のアルキル基又は炭素数が1〜5の一部もしくは全部がOR4で置換されたもしくは無置換のアルキル基であり;Z2は、複数ある場合はそれぞれ独立して、水素原子又はハロゲン原子(F、Cl、BrもしくはI)であり;Z3、Z4は、それぞれ独立して、水素原子、NR2R3、OR4又は炭素数が1〜5の一部もしくは全部がハロゲン原子(F、Cl、BrもしくはI)で置換されたもしくは無置換のアルキル基である。また、前記において、R1は、複数ある場合はそれぞれ独立して、アシル基、糖残基又は芳香族化合物であり;R2、R3は、それぞれ独立して、水素原子又は炭素数が1〜5の一部もしくは全部が置換されたもしくは無置換のアルキル基であり;R4は、複数ある場合はそれぞれ独立して、水素原子又は炭素数が1〜5の一部もしくは全部が置換されたもしくは無置換のアルキル基である。
【0034】
前記一般式(I)〜(V)で示される化合物は、前記直線型ナフトフルオレセイン(2)を基本骨格としているため、蛍光波長が長波長側にシフトしている。その結果、本実施形態に係る近赤外蛍光色素は、前記一般式(I)〜(V)で示される化合物のうちの少なくとも1つの化合物を含むものであるから、従来知られているフルオレセインや逆U字型ナフトフルオレセイン(1)よりもさらに長波長側に蛍光波長を有する。本実施形態に係る近赤外蛍光色素は、適応範囲が極めて広く、広範な産業上の利用可能性が期待される。
【0035】
なお、一般式(I)の少なくとも一方のYがOHである場合は、一般式(I)で示される化合物は一般式(II)で示される化合物と互変異性の関係にある。この場合において、一般式(II)で示される化合物は、周辺の環境(pHや塩基等)に応じて、一般式(I)で示される化合物から変異し、長波長側にシフトした蛍光の発現に寄与するものと考えられる。また、一般式(I)の少なくとも一方のYがNR2R3である場合は、一般式(I)で示される化合物は一般式(IV)で示される化合物と互変異性の関係にある。この場合においても、一般式(IV)で示される化合物は、周辺の環境(pHや塩基等)に応じて、一般式(I)で示される化合物から変異し、長波長側にシフトした蛍光の発現に寄与するものと考えられる。一方、一般式(III)で示される化合物は、一般式(II)で示される化合物においてCOOHを水素原子に置換した、一般式(II)に類似構造の化合物である。また、一般式(V)で示される化合物は、一般式(IV)で示される化合物においてCOO−を水素原子に置換した、一般式(IV)に類似構造の化合物である。
【0036】
前記一般式(I)、(II)で示される化合物のうち、Xが酸素原子であり、YがそれぞれOHであり、Z1、Z2、Z3及びZ4がそれぞれ水素原子である化合物は、前記直線型ナフトフルオレセイン(2)である。
【0037】
前記一般式(I)、(IV)で示される化合物のうち、Xが酸素原子であり、YがそれぞれNR2R3であり、Z1、Z2、Z3及びZ4がそれぞれ水素原子である化合物は、直線型ナフトローダミン類である。
【0038】
前記一般式(I)〜(V)で示される化合物のうち、Xがケイ素原子である化合物は、蛍光波長がさらに長波長側にシフトする。
【0039】
前記一般式(I)〜(V)で示される化合物のうちの少なくとも1つの化合物を含む近赤外蛍光色素を含む画像診断材料は、生体の自家蛍光との重なりによって使用が制限されるという不具合が解消され、生体イメージングの画像診断ツールとして極めて有用である。
【0040】
前記一般式(I)〜(V)で示される化合物のうちの少なくとも1つの化合物を含む近赤外蛍光色素を含む画像診断材料を用いて行う画像診断方法は、生体組織のより深い部位の状態観察が可能となり、例えば、全身に適用し得る画像診断方法である。
【0041】
[合成スキーム]
本実施形態に係る直線型ナフトフルオレセイン(2)は、フルオレセインの合成と同様、図1に示すように、2,7−ジヒドロキシナフタレンと無水フタル酸とを酸性条件下(例えば反応触媒としてのスルホン酸や塩化亜鉛の存在下)で反応させることにより合成することができる。一例として、メタンスルホン酸中、100℃で反応を行ったところ、本実施形態に係る直線型の化合物(2)の他に、2つのベンゼン環の縮合位置がキサンテンの[a、j]であるU字型ナフトフルオレセイン(3)と、2つのベンゼン環の縮合位置がキサンテンの[a、i]であるL字型ナフトフルオレセイン(4)とが構造異性体として得られ、この混合物を順相及び逆相クロマトグラフィー及び分取用TLCを組み合わせて精製することにより3種類の化合物(2)、(3)、(4)を単離することができた。収率は、直線型(2)が1%、U字型(3)が5%、L字型(4)が3%であった。
【0042】
他の改善された合成スキームを説明する。図2に示すように、まず、2,7−ジヒドロキシナフタレンの3位への臭素化を行う。酢酸中、臭素を作用させることにより、ジブロモ体へと導き、その後、スズを添加して加温することにより、1位の臭素を選択的に脱離させることにより、3−ブロモナフタレン−2,7−ジオール(5)が83%の収率で得られる。次いで、2つのフェノール性水酸基をメトキシメチル(MOM)基で保護する。このとき、強塩基である水素化ナトリウム(NaH)を用いることにより、反応は速やかに進行し、中間化合物(6)が定量的に得られる。次いで、中間化合物(6)にn−ブチルリチウムを作用させることにより、3位をリチオ化した後、無水フタル酸と反応させ、塩酸によりラクトン骨格を構築することにより、中間化合物(7)が62%の収率で得られる。次いで、中間化合物(7)の4つのメトキシメチル(MOM)基を塩酸で脱保護することにより、テトラオール体(8)が73%の収率で得られる。そして、メタンスルホン酸を用いてテトラオール体(8)の分子内環化を行うことにより、目的物質である本実施形態に係る直線型ナフトフルオレセイン(2)が77%の収率で得られる。以上により、5工程、トータル収率29%で、本実施形態に係るキサンテン様骨格を有する特定構造の化合物(直線型ナフトフルオレセイン(2))が選択的に合成できる。
【0043】
[呈色挙動]
一般に、フルオレセインは、キサンテン骨格にフェノール部位を含んでいるため、塩基性条件でアニオン種が生成した際に呈色及び蛍光を発するという性質を有している。本実施形態に係る直線型ナフトフルオレセイン(2)と、従来既知の逆U字型ナフトフルオレセイン(1)とを、水系で、pHを塩基性側の8.6から13.5まで変化させたときの呈色挙動を調べるため、UV−VIS測定を行った。その結果、従来のもの(1)は、図3に示すように、pH10.0から12.8までは、600nm(H2O)に吸収を示した。一方、本実施形態のもの(2)は、図4に示すように、pH10.6において吸収強度が最大となり、その吸収最大波長(λmax)は714nm(H2O)であった。これは、従来のもの(1)(λmax:600nm)に比べて110nm以上も、またフルオレセイン(λmax:493nm)に比べて220nm以上も長波長側に最大吸収を示すことになる。
【0044】
[発光挙動]
次に、本実施形態に係る直線型ナフトフルオレセイン(2)と、従来既知の逆U字型ナフトフルオレセイン(1)とについて、蛍光測定を行った。その結果、本実施形態のもの(2)は、図5に示すように、アミン程度の塩基性条件下において、近赤外領域(λ;700nm〜2500nm)に達するほどの長波長側に蛍光を発することが明らかとなった。その発光波長(λem)は768nm(H2O)であった。これは、従来のもの(1)(λem:656nm)に比べて110nm以上も、また図示していないがフルオレセイン(λem:510nm)に比べて250nm以上も長波長側にシフトしており近赤外領域に達していた。
【0045】
以上のことから、本実施形態に係る直線型ナフトフルオレセイン(2)は、フルオレセインに類似の構造を有し、水系で塩基に発光及び呈色応答し、近赤外領域で発光する、近赤外蛍光色素として十分に使用し得るものである。このような近赤外領域に吸収、発光波長を持つ蛍光色素は、生体イメージングに用いる色素として優れた性質を具備することになる。
【0046】
[用途]
したがって、本実施形態に係る直線型ナフトフルオレセイン(2)の用途として次のようなことが考えられる。生物学への適用として、細胞生物学や免疫組織学における細胞の標識及び追跡に好ましく使用し得る。蛍光顕微鏡やフローサイトメトリーにも用いられ得る。生物学的に活性のある抗体等の分子に本実施形態に係る直線型ナフトフルオレセイン(2)を付加することも考えられる。細胞内の特定のタンパク質や微細構造の標識の用途で用いられ得る。本実施形態に係る直線型ナフトフルオレセイン(2)のフェノール性水酸基部位に糖を結合すると蛍光が失われる(蛍光off)。そして、その誘導体を生体に投与して生体内で糖加水分解酵素によって前記結合が切断されると蛍光が復活する(蛍光on)。これは、糖加水分解酵素活性の検出プローブとして有用である。本実施形態に係るナフトフルオレセイン誘導体は、蛍光法による糖加水分解酵素活性のイメージング検査技術に使用し得る。つまり、糖加水分解酵素は、糖のグリコシド結合を加水分解する反応を触媒する消化酵素である。この消化酵素で、前記結合が切断されると、蛍光が復活し、蛍光ONとなり、蛍光が観察される。よって、糖加水分解酵素活性の有無が診断される。
【0047】
従来、フルオレセインを誘導体化した様々な蛍光プローブが利用されている。これらの手法を本実施形態に係る直線型のナフトフルオレセイン(2)に適用すれば、蛍光波長が768nm程度というような長波長側で発光する新たな蛍光プローブが得られる。このような蛍光プローブは、長波長の近赤外光が生体の奥深い部位まで到達するので、生体の奥深い部位での発光が実現し、例えば、全身の画像診断検査(画像診断方法)に適用することが可能となる。また、768nmの近赤外領域で発光する自家蛍光もないので、この本実施形態の直線型ナフトフルオレセイン(2)を用いた蛍光プローブないし画像診断方法は精度の高いものとなる。
【0048】
つまり、本実施形態に係る化合物(2)は、フルオレセインよりも258nm、既知のナフトフルオレセイン(1)よりも112nm、長波長側の近赤外領域で発光する。これにより、本実施形態に係る化合物(2)を画像診断ツールとして生体に用いる際、自家蛍光との重なりによる制限を受けることが低減し、画像診断がより正確に行える。
【実施例】
【0049】
以下、実施例を通して、本発明をさらに詳しく説明するが、本発明はこの実施例により限定されるものではない。
【0050】
<実施例1>
前記構造式(2)で示される直線型ナフトフルオレセインを図2に示される合成スキームに従って合成した。励起波長及び蛍光波長は、λex;714nm(H2O)、λem;768nm(H2O)であった。
【0051】
化合物(2):light blue solid; decomposition at 290oC; IR (KBr) 3423, 1736, 1637, 1506, 1441, 1346, 1290, 1178, 1147, 876, 756, 708 cm-1; 1H-NMR (270 MHz, CD3OD) δ 8.10 (dd, J = 6.5 Hz, 1.4 Hz, 1H), 7.85-7.74 (m, 2H), 7.57 (s, 2H), 7.55 (d, J = 8.9 Hz, 2H), 7.37 (dd, J = 6.6 Hz, 1.4 Hz, 1H), 7.30 (s, 2H), 7.10 (d, J = 2.4 Hz, 2H), 6.95 (dd, J = 8.9 Hz, 2.4 Hz, 2H); 13C-NMR (400 MHz, CD3OD) δ 172.3, 159.2, 155.0, 152.1, 138.8, 137.6, 132.3, 131.9, 129.4, 128.5, 127.3, 127.2, 126.1, 120.6, 120.0, 112.6, 109.3, 86.1; MS (EI) m/z (rel. intensity) = 432 (M+, 10), 388 (52), 371 (15), 284 (23), 241 (23), 213 (21), 185 (27), 129 (55), 73 (100); HRMS (EI) Calcd for C28H16O5 (M+) 432.0998, Found 432.0996.
【0052】
<実施例2>
下記構造式(9)で示される直線型ナフトフルオレセイン誘導体(ジブロモ体)を下記合成スキーム1に従って合成した。励起波長及び蛍光波長は、λex;731nm(H2O)、λem;785nm(H2O)であった。
【0053】
【化13】

【0054】
【化14】

【0055】
直線型ナフトフルオレセイン(2)(16.6mg、0.0384mmol)をN,N−ジメチルホルムアミド(0.8mL)に溶解し、N−ブロモスクシンイミド(14.3mg、0.0806mmol)のN,N−ジメチルホルムアミド(0.4mL)溶液を滴下し室温で6時間撹拌した。反応液を酢酸エチルに注ぎ入れ、水3回、飽和食塩水で洗浄し、無水硫酸ナトリウムで乾燥した。乾燥剤を濾別後、溶媒を減圧留去した。残渣をカラムクロマトグラフィー(ヘキサン:酢酸エチル=3:1)にて精製し、ジブロモ体(9)(12.7mg、収率56%)を得た。
【0056】
化合物(9):1H-NMR (270 MHz, CD3OD) δ 8.13-8.09 (m, 1H), 8.09 (s, 2H), 7.75-7.66 (m, 2H), 7.53 (d, J = 8.9 Hz, 2H), 7.41 (s, 2H), 7.36 (d, J = 1.1 Hz, 2H), 7.30-7.27 (m, 1H), 7.09 (dd, J = 8.9 Hz, 1.1 Hz, 2H).
【0057】
<実施例3>
下記構造式(10)で示される直線型ナフトフルオレセイン誘導体を下記合成スキーム2に従って合成した。励起波長及び蛍光波長は、λex;714nm(H2O)、λem;780nm(H2O)であった。
【0058】
【化15】

【0059】
【化16】

【0060】
窒素雰囲気下、図2に示される中間化合物(6)(626.8mg、1.92mmol)を無水THF(6mL)に溶解し、−78℃に冷却し、n−ブチルリチウム(1.6M n−ヘキサン溶液、1.23mL、2.00mmol)を10分間かけて滴下した。−78℃で50分間攪拌した後、化合物(11)(180.0mg、0.833mmol)の無水THF溶液(3mL)を15分間かけて滴下した。4時間攪拌を続け、自然に昇温し、室温に戻した。1M塩酸水(8mL)を加え5時間攪拌した。反応液を酢酸エチルに注ぎいれ、水2回、飽和食塩水で順次洗浄し、無水硫酸ナトリウムで乾燥した。乾燥剤を濾別後、溶媒を減圧留去した。残渣をカラムクロマトグラフィー(ヘキサン:酢酸エチル=7:1)及び分取シリカHPLC(ヘキサン:酢酸エチル=4:1)にて精製し、中間化合物(12)(170.3mg、収率29%)を透明オイルとして得た。次いで、中間化合物(12)(75.0mg、0.108mmol)を1,4−ジオキサン(1mL)に溶解し、4M HCl/1,4−ジオキサン(0.5mL、2.16mmol)を加え、13時間攪拌した。反応液中の溶媒を減圧留去した。残渣をカラムクロマトグラフィー(ヘキサン:酢酸エチル=4:1)にて精製し、テトラオール体(13)(33.0mg、収率59%)を得た。次いで、テトラオール体(13)(30.0mg、0.0579mmol)にトルエン(0.5mL)、メタンスルホン酸(0.1mL)を加え、60℃で1.5時間攪拌した。反応液を室温に戻し、酢酸エチルに注ぎいれ、水2回、飽和食塩水で順次洗浄し、無水硫酸ナトリウムで乾燥した。乾燥剤を濾別後、溶媒を減圧留去した。残渣をカラムクロマトグラフィー(トルエン:酢酸エチル=3:1)にて精製し、目的化合物(10)(8.7mg、収率30%)を得た。
【0061】
化合物(10):1H-NMR (270 MHz, CD3OD) δ 8.40 (s, 1H), 8.05 (d, J= 8.6 Hz, 1H), 7.56 (d, J = 8.9 Hz, 2H), 7.53 (s, 2H), 7.49 (d, J= 8.6 Hz, 1H), 7.33 (s, 2H), 7.08 (d, J= 2.4 Hz, 2H), 6.93 (dd, J = 8.9 Hz, 2.4 Hz, 2H).
【0062】
<実施例4>
下記構造式(14)で示される直線型ナフトフルオレセイン誘導体(モルホリノメチル体)を下記合成スキーム3に従って合成した。
【0063】
【化17】

【0064】
【化18】

【0065】
直線型ナフトフルオレセイン(2)(16.9mg、0.0391mmol)を酢酸に溶解し、38%ホルマリン(49.4μL、0.625mmol)及びモルホリン(54.4mg、0.625mmol)を加え、80℃で4時間攪拌した。反応液を酢酸エチルに注ぎ入れ、飽和炭酸水素ナトリウム水溶液、水、飽和食塩水で順次洗浄し、無水硫酸ナトリウムで乾燥した。乾燥剤を濾別後、溶媒を減圧留去した。残渣をカラムクロマトグラフィー(ヘキサン:酢酸エチル=1:2)にて精製し、モルホリノメチル体(14)(15.2mg、収率47%)を得た。
【0066】
化合物(14):1H-NMR (270 MHz, CD3OD) δ 8.13-8.09 (m, 1H), 7.70-7.66 (m, 2H), 7.69 (s, 2H), 7.50 (d, J = 9.2 Hz, 2H), 7.36 (s, 2H), 7.28-7.24 (m, 1H), 6.96 (d, J = 9.2 Hz, 2H), 4.15 (s, 4H), 3.82 (brs, 8H), 2.71 (brs, 8H).
【0067】
<実施例5>
下記構造式(15)で示される直線型ナフトフルオレセイン誘導体(テトラアセチル体)を下記合成スキーム4に従って合成した。
【0068】
【化19】

【0069】
【化20】

【0070】
モルホリノメチル体(14)(10.2mg、0.0162mmol)に酢酸(0.1mL)、無水酢酸(1.5mL)を加え、1時間還流した。反応液を室温に戻し、酢酸エチルに注ぎ入れ、飽和炭酸水素ナトリウム水溶液、水、飽和食塩水で洗浄し、無水硫酸ナトリウムで乾燥した。乾燥剤を濾別後、溶媒を減圧留去した。残渣をカラムクロマトグラフィー(ヘキサン:酢酸エチル=2:1)にて精製し、テトラアセチル体(15)(1.8mg、収率17%)を得た。
【0071】
化合物(15):1H-NMR (270 MHz, CDCl3) δ 8.12-8.09 (m, 1H), 8.06 (s, 2H), 7.73 (d, J= 9.2 Hz, 2H), 7.66-7.63 (m, 2H), 7.60 (s, 2H), 7.24-7.20 (m, 1H), 7.14 (d, J = 9.2 Hz, 2H), 5.57 (ABq, Δν = 10.0 Hz, JAB=12.4 Hz, 4H), 2.41 (s, 6H), 2.11 (s, 6H).
【0072】
<実施例6>
下記構造式(16)で示される直線型ナフトフルオレセイン誘導体(ジアセチル体)を下記合成スキーム5に従って合成した。
【0073】
【化21】

【0074】
【化22】

【0075】
直線型ナフトフルオレセイン(2)(20.0mg、0.0463mmol)に酢酸(0.3mL)、無水酢酸(0.4mL)を加え、80〜90℃で21時間、さらに8時間還流した。反応液を室温に戻し、酢酸エチルに注ぎ入れ、飽和炭酸水素ナトリウム水溶液、水、飽和食塩水で洗浄し、無水硫酸ナトリウムで乾燥した。乾燥剤を濾別後、溶媒を減圧留去した。残渣をカラムクロマトグラフィー(ヘキサン:酢酸エチル=3:1)にて精製し、ジアセチル体(16)(23.4mg、収率98%)を得た。
【0076】
化合物(16):1H-NMR (270 MHz, CDCl3) δ8.11-8.07 (m, 1H), 7.73 (s, 2H), 7.70 (d, J = 9.0 Hz, 2H), 7.65-7.61 (m, 2H), 7.57 (s, 2H), 7.56 (d, J = 2.4 Hz, 2H), 7.24-7.22 (m, 1H), 7.12 (dd, J = 9.0 Hz, 2.4 Hz, 2H), 2.35 (s, 6H).
【0077】
<実施例7>
下記構造式(17)で示される直線型ナフトフルオレセイン誘導体を下記合成スキーム6に従って合成した。励起波長及び蛍光波長は、λex;732nm(H2O)、λem;784nm(H2O)であった。
【0078】
【化23】

【0079】
【化24】

【0080】
窒素雰囲気下、図2に示される中間化合物(6)(626.8mg、1.92mmol)を無水THF(6mL)に溶解し、−78℃に冷却し、n−ブチルリチウム(1.6M n−ヘキサン溶液、1.23mL、2.00mmol)を10分間かけて滴下した。−78℃で50分間攪拌した後、化合物(11)(180.0mg、0.833mmol)の無水THF溶液(3mL)を15分間かけて滴下した。4時間攪拌を続け、自然に昇温し、室温に戻した。1M塩酸水(8mL)を加え5時間攪拌した。反応液を酢酸エチルに注ぎいれ、水2回、飽和食塩水で順次洗浄し、無水硫酸ナトリウムで乾燥した。乾燥剤を濾別後、溶媒を減圧留去した。残渣をカラムクロマトグラフィー(ヘキサン:酢酸エチル=7:1)及び分取シリカHPLC(ヘキサン:酢酸エチル=4:1)にて精製し、中間化合物(18)(120.1mg、収率21%)を得た。次いで、中間化合物(18)(88.0mg、0.127mmol)を1,4−ジオキサン(1mL)に溶解し、4M HCl/1,4−ジオキサン(0.6mL、2.53mmol)を加え、17時間攪拌した。反応液中の溶媒を減圧留去した。残渣をカラムクロマトグラフィー(ヘキサン:酢酸エチル=1:1)にて精製し、テトラオール体(19)(32.0mg、収率49%)を得た。次いで、テトラオール体(19)(24.2mg、0.0467mmol)にトルエン(1mL)、メタンスルホン酸(0.2mL)を加え、60℃で1.5時間攪拌した。反応液を室温に戻し、酢酸エチルに注ぎいれ、水2回、飽和食塩水で順次洗浄し、無水硫酸ナトリウムで乾燥した。乾燥剤を濾別後、溶媒を減圧留去した。残渣をカラムクロマトグラフィー(トルエン:酢酸エチル=3:1)にて精製し、目的化合物(17)(17.6mg、収率76%)を得た。
【0081】
化合物(17):1H-NMR (270 MHz, CD3OD) δ 8.18 (d, J = 8.1 Hz, 1H), 7.96 (d, J = 8.1 Hz, 1H), 7.59 (s, 1H), 7.46 (d, J = 8.9 Hz, 2H), 7.45 (s, 2H), 7.23 (s, 2H), 6.98 (d, J = 2.1 Hz, 2H), 6.84 (dd, J = 8.9 Hz, 2.1 Hz, 2H).
【0082】
<実施例8>
下記構造式(20)で示される直線型ナフトローダミン類を合成した。
【0083】
【化25】

【0084】
<実施例9>
下記構造式(21)で示される直線型ナフトフルオレセイン誘導体を合成した。
【0085】
【化26】

【0086】
<実施例10>
下記構造式(22)で示される直線型ナフトフルオレセイン誘導体を合成した。
【0087】
【化27】

【0088】
<実施例11>
下記構造式(23)で示される化合物を合成した。
【0089】
【化28】

【0090】
<実施例12>
下記構造式(24)で示される化合物を合成した。
【0091】
【化29】

【0092】
<実施例13>
下記構造式(25)で示される化合物を合成した。
【0093】
【化30】

【符号の説明】
【0094】
1 逆U字型ナフトフルオレセイン
2 直線型ナフトフルオレセイン
3 U字型ナフトフルオレセイン
4 L字型ナフトフルオレセイン
【特許請求の範囲】
【請求項1】
下記一般式(I)で示される化合物と、下記一般式(II)で示される化合物と、下記一般式(III)で示される化合物と、下記一般式(IV)で示される化合物と、下記一般式(V)で示される化合物とからなる群より選ばれる少なくとも1つの化合物を含む近赤外蛍光色素。
【化1】

【化2】

【化3】

【化4】

【化5】

[式中、Xは、酸素原子又はケイ素原子であり;Yは、複数ある場合はそれぞれ独立して、OH、OR1又はNR2R3であり;Z1は、複数ある場合はそれぞれ独立して、水素原子、ハロゲン原子(F、Cl、BrもしくはI)、炭素数が1〜5の一部もしくは全部がNR2R3で置換されたもしくは無置換のアルキル基又は炭素数が1〜5の一部もしくは全部がOR4で置換されたもしくは無置換のアルキル基であり;Z2は、複数ある場合はそれぞれ独立して、水素原子又はハロゲン原子(F、Cl、BrもしくはI)であり;Z3、Z4は、それぞれ独立して、水素原子、NR2R3、OR4又は炭素数が1〜5の一部もしくは全部がハロゲン原子(F、Cl、BrもしくはI)で置換されたもしくは無置換のアルキル基である。前記において、R1は、複数ある場合はそれぞれ独立して、アシル基、糖残基又は芳香族化合物であり;R2、R3は、それぞれ独立して、水素原子又は炭素数が1〜5の一部もしくは全部が置換されたもしくは無置換のアルキル基であり;R4は、複数ある場合はそれぞれ独立して、水素原子又は炭素数が1〜5の一部もしくは全部が置換されたもしくは無置換のアルキル基である。]
【請求項2】
前記一般式(I)及び(II)において、Xは酸素原子であり、YはそれぞれOHであり、Z1、Z2、Z3及びZ4はそれぞれ水素原子である請求項1に記載の近赤外蛍光色素。
【請求項3】
請求項1又は2に記載の近赤外蛍光色素を含む画像診断材料。
【請求項4】
請求項3に記載の画像診断材料を用いて行う画像診断方法。
【請求項1】
下記一般式(I)で示される化合物と、下記一般式(II)で示される化合物と、下記一般式(III)で示される化合物と、下記一般式(IV)で示される化合物と、下記一般式(V)で示される化合物とからなる群より選ばれる少なくとも1つの化合物を含む近赤外蛍光色素。
【化1】

【化2】

【化3】

【化4】

【化5】

[式中、Xは、酸素原子又はケイ素原子であり;Yは、複数ある場合はそれぞれ独立して、OH、OR1又はNR2R3であり;Z1は、複数ある場合はそれぞれ独立して、水素原子、ハロゲン原子(F、Cl、BrもしくはI)、炭素数が1〜5の一部もしくは全部がNR2R3で置換されたもしくは無置換のアルキル基又は炭素数が1〜5の一部もしくは全部がOR4で置換されたもしくは無置換のアルキル基であり;Z2は、複数ある場合はそれぞれ独立して、水素原子又はハロゲン原子(F、Cl、BrもしくはI)であり;Z3、Z4は、それぞれ独立して、水素原子、NR2R3、OR4又は炭素数が1〜5の一部もしくは全部がハロゲン原子(F、Cl、BrもしくはI)で置換されたもしくは無置換のアルキル基である。前記において、R1は、複数ある場合はそれぞれ独立して、アシル基、糖残基又は芳香族化合物であり;R2、R3は、それぞれ独立して、水素原子又は炭素数が1〜5の一部もしくは全部が置換されたもしくは無置換のアルキル基であり;R4は、複数ある場合はそれぞれ独立して、水素原子又は炭素数が1〜5の一部もしくは全部が置換されたもしくは無置換のアルキル基である。]
【請求項2】
前記一般式(I)及び(II)において、Xは酸素原子であり、YはそれぞれOHであり、Z1、Z2、Z3及びZ4はそれぞれ水素原子である請求項1に記載の近赤外蛍光色素。
【請求項3】
請求項1又は2に記載の近赤外蛍光色素を含む画像診断材料。
【請求項4】
請求項3に記載の画像診断材料を用いて行う画像診断方法。
【図1】


【図2】


【図3】


【図4】


【図5】




【図2】


【図3】


【図4】


【図5】


【公開番号】特開2012−219258(P2012−219258A)
【公開日】平成24年11月12日(2012.11.12)
【国際特許分類】
【出願番号】特願2011−90109(P2011−90109)
【出願日】平成23年4月14日(2011.4.14)
【出願人】(509349141)京都府公立大学法人 (19)
【Fターム(参考)】
【公開日】平成24年11月12日(2012.11.12)
【国際特許分類】
【出願日】平成23年4月14日(2011.4.14)
【出願人】(509349141)京都府公立大学法人 (19)
【Fターム(参考)】
[ Back to top ]

