逆熱的ゲル化特性を有する生分解性低分子量トリブロックポリ(ラクチド−co−グリコリド)−ポリエチレングリコールコポリマー
【課題】疎水性ブロックの重量%濃度が高い水溶性低分子量感熱生分解性ブロックコポリマーの提供。
【解決手段】Aブロックとしてのポリ(ラクチド−co−グリコリド)またはポリ(ラクチド)ポリマーから構成される過半量の疎水性ポリマー、およびより少量の親水性ポリエチレングリコールポリマーBブロックからなり、全体重量平均分子量が約2000〜4990であり、そして逆熱的ゲル化特性を有する、水溶性生分解性ABAまたはBABタイプのトリブロックポリマー。
【解決手段】Aブロックとしてのポリ(ラクチド−co−グリコリド)またはポリ(ラクチド)ポリマーから構成される過半量の疎水性ポリマー、およびより少量の親水性ポリエチレングリコールポリマーBブロックからなり、全体重量平均分子量が約2000〜4990であり、そして逆熱的ゲル化特性を有する、水溶性生分解性ABAまたはBABタイプのトリブロックポリマー。
【発明の詳細な説明】
【技術分野】
【0001】
本発明は、疎水性ブロックの重量%濃度が高い水溶性低分子量感熱生分解性ブロックコポリマー、および薬剤を非経口、眼、局所、経皮、膣、口腔、経粘膜、肺、経尿道、直腸、鼻、口、または耳投与するためのそれらの使用に関する。本発明は、以下に詳しく記すポリ(ラクチド−co−グリコリド)またはポリ(ラクチド)およびポリエチレングリコールブロックに基づく感熱生分解性トリブロックポリマーの使用によって可能となる。この系は、分子量が比較的低くかつ疎水性ブロックポリマー含量が比較的高いブロックコポリマーの選択されたグループが、5〜25℃またはその付近の温度の水中では透明な溶液として存在するが、温度を体温(一般に、人の場合は37℃)近くに上げると、自発的に相互作用して、水を高い割合でゲルネットワーク内に取り込んで含有するが、依然として水に実質的に不溶性である、半固体ヒドロゲル(すなわち、ゲル)を形成するという発見に基づく。
【背景技術】
【0002】
近年、各種治療に有効な多くのペプチド/タンパク質薬剤が、組み換えDNAおよび他の技術の進歩により商業的に入手しうるようになってきた。しかしながら、ポリペプチドまたはタンパク質のように、高分子量であり、胃腸管で分解され、体内における半減期が短いものの投与ルートは、静脈内または筋肉内のような非経口投与および皮下注射に限られている。多くのペプチド薬剤は慣用的な液体担体中の溶解性および/または安定性が限られていて、配合および投与が難しい。また、多くの場合、期待される治療効果を長期間得るために非常に多くの投与が必要とされる。これらの薬剤の実際の使用および進歩したバイオテクノロジーによって得られる薬剤の利用には、そのようなポリペプチドまたはタンパク質の長期調整放出が必須である。別の問題は患者の協力である。特に慢性疾患に対する処方のとき、および薬剤に激しい副作用があるとき、所定の投与法に患者を従わせるのが難しいことがよくある。従って、治療効力を最適なものにし、副作用および毒性を最少限にし、それによって効力を高めかつ患者の協力を大いに得るために、薬剤、特にポリペプチドおよびタンパク質薬剤を上記の問題なしで、持続期間にわたって調整された速度で放出するシステムを提供することが非常に望ましい。
【0003】
薬剤添加ポリマー製剤および投与形態は、様々な疾患の長間治療のために研究されてきた。このポリマーの重要な性質は生分解性であり、生分解性とは、薬剤の放出と同時にまたは全薬剤の放出後に、ポリマーが体内で非毒性成分に分解または崩壊しうることを意味する。さらに、製剤の製造および薬剤の添加に用いられる技術、手順、溶媒および他の添加剤は、患者にとって安全であり、周囲組織への刺激ができるだけ少なく、かつ薬剤に適合した媒質となる投与形態が得られるものであるべきである。一般に、生分解性のインプラント可能な調整放出製剤は、ポリグリコール酸、ポリ乳酸、またはグリコール酸と乳酸とのコポリマーのような固体ポリマーから製造される。これらのポリマーは疎水性であるため、これらの物質を用いる薬剤添加および製剤製造には有機溶媒、例えば塩化メチレン、クロロホルム、酢酸またはジメチルホルムアミドが必要である。いくつかの溶媒は毒性であるため、このプロセスの後に長時間の乾燥が一般に必要であることは、明らかである。たいていの場合、最終ポリマー製剤は、しばしば手術による外傷を伴うインプラントを必要とする様々な固体形(例えば、球、スラブまたはロッド)で製造される。
【0004】
現在、生物適合性、明示された劣化の道筋、および劣化生成物の安全性のような厳しい規定要件があるため、ペプチドおよびタンパク質薬剤を含む薬剤の調整放出に用いうる合成または天然ポリマー物質はほとんどない。利用しうる毒物学的および臨床的データに基づいて最も広く研究かつ開発された生分解性ポリマーは、脂肪族ポリ(α−ヒドロキシ酸)、例えばポリ(D,L−またはL−乳酸)(PLA)およびポリ(グリコール酸)(PGA)並びにそれらのコポリマー(PLGA)である。これらのポリマーは商業的に入手することができ、現在、生体再吸収性縫合糸として用いられている。FDAが承認したロイプロライドアセテートの調整放出用の系であるLupron Depot(登録商標)も、PLGAコポリマーに基づいている。Lupron Depot(登録商標)は注射可能な微小球からなり、これらは前立腺癌の治療のために長期間(例えば、約30日)にわたってロイプロライドアセテートを放出する。この使用履歴に基づいて、PLGAコポリマーは、生分解性担体を用いる非経口調整放出薬剤送逹系の初期の設計に選ばれた物質であった。
【0005】
わずかに成功したものがあるが、これらのポリマーはそれらの物理化学的性質および製造法にも問題がある。ポリペプチドのような親水性巨大分子は疎水性マトリックスまたはポリラクチド膜を通しての拡散が困難である。PLAおよびPLGAを用いる薬剤添加および製剤製造は毒性有機溶媒をしばしば必要とし、その固体投与形態は組織刺激を機械的に引き起こしうる。
【0006】
A. S. Sawhney およびJ. A. Hubbell 、J. Biomed. Mat. Res.、24、1197−1411(1990)は、in vitroで迅速に劣化するD,L−ラクチド、グリコリドおよびε−カプロラクトンのターポリマーを合成した。例えば、60%グリコリド、30%ラクチドおよび10%ε−カプロラクトンのターポリマー組成物は、半減期が17日である。この物質の親水性は、ポロキサマー界面活性剤(PluronicF−68)との共重合によって増加した。このポロキサマーは、約80重量%の比較的疎水性のポリ(オキシプロピレン)ブロックおよび20重量%の親水性ポリ(オキシエチレン)ブロックを含むブロックコポリマーである。ポロキサマーとの共重合で、生理学的温度(例えば、37℃)の水中で機械的に安定したより強力なかつ部分的に結晶質の物質が生じた。このコポリマーの半減期は基本ポリマーと比べて少し増加した。しかしながら、ポロキサマータイプの界面活性剤は生分解性ではない。
【0007】
注射可能なまたはインプラント可能なポリマー薬剤送逹製剤としての使用に最適な物質は、生分解性で、親水性または疎水性薬剤と適合性であるべきであり、そして扱いやすい安全な溶媒、例えば水で製造することができ、投与後に追加の重合または他の共有結合形成反応を必要としない。
【0008】
水溶液で製造することができる1つの系は、上記のブロックコポリマーの種類であり、Pluronicの登録商標で販売されている。これらのコポリマーは2種類のポリマーブロック、すなわち、親水性ポリ(オキシエチレン)ブロックおよび疎水性ポリ(オキシプロピレン)ブロックからなり、ポリ(オキシエチレン)−ポリ(オキシプロピレン)−ポリ(オキシエチレン)のトリブロックからなる。トリブロックコポリマーは水を吸収して、逆熱的ゲル化挙動を示すゲルを形成する。しかしながら、Pluronic(登録商標)系は生分解性ではなく、ゲルの性質 (水溶性ゲル)およびこれらのゲルからの薬剤放出速度(非常に速い)が有用でないことは証明されており、かなりの改良を必要とする。
【0009】
水溶性ポリペプチドを溶液に混和するのに用いうる親水性生分解性物質が強く求められている。A. S. Sawhney 等、Macromolecules、第26巻、4号、581−589(1993)は、オリゴ(D,L−乳酸)またはオリゴ(グリコール酸)のようなα−ヒドロキシ酸のオリゴマーで広がり、アクリレート基で終わる、ポリエチレングリコール中心ブロックを有するマクロマーを合成した。非毒性光重合開始剤を用いると、これらのマクロマーは可視光線で急速に重合することができる。マクロマーの多官能基により、重合で架橋ゲルが形成する。ゲルは、オリゴ(α−ヒドロキシ酸)領域の加水分解で、ポリエチレングリコール、α−ヒドロキシ酸、およびオリゴ(アクリル酸)に劣化し、それらの劣化速度はオリゴ(α−ヒドロキシ酸)の適切な選択により1日以内から4カ月までで調整することができる。しかしながら、この系では、追加成分である光重合開始剤、並びに追加共有結合形成光架橋反応が用いられる。人によって皮膚の厚さおよび透明度が異なるため、この方法では人により性能が非常に異なる。
【0010】
岡田等、日本特許2−78629(1990)は、ポリ(乳酸)(PLA)またはポリ(乳酸)/グリコール酸(PLGA)およびポリエチレングリコール
(PEG)のエステル交換によって生分解性ブロックコポリマー物質を合成した。分子量範囲は、PLGAが400〜5,000、PEGが200〜2,000である。混合物を100〜250℃で1〜20時間、窒素雰囲気下で加熱した。生成物は水混和性であり、ヒドロゲルを形成した;しかしながら、室温以上の水中では沈殿した。つまり、水への溶解度およびインターポリマー鎖相互作用は温度と共に変化した。このポリマーは以下で論じるChurchill の特許に記載のポリマーと似ており、水性懸濁液として用いられたり、またはインプラント用の固体ブロックに形成される。このポリマーが逆熱的ゲル化特性を示して、ポリマーのコロイド懸濁液としてではなく、溶液として注射されることを示す記載はない。
【0011】
T. Matsuda、ASAIO Journal 、M512−M517(1993)は、生分解性ポリマーゲルを用い、有効なペプチジル抗増殖剤であるアンギペプチンを放出して、病気の血管を人工移植片で置き換えたときまたは血管内製剤で治療したときに生じる筋内膜増殖を防いだ。ポリ(乳酸)およびポリエチレングリコール(PLA−PEG)ブロックセグメントからなるブロックコポリマーの非常に粘稠な液体は、その場で被覆可能な薬剤担体として用いられた。この物質は日本の兵庫のタキ・ケミカル社から供給された。0.5gのPLA−PEGおよび0.5mgのアンギオペプチンからなるポリマーゲルからのアンギオペプチンの長期放出は、ゲルを37℃に維持した緩衝溶液中に保持したとき、数週間にわたってin vitroで観察された。アンギオペプチンの早期の急な放出は観察されなかった。これらの結果に基づいて、生体内の損傷血管を被覆した生分解性ポリマーゲルからの局所持続アンギオペプチン放出が有効であることが理論づけられた。
【0012】
L. Martini等、J. Chem. Soc. 、Faraday Trans.、90(13)、1961−1966(1994)は、エステル結合を含む加水分解鎖分離によりin vivo 劣化されることが知られている疎水性ポリ(ε−カプロラクトン)を組み込むことにより非常に低分子量のABAタイプのトリブロックコポリマーを合成し、PCL−PEG−PCLブロックコポリマーの溶液特性を報告している。ブロックコポリマーの水溶液をゆっくり加熱すると、曇るのが目で観察された。コポリマーの2重量%水溶液の曇点は、PCL−PEG−PCL(450:4000:450)およびPCL−PEG−PCL(680:4000:680)の場合、各々65℃および55℃であった。PCL−PEG−PCL(680:4000:680)の溶液の冷却時の可逆ゲル化は、25℃での13%〜80℃での30%の臨界濃度および温度で観察された。溶液を0℃へさらに冷却したとき、より低いゲル/ゾル転移は観察されなかった。PCL−PEG−PCL(680:4000:680)の in vitro 劣化速度は非常に遅い。16週間中のモル量の減少はわずか約20%(GPCから)であることが観察された。そのように遅い劣化は、実際の薬剤送逹賦形剤には不十分である。
【0013】
Churchill 等、米国特許第4,526,936号および第4,745,160号は、いずれかが自己分散性であるか、あるいは水溶液中で自己分散性となりうるコポリマーを示している。これらのコポリマーは、疎水性Aブロック、例えばポリラクチド(PLA)またはポリ(ラクチド−co−グリコリド)(PLGA)、および親水性Bブロック、例えばポリエチレングリコール(PEG)またはポリビニルピロリドンよりなる、ABAトリブロックまたはABブロックコポリマーである。好ましくは、有機溶媒なしで水に自己分散性であるには、これらのポリマーは、疎水性(Aブロック)成分と比べて、50重量%を越える親水性(Bブロック)成分を含有しなければならないか、あるいは疎水性成分(Aブロック)の重量平均分子量が5,000未満であるコポリマーでなければならない。重量平均分子量が1000のように低いポリマーの記述があるが、そのようなポリマーの直接的な教示、あるいは分子量が5000未満のABAタイプポリマーが機能することの直接的な教示はない。さらに、疎水性成分が少なくとも50重量%の高分子量ポリマー以外のABAタイプポリマーは例示されていない。これらのブロックコポリマーが有機溶媒を使用せずにどのような温度の水溶液にも可溶性であることの記載も、また薬剤/ポリマーを液剤として投与しうる記載もない。むしろ、ポリマーのコロイド懸濁液としての投与が開示されていたり、薬剤/ポリマー分散液を粉剤に凍結乾燥し、圧縮成形によって加工してインプラント可能な貯蔵物としての使用に適した固形剤を形成している。水性薬剤/ポリマー懸濁液または分散液は、分散ポリマー相が連続水性相に懸濁されている2相系である。そのような分散液は、バクテリアまたは他の毒性粒状物質の除去に殺菌濾過工程が必要とされる状況での使用には適していない。というのは、そのような工程は薬剤/ポリマー粒子も除去し、その結果、治療投与量に満たなくなるからである。水溶性でありかつ温度によってゲルとなるABAタイプブロックコポリマーは、Churchill 等の特許に含まれていない。
【0014】
上記の議論から、公知の熱的可逆性ゲル(例えば、Pluronics (登録商標))が薬剤送逹系として本来有用でないことが分かるはずである。逆熱的ゲル化特性を有するブロックコポリマーの記載はあるが、これらのゲルには、持続期間中の薬剤放出の調整に必要な重要な特性が欠けており、そしてそれらは非生分解性であるため、毒性または生体適合性に関する問題が存在する。従って、逆熱的ゲル化の性質は薬剤送逹分野において特有かつ潜在的に非常に有用であると一般に認められているが、さらに、実行可能な系に必要な性質を有する系に開発する必要がある。
【先行技術文献】
【特許文献】
【0015】
【特許文献1】日本特許2−78629(1990)
【特許文献2】米国特許第4,526,936号
【特許文献3】米国特許第4,745,160号
【非特許文献】
【0016】
【非特許文献1】J. Biomed. Mat. Res.、24、1197−1411(1990)
【非特許文献2】Macromolecules、第26巻、4号、581−589(1993)
【非特許文献3】ASAIO Journal 、M512−M517(1993)
【非特許文献4】J. Chem. Soc. 、Faraday Trans.、90(13)、1961−1966(1994)
【発明の概要】
【発明が解決しようとする課題】
【0017】
本発明の目的は、生分解性であり、逆熱的ゲル化挙動を示す、すなわち、低温では溶液として存在し、生理学的関連温度では逆にゲルを形成し、そして良好な薬剤放出特性をもたらす、低分子量トリブロックコポリマー薬剤送逹系を提供することである。
【0018】
本発明の別の目的は、親水性および疎水性薬剤、ペプチドおよびタンパク質薬剤、およびオリゴヌクレオチドの非経口投与のための薬剤送逹系を提供することである。
本発明のさらに別の目的は、薬剤が制御された速度で放出される体内でのゲル貯蔵物を形成することになる、生分解性ポリマーマトリックス中の薬剤の非経口投与法を提供することである。
【課題を解決するための手段】
【0019】
これらのおよび他の目的は、ポリ(ラクチド−co−グリコリド)(PLGA)ブロックコポリマーまたはポリ(ラクチド)(PLA)ポリマーからなる約51〜83重量%の疎水性Aブロック、およびポリエチレングリコールからなる約17〜49重量%の親水性Bポリマーブロックよりなる、平均分子量が約2000〜4990の生分解性ABAまたはBABタイプのブロックコポリマーによって達成される。ポリエチレングリコール(PEG)は、ポリ(エチレンオキシド)(PEO)またはポリ(オキシエチレン)とも呼ばれ、この用語は本発明では置き換えて用いてもよい。疎水性Aブロックにおいて、ラクテート含量は約30〜100モル%、好ましくは約30〜80モル%、最も好ましくは約50〜80モル%である。グリコレート含量は約0〜70モル%、好ましくは約20〜70モル%、最も好ましくは約20〜50モル%である。
【0020】
本発明のさらに別の目的および利点は、本発明を構成する様々な態様についての次の要旨および詳細な説明から明らかになる。
ここで用いられるように、次の用語は以下の意味を有する:
「非経口」とは、筋肉内、腹膜内、腹腔内、皮下、そして可能な程度までの静脈内および動脈内を意味する。
【0021】
「ゲル化温度」とは、生分解性ブロックコポリマーが逆熱的ゲル化を行う温度、すなわち、その温度より下ではブロックコポリマーが水溶性であり、その温度より上ではブロックコポリマーが相転移して、粘度が上昇するか、あるいは半固体ゲルを形成する温度を意味する。
【0022】
「ゲル化温度」および「逆熱的ゲル化温度」等の用語は、置き換えて用いることができ、ゲル化温度のことを指す。
「ポリマー溶液」、「水溶液」等とは、そのような溶液に含まれる生分解性ブロックコポリマーに関して用いられるとき、機能濃度でそこに溶解したそのようなブロックコポリマーを有し、かつそのブロックコポリマーのゲル化温度より下の温度に維持されている、水をベースにした溶液を意味する。
【0023】
「逆熱的ゲル化」とは、ブロックコポリマー溶液の温度をそのコポリマーのゲル化温度より上に上げるにつれて、ブロックコポリマー溶液の粘度が自発的に増加し、そして多くの場合、半固体ゲルに変わる現象である。本発明において、「ゲル」という用語には、ゲル化温度より上の温度で存在する半固体ゲル状態および高粘度状態の両方が含まれる。ゲル化温度より下の温度に冷却すると、ゲルは自発的に逆戻りして再びより低粘性の溶液を形成する。ゾル/ゲル転移はポリマー系の化学組成の変化を伴わないので、溶液とゲルとの間のこの循環は無限に繰り返される。ゲルを形成する全ての相互作用は本来物理的なものであって、共有結合の形成または切断を伴わない。
【0024】
「薬剤送逹液」または「逆熱的ゲル化特性を有する薬剤送逹液」とは、温度がブロックコポリマーのゲル化温度にまたはそれより上の温度に上がったとき、ゲル化薬剤貯蔵物を形成する、温血動物への投与に適した薬剤(薬剤自体は溶解されてもコロイド状となってもよい)を含有するポリマー溶液を意味する。
【0025】
「貯蔵物」とは、温度がゲル化温度にまたはそれより上の温度に上がったときにゲルを形成した、温血動物への投与後の薬剤送逹液を意味する。
「ゲル」とは、「ポリマー溶液」または「薬剤送逹液」の温度をブロックコポリマーのゲル化温度にまたはそれより上の温度に上げるにつれて、自発的に生じる半固体相を意味する。
【0026】
「水性ポリマー組成物」とは、薬剤および生分解性ブロックコポリマーを均質に含有する水相を含む薬剤送逹液またはゲルを意味する。ゲル化温度より下の温度では、コポリマーは水相に可溶性であるので、その組成物は溶液となる。ゲル化温度またはそれより上の温度では、コポリマーは固化して水相と共にゲルを形成するので、その組成物はゲルまたは半固体となる。
【0027】
「生分解性」とは、ブロックコポリマーが体内で化学的に分解または劣化して非毒性成分を形成しうることを意味する。劣化速度は薬剤放出速度と同じでも異なっていてもよい。
【0028】
「薬剤」とは、生物活性であり、治療目的に適するかまたは用いられる有機もしくは無機化合物または物質を意味する。タンパク質、オリゴヌクレオチド、DNAおよび遺伝子治療は、より広い定義で薬剤に含まれる。
【0029】
「ペプチド」、「ポリペプチド」、「オリゴペプチド」および「タンパク質」は、ペプチドまたはタンパク質薬剤に関するときは置き換えて用いられ、特に断りがなければ、特定の分子量、ペプチド配列もしくは長さ、生物活性の範囲または治療用途については限定されない。
【0030】
「ポリ(ラクチド−co−グリコリド)」または「PLGA」とは、乳酸およびグリコール酸の縮合共重合から誘導されるコポリマー、あるいはラクチドまたはグリコリドのようなα−ヒドロキシ酸前駆体の開環重合によって誘導されるコポリマーを意味する。「ラクチド」、「ラクテート」、「グリコリド」および「グリコレート」は、置き換えて用いられる。
【0031】
「ポリ(ラクチド)」または「PLA」とは、乳酸の縮合から誘導されるポリマー、あるいはラクチドの開環重合によって誘導されるポリマーを意味する。
「ラクチド」および「ラクテート」は、置き換えて用いられる。
【0032】
従って、本発明は、Aブロックが比較的疎水性のポリ(ラクチド−co−グリコリド)(PLGA)または疎水性のポリ(ラクチド)(PLA)であり、Bブロックが比較的親水性のポリエチレングリコール(PEG)である、ABAまたはBABタイプのブロックコポリマーであって、疎水性含量が約51〜83重量%であり、約2000〜4990の全体ブロックコポリマー分子量を有し、低い温度で水溶性を示し、哺乳動物の生理学的な体温で可逆的熱的ゲル化を行うことを発見したことに基づくものである。そのように高い疎水性含量で、そのようなブロックコポリマーが水溶性であることは、意外なことである。疎水性含量が50重量%を越えるポリマーは水に実質的に不溶性であり、仮に特定量の有機補助溶媒を加えたとしても、水性系に多少可溶性になるだけであることは、一般に教示されている。
【0033】
従って、本発明の基本は、式:
[化1]
PL(G)z-1 A−PEG−PL(G)z-1 A
または
PEG−PL(G)z-1 A−PEG
(式中、zは1または2の整数である)
の疎水性PL(G)z-1 A Aブロックセグメントおよび親水性PEG Bブロックセグメントを有する、ABAまたはBABタイプのブロックコポリマーを用いることである。本発明に開示するように用いられるブロックコポリマーは、表1にまとめた基準、すなわち、望ましい逆熱的ゲル化挙動を示すブロックコポリマーとなる指示範囲内の組成を満たす。分子量パラメーターを開示するために、報告した全ての分子量の値は、NMRまたはGPC(ゲル透過クロマトグラフィー)分析法による測定に基づく。報告した重量平均分子量および数平均分子量は、それぞれ、GPCおよびNMRにより測定した。報告したラクチド/グリコリド比はNMRデータから計算した。GPC分析は、RI検出および溶離剤としてのクロロホルムを用いるPEGで較正したStyragel HR-3 カラムで行うか、あるいはRI検出および溶離剤としてのテトラヒドロフランを用いるPEGで較正したPhenogel混合床およびPhenogel500オングストロームカラムの組み合わせで行った。NMRスペクトルは、Bruker200MHz 装置でCDCl3 中で得た。
【0034】
[表1]
──────────────────────────
全体重量平均分子量: 2000〜4990
PEG含量: 17〜49重量%
全体PLGAまたはPLA含量: 51〜83重量%
ラクテート含量: 30〜100モル%
グリコレート含量: 0〜70モル%
挙動: ゲル化温度より下では水溶性
ゲル化温度より上ではゲル
───────────────────────────
生分解性疎水性Aブロックセグメントは、本発明において、それぞれ、ポリ(ラクチド−co−グリコリド)およびポリ(ラクチド)と呼ばれる、ポリ(D,L−ラクチド−co−グリコリド)、ポリ(L−ラクチド−co−グリコリド)、ポリ(D,L−ラクチド)およびポリ(L−ラクチド)よりなる群から誘導または選択されるポリ(α−ヒドロキシ酸)である。表1に示す全体分子量および重量%PLGAまたはPLAについての値から計算し、そしてABAトリブロックコポリマー中のAブロックまたはBABトリブロックコポリマー中のBブロックの各々の重量平均分子量が本質的に同じであるとすると、各ポリ(ラクチド−co−グリコリド)またはポリ(ラクチド)ポリマーAブロックの重量平均分子量は約600〜3000である。
【0035】
同様な計算により、親水性Bブロックセグメントは、平均分子量が約500〜2200のポリエチレングリコール(PEG)であるのが好ましい。
ABAトリブロックコポリマーは次の反応スキームによる開環重合または重縮合によって合成しうる:
【0036】
【化2】

【0037】
【化3】

【0038】
BABタイプのトリブロックポリマーは、反応条件を適当に選択することによって同様に製造しうる。例えば、B(PEG)ブロックは、エステルまたはウレタン結合等によってA(PLGAまたはPLA)ブロックに結合しうる。重縮合および開環重合法は、イソシアネートのようなカップリング剤の存在下での1官能価親水性Bブロックの2官能価疎水性Aブロックのいずれかの末端へのカップリングと同様に用いうる。さらに、カップリング反応は、カルボニルジイミダゾール、無水コハク酸、N−ヒドロキシスクシンイミドおよびp−ニトロフェニルクロロホルメート等のような活性剤での官能基の活性を伴ってもよい。
【0039】
親水性Bブロックは適当な分子量のPEGから形成される。PEGは、そのユニークな生体適合性、非毒性、親水性、可溶化性、および患者の体からの急速な浄化性のために、親水性水溶性ブロックとして選択された。
【0040】
疎水性Aブロックは、それらの生分解性、生体適合性および可溶化性の故に、合成されて利用される。これらの疎水性ポリ(ラクチド−co−グリコリド)およびポリ(ラクチド)Aブロックの in vitro および in vivo劣化については十分に理解されており、その劣化生成物は患者の体によって容易に代謝および/または排除される天然化合物である。
【0041】
驚いたことに、疎水性ポリ(ラクチド−co−グリコリド)およびポリ(ラクチド)Aブロックの総重量%は、親水性PEG Bブロックのそれと比較して高く、例えば、約51〜83重量%、最も好ましくは約65〜78重量%であり、それにもかかわらず、得られるトリブロックポリマーは望ましい水溶性および逆熱的ゲル化特性を保持する。そのような高い割合で疎水性成分を有するブロックコポリマーが、冷蔵庫温度(5℃)のような通常の室温より低い温度で水溶性であることは、意外な発見である。全トリブロックコポリマーの全体的に低い分子量を約2000〜4990に維持するので、このような望ましい溶解度特性が可能であると考えられる。かくして、親水性Bブロックがコポリマーの約17〜49重量%を構成し、疎水性Aブロックがコポリマーの約51〜83重量%を構成する、熱的可逆性ゲル化特性を有する水溶性生分解性ブロックコポリマーが製造される。好ましい態様では、PLGA AブロックまたはPLA Aブロックはコポリマーの約65〜78重量%を構成し、PEG Bブロックはコポリマーの約22〜35重量%を構成する。さらに、全トリブロックコポリマーの好ましい全体平均分子量は約2800〜4990である。
【0042】
ブロックコポリマーがゲル化温度より下の温度で可溶性である濃度を、機能濃度と見なしうる。一般に、3%の低いブロックコポリマー濃度から約50重量%までの濃度で用いることができ、依然として機能性である。しかしながら、約5〜40重量%の濃度が好ましく、約10〜30重量%の濃度が最も好ましい。コポリマーでゲル相転移を可能にするには、3重量%のような特定の最低濃度が必要である。それより低い機能濃度範囲では、相転移で弱いゲルが形成される。それより高濃度では、強いゲルネットワークが形成される。
【0043】
生分解性コポリマーおよびペプチド/タンパク質薬剤、および/または他のタイプの薬剤の混合物は、ゲル化温度より低い温度のコポリマー水溶液として製造すると、薬剤が部分的にまたは完全に溶解しうる薬剤送逹液を形成しうる。薬剤が部分的に溶解されているとき、あるいは薬剤が本質的に不溶性であるとき、薬剤は懸濁液またはエマルジョンのようなコロイド状態で存在する。この薬剤送逹液は、その後、非経口、局所、経皮または経粘膜投与されるか、あるいは、例えば、眼、膣、尿道、直腸、鼻、口、口腔、肺または耳のような腔部へ吸入または挿入され、このとき、体温はゲル化温度より上であろうから逆熱的ゲル化が起こる。
【0044】
ゲルの材料が生分解性でありかつゲルが柔軟性であるため、この系は周囲組織への毒性および機械的刺激が極めて少なく、特定の時間内に乳酸、グリコール酸およびPEGに完全に分解する。薬剤放出、ゲル強度、ゲル化温度および劣化速度は、様々なコポリマーブロックの適切な設計および製造、すなわち、AブロックおよびBブロックの重量%、ラクテートおよびグリコレートのモルパーセント、並びにABAまたはBABトリブロックコポリマーの分子量および多分散度の変更によって調節することができる。薬剤の放出は薬剤送逹液中のポリマー濃度の調節によって制御することもできる。
【0045】
懸濁液またはエマルジョンとして溶解した薬剤または薬剤を含有するブロックコポリマー溶液からなる投与形態を体に投与する。次いで、そのブロックコポリマーの逆熱的ゲル化特性により、この製剤は自発的にゲル化して、製剤の温度が体温になるにつれて薬剤貯蔵物を形成する。どれくらいの薬剤を製剤に添加しうるかについての唯一の制限は機能性である。すなわち、コポリマーの熱的ゲル化特性が許容できないほどの悪影響を受けるまで、あるいは製剤の性質が製剤の投与を許容できないくらいに難しくするほどの悪影響を受けるまで、薬剤の添加を増加させうる。一般に、たいていの場合、薬剤は製剤の約0.01〜20重量%を構成し、約0.01〜10%の範囲が非常に一般的である。これらの薬剤添加範囲は本発明を制限するものではない。機能性が維持されるならば、これらの範囲外の薬剤添加は本発明の範囲に入る。
【0046】
本発明の組成物の明確な利点は、ブロックコポリマーが多くの薬剤物質の溶解度を高めうることである。疎水性Aブロックおよび親水性Bブロックの組み合わせは、ブロックコポリマーを両親媒性にする。これに関して、この性質は親水性および疎水性の両方の性質を有するセッケンまたは界面活性剤のように機能する。これはシクロスポリンおよびパクリタクセルのような疎水性または水溶性に乏しい薬剤の可溶化に特に有利である。驚いたことは、ブロックコポリマーの主成分が疎水性Aブロック成分であるので、全てではないがたいていの薬剤の可溶化である。しかしながら、すでに述べたように、疎水性ポリマーブロックが主成分であっても、ブロックコポリマーは水溶性であるので、そして薬剤をブロックコポリマーの水相に混ぜると、薬剤溶解度はさらに高まることが分かった。
【0047】
本発明の組成物の別の利点は、ブロックコポリマーが多くの薬剤物質の化学的安定性を高めうることである。薬剤を化学的に不安定にする薬剤の劣化に関する様々なメカニズムが、薬剤をブロックコポリマー中に存在させると抑制されることが観察された。例えば、パクリタクセルおよびシクロスポリンAは、有機補助溶媒が存在するこれらの同じ薬剤の一定の水溶液に比べて、本発明の水性ポリマー組成物中で実質的に安定化される。パクリタクセルおよびシクロスポリンAにおけるこの安定化効果は、多くの他の薬剤物質で得られる効果の一例にすぎない。
【0048】
特定の状況では、薬剤添加ポリマーは溶液としてではなくゲル状態で投与されてもよい。ゲル化は、薬剤添加ポリマー溶液の温度が投与前にポリマーのゲル化温度より上に上昇した結果でも、あるいは溶液中のポリマー濃度が投与温度で飽和濃度より上になったことによって生じたものであっても、あるいは溶液をゲルにするポリマー溶液への添加物によって生じたものであってもよい。いずれにしても、このようにして形成されたゲルは非経口、局所、経皮、経粘膜投与しても、あるいは、例えば、眼、膣、尿道、直腸、鼻、口、口腔、肺または耳のような腔部へ吸入または挿入してもよい。
【0049】
本発明は、あらゆる種類の生物活性剤および薬剤に適用することができ、そしてポリペプチドおよびタンパク質を放出する非常に効果的な方法を提供する。多くの不安定なペプチドおよびタンパク質薬剤は、本発明のブロックコポリマーへ配合しやすく、ここに記載の逆熱的ゲル化法からの利点を得ることができる。以下のものに特に限定するものではないが、薬学的に有用なポリペプチドおよびタンパク質は以下に記載の群から選択しうる:オキシトシン、バソプレシン、副腎皮質刺激性ホルモン、表皮成長因子、血小板誘導成長因子(PDGF)、プロラクチン、ルリベリン、黄体形成ホルモン放出ホルモン(LHRH)、LHRHアゴニスト、LHRHアンタゴニスト、成長ホルモン(人、豚、牛等)、成長ホルモン放出因子、インスリン、ソマトスタチン、グルカゴン、インターロイキン−2(IL−2)、インターフェロン−α,βまたはγ、ガストリン、テトラガストリン、ペンタガストリン、ウロガストロン、セクレチン、カルシトニン、エンケファリン、エンドルフィン、アンギオテンシン、チロトロピン放出ホルモン(TRH)、腫瘍壊死因子(TNF)、神経成長因子(NGF)、顆粒球−コロニー刺激因子(G−CSF)、顆粒球マクロファージ−コロニー刺激因子(GM−CSF)、マクロファージ−コロニー刺激因子(M−CSF)、ヘパリナーゼ、骨形態発生タンパク質(BMP)、hANP、グルカゴン様ペプチド(GLP−1)、インターロイキン−11(IL−11)、レニン、ブラジキニン、バシトラシン、ポリミキシン、コリスチン、チロシジン、グラミシジン、シクロスポリン、並びにそれらの合成類似体、変種、および薬理学的に活性なそれらのフラグメント、酵素、サイトカイン、モノクローナル抗体およびワクチン。
【0050】
利用しうるポリペプチドまたはタンパク質薬剤に対する唯一の制限は、機能性のものであることである。場合によっては、ポリペプチドおよびタンパク質の機能性または物理的安定性も、ポリペプチドまたはタンパク質薬剤の水溶液または懸濁液への各種添加剤によって高めることができる。添加剤、例えばポリオール(糖を含む)、アミノ酸、界面活性剤、ポリマー、他のタンパク質および特定の塩を用いてもよい。これらの添加剤は、本発明の逆熱的ゲル化を行うブロックコポリマーに容易に混合することができる。
【0051】
タンパク質工学の発展により、ポリペプチドまたはタンパク質の本来の安定性を高めることができる。そのような工業処理または改質されたタンパク質は規定では新規物質とみなしうるが、本発明での使用に対する適性は変わらない。改質の一般的な例の1つは、ポリペプチド薬剤の安定性が、ポリエチレングリコールのような水溶性ポリマーとポリペプチドとの共有結合によって大幅に改善されるPEG化である。別の例は、末端および/または内部付加、除去または置換による1つ以上のアミノ酸残基の種類または位置の面でのアミノ酸配列の変更である。安定性の向上によって、治療に有効なポリペプチドまたはタンパク質を、患者への薬剤送逹液のただ1回の投与の後、長期間にわたって連続放出することが可能となる。
【0052】
ペプチドまたはタンパク質に基づく薬剤に加えて、治療学的および医学的に有用なあらゆる種類からの他の薬剤を用いうる。これらの薬剤はメルクインデックス、Physicians Desk Reference 、およびThe Pharmacological Basis of Therapeutics のような周知の文献に記載されている。具体的な薬剤の簡単なリストを説明のために示すが、これは本発明を限定するものではない:抗癌剤、例えばマイトマイシン、ブレオマイシン、BCNU、カルボプラチン、ドキソルビシン、ダウノルビシン、メトトレキセート、パクリタクセル、タキソテレ(登録商標)、アクチノマイシンDおよびカンプトテシン;抗精神病薬、例えばオランザビンおよびジプラシドン;抗菌薬、例えばセフォキシチン;駆虫薬、例えばイベルメクチン;抗ウイルス薬、例えばアシクロビール;免疫抑制薬、例えばシクロスポリンA(環状ポリペプチドタイプ薬剤)、ステロイド、およびプロスタグランジン。
【0053】
本発明の上記および他の目的、特徴および利点は次の詳細な説明、添付の図面から明らかになる。
【図面の簡単な説明】
【0054】
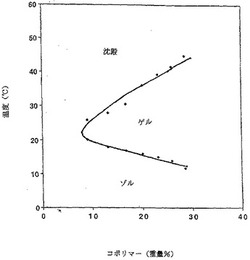
【図1】様々な濃度および温度において調べた、PLGA−PEG−PLGAトリブロックコポリマー水溶液のゲル化挙動を示す、相ダイアグラムである。
【図2a】図2aは様々な温度およびpHでインキュベートしたPLGA−PEG−PLGAトリブロックコポリマーのin vitro分解を示す分解分析グラフである。
【図2b】図2bは様々な温度およびpHでインキュベートしたPLGA−PEG−PLGAトリブロックコポリマーのin vitro分解を示す分解分析グラフである。
【図2c】図2cは様々な温度およびpHでインキュベートしたPLGA−PEG−PLGAトリブロックコポリマーのin vitro分解を示す分解分析グラフである。
【図3】PLGA−PEG−PLGAトリブロックコポリマーからの持続期間中のインスリンの連続放出を示すグラフである。
【図4】約50日間のパクリタクセルの蓄積調整放出を示す、PLGAPEG−PLGAトリブロックコポリマー温度ゲル製剤からのパクリタクセルの放出分析グラフである。
【発明を実施するための形態】
【0055】
本発明の好ましい態様を説明するために、64〜80重量%の疎水性Aブロック(ポリ(ラクチド−co−グリコリド))(PLGA)またはポリ(ラクチド)(PLA)および20〜36重量%の親水性Bブロック(ポリエチレングリコール)(PEG)からなる各種低分子量ABAブロックコポリマーの合成を行った。目的は、各々の重量平均分子量が約600〜2000のAブロックおよび重量平均分子量が約600〜2200のBブロックよりなる、重量平均分子量約2000〜4990のPLGA−PEG−PLGAまたはPLA−PEG−PLAトリブロックコポリマーの製造であった。各Aブロックは約30〜100モル%のラクテートおよび0〜70モル%のグリコレートからなる。
【0056】
以下は、本発明の好ましい態様を説明する実施例であるが、代表例にすぎない。
【実施例】
【0057】
実施例1
開環共重合によるPLGA−PEG−PLGAトリブロックコポリマーの合成
上記の反応スキームに従い、PEG(Mw =1000)を、窒素雰囲気下、トルエン(2×75ml)でのフラスコ内共沸蒸留によって乾燥し、次いで、真空下(5mmHg)、130℃で乾燥した。ラクチドおよびグリコリドモノマー(各々、モル比3:1)をフラスコに加え、次いでオクタン酸第1錫(0.1重量%)を加え、そして反応混合物を真空下(5mmHg)、150℃で加熱した。反応の進行はGPC(ゲル透過クロマトグラフィー)で追跡した。適当な時間の後、反応を停止し、フラスコを室温に冷却した。残渣を冷水に溶解し、70〜80℃に加熱して、形成したポリマーを沈殿させた。上澄みをデカントし、ポリマー残渣を冷水に再び溶解し、加熱して、沈殿させた。溶解した後に沈殿させるこのプロセスを3回繰り返した。最後に、ポリマーをできるだけ少ない量の水に溶解し、凍結乾燥させた。
【0058】
得られたPLGA−PEG−PLGAコポリマーの重量平均分子量(Mw )は3737、数平均分子量(Mn )は2928、Mw /Mn 比は1.3であった。このコポリマーは、実施例4でさらに詳しく記す逆熱的ゲル化特性を示した。
【0059】
実施例2
実施例1に示した基本的な手順に従って、他のトリブロックコポリマーを、同じPEG(Mw =1000)を用いるが、ラクチドおよび/またはグリコリド含量を変えて合成した。これらのトリブロックコポリマーの性質は次の表に示す:
【0060】
【表2】

【0061】
上記の表に示したポリマーは全て、ラクチド(LA)含量を30〜100モル%で、グリコリド(GA)含量を0〜70モル%で変えても、逆熱的ゲル化特性を有することが認められる。従って、PLGA−PEG−PLGAおよびPLA−PEG−PLAトリブロックはいずれもこの実施例において示されている。
【0062】
実施例3
重縮合によるPLGA−PEG−PLGAトリブロックコポリマーの合成
窒素送入口、温度計、および水除去用の蒸留ヘッドを備えた三つ口フラスコに、DL−乳酸およびグリコール酸(各々、3:1のモル比)を入れた。反応混合物を、3時間、大気圧で、その後は減圧(5mmHg)下で、撹拌しながら、窒素下、160℃で加熱した。反応の進行はGPCで追跡した。反応を適当な時間で停止し、形成されたポリマーを、ジクロロメタン溶液から大量のメタノールへ沈殿させることによって精製した。残渣をメタノール中で粉砕し、真空(0.05mmHg)下、23℃で乾燥させた。PLGAオリゴマーはGPC、IRおよびNMRで特性決定した。得られたPLGAオリゴマーの重量平均分子量(Mw )は9900、数平均分子量(Mn )は5500、Mw /Mn 比は1.8であった。
【0063】
PLGAをPEG(Mw =1000)と混合し、フラスコ内で窒素雰囲気下、160℃で加熱した。反応の進行はGPCで追跡した。適当な時間の後、反応を停止し、フラスコを室温に冷却した。残渣を冷水に溶解し、70〜80℃に加熱してコポリマーを沈殿させた。上澄みをデカントし、残渣を冷水に再び溶解し、加熱して、ポリマーを沈殿させた。溶解および沈殿のこのプロセスを、3回繰り返した。最後に、ポリマーをできるだけ少ない量の水に溶解し、凍結乾燥させた。
【0064】
得られたPLGA−PEG−PLGAコポリマーの重量平均分子量(Mw )は4043、数平均分子量(Mn )は2905、Mw /Mn 比は1.4であった。重量平均分子量および数平均分子量はGPCおよびNMRで各々測定した。ラクチド/グリコリド比はNMRデータから計算した。GPC分析は、RI検出および溶離剤としてのクロロホルムを用いるPEGで較正したStyragel HR-3 カラムで行った。NMRスペクトルは、Bruker200MHz 装置においてCDCl3 中で得た。NMRピーク決定で、トリブロックコポリマーABA構造を確認した。
【0065】
実施例4
実施例1のABAトリブロックコポリマー水溶液のゲル化挙動を、様々な濃度で調べた。9〜30重量%のポリマー溶液を水中で製造し、粘度変化は10〜60℃の温度で観察した。ゲル化は、ポリマー溶液のバイアルを逆さにしたとき、ポリマー溶液が容易に流れない物理的状態と定義した。温度およびトリブロックコポリマー濃度の関数とした実施例1のポリマーの相ダイアグラム(図1)を作った。新規な逆熱的ゲル化挙動は明白であり、トリブロックコポリマー溶液を加熱するにつれて生じた。生理学的温度(例えば、37℃)でのゲル化は特に効果的であり、薬剤送逹のための系を実質的に実用的なものにする基礎を形成した。
【0066】
実施例5
実施例1のPLGA−PEG−PLGAトリブロックコポリマーのin vitro分解を、30週にわたって、様々な温度(−10℃、5℃、23℃および37℃)および様々な初期pH(3.0、5.0および7.4)でインキュベートしたコポリマーの23重量%溶液またはゲル(1ml)について測定した。このトリブロックコポリマーの分解および生分解性は加水分解によって引き起こされ、最終分解生成物として乳酸、グリコール酸およびPEGを生じた。
【0067】
試料(50)は毎週採取した。試料は凍結乾燥し、クロロホルムに溶解し、ポリマー残渣の分子量を前記のようにGPCで測定した。ポリマーの分解は、3.0〜7.4の初期pHに実質的に無関係であり、これはポリマーが加水分解されて乳酸およびグリコール酸を形成するにつれて媒質が酸性化することに起因する。温度ゲル化挙動はずっと同じpH範囲であるpHにも無関係である。分解は温度が高いほど速かった。得られた分解分析図は、図2a、2bおよび2cに示す。
【0068】
実施例6
実施例1のポリマーの生分解を4週にわたって測定した。23重量%のトリブロックコポリマーを含有する冷水溶液の0.40〜0.45ml試料を、ラットの腹腔内に注射した。ポリマーのゲル化温度より上である体温に達したとき、目に明らかなゲル塊がただちに形成した。試料を時間の関数として手術で回収した。ゲルは2週間にわたってしだいに小さくなることが分かった。2週と4週との間で、注射したトリブロックコポリマーの物理的状態はゲルから、ゲルの粘性液中混合物へ、そして最終的には、ゲルが徐々に完全に再吸収されて、ゲルを含有しない粘性液へ変化した。4週間の終わりで、製剤は注射部位に見られなかった。顕微鏡によると、粘性液の小さいポケットが観察され、これはまたその後の2週間で完全に再吸収されたことが観察された。
【0069】
実施例7
パクリタクセルおよびシクロスポリンAは、水に非常に不溶性(溶解度は約4/ml)の疎水性薬剤である。しかしながら、これらの薬剤は、PLGA−PEG−PLGAトリブロックコポリマーの水溶液に溶解すると、かなり高い溶解度を示した。例えば、20重量%水性コポリマー溶液(実施例3のポリマー)では、パクリタクセルは5mg/ml まで、シクロスポリンAは2mg/ml まで溶解した。
【0070】
パクリタクセルおよびシクロスポリンAは、水性補助溶媒溶液(例えば、水/アセトニトリル溶液)中で非常に不安定であった。20重量%水性PLGA−PEG−PLGAトリブロックコポリマー溶液(すなわち、コポリマーのゲル化温度より低い温度)またはゲル(すなわち、コポリマーのゲル化温度より高い温度)のいずれかに含まれるパクリタクセルは、120日間貯蔵(5℃および37℃)後、>85%が損なわれず、一方、シクロスポリンAは100日間(5℃)にわたって安定であった。
【0071】
実施例8
実施例1のPLGA−PEG−PLGAトリブロックコポリマーの28重量%水溶液を製造した。真性糖尿病の治療において有益な効果が証明された非経口投与タンパク質であるインスリン(亜鉛非含有)を、トリブロックコポリマーのこの水溶液に懸濁して、最終濃度を5mg/ml にした。約2mlのこの組成物を37℃で平衡にした時計皿に置いた。組成物はただちにゲル化し、時計皿に付着した。これをpH7.4、37℃の10mMリン酸塩緩衝化食塩水に直接入れ、ゲルからのインスリンの放出速度を、UV検出および勾配溶離を用いる逆相HPLCによりモニターした。データは表3にグラフで示した。インスリンは約1週間、連続して放出された。持続期間中のタンパク質およびペプチドの調整放出におけるトリブロックコポリマー温度ゲルの有用性は、この実施例ではっきりと確かめられ、説明された。
【0072】
実施例9
実施例1のPLGA−PEG−PLGAトリブロックコポリマーの23重量%水溶液に、薬剤約2.0mg/ml とするのに十分なパクリタクセルを加えた。この溶液の2ml試料を時計皿に置き、37℃で平衡にした。温度はコポリマーのゲル化温度より高いので、時計皿にゲルが形成された。時計皿を、37℃で平衡にした2.4重量%のTween-80および4重量%のCremophor ELを含有するPBS(pH7.4)150mlを含む放出媒質の入った200mlビーカーに入れた。ビーカー内の溶液は撹拌した。ビーカーの上部は閉じて蒸発を防止した。全体を37℃のインキュベーターに入れた。放出については三重反復して調べた。様々な時間で放出媒質の5mlアリコートを採取し、パクリタクセルについて分析した。各アリコートを取り出した後、PBS溶液は新しいPBSに代えた。試料は1、2、4、8、18および24時間で、そしてその後は24時間間隔で集め、HPLCにより分析した。ゲルからのパクリタクセルの放出分析図は図4に示す。ゲル製剤の約50日間のパクリタクセルの放出調整はすばらしかった。
【0073】
実施例10
BABトリブロックコポリマーは、いすれかの末端に同じPEG Bブロック(Mw =550)を用いて合成したが、ポリ(ラクチド)および/またはポリ(ブリコリド)含量を変えた。PEGおよびPLGAはエステル、ウレタン、またはエステルおよびウレタン結合の組み合わせにより互いに結合させた。これらのトリブロックコポリマーの性質は次の表に示す:
【0074】
【表3】

【0075】
上記表に示した全てのPEG−PLGA−PEGトリブロックコポリマーは、逆熱的ゲル化特性を有していた。上記トリブロックポリマーのゾル/ゲル転移温度は、各々36、34、30および26℃であった。
【0076】
上の記載により、本技術分野における当業者は、逆熱的ゲル化特性を有する水溶液を形成するABA(例えば、PLGA−PEG−PLGAおよびPLA−PEG−PLA)またはBAB(例えば、PEG−PLGA−PEGおよびPEG−PLA−PEG)タイプのトリブロックコポリマーの製造、並びに薬剤送逹分野におけるこれの利用が可能になる。慣用的な薬剤(パクリタクセル)およびタンパク質薬剤(インスリン)の調整放出を実施例で説明して、トリブロックコポリマー水溶液から形成されるヒドロゲルの機能性を示したが、これらの記載は生分解性ブロックコポリマーに利用および添加することができるすべての薬剤を完全に記述したものではない。様々な種類の治療薬の多くの他の薬剤が、本発明のこの明細書に記載されたようなトリブロックコポリマーの水性組成物からの放出に十分に適していることは確かである。具体的に示したのは、製造しうる全てのブロックコポリマーでもなく、また重要な逆熱的ゲル化特性を示す全てのブロックコポリマーでもない。しかしながら、特許請求の範囲等によってのみ限定される本発明の範囲から逸脱することなく様々な変更が可能なことは、本技術分野における当業者にとって明らかなことである。
【0077】
これに限定されるわけではないが、本発明は以下の発明を包含する。
(1) 生分解性ABAまたはBABタイプのトリブロックポリマーであって、前記ABAトリブロックは、式:
[化4]
PL(G)z-1 A−PEG−PL(G)z-1 A
を有し、前記BABトリブロックは、式:
[化5]
PEG−PL(G)z-1 A−PEG
[式中、zは1または2の整数であり、AブロックはPL(G)z-1 Aで表される結果、zが2のときAブロックはポリ(ラクチド−co−グリコリド)またはPLGAコポリマーであり、zが1のときAブロックはポリ(ラクチド)またはPLAポリマーであり、Bブロックは親水性ポリエチレングリコールポリマーであるPEGで表される。]を有し、前記ブロックコポリマーが約2000〜4990の重量平均分子量を有しかつ逆熱的ゲル化特性を有するトリブロックポリマー。
(2) PL(G)z-1 A Aブロックが前記ポリマーの約51〜83重量%を構成し、PEG Bブロックが前記ポリマーの約17〜49重量%を構成する、(1)に記載のトリブロックポリマー。
(3) 該ポリマーがBABタイプである、(2)に記載のトリブロックポリマー。
(4) 該ポリマーがABAタイプである、(2)に記載のトリブロックポリマー。
(5) zが1である結果、AブロックがPLAポリマーである、(4)に記載のトリブロックポリマー。
(6) zが2である結果、AブロックがPLGAコポリマーとなる、(4)に記載のトリブロックポリマー。
(7) Aブロックが、約80〜20モル%のラクチドおよび約20〜80モル%のグリコリドを含むPLGAコポリマーである、(6)に記載のトリブロックポリマー。
(8) PLGA Aブロックがトリブロックコポリマーの約65〜78重量%を構成し、PEG Bブロックが前記トリブロックコポリマーの約22〜35重量%を構成する、(7)に記載のトリブロックポリマー。
(9) 各PLGA Aブロックの重量平均分子量が約600〜3000であり、各PEG Bブロックの重量平均分子量が約500〜2200である、(7)に記載のトリブロックポリマー。
(10) 逆熱的ゲル化特性を有する水性生分解性ポリマー薬剤送逹組成物であって、
(a)有効量の薬剤;および
(b)生分解性ABAまたはBABタイプのトリブロックポリマーであって、前記ABAトリブロックが、式:
[化6]
PL(G)z-1 A−PEG−PL(G)z-1 A
を有し、前記BABトリブロックが、式:
[化7]
PEG−PL(G)z-1 A−PEG
[式中、zは1または2の整数であり、AブロックはPL(G)z-1 Aで表される結果、zが2のときAブロックはポリ(ラクチド−co−グリコリド)またはPLGAコポリマーであり、zが1のときAブロックはポリ(ラクチド)またはPLAポリマーであり、Bブロックは親水性ポリエチレングリコールポリマーであるPEGで表される。]を有し、前記トリブロックポリマーの重量平均分子量が約2000〜4990であるトリブロックポリマーを、均質に含有する水性相を含んでなる組成物。
(11) 組成物のトリブロックポリマー含量が約3〜50重量%である、(10)に記載の水性ポリマー組成物。
(12) 該トリブロックポリマーにおいて、PL(G)z-1 A Aブロックが該ポリマーの約51〜83重量%を構成し、PEG Bブロックが前記ポリマーの約17〜49重量%を構成する、(11)に記載の水性ポリマー組成物。
(13) トリブロックポリマーがBABタイプである、(12)に記載の水性ポリマー組成物。
(14) 該ポリマーがABAタイプである、(12)に記載の水性ポリマー組成物。
(15) 該トリブロックポリマーにおいて、zが1である結果、AブロックがPLAポリマーである、(14)に記載の水性ポリマー組成物。
(16) 該トリブロックポリマーにおいて、zが2である結果、AブロックがPLGAコポリマーである、(14)に記載の水性ポリマー組成物。
(17) 該トリブロックポリマーにおいて、Aブロックが、約80〜20モル%のラクチドおよび約20〜80モル%のグリコリドを含むPLGAコポリマーである、(16)に記載の水性ポリマー組成物。
(18) 該トリブロックポリマーにおいて、PLGA Aブロックが前記トリブロックポリマーの約65〜78重量%を構成し、前記PEG Bブロックが前記トリブロックポリマーの約22〜35重量%を構成する、(17)に記載の水性ポリマー組成物。
(19) 該トリブロックポリマーにおいて、各PLGA Aブロックが約600〜3000の重量平均分子量を有し、各PEG Bブロックが約500〜2200の重量平均分子量を有する、(17)に記載の水性ポリマー組成物。
(20) 薬剤がポリペプチドまたはタンパク質である、(17)に記載の水性ポリマー組成物。
(21) ポリペプチドまたはタンパク質が、オキシトシン、バソプレシン、副腎皮質刺激性ホルモン、表皮成長因子、血小板誘導成長因子(PDGF)、プロラクチン、ルリベリン、黄体形成ホルモン放出ホルモン(LHRH)、LHRHアゴニスト、LHRHアンタゴニスト、成長ホルモン(人、豚、牛等)、成長ホルモン放出因子、インスリン、ソマトスタチン、グルカゴン、インターロイキン−2(IL−2)、インターフェロン−α,βまたはγ、ガストリン、テトラガストリン、ペンタガストリン、ウロガストロン、セクレチン、カルシトニン、エンケファリン、エンドルフィン、アンギオテンシン、チロトロピン放出ホルモン(TRH)、腫瘍壊死因子(TNF)、神経成長因子(NGF)、顆粒球−コロニー刺激因子(G−CSF)、顆粒球マクロファージ−コロニー刺激因子(GM−CSF)、マクロファージ−コロニー刺激因子(M−CSF)、ヘパリナーゼ、骨形態発生タンパク質(BMP)、hANP、グルカゴン様ペプチド(GLP−1)、インターロイキン−11(IL−11)、レニン、ブラジキニン、バシトラシン、ポリミキシン、コリスチン、チロシジン、グラミシジン、シクロスポリン、並びにそれらの合成類似体、変性体、および薬理学的に活性なそれらのフラグメント、酵素、サイトカイン、モノクローナル抗体およびワクチンよりなる群から選択されるものである、(20)に記載の水性ポリマー組成物。
(22) 組成物の薬剤含量が約0.01〜20重量%である、(21)に記載の水性ポリマー組成物。
(23) 薬剤が抗癌剤または抗細胞増殖薬である、(17)に記載の水性ポリマー組成物。
(24) 薬剤が、マイトマイシン、ブレオマイシン、BCNU、カルボプラチン、ドキソルビシン、ダウノルビシン、メトトレキセート、パクリタクセル、タキソテレ、アクチノマイシンDおよびカンプトテシンよりなる群から選択される抗癌剤である、(23)に記載の水性ポリマー組成物。
(25) 組成物の薬剤含量が約0.01〜20重量%である、(24)に記載の水性ポリマー組成物。
(26) 薬剤を制御された放出形態で温血動物に投与する方法であって、
(i)逆熱的ゲル化特性を有する水性生分解性ポリマー薬剤送逹組成物であって、
(a)有効量の薬剤;および
(b)生分解性ABAまたはBABタイプのトリブロックポリマーであって、前記ABAトリブロックが、式:
[化8]
PL(G)z-1 A−PEG−PL(G)z-1 A
を有し、前記BABトリブロックが、式:
[化9]
PEG−PL(G)z-1 A−PEG
[式中、zは1または2の整数であり、AブロックはPL(G)z-1 Aで表される結果、zが2のときAブロックはポリ(ラクチド−co−グリコリド)またはPLGAコポリマーであり、zが1のときAブロックはポリ(ラクチド)またはPLAポリマーであり、Bブロックは親水性ポリエチレングリコールポリマーであるPEGで表される。]を有し、前記トリブロックポリマーの重量平均分子量が約2000〜4990であるトリブロックポリマーを均質に含有する水性相を含んでなる組成物を準備すること;
(ii)前記組成物をトリブロックポリマーのゲル化温度より下の温度で液体として維持すること;そして
(iii)前記組成物を液体として前記温血動物へ投与し、その後に前記組成物の温度が前記動物の体温により前記トリブロックポリマーのゲル化温度より高い温度に上昇するにつれてゲルが形成されること
を含んでなる方法。
(27) 投与が、非経口、眼、局所、吸入、経皮、膣、口腔、経粘膜、経尿道、直腸、鼻、口、肺または耳による、(26)に記載の方法。
(28) 組成物のトリブロックポリマー含量が約3〜50重量%である、(27)に記載の方法。
(29) 該トリブロックポリマーにおいて、PL(G)z-1 A Aブロックが前記ポリマーの約51〜83重量%を構成し、PEG Bブロックが前記ポリマーの約17〜49重量%を構成する、(28)に記載の方法。
(30) 該トリブロックポリマーがBABタイプである、(29)に記載の方法。
(31) 該トリブロックポリマーがABAタイプである、(29)に記載の方法。
(32) 該トリブロックポリマーにおいて、zが1である結果、AブロックがPLAポリマーである、(31)に記載の方法。
(33) 該トリブロックポリマーにおいて、zが2である結果、AブロックがPLGAコポリマーである、(31)に記載の方法。
(34) 該トリブロックポリマーにおいて、Aブロックが、約80〜20モル%のラクチドおよび約20〜80モル%のグリコリドを含むPLGAコポリマーである、(33)に記載の方法。
(35) 該トリブロックポリマーにおいて、PLGA Aブロックがトリブロックポリマーの約65〜78重量%を構成し、PEG Bブロックがトリブロックポリマーの約22〜35重量%を構成する、(34)に記載の方法。
(36) 該トリブロックポリマーにおいて、各PLGA Aブロックが約600〜3000の重量平均分子量を有し、各PEG Bブロックが約500〜2200の重量平均分子量を有する、(35)に記載の方法。
(37) 投与される薬剤がポリペプチドまたはタンパク質である、(34)に記載の方法。
(38) ポリペプチドまたはタンパク質が、オキシトシン、バソプレシン、副腎皮質刺激性ホルモン、表皮成長因子、血小板誘導成長因子(PDGF)、プロラクチン、ルリベリン、黄体形成ホルモン放出ホルモン(LHRH)、LHRHアゴニスト、LHRHアンタゴニスト、成長ホルモン(人、豚、牛等)、成長ホルモン放出因子、インスリン、ソマトスタチン、グルカゴン、インターロイキン−2(IL−2)、インターフェロン−α,βまたはγ、ガストリン、テトラガストリン、ペンタガストリン、ウロガストロン、セクレチン、カルシトニン、エンケファリン、エンドルフィン、アンギオテンシン、チロトロピン放出ホルモン(TRH)、腫瘍壊死因子(TNF)、神経成長因子(NGF)、顆粒球−コロニー刺激因子(G−CSF)、顆粒球マクロファージ−コロニー刺激因子(GM−CSF)、マクロファージ−コロニー刺激因子(M−CSF)、ヘパリナーゼ、骨形態発生タンパク質(BMP)、hANP、グルカゴン様ペプチド(GLP−1)、インターロイキン−11(IL−11)、レニン、ブラジキニン、バシトラシン、ポリミキシン、コリスチン、チロシジン、グラミシジン、シクロスポリン、並びにそれらの合成類似体、変性体、および薬理学的に活性なそれらのフラグメント、酵素、サイトカイン、モノクローナル抗体およびワクチンよりなる群から選択されるものである、(37)に記載の方法。
(39) 前記組成物の薬剤含量が約0.01〜20重量%である、(37)に記載の方法。
(40) 投与される薬剤が抗癌剤または抗細胞増殖薬である、(34)に記載の方法。
(41) 薬剤が、マイトマイシン、ブレオマイシン、BCNU、カルボプラチン、ドキソルビシン、ダウノルビシン、メトトレキセート、パクリタクセル、タキソテレ、アクチノマイシンDおよびカンプトテシンよりなる群から選択される抗癌剤である、(40)に記載の方法。
(42) 前記組成物の薬剤含量が約0.01〜20重量%である、(40)に記載の方法。
(43) 薬剤の溶解度を高める方法であって、有効量の前記薬剤を逆熱的ゲル化特性を有する水性生分解性ポリマー薬剤送逹組成物に均質に混合することを含む方法であり、前記水性組成物が、生分解性ABAまたはBABタイプのトリブロックポリマーを均質に含有する水性相を含んでなり、前記ABAトリブロックが、式:
[化10]
PL(G)z-1 A−PEG−PL(G)z-1 A
を有し、前記BABトリブロックが、式:
[化11]
PEG−PL(G)z-1 A−PEG
[式中、zは1または2の整数であり、AブロックはPL(G)z-1 Aで表される結果、zが2のときAブロックはポリ(ラクチド−co−グリコリド)またはPLGAコポリマーであり、zが1のときAブロックはポリ(ラクチド)またはPLAポリマーであり、Bブロックは親水性ポリエチレングリコールポリマーであるPEGで表される。]を有し、前記トリブロックポリマーの重量平均分子量が約2000〜4990である方法。
(44) 前記組成物のトリブロックポリマー含量が約3〜50重量%である、(43)に記載の方法。
(45) 該トリブロックポリマーにおいて、PL(G)z-1 A Aブロックが前記ポリマーの約51〜83重量%を構成し、PEG Bブロックが前記ポリマーの約17〜49重量%を構成する、(44)に記載の方法。
(46) 該トリブロックポリマーがBABタイプである、(45)に記載の方法。
(47) 該トリブロックポリマーがABAタイプである、(45)に記載の方法。
(48) 該トリブロックポリマーにおいて、zが1である結果、AブロックがPLAポリマーである、(47)に記載の方法。
(49) 該トリブロックポリマーにおいて、zが2である結果、AブロックがPLGAコポリマーである、(47)に記載の方法。
(50) 該トリブロックポリマーにおいて、Aブロックが、約80〜20モル%のラクチドおよび約20〜80モル%のグリコリドを含むPLGAコポリマーである、(49)に記載の方法。
(51) 該トリブロックポリマーにおいて、PLGA Aブロックがトリブロックポリマーの約65〜78重量%を構成し、PEG Bブロックがトリブロックポリマーの約22〜35重量%を構成する、(50)に記載の方法。
(52) 該トリブロックポリマーにおいて、各PLGA Aブロックが約600〜3000の重量平均分子量を有し、各PEG Bブロックが約500〜2200の重量平均分子量を有する、(51)に記載の方法。
(53) 薬剤がポリペプチドまたはタンパク質である、(50)に記載の方法。
(54) ポリペプチドまたはタンパク質が、オキシトシン、バソプレシン、副腎皮質刺激性ホルモン、表皮成長因子、血小板誘導成長因子(PDGF)、プロラクチン、ルリベリン、黄体形成ホルモン放出ホルモン(LHRH)、LHRHアゴニスト、LHRHアンタゴニスト、成長ホルモン(人、豚、牛等)、成長ホルモン放出因子、インスリン、ソマトスタチン、グルカゴン、インターロイキン−2(IL−2)、インターフェロン−α,βまたはγ、ガストリン、テトラガストリン、ペンタガストリン、ウロガストロン、セクレチン、カルシトニン、エンケファリン、エンドルフィン、アンギオテンシン、チロトロピン放出ホルモン(TRH)、腫瘍壊死因子(TNF)、神経成長因子(NGF)、顆粒球−コロニー刺激因子(G−CSF)、顆粒球マクロファージ−コロニー刺激因子(GM−CSF)、マクロファージ−コロニー刺激因子(M−CSF)、ヘパリナーゼ、骨形態発生タンパク質(BMP)、hANP、グルカゴン様ペプチド(GLP−1)、インターロイキン−11(IL−11)、レニン、ブラジキニン、バシトラシン、ポリミキシン、コリスチン、チロシジン、グラミシジン、シクロスポリン、並びにそれらの合成類似体、変性体、および薬理学的に活性なそれらのフラグメント、酵素、サイトカイン、モノクローナル抗体およびワクチンよりなる群から選択されるものである、(53)に記載の方法。
(55) 該組成物の薬剤含量が約0.01〜20重量%である、(53)に記載の方法。
(56) 投与される薬剤が抗癌剤または抗細胞増殖薬である、(50)に記載の方法。
(57) 薬剤が、マイトマイシン、ブレオマイシン、BCNU、カルボプラチン、ドキソルビシン、ダウノルビシン、メトトレキセート、パクリタクセル、タキソテレ、アクチノマイシンDおよびカンプトテシンよりなる群から選択される抗癌剤である、(56)に記載の方法。
(58) 該組成物の薬剤含量が約0.01〜20重量%である、(56)に記載の方法。
(59) 有効量の薬剤を、逆熱的ゲル化特性を有する水性生分解性ポリマー薬剤送逹組成物に均質に混合することを含む、薬剤の安定性を高める方法であって、前記水性組成物は、生分解性ABAまたはBABタイプトリブロックポリマーを均質に含有する水性相を含んでなり、前記ABAトリブロックが、式:
[化12]
PL(G)z-1 A−PEG−PL(G)z-1 A
を有し、前記BABトリブロックが、式:
[化13]
PEG−PL(G)z-1 A−PEG
[式中、zは1または2の整数であり、AブロックはPL(G)z-1 Aで表される結果、zが2のときAブロックはポリ(ラクチド−co−グリコリド)またはPLGAコポリマーであり、zが1のときAブロックはポリ(ラクチド)またはPLAポリマーであり、Bブロックは親水性ポリエチレングリコールポリマーであるPEGで表される。]を有し、前記トリブロックポリマーの重量平均分子量が約2000〜4990である方法。
(60) 前記組成物のトリブロックポリマー含量が約3〜50重量%である、(59)に記載の方法。
(61) 該トリブロックポリマーにおいて、PL(G)z-1 A Aブロックが前記ポリマーの約51〜83重量%を構成し、PEG Bブロックが前記ポリマーの約17〜49重量%を構成する、(60)に記載の方法。
(62) 該トリブロックポリマーがBABタイプである、(61)に記載の方法。
(63) 該トリブロックポリマーがABAタイプである、(61)に記載の方法。
(64) 該トリブロックポリマーにおいて、zが1である結果、AブロックがPLAポリマーである、(63)に記載の方法。
(65) 該トリブロックポリマーにおいて、zが2である結果、AブロックがPLGAコポリマーである、(63)に記載の方法。
(66) 該トリブロックポリマーにおいて、Aブロックが、約80〜20モル%のラクチドおよび約20〜80モル%のグリコリドを含むPLGAコポリマーである、(65)に記載の方法。
(67) 該トリブロックポリマーにおいて、PLGA Aブロックがトリブロックポリマーの約65〜78重量%を構成し、PEG Bブロックがトリブロックポリマーの約22〜35重量%を構成する、(66)に記載の方法。
(68) 該トリブロックポリマーにおいて、各PLGA Aブロックの重量平均分子量が約600〜3000であり、各PEG Bブロックの重量平均分子量が約500〜2200である、(67)に記載の方法。
(69) 薬剤がポリペプチドまたはタンパク質である、(66)に記載の方法。
(70) ポリペプチドまたはタンパク質が、オキシトシン、バソプレシン、副腎皮質刺激性ホルモン、表皮成長因子、血小板誘導成長因子(PDGF)、プロラクチン、ルリベリン、黄体形成ホルモン放出ホルモン(LHRH)、LHRHアゴニスト、LHRHアンタゴニスト、成長ホルモン(人、豚、牛等)、成長ホルモン放出因子、インスリン、ソマトスタチン、グルカゴン、インターロイキン−2(IL−2)、インターフェロン−α,βまたはγ、ガストリン、テトラガストリン、ペンタガストリン、ウロガストロン、セクレチン、カルシトニン、エンケファリン、エンドルフィン、アンギオテンシン、チロトロピン放出ホルモン(TRH)、腫瘍壊死因子(TNF)、神経成長因子(NGF)、顆粒球−コロニー刺激因子(G−CSF)、顆粒球マクロファージ−コロニー刺激因子(GM−CSF)、マクロファージ−コロニー刺激因子(M−CSF)、ヘパリナーゼ、骨形態発生タンパク質(BMP)、hANP、グルカゴン様ペプチド(GLP−1)、インターロイキン−11(IL−11)、レニン、ブラジキニン、バシトラシン、ポリミキシン、コリスチン、チロシジン、グラミシジン、シクロスポリン、並びにそれらの合成類似体、変性体、および薬理学的に活性なそれらのフラグメント、酵素、サイトカイン、モノクローナル抗体およびワクチンよりなる群から選択されるものである、(69)に記載の方法。
(71) 該組成物の薬剤含量が約0.01〜20重量%である、(69)に記載の方法。
(72) 投与される薬剤が抗癌剤または抗細胞増殖薬である、(66)に記載の方法。
(73) 薬剤が、マイトマイシン、ブレオマイシン、BCNU、カルボプラチン、ドキソルビシン、ダウノルビシン、メトトレキセート、パクリタクセル、タキソテレ、アクチノマイシンDおよびカンプトテシンよりなる群から選択される抗癌剤である、(72)に記載の方法。
(74) 前記組成物の薬剤含量が約0.01〜20重量%である、(72)に記載の方法。
【技術分野】
【0001】
本発明は、疎水性ブロックの重量%濃度が高い水溶性低分子量感熱生分解性ブロックコポリマー、および薬剤を非経口、眼、局所、経皮、膣、口腔、経粘膜、肺、経尿道、直腸、鼻、口、または耳投与するためのそれらの使用に関する。本発明は、以下に詳しく記すポリ(ラクチド−co−グリコリド)またはポリ(ラクチド)およびポリエチレングリコールブロックに基づく感熱生分解性トリブロックポリマーの使用によって可能となる。この系は、分子量が比較的低くかつ疎水性ブロックポリマー含量が比較的高いブロックコポリマーの選択されたグループが、5〜25℃またはその付近の温度の水中では透明な溶液として存在するが、温度を体温(一般に、人の場合は37℃)近くに上げると、自発的に相互作用して、水を高い割合でゲルネットワーク内に取り込んで含有するが、依然として水に実質的に不溶性である、半固体ヒドロゲル(すなわち、ゲル)を形成するという発見に基づく。
【背景技術】
【0002】
近年、各種治療に有効な多くのペプチド/タンパク質薬剤が、組み換えDNAおよび他の技術の進歩により商業的に入手しうるようになってきた。しかしながら、ポリペプチドまたはタンパク質のように、高分子量であり、胃腸管で分解され、体内における半減期が短いものの投与ルートは、静脈内または筋肉内のような非経口投与および皮下注射に限られている。多くのペプチド薬剤は慣用的な液体担体中の溶解性および/または安定性が限られていて、配合および投与が難しい。また、多くの場合、期待される治療効果を長期間得るために非常に多くの投与が必要とされる。これらの薬剤の実際の使用および進歩したバイオテクノロジーによって得られる薬剤の利用には、そのようなポリペプチドまたはタンパク質の長期調整放出が必須である。別の問題は患者の協力である。特に慢性疾患に対する処方のとき、および薬剤に激しい副作用があるとき、所定の投与法に患者を従わせるのが難しいことがよくある。従って、治療効力を最適なものにし、副作用および毒性を最少限にし、それによって効力を高めかつ患者の協力を大いに得るために、薬剤、特にポリペプチドおよびタンパク質薬剤を上記の問題なしで、持続期間にわたって調整された速度で放出するシステムを提供することが非常に望ましい。
【0003】
薬剤添加ポリマー製剤および投与形態は、様々な疾患の長間治療のために研究されてきた。このポリマーの重要な性質は生分解性であり、生分解性とは、薬剤の放出と同時にまたは全薬剤の放出後に、ポリマーが体内で非毒性成分に分解または崩壊しうることを意味する。さらに、製剤の製造および薬剤の添加に用いられる技術、手順、溶媒および他の添加剤は、患者にとって安全であり、周囲組織への刺激ができるだけ少なく、かつ薬剤に適合した媒質となる投与形態が得られるものであるべきである。一般に、生分解性のインプラント可能な調整放出製剤は、ポリグリコール酸、ポリ乳酸、またはグリコール酸と乳酸とのコポリマーのような固体ポリマーから製造される。これらのポリマーは疎水性であるため、これらの物質を用いる薬剤添加および製剤製造には有機溶媒、例えば塩化メチレン、クロロホルム、酢酸またはジメチルホルムアミドが必要である。いくつかの溶媒は毒性であるため、このプロセスの後に長時間の乾燥が一般に必要であることは、明らかである。たいていの場合、最終ポリマー製剤は、しばしば手術による外傷を伴うインプラントを必要とする様々な固体形(例えば、球、スラブまたはロッド)で製造される。
【0004】
現在、生物適合性、明示された劣化の道筋、および劣化生成物の安全性のような厳しい規定要件があるため、ペプチドおよびタンパク質薬剤を含む薬剤の調整放出に用いうる合成または天然ポリマー物質はほとんどない。利用しうる毒物学的および臨床的データに基づいて最も広く研究かつ開発された生分解性ポリマーは、脂肪族ポリ(α−ヒドロキシ酸)、例えばポリ(D,L−またはL−乳酸)(PLA)およびポリ(グリコール酸)(PGA)並びにそれらのコポリマー(PLGA)である。これらのポリマーは商業的に入手することができ、現在、生体再吸収性縫合糸として用いられている。FDAが承認したロイプロライドアセテートの調整放出用の系であるLupron Depot(登録商標)も、PLGAコポリマーに基づいている。Lupron Depot(登録商標)は注射可能な微小球からなり、これらは前立腺癌の治療のために長期間(例えば、約30日)にわたってロイプロライドアセテートを放出する。この使用履歴に基づいて、PLGAコポリマーは、生分解性担体を用いる非経口調整放出薬剤送逹系の初期の設計に選ばれた物質であった。
【0005】
わずかに成功したものがあるが、これらのポリマーはそれらの物理化学的性質および製造法にも問題がある。ポリペプチドのような親水性巨大分子は疎水性マトリックスまたはポリラクチド膜を通しての拡散が困難である。PLAおよびPLGAを用いる薬剤添加および製剤製造は毒性有機溶媒をしばしば必要とし、その固体投与形態は組織刺激を機械的に引き起こしうる。
【0006】
A. S. Sawhney およびJ. A. Hubbell 、J. Biomed. Mat. Res.、24、1197−1411(1990)は、in vitroで迅速に劣化するD,L−ラクチド、グリコリドおよびε−カプロラクトンのターポリマーを合成した。例えば、60%グリコリド、30%ラクチドおよび10%ε−カプロラクトンのターポリマー組成物は、半減期が17日である。この物質の親水性は、ポロキサマー界面活性剤(PluronicF−68)との共重合によって増加した。このポロキサマーは、約80重量%の比較的疎水性のポリ(オキシプロピレン)ブロックおよび20重量%の親水性ポリ(オキシエチレン)ブロックを含むブロックコポリマーである。ポロキサマーとの共重合で、生理学的温度(例えば、37℃)の水中で機械的に安定したより強力なかつ部分的に結晶質の物質が生じた。このコポリマーの半減期は基本ポリマーと比べて少し増加した。しかしながら、ポロキサマータイプの界面活性剤は生分解性ではない。
【0007】
注射可能なまたはインプラント可能なポリマー薬剤送逹製剤としての使用に最適な物質は、生分解性で、親水性または疎水性薬剤と適合性であるべきであり、そして扱いやすい安全な溶媒、例えば水で製造することができ、投与後に追加の重合または他の共有結合形成反応を必要としない。
【0008】
水溶液で製造することができる1つの系は、上記のブロックコポリマーの種類であり、Pluronicの登録商標で販売されている。これらのコポリマーは2種類のポリマーブロック、すなわち、親水性ポリ(オキシエチレン)ブロックおよび疎水性ポリ(オキシプロピレン)ブロックからなり、ポリ(オキシエチレン)−ポリ(オキシプロピレン)−ポリ(オキシエチレン)のトリブロックからなる。トリブロックコポリマーは水を吸収して、逆熱的ゲル化挙動を示すゲルを形成する。しかしながら、Pluronic(登録商標)系は生分解性ではなく、ゲルの性質 (水溶性ゲル)およびこれらのゲルからの薬剤放出速度(非常に速い)が有用でないことは証明されており、かなりの改良を必要とする。
【0009】
水溶性ポリペプチドを溶液に混和するのに用いうる親水性生分解性物質が強く求められている。A. S. Sawhney 等、Macromolecules、第26巻、4号、581−589(1993)は、オリゴ(D,L−乳酸)またはオリゴ(グリコール酸)のようなα−ヒドロキシ酸のオリゴマーで広がり、アクリレート基で終わる、ポリエチレングリコール中心ブロックを有するマクロマーを合成した。非毒性光重合開始剤を用いると、これらのマクロマーは可視光線で急速に重合することができる。マクロマーの多官能基により、重合で架橋ゲルが形成する。ゲルは、オリゴ(α−ヒドロキシ酸)領域の加水分解で、ポリエチレングリコール、α−ヒドロキシ酸、およびオリゴ(アクリル酸)に劣化し、それらの劣化速度はオリゴ(α−ヒドロキシ酸)の適切な選択により1日以内から4カ月までで調整することができる。しかしながら、この系では、追加成分である光重合開始剤、並びに追加共有結合形成光架橋反応が用いられる。人によって皮膚の厚さおよび透明度が異なるため、この方法では人により性能が非常に異なる。
【0010】
岡田等、日本特許2−78629(1990)は、ポリ(乳酸)(PLA)またはポリ(乳酸)/グリコール酸(PLGA)およびポリエチレングリコール
(PEG)のエステル交換によって生分解性ブロックコポリマー物質を合成した。分子量範囲は、PLGAが400〜5,000、PEGが200〜2,000である。混合物を100〜250℃で1〜20時間、窒素雰囲気下で加熱した。生成物は水混和性であり、ヒドロゲルを形成した;しかしながら、室温以上の水中では沈殿した。つまり、水への溶解度およびインターポリマー鎖相互作用は温度と共に変化した。このポリマーは以下で論じるChurchill の特許に記載のポリマーと似ており、水性懸濁液として用いられたり、またはインプラント用の固体ブロックに形成される。このポリマーが逆熱的ゲル化特性を示して、ポリマーのコロイド懸濁液としてではなく、溶液として注射されることを示す記載はない。
【0011】
T. Matsuda、ASAIO Journal 、M512−M517(1993)は、生分解性ポリマーゲルを用い、有効なペプチジル抗増殖剤であるアンギペプチンを放出して、病気の血管を人工移植片で置き換えたときまたは血管内製剤で治療したときに生じる筋内膜増殖を防いだ。ポリ(乳酸)およびポリエチレングリコール(PLA−PEG)ブロックセグメントからなるブロックコポリマーの非常に粘稠な液体は、その場で被覆可能な薬剤担体として用いられた。この物質は日本の兵庫のタキ・ケミカル社から供給された。0.5gのPLA−PEGおよび0.5mgのアンギオペプチンからなるポリマーゲルからのアンギオペプチンの長期放出は、ゲルを37℃に維持した緩衝溶液中に保持したとき、数週間にわたってin vitroで観察された。アンギオペプチンの早期の急な放出は観察されなかった。これらの結果に基づいて、生体内の損傷血管を被覆した生分解性ポリマーゲルからの局所持続アンギオペプチン放出が有効であることが理論づけられた。
【0012】
L. Martini等、J. Chem. Soc. 、Faraday Trans.、90(13)、1961−1966(1994)は、エステル結合を含む加水分解鎖分離によりin vivo 劣化されることが知られている疎水性ポリ(ε−カプロラクトン)を組み込むことにより非常に低分子量のABAタイプのトリブロックコポリマーを合成し、PCL−PEG−PCLブロックコポリマーの溶液特性を報告している。ブロックコポリマーの水溶液をゆっくり加熱すると、曇るのが目で観察された。コポリマーの2重量%水溶液の曇点は、PCL−PEG−PCL(450:4000:450)およびPCL−PEG−PCL(680:4000:680)の場合、各々65℃および55℃であった。PCL−PEG−PCL(680:4000:680)の溶液の冷却時の可逆ゲル化は、25℃での13%〜80℃での30%の臨界濃度および温度で観察された。溶液を0℃へさらに冷却したとき、より低いゲル/ゾル転移は観察されなかった。PCL−PEG−PCL(680:4000:680)の in vitro 劣化速度は非常に遅い。16週間中のモル量の減少はわずか約20%(GPCから)であることが観察された。そのように遅い劣化は、実際の薬剤送逹賦形剤には不十分である。
【0013】
Churchill 等、米国特許第4,526,936号および第4,745,160号は、いずれかが自己分散性であるか、あるいは水溶液中で自己分散性となりうるコポリマーを示している。これらのコポリマーは、疎水性Aブロック、例えばポリラクチド(PLA)またはポリ(ラクチド−co−グリコリド)(PLGA)、および親水性Bブロック、例えばポリエチレングリコール(PEG)またはポリビニルピロリドンよりなる、ABAトリブロックまたはABブロックコポリマーである。好ましくは、有機溶媒なしで水に自己分散性であるには、これらのポリマーは、疎水性(Aブロック)成分と比べて、50重量%を越える親水性(Bブロック)成分を含有しなければならないか、あるいは疎水性成分(Aブロック)の重量平均分子量が5,000未満であるコポリマーでなければならない。重量平均分子量が1000のように低いポリマーの記述があるが、そのようなポリマーの直接的な教示、あるいは分子量が5000未満のABAタイプポリマーが機能することの直接的な教示はない。さらに、疎水性成分が少なくとも50重量%の高分子量ポリマー以外のABAタイプポリマーは例示されていない。これらのブロックコポリマーが有機溶媒を使用せずにどのような温度の水溶液にも可溶性であることの記載も、また薬剤/ポリマーを液剤として投与しうる記載もない。むしろ、ポリマーのコロイド懸濁液としての投与が開示されていたり、薬剤/ポリマー分散液を粉剤に凍結乾燥し、圧縮成形によって加工してインプラント可能な貯蔵物としての使用に適した固形剤を形成している。水性薬剤/ポリマー懸濁液または分散液は、分散ポリマー相が連続水性相に懸濁されている2相系である。そのような分散液は、バクテリアまたは他の毒性粒状物質の除去に殺菌濾過工程が必要とされる状況での使用には適していない。というのは、そのような工程は薬剤/ポリマー粒子も除去し、その結果、治療投与量に満たなくなるからである。水溶性でありかつ温度によってゲルとなるABAタイプブロックコポリマーは、Churchill 等の特許に含まれていない。
【0014】
上記の議論から、公知の熱的可逆性ゲル(例えば、Pluronics (登録商標))が薬剤送逹系として本来有用でないことが分かるはずである。逆熱的ゲル化特性を有するブロックコポリマーの記載はあるが、これらのゲルには、持続期間中の薬剤放出の調整に必要な重要な特性が欠けており、そしてそれらは非生分解性であるため、毒性または生体適合性に関する問題が存在する。従って、逆熱的ゲル化の性質は薬剤送逹分野において特有かつ潜在的に非常に有用であると一般に認められているが、さらに、実行可能な系に必要な性質を有する系に開発する必要がある。
【先行技術文献】
【特許文献】
【0015】
【特許文献1】日本特許2−78629(1990)
【特許文献2】米国特許第4,526,936号
【特許文献3】米国特許第4,745,160号
【非特許文献】
【0016】
【非特許文献1】J. Biomed. Mat. Res.、24、1197−1411(1990)
【非特許文献2】Macromolecules、第26巻、4号、581−589(1993)
【非特許文献3】ASAIO Journal 、M512−M517(1993)
【非特許文献4】J. Chem. Soc. 、Faraday Trans.、90(13)、1961−1966(1994)
【発明の概要】
【発明が解決しようとする課題】
【0017】
本発明の目的は、生分解性であり、逆熱的ゲル化挙動を示す、すなわち、低温では溶液として存在し、生理学的関連温度では逆にゲルを形成し、そして良好な薬剤放出特性をもたらす、低分子量トリブロックコポリマー薬剤送逹系を提供することである。
【0018】
本発明の別の目的は、親水性および疎水性薬剤、ペプチドおよびタンパク質薬剤、およびオリゴヌクレオチドの非経口投与のための薬剤送逹系を提供することである。
本発明のさらに別の目的は、薬剤が制御された速度で放出される体内でのゲル貯蔵物を形成することになる、生分解性ポリマーマトリックス中の薬剤の非経口投与法を提供することである。
【課題を解決するための手段】
【0019】
これらのおよび他の目的は、ポリ(ラクチド−co−グリコリド)(PLGA)ブロックコポリマーまたはポリ(ラクチド)(PLA)ポリマーからなる約51〜83重量%の疎水性Aブロック、およびポリエチレングリコールからなる約17〜49重量%の親水性Bポリマーブロックよりなる、平均分子量が約2000〜4990の生分解性ABAまたはBABタイプのブロックコポリマーによって達成される。ポリエチレングリコール(PEG)は、ポリ(エチレンオキシド)(PEO)またはポリ(オキシエチレン)とも呼ばれ、この用語は本発明では置き換えて用いてもよい。疎水性Aブロックにおいて、ラクテート含量は約30〜100モル%、好ましくは約30〜80モル%、最も好ましくは約50〜80モル%である。グリコレート含量は約0〜70モル%、好ましくは約20〜70モル%、最も好ましくは約20〜50モル%である。
【0020】
本発明のさらに別の目的および利点は、本発明を構成する様々な態様についての次の要旨および詳細な説明から明らかになる。
ここで用いられるように、次の用語は以下の意味を有する:
「非経口」とは、筋肉内、腹膜内、腹腔内、皮下、そして可能な程度までの静脈内および動脈内を意味する。
【0021】
「ゲル化温度」とは、生分解性ブロックコポリマーが逆熱的ゲル化を行う温度、すなわち、その温度より下ではブロックコポリマーが水溶性であり、その温度より上ではブロックコポリマーが相転移して、粘度が上昇するか、あるいは半固体ゲルを形成する温度を意味する。
【0022】
「ゲル化温度」および「逆熱的ゲル化温度」等の用語は、置き換えて用いることができ、ゲル化温度のことを指す。
「ポリマー溶液」、「水溶液」等とは、そのような溶液に含まれる生分解性ブロックコポリマーに関して用いられるとき、機能濃度でそこに溶解したそのようなブロックコポリマーを有し、かつそのブロックコポリマーのゲル化温度より下の温度に維持されている、水をベースにした溶液を意味する。
【0023】
「逆熱的ゲル化」とは、ブロックコポリマー溶液の温度をそのコポリマーのゲル化温度より上に上げるにつれて、ブロックコポリマー溶液の粘度が自発的に増加し、そして多くの場合、半固体ゲルに変わる現象である。本発明において、「ゲル」という用語には、ゲル化温度より上の温度で存在する半固体ゲル状態および高粘度状態の両方が含まれる。ゲル化温度より下の温度に冷却すると、ゲルは自発的に逆戻りして再びより低粘性の溶液を形成する。ゾル/ゲル転移はポリマー系の化学組成の変化を伴わないので、溶液とゲルとの間のこの循環は無限に繰り返される。ゲルを形成する全ての相互作用は本来物理的なものであって、共有結合の形成または切断を伴わない。
【0024】
「薬剤送逹液」または「逆熱的ゲル化特性を有する薬剤送逹液」とは、温度がブロックコポリマーのゲル化温度にまたはそれより上の温度に上がったとき、ゲル化薬剤貯蔵物を形成する、温血動物への投与に適した薬剤(薬剤自体は溶解されてもコロイド状となってもよい)を含有するポリマー溶液を意味する。
【0025】
「貯蔵物」とは、温度がゲル化温度にまたはそれより上の温度に上がったときにゲルを形成した、温血動物への投与後の薬剤送逹液を意味する。
「ゲル」とは、「ポリマー溶液」または「薬剤送逹液」の温度をブロックコポリマーのゲル化温度にまたはそれより上の温度に上げるにつれて、自発的に生じる半固体相を意味する。
【0026】
「水性ポリマー組成物」とは、薬剤および生分解性ブロックコポリマーを均質に含有する水相を含む薬剤送逹液またはゲルを意味する。ゲル化温度より下の温度では、コポリマーは水相に可溶性であるので、その組成物は溶液となる。ゲル化温度またはそれより上の温度では、コポリマーは固化して水相と共にゲルを形成するので、その組成物はゲルまたは半固体となる。
【0027】
「生分解性」とは、ブロックコポリマーが体内で化学的に分解または劣化して非毒性成分を形成しうることを意味する。劣化速度は薬剤放出速度と同じでも異なっていてもよい。
【0028】
「薬剤」とは、生物活性であり、治療目的に適するかまたは用いられる有機もしくは無機化合物または物質を意味する。タンパク質、オリゴヌクレオチド、DNAおよび遺伝子治療は、より広い定義で薬剤に含まれる。
【0029】
「ペプチド」、「ポリペプチド」、「オリゴペプチド」および「タンパク質」は、ペプチドまたはタンパク質薬剤に関するときは置き換えて用いられ、特に断りがなければ、特定の分子量、ペプチド配列もしくは長さ、生物活性の範囲または治療用途については限定されない。
【0030】
「ポリ(ラクチド−co−グリコリド)」または「PLGA」とは、乳酸およびグリコール酸の縮合共重合から誘導されるコポリマー、あるいはラクチドまたはグリコリドのようなα−ヒドロキシ酸前駆体の開環重合によって誘導されるコポリマーを意味する。「ラクチド」、「ラクテート」、「グリコリド」および「グリコレート」は、置き換えて用いられる。
【0031】
「ポリ(ラクチド)」または「PLA」とは、乳酸の縮合から誘導されるポリマー、あるいはラクチドの開環重合によって誘導されるポリマーを意味する。
「ラクチド」および「ラクテート」は、置き換えて用いられる。
【0032】
従って、本発明は、Aブロックが比較的疎水性のポリ(ラクチド−co−グリコリド)(PLGA)または疎水性のポリ(ラクチド)(PLA)であり、Bブロックが比較的親水性のポリエチレングリコール(PEG)である、ABAまたはBABタイプのブロックコポリマーであって、疎水性含量が約51〜83重量%であり、約2000〜4990の全体ブロックコポリマー分子量を有し、低い温度で水溶性を示し、哺乳動物の生理学的な体温で可逆的熱的ゲル化を行うことを発見したことに基づくものである。そのように高い疎水性含量で、そのようなブロックコポリマーが水溶性であることは、意外なことである。疎水性含量が50重量%を越えるポリマーは水に実質的に不溶性であり、仮に特定量の有機補助溶媒を加えたとしても、水性系に多少可溶性になるだけであることは、一般に教示されている。
【0033】
従って、本発明の基本は、式:
[化1]
PL(G)z-1 A−PEG−PL(G)z-1 A
または
PEG−PL(G)z-1 A−PEG
(式中、zは1または2の整数である)
の疎水性PL(G)z-1 A Aブロックセグメントおよび親水性PEG Bブロックセグメントを有する、ABAまたはBABタイプのブロックコポリマーを用いることである。本発明に開示するように用いられるブロックコポリマーは、表1にまとめた基準、すなわち、望ましい逆熱的ゲル化挙動を示すブロックコポリマーとなる指示範囲内の組成を満たす。分子量パラメーターを開示するために、報告した全ての分子量の値は、NMRまたはGPC(ゲル透過クロマトグラフィー)分析法による測定に基づく。報告した重量平均分子量および数平均分子量は、それぞれ、GPCおよびNMRにより測定した。報告したラクチド/グリコリド比はNMRデータから計算した。GPC分析は、RI検出および溶離剤としてのクロロホルムを用いるPEGで較正したStyragel HR-3 カラムで行うか、あるいはRI検出および溶離剤としてのテトラヒドロフランを用いるPEGで較正したPhenogel混合床およびPhenogel500オングストロームカラムの組み合わせで行った。NMRスペクトルは、Bruker200MHz 装置でCDCl3 中で得た。
【0034】
[表1]
──────────────────────────
全体重量平均分子量: 2000〜4990
PEG含量: 17〜49重量%
全体PLGAまたはPLA含量: 51〜83重量%
ラクテート含量: 30〜100モル%
グリコレート含量: 0〜70モル%
挙動: ゲル化温度より下では水溶性
ゲル化温度より上ではゲル
───────────────────────────
生分解性疎水性Aブロックセグメントは、本発明において、それぞれ、ポリ(ラクチド−co−グリコリド)およびポリ(ラクチド)と呼ばれる、ポリ(D,L−ラクチド−co−グリコリド)、ポリ(L−ラクチド−co−グリコリド)、ポリ(D,L−ラクチド)およびポリ(L−ラクチド)よりなる群から誘導または選択されるポリ(α−ヒドロキシ酸)である。表1に示す全体分子量および重量%PLGAまたはPLAについての値から計算し、そしてABAトリブロックコポリマー中のAブロックまたはBABトリブロックコポリマー中のBブロックの各々の重量平均分子量が本質的に同じであるとすると、各ポリ(ラクチド−co−グリコリド)またはポリ(ラクチド)ポリマーAブロックの重量平均分子量は約600〜3000である。
【0035】
同様な計算により、親水性Bブロックセグメントは、平均分子量が約500〜2200のポリエチレングリコール(PEG)であるのが好ましい。
ABAトリブロックコポリマーは次の反応スキームによる開環重合または重縮合によって合成しうる:
【0036】
【化2】

【0037】
【化3】

【0038】
BABタイプのトリブロックポリマーは、反応条件を適当に選択することによって同様に製造しうる。例えば、B(PEG)ブロックは、エステルまたはウレタン結合等によってA(PLGAまたはPLA)ブロックに結合しうる。重縮合および開環重合法は、イソシアネートのようなカップリング剤の存在下での1官能価親水性Bブロックの2官能価疎水性Aブロックのいずれかの末端へのカップリングと同様に用いうる。さらに、カップリング反応は、カルボニルジイミダゾール、無水コハク酸、N−ヒドロキシスクシンイミドおよびp−ニトロフェニルクロロホルメート等のような活性剤での官能基の活性を伴ってもよい。
【0039】
親水性Bブロックは適当な分子量のPEGから形成される。PEGは、そのユニークな生体適合性、非毒性、親水性、可溶化性、および患者の体からの急速な浄化性のために、親水性水溶性ブロックとして選択された。
【0040】
疎水性Aブロックは、それらの生分解性、生体適合性および可溶化性の故に、合成されて利用される。これらの疎水性ポリ(ラクチド−co−グリコリド)およびポリ(ラクチド)Aブロックの in vitro および in vivo劣化については十分に理解されており、その劣化生成物は患者の体によって容易に代謝および/または排除される天然化合物である。
【0041】
驚いたことに、疎水性ポリ(ラクチド−co−グリコリド)およびポリ(ラクチド)Aブロックの総重量%は、親水性PEG Bブロックのそれと比較して高く、例えば、約51〜83重量%、最も好ましくは約65〜78重量%であり、それにもかかわらず、得られるトリブロックポリマーは望ましい水溶性および逆熱的ゲル化特性を保持する。そのような高い割合で疎水性成分を有するブロックコポリマーが、冷蔵庫温度(5℃)のような通常の室温より低い温度で水溶性であることは、意外な発見である。全トリブロックコポリマーの全体的に低い分子量を約2000〜4990に維持するので、このような望ましい溶解度特性が可能であると考えられる。かくして、親水性Bブロックがコポリマーの約17〜49重量%を構成し、疎水性Aブロックがコポリマーの約51〜83重量%を構成する、熱的可逆性ゲル化特性を有する水溶性生分解性ブロックコポリマーが製造される。好ましい態様では、PLGA AブロックまたはPLA Aブロックはコポリマーの約65〜78重量%を構成し、PEG Bブロックはコポリマーの約22〜35重量%を構成する。さらに、全トリブロックコポリマーの好ましい全体平均分子量は約2800〜4990である。
【0042】
ブロックコポリマーがゲル化温度より下の温度で可溶性である濃度を、機能濃度と見なしうる。一般に、3%の低いブロックコポリマー濃度から約50重量%までの濃度で用いることができ、依然として機能性である。しかしながら、約5〜40重量%の濃度が好ましく、約10〜30重量%の濃度が最も好ましい。コポリマーでゲル相転移を可能にするには、3重量%のような特定の最低濃度が必要である。それより低い機能濃度範囲では、相転移で弱いゲルが形成される。それより高濃度では、強いゲルネットワークが形成される。
【0043】
生分解性コポリマーおよびペプチド/タンパク質薬剤、および/または他のタイプの薬剤の混合物は、ゲル化温度より低い温度のコポリマー水溶液として製造すると、薬剤が部分的にまたは完全に溶解しうる薬剤送逹液を形成しうる。薬剤が部分的に溶解されているとき、あるいは薬剤が本質的に不溶性であるとき、薬剤は懸濁液またはエマルジョンのようなコロイド状態で存在する。この薬剤送逹液は、その後、非経口、局所、経皮または経粘膜投与されるか、あるいは、例えば、眼、膣、尿道、直腸、鼻、口、口腔、肺または耳のような腔部へ吸入または挿入され、このとき、体温はゲル化温度より上であろうから逆熱的ゲル化が起こる。
【0044】
ゲルの材料が生分解性でありかつゲルが柔軟性であるため、この系は周囲組織への毒性および機械的刺激が極めて少なく、特定の時間内に乳酸、グリコール酸およびPEGに完全に分解する。薬剤放出、ゲル強度、ゲル化温度および劣化速度は、様々なコポリマーブロックの適切な設計および製造、すなわち、AブロックおよびBブロックの重量%、ラクテートおよびグリコレートのモルパーセント、並びにABAまたはBABトリブロックコポリマーの分子量および多分散度の変更によって調節することができる。薬剤の放出は薬剤送逹液中のポリマー濃度の調節によって制御することもできる。
【0045】
懸濁液またはエマルジョンとして溶解した薬剤または薬剤を含有するブロックコポリマー溶液からなる投与形態を体に投与する。次いで、そのブロックコポリマーの逆熱的ゲル化特性により、この製剤は自発的にゲル化して、製剤の温度が体温になるにつれて薬剤貯蔵物を形成する。どれくらいの薬剤を製剤に添加しうるかについての唯一の制限は機能性である。すなわち、コポリマーの熱的ゲル化特性が許容できないほどの悪影響を受けるまで、あるいは製剤の性質が製剤の投与を許容できないくらいに難しくするほどの悪影響を受けるまで、薬剤の添加を増加させうる。一般に、たいていの場合、薬剤は製剤の約0.01〜20重量%を構成し、約0.01〜10%の範囲が非常に一般的である。これらの薬剤添加範囲は本発明を制限するものではない。機能性が維持されるならば、これらの範囲外の薬剤添加は本発明の範囲に入る。
【0046】
本発明の組成物の明確な利点は、ブロックコポリマーが多くの薬剤物質の溶解度を高めうることである。疎水性Aブロックおよび親水性Bブロックの組み合わせは、ブロックコポリマーを両親媒性にする。これに関して、この性質は親水性および疎水性の両方の性質を有するセッケンまたは界面活性剤のように機能する。これはシクロスポリンおよびパクリタクセルのような疎水性または水溶性に乏しい薬剤の可溶化に特に有利である。驚いたことは、ブロックコポリマーの主成分が疎水性Aブロック成分であるので、全てではないがたいていの薬剤の可溶化である。しかしながら、すでに述べたように、疎水性ポリマーブロックが主成分であっても、ブロックコポリマーは水溶性であるので、そして薬剤をブロックコポリマーの水相に混ぜると、薬剤溶解度はさらに高まることが分かった。
【0047】
本発明の組成物の別の利点は、ブロックコポリマーが多くの薬剤物質の化学的安定性を高めうることである。薬剤を化学的に不安定にする薬剤の劣化に関する様々なメカニズムが、薬剤をブロックコポリマー中に存在させると抑制されることが観察された。例えば、パクリタクセルおよびシクロスポリンAは、有機補助溶媒が存在するこれらの同じ薬剤の一定の水溶液に比べて、本発明の水性ポリマー組成物中で実質的に安定化される。パクリタクセルおよびシクロスポリンAにおけるこの安定化効果は、多くの他の薬剤物質で得られる効果の一例にすぎない。
【0048】
特定の状況では、薬剤添加ポリマーは溶液としてではなくゲル状態で投与されてもよい。ゲル化は、薬剤添加ポリマー溶液の温度が投与前にポリマーのゲル化温度より上に上昇した結果でも、あるいは溶液中のポリマー濃度が投与温度で飽和濃度より上になったことによって生じたものであっても、あるいは溶液をゲルにするポリマー溶液への添加物によって生じたものであってもよい。いずれにしても、このようにして形成されたゲルは非経口、局所、経皮、経粘膜投与しても、あるいは、例えば、眼、膣、尿道、直腸、鼻、口、口腔、肺または耳のような腔部へ吸入または挿入してもよい。
【0049】
本発明は、あらゆる種類の生物活性剤および薬剤に適用することができ、そしてポリペプチドおよびタンパク質を放出する非常に効果的な方法を提供する。多くの不安定なペプチドおよびタンパク質薬剤は、本発明のブロックコポリマーへ配合しやすく、ここに記載の逆熱的ゲル化法からの利点を得ることができる。以下のものに特に限定するものではないが、薬学的に有用なポリペプチドおよびタンパク質は以下に記載の群から選択しうる:オキシトシン、バソプレシン、副腎皮質刺激性ホルモン、表皮成長因子、血小板誘導成長因子(PDGF)、プロラクチン、ルリベリン、黄体形成ホルモン放出ホルモン(LHRH)、LHRHアゴニスト、LHRHアンタゴニスト、成長ホルモン(人、豚、牛等)、成長ホルモン放出因子、インスリン、ソマトスタチン、グルカゴン、インターロイキン−2(IL−2)、インターフェロン−α,βまたはγ、ガストリン、テトラガストリン、ペンタガストリン、ウロガストロン、セクレチン、カルシトニン、エンケファリン、エンドルフィン、アンギオテンシン、チロトロピン放出ホルモン(TRH)、腫瘍壊死因子(TNF)、神経成長因子(NGF)、顆粒球−コロニー刺激因子(G−CSF)、顆粒球マクロファージ−コロニー刺激因子(GM−CSF)、マクロファージ−コロニー刺激因子(M−CSF)、ヘパリナーゼ、骨形態発生タンパク質(BMP)、hANP、グルカゴン様ペプチド(GLP−1)、インターロイキン−11(IL−11)、レニン、ブラジキニン、バシトラシン、ポリミキシン、コリスチン、チロシジン、グラミシジン、シクロスポリン、並びにそれらの合成類似体、変種、および薬理学的に活性なそれらのフラグメント、酵素、サイトカイン、モノクローナル抗体およびワクチン。
【0050】
利用しうるポリペプチドまたはタンパク質薬剤に対する唯一の制限は、機能性のものであることである。場合によっては、ポリペプチドおよびタンパク質の機能性または物理的安定性も、ポリペプチドまたはタンパク質薬剤の水溶液または懸濁液への各種添加剤によって高めることができる。添加剤、例えばポリオール(糖を含む)、アミノ酸、界面活性剤、ポリマー、他のタンパク質および特定の塩を用いてもよい。これらの添加剤は、本発明の逆熱的ゲル化を行うブロックコポリマーに容易に混合することができる。
【0051】
タンパク質工学の発展により、ポリペプチドまたはタンパク質の本来の安定性を高めることができる。そのような工業処理または改質されたタンパク質は規定では新規物質とみなしうるが、本発明での使用に対する適性は変わらない。改質の一般的な例の1つは、ポリペプチド薬剤の安定性が、ポリエチレングリコールのような水溶性ポリマーとポリペプチドとの共有結合によって大幅に改善されるPEG化である。別の例は、末端および/または内部付加、除去または置換による1つ以上のアミノ酸残基の種類または位置の面でのアミノ酸配列の変更である。安定性の向上によって、治療に有効なポリペプチドまたはタンパク質を、患者への薬剤送逹液のただ1回の投与の後、長期間にわたって連続放出することが可能となる。
【0052】
ペプチドまたはタンパク質に基づく薬剤に加えて、治療学的および医学的に有用なあらゆる種類からの他の薬剤を用いうる。これらの薬剤はメルクインデックス、Physicians Desk Reference 、およびThe Pharmacological Basis of Therapeutics のような周知の文献に記載されている。具体的な薬剤の簡単なリストを説明のために示すが、これは本発明を限定するものではない:抗癌剤、例えばマイトマイシン、ブレオマイシン、BCNU、カルボプラチン、ドキソルビシン、ダウノルビシン、メトトレキセート、パクリタクセル、タキソテレ(登録商標)、アクチノマイシンDおよびカンプトテシン;抗精神病薬、例えばオランザビンおよびジプラシドン;抗菌薬、例えばセフォキシチン;駆虫薬、例えばイベルメクチン;抗ウイルス薬、例えばアシクロビール;免疫抑制薬、例えばシクロスポリンA(環状ポリペプチドタイプ薬剤)、ステロイド、およびプロスタグランジン。
【0053】
本発明の上記および他の目的、特徴および利点は次の詳細な説明、添付の図面から明らかになる。
【図面の簡単な説明】
【0054】
【図1】様々な濃度および温度において調べた、PLGA−PEG−PLGAトリブロックコポリマー水溶液のゲル化挙動を示す、相ダイアグラムである。
【図2a】図2aは様々な温度およびpHでインキュベートしたPLGA−PEG−PLGAトリブロックコポリマーのin vitro分解を示す分解分析グラフである。
【図2b】図2bは様々な温度およびpHでインキュベートしたPLGA−PEG−PLGAトリブロックコポリマーのin vitro分解を示す分解分析グラフである。
【図2c】図2cは様々な温度およびpHでインキュベートしたPLGA−PEG−PLGAトリブロックコポリマーのin vitro分解を示す分解分析グラフである。
【図3】PLGA−PEG−PLGAトリブロックコポリマーからの持続期間中のインスリンの連続放出を示すグラフである。
【図4】約50日間のパクリタクセルの蓄積調整放出を示す、PLGAPEG−PLGAトリブロックコポリマー温度ゲル製剤からのパクリタクセルの放出分析グラフである。
【発明を実施するための形態】
【0055】
本発明の好ましい態様を説明するために、64〜80重量%の疎水性Aブロック(ポリ(ラクチド−co−グリコリド))(PLGA)またはポリ(ラクチド)(PLA)および20〜36重量%の親水性Bブロック(ポリエチレングリコール)(PEG)からなる各種低分子量ABAブロックコポリマーの合成を行った。目的は、各々の重量平均分子量が約600〜2000のAブロックおよび重量平均分子量が約600〜2200のBブロックよりなる、重量平均分子量約2000〜4990のPLGA−PEG−PLGAまたはPLA−PEG−PLAトリブロックコポリマーの製造であった。各Aブロックは約30〜100モル%のラクテートおよび0〜70モル%のグリコレートからなる。
【0056】
以下は、本発明の好ましい態様を説明する実施例であるが、代表例にすぎない。
【実施例】
【0057】
実施例1
開環共重合によるPLGA−PEG−PLGAトリブロックコポリマーの合成
上記の反応スキームに従い、PEG(Mw =1000)を、窒素雰囲気下、トルエン(2×75ml)でのフラスコ内共沸蒸留によって乾燥し、次いで、真空下(5mmHg)、130℃で乾燥した。ラクチドおよびグリコリドモノマー(各々、モル比3:1)をフラスコに加え、次いでオクタン酸第1錫(0.1重量%)を加え、そして反応混合物を真空下(5mmHg)、150℃で加熱した。反応の進行はGPC(ゲル透過クロマトグラフィー)で追跡した。適当な時間の後、反応を停止し、フラスコを室温に冷却した。残渣を冷水に溶解し、70〜80℃に加熱して、形成したポリマーを沈殿させた。上澄みをデカントし、ポリマー残渣を冷水に再び溶解し、加熱して、沈殿させた。溶解した後に沈殿させるこのプロセスを3回繰り返した。最後に、ポリマーをできるだけ少ない量の水に溶解し、凍結乾燥させた。
【0058】
得られたPLGA−PEG−PLGAコポリマーの重量平均分子量(Mw )は3737、数平均分子量(Mn )は2928、Mw /Mn 比は1.3であった。このコポリマーは、実施例4でさらに詳しく記す逆熱的ゲル化特性を示した。
【0059】
実施例2
実施例1に示した基本的な手順に従って、他のトリブロックコポリマーを、同じPEG(Mw =1000)を用いるが、ラクチドおよび/またはグリコリド含量を変えて合成した。これらのトリブロックコポリマーの性質は次の表に示す:
【0060】
【表2】

【0061】
上記の表に示したポリマーは全て、ラクチド(LA)含量を30〜100モル%で、グリコリド(GA)含量を0〜70モル%で変えても、逆熱的ゲル化特性を有することが認められる。従って、PLGA−PEG−PLGAおよびPLA−PEG−PLAトリブロックはいずれもこの実施例において示されている。
【0062】
実施例3
重縮合によるPLGA−PEG−PLGAトリブロックコポリマーの合成
窒素送入口、温度計、および水除去用の蒸留ヘッドを備えた三つ口フラスコに、DL−乳酸およびグリコール酸(各々、3:1のモル比)を入れた。反応混合物を、3時間、大気圧で、その後は減圧(5mmHg)下で、撹拌しながら、窒素下、160℃で加熱した。反応の進行はGPCで追跡した。反応を適当な時間で停止し、形成されたポリマーを、ジクロロメタン溶液から大量のメタノールへ沈殿させることによって精製した。残渣をメタノール中で粉砕し、真空(0.05mmHg)下、23℃で乾燥させた。PLGAオリゴマーはGPC、IRおよびNMRで特性決定した。得られたPLGAオリゴマーの重量平均分子量(Mw )は9900、数平均分子量(Mn )は5500、Mw /Mn 比は1.8であった。
【0063】
PLGAをPEG(Mw =1000)と混合し、フラスコ内で窒素雰囲気下、160℃で加熱した。反応の進行はGPCで追跡した。適当な時間の後、反応を停止し、フラスコを室温に冷却した。残渣を冷水に溶解し、70〜80℃に加熱してコポリマーを沈殿させた。上澄みをデカントし、残渣を冷水に再び溶解し、加熱して、ポリマーを沈殿させた。溶解および沈殿のこのプロセスを、3回繰り返した。最後に、ポリマーをできるだけ少ない量の水に溶解し、凍結乾燥させた。
【0064】
得られたPLGA−PEG−PLGAコポリマーの重量平均分子量(Mw )は4043、数平均分子量(Mn )は2905、Mw /Mn 比は1.4であった。重量平均分子量および数平均分子量はGPCおよびNMRで各々測定した。ラクチド/グリコリド比はNMRデータから計算した。GPC分析は、RI検出および溶離剤としてのクロロホルムを用いるPEGで較正したStyragel HR-3 カラムで行った。NMRスペクトルは、Bruker200MHz 装置においてCDCl3 中で得た。NMRピーク決定で、トリブロックコポリマーABA構造を確認した。
【0065】
実施例4
実施例1のABAトリブロックコポリマー水溶液のゲル化挙動を、様々な濃度で調べた。9〜30重量%のポリマー溶液を水中で製造し、粘度変化は10〜60℃の温度で観察した。ゲル化は、ポリマー溶液のバイアルを逆さにしたとき、ポリマー溶液が容易に流れない物理的状態と定義した。温度およびトリブロックコポリマー濃度の関数とした実施例1のポリマーの相ダイアグラム(図1)を作った。新規な逆熱的ゲル化挙動は明白であり、トリブロックコポリマー溶液を加熱するにつれて生じた。生理学的温度(例えば、37℃)でのゲル化は特に効果的であり、薬剤送逹のための系を実質的に実用的なものにする基礎を形成した。
【0066】
実施例5
実施例1のPLGA−PEG−PLGAトリブロックコポリマーのin vitro分解を、30週にわたって、様々な温度(−10℃、5℃、23℃および37℃)および様々な初期pH(3.0、5.0および7.4)でインキュベートしたコポリマーの23重量%溶液またはゲル(1ml)について測定した。このトリブロックコポリマーの分解および生分解性は加水分解によって引き起こされ、最終分解生成物として乳酸、グリコール酸およびPEGを生じた。
【0067】
試料(50)は毎週採取した。試料は凍結乾燥し、クロロホルムに溶解し、ポリマー残渣の分子量を前記のようにGPCで測定した。ポリマーの分解は、3.0〜7.4の初期pHに実質的に無関係であり、これはポリマーが加水分解されて乳酸およびグリコール酸を形成するにつれて媒質が酸性化することに起因する。温度ゲル化挙動はずっと同じpH範囲であるpHにも無関係である。分解は温度が高いほど速かった。得られた分解分析図は、図2a、2bおよび2cに示す。
【0068】
実施例6
実施例1のポリマーの生分解を4週にわたって測定した。23重量%のトリブロックコポリマーを含有する冷水溶液の0.40〜0.45ml試料を、ラットの腹腔内に注射した。ポリマーのゲル化温度より上である体温に達したとき、目に明らかなゲル塊がただちに形成した。試料を時間の関数として手術で回収した。ゲルは2週間にわたってしだいに小さくなることが分かった。2週と4週との間で、注射したトリブロックコポリマーの物理的状態はゲルから、ゲルの粘性液中混合物へ、そして最終的には、ゲルが徐々に完全に再吸収されて、ゲルを含有しない粘性液へ変化した。4週間の終わりで、製剤は注射部位に見られなかった。顕微鏡によると、粘性液の小さいポケットが観察され、これはまたその後の2週間で完全に再吸収されたことが観察された。
【0069】
実施例7
パクリタクセルおよびシクロスポリンAは、水に非常に不溶性(溶解度は約4/ml)の疎水性薬剤である。しかしながら、これらの薬剤は、PLGA−PEG−PLGAトリブロックコポリマーの水溶液に溶解すると、かなり高い溶解度を示した。例えば、20重量%水性コポリマー溶液(実施例3のポリマー)では、パクリタクセルは5mg/ml まで、シクロスポリンAは2mg/ml まで溶解した。
【0070】
パクリタクセルおよびシクロスポリンAは、水性補助溶媒溶液(例えば、水/アセトニトリル溶液)中で非常に不安定であった。20重量%水性PLGA−PEG−PLGAトリブロックコポリマー溶液(すなわち、コポリマーのゲル化温度より低い温度)またはゲル(すなわち、コポリマーのゲル化温度より高い温度)のいずれかに含まれるパクリタクセルは、120日間貯蔵(5℃および37℃)後、>85%が損なわれず、一方、シクロスポリンAは100日間(5℃)にわたって安定であった。
【0071】
実施例8
実施例1のPLGA−PEG−PLGAトリブロックコポリマーの28重量%水溶液を製造した。真性糖尿病の治療において有益な効果が証明された非経口投与タンパク質であるインスリン(亜鉛非含有)を、トリブロックコポリマーのこの水溶液に懸濁して、最終濃度を5mg/ml にした。約2mlのこの組成物を37℃で平衡にした時計皿に置いた。組成物はただちにゲル化し、時計皿に付着した。これをpH7.4、37℃の10mMリン酸塩緩衝化食塩水に直接入れ、ゲルからのインスリンの放出速度を、UV検出および勾配溶離を用いる逆相HPLCによりモニターした。データは表3にグラフで示した。インスリンは約1週間、連続して放出された。持続期間中のタンパク質およびペプチドの調整放出におけるトリブロックコポリマー温度ゲルの有用性は、この実施例ではっきりと確かめられ、説明された。
【0072】
実施例9
実施例1のPLGA−PEG−PLGAトリブロックコポリマーの23重量%水溶液に、薬剤約2.0mg/ml とするのに十分なパクリタクセルを加えた。この溶液の2ml試料を時計皿に置き、37℃で平衡にした。温度はコポリマーのゲル化温度より高いので、時計皿にゲルが形成された。時計皿を、37℃で平衡にした2.4重量%のTween-80および4重量%のCremophor ELを含有するPBS(pH7.4)150mlを含む放出媒質の入った200mlビーカーに入れた。ビーカー内の溶液は撹拌した。ビーカーの上部は閉じて蒸発を防止した。全体を37℃のインキュベーターに入れた。放出については三重反復して調べた。様々な時間で放出媒質の5mlアリコートを採取し、パクリタクセルについて分析した。各アリコートを取り出した後、PBS溶液は新しいPBSに代えた。試料は1、2、4、8、18および24時間で、そしてその後は24時間間隔で集め、HPLCにより分析した。ゲルからのパクリタクセルの放出分析図は図4に示す。ゲル製剤の約50日間のパクリタクセルの放出調整はすばらしかった。
【0073】
実施例10
BABトリブロックコポリマーは、いすれかの末端に同じPEG Bブロック(Mw =550)を用いて合成したが、ポリ(ラクチド)および/またはポリ(ブリコリド)含量を変えた。PEGおよびPLGAはエステル、ウレタン、またはエステルおよびウレタン結合の組み合わせにより互いに結合させた。これらのトリブロックコポリマーの性質は次の表に示す:
【0074】
【表3】

【0075】
上記表に示した全てのPEG−PLGA−PEGトリブロックコポリマーは、逆熱的ゲル化特性を有していた。上記トリブロックポリマーのゾル/ゲル転移温度は、各々36、34、30および26℃であった。
【0076】
上の記載により、本技術分野における当業者は、逆熱的ゲル化特性を有する水溶液を形成するABA(例えば、PLGA−PEG−PLGAおよびPLA−PEG−PLA)またはBAB(例えば、PEG−PLGA−PEGおよびPEG−PLA−PEG)タイプのトリブロックコポリマーの製造、並びに薬剤送逹分野におけるこれの利用が可能になる。慣用的な薬剤(パクリタクセル)およびタンパク質薬剤(インスリン)の調整放出を実施例で説明して、トリブロックコポリマー水溶液から形成されるヒドロゲルの機能性を示したが、これらの記載は生分解性ブロックコポリマーに利用および添加することができるすべての薬剤を完全に記述したものではない。様々な種類の治療薬の多くの他の薬剤が、本発明のこの明細書に記載されたようなトリブロックコポリマーの水性組成物からの放出に十分に適していることは確かである。具体的に示したのは、製造しうる全てのブロックコポリマーでもなく、また重要な逆熱的ゲル化特性を示す全てのブロックコポリマーでもない。しかしながら、特許請求の範囲等によってのみ限定される本発明の範囲から逸脱することなく様々な変更が可能なことは、本技術分野における当業者にとって明らかなことである。
【0077】
これに限定されるわけではないが、本発明は以下の発明を包含する。
(1) 生分解性ABAまたはBABタイプのトリブロックポリマーであって、前記ABAトリブロックは、式:
[化4]
PL(G)z-1 A−PEG−PL(G)z-1 A
を有し、前記BABトリブロックは、式:
[化5]
PEG−PL(G)z-1 A−PEG
[式中、zは1または2の整数であり、AブロックはPL(G)z-1 Aで表される結果、zが2のときAブロックはポリ(ラクチド−co−グリコリド)またはPLGAコポリマーであり、zが1のときAブロックはポリ(ラクチド)またはPLAポリマーであり、Bブロックは親水性ポリエチレングリコールポリマーであるPEGで表される。]を有し、前記ブロックコポリマーが約2000〜4990の重量平均分子量を有しかつ逆熱的ゲル化特性を有するトリブロックポリマー。
(2) PL(G)z-1 A Aブロックが前記ポリマーの約51〜83重量%を構成し、PEG Bブロックが前記ポリマーの約17〜49重量%を構成する、(1)に記載のトリブロックポリマー。
(3) 該ポリマーがBABタイプである、(2)に記載のトリブロックポリマー。
(4) 該ポリマーがABAタイプである、(2)に記載のトリブロックポリマー。
(5) zが1である結果、AブロックがPLAポリマーである、(4)に記載のトリブロックポリマー。
(6) zが2である結果、AブロックがPLGAコポリマーとなる、(4)に記載のトリブロックポリマー。
(7) Aブロックが、約80〜20モル%のラクチドおよび約20〜80モル%のグリコリドを含むPLGAコポリマーである、(6)に記載のトリブロックポリマー。
(8) PLGA Aブロックがトリブロックコポリマーの約65〜78重量%を構成し、PEG Bブロックが前記トリブロックコポリマーの約22〜35重量%を構成する、(7)に記載のトリブロックポリマー。
(9) 各PLGA Aブロックの重量平均分子量が約600〜3000であり、各PEG Bブロックの重量平均分子量が約500〜2200である、(7)に記載のトリブロックポリマー。
(10) 逆熱的ゲル化特性を有する水性生分解性ポリマー薬剤送逹組成物であって、
(a)有効量の薬剤;および
(b)生分解性ABAまたはBABタイプのトリブロックポリマーであって、前記ABAトリブロックが、式:
[化6]
PL(G)z-1 A−PEG−PL(G)z-1 A
を有し、前記BABトリブロックが、式:
[化7]
PEG−PL(G)z-1 A−PEG
[式中、zは1または2の整数であり、AブロックはPL(G)z-1 Aで表される結果、zが2のときAブロックはポリ(ラクチド−co−グリコリド)またはPLGAコポリマーであり、zが1のときAブロックはポリ(ラクチド)またはPLAポリマーであり、Bブロックは親水性ポリエチレングリコールポリマーであるPEGで表される。]を有し、前記トリブロックポリマーの重量平均分子量が約2000〜4990であるトリブロックポリマーを、均質に含有する水性相を含んでなる組成物。
(11) 組成物のトリブロックポリマー含量が約3〜50重量%である、(10)に記載の水性ポリマー組成物。
(12) 該トリブロックポリマーにおいて、PL(G)z-1 A Aブロックが該ポリマーの約51〜83重量%を構成し、PEG Bブロックが前記ポリマーの約17〜49重量%を構成する、(11)に記載の水性ポリマー組成物。
(13) トリブロックポリマーがBABタイプである、(12)に記載の水性ポリマー組成物。
(14) 該ポリマーがABAタイプである、(12)に記載の水性ポリマー組成物。
(15) 該トリブロックポリマーにおいて、zが1である結果、AブロックがPLAポリマーである、(14)に記載の水性ポリマー組成物。
(16) 該トリブロックポリマーにおいて、zが2である結果、AブロックがPLGAコポリマーである、(14)に記載の水性ポリマー組成物。
(17) 該トリブロックポリマーにおいて、Aブロックが、約80〜20モル%のラクチドおよび約20〜80モル%のグリコリドを含むPLGAコポリマーである、(16)に記載の水性ポリマー組成物。
(18) 該トリブロックポリマーにおいて、PLGA Aブロックが前記トリブロックポリマーの約65〜78重量%を構成し、前記PEG Bブロックが前記トリブロックポリマーの約22〜35重量%を構成する、(17)に記載の水性ポリマー組成物。
(19) 該トリブロックポリマーにおいて、各PLGA Aブロックが約600〜3000の重量平均分子量を有し、各PEG Bブロックが約500〜2200の重量平均分子量を有する、(17)に記載の水性ポリマー組成物。
(20) 薬剤がポリペプチドまたはタンパク質である、(17)に記載の水性ポリマー組成物。
(21) ポリペプチドまたはタンパク質が、オキシトシン、バソプレシン、副腎皮質刺激性ホルモン、表皮成長因子、血小板誘導成長因子(PDGF)、プロラクチン、ルリベリン、黄体形成ホルモン放出ホルモン(LHRH)、LHRHアゴニスト、LHRHアンタゴニスト、成長ホルモン(人、豚、牛等)、成長ホルモン放出因子、インスリン、ソマトスタチン、グルカゴン、インターロイキン−2(IL−2)、インターフェロン−α,βまたはγ、ガストリン、テトラガストリン、ペンタガストリン、ウロガストロン、セクレチン、カルシトニン、エンケファリン、エンドルフィン、アンギオテンシン、チロトロピン放出ホルモン(TRH)、腫瘍壊死因子(TNF)、神経成長因子(NGF)、顆粒球−コロニー刺激因子(G−CSF)、顆粒球マクロファージ−コロニー刺激因子(GM−CSF)、マクロファージ−コロニー刺激因子(M−CSF)、ヘパリナーゼ、骨形態発生タンパク質(BMP)、hANP、グルカゴン様ペプチド(GLP−1)、インターロイキン−11(IL−11)、レニン、ブラジキニン、バシトラシン、ポリミキシン、コリスチン、チロシジン、グラミシジン、シクロスポリン、並びにそれらの合成類似体、変性体、および薬理学的に活性なそれらのフラグメント、酵素、サイトカイン、モノクローナル抗体およびワクチンよりなる群から選択されるものである、(20)に記載の水性ポリマー組成物。
(22) 組成物の薬剤含量が約0.01〜20重量%である、(21)に記載の水性ポリマー組成物。
(23) 薬剤が抗癌剤または抗細胞増殖薬である、(17)に記載の水性ポリマー組成物。
(24) 薬剤が、マイトマイシン、ブレオマイシン、BCNU、カルボプラチン、ドキソルビシン、ダウノルビシン、メトトレキセート、パクリタクセル、タキソテレ、アクチノマイシンDおよびカンプトテシンよりなる群から選択される抗癌剤である、(23)に記載の水性ポリマー組成物。
(25) 組成物の薬剤含量が約0.01〜20重量%である、(24)に記載の水性ポリマー組成物。
(26) 薬剤を制御された放出形態で温血動物に投与する方法であって、
(i)逆熱的ゲル化特性を有する水性生分解性ポリマー薬剤送逹組成物であって、
(a)有効量の薬剤;および
(b)生分解性ABAまたはBABタイプのトリブロックポリマーであって、前記ABAトリブロックが、式:
[化8]
PL(G)z-1 A−PEG−PL(G)z-1 A
を有し、前記BABトリブロックが、式:
[化9]
PEG−PL(G)z-1 A−PEG
[式中、zは1または2の整数であり、AブロックはPL(G)z-1 Aで表される結果、zが2のときAブロックはポリ(ラクチド−co−グリコリド)またはPLGAコポリマーであり、zが1のときAブロックはポリ(ラクチド)またはPLAポリマーであり、Bブロックは親水性ポリエチレングリコールポリマーであるPEGで表される。]を有し、前記トリブロックポリマーの重量平均分子量が約2000〜4990であるトリブロックポリマーを均質に含有する水性相を含んでなる組成物を準備すること;
(ii)前記組成物をトリブロックポリマーのゲル化温度より下の温度で液体として維持すること;そして
(iii)前記組成物を液体として前記温血動物へ投与し、その後に前記組成物の温度が前記動物の体温により前記トリブロックポリマーのゲル化温度より高い温度に上昇するにつれてゲルが形成されること
を含んでなる方法。
(27) 投与が、非経口、眼、局所、吸入、経皮、膣、口腔、経粘膜、経尿道、直腸、鼻、口、肺または耳による、(26)に記載の方法。
(28) 組成物のトリブロックポリマー含量が約3〜50重量%である、(27)に記載の方法。
(29) 該トリブロックポリマーにおいて、PL(G)z-1 A Aブロックが前記ポリマーの約51〜83重量%を構成し、PEG Bブロックが前記ポリマーの約17〜49重量%を構成する、(28)に記載の方法。
(30) 該トリブロックポリマーがBABタイプである、(29)に記載の方法。
(31) 該トリブロックポリマーがABAタイプである、(29)に記載の方法。
(32) 該トリブロックポリマーにおいて、zが1である結果、AブロックがPLAポリマーである、(31)に記載の方法。
(33) 該トリブロックポリマーにおいて、zが2である結果、AブロックがPLGAコポリマーである、(31)に記載の方法。
(34) 該トリブロックポリマーにおいて、Aブロックが、約80〜20モル%のラクチドおよび約20〜80モル%のグリコリドを含むPLGAコポリマーである、(33)に記載の方法。
(35) 該トリブロックポリマーにおいて、PLGA Aブロックがトリブロックポリマーの約65〜78重量%を構成し、PEG Bブロックがトリブロックポリマーの約22〜35重量%を構成する、(34)に記載の方法。
(36) 該トリブロックポリマーにおいて、各PLGA Aブロックが約600〜3000の重量平均分子量を有し、各PEG Bブロックが約500〜2200の重量平均分子量を有する、(35)に記載の方法。
(37) 投与される薬剤がポリペプチドまたはタンパク質である、(34)に記載の方法。
(38) ポリペプチドまたはタンパク質が、オキシトシン、バソプレシン、副腎皮質刺激性ホルモン、表皮成長因子、血小板誘導成長因子(PDGF)、プロラクチン、ルリベリン、黄体形成ホルモン放出ホルモン(LHRH)、LHRHアゴニスト、LHRHアンタゴニスト、成長ホルモン(人、豚、牛等)、成長ホルモン放出因子、インスリン、ソマトスタチン、グルカゴン、インターロイキン−2(IL−2)、インターフェロン−α,βまたはγ、ガストリン、テトラガストリン、ペンタガストリン、ウロガストロン、セクレチン、カルシトニン、エンケファリン、エンドルフィン、アンギオテンシン、チロトロピン放出ホルモン(TRH)、腫瘍壊死因子(TNF)、神経成長因子(NGF)、顆粒球−コロニー刺激因子(G−CSF)、顆粒球マクロファージ−コロニー刺激因子(GM−CSF)、マクロファージ−コロニー刺激因子(M−CSF)、ヘパリナーゼ、骨形態発生タンパク質(BMP)、hANP、グルカゴン様ペプチド(GLP−1)、インターロイキン−11(IL−11)、レニン、ブラジキニン、バシトラシン、ポリミキシン、コリスチン、チロシジン、グラミシジン、シクロスポリン、並びにそれらの合成類似体、変性体、および薬理学的に活性なそれらのフラグメント、酵素、サイトカイン、モノクローナル抗体およびワクチンよりなる群から選択されるものである、(37)に記載の方法。
(39) 前記組成物の薬剤含量が約0.01〜20重量%である、(37)に記載の方法。
(40) 投与される薬剤が抗癌剤または抗細胞増殖薬である、(34)に記載の方法。
(41) 薬剤が、マイトマイシン、ブレオマイシン、BCNU、カルボプラチン、ドキソルビシン、ダウノルビシン、メトトレキセート、パクリタクセル、タキソテレ、アクチノマイシンDおよびカンプトテシンよりなる群から選択される抗癌剤である、(40)に記載の方法。
(42) 前記組成物の薬剤含量が約0.01〜20重量%である、(40)に記載の方法。
(43) 薬剤の溶解度を高める方法であって、有効量の前記薬剤を逆熱的ゲル化特性を有する水性生分解性ポリマー薬剤送逹組成物に均質に混合することを含む方法であり、前記水性組成物が、生分解性ABAまたはBABタイプのトリブロックポリマーを均質に含有する水性相を含んでなり、前記ABAトリブロックが、式:
[化10]
PL(G)z-1 A−PEG−PL(G)z-1 A
を有し、前記BABトリブロックが、式:
[化11]
PEG−PL(G)z-1 A−PEG
[式中、zは1または2の整数であり、AブロックはPL(G)z-1 Aで表される結果、zが2のときAブロックはポリ(ラクチド−co−グリコリド)またはPLGAコポリマーであり、zが1のときAブロックはポリ(ラクチド)またはPLAポリマーであり、Bブロックは親水性ポリエチレングリコールポリマーであるPEGで表される。]を有し、前記トリブロックポリマーの重量平均分子量が約2000〜4990である方法。
(44) 前記組成物のトリブロックポリマー含量が約3〜50重量%である、(43)に記載の方法。
(45) 該トリブロックポリマーにおいて、PL(G)z-1 A Aブロックが前記ポリマーの約51〜83重量%を構成し、PEG Bブロックが前記ポリマーの約17〜49重量%を構成する、(44)に記載の方法。
(46) 該トリブロックポリマーがBABタイプである、(45)に記載の方法。
(47) 該トリブロックポリマーがABAタイプである、(45)に記載の方法。
(48) 該トリブロックポリマーにおいて、zが1である結果、AブロックがPLAポリマーである、(47)に記載の方法。
(49) 該トリブロックポリマーにおいて、zが2である結果、AブロックがPLGAコポリマーである、(47)に記載の方法。
(50) 該トリブロックポリマーにおいて、Aブロックが、約80〜20モル%のラクチドおよび約20〜80モル%のグリコリドを含むPLGAコポリマーである、(49)に記載の方法。
(51) 該トリブロックポリマーにおいて、PLGA Aブロックがトリブロックポリマーの約65〜78重量%を構成し、PEG Bブロックがトリブロックポリマーの約22〜35重量%を構成する、(50)に記載の方法。
(52) 該トリブロックポリマーにおいて、各PLGA Aブロックが約600〜3000の重量平均分子量を有し、各PEG Bブロックが約500〜2200の重量平均分子量を有する、(51)に記載の方法。
(53) 薬剤がポリペプチドまたはタンパク質である、(50)に記載の方法。
(54) ポリペプチドまたはタンパク質が、オキシトシン、バソプレシン、副腎皮質刺激性ホルモン、表皮成長因子、血小板誘導成長因子(PDGF)、プロラクチン、ルリベリン、黄体形成ホルモン放出ホルモン(LHRH)、LHRHアゴニスト、LHRHアンタゴニスト、成長ホルモン(人、豚、牛等)、成長ホルモン放出因子、インスリン、ソマトスタチン、グルカゴン、インターロイキン−2(IL−2)、インターフェロン−α,βまたはγ、ガストリン、テトラガストリン、ペンタガストリン、ウロガストロン、セクレチン、カルシトニン、エンケファリン、エンドルフィン、アンギオテンシン、チロトロピン放出ホルモン(TRH)、腫瘍壊死因子(TNF)、神経成長因子(NGF)、顆粒球−コロニー刺激因子(G−CSF)、顆粒球マクロファージ−コロニー刺激因子(GM−CSF)、マクロファージ−コロニー刺激因子(M−CSF)、ヘパリナーゼ、骨形態発生タンパク質(BMP)、hANP、グルカゴン様ペプチド(GLP−1)、インターロイキン−11(IL−11)、レニン、ブラジキニン、バシトラシン、ポリミキシン、コリスチン、チロシジン、グラミシジン、シクロスポリン、並びにそれらの合成類似体、変性体、および薬理学的に活性なそれらのフラグメント、酵素、サイトカイン、モノクローナル抗体およびワクチンよりなる群から選択されるものである、(53)に記載の方法。
(55) 該組成物の薬剤含量が約0.01〜20重量%である、(53)に記載の方法。
(56) 投与される薬剤が抗癌剤または抗細胞増殖薬である、(50)に記載の方法。
(57) 薬剤が、マイトマイシン、ブレオマイシン、BCNU、カルボプラチン、ドキソルビシン、ダウノルビシン、メトトレキセート、パクリタクセル、タキソテレ、アクチノマイシンDおよびカンプトテシンよりなる群から選択される抗癌剤である、(56)に記載の方法。
(58) 該組成物の薬剤含量が約0.01〜20重量%である、(56)に記載の方法。
(59) 有効量の薬剤を、逆熱的ゲル化特性を有する水性生分解性ポリマー薬剤送逹組成物に均質に混合することを含む、薬剤の安定性を高める方法であって、前記水性組成物は、生分解性ABAまたはBABタイプトリブロックポリマーを均質に含有する水性相を含んでなり、前記ABAトリブロックが、式:
[化12]
PL(G)z-1 A−PEG−PL(G)z-1 A
を有し、前記BABトリブロックが、式:
[化13]
PEG−PL(G)z-1 A−PEG
[式中、zは1または2の整数であり、AブロックはPL(G)z-1 Aで表される結果、zが2のときAブロックはポリ(ラクチド−co−グリコリド)またはPLGAコポリマーであり、zが1のときAブロックはポリ(ラクチド)またはPLAポリマーであり、Bブロックは親水性ポリエチレングリコールポリマーであるPEGで表される。]を有し、前記トリブロックポリマーの重量平均分子量が約2000〜4990である方法。
(60) 前記組成物のトリブロックポリマー含量が約3〜50重量%である、(59)に記載の方法。
(61) 該トリブロックポリマーにおいて、PL(G)z-1 A Aブロックが前記ポリマーの約51〜83重量%を構成し、PEG Bブロックが前記ポリマーの約17〜49重量%を構成する、(60)に記載の方法。
(62) 該トリブロックポリマーがBABタイプである、(61)に記載の方法。
(63) 該トリブロックポリマーがABAタイプである、(61)に記載の方法。
(64) 該トリブロックポリマーにおいて、zが1である結果、AブロックがPLAポリマーである、(63)に記載の方法。
(65) 該トリブロックポリマーにおいて、zが2である結果、AブロックがPLGAコポリマーである、(63)に記載の方法。
(66) 該トリブロックポリマーにおいて、Aブロックが、約80〜20モル%のラクチドおよび約20〜80モル%のグリコリドを含むPLGAコポリマーである、(65)に記載の方法。
(67) 該トリブロックポリマーにおいて、PLGA Aブロックがトリブロックポリマーの約65〜78重量%を構成し、PEG Bブロックがトリブロックポリマーの約22〜35重量%を構成する、(66)に記載の方法。
(68) 該トリブロックポリマーにおいて、各PLGA Aブロックの重量平均分子量が約600〜3000であり、各PEG Bブロックの重量平均分子量が約500〜2200である、(67)に記載の方法。
(69) 薬剤がポリペプチドまたはタンパク質である、(66)に記載の方法。
(70) ポリペプチドまたはタンパク質が、オキシトシン、バソプレシン、副腎皮質刺激性ホルモン、表皮成長因子、血小板誘導成長因子(PDGF)、プロラクチン、ルリベリン、黄体形成ホルモン放出ホルモン(LHRH)、LHRHアゴニスト、LHRHアンタゴニスト、成長ホルモン(人、豚、牛等)、成長ホルモン放出因子、インスリン、ソマトスタチン、グルカゴン、インターロイキン−2(IL−2)、インターフェロン−α,βまたはγ、ガストリン、テトラガストリン、ペンタガストリン、ウロガストロン、セクレチン、カルシトニン、エンケファリン、エンドルフィン、アンギオテンシン、チロトロピン放出ホルモン(TRH)、腫瘍壊死因子(TNF)、神経成長因子(NGF)、顆粒球−コロニー刺激因子(G−CSF)、顆粒球マクロファージ−コロニー刺激因子(GM−CSF)、マクロファージ−コロニー刺激因子(M−CSF)、ヘパリナーゼ、骨形態発生タンパク質(BMP)、hANP、グルカゴン様ペプチド(GLP−1)、インターロイキン−11(IL−11)、レニン、ブラジキニン、バシトラシン、ポリミキシン、コリスチン、チロシジン、グラミシジン、シクロスポリン、並びにそれらの合成類似体、変性体、および薬理学的に活性なそれらのフラグメント、酵素、サイトカイン、モノクローナル抗体およびワクチンよりなる群から選択されるものである、(69)に記載の方法。
(71) 該組成物の薬剤含量が約0.01〜20重量%である、(69)に記載の方法。
(72) 投与される薬剤が抗癌剤または抗細胞増殖薬である、(66)に記載の方法。
(73) 薬剤が、マイトマイシン、ブレオマイシン、BCNU、カルボプラチン、ドキソルビシン、ダウノルビシン、メトトレキセート、パクリタクセル、タキソテレ、アクチノマイシンDおよびカンプトテシンよりなる群から選択される抗癌剤である、(72)に記載の方法。
(74) 前記組成物の薬剤含量が約0.01〜20重量%である、(72)に記載の方法。
【特許請求の範囲】
【請求項1】
生分解性ABAまたはBABタイプのトリブロックポリマーであって、前記ABAトリブロックは、式:
[化1]
PL(G)z-1 A−PEG−PL(G)z-1 A
を有し、前記BABトリブロックは、式:
[化2]
PEG−PL(G)z-1 A−PEG
[式中、zは1または2の整数であり、AブロックはPL(G)z-1 Aで表される結果、zが2のときAブロックはポリ(ラクチド−co−グリコリド)またはPLGAコポリマーであり、zが1のときAブロックはポリ(ラクチド)またはPLAポリマーであり、Bブロックは親水性ポリエチレングリコールポリマーであるPEGで表される。]を有し、前記ブロックコポリマーが約2000〜4990の重量平均分子量を有しかつ逆熱的ゲル化特性を有するトリブロックポリマー。
【請求項1】
生分解性ABAまたはBABタイプのトリブロックポリマーであって、前記ABAトリブロックは、式:
[化1]
PL(G)z-1 A−PEG−PL(G)z-1 A
を有し、前記BABトリブロックは、式:
[化2]
PEG−PL(G)z-1 A−PEG
[式中、zは1または2の整数であり、AブロックはPL(G)z-1 Aで表される結果、zが2のときAブロックはポリ(ラクチド−co−グリコリド)またはPLGAコポリマーであり、zが1のときAブロックはポリ(ラクチド)またはPLAポリマーであり、Bブロックは親水性ポリエチレングリコールポリマーであるPEGで表される。]を有し、前記ブロックコポリマーが約2000〜4990の重量平均分子量を有しかつ逆熱的ゲル化特性を有するトリブロックポリマー。
【図1】


【図2a】


【図2b】


【図2c】


【図3】


【図4】




【図2a】


【図2b】


【図2c】


【図3】


【図4】


【公開番号】特開2012−12606(P2012−12606A)
【公開日】平成24年1月19日(2012.1.19)
【国際特許分類】
【出願番号】特願2011−152462(P2011−152462)
【出願日】平成23年7月11日(2011.7.11)
【分割の表示】特願2009−297893(P2009−297893)の分割
【原出願日】平成10年10月2日(1998.10.2)
【出願人】(507050160)プロセリックス・ソルト・レイク・シティ,インコーポレーテッド (3)
【Fターム(参考)】
【公開日】平成24年1月19日(2012.1.19)
【国際特許分類】
【出願日】平成23年7月11日(2011.7.11)
【分割の表示】特願2009−297893(P2009−297893)の分割
【原出願日】平成10年10月2日(1998.10.2)
【出願人】(507050160)プロセリックス・ソルト・レイク・シティ,インコーポレーテッド (3)
【Fターム(参考)】
[ Back to top ]

