透過型電子顕微鏡用試料保持体およびその製造方法、透過型電子顕微鏡用試料およびその製造方法、並びに、透過型電子顕微鏡用試料を用いた観測方法および結晶構造解析方法
【課題】透過型電子顕微鏡を用いた観測により、種々の方向における観測対象物の観測データを取得することが可能な、透過型電子顕微鏡用試料保持体およびその製造方法、透過型電子顕微鏡用試料およびその製造方法、並びに、透過型電子顕微鏡用試料を用いた観測方法および結晶構造解析方法を提供する。
【解決手段】本発明のマイクログリッド10は、グリッド本体12と、グリッド本体12の縁部に形成された触媒層14と、触媒層14の表面上に形成されたカーボンナノチューブ16とから構成される。また本発明の試料20は、本発明のマイクログリッド10と、マイクログリッド10を構成するカーボンナノチューブ16の側面に被覆した観測対象物(例えば、蛋白質層18)とから構成される。さらに本発明の観測方法は、本発明の試料20を試料ホルダーにセットして透過型電子顕微鏡に装着する事により行う。
【解決手段】本発明のマイクログリッド10は、グリッド本体12と、グリッド本体12の縁部に形成された触媒層14と、触媒層14の表面上に形成されたカーボンナノチューブ16とから構成される。また本発明の試料20は、本発明のマイクログリッド10と、マイクログリッド10を構成するカーボンナノチューブ16の側面に被覆した観測対象物(例えば、蛋白質層18)とから構成される。さらに本発明の観測方法は、本発明の試料20を試料ホルダーにセットして透過型電子顕微鏡に装着する事により行う。
【発明の詳細な説明】
【技術分野】
【0001】
本発明は、透過型電子顕微鏡用試料保持体およびその製造方法、透過型電子顕微鏡用試料およびその製造方法、並びに、透過型電子顕微鏡用試料を用いた観測方法および結晶構造解析方法に関するものである。
【背景技術】
【0002】
一般的に、結晶構造の解析を行う場合は中性子線回折あるいは精密X線回折等を用いることが多く、試料として数ミリ程度の大きさまで成長した結晶が必要となる。しかし蛋白質は一般的に結晶化が難しく、さらに数ミリ程度の大きさまで結晶を成長させることは非常に困難である。
【0003】
微小で厚さの薄い試料の観察および評価を行う方法としては、透過型電子顕微鏡等を用いる方法が知られている。特に高分解能透過型電子顕微鏡は、微小薄膜試料を原子レベルで観察することができるため、微小薄膜蛋白質結晶の構造解析が可能になると考えられる。
【0004】
一方、蛋白質の分散液を液体表面に展開する事により蛋白質を変性させ、その変性した蛋白質をカーボンナノチューブの側面に被覆させた、カーボンナノチューブ構造体に関する技術が提案されている(特許文献1)。
【0005】
このカーボンナノチューブ構造体においては、カーボンナノチューブの側面に被覆された蛋白質層が薄いため、中性子線回折あるいはX線回折等による結晶構造解析は困難であるが、透過型電子顕微鏡を用いれば、蛋白質層の結晶構造解析が可能になると考えられる。
【特許文献1】再公表特許W02004/041719号公報
【発明の開示】
【発明が解決しようとする課題】
【0006】
上記のように、蛋白質に代表される観測対象物を、カーボンナノチューブに代表される担持コアの側面に被覆し、側面が被覆された担持コアの被覆層を透過型電子顕微鏡により観測することにより、観測対象物の結晶構造を始めとする様々な情報を得ることができる。
【0007】
しかし、透過型電子顕微鏡による観測においては、観測方向が制限されることが多い。よって、観測対象物が配向性を持った状態で観測されると、所定の観測データが得られないことがある。このため、様々な方向を向いている観測対象物を存在させて、種々の方向における観測対象物の観測データを取得できることが求められている。
【0008】
そこで本発明は、上記問題点に鑑み、透過型電子顕微鏡を用いた観測により、種々の方向における観測対象物の観測データを取得することが可能な、透過型電子顕微鏡用試料保持体およびその製造方法、透過型電子顕微鏡用試料およびその製造方法、並びに、透過型電子顕微鏡用試料を用いた観測方法および結晶構造解析方法を提供する。
【課題を解決するための手段】
【0009】
上記課題は、以下の手段により解決される。即ち、
本発明の透過型電子顕微鏡用試料保持体は、保持体本体と、観測対象物を担持するための担持コアであって、前記保持体本体の縁部の少なくとも一部に設けられた担持コアと、を有することを特徴としている。
【0010】
本発明の透過型電子顕微鏡用試料保持体では、保持体本体は、その形状により、例えば曲面や複数の面から構成されていることとなるため、本体縁部を構成する面は種々の方向に向いている。このため、保持体本体の縁部に形成される担持コアは、種々の方向を向いて形成されることとなる。したがって結果的に、透過型電子顕微鏡用試料保持体上に保持された観測対象物も種々の方向を向いていることとなり、透過型電子顕微鏡の性質上観測の方向が制限されていても、種々の方向における観測対象物の観測データを取得することが可能となる。
【0011】
本発明の透過型電子顕微鏡用試料保持体において、前記担持コアは、触媒を介して前記保持体本体に設けられることができる。また前記触媒は、Co、Ni、及びFeから選択される少なくとも1種以上の元素である事が好適である。
【0012】
本発明の透過型電子顕微鏡用試料保持体において、前記担持コアは、カーボンナノチューブを含む事が好適である。
【0013】
本発明の透過型電子顕微鏡用試料は、本発明の透過型電子顕微鏡用試料保持体と、前記透過型電子顕微鏡用試料保持体の前記担持コアに担持された観測対象物と、を有することを特徴としている。
【0014】
本発明の透過型電子顕微鏡用試料では、上述したように、透過型電子顕微鏡用試料保持体の担持コアが種々の方向を向いて形成されているため、担持コア上に担持された観測対象物も種々の方向を向いていることとなり、透過型電子顕微鏡の性質上観測の方向が制限されていても、種々の方向における観測対象物の観測データを取得することが可能となる。
【0015】
本発明の透過型電子顕微鏡用試料において、前記観測対象物は、蛋白質であることが好適である。
【0016】
本発明の透過型電子顕微鏡用試料保持体の製造方法は、保持体本体を準備する第1工程と、前記保持体本体の縁部の少なくとも一部に、観測対象物を担持するための担持コアを形成する第2工程と、を有することを特徴としている。
【0017】
本発明の透過型電子顕微鏡用試料保持体の製造方法により、上記本発明の透過型電子顕微鏡用試料保持体を得ることが出来る。
【0018】
本発明の透過型電子顕微鏡用試料保持体の製造方法においては、前記第2工程は、前記保持体本体の前記縁部の少なくとも一部に触媒を形成した後、前記触媒上に前記担持コアを形成する工程とすることができる。
【0019】
本発明の透過型電子顕微鏡用試料保持体の製造方法においては、前記触媒は、Co、Ni、及びFeから選択される少なくとも1種以上の元素である事が好適である。
【0020】
本発明の透過型電子顕微鏡用試料保持体の製造方法においては、前記担持コアは、カーボンナノチューブを含む事が好適である。
【0021】
本発明の透過型電子顕微鏡用試料の製造方法は、本発明の透過型電子顕微鏡用試料保持体を準備する工程と、前記保持体本体の前記縁部の少なくとも一部に形成された前記担持コアに、観測対象物を担持させる工程と、を有することを特徴としている。
【0022】
本発明の透過型電子顕微鏡用試料の製造方法により、上記本発明の透過型電子顕微鏡用試料を得ることが出来る。
【0023】
本発明の透過型電子顕微鏡用試料の製造方法においては、前記観測対象物は、蛋白質であることが好適である。
【0024】
本発明の観測方法は、本発明の透過型電子顕微鏡用試料を試料ホルダーに保持する工程と、前記試料ホルダーを透過型電子顕微鏡へ装着する事により、前記透過型電子顕微鏡用試料を前記透過型電子顕微鏡へ導入する工程と、前記透過型電子顕微鏡用試料を前記透過型電子顕微鏡で観測する工程と、を含むことを特徴としている。
【0025】
本発明の観測方法では、上記本発明の透過型電子顕微鏡用試料を用いるので、透過型電子顕微鏡の性質上観測の方向が制限されていても、種々の方向における観測対象物の観測データを取得することが可能となる。
【0026】
本発明の結晶構造解析方法は、本発明の観測方法により観測する観測工程と、前記観測工程により得られた観測データを用いて結晶構造の解析を行う解析工程と、を有することを特徴としている。
【0027】
本発明の結晶構造解析方法では、上記本発明の透過型電子顕微鏡用試料を用いるので、透過型電子顕微鏡の性質上観測の方向が制限されていても、種々の方向における観測データを取得することが可能となる。このため、従来と比べてより正確な結晶構造解析を行うことができる。
【0028】
本発明の蛋白質結晶構造解析方法は、本発明の保持体本体を準備して、前記保持体本体の縁部の少なくとも一部に触媒を形成した後、前記触媒にカーボンナノチューブを形成することにより透過型電子顕微鏡用試料保持体を製造する試料保持体製造工程と、前記透過型電子顕微鏡用試料保持体の前記カーボンナノチューブに蛋白質を担持させることにより透過型電子顕微鏡用試料を製造する試料製造工程と、前記透過型電子顕微鏡用試料を試料ホルダーに保持した後、前記試料ホルダーを透過型電子顕微鏡へ装着する事により、前記透過型電子顕微鏡用試料を前記透過型電子顕微鏡へ導入する試料導入工程と、前記透過型電子顕微鏡用試料を前記透過型電子顕微鏡で観測する観測工程と、前記観測工程により得られた観測データを用いて蛋白質結晶構造の解析を行う解析工程と、を有することを特徴としている。
【0029】
本発明の蛋白質結晶構造解析方法では、上記本発明の透過型電子顕微鏡用試料保持体で説明したように、カーボンナノチューブが種々の方向を向いて形成されているため、カーボンナノチューブ上に担持された蛋白質は、透過型電子顕微鏡の性質上観測の方向が制限されていても、種々の方向における蛋白質の観測データを取得することができ、従来と比べてより正確な蛋白質の結晶構造解析を行うことが出来る。
【発明の効果】
【0030】
本発明によれば、透過型電子顕微鏡を用いた観測により、種々の方向における観測対象物の観測データを取得することが可能な、透過型電子顕微鏡用試料保持体およびその製造方法、透過型電子顕微鏡用試料およびその製造方法、並びに、透過型電子顕微鏡用試料を用いた観測方法および結晶構造解析方法を提供することができる。
【発明を実施するための最良の形態】
【0031】
以下、本発明について図面を参照しつつ説明する。なお、実質的に同一の機能を有する部材には全図面と押して同じ符号を付与し、重複する説明は省略する場合がある。
【0032】
(第1実施形態)
図1は、第1実施形態に係る透過型電子顕微鏡用マイクログリッド(以下、単にマイクログリッドと略す場合がある。)の構成を示す概略図であり、図1(A)は平面図、図1(B)は1B−1B端面図である。
【0033】
第1実施形態に係るマイクログリッド10(透過型電子顕微鏡用試料保持体)は、図1に示すように、グリッド本体12(保持体本体)と、グリッド本体12に形成された触媒層14(触媒)と、触媒層14の表面上に形成されたカーボンナノチューブ16(担持コア)とから構成される。
【0034】
グリッド本体12としては例えば、金属または合金で作られたもの、あるいは、金属または合金にスパッタ法またはパルスレーザー法により酸化物導電体を成膜したものなどが挙げられる。金属としては例えば、Mo、Pt、Rh、Cuなどが挙げられ、酸化物導電体としては例えば、RuO2、IrO2、SrRuO3などが挙げられる。熱伝導性、電気伝導性を考慮すると、グリッド本体12の材質は、Mo、Pt、Rh、Cuであることが好ましい。さらに耐熱性を考慮すると、グリッド本体12の材質は、Mo、Pt、Rhであることがさらに好ましい。本第1実施形態において、グリッド本体12はMoで構成したものを適用している。
【0035】
グリッド本体12は、例えば中央部に開口部を有する円盤で構成されている。そして、その開口部を構成する縁部に、カーボンナノチューブ16が、開口部にはみ出すように形成されている。
【0036】
また、グリッド本体12の開口部側縁部を構成する面は、種々の方向を向いている。具体的には例えば、グリッド本体12の内周面11は曲面であり、内周面11の法線が位置によって異なる方向を向いている。つまり、グリッド本体12の内周面11は、円盤上部面13と平行な面において二次元的に種々の方向を向いている。
なお、グリッド本体12の内周面11が曲面で構成されると共に、内周面11と円盤上部面13の連結部が曲面となる場合、連結部を構成する曲面の法線が位置によって異なる方向を向くこととなる。つまり、該曲面は、円盤上部面13と平行な面に対して角度を持って、三次元的に種々の方向を向くことになる。
【0037】
またグリッド本体12の形状は、上記形状に限られず、例えば複数の開口部が格子状に配列された円盤形状など、開口部を有する様々な円盤形状が挙げられる。さらにグリッド本体12の形状は、開口部を有する円盤形状に限られず、例えば一部に切り欠き部を有する円盤形状、開口部を有する多角形板形状、三日月形状、および二つの三日月形状の内側中心部同士を連結した形状などの様に、試料が試料ホルダーなどにセットされた状態において、グリッド本体12の縁部が露出するような形状であれば、適用可能である。
【0038】
触媒層14は、例えば所定の厚みを持った薄膜状の触媒であり、グリッド本体12の開口部側縁部に所定の面積で等間隔に配置されている。触媒層14に対するカーボンナノチューブ16の成長は膜厚依存性が無いので、触媒層14の厚みは、数nm〜数μmの範囲で適用することができる。
カーボンナノチューブ16は触媒層14の表面上にのみ形成されるため、触媒層14の配置を制御することにより、カーボンナノチューブ16を所定の箇所に容易に形成することができる。よって触媒層14の配置は等間隔に限られず、触媒層14がグリッド本体12の縁部の少なくとも一部に形成されていれば、触媒層14が非等間隔に配置されていても、グリッド本体12の表面全体に形成されていても、差し支えない。
なおカーボンナノチューブ16の形成方法によっては、触媒を介さなくても、グリッド本体12の縁部にカーボンナノチューブを形成することができる場合がある。その場合においては、触媒層14を用いないことも可能である。
【0039】
また触媒層14は所定の厚みを持った薄膜であるため、触媒層14の表面形状は、グリッド本体12の開口部側縁部を構成する面をそのまま反映しており、種々の方向を向いている。よって、上述したとおり、カーボンナノチューブ16が種々の方向を向いた状態で存在している。
なお、触媒層14は所定の厚みを持った薄膜に限られず、例えば厚みが一定でない膜、多孔質膜、または粒状物を点在させたものなどであっても、結果として表面形状が種々の方向を向いていれば適用できる。さらに触媒層14は、単層膜に限られず、例えば多層膜であってもよく、構成する層は、単結晶、多結晶、または非結晶であってもよい。
【0040】
触媒層14の材質としては例えば、金属(例えば、Ni、Fe、Coなどの鉄族;Pd、Pt、Rhなどの白金族;La、Yなどの希土類金属;Mo、Mnなどの遷移金属)、合金(二種以上の金属を含むもの)、金属酸化物(例えば、チタン酸化物など)、またはこれらの混合物などが挙げられる。熱伝導性、電気伝導性を考慮すると、触媒層14の材質は、金属、または合金が好ましい。さらに触媒層14にカーボンナノチューブ16を化学的気相成長法(CVD法)により形成する場合には、触媒層14の材質は、Co、Ni、及びFeから選択される少なくとも1種以上の元素である事が好ましい。触媒層14は、基本的に遷移金属およびその酸化物であれば触媒作用が発現される。本第1実施形態では、Feを適用している。
【0041】
なお触媒層14は、カーボンナノチューブ16をCVD法以外の方法で形成する場合や、カーボンナノチューブ以外の材料を担持コアとして用いる場合などは、それぞれの形成方法および担持コア材料に応じて適した材質とすることができる。
【0042】
カーボンナノチューブ16は、触媒層14の表面上にのみ形成され、ナノチューブの軸方向が触媒層14の表面に対して様々な角度をなしている。図10は、実際に、グリッド本体12の開口部にはみ出したカーボンナノチューブ16を、高分解能透過型電子顕微鏡(H−1500、Hitachi製、加速電圧:800kV)により観察したTEM像である。図10のTEM像より、カーボンナノチューブが種々の方向を向いていることが分かる。ただし、図10のTEM像に写っているカーボンナノチューブは、観測対象物としての蛋白質層に被覆された状態である。
【0043】
なお上述したように、グリッド本体12の縁部を構成する面は、種々の方向を向いているため、触媒層14の表面も種々の方向を向いている。したがって、カーボンナノチューブ16の軸方向が、触媒層14の表面に対して一定の方向(例えば垂直方向)に配向していても、結果的に種々の方向のチューブ軸を持ったカーボンナノチューブ16を得ることができるため、種々の方向における観測対象物の観測データを取得することができる。
【0044】
またカーボンナノチューブ16は熱伝導性および電気伝導性が大変優れているため、グリッド本体12および触媒層14にも熱伝導性および電気伝導性のよい材料を用いた場合は(本第1実施形態においては、熱伝導性および電気伝導性が比較的よい材料として、グリッド本体12にはMo、触媒層14にはFeを適用している。)、熱やチャージアップによる観測対象物へのダメージを抑える事ができる。さらに観測対象物が蛋白質である場合には、カーボンナノチューブ16に担持する事により、熱および電荷による蛋白質のダメージを減らす事が出来ると共に、容易な蛋白質結晶化も可能となる。
【0045】
なお、カーボンナノチューブ16は、単層カーボンナノチューブであっても、多層カーボンナノチューブであっても良い。またカーボンナノチューブの代わりに、カーボンナノホーン、カーボンナノファイバー、フラーレン等に代表されるカーボンナノ材料;ボロンナイトライドナノチューブ(BNナノチューブ)などのボロン系ナノ材料;BCNナノチューブなどの炭素と窒素とホウ素から構成されたナノ材料;等を、担持コアとして用いてもよい。また、これらに限られず、非局在化したπ電子があるものであれば、担持コアとして用いることができる。
【0046】
次に、第1実施形態に係る透過型電子顕微鏡用マイクログリッドの製造方法について説明する。図2は、第1実施形態に係る透過型電子顕微鏡用マイクログリッドの製造方法を、工程別に示した図である。
【0047】
まず図2(A)に示すように、グリッド本体12を準備する。例えば、市販のグリッド本体(例えば、単孔メッシュ0.3mm〜単孔1.5mmメッシュ(Mo製)、応研商事販売)を購入したり、金属板をパンチング加工して得ることができる。なお、応研商事より購入可能なグリッド本体としては、上記のグリッド本体に限られず、1スロットメッシュ〜4スリットメッシュ、50−Aメッシュ、75Aメッシュ、100Aメッシュ、150Aメッシュなどが挙げられ、例えば50メッシュの場合、Pitch:500μm、Hole:450μm、Ber:50μmである。
【0048】
次に図2(B)に示すように、触媒層14を、グリッド本体12の開口部側縁部に等間隔に形成する。具体的には例えば、グリッド本体12上に、所定の開口が形成された金属マスクを被せた後、スパッタ法により、当該開口領域に金属膜を形成することにより、触媒層14を形成する。また、触媒層14の形状および形成位置は、例えば金属マスクの開口形状および開口位置によって制御する事が出来る。
なお触媒層14の形状および形成位置は、フォトレジスト法によって制御することも可能である。
【0049】
なお上述したように、触媒層14の形状、配置、および材質については特に限定されない。また、触媒層14の形成における具体的なスパッタ条件としては、触媒の材質に応じて一般的に用いられている条件を適用することができる。さらに触媒層14の形成方法としては、スパッタ法に限られることもなく、蒸着法などの公知の成膜方法を用いることができる。
【0050】
さらに図2(C)に示すように、触媒層14の表面上に、プラズマCVD法により、カーボンナノチューブ16を形成する。カーボンナノチューブ16の具体的な形成条件としては、例えば、圧力が1.33kPa(10Torr)、温度1000℃のCVDチャンバーに触媒層14の付いたグリッド本体12を設置し、炭素供給源としてC2H2ガスを50sccm、およびキャリアガスとしてNH3ガスを150sccmの流量で流し、その状態で1時間置く。ここで、sccmは流量の単位であり、1sccmは、0℃・1気圧の流体が1分間に1cm3流れることを示す。
【0051】
なお、プラズマCVD法における炭素供給源としては、C2H2ガスの他に、例えばメタン、プロピレン、エタノールなどのガスを用いることもでき、キャリアガスとしては、NH3ガスの他に、例えばAr、He、H2などを用いることも出来る。さらにカーボンナノチューブ16の形成方法として、プラズマCVD法以外のCVD法を用いることもでき、その他にアーク放電法、レーザーアブレーション法などを用いることもできる。
【0052】
カーボンナノチューブの代わりに担持コアとして他のナノ材料を用いる場合についても、同様の担持コア形成方法を用いることができ、また担持コアとして用いるナノ材料に応じて、これらの担持コア形成方法を選択して用いることができる。
【0053】
さらに、担持コアとして用いるナノ材料および担持コア形成方法に応じて、触媒層14の形状、配置、および材質を選択することができ、触媒層14を介さずにグリッド本体12の縁部の表面上に直接担持コアを成長させる方法を用いることも出来る。
【0054】
以上説明したように、第1実施形態に係る透過型電子顕微鏡用マイクログリッド10では、上述したように、カーボンナノチューブ16が形成されるグリッド本体12の面が種々の方向を向いているので、その結果、カーボンナノチューブ16も種々の方向を向いて形成される(図10参照)。よって、カーボンナノチューブ16に観測対象物を保持させてTEMによる観測を行うと、種々の方向における観測対象物の観測データを取得できることから、観測対象物のより正確な情報を得る事が出来る。
【0055】
(第2実施形態)
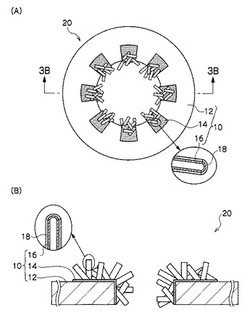
図3は、第2実施形態に係る透過型電子顕微鏡用試料(以下、単に試料と略す場合がある。)の構成を示す概略図であり、図3(A)は平面図、図3(B)は3B−3B端面図である。
【0056】
第2実施形態に係る試料20は、図3に示すように、第1実施形態のマイクログリッド10と、マイクログリッド10のカーボンナノチューブ16の側面に被覆した蛋白質層18(観測対象物)とから構成される。マイクログリッド10についての詳細は、第1実施形態で示したとおりである。
【0057】
蛋白質層18は、図3の拡大図に示すように、カーボンナノチューブ16の側面全体を薄膜状に被覆している。ただし蛋白質層18は、カーボンナノチューブ16の側面全体を薄膜状に被覆した状態に限られず、TEMを用いた観測が可能な程度にカーボンナノチューブ16に担持されていれば、カーボンナノチューブ16の側面を部分的に被覆した状態であってもよい。さらに観測対象物によっては、カーボンナノチューブ16の端部、または内部に部分的に担持された状態であっても差し支えない。
【0058】
蛋白質層18の種類としては、本第2実施形態においてはバクテリオロドプシンを用いているが、これに限られず、ハロロドプシンなどのその他の蛋白質を適用することができる。また観測対象物としては、蛋白質に限られず、例えば蛋白質以外の高分子化合物、低分子化合物、無機化合物、金属など、担持コアに担持することが出来るものであれば、適用することができる。
【0059】
次に、第2実施形態に係る透過型電子顕微鏡用試料の製造方法について説明する。図4乃至6は、第2実施形態に係る試料の製造方法を工程別に示した図である。以下、蛋白質として、バクテリオロドプシンを用いた形態を説明する。
【0060】
まず例えば、高度好塩菌(Halobacuterium Salinarum)から遠心分離機によって抽出した紫膜を、33体積%のジメチルホルムアルデヒド水溶液に分散させることにより、蛋白質濃度が8μmol/lの紫膜展開液26を調整する。次に図4に示すように、ラングミュアブロジェット膜(LB膜)作製装置22に張った下層液24(pH3.5の塩酸)の液面(面積:480cm2)上に、シリンジ27により紫膜展開液26(体積:180μl)を滴下すると、紫膜展開液26は、下層液24の液面上で展開される。
【0061】
本第2実施形態で用いている蛋白質の種類は、上記のとおりバクテリオロドプシンであり、紫膜に含まれるバクテリオロドプシンは、7本のαへリックスが会合した球状蛋白質である。上記のように、紫膜展開液26を下層液24の液面上に展開すると、時間がたつにつれて、紫膜展開液26中に含まれる蛋白質28のαヘリックスの会合状態が崩れていく。そこで、図4の拡大図に示すように、蛋白質28におけるαヘリックスの会合状態が完全に崩れた状態にするために、例えば少なくとも5時間静置する。その後、可動式バリア30を用い、表面膜圧が15mN/mとなるまで圧縮することによって、蛋白質28の単分子膜を作製する。
【0062】
次に図5に示すように、蛋白質28の単分子膜に、第1実施形態に係るマイクログリッド10を、静かに浮かべる。その後1時間放置すると、マイクログリッド10のカーボンナノチューブ16に蛋白質層18が被覆した状態(図6)となり、試料20が出来上がる。試料20は、その後液面から静かに引き上げる。
【0063】
この際、図7に示すように、下層液24の液面上における蛋白質28は、カーボンナノチューブ16に接すると、自然に三次元的な構造変化を起こし、αヘリックスがβシートに変化する。カーボンナノチューブ16の側面でβシートに変化した蛋白質28は、カーボンナノチューブ16の側面を層状に被覆し、結晶性の蛋白質層18を形成する。
【0064】
また、カーボンナノチューブ16に被覆している状態の蛋白質層18の表面が、下層液24の液面上において単分子膜状態となっている蛋白質28と接した場合も同様に、蛋白質28の三次元的な構造変化が起こり、蛋白質層18の表面をさらに被覆する。よって、マイクログリッド10を蛋白質28の単分子膜上に浮かべて放置する時間を制御する事により、結晶化した蛋白質層18の厚さを制御する事が出来る。
【0065】
ここで図7は、下層液24の液面上において、マイクログリッド10のカーボンナノチューブ16に蛋白質28が被覆して、蛋白質層18が形成される様子を示す模式図である。
【0066】
以上説明したように、第2実施形態に係る試料20は、第1実施形態で述べたように、カーボンナノチューブ16に観測対象物を保持させてTEMによる観測を行うと、種々の方向における観測対象物の観測データを取得できることから、観測対象物のより正確な情報を得る事が出来る。
【0067】
(第3実施形態)
第3実施形態に係る蛋白質結晶構造解析方法について説明する。
【0068】
まず図8に示すように、本発明の試料20を試料ホルダー台32に乗せ、試料ホルダー用蓋34でふたをする事により、試料20を試料ホルダー30に固定する(図9)。図9に示すように、試料20が試料ホルダー30にセット(保持)された状態において、試料20のグリッド本体12の開口部側縁部、グリッド本体12の開口部側縁部に形成されたカーボンナノチューブ16、およびカーボンナノチューブ16の側面に被覆された蛋白質層18はすべて、露出している。
なお、試料ホルダー30の形状および材質は、用いるTEMの種類および観測目的に応じて、公知のものを用いる事ができる。
【0069】
次に、試料20をセットした試料ホルダー30をTEMへ導入し、観測を行う。観測は、カーボンナノチューブ16の側面に被覆している蛋白質層18のうち、グリッド本体12の開口部にはみ出している箇所において、透過または回折した電子を検出することにより行い、それによって得られる観測データ(例えば回折パターン)を用いて、蛋白質結晶構造解析を行う。
【0070】
具体的には例えば、観測データの取得、蛋白質結晶構造解析は、次のように行う。所定の蛋白質の観察エリアに制限視野回折アパチャーを入れ、TEMの画像モードをTEM観察モードから回折モードに切り替えて、このアパチャーで限定された領域から、単結晶の構造の情報をもった電子線回折パターンを得る。ここで、アパチャーは、所定の単結晶からの電子線回折パターンのみを観測するために、視野を制限するものである。このようにして得られた電子線回折パターンを、銀塩フィルムに撮影する。なお、電子線か伊勢いつパターンは、銀塩フィルムへの撮影する代わりに、CCDカメラを用いて直接コンピューターに取り込むこともできる。
【0071】
ここで、上記手法により、第2実施形態で用いた蛋白質であるバクテリオロドプシン(試料20)を、高分解能透過型電子顕微鏡(H−1500、Hitachi製、加速電圧:800kV)を用いて観測を行った結果得られた、逆格子空間における回折パターンの一例を図12に示す。また図12の回折パターンを逆フーリエ変換することによって得られた超高分解能TEM像を図11に示す。
【0072】
また、本第3実施形態で用いた蛋白質であるバクテリオロドプシンにおける一本のペプチド鎖の模式図を図13(A)に示し、逆平行βシート構造の模式図を図13(B)に示す。
【0073】
一般的にβシート構造は、図13(A)に示すような伸びたペプチド鎖が、図13(B)に示すように、平行または逆平行の方向で、ペプチド鎖のC=O基のO原子と、隣のペプチド鎖のN−H基のH原子が、水素結合することにより形成されている。
【0074】
一方、上記結晶構造解析方法で得られた図11の超高分解能TEM像では、平行に並んだペプチド鎖と、ペプチド鎖間の水素結合が、黒い影として写っている。この図11の超高分解能TEM像における黒い影の形状から、蛋白質層18の結晶構造は、図13(B)に示すような逆平行βシート構造であることが分かる。
【0075】
さらに、図12の回折パターンにおける、回折スポットと透過スポットの距離に基づき、蛋白質層18におけるペプチド鎖間の距離が0.47nm、アミノ酸残基の単位長さが0.29nmと求めることができる。
【0076】
このようにして、蛋白質結晶構造解析を行うことができる。
なお結晶構造解析手段については、上述した具体的手段に限られず、公知の手段を用いることができる。また、本第3実施形態においてはTEMの回折モードを用いて結晶構造解析を行っているが、図10のように、単に透過電子を観測することによりTEM像を得ることもできる。
さらに、高分解能透過型電子顕微鏡の代わりに、その他のTEM(例えば走査透過電子顕微鏡など)を用いて、公知の観測手段により観測する事もできる。
【0077】
以上説明したように、第3実施形態に係る蛋白質結晶構造解析方法を用いると、カーボンナノチューブ12が種々の方向を向いているため、種々の方向を向いた蛋白質結晶についての観測データを得る事ができ、従来に比べてより正確な蛋白質結晶構造解析を行う事ができる。
【図面の簡単な説明】
【0078】
【図1】本発明の透過型電子顕微鏡用マイクログリッドの構成を示す概略図であり、(A)平面図、(B)1B−1B端面図である。
【図2】第1実施形態に係る透過型電子顕微鏡用マイクログリッドの製造方法を、工程別に示した工程図である。
【図3】第2実施形態に係る透過型電子顕微鏡用試料の構成を示す概略図であり、(A)平面図、(B)3B−3B端面図である。
【図4】第2実施形態に係る透過型電子顕微鏡用試料の製造方法において、蛋白質の単分子膜を作製する工程を示した工程図である。
【図5】第2実施形態に係る透過型電子顕微鏡用試料の製造方法において、蛋白質の単分子膜にマイクログリッドを浮かべる工程を示した工程図である。
【図6】第2実施形態に係る透過型電子顕微鏡用試料の製造方法において、マイクログリッドのカーボンナノチューブ側面上に蛋白質層が形成された状態を示した模式図である。
【図7】カーボンナノチューブの側面上に蛋白質層が形成される様子を示す模式図である。
【図8】本発明の透過型電子顕微鏡用試料および試料ホルダーの分解斜視図である。
【図9】本発明の透過型電子顕微鏡用試料が試料ホルダーにセットされた状態を示す斜視図である。
【図10】本発明の透過型電子顕微鏡用試料のTEM像である。
【図11】本発明の蛋白質結晶構造解析方法の過程で得られた、蛋白質層の超高分解TEM像である。
【図12】本発明の蛋白質結晶構造解析方法の過程で得られた、逆格子空間における回折パターンである。
【図13】バクテリオロドプシンにおける、(A)一本のペプチド鎖の模式図、および(B)逆平行βシート構造の化学式である。
【符号の説明】
【0079】
10…マイクログリッド(透過型電子顕微鏡用試料保持体)
12…グリッド本体(保持体本体)
14…触媒層(触媒)
16…カーボンナノチューブ(担持コア)
18…蛋白質層(観測対象物)
20…試料(透過型電子顕微鏡用試料)
【技術分野】
【0001】
本発明は、透過型電子顕微鏡用試料保持体およびその製造方法、透過型電子顕微鏡用試料およびその製造方法、並びに、透過型電子顕微鏡用試料を用いた観測方法および結晶構造解析方法に関するものである。
【背景技術】
【0002】
一般的に、結晶構造の解析を行う場合は中性子線回折あるいは精密X線回折等を用いることが多く、試料として数ミリ程度の大きさまで成長した結晶が必要となる。しかし蛋白質は一般的に結晶化が難しく、さらに数ミリ程度の大きさまで結晶を成長させることは非常に困難である。
【0003】
微小で厚さの薄い試料の観察および評価を行う方法としては、透過型電子顕微鏡等を用いる方法が知られている。特に高分解能透過型電子顕微鏡は、微小薄膜試料を原子レベルで観察することができるため、微小薄膜蛋白質結晶の構造解析が可能になると考えられる。
【0004】
一方、蛋白質の分散液を液体表面に展開する事により蛋白質を変性させ、その変性した蛋白質をカーボンナノチューブの側面に被覆させた、カーボンナノチューブ構造体に関する技術が提案されている(特許文献1)。
【0005】
このカーボンナノチューブ構造体においては、カーボンナノチューブの側面に被覆された蛋白質層が薄いため、中性子線回折あるいはX線回折等による結晶構造解析は困難であるが、透過型電子顕微鏡を用いれば、蛋白質層の結晶構造解析が可能になると考えられる。
【特許文献1】再公表特許W02004/041719号公報
【発明の開示】
【発明が解決しようとする課題】
【0006】
上記のように、蛋白質に代表される観測対象物を、カーボンナノチューブに代表される担持コアの側面に被覆し、側面が被覆された担持コアの被覆層を透過型電子顕微鏡により観測することにより、観測対象物の結晶構造を始めとする様々な情報を得ることができる。
【0007】
しかし、透過型電子顕微鏡による観測においては、観測方向が制限されることが多い。よって、観測対象物が配向性を持った状態で観測されると、所定の観測データが得られないことがある。このため、様々な方向を向いている観測対象物を存在させて、種々の方向における観測対象物の観測データを取得できることが求められている。
【0008】
そこで本発明は、上記問題点に鑑み、透過型電子顕微鏡を用いた観測により、種々の方向における観測対象物の観測データを取得することが可能な、透過型電子顕微鏡用試料保持体およびその製造方法、透過型電子顕微鏡用試料およびその製造方法、並びに、透過型電子顕微鏡用試料を用いた観測方法および結晶構造解析方法を提供する。
【課題を解決するための手段】
【0009】
上記課題は、以下の手段により解決される。即ち、
本発明の透過型電子顕微鏡用試料保持体は、保持体本体と、観測対象物を担持するための担持コアであって、前記保持体本体の縁部の少なくとも一部に設けられた担持コアと、を有することを特徴としている。
【0010】
本発明の透過型電子顕微鏡用試料保持体では、保持体本体は、その形状により、例えば曲面や複数の面から構成されていることとなるため、本体縁部を構成する面は種々の方向に向いている。このため、保持体本体の縁部に形成される担持コアは、種々の方向を向いて形成されることとなる。したがって結果的に、透過型電子顕微鏡用試料保持体上に保持された観測対象物も種々の方向を向いていることとなり、透過型電子顕微鏡の性質上観測の方向が制限されていても、種々の方向における観測対象物の観測データを取得することが可能となる。
【0011】
本発明の透過型電子顕微鏡用試料保持体において、前記担持コアは、触媒を介して前記保持体本体に設けられることができる。また前記触媒は、Co、Ni、及びFeから選択される少なくとも1種以上の元素である事が好適である。
【0012】
本発明の透過型電子顕微鏡用試料保持体において、前記担持コアは、カーボンナノチューブを含む事が好適である。
【0013】
本発明の透過型電子顕微鏡用試料は、本発明の透過型電子顕微鏡用試料保持体と、前記透過型電子顕微鏡用試料保持体の前記担持コアに担持された観測対象物と、を有することを特徴としている。
【0014】
本発明の透過型電子顕微鏡用試料では、上述したように、透過型電子顕微鏡用試料保持体の担持コアが種々の方向を向いて形成されているため、担持コア上に担持された観測対象物も種々の方向を向いていることとなり、透過型電子顕微鏡の性質上観測の方向が制限されていても、種々の方向における観測対象物の観測データを取得することが可能となる。
【0015】
本発明の透過型電子顕微鏡用試料において、前記観測対象物は、蛋白質であることが好適である。
【0016】
本発明の透過型電子顕微鏡用試料保持体の製造方法は、保持体本体を準備する第1工程と、前記保持体本体の縁部の少なくとも一部に、観測対象物を担持するための担持コアを形成する第2工程と、を有することを特徴としている。
【0017】
本発明の透過型電子顕微鏡用試料保持体の製造方法により、上記本発明の透過型電子顕微鏡用試料保持体を得ることが出来る。
【0018】
本発明の透過型電子顕微鏡用試料保持体の製造方法においては、前記第2工程は、前記保持体本体の前記縁部の少なくとも一部に触媒を形成した後、前記触媒上に前記担持コアを形成する工程とすることができる。
【0019】
本発明の透過型電子顕微鏡用試料保持体の製造方法においては、前記触媒は、Co、Ni、及びFeから選択される少なくとも1種以上の元素である事が好適である。
【0020】
本発明の透過型電子顕微鏡用試料保持体の製造方法においては、前記担持コアは、カーボンナノチューブを含む事が好適である。
【0021】
本発明の透過型電子顕微鏡用試料の製造方法は、本発明の透過型電子顕微鏡用試料保持体を準備する工程と、前記保持体本体の前記縁部の少なくとも一部に形成された前記担持コアに、観測対象物を担持させる工程と、を有することを特徴としている。
【0022】
本発明の透過型電子顕微鏡用試料の製造方法により、上記本発明の透過型電子顕微鏡用試料を得ることが出来る。
【0023】
本発明の透過型電子顕微鏡用試料の製造方法においては、前記観測対象物は、蛋白質であることが好適である。
【0024】
本発明の観測方法は、本発明の透過型電子顕微鏡用試料を試料ホルダーに保持する工程と、前記試料ホルダーを透過型電子顕微鏡へ装着する事により、前記透過型電子顕微鏡用試料を前記透過型電子顕微鏡へ導入する工程と、前記透過型電子顕微鏡用試料を前記透過型電子顕微鏡で観測する工程と、を含むことを特徴としている。
【0025】
本発明の観測方法では、上記本発明の透過型電子顕微鏡用試料を用いるので、透過型電子顕微鏡の性質上観測の方向が制限されていても、種々の方向における観測対象物の観測データを取得することが可能となる。
【0026】
本発明の結晶構造解析方法は、本発明の観測方法により観測する観測工程と、前記観測工程により得られた観測データを用いて結晶構造の解析を行う解析工程と、を有することを特徴としている。
【0027】
本発明の結晶構造解析方法では、上記本発明の透過型電子顕微鏡用試料を用いるので、透過型電子顕微鏡の性質上観測の方向が制限されていても、種々の方向における観測データを取得することが可能となる。このため、従来と比べてより正確な結晶構造解析を行うことができる。
【0028】
本発明の蛋白質結晶構造解析方法は、本発明の保持体本体を準備して、前記保持体本体の縁部の少なくとも一部に触媒を形成した後、前記触媒にカーボンナノチューブを形成することにより透過型電子顕微鏡用試料保持体を製造する試料保持体製造工程と、前記透過型電子顕微鏡用試料保持体の前記カーボンナノチューブに蛋白質を担持させることにより透過型電子顕微鏡用試料を製造する試料製造工程と、前記透過型電子顕微鏡用試料を試料ホルダーに保持した後、前記試料ホルダーを透過型電子顕微鏡へ装着する事により、前記透過型電子顕微鏡用試料を前記透過型電子顕微鏡へ導入する試料導入工程と、前記透過型電子顕微鏡用試料を前記透過型電子顕微鏡で観測する観測工程と、前記観測工程により得られた観測データを用いて蛋白質結晶構造の解析を行う解析工程と、を有することを特徴としている。
【0029】
本発明の蛋白質結晶構造解析方法では、上記本発明の透過型電子顕微鏡用試料保持体で説明したように、カーボンナノチューブが種々の方向を向いて形成されているため、カーボンナノチューブ上に担持された蛋白質は、透過型電子顕微鏡の性質上観測の方向が制限されていても、種々の方向における蛋白質の観測データを取得することができ、従来と比べてより正確な蛋白質の結晶構造解析を行うことが出来る。
【発明の効果】
【0030】
本発明によれば、透過型電子顕微鏡を用いた観測により、種々の方向における観測対象物の観測データを取得することが可能な、透過型電子顕微鏡用試料保持体およびその製造方法、透過型電子顕微鏡用試料およびその製造方法、並びに、透過型電子顕微鏡用試料を用いた観測方法および結晶構造解析方法を提供することができる。
【発明を実施するための最良の形態】
【0031】
以下、本発明について図面を参照しつつ説明する。なお、実質的に同一の機能を有する部材には全図面と押して同じ符号を付与し、重複する説明は省略する場合がある。
【0032】
(第1実施形態)
図1は、第1実施形態に係る透過型電子顕微鏡用マイクログリッド(以下、単にマイクログリッドと略す場合がある。)の構成を示す概略図であり、図1(A)は平面図、図1(B)は1B−1B端面図である。
【0033】
第1実施形態に係るマイクログリッド10(透過型電子顕微鏡用試料保持体)は、図1に示すように、グリッド本体12(保持体本体)と、グリッド本体12に形成された触媒層14(触媒)と、触媒層14の表面上に形成されたカーボンナノチューブ16(担持コア)とから構成される。
【0034】
グリッド本体12としては例えば、金属または合金で作られたもの、あるいは、金属または合金にスパッタ法またはパルスレーザー法により酸化物導電体を成膜したものなどが挙げられる。金属としては例えば、Mo、Pt、Rh、Cuなどが挙げられ、酸化物導電体としては例えば、RuO2、IrO2、SrRuO3などが挙げられる。熱伝導性、電気伝導性を考慮すると、グリッド本体12の材質は、Mo、Pt、Rh、Cuであることが好ましい。さらに耐熱性を考慮すると、グリッド本体12の材質は、Mo、Pt、Rhであることがさらに好ましい。本第1実施形態において、グリッド本体12はMoで構成したものを適用している。
【0035】
グリッド本体12は、例えば中央部に開口部を有する円盤で構成されている。そして、その開口部を構成する縁部に、カーボンナノチューブ16が、開口部にはみ出すように形成されている。
【0036】
また、グリッド本体12の開口部側縁部を構成する面は、種々の方向を向いている。具体的には例えば、グリッド本体12の内周面11は曲面であり、内周面11の法線が位置によって異なる方向を向いている。つまり、グリッド本体12の内周面11は、円盤上部面13と平行な面において二次元的に種々の方向を向いている。
なお、グリッド本体12の内周面11が曲面で構成されると共に、内周面11と円盤上部面13の連結部が曲面となる場合、連結部を構成する曲面の法線が位置によって異なる方向を向くこととなる。つまり、該曲面は、円盤上部面13と平行な面に対して角度を持って、三次元的に種々の方向を向くことになる。
【0037】
またグリッド本体12の形状は、上記形状に限られず、例えば複数の開口部が格子状に配列された円盤形状など、開口部を有する様々な円盤形状が挙げられる。さらにグリッド本体12の形状は、開口部を有する円盤形状に限られず、例えば一部に切り欠き部を有する円盤形状、開口部を有する多角形板形状、三日月形状、および二つの三日月形状の内側中心部同士を連結した形状などの様に、試料が試料ホルダーなどにセットされた状態において、グリッド本体12の縁部が露出するような形状であれば、適用可能である。
【0038】
触媒層14は、例えば所定の厚みを持った薄膜状の触媒であり、グリッド本体12の開口部側縁部に所定の面積で等間隔に配置されている。触媒層14に対するカーボンナノチューブ16の成長は膜厚依存性が無いので、触媒層14の厚みは、数nm〜数μmの範囲で適用することができる。
カーボンナノチューブ16は触媒層14の表面上にのみ形成されるため、触媒層14の配置を制御することにより、カーボンナノチューブ16を所定の箇所に容易に形成することができる。よって触媒層14の配置は等間隔に限られず、触媒層14がグリッド本体12の縁部の少なくとも一部に形成されていれば、触媒層14が非等間隔に配置されていても、グリッド本体12の表面全体に形成されていても、差し支えない。
なおカーボンナノチューブ16の形成方法によっては、触媒を介さなくても、グリッド本体12の縁部にカーボンナノチューブを形成することができる場合がある。その場合においては、触媒層14を用いないことも可能である。
【0039】
また触媒層14は所定の厚みを持った薄膜であるため、触媒層14の表面形状は、グリッド本体12の開口部側縁部を構成する面をそのまま反映しており、種々の方向を向いている。よって、上述したとおり、カーボンナノチューブ16が種々の方向を向いた状態で存在している。
なお、触媒層14は所定の厚みを持った薄膜に限られず、例えば厚みが一定でない膜、多孔質膜、または粒状物を点在させたものなどであっても、結果として表面形状が種々の方向を向いていれば適用できる。さらに触媒層14は、単層膜に限られず、例えば多層膜であってもよく、構成する層は、単結晶、多結晶、または非結晶であってもよい。
【0040】
触媒層14の材質としては例えば、金属(例えば、Ni、Fe、Coなどの鉄族;Pd、Pt、Rhなどの白金族;La、Yなどの希土類金属;Mo、Mnなどの遷移金属)、合金(二種以上の金属を含むもの)、金属酸化物(例えば、チタン酸化物など)、またはこれらの混合物などが挙げられる。熱伝導性、電気伝導性を考慮すると、触媒層14の材質は、金属、または合金が好ましい。さらに触媒層14にカーボンナノチューブ16を化学的気相成長法(CVD法)により形成する場合には、触媒層14の材質は、Co、Ni、及びFeから選択される少なくとも1種以上の元素である事が好ましい。触媒層14は、基本的に遷移金属およびその酸化物であれば触媒作用が発現される。本第1実施形態では、Feを適用している。
【0041】
なお触媒層14は、カーボンナノチューブ16をCVD法以外の方法で形成する場合や、カーボンナノチューブ以外の材料を担持コアとして用いる場合などは、それぞれの形成方法および担持コア材料に応じて適した材質とすることができる。
【0042】
カーボンナノチューブ16は、触媒層14の表面上にのみ形成され、ナノチューブの軸方向が触媒層14の表面に対して様々な角度をなしている。図10は、実際に、グリッド本体12の開口部にはみ出したカーボンナノチューブ16を、高分解能透過型電子顕微鏡(H−1500、Hitachi製、加速電圧:800kV)により観察したTEM像である。図10のTEM像より、カーボンナノチューブが種々の方向を向いていることが分かる。ただし、図10のTEM像に写っているカーボンナノチューブは、観測対象物としての蛋白質層に被覆された状態である。
【0043】
なお上述したように、グリッド本体12の縁部を構成する面は、種々の方向を向いているため、触媒層14の表面も種々の方向を向いている。したがって、カーボンナノチューブ16の軸方向が、触媒層14の表面に対して一定の方向(例えば垂直方向)に配向していても、結果的に種々の方向のチューブ軸を持ったカーボンナノチューブ16を得ることができるため、種々の方向における観測対象物の観測データを取得することができる。
【0044】
またカーボンナノチューブ16は熱伝導性および電気伝導性が大変優れているため、グリッド本体12および触媒層14にも熱伝導性および電気伝導性のよい材料を用いた場合は(本第1実施形態においては、熱伝導性および電気伝導性が比較的よい材料として、グリッド本体12にはMo、触媒層14にはFeを適用している。)、熱やチャージアップによる観測対象物へのダメージを抑える事ができる。さらに観測対象物が蛋白質である場合には、カーボンナノチューブ16に担持する事により、熱および電荷による蛋白質のダメージを減らす事が出来ると共に、容易な蛋白質結晶化も可能となる。
【0045】
なお、カーボンナノチューブ16は、単層カーボンナノチューブであっても、多層カーボンナノチューブであっても良い。またカーボンナノチューブの代わりに、カーボンナノホーン、カーボンナノファイバー、フラーレン等に代表されるカーボンナノ材料;ボロンナイトライドナノチューブ(BNナノチューブ)などのボロン系ナノ材料;BCNナノチューブなどの炭素と窒素とホウ素から構成されたナノ材料;等を、担持コアとして用いてもよい。また、これらに限られず、非局在化したπ電子があるものであれば、担持コアとして用いることができる。
【0046】
次に、第1実施形態に係る透過型電子顕微鏡用マイクログリッドの製造方法について説明する。図2は、第1実施形態に係る透過型電子顕微鏡用マイクログリッドの製造方法を、工程別に示した図である。
【0047】
まず図2(A)に示すように、グリッド本体12を準備する。例えば、市販のグリッド本体(例えば、単孔メッシュ0.3mm〜単孔1.5mmメッシュ(Mo製)、応研商事販売)を購入したり、金属板をパンチング加工して得ることができる。なお、応研商事より購入可能なグリッド本体としては、上記のグリッド本体に限られず、1スロットメッシュ〜4スリットメッシュ、50−Aメッシュ、75Aメッシュ、100Aメッシュ、150Aメッシュなどが挙げられ、例えば50メッシュの場合、Pitch:500μm、Hole:450μm、Ber:50μmである。
【0048】
次に図2(B)に示すように、触媒層14を、グリッド本体12の開口部側縁部に等間隔に形成する。具体的には例えば、グリッド本体12上に、所定の開口が形成された金属マスクを被せた後、スパッタ法により、当該開口領域に金属膜を形成することにより、触媒層14を形成する。また、触媒層14の形状および形成位置は、例えば金属マスクの開口形状および開口位置によって制御する事が出来る。
なお触媒層14の形状および形成位置は、フォトレジスト法によって制御することも可能である。
【0049】
なお上述したように、触媒層14の形状、配置、および材質については特に限定されない。また、触媒層14の形成における具体的なスパッタ条件としては、触媒の材質に応じて一般的に用いられている条件を適用することができる。さらに触媒層14の形成方法としては、スパッタ法に限られることもなく、蒸着法などの公知の成膜方法を用いることができる。
【0050】
さらに図2(C)に示すように、触媒層14の表面上に、プラズマCVD法により、カーボンナノチューブ16を形成する。カーボンナノチューブ16の具体的な形成条件としては、例えば、圧力が1.33kPa(10Torr)、温度1000℃のCVDチャンバーに触媒層14の付いたグリッド本体12を設置し、炭素供給源としてC2H2ガスを50sccm、およびキャリアガスとしてNH3ガスを150sccmの流量で流し、その状態で1時間置く。ここで、sccmは流量の単位であり、1sccmは、0℃・1気圧の流体が1分間に1cm3流れることを示す。
【0051】
なお、プラズマCVD法における炭素供給源としては、C2H2ガスの他に、例えばメタン、プロピレン、エタノールなどのガスを用いることもでき、キャリアガスとしては、NH3ガスの他に、例えばAr、He、H2などを用いることも出来る。さらにカーボンナノチューブ16の形成方法として、プラズマCVD法以外のCVD法を用いることもでき、その他にアーク放電法、レーザーアブレーション法などを用いることもできる。
【0052】
カーボンナノチューブの代わりに担持コアとして他のナノ材料を用いる場合についても、同様の担持コア形成方法を用いることができ、また担持コアとして用いるナノ材料に応じて、これらの担持コア形成方法を選択して用いることができる。
【0053】
さらに、担持コアとして用いるナノ材料および担持コア形成方法に応じて、触媒層14の形状、配置、および材質を選択することができ、触媒層14を介さずにグリッド本体12の縁部の表面上に直接担持コアを成長させる方法を用いることも出来る。
【0054】
以上説明したように、第1実施形態に係る透過型電子顕微鏡用マイクログリッド10では、上述したように、カーボンナノチューブ16が形成されるグリッド本体12の面が種々の方向を向いているので、その結果、カーボンナノチューブ16も種々の方向を向いて形成される(図10参照)。よって、カーボンナノチューブ16に観測対象物を保持させてTEMによる観測を行うと、種々の方向における観測対象物の観測データを取得できることから、観測対象物のより正確な情報を得る事が出来る。
【0055】
(第2実施形態)
図3は、第2実施形態に係る透過型電子顕微鏡用試料(以下、単に試料と略す場合がある。)の構成を示す概略図であり、図3(A)は平面図、図3(B)は3B−3B端面図である。
【0056】
第2実施形態に係る試料20は、図3に示すように、第1実施形態のマイクログリッド10と、マイクログリッド10のカーボンナノチューブ16の側面に被覆した蛋白質層18(観測対象物)とから構成される。マイクログリッド10についての詳細は、第1実施形態で示したとおりである。
【0057】
蛋白質層18は、図3の拡大図に示すように、カーボンナノチューブ16の側面全体を薄膜状に被覆している。ただし蛋白質層18は、カーボンナノチューブ16の側面全体を薄膜状に被覆した状態に限られず、TEMを用いた観測が可能な程度にカーボンナノチューブ16に担持されていれば、カーボンナノチューブ16の側面を部分的に被覆した状態であってもよい。さらに観測対象物によっては、カーボンナノチューブ16の端部、または内部に部分的に担持された状態であっても差し支えない。
【0058】
蛋白質層18の種類としては、本第2実施形態においてはバクテリオロドプシンを用いているが、これに限られず、ハロロドプシンなどのその他の蛋白質を適用することができる。また観測対象物としては、蛋白質に限られず、例えば蛋白質以外の高分子化合物、低分子化合物、無機化合物、金属など、担持コアに担持することが出来るものであれば、適用することができる。
【0059】
次に、第2実施形態に係る透過型電子顕微鏡用試料の製造方法について説明する。図4乃至6は、第2実施形態に係る試料の製造方法を工程別に示した図である。以下、蛋白質として、バクテリオロドプシンを用いた形態を説明する。
【0060】
まず例えば、高度好塩菌(Halobacuterium Salinarum)から遠心分離機によって抽出した紫膜を、33体積%のジメチルホルムアルデヒド水溶液に分散させることにより、蛋白質濃度が8μmol/lの紫膜展開液26を調整する。次に図4に示すように、ラングミュアブロジェット膜(LB膜)作製装置22に張った下層液24(pH3.5の塩酸)の液面(面積:480cm2)上に、シリンジ27により紫膜展開液26(体積:180μl)を滴下すると、紫膜展開液26は、下層液24の液面上で展開される。
【0061】
本第2実施形態で用いている蛋白質の種類は、上記のとおりバクテリオロドプシンであり、紫膜に含まれるバクテリオロドプシンは、7本のαへリックスが会合した球状蛋白質である。上記のように、紫膜展開液26を下層液24の液面上に展開すると、時間がたつにつれて、紫膜展開液26中に含まれる蛋白質28のαヘリックスの会合状態が崩れていく。そこで、図4の拡大図に示すように、蛋白質28におけるαヘリックスの会合状態が完全に崩れた状態にするために、例えば少なくとも5時間静置する。その後、可動式バリア30を用い、表面膜圧が15mN/mとなるまで圧縮することによって、蛋白質28の単分子膜を作製する。
【0062】
次に図5に示すように、蛋白質28の単分子膜に、第1実施形態に係るマイクログリッド10を、静かに浮かべる。その後1時間放置すると、マイクログリッド10のカーボンナノチューブ16に蛋白質層18が被覆した状態(図6)となり、試料20が出来上がる。試料20は、その後液面から静かに引き上げる。
【0063】
この際、図7に示すように、下層液24の液面上における蛋白質28は、カーボンナノチューブ16に接すると、自然に三次元的な構造変化を起こし、αヘリックスがβシートに変化する。カーボンナノチューブ16の側面でβシートに変化した蛋白質28は、カーボンナノチューブ16の側面を層状に被覆し、結晶性の蛋白質層18を形成する。
【0064】
また、カーボンナノチューブ16に被覆している状態の蛋白質層18の表面が、下層液24の液面上において単分子膜状態となっている蛋白質28と接した場合も同様に、蛋白質28の三次元的な構造変化が起こり、蛋白質層18の表面をさらに被覆する。よって、マイクログリッド10を蛋白質28の単分子膜上に浮かべて放置する時間を制御する事により、結晶化した蛋白質層18の厚さを制御する事が出来る。
【0065】
ここで図7は、下層液24の液面上において、マイクログリッド10のカーボンナノチューブ16に蛋白質28が被覆して、蛋白質層18が形成される様子を示す模式図である。
【0066】
以上説明したように、第2実施形態に係る試料20は、第1実施形態で述べたように、カーボンナノチューブ16に観測対象物を保持させてTEMによる観測を行うと、種々の方向における観測対象物の観測データを取得できることから、観測対象物のより正確な情報を得る事が出来る。
【0067】
(第3実施形態)
第3実施形態に係る蛋白質結晶構造解析方法について説明する。
【0068】
まず図8に示すように、本発明の試料20を試料ホルダー台32に乗せ、試料ホルダー用蓋34でふたをする事により、試料20を試料ホルダー30に固定する(図9)。図9に示すように、試料20が試料ホルダー30にセット(保持)された状態において、試料20のグリッド本体12の開口部側縁部、グリッド本体12の開口部側縁部に形成されたカーボンナノチューブ16、およびカーボンナノチューブ16の側面に被覆された蛋白質層18はすべて、露出している。
なお、試料ホルダー30の形状および材質は、用いるTEMの種類および観測目的に応じて、公知のものを用いる事ができる。
【0069】
次に、試料20をセットした試料ホルダー30をTEMへ導入し、観測を行う。観測は、カーボンナノチューブ16の側面に被覆している蛋白質層18のうち、グリッド本体12の開口部にはみ出している箇所において、透過または回折した電子を検出することにより行い、それによって得られる観測データ(例えば回折パターン)を用いて、蛋白質結晶構造解析を行う。
【0070】
具体的には例えば、観測データの取得、蛋白質結晶構造解析は、次のように行う。所定の蛋白質の観察エリアに制限視野回折アパチャーを入れ、TEMの画像モードをTEM観察モードから回折モードに切り替えて、このアパチャーで限定された領域から、単結晶の構造の情報をもった電子線回折パターンを得る。ここで、アパチャーは、所定の単結晶からの電子線回折パターンのみを観測するために、視野を制限するものである。このようにして得られた電子線回折パターンを、銀塩フィルムに撮影する。なお、電子線か伊勢いつパターンは、銀塩フィルムへの撮影する代わりに、CCDカメラを用いて直接コンピューターに取り込むこともできる。
【0071】
ここで、上記手法により、第2実施形態で用いた蛋白質であるバクテリオロドプシン(試料20)を、高分解能透過型電子顕微鏡(H−1500、Hitachi製、加速電圧:800kV)を用いて観測を行った結果得られた、逆格子空間における回折パターンの一例を図12に示す。また図12の回折パターンを逆フーリエ変換することによって得られた超高分解能TEM像を図11に示す。
【0072】
また、本第3実施形態で用いた蛋白質であるバクテリオロドプシンにおける一本のペプチド鎖の模式図を図13(A)に示し、逆平行βシート構造の模式図を図13(B)に示す。
【0073】
一般的にβシート構造は、図13(A)に示すような伸びたペプチド鎖が、図13(B)に示すように、平行または逆平行の方向で、ペプチド鎖のC=O基のO原子と、隣のペプチド鎖のN−H基のH原子が、水素結合することにより形成されている。
【0074】
一方、上記結晶構造解析方法で得られた図11の超高分解能TEM像では、平行に並んだペプチド鎖と、ペプチド鎖間の水素結合が、黒い影として写っている。この図11の超高分解能TEM像における黒い影の形状から、蛋白質層18の結晶構造は、図13(B)に示すような逆平行βシート構造であることが分かる。
【0075】
さらに、図12の回折パターンにおける、回折スポットと透過スポットの距離に基づき、蛋白質層18におけるペプチド鎖間の距離が0.47nm、アミノ酸残基の単位長さが0.29nmと求めることができる。
【0076】
このようにして、蛋白質結晶構造解析を行うことができる。
なお結晶構造解析手段については、上述した具体的手段に限られず、公知の手段を用いることができる。また、本第3実施形態においてはTEMの回折モードを用いて結晶構造解析を行っているが、図10のように、単に透過電子を観測することによりTEM像を得ることもできる。
さらに、高分解能透過型電子顕微鏡の代わりに、その他のTEM(例えば走査透過電子顕微鏡など)を用いて、公知の観測手段により観測する事もできる。
【0077】
以上説明したように、第3実施形態に係る蛋白質結晶構造解析方法を用いると、カーボンナノチューブ12が種々の方向を向いているため、種々の方向を向いた蛋白質結晶についての観測データを得る事ができ、従来に比べてより正確な蛋白質結晶構造解析を行う事ができる。
【図面の簡単な説明】
【0078】
【図1】本発明の透過型電子顕微鏡用マイクログリッドの構成を示す概略図であり、(A)平面図、(B)1B−1B端面図である。
【図2】第1実施形態に係る透過型電子顕微鏡用マイクログリッドの製造方法を、工程別に示した工程図である。
【図3】第2実施形態に係る透過型電子顕微鏡用試料の構成を示す概略図であり、(A)平面図、(B)3B−3B端面図である。
【図4】第2実施形態に係る透過型電子顕微鏡用試料の製造方法において、蛋白質の単分子膜を作製する工程を示した工程図である。
【図5】第2実施形態に係る透過型電子顕微鏡用試料の製造方法において、蛋白質の単分子膜にマイクログリッドを浮かべる工程を示した工程図である。
【図6】第2実施形態に係る透過型電子顕微鏡用試料の製造方法において、マイクログリッドのカーボンナノチューブ側面上に蛋白質層が形成された状態を示した模式図である。
【図7】カーボンナノチューブの側面上に蛋白質層が形成される様子を示す模式図である。
【図8】本発明の透過型電子顕微鏡用試料および試料ホルダーの分解斜視図である。
【図9】本発明の透過型電子顕微鏡用試料が試料ホルダーにセットされた状態を示す斜視図である。
【図10】本発明の透過型電子顕微鏡用試料のTEM像である。
【図11】本発明の蛋白質結晶構造解析方法の過程で得られた、蛋白質層の超高分解TEM像である。
【図12】本発明の蛋白質結晶構造解析方法の過程で得られた、逆格子空間における回折パターンである。
【図13】バクテリオロドプシンにおける、(A)一本のペプチド鎖の模式図、および(B)逆平行βシート構造の化学式である。
【符号の説明】
【0079】
10…マイクログリッド(透過型電子顕微鏡用試料保持体)
12…グリッド本体(保持体本体)
14…触媒層(触媒)
16…カーボンナノチューブ(担持コア)
18…蛋白質層(観測対象物)
20…試料(透過型電子顕微鏡用試料)
【特許請求の範囲】
【請求項1】
保持体本体と、
観測対象物を担持するための担持コアであって、前記保持体本体の縁部の少なくとも一部に設けられた担持コアと、
を有する、透過型電子顕微鏡用試料保持体。
【請求項2】
前記担持コアは、触媒を介して前記保持体本体に設けられた、
請求項1に記載の透過型電子顕微鏡用試料保持体。
【請求項3】
前記触媒は、Co、Ni、及びFeから選択される少なくとも1種以上の元素を含んで構成される、
請求項1または2に記載の透過型電子顕微鏡用試料保持体。
【請求項4】
前記担持コアは、カーボンナノチューブを含む、
請求項1乃至3のいずれか1項に記載の透過型電子顕微鏡用試料保持体。
【請求項5】
請求項1乃至4のいずれか1項に記載の透過型電子顕微鏡用試料保持体と、
前記透過型電子顕微鏡用試料保持体の前記担持コアに担持された観測対象物と、
を有する、透過型電子顕微鏡用試料。
【請求項6】
前記観測対象物は、蛋白質である、
請求項5に記載の透過型電子顕微鏡用試料。
【請求項7】
保持体本体を準備する第1工程と、
前記保持体本体の縁部の少なくとも一部に、観測対象物を担持するための担持コアを形成する第2工程と、
を有する、透過型電子顕微鏡用試料保持体の製造方法。
【請求項8】
前記第2工程は、前記保持体本体の前記縁部の少なくとも一部に触媒を形成した後、前記触媒上に前記担持コアを形成する工程である、
請求項7に記載の透過型電子顕微鏡用試料保持体の製造方法。
【請求項9】
前記触媒は、Co、Ni、及びFeから選択される少なくとも1種以上の元素を含んで構成される、
請求項7または8に記載の透過型電子顕微鏡用試料保持体の製造方法。
【請求項10】
前記担持コアは、カーボンナノチューブを含む、
請求項7乃至9のいずれか1項に記載の透過型電子顕微鏡用試料保持体の製造方法。
【請求項11】
請求項1乃至4のいずれか1項に記載の透過型電子顕微鏡用試料保持体を準備する工程と、
前記保持体本体の前記縁部の少なくとも一部に形成された前記担持コアに、観測対象物を担持させる工程と、
を有する、透過型電子顕微鏡用試料の製造方法。
【請求項12】
前記観測対象物は、蛋白質である、
請求項11に記載の透過型電子顕微鏡用試料の製造方法。
【請求項13】
請求項5または6に記載の透過型電子顕微鏡用試料を試料ホルダーに保持する工程と、
前記試料ホルダーを透過型電子顕微鏡へ装着する事により、前記透過型電子顕微鏡用試料を前記透過型電子顕微鏡へ導入する工程と、
前記透過型電子顕微鏡用試料を前記透過型電子顕微鏡で観測する工程と、
を有する、観測方法。
【請求項14】
請求項13に記載の観測方法により観測する観測工程と、
前記観測工程により得られた観測データを用いて結晶構造の解析を行う解析工程と、
を有する、結晶構造解析方法。
【請求項15】
保持体本体を準備して、前記保持体本体の縁部の少なくとも一部に触媒を形成した後、前記触媒にカーボンナノチューブを形成することにより透過型電子顕微鏡用試料保持体を製造する試料保持体製造工程と、
前記透過型電子顕微鏡用試料保持体の前記カーボンナノチューブに蛋白質を担持させることにより透過型電子顕微鏡用試料を製造する試料製造工程と、
前記透過型電子顕微鏡用試料を試料ホルダーに保持した後、前記試料ホルダーを透過型電子顕微鏡へ装着する事により、前記透過型電子顕微鏡用試料を前記透過型電子顕微鏡へ導入する試料導入工程と、
前記透過型電子顕微鏡用試料を前記透過型電子顕微鏡で観測する観測工程と、
前記観測工程により得られた観測データを用いて蛋白質結晶構造の解析を行う解析工程と、
を有する、蛋白質結晶構造解析方法。
【請求項1】
保持体本体と、
観測対象物を担持するための担持コアであって、前記保持体本体の縁部の少なくとも一部に設けられた担持コアと、
を有する、透過型電子顕微鏡用試料保持体。
【請求項2】
前記担持コアは、触媒を介して前記保持体本体に設けられた、
請求項1に記載の透過型電子顕微鏡用試料保持体。
【請求項3】
前記触媒は、Co、Ni、及びFeから選択される少なくとも1種以上の元素を含んで構成される、
請求項1または2に記載の透過型電子顕微鏡用試料保持体。
【請求項4】
前記担持コアは、カーボンナノチューブを含む、
請求項1乃至3のいずれか1項に記載の透過型電子顕微鏡用試料保持体。
【請求項5】
請求項1乃至4のいずれか1項に記載の透過型電子顕微鏡用試料保持体と、
前記透過型電子顕微鏡用試料保持体の前記担持コアに担持された観測対象物と、
を有する、透過型電子顕微鏡用試料。
【請求項6】
前記観測対象物は、蛋白質である、
請求項5に記載の透過型電子顕微鏡用試料。
【請求項7】
保持体本体を準備する第1工程と、
前記保持体本体の縁部の少なくとも一部に、観測対象物を担持するための担持コアを形成する第2工程と、
を有する、透過型電子顕微鏡用試料保持体の製造方法。
【請求項8】
前記第2工程は、前記保持体本体の前記縁部の少なくとも一部に触媒を形成した後、前記触媒上に前記担持コアを形成する工程である、
請求項7に記載の透過型電子顕微鏡用試料保持体の製造方法。
【請求項9】
前記触媒は、Co、Ni、及びFeから選択される少なくとも1種以上の元素を含んで構成される、
請求項7または8に記載の透過型電子顕微鏡用試料保持体の製造方法。
【請求項10】
前記担持コアは、カーボンナノチューブを含む、
請求項7乃至9のいずれか1項に記載の透過型電子顕微鏡用試料保持体の製造方法。
【請求項11】
請求項1乃至4のいずれか1項に記載の透過型電子顕微鏡用試料保持体を準備する工程と、
前記保持体本体の前記縁部の少なくとも一部に形成された前記担持コアに、観測対象物を担持させる工程と、
を有する、透過型電子顕微鏡用試料の製造方法。
【請求項12】
前記観測対象物は、蛋白質である、
請求項11に記載の透過型電子顕微鏡用試料の製造方法。
【請求項13】
請求項5または6に記載の透過型電子顕微鏡用試料を試料ホルダーに保持する工程と、
前記試料ホルダーを透過型電子顕微鏡へ装着する事により、前記透過型電子顕微鏡用試料を前記透過型電子顕微鏡へ導入する工程と、
前記透過型電子顕微鏡用試料を前記透過型電子顕微鏡で観測する工程と、
を有する、観測方法。
【請求項14】
請求項13に記載の観測方法により観測する観測工程と、
前記観測工程により得られた観測データを用いて結晶構造の解析を行う解析工程と、
を有する、結晶構造解析方法。
【請求項15】
保持体本体を準備して、前記保持体本体の縁部の少なくとも一部に触媒を形成した後、前記触媒にカーボンナノチューブを形成することにより透過型電子顕微鏡用試料保持体を製造する試料保持体製造工程と、
前記透過型電子顕微鏡用試料保持体の前記カーボンナノチューブに蛋白質を担持させることにより透過型電子顕微鏡用試料を製造する試料製造工程と、
前記透過型電子顕微鏡用試料を試料ホルダーに保持した後、前記試料ホルダーを透過型電子顕微鏡へ装着する事により、前記透過型電子顕微鏡用試料を前記透過型電子顕微鏡へ導入する試料導入工程と、
前記透過型電子顕微鏡用試料を前記透過型電子顕微鏡で観測する観測工程と、
前記観測工程により得られた観測データを用いて蛋白質結晶構造の解析を行う解析工程と、
を有する、蛋白質結晶構造解析方法。
【図1】


【図2】


【図3】


【図4】


【図5】


【図6】


【図7】


【図8】


【図9】


【図10】


【図11】


【図12】


【図13】




【図2】


【図3】


【図4】


【図5】


【図6】


【図7】


【図8】


【図9】


【図10】


【図11】


【図12】


【図13】


【公開番号】特開2008−27763(P2008−27763A)
【公開日】平成20年2月7日(2008.2.7)
【国際特許分類】
【出願番号】特願2006−199633(P2006−199633)
【出願日】平成18年7月21日(2006.7.21)
【出願人】(304023318)国立大学法人静岡大学 (416)
【Fターム(参考)】
【公開日】平成20年2月7日(2008.2.7)
【国際特許分類】
【出願日】平成18年7月21日(2006.7.21)
【出願人】(304023318)国立大学法人静岡大学 (416)
【Fターム(参考)】
[ Back to top ]

