造血幹細胞を単離、生体外(exvivo)増殖および回収するためのシステムおよび方法
【課題】バッチ処理または連続処理法により造血幹細胞を単離、生体外増殖、および回収する効率的で、短時間で簡単に操作可能な方法およびシステムを提供する。
【解決手段】(1)2μmから100μmの孔径を有する膜よりなる濾過チャンバー、(2)濾過チャンバーに造血幹細胞源を導入する第1注入口、(3)濾過チャンバーに洗浄液を導入する第2注入口、(4)濾過チャンバーに洗浄液を排出させる第1排出口、よりなる造血幹細胞の単離、生体外増殖および回収システムおよびこのシステムを用いて、(a)第1注入口より造血幹細胞源を濾過チャンバーへ導入、(b)第2注入口より洗浄液を濾過チャンバーへ導入(c)造血幹細胞を増殖させるために、造血幹細胞が保持されている膜を幹細胞培養液中で培養するバッチ処理システムと方法または連続処理システムと方法。
【解決手段】(1)2μmから100μmの孔径を有する膜よりなる濾過チャンバー、(2)濾過チャンバーに造血幹細胞源を導入する第1注入口、(3)濾過チャンバーに洗浄液を導入する第2注入口、(4)濾過チャンバーに洗浄液を排出させる第1排出口、よりなる造血幹細胞の単離、生体外増殖および回収システムおよびこのシステムを用いて、(a)第1注入口より造血幹細胞源を濾過チャンバーへ導入、(b)第2注入口より洗浄液を濾過チャンバーへ導入(c)造血幹細胞を増殖させるために、造血幹細胞が保持されている膜を幹細胞培養液中で培養するバッチ処理システムと方法または連続処理システムと方法。
【発明の詳細な説明】
【技術分野】
【0001】
本発明は一般に、造血幹細胞の単離、生体外増殖(ex vivo expanding)および回収を行うための方法およびシステムに関する。
【背景技術】
【0002】
幹細胞は、細胞および組織の再生源を提供するので、極めて多くの疾患、症状、障害の治療において、多大な期待が寄せられている。幹細胞の主な供給源は、胚性幹細胞または体性幹細胞である。胚性幹細胞は胚から得られるのに対して、体性幹細胞は通常各組織中に極少数で存在しており、脳、骨髄、末梢血、血管、骨格筋、皮膚、臍帯血、脂肪組織および肝臓を含む様々な組織や臓器において見出されている。疾患の治療に胚性幹細胞を用いることは、胚性幹細胞の生命との密接な関係のために論議の的となっている。対照的に、体性幹細胞は倫理的なジレンマは提起されていない。体性幹細胞の有利な点は、患者自身の細胞を培養し、その患者に注入し得ることにある。さらに、患者自身の体性幹細胞を用いることは、免疫抑制剤を使用せずに免疫系による細胞拒絶を防ぐことができる。
【0003】
造血幹細胞は、臨床処置において最も汎用的に使用されている体性幹細胞である。しかしながら、これらの細胞は成人組織中には極わずかであり、それらの数を細胞培養で増殖させるのは困難であるため、体性幹細胞の十分な数を実際の臨床目的のために得るために、体性幹細胞を単離し細胞培養で増殖させることが研究されている。特公平8−69(特許文献1)には、臍帯血から単核球細胞を単離する方法が記載されているが、該方法は開放系であり、バクテリアまたは菌によって汚染される可能性がある。さらに、単核球細胞を体外増殖させる前に、単核球細胞を単離するのに約3時間を要する。労働集約的な方法が特開2008−237136(特許文献2)に記載されており、この方法では、CD34+造血幹細胞をHES法を用い、引き続き磁気ビーズ法を用いて単離されている。同様に造血CD34+造血幹細胞を体外増殖させる前に、CD34+造血幹細胞を単離するのに約3時間から5時間を要する。特開平10−84950(特許文献3)は、透過法を提示している。この方法は、親水性共重合体でコーティングした不織布を赤血球は透過し、CD34+造血幹細胞は不織布により保持される。しかしながら、収量はあまりにも低く、実用的に使用することはできない。
【先行技術文献】
【特許文献】
【0004】
【特許文献1】特公平8−69号公報
【特許文献2】特開2008−237136号公報
【特許文献3】特開平10−84950号公報
【発明の概要】
【発明が解決しようとする課題】
【0005】
以上の観点から、当該分野において、骨髄移植を含めた医療処置への利用のために、体性幹細胞、特にヒト造血幹細胞を単離および増殖させる改良された方法への必要性が存在する。
【発明の効果】
【0006】
本明細書に例示および広範に記載するように、本発明は、造血幹細胞を単離、生体外増殖、および回収するシステムおよび方法を特徴とする。本明細書に記載の該方法およびシステムは、効率的で、簡単に操作することができ、バッチ処理または連続処理法により造血幹細胞を単離、生体外増殖、および回収することを可能にする。
【課題を解決するための手段】
【0007】
一つの面において、本発明は、造血幹細胞を単離、生体外増殖、および回収するためのシステムを提供する。
一つの態様において、本システムは、バッチ式システムであって、2μmから100μmの孔径を有する膜を備えた濾過チャンバー、濾過チャンバーへ造血幹細胞源を導入する第1注入口、濾過チャンバーへ洗浄液を導入する第2注入口、および濾過チャンバーの外へ洗浄液を排出させる第1排出口を備えている。一つの例において、造血幹細胞源を濾過チャンバーに透過させた後、該造血幹細胞源を貯蔵する貯蔵チャンバーをさらに含む。他の例において、造血幹細胞が濾過チャンバーの膜に保持され、造血幹細胞を保持した膜が該チャンバーから取り出され、幹細胞培地中で生体外培養される。
【0008】
他の態様において、本システムは、連続式システムであって、2μmから100μmの孔径を有する膜を備えた濾過チャンバー、濾過チャンバーへ造血幹細胞源を導入する第1注入口、濾過チャンバーへ洗浄液を導入する第2注入口、濾過チャンバーへ幹細胞培地を導入する第3注入口、システムにおいて幹細胞培地を循環させるポンプ、濾過チャンバーの外へ洗浄液を排出させる第1排出口、および造血幹細胞を収集する第2排出口を備えている。一つの例において、システムは、造血幹細胞源を濾過チャンバーに透過させた後、造血幹細胞源を貯蔵する貯蔵チャンバーをさらに含む。他の例において、造血幹細胞が、第2排出口より収集された幹細胞培地から連続的に回収される。
【0009】
第2の面において、本発明は、本発明のシステムの使用によって、造血幹細胞を単離、生体外増殖、回収する方法を提供する。
一つの態様において、本方法は、バッチ式により、造血幹細胞を単離、生体外増殖、回収する方法であって、該方法は、
(a)造血幹細胞を単離、生体外増殖、回収するバッチ式システムを提供する工程であって、該システムは、
2μmから100μmの孔径を有する膜を備えた濾過チャンバー、
濾過チャンバーへ造血幹細胞源を導入する第1注入口、
濾過チャンバーへ洗浄液を導入する第2注入口、
濾過チャンバーの外へ洗浄液を排出させる第1排出口を備えており、
(b)第1注入口より造血幹細胞源を濾過チャンバーへ導入する工程、
(c)第2注入口より洗浄液を濾過チャンバーへ導入する工程、
(d)膜を幹細胞培地中で培養し、そこに保持された造血幹細胞を増殖させる工程
の順で含む。
【0010】
一つの例において、本方法は、工程(c)の後、濾過チャンバーの外へ洗浄液を第1排出口から排出させること(c1)をさらに含む。
【0011】
第二の態様において、本方法は、連続式に造血幹細胞を単離、生体外増殖、回収する方法に関し、該方法は、
(a)造血幹細胞を単離、生体外増殖、回収する連続式システムを提供する工程であって、該システムは、
濾過チャンバーへ造血幹細胞源を導入する第1注入口、
濾過チャンバーへ洗浄液を導入する第2注入口、
濾過チャンバーへ幹細胞培地を導入する第3注入口、
システムにおいて幹細胞培地を循環させるポンプ、
濾過チャンバーの外へ洗浄液を排出させる第1排出口、
造血幹細胞を収集する第2排出口
を備えており、
(b)第1注入口より造血幹細胞源を濾過チャンバーへ導入する工程、
(c)第2注入口より洗浄液を濾過チャンバーへ導入する工程、
(d)第3注入口より濾過チャンバーに幹細胞培地を導入する工程、
(e)システム中に幹細胞培地を循環させるポンプを作動させる工程、
(f)第2排出口より収集した幹細胞培地から造血幹細胞を回収する工程
の順で含む。
【0012】
一つの例において、本方法は、(b1)工程(b)において造血幹細胞源を濾過チャンバーに透過させた後、該造血幹細胞源を貯蔵チャンバーに貯蔵させる工程、(c1)工程(c)の後、洗浄液を第1排出口より濾過チャンバーの外へ排出させる工程、および、(e1)工程(e)の後、幹細胞培地の一部を取り出すことによって、造血幹細胞を第2排出口よりサンプリングする工程をさらに含む。
【図面の簡単な説明】
【0013】
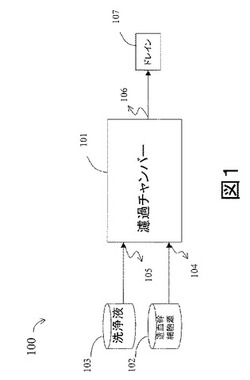
【図1】本発明のバッチ型システムを示す図である。
【図2】本発明の連続型システムを示す図である。
【発明を実施するための形態】
【0014】
より詳細な本発明の1つまたはそれ以上の態様は、下記に続く文章に記載する。本発明の他の特徴や有利な点は、以下の詳細な記載および請求項から明らかになろう。
また、以下に続く一般的な記載と詳細な記載はともに例により、クレームされたものとしての本発明のさらなる説明であることを理解すべきである。
定義
「幹細胞」という用語は、組織や臓器の特定細胞を形成するための無限に再生可能な主細胞である。幹細胞は二つの娘幹細胞または、一つの娘幹細胞と一つの前駆細胞へと分裂可能であり、その前駆細胞は組織の成熟した完全に分化した細胞に増殖する。「幹細胞」という用語は、多能性細胞を意味し、「多能性細胞」は、ある組織または臓器中でほ乳類動物の2つまたはそれ以上の異なった細胞種に成長することが可能な細胞を意味する。「造血幹細胞」とは、成熟した血液細胞に成長する能力を有する多能性細胞である。ここで成熟した血液細胞は、限定はされないが、赤血球、白血球、巨核球細胞、血小板や、T細胞、B細胞を含んでいる。
【0015】
本発明の広範囲を規定する多様な範囲およびパラメーターは概略ではあるが、実施例における数値は可能な限り正確に記述する。しかしながら、測定評価中には、いかなる数値も標準偏差から生ずるある程度の誤差を含んでいる。
ここで用いたようにおよび添付のクレームにおいて、単数形の「a」、「an」および「the」は、明確に示す以外は、複数の対象を含むことに留意すべきである。
【0016】
本発明の実施において用いることができる方法、手法および/またはプロトコール(まとめて「方法」という)は、明細書と通じて述べられた手順のこれらの特定の例に限定されることはなく、同じ目的のために当該分野において知られた任意の手順をも包含される。さらに、いくつかの方法は、特異的に記述されるが、これらに制限されるものではない。
【0017】
本発明の概要
本発明の実施について、造血幹細胞の単離、増殖、回収のための方法およびシステムに関し詳細に記載する。
バッチ式造血幹細胞の単離、生体外増殖、回収システムおよび方法
本発明の一つの態様について、バッチ式造血幹細胞の単離、生体外増殖、回収システムは、2μmから100μmの孔径を有する膜を備えた濾過チャンバー、濾過チャンバーへ造血幹細胞源を導入する第1注入口、濾過チャンバーへ洗浄液を導入する第2注入口、および濾過チャンバーの外へ洗浄液を排出させる第1排出口を備えている。
【0018】
図1は、本発明の一つの態様であるバッチ型システム100を示す。バッチ型システム100は、濾過チャンバー101、第1注入口104,第2注入口105,第1排出口106およびドレイン107を備えている。濾過チャンバー101は、2μmから100μm、例えば、2μmから25μm、3μmから20μm、または3μmから15μmの孔径を有する膜を備えている、。使用法は、造血幹細胞源102を、第1注入口104より濾過チャンバー101に導入する。次に、洗浄液103を第2注入口105より濾過チャンバー101に導入し、濾過チャンバー101より排出された使用済み洗浄液103は第1排出口106を通ってドレイン107に排出される。造血幹細胞は濾過チャンバー101中の膜に保持される。さらに、造血幹細胞を保持した膜全体は濾過チャンバー101より取り出され、生体外培養用幹細胞培地を含む培養器中に設置する。
【0019】
本発明に使用できる造血幹細胞の適した供給源としては、臍体血、骨髄液または末梢血であるが、これらに限定されるものでもない。一つの例として、臍体血源は、インフォームドコンセントを得た帝王切開または正常出生をおこなった婦人の切除後の臍帯より収集された臍帯血である。他の例として、造血幹細胞源はインフォームドコンセントを得た適正なドナーより収集された末梢血である。骨髄液または末梢血はシリンジを用いて採取され、クエン酸またはヘパリンのような抗凝固剤が含まれた血液バッグ中に保存される。
【0020】
また他の例において、造血幹細胞源はインフォームドコンセントを得た適正なドナーより標準骨髄液採取法により採取された骨髄液である。造血幹細胞源102を、濾過チャンバー101に透過させた後、洗浄液103は、システム100に第2注入口105より導入される。洗浄工程は、赤血球等を除去することにより造血幹細胞源を純化させる目的を有している。すなわち、赤血球等は造血幹細胞の増殖を抑制する効果があると考えられているからである。本発明で用いられる適正な洗浄液103は、無血清培地、血清培地、生理食塩水、緩衝液、EDTA含有生理食塩水、EDTA含有緩衝液、貧血小板血漿のいずれかまたはこれらの組み合わせを含むが、これらに限定されるものではない。貧血小板血漿は、血液を供給源とすればいかなる公知の方法により調製されても良い。一つの例において、臍帯血は適切な速度で遠心分離され、血球細胞を取り除くために、上澄み液を膜フィルター(孔径0.22μm)を用いてろ過させ、貧血小板血漿を調製する。
【0021】
他の方法において、培地、生理食塩水または緩衝液を洗浄液103として使用する。培地は、血清を含む場合と含まない場合が考えられる。緩衝液は、エチレンジアミン四酢酸(EDTA)を含む場合と含まない場合が考えられる。一つの例として、洗浄液103はStemCell Technologies (USA)より直接購入したStemSpan SFEM培地のような無血清培地である。この場合、StemSpan SFEM培地に造血成長因子や他のサイトカインが含まれても含まれなくても良い。他の例において、洗浄液103は無血清培地と貧血小板血漿との組み合わせである。造血幹細胞源または洗浄液をシステム中に導入するのに、ペリスターポンプのようなポンプを使用して導入することも可能である。流体である造血幹細胞源102または洗浄液103は、濾過チャンバー101に流速1〜10mL/分で透過させる。一つの例において、1mL/分である。
【0022】
濾過チャンバー101は、その中に2μmから100μmの孔径を有する膜を備えている。例えば、孔径は、2μmから25μm、3μmから20μmまたは3μmから15μmである。様々な手法により膜の平均孔径を測定することが可能である。例えば、電子顕微鏡、液体噴出孔径メーター(liquid extrusion porosimetry)や他の適切な既知な方法である。示した実施例においては、孔径は、液体噴出孔径メーターで概算した。孔径の測定は、測定に用いた特定の手法により異なることに留意すべきである。適正な膜材料は、良好な生体適合性、良好な成形性、良好な滅菌性および細胞に対して低毒性である必要がある。
【0023】
一般的には、膜は以下で示す合成ポリマーより調製される。すなわち、ポリエチレン、ポリプロピレン、ポリスチレン、アクリル樹脂、ナイロン、ポリエステル、ポリカーボネート、ポリアクリルアミドおよびポリウレタン等であるが、これらに限定されるわけではない。さらには、天然ゴムもこれらの素材として含まれ、さらにはアガロース、セルロース、酢酸セルロース、アルギネート等であるがこれらに限定されるわけではない。また、さらにはヒドロキシアパタイト、アルミナ、チタニア等の無機材料およびステンレス鋼、チタン、アルミニウム等の金属も含まれるがこれらに限定されるわけではない。好ましくは、膜はポリウレタンをベースポリマーまたはポリエチレンテレフタレートをベースポリマー(例えば、不織布)として調製されている。ベースポリマーは、さらにその主鎖および/または側鎖に他の分子をグラフトさせていても良い。この他の分子としては、アミノ酸、ペプチド、グリコサミノグリカンや糖鎖蛋白質であるがこれらに限定されるわけではない。ひとつの例として、特開2005−323534に記載されている方法のように、ポリウレタンをベースとしたポリマーは、カルボキシルグループのような官能基をポリマー表面にプラズマ放電法を用いてグラフトされる。
【0024】
ポリエチレンテレフタレートをベースポリマーとして用いる場合、表面に下記のポリマーをコーティングするのも良い。このコーティング用ポリマーは以下のモノマーを少なくとも一つ選択して作成される;ヒドロキシエチルメタクリレート(HEMA)、ジメチルアミノエチルメタクリレート(DM)、n−ブチルメタクリレート(BMA)、N,N−ジメチルアクリルアミド(DMA)、N−アクリロイルモルホリン(AMO)、およびN−ビニルピロリドン(VP)。例として、BMAとDMAより調製されたポリマーをコーティングされたポリエチレンテレフタレートをベースポリマー(不織布)としたものより膜は調製される。
【0025】
透過後、造血幹細胞は濾過チャンバー101にある膜に保持されている。そこで、造血幹細胞を保持した膜は濾過チャンバー101より取り出され、直接生体外培養するために適切な幹細胞培地を含む培養容器に注意深く設置される。例として、幹細胞培地はサイトカイン混合物と低密度リポタンパク質(LDL)を添加させたStemSpan SFEM培地である。サイトカイン混合物は、組み換えヒト幹細胞因子(recombinant human stem cell factor)、組み換えヒトスロンボポエチン(recombinant human thrombopoietin)および組み換えヒトFlt-3リガンド(recombinant human Flt-3 ligand)等である。各々のサイトカインは、培養初期には、5ng/mLから500ng/mLの間の濃度であり、10ng/mLから100ng/mLの間の濃度で用いることが好ましい。場合によっては、LDLも使用しても良い。この場合、培養初期には通常0.1mg/mLから20mg/mLの量を用い、詳しくは5mg/mLの濃度が好ましい。ひとつの例として、無血清培地は、濾過チャンバー101を透過させる洗浄液103として使用される。従って、造血幹細胞を保持した膜は約10日程度の直接生体外培養を行うことができ、造血幹細胞源から直接幹細胞を単離し、生体外培養中に設置されて増殖した造血幹細胞数はコントロールと比べて少なくとも63%である。他の例として、貧血小板血が濾過チャンバー101を透過させる洗浄液103として使用される。この場合、増殖した造血幹細胞数はコントロールと比べて少なくとも280%である。
【0026】
本態様のバッチ型システムは簡単に使用でき造血幹細胞を単離するのに時間効率が良いシステムであり、造血幹細胞源を濾過チャンバーに透過させてから単離した造血幹細胞を培養デッシュに挿入するまでの操作時間は10分から60分と比較的短時間である。ひとつの好ましい態様では、操作時間は18分である。
【0027】
造血幹細胞単離、生体外増殖、回収のための連続型システムおよび方法
本発明の他の態様について、連続式造血幹細胞の単離、生体外増殖、回収システムは、2μmから100μmの孔径を有する膜を備えた濾過チャンバー、濾過チャンバーへ造血幹細胞源を導入する第1注入口、濾過チャンバーへ洗浄液を導入する第2注入口、濾過チャンバーに幹細胞培地を導入する第3注入口を有すること、システム内に幹細胞培地を循環させるポンプ、濾過チャンバーの外へ洗浄液を排出させる第1排出口、さらに造血幹細胞を収集させる第2排出口を備えている。
【0028】
図2は、本発明の一つの態様である連続型システム200を示す。連続型システム200は、濾過チャンバー201、第1注入口204、第2注入口205,第1排出口206、ドレイン207、第2排出口208、造血幹細胞収集容器209、第3注入口211およびポンプ213よりなる。本システムは、オプションとして濾過チャンバー201に接続した貯蔵チャンバー210を有していても良い。濾過チャンバー201は、その中に2μmから100μmの孔径を有する膜を有している。
【0029】
操作において、造血幹細胞源202を、第1注入口204より濾過チャンバー201に導入する。オプションとして、濾過チャンバー201を透過した造血幹細胞源202は、オプション貯蔵チャンバー210中に回収、保存される。次に、洗浄液203を第2注入口205より濾過チャンバー201に導入し、濾過チャンバー201より排出された使用済み洗浄液203は第1排出口206よりドレイン207に排出される。引き続き、幹細胞培地212は第3注入口211より濾過チャンバー201に挿入され、ポンプ213を用いてシステム200中に循環させる。幹細胞培地212は、たとえば2日おき等のように数日おきに新鮮な培地212と交換する。使用済み培地212は第1排出口206よりドレイン207に排出される。一方幹細胞は濾過チャンバー201中の培養状態で保持されている。幹細胞培地212の少量を、培養中第2排出口208より採取し、幹細胞培地212中の造血幹細胞202の数を分析し、造血幹細胞202が十分な数に達したかどうかを確かめることも可能である。試料培地212中の造血幹細胞202の数が求めている値に達したとき、濾過チャンバー201中の培地212は第2排出口208より排出させ、造血幹細胞収集容器209中に挿入し、収集容器209中の培地212より造血幹細胞202は回収される。
【0030】
他の方法として、収集容器209中の培地212より造血幹細胞202は数日ごとに連続的に回収され、それらはまとめて使用されることも可能である。必要であれば、適切な2方または3方バルブ(図示はしていない)をシステムに設置し、異なった回路を形成することも良い。例えば、培地212が第3注入口211より導入されるとき、第1注入口204、第2注入口205,ドレイン207、収集容器209およびオプションの貯蔵チャンバー210に導くラインに取り付けられたバルブはすべて閉じることにより、ポンプ、培地212および濾過チャンバー201周辺の閉鎖回路が形成される。同様に、培養中に少量の培地212を採取したいとき、収集容器209に通じるバルブは開けられる一方、第1注入口204、第2注入口205、ドレイン207、およびオプションの貯蔵チャンバー210に通じるラインに取り付けられたバルブは閉じられることにより、ポンプ、培地212、濾過チャンバー201および収集容器209周辺の閉鎖回路が形成される。
【0031】
同様に、本発明に使用される造血幹細胞の適した供給源として、臍体血、骨髄液または末梢血であるが、これらに限定されるものでもない。一つの例として、造血幹細胞源は、インフォームドコンセントを得た帝王切開または正常出生をおこなった婦人の切除後の臍帯より収集された臍帯血である。他の例として、造血幹細胞源はインフォームドコンセントを得た適正なドナーより収集された末梢血である。骨髄液または末梢血はシリンジを用いて採取され、クエン酸またはヘパリンのような抗凝固剤が含まれた血液バッグ中に保存される。また他の例では、造血幹細胞源は、インフォームドコンセントを得た適正なドナーより標準骨髄液採取法により採取された骨髄液である。
【0032】
造血幹細胞源202は、第1注入口204を通して濾過チャンバー201に透過させる。さらに貯蔵チャンバー210に再収集され得る。洗浄液203は、システム200に第2注入口205より導入される。導入された洗浄液203は、赤血球等を除去することにより造血幹細胞源を純化させる目的を有している。すなわち、赤血球等は造血幹細胞の増殖を抑制する効果があると考えられているからである。
【0033】
本発明で用いられる適正な洗浄液203は、無血清培地、血清培地、生理食塩水、緩衝液、EDTA含有生理食塩水、EDTA含有緩衝液、貧血小板血漿のいずれかまたはこれらの組み合わせよりなることであるが、これらに限定されるものではない。貧血小板血漿は、血液を供給源とすればいかなる公知の方法により調製されても良い。一つの例として、臍帯血は適切な速度で遠心分離され、血球細胞を取り除くために、上澄み液を膜フィルター(孔径0.22μm)を用いてろ過させ、貧血小板血漿を調製する。他の方法において、培地、生理食塩水または緩衝液を洗浄液203として使用される。培地は、血清を含む場合と含まない場合が考えられ、緩衝液は4酢酸エチレンジアミン(EDTA)を含む場合と含まない場合が考えられる。
【0034】
一つの例において、洗浄液203はStemCell Technologies (USA)より直接購入したStemSpan SFEM培地のような無血清培地である。この場合、StemSpan SFEM培地に造血成長因子や他のサイトカインが含まれても含まれなくても良い。他の例において、洗浄液203は無血清培地と貧血小板血漿との組み合わせである。造血幹細胞源または洗浄液をシステム中に導入するのに、ペリスターポンプのようなポンプ(図示せず)を使用して導入することも可能である。造血幹細胞源202または洗浄液203のような流体は、濾過チャンバー201に流速1〜10mL/分で透過させる。
【0035】
濾過チャンバー201は、その中に2μmから100μmの孔径を有する膜よりなる。例えば、孔径は2μmから25μm、3μmから20μmまたは3μmから15μmである。様々な手法により膜の平均孔径を測定することが可能であり、例えば、電子顕微鏡、液体噴出孔径メーター(liquid extrusion porosimetry)や他の適切な既知な方法である。記述した実施例では、孔径は液体噴出孔径メーター(liquid extrusion porosimetry)により測定された。孔径の測定は測定に用いた特定の手法により異なることを記しておく。適正な膜材料は、良好な成形性、良好な生体適合性、良好な滅菌性および細胞に対して低毒性である必要がある。
【0036】
一般的には、膜は以下で示す合成ポリマーより調製されるがこれらに限定されるわけではない。すなわち、ポリエチレン、ポリプロピレン、ポリスチレン、アクリル樹脂、ナイロン、ポリエステル、ポリカーボネート、ポリアクリルアミドおよびポリウレタン、さらには以下に示すアガロース、セルロース、酢酸セルロース、アルギネート等の天然ポリマーであるがこれらに限定されるわけではない。また、さらにはヒドロキシアパタイト、ガラス、アルミナ、チタニア等の無機材料およびステンレス鋼、チタン、アルミニウム等の金属も含まれるがこれらに限定されるわけではない。好ましくは、膜はポリウレタンベースポリマーまたはポリエチレンテレフタレートベースポリマー(例えば、不織布)によって調製されている。ベースポリマーは、さらにその主鎖および/または側鎖に他の分子をグラフトさせていても良い。この他の分子としては、アミノ酸、ペプチド、グリコサミノグリカンや糖鎖蛋白質であるがこれらに限定されるわけではない。
【0037】
ひとつの例として、特開2005−323534に記載されている方法のように、ポリウレタンベースポリマーはカルボキシルグループのような官能基をポリマー表面に既知のプラズマ放電法を用いてグラフトされる。ポリエチレンテレフタレートをベースポリマーとして用いる場合、表面に下記のポリマーをコーティングするのも良い。このコーティング用ポリマーは少なくとも以下のモノマー一つより選択して作成される;ヒドロキシエチルメタクリレート(HEMA)、ジメチルアミノエチルメタクリレート(DM)、n−ブチルメタクリレート(BMA)、N,N−ジメチルアクリルアミド(DMA)、N−アクリロイルモルホリン(AMO)、およびN−ビニルピロリドン(VP)。一つの例として膜は、カルボキシルグループを含むまたは含まないポリウレタンベースポリマーより調製される。他の例として、BMAとDMAより調製されたポリマーをコーティングしたポリエチレンテレフタレートベースポリマー(不織布)によって膜は調製される。
【0038】
透過後、造血幹細胞は濾過チャンバー201にある膜に保持されている。直接対外培養するために適切な幹細胞培地は第3注入口211より濾過チャンバー201に導入され、ポンプ213を用いて循環させる。好ましくは、ポンプ213はペリスターポンプであり、システム200中、特に濾過チャンバー201中の培養培地212を循環させる。ポンプ213は、システム中の培養培地の循環を閉鎖系にする限り、様々な適切な部分を循環させることができる。ひとつの態様として、第1注入口204、第2注入口205、オプションである貯蔵チャンバー210、ドレイン207および第2排出口208に通じるラインに設置されたバルブを閉じることにより、ポンプ213、培養培地212および濾過チャンバー201中で閉鎖系が形成される。他の態様として、第1注入口204、第2注入口205、ドレイン207、オプションである貯蔵チャンバー210に通じるラインに設置されたバルブを閉じることにより、ポンプ213、培養培地212、濾過チャンバー201および収集容器209中で閉鎖系が形成される(データは示していない)。
【0039】
例として、幹細胞培地はサイトカイン混合物と低密度リポタンパク質(LDL)を添加させたStemSpan SFEM培地である。StemSpan SFEM培地は、StemCell Technologies (USA)より直接購入することができ、造血幹細胞因子や他のサイトカインを含んでも、含まなくても良い。サイトカイン混合物は、組み換えヒト幹細胞因子(recombinant human stem cell factor)、組み換えヒトスロンボポエチン(recombinant human thrombopoietin)および組み換えヒトFlt-3リガンド(recombinant human Flt-3 ligand)等である。各々のサイトカインは、培養初期には、5ng/mLから500ng/mLの間の濃度であり、10ng/mLから100ng/mLの間の濃度で用いることが好ましい。場合によっては、LDLも使用する。この場合、培養初期には通常0.1mg/mLから20mg/mLの量を用い、詳しくは5mg/mLの濃度が好ましい。細胞培地212は新鮮な細胞培地212と一日ごとに交換され、使用済みの細胞培地212の少量は採取され、細胞培地212中の造血幹細胞数が決定される。
【0040】
ひとたび、採取した培地212中の造血幹細胞202があらかじめ定めていた値に到達したら、濾過チャンバー211中の培地212は、第2排出口208より造血幹細胞収集容器209中に排出され、造血幹細胞202は収集容器209中の培地中に収穫される。他の態様として、造血幹細胞202は、収集容器209中に収集した培地212から数日ごとに連続的に収穫され、以後の使用のために貯蔵することも可能である。ひとつの例として、培地212から収穫された造血幹細胞は、生体外培養の後、コントロールと比べて少なくとも1以上である。例えば、臍帯血から単離され、直接生体外培養された幹細胞は、生体外培養後、10日後には14から15倍と高い値に到達することもある。
【0041】
さらに、本態様の連続システムにより単離し、生体外増殖し、収穫された造血幹細胞はコロニーを形成する能力を有している。ひとつの例として、単離し、生体外増殖された造血幹細胞より形成されたコロニー数は、コントロールの値と同等であり、約150コロニー数であった(データは示さず)。
同様に、本態様の連続システムは、造血幹細胞を単離するのに手軽に操作でき、時間効率的である。すなわち、生体外培養に必要な時間を考慮しない場合、造血幹細胞源を単離するために濾過チャンバーに透過を始めてからシステム中で生体外培養するまでの操作時間は、約10分から60分と比較的短時間である。本態様では、操作時間は約18分である。
【0042】
[実施例]
以下、発明の実施の態様を通じて本発明を説明するが、以下の実施態様は特許請求の範囲にかかる発明を限定するものではなく、また実施態様の中で説明されている特徴の組み合わせの全てが発明の解決手段に必須であるとは限らない。
【0043】
実施例1 表面修飾PU膜の調製
1.1 PU−GMA膜の調製
PU−GMA膜は先の文献、特開2005−323534公報記載のプラズマ放電法を用いて調製した。簡潔に記載すると、白血球除去膜(イムガードIII-RC、テルモ社製)から取り出したポリウレタン膜をこの実施例では使用する。アルゴンプラズマを用いて反応容器中のポリウレタン(PU)膜表面にグリシジルメタクリレート(GMA)は導入された。アルゴンガス(約26.6パスカルの圧力)を反応容器中に約30秒間流し、高周波電源(出力200W)供給下において、アルゴンプラズマを発生させた。その後、GMAとPU膜間でグラフト重合を反応容器中にて5分間、0.65パスカルの圧力下で行った。引き続き、GMA架橋PU膜は、水とメタノールの混合溶液(1:1体積比)で30分間振動下で洗浄し、さらに純水で30分間洗浄した。PU膜表面に導入されたGMA架橋率は次式で定義された。
GMA導入率(%)=(X/Y)×100
ここでGMA導入率はプラズマ放電後のPU−GMA膜の乾燥重量(Xグラム、80度24時間真空乾燥)をプラズマ放電前のPU膜の乾燥重量(Yグラム、80度24時間真空乾燥)で割った比と定義した。この例では、GMA導入率は0.61%であった。
【0044】
1.2 PU−COOH膜の調製
上記記載の操作で調製したPU−GMA膜(孔径約5μmと推定)を直径25mmの円状に各切断した。3枚のPU−GMA膜は、水酸化ナトリウム水溶液含有グリシン溶液中に浸漬させた(20mL、0.1M、水酸化ナトリウム水溶液中のグリシン濃度は0.4M)。その後、80度で24時間培養することによりカルボキシル基導入PU膜を調製した。反応が終了した後、膜は、超純水中で振とうさせながら、10分間25度で洗浄した。洗浄は2回を行い、超純水中に4度にて冷蔵保存した。調製したPU膜は、「PU−COOH膜」と命名した。
【0045】
実施例2 造血幹細胞の単離、生体外増殖および回収のためのバッチシステム
インフォームドコンセプトに同意されている妊婦より臍帯血を得た。臍帯血は、血液抗凝固剤(クエン酸、デキストロース他)を含有している採血bag(CPDA-1、テルモ株式会社製)中に挿入した。ろ過装置は上記記載の3枚のPU−COOH膜をフィルタホルダー(MILLIPORE製 25mm)に装着させて組み立てた。6mLの臍帯血を1mL/minの速度でろ過装置に透過させた。その後、洗浄液(6mL)を1mL/minの速度で6分間透過させた。洗浄液として、(a)血漿A、または(b)StemSpan SFEM培地を用いた。血漿Aは、以下の方法により調製した。すなわち、臍帯血を1800rpmの速度で遠心して貧血小板血漿を得た。さらに、この貧血小板血漿を、孔径0.22μmのフィルター(MiLlex GS, MILLIPORE製)を用いてろ過して、完全に血球細胞を除去した血漿を作成した(血漿A)。StemSpan SFEM培地は販売会社より直接購入した(#09650, StemCell Technologies社製)。
【0046】
洗浄後、PU−COOH膜を膜ホルダーより取り出し、下記に記載する細胞培地中に浸漬させて、10日間37度、5%のCO2濃度のCO2培養槽中でPU−COOH膜に接着している造血幹細胞を培養した。この実施例中、単離した造血幹細胞の生体外培養に用いた培養培地は、StemSpan SFEM培地を基本培地として用い、これにサイトカインカクテルであるStemSpan CC110(#02697,StemCell Technologies社製)と5mg/mLの低密度リポ蛋白質(LDL)を添加させた培地を本発明では用い、以後HSC培地Aと命名した。臍帯血を膜透過させてから造血幹細胞を培養デッシュに播種するまでの全操作時間は18分のみと短時間であった。
【0047】
10日後に、造血幹細胞数はフローサイトメトリー(Beckman-Coulter社製 EPICSTM XL)を用いて測定した。すなわち、CD34+造血幹細胞の分析は、ISHAGEガイドライン(国際血液療法・移植学会, Keeney M. et al., Cytometry (1998) 34, 61-70)の実験法に基づいて行った。すなわち、サンプル管(Beckman-Coulter社製)をサンプルと同数準備した。20μLの抗CD34抗体(Beckman-Coulter社製 CD45-FITC/CD34−PE)をサンプル管に添加した。100μLの各サンプルを抗CD34抗体含有の各サンプル管に加え、よく撹拌した後、細胞生存度測定色素(Beckman-Coulter製 7-ADD Viability Dye)を20μL添加し、室温暗所で15分間培養した。次いで、500μLの溶血剤(OptiLyseC)を各sample管に添加し、よく撹拌した後、室温で10分間培養した。500μLのリン酸緩衝液を各sample管に添加し、よく撹拌して、室温で10分間培養した。このように調製したサンプルをフローサイトメトリーを用いて分析した。試料として採取した臍帯血に含まれるCD34+造血幹細胞数を予め分析しておき、血漿AとStemSpan SFEM培地を洗浄液として用いたときの造血幹細胞の生体外増殖効率の比較として用いた。増殖・回収後の培地中に存在するCD34+造血幹細胞数を分析した。CD34+造血幹細胞の生体外増殖率は下記式より計算で求められる。
【数1】

式中、N2は、増殖・回収後における培地中のCD34+造血幹細胞数であり、N1は試料として採取した臍帯血中に含まれるCD34+造血幹細胞数である。結果を表1に示す。造血幹細胞の生体外増殖率は、洗浄液として、血漿AおよびStemSpan SFEM培地を用いたときに、それぞれ2.5倍および0.63倍であった。
【0048】
【表1】

【0049】
実施例3 実施例2のバッチシステムにより単離、増殖および回収された造血幹細胞
6mLの臍帯血の代わりに1mLの臍帯血を用い、細胞培養開始後5日目の細胞培養液(HSC培地A)の交換または未交換以外は、実施例2に記載の方法により造血幹細胞を単離、増殖、回収した。血漿Aを本実験では洗浄液として使用した。表2に結果を示す。本実施例に記載の方法を用いた造血幹細胞単離、増殖において、コントロールと比べると2.7倍から6.2倍の増殖率を得た。
なお、臍帯血を膜透過させてから造血幹細胞を培養デッシュに播種するまでの全操作時間は15分以下と短時間であった。
【0050】
【表2】

【0051】
実施例4 造血幹細胞の単離、生体外増殖および回収のための連続システム
臍帯血は上記実施例2記載の方法により採取した。造血幹細胞の単離、生体外増殖、回収の連続システムは図2記載の通り設置した。血液バッグ中の臍帯血20gを6枚のポリウレタン(PU)膜(イムガードIII-RC、テルモ社製)よりなる201部位に2mL/分の透過速度で透過させた。PU膜の各シートの平均孔径は、キャピラリーフローポロメーター(Porous Materials Inc.)の測定から5から12μmであった。フィルター部位を透過した臍帯血は貯蔵部位206に貯蔵された。血漿A(20g)は、フィルター部位201を2mL/分の透過速度で透過させ、続いてフィルター部位201を洗浄するためにStemSpan SFEM培地(60g)を透過させた。HSC培養液A(サイトカインカクテルであるStemSpan CC110(#02697,StemCell Technologies社製)と5mg/mLの低密度リポ蛋白質(LDL)を添加させたStemSpan SFEM培地)をフィルター部位201に透過させ、さらにペリスターポンプを用いて0.5mL/分の速度で循環させた。新鮮なHSC培養液A(20g)は、1日目と5日目にシステムに導入され、使用した古いHSC培養液Aは排出口206を通して排出し、ドレイン207に導入させた。一方、フィルター部位201中に保持された造血幹細胞は、培養が引き続き続けられた。1日目と6日目と10日目にHSC培養液Aの少量をドレイン207より採取し、細胞培地中の造血幹細胞数を分析した。細胞数は、実施例2記載の方法に従い測定した。表3に結果を示す。
【0052】
表3に示された結果より、本実施例はコントロール(臍帯血から単離し、通常の培養操作に直接用いられる幹細胞)に比べて少なくとも6.8倍という幹細胞の高い増殖率を与えることが明らかである。さらに、本実施例における連続操作により臍帯血を透過させて、HSC培養液Aをフィルター部位に導入し、連続培養するまでに、30分とかからず、幹細胞を単離、生体外培養そして回収する連続操作は、通常の幹細胞分離および培養法に比べると比較的簡単である。
【0053】
【表3】

【0054】
実施例5 実施例4の連続システムにより単離、増殖および回収された造血幹細胞
細胞培養後、2日目、4日目、6日目および8日目に培養培地(HSC培養液A)を交換した以外は、実施例4に記載の方法に従い造血幹細胞を、単離、生体外増殖ならびに回収した。連続操作により臍帯血を透過させて、HSC培養液Aをフィルター部位に導入し、連続培養するまでに約30分しか要しなかった。表4に結果を示す。幹細胞を単離し、本実施例に記載された方法により幹細胞を単離、増殖することにより、コントロールと比べて46倍もの高い増殖率が得られた。
【0055】
【表4】

【0056】
実施例6 フィルターとして不織布を用いた実施例4の連続システムにおける造血幹細胞の単離、生体外増殖および回収
ポリウレタン膜の代わりに不織布(Asahi Medical Co., SepaCell R, R-500B2(3)-1)をフィルター膜として使用し、細胞培養後、2日目、4日目、6日目および8日目に培養培地(HSC培養液A)を交換した以外は、実施例4に記載の方法に従い造血幹細胞を単離、生体外増殖ならびに回収した。
表5に結果を示す。本実施例に記載された方法に従い幹細胞を単離、増殖することにより、コントロールと比べて3.7倍の増殖率が得られた。
【0057】
【表5】

【0058】
実施例7 実施例4の連続システムを用いた末梢血からの造血幹細胞の単離、生体外増殖および回収
臍帯血の代わりに末梢血を用い、新鮮な培養液(HSC培養液A)を細胞培養後、2日目、4日目、6日目および8日目に供給した以外は、実施例4に記載の方法に従い造血幹細胞を、単離、生体外増殖ならびに回収した。本実施例に記載された方法に従い幹細胞を単離、増殖することにより、コントロールと比べて増殖率が増加することが予想される。
【0059】
実施例8 実施例4の連続システムを用いた骨髄液からの造血幹細胞の単離、生体外増殖および回収
臍帯血の代わりに骨髄液を用い、新鮮な培養液(HSC培養液A)を細胞培養後、2日目、4日目、6日目および8日目に供給した以外は、実施例4に記載の方法に従い造血幹細胞を、単離、生体外増殖ならびに回収した。本実施例に記載された方法に従い幹細胞を単離、増殖することにより、コントロールと比べて増殖率が増加することが予想される。
[比較例]
【0060】
臍帯血から通常のFicoll-Paque比重分離法(例えば、Fotino M., et al., Ann. Clin. Lab. Sci., 1,131-133 (1971))により単核球を分離した。以下に、操作法を記す。
即ち、臍帯血を2mMのEDTAと0.5%の牛血清アルブミン(BSA)入りリン酸緩衝液(以後、リン酸緩衝液Aと命名)で1:4の割合で希釈した。この希釈臍帯血35mLを15mLのFicoll-Paque(Ficoll-Paque, Pharmacia)液上に重層した。400G、20℃で40分間遠心して比重分離を行なった。遠心後、分離された単核球を注意深く分取した。再度リン酸緩衝液Aを加えて50mLとし、軽い転倒混和の後、300Gで10分間遠心した。
【0061】
下層0.5mLを残して、上澄みをすべて取り除いた。この造血幹細胞含有溶液中に含まれる赤血球、白血球、血小板、ISHAGEガイドラインに基づくCD34+造血幹細胞数は、5181細胞/μL、11,935細胞/μL、171,812細胞/μL、185細胞/μLであった。上記操作は、3時間の操作時間を有した。
次に、上記記載の方法で純化させたCD34+造血幹細胞1000細胞を造血幹細胞培地(HSC培養液A)1 mL含有24穴プレート中で培養した。10日後に、CD34+造血幹細胞を回収し、実施例2の方法で細胞培地中の造血幹細胞の生体外増殖率(EVER)を分析したところ、生体外増殖率は143%であった。
【0062】
結論として、常法である上記記載のFicoll-Paque法による造血幹細胞を単離する時間は、本発明の実施例2、3、4、5および6に示された方法より操作時間はとても長かった。Ficoll-Paque法により単離されたCD34+細胞を用いたCD34+造血幹細胞の生体外増殖率は、実施例3、4、5および6に示された本発明の方法の生体外増殖率より低かった。
【0063】
以上、本発明を実施の態様を用いて説明したが、本発明の技術的範囲は上記実施の態様に記載の範囲には限定されない。上記実施の態様に、多様な変更または改良を加えることができることは当業者に明らかである。その様な変更または改良を加えた態様も本発明の技術的範囲に含まれ得ることが、特許請求の範囲の記載から明らかである。
【符号の説明】
【0064】
100 バッチ型システム
101 濾過チャンバー
102 造血幹細胞源
103 洗浄液
104 第1注入口
105 第2注入口
106 第1排出口
107 ドレイン 200 連続型システム
201 濾過チャンバー
202 造血幹細胞源
203 洗浄液
204 第1注入口
205 第2注入口
206 第1排出口
207 ドレイン
208 第2排出口
209 収集容器
210 貯蔵チャンバー
211 第3注入口
212 培地
213 ポンプ
【技術分野】
【0001】
本発明は一般に、造血幹細胞の単離、生体外増殖(ex vivo expanding)および回収を行うための方法およびシステムに関する。
【背景技術】
【0002】
幹細胞は、細胞および組織の再生源を提供するので、極めて多くの疾患、症状、障害の治療において、多大な期待が寄せられている。幹細胞の主な供給源は、胚性幹細胞または体性幹細胞である。胚性幹細胞は胚から得られるのに対して、体性幹細胞は通常各組織中に極少数で存在しており、脳、骨髄、末梢血、血管、骨格筋、皮膚、臍帯血、脂肪組織および肝臓を含む様々な組織や臓器において見出されている。疾患の治療に胚性幹細胞を用いることは、胚性幹細胞の生命との密接な関係のために論議の的となっている。対照的に、体性幹細胞は倫理的なジレンマは提起されていない。体性幹細胞の有利な点は、患者自身の細胞を培養し、その患者に注入し得ることにある。さらに、患者自身の体性幹細胞を用いることは、免疫抑制剤を使用せずに免疫系による細胞拒絶を防ぐことができる。
【0003】
造血幹細胞は、臨床処置において最も汎用的に使用されている体性幹細胞である。しかしながら、これらの細胞は成人組織中には極わずかであり、それらの数を細胞培養で増殖させるのは困難であるため、体性幹細胞の十分な数を実際の臨床目的のために得るために、体性幹細胞を単離し細胞培養で増殖させることが研究されている。特公平8−69(特許文献1)には、臍帯血から単核球細胞を単離する方法が記載されているが、該方法は開放系であり、バクテリアまたは菌によって汚染される可能性がある。さらに、単核球細胞を体外増殖させる前に、単核球細胞を単離するのに約3時間を要する。労働集約的な方法が特開2008−237136(特許文献2)に記載されており、この方法では、CD34+造血幹細胞をHES法を用い、引き続き磁気ビーズ法を用いて単離されている。同様に造血CD34+造血幹細胞を体外増殖させる前に、CD34+造血幹細胞を単離するのに約3時間から5時間を要する。特開平10−84950(特許文献3)は、透過法を提示している。この方法は、親水性共重合体でコーティングした不織布を赤血球は透過し、CD34+造血幹細胞は不織布により保持される。しかしながら、収量はあまりにも低く、実用的に使用することはできない。
【先行技術文献】
【特許文献】
【0004】
【特許文献1】特公平8−69号公報
【特許文献2】特開2008−237136号公報
【特許文献3】特開平10−84950号公報
【発明の概要】
【発明が解決しようとする課題】
【0005】
以上の観点から、当該分野において、骨髄移植を含めた医療処置への利用のために、体性幹細胞、特にヒト造血幹細胞を単離および増殖させる改良された方法への必要性が存在する。
【発明の効果】
【0006】
本明細書に例示および広範に記載するように、本発明は、造血幹細胞を単離、生体外増殖、および回収するシステムおよび方法を特徴とする。本明細書に記載の該方法およびシステムは、効率的で、簡単に操作することができ、バッチ処理または連続処理法により造血幹細胞を単離、生体外増殖、および回収することを可能にする。
【課題を解決するための手段】
【0007】
一つの面において、本発明は、造血幹細胞を単離、生体外増殖、および回収するためのシステムを提供する。
一つの態様において、本システムは、バッチ式システムであって、2μmから100μmの孔径を有する膜を備えた濾過チャンバー、濾過チャンバーへ造血幹細胞源を導入する第1注入口、濾過チャンバーへ洗浄液を導入する第2注入口、および濾過チャンバーの外へ洗浄液を排出させる第1排出口を備えている。一つの例において、造血幹細胞源を濾過チャンバーに透過させた後、該造血幹細胞源を貯蔵する貯蔵チャンバーをさらに含む。他の例において、造血幹細胞が濾過チャンバーの膜に保持され、造血幹細胞を保持した膜が該チャンバーから取り出され、幹細胞培地中で生体外培養される。
【0008】
他の態様において、本システムは、連続式システムであって、2μmから100μmの孔径を有する膜を備えた濾過チャンバー、濾過チャンバーへ造血幹細胞源を導入する第1注入口、濾過チャンバーへ洗浄液を導入する第2注入口、濾過チャンバーへ幹細胞培地を導入する第3注入口、システムにおいて幹細胞培地を循環させるポンプ、濾過チャンバーの外へ洗浄液を排出させる第1排出口、および造血幹細胞を収集する第2排出口を備えている。一つの例において、システムは、造血幹細胞源を濾過チャンバーに透過させた後、造血幹細胞源を貯蔵する貯蔵チャンバーをさらに含む。他の例において、造血幹細胞が、第2排出口より収集された幹細胞培地から連続的に回収される。
【0009】
第2の面において、本発明は、本発明のシステムの使用によって、造血幹細胞を単離、生体外増殖、回収する方法を提供する。
一つの態様において、本方法は、バッチ式により、造血幹細胞を単離、生体外増殖、回収する方法であって、該方法は、
(a)造血幹細胞を単離、生体外増殖、回収するバッチ式システムを提供する工程であって、該システムは、
2μmから100μmの孔径を有する膜を備えた濾過チャンバー、
濾過チャンバーへ造血幹細胞源を導入する第1注入口、
濾過チャンバーへ洗浄液を導入する第2注入口、
濾過チャンバーの外へ洗浄液を排出させる第1排出口を備えており、
(b)第1注入口より造血幹細胞源を濾過チャンバーへ導入する工程、
(c)第2注入口より洗浄液を濾過チャンバーへ導入する工程、
(d)膜を幹細胞培地中で培養し、そこに保持された造血幹細胞を増殖させる工程
の順で含む。
【0010】
一つの例において、本方法は、工程(c)の後、濾過チャンバーの外へ洗浄液を第1排出口から排出させること(c1)をさらに含む。
【0011】
第二の態様において、本方法は、連続式に造血幹細胞を単離、生体外増殖、回収する方法に関し、該方法は、
(a)造血幹細胞を単離、生体外増殖、回収する連続式システムを提供する工程であって、該システムは、
濾過チャンバーへ造血幹細胞源を導入する第1注入口、
濾過チャンバーへ洗浄液を導入する第2注入口、
濾過チャンバーへ幹細胞培地を導入する第3注入口、
システムにおいて幹細胞培地を循環させるポンプ、
濾過チャンバーの外へ洗浄液を排出させる第1排出口、
造血幹細胞を収集する第2排出口
を備えており、
(b)第1注入口より造血幹細胞源を濾過チャンバーへ導入する工程、
(c)第2注入口より洗浄液を濾過チャンバーへ導入する工程、
(d)第3注入口より濾過チャンバーに幹細胞培地を導入する工程、
(e)システム中に幹細胞培地を循環させるポンプを作動させる工程、
(f)第2排出口より収集した幹細胞培地から造血幹細胞を回収する工程
の順で含む。
【0012】
一つの例において、本方法は、(b1)工程(b)において造血幹細胞源を濾過チャンバーに透過させた後、該造血幹細胞源を貯蔵チャンバーに貯蔵させる工程、(c1)工程(c)の後、洗浄液を第1排出口より濾過チャンバーの外へ排出させる工程、および、(e1)工程(e)の後、幹細胞培地の一部を取り出すことによって、造血幹細胞を第2排出口よりサンプリングする工程をさらに含む。
【図面の簡単な説明】
【0013】
【図1】本発明のバッチ型システムを示す図である。
【図2】本発明の連続型システムを示す図である。
【発明を実施するための形態】
【0014】
より詳細な本発明の1つまたはそれ以上の態様は、下記に続く文章に記載する。本発明の他の特徴や有利な点は、以下の詳細な記載および請求項から明らかになろう。
また、以下に続く一般的な記載と詳細な記載はともに例により、クレームされたものとしての本発明のさらなる説明であることを理解すべきである。
定義
「幹細胞」という用語は、組織や臓器の特定細胞を形成するための無限に再生可能な主細胞である。幹細胞は二つの娘幹細胞または、一つの娘幹細胞と一つの前駆細胞へと分裂可能であり、その前駆細胞は組織の成熟した完全に分化した細胞に増殖する。「幹細胞」という用語は、多能性細胞を意味し、「多能性細胞」は、ある組織または臓器中でほ乳類動物の2つまたはそれ以上の異なった細胞種に成長することが可能な細胞を意味する。「造血幹細胞」とは、成熟した血液細胞に成長する能力を有する多能性細胞である。ここで成熟した血液細胞は、限定はされないが、赤血球、白血球、巨核球細胞、血小板や、T細胞、B細胞を含んでいる。
【0015】
本発明の広範囲を規定する多様な範囲およびパラメーターは概略ではあるが、実施例における数値は可能な限り正確に記述する。しかしながら、測定評価中には、いかなる数値も標準偏差から生ずるある程度の誤差を含んでいる。
ここで用いたようにおよび添付のクレームにおいて、単数形の「a」、「an」および「the」は、明確に示す以外は、複数の対象を含むことに留意すべきである。
【0016】
本発明の実施において用いることができる方法、手法および/またはプロトコール(まとめて「方法」という)は、明細書と通じて述べられた手順のこれらの特定の例に限定されることはなく、同じ目的のために当該分野において知られた任意の手順をも包含される。さらに、いくつかの方法は、特異的に記述されるが、これらに制限されるものではない。
【0017】
本発明の概要
本発明の実施について、造血幹細胞の単離、増殖、回収のための方法およびシステムに関し詳細に記載する。
バッチ式造血幹細胞の単離、生体外増殖、回収システムおよび方法
本発明の一つの態様について、バッチ式造血幹細胞の単離、生体外増殖、回収システムは、2μmから100μmの孔径を有する膜を備えた濾過チャンバー、濾過チャンバーへ造血幹細胞源を導入する第1注入口、濾過チャンバーへ洗浄液を導入する第2注入口、および濾過チャンバーの外へ洗浄液を排出させる第1排出口を備えている。
【0018】
図1は、本発明の一つの態様であるバッチ型システム100を示す。バッチ型システム100は、濾過チャンバー101、第1注入口104,第2注入口105,第1排出口106およびドレイン107を備えている。濾過チャンバー101は、2μmから100μm、例えば、2μmから25μm、3μmから20μm、または3μmから15μmの孔径を有する膜を備えている、。使用法は、造血幹細胞源102を、第1注入口104より濾過チャンバー101に導入する。次に、洗浄液103を第2注入口105より濾過チャンバー101に導入し、濾過チャンバー101より排出された使用済み洗浄液103は第1排出口106を通ってドレイン107に排出される。造血幹細胞は濾過チャンバー101中の膜に保持される。さらに、造血幹細胞を保持した膜全体は濾過チャンバー101より取り出され、生体外培養用幹細胞培地を含む培養器中に設置する。
【0019】
本発明に使用できる造血幹細胞の適した供給源としては、臍体血、骨髄液または末梢血であるが、これらに限定されるものでもない。一つの例として、臍体血源は、インフォームドコンセントを得た帝王切開または正常出生をおこなった婦人の切除後の臍帯より収集された臍帯血である。他の例として、造血幹細胞源はインフォームドコンセントを得た適正なドナーより収集された末梢血である。骨髄液または末梢血はシリンジを用いて採取され、クエン酸またはヘパリンのような抗凝固剤が含まれた血液バッグ中に保存される。
【0020】
また他の例において、造血幹細胞源はインフォームドコンセントを得た適正なドナーより標準骨髄液採取法により採取された骨髄液である。造血幹細胞源102を、濾過チャンバー101に透過させた後、洗浄液103は、システム100に第2注入口105より導入される。洗浄工程は、赤血球等を除去することにより造血幹細胞源を純化させる目的を有している。すなわち、赤血球等は造血幹細胞の増殖を抑制する効果があると考えられているからである。本発明で用いられる適正な洗浄液103は、無血清培地、血清培地、生理食塩水、緩衝液、EDTA含有生理食塩水、EDTA含有緩衝液、貧血小板血漿のいずれかまたはこれらの組み合わせを含むが、これらに限定されるものではない。貧血小板血漿は、血液を供給源とすればいかなる公知の方法により調製されても良い。一つの例において、臍帯血は適切な速度で遠心分離され、血球細胞を取り除くために、上澄み液を膜フィルター(孔径0.22μm)を用いてろ過させ、貧血小板血漿を調製する。
【0021】
他の方法において、培地、生理食塩水または緩衝液を洗浄液103として使用する。培地は、血清を含む場合と含まない場合が考えられる。緩衝液は、エチレンジアミン四酢酸(EDTA)を含む場合と含まない場合が考えられる。一つの例として、洗浄液103はStemCell Technologies (USA)より直接購入したStemSpan SFEM培地のような無血清培地である。この場合、StemSpan SFEM培地に造血成長因子や他のサイトカインが含まれても含まれなくても良い。他の例において、洗浄液103は無血清培地と貧血小板血漿との組み合わせである。造血幹細胞源または洗浄液をシステム中に導入するのに、ペリスターポンプのようなポンプを使用して導入することも可能である。流体である造血幹細胞源102または洗浄液103は、濾過チャンバー101に流速1〜10mL/分で透過させる。一つの例において、1mL/分である。
【0022】
濾過チャンバー101は、その中に2μmから100μmの孔径を有する膜を備えている。例えば、孔径は、2μmから25μm、3μmから20μmまたは3μmから15μmである。様々な手法により膜の平均孔径を測定することが可能である。例えば、電子顕微鏡、液体噴出孔径メーター(liquid extrusion porosimetry)や他の適切な既知な方法である。示した実施例においては、孔径は、液体噴出孔径メーターで概算した。孔径の測定は、測定に用いた特定の手法により異なることに留意すべきである。適正な膜材料は、良好な生体適合性、良好な成形性、良好な滅菌性および細胞に対して低毒性である必要がある。
【0023】
一般的には、膜は以下で示す合成ポリマーより調製される。すなわち、ポリエチレン、ポリプロピレン、ポリスチレン、アクリル樹脂、ナイロン、ポリエステル、ポリカーボネート、ポリアクリルアミドおよびポリウレタン等であるが、これらに限定されるわけではない。さらには、天然ゴムもこれらの素材として含まれ、さらにはアガロース、セルロース、酢酸セルロース、アルギネート等であるがこれらに限定されるわけではない。また、さらにはヒドロキシアパタイト、アルミナ、チタニア等の無機材料およびステンレス鋼、チタン、アルミニウム等の金属も含まれるがこれらに限定されるわけではない。好ましくは、膜はポリウレタンをベースポリマーまたはポリエチレンテレフタレートをベースポリマー(例えば、不織布)として調製されている。ベースポリマーは、さらにその主鎖および/または側鎖に他の分子をグラフトさせていても良い。この他の分子としては、アミノ酸、ペプチド、グリコサミノグリカンや糖鎖蛋白質であるがこれらに限定されるわけではない。ひとつの例として、特開2005−323534に記載されている方法のように、ポリウレタンをベースとしたポリマーは、カルボキシルグループのような官能基をポリマー表面にプラズマ放電法を用いてグラフトされる。
【0024】
ポリエチレンテレフタレートをベースポリマーとして用いる場合、表面に下記のポリマーをコーティングするのも良い。このコーティング用ポリマーは以下のモノマーを少なくとも一つ選択して作成される;ヒドロキシエチルメタクリレート(HEMA)、ジメチルアミノエチルメタクリレート(DM)、n−ブチルメタクリレート(BMA)、N,N−ジメチルアクリルアミド(DMA)、N−アクリロイルモルホリン(AMO)、およびN−ビニルピロリドン(VP)。例として、BMAとDMAより調製されたポリマーをコーティングされたポリエチレンテレフタレートをベースポリマー(不織布)としたものより膜は調製される。
【0025】
透過後、造血幹細胞は濾過チャンバー101にある膜に保持されている。そこで、造血幹細胞を保持した膜は濾過チャンバー101より取り出され、直接生体外培養するために適切な幹細胞培地を含む培養容器に注意深く設置される。例として、幹細胞培地はサイトカイン混合物と低密度リポタンパク質(LDL)を添加させたStemSpan SFEM培地である。サイトカイン混合物は、組み換えヒト幹細胞因子(recombinant human stem cell factor)、組み換えヒトスロンボポエチン(recombinant human thrombopoietin)および組み換えヒトFlt-3リガンド(recombinant human Flt-3 ligand)等である。各々のサイトカインは、培養初期には、5ng/mLから500ng/mLの間の濃度であり、10ng/mLから100ng/mLの間の濃度で用いることが好ましい。場合によっては、LDLも使用しても良い。この場合、培養初期には通常0.1mg/mLから20mg/mLの量を用い、詳しくは5mg/mLの濃度が好ましい。ひとつの例として、無血清培地は、濾過チャンバー101を透過させる洗浄液103として使用される。従って、造血幹細胞を保持した膜は約10日程度の直接生体外培養を行うことができ、造血幹細胞源から直接幹細胞を単離し、生体外培養中に設置されて増殖した造血幹細胞数はコントロールと比べて少なくとも63%である。他の例として、貧血小板血が濾過チャンバー101を透過させる洗浄液103として使用される。この場合、増殖した造血幹細胞数はコントロールと比べて少なくとも280%である。
【0026】
本態様のバッチ型システムは簡単に使用でき造血幹細胞を単離するのに時間効率が良いシステムであり、造血幹細胞源を濾過チャンバーに透過させてから単離した造血幹細胞を培養デッシュに挿入するまでの操作時間は10分から60分と比較的短時間である。ひとつの好ましい態様では、操作時間は18分である。
【0027】
造血幹細胞単離、生体外増殖、回収のための連続型システムおよび方法
本発明の他の態様について、連続式造血幹細胞の単離、生体外増殖、回収システムは、2μmから100μmの孔径を有する膜を備えた濾過チャンバー、濾過チャンバーへ造血幹細胞源を導入する第1注入口、濾過チャンバーへ洗浄液を導入する第2注入口、濾過チャンバーに幹細胞培地を導入する第3注入口を有すること、システム内に幹細胞培地を循環させるポンプ、濾過チャンバーの外へ洗浄液を排出させる第1排出口、さらに造血幹細胞を収集させる第2排出口を備えている。
【0028】
図2は、本発明の一つの態様である連続型システム200を示す。連続型システム200は、濾過チャンバー201、第1注入口204、第2注入口205,第1排出口206、ドレイン207、第2排出口208、造血幹細胞収集容器209、第3注入口211およびポンプ213よりなる。本システムは、オプションとして濾過チャンバー201に接続した貯蔵チャンバー210を有していても良い。濾過チャンバー201は、その中に2μmから100μmの孔径を有する膜を有している。
【0029】
操作において、造血幹細胞源202を、第1注入口204より濾過チャンバー201に導入する。オプションとして、濾過チャンバー201を透過した造血幹細胞源202は、オプション貯蔵チャンバー210中に回収、保存される。次に、洗浄液203を第2注入口205より濾過チャンバー201に導入し、濾過チャンバー201より排出された使用済み洗浄液203は第1排出口206よりドレイン207に排出される。引き続き、幹細胞培地212は第3注入口211より濾過チャンバー201に挿入され、ポンプ213を用いてシステム200中に循環させる。幹細胞培地212は、たとえば2日おき等のように数日おきに新鮮な培地212と交換する。使用済み培地212は第1排出口206よりドレイン207に排出される。一方幹細胞は濾過チャンバー201中の培養状態で保持されている。幹細胞培地212の少量を、培養中第2排出口208より採取し、幹細胞培地212中の造血幹細胞202の数を分析し、造血幹細胞202が十分な数に達したかどうかを確かめることも可能である。試料培地212中の造血幹細胞202の数が求めている値に達したとき、濾過チャンバー201中の培地212は第2排出口208より排出させ、造血幹細胞収集容器209中に挿入し、収集容器209中の培地212より造血幹細胞202は回収される。
【0030】
他の方法として、収集容器209中の培地212より造血幹細胞202は数日ごとに連続的に回収され、それらはまとめて使用されることも可能である。必要であれば、適切な2方または3方バルブ(図示はしていない)をシステムに設置し、異なった回路を形成することも良い。例えば、培地212が第3注入口211より導入されるとき、第1注入口204、第2注入口205,ドレイン207、収集容器209およびオプションの貯蔵チャンバー210に導くラインに取り付けられたバルブはすべて閉じることにより、ポンプ、培地212および濾過チャンバー201周辺の閉鎖回路が形成される。同様に、培養中に少量の培地212を採取したいとき、収集容器209に通じるバルブは開けられる一方、第1注入口204、第2注入口205、ドレイン207、およびオプションの貯蔵チャンバー210に通じるラインに取り付けられたバルブは閉じられることにより、ポンプ、培地212、濾過チャンバー201および収集容器209周辺の閉鎖回路が形成される。
【0031】
同様に、本発明に使用される造血幹細胞の適した供給源として、臍体血、骨髄液または末梢血であるが、これらに限定されるものでもない。一つの例として、造血幹細胞源は、インフォームドコンセントを得た帝王切開または正常出生をおこなった婦人の切除後の臍帯より収集された臍帯血である。他の例として、造血幹細胞源はインフォームドコンセントを得た適正なドナーより収集された末梢血である。骨髄液または末梢血はシリンジを用いて採取され、クエン酸またはヘパリンのような抗凝固剤が含まれた血液バッグ中に保存される。また他の例では、造血幹細胞源は、インフォームドコンセントを得た適正なドナーより標準骨髄液採取法により採取された骨髄液である。
【0032】
造血幹細胞源202は、第1注入口204を通して濾過チャンバー201に透過させる。さらに貯蔵チャンバー210に再収集され得る。洗浄液203は、システム200に第2注入口205より導入される。導入された洗浄液203は、赤血球等を除去することにより造血幹細胞源を純化させる目的を有している。すなわち、赤血球等は造血幹細胞の増殖を抑制する効果があると考えられているからである。
【0033】
本発明で用いられる適正な洗浄液203は、無血清培地、血清培地、生理食塩水、緩衝液、EDTA含有生理食塩水、EDTA含有緩衝液、貧血小板血漿のいずれかまたはこれらの組み合わせよりなることであるが、これらに限定されるものではない。貧血小板血漿は、血液を供給源とすればいかなる公知の方法により調製されても良い。一つの例として、臍帯血は適切な速度で遠心分離され、血球細胞を取り除くために、上澄み液を膜フィルター(孔径0.22μm)を用いてろ過させ、貧血小板血漿を調製する。他の方法において、培地、生理食塩水または緩衝液を洗浄液203として使用される。培地は、血清を含む場合と含まない場合が考えられ、緩衝液は4酢酸エチレンジアミン(EDTA)を含む場合と含まない場合が考えられる。
【0034】
一つの例において、洗浄液203はStemCell Technologies (USA)より直接購入したStemSpan SFEM培地のような無血清培地である。この場合、StemSpan SFEM培地に造血成長因子や他のサイトカインが含まれても含まれなくても良い。他の例において、洗浄液203は無血清培地と貧血小板血漿との組み合わせである。造血幹細胞源または洗浄液をシステム中に導入するのに、ペリスターポンプのようなポンプ(図示せず)を使用して導入することも可能である。造血幹細胞源202または洗浄液203のような流体は、濾過チャンバー201に流速1〜10mL/分で透過させる。
【0035】
濾過チャンバー201は、その中に2μmから100μmの孔径を有する膜よりなる。例えば、孔径は2μmから25μm、3μmから20μmまたは3μmから15μmである。様々な手法により膜の平均孔径を測定することが可能であり、例えば、電子顕微鏡、液体噴出孔径メーター(liquid extrusion porosimetry)や他の適切な既知な方法である。記述した実施例では、孔径は液体噴出孔径メーター(liquid extrusion porosimetry)により測定された。孔径の測定は測定に用いた特定の手法により異なることを記しておく。適正な膜材料は、良好な成形性、良好な生体適合性、良好な滅菌性および細胞に対して低毒性である必要がある。
【0036】
一般的には、膜は以下で示す合成ポリマーより調製されるがこれらに限定されるわけではない。すなわち、ポリエチレン、ポリプロピレン、ポリスチレン、アクリル樹脂、ナイロン、ポリエステル、ポリカーボネート、ポリアクリルアミドおよびポリウレタン、さらには以下に示すアガロース、セルロース、酢酸セルロース、アルギネート等の天然ポリマーであるがこれらに限定されるわけではない。また、さらにはヒドロキシアパタイト、ガラス、アルミナ、チタニア等の無機材料およびステンレス鋼、チタン、アルミニウム等の金属も含まれるがこれらに限定されるわけではない。好ましくは、膜はポリウレタンベースポリマーまたはポリエチレンテレフタレートベースポリマー(例えば、不織布)によって調製されている。ベースポリマーは、さらにその主鎖および/または側鎖に他の分子をグラフトさせていても良い。この他の分子としては、アミノ酸、ペプチド、グリコサミノグリカンや糖鎖蛋白質であるがこれらに限定されるわけではない。
【0037】
ひとつの例として、特開2005−323534に記載されている方法のように、ポリウレタンベースポリマーはカルボキシルグループのような官能基をポリマー表面に既知のプラズマ放電法を用いてグラフトされる。ポリエチレンテレフタレートをベースポリマーとして用いる場合、表面に下記のポリマーをコーティングするのも良い。このコーティング用ポリマーは少なくとも以下のモノマー一つより選択して作成される;ヒドロキシエチルメタクリレート(HEMA)、ジメチルアミノエチルメタクリレート(DM)、n−ブチルメタクリレート(BMA)、N,N−ジメチルアクリルアミド(DMA)、N−アクリロイルモルホリン(AMO)、およびN−ビニルピロリドン(VP)。一つの例として膜は、カルボキシルグループを含むまたは含まないポリウレタンベースポリマーより調製される。他の例として、BMAとDMAより調製されたポリマーをコーティングしたポリエチレンテレフタレートベースポリマー(不織布)によって膜は調製される。
【0038】
透過後、造血幹細胞は濾過チャンバー201にある膜に保持されている。直接対外培養するために適切な幹細胞培地は第3注入口211より濾過チャンバー201に導入され、ポンプ213を用いて循環させる。好ましくは、ポンプ213はペリスターポンプであり、システム200中、特に濾過チャンバー201中の培養培地212を循環させる。ポンプ213は、システム中の培養培地の循環を閉鎖系にする限り、様々な適切な部分を循環させることができる。ひとつの態様として、第1注入口204、第2注入口205、オプションである貯蔵チャンバー210、ドレイン207および第2排出口208に通じるラインに設置されたバルブを閉じることにより、ポンプ213、培養培地212および濾過チャンバー201中で閉鎖系が形成される。他の態様として、第1注入口204、第2注入口205、ドレイン207、オプションである貯蔵チャンバー210に通じるラインに設置されたバルブを閉じることにより、ポンプ213、培養培地212、濾過チャンバー201および収集容器209中で閉鎖系が形成される(データは示していない)。
【0039】
例として、幹細胞培地はサイトカイン混合物と低密度リポタンパク質(LDL)を添加させたStemSpan SFEM培地である。StemSpan SFEM培地は、StemCell Technologies (USA)より直接購入することができ、造血幹細胞因子や他のサイトカインを含んでも、含まなくても良い。サイトカイン混合物は、組み換えヒト幹細胞因子(recombinant human stem cell factor)、組み換えヒトスロンボポエチン(recombinant human thrombopoietin)および組み換えヒトFlt-3リガンド(recombinant human Flt-3 ligand)等である。各々のサイトカインは、培養初期には、5ng/mLから500ng/mLの間の濃度であり、10ng/mLから100ng/mLの間の濃度で用いることが好ましい。場合によっては、LDLも使用する。この場合、培養初期には通常0.1mg/mLから20mg/mLの量を用い、詳しくは5mg/mLの濃度が好ましい。細胞培地212は新鮮な細胞培地212と一日ごとに交換され、使用済みの細胞培地212の少量は採取され、細胞培地212中の造血幹細胞数が決定される。
【0040】
ひとたび、採取した培地212中の造血幹細胞202があらかじめ定めていた値に到達したら、濾過チャンバー211中の培地212は、第2排出口208より造血幹細胞収集容器209中に排出され、造血幹細胞202は収集容器209中の培地中に収穫される。他の態様として、造血幹細胞202は、収集容器209中に収集した培地212から数日ごとに連続的に収穫され、以後の使用のために貯蔵することも可能である。ひとつの例として、培地212から収穫された造血幹細胞は、生体外培養の後、コントロールと比べて少なくとも1以上である。例えば、臍帯血から単離され、直接生体外培養された幹細胞は、生体外培養後、10日後には14から15倍と高い値に到達することもある。
【0041】
さらに、本態様の連続システムにより単離し、生体外増殖し、収穫された造血幹細胞はコロニーを形成する能力を有している。ひとつの例として、単離し、生体外増殖された造血幹細胞より形成されたコロニー数は、コントロールの値と同等であり、約150コロニー数であった(データは示さず)。
同様に、本態様の連続システムは、造血幹細胞を単離するのに手軽に操作でき、時間効率的である。すなわち、生体外培養に必要な時間を考慮しない場合、造血幹細胞源を単離するために濾過チャンバーに透過を始めてからシステム中で生体外培養するまでの操作時間は、約10分から60分と比較的短時間である。本態様では、操作時間は約18分である。
【0042】
[実施例]
以下、発明の実施の態様を通じて本発明を説明するが、以下の実施態様は特許請求の範囲にかかる発明を限定するものではなく、また実施態様の中で説明されている特徴の組み合わせの全てが発明の解決手段に必須であるとは限らない。
【0043】
実施例1 表面修飾PU膜の調製
1.1 PU−GMA膜の調製
PU−GMA膜は先の文献、特開2005−323534公報記載のプラズマ放電法を用いて調製した。簡潔に記載すると、白血球除去膜(イムガードIII-RC、テルモ社製)から取り出したポリウレタン膜をこの実施例では使用する。アルゴンプラズマを用いて反応容器中のポリウレタン(PU)膜表面にグリシジルメタクリレート(GMA)は導入された。アルゴンガス(約26.6パスカルの圧力)を反応容器中に約30秒間流し、高周波電源(出力200W)供給下において、アルゴンプラズマを発生させた。その後、GMAとPU膜間でグラフト重合を反応容器中にて5分間、0.65パスカルの圧力下で行った。引き続き、GMA架橋PU膜は、水とメタノールの混合溶液(1:1体積比)で30分間振動下で洗浄し、さらに純水で30分間洗浄した。PU膜表面に導入されたGMA架橋率は次式で定義された。
GMA導入率(%)=(X/Y)×100
ここでGMA導入率はプラズマ放電後のPU−GMA膜の乾燥重量(Xグラム、80度24時間真空乾燥)をプラズマ放電前のPU膜の乾燥重量(Yグラム、80度24時間真空乾燥)で割った比と定義した。この例では、GMA導入率は0.61%であった。
【0044】
1.2 PU−COOH膜の調製
上記記載の操作で調製したPU−GMA膜(孔径約5μmと推定)を直径25mmの円状に各切断した。3枚のPU−GMA膜は、水酸化ナトリウム水溶液含有グリシン溶液中に浸漬させた(20mL、0.1M、水酸化ナトリウム水溶液中のグリシン濃度は0.4M)。その後、80度で24時間培養することによりカルボキシル基導入PU膜を調製した。反応が終了した後、膜は、超純水中で振とうさせながら、10分間25度で洗浄した。洗浄は2回を行い、超純水中に4度にて冷蔵保存した。調製したPU膜は、「PU−COOH膜」と命名した。
【0045】
実施例2 造血幹細胞の単離、生体外増殖および回収のためのバッチシステム
インフォームドコンセプトに同意されている妊婦より臍帯血を得た。臍帯血は、血液抗凝固剤(クエン酸、デキストロース他)を含有している採血bag(CPDA-1、テルモ株式会社製)中に挿入した。ろ過装置は上記記載の3枚のPU−COOH膜をフィルタホルダー(MILLIPORE製 25mm)に装着させて組み立てた。6mLの臍帯血を1mL/minの速度でろ過装置に透過させた。その後、洗浄液(6mL)を1mL/minの速度で6分間透過させた。洗浄液として、(a)血漿A、または(b)StemSpan SFEM培地を用いた。血漿Aは、以下の方法により調製した。すなわち、臍帯血を1800rpmの速度で遠心して貧血小板血漿を得た。さらに、この貧血小板血漿を、孔径0.22μmのフィルター(MiLlex GS, MILLIPORE製)を用いてろ過して、完全に血球細胞を除去した血漿を作成した(血漿A)。StemSpan SFEM培地は販売会社より直接購入した(#09650, StemCell Technologies社製)。
【0046】
洗浄後、PU−COOH膜を膜ホルダーより取り出し、下記に記載する細胞培地中に浸漬させて、10日間37度、5%のCO2濃度のCO2培養槽中でPU−COOH膜に接着している造血幹細胞を培養した。この実施例中、単離した造血幹細胞の生体外培養に用いた培養培地は、StemSpan SFEM培地を基本培地として用い、これにサイトカインカクテルであるStemSpan CC110(#02697,StemCell Technologies社製)と5mg/mLの低密度リポ蛋白質(LDL)を添加させた培地を本発明では用い、以後HSC培地Aと命名した。臍帯血を膜透過させてから造血幹細胞を培養デッシュに播種するまでの全操作時間は18分のみと短時間であった。
【0047】
10日後に、造血幹細胞数はフローサイトメトリー(Beckman-Coulter社製 EPICSTM XL)を用いて測定した。すなわち、CD34+造血幹細胞の分析は、ISHAGEガイドライン(国際血液療法・移植学会, Keeney M. et al., Cytometry (1998) 34, 61-70)の実験法に基づいて行った。すなわち、サンプル管(Beckman-Coulter社製)をサンプルと同数準備した。20μLの抗CD34抗体(Beckman-Coulter社製 CD45-FITC/CD34−PE)をサンプル管に添加した。100μLの各サンプルを抗CD34抗体含有の各サンプル管に加え、よく撹拌した後、細胞生存度測定色素(Beckman-Coulter製 7-ADD Viability Dye)を20μL添加し、室温暗所で15分間培養した。次いで、500μLの溶血剤(OptiLyseC)を各sample管に添加し、よく撹拌した後、室温で10分間培養した。500μLのリン酸緩衝液を各sample管に添加し、よく撹拌して、室温で10分間培養した。このように調製したサンプルをフローサイトメトリーを用いて分析した。試料として採取した臍帯血に含まれるCD34+造血幹細胞数を予め分析しておき、血漿AとStemSpan SFEM培地を洗浄液として用いたときの造血幹細胞の生体外増殖効率の比較として用いた。増殖・回収後の培地中に存在するCD34+造血幹細胞数を分析した。CD34+造血幹細胞の生体外増殖率は下記式より計算で求められる。
【数1】

式中、N2は、増殖・回収後における培地中のCD34+造血幹細胞数であり、N1は試料として採取した臍帯血中に含まれるCD34+造血幹細胞数である。結果を表1に示す。造血幹細胞の生体外増殖率は、洗浄液として、血漿AおよびStemSpan SFEM培地を用いたときに、それぞれ2.5倍および0.63倍であった。
【0048】
【表1】

【0049】
実施例3 実施例2のバッチシステムにより単離、増殖および回収された造血幹細胞
6mLの臍帯血の代わりに1mLの臍帯血を用い、細胞培養開始後5日目の細胞培養液(HSC培地A)の交換または未交換以外は、実施例2に記載の方法により造血幹細胞を単離、増殖、回収した。血漿Aを本実験では洗浄液として使用した。表2に結果を示す。本実施例に記載の方法を用いた造血幹細胞単離、増殖において、コントロールと比べると2.7倍から6.2倍の増殖率を得た。
なお、臍帯血を膜透過させてから造血幹細胞を培養デッシュに播種するまでの全操作時間は15分以下と短時間であった。
【0050】
【表2】

【0051】
実施例4 造血幹細胞の単離、生体外増殖および回収のための連続システム
臍帯血は上記実施例2記載の方法により採取した。造血幹細胞の単離、生体外増殖、回収の連続システムは図2記載の通り設置した。血液バッグ中の臍帯血20gを6枚のポリウレタン(PU)膜(イムガードIII-RC、テルモ社製)よりなる201部位に2mL/分の透過速度で透過させた。PU膜の各シートの平均孔径は、キャピラリーフローポロメーター(Porous Materials Inc.)の測定から5から12μmであった。フィルター部位を透過した臍帯血は貯蔵部位206に貯蔵された。血漿A(20g)は、フィルター部位201を2mL/分の透過速度で透過させ、続いてフィルター部位201を洗浄するためにStemSpan SFEM培地(60g)を透過させた。HSC培養液A(サイトカインカクテルであるStemSpan CC110(#02697,StemCell Technologies社製)と5mg/mLの低密度リポ蛋白質(LDL)を添加させたStemSpan SFEM培地)をフィルター部位201に透過させ、さらにペリスターポンプを用いて0.5mL/分の速度で循環させた。新鮮なHSC培養液A(20g)は、1日目と5日目にシステムに導入され、使用した古いHSC培養液Aは排出口206を通して排出し、ドレイン207に導入させた。一方、フィルター部位201中に保持された造血幹細胞は、培養が引き続き続けられた。1日目と6日目と10日目にHSC培養液Aの少量をドレイン207より採取し、細胞培地中の造血幹細胞数を分析した。細胞数は、実施例2記載の方法に従い測定した。表3に結果を示す。
【0052】
表3に示された結果より、本実施例はコントロール(臍帯血から単離し、通常の培養操作に直接用いられる幹細胞)に比べて少なくとも6.8倍という幹細胞の高い増殖率を与えることが明らかである。さらに、本実施例における連続操作により臍帯血を透過させて、HSC培養液Aをフィルター部位に導入し、連続培養するまでに、30分とかからず、幹細胞を単離、生体外培養そして回収する連続操作は、通常の幹細胞分離および培養法に比べると比較的簡単である。
【0053】
【表3】

【0054】
実施例5 実施例4の連続システムにより単離、増殖および回収された造血幹細胞
細胞培養後、2日目、4日目、6日目および8日目に培養培地(HSC培養液A)を交換した以外は、実施例4に記載の方法に従い造血幹細胞を、単離、生体外増殖ならびに回収した。連続操作により臍帯血を透過させて、HSC培養液Aをフィルター部位に導入し、連続培養するまでに約30分しか要しなかった。表4に結果を示す。幹細胞を単離し、本実施例に記載された方法により幹細胞を単離、増殖することにより、コントロールと比べて46倍もの高い増殖率が得られた。
【0055】
【表4】

【0056】
実施例6 フィルターとして不織布を用いた実施例4の連続システムにおける造血幹細胞の単離、生体外増殖および回収
ポリウレタン膜の代わりに不織布(Asahi Medical Co., SepaCell R, R-500B2(3)-1)をフィルター膜として使用し、細胞培養後、2日目、4日目、6日目および8日目に培養培地(HSC培養液A)を交換した以外は、実施例4に記載の方法に従い造血幹細胞を単離、生体外増殖ならびに回収した。
表5に結果を示す。本実施例に記載された方法に従い幹細胞を単離、増殖することにより、コントロールと比べて3.7倍の増殖率が得られた。
【0057】
【表5】

【0058】
実施例7 実施例4の連続システムを用いた末梢血からの造血幹細胞の単離、生体外増殖および回収
臍帯血の代わりに末梢血を用い、新鮮な培養液(HSC培養液A)を細胞培養後、2日目、4日目、6日目および8日目に供給した以外は、実施例4に記載の方法に従い造血幹細胞を、単離、生体外増殖ならびに回収した。本実施例に記載された方法に従い幹細胞を単離、増殖することにより、コントロールと比べて増殖率が増加することが予想される。
【0059】
実施例8 実施例4の連続システムを用いた骨髄液からの造血幹細胞の単離、生体外増殖および回収
臍帯血の代わりに骨髄液を用い、新鮮な培養液(HSC培養液A)を細胞培養後、2日目、4日目、6日目および8日目に供給した以外は、実施例4に記載の方法に従い造血幹細胞を、単離、生体外増殖ならびに回収した。本実施例に記載された方法に従い幹細胞を単離、増殖することにより、コントロールと比べて増殖率が増加することが予想される。
[比較例]
【0060】
臍帯血から通常のFicoll-Paque比重分離法(例えば、Fotino M., et al., Ann. Clin. Lab. Sci., 1,131-133 (1971))により単核球を分離した。以下に、操作法を記す。
即ち、臍帯血を2mMのEDTAと0.5%の牛血清アルブミン(BSA)入りリン酸緩衝液(以後、リン酸緩衝液Aと命名)で1:4の割合で希釈した。この希釈臍帯血35mLを15mLのFicoll-Paque(Ficoll-Paque, Pharmacia)液上に重層した。400G、20℃で40分間遠心して比重分離を行なった。遠心後、分離された単核球を注意深く分取した。再度リン酸緩衝液Aを加えて50mLとし、軽い転倒混和の後、300Gで10分間遠心した。
【0061】
下層0.5mLを残して、上澄みをすべて取り除いた。この造血幹細胞含有溶液中に含まれる赤血球、白血球、血小板、ISHAGEガイドラインに基づくCD34+造血幹細胞数は、5181細胞/μL、11,935細胞/μL、171,812細胞/μL、185細胞/μLであった。上記操作は、3時間の操作時間を有した。
次に、上記記載の方法で純化させたCD34+造血幹細胞1000細胞を造血幹細胞培地(HSC培養液A)1 mL含有24穴プレート中で培養した。10日後に、CD34+造血幹細胞を回収し、実施例2の方法で細胞培地中の造血幹細胞の生体外増殖率(EVER)を分析したところ、生体外増殖率は143%であった。
【0062】
結論として、常法である上記記載のFicoll-Paque法による造血幹細胞を単離する時間は、本発明の実施例2、3、4、5および6に示された方法より操作時間はとても長かった。Ficoll-Paque法により単離されたCD34+細胞を用いたCD34+造血幹細胞の生体外増殖率は、実施例3、4、5および6に示された本発明の方法の生体外増殖率より低かった。
【0063】
以上、本発明を実施の態様を用いて説明したが、本発明の技術的範囲は上記実施の態様に記載の範囲には限定されない。上記実施の態様に、多様な変更または改良を加えることができることは当業者に明らかである。その様な変更または改良を加えた態様も本発明の技術的範囲に含まれ得ることが、特許請求の範囲の記載から明らかである。
【符号の説明】
【0064】
100 バッチ型システム
101 濾過チャンバー
102 造血幹細胞源
103 洗浄液
104 第1注入口
105 第2注入口
106 第1排出口
107 ドレイン 200 連続型システム
201 濾過チャンバー
202 造血幹細胞源
203 洗浄液
204 第1注入口
205 第2注入口
206 第1排出口
207 ドレイン
208 第2排出口
209 収集容器
210 貯蔵チャンバー
211 第3注入口
212 培地
213 ポンプ
【特許請求の範囲】
【請求項1】
造血幹細胞の単離、生体外増殖および回収を行うためのシステムであって、
2μmから100μmの孔径を有する膜を備えた濾過チャンバー、
濾過チャンバーへ造血幹細胞源を導入する第1注入口、
濾過チャンバーへ洗浄液を導入する第2注入口、および
濾過チャンバーの外へ洗浄液を排出させる第1排出口
を備えた、前記システム。
【請求項2】
造血幹細胞源を濾過チャンバーに透過させた後、該造血幹細胞源を貯蔵するための貯蔵チャンバーをさらに備えてなる、請求項1に記載のシステム。
【請求項3】
洗浄液が、無血清培地、血清培地、生理食塩水、緩衝液、EDTA含有生理食塩水、EDTA含有緩衝液、貧血小板血漿のいずれか、またはこれらの組み合わせである、請求項1に記載のシステム。
【請求項4】
造血幹細胞源が、臍帯血、骨髄液または末梢血のいずれかである、請求項1に記載のシステム。
【請求項5】
造血幹細胞が、膜に保持されている、請求項1に記載のシステム。
【請求項6】
膜が、ポリウレタンをベースとしたポリマーまたはポリエチレンテレフタレートをベースとしたポリマーである、請求項1に記載のシステム。
【請求項7】
ポリエチレンテレフタレートをベースとしたポリマーが、ヒドロキシエチルメタクリレート(HEMA)、ジメチルアミノエチルメタクリレート(DM)、n−ブチルメタクリレート(BMA)、N,N−ジメチルアクリルアミド(DMA)、N−アクリロイルモルホリン(AMO)、およびN−ビニルピロリドン(VP)からなる群から選択される少なくとも1つから作られたポリマーコーティングをさらに含む、請求項6に記載のシステム。
【請求項8】
システムの操作時間が、約10分から約30分である、請求項1に記載のシステム。
【請求項9】
濾過チャンバーへ幹細胞培地を導入する第3注入口、
システムにおいて幹細胞培地を循環させるためのポンプ、および
造血幹細胞を収集する第2排出口
をさらに備えてなる、請求項1記載のシステム。
【請求項10】
造血幹細胞源を濾過チャンバーに透過させた後、該造血幹細胞源を貯蔵するための貯蔵チャンバーをさらに備えてなる、請求項9に記載のシステム。
【請求項11】
幹細胞培地が、サイトカインをさらに含む、請求項9に記載のシステム。
【請求項12】
幹細胞培地が、低密度リポタンパク質をさらに含む、請求項11に記載のシステム。
【請求項13】
造血幹細胞が、第2排出口から収集された幹細胞培地から回収される、請求項9に記載のシステム。
【請求項14】
造血幹細胞を単離、生体外増殖および回収する方法であって、
(a)請求項1に記載のシステムを提供する工程、
(b)第1注入口より造血幹細胞源を濾過チャンバーへ導入する工程、
(c)第2注入口より洗浄液を濾過チャンバーへ導入する工程、
(d)膜を幹細胞培地で培養し、そこに保持された造血幹細胞を増殖させる工程
の順で含む、前記方法。
【請求項15】
工程(c)の後、洗浄液を第1排出口から濾過チャンバーの外へ排出させること(c1)をさらに含む、請求項14に記載の方法。
【請求項16】
造血幹細胞源が、臍帯血、骨髄液または末梢血のいずれかである、請求項14に記載の方法。
【請求項17】
洗浄液が、無血清培地、血清培地、生理食塩水、緩衝液、EDTA含有生理食塩水、EDTA含有緩衝液、貧血小板血漿のいずれか、またはこれらの組み合わせである、請求項14に記載の方法。
【請求項18】
膜が、ポリウレタンをベースとしたポリマーまたはポリエチレンテレフタレートをベースとしたポリマーである、請求項14に記載の方法。
【請求項19】
ポリエチレンテレフタレートをベースとしたポリマーが、ヒドロキシエチルメタクリレート(HEMA)、ジメチルアミノエチルメタクリレート(DM)、n−ブチルメタクリレート(BMA)、N,N−ジメチルアクリルアミド(DMA)、N−アクリロイルモルホリン(AMO)、およびN−ビニルピロリドン(VP)からなる群から選択される少なくとも1つから作られたポリマーコーティングをさらに含む、請求項18に記載の方法。
【請求項20】
造血幹細胞を単離、生体外増殖および回収する方法であって、
(a)請求項9に記載のシステムを提供する工程、
(b)第1注入口より造血幹細胞源を濾過チャンバーへ導入する工程、
(c)第2注入口より洗浄液を濾過チャンバーへ導入する工程、
(d)第3注入口より幹細胞培地を濾過チャンバーへ導入する工程、
(e)システム中に幹細胞培地を循環させるポンプを作動させる工程、
(f)第2排出口より収集した幹細胞培地から造血幹細胞を回収する工程
の順で含む、前記方法。
【請求項21】
(b1)工程(b)において造血幹細胞源を濾過チャンバーに透過させた後、該造血幹細胞源を貯蔵チャンバーに貯蔵すること、
(c1)工程(c)の後、洗浄液を第1排出口より濾過チャンバーの外へ排出させること、および
(e1)工程(e)の後、幹細胞培地の一部を取り出すことによって、造血幹細胞を第2排出口よりサンプリングすること
をさらに含む、請求項20に記載の方法。
【請求項22】
造血幹細胞源が、臍帯血、骨髄液または末梢血のいずれかである、請求項20に記載の方法。
【請求項23】
洗浄液が、無血清培地、血清培地、生理食塩水、緩衝液、EDTA含有生理食塩水、EDTA含有緩衝液、貧血小板血漿のいずれか、またはこれらの組み合わせである、請求項20に記載の方法。
【請求項24】
膜が、ポリウレタンをベースとしたポリマーまたはポリエチレンテレフタレートをベースとしたポリマーである、請求項20に記載の方法。
【請求項25】
ポリエチレンテレフタレートをベースとしたポリマーが、ヒドロキシエチルメタクリレート(HEMA)、ジメチルアミノエチルメタクリレート(DM)、n−ブチルメタクリレート(BMA)、N,N−ジメチルアクリルアミド(DMA)、N−アクリロイルモルホリン(AMO)、およびN−ビニルピロリドン(VP)からなる群から選択される少なくとも1つから作られたポリマーコーティングをさらに含む、請求項24に記載の方法。
【請求項1】
造血幹細胞の単離、生体外増殖および回収を行うためのシステムであって、
2μmから100μmの孔径を有する膜を備えた濾過チャンバー、
濾過チャンバーへ造血幹細胞源を導入する第1注入口、
濾過チャンバーへ洗浄液を導入する第2注入口、および
濾過チャンバーの外へ洗浄液を排出させる第1排出口
を備えた、前記システム。
【請求項2】
造血幹細胞源を濾過チャンバーに透過させた後、該造血幹細胞源を貯蔵するための貯蔵チャンバーをさらに備えてなる、請求項1に記載のシステム。
【請求項3】
洗浄液が、無血清培地、血清培地、生理食塩水、緩衝液、EDTA含有生理食塩水、EDTA含有緩衝液、貧血小板血漿のいずれか、またはこれらの組み合わせである、請求項1に記載のシステム。
【請求項4】
造血幹細胞源が、臍帯血、骨髄液または末梢血のいずれかである、請求項1に記載のシステム。
【請求項5】
造血幹細胞が、膜に保持されている、請求項1に記載のシステム。
【請求項6】
膜が、ポリウレタンをベースとしたポリマーまたはポリエチレンテレフタレートをベースとしたポリマーである、請求項1に記載のシステム。
【請求項7】
ポリエチレンテレフタレートをベースとしたポリマーが、ヒドロキシエチルメタクリレート(HEMA)、ジメチルアミノエチルメタクリレート(DM)、n−ブチルメタクリレート(BMA)、N,N−ジメチルアクリルアミド(DMA)、N−アクリロイルモルホリン(AMO)、およびN−ビニルピロリドン(VP)からなる群から選択される少なくとも1つから作られたポリマーコーティングをさらに含む、請求項6に記載のシステム。
【請求項8】
システムの操作時間が、約10分から約30分である、請求項1に記載のシステム。
【請求項9】
濾過チャンバーへ幹細胞培地を導入する第3注入口、
システムにおいて幹細胞培地を循環させるためのポンプ、および
造血幹細胞を収集する第2排出口
をさらに備えてなる、請求項1記載のシステム。
【請求項10】
造血幹細胞源を濾過チャンバーに透過させた後、該造血幹細胞源を貯蔵するための貯蔵チャンバーをさらに備えてなる、請求項9に記載のシステム。
【請求項11】
幹細胞培地が、サイトカインをさらに含む、請求項9に記載のシステム。
【請求項12】
幹細胞培地が、低密度リポタンパク質をさらに含む、請求項11に記載のシステム。
【請求項13】
造血幹細胞が、第2排出口から収集された幹細胞培地から回収される、請求項9に記載のシステム。
【請求項14】
造血幹細胞を単離、生体外増殖および回収する方法であって、
(a)請求項1に記載のシステムを提供する工程、
(b)第1注入口より造血幹細胞源を濾過チャンバーへ導入する工程、
(c)第2注入口より洗浄液を濾過チャンバーへ導入する工程、
(d)膜を幹細胞培地で培養し、そこに保持された造血幹細胞を増殖させる工程
の順で含む、前記方法。
【請求項15】
工程(c)の後、洗浄液を第1排出口から濾過チャンバーの外へ排出させること(c1)をさらに含む、請求項14に記載の方法。
【請求項16】
造血幹細胞源が、臍帯血、骨髄液または末梢血のいずれかである、請求項14に記載の方法。
【請求項17】
洗浄液が、無血清培地、血清培地、生理食塩水、緩衝液、EDTA含有生理食塩水、EDTA含有緩衝液、貧血小板血漿のいずれか、またはこれらの組み合わせである、請求項14に記載の方法。
【請求項18】
膜が、ポリウレタンをベースとしたポリマーまたはポリエチレンテレフタレートをベースとしたポリマーである、請求項14に記載の方法。
【請求項19】
ポリエチレンテレフタレートをベースとしたポリマーが、ヒドロキシエチルメタクリレート(HEMA)、ジメチルアミノエチルメタクリレート(DM)、n−ブチルメタクリレート(BMA)、N,N−ジメチルアクリルアミド(DMA)、N−アクリロイルモルホリン(AMO)、およびN−ビニルピロリドン(VP)からなる群から選択される少なくとも1つから作られたポリマーコーティングをさらに含む、請求項18に記載の方法。
【請求項20】
造血幹細胞を単離、生体外増殖および回収する方法であって、
(a)請求項9に記載のシステムを提供する工程、
(b)第1注入口より造血幹細胞源を濾過チャンバーへ導入する工程、
(c)第2注入口より洗浄液を濾過チャンバーへ導入する工程、
(d)第3注入口より幹細胞培地を濾過チャンバーへ導入する工程、
(e)システム中に幹細胞培地を循環させるポンプを作動させる工程、
(f)第2排出口より収集した幹細胞培地から造血幹細胞を回収する工程
の順で含む、前記方法。
【請求項21】
(b1)工程(b)において造血幹細胞源を濾過チャンバーに透過させた後、該造血幹細胞源を貯蔵チャンバーに貯蔵すること、
(c1)工程(c)の後、洗浄液を第1排出口より濾過チャンバーの外へ排出させること、および
(e1)工程(e)の後、幹細胞培地の一部を取り出すことによって、造血幹細胞を第2排出口よりサンプリングすること
をさらに含む、請求項20に記載の方法。
【請求項22】
造血幹細胞源が、臍帯血、骨髄液または末梢血のいずれかである、請求項20に記載の方法。
【請求項23】
洗浄液が、無血清培地、血清培地、生理食塩水、緩衝液、EDTA含有生理食塩水、EDTA含有緩衝液、貧血小板血漿のいずれか、またはこれらの組み合わせである、請求項20に記載の方法。
【請求項24】
膜が、ポリウレタンをベースとしたポリマーまたはポリエチレンテレフタレートをベースとしたポリマーである、請求項20に記載の方法。
【請求項25】
ポリエチレンテレフタレートをベースとしたポリマーが、ヒドロキシエチルメタクリレート(HEMA)、ジメチルアミノエチルメタクリレート(DM)、n−ブチルメタクリレート(BMA)、N,N−ジメチルアクリルアミド(DMA)、N−アクリロイルモルホリン(AMO)、およびN−ビニルピロリドン(VP)からなる群から選択される少なくとも1つから作られたポリマーコーティングをさらに含む、請求項24に記載の方法。
【図1】


【図2】




【図2】


【公開番号】特開2010−263800(P2010−263800A)
【公開日】平成22年11月25日(2010.11.25)
【国際特許分類】
【外国語出願】
【出願番号】特願2009−115842(P2009−115842)
【出願日】平成21年5月12日(2009.5.12)
【出願人】(504007741)國立中央大學 (28)
【Fターム(参考)】
【公開日】平成22年11月25日(2010.11.25)
【国際特許分類】
【出願番号】特願2009−115842(P2009−115842)
【出願日】平成21年5月12日(2009.5.12)
【出願人】(504007741)國立中央大學 (28)
【Fターム(参考)】
[ Back to top ]

