過塩素酸塩の製造装置および製造方法
【課題】ナトリウムイオンの移動量を容易にモニタリングする過塩素酸塩の製造装置及び製造方法の提供。
【解決手段】陽極4が設けられる陽極側4Aと陰極5が設けられる陰極側5Aとが陽イオン交換膜6で仕切られ、陽極側4Aにおいて塩化ナトリウム水溶液を電解酸化する一次電解槽1と、陰極側5Aにおいて上記電解酸化に伴い変化するpH値、水温及び液量に基づいて、上記電解酸化に伴い陽極側4Aから陽イオン交換膜6を通過して陰極側5Aに移動したナトリウムイオンの移動量を計測する計測装置13と、を有する過塩素酸アンモニウム製造装置Aを採用する。
【解決手段】陽極4が設けられる陽極側4Aと陰極5が設けられる陰極側5Aとが陽イオン交換膜6で仕切られ、陽極側4Aにおいて塩化ナトリウム水溶液を電解酸化する一次電解槽1と、陰極側5Aにおいて上記電解酸化に伴い変化するpH値、水温及び液量に基づいて、上記電解酸化に伴い陽極側4Aから陽イオン交換膜6を通過して陰極側5Aに移動したナトリウムイオンの移動量を計測する計測装置13と、を有する過塩素酸アンモニウム製造装置Aを採用する。
【発明の詳細な説明】
【技術分野】
【0001】
本発明は、過塩素酸塩の製造装置および製造方法に関するものである。
【背景技術】
【0002】
過塩素酸塩は、固体燃料ロケットの推進薬の酸化剤(過塩素酸アンモニウム)を始め、リチウム電池の支持電解質(過塩素酸リチウム)やエアバックの着火剤(過塩素酸カリウム)など、様々な用途に利用されている。
ここで、過塩素酸塩の製造方法としては、非特許文献1に詳しく記述されているように、工業的には塩化ナトリウム水溶液の電解酸化により合成した塩素酸ナトリウム水溶液を更に電解酸化して過塩素酸ナトリウムを合成した後、所定の処理を経て製造される。そこで、これまでの従来技術では、例えば特許文献1や特許文献2に記載に記載されているように、過塩素酸ナトリウム(NaClO4)水溶液を効率的に電解合成するための方法に焦点が当てられてきた。
【先行技術文献】
【特許文献】
【0003】
【特許文献1】特開平3−199387号公報
【特許文献2】特開2007−197740号公報
【0004】
【非特許文献1】J. C. Schumacher(ed.), Perchlorates, A.C.S.Monograph No.146, Reinhold, New York, 1960
【発明の概要】
【発明が解決しようとする課題】
【0005】
しかし、過塩素酸ナトリウム以外の過塩素酸塩を製造するにあたり、必ずしも過塩素酸ナトリウムを経由する必要は無い。そこで、本願発明者らは、過塩素酸ナトリウムの製造を経由しないで製造工程を簡略化した過塩素酸塩の製造方法を考案した。この製造方法では、陽極が設けられる陽極側と陰極が設けられる陰極側とを陽イオン交換膜で仕切った電解槽を用い、塩化ナトリウム水溶液あるいは塩素酸ナトリウム水溶液を陽極側で電解酸化して過塩素酸水溶液を生成すると共に、最終生成物の不純物となる陽極側に存在するナトリウムイオンを陽極側から陽イオン交換膜を介して陰極側に移動させて除去する。そして、この電解酸化で生成した過塩素酸水溶液に所定のアルカリ性水溶液を加えて、中和反応により過塩素酸塩を合成する。
ところで、本製造方法では、最終生成物である過塩素酸塩の濃度を制御するにあたり、アノード液中に存在するナトリウムイオン濃度、すなわち上記電解酸化に伴って陽極側から陰極側へ移動するナトリウムイオンの移動量のモニタリングが欠かすことができない。通常、ナトリウムイオン濃度を計測するには液体イオンクロマトグラフィーやICP(Inductive Coupled Plasma)発光分析装置が用いられている。しかし、該分析装置は、分析精度は高いが、分析に時間と手間がかかるため、ナトリウムイオンの移動量をモニタリングする手段としては適していない。
【0006】
本発明は、上記課題に鑑みてなされたものであり、ナトリウムイオンの移動量を容易にモニタリングする過塩素酸塩の製造装置及び製造方法の提供を目的とする。
【課題を解決するための手段】
【0007】
上記の課題を解決するために、本発明は、陽極が設けられる陽極側と陰極が設けられる陰極側とが陽イオン交換膜で仕切られ、上記陽極側において塩化ナトリウム水溶液あるいは塩素酸ナトリウム水溶液を電解酸化する電解槽と、上記陰極側において上記電解酸化に伴い変化するpH値、水温及び液量に基づいて、上記電解酸化に伴い上記陽極側から上記陽イオン交換膜を通過して上記陰極側に移動したナトリウムイオンの移動量を計測する計測装置と、を有する過塩素酸塩の製造装置を採用する。
【0008】
さらに、本発明において、上記計測装置は、大気中に含まれる二酸化炭素の上記陰極側への溶解量に基づいて、上記計測したナトリウムイオンの移動量を補正するという構成を採用する。
一方で、本発明において、上記陰極側には、上記電解酸化に伴い上記陰極で発生した水素ガスを大気中に排気する水素ガス排気管が設けられており、上記水素ガス排気管は、大気中から上記陰極側への二酸化炭素の流入を阻止するトラップを有するという構成を採用する。
【0009】
また、本発明においては、陽極が設けられる陽極側と陰極が設けられる陰極側とが陽イオン交換膜で仕切られている電解槽を用い、上記陽極側において塩化ナトリウム水溶液あるいは塩素酸ナトリウム水溶液を電解酸化する工程と、上記陰極側におけるpH値、水温及び液量に基づいて、上記電解酸化に伴い上記陽極側から上記陽イオン交換膜を通過して上記陰極側に移動したナトリウムイオンの移動量を計測する工程と、を有する過塩素酸塩の製造方法を採用する。
【発明の効果】
【0010】
本発明によれば、検出に手間と時間が掛からない陰極側のpH値と水温と液量とに基づいてナトリウムイオンの移動量を計測することで、従来よりもナトリウムイオンの移動量を容易にモニタリングすることができる。
ここで、pH値は、電解酸化に伴い陽イオン交換膜を通過して陽極側から陰極側へと移動するナトリウムイオンの移動量(水酸化ナトリウムの生成量)に依存する値である。また、水温は、両極に電圧を印加した際のジュール熱によって時間と共に変化する値である。そして、液量は、電解酸化に伴い陽イオン交換膜を通過して陽極側から陰極側へと移動するプロトン及びナトリウムイオンに付随する水によって時間と共に変化する値であり、単位時間当たりの液量の変化は電流密度に依存する。水温及び液量の変化は、ナトリウムイオンの移動量と同様に、陰極側のpH値に影響を及ぼす。
すなわち、本発明では、電解酸化に伴いナトリウムイオンの移動量に依存して変化するpH値、そしてそのpH値に影響を及ぼす水温及び液量の変化を考慮することで、ナトリウムイオンの移動量をモニタリングすることが可能となる。
【0011】
なお、陰極側のpH値に影響を及ぼす因子としては、水温及び液量の他に、大気中に存在する二酸化炭素のカソード液への溶解があり、本発明では、さらにこの二酸化炭素の溶解量を考慮することでモニタリングの精度を高めることが可能となる。
また、この二酸化炭素は、陰極で発生する水素ガスを大気中に排気する配管から流入する場合があり、この配管に二酸化炭素用のトラップを設け、二酸化炭素の溶解の影響を低減させることで、モニタリングの精度を高めることが可能となる。
【図面の簡単な説明】
【0012】
【図1】本発明の実施形態における過塩素酸アンモニウムの製造工程を示すフロー図である。
【図2】本発明の実施形態における過塩素酸アンモニウム製造装置の概略構成図である。
【図3】本発明の実施形態における一次電解槽の構成図である。
【図4】本発明の実施形態における二酸化炭素用トラップの構成図である。
【図5】本発明の実施形態における二次電解槽の構成図である。
【発明を実施するための形態】
【0013】
以下、本発明の実施形態の過塩素酸塩の製造装置および製造方法について図面を参照して説明する。なお、以下では、本発明を過塩素酸アンモニウムの製造装置および製造方法に適用した場合の例について説明する。
【0014】
図1は、本発明の実施形態における過塩素酸アンモニウムの製造工程を示すフロー図である。図に示すように、本発明の過塩素酸アンモニウムの製造工程は、大きく分けて、一次電解工程S1、二次電解工程S2、反応工程S3、晶析工程S4の4つの工程からなる。
一次電解工程S1は、塩化ナトリウム水溶液を電解酸化し、塩素酸を主成分とする水溶液を生成する工程である。次の二次電解工程S2は、一次電解工程S1により生成した塩素酸を主成分とする水溶液を電解酸化し、過塩素酸水溶液を生成する工程である。その次の反応工程S3は、二次電解工程S2により生成した過塩素酸水溶液にアンモニア水溶液を添加して中和反応により過塩素酸アンモニウムを合成する工程である。最後の晶析工程S4は、中和反応後の水溶液を真空環境下において蒸発させ、過塩素酸アンモニウムを晶析させる工程である。
【0015】
続いて、この製造工程を実施する過塩素酸アンモニウム製造装置について説明する。
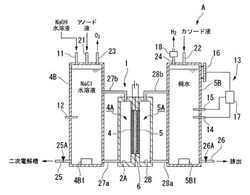
図2は、本発明の実施形態における過塩素酸アンモニウム製造装置(過塩素酸塩の製造装置)Aの概略構成図である。図中のg、l、sの符号は、それぞれ気体、液体、固体の状態であることを示す。実施形態の過塩素酸アンモニウム製造装置Aは、一次電解工程S1を行う一次電解槽1と、二次電解工程S2を行う二次電解槽2と、反応工程S3及び晶析工程S4を行う反応・蒸発槽3とを備えている。
【0016】
図3は、本発明の実施形態における一次電解槽1の構成図である。
一次電解槽1は、陽極4が設けられる陽極側4Aと、陰極5が設けられる陰極側5Aとを仕切るように設けられた陽イオン交換膜6を有する。一次電解槽1は、後述する電解酸化により、陽極側溶液(アノード液)が強酸性に、陰極側溶液(カソード液)が強アルカリ性になるため、一次電解槽1の本体には、耐化学薬品安定性に優れたもの、例えばテフロン(デュポン(株)、登録商標)や塩化ビニル、ガラスを使用することが望ましい。また、配管の継ぎ手についても、耐化学薬品安定性に優れたもの、例えばテフロン(デュポン(株)、登録商標)を用いることが望ましい。
【0017】
陽イオン交換膜6は、一次電解槽1内で陽極4と陰極5との間にギャップ無しで挟みこまれたゼロギャップ型の電解セルを構成する。この陽イオン交換膜6は、陽イオンが通過でき、且つ、陰イオンが通過できないという特性を有する膜であり、本実施形態では、陽イオン交換膜6にナフィオン424(Nafion、デュポン(株)、登録商標)が用いられている。なお、陽イオン交換膜としては、苛性ソーダ製造に広く用いられているAciplex(旭化成(株)、登録商標)やFlemion(旭硝子(株)、登録商標)を用いても良い。
【0018】
陽極4は、陽極側4Aにおける塩素酸イオンの電解合成反応の促進を図るため触媒を被覆したエキスパンドメタルからなる。本実施形態の陽極4は、基体であるチタンエキスパンドメタルの表面を、酸素ガスの発生を抑える効果のある、焼成法により酸化イリジウム及び白金からなる触媒層で被覆した電極、あるいは、焼成法により酸化イリジウム及び酸化ルテニウムからなる触媒層で被覆した電極、あるいは、焼成法により酸化イリジウム及び酸化ルテニウム及び白金からなる触媒層で被覆した電極、あるいは、焼成法により酸化タンタル及び白金からなる触媒層で被覆した電極から構成される。
一方、この陽極4と対となる陰極5は、基体であるチタンエキスパンドメタルの表面を電解メッキにより白金の触媒層で被覆した電極、または、ニッケルエキスパンドメタルからなる電極から構成される。
【0019】
陽極側4Aには、アノード液を貯溜するアノード液タンク4Bが設けられている(以下、電解槽1の陽極側4Aを陽極側電解槽2Aと称する)。アノード液タンク4Bにおけるアノード液の液面は、陽極側電解槽2A内の液面よりも高くなっている。アノード液タンク4Bと陽極側電解槽2Aとは、配管27a及び配管27bで接続されている。配管27aは、陽極側電解槽2Aの底部とアノード液タンク4Bの底部とを接続するものであり、配管27bは、陽極側電解槽2Aの天部とアノード液タンク4Bの側部とを接続するものである。なお、アノード液タンク4Bの底部には、アノード液の濃度を均一に保つための超音波振動子4B1を設ける。
【0020】
一方、陰極側5Aには、カソード液を貯溜するカソード液タンク5Bが設けられる(以下、電解槽1の陰極側5Aを陰極側電解槽2Bと称する)。カソード液タンク5Bにおけるカソード液の液面は、陰極側電解槽2B内の液面よりも高くなっている。カソード液タンク5Bと陰極側電解槽2Bとは、配管28a及び配管28bで接続されている。配管28aは、陰極側電解槽2Bの底部とカソード液タンク5Bの底部とを接続するものであり、配管28bは、陰極側電解槽2Bの天部とカソード液タンク5Bの側部とを接続するものである。なお、カソード液タンク5Bの底部には、カソード液の濃度を均一に保つための超音波振動子5B1を設ける。
【0021】
アノード液タンク4Bの天部にはアノード液導入配管21が接続されており、塩化ナトリウム水溶液がアノード液導入配管21を介して導入され、陽極側4A(陽極側電解槽2A、アノード液タンク4Bを含む)を満たす。また、アノード液タンク4Bの天部には、電解酸化時のアノード液のpH値を調節するpH調節剤として水酸化ナトリウム水溶液を導入するpH調節剤導入配管11が接続されている。また、アノード液タンク4Bには、アノード液のpH値を計測するpH計12が設けられる。
【0022】
一方、カソード液タンク5Bの天部にはカソード液導入配管22が接続されており、純水がカソード液導入配管22を介して導入され、陰極側5A(陰極側電解槽2B、カソード液タンク5Bを含む)を満たす。また、カソード液タンク5Bには、カソード液のpH値を計測するpH計14と、カソード液の水温を計測する水温計15と、カソード液タンク5Bの液面高さに基づいてカソード液の液量を計測する液面計16とが設けられる。
【0023】
一次電解槽1の内部で各液にそれぞれ浸された陽極4及び陰極5の両極に電圧を印加すると、次のような反応が進行する。
陽極側4Aにおいては、塩化ナトリウム水溶液が電解酸化され、下記の反応式(1)、反応式(2)に示す反応が生じる。
2Cl− → Cl2+2e− …(1)
2H2O → O2+4H++4e− …(2)
ここで発生した塩素ガスにより、下記の反応式(3)、反応式(4)に示す平衡反応が生じる。この平衡反応は、水溶液のpH値によりその形態が変化する。
Cl2+H2O ⇔ H++Cl−+HClO …(3)
HClO ⇔ H++ClO− …(4)
【0024】
この反応で生じた次亜塩素酸を電解酸化すると、下記の反応式(5)、反応式(6)に示す反応により亜塩素酸が生成される。
ClO−+H2O → ClO2−+2H++2e− …(5)
HClO+H2O → HClO2−+2H++2e− …(6)
生成された亜塩素酸を更に電解酸化すると、下記の反応式(7)、反応式(8)に示す反応により塩素酸が生成される。
ClO2−+H2O → ClO3−+2H++2e− …(7)
HClO2+H2O → HClO3−+2H++2e− …(8)
【0025】
上記反応式(1)〜反応式(8)に示すように、一次電解工程では、塩素酸と副生成物として酸素ガスが生成される。
ここで、陽極側4Aの液中に含まれるナトリウムイオンは、両極間の電位差によって陽イオン交換膜6を通過して陽極側4Aから陰極側5Aに移動する。一方、次亜塩素酸イオン、亜塩素酸イオンは陽イオン交換膜6を通過できず、水溶液‐陽極4‐陽イオン交換膜6で構成される三界面での反応により塩素酸イオンとなる。
【0026】
なお、陽極側電解槽2Aで生じた酸素ガス(気泡)は、配管27bを介してアノード液タンク4Bに導かれる。アノード液タンク4Bの天部には酸素ガス配管23が設けられており、酸素ガス配管23を介して酸素ガスが外部に順次排気される。
また、陽極側電解槽2Aの底部からは、液面の差(水圧差)により配管27aを介してアノード液タンク4Bからアノード液が順次導入されるため、電解酸化されたアノード液は、陽極側電解槽2Aから、配管27bを介してアノード液タンク4B側に押し出される。従って、アノード液はポンプ等の駆動機構によらずに陽極側電解槽2Aとアノード液タンク4Bとの間で循環するため、より多くのアノード液が陽極側電解槽2Aで電解酸化される。
【0027】
陰極側5Aにおいては、下記の反応式(9)、反応式(10)に示す反応が生じ、水素ガスと水酸化ナトリウムとが生成される。
2H++2e− → H2 …(9)
2Na++2H2O+2e− → 2NaOH+H2 …(10)
なお、陰極側電解槽2Bで生じた水素ガス(気泡)は、配管28bを介してカソード液タンク5Bに導かれる。カソード液タンク5Bの天部には水素ガス配管(水素ガス排気間)24が設けられており、水素ガス配管24を介して水素ガスが外部に順次排気される。また、陽極側4Aにおいてアノード液が循環することと同様に、陰極側5Aにおいても、カソード液の循環作用が得られる。
本実施形態の水素ガス配管24には、外部から陰極側5Aへ、その大気中に含まれる二酸化炭素の浸入を阻止するトラップ18が設けられている。トラップ18は、図4に示すように、水素ガス配管24の先端開口部を水Wに浸漬させ、該開口部からの二酸化炭素の浸入を阻止する構成となっている。なお、トラップ18は、例えば水素ガス配管24をU字管状にして、そのU字状になった部位に二酸化炭素を吸着する水を滞留させることで構成されてもよい。
【0028】
計測装置13は、上記電解酸化に伴うナトリウムイオンの移動量をモニタリングするものであり、pH計14、水温計15、液面計16、演算装置17を用い、陰極側5Aにおいて上記電解酸化に伴い変化するpH値と水温と液量とに基づいて、ナトリウムイオンの陽極側4Aから陰極側5Aへの移動量を演算し、その移動量をリアルタイム計測する。演算装置17は、pH計14、水温計15、液面計16と電気的に接続されており、各々からの計測結果のデータが入力され、該データに基づいてナトリウムイオンの移動量を演算する演算プログラムを有する。
以下、この演算プログラムについて、詳しく説明する。
【0029】
ナトリウムイオンの移動量を演算する際に必要となる測定値は、陰極側5AのpH値、水温、液量である。
ここで、pH値は、反応式(10)に示したように、電解酸化に伴い陽イオン交換膜6を通過して陽極側4Aから陰極側5Aへと移動するナトリウムイオンの移動量(水酸化ナトリウムの生成量)に依存する値である。また、水温は、両極に電圧を印加した際のジュール熱によって時間と共に変化する値である。そして、液量は、電解酸化に伴い陽イオン交換膜6を通過して陽極側4Aから陰極側5Aへと移動するプロトン及びナトリウムイオンに付随する水によって時間と共に変化する値であり、単位時間当たりの液量の変化は電流密度に依存する。水温及び液量の変化は、ナトリウムイオンの移動量と同様に、陰極側5AのpH値に影響を及ぼす。
このため、本演算手法では、電解酸化に伴いナトリウムイオンの移動量に依存して変化するpH値、そしてそのpH値に影響を及ぼす水温及び液量の変化を考慮することで、ナトリウムイオンの移動量を算出する。
【0030】
両極に電圧を印加して電解酸化を開始してからt時間後、陽極側4Aから陰極側5Aへと移動したナトリウムイオンの移動量(mol)は、電解前に陰極側5Aに存在するナトリウムイオンの量との差分で、下記の数式(a)で表すことができる。ここでの添え字tは、電解酸化開始からt時間後、0は電解酸化開始前を表す。
【0031】
【数1】

【0032】
水酸化ナトリウムの電離度は1であるため、カソード液タンク5Bにおける水酸化イオンの増加量(mol)は、ナトリウムイオンの移動量と等しいとみなせることから、下記の数式(b)で表すことができる。
【0033】
【数2】

【0034】
電解酸化前の水のイオン積X0は、水酸化イオンのモル濃度[OH−]と水素イオンのモル濃度[H+]との積であるから、電解酸化前の水酸化イオンのモル量を(OH−)とし、電解酸化前の水素イオンのモル量を(H+)とし、電解酸化前の陰極側5Aのカソード液の液量をV0とすると、下記の数式(c)で表すことができる。
【0035】
【数3】

【0036】
イオン積Xは温度依存性の変数であり、標準ギブス自由エネルギーとの関係式を変形して得られる標準エンタルピーΔHとの関係から、下記の数式(d)及び(e)で表すことができる。ここで、Tはカソード液の水温、Rはモル気体定数(8.314J/mol・K)、ΔHは水の電離平衡のモル標準エンタルピー(56500J/mol)を表す。
【0037】
【数4】

【0038】
電解酸化を開始してからt時間後のイオン積Xtは、電解開始からt時間後のカソード液の液量について陽極側4Aから陽イオンに付随して陰極側5Aに流入する水を考慮し、その増加量をvとすると、下記の数式(f)で表すことができる。
【0039】
【数5】

【0040】
ここで、数式(c)を水酸化イオンのモル量を示す式に変形すると、下記の数式(g)で表すことができる。
【0041】
【数6】

【0042】
また、数式(g)を、電解酸化を開始してからt時間後の水酸化イオンのモル量を示す式に変形すると、下記の数式(h)で表すことができる。
【0043】
【数7】

【0044】
数式(g)及び数式(h)を数式(b)に代入すると、ナトリウムイオンの移動量は結論として、下記の数式(i)で表すことができる。
【0045】
【数8】

【0046】
数式(i)によれば、電解酸化を開始してからt時間後のpH値と水温と液量とに基づいて、そのt時間後のナトリウムイオンの移動量が算出できるため、ナトリウムイオン量のリアルタイム計測が可能となる。
【0047】
なお、大気中の二酸化炭素のカソード液への溶け込みによって、反応式(11)に示す反応が生じる。
CO2+H2O → H++CO3− …(11)
本実施形態では水素ガス配管24に二酸化炭素用のトラップ18を設置するため、ナトリウムイオンの移動量を算出するにあたり、大気中の二酸化炭素がカソード液へ溶解することによるpH値の低下を考慮する必要性は殆どない。しかし、トラップ18を設けない場合においても、本演算式を適用可能とするため、二酸化炭素の溶解によるpH値の低下を考慮すると、その補正式としては下記のように表すことができる。
【0048】
二酸化炭素の溶け込みによる電解酸化前の水素イオンの濃度をy0とし、電解酸化を開始してからt時間後の水素イオン濃度をytとして数式(i)を補正すると、下記の数式(j)〜数式(l)で表すことができる。
【0049】
【数9】

【0050】
水素イオン濃度y0及び水素イオン濃度ytは、二酸化炭素の分圧が一定であれば温度に依存した既知の値、すなわち、二酸化炭素の溶解度S、大気中の二酸化炭素の密度Z、数式(i)における酸解離定数Ka、そして分圧pとする下記の数式(m)で表すことができる。従って、二酸化炭素の溶解によるpH値の低下を考慮した補正式は、数式(j)に、数式(k)〜数式(m)を代入することで表すことができる。
【0051】
【数10】

【0052】
計測装置13は、上記演算プログラムに基づき電解酸化に伴うナトリウムイオンの移動量をモニタリングする。そして、その移動量から陽極側4Aのナトリウムイオン濃度を把握する。
一次電解槽1での電解酸化により、十分な量の塩素酸が生成されたアノード液(塩素酸ナトリウムを含む)は、弁25Aを閉状態から開状態にしたアノード液輸送配管25を介してアノード液タンク4Bから二次電解槽2に輸送される。一方、カソード液は、弁26Aを閉状態から開状態にしたカソード液輸送配管26を介してカソード液タンク5Bから外部に輸送される。
【0053】
図5は、本発明の実施形態における二次電解槽2の構成図である。
二次電解槽2は、一次電解槽1で生成した塩素酸を主成分とするアノード液を電解酸化して過塩素酸を生成する。
なお、以下説明する二次電解槽2の構成は、重複説明を避けるため、上述の一次電解槽1と同一又は同等の構成部分については同一の符号を付し、その説明を簡略若しくは省略する。
【0054】
二次電解槽2において、陽イオン交換膜6は陽極4´と陰極5´との間にギャップ無しで挟みこまれたゼロギャップ型の電解セルを構成する。
陽極4´は、陽極側4Aにおける過塩素酸イオンの電解合成反応の促進を図るため触媒を被覆したエキスパンドメタルからなる。この陽極4´は、基体であるチタンエキスパンドメタルの表面を、電解メッキにより白金の触媒層で被覆した電極から構成される。
一方、この陽極4´と対となる陰極5´は、触媒を被覆したエキスパンドメタルからなる。この陰極5´は、基体であるチタンエキスパンドメタルの表面を、電解メッキにより白金の触媒層で被覆した電極、または、SUS316エキスパンドメタルからなる電極、または、ニッケルエキスパンドメタルからなる電極から構成される。
【0055】
二次電解槽2のアノード液タンク4Bの天部にはアノード液導入配管として、一次電解槽1のアノード液輸送配管25が接続されており、一次電解工程を経たアノード液がアノード液輸送配管25を介して導入され、陽極側4A(陽極側電解槽2A、アノード液タンク4Bを含む)を満たす。一方、カソード液タンク5Bの天部にはカソード液導入配管22が接続されており、純水がカソード液導入配管22を介して導入され、陰極側5A(陰極側電解槽2B、カソード液タンク5Bを含む)を満たす。二次電解槽2の内部で各液にそれぞれ浸された陽極4´及び陰極5´の両極に電圧を印加すると、次のような反応が進行する。
【0056】
陽極側4Aにおいては、一次電解工程を経たアノード液が電解酸化され、下記の反応式(12)、反応式(13)に示すように、過塩素酸イオンと副生成物として酸素ガスが生成される。なお、微量ではあるが、下記の反応式(14)に示すように、オゾンガスも副生成物として生成される。
ClO3−+H2O → ClO4−+2H++2e− …(12)
2H2O → O2+4H++4e− …(13)
3H2O → O3+6H++6e− …(14)
ここで、陽極側4Aのアノード液中に含まれるナトリウムイオンは、両極間の電位差によって陽イオン交換膜6を通過して陽極側4Aから陰極側5Aに移動する。一方、塩素酸イオンは陽イオン交換膜6を通過できず、水溶液‐陽極4´‐陽イオン交換膜6で構成される三界面で反応式(12)に示す反応により過塩素酸イオンとなる。
【0057】
陰極側5Aにおいては、下記の反応式(15)、反応式(16)に示す反応が生じ、水素ガスと水酸化ナトリウムとが生成される。
2H++2e− → H2 …(15)
2Na++2H2O+2e− → 2NaOH+H2 …(16)
【0058】
二次電解槽2の計測装置13は、前述した演算プログラムに基づき、電解酸化に伴うナトリウムイオンの移動量をモニタリングする。そして、その移動量から陽極側4Aのナトリウムイオン濃度を把握する。
十分な量の過塩素酸イオンが生成されたアノード液は、弁25Aを閉状態から開状態にしたアノード液輸送配管25´を介してアノード液タンク4Bから反応・蒸発槽3に輸送される。一方、カソード液は、弁26Aを閉状態から開状態にしたカソード液輸送配管26を介してカソード液タンク5Bから外部に輸送される。
【0059】
反応・蒸発槽3では、電解酸化後のアノード液中にアンモニア水溶液を添加して過塩素酸アンモニウムを合成する工程と、合成後のアノード液を減圧環境下で蒸発させて過塩素酸アンモニウムを晶析させる工程とを行う。なお、ここでアンモニア水溶液の代わりにアンモニアガスをバブリングして添加してもよい。
反応・蒸発槽3には、アンモニア供給配管31が接続されており、電解酸化後のアノード液中にアンモニア水溶液を供給する構成となっている。電解酸化後のアノード液中にアンモニア水溶液を添加すると、下記の反応式(17)に示す中和反応が生じ、過塩素酸アンモニウムが合成される。
HClO4+NH4OH → NH4ClO4+H2O …(17)
【0060】
次に、反応・蒸発槽3において、合成後のアノード液を真空環境下で蒸発させて過塩素酸アンモニウムを結晶として取り出す。反応式(17)に示すように、過塩素酸アンモニウムと共に得られる副生成物は水であるため、水を蒸発させるだけで高純度の過塩素酸アンモニウムの結晶が得られる。
【0061】
以上のように、本実施形態によれば、陽極4が設けられる陽極側4Aと陰極5が設けられる陰極側5Aとが陽イオン交換膜6で仕切られ、陽極側4Aにおいて塩化ナトリウム水溶液を電解酸化する一次電解槽1及び二次電解槽2と、陰極側5Aにおいて上記電解酸化に伴い変化するpH値と水温と液量とに基づいて、上記電解酸化に伴い陽極側4Aから陽イオン交換膜6を通過して陰極側5Aに移動したナトリウムイオンの移動量を計測する計測装置13と、を有する過塩素酸アンモニウム製造装置Aを採用することにより、検出に手間と時間が掛からない陰極側5AのpH値と水温と液量とに基づいてナトリウムイオンの移動量を算出することで、従来よりもナトリウムイオンの移動量を容易にモニタリングすることができる。
【0062】
また、本実施形態では、電解酸化に伴いナトリウムイオンの移動量に依存して変化するpH値、そしてそのpH値に影響を及ぼす水温及び液量の変化を考慮することで、ナトリウムイオンの移動量を精度良くモニタリングすることが可能となる。
なお、陰極側のpH値に影響を及ぼす因子としては、水温及び液量の他に、大気中に存在する二酸化炭素のカソード液への溶解があり、本実施形態では、この二酸化炭素の溶解量を考慮した補正式を用いることでモニタリングの精度をさらに高めることが可能となる。
【0063】
以上、図面を参照しながら本発明の好適な実施形態について説明したが、本発明は上記実施形態に限定されるものではない。上述した実施形態において示した各構成部材の諸形状や組み合わせ等は一例であって、本発明の主旨から逸脱しない範囲において設計要求等に基づき種々変更可能である。
【0064】
例えば、上記実施形態では、電解槽の陽極側において電解酸化する原料として、塩化ナトリウム水溶液を用いて電解酸化する形態を例示して説明したが、塩素酸ナトリウム水溶液を用いて電解酸化する形態であっても良い。
【0065】
また、例えば、本発明は、上述した過塩素酸アンモニウムの製造装置への適用に限定されるものではなく、過塩素酸リチウムや過塩素酸カリウム等のアルカリ金属過塩素酸塩の製造装置、過塩素酸カルシウム等のアルカリ土類金属過塩素酸塩の製造装置、また、過塩素酸銀の製造装置等にも適用可能である。
【符号の説明】
【0066】
A…過塩素酸アンモニウム製造装置(過塩素酸塩の製造装置)、S1…一次電解工程、…、S2…二次電解工程、S3…反応工程(合成工程)、S4…晶析工程、1…一次電解槽、2…二次電解槽、3…反応・蒸発槽、4…陽極、4´…陽極、4A…陽極側、5…陰極、5´…陰極、5A…陰極側、6…陽イオン交換膜、13…計測装置、14…pH計、15…水温計、16…液面計、17…演算装置、18…トラップ、24…水素ガス配管(水素ガス排気管)
【技術分野】
【0001】
本発明は、過塩素酸塩の製造装置および製造方法に関するものである。
【背景技術】
【0002】
過塩素酸塩は、固体燃料ロケットの推進薬の酸化剤(過塩素酸アンモニウム)を始め、リチウム電池の支持電解質(過塩素酸リチウム)やエアバックの着火剤(過塩素酸カリウム)など、様々な用途に利用されている。
ここで、過塩素酸塩の製造方法としては、非特許文献1に詳しく記述されているように、工業的には塩化ナトリウム水溶液の電解酸化により合成した塩素酸ナトリウム水溶液を更に電解酸化して過塩素酸ナトリウムを合成した後、所定の処理を経て製造される。そこで、これまでの従来技術では、例えば特許文献1や特許文献2に記載に記載されているように、過塩素酸ナトリウム(NaClO4)水溶液を効率的に電解合成するための方法に焦点が当てられてきた。
【先行技術文献】
【特許文献】
【0003】
【特許文献1】特開平3−199387号公報
【特許文献2】特開2007−197740号公報
【0004】
【非特許文献1】J. C. Schumacher(ed.), Perchlorates, A.C.S.Monograph No.146, Reinhold, New York, 1960
【発明の概要】
【発明が解決しようとする課題】
【0005】
しかし、過塩素酸ナトリウム以外の過塩素酸塩を製造するにあたり、必ずしも過塩素酸ナトリウムを経由する必要は無い。そこで、本願発明者らは、過塩素酸ナトリウムの製造を経由しないで製造工程を簡略化した過塩素酸塩の製造方法を考案した。この製造方法では、陽極が設けられる陽極側と陰極が設けられる陰極側とを陽イオン交換膜で仕切った電解槽を用い、塩化ナトリウム水溶液あるいは塩素酸ナトリウム水溶液を陽極側で電解酸化して過塩素酸水溶液を生成すると共に、最終生成物の不純物となる陽極側に存在するナトリウムイオンを陽極側から陽イオン交換膜を介して陰極側に移動させて除去する。そして、この電解酸化で生成した過塩素酸水溶液に所定のアルカリ性水溶液を加えて、中和反応により過塩素酸塩を合成する。
ところで、本製造方法では、最終生成物である過塩素酸塩の濃度を制御するにあたり、アノード液中に存在するナトリウムイオン濃度、すなわち上記電解酸化に伴って陽極側から陰極側へ移動するナトリウムイオンの移動量のモニタリングが欠かすことができない。通常、ナトリウムイオン濃度を計測するには液体イオンクロマトグラフィーやICP(Inductive Coupled Plasma)発光分析装置が用いられている。しかし、該分析装置は、分析精度は高いが、分析に時間と手間がかかるため、ナトリウムイオンの移動量をモニタリングする手段としては適していない。
【0006】
本発明は、上記課題に鑑みてなされたものであり、ナトリウムイオンの移動量を容易にモニタリングする過塩素酸塩の製造装置及び製造方法の提供を目的とする。
【課題を解決するための手段】
【0007】
上記の課題を解決するために、本発明は、陽極が設けられる陽極側と陰極が設けられる陰極側とが陽イオン交換膜で仕切られ、上記陽極側において塩化ナトリウム水溶液あるいは塩素酸ナトリウム水溶液を電解酸化する電解槽と、上記陰極側において上記電解酸化に伴い変化するpH値、水温及び液量に基づいて、上記電解酸化に伴い上記陽極側から上記陽イオン交換膜を通過して上記陰極側に移動したナトリウムイオンの移動量を計測する計測装置と、を有する過塩素酸塩の製造装置を採用する。
【0008】
さらに、本発明において、上記計測装置は、大気中に含まれる二酸化炭素の上記陰極側への溶解量に基づいて、上記計測したナトリウムイオンの移動量を補正するという構成を採用する。
一方で、本発明において、上記陰極側には、上記電解酸化に伴い上記陰極で発生した水素ガスを大気中に排気する水素ガス排気管が設けられており、上記水素ガス排気管は、大気中から上記陰極側への二酸化炭素の流入を阻止するトラップを有するという構成を採用する。
【0009】
また、本発明においては、陽極が設けられる陽極側と陰極が設けられる陰極側とが陽イオン交換膜で仕切られている電解槽を用い、上記陽極側において塩化ナトリウム水溶液あるいは塩素酸ナトリウム水溶液を電解酸化する工程と、上記陰極側におけるpH値、水温及び液量に基づいて、上記電解酸化に伴い上記陽極側から上記陽イオン交換膜を通過して上記陰極側に移動したナトリウムイオンの移動量を計測する工程と、を有する過塩素酸塩の製造方法を採用する。
【発明の効果】
【0010】
本発明によれば、検出に手間と時間が掛からない陰極側のpH値と水温と液量とに基づいてナトリウムイオンの移動量を計測することで、従来よりもナトリウムイオンの移動量を容易にモニタリングすることができる。
ここで、pH値は、電解酸化に伴い陽イオン交換膜を通過して陽極側から陰極側へと移動するナトリウムイオンの移動量(水酸化ナトリウムの生成量)に依存する値である。また、水温は、両極に電圧を印加した際のジュール熱によって時間と共に変化する値である。そして、液量は、電解酸化に伴い陽イオン交換膜を通過して陽極側から陰極側へと移動するプロトン及びナトリウムイオンに付随する水によって時間と共に変化する値であり、単位時間当たりの液量の変化は電流密度に依存する。水温及び液量の変化は、ナトリウムイオンの移動量と同様に、陰極側のpH値に影響を及ぼす。
すなわち、本発明では、電解酸化に伴いナトリウムイオンの移動量に依存して変化するpH値、そしてそのpH値に影響を及ぼす水温及び液量の変化を考慮することで、ナトリウムイオンの移動量をモニタリングすることが可能となる。
【0011】
なお、陰極側のpH値に影響を及ぼす因子としては、水温及び液量の他に、大気中に存在する二酸化炭素のカソード液への溶解があり、本発明では、さらにこの二酸化炭素の溶解量を考慮することでモニタリングの精度を高めることが可能となる。
また、この二酸化炭素は、陰極で発生する水素ガスを大気中に排気する配管から流入する場合があり、この配管に二酸化炭素用のトラップを設け、二酸化炭素の溶解の影響を低減させることで、モニタリングの精度を高めることが可能となる。
【図面の簡単な説明】
【0012】
【図1】本発明の実施形態における過塩素酸アンモニウムの製造工程を示すフロー図である。
【図2】本発明の実施形態における過塩素酸アンモニウム製造装置の概略構成図である。
【図3】本発明の実施形態における一次電解槽の構成図である。
【図4】本発明の実施形態における二酸化炭素用トラップの構成図である。
【図5】本発明の実施形態における二次電解槽の構成図である。
【発明を実施するための形態】
【0013】
以下、本発明の実施形態の過塩素酸塩の製造装置および製造方法について図面を参照して説明する。なお、以下では、本発明を過塩素酸アンモニウムの製造装置および製造方法に適用した場合の例について説明する。
【0014】
図1は、本発明の実施形態における過塩素酸アンモニウムの製造工程を示すフロー図である。図に示すように、本発明の過塩素酸アンモニウムの製造工程は、大きく分けて、一次電解工程S1、二次電解工程S2、反応工程S3、晶析工程S4の4つの工程からなる。
一次電解工程S1は、塩化ナトリウム水溶液を電解酸化し、塩素酸を主成分とする水溶液を生成する工程である。次の二次電解工程S2は、一次電解工程S1により生成した塩素酸を主成分とする水溶液を電解酸化し、過塩素酸水溶液を生成する工程である。その次の反応工程S3は、二次電解工程S2により生成した過塩素酸水溶液にアンモニア水溶液を添加して中和反応により過塩素酸アンモニウムを合成する工程である。最後の晶析工程S4は、中和反応後の水溶液を真空環境下において蒸発させ、過塩素酸アンモニウムを晶析させる工程である。
【0015】
続いて、この製造工程を実施する過塩素酸アンモニウム製造装置について説明する。
図2は、本発明の実施形態における過塩素酸アンモニウム製造装置(過塩素酸塩の製造装置)Aの概略構成図である。図中のg、l、sの符号は、それぞれ気体、液体、固体の状態であることを示す。実施形態の過塩素酸アンモニウム製造装置Aは、一次電解工程S1を行う一次電解槽1と、二次電解工程S2を行う二次電解槽2と、反応工程S3及び晶析工程S4を行う反応・蒸発槽3とを備えている。
【0016】
図3は、本発明の実施形態における一次電解槽1の構成図である。
一次電解槽1は、陽極4が設けられる陽極側4Aと、陰極5が設けられる陰極側5Aとを仕切るように設けられた陽イオン交換膜6を有する。一次電解槽1は、後述する電解酸化により、陽極側溶液(アノード液)が強酸性に、陰極側溶液(カソード液)が強アルカリ性になるため、一次電解槽1の本体には、耐化学薬品安定性に優れたもの、例えばテフロン(デュポン(株)、登録商標)や塩化ビニル、ガラスを使用することが望ましい。また、配管の継ぎ手についても、耐化学薬品安定性に優れたもの、例えばテフロン(デュポン(株)、登録商標)を用いることが望ましい。
【0017】
陽イオン交換膜6は、一次電解槽1内で陽極4と陰極5との間にギャップ無しで挟みこまれたゼロギャップ型の電解セルを構成する。この陽イオン交換膜6は、陽イオンが通過でき、且つ、陰イオンが通過できないという特性を有する膜であり、本実施形態では、陽イオン交換膜6にナフィオン424(Nafion、デュポン(株)、登録商標)が用いられている。なお、陽イオン交換膜としては、苛性ソーダ製造に広く用いられているAciplex(旭化成(株)、登録商標)やFlemion(旭硝子(株)、登録商標)を用いても良い。
【0018】
陽極4は、陽極側4Aにおける塩素酸イオンの電解合成反応の促進を図るため触媒を被覆したエキスパンドメタルからなる。本実施形態の陽極4は、基体であるチタンエキスパンドメタルの表面を、酸素ガスの発生を抑える効果のある、焼成法により酸化イリジウム及び白金からなる触媒層で被覆した電極、あるいは、焼成法により酸化イリジウム及び酸化ルテニウムからなる触媒層で被覆した電極、あるいは、焼成法により酸化イリジウム及び酸化ルテニウム及び白金からなる触媒層で被覆した電極、あるいは、焼成法により酸化タンタル及び白金からなる触媒層で被覆した電極から構成される。
一方、この陽極4と対となる陰極5は、基体であるチタンエキスパンドメタルの表面を電解メッキにより白金の触媒層で被覆した電極、または、ニッケルエキスパンドメタルからなる電極から構成される。
【0019】
陽極側4Aには、アノード液を貯溜するアノード液タンク4Bが設けられている(以下、電解槽1の陽極側4Aを陽極側電解槽2Aと称する)。アノード液タンク4Bにおけるアノード液の液面は、陽極側電解槽2A内の液面よりも高くなっている。アノード液タンク4Bと陽極側電解槽2Aとは、配管27a及び配管27bで接続されている。配管27aは、陽極側電解槽2Aの底部とアノード液タンク4Bの底部とを接続するものであり、配管27bは、陽極側電解槽2Aの天部とアノード液タンク4Bの側部とを接続するものである。なお、アノード液タンク4Bの底部には、アノード液の濃度を均一に保つための超音波振動子4B1を設ける。
【0020】
一方、陰極側5Aには、カソード液を貯溜するカソード液タンク5Bが設けられる(以下、電解槽1の陰極側5Aを陰極側電解槽2Bと称する)。カソード液タンク5Bにおけるカソード液の液面は、陰極側電解槽2B内の液面よりも高くなっている。カソード液タンク5Bと陰極側電解槽2Bとは、配管28a及び配管28bで接続されている。配管28aは、陰極側電解槽2Bの底部とカソード液タンク5Bの底部とを接続するものであり、配管28bは、陰極側電解槽2Bの天部とカソード液タンク5Bの側部とを接続するものである。なお、カソード液タンク5Bの底部には、カソード液の濃度を均一に保つための超音波振動子5B1を設ける。
【0021】
アノード液タンク4Bの天部にはアノード液導入配管21が接続されており、塩化ナトリウム水溶液がアノード液導入配管21を介して導入され、陽極側4A(陽極側電解槽2A、アノード液タンク4Bを含む)を満たす。また、アノード液タンク4Bの天部には、電解酸化時のアノード液のpH値を調節するpH調節剤として水酸化ナトリウム水溶液を導入するpH調節剤導入配管11が接続されている。また、アノード液タンク4Bには、アノード液のpH値を計測するpH計12が設けられる。
【0022】
一方、カソード液タンク5Bの天部にはカソード液導入配管22が接続されており、純水がカソード液導入配管22を介して導入され、陰極側5A(陰極側電解槽2B、カソード液タンク5Bを含む)を満たす。また、カソード液タンク5Bには、カソード液のpH値を計測するpH計14と、カソード液の水温を計測する水温計15と、カソード液タンク5Bの液面高さに基づいてカソード液の液量を計測する液面計16とが設けられる。
【0023】
一次電解槽1の内部で各液にそれぞれ浸された陽極4及び陰極5の両極に電圧を印加すると、次のような反応が進行する。
陽極側4Aにおいては、塩化ナトリウム水溶液が電解酸化され、下記の反応式(1)、反応式(2)に示す反応が生じる。
2Cl− → Cl2+2e− …(1)
2H2O → O2+4H++4e− …(2)
ここで発生した塩素ガスにより、下記の反応式(3)、反応式(4)に示す平衡反応が生じる。この平衡反応は、水溶液のpH値によりその形態が変化する。
Cl2+H2O ⇔ H++Cl−+HClO …(3)
HClO ⇔ H++ClO− …(4)
【0024】
この反応で生じた次亜塩素酸を電解酸化すると、下記の反応式(5)、反応式(6)に示す反応により亜塩素酸が生成される。
ClO−+H2O → ClO2−+2H++2e− …(5)
HClO+H2O → HClO2−+2H++2e− …(6)
生成された亜塩素酸を更に電解酸化すると、下記の反応式(7)、反応式(8)に示す反応により塩素酸が生成される。
ClO2−+H2O → ClO3−+2H++2e− …(7)
HClO2+H2O → HClO3−+2H++2e− …(8)
【0025】
上記反応式(1)〜反応式(8)に示すように、一次電解工程では、塩素酸と副生成物として酸素ガスが生成される。
ここで、陽極側4Aの液中に含まれるナトリウムイオンは、両極間の電位差によって陽イオン交換膜6を通過して陽極側4Aから陰極側5Aに移動する。一方、次亜塩素酸イオン、亜塩素酸イオンは陽イオン交換膜6を通過できず、水溶液‐陽極4‐陽イオン交換膜6で構成される三界面での反応により塩素酸イオンとなる。
【0026】
なお、陽極側電解槽2Aで生じた酸素ガス(気泡)は、配管27bを介してアノード液タンク4Bに導かれる。アノード液タンク4Bの天部には酸素ガス配管23が設けられており、酸素ガス配管23を介して酸素ガスが外部に順次排気される。
また、陽極側電解槽2Aの底部からは、液面の差(水圧差)により配管27aを介してアノード液タンク4Bからアノード液が順次導入されるため、電解酸化されたアノード液は、陽極側電解槽2Aから、配管27bを介してアノード液タンク4B側に押し出される。従って、アノード液はポンプ等の駆動機構によらずに陽極側電解槽2Aとアノード液タンク4Bとの間で循環するため、より多くのアノード液が陽極側電解槽2Aで電解酸化される。
【0027】
陰極側5Aにおいては、下記の反応式(9)、反応式(10)に示す反応が生じ、水素ガスと水酸化ナトリウムとが生成される。
2H++2e− → H2 …(9)
2Na++2H2O+2e− → 2NaOH+H2 …(10)
なお、陰極側電解槽2Bで生じた水素ガス(気泡)は、配管28bを介してカソード液タンク5Bに導かれる。カソード液タンク5Bの天部には水素ガス配管(水素ガス排気間)24が設けられており、水素ガス配管24を介して水素ガスが外部に順次排気される。また、陽極側4Aにおいてアノード液が循環することと同様に、陰極側5Aにおいても、カソード液の循環作用が得られる。
本実施形態の水素ガス配管24には、外部から陰極側5Aへ、その大気中に含まれる二酸化炭素の浸入を阻止するトラップ18が設けられている。トラップ18は、図4に示すように、水素ガス配管24の先端開口部を水Wに浸漬させ、該開口部からの二酸化炭素の浸入を阻止する構成となっている。なお、トラップ18は、例えば水素ガス配管24をU字管状にして、そのU字状になった部位に二酸化炭素を吸着する水を滞留させることで構成されてもよい。
【0028】
計測装置13は、上記電解酸化に伴うナトリウムイオンの移動量をモニタリングするものであり、pH計14、水温計15、液面計16、演算装置17を用い、陰極側5Aにおいて上記電解酸化に伴い変化するpH値と水温と液量とに基づいて、ナトリウムイオンの陽極側4Aから陰極側5Aへの移動量を演算し、その移動量をリアルタイム計測する。演算装置17は、pH計14、水温計15、液面計16と電気的に接続されており、各々からの計測結果のデータが入力され、該データに基づいてナトリウムイオンの移動量を演算する演算プログラムを有する。
以下、この演算プログラムについて、詳しく説明する。
【0029】
ナトリウムイオンの移動量を演算する際に必要となる測定値は、陰極側5AのpH値、水温、液量である。
ここで、pH値は、反応式(10)に示したように、電解酸化に伴い陽イオン交換膜6を通過して陽極側4Aから陰極側5Aへと移動するナトリウムイオンの移動量(水酸化ナトリウムの生成量)に依存する値である。また、水温は、両極に電圧を印加した際のジュール熱によって時間と共に変化する値である。そして、液量は、電解酸化に伴い陽イオン交換膜6を通過して陽極側4Aから陰極側5Aへと移動するプロトン及びナトリウムイオンに付随する水によって時間と共に変化する値であり、単位時間当たりの液量の変化は電流密度に依存する。水温及び液量の変化は、ナトリウムイオンの移動量と同様に、陰極側5AのpH値に影響を及ぼす。
このため、本演算手法では、電解酸化に伴いナトリウムイオンの移動量に依存して変化するpH値、そしてそのpH値に影響を及ぼす水温及び液量の変化を考慮することで、ナトリウムイオンの移動量を算出する。
【0030】
両極に電圧を印加して電解酸化を開始してからt時間後、陽極側4Aから陰極側5Aへと移動したナトリウムイオンの移動量(mol)は、電解前に陰極側5Aに存在するナトリウムイオンの量との差分で、下記の数式(a)で表すことができる。ここでの添え字tは、電解酸化開始からt時間後、0は電解酸化開始前を表す。
【0031】
【数1】

【0032】
水酸化ナトリウムの電離度は1であるため、カソード液タンク5Bにおける水酸化イオンの増加量(mol)は、ナトリウムイオンの移動量と等しいとみなせることから、下記の数式(b)で表すことができる。
【0033】
【数2】

【0034】
電解酸化前の水のイオン積X0は、水酸化イオンのモル濃度[OH−]と水素イオンのモル濃度[H+]との積であるから、電解酸化前の水酸化イオンのモル量を(OH−)とし、電解酸化前の水素イオンのモル量を(H+)とし、電解酸化前の陰極側5Aのカソード液の液量をV0とすると、下記の数式(c)で表すことができる。
【0035】
【数3】

【0036】
イオン積Xは温度依存性の変数であり、標準ギブス自由エネルギーとの関係式を変形して得られる標準エンタルピーΔHとの関係から、下記の数式(d)及び(e)で表すことができる。ここで、Tはカソード液の水温、Rはモル気体定数(8.314J/mol・K)、ΔHは水の電離平衡のモル標準エンタルピー(56500J/mol)を表す。
【0037】
【数4】

【0038】
電解酸化を開始してからt時間後のイオン積Xtは、電解開始からt時間後のカソード液の液量について陽極側4Aから陽イオンに付随して陰極側5Aに流入する水を考慮し、その増加量をvとすると、下記の数式(f)で表すことができる。
【0039】
【数5】

【0040】
ここで、数式(c)を水酸化イオンのモル量を示す式に変形すると、下記の数式(g)で表すことができる。
【0041】
【数6】

【0042】
また、数式(g)を、電解酸化を開始してからt時間後の水酸化イオンのモル量を示す式に変形すると、下記の数式(h)で表すことができる。
【0043】
【数7】

【0044】
数式(g)及び数式(h)を数式(b)に代入すると、ナトリウムイオンの移動量は結論として、下記の数式(i)で表すことができる。
【0045】
【数8】

【0046】
数式(i)によれば、電解酸化を開始してからt時間後のpH値と水温と液量とに基づいて、そのt時間後のナトリウムイオンの移動量が算出できるため、ナトリウムイオン量のリアルタイム計測が可能となる。
【0047】
なお、大気中の二酸化炭素のカソード液への溶け込みによって、反応式(11)に示す反応が生じる。
CO2+H2O → H++CO3− …(11)
本実施形態では水素ガス配管24に二酸化炭素用のトラップ18を設置するため、ナトリウムイオンの移動量を算出するにあたり、大気中の二酸化炭素がカソード液へ溶解することによるpH値の低下を考慮する必要性は殆どない。しかし、トラップ18を設けない場合においても、本演算式を適用可能とするため、二酸化炭素の溶解によるpH値の低下を考慮すると、その補正式としては下記のように表すことができる。
【0048】
二酸化炭素の溶け込みによる電解酸化前の水素イオンの濃度をy0とし、電解酸化を開始してからt時間後の水素イオン濃度をytとして数式(i)を補正すると、下記の数式(j)〜数式(l)で表すことができる。
【0049】
【数9】

【0050】
水素イオン濃度y0及び水素イオン濃度ytは、二酸化炭素の分圧が一定であれば温度に依存した既知の値、すなわち、二酸化炭素の溶解度S、大気中の二酸化炭素の密度Z、数式(i)における酸解離定数Ka、そして分圧pとする下記の数式(m)で表すことができる。従って、二酸化炭素の溶解によるpH値の低下を考慮した補正式は、数式(j)に、数式(k)〜数式(m)を代入することで表すことができる。
【0051】
【数10】

【0052】
計測装置13は、上記演算プログラムに基づき電解酸化に伴うナトリウムイオンの移動量をモニタリングする。そして、その移動量から陽極側4Aのナトリウムイオン濃度を把握する。
一次電解槽1での電解酸化により、十分な量の塩素酸が生成されたアノード液(塩素酸ナトリウムを含む)は、弁25Aを閉状態から開状態にしたアノード液輸送配管25を介してアノード液タンク4Bから二次電解槽2に輸送される。一方、カソード液は、弁26Aを閉状態から開状態にしたカソード液輸送配管26を介してカソード液タンク5Bから外部に輸送される。
【0053】
図5は、本発明の実施形態における二次電解槽2の構成図である。
二次電解槽2は、一次電解槽1で生成した塩素酸を主成分とするアノード液を電解酸化して過塩素酸を生成する。
なお、以下説明する二次電解槽2の構成は、重複説明を避けるため、上述の一次電解槽1と同一又は同等の構成部分については同一の符号を付し、その説明を簡略若しくは省略する。
【0054】
二次電解槽2において、陽イオン交換膜6は陽極4´と陰極5´との間にギャップ無しで挟みこまれたゼロギャップ型の電解セルを構成する。
陽極4´は、陽極側4Aにおける過塩素酸イオンの電解合成反応の促進を図るため触媒を被覆したエキスパンドメタルからなる。この陽極4´は、基体であるチタンエキスパンドメタルの表面を、電解メッキにより白金の触媒層で被覆した電極から構成される。
一方、この陽極4´と対となる陰極5´は、触媒を被覆したエキスパンドメタルからなる。この陰極5´は、基体であるチタンエキスパンドメタルの表面を、電解メッキにより白金の触媒層で被覆した電極、または、SUS316エキスパンドメタルからなる電極、または、ニッケルエキスパンドメタルからなる電極から構成される。
【0055】
二次電解槽2のアノード液タンク4Bの天部にはアノード液導入配管として、一次電解槽1のアノード液輸送配管25が接続されており、一次電解工程を経たアノード液がアノード液輸送配管25を介して導入され、陽極側4A(陽極側電解槽2A、アノード液タンク4Bを含む)を満たす。一方、カソード液タンク5Bの天部にはカソード液導入配管22が接続されており、純水がカソード液導入配管22を介して導入され、陰極側5A(陰極側電解槽2B、カソード液タンク5Bを含む)を満たす。二次電解槽2の内部で各液にそれぞれ浸された陽極4´及び陰極5´の両極に電圧を印加すると、次のような反応が進行する。
【0056】
陽極側4Aにおいては、一次電解工程を経たアノード液が電解酸化され、下記の反応式(12)、反応式(13)に示すように、過塩素酸イオンと副生成物として酸素ガスが生成される。なお、微量ではあるが、下記の反応式(14)に示すように、オゾンガスも副生成物として生成される。
ClO3−+H2O → ClO4−+2H++2e− …(12)
2H2O → O2+4H++4e− …(13)
3H2O → O3+6H++6e− …(14)
ここで、陽極側4Aのアノード液中に含まれるナトリウムイオンは、両極間の電位差によって陽イオン交換膜6を通過して陽極側4Aから陰極側5Aに移動する。一方、塩素酸イオンは陽イオン交換膜6を通過できず、水溶液‐陽極4´‐陽イオン交換膜6で構成される三界面で反応式(12)に示す反応により過塩素酸イオンとなる。
【0057】
陰極側5Aにおいては、下記の反応式(15)、反応式(16)に示す反応が生じ、水素ガスと水酸化ナトリウムとが生成される。
2H++2e− → H2 …(15)
2Na++2H2O+2e− → 2NaOH+H2 …(16)
【0058】
二次電解槽2の計測装置13は、前述した演算プログラムに基づき、電解酸化に伴うナトリウムイオンの移動量をモニタリングする。そして、その移動量から陽極側4Aのナトリウムイオン濃度を把握する。
十分な量の過塩素酸イオンが生成されたアノード液は、弁25Aを閉状態から開状態にしたアノード液輸送配管25´を介してアノード液タンク4Bから反応・蒸発槽3に輸送される。一方、カソード液は、弁26Aを閉状態から開状態にしたカソード液輸送配管26を介してカソード液タンク5Bから外部に輸送される。
【0059】
反応・蒸発槽3では、電解酸化後のアノード液中にアンモニア水溶液を添加して過塩素酸アンモニウムを合成する工程と、合成後のアノード液を減圧環境下で蒸発させて過塩素酸アンモニウムを晶析させる工程とを行う。なお、ここでアンモニア水溶液の代わりにアンモニアガスをバブリングして添加してもよい。
反応・蒸発槽3には、アンモニア供給配管31が接続されており、電解酸化後のアノード液中にアンモニア水溶液を供給する構成となっている。電解酸化後のアノード液中にアンモニア水溶液を添加すると、下記の反応式(17)に示す中和反応が生じ、過塩素酸アンモニウムが合成される。
HClO4+NH4OH → NH4ClO4+H2O …(17)
【0060】
次に、反応・蒸発槽3において、合成後のアノード液を真空環境下で蒸発させて過塩素酸アンモニウムを結晶として取り出す。反応式(17)に示すように、過塩素酸アンモニウムと共に得られる副生成物は水であるため、水を蒸発させるだけで高純度の過塩素酸アンモニウムの結晶が得られる。
【0061】
以上のように、本実施形態によれば、陽極4が設けられる陽極側4Aと陰極5が設けられる陰極側5Aとが陽イオン交換膜6で仕切られ、陽極側4Aにおいて塩化ナトリウム水溶液を電解酸化する一次電解槽1及び二次電解槽2と、陰極側5Aにおいて上記電解酸化に伴い変化するpH値と水温と液量とに基づいて、上記電解酸化に伴い陽極側4Aから陽イオン交換膜6を通過して陰極側5Aに移動したナトリウムイオンの移動量を計測する計測装置13と、を有する過塩素酸アンモニウム製造装置Aを採用することにより、検出に手間と時間が掛からない陰極側5AのpH値と水温と液量とに基づいてナトリウムイオンの移動量を算出することで、従来よりもナトリウムイオンの移動量を容易にモニタリングすることができる。
【0062】
また、本実施形態では、電解酸化に伴いナトリウムイオンの移動量に依存して変化するpH値、そしてそのpH値に影響を及ぼす水温及び液量の変化を考慮することで、ナトリウムイオンの移動量を精度良くモニタリングすることが可能となる。
なお、陰極側のpH値に影響を及ぼす因子としては、水温及び液量の他に、大気中に存在する二酸化炭素のカソード液への溶解があり、本実施形態では、この二酸化炭素の溶解量を考慮した補正式を用いることでモニタリングの精度をさらに高めることが可能となる。
【0063】
以上、図面を参照しながら本発明の好適な実施形態について説明したが、本発明は上記実施形態に限定されるものではない。上述した実施形態において示した各構成部材の諸形状や組み合わせ等は一例であって、本発明の主旨から逸脱しない範囲において設計要求等に基づき種々変更可能である。
【0064】
例えば、上記実施形態では、電解槽の陽極側において電解酸化する原料として、塩化ナトリウム水溶液を用いて電解酸化する形態を例示して説明したが、塩素酸ナトリウム水溶液を用いて電解酸化する形態であっても良い。
【0065】
また、例えば、本発明は、上述した過塩素酸アンモニウムの製造装置への適用に限定されるものではなく、過塩素酸リチウムや過塩素酸カリウム等のアルカリ金属過塩素酸塩の製造装置、過塩素酸カルシウム等のアルカリ土類金属過塩素酸塩の製造装置、また、過塩素酸銀の製造装置等にも適用可能である。
【符号の説明】
【0066】
A…過塩素酸アンモニウム製造装置(過塩素酸塩の製造装置)、S1…一次電解工程、…、S2…二次電解工程、S3…反応工程(合成工程)、S4…晶析工程、1…一次電解槽、2…二次電解槽、3…反応・蒸発槽、4…陽極、4´…陽極、4A…陽極側、5…陰極、5´…陰極、5A…陰極側、6…陽イオン交換膜、13…計測装置、14…pH計、15…水温計、16…液面計、17…演算装置、18…トラップ、24…水素ガス配管(水素ガス排気管)
【特許請求の範囲】
【請求項1】
陽極が設けられる陽極側と陰極が設けられる陰極側とが陽イオン交換膜で仕切られ、前記陽極側において塩化ナトリウム水溶液あるいは塩素酸ナトリウム水溶液を電解酸化する電解槽と、
前記陰極側において前記電解酸化に伴い変化するpH値、水温及び液量に基づいて、前記電解酸化に伴い前記陽極側から前記陽イオン交換膜を通過して前記陰極側に移動したナトリウムイオンの移動量を計測する計測装置と、を有することを特徴とする過塩素酸塩の製造装置。
【請求項2】
前記計測装置は、大気中に含まれる二酸化炭素の前記陰極側への溶解量に基づいて、前記計測したナトリウムイオンの移動量を補正することを特徴とする請求項1に記載の過塩素酸塩の製造装置。
【請求項3】
前記陰極側には、前記電解酸化に伴い前記陰極で発生した水素ガスを大気中に排気する水素ガス排気管が設けられており、
前記水素ガス排気管は、大気中から前記陰極側への二酸化炭素の流入を阻止するトラップを有することを特徴とする請求項1または2に記載の過塩素酸塩の製造装置。
【請求項4】
陽極が設けられる陽極側と陰極が設けられる陰極側とが陽イオン交換膜で仕切られている電解槽を用い、前記陽極側において塩化ナトリウム水溶液あるいは塩素酸ナトリウム水溶液を電解酸化する工程と、
前記陰極側におけるpH値、水温及び液量に基づいて、前記電解酸化に伴い前記陽極側から前記陽イオン交換膜を通過して前記陰極側に移動したナトリウムイオンの移動量を計測する工程と、を有することを特徴とする過塩素酸塩の製造方法。
【請求項1】
陽極が設けられる陽極側と陰極が設けられる陰極側とが陽イオン交換膜で仕切られ、前記陽極側において塩化ナトリウム水溶液あるいは塩素酸ナトリウム水溶液を電解酸化する電解槽と、
前記陰極側において前記電解酸化に伴い変化するpH値、水温及び液量に基づいて、前記電解酸化に伴い前記陽極側から前記陽イオン交換膜を通過して前記陰極側に移動したナトリウムイオンの移動量を計測する計測装置と、を有することを特徴とする過塩素酸塩の製造装置。
【請求項2】
前記計測装置は、大気中に含まれる二酸化炭素の前記陰極側への溶解量に基づいて、前記計測したナトリウムイオンの移動量を補正することを特徴とする請求項1に記載の過塩素酸塩の製造装置。
【請求項3】
前記陰極側には、前記電解酸化に伴い前記陰極で発生した水素ガスを大気中に排気する水素ガス排気管が設けられており、
前記水素ガス排気管は、大気中から前記陰極側への二酸化炭素の流入を阻止するトラップを有することを特徴とする請求項1または2に記載の過塩素酸塩の製造装置。
【請求項4】
陽極が設けられる陽極側と陰極が設けられる陰極側とが陽イオン交換膜で仕切られている電解槽を用い、前記陽極側において塩化ナトリウム水溶液あるいは塩素酸ナトリウム水溶液を電解酸化する工程と、
前記陰極側におけるpH値、水温及び液量に基づいて、前記電解酸化に伴い前記陽極側から前記陽イオン交換膜を通過して前記陰極側に移動したナトリウムイオンの移動量を計測する工程と、を有することを特徴とする過塩素酸塩の製造方法。
【図1】


【図2】


【図3】


【図4】


【図5】




【図2】


【図3】


【図4】


【図5】


【公開番号】特開2011−195901(P2011−195901A)
【公開日】平成23年10月6日(2011.10.6)
【国際特許分類】
【出願番号】特願2010−64404(P2010−64404)
【出願日】平成22年3月19日(2010.3.19)
【出願人】(000000099)株式会社IHI (5,014)
【Fターム(参考)】
【公開日】平成23年10月6日(2011.10.6)
【国際特許分類】
【出願日】平成22年3月19日(2010.3.19)
【出願人】(000000099)株式会社IHI (5,014)
【Fターム(参考)】
[ Back to top ]

