過酸化水素検出具、4−アミノアンチピリン法による過酸化水素検出方法及び水素供与体検出具
【課題】前処理の手間を軽減可能であり、特別の器具等を使用することなく何人も簡単に操作をすることができる過酸化水素検出具及び過酸化水素検出方法、水素供与体検出具の提供することを目的とする。
【解決手段】過酸化水素検出具1は、4−アミノアンチピリン法による過酸化水素の検出に用いるための4―アミノアンチピリン又はその誘導体、水素供与体、または、ぺルオキシダーゼのうち、少なくともぺルオキシダーゼが担持されている担持体3を備えている構成にしてある。
【解決手段】過酸化水素検出具1は、4−アミノアンチピリン法による過酸化水素の検出に用いるための4―アミノアンチピリン又はその誘導体、水素供与体、または、ぺルオキシダーゼのうち、少なくともぺルオキシダーゼが担持されている担持体3を備えている構成にしてある。
【発明の詳細な説明】
【技術分野】
【0001】
本発明は、過酸化水素検出具、過酸化水素検出方法及び水素供与体検出具に関するものである。
【背景技術】
【0002】
シラス干しなどの食品の加工に用いる器具や機械、装置などを殺菌洗浄する際、過酸化水素を用いた洗浄を行う場合がある。しかし、この過酸化水素については発ガン性により、食品衛生法において最終製品の完成前に過酸化水素を分解又は除去することと規定されている。
【0003】
このため、加工食品に過酸化水素が残存していないかどうかを検査する必要があり、かかる過酸化水素の検出方法としては、硫酸チタンや硫酸バナジウムを用い過酸化水素を含む検液を発色させる方法や、ぺルオキシダーゼの存在下過酸化水素によって4−アミノアンチピリンとフェノールなどの水素供与体とを酸化縮合させ、被検査物を含む検液を発色させる方法(4−アミノアンチピリン法)、同じくぺルオキシダーゼの存在下4−メトキシ−1−ナフトールを添加することで検液を発色させる方法(メトキシナフトール法)等がある。また、更に他の方法として、過マンガン酸カリウム法やヨウ素法などの滴定法がある。
【0004】
下記特許文献1には、4−アミノアンチピリン法で用いる試薬に、両性界面活性剤を配合することで試薬を安定化する方法に関する開示がある。
【0005】
また、下記特許文献2には、過酸化水素に固有の酸化還元電位について電極間に生じる電圧或いは電流を検出する装置を用いて、過酸化水素を簡易にかつ精度よく検出する酸素電極法が開示されている。
【0006】
【特許文献1】特開2006−10711号公報
【0007】
【特許文献2】特開2006−3330号公報
【発明の開示】
【発明が解決しようとする課題】
【0008】
しかしながら、硫酸チタンや硫酸バナジウムを用い過酸化水素を含む検液を発色させる方法では、過酸化水素の検出限界が10ppmと感度が悪く、また、過マンガン酸カリウム法やヨウ素法などの滴定法は過酸化水素以外の物質を過酸化水素として検出してしまうので特異性がなく、蛋白質を除去する等の前処理を必要としかかる作業は非常に煩雑である。
【0009】
また、従来の4−アミノアンチピリン法による検出では、0.05ppmという微量の過酸化水素の検出を行っているために濃縮などの前処理に非常に手間がかかるとともに、発色した検液の吸光度を測定するため高額な分析機器を必要とする。そして、酸素電極法による検出においても、4−アミノアンチピリン法と同様、前処理の手間や高額な分析機器を必要とする。よって、製造業者等の過酸化水素や水素供与体の検査を行い者が例えば食品製造の都度このような過酸化水素の検出作業を行うことは困難である。
【0010】
本発明は、上記した従来の問題点に鑑みてなされたものであって、前処理の手間を軽減可能であり、特別の器具等を使用することなく何人も簡単に操作をすることができる過酸化水素検出具及び過酸化水素検出方法、水素供与体検出具の提供することを目的とする。
【課題を解決するための手段】
【0011】
上記目的を達成するために、本発明に係る過酸化水素検出具は、4−アミノアンチピリン法による過酸化水素の検出に用いるための4−アミノアンチピリン又はその誘導体、水素供与体、または、ぺルオキシダーゼのうち、少なくともぺルオキシダーゼが担持されている担持体を備えている構成にしてある。
【0012】
また、前記構成において、担持体が膜状部材であるものである。
【0013】
そして、前記した構成において、膜状部材がニトロセルロ−ス膜であるものである。
【0014】
更に、本発明に係る4−アミノアンチピリン法による過酸化水素検出方法は、被検査物を含む検液に、ペルオキシダーゼ、水素供与体、及び4−アミノアンチピリンを添加して被検査物に含まれている過酸化水素を検出する4−アミノアンチピリン法による過酸化水素検出方法であって、ペルオキシダーゼが担持された担持体を検液に浸漬することを特徴とする被検査物を含む検液に、ペルオキシダーゼ、水素供与体、及び4−アミノアンチピリンを添加して被検査物に含まれている過酸化水素を検出する過酸化水素検出方法であって、ペルオキシダーゼが担持された担持体を検液に浸漬することを特徴とするものである。
【0015】
更に、本発明に係る水素供与体検出具は、水素供与体の検出に用いるための4−アミノアンチピリン又はその誘導体、過酸化水素、または、ぺルオキシダーゼのうち、少なくともぺルオキシダーゼが担持されている担持体を備えていることを特徴とするものである。
【発明の効果】
【0016】
本発明に係る過酸化水素検出具によれば、4−アミノアンチピリン法による過酸化水素の検出に用いるための4−アミノアンチピリン又はその誘導体、水素供与体、または、ぺルオキシダーゼのうち、少なくともぺルオキシダーゼが担持されている担持体を備えているので、該担持体を被検査物を含む検液に浸漬することで、過酸化水素の有無を検出でき、特別の器具等を使用することなく簡単な操作を行うだけでよく、前処理の手間を軽減可能である。
【0017】
また、担持体が膜状部材である場合は、過酸化水素検出具の取り扱いが容易となる。
【0018】
そして、膜状部材がニトロセルロ−ス膜である場合には、過酸化水素検出具を検液に浸漬した際ペルオキシダーゼが担持体から検液中に溶出することなく、ニトロセルロ−ス膜に担持されたままの状態で発色するので、ペルオキシダーゼが検液中に溶解するために濃度が低下するといったことなく、担持体において濃い色で発色するため、過酸化水素の有無の判定が容易となる。
【0019】
更に、本発明に係る過酸化水素検出方法は、被検査物を含む検液に、ペルオキシダーゼ、水素供与体、及び4−アミノアンチピリンを添加して被検査物に含まれている過酸化水素を検出する4−アミノアンチピリン法による過酸化水素検出方法であって、ペルオキシダーゼが担持された担持体を検液に浸漬することを特徴とするので、特別の器具等を使用することなく簡単な操作で容易に過酸化水素の検出を行うことができる。
【0020】
更に、本発明に係る水素供与体検出具によれば、水素供与体の検出に用いるための4−アミノアンチピリン又はその誘導体、過酸化水素、または、ぺルオキシダーゼのうち、少なくともぺルオキシダーゼが担持されている担持体を備えているので、該担持体を被検査物を含む検液に浸漬することで、水素供与体の有無を検出でき、特別の器具等を使用することなく簡単な操作を行うだけでよく、前処理の手間を軽減可能である。
【発明を実施するための最良の形態】
【0021】
本発明の最良の実施形態を図面に基づいて説明する。ここに、図1は本発明の一実施形態に係る過酸化水素検出具の斜視図、図2は前記過酸化水素検出具を用いた過酸化水素検出方法の操作手順を示す図である。
図1において、この実施形態に係る過酸化水素検出具1は、担持体3に4−アミノアンチピリン法による過酸化水素の検出に用いるための4−アミノアンチピリン又はその誘導体、水素供与体、または、ぺルオキシダーゼのうち、少なくともぺルオキシダーゼが担持されている担持部2を備えている。尚、図1〜3では担持部2を1箇所のみとしたが、これに限定されず、2箇所以上としても構わない。
【0022】
担持体3には少なくともペルオキシダーゼが担持されていればよく、4−アミノアンチピリン又はその誘導体、水素供与体のいずれか又は双方が担持体3に担持されなくても構わない。このように4−アミノアンチピリン又はその誘導体、水素供与体のいずれか又は双方が担持体3に担持されない場合には、この担持されていない物質を別途所定量を検液へ添加する必要がある。
【0023】
担持体3に4−アミノアンチピリン又はその誘導体、及び/または水素供与体が担持されていない場合のこれらの物質の検液への添加方法は、4−アミノアンチピリン又はその誘導体、または水素供与体のそれぞれの原液をそのまま添加してもよく、水などの溶媒により希釈した希釈液を添加してもよい。また、4−アミノアンチピリン又はその誘導体と水素供与体とを混合した後で検液に添加してもよい。
【0024】
そして、4−アミノアンチピリン又はその誘導体、及び水素供与体の原液又は希釈液中に、過酸化水素検出具1とは別の担持体を各々浸漬するなどして、該別の担持体に担持させたものを添加してもよい。更には、4−アミノアンチピリン、又は水素供与体を凍結乾燥し、粉末状としたものを用いてもよい。
【0025】
4−アミノアンチピリン又はその誘導体は、後述する水素供与体と酸化縮合反応して発色する物質であれば特に限定されないが、特に汎用性があり、良好な発色性を示す点で4−アミノアンチピリンが好ましい。4−アミノアンチピリン又はその誘導体の濃度は、特に限定されないが、通常、被検査物に対し0.05重量%〜1重量%程度が好ましい。
【0026】
水素供与体は、例えば、フェノール、2−クロロフェノール、4−クロロフェノール、2,4−ジクロロフェノールなどのフェノール類、アニリン、N,N−ジメチルアニリン、N,Nーゼチルアニリン、N,Nーゼチル−m−トルイジン、N,N−ジメチル−m−アニシジン、N−エチル−N−(3−メチルフェニル)−N'−アセチルエチレンジアミン、N−エチル−N−(β−ヒドロキシエチル)−m−トルイジン、N−エチル−N−(2−ヒドロキシ−3−スルホプロピル)−m−トルイジン、N−エチル−N−スルホプロピル−m−トルイジン、N−エチル−N−スルホプロピル−3,5−ジメトキシアニリン、N−エチル−N−(2−ヒドロキシ−3−スルホプロピル)−3,5−ジメトキシアニリン、N−(2−ヒドロキシ−3−スルホプロピル)−3,5−ジメトキシアニリン、N−エチル−N−スルホプロピル−m−アニシジン、N−エチル−N−(3−メチルフェニル)−N'−サクシニルエチレンジアミン、N−エチル−N−(2−ヒドロキシ−3−スルホプロピル)−m−アニシジン、N−エチル−N−(2−ヒドロキシ−3−スルホプロピル)−m−トルイジンなどのアニリン類が用いられる。
水素供与体の濃度は特に限定されないが、被検査物に対し0.5重量%〜8重量%程度が好ましい。
【0027】
ぺルオキシダーゼは、その起源、由来に特に限定はなく、植物、動物、微生物から得られるペルオキシダーゼが、1種若しくは要すれば2種以上組み合わせて用いられる。また、その使用量は目的に応じて適宜定められ、特に限定されないが、例えば、被検査物に対し1ppm〜100ppm 程度が好ましい。
【0028】
担持体3は、有機、無機のいずれの材質でもよく、例えば、無機系の担持体3としては、ケイソウ土、カオリナイトーゼオライト、多孔質ガラス、セラミック等を、有機系の担持体3としては、ナイロン樹脂、ポリエチレン樹脂、アクリル樹脂、ポリプロピレン樹脂、ポリエステル樹脂、セルロース樹脂等を挙げることができる。
【0029】
図1においては操作性が良好である点から担持体3として膜状部材を示したが、これに限定されず、他の形状、例えば、粒状部材等であってもよい。担持体3が膜状部材の場合、例えば、濾紙、ガラス繊維膜、多孔性又は非多孔性の高分子膜等を用いることができる。高分子膜として、ナイロン膜、ポリエチレン膜、ポリエチレンテレフタレート膜、ポリプロピレン膜、ポリビニリデンフルオライド(PVDF)膜、ニトロセルロース膜や酢酸セルロース膜等のセルロース類膜などが挙げられる。
【0030】
膜状部材を用いる場合、その大きさは特に限定されないが、容易に処理及び保管可能であることが好ましい。例えば、縦10mm〜50mm、横8mm〜15mm、厚さ0.05mm〜2.0mm程度であれば、作成及び取り扱いが容易となり好ましい。
【0031】
そして、上記膜状部材の中でも特にニトロセルロース膜が好ましい。ニトロセルロース膜は、過酸化水素検出具を検液に浸漬した際ペルオキシダーゼが担持体から検液中に溶出することなく、ニトロセルロ−ス膜に担持されたままの状態で発色するので、ペルオキシダーゼが検液中に溶解するために濃度が低下するといったことなく、担持体で濃い色の発色をするため、過酸化水素の有無の判定が容易となる。
【0032】
また、4−アミノアンチピリン又はその誘導体、水素供与体、またはペルオキシダーゼの担持部2への担持方法は、化学結合であってもよく、物理的な相互作用であってもよい。例えば、担持体3表面の所定箇所にこれらの物質をピペットなどにより所定量滴下し、自然乾燥させる方法等があげられる。その際、ペルオキシダーゼ以外に4−アミノアンチピリン又はその誘導体及び/または水素供与体を担持体3に担持する場合には、4−アミノアンチピリン又はその誘導体及び/または水素供与体をペルオキシダーゼより先に担持部2に担持させた後、ペルオキシダーゼを担持されることが好ましい。理由は、ペルオキシダーゼが表面側にあることにより過酸化水素に直接接触しやすいためと考えられる。
【0033】
固定化の温度は酵素が失活しない温度であれば限定されないが、5℃から30℃が好ましい。
【0034】
また担持体には、4−アミノアンチピリン又はその誘導体、水素供与体、または、ぺルオキシダーゼの他、酵素活性を維持するための、pH調整剤や酵素活性保護剤等を担持させてもよい。例えばpH調整剤には、一般的な緩衝剤を用いる方法を適用できる。緩衝剤としては、公知の試薬組成物に用いられているいずれのものであってもよく、例えば、pHを5〜8に維持することができるリン酸、グリシン、トリス及びグッドの緩衝液を挙げることができる。pH調整剤を加える場合その濃度は特に限定されないが、通常、0.1M〜1M程度が好ましい。また、上記pH調整剤や酵素活性保護剤等を担持体に担持しない場合であっても、過酸化水素の検出を行う際検液に上記pH調整剤や酵素活性保護剤等を添加することとしてもよい。
【0035】
検液中に過酸化水素が存在すると、ペルオキシダーゼが過酸化水素を分解して活性な酸素を放出し、この活性な酸素により水素供与体と4−アミノアンチピリン又はその誘導体とを酸化縮合させ、発色する芳香環を化合物であるキノン色素を生成させる。係る反応式の一例を下記に示す。
【0036】
【化1】

上記反応式は、ペルオキシダーゼ存在下、過酸化水素、4−アミノアンチピリン又はその誘導体としての4−アミノアンチピリン、水素供与体としてのフェノールとが酸化縮合反応し、水を生成することを示している。
【0037】
過酸化水素検出具1は、過酸化水素検出操作を行う際、その都度作成し、作成後すぐに使用することしてもよいが、冷蔵庫内で保管することにより例えば2〜3ヶ月といった所定期間の保存が可能である。冷蔵庫内で保管する際には、密閉容器内で窒素を封入し、シリカゲル等の乾燥剤とともに保管することが好ましい。これにより、過酸化水素検出具1が空気中の酸素と反応するといったことなく、より長期間の保存が可能となる。
【0038】
ここで、過酸化水素検出具1を用いて過酸化水素の検出を行う被検査物としては、過酸化水素の検出を必要とする物質、例えば、シラス干し、チリメン、カマボコ、うどんが挙げられる。ここで、シラス干しとは、カタクチイワシ、マイワシ、ウナギ、アユ等の稚魚を釜ゆで後、乾燥したものである。
【0039】
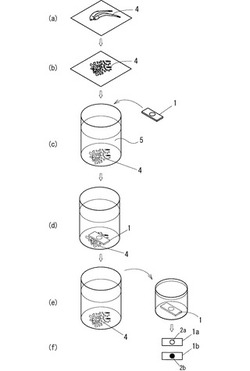
引続き、過酸化水素検出具を用いた過酸化水素の検出方法につき、以下に説明する。図2は、本実施形態に係る過酸化水素検出方法の操作手順を示す図である。図2では、被検査物4の一例としてシラス干しを用いた例を示す。まず、図2(a)に示す被検査物4を(b)に示すように複数の小片に裁断し、(c)において所定量の検液5に添加する。被検査物4と検液5との割合は、被検査物に対する検液の重量が、2〜8程度が好ましく、例えば被検査物5gに対し検液としての0.2Mリン酸緩衝液が25mlである。
【0040】
次に、(d)に示すように被検査物4を含む検液5中に過酸化水素検出具1を添加し、常温常圧下で所定時間、例えば、5分〜30分程度放置する。図2に示す方法では、担持体3に4−アミノアンチピリン又はその誘導体、水素供与体、及びぺルオキシダーゼの全てが担持された過酸化水素検出具1を用いている。その後、(e)に示すように過酸化水素検出具1を検液5から取り出し、水洗し、(f)においてペルオキシダーゼの発色の有無を判断する。
【0041】
この結果、図2(f)の過酸化水素検出具1aのように、担持部2aが発色しない場合には、1ppm以上の過酸化水素は検出されなかったこととなる。これに対し、過酸化水素検出具1bのように、ペルオキシダーゼを担持した担持部2bが赤色に発色していれば、被検査物4に1ppm以上の過酸化水素が検出されたこととなる。
【0042】
図2では、担持体3の担持部2には、4−アミノアンチピリン又はその誘導体、水素供与体及びペルオキシダーゼの全てが担持された過酸化水素検出具1を用いた例を示したが、他の実施形態として、過酸化水素検出具1の担持部2にペルオキシダーゼのみ担持し、水素供与体及び4−アミノアンチピリンは担持しない例を以下に示す。
【0043】
図3は、4−アミノアンチピリン又はその誘導体、及び水素供与体を担持していない過酸化水素検出具1cを用いて、過酸化水素の検出を行う場合の操作手順の一部を示す。4−アミノアンチピリン又はその誘導体、及び水素供与体が過酸化水素検出具1cに担持されない場合にも、図2に示す(a)(b)と同様の工程を行って、被検査物4を複数の小片に裁断し、所定量の検液5に添加する。その後、図2の(c)〜(f)の工程に替えて図3(c’)〜(f’)の工程を行う。
【0044】
図3の(c’)において、例えば、過酸化水素検出具1cとは別の担持体6,7にそれぞれ担持された4−アミノアンチピリン又はその誘導体及び水素供与体を、ペルオキシダーゼを担持部2に担持する過酸化水素検出具1cとともに検液5cに添加する。
【0045】
図3(d’)に示す状態で、5分〜20分程度の所定時間経過すると、担持体6,7から4−アミノアンチピリン及び水素供与体がそれぞれ検液中に溶出する。そして、図3(e’)に示すように、過酸化水素検出具1cを取り出し、水洗する。検液中に過酸化水素がない場合または、1ppmより少ない場合には図3(f’)の過酸化水素検出具1dに示すように、担持部2dが発色しない。これに対し、検液が1ppm以上の過酸化水素を含有する場合には過酸化水素検出具1eのように、ペルオキシダーゼを担持する担持部2eが赤色に発色する。これにより被検査物から1ppm以上の過酸化水素が検出されたことを判断可能である。
【0046】
以上より、従来、4−アミノアンチピリン法により、吸光度測定機器を用いて過酸化水素の検出を行った場合には、過酸化水素が検出されるかどうかの判断に約1日かかっていたところ、5〜20分で判断可能であるので、時間の大幅の短縮が可能となる。これにより、食品加工業者が工場内で簡易に過酸化水素の検出する際の手間を省くことができる。
【0047】
尚、本発明の過酸化水素検出具及び過酸化水素検出方法に用いるぺルオキシダーゼが担持されている担持体3は、過酸化水素の存在下、4−アミノアンチピリンと水素供与体と結合してキノン色素を生成する性質を有しているので、これを過酸化水素検出具としてだけではなく、水素供与体の検出用として用いてもよい。このような目的で使用する場合、水素供与体検出具の担持体には4−アミノアンチピリン又はその誘導体、過酸化水素、または、ぺルオキシダーゼのうち、少なくともぺルオキシダーゼが担持され、被検査物に水素供与体が検出された場合に、担持部が発色する構造とする。そして、水素供与体検出具は、4−アミノアンチピリン又はその誘導体、過酸化水素を担持体に担持しなくてもよく、水素供与体の検出操作を行う際これら物質を別途添加する構造としてもよい。水素供与体の担持体に担持するペルオキシターゼの使用濃度としては、通常1ppm〜100ppm、好ましくは40ppm〜60ppmである。
【実施例1】
【0048】
過酸化水素を0.2Mリン酸緩衝液に溶解し濃度を5.0ppmとした検液2mLと、過酸化水素を添加しない0.2Mリン酸緩衝液のみの検液2mLとを用い、本発明に係る過酸化水素検出具の発色の状態を比較した。担持体は、縦18mm〜20mm、横8mm〜10mmに裁断したバイオラド社製ニトロセルロース膜(厚さ0.1mm)を用いた。ペルオキシダーゼを5ppmに調整し、エッペンドルフ社製マイクロピペット(型番リファレンス4910)により前記担持体の表面に、1箇所につき20μLずつを2箇所に滴下し、自然乾燥を行うため室温で20分間放置した。このようにして、ペルオキシダーゼのみが担持体の2箇所の担持部に円形状に担持されている過酸化水素検出具を作成した。
【0049】
そして、0.4重量%4−アミノアンチピリン0.1mLと、水素供与体として1.9重量%フェノール0.3mLとをそれぞれ検液に添加すると共に、上記のように作成した過酸化水素検出具を検液中に浸漬した。過酸化水素検出具の浸漬より20分経過した時点で、担持体を検液から取り出し蒸留水により洗浄し、発色の状態を島津製作所製デンシトメーターCS9000を用いて測定した。測定条件は、波長を520nmした。
(比較例1)
【0050】
過酸化水素の検出方法として4−アミノアンチピリン法と、メトキシナフトール法との比較を行うため、上記実施例1と同様の条件で5ppmペルオキシダーゼ20μLを2箇所の担持部に滴下し、担持されて作成した過酸化水素検出具を用いると共に、上記実施例1に係る4−アミノアンチピリン及びフェノールに替えて、0.15重量%4−メトキシ−1−ナフトールを0.4mL検液に添加し、その後の処理は上記実施例1と同様の条件で試験を行った。実施例1及び比較例1の結果を表1及び図4に以下に示す。
【0051】
【表1】

【0052】
表1において各数値は担持部の発色の濃淡の測定値であり、数値が高い程担持部が濃い発色となっていることを示す。これらの数値は各々の条件において得られた複数の測定値の平均値を示している。また、図4は縦軸に表1に示す数値をとり、横軸に各条件をとったものであり、横軸に示した文字BLは過酸化水素を添加しない場合であり、ST5ppmは5.0ppmの過酸化水素を添加した場合である。更に、図4には、検出試験の結果得られた過酸化水素検出具の発色状態を示している。
【0053】
表1及び図4に示すように、比較例1に係る4−メトキシ−1−ナフトールを添加した担持体は、過酸化水素を添加しない検液に浸漬した場合にも薄い青色の発色を示した。これに対し、実施例1に係る4−アミノアンチピリン及び水素供与体を添加した検液の担持体は過酸化水素を含有しない検液は全く発色せず、5.0ppmの過酸化水素を添加した検液では赤く発色するという適正な結果が得られた。
【実施例2】
【0054】
担持体の材質の検討を行うため、担持体として、上記実施例1のバイオラド社製ニトロセルロース膜の他、アドバンテック社製濾紙(厚さ0.2mm)、アドバンテック社製ガラス繊維(厚さ0.5mm)、ミリポア社製親水性PVDF膜(厚さ0.1mm)の4種を用い、5.0ppmの過酸化水素を検液2mLとして、上記実施例1と同様の条件で試験を行った。検液に担持体を浸漬した後約20分間放置した時点の検液及び過酸化水素検出具を図5に示す。
【0055】
図5より、いずれの担持体も赤色に発色した。特に、濾紙については担持体全体が薄い色に発色するとともに検液自体も薄い赤色に発色した。ガラス繊維膜、PVDF膜については担持体全体が濃い色に発色すると共に、検液自体も濾紙を浸漬させた検液よりも濃い赤色に発色した。
【0056】
これに対し、ニトロセルロース膜は担持体のペルオキシダーゼを担持させた担持部のみ円形状に赤色に発色し、担持部以外は発色しなかった。また、検液が発色することもなかった。これは、濾紙、ガラス繊維膜、PVDF膜では、ペルオキシダーゼが担持体から検液中に溶出したと考えられ、ニトロセルロース膜では担持体から検液中に溶出することなく、担持体に担持されたままであると考えられる。
【実施例3】
【0057】
水素供与体としてのフェノールの濃度を変更し、担持体の発色状況を試験した。フェノールの濃度範囲は0.5重量%〜8.0重量%とし、他の条件は5.0ppmの過酸化水素を検液2mLとした上記実施例1と同様とした。結果を表2に示す。
【表2】

【0058】
表2より、0.5重量%〜8.0重量%の全範囲で発色が認められる良好な結果が得られた。特に水素供与体の濃度が高い程、濃い色に発色する傾向となり、8.0重量%の値が49mmと最も良かった。これより、実施例1と同様の条件で作成した5ppmのぺルオキシダーゼのみが担持されてなる担持体を、水素供与体の検出を行う際にも利用可能であることが分かった。即ち、ペルオキシダーゼを担持させてなる担持体を水素供与体の検出を行いたい検液中に浸漬すると共に、所定量の過酸化水素及び4−アミノアンチピリンを該検液に添加することで水素供与体の検出が可能となる。
【実施例4】
【0059】
4−アミノアンチピリンの濃度を0.05重量%〜1.0重量%の範囲で変更すると共に、1.9重量%フェノールに替えて8.0重量%フェノールを用いた以外は5.00ppm過酸化水素を検液とした上記実施例1と同様に担持体の発色状況を試験した。結果を表3に示す。
【表3】

【0060】
表3より、全ての範囲で発色が認められる良好な結果が得られ、特に、0.1重量%で最も濃い発色となった。
【実施例5】
【0061】
ペルオキシダーゼの濃度を1ppm〜100ppmの範囲で変更すると共に、1.9重量%フェノールに替えて8.0重量%フェノールを、0.4重量%4−アミノアンチピリンに替えて0.1重量%4−アミノアンチピリンを用いた以外は5.00ppm過酸化水素を検液とした上記実施例1と同様に担持体の発色状態を測定した。結果を表4に示す。
【表4】

【0062】
この結果全範囲で発色が認められる良好な結果が得られ、特に5〜100ppmにおいてより濃い発色となる結果が得られ、この範囲内では余り差が認められなかった。
【実施例6】
【0063】
担持体に担持させるペルオキシダーゼの量を検討するため、実施例1では5ppmペルオキシダーゼ20μLを担持体に担持させたところ、5ppmペルオキシダーゼを用い1箇所の滴下量を5μL〜50μLの範囲で変更し、また、1.9重量%フェノールに替えて8.0重量%フェノールを、0.4重量%4−アミノアンチピリンに替えて0.1重量%4−アミノアンチピリンを用いた以外は5.00ppm過酸化水素を検液とした上記実施例1と同様とした。結果を表5に示す。
【表5】

【0064】
表5より、全範囲で発色が認められる良好な結果が得られた。再現性に関しては20μLが最も良い結果となり、7回測定を行ったところ標準偏差3.7、変動係数3.4%であった。
【実施例7】
【0065】
担持部の発色状態の変化を確認するため、5.0ppmの過酸化水素2mLに、8.0重量%のフェノール0.3mL、0.1重量%4−アミノアンチピリン0.1mLを添加した検液に、5ppmのペルオキシダーゼ20μLずつを2箇所に担持した担持体を浸漬した。15分間の浸漬後、担持体を検液から取り出して蒸留水で1分間洗浄し、ろ紙にはさんで水分を除き、10分間放置した。この時点での発色状態を測定し、得られた数値を基準とし、15分〜420分までの間の各時点で発色状態を測定した場合の担持部の濃さの割合を算出した。結果を表6に示す。
【表6】

【0066】
表6より、担持体が湿っている状態の15分の時点では、色が濃く見えるために数値が安定しないが、担持体が乾燥する20分以後は数値がほぼ一定となり、20分〜420分経過後について発色状態にほとんど変化が見られなかった。
【実施例8】
【0067】
担持体の発色に要する時間を測定するため、ペルオキシダーゼを担持させた担持体を検液中に浸漬する際の浸漬時間を5〜30分の間で変更した。また、フェノールの濃度を1.9重量%に替えて8.0重量%に、0.4重量%4−アミノアンチピリンに替えて0.1重量%4−アミノアンチピリンとし、他の条件は5.00ppm過酸化水素を検液とした上記実施例1と同様とした。結果を表7に示す。
【表7】

【0068】
表7より、5分〜30分の範囲でいずれも良好な発色状態であり、全範囲でほとんど差は見られなかった。これより、約5分で反応が終了していると考えられる。
【実施例9】
【0069】
担持体の過酸化水素の検出限界となる濃度を確認するため、過酸化水素の濃度を0.1〜10ppmの範囲で変更し、また、フェノールの濃度を1.9重量%に替えて8.0重量%に、0.4重量%4−アミノアンチピリンに替えて0.1重量%4−アミノアンチピリンとし、他の条件は5.00ppm過酸化水素を検液とした上記実施例1と同様とした。結果を表8及び図3に示す。
【表8】

【0070】
表8より、発色の程度は低いものの0.1ppmから担持部の発色が確認でき、3ppmまでは直線性が認められ、それ以上の範囲では十分濃い色の発色が確認できた。
【実施例10】
【0071】
ペルオキシダーゼ等の物質を担持させ、検出具を作成後、直ちに検出を行うのではなく、暫く保管した後に検出を行う際にも適正な結果が得られるかどうか、保存安定性の確認試験を行った。即ち、上記実施例1と同様の条件で過酸化水素検出具を作成した。作成直後及び30度の室温において5時間放置後の過酸化水素検出具を用いて、5ppmの過酸化水素の発色試験を行った。尚、発色試験は検液に添加するフェノールの濃度を1.9重量%に替えて、8.0重量%に、0.4重量%4−アミノアンチピリンに替えて0.1重量%4−アミノアンチピリンとした以外は上記実施例1と同様の条件とした。
【0072】
また、30度の室温において5時間の放置の際の保存方法は、1.そのまま放置、2.密閉容器内に酸素吸収剤(アイ・エス・オー社製A-500HS、4g入/袋、以下同じ)と保存、3.密閉容器内に窒素を充填し酸素吸収剤と共に保存、4.密閉容器内に窒素を充填し保存、5.密閉容器内にシリカゲル(豊田化工株式会社製乾燥剤5g入/袋、以下同じ)と保存、6.密閉容器内に窒素を充填しシリカゲルと共に保存、7.密閉容器内に五酸化リンと保存の7種類の条件とした。結果を表9に示す。
【表9】

【0073】
表9では、各条件における発色の濃さを示す数値とともに、過酸化水素検出具の作成直後の発色状態を100%とし、これに対する5時間放置後の検出具の発色状態の変化の割合を算出したものを示している。表9より、そのまま室内で放置した場合には発色の状態が20.7%にまで低下していた。この原因としては、空気中の酸素によって過酸化水素検出具が酸化されたか、又は空気中の水分が過酸化水素検出具に何らかの影響を与えていると考えられる。
【0074】
そこで、まず、空気中の酸素による酸化を防止するため密閉容器内に酸素吸収剤と保存した場合には29.6%、密閉容器内に窒素を充填し酸素吸収剤と共に保存した場合は27.8%、密閉容器内に窒素を充填し保存した場合は53.3%という結果が得られ、そのまま放置した場合に比較して、発色状態は、酸素吸収剤使用では同程度であったが、窒素充填のみで保存すると、2倍の改善が認められた。
【0075】
次に、空気中の水分を排除した状態で保存するため、過酸化水素検出具を、密閉容器内にシリカゲルと保存した場合、密閉容器内に窒素を充填しシリカゲルと共に保存した場合、密閉容器内に五酸化リンと保存した場合には、64.4%〜75.2%の発色状態が維持可能であることが分かった。よって、空気中の水分を排除した状態で保存することにより、予め多数の過酸化水素検出具を作成し必要量を複数回に分けて使用したいような場合にも、適正な検出結果を得ることが可能であることが確認できた。
【実施例11】
【0076】
実施例10にかかる保存安定性について、担持体に担持させるペルオキシダーゼの濃度を高くすることで発色状態の低下防止の効果があるかどうか確認するため、ペルオキシダーゼの濃度を5ppm及び50ppmの2種類とした以外は上記実施例10と同様の条件で過酸化水素検出具を作成し、約30℃の室温で5時間放置した。放置の際は密閉容器内に窒素を充填し、シリカゲルと共に保存することとした。結果を表10に示す。
【表10】

【0077】
表10よりペルオキシダーゼの濃度を50ppmとすることで、検出具作成の後5時間放置後においても良好な発色性を示すことが分かった。尚、上記実施例5において過酸化水素検出具を作成した直後に使用する場合には、ペルオキシダーゼの濃度が5〜100ppmの範囲内では余り差が認められていない。よって、過酸化水素検出具を作成後直ちに使用する場合には担持させるペルオキシダーゼの濃度は5ppm、50ppmのいずれでもほぼ同じ結果が得られるが、暫く保存後使用する場合には50ppmとした方がよりよいことが分かる。
【実施例12】
【0078】
過酸化水素検出具の保存の際の温度による影響を確認するため上記実施例11における約30度の室温で保存に替えて、約4℃の冷蔵庫内、−30℃及び−80℃の冷凍庫内で、それぞれ過酸化水素検出具の作成後10日間保存した。結果を表11に示す。
【表11】

【0079】
表11より、過酸化水素検出具を−80℃〜4℃の低温にて保存することで10日経過後においても発色の状態がほとんど低下しないという良好な結果が得られた。これより、本発明に係る過酸化水素検出具を作成直後に使用せず、所定期間経過後使用する場合には、食品加工業者では通常設置されている冷蔵庫又は冷凍庫にて保存することで保存安定性を維持できることが分かった。
【実施例13】
【0080】
実施例12では10日間程度の保存安定性について試験したが、更に長期間の保存状態を確認するため以下の試験を行った。即ち、実施例12と同様に、50ppmのペルオキシダーゼ20μLをニトロセルロース膜からなる担持体に担持させ、密閉容器内に窒素を充填し、シリカゲルと共に、約4℃の冷蔵庫内で作成直後〜12ヶ月間保存した。
【0081】
また、水素供与体及び4−アミノアンチピリンについても担持体に担持させた状態での保存を行った。水素供与体としてのフェノールはアドバンテック社製濾紙(厚さ0.2mm)を縦2cm、横2cmに裁断してなる担持体に、24重量%エタノール溶液100μLを吸収させ、室内で放置し自然乾燥させた。4−アミノアンチピリンは水素供与体と同じアドバンテック社製濾紙を縦2cm、横1cmに裁断してなる担持体に、0.2重量%4−アミノアンチピリン水溶液を50μL吸収させた後、冷蔵庫(4℃)で乾燥させた。
【0082】
その後、該フェノール及び4−アミノアンチピリンをそれぞれ担持した担持体を密閉容器内に窒素を充填し、シリカゲルと共に、約4℃の冷蔵庫内で保存した。
【0083】
更に、ペルオキシダーゼと共に、水素供与体及び4−アミノアンチピリンを一個の担持体に担持させた過酸化水素検出具についても上記と同様の試験を行った。即ち、バイオラド社製ニトロセルロース膜(厚さ0.1mm)に8.0重量%フェノール15μLをエッペンドルフ社製マイクロピペット(型番リファレンス4910)により滴下し、乾燥した後、0.1重量%4−アミノアンチピリン5μLを同様に滴下、乾燥し、更に、50ppmペルオキシダーゼ20μLを同様に滴下、乾燥し、過酸化水素検出具を作成した。該過酸化水素検出具を上記同様、密閉容器内に窒素を充填し、シリカゲルと共に、4℃の冷蔵庫内で作成直後〜12ヶ月保存を行った。結果を表12に示す。
【表12】

【0084】
表12より、ペルオキシダーゼ、フェノール及び4−アミノアンチピリンをそれぞれ異なる担持体に担持させた場合、及びこれらを全て一個の担持体に担持させた場合の双方において6ヶ月間保存した際にも発色状態を約100%維持可能であり、12ヶ月保存した場合においても発色性がほとんど低下せず、長期保存が可能であることが分かった。
【実施例14】
【0085】
試験用シラスを作成し、該試験用シラスについて本発明に係る過酸化水素検出具と、酸素電極法との過酸化水素検出のための比較実験を行った。試験用シラスは、沸騰水1Lに食塩20gと過酸化水素標準液を5,000μg〜100,000μg添加し、ここに水道水でよく洗浄した生シラス120gを添加し5分間煮沸した。その後、ザルに取り出して水切りを行い、10分間放冷することにより作成した。得られた試験用シラス5gを
すりつぶし、0.2Mリン酸緩衝液25mLに添加した。ここに上記実施例13のペルオキシダーゼ、フェノール及び4−アミノアンチピリンの各々の担持体と同様の条件で作成した過酸化水素検出具を浸漬させ10分間放置した後、蒸留水で洗浄した。発色の状態を、島津製作所製デンシトメーターCS9000により算出した。
(比較例2)
【0086】
上記実施例14と同様の条件で作成した試験用シラス5gの過酸化水素濃度を酸素電極法により測定するため、以下の試験を行った。実施例14と同様の条件で作成した試験用シラスをホモジナイズし、その5gを秤量し0.5%臭素酸カリウム含有0.2Mリン酸緩衝液を加えて50mLとし、その溶液をろ過し、ろ液を酸素電極法により測定した。測定機器は、セントラル科学社製高感度過酸化水素計スーパーオリテクターモデル5(SUPER ORITECTOR MODEL5)を用い、測定条件をRangを0.1、サンプル液量を2mL、窒素流量を65mL/min、カタラーゼ液量を25μLとした。実施例14及び比較例2の結果を表13に示す。
【表13】

【0087】
表13より、本発明に係る過酸化水素検出具を用いた過酸化水素の検出結果と、酸素電極法による検出結果はほぼ等しいものであった。これより、本発明に係る過酸化水素検出具を用いた試験はデータの信頼性が十分高いことが確認できた。
【実施例15】
【0088】
市販のシラス干し10検体について、本発明に係る過酸化水素検出具を用いた簡易検出方法及び酸素電極法で過酸化水素の含有量の比較試験を行った。結果を表14に示す。
【表14】

【0089】
表14より、本発明に係る過酸化水素検出具は酸素電極法により得られた過酸化水素濃度と略同じ程度の値を示しめすことが確認できた。よって、食品に1ppm前後以上の過酸化水素が含有されているかどうか確認することができ、食品製造業者の食品の衛生管理に要する負担を軽減可能である。
【図面の簡単な説明】
【0090】
【図1】本発明の一実施形態に係る過酸化水素検出具の斜視図である。
【図2】本発明の一実施形態に係る過酸化水素の検出方法を示す図である。
【図3】本発明の他の実施形態に係る過酸化水素の検出方法を示す図である。
【図4】前記他の実施形態にかかる過酸化水素検出具の実施例及び比較例の発色状態を示す図である。
【図5】前記他の実施形態にかかる複数の過酸化水素検出具の発色状態を示す図である。
【符号の説明】
【0091】
11a,1b,1c,1d,1e 過酸化水素検出具
3 担持体
4,4a 被検査物
5,5c 検液
【技術分野】
【0001】
本発明は、過酸化水素検出具、過酸化水素検出方法及び水素供与体検出具に関するものである。
【背景技術】
【0002】
シラス干しなどの食品の加工に用いる器具や機械、装置などを殺菌洗浄する際、過酸化水素を用いた洗浄を行う場合がある。しかし、この過酸化水素については発ガン性により、食品衛生法において最終製品の完成前に過酸化水素を分解又は除去することと規定されている。
【0003】
このため、加工食品に過酸化水素が残存していないかどうかを検査する必要があり、かかる過酸化水素の検出方法としては、硫酸チタンや硫酸バナジウムを用い過酸化水素を含む検液を発色させる方法や、ぺルオキシダーゼの存在下過酸化水素によって4−アミノアンチピリンとフェノールなどの水素供与体とを酸化縮合させ、被検査物を含む検液を発色させる方法(4−アミノアンチピリン法)、同じくぺルオキシダーゼの存在下4−メトキシ−1−ナフトールを添加することで検液を発色させる方法(メトキシナフトール法)等がある。また、更に他の方法として、過マンガン酸カリウム法やヨウ素法などの滴定法がある。
【0004】
下記特許文献1には、4−アミノアンチピリン法で用いる試薬に、両性界面活性剤を配合することで試薬を安定化する方法に関する開示がある。
【0005】
また、下記特許文献2には、過酸化水素に固有の酸化還元電位について電極間に生じる電圧或いは電流を検出する装置を用いて、過酸化水素を簡易にかつ精度よく検出する酸素電極法が開示されている。
【0006】
【特許文献1】特開2006−10711号公報
【0007】
【特許文献2】特開2006−3330号公報
【発明の開示】
【発明が解決しようとする課題】
【0008】
しかしながら、硫酸チタンや硫酸バナジウムを用い過酸化水素を含む検液を発色させる方法では、過酸化水素の検出限界が10ppmと感度が悪く、また、過マンガン酸カリウム法やヨウ素法などの滴定法は過酸化水素以外の物質を過酸化水素として検出してしまうので特異性がなく、蛋白質を除去する等の前処理を必要としかかる作業は非常に煩雑である。
【0009】
また、従来の4−アミノアンチピリン法による検出では、0.05ppmという微量の過酸化水素の検出を行っているために濃縮などの前処理に非常に手間がかかるとともに、発色した検液の吸光度を測定するため高額な分析機器を必要とする。そして、酸素電極法による検出においても、4−アミノアンチピリン法と同様、前処理の手間や高額な分析機器を必要とする。よって、製造業者等の過酸化水素や水素供与体の検査を行い者が例えば食品製造の都度このような過酸化水素の検出作業を行うことは困難である。
【0010】
本発明は、上記した従来の問題点に鑑みてなされたものであって、前処理の手間を軽減可能であり、特別の器具等を使用することなく何人も簡単に操作をすることができる過酸化水素検出具及び過酸化水素検出方法、水素供与体検出具の提供することを目的とする。
【課題を解決するための手段】
【0011】
上記目的を達成するために、本発明に係る過酸化水素検出具は、4−アミノアンチピリン法による過酸化水素の検出に用いるための4−アミノアンチピリン又はその誘導体、水素供与体、または、ぺルオキシダーゼのうち、少なくともぺルオキシダーゼが担持されている担持体を備えている構成にしてある。
【0012】
また、前記構成において、担持体が膜状部材であるものである。
【0013】
そして、前記した構成において、膜状部材がニトロセルロ−ス膜であるものである。
【0014】
更に、本発明に係る4−アミノアンチピリン法による過酸化水素検出方法は、被検査物を含む検液に、ペルオキシダーゼ、水素供与体、及び4−アミノアンチピリンを添加して被検査物に含まれている過酸化水素を検出する4−アミノアンチピリン法による過酸化水素検出方法であって、ペルオキシダーゼが担持された担持体を検液に浸漬することを特徴とする被検査物を含む検液に、ペルオキシダーゼ、水素供与体、及び4−アミノアンチピリンを添加して被検査物に含まれている過酸化水素を検出する過酸化水素検出方法であって、ペルオキシダーゼが担持された担持体を検液に浸漬することを特徴とするものである。
【0015】
更に、本発明に係る水素供与体検出具は、水素供与体の検出に用いるための4−アミノアンチピリン又はその誘導体、過酸化水素、または、ぺルオキシダーゼのうち、少なくともぺルオキシダーゼが担持されている担持体を備えていることを特徴とするものである。
【発明の効果】
【0016】
本発明に係る過酸化水素検出具によれば、4−アミノアンチピリン法による過酸化水素の検出に用いるための4−アミノアンチピリン又はその誘導体、水素供与体、または、ぺルオキシダーゼのうち、少なくともぺルオキシダーゼが担持されている担持体を備えているので、該担持体を被検査物を含む検液に浸漬することで、過酸化水素の有無を検出でき、特別の器具等を使用することなく簡単な操作を行うだけでよく、前処理の手間を軽減可能である。
【0017】
また、担持体が膜状部材である場合は、過酸化水素検出具の取り扱いが容易となる。
【0018】
そして、膜状部材がニトロセルロ−ス膜である場合には、過酸化水素検出具を検液に浸漬した際ペルオキシダーゼが担持体から検液中に溶出することなく、ニトロセルロ−ス膜に担持されたままの状態で発色するので、ペルオキシダーゼが検液中に溶解するために濃度が低下するといったことなく、担持体において濃い色で発色するため、過酸化水素の有無の判定が容易となる。
【0019】
更に、本発明に係る過酸化水素検出方法は、被検査物を含む検液に、ペルオキシダーゼ、水素供与体、及び4−アミノアンチピリンを添加して被検査物に含まれている過酸化水素を検出する4−アミノアンチピリン法による過酸化水素検出方法であって、ペルオキシダーゼが担持された担持体を検液に浸漬することを特徴とするので、特別の器具等を使用することなく簡単な操作で容易に過酸化水素の検出を行うことができる。
【0020】
更に、本発明に係る水素供与体検出具によれば、水素供与体の検出に用いるための4−アミノアンチピリン又はその誘導体、過酸化水素、または、ぺルオキシダーゼのうち、少なくともぺルオキシダーゼが担持されている担持体を備えているので、該担持体を被検査物を含む検液に浸漬することで、水素供与体の有無を検出でき、特別の器具等を使用することなく簡単な操作を行うだけでよく、前処理の手間を軽減可能である。
【発明を実施するための最良の形態】
【0021】
本発明の最良の実施形態を図面に基づいて説明する。ここに、図1は本発明の一実施形態に係る過酸化水素検出具の斜視図、図2は前記過酸化水素検出具を用いた過酸化水素検出方法の操作手順を示す図である。
図1において、この実施形態に係る過酸化水素検出具1は、担持体3に4−アミノアンチピリン法による過酸化水素の検出に用いるための4−アミノアンチピリン又はその誘導体、水素供与体、または、ぺルオキシダーゼのうち、少なくともぺルオキシダーゼが担持されている担持部2を備えている。尚、図1〜3では担持部2を1箇所のみとしたが、これに限定されず、2箇所以上としても構わない。
【0022】
担持体3には少なくともペルオキシダーゼが担持されていればよく、4−アミノアンチピリン又はその誘導体、水素供与体のいずれか又は双方が担持体3に担持されなくても構わない。このように4−アミノアンチピリン又はその誘導体、水素供与体のいずれか又は双方が担持体3に担持されない場合には、この担持されていない物質を別途所定量を検液へ添加する必要がある。
【0023】
担持体3に4−アミノアンチピリン又はその誘導体、及び/または水素供与体が担持されていない場合のこれらの物質の検液への添加方法は、4−アミノアンチピリン又はその誘導体、または水素供与体のそれぞれの原液をそのまま添加してもよく、水などの溶媒により希釈した希釈液を添加してもよい。また、4−アミノアンチピリン又はその誘導体と水素供与体とを混合した後で検液に添加してもよい。
【0024】
そして、4−アミノアンチピリン又はその誘導体、及び水素供与体の原液又は希釈液中に、過酸化水素検出具1とは別の担持体を各々浸漬するなどして、該別の担持体に担持させたものを添加してもよい。更には、4−アミノアンチピリン、又は水素供与体を凍結乾燥し、粉末状としたものを用いてもよい。
【0025】
4−アミノアンチピリン又はその誘導体は、後述する水素供与体と酸化縮合反応して発色する物質であれば特に限定されないが、特に汎用性があり、良好な発色性を示す点で4−アミノアンチピリンが好ましい。4−アミノアンチピリン又はその誘導体の濃度は、特に限定されないが、通常、被検査物に対し0.05重量%〜1重量%程度が好ましい。
【0026】
水素供与体は、例えば、フェノール、2−クロロフェノール、4−クロロフェノール、2,4−ジクロロフェノールなどのフェノール類、アニリン、N,N−ジメチルアニリン、N,Nーゼチルアニリン、N,Nーゼチル−m−トルイジン、N,N−ジメチル−m−アニシジン、N−エチル−N−(3−メチルフェニル)−N'−アセチルエチレンジアミン、N−エチル−N−(β−ヒドロキシエチル)−m−トルイジン、N−エチル−N−(2−ヒドロキシ−3−スルホプロピル)−m−トルイジン、N−エチル−N−スルホプロピル−m−トルイジン、N−エチル−N−スルホプロピル−3,5−ジメトキシアニリン、N−エチル−N−(2−ヒドロキシ−3−スルホプロピル)−3,5−ジメトキシアニリン、N−(2−ヒドロキシ−3−スルホプロピル)−3,5−ジメトキシアニリン、N−エチル−N−スルホプロピル−m−アニシジン、N−エチル−N−(3−メチルフェニル)−N'−サクシニルエチレンジアミン、N−エチル−N−(2−ヒドロキシ−3−スルホプロピル)−m−アニシジン、N−エチル−N−(2−ヒドロキシ−3−スルホプロピル)−m−トルイジンなどのアニリン類が用いられる。
水素供与体の濃度は特に限定されないが、被検査物に対し0.5重量%〜8重量%程度が好ましい。
【0027】
ぺルオキシダーゼは、その起源、由来に特に限定はなく、植物、動物、微生物から得られるペルオキシダーゼが、1種若しくは要すれば2種以上組み合わせて用いられる。また、その使用量は目的に応じて適宜定められ、特に限定されないが、例えば、被検査物に対し1ppm〜100ppm 程度が好ましい。
【0028】
担持体3は、有機、無機のいずれの材質でもよく、例えば、無機系の担持体3としては、ケイソウ土、カオリナイトーゼオライト、多孔質ガラス、セラミック等を、有機系の担持体3としては、ナイロン樹脂、ポリエチレン樹脂、アクリル樹脂、ポリプロピレン樹脂、ポリエステル樹脂、セルロース樹脂等を挙げることができる。
【0029】
図1においては操作性が良好である点から担持体3として膜状部材を示したが、これに限定されず、他の形状、例えば、粒状部材等であってもよい。担持体3が膜状部材の場合、例えば、濾紙、ガラス繊維膜、多孔性又は非多孔性の高分子膜等を用いることができる。高分子膜として、ナイロン膜、ポリエチレン膜、ポリエチレンテレフタレート膜、ポリプロピレン膜、ポリビニリデンフルオライド(PVDF)膜、ニトロセルロース膜や酢酸セルロース膜等のセルロース類膜などが挙げられる。
【0030】
膜状部材を用いる場合、その大きさは特に限定されないが、容易に処理及び保管可能であることが好ましい。例えば、縦10mm〜50mm、横8mm〜15mm、厚さ0.05mm〜2.0mm程度であれば、作成及び取り扱いが容易となり好ましい。
【0031】
そして、上記膜状部材の中でも特にニトロセルロース膜が好ましい。ニトロセルロース膜は、過酸化水素検出具を検液に浸漬した際ペルオキシダーゼが担持体から検液中に溶出することなく、ニトロセルロ−ス膜に担持されたままの状態で発色するので、ペルオキシダーゼが検液中に溶解するために濃度が低下するといったことなく、担持体で濃い色の発色をするため、過酸化水素の有無の判定が容易となる。
【0032】
また、4−アミノアンチピリン又はその誘導体、水素供与体、またはペルオキシダーゼの担持部2への担持方法は、化学結合であってもよく、物理的な相互作用であってもよい。例えば、担持体3表面の所定箇所にこれらの物質をピペットなどにより所定量滴下し、自然乾燥させる方法等があげられる。その際、ペルオキシダーゼ以外に4−アミノアンチピリン又はその誘導体及び/または水素供与体を担持体3に担持する場合には、4−アミノアンチピリン又はその誘導体及び/または水素供与体をペルオキシダーゼより先に担持部2に担持させた後、ペルオキシダーゼを担持されることが好ましい。理由は、ペルオキシダーゼが表面側にあることにより過酸化水素に直接接触しやすいためと考えられる。
【0033】
固定化の温度は酵素が失活しない温度であれば限定されないが、5℃から30℃が好ましい。
【0034】
また担持体には、4−アミノアンチピリン又はその誘導体、水素供与体、または、ぺルオキシダーゼの他、酵素活性を維持するための、pH調整剤や酵素活性保護剤等を担持させてもよい。例えばpH調整剤には、一般的な緩衝剤を用いる方法を適用できる。緩衝剤としては、公知の試薬組成物に用いられているいずれのものであってもよく、例えば、pHを5〜8に維持することができるリン酸、グリシン、トリス及びグッドの緩衝液を挙げることができる。pH調整剤を加える場合その濃度は特に限定されないが、通常、0.1M〜1M程度が好ましい。また、上記pH調整剤や酵素活性保護剤等を担持体に担持しない場合であっても、過酸化水素の検出を行う際検液に上記pH調整剤や酵素活性保護剤等を添加することとしてもよい。
【0035】
検液中に過酸化水素が存在すると、ペルオキシダーゼが過酸化水素を分解して活性な酸素を放出し、この活性な酸素により水素供与体と4−アミノアンチピリン又はその誘導体とを酸化縮合させ、発色する芳香環を化合物であるキノン色素を生成させる。係る反応式の一例を下記に示す。
【0036】
【化1】

上記反応式は、ペルオキシダーゼ存在下、過酸化水素、4−アミノアンチピリン又はその誘導体としての4−アミノアンチピリン、水素供与体としてのフェノールとが酸化縮合反応し、水を生成することを示している。
【0037】
過酸化水素検出具1は、過酸化水素検出操作を行う際、その都度作成し、作成後すぐに使用することしてもよいが、冷蔵庫内で保管することにより例えば2〜3ヶ月といった所定期間の保存が可能である。冷蔵庫内で保管する際には、密閉容器内で窒素を封入し、シリカゲル等の乾燥剤とともに保管することが好ましい。これにより、過酸化水素検出具1が空気中の酸素と反応するといったことなく、より長期間の保存が可能となる。
【0038】
ここで、過酸化水素検出具1を用いて過酸化水素の検出を行う被検査物としては、過酸化水素の検出を必要とする物質、例えば、シラス干し、チリメン、カマボコ、うどんが挙げられる。ここで、シラス干しとは、カタクチイワシ、マイワシ、ウナギ、アユ等の稚魚を釜ゆで後、乾燥したものである。
【0039】
引続き、過酸化水素検出具を用いた過酸化水素の検出方法につき、以下に説明する。図2は、本実施形態に係る過酸化水素検出方法の操作手順を示す図である。図2では、被検査物4の一例としてシラス干しを用いた例を示す。まず、図2(a)に示す被検査物4を(b)に示すように複数の小片に裁断し、(c)において所定量の検液5に添加する。被検査物4と検液5との割合は、被検査物に対する検液の重量が、2〜8程度が好ましく、例えば被検査物5gに対し検液としての0.2Mリン酸緩衝液が25mlである。
【0040】
次に、(d)に示すように被検査物4を含む検液5中に過酸化水素検出具1を添加し、常温常圧下で所定時間、例えば、5分〜30分程度放置する。図2に示す方法では、担持体3に4−アミノアンチピリン又はその誘導体、水素供与体、及びぺルオキシダーゼの全てが担持された過酸化水素検出具1を用いている。その後、(e)に示すように過酸化水素検出具1を検液5から取り出し、水洗し、(f)においてペルオキシダーゼの発色の有無を判断する。
【0041】
この結果、図2(f)の過酸化水素検出具1aのように、担持部2aが発色しない場合には、1ppm以上の過酸化水素は検出されなかったこととなる。これに対し、過酸化水素検出具1bのように、ペルオキシダーゼを担持した担持部2bが赤色に発色していれば、被検査物4に1ppm以上の過酸化水素が検出されたこととなる。
【0042】
図2では、担持体3の担持部2には、4−アミノアンチピリン又はその誘導体、水素供与体及びペルオキシダーゼの全てが担持された過酸化水素検出具1を用いた例を示したが、他の実施形態として、過酸化水素検出具1の担持部2にペルオキシダーゼのみ担持し、水素供与体及び4−アミノアンチピリンは担持しない例を以下に示す。
【0043】
図3は、4−アミノアンチピリン又はその誘導体、及び水素供与体を担持していない過酸化水素検出具1cを用いて、過酸化水素の検出を行う場合の操作手順の一部を示す。4−アミノアンチピリン又はその誘導体、及び水素供与体が過酸化水素検出具1cに担持されない場合にも、図2に示す(a)(b)と同様の工程を行って、被検査物4を複数の小片に裁断し、所定量の検液5に添加する。その後、図2の(c)〜(f)の工程に替えて図3(c’)〜(f’)の工程を行う。
【0044】
図3の(c’)において、例えば、過酸化水素検出具1cとは別の担持体6,7にそれぞれ担持された4−アミノアンチピリン又はその誘導体及び水素供与体を、ペルオキシダーゼを担持部2に担持する過酸化水素検出具1cとともに検液5cに添加する。
【0045】
図3(d’)に示す状態で、5分〜20分程度の所定時間経過すると、担持体6,7から4−アミノアンチピリン及び水素供与体がそれぞれ検液中に溶出する。そして、図3(e’)に示すように、過酸化水素検出具1cを取り出し、水洗する。検液中に過酸化水素がない場合または、1ppmより少ない場合には図3(f’)の過酸化水素検出具1dに示すように、担持部2dが発色しない。これに対し、検液が1ppm以上の過酸化水素を含有する場合には過酸化水素検出具1eのように、ペルオキシダーゼを担持する担持部2eが赤色に発色する。これにより被検査物から1ppm以上の過酸化水素が検出されたことを判断可能である。
【0046】
以上より、従来、4−アミノアンチピリン法により、吸光度測定機器を用いて過酸化水素の検出を行った場合には、過酸化水素が検出されるかどうかの判断に約1日かかっていたところ、5〜20分で判断可能であるので、時間の大幅の短縮が可能となる。これにより、食品加工業者が工場内で簡易に過酸化水素の検出する際の手間を省くことができる。
【0047】
尚、本発明の過酸化水素検出具及び過酸化水素検出方法に用いるぺルオキシダーゼが担持されている担持体3は、過酸化水素の存在下、4−アミノアンチピリンと水素供与体と結合してキノン色素を生成する性質を有しているので、これを過酸化水素検出具としてだけではなく、水素供与体の検出用として用いてもよい。このような目的で使用する場合、水素供与体検出具の担持体には4−アミノアンチピリン又はその誘導体、過酸化水素、または、ぺルオキシダーゼのうち、少なくともぺルオキシダーゼが担持され、被検査物に水素供与体が検出された場合に、担持部が発色する構造とする。そして、水素供与体検出具は、4−アミノアンチピリン又はその誘導体、過酸化水素を担持体に担持しなくてもよく、水素供与体の検出操作を行う際これら物質を別途添加する構造としてもよい。水素供与体の担持体に担持するペルオキシターゼの使用濃度としては、通常1ppm〜100ppm、好ましくは40ppm〜60ppmである。
【実施例1】
【0048】
過酸化水素を0.2Mリン酸緩衝液に溶解し濃度を5.0ppmとした検液2mLと、過酸化水素を添加しない0.2Mリン酸緩衝液のみの検液2mLとを用い、本発明に係る過酸化水素検出具の発色の状態を比較した。担持体は、縦18mm〜20mm、横8mm〜10mmに裁断したバイオラド社製ニトロセルロース膜(厚さ0.1mm)を用いた。ペルオキシダーゼを5ppmに調整し、エッペンドルフ社製マイクロピペット(型番リファレンス4910)により前記担持体の表面に、1箇所につき20μLずつを2箇所に滴下し、自然乾燥を行うため室温で20分間放置した。このようにして、ペルオキシダーゼのみが担持体の2箇所の担持部に円形状に担持されている過酸化水素検出具を作成した。
【0049】
そして、0.4重量%4−アミノアンチピリン0.1mLと、水素供与体として1.9重量%フェノール0.3mLとをそれぞれ検液に添加すると共に、上記のように作成した過酸化水素検出具を検液中に浸漬した。過酸化水素検出具の浸漬より20分経過した時点で、担持体を検液から取り出し蒸留水により洗浄し、発色の状態を島津製作所製デンシトメーターCS9000を用いて測定した。測定条件は、波長を520nmした。
(比較例1)
【0050】
過酸化水素の検出方法として4−アミノアンチピリン法と、メトキシナフトール法との比較を行うため、上記実施例1と同様の条件で5ppmペルオキシダーゼ20μLを2箇所の担持部に滴下し、担持されて作成した過酸化水素検出具を用いると共に、上記実施例1に係る4−アミノアンチピリン及びフェノールに替えて、0.15重量%4−メトキシ−1−ナフトールを0.4mL検液に添加し、その後の処理は上記実施例1と同様の条件で試験を行った。実施例1及び比較例1の結果を表1及び図4に以下に示す。
【0051】
【表1】

【0052】
表1において各数値は担持部の発色の濃淡の測定値であり、数値が高い程担持部が濃い発色となっていることを示す。これらの数値は各々の条件において得られた複数の測定値の平均値を示している。また、図4は縦軸に表1に示す数値をとり、横軸に各条件をとったものであり、横軸に示した文字BLは過酸化水素を添加しない場合であり、ST5ppmは5.0ppmの過酸化水素を添加した場合である。更に、図4には、検出試験の結果得られた過酸化水素検出具の発色状態を示している。
【0053】
表1及び図4に示すように、比較例1に係る4−メトキシ−1−ナフトールを添加した担持体は、過酸化水素を添加しない検液に浸漬した場合にも薄い青色の発色を示した。これに対し、実施例1に係る4−アミノアンチピリン及び水素供与体を添加した検液の担持体は過酸化水素を含有しない検液は全く発色せず、5.0ppmの過酸化水素を添加した検液では赤く発色するという適正な結果が得られた。
【実施例2】
【0054】
担持体の材質の検討を行うため、担持体として、上記実施例1のバイオラド社製ニトロセルロース膜の他、アドバンテック社製濾紙(厚さ0.2mm)、アドバンテック社製ガラス繊維(厚さ0.5mm)、ミリポア社製親水性PVDF膜(厚さ0.1mm)の4種を用い、5.0ppmの過酸化水素を検液2mLとして、上記実施例1と同様の条件で試験を行った。検液に担持体を浸漬した後約20分間放置した時点の検液及び過酸化水素検出具を図5に示す。
【0055】
図5より、いずれの担持体も赤色に発色した。特に、濾紙については担持体全体が薄い色に発色するとともに検液自体も薄い赤色に発色した。ガラス繊維膜、PVDF膜については担持体全体が濃い色に発色すると共に、検液自体も濾紙を浸漬させた検液よりも濃い赤色に発色した。
【0056】
これに対し、ニトロセルロース膜は担持体のペルオキシダーゼを担持させた担持部のみ円形状に赤色に発色し、担持部以外は発色しなかった。また、検液が発色することもなかった。これは、濾紙、ガラス繊維膜、PVDF膜では、ペルオキシダーゼが担持体から検液中に溶出したと考えられ、ニトロセルロース膜では担持体から検液中に溶出することなく、担持体に担持されたままであると考えられる。
【実施例3】
【0057】
水素供与体としてのフェノールの濃度を変更し、担持体の発色状況を試験した。フェノールの濃度範囲は0.5重量%〜8.0重量%とし、他の条件は5.0ppmの過酸化水素を検液2mLとした上記実施例1と同様とした。結果を表2に示す。
【表2】

【0058】
表2より、0.5重量%〜8.0重量%の全範囲で発色が認められる良好な結果が得られた。特に水素供与体の濃度が高い程、濃い色に発色する傾向となり、8.0重量%の値が49mmと最も良かった。これより、実施例1と同様の条件で作成した5ppmのぺルオキシダーゼのみが担持されてなる担持体を、水素供与体の検出を行う際にも利用可能であることが分かった。即ち、ペルオキシダーゼを担持させてなる担持体を水素供与体の検出を行いたい検液中に浸漬すると共に、所定量の過酸化水素及び4−アミノアンチピリンを該検液に添加することで水素供与体の検出が可能となる。
【実施例4】
【0059】
4−アミノアンチピリンの濃度を0.05重量%〜1.0重量%の範囲で変更すると共に、1.9重量%フェノールに替えて8.0重量%フェノールを用いた以外は5.00ppm過酸化水素を検液とした上記実施例1と同様に担持体の発色状況を試験した。結果を表3に示す。
【表3】

【0060】
表3より、全ての範囲で発色が認められる良好な結果が得られ、特に、0.1重量%で最も濃い発色となった。
【実施例5】
【0061】
ペルオキシダーゼの濃度を1ppm〜100ppmの範囲で変更すると共に、1.9重量%フェノールに替えて8.0重量%フェノールを、0.4重量%4−アミノアンチピリンに替えて0.1重量%4−アミノアンチピリンを用いた以外は5.00ppm過酸化水素を検液とした上記実施例1と同様に担持体の発色状態を測定した。結果を表4に示す。
【表4】

【0062】
この結果全範囲で発色が認められる良好な結果が得られ、特に5〜100ppmにおいてより濃い発色となる結果が得られ、この範囲内では余り差が認められなかった。
【実施例6】
【0063】
担持体に担持させるペルオキシダーゼの量を検討するため、実施例1では5ppmペルオキシダーゼ20μLを担持体に担持させたところ、5ppmペルオキシダーゼを用い1箇所の滴下量を5μL〜50μLの範囲で変更し、また、1.9重量%フェノールに替えて8.0重量%フェノールを、0.4重量%4−アミノアンチピリンに替えて0.1重量%4−アミノアンチピリンを用いた以外は5.00ppm過酸化水素を検液とした上記実施例1と同様とした。結果を表5に示す。
【表5】

【0064】
表5より、全範囲で発色が認められる良好な結果が得られた。再現性に関しては20μLが最も良い結果となり、7回測定を行ったところ標準偏差3.7、変動係数3.4%であった。
【実施例7】
【0065】
担持部の発色状態の変化を確認するため、5.0ppmの過酸化水素2mLに、8.0重量%のフェノール0.3mL、0.1重量%4−アミノアンチピリン0.1mLを添加した検液に、5ppmのペルオキシダーゼ20μLずつを2箇所に担持した担持体を浸漬した。15分間の浸漬後、担持体を検液から取り出して蒸留水で1分間洗浄し、ろ紙にはさんで水分を除き、10分間放置した。この時点での発色状態を測定し、得られた数値を基準とし、15分〜420分までの間の各時点で発色状態を測定した場合の担持部の濃さの割合を算出した。結果を表6に示す。
【表6】

【0066】
表6より、担持体が湿っている状態の15分の時点では、色が濃く見えるために数値が安定しないが、担持体が乾燥する20分以後は数値がほぼ一定となり、20分〜420分経過後について発色状態にほとんど変化が見られなかった。
【実施例8】
【0067】
担持体の発色に要する時間を測定するため、ペルオキシダーゼを担持させた担持体を検液中に浸漬する際の浸漬時間を5〜30分の間で変更した。また、フェノールの濃度を1.9重量%に替えて8.0重量%に、0.4重量%4−アミノアンチピリンに替えて0.1重量%4−アミノアンチピリンとし、他の条件は5.00ppm過酸化水素を検液とした上記実施例1と同様とした。結果を表7に示す。
【表7】

【0068】
表7より、5分〜30分の範囲でいずれも良好な発色状態であり、全範囲でほとんど差は見られなかった。これより、約5分で反応が終了していると考えられる。
【実施例9】
【0069】
担持体の過酸化水素の検出限界となる濃度を確認するため、過酸化水素の濃度を0.1〜10ppmの範囲で変更し、また、フェノールの濃度を1.9重量%に替えて8.0重量%に、0.4重量%4−アミノアンチピリンに替えて0.1重量%4−アミノアンチピリンとし、他の条件は5.00ppm過酸化水素を検液とした上記実施例1と同様とした。結果を表8及び図3に示す。
【表8】

【0070】
表8より、発色の程度は低いものの0.1ppmから担持部の発色が確認でき、3ppmまでは直線性が認められ、それ以上の範囲では十分濃い色の発色が確認できた。
【実施例10】
【0071】
ペルオキシダーゼ等の物質を担持させ、検出具を作成後、直ちに検出を行うのではなく、暫く保管した後に検出を行う際にも適正な結果が得られるかどうか、保存安定性の確認試験を行った。即ち、上記実施例1と同様の条件で過酸化水素検出具を作成した。作成直後及び30度の室温において5時間放置後の過酸化水素検出具を用いて、5ppmの過酸化水素の発色試験を行った。尚、発色試験は検液に添加するフェノールの濃度を1.9重量%に替えて、8.0重量%に、0.4重量%4−アミノアンチピリンに替えて0.1重量%4−アミノアンチピリンとした以外は上記実施例1と同様の条件とした。
【0072】
また、30度の室温において5時間の放置の際の保存方法は、1.そのまま放置、2.密閉容器内に酸素吸収剤(アイ・エス・オー社製A-500HS、4g入/袋、以下同じ)と保存、3.密閉容器内に窒素を充填し酸素吸収剤と共に保存、4.密閉容器内に窒素を充填し保存、5.密閉容器内にシリカゲル(豊田化工株式会社製乾燥剤5g入/袋、以下同じ)と保存、6.密閉容器内に窒素を充填しシリカゲルと共に保存、7.密閉容器内に五酸化リンと保存の7種類の条件とした。結果を表9に示す。
【表9】

【0073】
表9では、各条件における発色の濃さを示す数値とともに、過酸化水素検出具の作成直後の発色状態を100%とし、これに対する5時間放置後の検出具の発色状態の変化の割合を算出したものを示している。表9より、そのまま室内で放置した場合には発色の状態が20.7%にまで低下していた。この原因としては、空気中の酸素によって過酸化水素検出具が酸化されたか、又は空気中の水分が過酸化水素検出具に何らかの影響を与えていると考えられる。
【0074】
そこで、まず、空気中の酸素による酸化を防止するため密閉容器内に酸素吸収剤と保存した場合には29.6%、密閉容器内に窒素を充填し酸素吸収剤と共に保存した場合は27.8%、密閉容器内に窒素を充填し保存した場合は53.3%という結果が得られ、そのまま放置した場合に比較して、発色状態は、酸素吸収剤使用では同程度であったが、窒素充填のみで保存すると、2倍の改善が認められた。
【0075】
次に、空気中の水分を排除した状態で保存するため、過酸化水素検出具を、密閉容器内にシリカゲルと保存した場合、密閉容器内に窒素を充填しシリカゲルと共に保存した場合、密閉容器内に五酸化リンと保存した場合には、64.4%〜75.2%の発色状態が維持可能であることが分かった。よって、空気中の水分を排除した状態で保存することにより、予め多数の過酸化水素検出具を作成し必要量を複数回に分けて使用したいような場合にも、適正な検出結果を得ることが可能であることが確認できた。
【実施例11】
【0076】
実施例10にかかる保存安定性について、担持体に担持させるペルオキシダーゼの濃度を高くすることで発色状態の低下防止の効果があるかどうか確認するため、ペルオキシダーゼの濃度を5ppm及び50ppmの2種類とした以外は上記実施例10と同様の条件で過酸化水素検出具を作成し、約30℃の室温で5時間放置した。放置の際は密閉容器内に窒素を充填し、シリカゲルと共に保存することとした。結果を表10に示す。
【表10】

【0077】
表10よりペルオキシダーゼの濃度を50ppmとすることで、検出具作成の後5時間放置後においても良好な発色性を示すことが分かった。尚、上記実施例5において過酸化水素検出具を作成した直後に使用する場合には、ペルオキシダーゼの濃度が5〜100ppmの範囲内では余り差が認められていない。よって、過酸化水素検出具を作成後直ちに使用する場合には担持させるペルオキシダーゼの濃度は5ppm、50ppmのいずれでもほぼ同じ結果が得られるが、暫く保存後使用する場合には50ppmとした方がよりよいことが分かる。
【実施例12】
【0078】
過酸化水素検出具の保存の際の温度による影響を確認するため上記実施例11における約30度の室温で保存に替えて、約4℃の冷蔵庫内、−30℃及び−80℃の冷凍庫内で、それぞれ過酸化水素検出具の作成後10日間保存した。結果を表11に示す。
【表11】

【0079】
表11より、過酸化水素検出具を−80℃〜4℃の低温にて保存することで10日経過後においても発色の状態がほとんど低下しないという良好な結果が得られた。これより、本発明に係る過酸化水素検出具を作成直後に使用せず、所定期間経過後使用する場合には、食品加工業者では通常設置されている冷蔵庫又は冷凍庫にて保存することで保存安定性を維持できることが分かった。
【実施例13】
【0080】
実施例12では10日間程度の保存安定性について試験したが、更に長期間の保存状態を確認するため以下の試験を行った。即ち、実施例12と同様に、50ppmのペルオキシダーゼ20μLをニトロセルロース膜からなる担持体に担持させ、密閉容器内に窒素を充填し、シリカゲルと共に、約4℃の冷蔵庫内で作成直後〜12ヶ月間保存した。
【0081】
また、水素供与体及び4−アミノアンチピリンについても担持体に担持させた状態での保存を行った。水素供与体としてのフェノールはアドバンテック社製濾紙(厚さ0.2mm)を縦2cm、横2cmに裁断してなる担持体に、24重量%エタノール溶液100μLを吸収させ、室内で放置し自然乾燥させた。4−アミノアンチピリンは水素供与体と同じアドバンテック社製濾紙を縦2cm、横1cmに裁断してなる担持体に、0.2重量%4−アミノアンチピリン水溶液を50μL吸収させた後、冷蔵庫(4℃)で乾燥させた。
【0082】
その後、該フェノール及び4−アミノアンチピリンをそれぞれ担持した担持体を密閉容器内に窒素を充填し、シリカゲルと共に、約4℃の冷蔵庫内で保存した。
【0083】
更に、ペルオキシダーゼと共に、水素供与体及び4−アミノアンチピリンを一個の担持体に担持させた過酸化水素検出具についても上記と同様の試験を行った。即ち、バイオラド社製ニトロセルロース膜(厚さ0.1mm)に8.0重量%フェノール15μLをエッペンドルフ社製マイクロピペット(型番リファレンス4910)により滴下し、乾燥した後、0.1重量%4−アミノアンチピリン5μLを同様に滴下、乾燥し、更に、50ppmペルオキシダーゼ20μLを同様に滴下、乾燥し、過酸化水素検出具を作成した。該過酸化水素検出具を上記同様、密閉容器内に窒素を充填し、シリカゲルと共に、4℃の冷蔵庫内で作成直後〜12ヶ月保存を行った。結果を表12に示す。
【表12】

【0084】
表12より、ペルオキシダーゼ、フェノール及び4−アミノアンチピリンをそれぞれ異なる担持体に担持させた場合、及びこれらを全て一個の担持体に担持させた場合の双方において6ヶ月間保存した際にも発色状態を約100%維持可能であり、12ヶ月保存した場合においても発色性がほとんど低下せず、長期保存が可能であることが分かった。
【実施例14】
【0085】
試験用シラスを作成し、該試験用シラスについて本発明に係る過酸化水素検出具と、酸素電極法との過酸化水素検出のための比較実験を行った。試験用シラスは、沸騰水1Lに食塩20gと過酸化水素標準液を5,000μg〜100,000μg添加し、ここに水道水でよく洗浄した生シラス120gを添加し5分間煮沸した。その後、ザルに取り出して水切りを行い、10分間放冷することにより作成した。得られた試験用シラス5gを
すりつぶし、0.2Mリン酸緩衝液25mLに添加した。ここに上記実施例13のペルオキシダーゼ、フェノール及び4−アミノアンチピリンの各々の担持体と同様の条件で作成した過酸化水素検出具を浸漬させ10分間放置した後、蒸留水で洗浄した。発色の状態を、島津製作所製デンシトメーターCS9000により算出した。
(比較例2)
【0086】
上記実施例14と同様の条件で作成した試験用シラス5gの過酸化水素濃度を酸素電極法により測定するため、以下の試験を行った。実施例14と同様の条件で作成した試験用シラスをホモジナイズし、その5gを秤量し0.5%臭素酸カリウム含有0.2Mリン酸緩衝液を加えて50mLとし、その溶液をろ過し、ろ液を酸素電極法により測定した。測定機器は、セントラル科学社製高感度過酸化水素計スーパーオリテクターモデル5(SUPER ORITECTOR MODEL5)を用い、測定条件をRangを0.1、サンプル液量を2mL、窒素流量を65mL/min、カタラーゼ液量を25μLとした。実施例14及び比較例2の結果を表13に示す。
【表13】

【0087】
表13より、本発明に係る過酸化水素検出具を用いた過酸化水素の検出結果と、酸素電極法による検出結果はほぼ等しいものであった。これより、本発明に係る過酸化水素検出具を用いた試験はデータの信頼性が十分高いことが確認できた。
【実施例15】
【0088】
市販のシラス干し10検体について、本発明に係る過酸化水素検出具を用いた簡易検出方法及び酸素電極法で過酸化水素の含有量の比較試験を行った。結果を表14に示す。
【表14】

【0089】
表14より、本発明に係る過酸化水素検出具は酸素電極法により得られた過酸化水素濃度と略同じ程度の値を示しめすことが確認できた。よって、食品に1ppm前後以上の過酸化水素が含有されているかどうか確認することができ、食品製造業者の食品の衛生管理に要する負担を軽減可能である。
【図面の簡単な説明】
【0090】
【図1】本発明の一実施形態に係る過酸化水素検出具の斜視図である。
【図2】本発明の一実施形態に係る過酸化水素の検出方法を示す図である。
【図3】本発明の他の実施形態に係る過酸化水素の検出方法を示す図である。
【図4】前記他の実施形態にかかる過酸化水素検出具の実施例及び比較例の発色状態を示す図である。
【図5】前記他の実施形態にかかる複数の過酸化水素検出具の発色状態を示す図である。
【符号の説明】
【0091】
11a,1b,1c,1d,1e 過酸化水素検出具
3 担持体
4,4a 被検査物
5,5c 検液
【特許請求の範囲】
【請求項1】
4−アミノアンチピリン法による過酸化水素の検出に用いるための4―アミノアンチピリン又はその誘導体、水素供与体、または、ぺルオキシターゼのうち、少なくともぺルオキシターゼが担持されてなる担持体を備えてなることを特徴とする過酸化水素検出具。
【請求項2】
担持体が膜状部材であることを特徴とする請求項1に記載の過酸化水素検出具。
【請求項3】
膜状部材がニトロセルロ−ス膜であることを特徴とする請求項2に記載の過酸化水素検出具。
【請求項4】
被検査物を含む検液に、ペルオキシターゼ、水素供与体、及び4―アミノアンチピリンを添加して被検査物に含まれている過酸化水素を検出する4−アミノアンチピリン法による過酸化水素検出方法であって、
ペルオキシターゼが担持された担持体を検液に浸漬することを特徴とする4−アミノアンチピリン法による過酸化水素検出方法。
【請求項5】
水素供与体の検出に用いるための4―アミノアンチピリン又はその誘導体、過酸化水素、または、ぺルオキシターゼのうち、少なくともぺルオキシターゼが担持されてなる担持体を備えてなることを特徴とする水素供与体検出具。
【請求項1】
4−アミノアンチピリン法による過酸化水素の検出に用いるための4―アミノアンチピリン又はその誘導体、水素供与体、または、ぺルオキシターゼのうち、少なくともぺルオキシターゼが担持されてなる担持体を備えてなることを特徴とする過酸化水素検出具。
【請求項2】
担持体が膜状部材であることを特徴とする請求項1に記載の過酸化水素検出具。
【請求項3】
膜状部材がニトロセルロ−ス膜であることを特徴とする請求項2に記載の過酸化水素検出具。
【請求項4】
被検査物を含む検液に、ペルオキシターゼ、水素供与体、及び4―アミノアンチピリンを添加して被検査物に含まれている過酸化水素を検出する4−アミノアンチピリン法による過酸化水素検出方法であって、
ペルオキシターゼが担持された担持体を検液に浸漬することを特徴とする4−アミノアンチピリン法による過酸化水素検出方法。
【請求項5】
水素供与体の検出に用いるための4―アミノアンチピリン又はその誘導体、過酸化水素、または、ぺルオキシターゼのうち、少なくともぺルオキシターゼが担持されてなる担持体を備えてなることを特徴とする水素供与体検出具。
【図1】


【図2】


【図3】


【図4】


【図5】




【図2】


【図3】


【図4】


【図5】


【公開番号】特開2010−127888(P2010−127888A)
【公開日】平成22年6月10日(2010.6.10)
【国際特許分類】
【出願番号】特願2008−306248(P2008−306248)
【出願日】平成20年12月1日(2008.12.1)
【出願人】(591023594)和歌山県 (62)
【Fターム(参考)】
【公開日】平成22年6月10日(2010.6.10)
【国際特許分類】
【出願日】平成20年12月1日(2008.12.1)
【出願人】(591023594)和歌山県 (62)
【Fターム(参考)】
[ Back to top ]

