過酸化物分解酵素
【課題】 乳酸菌に由来する新規な過酸化物分解酵素の提供。
【解決手段】 ラクトバチルス・プランタラム(Lactobacillus plantarum)TY1572株(NITE P-90)由来で、下記の理化学的性質を有する過酸化物分解酵素A及び/又はB。
〔過酸化物分解酵素A〕(1)基質特異性:NAD(P)Hの存在下、過酸化物に高い反応性を示し、かつ過酸化水素にも反応する、(2)分子量:43kDa(SDSポリアクリルアミドゲル電気泳動による測定)
〔過酸化物分解酵素B〕(1)基質特異性:NAD(P)Hの存在下、過酸化物に高い反応性を示し、かつ過酸化水素にも反応する、(2)分子量:48kDa(SDSポリアクリルアミドゲル電気泳動による測定)
【解決手段】 ラクトバチルス・プランタラム(Lactobacillus plantarum)TY1572株(NITE P-90)由来で、下記の理化学的性質を有する過酸化物分解酵素A及び/又はB。
〔過酸化物分解酵素A〕(1)基質特異性:NAD(P)Hの存在下、過酸化物に高い反応性を示し、かつ過酸化水素にも反応する、(2)分子量:43kDa(SDSポリアクリルアミドゲル電気泳動による測定)
〔過酸化物分解酵素B〕(1)基質特異性:NAD(P)Hの存在下、過酸化物に高い反応性を示し、かつ過酸化水素にも反応する、(2)分子量:48kDa(SDSポリアクリルアミドゲル電気泳動による測定)
【発明の詳細な説明】
【技術分野】
【0001】
本発明は、乳酸菌が産生する過酸化物分解酵素に関する。
【背景技術】
【0002】
生体内外の過酸化物を除去するために、生物は様々な過酸化物分解酵素を有しており、代表的な過酸化物分解酵素として、例えば、グルタチオンペルオキシダーゼが挙げられる。
【0003】
グルタチオンペルオキシダーゼは、動物をはじめとする生物全般に広く存在し、グルタチオンを介した複数段階の反応によって下記一般式(1)に示されるように、過酸化物をアルコール類と水に変換する(非特許文献1〜4参照)。
【0004】
【化1】

【0005】
このように、過酸化物分解酵素は動植物をはじめとする生物に広く存在し、強酸、強アルカリ、加熱等による変性失活のおそれがない限り、抗酸化能力を有する。
【先行技術文献】
【非特許文献】
【0006】
【非特許文献1】吉川敏一、他3名、「活性酸素・フリーラジカルの全て」、丸善株式会社、p.85-92
【非特許文献2】谷口直之、「活性酸素実験プロトコール」、秀潤社、p.84-95
【非特許文献3】二木鋭雄,他2名、「抗酸化物質」、学会出版センター、p79-86、p321-323
【非特許文献4】国際生化学連合酵素委員会報告 「酵素名・酵素反応記号一覧」共立出版株式会社、p70-88
【発明の概要】
【発明が解決しようとする課題】
【0007】
ところで、ヨーグルトなど広く発酵食品に利用されている乳酸菌の一部は抗酸化酵素を有していると言われているが、その諸性質については不明な点が多く、そのため前記酵素の諸性質を明らかにすることが求められている。
【課題を解決するための手段】
【0008】
そこで、本発明者らは、種々の発酵食品から乳酸菌を分離し、該乳酸菌の培養菌体の諸性質について鋭意検討したところ、ラクトバチルス属(Lactobacillus)に属する乳酸菌が産生する酵素が過酸化物に対して分解特性を示すことを見出し、本発明を完成した。
【0009】
すなわち、本発明の要旨は以下のとおりである。
〔1〕 ラクトバチルス・プランタラム(Lactobacillus plantarum) TY-1572株(NITE P-90)由来で、下記の理化学的性質を有する過酸化物分解酵素、
(1)基質特異性
NAD(P)Hの存在下、過酸化物に高い反応性を示し、かつ過酸化水素にも反応する
(2)分子量
43kDa(SDSポリアクリルアミドゲル電気泳動による測定)
〔2〕 ラクトバチルス・プランタラム(Lactobacillus plantarum) TY-1572株(NITE P-90)由来で、下記の理化学的性質を有する過酸化物分解酵素、
(1)基質特異性
NAD(P)Hの存在下、過酸化物に高い反応性を示し、かつ過酸化水素にも反応する
(2)分子量
48kDa(SDSポリアクリルアミドゲル電気泳動による測定)
〔3〕 前記〔1〕及び/又は〔2〕記載の過酸化物分解酵素を含有する飲食品、化粧品または医薬品。
【発明の効果】
【0010】
本発明によれば、乳酸菌のうち、ラクトバチルス・プランタラム(Lactobacillus plantarum) TY-1572株(NITE P-90)に由来する新規な過酸化物分解酵素を提供することができる。また、前記酵素を飲食品、化粧品または医薬品に含有させることにより、該酵素が有する過酸化物除去能力を活用することが期待できる。
【図面の簡単な説明】
【0011】
【図1】酵素Aの電気泳動図である。
【図2】酵素Bの電気泳動図である。
【発明を実施するための最良の形態】
【0012】
本発明の過酸化物分解酵素の製造に用いられる乳酸菌は、ラクトバチルス・プランタラム(Lactobacillus plantarum) TY-1572株(NITE P-90)である。本発明者らが検討したところ、該菌株は本発明において「酵素A」および「酵素B」と称する2種類の過酸化物分解酵素を産生する。酵素Aは、(1)基質特異性として、NAD(P)Hの存在下、過酸化物に高い反応性を示し、かつ過酸化水素にも反応し、(2)分子量として、SDSポリアクリルアミドゲル電気泳動(SDS−PAGE)による測定で43kDaを示す。酵素Bは、(1)基質特異性として、NAD(P)Hの存在下、過酸化物に高い反応性を示し、かつ過酸化水素にも反応し、(2)分子量として、SDSポリアクリルアミドゲル電気泳動(SDS−PAGE)による測定で48kDaを示す。すなわち、酵素A,Bはともに同様の基質特異性を示す一方、分子量が異なるものである。
【0013】
なお、本発明において過酸化水素とは、水素原子に過酸基を有する過酸化物であり、過酸化物とは、通常の過酸化脂質(例えば、過酸化リノール酸など)の他、炭化水素基に過酸基を有する過酸化物(例えば、過酸化ブチル、過酸化クメンなど)を含む概念であり、過酸化水素は含まれない。また、上記の酵素反応において、過酸化物はアルコール類と水に分解(還元)されていると推測され、過酸化水素は水に分解(還元)されていると推測される。
【0014】
過酸化物に対して分解特性を示すラクトバチルス・プランタラム(Lactobacillus plantarum) TY-1572株(NITE P-90)は次のようにしてスクリーニングすることができる。すなわち、まず、各種発酵食品を分離源とし、該分離源を固形培地で培養して乳酸菌を単離し、該単離した乳酸菌を液体培地で培養して得られる培養物から菌体を回収し、次いで該菌体を含有する菌体懸濁液を被検液として、該被検液が、過酸化物に対する分解特性を有するか否か調べることによりスクリーニングすることができる。
【0015】
本発明において発酵食品とは、一般的に乳酸菌が含まれている動物性および植物性の発酵食品をいい、代表的な発酵食品を例示すれば、例えば、散麹、豆麹、餅麹、麹漬、味噌漬け、糠漬、野沢菜漬、すんき漬、ベッタラ漬、味噌、醤油、酒粕、納豆、米酢、バルサミコ酢、リンゴ酢、キムチ、腐乳、ナンプラー、とうふよう、ワイン粕、酒粕、ヨーグルト、ベジマイト、クワス、クミス、ギビヤック、ピクルス、クミス、サワークラウト等が挙げられる。そして、培養に際して、前記発酵食品を破砕し、例えば生理食塩水で希釈した食品懸濁液とすることが好ましい。
【0016】
固形培地としては、乳酸菌の培養に通常用いられる培地であればよく、代表的なものを例示すれば、例えば、酵母エキスペプトン培地、ブドウ糖培地、フェネチルアルコール培地、アセテート培地、GYP培地、MRS培地、TITG培地、SL培地、システイン・ミルク培地、LBS培地、TATAC培地、MG培地、食塩18%-硝酸カリ培地、麹汁培地、BCP培地、チオグリコレイト培地、稀釈ブドウ果汁培地、ESY培地、吉栖氏培地、耐塩性乳酸菌用培地、耐塩性乳酸菌用醤油培地、上野培地、飯塚・山里培地、TYG培地、ラクチック培地、M17培地、Lactic streptococciの分別培地、クエン酸を発酵するLactic streptococciの分別培地、PPYL培地、YPG培地、酸性トマト培地、Mayeux&ColmerのLeuconostoc検出培地、浜本らのLeuconostoc検出培地、Pearce&HaliganのLeuconostoc計測培地、APT培地、Briggsのトマトジュース培地、Rogosa培地、NAP培地等に、固形化剤として0.5〜2.0%の寒天を添加したものが挙げられる。また、培地上に乳酸菌を選択的に増殖させるため、好気性菌の発育を阻害する物質(例えば、アジ化ナトリウム)、グラム陰性菌の発育を阻害する物質(例えば、ポリミキシンB)、真菌の発育を阻害する物質(例えば、シクロヘキシミド)などを適宜組み合わせて前記固形培地に含有させてもよい。また、液体培地としては、乳酸菌の培養に通常用いられる培地であればよく、代表的なものを例示すれば、例えば、酵母エキスペプトン培地、ブドウ糖培地、フェネチルアルコール培地、アセテート培地、GYP培地、MRS培地、TITG培地、SL培地、システイン・ミルク培地、LBS培地、TATAC培地、MG培地、食塩18%-硝酸カリ培地、麹汁培地、BCP培地、チオグリコレイト培地、稀釈ブドウ果汁培地、ESY培地、吉栖氏培地、耐塩性乳酸菌用培地、耐塩性乳酸菌用醤油培地、上野培地、飯塚・山里培地、TYG培地、ラクチック培地、M17培地、Lactic streptococciの分別培地、クエン酸を発酵するLactic streptococciの分別培地、PPYL培地、YPG培地、酸性トマト培地、Mayeux&ColmerのLeuconostoc検出培地、浜本らのLeuconostoc検出培地、Pearce&HaliganのLeuconostoc計測培地、APT培地、Briggsのトマトジュース培地、Rogosa培地、NAP培地等が挙げられる。
【0017】
乳酸菌の培養は、常法にしたがって行えばよく、例えば、30〜40℃、10〜40時間の条件で好気的培養、静置培養または中和培養などを行えばよい。
【0018】
培養終了後、乳酸菌のコロニーを1コロニーずつ単離し、常法にしたがって純化することが好ましい。そして、前記単離した乳酸菌株を常法にしたがって培養し、得られた培養物を遠心分離して菌体を回収し、該菌体に緩衝液を加えてOD660nm=1.5〜1.7に濃度調節した菌体懸濁液を調製し、該菌体懸濁液が、過酸化物に対する分解特性を示すか否か調べ、過酸化物に対する分解特性を示す乳酸菌株を本発明の目的に適した乳酸菌とする。
【0019】
過酸化物に対する分解特性は、例えば、前記菌体懸濁液に過酸化物(終濃度1.0〜3.0mM)、および必要に応じて糖類(例えば、グルコース)(終濃度30〜100mM)をそれぞれ添加して、37℃で3時間反応させ、反応終了後の反応液を遠心分離し、上清に含まれる過酸化物残量を測定することにより評価される。なお、前記糖類は、乳酸菌株の代謝によるエネルギーを供与するために添加するものであるが、必ずしも添加しなくてもよい。
【0020】
以上のようにして分離した乳酸菌株の過酸化物分解特性を評価することにより、過酸化物分解特性を示すものとして、乳酸菌TY-1572株を選択することができる。そして、菌学的性質および遺伝学的特性の結果から、乳酸菌TY-1572株は、ラクトバチルス・プランタラム(Lactobacillus plantarum)と同定された。上記菌株は、ラクトバチルス・プランタラム(Lactobacillus plantarum)TY1572(NITE P-90)として独立行政法人製品評価技術基盤機構特許微生物寄託センターに寄託されている。
【0021】
本発明では、上述のようにして単離した乳酸菌TY-1572株を常法にしたがって培養し、得られた培養物を遠心分離して菌体を回収し、該菌体に緩衝液を加えた菌体懸濁液や、該菌体懸濁液を機械的方法、酵素的方法等で破砕して得られる無細胞抽出液など粗酵素の状態で利用することができる。該粗酵素中には本発明に係る酵素A,Bは共存しているため、粗酵素の状態で利用する場合、酵素A,Bは併用されることになる。また、該粗酵素液を被覆保護材(例えば、レシチン、キチン等)でミセル化してカプセルとして、あるいは賦形剤(例えば、デキストリン等)で吸着させて粉末として利用してもよい。さらに、前記粗酵素液は、常法にしたがい、凍結乾燥,噴霧乾燥などを行い、乾燥品としても利用可能である。
【0022】
酵素A,Bをそれぞれ単独使用する場合は、前記粗酵素液を精製して使用すればよい。該粗酵素液の精製にあたっては、例えば、前記菌体懸濁液を破砕して得られる無細胞抽出液に遠心処理を行い、該無細胞抽出液から未破砕菌体を除去したものが粗酵素液として用いられる。そして、この粗酵素液に、例えば、硫酸アンモニウム、硫酸ナトリウム等の塩析処理、および疎水ブチルカラム、弱陰イオン交換カラム、ゲルろ過カラム、アフィニティーカラム等のクロマトグラフィーを適宜組み合わせることで精製酵素を得ることができる。精製された酵素A,Bは、SDS−PAGEでそれぞれほぼ単一のバンドを示す程度に純化されている。
【0023】
なお、上記の各種クロマト法を適用した際に得られる各画分については、各画分の過酸化物分解活性、およびタンパク質のピークパターンを分析することで酵素AまたはBを含有する画分が回収される。過酸化物分解活性は、各画分に電子供与体であるNADHまたはNADPH(以下、「NAD(P)H」という場合がある)および電子受容体である過酸化物を添加し、37℃で3分間反応させ、反応後におけるNAD(P)H濃度と過酸化物濃度を測定することで評価される。NAD(P)H濃度は340nmの吸光度により測定され、過酸化物濃度は公知のチオシアン酸−鉄錯体による発色法により測定される。
【0024】
上記のようにして得られる酵素Aは以下の理化学的性質を示す。
(1)基質特異性
NAD(P)Hの存在下、過酸化物に高い反応性を示し、かつ過酸化水素にも反応する。
(2)分子量
43kDa(SDSポリアクリルアミドゲル電気泳動による測定)。
なお、過酸化水素分解活性は、酵素Aの方が酵素Bよりも低い。
【0025】
また、酵素Bは以下の理化学的性質を示す。
(1)基質特異性
NAD(P)Hの存在下、過酸化物に高い反応性を示し、かつ過酸化水素にも反応する。
(2)分子量
48kDa(SDSポリアクリルアミドゲル電気泳動による測定)。
【0026】
本発明に係る酵素A,Bはそれぞれ単独でまたは両者を共存させて、例えば、飲食品、化粧品、医薬品に含有させた状態で用いることができる。前記酵素を飲食品等に含有させることにより、該酵素が有する過酸化物除去能力を活用することが期待できる。
【実施例】
【0027】
以下に実施例を示して本発明を詳細に説明するが、本発明は当該実施例に限定されるものではない。
【0028】
1.乳酸菌のスクリーニング
1-1.食品懸濁液の調製
乳酸菌の分離源として、散麹、豆麹、餅麹、麹漬、味噌漬け、糠漬、野沢菜漬、すんき漬、ベッタラ漬、味噌、醤油、酒粕、納豆、米酢、バルサミコ酢、リンゴ酢、キムチ、腐乳、ナンプラー、とうふよう、ワイン粕、酒粕、ヨーグルト、ベジマイト、クワス、クミス、ギビヤック、ピクルス、クミス、サワークラウト、果実、野菜、海藻、魚類を入手し、前記食品をそれぞれ破砕した後、生理食塩水で希釈して食品懸濁液とした。
【0029】
1-2.スクリーニング
GYP培地(1% グルコース,1% 酵母エキス,0.5% ペプトン,0.2% 酢酸ナトリウム・3H20,20ppm MgSO4・7H20,1ppm MnSO4・4H20,1ppm FeSO4・7H20,1ppm NaCl,50ppm Tween80)にアジ化ナトリウム(終濃度30ppm)、ポリミキシンB(終濃度30ppm)およびシクロヘキシミド(終濃度30ppm)を含む選択寒天培地に前記「1-1.食品懸濁液の調製」で調製した食品懸濁液をそれぞれ添加し、30℃で16時間静置培養した。培養終了後、前記「1-1.食品懸濁液の調製」に記載の分離源から調製した食品懸濁液添加試料からコロニーが生育していることが確認され、1コロニーずつ単離した。そして、得られた乳酸菌株のコロニーをGYP寒天培地上に植菌して常法にしたがい純化した。そして、上記食品群から分離した乳酸菌株をTY-1572株と命名した。
【0030】
2.乳酸菌の菌学的性質
前記「1-2.スクリーニング」で分離した乳酸菌株(TY-1572株)の菌学的性質を、乳酸菌実験マニュアル(小崎道雄監修、内村泰、岡田早苗著、朝倉書店)にしたがって検討した。結果を表1に示す。
【0031】
【表1】

【0032】
3.乳酸菌の遺伝学的特性
前記「1-2.スクリーニング」で分離したTY-1572株について、常法にしたがい16S rDNAの塩基配列を決定し、BLASTプログラムおよびClustal Wプログラムを使用して、既存の乳酸菌のうちどの菌種の配列に最も近いか検索した。その結果、乳酸菌TY-1572株の16S rDNAの塩基配列がラクトバチルス・プランタラム(Lactobacillus plantarum)の16S rDNAの塩基配列と100%一致した。以上の結果から、乳酸菌TY-1572株はラクトバチルス・プランタラム(Lactobacillus plantarum)と同定された。
【0033】
4.乳酸菌の過酸化物分解特性
前記「3.乳酸菌の遺伝学的特性」で同定されたTY-1572株の菌体懸濁液に過酸化物を添加し、所定時間経過後の反応液中に残存する過酸化物の残量を測定して、過酸化物に対する分解特性を調べた。
【0034】
4-1.菌体懸濁液の調製
TY-1572株の菌株をそれぞれGYP培地に接種して37℃で約24時間静置培養した。培養終了後、培養物を8,000rpmで10分間遠心分離し、上清を除去することにより菌体を集菌した。次いで、集菌した菌体をリン酸緩衝液に懸濁し、OD660nm=1.6に濃度調節したものを菌体懸濁液とした。
【0035】
4-2.過酸化物に対する分解特性
前記「4-1.菌体懸濁液の調製」で調製した菌体懸濁液に過酸化物(過酸化クメンまたは過酸化t−ブチル)(終濃度3.0mM)とグルコース(終濃度50mM)をそれぞれ加え、水平震盪機にて37℃で3時間反応させた。反応終了後、卓上遠心機にて反応液を遠心処理し、上清に含まれる未反応の前記過酸化物濃度を測定した。
【0036】
過酸化物の濃度測定には、ヘモグロビン存在下における過酸化物とメチレンブルー誘導体の等モル呈色反応を利用した八木別法を用いた。測定方法は八木別法測定キットであるデタミナーLPO(協和メデックス)の説明書に準ずる。得られたデータに基づいて過酸化物の分解量を算出したところ、過酸化クメンについては約2800μMであり、過酸化t−ブチルについては約800μMであった。
【0037】
4-3.過酸化物に対する分解特性
前記「4-2.過酸化物に対する分解特性」で使用した過酸化物に代えてリノール酸由来の過酸化物(過酸化リノール酸)を実験に供した。過酸化物は、リノール酸溶液にリポキシゲナーゼを加えて湯浴中(30℃)で約5分間、酸素を吹き込みながら激しく撹拌して得られたものを使用した。なお、過酸化リノール酸の確認には薄層クロマトグラフィーを用いた(参考文献:過酸化脂質実験法、金田尚志、植田伸夫編集、医歯薬出版株式会社、Agric.Biol.Chem. 45,P587−593,1981、汎用衛生試験法と解説、日本薬学会編、南山堂、P33、脂質分析法入門、藤野安彦、学会出版センター、P100)。実験に際しては、得られた過酸化リノール酸を乳化分散させたものを使用した。乳化分散した過酸化リノール酸液の過酸化物濃度は、約1000μMであった。
【0038】
そして、前記「4-2.過酸化物に対する分解特性」で調製した菌体懸濁液に上述した過酸化リノール酸水溶液(終濃度1mM)とグルコース(終濃度50mM)をそれぞれ加え、水平震盪機にて37℃で3時間反応させた。反応終了後、卓上遠心機にて反応液を遠心分離し、上清に含まれる未反応の過酸化リノール酸濃度を測定した。過酸化リノール酸濃度の測定方法は前記「4-2.過酸化物に対する分解特性」に準じて行った。得られたデータに基づいて過酸化リノール酸の分解量を算出したところ、約850μMであった。
【0039】
5.過酸化物分解酵素の精製
過酸化物分解酵素の精製を次のようにして行った。なお、各精製段階における、NADH濃度、過酸化クメン(過酸化物として)濃度、タンパク質濃度およびSDS−PAGEは下記の方法にて測定した。
【0040】
(NADH濃度)
NADHの濃度測定には、該物質が有する吸光波長(λ=340nm)の減少にて活性を測定した。具体的には、マイクロブラックセルに約10mM、pH無調製トリス緩衝液500μlに溶解した終濃度150μM NADH、終濃度500μM 過酸化クメン、1/100倍容 被検試料(無細胞抽出液又は各精製段階で得られた各画分)を予め3分間37℃にて加温し、順次添加しその都度転換混和した。ダブルビーム吸光度計(ε340=6.220 M−1cm−1)にて本酵素の活性を37℃で経時的にNADHの減少量として測定した。過酸化クメンの分解に伴うNADH減少活性は、過酸化クメンを添加した際の初速から添加直後の前記被検試料の初速を引いて算出した。必要に応じてNADHの代わりにNADPHを用いて測定した。
【0041】
(過酸化クメン濃度)
過酸化クメンの濃度測定は、チオシアン酸−鉄錯体による発色法を用いた。前記「(NADH濃度)」と同じ実験系を用い、過酸化クメンと反応させた過酸化物分解酵素を適宜希釈し、500μl、2.0 mlエッペンドルフチューブに採取し、10%トリクロロ酢酸水溶液を500μl、0.01 N 硫酸にて溶解した硫酸アンモニウム鉄(II)10 mMを100μl、2.5 M チオシアン酸カリウムを500μl順次添加し、赤色に反応したサンプルを、ダブルビーム分光光度計にてλ=480nmにて測定した。
【0042】
(タンパク質濃度)
過酸化クメン分解活性を有する各画分のタンパク質濃度は、ブラッドフォード法と呼ばれる常法を用いて算出した。測定原理はクマシーブリリアントブルー(CBB)という色素がタンパク質と結合した際の赤紫色から青への変色を利用したものである。タンパク質の濃度の定量を行う際には、既知のタンパク質である鶏卵白アルブミンにて検量線を作製し、タンパク質濃度を算出した。
【0043】
(SDS−PAGE)
酵素精製過程における精製度の確認や、回収に際し有用な画分の判断には、SDS−PAGEを使用した。酵素の解析には、「初歩からのバイオ実験」(大山 徹、渡部 俊弘編著、三共出版)を参考に実施し、必要に応じて前著の変法を用いている。
【0044】
アクリルアミド29.2g、N,N’-メチレンビスアクリルアミド0.8g、100ml蒸留水にて調製したゲル作製ストック溶液A液、pH8.8に調整した1.5Mトリス緩衝液に0.4%SDSを溶解せしめたゲル作製ストック溶液B液、pH6.8に調整した0.5Mトリス緩衝液に0.4%SDSを溶解せしめたゲル作製ストック溶液C液、および10%過硫酸アンモニウム溶液からなるゲル作製ストック溶液D液をそれぞれ調製し作成用プレートに分注した。分離用SDSポリアクリルアミドゲルの硬化後、濃縮用SDSポリアクリルアミドゲルを重層した。
【0045】
作製したゲルプレートを泳動用緩衝液で満たした泳動槽にセットし濃縮ゲル部分では7.5〜10mA、濃縮ゲル通過後は15〜20mAに電流を印加し電気泳動を行った。電気泳動はゲルプレート下端手前約1cmにて泳動を停止し、染色工程に移行した。
【0046】
泳動終了後のポリアクリルアミドゲルをクマシーブリリアントブルー(CBB) 染色液にて染色し、その後明瞭な染色バンドが得られるまで脱色作業を行った。
【0047】
5-1.粗酵素液の調製
乳酸菌を培養する方法については、当業者が用いる常法に従って行った。乳酸菌の培養に通常用いられるGYP液体培地20 l にラクトバチルス・プランタラム(Lactobacillus plantarum)TY-1572株(NITE P-90)を接種し、ジャーファーメンターにて37℃、13〜14時間培養した。対数増殖期後期に培養菌体を遠心処理にて回収した。回収培養菌体についてはpH7.0、50mMリン酸緩衝液にて培養菌体を洗浄した。
【0048】
該菌体懸濁液をリゾチーム処理、超音波処理による破砕、超高圧細胞破砕機による破砕にて得られたものを粗酵素液とした。
【0049】
5-2.塩析処理、脱核酸処理およびクロマトグラフィー
上述の操作で得られた粗酵素液に硫酸アンモニウムによる塩析処理、ストレプトマイシン硫酸塩による脱核酸処理を行った。本工程で得られた上清をカラムに供して精製を実施した。
【0050】
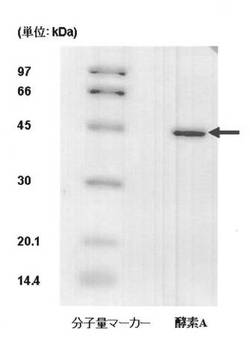
上述の操作で得られた粗酵素液の上清を疎水ブチルカラム、弱陰イオン交換カラム、ゲル濾過カラムに供して酵素Aを得た。画分回収の判断はAbs280nmによるタンパク回収量と、過酸化クメンに対する分解活性を指標として判断した。画分は回収毎に透析処理を行った。回収画分中に特に過酸化クメンの分解能力が高く、精製されているバンドをSDS−PAGEにかけたところ、約43kDaの位置に単一バンドの存在を確認し、本画分を精製酵素とした。電気泳動の結果を示す(図1)。
【0051】
上述の操作で得られた粗酵素液の上清を疎水ブチルカラム、アフィニティーカラムに供して酵素Bを得た。画分回収の判断はAbs280nmによるタンパク回収量と、過酸化クメンの分解活性を指標として判断した。画分は回収毎に透析処理を行った。
【0052】
回収画分中に特に過酸化クメンの分解能力が高く、精製されているバンドをSDS−PAGEにかけたところ、約48kDaの位置に単一バンドの存在を確認し、本画分を精製酵素とした。電気泳動の結果を示す(図2)。
【0053】
6.基質特異性
前記「5.過酸化物分解酵素の精製 (NADH濃度)」の実験系のうち、被検試料として精製した酵素AおよびBを使用し、過酸化クメンに代えて過酸化水素を使用した以外は前記と同様に酵素反応を行わせることにより、酵素A,Bの過酸化水素に対する分解活性を調べた。過酸化水素の濃度測定は、前記「5.過酸化物分解酵素の精製 (過酸化クメン濃度)」に準じて行った。測定の結果、酵素A,Bはともに過酸化水素にも反応し、過酸化水素分解活性は、酵素Aの方が酵素Bよりも低かった。
【0054】
また、精製した酵素AおよびBを使用し、過酸化クメンの存在下において阻害剤の検討を行った。阻害剤は、KCN、NaOH、pCMB、HgCl2、エタノール、quinine、quinacrineを使用した。試験条件は前記「5.過酸化物分解酵素の精製 (NADH濃度)」の実験系に準ずるが、阻害剤は終濃度2mMとし、過酸化クメン濃度は終濃度500μM、NADH濃度は終濃度150μMとした。測定の結果、酵素A,Bともに、KCN、pCMB、HgCl2、quinine、quinacrineを添加した際に過酸化物分解反応阻害効果が確認できた。
【0055】
7.過酸化物分解酵素の用途
7-1.過酸化物分解粗酵素液の製造例
水97.5重量部、ブドウ糖1重量部、大豆ペプチド0.5重量部および酵母エキス1重量部から構成される培地にTY-1572株を接種して、30℃で16時間静置培養し、培養後の培養物を遠心処理によって菌体を採取した。この菌体を湿重量に対し5倍容のリン酸緩衝液に懸濁し、270MPa以上の高圧処理にて菌体を破砕し、これを過酸化物分解粗酵素液とした。
【0056】
7-2.ヨーグルトの製造例
水44.36重量部、ゼラチン0.1重量部、砂糖8.2重量部、乳酸菌スターター0.05重量部、脱脂粉乳5.81重量部、牛乳41.4重量部、過酸化物分解粗酵素液0.03重量部、香料0.05重量部を混合してヨーグルトを得た。なお、過酸化物分解粗酵素液は前記で製造したものを使用した。
【0057】
7-3.アイスクリームの製造例
水55.85重量部、砂糖8.0重量部、水飴8.0重量部、液糖4.0重量部、植物油脂13.0重量部、脱脂粉乳8.5重量部、加糖卵黄(20%卵黄分)2.0重量部、過酸化物分解粗酵素液0.05重量部、安定剤0.5重量部および香料0.1重量部を混合してアイスクリームを得た。なお、過酸化物分解粗酵素液は前記で製造したものを使用した。
【0058】
7-4.化粧水の製造例
水73.89重量部、グリセリン5重量部、可溶化剤5重量部、界面活性剤1重量部、エタノール15.0重量部、過酸化物分解粗酵素液0.1重量部、防腐剤0.005重量部および香料0.005重量部を混合して化粧水を製造した。なお、過酸化物分解粗酵素液は前記で製造したものを使用した。
【技術分野】
【0001】
本発明は、乳酸菌が産生する過酸化物分解酵素に関する。
【背景技術】
【0002】
生体内外の過酸化物を除去するために、生物は様々な過酸化物分解酵素を有しており、代表的な過酸化物分解酵素として、例えば、グルタチオンペルオキシダーゼが挙げられる。
【0003】
グルタチオンペルオキシダーゼは、動物をはじめとする生物全般に広く存在し、グルタチオンを介した複数段階の反応によって下記一般式(1)に示されるように、過酸化物をアルコール類と水に変換する(非特許文献1〜4参照)。
【0004】
【化1】

【0005】
このように、過酸化物分解酵素は動植物をはじめとする生物に広く存在し、強酸、強アルカリ、加熱等による変性失活のおそれがない限り、抗酸化能力を有する。
【先行技術文献】
【非特許文献】
【0006】
【非特許文献1】吉川敏一、他3名、「活性酸素・フリーラジカルの全て」、丸善株式会社、p.85-92
【非特許文献2】谷口直之、「活性酸素実験プロトコール」、秀潤社、p.84-95
【非特許文献3】二木鋭雄,他2名、「抗酸化物質」、学会出版センター、p79-86、p321-323
【非特許文献4】国際生化学連合酵素委員会報告 「酵素名・酵素反応記号一覧」共立出版株式会社、p70-88
【発明の概要】
【発明が解決しようとする課題】
【0007】
ところで、ヨーグルトなど広く発酵食品に利用されている乳酸菌の一部は抗酸化酵素を有していると言われているが、その諸性質については不明な点が多く、そのため前記酵素の諸性質を明らかにすることが求められている。
【課題を解決するための手段】
【0008】
そこで、本発明者らは、種々の発酵食品から乳酸菌を分離し、該乳酸菌の培養菌体の諸性質について鋭意検討したところ、ラクトバチルス属(Lactobacillus)に属する乳酸菌が産生する酵素が過酸化物に対して分解特性を示すことを見出し、本発明を完成した。
【0009】
すなわち、本発明の要旨は以下のとおりである。
〔1〕 ラクトバチルス・プランタラム(Lactobacillus plantarum) TY-1572株(NITE P-90)由来で、下記の理化学的性質を有する過酸化物分解酵素、
(1)基質特異性
NAD(P)Hの存在下、過酸化物に高い反応性を示し、かつ過酸化水素にも反応する
(2)分子量
43kDa(SDSポリアクリルアミドゲル電気泳動による測定)
〔2〕 ラクトバチルス・プランタラム(Lactobacillus plantarum) TY-1572株(NITE P-90)由来で、下記の理化学的性質を有する過酸化物分解酵素、
(1)基質特異性
NAD(P)Hの存在下、過酸化物に高い反応性を示し、かつ過酸化水素にも反応する
(2)分子量
48kDa(SDSポリアクリルアミドゲル電気泳動による測定)
〔3〕 前記〔1〕及び/又は〔2〕記載の過酸化物分解酵素を含有する飲食品、化粧品または医薬品。
【発明の効果】
【0010】
本発明によれば、乳酸菌のうち、ラクトバチルス・プランタラム(Lactobacillus plantarum) TY-1572株(NITE P-90)に由来する新規な過酸化物分解酵素を提供することができる。また、前記酵素を飲食品、化粧品または医薬品に含有させることにより、該酵素が有する過酸化物除去能力を活用することが期待できる。
【図面の簡単な説明】
【0011】
【図1】酵素Aの電気泳動図である。
【図2】酵素Bの電気泳動図である。
【発明を実施するための最良の形態】
【0012】
本発明の過酸化物分解酵素の製造に用いられる乳酸菌は、ラクトバチルス・プランタラム(Lactobacillus plantarum) TY-1572株(NITE P-90)である。本発明者らが検討したところ、該菌株は本発明において「酵素A」および「酵素B」と称する2種類の過酸化物分解酵素を産生する。酵素Aは、(1)基質特異性として、NAD(P)Hの存在下、過酸化物に高い反応性を示し、かつ過酸化水素にも反応し、(2)分子量として、SDSポリアクリルアミドゲル電気泳動(SDS−PAGE)による測定で43kDaを示す。酵素Bは、(1)基質特異性として、NAD(P)Hの存在下、過酸化物に高い反応性を示し、かつ過酸化水素にも反応し、(2)分子量として、SDSポリアクリルアミドゲル電気泳動(SDS−PAGE)による測定で48kDaを示す。すなわち、酵素A,Bはともに同様の基質特異性を示す一方、分子量が異なるものである。
【0013】
なお、本発明において過酸化水素とは、水素原子に過酸基を有する過酸化物であり、過酸化物とは、通常の過酸化脂質(例えば、過酸化リノール酸など)の他、炭化水素基に過酸基を有する過酸化物(例えば、過酸化ブチル、過酸化クメンなど)を含む概念であり、過酸化水素は含まれない。また、上記の酵素反応において、過酸化物はアルコール類と水に分解(還元)されていると推測され、過酸化水素は水に分解(還元)されていると推測される。
【0014】
過酸化物に対して分解特性を示すラクトバチルス・プランタラム(Lactobacillus plantarum) TY-1572株(NITE P-90)は次のようにしてスクリーニングすることができる。すなわち、まず、各種発酵食品を分離源とし、該分離源を固形培地で培養して乳酸菌を単離し、該単離した乳酸菌を液体培地で培養して得られる培養物から菌体を回収し、次いで該菌体を含有する菌体懸濁液を被検液として、該被検液が、過酸化物に対する分解特性を有するか否か調べることによりスクリーニングすることができる。
【0015】
本発明において発酵食品とは、一般的に乳酸菌が含まれている動物性および植物性の発酵食品をいい、代表的な発酵食品を例示すれば、例えば、散麹、豆麹、餅麹、麹漬、味噌漬け、糠漬、野沢菜漬、すんき漬、ベッタラ漬、味噌、醤油、酒粕、納豆、米酢、バルサミコ酢、リンゴ酢、キムチ、腐乳、ナンプラー、とうふよう、ワイン粕、酒粕、ヨーグルト、ベジマイト、クワス、クミス、ギビヤック、ピクルス、クミス、サワークラウト等が挙げられる。そして、培養に際して、前記発酵食品を破砕し、例えば生理食塩水で希釈した食品懸濁液とすることが好ましい。
【0016】
固形培地としては、乳酸菌の培養に通常用いられる培地であればよく、代表的なものを例示すれば、例えば、酵母エキスペプトン培地、ブドウ糖培地、フェネチルアルコール培地、アセテート培地、GYP培地、MRS培地、TITG培地、SL培地、システイン・ミルク培地、LBS培地、TATAC培地、MG培地、食塩18%-硝酸カリ培地、麹汁培地、BCP培地、チオグリコレイト培地、稀釈ブドウ果汁培地、ESY培地、吉栖氏培地、耐塩性乳酸菌用培地、耐塩性乳酸菌用醤油培地、上野培地、飯塚・山里培地、TYG培地、ラクチック培地、M17培地、Lactic streptococciの分別培地、クエン酸を発酵するLactic streptococciの分別培地、PPYL培地、YPG培地、酸性トマト培地、Mayeux&ColmerのLeuconostoc検出培地、浜本らのLeuconostoc検出培地、Pearce&HaliganのLeuconostoc計測培地、APT培地、Briggsのトマトジュース培地、Rogosa培地、NAP培地等に、固形化剤として0.5〜2.0%の寒天を添加したものが挙げられる。また、培地上に乳酸菌を選択的に増殖させるため、好気性菌の発育を阻害する物質(例えば、アジ化ナトリウム)、グラム陰性菌の発育を阻害する物質(例えば、ポリミキシンB)、真菌の発育を阻害する物質(例えば、シクロヘキシミド)などを適宜組み合わせて前記固形培地に含有させてもよい。また、液体培地としては、乳酸菌の培養に通常用いられる培地であればよく、代表的なものを例示すれば、例えば、酵母エキスペプトン培地、ブドウ糖培地、フェネチルアルコール培地、アセテート培地、GYP培地、MRS培地、TITG培地、SL培地、システイン・ミルク培地、LBS培地、TATAC培地、MG培地、食塩18%-硝酸カリ培地、麹汁培地、BCP培地、チオグリコレイト培地、稀釈ブドウ果汁培地、ESY培地、吉栖氏培地、耐塩性乳酸菌用培地、耐塩性乳酸菌用醤油培地、上野培地、飯塚・山里培地、TYG培地、ラクチック培地、M17培地、Lactic streptococciの分別培地、クエン酸を発酵するLactic streptococciの分別培地、PPYL培地、YPG培地、酸性トマト培地、Mayeux&ColmerのLeuconostoc検出培地、浜本らのLeuconostoc検出培地、Pearce&HaliganのLeuconostoc計測培地、APT培地、Briggsのトマトジュース培地、Rogosa培地、NAP培地等が挙げられる。
【0017】
乳酸菌の培養は、常法にしたがって行えばよく、例えば、30〜40℃、10〜40時間の条件で好気的培養、静置培養または中和培養などを行えばよい。
【0018】
培養終了後、乳酸菌のコロニーを1コロニーずつ単離し、常法にしたがって純化することが好ましい。そして、前記単離した乳酸菌株を常法にしたがって培養し、得られた培養物を遠心分離して菌体を回収し、該菌体に緩衝液を加えてOD660nm=1.5〜1.7に濃度調節した菌体懸濁液を調製し、該菌体懸濁液が、過酸化物に対する分解特性を示すか否か調べ、過酸化物に対する分解特性を示す乳酸菌株を本発明の目的に適した乳酸菌とする。
【0019】
過酸化物に対する分解特性は、例えば、前記菌体懸濁液に過酸化物(終濃度1.0〜3.0mM)、および必要に応じて糖類(例えば、グルコース)(終濃度30〜100mM)をそれぞれ添加して、37℃で3時間反応させ、反応終了後の反応液を遠心分離し、上清に含まれる過酸化物残量を測定することにより評価される。なお、前記糖類は、乳酸菌株の代謝によるエネルギーを供与するために添加するものであるが、必ずしも添加しなくてもよい。
【0020】
以上のようにして分離した乳酸菌株の過酸化物分解特性を評価することにより、過酸化物分解特性を示すものとして、乳酸菌TY-1572株を選択することができる。そして、菌学的性質および遺伝学的特性の結果から、乳酸菌TY-1572株は、ラクトバチルス・プランタラム(Lactobacillus plantarum)と同定された。上記菌株は、ラクトバチルス・プランタラム(Lactobacillus plantarum)TY1572(NITE P-90)として独立行政法人製品評価技術基盤機構特許微生物寄託センターに寄託されている。
【0021】
本発明では、上述のようにして単離した乳酸菌TY-1572株を常法にしたがって培養し、得られた培養物を遠心分離して菌体を回収し、該菌体に緩衝液を加えた菌体懸濁液や、該菌体懸濁液を機械的方法、酵素的方法等で破砕して得られる無細胞抽出液など粗酵素の状態で利用することができる。該粗酵素中には本発明に係る酵素A,Bは共存しているため、粗酵素の状態で利用する場合、酵素A,Bは併用されることになる。また、該粗酵素液を被覆保護材(例えば、レシチン、キチン等)でミセル化してカプセルとして、あるいは賦形剤(例えば、デキストリン等)で吸着させて粉末として利用してもよい。さらに、前記粗酵素液は、常法にしたがい、凍結乾燥,噴霧乾燥などを行い、乾燥品としても利用可能である。
【0022】
酵素A,Bをそれぞれ単独使用する場合は、前記粗酵素液を精製して使用すればよい。該粗酵素液の精製にあたっては、例えば、前記菌体懸濁液を破砕して得られる無細胞抽出液に遠心処理を行い、該無細胞抽出液から未破砕菌体を除去したものが粗酵素液として用いられる。そして、この粗酵素液に、例えば、硫酸アンモニウム、硫酸ナトリウム等の塩析処理、および疎水ブチルカラム、弱陰イオン交換カラム、ゲルろ過カラム、アフィニティーカラム等のクロマトグラフィーを適宜組み合わせることで精製酵素を得ることができる。精製された酵素A,Bは、SDS−PAGEでそれぞれほぼ単一のバンドを示す程度に純化されている。
【0023】
なお、上記の各種クロマト法を適用した際に得られる各画分については、各画分の過酸化物分解活性、およびタンパク質のピークパターンを分析することで酵素AまたはBを含有する画分が回収される。過酸化物分解活性は、各画分に電子供与体であるNADHまたはNADPH(以下、「NAD(P)H」という場合がある)および電子受容体である過酸化物を添加し、37℃で3分間反応させ、反応後におけるNAD(P)H濃度と過酸化物濃度を測定することで評価される。NAD(P)H濃度は340nmの吸光度により測定され、過酸化物濃度は公知のチオシアン酸−鉄錯体による発色法により測定される。
【0024】
上記のようにして得られる酵素Aは以下の理化学的性質を示す。
(1)基質特異性
NAD(P)Hの存在下、過酸化物に高い反応性を示し、かつ過酸化水素にも反応する。
(2)分子量
43kDa(SDSポリアクリルアミドゲル電気泳動による測定)。
なお、過酸化水素分解活性は、酵素Aの方が酵素Bよりも低い。
【0025】
また、酵素Bは以下の理化学的性質を示す。
(1)基質特異性
NAD(P)Hの存在下、過酸化物に高い反応性を示し、かつ過酸化水素にも反応する。
(2)分子量
48kDa(SDSポリアクリルアミドゲル電気泳動による測定)。
【0026】
本発明に係る酵素A,Bはそれぞれ単独でまたは両者を共存させて、例えば、飲食品、化粧品、医薬品に含有させた状態で用いることができる。前記酵素を飲食品等に含有させることにより、該酵素が有する過酸化物除去能力を活用することが期待できる。
【実施例】
【0027】
以下に実施例を示して本発明を詳細に説明するが、本発明は当該実施例に限定されるものではない。
【0028】
1.乳酸菌のスクリーニング
1-1.食品懸濁液の調製
乳酸菌の分離源として、散麹、豆麹、餅麹、麹漬、味噌漬け、糠漬、野沢菜漬、すんき漬、ベッタラ漬、味噌、醤油、酒粕、納豆、米酢、バルサミコ酢、リンゴ酢、キムチ、腐乳、ナンプラー、とうふよう、ワイン粕、酒粕、ヨーグルト、ベジマイト、クワス、クミス、ギビヤック、ピクルス、クミス、サワークラウト、果実、野菜、海藻、魚類を入手し、前記食品をそれぞれ破砕した後、生理食塩水で希釈して食品懸濁液とした。
【0029】
1-2.スクリーニング
GYP培地(1% グルコース,1% 酵母エキス,0.5% ペプトン,0.2% 酢酸ナトリウム・3H20,20ppm MgSO4・7H20,1ppm MnSO4・4H20,1ppm FeSO4・7H20,1ppm NaCl,50ppm Tween80)にアジ化ナトリウム(終濃度30ppm)、ポリミキシンB(終濃度30ppm)およびシクロヘキシミド(終濃度30ppm)を含む選択寒天培地に前記「1-1.食品懸濁液の調製」で調製した食品懸濁液をそれぞれ添加し、30℃で16時間静置培養した。培養終了後、前記「1-1.食品懸濁液の調製」に記載の分離源から調製した食品懸濁液添加試料からコロニーが生育していることが確認され、1コロニーずつ単離した。そして、得られた乳酸菌株のコロニーをGYP寒天培地上に植菌して常法にしたがい純化した。そして、上記食品群から分離した乳酸菌株をTY-1572株と命名した。
【0030】
2.乳酸菌の菌学的性質
前記「1-2.スクリーニング」で分離した乳酸菌株(TY-1572株)の菌学的性質を、乳酸菌実験マニュアル(小崎道雄監修、内村泰、岡田早苗著、朝倉書店)にしたがって検討した。結果を表1に示す。
【0031】
【表1】

【0032】
3.乳酸菌の遺伝学的特性
前記「1-2.スクリーニング」で分離したTY-1572株について、常法にしたがい16S rDNAの塩基配列を決定し、BLASTプログラムおよびClustal Wプログラムを使用して、既存の乳酸菌のうちどの菌種の配列に最も近いか検索した。その結果、乳酸菌TY-1572株の16S rDNAの塩基配列がラクトバチルス・プランタラム(Lactobacillus plantarum)の16S rDNAの塩基配列と100%一致した。以上の結果から、乳酸菌TY-1572株はラクトバチルス・プランタラム(Lactobacillus plantarum)と同定された。
【0033】
4.乳酸菌の過酸化物分解特性
前記「3.乳酸菌の遺伝学的特性」で同定されたTY-1572株の菌体懸濁液に過酸化物を添加し、所定時間経過後の反応液中に残存する過酸化物の残量を測定して、過酸化物に対する分解特性を調べた。
【0034】
4-1.菌体懸濁液の調製
TY-1572株の菌株をそれぞれGYP培地に接種して37℃で約24時間静置培養した。培養終了後、培養物を8,000rpmで10分間遠心分離し、上清を除去することにより菌体を集菌した。次いで、集菌した菌体をリン酸緩衝液に懸濁し、OD660nm=1.6に濃度調節したものを菌体懸濁液とした。
【0035】
4-2.過酸化物に対する分解特性
前記「4-1.菌体懸濁液の調製」で調製した菌体懸濁液に過酸化物(過酸化クメンまたは過酸化t−ブチル)(終濃度3.0mM)とグルコース(終濃度50mM)をそれぞれ加え、水平震盪機にて37℃で3時間反応させた。反応終了後、卓上遠心機にて反応液を遠心処理し、上清に含まれる未反応の前記過酸化物濃度を測定した。
【0036】
過酸化物の濃度測定には、ヘモグロビン存在下における過酸化物とメチレンブルー誘導体の等モル呈色反応を利用した八木別法を用いた。測定方法は八木別法測定キットであるデタミナーLPO(協和メデックス)の説明書に準ずる。得られたデータに基づいて過酸化物の分解量を算出したところ、過酸化クメンについては約2800μMであり、過酸化t−ブチルについては約800μMであった。
【0037】
4-3.過酸化物に対する分解特性
前記「4-2.過酸化物に対する分解特性」で使用した過酸化物に代えてリノール酸由来の過酸化物(過酸化リノール酸)を実験に供した。過酸化物は、リノール酸溶液にリポキシゲナーゼを加えて湯浴中(30℃)で約5分間、酸素を吹き込みながら激しく撹拌して得られたものを使用した。なお、過酸化リノール酸の確認には薄層クロマトグラフィーを用いた(参考文献:過酸化脂質実験法、金田尚志、植田伸夫編集、医歯薬出版株式会社、Agric.Biol.Chem. 45,P587−593,1981、汎用衛生試験法と解説、日本薬学会編、南山堂、P33、脂質分析法入門、藤野安彦、学会出版センター、P100)。実験に際しては、得られた過酸化リノール酸を乳化分散させたものを使用した。乳化分散した過酸化リノール酸液の過酸化物濃度は、約1000μMであった。
【0038】
そして、前記「4-2.過酸化物に対する分解特性」で調製した菌体懸濁液に上述した過酸化リノール酸水溶液(終濃度1mM)とグルコース(終濃度50mM)をそれぞれ加え、水平震盪機にて37℃で3時間反応させた。反応終了後、卓上遠心機にて反応液を遠心分離し、上清に含まれる未反応の過酸化リノール酸濃度を測定した。過酸化リノール酸濃度の測定方法は前記「4-2.過酸化物に対する分解特性」に準じて行った。得られたデータに基づいて過酸化リノール酸の分解量を算出したところ、約850μMであった。
【0039】
5.過酸化物分解酵素の精製
過酸化物分解酵素の精製を次のようにして行った。なお、各精製段階における、NADH濃度、過酸化クメン(過酸化物として)濃度、タンパク質濃度およびSDS−PAGEは下記の方法にて測定した。
【0040】
(NADH濃度)
NADHの濃度測定には、該物質が有する吸光波長(λ=340nm)の減少にて活性を測定した。具体的には、マイクロブラックセルに約10mM、pH無調製トリス緩衝液500μlに溶解した終濃度150μM NADH、終濃度500μM 過酸化クメン、1/100倍容 被検試料(無細胞抽出液又は各精製段階で得られた各画分)を予め3分間37℃にて加温し、順次添加しその都度転換混和した。ダブルビーム吸光度計(ε340=6.220 M−1cm−1)にて本酵素の活性を37℃で経時的にNADHの減少量として測定した。過酸化クメンの分解に伴うNADH減少活性は、過酸化クメンを添加した際の初速から添加直後の前記被検試料の初速を引いて算出した。必要に応じてNADHの代わりにNADPHを用いて測定した。
【0041】
(過酸化クメン濃度)
過酸化クメンの濃度測定は、チオシアン酸−鉄錯体による発色法を用いた。前記「(NADH濃度)」と同じ実験系を用い、過酸化クメンと反応させた過酸化物分解酵素を適宜希釈し、500μl、2.0 mlエッペンドルフチューブに採取し、10%トリクロロ酢酸水溶液を500μl、0.01 N 硫酸にて溶解した硫酸アンモニウム鉄(II)10 mMを100μl、2.5 M チオシアン酸カリウムを500μl順次添加し、赤色に反応したサンプルを、ダブルビーム分光光度計にてλ=480nmにて測定した。
【0042】
(タンパク質濃度)
過酸化クメン分解活性を有する各画分のタンパク質濃度は、ブラッドフォード法と呼ばれる常法を用いて算出した。測定原理はクマシーブリリアントブルー(CBB)という色素がタンパク質と結合した際の赤紫色から青への変色を利用したものである。タンパク質の濃度の定量を行う際には、既知のタンパク質である鶏卵白アルブミンにて検量線を作製し、タンパク質濃度を算出した。
【0043】
(SDS−PAGE)
酵素精製過程における精製度の確認や、回収に際し有用な画分の判断には、SDS−PAGEを使用した。酵素の解析には、「初歩からのバイオ実験」(大山 徹、渡部 俊弘編著、三共出版)を参考に実施し、必要に応じて前著の変法を用いている。
【0044】
アクリルアミド29.2g、N,N’-メチレンビスアクリルアミド0.8g、100ml蒸留水にて調製したゲル作製ストック溶液A液、pH8.8に調整した1.5Mトリス緩衝液に0.4%SDSを溶解せしめたゲル作製ストック溶液B液、pH6.8に調整した0.5Mトリス緩衝液に0.4%SDSを溶解せしめたゲル作製ストック溶液C液、および10%過硫酸アンモニウム溶液からなるゲル作製ストック溶液D液をそれぞれ調製し作成用プレートに分注した。分離用SDSポリアクリルアミドゲルの硬化後、濃縮用SDSポリアクリルアミドゲルを重層した。
【0045】
作製したゲルプレートを泳動用緩衝液で満たした泳動槽にセットし濃縮ゲル部分では7.5〜10mA、濃縮ゲル通過後は15〜20mAに電流を印加し電気泳動を行った。電気泳動はゲルプレート下端手前約1cmにて泳動を停止し、染色工程に移行した。
【0046】
泳動終了後のポリアクリルアミドゲルをクマシーブリリアントブルー(CBB) 染色液にて染色し、その後明瞭な染色バンドが得られるまで脱色作業を行った。
【0047】
5-1.粗酵素液の調製
乳酸菌を培養する方法については、当業者が用いる常法に従って行った。乳酸菌の培養に通常用いられるGYP液体培地20 l にラクトバチルス・プランタラム(Lactobacillus plantarum)TY-1572株(NITE P-90)を接種し、ジャーファーメンターにて37℃、13〜14時間培養した。対数増殖期後期に培養菌体を遠心処理にて回収した。回収培養菌体についてはpH7.0、50mMリン酸緩衝液にて培養菌体を洗浄した。
【0048】
該菌体懸濁液をリゾチーム処理、超音波処理による破砕、超高圧細胞破砕機による破砕にて得られたものを粗酵素液とした。
【0049】
5-2.塩析処理、脱核酸処理およびクロマトグラフィー
上述の操作で得られた粗酵素液に硫酸アンモニウムによる塩析処理、ストレプトマイシン硫酸塩による脱核酸処理を行った。本工程で得られた上清をカラムに供して精製を実施した。
【0050】
上述の操作で得られた粗酵素液の上清を疎水ブチルカラム、弱陰イオン交換カラム、ゲル濾過カラムに供して酵素Aを得た。画分回収の判断はAbs280nmによるタンパク回収量と、過酸化クメンに対する分解活性を指標として判断した。画分は回収毎に透析処理を行った。回収画分中に特に過酸化クメンの分解能力が高く、精製されているバンドをSDS−PAGEにかけたところ、約43kDaの位置に単一バンドの存在を確認し、本画分を精製酵素とした。電気泳動の結果を示す(図1)。
【0051】
上述の操作で得られた粗酵素液の上清を疎水ブチルカラム、アフィニティーカラムに供して酵素Bを得た。画分回収の判断はAbs280nmによるタンパク回収量と、過酸化クメンの分解活性を指標として判断した。画分は回収毎に透析処理を行った。
【0052】
回収画分中に特に過酸化クメンの分解能力が高く、精製されているバンドをSDS−PAGEにかけたところ、約48kDaの位置に単一バンドの存在を確認し、本画分を精製酵素とした。電気泳動の結果を示す(図2)。
【0053】
6.基質特異性
前記「5.過酸化物分解酵素の精製 (NADH濃度)」の実験系のうち、被検試料として精製した酵素AおよびBを使用し、過酸化クメンに代えて過酸化水素を使用した以外は前記と同様に酵素反応を行わせることにより、酵素A,Bの過酸化水素に対する分解活性を調べた。過酸化水素の濃度測定は、前記「5.過酸化物分解酵素の精製 (過酸化クメン濃度)」に準じて行った。測定の結果、酵素A,Bはともに過酸化水素にも反応し、過酸化水素分解活性は、酵素Aの方が酵素Bよりも低かった。
【0054】
また、精製した酵素AおよびBを使用し、過酸化クメンの存在下において阻害剤の検討を行った。阻害剤は、KCN、NaOH、pCMB、HgCl2、エタノール、quinine、quinacrineを使用した。試験条件は前記「5.過酸化物分解酵素の精製 (NADH濃度)」の実験系に準ずるが、阻害剤は終濃度2mMとし、過酸化クメン濃度は終濃度500μM、NADH濃度は終濃度150μMとした。測定の結果、酵素A,Bともに、KCN、pCMB、HgCl2、quinine、quinacrineを添加した際に過酸化物分解反応阻害効果が確認できた。
【0055】
7.過酸化物分解酵素の用途
7-1.過酸化物分解粗酵素液の製造例
水97.5重量部、ブドウ糖1重量部、大豆ペプチド0.5重量部および酵母エキス1重量部から構成される培地にTY-1572株を接種して、30℃で16時間静置培養し、培養後の培養物を遠心処理によって菌体を採取した。この菌体を湿重量に対し5倍容のリン酸緩衝液に懸濁し、270MPa以上の高圧処理にて菌体を破砕し、これを過酸化物分解粗酵素液とした。
【0056】
7-2.ヨーグルトの製造例
水44.36重量部、ゼラチン0.1重量部、砂糖8.2重量部、乳酸菌スターター0.05重量部、脱脂粉乳5.81重量部、牛乳41.4重量部、過酸化物分解粗酵素液0.03重量部、香料0.05重量部を混合してヨーグルトを得た。なお、過酸化物分解粗酵素液は前記で製造したものを使用した。
【0057】
7-3.アイスクリームの製造例
水55.85重量部、砂糖8.0重量部、水飴8.0重量部、液糖4.0重量部、植物油脂13.0重量部、脱脂粉乳8.5重量部、加糖卵黄(20%卵黄分)2.0重量部、過酸化物分解粗酵素液0.05重量部、安定剤0.5重量部および香料0.1重量部を混合してアイスクリームを得た。なお、過酸化物分解粗酵素液は前記で製造したものを使用した。
【0058】
7-4.化粧水の製造例
水73.89重量部、グリセリン5重量部、可溶化剤5重量部、界面活性剤1重量部、エタノール15.0重量部、過酸化物分解粗酵素液0.1重量部、防腐剤0.005重量部および香料0.005重量部を混合して化粧水を製造した。なお、過酸化物分解粗酵素液は前記で製造したものを使用した。
【特許請求の範囲】
【請求項1】
ラクトバチルス・プランタラム(Lactobacillus plantarum) TY-1572株(NITE P-90)由来で、下記の理化学的性質を有する過酸化物分解酵素。
(1)基質特異性
NAD(P)Hの存在下、過酸化物に高い反応性を示し、過酸化水素にも反応する。
(2)分子量
43kDa(SDSポリアクリルアミドゲル電気泳動による測定)。
【請求項2】
ラクトバチルス・プランタラム(Lactobacillus plantarum) TY-1572株(NITE P-90)由来で、下記の理化学的性質を有する過酸化物分解酵素。
(1)基質特異性
NAD(P)Hの存在下、過酸化物に高い反応性を示し、かつ過酸化水素にも反応する。
(2)分子量
48kDa(SDSポリアクリルアミドゲル電気泳動による測定)。
【請求項3】
請求項1及び/又は2記載の過酸化物分解酵素を含有する飲食品、化粧品または医薬品。
【請求項1】
ラクトバチルス・プランタラム(Lactobacillus plantarum) TY-1572株(NITE P-90)由来で、下記の理化学的性質を有する過酸化物分解酵素。
(1)基質特異性
NAD(P)Hの存在下、過酸化物に高い反応性を示し、過酸化水素にも反応する。
(2)分子量
43kDa(SDSポリアクリルアミドゲル電気泳動による測定)。
【請求項2】
ラクトバチルス・プランタラム(Lactobacillus plantarum) TY-1572株(NITE P-90)由来で、下記の理化学的性質を有する過酸化物分解酵素。
(1)基質特異性
NAD(P)Hの存在下、過酸化物に高い反応性を示し、かつ過酸化水素にも反応する。
(2)分子量
48kDa(SDSポリアクリルアミドゲル電気泳動による測定)。
【請求項3】
請求項1及び/又は2記載の過酸化物分解酵素を含有する飲食品、化粧品または医薬品。
【図1】


【図2】




【図2】


【公開番号】特開2011−50366(P2011−50366A)
【公開日】平成23年3月17日(2011.3.17)
【国際特許分類】
【出願番号】特願2009−205130(P2009−205130)
【出願日】平成21年9月4日(2009.9.4)
【新規性喪失の例外の表示】特許法第30条第1項適用申請有り 平成21年3月29日に日本農芸化学会大会にて発表
【出願人】(000208086)大洋香料株式会社 (34)
【Fターム(参考)】
【公開日】平成23年3月17日(2011.3.17)
【国際特許分類】
【出願日】平成21年9月4日(2009.9.4)
【新規性喪失の例外の表示】特許法第30条第1項適用申請有り 平成21年3月29日に日本農芸化学会大会にて発表
【出願人】(000208086)大洋香料株式会社 (34)
【Fターム(参考)】
[ Back to top ]

