適合溶質の製造方法
【課題】所望の適合溶質を容易に高生産可能な製法を提供する。具体的には、微生物内に所望の適合溶質を生合成させ、容易に分離・回収可能な製法を提供する。
【解決手段】微生物が本来有する主要な適合溶質の生合成能を低下又は欠失させ、且つ所望の適合溶質生合成に関連する外来遺伝子を導入した微生物を高浸透圧条件下で培養し、当該微生物中で所望の適合溶質を生合成させる工程を含み、さらに当該微生物中で生合成した所望の適合溶質を、低浸透圧条件下で微生物から排出させ、回収する工程を含む製造方法による。
【解決手段】微生物が本来有する主要な適合溶質の生合成能を低下又は欠失させ、且つ所望の適合溶質生合成に関連する外来遺伝子を導入した微生物を高浸透圧条件下で培養し、当該微生物中で所望の適合溶質を生合成させる工程を含み、さらに当該微生物中で生合成した所望の適合溶質を、低浸透圧条件下で微生物から排出させ、回収する工程を含む製造方法による。
【発明の詳細な説明】
【技術分野】
【0001】
本発明は、微生物を利用することを特徴とする適合溶質の製造方法に関する。具体的には、微生物を利用することを特徴とするメチル化グリシンの製造方法に関する。
【背景技術】
【0002】
環境ストレスにさらされたとき、水に代わって生体成分を保護するために体内に蓄積されてくる低分子の化合物を、適合溶質という。一般には、耐塩性、乾燥耐性、凍結耐性など、細胞質の脱水を引き起こす高浸透圧ストレスに対する耐性を細胞に与える機能を持つと考えられている。
【0003】
生物が高濃度の塩分、乾燥、凍結などに曝されることにより生じる脱水ストレス条件下では、細菌から真菌、植物、動物を含むすべての生物は細胞の膨圧を維持して保湿性を保つために浸透圧調節物質を細胞内に高密度蓄積する。実際に生物が細胞内に蓄積している浸透圧調節物質としては、K+ や Na+ などのイオンの他に、高密度蓄積しても細胞内の代謝を阻害しない適合溶質と呼ばれる低分子有機化合物(アミノ酸類、糖類、ポリオール類など)が知られている。適合溶質は、単に浸透圧の調節を行うだけでなく、タンパク質及び膜の安定化、ヒドロキシラジカル (HO・) 消去、核酸の Tm値低下による DNA複製や転写、翻訳の保護などの機能を持つことが示されており、種々の環境ストレスから細胞を保護するために重要な役割を担っている。
【0004】
適合溶質のうち、エクトインや、グリシンがトリメチル化されたグリシンベタイン(N,N,N-トリメチルグリシン)は、浸透圧調節、タンパク質保護、膜の保護、ラジカル消去などの機能を発揮することが知られている。また、グリシンベタインよりは若干劣るものの、ジメチルグリシンについても、細胞の浸透圧調節、タンパク質合成活性の保護機能や凍結耐性の機能があるといわれている。適合溶質のうち、微生物におけるエクトイン生合成の経路及びエクトインの機能については、非特許文献1に詳述されている。
【0005】
微生物を用いて生産効率を上げる方法は、従来より研究がなされており、高密度培養の研究も数多くなされている。しかしながら、糖類や塩類等の濃度を上げた培地を用いて目的物の生産性を高めることは簡便な方法であるが、高濃度の培地成分によって浸透圧が上昇するため、一定の浸透圧以上となると、微生物はもはや生育できなくなる。これを改善するために、例えば初発の糖濃度を上げた培地にベタインを添加することで、乳酸菌からマンニトールを効率的に生産する方法が知られている。また、塩、糖、ポリオールなどの栄養成分を高濃度に含んだ培地に、好塩性細菌ハロモナスから分離したエクトインを添加して微生物を高密度培養すると、培養効率を上げることができることが報告されている(特許文献1)。
【0006】
グリシンベタインは、エビ、カニ、タコ、イカ、貝類などの水産物やテンサイ、麦芽、キノコ類、果実などの食材に多く含まれており、"甘味"と"うま味"の一成分となっている。そのため、日本では安全性の高い食品添加物として広く使用されている。また、グリシンベタインは優れた保湿機能や生体分子保護機能を有するため、化粧品や整髪料などにも使用されている。グリシンベタインは、さらに動脈硬化の危険因子であるホモシステインの代謝に関係することから、ホモシステイン尿症患者に対する医薬品としても用いられる。加えて循環器の健康維持のためのサプリメント成分としても利用されている。世界的にも、家畜の必須栄養素コリンの欠乏を補う目的にグリシンベタインが飼料添加物として使用されている。
【0007】
グリシンベタインは "テンサイ"(別名:サトウダイコン)の根部から製造される砂糖の副産物であるテンサイ糖蜜から抽出して生産される。このため生産量は原料となるテンサイの収穫量に依存し、その有用性の高さにも関わらずグリシンベタインの増産には限界があった。
【0008】
根粒菌は、適合溶質の生合成能又は蓄積能が低いために、ストレスの影響を大きく受けてしまうと考えられており、根粒菌のストレス耐性能力の向上のために、適合溶質のうち、グリシンベタインの製法について検討がなされている(特許文献2)。ここでは、グリシンベタイン生合成能又は蓄積能が低い根粒菌に、グリシンベタイン生合成に関与するコリンオキシダーゼをコードする遺伝子を導入することにより、グリシンベタインの生合成能及び蓄積能が向上することが開示されている。ここで報告されるグリシンベタインの製法は、いわゆるコリンを基質としたコリン酸化経路によるものである。
【先行技術文献】
【非特許文献】
【0009】
【非特許文献1】Biotechnology Advances 28 (2010) 782-801
【特許文献】
【0010】
【特許文献1】特開平8-154670号公報
【特許文献2】特開2004-229557号公報
【発明の概要】
【発明が解決しようとする課題】
【0011】
本発明は、所望の適合溶質を容易に高生産可能な製法を提供することを課題とする。具体的には、微生物内に所望の適合溶質を生合成させ、容易に分離・回収可能な製法を提供することを課題とする。
【課題を解決するための手段】
【0012】
本発明者らは、上記課題を解決するために鋭意研究を重ねた結果、微生物が本来産生しうる主要な適合溶質の生合成能を低下又は欠失させ、且つ所望の適合溶質生合成に関連する外来遺伝子を導入した微生物を高浸透圧条件下で培養し、当該微生物中で所望の適合溶質を生合成させる工程を含み、さらに当該微生物中で生合成した所望の適合溶質を、低浸透圧条件下で微生物から排出させ、回収する工程を含む製造方法により、上記課題を解決しうることを見出し、本発明を完成した。
【0013】
すなわち本発明は、以下よりなる。
1.以下の工程を含む、微生物を用いた適合溶質(A)の製造方法:
1)適合溶質(B)の生合成能を低下又は欠失させ、且つ適合溶質(A)生合成に関連する外来遺伝子を導入した微生物を高浸透圧条件下で培養し、微生物中で適合溶質(A)を生合成させる工程;
2)前記微生物中で生合成した適合溶質(A)を、低浸透圧条件下で微生物から排出させ、回収する工程。
2.高浸透圧条件が、塩化ナトリウム濃度(NaCl)で換算した場合に0.5〜4 Mであり、低浸透圧条件が、同様に塩化ナトリウム濃度で換算した場合に0〜0.5 Mであることを特徴とする、前項1に記載の製造方法。
3.微生物が、ハロモナス属(Halomonas)に属する微生物であることを特徴とする、前項1又は2に記載の製造方法。
4.ハロモナス属に属する微生物が、Halomonas elongataに属する微生物であることを特徴とする、前項3に記載の製造方法。
5.前記適合溶質(B)が、エクトインであることを特徴とする、前項3又は4に記載の製造方法。
6.適合溶質(B)の生合成能を低下又は欠失させることが、前記微生物のゲノム上に存在するエクトイン生合成オペロンのうち、エクトイン生合成に特異的な遺伝子の一部若しくは全部を除去することである、前項5に記載の製造方法。
7.適合溶質(A)が、メチル化グリシンであることを特徴とする、前項1〜6のいずれかに記載の製造方法。
8.メチル化グリシンが、グリシンからサルコシンを合成する経路を介して生合成されることを特徴とする、前項7に記載の製造方法。
9.メチル化グリシンが、少なくともグルコース、グリセロール及び/又はキシロースを炭素源として生合成されることを特徴とする、前項7又は8に記載の製造方法。
10.適合溶質(A)の生合成に関連する外来遺伝子が、少なくともグリシンサルコシンメチル基転移酵素(GSMT)関連遺伝子である、前項7〜9のいずれかに記載の製造方法。
11.グリシンサルコシンメチル基転移酵素(GSMT)関連遺伝子が、以下に示すいずれかの塩基配列からなる、前項10に記載の製造方法:
1)配列表の配列番号1に示す塩基配列;
2)前記1)に記載の塩基配列のうち、1若しくは数個の塩基が置換、欠失、挿入又は付加といった変異された配列からなる塩基配列;
3)前記1)又は2)に記載の塩基配列に対して縮重し、グリシンサルコシンメチル基転移酵素(GSMT)が有するアミノ酸配列をコードする塩基配列;
4)前記1)〜3)のいずれかに記載の配列と、80%以上の相同性を有する塩基配列。
12.適合溶質(A)の生合成に関連する外来遺伝子が、さらに、ジメチルグリシンメチル基転移酵素(DMT)関連遺伝子である、前項10又は11に記載の製造方法。
13.メチルグリシンメチル基転移酵素(DMT)関連遺伝子が、以下に示すいずれかの塩基配列からなる、前項12に記載の製造方法:
1)配列表の配列番号2に示す塩基配列;
2)前記1)に記載の塩基配列のうち、1若しくは数個の塩基が置換、欠失、挿入又は付加といった変異された塩基配列;
3)前記1)又は2)に記載の塩基配列に対して縮重し、メチルグリシンメチル基転移酵素(DMT)が有するアミノ酸配列をコードする塩基配列;
4)前記1)〜3)のいずれかに記載の塩基配列と、80%以上の相同性を有する塩基配列。
14.適合溶質(A)の生合成に関連する外来遺伝子が、さらにS−アデノシルメチオニン(SAM)合成酵素関連遺伝子である、前項10〜13のいずれかに記載の製造方法。
15.S−アデノシルメチオニン(SAM)合成酵素関連遺伝子が、以下に示すいずれかの塩基配列からなる、前項14に記載の製造方法:
1)配列表の配列番号3に示す塩基配列;
2)前記1)に記載の塩基配列のうち、1若しくは数個の塩基が置換、欠失、挿入又は付加といった変異された塩基配列;
3)前記1)又は2)に記載の塩基配列に対して縮重し、S−アデノシルメチオニン(SAM)合成酵素が有するアミノ酸配列をコードする塩基配列;
4)前記1)〜3)のいずれかに記載の塩基配列と、80%以上の相同性を有する塩基配列。
16.外来遺伝子の導入が、ハロモナス属に属する微生物のゲノム上に存在するエクトイン生合成オペロンのうち、浸透圧応答性プロモーターの制御下にある領域に、前項11に記載のいずれかの塩基配列からなる遺伝子を導入することによる、前項3〜11に記載製造方法。
17.外来遺伝子の導入が、ハロモナス属に属する微生物のゲノム上に存在するエクトイン生合成オペロンのうち、浸透圧応答性プロモーターの制御下にある領域に、さらに前項13に記載のいずれかの塩基配列からなる遺伝子を導入することによる、前項16に記載の製造方法。
18.外来遺伝子の導入が、ハロモナス属に属する微生物のゲノム上に存在するエクトイン生合成オペロンのうち、浸透圧応答性プロモーターの制御下にある領域に、前項15に記載のいずれかの遺伝子を導入することによる、前項16又は17に記載の製造方法。
19.浸透圧応答性プロモーターが、ハロモナス属に属する微生物のゲノム上に存在するエクトインの生合成オペロンの上流配列(UectA)中に含まれることを特徴とする、前項16〜18のいずれかに記載の製造方法。
20.メチル化グリシンが、グリシンベタインである、前項7〜19のいずれかに記載の製造方法。
21.メチル化グリシンが、ジメチルグリシンである、前項7〜11、14〜16、18〜19のいずれかに記載の製造方法。
22.ハロモナス属に属する微生物のゲノムにおいて、エクトインの生合成オペロンのうち、浸透圧応答性のプロモーターを含み、エクトインの生合成に特異的な遺伝子の一部又は全部を欠損あるいは置換していることを特徴とする微生物。
23.エクトインの生合成に特異的な遺伝子が、L-アスパラギン酸-β-セミアルデヒドからエクトインへの代謝において、L-ジアミノ酪酸アミノ基転移酵素及び/又はL-ジアミノ酪酸アセチル基転移酵素の発現に必須な領域であることを特徴とする前項22に記載の微生物。
24.受領番号FERM AP-22094で特定される微生物である、前項22又は23に記載の微生物。
【発明の効果】
【0014】
本発明の適合溶質の製造方法により、所望の適合溶質(A)を微生物内に生合成させ、高密度で蓄積させることを可能とし、かつ、蓄積された微生物内の適合溶質(A)を容易に分離回収することができる。これにより、適合溶質(A)を高生産することができる。
具体的には、微生物が本来有する適合溶質(B)の生合成能を低下又は欠失させ、且つ適合溶質(A)の生合成に関連する外来遺伝子を導入した微生物を高浸透圧条件下で培養することにより、適合溶質(A)を微生物内に生合成させ、高密度で蓄積させることができる。また、当該微生物を低浸透圧条件で処理することで、微生物を破砕することなく適合溶質(A)を容易に微生物該へ排出させ、回収することができる。
さらに、使用した微生物を繰り返し利用することで、適合溶質(A)を連続して高生産することができ、安定的に供給可能となる。
【図面の簡単な説明】
【0015】
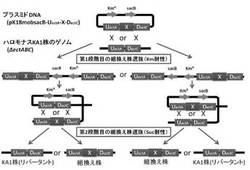
【図1】二段階の相同組換法による組換型ハロモナス菌株の作製方法を示す図である。(実施例1)
【図2】野生型H. elongataのゲノム上に有するエクトイン生合成オペロン(ectABC)の上流配列(UectA)を示す図である。図2に示す配列部分は、配列番号11の1096-1227部分に該当する。UectAには、適合溶質の産生に必要なプロモーター領域が含まれる。(実施例1)
【図3】各種ハロモナス菌株におけるエクトイン生合成オペロン領域のゲノム構造を示す図である。(実施例1)
【図4】グリシンベタインの2つの異なる生合成経路を示す概念図である。A.コリン酸化経路; コリンを基質とし、コリンデヒドロゲナーゼ(BetA)及びベタインアルデヒドデヒドロゲナーゼ(BetB)の2種類の酵素による酸化反応により、グリシンベタインが生合成される。B.グリシンメチル化経路; 2種類のメチル基転移酵素により触媒される、グリシンを基質とした三段階のメチル化反応によりグリシンベタインが生合成される。
【図5】グリシンベタインのグリシンメチル化による生合成経路を示す図である。
【図6】GMST関連遺伝子の塩基配列を示す図である。(配列番号1,7)
【図7】DMT関連遺伝子の塩基配列を示す図である。(配列番号2,8)
【図8】SAMS関連遺伝子の塩基配列を示す図である。(配列番号3,9)
【図9】mCerry関連遺伝子の塩基配列を示す図である。(配列番号4,10)
【図10】UectA領域の塩基配列を示す図である。(配列番号5,11)
【図11】DectC領域の塩基配列を示す図である。(配列番号6,12)
【図12】各種ハロモナス菌株におけるグリシンベタイン生合成オペロンの発現解析結果を示す写真図である。(実験例1−1)
【図13】各種ハロモナス株の細胞抽出液中の各種適合溶質成分のHPLC分析による、ジメチルグリシン、グリシンベタイン及びエクトインの検出結果を示す図である。(実験例1−2)
【図14】エクトイン非生産性のハロモナス株において、エクトインの代わりに生産されたグリシンベタインが適合溶質として機能することにより、エクトイン非生産性のハロモナス株の塩ストレス耐性が向上することを示す図である。(実験例1−2)
【図15】高浸透圧条件下でのグリシンベタイン生産結果を示す図である。A.細胞抽出液中のベタイン濃度及び培養液中から回収された細胞量(n=3)。B.培養液当たり又は細胞当たりのグリシンベタイン生産量(Aの値から算出)を示す図である。(実施例2)
【図16】高浸透圧条件での二段階培養プロセスによるグリシンベタイン生産結果を示す図である。(実施例3)
【図17】炭素源としてグルコースを添加した条件での、各種ハロモナス菌株における人工海水培地におけるジメチルグリシン、グリシンベタイン及びエクトインの生合成結果を示す図である。(実施例4)
【図18】炭素源としてグリセロールを添加した条件での、各種ハロモナス菌株における人工海水培地におけるジメチルグリシン、グリシンベタイン及びエクトインの生合成結果を示す図である。(実施例4)
【図19】炭素源としてキシロースを添加した条件での、各種ハロモナス菌株における人工海水培地におけるジメチルグリシン、グリシンベタイン及びエクトインの生合成結果を示す図である。(実施例4)
【発明を実施するための形態】
【0016】
本発明は、微生物を利用することを特徴とする適合溶質の製造方法に関する。本発明は、高浸透圧条件下で適合溶質を生合成・蓄積しうる微生物を宿主として用いて、所望の適合溶質を製造する方法に関する。
【0017】
本明細書において「所望の適合溶質」は、「微生物が本来産生しうる主要な適合溶質」とは異なる別の物質の意味で用いられる。以下、本明細書において、所望の適合溶質を「適合溶質(A)」といい、当該微生物が本来産生しうる主要な適合溶質を「適合溶質(B)」として区別して述べる。また、本明細書において適合溶質全般を意味し、両者を区別しない場合は、(A)や(B)などの識別する用語を用いないものとする。
【0018】
本明細書において、適合溶質(A)の製造方法は以下の工程を含む。
1)微生物が本来有する適合溶質(B)の生合成能を低下又は欠失させ、且つ適合溶質(A)生合成に関連する外来遺伝子を導入した微生物を高浸透圧条件下で培養し、微生物中で適合溶質(A)を生合成させる工程;
2)前記微生物中で生合成した適合溶質(A)を、低浸透圧条件下で微生物から排出させ、回収する工程。
本発明の製造方法において、高浸透圧条件及び低浸透圧条件は、上記の工程1)の浸透圧条件(高浸透圧条件)に比べて、工程2)の浸透圧条件が相対的に低い浸透圧条件(低浸透圧条件)であればよい。微生物を、工程1)の浸透圧条件に比べて、工程2)で相対的に低い浸透圧条件で処理することにより、適合溶質(A)を微生物から排出させることができる。
【0019】
本明細書において、「高浸透圧条件」とは、塩化ナトリウム(NaCl)濃度で換算した場合に、0.5〜4 M程度の条件とすることができ、例えば0.51〜3.6 Mであり、好ましくは0.75〜3.6 Mであり、より好ましくは1.0〜3.2 Mであり、さらに好ましくは約2.0〜2.6 Mである。また、本発明における「低浸透圧条件」とは、同様に塩化ナトリウム濃度で換算した場合に0〜0.5 M程度の条件とすることができ、好ましくは、0〜0.34 Mとすることができ、例えば水の条件であってもよい。ただし、本発明の製造方法に使用する微生物を製造において複数回使用することを考慮すると、微生物が破裂しない程度の低浸透圧条件であることが好適である。そのような条件としては、0.02〜0.06 Mである。上記の範囲から、工程1)で選択した高浸透圧条件に比べ、工程2)では工程1)で選択した条件より相対的に低い浸透圧条件を適宜選択することができる。
【0020】
本明細書において、「微生物」とは、高浸透圧条件下で適合溶質を生合成・蓄積しうる微生物であり、例えば好塩性菌が挙げられる。好塩性菌の種類としては、至適塩濃度により、低度好塩性菌、中度好塩性菌、高度好塩性菌等が挙げられる。本発明に使用可能な微生物としては、好ましくは中度好塩性菌であり、具体的にはハロモナス属(Halomonas)、クロモハロバクター属(Chromohalobacter)、アクロモバクター属(Achromobacter)、アシディフィラム属(Acidiphilium)、アルカニボラクス属(Alcanivorax)、アミコラトプシス属(Amycolatopsis)、バチルス属(Bacillus)、ヘルミニイモナス属(Herminiimonas)、ハイフォモナス属(Hyphomonas)、キトコッカス属(Kytococcus)、マリノバクター属(Marinobacter)、マリノモナス属(Marinomonas)、マイコバクテリウム属(Mycobacterium)、ニトロソプミルス属(Nitrosopumilus)、ノカルジア属(Nocardia)、オクロバクテリウム属(Ochrobactrum)、パエニバチルス属(Paenibacillus)、リゾビウム属(Rhizobium)、ロドコッカス属(Rhodococcus)、サッカロモノスポラ属(Saccharopolyspora)、サッカロポリスポラ属(Saccharopolyspora)、スフィンゴピキシス属(Sphingopyxis)、 スチグマテラ属(Stigmatella)、ストレプトマイセス属(Streptomyces)などに属する微生物等が挙げられるが、これらに限定されるものではない。上記のうち、ハロモナス属に属する微生物としては、H. elongata、H. boliviensis、H. campisalis、H. halmophila、H. halophila、H. halodenitrificans、H. variabilis が挙げられ、入手可能な菌株としては、H. boliviensis DSM 15516T、H. campisalis ATCC 700597、H. elongata ATTC 33173T、H. elongata DSM 142、H. elongata DSM 2581T、H. elongata OUT30018、H. halmophila CCM 2833T、H. halophila CCM 3662T、H. halodenitrificans DSM 735T、H. variabilis DSM 3051Tが挙げられる。また、クロモハロバクター属に属する微生物としては、C. marismortui及びC. salexigensが挙げられ、入手可能な菌株としては、C. marismortui ATCC 17056及びC. salexigens DSM 3043Tが挙げられる。上記のうち、エクトイン生合成遺伝子を有する全ゲノム解読済みの菌株としてはH. elongata DSM 2581T及びC. salexigens DSM 3043が挙げられる。その他、エクトイン生合成遺伝子を有する全ゲノム解読済みの菌株としては、例えばAchromobacter xylosoxidans A8、Acidiphilium cryptum JF-5、Acidiphilium multivorum AIU301、Alcanivorax borkumensis SK2、Amycolatopsis mediterranei U32、Bacillus clausii KSM-K16、Bacillus pseudofirmus OF4、Bordetella avium 197N、Brachybacterium faecium DSM 4810、Herminiimonas arsenicoxydans、Hyphomonas neptunium ATCC 15444、Kytococcus sedentarius DSM 20547、Marinobacter aquaeolei VT8、Marinomonas sp. MWYL1、Mycobacterium gilvum PYR-GCK、Mycobacterium smegmatis str. MC2 155、Mycobacterium sp. JLS、Mycobacterium sp. KMS、Mycobacterium sp. MCS、Mycobacterium vanbaalenii PYR-1、Nitrosopumilus maritimus SCM1、Nocardia farcinica IFM 10152、Ochrobactrum anthropi ATCC 49188、Paenibacillus sp. Y412MC10、Rhizobium leguminosarum bv. viciae 3841、Rhodococcus equi 103S、Rhodococcus opacus B4、Saccharomonospora viridis DSM 43017、Saccharopolyspora erythraea NRRL 2338、Sphingopyxis alaskensis RB2256、Stigmatella aurantiaca DW4/3-1、Streptomyces avermitilis MA-4680、Streptomyces griseus subsp. griseus NBRC 13350、Streptomyces scabiei 87.22等が挙げられる。その他、エクトインを産生しうる微生物として、Brevibacterium epidermis DSM 20659、Brevibacterium linens、Brevibacterium sp. strain JCM 6894、Kocuria varians CCM3316、Nesterenkonia halobia DSM 20541T、Nocardiopsis sp. A5-1、Streptomyces coelicolor A3、Streptomyces griseolus DSM 40067T、Bacillus alcalophilus DSM 485T、Bacillus agaradhaerens DSM 8721T、Bacillus clarkii DSM 8720T 、Bacillus halodurans DSM 497T、Bacillus mojavensis DSM 9205T、Bacillus pseudalcaliphilus DSM 8725T、Bacillus pseudofirmus DSM 8715T、Gracilibacillus halotolerans DSM 11805T、Halobacillus halophilus DSMZ 2266T
Halobacillus trueperi DSM 10404T、Marinococcus halophilus DSM 20408T、Marinococcus sp. M52、Salimicrobium albus DSM 20748T、Sporosarcina pasteurii DSM 33T、Sporosarcina psycrophila DSM 3T、Virgibacillus marismortui DSM 12325T、Virgibacillus pantothenticus DSM 26、Virgibacillus salexigens DSM 11438、Rhodovibrio salinarum BN 40、Rhodovulum sulfidophilum DSM 1374T、Halorhodospira abdelmalekii DSM 2110T、Halorhodospira halochloris DSM 1059T、Halorhodospira halophila DSM 244T、Pantoea agglomerans strain CPA-2、Pseudomonas halophila DSM 3050T、Pseudomonas halosaccharolytica CCM 2851、Thioalkalibacter halophilus DSMZ 19224、Vibrio alginolyticus DSM 2171T、Vibrio cholerae O139 strain MO10、Vibrio costicola CCM 2811、Vibrio fischeri DSM 507、Vibrio fischeri DSM 7151、Vibrio harveyi DSM 2165、Vibrio harveyi DSM 6904、Vibrio parahaemolyticus RIMD2210633等が挙げられる。
【0021】
本明細書において、「適合溶質(B)」とは、高浸透圧条件下で適合溶質を生合成・蓄積しうる微生物が、本来産生しうる適合溶質であればよく、特に当該微生物内に高密度に蓄積される適合溶質が好ましい。例えばハロモナス属に属する微生物では、エクトイン、ヒドロキシエクトイン、N-γ-アセチルジアミノ酪酸などが挙げられ、特に好ましくはエクトインである。アクチノポリスポラ(Actinopolyspora)属に属する微生物では、グリシベタイン、トレハロースなどが挙げられ、バシラス(Bacillus)属に属する微生物では、プロリン、グルタミン酸、グルタミンなどが挙げられる。
【0022】
本明細書において、「適合溶質(B)の生合成能を低下又は欠失」とは、適合溶質(B)の生合成能が通常の場合より低い量に抑制されていること、又は全く生合成されないことをいう。この場合において、適合溶質(B)の生合成能は低いほうが適合溶質(A)を高密度に生合成することができる。従って、適合溶質(B)の生合成能は、野生型を100%とした場合に、60%以下、好ましくは、40%以下、より好ましくは20%以下に低下しているのか好ましく、生合成能が欠失しているのが最も好ましい。適合溶質(B)の生合成能を低下又は欠失させるための手段として、適合溶質(B)を生合成するのに必須の酵素をコードする遺伝子のコード領域内の変異導入による酵素活性の低下又は欠失させることができればよい。遺伝子のコード領域内の変異導入は、微生物のゲノム上に存在する適合溶質(B)生合成に特異的な遺伝子の一部又は全部を欠損させることが考えられる。「適合溶質(B)生合成に特異的な遺伝子」としては、例えば適合溶質(B)を生合成するのに必須の酵素関連遺伝子が挙げられる。適合溶質(B)の生合成において複数の酵素が必須の場合は、それらの酵素のうちいずれか1種以上又は全ての酵素関連遺伝子の一部又は全部を欠損させてもよい。生合成に特異的な遺伝子の一部又は全部を欠損させる方法は、遺伝子組み換えの手法等、自体公知の方法によることができる。例えば、目的遺伝子の部分配列を改変し、正常に機能する酵素を産生しないようにした変異型遺伝子を作製し、当該変異型遺伝子を含むDNA、或いは遺伝子の一部又は全部を欠損させたDNAで、微生物のゲノム上の遺伝子と相同組換えを起こさせることにより、ゲノム上の目的遺伝子の一部又は全部を欠損させることが出来る。このような相同組換えを利用した遺伝子置換は、「Redドリブンインテグレーション(Red-driven integration)」と呼ばれる方法(Proc. Natl. Acad. Sci. USA Vol.97, p.6640-6645 (2000))、Redドリブンインテグレーション法とλファージ由来の切り出しシステム(J. Bacteriol. Vol.184, p.5200-5203 (2002))と組合わせた方法(WO2005/010175号参照)等を参照することができる。さらに、ハロモナス属に属する菌株の遺伝子操作に参考となる公知文献としては、Journal of Bacteriology Vol.184, p.3078-3085 (2002)が挙げられる。
【0023】
上記において、適合溶質(B)を本来産生する微生物のゲノム上に有する浸透圧応答性のプロモーターは、除去しないことが必要である。当該微生物が有する浸透圧応答性プロモーターの下流に、適合溶質(A)の生合成に関連する外来遺伝子を導入することで、高浸透圧条件下で適合溶質(A)を生合成することが可能となるからである。この場合において、「適合溶質(A)」は、「適合溶質(B)」とは異なる適合溶質であればよく、特に限定されない。
【0024】
本発明における「浸透圧応答性プロモーター」とは、微生物の適合溶質(B)の産生系に必要な浸透圧応答性プロモーターが挙げられる。具体的には、例えばハロモナス属に属するH. elongataの適合溶質(B)であるエクトインの産生系に必要な浸透圧応答性プロモーターが挙げられる。H. elongataの場合は、浸透圧応答性プロモーターは、当該微生物のゲノム上に存在するエクトインの生合成オペロンの上流配列(UectA)中に含まれる(図1、2参照)。
【0025】
本明細書において、「適合溶質(A)の生合成に関連する外来遺伝子」とは、本明細書の微生物がゲノム上に本来有する遺伝子とは異なる遺伝子であって、適合溶質(A)の生合成に必須のタンパク質等に関連する遺伝子が挙げられる。生合成に必須のタンパク質として、例えば、微生物内で所望の適合溶質(A)を生合成するために必要な酵素等が挙げられる。
【0026】
例えば、ハロモナス属に属する微生物では、適合溶質(B)としてのエクトインの生合成能を低下又は欠失させて、適合溶質(A)の生合成に関連する外来遺伝子を導入することで、高浸透圧条件下で適合溶質(A)を生合成することができる(図1参照)。エクトインの生合成能を低下又は欠失させるためには、ハロモナス属に属する微生物のゲノムにおいて、エクトインの生合成オペロンのうち上流配列(UectA)中に含まれる浸透圧応答性プロモーターを残しておけば、エクトイン生合成に特異的な遺伝子の一部又は全部を欠損させてもよい。エクトイン生合成に特異的な遺伝子として、L-アスパラギン酸-β-セミアルデヒドからエクトインへの代謝に必要な酵素関連遺伝子が挙げられる。当該必要な酵素として、L-ジアミノ酪酸アミノ基転移酵素及び/又はL-ジアミノ酪酸アセチル基転移酵素が挙げられる(非特許文献1参照)。これらの酵素は、EctA、EctB、EctCで表すことができ、これらに関連する遺伝子を各々ectA、ectB、ectCで表すことができる(図3(a)参照)。本明細書において、「エクトインの生合成能を低下又は欠失」は、エクトインの生合成オペロンのうち、ectA、ectB、ectCから選択される1種又は複数の遺伝子の、一部又は全部を欠損させることにより、達成することができる(図3(b)参照)。この場合において、エクトインの生合成能は低いほうが適合溶質(A)を高密度に生合成することができる。従って、エクトインの生合成能は、野生型を100%とした場合に、60%以下、好ましくは40%以下、より好ましくは20%以下に低下しているのか好ましく、生合成能が欠失しているのが最も好ましい。
【0027】
上記において、適合溶質(A)の種類は、上記のハロモナス属に属する微生物がゲノム上に有する浸透圧応答性プロモーターの制御下、即ち、当該浸透圧応答性プロモーターの下流に、適合溶質(A)の生合成に関連する外来遺伝子を導入することができるのであれば特に限定されない。
【0028】
本発明の製造方法において、「適合溶質(A)」として、具体的にはメチル化グリシンを製造することができる。本明細書の「メチル化グリシン」としては、例えばグリシンベタイン、ジメチルグリシンやサルコシンが挙げられ、最も好適にはグリシンベタインが挙げられる。
【0029】
グリシンベタインは、種々の生物が乾燥や塩ストレスなど外的浸透圧変化に応じて細胞内の浸透圧を維持するために蓄積する適合溶質の1種である。細菌、植物、動物は、乾燥又は塩ストレスの条件のもとでベタインを生合成し、蓄積するが、これらの多くの生物においては、コリンからベタインアルデヒド、さらにベタインアルデヒドからグリシンベタインへの二段階酸化反応によってグリシンベタインが生合成される(図4)。大腸菌を含む多くの細菌や植物の葉緑体などでは、コリンデヒドロゲナーゼ(BetA)及びベタインアルデヒドデヒドロゲナーゼ(BetB)が各段階の反応を触媒することが知られている。
【0030】
古細菌のメタン細菌、好気性従属真正細菌、嫌気性光栄養細菌、シアノバクテリアの中には単純な炭素源からグリシンベタインを生合成する能力を有する生物種が発見されている。これまでに、好気性従属真正細菌であるActinopolyspora halophila、嫌気性光栄養細菌であるEctothiorhodopspira halochloris、シアノバクテリアであるAphanothece halophyticaにおいて、アミノ酸であるグリシンからサルコシン、サルコシンからジメチルグリシン、ジメチルグリシンからグリシンベタインの三段階のメチル化反応によってグリシンベタインが生合成されることが明らにされている(図4、5)。グリシンからサルコシンを合成する経路を介してメチル化グリシンを産生する場合には、グリシンからのメチル基転移反応にメチル基転移酵素を必要とする。グリシンからサルコシンへ、サルコシンからジメチルグリシンへのメチル化反応に必須のメチル基転移酵素は、グリシンサルコシンメチル基転移酵素(以下単に、「GSMT」ともいう。)である。また、ジメチルグリシンからグリシンベタインへのメチル化反応に必須の酵素は、ジメチルグリシンメチル基転移酵素(以下、単に「DMT」ともいう。)である(図4、5参照)。また、グリシンへのメチル基供与体として、S-アデノシルメチオニン(以下、単に「SAM」ともいう。)が挙げられる(図5参照)。メチオニンにアデノシン三リン酸(ATP)とSAM合成酵素(SAMS)が作用してSAMが生合成される。
【0031】
「適合溶質(A)」としてのメチル化グリシンは、微生物中にグリシンからサルコシンを生合成する経路が存在しない場合に、グリシンからサルコシンを生合成する経路に関連する外来遺伝子を導入することで、生合成することができる。より詳しくは、当該微生物の適合溶質(B)の生合成能を低下又は欠失させ、且つグリシンからサルコシンを合成するのに必要なメチル基転移酵素に関連する外来遺伝子を導入し、当該微生物を高浸透圧条件下で培養することで、微生物中でメチル化グリシンを生合成することができる。この場合に使用可能な微生物は、上述の本明細書における微生物であって、グリシンからサルコシンを生合成する経路が存在しない微生物であればよく、特に限定されない。前記微生物に、メチル基転移酵素に関連する遺伝子を導入することにより、グリシンからサルコシンを合成する経路を介してメチル化グリシンを生合成することができる(図4参照)。
【0032】
グリシンからサルコシンを生合成する経路に関連する外来遺伝子として、上述のごとく、グリシンからサルコシンへのメチル基転移反応に必要なメチル基転移酵素関連遺伝子が挙げられる。具体的には、上述のGSMT関連遺伝子が挙げられる。GSMT関連遺伝子を本発明の微生物に導入することで、グリシンからサルコシンを合成する経路を、微生物に導入することができる。さらに、GSMTは、サルコシンからジメチルグリシンの生合成にも作用する。従って、本発明の「適合溶質の製造方法」のうち、メチル化グリシンの製造方法においては、微生物に少なくともGSMT関連遺伝子を導入することが必要である。また、ジメチル化グリシンからグリシンベタインを生合成させるために、DMT関連遺伝子を導入することが必要である。また、GSMT及びDMTがつながった酵素(GSDMT)もクローニングされており(J Biological Chemistry, 278, pp.4932-4942 (2003))、GSDMT関連遺伝子を本発明の微生物に導入してもよい。グリシンのメチル化を効率的に行うために、SAM合成酵素関連遺伝子を本発明の微生物にさらに導入してもよい。SAM合成酵素を発現させるために、本発明の微生物のゲノム上に存在するSAM合成酵素関連遺伝子を利用してもよい。
【0033】
本発明の微生物が、ハロモナス属に属する微生物、具体的にはH. elongataの場合は、メチル化グリシンのうち、特にサルコシン及び/又はジメチルグリシンを生合成させるために、エクトインの産生系に必要な浸透圧応答性プロモーターの下流領域に、少なくともGSMT関連遺伝子を導入することができる。さらに、グリシンベタインを生合成させるために、DMT関連遺伝子を導入することができる(図3(d)参照)。GSMT関連遺伝子及びDMT関連遺伝子を、エクトインの産生系に必要な浸透圧応答性プロモーターの下流領域に導入することにより、グリシンベタイン産生用のポリシストロン性オペロンを構築することができる。当該グリシンベタイン産生用のポリシストロン性オペロンには、SAM合成酵素関連遺伝子を含んでいてもよい(図3(e)参照)。
【0034】
本発明の微生物が、ハロモナス属に属する微生物、具体的にはH. elongataの場合では、野生型の場合に、グリシンベタインは脂質の代謝経路であるコリンからの二段階酸化反応によって生合成されるが(図4参照)、コリンから産生されるグリシンベタインの産生量は限られている。一方、本発明の製造方法によれば、植物バイオマス由来の主要な炭素源である、グルコース、グリセロール及び/又はキシロースなどの豊富で単純な炭素源を利用し、これより産生される必須アミノ酸のグリシンを介して、微生物内にメチル化グリシンを生合成し、高密度に蓄積することができる。
【0035】
本発明において、GSMT関連遺伝子は、以下に示すいずれかの塩基配列からなる。
1)配列表の配列番号1に示す塩基配列;
2)前記1)に記載の塩基配列のうち、1若しくは数個の塩基が置換、欠失、挿入又は付加といった変異された配列からなる塩基配列;
3)前記1)又は2)に記載の塩基配列に対して縮重し、GSMTが有するアミノ酸配列をコードする塩基配列;
4)前記1)〜3)のいずれかに記載の配列と、80%以上の相同性を有する塩基配列。
【0036】
本発明において、DMT関連遺伝子は、以下に示すいずれかの塩基配列からなる。
1)配列表の配列番号2に示す塩基配列;
2)前記1)に記載の塩基配列のうち、1若しくは数個の塩基が置換、欠失、挿入又は付加といった変異された塩基配列;
3)前記1)又は2)に記載の塩基配列に対して縮重し、DMTが有するアミノ酸配列をコードする塩基配列;
4)前記1)〜3)のいずれかに記載の塩基配列と、80%以上の相同性を有する塩基配列。
【0037】
本発明において、SAMS関連遺伝子は、以下に示すいずれかの塩基配列からなる。
1)配列表の配列番号3に示す塩基配列;
2)前記1)に記載の塩基配列のうち、1若しくは数個の塩基が置換、欠失、挿入又は付加といった変異された塩基配列;
3)前記1)又は2)に記載の塩基配列に対して縮重し、SAM合成酵素が有するアミノ酸配列をコードする塩基配列;
4)前記1)〜3)のいずれかに記載の塩基配列と、80%以上の相同性を有する塩基配列。
【0038】
各酵素遺伝子の塩基配列のうち、「1若しくは数個の塩基が置換、欠失、挿入又は付加」の変異を生じさせる方法としては、PCR法、エラープローンPCR法、DNAシャッフリング法やキメラ酵素を作製する手法等の公知の方法を利用することができる。これらの手法を用いて得られた各酵素遺伝子の塩基配列によりコードされる各アミノ酸配列を有する酵素の比活性や安定性の評価を行うことで、本願に適した高活性酵素又は高安定性酵素を選抜することができる。この場合において、「1若しくは数個の塩基が置換、欠失、挿入又は付加」とは、1〜15個程度の塩基が置換、欠失、挿入又は付加していてもよいことを意味する。
【0039】
本発明は、ハロモナス属に属する微生物のゲノムにおいて、エクトインの生合成オペロンのうち、浸透圧応答性のプロモーターを含み、エクトインの生合成に特異的な遺伝子領域の一部又は全部を欠損あるいは置換していることを特徴とする微生物にも及ぶ。「エクトインの生合成に特異的な領域」とは、エクトインの生合成オペロンのうち、エクトインの生合成に特異的な酵素をコードする遺伝子領域が挙げられる。「エクトインの生合成に特異的な酵素」とは、L-アスパラギン酸-β-セミアルデヒドからエクトインへの代謝において、L-ジアミノ酪酸アミノ基転移酵素及び/又はL-ジアミノ酪酸アセチル基転移酵素が挙げられる(非特許文献1:Biotechnology Advances 28 (2010) 782-801参照)。これらの酵素は、EctA、EctB、EctCで表すことができ、これらに関連する遺伝子を各々ectA、ectB、ectCで表すことができる(図3(a)参照)。「エクトインの生合成に特異的な遺伝子領域の一部又は全部を欠損あるいは置換している」とは、具体的にはectA、ectB及びectCから選択される1種又は複数の遺伝子の一部又は全部を欠損し(図3(b)参照)、あるいは他の遺伝子に置換されている(例えば図3(c)〜(e)参照)ことをいう。具体的には、H. elongataのエクトインの生合成オペロン(ectABC)領域を欠失している株(Halomonas elongata KA1)が挙げられ、独立行政法人産業技術総合研究所特許生物寄託センター(〒305-8566 茨城県つくば市東1-1-1つくばセンター中央第6)に寄託申請され、受領番号FERM AP-22094として平成23年3月31日に受領されている。
【0040】
本発明において、適合溶質(B)の生合成能を低下又は欠失させ、且つ適合溶質(A)生合成に関連する外来遺伝子を導入した微生物を高浸透圧条件下で培養して生合成された適合溶質(A)は、微生物中に生合成され、高密度に蓄積されており、係る微生物を低浸透圧条件で処理することで微生物を破砕することなく、適合溶質(A)を容易に微生物該へ排出させ、回収することができる。具体的には、ハロモナス属に属する微生物(例えば、H. elongata)が本来産生しうるエクトインの生合成能を低下又は欠失させ、且つメチル化グリシン生合成に関連する外来遺伝子を導入した微生物を高浸透圧条件下で培養して生合成されたメチル化グリシン(例えば、グリシンベタイン、ジメチルグリシン)は、微生物中に高密度で蓄積されており、係る微生物を低浸透圧条件で処理することで微生物を破砕することなく、メチル化グリシンを容易に微生物外へ排出させ、回収することができる。例えば当該低浸透圧溶液に微生物を懸濁することで、微生物を破砕することなく、メチル化グリシンを容易に微生物外へ排出させ、回収することができる。
【実施例】
【0041】
本発明の理解を深めるために、以下に実施例及び実験例を示して具体的に説明するが、本発明はこれら実施例に限定されるものではないことは明らかである。
【0042】
(実施例1)グリシンベタイン生合成のための組換型ハロモナス菌株の作製
本実施例では、中度好塩性細菌が高浸透圧条件下で適合溶質のエクトインを高密度に生合成する機構を活用し、エクトインに替わりグリシンベタインを高密度に生合成する組換型ハロモナス菌株を作製した。
【0043】
1)使用菌株(以下の実施例、実験例でも同様)
エクトイン生合成オペロンを欠損したH. elongata KA1株(以下、「ハロモナス菌(KA1株)」)を使用した。即ち、ハロモナス菌(KA1株)は、エクトイン非産生株である。ハロモナス菌の培養は37℃で行い、LB(Luria-Bertani)培地、M63最小培地(炭素源として、0.2%グリセロール又はグルコースを添加)、又は人工海水培地(炭素源として0.2%グルコース、グリセロール、又はキシロースを添加)を基本として使用し、必要に応じて2×又は4×ダイゴIMK培地及びNaClを適当量添加した培地を使用した。
【0044】
2)グリシンベタイン生合成のための遺伝子の設計
ハロモナス菌(KA1株)に、グリシンを出発物質としたグリシンベタイン生合成能力を付与するのに必要な2種類の酵素、GMST及びDMTに関連する各遺伝子は、耐塩性シアノバクテリアAphanothece halophyticaにおいて同定された酵素のアミノ酸配列をもとに設計した。GSMT関連遺伝子及びDMT関連遺伝子については、それらのコドン使用頻度をハロモナス菌(KA1株)での発現用に最適化した人工遺伝子HeGSMT(配列番号1)及びHeDMT(配列番号2)を設計して使用した。さらに、SAMの供給に機能するSAM合成酵素(SAMS)については、ハロモナス菌ゲノム上にコードされたSAMS関連遺伝子(配列番号3)をサブクローニングして使用した。また、遺伝子発現量を解析するためのレポーターとして赤色蛍光タンパク質をコードしたmCherry遺伝子(赤色蛍光タンパク質レポーター遺伝子)(配列番号4)を使用した。各遺伝子について、遺伝子組換え操作等のために制限酵素認識部位を付加したものは、各々配列番号7〜10に示した(図6〜9参照)。
【0045】
3)相同組換用プラスミドの構築
ハロモナス菌が高浸透圧条件下で適合溶質のエクトインを高密度に生合成する機構を活用し、ハロモナス菌(KA1株)を用いて、エクトインの替わりにグリシンベタインを高密度に生合成する組換型ハロモナス菌株を作製するためのプラスミドを構築した。プラスミドは、必要な相同組換領域として、エクトイン生合成オペロン(ectABC)の上流配列(UectA)(配列番号5)及び下流配列(DectC)(配列番号6)をゲノムPCR法によりクローン化し、赤色蛍光タンパク質(mCherry)をコードしたレポーター遺伝子(配列番号4)と連結して、pK18mobsacB-UectA-mCherry-DectCプラスミドとした。そして、mCherryの下流に目的遺伝子(X)、具体的には2種類のメチル基転移酵素関連遺伝子(HeGSMT及びHeDMT)をポリシストロン性のオペロンとして挿入し、pK18mobsacB-UectA-mCherry-GSMT-DMT-DectCプラスミドを構築した(図1参照)。さらに、配列番号3に示す配列からなるSAMS関連遺伝子をポリシストロン性のオペロンとして挿入し、pK18mobsacB-UectA-mCherry-GSMT-SAMS-DMT-DectCプラスミドを構築した。コントロールとして、mCherry遺伝子単独発現のプラスミドを同様に構築した。エクトイン生合成オペロン(ectABC)の上流配列(UectA)には、エクトインの産生に必要なプロモーター領域が含まれる(図2参照)。UectA及びDectCについて、制限酵素認識部位を付加したものは、各々配列番号11及び12に示した(図10〜11参照)。
【0046】
4)組換型ハロモナス菌株の作製
上記3)で構築した各種オペロンを含む上述の各種相同組換用プラスミドを、接合伝達法によりハロモナス菌(KA1株)へ導入した。そして、導入した相同組換用プラスミドDNAとハロモナス菌ゲノム上の標的DNAの相同領域配列(UectA又はDectC)間で起きる二段階の相同組換反応により、目的遺伝子(X)を標的領域、即ち高浸透圧条件に応答して発現が誘導される適合溶質エクトインの生合成オペロン(ectABC)のプロモーター領域を含むUectA配列の下流に挿入した組換型ハロモナス菌株を作製した(図1参照)。
【0047】
ハロモナス菌野生型株及び組換型ハロモナス菌株におけるエクトイン生合成オペロン領域のゲノム構造を図3に示した。図3に示したエクトイン非生産性のハロモナス菌株(KA1)は、野生型のハロモナス菌がゲノム上に有する適合溶質エクトインの生合成オペロン(ectABC)のうち、ectAの第2コドンからectCの最終コドンの領域を欠損したゲノム構造を有しており、ectABCオペロンのプロモーター領域を含むUectA配列とectABCオペロンのターミネーター領域を含むDectCを保持している。
(a)野生型株:エクトイン生合成オペロン(ectABC)を有する野生型株
(b)△ect株:ectABCを欠損した株(KA1株)
(c)△ect::mCherry株:ectABCオペロンのプロモーター領域を含むUectA配列の下流にmCherryを挿入した株
(d)△ect::mCherry-GSMT-DMT株:ectABCオペロンプロモーター領域を含むUectA配列の下流にmCherry、HeGSMT、及びHeDMTを挿入した株
(e)△ect::mCherry-GSMT-SAMS-DMT株:ectABCオペロンのプロモーター領域を含むUectA配列の下流にmCherry、HeGSMT、HeDMT、及びSAM合成酵素遺伝子(SAMS) を挿入した株
【0048】
上記のうち、(b)H. elongataよりエクトインの生合成オペロン(ectABC)領域を欠損させた△ect株(Halomonas elongata KA1)は、独立行政法人産業技術総合研究所特許生物寄託センター(〒305-8566 茨城県つくば市東1-1-1つくばセンター中央第6)に寄託申請され、受領番号FERM AP-22094として平成23年3月31日に受領されている。
【0049】
(実験例1−1)発現解析
本実験例では、実施例1で作製した組換型ハロモナス菌株に導入したグリシンベタイン生合成オペロンの発現解析を行った。レポーターとして導入したmCherry遺伝子の発現量を蛍光シグナルとして検出することにより、塩ストレスに応答したグリシンベタイン生合成オペロンの遺伝子発現様式を解析した。2%又は6% NaClを含む改変LB寒天培地上で培養した組換型ハロモナス菌株の赤色蛍光シグナルを検出した。mCherry蛍光の写真はLAS4010(GE社製)にて撮影した。
【0050】
その結果、2% NaCl条件に対し、6% NaClの高浸透圧条件下でより強い蛍光シグナルが検出されたことから、高浸透圧条件に応答して人工グリシンベタイン生合成オペロンを強発現する組換型ハロモナス菌株の創製に成功したことが示された(図12)。図12における色が濃いものについて、mCherry由来の赤色蛍光シグナル強度が強いことを示す。
【0051】
(実験例1−2)組換型ハロモナス菌株によるグリシンベタインの検出
本実験例では、実施例1で作製した組換型ハロモナス菌株において、導入したグリシンベタイン生合成オペロンが機能的に発現しているかを検証するため、3% NaClを含むM63最少培地(炭素源として0.2%グルコースを含む)で各種ハロモナス菌株を培養した。各種ハロモナス菌株から超純水による低浸透圧処理により抽出された適合溶質成分(ジメチルグリシン、グリシンベタイン、エクトイン)をHPLCにより分析した。
【0052】
HPLCの分析手法は、Clinical Chemistry 44:9, 1937-1941 (1998)を参照した。具体的には、細胞抽出液中のカルボニル基を有するグリシンベタインやエクトインを含む化合物を4-ブロモフェナシルブロミドでラベル化して行った。HPLC分析カラムは、SupelcosilTM LC-SCX, 5μm, 25 cm×4.6 cm (Supelco Inc.)を使用し、カラム温度28℃、流速1.5 mL/min、UV検出器の波長254 nmの条件により検出した。溶媒は22 mMコリンを添加した90%アセトニトリル溶液を使用した。
【0053】
その結果、(a)野生型ハロモナス菌株ではエクトインのみが顕著量検出されたのに対し、エクトイン生合成遺伝子を欠損したハロモナス菌株((c)〜(e))ではエクトインが検出されなかった。その一方で、グリシンベタイン生合成オペロンを導入した組換型ハロモナス菌株((d)△ect::mCherry-GSMT-DMT株及び(e)△ect::mCherry-GSMT-SAMS-DMT株)では、グリシンベタインが顕著量検出された。それに対して、コントロールの(c)△ect::mCherry株ではエクトイン及びグリシンベタインは顕著量検出されなかった。さらに、(d)△ect::mCherry-GSMT-DMT株よりも、(e)△ect::mCherry-GSMT-SAMS-DMT株の方が多量のグリシンベタインが検出されたことから、SAMの供給を強化した(d)△ect::mCherry-GSMT-SAMS-DMT株がグリシンベタインを高密度で生合成しうる株として有用であることが示された(図13)。また、4×ダイゴIMK培地を含むM63最少培地(炭素源として0.2%グルコースを含む)に6% NaClを添加した高浸透圧条件では、エクトインを生産しないコントロールの(c)△ect::mCherry株は増殖できないのに対し、グリシンベタインを生産する(e)△ect::mCherry-GSMT-SAMS-DMT株は増殖が可能であったことから、エクトイン非生産株で生産されたグリシンベタインが適合溶質として機能することが示された(図14)。
【0054】
(実施例2)高浸透圧条件下でのグリシンベタイン産生
本実施例では、実施例1で作製した組換型ハロモナス菌株((e)△ect::mCherry-GSMT-SAMS-DMT株)について、各濃度のNaClを含むLB培地で培養したときのグリシンベタインの産生を確認した。培養は37℃で24時間行い、培地はNaCl濃度を2〜12%に増量したLB培地5 mLを使用した。そして、培養液から組換型ハロモナス菌株の細胞を遠心分離によりペレットとして回収し、回収細胞量の新鮮重量を測定した。抽出は、10 mg新鮮重量あたり40μLの超純水を加えて細胞を懸濁することにより行い、遠心分離した上澄み液を抽出液として回収した。
【0055】
その結果、2%の低NaCl濃度条件に比べて、3, 6, 9, 12%のNaCl濃度の上昇に伴い、組換型ハロモナス菌株の細胞から抽出されたグリシンベタイン濃度の顕著な上昇がみられた(図15A)。しかしながら、9%以上のNaCl濃度域では回収された細胞量が減少していたため、6%条件でのグリシンベタインの培養液あたりの生産量が最大であった(図15B)。
【0056】
高浸透圧条件でグリシンベタインを高密度で生合成した組換型ハロモナス菌株の細胞からのグリシンベタイン抽出は、細胞を破砕することなく超純水での懸濁による低浸透圧処理のみで十分であることが示唆された。以上の結果から、(e)△ect::mCherry-GSMT-SAMS-DMT株を用いることにより、高浸透圧条件でのグリシンベタインを高密度で生合成させるプロセスの構築が可能であることが示された。また、菌株の細胞内に高密度に生合成され、蓄積されたグリシンベタインの抽出には細胞破砕を必要とせず、超純水を用いた低浸透圧処理によるグリシンベタインの抽出プロセスの構築が可能であることが示唆された。
【0057】
(実施例3)高浸透圧条件での二段階培養によるグリシンベタイン生産
本実施例では、実施例1で作製した組換型ハロモナス菌株((e)△ect::mCherry-GSMT-SAMS-DMT株)について、高浸透圧条件での二段階培養によるグリシンベタインの高生産プロセスの検討を行った。実施例2の結果より、NaCl濃度が高すぎると、当該組換型菌株の細胞増殖が阻害されたが、グリシンベタインの生産性はNaCl濃度が高いほど向上していた。そこで、6%のNaCl濃度条件で当該組換型菌株を培養して細胞をあらかじめ増殖させておき、続いて15%のNaCl濃度条件下で継続して培養する二段階培養によるグリシンベタインの高生産プロセスの検討を行った。培養は37℃で行い、培地はNaCl濃度を6%又は15%に増量したLB培地50 mLを使用した。分析は実施例1と同手法にて行った。
【0058】
その結果を図16に示した。LB培地に6%のNaClを添加した条件下で24時間培養した組換型ハロモナス菌株より、22 mMのグリシンベタイン抽出液が得られた(6%, 24時間)。その一方で、LB培地に6%のNaClを添加した条件下で24時間培養した後、さらに継続して15%のNaClを添加した条件で12時間の二段培養を行った当該組換型菌株からは、50 mMのグリシンベタイン抽出液が得られ(6%, 24時間→15%, 12時間)、24時間まで二段目の培養を行った当該組換型菌株からは、60 mMのグリシンベタイン抽出液が得られた(6%, 24時間 → 15%, 24時間)。
【0059】
上記の結果、二段階培養を開始して12時間目で50 mMのグリシンベタイン抽出液を得ることができた。さらに24時間目には、60 mMのグリシンベタイン抽出液が得られた。以上の結果により、二段階培養により、ハロモナス菌株の細胞増殖を確保したうえで、グリシンベタインを高生産することに成功した。
【0060】
(実施例4)人工海水培地によるグリシンベタイン生産
実施例2及び3で使用したLB培地の成分中には、コリンやグリシンベタインそのものなどが含まれるため、コリンやグリシンベタインを取り込む活性が生産性の評価に影響を及ぼすことが懸念された。また、実施例1で使用したM63最少培地ではグリシンベタイン生合成量が低いため、塩ストレス下での細胞増殖自体が悪いという結果が得られた。そのため、グリシンベタイン生合成に適した無機塩培地を検討した。
【0061】
ハロモナス菌株を使用する利点として、水資源枯渇問題に対応するため、海水を直接使用可能である点があげられる。そこで、本実施例では、微細藻類の培養用に開発されたダイゴIMK培地を含む人工海水培地の利用を検討した。微細藻類の細胞増殖が良くなるとされる、2×ダイゴIMK培地を含む人工海水を使用した。また、炭素源として、植物バイオマス由来の主要な炭素源であるグルコース、グリセロール、キシロースの3種について検討を行った。
【0062】
その結果、いずれの炭素源においても、組換型ハロモナス菌株((d)△ect::mCherry-GSMT-DMT株及び(e)△ect::mCherry-GSMT-SAMS-DMT株)において、グリシンベタインの生合成が確認できたことから、海水及び植物バイオマス由来炭素源を用いたグリシンベタインの生合成が可能であることが示唆された(図17〜19)。
【産業上の利用可能性】
【0063】
以上詳述したように本発明の製造方法により、所望の適合溶質(A)を微生物内で生合成し、高密度で蓄積し、かつ容易に分離・回収することができる。本発明の方法により、所望の適合溶質(A)を大量に安定的に供給することが可能となる。
【0064】
適合溶質の具体例としてメチル化グリシンについて、グリシンからのサルコシン、サルコシンからジメチルグリシン、ジメチルグリシンからグリシンベタインへの三段階のメチル化反応によるグリシンベタイン合成のための代謝経路を、例えばハロモナス菌に導入する本発明の製造方法により、豊富な炭素源から生合成する必須アミノ酸のグリシンを出発物質として、ハロモナス菌内にグリシンベタインを生合成し、高密度に蓄積させることができる。更に、グリシンベタインの合成にメチル基供与体として使われるS-アデノシルメチオニン(SAM)の合成系を並行して強化することで、より大量のグリシンベタインを生合成することができる。本発明の製造方法により、植物バイオマス由来の単純な炭素源からメチル化グリシン、例えばグリシンベタインを微生物内で高密度に蓄積することができ、さらには淡水などの低浸透圧条件下でグリシンベタインを排出させ、容易に分離・回収することができる。さらには、使用した微生物を繰り返し利用することで、グリシンベタインを連続して高生産することができる。
【技術分野】
【0001】
本発明は、微生物を利用することを特徴とする適合溶質の製造方法に関する。具体的には、微生物を利用することを特徴とするメチル化グリシンの製造方法に関する。
【背景技術】
【0002】
環境ストレスにさらされたとき、水に代わって生体成分を保護するために体内に蓄積されてくる低分子の化合物を、適合溶質という。一般には、耐塩性、乾燥耐性、凍結耐性など、細胞質の脱水を引き起こす高浸透圧ストレスに対する耐性を細胞に与える機能を持つと考えられている。
【0003】
生物が高濃度の塩分、乾燥、凍結などに曝されることにより生じる脱水ストレス条件下では、細菌から真菌、植物、動物を含むすべての生物は細胞の膨圧を維持して保湿性を保つために浸透圧調節物質を細胞内に高密度蓄積する。実際に生物が細胞内に蓄積している浸透圧調節物質としては、K+ や Na+ などのイオンの他に、高密度蓄積しても細胞内の代謝を阻害しない適合溶質と呼ばれる低分子有機化合物(アミノ酸類、糖類、ポリオール類など)が知られている。適合溶質は、単に浸透圧の調節を行うだけでなく、タンパク質及び膜の安定化、ヒドロキシラジカル (HO・) 消去、核酸の Tm値低下による DNA複製や転写、翻訳の保護などの機能を持つことが示されており、種々の環境ストレスから細胞を保護するために重要な役割を担っている。
【0004】
適合溶質のうち、エクトインや、グリシンがトリメチル化されたグリシンベタイン(N,N,N-トリメチルグリシン)は、浸透圧調節、タンパク質保護、膜の保護、ラジカル消去などの機能を発揮することが知られている。また、グリシンベタインよりは若干劣るものの、ジメチルグリシンについても、細胞の浸透圧調節、タンパク質合成活性の保護機能や凍結耐性の機能があるといわれている。適合溶質のうち、微生物におけるエクトイン生合成の経路及びエクトインの機能については、非特許文献1に詳述されている。
【0005】
微生物を用いて生産効率を上げる方法は、従来より研究がなされており、高密度培養の研究も数多くなされている。しかしながら、糖類や塩類等の濃度を上げた培地を用いて目的物の生産性を高めることは簡便な方法であるが、高濃度の培地成分によって浸透圧が上昇するため、一定の浸透圧以上となると、微生物はもはや生育できなくなる。これを改善するために、例えば初発の糖濃度を上げた培地にベタインを添加することで、乳酸菌からマンニトールを効率的に生産する方法が知られている。また、塩、糖、ポリオールなどの栄養成分を高濃度に含んだ培地に、好塩性細菌ハロモナスから分離したエクトインを添加して微生物を高密度培養すると、培養効率を上げることができることが報告されている(特許文献1)。
【0006】
グリシンベタインは、エビ、カニ、タコ、イカ、貝類などの水産物やテンサイ、麦芽、キノコ類、果実などの食材に多く含まれており、"甘味"と"うま味"の一成分となっている。そのため、日本では安全性の高い食品添加物として広く使用されている。また、グリシンベタインは優れた保湿機能や生体分子保護機能を有するため、化粧品や整髪料などにも使用されている。グリシンベタインは、さらに動脈硬化の危険因子であるホモシステインの代謝に関係することから、ホモシステイン尿症患者に対する医薬品としても用いられる。加えて循環器の健康維持のためのサプリメント成分としても利用されている。世界的にも、家畜の必須栄養素コリンの欠乏を補う目的にグリシンベタインが飼料添加物として使用されている。
【0007】
グリシンベタインは "テンサイ"(別名:サトウダイコン)の根部から製造される砂糖の副産物であるテンサイ糖蜜から抽出して生産される。このため生産量は原料となるテンサイの収穫量に依存し、その有用性の高さにも関わらずグリシンベタインの増産には限界があった。
【0008】
根粒菌は、適合溶質の生合成能又は蓄積能が低いために、ストレスの影響を大きく受けてしまうと考えられており、根粒菌のストレス耐性能力の向上のために、適合溶質のうち、グリシンベタインの製法について検討がなされている(特許文献2)。ここでは、グリシンベタイン生合成能又は蓄積能が低い根粒菌に、グリシンベタイン生合成に関与するコリンオキシダーゼをコードする遺伝子を導入することにより、グリシンベタインの生合成能及び蓄積能が向上することが開示されている。ここで報告されるグリシンベタインの製法は、いわゆるコリンを基質としたコリン酸化経路によるものである。
【先行技術文献】
【非特許文献】
【0009】
【非特許文献1】Biotechnology Advances 28 (2010) 782-801
【特許文献】
【0010】
【特許文献1】特開平8-154670号公報
【特許文献2】特開2004-229557号公報
【発明の概要】
【発明が解決しようとする課題】
【0011】
本発明は、所望の適合溶質を容易に高生産可能な製法を提供することを課題とする。具体的には、微生物内に所望の適合溶質を生合成させ、容易に分離・回収可能な製法を提供することを課題とする。
【課題を解決するための手段】
【0012】
本発明者らは、上記課題を解決するために鋭意研究を重ねた結果、微生物が本来産生しうる主要な適合溶質の生合成能を低下又は欠失させ、且つ所望の適合溶質生合成に関連する外来遺伝子を導入した微生物を高浸透圧条件下で培養し、当該微生物中で所望の適合溶質を生合成させる工程を含み、さらに当該微生物中で生合成した所望の適合溶質を、低浸透圧条件下で微生物から排出させ、回収する工程を含む製造方法により、上記課題を解決しうることを見出し、本発明を完成した。
【0013】
すなわち本発明は、以下よりなる。
1.以下の工程を含む、微生物を用いた適合溶質(A)の製造方法:
1)適合溶質(B)の生合成能を低下又は欠失させ、且つ適合溶質(A)生合成に関連する外来遺伝子を導入した微生物を高浸透圧条件下で培養し、微生物中で適合溶質(A)を生合成させる工程;
2)前記微生物中で生合成した適合溶質(A)を、低浸透圧条件下で微生物から排出させ、回収する工程。
2.高浸透圧条件が、塩化ナトリウム濃度(NaCl)で換算した場合に0.5〜4 Mであり、低浸透圧条件が、同様に塩化ナトリウム濃度で換算した場合に0〜0.5 Mであることを特徴とする、前項1に記載の製造方法。
3.微生物が、ハロモナス属(Halomonas)に属する微生物であることを特徴とする、前項1又は2に記載の製造方法。
4.ハロモナス属に属する微生物が、Halomonas elongataに属する微生物であることを特徴とする、前項3に記載の製造方法。
5.前記適合溶質(B)が、エクトインであることを特徴とする、前項3又は4に記載の製造方法。
6.適合溶質(B)の生合成能を低下又は欠失させることが、前記微生物のゲノム上に存在するエクトイン生合成オペロンのうち、エクトイン生合成に特異的な遺伝子の一部若しくは全部を除去することである、前項5に記載の製造方法。
7.適合溶質(A)が、メチル化グリシンであることを特徴とする、前項1〜6のいずれかに記載の製造方法。
8.メチル化グリシンが、グリシンからサルコシンを合成する経路を介して生合成されることを特徴とする、前項7に記載の製造方法。
9.メチル化グリシンが、少なくともグルコース、グリセロール及び/又はキシロースを炭素源として生合成されることを特徴とする、前項7又は8に記載の製造方法。
10.適合溶質(A)の生合成に関連する外来遺伝子が、少なくともグリシンサルコシンメチル基転移酵素(GSMT)関連遺伝子である、前項7〜9のいずれかに記載の製造方法。
11.グリシンサルコシンメチル基転移酵素(GSMT)関連遺伝子が、以下に示すいずれかの塩基配列からなる、前項10に記載の製造方法:
1)配列表の配列番号1に示す塩基配列;
2)前記1)に記載の塩基配列のうち、1若しくは数個の塩基が置換、欠失、挿入又は付加といった変異された配列からなる塩基配列;
3)前記1)又は2)に記載の塩基配列に対して縮重し、グリシンサルコシンメチル基転移酵素(GSMT)が有するアミノ酸配列をコードする塩基配列;
4)前記1)〜3)のいずれかに記載の配列と、80%以上の相同性を有する塩基配列。
12.適合溶質(A)の生合成に関連する外来遺伝子が、さらに、ジメチルグリシンメチル基転移酵素(DMT)関連遺伝子である、前項10又は11に記載の製造方法。
13.メチルグリシンメチル基転移酵素(DMT)関連遺伝子が、以下に示すいずれかの塩基配列からなる、前項12に記載の製造方法:
1)配列表の配列番号2に示す塩基配列;
2)前記1)に記載の塩基配列のうち、1若しくは数個の塩基が置換、欠失、挿入又は付加といった変異された塩基配列;
3)前記1)又は2)に記載の塩基配列に対して縮重し、メチルグリシンメチル基転移酵素(DMT)が有するアミノ酸配列をコードする塩基配列;
4)前記1)〜3)のいずれかに記載の塩基配列と、80%以上の相同性を有する塩基配列。
14.適合溶質(A)の生合成に関連する外来遺伝子が、さらにS−アデノシルメチオニン(SAM)合成酵素関連遺伝子である、前項10〜13のいずれかに記載の製造方法。
15.S−アデノシルメチオニン(SAM)合成酵素関連遺伝子が、以下に示すいずれかの塩基配列からなる、前項14に記載の製造方法:
1)配列表の配列番号3に示す塩基配列;
2)前記1)に記載の塩基配列のうち、1若しくは数個の塩基が置換、欠失、挿入又は付加といった変異された塩基配列;
3)前記1)又は2)に記載の塩基配列に対して縮重し、S−アデノシルメチオニン(SAM)合成酵素が有するアミノ酸配列をコードする塩基配列;
4)前記1)〜3)のいずれかに記載の塩基配列と、80%以上の相同性を有する塩基配列。
16.外来遺伝子の導入が、ハロモナス属に属する微生物のゲノム上に存在するエクトイン生合成オペロンのうち、浸透圧応答性プロモーターの制御下にある領域に、前項11に記載のいずれかの塩基配列からなる遺伝子を導入することによる、前項3〜11に記載製造方法。
17.外来遺伝子の導入が、ハロモナス属に属する微生物のゲノム上に存在するエクトイン生合成オペロンのうち、浸透圧応答性プロモーターの制御下にある領域に、さらに前項13に記載のいずれかの塩基配列からなる遺伝子を導入することによる、前項16に記載の製造方法。
18.外来遺伝子の導入が、ハロモナス属に属する微生物のゲノム上に存在するエクトイン生合成オペロンのうち、浸透圧応答性プロモーターの制御下にある領域に、前項15に記載のいずれかの遺伝子を導入することによる、前項16又は17に記載の製造方法。
19.浸透圧応答性プロモーターが、ハロモナス属に属する微生物のゲノム上に存在するエクトインの生合成オペロンの上流配列(UectA)中に含まれることを特徴とする、前項16〜18のいずれかに記載の製造方法。
20.メチル化グリシンが、グリシンベタインである、前項7〜19のいずれかに記載の製造方法。
21.メチル化グリシンが、ジメチルグリシンである、前項7〜11、14〜16、18〜19のいずれかに記載の製造方法。
22.ハロモナス属に属する微生物のゲノムにおいて、エクトインの生合成オペロンのうち、浸透圧応答性のプロモーターを含み、エクトインの生合成に特異的な遺伝子の一部又は全部を欠損あるいは置換していることを特徴とする微生物。
23.エクトインの生合成に特異的な遺伝子が、L-アスパラギン酸-β-セミアルデヒドからエクトインへの代謝において、L-ジアミノ酪酸アミノ基転移酵素及び/又はL-ジアミノ酪酸アセチル基転移酵素の発現に必須な領域であることを特徴とする前項22に記載の微生物。
24.受領番号FERM AP-22094で特定される微生物である、前項22又は23に記載の微生物。
【発明の効果】
【0014】
本発明の適合溶質の製造方法により、所望の適合溶質(A)を微生物内に生合成させ、高密度で蓄積させることを可能とし、かつ、蓄積された微生物内の適合溶質(A)を容易に分離回収することができる。これにより、適合溶質(A)を高生産することができる。
具体的には、微生物が本来有する適合溶質(B)の生合成能を低下又は欠失させ、且つ適合溶質(A)の生合成に関連する外来遺伝子を導入した微生物を高浸透圧条件下で培養することにより、適合溶質(A)を微生物内に生合成させ、高密度で蓄積させることができる。また、当該微生物を低浸透圧条件で処理することで、微生物を破砕することなく適合溶質(A)を容易に微生物該へ排出させ、回収することができる。
さらに、使用した微生物を繰り返し利用することで、適合溶質(A)を連続して高生産することができ、安定的に供給可能となる。
【図面の簡単な説明】
【0015】
【図1】二段階の相同組換法による組換型ハロモナス菌株の作製方法を示す図である。(実施例1)
【図2】野生型H. elongataのゲノム上に有するエクトイン生合成オペロン(ectABC)の上流配列(UectA)を示す図である。図2に示す配列部分は、配列番号11の1096-1227部分に該当する。UectAには、適合溶質の産生に必要なプロモーター領域が含まれる。(実施例1)
【図3】各種ハロモナス菌株におけるエクトイン生合成オペロン領域のゲノム構造を示す図である。(実施例1)
【図4】グリシンベタインの2つの異なる生合成経路を示す概念図である。A.コリン酸化経路; コリンを基質とし、コリンデヒドロゲナーゼ(BetA)及びベタインアルデヒドデヒドロゲナーゼ(BetB)の2種類の酵素による酸化反応により、グリシンベタインが生合成される。B.グリシンメチル化経路; 2種類のメチル基転移酵素により触媒される、グリシンを基質とした三段階のメチル化反応によりグリシンベタインが生合成される。
【図5】グリシンベタインのグリシンメチル化による生合成経路を示す図である。
【図6】GMST関連遺伝子の塩基配列を示す図である。(配列番号1,7)
【図7】DMT関連遺伝子の塩基配列を示す図である。(配列番号2,8)
【図8】SAMS関連遺伝子の塩基配列を示す図である。(配列番号3,9)
【図9】mCerry関連遺伝子の塩基配列を示す図である。(配列番号4,10)
【図10】UectA領域の塩基配列を示す図である。(配列番号5,11)
【図11】DectC領域の塩基配列を示す図である。(配列番号6,12)
【図12】各種ハロモナス菌株におけるグリシンベタイン生合成オペロンの発現解析結果を示す写真図である。(実験例1−1)
【図13】各種ハロモナス株の細胞抽出液中の各種適合溶質成分のHPLC分析による、ジメチルグリシン、グリシンベタイン及びエクトインの検出結果を示す図である。(実験例1−2)
【図14】エクトイン非生産性のハロモナス株において、エクトインの代わりに生産されたグリシンベタインが適合溶質として機能することにより、エクトイン非生産性のハロモナス株の塩ストレス耐性が向上することを示す図である。(実験例1−2)
【図15】高浸透圧条件下でのグリシンベタイン生産結果を示す図である。A.細胞抽出液中のベタイン濃度及び培養液中から回収された細胞量(n=3)。B.培養液当たり又は細胞当たりのグリシンベタイン生産量(Aの値から算出)を示す図である。(実施例2)
【図16】高浸透圧条件での二段階培養プロセスによるグリシンベタイン生産結果を示す図である。(実施例3)
【図17】炭素源としてグルコースを添加した条件での、各種ハロモナス菌株における人工海水培地におけるジメチルグリシン、グリシンベタイン及びエクトインの生合成結果を示す図である。(実施例4)
【図18】炭素源としてグリセロールを添加した条件での、各種ハロモナス菌株における人工海水培地におけるジメチルグリシン、グリシンベタイン及びエクトインの生合成結果を示す図である。(実施例4)
【図19】炭素源としてキシロースを添加した条件での、各種ハロモナス菌株における人工海水培地におけるジメチルグリシン、グリシンベタイン及びエクトインの生合成結果を示す図である。(実施例4)
【発明を実施するための形態】
【0016】
本発明は、微生物を利用することを特徴とする適合溶質の製造方法に関する。本発明は、高浸透圧条件下で適合溶質を生合成・蓄積しうる微生物を宿主として用いて、所望の適合溶質を製造する方法に関する。
【0017】
本明細書において「所望の適合溶質」は、「微生物が本来産生しうる主要な適合溶質」とは異なる別の物質の意味で用いられる。以下、本明細書において、所望の適合溶質を「適合溶質(A)」といい、当該微生物が本来産生しうる主要な適合溶質を「適合溶質(B)」として区別して述べる。また、本明細書において適合溶質全般を意味し、両者を区別しない場合は、(A)や(B)などの識別する用語を用いないものとする。
【0018】
本明細書において、適合溶質(A)の製造方法は以下の工程を含む。
1)微生物が本来有する適合溶質(B)の生合成能を低下又は欠失させ、且つ適合溶質(A)生合成に関連する外来遺伝子を導入した微生物を高浸透圧条件下で培養し、微生物中で適合溶質(A)を生合成させる工程;
2)前記微生物中で生合成した適合溶質(A)を、低浸透圧条件下で微生物から排出させ、回収する工程。
本発明の製造方法において、高浸透圧条件及び低浸透圧条件は、上記の工程1)の浸透圧条件(高浸透圧条件)に比べて、工程2)の浸透圧条件が相対的に低い浸透圧条件(低浸透圧条件)であればよい。微生物を、工程1)の浸透圧条件に比べて、工程2)で相対的に低い浸透圧条件で処理することにより、適合溶質(A)を微生物から排出させることができる。
【0019】
本明細書において、「高浸透圧条件」とは、塩化ナトリウム(NaCl)濃度で換算した場合に、0.5〜4 M程度の条件とすることができ、例えば0.51〜3.6 Mであり、好ましくは0.75〜3.6 Mであり、より好ましくは1.0〜3.2 Mであり、さらに好ましくは約2.0〜2.6 Mである。また、本発明における「低浸透圧条件」とは、同様に塩化ナトリウム濃度で換算した場合に0〜0.5 M程度の条件とすることができ、好ましくは、0〜0.34 Mとすることができ、例えば水の条件であってもよい。ただし、本発明の製造方法に使用する微生物を製造において複数回使用することを考慮すると、微生物が破裂しない程度の低浸透圧条件であることが好適である。そのような条件としては、0.02〜0.06 Mである。上記の範囲から、工程1)で選択した高浸透圧条件に比べ、工程2)では工程1)で選択した条件より相対的に低い浸透圧条件を適宜選択することができる。
【0020】
本明細書において、「微生物」とは、高浸透圧条件下で適合溶質を生合成・蓄積しうる微生物であり、例えば好塩性菌が挙げられる。好塩性菌の種類としては、至適塩濃度により、低度好塩性菌、中度好塩性菌、高度好塩性菌等が挙げられる。本発明に使用可能な微生物としては、好ましくは中度好塩性菌であり、具体的にはハロモナス属(Halomonas)、クロモハロバクター属(Chromohalobacter)、アクロモバクター属(Achromobacter)、アシディフィラム属(Acidiphilium)、アルカニボラクス属(Alcanivorax)、アミコラトプシス属(Amycolatopsis)、バチルス属(Bacillus)、ヘルミニイモナス属(Herminiimonas)、ハイフォモナス属(Hyphomonas)、キトコッカス属(Kytococcus)、マリノバクター属(Marinobacter)、マリノモナス属(Marinomonas)、マイコバクテリウム属(Mycobacterium)、ニトロソプミルス属(Nitrosopumilus)、ノカルジア属(Nocardia)、オクロバクテリウム属(Ochrobactrum)、パエニバチルス属(Paenibacillus)、リゾビウム属(Rhizobium)、ロドコッカス属(Rhodococcus)、サッカロモノスポラ属(Saccharopolyspora)、サッカロポリスポラ属(Saccharopolyspora)、スフィンゴピキシス属(Sphingopyxis)、 スチグマテラ属(Stigmatella)、ストレプトマイセス属(Streptomyces)などに属する微生物等が挙げられるが、これらに限定されるものではない。上記のうち、ハロモナス属に属する微生物としては、H. elongata、H. boliviensis、H. campisalis、H. halmophila、H. halophila、H. halodenitrificans、H. variabilis が挙げられ、入手可能な菌株としては、H. boliviensis DSM 15516T、H. campisalis ATCC 700597、H. elongata ATTC 33173T、H. elongata DSM 142、H. elongata DSM 2581T、H. elongata OUT30018、H. halmophila CCM 2833T、H. halophila CCM 3662T、H. halodenitrificans DSM 735T、H. variabilis DSM 3051Tが挙げられる。また、クロモハロバクター属に属する微生物としては、C. marismortui及びC. salexigensが挙げられ、入手可能な菌株としては、C. marismortui ATCC 17056及びC. salexigens DSM 3043Tが挙げられる。上記のうち、エクトイン生合成遺伝子を有する全ゲノム解読済みの菌株としてはH. elongata DSM 2581T及びC. salexigens DSM 3043が挙げられる。その他、エクトイン生合成遺伝子を有する全ゲノム解読済みの菌株としては、例えばAchromobacter xylosoxidans A8、Acidiphilium cryptum JF-5、Acidiphilium multivorum AIU301、Alcanivorax borkumensis SK2、Amycolatopsis mediterranei U32、Bacillus clausii KSM-K16、Bacillus pseudofirmus OF4、Bordetella avium 197N、Brachybacterium faecium DSM 4810、Herminiimonas arsenicoxydans、Hyphomonas neptunium ATCC 15444、Kytococcus sedentarius DSM 20547、Marinobacter aquaeolei VT8、Marinomonas sp. MWYL1、Mycobacterium gilvum PYR-GCK、Mycobacterium smegmatis str. MC2 155、Mycobacterium sp. JLS、Mycobacterium sp. KMS、Mycobacterium sp. MCS、Mycobacterium vanbaalenii PYR-1、Nitrosopumilus maritimus SCM1、Nocardia farcinica IFM 10152、Ochrobactrum anthropi ATCC 49188、Paenibacillus sp. Y412MC10、Rhizobium leguminosarum bv. viciae 3841、Rhodococcus equi 103S、Rhodococcus opacus B4、Saccharomonospora viridis DSM 43017、Saccharopolyspora erythraea NRRL 2338、Sphingopyxis alaskensis RB2256、Stigmatella aurantiaca DW4/3-1、Streptomyces avermitilis MA-4680、Streptomyces griseus subsp. griseus NBRC 13350、Streptomyces scabiei 87.22等が挙げられる。その他、エクトインを産生しうる微生物として、Brevibacterium epidermis DSM 20659、Brevibacterium linens、Brevibacterium sp. strain JCM 6894、Kocuria varians CCM3316、Nesterenkonia halobia DSM 20541T、Nocardiopsis sp. A5-1、Streptomyces coelicolor A3、Streptomyces griseolus DSM 40067T、Bacillus alcalophilus DSM 485T、Bacillus agaradhaerens DSM 8721T、Bacillus clarkii DSM 8720T 、Bacillus halodurans DSM 497T、Bacillus mojavensis DSM 9205T、Bacillus pseudalcaliphilus DSM 8725T、Bacillus pseudofirmus DSM 8715T、Gracilibacillus halotolerans DSM 11805T、Halobacillus halophilus DSMZ 2266T
Halobacillus trueperi DSM 10404T、Marinococcus halophilus DSM 20408T、Marinococcus sp. M52、Salimicrobium albus DSM 20748T、Sporosarcina pasteurii DSM 33T、Sporosarcina psycrophila DSM 3T、Virgibacillus marismortui DSM 12325T、Virgibacillus pantothenticus DSM 26、Virgibacillus salexigens DSM 11438、Rhodovibrio salinarum BN 40、Rhodovulum sulfidophilum DSM 1374T、Halorhodospira abdelmalekii DSM 2110T、Halorhodospira halochloris DSM 1059T、Halorhodospira halophila DSM 244T、Pantoea agglomerans strain CPA-2、Pseudomonas halophila DSM 3050T、Pseudomonas halosaccharolytica CCM 2851、Thioalkalibacter halophilus DSMZ 19224、Vibrio alginolyticus DSM 2171T、Vibrio cholerae O139 strain MO10、Vibrio costicola CCM 2811、Vibrio fischeri DSM 507、Vibrio fischeri DSM 7151、Vibrio harveyi DSM 2165、Vibrio harveyi DSM 6904、Vibrio parahaemolyticus RIMD2210633等が挙げられる。
【0021】
本明細書において、「適合溶質(B)」とは、高浸透圧条件下で適合溶質を生合成・蓄積しうる微生物が、本来産生しうる適合溶質であればよく、特に当該微生物内に高密度に蓄積される適合溶質が好ましい。例えばハロモナス属に属する微生物では、エクトイン、ヒドロキシエクトイン、N-γ-アセチルジアミノ酪酸などが挙げられ、特に好ましくはエクトインである。アクチノポリスポラ(Actinopolyspora)属に属する微生物では、グリシベタイン、トレハロースなどが挙げられ、バシラス(Bacillus)属に属する微生物では、プロリン、グルタミン酸、グルタミンなどが挙げられる。
【0022】
本明細書において、「適合溶質(B)の生合成能を低下又は欠失」とは、適合溶質(B)の生合成能が通常の場合より低い量に抑制されていること、又は全く生合成されないことをいう。この場合において、適合溶質(B)の生合成能は低いほうが適合溶質(A)を高密度に生合成することができる。従って、適合溶質(B)の生合成能は、野生型を100%とした場合に、60%以下、好ましくは、40%以下、より好ましくは20%以下に低下しているのか好ましく、生合成能が欠失しているのが最も好ましい。適合溶質(B)の生合成能を低下又は欠失させるための手段として、適合溶質(B)を生合成するのに必須の酵素をコードする遺伝子のコード領域内の変異導入による酵素活性の低下又は欠失させることができればよい。遺伝子のコード領域内の変異導入は、微生物のゲノム上に存在する適合溶質(B)生合成に特異的な遺伝子の一部又は全部を欠損させることが考えられる。「適合溶質(B)生合成に特異的な遺伝子」としては、例えば適合溶質(B)を生合成するのに必須の酵素関連遺伝子が挙げられる。適合溶質(B)の生合成において複数の酵素が必須の場合は、それらの酵素のうちいずれか1種以上又は全ての酵素関連遺伝子の一部又は全部を欠損させてもよい。生合成に特異的な遺伝子の一部又は全部を欠損させる方法は、遺伝子組み換えの手法等、自体公知の方法によることができる。例えば、目的遺伝子の部分配列を改変し、正常に機能する酵素を産生しないようにした変異型遺伝子を作製し、当該変異型遺伝子を含むDNA、或いは遺伝子の一部又は全部を欠損させたDNAで、微生物のゲノム上の遺伝子と相同組換えを起こさせることにより、ゲノム上の目的遺伝子の一部又は全部を欠損させることが出来る。このような相同組換えを利用した遺伝子置換は、「Redドリブンインテグレーション(Red-driven integration)」と呼ばれる方法(Proc. Natl. Acad. Sci. USA Vol.97, p.6640-6645 (2000))、Redドリブンインテグレーション法とλファージ由来の切り出しシステム(J. Bacteriol. Vol.184, p.5200-5203 (2002))と組合わせた方法(WO2005/010175号参照)等を参照することができる。さらに、ハロモナス属に属する菌株の遺伝子操作に参考となる公知文献としては、Journal of Bacteriology Vol.184, p.3078-3085 (2002)が挙げられる。
【0023】
上記において、適合溶質(B)を本来産生する微生物のゲノム上に有する浸透圧応答性のプロモーターは、除去しないことが必要である。当該微生物が有する浸透圧応答性プロモーターの下流に、適合溶質(A)の生合成に関連する外来遺伝子を導入することで、高浸透圧条件下で適合溶質(A)を生合成することが可能となるからである。この場合において、「適合溶質(A)」は、「適合溶質(B)」とは異なる適合溶質であればよく、特に限定されない。
【0024】
本発明における「浸透圧応答性プロモーター」とは、微生物の適合溶質(B)の産生系に必要な浸透圧応答性プロモーターが挙げられる。具体的には、例えばハロモナス属に属するH. elongataの適合溶質(B)であるエクトインの産生系に必要な浸透圧応答性プロモーターが挙げられる。H. elongataの場合は、浸透圧応答性プロモーターは、当該微生物のゲノム上に存在するエクトインの生合成オペロンの上流配列(UectA)中に含まれる(図1、2参照)。
【0025】
本明細書において、「適合溶質(A)の生合成に関連する外来遺伝子」とは、本明細書の微生物がゲノム上に本来有する遺伝子とは異なる遺伝子であって、適合溶質(A)の生合成に必須のタンパク質等に関連する遺伝子が挙げられる。生合成に必須のタンパク質として、例えば、微生物内で所望の適合溶質(A)を生合成するために必要な酵素等が挙げられる。
【0026】
例えば、ハロモナス属に属する微生物では、適合溶質(B)としてのエクトインの生合成能を低下又は欠失させて、適合溶質(A)の生合成に関連する外来遺伝子を導入することで、高浸透圧条件下で適合溶質(A)を生合成することができる(図1参照)。エクトインの生合成能を低下又は欠失させるためには、ハロモナス属に属する微生物のゲノムにおいて、エクトインの生合成オペロンのうち上流配列(UectA)中に含まれる浸透圧応答性プロモーターを残しておけば、エクトイン生合成に特異的な遺伝子の一部又は全部を欠損させてもよい。エクトイン生合成に特異的な遺伝子として、L-アスパラギン酸-β-セミアルデヒドからエクトインへの代謝に必要な酵素関連遺伝子が挙げられる。当該必要な酵素として、L-ジアミノ酪酸アミノ基転移酵素及び/又はL-ジアミノ酪酸アセチル基転移酵素が挙げられる(非特許文献1参照)。これらの酵素は、EctA、EctB、EctCで表すことができ、これらに関連する遺伝子を各々ectA、ectB、ectCで表すことができる(図3(a)参照)。本明細書において、「エクトインの生合成能を低下又は欠失」は、エクトインの生合成オペロンのうち、ectA、ectB、ectCから選択される1種又は複数の遺伝子の、一部又は全部を欠損させることにより、達成することができる(図3(b)参照)。この場合において、エクトインの生合成能は低いほうが適合溶質(A)を高密度に生合成することができる。従って、エクトインの生合成能は、野生型を100%とした場合に、60%以下、好ましくは40%以下、より好ましくは20%以下に低下しているのか好ましく、生合成能が欠失しているのが最も好ましい。
【0027】
上記において、適合溶質(A)の種類は、上記のハロモナス属に属する微生物がゲノム上に有する浸透圧応答性プロモーターの制御下、即ち、当該浸透圧応答性プロモーターの下流に、適合溶質(A)の生合成に関連する外来遺伝子を導入することができるのであれば特に限定されない。
【0028】
本発明の製造方法において、「適合溶質(A)」として、具体的にはメチル化グリシンを製造することができる。本明細書の「メチル化グリシン」としては、例えばグリシンベタイン、ジメチルグリシンやサルコシンが挙げられ、最も好適にはグリシンベタインが挙げられる。
【0029】
グリシンベタインは、種々の生物が乾燥や塩ストレスなど外的浸透圧変化に応じて細胞内の浸透圧を維持するために蓄積する適合溶質の1種である。細菌、植物、動物は、乾燥又は塩ストレスの条件のもとでベタインを生合成し、蓄積するが、これらの多くの生物においては、コリンからベタインアルデヒド、さらにベタインアルデヒドからグリシンベタインへの二段階酸化反応によってグリシンベタインが生合成される(図4)。大腸菌を含む多くの細菌や植物の葉緑体などでは、コリンデヒドロゲナーゼ(BetA)及びベタインアルデヒドデヒドロゲナーゼ(BetB)が各段階の反応を触媒することが知られている。
【0030】
古細菌のメタン細菌、好気性従属真正細菌、嫌気性光栄養細菌、シアノバクテリアの中には単純な炭素源からグリシンベタインを生合成する能力を有する生物種が発見されている。これまでに、好気性従属真正細菌であるActinopolyspora halophila、嫌気性光栄養細菌であるEctothiorhodopspira halochloris、シアノバクテリアであるAphanothece halophyticaにおいて、アミノ酸であるグリシンからサルコシン、サルコシンからジメチルグリシン、ジメチルグリシンからグリシンベタインの三段階のメチル化反応によってグリシンベタインが生合成されることが明らにされている(図4、5)。グリシンからサルコシンを合成する経路を介してメチル化グリシンを産生する場合には、グリシンからのメチル基転移反応にメチル基転移酵素を必要とする。グリシンからサルコシンへ、サルコシンからジメチルグリシンへのメチル化反応に必須のメチル基転移酵素は、グリシンサルコシンメチル基転移酵素(以下単に、「GSMT」ともいう。)である。また、ジメチルグリシンからグリシンベタインへのメチル化反応に必須の酵素は、ジメチルグリシンメチル基転移酵素(以下、単に「DMT」ともいう。)である(図4、5参照)。また、グリシンへのメチル基供与体として、S-アデノシルメチオニン(以下、単に「SAM」ともいう。)が挙げられる(図5参照)。メチオニンにアデノシン三リン酸(ATP)とSAM合成酵素(SAMS)が作用してSAMが生合成される。
【0031】
「適合溶質(A)」としてのメチル化グリシンは、微生物中にグリシンからサルコシンを生合成する経路が存在しない場合に、グリシンからサルコシンを生合成する経路に関連する外来遺伝子を導入することで、生合成することができる。より詳しくは、当該微生物の適合溶質(B)の生合成能を低下又は欠失させ、且つグリシンからサルコシンを合成するのに必要なメチル基転移酵素に関連する外来遺伝子を導入し、当該微生物を高浸透圧条件下で培養することで、微生物中でメチル化グリシンを生合成することができる。この場合に使用可能な微生物は、上述の本明細書における微生物であって、グリシンからサルコシンを生合成する経路が存在しない微生物であればよく、特に限定されない。前記微生物に、メチル基転移酵素に関連する遺伝子を導入することにより、グリシンからサルコシンを合成する経路を介してメチル化グリシンを生合成することができる(図4参照)。
【0032】
グリシンからサルコシンを生合成する経路に関連する外来遺伝子として、上述のごとく、グリシンからサルコシンへのメチル基転移反応に必要なメチル基転移酵素関連遺伝子が挙げられる。具体的には、上述のGSMT関連遺伝子が挙げられる。GSMT関連遺伝子を本発明の微生物に導入することで、グリシンからサルコシンを合成する経路を、微生物に導入することができる。さらに、GSMTは、サルコシンからジメチルグリシンの生合成にも作用する。従って、本発明の「適合溶質の製造方法」のうち、メチル化グリシンの製造方法においては、微生物に少なくともGSMT関連遺伝子を導入することが必要である。また、ジメチル化グリシンからグリシンベタインを生合成させるために、DMT関連遺伝子を導入することが必要である。また、GSMT及びDMTがつながった酵素(GSDMT)もクローニングされており(J Biological Chemistry, 278, pp.4932-4942 (2003))、GSDMT関連遺伝子を本発明の微生物に導入してもよい。グリシンのメチル化を効率的に行うために、SAM合成酵素関連遺伝子を本発明の微生物にさらに導入してもよい。SAM合成酵素を発現させるために、本発明の微生物のゲノム上に存在するSAM合成酵素関連遺伝子を利用してもよい。
【0033】
本発明の微生物が、ハロモナス属に属する微生物、具体的にはH. elongataの場合は、メチル化グリシンのうち、特にサルコシン及び/又はジメチルグリシンを生合成させるために、エクトインの産生系に必要な浸透圧応答性プロモーターの下流領域に、少なくともGSMT関連遺伝子を導入することができる。さらに、グリシンベタインを生合成させるために、DMT関連遺伝子を導入することができる(図3(d)参照)。GSMT関連遺伝子及びDMT関連遺伝子を、エクトインの産生系に必要な浸透圧応答性プロモーターの下流領域に導入することにより、グリシンベタイン産生用のポリシストロン性オペロンを構築することができる。当該グリシンベタイン産生用のポリシストロン性オペロンには、SAM合成酵素関連遺伝子を含んでいてもよい(図3(e)参照)。
【0034】
本発明の微生物が、ハロモナス属に属する微生物、具体的にはH. elongataの場合では、野生型の場合に、グリシンベタインは脂質の代謝経路であるコリンからの二段階酸化反応によって生合成されるが(図4参照)、コリンから産生されるグリシンベタインの産生量は限られている。一方、本発明の製造方法によれば、植物バイオマス由来の主要な炭素源である、グルコース、グリセロール及び/又はキシロースなどの豊富で単純な炭素源を利用し、これより産生される必須アミノ酸のグリシンを介して、微生物内にメチル化グリシンを生合成し、高密度に蓄積することができる。
【0035】
本発明において、GSMT関連遺伝子は、以下に示すいずれかの塩基配列からなる。
1)配列表の配列番号1に示す塩基配列;
2)前記1)に記載の塩基配列のうち、1若しくは数個の塩基が置換、欠失、挿入又は付加といった変異された配列からなる塩基配列;
3)前記1)又は2)に記載の塩基配列に対して縮重し、GSMTが有するアミノ酸配列をコードする塩基配列;
4)前記1)〜3)のいずれかに記載の配列と、80%以上の相同性を有する塩基配列。
【0036】
本発明において、DMT関連遺伝子は、以下に示すいずれかの塩基配列からなる。
1)配列表の配列番号2に示す塩基配列;
2)前記1)に記載の塩基配列のうち、1若しくは数個の塩基が置換、欠失、挿入又は付加といった変異された塩基配列;
3)前記1)又は2)に記載の塩基配列に対して縮重し、DMTが有するアミノ酸配列をコードする塩基配列;
4)前記1)〜3)のいずれかに記載の塩基配列と、80%以上の相同性を有する塩基配列。
【0037】
本発明において、SAMS関連遺伝子は、以下に示すいずれかの塩基配列からなる。
1)配列表の配列番号3に示す塩基配列;
2)前記1)に記載の塩基配列のうち、1若しくは数個の塩基が置換、欠失、挿入又は付加といった変異された塩基配列;
3)前記1)又は2)に記載の塩基配列に対して縮重し、SAM合成酵素が有するアミノ酸配列をコードする塩基配列;
4)前記1)〜3)のいずれかに記載の塩基配列と、80%以上の相同性を有する塩基配列。
【0038】
各酵素遺伝子の塩基配列のうち、「1若しくは数個の塩基が置換、欠失、挿入又は付加」の変異を生じさせる方法としては、PCR法、エラープローンPCR法、DNAシャッフリング法やキメラ酵素を作製する手法等の公知の方法を利用することができる。これらの手法を用いて得られた各酵素遺伝子の塩基配列によりコードされる各アミノ酸配列を有する酵素の比活性や安定性の評価を行うことで、本願に適した高活性酵素又は高安定性酵素を選抜することができる。この場合において、「1若しくは数個の塩基が置換、欠失、挿入又は付加」とは、1〜15個程度の塩基が置換、欠失、挿入又は付加していてもよいことを意味する。
【0039】
本発明は、ハロモナス属に属する微生物のゲノムにおいて、エクトインの生合成オペロンのうち、浸透圧応答性のプロモーターを含み、エクトインの生合成に特異的な遺伝子領域の一部又は全部を欠損あるいは置換していることを特徴とする微生物にも及ぶ。「エクトインの生合成に特異的な領域」とは、エクトインの生合成オペロンのうち、エクトインの生合成に特異的な酵素をコードする遺伝子領域が挙げられる。「エクトインの生合成に特異的な酵素」とは、L-アスパラギン酸-β-セミアルデヒドからエクトインへの代謝において、L-ジアミノ酪酸アミノ基転移酵素及び/又はL-ジアミノ酪酸アセチル基転移酵素が挙げられる(非特許文献1:Biotechnology Advances 28 (2010) 782-801参照)。これらの酵素は、EctA、EctB、EctCで表すことができ、これらに関連する遺伝子を各々ectA、ectB、ectCで表すことができる(図3(a)参照)。「エクトインの生合成に特異的な遺伝子領域の一部又は全部を欠損あるいは置換している」とは、具体的にはectA、ectB及びectCから選択される1種又は複数の遺伝子の一部又は全部を欠損し(図3(b)参照)、あるいは他の遺伝子に置換されている(例えば図3(c)〜(e)参照)ことをいう。具体的には、H. elongataのエクトインの生合成オペロン(ectABC)領域を欠失している株(Halomonas elongata KA1)が挙げられ、独立行政法人産業技術総合研究所特許生物寄託センター(〒305-8566 茨城県つくば市東1-1-1つくばセンター中央第6)に寄託申請され、受領番号FERM AP-22094として平成23年3月31日に受領されている。
【0040】
本発明において、適合溶質(B)の生合成能を低下又は欠失させ、且つ適合溶質(A)生合成に関連する外来遺伝子を導入した微生物を高浸透圧条件下で培養して生合成された適合溶質(A)は、微生物中に生合成され、高密度に蓄積されており、係る微生物を低浸透圧条件で処理することで微生物を破砕することなく、適合溶質(A)を容易に微生物該へ排出させ、回収することができる。具体的には、ハロモナス属に属する微生物(例えば、H. elongata)が本来産生しうるエクトインの生合成能を低下又は欠失させ、且つメチル化グリシン生合成に関連する外来遺伝子を導入した微生物を高浸透圧条件下で培養して生合成されたメチル化グリシン(例えば、グリシンベタイン、ジメチルグリシン)は、微生物中に高密度で蓄積されており、係る微生物を低浸透圧条件で処理することで微生物を破砕することなく、メチル化グリシンを容易に微生物外へ排出させ、回収することができる。例えば当該低浸透圧溶液に微生物を懸濁することで、微生物を破砕することなく、メチル化グリシンを容易に微生物外へ排出させ、回収することができる。
【実施例】
【0041】
本発明の理解を深めるために、以下に実施例及び実験例を示して具体的に説明するが、本発明はこれら実施例に限定されるものではないことは明らかである。
【0042】
(実施例1)グリシンベタイン生合成のための組換型ハロモナス菌株の作製
本実施例では、中度好塩性細菌が高浸透圧条件下で適合溶質のエクトインを高密度に生合成する機構を活用し、エクトインに替わりグリシンベタインを高密度に生合成する組換型ハロモナス菌株を作製した。
【0043】
1)使用菌株(以下の実施例、実験例でも同様)
エクトイン生合成オペロンを欠損したH. elongata KA1株(以下、「ハロモナス菌(KA1株)」)を使用した。即ち、ハロモナス菌(KA1株)は、エクトイン非産生株である。ハロモナス菌の培養は37℃で行い、LB(Luria-Bertani)培地、M63最小培地(炭素源として、0.2%グリセロール又はグルコースを添加)、又は人工海水培地(炭素源として0.2%グルコース、グリセロール、又はキシロースを添加)を基本として使用し、必要に応じて2×又は4×ダイゴIMK培地及びNaClを適当量添加した培地を使用した。
【0044】
2)グリシンベタイン生合成のための遺伝子の設計
ハロモナス菌(KA1株)に、グリシンを出発物質としたグリシンベタイン生合成能力を付与するのに必要な2種類の酵素、GMST及びDMTに関連する各遺伝子は、耐塩性シアノバクテリアAphanothece halophyticaにおいて同定された酵素のアミノ酸配列をもとに設計した。GSMT関連遺伝子及びDMT関連遺伝子については、それらのコドン使用頻度をハロモナス菌(KA1株)での発現用に最適化した人工遺伝子HeGSMT(配列番号1)及びHeDMT(配列番号2)を設計して使用した。さらに、SAMの供給に機能するSAM合成酵素(SAMS)については、ハロモナス菌ゲノム上にコードされたSAMS関連遺伝子(配列番号3)をサブクローニングして使用した。また、遺伝子発現量を解析するためのレポーターとして赤色蛍光タンパク質をコードしたmCherry遺伝子(赤色蛍光タンパク質レポーター遺伝子)(配列番号4)を使用した。各遺伝子について、遺伝子組換え操作等のために制限酵素認識部位を付加したものは、各々配列番号7〜10に示した(図6〜9参照)。
【0045】
3)相同組換用プラスミドの構築
ハロモナス菌が高浸透圧条件下で適合溶質のエクトインを高密度に生合成する機構を活用し、ハロモナス菌(KA1株)を用いて、エクトインの替わりにグリシンベタインを高密度に生合成する組換型ハロモナス菌株を作製するためのプラスミドを構築した。プラスミドは、必要な相同組換領域として、エクトイン生合成オペロン(ectABC)の上流配列(UectA)(配列番号5)及び下流配列(DectC)(配列番号6)をゲノムPCR法によりクローン化し、赤色蛍光タンパク質(mCherry)をコードしたレポーター遺伝子(配列番号4)と連結して、pK18mobsacB-UectA-mCherry-DectCプラスミドとした。そして、mCherryの下流に目的遺伝子(X)、具体的には2種類のメチル基転移酵素関連遺伝子(HeGSMT及びHeDMT)をポリシストロン性のオペロンとして挿入し、pK18mobsacB-UectA-mCherry-GSMT-DMT-DectCプラスミドを構築した(図1参照)。さらに、配列番号3に示す配列からなるSAMS関連遺伝子をポリシストロン性のオペロンとして挿入し、pK18mobsacB-UectA-mCherry-GSMT-SAMS-DMT-DectCプラスミドを構築した。コントロールとして、mCherry遺伝子単独発現のプラスミドを同様に構築した。エクトイン生合成オペロン(ectABC)の上流配列(UectA)には、エクトインの産生に必要なプロモーター領域が含まれる(図2参照)。UectA及びDectCについて、制限酵素認識部位を付加したものは、各々配列番号11及び12に示した(図10〜11参照)。
【0046】
4)組換型ハロモナス菌株の作製
上記3)で構築した各種オペロンを含む上述の各種相同組換用プラスミドを、接合伝達法によりハロモナス菌(KA1株)へ導入した。そして、導入した相同組換用プラスミドDNAとハロモナス菌ゲノム上の標的DNAの相同領域配列(UectA又はDectC)間で起きる二段階の相同組換反応により、目的遺伝子(X)を標的領域、即ち高浸透圧条件に応答して発現が誘導される適合溶質エクトインの生合成オペロン(ectABC)のプロモーター領域を含むUectA配列の下流に挿入した組換型ハロモナス菌株を作製した(図1参照)。
【0047】
ハロモナス菌野生型株及び組換型ハロモナス菌株におけるエクトイン生合成オペロン領域のゲノム構造を図3に示した。図3に示したエクトイン非生産性のハロモナス菌株(KA1)は、野生型のハロモナス菌がゲノム上に有する適合溶質エクトインの生合成オペロン(ectABC)のうち、ectAの第2コドンからectCの最終コドンの領域を欠損したゲノム構造を有しており、ectABCオペロンのプロモーター領域を含むUectA配列とectABCオペロンのターミネーター領域を含むDectCを保持している。
(a)野生型株:エクトイン生合成オペロン(ectABC)を有する野生型株
(b)△ect株:ectABCを欠損した株(KA1株)
(c)△ect::mCherry株:ectABCオペロンのプロモーター領域を含むUectA配列の下流にmCherryを挿入した株
(d)△ect::mCherry-GSMT-DMT株:ectABCオペロンプロモーター領域を含むUectA配列の下流にmCherry、HeGSMT、及びHeDMTを挿入した株
(e)△ect::mCherry-GSMT-SAMS-DMT株:ectABCオペロンのプロモーター領域を含むUectA配列の下流にmCherry、HeGSMT、HeDMT、及びSAM合成酵素遺伝子(SAMS) を挿入した株
【0048】
上記のうち、(b)H. elongataよりエクトインの生合成オペロン(ectABC)領域を欠損させた△ect株(Halomonas elongata KA1)は、独立行政法人産業技術総合研究所特許生物寄託センター(〒305-8566 茨城県つくば市東1-1-1つくばセンター中央第6)に寄託申請され、受領番号FERM AP-22094として平成23年3月31日に受領されている。
【0049】
(実験例1−1)発現解析
本実験例では、実施例1で作製した組換型ハロモナス菌株に導入したグリシンベタイン生合成オペロンの発現解析を行った。レポーターとして導入したmCherry遺伝子の発現量を蛍光シグナルとして検出することにより、塩ストレスに応答したグリシンベタイン生合成オペロンの遺伝子発現様式を解析した。2%又は6% NaClを含む改変LB寒天培地上で培養した組換型ハロモナス菌株の赤色蛍光シグナルを検出した。mCherry蛍光の写真はLAS4010(GE社製)にて撮影した。
【0050】
その結果、2% NaCl条件に対し、6% NaClの高浸透圧条件下でより強い蛍光シグナルが検出されたことから、高浸透圧条件に応答して人工グリシンベタイン生合成オペロンを強発現する組換型ハロモナス菌株の創製に成功したことが示された(図12)。図12における色が濃いものについて、mCherry由来の赤色蛍光シグナル強度が強いことを示す。
【0051】
(実験例1−2)組換型ハロモナス菌株によるグリシンベタインの検出
本実験例では、実施例1で作製した組換型ハロモナス菌株において、導入したグリシンベタイン生合成オペロンが機能的に発現しているかを検証するため、3% NaClを含むM63最少培地(炭素源として0.2%グルコースを含む)で各種ハロモナス菌株を培養した。各種ハロモナス菌株から超純水による低浸透圧処理により抽出された適合溶質成分(ジメチルグリシン、グリシンベタイン、エクトイン)をHPLCにより分析した。
【0052】
HPLCの分析手法は、Clinical Chemistry 44:9, 1937-1941 (1998)を参照した。具体的には、細胞抽出液中のカルボニル基を有するグリシンベタインやエクトインを含む化合物を4-ブロモフェナシルブロミドでラベル化して行った。HPLC分析カラムは、SupelcosilTM LC-SCX, 5μm, 25 cm×4.6 cm (Supelco Inc.)を使用し、カラム温度28℃、流速1.5 mL/min、UV検出器の波長254 nmの条件により検出した。溶媒は22 mMコリンを添加した90%アセトニトリル溶液を使用した。
【0053】
その結果、(a)野生型ハロモナス菌株ではエクトインのみが顕著量検出されたのに対し、エクトイン生合成遺伝子を欠損したハロモナス菌株((c)〜(e))ではエクトインが検出されなかった。その一方で、グリシンベタイン生合成オペロンを導入した組換型ハロモナス菌株((d)△ect::mCherry-GSMT-DMT株及び(e)△ect::mCherry-GSMT-SAMS-DMT株)では、グリシンベタインが顕著量検出された。それに対して、コントロールの(c)△ect::mCherry株ではエクトイン及びグリシンベタインは顕著量検出されなかった。さらに、(d)△ect::mCherry-GSMT-DMT株よりも、(e)△ect::mCherry-GSMT-SAMS-DMT株の方が多量のグリシンベタインが検出されたことから、SAMの供給を強化した(d)△ect::mCherry-GSMT-SAMS-DMT株がグリシンベタインを高密度で生合成しうる株として有用であることが示された(図13)。また、4×ダイゴIMK培地を含むM63最少培地(炭素源として0.2%グルコースを含む)に6% NaClを添加した高浸透圧条件では、エクトインを生産しないコントロールの(c)△ect::mCherry株は増殖できないのに対し、グリシンベタインを生産する(e)△ect::mCherry-GSMT-SAMS-DMT株は増殖が可能であったことから、エクトイン非生産株で生産されたグリシンベタインが適合溶質として機能することが示された(図14)。
【0054】
(実施例2)高浸透圧条件下でのグリシンベタイン産生
本実施例では、実施例1で作製した組換型ハロモナス菌株((e)△ect::mCherry-GSMT-SAMS-DMT株)について、各濃度のNaClを含むLB培地で培養したときのグリシンベタインの産生を確認した。培養は37℃で24時間行い、培地はNaCl濃度を2〜12%に増量したLB培地5 mLを使用した。そして、培養液から組換型ハロモナス菌株の細胞を遠心分離によりペレットとして回収し、回収細胞量の新鮮重量を測定した。抽出は、10 mg新鮮重量あたり40μLの超純水を加えて細胞を懸濁することにより行い、遠心分離した上澄み液を抽出液として回収した。
【0055】
その結果、2%の低NaCl濃度条件に比べて、3, 6, 9, 12%のNaCl濃度の上昇に伴い、組換型ハロモナス菌株の細胞から抽出されたグリシンベタイン濃度の顕著な上昇がみられた(図15A)。しかしながら、9%以上のNaCl濃度域では回収された細胞量が減少していたため、6%条件でのグリシンベタインの培養液あたりの生産量が最大であった(図15B)。
【0056】
高浸透圧条件でグリシンベタインを高密度で生合成した組換型ハロモナス菌株の細胞からのグリシンベタイン抽出は、細胞を破砕することなく超純水での懸濁による低浸透圧処理のみで十分であることが示唆された。以上の結果から、(e)△ect::mCherry-GSMT-SAMS-DMT株を用いることにより、高浸透圧条件でのグリシンベタインを高密度で生合成させるプロセスの構築が可能であることが示された。また、菌株の細胞内に高密度に生合成され、蓄積されたグリシンベタインの抽出には細胞破砕を必要とせず、超純水を用いた低浸透圧処理によるグリシンベタインの抽出プロセスの構築が可能であることが示唆された。
【0057】
(実施例3)高浸透圧条件での二段階培養によるグリシンベタイン生産
本実施例では、実施例1で作製した組換型ハロモナス菌株((e)△ect::mCherry-GSMT-SAMS-DMT株)について、高浸透圧条件での二段階培養によるグリシンベタインの高生産プロセスの検討を行った。実施例2の結果より、NaCl濃度が高すぎると、当該組換型菌株の細胞増殖が阻害されたが、グリシンベタインの生産性はNaCl濃度が高いほど向上していた。そこで、6%のNaCl濃度条件で当該組換型菌株を培養して細胞をあらかじめ増殖させておき、続いて15%のNaCl濃度条件下で継続して培養する二段階培養によるグリシンベタインの高生産プロセスの検討を行った。培養は37℃で行い、培地はNaCl濃度を6%又は15%に増量したLB培地50 mLを使用した。分析は実施例1と同手法にて行った。
【0058】
その結果を図16に示した。LB培地に6%のNaClを添加した条件下で24時間培養した組換型ハロモナス菌株より、22 mMのグリシンベタイン抽出液が得られた(6%, 24時間)。その一方で、LB培地に6%のNaClを添加した条件下で24時間培養した後、さらに継続して15%のNaClを添加した条件で12時間の二段培養を行った当該組換型菌株からは、50 mMのグリシンベタイン抽出液が得られ(6%, 24時間→15%, 12時間)、24時間まで二段目の培養を行った当該組換型菌株からは、60 mMのグリシンベタイン抽出液が得られた(6%, 24時間 → 15%, 24時間)。
【0059】
上記の結果、二段階培養を開始して12時間目で50 mMのグリシンベタイン抽出液を得ることができた。さらに24時間目には、60 mMのグリシンベタイン抽出液が得られた。以上の結果により、二段階培養により、ハロモナス菌株の細胞増殖を確保したうえで、グリシンベタインを高生産することに成功した。
【0060】
(実施例4)人工海水培地によるグリシンベタイン生産
実施例2及び3で使用したLB培地の成分中には、コリンやグリシンベタインそのものなどが含まれるため、コリンやグリシンベタインを取り込む活性が生産性の評価に影響を及ぼすことが懸念された。また、実施例1で使用したM63最少培地ではグリシンベタイン生合成量が低いため、塩ストレス下での細胞増殖自体が悪いという結果が得られた。そのため、グリシンベタイン生合成に適した無機塩培地を検討した。
【0061】
ハロモナス菌株を使用する利点として、水資源枯渇問題に対応するため、海水を直接使用可能である点があげられる。そこで、本実施例では、微細藻類の培養用に開発されたダイゴIMK培地を含む人工海水培地の利用を検討した。微細藻類の細胞増殖が良くなるとされる、2×ダイゴIMK培地を含む人工海水を使用した。また、炭素源として、植物バイオマス由来の主要な炭素源であるグルコース、グリセロール、キシロースの3種について検討を行った。
【0062】
その結果、いずれの炭素源においても、組換型ハロモナス菌株((d)△ect::mCherry-GSMT-DMT株及び(e)△ect::mCherry-GSMT-SAMS-DMT株)において、グリシンベタインの生合成が確認できたことから、海水及び植物バイオマス由来炭素源を用いたグリシンベタインの生合成が可能であることが示唆された(図17〜19)。
【産業上の利用可能性】
【0063】
以上詳述したように本発明の製造方法により、所望の適合溶質(A)を微生物内で生合成し、高密度で蓄積し、かつ容易に分離・回収することができる。本発明の方法により、所望の適合溶質(A)を大量に安定的に供給することが可能となる。
【0064】
適合溶質の具体例としてメチル化グリシンについて、グリシンからのサルコシン、サルコシンからジメチルグリシン、ジメチルグリシンからグリシンベタインへの三段階のメチル化反応によるグリシンベタイン合成のための代謝経路を、例えばハロモナス菌に導入する本発明の製造方法により、豊富な炭素源から生合成する必須アミノ酸のグリシンを出発物質として、ハロモナス菌内にグリシンベタインを生合成し、高密度に蓄積させることができる。更に、グリシンベタインの合成にメチル基供与体として使われるS-アデノシルメチオニン(SAM)の合成系を並行して強化することで、より大量のグリシンベタインを生合成することができる。本発明の製造方法により、植物バイオマス由来の単純な炭素源からメチル化グリシン、例えばグリシンベタインを微生物内で高密度に蓄積することができ、さらには淡水などの低浸透圧条件下でグリシンベタインを排出させ、容易に分離・回収することができる。さらには、使用した微生物を繰り返し利用することで、グリシンベタインを連続して高生産することができる。
【特許請求の範囲】
【請求項1】
以下の工程を含む、微生物を用いた適合溶質(A)の製造方法:
1)適合溶質(B)の生合成能を低下又は欠失させ、且つ適合溶質(A)生合成に関連する外来遺伝子を導入した微生物を高浸透圧条件下で培養し、微生物中で適合溶質(A)を生合成させる工程;
2)前記微生物中で生合成した適合溶質(A)を、低浸透圧条件下で微生物から排出させ、回収する工程。
【請求項2】
高浸透圧条件が、塩化ナトリウム濃度(NaCl)で換算した場合に0.5〜4 Mであり、低浸透圧条件が、同様に塩化ナトリウム濃度で換算した場合に0〜0.5 Mであることを特徴とする、請求項1に記載の製造方法。
【請求項3】
微生物が、ハロモナス属に属する微生物であることを特徴とする、請求項1又は2に記載の製造方法。
【請求項4】
ハロモナス属に属する微生物が、Halomonas elongataに属する微生物であることを特徴とする、請求項3に記載の製造方法。
【請求項5】
適合溶質(B)が、エクトインであることを特徴とする、請求項3又は4に記載の製造方法。
【請求項6】
適合溶質(B)の生合成能を低下又は欠失させることが、前記微生物のゲノム上に存在するエクトイン生合成オペロンのうち、エクトイン生合成に特異的な遺伝子の一部若しくは全部を除去することである、請求項5に記載の製造方法。
【請求項7】
適合溶質(A)が、メチル化グリシンであることを特徴とする、請求項1〜6のいずれかに記載の製造方法。
【請求項8】
メチル化グリシンが、グリシンからサルコシンを合成する経路を介して生合成されることを特徴とする、請求項7に記載の製造方法。
【請求項9】
メチル化グリシンが、少なくともグルコース、グリセロール及び/又はキシロースを炭素源として生合成されることを特徴とする、請求項7又は8に記載の製造方法。
【請求項10】
適合溶質(A)の生合成に関連する外来遺伝子が、少なくともグリシンサルコシンメチル基転移酵素(GSMT)に関連する遺伝子である、請求項7〜9のいずれかに記載の製造方法。
【請求項11】
グリシンサルコシンメチル基転移酵素(GSMT)に関連する遺伝子が、以下に示すいずれかの塩基配列からなる、請求項10に記載の製造方法:
1)配列表の配列番号1に示す塩基配列;
2)前記1)に記載の塩基配列のうち、1若しくは数個の塩基が置換、欠失、挿入又は付加といった変異された配列からなる塩基配列;
3)前記1)又は2)に記載の塩基配列に対して縮重し、グリシンサルコシンメチル基転移酵素(GSMT)が有するアミノ酸配列をコードする塩基配列;
4)前記1)〜3)のいずれかに記載の配列と、80%以上の相同性を有する塩基配列。
【請求項12】
適合溶質(A)の生合成に関連する外来遺伝子が、さらに、ジメチルグリシンメチル基転移酵素(DMT)に関連する遺伝子である、請求項10又は11に記載の製造方法。
【請求項13】
メチルグリシンメチル基転移酵素(DMT)に関連する遺伝子が、以下に示すいずれかの塩基配列からなる、請求項12に記載の製造方法:
1)配列表の配列番号2に示す塩基配列;
2)前記1)に記載の塩基配列のうち、1若しくは数個の塩基が置換、欠失、挿入又は付加といった変異された塩基配列;
3)前記1)又は2)に記載の塩基配列に対して縮重し、メチルグリシンメチル基転移酵素(DMT)が有するアミノ酸配列をコードする塩基配列;
4)前記1)〜3)のいずれかに記載の塩基配列と、80%以上の相同性を有する塩基配列。
【請求項14】
適合溶質(A)の生合成に関連する外来遺伝子が、さらにS−アデノシルメチオニン(SAM)合成酵素に関連する遺伝子である、請求項10〜13のいずれかに記載の製造方法。
【請求項15】
S−アデノシルメチオニン(SAM)合成酵素に関連する遺伝子が、以下に示すいずれかの塩基配列からなる、請求項14に記載の製造方法:
1)配列表の配列番号3に示す塩基配列;
2)前記1)に記載の塩基配列のうち、1若しくは数個の塩基が置換、欠失、挿入又は付加といった変異された塩基配列;
3)前記1)又は2)に記載の塩基配列に対して縮重し、S−アデノシルメチオニン(SAM)合成酵素が有するアミノ酸配列をコードする塩基配列;
4)前記1)〜3)のいずれかに記載の塩基配列と、80%以上の相同性を有する塩基配列。
【請求項16】
外来遺伝子の導入が、ハロモナス属に属する微生物のゲノム上に存在するエクトイン生合成オペロンのうち、浸透圧応答性プロモーターの制御下にある領域に、請求項11に記載のいずれかの塩基配列からなる遺伝子を導入することによる、請求項3〜11に記載製造方法。
【請求項17】
外来遺伝子の導入が、ハロモナス属に属する微生物のゲノム上に存在するエクトイン生合成オペロンのうち、浸透圧応答性プロモーターの制御下にある領域に、さらに請求項13に記載のいずれかの塩基配列からなる遺伝子を導入することによる、請求項16に記載の製造方法。
【請求項18】
外来遺伝子の導入が、ハロモナス属に属する微生物のゲノム上に存在するエクトイン生合成オペロンのうち、浸透圧応答性プロモーターの制御下にある領域に、請求項15に記載のいずれかの遺伝子を導入することによる、請求項16又は17に記載の製造方法。
【請求項19】
浸透圧応答性プロモーターが、ハロモナス属に属する微生物のゲノム上に存在するエクトインの生合成オペロンの上流配列(UectA)中に含まれることを特徴とする、請求項16〜18のいずれかに記載の製造方法。
【請求項20】
メチル化グリシンが、グリシンベタインである、請求項7〜19のいずれかに記載の製造方法。
【請求項21】
メチル化グリシンが、ジメチルグリシンである、請求項7〜11、14〜16、18〜19のいずれかに記載の製造方法。
【請求項22】
ハロモナス属に属する微生物のゲノムにおいて、エクトインの生合成オペロンのうち、浸透圧応答性のプロモーターを含み、エクトインの生合成に特異的な遺伝子領域の一部又は全部を欠損あるいは置換していることを特徴とする微生物。
【請求項23】
エクトインの生合成に特異的な遺伝子領域が、L-アスパラギン酸-β-セミアルデヒドからエクトインへの代謝において、L-ジアミノ酪酸アミノ基転移酵素及び/又はL-ジアミノ酪酸アセチル基転移酵素の発現に必須な領域であることを特徴とする請求項22に記載の微生物。
【請求項24】
受領番号FERM AP-22094で特定される微生物である、請求項22又は23に記載の微生物。
【請求項1】
以下の工程を含む、微生物を用いた適合溶質(A)の製造方法:
1)適合溶質(B)の生合成能を低下又は欠失させ、且つ適合溶質(A)生合成に関連する外来遺伝子を導入した微生物を高浸透圧条件下で培養し、微生物中で適合溶質(A)を生合成させる工程;
2)前記微生物中で生合成した適合溶質(A)を、低浸透圧条件下で微生物から排出させ、回収する工程。
【請求項2】
高浸透圧条件が、塩化ナトリウム濃度(NaCl)で換算した場合に0.5〜4 Mであり、低浸透圧条件が、同様に塩化ナトリウム濃度で換算した場合に0〜0.5 Mであることを特徴とする、請求項1に記載の製造方法。
【請求項3】
微生物が、ハロモナス属に属する微生物であることを特徴とする、請求項1又は2に記載の製造方法。
【請求項4】
ハロモナス属に属する微生物が、Halomonas elongataに属する微生物であることを特徴とする、請求項3に記載の製造方法。
【請求項5】
適合溶質(B)が、エクトインであることを特徴とする、請求項3又は4に記載の製造方法。
【請求項6】
適合溶質(B)の生合成能を低下又は欠失させることが、前記微生物のゲノム上に存在するエクトイン生合成オペロンのうち、エクトイン生合成に特異的な遺伝子の一部若しくは全部を除去することである、請求項5に記載の製造方法。
【請求項7】
適合溶質(A)が、メチル化グリシンであることを特徴とする、請求項1〜6のいずれかに記載の製造方法。
【請求項8】
メチル化グリシンが、グリシンからサルコシンを合成する経路を介して生合成されることを特徴とする、請求項7に記載の製造方法。
【請求項9】
メチル化グリシンが、少なくともグルコース、グリセロール及び/又はキシロースを炭素源として生合成されることを特徴とする、請求項7又は8に記載の製造方法。
【請求項10】
適合溶質(A)の生合成に関連する外来遺伝子が、少なくともグリシンサルコシンメチル基転移酵素(GSMT)に関連する遺伝子である、請求項7〜9のいずれかに記載の製造方法。
【請求項11】
グリシンサルコシンメチル基転移酵素(GSMT)に関連する遺伝子が、以下に示すいずれかの塩基配列からなる、請求項10に記載の製造方法:
1)配列表の配列番号1に示す塩基配列;
2)前記1)に記載の塩基配列のうち、1若しくは数個の塩基が置換、欠失、挿入又は付加といった変異された配列からなる塩基配列;
3)前記1)又は2)に記載の塩基配列に対して縮重し、グリシンサルコシンメチル基転移酵素(GSMT)が有するアミノ酸配列をコードする塩基配列;
4)前記1)〜3)のいずれかに記載の配列と、80%以上の相同性を有する塩基配列。
【請求項12】
適合溶質(A)の生合成に関連する外来遺伝子が、さらに、ジメチルグリシンメチル基転移酵素(DMT)に関連する遺伝子である、請求項10又は11に記載の製造方法。
【請求項13】
メチルグリシンメチル基転移酵素(DMT)に関連する遺伝子が、以下に示すいずれかの塩基配列からなる、請求項12に記載の製造方法:
1)配列表の配列番号2に示す塩基配列;
2)前記1)に記載の塩基配列のうち、1若しくは数個の塩基が置換、欠失、挿入又は付加といった変異された塩基配列;
3)前記1)又は2)に記載の塩基配列に対して縮重し、メチルグリシンメチル基転移酵素(DMT)が有するアミノ酸配列をコードする塩基配列;
4)前記1)〜3)のいずれかに記載の塩基配列と、80%以上の相同性を有する塩基配列。
【請求項14】
適合溶質(A)の生合成に関連する外来遺伝子が、さらにS−アデノシルメチオニン(SAM)合成酵素に関連する遺伝子である、請求項10〜13のいずれかに記載の製造方法。
【請求項15】
S−アデノシルメチオニン(SAM)合成酵素に関連する遺伝子が、以下に示すいずれかの塩基配列からなる、請求項14に記載の製造方法:
1)配列表の配列番号3に示す塩基配列;
2)前記1)に記載の塩基配列のうち、1若しくは数個の塩基が置換、欠失、挿入又は付加といった変異された塩基配列;
3)前記1)又は2)に記載の塩基配列に対して縮重し、S−アデノシルメチオニン(SAM)合成酵素が有するアミノ酸配列をコードする塩基配列;
4)前記1)〜3)のいずれかに記載の塩基配列と、80%以上の相同性を有する塩基配列。
【請求項16】
外来遺伝子の導入が、ハロモナス属に属する微生物のゲノム上に存在するエクトイン生合成オペロンのうち、浸透圧応答性プロモーターの制御下にある領域に、請求項11に記載のいずれかの塩基配列からなる遺伝子を導入することによる、請求項3〜11に記載製造方法。
【請求項17】
外来遺伝子の導入が、ハロモナス属に属する微生物のゲノム上に存在するエクトイン生合成オペロンのうち、浸透圧応答性プロモーターの制御下にある領域に、さらに請求項13に記載のいずれかの塩基配列からなる遺伝子を導入することによる、請求項16に記載の製造方法。
【請求項18】
外来遺伝子の導入が、ハロモナス属に属する微生物のゲノム上に存在するエクトイン生合成オペロンのうち、浸透圧応答性プロモーターの制御下にある領域に、請求項15に記載のいずれかの遺伝子を導入することによる、請求項16又は17に記載の製造方法。
【請求項19】
浸透圧応答性プロモーターが、ハロモナス属に属する微生物のゲノム上に存在するエクトインの生合成オペロンの上流配列(UectA)中に含まれることを特徴とする、請求項16〜18のいずれかに記載の製造方法。
【請求項20】
メチル化グリシンが、グリシンベタインである、請求項7〜19のいずれかに記載の製造方法。
【請求項21】
メチル化グリシンが、ジメチルグリシンである、請求項7〜11、14〜16、18〜19のいずれかに記載の製造方法。
【請求項22】
ハロモナス属に属する微生物のゲノムにおいて、エクトインの生合成オペロンのうち、浸透圧応答性のプロモーターを含み、エクトインの生合成に特異的な遺伝子領域の一部又は全部を欠損あるいは置換していることを特徴とする微生物。
【請求項23】
エクトインの生合成に特異的な遺伝子領域が、L-アスパラギン酸-β-セミアルデヒドからエクトインへの代謝において、L-ジアミノ酪酸アミノ基転移酵素及び/又はL-ジアミノ酪酸アセチル基転移酵素の発現に必須な領域であることを特徴とする請求項22に記載の微生物。
【請求項24】
受領番号FERM AP-22094で特定される微生物である、請求項22又は23に記載の微生物。
【図6】


【図7】


【図8】


【図9】


【図10】


【図11】


【図15】


【図16】


【図1】


【図2】


【図3】


【図4】


【図5】


【図12】


【図13】


【図14】


【図17】


【図18】


【図19】




【図7】


【図8】


【図9】


【図10】


【図11】


【図15】


【図16】


【図1】


【図2】


【図3】


【図4】


【図5】


【図12】


【図13】


【図14】


【図17】


【図18】


【図19】


【公開番号】特開2012−29679(P2012−29679A)
【公開日】平成24年2月16日(2012.2.16)
【国際特許分類】
【公開請求】
【出願番号】特願2011−94455(P2011−94455)
【出願日】平成23年4月20日(2011.4.20)
【出願人】(303046314)旭化成ケミカルズ株式会社 (2,513)
【出願人】(504150450)国立大学法人神戸大学 (421)
【Fターム(参考)】
【公開日】平成24年2月16日(2012.2.16)
【国際特許分類】
【出願番号】特願2011−94455(P2011−94455)
【出願日】平成23年4月20日(2011.4.20)
【出願人】(303046314)旭化成ケミカルズ株式会社 (2,513)
【出願人】(504150450)国立大学法人神戸大学 (421)
【Fターム(参考)】
[ Back to top ]

