選択マーカーとして多糖分解酵素遺伝子を含むベクター、このベクターにより形質転換された宿主、形質転換体の選抜方法、形質転換体の選抜用培地及びその製造方法
本発明は、選択マーカーとして多糖分解酵素遺伝子を含むベクターとそのベクターにより形質転換された宿主と、本発明のベクターを用いて外来遺伝子が導入された形質転換体を選抜する方法と、選択培地及び選択培地の製造方法に関する。本発明によるベクターは、従来のβ-ガラクトシダーゼを選択マーカーとして含むベクターに比べ使用方法が簡便である。色の発現のために使用される試薬を含めて全体の費用が非常に安価である。広範の宿主細胞に利用できるという利点を有する。
【発明の詳細な説明】
【0001】
技術分野 本発明は、多糖分解酵素遺伝子を選択マーカーとして含むベクター、そのベクターにより形質転換された宿主、形質転換体を選抜するための方法及び培地、並びに形質転換体の選抜用培地を製造するための方法に関する。
背景技術 一般に、クローニングベクター(cloning vector)あるいはサブクローニングベクターは、組換えDNAの生成の初期の段階において標的となるDNAフラグメントを導入するために使用される。このため、このベクターにはいくつかの性質が要求される。
第一に、ベクターをクローニングする工程は、例えば、PCR、配列決定及びサブクローニングのような実験の完成段階ではなく、初期段階において使用されるため、迅速かつ正確に実施される必要がある。多量のDNAを得るために、コピーの数(copy number)も多くなければならないし、クローニングの結果の早い確認が可能であることが好ましい。
【0002】
第二に、クローニングベクターは、種々の実験の初期段階において多量に、かつ繰り返し使用されるので、経済的な負担が少なくなければならない。そうでなければ、クローニングベクターを使用する追加の実験の費用が高くなるであろう。
【0003】
従来から種々のクローニングベクターが開発、かつ使用されており、例えば、pUC18、pUC19、pBluescript等が挙げられる。これらのクローニングベクターには、コピーの数が多い点と、選択マーカー(selection marker)としてβ-ガラクトシダーゼ(galactosidase)(lacZ)を使用する点とに共通点がある。
【0004】
β-ガラクトシダーゼ(lacZ)が選択マーカーとして使用される理由は、組換えベクターを含む形質転換体が無色であり、非−形質転換体の青色との区別が容易にできる点にある。β−ガラクトシダーゼ(lacZ)の選択は、宿主中においてα−ペプチドが欠損した変異型β−ガラクトシダーゼタンパク質をベクター中のα−ペプチドと結合して、機能的酵素分子を生成することによって行われる。
【0005】
このベクターは、lacZの全序列(full sequence)を含んではいないが、ベクターは、β−ガラクトシダーゼ(lacZ)の選択マーカーを使用する。その結果、使用されるベクターのサイズを減らす効果を奏することとなる。
【0006】
しかし、β-ガラクトシダーゼ(lacZ)の選択マーカーとしての使用は、いくつかの問題点を有している。第一に、x−galの価格が非常に高いので、実験に要する費用が増大する点が挙げられる。第2に、x−galの溶媒であるN,N−ジメチルホルムアミドが宿主の細菌に毒性を表すことである。形質転換体をプレートにスプレッド(spreading)する前に、先ずx−galを3乃至4時間の間スプレッドしなくてはならないので、実験の操作上煩わしさを伴うこととなる。第3に、この時に使用されるx−gal保存液(stock solution)の濃度は20mg/mlであり、1個のプレート当りこの溶液が40μlずつスプレッドされる。もしこの時にx−galが均一にスプレッドされないと、選抜の結果も不正確なものになる。第4に、x−galは別途に調製されて、後に添加されるため、プレートが汚染に曝される時間を増加させる可能性もある。第5に、β−ガラクトシダーゼを用いるベクターは、β−ガラクトシダーゼ(lacZ)の変異がなされる宿主においてのみ使用されるので、その使用できる宿主の範囲が限られている。
発明の開示 よって、本発明の目的は、既存のβ-ガラクトシダーゼ(lacZ)を選択マーカーとして用いるベクターの限界を克服して、経済的、かつ簡便に使用できるクローニングベクターを提供することにある。
【0007】
本発明の他の目的は、本発明のクローニングベクターを使用して形質転換された宿主細胞を提供することである。
本発明のさらに他の目的は、本発明のクローニングベクターを使用して様々な宿主細胞を高効率で形質転換させることができる形質転換体の選抜方法を提供することである。
【0008】
本発明のさらに他の目的は、多糖分解酵素遺伝子を選択マーカーとして含むプラスミドの選別に有効に使用される培地を提供することである。
本発明のさらに他の目的は、多糖分解酵素遺伝子を選択マーカーとして含むプラスミドの選別に有効に使用される培地の製造方法を提供することである。
【0009】
本発明により、選択マーカーとして多糖分解酵素遺伝子を含むベクターが提供される。
発明を実施するための最良の形態 本発明によるプラスミドは、選択マーカーとして多糖分解酵素遺伝子を含む。よって、本発明のプラスミドが導入された形質転換体は、導入された多糖分解酵素の発現によりそれに該当する多糖を分解するため、分解された多糖に対する発色試薬によりプラスミドが導入されているか否かを判断することができる。但し、宿主が導入される多糖分解酵素を自体的に生産する場合には、形質転換の前に該酵素を不活性化させなければならない。
【0010】
本発明において、プラスミドに導入される多糖分解酵素としては、セルラーゼ(cellulase)、アミラーゼ(amylase)又はキシラナーゼ(xylanase)等を使用することができる。
【0011】
これらの多糖分解酵素の遺伝子は公知の方法でプラスミドに導入される。このように導入されたプラスミドは選択マーカーとして多糖分解酵素遺伝子を含むこととなる。よって、本発明のプラスミドに所望の遺伝子を導入し、得られたプラスミドで宿主を形質転換することにより調製された形質転換した宿主の多糖分解能を判断することにより、外来遺伝子で形質転換された宿主が判別できる。
【0012】
本発明のプラスミドで形質転換される宿主としては、例えば大腸菌、酵母及び乳酸菌等が含まれるが、プラスミドの導入及び発現における使用に関しては、これらに限定されるものではない。
【0013】
別の実施形態において、本発明は、選択マーカーとして多糖分解酵素遺伝子を含むベクターを使用して形質転換体を選抜する方法を提供する。該方法は、選択マーカーとして多糖分解酵素遺伝子を含むベクターに目的の外来遺伝子を導入する工程と、該ベクターで宿主を形質転換させる工程と、該宿主細胞を多糖を含むプレートに塗抹して培養する工程と、該プレートに発色試薬を添加する工程と、変色の存在を検出して外来遺伝子を含む形質転換体を選抜する工程とを含んでいる。
【0014】
本発明の方法において、先ず、多糖分解酵素の遺伝子が導入されたベクターに目的の外来遺伝子を導入する。この組換えベクターを使用してベクターの導入及び発現が容易な宿主細胞を形質転換させる。この時、宿主自体が多糖分解酵素を有している場合には、これを不活性化させなければならない。
【0015】
形質転換が試みられた宿主細胞はプラスミドに導入された多糖分解酵素の遺伝子の発現により分泌される酵素で分解可能な多糖を含む平面のプレートに塗抹される。即ち、プラスミドにセルラーゼ遺伝子が導入されていると、プレートにもセルロースが含まれていなければならないし、プラスミドにアミラーゼ又はキシラナーゼ遺伝子が導入されていると、プレートにもアミロース又はキシロースが含まれていなければならない。
【0016】
形質転換体を一定の時間培養した後、プレート中において分解された糖と反応して色の変化を起こす試薬を添加する。例えば、セルラーゼの分解作用によりセルロースが分解されてグルコースとなった場合には、濃赤色から淡橙色へと変化する発色試薬を添加する。ここで、発色試薬は宿主を培地で培養した後に添加しても良く、培地に試薬が添加された状態で宿主を培養しても良い。
【0017】
一方、導入される多糖がアミロースである場合にはヨード試薬を、キシロースである場合にはコンゴレッド試薬を使用する。該試薬により培地の色が変化し、変色(ハロー生成(formation of a halo))した部位のコロニーが所望の外来遺伝子を含んでいることを示す。よって、所望の遺伝子が導入された形質転換体が選抜できる。
【0018】
下記の実施例では、導入されたプラスミドのセルラーゼが形質転換体において発現されるかを確認するために、セルロースと発色試薬を含む培地内におけるハローの生成を確認した。クローニングベクターとしての利用可能性は、セルラーゼ遺伝子内に外来遺伝子を挿入してセルラーゼ遺伝子が破壊されるか否かを検出する実験により証明した。また、このようにして得られたセルラーゼ酵素が発現されない形質転換体から、該形質転換体をランダムに選んでプラスミドDNAを分離した。プラズミドDNAは制限酵素を用いて処理され、プラスミドのセルラーゼ遺伝子内に外来遺伝子が挿入されたか否かを確認した。
【0019】
別の実施形態において、本発明は、多糖分解酵素遺伝子を選択マーカーとして含むプラスミドで形質転換された宿主細胞の選抜において、多糖類及びその多糖類の分解産物により培地が色変を起こす発色試薬を含む培地が提供される。
【0020】
この実施形態において、多糖分解酵素に関する遺伝子を含むプラスミドに目的とする外来遺伝子を導入する。外来遺伝子が導入されたプラスミドを用いて大腸菌(E.coli)、酵母又は乳酸菌のような宿主細胞を形質転換させる。実際にプラスミドが宿主細胞内へ導入されて形質転換が成された形質転換体を選抜するために本発明の培地が使用される。
【0021】
上述したように、形質転換された宿主細胞から分泌される多糖分解酵素により分解を起こす必要があるので、本発明の培地は該当酵素により分解され得る多糖類を含んでいる。該培地はまた、該多糖類の分解産物により変色されて可視的に色の変化を感知し得る染料を含んでいる。
【0022】
よって、本発明による培地は、多糖類と発色試薬とを含み、多糖類としてはカルボキシメチルセルロース(CMC)、又はセルロースを含む多糖類等が挙げられる。即ち、多糖分解酵素により分解され得る基質は、本発明の培地の構成要素として使用される。
【0023】
また、発色試薬として、トリパンブルー(Trypan blue)、コンゴレッド(Congo red)、メチレンブルー(Methylene blue)、ビスマルクブラウン(Bismark brown)、ブリリアントクレシルブルー(Brilliant cresyl blue)、ヤンスグリーン(Jans green)、イントラビタム(Intra vitam)等が含まれる。
【0024】
培地には、全培地の重量を基準として、多糖が0.1乃至1.5重量%、発色試薬が0.01乃至0.19重量%の割合で含まれることが好ましく、残りは基本的な基質として寒天、LB培地等が含まれている。多糖類及び発色試薬の含有量が前記下限値の未満であるか上限値の以上であれば、ハロー生成を可視的に識別することが困難になる。
【0025】
本発明の別の実施形態において、選択マーカーとして多糖分解酵素遺伝子を含むプラスミドで形質転換された形質転換体の選択培地を製造する方法が提供される。該方法は、全混合物の重量を基準として多糖類0.5乃至1.5重量%、発色試薬0.01乃至0.19重量%を含む混合物を調製する工程と、前記混合物を40乃至45℃の温度で加熱しながら寒天が含有されたLB培地と混合する工程と、前記混合物を滅菌する工程と、前記混合物を常温に冷却させる工程とを含んでいる。
【0026】
好ましくは、全培地の重量を基準として多糖類が0.1乃至1.5重量%、発色試薬が0.05乃至0.1重量%含まれている。
混合物を40乃至45℃で加熱して均質に混合させた後、寒天を含有するLB培地とさらに混合した後に加圧滅菌し、冷却させる。アンピシリン抵抗遺伝子を含んでいるプラスミドの場合、冷却した培地に100μg/mlの濃度のアンピシリンを添加して、本発明による培地を調製する。
実施例1(1)宿主細胞及びプラスミド 宿主細胞として一般に多用される六種の大腸菌菌株を用いた。これらの菌株の種類と遺伝的マーカー及び入手先を以下の表1及び2に示す。
【0027】
【表1】

【0028】
【表2】

(2)pCEL1作製(construction)
T−easyベクター、pTCELAをEcoRI制限酵素で切断して1.4kbのセルラーゼ遺伝子フラグメントを得た。このフラグメントをEcoRI制限酵素によりpUC18の切断部位に挿入させた。セルラーゼ遺伝子が選択マーカーとしての機能を有するようにベクター内にあった既存のマーカーであるlazZを除去するためにセルラーゼ酵素遺伝子を含むベクターをNdeI及びSmaI制限酵素でカットした。切断されたベクターをDNAアガロースゲル上にて流し(run)、LazZ遺伝子を含む約0.2kbのフラグメントとApr遺伝子、ColE1由来(origin)、セルラーゼ遺伝子を含む3.8kbのフラグメントを分離した。3.8kbフラグメントのみをDNAアガロースゲル上から取り出し、DNAゲル精製で処理した。得られたDNAフラグメントを平滑末端化させ(blunted)、自己結合(self ligation)させた。該フラグメントは形質転換させた後に確認した。
【0029】
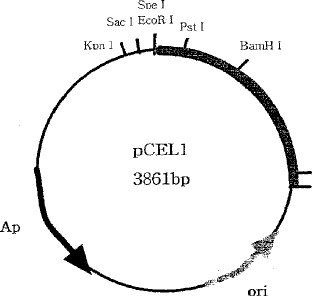
この実験を行うことで、lacZが除去されると共に、既存のベクター内に存在していたマルチプルクローニング部位の相当部分(SmaI,BamHI,XbaI,SalI,PstI,HindIII)が除去された。よって、セルラーゼ遺伝子内の酵素部位(enzyme site)をワン-カット部位(one cut site)に作って外来遺伝子の挿入を容易とした。こうして得られたベクターがpCEL1であり、その大きさは3.8kbとなった(図1参照)。
(3)pCEL1による形質転換及び形質転換体の選抜 pCEL1プラスミドを大腸菌菌株(XL1−blue)にエレクトロポレーション(electroporation)により導入した。形質転換体を選抜するために、得られた形質転換細胞をセルロースと発色試薬(コンゴレッド)を添加したLB寒天平坦培地に接種して37℃で16時間培養した。選択されたコロニーはLB培養液中にて培養された。pCEL1の所望の形質転換体を確認するためにpCEL1DNAを精製した。得られた形質転換体は、1999年4月6日付にてKorean Culture Center of Microorganismにブダペスト条約の下に寄託されており、2000年4月28日付にて交換された(微生物の名称:E.coli/XL−Blue:pCEL1,寄託番号:KCCM−10186)。
(4)pCEL1のクローニングベクターとしての機能確認 pCEL1プラスミドのセルラーゼ遺伝子内のBamHI部位をカットした。様々な大きさのγDNAのBamHI−BglIIフラグメントをカットされたプラスミドと結合(ligation)させた。この組換えベクターは、XL1−blueコンピテント細胞(competent cell)にエレクトロポレーションで形質転換させた。1時間後にセルラーゼと発色試薬が含有されているLBプレートに形質転換された細胞をスプレッドした。
【0030】
12時間培養した後、ハローを生成したコロニーと生成していないコロニーとが確認されており(図2参照)、各々のコロニーを液体培養した。プラスミド分離方法により培養液からプラスミドDNAを精製した。DNAは、制限酵素(NgoMIV)によって切断され、外来遺伝子の存在を確認した(図3参照)。これにより、pCEL1のみが含有されているコロニー、即ち、外来遺伝子が含有されていないコロニーはハローを生成し、外来遺伝子が挿入されたpCEl1はハローを生成しないことが証明された。
(5)広範の宿主における利用可能性の確認 様々な大腸菌菌株においてpCEL1が使用可能であるかを確認するために、実験上一般に広く使われる六種の大腸菌菌株に対し本発明のプラスミドによる形質転換を実験した。即ち、六種の大腸菌菌株のコンピテント細胞(XL1−blue、DH5α、JM105、JM109、HB101、MC1061)をそれぞれ調製した。プラスミドpCEL1を各々のコンピテント細胞にエレクトロポレーションにより形質転換させた。その結果、六種の全てにおいてハローを生成しており、プラスミドpCEL1は、pUC18よりは広範の菌株に使用できることが証明された。
【0031】
よって、本発明のベクターが既存のベクターより広範囲の宿主菌株に利用可能であることは、既存のプラスミドpUC18、即ち遺伝的な特性により、既存の選択マーカーとしてβ-ガラクトシダーゼ(lacZ)を有しているベクターであるpUC18では選択が不可能な菌株であるHB101又はMC1061を使用することによって確認された。
(6)酵母におけるセルロース遺伝子の選択マーカーとしての機能確認 pCEL1プラスミドに酵母複製開始点を挿入した。組換えベクターを酵母にエレクトロポレーションにより導入した。得られた酵母形質転換体は、セルロースと発色試薬(コンゴレッド)を含むYPD寒天プレートに接種して30℃で24時間培養した。ハローの認められた形質転換体は、酵母の形質転換体として選択された(図4参照)。よって、酵母においてもセルロース遺伝子を選択マーカーとして使用し得ることが確認された。
(7)乳酸菌におけるセルラーゼ遺伝子の選択マーカーとしての機能確認 pCEL1プラスミドに乳酸菌複製開始点を挿入した。組換えベクターを乳酸菌にエレクトロポレーションにより導入した。得られた形質転換体は、セルロースと発色試薬(コンゴレッド)を含むM17寒天プレートに接種して30℃で24時間培養した。ハローの認められた形質転換体は、乳酸菌の形質転換体として選択された。以下の表3に示す通り、セルラーゼ遺伝子が含まれたベクターで形質転換された乳酸菌のみでセルロースを含む培地においてハローが生成されることが確認された。この実験において、セルロース遺伝子を酵母において選択マーカーとして使用し得ることが確認された。
【0032】
【表3】

調製例1 全培地の重量を基準として、CMC(カルボキシメチルセルロース)0.5重量%とトリパンブルー0.05重量%とを混合した。混合物を十分に混合するために40℃乃至45℃で30分間加熱した後、1.5重量%の寒天を含有しているE.coli用LB培地(1リットル当りバクトトリプトン(Bactotrypton)10g、イースト抽出物(Yeast Extract)、10g、NaCl10g)とさらに混合した。混合物を121℃で15分間オートクレーブにて加圧滅菌して冷却した。培地にアンピシリン(100μg/ml)を添加して本発明のプレート型培地を得た。
調製例2 調製例1におけるCMCの濃度を0.5重量%に代えて1.0重量%で添加したことを除いては、調製例1の方法により本発明のプレート型培地を調製した。
調製例3 調製例1におけるCMCの濃度を0.5重量%に代えて1.5重量%で添加したことを除いては、調製例1の方法により本発明のプレート型培地を調製した。
調製例4 調製例1におけるCMCの濃度を0.5重量%に代えて2.0重量%で添加したことを除いては、調製例1の方法により本発明のプレート型培地を調製した。
調製例5 調製例1におけるトリパンブルーの濃度を0.5重量%に代えて0.07重量%で添加したことを除いては、調製例1の方法により本発明のプレート型培地を調製した。
調製例6 調製例1におけるトリパンブルーの濃度を0.5重量%に代えて0.1重量%で添加したことを除いては、調製例1の方法により本発明のプレート型培地を調製した。
調製例7 調製例1におけるトリパンブルーの濃度を0.5重量%に代えて0.2重量%で添加したことを除いては、調製例1の方法により本発明のプレート型培地を調製した。
実施例2 形質転換されたE.coli/XL1−Blue:pCEL1を調製例1の培地に塗抹し、37℃で12時間培養した。培養の結果、形質転換体の領域でハローが観察され、ハローのサイズを計測した。その結果を表1に示す。
実施例3 形質転換されたE.coli/XL1−Blue:pCEL1を調製例2の培地に塗抹し、37℃で12時間培養し、ハローの生成及びそのサイズを観察した。その結果を表1に示す。
実施例4 形質転換されたE.coli/XL1−Blue:pCEL1を調製例3の培地に塗抹し、37℃で12時間培養し、ハローの生成及びそのサイズを観察した。その結果を表1に示す。
実施例5 形質転換されたE.coli/XL1−Blue:pCEL1を調製例4の培地に塗抹し、37℃で12時間培養し、ハローの生成及びそのサイズを観察した。その結果を表1に示す。
実施例6 形質転換されたE.coli/XL1−Blue:pCEL1を調製例5の培地に塗抹し、37℃で12時間培養し、ハローの生成及びそのサイズを観察した。その結果を表2に示す。
実施例7 形質転換されたE.coli/XL1−Blue:pCEL1を調製例6の培地に塗抹し、37℃で12時間培養し、ハローの生成及びそのサイズを観察した。その結果を表2に示す。
実施例8 形質転換されたE.coli/XL1−Blue:pCEL1を調製例7の培地に塗抹し、37℃で12時間培養し、ハローの生成及びそのサイズを観察した。その結果を表2に示す。
【0033】
【表4】

【0034】
【表5】

実施例9 CMC(カルボキシメチルセルロース)の濃度を1.5重量%、トリパンブルーの濃度を0.05乃至0.1重量%で混合して乳酸菌用のMRS培地を調製した。セルラーゼ遺伝子を含むベクターで形質転換された乳酸菌を前記調製したMRS培地に塗抹して、24時間培養した。ハローの生成が観察された。
実施例10 CMCの(カルボキシメチルセルロース)濃度を1.5重量%、トリパンブルーの濃度を0.05乃至0.1重量%で混合して酵母用のYPD培地を調製した。セルラーゼ遺伝子を含むベクターで形質転換された酵母を前記YPD培地に塗抹して、24時間培養した。ハローの生成が観察された。
産業上の利用可能性 以上の説明から明らかなように、多糖分解酵素の遺伝子を含む本発明の改良された形質転換体は、外来遺伝子が導入されているか否かを決定し得る選択マーカーとして使用できる。よって、本発明の選択マーカーは、種々の実験に対する使用可能な選択の幅が拡大することは勿論、従来のβ-ガラクトシダーゼ遺伝子(lacZ)に比べ非常に低コストで優れた選択機能が発揮できるという長所がある。実際、本発明の試薬は、lacZに比べ約1/10,000−1/100,000倍も安価なので、本発明の試薬を用いると費用を大幅に削減することができる。
【0035】
また、本発明の選択マーカーは、宿主細胞に対する毒性も無く、更なる工程に係る様々な煩わしさを無くすことができる。
特に、ほとんどの大腸菌菌株にはセルラーゼ遺伝子が無いため、本発明によるベクターは、先に実験した六種の大腸菌の菌株は勿論のこと、実質的にほぼ全ての大腸菌で使用し得る広範のクローニングベクターである。更に、該ベクターは、既存のクローニングベクターと比較して、外来遺伝子のクローニングを確認することや形質転換の効率においても同等である。
【0036】
また、本発明のセルラーゼ遺伝子は、遺伝子が形質転換体を選抜するために使用されるので、酵母及び乳酸菌のクローニングにおいても有効な選択マーカーとして使用できる。よって、セルラーゼをマーカーとして使用するプラスミドでクローニングを行った時、本発明の培地は分解産物の色変により、迅速かつ容易に形質転換体を選抜することができる。また、セルラーゼマーカーを含む外来遺伝子が挿入されたプラスミドにより得られた形質転換体は、容易、迅速、かつ正確に探すことができるという効果を奏する。
【図面の簡単な説明】
【図1】 プラスミドpCEL1の制限酵素の位置を示す地図である。
【図2】 プラスミドpCEL1のセルラーゼ遺伝子中に様々なサイズのBamHI、BglIIで切断されたλDNAフラグメントを導入して形質転換体を調製した後、培養された形質転換体から分離され、NgoMIV制限酵素で切ることにより得られたプラスミドを示す電気泳動写真である。
【図3】 図2の形質転換体の発色状態を撮影した写真である。
【図4】 本発明のプラスミドpCEL1で修飾された酵母用ベクターで該酵母宿主を形質転換させた後における、ハローの生成示す写真である。
【0001】
技術分野 本発明は、多糖分解酵素遺伝子を選択マーカーとして含むベクター、そのベクターにより形質転換された宿主、形質転換体を選抜するための方法及び培地、並びに形質転換体の選抜用培地を製造するための方法に関する。
背景技術 一般に、クローニングベクター(cloning vector)あるいはサブクローニングベクターは、組換えDNAの生成の初期の段階において標的となるDNAフラグメントを導入するために使用される。このため、このベクターにはいくつかの性質が要求される。
第一に、ベクターをクローニングする工程は、例えば、PCR、配列決定及びサブクローニングのような実験の完成段階ではなく、初期段階において使用されるため、迅速かつ正確に実施される必要がある。多量のDNAを得るために、コピーの数(copy number)も多くなければならないし、クローニングの結果の早い確認が可能であることが好ましい。
【0002】
第二に、クローニングベクターは、種々の実験の初期段階において多量に、かつ繰り返し使用されるので、経済的な負担が少なくなければならない。そうでなければ、クローニングベクターを使用する追加の実験の費用が高くなるであろう。
【0003】
従来から種々のクローニングベクターが開発、かつ使用されており、例えば、pUC18、pUC19、pBluescript等が挙げられる。これらのクローニングベクターには、コピーの数が多い点と、選択マーカー(selection marker)としてβ-ガラクトシダーゼ(galactosidase)(lacZ)を使用する点とに共通点がある。
【0004】
β-ガラクトシダーゼ(lacZ)が選択マーカーとして使用される理由は、組換えベクターを含む形質転換体が無色であり、非−形質転換体の青色との区別が容易にできる点にある。β−ガラクトシダーゼ(lacZ)の選択は、宿主中においてα−ペプチドが欠損した変異型β−ガラクトシダーゼタンパク質をベクター中のα−ペプチドと結合して、機能的酵素分子を生成することによって行われる。
【0005】
このベクターは、lacZの全序列(full sequence)を含んではいないが、ベクターは、β−ガラクトシダーゼ(lacZ)の選択マーカーを使用する。その結果、使用されるベクターのサイズを減らす効果を奏することとなる。
【0006】
しかし、β-ガラクトシダーゼ(lacZ)の選択マーカーとしての使用は、いくつかの問題点を有している。第一に、x−galの価格が非常に高いので、実験に要する費用が増大する点が挙げられる。第2に、x−galの溶媒であるN,N−ジメチルホルムアミドが宿主の細菌に毒性を表すことである。形質転換体をプレートにスプレッド(spreading)する前に、先ずx−galを3乃至4時間の間スプレッドしなくてはならないので、実験の操作上煩わしさを伴うこととなる。第3に、この時に使用されるx−gal保存液(stock solution)の濃度は20mg/mlであり、1個のプレート当りこの溶液が40μlずつスプレッドされる。もしこの時にx−galが均一にスプレッドされないと、選抜の結果も不正確なものになる。第4に、x−galは別途に調製されて、後に添加されるため、プレートが汚染に曝される時間を増加させる可能性もある。第5に、β−ガラクトシダーゼを用いるベクターは、β−ガラクトシダーゼ(lacZ)の変異がなされる宿主においてのみ使用されるので、その使用できる宿主の範囲が限られている。
発明の開示 よって、本発明の目的は、既存のβ-ガラクトシダーゼ(lacZ)を選択マーカーとして用いるベクターの限界を克服して、経済的、かつ簡便に使用できるクローニングベクターを提供することにある。
【0007】
本発明の他の目的は、本発明のクローニングベクターを使用して形質転換された宿主細胞を提供することである。
本発明のさらに他の目的は、本発明のクローニングベクターを使用して様々な宿主細胞を高効率で形質転換させることができる形質転換体の選抜方法を提供することである。
【0008】
本発明のさらに他の目的は、多糖分解酵素遺伝子を選択マーカーとして含むプラスミドの選別に有効に使用される培地を提供することである。
本発明のさらに他の目的は、多糖分解酵素遺伝子を選択マーカーとして含むプラスミドの選別に有効に使用される培地の製造方法を提供することである。
【0009】
本発明により、選択マーカーとして多糖分解酵素遺伝子を含むベクターが提供される。
発明を実施するための最良の形態 本発明によるプラスミドは、選択マーカーとして多糖分解酵素遺伝子を含む。よって、本発明のプラスミドが導入された形質転換体は、導入された多糖分解酵素の発現によりそれに該当する多糖を分解するため、分解された多糖に対する発色試薬によりプラスミドが導入されているか否かを判断することができる。但し、宿主が導入される多糖分解酵素を自体的に生産する場合には、形質転換の前に該酵素を不活性化させなければならない。
【0010】
本発明において、プラスミドに導入される多糖分解酵素としては、セルラーゼ(cellulase)、アミラーゼ(amylase)又はキシラナーゼ(xylanase)等を使用することができる。
【0011】
これらの多糖分解酵素の遺伝子は公知の方法でプラスミドに導入される。このように導入されたプラスミドは選択マーカーとして多糖分解酵素遺伝子を含むこととなる。よって、本発明のプラスミドに所望の遺伝子を導入し、得られたプラスミドで宿主を形質転換することにより調製された形質転換した宿主の多糖分解能を判断することにより、外来遺伝子で形質転換された宿主が判別できる。
【0012】
本発明のプラスミドで形質転換される宿主としては、例えば大腸菌、酵母及び乳酸菌等が含まれるが、プラスミドの導入及び発現における使用に関しては、これらに限定されるものではない。
【0013】
別の実施形態において、本発明は、選択マーカーとして多糖分解酵素遺伝子を含むベクターを使用して形質転換体を選抜する方法を提供する。該方法は、選択マーカーとして多糖分解酵素遺伝子を含むベクターに目的の外来遺伝子を導入する工程と、該ベクターで宿主を形質転換させる工程と、該宿主細胞を多糖を含むプレートに塗抹して培養する工程と、該プレートに発色試薬を添加する工程と、変色の存在を検出して外来遺伝子を含む形質転換体を選抜する工程とを含んでいる。
【0014】
本発明の方法において、先ず、多糖分解酵素の遺伝子が導入されたベクターに目的の外来遺伝子を導入する。この組換えベクターを使用してベクターの導入及び発現が容易な宿主細胞を形質転換させる。この時、宿主自体が多糖分解酵素を有している場合には、これを不活性化させなければならない。
【0015】
形質転換が試みられた宿主細胞はプラスミドに導入された多糖分解酵素の遺伝子の発現により分泌される酵素で分解可能な多糖を含む平面のプレートに塗抹される。即ち、プラスミドにセルラーゼ遺伝子が導入されていると、プレートにもセルロースが含まれていなければならないし、プラスミドにアミラーゼ又はキシラナーゼ遺伝子が導入されていると、プレートにもアミロース又はキシロースが含まれていなければならない。
【0016】
形質転換体を一定の時間培養した後、プレート中において分解された糖と反応して色の変化を起こす試薬を添加する。例えば、セルラーゼの分解作用によりセルロースが分解されてグルコースとなった場合には、濃赤色から淡橙色へと変化する発色試薬を添加する。ここで、発色試薬は宿主を培地で培養した後に添加しても良く、培地に試薬が添加された状態で宿主を培養しても良い。
【0017】
一方、導入される多糖がアミロースである場合にはヨード試薬を、キシロースである場合にはコンゴレッド試薬を使用する。該試薬により培地の色が変化し、変色(ハロー生成(formation of a halo))した部位のコロニーが所望の外来遺伝子を含んでいることを示す。よって、所望の遺伝子が導入された形質転換体が選抜できる。
【0018】
下記の実施例では、導入されたプラスミドのセルラーゼが形質転換体において発現されるかを確認するために、セルロースと発色試薬を含む培地内におけるハローの生成を確認した。クローニングベクターとしての利用可能性は、セルラーゼ遺伝子内に外来遺伝子を挿入してセルラーゼ遺伝子が破壊されるか否かを検出する実験により証明した。また、このようにして得られたセルラーゼ酵素が発現されない形質転換体から、該形質転換体をランダムに選んでプラスミドDNAを分離した。プラズミドDNAは制限酵素を用いて処理され、プラスミドのセルラーゼ遺伝子内に外来遺伝子が挿入されたか否かを確認した。
【0019】
別の実施形態において、本発明は、多糖分解酵素遺伝子を選択マーカーとして含むプラスミドで形質転換された宿主細胞の選抜において、多糖類及びその多糖類の分解産物により培地が色変を起こす発色試薬を含む培地が提供される。
【0020】
この実施形態において、多糖分解酵素に関する遺伝子を含むプラスミドに目的とする外来遺伝子を導入する。外来遺伝子が導入されたプラスミドを用いて大腸菌(E.coli)、酵母又は乳酸菌のような宿主細胞を形質転換させる。実際にプラスミドが宿主細胞内へ導入されて形質転換が成された形質転換体を選抜するために本発明の培地が使用される。
【0021】
上述したように、形質転換された宿主細胞から分泌される多糖分解酵素により分解を起こす必要があるので、本発明の培地は該当酵素により分解され得る多糖類を含んでいる。該培地はまた、該多糖類の分解産物により変色されて可視的に色の変化を感知し得る染料を含んでいる。
【0022】
よって、本発明による培地は、多糖類と発色試薬とを含み、多糖類としてはカルボキシメチルセルロース(CMC)、又はセルロースを含む多糖類等が挙げられる。即ち、多糖分解酵素により分解され得る基質は、本発明の培地の構成要素として使用される。
【0023】
また、発色試薬として、トリパンブルー(Trypan blue)、コンゴレッド(Congo red)、メチレンブルー(Methylene blue)、ビスマルクブラウン(Bismark brown)、ブリリアントクレシルブルー(Brilliant cresyl blue)、ヤンスグリーン(Jans green)、イントラビタム(Intra vitam)等が含まれる。
【0024】
培地には、全培地の重量を基準として、多糖が0.1乃至1.5重量%、発色試薬が0.01乃至0.19重量%の割合で含まれることが好ましく、残りは基本的な基質として寒天、LB培地等が含まれている。多糖類及び発色試薬の含有量が前記下限値の未満であるか上限値の以上であれば、ハロー生成を可視的に識別することが困難になる。
【0025】
本発明の別の実施形態において、選択マーカーとして多糖分解酵素遺伝子を含むプラスミドで形質転換された形質転換体の選択培地を製造する方法が提供される。該方法は、全混合物の重量を基準として多糖類0.5乃至1.5重量%、発色試薬0.01乃至0.19重量%を含む混合物を調製する工程と、前記混合物を40乃至45℃の温度で加熱しながら寒天が含有されたLB培地と混合する工程と、前記混合物を滅菌する工程と、前記混合物を常温に冷却させる工程とを含んでいる。
【0026】
好ましくは、全培地の重量を基準として多糖類が0.1乃至1.5重量%、発色試薬が0.05乃至0.1重量%含まれている。
混合物を40乃至45℃で加熱して均質に混合させた後、寒天を含有するLB培地とさらに混合した後に加圧滅菌し、冷却させる。アンピシリン抵抗遺伝子を含んでいるプラスミドの場合、冷却した培地に100μg/mlの濃度のアンピシリンを添加して、本発明による培地を調製する。
実施例1(1)宿主細胞及びプラスミド 宿主細胞として一般に多用される六種の大腸菌菌株を用いた。これらの菌株の種類と遺伝的マーカー及び入手先を以下の表1及び2に示す。
【0027】
【表1】

【0028】
【表2】

(2)pCEL1作製(construction)
T−easyベクター、pTCELAをEcoRI制限酵素で切断して1.4kbのセルラーゼ遺伝子フラグメントを得た。このフラグメントをEcoRI制限酵素によりpUC18の切断部位に挿入させた。セルラーゼ遺伝子が選択マーカーとしての機能を有するようにベクター内にあった既存のマーカーであるlazZを除去するためにセルラーゼ酵素遺伝子を含むベクターをNdeI及びSmaI制限酵素でカットした。切断されたベクターをDNAアガロースゲル上にて流し(run)、LazZ遺伝子を含む約0.2kbのフラグメントとApr遺伝子、ColE1由来(origin)、セルラーゼ遺伝子を含む3.8kbのフラグメントを分離した。3.8kbフラグメントのみをDNAアガロースゲル上から取り出し、DNAゲル精製で処理した。得られたDNAフラグメントを平滑末端化させ(blunted)、自己結合(self ligation)させた。該フラグメントは形質転換させた後に確認した。
【0029】
この実験を行うことで、lacZが除去されると共に、既存のベクター内に存在していたマルチプルクローニング部位の相当部分(SmaI,BamHI,XbaI,SalI,PstI,HindIII)が除去された。よって、セルラーゼ遺伝子内の酵素部位(enzyme site)をワン-カット部位(one cut site)に作って外来遺伝子の挿入を容易とした。こうして得られたベクターがpCEL1であり、その大きさは3.8kbとなった(図1参照)。
(3)pCEL1による形質転換及び形質転換体の選抜 pCEL1プラスミドを大腸菌菌株(XL1−blue)にエレクトロポレーション(electroporation)により導入した。形質転換体を選抜するために、得られた形質転換細胞をセルロースと発色試薬(コンゴレッド)を添加したLB寒天平坦培地に接種して37℃で16時間培養した。選択されたコロニーはLB培養液中にて培養された。pCEL1の所望の形質転換体を確認するためにpCEL1DNAを精製した。得られた形質転換体は、1999年4月6日付にてKorean Culture Center of Microorganismにブダペスト条約の下に寄託されており、2000年4月28日付にて交換された(微生物の名称:E.coli/XL−Blue:pCEL1,寄託番号:KCCM−10186)。
(4)pCEL1のクローニングベクターとしての機能確認 pCEL1プラスミドのセルラーゼ遺伝子内のBamHI部位をカットした。様々な大きさのγDNAのBamHI−BglIIフラグメントをカットされたプラスミドと結合(ligation)させた。この組換えベクターは、XL1−blueコンピテント細胞(competent cell)にエレクトロポレーションで形質転換させた。1時間後にセルラーゼと発色試薬が含有されているLBプレートに形質転換された細胞をスプレッドした。
【0030】
12時間培養した後、ハローを生成したコロニーと生成していないコロニーとが確認されており(図2参照)、各々のコロニーを液体培養した。プラスミド分離方法により培養液からプラスミドDNAを精製した。DNAは、制限酵素(NgoMIV)によって切断され、外来遺伝子の存在を確認した(図3参照)。これにより、pCEL1のみが含有されているコロニー、即ち、外来遺伝子が含有されていないコロニーはハローを生成し、外来遺伝子が挿入されたpCEl1はハローを生成しないことが証明された。
(5)広範の宿主における利用可能性の確認 様々な大腸菌菌株においてpCEL1が使用可能であるかを確認するために、実験上一般に広く使われる六種の大腸菌菌株に対し本発明のプラスミドによる形質転換を実験した。即ち、六種の大腸菌菌株のコンピテント細胞(XL1−blue、DH5α、JM105、JM109、HB101、MC1061)をそれぞれ調製した。プラスミドpCEL1を各々のコンピテント細胞にエレクトロポレーションにより形質転換させた。その結果、六種の全てにおいてハローを生成しており、プラスミドpCEL1は、pUC18よりは広範の菌株に使用できることが証明された。
【0031】
よって、本発明のベクターが既存のベクターより広範囲の宿主菌株に利用可能であることは、既存のプラスミドpUC18、即ち遺伝的な特性により、既存の選択マーカーとしてβ-ガラクトシダーゼ(lacZ)を有しているベクターであるpUC18では選択が不可能な菌株であるHB101又はMC1061を使用することによって確認された。
(6)酵母におけるセルロース遺伝子の選択マーカーとしての機能確認 pCEL1プラスミドに酵母複製開始点を挿入した。組換えベクターを酵母にエレクトロポレーションにより導入した。得られた酵母形質転換体は、セルロースと発色試薬(コンゴレッド)を含むYPD寒天プレートに接種して30℃で24時間培養した。ハローの認められた形質転換体は、酵母の形質転換体として選択された(図4参照)。よって、酵母においてもセルロース遺伝子を選択マーカーとして使用し得ることが確認された。
(7)乳酸菌におけるセルラーゼ遺伝子の選択マーカーとしての機能確認 pCEL1プラスミドに乳酸菌複製開始点を挿入した。組換えベクターを乳酸菌にエレクトロポレーションにより導入した。得られた形質転換体は、セルロースと発色試薬(コンゴレッド)を含むM17寒天プレートに接種して30℃で24時間培養した。ハローの認められた形質転換体は、乳酸菌の形質転換体として選択された。以下の表3に示す通り、セルラーゼ遺伝子が含まれたベクターで形質転換された乳酸菌のみでセルロースを含む培地においてハローが生成されることが確認された。この実験において、セルロース遺伝子を酵母において選択マーカーとして使用し得ることが確認された。
【0032】
【表3】

調製例1 全培地の重量を基準として、CMC(カルボキシメチルセルロース)0.5重量%とトリパンブルー0.05重量%とを混合した。混合物を十分に混合するために40℃乃至45℃で30分間加熱した後、1.5重量%の寒天を含有しているE.coli用LB培地(1リットル当りバクトトリプトン(Bactotrypton)10g、イースト抽出物(Yeast Extract)、10g、NaCl10g)とさらに混合した。混合物を121℃で15分間オートクレーブにて加圧滅菌して冷却した。培地にアンピシリン(100μg/ml)を添加して本発明のプレート型培地を得た。
調製例2 調製例1におけるCMCの濃度を0.5重量%に代えて1.0重量%で添加したことを除いては、調製例1の方法により本発明のプレート型培地を調製した。
調製例3 調製例1におけるCMCの濃度を0.5重量%に代えて1.5重量%で添加したことを除いては、調製例1の方法により本発明のプレート型培地を調製した。
調製例4 調製例1におけるCMCの濃度を0.5重量%に代えて2.0重量%で添加したことを除いては、調製例1の方法により本発明のプレート型培地を調製した。
調製例5 調製例1におけるトリパンブルーの濃度を0.5重量%に代えて0.07重量%で添加したことを除いては、調製例1の方法により本発明のプレート型培地を調製した。
調製例6 調製例1におけるトリパンブルーの濃度を0.5重量%に代えて0.1重量%で添加したことを除いては、調製例1の方法により本発明のプレート型培地を調製した。
調製例7 調製例1におけるトリパンブルーの濃度を0.5重量%に代えて0.2重量%で添加したことを除いては、調製例1の方法により本発明のプレート型培地を調製した。
実施例2 形質転換されたE.coli/XL1−Blue:pCEL1を調製例1の培地に塗抹し、37℃で12時間培養した。培養の結果、形質転換体の領域でハローが観察され、ハローのサイズを計測した。その結果を表1に示す。
実施例3 形質転換されたE.coli/XL1−Blue:pCEL1を調製例2の培地に塗抹し、37℃で12時間培養し、ハローの生成及びそのサイズを観察した。その結果を表1に示す。
実施例4 形質転換されたE.coli/XL1−Blue:pCEL1を調製例3の培地に塗抹し、37℃で12時間培養し、ハローの生成及びそのサイズを観察した。その結果を表1に示す。
実施例5 形質転換されたE.coli/XL1−Blue:pCEL1を調製例4の培地に塗抹し、37℃で12時間培養し、ハローの生成及びそのサイズを観察した。その結果を表1に示す。
実施例6 形質転換されたE.coli/XL1−Blue:pCEL1を調製例5の培地に塗抹し、37℃で12時間培養し、ハローの生成及びそのサイズを観察した。その結果を表2に示す。
実施例7 形質転換されたE.coli/XL1−Blue:pCEL1を調製例6の培地に塗抹し、37℃で12時間培養し、ハローの生成及びそのサイズを観察した。その結果を表2に示す。
実施例8 形質転換されたE.coli/XL1−Blue:pCEL1を調製例7の培地に塗抹し、37℃で12時間培養し、ハローの生成及びそのサイズを観察した。その結果を表2に示す。
【0033】
【表4】

【0034】
【表5】

実施例9 CMC(カルボキシメチルセルロース)の濃度を1.5重量%、トリパンブルーの濃度を0.05乃至0.1重量%で混合して乳酸菌用のMRS培地を調製した。セルラーゼ遺伝子を含むベクターで形質転換された乳酸菌を前記調製したMRS培地に塗抹して、24時間培養した。ハローの生成が観察された。
実施例10 CMCの(カルボキシメチルセルロース)濃度を1.5重量%、トリパンブルーの濃度を0.05乃至0.1重量%で混合して酵母用のYPD培地を調製した。セルラーゼ遺伝子を含むベクターで形質転換された酵母を前記YPD培地に塗抹して、24時間培養した。ハローの生成が観察された。
産業上の利用可能性 以上の説明から明らかなように、多糖分解酵素の遺伝子を含む本発明の改良された形質転換体は、外来遺伝子が導入されているか否かを決定し得る選択マーカーとして使用できる。よって、本発明の選択マーカーは、種々の実験に対する使用可能な選択の幅が拡大することは勿論、従来のβ-ガラクトシダーゼ遺伝子(lacZ)に比べ非常に低コストで優れた選択機能が発揮できるという長所がある。実際、本発明の試薬は、lacZに比べ約1/10,000−1/100,000倍も安価なので、本発明の試薬を用いると費用を大幅に削減することができる。
【0035】
また、本発明の選択マーカーは、宿主細胞に対する毒性も無く、更なる工程に係る様々な煩わしさを無くすことができる。
特に、ほとんどの大腸菌菌株にはセルラーゼ遺伝子が無いため、本発明によるベクターは、先に実験した六種の大腸菌の菌株は勿論のこと、実質的にほぼ全ての大腸菌で使用し得る広範のクローニングベクターである。更に、該ベクターは、既存のクローニングベクターと比較して、外来遺伝子のクローニングを確認することや形質転換の効率においても同等である。
【0036】
また、本発明のセルラーゼ遺伝子は、遺伝子が形質転換体を選抜するために使用されるので、酵母及び乳酸菌のクローニングにおいても有効な選択マーカーとして使用できる。よって、セルラーゼをマーカーとして使用するプラスミドでクローニングを行った時、本発明の培地は分解産物の色変により、迅速かつ容易に形質転換体を選抜することができる。また、セルラーゼマーカーを含む外来遺伝子が挿入されたプラスミドにより得られた形質転換体は、容易、迅速、かつ正確に探すことができるという効果を奏する。
【図面の簡単な説明】
【図1】 プラスミドpCEL1の制限酵素の位置を示す地図である。
【図2】 プラスミドpCEL1のセルラーゼ遺伝子中に様々なサイズのBamHI、BglIIで切断されたλDNAフラグメントを導入して形質転換体を調製した後、培養された形質転換体から分離され、NgoMIV制限酵素で切ることにより得られたプラスミドを示す電気泳動写真である。
【図3】 図2の形質転換体の発色状態を撮影した写真である。
【図4】 本発明のプラスミドpCEL1で修飾された酵母用ベクターで該酵母宿主を形質転換させた後における、ハローの生成示す写真である。
【特許請求の範囲】
【請求項1】 選択マーカーとして多糖分解酵素遺伝子を含むベクター。
【請求項2】 前記多糖分解酵素遺伝子がセルラーゼ、アミラーゼ及びキシラナーゼで構成された群から選択されることを特徴とする請求項1に記載のベクター。
【請求項3】 選択マーカーとして多糖分解遺伝子を含むベクターにより形質転換された宿主。
【請求項4】 前記宿主が大腸菌、酵母及び乳酸菌で構成された群から選択されることを特徴とする請求項3に記載の宿主。
【請求項5】 選択マーカーとして多糖分解酵素遺伝子を含むベクターに目的の外来遺伝子を導入する工程と、 前記ベクターで宿主を形質転換させる工程と、 前記宿主を多糖を含む培地に塗抹して培養する工程と、 前記培地に発色試薬を添加する工程と、 変色の存在を検出して外来遺伝子が導入された形質転換体を選抜する工程とを含む、選択マーカーとして多糖分解酵素遺伝子を含むベクターを用いて形質転換体を選抜する方法。
【請求項6】 多糖分解酵素遺伝子を選択マーカーとして含むプラスミドで形質転換された宿主を選抜するために、多糖類及びその多糖類の分解産物により色変を起こす発色試薬を含む培地。
【請求項7】 前記多糖類がカルボキシメチルセルロース及びセルロースを含む基質で構成された群から選択されることを特徴とする請求項6に記載の培地。
【請求項8】 前記多糖類が全培地の重量を基準として、0.1乃至1.9重量%の濃度で添加されることを特徴とする請求項7に記載の培地。
【請求項9】 前記発色試薬がトリパンブルー、コンゴレッド、メチレンブルー、ビスマルクブラウン、ブリリアントクレシルブルー、ヤンスグリーン、及びイントラビタムで構成された群から選択されることを特徴とする請求項6に記載の培地。
【請求項10】 前記発色試薬が全培地の重量を基準として、0.01乃至0.19重量%の濃度で添加されることを特徴とする請求項9に記載の培地。
【請求項11】 全混合物の重量を基準として、多糖類0.5乃至1.5重量%と、発色試薬0.05乃至0.1重量%と基礎の基質とを含む混合物を調製する工程と、 前記混合物を40乃至45℃の温度で加熱する工程と、 前記混合物を滅菌する工程と、 前記混合物を常温に冷却させる工程と含む、選択マーカーとして多糖分解酵素遺伝子を含むプラスミドで形質転換された形質転換体の選抜用培地を製造する方法。
【請求項1】 選択マーカーとして多糖分解酵素遺伝子を含むベクター。
【請求項2】 前記多糖分解酵素遺伝子がセルラーゼ、アミラーゼ及びキシラナーゼで構成された群から選択されることを特徴とする請求項1に記載のベクター。
【請求項3】 選択マーカーとして多糖分解遺伝子を含むベクターにより形質転換された宿主。
【請求項4】 前記宿主が大腸菌、酵母及び乳酸菌で構成された群から選択されることを特徴とする請求項3に記載の宿主。
【請求項5】 選択マーカーとして多糖分解酵素遺伝子を含むベクターに目的の外来遺伝子を導入する工程と、 前記ベクターで宿主を形質転換させる工程と、 前記宿主を多糖を含む培地に塗抹して培養する工程と、 前記培地に発色試薬を添加する工程と、 変色の存在を検出して外来遺伝子が導入された形質転換体を選抜する工程とを含む、選択マーカーとして多糖分解酵素遺伝子を含むベクターを用いて形質転換体を選抜する方法。
【請求項6】 多糖分解酵素遺伝子を選択マーカーとして含むプラスミドで形質転換された宿主を選抜するために、多糖類及びその多糖類の分解産物により色変を起こす発色試薬を含む培地。
【請求項7】 前記多糖類がカルボキシメチルセルロース及びセルロースを含む基質で構成された群から選択されることを特徴とする請求項6に記載の培地。
【請求項8】 前記多糖類が全培地の重量を基準として、0.1乃至1.9重量%の濃度で添加されることを特徴とする請求項7に記載の培地。
【請求項9】 前記発色試薬がトリパンブルー、コンゴレッド、メチレンブルー、ビスマルクブラウン、ブリリアントクレシルブルー、ヤンスグリーン、及びイントラビタムで構成された群から選択されることを特徴とする請求項6に記載の培地。
【請求項10】 前記発色試薬が全培地の重量を基準として、0.01乃至0.19重量%の濃度で添加されることを特徴とする請求項9に記載の培地。
【請求項11】 全混合物の重量を基準として、多糖類0.5乃至1.5重量%と、発色試薬0.05乃至0.1重量%と基礎の基質とを含む混合物を調製する工程と、 前記混合物を40乃至45℃の温度で加熱する工程と、 前記混合物を滅菌する工程と、 前記混合物を常温に冷却させる工程と含む、選択マーカーとして多糖分解酵素遺伝子を含むプラスミドで形質転換された形質転換体の選抜用培地を製造する方法。
【図1】


【図2】


【図3】


【図4】




【図2】


【図3】


【図4】


【公表番号】特表2003−519469(P2003−519469A)
【公表日】平成15年6月24日(2003.6.24)
【国際特許分類】
【出願番号】特願2001−500784(P2001−500784)
【出願日】平成12年4月29日(2000.4.29)
【国際出願番号】PCT/KR00/00409
【国際公開番号】WO00/073472
【国際公開日】平成12年12月7日(2000.12.7)
【出願人】
【氏名又は名称】チャン、デ キュン
【氏名又は名称原語表記】CHUNG,Dae Kyun
【Fターム(参考)】
【公表日】平成15年6月24日(2003.6.24)
【国際特許分類】
【出願日】平成12年4月29日(2000.4.29)
【国際出願番号】PCT/KR00/00409
【国際公開番号】WO00/073472
【国際公開日】平成12年12月7日(2000.12.7)
【出願人】
【氏名又は名称】チャン、デ キュン
【氏名又は名称原語表記】CHUNG,Dae Kyun
【Fターム(参考)】
[ Back to top ]

