選択的アンドロゲン受容体調節剤による骨関連疾患の治療
【課題】骨関連疾患を治療、予防、抑止及び抑制する並びに骨関連疾患が進行する危険性を減少させる方法を提供する。
【解決手段】本発明は、骨粗鬆症、骨減少症、骨吸収の増加、骨折、骨の脆弱化、骨ミネラル濃度(BMD)の減少などの骨関連疾患を、治療、予防、抑止及び抑制する並びにそれらの疾患が進行する危険性を減少させる方法であって、患者に、治療に効果的な量の選択的アンドロゲン受容体調節剤(SARM)及び/又はその類似体、誘導体、異性体、代謝産物、薬学的に許容される塩、医薬品、水和物、N酸化物或いはそれらの組み合わせを投与するステップを含む方法を提供する。また、本発明は、脂肪量を減少させる又は除脂肪量を増加させる方法であって、SARMを投与するステップを含む方法を提供する。
【解決手段】本発明は、骨粗鬆症、骨減少症、骨吸収の増加、骨折、骨の脆弱化、骨ミネラル濃度(BMD)の減少などの骨関連疾患を、治療、予防、抑止及び抑制する並びにそれらの疾患が進行する危険性を減少させる方法であって、患者に、治療に効果的な量の選択的アンドロゲン受容体調節剤(SARM)及び/又はその類似体、誘導体、異性体、代謝産物、薬学的に許容される塩、医薬品、水和物、N酸化物或いはそれらの組み合わせを投与するステップを含む方法を提供する。また、本発明は、脂肪量を減少させる又は除脂肪量を増加させる方法であって、SARMを投与するステップを含む方法を提供する。
【発明の詳細な説明】
【技術分野】
【0001】
本発明は、骨粗鬆症、骨減少症、骨吸収の増加、骨折、骨の脆弱化、骨ミネラル濃度の減少などの骨関連疾患を治療、予防、抑止及び抑制する並びにそれらの疾患が進行する危険性を減少させる方法であって、患者に、治療に効果的な量の選択的アンドロゲン受容体調節剤(selective androgen receptor modulator:SARM)及び/又はその類似体、誘導体、異性体、代謝産物、薬学的に許容される塩、医薬品、水和物、N酸化物或いはそれらの組み合わせを投与するステップを含む方法を提供する。また、本発明は、脂肪量(fat mass)を減少させる又は除脂肪量(lean mass)を増加させる方法であって、SARMを投与するステップを含む方法を提供する。
【背景技術】
【0002】
骨ミネラル濃度(bone mineral density:BMD)は、男性でも女性でも年齢と共に減少する。BMDと骨塩量(bone mineral content:BMC)が減少すると、骨の強度が低下するため骨折しやすくなる。
【0003】
骨粗鬆症は全身性の骨疾患であり、骨量の低下及び骨組織の劣化という特徴がある。そのため、骨粗鬆症にかかると、骨が脆くなって骨折しやすくなる。アメリカ合衆国では、毎年、2500万人以上がこの病気にかかっており、1300万人以上が骨折している(毎年、50万人が背骨を、25万人が股関節を、24万人が手首を骨折している)。股関節の骨折は骨粗鬆症における最も深刻な問題であり、患者の5〜20%は骨折後1年以内に死に至る。また、死に至らなかったとしても、50%以上が再起不能となる。高齢者は骨粗鬆症にかかる危険性が非常に高いため、高齢化社会が進むにつれてこの問題は極めて深刻化すると懸念されている。全世界での骨折の発生率は、次の60年間で3倍になると予測される。また、ある調査では、2050年には全世界で450万人の股関節骨折が起こると推測している。
【0004】
骨粗鬆症及び他の骨関連疾患の罹患率の増加に伴って、骨関連疾患は男性及び女性の両方で、健康上の重要な関心事となっている。そこで、骨関連疾患の罹患率を減少させるために、基礎科学と臨床レベルの両方において新規で革新的なアプローチが緊急に必要とされている。
【先行技術文献】
【非特許文献】
【0005】
【非特許文献1】Wahner H W,et al, "Nuclear Medicine: Quantitative Procedures ", Toronto little, Brown&Co., 1983, pp.107-132
【非特許文献2】"Assessment of Bone Mineral Part 1", J Nucl Medicine 26, pp.1134-1141,1984
【非特許文献3】"T Bone mineral Denisty of The Radius ", J Nucl Medicine 26, pp.13-39,1985
【発明の概要】
【発明が解決しようとする課題】
【0006】
本発明は、上記したような必要を、次のような手法により満たす。
【課題を解決するための手段】
【0007】
ある実施形態では、本発明は、骨関連疾患の患者を治療する方法であって、患者にSARM化合物を投与するステップを含む方法を提供する。他の実施形態では、この方法は、SARM化合物の類似体、誘導体、異性体、代謝産物、薬学的に許容される塩、医薬品、水和物、N酸化物又はそれらの組み合わせの投与を含んでいる。
【0008】
他の実施形態では、本発明は、骨関連疾患の罹患率を減少させる方法であって、患者にSARM化合物を投与するステップを含む方法を提供する。他の実施形態では、この方法は、SARM化合物の類似体、誘導体、異性体、代謝産物、薬学的に許容される塩、医薬品、水和物、N酸化物又はそれらの組み合わせの投与を含んでいる。
【0009】
他の実施形態では、本発明は、骨強度を増加させる方法であって、患者にSARM化合物を投与するステップを含む方法を提供する。他の実施形態では、この方法は、SARM化合物の類似体、誘導体、異性体、代謝産物、薬学的に許容される塩、医薬品、水和物、N酸化物又はそれらの組み合わせの投与を含んでいる。
【0010】
他の実施形態では、本発明は、骨量を増加させる方法であって、患者にSARM化合物を投与するステップを含む方法を提供する。他の実施形態では、この方法は、SARM化合物の類似体、誘導体、異性体、代謝産物、薬学的に許容される塩、医薬品、水和物、N酸化物又はそれらの組み合わせの投与を含んでいる。
【0011】
他の実施形態では、本発明は、骨吸収の割合を減少させる方法であって、患者にSARM化合物を投与するステップを含む方法を提供する。他の実施形態では、この方法は、SARM化合物の類似体、誘導体、異性体、代謝産物、薬学的に許容される塩、医薬品、水和物、N酸化物又はそれらの組み合わせの投与を含んでいる。
【0012】
他の実施形態では、本発明は、脂肪量(fat mass)を減少させる方法であって、患者にSARM化合物を投与するステップを含む方法を提供する。他の実施形態では、この方法は、SARM化合物の類似体、誘導体、異性体、代謝産物、薬学的に許容される塩、医薬品、水和物、N酸化物又はそれらの組み合わせの投与を含んでいる。
【0013】
他の実施形態では、本発明は、脂肪量の増加率を低減させる方法であって、患者にSARM化合物を投与するステップを含む方法を提供する。他の実施形態では、この方法は、SARM化合物の類似体、誘導体、異性体、代謝産物、薬学的に許容される塩、医薬品、水和物、N酸化物又はそれらの組み合わせの投与を含んでいる。
【0014】
他の実施形態では、本発明は、筋肉量(muscle mass)を増加させる方法であって、患者にSARM化合物を投与するステップを含む方法を提供する。他の実施形態では、この方法は、SARM化合物の類似体、誘導体、異性体、代謝産物、薬学的に許容される塩、医薬品、水和物、N酸化物又はそれらの組み合わせの投与を含んでいる。
【0015】
他の実施形態では、本発明は、筋肉量の減少率を低減させる方法であって、患者にSARM化合物を投与するステップを含む方法を提供する。他の実施形態では、この方法は、SARM化合物の類似体、誘導体、異性体、代謝産物、薬学的に許容される塩、医薬品、水和物、N酸化物又はそれらの組み合わせの投与を含んでいる。
【0016】
他の実施形態では、本発明は、除脂肪量(lean mass)を増加させる方法であって、患者にSARM化合物を投与するステップを含む方法を提供する。他の実施形態では、この方法は、SARM化合物の類似体、誘導体、異性体、代謝産物、薬学的に許容される塩、医薬品、水和物、N酸化物又はそれらの組み合わせの投与を含んでいる。
【図面の簡単な説明】
【0017】
【図1】実験結果を示す表であり、120日目の全身BMDを示す。なお、データは平均値±測定の標準誤差で示している。 a=P<0.05vs.OVX対照 b=P<0.05vs.無傷対照
【図2】実験結果を示す表であり、120日目の腰椎(L5−L6)を示す。なお、データは平均値±測定の標準誤差で示している。 a=P<0.05vs.OVX対照 b=P<0.05vs.無傷対照
【図3】実験結果を示す表であり、120日目の腰椎(L2−L4)を示す。なお、データは平均値±測定の標準誤差で示している。
【図4】実験結果を示す表であり、120日目の大腿領域4を示す。なお、データは平均値±測定の標準誤差で示している。 a=P<0.05vs.OVX対照 b=P<0.05vs.無傷対照
【図5】実験結果を示す表であり、120日目の近位大腿を示す。なお、データは平均値±測定の標準誤差で示している。
【図6】実験結果を示す表であり、120日目の大腿骨中央骨幹の皮質厚を示す。なお、データは平均値±測定の標準誤差で示している。 a=P<0.05vs.OVX対照 b=P<0.05vs.無傷対照
【図7】実験結果を示す表であり、120日目の大腿骨中央骨幹の皮質含量を示す。なお、データは平均値±測定の標準誤差で示している。a=P<0.05vs.OVX対照 b=P<0.05vs.無傷対照
【図8】実験結果を示す表であり、120日目の大腿骨中央骨幹の骨膜を示す。なお、データは平均値±測定の標準誤差で示している。 a=P<0.05vs.OVX対照 b=P<0.05vs.無傷対照
【図9】実験結果を示す表であり、120日目の遠位大腿骨の骨梁密度を示す。なお、データは平均値±測定の標準誤差で示している。 a=P<0.05vs.OVX対照 b=P<0.05vs.無傷対照
【図10】実験結果を示す表であり、120日目の大腿最大負荷を示す。なお、データは平均値±測定の標準誤差で示している。 a=P<0.05vs.OVX対照 b=P<0.05vs.無傷対照
【図11】実験結果を示す表であり、L5脊椎の圧縮強さを示す。なお、データは平均値±測定の標準誤差で示している。
【図12】実験結果を示す表である。A及びBからなり、Aは120日目のBMCの変化割合(%)、BはBMCの経時変化を示す。なお、データは平均値±測定の標準誤差で示している。
【図13】実験結果を示す表であり、30日目のBMCの変化割合(%)を示す。なお、データは平均値±測定の標準誤差で示している。
【図14】実験結果を示す表であり、120日目の体重を示す。なお、データは平均値±測定の標準誤差で示している。 a=P<0.05vs.OVX対照 b=P<0.05vs.無傷対照
【図15】実験結果を示す表であり、120日目のFM割合(%)を示す。なお、データは平均値±測定の標準誤差で示している。 a=P<0.05vs.OVX対照 b=P<0.05vs.無傷対照
【図16】実験結果を示す表であり、120日目の血清オステオカルシンレベルを示す。なお、データは平均値±測定の標準誤差で示している。 a=P<0.05vs.OVX対照 b=P<0.05vs.無傷対照
【図17】実験結果を示す表であり、210日目の全身BMCを示す。なお、データは平均値±測定の標準誤差で示している。 a=P<0.05vs.OVX対照 b=P<0.05vs.無傷対照
【図18】実験結果を示す表であり、210日目の腰椎(L5−L6)BMCを示す。なお、データは平均値±測定の標準誤差で示している。 a=P<0.05vs.OVX対照 b=P<0.05vs.無傷対照 無傷対照は210日目に屠殺した
【図19】実験結果を示す表であり、210日目の全身BMDを示す。なお、データは平均値±測定の標準誤差で示している。 a=P<0.05vs.OVX対照 b=P<0.05vs.無傷対照 無傷対照は210日目に屠殺した
【図20】実験結果を示す表であり、210日目の大腿骨中央骨幹の皮質含量を示す。なお、データは平均値±測定の標準誤差で示している。 a=P<0.05vs.OVX対照 b=P<0.05vs.無傷対照
【図21】実験結果を示す表であり、210日目の大腿骨中央骨幹の皮質厚を示す。なお、データは平均値±測定の標準誤差で示している。 a=P<0.05vs.OVX対照 b=P<0.05vs.無傷対照
【図22】実験結果を示す表であり、210日目の大腿骨中央骨幹の骨膜を示す。なお、データは平均値±測定の標準誤差で示している。 a=P<0.05vs.OVX対照 b=P<0.05vs.無傷対照
【図23】実験結果を示す表であり、210日目の遠位大腿骨の骨梁密度を示す。なお、データは平均値±測定の標準誤差で示している。 a=P<0.05vs.OVX対照 b=P<0.05vs.無傷対照
【図24】実験結果を示す表であり、210日目の大腿最大負荷を示す。なお、データは平均値±測定の標準誤差で示している。 a=P<0.05vs.OVX対照 b=P<0.05vs.無傷対照
【図25】実験結果を示す表であり、210日目の体重を示す。なお、データは平均値±測定の標準誤差で示している。 a=P<0.05vs.OVX対照 b=P<0.05vs.無傷対照
【図26】実験結果を示す表であり、210日目のFM割合(%)を示す。なお、データは平均値±測定の標準誤差で示している。 a=P<0.05vs.OVX対照 b=P<0.05vs.無傷対照
【図27】実験結果を示す表であり、120日目の全身BMDを示す。なお、データは平均値±測定の標準誤差で示している。 a=P<0.05vs.OVX対照 b=P<0.05vs.無傷対照
【図28】実験結果を示す表であり、120日目のL5−L6脊椎のBMDを示す。なお、データは平均値±測定の標準誤差で示している。 a=P<0.05vs.OVX対照 b=P<0.05vs.無傷対照
【図29】実験結果を示す表であり、210日目の全身BMDを示す。なお、データは平均値±測定の標準誤差で示している。 a=P<0.05vs.OVX対照 b=P<0.05vs.無傷対照
【図30】実験結果を示す表であり、210日目のL5−L6脊椎のBMDを示す。なお、データは平均値±測定の標準誤差で示している。 a=P<0.05vs.OVX対照 b=P<0.05vs.無傷対照
【図31】実験結果を示す表であり、120日目の体重を示す。なお、データは平均値±測定の標準誤差で示している。 a=P<0.05vs.OVX対照 b=P<0.05vs.無傷対照
【図32】実験結果を示す表であり、210日目の体重を示す。なお、データは平均値±測定の標準誤差で示している。 a=P<0.05vs.OVX対照 b=P<0.05vs.無傷対照
【図33】実験結果を示す表であり、120日目のFM割合(%)を示す。なお、データは平均値±測定の標準誤差で示している。 a=P<0.05vs.OVX対照 b=P<0.05vs.無傷対照
【図34】実験結果を示す表であり、210日目のFM割合(%)を示す。なお、データは平均値±測定の標準誤差で示している。 a=P<0.05vs.OVX対照 b=P<0.05vs.無傷対照
【発明を実施するための形態】
【0018】
本発明は、骨関連疾患を治療、予防、抑止及び抑制する並びに骨関連疾患の罹患率を減少させる方法であって、患者に、選択的アンドロゲン受容体調節剤(selective androgen receptor modulator:SARM)及び/又はその類似体、誘導体、異性体、代謝産物、薬学的に許容される塩、医薬品、水和物、N酸化物或いはそれらの組み合わせを投与するステップを含む方法を提供する。また、本発明は、患者の骨強度又は骨量を増加させる方法、患者の筋肉量を増加させる方法、又は、患者の脂肪量を減少させる方法であって、SARM化合物を投与するステップを含む方法を提供する。
【0019】
他の実施形態では、本発明は、骨関連疾患の罹患率を減少させる方法であって、患者にSARM化合物を投与するステップを含む方法を提供する。他の実施形態では、この方法は、SARM化合物の類似体、誘導体、異性体、代謝産物、薬学的に許容される塩、医薬品、水和物、N酸化物又はそれらの組み合わせの投与を含んでいる。
【0020】
他の実施形態では、本発明は、骨関連疾患を予防する方法であって、患者にSARM化合物を投与するステップを含む方法を提供する。他の実施形態では、この方法は、SARM化合物の類似体、誘導体、異性体、代謝産物、薬学的に許容される塩、医薬品、水和物、N酸化物又はそれらの組み合わせの投与を含んでいる。
【0021】
ある実施形態では、骨関連疾患は骨粗鬆症である。ある実施形態では、骨関連疾患は骨減少症である。ある実施形態では、骨関連疾患は骨吸収の増加である。ある実施形態では、骨関連疾患は骨折である。ある実施形態では、骨関連疾患は骨の脆弱化である。ある実施形態では、骨関連疾患はBMDの減少である。ある実施形態では、骨関連疾患は、骨粗鬆症、骨減少症、骨吸収の増加、骨折、骨の脆弱化及びBMD減少の任意の組み合わせである。それぞれの疾患は、本発明の別個の実施形態に相当する。
【0022】
“骨粗鬆症”は、ある実施形態では、カルシウムや骨タンパク質の不足に起因する骨量の減少によって、骨が細くなる病気である。他の実施形態では、骨粗鬆症は全身性の骨疾患であり、骨量の低下及び骨組織の劣化という特徴がある。そのため、骨粗鬆症にかかると、骨は脆くなって骨折しやすくなる。ある実施形態では、骨粗鬆症にかかると、骨強度が正常でなくなるので、骨折しやすくなる。他の実施形態では、骨粗鬆症にかかると、通常は骨内に見られるカルシウム及びタンパク質コラーゲンの両方を激減させる。ある実施形態では、その結果、骨質の異常や骨密度の減少をもたらす。他の実施形態では、骨粗鬆症にかかった骨は、通常は骨折しないようなちょっとした転倒でも、骨折したり損傷したりする。骨折は、ある実施形態では、亀裂骨折(例えば股関節の)又は崩壊骨折(例えば背骨の圧迫骨折)である。骨粗鬆症によって骨折する一般的な部位は背骨、股関節及び手首である(ただし、骨折は他の骨格部位でも起こり得る)。骨粗鬆症を治療せずに放っておくと、姿勢の変化、身体の異常及び可動域の減少が生じ得る。
【0023】
ある実施形態では、骨粗鬆症は、アンドロゲンの欠乏に起因して生じる。他の実施形態では、骨粗鬆症は、アンドロゲンの欠乏をもたらす。他の実施形態では、骨粗鬆症は原発性骨粗鬆症である。他の実施形態では、骨粗鬆症は続発性骨粗鬆症である。他の実施形態では、骨粗鬆症は閉経後骨粗鬆症である。他の実施形態では、骨粗鬆症は若年性骨粗鬆症である。他の実施形態では、骨粗鬆症は特発性骨粗鬆症である。他の実施形態では、骨粗鬆症は老人性骨粗鬆症である。
【0024】
他の実施形態では、原発性骨粗鬆症はI型原発性骨粗鬆症である。他の実施形態では、原発性骨粗鬆症はII型原発性骨粗鬆症である。それぞれの骨粗鬆症は、本発明の別個の実施形態に相当する。
【0025】
骨粗鬆症及び骨減少症は、他の実施形態では、全身性の骨疾患であり、骨量の低下及び骨組織の微細構造の劣化という特徴がある。“微細構造の劣化”は、ある実施形態では、骨梁(後に定義する)が細くなり、骨内の骨梁間の結合が失われることである。他の実施形態では、“骨粗鬆症”は、BMDが若年成人の平均値を2.5SD(standard deviation:標準偏差)以上下回った状態と定義される。他の実施形態では、“骨粗鬆症”は、BMCが若年成人の平均値を2.5以上下回った状態と定義される。他の実施形態では、“骨粗鬆症”は、BMDが若年成人の平均値を2.0SD以上下回った状態と定義される。他の実施形態では、“骨粗鬆症”は、BMCが若年成人の平均値を2.0SD以上下回った状態と定義される。他の実施形態では、“骨粗鬆症”は、BMDが若年成人の平均値を3.0SD以上下回った状態と定義される。他の実施形態では、“骨粗鬆症”は、BMCが若年成人の平均値を3.0SD以上下回った状態と定義される。骨粗鬆症及び骨減少症のそれぞれの定義は、本発明の別個の実施形態に相当する。
【0026】
他の実施形態では、“骨粗鬆症”は、BMDが若年成人の平均値を2.5SD下回った状態と定義される。他の実施形態では、“骨粗鬆症”は、BMCが若年成人の平均値を2.5下回った状態と定義される。他の実施形態では、“骨粗鬆症”は、BMDが若年成人の平均値を2.0SD下回った状態と定義される。他の実施形態では、“骨粗鬆症”は、BMCが若年成人の平均値を2.0SD下回った状態と定義される。他の実施形態では、“骨粗鬆症”は、BMDが若年成人の平均値を3.0SD下回った状態と定義される。他の実施形態では、“骨粗鬆症”は、BMCが若年成人の平均値を3.0SD下回った状態と定義される。骨粗鬆症及び骨減少症のそれぞれの定義は、本発明の別個の実施形態に相当する。
【0027】
骨粗鬆症及び骨減少症の評価方法は、当該技術分野では周知である。例えば、ある実施形態では、濃度測定によって測定された患者のBMD(g/cm2)を、性別が同一の若年成人における骨量ピーク時のBMD平均値である“正常値”と比較した“Tスコア”によって評価する。他の実施形態では、患者の骨量減少を表すZスコアを、性別及び年齢が同一の人間の予測される損失と比較して評価する。他の実施形態では、“骨粗鬆症”は、Tスコアが若年成人の平均値を2.5SD以上下回った状態と定義される。他の実施形態では、“骨粗鬆症”は、Zスコアが若年成人の平均値を2.5SD以上下回った状態と定義される。他の実施形態では、“骨粗鬆症”は、Tスコアが若年成人の平均値を2.0SD以上下回った状態と定義される。他の実施形態では、“骨粗鬆症”は、Zスコアが若年成人の平均値を2.0SD以上下回った状態と定義される。他の実施形態では、“骨粗鬆症”は、Tスコアが若年成人の平均値を3.0SD以上下回った状態と定義される。他の実施形態では、“骨粗鬆症”は、Zスコアが若年成人の平均値を3.0SD以上下回った状態と定義される。
【0028】
他の実施形態では、“骨粗鬆症”は、Tスコアが若年成人の平均値を2.5SD下回った状態と定義される。他の実施形態では、“骨粗鬆症”は、Zスコアが若年成人の平均値を2.5SD下回った状態と定義される。他の実施形態では、“骨粗鬆症”は、Tスコアが若年成人の平均値を2.0SD下回った状態と定義される。他の実施形態では、“骨粗鬆症”は、Zスコアが若年成人の平均値を2.0SD下回った状態と定義される。他の実施形態では、“骨粗鬆症”は、Tスコアが若年成人の平均値を3.0SD下回った状態と定義される。他の実施形態では、“骨粗鬆症”は、Zスコアが若年成人の平均値を3.0SD下回った状態と定義される。骨粗鬆症及び骨減少症のそれぞれの定義は、本発明の別個の実施形態に相当する。
【0029】
“BMD”は、ある実施形態では、骨量の真の測定値を意味する。BMDによって測定される骨の絶対量は、一般的に、骨強度及び重量に耐える能力と関係がある。血圧の測定によって脳梗塞の危険が予測可能であるのと同様に、BMDの測定によって骨折の危険が予測可能である。
【0030】
BMDは、ある実施形態では、公知のBMDマッピング手法によって測定できる。ある実施形態では、腰、背骨、手首又は踵骨の骨密度を、様々な手法によって測定する。好ましいBMD測定手法は、二重エネルギーX線吸収測定法(dual-energy x-ray absorptiometry:DEXA)である。腰、前後方向の背骨(anteroposteriorl spine)、側方の背骨(lateral spine)及び手首のBMDは、この手法によって測定できる。その部位における全体的な骨折の予測はどの部分の測定によっても行えるが、特定部分の情報がその部位における骨折の予測に適している。背骨のBMDの測定には、定量的コンピュータ断層撮影(quantitative computerized tomography:QCT)を使用することもできる。詳しくは、例えば、「Nuclear Medicine: Quantitative Procedures(by Wahner H W,et al, Toronto little, Brown&Co., 1983, pp.107-132)(非特許文献1)、「Assessment of Bone Mineral Part 1(J Nucl Medicine 26, pp.1134-1141,1984)」(非特許文献2)、及び、「Bone mineral Denisty of The Radius(J Nucl Medicine 26, pp.13-39,1985)」(非特許文献3)を参照されたい。それぞれの手法は、本発明の別個の実施形態に相当する。
【0031】
“骨減少症”は、ある実施形態では、BMD又はBMCが若年成人の平均値を1〜2.5SD下回った状態である。他の実施形態では、骨減少症は、骨の石灰化又は骨の密度を減少させることを意味する。この用語は、ある実施形態では、そのような状態が見られる全ての骨格系を含む。本発明において開示されている判断のそれぞれの定義又は意味は、本発明の別個の実施形態に相当する。
【0032】
ある実施形態では、“骨折”は、骨の破壊を意味し、脊椎骨折及び非脊椎骨折の両方を含む。“骨の脆弱化”は、ある実施形態では、骨が弱体化し、骨折しやすくなった状態を意味する。
【0033】
ある実施形態では、本発明に係る骨粗鬆症、骨減少症、骨吸収の増加、骨折、骨の脆弱化、BMDの減少及び他の疾患・障害は、ホルモン障害、ホルモン崩壊又はホルモン失調によって生じる。他の実施形態では、これらの状態は、ホルモン障害、ホルモン崩壊又はホルモン失調とは無関係に生じる。それぞれの可能性は、本発明の別個の実施形態に相当する。
【0034】
ある実施形態では、ホルモン障害、ホルモン崩壊及びホルモン失調は、ホルモン過剰を含む。他の実施形態では、ホルモン障害、ホルモン崩壊及びホルモン失調は、ホルモン欠乏を含む。ある実施形態では、ホルモンはステロイド・ホルモンである。他の実施形態では、ホルモンはエストロゲンである。他の実施形態では、ホルモンはアンドロゲンである。他の実施形態では、ホルモンはグルココルチコイトである。他の実施形態では、ホルモンはコルチコイト・ステロイドである。他の実施形態では、ホルモンは黄体形成ホルモン(LH)である。他の実施形態では、ホルモンは卵胞刺激ホルモン(FSH)である。他の実施形態では、ホルモンは、当該技術分野では周知の任意のホルモンである。他の実施形態では、ホルモン障害、ホルモン崩壊及びホルモン失調は、更年期障害と関係がある。それぞれの可能性は、本発明の別個の実施形態に相当する。
【0035】
例えば、図1〜5に示した結果は、身体の全体及び多くの特定部位の両方において、SARMがBMDの減少を防止することを実証している。これらの実験は、人間の骨粗鬆症治療に役立つことが大いに予測されている、卵巣を切除した(OVX)ラットモデルを利用して行う(Kalu DN,Bone Miner 15:175-91,1991)。BMDの減少は、骨粗鬆症の重要な指標であり、骨強度の減少と及び骨折の発生率増加と関係がある。BMDの減少を抑制することによって、骨粗鬆症のこれらの症状(及び他の症状)は同様に防止される。図12〜13に示した結果は、SARMがBMCを増加させることを示しており、骨粗鬆症マウスにおける骨強度の他の指標は、図1〜5の結果を実証している。
【0036】
他の実施形態では、本発明は、骨強度を増加させる方法であって、患者にSARM化合物を投与するステップを含む方法を提供する。他の実施形態では、この方法は、SARM化合物の類似体、誘導体、異性体、代謝産物、薬学的に許容される塩、医薬品、水和物、N酸化物又はそれらの組み合わせの投与を含んでいる。
【0037】
他の実施形態では、本発明は、患者の質を向上させる方法であって、患者にSARM化合物を投与するステップを含む方法を提供する。他の実施形態では、この方法は、SARM化合物の類似体、誘導体、異性体、代謝産物、薬学的に許容される塩、医薬品、水和物、N酸化物又はそれらの組み合わせの投与を含んでいる。
【0038】
骨量、骨強度及び骨質の評価方法は、当該技術分野では周知である。例えば、骨強度は、ある実施形態では、生体力学的試験によって評価することができる(図10、11、24)。骨量は、ある実施形態では、DEXA(図1、2,4、14、15、17〜19、25、26)又はpQCT(図6〜9、図20〜23)によって評価することができる。骨質は、BMCを測定することによって評価することができる(図12〜13)。骨量及び骨強度を評価するための他の方法は、例えば、Faulkner KGら(Am J Roesntgenology 157:1229-1237,1991)によって開示されている。それぞれの方法は、本発明の別個の実施形態に相当する。
【0039】
本発明で使用される様々な骨量、骨強度及び骨質の測定方法では、同様の結果が得られる。異なる測定方法での結果が一致することは、本発明での実験結果の正当性を証明している。
【0040】
他の実施形態では、本発明は、患者の骨量を増加させる方法であって、患者にSARM化合物を投与するステップを含む方法を提供する。他の実施形態では、この方法は、SARM化合物の類似体、誘導体、異性体、代謝産物、薬学的に許容される塩、医薬品、水和物、N酸化物又はそれらの組み合わせの投与を含んでいる。
【0041】
他の実施形態では、本発明は、患者の骨吸収の割合を減少させる方法であって、患者にSARM化合物を投与するステップを含む方法を提供する。この方法は、SARM化合物の類似体、誘導体、異性体、代謝産物、薬学的に許容される塩、医薬品、水和物、N酸化物又はそれらの組み合わせの投与を含んでいる。
【0042】
他の実施形態では、本発明は、患者の骨吸収を防止する方法であって、患者にSARM化合物を投与するステップを含む方法を提供する。他の実施形態では、この方法は、SARM化合物の類似体、誘導体、異性体、代謝産物、薬学的に許容される塩、医薬品、水和物、N酸化物又はそれらの組み合わせの投与を含んでいる。
【0043】
骨吸収は、ある実施形態では、骨粗鬆症、更年期障害及び/又はアンドロゲン欠乏などの疾患によって、骨量及び/又は骨強度が減少するという主な作用である。骨吸収の測定方法は、当該技術分野では周知である。例えば、骨吸収は、ある実施形態では、骨吸収と相関する、血清中のオステオカルシン濃度を測定することによって評価できる(実施形態8)。他の実施形態では、骨吸収は、BMDを測定することによって評価できる(図12〜13)。他の実施形態では、骨吸収は、尿中のデオキシピリジノリンの濃度を測定することによって評価できる。ある実施形態では、骨吸収は、血中のインスリン様成長因子1(IGF−1)濃度を測定することによって評価できる。骨吸収を評価するそれぞれの方法は、本発明の別個の実施形態に相当する。
【0044】
他の実施形態では、“骨吸収”は、破骨細胞活性に起因する骨量の減少を意味する。人間の骨は、絶えず、骨吸収及び骨形成の再生活動を活発に行っている。骨吸収は、この実施形態では、破骨細胞が骨基質を破壊することによって行われる。また、骨疾患の大部分は、骨形成と骨吸収の釣り合いが崩れることによって生じる。骨粗鬆症は、再生活動中に、骨吸収に対して新骨形成が不足することによって生じる。
【0045】
ある実施形態では、本発明の治療対象は骨粗鬆症である。他の実施形態では、本発明の治療対象は骨減少症である。他の実施形態では、本発明の治療対象は骨吸収の増加である。他の実施形態では、本発明の治療対象は骨折である。他の実施形態では、本発明の治療対象は骨の脆弱化である。本発明の治療対象はBMDの減少したである。本発明の治療対象は、骨粗鬆症、骨減少症、骨吸収の増加、骨折及び骨の脆弱化の任意の組み合わせである。それぞれの疾患は、本発明の別個の実施形態に相当する。
【0046】
例えば、図1〜13に示した結果は、卵巣を切除した結果生じる骨吸収の増加、BMDの減少及び骨強度の減少は、評価される骨の場所及び種類に応じて、SARM治療によって部分的又は完全に抑制されることを示している。したがって、SARMは、例えば骨粗鬆症、更年期障害又は前述した他の疾患によって生じる、骨吸収の増加、BMDの減少及び骨強度の減少を低減させるのに有効である。
【0047】
ある実施形態では、本発明の治療対象は男性である。他の実施形態では、本発明の治療対象は高齢男性である。他の実施形態では、本発明の治療対象は、去勢された男性である。他の実施形態では、本発明の治療対象は、アンドロゲン欠乏治療を受けている男性である。他の実施形態では、本発明の治療対象は、前立腺癌の患者である。他の実施形態では、本発明の治療対象は、他の種類の癌患者(男性又は女性)である。他の実施形態では、本発明の治療対象は、化学療法を受けている患者である。他の実施形態では、本発明の治療対象は、最近になって化学療法を受けている患者である。
【0048】
他の実施形態では、治療対象は、女性である。他の実施形態では、治療対象は、高齢女性である。他の実施形態では、治療対象は、HIV陽性の閉経前女性である。他の実施形態では、治療対象は、アジソン病の女性である。他の実施形態では、治療対象は、下垂体機能低下症の女性である。他の実施形態では、治療対象は、OVXの女性である。
【0049】
他の実施形態では、本発明に係るSARM化合物が投与される患者は、高齢の男性である。“高齢(aging)”は、ある実施形態では、高齢になるまでの途中過程を意味する。他の実施形態では、高齢の患者は、40歳以上である。他の実施形態では、高齢の患者は、45歳以上である。他の実施形態では、高齢の患者は、50歳以上である。他の実施形態では、高齢の患者は、55歳以上である。他の実施形態では、高齢の患者は、60歳以上である。他の実施形態では、高齢の患者は、65歳以上である。他の実施形態では、高齢の患者は、70歳以上である。患者のそれぞれの種類は、本発明の別個の実施形態に相当する。
【0050】
他の実施形態では、本発明の治療対象は、骨粗鬆症、骨減少症、骨吸収の増加、骨折、骨の脆弱化又はBMDの減少ではない。図16〜24に示した結果は、骨粗鬆症によって生じたBMD減少と骨強度減少を、SARMによって覆す(reverse)できることを示している。つまり、SARMは、骨吸収を抑制する作用とは無関係の、同化作用を有している。したがって、SARMのBMD、骨強度及び骨質に対するプラス効果は、骨関連疾患患者だけに限定されない。SARMの長所は、BMD、骨強度及び骨質の向上が求められる任意の状況に適用可能なことである。
【0051】
したがって、他の実施形態では、本発明は、BMDの減少を覆す方法であって、患者にSARM又はその代謝物或いはそれらの誘導体を投与するステップを含む方法を提供する。他の実施形態では、本発明は、骨粗鬆症を覆す方法であって、患者にSARM又はその代謝物或いはそれらの誘導体を投与するステップを含む方法を提供する。他の実施形態では、本発明は、骨減少症を覆す方法であって、患者にSARM又はその代謝物或いはそれらの誘導体を投与するステップを含む方法を提供する。他の実施形態では、本発明は、骨の脆弱化を覆す方法であって、患者にSARM又はその代謝物或いはそれらの誘導体を投与するステップを含む方法を提供する。他の実施形態では、BMDの減少、骨粗鬆症、骨減少症又は骨の脆弱化は、更年期障害又は他のホルモン障害或いは失調によって起こり得る。それぞれの方法は、本発明の別個の実施形態に相当する。
【0052】
骨格には、例えば皮質骨や骨梁などの、様々な異なる種類の骨が存在する。皮質骨は、骨梁を取り囲み、保護的に被覆する。皮質骨は、骨膜層(骨の外皮)、皮質内層(中間層)、骨内膜層(骨髄腔に隣接した層)という3つの層から成る。皮質骨は、手足(limb)内で顕著であり、ある実施形態では骨格の強度において大きな役割を果たしている。ある実施形態では、皮質骨は、ハバース(Haversian)又は緻密骨と呼ばれる。骨梁は骨代謝に関与し、ある実施形態では、海綿骨又は網状骨として知られている。皮質骨と骨梁の割合は、身体内で骨によって異なる。
【0053】
したがって、ある実施形態では、強度又は量が増加する骨は皮質骨である。皮質骨に対してのSARMの有益な作用は、図6〜8及び20〜22に示されている。他の実施形態では、骨は骨梁である。骨梁に対してのSARMの有益な作用は、図9に示されている。他の実施形態では、骨は網状骨である。他の実施形態では、骨はハバース骨である。他の実施形態では、骨は、様々な種類の骨組織を含んでいる無傷の骨である。他の実施形態では、皮質骨の特定の層は、本発明に係る方法の作用を受け得る。ある実施形態では、前記層は骨膜層である。他の実施形態では、前記層は皮質内層である。他の実施形態では、前記層は骨内膜層である。骨のそれぞれの種類は、本発明の別個の実施形態に相当する。
【0054】
他の実施形態では、本発明は患者の脂肪量(fat mass)を減少させる方法であって、患者にSARM化合物を投与するステップを含む方法を提供する。他の実施形態では、この方法は、SARM化合物の類似体、誘導体、異性体、代謝産物、薬学的に許容される塩、医薬品、水和物、N酸化物又はそれらの組み合わせの投与を含んでいる。
【0055】
他の実施形態では、本発明は患者の脂肪量の増加を低減させる方法であって、者にSARM化合物を投与するステップを含む方法を提供する。他の実施形態では、この方法は、SARM化合物の類似体、誘導体、異性体、代謝産物、薬学的に許容される塩、医薬品、水和物、N酸化物又はそれらの組み合わせの投与を含んでいる。
【0056】
他の実施形態では、本発明は患者の筋肉量を増加させる方法であって、患者にSARM化合物を投与するステップを含む方法を提供する。他の実施形態では、この方法は、SARM化合物の類似体、誘導体、異性体、代謝産物、薬学的に許容される塩、医薬品、水和物、N酸化物又はそれらの組み合わせの投与を含んでいる。
【0057】
他の実施形態では、本発明は患者の筋肉量の減少を低減させる方法であって、患者にSARM化合物を投与するステップを含む方法を提供する。他の実施形態では、この方法は、SARM化合物の類似体、誘導体、異性体、代謝産物、薬学的に許容される塩、医薬品、水和物、N酸化物又はそれらの組み合わせの投与を含んでいる。
【0058】
他の実施形態では、本発明は、患者の除脂肪量(lean mass)を増加させる方法であって、患者にSARM化合物を投与するステップを含む方法を提供する。他の実施形態では、この方法は、SARM化合物の類似体、誘導体、異性体、代謝産物、薬学的に許容される塩、医薬品、水和物、N酸化物又はそれらの組み合わせの投与を含んでいる。
【0059】
他の実施形態では、実施例7の結果は、SARMが脂肪量の割合を減少させることを示しており、OVX動物における除脂肪量の割合を増加させることを示している。
【0060】
例えば、図7の結果は、SARMが脂肪量の割合を減少させ、OVX動物における除脂肪量の割合を増大させることを示している。除脂肪量は、いくつかの理由によって骨折の危険性に影響を及ぼす。第1に、筋肉量の増加は、BMDの増加に間接的に関与する。第2に、筋肉量の増加は、筋肉のバランスと強度を向上させ、高齢者の骨折の主な原因である転倒の危険性を減少させる。したがって、他の実施形態では、本発明は、筋肉量を増加させることによって、骨折の危険性を減少させる方法を提供する。他の実施形態では、本発明は、脂肪量を減少させることによって、骨折の危険性を減少させる方法を提供する。これらの結果は、図25に示した体重の実験結果と共に、除脂肪量の減少が覆されることを示している。したがって、脂肪量、筋肉量及び除脂肪量に対してのSARMのプラス効果は骨関連疾患の患者に限定されるものではなく、脂肪量を減少させたい状況並びに筋肉量及び除脂肪量を増加させたい状況にも当て嵌まる。
【0061】
“脂肪量(FM)”は、ある実施形態では、患者の全脂肪の合計量を意味する。他の実施形態では、脂肪量は、患者の体脂肪の割合を意味する。他の実施形態では、脂肪量は、身体の特定の部位における脂肪の総計又は脂肪の割合を意味する。他の実施形態では、脂肪量は、特定種類の脂肪の総計又は割合を意味する。脂肪量のそれぞれの種類は、本発明の別個の実施形態に相当する。
【0062】
ある実施形態では、本発明の作用を受ける脂肪は、皮下脂肪である。他の実施形態では、本発明の作用を受ける脂肪は、体幹脂肪である。他の実施形態では、本発明の作用を受ける脂肪は、腹内脂肪である。他の実施形態では、本発明の作用を受ける脂肪は、当該技術分野では周知の他の脂肪である。脂肪のそれぞれの種類は、本発明の別個の実施形態に相当する。
【0063】
ある実施形態では、脂肪量の減少、並びに、除脂肪量及び/又は筋肉量の増加は、グルコース代謝作用の低下に対してプラスの効果を与える。他の実施形態では、脂肪量の減少、並びに、除脂肪量及び/又は筋肉量の増加は、糖尿病に対してプラスの効果を与える。他の実施形態では、脂肪量の減少、並びに、除脂肪量及び/又は筋肉量の増加は、高血圧に対してプラスの効果を与える。他の実施形態では、脂肪量の減少、並びに、除脂肪量及び/又は筋肉量の増加は、冠状動脈性心臓病に対してプラスの効果を与える。他の実施形態では、脂肪量の減少、並びに、除脂肪量及び/又は筋肉量の増加は、肥満に対してプラスの効果を与える。他の実施形態では、脂肪量の減少、並びに、除脂肪量及び/又は筋肉量の増加は、グルコース代謝作用の低下、糖尿病、高血圧、冠状動脈性心臓病又は肥満に関連する疾病或いは疾患に対してプラスの効果を与える。したがって、他の実施形態では、本発明は、グルコース代謝作用の低下、糖尿病、高血圧、冠状動脈性心臓病、肥満又はそれらに関連する疾病或いは疾患を治療又は改善する方法であって、患者にSARM化合物又はその代謝物或いはそれらの誘導体を投与するステップを含む方法を提供する。
【0064】
《選択的アンドロゲン受容体調節剤(SARM)》
本発明に係るSARM化合物は、ある実施形態では、アンドロゲン又は抗アンドロゲン活性及びタンパク同化作用を有する、新しい種類のAR標的物質である。他の実施形態では、本発明に係るSARM化合物は、アンドロゲン受容体(androgen receptor:AR)に対する新しい種類の非ステロイド性リガンドである。
【0065】
他の実施形態では、本発明に係るSARM化合物は、その生物活性に応じてサブグループに分類される。例えば、いくつかのSARM化合物は、筋肉又は骨に対してのアゴニスト作用を有するが、他のSARM化合物は、筋肉又は骨に対してのアゴニスト作用を有さない。
【0066】
ARは、その内因性アンドロゲン(男性ホルモン)との活性を介して男性の性的発育及び機能の誘発を仲立ちする、リガンドが活性化された転写調節タンパク質である。アンドロゲン(例えばDHTやテストステロン)は、体内の睾丸及び副腎皮質から分泌されるステロイドである。したがって、ある実施形態では、このSARMは、非ステロイドなので、従来知られているARリガンドとは異なるARリガンドである。
【0067】
受容体アゴニストは、ある実施形態では、受容体と結合して、その受容体を活性化させる物質である。受容体部分アゴニストは、ある実施形態では、受容体と結合して、その受容体を部分的に活性化させる物質である。受容体アンタゴニストは、ある実施形態では、受容体と結合して、その受容体を不活性にする物質である。ある実施形態では、本発明に係るSARM化合物は組織選択性を有し、組織に応じて、ある物質は、アゴニスト、部分的アゴニスト及び/又はアンタゴニストである。例えば、SARM化合物は、筋肉組織を刺激すると同時に、前立腺組織を抑制する。ある実施形態では、本発明に係るSARM化合物はARアゴニストである。他の実施形態では、本発明に係るSARM化合物はARアンタゴニストである。本発明に係る化合物がARアゴニストであるかアンタゴニストであるかを判断するための分析方法は、当該技術分野では周知である。例えば、ARアゴニスト活性は、重量測定によって計測したSARM化合物における、AR含有組織(例えば前立腺や精嚢)の成長を維持及び/又は刺激する能力をモニタリングすることで判断できる。ARアンタゴニスト活性は、SARM化合物における、AR含有組織の成長を阻害する能力をモニタリングすることで判断できる。
【0068】
他の実施形態では、本発明に係るSARM化合物は、ARの部分的アゴニスト又はアンタゴニストとして分類することもできる。SARMはある組織内ではARアゴニストであり、AR反応遺伝子の転写を増加させる(例えば筋肉同化効果)。他の組織内では、これらの化合物は、天然アンドロゲンのアゴニスト作用を予防するために、ARにおいてテストステロン及び/又はジヒドロテストステロン(dihydrotestosterone:DHT)の拮抗阻害剤して作用する。SARMのそれぞれの種類は、本発明の別個の実施形態に相当する。
【0069】
ある実施形態では、本発明に係るSARM化合物は、ARと可逆的又は不可逆的に結合する。他の実施形態では、SARM化合物は、ARと可逆的に結合する。ある実施形態では、SARM化合物は、ARと不可逆的に結合する。本発明に係るSARM化合物は、AR(すなわち共有結合構造)のアルキル化が可能な官能基(親和性標識)を有している。この場合、SARM化合物は、受容体と不可逆的に結合するので、内在性リガンドDHTやテストステロンなどのステロイドによって置換されない。
【0070】
本発明のある実施形態では、SARM化合物が患者に投与される。他の実施形態では、SARM化合物の類似体が患者に投与される。他の実施形態では、SARM化合物の誘導体が患者に投与される。他の実施形態では、SARM化合物の異性体が患者に投与される。他の実施形態では、SARM化合物の代謝産物が患者に投与される。他の実施形態では、SARM化合物の薬学的に許容される塩が患者に投与される。他の実施形態では、SARM化合物の医薬品が患者に投与される。他の実施形態では、SARM化合物の水和物が患者に投与される。他の実施形態では、SARM化合物のN酸化物が患者に投与される。他の実施形態では、本発明に係る方法では、SARM化合物の類似体、異性体、代謝産物、誘導体、薬学的に許容される塩、医薬品、水和物又はN酸化物の任意の組み合わせが患者に投与される。
【0071】
“異性体”という用語は、ある実施形態では、光学異性体を意味する。他の実施形態では、“異性体”は、類似体を意味する。他の実施形態では、“異性体”は、構造異性体を意味する。他の実施形態では、“異性体”は、構造的類似体を意味する。他の実施形態では、“異性体”は、配座異性体を意味する。他の実施形態では、“異性体”は、当該技術分野では周知である他の種類の異性体を意味する。異性体のそれぞれの種類は、本発明の別個の実施形態に相当する。
【0072】
他の実施形態では、本発明は、SARM化合物の様々な光学異性体の使用を含んでいる。本発明に係るSARMが少なくとも1つのキラル中心を有していることは、当業者なら容易に理解できるであろう。したがって、本発明に係る方法で使用されるSARMは、光学的活性体又はラセミ体内で単離した状態で存在している。ある化合物は、多形性を示す。当然のことながら、本発明は、前述したアンドロゲンに関連する病気の治療に役立つ形状である、任意のラセミ体、光学活性体、多形性、立体異性形状又はそれらの混合物を含む。ある実施形態では、SARMは、純粋な(R)異性体である。他の実施形態では、SARMは、純粋な(S)異性体である。他の実施形態では、SARMは、(R)異性体と(S)異性体との混合物である。他の実施形態では、SARMは、(R)異性体と(S)異性体とを同量含むラセミ混合物である。当該技術分野では、光学活性体を作成する方法は周知である(例えば、再結晶法によるラセミ体の分解によって、光学体活体開始物質の合成によって、キラル合成によって、又は、キラル固定相を使用したクロマトグラフ分離によって作成する)。
【0073】
本発明は、他の実施形態では、例えばクエン酸や塩酸のような、有機酸又は無機酸を有するアミノ置換化合物の“薬学的に許容される塩”を含む。また、本発明は、前述した化合物のアミノ置換基のN酸化物を含む。薬学的に許容される塩は、例えば水酸化ナトリウムのような無機塩基を処理することによって、フェノール化合物から生成することもできる。また、フェノール化合物のエステルは、脂肪族及び芳香族カルボン酸(例えば酢酸エステルと安息香酸エステル)から生成することもできる。
【0074】
本発明は、SARM化合物の誘導体をさらに含む。“誘導体”という用語は、エーテル誘導体、酸誘導体、アミノ誘導体、エステル誘導体などを含む(ただし、これらに限定されるものではない)。さらに、本発明は、SARM化合物の水和物を含む。“水和物”という用語は、半水和物、一水和物、二水和物、三水和物などを含む(ただし、これらに限定されるものではない)。
【0075】
本発明は、SARM化合物の代謝産物をさらに含む。“代謝産物”という用語は、ある実施形態では、別の物質から代謝作用又は代謝過程によって生成された物質を意味する。
【0076】
本発明は、ある実施形態では、SARM化合物の医薬品をさらに含む。“医薬品”という用語は、ここで定義するように、ある実施形態では、医薬品としての使用に適した組成物(医薬組成物)を意味する。
【0077】
ある実施形態では、本発明のSARM化合物は、次の化学構造式Iで表される化合物である。

【0078】
他の実施形態では、本発明のSARM化合物は、次の化学構造式IIで表される化合物である。

ただし、Xは、結合部、O、CH2、NH、Se、PR、NO又はNRであり、
Zは、NO2、CN、COOH、COR、NHCOR又はCONHRであり、
Yは、CF3、F、I、Br、Cl、CN、CR3又はSnR3であり、
Qは、アルキル、F、I、Br、Cl、CF3、CN、CR3、SnR3、NR2、NHCOCH3、NHCOCF3、NHCOR、NHCONHR、NHCOOR、OCONHR、CONHR、NHCSCH3、NHCSCF3、NHCSR、NHSO2CH3、NHSO2R、OR、COR、OCOR、OSO2R、SO2R、SR、CSN、NCS、OCN又はNCOである。或いは、Qは、次の構造式A、B又はCで表される縮合環システムのベンゼン環と結合するようなものからなり、

Rは、アルキル、ハロアルキル、ジハロアルキル、トリハロアルキル、CH2F、CHF2、CF3、CF2CF3、アリル、フェニル、F、I、Br、Cl又はOHである。
【0079】
ある実施形態では、SARM化合物は、XがOである化学構造式IIの化合物である。他の実施形態では、SARM化合物は、ZがNO2である化学構造式IIの化合物である。他の実施形態では、SARM化合物は、ZがCNである化学構造式IIの化合物である。他の実施形態では、SARM化合物は、YがCF3である化学構造式IIの化合物である。他の実施形態では、SARM化合物は、QがNHCOCH3である化学構造式IIの化合物である。他の実施形態では、SARM化合物は、QがFである化学構造式IIの化合物である。
【0080】
ある実施形態では、化合物(I)又は(II)の置換基Rはアルキル基である。他の実施形態では、置換基Rはハロアルキル基である。他の実施形態では、置換基Rはジハロアルキル基である。他の実施形態では、置換基Rはトリハロアルキル基である。他の実施形態では、置換基RはCH2F基である。他の実施形態では、置換基RはCHF2基である。他の実施形態では、置換基RはCF3基である。他の実施形態では、置換基RはCF2CF3基である。他の実施形態では、置換基Rはアリル基である。他の実施形態では、置換基Rはフェニル基である。他の実施形態では、置換基RはFである。他の実施形態では、置換基RはIである。他の実施形態では、置換基RはBrである。他の実施形態では、置換基RはClである。他の実施形態では、置換基Rはアルケニル基である。他の実施形態では、置換基RはOH基である。各置換基は本発明の異なる実施形態を表す。
【0081】
他の実施形態では、本発明のSARM化合物は、次の化学構造式IIIで表される化合物である。

ただし、Xは、結合部、O、CH2、NH、Se、PR、NO又はNRであり、
Gは、O又はSであり、
R1は、CH3、CH2F、CHF2、CF3、CH2CH3又はCF2CF3であり、
Tは、OH、OR、−NHCOCH3又はNHCORであり、
Rは、アルキル、ハロアルキル、ジハロアルキル、トリハロアルキル、CH2F、CHF2、CF3、CF2CF3、アリル、フェニル、F、I、Br、Cl、アルケニル又はOHであり、
Aは、

から選択される環であり、
Bは、

から選択される環である。
ただし、A及びBは同時にはベンゼン環であり得ず、
Zは、NO2、CN、COOH、COR、NHCOR又はCONHRであり、
Yは、CF3、F、I、Br、Cl、CN、CR3又はSnR3であり、
Q1及びQ2は、互いに独立して、水素、アルキル、F、I、Br、Cl、CF3、CN、CR3、SnR3、NR2、NHCOCH3、NHCOCF3、NHCOR、NHCONHR、NHCOOR、OCONHR、CONHR、NHCSCH3、NHCSCF3、NHCSR、NHSO2CH3、NHSO2R、OR、COR、OCOR、OSO2R、SO2R、SR、SCN、NCS、OCN、NCO又は

であり、
また、Q3及びQ4は、互いに独立して、水素、アルキル、F、I、Br、Cl、CF3、CN、CR3、SnR3、NR2、NHCOCH3、NHCOCF3、NHCOR、NHCONHR、NHCOOR、OCONHR、CONHR、NHCSCH3、NHCSCF3、NHCSR、NHSO2CH3、NHSO2R、OR、COR、OCOR、OSO2R、SO2R、SR、SCN、NCS、OCN又はNCOであり、
W1は、O、NH、NR、NO又はSであり、
W2は、N又はNOである。
【0082】
ある実施形態では、SARM化合物は、XがOである化学構造式IIIの化合物である。他の実施形態では、SARM化合物は、GがOである化学構造式IIIの化合物である。他の実施形態では、SARM化合物は、TがOHである化学構造式IIIの化合物である。他の実施形態では、SARM化合物は、R1がCH3である化学構造式IIIの化合物である。他の実施形態では、SARM化合物は、ZがNO2である化学構造式IIIの化合物である。他の実施形態では、SARM化合物は、ZがCNである化学構造式IIIの化合物である。他の実施形態では、SARM化合物は、YがCF3である化学構造式IIIの化合物である。他の実施形態では、SARM化合物は、Q1がNHCOCH3である化学構造式IIIの化合物である。他の実施形態では、SARM化合物は、Q1がFである化学構造式IIIの化合物である。
【0083】
置換基Z及びYは、ある実施形態では、それらの置換基を有する環(以下、「環A」という)の任意の場所に位置することができる。ある実施形態では、置換基Zは、環Aのパラ位置にある。他の実施形態では、置換基Yは、環Aのメタ位置にある。他の実施形態では、置換基Zは環Aのパラ位置にあり、置換基Yは環Aのメタ位置にある。
【0084】
置換基Q1及びQ2は、ある実施形態では、それらの置換基を有する環(以下、「環B」という)の任意の場所に位置することができる。ある実施形態では、置換基Q1は、環Bのパラ位置にある。他の実施形態では、置換基Q2はHである。他の実施形態では、置換基Q1は、環Bのパラ位置にあり、置換基Q2はHである。他の実施形態では、置換基Q1は、NHCOCH3であり、環Bのパラ位置にあり、置換基Q2はHである。
【0085】
上記各変形例の各置換基は、それぞれ本発明の異なる実施形態を表す。さらに、上記各置換基の列挙された各位置は、それぞれ本発明の異なる実施形態を表す。
【0086】
他の実施形態では、本発明のSARM化合物は、次の化学構造式IVで表される化合物である。

ただし、Xは、結合部、O、CH2、NH、Se、PR、NO又はNRであり、
Gは、O又はSであり、
Tは、OH、OR、−NHCOCH3又はNHCORであり、
Rは、アルキル、ハロアルキル、ジハロアルキル、トリハロアルキル、CH2F、CHF2、CF3、CF2CF3、アリル、フェニル、F、I、Br、Cl、アルケニル又はOHであり、
R1は、CH3、CH2F、CHF2、CF3、CH2CH3又はCF2CF3であり、
R2は、F、Cl、Br、I、CH3、CF3、OH、CN、NO2、NHCOCH3、NHCOCF3、NHCOR、アルキル、アリールアルキル、OR、NH2、NHR、NR2、SR、SCN、NCS、OCN又はNCOであり、
R3は、F、Cl、Br、I、CN、NO2、COR、COOH、CONHR、CF3、又はSnR3である。或いは、R3は、次の構造式で表される縮合環システムのベンゼン環と結合するようなものからなる。

ただし、Zは、NO2、CN、COR、COOH又はCONHRであり、
Yは、CF3、F、Br、Cl、I、CN又はSnR3であり、
Qは、H、アルキル、F、I、Br、Cl、CF3、CN、CR3、SnR3、NR2、NHCOCH3、NHCOCF3、NHCOR、NHCONHR、NHCOOR、OCONHR、CONHR、NHCSCH3、NHCSCF3、NHCSR、NHSO2CH3、NHSO2R、OH、OR、COR、OCOR、OSO2R、SO2R又はSRである。或いは、Qは、次の構造式A、B又はCで表される縮合環システムのベンゼン環と結合するようなものからなり、

nは、1〜4の整数であり、
mは、1〜3の整数である。
【0087】
ある実施形態では、SARM化合物は、XがOである化学構造式IVの化合物である。他の実施形態では、SARM化合物は、GがOである化学構造式IVの化合物である。他の実施形態では、SARM化合物は、ZがNO2である化学構造式IVの化合物である。他の実施形態では、SARM化合物は、ZがCNである化学構造式IVの化合物である。他の実施形態では、SARM化合物は、YがCF3である化学構造式IVの化合物である。他の実施形態では、SARM化合物は、QがNHCOCH3である化学構造式IVの化合物である。他の実施形態では、SARM化合物は、QがFである化学構造式IVの化合物である。他の実施形態では、SARM化合物は、TがOHである化学構造式IVの化合物である。他の実施形態では、SARM化合物は、R1がCH3である化学構造式IVの化合物である。他の実施形態では、SARM化合物は、QがFであり、R2がCH3である化学構造式IVの化合物である。他の実施形態では、SARM化合物は、QがFであり、R2がClである化学構造式IVの化合物である。
【0088】
置換基Z、Y及びR3は、ある実施形態では、それらの置換基を有する環(以下、「環A」という)の任意の場所に位置することができる。ある実施形態では、置換基Zは、環Aのパラ位置にある。他の実施形態では、置換基Yは、環Aのメタ位置にある。他の実施形態では、置換基Zは環Aのパラ位置にあり、置換基Yは環Aのメタ位置にある。
【0089】
置換基Q及びR2は、ある実施形態では、それらの置換基を有する環(以下、「環B」という)の任意の場所に位置することができる。ある実施形態では、置換基Qは、環Bのパラ位置にある。他の実施形態では、置換基Qは環Bのパラ位置にある。他の実施形態では、置換基Qは、NHCOCH3であり、環Bのパラ位置にある。
【0090】
ある実施形態では、整数m及びnが1より大きいときに、置換基R2及びR3は1つの特定の置換基に限定されず、前記した置換基の任意の組み合わせであってよい。
【0091】
上記各変形例の各置換基は、それぞれ本発明の異なる実施形態を表す。さらに、上記各置換基の列挙された各位置は、それぞれ本発明の異なる実施形態を表す。さらに、上記各整数の列挙された各数字は、それぞれ本発明の異なる実施形態を表す。
【0092】
他の実施形態では、本発明のSARM化合物は、次の化学構造式Vで表される化合物である。

ただし、R2は、F、Cl、Br、I、CH3、CF3、OH、CN、NO2、NHCOCH3、NHCOCF3、NHCOR、アルキル、アリールアルキル、OR、NH2、NHR、NR2又はSRであり、
R3は、F、Cl、Br、I、CN、NO2、COR、COOH、CONHR、CF3又はSnR3である。或いは、R3は、次の構造式で表される縮合環システムのベンゼン環と結合するようなものからなる。

ただし、Rは、アルキル、ハロアルキル、ジハロアルキル、トリハロアルキル、CH2F、CHF2、CF3、CF2CF3、アリル、フェニル、F、Cl、Br、I、アルケニル又はOHであり、
Zは、NO2、CN、COR、COOH又はCONHRであり、
Yは、CF3、F、Br、Cl、I、CN又はSnR3であり、
Qは、H、アルキル、F、Cl、Br、I、CF3、CN、CR3、SnR3、NR2、NHCOCH3、NHCOCF3、NHCOR、NHCONHR、NHCOOR、OCONHR、CONHR、NHCSCH3、NHCSCF3、NHCSR、NHSO2CH3、NHSO2R、OH、OR、COR、OCOR、OSO2R、SO2R又はSRである。或いは、Qは、次の構造式A、B又はCで表される縮合環システムのベンゼン環と結合するようなものからなり、

nは、1〜4の整数であり、
mは、1〜3の整数である。
【0093】
ある実施形態では、SARMは、ZがNO2である化学構造式Vの化合物である。他の実施形態では、SARMは、ZがCNである化学構造式Vの化合物である。他の実施形態では、SARMは、YがCF3である化学構造式Vの化合物である。他の実施形態では、SARMは、QがNHCOCH3である化学構造式Vの化合物である。他の実施形態では、SARMは、QがFである化学構造式Vの化合物である。他の実施形態では、SARMは、QがFであり、R2がCH3である化学構造式Vの化合物である。他の実施形態では、SARMは、QがFであり、R2がClである化学構造式Vの化合物である。
【0094】
化合物IVにおいて前述したように、置換基Z、Y及びR3は、ある実施形態では、環Aの任意の場所に位置することができ、置換基Q及びR2は、ある実施形態では、環Bの任意の場所に位置することができる。さらに、前述したように、整数m及びnが1より大きい場合、置換基R2及びR3は1つの特定の置換基に限定されず、前記した置換基の任意の組み合わせであってよい。
【0095】
上記各変形例の各置換基は、それぞれ本発明の異なる実施形態を表す。さらに、上記各置換基の列挙された各位置は、それぞれ本発明の異なる実施形態を表す。さらに、上記各整数の列挙された各数字は、それぞれ本発明の異なる実施形態を表す。
【0096】
他の実施形態では、本発明のSARM化合物は、次の化学構造式VIで表される化合物である。

【0097】
本発明の結果は、化合物VIは上述のように骨、脂肪、筋肉組織に有効であることを示す。加えて、化合物VIの薬物速度論的特性は、本発明に開示された症状の薬品治療として使用することに適っている。本発明は、化合物VIがテストステロンに比べて代謝クリアランスを減少させ、経口バイオアベイラビリティを増大させることを示している。最高血漿濃度に速く達するだけでなく、これらの特性は、最大の薬理効果を誘発する投与量における化合物VIに観察される(実施例15)。
【0098】
他の実施形態では、本発明のSARM化合物は、次の化学構造式VIIで表される化合物である。

【0099】
他の実施形態では、本発明のSARM化合物は、次の化学構造式VIIIで表される化合物である。

【0100】
他の実施形態では、本発明のSARM化合物は、次の化学構造式IXで表される化合物である。

【0101】
他の実施形態では、本発明のSARM化合物は、次の化学構造式Xで表される化合物である。

【0102】
他の実施形態では、本発明のSARM化合物は、次の化学構造式XIで表される化合物である。

【0103】
他の実施形態では、本発明のSARM化合物は、次の化学構造式XIIで表される化合物である。

【0104】
ある実施形態では、pは2である。他の実施形態では、pは3である。他の実施形態では、pは4である。他の実施形態では、pは5である。残りの置換基は上記化学構造式IVで定義された通りである。
【0105】
他の実施形態では、本発明のSARM化合物は、次の化学構造式XIIIで表される化合物である。

【0106】
他の実施形態では、本発明のSARM化合物は、次の化学構造式XIVで表される化合物である。

【0107】
他の実施形態では、本発明のSARM化合物は、次の化学構造式XVで表される化合物である。

【0108】
他の実施形態では、pは1である。ある実施形態では、pは2である。他の実施形態では、pは3である。他の実施形態では、pは4である。残りの置換基は上記化学構造式Vで定義された通りである。
【0109】
他の実施形態では、本発明のSARM化合物は、次の化学構造式XVIで表される化合物である。

【0110】
他の実施形態では、本発明のSARM化合物は、次の化学構造式XVIIで表される化合物である。

【0111】
ある実施形態では、SARMは、Qがアセトアミド(NHCOCH3)である化学構造式XVIIの化合物である。他の実施形態では、SARMは、Qがトリフルオロアセトアミド(NHCOCF3)である化学構造式XVIIの化合物である。
【0112】
他の実施形態では、SARMは、ZがNO2である化学構造式XVIIの化合物である。他の実施形態では、SARMは、ZがCNである化学構造式XVIIの化合物である。他の実施形態では、SARMは、ZがCORである化学構造式XVIIの化合物である。他の実施形態では、SARMは、ZがCONHRである化学構造式XVIIの化合物である。
【0113】
他の実施形態では、SARMは、YがCF3である化学構造式XVIIの化合物である。他の実施形態では、SARMは、YがIである化学構造式XVIIの化合物である。他の実施形態では、SARMは、YがBrである化学構造式XVIIの化合物である。他の実施形態では、SARMは、YがClである化学構造式XVIIの化合物である。他の実施形態では、SARMは、YがSnR3である化学構造式XVIIの化合物である。
【0114】
ある実施形態では、SARMは、Rがアルキル基である化学構造式XVIIの化合物である。他の実施形態では、SARMは、RがOHである化学構造式XVIIの化合物である。
【0115】
上記各変形例の各置換基は、それぞれ本発明の異なる実施形態を表す。さらに、上記各置換基の列挙された各位置は、それぞれ本発明の異なる実施形態を表す。
【0116】
他の実施形態では、本発明のSARM化合物は、次の化学構造式XVIIIで表される化合物である。

ただし、Xは、O、CH2、NH、Se、PR、NO又はNRであり、
Tは、OH、OR、−NHCOCH3又はNHCORであり、
Zは、NO2、CN、COOH、COR、NHCOR又はCONHRであり、
Yは、CF3、F、I、Br、Cl、CN、CR3又はSnR3であり、
Qは、アルキル、F、I、Br、Cl、CF3、CN、CR3、SnR3、NR2、NHCOCH3、NHCOCF3、NHCOR、NHCONHR、NHCOOR、OCONHR、CONHR、NHCSCH3、NHCSCF3、NHCSR、NHSO2CH3、NHSO2R、OR、COR、OCOR、OSO2R、SO2R又はSRである。或いは、Qは、次の構造式A、B又はCで表される縮合環システムのベンゼン環と結合するようなものからなる。

ただし、Rは、アルキル、ハロアルキル、ジハロアルキル、トリハロアルキル、CH2F、CHF2、CF3、CF2CF3、アリル、フェニル、F、Cl、Br、I、アルケニル又はOHであり、
R1は、CH3、CH2F、CHF2、CF3、CH2CH3又はCF2CF3である。
【0117】
上記各変形例の各置換基は、それぞれ本発明の異なる実施形態を表す。さらに、上記各置換基の列挙された各位置は、それぞれ本発明の異なる実施形態を表す。
【0118】
ある実施形態では、SARM化合物は、XがOである上記化学構造式の内の1つの化合物である。他の実施形態では、SARM化合物は、Xが結合部である上記化学構造式の内の1つの化合物である。他の実施形態では、SARM化合物は、XがCH2である上記化学構造式の内の1つの化合物である。他の実施形態では、SARM化合物は、XがNHである上記化学構造式の内の1つの化合物である。他の実施形態では、SARM化合物は、XがSeである上記化学構造式の内の1つの化合物である。他の実施形態では、SARM化合物は、XがPRである上記化学構造式の内の1つの化合物である。他の実施形態では、SARM化合物は、XがNOである上記化学構造式の内の1つの化合物である。他の実施形態では、SARM化合物は、XがNRである上記化学構造式の内の1つの化合物である。
【0119】
ある実施形態では、SARM化合物は、GがOである上記化学構造式の内の1つの化合物である。他の実施形態では、SARM化合物は、GがSである上記化学構造式の内の1つの化合物である。
【0120】
ある実施形態では、SARM化合物は、TがOHである上記化学構造式の内の1つの化合物である。他の実施形態では、SARM化合物は、TがORである上記化学構造式の内の1つの化合物である。他の実施形態では、SARM化合物は、Tが−NHCOCH3である上記化学構造式の内の1つの化合物である。他の実施形態では、SARM化合物は、TがNHCORである上記化学構造式の内の1つの化合物である。
【0121】
ある実施形態では、SARM化合物は、ZがNO2である上記化学構造式の内の1つの化合物である。他の実施形態では、SARMは、ZがCNである上記化学構造式の内の1つの化合物である。他の実施形態では、SARMは、ZがCOOHである上記化学構造式の内の1つの化合物である。他の実施形態では、SARMは、ZがCORである上記化学構造式の内の1つの化合物である。他の実施形態では、SARMは、ZがNHCORである上記化学構造式の内の1つの化合物である。他の実施形態では、SARMは、ZがCONHRである上記化学構造式の内の1つの化合物である。
【0122】
他の実施形態では、SARM化合物は、YがCF3である上記化学構造式の内の1つの化合物である。他の実施形態では、SARM化合物は、YがFである上記化学構造式の内の1つの化合物である。他の実施形態では、SARM化合物は、YがIである上記化学構造式の内の1つの化合物である。他の実施形態では、SARM化合物は、YがBrである上記化学構造式の内の1つの化合物である。他の実施形態では、SARM化合物は、YがClである上記化学構造式の内の1つの化合物である。他の実施形態では、SARM化合物は、YがCNである上記化学構造式の内の1つの化合物である。他の実施形態では、SARM化合物は、YがCR3である上記化学構造式の内の1つの化合物である。他の実施形態では、SARM化合物は、YがSnR3である上記化学構造式の内の1つの化合物である。
【0123】
他の実施形態では、SARM化合物は、QがNHCOCH3である上記化学構造式の内の1つの化合物である。他の実施形態では、SARM化合物は、QがFである上記化学構造式の内の1つの化合物である。他の実施形態では、SARM化合物は、Qがアルキルである上記化学構造式の内の1つの化合物である。他の実施形態では、SARM化合物は、QがIである上記化学構造式の内の1つの化合物である。他の実施形態では、SARM化合物は、QがBrである上記化学構造式の内の1つの化合物である。他の実施形態では、SARM化合物は、QがClである上記化学構造式の内の1つの化合物である。他の実施形態では、SARM化合物は、QがCF3である上記化学構造式の内の1つの化合物である。他の実施形態では、SARM化合物は、QがCNである上記化学構造式の内の1つの化合物である。他の実施形態では、SARM化合物は、QがCR3である上記化学構造式の内の1つの化合物である。他の実施形態では、SARM化合物は、QがSnR3である上記化学構造式の内の1つの化合物である。他の実施形態では、SARM化合物は、QがNR2である上記化学構造式の内の1つの化合物である。他の実施形態では、SARM化合物は、QがNHCOCF3である上記化学構造式の内の1つの化合物である。他の実施形態では、SARM化合物は、QがNHCORである上記化学構造式の内の1つの化合物である。他の実施形態では、SARM化合物は、QがNHCONHRである上記化学構造式の内の1つの化合物である。他の実施形態では、SARM化合物は、QがNHCOORである上記化学構造式の内の1つの化合物である。他の実施形態では、SARM化合物は、QがOCONHRである上記化学構造式の内の1つの化合物である。他の実施形態では、SARM化合物は、QがCONHRである上記化学構造式の内の1つの化合物である。他の実施形態では、SARM化合物は、QがNHCSCH3である上記化学構造式の内の1つの化合物である。他の実施形態では、SARM化合物は、QがNHCSCF3である上記化学構造式の内の1つの化合物である。他の実施形態では、SARM化合物は、QがNHCSRである上記化学構造式の内の1つの化合物である。他の実施形態では、SARM化合物は、QがNHSO2CH3である上記化学構造式の内の1つの化合物である。他の実施形態では、SARM化合物は、QがNHSO2Rである上記化学構造式の内の1つの化合物である。他の実施形態では、SARM化合物は、QがORである上記化学構造式の内の1つの化合物である。他の実施形態では、SARM化合物は、QがCORである上記化学構造式の内の1つの化合物である。他の実施形態では、SARM化合物は、QがOCORである上記化学構造式の内の1つの化合物である。他の実施形態では、SARM化合物は、QがOSO2Rである上記化学構造式の内の1つの化合物である。他の実施形態では、SARM化合物は、QがSO2Rである上記化学構造式の内の1つの化合物である。他の実施形態では、SARM化合物は、QがSRである上記化学構造式の内の1つの化合物である。他の実施形態では、SARM化合物は、QがCSNである上記化学構造式の内の1つの化合物である。他の実施形態では、SARM化合物は、QがNCSである上記化学構造式の内の1つの化合物である。他の実施形態では、SARM化合物は、QがOCNである上記化学構造式の内の1つの化合物である。他の実施形態では、SARM化合物は、QがNCOである上記化学構造式の内の1つの化合物である。
【0124】
他の実施形態では、SARM化合物は、Qが次の構造式A、B又はCで表される縮合環システムのベンゼン環と結合するようなものからなる上記化学構造式の内の1つの化合物である。

【0125】
他の実施形態では、SARM化合物は、Rがアルキルである上記化学構造式の内の1つの化合物である。他の実施形態では、SARM化合物は、Rがハロアルキルである上記化学構造式の内の1つの化合物である。他の実施形態では、SARM化合物は、Rがジハロアルキルである上記化学構造式の内の1つの化合物である。他の実施形態では、SARM化合物は、Rがトリハロアルキルである上記化学構造式の内の1つの化合物である。他の実施形態では、SARM化合物は、RがCH2Fである上記化学構造式の内の1つの化合物である。他の実施形態では、SARM化合物は、RがCHF2である上記化学構造式の内の1つの化合物である。他の実施形態では、SARM化合物は、RがCF3である上記化学構造式の内の1つの化合物である。他の実施形態では、SARM化合物は、RがCF2CF3である上記化学構造式の内の1つの化合物である。他の実施形態では、SARM化合物は、Rがアリルである上記化学構造式の内の1つの化合物である。他の実施形態では、SARM化合物は、Rがフェニルである上記化学構造式の内の1つの化合物である。他の実施形態では、SARM化合物は、RがFである上記化学構造式の内の1つの化合物である。他の実施形態では、SARM化合物は、RがIである上記化学構造式の内の1つの化合物である。他の実施形態では、SARM化合物は、RがBrである上記化学構造式の内の1つの化合物である。他の実施形態では、SARM化合物は、RがClである上記化学構造式の内の1つの化合物である。他の実施形態では、SARM化合物は、Rがアルケニルである上記化学構造式の内の1つの化合物である。他の実施形態では、SARM化合物は、RがOHである上記化学構造式の内の1つの化合物である。
【0126】
他の実施形態では、SARM化合物は、R1がCH3である上記化学構造式の内の1つの化合物である。他の実施形態では、SARM化合物は、R1がCH2Fである上記化学構造式の内の1つの化合物である。他の実施形態では、SARM化合物は、R1がCHF2である上記化学構造式の内の1つの化合物である。他の実施形態では、SARM化合物は、R1がCF3である上記化学構造式の内の1つの化合物である。他の実施形態では、SARM化合物は、R1がCH2CH3である上記化学構造式の内の1つの化合物である。他の実施形態では、SARM化合物は、R1がCF2CF3である上記化学構造式の内の1つの化合物である。
【0127】
上記各化学構造式のX,Y,Z,G,T,Q,R及びR1の各置換基は、それぞれ本発明の異なる実施形態を表す。さらに、上記各置換基の列挙された各位置は、それぞれ本発明の異なる実施形態を表す。さらに、上記各整数の列挙された各数字は、それぞれ本発明の異なる実施形態を表す。
【0128】
他の実施形態では、本発明のSARM化合物は、次の化学構造式XIXで表される化合物である。

【0129】
他の実施形態では、本発明のSARM化合物は、次の化学構造式XXで表される化合物である。

【0130】
他の実施形態では、本発明のSARM化合物は、次の化学構造式XXIで表される化合物である。

【0131】
他の実施形態では、本発明のSARM化合物は、次の化学構造式XXIIで表される化合物である。

【0132】
他の実施形態では、本発明のSARM化合物は、次の化学構造式XXIIIで表される化合物である。

【0133】
他の実施形態では、本発明のSARM化合物は、次の化学構造式XXIVで表される化合物である。

【0134】
“アルキル”基は、ある実施形態では、直鎖型、分枝型又は環状の飽和脂肪族炭化水素である。ある実施形態では、アルキル基は、1〜12個の炭素を有する。他の実施形態では、アルキル基は、1〜7個の炭素を有する。ある実施形態では、アルキル基は、1〜6個の炭素を有する。ある実施形態では、アルキル基は、1〜4個の炭素を有する。アルキル基は、F、Cl、Br、I、水酸基、アルコキシ・カルボニル基、アミド基、アルキルアミド基、ジアルキルアミド基、ニトロ基、アミノ基、アルキルアミノ基、ジアルキルアミノ基、カルボニル基、チオ基及びチオアルキル基から成る群より選択される1つ又は複数の基と置換又は無置換される。
【0135】
“アルケニル”基は、ある実施形態では、1つ以上の二重結合を有する直鎖型、分枝型又は環状の不飽和炭化水素である。アルケニル基は、二重結合を1つ、2つ又は3つ有している。アルケニル基の例としては、エテニル、プロペニル、ブテニル、シクロヘキセニルなどがある。アルケニル基は、F、I、Br、Cl、水酸基、アルコキシ・カルボニル基、アミド基、アルキルアミド基、ジアルキルアミド基、ニトロ基、アミノ基、アルキルアミノ基、ジアルキルアミノ基、カルボニル基、チオ基及びチオアルキル基から成る群より選択される1つ又は複数の基と置換又は無置換される。
【0136】
“ハロアルキル”基は、ある実施形態では、上記に定義したアルキル基を1つ又は複数のハロゲン原子(例えばF、Cl、Br又はI)で置換したものである。
【0137】
“アリル”基は、ある実施形態では、少なくとも1つの炭素環式芳香族基又は複素環式芳香族基を有する芳香族基であり、F、Cl、Br、I、ハロアルキル基、水酸基、アルコキシ・カルボニル基、アミド基、アルキルアミド基、ジアルキルアミド基、ニトロ基、アミノ基、アルキルアミノ基、ジアルキルアミノ基、カルボニル基、チオ基、及びチオアルキル基から成る群より選択される1つ又は複数の基と置換又は無置換される。アリル環の例としては、フェニル、ナフチル、ピラニル、ピロリル、ピラジニル、ピリミジニル、ピラゾリル、ピリジニル、フラニル、チオフェニル、チアゾリル、イミダゾリル、イソオキサゾリルなどがある(ただし、これらに限定されるものではない)。
【0138】
“ヒドロキシル”基は、ある実施形態では、OH基である。“アルケニル”基は、少なくとも1つの炭素間二重結合を有する基である。ハロ基は、ある実施形態では、F、Cl、Br又はIである。
【0139】
“アリルアルキル”基は、ある実施形態では、アリル基と結合したアルキル基である。なお、アルキル基とアリル基は、上記に定義したとおりである。アリルアルキル基としては、例えば、ベンジル基がある。
【0140】
《医薬品組成物》
“医薬品組成物”は、ある実施形態では、“治療に効果的な量”の活性化成分、すなわちSARM化合物と、薬学的に許容される担体又は希釈液とを組み合わせたものである。“治療に効果的な量”は、ある実施形態では、与条件及び投薬計画において治療効果がある量を意味する。
【0141】
SARM物質を含んでいる医薬品組成物は、例えば、非経口、側癌的(paracanceraly)、経粘膜的、経皮的、筋肉内、静脈内、皮内、皮下、腹膜内、脳室内、脳内、膣内又は腫瘍内投与などの当業者に周知の方法によって患者に投与される。
【0142】
ある実施形態では、医薬品組成物は経口投与される。そのため、医薬品組成物は、経口投与に適した形状(すなわち、固体又は液体製剤)に形成される。適切な固体の経口剤としては、錠剤、カプセル、ピル、顆粒、ペレットなどがある。また、適切な液体の経口剤としては、溶液、懸濁液、分散液、乳濁液、油などなどがある。本発明のある実施形態では、SARM化合物はカプセル状に形成される。この実施形態では、本発明に係る組成物は、SARM活性化合物及び不活性担体(又は希釈液)に加えて、硬ゲル化カプセルを含む。
【0143】
さらに、他の実施形態では、医薬品組成物は、液体製剤の静脈内注射、動脈内注射又は筋肉内注射によって投与される。適切な液体製剤としては、溶液、懸濁液、分散液、乳濁液、油などがある。ある実施形態では、医薬品組成物は、静脈内投与に適した形状に形成され、静脈内に投与される。他の実施形態では、医薬品組成物は、動脈内投与に適した形状に形成され、動脈内に投与される。他の実施形態では、医薬品組成物は、筋肉内投与に適した形状に形成され、筋肉内に投与される。
【0144】
さらに、他の実施形態では、医薬品組成物は、局所投与に適した形状に形成され、体の表面に局所的に投与される。適切な局所性製剤としては、ゲル、軟膏、クリーム、ローション、液滴などがある。局所的に投与するために、SARM物質又はその誘導体であって生理学的に耐容性を示すもの(例えば塩、エステル、N酸化物)を調製し、薬品担体を用いて又は用いることなく、生理学的に認容されている希釈液と共に、水溶液、懸濁液、又は乳状液として投与される。
【0145】
さらに、他の実施形態では、医薬品組成物は、直腸座薬や尿道座薬などの座薬として投与される。さらに、他の実施形態では、医薬品組成物は、ペレットの皮下埋め込みによって投与される。さらなる実施形態では、ペレットは、長時間にわたるSARM物質の徐放をもたらす。
【0146】
他の実施形態では、活性化合物は、小胞(特にリポソーム)に送達される。詳細については、Langer, Science 249: 1527-1533, 1990; Treat et al., in Liposomes in the Therapy of Infectious Disease and Cancer, Lopez-Berestein and Fidler (eds.), Liss, New York, 353-365, 1989; Lopez-Berestein, ibid, 317-327を参照されたい(主にibidを参照されたい)。
【0147】
“薬学的に許容される担体又は希釈液”は、当業者に周知である。担体又は希釈液としては、固体製剤用の固体担体又は希釈液、液体製剤用の液体担体又は希釈液、又は、これらの混合物がある。
【0148】
固体担体/希釈液としては、ガム、デンプン(例えばコーンのデンプン、予めゲル化されたデンプン)、糖(例えば乳糖、マンニトール、ショ糖、ブドウ糖)、セルロース系材料(例えば微結晶性セルロース)、アクリル酸塩(例えばポリメチルアクリレート)、炭酸カルシウム、酸化マグネシウム、滑石、又はこれらの混合物がある(ただし、これらに限定されるものではない)。
【0149】
液体製剤の場合、薬学的に許容される担体としては、水溶性又は非水性の溶液、懸濁液、乳濁液又は油がある。非水溶媒の例としては、プロピレン・グリコール、ポリエチレン・グリコールや、注射用有機エステル(例えばオレイン酸エチル)がある。水溶性担体としては、水、アルコール性/水溶性の溶液、乳濁液又は懸濁液(生理食塩水及び緩衝培地を含む)がある。油の例としては、石油、動物性、植物性又は合成されたものがある(例えばラッカセイ油、大豆油、鉱油、オリーブ油、ひまわり油、魚肝油)。
【0150】
非経口媒体(皮下注射、静脈内注射、動脈内注射又は筋肉内注射用)としては、塩化ナトリウム溶液、リンガー・デキストロース、デキストロース及び塩化ナトリウム、乳酸加リンガーオイル及び固定油がある。経静脈媒体としては、液体及び栄養補充薬、電解質補充薬(例えばリンガー・デキストロースに基づくもの)などがある。一例としては、界面活性剤及び他の薬学的に許容されるアジュバントを添加した又は添加しない、水や油などの無菌液がある。一般的に、水、生理食塩水、水溶性デキストロースや関連糖液、及びグリコール(例えばプロピレン・グリコールやポリエチレン・グリコール)は、液体担体として適している(特に、注射用溶液に適している)。油の例としては、石油、動物性、植物性又は合成されたものがある(例えばラッカセイ油、大豆油、鉱油、オリーブ油、ひまわり油、魚肝油)。
【0151】
また、この医薬品組成物は、さらに、結合剤(例えば、アカシア、コーンスターチ、ゼラチン、カルボマー、エチルセルロース、グアールガム、ヒドロキシプロピルセルロース、ヒドロキシプロピルメチルセルロース、ポビドン)、崩壊剤(例えば、コーンスターチ、ジャガイモデンプン、アルギン酸、二酸化ケイ素、クロスカルメロースナトリウム、クロスポビドン、グアールガム、澱粉グリコール酸エステルナトリウム)、種々のpH及びイオン強度の緩衝液(例えば、トリス−HCI、アセテート、リン酸塩)、界面に対する吸収を予防するためのアルブミン又はゼラチンのような添加物、洗剤(例えば、トウィーン20、トウィーン80、プルロニックF68、胆汁酸塩)、プロテアーゼインヒビター、界面活性剤(例えば、ラウリル硫酸ナトリウム)、浸透エンハンサー、可溶化剤(例えば、グリセロール、ポリエチレングリセロール)、抗酸化剤(例えば、アスコルビン酸、メタ重亜硫酸ナトリウム、ブチルヒドロキシアニソール)、安定剤(例えば、ヒドロキシプロピルセルロース、ヒドロキシプロピルメチルセルロース)、粘度上昇剤(例えば、カルボマー、コロイド状二酸化ケイ素、エチルセルロース、グアールガム)、甘味料(例えば、アスパルテーム、クエン酸)、防腐剤(例えば、チメロサール、ベンジルアルコール、パラオキシ安息香酸エステル類)、潤滑剤(例えば、ステアリン酸、ステアリン酸マグネシウム、ポリエチレン・グリコール、ラウリル硫酸ナトリウム)、流動助剤(例えば、コロイド状二酸化ケイ素)、可塑剤(例えば、フタル酸ジエチル、クエン酸トリエチル)、乳化剤(例えば、カルボマー、ヒドロキシプロピルセルロース、ラウリル硫酸ナトリウム)、ポリマーコーティング(例えば、ポロキサマー、ポロキサミン)、被覆及び膜形成剤(例えば、エチルセルロース、アクリル酸塩、ポリメタクリル酸塩)、及び/又は、アジュバントを含むことができる。
【0152】
ある実施形態では、この医薬品組成物は、投与後にSARM化合物を長時間に渡って放出する徐放組成物である。徐放又は持続放出組成物としては、脂溶性の持続性薬剤(例えば、脂肪酸、ワックス、オイル)内の組成物を含む。他の実施形態では、この医薬品組成物は、投与後に全てのSARM化合物を直ちに放出する即放組成物である。
【0153】
さらに他の実施形態では、この医薬品組成物は、徐放システムによって送達される。例えば、この薬剤は、静脈内注入、植込型浸透圧ポンプ、経皮パッチ、リポソーム又は他の投与形態により投与される。ある実施形態では、ポンプを使用することができる(例えば、Langer, supra; Sefton, CRC Crit. Ref. Biomed. Eng. 14:201, 1987; Buchwald et al., Surgery 88:507, 1980; Saudek et al., N. Engl. J. Med. 321:574, 1989を参照されたい)。他の実施形態では、高分子材料を使用することができる。さらに他の実施形態では、徐放システムは、治療ターゲットすなわち脳の近くに設けることが可能である。その場合、必要とされる投与量は、全身投与量と比べるとほんの少量である(例えば、Goodson, in Medical Applications of Controlled Release, supra, vol. 2, pp.115-138, 1984を参照)。他の徐放システムは、Langer(Science 249:1527-1533, 1990)によるレビューに記載されている。
【0154】
この医薬品組成物は、ポリマー化合物(例えば、ポリ乳酸、ポリグリコール酸、ヒドロゲルなど)の粒子状製剤や、リポソーム、マイクロエマルション、ミセル、単層又は多層状の小胞、赤血球ゴースト、スフェロプラストなどの活性物質と結合することができる。そのような組成物は、物理的状態、溶解度、安定性、インビボでの放出速度、及び、インビボでの排出速度に影響を与える。
【0155】
ポリマー(例えば、ポロキサマー又はポロキサミン)で被覆された粒子状組成物も本発明に含まれる。また、組織特異性受容体、リガンド又は抗原に対する抗体と結合した化合物や、組織特異性受容体のリガンドと結合した化合物も本発明に含まれる。
【0156】
また、水溶性ポリマーの共有結合によって修飾された化合物も本発明に含まれる。前記水溶性ポリマーとしては、例えば、ポリエチレン・グリコール、ポリエチレン・グリコールとポリプロピレン・グリコールのコポリマー、カルボキシメチル・セルロース、デキストラン、ポリビニル・アルコール、ポリビニルピロリドン、及び、ポリプロリンがある。これらの修飾された化合物は、対応する修飾されていない化合物と比較して、静脈注射後、血液中で著しく長い半減期を示すことが知られている(詳しくは、Abuchowski et al., 1981; Newmark et al., 1982; 及び Katre et al., 1987を参照されたい)。また、そのような修飾は、水溶液中での化合物の溶解度を高め、凝集を予防し、化合物の物理的及び化学的安定性を向上させ、化合物の免疫原性及び反応性を著しく低下させる。そのため、ポリマー化合物は、修飾されていない化合物よりも低い頻度の投与又は少ない投与量で、インビボでの望ましい生物学的活性を得ることができる。
【0157】
活性成分を含有する医薬品組成物の作成は、当該技術分野で周知である(例えば、混合、顆粒化又は錠剤形成によって作成する)。活性治療成分は、多くの場合は、薬学的に許容され活性化成分と適合する媒体と混合される。経口投与の場合は、SARM物質又はその誘導体であって生理学的に耐容性を示すもの(例えば、塩、エステル、N酸化物)は、この目的に通常使用される添加物(例えば、媒体、安定剤、不活性希釈液)と混合され、通常の方法によって投与に適した形状(例えば、錠剤、コート錠、硬ゼラチンカプセル、軟ゼラチンカプセル、水溶性、アルコール性溶液、油性溶液)に変えられる。非経口投与の場合は、SARM物質又はその誘導体であって生理学的に耐容性を示すもの(例えば、塩、エステル、N酸化物)は、必要に応じて、この目的に通常使用される適切な物質(例えば、可溶化剤など)によって、溶液、懸濁液又は乳濁液に変えられる。
【0158】
活性成分は、中和された薬学的に許容される塩の形態で、医薬品組成物内に配合することができる。薬学的に許容される塩としては、例えば、無機酸(例えば、塩酸、リン酸)や有機酸(例えば、酢酸、シュウ酸、酒石酸、マンデル酸)によって形成される酸付加塩(ポリペプチド又は抗体分子の遊離アミノ基で形成される)がある。遊離カルボキシル基から形成される塩は、例えば、無機塩(例えば、ナトリウム、カリウム、アンモニウム、カルシウム、水酸化第二鉄)や、有機塩基(例えば、イソプロピルアミン、トリメチルアミン、2−エチルアミノエタノール、ヒスチジン、プロカイン)からも生成できる。
【0159】
医学的に使用するために、SARMの塩を薬学的に許容される塩として使用し得る。また、本発明に係る化合物又はその薬学的に許容される塩の作成に他の塩を使用し得る。本発明に係る化合物における適切な薬学的に許容される塩としては、例えば、本発明に係る化合物の溶液と、薬学的に許容される酸(例えば、塩酸、硫酸、メタンスルホン酸、フマル酸、マレイン酸、コハク酸、酢酸、安息香酸、シュウ酸、クエン酸、酒石酸、炭酸、リン酸)の溶液とを混合することによって形成した酸付加塩がある。
【0160】
“投与”という用語は、患者に本発明に係るSARM化合物を接触させることを意味する。投与は、インビトロ(すなわち試験管内)又はインビボ(すなわち、例えばヒトなどの生体の細胞又は組織内)で実施される。ある実施形態では、本発明は、患者に本発明に係る化合物を投与することを含んでいる。
【0161】
他の実施形態では、“接触”という用語は、本発明に係るSARM化合物が治療対象患者に投与され、インビボでSARM化合物がARと接触することを意味する。
【0162】
ある実施形態では、本発明に係るSARM化合物は、唯一の活性化成分として投与される。また、SARM化合物が1つ又は複数の治療物質と一緒に投与される、ホルモン治療、前立腺癌治療、前立腺癌の進行を遅らせる、及び、前立腺癌の再発を予防及び/又は治療するための方法も本発明の範囲に含まれる。前記治療物質としては、LHRH類似体、可逆的抗アンドロゲン、抗エストロゲン、抗癌剤、5−αレダクターゼ阻害剤、アロマターゼ阻害剤、プロゲスチン、別の核ホルモン受容体を介して作用する物質、選択的エストロゲン受容体調節剤(selective estrogen receptor modulator:SERM)、プロゲステロン、エストロゲン、PDE5抑制剤、アポモルヒネ、ビスホスフォネート、及び、1つ以上のさらなるSARM(例えば、アゴニスト作用を有する他のSARM)がある(ただし、これらに限定されるものではない)。
【0163】
したがって、ある実施形態では、本発明に係る方法は、SARM化合物をLHRH類似体と共に投与することを含む。ある実施形態では、本発明に係る方法は、SARM化合物を可逆的抗アンドロゲンと共に投与することを含む。ある実施形態では、本発明に係る方法は、SARM化合物を抗エストロゲンと共に投与することを含む。ある実施形態では、本発明に係る方法は、SARM化合物を抗癌剤と共に投与することを含む。ある実施形態では、本発明に係る方法は、SARM化合物を5−αレダクターゼ阻害剤と共に投与することを含む。ある実施形態では、本発明に係る方法は、SARM化合物をアロマターゼ阻害剤と共に投与することを含む。ある実施形態では、本発明に係る方法は、SARM化合物をプロゲスチンと共に投与することを含む。ある実施形態では、本発明に係る方法は、SARM化合物を、別の核ホルモン受容体を介して作用する物質と共に投与することを含む。ある実施形態では、本発明に係る方法は、SARM化合物を選択的エストロゲン受容体調節剤(SERM)と共に投与することを含む。ある実施形態では、本発明に係る方法は、SARM化合物をプロゲステロンと共に投与することを含む。ある実施形態では、本発明に係る方法は、SARM化合物をエストロゲンと共に投与することを含む。ある実施形態では、本発明に係る方法は、SARM化合物をPDE5抑制剤と共に投与することを含む。ある実施形態では、本発明に係る方法は、SARM化合物をアポモルヒネと共に投与することを含む。ある実施形態では、本発明に係る方法は、SARM化合物をビスホスフォネートと共に投与することを含む。ある実施形態では、本発明に係る方法は、SARM化合物を、1つ以上のさらなるSARMと共に投与することを含む。
【実施例】
【0164】
次の実施例は、本発明の実施形態をより詳細に説明するためのものである。ただし、これらの実施例は、本発明の範囲を限定するものではない。
【0165】
《実施例1 実験デザイン−実施例1〜14》
動物を下表に示される各治療群に、各群に10匹ずつ、無作為に分けた。実験の1日目(day 1)に動物に外科的な卵巣切除(卵巣切除:OVX)を施した群もあった。化合物VI、化合物IX及び化合物XI、抗アンドロゲン、及び/又はDHTによる薬物投与を直ちに(つまりOVXが行なわれた日に)或いはOVXの90日後に開始し、これら化合物の骨吸収抑制(即時治療)又は骨形成促進(遅延治療)の性能を評価した。関連する化合物を、実験の180日目まで毎日皮下注射(0.25ミリリットル[mL])により投与した。薬液をエタノールに溶かしてポリエチレン・グリコール300で希釈することにより毎日作成した。エタノールの比率はすべての媒体で同一とし、テスト化合物の溶解性に基づいて決定した。
【0166】
下表に示すように、全身の二重エネルギーX線吸収測定法(DEXA)のX線骨密度測定画像をOVX後最大210日間採集した。BMD、BMC、骨塩面積(BMA)、除脂肪体重(LBM)、FM、総体重(TBM)と、腰椎及び左大腿骨の準局所的なBMDを各時点で測定した。
【0167】
全ての動物を治療開始から120日目に屠殺した。屠殺したラットから大腿骨及び脛骨を将来の実験のため切除した。各群の動物に対し、屠殺前或いは屠殺時に血清と尿検体を採集し、オステオカルシン、IL−6、IGF−1の血清濃度と、デオキシピリジノリン及びクレアチニンの尿濃度を測定するために使用した。



【0168】
【表1】

【0169】
《実施例2 化合物VIはラットの骨粗鬆症モデルにおけるBMDの低下を阻止する》
実験動物及び実験方法(実施例2〜14)
動物
メスのSDラットをハーラン社(Harlan; Indianapolis, IN)から購入した。動物を1ケージ当たり3匹ずつ収容し、水道水と市販のラット用エサ(Harlan Teklad 22/5 rodent diet-8640)を自由に飲食できるようにした。実験期間中、動物を12時間の明暗サイクルで飼育した。この実験は、オハイオ州立大学の研究機関内の管理及び使用に関する委員会(Institutional Laboratory Care and Use Committee)によって審査及び承認されたものである。
【0170】
実験デザイン
23週齢となったときに、動物に卵巣切除(OVX)または偽手術を施し、12の処置群のうち1つに振り分け(表2)、1群につき10匹の動物からなるようにした。各群は、結果の章に記載しているように、種々の量の化合物VIを投与し、または他の処置を施したか、或いは非処置とした。卵巣が切除されていないことを示すために偽手術した動物を「無傷」と呼ぶ。一連の研究中に5匹の動物が非薬物関連の死因で死亡した。従って、群1、6、10はそれぞれ9匹の動物からなり、群4は8匹の動物からなっていた。薬物をDMSOに溶かしてポリエチレン・グリコール300(PEG300)で希釈することにより薬液を毎日作成した。120日間毎日0.20mlを皮下注射することによって全ての薬量を投与した。
【0171】
【表2】

【0172】
120日目の全身型DEXAスキャンの直後に群2〜12を屠殺し、腰椎、大腿骨及び脛骨を切除し、軟繊維を取り除いた。この研究のための無傷対照群(群1)は、実施例9〜13に記載の同時的遅延処置研究に対する対照群としても供された。よって、群1は210日目に屠殺した。
【0173】
身体パラメータ測定
0日目及び120日目(day 120)に小動物ソフトウェア(Lunar enCORE、バージョン6.60.041)を用いてDEXA(GE社、Lunar Prodigy(登録商標))によって全身のBMD、FM比率、体重(BW)、BMC、骨塩面積(BMA)、除脂肪体重(LBM)を測定した。700シリーズのオーハウス(Ohaus)トリプルビーム動物天秤(Florham Park, NJ)を用いて標準重量法によって動物の体重も測定した。DEXAスキャンを行うために、ケタミン:キシラジン(87:13mg/kg)により動物に麻酔をかけ、腹臥位に置いた。データ処理中に、動物全体を含む範囲を関心領域即ちROI(region of interest)として選択することによって、全身データを得た。本明細書中では、より大きな動的範囲でホルモン感受性が最も高い測定の分析に焦点を当てるために、エストロゲン投与中止に感受性が最も高い(即ち無傷群と対照群間の差が最大である)と決定されたパラメータを用いて報告した。
【0174】
切除した骨を深さ3インチの室温水浴にてスキャンし、軟組織をシミュレートした。近位大腿骨、遠位大腿骨、近位脛骨、L2−L4脊椎、L5−L6脊椎をROIとしてDEXAスキャンから選択し、BMD分析した。大腿の画像を近位(領域1)から遠位(領域10)まで10の等しいROIに細分し、各領域のBMDをLunar enCORE小動物ソフトウェアによって決定した。
【0175】
遠位骨用定量的コンピュータ断層撮影(pQCT)分析及び生体力学試験を行うために、OVX+0.1mg/日の化合物VI(群11)、OVX+3.0mg/日の化合物VI(群12)、OVX+1.0mg/日のDHT(群5)、OVX対照(群4)、無傷+1mg/日の化合物VI(群3)、無傷対照(群1)からの右大腿骨をスケルテック社(Skeletech:ボセル,WA)へ送った。ストラテック(Stratec)XCT−RM及び関連するソフトウェア(Stratec Medizintechnik社、プフォルツハイム,ドイツ、ソフトウェア・バージョン5.40C)を使用し、大腿骨をpQCTスキャンした。大腿骨の中央骨幹領域及び遠位領域の両方を分析した。スカウトスキャンの像を用いて大腿骨の長さを決定し、中央骨幹領域(大腿骨長さの50%)及び遠位領域(遠位端から開始する大腿骨長さの20%)をROIとして選択した。大腿骨の長軸に垂直な1つの0.5mm薄片を分析に用いた。全身のBMD、総骨面積、全BMD、皮質骨塩含量、皮質骨面積、皮質BMD、皮質厚、骨膜周辺(周囲)及び皮質周辺を大腿骨の中央骨幹で決定した。遠位大腿骨では、全BMC、総骨面積、全BMD、骨梁骨塩含量、骨梁骨面積及び骨梁BMDを決定した。
【0176】
pQCT分析後、脱肉処理した大腿骨全体を用いて3点曲げ試験を行った。電子キャリパスを用いて大腿骨幹の中心での前後径(APD)(単位:ミリメートル[mm])を測定した。インストロン物理試験機(インストロン5500型にレトロフィットされた4465型)(Canton, MA)において3点曲げ具の下支点上に大腿骨の前側を下向きにして大腿骨を載置した。下支点間の長さ(L)は14mmに設定した。大腿骨幹の中央に合わせて上側荷重負荷装置の向きを調整した。6mm/分の一定の変位速度で大腿骨が折れるまで負荷をかけた。物理試験機により最大負荷(Fu)(単位:N)、堅さ(S)(単位:N/mm)、及び吸収エネルギー(W)(単位:mJ)を直接測定した。大腿骨の中央骨幹のpQCT分析中にソフトウェアにより慣性軸面積モーメント(I)(単位:mm4)を計算した。応力(σ)(単位:N/mm2)、弾性係数(E)(単位:Mpa)、靱性(T)(単位:mJ/m3)を次式により計算した。応力σ=(Fu×L×(a/2))/(4×I);弾性係数E=S×L3/(48×I);靱性T=3×W×(APD/2)2/(L×I)。
【0177】
統計分析
一因子分散分析(ANOVA)により統計分析を行った。P値が0.05以下のときに統計的有意差があるとした。
【0178】
結果
ラットを12の群のうちの1群に割り当てた。0日目に群4〜12は卵巣切除を行い、群1〜3は無傷ラットとした。群7〜12にはそれぞれ0.1、0.3、0.5、0.75、1.0、3mg/日の薬量を毎日皮下注射することにより化合物VIを投与した。群1及び4はそれぞれ無傷(即ち非OVX)群、OVX陰性対照群であり、DMSOを単独投与した。群2及び5(無傷及びOVX)にはアンドロゲン・デヒドロテストステロン(DHT)(1mg/日)を投与し、陽性対照とした。群3は、1.0mg/日の化合物VIを投与された無傷ラットである。化合物VIのAR介在効果とAR非依存効果を示すために、群6(OVX)に0.5mg/日の化合物VIと1.0mg/日の抗アンドロゲンビカルタミドを投与した。1、30、60、90、120日目にBMCを決定した。
【0179】
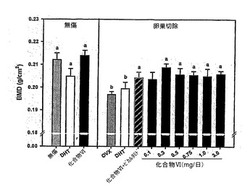
全群に対する120日目の全身BMDを図1に示す。予想通り、OVXラットのBMD(0.196g/cm2)は、120日目に無傷OVX対照に見られるBMD(0.214g/cm2)より有意に低かった。化合物VI処置は、0.1mg/日より多い薬量でOVXラットにおける骨格BMDの低下を部分的に(即ちOVX対照より有意に大きいBMD)または完全に(即ち無傷対照とは有意には異ならないBMD)阻止した。DHTは、OVXラットにおいてBMDを十分に維持した。しかし、無傷ラットにおいては、DHTはBMDを有意に減少させ、無傷ラットにおける化合物VI処置はBMDを無傷対照のレベルに維持した。抗アンドロゲンビカルタミドの同時投与は、化合物VIの効果を部分的に阻止し、ARが部分的に化合物VIへの骨反応を媒介したことを示している。このように、化合物VIは、OVXラットにおけるBMDの低下を阻止した。
【0180】
切除したL5−L6脊椎のDEXA分析の結果を図2に示す。対照OVXラットは一連の研究の間に有意な量の脊椎のBMDを失ったが、化合物VI処置は、3mg/日の化合物VIではOVXに誘導される骨低下を完全に阻止し、0.5及び1mg/日の化合物VIでは部分的に阻止するような、用量依存的な骨温存効果(bone-sparing effect)を有していた。0.1、0.3、0.75mg/日の化合物VIを投与したOVXラットは、対照OVXラットより高いBMDを示したが、その差は統計学的に有意ではなかった。ビカルタミドの同時投与は、化合物VIの骨温存効果を部分的に抑制した。化合物VIとは対照的に、OVXラットにおけるDHT処置はL5−L6脊椎における骨低下を阻止しなかった。化合物VIは無傷ラットにおけるBMDには効果がなかったが、DHT処置はBMDをOVX対照に類似のレベルまで有意に増加させた。化合物VIは、L2−L4脊椎(図3)、大腿領域4(図4)、及び近位大腿(図5)におけるOVX誘導BMD減少を阻止した。このように、化合物VIは、L2−L4及びL5−L6脊椎におけるOVX誘導BMDの減少を阻止した。
【0181】
この実施例における発見は、全体的にも、体の幾つかの特定位置においても、いずれでも、化合物VIが卵巣切除に起因するBMDの低下を阻止することを示している。このように、SARMSは、閉経などのホルモンの原因に起因する骨低下の阻止に有益である。
【0182】
《実施例3 化合物VIは、骨粗鬆症に起因する皮質骨の低下を阻止し、健康な治療対象における皮質骨量を増加させる》
実施例2からのラットの大腿骨の中央骨幹において皮質厚(CT)を決定した(図6)。OVXラットは、無傷対照ラットに比べて皮質密度の増加を示した。化合物VI及びDHTは共にCTの減少を阻止したが、化合物VIで処置した群はDHTで処置した群より高いCTを示した。その上、無傷ラット及び化合物VIを投与したOVXラットは、無傷対照のレベル以上にCTの有意な増加を示した。
【0183】
大腿骨の中央骨幹での皮質含量(CC)も評価した(図7)。OVX対照ラットにおいて、10.3から8.8mg/mmへのCCの有意な減少が観察された。化合物VIはCCの低下を完全にブロックしたが、低下はDHTによって部分的に阻止されたに過ぎなかった。それに加えて、3mg/日の化合物VIを投与された群は、無傷対照レベルに対してCCの増加を示した。
【0184】
大腿骨の中央骨幹の骨膜周囲(PC)も測定した(図8)。OVXラットにおけるPCは減少したが、減少は化合物VI処置によって完全に阻止された。
【0185】
大腿骨の中央骨幹の皮質骨塩密度(CD)をpQCTにより測定した。化合物VIはOVXにより生じたCDの低下を完全に阻止したが、DHTはCDの低下を部分的に阻止したに過ぎなかった。化合物VIを投与された無傷ラットでは、OVX及び無傷対照ラットに比べてCDの増加が見られた。
【0186】
CT、CC、PC、CDは、皮質骨含量、密度、強さの指標である。このように、化合物VIがOVXラットにおけるこれらの指標を安定化するという発見は、SARMSの骨安定化の質が皮質骨において顕性であることを示している。その上、この実施例の発見は、骨粗鬆症(OVX)の治療対象及び非骨粗鬆症の治療対象の両者においてSARMSが皮質骨を増加させることを示している。
【0187】
《実施例4 化合物VIは、骨粗鬆症に起因する骨梁骨の低下を阻止し、健康な治療対象において骨梁骨量を増加させる》
実施例2からのラットの遠位大腿骨において骨梁BMDを測定した(図9)。有意な骨梁骨低下即ち735〜609mg/cm3が、OVX後に見られたが、これは化合物VI及びDHTによって部分的に阻止された。その上、無傷ラットを化合物VIで処置すると、無傷対照より有意に高いレベルまで骨梁BMDが増加した。
【0188】
この実施例の発見は、SARMSの骨安定化の質が骨梁骨において顕性であることを示している。その上、この発見は、SARMSが骨粗鬆症(OVX)の治療対象及び非骨粗鬆症の治療対象の両者において骨梁骨を増加させることを示している。
【0189】
《実施例5 化合物VIは骨粗鬆症の治療対象及び健康な治療対象の両者において骨を強化する》
更に、大腿骨の生体力学的強さを決定した(図10)。OVX対照ラットは、大腿の生体力学的強さの有意な低下を示した。これは、化合物VI処置及びDHT処置によって完全に阻止された。化合物VIは、無傷ラットに対する影響を示さなかった。
【0190】
それに加えて、このL5脊椎の例では、ラットの骨の圧縮強さ(CS)を測定した(図11)。OVXはCSを有意に低下させなかったが、化合物VIは無傷及びOVXラットの両者においてCSを増加させた。
【0191】
この実施例の発見は、骨粗鬆症(OVX)の治療対象及び非骨粗鬆症の治療対象の両者においてSARMSが骨を強化することを示している。
【0192】
《実施例6 化合物VIは骨粗鬆症の治療対象においてBMCを増加させる》
時間及び用量依存的なBMCの増加は、実施例2に記載の実験の化合物VIで処置した群全てに見られ、群7〜12において、120日目で、対照OVXラットと比較してそれぞれ22%、9%、26.0%、28.5%、30.5%、30.0%、40.1%増加した(図12A−B)。DHTは、BMCを少量(15%)増加させた。30日目の時点では、DHTで処置したマウスではなく化合物VIで処置したマウスがBMCの増加を示した(図13)。このように、化合物VIはOVXラットにおいてBMCを増加させ、SARMSが骨粗鬆症の治療対象におけるBMCを向上させることを示した。
【0193】
《実施例7 化合物VIは骨粗鬆症の治療対象において体脂肪量を減少させ、除脂肪BMCを増加させる》
研究開始時の全ての群に対し、平均体重は267±17g(平均値±偏差、n=120)であった。全てのラットは、一連の研究中に有意な量の重量が増加した(図14)。体重は全てのOVX群において無傷対照群よりも大きく、ラット成長に対するエストロゲン欠乏の影響を示していた。化合物VIを3mg/日投与した群には更なる体重増加が見られた。無傷ラットにおいては、DHTは無傷対照に比べて体重を増加させ、化合物VIはOVX及び無傷対照の両者に関して有意な増加を得た。
【0194】
120日目に体脂肪量(FM)割合をDEXAにより測定した(図15)。OVX対照群は、無傷対照より有意に高いFMを示し、エストロゲン欠乏の身体組成への影響を明らかにした。化合物VIによる処置は、3mg/日投与した群における無傷対照レベルと同等のFMレベルを保ちながら用量依存的な方法でFMを減少させた。化合物VI介在減少は、ビカルタミドの同時投与により阻止された。無傷及びOVXラットの両者におけるDHT処置は、無傷対照よりは高いがOVX対照で観察されるものよりは低い値までFMを増加させた。化合物VIを投与した無傷ラットは、無傷対照に比べてFMの減少を示した。全ての群において、対応する除脂肪量率の変化が観察された。よって、化合物VIは、FM割合のOVX誘発性増加を阻止した。
【0195】
この実施例の発見は、骨粗鬆症の治療対象においてSARMSが除脂肪量/FM比の増加を阻止することが可能であることを示している。
【0196】
《実施例8 化合物VIは骨粗鬆症の治療対象において血清オステオカルシンの上昇を阻止する》
屠殺直前に採取した血清サンプル中のオステオカルシンを測定した。OVXはオステオカルシンレベルを増加させ、化合物VI及びDHTの両者による処置はオステオカルシンレベルを非OVX対照において観察されるレベルまで戻した(図16)。
【0197】
結論としては、実施例2〜8は、化合物VIが骨粗鬆症の治療対象において皮質骨と骨梁骨の両方の低下、骨強度の低下、FMの増加を抑制することを示している。更に、ほとんどの場合、化合物VIの正の効果はDHTと同程度またはそれ以上であった。このように、本発明は、(a)SARMSが骨粗鬆症の存在下でも不存在下でも骨同化作用(osteo-anabolic)効果を有すること、(b)SARMSが骨粗鬆症の結果に有効な再吸収阻害効果を有することを示している。
【0198】
《実施例9 化合物VIは骨粗鬆症の治療対象においてBMDの低下を逆戻りさせる》
実験動物及び実験方法
実施例9〜13のマウスを卵巣切除し、実施例2で述べたのと同じ処置を施した。但し、このケースではOVX後90日目までは処置を開始しなかった。実施例2に記載のようにマウスを210日目に屠殺し、分析した。
【0199】
結果
図17に示すように、OVX対照群の全身BMD(0.197g/cm2)は無傷対照群(0.212g/cm2)より低かった。化合物VIは、0.3、0.5、0.75、1.0、3.0mg/日投与群におけるBMDの低下を0.204、0.209、0.206、0.205、0.205、0.206g/cm2にそれぞれ逆戻りさせた。それに反して、DHTはBMDを回復させなかった。DHTも化合物VIも無傷動物のBMDを増加させなかった。化合物VIは、無傷動物のBMDを0.214g/cm2まで統計学的に有意ではない量だけ増加させた。DHTは、それどころか、BMDを0.205g/cm2まで減少させた。化合物VIとビカルタミドを同時投与した動物は、化合物VIを単独で投与した動物と異なっていなかった。このように、化合物VIは、骨粗鬆症ラットにおけるBMDの低下を逆戻りさせた。
【0200】
全身BMDと同様に、OVXはL5−L6脊椎においてBMDに悪影響を与え、無傷動物における0.234g/cm2からOVX対照における0.192g/cm2まで減少させた(図18)。L5−L6BMDは、3.0mg/日、0.3mg/日をそれぞれ投与されたOVX対照動物に比べて有意に増加したか或いは完全に回復させた。化合物VIの他の薬量は、統計学的有意性に到達しない増加を生じさせた。同様に、DHT処置は、OVX動物におけるL5−L6BMDを部分的に回復させた。化合物VIは無傷動物においてL5−L6BMDに影響しなかったが、DHTはOVX対照に類似のレベルまで有意な増加がもたらされた。化合物VI+ビカルタミドにより処置した動物におけるL5−L6BMDは、同量の化合物VI単独で処置した動物において観察されるものと有意には異なっていなかった。薬量0.1、0.75、3.0mg/日の化合物VIで統計学的有意性に到達したこと以外は類似の結果が大腿のBMD測定において観察された(図19)。このように、化合物VIは、OVXの結果として失われたBMDを回復させる。この実施例の結果は、SARMSは骨粗鬆症に由来するBMD低下を逆戻りさせることができることを示している。骨粗鬆症が発生するまで処置を遅延させることによって、再吸収阻害活性の寄与度が小さくあるべき場所における化合物VIの同化作用活性の評価が可能になった。このように、骨同化作用活性は、SARMSが骨粗鬆症及び非骨粗鬆症の治療対象における骨量を増加させるメカニズムの少なくとも1つである。
【0201】
《実施例10 化合物VIは骨粗鬆症の治療対象における皮質骨の低下を逆戻りさせる》
実施例8のラットに対して大腿骨の中央骨幹でのCCを決定した。OVXラットにおいてCCは10.3から8.9mg/mmに減少した(図20)。1.0mg/日及び3.0mg/日薬量の化合物VIはそれぞれCCの低下を部分的に(9.6mg/mm)及び完全に(10.1mg/mm)逆戻りさせた。DHTは、CCを9.9mg/mmに完全に回復させた。CTは、OVXの結果として0.72mmから0.66mmに減少した。この減少は、化合物VIで処置した群の幾つかにおいて有意に逆戻りした(図21)。CCと同様に、PCはOVX後に11.98から11.45mmに減少した。減少は、1及び3mg/日の化合物VIを与えたラットにおいてそれぞれ12.06及び12.21mmに完全に逆戻りさせた(図22)。DHT処置は、11.84mmへの僅かな統計学的に有意ではない増加を生じさせた。
【0202】
この実施例の結果は、SARMSは骨粗鬆症の結果起こる皮質骨低下を逆戻りさせることができることを示している。
【0203】
《実施例11 化合物VIは骨粗鬆症の治療対象における骨梁骨の低下を逆戻りさせる》
それに加えて、遠位大腿骨で骨梁BMDを測定した(図23)。OVX後、骨梁骨低下は遠位大腿骨において明らかであった。DHT及び化合物VIは共に骨梁BMDを部分的に回復させたが、このことは、SARMSは骨粗鬆症の結果起こる骨梁骨低下を部分的に逆戻りさせることができることを示している。
【0204】
《実施例12 化合物VIは骨粗鬆症の治療対象における骨の衰弱を逆戻りさせる》
実施例8のラットの大腿骨の生体力学的強さを3点曲げにより決定した(図24)。OVXは、最大負荷を233Nから191Nに低下させた。1.0及び3.0mg/日の化合物VIによる処置は、最大負荷をそれぞれ217N、215Nに増加させた。値は無傷対照と有意には異ならず、SARMSは骨粗鬆症の結果起こる骨の衰弱を逆戻りさせることができることを示している。DHT処置は、最大負荷を214Nに増加させた。
【0205】
《実施例13 化合物VIは骨粗鬆症の治療対象において増加したFMを逆戻りさせる》
実施例8のラットの体重は、OVXによって308gから336gに増加し、化合物VIによって用量依存的な方法で更に増加した(図25)。例えば、0.1及び3.0mg/日の化合物VIにより処置した群は、それぞれ平均して350g及び381gであった。化合物VIにより処置した無傷動物の体重は無傷対照と同じであったが、無傷動物においてDHTによる処置を行ったところ、体重が357gに増加した。
【0206】
更に、ラットのFM割合を評価した。OVX対照群におけるFMは、29%から41%に増加した。化合物VI処置は、全ての薬量群においてOVX対照群より低いFMを生じさせたが、有意な差がない薬量群もあった(図26)。減少はDHT処置でも見られた。ビカルタミドと化合物VIの同時投与は、化合物VI処置単独の場合に見られるFMへの正の効果を部分的に取り消した。無傷動物の化合物VI及びDHT処置により、PMはそれぞれ2%減少及び8%増加した。
【0207】
この実施例の発見は、(a)SARMSは骨粗鬆症に由来する増加したFMを逆戻りさせることができ、(b)SARMSは骨粗鬆症の治療対象において肥満度(body mass)を増加させることができることを示している。
【0208】
要約すれば、実施例9〜13の発見は、SARMSが骨粗鬆症の治療対象においてBMDの低下、骨皮質及び骨梁骨の低下、骨の衰弱、及び増加したFMを逆戻りさせ得ることを示している。骨粗鬆症の開始後まで薬物を加えなかったので、これらの実施例の発見は、化合物VIの再吸収阻害活性に反対する同化作用活性を評価した。これらの発見は、(a)骨同化作用活性と、(b)SARMSの骨粗鬆症に対する防御活性を確認し、実施例2〜8の結果の補強に資する。
【0209】
《実施例14 化合物VIと化合物IX及びXIの比較》
実施例1〜13に記載の研究と同時に、OVXモデルにおける骨格成長及び維持に対する化合物VIの効果と、A環のパラ−ニトロ置換基がパラ−シアノ置換基に置換されてB環のパラ−アセトアミド置換基がパラ−フルオロ置換基(化合物IX)またはパラ−クロロ置換基(化合物XI)に置換された化合物VIの2つの構造類似体の効果とを比較した。OVX直後にもその後90日目にも化合物を投与した。実施例2〜13に述べた如くラットを分析した。
【0210】
120日目の屠殺後すぐに処置した即時処置群に対する結果を図27〜28に示す。予想通り、OVX動物のBMDは120日目で無傷対照より有意に小さかった。化合物VI、IX、XIは全て、全体として体のBMD低下を部分的に阻止した(図27)。
【0211】
LS−L6脊椎のBMDも評価した。OVX(vehicle)対照動物は、有意な量のBMDを失った(図28)。薬量1mg/日の化合物VI、IX、XIは全て、OVX誘発性の骨低下を部分的に阻止したが、DHTはそうはしなかった。化合物XIは、全身及びL5−L6脊椎の両方においてBMDへの最大の効果を示した。尤も、効果は、評価された他のSARMSと統計学的には異ならなかった。無傷動物におけるDHT処置は、OVX対照と同様のレベルまでBMDを有意に減少させたが、化合物VIを与えた無傷動物におけるBMDは、無傷対照と同様であった。
【0212】
これらの結果は、化合物VIと同様、化合物IX及びXIが、骨を保護する効果を示しかつ筋肉衰弱及び骨粗鬆症の処置に適用できる強力なSARMSであることを示している。
【0213】
時間を置いて210日目に処置した遅延処置群のBMD研究を図29〜30に示す。OVXは、化合物VI及びDHTによって部分的に阻止されたが化合物IXまたはXIによっては阻止されなかった全身BMDを有意に減少させた(図29)。L5−L6脊椎の場合、DHT処置もまたBMC(図30)の減少を阻止しなかった。無傷動物においては、化合物VIではなくDHTがBMDを有意に減少させた。
【0214】
全ての即時処置群に対する平均体重は、262±3g(平均値±偏差)であった。全ての動物は、一連の研究間に有意な量の重量が増加したが(図31)、OVXによる更なる増加があった。化合物IX及びIXによる処置は、無傷対照またはOVX対照に対して更に体重を増加させた。無傷動物においては、化合物VIではなくDHTによる処置は、無傷対照に比べて体重を更に増加させた。遅延処置群においても類似の結果が見られた(図32)。
【0215】
FMは、OVXによって増加し、化合物IX及びXIによる処置によって更に増加した(図33)。しかし、増加は、化合物VIで観察されたものより有意に少なかった。無傷及びOVX動物の両者におけるDHT処置は、それぞれ、無傷対照よりは高いがOVX対照で観察されるものよりは低いレベルまでFMを増加させた。無傷ラットへの化合物VIの投与は、FMを減少させた。遅延処置群において、OVX対照群と有意に異なる処置OVX群はなかった(図34)。
【0216】
この実施例に示される結果は、骨を保護する効果が化合物VIに特有のものではなく、むしろ他のSARMSによっても示されるものであることを明らかにしている。
【0217】
《実施例15 化合物VIの薬物動態特性》
研究デザイン
動物を各群に5匹で7つの群に無作為に分けた。頚静脈カテーテルによって静脈内(i.v.)投与(0.5、1、10、30mg kg−1)を投与した。最終体積0.2〜0.3mlで薬量を送達するために適正濃度で薬液を調製した。0.1mlの目盛り付きの1ml注射器を用いて薬量を体積的に送達した。薬量の投与後、無菌ヘパリン化生理食塩水の一定分量(投与薬量の体積の3倍)によりカテーテルを洗い流した。経口(p.o.)投与(1、10、30 mg kg−1)を0.2〜0.3mlの体積で経口胃管栄養法により胃に直接導入した。これらの薬量は、前臨床薬理学中に用いた化合物VI薬量の範囲、安全性、及び毒物学の研究を表すために選択された。
【0218】
静脈内投与後の化合物VIの薬物動態
化合物VIは、0.5、1、10、30mg kg−1の静脈内投与後、それぞれ1.6、2.3、28、168μg ml−1の平均最大血漿濃度に達した。化合物VIに対する分布の平均定常状態の体積(0.45L kg−1)は、全体内水分(0.67L kg−1)より僅かに少なかった。CLは比較的一定のままであり、薬量0.5、1mg kg−1及び10mg kg−1に対してそれぞれ1.92、2.12、1.52 ml min−1kg−1であった。しかし、化合物VIのCLは、薬量30mg kg−1で(1.00ml min−1kg−1、p<0.05)低下した。それに応じて、血漿薬物濃度下面積(AUC)は薬量10mg kg−1まで比例的に増加した。しかし、30mg kg−1の静脈内投与では、AUCは薬量29mg kg−1まで非比例的に増加した。尿中排泄データは、薬物の0.5%以下が不変で排泄されることを示し、不変の薬物としての化合物VIの腎排泄が無視できることを示していた。化合物VIのT1/2は、0.5、1、10、30mg kg−1の投与後、それぞれ154、182、223、316分であった。MRIは、クリアランスの減少により、薬量0.5及び1mg kg−1で222及び240分から薬量10及び30mg kg−1で305及び423分までそれぞれ増加した。
【0219】
経口投与後の化合物VIの薬物動態
化合物VIは、1、10、30mg kg−1の経口投与後、それぞれ1.4、11、20μg ml−1の平均最大血漿濃度に達した。最大血漿濃度に到達するまでの時間(Tmax)は、1、10、30mg kg−1の投与に対してそれぞれ48、84、336分であった。化合物VIは薬量1及び10mgに対して完全に生物学的利用可能であった。しかし、30mg kg−1の投与後、化合物VIの生物学的利用率は57%に減少し、化合物VIのT1/2は、1、10、30mg kg−1の投与後、それぞれ、203、173、266分であった。
【0220】
以上本発明について説明したが、当業者であれば、本明細書中に特に示された内容によって本発明が限定されるものでないことを理解するであろう。発明の範囲は、むしろ、特許請求の範囲によって画定される。
【技術分野】
【0001】
本発明は、骨粗鬆症、骨減少症、骨吸収の増加、骨折、骨の脆弱化、骨ミネラル濃度の減少などの骨関連疾患を治療、予防、抑止及び抑制する並びにそれらの疾患が進行する危険性を減少させる方法であって、患者に、治療に効果的な量の選択的アンドロゲン受容体調節剤(selective androgen receptor modulator:SARM)及び/又はその類似体、誘導体、異性体、代謝産物、薬学的に許容される塩、医薬品、水和物、N酸化物或いはそれらの組み合わせを投与するステップを含む方法を提供する。また、本発明は、脂肪量(fat mass)を減少させる又は除脂肪量(lean mass)を増加させる方法であって、SARMを投与するステップを含む方法を提供する。
【背景技術】
【0002】
骨ミネラル濃度(bone mineral density:BMD)は、男性でも女性でも年齢と共に減少する。BMDと骨塩量(bone mineral content:BMC)が減少すると、骨の強度が低下するため骨折しやすくなる。
【0003】
骨粗鬆症は全身性の骨疾患であり、骨量の低下及び骨組織の劣化という特徴がある。そのため、骨粗鬆症にかかると、骨が脆くなって骨折しやすくなる。アメリカ合衆国では、毎年、2500万人以上がこの病気にかかっており、1300万人以上が骨折している(毎年、50万人が背骨を、25万人が股関節を、24万人が手首を骨折している)。股関節の骨折は骨粗鬆症における最も深刻な問題であり、患者の5〜20%は骨折後1年以内に死に至る。また、死に至らなかったとしても、50%以上が再起不能となる。高齢者は骨粗鬆症にかかる危険性が非常に高いため、高齢化社会が進むにつれてこの問題は極めて深刻化すると懸念されている。全世界での骨折の発生率は、次の60年間で3倍になると予測される。また、ある調査では、2050年には全世界で450万人の股関節骨折が起こると推測している。
【0004】
骨粗鬆症及び他の骨関連疾患の罹患率の増加に伴って、骨関連疾患は男性及び女性の両方で、健康上の重要な関心事となっている。そこで、骨関連疾患の罹患率を減少させるために、基礎科学と臨床レベルの両方において新規で革新的なアプローチが緊急に必要とされている。
【先行技術文献】
【非特許文献】
【0005】
【非特許文献1】Wahner H W,et al, "Nuclear Medicine: Quantitative Procedures ", Toronto little, Brown&Co., 1983, pp.107-132
【非特許文献2】"Assessment of Bone Mineral Part 1", J Nucl Medicine 26, pp.1134-1141,1984
【非特許文献3】"T Bone mineral Denisty of The Radius ", J Nucl Medicine 26, pp.13-39,1985
【発明の概要】
【発明が解決しようとする課題】
【0006】
本発明は、上記したような必要を、次のような手法により満たす。
【課題を解決するための手段】
【0007】
ある実施形態では、本発明は、骨関連疾患の患者を治療する方法であって、患者にSARM化合物を投与するステップを含む方法を提供する。他の実施形態では、この方法は、SARM化合物の類似体、誘導体、異性体、代謝産物、薬学的に許容される塩、医薬品、水和物、N酸化物又はそれらの組み合わせの投与を含んでいる。
【0008】
他の実施形態では、本発明は、骨関連疾患の罹患率を減少させる方法であって、患者にSARM化合物を投与するステップを含む方法を提供する。他の実施形態では、この方法は、SARM化合物の類似体、誘導体、異性体、代謝産物、薬学的に許容される塩、医薬品、水和物、N酸化物又はそれらの組み合わせの投与を含んでいる。
【0009】
他の実施形態では、本発明は、骨強度を増加させる方法であって、患者にSARM化合物を投与するステップを含む方法を提供する。他の実施形態では、この方法は、SARM化合物の類似体、誘導体、異性体、代謝産物、薬学的に許容される塩、医薬品、水和物、N酸化物又はそれらの組み合わせの投与を含んでいる。
【0010】
他の実施形態では、本発明は、骨量を増加させる方法であって、患者にSARM化合物を投与するステップを含む方法を提供する。他の実施形態では、この方法は、SARM化合物の類似体、誘導体、異性体、代謝産物、薬学的に許容される塩、医薬品、水和物、N酸化物又はそれらの組み合わせの投与を含んでいる。
【0011】
他の実施形態では、本発明は、骨吸収の割合を減少させる方法であって、患者にSARM化合物を投与するステップを含む方法を提供する。他の実施形態では、この方法は、SARM化合物の類似体、誘導体、異性体、代謝産物、薬学的に許容される塩、医薬品、水和物、N酸化物又はそれらの組み合わせの投与を含んでいる。
【0012】
他の実施形態では、本発明は、脂肪量(fat mass)を減少させる方法であって、患者にSARM化合物を投与するステップを含む方法を提供する。他の実施形態では、この方法は、SARM化合物の類似体、誘導体、異性体、代謝産物、薬学的に許容される塩、医薬品、水和物、N酸化物又はそれらの組み合わせの投与を含んでいる。
【0013】
他の実施形態では、本発明は、脂肪量の増加率を低減させる方法であって、患者にSARM化合物を投与するステップを含む方法を提供する。他の実施形態では、この方法は、SARM化合物の類似体、誘導体、異性体、代謝産物、薬学的に許容される塩、医薬品、水和物、N酸化物又はそれらの組み合わせの投与を含んでいる。
【0014】
他の実施形態では、本発明は、筋肉量(muscle mass)を増加させる方法であって、患者にSARM化合物を投与するステップを含む方法を提供する。他の実施形態では、この方法は、SARM化合物の類似体、誘導体、異性体、代謝産物、薬学的に許容される塩、医薬品、水和物、N酸化物又はそれらの組み合わせの投与を含んでいる。
【0015】
他の実施形態では、本発明は、筋肉量の減少率を低減させる方法であって、患者にSARM化合物を投与するステップを含む方法を提供する。他の実施形態では、この方法は、SARM化合物の類似体、誘導体、異性体、代謝産物、薬学的に許容される塩、医薬品、水和物、N酸化物又はそれらの組み合わせの投与を含んでいる。
【0016】
他の実施形態では、本発明は、除脂肪量(lean mass)を増加させる方法であって、患者にSARM化合物を投与するステップを含む方法を提供する。他の実施形態では、この方法は、SARM化合物の類似体、誘導体、異性体、代謝産物、薬学的に許容される塩、医薬品、水和物、N酸化物又はそれらの組み合わせの投与を含んでいる。
【図面の簡単な説明】
【0017】
【図1】実験結果を示す表であり、120日目の全身BMDを示す。なお、データは平均値±測定の標準誤差で示している。 a=P<0.05vs.OVX対照 b=P<0.05vs.無傷対照
【図2】実験結果を示す表であり、120日目の腰椎(L5−L6)を示す。なお、データは平均値±測定の標準誤差で示している。 a=P<0.05vs.OVX対照 b=P<0.05vs.無傷対照
【図3】実験結果を示す表であり、120日目の腰椎(L2−L4)を示す。なお、データは平均値±測定の標準誤差で示している。
【図4】実験結果を示す表であり、120日目の大腿領域4を示す。なお、データは平均値±測定の標準誤差で示している。 a=P<0.05vs.OVX対照 b=P<0.05vs.無傷対照
【図5】実験結果を示す表であり、120日目の近位大腿を示す。なお、データは平均値±測定の標準誤差で示している。
【図6】実験結果を示す表であり、120日目の大腿骨中央骨幹の皮質厚を示す。なお、データは平均値±測定の標準誤差で示している。 a=P<0.05vs.OVX対照 b=P<0.05vs.無傷対照
【図7】実験結果を示す表であり、120日目の大腿骨中央骨幹の皮質含量を示す。なお、データは平均値±測定の標準誤差で示している。a=P<0.05vs.OVX対照 b=P<0.05vs.無傷対照
【図8】実験結果を示す表であり、120日目の大腿骨中央骨幹の骨膜を示す。なお、データは平均値±測定の標準誤差で示している。 a=P<0.05vs.OVX対照 b=P<0.05vs.無傷対照
【図9】実験結果を示す表であり、120日目の遠位大腿骨の骨梁密度を示す。なお、データは平均値±測定の標準誤差で示している。 a=P<0.05vs.OVX対照 b=P<0.05vs.無傷対照
【図10】実験結果を示す表であり、120日目の大腿最大負荷を示す。なお、データは平均値±測定の標準誤差で示している。 a=P<0.05vs.OVX対照 b=P<0.05vs.無傷対照
【図11】実験結果を示す表であり、L5脊椎の圧縮強さを示す。なお、データは平均値±測定の標準誤差で示している。
【図12】実験結果を示す表である。A及びBからなり、Aは120日目のBMCの変化割合(%)、BはBMCの経時変化を示す。なお、データは平均値±測定の標準誤差で示している。
【図13】実験結果を示す表であり、30日目のBMCの変化割合(%)を示す。なお、データは平均値±測定の標準誤差で示している。
【図14】実験結果を示す表であり、120日目の体重を示す。なお、データは平均値±測定の標準誤差で示している。 a=P<0.05vs.OVX対照 b=P<0.05vs.無傷対照
【図15】実験結果を示す表であり、120日目のFM割合(%)を示す。なお、データは平均値±測定の標準誤差で示している。 a=P<0.05vs.OVX対照 b=P<0.05vs.無傷対照
【図16】実験結果を示す表であり、120日目の血清オステオカルシンレベルを示す。なお、データは平均値±測定の標準誤差で示している。 a=P<0.05vs.OVX対照 b=P<0.05vs.無傷対照
【図17】実験結果を示す表であり、210日目の全身BMCを示す。なお、データは平均値±測定の標準誤差で示している。 a=P<0.05vs.OVX対照 b=P<0.05vs.無傷対照
【図18】実験結果を示す表であり、210日目の腰椎(L5−L6)BMCを示す。なお、データは平均値±測定の標準誤差で示している。 a=P<0.05vs.OVX対照 b=P<0.05vs.無傷対照 無傷対照は210日目に屠殺した
【図19】実験結果を示す表であり、210日目の全身BMDを示す。なお、データは平均値±測定の標準誤差で示している。 a=P<0.05vs.OVX対照 b=P<0.05vs.無傷対照 無傷対照は210日目に屠殺した
【図20】実験結果を示す表であり、210日目の大腿骨中央骨幹の皮質含量を示す。なお、データは平均値±測定の標準誤差で示している。 a=P<0.05vs.OVX対照 b=P<0.05vs.無傷対照
【図21】実験結果を示す表であり、210日目の大腿骨中央骨幹の皮質厚を示す。なお、データは平均値±測定の標準誤差で示している。 a=P<0.05vs.OVX対照 b=P<0.05vs.無傷対照
【図22】実験結果を示す表であり、210日目の大腿骨中央骨幹の骨膜を示す。なお、データは平均値±測定の標準誤差で示している。 a=P<0.05vs.OVX対照 b=P<0.05vs.無傷対照
【図23】実験結果を示す表であり、210日目の遠位大腿骨の骨梁密度を示す。なお、データは平均値±測定の標準誤差で示している。 a=P<0.05vs.OVX対照 b=P<0.05vs.無傷対照
【図24】実験結果を示す表であり、210日目の大腿最大負荷を示す。なお、データは平均値±測定の標準誤差で示している。 a=P<0.05vs.OVX対照 b=P<0.05vs.無傷対照
【図25】実験結果を示す表であり、210日目の体重を示す。なお、データは平均値±測定の標準誤差で示している。 a=P<0.05vs.OVX対照 b=P<0.05vs.無傷対照
【図26】実験結果を示す表であり、210日目のFM割合(%)を示す。なお、データは平均値±測定の標準誤差で示している。 a=P<0.05vs.OVX対照 b=P<0.05vs.無傷対照
【図27】実験結果を示す表であり、120日目の全身BMDを示す。なお、データは平均値±測定の標準誤差で示している。 a=P<0.05vs.OVX対照 b=P<0.05vs.無傷対照
【図28】実験結果を示す表であり、120日目のL5−L6脊椎のBMDを示す。なお、データは平均値±測定の標準誤差で示している。 a=P<0.05vs.OVX対照 b=P<0.05vs.無傷対照
【図29】実験結果を示す表であり、210日目の全身BMDを示す。なお、データは平均値±測定の標準誤差で示している。 a=P<0.05vs.OVX対照 b=P<0.05vs.無傷対照
【図30】実験結果を示す表であり、210日目のL5−L6脊椎のBMDを示す。なお、データは平均値±測定の標準誤差で示している。 a=P<0.05vs.OVX対照 b=P<0.05vs.無傷対照
【図31】実験結果を示す表であり、120日目の体重を示す。なお、データは平均値±測定の標準誤差で示している。 a=P<0.05vs.OVX対照 b=P<0.05vs.無傷対照
【図32】実験結果を示す表であり、210日目の体重を示す。なお、データは平均値±測定の標準誤差で示している。 a=P<0.05vs.OVX対照 b=P<0.05vs.無傷対照
【図33】実験結果を示す表であり、120日目のFM割合(%)を示す。なお、データは平均値±測定の標準誤差で示している。 a=P<0.05vs.OVX対照 b=P<0.05vs.無傷対照
【図34】実験結果を示す表であり、210日目のFM割合(%)を示す。なお、データは平均値±測定の標準誤差で示している。 a=P<0.05vs.OVX対照 b=P<0.05vs.無傷対照
【発明を実施するための形態】
【0018】
本発明は、骨関連疾患を治療、予防、抑止及び抑制する並びに骨関連疾患の罹患率を減少させる方法であって、患者に、選択的アンドロゲン受容体調節剤(selective androgen receptor modulator:SARM)及び/又はその類似体、誘導体、異性体、代謝産物、薬学的に許容される塩、医薬品、水和物、N酸化物或いはそれらの組み合わせを投与するステップを含む方法を提供する。また、本発明は、患者の骨強度又は骨量を増加させる方法、患者の筋肉量を増加させる方法、又は、患者の脂肪量を減少させる方法であって、SARM化合物を投与するステップを含む方法を提供する。
【0019】
他の実施形態では、本発明は、骨関連疾患の罹患率を減少させる方法であって、患者にSARM化合物を投与するステップを含む方法を提供する。他の実施形態では、この方法は、SARM化合物の類似体、誘導体、異性体、代謝産物、薬学的に許容される塩、医薬品、水和物、N酸化物又はそれらの組み合わせの投与を含んでいる。
【0020】
他の実施形態では、本発明は、骨関連疾患を予防する方法であって、患者にSARM化合物を投与するステップを含む方法を提供する。他の実施形態では、この方法は、SARM化合物の類似体、誘導体、異性体、代謝産物、薬学的に許容される塩、医薬品、水和物、N酸化物又はそれらの組み合わせの投与を含んでいる。
【0021】
ある実施形態では、骨関連疾患は骨粗鬆症である。ある実施形態では、骨関連疾患は骨減少症である。ある実施形態では、骨関連疾患は骨吸収の増加である。ある実施形態では、骨関連疾患は骨折である。ある実施形態では、骨関連疾患は骨の脆弱化である。ある実施形態では、骨関連疾患はBMDの減少である。ある実施形態では、骨関連疾患は、骨粗鬆症、骨減少症、骨吸収の増加、骨折、骨の脆弱化及びBMD減少の任意の組み合わせである。それぞれの疾患は、本発明の別個の実施形態に相当する。
【0022】
“骨粗鬆症”は、ある実施形態では、カルシウムや骨タンパク質の不足に起因する骨量の減少によって、骨が細くなる病気である。他の実施形態では、骨粗鬆症は全身性の骨疾患であり、骨量の低下及び骨組織の劣化という特徴がある。そのため、骨粗鬆症にかかると、骨は脆くなって骨折しやすくなる。ある実施形態では、骨粗鬆症にかかると、骨強度が正常でなくなるので、骨折しやすくなる。他の実施形態では、骨粗鬆症にかかると、通常は骨内に見られるカルシウム及びタンパク質コラーゲンの両方を激減させる。ある実施形態では、その結果、骨質の異常や骨密度の減少をもたらす。他の実施形態では、骨粗鬆症にかかった骨は、通常は骨折しないようなちょっとした転倒でも、骨折したり損傷したりする。骨折は、ある実施形態では、亀裂骨折(例えば股関節の)又は崩壊骨折(例えば背骨の圧迫骨折)である。骨粗鬆症によって骨折する一般的な部位は背骨、股関節及び手首である(ただし、骨折は他の骨格部位でも起こり得る)。骨粗鬆症を治療せずに放っておくと、姿勢の変化、身体の異常及び可動域の減少が生じ得る。
【0023】
ある実施形態では、骨粗鬆症は、アンドロゲンの欠乏に起因して生じる。他の実施形態では、骨粗鬆症は、アンドロゲンの欠乏をもたらす。他の実施形態では、骨粗鬆症は原発性骨粗鬆症である。他の実施形態では、骨粗鬆症は続発性骨粗鬆症である。他の実施形態では、骨粗鬆症は閉経後骨粗鬆症である。他の実施形態では、骨粗鬆症は若年性骨粗鬆症である。他の実施形態では、骨粗鬆症は特発性骨粗鬆症である。他の実施形態では、骨粗鬆症は老人性骨粗鬆症である。
【0024】
他の実施形態では、原発性骨粗鬆症はI型原発性骨粗鬆症である。他の実施形態では、原発性骨粗鬆症はII型原発性骨粗鬆症である。それぞれの骨粗鬆症は、本発明の別個の実施形態に相当する。
【0025】
骨粗鬆症及び骨減少症は、他の実施形態では、全身性の骨疾患であり、骨量の低下及び骨組織の微細構造の劣化という特徴がある。“微細構造の劣化”は、ある実施形態では、骨梁(後に定義する)が細くなり、骨内の骨梁間の結合が失われることである。他の実施形態では、“骨粗鬆症”は、BMDが若年成人の平均値を2.5SD(standard deviation:標準偏差)以上下回った状態と定義される。他の実施形態では、“骨粗鬆症”は、BMCが若年成人の平均値を2.5以上下回った状態と定義される。他の実施形態では、“骨粗鬆症”は、BMDが若年成人の平均値を2.0SD以上下回った状態と定義される。他の実施形態では、“骨粗鬆症”は、BMCが若年成人の平均値を2.0SD以上下回った状態と定義される。他の実施形態では、“骨粗鬆症”は、BMDが若年成人の平均値を3.0SD以上下回った状態と定義される。他の実施形態では、“骨粗鬆症”は、BMCが若年成人の平均値を3.0SD以上下回った状態と定義される。骨粗鬆症及び骨減少症のそれぞれの定義は、本発明の別個の実施形態に相当する。
【0026】
他の実施形態では、“骨粗鬆症”は、BMDが若年成人の平均値を2.5SD下回った状態と定義される。他の実施形態では、“骨粗鬆症”は、BMCが若年成人の平均値を2.5下回った状態と定義される。他の実施形態では、“骨粗鬆症”は、BMDが若年成人の平均値を2.0SD下回った状態と定義される。他の実施形態では、“骨粗鬆症”は、BMCが若年成人の平均値を2.0SD下回った状態と定義される。他の実施形態では、“骨粗鬆症”は、BMDが若年成人の平均値を3.0SD下回った状態と定義される。他の実施形態では、“骨粗鬆症”は、BMCが若年成人の平均値を3.0SD下回った状態と定義される。骨粗鬆症及び骨減少症のそれぞれの定義は、本発明の別個の実施形態に相当する。
【0027】
骨粗鬆症及び骨減少症の評価方法は、当該技術分野では周知である。例えば、ある実施形態では、濃度測定によって測定された患者のBMD(g/cm2)を、性別が同一の若年成人における骨量ピーク時のBMD平均値である“正常値”と比較した“Tスコア”によって評価する。他の実施形態では、患者の骨量減少を表すZスコアを、性別及び年齢が同一の人間の予測される損失と比較して評価する。他の実施形態では、“骨粗鬆症”は、Tスコアが若年成人の平均値を2.5SD以上下回った状態と定義される。他の実施形態では、“骨粗鬆症”は、Zスコアが若年成人の平均値を2.5SD以上下回った状態と定義される。他の実施形態では、“骨粗鬆症”は、Tスコアが若年成人の平均値を2.0SD以上下回った状態と定義される。他の実施形態では、“骨粗鬆症”は、Zスコアが若年成人の平均値を2.0SD以上下回った状態と定義される。他の実施形態では、“骨粗鬆症”は、Tスコアが若年成人の平均値を3.0SD以上下回った状態と定義される。他の実施形態では、“骨粗鬆症”は、Zスコアが若年成人の平均値を3.0SD以上下回った状態と定義される。
【0028】
他の実施形態では、“骨粗鬆症”は、Tスコアが若年成人の平均値を2.5SD下回った状態と定義される。他の実施形態では、“骨粗鬆症”は、Zスコアが若年成人の平均値を2.5SD下回った状態と定義される。他の実施形態では、“骨粗鬆症”は、Tスコアが若年成人の平均値を2.0SD下回った状態と定義される。他の実施形態では、“骨粗鬆症”は、Zスコアが若年成人の平均値を2.0SD下回った状態と定義される。他の実施形態では、“骨粗鬆症”は、Tスコアが若年成人の平均値を3.0SD下回った状態と定義される。他の実施形態では、“骨粗鬆症”は、Zスコアが若年成人の平均値を3.0SD下回った状態と定義される。骨粗鬆症及び骨減少症のそれぞれの定義は、本発明の別個の実施形態に相当する。
【0029】
“BMD”は、ある実施形態では、骨量の真の測定値を意味する。BMDによって測定される骨の絶対量は、一般的に、骨強度及び重量に耐える能力と関係がある。血圧の測定によって脳梗塞の危険が予測可能であるのと同様に、BMDの測定によって骨折の危険が予測可能である。
【0030】
BMDは、ある実施形態では、公知のBMDマッピング手法によって測定できる。ある実施形態では、腰、背骨、手首又は踵骨の骨密度を、様々な手法によって測定する。好ましいBMD測定手法は、二重エネルギーX線吸収測定法(dual-energy x-ray absorptiometry:DEXA)である。腰、前後方向の背骨(anteroposteriorl spine)、側方の背骨(lateral spine)及び手首のBMDは、この手法によって測定できる。その部位における全体的な骨折の予測はどの部分の測定によっても行えるが、特定部分の情報がその部位における骨折の予測に適している。背骨のBMDの測定には、定量的コンピュータ断層撮影(quantitative computerized tomography:QCT)を使用することもできる。詳しくは、例えば、「Nuclear Medicine: Quantitative Procedures(by Wahner H W,et al, Toronto little, Brown&Co., 1983, pp.107-132)(非特許文献1)、「Assessment of Bone Mineral Part 1(J Nucl Medicine 26, pp.1134-1141,1984)」(非特許文献2)、及び、「Bone mineral Denisty of The Radius(J Nucl Medicine 26, pp.13-39,1985)」(非特許文献3)を参照されたい。それぞれの手法は、本発明の別個の実施形態に相当する。
【0031】
“骨減少症”は、ある実施形態では、BMD又はBMCが若年成人の平均値を1〜2.5SD下回った状態である。他の実施形態では、骨減少症は、骨の石灰化又は骨の密度を減少させることを意味する。この用語は、ある実施形態では、そのような状態が見られる全ての骨格系を含む。本発明において開示されている判断のそれぞれの定義又は意味は、本発明の別個の実施形態に相当する。
【0032】
ある実施形態では、“骨折”は、骨の破壊を意味し、脊椎骨折及び非脊椎骨折の両方を含む。“骨の脆弱化”は、ある実施形態では、骨が弱体化し、骨折しやすくなった状態を意味する。
【0033】
ある実施形態では、本発明に係る骨粗鬆症、骨減少症、骨吸収の増加、骨折、骨の脆弱化、BMDの減少及び他の疾患・障害は、ホルモン障害、ホルモン崩壊又はホルモン失調によって生じる。他の実施形態では、これらの状態は、ホルモン障害、ホルモン崩壊又はホルモン失調とは無関係に生じる。それぞれの可能性は、本発明の別個の実施形態に相当する。
【0034】
ある実施形態では、ホルモン障害、ホルモン崩壊及びホルモン失調は、ホルモン過剰を含む。他の実施形態では、ホルモン障害、ホルモン崩壊及びホルモン失調は、ホルモン欠乏を含む。ある実施形態では、ホルモンはステロイド・ホルモンである。他の実施形態では、ホルモンはエストロゲンである。他の実施形態では、ホルモンはアンドロゲンである。他の実施形態では、ホルモンはグルココルチコイトである。他の実施形態では、ホルモンはコルチコイト・ステロイドである。他の実施形態では、ホルモンは黄体形成ホルモン(LH)である。他の実施形態では、ホルモンは卵胞刺激ホルモン(FSH)である。他の実施形態では、ホルモンは、当該技術分野では周知の任意のホルモンである。他の実施形態では、ホルモン障害、ホルモン崩壊及びホルモン失調は、更年期障害と関係がある。それぞれの可能性は、本発明の別個の実施形態に相当する。
【0035】
例えば、図1〜5に示した結果は、身体の全体及び多くの特定部位の両方において、SARMがBMDの減少を防止することを実証している。これらの実験は、人間の骨粗鬆症治療に役立つことが大いに予測されている、卵巣を切除した(OVX)ラットモデルを利用して行う(Kalu DN,Bone Miner 15:175-91,1991)。BMDの減少は、骨粗鬆症の重要な指標であり、骨強度の減少と及び骨折の発生率増加と関係がある。BMDの減少を抑制することによって、骨粗鬆症のこれらの症状(及び他の症状)は同様に防止される。図12〜13に示した結果は、SARMがBMCを増加させることを示しており、骨粗鬆症マウスにおける骨強度の他の指標は、図1〜5の結果を実証している。
【0036】
他の実施形態では、本発明は、骨強度を増加させる方法であって、患者にSARM化合物を投与するステップを含む方法を提供する。他の実施形態では、この方法は、SARM化合物の類似体、誘導体、異性体、代謝産物、薬学的に許容される塩、医薬品、水和物、N酸化物又はそれらの組み合わせの投与を含んでいる。
【0037】
他の実施形態では、本発明は、患者の質を向上させる方法であって、患者にSARM化合物を投与するステップを含む方法を提供する。他の実施形態では、この方法は、SARM化合物の類似体、誘導体、異性体、代謝産物、薬学的に許容される塩、医薬品、水和物、N酸化物又はそれらの組み合わせの投与を含んでいる。
【0038】
骨量、骨強度及び骨質の評価方法は、当該技術分野では周知である。例えば、骨強度は、ある実施形態では、生体力学的試験によって評価することができる(図10、11、24)。骨量は、ある実施形態では、DEXA(図1、2,4、14、15、17〜19、25、26)又はpQCT(図6〜9、図20〜23)によって評価することができる。骨質は、BMCを測定することによって評価することができる(図12〜13)。骨量及び骨強度を評価するための他の方法は、例えば、Faulkner KGら(Am J Roesntgenology 157:1229-1237,1991)によって開示されている。それぞれの方法は、本発明の別個の実施形態に相当する。
【0039】
本発明で使用される様々な骨量、骨強度及び骨質の測定方法では、同様の結果が得られる。異なる測定方法での結果が一致することは、本発明での実験結果の正当性を証明している。
【0040】
他の実施形態では、本発明は、患者の骨量を増加させる方法であって、患者にSARM化合物を投与するステップを含む方法を提供する。他の実施形態では、この方法は、SARM化合物の類似体、誘導体、異性体、代謝産物、薬学的に許容される塩、医薬品、水和物、N酸化物又はそれらの組み合わせの投与を含んでいる。
【0041】
他の実施形態では、本発明は、患者の骨吸収の割合を減少させる方法であって、患者にSARM化合物を投与するステップを含む方法を提供する。この方法は、SARM化合物の類似体、誘導体、異性体、代謝産物、薬学的に許容される塩、医薬品、水和物、N酸化物又はそれらの組み合わせの投与を含んでいる。
【0042】
他の実施形態では、本発明は、患者の骨吸収を防止する方法であって、患者にSARM化合物を投与するステップを含む方法を提供する。他の実施形態では、この方法は、SARM化合物の類似体、誘導体、異性体、代謝産物、薬学的に許容される塩、医薬品、水和物、N酸化物又はそれらの組み合わせの投与を含んでいる。
【0043】
骨吸収は、ある実施形態では、骨粗鬆症、更年期障害及び/又はアンドロゲン欠乏などの疾患によって、骨量及び/又は骨強度が減少するという主な作用である。骨吸収の測定方法は、当該技術分野では周知である。例えば、骨吸収は、ある実施形態では、骨吸収と相関する、血清中のオステオカルシン濃度を測定することによって評価できる(実施形態8)。他の実施形態では、骨吸収は、BMDを測定することによって評価できる(図12〜13)。他の実施形態では、骨吸収は、尿中のデオキシピリジノリンの濃度を測定することによって評価できる。ある実施形態では、骨吸収は、血中のインスリン様成長因子1(IGF−1)濃度を測定することによって評価できる。骨吸収を評価するそれぞれの方法は、本発明の別個の実施形態に相当する。
【0044】
他の実施形態では、“骨吸収”は、破骨細胞活性に起因する骨量の減少を意味する。人間の骨は、絶えず、骨吸収及び骨形成の再生活動を活発に行っている。骨吸収は、この実施形態では、破骨細胞が骨基質を破壊することによって行われる。また、骨疾患の大部分は、骨形成と骨吸収の釣り合いが崩れることによって生じる。骨粗鬆症は、再生活動中に、骨吸収に対して新骨形成が不足することによって生じる。
【0045】
ある実施形態では、本発明の治療対象は骨粗鬆症である。他の実施形態では、本発明の治療対象は骨減少症である。他の実施形態では、本発明の治療対象は骨吸収の増加である。他の実施形態では、本発明の治療対象は骨折である。他の実施形態では、本発明の治療対象は骨の脆弱化である。本発明の治療対象はBMDの減少したである。本発明の治療対象は、骨粗鬆症、骨減少症、骨吸収の増加、骨折及び骨の脆弱化の任意の組み合わせである。それぞれの疾患は、本発明の別個の実施形態に相当する。
【0046】
例えば、図1〜13に示した結果は、卵巣を切除した結果生じる骨吸収の増加、BMDの減少及び骨強度の減少は、評価される骨の場所及び種類に応じて、SARM治療によって部分的又は完全に抑制されることを示している。したがって、SARMは、例えば骨粗鬆症、更年期障害又は前述した他の疾患によって生じる、骨吸収の増加、BMDの減少及び骨強度の減少を低減させるのに有効である。
【0047】
ある実施形態では、本発明の治療対象は男性である。他の実施形態では、本発明の治療対象は高齢男性である。他の実施形態では、本発明の治療対象は、去勢された男性である。他の実施形態では、本発明の治療対象は、アンドロゲン欠乏治療を受けている男性である。他の実施形態では、本発明の治療対象は、前立腺癌の患者である。他の実施形態では、本発明の治療対象は、他の種類の癌患者(男性又は女性)である。他の実施形態では、本発明の治療対象は、化学療法を受けている患者である。他の実施形態では、本発明の治療対象は、最近になって化学療法を受けている患者である。
【0048】
他の実施形態では、治療対象は、女性である。他の実施形態では、治療対象は、高齢女性である。他の実施形態では、治療対象は、HIV陽性の閉経前女性である。他の実施形態では、治療対象は、アジソン病の女性である。他の実施形態では、治療対象は、下垂体機能低下症の女性である。他の実施形態では、治療対象は、OVXの女性である。
【0049】
他の実施形態では、本発明に係るSARM化合物が投与される患者は、高齢の男性である。“高齢(aging)”は、ある実施形態では、高齢になるまでの途中過程を意味する。他の実施形態では、高齢の患者は、40歳以上である。他の実施形態では、高齢の患者は、45歳以上である。他の実施形態では、高齢の患者は、50歳以上である。他の実施形態では、高齢の患者は、55歳以上である。他の実施形態では、高齢の患者は、60歳以上である。他の実施形態では、高齢の患者は、65歳以上である。他の実施形態では、高齢の患者は、70歳以上である。患者のそれぞれの種類は、本発明の別個の実施形態に相当する。
【0050】
他の実施形態では、本発明の治療対象は、骨粗鬆症、骨減少症、骨吸収の増加、骨折、骨の脆弱化又はBMDの減少ではない。図16〜24に示した結果は、骨粗鬆症によって生じたBMD減少と骨強度減少を、SARMによって覆す(reverse)できることを示している。つまり、SARMは、骨吸収を抑制する作用とは無関係の、同化作用を有している。したがって、SARMのBMD、骨強度及び骨質に対するプラス効果は、骨関連疾患患者だけに限定されない。SARMの長所は、BMD、骨強度及び骨質の向上が求められる任意の状況に適用可能なことである。
【0051】
したがって、他の実施形態では、本発明は、BMDの減少を覆す方法であって、患者にSARM又はその代謝物或いはそれらの誘導体を投与するステップを含む方法を提供する。他の実施形態では、本発明は、骨粗鬆症を覆す方法であって、患者にSARM又はその代謝物或いはそれらの誘導体を投与するステップを含む方法を提供する。他の実施形態では、本発明は、骨減少症を覆す方法であって、患者にSARM又はその代謝物或いはそれらの誘導体を投与するステップを含む方法を提供する。他の実施形態では、本発明は、骨の脆弱化を覆す方法であって、患者にSARM又はその代謝物或いはそれらの誘導体を投与するステップを含む方法を提供する。他の実施形態では、BMDの減少、骨粗鬆症、骨減少症又は骨の脆弱化は、更年期障害又は他のホルモン障害或いは失調によって起こり得る。それぞれの方法は、本発明の別個の実施形態に相当する。
【0052】
骨格には、例えば皮質骨や骨梁などの、様々な異なる種類の骨が存在する。皮質骨は、骨梁を取り囲み、保護的に被覆する。皮質骨は、骨膜層(骨の外皮)、皮質内層(中間層)、骨内膜層(骨髄腔に隣接した層)という3つの層から成る。皮質骨は、手足(limb)内で顕著であり、ある実施形態では骨格の強度において大きな役割を果たしている。ある実施形態では、皮質骨は、ハバース(Haversian)又は緻密骨と呼ばれる。骨梁は骨代謝に関与し、ある実施形態では、海綿骨又は網状骨として知られている。皮質骨と骨梁の割合は、身体内で骨によって異なる。
【0053】
したがって、ある実施形態では、強度又は量が増加する骨は皮質骨である。皮質骨に対してのSARMの有益な作用は、図6〜8及び20〜22に示されている。他の実施形態では、骨は骨梁である。骨梁に対してのSARMの有益な作用は、図9に示されている。他の実施形態では、骨は網状骨である。他の実施形態では、骨はハバース骨である。他の実施形態では、骨は、様々な種類の骨組織を含んでいる無傷の骨である。他の実施形態では、皮質骨の特定の層は、本発明に係る方法の作用を受け得る。ある実施形態では、前記層は骨膜層である。他の実施形態では、前記層は皮質内層である。他の実施形態では、前記層は骨内膜層である。骨のそれぞれの種類は、本発明の別個の実施形態に相当する。
【0054】
他の実施形態では、本発明は患者の脂肪量(fat mass)を減少させる方法であって、患者にSARM化合物を投与するステップを含む方法を提供する。他の実施形態では、この方法は、SARM化合物の類似体、誘導体、異性体、代謝産物、薬学的に許容される塩、医薬品、水和物、N酸化物又はそれらの組み合わせの投与を含んでいる。
【0055】
他の実施形態では、本発明は患者の脂肪量の増加を低減させる方法であって、者にSARM化合物を投与するステップを含む方法を提供する。他の実施形態では、この方法は、SARM化合物の類似体、誘導体、異性体、代謝産物、薬学的に許容される塩、医薬品、水和物、N酸化物又はそれらの組み合わせの投与を含んでいる。
【0056】
他の実施形態では、本発明は患者の筋肉量を増加させる方法であって、患者にSARM化合物を投与するステップを含む方法を提供する。他の実施形態では、この方法は、SARM化合物の類似体、誘導体、異性体、代謝産物、薬学的に許容される塩、医薬品、水和物、N酸化物又はそれらの組み合わせの投与を含んでいる。
【0057】
他の実施形態では、本発明は患者の筋肉量の減少を低減させる方法であって、患者にSARM化合物を投与するステップを含む方法を提供する。他の実施形態では、この方法は、SARM化合物の類似体、誘導体、異性体、代謝産物、薬学的に許容される塩、医薬品、水和物、N酸化物又はそれらの組み合わせの投与を含んでいる。
【0058】
他の実施形態では、本発明は、患者の除脂肪量(lean mass)を増加させる方法であって、患者にSARM化合物を投与するステップを含む方法を提供する。他の実施形態では、この方法は、SARM化合物の類似体、誘導体、異性体、代謝産物、薬学的に許容される塩、医薬品、水和物、N酸化物又はそれらの組み合わせの投与を含んでいる。
【0059】
他の実施形態では、実施例7の結果は、SARMが脂肪量の割合を減少させることを示しており、OVX動物における除脂肪量の割合を増加させることを示している。
【0060】
例えば、図7の結果は、SARMが脂肪量の割合を減少させ、OVX動物における除脂肪量の割合を増大させることを示している。除脂肪量は、いくつかの理由によって骨折の危険性に影響を及ぼす。第1に、筋肉量の増加は、BMDの増加に間接的に関与する。第2に、筋肉量の増加は、筋肉のバランスと強度を向上させ、高齢者の骨折の主な原因である転倒の危険性を減少させる。したがって、他の実施形態では、本発明は、筋肉量を増加させることによって、骨折の危険性を減少させる方法を提供する。他の実施形態では、本発明は、脂肪量を減少させることによって、骨折の危険性を減少させる方法を提供する。これらの結果は、図25に示した体重の実験結果と共に、除脂肪量の減少が覆されることを示している。したがって、脂肪量、筋肉量及び除脂肪量に対してのSARMのプラス効果は骨関連疾患の患者に限定されるものではなく、脂肪量を減少させたい状況並びに筋肉量及び除脂肪量を増加させたい状況にも当て嵌まる。
【0061】
“脂肪量(FM)”は、ある実施形態では、患者の全脂肪の合計量を意味する。他の実施形態では、脂肪量は、患者の体脂肪の割合を意味する。他の実施形態では、脂肪量は、身体の特定の部位における脂肪の総計又は脂肪の割合を意味する。他の実施形態では、脂肪量は、特定種類の脂肪の総計又は割合を意味する。脂肪量のそれぞれの種類は、本発明の別個の実施形態に相当する。
【0062】
ある実施形態では、本発明の作用を受ける脂肪は、皮下脂肪である。他の実施形態では、本発明の作用を受ける脂肪は、体幹脂肪である。他の実施形態では、本発明の作用を受ける脂肪は、腹内脂肪である。他の実施形態では、本発明の作用を受ける脂肪は、当該技術分野では周知の他の脂肪である。脂肪のそれぞれの種類は、本発明の別個の実施形態に相当する。
【0063】
ある実施形態では、脂肪量の減少、並びに、除脂肪量及び/又は筋肉量の増加は、グルコース代謝作用の低下に対してプラスの効果を与える。他の実施形態では、脂肪量の減少、並びに、除脂肪量及び/又は筋肉量の増加は、糖尿病に対してプラスの効果を与える。他の実施形態では、脂肪量の減少、並びに、除脂肪量及び/又は筋肉量の増加は、高血圧に対してプラスの効果を与える。他の実施形態では、脂肪量の減少、並びに、除脂肪量及び/又は筋肉量の増加は、冠状動脈性心臓病に対してプラスの効果を与える。他の実施形態では、脂肪量の減少、並びに、除脂肪量及び/又は筋肉量の増加は、肥満に対してプラスの効果を与える。他の実施形態では、脂肪量の減少、並びに、除脂肪量及び/又は筋肉量の増加は、グルコース代謝作用の低下、糖尿病、高血圧、冠状動脈性心臓病又は肥満に関連する疾病或いは疾患に対してプラスの効果を与える。したがって、他の実施形態では、本発明は、グルコース代謝作用の低下、糖尿病、高血圧、冠状動脈性心臓病、肥満又はそれらに関連する疾病或いは疾患を治療又は改善する方法であって、患者にSARM化合物又はその代謝物或いはそれらの誘導体を投与するステップを含む方法を提供する。
【0064】
《選択的アンドロゲン受容体調節剤(SARM)》
本発明に係るSARM化合物は、ある実施形態では、アンドロゲン又は抗アンドロゲン活性及びタンパク同化作用を有する、新しい種類のAR標的物質である。他の実施形態では、本発明に係るSARM化合物は、アンドロゲン受容体(androgen receptor:AR)に対する新しい種類の非ステロイド性リガンドである。
【0065】
他の実施形態では、本発明に係るSARM化合物は、その生物活性に応じてサブグループに分類される。例えば、いくつかのSARM化合物は、筋肉又は骨に対してのアゴニスト作用を有するが、他のSARM化合物は、筋肉又は骨に対してのアゴニスト作用を有さない。
【0066】
ARは、その内因性アンドロゲン(男性ホルモン)との活性を介して男性の性的発育及び機能の誘発を仲立ちする、リガンドが活性化された転写調節タンパク質である。アンドロゲン(例えばDHTやテストステロン)は、体内の睾丸及び副腎皮質から分泌されるステロイドである。したがって、ある実施形態では、このSARMは、非ステロイドなので、従来知られているARリガンドとは異なるARリガンドである。
【0067】
受容体アゴニストは、ある実施形態では、受容体と結合して、その受容体を活性化させる物質である。受容体部分アゴニストは、ある実施形態では、受容体と結合して、その受容体を部分的に活性化させる物質である。受容体アンタゴニストは、ある実施形態では、受容体と結合して、その受容体を不活性にする物質である。ある実施形態では、本発明に係るSARM化合物は組織選択性を有し、組織に応じて、ある物質は、アゴニスト、部分的アゴニスト及び/又はアンタゴニストである。例えば、SARM化合物は、筋肉組織を刺激すると同時に、前立腺組織を抑制する。ある実施形態では、本発明に係るSARM化合物はARアゴニストである。他の実施形態では、本発明に係るSARM化合物はARアンタゴニストである。本発明に係る化合物がARアゴニストであるかアンタゴニストであるかを判断するための分析方法は、当該技術分野では周知である。例えば、ARアゴニスト活性は、重量測定によって計測したSARM化合物における、AR含有組織(例えば前立腺や精嚢)の成長を維持及び/又は刺激する能力をモニタリングすることで判断できる。ARアンタゴニスト活性は、SARM化合物における、AR含有組織の成長を阻害する能力をモニタリングすることで判断できる。
【0068】
他の実施形態では、本発明に係るSARM化合物は、ARの部分的アゴニスト又はアンタゴニストとして分類することもできる。SARMはある組織内ではARアゴニストであり、AR反応遺伝子の転写を増加させる(例えば筋肉同化効果)。他の組織内では、これらの化合物は、天然アンドロゲンのアゴニスト作用を予防するために、ARにおいてテストステロン及び/又はジヒドロテストステロン(dihydrotestosterone:DHT)の拮抗阻害剤して作用する。SARMのそれぞれの種類は、本発明の別個の実施形態に相当する。
【0069】
ある実施形態では、本発明に係るSARM化合物は、ARと可逆的又は不可逆的に結合する。他の実施形態では、SARM化合物は、ARと可逆的に結合する。ある実施形態では、SARM化合物は、ARと不可逆的に結合する。本発明に係るSARM化合物は、AR(すなわち共有結合構造)のアルキル化が可能な官能基(親和性標識)を有している。この場合、SARM化合物は、受容体と不可逆的に結合するので、内在性リガンドDHTやテストステロンなどのステロイドによって置換されない。
【0070】
本発明のある実施形態では、SARM化合物が患者に投与される。他の実施形態では、SARM化合物の類似体が患者に投与される。他の実施形態では、SARM化合物の誘導体が患者に投与される。他の実施形態では、SARM化合物の異性体が患者に投与される。他の実施形態では、SARM化合物の代謝産物が患者に投与される。他の実施形態では、SARM化合物の薬学的に許容される塩が患者に投与される。他の実施形態では、SARM化合物の医薬品が患者に投与される。他の実施形態では、SARM化合物の水和物が患者に投与される。他の実施形態では、SARM化合物のN酸化物が患者に投与される。他の実施形態では、本発明に係る方法では、SARM化合物の類似体、異性体、代謝産物、誘導体、薬学的に許容される塩、医薬品、水和物又はN酸化物の任意の組み合わせが患者に投与される。
【0071】
“異性体”という用語は、ある実施形態では、光学異性体を意味する。他の実施形態では、“異性体”は、類似体を意味する。他の実施形態では、“異性体”は、構造異性体を意味する。他の実施形態では、“異性体”は、構造的類似体を意味する。他の実施形態では、“異性体”は、配座異性体を意味する。他の実施形態では、“異性体”は、当該技術分野では周知である他の種類の異性体を意味する。異性体のそれぞれの種類は、本発明の別個の実施形態に相当する。
【0072】
他の実施形態では、本発明は、SARM化合物の様々な光学異性体の使用を含んでいる。本発明に係るSARMが少なくとも1つのキラル中心を有していることは、当業者なら容易に理解できるであろう。したがって、本発明に係る方法で使用されるSARMは、光学的活性体又はラセミ体内で単離した状態で存在している。ある化合物は、多形性を示す。当然のことながら、本発明は、前述したアンドロゲンに関連する病気の治療に役立つ形状である、任意のラセミ体、光学活性体、多形性、立体異性形状又はそれらの混合物を含む。ある実施形態では、SARMは、純粋な(R)異性体である。他の実施形態では、SARMは、純粋な(S)異性体である。他の実施形態では、SARMは、(R)異性体と(S)異性体との混合物である。他の実施形態では、SARMは、(R)異性体と(S)異性体とを同量含むラセミ混合物である。当該技術分野では、光学活性体を作成する方法は周知である(例えば、再結晶法によるラセミ体の分解によって、光学体活体開始物質の合成によって、キラル合成によって、又は、キラル固定相を使用したクロマトグラフ分離によって作成する)。
【0073】
本発明は、他の実施形態では、例えばクエン酸や塩酸のような、有機酸又は無機酸を有するアミノ置換化合物の“薬学的に許容される塩”を含む。また、本発明は、前述した化合物のアミノ置換基のN酸化物を含む。薬学的に許容される塩は、例えば水酸化ナトリウムのような無機塩基を処理することによって、フェノール化合物から生成することもできる。また、フェノール化合物のエステルは、脂肪族及び芳香族カルボン酸(例えば酢酸エステルと安息香酸エステル)から生成することもできる。
【0074】
本発明は、SARM化合物の誘導体をさらに含む。“誘導体”という用語は、エーテル誘導体、酸誘導体、アミノ誘導体、エステル誘導体などを含む(ただし、これらに限定されるものではない)。さらに、本発明は、SARM化合物の水和物を含む。“水和物”という用語は、半水和物、一水和物、二水和物、三水和物などを含む(ただし、これらに限定されるものではない)。
【0075】
本発明は、SARM化合物の代謝産物をさらに含む。“代謝産物”という用語は、ある実施形態では、別の物質から代謝作用又は代謝過程によって生成された物質を意味する。
【0076】
本発明は、ある実施形態では、SARM化合物の医薬品をさらに含む。“医薬品”という用語は、ここで定義するように、ある実施形態では、医薬品としての使用に適した組成物(医薬組成物)を意味する。
【0077】
ある実施形態では、本発明のSARM化合物は、次の化学構造式Iで表される化合物である。

【0078】
他の実施形態では、本発明のSARM化合物は、次の化学構造式IIで表される化合物である。

ただし、Xは、結合部、O、CH2、NH、Se、PR、NO又はNRであり、
Zは、NO2、CN、COOH、COR、NHCOR又はCONHRであり、
Yは、CF3、F、I、Br、Cl、CN、CR3又はSnR3であり、
Qは、アルキル、F、I、Br、Cl、CF3、CN、CR3、SnR3、NR2、NHCOCH3、NHCOCF3、NHCOR、NHCONHR、NHCOOR、OCONHR、CONHR、NHCSCH3、NHCSCF3、NHCSR、NHSO2CH3、NHSO2R、OR、COR、OCOR、OSO2R、SO2R、SR、CSN、NCS、OCN又はNCOである。或いは、Qは、次の構造式A、B又はCで表される縮合環システムのベンゼン環と結合するようなものからなり、

Rは、アルキル、ハロアルキル、ジハロアルキル、トリハロアルキル、CH2F、CHF2、CF3、CF2CF3、アリル、フェニル、F、I、Br、Cl又はOHである。
【0079】
ある実施形態では、SARM化合物は、XがOである化学構造式IIの化合物である。他の実施形態では、SARM化合物は、ZがNO2である化学構造式IIの化合物である。他の実施形態では、SARM化合物は、ZがCNである化学構造式IIの化合物である。他の実施形態では、SARM化合物は、YがCF3である化学構造式IIの化合物である。他の実施形態では、SARM化合物は、QがNHCOCH3である化学構造式IIの化合物である。他の実施形態では、SARM化合物は、QがFである化学構造式IIの化合物である。
【0080】
ある実施形態では、化合物(I)又は(II)の置換基Rはアルキル基である。他の実施形態では、置換基Rはハロアルキル基である。他の実施形態では、置換基Rはジハロアルキル基である。他の実施形態では、置換基Rはトリハロアルキル基である。他の実施形態では、置換基RはCH2F基である。他の実施形態では、置換基RはCHF2基である。他の実施形態では、置換基RはCF3基である。他の実施形態では、置換基RはCF2CF3基である。他の実施形態では、置換基Rはアリル基である。他の実施形態では、置換基Rはフェニル基である。他の実施形態では、置換基RはFである。他の実施形態では、置換基RはIである。他の実施形態では、置換基RはBrである。他の実施形態では、置換基RはClである。他の実施形態では、置換基Rはアルケニル基である。他の実施形態では、置換基RはOH基である。各置換基は本発明の異なる実施形態を表す。
【0081】
他の実施形態では、本発明のSARM化合物は、次の化学構造式IIIで表される化合物である。

ただし、Xは、結合部、O、CH2、NH、Se、PR、NO又はNRであり、
Gは、O又はSであり、
R1は、CH3、CH2F、CHF2、CF3、CH2CH3又はCF2CF3であり、
Tは、OH、OR、−NHCOCH3又はNHCORであり、
Rは、アルキル、ハロアルキル、ジハロアルキル、トリハロアルキル、CH2F、CHF2、CF3、CF2CF3、アリル、フェニル、F、I、Br、Cl、アルケニル又はOHであり、
Aは、

から選択される環であり、
Bは、

から選択される環である。
ただし、A及びBは同時にはベンゼン環であり得ず、
Zは、NO2、CN、COOH、COR、NHCOR又はCONHRであり、
Yは、CF3、F、I、Br、Cl、CN、CR3又はSnR3であり、
Q1及びQ2は、互いに独立して、水素、アルキル、F、I、Br、Cl、CF3、CN、CR3、SnR3、NR2、NHCOCH3、NHCOCF3、NHCOR、NHCONHR、NHCOOR、OCONHR、CONHR、NHCSCH3、NHCSCF3、NHCSR、NHSO2CH3、NHSO2R、OR、COR、OCOR、OSO2R、SO2R、SR、SCN、NCS、OCN、NCO又は

であり、
また、Q3及びQ4は、互いに独立して、水素、アルキル、F、I、Br、Cl、CF3、CN、CR3、SnR3、NR2、NHCOCH3、NHCOCF3、NHCOR、NHCONHR、NHCOOR、OCONHR、CONHR、NHCSCH3、NHCSCF3、NHCSR、NHSO2CH3、NHSO2R、OR、COR、OCOR、OSO2R、SO2R、SR、SCN、NCS、OCN又はNCOであり、
W1は、O、NH、NR、NO又はSであり、
W2は、N又はNOである。
【0082】
ある実施形態では、SARM化合物は、XがOである化学構造式IIIの化合物である。他の実施形態では、SARM化合物は、GがOである化学構造式IIIの化合物である。他の実施形態では、SARM化合物は、TがOHである化学構造式IIIの化合物である。他の実施形態では、SARM化合物は、R1がCH3である化学構造式IIIの化合物である。他の実施形態では、SARM化合物は、ZがNO2である化学構造式IIIの化合物である。他の実施形態では、SARM化合物は、ZがCNである化学構造式IIIの化合物である。他の実施形態では、SARM化合物は、YがCF3である化学構造式IIIの化合物である。他の実施形態では、SARM化合物は、Q1がNHCOCH3である化学構造式IIIの化合物である。他の実施形態では、SARM化合物は、Q1がFである化学構造式IIIの化合物である。
【0083】
置換基Z及びYは、ある実施形態では、それらの置換基を有する環(以下、「環A」という)の任意の場所に位置することができる。ある実施形態では、置換基Zは、環Aのパラ位置にある。他の実施形態では、置換基Yは、環Aのメタ位置にある。他の実施形態では、置換基Zは環Aのパラ位置にあり、置換基Yは環Aのメタ位置にある。
【0084】
置換基Q1及びQ2は、ある実施形態では、それらの置換基を有する環(以下、「環B」という)の任意の場所に位置することができる。ある実施形態では、置換基Q1は、環Bのパラ位置にある。他の実施形態では、置換基Q2はHである。他の実施形態では、置換基Q1は、環Bのパラ位置にあり、置換基Q2はHである。他の実施形態では、置換基Q1は、NHCOCH3であり、環Bのパラ位置にあり、置換基Q2はHである。
【0085】
上記各変形例の各置換基は、それぞれ本発明の異なる実施形態を表す。さらに、上記各置換基の列挙された各位置は、それぞれ本発明の異なる実施形態を表す。
【0086】
他の実施形態では、本発明のSARM化合物は、次の化学構造式IVで表される化合物である。

ただし、Xは、結合部、O、CH2、NH、Se、PR、NO又はNRであり、
Gは、O又はSであり、
Tは、OH、OR、−NHCOCH3又はNHCORであり、
Rは、アルキル、ハロアルキル、ジハロアルキル、トリハロアルキル、CH2F、CHF2、CF3、CF2CF3、アリル、フェニル、F、I、Br、Cl、アルケニル又はOHであり、
R1は、CH3、CH2F、CHF2、CF3、CH2CH3又はCF2CF3であり、
R2は、F、Cl、Br、I、CH3、CF3、OH、CN、NO2、NHCOCH3、NHCOCF3、NHCOR、アルキル、アリールアルキル、OR、NH2、NHR、NR2、SR、SCN、NCS、OCN又はNCOであり、
R3は、F、Cl、Br、I、CN、NO2、COR、COOH、CONHR、CF3、又はSnR3である。或いは、R3は、次の構造式で表される縮合環システムのベンゼン環と結合するようなものからなる。

ただし、Zは、NO2、CN、COR、COOH又はCONHRであり、
Yは、CF3、F、Br、Cl、I、CN又はSnR3であり、
Qは、H、アルキル、F、I、Br、Cl、CF3、CN、CR3、SnR3、NR2、NHCOCH3、NHCOCF3、NHCOR、NHCONHR、NHCOOR、OCONHR、CONHR、NHCSCH3、NHCSCF3、NHCSR、NHSO2CH3、NHSO2R、OH、OR、COR、OCOR、OSO2R、SO2R又はSRである。或いは、Qは、次の構造式A、B又はCで表される縮合環システムのベンゼン環と結合するようなものからなり、

nは、1〜4の整数であり、
mは、1〜3の整数である。
【0087】
ある実施形態では、SARM化合物は、XがOである化学構造式IVの化合物である。他の実施形態では、SARM化合物は、GがOである化学構造式IVの化合物である。他の実施形態では、SARM化合物は、ZがNO2である化学構造式IVの化合物である。他の実施形態では、SARM化合物は、ZがCNである化学構造式IVの化合物である。他の実施形態では、SARM化合物は、YがCF3である化学構造式IVの化合物である。他の実施形態では、SARM化合物は、QがNHCOCH3である化学構造式IVの化合物である。他の実施形態では、SARM化合物は、QがFである化学構造式IVの化合物である。他の実施形態では、SARM化合物は、TがOHである化学構造式IVの化合物である。他の実施形態では、SARM化合物は、R1がCH3である化学構造式IVの化合物である。他の実施形態では、SARM化合物は、QがFであり、R2がCH3である化学構造式IVの化合物である。他の実施形態では、SARM化合物は、QがFであり、R2がClである化学構造式IVの化合物である。
【0088】
置換基Z、Y及びR3は、ある実施形態では、それらの置換基を有する環(以下、「環A」という)の任意の場所に位置することができる。ある実施形態では、置換基Zは、環Aのパラ位置にある。他の実施形態では、置換基Yは、環Aのメタ位置にある。他の実施形態では、置換基Zは環Aのパラ位置にあり、置換基Yは環Aのメタ位置にある。
【0089】
置換基Q及びR2は、ある実施形態では、それらの置換基を有する環(以下、「環B」という)の任意の場所に位置することができる。ある実施形態では、置換基Qは、環Bのパラ位置にある。他の実施形態では、置換基Qは環Bのパラ位置にある。他の実施形態では、置換基Qは、NHCOCH3であり、環Bのパラ位置にある。
【0090】
ある実施形態では、整数m及びnが1より大きいときに、置換基R2及びR3は1つの特定の置換基に限定されず、前記した置換基の任意の組み合わせであってよい。
【0091】
上記各変形例の各置換基は、それぞれ本発明の異なる実施形態を表す。さらに、上記各置換基の列挙された各位置は、それぞれ本発明の異なる実施形態を表す。さらに、上記各整数の列挙された各数字は、それぞれ本発明の異なる実施形態を表す。
【0092】
他の実施形態では、本発明のSARM化合物は、次の化学構造式Vで表される化合物である。

ただし、R2は、F、Cl、Br、I、CH3、CF3、OH、CN、NO2、NHCOCH3、NHCOCF3、NHCOR、アルキル、アリールアルキル、OR、NH2、NHR、NR2又はSRであり、
R3は、F、Cl、Br、I、CN、NO2、COR、COOH、CONHR、CF3又はSnR3である。或いは、R3は、次の構造式で表される縮合環システムのベンゼン環と結合するようなものからなる。

ただし、Rは、アルキル、ハロアルキル、ジハロアルキル、トリハロアルキル、CH2F、CHF2、CF3、CF2CF3、アリル、フェニル、F、Cl、Br、I、アルケニル又はOHであり、
Zは、NO2、CN、COR、COOH又はCONHRであり、
Yは、CF3、F、Br、Cl、I、CN又はSnR3であり、
Qは、H、アルキル、F、Cl、Br、I、CF3、CN、CR3、SnR3、NR2、NHCOCH3、NHCOCF3、NHCOR、NHCONHR、NHCOOR、OCONHR、CONHR、NHCSCH3、NHCSCF3、NHCSR、NHSO2CH3、NHSO2R、OH、OR、COR、OCOR、OSO2R、SO2R又はSRである。或いは、Qは、次の構造式A、B又はCで表される縮合環システムのベンゼン環と結合するようなものからなり、

nは、1〜4の整数であり、
mは、1〜3の整数である。
【0093】
ある実施形態では、SARMは、ZがNO2である化学構造式Vの化合物である。他の実施形態では、SARMは、ZがCNである化学構造式Vの化合物である。他の実施形態では、SARMは、YがCF3である化学構造式Vの化合物である。他の実施形態では、SARMは、QがNHCOCH3である化学構造式Vの化合物である。他の実施形態では、SARMは、QがFである化学構造式Vの化合物である。他の実施形態では、SARMは、QがFであり、R2がCH3である化学構造式Vの化合物である。他の実施形態では、SARMは、QがFであり、R2がClである化学構造式Vの化合物である。
【0094】
化合物IVにおいて前述したように、置換基Z、Y及びR3は、ある実施形態では、環Aの任意の場所に位置することができ、置換基Q及びR2は、ある実施形態では、環Bの任意の場所に位置することができる。さらに、前述したように、整数m及びnが1より大きい場合、置換基R2及びR3は1つの特定の置換基に限定されず、前記した置換基の任意の組み合わせであってよい。
【0095】
上記各変形例の各置換基は、それぞれ本発明の異なる実施形態を表す。さらに、上記各置換基の列挙された各位置は、それぞれ本発明の異なる実施形態を表す。さらに、上記各整数の列挙された各数字は、それぞれ本発明の異なる実施形態を表す。
【0096】
他の実施形態では、本発明のSARM化合物は、次の化学構造式VIで表される化合物である。

【0097】
本発明の結果は、化合物VIは上述のように骨、脂肪、筋肉組織に有効であることを示す。加えて、化合物VIの薬物速度論的特性は、本発明に開示された症状の薬品治療として使用することに適っている。本発明は、化合物VIがテストステロンに比べて代謝クリアランスを減少させ、経口バイオアベイラビリティを増大させることを示している。最高血漿濃度に速く達するだけでなく、これらの特性は、最大の薬理効果を誘発する投与量における化合物VIに観察される(実施例15)。
【0098】
他の実施形態では、本発明のSARM化合物は、次の化学構造式VIIで表される化合物である。

【0099】
他の実施形態では、本発明のSARM化合物は、次の化学構造式VIIIで表される化合物である。

【0100】
他の実施形態では、本発明のSARM化合物は、次の化学構造式IXで表される化合物である。

【0101】
他の実施形態では、本発明のSARM化合物は、次の化学構造式Xで表される化合物である。

【0102】
他の実施形態では、本発明のSARM化合物は、次の化学構造式XIで表される化合物である。

【0103】
他の実施形態では、本発明のSARM化合物は、次の化学構造式XIIで表される化合物である。

【0104】
ある実施形態では、pは2である。他の実施形態では、pは3である。他の実施形態では、pは4である。他の実施形態では、pは5である。残りの置換基は上記化学構造式IVで定義された通りである。
【0105】
他の実施形態では、本発明のSARM化合物は、次の化学構造式XIIIで表される化合物である。

【0106】
他の実施形態では、本発明のSARM化合物は、次の化学構造式XIVで表される化合物である。

【0107】
他の実施形態では、本発明のSARM化合物は、次の化学構造式XVで表される化合物である。

【0108】
他の実施形態では、pは1である。ある実施形態では、pは2である。他の実施形態では、pは3である。他の実施形態では、pは4である。残りの置換基は上記化学構造式Vで定義された通りである。
【0109】
他の実施形態では、本発明のSARM化合物は、次の化学構造式XVIで表される化合物である。

【0110】
他の実施形態では、本発明のSARM化合物は、次の化学構造式XVIIで表される化合物である。

【0111】
ある実施形態では、SARMは、Qがアセトアミド(NHCOCH3)である化学構造式XVIIの化合物である。他の実施形態では、SARMは、Qがトリフルオロアセトアミド(NHCOCF3)である化学構造式XVIIの化合物である。
【0112】
他の実施形態では、SARMは、ZがNO2である化学構造式XVIIの化合物である。他の実施形態では、SARMは、ZがCNである化学構造式XVIIの化合物である。他の実施形態では、SARMは、ZがCORである化学構造式XVIIの化合物である。他の実施形態では、SARMは、ZがCONHRである化学構造式XVIIの化合物である。
【0113】
他の実施形態では、SARMは、YがCF3である化学構造式XVIIの化合物である。他の実施形態では、SARMは、YがIである化学構造式XVIIの化合物である。他の実施形態では、SARMは、YがBrである化学構造式XVIIの化合物である。他の実施形態では、SARMは、YがClである化学構造式XVIIの化合物である。他の実施形態では、SARMは、YがSnR3である化学構造式XVIIの化合物である。
【0114】
ある実施形態では、SARMは、Rがアルキル基である化学構造式XVIIの化合物である。他の実施形態では、SARMは、RがOHである化学構造式XVIIの化合物である。
【0115】
上記各変形例の各置換基は、それぞれ本発明の異なる実施形態を表す。さらに、上記各置換基の列挙された各位置は、それぞれ本発明の異なる実施形態を表す。
【0116】
他の実施形態では、本発明のSARM化合物は、次の化学構造式XVIIIで表される化合物である。

ただし、Xは、O、CH2、NH、Se、PR、NO又はNRであり、
Tは、OH、OR、−NHCOCH3又はNHCORであり、
Zは、NO2、CN、COOH、COR、NHCOR又はCONHRであり、
Yは、CF3、F、I、Br、Cl、CN、CR3又はSnR3であり、
Qは、アルキル、F、I、Br、Cl、CF3、CN、CR3、SnR3、NR2、NHCOCH3、NHCOCF3、NHCOR、NHCONHR、NHCOOR、OCONHR、CONHR、NHCSCH3、NHCSCF3、NHCSR、NHSO2CH3、NHSO2R、OR、COR、OCOR、OSO2R、SO2R又はSRである。或いは、Qは、次の構造式A、B又はCで表される縮合環システムのベンゼン環と結合するようなものからなる。

ただし、Rは、アルキル、ハロアルキル、ジハロアルキル、トリハロアルキル、CH2F、CHF2、CF3、CF2CF3、アリル、フェニル、F、Cl、Br、I、アルケニル又はOHであり、
R1は、CH3、CH2F、CHF2、CF3、CH2CH3又はCF2CF3である。
【0117】
上記各変形例の各置換基は、それぞれ本発明の異なる実施形態を表す。さらに、上記各置換基の列挙された各位置は、それぞれ本発明の異なる実施形態を表す。
【0118】
ある実施形態では、SARM化合物は、XがOである上記化学構造式の内の1つの化合物である。他の実施形態では、SARM化合物は、Xが結合部である上記化学構造式の内の1つの化合物である。他の実施形態では、SARM化合物は、XがCH2である上記化学構造式の内の1つの化合物である。他の実施形態では、SARM化合物は、XがNHである上記化学構造式の内の1つの化合物である。他の実施形態では、SARM化合物は、XがSeである上記化学構造式の内の1つの化合物である。他の実施形態では、SARM化合物は、XがPRである上記化学構造式の内の1つの化合物である。他の実施形態では、SARM化合物は、XがNOである上記化学構造式の内の1つの化合物である。他の実施形態では、SARM化合物は、XがNRである上記化学構造式の内の1つの化合物である。
【0119】
ある実施形態では、SARM化合物は、GがOである上記化学構造式の内の1つの化合物である。他の実施形態では、SARM化合物は、GがSである上記化学構造式の内の1つの化合物である。
【0120】
ある実施形態では、SARM化合物は、TがOHである上記化学構造式の内の1つの化合物である。他の実施形態では、SARM化合物は、TがORである上記化学構造式の内の1つの化合物である。他の実施形態では、SARM化合物は、Tが−NHCOCH3である上記化学構造式の内の1つの化合物である。他の実施形態では、SARM化合物は、TがNHCORである上記化学構造式の内の1つの化合物である。
【0121】
ある実施形態では、SARM化合物は、ZがNO2である上記化学構造式の内の1つの化合物である。他の実施形態では、SARMは、ZがCNである上記化学構造式の内の1つの化合物である。他の実施形態では、SARMは、ZがCOOHである上記化学構造式の内の1つの化合物である。他の実施形態では、SARMは、ZがCORである上記化学構造式の内の1つの化合物である。他の実施形態では、SARMは、ZがNHCORである上記化学構造式の内の1つの化合物である。他の実施形態では、SARMは、ZがCONHRである上記化学構造式の内の1つの化合物である。
【0122】
他の実施形態では、SARM化合物は、YがCF3である上記化学構造式の内の1つの化合物である。他の実施形態では、SARM化合物は、YがFである上記化学構造式の内の1つの化合物である。他の実施形態では、SARM化合物は、YがIである上記化学構造式の内の1つの化合物である。他の実施形態では、SARM化合物は、YがBrである上記化学構造式の内の1つの化合物である。他の実施形態では、SARM化合物は、YがClである上記化学構造式の内の1つの化合物である。他の実施形態では、SARM化合物は、YがCNである上記化学構造式の内の1つの化合物である。他の実施形態では、SARM化合物は、YがCR3である上記化学構造式の内の1つの化合物である。他の実施形態では、SARM化合物は、YがSnR3である上記化学構造式の内の1つの化合物である。
【0123】
他の実施形態では、SARM化合物は、QがNHCOCH3である上記化学構造式の内の1つの化合物である。他の実施形態では、SARM化合物は、QがFである上記化学構造式の内の1つの化合物である。他の実施形態では、SARM化合物は、Qがアルキルである上記化学構造式の内の1つの化合物である。他の実施形態では、SARM化合物は、QがIである上記化学構造式の内の1つの化合物である。他の実施形態では、SARM化合物は、QがBrである上記化学構造式の内の1つの化合物である。他の実施形態では、SARM化合物は、QがClである上記化学構造式の内の1つの化合物である。他の実施形態では、SARM化合物は、QがCF3である上記化学構造式の内の1つの化合物である。他の実施形態では、SARM化合物は、QがCNである上記化学構造式の内の1つの化合物である。他の実施形態では、SARM化合物は、QがCR3である上記化学構造式の内の1つの化合物である。他の実施形態では、SARM化合物は、QがSnR3である上記化学構造式の内の1つの化合物である。他の実施形態では、SARM化合物は、QがNR2である上記化学構造式の内の1つの化合物である。他の実施形態では、SARM化合物は、QがNHCOCF3である上記化学構造式の内の1つの化合物である。他の実施形態では、SARM化合物は、QがNHCORである上記化学構造式の内の1つの化合物である。他の実施形態では、SARM化合物は、QがNHCONHRである上記化学構造式の内の1つの化合物である。他の実施形態では、SARM化合物は、QがNHCOORである上記化学構造式の内の1つの化合物である。他の実施形態では、SARM化合物は、QがOCONHRである上記化学構造式の内の1つの化合物である。他の実施形態では、SARM化合物は、QがCONHRである上記化学構造式の内の1つの化合物である。他の実施形態では、SARM化合物は、QがNHCSCH3である上記化学構造式の内の1つの化合物である。他の実施形態では、SARM化合物は、QがNHCSCF3である上記化学構造式の内の1つの化合物である。他の実施形態では、SARM化合物は、QがNHCSRである上記化学構造式の内の1つの化合物である。他の実施形態では、SARM化合物は、QがNHSO2CH3である上記化学構造式の内の1つの化合物である。他の実施形態では、SARM化合物は、QがNHSO2Rである上記化学構造式の内の1つの化合物である。他の実施形態では、SARM化合物は、QがORである上記化学構造式の内の1つの化合物である。他の実施形態では、SARM化合物は、QがCORである上記化学構造式の内の1つの化合物である。他の実施形態では、SARM化合物は、QがOCORである上記化学構造式の内の1つの化合物である。他の実施形態では、SARM化合物は、QがOSO2Rである上記化学構造式の内の1つの化合物である。他の実施形態では、SARM化合物は、QがSO2Rである上記化学構造式の内の1つの化合物である。他の実施形態では、SARM化合物は、QがSRである上記化学構造式の内の1つの化合物である。他の実施形態では、SARM化合物は、QがCSNである上記化学構造式の内の1つの化合物である。他の実施形態では、SARM化合物は、QがNCSである上記化学構造式の内の1つの化合物である。他の実施形態では、SARM化合物は、QがOCNである上記化学構造式の内の1つの化合物である。他の実施形態では、SARM化合物は、QがNCOである上記化学構造式の内の1つの化合物である。
【0124】
他の実施形態では、SARM化合物は、Qが次の構造式A、B又はCで表される縮合環システムのベンゼン環と結合するようなものからなる上記化学構造式の内の1つの化合物である。

【0125】
他の実施形態では、SARM化合物は、Rがアルキルである上記化学構造式の内の1つの化合物である。他の実施形態では、SARM化合物は、Rがハロアルキルである上記化学構造式の内の1つの化合物である。他の実施形態では、SARM化合物は、Rがジハロアルキルである上記化学構造式の内の1つの化合物である。他の実施形態では、SARM化合物は、Rがトリハロアルキルである上記化学構造式の内の1つの化合物である。他の実施形態では、SARM化合物は、RがCH2Fである上記化学構造式の内の1つの化合物である。他の実施形態では、SARM化合物は、RがCHF2である上記化学構造式の内の1つの化合物である。他の実施形態では、SARM化合物は、RがCF3である上記化学構造式の内の1つの化合物である。他の実施形態では、SARM化合物は、RがCF2CF3である上記化学構造式の内の1つの化合物である。他の実施形態では、SARM化合物は、Rがアリルである上記化学構造式の内の1つの化合物である。他の実施形態では、SARM化合物は、Rがフェニルである上記化学構造式の内の1つの化合物である。他の実施形態では、SARM化合物は、RがFである上記化学構造式の内の1つの化合物である。他の実施形態では、SARM化合物は、RがIである上記化学構造式の内の1つの化合物である。他の実施形態では、SARM化合物は、RがBrである上記化学構造式の内の1つの化合物である。他の実施形態では、SARM化合物は、RがClである上記化学構造式の内の1つの化合物である。他の実施形態では、SARM化合物は、Rがアルケニルである上記化学構造式の内の1つの化合物である。他の実施形態では、SARM化合物は、RがOHである上記化学構造式の内の1つの化合物である。
【0126】
他の実施形態では、SARM化合物は、R1がCH3である上記化学構造式の内の1つの化合物である。他の実施形態では、SARM化合物は、R1がCH2Fである上記化学構造式の内の1つの化合物である。他の実施形態では、SARM化合物は、R1がCHF2である上記化学構造式の内の1つの化合物である。他の実施形態では、SARM化合物は、R1がCF3である上記化学構造式の内の1つの化合物である。他の実施形態では、SARM化合物は、R1がCH2CH3である上記化学構造式の内の1つの化合物である。他の実施形態では、SARM化合物は、R1がCF2CF3である上記化学構造式の内の1つの化合物である。
【0127】
上記各化学構造式のX,Y,Z,G,T,Q,R及びR1の各置換基は、それぞれ本発明の異なる実施形態を表す。さらに、上記各置換基の列挙された各位置は、それぞれ本発明の異なる実施形態を表す。さらに、上記各整数の列挙された各数字は、それぞれ本発明の異なる実施形態を表す。
【0128】
他の実施形態では、本発明のSARM化合物は、次の化学構造式XIXで表される化合物である。

【0129】
他の実施形態では、本発明のSARM化合物は、次の化学構造式XXで表される化合物である。

【0130】
他の実施形態では、本発明のSARM化合物は、次の化学構造式XXIで表される化合物である。

【0131】
他の実施形態では、本発明のSARM化合物は、次の化学構造式XXIIで表される化合物である。

【0132】
他の実施形態では、本発明のSARM化合物は、次の化学構造式XXIIIで表される化合物である。

【0133】
他の実施形態では、本発明のSARM化合物は、次の化学構造式XXIVで表される化合物である。

【0134】
“アルキル”基は、ある実施形態では、直鎖型、分枝型又は環状の飽和脂肪族炭化水素である。ある実施形態では、アルキル基は、1〜12個の炭素を有する。他の実施形態では、アルキル基は、1〜7個の炭素を有する。ある実施形態では、アルキル基は、1〜6個の炭素を有する。ある実施形態では、アルキル基は、1〜4個の炭素を有する。アルキル基は、F、Cl、Br、I、水酸基、アルコキシ・カルボニル基、アミド基、アルキルアミド基、ジアルキルアミド基、ニトロ基、アミノ基、アルキルアミノ基、ジアルキルアミノ基、カルボニル基、チオ基及びチオアルキル基から成る群より選択される1つ又は複数の基と置換又は無置換される。
【0135】
“アルケニル”基は、ある実施形態では、1つ以上の二重結合を有する直鎖型、分枝型又は環状の不飽和炭化水素である。アルケニル基は、二重結合を1つ、2つ又は3つ有している。アルケニル基の例としては、エテニル、プロペニル、ブテニル、シクロヘキセニルなどがある。アルケニル基は、F、I、Br、Cl、水酸基、アルコキシ・カルボニル基、アミド基、アルキルアミド基、ジアルキルアミド基、ニトロ基、アミノ基、アルキルアミノ基、ジアルキルアミノ基、カルボニル基、チオ基及びチオアルキル基から成る群より選択される1つ又は複数の基と置換又は無置換される。
【0136】
“ハロアルキル”基は、ある実施形態では、上記に定義したアルキル基を1つ又は複数のハロゲン原子(例えばF、Cl、Br又はI)で置換したものである。
【0137】
“アリル”基は、ある実施形態では、少なくとも1つの炭素環式芳香族基又は複素環式芳香族基を有する芳香族基であり、F、Cl、Br、I、ハロアルキル基、水酸基、アルコキシ・カルボニル基、アミド基、アルキルアミド基、ジアルキルアミド基、ニトロ基、アミノ基、アルキルアミノ基、ジアルキルアミノ基、カルボニル基、チオ基、及びチオアルキル基から成る群より選択される1つ又は複数の基と置換又は無置換される。アリル環の例としては、フェニル、ナフチル、ピラニル、ピロリル、ピラジニル、ピリミジニル、ピラゾリル、ピリジニル、フラニル、チオフェニル、チアゾリル、イミダゾリル、イソオキサゾリルなどがある(ただし、これらに限定されるものではない)。
【0138】
“ヒドロキシル”基は、ある実施形態では、OH基である。“アルケニル”基は、少なくとも1つの炭素間二重結合を有する基である。ハロ基は、ある実施形態では、F、Cl、Br又はIである。
【0139】
“アリルアルキル”基は、ある実施形態では、アリル基と結合したアルキル基である。なお、アルキル基とアリル基は、上記に定義したとおりである。アリルアルキル基としては、例えば、ベンジル基がある。
【0140】
《医薬品組成物》
“医薬品組成物”は、ある実施形態では、“治療に効果的な量”の活性化成分、すなわちSARM化合物と、薬学的に許容される担体又は希釈液とを組み合わせたものである。“治療に効果的な量”は、ある実施形態では、与条件及び投薬計画において治療効果がある量を意味する。
【0141】
SARM物質を含んでいる医薬品組成物は、例えば、非経口、側癌的(paracanceraly)、経粘膜的、経皮的、筋肉内、静脈内、皮内、皮下、腹膜内、脳室内、脳内、膣内又は腫瘍内投与などの当業者に周知の方法によって患者に投与される。
【0142】
ある実施形態では、医薬品組成物は経口投与される。そのため、医薬品組成物は、経口投与に適した形状(すなわち、固体又は液体製剤)に形成される。適切な固体の経口剤としては、錠剤、カプセル、ピル、顆粒、ペレットなどがある。また、適切な液体の経口剤としては、溶液、懸濁液、分散液、乳濁液、油などなどがある。本発明のある実施形態では、SARM化合物はカプセル状に形成される。この実施形態では、本発明に係る組成物は、SARM活性化合物及び不活性担体(又は希釈液)に加えて、硬ゲル化カプセルを含む。
【0143】
さらに、他の実施形態では、医薬品組成物は、液体製剤の静脈内注射、動脈内注射又は筋肉内注射によって投与される。適切な液体製剤としては、溶液、懸濁液、分散液、乳濁液、油などがある。ある実施形態では、医薬品組成物は、静脈内投与に適した形状に形成され、静脈内に投与される。他の実施形態では、医薬品組成物は、動脈内投与に適した形状に形成され、動脈内に投与される。他の実施形態では、医薬品組成物は、筋肉内投与に適した形状に形成され、筋肉内に投与される。
【0144】
さらに、他の実施形態では、医薬品組成物は、局所投与に適した形状に形成され、体の表面に局所的に投与される。適切な局所性製剤としては、ゲル、軟膏、クリーム、ローション、液滴などがある。局所的に投与するために、SARM物質又はその誘導体であって生理学的に耐容性を示すもの(例えば塩、エステル、N酸化物)を調製し、薬品担体を用いて又は用いることなく、生理学的に認容されている希釈液と共に、水溶液、懸濁液、又は乳状液として投与される。
【0145】
さらに、他の実施形態では、医薬品組成物は、直腸座薬や尿道座薬などの座薬として投与される。さらに、他の実施形態では、医薬品組成物は、ペレットの皮下埋め込みによって投与される。さらなる実施形態では、ペレットは、長時間にわたるSARM物質の徐放をもたらす。
【0146】
他の実施形態では、活性化合物は、小胞(特にリポソーム)に送達される。詳細については、Langer, Science 249: 1527-1533, 1990; Treat et al., in Liposomes in the Therapy of Infectious Disease and Cancer, Lopez-Berestein and Fidler (eds.), Liss, New York, 353-365, 1989; Lopez-Berestein, ibid, 317-327を参照されたい(主にibidを参照されたい)。
【0147】
“薬学的に許容される担体又は希釈液”は、当業者に周知である。担体又は希釈液としては、固体製剤用の固体担体又は希釈液、液体製剤用の液体担体又は希釈液、又は、これらの混合物がある。
【0148】
固体担体/希釈液としては、ガム、デンプン(例えばコーンのデンプン、予めゲル化されたデンプン)、糖(例えば乳糖、マンニトール、ショ糖、ブドウ糖)、セルロース系材料(例えば微結晶性セルロース)、アクリル酸塩(例えばポリメチルアクリレート)、炭酸カルシウム、酸化マグネシウム、滑石、又はこれらの混合物がある(ただし、これらに限定されるものではない)。
【0149】
液体製剤の場合、薬学的に許容される担体としては、水溶性又は非水性の溶液、懸濁液、乳濁液又は油がある。非水溶媒の例としては、プロピレン・グリコール、ポリエチレン・グリコールや、注射用有機エステル(例えばオレイン酸エチル)がある。水溶性担体としては、水、アルコール性/水溶性の溶液、乳濁液又は懸濁液(生理食塩水及び緩衝培地を含む)がある。油の例としては、石油、動物性、植物性又は合成されたものがある(例えばラッカセイ油、大豆油、鉱油、オリーブ油、ひまわり油、魚肝油)。
【0150】
非経口媒体(皮下注射、静脈内注射、動脈内注射又は筋肉内注射用)としては、塩化ナトリウム溶液、リンガー・デキストロース、デキストロース及び塩化ナトリウム、乳酸加リンガーオイル及び固定油がある。経静脈媒体としては、液体及び栄養補充薬、電解質補充薬(例えばリンガー・デキストロースに基づくもの)などがある。一例としては、界面活性剤及び他の薬学的に許容されるアジュバントを添加した又は添加しない、水や油などの無菌液がある。一般的に、水、生理食塩水、水溶性デキストロースや関連糖液、及びグリコール(例えばプロピレン・グリコールやポリエチレン・グリコール)は、液体担体として適している(特に、注射用溶液に適している)。油の例としては、石油、動物性、植物性又は合成されたものがある(例えばラッカセイ油、大豆油、鉱油、オリーブ油、ひまわり油、魚肝油)。
【0151】
また、この医薬品組成物は、さらに、結合剤(例えば、アカシア、コーンスターチ、ゼラチン、カルボマー、エチルセルロース、グアールガム、ヒドロキシプロピルセルロース、ヒドロキシプロピルメチルセルロース、ポビドン)、崩壊剤(例えば、コーンスターチ、ジャガイモデンプン、アルギン酸、二酸化ケイ素、クロスカルメロースナトリウム、クロスポビドン、グアールガム、澱粉グリコール酸エステルナトリウム)、種々のpH及びイオン強度の緩衝液(例えば、トリス−HCI、アセテート、リン酸塩)、界面に対する吸収を予防するためのアルブミン又はゼラチンのような添加物、洗剤(例えば、トウィーン20、トウィーン80、プルロニックF68、胆汁酸塩)、プロテアーゼインヒビター、界面活性剤(例えば、ラウリル硫酸ナトリウム)、浸透エンハンサー、可溶化剤(例えば、グリセロール、ポリエチレングリセロール)、抗酸化剤(例えば、アスコルビン酸、メタ重亜硫酸ナトリウム、ブチルヒドロキシアニソール)、安定剤(例えば、ヒドロキシプロピルセルロース、ヒドロキシプロピルメチルセルロース)、粘度上昇剤(例えば、カルボマー、コロイド状二酸化ケイ素、エチルセルロース、グアールガム)、甘味料(例えば、アスパルテーム、クエン酸)、防腐剤(例えば、チメロサール、ベンジルアルコール、パラオキシ安息香酸エステル類)、潤滑剤(例えば、ステアリン酸、ステアリン酸マグネシウム、ポリエチレン・グリコール、ラウリル硫酸ナトリウム)、流動助剤(例えば、コロイド状二酸化ケイ素)、可塑剤(例えば、フタル酸ジエチル、クエン酸トリエチル)、乳化剤(例えば、カルボマー、ヒドロキシプロピルセルロース、ラウリル硫酸ナトリウム)、ポリマーコーティング(例えば、ポロキサマー、ポロキサミン)、被覆及び膜形成剤(例えば、エチルセルロース、アクリル酸塩、ポリメタクリル酸塩)、及び/又は、アジュバントを含むことができる。
【0152】
ある実施形態では、この医薬品組成物は、投与後にSARM化合物を長時間に渡って放出する徐放組成物である。徐放又は持続放出組成物としては、脂溶性の持続性薬剤(例えば、脂肪酸、ワックス、オイル)内の組成物を含む。他の実施形態では、この医薬品組成物は、投与後に全てのSARM化合物を直ちに放出する即放組成物である。
【0153】
さらに他の実施形態では、この医薬品組成物は、徐放システムによって送達される。例えば、この薬剤は、静脈内注入、植込型浸透圧ポンプ、経皮パッチ、リポソーム又は他の投与形態により投与される。ある実施形態では、ポンプを使用することができる(例えば、Langer, supra; Sefton, CRC Crit. Ref. Biomed. Eng. 14:201, 1987; Buchwald et al., Surgery 88:507, 1980; Saudek et al., N. Engl. J. Med. 321:574, 1989を参照されたい)。他の実施形態では、高分子材料を使用することができる。さらに他の実施形態では、徐放システムは、治療ターゲットすなわち脳の近くに設けることが可能である。その場合、必要とされる投与量は、全身投与量と比べるとほんの少量である(例えば、Goodson, in Medical Applications of Controlled Release, supra, vol. 2, pp.115-138, 1984を参照)。他の徐放システムは、Langer(Science 249:1527-1533, 1990)によるレビューに記載されている。
【0154】
この医薬品組成物は、ポリマー化合物(例えば、ポリ乳酸、ポリグリコール酸、ヒドロゲルなど)の粒子状製剤や、リポソーム、マイクロエマルション、ミセル、単層又は多層状の小胞、赤血球ゴースト、スフェロプラストなどの活性物質と結合することができる。そのような組成物は、物理的状態、溶解度、安定性、インビボでの放出速度、及び、インビボでの排出速度に影響を与える。
【0155】
ポリマー(例えば、ポロキサマー又はポロキサミン)で被覆された粒子状組成物も本発明に含まれる。また、組織特異性受容体、リガンド又は抗原に対する抗体と結合した化合物や、組織特異性受容体のリガンドと結合した化合物も本発明に含まれる。
【0156】
また、水溶性ポリマーの共有結合によって修飾された化合物も本発明に含まれる。前記水溶性ポリマーとしては、例えば、ポリエチレン・グリコール、ポリエチレン・グリコールとポリプロピレン・グリコールのコポリマー、カルボキシメチル・セルロース、デキストラン、ポリビニル・アルコール、ポリビニルピロリドン、及び、ポリプロリンがある。これらの修飾された化合物は、対応する修飾されていない化合物と比較して、静脈注射後、血液中で著しく長い半減期を示すことが知られている(詳しくは、Abuchowski et al., 1981; Newmark et al., 1982; 及び Katre et al., 1987を参照されたい)。また、そのような修飾は、水溶液中での化合物の溶解度を高め、凝集を予防し、化合物の物理的及び化学的安定性を向上させ、化合物の免疫原性及び反応性を著しく低下させる。そのため、ポリマー化合物は、修飾されていない化合物よりも低い頻度の投与又は少ない投与量で、インビボでの望ましい生物学的活性を得ることができる。
【0157】
活性成分を含有する医薬品組成物の作成は、当該技術分野で周知である(例えば、混合、顆粒化又は錠剤形成によって作成する)。活性治療成分は、多くの場合は、薬学的に許容され活性化成分と適合する媒体と混合される。経口投与の場合は、SARM物質又はその誘導体であって生理学的に耐容性を示すもの(例えば、塩、エステル、N酸化物)は、この目的に通常使用される添加物(例えば、媒体、安定剤、不活性希釈液)と混合され、通常の方法によって投与に適した形状(例えば、錠剤、コート錠、硬ゼラチンカプセル、軟ゼラチンカプセル、水溶性、アルコール性溶液、油性溶液)に変えられる。非経口投与の場合は、SARM物質又はその誘導体であって生理学的に耐容性を示すもの(例えば、塩、エステル、N酸化物)は、必要に応じて、この目的に通常使用される適切な物質(例えば、可溶化剤など)によって、溶液、懸濁液又は乳濁液に変えられる。
【0158】
活性成分は、中和された薬学的に許容される塩の形態で、医薬品組成物内に配合することができる。薬学的に許容される塩としては、例えば、無機酸(例えば、塩酸、リン酸)や有機酸(例えば、酢酸、シュウ酸、酒石酸、マンデル酸)によって形成される酸付加塩(ポリペプチド又は抗体分子の遊離アミノ基で形成される)がある。遊離カルボキシル基から形成される塩は、例えば、無機塩(例えば、ナトリウム、カリウム、アンモニウム、カルシウム、水酸化第二鉄)や、有機塩基(例えば、イソプロピルアミン、トリメチルアミン、2−エチルアミノエタノール、ヒスチジン、プロカイン)からも生成できる。
【0159】
医学的に使用するために、SARMの塩を薬学的に許容される塩として使用し得る。また、本発明に係る化合物又はその薬学的に許容される塩の作成に他の塩を使用し得る。本発明に係る化合物における適切な薬学的に許容される塩としては、例えば、本発明に係る化合物の溶液と、薬学的に許容される酸(例えば、塩酸、硫酸、メタンスルホン酸、フマル酸、マレイン酸、コハク酸、酢酸、安息香酸、シュウ酸、クエン酸、酒石酸、炭酸、リン酸)の溶液とを混合することによって形成した酸付加塩がある。
【0160】
“投与”という用語は、患者に本発明に係るSARM化合物を接触させることを意味する。投与は、インビトロ(すなわち試験管内)又はインビボ(すなわち、例えばヒトなどの生体の細胞又は組織内)で実施される。ある実施形態では、本発明は、患者に本発明に係る化合物を投与することを含んでいる。
【0161】
他の実施形態では、“接触”という用語は、本発明に係るSARM化合物が治療対象患者に投与され、インビボでSARM化合物がARと接触することを意味する。
【0162】
ある実施形態では、本発明に係るSARM化合物は、唯一の活性化成分として投与される。また、SARM化合物が1つ又は複数の治療物質と一緒に投与される、ホルモン治療、前立腺癌治療、前立腺癌の進行を遅らせる、及び、前立腺癌の再発を予防及び/又は治療するための方法も本発明の範囲に含まれる。前記治療物質としては、LHRH類似体、可逆的抗アンドロゲン、抗エストロゲン、抗癌剤、5−αレダクターゼ阻害剤、アロマターゼ阻害剤、プロゲスチン、別の核ホルモン受容体を介して作用する物質、選択的エストロゲン受容体調節剤(selective estrogen receptor modulator:SERM)、プロゲステロン、エストロゲン、PDE5抑制剤、アポモルヒネ、ビスホスフォネート、及び、1つ以上のさらなるSARM(例えば、アゴニスト作用を有する他のSARM)がある(ただし、これらに限定されるものではない)。
【0163】
したがって、ある実施形態では、本発明に係る方法は、SARM化合物をLHRH類似体と共に投与することを含む。ある実施形態では、本発明に係る方法は、SARM化合物を可逆的抗アンドロゲンと共に投与することを含む。ある実施形態では、本発明に係る方法は、SARM化合物を抗エストロゲンと共に投与することを含む。ある実施形態では、本発明に係る方法は、SARM化合物を抗癌剤と共に投与することを含む。ある実施形態では、本発明に係る方法は、SARM化合物を5−αレダクターゼ阻害剤と共に投与することを含む。ある実施形態では、本発明に係る方法は、SARM化合物をアロマターゼ阻害剤と共に投与することを含む。ある実施形態では、本発明に係る方法は、SARM化合物をプロゲスチンと共に投与することを含む。ある実施形態では、本発明に係る方法は、SARM化合物を、別の核ホルモン受容体を介して作用する物質と共に投与することを含む。ある実施形態では、本発明に係る方法は、SARM化合物を選択的エストロゲン受容体調節剤(SERM)と共に投与することを含む。ある実施形態では、本発明に係る方法は、SARM化合物をプロゲステロンと共に投与することを含む。ある実施形態では、本発明に係る方法は、SARM化合物をエストロゲンと共に投与することを含む。ある実施形態では、本発明に係る方法は、SARM化合物をPDE5抑制剤と共に投与することを含む。ある実施形態では、本発明に係る方法は、SARM化合物をアポモルヒネと共に投与することを含む。ある実施形態では、本発明に係る方法は、SARM化合物をビスホスフォネートと共に投与することを含む。ある実施形態では、本発明に係る方法は、SARM化合物を、1つ以上のさらなるSARMと共に投与することを含む。
【実施例】
【0164】
次の実施例は、本発明の実施形態をより詳細に説明するためのものである。ただし、これらの実施例は、本発明の範囲を限定するものではない。
【0165】
《実施例1 実験デザイン−実施例1〜14》
動物を下表に示される各治療群に、各群に10匹ずつ、無作為に分けた。実験の1日目(day 1)に動物に外科的な卵巣切除(卵巣切除:OVX)を施した群もあった。化合物VI、化合物IX及び化合物XI、抗アンドロゲン、及び/又はDHTによる薬物投与を直ちに(つまりOVXが行なわれた日に)或いはOVXの90日後に開始し、これら化合物の骨吸収抑制(即時治療)又は骨形成促進(遅延治療)の性能を評価した。関連する化合物を、実験の180日目まで毎日皮下注射(0.25ミリリットル[mL])により投与した。薬液をエタノールに溶かしてポリエチレン・グリコール300で希釈することにより毎日作成した。エタノールの比率はすべての媒体で同一とし、テスト化合物の溶解性に基づいて決定した。
【0166】
下表に示すように、全身の二重エネルギーX線吸収測定法(DEXA)のX線骨密度測定画像をOVX後最大210日間採集した。BMD、BMC、骨塩面積(BMA)、除脂肪体重(LBM)、FM、総体重(TBM)と、腰椎及び左大腿骨の準局所的なBMDを各時点で測定した。
【0167】
全ての動物を治療開始から120日目に屠殺した。屠殺したラットから大腿骨及び脛骨を将来の実験のため切除した。各群の動物に対し、屠殺前或いは屠殺時に血清と尿検体を採集し、オステオカルシン、IL−6、IGF−1の血清濃度と、デオキシピリジノリン及びクレアチニンの尿濃度を測定するために使用した。



【0168】
【表1】

【0169】
《実施例2 化合物VIはラットの骨粗鬆症モデルにおけるBMDの低下を阻止する》
実験動物及び実験方法(実施例2〜14)
動物
メスのSDラットをハーラン社(Harlan; Indianapolis, IN)から購入した。動物を1ケージ当たり3匹ずつ収容し、水道水と市販のラット用エサ(Harlan Teklad 22/5 rodent diet-8640)を自由に飲食できるようにした。実験期間中、動物を12時間の明暗サイクルで飼育した。この実験は、オハイオ州立大学の研究機関内の管理及び使用に関する委員会(Institutional Laboratory Care and Use Committee)によって審査及び承認されたものである。
【0170】
実験デザイン
23週齢となったときに、動物に卵巣切除(OVX)または偽手術を施し、12の処置群のうち1つに振り分け(表2)、1群につき10匹の動物からなるようにした。各群は、結果の章に記載しているように、種々の量の化合物VIを投与し、または他の処置を施したか、或いは非処置とした。卵巣が切除されていないことを示すために偽手術した動物を「無傷」と呼ぶ。一連の研究中に5匹の動物が非薬物関連の死因で死亡した。従って、群1、6、10はそれぞれ9匹の動物からなり、群4は8匹の動物からなっていた。薬物をDMSOに溶かしてポリエチレン・グリコール300(PEG300)で希釈することにより薬液を毎日作成した。120日間毎日0.20mlを皮下注射することによって全ての薬量を投与した。
【0171】
【表2】

【0172】
120日目の全身型DEXAスキャンの直後に群2〜12を屠殺し、腰椎、大腿骨及び脛骨を切除し、軟繊維を取り除いた。この研究のための無傷対照群(群1)は、実施例9〜13に記載の同時的遅延処置研究に対する対照群としても供された。よって、群1は210日目に屠殺した。
【0173】
身体パラメータ測定
0日目及び120日目(day 120)に小動物ソフトウェア(Lunar enCORE、バージョン6.60.041)を用いてDEXA(GE社、Lunar Prodigy(登録商標))によって全身のBMD、FM比率、体重(BW)、BMC、骨塩面積(BMA)、除脂肪体重(LBM)を測定した。700シリーズのオーハウス(Ohaus)トリプルビーム動物天秤(Florham Park, NJ)を用いて標準重量法によって動物の体重も測定した。DEXAスキャンを行うために、ケタミン:キシラジン(87:13mg/kg)により動物に麻酔をかけ、腹臥位に置いた。データ処理中に、動物全体を含む範囲を関心領域即ちROI(region of interest)として選択することによって、全身データを得た。本明細書中では、より大きな動的範囲でホルモン感受性が最も高い測定の分析に焦点を当てるために、エストロゲン投与中止に感受性が最も高い(即ち無傷群と対照群間の差が最大である)と決定されたパラメータを用いて報告した。
【0174】
切除した骨を深さ3インチの室温水浴にてスキャンし、軟組織をシミュレートした。近位大腿骨、遠位大腿骨、近位脛骨、L2−L4脊椎、L5−L6脊椎をROIとしてDEXAスキャンから選択し、BMD分析した。大腿の画像を近位(領域1)から遠位(領域10)まで10の等しいROIに細分し、各領域のBMDをLunar enCORE小動物ソフトウェアによって決定した。
【0175】
遠位骨用定量的コンピュータ断層撮影(pQCT)分析及び生体力学試験を行うために、OVX+0.1mg/日の化合物VI(群11)、OVX+3.0mg/日の化合物VI(群12)、OVX+1.0mg/日のDHT(群5)、OVX対照(群4)、無傷+1mg/日の化合物VI(群3)、無傷対照(群1)からの右大腿骨をスケルテック社(Skeletech:ボセル,WA)へ送った。ストラテック(Stratec)XCT−RM及び関連するソフトウェア(Stratec Medizintechnik社、プフォルツハイム,ドイツ、ソフトウェア・バージョン5.40C)を使用し、大腿骨をpQCTスキャンした。大腿骨の中央骨幹領域及び遠位領域の両方を分析した。スカウトスキャンの像を用いて大腿骨の長さを決定し、中央骨幹領域(大腿骨長さの50%)及び遠位領域(遠位端から開始する大腿骨長さの20%)をROIとして選択した。大腿骨の長軸に垂直な1つの0.5mm薄片を分析に用いた。全身のBMD、総骨面積、全BMD、皮質骨塩含量、皮質骨面積、皮質BMD、皮質厚、骨膜周辺(周囲)及び皮質周辺を大腿骨の中央骨幹で決定した。遠位大腿骨では、全BMC、総骨面積、全BMD、骨梁骨塩含量、骨梁骨面積及び骨梁BMDを決定した。
【0176】
pQCT分析後、脱肉処理した大腿骨全体を用いて3点曲げ試験を行った。電子キャリパスを用いて大腿骨幹の中心での前後径(APD)(単位:ミリメートル[mm])を測定した。インストロン物理試験機(インストロン5500型にレトロフィットされた4465型)(Canton, MA)において3点曲げ具の下支点上に大腿骨の前側を下向きにして大腿骨を載置した。下支点間の長さ(L)は14mmに設定した。大腿骨幹の中央に合わせて上側荷重負荷装置の向きを調整した。6mm/分の一定の変位速度で大腿骨が折れるまで負荷をかけた。物理試験機により最大負荷(Fu)(単位:N)、堅さ(S)(単位:N/mm)、及び吸収エネルギー(W)(単位:mJ)を直接測定した。大腿骨の中央骨幹のpQCT分析中にソフトウェアにより慣性軸面積モーメント(I)(単位:mm4)を計算した。応力(σ)(単位:N/mm2)、弾性係数(E)(単位:Mpa)、靱性(T)(単位:mJ/m3)を次式により計算した。応力σ=(Fu×L×(a/2))/(4×I);弾性係数E=S×L3/(48×I);靱性T=3×W×(APD/2)2/(L×I)。
【0177】
統計分析
一因子分散分析(ANOVA)により統計分析を行った。P値が0.05以下のときに統計的有意差があるとした。
【0178】
結果
ラットを12の群のうちの1群に割り当てた。0日目に群4〜12は卵巣切除を行い、群1〜3は無傷ラットとした。群7〜12にはそれぞれ0.1、0.3、0.5、0.75、1.0、3mg/日の薬量を毎日皮下注射することにより化合物VIを投与した。群1及び4はそれぞれ無傷(即ち非OVX)群、OVX陰性対照群であり、DMSOを単独投与した。群2及び5(無傷及びOVX)にはアンドロゲン・デヒドロテストステロン(DHT)(1mg/日)を投与し、陽性対照とした。群3は、1.0mg/日の化合物VIを投与された無傷ラットである。化合物VIのAR介在効果とAR非依存効果を示すために、群6(OVX)に0.5mg/日の化合物VIと1.0mg/日の抗アンドロゲンビカルタミドを投与した。1、30、60、90、120日目にBMCを決定した。
【0179】
全群に対する120日目の全身BMDを図1に示す。予想通り、OVXラットのBMD(0.196g/cm2)は、120日目に無傷OVX対照に見られるBMD(0.214g/cm2)より有意に低かった。化合物VI処置は、0.1mg/日より多い薬量でOVXラットにおける骨格BMDの低下を部分的に(即ちOVX対照より有意に大きいBMD)または完全に(即ち無傷対照とは有意には異ならないBMD)阻止した。DHTは、OVXラットにおいてBMDを十分に維持した。しかし、無傷ラットにおいては、DHTはBMDを有意に減少させ、無傷ラットにおける化合物VI処置はBMDを無傷対照のレベルに維持した。抗アンドロゲンビカルタミドの同時投与は、化合物VIの効果を部分的に阻止し、ARが部分的に化合物VIへの骨反応を媒介したことを示している。このように、化合物VIは、OVXラットにおけるBMDの低下を阻止した。
【0180】
切除したL5−L6脊椎のDEXA分析の結果を図2に示す。対照OVXラットは一連の研究の間に有意な量の脊椎のBMDを失ったが、化合物VI処置は、3mg/日の化合物VIではOVXに誘導される骨低下を完全に阻止し、0.5及び1mg/日の化合物VIでは部分的に阻止するような、用量依存的な骨温存効果(bone-sparing effect)を有していた。0.1、0.3、0.75mg/日の化合物VIを投与したOVXラットは、対照OVXラットより高いBMDを示したが、その差は統計学的に有意ではなかった。ビカルタミドの同時投与は、化合物VIの骨温存効果を部分的に抑制した。化合物VIとは対照的に、OVXラットにおけるDHT処置はL5−L6脊椎における骨低下を阻止しなかった。化合物VIは無傷ラットにおけるBMDには効果がなかったが、DHT処置はBMDをOVX対照に類似のレベルまで有意に増加させた。化合物VIは、L2−L4脊椎(図3)、大腿領域4(図4)、及び近位大腿(図5)におけるOVX誘導BMD減少を阻止した。このように、化合物VIは、L2−L4及びL5−L6脊椎におけるOVX誘導BMDの減少を阻止した。
【0181】
この実施例における発見は、全体的にも、体の幾つかの特定位置においても、いずれでも、化合物VIが卵巣切除に起因するBMDの低下を阻止することを示している。このように、SARMSは、閉経などのホルモンの原因に起因する骨低下の阻止に有益である。
【0182】
《実施例3 化合物VIは、骨粗鬆症に起因する皮質骨の低下を阻止し、健康な治療対象における皮質骨量を増加させる》
実施例2からのラットの大腿骨の中央骨幹において皮質厚(CT)を決定した(図6)。OVXラットは、無傷対照ラットに比べて皮質密度の増加を示した。化合物VI及びDHTは共にCTの減少を阻止したが、化合物VIで処置した群はDHTで処置した群より高いCTを示した。その上、無傷ラット及び化合物VIを投与したOVXラットは、無傷対照のレベル以上にCTの有意な増加を示した。
【0183】
大腿骨の中央骨幹での皮質含量(CC)も評価した(図7)。OVX対照ラットにおいて、10.3から8.8mg/mmへのCCの有意な減少が観察された。化合物VIはCCの低下を完全にブロックしたが、低下はDHTによって部分的に阻止されたに過ぎなかった。それに加えて、3mg/日の化合物VIを投与された群は、無傷対照レベルに対してCCの増加を示した。
【0184】
大腿骨の中央骨幹の骨膜周囲(PC)も測定した(図8)。OVXラットにおけるPCは減少したが、減少は化合物VI処置によって完全に阻止された。
【0185】
大腿骨の中央骨幹の皮質骨塩密度(CD)をpQCTにより測定した。化合物VIはOVXにより生じたCDの低下を完全に阻止したが、DHTはCDの低下を部分的に阻止したに過ぎなかった。化合物VIを投与された無傷ラットでは、OVX及び無傷対照ラットに比べてCDの増加が見られた。
【0186】
CT、CC、PC、CDは、皮質骨含量、密度、強さの指標である。このように、化合物VIがOVXラットにおけるこれらの指標を安定化するという発見は、SARMSの骨安定化の質が皮質骨において顕性であることを示している。その上、この実施例の発見は、骨粗鬆症(OVX)の治療対象及び非骨粗鬆症の治療対象の両者においてSARMSが皮質骨を増加させることを示している。
【0187】
《実施例4 化合物VIは、骨粗鬆症に起因する骨梁骨の低下を阻止し、健康な治療対象において骨梁骨量を増加させる》
実施例2からのラットの遠位大腿骨において骨梁BMDを測定した(図9)。有意な骨梁骨低下即ち735〜609mg/cm3が、OVX後に見られたが、これは化合物VI及びDHTによって部分的に阻止された。その上、無傷ラットを化合物VIで処置すると、無傷対照より有意に高いレベルまで骨梁BMDが増加した。
【0188】
この実施例の発見は、SARMSの骨安定化の質が骨梁骨において顕性であることを示している。その上、この発見は、SARMSが骨粗鬆症(OVX)の治療対象及び非骨粗鬆症の治療対象の両者において骨梁骨を増加させることを示している。
【0189】
《実施例5 化合物VIは骨粗鬆症の治療対象及び健康な治療対象の両者において骨を強化する》
更に、大腿骨の生体力学的強さを決定した(図10)。OVX対照ラットは、大腿の生体力学的強さの有意な低下を示した。これは、化合物VI処置及びDHT処置によって完全に阻止された。化合物VIは、無傷ラットに対する影響を示さなかった。
【0190】
それに加えて、このL5脊椎の例では、ラットの骨の圧縮強さ(CS)を測定した(図11)。OVXはCSを有意に低下させなかったが、化合物VIは無傷及びOVXラットの両者においてCSを増加させた。
【0191】
この実施例の発見は、骨粗鬆症(OVX)の治療対象及び非骨粗鬆症の治療対象の両者においてSARMSが骨を強化することを示している。
【0192】
《実施例6 化合物VIは骨粗鬆症の治療対象においてBMCを増加させる》
時間及び用量依存的なBMCの増加は、実施例2に記載の実験の化合物VIで処置した群全てに見られ、群7〜12において、120日目で、対照OVXラットと比較してそれぞれ22%、9%、26.0%、28.5%、30.5%、30.0%、40.1%増加した(図12A−B)。DHTは、BMCを少量(15%)増加させた。30日目の時点では、DHTで処置したマウスではなく化合物VIで処置したマウスがBMCの増加を示した(図13)。このように、化合物VIはOVXラットにおいてBMCを増加させ、SARMSが骨粗鬆症の治療対象におけるBMCを向上させることを示した。
【0193】
《実施例7 化合物VIは骨粗鬆症の治療対象において体脂肪量を減少させ、除脂肪BMCを増加させる》
研究開始時の全ての群に対し、平均体重は267±17g(平均値±偏差、n=120)であった。全てのラットは、一連の研究中に有意な量の重量が増加した(図14)。体重は全てのOVX群において無傷対照群よりも大きく、ラット成長に対するエストロゲン欠乏の影響を示していた。化合物VIを3mg/日投与した群には更なる体重増加が見られた。無傷ラットにおいては、DHTは無傷対照に比べて体重を増加させ、化合物VIはOVX及び無傷対照の両者に関して有意な増加を得た。
【0194】
120日目に体脂肪量(FM)割合をDEXAにより測定した(図15)。OVX対照群は、無傷対照より有意に高いFMを示し、エストロゲン欠乏の身体組成への影響を明らかにした。化合物VIによる処置は、3mg/日投与した群における無傷対照レベルと同等のFMレベルを保ちながら用量依存的な方法でFMを減少させた。化合物VI介在減少は、ビカルタミドの同時投与により阻止された。無傷及びOVXラットの両者におけるDHT処置は、無傷対照よりは高いがOVX対照で観察されるものよりは低い値までFMを増加させた。化合物VIを投与した無傷ラットは、無傷対照に比べてFMの減少を示した。全ての群において、対応する除脂肪量率の変化が観察された。よって、化合物VIは、FM割合のOVX誘発性増加を阻止した。
【0195】
この実施例の発見は、骨粗鬆症の治療対象においてSARMSが除脂肪量/FM比の増加を阻止することが可能であることを示している。
【0196】
《実施例8 化合物VIは骨粗鬆症の治療対象において血清オステオカルシンの上昇を阻止する》
屠殺直前に採取した血清サンプル中のオステオカルシンを測定した。OVXはオステオカルシンレベルを増加させ、化合物VI及びDHTの両者による処置はオステオカルシンレベルを非OVX対照において観察されるレベルまで戻した(図16)。
【0197】
結論としては、実施例2〜8は、化合物VIが骨粗鬆症の治療対象において皮質骨と骨梁骨の両方の低下、骨強度の低下、FMの増加を抑制することを示している。更に、ほとんどの場合、化合物VIの正の効果はDHTと同程度またはそれ以上であった。このように、本発明は、(a)SARMSが骨粗鬆症の存在下でも不存在下でも骨同化作用(osteo-anabolic)効果を有すること、(b)SARMSが骨粗鬆症の結果に有効な再吸収阻害効果を有することを示している。
【0198】
《実施例9 化合物VIは骨粗鬆症の治療対象においてBMDの低下を逆戻りさせる》
実験動物及び実験方法
実施例9〜13のマウスを卵巣切除し、実施例2で述べたのと同じ処置を施した。但し、このケースではOVX後90日目までは処置を開始しなかった。実施例2に記載のようにマウスを210日目に屠殺し、分析した。
【0199】
結果
図17に示すように、OVX対照群の全身BMD(0.197g/cm2)は無傷対照群(0.212g/cm2)より低かった。化合物VIは、0.3、0.5、0.75、1.0、3.0mg/日投与群におけるBMDの低下を0.204、0.209、0.206、0.205、0.205、0.206g/cm2にそれぞれ逆戻りさせた。それに反して、DHTはBMDを回復させなかった。DHTも化合物VIも無傷動物のBMDを増加させなかった。化合物VIは、無傷動物のBMDを0.214g/cm2まで統計学的に有意ではない量だけ増加させた。DHTは、それどころか、BMDを0.205g/cm2まで減少させた。化合物VIとビカルタミドを同時投与した動物は、化合物VIを単独で投与した動物と異なっていなかった。このように、化合物VIは、骨粗鬆症ラットにおけるBMDの低下を逆戻りさせた。
【0200】
全身BMDと同様に、OVXはL5−L6脊椎においてBMDに悪影響を与え、無傷動物における0.234g/cm2からOVX対照における0.192g/cm2まで減少させた(図18)。L5−L6BMDは、3.0mg/日、0.3mg/日をそれぞれ投与されたOVX対照動物に比べて有意に増加したか或いは完全に回復させた。化合物VIの他の薬量は、統計学的有意性に到達しない増加を生じさせた。同様に、DHT処置は、OVX動物におけるL5−L6BMDを部分的に回復させた。化合物VIは無傷動物においてL5−L6BMDに影響しなかったが、DHTはOVX対照に類似のレベルまで有意な増加がもたらされた。化合物VI+ビカルタミドにより処置した動物におけるL5−L6BMDは、同量の化合物VI単独で処置した動物において観察されるものと有意には異なっていなかった。薬量0.1、0.75、3.0mg/日の化合物VIで統計学的有意性に到達したこと以外は類似の結果が大腿のBMD測定において観察された(図19)。このように、化合物VIは、OVXの結果として失われたBMDを回復させる。この実施例の結果は、SARMSは骨粗鬆症に由来するBMD低下を逆戻りさせることができることを示している。骨粗鬆症が発生するまで処置を遅延させることによって、再吸収阻害活性の寄与度が小さくあるべき場所における化合物VIの同化作用活性の評価が可能になった。このように、骨同化作用活性は、SARMSが骨粗鬆症及び非骨粗鬆症の治療対象における骨量を増加させるメカニズムの少なくとも1つである。
【0201】
《実施例10 化合物VIは骨粗鬆症の治療対象における皮質骨の低下を逆戻りさせる》
実施例8のラットに対して大腿骨の中央骨幹でのCCを決定した。OVXラットにおいてCCは10.3から8.9mg/mmに減少した(図20)。1.0mg/日及び3.0mg/日薬量の化合物VIはそれぞれCCの低下を部分的に(9.6mg/mm)及び完全に(10.1mg/mm)逆戻りさせた。DHTは、CCを9.9mg/mmに完全に回復させた。CTは、OVXの結果として0.72mmから0.66mmに減少した。この減少は、化合物VIで処置した群の幾つかにおいて有意に逆戻りした(図21)。CCと同様に、PCはOVX後に11.98から11.45mmに減少した。減少は、1及び3mg/日の化合物VIを与えたラットにおいてそれぞれ12.06及び12.21mmに完全に逆戻りさせた(図22)。DHT処置は、11.84mmへの僅かな統計学的に有意ではない増加を生じさせた。
【0202】
この実施例の結果は、SARMSは骨粗鬆症の結果起こる皮質骨低下を逆戻りさせることができることを示している。
【0203】
《実施例11 化合物VIは骨粗鬆症の治療対象における骨梁骨の低下を逆戻りさせる》
それに加えて、遠位大腿骨で骨梁BMDを測定した(図23)。OVX後、骨梁骨低下は遠位大腿骨において明らかであった。DHT及び化合物VIは共に骨梁BMDを部分的に回復させたが、このことは、SARMSは骨粗鬆症の結果起こる骨梁骨低下を部分的に逆戻りさせることができることを示している。
【0204】
《実施例12 化合物VIは骨粗鬆症の治療対象における骨の衰弱を逆戻りさせる》
実施例8のラットの大腿骨の生体力学的強さを3点曲げにより決定した(図24)。OVXは、最大負荷を233Nから191Nに低下させた。1.0及び3.0mg/日の化合物VIによる処置は、最大負荷をそれぞれ217N、215Nに増加させた。値は無傷対照と有意には異ならず、SARMSは骨粗鬆症の結果起こる骨の衰弱を逆戻りさせることができることを示している。DHT処置は、最大負荷を214Nに増加させた。
【0205】
《実施例13 化合物VIは骨粗鬆症の治療対象において増加したFMを逆戻りさせる》
実施例8のラットの体重は、OVXによって308gから336gに増加し、化合物VIによって用量依存的な方法で更に増加した(図25)。例えば、0.1及び3.0mg/日の化合物VIにより処置した群は、それぞれ平均して350g及び381gであった。化合物VIにより処置した無傷動物の体重は無傷対照と同じであったが、無傷動物においてDHTによる処置を行ったところ、体重が357gに増加した。
【0206】
更に、ラットのFM割合を評価した。OVX対照群におけるFMは、29%から41%に増加した。化合物VI処置は、全ての薬量群においてOVX対照群より低いFMを生じさせたが、有意な差がない薬量群もあった(図26)。減少はDHT処置でも見られた。ビカルタミドと化合物VIの同時投与は、化合物VI処置単独の場合に見られるFMへの正の効果を部分的に取り消した。無傷動物の化合物VI及びDHT処置により、PMはそれぞれ2%減少及び8%増加した。
【0207】
この実施例の発見は、(a)SARMSは骨粗鬆症に由来する増加したFMを逆戻りさせることができ、(b)SARMSは骨粗鬆症の治療対象において肥満度(body mass)を増加させることができることを示している。
【0208】
要約すれば、実施例9〜13の発見は、SARMSが骨粗鬆症の治療対象においてBMDの低下、骨皮質及び骨梁骨の低下、骨の衰弱、及び増加したFMを逆戻りさせ得ることを示している。骨粗鬆症の開始後まで薬物を加えなかったので、これらの実施例の発見は、化合物VIの再吸収阻害活性に反対する同化作用活性を評価した。これらの発見は、(a)骨同化作用活性と、(b)SARMSの骨粗鬆症に対する防御活性を確認し、実施例2〜8の結果の補強に資する。
【0209】
《実施例14 化合物VIと化合物IX及びXIの比較》
実施例1〜13に記載の研究と同時に、OVXモデルにおける骨格成長及び維持に対する化合物VIの効果と、A環のパラ−ニトロ置換基がパラ−シアノ置換基に置換されてB環のパラ−アセトアミド置換基がパラ−フルオロ置換基(化合物IX)またはパラ−クロロ置換基(化合物XI)に置換された化合物VIの2つの構造類似体の効果とを比較した。OVX直後にもその後90日目にも化合物を投与した。実施例2〜13に述べた如くラットを分析した。
【0210】
120日目の屠殺後すぐに処置した即時処置群に対する結果を図27〜28に示す。予想通り、OVX動物のBMDは120日目で無傷対照より有意に小さかった。化合物VI、IX、XIは全て、全体として体のBMD低下を部分的に阻止した(図27)。
【0211】
LS−L6脊椎のBMDも評価した。OVX(vehicle)対照動物は、有意な量のBMDを失った(図28)。薬量1mg/日の化合物VI、IX、XIは全て、OVX誘発性の骨低下を部分的に阻止したが、DHTはそうはしなかった。化合物XIは、全身及びL5−L6脊椎の両方においてBMDへの最大の効果を示した。尤も、効果は、評価された他のSARMSと統計学的には異ならなかった。無傷動物におけるDHT処置は、OVX対照と同様のレベルまでBMDを有意に減少させたが、化合物VIを与えた無傷動物におけるBMDは、無傷対照と同様であった。
【0212】
これらの結果は、化合物VIと同様、化合物IX及びXIが、骨を保護する効果を示しかつ筋肉衰弱及び骨粗鬆症の処置に適用できる強力なSARMSであることを示している。
【0213】
時間を置いて210日目に処置した遅延処置群のBMD研究を図29〜30に示す。OVXは、化合物VI及びDHTによって部分的に阻止されたが化合物IXまたはXIによっては阻止されなかった全身BMDを有意に減少させた(図29)。L5−L6脊椎の場合、DHT処置もまたBMC(図30)の減少を阻止しなかった。無傷動物においては、化合物VIではなくDHTがBMDを有意に減少させた。
【0214】
全ての即時処置群に対する平均体重は、262±3g(平均値±偏差)であった。全ての動物は、一連の研究間に有意な量の重量が増加したが(図31)、OVXによる更なる増加があった。化合物IX及びIXによる処置は、無傷対照またはOVX対照に対して更に体重を増加させた。無傷動物においては、化合物VIではなくDHTによる処置は、無傷対照に比べて体重を更に増加させた。遅延処置群においても類似の結果が見られた(図32)。
【0215】
FMは、OVXによって増加し、化合物IX及びXIによる処置によって更に増加した(図33)。しかし、増加は、化合物VIで観察されたものより有意に少なかった。無傷及びOVX動物の両者におけるDHT処置は、それぞれ、無傷対照よりは高いがOVX対照で観察されるものよりは低いレベルまでFMを増加させた。無傷ラットへの化合物VIの投与は、FMを減少させた。遅延処置群において、OVX対照群と有意に異なる処置OVX群はなかった(図34)。
【0216】
この実施例に示される結果は、骨を保護する効果が化合物VIに特有のものではなく、むしろ他のSARMSによっても示されるものであることを明らかにしている。
【0217】
《実施例15 化合物VIの薬物動態特性》
研究デザイン
動物を各群に5匹で7つの群に無作為に分けた。頚静脈カテーテルによって静脈内(i.v.)投与(0.5、1、10、30mg kg−1)を投与した。最終体積0.2〜0.3mlで薬量を送達するために適正濃度で薬液を調製した。0.1mlの目盛り付きの1ml注射器を用いて薬量を体積的に送達した。薬量の投与後、無菌ヘパリン化生理食塩水の一定分量(投与薬量の体積の3倍)によりカテーテルを洗い流した。経口(p.o.)投与(1、10、30 mg kg−1)を0.2〜0.3mlの体積で経口胃管栄養法により胃に直接導入した。これらの薬量は、前臨床薬理学中に用いた化合物VI薬量の範囲、安全性、及び毒物学の研究を表すために選択された。
【0218】
静脈内投与後の化合物VIの薬物動態
化合物VIは、0.5、1、10、30mg kg−1の静脈内投与後、それぞれ1.6、2.3、28、168μg ml−1の平均最大血漿濃度に達した。化合物VIに対する分布の平均定常状態の体積(0.45L kg−1)は、全体内水分(0.67L kg−1)より僅かに少なかった。CLは比較的一定のままであり、薬量0.5、1mg kg−1及び10mg kg−1に対してそれぞれ1.92、2.12、1.52 ml min−1kg−1であった。しかし、化合物VIのCLは、薬量30mg kg−1で(1.00ml min−1kg−1、p<0.05)低下した。それに応じて、血漿薬物濃度下面積(AUC)は薬量10mg kg−1まで比例的に増加した。しかし、30mg kg−1の静脈内投与では、AUCは薬量29mg kg−1まで非比例的に増加した。尿中排泄データは、薬物の0.5%以下が不変で排泄されることを示し、不変の薬物としての化合物VIの腎排泄が無視できることを示していた。化合物VIのT1/2は、0.5、1、10、30mg kg−1の投与後、それぞれ154、182、223、316分であった。MRIは、クリアランスの減少により、薬量0.5及び1mg kg−1で222及び240分から薬量10及び30mg kg−1で305及び423分までそれぞれ増加した。
【0219】
経口投与後の化合物VIの薬物動態
化合物VIは、1、10、30mg kg−1の経口投与後、それぞれ1.4、11、20μg ml−1の平均最大血漿濃度に達した。最大血漿濃度に到達するまでの時間(Tmax)は、1、10、30mg kg−1の投与に対してそれぞれ48、84、336分であった。化合物VIは薬量1及び10mgに対して完全に生物学的利用可能であった。しかし、30mg kg−1の投与後、化合物VIの生物学的利用率は57%に減少し、化合物VIのT1/2は、1、10、30mg kg−1の投与後、それぞれ、203、173、266分であった。
【0220】
以上本発明について説明したが、当業者であれば、本明細書中に特に示された内容によって本発明が限定されるものでないことを理解するであろう。発明の範囲は、むしろ、特許請求の範囲によって画定される。
【特許請求の範囲】
【請求項1】
骨関連疾患を治療する薬剤を製造するための、選択的アンドロゲン受容体(SARM)化合物の使用であって、
前記SARM化合物が、次の化学構造式Iで表されることを特徴とする使用。

ただし、Gは、O又はSであり、
Xは、Xは、Oであり、
Tは、OH、OR、−NHCOCH3又はNHCORであり、
Zは、NO2、CN、COOH、COR、NHCOR又はCONHRであり、
Yは、CF3、F、I、Br、Cl、CN、C(R)3又はSn(R)3であり、
Qは、アルキル、F、I、Br、Cl、CF3、CN、C(R)3、Sn(R)3、N(R)2、NHCOCH3、NHCOCF3、NHCOR、NHCONHR、NHCOOR、OCONHR、CONHR、NHCSCH3、NHCSCF3、NHCSR、NHSO2CH3、NHSO2R、OR、COR、OCOR、OSO2R、SO2R、SR、CSN、NCS、OCN又はNCOであり、
Rは、アルキル、ハロアルキル、ジハロアルキル、トリハロアルキル、CH2F、CHF2、CF3、CF2CF3、アリル、フェニル、F、I、Br、Cl又はOHであり、
R1は、CH3、CH2F、CHF2、CF3、CH2CH3又はCF2CF3である。
【請求項2】
前記骨関連疾患は、骨粗鬆症、骨減少症、骨吸収の増加、骨折、骨の脆弱化、骨ミネラル濃度(BMD)の減少、又はそれらの任意の組み合わせであることを特徴とする請求項1に記載の使用。
【請求項3】
前記SARM化合物が、次の化学構造式IIで表されることを特徴とする請求項1に記載の使用。

ただし、Xは、Oであり、
Zは、NO2、CN、COOH、COR、NHCOR又はCONHRであり、
Yは、CF3、F、I、Br、Cl、CN、C(R)3又はSn(R)3であり
Qは、アルキル、F、I、Br、Cl、CF3、CN、C(R)3、Sn(R)3、N(R)2、NHCOCH3、NHCOCF3、NHCOR、NHCONHR、NHCOOR、OCONHR、CONHR、NHCSCH3、NHCSCF3、NHCSR、NHSO2CH3、NHSO2R、OR、COR、OCOR、OSO2R、SO2R、SR、CSN、NCS、OCN又はNCOであり、
Rは、アルキル、ハロアルキル、ジハロアルキル、トリハロアルキル、CH2F、CHF2、CF3、CF2CF3、アリル、フェニル、F、I、Br、Cl、アルケニル又はOHである。
【請求項4】
前記SARM化合物が、次の化学構造式VIで表されることを特徴とする請求項1に記載の使用。

【請求項5】
前記SARM化合物が、次の化学構造式IXで表されることを特徴とする請求項1に記載の使用。

【請求項6】
前記SARM化合物が、次の化学構造式XIで表されることを特徴とする請求項1に記載の使用。

【請求項7】
前記SARM化合物が、次の化学構造式XVIで表されることを特徴とする請求項1に記載の使用。

【請求項8】
患者の骨強度を増加させる薬剤を製造するための、選択的アンドロゲン受容体(SARM)化合物の使用であって、
前記SARM化合物が、次の化学構造式Iで表されることを特徴とする請求項10に記載の使用。

ただし、Gは、O又はSであり、
Xは、Xは、Oであり、
Tは、OH、OR、−NHCOCH3又はNHCORであり、
Zは、NO2、CN、COOH、COR、NHCOR又はCONHRであり、
Yは、CF3、F、I、Br、Cl、CN、C(R)3又はSn(R)3であり、
Qは、アルキル、F、I、Br、Cl、CF3、CN、C(R)3、Sn(R)3、N(R)2、NHCOCH3、NHCOCF3、NHCOR、NHCONHR、NHCOOR、OCONHR、CONHR、NHCSCH3、NHCSCF3、NHCSR、NHSO2CH3、NHSO2R、OR、COR、OCOR、OSO2R、SO2R、SR、CSN、NCS、OCN又はNCOであり、
Rは、アルキル、ハロアルキル、ジハロアルキル、トリハロアルキル、CH2F、CHF2、CF3、CF2CF3、アリル、フェニル、F、I、Br、Cl又はOHであり、
R1は、CH3、CH2F、CHF2、CF3、CH2CH3又はCF2CF3である。
【請求項9】
前記薬剤が骨粗鬆症の患者の骨強度を増加させることを特徴とする請求項8に記載の使用。
【請求項10】
前記骨粗鬆症がホルモン的に誘発されたことを特徴とする請求項9に記載の使用。
【請求項11】
前記SARM化合物が、次の化学構造式IIで表されることを特徴とする請求項8に記載の使用。

ただし、Xは、Oであり、
Zは、NO2、CN、COOH、COR、NHCOR又はCONHRであり、
Yは、CF3、F、I、Br、Cl、CN、C(R)3又はSn(R)3であり
Qは、アルキル、F、I、Br、Cl、CF3、CN、C(R)3、Sn(R)3、N(R)2、NHCOCH3、NHCOCF3、NHCOR、NHCONHR、NHCOOR、OCONHR、CONHR、NHCSCH3、NHCSCF3、NHCSR、NHSO2CH3、NHSO2R、OR、COR、OCOR、OSO2R、SO2R、SR、CSN、NCS、OCN又はNCOであり、
Rは、アルキル、ハロアルキル、ジハロアルキル、トリハロアルキル、CH2F、CHF2、CF3、CF2CF3、アリル、フェニル、F、I、Br、Cl、アルケニル又はOHである。
【請求項12】
前記SARM化合物が、次の化学構造式VIで表されることを特徴とする請求項8に記載の使用。

【請求項13】
前記SARM化合物が、次の化学構造式IXで表されることを特徴とする請求項8に記載の使用。

【請求項14】
前記SARM化合物が、次の化学構造式XIで表されることを特徴とする請求項8に記載の使用。

【請求項15】
前記SARM化合物が、次の化学構造式XVIで表されることを特徴とする請求項8に記載の使用。

【請求項16】
患者の骨量を増加させる薬剤を製造するための、選択的アンドロゲン受容体(SARM)化合物の使用であって、
前記SARM化合物が、次の化学構造式Iで表されることを特徴とする使用。

ただし、Gは、O又はSであり、
Xは、Xは、Oであり、
Tは、OH、OR、−NHCOCH3又はNHCORであり、
Zは、NO2、CN、COOH、COR、NHCOR又はCONHRであり、
Yは、CF3、F、I、Br、Cl、CN、C(R)3又はSn(R)3であり、
Qは、アルキル、F、I、Br、Cl、CF3、CN、C(R)3、Sn(R)3、N(R)2、NHCOCH3、NHCOCF3、NHCOR、NHCONHR、NHCOOR、OCONHR、CONHR、NHCSCH3、NHCSCF3、NHCSR、NHSO2CH3、NHSO2R、OR、COR、OCOR、OSO2R、SO2R、SR、CSN、NCS、OCN又はNCOであり、
Rは、アルキル、ハロアルキル、ジハロアルキル、トリハロアルキル、CH2F、CHF2、CF3、CF2CF3、アリル、フェニル、F、I、Br、Cl又はOHであり、
R1は、CH3、CH2F、CHF2、CF3、CH2CH3又はCF2CF3である。
【請求項17】
前記薬剤が骨粗鬆症の患者の骨量を増加させることを特徴とする請求項16に記載の使用。
【請求項18】
前記骨粗鬆症がホルモンにより誘発されたことを特徴とする請求項17に記載の使用。
【請求項19】
前記骨量が皮質骨量であることを特徴とする請求項16に記載の使用。
【請求項20】
前記骨量が骨梁量又は海綿骨の骨量であることを特徴とする請求項16に記載の使用。
【請求項21】
前記SARM化合物が、次の化学構造式IIで表されることを特徴とする請求項16に記載の使用。

ただし、Xは、Oであり、
Zは、NO2、CN、COOH、COR、NHCOR又はCONHRであり、
Yは、CF3、F、I、Br、Cl、CN、C(R)3又はSn(R)3であり
Qは、アルキル、F、I、Br、Cl、CF3、CN、C(R)3、Sn(R)3、N(R)2、NHCOCH3、NHCOCF3、NHCOR、NHCONHR、NHCOOR、OCONHR、CONHR、NHCSCH3、NHCSCF3、NHCSR、NHSO2CH3、NHSO2R、OR、COR、OCOR、OSO2R、SO2R、SR、CSN、NCS、OCN又はNCOであり、
Rは、アルキル、ハロアルキル、ジハロアルキル、トリハロアルキル、CH2F、CHF2、CF3、CF2CF3、アリル、フェニル、F、I、Br、Cl、アルケニル又はOHである。
【請求項22】
前記SARM化合物が、次の化学構造式VIで表されることを特徴とする請求項16に記載の使用。

【請求項23】
前記SARM化合物が、次の化学構造式IXで表されることを特徴とする請求項16に記載の使用。

【請求項24】
前記SARM化合物が、次の化学構造式XIで表されることを特徴とする請求項16に記載の使用。

【請求項25】
前記SARM化合物が、次の化学構造式XVIで表されることを特徴とする請求項16に記載の使用。

【請求項26】
骨関連疾患を治療する薬剤、または患者において骨量を増加させる薬剤を製造するための、請求項1若しくは16に記載の選択的アンドロゲン受容体(SARM)化合物、又はその薬学的に許容される塩、水和物、N酸化物或いはそれらの任意の組み合わせの使用。
【請求項27】
前記薬剤が、薬学的に許容される担体をさらに含むことを特徴とする請求項1若しくは16に記載の使用。
【請求項1】
骨関連疾患を治療する薬剤を製造するための、選択的アンドロゲン受容体(SARM)化合物の使用であって、
前記SARM化合物が、次の化学構造式Iで表されることを特徴とする使用。

ただし、Gは、O又はSであり、
Xは、Xは、Oであり、
Tは、OH、OR、−NHCOCH3又はNHCORであり、
Zは、NO2、CN、COOH、COR、NHCOR又はCONHRであり、
Yは、CF3、F、I、Br、Cl、CN、C(R)3又はSn(R)3であり、
Qは、アルキル、F、I、Br、Cl、CF3、CN、C(R)3、Sn(R)3、N(R)2、NHCOCH3、NHCOCF3、NHCOR、NHCONHR、NHCOOR、OCONHR、CONHR、NHCSCH3、NHCSCF3、NHCSR、NHSO2CH3、NHSO2R、OR、COR、OCOR、OSO2R、SO2R、SR、CSN、NCS、OCN又はNCOであり、
Rは、アルキル、ハロアルキル、ジハロアルキル、トリハロアルキル、CH2F、CHF2、CF3、CF2CF3、アリル、フェニル、F、I、Br、Cl又はOHであり、
R1は、CH3、CH2F、CHF2、CF3、CH2CH3又はCF2CF3である。
【請求項2】
前記骨関連疾患は、骨粗鬆症、骨減少症、骨吸収の増加、骨折、骨の脆弱化、骨ミネラル濃度(BMD)の減少、又はそれらの任意の組み合わせであることを特徴とする請求項1に記載の使用。
【請求項3】
前記SARM化合物が、次の化学構造式IIで表されることを特徴とする請求項1に記載の使用。

ただし、Xは、Oであり、
Zは、NO2、CN、COOH、COR、NHCOR又はCONHRであり、
Yは、CF3、F、I、Br、Cl、CN、C(R)3又はSn(R)3であり
Qは、アルキル、F、I、Br、Cl、CF3、CN、C(R)3、Sn(R)3、N(R)2、NHCOCH3、NHCOCF3、NHCOR、NHCONHR、NHCOOR、OCONHR、CONHR、NHCSCH3、NHCSCF3、NHCSR、NHSO2CH3、NHSO2R、OR、COR、OCOR、OSO2R、SO2R、SR、CSN、NCS、OCN又はNCOであり、
Rは、アルキル、ハロアルキル、ジハロアルキル、トリハロアルキル、CH2F、CHF2、CF3、CF2CF3、アリル、フェニル、F、I、Br、Cl、アルケニル又はOHである。
【請求項4】
前記SARM化合物が、次の化学構造式VIで表されることを特徴とする請求項1に記載の使用。

【請求項5】
前記SARM化合物が、次の化学構造式IXで表されることを特徴とする請求項1に記載の使用。

【請求項6】
前記SARM化合物が、次の化学構造式XIで表されることを特徴とする請求項1に記載の使用。

【請求項7】
前記SARM化合物が、次の化学構造式XVIで表されることを特徴とする請求項1に記載の使用。

【請求項8】
患者の骨強度を増加させる薬剤を製造するための、選択的アンドロゲン受容体(SARM)化合物の使用であって、
前記SARM化合物が、次の化学構造式Iで表されることを特徴とする請求項10に記載の使用。

ただし、Gは、O又はSであり、
Xは、Xは、Oであり、
Tは、OH、OR、−NHCOCH3又はNHCORであり、
Zは、NO2、CN、COOH、COR、NHCOR又はCONHRであり、
Yは、CF3、F、I、Br、Cl、CN、C(R)3又はSn(R)3であり、
Qは、アルキル、F、I、Br、Cl、CF3、CN、C(R)3、Sn(R)3、N(R)2、NHCOCH3、NHCOCF3、NHCOR、NHCONHR、NHCOOR、OCONHR、CONHR、NHCSCH3、NHCSCF3、NHCSR、NHSO2CH3、NHSO2R、OR、COR、OCOR、OSO2R、SO2R、SR、CSN、NCS、OCN又はNCOであり、
Rは、アルキル、ハロアルキル、ジハロアルキル、トリハロアルキル、CH2F、CHF2、CF3、CF2CF3、アリル、フェニル、F、I、Br、Cl又はOHであり、
R1は、CH3、CH2F、CHF2、CF3、CH2CH3又はCF2CF3である。
【請求項9】
前記薬剤が骨粗鬆症の患者の骨強度を増加させることを特徴とする請求項8に記載の使用。
【請求項10】
前記骨粗鬆症がホルモン的に誘発されたことを特徴とする請求項9に記載の使用。
【請求項11】
前記SARM化合物が、次の化学構造式IIで表されることを特徴とする請求項8に記載の使用。

ただし、Xは、Oであり、
Zは、NO2、CN、COOH、COR、NHCOR又はCONHRであり、
Yは、CF3、F、I、Br、Cl、CN、C(R)3又はSn(R)3であり
Qは、アルキル、F、I、Br、Cl、CF3、CN、C(R)3、Sn(R)3、N(R)2、NHCOCH3、NHCOCF3、NHCOR、NHCONHR、NHCOOR、OCONHR、CONHR、NHCSCH3、NHCSCF3、NHCSR、NHSO2CH3、NHSO2R、OR、COR、OCOR、OSO2R、SO2R、SR、CSN、NCS、OCN又はNCOであり、
Rは、アルキル、ハロアルキル、ジハロアルキル、トリハロアルキル、CH2F、CHF2、CF3、CF2CF3、アリル、フェニル、F、I、Br、Cl、アルケニル又はOHである。
【請求項12】
前記SARM化合物が、次の化学構造式VIで表されることを特徴とする請求項8に記載の使用。

【請求項13】
前記SARM化合物が、次の化学構造式IXで表されることを特徴とする請求項8に記載の使用。

【請求項14】
前記SARM化合物が、次の化学構造式XIで表されることを特徴とする請求項8に記載の使用。

【請求項15】
前記SARM化合物が、次の化学構造式XVIで表されることを特徴とする請求項8に記載の使用。

【請求項16】
患者の骨量を増加させる薬剤を製造するための、選択的アンドロゲン受容体(SARM)化合物の使用であって、
前記SARM化合物が、次の化学構造式Iで表されることを特徴とする使用。

ただし、Gは、O又はSであり、
Xは、Xは、Oであり、
Tは、OH、OR、−NHCOCH3又はNHCORであり、
Zは、NO2、CN、COOH、COR、NHCOR又はCONHRであり、
Yは、CF3、F、I、Br、Cl、CN、C(R)3又はSn(R)3であり、
Qは、アルキル、F、I、Br、Cl、CF3、CN、C(R)3、Sn(R)3、N(R)2、NHCOCH3、NHCOCF3、NHCOR、NHCONHR、NHCOOR、OCONHR、CONHR、NHCSCH3、NHCSCF3、NHCSR、NHSO2CH3、NHSO2R、OR、COR、OCOR、OSO2R、SO2R、SR、CSN、NCS、OCN又はNCOであり、
Rは、アルキル、ハロアルキル、ジハロアルキル、トリハロアルキル、CH2F、CHF2、CF3、CF2CF3、アリル、フェニル、F、I、Br、Cl又はOHであり、
R1は、CH3、CH2F、CHF2、CF3、CH2CH3又はCF2CF3である。
【請求項17】
前記薬剤が骨粗鬆症の患者の骨量を増加させることを特徴とする請求項16に記載の使用。
【請求項18】
前記骨粗鬆症がホルモンにより誘発されたことを特徴とする請求項17に記載の使用。
【請求項19】
前記骨量が皮質骨量であることを特徴とする請求項16に記載の使用。
【請求項20】
前記骨量が骨梁量又は海綿骨の骨量であることを特徴とする請求項16に記載の使用。
【請求項21】
前記SARM化合物が、次の化学構造式IIで表されることを特徴とする請求項16に記載の使用。

ただし、Xは、Oであり、
Zは、NO2、CN、COOH、COR、NHCOR又はCONHRであり、
Yは、CF3、F、I、Br、Cl、CN、C(R)3又はSn(R)3であり
Qは、アルキル、F、I、Br、Cl、CF3、CN、C(R)3、Sn(R)3、N(R)2、NHCOCH3、NHCOCF3、NHCOR、NHCONHR、NHCOOR、OCONHR、CONHR、NHCSCH3、NHCSCF3、NHCSR、NHSO2CH3、NHSO2R、OR、COR、OCOR、OSO2R、SO2R、SR、CSN、NCS、OCN又はNCOであり、
Rは、アルキル、ハロアルキル、ジハロアルキル、トリハロアルキル、CH2F、CHF2、CF3、CF2CF3、アリル、フェニル、F、I、Br、Cl、アルケニル又はOHである。
【請求項22】
前記SARM化合物が、次の化学構造式VIで表されることを特徴とする請求項16に記載の使用。

【請求項23】
前記SARM化合物が、次の化学構造式IXで表されることを特徴とする請求項16に記載の使用。

【請求項24】
前記SARM化合物が、次の化学構造式XIで表されることを特徴とする請求項16に記載の使用。

【請求項25】
前記SARM化合物が、次の化学構造式XVIで表されることを特徴とする請求項16に記載の使用。

【請求項26】
骨関連疾患を治療する薬剤、または患者において骨量を増加させる薬剤を製造するための、請求項1若しくは16に記載の選択的アンドロゲン受容体(SARM)化合物、又はその薬学的に許容される塩、水和物、N酸化物或いはそれらの任意の組み合わせの使用。
【請求項27】
前記薬剤が、薬学的に許容される担体をさらに含むことを特徴とする請求項1若しくは16に記載の使用。
【図1】


【図2】


【図3】


【図4】


【図5】


【図6】


【図7】


【図8】


【図9】


【図10】


【図11】


【図12】


【図13】


【図14】


【図15】


【図16】


【図17】


【図18】


【図19】


【図20】


【図21】


【図22】


【図23】


【図24】


【図25】


【図26】


【図27】


【図28】


【図29】


【図30】


【図31】


【図32】


【図33】


【図34】




【図2】


【図3】


【図4】


【図5】


【図6】


【図7】


【図8】


【図9】


【図10】


【図11】


【図12】


【図13】


【図14】


【図15】


【図16】


【図17】


【図18】


【図19】


【図20】


【図21】


【図22】


【図23】


【図24】


【図25】


【図26】


【図27】


【図28】


【図29】


【図30】


【図31】


【図32】


【図33】


【図34】


【公開番号】特開2010−280733(P2010−280733A)
【公開日】平成22年12月16日(2010.12.16)
【国際特許分類】
【出願番号】特願2010−212921(P2010−212921)
【出願日】平成22年9月23日(2010.9.23)
【分割の表示】特願2006−535571(P2006−535571)の分割
【原出願日】平成16年10月12日(2004.10.12)
【出願人】(504206621)ジーティーエックス・インコーポレイテッド (20)
【Fターム(参考)】
【公開日】平成22年12月16日(2010.12.16)
【国際特許分類】
【出願日】平成22年9月23日(2010.9.23)
【分割の表示】特願2006−535571(P2006−535571)の分割
【原出願日】平成16年10月12日(2004.10.12)
【出願人】(504206621)ジーティーエックス・インコーポレイテッド (20)
【Fターム(参考)】
[ Back to top ]

