選択的エストロゲン受容体モジュレーターとしてのシクロアルキリデン化合物
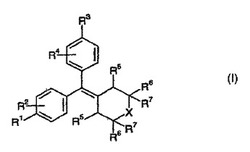
本発明は、様々な治療的使用を有する式(I)に示される化合物、より具体的には選択的エストロゲン受容体モジュレーションに有用である、置換シクロアルキリデン化合物に関する。
【化1】

【化1】

【発明の詳細な説明】
【技術分野】
【0001】
本発明は、様々な治療的使用を有する新規な化合物、より具体的には選択的エストロゲン受容体モジュレーションに特に有用である、新規な置換シクロアルキリデン化合物に関する。
【背景技術】
【0002】
エストロゲンは、生殖器系の発達及び維持に関係する細胞過程における周知の内分泌レギュレーターである。エストロゲンはまた、骨、肝臓、心臓血管系、および中枢神経系などの多くの非生殖器組織においても重要な作用を有することが明らかにされている。エストロゲンがどのようにその作用を発揮するかに関する最も広く受け入れられている仮説は、細胞内ステロイドホルモン受容体への結合である。受容体および結合されたリガンドが細胞の核に移行した後、該複合体がDNA中の認識部位に結合することにより、特定の遺伝子のモジュレーションが可能になる。このほか、エストロゲンが膜始動シグナリングカスケードを介してその作用を媒介する可能性があることが、現在、明らかになりつつあるが、この研究の大部分は、いまだ実験的なものである。Kousteni et al., Journal of Clinical Investigation, (2003), 111, 1651-1664(非特許文献1、そのような教示に関して、参照により本明細書に組み入れられるものとする)を参照されたい。
【0003】
ある種の物質はその生物学的活性を「組織選択的」方法で示しうると説明されている。言い換えれば、組織選択性により、特定の組織ではエストロゲンアゴニストとして機能しうるが、他の組織ではエストロゲンアンタゴニストとして作用しうる。「選択的エストロゲン受容体モジュレーター」(SERM)という用語は、これらの分子に与えられたものである。SERMの例としては、タモキシフェン、ラロキシフェン、ラソフォキシフェン、クロミフェン、およびナフォキシジンが挙げられる。この組織選択的活性の分子論的基礎は、完全には解明されていない。なんら特定の理論に限定するものではないが、エストロゲン受容体をさまざまなコンフォメーション状態にさせてコアクチベータータンパク質およびコリプレッサータンパク質、ならびに転写レギュレーションに関係する他の重要なタンパク質を動員するにあたり、特異な能力を示しうるリガンドの能力が関与していると考えられる。McDonnell, D. P., The Molecular Pharmacology of SERMs, Trends Endocrinol. Metab. 1999, 301-311(非特許文献2、そのような内容に関して、参照により本明細書に組み入れられるものとする)を参照されたい。
【0004】
歴史的にみると、エストロゲンは、エストロゲン受容体アルファ(ERα)と現在呼ばれる単一のエストロゲン受容体を介してその生物学的活性を示すと考えられていた。しかしながら、最近になって、エストロゲン受容体ベータ(ERβ)と呼ばれる第2のサブタイプのエストロゲン受容体が発見された。Kuiper et al., WO 97/09348(特許文献1)およびKuiper et al.,「ラットの前立腺および卵巣で発現される新規なエストロゲン受容体のクローニング(Cloning of a Novel Estrogen Receptor Expressed in Rat Prostate and Ovary)」, Proc. Natl. Acad. Sci. U.S.A., 1996, pp. 5925-5930(非特許文献3、いずれも、そのようなサブタイプに関して、参照により本明細書に組み入れられるものとする)を参照されたい。ERβは、ヒトにおいて発現される。Mosselman et al.,「ERβ:新規なヒトエストロゲン受容体の同定および特徴付け(ERβ: Identification and Characterization of a Novel Human Estrogen Receptor)」, FEBS Lett., 1996, pp. 49-53(非特許文献4、そのような発現に関して、参照により本明細書に組み入れられるものとする)を参照されたい。この第2のサブタイプのエストロゲン受容体の発見により、エストロゲンシグナリングの生物学的複雑さが著しく増大され、現在入手可能なSERMの組織選択的作用の一部に関与していると思われる。
【0005】
先に述べたように、エストロゲンは、多くの非生殖器組織において重要な作用を有する。したがって、エストロゲンモジュレーションは、骨、肝臓、および中枢神経系を含むそのような組織に関連する疾患および障害の治療または予防に有用であると考えられる。たとえば、骨粗鬆症は、単位体積あたりの骨量の正味の損失により特徴付けられる。そのような骨量損失が起こると、身体の適切な構造上の支持を提供する骨格が衰弱するので、骨折を起こす危険性が増大する。最も多く見受けられるタイプの骨粗鬆症の1つは、女性における月経停止後の加速的な骨量損失および内因性エストロゲンレベルの低下に関連する閉経後骨粗鬆症である。エストロゲンレベルの低下により急速な骨量損失が進行している閉経期近くの女性および閉経後の女性では、骨の密度測定値と骨折を起こす危険性との間に逆相関が存在する。Slemenda, et al.,「閉経周辺期の女性における骨量の予測因子, 光子吸収法を用いる臨床データの予測的研究(Predictors of Bone Mass in Perimenopausal Women, A Prospective Study of Clinical Data Using Photon Absorptiometry)」, Ann. Intern. Med., 1990, pp. 96-101(非特許文献5)およびMarshall, et al.,「骨ミネラル密度の測定値がどの程度良好に骨粗鬆症性骨折の発生を予測するかに関するメタ分析(Meta-Analysis of How Well Measures of Bone Mineral Density Predict Occurrence of Osteoporotic Fractures)」, Br. Med. J., 1996, pp. 1254-1259(非特許文献6、いずれも、そのような相関に関して、参照により本明細書に組み入れられるものとする)を参照されたい。高齢の女性では、現在のところ、生涯にわたり骨折を起こす危険性は約75%である。さらに、米国の50歳以上の白人女性では、股関節部骨折を起こす危険性は約40%である。骨粗鬆症性骨折による経済的負担は、入院が必要であるため、かなり大きい。さらに、骨粗鬆症は一般的には命にかかわるものと考えられていないが、股関節部骨折の4ヶ月間以内の死亡率は、現在、約20〜30%である。閉経後骨粗鬆症に対する現在の療法としては、ホルモン補充療法、ビスホスホネートやカルシトニンなどの他の抗吸収剤を用いる治療が挙げられる。同様に、SERMは、閉経後骨粗鬆症の治療に有効であることが明らかにされている(Lindsay, R. :「骨粗鬆症の病理発生および予防における性ステロイド(Sex steroids in the pathogenesis and prevention of osteoporosis)」. In: Osteoporosis 1988. Etiology, Diagnosis and Management. Riggs BL (ed)l, Raven Press, New York, USA (1988):333-358(非特許文献7); Barzel US:「閉経後骨粗鬆症の予防および治療におけるエストロゲン:総説 (Estrogens in the prevention and treatment of postmenopausal osteoporosis: a review)」. Am J. Med (1988) 85:847-850(非特許文献8); 及び Ettinger, B., Black, D.M., et al.,「ラロキシフェンで治療された骨粗鬆症の閉経後の女性における脊椎骨折を起こす危険性の減少(Reduction of Vertebral Fracture Risk in Postmenopausal Women with Osteoporosis Treated with Raloxifene)」, JAMA, 1999, 282, 637-645(非特許文献9、いずれも、そのような教示に関して、参照により組み入れられるものとする)を参照されたい)。
【0006】
他の例として、乳房組織、特に乳癌に及ぼすエストロゲンの作用については、十分な裏付けがなされている。たとえば、すでに同定されているSERMのタモキシフェンは、再発性乳癌、対側乳癌に罹患する危険性および死亡率を減少させるとともに、疾患の多くの病期において乳癌の患者の無病生存率を増大させる。Cosman, F., Lindsay, R. 「選択的エストロゲン受容体モジュレーター:臨床スペクトル(Selective Estrogen Receptor Modulators: Clinical Spectrum)」, Endocrine Rev., 1999, pp. 418-434(非特許文献10、そのような教示に関して、参照により本明細書に組み入れられるものとする)を参照されたい。しかしながら、タモキシフェンのプロフィールは、子宮組織のような生殖器組織に対して相互作用性を有する可能性があるため、理想的なものではない。そのような癌を治療するために治療法を改善する余地がある(すなわち、いかなる生殖器組織に対してもアゴニスト性を有していないSERM)。
【0007】
心臓血管疾患は、閉経後の女性の主要な死亡原因である。最近まで、閉経後の女性におけるエストロゲン補充療法が心臓血管疾患の危険性を低減することが大半のデータから示唆されたが、全死亡率に対して有益な効果がないことがいくつかの研究で報告された。Barrett-Connor, E. et al.,「冠動脈性心疾患の危険性を低減させるSERMの可能性(The Potential of SERMs for Reducing the Risk of Coronary Heart Disease)」, Trends Endocrinol. Metab., 1999, pp. 320-325(非特許文献11、参照により本明細書に組み入れられるものとする)を参照されたい。エストロゲンが心臓血管系に対してその有益な作用を発揮すると考えられた機序は、完全には明らかになっていない。可能性として、血清コレステロールおよびリポタンパク質に及ぼすエストロゲンの作用、抗酸化性、血管平滑筋増殖、および動脈コレステロール蓄積の抑制が関与すると考えられた。上記文献参照。また、Cosman, F., Lindsay, R. 「選択的エストロゲン受容体モジュレーター:臨床スペクトル(Selective Estrogen Receptor Modulators: Clinical Spectrum)」, Endocrine Rev., 1999, pp. 418-434(非特許文献10、参照により本明細書に組み入れられるものとする)をも参照されたい。しかしながら、HERS IIおよびWHI研究に関する最近の報告から判断して、連続的組合せホルモン療法(すなわち、CEE+MPA[抱合ウマエストロゲン+酢酸メドロキシプロゲステロン])は、閉経期の女性において心臓血管に有益な効果を示さない。Hulley S., Grady, D., Bush, T., et al.,「閉経後の女性における冠動脈性心疾患を二次予防するためのエストロゲン+プロゲスチンの無作為化試験(Randomized trial of estrogen plus progestin for secondary prevention of coronary heart disease in postmenopausal women)」. Heart and Estrogen/progestin Replacement Study (HERS) Research Group. J. Am. Med. Assoc. (1998) 280:605-613(非特許文献12)およびWassertheil-Smoller S., Hendrix, S.L., Limacher, M., et al., for the WHI Investigators.「閉経後の女性における発作に及ぼすエストロゲン+プロゲスチンの作用(Effect of estrogen plus progestin on stroke in postmenopausal women)」: the Women's Health Initiative: a randomized trial. JAMA (2003) 289, 2673-2684(非特許文献13、いずれも、そのような教示に関して、参照により本明細書に組み入れられるものとする)を参照されたい。これらの知見がどの程度までSERMにあてはまりうるかは、いまだに決定されていない問題である。
【0008】
療法の他の選択肢としては、血管運動性症状、泌尿生殖器萎縮、鬱病、および糖尿病の治療に有用でありうるエストロゲン補充療法および/またはホルモン補充療法が挙げられる。女性の75%以上は、更年期中に血管運動性症状を経験する。血管運動性症状や泌尿生殖器萎縮のような臨床的症状は、エストロゲン補充療法で治療すると寛解する。Sagraves, R., J. Clin. Pharmacol. (1995), 35(9 Suppl):2S-10S(非特許文献14、そのような教示に関して、参照により本明細書に組み入れられるものとする)を参照されたい。エストラジオールが閉経周辺期中における鬱病を軽減しうることおよびエストロゲンと選択的セロトニン再取込み阻害剤との組合せが閉経後の期間中における鬱病を軽減しうることが予備データから示唆される。Soares, C. N., Poitras, J. R., and Prouty, J., Drugs Aging, (2003), 20(2), 85-100(非特許文献15、そのような教示に関して参照により本明細書に組み入れられるものとする)を参照されたい。さらに、ホルモン補充療法により、糖尿病の女性で血糖コントロールが改善されうる。Palin, S.L. et al., Diabetes Research and Clinical Practice, (2001), 54, 67-77(非特許文献16); Ferrara, A. et al., Diabetes Care, (2001), 24(7), 1144-1150(非特許文献17、いずれも、そのような教示に関して参照により本明細書に組み入れられるものとする)を参照されたい。しかしながら、HRTと比較してより良好な副作用プロフィールを示す改善された療法が必要とされている。
【0009】
本発明者らは、エストロゲン受容体αおよびエストロゲン受容体βに結合するシクロアルキリデン化合物の新規な群を見いだした。これらの化合物は、SERMとして、閉経期または閉経後の障害、血管運動性症状、泌尿生殖器または外陰腟の萎縮、萎縮性膣炎、女性性機能不全、乳癌、抑鬱症状、糖尿病、骨無機質脱落の治療および/または予防、さらには骨粗鬆症の治療および/または予防に有用であると考えられる。
【特許文献1】WO 97/09348
【非特許文献1】Kousteni et al., Journal of Clinical Investigation, (2003), 111, 1651-1664
【非特許文献2】McDonnell, D. P., The Molecular Pharmacology of SERMs, Trends Endocrinol. Metab. 1999, 301-311
【非特許文献3】Kuiper et al.,「ラットの前立腺および卵巣で発現される新規なエストロゲン受容体のクローニング(Cloning of a Novel Estrogen Receptor Expressed in Rat Prostate and Ovary)」, Proc. Natl. Acad. Sci. U.S.A., 1996, pp. 5925-5930
【非特許文献4】Mosselman et al.,「ERβ:新規なヒトエストロゲン受容体の同定および特徴付け(ERβ: Identification and Characterization of a Novel Human Estrogen Receptor)」, FEBS Lett., 1996, pp. 49-53
【非特許文献5】Slemenda, et al.,「閉経周辺期の女性における骨量の予測因子, 光子吸収法を用いる臨床データの予測的研究(Predictors of Bone Mass in Perimenopausal Women, A Prospective Study of Clinical Data Using Photon Absorptiometry)」, Ann. Intern. Med., 1990, pp. 96-101
【非特許文献6】Marshall, et al.,「骨ミネラル密度の測定値がどの程度良好に骨粗鬆症性骨折の発生を予測するかに関するメタ分析(Meta-Analysis of How Well Measures of Bone Mineral Density Predict Occurrence of Osteoporotic Fractures)」, Br. Med. J., 1996, pp. 1254-1259
【非特許文献7】Lindsay, R. :「骨粗鬆症の病理発生および予防における性ステロイド(Sex steroids in the pathogenesis and prevention of osteoporosis)」. In: Osteoporosis 1988. Etiology, Diagnosis and Management. Riggs BL (ed)l, Raven Press, New York, USA (1988):333-358
【非特許文献8】Barzel US:「閉経後骨粗鬆症の予防および治療におけるエストロゲン:総説 (Estrogens in the prevention and treatment of postmenopausal osteoporosis: a review)」. Am J. Med (1988) 85:847-850
【非特許文献9】Ettinger, B., Black, D.M., et al.,「ラロキシフェンで治療された骨粗鬆症の閉経後の女性における脊椎骨折を起こす危険性の減少(Reduction of Vertebral Fracture Risk in Postmenopausal Women with Osteoporosis Treated with Raloxifene)」, JAMA, 1999, 282, 637-645
【非特許文献10】Cosman, F., Lindsay, R. 「選択的エストロゲン受容体モジュレーター:臨床スペクトル(Selective Estrogen Receptor Modulators: Clinical Spectrum)」, Endocrine Rev., 1999, pp. 418-434
【非特許文献11】Barrett-Connor, E. et al.,「冠動脈性心疾患に罹患する危険性を低減させるSERMの可能性(The Potential of SERMs for Reducing the Risk of Coronary Heart Disease)」, Trends Endocrinol. Metab., 1999, pp. 320-325
【非特許文献12】Hulley S., Grady, D., Bush, T., et al.,「閉経後の女性において冠動脈性心疾患を二次予防するためのエストロゲン+プロゲスチンの無作為化試験(Randomized trial of estrogen plus progestin for secondary prevention of coronary heart disease in postmenopausal women)」. Heart and Estrogen/progestin Replacement Study (HERS) Research Group. J. Am. Med. Assoc. (1998) 280:605-613
【非特許文献13】Wassertheil-Smoller S., Hendrix, S.L., Limacher, M., et al., for the WHI Investigators.「閉経後の女性における発作に及ぼすエストロゲン+プロゲスチンの作用(Effect of estrogen plus progestin on stroke in postmenopausal women)」: the Women's Health Initiative: a randomized trial. JAMA (2003) 289, 2673-2684
【非特許文献14】Sagraves, R., J. Clin. Pharmacol. (1995), 35(9 Suppl):2S-10S
【非特許文献15】Soares, C. N., Poitras, J. R., and Prouty, J., Drugs Aging, (2003), 20(2), 85-100
【非特許文献16】Palin, S.L. et al., Diabetes Research and Clinical Practice, (2001), 54, 67-77
【非特許文献17】Ferrara, A. et al., Diabetes Care, (2001), 24(7), 1144-1150
【発明の開示】
【課題を解決するための手段】
【0010】
発明の概要
本発明は、式(I):
【化1】

【0011】
(式中、
R1は、HまたはFであり、
R2およびR4は、それぞれ独立して、H、OH、アルキル、アルケニル、アルキニル、アルコキシ、ハロゲン、ハルアルキルまたはシアノから選択され;
R3は、-(Y)Z-R8であり;
Zは、0または1であり;
Yは、炭素-炭素三重結合または-CRe=CRf-であり;
R5の各基は、Hであり;あるいは、
R5の両基は、R6の各基およびR7の各基がHであり、かつXが-(CH2)m-2-である場合、一緒に結合して架橋アルキレン鎖-(CH2)m-(ここで、mは、2、3または4である)を形成しており;
R6およびR7の各基は、Hまたはアルキルから選択され;あるいは
Xが-(CH2)m-の場合、R6の両基はHであり、かつR7の両基は、一緒に結合して架橋アルキレン鎖-(CH2)m-を形成しており(ここで、各mは同じであり、かつ定義されたとおりである);あるいは、
Xが-(CH2)m-の場合、R7の両基はHであり、かつR6の両基は、一緒に結合して架橋アルキレン鎖-(CH2)m-を形成しており(ここで、各mは同じであり、かつ定義されたとおりである);
Zが0の場合、R8は、アルキル、アルケニル、アルキニル、アルコキシ、アリール、ヘテロシクリル、1つ以上のアルキルで置換されたヘテロシクリル、シアノ、-O(CH2)tCN、-CO2H、-(CH2)tCO2H、-O(CH2)tCO2H、-(CH2)tOH、-O(CH2)tOH、-O(CH2)tO(CH2)tOH、-C(O)NRaRb、-O(CH2)tC(O)NRaRb、-NRaSO2Rd、または-NRaC(O)Rcであり;
Zが1の場合、R8は、-CO2H、-(CH2)tCO2H、-(CH2)tOH、-C(O)NRaRb、または-PO3HRaであり;
各tは、独立して、1〜8であり;
Xは、-(CH2)n-(ここで、nは、0、1、2または3である)、-C(Rh)2-、-O-、-S(O)p(式中、pは、0、1または2である)、-C(Rg)2OC(Rg)2-、または-C(CH2)v-(ここで、vは2〜7であり、Xを含む上記表示された環とスピロ環を形成している)であり;
Raは、H、アルキル、アルケニル、アルキニル、アルコキシ、シクロアルキル、アリール、またはヘテロシクリルであり;
Rbは、H、アルキル、アルケニル、アルキニル、アルコキシ、シクロアルキル、アリール、またはヘテロシクリルであり;
Rcは、アルキル、アルケニル、アルキニル、アルコキシ、シクロアルキル、アリール、またはヘテロシクリルであり;
Rdは、アルキル、アルケニル、アルキニル、アルコキシ、シクロアルキル、アリール、またはヘテロシクリルであり;あるいは
RaおよびRb、RaおよびRc、またはRaおよびRdは、結合している原子と結合して任意に置換されたヘテロシクリルを形成していてもよく;および
ReおよびRfの各基は、独立して、H、アルキル、ハロゲンおよびハロアルキルから選択され;
Rgは、H、アルキル、アルケニル、アルキニル、アルコキシ、シクロアルキル、アリール、またはヘテロシクリルであり;
Rhは、アルキル、アルケニル、アルキニル、アルコキシ、シクロアルキル、アリール、またはヘテロシクリルであり;
ここで、アルキル、アルケニル、アルキニル、シクロアルキル、アリール、へテロアリール、およびヘテロシクリルはそれぞれの出現ごとに、任意に置換されていてもよい)
で表される化合物、ならびにその塩、溶媒和物、および薬理学的に機能的な誘導体の1つ以上の化合物を包含する。
【0012】
より具体的には、本発明は、式(I−A):
【化2】

【0013】
(式中、
R1は、HまたはFであり;
R3は、-(Y)z-R8であり;
zは、0または1であり;
Yは、-CH=CH-であり;
R6およびR7の各基は、Hまたはアルキルから選択され;
zが0の場合、R8は、ヘテロシクリル、1つ以上のアルキルで置換されたヘテロシクリル、-O(CH2)tCN、-CO2H、-(CH2)tCO2H、-O(CH2)tCO2H、-O(CH2)tOH、-O(CH2)tO(CH2)tOH、または-O(CH2)tC(O)NH2であり;
zが1の場合、R8は、-CO2Hまたは-CONH2であり;
各tは、独立して、1〜8であり;および
Xは、-(CH2)n-(式中、nは、0、1、または2である)、またはOである)
で表される化合物、ならびにその塩、溶媒和物、および薬理学的に機能的な誘導体の1つ以上の化合物を包含する。
【0014】
更に、本発明は、
(2E)-3-{4-[シクロヘプチリデン(フェニル)メチル]フェニル}プロパ-2-エン酸;
(2E)-3-{4-[シクロヘプチリデン(フェニル)メチル]フェニル}プロパ-2-エンアミド;
2-({4-[フェニル(3,3,5,5-テトラメチルシクロヘキシリデン)メチル]フェニル}オキシ)エタノール;
2-{[2-({4-[フェニル(3,3,5,5-テトラメチルシクロヘキシリデン)メチル]フェニル}オキシ)エチル]オキシ}エタノール;
({4-[(4-フルオロフェニル)(3,3,5,5-テトラメチルシクロヘキシリデン)メチル]フェニル}オキシ)酢酸;
4-({4-[(4-フルオロフェニル)(3,3,5,5-テトラメチルシクロヘキシリデン)メチル]フェニル}オキシ)ブタン酸;
({4-[(4-フルオロフェニル)(3,3,5,5-テトラメチルシクロヘキシリデン)メチル]フェニル}オキシ)アセトニトリル;
2-({4-[(4-フルオロフェニル)(3,3,5,5-テトラメチルシクロヘキシリデン)メチル]フェニル}オキシ)エタノール;
(2E)-3-{4-[フェニル(3,3,5,5-テトラメチルシクロヘキシリデン)メチル]フェニル}-2-プロペン酸;
4-[フェニル(3,3,5,5-テトラメチルシクロヘキシリデン)メチル]安息香酸;
3,5-ジメチル-4-{4-[フェニル(3,3,5,5-テトラメチルシクロヘキシリデン)メチル]フェニル}イソオキサゾール;
1-メチル-4-{4-[フェニル(3,3,5,5-テトラメチルシクロヘキシリデン)メチル]フェニル}-1H-ピラゾール;
4-{4-[(4-フルオロフェニル)(3,3,5,5-テトラメチルシクロヘキシリデン)メチル]フェニル}-3,5-ジメチルイソオキサゾール;
3-{4-[(4-フルオロフェニル)(3,3,5,5-テトラメチルシクロヘキシリデン)メチル]フェニル}フラン;
2-{[2-({4-[(4-フルオロフェニル)(3,3,5,5-テトラメチルシクロヘキシリデン)メチル]フェニル}オキシ)エチル]オキシ}エタノール;
2-{4-[(4-フルオロフェニル)(3,3,5,5-テトラメチルシクロヘキシリデン)メチル]フェニル}フラン;
4-{4-[(4-フルオロフェニル)(3,3,5,5-テトラメチルシクロヘキシリデン)メチル]フェニル}-1-メチル-1H-ピラゾール;
4-({4-[フェニル(3,3,5,5-テトラメチルシクロヘキシリデン)メチル]フェニル}オキシ)-1-ブタノール;
2-({4-[フェニル(3,3,5,5-テトラメチルシクロヘキシリデン)メチル]フェニル}オキシ)アセトアミド;
({2-メチル-5-[フェニル(3,3,5,5-テトラメチルシクロヘキシリデン)メチル]フェニル}オキシ)酢酸;
2-({2-メチル-5-[フェニル(3,3,5,5-テトラメチルシクロヘキシリデン)メチル]フェニル}オキシ)エタノール;
({2-メチル-5-[フェニル(3,3,5,5-テトラメチルシクロヘキシリデン)メチル]フェニル}オキシ)アセトニトリル;
4-({2-メチル-5-[フェニル(3,3,5,5-テトラメチルシクロヘキシリデン)メチル]フェニル}オキシ)ブタン酸;
4-({2-メチル-5-[フェニル(3,3,5,5-テトラメチルシクロヘキシリデン)メチル]フェニル}オキシ)-1-ブタノール;
5-[({2-メチル-5-[フェニル(3,3,5,5-テトラメチルシクロヘキシリデン)メチル]フェニル}オキシ)メチル]-1H-テトラゾール;
2-{[2-({2-メチル-5-[フェニル(3,3,5,5-テトラメチルシクロヘキシリデン)メチル]フェニル}オキシ)エチル]オキシ}エタノール;
4-({4-[フェニル(3,3,5,5-テトラメチルシクロヘキシリデン)メチル]フェニル}オキシ)ブタン酸;
({4-[フェニル(3,3,5,5-テトラメチルシクロヘキシリデン)メチル]フェニル}オキシ)酢酸;
(2E)-3-{4-[(4-フルオロフェニル)(3,3,5,5-テトラメチルシクロヘキシリデン)メチル]フェニル}-2-プロペン酸;
(2E)-3-{4-[(4-フルオロフェニル)(2,2,6,6-テトラメチルテトラヒドロ-4H-ピラン-4-イリデン)メチル]フェニル}-2-プロペン酸;
(2E)-3-{4-[フェニル(2,2,6,6-テトラメチルテトラヒドロ-4H-ピラン-4-イリデン)メチル]フェニル}-2-プロペン酸;
4-{4-[フェニル(2,2,6,6-テトラメチルテトラヒドロ-4H-ピラン-4-イリデン)メチル]フェニル}ブタン酸;
4-{4-[(4-フルオロフェニル)(2,2,6,6-テトラメチルテトラヒドロ-4H-ピラン-4-イリデン)メチル]フェニル}ブタン酸;
2-({4-[(4-フルオロフェニル)(2,2,6,6-テトラメチルテトラヒドロ-4H-ピラン-4-イリデン)メチル]フェニル}オキシ)エタノール;
2-({4-[フェニル(2,2,6,6-テトラメチルテトラヒドロ-4H-ピラン-4-イリデン)メチル]フェニル}オキシ)エタノール;
2-{[2-({4-[フェニル(2,2,6,6-テトラメチルテトラヒドロ-4H-ピラン-4-イリデン)メチル]フェニル}オキシ)エチル]オキシ}エタノール;
2-{[2-({4-[(4-フルオロフェニル)(2,2,6,6-テトラメチルテトラヒドロ-4H-ピラン-4-イリデン)メチル]フェニル}オキシ)エチル]オキシ}エタノール;
4-[(4-フルオロフェニル)(2,2,6,6-テトラメチルテトラヒドロ-4H-ピラン-4-イリデン)メチル]安息香酸;
4-[フェニル(2,2,6,6-テトラメチルテトラヒドロ-4H-ピラン-4-イリデン)メチル]安息香酸;および
4-[(4-フルオロフェニル)(3,3,5,5-テトラメチルシクロヘキシリデン)メチル]安息香酸、その塩、溶媒和物、および薬理学的に機能的な誘導体を包含する。
【0015】
更に、本発明は、次式:
【化3】

【0016】
で表される化合物、ならびにその塩、溶媒和物および薬理学的に機能的な誘導体を包含する。
【0017】
更に、本発明は、次式:
【化4】

【0018】
で表される化合物、ならびにその塩、溶媒和物および薬理学的に機能的な誘導体を包含する。
【0019】
本発明は、実施例のいずれかに記載の実質的に上記に定義された化合物である、本発明の1つ以上の化合物を包含する。
【0020】
本発明は、本発明の1つ以上の化合物と製薬上許容される担体を含む医薬組成物を包含する。
【0021】
本発明は、活性治療物質として使用するための本発明の1つ以上の化合物を包含する。
【0022】
本発明は、選択的エストロゲン受容体モジュレーションの影響を受けている症状または障害の治療または予防で使用するための本発明の1つ以上の化合物を包含する。特に、本発明は、治療または予防が、骨粗鬆症、骨鉱物質消失、骨量、密度または成長の減少、骨関節炎、骨折修復および治癒の促進、関節置換の治癒の促進、歯槽膿漏症、歯の修復または成長の促進、パジェット病、骨軟骨形成異常、筋肉消耗、筋力および筋機能の維持および増強、脆さ(frailty)または加齢に伴う機能低下(「ARFD」)、サルコぺニア、慢性疲労症候群、慢性筋肉痛(myaligia)、急性疲労症候群、創傷治癒の促進、感覚機能の維持、慢性肝炎、AIDS、無重量感、火傷および外傷の回復、血小板減少症、短腸症候群、過敏性腸症候群、炎症性腸疾患、クローン病および潰瘍性大腸炎、肥満、カヘキシーまたは老化に伴う拒食症を含む摂食障害、副腎皮質機能亢進症およびクッシング症候群、心血管疾患または心機能不全、うっ血性心不全、高血圧、乳癌、乳房、脳、皮膚、卵巣、膀胱、リンパ、肝臓、腎臓、子宮、膵臓、子宮内膜、肺、結腸および前立腺を含む、アンドロゲン受容体を含有する悪性腫瘍細胞、前立腺肥大、多毛、ざ瘡、脂漏、男性ホルモン性脱毛症、貧血、超多毛性、前立腺の腺腫および腫瘍形成、高インスリン血症、インスリン耐性、糖尿病、X症候群、異脂肪血症、尿失禁、アテローム性動脈硬化症、性欲増強、性機能障害、鬱病、抑鬱症状、神経質、短気、ストレス、精神的能力の低下および低自尊心、認知機能の改善、子宮内膜症、多嚢胞性卵巣症候群、子癇前症の予防、月経前症候群、避妊、子宮類線維症、および/または大動脈平滑筋細胞増殖、膣乾燥、心因掻痒、性交疼痛症、排尿障害、頻尿、尿路感染、高コレステロール血症、高脂血症、末梢血管疾患、再狭窄、血管痙攣、免疫反応に起因する血管壁損傷、アルツハイマー病、骨疾患、老化、炎症、慢性関節リウマチ、呼吸器疾患、肺気腫、再潅流傷害、ウイルス性肝炎、結核、乾癬、全身性エリテマトーデス、筋萎縮性側索硬化症、卒中、CNS外傷、痴呆、神経変性、乳房痛および月経困難症、更年期障害または閉経後障害、血管運動症状、尿生殖萎縮または外陰膣萎縮、萎縮性膣炎、女性性機能不全、性欲亢進目的、性的欲求低下障害の治療目的、性的刺激障害、オルガスムスの頻度および強度の向上目的、膣痙、オステオペニア、子宮内膜症、BPH(良性前立腺肥大)、月経困難症、自己免疫性疾患、橋本甲状腺炎、SLE(全身性エリテマトーデス)、重症筋無力症、あるいは虚血心筋の再灌流損傷に関する、本発明の1つ以上の化合物の使用を包含する。本発明は、治療または予防が、更年期障害または閉経後障害、血管運動症状、尿生殖萎縮または外陰膣萎縮、萎縮性膣炎、女性性機能不全、乳癌、抑鬱症状、糖尿病、骨鉱物質消失、または骨粗鬆症に関する、本発明の1つ以上の化合物の使用を包含する。
【0023】
本発明は、選択的エストロゲン受容体モジュレーションに関連する症状または障害の治療または予防で使用するための薬剤の製造における本発明の1つ以上の化合物の使用を包含する。更に、本発明は、骨粗鬆症、骨鉱物質消失、骨量、密度または成長の減少、骨関節炎、骨折修復および治癒の促進、関節置換術の治癒の促進、歯槽膿漏症、歯の修復または成長の促進、パジェット病、骨軟骨形成異常、筋肉消耗、筋力および筋機能の維持および増強、脆さ(frailty)または加齢に伴う機能低下(「ARFD」)、サルコぺニア、慢性疲労症候群、慢性筋肉痛(myaligia)、急性疲労症候群、創傷治癒の促進、感覚機能の維持、慢性肝炎、AIDS、無重量感、火傷および外傷の回復、血小板減少症、短腸症候群、過敏性腸症候群、炎症性腸疾患、クローン病および潰瘍性大腸炎、肥満、カヘキシーまたは老化に伴う拒食症を含む摂食障害、副腎皮質機能亢進症およびクッシング症候群、心血管疾患または心機能不全、うっ血性心不全、高血圧、乳癌、乳房、脳、皮膚、卵巣、膀胱、リンパ、肝臓、腎臓、子宮、膵臓、子宮内膜、肺、結腸および前立腺を含む、アンドロゲン受容体を含有する悪性腫瘍細胞、前立腺肥大、多毛、ざ瘡、脂漏、男性ホルモン性脱毛症、貧血、超多毛性、前立腺の腺腫および腫瘍形成、高インスリン血症、インスリン耐性、糖尿病、X症候群、異脂肪血症、尿失禁、アテローム性動脈硬化症、性欲増強、性機能障害、鬱病、抑鬱症状、神経質、短気、ストレス、精神的能力の低下および低自尊心、認知機能の改善、子宮内膜症、多嚢胞性卵巣症候群、子癇前症の予防、月経前症候群、避妊、子宮類線維症、および/または大動脈平滑筋細胞増殖、膣乾燥、心因掻痒、性交疼痛症、排尿障害、頻尿、尿路感染、高コレステロール血症、高脂血症、末梢血管疾患、再狭窄、血管痙攣、免疫反応に起因する血管壁損傷、アルツハイマー病、骨疾患、老化、炎症、慢性関節リウマチ、呼吸器疾患、肺気腫、再潅流傷害、ウイルス性肝炎、結核、乾癬、全身性エリテマトーデス、筋萎縮性側索硬化症、卒中、CNS外傷、痴呆、神経変性、乳房痛および月経困難症、更年期障害または閉経後障害、血管運動症状、尿生殖萎縮または外陰膣萎縮、萎縮性膣炎、女性性機能不全、性欲亢進目的、性的欲求低下障害の治療目的、性的刺激障害、オルガスムスの頻度および強度の向上目的、膣痙、オステオペニア、子宮内膜症、BPH(良性前立腺肥大)、月経困難症、自己免疫性疾患、橋本甲状腺炎、SLE(全身性エリテマトーデス)、重症筋無力症、あるいは虚血心筋の再灌流損傷の治療または予防で使用するための薬剤の製造における本発明の1つ以上の化合物の使用を包含する。本発明は、疾患または障害が、更年期障害または閉経後障害、血管運動症状、尿生殖萎縮または外陰膣萎縮、萎縮性膣炎、女性性機能不全、乳癌、抑鬱症状、糖尿病、骨鉱物質消失、または骨粗鬆症である、本発明の1つ以上の化合物の使用を包含する。
【0024】
本発明は、本発明の1つ以上の化合物を投与することを含む、選択的エストロゲン受容体モジュレーションに関連する症状または障害の治療または予防方法を包含する。本発明は、本発明の1つ以上の化合物を投与することを含む、骨粗鬆症、骨鉱物質消失、骨量、密度または成長の減少、骨関節炎、骨折修復および治癒の促進、関節置換術の治癒の促進、歯槽膿漏症、歯の修復または成長の促進、パジェット病、骨軟骨形成異常、筋肉消耗、筋力および筋機能の維持および増強、脆さ(frailty)または加齢に伴う機能低下(「ARFD」)、サルコぺニア、慢性疲労症候群、慢性筋肉痛(myaligia)、急性疲労症候群、創傷治癒の促進、感覚機能の維持、慢性肝炎、AIDS、無重量感、火傷および外傷の回復、血小板減少症、短腸症候群、過敏性腸症候群、炎症性腸疾患、クローン病および潰瘍性大腸炎、肥満、カヘキシーまたは老化に伴う拒食症を含む摂食障害、副腎皮質機能亢進症およびクッシング症候群、心血管疾患または心機能不全、うっ血性心不全、高血圧、乳癌、乳房、脳、皮膚、卵巣、膀胱、リンパ、肝臓、腎臓、子宮、膵臓、子宮内膜、肺、結腸および前立腺を含む、アンドロゲン受容体を含有する悪性腫瘍細胞、前立腺肥大、多毛、ざ瘡、脂漏、男性ホルモン性脱毛症、貧血、超多毛性、前立腺の腺腫および腫瘍形成、高インスリン血症、インスリン耐性、糖尿病、X症候群、異脂肪血症、尿失禁、アテローム性動脈硬化症、性欲増強、性機能障害、鬱病、抑鬱症状、神経質、短気、ストレス、精神的能力の低下および低自尊心、認知機能の改善、子宮内膜症、多嚢胞性卵巣症候群、子癇前症の予防、月経前症候群、避妊、子宮類線維症、および/または大動脈平滑筋細胞増殖、膣乾燥、心因掻痒、性交疼痛症、排尿障害、頻尿、尿路感染、高コレステロール血症、高脂血症、末梢血管疾患、再狭窄、血管痙攣、免疫反応に起因する血管壁損傷、アルツハイマー病、骨疾患、老化、炎症、慢性関節リウマチ、呼吸器疾患、肺気腫、再潅流傷害、ウイルス性肝炎、結核、乾癬、全身性エリテマトーデス、筋萎縮性側索硬化症、卒中、CNS外傷、痴呆、神経変性、乳房痛および月経困難症、更年期障害または閉経後障害、血管運動症状、尿生殖萎縮または外陰膣萎縮、萎縮性膣炎、女性性機能不全、性欲亢進目的、性的欲求低下障害の治療目的、性的刺激障害、オルガスムスの頻度および強度の向上目的、膣痙、オステオペニア、子宮内膜症、BPH(良性前立腺肥大)、月経困難症、自己免疫性疾患、橋本甲状腺炎、SLE(全身性エリテマトーデス)、重症筋無力症、あるいは虚血心筋の再灌流損傷に関する治療または予防方法を包含する。更に、本発明は、疾患または障害が、更年期障害または閉経後障害、血管運動症状、尿生殖萎縮または外陰膣萎縮、萎縮性膣炎、女性性機能不全、乳癌、抑鬱症状、糖尿病、骨鉱物質消失、または骨粗鬆症である、本発明の1つ以上の化合物を包含する。
【発明を実施するための最良の形態】
【0025】
好ましい実施形態の詳細な説明
本発明は、当業者に知られ、認識されている用語で記載されている。以下に、参照を容易にするために特定の用語について定義する。しかし、特定の用語を定義するという事実を、定義されていないすべての用語を不明確であると示すものとして考えるべきではない。むしろ、本明細書に使用されているすべての用語は、当業者が本発明の範囲を認識することができるような用語で本発明を記載しているものと考えられたい。
【0026】
本明細書では、「アルキル」という用語は、例えば1〜12個の炭素原子を有する、直鎖状または分枝鎖状の炭化水素を意味する。本明細書に使用する「アルキル」の例としては、これらに限定されるものではないが、メチル、エチル、プロピル、イソプロピル、イソブチル、n-ブチル、tert-ブチル、イソペンチル、n-ペンチル等が挙げられる。
【0027】
本明細書では、「アルケニル」という用語は、例えば2〜12個の炭素原子を有する、1つ以上の炭素と炭素の二重結合を含む、直鎖状または分枝鎖状の炭化水素を意味する。本明細書に使用する「アルケニル」の例としては、これらに限定されるものではないが、ビニル、1-プロペニル、アリル等が挙げられる。
【0028】
本明細書では、「アルキニル」という用語は、例えば2〜12個の炭素を有する、1つ以上の炭素と炭素の三重結合を含む、直鎖状または分枝鎖状の炭化水素を意味する。本明細書に使用する「アルキニル」の例としては、これらに限定されるものではないが、エチニル、1-プロピニル、2-プロピニル等が挙げられる。
【0029】
本明細書では、「アルキレン」という用語は、例えば1〜10個の炭素原子を有する、直鎖状または分枝鎖状の二価の炭化水素基を意味する。本明細書で使用する「アルキレン」の例としては、これらに限定されるものではないが、メチレン、エチレン、n-プロピレン、n-ブチレン等が挙げられる。
【0030】
本明細書では、「ハロゲン」という用語は、フッ素、塩素、臭素またはヨウ素を意味する。
【0031】
本明細書では、「ハロアルキル」という用語は、少なくとも1個のハロゲンで置換されている、本明細書に定義したとおりのアルキル基を意味する。本発明に有用な分枝鎖状または直鎖状の「ハロアルキル」基の例としては、これらに限定されるものではないが、1個または複数個のハロゲン(例えば、フルオロ、クロロ、ブロモおよびヨード)で独立して置換されているメチル、エチル、プロピル、イソプロピル、n-ブチルおよびt-ブチルが挙げられる。「ハロアルキル」という用語は、ペルフルオロアルキル基などの置換基等を含むものと解釈すべきである。
【0032】
本明細書では、「アルコキシ」という用語は-OR基を意味し、式中、Rは上で定義したアルキルである。
【0033】
本明細書では、「アシル」という用語は-C(O)R基を意味し、式中、Rは、本明細書で各々定義されているアルキル、アリール、またはヘテロシクリルである。
【0034】
本明細書では、「ヒドロキシ」という用語は-OH基を意味する。
【0035】
本明細書では、「カルボキシ」という用語は-C(O)OH基を意味する。
【0036】
本明細書では、「ニトロ」という用語は-NO2基を意味する。
【0037】
本明細書では、「アミノ」という用語は-NH2基を意味するか、あるいは、置換アミノとして意味する場合、アルキルで置換されているそのような基と定義する。
【0038】
本明細書では、「シクロアルキル」という用語は、例えば3〜10個の炭素原子を有する、非芳香族の環式炭化水素環を意味する。具体的な「シクロアルキル」基としては、これらに限定されるものではないが、シクロプロピル、シクロブチル、シクロペンチル、シクロヘキシル、シクロヘプチル等が挙げられる。
【0039】
本明細書では、「アリール」という用語は、ベンゼンおよびその誘導体に由来する置換基を意味し、縮合されたベンゼン環系、例えば、アントラセン、フェナントレンもしくはナフタリン環系を含む。「アリール」基の例としては、これらに限定されるものではないが、フェニル、2-ナフチル、1-ナフチル、およびビフェニルが挙げられる。
【0040】
本明細書では、「複素環」、「ヘテロシクリル」または「複素環の」という用語は、任意に1つ以上の不飽和度を含有する1個または複数のヘテロ原子を含有しているモノ環状またはポリ環状の環系を意味する。好ましいヘテロ原子としてはN、Oおよび/またはSが挙げられ、N-酸化物、硫黄酸化物、およびジオキシドを含む。例えば、ヘテロシクリル環系は3員から10員であって、飽和されているか、1つ以上の不飽和度を有している。そのような環は、任意に、1つ以上の別の「複素環」、アリール環、またはシクロアルキル環に縮合していてもよく、「複素環」基として参照され得る。「複素環」基の例としては、これらに限定されるものではないが、テトラヒドロフラン、ピラン、1,4-ジオキサン、1,3-ジオキサン、ピペリジン、ピロリジン、モルホリン、テトラヒドロチオピラン、テトラヒドロチオフェン、フラン、チオフェン、ピロール、イミダゾール、ピラゾール、トリアゾール、テトラゾール、チアゾール、オキサゾール、イソオキサゾール、オキサジアゾール、チアジアゾール、イソチアゾール、ピリジン、ピリダジン、ピラジン、ピリミジン、キノリン、イソキノリン、ベンゾフラン、ベンゾチオフェン、インドール、インダゾール等が挙げられる。
【0041】
本明細書では、「スピロ環」という用語は、共通の原子を共有する2つの環を含む環系をいう。スピロ環化合物の例としては、スピロ[4.4]ノナン等が挙げられる。
【0042】
式(I)の化合物は、複数の形態(多形として知られている特性)で結晶化され得、そのような多形態(「多形体」)は式(I)の範囲内にある。多形は、一般的に、温度、圧力またはその両方の変化に対する応答として生じ得る。また多形は、結晶工程のバリエーションによっても生じ得る。多形体は、X線回折パターン、溶解性および融点などの当技術分野で公知の様々な物理的特性によって区別することができる。
【0043】
本明細書に記載されている特定の化合物は、1個または複数のキラル中心を含有しているか、あるいは複数の立体異性体として存在し得る。本発明の範囲には、立体異性体の混合物、および精製鏡像異性体または鏡像異性体的/ジアステレオマー的に富んだ混合物が含まれる。さらに本発明の範囲内には、式(I)によって表される化合物の各異性体、およびその全体的に平衡である混合物または部分的に平衡である混合物が含まれる。また本発明には、1個または複数のキラル中心が反転しているその異性体との混合物としての、上記式によって表される化合物の各異性体も含まれる。
【0044】
一般的には、本発明の塩は製薬上許容可能な塩である。「製薬上許容可能な塩」という用語内に包含される塩は、本発明の化合物の非毒性の塩を意味する。本発明の化合物の塩は、酸付加塩を含み得る。代表的な塩としては、酢酸塩、ベンゼンスルホン酸塩、安息香酸塩、重炭酸塩、重硫酸塩、酒石酸水素塩、ホウ酸塩、臭化塩、カルシウムエデト酸塩、カンシル酸塩、炭酸塩、塩化塩、クラブラン酸塩、クエン酸塩、二塩酸塩、エデト酸塩、エジシル酸塩、エストール酸塩、エシル酸塩、フマル酸塩、グルセプト酸塩、グルコン酸塩、グルタミン酸塩、グリコリルアルサニル酸塩、ヘキシルレソルシン酸塩、ヒドラバミン、臭化水素酸塩、塩酸塩、ヒドロキシナフトエ酸塩、ヨウ化塩、イセチオン酸塩、乳酸塩、ラクトビオン酸塩、ラウリン酸塩、リンゴ酸塩、マレイン酸塩、マンデル酸塩、メシル酸塩、臭化メチル、硝酸メチル、硫酸メチル、マレイン酸一カリウム塩、粘液酸塩、ナプシル酸塩、硝酸塩、N-メチルグルカミン、シュウ酸塩、パモ酸塩(エンボン酸塩)、パルミチン酸塩、パントテン酸塩、リン酸塩/二リン酸塩、ポリガラクツロン酸塩、カリウム、サリチル酸塩、ナトリウム塩、ステアリン酸塩、塩基性酢酸塩、コハク酸塩、硫酸塩、タンニン酸塩、酒石酸塩、テオクル酸塩、トシル酸塩、トリエチオダイド(triethiodide)、トリメチルアンモニウム塩、および吉草酸塩が挙げられる。製薬上許容可能でない他の塩は、本発明の化合物の調製において有用である場合があり、これらは本発明のさらなる態様を構成するものと考えるべきである。
【0045】
本明細書では、「溶媒和物」という用語は、溶質(本発明において、式(I)の化合物、またはその塩もしくはその生理学上機能的な誘導体)と溶媒によって形成される可変的な化学量論の錯体を意味する。そのような溶媒は、本発明の目的において、溶質の生物活性を妨げるものではあってはならない。適切な溶媒の例としては、これらに限定されるものではないが、水、メタノール、エタノールおよび酢酸が挙げられる。好ましくは、使用する溶媒は、製薬上許容可能な溶媒である。好適な製薬上許容可能な溶媒の例は、これらに限定されるものではないが、水、エタノールおよび酢酸が挙げられる。使用される最も好ましい溶媒は水である。
【0046】
本明細書では、「生理学上機能的な誘導体」という用語は、哺乳動物への投与の際に、本発明の化合物またはその活性代謝物を(直接的または間接的に)提供可能な、本発明の化合物の任意の製薬上許容可能な誘導体を意味する。そのような誘導体(例えば、エステルおよびアミド)は、過度の実験を行うことなく、当業者には明らかであろう。Burger's Medicinal Chemistry And Drug Discovery, 第5版, 第1巻: Principles and Practiceの教示を参照するものとする。なお、前記文献は、生理学上機能的な誘導体を教示する範囲について、参照により本明細書に組み入れるものとする。
【0047】
本明細書では、「有効量」という用語は、例えば、研究者または臨床医に求められている、組織、系、動物またはヒトの生物学的応答または医学的応答を誘導する医薬品または薬剤の量を意味する。「治療上の有効量」という用語は、そのような量を投与されていない対応の被験体と比較した場合に、疾患、障害または副作用の治療、治癒、予防または回復を改善するか、あるいは疾患または障害の進行速度を遅くする任意の量を意味する。またこの用語には、その範囲内に、正常な生理機能を亢進するのに有効な量も含まれる。
【0048】
治療における使用の場合、治療上の有効量の式(I)で表される化合物、ならびにその塩、溶媒和物および生理学上機能的な誘導体は、未加工の化学物質として投与され得る。さらに、該有効成分は、医薬組成物として提供され得る。従って、本発明はさらに、有効量の式(I)の化合物ならびにその塩、溶媒和物および生理学上機能的な誘導体、ならびに1種または複数の製薬上許容可能な担体、希釈剤または賦形剤を含む医薬組成物を提供する。式(I)の化合物ならびにその塩、溶媒和物および生理学上機能的な誘導体は、上に記載のとおりである。担体、希釈剤または賦形剤は、本製剤の他の成分と適合し、かつ本医薬組成物の服用者にとって有害でないという点で、許容され得るものでなければならない。本発明の別の態様によれば、式(I)の化合物またはその塩、溶媒和物および生理学上の機能的誘導体を、1種または複数の製薬上許容可能な担体、希釈剤または添加剤と混合することを含む医薬用製剤の調製方法も提供する。
【0049】
本発明の化合物の治療上の有効量は、多数の要因によって変わる。例えば、動物の年齢および体重、治療を必要とする正確な症状とその重症度、製剤の性質、および投与経路はすべて検討されるべき要因である。治療上の有効量は、最終的に、担当の医師または獣医によって判断されるべきである。例えば、骨粗鬆症に罹患しているヒトを治療するための式(I)の化合物の有効量は、一般的に、1日当たり、0.1〜100mg/服用者(哺乳動物)の体重kgの範囲にあるべきである。より一般的には、その有効量は、1日当たり、1〜10mg/kg体重の範囲にあるべきである。従って、70kgの成体哺乳動物に対しては、1日当たりの実際量は、通常70〜700mgになる。この量は、1日当たり単回投与で、または日用量の全量が同じとなるような1日当たりの多回分割投与(例えば、2、3、4または5回以上)で投与することができる。その塩、溶媒和物または生理学上機能的な誘導体の有効量は、本質的に式(I)の化合物の有効量のある割合として決定され得る。エストロゲンが介在する本明細書に記載の他の疾患の治療に対して、同様の用量が適するはずである。
【0050】
医薬製剤は、単位投与用量当たりの所定量の有効成分を含有する単位投与用量形態で提供することができる。そのような単位は、例えば(これに限定されるものではない)、治療する疾患、投与経路、ならびに患者の年齢、体重および症状に応じて、0.5mgから1gの式(I)の化合物を含有し得る。好ましい単位用量製剤は、本明細書で上述した日用量または分割投与量を含有しているもの、あるいは有効成分のそれらの適切な画分である。そのような製剤は、薬学分野において周知の任意の方法によって調製することができる。
【0051】
医薬製剤は、任意の適切な経路、例えば、経口経路(口腔経路または舌下経路を含む)、直腸経路、経鼻経路、局所経路(口腔経路、舌下経路または経皮経路を含む)、膣経路、あるいは非経口経路(皮下経路、筋肉内経路、静脈内経路または皮内経路を含む)による投与に適用可能である。そのような製剤は、薬学分野で公知の任意の方法によって、例えば、有効成分を担体または賦形剤と組合せることによって調製することができる。
【0052】
経口投与に適した医薬製剤は、例えば、カプセル剤または錠剤;散剤または顆粒剤;溶液または懸濁液(各液は、水溶液または非水溶液である);食用の泡状剤またはホイップ剤;あるいは水中油滴型乳濁液または油中水滴型乳濁液などの別個のユニットとして提供することができる。例えば、錠剤またはカプセル剤の形態での経口投与については、薬剤有効成分は、エタノール、グリセロール、水等の、経口用の非毒性の製薬上許容可能な不活性担体と組み合わせることができる。一般的に、散剤は、本化合物に好適な微細サイズに粉砕化し、適切な製薬上の担体(例えば、デンプンまたはマンニトールなどの食用炭水化物等)と混合することにより調製される。また、香味剤、保存剤、分散剤および着色剤も入れることができる。
【0053】
カプセル剤は、散剤、液体または懸濁液混合物を調製し、ゼラチンまたは他の適切ないくつかの殻材料でカプセル化することにより製造される。流動促進剤および滑沢剤、例えば、コロイド状シリカ、タルク、ステアリン酸マグネシウム、ステアリン酸カルシウム、または固体ポリエチレングリコールは、カプセル化前に混合物に添加することができる。崩壊剤または可溶化剤、例えば、寒天(agar-agar)、炭酸カルシウムまたは炭酸ナトリウムは、カプセルを摂取した場合の薬剤の有効性を改善するために添加することができる。さらに、所望の場合または必要な場合には、好適な結合剤、滑沢剤、崩壊剤および着色剤を混合物に加えることもできる。好適な結合剤の例としては、デンプン、ゼラチン、天然の糖、例えばグルコースまたはベータラクトース、トウモロコシ甘味剤、天然ゴムおよび合成ゴム、例えばアラビアゴム、トラガカントゴムまたはアルギン酸ナトリウム、カルボキシメチルセルロース、ポリエチレングリコール、ワックス等が挙げられる。これらの剤形で有用な滑沢剤としては、例えば、オレイン酸ナトリウム、ステアリン酸ナトリウム、ステアリン酸マグネシウム、安息香酸ナトリウム、酢酸ナトリウム、塩化ナトリウム等が挙げられる。崩壊剤としては、これらに限定されるものではないが、デンプン、メチルセルロース、寒天、ベントナイト、キサンタンガム等が挙げられる。錠剤は、例えば、粉末混合物の調製し、顆粒化または造粒化し、滑沢剤および崩壊剤を添加し、錠剤へ加圧成形することにより製剤化する。粉末混合物は、本化合物(好適には粉砕物)を、上記希釈剤または基剤と混合することにより調製することができる。任意の成分としては、結合剤、例えばカルボキシメチルセルロース、アルギン酸塩、ゼラチンまたはポリビニルピロリドン、溶液遅延剤、例えばパラフィン、吸収遅延剤、例えば第四級塩、および/または吸収剤、例えば、ベントナイト、カオリンまたは第二リン酸カルシウムが挙げられる。粉末混合物は、結合剤、例えば、シロップ、デンプン糊、アラビアゴム漿、またはセルロース材料もしくは高分子材料の溶液を用いて湿式造粒し、篩を通過させることができる。造粒の別法として、粉末混合物を錠剤機にかけると、完全に形成されていないスラッグが得られ、これを顆粒剤へと分解する。顆粒剤は、ステアリン酸、ステアリン酸塩、タルクまたは鉱油を添加することによって滑沢化し、錠剤の成形型にくっつかないようにすることができる。次いで、滑沢化した混合物を圧縮して錠剤にする。また、本発明の化合物は、自由流動性の不活性担体と組み合わせて、造粒工程またはスラッグ化工程を行うことなく、直接錠剤に圧縮することができる。シェラックのシールコーティング、糖または高分子物質のコーティング、ならびにワックスの艶出しコーティングからなる透明または不透明の保護コーティングを供することができる。これらのコーティングに色素を添加して、異なる単位用量を区別することができる。
【0054】
溶液、シロップ剤およびエリキシル剤などの経口用液体は、所与の量が所定量の本化合物を含むような単位製剤形態に調製することができる。シロップ剤は、例えば、好適に風味付けした水溶液中に本化合物を溶解させることによって調製可能であり、エリキシル剤は、非毒性のアルコールビヒクルを使用することによって調製される。懸濁液は、一般的に、非毒性ビヒクル中に化合物を分散させることにより製剤化することができる。可溶化剤および乳化剤、例えば、エトキシ化イソステアリルアルコールおよびポリオキシエチレンソルビトールエーテル、保存剤;風味添加剤、例えば、ハッカ油、または天然甘味料、サッカリン、あるいは他の人工甘味料;等も添加することができる。
【0055】
必要に応じて、経口投与用の用量単位製剤をマイクロカプセル化することができる。この製剤も、例えば、粒状物質をポリマー、ワックス等でコーティングまたは包埋することによって、放出を延長または持続するように調製することができる。
【0056】
また、式(I)の化合物ならびにその塩、溶媒和物および生理学上機能的な誘導体は、リポソーム送達系、例えば、小型単層小胞、大型単層小胞および多層小胞の形態で投与することができる。リポソームは、コレステロール、ステアリルアミンまたはホスファチジルコリンなどの種々のリン脂質から形成され得る。
【0057】
また、式(I)の化合物ならびにその塩、溶媒和物および生理学上機能的な誘導体は、その化合物分子が結合されている個々の担体としてモノクローナル抗体を使用することによって送達することもできる。また該化合物は、標的を設定することができる医薬品担体としての可溶性ポリマーと結合させることもできる。そのようなポリマーとしては、ポリビニルピロリドン(PVP)、ピラン共重合体、ポリヒドロキシプロピルメタクリルアミド-フェノール、ポリヒドロキシエチルアスパルトアミドフェノール、またはパルミトイル残基で置換されているポリエチレンオキシドポリリシンを挙げることができる。さらに、本化合物は、医薬品の制御放出を達成するのに有用な生分解性ポリマーのクラス、例えば、ポリ乳酸、ポリイプシロンカプロラクトン、ポリヒドロキシ酪酸、ポリオルトエステル、ポリアセタール、ポリジヒドロピラン、ポリシアノアクリレート、およびヒドロゲルの架橋結合型または両親媒性のブロック共重合体に結合させることができる。
【0058】
経皮投与に適した医薬製剤は、長時間にわたって服用者の表皮との密接な接触を保つことを意図する個別の貼付剤として提供することができる。例えば、有効成分は、Pharmaceutical Research, 3(6), 318 (1986)に一般的に記載されているようなイオン導入によって貼付剤から送達することができる。なお、前記文献は、そのような送達系に関して参照により本明細書に組み入れるものとする。
【0059】
局所投与に適した製剤は、軟膏剤、クリーム剤、懸濁液、ローション剤、散剤、溶液、泥膏、ゲル剤、噴霧剤、エアロゾルまたは油剤として製剤化することができる。
【0060】
眼部または他の外部組織(例えば、口および皮膚)の治療については、局所軟膏またはクリームとして製剤を適用することができる。軟膏で製剤化する場合、有効成分はパラフィン性または水混和性軟膏基剤のいずれかを用いることができる。あるいは、有効成分を水中油滴型クリーム基剤または油中水滴型基剤を含むクリーム剤で製剤化することができる。眼部への局所投与に適した製剤には、有効成分を好適な担体、特に水溶性溶媒中に溶解または懸濁させた目薬が含まれる。口内への局所投与に適した製剤には、ロゼンジ、香錠および口内洗浄液が含まれる。
【0061】
担体が固体である場合、経鼻投与に適した医薬製剤は、例えば、20〜500ミクロンの範囲の粒子径を有する粗末が含まれる。散剤は、鼻から吸い込む方法で、すなわち、鼻に接近させた散剤入りの容器から鼻腔を通して急速に吸入することによって投与する。担体が液体である場合、鼻内噴霧として、または点鼻液としての投与に適した製剤には、有効成分の水溶性または油性溶液が含まれる。
【0062】
吸入による投与に適した医薬製剤には、微粒子の粉剤または噴霧剤が含まれるが、これらは、様々なタイプの定量型用量加圧式エアロゾル、噴霧器または注入器の手段によって生成され得る。
【0063】
直腸内投与に適した医薬製剤は、坐剤として、または浣腸剤として提供され得る。
【0064】
膣投与に適した医薬製剤は、ペッサリー、タンポン、クリーム剤、ゲル剤、泥膏、フォーム剤、または噴霧剤として提供することができる。
【0065】
非経口投与に適した医薬製剤には、酸化防止剤、バッファー、静菌剤、および対象の服用者の血液と等張の製剤にする溶質を含有し得る水溶性および非水溶性の殺菌注射溶液;ならびに懸濁化剤および粘稠化剤を含有し得る水溶性および非水溶性の殺菌懸濁液が含まれる。これらの製剤は、単位投与用量容器または多回投与用量容器、例えば、密閉アンプルおよびバイアル等に入れて提供することができ、また、使用の直前に、殺菌液体担体(例えば、注射用水)の添加だけが必要であるフリーズドライ(凍結乾燥)状態で保存することができる。即時注射溶液および懸濁液は、殺菌済み散剤、顆粒剤および錠剤から調製することができる。
【0066】
本製剤は、上に詳しく記載した成分の他に、製剤のタイプを考慮して、当技術分野の慣用の他の薬剤を含むことができる。例えば、経口投与に好適な製剤には香味剤を含むことができる。
【0067】
本発明の化合物ならびにその塩、溶媒和物および生理学上機能的な誘導体は、単独で、または本明細書に記載した疾患を治療するための他の治療用薬剤と組み合わせて使用することができる。例えば、骨粗鬆症治療では、他の骨粗鬆症剤との組み合わせが考えられる。従って、例えば、本発明による骨粗鬆症組み合わせ治療は、少なくとも1種の式(I)の化合物またはその塩、溶媒和物もしくは生理学上機能的な誘導体、あるいはそれらの組合せの投与と、少なくとも1種の他の薬剤の使用とを含む。例えば、骨粗鬆症の治療において、本発明の1種以上の化合物を、骨形成剤(bone building agent)と組合せることができる。
【0068】
式(I)で表される化合物および他の製薬的に活性な薬剤の量と、投与の相対的なタイミングは、所望の組み合わせによる治療効果を達成するために選択される。本発明の化合物と他の治療薬との組み合わせにおける投与は、(1)各化合物を含む単一の医薬組成物;または(2)それらの化合物の1種を各々含む個別の医薬組成物での併用投与による組み合わせであってよい。あるいは、組み合わせは、最初に1つの治療薬を投与し、続いて別の治療薬を投与するか、あるいはその逆の投与を行う連続法で別々に投与することができる。そのような連続投与は、時間を置かなくてもよく、あるいは時間を置いてもよい。従って、前記組み合わせを、一緒に、あるいは別々に投与してもよく、別々に投与する場合は、投与は同時にまたは任意の順番で連続的に行ってもよい。
【0069】
記載のとおり、有望な添加可能な骨粗鬆症治療薬の1つは、骨形成(同化)剤である。骨ミネラル濃度などのパラメーターを、抗再吸収薬で達成され得るものよりも高めることができる。場合によっては、そのような同化剤は、骨梁の連結性(trabecular connectivity)を高め、骨の構造をさらに完全な状態に導くことができる。
【0070】
他の有望な治療の組み合わせには、成長促進剤、成長ホルモン分泌促進物質、成長ホルモン放出因子およびその類似体、成長ホルモンおよびその類似体、ソマトメジン、α-アドレナリンアゴニスト、セロトニン5-HTDアゴニスト、選択的セロトニン再取り込み阻害剤、ソマトスタチンまたはその放出を阻害する薬剤、5-α-還元酵素阻害剤、アロマターゼ阻害薬、GnRH阻害剤、副甲状腺ホルモン、ビスホスホネート、エストロゲン、テストステロン、プロゲステロン受容体アゴニストと組合せた、および/または本発明の別の化合物を含むSERMなどの核内ホルモン受容体の他のモジュレーターと組合せた、本発明の化合物が含まれる。
【0071】
以下に限定されるものではないが、例としては、抗糖尿剤、抗骨粗鬆症剤、抗肥満剤、抗炎症剤、抗不安剤、抗うつ剤、抗昇圧剤、抗血小板剤、抗血栓症剤および血栓溶解剤、強心性配糖体、コレステロールまたは脂質低下剤、ミネラルコルチコイド受容体アンタゴニスト、ホスホジエステラーゼ阻害薬、キナーゼ阻害剤、甲状腺擬似体、同化剤、ウイルス治療剤、認知障害治療、睡眠障害治療、性機能障害治療、避妊薬、細胞毒性薬、放射線治療、抗増殖剤、および抗腫瘍剤と、本発明の1つ以上の化合物の組み合わせが挙げられる。さらに、本発明の化合物は、アミノ酸、トリグリセリド、ビタミン、ミネラル、クレアチン、ピロ酸(piloic acid)、カルニチン、または補酵素Q10などの栄養補給剤と組み合わせることもできる。
【0072】
本発明の一態様は、これらに限定されるものではないが、骨粗鬆症、骨鉱物質消失、骨量、密度または成長の減少、骨関節炎、骨折修復および治癒の促進、関節置換の治癒の促進、歯槽膿漏症、歯の修復または成長の促進、パジェット病、骨軟骨形成異常、筋肉消耗、筋力および筋機能の維持および増強、脆さ(frailty)または加齢に伴う機能低下(「ARFD」)、サルコぺニア、慢性疲労症候群、慢性筋肉痛、急性疲労症候群、創傷治癒の促進、感覚機能の維持、慢性肝炎、AIDS、無重量感、火傷および外傷の回復、血小板減少症、短腸症候群、過敏性腸症候群、炎症性腸疾患、クローン病および潰瘍性大腸炎、肥満、カヘキシーまたは老化に伴う拒食症を含む摂食障害、副腎皮質機能亢進症およびクッシング症候群、心血管疾患または心機能不全、うっ血性心不全、高血圧、乳癌、乳房、脳、皮膚、卵巣、膀胱、リンパ、肝臓、腎臓、子宮、膵臓、子宮内膜、肺、結腸および前立腺を含む、アンドロゲン受容体を含有する悪性腫瘍細胞、前立腺肥大、多毛、ざ瘡、脂漏、男性ホルモン性脱毛症、貧血、超多毛性、前立腺の腺腫および腫瘍形成、高インスリン血症、インスリン耐性、糖尿病、X症候群、異脂肪血症、尿失禁、アテローム性動脈硬化症、性欲増強、性機能障害、鬱病、抑鬱症状、神経質、短気、ストレス、精神的能力の低下および低自尊心、認知機能の改善、子宮内膜症、多嚢胞性卵巣症候群、子癇前症の予防、月経前症候群、避妊、子宮類線維症、および/または大動脈平滑筋細胞増殖、膣乾燥、心因掻痒、性交疼痛症、排尿障害、頻尿、尿路感染、高コレステロール血症、高脂血症、末梢血管疾患、再狭窄、血管痙攣、免疫反応に起因する血管壁損傷、アルツハイマー病、骨疾患、老化、炎症、慢性関節リウマチ、呼吸器疾患、肺気腫、再潅流傷害、ウイルス性肝炎、結核、乾癬、筋萎縮性側索硬化症、卒中、CNS外傷、痴呆、神経変性、乳房痛および月経困難症、更年期障害または閉経後障害、血管運動症状、尿生殖萎縮または外陰膣萎縮、萎縮性膣炎、女性性機能不全、性欲亢進目的、性的欲求低下障害の治療目的、性的刺激障害、オルガスムスの頻度および強度の向上目的、膣痙、オステオペニア、子宮内膜症、BPH(良性前立腺肥大)、自己免疫性疾患、橋本甲状腺炎、SLE(全身性エリテマトーデス)、重症筋無力症、あるいは虚血心筋の再灌流損傷を含む、種々の障害の治療または予防における本発明の化合物の使用である。
【0073】
特に、本発明の化合物は、更年期障害または閉経後障害、血管運動症状、尿生殖萎縮または外陰膣萎縮、萎縮性膣炎、女性性機能不全、乳癌、抑鬱症状、糖尿病、骨鉱物質消失の治療、ならびに骨粗鬆症の治療および/または予防において、単独で、あるいは他の薬剤との組み合わせで有用であると考えられる。
【0074】
本発明の化合物は、周知の標準的な合成方法を含む種々の方法によって製造することができる。例として一般的合成法を以下に述べ、次いで、本発明の具体的な化合物を実施例で調製する。
【0075】
以下に記載される例において、感受性基または反応基に対する保護基は、合成化学の一般的な原理に従って必要に応じて用いる。保護基は、有機合成の標準方法に従って処理する(T. W. GreenおよびP. G. M. Wuts (1991) Protecting Groups in Organic Synthesis, John Wiley & Sons、保護基に関して、参照により本明細書に組み入れるものとする)。これらの基は、当業者に容易に理解される方法を用いて、本化合物の合成の都合のよい段階で除去する。方法の選択、並びにこれらの実施の反応条件および順序は、式(I)の化合物の調製に従うものとする。
【0076】
当業者は、立体中心が式(I)の化合物に存在するかどうかについて理解するであろう。従って、本発明にはあらゆる立体異性体が含まれており、ラセミ化合物だけでなく各鏡像異性体も同様に含まれる。化合物を1つの鏡像異性体として所望する場合、当技術分野で公知である立体特異的合成によって、最終産物もしくは任意の都合のよい中間体の分割によって、またはキラルクロマトグラフ法によって、そのような化合物を得ることができる。最終産物、中間体または出発原料の分割は、当技術分野で公知の任意の好適な方法により達成することができる。例えば、E. L. Eliel, S. H. Wilen, およびL. N. Mander (Wiley-Interscience, 1994)によるStereochemistry of Organic Compoundsを参照されたい。なお、この文献は、立体化学に関して、参照により本明細書に組み入れるものとする。
【0077】
実験セクション
略語:
本明細書では、これらの方法、スキームおよび実施例の中で用いられている記号および表記は、最新の科学文献(例えば、the Journal of the American Chemical Societyまたはthe Journal of Biological Chemistry)で用いられているものに従う。特に、実施例および明細書全体にわたって、以下の略語を用いることができる:
g(グラム); mg(ミリグラム);
L(リットル); mL(ミリリットル);
μL(マイクロリットル); psi (ポンド毎平方インチ);
M(モル); mM(ミリモル);
Hz(ヘルツ); MHz(メガヘルツ);
mol(モル); mmol(ミリモル);
RT(室温); h(時間);
d(日); EI(電子衝撃);
min(分); TLC(薄層クロマトグラフィー);
mp(融点); RP(逆相);
Tr(保持時間); TFA(トリフルオロ酢酸);
TEA(トリエチルアミン); THF(テトラヒドロフラン);
TFAA(トリフルオロ酢酸無水物); CD3OD(重水素化メタノール);
CDCl3(重水素化クロロホルム); DMSO(ジメチルスルホキシド);
SiO2(シリカ); atm(気圧);
EtOAc(EtOAc); CHCl3(クロロホルム);
HCl(塩酸); Ac(アセチル);
DMF(N,N-ジメチルホルムアミド); Me(メチル);
Cs2CO3(炭酸セシウム); EtOH(エタノール);
Et(エチル); tBu(tert-ブチル);
MeOH(メタノール); CH2Cl2(ジクロロメタン);
MgSO4(硫酸マグネシウム); CH3CN(アセトニトリル);
K2CO3(炭酸カリウム); TiCl4(四塩化チタン);
EtOAc(EtOAc); CO2(二酸化炭素);
Pd(OAc)2(酢酸パラジウム); Et2O(ジエチルエーテル);
P(o-tolyl)3(トリ-o-トリルホスフィン); Na2SO4(硫酸ナトリウム);
NaH(水素化ナトリウム); DME(1,2-ジメトキシエタン);
NaI(ヨウ化ナトリウム); NaOH(水酸化ナトリウム);
NH4Cl(塩化アンモニウム); NaHCO3(重炭酸ナトリウム);
AlCl3(塩化アルミニウム); (C2H5O)2P(O)H(亜燐酸ジエチル);
NaN3(アジ化ナトリウム); CBR4(四臭化炭素);
PPh(トリフェニルホスフィン); CuI(ヨウ化銅(I));
Pd(Ph3P)4(テトラキス(トリフェニルホスフィン)パラジウム(0));
(iPrO)3B(ホウ酸トリイソプロピル); nBuLi(ブチルリチウム);
Na2CO3(炭酸ナトリウム); DMAP(4-(ジメチルアミノ)ピリジン);
eq(当量);
HRMS(高分解能質量分析);
LCMS(液体クロマトグラフィー質量分析);
LRMS(低分解能質量分析);
APCI(大気圧化学イオン化);
LiHMDS(リチウムビス(トリメチルシリル)アミド);
Pd(Ph3P)2Cl2(ジクロロビス(トリフェニルホスフィン)パラジウム(II));
EDC(N-(3-ジメチルアミノプロピル)-N'-エチルカルボジイミド;
dpppe(1,5-ビス(ジフェニルホスファニル)ペンタン;
DMAc(N,N-ジメチルアセトアミド);
HPLC(高速液体クロマトグラフィー);
tmeda(N,N,N',N',-テトラメチルエチレンジアミン);
Pd2(dba)3(ジパラジウムトリス(ジベンジリデンアセトン))。
【0078】
特に記載がない限り、試薬および溶媒は販売業者から入手し、さらなる精製は行わずに用いた。また、特に明記しない限り、全ての反応は室温で行い、全ての温度は℃(摂氏度)で表す。
【0079】
薄層クロマトグラフィー(TLC)は、シリカゲル60 F254 プレコートプレート上で実施した。検出は、紫外線(254nm)に曝露することにより行った。フラッシュ(flash)およびフラッシュ(flush)カラムクロマトグラフィーは、シリカゲル60を用いて行なった。逆相分取および分析HPLCは、C18カラムと調節剤として0.05% TFAを用いるアセトニトリル:水勾配を使用して行った。
【0080】
化合物の純度および特性は、1H-NMR、液体クロマトグラフィー質量分析(LCMS)、高分解能質量分析(HRMS)、燃焼(元素)分析、HPLC、および融点によって測定した。一般式Iの化合物は、一般的に、90%を超える(>90%)純度を有することが確認された。
【0081】
1H NMRスペクトルは、Varian INOVA-300およびVarian INOVA-400計器(intrument)に記録した。化学シフトは、百万分の一(ppm、δ単位)で表した。結合定数はヘルツ(Hz)単位である。分裂パターンは見かけの多重度を記載しており、s(一重線)、d(二重線)、dd(二重線の二重線)、t(三重線)、q(四重線)、m(多重線)またはbr(幅広)として示している。
【0082】
低分解能質量スペクトルは、Atmospheric Pressure Chemical Ionization (APCI)またはESI Ionization (ESI)のいずれかを用いて、Micromass Ltd., Altricham, UK製のMicromass ZQ、Micromass ZMD、Micromass QuattroMicroおよびMicromass GCTの各機器により得た。
【0083】
高解像度質量スペクトルデータ(HRMS)は、Micromass LCTおよびMicromass GCTの各機器で記録した。
【0084】
燃焼分析は、Atlantic Microlab, Inc. (Norcross, Georgia)により行われた。
【0085】
融点はオープンキャピラリチューブで記録し、未修正である。
【0086】
太字の数字は、以下のスキームに表示した化合物の参照符である。
【0087】
スキーム1
置換シクロアルキリデンジフェニルエチレンまでの一般的経路
【化5】

【0088】
対称シクロアルキリデンジフェニルエチレンVIは、スキーム1に示したように、ベンゾフェノンIVとケトンV間のマクマリーカップリング反応により得られる。マクマリー反応条件は、Mukaiyama et al., Chem. Lett. (1973), 1041; Lenoir, Synthesis, (1977), 553; Lenoir and Burghard, J. Chem. Res. (S) (1980), 396; McMurry, Chem. Rev. (1989), 89, 1513-1524; McMurry, Acc. Chem. Res. (1983) 16, 405-511;およびS. Gauthier et al., J. Org. Chem., (1996), 61, 3890-3893を参照されたい。なお、各文献は、そのような教示に関して、参照により本明細書に組み入れるものとする。ケトンVは、市販品を購入可能であるか、あるいは当業者によって認められている合成法により調製することができる。ベンゾフェノンIVは、市販品を購入可能であるか、あるいは当業者によって認められている方法を用いて酸塩化物とアニソール誘導体間のフリーデル−クラフツアシル化により調製することができる。フリーデル-クラフツ反応の条件については、Friedel-Crafts and Related Reactions, G. A. Olah, 編集, Vol 3, Pt 1, pp 1-382, J. Wiley and Sons, New York (1964);G. A. Olah, Friedel-Crafts Chemistry, Wiley Interscience, New York, (1973);およびLarock, R. C., Comprehensive Organic Transformations, VCH Publishers, New York, 1989を参照されたい。なお、各文献は、そのような教示に関して、参照により本明細書に組み入れるものとする。あるいは、IVなどのベンゾフェノンは、WeinrebアミドII誘導体をアリールグリニャール試薬IIIで処理することによって調製することができる。Tetrahedron Letters, 22(39), 3815-18; 19)を参照されたい。なお、そのような教示に関して、参照により本明細書に組み入れるものとする。
【0089】
VIのR3置換基についてさらに合成(elaboration)を行なうことができる。例えば、R3がエステルである場合、けん化によりカルボン酸VIIが得られ、また、LAHなどの還元剤で処理することにより対応するアルコールVIIIが得られる。酸VIIはカルボキサミドIXに変換することもできる。ジクロロメタン中のEDCおよびDMAPなどのカップリング剤の存在下で酸(VII)をアミンで処理するとアミドIXが得られる。あるいは、トルエン中の塩化オキサリルおよびDMFを用いて酸VIIを酸塩化物に変換し、続いてアミンによりその粗製酸塩化物を処理すると、アミドIXが得られる。カルボン酸からアミドへの変換については、Larock, R. C., Comprehensive Organic Transformations, VCH Publishers, New York, 1989を参照されたい。なお、そのような教示に関して、参照により本明細書に組み入れるものとする。
【0090】
スキーム2
シクロアルキリデンジフェニルエチレンアクリル酸およびアクリルアミドまでの一般的経路
【化6】

【0091】
アクリル酸XIは、スキーム2に示したように、化合物VIから2ステップで調製することができる。アクリレートエステル(式中、表示されたRは好適なアルキル基(例えば、メチル、エチル、tert-ブチル)である)とVIとのHeckカップリングによりXが得られる。Heck反応の概説については、Heck, Acc. Chem. Res. (1979), 12, 146-151; Heck, Pure Appl. Chem. (1978), 50, 691-701;R. F. Heck, Palladium Reagents in Oraganic Syntheses, Academic Press, New York (1985), 179-321, Bender, Stakem, and Heck, J. Org. Chem. (1982), 47, 1278;Spencer, J. Organomet. Chem. (1983), 258, 101;並びにBrase, Stefan; De Meijere, Armin. Palladium-catalyzed Coupling of Oranyl Halides to Alkenes - the Heck Reaction, Metal-Catalyzed Cross-Coupling Reactions (1998), 99-166, Publisher: Wiley-VCH Verlag GmbH, Weinheim, Germanyを参照されたい。なお、各文献は、そのような教示に関して、参照により本明細書に組み入れるものとする。Xのエステル加水分解によりアクリル酸XIが得られる。
【0092】
R1がFであるXIの類似体は、(4-ブロモフェニル)(4-フルオロフェニル)メタノンを用いることによって、スキーム1およびスキーム2に示される方法により調製することができるが、これは、文献に記載されている方法(例えば、Z. Vejdelekら, Collect. Czech. Chem. Commun., (1984), 49(11), 2649-2660を参照されたい。なお、この文献は、そのような教示に関して、参照により本明細書に組み入れるものとする)によって調製することができる。
【0093】
アクリル酸XIは、スキーム2で示したように、アミドに変換することができる。ジクロロメタン中のEDCおよびDMAPなどのカップリング剤の存在下、アクリル酸(XI)をアミンで処理するとアミドXIIが得られる。あるいは、トルエン中の塩化オキサリルおよびDMFを用いて、アクリル酸XIを酸塩化物に変換し、続いて、その粗製酸塩化物をアミンで処理するとアミドXIIが得られる。カルボン酸からアミドへの変換については、Larock, R. C., Comprehensive Organic Transformations, VCH Publishers, New York, 1989を参照されたい。なお、そのような教示に関して、参照により本明細書に組み入れるものとする。
【0094】
スキーム3
ハロゲン化アリールVIからシクロアルキリデンジフェニルエチレンまでの一般的経路
【化7】

【0095】
シクロアルキリデンVIは、スキーム3に示すように、種々の化合物の調製に使用可能な用途の広い中間体である。
【0096】
Suzuki反応条件を用いて、VIをアリールまたはヘテロアリール置換ボロン酸とカップリングすることによりXIIIが得られる。Suzukiカップリング反応の反応条件については、Miyaura, N., Suzuki, A. Chem. Rev. 1995, 95, 2457-2483; Suzuki, A., J. Oranometallic Chem. (1999), 576, 147-168;およびSuzuki, A. in Metal-catalyzed Cross-coupling Reactions, Diederich, F., and Stang, P. J., Eds.;Wiley-VCH: New York, (1998), pp. 49-97を参照されたい。なお、各文献は、そのような教示に関して、参照により本明細書に組み入れるものとする。あるいは、XIIIは、ボロン酸XVとハロゲン化アリールまたはハロゲン化ヘテロアリールとのSuzukiカップリング反応により調製することができる。ボロン酸XVは、ブチルリチウムを用いてVIを金属ハロゲン交換し、得られた有機リチウムをホウ酸トリイソプロピルで処理し、その後加水分解することにより調製することができる。反応条件については、X. Dengら, J. Org. Chem., (2002), 67(15), 5279-5283、およびP. J. Hajdukら, J. Amer. Chem. Soc., (1997), 119(25), 5818-5827を参照されたい。なお、各文献は、そのような教示に関して、参照により本明細書に組み入れるものとする。
【0097】
ブチルリチウムを用いてVIの金属ハロゲン交換を行い、次いで、二酸化炭素またはDMFで処理することによって、それぞれ安息香酸XVIおよびベンズアルデヒドXVIIが得られる。反応条件については、T. Mizunoら, Tetrahedron, (1999), 55(31), 9455-9468; J. W. Lampeら, J. Med. Chem., (2002), 45(12), 2624-2643; R. G. Leendersら, Bioorg. Med. Chem. (1999), 7(8), 1597-1610; およびA. Endoら, J. Amer. Chem. Soc., (2002), 124(23), 6552-6554を参照されたい。なお、各文献は、そのような教示に関して、参照により本明細書に組み入れるものとする。
【0098】
アミドは、スキーム2に示した方法によって、XVIから調製することができる。ベンズアルデヒドXVIIは、Wadsworth-Emmons化学によってアクリレートエステルXに変換することができる(Wadsworth-Emmons化学については、J. BoutagyおよびR. Thomas Chem. Rev. (1974), 74, 87-99; Wadsworth, Org. React (1977), 25, 73-253; Y. Momoseら, J. Med. Chem., (2002), 45(7), 1518-1534; 並びにS. D. Bullら, J. Chem. Soc. Perkin Trans I, (2001), 23, 3112-3121を参照されたい。なお、各文献は、そのような教示に関して参照により本明細書に組み入れるものとする)。
【0099】
VIとプロピオル酸エステル、プロピオル酸アルコールまたは(トリメチルシリル)アセチレンとのSonagashiraカップリング法を行うことにより、芳香族アルキンXIVが得られる。Campbell, I. B. "The Sonagashira Cu-Pd-catalyzed alkyne coupling Reaction", Organocopper Reagents, Taylor, Richard J. K. 編集, (1994), 217-35. 出版社:IRL Press, Oxford, UK; G. C. Nwokogu ら, J. Org. Chem., (1994), 59(9), 2506-2510; 並びにA. P. Kozikowski J. Med. Chem. (2000), 43 (6), 1215-1222、並びにT. EckertおよびJ. Ipaktschi Synth. Commun. (1998), 28, 327-336を参照されたい。なお、各文献は、そのような教示に関して、参照により本明細書に組み入れるものとする。化合物XIVは、さらに処理して、さらなる新しい類似体を調製することができる。例えば、表示されたR基がTMSである場合、TMS基を除去すると対応する末端アセチレンを得ることができる。表示されたR基がエステルである場合、加水分解または還元を行うと、それぞれ対応する酸またはアルコールが得られる(スキーム1に示された条件を参照されたい)。
【0100】
スキーム4
シクロアルキリデンジフェニルエチレンオキサゾールの一般的合成
【化8】

【0101】
二置換オキサゾールXVIIIは、スキーム4に示されるように、安息香酸XVIから2ステップで調製される。XVIを塩化オキサリルで処理することによって酸塩化物XIXが得られ、次いで、塩基の存在下に1H-1,2,3-トリアゾールで処理することによってオキサゾールXVIIIが得られる。芳香族酸塩化物またはベンズアミドからオキサゾール形成を導く反応条件については、Murugesan, N.ら, J. Med. Chem. (2000), 43, 3111-3117を参照されたい。なお、該文献は、そのような教示に関して、参照により本明細書に組み入れるものとする。
【0102】
スキーム5
シクロアルキリデンジフェニルエチレンスルホンアミドおよびアミドの一般的合成
【化9】

【0103】
ニトロアニリンXXは、スキーム5に示されるように、スルホンアミド(XXIV)またはアミド(XXV)に変換することができる。XXを亜ジチオン酸ナトリウムなどの還元剤で処理することによってアニリンXXIが得られる。XXIを塩化スルホニルまたは酸塩化物でアシル化すると、それぞれ、スルホンアミドXXIIまたはカルボキサミドXXIIIが得られる。スキーム1に示されるように、XXIIまたはXXIIIをケトンVでマクマリーカップリングを実施することにより、XXIVまたはXXVが得られる。XXIを当業者に公知の方法により還元的アルキル化を行うとアニリンXXVIが得られ、次いで、上述のように処理することによりスルホンアミドXXVIIまたはアミドXXVIIIを得ることができる。XXVIIまたはXXVIIIをケトンVで処理することにより、スルホンアミドXXIXまたはアミドXXXが得られる。
【0104】
スキーム6
オキシアルキル置換シクロアルキリデンジフェニルエチレンの合成
【化8】

【0105】
種々のアルキル誘導体は、スキーム6に示したように、フェノールXXXIのO-アルキル化によって2ステップまたは3ステップで調製することができる。上述のように、XXXIに類似の化合物は、適切に置換されているベンゾフェノンとケトンVの間のマクマリーカップリングによって調製することができる。マクマリー反応条件については、上記スキーム1で引用されている文献を参照されたい。XXXIのO-アルキル化は、好適な塩基とXXXII(式中、表示されたR基は好適なアルキル基(例えば、メチル、エチル、tert-ブチル等)である)などのハロエステルの存在下で達成することができる。得られたエステルXXXIIIをけん化すると酸XXXIVが得られる。エステルXXXIIIのアルコールXXXVへの変換は、水素化アルミニウムリチウム(LAH)などの還元剤で処理することによって達成することができる。同様に、フェノールXXXIをハロアセトニトリルXXXVIまたはハロアルコールXXXVIIでアルキル化することにより、それぞれ化合物XXXVIIIおよびXXXIXを得ることができる。関連のフェノールアルキル化反応の例については、Rubin, V.ら, Bioorganic & Med. Chem. (2001), 9, 1579-1586を参照されたい。なお、そのような教示に関して、参照により本明細書に組み入れるものとする。
【実施例】
【0106】
以下の具体的な実施例は例証として記載したものであり、本発明の範囲を限定するものと解釈されてはならない。簡便な参照のために、本明細書において特定の化合物を太字(下線)の数を用いて表す。この省略した参照法を用いる場合、それは合成された具体的な化合物ではなく一般的化合物を意味する。
【0107】
実施例1(3)
(2E)-3-{4-[シクロヘプチリデン(フェニル)メチル]フェニル}プロパ-2-エン酸 (3)
【化11】

【0108】
工程1 : [(4-ブロモフェニル)(フェニル)メチレン]シクロヘプタン(1)
Zn粉末(4.80 g、73.5 mmol)とTHF (100 mL)の撹拌懸濁物に、N2 下でTiCl4 (3.9 mL, 35.7 mmol)を滴下した。生じた黄色い懸濁物を室温にて45分撹拌し、その後2.5時間還流した。この還流反応物に、THF (40 mL)中のシクロヘプタノン(3.42 g, 30.6 mmol)と4-ブロモベンゾフェノン (2.54 g, 9.75 mmol)の溶液を、15分にわたり滴下しながら加えた。2時間後に反応を室温に冷却し、その後、水(75 mL)と10% Na2CO3水溶液(75 mL)を順次滴下することによりクエンチ(反応停止)した。この混合物を室温で一晩撹拌し、その後、EtOAc (300 mL)で希釈し、次いでセライトのパッドで濾過した。このセライトのパッドをEtOAc (250 mL)ですすぎ、無色の濾液を分液漏斗に移した。有機画分を塩水(300 mL)で洗浄し、乾燥させ(Na2SO4)、その後6.50 gの無色の油状物へと濃縮した。この油状物を、シリカゲル(150 g)上でヘキサンに続く2% EtOAc:ヘキサンを使用するカラムクロマトグラフィーにかけることにより精製し、生成物1を無色の油状物として単離し、これを放置して固化させた(2.54 g, 76%)。

【0109】
工程2: tert-ブチル(2E)-3-{4-[シクロヘプチリデン(フェニル)メチル]フェニル}プロパ-2-エノエート (2)
1 (0.77 g, 2.24 mmol), TEA (1.86 mL, 13.4 mmol), t-ブチルアクリレート(1.96mL, 13.4 mmol), Pd(OAc)2 (0.12 g, 0.50 mmol), P(o-トリル)3 (0.28 g, 0.90 mmol)およびCH3CNの撹拌懸濁物を、N2下で撹拌しながら還流した。2時間後に加熱を中断し、反応物を、EtOAc (50 mL)および水(50 mL)で希釈した。セライトのパッドを用いてこの混合物を濾過し、その後、濾液を分液漏斗に移した。有機画分を、50 mL塩水(50 mL)を用いて洗浄し、乾燥させ(MgSO4)、濾過し、1.39 gの琥珀色の油状物へと濃縮した。粗生成物を、ヘキサンから5% EtOAc:ヘキサンへの濃度勾配を用いたシリカゲル上でのフラッシュクロマトグラフィーにより精製した。生成物2を、無色の粘性油状物として単離した(900 mg, 100%)。

【0110】
工程3: (2E)-3-{4-[シクロヘプチリデン(フェニル)メチル]フェニル}プロパ-2-エン酸(3)
CH2Cl2 (25 mL)中の2 (0.77 g, 2.24 mmol)の撹拌溶液に、0℃にて、TFAを15分にわたり滴下した。淡黄色の反応液を0℃にて1時間撹拌し、その後室温にて15分放置した。反応液を粘性の油状物へと濃縮し、CH2Cl2 (20 mL)に再度溶解させ、その後、ゴム状の固形物へと再度濃縮した。この粗生成物をエーテル/ヘキサンより結晶化させ、表題の化合物(3)を白色の固形物 (0.30 g, 41%)として得た。

【0111】
C23H24O2の認知機能計算値: C, 83.07; H, 7.30; 実測値: C, 82.73; H, 7.25。
【0112】
実施例2 (4)
(2E)-3-{4-[シクロヘプチリデン(フェニル)メチル]フェニル}プロパ-2-エンアミド (4)
【化12】

【0113】
[(4-ブロモフェニル)(フェニル)メチレン]シクロヘプタン (1) (0.50 g, 1.47 mmol), 10 TEA (1.21 mL, 8.71 mmol), アクリルアミド(0.62 g, 8.73 mmol), Pd(OAc)2 (0.080 g, 0.36 mmol), P(o-トリル)3 (0.19 g, 0.63 mmol)およびCH3CNの懸濁物をN2下で還流しながら撹拌した。2時間後に加熱を中止し、反応液をEtOAc (50 mL)および水(50 mL)で希釈した。セライトのパッドを用いてこの混合物を濾過し、その後、濾液を分液漏斗に移した。有機画分を、塩水(50 mL)を用いて洗浄し、乾燥させ(MgSO4)、濾過し、その後、琥珀色の油状物へと濃縮した。この油状物を、ヘキサンから25% EtOAc:ヘキサンを経由する100% EtOAcへの濃度勾配を用いたシリカゲル(50 g)でのカラムクロマトグラフィーにより精製して淡黄色の固形物を得た。EtOAc (25 mL)を用いてこの固形物を摩砕することにより、164 mg (33%)の表題の化合物(4)を白色の固形物として得た。

【0114】
C23H25NO・0.1 H2Oの分析計算値: C, 82.67; H, 7.63; N, 4.19; 実測値: C, 82.75; H, 7.56; N, 4.20。
【0115】
実施例3 (6)
2-({4-[フェニル(3,3,5,5-テトラメチルシクロヘキシリデン)メチル]フェニル}オキシ)エタノール (6)
【化13】

【0116】
工程1:{4-[(2-ヒドロキシエチル)オキシ]フェニル}(フェニル)メタノン (5)
アセトン(50 mL)中の4-ヒドロキシベンゾフェノン (6.0 g, 29.7 mmol)の溶液に、K2CO3 (12.3 g, 89.0 mmol)および2-クロロエタノール (4.0 mL, 59.3 mmol)を添加し、その後、NaI (4.50 g, 29.7 mmol)を添加した。この反応混合物を窒素下で一晩還流した。この混合物を室温に冷却した。白色の固形物を濾過して除き、アセトン(100 mL)で洗浄した。濾液を濃縮して、いくらかの白色の固形物を伴う茶色い油状残留物を得た。EtOAc (200 mL)を添加し、白色の固形物を濾過して除き、その後50 mLのEtOAcを用いて洗浄した。濾液を、1N NaOH、水、塩水で洗浄しNa2SO4を用いて乾燥させた。濃縮により、淡黄色油状物が得られ、これをさらに、シリカゲルカラム上でヘキサンから60%EtOAc:ヘキサンへの濃度勾配を用いて溶出を行ったクロマトグラフィーにより精製し、5を、白色の固形物(1.52 g, 21%)として得た。

【0117】
工程2:2-({4-[フェニル(3,3,5,5-テトラメチルシクロヘキシリデン)メチル]フェニル}オキシ)エタノール (6)
THF (10 mL)中のZn (0.65 g, 9.91 mmol)の撹拌懸濁物に、TiCl4 (0.55 mL, 4.95 mmol)を滴下した。この混合物を窒素下で2.5時間にわたり還流した。室温に冷却後、THF (17 mL)中の5 (0.30 g, 1.24 mmol)と3,3,5,5-テトラメチルシクロヘキサノン(0.59 g, 3.71 mmol)の溶液を一度に添加した。この反応混合物をさらに2.5時間還流した。室温に冷却後、10% K2CO3 (40 mL)を用いて反応物をクエンチした。クエンチした反応混合物をセライトのパッドで濾過し、その後、パッドをEtOAc (100 mL)で洗浄した。この濾液を分液漏斗に移し、層を分離させ、その後、EtOAc (50 mL)を用いて水層を抽出した。有機抽出物を一緒にし、塩水で洗浄し、乾燥させ(Na2SO4)、その後、濃縮して淡黄色の油状物を得た。残留物をさらに、シリカゲルカラム上で、ヘキサンから20% EtOAc:ヘキサンへの濃度勾配を用いて溶出を行うクロマトグラフィーにより精製し、6を、白色の固形物 (0.35 g, 78%)として得た。融点131〜132℃。

【0118】
C25H32O2の分析計算値: C, 82.37; H, 8.85; 実測値: C, 82.11 ; H, 9.03。
【0119】
実施例4 (8)
2-{[2-({4-[フェニル(3,3,5,5-テトラメチルシクロヘキシリデン)メチル]フェニル}オキシ)エチル]オキシ}エタノール (8)
【化14】

【0120】
工程1 : [4-({2-[(2-ヒドロキシエチル)オキシ]エチル}オキシ)フェニル](フェニル)メタノン (7)
CH3CN (30 mL)中の4-ヒドロキシベンゾフェノン (4.0 g, 19.8 mmol) の懸濁物にK2CO3 (8.20 g, 59.3 mmol)を加えた。この混合物を窒素下で1時間にわたり還流した。室温に冷却後、2-(2-クロロエトキシ)エタノール(4.3 mL, 39.6 mmol)を加え、その後、NaI (3.00 g, 19.8 mmol)を加えた。この反応混合物を窒素下で一晩還流した。この混合物を室温に冷却し、EtOAc (50 mL)を加えた。沈殿した白色の固形物を濾過し、その後EtOAc (50 mL)で洗浄した。濾液を分液漏斗に移し、その後、1N NaOH、水、塩水で洗浄し、Na2SO4を用いて乾燥させた。濃縮により黄色の油状物が得られ、これをさらに、シリカゲルカラム上で、ヘキサンから70% EtOAc:ヘキサンへの濃度勾配を用いた溶出を行うクロマトグラフィーにより精製し、7を、無色の結晶物(4.96 g, 88%)として得た。融点31〜32℃。

【0121】
工程2: 2-{[2-({4-[フェニル(3,3,5,5-テトラメチルシクロヘキシリデン)メチル]フェニル}オキシ)エチル]オキシ}エタノール (8)
THF (10 mL)中のZn (0.59 g, 8.94 mmol)の撹拌懸濁物に、TiCl4 (0.50 mL, 4.47 mmol)を滴下した。この混合物を窒素下で2.5時間にわたり還流した。室温に冷却後、THF (15 mL)中の7 (0.32 g, 1.12 mmol)と3,3,5,5- テトラメチルシクロヘキサノン(0.53 g, 3.35 mmol)の溶液を添加し、次いで反応混合物をさらに2.5時間にわたり還流した。室温に冷却後、10% K2CO3 (40 mL)を用いて反応物をクエンチした。クエンチした反応混合物をセライトのパッドで濾過し、その後、パッドをEtOAc (100 mL)で洗浄した。濾液を分液漏斗に移し、層を分離し、EtOAc (50 mL)を用いて水層を抽出した。一緒にした有機抽出物を塩水で洗浄し、乾燥させ(Na2SO4)、濃縮して淡黄色の油状物とした。残留物をさらに、シリカゲルカラム上で、ヘキサンから45% EtOAc:ヘキサンへの濃度勾配を用いて溶出を行うクロマトグラフィーにより精製して、8を白色の固形物として得た。10:1のヘキサン:EtOAcからの結晶化により、無色の針状物 (0.27 g, 59%)が得られた。融点116〜117℃。

【0122】
C27H36O3の分析計算値: C, 79.37; H, 8.88; 実測値: C, 79.23; H, 8.95。
【0123】
実施例5(11)
({4-[(4-フルオロフェニル)(3,3,5,5-テトラメチルシクロヘキシリデン)メチル]フェニル}オキシ)酢酸 (11)
【化15】

【0124】
工程1 : 4-[(4-フルオロフェニル)(3,3,5,5-テトラメチルシクロヘキシリデン)メチル]フェノール (9)
1について記載したカップリング方法(実施例1 , 工程1)を用いた。(4-フルオロフェニル)(4-ヒドロキシフェニル)メタノン(4.32 g, 20 mmol), 3,3,5,5-テトラメチルシクロヘキサノン(9.26 g, 60 mmol), Zn (13 g, 200 mmol), TiCl4 (10.9 mL, 100 mmol), およびTHF (400 mL)の混合物を2.5時間にわたり還流した。標準的後処理およびそれに続く精製により、5.450 g (80%)の表題の生成物9を白色の固形物として得た。

【0125】
工程2:エチル({4-[(4-フルオロフェニル)(3,3,5,5-テトラメチルシクロヘキシリデン)メチル]フェニル}オキシ)アセテート (10)
4-[(4-フルオロフェニル)(3,3,5,5-テトラメチルシクロヘキシリデン)メチル]フェノール9 (0.339 g, 1.0 mmol), K2CO3 (0.276 g, 2.0 mmol), およびアセトン(40 mL) の撹拌懸濁物に、エチルブロモアセテート(0.221 mL, 2.5 mmol)を窒素雰囲気下で室温にて加えた。この反応混合物を6時間にわたり還流し、室温に冷却し、濾過した。濾液を減圧下で濃縮し、その後、粗生成物を、シリカゲル上でヘキサンおよびEtOAcを用いたフラッシュクロマトグラフィーにより精製して、0.340 g (80%)の化合物10 を白色の泡状物として得た。

【0126】
工程3: ({4-[(4-フルオロフェニル)(3,3,5,5-テトラメチルシクロヘキシリデン)メチル]フェニル}オキシ)酢酸 (11)
THF/EtOH (1:1, 8 mL)中のエチル({4-[(4-フルオロフェニル)(3,3,5,5-テトラメチルシクロヘキシリデン)メチル]フェニル}オキシ)アセテート(10) (0.290 g, 0.68 mmol)の溶液を、1N NaOH (4 mL)で70℃にて1時間にわたり処理した。この反応混合物を、20% HCl水溶液で酸性にし、その後EtOAcで抽出した。有機層を塩水で洗浄し、乾燥させ(Na2SO4)、その後、減圧下で濃縮して、粗生成物を得た。生成物を、クロロホルムとメタノールを溶離液として用いたフラッシュカラムクロマトグラフィーにより精製し、0.250 g (95%)の表題の化合物11を白色の固形物として得た。

【0127】
実施例6 (13)
4-({4-[(4-フルオロフェニル)(3,3,5,5-テトラメチルシクロヘキシリデン)メチル]フェニル}オキシ)ブタン酸 (13)
【化16】

【0128】
工程1 :エチル4-({4-[(4-フルオロフェニル)(3,3,5,5-テトラメチルシクロヘキシリデン)メチル]フェニル}オキシ)ブタノエート (12)
10 について記載したo-アルキル化方法(実施例5, 工程2)を使用した。4-[(4-フルオロフェニル)(3,3,5,5 テトラメチルシクロヘキシリデン)メチル]フェノール9 (0.590 g, 1.74 mmol), K2CO3 (0.482 g, 3.5 mmol), およびアセトン(50 mL)の撹拌懸濁物に、エチル4-ブロモブチレート (0.62 mL, 4.4 mmol)を窒素雰囲気下で室温にて加えた。この反応混合物を6時間にわたり還流し、室温に冷却し、その後濾過した。標準的な後処理およびその後の精製により0.712 g (90%)の化合物12を白色の泡状物として得た。

【0129】
工程2: 4-({4-[(4-フルオロフェニル)(3,3,5,5-テトラメチルシクロヘキシリデン)メチル]フェニル}オキシ)ブタン酸 (13)
11 について記載した加水分解方法(実施例5, 工程3)を用いた。THF/EtOH (1:1, 10 mL)中のエチル4-({4-[(4-フルオロフェニル)(3,3,5,5-テトラメチルシクロヘキシリデン)メチル]フェニル}オキシ)ブタノエート) (12) (0.665 g, 1.47 mmol)の溶液を、1N NaOH (5 mL, 過剰量)で70 ℃にて1時間にわたり処理した。この反応混合物を冷却し、その後、20% HCl水溶液(40 mL)に注ぎ込んだ。標準的な後処理およびその後の精製により0.525 g (84%)の表題の化合物13を白色の泡状物として得た。

【0130】
C27H33FO3の分析計算値 C, 76.39, H, 7.83, F, 4.47; 実測値: C, 76.30, H, 7.90, F, 4.52。
【0131】
実施例7 (14)
({4-[(4-フルオロフェニル)(3,3,5,5-テトラメチルシクロヘキシリデン)メチル]フェニル}オキシ)アセトニトリル (14)
【化17】

【0132】
10 について記載したo-アルキル化方法(実施例5, 工程2)を用いた。4-[(4-フルオロフェニル)(3,3,5,5-テトラメチルシクロヘキシリデン)メチル]フェノール9 (0.508 g, 1.5 mmol), K2CO3 (0.414 g, 3.0 mmol), およびアセトン(50 mL)の撹拌懸濁物に、N2 下で室温にて、ブロモアセトニトリル (0.21 mL, 3.0 mmol)を加えた。この反応混合物を4時間にわたり還流し、室温に冷却し、次いで、濾過した。標準的な後処理およびその後の精製により0.410g (72%)の表題化合物14を白色の泡状物として得た。融点100〜101℃。

【0133】
C25H28FNOの分析計算値, C, 79.54, H, 7.48, N, 3.71; 実測値: C, 79.21 , H, 7.46, N, 3.73。
【0134】
実施例8 (15)
2-({4-[(4-フルオロフェニル)(3,3,5,5-テトラメチルシクロヘキシリデン)メチル]フェニル}オキシ)エタノール (15)
【化18】

【0135】
無水THF (25 mL)中のエチル({4-[(4-フルオロフェニル)(3,3,5,5-テトラメチルシクロヘキシリデン)メチル]フェニル}オキシ)アセテート10 (0.580 g, 1.336 mmol)の溶液に、LiAlH4 (3.4 mL, 3.42 mmol, THF 中の1.0 M溶液)をN2 雰囲気下で室温にて滴下した。得られた溶液を室温にて0.5時間にわたり撹拌した。この反応混合物をEtOAc (10 mL)でクエンチし、その後、撹拌をさらに10分継続した。反応混合物を15% HCl水溶液(50 mL)に注ぎ込み、その後EtOAc (4×30 mL)で抽出した。一緒にした有機層を塩水(1×30 mL)で洗浄し、乾燥させ(Na2SO4)、その後減圧下で濃縮して粗生成物を得た。生成物を、溶離液としてヘキサン: EtOAc (19: 1から4: 1へ)を用いたシリカゲルカラムクロマトグラフィーにより精製し、0.41 g (79%)の表題の化合物(15)を白色の泡状物として得た。

【0136】
実施例9 (18)
(2E)-3-{4-[フェニル(3,3,5,5-テトラメチルシクロヘキシリデン)メチル]フェニル}-2-プロペン酸 (18)
【化19】

【0137】
工程1: 1-ブロモ-4-[フェニル(3,3,5,5-テトラメチルシクロヘキシリデン)メチル]ベンゼン (16)
N2 下における、Zn粉末(3.76 g, 57.5 mmol), 3,3,5,5-テトラメチルシクロヘキサノン(2.95 g, 19.2 mmol), 4-ブロモベンゾフェノン(5.00 g, 19.15 mmol)および無水THF (100 mL)の撹拌懸濁物を−10℃に冷却し、その後、トルエン (30 mL)中のTiCl4の1M溶液を10分にわたり滴下した。添加中、温度を0℃未満に維持した。添加が完了したら反応物を室温へと加温させ、その後90℃にて2時間にわたり加熱した。反応物を−10℃に冷却し、濃塩酸(15 mL)を滴下しその後、水(15 mL)を滴下した。30分の撹拌後に、EtOAc (100 mL)を加え、その後、淡黄色の2相混合物を水(2×75 mL)および塩水(1×75 mL)で洗浄し、次いで乾燥させ(MgSO4)、その後、濃縮して8.26 gの淡黄色油状物とした。粗製の油状物を、250 gシリカゲル上で2% EtOAc/ヘキサンを用いたカラムクロマトグラフィーにより精製し、4.17 g (58%)の表題化合物(16)を白色の固形物として得た。1H-NMRは、生成物(16)が、マクマリー反応中に形成されるピナコール中間体と一致する約8%の不純物で汚染されていることを示した。

【0138】
工程2:エチル(2E)-3-{4-[フェニル(3,3,5,5-テトラメチルシクロヘキシリデン)メチル]フェニル}-2-プロペノエート (17)
DMF (25 mL, 無水, Aldrich)中の16、Et3N、エチルアクリレートおよびジクロロビス(トリフェニルホスフィン)パラジウム(II)の黄色い溶液を、一晩、N2 下で110℃にて撹拌した。16時間後に反応を室温へと冷却し、濾過し、次いで濾液をエーテル(100 mL)と水(100 mL)で希釈した。エーテル層を水(2×75 mL)と塩水(1×74 mL)ですすぎ、その後乾燥させ (MgSO4)、次いで濃縮して5.75 gの黄色固形物とした。この粗生成物を、最初に、250 gシリカゲル上で2% EtOAc/ヘキサンを用いたカラムクロマトグラフィーにより精製して6.22 gの不純な白色の固形物を得た。ヘキサン (約100 mL)からの結晶化により2.39 g (55%)の表題化合物17を結晶質の白色の固形物として得た。

【0139】
工程3: (2E)-3-{4-[フェニル(3,3,5,5-テトラメチルシクロヘキシリデン)メチル]フェニル}-2-プロペン酸 (18)
17、THF (35 mL)および無水EtOH (35 mL)の混合物に1N NaOH水溶液 (46 mL)を加え、加熱還流した。90分後に反応を室温に冷却した。反応を1N HCl水溶液 (55 mL)およびEtOAc (100 mL)で希釈した。有機画分を、水(2×75 mL)および塩水(1000 mL)で洗浄し、その後乾燥させ(MgSO4)、次いで濃縮し白色の固形物とした。この固形物を、ヘキサン(25 mL)で摩砕し、その後、CH3CN (100 mL)から再結晶化させて、1.87 g (84%)の表題化合物18 を白色の固形物として得た。

【0140】
実施例10 (21)
4-[フェニル(3,3,5,5-テトラメチルシクロヘキシリデン)メチル]安息香酸 (21)
【化20】

【0141】
工程1 :メチル4-(フェニルカルボニル)ベンゾエート (19)
MeOH, 4-ベンゾイル安息香酸およびチオニルクロリドの撹拌溶液を7時間にわたり窒素雰囲気下で還流した。反応を室温に冷却し、白色の固形物が沈殿した。この混合物を一晩冷凍し、その後濾過し、氷冷MeOHですすぎ、次いで空気乾燥させて6.10 g(64%)の表題化合物19 を白色の固形物として得た。

【0142】
工程2:メチル4-[フェニル(3,3,5,5-テトラメチルシクロヘキシリデン)メチル]ベンゾエート (20)
N2にて、Zn粉末(2.45 g, 37.5 mmol), 3,3,5,5-テトラメチルシクロヘキサノン(1.93 g, 12.5 mmol), 19 (3.00 g, 12.5 mmol)およびTHF (100 mL)の撹拌懸濁物を、−10℃に冷却し、トルエン (19.5 mL)中のTiCl4 1M溶液を10分にわたり滴下した。添加の完了後に、反応液を室温まで加温させ、その後90℃にて7時間にわたり加熱した。反応液を室温まで冷却し、その後−10℃に冷却し、次いで濃塩酸 (15 mL)を滴下し、その後水(15 mL)を滴下した。暗反応は薄紫になった。EtOAc (60 mL)を加え、その後、混合物を水(2×60 mL)および塩水(1×60 mL)で洗浄し、次いで乾燥させ(MgSO4)、その後5.1 gの淡黄色油状物へと濃縮した。この粗生成物を、200 gシリカゲル上で100%ヘキサンから2% EtOAc/ヘキサンへの濃度勾配を用いたカラムクロマトグラフィーにより精製して、2.84 gの白色の固形物を得、これをヘキサンから再結晶化させた。収量: 0.95 g (21%)の表題の化合物20 、これは約5%のピナコール中間体で汚染されていた。

【0143】
C25H30O2の分析計算値: C, 82.80; H, 8.36; 実測値: C, 82.94; H, 8.51。
【0144】
工程3: 4-[フェニル(3,3,5,5-テトラメチルシクロヘキシリデン)メチル]安息香酸 (21)
20, THF(15 mL), EtOH(15 mL)の混合物に1N NaOH水溶液 (20 mL)を加え、加熱還流する。4時間後に反応を室温へと冷却させ、次いで1N HCl水溶液(30 mL)およびEtOAc (50 mL)で希釈した。有機画分を水(2×40 mL)および塩水(40 mL)で洗浄し、次いで乾燥させた (Na2SO4)。濃縮後に、固形物をヘキサン(25 mL)で摩砕し、濾過し、次いで空気乾燥させて、770 mg (86%)の表題化合物21 を白色の固形物として得た。

【0145】
C24H28O2の分析計算値: C, 82.69; H, 8.12; 実測値: C, 82.48; H, 8.14。
【0146】
実施例11 (22)
3,5-ジメチル-4-{4-[フェニル(3,3,5,5-テトラメチルシクロヘキシリデン)メチル]フェニル}イソオキサゾール (22)
【化21】

【0147】
16 (192 mg, 0.5 mmol), Pd(Ph3P)4 (58 mg, 0.05 mmol), (3,5-ジメチル-4-イソオキサゾリル)ボロン酸 (141 mg, 1.0 mmol), 2NのNa2CO3水溶液(0.5 mL, 1 mmol), およびTHF (5 mL)を丸底フラスコに加えた。この反応混合物を18時間にわたり還流した。この混合物を室温に冷却し、次いでEtOAc (100 mL)で希釈し、その後この混合物をH2O (1×25 mL),塩水(1×25 mL)で洗浄し、Na2SO4で乾燥させ、濾過し、その後、減圧下で濃縮して、粗生成物を得、これをフラッシュカラムクロマトグラフィーにより精製して、136 mg (68%)の表題の生成物22 を白色の固形物として得た。
【0148】

【0149】
実施例12(23)
1-メチル-4-{4-[フェニル(3,3,5,5-テトラメチルシクロヘキシリデン)メチル]フェニル}-1H-ピラゾール (23)
【化22】

【0150】
22 について記載した方法(実施例11 )を、16 (192 mg, 0.5 mmol), Pd(Ph3P)4 (58 mg, 0.05 mmol), 1-メチル-4-(4,4,5,5-テトラメチル-1,3,2-ジオキサボロラン-2-イル)-1H-ピラゾール(208 mg, 1.0 mmol), 2N Na2CO3 水溶液(0.5 mL, 1.0 mmol), およびTHF (3 mL)を用いて行った。この反応混合物を12時間にわたり還流した。水性の後処理およびそれに続くフラッシュカラムクロマトグラフィーにより170 mg (88%)の表題の生成物23 を灰色がかった白色の固形物として得た。

【0151】
実施例13 (24)
2-{[2-({4-[(4-フルオロフェニル)(3,3,5,5-テトラメチルシクロヘキシリデン)メチル]フェニル}オキシ)エチル]オキシ}エタノール (24)
【化23】

【0152】
10 について記載したO-アルキル化方法(実施例5, 工程2)を、9 (339 mg, 1 mmol), K2CO3 (414 mg, 3 mmol), 2-[(2-クロロエチル)オキシ]エタノール (0.63 mL, 6 mmol), およびアセトン(30 mL)を用いて行った。反応混合物を60時間にわたり還流した。反応混合物を濾過し、濃縮し、その後、カラムクロマトグラフィーにより精製して、190 mg (45%)の表題の生成物24 を白色の固形物として得た。

【0153】
実施例14(27)
(2E)-3-{4-[(4-フルオロフェニル)(3,3,5,5-テトラメチルシクロヘキシリデン)メチル]フェニル}-2-プロペン酸 (27)
【化24】

【0154】
工程1 : 4-[(4-フルオロフェニル)(3,3,5,5-テトラメチルシクロヘキシリデン)メチル]フェニルトリフルオロメタンスルホネート (25)
9 (1.0 g, 2.95 mmol)とCH2Cl2 (50 mL)の混合物に、5℃にてN2下で Et3N (1.22 mL, 8.86 mmol), DMAP (36 mg, 0.30 mmol)を加え、その後、トリフルオロメタンスルホン酸無水物 (0.99 mL, 5.91 mmol)を加えた。この反応混合物を室温にて2時間にわたり撹拌し、その後、CH2Cl2 (100 mL)で希釈し、次いでこの混合物をH2O (1×30 mL)、塩水(1×30 mL)で洗浄し、Na2SO4を用いて乾燥させ、濾過し、その後、濾液を濃縮して粗生成物を得た。生成物をカラムクロマトグラフィーにより精製して1.06 g (76%)の表題の生成物25 を白色の固形物として得た。

【0155】
工程2: 1,1-ジメチルエチル(2E)-3-{4-[(4-フルオロフェニル)(3,3,5,5-テトラメチルシクロヘキシリデン)メチル]フェニル}-2-プロペノエート (26)
17 について記載したヘックカップリング方法(実施例9, 工程2)に従い、トリフレート25 (840 mg, 1.79 mmol), PdCl2(PPh3)2 (125 mg, 0.18 mmol), Et3N (990 uL, 7.16 mmol)、1,1-ジメチルエチル2-プロペノエート(1.62 mL, 17.9 mmol)およびDMF (5 mL)の混合物を、110℃にて24時間にわたり撹拌した。この反応混合物を室温に冷却しEtOAc (150 mL)で希釈した。この混合物をH2O (2×40 mL)、塩水(1×50 mL)で洗浄し、乾燥させ、その後、減圧下で濃縮して粗生成物を得た。粗製物質を、SiO2 フラッシュカラムクロマトグラフィーにより精製して、生成物と出発物質の2:1 混合物 (TLC)を得、このとき生成物26が優勢であった。この混合物を、さらなる特徴付けをすることなく、次の工程に用いた。
【0156】
工程3:(2E)-3-{4-[(4-フルオロフェニル)(3,3,5,5-テトラメチルシクロヘキシリデン)メチル]フェニル}-2-プロペン酸 (27)
26 (約700 mg, 上より得られた混合物)およびCH2Cl2 (8 mL)の混合物を、室温にてCF3CO2H (2 mL)で処理した。この反応混合物を室温にてN2 下で1.5時間にわたり撹拌し、その後、減圧下で濃縮して粗生成物を得た。粗製物質をカラムクロマトグラフィーにより精製して165 mgの所望の生成物27 を白色の固形物として得た。出発トリフレート25の一部(350 mg)も回収した。27:についてのデータ:

【0157】
実施例15 (28)
4-{4-[(4-フルオロフェニル)(3,3,5,5-テトラメチルシクロヘキシリデン)メチル]フェニル}-3,5-ジメチルイソオキサゾール (28)
【化25】

【0158】
21 について記載した鈴木法を、トリフレート25 (200 mg, 0.425 mmol), Pd(Ph3P)4 (49 mg, 0.0425 mmol), 2NのNa2CO3水溶液(425 uL, 0.85 mmol), (3,5-ジメチル-4-イソオキサゾリル)ボロン酸(150mg, 1.06 mmol)およびTHF(25 mL)を用いて行った。この反応混合物を24時間にわたり還流し、その後室温に冷却した。標準的な後処理およびその後のカラムクロマトグラフィーにより132 mg (74 %)の表題の生成物28 を灰色がかった白色の固形物として得た。

【0159】
実施例16 (29)
3-{4-[(4-フルオロフェニル)(3,3,5,5-テトラメチルシクロヘキシリデン)メチル]フェニル}フラン (29)
【化26】

【0160】
28 について記載した方法を、トリフレート25(150 mg, 0.319 mmol), PdCl2(Ph3P)2 (23mg, 0.032 mmol), 2NのNa2CO3水溶液(320 uL, 0.638 mmol), 3-フラニルボロン酸(71 mg, 0.638 mmol), およびTHF (10 mL)を用いて行った。この反応混合物を15時間にわたり還流した。標準的な後処理およびその後の精製により50 mg (40 %)の表題の生成物29 (40%)を灰色がかった白色の固形物として得た。

【0161】
実施例17(30)
2-{4-[(4-フルオロフェニル)(3,3,5,5-テトラメチルシクロヘキシリデン)メチル]フェニル}フラン (30)
【化27】

【0162】
28 について記載した鈴木法を、トリフレート25 (150 mg, 0.319 mmol), PdCl2(Ph3P)2 (23 mg, 0.032 mmol), 2NのNa2CO3水溶液(1.6 mL, 3.2 mmol), 2-フラニルボロン酸 (179 mg, 1.6 mmol), およびTHF (2 mL)を用いて行った。この混合物を、マイクロ波条件で120℃にて15分にわたり加熱した。標準的な後処理およびその後の精製により100 mg (81 %)の表題の生成物30 を灰色がかった白色の固形物として得た。
【0163】

【0164】
実施例18 (31)
4-{4-[(4-フルオロフェニル)(3,3,5,5-テトラメチルシクロヘキシリデン)メチル]フェニル}-1-メチル-1H-ピラゾール(31)
【化28】

【0165】
28 について記載した鈴木法を、トリフレート25 (150 mg, 0.32 mmol), PdCl2(Ph3P)2 (23 mg, 0.032 mmol), 2NのNa2CO3水溶液(320 uL, 3.2 mmol), 1-メチル-4-(4,4,5,5-テトラメチル-1,3,2-ジオキサボロラン-2-イル)-1H-ピラゾール(334 mg, 1.6 mmol), およびDME (2 mL)を用いて行った。この混合物を120℃にて5分にわたりマイクロ波中で加熱した。水性の後処理およびそれに続く精製により116 mg (90%)の表題の生成物31 を白色の固形物として得た。

【0166】
実施例19(34)
({4-[フェニル(3,3,5,5-テトラメチルシクロヘキシリデン)メチル]フェニル}オキシ)酢酸 (34)
【化29】

【0167】
工程1: 4-[フェニル(3,3,5,5-テトラメチルシクロヘキシリデン)メチル]フェノール (32)
9 について記載したマクマリー方法(実施例5, 工程1)を、(4-ヒドロキシフェニル)(フェニル)メタノン(2.97 g, 14.9 mmol)、3,3,5,5-テトラメチルシクロヘキサノン(6.25 g, 44.9 mmol), Zn (9.69 g, 149 mmol), TiCl4・2THF錯体(25 g , 7.5 mmol), およびTHF (200 mL)を用いて行った。標準的な後処理およびその後の精製により4.50g (91%)の表題の生成物32 を白色の固形物として得た。

【0168】
工程2: エチル({4-[フェニル(3,3,5,5-テトラメチルシクロヘキシリデン)メチル]フェニル}オキシ)アセテート (33)
10 について記載したO-アルキル化方法(実施例5, 工程2)に従い、丸底フラスコに化合物32 (321mg, 1 mmol), K2CO3 (415 mg, 3 mmol), エチルブロモアセテート (221 uL, 2 mmol), およびアセトン(25 mL)を加えた。この反応混合物を5時間にわたり還流し、濾過し、濃縮した。粗生成物の精製により402 mg (99%)の表題の生成物33を得た。

【0169】
工程3: ({4-[フェニル(3,3,5,5-テトラメチルシクロヘキシリデン)メチル]フェニル}オキシ)酢酸 (34)
11について記載された鹸化法(実施例5, 工程3)を、化合物33 (310 mg, 0.76 mmol), 1N NaOH (5 mL), THF (10 mL)およびEtOH (10 mL)を用いて、70℃にて1時間にわたり行った。酸性の後処理およびそれに続く精製により268mg(93%)の表題の生成物34 を白色の固形物として得た。

【0170】
実施例20 (35)
2-({4-[フェニル(3,3,5,5-テトラメチルシクロヘキシリデン)メチル]フェニル}オキシ)アセトアミド (35)
【化30】

【0171】
34 (100 mg, 0.26 mmol)およびCH2Cl2 (mL)の溶液に、オキサリルクロリド(90 uL, 1.06 mmol)を加え、その後、この混合物を室温にて2時間にわたり撹拌した。この溶液に、10 mLのNH4OH (30%水溶液)を徐々に加え、6時間にわたり撹拌した。この混合物をH2O (100 mL)に注ぎ込み、その後EtOAc (2 ×100 mL)を用いて抽出した。有機層を後処理して粗生成物を得、これを精製して11mg(11%)の所望の生成物35 を白色の固形物として得た。

【0172】
実施例21 (37)
4-({4-[フェニル(3,3,5,5-テトラメチルシクロヘキシリデン)メチル]フェニル}オキシ)-1-ブタノール (37)
【化31】

【0173】
工程1 :エチル4-({4-[フェニル(3,3,5,5-テトラメチルシクロヘキシリデン)メチル]フェニル}オキシ)ブタノエート (36)
9 について記載されたO-アルキル化方法(実施例5, 工程2)を、32 (800 mg, 2.50 mmol), K2CO3 (1.04 g, 7.49 mmol)、エチル4-クロロブタノエート (715 uL, 5mmol), およびアセトン(30 mL)を用いて行った。この混合物を15時間にわたり還流し、その後、室温に冷却した。この混合物を濾過し、濃縮し、次いで精製して約1.05 g (純度80%)の表題の生成物 36を得た。この材料を、精製することなくそのまま使用した。
【0174】
工程2: 4-({4-[フェニル(3,3,5,5-テトラメチルシクロヘキシリデン)メチル]フェニル}オキシ)-1-ブタノール (37)
15 について記載されたLAH還元法(実施例5)を、THF (30 mL)中の36 (200 mg, 0.46 mmol), LAH (THF 中の1M溶液、1.4 mL, 1.38 mmol)を用いて行った。この反応物を0.5時間にわたり撹拌した。標準的な水性の後処理およびそれに続く精製により、126 mg (70%)の表題の生成物37を白色の固形物として得た。

【0175】
実施例22 (38)
4-({4-[フェニル(3,3,5,5-テトラメチルシクロヘキシリデン)メチル]フェニル}オキシ)ブタン酸 (38)
【化32】

【0176】
11について記載された鹸化法(実施例5, 工程3)に従い、化合物36 (250 mg (80%純度), 0.460 mmol)を、THF/EtOH (1:1, 10 mL)中のNaOH (1N, 4mL)で、70℃にて1時間にわたり処理した。酸性の後処理およびそれに続く精製により、186 mg (出発物質の純度に基づき100%)の表題の生成物38 を白色の固形物として得た。

【0177】
実施例23 (43)
({2-メチル-5-[フェニル(3,3,5,5-テトラメチルシクロヘキシリデン)メチル]フェニル}オキシ)酢酸 (43)
【化33】

【0178】
工程1 : [4-メチル-3-(メチルオキシ)フェニル](フェニル)メタノン (39)
N,3-ジメチル-N,4-ビス(メチルオキシ)ベンズアミド(ワインレブアミドの形成のための標準的な文献方法に従い対応する安息香酸から調製、6.2 g, 29.6 mmol)を、窒素下にて無水THF (110 mL)に溶解させ、この溶液を0℃に冷却した。次いでエーテル中の3M フェニルマグネシウムブロミドの溶液(15.0 mL, 44.4 mmol)を滴下し、このとき内部温度を0℃〜5℃に維持した。得られた混合物を3時間にわたり0℃〜5℃にて撹拌し、その後5% HCl水溶液(150 mL)を用いてクエンチし、次いで酢酸エチル(3×100 mL)を用いて抽出した。一緒にした有機抽出物を乾燥させ(MgSO4)、濾過し、次いで真空で濃縮して、9.2 gのクルード39 を得、これをさらなる精製を行うことなく使用した。
【0179】

【0180】
工程2: (3-ヒドロキシ-4-メチルフェニル)(フェニル)メタノン (40)
200 mLの丸底フラスコ中で、化合物39 (5 g, 22.1 mmol)をAlCl3 (9g, 66.3 mmol)および無水トルエン(50 mL)と一緒にした。撹拌混合物を窒素下で1時間にわたり還流し、その後、周囲温度まで冷却し、次いで1N HCl水溶液 (50 mL)を用いてクエンチした。酢酸エチル(3×100 mL)を用いて反応物を抽出した。一緒にした有機抽出物を乾燥させ(MgSO4)、濾過し、次いで溶媒を真空で除いた。得られた残留物を10% EtOAc/ヘキサンで処理し、このとき溶媒から固形物が沈殿した。この固形物を濾過し、真空で4時間にわたり乾燥させ、3.1 g (70%)の化合物40 を灰色の固形物として得た。

【0181】
工程3: 2-エチル-5-[フェニル(3,3,5,5-テトラメチルシクロヘキシリデン)メチル]フェノール (41)
N2下でのZn粉末(2.0 g, 36.0 mmol)およびTHF (50 mL)の撹拌懸濁物に、TiCl4 (6.0 g, 18.0 mmol)を加えた。得られた黄色い懸濁物を1時間にわたり還流した。この還流反応に、THF (50 mL)中の3,3,5,5-テトラメチルシクロヘキサノン(1.6 g, 10.7 mmol)および化合物40 (1.00 g, 3.6 mmol)の溶液を15分にわたり滴下した。2時間後に反応を室温に冷却し、次いで150 mL 50% HCl水溶液に注ぎ込み、その後、30分撹拌した。次いでこの混合物をEtOAc (150 mL)で希釈し、相を分離させた。水相を2×100 mL EtOAcで洗浄し、一緒にした有機相を塩水(150 mL)で洗浄した。次いで有機物をMgSO4で乾燥させ、濾過し、次いで溶媒を真空で除いた。この粗製物質を、シリカゲル(150 g)上で20% EtOAcを用いたカラムクロマトグラフィーにより精製して、3%の3,3,5,5-テトラメチルシクロヘキサノンで汚染された所望の生成物を得た。所望の生成物をヘキサンから再結晶化させて、1.8 g(48%)の41 を無色の固形物として得た。

【0182】
工程4:エチル({2-メチル-5-[フェニル(3,3,5,5-テトラメチルシクロヘキシリデン)メチル]フェニル}オキシ)アセテート (42)
ブロモエチルアセテート(187 mg, 1.12 mmol)、化合物41 (150 mg, 0.449 mmol)、およびK2CO3 (185 mg, 1.34 mmol)を、密閉したマイクロ波容器内で乾燥アセトン(5 mL)と一緒にした。この混合物を100℃にて20分にわたり、Personal Chemistry Emrys Optimizerマイクロ波照射器内で加熱した。反応を室温まで冷却し、固形物を濾過した。固形物をアセトンで2回すすぎ、次いで溶媒を真空で除き187 mg (99%)の化合物42を得た。この粗製物質をさらに精製することなく使用した。

【0183】
工程5: ({2-メチル-5-[フェニル(3,3,5,5-テトラメチルシクロヘキシリデン)メチル]フェニル}オキシ)酢酸 (43)
化合物42 (50 mg, 0.12 mmol)、NaOH(50 mg, 1.25 mmol)、エタノール(5 mL)および水(500 uL)を、密閉されたマイクロ波容器内で一緒にした。この混合物を100℃にて10分にわたりPersonal Chemistry Emrys Optimizerマイクロ波照射器で加熱した。次いで反応を1N HCl (5 mL)で酸性化し、EtOAc (3×10 mL)で抽出した。一緒にした有機抽出物をMgSO4で乾燥させ、濾過し、溶媒を真空で除き、46mg(98%)の43を紫色の固形物として得た。

【0184】
実施例24 (44)
2-({2-メチル-5-[フェニル(3,3,5,5-テトラメチルシクロヘキシリデン)メチル]フェニル}オキシ)エタノール (44)
【化34】

【0185】
化合物42(93 mg, 0.22 mmol)をTHF (5 mL)に溶解させ、次いで窒素下で0℃に冷却した。DIBAL-H (ヘキサン中で1M, 370μL, 0.55 mmol)を数分にわたり滴下した。氷浴を取り外し撹拌反応を周囲温度まで加温させた。この反応を0℃に再度冷却し、数分にわたり水(10 mL)を滴下した。氷浴を取り外し、固形物が形成し始めるまで反応を撹拌した。固形物を濾過し、濾液をジクロロメタンで数回洗浄して、確実にアルミネート固形物からすべての生成物が除かれるようにした。濾液を真空で濃縮して、82mg(98%)の化合物44 を白色の固形物として得た。

【0186】
実施例25 (45)
({2-メチル-5-[フェニル(3,3,5,5-テトラメチルシクロヘキシリデン)メチル]フェニル}オキシ)アセトニトリル (45)
【化35】

【0187】
ブロモアセトニトリル (134 mg, 1.12 mmol)、化合物41 (150 mg, 0.449 mmol)、およびK2CO3 (185 mg, 1.34 mmol)を、密閉されたマイクロ波容器内で乾燥アセトン(5 mL)と一緒にした。この混合物を、100℃にて20分にわたりPersonal Chemistry Emrys Optimizerマイクロ波照射器内で加熱した。反応を室温まで冷却させ、固形物を濾過した。固形物をアセトンで2回すすぎ、溶媒を真空で除いた。粗製の混合物を、溶離液としてジクロロメタンを使用するフラッシュカラムクロマトグラフィーを用いて精製し、60mg(36%)の45 を無色の固形物(36%)として得た。

【0188】
実施例26 (47)
4-({2-メチル-5-[フェニル(3,3,5,5-テトラメチルシクロヘキシリデン)メチル]フェニル}オキシ)ブタン酸 (47)
【化36】

【0189】
工程1 :エチル3-({2-メチル-5-[フェニル(3,3,5,5-テトラメチルシクロヘキシリデン)メチル]フェニル}オキシ)プロパノエート (46)
エチル4-ブロモブタノエート (219 mg, 1.12 mmol)、化合物40 (150 mg, 0.449 mmol)、およびK2CO3 (185 mg, 1.34 mmol)を密閉されたマイクロ波容器内で乾燥アセトン(5 mL)と一緒にした。この混合物を、100℃にて20分にわたりPersonal Chemistry Emrys Optimizerマイクロ波照射器内で加熱した。反応を室温まで冷却させ、固形物を濾過した。固形物をアセトンで2回すすぎ、溶媒を真空で除いて、200mg(98%)の化合物46 を得、この粗製物質をさらなる精製を行うことなく使用した。

【0190】
工程2: 4-({2-メチル-5-[フェニル(3,3,5,5-テトラメチルシクロヘキシリデン)メチル]フェニル}オキシ)ブタン酸 (47)
化合物46 (53 mg, 0.12 mmol)、NaOH (50 mg, 1.25 mmol)、エタノール(5 mL)および水(500 uL)を密閉されたマイクロ波容器内で一緒にした。この混合物を、100℃にて10分にわたりPersonal Chemistry Emrys Optimizerマイクロ波照射器内で加熱した。次いで反応を1N HCl (5 mL)で酸性にし、その後EtOAc(3×10 mL)で抽出した。一緒にした有機抽出物をMgSO4で乾燥した。固形物を濾過し、溶媒を真空で除いて43mg(86%)の化合物47 を固形物として得た。

【0191】
実施例27 (48)
4-({2-メチル-5-[フェニル(3,3,5,5-テトラメチルシクロヘキシリデン)メチル]フェニル}オキシ)-1-ブタノール (48)
【化37】

【0192】
化合物47 (50 mg, 0.11 mmol)をTHF (5 mL)に溶解させ、窒素下で0℃に冷却した。DIBAL (ヘキサン中で1.5M, 500 ul, 0.33 mmol)を数分にわたり滴下した。氷浴を取り外し撹拌反応を周囲温度まで加温させた。次いで反応を再び0℃に冷却し、数分にわたり水(10 mL)を滴下した。次いで氷浴を取り外し、固形物が形成し始めるまで反応を撹拌した。固形物を濾過し、濾液をジクロロメタンで数回洗浄した。濾液を真空で濃縮して、42mg(98%)の化合物48 を清明な油状物として得た。

【0193】
実施例28 (49)
5-[({2-メチル-5-[フェニル(3,3,5,5-テトラメチルシクロヘキシリデン)メチル]フェニル}オキシ)メチル]-1H-テトラゾール (49)
【化38】

【0194】
化合物45 (50 mg, 0.13 mmol)、NaN3 (60 mg, 0.86 mmol)、およびNH4Cl(50 mg, 0.94 mmol)を密閉されたマイクロ波容器内中でDMF (5 mL)と一緒にした。この混合物を、100℃にて20分にわたりPersonal Chemistry Emrys Optimizerマイクロ波照射器内で加熱した。次いでこの混合物をさらに16時間にわたり油浴上で100℃で撹拌した。反応を室温まで冷却させ、次いで5 mLの1N HClで希釈した。HClの添加により白色の固形物が形成された。次いでEtOAcを加えて固形物を溶解させ、その後、粗製の反応物をEtOAcで3回抽出した (各回10 mL)。一緒にした有機抽出物をMgSO4で乾燥させた。固形物を濾過により除き、溶媒を真空で除いて51mg(98%)の所望の化合物49をピンク色の固形物として得た。

【0195】
実施例29 (50)
2-{[2-({2-メチル-5-[フェニル(3,3,5,5-テトラメチルシクロヘキシリデン)メチル]フェニル}オキシ)エチル]オキシ}エタノール (50)
【化39】

【0196】
2-(2-クロロエトキシ)エタノール(139 mg, 1.12 mmol), 化合物41 (150 mg, 0.45 mmol), およびK2CO3(185 mg, 1.34 mmol)を、密閉されたマイクロ波容器内で乾燥アセトン(5 mL)と一緒にした。この混合物を、100℃にて20分にわたりPersonal Chemistry Emrys Optimizerマイクロ波照射器内で加熱した。反応を室温まで冷却させ、次いで固形物を濾過により除いた。固形物を、アセトンで2回すすぎ、その後、真空で溶媒を除いた。Agilent準分取HPLC (LUNA C18カラム, 23 mL/分、30〜70% CH3CN−水(TFA))を用いて反応物を精製し、76mg(40%)の所望の化合物50 を白色の固形物として得た。

【0197】
予言的実施例
本明細書に提供した合成の記載を用いて、以下の化合物を同様に調製することができる。合成方法において若干の変更が必要となるかもしれないが、それはすべて当技術分野の通常の技術の範囲内にある。
【0198】
予言的実施例30
【化40】

【0199】
(2E)-3-{4-[(4-フルオロフェニル)(2,2,6,6-テトラメチルテトラヒドロ-4H-ピラン-4-イリデン)メチル]フェニル}-2-プロペン酸 (51)
【0200】
予言的実施例31
【化41】

【0201】
(2E)-3-{4-[フェニル(2,2,6,6-テトラメチルテトラヒドロ-4H-ピラン-4-イリデン)メチル]フェニル}-2-プロペン酸 (52)
【0202】
予言的実施例32
【化42】

【0203】
4-{4-[フェニル(2,2,6,6-テトラメチルテトラヒドロ-4H-ピラン-4-イリデン)メチル]フェニル}ブタン酸 (53)
【0204】
予言的実施例33
【化43】

【0205】
4-{4-[(4-フルオロフェニル)(2,2,6,6-テトラメチルテトラヒドロ-4H-ピラン-4-イリデン)メチル]フェニル}ブタン酸 (54)
【0206】
予言的実施例34
【化44】

【0207】
2-({4-[(4-フルオロフェニル)(2,2,6,6-テトラメチルテトラヒドロ-4H-ピラン-4-イリデン)メチル]フェニル}オキシ)エタノール (55)
【0208】
予言的実施例35
【化45】

【0209】
2-({4-[フェニル(2,2,6,6-テトラメチルテトラヒドロ-4H-ピラン-4-イリデン)メチル]フェニル}オキシ)エタノール (56)
【0210】
予言的実施例36
【化46】

【0211】
2-{[2-({4-[フェニル(2,2,6,6-テトラメチルテトラヒドロ-4H-ピラン-4-イリデン)メチル]フェニル}オキシ)エチル]オキシ}エタノール (57)
【0212】
予言的実施例37
【化47】

【0213】
2-{[2-({4-[(4-フルオロフェニル)(2,2,6,6-テトラメチルテトラヒドロ-4H-ピラン-4-イリデン)メチル]フェニル}オキシ)エチル]オキシ}エタノール (58)
【0214】
予言的実施例38
【化48】

【0215】
4-[(4-フルオロフェニル)(2,2,6,6-テトラメチルテトラヒドロ-4H-ピラン-4-イリデン)メチル]安息香酸 (59)
【0216】
予言的実施例39
【化49】

【0217】
4-[フェニル(2,2,6,6-テトラメチルテトラヒドロ-4H-ピラン-4-イリデン)メチル]安息香酸 (60)
【0218】
予言的実施例40
【化50】

【0219】
4-[(4-フルオロフェニル)(3,3,5,5-テトラメチルシクロヘキシリデン)メチル]安息香酸 (61)
【0220】
生物学的データ
ERアルファ蛍光偏光アッセイ法
アッセイは予言的なものではない実施例化合物(上に実施例において示したもの)に対して、全長型およびリガンド結合ドメインタンパク質の両方を用いて行った。
【0221】
全長型ERアルファ−このアッセイは市販のキット(P3029, Invitrogen, Carlsbad, California)を用いて行った。アッセイは、製造者のプロトコルを若干変更して行った。すなわち、15 nM ERαおよび1nM Fluormone ELレッドを、完全ERレッドバッファーに溶解させ混合した。混合物10μlを、ジメチルスルホキシド(DMSO)中に10-5〜10-12Mの濃度範囲の化合物を有するGreiner低容量プレート−黒色で無地の低容量384ウェルプレート−(Greiner - 製品番号784076) の各ウェルに分配した。プレートを1分にわたり20Ogにて回転させ、試薬を光から保護するために覆い、その後室温にて2時間にわたりインキュベートした。プレートを、530〜25nm励起および580-10nm発光干渉フィルターおよび561 nm二色性ミラーを使用するAcquest, LJL Biosystems, Sunnyvale, CAを用いて読み取った。
【0222】
ERアルファ(リガンド結合ドメイン)−
6×His ERα LBD(297〜555)の配列

【0223】
ERα LBDの発現と精製
ヒトERαの残基297〜555に対応するcDNA配列を、N末端ヘキサ−ヒスチジンタグを有するpET24ベクター (Novagen, San Diego, CA)にクローニングした。このプラスミドを大腸菌BL21-DE3細胞に形質転換した。細胞を23℃にて18時間にわたり増殖させ、温度を18℃まで下げた後に250μM IPTGを添加した。細胞をさらに24時間増殖させその後、回収した。細胞を50 mM TRIS pH 8.0/250 mM NaCl/2 Mウレア中で溶解させ、遠心して落とした。上清をイミダゾール中50 mMで調製し、Ni-キレート形成セファロースカラム(Pharmicia)に加え、50〜500 mMイミダゾールの線形濃度勾配を用いて溶出させた。ERα LBDを含有する画分を一緒にし、50 mM TRIS pH 8.0/250 mM NaCl/5 mM DTTおよび10%グリセロールを用いて透析した。サンプルを小分けして−70℃にて凍結させた。アッセイは、15nM ERアルファLBDを、アッセイバッファー(Tris-HCl (5OmM; pH8), KCl (50OmM), ジチオトレイトール(1mM), エチレンジアミン四酢酸(1mM), グリセロール(10% v/v), 3コールアミドプロピル-ジメチルアンモニオ1-プロパンスルホネート −(2mM)、オルトバナジウム酸ナトリウム (1mM −これは蒸留水中に溶解させ、2回連続してpHを10に調整し沸騰および冷却を行うことにより10OmMストックとして調製した))中の1nM Fluormone-EL-レッド(Invitrogen No. P3030)と混合することにより行った。この混合物10μlを、ジメチルスルホキシド(DMSO)中に10-5〜10-12Mの濃度範囲の化合物を含有するGreiner低容量プレート−黒色の無地の低容量384ウェルプレート−(Greiner, Longwood, FL - 製品番号784076)の各ウェルに分配した。プレートを、1分にわたり20Ogにて回転させ、試薬を光から保護するために覆い、その後、室温で2時間にわたりインキュベートした。プレートを、530〜25nm励起および580-10nm発光干渉フィルターおよび561nm二色性ミラーを使用するAcquest装置を用いて読み取った。
【0224】
ERベータ蛍光偏光アッセイ法
アッセイは全長型およびリガンド結合ドメインタンパク質の両方を用いて行った。
【0225】
全長ERベータ − このアッセイは市販のキット(P3032, Invitrogen)を用いて行った。アッセイは、製造者のプロトコルに若干の変更を加えて行った。すなわち、30 nM ERβおよび1 nM Fluormone ELレッドを完全ERレッドバッファーに溶解させ混合した。この混合物10μl を、ジメチルスルホキシド(DMSO)中に10-5〜10-12Mの濃度範囲の化合物を有するGreiner低容量プレート−黒色の無地の低容量384ウェルプレート−(784076, Greiner)の各ウェルに分配した。プレートを、1分にわたり20Ogにて回転させ、試薬を光から保護するために覆い、その後、室温で2時間にわたりインキュベートした。プレートを、530〜25nm励起および580-10nm発光干渉フィルターおよび561nm二色性ミラーを用いたAcquest (Acquest/Biosystems)を使用して読み取った。
【0226】
ERベータ(リガンド結合ドメイン)−
6×His ERβ LBD(257-530)の配列

【0227】
ERβLBDの発現と精製
ヒトERβの残基257〜530に対応するcDNA配列を、N末端ヘキサ−ヒスチジンタグを有するpRSETa (Novagen)ベクターにクローニングした。このプラスミドを大腸菌BL21-DE3細胞に形質転換した。この細胞を23℃にて18時間にわたり増殖させ、温度を18℃に下げて250μMのIPTGを添加した。細胞をさらに24時間増殖させ、その後、回収した。細胞を50 mM TRIS pH 8.0/250 mM NaCl中で溶解させ、遠心して落とした。上清をイミダゾール中50 mMで調製し、その後、Niキレート形成セファロースカラム(Amersham Pharmacia Biotech, Piscataway, NJ.)に加え、50〜500 mMイミダゾールの線形濃度勾配で溶出させた。ERβLBDを含有する画分を一緒にし、50 mM NaClで希釈し、その後、50 mM TRIS pH 8.0/50 mM NaCl/5 mM DTTおよび10%グリセロールで平衡化したQ-セファロースカラム(Pharmacia)に加えた。ERβを、50 mM〜500mM NaClの線形濃度勾配を用いて溶出させた。ERβLBDを含有する画分を一緒にし、その後、50 mM TRIS pH 8.0/250 mM NaCl/5 mM DTTおよび10%グリセロールを用いて透析した。サンプルを小分けし、−70℃にて凍結させた。
【0228】
アッセイは、3OnM ERベータLBDを、アッセイバッファー(Tris-HCl (5OmM; pH8), KCl (50OmM), ジチオトレイトール (1mM) , エチレンジアミン四酢酸(1mM)、グリセロール(10% v/v), 3コールアミドプロピル-ジメチルアンモニオ1-プロパンスルホネート −(2mM), オルトバナジウム酸ナトリウム(1mM −これは、蒸留水中に溶解させ、2回連続してpHを10に調整し沸騰および冷却を行うことにより10OmMストックとして調製した))中の1nM Fluormone-EL-レッド(Invitrogen No. P3030)と混合することにより行った。この混合物10μlを、ジメチルスルホキシド (DMSO)中に10-5〜10-12Mの濃度範囲の化合物を有する黒色の無地の低容量384ウェルプレート−(784076, Greiner)の各ウェルに分配した。プレートを、1分にわたり20Ogにて遠心し、試薬を光から保護するために覆い、その後室温にて2時間にわたりインキュベートした。プレートを、530〜25nm励起および580-10nm発光干渉フィルターおよび561nm二色性ミラーを用いたAcquest装置を用いて読み取った。
【0229】
データ解析
全てのデータを、各プレート上の16の高および16の低対照ウェルの平均に対して正規化した。その後、以下の形の4パラメーター曲線フィットを適用した。
【数1】

【0230】
式中、aは最小値であり、bはHillの傾きであり、cはIC50であり、そしてdは最大値である。データは、n回の実験の平均の標準偏差を用いた、平均plC50 として提示する。
【0231】
上の予言的なものではない実施例の化合物は、6〜8.5の範囲のplC50値を示した。
【0232】
試験化合物は遊離形態または塩の形態で用いた。
【0233】
すべての研究は、実験動物取り扱いの指針(NIH publication No. 85-23, 1985改訂)および動物使用に関するGlaxoSmithKline指針に従った。
【0234】
本発明の特定の実施形態を本明細書に例証し詳細に説明したが、本発明はそれらに限定されるものではない。上記の詳細な説明は本発明の具体例として提供されたものであり、本発明のいかなる限定をも構成するものと解釈すべきではない。改変は当業者にとって明らかであり、本発明の趣旨から逸脱しないすべての変形(又は変更)は、特許請求の範囲に含まれることを意図する。
【技術分野】
【0001】
本発明は、様々な治療的使用を有する新規な化合物、より具体的には選択的エストロゲン受容体モジュレーションに特に有用である、新規な置換シクロアルキリデン化合物に関する。
【背景技術】
【0002】
エストロゲンは、生殖器系の発達及び維持に関係する細胞過程における周知の内分泌レギュレーターである。エストロゲンはまた、骨、肝臓、心臓血管系、および中枢神経系などの多くの非生殖器組織においても重要な作用を有することが明らかにされている。エストロゲンがどのようにその作用を発揮するかに関する最も広く受け入れられている仮説は、細胞内ステロイドホルモン受容体への結合である。受容体および結合されたリガンドが細胞の核に移行した後、該複合体がDNA中の認識部位に結合することにより、特定の遺伝子のモジュレーションが可能になる。このほか、エストロゲンが膜始動シグナリングカスケードを介してその作用を媒介する可能性があることが、現在、明らかになりつつあるが、この研究の大部分は、いまだ実験的なものである。Kousteni et al., Journal of Clinical Investigation, (2003), 111, 1651-1664(非特許文献1、そのような教示に関して、参照により本明細書に組み入れられるものとする)を参照されたい。
【0003】
ある種の物質はその生物学的活性を「組織選択的」方法で示しうると説明されている。言い換えれば、組織選択性により、特定の組織ではエストロゲンアゴニストとして機能しうるが、他の組織ではエストロゲンアンタゴニストとして作用しうる。「選択的エストロゲン受容体モジュレーター」(SERM)という用語は、これらの分子に与えられたものである。SERMの例としては、タモキシフェン、ラロキシフェン、ラソフォキシフェン、クロミフェン、およびナフォキシジンが挙げられる。この組織選択的活性の分子論的基礎は、完全には解明されていない。なんら特定の理論に限定するものではないが、エストロゲン受容体をさまざまなコンフォメーション状態にさせてコアクチベータータンパク質およびコリプレッサータンパク質、ならびに転写レギュレーションに関係する他の重要なタンパク質を動員するにあたり、特異な能力を示しうるリガンドの能力が関与していると考えられる。McDonnell, D. P., The Molecular Pharmacology of SERMs, Trends Endocrinol. Metab. 1999, 301-311(非特許文献2、そのような内容に関して、参照により本明細書に組み入れられるものとする)を参照されたい。
【0004】
歴史的にみると、エストロゲンは、エストロゲン受容体アルファ(ERα)と現在呼ばれる単一のエストロゲン受容体を介してその生物学的活性を示すと考えられていた。しかしながら、最近になって、エストロゲン受容体ベータ(ERβ)と呼ばれる第2のサブタイプのエストロゲン受容体が発見された。Kuiper et al., WO 97/09348(特許文献1)およびKuiper et al.,「ラットの前立腺および卵巣で発現される新規なエストロゲン受容体のクローニング(Cloning of a Novel Estrogen Receptor Expressed in Rat Prostate and Ovary)」, Proc. Natl. Acad. Sci. U.S.A., 1996, pp. 5925-5930(非特許文献3、いずれも、そのようなサブタイプに関して、参照により本明細書に組み入れられるものとする)を参照されたい。ERβは、ヒトにおいて発現される。Mosselman et al.,「ERβ:新規なヒトエストロゲン受容体の同定および特徴付け(ERβ: Identification and Characterization of a Novel Human Estrogen Receptor)」, FEBS Lett., 1996, pp. 49-53(非特許文献4、そのような発現に関して、参照により本明細書に組み入れられるものとする)を参照されたい。この第2のサブタイプのエストロゲン受容体の発見により、エストロゲンシグナリングの生物学的複雑さが著しく増大され、現在入手可能なSERMの組織選択的作用の一部に関与していると思われる。
【0005】
先に述べたように、エストロゲンは、多くの非生殖器組織において重要な作用を有する。したがって、エストロゲンモジュレーションは、骨、肝臓、および中枢神経系を含むそのような組織に関連する疾患および障害の治療または予防に有用であると考えられる。たとえば、骨粗鬆症は、単位体積あたりの骨量の正味の損失により特徴付けられる。そのような骨量損失が起こると、身体の適切な構造上の支持を提供する骨格が衰弱するので、骨折を起こす危険性が増大する。最も多く見受けられるタイプの骨粗鬆症の1つは、女性における月経停止後の加速的な骨量損失および内因性エストロゲンレベルの低下に関連する閉経後骨粗鬆症である。エストロゲンレベルの低下により急速な骨量損失が進行している閉経期近くの女性および閉経後の女性では、骨の密度測定値と骨折を起こす危険性との間に逆相関が存在する。Slemenda, et al.,「閉経周辺期の女性における骨量の予測因子, 光子吸収法を用いる臨床データの予測的研究(Predictors of Bone Mass in Perimenopausal Women, A Prospective Study of Clinical Data Using Photon Absorptiometry)」, Ann. Intern. Med., 1990, pp. 96-101(非特許文献5)およびMarshall, et al.,「骨ミネラル密度の測定値がどの程度良好に骨粗鬆症性骨折の発生を予測するかに関するメタ分析(Meta-Analysis of How Well Measures of Bone Mineral Density Predict Occurrence of Osteoporotic Fractures)」, Br. Med. J., 1996, pp. 1254-1259(非特許文献6、いずれも、そのような相関に関して、参照により本明細書に組み入れられるものとする)を参照されたい。高齢の女性では、現在のところ、生涯にわたり骨折を起こす危険性は約75%である。さらに、米国の50歳以上の白人女性では、股関節部骨折を起こす危険性は約40%である。骨粗鬆症性骨折による経済的負担は、入院が必要であるため、かなり大きい。さらに、骨粗鬆症は一般的には命にかかわるものと考えられていないが、股関節部骨折の4ヶ月間以内の死亡率は、現在、約20〜30%である。閉経後骨粗鬆症に対する現在の療法としては、ホルモン補充療法、ビスホスホネートやカルシトニンなどの他の抗吸収剤を用いる治療が挙げられる。同様に、SERMは、閉経後骨粗鬆症の治療に有効であることが明らかにされている(Lindsay, R. :「骨粗鬆症の病理発生および予防における性ステロイド(Sex steroids in the pathogenesis and prevention of osteoporosis)」. In: Osteoporosis 1988. Etiology, Diagnosis and Management. Riggs BL (ed)l, Raven Press, New York, USA (1988):333-358(非特許文献7); Barzel US:「閉経後骨粗鬆症の予防および治療におけるエストロゲン:総説 (Estrogens in the prevention and treatment of postmenopausal osteoporosis: a review)」. Am J. Med (1988) 85:847-850(非特許文献8); 及び Ettinger, B., Black, D.M., et al.,「ラロキシフェンで治療された骨粗鬆症の閉経後の女性における脊椎骨折を起こす危険性の減少(Reduction of Vertebral Fracture Risk in Postmenopausal Women with Osteoporosis Treated with Raloxifene)」, JAMA, 1999, 282, 637-645(非特許文献9、いずれも、そのような教示に関して、参照により組み入れられるものとする)を参照されたい)。
【0006】
他の例として、乳房組織、特に乳癌に及ぼすエストロゲンの作用については、十分な裏付けがなされている。たとえば、すでに同定されているSERMのタモキシフェンは、再発性乳癌、対側乳癌に罹患する危険性および死亡率を減少させるとともに、疾患の多くの病期において乳癌の患者の無病生存率を増大させる。Cosman, F., Lindsay, R. 「選択的エストロゲン受容体モジュレーター:臨床スペクトル(Selective Estrogen Receptor Modulators: Clinical Spectrum)」, Endocrine Rev., 1999, pp. 418-434(非特許文献10、そのような教示に関して、参照により本明細書に組み入れられるものとする)を参照されたい。しかしながら、タモキシフェンのプロフィールは、子宮組織のような生殖器組織に対して相互作用性を有する可能性があるため、理想的なものではない。そのような癌を治療するために治療法を改善する余地がある(すなわち、いかなる生殖器組織に対してもアゴニスト性を有していないSERM)。
【0007】
心臓血管疾患は、閉経後の女性の主要な死亡原因である。最近まで、閉経後の女性におけるエストロゲン補充療法が心臓血管疾患の危険性を低減することが大半のデータから示唆されたが、全死亡率に対して有益な効果がないことがいくつかの研究で報告された。Barrett-Connor, E. et al.,「冠動脈性心疾患の危険性を低減させるSERMの可能性(The Potential of SERMs for Reducing the Risk of Coronary Heart Disease)」, Trends Endocrinol. Metab., 1999, pp. 320-325(非特許文献11、参照により本明細書に組み入れられるものとする)を参照されたい。エストロゲンが心臓血管系に対してその有益な作用を発揮すると考えられた機序は、完全には明らかになっていない。可能性として、血清コレステロールおよびリポタンパク質に及ぼすエストロゲンの作用、抗酸化性、血管平滑筋増殖、および動脈コレステロール蓄積の抑制が関与すると考えられた。上記文献参照。また、Cosman, F., Lindsay, R. 「選択的エストロゲン受容体モジュレーター:臨床スペクトル(Selective Estrogen Receptor Modulators: Clinical Spectrum)」, Endocrine Rev., 1999, pp. 418-434(非特許文献10、参照により本明細書に組み入れられるものとする)をも参照されたい。しかしながら、HERS IIおよびWHI研究に関する最近の報告から判断して、連続的組合せホルモン療法(すなわち、CEE+MPA[抱合ウマエストロゲン+酢酸メドロキシプロゲステロン])は、閉経期の女性において心臓血管に有益な効果を示さない。Hulley S., Grady, D., Bush, T., et al.,「閉経後の女性における冠動脈性心疾患を二次予防するためのエストロゲン+プロゲスチンの無作為化試験(Randomized trial of estrogen plus progestin for secondary prevention of coronary heart disease in postmenopausal women)」. Heart and Estrogen/progestin Replacement Study (HERS) Research Group. J. Am. Med. Assoc. (1998) 280:605-613(非特許文献12)およびWassertheil-Smoller S., Hendrix, S.L., Limacher, M., et al., for the WHI Investigators.「閉経後の女性における発作に及ぼすエストロゲン+プロゲスチンの作用(Effect of estrogen plus progestin on stroke in postmenopausal women)」: the Women's Health Initiative: a randomized trial. JAMA (2003) 289, 2673-2684(非特許文献13、いずれも、そのような教示に関して、参照により本明細書に組み入れられるものとする)を参照されたい。これらの知見がどの程度までSERMにあてはまりうるかは、いまだに決定されていない問題である。
【0008】
療法の他の選択肢としては、血管運動性症状、泌尿生殖器萎縮、鬱病、および糖尿病の治療に有用でありうるエストロゲン補充療法および/またはホルモン補充療法が挙げられる。女性の75%以上は、更年期中に血管運動性症状を経験する。血管運動性症状や泌尿生殖器萎縮のような臨床的症状は、エストロゲン補充療法で治療すると寛解する。Sagraves, R., J. Clin. Pharmacol. (1995), 35(9 Suppl):2S-10S(非特許文献14、そのような教示に関して、参照により本明細書に組み入れられるものとする)を参照されたい。エストラジオールが閉経周辺期中における鬱病を軽減しうることおよびエストロゲンと選択的セロトニン再取込み阻害剤との組合せが閉経後の期間中における鬱病を軽減しうることが予備データから示唆される。Soares, C. N., Poitras, J. R., and Prouty, J., Drugs Aging, (2003), 20(2), 85-100(非特許文献15、そのような教示に関して参照により本明細書に組み入れられるものとする)を参照されたい。さらに、ホルモン補充療法により、糖尿病の女性で血糖コントロールが改善されうる。Palin, S.L. et al., Diabetes Research and Clinical Practice, (2001), 54, 67-77(非特許文献16); Ferrara, A. et al., Diabetes Care, (2001), 24(7), 1144-1150(非特許文献17、いずれも、そのような教示に関して参照により本明細書に組み入れられるものとする)を参照されたい。しかしながら、HRTと比較してより良好な副作用プロフィールを示す改善された療法が必要とされている。
【0009】
本発明者らは、エストロゲン受容体αおよびエストロゲン受容体βに結合するシクロアルキリデン化合物の新規な群を見いだした。これらの化合物は、SERMとして、閉経期または閉経後の障害、血管運動性症状、泌尿生殖器または外陰腟の萎縮、萎縮性膣炎、女性性機能不全、乳癌、抑鬱症状、糖尿病、骨無機質脱落の治療および/または予防、さらには骨粗鬆症の治療および/または予防に有用であると考えられる。
【特許文献1】WO 97/09348
【非特許文献1】Kousteni et al., Journal of Clinical Investigation, (2003), 111, 1651-1664
【非特許文献2】McDonnell, D. P., The Molecular Pharmacology of SERMs, Trends Endocrinol. Metab. 1999, 301-311
【非特許文献3】Kuiper et al.,「ラットの前立腺および卵巣で発現される新規なエストロゲン受容体のクローニング(Cloning of a Novel Estrogen Receptor Expressed in Rat Prostate and Ovary)」, Proc. Natl. Acad. Sci. U.S.A., 1996, pp. 5925-5930
【非特許文献4】Mosselman et al.,「ERβ:新規なヒトエストロゲン受容体の同定および特徴付け(ERβ: Identification and Characterization of a Novel Human Estrogen Receptor)」, FEBS Lett., 1996, pp. 49-53
【非特許文献5】Slemenda, et al.,「閉経周辺期の女性における骨量の予測因子, 光子吸収法を用いる臨床データの予測的研究(Predictors of Bone Mass in Perimenopausal Women, A Prospective Study of Clinical Data Using Photon Absorptiometry)」, Ann. Intern. Med., 1990, pp. 96-101
【非特許文献6】Marshall, et al.,「骨ミネラル密度の測定値がどの程度良好に骨粗鬆症性骨折の発生を予測するかに関するメタ分析(Meta-Analysis of How Well Measures of Bone Mineral Density Predict Occurrence of Osteoporotic Fractures)」, Br. Med. J., 1996, pp. 1254-1259
【非特許文献7】Lindsay, R. :「骨粗鬆症の病理発生および予防における性ステロイド(Sex steroids in the pathogenesis and prevention of osteoporosis)」. In: Osteoporosis 1988. Etiology, Diagnosis and Management. Riggs BL (ed)l, Raven Press, New York, USA (1988):333-358
【非特許文献8】Barzel US:「閉経後骨粗鬆症の予防および治療におけるエストロゲン:総説 (Estrogens in the prevention and treatment of postmenopausal osteoporosis: a review)」. Am J. Med (1988) 85:847-850
【非特許文献9】Ettinger, B., Black, D.M., et al.,「ラロキシフェンで治療された骨粗鬆症の閉経後の女性における脊椎骨折を起こす危険性の減少(Reduction of Vertebral Fracture Risk in Postmenopausal Women with Osteoporosis Treated with Raloxifene)」, JAMA, 1999, 282, 637-645
【非特許文献10】Cosman, F., Lindsay, R. 「選択的エストロゲン受容体モジュレーター:臨床スペクトル(Selective Estrogen Receptor Modulators: Clinical Spectrum)」, Endocrine Rev., 1999, pp. 418-434
【非特許文献11】Barrett-Connor, E. et al.,「冠動脈性心疾患に罹患する危険性を低減させるSERMの可能性(The Potential of SERMs for Reducing the Risk of Coronary Heart Disease)」, Trends Endocrinol. Metab., 1999, pp. 320-325
【非特許文献12】Hulley S., Grady, D., Bush, T., et al.,「閉経後の女性において冠動脈性心疾患を二次予防するためのエストロゲン+プロゲスチンの無作為化試験(Randomized trial of estrogen plus progestin for secondary prevention of coronary heart disease in postmenopausal women)」. Heart and Estrogen/progestin Replacement Study (HERS) Research Group. J. Am. Med. Assoc. (1998) 280:605-613
【非特許文献13】Wassertheil-Smoller S., Hendrix, S.L., Limacher, M., et al., for the WHI Investigators.「閉経後の女性における発作に及ぼすエストロゲン+プロゲスチンの作用(Effect of estrogen plus progestin on stroke in postmenopausal women)」: the Women's Health Initiative: a randomized trial. JAMA (2003) 289, 2673-2684
【非特許文献14】Sagraves, R., J. Clin. Pharmacol. (1995), 35(9 Suppl):2S-10S
【非特許文献15】Soares, C. N., Poitras, J. R., and Prouty, J., Drugs Aging, (2003), 20(2), 85-100
【非特許文献16】Palin, S.L. et al., Diabetes Research and Clinical Practice, (2001), 54, 67-77
【非特許文献17】Ferrara, A. et al., Diabetes Care, (2001), 24(7), 1144-1150
【発明の開示】
【課題を解決するための手段】
【0010】
発明の概要
本発明は、式(I):
【化1】

【0011】
(式中、
R1は、HまたはFであり、
R2およびR4は、それぞれ独立して、H、OH、アルキル、アルケニル、アルキニル、アルコキシ、ハロゲン、ハルアルキルまたはシアノから選択され;
R3は、-(Y)Z-R8であり;
Zは、0または1であり;
Yは、炭素-炭素三重結合または-CRe=CRf-であり;
R5の各基は、Hであり;あるいは、
R5の両基は、R6の各基およびR7の各基がHであり、かつXが-(CH2)m-2-である場合、一緒に結合して架橋アルキレン鎖-(CH2)m-(ここで、mは、2、3または4である)を形成しており;
R6およびR7の各基は、Hまたはアルキルから選択され;あるいは
Xが-(CH2)m-の場合、R6の両基はHであり、かつR7の両基は、一緒に結合して架橋アルキレン鎖-(CH2)m-を形成しており(ここで、各mは同じであり、かつ定義されたとおりである);あるいは、
Xが-(CH2)m-の場合、R7の両基はHであり、かつR6の両基は、一緒に結合して架橋アルキレン鎖-(CH2)m-を形成しており(ここで、各mは同じであり、かつ定義されたとおりである);
Zが0の場合、R8は、アルキル、アルケニル、アルキニル、アルコキシ、アリール、ヘテロシクリル、1つ以上のアルキルで置換されたヘテロシクリル、シアノ、-O(CH2)tCN、-CO2H、-(CH2)tCO2H、-O(CH2)tCO2H、-(CH2)tOH、-O(CH2)tOH、-O(CH2)tO(CH2)tOH、-C(O)NRaRb、-O(CH2)tC(O)NRaRb、-NRaSO2Rd、または-NRaC(O)Rcであり;
Zが1の場合、R8は、-CO2H、-(CH2)tCO2H、-(CH2)tOH、-C(O)NRaRb、または-PO3HRaであり;
各tは、独立して、1〜8であり;
Xは、-(CH2)n-(ここで、nは、0、1、2または3である)、-C(Rh)2-、-O-、-S(O)p(式中、pは、0、1または2である)、-C(Rg)2OC(Rg)2-、または-C(CH2)v-(ここで、vは2〜7であり、Xを含む上記表示された環とスピロ環を形成している)であり;
Raは、H、アルキル、アルケニル、アルキニル、アルコキシ、シクロアルキル、アリール、またはヘテロシクリルであり;
Rbは、H、アルキル、アルケニル、アルキニル、アルコキシ、シクロアルキル、アリール、またはヘテロシクリルであり;
Rcは、アルキル、アルケニル、アルキニル、アルコキシ、シクロアルキル、アリール、またはヘテロシクリルであり;
Rdは、アルキル、アルケニル、アルキニル、アルコキシ、シクロアルキル、アリール、またはヘテロシクリルであり;あるいは
RaおよびRb、RaおよびRc、またはRaおよびRdは、結合している原子と結合して任意に置換されたヘテロシクリルを形成していてもよく;および
ReおよびRfの各基は、独立して、H、アルキル、ハロゲンおよびハロアルキルから選択され;
Rgは、H、アルキル、アルケニル、アルキニル、アルコキシ、シクロアルキル、アリール、またはヘテロシクリルであり;
Rhは、アルキル、アルケニル、アルキニル、アルコキシ、シクロアルキル、アリール、またはヘテロシクリルであり;
ここで、アルキル、アルケニル、アルキニル、シクロアルキル、アリール、へテロアリール、およびヘテロシクリルはそれぞれの出現ごとに、任意に置換されていてもよい)
で表される化合物、ならびにその塩、溶媒和物、および薬理学的に機能的な誘導体の1つ以上の化合物を包含する。
【0012】
より具体的には、本発明は、式(I−A):
【化2】

【0013】
(式中、
R1は、HまたはFであり;
R3は、-(Y)z-R8であり;
zは、0または1であり;
Yは、-CH=CH-であり;
R6およびR7の各基は、Hまたはアルキルから選択され;
zが0の場合、R8は、ヘテロシクリル、1つ以上のアルキルで置換されたヘテロシクリル、-O(CH2)tCN、-CO2H、-(CH2)tCO2H、-O(CH2)tCO2H、-O(CH2)tOH、-O(CH2)tO(CH2)tOH、または-O(CH2)tC(O)NH2であり;
zが1の場合、R8は、-CO2Hまたは-CONH2であり;
各tは、独立して、1〜8であり;および
Xは、-(CH2)n-(式中、nは、0、1、または2である)、またはOである)
で表される化合物、ならびにその塩、溶媒和物、および薬理学的に機能的な誘導体の1つ以上の化合物を包含する。
【0014】
更に、本発明は、
(2E)-3-{4-[シクロヘプチリデン(フェニル)メチル]フェニル}プロパ-2-エン酸;
(2E)-3-{4-[シクロヘプチリデン(フェニル)メチル]フェニル}プロパ-2-エンアミド;
2-({4-[フェニル(3,3,5,5-テトラメチルシクロヘキシリデン)メチル]フェニル}オキシ)エタノール;
2-{[2-({4-[フェニル(3,3,5,5-テトラメチルシクロヘキシリデン)メチル]フェニル}オキシ)エチル]オキシ}エタノール;
({4-[(4-フルオロフェニル)(3,3,5,5-テトラメチルシクロヘキシリデン)メチル]フェニル}オキシ)酢酸;
4-({4-[(4-フルオロフェニル)(3,3,5,5-テトラメチルシクロヘキシリデン)メチル]フェニル}オキシ)ブタン酸;
({4-[(4-フルオロフェニル)(3,3,5,5-テトラメチルシクロヘキシリデン)メチル]フェニル}オキシ)アセトニトリル;
2-({4-[(4-フルオロフェニル)(3,3,5,5-テトラメチルシクロヘキシリデン)メチル]フェニル}オキシ)エタノール;
(2E)-3-{4-[フェニル(3,3,5,5-テトラメチルシクロヘキシリデン)メチル]フェニル}-2-プロペン酸;
4-[フェニル(3,3,5,5-テトラメチルシクロヘキシリデン)メチル]安息香酸;
3,5-ジメチル-4-{4-[フェニル(3,3,5,5-テトラメチルシクロヘキシリデン)メチル]フェニル}イソオキサゾール;
1-メチル-4-{4-[フェニル(3,3,5,5-テトラメチルシクロヘキシリデン)メチル]フェニル}-1H-ピラゾール;
4-{4-[(4-フルオロフェニル)(3,3,5,5-テトラメチルシクロヘキシリデン)メチル]フェニル}-3,5-ジメチルイソオキサゾール;
3-{4-[(4-フルオロフェニル)(3,3,5,5-テトラメチルシクロヘキシリデン)メチル]フェニル}フラン;
2-{[2-({4-[(4-フルオロフェニル)(3,3,5,5-テトラメチルシクロヘキシリデン)メチル]フェニル}オキシ)エチル]オキシ}エタノール;
2-{4-[(4-フルオロフェニル)(3,3,5,5-テトラメチルシクロヘキシリデン)メチル]フェニル}フラン;
4-{4-[(4-フルオロフェニル)(3,3,5,5-テトラメチルシクロヘキシリデン)メチル]フェニル}-1-メチル-1H-ピラゾール;
4-({4-[フェニル(3,3,5,5-テトラメチルシクロヘキシリデン)メチル]フェニル}オキシ)-1-ブタノール;
2-({4-[フェニル(3,3,5,5-テトラメチルシクロヘキシリデン)メチル]フェニル}オキシ)アセトアミド;
({2-メチル-5-[フェニル(3,3,5,5-テトラメチルシクロヘキシリデン)メチル]フェニル}オキシ)酢酸;
2-({2-メチル-5-[フェニル(3,3,5,5-テトラメチルシクロヘキシリデン)メチル]フェニル}オキシ)エタノール;
({2-メチル-5-[フェニル(3,3,5,5-テトラメチルシクロヘキシリデン)メチル]フェニル}オキシ)アセトニトリル;
4-({2-メチル-5-[フェニル(3,3,5,5-テトラメチルシクロヘキシリデン)メチル]フェニル}オキシ)ブタン酸;
4-({2-メチル-5-[フェニル(3,3,5,5-テトラメチルシクロヘキシリデン)メチル]フェニル}オキシ)-1-ブタノール;
5-[({2-メチル-5-[フェニル(3,3,5,5-テトラメチルシクロヘキシリデン)メチル]フェニル}オキシ)メチル]-1H-テトラゾール;
2-{[2-({2-メチル-5-[フェニル(3,3,5,5-テトラメチルシクロヘキシリデン)メチル]フェニル}オキシ)エチル]オキシ}エタノール;
4-({4-[フェニル(3,3,5,5-テトラメチルシクロヘキシリデン)メチル]フェニル}オキシ)ブタン酸;
({4-[フェニル(3,3,5,5-テトラメチルシクロヘキシリデン)メチル]フェニル}オキシ)酢酸;
(2E)-3-{4-[(4-フルオロフェニル)(3,3,5,5-テトラメチルシクロヘキシリデン)メチル]フェニル}-2-プロペン酸;
(2E)-3-{4-[(4-フルオロフェニル)(2,2,6,6-テトラメチルテトラヒドロ-4H-ピラン-4-イリデン)メチル]フェニル}-2-プロペン酸;
(2E)-3-{4-[フェニル(2,2,6,6-テトラメチルテトラヒドロ-4H-ピラン-4-イリデン)メチル]フェニル}-2-プロペン酸;
4-{4-[フェニル(2,2,6,6-テトラメチルテトラヒドロ-4H-ピラン-4-イリデン)メチル]フェニル}ブタン酸;
4-{4-[(4-フルオロフェニル)(2,2,6,6-テトラメチルテトラヒドロ-4H-ピラン-4-イリデン)メチル]フェニル}ブタン酸;
2-({4-[(4-フルオロフェニル)(2,2,6,6-テトラメチルテトラヒドロ-4H-ピラン-4-イリデン)メチル]フェニル}オキシ)エタノール;
2-({4-[フェニル(2,2,6,6-テトラメチルテトラヒドロ-4H-ピラン-4-イリデン)メチル]フェニル}オキシ)エタノール;
2-{[2-({4-[フェニル(2,2,6,6-テトラメチルテトラヒドロ-4H-ピラン-4-イリデン)メチル]フェニル}オキシ)エチル]オキシ}エタノール;
2-{[2-({4-[(4-フルオロフェニル)(2,2,6,6-テトラメチルテトラヒドロ-4H-ピラン-4-イリデン)メチル]フェニル}オキシ)エチル]オキシ}エタノール;
4-[(4-フルオロフェニル)(2,2,6,6-テトラメチルテトラヒドロ-4H-ピラン-4-イリデン)メチル]安息香酸;
4-[フェニル(2,2,6,6-テトラメチルテトラヒドロ-4H-ピラン-4-イリデン)メチル]安息香酸;および
4-[(4-フルオロフェニル)(3,3,5,5-テトラメチルシクロヘキシリデン)メチル]安息香酸、その塩、溶媒和物、および薬理学的に機能的な誘導体を包含する。
【0015】
更に、本発明は、次式:
【化3】

【0016】
で表される化合物、ならびにその塩、溶媒和物および薬理学的に機能的な誘導体を包含する。
【0017】
更に、本発明は、次式:
【化4】

【0018】
で表される化合物、ならびにその塩、溶媒和物および薬理学的に機能的な誘導体を包含する。
【0019】
本発明は、実施例のいずれかに記載の実質的に上記に定義された化合物である、本発明の1つ以上の化合物を包含する。
【0020】
本発明は、本発明の1つ以上の化合物と製薬上許容される担体を含む医薬組成物を包含する。
【0021】
本発明は、活性治療物質として使用するための本発明の1つ以上の化合物を包含する。
【0022】
本発明は、選択的エストロゲン受容体モジュレーションの影響を受けている症状または障害の治療または予防で使用するための本発明の1つ以上の化合物を包含する。特に、本発明は、治療または予防が、骨粗鬆症、骨鉱物質消失、骨量、密度または成長の減少、骨関節炎、骨折修復および治癒の促進、関節置換の治癒の促進、歯槽膿漏症、歯の修復または成長の促進、パジェット病、骨軟骨形成異常、筋肉消耗、筋力および筋機能の維持および増強、脆さ(frailty)または加齢に伴う機能低下(「ARFD」)、サルコぺニア、慢性疲労症候群、慢性筋肉痛(myaligia)、急性疲労症候群、創傷治癒の促進、感覚機能の維持、慢性肝炎、AIDS、無重量感、火傷および外傷の回復、血小板減少症、短腸症候群、過敏性腸症候群、炎症性腸疾患、クローン病および潰瘍性大腸炎、肥満、カヘキシーまたは老化に伴う拒食症を含む摂食障害、副腎皮質機能亢進症およびクッシング症候群、心血管疾患または心機能不全、うっ血性心不全、高血圧、乳癌、乳房、脳、皮膚、卵巣、膀胱、リンパ、肝臓、腎臓、子宮、膵臓、子宮内膜、肺、結腸および前立腺を含む、アンドロゲン受容体を含有する悪性腫瘍細胞、前立腺肥大、多毛、ざ瘡、脂漏、男性ホルモン性脱毛症、貧血、超多毛性、前立腺の腺腫および腫瘍形成、高インスリン血症、インスリン耐性、糖尿病、X症候群、異脂肪血症、尿失禁、アテローム性動脈硬化症、性欲増強、性機能障害、鬱病、抑鬱症状、神経質、短気、ストレス、精神的能力の低下および低自尊心、認知機能の改善、子宮内膜症、多嚢胞性卵巣症候群、子癇前症の予防、月経前症候群、避妊、子宮類線維症、および/または大動脈平滑筋細胞増殖、膣乾燥、心因掻痒、性交疼痛症、排尿障害、頻尿、尿路感染、高コレステロール血症、高脂血症、末梢血管疾患、再狭窄、血管痙攣、免疫反応に起因する血管壁損傷、アルツハイマー病、骨疾患、老化、炎症、慢性関節リウマチ、呼吸器疾患、肺気腫、再潅流傷害、ウイルス性肝炎、結核、乾癬、全身性エリテマトーデス、筋萎縮性側索硬化症、卒中、CNS外傷、痴呆、神経変性、乳房痛および月経困難症、更年期障害または閉経後障害、血管運動症状、尿生殖萎縮または外陰膣萎縮、萎縮性膣炎、女性性機能不全、性欲亢進目的、性的欲求低下障害の治療目的、性的刺激障害、オルガスムスの頻度および強度の向上目的、膣痙、オステオペニア、子宮内膜症、BPH(良性前立腺肥大)、月経困難症、自己免疫性疾患、橋本甲状腺炎、SLE(全身性エリテマトーデス)、重症筋無力症、あるいは虚血心筋の再灌流損傷に関する、本発明の1つ以上の化合物の使用を包含する。本発明は、治療または予防が、更年期障害または閉経後障害、血管運動症状、尿生殖萎縮または外陰膣萎縮、萎縮性膣炎、女性性機能不全、乳癌、抑鬱症状、糖尿病、骨鉱物質消失、または骨粗鬆症に関する、本発明の1つ以上の化合物の使用を包含する。
【0023】
本発明は、選択的エストロゲン受容体モジュレーションに関連する症状または障害の治療または予防で使用するための薬剤の製造における本発明の1つ以上の化合物の使用を包含する。更に、本発明は、骨粗鬆症、骨鉱物質消失、骨量、密度または成長の減少、骨関節炎、骨折修復および治癒の促進、関節置換術の治癒の促進、歯槽膿漏症、歯の修復または成長の促進、パジェット病、骨軟骨形成異常、筋肉消耗、筋力および筋機能の維持および増強、脆さ(frailty)または加齢に伴う機能低下(「ARFD」)、サルコぺニア、慢性疲労症候群、慢性筋肉痛(myaligia)、急性疲労症候群、創傷治癒の促進、感覚機能の維持、慢性肝炎、AIDS、無重量感、火傷および外傷の回復、血小板減少症、短腸症候群、過敏性腸症候群、炎症性腸疾患、クローン病および潰瘍性大腸炎、肥満、カヘキシーまたは老化に伴う拒食症を含む摂食障害、副腎皮質機能亢進症およびクッシング症候群、心血管疾患または心機能不全、うっ血性心不全、高血圧、乳癌、乳房、脳、皮膚、卵巣、膀胱、リンパ、肝臓、腎臓、子宮、膵臓、子宮内膜、肺、結腸および前立腺を含む、アンドロゲン受容体を含有する悪性腫瘍細胞、前立腺肥大、多毛、ざ瘡、脂漏、男性ホルモン性脱毛症、貧血、超多毛性、前立腺の腺腫および腫瘍形成、高インスリン血症、インスリン耐性、糖尿病、X症候群、異脂肪血症、尿失禁、アテローム性動脈硬化症、性欲増強、性機能障害、鬱病、抑鬱症状、神経質、短気、ストレス、精神的能力の低下および低自尊心、認知機能の改善、子宮内膜症、多嚢胞性卵巣症候群、子癇前症の予防、月経前症候群、避妊、子宮類線維症、および/または大動脈平滑筋細胞増殖、膣乾燥、心因掻痒、性交疼痛症、排尿障害、頻尿、尿路感染、高コレステロール血症、高脂血症、末梢血管疾患、再狭窄、血管痙攣、免疫反応に起因する血管壁損傷、アルツハイマー病、骨疾患、老化、炎症、慢性関節リウマチ、呼吸器疾患、肺気腫、再潅流傷害、ウイルス性肝炎、結核、乾癬、全身性エリテマトーデス、筋萎縮性側索硬化症、卒中、CNS外傷、痴呆、神経変性、乳房痛および月経困難症、更年期障害または閉経後障害、血管運動症状、尿生殖萎縮または外陰膣萎縮、萎縮性膣炎、女性性機能不全、性欲亢進目的、性的欲求低下障害の治療目的、性的刺激障害、オルガスムスの頻度および強度の向上目的、膣痙、オステオペニア、子宮内膜症、BPH(良性前立腺肥大)、月経困難症、自己免疫性疾患、橋本甲状腺炎、SLE(全身性エリテマトーデス)、重症筋無力症、あるいは虚血心筋の再灌流損傷の治療または予防で使用するための薬剤の製造における本発明の1つ以上の化合物の使用を包含する。本発明は、疾患または障害が、更年期障害または閉経後障害、血管運動症状、尿生殖萎縮または外陰膣萎縮、萎縮性膣炎、女性性機能不全、乳癌、抑鬱症状、糖尿病、骨鉱物質消失、または骨粗鬆症である、本発明の1つ以上の化合物の使用を包含する。
【0024】
本発明は、本発明の1つ以上の化合物を投与することを含む、選択的エストロゲン受容体モジュレーションに関連する症状または障害の治療または予防方法を包含する。本発明は、本発明の1つ以上の化合物を投与することを含む、骨粗鬆症、骨鉱物質消失、骨量、密度または成長の減少、骨関節炎、骨折修復および治癒の促進、関節置換術の治癒の促進、歯槽膿漏症、歯の修復または成長の促進、パジェット病、骨軟骨形成異常、筋肉消耗、筋力および筋機能の維持および増強、脆さ(frailty)または加齢に伴う機能低下(「ARFD」)、サルコぺニア、慢性疲労症候群、慢性筋肉痛(myaligia)、急性疲労症候群、創傷治癒の促進、感覚機能の維持、慢性肝炎、AIDS、無重量感、火傷および外傷の回復、血小板減少症、短腸症候群、過敏性腸症候群、炎症性腸疾患、クローン病および潰瘍性大腸炎、肥満、カヘキシーまたは老化に伴う拒食症を含む摂食障害、副腎皮質機能亢進症およびクッシング症候群、心血管疾患または心機能不全、うっ血性心不全、高血圧、乳癌、乳房、脳、皮膚、卵巣、膀胱、リンパ、肝臓、腎臓、子宮、膵臓、子宮内膜、肺、結腸および前立腺を含む、アンドロゲン受容体を含有する悪性腫瘍細胞、前立腺肥大、多毛、ざ瘡、脂漏、男性ホルモン性脱毛症、貧血、超多毛性、前立腺の腺腫および腫瘍形成、高インスリン血症、インスリン耐性、糖尿病、X症候群、異脂肪血症、尿失禁、アテローム性動脈硬化症、性欲増強、性機能障害、鬱病、抑鬱症状、神経質、短気、ストレス、精神的能力の低下および低自尊心、認知機能の改善、子宮内膜症、多嚢胞性卵巣症候群、子癇前症の予防、月経前症候群、避妊、子宮類線維症、および/または大動脈平滑筋細胞増殖、膣乾燥、心因掻痒、性交疼痛症、排尿障害、頻尿、尿路感染、高コレステロール血症、高脂血症、末梢血管疾患、再狭窄、血管痙攣、免疫反応に起因する血管壁損傷、アルツハイマー病、骨疾患、老化、炎症、慢性関節リウマチ、呼吸器疾患、肺気腫、再潅流傷害、ウイルス性肝炎、結核、乾癬、全身性エリテマトーデス、筋萎縮性側索硬化症、卒中、CNS外傷、痴呆、神経変性、乳房痛および月経困難症、更年期障害または閉経後障害、血管運動症状、尿生殖萎縮または外陰膣萎縮、萎縮性膣炎、女性性機能不全、性欲亢進目的、性的欲求低下障害の治療目的、性的刺激障害、オルガスムスの頻度および強度の向上目的、膣痙、オステオペニア、子宮内膜症、BPH(良性前立腺肥大)、月経困難症、自己免疫性疾患、橋本甲状腺炎、SLE(全身性エリテマトーデス)、重症筋無力症、あるいは虚血心筋の再灌流損傷に関する治療または予防方法を包含する。更に、本発明は、疾患または障害が、更年期障害または閉経後障害、血管運動症状、尿生殖萎縮または外陰膣萎縮、萎縮性膣炎、女性性機能不全、乳癌、抑鬱症状、糖尿病、骨鉱物質消失、または骨粗鬆症である、本発明の1つ以上の化合物を包含する。
【発明を実施するための最良の形態】
【0025】
好ましい実施形態の詳細な説明
本発明は、当業者に知られ、認識されている用語で記載されている。以下に、参照を容易にするために特定の用語について定義する。しかし、特定の用語を定義するという事実を、定義されていないすべての用語を不明確であると示すものとして考えるべきではない。むしろ、本明細書に使用されているすべての用語は、当業者が本発明の範囲を認識することができるような用語で本発明を記載しているものと考えられたい。
【0026】
本明細書では、「アルキル」という用語は、例えば1〜12個の炭素原子を有する、直鎖状または分枝鎖状の炭化水素を意味する。本明細書に使用する「アルキル」の例としては、これらに限定されるものではないが、メチル、エチル、プロピル、イソプロピル、イソブチル、n-ブチル、tert-ブチル、イソペンチル、n-ペンチル等が挙げられる。
【0027】
本明細書では、「アルケニル」という用語は、例えば2〜12個の炭素原子を有する、1つ以上の炭素と炭素の二重結合を含む、直鎖状または分枝鎖状の炭化水素を意味する。本明細書に使用する「アルケニル」の例としては、これらに限定されるものではないが、ビニル、1-プロペニル、アリル等が挙げられる。
【0028】
本明細書では、「アルキニル」という用語は、例えば2〜12個の炭素を有する、1つ以上の炭素と炭素の三重結合を含む、直鎖状または分枝鎖状の炭化水素を意味する。本明細書に使用する「アルキニル」の例としては、これらに限定されるものではないが、エチニル、1-プロピニル、2-プロピニル等が挙げられる。
【0029】
本明細書では、「アルキレン」という用語は、例えば1〜10個の炭素原子を有する、直鎖状または分枝鎖状の二価の炭化水素基を意味する。本明細書で使用する「アルキレン」の例としては、これらに限定されるものではないが、メチレン、エチレン、n-プロピレン、n-ブチレン等が挙げられる。
【0030】
本明細書では、「ハロゲン」という用語は、フッ素、塩素、臭素またはヨウ素を意味する。
【0031】
本明細書では、「ハロアルキル」という用語は、少なくとも1個のハロゲンで置換されている、本明細書に定義したとおりのアルキル基を意味する。本発明に有用な分枝鎖状または直鎖状の「ハロアルキル」基の例としては、これらに限定されるものではないが、1個または複数個のハロゲン(例えば、フルオロ、クロロ、ブロモおよびヨード)で独立して置換されているメチル、エチル、プロピル、イソプロピル、n-ブチルおよびt-ブチルが挙げられる。「ハロアルキル」という用語は、ペルフルオロアルキル基などの置換基等を含むものと解釈すべきである。
【0032】
本明細書では、「アルコキシ」という用語は-OR基を意味し、式中、Rは上で定義したアルキルである。
【0033】
本明細書では、「アシル」という用語は-C(O)R基を意味し、式中、Rは、本明細書で各々定義されているアルキル、アリール、またはヘテロシクリルである。
【0034】
本明細書では、「ヒドロキシ」という用語は-OH基を意味する。
【0035】
本明細書では、「カルボキシ」という用語は-C(O)OH基を意味する。
【0036】
本明細書では、「ニトロ」という用語は-NO2基を意味する。
【0037】
本明細書では、「アミノ」という用語は-NH2基を意味するか、あるいは、置換アミノとして意味する場合、アルキルで置換されているそのような基と定義する。
【0038】
本明細書では、「シクロアルキル」という用語は、例えば3〜10個の炭素原子を有する、非芳香族の環式炭化水素環を意味する。具体的な「シクロアルキル」基としては、これらに限定されるものではないが、シクロプロピル、シクロブチル、シクロペンチル、シクロヘキシル、シクロヘプチル等が挙げられる。
【0039】
本明細書では、「アリール」という用語は、ベンゼンおよびその誘導体に由来する置換基を意味し、縮合されたベンゼン環系、例えば、アントラセン、フェナントレンもしくはナフタリン環系を含む。「アリール」基の例としては、これらに限定されるものではないが、フェニル、2-ナフチル、1-ナフチル、およびビフェニルが挙げられる。
【0040】
本明細書では、「複素環」、「ヘテロシクリル」または「複素環の」という用語は、任意に1つ以上の不飽和度を含有する1個または複数のヘテロ原子を含有しているモノ環状またはポリ環状の環系を意味する。好ましいヘテロ原子としてはN、Oおよび/またはSが挙げられ、N-酸化物、硫黄酸化物、およびジオキシドを含む。例えば、ヘテロシクリル環系は3員から10員であって、飽和されているか、1つ以上の不飽和度を有している。そのような環は、任意に、1つ以上の別の「複素環」、アリール環、またはシクロアルキル環に縮合していてもよく、「複素環」基として参照され得る。「複素環」基の例としては、これらに限定されるものではないが、テトラヒドロフラン、ピラン、1,4-ジオキサン、1,3-ジオキサン、ピペリジン、ピロリジン、モルホリン、テトラヒドロチオピラン、テトラヒドロチオフェン、フラン、チオフェン、ピロール、イミダゾール、ピラゾール、トリアゾール、テトラゾール、チアゾール、オキサゾール、イソオキサゾール、オキサジアゾール、チアジアゾール、イソチアゾール、ピリジン、ピリダジン、ピラジン、ピリミジン、キノリン、イソキノリン、ベンゾフラン、ベンゾチオフェン、インドール、インダゾール等が挙げられる。
【0041】
本明細書では、「スピロ環」という用語は、共通の原子を共有する2つの環を含む環系をいう。スピロ環化合物の例としては、スピロ[4.4]ノナン等が挙げられる。
【0042】
式(I)の化合物は、複数の形態(多形として知られている特性)で結晶化され得、そのような多形態(「多形体」)は式(I)の範囲内にある。多形は、一般的に、温度、圧力またはその両方の変化に対する応答として生じ得る。また多形は、結晶工程のバリエーションによっても生じ得る。多形体は、X線回折パターン、溶解性および融点などの当技術分野で公知の様々な物理的特性によって区別することができる。
【0043】
本明細書に記載されている特定の化合物は、1個または複数のキラル中心を含有しているか、あるいは複数の立体異性体として存在し得る。本発明の範囲には、立体異性体の混合物、および精製鏡像異性体または鏡像異性体的/ジアステレオマー的に富んだ混合物が含まれる。さらに本発明の範囲内には、式(I)によって表される化合物の各異性体、およびその全体的に平衡である混合物または部分的に平衡である混合物が含まれる。また本発明には、1個または複数のキラル中心が反転しているその異性体との混合物としての、上記式によって表される化合物の各異性体も含まれる。
【0044】
一般的には、本発明の塩は製薬上許容可能な塩である。「製薬上許容可能な塩」という用語内に包含される塩は、本発明の化合物の非毒性の塩を意味する。本発明の化合物の塩は、酸付加塩を含み得る。代表的な塩としては、酢酸塩、ベンゼンスルホン酸塩、安息香酸塩、重炭酸塩、重硫酸塩、酒石酸水素塩、ホウ酸塩、臭化塩、カルシウムエデト酸塩、カンシル酸塩、炭酸塩、塩化塩、クラブラン酸塩、クエン酸塩、二塩酸塩、エデト酸塩、エジシル酸塩、エストール酸塩、エシル酸塩、フマル酸塩、グルセプト酸塩、グルコン酸塩、グルタミン酸塩、グリコリルアルサニル酸塩、ヘキシルレソルシン酸塩、ヒドラバミン、臭化水素酸塩、塩酸塩、ヒドロキシナフトエ酸塩、ヨウ化塩、イセチオン酸塩、乳酸塩、ラクトビオン酸塩、ラウリン酸塩、リンゴ酸塩、マレイン酸塩、マンデル酸塩、メシル酸塩、臭化メチル、硝酸メチル、硫酸メチル、マレイン酸一カリウム塩、粘液酸塩、ナプシル酸塩、硝酸塩、N-メチルグルカミン、シュウ酸塩、パモ酸塩(エンボン酸塩)、パルミチン酸塩、パントテン酸塩、リン酸塩/二リン酸塩、ポリガラクツロン酸塩、カリウム、サリチル酸塩、ナトリウム塩、ステアリン酸塩、塩基性酢酸塩、コハク酸塩、硫酸塩、タンニン酸塩、酒石酸塩、テオクル酸塩、トシル酸塩、トリエチオダイド(triethiodide)、トリメチルアンモニウム塩、および吉草酸塩が挙げられる。製薬上許容可能でない他の塩は、本発明の化合物の調製において有用である場合があり、これらは本発明のさらなる態様を構成するものと考えるべきである。
【0045】
本明細書では、「溶媒和物」という用語は、溶質(本発明において、式(I)の化合物、またはその塩もしくはその生理学上機能的な誘導体)と溶媒によって形成される可変的な化学量論の錯体を意味する。そのような溶媒は、本発明の目的において、溶質の生物活性を妨げるものではあってはならない。適切な溶媒の例としては、これらに限定されるものではないが、水、メタノール、エタノールおよび酢酸が挙げられる。好ましくは、使用する溶媒は、製薬上許容可能な溶媒である。好適な製薬上許容可能な溶媒の例は、これらに限定されるものではないが、水、エタノールおよび酢酸が挙げられる。使用される最も好ましい溶媒は水である。
【0046】
本明細書では、「生理学上機能的な誘導体」という用語は、哺乳動物への投与の際に、本発明の化合物またはその活性代謝物を(直接的または間接的に)提供可能な、本発明の化合物の任意の製薬上許容可能な誘導体を意味する。そのような誘導体(例えば、エステルおよびアミド)は、過度の実験を行うことなく、当業者には明らかであろう。Burger's Medicinal Chemistry And Drug Discovery, 第5版, 第1巻: Principles and Practiceの教示を参照するものとする。なお、前記文献は、生理学上機能的な誘導体を教示する範囲について、参照により本明細書に組み入れるものとする。
【0047】
本明細書では、「有効量」という用語は、例えば、研究者または臨床医に求められている、組織、系、動物またはヒトの生物学的応答または医学的応答を誘導する医薬品または薬剤の量を意味する。「治療上の有効量」という用語は、そのような量を投与されていない対応の被験体と比較した場合に、疾患、障害または副作用の治療、治癒、予防または回復を改善するか、あるいは疾患または障害の進行速度を遅くする任意の量を意味する。またこの用語には、その範囲内に、正常な生理機能を亢進するのに有効な量も含まれる。
【0048】
治療における使用の場合、治療上の有効量の式(I)で表される化合物、ならびにその塩、溶媒和物および生理学上機能的な誘導体は、未加工の化学物質として投与され得る。さらに、該有効成分は、医薬組成物として提供され得る。従って、本発明はさらに、有効量の式(I)の化合物ならびにその塩、溶媒和物および生理学上機能的な誘導体、ならびに1種または複数の製薬上許容可能な担体、希釈剤または賦形剤を含む医薬組成物を提供する。式(I)の化合物ならびにその塩、溶媒和物および生理学上機能的な誘導体は、上に記載のとおりである。担体、希釈剤または賦形剤は、本製剤の他の成分と適合し、かつ本医薬組成物の服用者にとって有害でないという点で、許容され得るものでなければならない。本発明の別の態様によれば、式(I)の化合物またはその塩、溶媒和物および生理学上の機能的誘導体を、1種または複数の製薬上許容可能な担体、希釈剤または添加剤と混合することを含む医薬用製剤の調製方法も提供する。
【0049】
本発明の化合物の治療上の有効量は、多数の要因によって変わる。例えば、動物の年齢および体重、治療を必要とする正確な症状とその重症度、製剤の性質、および投与経路はすべて検討されるべき要因である。治療上の有効量は、最終的に、担当の医師または獣医によって判断されるべきである。例えば、骨粗鬆症に罹患しているヒトを治療するための式(I)の化合物の有効量は、一般的に、1日当たり、0.1〜100mg/服用者(哺乳動物)の体重kgの範囲にあるべきである。より一般的には、その有効量は、1日当たり、1〜10mg/kg体重の範囲にあるべきである。従って、70kgの成体哺乳動物に対しては、1日当たりの実際量は、通常70〜700mgになる。この量は、1日当たり単回投与で、または日用量の全量が同じとなるような1日当たりの多回分割投与(例えば、2、3、4または5回以上)で投与することができる。その塩、溶媒和物または生理学上機能的な誘導体の有効量は、本質的に式(I)の化合物の有効量のある割合として決定され得る。エストロゲンが介在する本明細書に記載の他の疾患の治療に対して、同様の用量が適するはずである。
【0050】
医薬製剤は、単位投与用量当たりの所定量の有効成分を含有する単位投与用量形態で提供することができる。そのような単位は、例えば(これに限定されるものではない)、治療する疾患、投与経路、ならびに患者の年齢、体重および症状に応じて、0.5mgから1gの式(I)の化合物を含有し得る。好ましい単位用量製剤は、本明細書で上述した日用量または分割投与量を含有しているもの、あるいは有効成分のそれらの適切な画分である。そのような製剤は、薬学分野において周知の任意の方法によって調製することができる。
【0051】
医薬製剤は、任意の適切な経路、例えば、経口経路(口腔経路または舌下経路を含む)、直腸経路、経鼻経路、局所経路(口腔経路、舌下経路または経皮経路を含む)、膣経路、あるいは非経口経路(皮下経路、筋肉内経路、静脈内経路または皮内経路を含む)による投与に適用可能である。そのような製剤は、薬学分野で公知の任意の方法によって、例えば、有効成分を担体または賦形剤と組合せることによって調製することができる。
【0052】
経口投与に適した医薬製剤は、例えば、カプセル剤または錠剤;散剤または顆粒剤;溶液または懸濁液(各液は、水溶液または非水溶液である);食用の泡状剤またはホイップ剤;あるいは水中油滴型乳濁液または油中水滴型乳濁液などの別個のユニットとして提供することができる。例えば、錠剤またはカプセル剤の形態での経口投与については、薬剤有効成分は、エタノール、グリセロール、水等の、経口用の非毒性の製薬上許容可能な不活性担体と組み合わせることができる。一般的に、散剤は、本化合物に好適な微細サイズに粉砕化し、適切な製薬上の担体(例えば、デンプンまたはマンニトールなどの食用炭水化物等)と混合することにより調製される。また、香味剤、保存剤、分散剤および着色剤も入れることができる。
【0053】
カプセル剤は、散剤、液体または懸濁液混合物を調製し、ゼラチンまたは他の適切ないくつかの殻材料でカプセル化することにより製造される。流動促進剤および滑沢剤、例えば、コロイド状シリカ、タルク、ステアリン酸マグネシウム、ステアリン酸カルシウム、または固体ポリエチレングリコールは、カプセル化前に混合物に添加することができる。崩壊剤または可溶化剤、例えば、寒天(agar-agar)、炭酸カルシウムまたは炭酸ナトリウムは、カプセルを摂取した場合の薬剤の有効性を改善するために添加することができる。さらに、所望の場合または必要な場合には、好適な結合剤、滑沢剤、崩壊剤および着色剤を混合物に加えることもできる。好適な結合剤の例としては、デンプン、ゼラチン、天然の糖、例えばグルコースまたはベータラクトース、トウモロコシ甘味剤、天然ゴムおよび合成ゴム、例えばアラビアゴム、トラガカントゴムまたはアルギン酸ナトリウム、カルボキシメチルセルロース、ポリエチレングリコール、ワックス等が挙げられる。これらの剤形で有用な滑沢剤としては、例えば、オレイン酸ナトリウム、ステアリン酸ナトリウム、ステアリン酸マグネシウム、安息香酸ナトリウム、酢酸ナトリウム、塩化ナトリウム等が挙げられる。崩壊剤としては、これらに限定されるものではないが、デンプン、メチルセルロース、寒天、ベントナイト、キサンタンガム等が挙げられる。錠剤は、例えば、粉末混合物の調製し、顆粒化または造粒化し、滑沢剤および崩壊剤を添加し、錠剤へ加圧成形することにより製剤化する。粉末混合物は、本化合物(好適には粉砕物)を、上記希釈剤または基剤と混合することにより調製することができる。任意の成分としては、結合剤、例えばカルボキシメチルセルロース、アルギン酸塩、ゼラチンまたはポリビニルピロリドン、溶液遅延剤、例えばパラフィン、吸収遅延剤、例えば第四級塩、および/または吸収剤、例えば、ベントナイト、カオリンまたは第二リン酸カルシウムが挙げられる。粉末混合物は、結合剤、例えば、シロップ、デンプン糊、アラビアゴム漿、またはセルロース材料もしくは高分子材料の溶液を用いて湿式造粒し、篩を通過させることができる。造粒の別法として、粉末混合物を錠剤機にかけると、完全に形成されていないスラッグが得られ、これを顆粒剤へと分解する。顆粒剤は、ステアリン酸、ステアリン酸塩、タルクまたは鉱油を添加することによって滑沢化し、錠剤の成形型にくっつかないようにすることができる。次いで、滑沢化した混合物を圧縮して錠剤にする。また、本発明の化合物は、自由流動性の不活性担体と組み合わせて、造粒工程またはスラッグ化工程を行うことなく、直接錠剤に圧縮することができる。シェラックのシールコーティング、糖または高分子物質のコーティング、ならびにワックスの艶出しコーティングからなる透明または不透明の保護コーティングを供することができる。これらのコーティングに色素を添加して、異なる単位用量を区別することができる。
【0054】
溶液、シロップ剤およびエリキシル剤などの経口用液体は、所与の量が所定量の本化合物を含むような単位製剤形態に調製することができる。シロップ剤は、例えば、好適に風味付けした水溶液中に本化合物を溶解させることによって調製可能であり、エリキシル剤は、非毒性のアルコールビヒクルを使用することによって調製される。懸濁液は、一般的に、非毒性ビヒクル中に化合物を分散させることにより製剤化することができる。可溶化剤および乳化剤、例えば、エトキシ化イソステアリルアルコールおよびポリオキシエチレンソルビトールエーテル、保存剤;風味添加剤、例えば、ハッカ油、または天然甘味料、サッカリン、あるいは他の人工甘味料;等も添加することができる。
【0055】
必要に応じて、経口投与用の用量単位製剤をマイクロカプセル化することができる。この製剤も、例えば、粒状物質をポリマー、ワックス等でコーティングまたは包埋することによって、放出を延長または持続するように調製することができる。
【0056】
また、式(I)の化合物ならびにその塩、溶媒和物および生理学上機能的な誘導体は、リポソーム送達系、例えば、小型単層小胞、大型単層小胞および多層小胞の形態で投与することができる。リポソームは、コレステロール、ステアリルアミンまたはホスファチジルコリンなどの種々のリン脂質から形成され得る。
【0057】
また、式(I)の化合物ならびにその塩、溶媒和物および生理学上機能的な誘導体は、その化合物分子が結合されている個々の担体としてモノクローナル抗体を使用することによって送達することもできる。また該化合物は、標的を設定することができる医薬品担体としての可溶性ポリマーと結合させることもできる。そのようなポリマーとしては、ポリビニルピロリドン(PVP)、ピラン共重合体、ポリヒドロキシプロピルメタクリルアミド-フェノール、ポリヒドロキシエチルアスパルトアミドフェノール、またはパルミトイル残基で置換されているポリエチレンオキシドポリリシンを挙げることができる。さらに、本化合物は、医薬品の制御放出を達成するのに有用な生分解性ポリマーのクラス、例えば、ポリ乳酸、ポリイプシロンカプロラクトン、ポリヒドロキシ酪酸、ポリオルトエステル、ポリアセタール、ポリジヒドロピラン、ポリシアノアクリレート、およびヒドロゲルの架橋結合型または両親媒性のブロック共重合体に結合させることができる。
【0058】
経皮投与に適した医薬製剤は、長時間にわたって服用者の表皮との密接な接触を保つことを意図する個別の貼付剤として提供することができる。例えば、有効成分は、Pharmaceutical Research, 3(6), 318 (1986)に一般的に記載されているようなイオン導入によって貼付剤から送達することができる。なお、前記文献は、そのような送達系に関して参照により本明細書に組み入れるものとする。
【0059】
局所投与に適した製剤は、軟膏剤、クリーム剤、懸濁液、ローション剤、散剤、溶液、泥膏、ゲル剤、噴霧剤、エアロゾルまたは油剤として製剤化することができる。
【0060】
眼部または他の外部組織(例えば、口および皮膚)の治療については、局所軟膏またはクリームとして製剤を適用することができる。軟膏で製剤化する場合、有効成分はパラフィン性または水混和性軟膏基剤のいずれかを用いることができる。あるいは、有効成分を水中油滴型クリーム基剤または油中水滴型基剤を含むクリーム剤で製剤化することができる。眼部への局所投与に適した製剤には、有効成分を好適な担体、特に水溶性溶媒中に溶解または懸濁させた目薬が含まれる。口内への局所投与に適した製剤には、ロゼンジ、香錠および口内洗浄液が含まれる。
【0061】
担体が固体である場合、経鼻投与に適した医薬製剤は、例えば、20〜500ミクロンの範囲の粒子径を有する粗末が含まれる。散剤は、鼻から吸い込む方法で、すなわち、鼻に接近させた散剤入りの容器から鼻腔を通して急速に吸入することによって投与する。担体が液体である場合、鼻内噴霧として、または点鼻液としての投与に適した製剤には、有効成分の水溶性または油性溶液が含まれる。
【0062】
吸入による投与に適した医薬製剤には、微粒子の粉剤または噴霧剤が含まれるが、これらは、様々なタイプの定量型用量加圧式エアロゾル、噴霧器または注入器の手段によって生成され得る。
【0063】
直腸内投与に適した医薬製剤は、坐剤として、または浣腸剤として提供され得る。
【0064】
膣投与に適した医薬製剤は、ペッサリー、タンポン、クリーム剤、ゲル剤、泥膏、フォーム剤、または噴霧剤として提供することができる。
【0065】
非経口投与に適した医薬製剤には、酸化防止剤、バッファー、静菌剤、および対象の服用者の血液と等張の製剤にする溶質を含有し得る水溶性および非水溶性の殺菌注射溶液;ならびに懸濁化剤および粘稠化剤を含有し得る水溶性および非水溶性の殺菌懸濁液が含まれる。これらの製剤は、単位投与用量容器または多回投与用量容器、例えば、密閉アンプルおよびバイアル等に入れて提供することができ、また、使用の直前に、殺菌液体担体(例えば、注射用水)の添加だけが必要であるフリーズドライ(凍結乾燥)状態で保存することができる。即時注射溶液および懸濁液は、殺菌済み散剤、顆粒剤および錠剤から調製することができる。
【0066】
本製剤は、上に詳しく記載した成分の他に、製剤のタイプを考慮して、当技術分野の慣用の他の薬剤を含むことができる。例えば、経口投与に好適な製剤には香味剤を含むことができる。
【0067】
本発明の化合物ならびにその塩、溶媒和物および生理学上機能的な誘導体は、単独で、または本明細書に記載した疾患を治療するための他の治療用薬剤と組み合わせて使用することができる。例えば、骨粗鬆症治療では、他の骨粗鬆症剤との組み合わせが考えられる。従って、例えば、本発明による骨粗鬆症組み合わせ治療は、少なくとも1種の式(I)の化合物またはその塩、溶媒和物もしくは生理学上機能的な誘導体、あるいはそれらの組合せの投与と、少なくとも1種の他の薬剤の使用とを含む。例えば、骨粗鬆症の治療において、本発明の1種以上の化合物を、骨形成剤(bone building agent)と組合せることができる。
【0068】
式(I)で表される化合物および他の製薬的に活性な薬剤の量と、投与の相対的なタイミングは、所望の組み合わせによる治療効果を達成するために選択される。本発明の化合物と他の治療薬との組み合わせにおける投与は、(1)各化合物を含む単一の医薬組成物;または(2)それらの化合物の1種を各々含む個別の医薬組成物での併用投与による組み合わせであってよい。あるいは、組み合わせは、最初に1つの治療薬を投与し、続いて別の治療薬を投与するか、あるいはその逆の投与を行う連続法で別々に投与することができる。そのような連続投与は、時間を置かなくてもよく、あるいは時間を置いてもよい。従って、前記組み合わせを、一緒に、あるいは別々に投与してもよく、別々に投与する場合は、投与は同時にまたは任意の順番で連続的に行ってもよい。
【0069】
記載のとおり、有望な添加可能な骨粗鬆症治療薬の1つは、骨形成(同化)剤である。骨ミネラル濃度などのパラメーターを、抗再吸収薬で達成され得るものよりも高めることができる。場合によっては、そのような同化剤は、骨梁の連結性(trabecular connectivity)を高め、骨の構造をさらに完全な状態に導くことができる。
【0070】
他の有望な治療の組み合わせには、成長促進剤、成長ホルモン分泌促進物質、成長ホルモン放出因子およびその類似体、成長ホルモンおよびその類似体、ソマトメジン、α-アドレナリンアゴニスト、セロトニン5-HTDアゴニスト、選択的セロトニン再取り込み阻害剤、ソマトスタチンまたはその放出を阻害する薬剤、5-α-還元酵素阻害剤、アロマターゼ阻害薬、GnRH阻害剤、副甲状腺ホルモン、ビスホスホネート、エストロゲン、テストステロン、プロゲステロン受容体アゴニストと組合せた、および/または本発明の別の化合物を含むSERMなどの核内ホルモン受容体の他のモジュレーターと組合せた、本発明の化合物が含まれる。
【0071】
以下に限定されるものではないが、例としては、抗糖尿剤、抗骨粗鬆症剤、抗肥満剤、抗炎症剤、抗不安剤、抗うつ剤、抗昇圧剤、抗血小板剤、抗血栓症剤および血栓溶解剤、強心性配糖体、コレステロールまたは脂質低下剤、ミネラルコルチコイド受容体アンタゴニスト、ホスホジエステラーゼ阻害薬、キナーゼ阻害剤、甲状腺擬似体、同化剤、ウイルス治療剤、認知障害治療、睡眠障害治療、性機能障害治療、避妊薬、細胞毒性薬、放射線治療、抗増殖剤、および抗腫瘍剤と、本発明の1つ以上の化合物の組み合わせが挙げられる。さらに、本発明の化合物は、アミノ酸、トリグリセリド、ビタミン、ミネラル、クレアチン、ピロ酸(piloic acid)、カルニチン、または補酵素Q10などの栄養補給剤と組み合わせることもできる。
【0072】
本発明の一態様は、これらに限定されるものではないが、骨粗鬆症、骨鉱物質消失、骨量、密度または成長の減少、骨関節炎、骨折修復および治癒の促進、関節置換の治癒の促進、歯槽膿漏症、歯の修復または成長の促進、パジェット病、骨軟骨形成異常、筋肉消耗、筋力および筋機能の維持および増強、脆さ(frailty)または加齢に伴う機能低下(「ARFD」)、サルコぺニア、慢性疲労症候群、慢性筋肉痛、急性疲労症候群、創傷治癒の促進、感覚機能の維持、慢性肝炎、AIDS、無重量感、火傷および外傷の回復、血小板減少症、短腸症候群、過敏性腸症候群、炎症性腸疾患、クローン病および潰瘍性大腸炎、肥満、カヘキシーまたは老化に伴う拒食症を含む摂食障害、副腎皮質機能亢進症およびクッシング症候群、心血管疾患または心機能不全、うっ血性心不全、高血圧、乳癌、乳房、脳、皮膚、卵巣、膀胱、リンパ、肝臓、腎臓、子宮、膵臓、子宮内膜、肺、結腸および前立腺を含む、アンドロゲン受容体を含有する悪性腫瘍細胞、前立腺肥大、多毛、ざ瘡、脂漏、男性ホルモン性脱毛症、貧血、超多毛性、前立腺の腺腫および腫瘍形成、高インスリン血症、インスリン耐性、糖尿病、X症候群、異脂肪血症、尿失禁、アテローム性動脈硬化症、性欲増強、性機能障害、鬱病、抑鬱症状、神経質、短気、ストレス、精神的能力の低下および低自尊心、認知機能の改善、子宮内膜症、多嚢胞性卵巣症候群、子癇前症の予防、月経前症候群、避妊、子宮類線維症、および/または大動脈平滑筋細胞増殖、膣乾燥、心因掻痒、性交疼痛症、排尿障害、頻尿、尿路感染、高コレステロール血症、高脂血症、末梢血管疾患、再狭窄、血管痙攣、免疫反応に起因する血管壁損傷、アルツハイマー病、骨疾患、老化、炎症、慢性関節リウマチ、呼吸器疾患、肺気腫、再潅流傷害、ウイルス性肝炎、結核、乾癬、筋萎縮性側索硬化症、卒中、CNS外傷、痴呆、神経変性、乳房痛および月経困難症、更年期障害または閉経後障害、血管運動症状、尿生殖萎縮または外陰膣萎縮、萎縮性膣炎、女性性機能不全、性欲亢進目的、性的欲求低下障害の治療目的、性的刺激障害、オルガスムスの頻度および強度の向上目的、膣痙、オステオペニア、子宮内膜症、BPH(良性前立腺肥大)、自己免疫性疾患、橋本甲状腺炎、SLE(全身性エリテマトーデス)、重症筋無力症、あるいは虚血心筋の再灌流損傷を含む、種々の障害の治療または予防における本発明の化合物の使用である。
【0073】
特に、本発明の化合物は、更年期障害または閉経後障害、血管運動症状、尿生殖萎縮または外陰膣萎縮、萎縮性膣炎、女性性機能不全、乳癌、抑鬱症状、糖尿病、骨鉱物質消失の治療、ならびに骨粗鬆症の治療および/または予防において、単独で、あるいは他の薬剤との組み合わせで有用であると考えられる。
【0074】
本発明の化合物は、周知の標準的な合成方法を含む種々の方法によって製造することができる。例として一般的合成法を以下に述べ、次いで、本発明の具体的な化合物を実施例で調製する。
【0075】
以下に記載される例において、感受性基または反応基に対する保護基は、合成化学の一般的な原理に従って必要に応じて用いる。保護基は、有機合成の標準方法に従って処理する(T. W. GreenおよびP. G. M. Wuts (1991) Protecting Groups in Organic Synthesis, John Wiley & Sons、保護基に関して、参照により本明細書に組み入れるものとする)。これらの基は、当業者に容易に理解される方法を用いて、本化合物の合成の都合のよい段階で除去する。方法の選択、並びにこれらの実施の反応条件および順序は、式(I)の化合物の調製に従うものとする。
【0076】
当業者は、立体中心が式(I)の化合物に存在するかどうかについて理解するであろう。従って、本発明にはあらゆる立体異性体が含まれており、ラセミ化合物だけでなく各鏡像異性体も同様に含まれる。化合物を1つの鏡像異性体として所望する場合、当技術分野で公知である立体特異的合成によって、最終産物もしくは任意の都合のよい中間体の分割によって、またはキラルクロマトグラフ法によって、そのような化合物を得ることができる。最終産物、中間体または出発原料の分割は、当技術分野で公知の任意の好適な方法により達成することができる。例えば、E. L. Eliel, S. H. Wilen, およびL. N. Mander (Wiley-Interscience, 1994)によるStereochemistry of Organic Compoundsを参照されたい。なお、この文献は、立体化学に関して、参照により本明細書に組み入れるものとする。
【0077】
実験セクション
略語:
本明細書では、これらの方法、スキームおよび実施例の中で用いられている記号および表記は、最新の科学文献(例えば、the Journal of the American Chemical Societyまたはthe Journal of Biological Chemistry)で用いられているものに従う。特に、実施例および明細書全体にわたって、以下の略語を用いることができる:
g(グラム); mg(ミリグラム);
L(リットル); mL(ミリリットル);
μL(マイクロリットル); psi (ポンド毎平方インチ);
M(モル); mM(ミリモル);
Hz(ヘルツ); MHz(メガヘルツ);
mol(モル); mmol(ミリモル);
RT(室温); h(時間);
d(日); EI(電子衝撃);
min(分); TLC(薄層クロマトグラフィー);
mp(融点); RP(逆相);
Tr(保持時間); TFA(トリフルオロ酢酸);
TEA(トリエチルアミン); THF(テトラヒドロフラン);
TFAA(トリフルオロ酢酸無水物); CD3OD(重水素化メタノール);
CDCl3(重水素化クロロホルム); DMSO(ジメチルスルホキシド);
SiO2(シリカ); atm(気圧);
EtOAc(EtOAc); CHCl3(クロロホルム);
HCl(塩酸); Ac(アセチル);
DMF(N,N-ジメチルホルムアミド); Me(メチル);
Cs2CO3(炭酸セシウム); EtOH(エタノール);
Et(エチル); tBu(tert-ブチル);
MeOH(メタノール); CH2Cl2(ジクロロメタン);
MgSO4(硫酸マグネシウム); CH3CN(アセトニトリル);
K2CO3(炭酸カリウム); TiCl4(四塩化チタン);
EtOAc(EtOAc); CO2(二酸化炭素);
Pd(OAc)2(酢酸パラジウム); Et2O(ジエチルエーテル);
P(o-tolyl)3(トリ-o-トリルホスフィン); Na2SO4(硫酸ナトリウム);
NaH(水素化ナトリウム); DME(1,2-ジメトキシエタン);
NaI(ヨウ化ナトリウム); NaOH(水酸化ナトリウム);
NH4Cl(塩化アンモニウム); NaHCO3(重炭酸ナトリウム);
AlCl3(塩化アルミニウム); (C2H5O)2P(O)H(亜燐酸ジエチル);
NaN3(アジ化ナトリウム); CBR4(四臭化炭素);
PPh(トリフェニルホスフィン); CuI(ヨウ化銅(I));
Pd(Ph3P)4(テトラキス(トリフェニルホスフィン)パラジウム(0));
(iPrO)3B(ホウ酸トリイソプロピル); nBuLi(ブチルリチウム);
Na2CO3(炭酸ナトリウム); DMAP(4-(ジメチルアミノ)ピリジン);
eq(当量);
HRMS(高分解能質量分析);
LCMS(液体クロマトグラフィー質量分析);
LRMS(低分解能質量分析);
APCI(大気圧化学イオン化);
LiHMDS(リチウムビス(トリメチルシリル)アミド);
Pd(Ph3P)2Cl2(ジクロロビス(トリフェニルホスフィン)パラジウム(II));
EDC(N-(3-ジメチルアミノプロピル)-N'-エチルカルボジイミド;
dpppe(1,5-ビス(ジフェニルホスファニル)ペンタン;
DMAc(N,N-ジメチルアセトアミド);
HPLC(高速液体クロマトグラフィー);
tmeda(N,N,N',N',-テトラメチルエチレンジアミン);
Pd2(dba)3(ジパラジウムトリス(ジベンジリデンアセトン))。
【0078】
特に記載がない限り、試薬および溶媒は販売業者から入手し、さらなる精製は行わずに用いた。また、特に明記しない限り、全ての反応は室温で行い、全ての温度は℃(摂氏度)で表す。
【0079】
薄層クロマトグラフィー(TLC)は、シリカゲル60 F254 プレコートプレート上で実施した。検出は、紫外線(254nm)に曝露することにより行った。フラッシュ(flash)およびフラッシュ(flush)カラムクロマトグラフィーは、シリカゲル60を用いて行なった。逆相分取および分析HPLCは、C18カラムと調節剤として0.05% TFAを用いるアセトニトリル:水勾配を使用して行った。
【0080】
化合物の純度および特性は、1H-NMR、液体クロマトグラフィー質量分析(LCMS)、高分解能質量分析(HRMS)、燃焼(元素)分析、HPLC、および融点によって測定した。一般式Iの化合物は、一般的に、90%を超える(>90%)純度を有することが確認された。
【0081】
1H NMRスペクトルは、Varian INOVA-300およびVarian INOVA-400計器(intrument)に記録した。化学シフトは、百万分の一(ppm、δ単位)で表した。結合定数はヘルツ(Hz)単位である。分裂パターンは見かけの多重度を記載しており、s(一重線)、d(二重線)、dd(二重線の二重線)、t(三重線)、q(四重線)、m(多重線)またはbr(幅広)として示している。
【0082】
低分解能質量スペクトルは、Atmospheric Pressure Chemical Ionization (APCI)またはESI Ionization (ESI)のいずれかを用いて、Micromass Ltd., Altricham, UK製のMicromass ZQ、Micromass ZMD、Micromass QuattroMicroおよびMicromass GCTの各機器により得た。
【0083】
高解像度質量スペクトルデータ(HRMS)は、Micromass LCTおよびMicromass GCTの各機器で記録した。
【0084】
燃焼分析は、Atlantic Microlab, Inc. (Norcross, Georgia)により行われた。
【0085】
融点はオープンキャピラリチューブで記録し、未修正である。
【0086】
太字の数字は、以下のスキームに表示した化合物の参照符である。
【0087】
スキーム1
置換シクロアルキリデンジフェニルエチレンまでの一般的経路
【化5】

【0088】
対称シクロアルキリデンジフェニルエチレンVIは、スキーム1に示したように、ベンゾフェノンIVとケトンV間のマクマリーカップリング反応により得られる。マクマリー反応条件は、Mukaiyama et al., Chem. Lett. (1973), 1041; Lenoir, Synthesis, (1977), 553; Lenoir and Burghard, J. Chem. Res. (S) (1980), 396; McMurry, Chem. Rev. (1989), 89, 1513-1524; McMurry, Acc. Chem. Res. (1983) 16, 405-511;およびS. Gauthier et al., J. Org. Chem., (1996), 61, 3890-3893を参照されたい。なお、各文献は、そのような教示に関して、参照により本明細書に組み入れるものとする。ケトンVは、市販品を購入可能であるか、あるいは当業者によって認められている合成法により調製することができる。ベンゾフェノンIVは、市販品を購入可能であるか、あるいは当業者によって認められている方法を用いて酸塩化物とアニソール誘導体間のフリーデル−クラフツアシル化により調製することができる。フリーデル-クラフツ反応の条件については、Friedel-Crafts and Related Reactions, G. A. Olah, 編集, Vol 3, Pt 1, pp 1-382, J. Wiley and Sons, New York (1964);G. A. Olah, Friedel-Crafts Chemistry, Wiley Interscience, New York, (1973);およびLarock, R. C., Comprehensive Organic Transformations, VCH Publishers, New York, 1989を参照されたい。なお、各文献は、そのような教示に関して、参照により本明細書に組み入れるものとする。あるいは、IVなどのベンゾフェノンは、WeinrebアミドII誘導体をアリールグリニャール試薬IIIで処理することによって調製することができる。Tetrahedron Letters, 22(39), 3815-18; 19)を参照されたい。なお、そのような教示に関して、参照により本明細書に組み入れるものとする。
【0089】
VIのR3置換基についてさらに合成(elaboration)を行なうことができる。例えば、R3がエステルである場合、けん化によりカルボン酸VIIが得られ、また、LAHなどの還元剤で処理することにより対応するアルコールVIIIが得られる。酸VIIはカルボキサミドIXに変換することもできる。ジクロロメタン中のEDCおよびDMAPなどのカップリング剤の存在下で酸(VII)をアミンで処理するとアミドIXが得られる。あるいは、トルエン中の塩化オキサリルおよびDMFを用いて酸VIIを酸塩化物に変換し、続いてアミンによりその粗製酸塩化物を処理すると、アミドIXが得られる。カルボン酸からアミドへの変換については、Larock, R. C., Comprehensive Organic Transformations, VCH Publishers, New York, 1989を参照されたい。なお、そのような教示に関して、参照により本明細書に組み入れるものとする。
【0090】
スキーム2
シクロアルキリデンジフェニルエチレンアクリル酸およびアクリルアミドまでの一般的経路
【化6】

【0091】
アクリル酸XIは、スキーム2に示したように、化合物VIから2ステップで調製することができる。アクリレートエステル(式中、表示されたRは好適なアルキル基(例えば、メチル、エチル、tert-ブチル)である)とVIとのHeckカップリングによりXが得られる。Heck反応の概説については、Heck, Acc. Chem. Res. (1979), 12, 146-151; Heck, Pure Appl. Chem. (1978), 50, 691-701;R. F. Heck, Palladium Reagents in Oraganic Syntheses, Academic Press, New York (1985), 179-321, Bender, Stakem, and Heck, J. Org. Chem. (1982), 47, 1278;Spencer, J. Organomet. Chem. (1983), 258, 101;並びにBrase, Stefan; De Meijere, Armin. Palladium-catalyzed Coupling of Oranyl Halides to Alkenes - the Heck Reaction, Metal-Catalyzed Cross-Coupling Reactions (1998), 99-166, Publisher: Wiley-VCH Verlag GmbH, Weinheim, Germanyを参照されたい。なお、各文献は、そのような教示に関して、参照により本明細書に組み入れるものとする。Xのエステル加水分解によりアクリル酸XIが得られる。
【0092】
R1がFであるXIの類似体は、(4-ブロモフェニル)(4-フルオロフェニル)メタノンを用いることによって、スキーム1およびスキーム2に示される方法により調製することができるが、これは、文献に記載されている方法(例えば、Z. Vejdelekら, Collect. Czech. Chem. Commun., (1984), 49(11), 2649-2660を参照されたい。なお、この文献は、そのような教示に関して、参照により本明細書に組み入れるものとする)によって調製することができる。
【0093】
アクリル酸XIは、スキーム2で示したように、アミドに変換することができる。ジクロロメタン中のEDCおよびDMAPなどのカップリング剤の存在下、アクリル酸(XI)をアミンで処理するとアミドXIIが得られる。あるいは、トルエン中の塩化オキサリルおよびDMFを用いて、アクリル酸XIを酸塩化物に変換し、続いて、その粗製酸塩化物をアミンで処理するとアミドXIIが得られる。カルボン酸からアミドへの変換については、Larock, R. C., Comprehensive Organic Transformations, VCH Publishers, New York, 1989を参照されたい。なお、そのような教示に関して、参照により本明細書に組み入れるものとする。
【0094】
スキーム3
ハロゲン化アリールVIからシクロアルキリデンジフェニルエチレンまでの一般的経路
【化7】

【0095】
シクロアルキリデンVIは、スキーム3に示すように、種々の化合物の調製に使用可能な用途の広い中間体である。
【0096】
Suzuki反応条件を用いて、VIをアリールまたはヘテロアリール置換ボロン酸とカップリングすることによりXIIIが得られる。Suzukiカップリング反応の反応条件については、Miyaura, N., Suzuki, A. Chem. Rev. 1995, 95, 2457-2483; Suzuki, A., J. Oranometallic Chem. (1999), 576, 147-168;およびSuzuki, A. in Metal-catalyzed Cross-coupling Reactions, Diederich, F., and Stang, P. J., Eds.;Wiley-VCH: New York, (1998), pp. 49-97を参照されたい。なお、各文献は、そのような教示に関して、参照により本明細書に組み入れるものとする。あるいは、XIIIは、ボロン酸XVとハロゲン化アリールまたはハロゲン化ヘテロアリールとのSuzukiカップリング反応により調製することができる。ボロン酸XVは、ブチルリチウムを用いてVIを金属ハロゲン交換し、得られた有機リチウムをホウ酸トリイソプロピルで処理し、その後加水分解することにより調製することができる。反応条件については、X. Dengら, J. Org. Chem., (2002), 67(15), 5279-5283、およびP. J. Hajdukら, J. Amer. Chem. Soc., (1997), 119(25), 5818-5827を参照されたい。なお、各文献は、そのような教示に関して、参照により本明細書に組み入れるものとする。
【0097】
ブチルリチウムを用いてVIの金属ハロゲン交換を行い、次いで、二酸化炭素またはDMFで処理することによって、それぞれ安息香酸XVIおよびベンズアルデヒドXVIIが得られる。反応条件については、T. Mizunoら, Tetrahedron, (1999), 55(31), 9455-9468; J. W. Lampeら, J. Med. Chem., (2002), 45(12), 2624-2643; R. G. Leendersら, Bioorg. Med. Chem. (1999), 7(8), 1597-1610; およびA. Endoら, J. Amer. Chem. Soc., (2002), 124(23), 6552-6554を参照されたい。なお、各文献は、そのような教示に関して、参照により本明細書に組み入れるものとする。
【0098】
アミドは、スキーム2に示した方法によって、XVIから調製することができる。ベンズアルデヒドXVIIは、Wadsworth-Emmons化学によってアクリレートエステルXに変換することができる(Wadsworth-Emmons化学については、J. BoutagyおよびR. Thomas Chem. Rev. (1974), 74, 87-99; Wadsworth, Org. React (1977), 25, 73-253; Y. Momoseら, J. Med. Chem., (2002), 45(7), 1518-1534; 並びにS. D. Bullら, J. Chem. Soc. Perkin Trans I, (2001), 23, 3112-3121を参照されたい。なお、各文献は、そのような教示に関して参照により本明細書に組み入れるものとする)。
【0099】
VIとプロピオル酸エステル、プロピオル酸アルコールまたは(トリメチルシリル)アセチレンとのSonagashiraカップリング法を行うことにより、芳香族アルキンXIVが得られる。Campbell, I. B. "The Sonagashira Cu-Pd-catalyzed alkyne coupling Reaction", Organocopper Reagents, Taylor, Richard J. K. 編集, (1994), 217-35. 出版社:IRL Press, Oxford, UK; G. C. Nwokogu ら, J. Org. Chem., (1994), 59(9), 2506-2510; 並びにA. P. Kozikowski J. Med. Chem. (2000), 43 (6), 1215-1222、並びにT. EckertおよびJ. Ipaktschi Synth. Commun. (1998), 28, 327-336を参照されたい。なお、各文献は、そのような教示に関して、参照により本明細書に組み入れるものとする。化合物XIVは、さらに処理して、さらなる新しい類似体を調製することができる。例えば、表示されたR基がTMSである場合、TMS基を除去すると対応する末端アセチレンを得ることができる。表示されたR基がエステルである場合、加水分解または還元を行うと、それぞれ対応する酸またはアルコールが得られる(スキーム1に示された条件を参照されたい)。
【0100】
スキーム4
シクロアルキリデンジフェニルエチレンオキサゾールの一般的合成
【化8】

【0101】
二置換オキサゾールXVIIIは、スキーム4に示されるように、安息香酸XVIから2ステップで調製される。XVIを塩化オキサリルで処理することによって酸塩化物XIXが得られ、次いで、塩基の存在下に1H-1,2,3-トリアゾールで処理することによってオキサゾールXVIIIが得られる。芳香族酸塩化物またはベンズアミドからオキサゾール形成を導く反応条件については、Murugesan, N.ら, J. Med. Chem. (2000), 43, 3111-3117を参照されたい。なお、該文献は、そのような教示に関して、参照により本明細書に組み入れるものとする。
【0102】
スキーム5
シクロアルキリデンジフェニルエチレンスルホンアミドおよびアミドの一般的合成
【化9】

【0103】
ニトロアニリンXXは、スキーム5に示されるように、スルホンアミド(XXIV)またはアミド(XXV)に変換することができる。XXを亜ジチオン酸ナトリウムなどの還元剤で処理することによってアニリンXXIが得られる。XXIを塩化スルホニルまたは酸塩化物でアシル化すると、それぞれ、スルホンアミドXXIIまたはカルボキサミドXXIIIが得られる。スキーム1に示されるように、XXIIまたはXXIIIをケトンVでマクマリーカップリングを実施することにより、XXIVまたはXXVが得られる。XXIを当業者に公知の方法により還元的アルキル化を行うとアニリンXXVIが得られ、次いで、上述のように処理することによりスルホンアミドXXVIIまたはアミドXXVIIIを得ることができる。XXVIIまたはXXVIIIをケトンVで処理することにより、スルホンアミドXXIXまたはアミドXXXが得られる。
【0104】
スキーム6
オキシアルキル置換シクロアルキリデンジフェニルエチレンの合成
【化8】

【0105】
種々のアルキル誘導体は、スキーム6に示したように、フェノールXXXIのO-アルキル化によって2ステップまたは3ステップで調製することができる。上述のように、XXXIに類似の化合物は、適切に置換されているベンゾフェノンとケトンVの間のマクマリーカップリングによって調製することができる。マクマリー反応条件については、上記スキーム1で引用されている文献を参照されたい。XXXIのO-アルキル化は、好適な塩基とXXXII(式中、表示されたR基は好適なアルキル基(例えば、メチル、エチル、tert-ブチル等)である)などのハロエステルの存在下で達成することができる。得られたエステルXXXIIIをけん化すると酸XXXIVが得られる。エステルXXXIIIのアルコールXXXVへの変換は、水素化アルミニウムリチウム(LAH)などの還元剤で処理することによって達成することができる。同様に、フェノールXXXIをハロアセトニトリルXXXVIまたはハロアルコールXXXVIIでアルキル化することにより、それぞれ化合物XXXVIIIおよびXXXIXを得ることができる。関連のフェノールアルキル化反応の例については、Rubin, V.ら, Bioorganic & Med. Chem. (2001), 9, 1579-1586を参照されたい。なお、そのような教示に関して、参照により本明細書に組み入れるものとする。
【実施例】
【0106】
以下の具体的な実施例は例証として記載したものであり、本発明の範囲を限定するものと解釈されてはならない。簡便な参照のために、本明細書において特定の化合物を太字(下線)の数を用いて表す。この省略した参照法を用いる場合、それは合成された具体的な化合物ではなく一般的化合物を意味する。
【0107】
実施例1(3)
(2E)-3-{4-[シクロヘプチリデン(フェニル)メチル]フェニル}プロパ-2-エン酸 (3)
【化11】

【0108】
工程1 : [(4-ブロモフェニル)(フェニル)メチレン]シクロヘプタン(1)
Zn粉末(4.80 g、73.5 mmol)とTHF (100 mL)の撹拌懸濁物に、N2 下でTiCl4 (3.9 mL, 35.7 mmol)を滴下した。生じた黄色い懸濁物を室温にて45分撹拌し、その後2.5時間還流した。この還流反応物に、THF (40 mL)中のシクロヘプタノン(3.42 g, 30.6 mmol)と4-ブロモベンゾフェノン (2.54 g, 9.75 mmol)の溶液を、15分にわたり滴下しながら加えた。2時間後に反応を室温に冷却し、その後、水(75 mL)と10% Na2CO3水溶液(75 mL)を順次滴下することによりクエンチ(反応停止)した。この混合物を室温で一晩撹拌し、その後、EtOAc (300 mL)で希釈し、次いでセライトのパッドで濾過した。このセライトのパッドをEtOAc (250 mL)ですすぎ、無色の濾液を分液漏斗に移した。有機画分を塩水(300 mL)で洗浄し、乾燥させ(Na2SO4)、その後6.50 gの無色の油状物へと濃縮した。この油状物を、シリカゲル(150 g)上でヘキサンに続く2% EtOAc:ヘキサンを使用するカラムクロマトグラフィーにかけることにより精製し、生成物1を無色の油状物として単離し、これを放置して固化させた(2.54 g, 76%)。

【0109】
工程2: tert-ブチル(2E)-3-{4-[シクロヘプチリデン(フェニル)メチル]フェニル}プロパ-2-エノエート (2)
1 (0.77 g, 2.24 mmol), TEA (1.86 mL, 13.4 mmol), t-ブチルアクリレート(1.96mL, 13.4 mmol), Pd(OAc)2 (0.12 g, 0.50 mmol), P(o-トリル)3 (0.28 g, 0.90 mmol)およびCH3CNの撹拌懸濁物を、N2下で撹拌しながら還流した。2時間後に加熱を中断し、反応物を、EtOAc (50 mL)および水(50 mL)で希釈した。セライトのパッドを用いてこの混合物を濾過し、その後、濾液を分液漏斗に移した。有機画分を、50 mL塩水(50 mL)を用いて洗浄し、乾燥させ(MgSO4)、濾過し、1.39 gの琥珀色の油状物へと濃縮した。粗生成物を、ヘキサンから5% EtOAc:ヘキサンへの濃度勾配を用いたシリカゲル上でのフラッシュクロマトグラフィーにより精製した。生成物2を、無色の粘性油状物として単離した(900 mg, 100%)。

【0110】
工程3: (2E)-3-{4-[シクロヘプチリデン(フェニル)メチル]フェニル}プロパ-2-エン酸(3)
CH2Cl2 (25 mL)中の2 (0.77 g, 2.24 mmol)の撹拌溶液に、0℃にて、TFAを15分にわたり滴下した。淡黄色の反応液を0℃にて1時間撹拌し、その後室温にて15分放置した。反応液を粘性の油状物へと濃縮し、CH2Cl2 (20 mL)に再度溶解させ、その後、ゴム状の固形物へと再度濃縮した。この粗生成物をエーテル/ヘキサンより結晶化させ、表題の化合物(3)を白色の固形物 (0.30 g, 41%)として得た。

【0111】
C23H24O2の認知機能計算値: C, 83.07; H, 7.30; 実測値: C, 82.73; H, 7.25。
【0112】
実施例2 (4)
(2E)-3-{4-[シクロヘプチリデン(フェニル)メチル]フェニル}プロパ-2-エンアミド (4)
【化12】

【0113】
[(4-ブロモフェニル)(フェニル)メチレン]シクロヘプタン (1) (0.50 g, 1.47 mmol), 10 TEA (1.21 mL, 8.71 mmol), アクリルアミド(0.62 g, 8.73 mmol), Pd(OAc)2 (0.080 g, 0.36 mmol), P(o-トリル)3 (0.19 g, 0.63 mmol)およびCH3CNの懸濁物をN2下で還流しながら撹拌した。2時間後に加熱を中止し、反応液をEtOAc (50 mL)および水(50 mL)で希釈した。セライトのパッドを用いてこの混合物を濾過し、その後、濾液を分液漏斗に移した。有機画分を、塩水(50 mL)を用いて洗浄し、乾燥させ(MgSO4)、濾過し、その後、琥珀色の油状物へと濃縮した。この油状物を、ヘキサンから25% EtOAc:ヘキサンを経由する100% EtOAcへの濃度勾配を用いたシリカゲル(50 g)でのカラムクロマトグラフィーにより精製して淡黄色の固形物を得た。EtOAc (25 mL)を用いてこの固形物を摩砕することにより、164 mg (33%)の表題の化合物(4)を白色の固形物として得た。

【0114】
C23H25NO・0.1 H2Oの分析計算値: C, 82.67; H, 7.63; N, 4.19; 実測値: C, 82.75; H, 7.56; N, 4.20。
【0115】
実施例3 (6)
2-({4-[フェニル(3,3,5,5-テトラメチルシクロヘキシリデン)メチル]フェニル}オキシ)エタノール (6)
【化13】

【0116】
工程1:{4-[(2-ヒドロキシエチル)オキシ]フェニル}(フェニル)メタノン (5)
アセトン(50 mL)中の4-ヒドロキシベンゾフェノン (6.0 g, 29.7 mmol)の溶液に、K2CO3 (12.3 g, 89.0 mmol)および2-クロロエタノール (4.0 mL, 59.3 mmol)を添加し、その後、NaI (4.50 g, 29.7 mmol)を添加した。この反応混合物を窒素下で一晩還流した。この混合物を室温に冷却した。白色の固形物を濾過して除き、アセトン(100 mL)で洗浄した。濾液を濃縮して、いくらかの白色の固形物を伴う茶色い油状残留物を得た。EtOAc (200 mL)を添加し、白色の固形物を濾過して除き、その後50 mLのEtOAcを用いて洗浄した。濾液を、1N NaOH、水、塩水で洗浄しNa2SO4を用いて乾燥させた。濃縮により、淡黄色油状物が得られ、これをさらに、シリカゲルカラム上でヘキサンから60%EtOAc:ヘキサンへの濃度勾配を用いて溶出を行ったクロマトグラフィーにより精製し、5を、白色の固形物(1.52 g, 21%)として得た。

【0117】
工程2:2-({4-[フェニル(3,3,5,5-テトラメチルシクロヘキシリデン)メチル]フェニル}オキシ)エタノール (6)
THF (10 mL)中のZn (0.65 g, 9.91 mmol)の撹拌懸濁物に、TiCl4 (0.55 mL, 4.95 mmol)を滴下した。この混合物を窒素下で2.5時間にわたり還流した。室温に冷却後、THF (17 mL)中の5 (0.30 g, 1.24 mmol)と3,3,5,5-テトラメチルシクロヘキサノン(0.59 g, 3.71 mmol)の溶液を一度に添加した。この反応混合物をさらに2.5時間還流した。室温に冷却後、10% K2CO3 (40 mL)を用いて反応物をクエンチした。クエンチした反応混合物をセライトのパッドで濾過し、その後、パッドをEtOAc (100 mL)で洗浄した。この濾液を分液漏斗に移し、層を分離させ、その後、EtOAc (50 mL)を用いて水層を抽出した。有機抽出物を一緒にし、塩水で洗浄し、乾燥させ(Na2SO4)、その後、濃縮して淡黄色の油状物を得た。残留物をさらに、シリカゲルカラム上で、ヘキサンから20% EtOAc:ヘキサンへの濃度勾配を用いて溶出を行うクロマトグラフィーにより精製し、6を、白色の固形物 (0.35 g, 78%)として得た。融点131〜132℃。

【0118】
C25H32O2の分析計算値: C, 82.37; H, 8.85; 実測値: C, 82.11 ; H, 9.03。
【0119】
実施例4 (8)
2-{[2-({4-[フェニル(3,3,5,5-テトラメチルシクロヘキシリデン)メチル]フェニル}オキシ)エチル]オキシ}エタノール (8)
【化14】

【0120】
工程1 : [4-({2-[(2-ヒドロキシエチル)オキシ]エチル}オキシ)フェニル](フェニル)メタノン (7)
CH3CN (30 mL)中の4-ヒドロキシベンゾフェノン (4.0 g, 19.8 mmol) の懸濁物にK2CO3 (8.20 g, 59.3 mmol)を加えた。この混合物を窒素下で1時間にわたり還流した。室温に冷却後、2-(2-クロロエトキシ)エタノール(4.3 mL, 39.6 mmol)を加え、その後、NaI (3.00 g, 19.8 mmol)を加えた。この反応混合物を窒素下で一晩還流した。この混合物を室温に冷却し、EtOAc (50 mL)を加えた。沈殿した白色の固形物を濾過し、その後EtOAc (50 mL)で洗浄した。濾液を分液漏斗に移し、その後、1N NaOH、水、塩水で洗浄し、Na2SO4を用いて乾燥させた。濃縮により黄色の油状物が得られ、これをさらに、シリカゲルカラム上で、ヘキサンから70% EtOAc:ヘキサンへの濃度勾配を用いた溶出を行うクロマトグラフィーにより精製し、7を、無色の結晶物(4.96 g, 88%)として得た。融点31〜32℃。

【0121】
工程2: 2-{[2-({4-[フェニル(3,3,5,5-テトラメチルシクロヘキシリデン)メチル]フェニル}オキシ)エチル]オキシ}エタノール (8)
THF (10 mL)中のZn (0.59 g, 8.94 mmol)の撹拌懸濁物に、TiCl4 (0.50 mL, 4.47 mmol)を滴下した。この混合物を窒素下で2.5時間にわたり還流した。室温に冷却後、THF (15 mL)中の7 (0.32 g, 1.12 mmol)と3,3,5,5- テトラメチルシクロヘキサノン(0.53 g, 3.35 mmol)の溶液を添加し、次いで反応混合物をさらに2.5時間にわたり還流した。室温に冷却後、10% K2CO3 (40 mL)を用いて反応物をクエンチした。クエンチした反応混合物をセライトのパッドで濾過し、その後、パッドをEtOAc (100 mL)で洗浄した。濾液を分液漏斗に移し、層を分離し、EtOAc (50 mL)を用いて水層を抽出した。一緒にした有機抽出物を塩水で洗浄し、乾燥させ(Na2SO4)、濃縮して淡黄色の油状物とした。残留物をさらに、シリカゲルカラム上で、ヘキサンから45% EtOAc:ヘキサンへの濃度勾配を用いて溶出を行うクロマトグラフィーにより精製して、8を白色の固形物として得た。10:1のヘキサン:EtOAcからの結晶化により、無色の針状物 (0.27 g, 59%)が得られた。融点116〜117℃。

【0122】
C27H36O3の分析計算値: C, 79.37; H, 8.88; 実測値: C, 79.23; H, 8.95。
【0123】
実施例5(11)
({4-[(4-フルオロフェニル)(3,3,5,5-テトラメチルシクロヘキシリデン)メチル]フェニル}オキシ)酢酸 (11)
【化15】

【0124】
工程1 : 4-[(4-フルオロフェニル)(3,3,5,5-テトラメチルシクロヘキシリデン)メチル]フェノール (9)
1について記載したカップリング方法(実施例1 , 工程1)を用いた。(4-フルオロフェニル)(4-ヒドロキシフェニル)メタノン(4.32 g, 20 mmol), 3,3,5,5-テトラメチルシクロヘキサノン(9.26 g, 60 mmol), Zn (13 g, 200 mmol), TiCl4 (10.9 mL, 100 mmol), およびTHF (400 mL)の混合物を2.5時間にわたり還流した。標準的後処理およびそれに続く精製により、5.450 g (80%)の表題の生成物9を白色の固形物として得た。

【0125】
工程2:エチル({4-[(4-フルオロフェニル)(3,3,5,5-テトラメチルシクロヘキシリデン)メチル]フェニル}オキシ)アセテート (10)
4-[(4-フルオロフェニル)(3,3,5,5-テトラメチルシクロヘキシリデン)メチル]フェノール9 (0.339 g, 1.0 mmol), K2CO3 (0.276 g, 2.0 mmol), およびアセトン(40 mL) の撹拌懸濁物に、エチルブロモアセテート(0.221 mL, 2.5 mmol)を窒素雰囲気下で室温にて加えた。この反応混合物を6時間にわたり還流し、室温に冷却し、濾過した。濾液を減圧下で濃縮し、その後、粗生成物を、シリカゲル上でヘキサンおよびEtOAcを用いたフラッシュクロマトグラフィーにより精製して、0.340 g (80%)の化合物10 を白色の泡状物として得た。

【0126】
工程3: ({4-[(4-フルオロフェニル)(3,3,5,5-テトラメチルシクロヘキシリデン)メチル]フェニル}オキシ)酢酸 (11)
THF/EtOH (1:1, 8 mL)中のエチル({4-[(4-フルオロフェニル)(3,3,5,5-テトラメチルシクロヘキシリデン)メチル]フェニル}オキシ)アセテート(10) (0.290 g, 0.68 mmol)の溶液を、1N NaOH (4 mL)で70℃にて1時間にわたり処理した。この反応混合物を、20% HCl水溶液で酸性にし、その後EtOAcで抽出した。有機層を塩水で洗浄し、乾燥させ(Na2SO4)、その後、減圧下で濃縮して、粗生成物を得た。生成物を、クロロホルムとメタノールを溶離液として用いたフラッシュカラムクロマトグラフィーにより精製し、0.250 g (95%)の表題の化合物11を白色の固形物として得た。

【0127】
実施例6 (13)
4-({4-[(4-フルオロフェニル)(3,3,5,5-テトラメチルシクロヘキシリデン)メチル]フェニル}オキシ)ブタン酸 (13)
【化16】

【0128】
工程1 :エチル4-({4-[(4-フルオロフェニル)(3,3,5,5-テトラメチルシクロヘキシリデン)メチル]フェニル}オキシ)ブタノエート (12)
10 について記載したo-アルキル化方法(実施例5, 工程2)を使用した。4-[(4-フルオロフェニル)(3,3,5,5 テトラメチルシクロヘキシリデン)メチル]フェノール9 (0.590 g, 1.74 mmol), K2CO3 (0.482 g, 3.5 mmol), およびアセトン(50 mL)の撹拌懸濁物に、エチル4-ブロモブチレート (0.62 mL, 4.4 mmol)を窒素雰囲気下で室温にて加えた。この反応混合物を6時間にわたり還流し、室温に冷却し、その後濾過した。標準的な後処理およびその後の精製により0.712 g (90%)の化合物12を白色の泡状物として得た。

【0129】
工程2: 4-({4-[(4-フルオロフェニル)(3,3,5,5-テトラメチルシクロヘキシリデン)メチル]フェニル}オキシ)ブタン酸 (13)
11 について記載した加水分解方法(実施例5, 工程3)を用いた。THF/EtOH (1:1, 10 mL)中のエチル4-({4-[(4-フルオロフェニル)(3,3,5,5-テトラメチルシクロヘキシリデン)メチル]フェニル}オキシ)ブタノエート) (12) (0.665 g, 1.47 mmol)の溶液を、1N NaOH (5 mL, 過剰量)で70 ℃にて1時間にわたり処理した。この反応混合物を冷却し、その後、20% HCl水溶液(40 mL)に注ぎ込んだ。標準的な後処理およびその後の精製により0.525 g (84%)の表題の化合物13を白色の泡状物として得た。

【0130】
C27H33FO3の分析計算値 C, 76.39, H, 7.83, F, 4.47; 実測値: C, 76.30, H, 7.90, F, 4.52。
【0131】
実施例7 (14)
({4-[(4-フルオロフェニル)(3,3,5,5-テトラメチルシクロヘキシリデン)メチル]フェニル}オキシ)アセトニトリル (14)
【化17】

【0132】
10 について記載したo-アルキル化方法(実施例5, 工程2)を用いた。4-[(4-フルオロフェニル)(3,3,5,5-テトラメチルシクロヘキシリデン)メチル]フェノール9 (0.508 g, 1.5 mmol), K2CO3 (0.414 g, 3.0 mmol), およびアセトン(50 mL)の撹拌懸濁物に、N2 下で室温にて、ブロモアセトニトリル (0.21 mL, 3.0 mmol)を加えた。この反応混合物を4時間にわたり還流し、室温に冷却し、次いで、濾過した。標準的な後処理およびその後の精製により0.410g (72%)の表題化合物14を白色の泡状物として得た。融点100〜101℃。

【0133】
C25H28FNOの分析計算値, C, 79.54, H, 7.48, N, 3.71; 実測値: C, 79.21 , H, 7.46, N, 3.73。
【0134】
実施例8 (15)
2-({4-[(4-フルオロフェニル)(3,3,5,5-テトラメチルシクロヘキシリデン)メチル]フェニル}オキシ)エタノール (15)
【化18】

【0135】
無水THF (25 mL)中のエチル({4-[(4-フルオロフェニル)(3,3,5,5-テトラメチルシクロヘキシリデン)メチル]フェニル}オキシ)アセテート10 (0.580 g, 1.336 mmol)の溶液に、LiAlH4 (3.4 mL, 3.42 mmol, THF 中の1.0 M溶液)をN2 雰囲気下で室温にて滴下した。得られた溶液を室温にて0.5時間にわたり撹拌した。この反応混合物をEtOAc (10 mL)でクエンチし、その後、撹拌をさらに10分継続した。反応混合物を15% HCl水溶液(50 mL)に注ぎ込み、その後EtOAc (4×30 mL)で抽出した。一緒にした有機層を塩水(1×30 mL)で洗浄し、乾燥させ(Na2SO4)、その後減圧下で濃縮して粗生成物を得た。生成物を、溶離液としてヘキサン: EtOAc (19: 1から4: 1へ)を用いたシリカゲルカラムクロマトグラフィーにより精製し、0.41 g (79%)の表題の化合物(15)を白色の泡状物として得た。

【0136】
実施例9 (18)
(2E)-3-{4-[フェニル(3,3,5,5-テトラメチルシクロヘキシリデン)メチル]フェニル}-2-プロペン酸 (18)
【化19】

【0137】
工程1: 1-ブロモ-4-[フェニル(3,3,5,5-テトラメチルシクロヘキシリデン)メチル]ベンゼン (16)
N2 下における、Zn粉末(3.76 g, 57.5 mmol), 3,3,5,5-テトラメチルシクロヘキサノン(2.95 g, 19.2 mmol), 4-ブロモベンゾフェノン(5.00 g, 19.15 mmol)および無水THF (100 mL)の撹拌懸濁物を−10℃に冷却し、その後、トルエン (30 mL)中のTiCl4の1M溶液を10分にわたり滴下した。添加中、温度を0℃未満に維持した。添加が完了したら反応物を室温へと加温させ、その後90℃にて2時間にわたり加熱した。反応物を−10℃に冷却し、濃塩酸(15 mL)を滴下しその後、水(15 mL)を滴下した。30分の撹拌後に、EtOAc (100 mL)を加え、その後、淡黄色の2相混合物を水(2×75 mL)および塩水(1×75 mL)で洗浄し、次いで乾燥させ(MgSO4)、その後、濃縮して8.26 gの淡黄色油状物とした。粗製の油状物を、250 gシリカゲル上で2% EtOAc/ヘキサンを用いたカラムクロマトグラフィーにより精製し、4.17 g (58%)の表題化合物(16)を白色の固形物として得た。1H-NMRは、生成物(16)が、マクマリー反応中に形成されるピナコール中間体と一致する約8%の不純物で汚染されていることを示した。

【0138】
工程2:エチル(2E)-3-{4-[フェニル(3,3,5,5-テトラメチルシクロヘキシリデン)メチル]フェニル}-2-プロペノエート (17)
DMF (25 mL, 無水, Aldrich)中の16、Et3N、エチルアクリレートおよびジクロロビス(トリフェニルホスフィン)パラジウム(II)の黄色い溶液を、一晩、N2 下で110℃にて撹拌した。16時間後に反応を室温へと冷却し、濾過し、次いで濾液をエーテル(100 mL)と水(100 mL)で希釈した。エーテル層を水(2×75 mL)と塩水(1×74 mL)ですすぎ、その後乾燥させ (MgSO4)、次いで濃縮して5.75 gの黄色固形物とした。この粗生成物を、最初に、250 gシリカゲル上で2% EtOAc/ヘキサンを用いたカラムクロマトグラフィーにより精製して6.22 gの不純な白色の固形物を得た。ヘキサン (約100 mL)からの結晶化により2.39 g (55%)の表題化合物17を結晶質の白色の固形物として得た。

【0139】
工程3: (2E)-3-{4-[フェニル(3,3,5,5-テトラメチルシクロヘキシリデン)メチル]フェニル}-2-プロペン酸 (18)
17、THF (35 mL)および無水EtOH (35 mL)の混合物に1N NaOH水溶液 (46 mL)を加え、加熱還流した。90分後に反応を室温に冷却した。反応を1N HCl水溶液 (55 mL)およびEtOAc (100 mL)で希釈した。有機画分を、水(2×75 mL)および塩水(1000 mL)で洗浄し、その後乾燥させ(MgSO4)、次いで濃縮し白色の固形物とした。この固形物を、ヘキサン(25 mL)で摩砕し、その後、CH3CN (100 mL)から再結晶化させて、1.87 g (84%)の表題化合物18 を白色の固形物として得た。

【0140】
実施例10 (21)
4-[フェニル(3,3,5,5-テトラメチルシクロヘキシリデン)メチル]安息香酸 (21)
【化20】

【0141】
工程1 :メチル4-(フェニルカルボニル)ベンゾエート (19)
MeOH, 4-ベンゾイル安息香酸およびチオニルクロリドの撹拌溶液を7時間にわたり窒素雰囲気下で還流した。反応を室温に冷却し、白色の固形物が沈殿した。この混合物を一晩冷凍し、その後濾過し、氷冷MeOHですすぎ、次いで空気乾燥させて6.10 g(64%)の表題化合物19 を白色の固形物として得た。

【0142】
工程2:メチル4-[フェニル(3,3,5,5-テトラメチルシクロヘキシリデン)メチル]ベンゾエート (20)
N2にて、Zn粉末(2.45 g, 37.5 mmol), 3,3,5,5-テトラメチルシクロヘキサノン(1.93 g, 12.5 mmol), 19 (3.00 g, 12.5 mmol)およびTHF (100 mL)の撹拌懸濁物を、−10℃に冷却し、トルエン (19.5 mL)中のTiCl4 1M溶液を10分にわたり滴下した。添加の完了後に、反応液を室温まで加温させ、その後90℃にて7時間にわたり加熱した。反応液を室温まで冷却し、その後−10℃に冷却し、次いで濃塩酸 (15 mL)を滴下し、その後水(15 mL)を滴下した。暗反応は薄紫になった。EtOAc (60 mL)を加え、その後、混合物を水(2×60 mL)および塩水(1×60 mL)で洗浄し、次いで乾燥させ(MgSO4)、その後5.1 gの淡黄色油状物へと濃縮した。この粗生成物を、200 gシリカゲル上で100%ヘキサンから2% EtOAc/ヘキサンへの濃度勾配を用いたカラムクロマトグラフィーにより精製して、2.84 gの白色の固形物を得、これをヘキサンから再結晶化させた。収量: 0.95 g (21%)の表題の化合物20 、これは約5%のピナコール中間体で汚染されていた。

【0143】
C25H30O2の分析計算値: C, 82.80; H, 8.36; 実測値: C, 82.94; H, 8.51。
【0144】
工程3: 4-[フェニル(3,3,5,5-テトラメチルシクロヘキシリデン)メチル]安息香酸 (21)
20, THF(15 mL), EtOH(15 mL)の混合物に1N NaOH水溶液 (20 mL)を加え、加熱還流する。4時間後に反応を室温へと冷却させ、次いで1N HCl水溶液(30 mL)およびEtOAc (50 mL)で希釈した。有機画分を水(2×40 mL)および塩水(40 mL)で洗浄し、次いで乾燥させた (Na2SO4)。濃縮後に、固形物をヘキサン(25 mL)で摩砕し、濾過し、次いで空気乾燥させて、770 mg (86%)の表題化合物21 を白色の固形物として得た。

【0145】
C24H28O2の分析計算値: C, 82.69; H, 8.12; 実測値: C, 82.48; H, 8.14。
【0146】
実施例11 (22)
3,5-ジメチル-4-{4-[フェニル(3,3,5,5-テトラメチルシクロヘキシリデン)メチル]フェニル}イソオキサゾール (22)
【化21】

【0147】
16 (192 mg, 0.5 mmol), Pd(Ph3P)4 (58 mg, 0.05 mmol), (3,5-ジメチル-4-イソオキサゾリル)ボロン酸 (141 mg, 1.0 mmol), 2NのNa2CO3水溶液(0.5 mL, 1 mmol), およびTHF (5 mL)を丸底フラスコに加えた。この反応混合物を18時間にわたり還流した。この混合物を室温に冷却し、次いでEtOAc (100 mL)で希釈し、その後この混合物をH2O (1×25 mL),塩水(1×25 mL)で洗浄し、Na2SO4で乾燥させ、濾過し、その後、減圧下で濃縮して、粗生成物を得、これをフラッシュカラムクロマトグラフィーにより精製して、136 mg (68%)の表題の生成物22 を白色の固形物として得た。
【0148】

【0149】
実施例12(23)
1-メチル-4-{4-[フェニル(3,3,5,5-テトラメチルシクロヘキシリデン)メチル]フェニル}-1H-ピラゾール (23)
【化22】

【0150】
22 について記載した方法(実施例11 )を、16 (192 mg, 0.5 mmol), Pd(Ph3P)4 (58 mg, 0.05 mmol), 1-メチル-4-(4,4,5,5-テトラメチル-1,3,2-ジオキサボロラン-2-イル)-1H-ピラゾール(208 mg, 1.0 mmol), 2N Na2CO3 水溶液(0.5 mL, 1.0 mmol), およびTHF (3 mL)を用いて行った。この反応混合物を12時間にわたり還流した。水性の後処理およびそれに続くフラッシュカラムクロマトグラフィーにより170 mg (88%)の表題の生成物23 を灰色がかった白色の固形物として得た。

【0151】
実施例13 (24)
2-{[2-({4-[(4-フルオロフェニル)(3,3,5,5-テトラメチルシクロヘキシリデン)メチル]フェニル}オキシ)エチル]オキシ}エタノール (24)
【化23】

【0152】
10 について記載したO-アルキル化方法(実施例5, 工程2)を、9 (339 mg, 1 mmol), K2CO3 (414 mg, 3 mmol), 2-[(2-クロロエチル)オキシ]エタノール (0.63 mL, 6 mmol), およびアセトン(30 mL)を用いて行った。反応混合物を60時間にわたり還流した。反応混合物を濾過し、濃縮し、その後、カラムクロマトグラフィーにより精製して、190 mg (45%)の表題の生成物24 を白色の固形物として得た。

【0153】
実施例14(27)
(2E)-3-{4-[(4-フルオロフェニル)(3,3,5,5-テトラメチルシクロヘキシリデン)メチル]フェニル}-2-プロペン酸 (27)
【化24】

【0154】
工程1 : 4-[(4-フルオロフェニル)(3,3,5,5-テトラメチルシクロヘキシリデン)メチル]フェニルトリフルオロメタンスルホネート (25)
9 (1.0 g, 2.95 mmol)とCH2Cl2 (50 mL)の混合物に、5℃にてN2下で Et3N (1.22 mL, 8.86 mmol), DMAP (36 mg, 0.30 mmol)を加え、その後、トリフルオロメタンスルホン酸無水物 (0.99 mL, 5.91 mmol)を加えた。この反応混合物を室温にて2時間にわたり撹拌し、その後、CH2Cl2 (100 mL)で希釈し、次いでこの混合物をH2O (1×30 mL)、塩水(1×30 mL)で洗浄し、Na2SO4を用いて乾燥させ、濾過し、その後、濾液を濃縮して粗生成物を得た。生成物をカラムクロマトグラフィーにより精製して1.06 g (76%)の表題の生成物25 を白色の固形物として得た。

【0155】
工程2: 1,1-ジメチルエチル(2E)-3-{4-[(4-フルオロフェニル)(3,3,5,5-テトラメチルシクロヘキシリデン)メチル]フェニル}-2-プロペノエート (26)
17 について記載したヘックカップリング方法(実施例9, 工程2)に従い、トリフレート25 (840 mg, 1.79 mmol), PdCl2(PPh3)2 (125 mg, 0.18 mmol), Et3N (990 uL, 7.16 mmol)、1,1-ジメチルエチル2-プロペノエート(1.62 mL, 17.9 mmol)およびDMF (5 mL)の混合物を、110℃にて24時間にわたり撹拌した。この反応混合物を室温に冷却しEtOAc (150 mL)で希釈した。この混合物をH2O (2×40 mL)、塩水(1×50 mL)で洗浄し、乾燥させ、その後、減圧下で濃縮して粗生成物を得た。粗製物質を、SiO2 フラッシュカラムクロマトグラフィーにより精製して、生成物と出発物質の2:1 混合物 (TLC)を得、このとき生成物26が優勢であった。この混合物を、さらなる特徴付けをすることなく、次の工程に用いた。
【0156】
工程3:(2E)-3-{4-[(4-フルオロフェニル)(3,3,5,5-テトラメチルシクロヘキシリデン)メチル]フェニル}-2-プロペン酸 (27)
26 (約700 mg, 上より得られた混合物)およびCH2Cl2 (8 mL)の混合物を、室温にてCF3CO2H (2 mL)で処理した。この反応混合物を室温にてN2 下で1.5時間にわたり撹拌し、その後、減圧下で濃縮して粗生成物を得た。粗製物質をカラムクロマトグラフィーにより精製して165 mgの所望の生成物27 を白色の固形物として得た。出発トリフレート25の一部(350 mg)も回収した。27:についてのデータ:

【0157】
実施例15 (28)
4-{4-[(4-フルオロフェニル)(3,3,5,5-テトラメチルシクロヘキシリデン)メチル]フェニル}-3,5-ジメチルイソオキサゾール (28)
【化25】

【0158】
21 について記載した鈴木法を、トリフレート25 (200 mg, 0.425 mmol), Pd(Ph3P)4 (49 mg, 0.0425 mmol), 2NのNa2CO3水溶液(425 uL, 0.85 mmol), (3,5-ジメチル-4-イソオキサゾリル)ボロン酸(150mg, 1.06 mmol)およびTHF(25 mL)を用いて行った。この反応混合物を24時間にわたり還流し、その後室温に冷却した。標準的な後処理およびその後のカラムクロマトグラフィーにより132 mg (74 %)の表題の生成物28 を灰色がかった白色の固形物として得た。

【0159】
実施例16 (29)
3-{4-[(4-フルオロフェニル)(3,3,5,5-テトラメチルシクロヘキシリデン)メチル]フェニル}フラン (29)
【化26】

【0160】
28 について記載した方法を、トリフレート25(150 mg, 0.319 mmol), PdCl2(Ph3P)2 (23mg, 0.032 mmol), 2NのNa2CO3水溶液(320 uL, 0.638 mmol), 3-フラニルボロン酸(71 mg, 0.638 mmol), およびTHF (10 mL)を用いて行った。この反応混合物を15時間にわたり還流した。標準的な後処理およびその後の精製により50 mg (40 %)の表題の生成物29 (40%)を灰色がかった白色の固形物として得た。

【0161】
実施例17(30)
2-{4-[(4-フルオロフェニル)(3,3,5,5-テトラメチルシクロヘキシリデン)メチル]フェニル}フラン (30)
【化27】

【0162】
28 について記載した鈴木法を、トリフレート25 (150 mg, 0.319 mmol), PdCl2(Ph3P)2 (23 mg, 0.032 mmol), 2NのNa2CO3水溶液(1.6 mL, 3.2 mmol), 2-フラニルボロン酸 (179 mg, 1.6 mmol), およびTHF (2 mL)を用いて行った。この混合物を、マイクロ波条件で120℃にて15分にわたり加熱した。標準的な後処理およびその後の精製により100 mg (81 %)の表題の生成物30 を灰色がかった白色の固形物として得た。
【0163】

【0164】
実施例18 (31)
4-{4-[(4-フルオロフェニル)(3,3,5,5-テトラメチルシクロヘキシリデン)メチル]フェニル}-1-メチル-1H-ピラゾール(31)
【化28】

【0165】
28 について記載した鈴木法を、トリフレート25 (150 mg, 0.32 mmol), PdCl2(Ph3P)2 (23 mg, 0.032 mmol), 2NのNa2CO3水溶液(320 uL, 3.2 mmol), 1-メチル-4-(4,4,5,5-テトラメチル-1,3,2-ジオキサボロラン-2-イル)-1H-ピラゾール(334 mg, 1.6 mmol), およびDME (2 mL)を用いて行った。この混合物を120℃にて5分にわたりマイクロ波中で加熱した。水性の後処理およびそれに続く精製により116 mg (90%)の表題の生成物31 を白色の固形物として得た。

【0166】
実施例19(34)
({4-[フェニル(3,3,5,5-テトラメチルシクロヘキシリデン)メチル]フェニル}オキシ)酢酸 (34)
【化29】

【0167】
工程1: 4-[フェニル(3,3,5,5-テトラメチルシクロヘキシリデン)メチル]フェノール (32)
9 について記載したマクマリー方法(実施例5, 工程1)を、(4-ヒドロキシフェニル)(フェニル)メタノン(2.97 g, 14.9 mmol)、3,3,5,5-テトラメチルシクロヘキサノン(6.25 g, 44.9 mmol), Zn (9.69 g, 149 mmol), TiCl4・2THF錯体(25 g , 7.5 mmol), およびTHF (200 mL)を用いて行った。標準的な後処理およびその後の精製により4.50g (91%)の表題の生成物32 を白色の固形物として得た。

【0168】
工程2: エチル({4-[フェニル(3,3,5,5-テトラメチルシクロヘキシリデン)メチル]フェニル}オキシ)アセテート (33)
10 について記載したO-アルキル化方法(実施例5, 工程2)に従い、丸底フラスコに化合物32 (321mg, 1 mmol), K2CO3 (415 mg, 3 mmol), エチルブロモアセテート (221 uL, 2 mmol), およびアセトン(25 mL)を加えた。この反応混合物を5時間にわたり還流し、濾過し、濃縮した。粗生成物の精製により402 mg (99%)の表題の生成物33を得た。

【0169】
工程3: ({4-[フェニル(3,3,5,5-テトラメチルシクロヘキシリデン)メチル]フェニル}オキシ)酢酸 (34)
11について記載された鹸化法(実施例5, 工程3)を、化合物33 (310 mg, 0.76 mmol), 1N NaOH (5 mL), THF (10 mL)およびEtOH (10 mL)を用いて、70℃にて1時間にわたり行った。酸性の後処理およびそれに続く精製により268mg(93%)の表題の生成物34 を白色の固形物として得た。

【0170】
実施例20 (35)
2-({4-[フェニル(3,3,5,5-テトラメチルシクロヘキシリデン)メチル]フェニル}オキシ)アセトアミド (35)
【化30】

【0171】
34 (100 mg, 0.26 mmol)およびCH2Cl2 (mL)の溶液に、オキサリルクロリド(90 uL, 1.06 mmol)を加え、その後、この混合物を室温にて2時間にわたり撹拌した。この溶液に、10 mLのNH4OH (30%水溶液)を徐々に加え、6時間にわたり撹拌した。この混合物をH2O (100 mL)に注ぎ込み、その後EtOAc (2 ×100 mL)を用いて抽出した。有機層を後処理して粗生成物を得、これを精製して11mg(11%)の所望の生成物35 を白色の固形物として得た。

【0172】
実施例21 (37)
4-({4-[フェニル(3,3,5,5-テトラメチルシクロヘキシリデン)メチル]フェニル}オキシ)-1-ブタノール (37)
【化31】

【0173】
工程1 :エチル4-({4-[フェニル(3,3,5,5-テトラメチルシクロヘキシリデン)メチル]フェニル}オキシ)ブタノエート (36)
9 について記載されたO-アルキル化方法(実施例5, 工程2)を、32 (800 mg, 2.50 mmol), K2CO3 (1.04 g, 7.49 mmol)、エチル4-クロロブタノエート (715 uL, 5mmol), およびアセトン(30 mL)を用いて行った。この混合物を15時間にわたり還流し、その後、室温に冷却した。この混合物を濾過し、濃縮し、次いで精製して約1.05 g (純度80%)の表題の生成物 36を得た。この材料を、精製することなくそのまま使用した。
【0174】
工程2: 4-({4-[フェニル(3,3,5,5-テトラメチルシクロヘキシリデン)メチル]フェニル}オキシ)-1-ブタノール (37)
15 について記載されたLAH還元法(実施例5)を、THF (30 mL)中の36 (200 mg, 0.46 mmol), LAH (THF 中の1M溶液、1.4 mL, 1.38 mmol)を用いて行った。この反応物を0.5時間にわたり撹拌した。標準的な水性の後処理およびそれに続く精製により、126 mg (70%)の表題の生成物37を白色の固形物として得た。

【0175】
実施例22 (38)
4-({4-[フェニル(3,3,5,5-テトラメチルシクロヘキシリデン)メチル]フェニル}オキシ)ブタン酸 (38)
【化32】

【0176】
11について記載された鹸化法(実施例5, 工程3)に従い、化合物36 (250 mg (80%純度), 0.460 mmol)を、THF/EtOH (1:1, 10 mL)中のNaOH (1N, 4mL)で、70℃にて1時間にわたり処理した。酸性の後処理およびそれに続く精製により、186 mg (出発物質の純度に基づき100%)の表題の生成物38 を白色の固形物として得た。

【0177】
実施例23 (43)
({2-メチル-5-[フェニル(3,3,5,5-テトラメチルシクロヘキシリデン)メチル]フェニル}オキシ)酢酸 (43)
【化33】

【0178】
工程1 : [4-メチル-3-(メチルオキシ)フェニル](フェニル)メタノン (39)
N,3-ジメチル-N,4-ビス(メチルオキシ)ベンズアミド(ワインレブアミドの形成のための標準的な文献方法に従い対応する安息香酸から調製、6.2 g, 29.6 mmol)を、窒素下にて無水THF (110 mL)に溶解させ、この溶液を0℃に冷却した。次いでエーテル中の3M フェニルマグネシウムブロミドの溶液(15.0 mL, 44.4 mmol)を滴下し、このとき内部温度を0℃〜5℃に維持した。得られた混合物を3時間にわたり0℃〜5℃にて撹拌し、その後5% HCl水溶液(150 mL)を用いてクエンチし、次いで酢酸エチル(3×100 mL)を用いて抽出した。一緒にした有機抽出物を乾燥させ(MgSO4)、濾過し、次いで真空で濃縮して、9.2 gのクルード39 を得、これをさらなる精製を行うことなく使用した。
【0179】

【0180】
工程2: (3-ヒドロキシ-4-メチルフェニル)(フェニル)メタノン (40)
200 mLの丸底フラスコ中で、化合物39 (5 g, 22.1 mmol)をAlCl3 (9g, 66.3 mmol)および無水トルエン(50 mL)と一緒にした。撹拌混合物を窒素下で1時間にわたり還流し、その後、周囲温度まで冷却し、次いで1N HCl水溶液 (50 mL)を用いてクエンチした。酢酸エチル(3×100 mL)を用いて反応物を抽出した。一緒にした有機抽出物を乾燥させ(MgSO4)、濾過し、次いで溶媒を真空で除いた。得られた残留物を10% EtOAc/ヘキサンで処理し、このとき溶媒から固形物が沈殿した。この固形物を濾過し、真空で4時間にわたり乾燥させ、3.1 g (70%)の化合物40 を灰色の固形物として得た。

【0181】
工程3: 2-エチル-5-[フェニル(3,3,5,5-テトラメチルシクロヘキシリデン)メチル]フェノール (41)
N2下でのZn粉末(2.0 g, 36.0 mmol)およびTHF (50 mL)の撹拌懸濁物に、TiCl4 (6.0 g, 18.0 mmol)を加えた。得られた黄色い懸濁物を1時間にわたり還流した。この還流反応に、THF (50 mL)中の3,3,5,5-テトラメチルシクロヘキサノン(1.6 g, 10.7 mmol)および化合物40 (1.00 g, 3.6 mmol)の溶液を15分にわたり滴下した。2時間後に反応を室温に冷却し、次いで150 mL 50% HCl水溶液に注ぎ込み、その後、30分撹拌した。次いでこの混合物をEtOAc (150 mL)で希釈し、相を分離させた。水相を2×100 mL EtOAcで洗浄し、一緒にした有機相を塩水(150 mL)で洗浄した。次いで有機物をMgSO4で乾燥させ、濾過し、次いで溶媒を真空で除いた。この粗製物質を、シリカゲル(150 g)上で20% EtOAcを用いたカラムクロマトグラフィーにより精製して、3%の3,3,5,5-テトラメチルシクロヘキサノンで汚染された所望の生成物を得た。所望の生成物をヘキサンから再結晶化させて、1.8 g(48%)の41 を無色の固形物として得た。

【0182】
工程4:エチル({2-メチル-5-[フェニル(3,3,5,5-テトラメチルシクロヘキシリデン)メチル]フェニル}オキシ)アセテート (42)
ブロモエチルアセテート(187 mg, 1.12 mmol)、化合物41 (150 mg, 0.449 mmol)、およびK2CO3 (185 mg, 1.34 mmol)を、密閉したマイクロ波容器内で乾燥アセトン(5 mL)と一緒にした。この混合物を100℃にて20分にわたり、Personal Chemistry Emrys Optimizerマイクロ波照射器内で加熱した。反応を室温まで冷却し、固形物を濾過した。固形物をアセトンで2回すすぎ、次いで溶媒を真空で除き187 mg (99%)の化合物42を得た。この粗製物質をさらに精製することなく使用した。

【0183】
工程5: ({2-メチル-5-[フェニル(3,3,5,5-テトラメチルシクロヘキシリデン)メチル]フェニル}オキシ)酢酸 (43)
化合物42 (50 mg, 0.12 mmol)、NaOH(50 mg, 1.25 mmol)、エタノール(5 mL)および水(500 uL)を、密閉されたマイクロ波容器内で一緒にした。この混合物を100℃にて10分にわたりPersonal Chemistry Emrys Optimizerマイクロ波照射器で加熱した。次いで反応を1N HCl (5 mL)で酸性化し、EtOAc (3×10 mL)で抽出した。一緒にした有機抽出物をMgSO4で乾燥させ、濾過し、溶媒を真空で除き、46mg(98%)の43を紫色の固形物として得た。

【0184】
実施例24 (44)
2-({2-メチル-5-[フェニル(3,3,5,5-テトラメチルシクロヘキシリデン)メチル]フェニル}オキシ)エタノール (44)
【化34】

【0185】
化合物42(93 mg, 0.22 mmol)をTHF (5 mL)に溶解させ、次いで窒素下で0℃に冷却した。DIBAL-H (ヘキサン中で1M, 370μL, 0.55 mmol)を数分にわたり滴下した。氷浴を取り外し撹拌反応を周囲温度まで加温させた。この反応を0℃に再度冷却し、数分にわたり水(10 mL)を滴下した。氷浴を取り外し、固形物が形成し始めるまで反応を撹拌した。固形物を濾過し、濾液をジクロロメタンで数回洗浄して、確実にアルミネート固形物からすべての生成物が除かれるようにした。濾液を真空で濃縮して、82mg(98%)の化合物44 を白色の固形物として得た。

【0186】
実施例25 (45)
({2-メチル-5-[フェニル(3,3,5,5-テトラメチルシクロヘキシリデン)メチル]フェニル}オキシ)アセトニトリル (45)
【化35】

【0187】
ブロモアセトニトリル (134 mg, 1.12 mmol)、化合物41 (150 mg, 0.449 mmol)、およびK2CO3 (185 mg, 1.34 mmol)を、密閉されたマイクロ波容器内で乾燥アセトン(5 mL)と一緒にした。この混合物を、100℃にて20分にわたりPersonal Chemistry Emrys Optimizerマイクロ波照射器内で加熱した。反応を室温まで冷却させ、固形物を濾過した。固形物をアセトンで2回すすぎ、溶媒を真空で除いた。粗製の混合物を、溶離液としてジクロロメタンを使用するフラッシュカラムクロマトグラフィーを用いて精製し、60mg(36%)の45 を無色の固形物(36%)として得た。

【0188】
実施例26 (47)
4-({2-メチル-5-[フェニル(3,3,5,5-テトラメチルシクロヘキシリデン)メチル]フェニル}オキシ)ブタン酸 (47)
【化36】

【0189】
工程1 :エチル3-({2-メチル-5-[フェニル(3,3,5,5-テトラメチルシクロヘキシリデン)メチル]フェニル}オキシ)プロパノエート (46)
エチル4-ブロモブタノエート (219 mg, 1.12 mmol)、化合物40 (150 mg, 0.449 mmol)、およびK2CO3 (185 mg, 1.34 mmol)を密閉されたマイクロ波容器内で乾燥アセトン(5 mL)と一緒にした。この混合物を、100℃にて20分にわたりPersonal Chemistry Emrys Optimizerマイクロ波照射器内で加熱した。反応を室温まで冷却させ、固形物を濾過した。固形物をアセトンで2回すすぎ、溶媒を真空で除いて、200mg(98%)の化合物46 を得、この粗製物質をさらなる精製を行うことなく使用した。

【0190】
工程2: 4-({2-メチル-5-[フェニル(3,3,5,5-テトラメチルシクロヘキシリデン)メチル]フェニル}オキシ)ブタン酸 (47)
化合物46 (53 mg, 0.12 mmol)、NaOH (50 mg, 1.25 mmol)、エタノール(5 mL)および水(500 uL)を密閉されたマイクロ波容器内で一緒にした。この混合物を、100℃にて10分にわたりPersonal Chemistry Emrys Optimizerマイクロ波照射器内で加熱した。次いで反応を1N HCl (5 mL)で酸性にし、その後EtOAc(3×10 mL)で抽出した。一緒にした有機抽出物をMgSO4で乾燥した。固形物を濾過し、溶媒を真空で除いて43mg(86%)の化合物47 を固形物として得た。

【0191】
実施例27 (48)
4-({2-メチル-5-[フェニル(3,3,5,5-テトラメチルシクロヘキシリデン)メチル]フェニル}オキシ)-1-ブタノール (48)
【化37】

【0192】
化合物47 (50 mg, 0.11 mmol)をTHF (5 mL)に溶解させ、窒素下で0℃に冷却した。DIBAL (ヘキサン中で1.5M, 500 ul, 0.33 mmol)を数分にわたり滴下した。氷浴を取り外し撹拌反応を周囲温度まで加温させた。次いで反応を再び0℃に冷却し、数分にわたり水(10 mL)を滴下した。次いで氷浴を取り外し、固形物が形成し始めるまで反応を撹拌した。固形物を濾過し、濾液をジクロロメタンで数回洗浄した。濾液を真空で濃縮して、42mg(98%)の化合物48 を清明な油状物として得た。

【0193】
実施例28 (49)
5-[({2-メチル-5-[フェニル(3,3,5,5-テトラメチルシクロヘキシリデン)メチル]フェニル}オキシ)メチル]-1H-テトラゾール (49)
【化38】

【0194】
化合物45 (50 mg, 0.13 mmol)、NaN3 (60 mg, 0.86 mmol)、およびNH4Cl(50 mg, 0.94 mmol)を密閉されたマイクロ波容器内中でDMF (5 mL)と一緒にした。この混合物を、100℃にて20分にわたりPersonal Chemistry Emrys Optimizerマイクロ波照射器内で加熱した。次いでこの混合物をさらに16時間にわたり油浴上で100℃で撹拌した。反応を室温まで冷却させ、次いで5 mLの1N HClで希釈した。HClの添加により白色の固形物が形成された。次いでEtOAcを加えて固形物を溶解させ、その後、粗製の反応物をEtOAcで3回抽出した (各回10 mL)。一緒にした有機抽出物をMgSO4で乾燥させた。固形物を濾過により除き、溶媒を真空で除いて51mg(98%)の所望の化合物49をピンク色の固形物として得た。

【0195】
実施例29 (50)
2-{[2-({2-メチル-5-[フェニル(3,3,5,5-テトラメチルシクロヘキシリデン)メチル]フェニル}オキシ)エチル]オキシ}エタノール (50)
【化39】

【0196】
2-(2-クロロエトキシ)エタノール(139 mg, 1.12 mmol), 化合物41 (150 mg, 0.45 mmol), およびK2CO3(185 mg, 1.34 mmol)を、密閉されたマイクロ波容器内で乾燥アセトン(5 mL)と一緒にした。この混合物を、100℃にて20分にわたりPersonal Chemistry Emrys Optimizerマイクロ波照射器内で加熱した。反応を室温まで冷却させ、次いで固形物を濾過により除いた。固形物を、アセトンで2回すすぎ、その後、真空で溶媒を除いた。Agilent準分取HPLC (LUNA C18カラム, 23 mL/分、30〜70% CH3CN−水(TFA))を用いて反応物を精製し、76mg(40%)の所望の化合物50 を白色の固形物として得た。

【0197】
予言的実施例
本明細書に提供した合成の記載を用いて、以下の化合物を同様に調製することができる。合成方法において若干の変更が必要となるかもしれないが、それはすべて当技術分野の通常の技術の範囲内にある。
【0198】
予言的実施例30
【化40】

【0199】
(2E)-3-{4-[(4-フルオロフェニル)(2,2,6,6-テトラメチルテトラヒドロ-4H-ピラン-4-イリデン)メチル]フェニル}-2-プロペン酸 (51)
【0200】
予言的実施例31
【化41】

【0201】
(2E)-3-{4-[フェニル(2,2,6,6-テトラメチルテトラヒドロ-4H-ピラン-4-イリデン)メチル]フェニル}-2-プロペン酸 (52)
【0202】
予言的実施例32
【化42】

【0203】
4-{4-[フェニル(2,2,6,6-テトラメチルテトラヒドロ-4H-ピラン-4-イリデン)メチル]フェニル}ブタン酸 (53)
【0204】
予言的実施例33
【化43】

【0205】
4-{4-[(4-フルオロフェニル)(2,2,6,6-テトラメチルテトラヒドロ-4H-ピラン-4-イリデン)メチル]フェニル}ブタン酸 (54)
【0206】
予言的実施例34
【化44】

【0207】
2-({4-[(4-フルオロフェニル)(2,2,6,6-テトラメチルテトラヒドロ-4H-ピラン-4-イリデン)メチル]フェニル}オキシ)エタノール (55)
【0208】
予言的実施例35
【化45】

【0209】
2-({4-[フェニル(2,2,6,6-テトラメチルテトラヒドロ-4H-ピラン-4-イリデン)メチル]フェニル}オキシ)エタノール (56)
【0210】
予言的実施例36
【化46】

【0211】
2-{[2-({4-[フェニル(2,2,6,6-テトラメチルテトラヒドロ-4H-ピラン-4-イリデン)メチル]フェニル}オキシ)エチル]オキシ}エタノール (57)
【0212】
予言的実施例37
【化47】

【0213】
2-{[2-({4-[(4-フルオロフェニル)(2,2,6,6-テトラメチルテトラヒドロ-4H-ピラン-4-イリデン)メチル]フェニル}オキシ)エチル]オキシ}エタノール (58)
【0214】
予言的実施例38
【化48】

【0215】
4-[(4-フルオロフェニル)(2,2,6,6-テトラメチルテトラヒドロ-4H-ピラン-4-イリデン)メチル]安息香酸 (59)
【0216】
予言的実施例39
【化49】

【0217】
4-[フェニル(2,2,6,6-テトラメチルテトラヒドロ-4H-ピラン-4-イリデン)メチル]安息香酸 (60)
【0218】
予言的実施例40
【化50】

【0219】
4-[(4-フルオロフェニル)(3,3,5,5-テトラメチルシクロヘキシリデン)メチル]安息香酸 (61)
【0220】
生物学的データ
ERアルファ蛍光偏光アッセイ法
アッセイは予言的なものではない実施例化合物(上に実施例において示したもの)に対して、全長型およびリガンド結合ドメインタンパク質の両方を用いて行った。
【0221】
全長型ERアルファ−このアッセイは市販のキット(P3029, Invitrogen, Carlsbad, California)を用いて行った。アッセイは、製造者のプロトコルを若干変更して行った。すなわち、15 nM ERαおよび1nM Fluormone ELレッドを、完全ERレッドバッファーに溶解させ混合した。混合物10μlを、ジメチルスルホキシド(DMSO)中に10-5〜10-12Mの濃度範囲の化合物を有するGreiner低容量プレート−黒色で無地の低容量384ウェルプレート−(Greiner - 製品番号784076) の各ウェルに分配した。プレートを1分にわたり20Ogにて回転させ、試薬を光から保護するために覆い、その後室温にて2時間にわたりインキュベートした。プレートを、530〜25nm励起および580-10nm発光干渉フィルターおよび561 nm二色性ミラーを使用するAcquest, LJL Biosystems, Sunnyvale, CAを用いて読み取った。
【0222】
ERアルファ(リガンド結合ドメイン)−
6×His ERα LBD(297〜555)の配列

【0223】
ERα LBDの発現と精製
ヒトERαの残基297〜555に対応するcDNA配列を、N末端ヘキサ−ヒスチジンタグを有するpET24ベクター (Novagen, San Diego, CA)にクローニングした。このプラスミドを大腸菌BL21-DE3細胞に形質転換した。細胞を23℃にて18時間にわたり増殖させ、温度を18℃まで下げた後に250μM IPTGを添加した。細胞をさらに24時間増殖させその後、回収した。細胞を50 mM TRIS pH 8.0/250 mM NaCl/2 Mウレア中で溶解させ、遠心して落とした。上清をイミダゾール中50 mMで調製し、Ni-キレート形成セファロースカラム(Pharmicia)に加え、50〜500 mMイミダゾールの線形濃度勾配を用いて溶出させた。ERα LBDを含有する画分を一緒にし、50 mM TRIS pH 8.0/250 mM NaCl/5 mM DTTおよび10%グリセロールを用いて透析した。サンプルを小分けして−70℃にて凍結させた。アッセイは、15nM ERアルファLBDを、アッセイバッファー(Tris-HCl (5OmM; pH8), KCl (50OmM), ジチオトレイトール(1mM), エチレンジアミン四酢酸(1mM), グリセロール(10% v/v), 3コールアミドプロピル-ジメチルアンモニオ1-プロパンスルホネート −(2mM)、オルトバナジウム酸ナトリウム (1mM −これは蒸留水中に溶解させ、2回連続してpHを10に調整し沸騰および冷却を行うことにより10OmMストックとして調製した))中の1nM Fluormone-EL-レッド(Invitrogen No. P3030)と混合することにより行った。この混合物10μlを、ジメチルスルホキシド(DMSO)中に10-5〜10-12Mの濃度範囲の化合物を含有するGreiner低容量プレート−黒色の無地の低容量384ウェルプレート−(Greiner, Longwood, FL - 製品番号784076)の各ウェルに分配した。プレートを、1分にわたり20Ogにて回転させ、試薬を光から保護するために覆い、その後、室温で2時間にわたりインキュベートした。プレートを、530〜25nm励起および580-10nm発光干渉フィルターおよび561nm二色性ミラーを使用するAcquest装置を用いて読み取った。
【0224】
ERベータ蛍光偏光アッセイ法
アッセイは全長型およびリガンド結合ドメインタンパク質の両方を用いて行った。
【0225】
全長ERベータ − このアッセイは市販のキット(P3032, Invitrogen)を用いて行った。アッセイは、製造者のプロトコルに若干の変更を加えて行った。すなわち、30 nM ERβおよび1 nM Fluormone ELレッドを完全ERレッドバッファーに溶解させ混合した。この混合物10μl を、ジメチルスルホキシド(DMSO)中に10-5〜10-12Mの濃度範囲の化合物を有するGreiner低容量プレート−黒色の無地の低容量384ウェルプレート−(784076, Greiner)の各ウェルに分配した。プレートを、1分にわたり20Ogにて回転させ、試薬を光から保護するために覆い、その後、室温で2時間にわたりインキュベートした。プレートを、530〜25nm励起および580-10nm発光干渉フィルターおよび561nm二色性ミラーを用いたAcquest (Acquest/Biosystems)を使用して読み取った。
【0226】
ERベータ(リガンド結合ドメイン)−
6×His ERβ LBD(257-530)の配列

【0227】
ERβLBDの発現と精製
ヒトERβの残基257〜530に対応するcDNA配列を、N末端ヘキサ−ヒスチジンタグを有するpRSETa (Novagen)ベクターにクローニングした。このプラスミドを大腸菌BL21-DE3細胞に形質転換した。この細胞を23℃にて18時間にわたり増殖させ、温度を18℃に下げて250μMのIPTGを添加した。細胞をさらに24時間増殖させ、その後、回収した。細胞を50 mM TRIS pH 8.0/250 mM NaCl中で溶解させ、遠心して落とした。上清をイミダゾール中50 mMで調製し、その後、Niキレート形成セファロースカラム(Amersham Pharmacia Biotech, Piscataway, NJ.)に加え、50〜500 mMイミダゾールの線形濃度勾配で溶出させた。ERβLBDを含有する画分を一緒にし、50 mM NaClで希釈し、その後、50 mM TRIS pH 8.0/50 mM NaCl/5 mM DTTおよび10%グリセロールで平衡化したQ-セファロースカラム(Pharmacia)に加えた。ERβを、50 mM〜500mM NaClの線形濃度勾配を用いて溶出させた。ERβLBDを含有する画分を一緒にし、その後、50 mM TRIS pH 8.0/250 mM NaCl/5 mM DTTおよび10%グリセロールを用いて透析した。サンプルを小分けし、−70℃にて凍結させた。
【0228】
アッセイは、3OnM ERベータLBDを、アッセイバッファー(Tris-HCl (5OmM; pH8), KCl (50OmM), ジチオトレイトール (1mM) , エチレンジアミン四酢酸(1mM)、グリセロール(10% v/v), 3コールアミドプロピル-ジメチルアンモニオ1-プロパンスルホネート −(2mM), オルトバナジウム酸ナトリウム(1mM −これは、蒸留水中に溶解させ、2回連続してpHを10に調整し沸騰および冷却を行うことにより10OmMストックとして調製した))中の1nM Fluormone-EL-レッド(Invitrogen No. P3030)と混合することにより行った。この混合物10μlを、ジメチルスルホキシド (DMSO)中に10-5〜10-12Mの濃度範囲の化合物を有する黒色の無地の低容量384ウェルプレート−(784076, Greiner)の各ウェルに分配した。プレートを、1分にわたり20Ogにて遠心し、試薬を光から保護するために覆い、その後室温にて2時間にわたりインキュベートした。プレートを、530〜25nm励起および580-10nm発光干渉フィルターおよび561nm二色性ミラーを用いたAcquest装置を用いて読み取った。
【0229】
データ解析
全てのデータを、各プレート上の16の高および16の低対照ウェルの平均に対して正規化した。その後、以下の形の4パラメーター曲線フィットを適用した。
【数1】

【0230】
式中、aは最小値であり、bはHillの傾きであり、cはIC50であり、そしてdは最大値である。データは、n回の実験の平均の標準偏差を用いた、平均plC50 として提示する。
【0231】
上の予言的なものではない実施例の化合物は、6〜8.5の範囲のplC50値を示した。
【0232】
試験化合物は遊離形態または塩の形態で用いた。
【0233】
すべての研究は、実験動物取り扱いの指針(NIH publication No. 85-23, 1985改訂)および動物使用に関するGlaxoSmithKline指針に従った。
【0234】
本発明の特定の実施形態を本明細書に例証し詳細に説明したが、本発明はそれらに限定されるものではない。上記の詳細な説明は本発明の具体例として提供されたものであり、本発明のいかなる限定をも構成するものと解釈すべきではない。改変は当業者にとって明らかであり、本発明の趣旨から逸脱しないすべての変形(又は変更)は、特許請求の範囲に含まれることを意図する。
【特許請求の範囲】
【請求項1】
式(I):
【化1】

(式中、
R1は、HまたはFであり、
R2およびR4は、それぞれ独立して、H、OH、アルキル、アルケニル、アルキニル、アルコキシ、ハロゲン、ハルアルキルまたはシアノから選択され;
R3は、-(Y)Z-R8であり;
Zは、0または1であり;
Yは、炭素-炭素三重結合または-CRe=CRf-であり;
R5の各基は、Hであり;あるいは、
R5の両基は、R6の各基およびR7の各基がHであり、かつXが-(CH2)m-2-である場合、一緒に結合して架橋アルキレン鎖-(CH2)m-(ここで、mは、2、3または4である)を形成しており;
R6およびR7の各基は、Hまたはアルキルから選択され;あるいは
Xが-(CH2)m-の場合、R6の両基はHであり、かつR7の両基は、一緒に結合して架橋アルキレン鎖-(CH2)m-を形成しており(ここで、各mは同じであり、かつ定義されたとおりである);あるいは、
Xが-(CH2)m-の場合、R7の両基はHであり、かつR6の両基は、一緒に結合して架橋アルキレン鎖-(CH2)m-を形成しており(ここで、各mは同じであり、かつ定義されたとおりである);
Zが0の場合、R8は、アルキル、アルケニル、アルキニル、アルコキシ、アリール、ヘテロシクリル、1つ以上のアルキルで置換されたヘテロシクリル、シアノ、-O(CH2)tCN、-CO2H、-(CH2)tCO2H、-O(CH2)tCO2H、-(CH2)tOH、-O(CH2)tOH、-O(CH2)tO(CH2)tOH、-C(O)NRaRb、-O(CH2)tC(O)NRaRb、-NRaSO2Rd、または-NRaC(O)Rcであり;
Zが1の場合、R8は、-CO2H、-(CH2)tCO2H、-(CH2)tOH、-C(O)NRaRb、または-PO3HRaであり;
各tは、独立して、1〜8であり;
Xは、-(CH2)n-(ここで、nは、0、1、2または3である)、-C(Rh)2-、-O-、-S(O)p(式中、pは、0、1または2である)、-C(Rg)2OC(Rg)2-、または-C(CH2)v-(ここで、vは2〜7であり、Xを含む上記表示された環とスピロ環を形成している)であり;
Raは、H、アルキル、アルケニル、アルキニル、アルコキシ、シクロアルキル、アリール、またはヘテロシクリルであり;
Rbは、H、アルキル、アルケニル、アルキニル、アルコキシ、シクロアルキル、アリール、またはヘテロシクリルであり;
Rcは、アルキル、アルケニル、アルキニル、アルコキシ、シクロアルキル、アリール、またはヘテロシクリルであり;
Rdは、アルキル、アルケニル、アルキニル、アルコキシ、シクロアルキル、アリール、またはヘテロシクリルであり;あるいは
RaおよびRb、RaおよびRc、またはRaおよびRdは、結合している原子と結合して任意に置換されたヘテロシクリルを形成していてもよく;および
ReおよびRfの各基は、独立して、H、アルキル、ハロゲンおよびハロアルキルから選択され;
Rgは、H、アルキル、アルケニル、アルキニル、アルコキシ、シクロアルキル、アリール、またはヘテロシクリルであり;
Rhは、アルキル、アルケニル、アルキニル、アルコキシ、シクロアルキル、アリール、またはヘテロシクリルであり;
ここで、アルキル、アルケニル、アルキニル、シクロアルキル、アリール、へテロアリール、およびヘテロシクリルはそれぞれの出現ごとに、任意に置換されていてもよい)
で表される化合物、ならびにその塩、溶媒和物、および薬理学的に機能的な誘導体。
【請求項2】
式(I−A):
【化2】

(式中、
R1は、HまたはFであり;
R3は、-(Y)z-R8であり;
zは、0または1であり;
Yは、-CH=CH-であり;
R6およびR7の各基は、Hまたはアルキルから選択され;
zが0の場合、R8は、ヘテロシクリル、1つ以上のアルキルで置換されたヘテロシクリル、-O(CH2)tCN、-CO2H、-(CH2)tCO2H、-O(CH2)tCO2H、-O(CH2)tOH、-O(CH2)tO(CH2)tOH、または-O(CH2)tC(O)NH2であり;
zが1の場合、R8は、-CO2Hまたは-CONH2であり;
各tは、独立して、1〜8であり;および
Xは、-(CH2)n-(ここで、nは、0、1、または2である)、またはOである)
で表される化合物、ならびにその塩、溶媒和物、および薬理学的に機能的な誘導体。
【請求項3】
以下から選択される、化合物、ならびにその塩、溶媒和物、および薬理学的に機能的な誘導体。
(2E)-3-{4-[シクロヘプチリデン(フェニル)メチル]フェニル}プロパ-2-エン酸;
(2E)-3-{4-[シクロヘプチリデン(フェニル)メチル]フェニル}プロパ-2-エンアミド;
2-({4-[フェニル(3,3,5,5-テトラメチルシクロヘキシリデン)メチル]フェニル}オキシ)エタノール;
2-{[2-({4-[フェニル(3,3,5,5-テトラメチルシクロヘキシリデン)メチル]フェニル}オキシ)エチル]オキシ}エタノール;
({4-[(4-フルオロフェニル)(3,3,5,5-テトラメチルシクロヘキシリデン)メチル]フェニル}オキシ)酢酸;
4-({4-[(4-フルオロフェニル)(3,3,5,5-テトラメチルシクロヘキシリデン)メチル]フェニル}オキシ)ブタン酸;
({4-[(4-フルオロフェニル)(3,3,5,5-テトラメチルシクロヘキシリデン)メチル]フェニル}オキシ)アセトニトリル;
2-({4-[(4-フルオロフェニル)(3,3,5,5-テトラメチルシクロヘキシリデン)メチル]フェニル}オキシ)エタノール;
(2E)-3-{4-[フェニル(3,3,5,5-テトラメチルシクロヘキシリデン)メチル]フェニル}-2-プロペン酸;
4-[フェニル(3,3,5,5-テトラメチルシクロヘキシリデン)メチル]安息香酸;
3,5-ジメチル-4-{4-[フェニル(3,3,5,5-テトラメチルシクロヘキシリデン)メチル]フェニル}イソオキサゾール;
1-メチル-4-{4-[フェニル(3,3,5,5-テトラメチルシクロヘキシリデン)メチル]フェニル}-1H-ピラゾール;
4-{4-[(4-フルオロフェニル)(3,3,5,5-テトラメチルシクロヘキシリデン)メチル]フェニル}-3,5-ジメチルイソオキサゾール;
3-{4-[(4-フルオロフェニル)(3,3,5,5-テトラメチルシクロヘキシリデン)メチル]フェニル}フラン;
2-{[2-({4-[(4-フルオロフェニル)(3,3,5,5-テトラメチルシクロヘキシリデン)メチル]フェニル}オキシ)エチル]オキシ}エタノール;
2-{4-[(4-フルオロフェニル)(3,3,5,5-テトラメチルシクロヘキシリデン)メチル]フェニル}フラン;
4-{4-[(4-フルオロフェニル)(3,3,5,5-テトラメチルシクロヘキシリデン)メチル]フェニル}-1-メチル-1H-ピラゾール;
4-({4-[フェニル(3,3,5,5-テトラメチルシクロヘキシリデン)メチル]フェニル}オキシ)-1-ブタノール;
2-({4-[フェニル(3,3,5,5-テトラメチルシクロヘキシリデン)メチル]フェニル}オキシ)アセトアミド;
({2-メチル-5-[フェニル(3,3,5,5-テトラメチルシクロヘキシリデン)メチル]フェニル}オキシ)酢酸;
2-({2-メチル-5-[フェニル(3,3,5,5-テトラメチルシクロヘキシリデン)メチル]フェニル}オキシ)エタノール;
({2-メチル-5-[フェニル(3,3,5,5-テトラメチルシクロヘキシリデン)メチル]フェニル}オキシ)アセトニトリル;
4-({2-メチル-5-[フェニル(3,3,5,5-テトラメチルシクロヘキシリデン)メチル]フェニル}オキシ)ブタン酸;
4-({2-メチル-5-[フェニル(3,3,5,5-テトラメチルシクロヘキシリデン)メチル]フェニル}オキシ)-1-ブタノール;
5-[({2-メチル-5-[フェニル(3,3,5,5-テトラメチルシクロヘキシリデン)メチル]フェニル}オキシ)メチル]-1H-テトラゾール;
2-{[2-({2-メチル-5-[フェニル(3,3,5,5-テトラメチルシクロヘキシリデン)メチル]フェニル}オキシ)エチル]オキシ}エタノール;
4-({4-[フェニル(3,3,5,5-テトラメチルシクロヘキシリデン)メチル]フェニル}オキシ)ブタン酸;
({4-[フェニル(3,3,5,5-テトラメチルシクロヘキシリデン)メチル]フェニル}オキシ)酢酸;
(2E)-3-{4-[(4-フルオロフェニル)(3,3,5,5-テトラメチルシクロヘキシリデン)メチル]フェニル}-2-プロペン酸;
(2E)-3-{4-[(4-フルオロフェニル)(2,2,6,6-テトラメチルテトラヒドロ-4H-ピラン-4-イリデン)メチル]フェニル}-2-プロペン酸;
(2E)-3-{4-[フェニル(2,2,6,6-テトラメチルテトラヒドロ-4H-ピラン-4-イリデン)メチル]フェニル}-2-プロペン酸;
4-{4-[フェニル(2,2,6,6-テトラメチルテトラヒドロ-4H-ピラン-4-イリデン)メチル]フェニル}ブタン酸;
4-{4-[(4-フルオロフェニル)(2,2,6,6-テトラメチルテトラヒドロ-4H-ピラン-4-イリデン)メチル]フェニル}ブタン酸;
2-({4-[(4-フルオロフェニル)(2,2,6,6-テトラメチルテトラヒドロ-4H-ピラン-4-イリデン)メチル]フェニル}オキシ)エタノール;
2-({4-[フェニル(2,2,6,6-テトラメチルテトラヒドロ-4H-ピラン-4-イリデン)メチル]フェニル}オキシ)エタノール;
2-{[2-({4-[フェニル(2,2,6,6-テトラメチルテトラヒドロ-4H-ピラン-4-イリデン)メチル]フェニル}オキシ)エチル]オキシ}エタノール;
2-{[2-({4-[(4-フルオロフェニル)(2,2,6,6-テトラメチルテトラヒドロ-4H-ピラン-4-イリデン)メチル]フェニル}オキシ)エチル]オキシ}エタノール;
4-[(4-フルオロフェニル)(2,2,6,6-テトラメチルテトラヒドロ-4H-ピラン-4-イリデン)メチル]安息香酸;
4-[フェニル(2,2,6,6-テトラメチルテトラヒドロ-4H-ピラン-4-イリデン)メチル]安息香酸;および
4-[(4-フルオロフェニル)(3,3,5,5-テトラメチルシクロヘキシリデン)メチル]安息香酸。
【請求項4】
次式:
【化3】

で表される化合物、ならびにその塩、溶媒和物および薬理学的に機能的な誘導体。
【請求項5】
次式:
【化4】

で表される化合物、ならびにその塩、溶媒和物および薬理学的に機能的な誘導体。
【請求項6】
実施例のいずれかに記載の実質的に上記に定義された化合物である、請求項1〜5のいずれか1項に記載の化合物。
【請求項7】
請求項1〜5のいずれか1項に記載の化合物と製薬上許容される担体を含む医薬組成物。
【請求項8】
活性治療物質として使用するための請求項1〜5のいずれか1項に記載の化合物。
【請求項9】
選択的エストロゲン受容体モジュレーションの影響を受けている症状または障害の治療または予防で使用するための請求項1〜5のいずれか1項に記載の化合物。
【請求項10】
治療または予防が、骨粗鬆症、骨鉱物質消失、骨量、密度または成長の減少、骨関節炎、骨折修復および治癒の促進、関節置換の治癒の促進、歯槽膿漏症、歯の修復または成長の促進、パジェット病、骨軟骨形成異常、筋肉消耗、筋力および筋機能の維持および増強、脆さ(frailty)または加齢に伴う機能低下(「ARFD」)、サルコぺニア、慢性疲労症候群、慢性筋肉痛(myaligia)、急性疲労症候群、創傷治癒の促進、感覚機能の維持、慢性肝炎、AIDS、無重量感、火傷および外傷の回復、血小板減少症、短腸症候群、過敏性腸症候群、炎症性腸疾患、クローン病および潰瘍性大腸炎、肥満、カヘキシーまたは老化に伴う拒食症を含む摂食障害、副腎皮質機能亢進症およびクッシング症候群、心血管疾患または心機能不全、うっ血性心不全、高血圧、乳癌、乳房、脳、皮膚、卵巣、膀胱、リンパ、肝臓、腎臓、子宮、膵臓、子宮内膜、肺、結腸および前立腺を含む、アンドロゲン受容体を含有する悪性腫瘍細胞、前立腺肥大、多毛、ざ瘡、脂漏、男性ホルモン性脱毛症、貧血、超多毛性、前立腺の腺腫および腫瘍形成、高インスリン血症、インスリン耐性、糖尿病、X症候群、異脂肪血症、尿失禁、アテローム性動脈硬化症、性欲増強、性機能障害、鬱病、抑鬱症状、神経質、短気、ストレス、精神的能力の低下および低自尊心、認知機能の改善、子宮内膜症、多嚢胞性卵巣症候群、子癇前症の予防、月経前症候群、避妊、子宮類線維症、および/または大動脈平滑筋細胞増殖、膣乾燥、心因掻痒、性交疼痛症、排尿障害、頻尿、尿路感染、高コレステロール血症、高脂血症、末梢血管疾患、再狭窄、血管痙攣、免疫反応に起因する血管壁損傷、アルツハイマー病、骨疾患、老化、炎症、慢性関節リウマチ、呼吸器疾患、肺気腫、再潅流傷害、ウイルス性肝炎、結核、乾癬、全身性エリテマトーデス、筋萎縮性側索硬化症、卒中、CNS外傷、痴呆、神経変性、乳房痛および月経困難症、更年期障害または閉経後障害、血管運動症状、尿生殖萎縮または外陰膣萎縮、萎縮性膣炎、女性性機能不全、性欲亢進目的、性的欲求低下障害の治療目的、性的刺激障害、オルガスムスの頻度および強度の向上目的、膣痙、オステオペニア、子宮内膜症、BPH(良性前立腺肥大)、月経困難症、自己免疫性疾患、橋本甲状腺炎、SLE(全身性エリテマトーデス)、重症筋無力症、あるいは虚血心筋の再灌流損傷に関する、請求項9に記載の化合物。
【請求項11】
治療または予防が、更年期障害または閉経後障害、血管運動症状、尿生殖萎縮または外陰膣萎縮、萎縮性膣炎、女性性機能不全、乳癌、抑鬱症状、糖尿病、骨鉱物質消失、または骨粗鬆症に関する、請求項10に記載の化合物。
【請求項12】
選択的エストロゲン受容体モジュレーションに関連する疾患または障害の治療または予防で使用するための薬剤の製造における請求項1〜5のいずれか1項に記載の化合物の使用。
【請求項13】
骨粗鬆症、骨鉱物質消失、骨量、密度または成長の減少、骨関節炎、骨折修復および治癒の促進、関節置換術の治癒の促進、歯槽膿漏症、歯の修復または成長の促進、パジェット病、骨軟骨形成異常、筋肉消耗、筋力および筋機能の維持および増強、脆さ(frailty)または加齢に伴う機能低下(「ARFD」)、サルコぺニア、慢性疲労症候群、慢性筋肉痛(myaligia)、急性疲労症候群、創傷治癒の促進、感覚機能の維持、慢性肝炎、AIDS、無重量感、火傷および外傷の回復、血小板減少症、短腸症候群、過敏性腸症候群、炎症性腸疾患、クローン病および潰瘍性大腸炎、肥満、カヘキシーまたは老化に伴う拒食症を含む摂食障害、副腎皮質機能亢進症およびクッシング症候群、心血管疾患または心機能不全、うっ血性心不全、高血圧、乳癌、乳房、脳、皮膚、卵巣、膀胱、リンパ、肝臓、腎臓、子宮、膵臓、子宮内膜、肺、結腸および前立腺を含む、アンドロゲン受容体を含有する悪性腫瘍細胞、前立腺肥大、多毛、ざ瘡、脂漏、男性ホルモン性脱毛症、貧血、超多毛性、前立腺の腺腫および腫瘍形成、高インスリン血症、インスリン耐性、糖尿病、X症候群、異脂肪血症、尿失禁、アテローム性動脈硬化症、性欲増強、性機能障害、鬱病、抑鬱症状、神経質、短気、ストレス、精神的能力の低下および低自尊心、認知機能の改善、子宮内膜症、多嚢胞性卵巣症候群、子癇前症の予防、月経前症候群、避妊、子宮類線維症、および/または大動脈平滑筋細胞増殖、膣乾燥、心因掻痒、性交疼痛症、排尿障害、頻尿、尿路感染、高コレステロール血症、高脂血症、末梢血管疾患、再狭窄、血管痙攣、免疫反応に起因する血管壁損傷、アルツハイマー病、骨疾患、老化、炎症、慢性関節リウマチ、呼吸器疾患、肺気腫、再潅流傷害、ウイルス性肝炎、結核、乾癬、全身性エリテマトーデス、筋萎縮性側索硬化症、卒中、CNS外傷、痴呆、神経変性、乳房痛および月経困難症、更年期障害または閉経後障害、血管運動症状、尿生殖萎縮または外陰膣萎縮、萎縮性膣炎、女性性機能不全、性欲亢進目的、性的欲求低下障害の治療目的、性的刺激障害、オルガスムスの頻度および強度の向上目的、膣痙、オステオペニア、子宮内膜症、BPH(良性前立腺肥大)、月経困難症、自己免疫性疾患、橋本甲状腺炎、SLE(全身性エリテマトーデス)、重症筋無力症、あるいは虚血心筋の再灌流損傷の治療または予防で使用するための医薬品の製造における請求項1〜5のいずれか1項に記載の化合物の使用。
【請求項14】
疾患または障害が、更年期障害または閉経後障害、血管運動症状、尿生殖萎縮または外陰膣萎縮、萎縮性膣炎、女性性機能不全、乳癌、抑鬱症状、糖尿病、骨鉱物質消失、または骨粗鬆症である、請求項13に記載の化合物の使用。
【請求項15】
請求項1〜5のいずれか1項に記載の化合物を投与することを含む、選択的エストロゲン受容体モジュレーションに関連する症状または障害の治療または予防方法。
【請求項16】
請求項1〜5のいずれか1項に記載の化合物を投与することを含む、骨粗鬆症、骨鉱物質消失、骨量、密度または成長の減少、骨関節炎、骨折修復および治癒の促進、関節置換術の治癒の促進、歯槽膿漏症、歯の修復または成長の促進、パジェット病、骨軟骨形成異常、筋肉消耗、筋力および筋機能の維持および増強、脆さ(frailty)または加齢に伴う機能低下(「ARFD」)、サルコぺニア、慢性疲労症候群、慢性筋肉痛(myaligia)、急性疲労症候群、創傷治癒の促進、感覚機能の維持、慢性肝炎、AIDS、無重量感、火傷および外傷の回復、血小板減少症、短腸症候群、過敏性腸症候群、炎症性腸疾患、クローン病および潰瘍性大腸炎、肥満、カヘキシーまたは老化に伴う拒食症を含む摂食障害、副腎皮質機能亢進症およびクッシング症候群、心血管疾患または心機能不全、うっ血性心不全、高血圧、乳癌、乳房、脳、皮膚、卵巣、膀胱、リンパ、肝臓、腎臓、子宮、膵臓、子宮内膜、肺、結腸および前立腺を含む、アンドロゲン受容体を含有する悪性腫瘍細胞、前立腺肥大、多毛、ざ瘡、脂漏、男性ホルモン性脱毛症、貧血、超多毛性、前立腺の腺腫および腫瘍形成、高インスリン血症、インスリン耐性、糖尿病、X症候群、異脂肪血症、尿失禁、アテローム性動脈硬化症、性欲増強、性機能障害、鬱病、抑鬱症状、神経質、短気、ストレス、精神的能力の低下および低自尊心、認知機能の改善、子宮内膜症、多嚢胞性卵巣症候群、子癇前症の予防、月経前症候群、避妊、子宮類線維症、および/または大動脈平滑筋細胞増殖、膣乾燥、心因掻痒、性交疼痛症、排尿障害、頻尿、尿路感染、高コレステロール血症、高脂血症、末梢血管疾患、再狭窄、血管痙攣、免疫反応に起因する血管壁損傷、アルツハイマー病、骨疾患、老化、炎症、慢性関節リウマチ、呼吸器疾患、肺気腫、再潅流傷害、ウイルス性肝炎、結核、乾癬、全身性エリテマトーデス、筋萎縮性側索硬化症、卒中、CNS外傷、痴呆、神経変性、乳房痛および月経困難症、更年期障害または閉経後障害、血管運動症状、尿生殖萎縮または外陰膣萎縮、萎縮性膣炎、女性性機能不全、性欲亢進目的、性的欲求低下障害の治療目的、性的刺激障害、オルガスムスの頻度および強度の向上目的、膣痙、オステオペニア、子宮内膜症、BPH(良性前立腺肥大)、月経困難症、自己免疫性疾患、橋本甲状腺炎、SLE(全身性エリテマトーデス)、重症筋無力症、あるいは虚血心筋の再灌流損傷に関する治療または予防方法。
【請求項17】
疾患または障害が、更年期障害または閉経後障害、血管運動症状、尿生殖萎縮または外陰膣萎縮、萎縮性膣炎、女性性機能不全、乳癌、抑鬱症状、糖尿病、骨鉱物質消失、または骨粗鬆症である、請求項16に記載の方法。
【請求項1】
式(I):
【化1】

(式中、
R1は、HまたはFであり、
R2およびR4は、それぞれ独立して、H、OH、アルキル、アルケニル、アルキニル、アルコキシ、ハロゲン、ハルアルキルまたはシアノから選択され;
R3は、-(Y)Z-R8であり;
Zは、0または1であり;
Yは、炭素-炭素三重結合または-CRe=CRf-であり;
R5の各基は、Hであり;あるいは、
R5の両基は、R6の各基およびR7の各基がHであり、かつXが-(CH2)m-2-である場合、一緒に結合して架橋アルキレン鎖-(CH2)m-(ここで、mは、2、3または4である)を形成しており;
R6およびR7の各基は、Hまたはアルキルから選択され;あるいは
Xが-(CH2)m-の場合、R6の両基はHであり、かつR7の両基は、一緒に結合して架橋アルキレン鎖-(CH2)m-を形成しており(ここで、各mは同じであり、かつ定義されたとおりである);あるいは、
Xが-(CH2)m-の場合、R7の両基はHであり、かつR6の両基は、一緒に結合して架橋アルキレン鎖-(CH2)m-を形成しており(ここで、各mは同じであり、かつ定義されたとおりである);
Zが0の場合、R8は、アルキル、アルケニル、アルキニル、アルコキシ、アリール、ヘテロシクリル、1つ以上のアルキルで置換されたヘテロシクリル、シアノ、-O(CH2)tCN、-CO2H、-(CH2)tCO2H、-O(CH2)tCO2H、-(CH2)tOH、-O(CH2)tOH、-O(CH2)tO(CH2)tOH、-C(O)NRaRb、-O(CH2)tC(O)NRaRb、-NRaSO2Rd、または-NRaC(O)Rcであり;
Zが1の場合、R8は、-CO2H、-(CH2)tCO2H、-(CH2)tOH、-C(O)NRaRb、または-PO3HRaであり;
各tは、独立して、1〜8であり;
Xは、-(CH2)n-(ここで、nは、0、1、2または3である)、-C(Rh)2-、-O-、-S(O)p(式中、pは、0、1または2である)、-C(Rg)2OC(Rg)2-、または-C(CH2)v-(ここで、vは2〜7であり、Xを含む上記表示された環とスピロ環を形成している)であり;
Raは、H、アルキル、アルケニル、アルキニル、アルコキシ、シクロアルキル、アリール、またはヘテロシクリルであり;
Rbは、H、アルキル、アルケニル、アルキニル、アルコキシ、シクロアルキル、アリール、またはヘテロシクリルであり;
Rcは、アルキル、アルケニル、アルキニル、アルコキシ、シクロアルキル、アリール、またはヘテロシクリルであり;
Rdは、アルキル、アルケニル、アルキニル、アルコキシ、シクロアルキル、アリール、またはヘテロシクリルであり;あるいは
RaおよびRb、RaおよびRc、またはRaおよびRdは、結合している原子と結合して任意に置換されたヘテロシクリルを形成していてもよく;および
ReおよびRfの各基は、独立して、H、アルキル、ハロゲンおよびハロアルキルから選択され;
Rgは、H、アルキル、アルケニル、アルキニル、アルコキシ、シクロアルキル、アリール、またはヘテロシクリルであり;
Rhは、アルキル、アルケニル、アルキニル、アルコキシ、シクロアルキル、アリール、またはヘテロシクリルであり;
ここで、アルキル、アルケニル、アルキニル、シクロアルキル、アリール、へテロアリール、およびヘテロシクリルはそれぞれの出現ごとに、任意に置換されていてもよい)
で表される化合物、ならびにその塩、溶媒和物、および薬理学的に機能的な誘導体。
【請求項2】
式(I−A):
【化2】

(式中、
R1は、HまたはFであり;
R3は、-(Y)z-R8であり;
zは、0または1であり;
Yは、-CH=CH-であり;
R6およびR7の各基は、Hまたはアルキルから選択され;
zが0の場合、R8は、ヘテロシクリル、1つ以上のアルキルで置換されたヘテロシクリル、-O(CH2)tCN、-CO2H、-(CH2)tCO2H、-O(CH2)tCO2H、-O(CH2)tOH、-O(CH2)tO(CH2)tOH、または-O(CH2)tC(O)NH2であり;
zが1の場合、R8は、-CO2Hまたは-CONH2であり;
各tは、独立して、1〜8であり;および
Xは、-(CH2)n-(ここで、nは、0、1、または2である)、またはOである)
で表される化合物、ならびにその塩、溶媒和物、および薬理学的に機能的な誘導体。
【請求項3】
以下から選択される、化合物、ならびにその塩、溶媒和物、および薬理学的に機能的な誘導体。
(2E)-3-{4-[シクロヘプチリデン(フェニル)メチル]フェニル}プロパ-2-エン酸;
(2E)-3-{4-[シクロヘプチリデン(フェニル)メチル]フェニル}プロパ-2-エンアミド;
2-({4-[フェニル(3,3,5,5-テトラメチルシクロヘキシリデン)メチル]フェニル}オキシ)エタノール;
2-{[2-({4-[フェニル(3,3,5,5-テトラメチルシクロヘキシリデン)メチル]フェニル}オキシ)エチル]オキシ}エタノール;
({4-[(4-フルオロフェニル)(3,3,5,5-テトラメチルシクロヘキシリデン)メチル]フェニル}オキシ)酢酸;
4-({4-[(4-フルオロフェニル)(3,3,5,5-テトラメチルシクロヘキシリデン)メチル]フェニル}オキシ)ブタン酸;
({4-[(4-フルオロフェニル)(3,3,5,5-テトラメチルシクロヘキシリデン)メチル]フェニル}オキシ)アセトニトリル;
2-({4-[(4-フルオロフェニル)(3,3,5,5-テトラメチルシクロヘキシリデン)メチル]フェニル}オキシ)エタノール;
(2E)-3-{4-[フェニル(3,3,5,5-テトラメチルシクロヘキシリデン)メチル]フェニル}-2-プロペン酸;
4-[フェニル(3,3,5,5-テトラメチルシクロヘキシリデン)メチル]安息香酸;
3,5-ジメチル-4-{4-[フェニル(3,3,5,5-テトラメチルシクロヘキシリデン)メチル]フェニル}イソオキサゾール;
1-メチル-4-{4-[フェニル(3,3,5,5-テトラメチルシクロヘキシリデン)メチル]フェニル}-1H-ピラゾール;
4-{4-[(4-フルオロフェニル)(3,3,5,5-テトラメチルシクロヘキシリデン)メチル]フェニル}-3,5-ジメチルイソオキサゾール;
3-{4-[(4-フルオロフェニル)(3,3,5,5-テトラメチルシクロヘキシリデン)メチル]フェニル}フラン;
2-{[2-({4-[(4-フルオロフェニル)(3,3,5,5-テトラメチルシクロヘキシリデン)メチル]フェニル}オキシ)エチル]オキシ}エタノール;
2-{4-[(4-フルオロフェニル)(3,3,5,5-テトラメチルシクロヘキシリデン)メチル]フェニル}フラン;
4-{4-[(4-フルオロフェニル)(3,3,5,5-テトラメチルシクロヘキシリデン)メチル]フェニル}-1-メチル-1H-ピラゾール;
4-({4-[フェニル(3,3,5,5-テトラメチルシクロヘキシリデン)メチル]フェニル}オキシ)-1-ブタノール;
2-({4-[フェニル(3,3,5,5-テトラメチルシクロヘキシリデン)メチル]フェニル}オキシ)アセトアミド;
({2-メチル-5-[フェニル(3,3,5,5-テトラメチルシクロヘキシリデン)メチル]フェニル}オキシ)酢酸;
2-({2-メチル-5-[フェニル(3,3,5,5-テトラメチルシクロヘキシリデン)メチル]フェニル}オキシ)エタノール;
({2-メチル-5-[フェニル(3,3,5,5-テトラメチルシクロヘキシリデン)メチル]フェニル}オキシ)アセトニトリル;
4-({2-メチル-5-[フェニル(3,3,5,5-テトラメチルシクロヘキシリデン)メチル]フェニル}オキシ)ブタン酸;
4-({2-メチル-5-[フェニル(3,3,5,5-テトラメチルシクロヘキシリデン)メチル]フェニル}オキシ)-1-ブタノール;
5-[({2-メチル-5-[フェニル(3,3,5,5-テトラメチルシクロヘキシリデン)メチル]フェニル}オキシ)メチル]-1H-テトラゾール;
2-{[2-({2-メチル-5-[フェニル(3,3,5,5-テトラメチルシクロヘキシリデン)メチル]フェニル}オキシ)エチル]オキシ}エタノール;
4-({4-[フェニル(3,3,5,5-テトラメチルシクロヘキシリデン)メチル]フェニル}オキシ)ブタン酸;
({4-[フェニル(3,3,5,5-テトラメチルシクロヘキシリデン)メチル]フェニル}オキシ)酢酸;
(2E)-3-{4-[(4-フルオロフェニル)(3,3,5,5-テトラメチルシクロヘキシリデン)メチル]フェニル}-2-プロペン酸;
(2E)-3-{4-[(4-フルオロフェニル)(2,2,6,6-テトラメチルテトラヒドロ-4H-ピラン-4-イリデン)メチル]フェニル}-2-プロペン酸;
(2E)-3-{4-[フェニル(2,2,6,6-テトラメチルテトラヒドロ-4H-ピラン-4-イリデン)メチル]フェニル}-2-プロペン酸;
4-{4-[フェニル(2,2,6,6-テトラメチルテトラヒドロ-4H-ピラン-4-イリデン)メチル]フェニル}ブタン酸;
4-{4-[(4-フルオロフェニル)(2,2,6,6-テトラメチルテトラヒドロ-4H-ピラン-4-イリデン)メチル]フェニル}ブタン酸;
2-({4-[(4-フルオロフェニル)(2,2,6,6-テトラメチルテトラヒドロ-4H-ピラン-4-イリデン)メチル]フェニル}オキシ)エタノール;
2-({4-[フェニル(2,2,6,6-テトラメチルテトラヒドロ-4H-ピラン-4-イリデン)メチル]フェニル}オキシ)エタノール;
2-{[2-({4-[フェニル(2,2,6,6-テトラメチルテトラヒドロ-4H-ピラン-4-イリデン)メチル]フェニル}オキシ)エチル]オキシ}エタノール;
2-{[2-({4-[(4-フルオロフェニル)(2,2,6,6-テトラメチルテトラヒドロ-4H-ピラン-4-イリデン)メチル]フェニル}オキシ)エチル]オキシ}エタノール;
4-[(4-フルオロフェニル)(2,2,6,6-テトラメチルテトラヒドロ-4H-ピラン-4-イリデン)メチル]安息香酸;
4-[フェニル(2,2,6,6-テトラメチルテトラヒドロ-4H-ピラン-4-イリデン)メチル]安息香酸;および
4-[(4-フルオロフェニル)(3,3,5,5-テトラメチルシクロヘキシリデン)メチル]安息香酸。
【請求項4】
次式:
【化3】

で表される化合物、ならびにその塩、溶媒和物および薬理学的に機能的な誘導体。
【請求項5】
次式:
【化4】

で表される化合物、ならびにその塩、溶媒和物および薬理学的に機能的な誘導体。
【請求項6】
実施例のいずれかに記載の実質的に上記に定義された化合物である、請求項1〜5のいずれか1項に記載の化合物。
【請求項7】
請求項1〜5のいずれか1項に記載の化合物と製薬上許容される担体を含む医薬組成物。
【請求項8】
活性治療物質として使用するための請求項1〜5のいずれか1項に記載の化合物。
【請求項9】
選択的エストロゲン受容体モジュレーションの影響を受けている症状または障害の治療または予防で使用するための請求項1〜5のいずれか1項に記載の化合物。
【請求項10】
治療または予防が、骨粗鬆症、骨鉱物質消失、骨量、密度または成長の減少、骨関節炎、骨折修復および治癒の促進、関節置換の治癒の促進、歯槽膿漏症、歯の修復または成長の促進、パジェット病、骨軟骨形成異常、筋肉消耗、筋力および筋機能の維持および増強、脆さ(frailty)または加齢に伴う機能低下(「ARFD」)、サルコぺニア、慢性疲労症候群、慢性筋肉痛(myaligia)、急性疲労症候群、創傷治癒の促進、感覚機能の維持、慢性肝炎、AIDS、無重量感、火傷および外傷の回復、血小板減少症、短腸症候群、過敏性腸症候群、炎症性腸疾患、クローン病および潰瘍性大腸炎、肥満、カヘキシーまたは老化に伴う拒食症を含む摂食障害、副腎皮質機能亢進症およびクッシング症候群、心血管疾患または心機能不全、うっ血性心不全、高血圧、乳癌、乳房、脳、皮膚、卵巣、膀胱、リンパ、肝臓、腎臓、子宮、膵臓、子宮内膜、肺、結腸および前立腺を含む、アンドロゲン受容体を含有する悪性腫瘍細胞、前立腺肥大、多毛、ざ瘡、脂漏、男性ホルモン性脱毛症、貧血、超多毛性、前立腺の腺腫および腫瘍形成、高インスリン血症、インスリン耐性、糖尿病、X症候群、異脂肪血症、尿失禁、アテローム性動脈硬化症、性欲増強、性機能障害、鬱病、抑鬱症状、神経質、短気、ストレス、精神的能力の低下および低自尊心、認知機能の改善、子宮内膜症、多嚢胞性卵巣症候群、子癇前症の予防、月経前症候群、避妊、子宮類線維症、および/または大動脈平滑筋細胞増殖、膣乾燥、心因掻痒、性交疼痛症、排尿障害、頻尿、尿路感染、高コレステロール血症、高脂血症、末梢血管疾患、再狭窄、血管痙攣、免疫反応に起因する血管壁損傷、アルツハイマー病、骨疾患、老化、炎症、慢性関節リウマチ、呼吸器疾患、肺気腫、再潅流傷害、ウイルス性肝炎、結核、乾癬、全身性エリテマトーデス、筋萎縮性側索硬化症、卒中、CNS外傷、痴呆、神経変性、乳房痛および月経困難症、更年期障害または閉経後障害、血管運動症状、尿生殖萎縮または外陰膣萎縮、萎縮性膣炎、女性性機能不全、性欲亢進目的、性的欲求低下障害の治療目的、性的刺激障害、オルガスムスの頻度および強度の向上目的、膣痙、オステオペニア、子宮内膜症、BPH(良性前立腺肥大)、月経困難症、自己免疫性疾患、橋本甲状腺炎、SLE(全身性エリテマトーデス)、重症筋無力症、あるいは虚血心筋の再灌流損傷に関する、請求項9に記載の化合物。
【請求項11】
治療または予防が、更年期障害または閉経後障害、血管運動症状、尿生殖萎縮または外陰膣萎縮、萎縮性膣炎、女性性機能不全、乳癌、抑鬱症状、糖尿病、骨鉱物質消失、または骨粗鬆症に関する、請求項10に記載の化合物。
【請求項12】
選択的エストロゲン受容体モジュレーションに関連する疾患または障害の治療または予防で使用するための薬剤の製造における請求項1〜5のいずれか1項に記載の化合物の使用。
【請求項13】
骨粗鬆症、骨鉱物質消失、骨量、密度または成長の減少、骨関節炎、骨折修復および治癒の促進、関節置換術の治癒の促進、歯槽膿漏症、歯の修復または成長の促進、パジェット病、骨軟骨形成異常、筋肉消耗、筋力および筋機能の維持および増強、脆さ(frailty)または加齢に伴う機能低下(「ARFD」)、サルコぺニア、慢性疲労症候群、慢性筋肉痛(myaligia)、急性疲労症候群、創傷治癒の促進、感覚機能の維持、慢性肝炎、AIDS、無重量感、火傷および外傷の回復、血小板減少症、短腸症候群、過敏性腸症候群、炎症性腸疾患、クローン病および潰瘍性大腸炎、肥満、カヘキシーまたは老化に伴う拒食症を含む摂食障害、副腎皮質機能亢進症およびクッシング症候群、心血管疾患または心機能不全、うっ血性心不全、高血圧、乳癌、乳房、脳、皮膚、卵巣、膀胱、リンパ、肝臓、腎臓、子宮、膵臓、子宮内膜、肺、結腸および前立腺を含む、アンドロゲン受容体を含有する悪性腫瘍細胞、前立腺肥大、多毛、ざ瘡、脂漏、男性ホルモン性脱毛症、貧血、超多毛性、前立腺の腺腫および腫瘍形成、高インスリン血症、インスリン耐性、糖尿病、X症候群、異脂肪血症、尿失禁、アテローム性動脈硬化症、性欲増強、性機能障害、鬱病、抑鬱症状、神経質、短気、ストレス、精神的能力の低下および低自尊心、認知機能の改善、子宮内膜症、多嚢胞性卵巣症候群、子癇前症の予防、月経前症候群、避妊、子宮類線維症、および/または大動脈平滑筋細胞増殖、膣乾燥、心因掻痒、性交疼痛症、排尿障害、頻尿、尿路感染、高コレステロール血症、高脂血症、末梢血管疾患、再狭窄、血管痙攣、免疫反応に起因する血管壁損傷、アルツハイマー病、骨疾患、老化、炎症、慢性関節リウマチ、呼吸器疾患、肺気腫、再潅流傷害、ウイルス性肝炎、結核、乾癬、全身性エリテマトーデス、筋萎縮性側索硬化症、卒中、CNS外傷、痴呆、神経変性、乳房痛および月経困難症、更年期障害または閉経後障害、血管運動症状、尿生殖萎縮または外陰膣萎縮、萎縮性膣炎、女性性機能不全、性欲亢進目的、性的欲求低下障害の治療目的、性的刺激障害、オルガスムスの頻度および強度の向上目的、膣痙、オステオペニア、子宮内膜症、BPH(良性前立腺肥大)、月経困難症、自己免疫性疾患、橋本甲状腺炎、SLE(全身性エリテマトーデス)、重症筋無力症、あるいは虚血心筋の再灌流損傷の治療または予防で使用するための医薬品の製造における請求項1〜5のいずれか1項に記載の化合物の使用。
【請求項14】
疾患または障害が、更年期障害または閉経後障害、血管運動症状、尿生殖萎縮または外陰膣萎縮、萎縮性膣炎、女性性機能不全、乳癌、抑鬱症状、糖尿病、骨鉱物質消失、または骨粗鬆症である、請求項13に記載の化合物の使用。
【請求項15】
請求項1〜5のいずれか1項に記載の化合物を投与することを含む、選択的エストロゲン受容体モジュレーションに関連する症状または障害の治療または予防方法。
【請求項16】
請求項1〜5のいずれか1項に記載の化合物を投与することを含む、骨粗鬆症、骨鉱物質消失、骨量、密度または成長の減少、骨関節炎、骨折修復および治癒の促進、関節置換術の治癒の促進、歯槽膿漏症、歯の修復または成長の促進、パジェット病、骨軟骨形成異常、筋肉消耗、筋力および筋機能の維持および増強、脆さ(frailty)または加齢に伴う機能低下(「ARFD」)、サルコぺニア、慢性疲労症候群、慢性筋肉痛(myaligia)、急性疲労症候群、創傷治癒の促進、感覚機能の維持、慢性肝炎、AIDS、無重量感、火傷および外傷の回復、血小板減少症、短腸症候群、過敏性腸症候群、炎症性腸疾患、クローン病および潰瘍性大腸炎、肥満、カヘキシーまたは老化に伴う拒食症を含む摂食障害、副腎皮質機能亢進症およびクッシング症候群、心血管疾患または心機能不全、うっ血性心不全、高血圧、乳癌、乳房、脳、皮膚、卵巣、膀胱、リンパ、肝臓、腎臓、子宮、膵臓、子宮内膜、肺、結腸および前立腺を含む、アンドロゲン受容体を含有する悪性腫瘍細胞、前立腺肥大、多毛、ざ瘡、脂漏、男性ホルモン性脱毛症、貧血、超多毛性、前立腺の腺腫および腫瘍形成、高インスリン血症、インスリン耐性、糖尿病、X症候群、異脂肪血症、尿失禁、アテローム性動脈硬化症、性欲増強、性機能障害、鬱病、抑鬱症状、神経質、短気、ストレス、精神的能力の低下および低自尊心、認知機能の改善、子宮内膜症、多嚢胞性卵巣症候群、子癇前症の予防、月経前症候群、避妊、子宮類線維症、および/または大動脈平滑筋細胞増殖、膣乾燥、心因掻痒、性交疼痛症、排尿障害、頻尿、尿路感染、高コレステロール血症、高脂血症、末梢血管疾患、再狭窄、血管痙攣、免疫反応に起因する血管壁損傷、アルツハイマー病、骨疾患、老化、炎症、慢性関節リウマチ、呼吸器疾患、肺気腫、再潅流傷害、ウイルス性肝炎、結核、乾癬、全身性エリテマトーデス、筋萎縮性側索硬化症、卒中、CNS外傷、痴呆、神経変性、乳房痛および月経困難症、更年期障害または閉経後障害、血管運動症状、尿生殖萎縮または外陰膣萎縮、萎縮性膣炎、女性性機能不全、性欲亢進目的、性的欲求低下障害の治療目的、性的刺激障害、オルガスムスの頻度および強度の向上目的、膣痙、オステオペニア、子宮内膜症、BPH(良性前立腺肥大)、月経困難症、自己免疫性疾患、橋本甲状腺炎、SLE(全身性エリテマトーデス)、重症筋無力症、あるいは虚血心筋の再灌流損傷に関する治療または予防方法。
【請求項17】
疾患または障害が、更年期障害または閉経後障害、血管運動症状、尿生殖萎縮または外陰膣萎縮、萎縮性膣炎、女性性機能不全、乳癌、抑鬱症状、糖尿病、骨鉱物質消失、または骨粗鬆症である、請求項16に記載の方法。
【公表番号】特表2008−545699(P2008−545699A)
【公表日】平成20年12月18日(2008.12.18)
【国際特許分類】
【出願番号】特願2008−513693(P2008−513693)
【出願日】平成18年5月24日(2006.5.24)
【国際出願番号】PCT/US2006/020185
【国際公開番号】WO2006/127871
【国際公開日】平成18年11月30日(2006.11.30)
【出願人】(597173680)スミスクライン ビーチャム コーポレーション (157)
【Fターム(参考)】
【公表日】平成20年12月18日(2008.12.18)
【国際特許分類】
【出願日】平成18年5月24日(2006.5.24)
【国際出願番号】PCT/US2006/020185
【国際公開番号】WO2006/127871
【国際公開日】平成18年11月30日(2006.11.30)
【出願人】(597173680)スミスクライン ビーチャム コーポレーション (157)
【Fターム(参考)】
[ Back to top ]

