選択的サイクリン依存性キナーゼ4/6阻害剤を用いた化学療法化合物に対する造血系の防護
健康な細胞における細胞毒性化合物の効果を減少させる又は防護する方法を提供する。この方法は、造血幹細胞及び/又は造血前駆細胞のような、CDK4/6依存性細胞に一時的な休止を誘導するために、選択的サイクリン依存性キナーゼ(CDK)4/6阻害剤の使用に関する。健康な細胞において細胞毒性剤化合物の効果を減少又は防護する化合物を選択する方法についても開示する。
【発明の詳細な説明】
【技術分野】
【0001】
本出願は、2008年10月1日出願の米国特許出願61/101,824に基づく優先権を主張し、本明細書にはその全体が取り込まれている。
本発明は、米国国立保健研究所から助成金番号R01AG024379-01及びK08CA90679の援助を国立加齢研究所及び国立癌研究所を通して受けた。従って、合衆国連邦政府は本発明の一定の権利を有する。
この発明は、DNA損傷性化合物のような細胞毒性化合物から健康な細胞を防護する方法に関し、より詳細には、細胞毒性化合物に曝露した、これから曝露する、又は曝露する危険性のある患者に投与されたサイクリン依存性キナーゼ4(CDK4)及び/又はサイクリン依存性キナーゼ6(CDK6)阻害剤の防護作用に関する。
【背景技術】
【0002】
化学療法において、ガン細胞及び腫瘍を絶つために、シクロホスファミド、ドキソルビシン、ダウノルビシン、ビンブラスチン、ビンクリスチン、ブレオマイシン、エトポシド、トポテカン、イリノテカン、タキソテール、タキソール、5−フルオロウラシル、メトレキサート、ゲムシタビン、シスプラチン、カルボプラチン、又はクロランフェニコールのような、しかしこれらに制限されない、細胞毒性(例えば、DNA損傷性)薬剤が使用されている。化学療法化合物は非特異的であり、特に多量に投与した場合、正常で活発に分裂する細胞に対して毒性がある傾向がある。このことは、化学療法を受ける患者に様々な副作用をもたらしている。
【0003】
骨髄における血液生産の重篤な減少である骨髄抑制はこのような副作用の1つである。これは、骨髄抑制(貧血症、好中球減少症、顆粒球減少症、及び血小板減少症)及びリンパ球減少症の両者により特徴付けられる。好中球減少症は、循環好中球数の選択的減少及びバクテリア感染に対する感受性の増加により特徴付けられる。赤血球(erythrocyteとも表現)数、ヘモグロビン量又は赤血球濃縮液の体積(ヘマクリット測定により特徴付けられる)の減少である貧血症は、米国において、化学療法を受けるガン患者の約67%に影響を及ぼしている(非特許文献1)。化学療法薬剤の細胞毒性は、投与できる量を制限し、治療サイクルに影響を及ぼし、ガン患者の生活クオリティを深刻に危うくする。血小板減少症は、血小板数を減少させ、より出血し易くさせる。リンパ球減少症は、循環リンパ球数(T−及びB−細胞とも呼ばれる)を減少させることにより特徴付けられる化学療法の一般的な副作用である。リンパ球減少症は、多くの種類の感染を受けやすくする。
【0004】
ある種の化学療法化合物の副作用の幾つかを減らすために、低分子が用いられてきた。例えば、ロイコボリンは、骨髄細胞及び胃腸粘膜細胞へのメトレキサートの影響を緩和するために用いられてきた。アミホスチンはアルキル化剤又は白金含有化学療法薬剤を受ける患者の、好中球減少症関連発熱及び粘膜炎の発生を減らすために用いられてきた。また、デクスラゾキサンは、アントラサイクリン抗ガン化合物からの心臓防護を提供するために用いられてきた。不幸なことに、デクスラゾキサン及びアミノホスチンのような、多くの化学防護剤は、同時に投与する化学療法の効果を減じることがあるという懸念がある。
【0005】
特に貧血症及び好中球減少症に関連する化学療法に関して、更なる化学防護治療は、成長ホルモンの使用を含む。造血成長因子は、組み換えタンパク質として、市場で入手可能である。これらのタンパク質としては、好中球減少症の治療のために、顆粒球コロニー刺激因子(G-CSF)及び顆粒球−マクロファージコロニー刺激因子(GM-CSF)及びこれ等の誘導体、及び貧血の治療のために、赤血球生成促進因子(EPO, エリスロポエチン)及びこの誘導体が含まれる。しかしながら、これらの組み換えタンパク質は高価である。さらに、EPOはガン患者においてかなり毒性があり、幾つかの大規模な無作為治験において、血栓症、再発及び死の増加をもたらす。G-CSF及び GM-CSFは、白血病及び脊髄異形成のような続発性骨髄異常の遅延性リスク(>2年治療後)を増加させることが可能である。従って、これらの使用は限定され、かつ必要な全ての患者に入手可能ではない。さらに、成長因子は幾つかの種類の血液細胞リネージ(造血系細胞へ分化する細胞)の回復を早めることができるが、血小板、マクロファージ、T−細胞又はB−細胞の抑制を処置する治療は存在しない。
【0006】
非選択的キナーゼ阻害剤スタウロスポリンは、幾つかの培養細胞種において、DNA損傷作用物からの防護を行うことが示された(非特許文献2、3)。スタウロスポリンは天然産物であり、及び大部分の哺乳類キナーゼに高親和性で結合する非選択的キナーゼ阻害剤である(非特許文献4)。スタウロスポリン処理は、細胞種類、薬剤濃度、及び処理時間に応じて、アポトーシス、細胞周期停止及び細胞周期チェックポイント失効を含む一連の細胞応答を誘導することができる。例えば、スタウロスポリンは、G2チェックポイント応答の失効を含む幾つかの主張されたメカニズムにより、電離放射線及び化学療法のようなDNA損傷作用物に対する細胞の感受性を高めることが示された(非特許文献5〜15)。幾つかの培養細胞腫においてスタウロスポリン処理がDNA損傷作用物からの防護を提供するメカニズムははっきりしないが、幾つかの可能なメカニズムとして、タンパク質キナーゼCの阻害、又はCDK4タンパク質レベルの減少が示唆されている(非特許文献16,17)。スタウロスポリンは、造血前駆細胞に効果が無いことが示され、DNA損傷作用物曝露後充分後のスタウロスポリン使用は、防護を示さなかった。スタウロスポリンの非選択的キナーゼ阻害は、哺乳類へのin vivo投与後、細胞周期への効果に無関係の顕著な毒性(例えば、高血糖症)をもたらすことが示され、これらの毒性は、スタウロスポリンの臨床的使用を不可能にした。
【先行技術文献】
【非特許文献】
【0007】
【非特許文献1】BioWorld Today, page 4, July 23, 2002
【非特許文献2】Chen et al., J. Natl. Cancer Inst., 92, 1999-2008 (2000)
【非特許文献3】Ojeda et al., Int. J. Radiat. Biol., 61, 663-667 (1992)
【非特許文献4】Karaman et al., Nat. Biotechnol., 26, 127-132 (2008)
【非特許文献5】Bernhard et al., Int. J. Radiat. Biol., 69, 575-584 (1996)
【非特許文献6】Teyssier et al., Bull. Cancer, 86, 345-357 (1999)
【非特許文献7】Hallahan et al., Radiat. Res., 129, 345-350 (1992)
【非特許文献8】Zhang et al., J. Neurooncol., 15, 1-7 (1993)
【非特許文献9】Guo et al., Int. J. Radiat. Biol., 82, 97-109 (2006)
【非特許文献10】Bucher and Britten, Br. J. Cancer, 98, 523-528 (2008)
【非特許文献11】Laredo et al., Blood, 84, 229-237 (1994)
【非特許文献12】Luo et al., Neoplasia, 3, 411-419 (2001)
【非特許文献13】Wang et al., Yao Xue Xue Bao, 31, 411-415 (1996)
【非特許文献14】Chen et al., J. Natl. Cancer Inst., 92, 1999-2008 (2000)
【非特許文献15】Hirose et al., Cancer Res., 61, 5843-5849 (2001))
【非特許文献16】Chen et al., J. Natl. Cancer Inst., 92, 1999-2008 (2000)
【非特許文献17】Ojeda et al., Int. J. Radiat. Biol., 61, 663-667 (1992)
【発明の概要】
【発明が解決しようとする課題】
【0008】
上記載の方法の欠陥のため、化学療法を受けつつある、受ける予定がある、又は受けた患者を防護するための実際的方法が継続的に必要とされている。特に骨髄抑制及びリンパ球減少症から、化学療法の患者を防護することが特別に必要とされている。さらに、化学防護方法には、ガン患者の化学療法の効果を減少させないことが求められる。
本発明の目的は、患者に有効量の選択的CDK4/6阻害化合物を投与することにより、患者の健康な細胞をDNA損傷性化合物の影響から防護する方法を提供することである。
上記の目的は、本発明により全体的に又は部分的に達せられる。また、明細書及び図面が以下に最善に開示するに従って、この他の目的も明らかとなるであろう。
【課題を解決するための手段】
【0009】
本発明は、細胞毒性化合物に曝露した、これから曝露する、又は曝露する虞のある患者の健康な細胞に対する細胞毒性化合物の影響を低下させる又は防止する方法であって、この患者に有効量の阻害化合物又はその医薬的に許容可能な塩を投与することから成り、この健康な細胞が造血幹細胞又は造血前駆細胞であり、この阻害化合物がサイクリン依存性キナーゼ4(CDK4)及び/又はサイクリン依存性キナーゼ6(CDK6)を選択的に阻害することを特徴とする方法である。
幾つかの態様において、この阻害化合物はCDK4-及びCDK6の両者を選択的に阻害する。幾つかの態様において、この阻害化合物は、非天然化合物である。
【0010】
幾つかの態様において、この阻害化合物は、実質的にオフターゲット効果(標的非依存的効果)なしである。幾つかの態様において、このオフターゲット効果は、長期の毒性、抗酸化効果、発情効果、チロシンキナーゼ阻害、サイクリン依存性キナーゼ4/6(CDK4/6)以外のサイクリン依存性キナーゼ類(CDKs)阻害、及びCDK4/6非依存性細胞における細胞周期停止からなる群の1又はそれ以上の効果である。
幾つかの態様において、この阻害剤化合物は、CDK4/6依存性細胞において、G1期停止を選択的に誘導する。幾つかの態様において、この阻害化合物は、CDK4/6-依存性細胞において、実質的に純粋なG1期停止を誘動する。
【0011】
幾つかの態様において、この阻害化合物は、ピリド[2,3-d]ピリミジン、トリアミノピリミジン、アリール[a]ピロロ[3,4-c]カルバゾール、窒素含有ヘテロアリール置換尿素、5-ピリミジニル-2-アミノチアゾール、ベンゾチアジアジン、及びアクリジンチオンから成る群から選択される。
幾つかの態様において、このピリド[2,3-d]ピリミジンは、ピリド[2,3-d]ピリミジン-7-オン又は 2-アミノ-6-シアノ-ピリド[2,3-d]ピリミジン-4-オンである。幾つかの態様において、このピリド[2,3-d]ピリミジン-7-オンは、2-(2'-ピリジル)アミノピリド[2,3-d]ピリミジン-7-オンである。幾つかの態様において、このピリド[2,3-d]ピリミジン-7-オンは、6-アセチル-8-シクロペンチル-5-メチル-2-(5-ピペラジン-1-イル-ピリジン-2-イルアミノ)-8H-ピリド-[2,3-d]ピリミジン-7-オンである。
幾つかの態様において、アリール[a]ピロロ[3,4-c]カルバゾールは、ナフチル[a]ピロロ[3,4-c]カルバゾール, インドロ[a]ピロロ[3,4-c]カルバゾール、キノリニル[a]ピロロ[3,4-c]カルバゾール、及びイソキノリニル[a]ピロロ[3,4-c]カルバゾールからなる群から選択される。幾つかの態様において、このアリール[a]ピロロ[3,4-c]カルバゾールは、2-ブロモ-12,13-ジヒドロ-5H-インドロ[2,3-a]ピロロ[3,4]-カルバゾール-5,6-ジオンである。
【0012】
幾つかの態様において、この患者は哺乳類である。幾つかの態様において、この阻害化合物を患者に対して、経口投与、局所投与、鼻腔内投与、吸入、及び静脈内投与からなる群の1投与法により行う。
幾つかの態様において、この阻害化合物を、細胞毒性化合物の曝露前、曝露中、曝露後、又はこれらのすべての組合せの際、患者に投与する。幾つかの態様において、細胞毒性化合物曝露の前、約24時間以内に、この阻害化合物を患者に投与する。幾つかの態様において、この阻害化合物を、細胞毒性化合物曝露後約24時間又はそれ以後に患者に投与される。
幾つかの態様において、細胞毒性化合物は、DNAを損傷する化合物である。
幾つかの態様において、健康な細胞は、長期造血幹細胞(LT-HSCs)、短期造血幹細胞(ST-HSCs)、多分化能前駆細胞(MPPs)、骨髄共通前駆細胞(CMPs)、リンパ球共通前駆細胞(CLPs)、顆粒球単球前駆細胞(GMPs)及び赤芽球系前駆細胞(MEPs)からなる群から選択される。幾つかの態様において、この阻害化合物の投与により、造血幹細胞及び/又は造血前駆細胞が、一時的に薬理学的に休止する。
【0013】
幾つかの態様において、患者は、疾患を治療するために細胞毒性化合物を用いた医学的治療を受けた、受けている又はこれから受ける。幾つかの態様において、阻害化合物の投与は、疾患にかかった細胞の増殖に効果を持たない。
幾つかの態様において、この疾患は、ガンである。幾つかの態様において、このガンは、サイクリン依存性キナーゼ1(CDK1)の活性増加、サイクリン依存性キナーゼ2(CDK2)の活性増加、網膜芽腫腫瘍抑制タンパク質(RB)の欠失又は不在、高レベルのMYC発現、サイクリンEの増加、及びサイクリンAの増加からなる群の1以上の特徴を持つ。
幾つかの態様において、阻害化合物の投与により、阻害化合物の投与なしの場合に用いられる投与量より多量の細胞毒性化合物を用いて、疾患を治療することが可能になる。
幾つかの態様において、この患者は、誤って細胞毒性化合物に曝露される、又は過剰投与量の細胞毒性化合物に曝露される。
幾つかの態様において、この方法には、長期の血液学的毒性がない。幾つかの態様において、阻害化合物の投与は、阻害化合物の投与無しで細胞毒性化合物に曝露した場合に予想される結果と比べて、貧血を減少させ、リンパ球減少症を減らし、血小板減少症を減らし、又は好中球減少症を減らす結果をもたらす。
【0014】
幾つかの態様において、本発明は、健康な細胞における細胞毒性化合物の効果を防ぐために使用する化合物のスクリーニング方法であって、
(i)試験化合物をCDK4/6依存性細胞集団に一定時間接触させる段階、
(ii)前記細胞集団の細胞周期を解析する段階、及び
(iii)前記細胞集団において選択的にG1期停止を誘導する試験化合物を選択する段階
から成る方法である。
幾つかの態様において、このCDK4/6依存性細胞集団は、不死化ヒト二倍体繊維芽細胞又はINK4a/ARF欠失メラノーマ細胞から成る。
幾つかの態様において、上記細胞周期の解析は、フローサイトメトリー、蛍光測定法、細胞画像化及び蛍光分光法から成る群から選択される少なくとも1の技術を用いて行われる。幾つかの態様において、上記細胞周期の解析は、前記細胞集団を、5−ブロモ−2−デオキシウリジン(BrdU)及びヨウ化プロピジウム(PI)から成る群から選択される少なくとも1の標識試薬を用いて標識することから成る。
【0015】
幾つかの態様において、上記スクリーニング方法は、更に、
(iV)CDK4/6依存性細胞のG1期停止を誘導する前記試験化合物を、第2の細胞集団に一定時間接触させる段階、但し、この第2の細胞集団はCDK4/6非依存性細胞を含む、
(V)前記第2の細胞集団の細胞周期を解析する段階、及び
(Vi)前記第2の細胞集団においてG1期停止を選択的に誘導しない試験化合物を選択する段階、を含む。
幾つかの態様において、第2の細胞集団はガン細胞株である。幾つかの態様において、第2の細胞集団は、網膜芽腫腫瘍抑制タンパク質(RB)ヌルである。
幾つかの態様において、上記スクリーニング方法は、更に、
(Vii)前記試験化合物が、細胞毒性化合物と接触したex vivo細胞集団において、DNA損傷を減少させる、細胞生存を維持させる、又はその両者を行うことができるかどうかを検定することによって、該試験化合物の保護能の確認を行う段階、を含む。
幾つかの態様において、上記細胞集団におけるDNA損傷は、γ-H2AX検定を行うことで検定される。幾つかの態様において、細胞生存は、細胞増殖検定を行うことで検定される。
幾つかの態様において、細胞毒性化合物はDNAを損傷する化合物である。幾つかの態様において、このDNAを損傷する化合物は、ドキソルビシン、エトポシド及びカルボプラチンから成る群から選択される。
【図面の簡単な説明】
【0016】
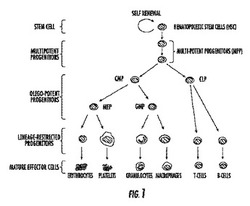
【図1】血液新生、造血幹細胞(HSC)の階層的増殖、及び増殖に際し分化が進む前駆細胞の概略図である。
【図2A】0nM(対照)、15nM、30nM、89nM又は270nM(上から下)の6-アセチル-8-シクロペンチル-5-メチル-2-(5-ピペラジン-1-イル-ピリジン-2-イルアミノ)-8H-ピリド-[2,3-d]-ピリミジン-7-オン (PD 0332991)で24時間処理したサイクリン依存性キナーゼ4/6(CDK4/6)依存性細胞(INK4a/ARF欠失ヒトメラノーマ細胞;WM2664)の細胞周期解析の一組の代表的ヒストグラムである。データを、Mod-Fit(R) software (Varity Software House, Topsham, Maine, USA)を用いてフィットさせた。
【0017】
【図2B】0nM(対照)、122nM、370nM、1.1μM又は3.3μM(上部から下部へ)の2-ブロモ-12,13-ジヒドロ-5H-インドロ[2,3-a]ピロロ[3,4]カルバゾール-5,6-ジオン (2BrIC)で24時間処理したサイクリン依存性キナーゼ4/6(CDK4/6)依存性細胞(WM2664)の細胞周期解析の一組の代表的ヒストグラムである。データを、Mod-Fit(R) softwareを用いてフィットさせた。
【0018】
【図2C】0nM(対照)、15nM、30nM、89nM又は270nMのPD 0332991又は0nM(対照)、122nM、370nM、1.1μM又は3.3μMの2BrICでサイクリン依存性キナーゼ4/6(CDK4/6)依存性細胞(WM2664)を24時間処理後、G1期における細胞の割合(%)を示すグラフである。
【0019】
【図2D】0nM(対照)、15nM、30nM、89nM又は270nMのPD 0332991又は0nM(対照)、122nM、370nM、1.1μM又は3.3μMの2BrICでサイクリン依存性キナーゼ4/6(CDK4/6)依存性細胞(WM2664)を24時間処理後、G2/M期における細胞の割合(%)を示すグラフである。
【0020】
【図2E】0nM(対照)、15nM、30nM、89nM又は270nMのPD 0332991又は0nM(対照)、122nM、370nM、1.1μM又は3.3μMの2BrICでサイクリン依存性キナーゼ4/6(CDK4/6)依存性細胞(WM2664)を24時間処理後、S期における細胞の割合(%)を示すグラフである。
【0021】
【図3A】サイクリン依存性キナーゼ4/6(CDK4/6)依存性細胞をカルボプラチン誘発性DNA損傷から防護する2-ブロモ-12,13-ジヒドロ-5H-インドロ[2,3-a]ピロロ[3,4]カルバゾール-5,6-ジオン (2BrIC)の防護能を示す(棒グラフ)。INK4a/ARF欠損ヒトメラノーマ細胞(WM2664)を16時間2BrICで前処理し、その後8時間カルボプラチン処理を行い、DNA損傷をγ-H2AX検定を用いて検定した。WM2664細胞について、γ-H2AXポジティブ細胞の割合(%)を、2BrIC前処理なしのカルボプラチン(CARBO)処理、及び0.122, 0.37, 1.1又は3.3μMの2BrICによる前処理後カルボプラチン(CARBO)処理について示す。
【0022】
【図3B】サイクリン依存性キナーゼ4/6(CDK4/6)依存性細胞をエトポシド誘発性DNA損傷から防護する2-ブロモ-12,13-ジヒドロ-5H-インドロ[2,3-a]ピロロ[3,4]カルバゾール-5,6-ジオン(2BrIC)の防護能を示す(棒グラフ)。INK4a/ARF欠損ヒトメラノーマ細胞(WM2664)を16時間2BrICで前処理し、その後8時間エトポシド処理を行い、DNA損傷をγ-H2AX検定を用いて検定した。WM2664細胞について、γ-H2AXポジティブ細胞の割合(%)を、2BrIC前処理なしのエトポシド(ETOP)処理、及び0.122, 0.37, 1.1又は3.3μMの2BrICによる前処理後エトポシド(ETOP)処理について示す。
【0023】
【図3C】サイクリン依存性キナーゼ4/6(CDK4/6)依存性細胞をドキソルビシン誘発性DNA損傷から防護する2BrICの防護能を示す(棒グラフ)。INK4a/ARF欠損ヒトメラノーマ細胞(WM2664)を16時間2BrICで前処理し、その後8時間ドキソルビシン処理を行い、DNA損傷をγ-H2AX検定を用いて検定した。WM2664細胞について、γ-H2AXポジティブ細胞の割合(%)を、2BrIC前処理なしのドキソルビシン(DOX)処理、及び0.122, 0.37, 1.1又は3.3μMの2BrICによる前処理後ドキソルビシン(DOX)処理について示す。
【0024】
【図4】γ-H2AXレベルを検定することにより、サイクリン依存性キナーゼ4/6(CDK4/6)依存性細胞を、ドキソルビシン−、カルボプラチン−又はエトポシド−誘発性DNA損傷から防護する2BrICの防護能を示す。非処理不死化ヒト二倍体繊維芽細胞(HS68細胞)について、γ-H2AXポジティブ細胞の割合(%)を、122nM、370nM、1.1又は3.3μMの2BrICで16時間処理したもの、2BrICの前処理なしでカルボプラチン(CARBO)、エトポシド(ETOP)又はドキソルビシン(DOX)の何れかで8時間処理したもの、122nM、370nM、1.1又は3.3μMの2BrICで16時間前処理した後、CARBO、ETOP又はDOXの何れかで8時間を処理したものを示す。
【0025】
【図5】γ-H2AXレベルを検定することにより、サイクリン依存性キナーゼ4/6(CDK4/6)非依存性細胞(ヒトRB-ヌルメラノーマ細胞A2058)を、ドキソルビシン−、カルボプラチン−又はエトポシド−誘発性DNA損傷から2BrICが防護できないことを示す。A2058細胞について、γ-H2AXポジティブ細胞の割合(%)を、122nM、370nM、1.1又は3.3μMの2BrICで16時間処理したもの、2BrICの前処理なしでカルボプラチン(CARBO)、エトポシド(ETOP)又はドキソルビシン(DOX)の何れかで8時間処理したもの、122nM、370nM、1.1又は3.3μMの2BrICで16時間前処理した後、CARBO、ETOP又はDOX何れかで8時間処理したものを示す。
【0026】
【図6A】サイクリン依存性キナーゼ4/6(CDK4/6)依存性細胞をカルボプラチン誘発DNA損傷から防護するPD 0332991(「PD」と表示する。)の防護能を示す(棒グラフ)。INK4a/ARF欠損ヒトメラノーマ細胞(WM2664)を16時間PD0332991で前処理し、その後8時間カルボプラチン(CARBO)処理を行い、DNA損傷をγ-H2AX検定を用いて検定した。WM2664細胞について、γ-H2AXポジティブ細胞の割合(%)を、PDの前処理なしでカルボプラチン処理したもの、15nM、30nM、89nM又は270nMのPDにより前処理した後カルボプラチン(CARBO)処理したものを示す。
【0027】
【図6B】サイクリン依存性キナーゼ4/6(CDK4/6)依存性細胞をエトポシド誘発DNA損傷から防護するPD 0332991(「PD」と表示する。)の防護能を示す(棒グラフ)。INK4a/ARF欠損ヒトメラノーマ細胞(WM2664)を16時間PD0332991で前処理し、その後8時間エトポシド(ETOP)処理を行い、DNA損傷をγ-H2AX検定を用いて検定した。WM2664細胞について、γ-H2AXポジティブ細胞の割合(%)を、PDの前処理なしでカルボプラチン処理したもの、15nM、30nM、89nM又は270nMのPDにより前処理した後エトポシド(ETOP)処理したものを示す。
【0028】
【図6C】サイクリン依存性キナーゼ4/6(CDK4/6)依存性細胞をドキソルビシン誘発DNA損傷から防護するPD 0332991(「PD」と表示する。)の防護能を示す(棒グラフ)。INK4a/ARF欠損ヒトメラノーマ細胞(WM2664)を16時間PD0332991で前処理し、その後8時間ドキソルビシン(DOX)処理を行い、DNA損傷をγ-H2AX検定を用いて検定した。WM2664細胞について、γ-H2AXポジティブ細胞の割合(%)を、PDの前処理なしでカルボプラチン処理したもの、15nM、30nM、89nM又は270nMのPDにより前処理した後ドキソルビシン(DOX)処理したものを示す。
【0029】
【図7】γ-H2AXレベルを検定することにより、サイクリン依存性キナーゼ4/6(CDK4/6)依存性細胞を、ドキソルビシン−、カルボプラチン−又はエトポシド−誘発性DNA損傷から防護するPD 0332991(「PD」と表示する。)の防護能を示す。非処理不死化ヒト二倍体繊維芽細胞(HS68細胞)について、γ-H2AXポジティブ細胞の割合(%)を、122nM、370nM、1.1又は3.3μMの2BrICで16時間処理したもの、PDの前処理なしでカルボプラチン(CARBO)、エトポシド(ETOP)又はドキソルビシン(DOX)の何れかで8時間処理したもの、122nM、370nM、1.1又は3.3μMのPDで16時間前処理した後、CARBO、ETOP又はDOXの何れかで8時間を処理したものを示す。
【0030】
【図8】γ-H2AXレベルを検定することにより、サイクリン依存性キナーゼ4/6(CDK4/6)非依存性細胞(ヒトRB-ヌルメラノーマ細胞A2058)を、ドキソルビシン−、カルボプラチン−又はエトポシド−誘発性DNA損傷からPD 0332991(「PD」と表示する。)が防護できないことを示す。A2058細胞について、γ-H2AXポジティブ細胞の割合(%)を、122nM、370nM、1.1又は3.3μMの2BrICで16時間処理したもの、PDの前処理なしでカルボプラチン(CARBO)、エトポシド(ETOP)又はドキソルビシン(DOX)の何れかで8時間処理したもの、122nM、370nM、1.1又は3.3μMのPDで16時間前処理した後、CARBO、ETOP又はDOX何れかで8時間処理したものを示す。
【0031】
【図9】WST-1検定を用いて細胞生存性を検定することにより、ドキソルビシン誘発性細胞毒性からINK4a/ARF欠損ヒトメラノーマ細胞(WM2664)を防護する2-ブロモ-12,13-ジヒドロ-5H-インドロ[2,3-a]ピロロ[3,4]カルバゾール-5,6-ジオン(2BrIC)の防護能を示す(棒グラフ)。相対的細胞数を、450nmの吸光度により測定した。2BrIC単独(0.0μM, 0.120μM, 0.370μM, 1.1μM又は3.3μM)(縞模様棒);2BrIC(0.0μM, 0.120μM, 0.370μM, 1.1μM又は3.3μM)及びドキソルビシン(DOX)(黒塗り棒);又はDOX単独(白棒)の処理細胞に対する結果を示す。
【0032】
【図10】WST-1検定を用いて細胞生存性を検定することにより、ドキソルビシン誘発性細胞毒性からINK4a/ARF欠損ヒトメラノーマ細胞(WM2664)を防護する6-アセチル-8-シクロペンチル-5-メチル-2-(5-ピペラジン-1-イル-ピリジン-2-イルアミノ)-8H-ピリド-[2,3-d]-ピリミジン-7-オン(PD 0332991)の防護能を示す(棒グラフ)。相対的細胞数を、450nmの吸光度により測定した。PD0332991単独 (0.0μM, 0.120μM, 0.370μM, 1.1μM又は3.3μM)(縞模様棒);PD0332991(0.0μM, 0.120μM, 0.370μM, 1.1μM又は3.3μM)及びドキソルビシン(DOX)(黒塗り棒);又はDOX単独(白棒)の処理細胞に対する結果を示す。
【0033】
【図11】WST-1検定を用いて細胞生存性を検定することにより、ドキソルビシン誘発性細胞毒性から不死化ヒト二倍体繊維芽細胞(tHDF; HS68)を防護する2-ブロモ-12,13-ジヒドロ-5H-インドロ[2,3-a]ピロロ[3,4]カルバゾール-5,6-ジオン (2BrIC)の防護能を示す(棒グラフ)。相対的細胞数を、450nmの吸光度により測定した。2BrIC単独(0.0μM, 0.120μM, 0.370μM, 1.1μM又は3.3μM)(縞模様棒);2BrIC(0.0μM, 0.120μM, 0.370μM, 1.1μM又は3.3μM)及びドキソルビシン(DOX)(黒塗り棒);又はDOX単独(白棒)の処理細胞に対する結果を示す。
【0034】
【図12】WST-1検定を用いて細胞生存性を検定することにより、ドキソルビシン誘発性細胞毒性から不死化ヒト二倍体繊維芽細胞(tHDF; HS68)を防護する6-アセチル-8-シクロペンチル-5-メチル-2-(5-ピペラジン-1-イル-ピリジン-2-イルアミノ)-8H-ピリド-[2,3-d]-ピリミジン-7-オン (PD 0332991)の防護能を示す(棒グラフ)。相対的細胞数を、450nmの吸光度により測定した。PD0332991単独(0.0μM, 0.120μM, 0.370μM, 1.1μM又は3.3μM)(縞模様棒);PD0332991(0.0μM, 0.120μM, 0.370μM, 1.1μM又は3.3μM)及びドキソルビシン(DOX)(黒塗り棒);又はDOX単独(白棒)の処理細胞に対する結果を示す。
【0035】
【図13】WST-1検定を用いて細胞生存性を検定することにより、ドキソルビシン誘発性細胞毒性から、2-ブロモ-12,13-ジヒドロ-5H-インドロ[2,3-a]ピロロ[3,4]カルバゾール-5,6-ジオン (2BrIC)は、ヒトRB-ヌルメラノーマ細胞(A2058)を防護できないことを示す(棒グラフ)。相対的細胞数を、450nmの吸光度により測定した。2BrIC単独(0.0μM, 0.120μM, 0.370μM, 1.1μM又は3.3μM)(縞模様棒);2BrIC(0.0μM, 0.120μM, 0.370μM, 1.1μM又は3.3μM)及びドキソルビシン(DOX)(黒塗り棒);又はDOX単独(白棒)の処理細胞に対する結果を示す。
【0036】
【図14】WST-1検定を用いて細胞生存性を検定することにより、ドキソルビシン誘発性細胞毒性からヒトRB-ヌル・メラノーマ細胞(A2058)を防護する6-アセチル-8-シクロペンチル-5-メチル-2-(5-ピペラジン-1-イル-ピリジン-2-イルアミノ)-8H-ピリド-[2,3-d]-ピリミジン-7-オン (PD 0332991)の防護能を示す(棒グラフ)。相対的細胞数を、450nmの吸光度により測定した。PD0332991単独(0.0μM, 0.120μM, 0.370μM, 1.1μM又は3.3μM)(縞模様棒);PD0332991(0.0μM, 0.120μM, 0.370μM, 1.1μM又は3.3μM)及びドキソルビシン(DOX)(黒塗り棒);又はDOX単独(白棒)の処理細胞に対する結果を示す。
【0037】
【図15A】細胞表面抗原を用いた、非処理多分化能前駆細胞(MPP)(上部)及び2-ブロモ-12,13-ジヒドロ-5H-インドロ[2,3-a]ピロロ[3,4]カルバゾール-5,6-ジオン (2BrIC)処理MPP細胞(下部)に対するフローサイトメトリー・ゲート図である。24時間2BrIC処理又は非処理に加えて、細胞はまた、5−ブロモ−2−デオキシウリジン(BrdU)存在下にあった。
【0038】
【図15B】図15AからのLin-Kit+Sca-1ポジティブな、非処理及び2-ブロモ-12,13-ジヒドロ-5H-インドロ[2,3-a]ピロロ[3,4]カルバゾール-5,6-ジオン (2BrIC)-処理細胞集団における、5−ブロモ−2−デオキシウリジン(BrdU)ポジティブ細胞の割合を示す(棒グラフ)。BrdU取り込みは、in vivo 2BrIC処理が明白にMPPの増殖を減少させることを示し、G1期からS期への細胞周期移行の尺度を表す。
【0039】
【図16A】細胞表面抗原を用いた、造血幹細胞(HSC)、多分化能前駆細胞(MPP)(上部)及び骨髄系前駆細胞(下部)に対するフローサイトメトリー・ゲート図である。
【図16B】6-アセチル-8-シクロペンチル-5-メチル-2-(5-ピペラジン-1-イル-ピリジン-2-イルアミノ)-8H-ピリド-[2,3-d]-ピリミジン-7-オン (PD 0332991)の48時間の処理又は非処理(N=6)、及びBrdUの24時間曝露後の、5−ブロモ−2−デオキシウリジン(BrdU)取り込み、及びKi67発現による、造血幹細胞及び前駆細胞(HSPC)集団における増殖の代表的等高線プロットである。等高線は5%密度を表す。G1期からS期への細胞周期移行の尺度としてのBrdU取り込み、及びKi67発現は、増殖細胞のマーカーである。PD0332991処理は、明らかにこれらの初期HSPCの増殖を減少させる。
【0040】
【図16C】図16BからのPD0332991処理(影付き棒)及び非処理(白棒)細胞集団における5−ブロモ−2−デオキシウリジン(BrdU)及びKi67の定量データを示す一組の棒グラフである。*p,0.05; **p<0.01, ***p<0.001。誤差バーは、平均の標準誤差を表す。
【図16D】48時間のPD0332991処理(影付き棒)及び非処理(白棒)、及び24時間の5−ブロモ−2−デオキシウリジン(BrdU)曝露後の細胞集団におけるLin-, HSC, MPP、又は Lin-cKit+Sca1-集団の相対的な割合を示す。*p,0.05; **p<0.01, ***p<0.001。誤差バーは、平均の標準誤差を表す。CDK4/6阻害剤存在下で、多くの分化した骨髄細胞が、かなり多く増えて分裂及び分化を続けるので、サイクリン依存性キナーゼ4/6(CDK4/6)阻害剤処理により、HSCとMPPは相対的に増える。
【0041】
【図17】2-ブロモ-12,13-ジヒドロ-5H-インドロ[2,3-a]ピロロ[3,4]カルバゾール-5,6-ジオン (2BrIC;150mg/kg、強制経口給餌による)が、マウスin vivoにおいて、カルボプラチン(Carbo;100mg/kg、i.p.)の効果からの、赤血球及びヘモグロビンの防護を提供することを示す、一組の棒グラフを示す。マウスには、Carbo注射1時間前に、2BrIC処理を行った。Carbo注射後6日目に、血液を採取し、全赤血球数を測定した。影付き棒は、Carbo及び3BrIC処理した動物からのデータを表すが、他方、白棒は、Carbo単独処理した動物からのデータを表す。誤差バーは、平均の標準誤差である。
【0042】
【図18】6-アセチル-8-シクロペンチル-5-メチル-2-(5-ピペラジン-1-イル-ピリジン-2-イルアミノ)-8H-ピリド-[2,3-d]-ピリミジン-7-オン (PD 0332991;150mg/kg、強制経口給餌による)が、マウスin vivoにおいて、ドキソルビシン(DOX;10mg/kg、i.p.)の効果からの、4種リネージの防護を提供することを示す、一組の棒グラフを示す。マウスには、DOX注射1時間前に、PD0332991処理を行った。DOX注射を、7日後繰り返した。初回のDOX注射後14日目に、血液を採取し、全赤血球数を測定した。影付き棒は、DOX及びPD0332991処理した動物からのデータを表すが、他方、白棒は、DOX単独処理した動物からのデータを表す。誤差バーは、平均の標準誤差である。
【0043】
【図19】6-アセチル-8-シクロペンチル-5-メチル-2-(5-ピペラジン-1-イル-ピリジン-2-イルアミノ)-8H-ピリド-[2,3-d]-ピリミジン-7-オン (PD 0332991;150mg/kg、強制経口給餌による)が、マウスin vivoにおいて、カルボプラチン(Carbo;10mg/kg、i.p.)の効果からの、4種リネージの防護を提供することを示す、一組の棒グラフを示す。マウスには、Carbo注射1時間前に、PD0332991処理を行った。血液を、7日間隔で採取し、全赤血球数を測定した。より淡い影付き棒は、Carbo及びPD0332991処理した動物からのデータを表すが、他方、より濃い影付け棒は、Carbo単独処理した動物からのデータを表す。誤差バーは、平均の標準誤差である。
【0044】
【図20A】フラボピリドール及び5−ブロモ−2−デオキシウリジン(BrdU)処理した様々な種類の細胞に対するフローサイトメトリーゲート図を示す。この図は、フラボピリドールはサイクリン依存性キナーゼ4/6(CDK4/6)−依存性細胞においてG1期停止を誘導しないことを示している。上の図は、INK4a/ARFを欠損したヒトメラノーマ細胞(WM2664)に対する図を示し、中間の図は、不死化したヒト二倍体繊維芽細胞(tHDF; HS68)に対する図を示し、下の図は、ヒトRB-ヌル・メラノーマ細胞(A2058)に対する図を示す。
【0045】
【図20B】サイクリン依存キナーゼ4/6(CDK4/6)−依存性細胞において、フラボピリドールは化学防護効果を持たないことを示す(棒グラフ)。データを、非処理INK4a/ARFを欠損したヒトメラノーマ細胞(WM2664細胞);900, 300, 100又は30nMフラボピリドール(16時間)で処理したWM2664細胞;ドキソルビシン(DOX;122nM、8時間)処理したWM2664細胞;DOX(122nM)8時間処理後、16時間の900, 300, 100又は30nMフラボピリドール処理したWM2664細胞に対して提供する。処理培地を交換し、細胞生存性を7日後に、CellTiter-Glo(R)assay (CTG; Promega, Madison, Wisconsin, USA)を用いて測定し、データを相対的光単位(RLU)で表す。誤差バーを平均の標準誤差で表す。
【0046】
【図20C】サイクリン依存キナーゼ4/6(CDK4/6)−依存性細胞において、フラボピリドールは化学防護効果を持たないことを示す(棒グラフ)。データを、非処理不死化ヒト二倍体繊維芽細胞(tHDF;HS68細胞);900, 300, 100又は30nMフラボピリドール(16時間)で処理したHS68細胞;ドキソルビシン(DOX;370nM、8時間)処理したHS68細胞;16時間の900, 300, 100又は30nMフラボピリドール前処理後、DOX(370nM)8時間処理したHS68細胞に対して提供する。処理培地を交換し、細胞生存性を7日後に、CellTiter-Glo(R)assay (CTG; Promega, Madison, Wisconsin, USA)を用いて測定し、データを相対的光単位(RLU)で表す。誤差バーを平均の標準誤差で表す。
【0047】
【図20D】サイクリン依存キナーゼ4/6(CDK4/6)−非依存性細胞において、フラボピリドールは化学防護効果を持たないことを示す(棒グラフ)。データを、非処理ヒト網膜芽腫腫瘍抑制タンパク質(RB)−ヌル・メラノーマ細胞(A2058; 細胞);900, 300, 100又は30nMフラボピリドール(16時間)で処理したA2058細胞;ドキソルビシン(DOX;370nM、8時間)処理したA2058細胞;及び16時間の900, 300, 100又は30nMフラボピリドール前処理後、DOX(370nM)8時間処理したA2058細胞に対して提供する。処理培地を交換し、細胞生存性を7日後に、CellTiter-Glo(R) assay (CTG; Promega, Madison, Wisconsin, USA)を用いて測定し、データを相対的光単位(RLU)で表す。誤差バーを平均の標準誤差で表す。
【0048】
【図21A】化合物7(R547)及び5−ブロモ−2−デオキシウリジン(BrdU)処理した様々な種類の細胞に対するフローサイトメトリーゲート図を示し、これは化合物7はサイクリン依存性キナーゼ4/6(CDK4/6)−依存性細胞においてG1期停止を誘導しないことを示す。上の図は、INK4a/ARFを欠損したヒトメラノーマ細胞(WM2664)に対する図;中間の図は、不死化したヒト二倍体繊維芽細胞(tHDF; HS68)に対する図;及び下の図は、ヒト網膜芽腫腫瘍抑制タンパク質(RB)−ヌル・メラノーマ細胞(A2058)に対する図である。
【0049】
【図21B】サイクリン依存性キナーゼ4/6(CDK4/6)−依存性細胞において、化合物7(R547)は化学防護効果を持たないことを示す(棒グラフ)。データを、非処理INK4a/ARF欠損ヒトメラノーマ細胞(WM2664細胞);900, 300, 100又は30nMの化合物7(16時間)で処理したWM2664細胞;ドキソルビシン(DOX;122nM、8時間)処理したWM2664細胞;16時間の900, 300, 100又は30nMの化合物7前処理後、DOX(122nM)8時間処理したWM2664細胞に対して提供する。処理培地を交換し、細胞生存性を7日後に、CellTiter-Glo(R) assay (CTG; Promega, Madison, Wisconsin, USA)を用いて測定し、データを相対的光単位(RLU)で表す。誤差バーを平均の標準誤差で表す。
【0050】
【図21C】サイクリン依存性キナーゼ4/6(CDK4/6)−依存性細胞において、化合物7(R547)は化学防護効果を持たないことを示す(棒グラフ)。データを、非処理不死化ヒト二倍体繊維芽細胞(tHDF; HS68細胞);900, 300, 100又は30nM化合物7(16時間)で処理したHS68細胞;ドキソルビシン(DOX;370nM、8時間)処理したHS568細胞;16時間の900, 300, 100又は30nMの化合物7前処理後、DOX(370nM)8時間処理したHS68細胞に対して提供する。処理培地を交換し、細胞生存性を7日後に、CellTiter-Glo(R) assay (CTG; Promega, Madison, Wisconsin, USA)を用いて測定し、データを相対的光単位(RLU)で表す。誤差バーを平均の標準誤差で表す。
【0051】
【図21D】サイクリン依存性キナーゼ4/6(CDK4/6)−非依存性細胞において、化合物7(R547)は化学防護効果を持たないことを示す(棒グラフ)。データを、非処理ヒト網膜芽腫腫瘍抑制タンパク質(RB)−ヌル・メラノーマ細胞(A2058細胞);900, 300, 100又は30nM化合物7(16時間)で処理したA2058細胞;ドキソルビシン(DOX;370nM、8時間)処理したA2058細胞;16時間の900, 300, 100又は30nMの化合物7前処理後、DOX(370nM)8時間処理したA2058細胞に対して提供する。処理培地を交換し、細胞生存性を7日後に、CellTiter-Glo(R) assay (CTG; Promega, Madison, Wisconsin, USA)を用いて測定し、データを相対的光単位(RLU)で表す。誤差バーを平均の標準誤差で表す。
【0052】
【図22A】ロスコビチン及び5−ブロモ−2−デオキシウリジン(BrdU)処理した様々な種類の細胞に対するフローサイトメトリーゲート図を示し、これはロスコビチンは、サイクリン依存性キナーゼ4/6(CDK4/6)−依存性細胞においてG1期停止を誘導しないことを示す。上の図は、INK4a/ARFを欠損したヒトメラノーマ細胞(WM2664)に対する図;中間の図は、不死化したヒト二倍体繊維芽細胞(tHDF; HS68)に対する図;及び下の図は、ヒト(RB)−ヌル・メラノーマ細胞(A2058)に対する図である。
【0053】
【図22B】サイクリン依存性キナーゼ4/6(CDK4/6)−依存性細胞において、ロスコビチンは化学防護効果を持たないことを示す(棒グラフ)。データを、非処理INK4a/ARF欠損ヒトメラノーマ細胞(WM2664細胞);900, 300, 100又は30nMロスコビチン(16時間)で処理したWM2664細胞;ドキソルビシン(DOX;122nM、8時間)処理したWM2664細胞;16時間の900, 300, 100又は30nMのロスコビチン前処理後、DOX(122nM)8時間処理したWM2664細胞に対して提供する。処理培地を交換し、細胞生存性を7日後に、CellTiter-Glo(R) assay (CTG; Promega, Madison, Wisconsin, USA)を用いて測定し、データを相対的光単位(RLU)で表す。誤差バーを平均の標準誤差で表す。
【0054】
【図22C】サイクリン依存性キナーゼ4/6(CDK4/6)−依存性細胞において、ロスコビチンは化学防護効果を持たないことを示す(棒グラフ)。データを、非処理不死化ヒト二倍体繊維芽細胞(tHDF;HS68細胞);900, 300, 100又は30nMロスコビチン(16時間)で処理したHS68細胞;ドキソルビシン(DOX;370nM、8時間)処理したHS68細胞;16時間の900, 300, 100又は30nMロスコビチン前処理後、DOX(370nM)8時間処理したHS68細胞に対して提供する。処理培地を交換し、細胞生存性を7日後に、CellTiter-Glo(R) assay (CTG; Promega, Madison, Wisconsin, USA)を用いて測定し、データを相対的光単位(RLU)で表す。誤差バーを平均の標準誤差で表す。
【0055】
【図22D】サイクリン依存性キナーゼ4/6(CDK4/6)−非依存性細胞において、ロスコビチンは化学防護効果を持たないことを示す(棒グラフ)。データを、非処理ヒト網膜芽腫腫瘍抑制タンパク質(RB)−ヌル・メラノーマ細胞(A2058細胞);900,300,100又は30nMロスコビチン(16時間)で処理したA2058細胞;ドキソルビシン(DOX;370nM、8時間)処理したA2058細胞;16時間の900, 300, 100又は30nMロスコビチン前処理後、DOX(370nM)8時間処理したA2058細胞に対して提供する。処理培地を交換し、細胞生存性を7日後に、CellTiter-Glo(R) assay (CTG; Promega, Madison, Wisconsin, USA)を用いて測定し、データを相対的光単位(RLU)で表す。誤差バーを平均の標準誤差で表す。
【0056】
【図23A】サイクリン依存性キナーゼ4/6(CDK4/6)−依存性細胞において、ゲニステインは化学防護効果を持たないことを示す棒グラフである。データを、非処理INK4a/ARF欠損ヒトメラノーマ細胞(WM2664細胞);100, 30, 10又は3μMゲニステイン(16時間)で処理したWM2664細胞;ドキソルビシン(DOX;122nM、8時間)処理したWM2664細胞;16時間の100, 30, 10又は3μMのゲニステイン前処理後、DOX(122nM)8時間処理したWM2664細胞に対して提供する。処理培地を交換し、細胞生存性を7日後に、CellTiter-Glo(R)assay (CTG; Promega, Madison, Wisconsin, USA)を用いて測定し、データを相対的光単位(RLU)で表す。誤差バーを平均の標準誤差で表す。
【0057】
【図23B】サイクリン依存性キナーゼ4/6(CDK4/6)−依存性細胞において、ゲニステインは化学防護効果を持たないことを示す棒グラフである。データを、非処理不死化ヒト二倍体繊維芽細胞(tHDF;HS68細胞);300, 100, 30又は3μMゲニステイン(16時間)で処理したHS68細胞;ドキソルビシン(DOX;370nM、8時間)処理したHS68細胞;16時間の300, 100, 30又は3μMゲニステイン前処理後、DOX(370nM)8時間処理したHS68細胞に対して提供する。処理培地を交換し、細胞生存性を7日後に、CellTiter-Glo(R) assay (CTG; Promega, Madison, Wisconsin, USA)を用いて測定し、データを相対的光単位(RLU)で表す。誤差バーを平均の標準誤差で表す。
【0058】
【図23C】サイクリン性依存キナーゼ4/6(CDK4/6)−非依存性細胞において、ゲニステインは化学防護効果を持たないことを示す(棒グラフ)。データを、非処理ヒト網膜芽腫腫瘍抑制タンパク質(RB)−ヌル・メラノーマ細胞(A2058細胞);100, 30, 10又は3μMゲニステイン(16時間)で処理したA2058細胞;ドキソルビシン(DOX;370nM、8時間)処理したA2058細胞;16時間の100, 30, 10又は3μMゲニステイン前処理後、DOX(370nM)8時間処理したA2058細胞に対して提供する。処理培地を交換し、細胞生存性を7日後に、CellTiter-Glo(R)assay (CTG; Promega, Madison, Wisconsin, USA)を用いて測定し、データを相対的光単位(RLU)で表す。誤差バーを平均の標準誤差で表す。
【0059】
【図24A】1.1又は3.3μMの非CDK4/6選択性化合物8、9、11、14、10、13又は12で処理した後、G1期にあるサイクリン依存性キナーゼ4/6(CDK4/6)依存性細胞の割合(%)を示す(棒グラフ)。比較のために、非処理細胞集合に対するデータも示した(対照1〜4)。
【0060】
【図24B】1.1又は3.3μMの化合物8、9、11、14、10、13又は12で処理した後、G2/M期にあるサイクリン依存性キナーゼ4/6(CDK4/6)依存性細胞の割合(%)を示す(棒グラフ)。比較のために、非処理細胞集合に対するデータも示した(対照1〜4)。
【図24C】1.1又は3.3μMの化合物8、9、11、14、10、13又は12で処理した後、S期にあるサイクリン依存性キナーゼ4/6(CDK4/6)依存性細胞の割合(%)を示す棒グラフである。比較のために、非処理細胞集合に対するデータも示した(対照1〜4)。
【0061】
【図24D】細胞処理7日後のWST-1検定を用いた細胞生存性により測定した、化合物8が、サイクリン非依存キナーゼ4/6(CDK4/6)−依存性細胞(INK4a/ARF欠損ヒトメラノーマ細胞(WM2664))を、ドキソルビシン誘発の細胞毒性から防護することができないことを示す(棒グラフ)。細胞数を、450nmの吸光度から測定した。化合物8のみを16時間処理(縞模様棒、0.0μM, 0.120μM, 0.370μM, 1.1μM又は3.3μM);16時間化合物8(0.0μM, 0.120μM, 0.370μM, 1.1μM又は3.3μM)を処理後、8時間のドキソルビシン処理(DOX;122nM;黒塗り棒);又はDOXのみ(122nM;8時間;白棒)を処理した細胞に対して、結果を示す。誤差バーを平均の標準誤差で表す。
【0062】
【図24E】細胞処理7日後のWST-1検定を用いた細胞生存性により測定した、化合物9が、サイクリン性依存キナーゼ4/6(CDK4/6)−依存性細胞(INK4a/ARF欠損ヒトメラノーマ細胞(WM2664))を、ドキソルビシン誘導の細胞毒性から防護することができないことを示す(棒グラフ)。細胞数を、450nmの吸光度から測定した。化合物9のみを16時間処理(縞模様棒、0.0μM, 0.120μM, 0.370μM, 1.1μM又は3.3μM);16時間化合物9(0.0μM, 0.120μM, 0.370μM, 1.1μM又は3.3μM)を処理後、8時間のドキソルビシン処理(DOX;122nM;黒塗り棒);又はDOXのみ(122nM;白棒)を8時間処理した細胞に対して、結果を示す。誤差バーを平均の標準誤差で表す。
【0063】
【図24F】細胞処理7日後のWST-1検定を用いた細胞生存性により測定した、化合物11が、サイクリン依存性キナーゼ4/6(CDK4/6)−依存性細胞(INK4a/ARF欠損ヒトメラノーマ細胞(WM2664))を、ドキソルビシン誘導の細胞毒性から防護することができないことを示す(棒グラフ)。細胞数を、450nmの吸光度から測定した。化合物11のみを16時間処理(縞模様棒、0.0μM, 0.120μM, 0.370μM, 1.1μM又は3.3μM);16時間化合物11(0.0μM, 0.120μM, 0.370μM, 1.1μM又は3.3μM)を処理後、8時間のドキソルビシン処理(DOX;122nM;黒塗り棒);又はDOXのみ(122nM;白棒)を8時間処理した細胞に対して、結果を示す。誤差バーを平均の標準誤差で表す。
【0064】
【図24G】細胞処理7日後のWST-1検定を用いた細胞生存性により測定した、化合物8が、サイクリン依存性キナーゼ4/6(CDK4/6)−依存性細胞(不死化ヒト二倍体繊維芽細胞(tHDF; HS68))を、ドキソルビシン誘導の細胞毒性から防護することができないことを示す(棒グラフ)。細胞数を、450nmの吸光度から測定した。化合物8のみを16時間処理(縞模様棒、0.0μM, 0.120μM, 0.370μM, 1.1μM又は3.3μM);16時間化合物8(0.0μM, 0.120μM, 0.370μM, 1.1μM又は3.3μM)を処理後、8時間のドキソルビシン処理(DOX;370nM;黒塗り棒);又はDOXのみ(370nM;白棒)を8時間処理した細胞に対して、結果を示す。誤差バーを平均の標準誤差で表す。
【0065】
【図24H】細胞処理7日後のWST-1検定を用いた細胞生存性により測定した、化合物9が、サイクリン依存性キナーゼ4/6(CDK4/6)−依存性細胞(不死化ヒト二倍体繊維芽細胞(tHDF; HS68))を、ドキソルビシン誘導の細胞毒性から防護することができないことを示す(棒グラフ)。細胞数を、450nmの吸光度から測定した。化合物9のみを16時間処理(縞模様棒、0.0μM, 0.120μM, 0.370μM, 1.1μM又は3.3μM);16時間化合物9(0.0μM, 0.120μM, 0.370μM, 1.1μM又は3.3μM)を処理後、8時間のドキソルビシン処理(DOX;370nM;黒塗り棒);又はDOXのみ(370nM;白棒)を8時間処理した細胞に対して、結果を示す。誤差バーを平均の標準誤差で表す。
【0066】
【図24I】細胞処理7日後のWST-1検定を用いた細胞生存性により測定した、化合物11が、サイクリン依存性キナーゼ4/6(CDK4/6)−依存性細胞(不死化ヒト二倍体繊維芽細胞(tHDF; HS68))を、ドキソルビシン誘導の細胞毒性から防護することができないことを示す(棒グラフ)。細胞数を、450nmの吸光度から測定した。化合物11のみを16時間処理(縞模様棒、0.0μM, 0.120μM, 0.370μM, 1.1μM又は3.3μM);16時間化合物11(0.0μM, 0.120μM, 0.370μM, 1.1μM又は3.3μM)を処理後、8時間のドキソルビシン処理(DOX;370nM;黒塗り棒);又はDOXのみ(370nM;白棒)を8時間処理した細胞に対して、結果を示す。誤差バーを平均の標準誤差で表す。
【0067】
【図25A】6-アセチル-8-シクロペンチル-5-メチル-2-(5-ピペラジン-1-イル-ピリジン-2-イルアミノ)-8H-ピリド-[2,3-d]-ピリミジン-7-オン (PD 0332991)が、サイクリン依存性キナーゼ4/6(CDK4/6)依存的様式で、化学療法誘発性細胞毒性を阻害することを示す(棒グラフ)。非処理INK4a/ARF欠損ヒトメラノーマ細胞(WM2664細胞);15nM、30nM、89nM又は270nMのPD0332991と16時間インキュベートしたWM2664細胞;カルボプラチン(Carbo;50μM)、ドキソルビシン(DOX;122nM)又はエトポシド(Etop;2.5μM)を8時間処理したWM2664細胞;15nM、30nM、89nM又は270nMのPD0332991を16時間処理後、DOX(122nM)、Carbo(50μM)、又はEtop(2.5μM)を8時間処理したWM2664細胞に対してデータを提供する。インキュベーション後、培養培地の一部を取りだし、細胞毒性をアデニル酸キナーゼ量を定量して検定した。データは相対的光単位(RLU)で示す。
【0068】
【図25B】PD 0332991が、サイクリン依存性キナーゼ4/6(CDK4/6)依存的様式で、化学療法誘発性細胞毒性を阻害することを示す(棒グラフ)。非処理ヒトHS68細胞;15nM、30nM、89nM又は270nMのPD0332991と16時間インキュベートしたHS68細胞;カルボプラチン(Carbo;50μM)、ドキソルビシン(DOX;122nM)又はエトポシド(Etop;2.5μM)を8時間処理したHS68細胞;及び15nM、30nM、89nM又は270nMのPD0332991を16時間処理後、DOX(122nM)、Carbo(50μM)、又はEtop(2.5μM)を8時間処理したHS68細胞に対してデータを提供する。インキュベーション後、培養培地の一部を取りだし、細胞毒性をアデニル酸キナーゼ量を定量して検定した。データは相対的光単位(RLU)で示す。
【0069】
【図25C】PD 0332991が、サイクリン依存性キナーゼ4/6(CDK4/6)依存的様式で、化学療法誘発性細胞毒性を阻害することを示す(棒グラフ)。非処理網膜芽腫腫瘍抑制タンパク質(RB−ヌル)ヒトメラノーマ細胞(A2058細胞);15nM、30nM、89nM又は270nMのPD0332991と16時間インキュベートしたA2058細胞;カルボプラチン(Carbo;50μM)、ドキソルビシン(DOX;122nM)又はエトポシド(Etop;2.5μM)を8時間処理したA2058細胞;及び15nM、30nM、89nM又は270nMのPD0332991を16時間処理後、DOX(122nM)、Carbo(50μM)、又はEtop(2.5μM)を8時間処理したA2058細胞に対してデータを提供する。インキュベーション後、培養培地の一部を取りだし、細胞毒性をアデニル酸キナーゼ量を定量して検定した。データは相対的光単位(RLU)で示す。
【0070】
【図25D】スタウロスポリン(STAUR)が、サイクリン依存性キナーゼ4/6(CDK4/6)非依存的様式で、化学療法誘発性細胞毒性を高めることを示す(棒グラフ)。非処理INK4a/ARF欠損ヒトメラノーマ細胞(WM2664細胞);160pM,500pM,1.5nM又は4.5nMのスタウロスポリンと16時間インキュベートしたWM2664細胞;カルボプラチン(Carbo;50μM)、ドキソルビシン(DOX;122nM)又はエトポシド(Etop;2.5μM)を8時間処理したWM2664細胞;及び160pM,500pM,1.5nM又は4.5nMのスタウロスポリンを16時間処理後、DOX(122nM)、Carbo(50μM)、又はEtop(2.5μM)を8時間処理したWM2664細胞に対してデータを提供する。インキュベーション後、培養培地の一部を取りだし、細胞毒性をアデニル酸キナーゼ量を定量して検定した。データは相対的光単位(RLU)で示す。
【0071】
【図25E】スタウロスポリン(STAUR)が、サイクリン依存性キナーゼ4/6(CDK4/6)非依存的様式で、化学療法誘発性細胞毒性を高めることを示す(棒グラフ)。非処理HS68細胞;160pM,500pM,1.5nM又は4.5nMのスタウロスポリンと16時間インキュベートしたHS68細胞;カルボプラチン(Carbo;50μM)、ドキソルビシン(DOX;122nM)又はエトポシド(Etop;2.5μM)を8時間処理したHS68細胞;及び160pM,500pM,1.5nM又は4.5nMのスタウロスポリンを24時間処理後、DOX(122nM)、Carbo(50μM)、又はEtop(2.5μM)を8時間処理後したHS68細胞に対してデータを提供する。インキュベーション後、培養培地の一部を取りだし、細胞毒性をアデニル酸キナーゼ量を定量して検定した。データは相対的光単位(RLU)で示す。
【0072】
【図25F】スタウロスポリン(STAUR)が、サイクリン依存性キナーゼ4/6(CDK4/6)非依存的様式で、化学療法誘発性細胞毒性を高めることを示す(棒グラフ)。非処理網膜芽腫腫瘍抑制タンパク質(RB-ヌル)ヒトメラノーマ細胞(A2058細胞);160pM,500pM,1.5nM又は4.5nMのスタウロスポリンと16時間インキュベートしたA2058細胞;カルボプラチン(Carbo;50μM)、ドキソルビシン(DOX;122nM)又はエトポシド(Etop;2.5μM)を8時間処理したA2058細胞;及び160pM,500pM,1.5nM又は4.5nMのスタウロスポリンを16時間前処理後、カルボプラチン(Carbo;50μM)、ドキソルビシン(DOX;122nM)又はエトポシド(Etop;2.5μM)を8時間処理したA2058細胞に対してデータを提供する。インキュベーション後、培養培地の一部を取りだし、細胞毒性をアデニル酸キナーゼ量を定量して検定した。データは相対的光単位(RLU)で示す。
【0073】
【図26A】160pM,500pM,1.5nM又は4.5nMのスタウロスポリン(STAUR)を24時間処理後、サイクリン依存性キナーゼ4/6(CDK4/6)依存性細胞(HS68)が、G1期(淡い影付き棒)、G2/M期(濃い影付き棒)及びS期(白棒)にある割合(%)を示す棒グラフである。スタウロスポリンは、HS68細胞において、G1細胞周期停止を誘導するようである。
【0074】
【図26B】サイクリン依存性キナーゼ4/6(CDK4/6)依存性細胞において、スタウロスポリン(STAUR)が化学防護効果を持たないことを示す(棒グラフ)。非処理HS68細胞;160pM,500pM,1.5nM又は4.5nMのスタウロスポリンで処理(16時間)したHS68細胞;ドキソルビシン(DOX;122nM;8時間)処理HS68細胞;DOX(122nM)8時間処理後、160pM,500pM,1.5nM又は4.5nMのスタウロスポリンで処理(16時間)したHS68細胞;カルボプラチン(Carbo;50μM;8時間)HS68細胞;Carbo(50μM)8時間処理後、160pM,500pM,1.5nM又は4.5nMのスタウロスポリンで処理(16時間)したHS68細胞;エトポシド(Etop;2.5μM;8時間)処理したHS68細胞;160pM,500pM,1.5nM又は4.5nMのスタウロスポリンを前処理(16時間)後、Etop(2.5μM)8時間処理したHS68細胞データを提供する。処理培地は置き換え、及び細胞生存性は7日後にCellTiter-Glo(R)assay (CTG; Promega, Madison, Wisconsin, USA)を用いて測定し、及び細胞毒性は、アデニル酸キナーゼ量の定量により検定した。データを相対的光単位(RLU)で示した。
【0075】
【図27A】γ-H2AXレベルを検定することにより、スタウロスポリン(STAUR)が、サイクリン依存性キナーゼ4/6(CDK4/6)依存性細胞(ヒトINKa/ARFメラノーマ細胞(WM2664)を、ドキソルビシン、カルボプラチン−又はエトポシド−誘発性DNA損傷から防護できないことを示す棒グラフである。γ-H2AXポジティブ細胞の割合(%)を、非処理WM2664細胞に対して;16時間、160pM,500pM,1.5nM又は4.5nMのスタウロスポリン処理したWM2664細胞に対して;8時間、カルボプラチン(Carbo、50μM), エトポシド(Etop、2.5μM)又はドキソルビシン(Dox、122nM)の何れかを単独処理したWM2664細胞に対して;及び16時間、160pM,500pM,1.5nM又は4.5nMのスタウロスポリン前処理後、8時間のCarbo(50μM), Etop(2.5μM)又は Dox(122nM)の何れかを処理したWM2664細胞に対して示す。スタウロスポリンは、WM2664細胞を化学療法誘発性DNA損傷から防護しないようである。
【0076】
【図27B】γ-H2AXレベルを検定することにより、スタウロスポリン(STAUR)が、サイクリン依存性キナーゼ4/6(CDK4/6)依存性細胞(ヒト不死化二倍体繊維芽細胞(tHDF;HS68)を、ドキソルビシン、カルボプラチン−又はエトポシド−誘発性DNA損傷から、防護することができないことを示す(棒グラフ)。γ-H2AXポジティブ細胞の割合(%)を、非処理HS68細胞に対して;16時間、160pM,500pM,1.5nM又は4.5nMのスタウロスポリン処理したHS68細胞に対して;8時間、カルボプラチン(Carbo、50μM), エトポシド(Etop、2.5μM)又はドキソルビシン(Dox、122nM)の何れかを単独処理したHS68細胞に対して;及び16時間、160pM,500pM,1.5nM又は4.5nMのスタウロスポリン前処理後、8時間のCarbo(50μM)、Etop(2.5μM)又は Dox(122nM)の何れかを処理したHS68細胞に対して示す。スタウロスポリンは、HS68細胞を化学療法誘発性DNA損傷から防護しないようである。
【0077】
【図27C】γ-H2AXレベルを検定することにより、スタウロスポリン(STAUR)が、サイクリン依存性キナーゼ4/6(CDK4/6)非依存性細胞(ヒトRB−ヌルメラノーマ細胞(A2058)を、ドキソルビシン、カルボプラチン−又はエトポシド−誘発性DNA損傷から、防護することができないことを示す(棒グラフ)。γ-H2AXポジティブ細胞の割合(%)を、非処理A2058細胞に対して;16時間、160pM,500pM,1.5nM又は4.5nMのスタウロスポリン処理したA2058細胞に対して;8時間、カルボプラチン(Carbo、50μM), エトポシド(Etop、2.5μM)又はドキソルビシン(Dox、122nM)の何れかを単独処理したA2058細胞に対して;及び16時間、160pM,500pM,1.5nM又は4.5nMのスタウロスポリン前処理後、8時間のCarbo(50μM), Etop(2.5μM)又は Dox(122nM)の何れかを処理したA2058細胞に対して示す。スタウロスポリンは、A2058細胞を化学療法誘発性DNA損傷から防護しないようである。
【発明を実施するための最良の形態】
【0078】
代表的実施形態を示す実施例を参考にして、本明細書で本発明を詳細に説明する。しかしながら、本発明は、異なる形式に具体化することができる、また本明細書に記載された実施形態に制限されると考えるべきではない。むしろ、これらの実施形態は、本開示が充分であり完全であり、及び当業者にとって実施形態の範囲を完全に伝達するために提供されている。
もし、別なやり方で定義しなければ、本明細書に用いる全ての技術的及び科学的用語は、本発明が属する技術分野の当業者が通常理解するのと同じ意味を持つ。本明細書で述べた全ての出版物、特許申請、特許、及び他の参照をその全体について参考文献として取り込む。
明細書及び特許請求の範囲を通して、与えられた化学式、又は化学名は、全ての光学的、及び立体的異性体、及びこれらの異性体及び混合物が存在するラセミ体を包含する。
【0079】
本明細書で用いる略語は次の意味である:
℃=摂氏、%=パーセント、μL=マイクロリットル、μM=マイクロモル(数)、2BrIC=2-ブロモ-12,13-ジヒドロ-5H-インドロ[2,3-a]ピロロ[3,4]-カルバゾール-5,6-ジオン、BM=骨髄、BM-MNC=骨髄単核細胞、BrdU=5-ブロモ-2-デオキシウリジン、Carbo=カルボプラチン、CAFC=敷石状領域形成細胞、CBC=全血球計数、CDK=サイクリン依存性キナーゼ、CDK4/6=サイクリン依存性キナーゼ4 及び/又はサイクリン依存性キナーゼ 6、CLP=リンパ球共通前駆細胞、CMP=骨髄共通前駆細胞、CNS=中枢神経、DMEM=Dulbeccoの改変Eagle培地、DMF=ジメチルホルムアミド、DNA=デオキシリボ核酸、DOX=ドキソルビシン、EPO=エリスロポエチン(赤血球生成促進因子)、ESI=電気スプレイ電離、EtOAc=酢酸エチル、EtOH=エタノール、Etop=エトポシド、FBS=仔牛胎児血清、g=グラム、G-CSF=顆粒球コロニー刺激因子、GM-CSF=顆粒球マクロファージコロニー刺激因子、GMP=顆粒球単球前駆細胞、h=時間、HSC=造血幹細胞、HSPC=造血幹細胞及び前駆細胞、IC50=50% 阻害濃度、i.p.=腹腔、kg=キログラム、LC-MS=液体クロマトグラフィー質量分析器、LT-HSC=長期造血幹細胞、M=モル(濃度)、MEP=赤芽球系前駆細胞、mg=ミリグラム、MHz=メガヘルツ、mL=ミリリットル、mmol=ミリモル(数)、mol=モル(数)、Mp=融点、Mpk=ミリグラム/キログラム、MPP=多分化能前駆細胞、NBS=N-ブロモスクシンイミド、nm=ナノメートル、nM=ナノモル(濃度)、NMR=核磁気共鳴、PD=6-アセチル-8-シクロペンチル-5-メチル-2-(5-ピペラジン-1-イル-ピリジン-2-イルアミノ)-8-ピリド- [2,3-d]-ピリミジン-7-オン(PD 0332991とも呼ばれる)、PI=ヨウ化プロピジウム、PQ=医薬学的休止、RB=網膜芽腫腫瘍抑制タンパク質、RLU=相対的光単位、r.t.=室温、ST-HSC=短期造血幹細胞、tHDF=不死化ヒト二倍体繊維芽細胞、THF=テトラヒドロフラン、UV=紫外線
【0080】
I.定義
以下の用語は、当業者により良く理解されると信ずるが、以下の定義は本発明の説明を円滑にするために示すものである。
長年の特許法慣習に従い用語"a(1つ、ある)"、"an(1つ、ある)"及び"the(その、この)"は、請求の範囲を含めて本申請で用いる際"1以上"を表す。従って、例えば、"a compound(ある化合物)"又は"a cell(ある細胞)"に関しては、複数のこのような化合物又は細胞等々を含む。
2個の項目又は条件の記載に用いる場合、例えば、CDK4及び/又はCDK6、用語"及び/又は"は、両項目又は条件が存在する又は適用可能である状況に対して、及び両項目又は条件の1つだけが存在する、又は適用可能である状況を表す。従って、CDK4及び/又はCDK6阻害剤は、CDK4及びCDK6の両者を阻害する化合物であること、CDK4のみを阻害する化合物、又はCDK6のみを阻害する化合物であってもよい。
【0081】
"健康な細胞"又は"正常な細胞"は、疾病(ガン又は他の増殖性疾患)の症候又はマーカーを示さない患者のいかなる細胞をも意味する。幾つかの態様において、健康な細胞は、造血幹細胞又は造血前駆細胞である。前駆細胞としては、長期造血幹細胞(LT-HSCs)、短期造血幹細胞(ST-HSCs)、多分化能前駆細胞(MPPs)、骨髄共通前駆細胞(CMPs)、リンパ球共通前駆細胞(CLPs)、顆粒球単球前駆細胞(GMPs)、及び赤芽球系前駆細胞(MEPs)を含むことができるが、これらに制限されない。
【0082】
本明細書で用いる用語"ガン"は、制御不能な細胞分裂、転移能を持つ、又は他の部位に新増殖を樹立できる細胞により引き起こされる疾患を表す。用語"悪性""新生物""腫瘍"及びこれ等の類似語は、ガン細胞又はガン細胞群を表す。ガンの特異な種類としては、皮膚癌、結合組織癌、脂肪腫瘍、乳癌、肺癌、胃癌、膵臓癌、卵巣癌、子宮頸癌、子宮癌、肛門性器癌、腎臓癌、膀胱癌、結腸癌、前立腺癌、頭頚部癌、脳腫瘍、中枢神経(CNS)癌、網膜癌、血液ガン、及びリンパ球ガンなどがあるが、これらに制限されない。
【0083】
本明細書で用いるように、用語"化学療法"は、細胞毒性化合物(例えば、DNA損傷性化合物)を用いて、ガン細胞のような、しかしこれに制限されない、望ましくない細胞の成長又は増殖を減らす、又は除くために、治療することを表す。従って、本明細書で用いるように、"化学療法化合物"は、ガンを治療するために用いられる細胞毒性化合物を表す。化合物の細胞毒性効果は、核酸インターカレーション、又は結合、DNA又はRNAアルキル化、RNA又はDNA合成の阻害、他の核酸関連活性(例えば、タンパク質合成)の阻害、又はすべての他の細胞毒性効果の中の1以上の結果であることが可能である。
【0084】
従って"細胞毒性化合物"は、"抗癌剤"又は"化学療法薬剤"としても記載された如何なる1つ又は如何なる組合せの化合物もあることができる。このような化合物としては、DNA損傷性化合物及び細胞を殺すことができる他の化学物質があるが、これらに制限されない。"DNA損傷性化合物"としては、アルキル化剤、DNAインターカレーター、タンパク質合成阻害剤、DNA又はRNA合成阻害剤、DNA塩基類似体、トポイソメラーゼ阻害剤、及びテロメラーゼ阻害剤又はテロメアDNA結合化合物があるが、これらに制限されない。例えば、アルキル化剤は、ブスルファン、インプロスルファン、及びピポスルファンのようなアルキルスルホン酸塩;ベンゾジゼパ、カルボコン、メツレデパ、及びウレデパのようなアジリジン;アルトレタミン、トリエチレンメラミン、トリエチレンホスホラミド、トリエチレンチオホスホラミド、及びトリメチロールメラミンのような、エチレンイミン及びメチルメラミン;クロランブシル、クロルナファジン、シクロホスファミド、エストラムスチン、イホスファミド、メクロレタミン、メクロレタミンオキシド塩酸塩、メルファラン、ノベンビチン、フェネステリン、プレドニマスチン、トロホスファミド、及びウラシルマスタードのようなナイトロジェンマスタード;及びカルムスチン、クロロゾトシン、ホテムスチン、ロムスチン、ニムスチン、及びラニムスチンのようなニトロソウレアを含む。
【0085】
ガンの治療に用いられる抗生物質としては、ダクチノマイシン、ダウノルビシン、ドキソルビシン、イダルビシン、ブレオマイシン硫酸塩、マイトマイシン、プリカマイシン、及びストレプトゾシンがある。化学治療のための抗代謝物質としては、メルカプトプリン、チオグアニン、クラドリビン、フルダラビンリン酸塩、フルオロウラシル(5-FU)、フロクスウリジン、シタラビン、ペントスタチン、メトレキサート及びアザチオプリン、アシクロビル、アデニンβ−1−D-アラビノシド、アメトプテリン、アミノプテリン、2−アミノプリン、アフィジコリン、8−アザグアニン、アザセリン、6−アザウラシル、2'−アジド−2'−デオキシヌクレオシド、5−ブロモデオキシシチジン、シトシン、β−1−D−アラビノシド、ジアゾオキシノルロイシン、ジデオキシヌクレオシド、5−フルオロデオキシシチジン、5−フルオロデオキシウリジン、及びヒドロキシウレアを含む。
【0086】
化学療法タンパク質構成阻害剤は、アブリン、アウリントリカルボン酸、クロランフェニコール、コリシンE3,シクロヘキシミド、ジフテリア毒素、エデインA,エメチン、エリスロマイシン、エチオニン、フッ化物、5−フルオロトリプトファン、フシジン酸、グアニリルメチレンジホスホネート、及びグアニリルイミド2リン酸塩、カナマイシン、カスガマイシン、キロマイシン、及びO−メチルスレオニンを含む。更なる、タンパク質合成阻害剤は、モデシン、ネオマイシン、ノルバリン、パクタマイシン、パロモマイシン、ピューロマイシン、リシン、シガ毒素、ショウドマイシン、スパルソマイシン、スペクチノマイシン、ストレプトマイシン、テトラサイクリン、チオストレプトン、及びトリメトプリムを含む。DNA合成阻害剤は、硫酸ジメチル、マイトマイシンC,ナイトロジェン及びスルファマスタードのようなアルキル化剤、アクリジン色素、アクチノマイシン、アドリアマイシン、アントラセン、ベンゾピレン、臭化エチジウム、2ヨウ化プロピジウム−インタートウィニングのようなインターカレート薬剤;及びジスタマイシン、ネトロプシンのような他の薬剤が含まれる。クメルマイシン、ナリジクス酸、ノボビオシン、及びオキソリン酸のようなトポイソメラーゼ阻害剤;コルセミド、コルヒチン、ビンブラスチン、及びビンクリスチンのような細胞分裂阻害剤;及びアクチノマイシンD,α−アマニチン、及び他の菌類のアマトキシン、コルジセピン(3'−デオキシアデノシン)、ジクロロリボフラノシル・ベンズイミダゾール、リファンピシン、ストレプトバリシンを含むRNA合成阻害剤を含み、及びストレプトリジギンもまたDNA損傷性化合物である。
【0087】
従って、その毒性が本明細書で開示した選択的CDK4/6阻害剤で緩和することができる、現在の化学療法化合物として、アドリアマイシン、5−フッ化ウラシル(5FU)、エトポシド、カンプトテシン、アクチノマイシン−D、マイトマイシン、シスプラチン、過酸化水素、カルボプラチン、プロカルバジン、メクロレタミン、シクロホスファミド、イホスファミド、メルファラン、クロランブシル、ビスルファン、ニトロソウレア、ダクチノマイシン、ダウノルビシン、ドキソルビシン、ブレオマイシン、プリコマイシン、タモキシフェン、タキソール、トランスプラチナ、ビンブラスチン、及びメトレキサート、等々が含まれる。
【0088】
"細胞毒性化合物による治療を受ける危険性"は、将来細胞毒性化合物(例えば、DNA障害性)の治療を受ける予定のある患者(計画された化学療法診察により)、又は将来気付かずに細胞毒性化合物への曝露の機会を有する患者を意味する。気付かない曝露は、事故、又は計画されてない環境又は職業上の曝露又は医学的治療の一部として被った細胞毒性化合物の過剰投与を含む。
【0089】
"有効量の阻害化合物"は、患者の健康な造血幹細胞及び前駆細胞(HSPC)における化学療法又は細胞毒性化合物の他の曝露に関連した毒性を減少又は除去するに有効な量を意味する。幾つかの態様において、有効量は、患者において、一時的(例えば、数時間又は数日)に造血幹細胞の増殖を阻害する(即ち、造血幹細胞の休止状態を誘導する)に必要な量である。
【0090】
"長期血液学的毒性"は、細胞毒性化合物の投与後、1週間以上、数ヶ月又は数年以上続く期間患者に作用する血液学的毒性を意味する。長期血液学的毒性は、血液細胞の非効率的産生(即ち、骨髄異形成)及び/又はリンパ球の非効率的産生(をひき起こすことが可能な骨髄障害をもたらすことができる。血液学的毒性は、例えば、貧血、血小板数の減少(即ち、血小板減少症)として、又は白血球数の減少(好中球減少症)として、観察することができる。幾つかの症例において、骨髄異形成は白血病の進行をもたらす。化学療法に関係する長期毒性はまた、血液細胞に加えて、患者の他の自己再生細胞を損傷することが可能である。従って、長期毒性はまた、白髪及び虚弱をもたらすことが可能である。
【0091】
"〜からフリー(〜がない)"は、本明細書に開示した方法に従い選択的CDK4/6阻害剤で治療した患者は、長期血液学的毒性の検知できる徴候又は症候を示さず、又はCDK4/6阻害剤の1回又は複数回の投与を受けずに細胞毒性化合物治療を受けた患者に示されるであろう徴候/症候と比較して、顕著に減少した(例えば、10分の1に減少、又は100分の1より少なく減少)長期血液学的毒性の徴候又は症候を示す。
"〜からフリー(〜がない)"はまた、特にin vivo又は細胞をベースとした検定による検査で好ましくない、又はオフターゲット効果を持たない、選択的CDK4/6阻害化合物を表すことができる。従って、"からフリー"は、長期毒性、抗酸化効果、エストロゲン様作用、チロシンキナーゼ阻害効果、CDK4/6以外のCDKへの阻害効果、及びCDK4/6非依存性細胞における細胞周期停止のような、しかしこれらに制限されない、オフターゲット効果を持たない、選択的CDK4/6阻害剤を表すことができる。
【0092】
オフターゲット効果"から実質的にフリーな"CDK4/6阻害剤は、幾つかの軽微なオフターゲット効果を持つことができるCDK4/6阻害剤であり、このオフターゲット効果は、CDK4/6依存性細胞を細胞毒性化合物から防護する阻害剤の防護能を妨害しない。例えば、オフターゲット効果"から実質的にフリーな"CDK4/6阻害剤は、この阻害剤がCDK4/6依存性細胞の選択的G1期停止をもたらす限り、他のCDKに対する幾つかの軽微な阻害効果(例えば、CDK1又はCDK2に対するIC50が、>0.5μM;>1.0μM;又は>5.0μM)を持つことができる。
【0093】
"減少した"又は"妨げた"又はこれらの文法的同義語は、夫々、医学的治療の好ましくない副作用を低下させる、又は好ましくない副作用が完全に発生しないようにすることである。
幾つかの態様において、本明細書に記載した方法は、全ての脊椎動物種について有効であり、これらも用語"患者"に含むことを意図するが、本発明で治療を受けた患者は、好ましくは、ヒトである。
【0094】
より詳細には、本明細書に、ヒト及び、絶滅の危機にある重要な哺乳類(例えば、シベリアトラ)、ヒトに対し経済的に重要な哺乳類(ヒトにより消費されるために農場で飼育されている動物)及び/又は、例えば、ヒト以外の肉食動物(例えば、ネコ及びイヌ、)ブタ類(ブタ、去勢ブタ、及びヨーロッパイノシシ)、反芻動物(畜牛、去勢ウシ、ヒツジ、キリン、シカ、ヤギ、バイソン、及びラクダのような)及びウマのように、ヒトに対し社会的に重要な哺乳類(ペットとして、又は動物園で飼われている動物)のような哺乳類の治療が含まれている。従って、本明細書に記載した本方法の態様は、家畜性ブタ類(ブタ及び去勢ブタ)、反芻動物、馬、家禽類等々の治療を含むが、これらに制限されない。
【0095】
本明細書で用いるように、用語"アルキル基"は、線型(即ち、直鎖)、分枝型、又は環状、飽和、又は少なくとも部分的に飽和、及び幾つかの場合完全に不飽和型(即ち、アルケニル基及びアルキニル基)炭化水素鎖を含むC1〜20を表わし、例えば、メチル基、エチル基、プロピル基、イソプロピル基、ブチル基、イソブチル基、tert-ブチル基、ペンチル基、ヘキシル基、オクチル基、エテニル基、プロペニル基、ブテニル基、ペンテニル基、ヘキセニル基、オクテニル基、ブタジエニル基、プロピニル基、ブチニル基、ペンチニル基、ヘキシニル基、ヘプチニル基、及びアレニル基が含まれる。"分枝型"は、メチル基、エチル基又はプロピル基のような低級アルキル基が線型アルキル鎖に付加したアルキル基を表す。"低級アルキル基"は、1から8炭素原子(即ち、C1〜8アルキル基)例えば、1,2,3,4,5,6,7又は8炭素原子、を有するアルキル基を表す。"高級アルキル基"は、約10から約20炭素原子、例えば、10,11,12,13,14,15,16,17,18,19,又は20炭素原子、を有するアルキル基を表す。ある態様において、"アルキル基"は特に、C1〜8直鎖アルキル基を表す。他の態様において、"アルキル基"は特に、C1〜8分枝鎖アルキル基を表す。
【0096】
アルキル基を、任意に1個以上の、同一又は異なる、アルキル基置換基により置換することができる("置換アルキル基")。用語"アルキル基置換基"はアルキル基、置換アルキル基、ハロ基、アリールアミノ基、アシル基、ヒドロキシル基、アリールオキシル基、アルコキシル基、アルキルチオ基、アリールチオ基、アラルキルオキシル基、アラルキルチオ基、カルボキシル基、アルコキシカルボニル基、オキソ基及びシクロアルキル基を含むが、これらに制限されない。アルキル鎖に沿って、任意に、1以上の酸素原子、イオウ原子又は置換窒素原子又は非置換窒素原子を挿入することができて、ここで、窒素置換基は、水素原子、低級アルキル基(本明細書ではまた、"アルキルアミノアルキル基"と表す)又はアリール基である。
【0097】
従って、本明細書で用いるように、用語"置換アルキル基"は、本明細書で定義したように、アルキル基を含み、ここでアルキル基の1以上の原子又は官能基が他の原子又は官能基に置き換えられ、例えば、アルキル基、置換アルキル基、ハロゲン原子、アリール基、置換アリール基、アルコキシル基、ヒドロキシル基、ニトロ基、アミノ基、アルキルアミノ基、ジアルキルアミノ基、硫酸基及びメルカプト基が含まれる。
【0098】
本明細書で用いる用語"アリール基"は、単一芳香族環、又は互いに融合した、又は共有結合で連結した、又はメチレン基又はエチレン基部分のような、しかしこれらに制限されない、一般的な置換基に結合した芳香族部分を表す。一般的な連結基はまた、ベンゾフェノンにおける様なカルボニル基、又はジフェニルエーテルにおける様な酸素原子、又はジフェニルアミンにおける様な窒素原子であってもよい。用語"アリール基"は、とりわけ複素環式芳香族化合物を含む。この芳香族環(複数もあり)は、フェニル基、ナフチル基、ビフェニル基、ジフェニルエーテル基、ジフェニルアミン基及びベンゾフェノン基を含むことができる。特別の実施形態において、用語"アリール基"は、約5から約10炭素原子、即ち5,6,7,8,9又は10炭素原子を含む環状芳香族基を意味し、及び5−及び6−員環の炭化水素、及び複素環式芳香族環を含む。
【0099】
アリール基は、任意に、1以上の同一又は異なる、アリール基置換基と置き換えることができて("置換アリール基")、ここで"アリール基置換基は"アルキル基、置換アルキル基、アリール基、置換アリール基、アラルキル基、ヒドロキシル基、アルコキシル基、アリールオキシル基、アラルキルオキシル基、カルボキシル基、カルボニル基、アシル基、ハロ基、ニトロ基、アルコキシカルボニル基、アリールオキシカルボニル基、アラルコキシカルボニル基、アシルオキシル基、アシルアミノ基、アロイルアミノ基、カルバモイル基、アルキルカルバモイル基、ジアルキルカルバモイル基、アリールチオ基、アルキルチオ基、アルキレン基及びNR'R"を含み、ここでR'及びR"は、夫々独立に、水素原子、アルキル基、置換アルキル基、アリール基、置換アリール基、及びアラルキル基である。
【0100】
従って、本明細書で用いるように、用語"置換アリール基"は、本明細書で定義したように、アリール基を含み、ここでアリール基の1以上の原子又は官能基は、他の原子又は官能基と置き換えられ、官能基としては、例えば、アルキル基、置換アルキル基、ハロゲン原子、アリール基、置換アリール基、アルコキシル基、ヒドロキシル基、ニトロ基、アミノ基、アルキルアミノ基、ジアルキルアミノ基、硫酸基及びメルカプト基が含まれる。
アリール基の特別な例としては、シクロペンタジエニル基、フェニル基、フラン基、チオフェン基、ピロール基、ピラン基、ピリジン基、イミダゾール基、ベンズイミダゾール基、イソチアゾール基、イソクサゾール基、ピラゾール基、ピラジン基、トリアジン基、ピリミジン基、キノリン基、イソキノリン基、インドール基、カルバゾール基等々が含まれるが、これらに制限されない。
用語"ヘテロアリール基"は、芳香族環又は芳香族環類の骨格の少なくとも1原子が、炭素以外の原子である、アリール基を表す。従って、ヘテロアリール基は、窒素、酸素、イオウ原子を含むが、これらに制限されない、群から選択された1以上の非炭素原子を有する。
【0101】
本明細書で用いるように、用語"アシル基"は、有機カルボン酸基を表し、ここでカルボキシル基の−OHは他の置換体(即ち、RCO−で表せるように、ここでRは、アルキル基、又は本明細書で定義されたアリール基である)で置換される。従って、用語"アシル基"は、特に、アセチルフラン基及びフェナシル基のような、アリールアシル基を含む。アシル基の特別な例として、アセチル基及びベンゾイル基が含まれる。
【0102】
"環状"及び"シクロアルキル基"は、約3から約10個の炭素原子、例えば、3,4,5,6,7,8,9又は10炭素原子の、非芳香属性単環式又は多環式環状システムを表す。このシクロアルキル基は、任意に、部分的に不飽和であってもよい。シクロアルキル基は、任意に、本明細書で定義したように、オキソ基及び/又はアルキレン基のような、アルキル基置換体により置換されてもよい。環状アルキル鎖に沿って、任意に、1以上の酸素、硫黄、又は置換した又は非置換の窒素原子を挿入することができて、ここで、窒素置換基は、水素、アルキル基、置換アルキル基、アリール基、又は置換アリール基であり、従って、複素環式置換基を提供する。代表的な単環式シクロアルキル環は、シクロペンチル基、シクロヘキシル基、及びシクロヘプチル基を含む。多環式シクロアルキル環は、アダマンチル、オクタヒドロナフチル基、デカリン、樟脳、カンファン、及びノラダマンチルを含む。
【0103】
用語"複素環"又は"複素環式基"は、環状環の1以上の骨格炭素原子が、ヘテロ原子(例えば、窒素、硫黄、又は酸素原子)により置き換えられたシクロアルキル基(即ち、本明細書に記載された非芳香環、環状基)を表す。複素環の例としては、テトラヒドロフラン、テトラヒドロピラン、モルホリン、ジオキサン、ピペリジン、ピペラジン、及びピロリジンが含まれるが、これらに制限されない。
"アルコキシル基"又は"アルコキシ基"は、アルキル−O−基を表し、ここでアルキル基は、既述の通りである。本明細書の用語"アルコキシル基"は、例えば、メトキシル基、エトキシル基、プロポキシル基、イソプロポキシル基、ブトキシル基、t−ブトキシル基、及びペントキシル基と表すことができる。用語"オキシアルキル基"は、"アルコキシル基"と互換的に用いることができる。
【0104】
"アリールオキシル基"又は"アリールオキシ基"は、アリール−O−基を表し、ここでアリール基は、置換アリール基を含み、既述の通りである。本明細書で用いる用語"アリールオキシル基"は、フェニルオキシル基又はヘキシルオキシル基、及びアルキル基、置換アルキル基、ハロ、又はアルコキシル置換フェニルオキシル基又はヘキシルオキシル基と表すことができる。
"アラルキル基"は、アリール−アルキル基を表し、ここでアリール基及びアルキル基は既述通りであり、また置換アリール基及び置換アルキル基を含む。アラルキル基の例として、ベンジル基、フェニルエチル基、及びナフチルメチル基が含まれる。
"アラルキルオキシル基"又は"アラルキルオキシ基"は、アラルキル−O−基を表し、ここでアラルキル基は既述通りである。アラルキルオキシル基の例として、ベンジルオキシル基がある。
【0105】
用語"アミノ基"は、-NR'R"基を表し、ここでR'及びR"は夫々独立に、H原子、置換及び非置換アルキル基、シクロアルキル基、複素環式基、アラルキル基、アリール基、及びヘテロアリール基を含む群から選択される。幾つかの態様において、このアミノ基は-NH2である。"アミノアルキル基"及び"アミノアリール基"は、-NR'R"基を表し、ここでR'はアミノ基に対して定義されたものであり、及びR"は、夫々、置換又は非置換のアルキル基、又はアリール基である。
"アシルアミノ基"は、アシル−NH−基を表し、ここでアシル基は、既述の通りである。
用語"カルボニル基"は-(C=O)-又は前に名付けた親置換基の炭素原子に付加した2重結合酸素置換体を表す。
用語"カルボキシル基"は、-COOH基を表す。
本明細書で用いる用語"ハロ"、"ハロゲン化物"又は"ハロゲン"は、フルオロ基、クロロ基、ブロモ基、及びヨード基を表す。
用語"ヒドロキシル基"及び"ヒドロキシ基"は、-OH基を表す。
用語"オキソ基"は本明細書に既載の化合物を表し、炭素原子が、酸素原子に置き換えられる。
用語"シアノ基"は、-CN基を表す。
用語"ニトロ基"は、-NO2基を表す。
用語"チオ基"は、本明細書に記載の化合物を表し、炭素原子又は酸素原子が、イオウ原子に置き換えられる。
【0106】
II.造血幹細胞及び前駆細胞及びサイクリン依存性キナーゼ阻害剤
組織特異的幹細胞は、自己再生能があり、これは成熟した哺乳類の一生を通して制御された複製により、これらの細胞自体を置き換える能力があることを意味する。さらに、幹細胞は、非対称的に分裂して、与えられた器官の様々な構成要素を次々に産生する"子孫"又は"前駆"細胞を作り出す。例えば、造血システムにおいて、造血幹細胞は、次々に血液中の全ての分化した構成要素(例えば、白血球、赤血球、リンパ球及び血小板)を産生する前駆細胞を産み出す(図1)。
【0107】
本発明は、成熟哺乳類の初期の造血幹細胞/前駆細胞(HSPC)の特異的生化学的要求に関する。より詳細には、これらの細胞は、細胞複製のために、増殖キナーゼであるサイクリン依存性キナーゼ4(CDK4)及び/又はサイクリン依存性キナーゼ6(CDK6)の酵素活性を要求する。対照的に、成熟哺乳類の大部分の増殖細胞は、CDK4及び/又はCDK6(即ちCDK4/6)の活性を要求しない。これらの分化した細胞は、サイクリン依存性キナーゼ2(CDK2)又はサイクリン依存性キナーゼ1(CDK1)のような、他の増殖性キナーゼを用いて、CDK4/6活性無しに増殖することができる。従って、哺乳類を選択的CDK4/6阻害剤で処理すると非常に制限された幹細胞及び前駆構成要素の増殖阻害(即ち、医薬的休止(PQ))をもたらすことができる。
【0108】
大部分の急性及び重篤な化学療法の毒性は、幹細胞及び前駆細胞への効果を通してである。従って、造血幹細胞及び前駆細胞(HSPC)を化学療法抵抗性にすることは、全生物体を化学療法の急性及び慢性毒性から防護できる。本発明は、選択的CDK4/6阻害剤の投与により、患者の造血幹細胞及び前駆細胞(HSPC)を細胞毒性化合物から防護する方法に関する。如何なる理論に囚われることなく、このような阻害剤の投与は、患者の幹細胞及び前駆細胞を医薬的休止(PQ)状態にさせて、造血幹細胞及び前駆細胞(HSPC)が化学療法化合物の細胞毒効果に対して、増殖細胞より、抵抗性があるようにすることが期待される。
【0109】
従って、幾つかの態様において、本発明は、非毒性の選択的CDK4/6阻害剤(例えば、少なくとも約48,24,20,16,12,10,8,6,4,2,又は1時間より短い間)の一時的処理(例えば、経口摂取可能、非毒性CDK4/6阻害剤)により、造血幹細胞及び前駆細胞を休止状態に誘導することにより、化学療法化合物の急性及び慢性毒性から哺乳類を防護する方法を提供する。休止期の間、患者の造血幹細胞及び前駆細胞(HSPC)は、化学療法化合物の効果から防護される。阻害剤処理が止まった後、造血幹細胞及び前駆細胞(HSPC)は、一時的休止期間から回復して、その後正常に機能する。従って、選択的CDK4/6阻害剤を用いた化学療法抵抗性は、著しい骨髄防護を提供し、及び化学療法後、末梢血液数(ヘマクリット、血小板、リンパ球、及び骨髄細胞)のより急速な回復をもたらすことができる。
【0110】
Davisらの米国特許第6,369,086号(本明細書では、以後「086特許」という。)は、選択的CDK阻害剤は細胞毒性薬剤の毒性を制限する上で重要であり、化学療法誘導性脱毛症から防護するために使用できることを記載する。特に、この086特許は、特異的CDK2阻害剤としてオキシインドール化合物を記載する。関係する雑誌文献(Davis et al., Science, 291, 134-137 (2001))は、CDK2阻害は、細胞周期停止をもたらし、細胞周期活性抗腫瘍薬剤に対する上皮細胞の感受性を減少させ、化学療法誘導性脱毛症を防護することができることを記載するようである。しかしながら、この雑誌文献は後に結果に再現性がないという理由で撤回された。雑誌論文の撤回により疑問が生じた、噂で言われるこれらの選択的CDK2阻害剤の防護的効果と反対に、本発明は、造血幹細胞及び前駆細胞(HSPC)の防護に関係し及び血液学的毒性からの防護に関係する。
【0111】
幹細胞/前駆細胞の防護能は、ガンの治療及び、細胞毒性化学物質への偶然の曝露又は過剰投与効果の緩和の両者において望ましい。阻害剤の前処理(即ち、細胞毒性化合物への曝露が計画されている、又は曝露の危険性がある、患者に対するCDK4/6阻害剤の前処理)、CDK4/6阻害剤及び細胞毒性化合物の同時処理、又はCDK4/6阻害剤の後処理(細胞毒性化合物への曝露後に、CDK4/6阻害剤の処理)を通して、選択的CDK4/6阻害剤の防護的効果を、患者に提供することができる。従って、幾つかの態様において、本発明の方法は、化学療法化合物による治療を受けつつある、又は受けようとする患者に対する化学療法抵抗を提供するための、また患者を細胞毒性化合物に対する他の曝露から防護するための、選択的CDK4/6阻害化合物の使用に関する。
【0112】
本明細書では、用語"選択的CDK4/6阻害化合物"とは、CDK4及びCDK6の少なくとも1つを選択的に阻害する化合物、又はその主な作用がCDK4及び/又はCDK6の阻害によるものである化合物を表す。従って、選択的CDK4/6阻害剤は、一般的に、CDK4及び/又はCDK6に対して、他のキナーゼに対する50%阻害濃度(IC50)より低いIC50を有する化合物である。また幾つかの態様において、選択的CDK4/6阻害剤は、CDK4及び/又はCDK6に対して、他のCDK(例えば、CDK1及び CDK2)に対する化合物のIC50より、少なくとも2,3,4,5,6,7,8,9又は10倍低いIC50を有することができる。また幾つかの態様において、選択的CDK4/6阻害剤は、CDK4及び/又はCDK6に対して、他のCDKに対する化合物のIC50より、少なくとも20,30,40,50,60,70,80,90又は100倍低いIC50を有することができる。また幾つかの態様において、選択的CDK4/6阻害剤は、CDK4及び/又はCDK6に対して、他のCDKに対する化合物のIC50より100倍又は1000倍を超えて低いIC50を有することができる。幾つかの態様において、選択的CDK4/6阻害化合物は、CDK4及びCDK6の両者を選択的に阻害する化合物である。
【0113】
幾つかの態様において、選択的CDK4/6阻害剤は、CDK4/6依存性細胞の選択的G1期停止を誘導する(例えば、細胞をベースとしたin vitro検定で測定されたように)ことができる化合物である。従って、本発明の方法に従い選択的CDK4/6阻害剤を用いて処理した場合、G1期におけるCDK4/6依存性細胞の割合は増加するが、G2/M期及びS期のCDK4/6依存性細胞の割合は減少する。幾つかの態様において、選択的CDK4/6阻害剤は、CDK4/6依存性細胞の、実質的に純粋な(即ち、"きれいな")G1細胞周期停止を誘導する化合物である(例えば、選択的CDK4/6阻害剤を用いた処理は、細胞の大部分が、標準的方法(例えば、ヨウ化プロピジウム(PI)染色又は他の方法)で定義されたG1期停止するように細胞周期停止を誘導し、G2/M期及びS期を合わせた周期にある細胞集団が、全細胞集団の中、20%、15%、12%、10%、8%、6%、5%、4%、3%、2%、1%又はそれ未満である。)
【0114】
非特異的キナーゼ阻害剤である、スタウロスポリンは、幾つかの種類の細胞においてG1期停止を間接的に誘導すると報告されているが(Chen et al., J. Nat. Cancer Inst., 92, 1999-2008 (2000))。細胞におけるG1細胞周期停止(造血幹細胞及び前駆細胞(HSPC)の特定の部分)を直接及び選択的に誘導するために、選択的CDK4/6阻害剤の本発明での使用は、化学的防護を提供することができて、これは長期の毒性が少なく、及びDNA損傷化合物への曝露前に阻害剤を用いた長期にわたる(例えば、48時間又はより長期)治療の必要が無い。特に、幾つかの非選択的キナーゼ阻害剤が、CDK4タンパク質レベルを低下させることにより、幾つかの種類の細胞においてG1期停止を起こすことができるが、本発明の方法の利点は、いかなる理論に束縛されることなく、造血幹細胞及び前駆細胞(HSPC)において細胞内濃度を減らすことなく、CDK4/6のキナーゼ活性を直接阻害する、選択的CDK4/6阻害剤の持つ阻害能に少なくとも部分的によると信じられる。
【0115】
幾つかの態様において、選択的CDK4/6阻害化合物は、実質的にオフターゲット効果(特にCDK4及び/又はCDK6以外のキナーゼの阻害に関係する)がない化合物である。幾つかの態様において、選択的CDK4/6阻害化合物は、CDK4/6以外のCDK(例えば、CDK1 及びCDK2)について阻害剤として劣る(例えば、>1μM IC50)。幾つかの態様において、CDK4/6阻害化合物は、選択的CDK4/6非依存性細胞の細胞周期停止を誘導しない。幾つかの態様において、選択的CDK4/6阻害化合物は、チロシンキナーゼの阻害剤として劣る(例えば、>1μM IC50)。さらに、好ましくないオフターゲット効果として、長期毒性、抗酸化効果、及びエストロゲン様効果がある、がこれらに制限されない。
【0116】
抗酸化効果は、当業者に既知の標準的検定で測定することができる。例えば、最早顕著な抗酸化効果を持たない化合物は、酸素ラジカルのような、フリーラジカルを顕著に捕捉しない。化合物の抗酸化効果は、ゲニステインのような、既知の抗酸化活性を持つ化合物と比較することができる。従って、顕著な抗酸化活性を持たない化合物は、ゲニステインに比べると、抗酸化活性が約2,3,5,10,30,又は100倍低い化合物である。エストロゲン様活性もまた、既知の検定により測定することができる。例えば、非エストロゲン様化合物は、エストロゲン受容体と顕著に結合せず、及びこの受容体を活性化しない化合物である。実質的にエストロゲン様効果フリーである化合物は、エストロゲン様活性を持つ化合物、例えば、ゲニステイン、と比較して、エステロゲン様活性が約2,3,5,10,20,又は100倍低い化合物である。
【0117】
本発明の方法に従って用いることができる選択的CDK4/6阻害剤は、全ての既知の低分子(例えば、<1000ダルトン、<750ダルトン又は<500ダルトンより低分子である)、選択的CDK4/6阻害剤、又はこれらの医薬的に許容された塩を含む。幾つかの態様において、その阻害剤は非天然化合物(即ち、自然界に見出されない化合物)である。幾つかの種類の化学化合物がCDK4/6阻害能を持つとして報告された(例えば、無細胞型検定において)。本発明法において有用な選択的CDK4/6阻害剤は、ピリド[2,3-d]ピリミジン(例えば、ピリド[2,3-d]ピリミジン-7-オン、及び2-アミノ-6-シアノ-ピリド[2,3-d]ピリミジン-4-オン)、トリアミノピリミジン、アリール[a]ピロロ[3,4-d]カルバゾール、窒素含有ヘテロアリール置換尿素、5-ピリミジニルl-2-アミノチアゾール、ベンゾチアジアジン、アクリジンチオン、及びイソキノロンを含むが、これらに制限されない。
【0118】
幾つかの態様において、このピリド[2,3-d]ピリミジンは、ピリド[2,3-d]ピリミジノンである。幾つかの態様において、このピリド[2,3-d]ピリミジノンは、ピリド[2,3-d]ピリミジン-7-オンである。幾つかの態様において、このピリド[2,3-d]ピリミジン-7-オンは、アミノアリール基又はアミノヘテロアリール基により置換される。幾つかの態様において、このピリド[2,3-d]ピリミジン-7-オンは、アミノピリジン基により置換される。幾つかの態様において、このピリド[2,3-d]ピリミジン-7-オンは、2-(2-ピリジニル)アミノ-ピリド[2,3-d]ピリミジン-7-オンである。例えば、このピリド[2,3-d]ピリミジン-7-オン化合物は、その全体が参照文献として取り込まれているBarvianらの米国特許公開2007/0179118に記載の化学式(II)の構造であってもよい。幾つかの態様において、このピリド[2,3-d]ピリミジン化合物は、6-アセチル-8-シクロペンチル-5-メチル-2-(5-ピペラジン-1-イル-ピリジン-2-イルアミノ)-8H-ピリド-[2,3-d]-ピリミジン-7-オン(即ち、PD 0332991)又はこの医薬的に許容可能な塩である(Toogood et al., J. Med. Chem., 2005, 48, 2388-2406)。
幾つかの態様において、このピリド[2,3-d]ピリミジノンは、2-アミノ-6-シアノ-ピリド[2,3-d]ピリミジン-4-オンである。2-アミノ-6-シアノ-ピリド[2,3-d]ピリミジン-4-オンを含む選択的CDK4/6阻害剤は、例えば、Tu等により開示されている(Tu et al., Bioorg. Med. Chem. Lett., 2006, 16, 3578-3581)。
【0119】
本明細書の"トリアミノピリミジン"は、ピリミジン環の少なくとも3個の炭素が、化学式-NR1R2を持つ置換基で置き換えられているピリミジン化合物であり、ここでR1及びR2は、水素原子、アルキル基、アラルキル基、シクロアルキル基、複素環、アリール基、及びヘテロアリール基からなる群から独立に選択される。各R1及びR2のアルキル基、アラルキル基、シクロアルキル基、複素環、アリール基、及びヘテロアリール基は、さらに1以上の水酸基、ハロ基、アミノ基、アルキル基、アラルキル基、シクロアルキル基、複素環式基、アリール基、又はヘテロアリール基により置換されてもよい。幾つかの態様において、アミノ基の少なくとも1個は、構造-NHRを持つアルキルアミノ基であり、ここでRは、C1〜C6アルキル基である。幾つかの態様において、少なくとも1つのアミノ基は、化学式-NHRを持つシクロアルキルアミノ基、又は水酸基により置換されたシクロアルキルアミノ基であり、ここでRは、水酸基により置換された、又は非置換の、C3〜C7シクロアルキル基である。幾つかの態様において、少なくとも1個のアミノ基は、ヘテロアリール基−置換アミノアルキル基であり、ここでヘテロアリール基は、さらに、アリール基置換体により置換されてもよい。
【0120】
アリール[a]ピロロ[3,4-d]カルバゾールは、ナフチル[a]ピロロ[3,4-c]カルバゾール、インドロ[a]ピロロ[3,4-c]カルバゾール、キノリニル[a]ピロロ[3,4-c]カルバゾール及びイソキノリニル[a]ピロロ[3,4-c]カルバゾールを含むが、これらに制限されない(Engler et al., Bioorg. Med. Chem. Lett., 2003, 13, 2261-2267; Sanchez-Martinez et al., Bioorg. Med. Chem. Lett., 2003, 13, 3835-3839; Sanchez-Martinez et al., Bioorg. Med. Chem. Lett., 2003, 13, 3841-3846; Zhu et al., Bioorg. Med. Chem. Lett., 2003, 13, 1231-1235; 及びZhu et al., J. Med Chem., 2003, 46, 2027-2030)。適切な、アリール[a]ピロロ[3,4-d]カルバゾールはまた、米国特許公開2003/0229026及び2004/0048915に開示されている。
【0121】
含窒素ヘテロアリール置換尿素は、尿素の窒素原子の1個が、含窒素ヘテロアリール基により置換されている、尿素部分を含む化合物である。含窒素ヘテロアリール基は、少なくとも1個の窒素原子を含む5から10員のアリール基を含むが、これらに制限されない。従って、含窒素ヘテロアリール基は、例えば、ピリジン、ピロール、インドール、カルバゾール、イミダゾール、チアゾール、イソクサゾール、ピラゾール、イソチアゾール、ピラジン、トリアゾール、テトラゾール、ピリミジン、ピリダジン、プリン、キノリン、イソキノリン、キノクサリン、シンノリン、キナゾリン、ベンズイミダゾール、フタリミド、等々を含む。幾つかの態様において、この含窒素ヘテロアリール基は、1個以上のアルキル基、シクロアルキル基、複素環式基、アラルキル基、アリール基、ヘテロアリール基、ヒドロキシル基、ハロ基、カルボニル基、カルボキシル基、ニトロ基、シアノ基、アルコキシル基、又はアミノ基により置換されてもよい。幾つかの態様において、含窒素ヘテロアリール置換尿素は、ピラゾール-3-イル尿素である。ピラゾールはさらに、シクロアルキル基又は複素環式基により置換されてもよい。
【0122】
幾つかの態様において、このピラゾール-3-イル尿素は:
【化1】

である(Ikuta, et al., J. Biol. Chem., 2001, 276, 27548-27554)。本発明に従い使用することができる更なる尿素としては、米国特許公開2007/0027147に記載された化学式(I)のビアリール尿素化合物である。また、Honma et al., J. Med. Chem., 2001, 44, 4615-4627; 及び Honma et al., J. Med. Chem., 2001, 44, 4628-4640を参照されたい。
【0123】
適切な5-ピリミジニル-2-アミノチアゾールCDK4/6阻害剤は、Shimamura等により開示載されている(Shimamura et al., Bioorg. Med. Chem. Lett., 2006, 16, 3751-3754)。幾つかの態様において、この5-ピリミジニル2-アミノチアゾールは:
【化2】

の構造を有する。
【0124】
有用なベンゾチアジアジン及びアクリジンチオン化合物は、例えば、Kubo等により開示された化合物を含む(Kubo et al., Clin. Cancer Res. 1999, 5, 4279-4286 及びその全体が参考文献に取り込まれている米国特許公開2004/0006074)。幾つかの態様において、このベンゾチアジアジンは、1個以上のハロ基、ハロアリール基、又はアルキル基により置換される。幾つかの態様において、このベンゾチアジアジンは、4-(4-フルオロベンジルアミノ)-1,2,3-ベンゾチアジアジン-1,1-ジオキシド、3-クロロ-4-メチル-4H-ベンゾ[e][1,2,4]チアジアジン1,1-ジオキシド、及び3-クロロ-4-エチル-4H-ベンゾ[e][1,2,4]チアジアジン-1,1-ジオキシドからなる群より選択される。幾つかの態様において、このアクリジンチオンは、1個以上のアミノ基又はアルコキシ基により置換される。幾つかの態様において、このアクリジンチオンは、3-アミノ-10H-アクリドン-9-チオン (3ATA)、9(10H)-アクリジンチオン、1,4-ジメトキシ-10H-アクリジン-9-チオン、及び2,2'-ジフェニルジアミン-bis-[N,N'-[3-アミド-N-メチルアミノ]-10H-アクリジン-9-チオン]]からなる群から選択される。
【0125】
幾つかの態様において、本発明の方法の患者は、細胞増殖性の疾患に対する治療の間に、化学療法化合物の曝露を受けた、曝露を受けている途中である、又は曝露される予定である患者である。このような疾患は、ガン性の又は非癌性の増殖性疾病である。例えば、本発明の化合物は、乳癌、前立腺癌、卵巣癌、皮膚癌、肺癌、結腸癌、脳腫瘍(即ち、神経膠腫)及び腎臓癌を含むが、これらに制限されない、幅広い種類の腫瘍の化学療法治療の間に、健康な造血幹細胞及び前駆細胞を防護する上で有効であると信じられている。
【0126】
選択的CDK4/6阻害剤は、それ自体が、ガン細胞の増殖を停止させることにより、化学療法化合物の有効性を失効させないことが好ましいので、理想的には、化学療法化合物により治療されているガンの増殖は、選択的CDK4/6阻害剤により影響を受けるべきでない。大部分のガンは、増殖性キナーゼ類を無差別に用いることができる(例えば、CDK1/2/4/又は6を用いることができる)、又はCDKにより不活性化される網膜芽腫腫瘍抑制タンパク質(RB)機能を欠失しているので、増殖に対して、CDK4/6の活性に依存しないようである。従って、CDK4/6単独の阻害は、大部分のガンの化学療法応答に影響するはずがない。当業者は理解するように、ある種の腫瘍のCDK4/6阻害に対する潜在的な感受性は、腫瘍の種類及び分子遺伝学に基づいて推量することができる。CDK4/6の阻害の影響を受けないと予想されるガンは、CDK1又はCDK2の活性増加、網膜芽腫腫瘍抑制タンパク質(RB)の喪失又は不在、高いMYC発現、サイクリンEの増加及びサイクリンAの増加を含む、がこれらに制限されない、群の1以上により特徴付けられるガンである。このようなガンとしては、肺小細胞癌、網膜芽腫、子宮頸癌、及びある種の頭頚部ガンのようなHPV陽性悪性腫瘍、Burkittsリンパ腫のようなMYC増幅腫瘍、及びトリプルネガティブ乳癌;ある種の肉腫、ある種の非肺小細胞癌、ある種のメラノーマ、ある種の膵臓癌、ある種の白血病、ある種のリンパ腫、ある種の脳腫瘍、ある種の大腸癌、ある種の前立腺癌、ある種の卵巣癌、ある種の子宮癌、ある種の甲状腺及び他の内分泌組織癌、ある種の唾腺癌、ある種の胸腺腫、ある種の腎臓癌、ある種の膀胱癌、及びある種の睾丸癌が含まれる、がこれらに制限されない。
【0127】
例えば、幾つかの態様において、ガンは、肺小細胞癌、網膜芽腫、及びトリプルネガティブ(ER/PR/Her2陰性)又は基底膜細胞型(basal-like)乳癌から選択される。肺小細胞癌及び網膜芽腫は、殆ど常に、網膜芽腫腫瘍抑制タンパク質(RB)を不活性化しており、従って、増殖のためにCDK4/6活性を要求しない。従って、CDK4/6阻害剤処理は、骨髄及び他の正常宿主の医薬的休止(PQ)に影響するであろうが、腫瘍の医薬的休止(PQ)には影響しないであろう。トリプルネガティブ(基底膜細胞型)乳癌もまた、殆ど常に、網膜芽腫腫瘍抑制タンパク質(RB)-ヌルである。また、ある種のウィルス誘発性ガン(例えば、子宮頸癌、及び頭頚部癌の一部)はウィルスタンパク質(E7)を発現し、これは網膜芽腫腫瘍抑制タンパク質(RB)を不活性化しこれらの腫瘍を機能的にRB-ヌルにする。幾つかの肺癌はまた、HPVにより引き起こされると信じられている。当業者に理解されるように、CDK4/6阻害剤により影響を受けないと予想されるガン(例えば、RB-ヌルのガン、ウィルスタンパク質E7を発現するガン、又はMYCを過剰発現するガン)は、DNA解析、免疫染色、Westernブロット解析、及び遺伝子発現プロファイリングを含む、がこれらに制限されない、方法により決定される。
【0128】
部分的に、選択的CDK4/6阻害剤を用いた化学防護処理の効果は、外因性成長因子(例えば、顆粒球コロニー刺激因子(G-CSF)及びエリスロポエチン)の使用で見られる効果と比較しうることが予期される。しかしながら、選酪的CDK4/6阻害化合物を用いた処理は、以前報告された治療では、有効に行うことができなかった、血小板及びリンパ球の抑制を改善することができるという点に多くの利点を有するはずである。従って、本発明の方法を、化学療法薬剤誘導性血小板減少症及びリンパ球減少症を緩和するために用いることができる。
【0129】
さらに、選択的CDK4/6阻害剤を用いた治療は、幹細胞により早い速度の増殖を強いないであろう。強いられた増殖は、DNA損傷の影響を改善することを意図した成長因子補助を受けたヒト及びマウスにおいて見られる後期の、及び長期の骨髄毒性を、強めることができるのでこのことは好ましい(Herodin et al., Blood, 2003, 101, 2609-2616; Hershman et al., J. Natl. Cancer Inst., 2007, 99, 196-205; 及び Le Deley et al., J. Clin. Oncol., 2007, 25, 292-300)。幾つかのグループは、顆粒球コロニー刺激因子(G-CSF)の使用は、ガンを克服したガン患者において、後期の(化学療法後>3年)骨髄毒性(例えば、骨髄形成異常症)の発生を顕著に増やすということを報告した。幾つかのグループはまた、EPO及び関連する赤血球増加刺激化合物は、化学療法を受けた患者の癌関連死亡率を増加させる様であると報告した(Khuri, N. Engl. J. Med., 2007, 356, 2445-2448)。このことはEPOが、腫瘍増殖又は腫瘍脈管形成の刺激能を表すかどうかは確かではないが、これらの治験は、腫瘍学の分野におけるEPOの使用に対する主要な障害を指摘する。医薬的休止(PQ)は、腫瘍増殖を促進するとは期待されず、及びEPOの使用が禁忌された場合に、赤血球細胞数を増加させるために、治療において安全に用いることができるであろう。
【0130】
幾つかの他の利点を、選択的CDK4/6阻害剤を用いた化学防護方法は結果として生ずることができる。健康な細胞に関して、選択的CDK4/6阻害剤により与えられた化学毒性の減少は、ガン細胞の成長及び増殖を減少させる化学療法化合物の効力に影響を与えないと予想される。さらに、化学毒性の減少は、投与の強化(例えば、より高い投与量及び/又は与えられた期間又はより短い投与期間でのより高い投与量)を可能にすることが期待され、このことはより良い有効性と言い換えられるだろう。従って、本明細書で開示した方法は、より少ない毒性及びより高い有効性である、化学療法体制をもたらすことができる。
【0131】
また、外因性の生物成長因子を用いた防護的治療と比較して選択的CDK4/6阻害剤は、多くの低価格の、経口的に可能な低分子を含み、これらの低分子を、多くの異なる経路を経て投与するために処方することができる。ふさわしい場合には、このような低分子を、経口、局所、鼻腔内、吸入、静脈内、又はすべての他の投与法のために処方することができる。さらに、生物製剤と反対に、安定な低分子はより容易に備蓄し、保存することができる。従って、細胞毒性(例えばDNA損傷性)化合物に対して化学事故により曝露された患者が、報告できる救急室に、又は化学物質又は薬剤製造設備又は化学研究実験室を含め、化学的曝露が特に生じ易い場所に、選択的CDK4/6阻害化合物を、より容易に、安価に常備することができる。
【0132】
選択的CDK4/6阻害剤を、非ガン性増殖性疾患における異常組織への化学療法薬剤治療の間、健康な造血幹細胞及び前駆細胞を防護する上でも用いることができるが、非ガン性増殖性疾患としては、新生児の多発性血管腫症、二次的進行性多発性硬化症、慢性進行性骨髄萎縮症、神経線維腫症、神経節神経腫症、ケロイド形成、骨のPaget病、乳房線維嚢胞病、Perony及びDuputren線維症、再発狭窄症、及び肝硬変が含まれるが、これらに制限されない。さらに、選択的CDK4/6阻害剤は、化学事故による曝露又は過剰投与(例えば、メトレキサート過剰投与)におけるDNA損傷性(例えば、インターカレーション、又はアルキル化を起こす)化合物の影響を改善するために用いることができる。従って、本明細書に開示した方法は、化学プラント作業者、化学研究者、及び例えば、化学物質流出のような、職業上の曝露からの救急報告者、を防護するために用いることができる。
【0133】
本発明に従い、化学防護化合物が、化学療法薬剤の投与前、投与中、又は投与後に投与される限り、化学療法薬剤を、治療の所定の進行と一致した如何なる計画でも、及び如何なる投与量でも、患者に対して投与することができる。一般的に、化学防護化合物は、化学治療化合物への曝露の24時間前から曝露24時間後までの範囲の時間内に患者に投与される。しかしながら、この時間期間は、化学療法薬剤への曝露前24時間より前の時間に延ばすことができる(化合物が適切な血漿濃度に達するに要する時間及び/又は化合物の血漿内での半減期に基づいて)。さらに、CDK4/6阻害剤のより遅い投与が、少なくとも幾らかの防護効果をもたらす限り、この時間期間は、化学療法化合物又は他のDNA損傷性化合物に対する曝露後24時間より長く伸ばすことができる。このような、曝露後治療は、事故による曝露又は過剰投与の場合特に有用であることができる。
【0134】
幾つかの態様において、この選択的CDK4/6阻害剤を、化学療法薬剤の投与前のある時間期間に患者に投与することができて、その結果選択的CDK4/6阻害剤の血漿レベルは、化学療法化合物の投与時にピークとなる。もし都合良ければ、治療投薬計画を簡単にするために、この選択的CDK4/6阻害剤を、化学療法薬剤と同時に投与することができる。幾つかの態様において、化学防護剤及び化学療法薬剤を、単一処方物として提供することができる。
必要ならば、化学防護化合物の多数回投与を患者に行うことができる。あるいは、患者は、単回の選択的CDK4/6投与を受けることができる。化学治療及び化学防護剤治療のコースは、患者から患者で異なることができて、及び与えられた臨床施設において、当業者は、直ちに適切な投与量及び化学療法薬剤及び関係する化学防護剤治療計画を決めることができる。
【0135】
III.活性化合物、塩、及び処方物
本明細書で用いる用語"活性化合物"は、選択的CDK4/6阻害剤化合物又はこれらの医薬的に許容された塩である。活性化合物を、いかなる適切な方法でも患者に投与することができる。投与された活性化合物の量及びタイミングは、勿論、治療される患者、患者が被爆中の、被爆した、又は被爆すると予想されるDNA損傷性化合物の投与量、投与の方法、活性化合物の薬物動力学的特徴、及び処方する医師の判断に依存する。従って、患者が多様なので、以下の投与量は、ガイドラインであり、及び医師が患者に対して適切と考える治療するために、医師は化合物の投与量を徐々に増量することができる。望ましい治療を考えて、医師は、年齢、患者の体重、既往症の存在、及び他の疾患の存在のような様々な因子をバランスすることができる。医薬処方物は、以下により詳細に考察するように、経口、静脈内、又は噴霧剤投与を含むが、これらに制限されない、いかなる投与ルートに対しても調製することができる。
【0136】
この使用が本明細書の態様の範囲内である、特定の活性化合物の治療上有効な投与量は、化合物から化合物、患者によって幾らか異なってもよく、患者の状態及び投与経路により異なってもよい。一般的提案として、約0.1から約200mg/kgの投与量は、治療上の有効性を持ち、ここで全ての重さは、活性化合物の重さに基づいて計算され、塩を用いる場合を含む。幾つかの態様において、投与量は、活性化合物の血清濃度が約1及び5μMの間まで、又はより高い濃度を提供するに必要な化合物の量であってもよい。より高い濃度における毒性が心配ならば、静脈内投与量を、約10mg/kgまでのような、より低レベルに制限してもよく、ここで全ての重さは、活性化合物の重さに基づいて計算され、塩を用いる場合を含む。経口投与の場合、約10mg/kgから約50mg/kgまでの投与量を用いることができる。一般的に、約0.5mg/kgから5mg/kgまでの投与量を筋肉内注射に用いることができる。幾つかの態様において、投与量は約1μmol/kgから約50μmol/kgであってもよく、又は、任意に、静脈内又は経口投与に対して、約22μmol/kg及び約33μmol/kgであってもよい。
【0137】
本発明の方法に従い、本明細書に記載した医薬的に活性な化合物を、固体又は液体として経口的に、又は溶液、懸濁物又は乳濁液として、筋肉内、静脈内、又は吸入により投与することができる。幾つかの態様において、この化合物又は塩を、リポソーム懸濁液として、吸入、静脈内、又は筋肉内に投与することができる。吸入を通して投与する際、この活性化合物又は塩は、約0.5から約5μmの、任意に約1から約2μmまでの粒子サイズを持つ、複数の固体粒子又はドロップ状であってもよい。
【0138】
医薬処方物は、全ての医薬的に許容された担体中の、本明細書に記載した活性化合物又はこの化合物の医薬的に許容された塩を含むことができる。溶液を望む場合、水溶性の化合物又は塩に関しては、水が選択される担体である。水溶性の化合物又は塩に関して、グリセロール、プロピレングリコール、ポリエチレングリコール、又はこれらの混合物のような有機媒体が適切である。後者の場合、有機媒体は、かなりの量の水を含むことができる。どちらの場合の溶液も、当業者が既知の適切な処方で滅菌することができて、及び一般的には0.22μmフィルターを通す。滅菌の後、この溶液を、ピロゲンを除いたガラスバイアルのような、適切な容器に分配することができる。この分配を、任意に無菌的方法で行うことができる。滅菌的密封をガラスバイアルに施し、必要なら、バイアルの内容物を凍結乾燥することができる。
【0139】
活性化合物又はその塩に加えて、医薬処方物は、pH調節添加物のような、他の添加物を含むことができる。特に、有用なpH調節試薬は、塩酸のような酸、塩基、乳酸ナトリウム、酢酸ナトリウム、リン酸ナトリウム、クエン酸ナトリウム、ホウ酸ナトリウム、又はグルコン酸ナトリウムのような緩衝剤を含む。さらに、この処方物は、抗菌保存剤を含むことができる。有用な抗菌保存剤としては、メチルパラベン、プロピルパラベン、及びベンジルアルコールがある。抗菌保存剤は、一般的に、処方物が、複数回投与使用のためにデザインされたバイアルに置かれる際に用いられる。本明細書に記載した医薬処方物は、当業者に既知の方法で、凍結乾燥できる。
【0140】
経口投与のために、医薬組成物は、溶液、懸濁液、錠剤、ピル、カプセル、粉末等々の形をとることができる。クエン酸ナトリウム、炭酸カルシウム、リン酸カルシウムのような様々な賦形剤を含む錠剤が、ポリビニルピロリドン、砂糖、ゼラチン、及びアカシアのような結合剤と共に、澱粉、(例えば、ジャガイモ、又はタピオカ澱粉)及びある種の複合ケイ酸塩のような錠剤分解物質と共に用いられる。さらに、ステアリン酸マグネシウム、ラウリル硫酸ナトリウム、及び滑石のような潤滑剤が錠剤作成目的に非常に有用である。同様の種類の固体組成物がまた、硬軟に調合したジェラチンカプセルの充填物として用いられる。これに関連する材料としてまた、ラクトース又はミルク砂糖及び高分子量ポリエチレングリコールが含まれる。経口投与のために、水性の懸濁物及び/又はエリクシルを好む場合、本発明の化合物を様々な甘味料、芳香剤、着色剤、乳化剤、及び/又は懸濁化剤、及び水、エタノール、プロピレングリコール、グリセリン及びこれらの類似の組合せのような稀釈剤と組み合わせることができる。
【0141】
本明細書に記載した発明の他の態様において、本明細書で記載した活性化合物、又はこの塩を、密閉した容器内に単位投与量の形で含む、注射可能な、安定な、滅菌した処方物を提供する。この化合物又は塩は、適切な医薬的に許容可能な担体とともに再構成し、患者へのこの化合物の注射に適した液体処方物を作成することができる、凍結乾燥物の形で提供される。この化合物又は塩が、実質的に非水溶性の場合、医薬的に許容された、充分量の乳化剤を充分量使って、水溶性担体中の化合物又は塩を乳化することができる。特に有用な乳化剤は、ホスファチジルコリン及びレシチンである。
【0142】
本明細書で提供された他の態様は、本明細書に開示した活性化合物のリポソーム処方物を含む。リポソーム懸濁液の作成法は、当業者に既知である。化合物が水溶性の塩である時、従来のリポソーム技術を用いて、脂質小胞にこの化合物を取り込むことができる。このような例として、活性化合物が水に溶解度があるので、活性化合物は実質的に親水性中心又はリポソームのコアに取り込まれる。用いられる脂質層は、全ての従来の組成であることができて、及びコレステロールを含むことができるか、又はコレステロールフリーであってもよい。当該の活性化合物が、水に不溶な場合、再び従来のリポソーム作成技術を用いて、塩を、リポソームの構造をとる実質的に疎水性脂質2重層に取り込むことができる。どちらの場合も標準的超音波処理及び均一化技術を用いて、作成するリポソームはサイズを小さくできる。本明細書に開示した活性化合物を含むリポソーム処方物を、凍結乾燥して、凍結乾燥物とさせ、水のような医薬的に許容された担体を用いて再構成して、リポソーム懸濁物を再構成することができる。
【0143】
吸入による噴霧物としての投与に適した医薬処方物がまた提供される。これらの処方物は、本明細書に記載した所望の化合物又はこの塩の溶液又は懸濁液、又はこの化合物又は塩の複数の固体粒子を含む。所望の処方物を小チャンバーに入れて噴霧化する。噴霧化は、圧縮空気又は超音波エネルギーにより行い、この化合物又は塩を含む複数の液滴又は固体粒子を形成することができる。この液滴又は固体粒子は、約0.5から約10μm、任意に約0.5から約5μmの粒子サイズの範囲に有るべきである。この固体粒子は、微粉化のような、当業者に既知のいかなる適切な方法によってでも、固体化合物又はこの塩を加工して得ることができる。任意に、固体粒子又は液滴のサイズは、約1μmから約2μmであってもよい。この点に関して、この目的を達成するために市販の噴霧器を用いることができる。この化合物を、その開示全体が本明細書の参考文献に取り込まれている米国特許第5,628,984号に示された方法で、吸入できる粒子の煙霧状の懸濁物を通して投与してもよい。
投与に適した煙霧剤としての医薬処方物が液体状の場合、この処方物は、水を含む担体中の水溶性活性化合物を含むことができる。処方物の表面張力を充分低下させ、噴霧器で使われた時、所定のサイズ範囲内の液滴を作ることができる、界面活性剤は存在してもよい。
【0144】
指摘したように、水溶性及び非水溶性活性化合物が提供される。本明細書で用いるように、用語"水溶性"は、約50mg/mLより多量に水に可溶な全ての組成物を定義することを意味する。また、本明細書で用いるように、用語"非水溶性"は、約20mg/mL未満の水への溶解度を持つ全ての組成物を定義することを意味する。幾つかの態様において、水溶性化合物又は塩は、好ましいが、他の態様において、非水溶性化合物又は塩は同様に好ましい。
【0145】
本明細書の用語"医薬的に許容される塩"は、充分な医学的判定の範囲で、過度な毒性、炎症、アレルギー反応、等々無しに、患者(例えば、ヒト患者)と接触した使用に適し、合理的な利点/危険性比と釣り合い、意図した使用に有効であり、さらに本発明の化合物のできたら両性イオンの型である塩を表す。
従って、用語"塩"は、本発明の化合物の相対的に非毒性の、無機酸及び有機酸の付加塩を表す。これらの塩を、化合物の最終的分離と精製の間in situで製造することができる、又は塩基フリーの形に精製した化合物を適切な有機酸又は無機酸と別々に反応させ、及びこのように作成した塩を単離して製造してもよい。本発明の化合物が塩基性化合物である限り、様々な無機酸及び有機酸と反応して広く様々な異なる塩を形成してもよい。このような塩は、動物に投与するためには、医薬的に許可されなければならないが、実際上、最初、反応混合物から塩基性化合物を医薬的に許可されない塩として分離し、その後アルカリ性試薬との処理で、フリー塩基化合物に変換し、その後、このフリー塩基を医薬的に許可される酸付加塩に変換することがしばしば望ましい。塩基性化合物の酸付加塩は、従来の方法で塩を作成するために、フリー塩基型を十分量の所定の酸と接触させて調製する。このフリー塩基型は、塩型を塩基と接触させ、フリー塩基を従来の方法で単離して、産生できる。このフリー塩基型は、夫々の塩型と、極性溶媒への溶解度のようなある種の物理的特徴において幾らか異なるが、他の点で、本発明の目的のために、塩は夫々のフリー塩基と等価である。
【0146】
医薬的に許可される塩基付加塩は、アルカリ及びアルカリ土金属水酸化物のような金属又はアミンと共に、又は有機アミンの形で作成される。カチオンとして用いられる金属の例は、ナトリウム、カリウム、マグネシウム、カルシウム、等々を含む、がこれらに制限されない。適切なアミンの例として、N,N'-ジベンジルエチレンジアミン、クロロプロカイン、コリン、ジエタノールアミン、エチレンジアミン、N-メチルグルカミン及びプロカインが含まれる、がこれらに制限されない。
酸性化合物の塩基付加塩は、従来の方法で塩を作成するために、フリー酸型を十分な量の所定の塩基と接触させて調製する。フリー酸型は、塩型を酸と接触させ、及び従来の方法でフリー酸を単離して産生してもよい。フリー酸型は、それぞれの塩型と、極性溶媒への溶解度のようなある種の物理的特徴において幾らか異なるが、他の点で、本発明の目的のために、塩は夫々のフリー酸と等価である。
【0147】
塩を、塩化水素の、硝酸の、リン酸の、硫酸の、臭化水素の、ヨウ化水素の、リン酸の、等々のような、無機酸硫酸塩、ピロ硫酸塩、重硫酸塩、亜硫酸塩、重亜硫酸塩、硝酸塩、リン酸塩、リン酸1水素塩、リン酸2水素塩、メタリン酸塩、ピロリン酸塩、塩化物、臭化物、ヨウ化物から作成してもよい。代表的塩としては、臭化水素塩、塩化水素塩、硫酸塩、重硫酸塩、硝酸塩、酢酸塩、シュウ酸塩、吉草酸塩、オレイン酸塩、パルミチン酸塩、ステアリン酸塩、ラウリン酸塩、ホウ酸塩、安息香酸塩、乳酸塩、リン酸塩、トシラート、クエン酸塩、マレイン酸塩、フマル酸塩、コハク酸塩、酒石酸塩、ナフチル酸塩メシラート、グルコヘプタン酸塩、ラクトビオン酸塩、ラウリルスルホン酸塩及びイセチオン酸塩、等々を含む。塩はまた、脂肪族モノー、及びジカルボン酸、フェニル置換アルカン酸、ヒドロキシアルカン酸、アルカン二酸、芳香族酸、脂肪族及び芳香族スルホン酸、他、等々のような有機酸から作成される。代表的塩としては、酢酸塩、プロピオン酸塩、カプリル酸塩、イソブチル酸塩、シュウ酸塩、マロン酸塩、コハク酸塩、スベリン酸塩、セバシン酸塩、フマル酸塩、マレイン酸塩、マンデル酸塩、安息香酸塩、クロロ安息香酸塩、メチル安息香酸塩、ジニトロ安息香酸塩、フタル酸塩、ベンゼンスルホン酸塩、トルエンスルホン酸塩、フェニル酢酸塩、クエン酸塩、乳酸塩、マレイン酸塩、酒石酸塩、メタンスルホン酸塩、等々を含む。医薬的に許容される塩は、ナトリウム、リチウム、カリウム、カルシウム、マグネシウム、等々のような、アルカリ及びアルカリ土金属をベースとしたカチオン、及び非毒性アンモニウム、第四級アンモニウム、及びアンモニウム、テトラメチルアンモニウム、テトラエチルアンモニウム、メチルアミン、ジメチルアミン、トリメチルアミン、トリエチルアミン、エチルアミン等々を含む、がこれらに制限されない、アミンカチオンを含むことができる。アルギニン塩、グルコン酸塩、ガラクツロン酸塩等々のアミノ酸塩もまた検討される。参考文献に取り込まれている、Berge et al., J. Pharm. Sci., 1977, 66, 1-19を参照。
【0148】
IV. 化学防護活性を持つ化合物をスクリーニングする方法
幾つかの態様において、本発明は、化学防護化合物を選択する方法を提供する。特に、本発明は、健康な細胞において、一時的休止を作り出し、腫瘍を細胞毒性(例えば、DNA損傷性)化合物又は他の試薬(例えば、電離放射線)を用いて治療することを可能にするが、長期の(又は他の不都合な)毒性を引き起こさない、及び長期の前処理期間無しに化学防護を提供することができる化学防護化合物を選択する方法を提供する。幾つかの態様において、1以上の細胞をベースとした検定により、試験化合物又は化合物類をスクリーニングすることが望まれる。細胞をベースとした検定の使用は、非細胞ベースの検定においてCDK4/6阻害能を持つ化合物の有効性を確認することができて、不都合なオフターゲット効果を持つ化合物を除外する上で役立つ。本明細書に記載する、この細胞に基づく検定スクリーニング法が、化合物のin vivoでの化学防護能を予言することを示す。
【0149】
幾つかの態様において、本発明は、健康な細胞における細胞毒性化合物の効果を防ぐために使用する化合物のスクリーニング方法であって、(i)試験化合物をCDK4/6依存性細胞集団に一定時間接触させる段階、(ii)前記細胞集団の細胞周期を解析する段階、及び(iii)前記細胞集団において選択的にG1期停止を誘導する試験化合物を選択する段階から成る方法である。
幾つかの態様において、このスクリーニングは、実質的に純粋なG1停止(即ち、実質的にG2/M又はS期停止がない、又は20, 15, 12, 10, 8, 6, 5, 4, 3, 2又は1%より少ないG2/M及び/又はS期停止)を誘導する試験化合物を選択することを含む。
【0150】
適切な試験化合物は、様々な異なる化合物を含む。例えば、この試験化合物は、CDK4/6阻害効果を有すると知られている、又は疑われている化合物であってもよい。試験化合物は、無細胞検定によりCDK4/6阻害効果が知られている化合物を含むことができる。幾つかの態様において、この試験化合物を、本明細書で既に記載した化合物のような、ピリド[2,3-d]ピリミジン(例えば、ピリド[2,3-d]ピリミジン7-オン及び2-アミノ-6-シアノ-ピリド[2,3-d]ピリミジン-4-オン)、トリアミノピリミジン アリールl[a]ピロロ[3,4-d]カルバゾール、窒素含有 ヘテロアリール-置換尿素、5-ピリミジニル-2-アミノチアゾール、ベンゾチアジアジン、アクリジンチオン、及びイソキノロンを含むが、これらに制限されない群から選択してもよい。
【0151】
本明細書に開示した方法に従う使用のために適した細胞集団は、不死化ヒト二倍体繊維芽細胞(tHDF)又はCDK4/6依存性ガン細胞株を含むが、これらに制限されない。幾つかの態様において、このCDK4/6依存性ガン細胞株は、INK4a/ARF欠失ガン細胞株である。幾つかの態様において、この細胞集団を、細胞集団の細胞周期解析を行う前に、24時間以下の間(例えば、24, 23, 22, 21, 20, 19, 18, 17, 16, 15, 14, 13, 12, 11, 10, 9, 8, 7, 6, 5, 4, 3, 2又は1時間)試験化合物と接触してもよい。すべての適切な試験化合物量を細胞集団との接触に用いることができる。例えば、細胞集団と接触するために用いる試験化合物の適切な量は、化合物に関する既知のデータ(例えば、無細胞キナーゼ阻害研究により測定される既知のIC50)に基づくことができる。スクリーニングはさらに、複数の細胞集団の試験化合物処理を含むことができるが、処理用量依存効果を測定するために、ここで複数の細胞集団の各々は、異なる濃度の特定の試験化合物で処理される。
【0152】
細胞集団を試験化合物と所定の時間接触させた後、特定の細胞周期(例えば、G1期、G2/M期、又はS期)又は複数の周期にある細胞の割合(%)を測定するために、細胞周期解析を行った。比較のために、試験化合物で処理してない細胞集団についても細胞周期解析を行うことができる。
細胞集団の細胞周期を検定する方法は当業者には既知であり、及び、例えば、米国特許公開2002/0224522に記載される。細胞周期は、フローサイトメトリー解析、顕微鏡解析、密度勾配遠心法、エルトリエーション法、及び免疫蛍光法(例えば、前記のどの技術との組合せで用いることもできる)を含む蛍光技術を含む様々の方法で検定できる。フローサイトメトリー法は、例えば、ヨウ化プロピジウム(PI)のようなDNA結合色素のような標識試薬又は標識染色剤で細胞を処理すること、及び細胞DNA含量をフローサイトメトリーにより解析すること、を含む。免疫蛍光法は、例えば、蛍光抗体を伴うチミジン類似体(例えば、5−ブロモ−2−デオキシウリジン(BrdU)又はヨウ化デオキシウリジン)のような特異的細胞周期指示薬の検出を含む。
【0153】
フローサイトメトリーを用いた細胞周期解析の1方法において、細胞の核DNA量を細胞周期の指標として、定量的に高速度で測定することができる。細胞のDNA含量は、細胞周期の幾つかの期の間で変化するので、DNA含量は、細胞周期の指標である。G0/1期にある細胞は、1単位のDNAに等しいDNA含量を有し;S期において細胞はDNAを複製し、S期を通過する間に比例してその含量を増加させ;及びG2期、その後M期に入り、細胞はG0/1期のDNA含量の2倍となる(即ち、2単位のDNA)。従って、S期細胞は、G1期及びG2/M期(G1期の細胞の2倍のDNAを持つ)の細胞の間の中間となるDNA含量を有する。細胞DNA含量の単変量解析により、G0/1、S及びG2/M期細胞を識別することができる。
【0154】
細胞DNA含量のフローサイトメトリー測定は、一般的に、透過性細胞又は核の懸濁液における、DNAに化学量論的に結合する色素の添加を伴う。一般的に、細胞は固定化又は例えば、界面活性剤を用いて、透過化され、その後DNA結合色素を用いて染色される。このような色素の例としては、核酸特異的蛍光色素、ヨウ化プロピジウム(PI)、又は4'6'−ジアミジノ−2−フェニルインドール(DAPI)があるが、これらに制限されない。PIは、DNA以外にRNAも染色する;従って、細胞中のDNA含量を測定する場合RNAによる蛍光の測定の含有を避けるために、RNaseとのインキュベーションによりRNAを除くことが望ましい。このDNA結合PIは、青色光(488nm)で励起した時、赤色蛍光を発する。DAPI-DNA複合体を、紫外(UV)光(360nm)で励起することができて、青色蛍光を発する。DNAをまた、生細胞においてUV光励起可能蛍光色素Hoeschst33242(これも、青色蛍光を発する)で染色してもよい。他のDNA結合色素としては、Hoechst 33258、7-AAD、LDS 751、及びSYTO 16(例えば、Molecular Probes Handbook of Fluorescent Probes and Research Chemicals, Haugland, Sixth Ed.; 特に、第8章及び第16 章参照)があるが、これらに制限されない。一般的に、DNA結合色素は、細胞により、受け身的に取り込まれ、及びDNAとインターカレーションにより結合するが、幾つかのDNA結合色素は、DNAの主溝又は副溝結合化合物である。
【0155】
染色材料はDNA量に比例した色素量を取り込む。この染色材料は、その後、フローサイトメーターにおいて測定され、発光した蛍光シグナルは、細胞からの全蛍光発光に比例した高さ(振幅)を持つ電気パルスを発生する。蛍光測定の結果はまた、細胞DNA含量頻度棒グラフとしても表示できて、これは蛍光強度の差異に基づいた細胞周期の様々な期にある細胞の割合を示す。単一項のDNA棒グラフにフィットする数学モデルを含むソフトウェアが開発され、細胞周期の異なる期にある細胞の割合を計算する。幾つかの製造者は、細胞周期解析のためのソフトウェア、例えば、CELLFIT(TM)(Becton, Dickinson and Company , Franklin Lakes, New Jersey, USA)を提供する。
【0156】
様々な核酸類似体を、細胞複製の間にDNAに取り込むことができる。例えば、BrdUは、類似体処理した細胞の複製の間に、DNAに取り込まれる。類似体を取り込んだDNAは、蛍光色素標識した抗BrdU抗体を用いて、免疫細胞化学的に検出できる。DNA含量は、例えば、PI又は7−アミノアクチノマイシンD(7-AAD)のような赤色のインターカレートする蛍光色素による、例えば、対比染色により検定できる。抗BrdU抗体の免疫蛍光に対するDNA含量の二変数解析により、G1又はG2/M期細胞からのDNA含量の差異に基づき、及びまた、緑色蛍光抗BrdU抗体の取り込みに基づき、S期細胞を識別する。
【0157】
遠心法及び遠心エルトリエーション法を用いて、細胞をサイズにより分画することができる。異なる細胞周期にある細胞は、サイズを異にするので、これらの方法を用いて、細胞を細胞周期により分類することができて、これにより細胞の周期を検定できる。例えば、初期G1期細胞は、分裂期又は後期G2細胞のサイズの約半分である。
【0158】
クロモソーム(染色体)は、細胞周期の進行に従い、形態的、超微細構造的及びトポロジー的に変化する。従って、細胞周期の異なる期にある細胞からのクロモソームは、特徴的であることができる。クロモソームのトポロジーは、細胞周期の異なる期にある細胞で異なる。間期クロモソームDNAは、遺伝子発現に役立つために、様々に凝縮した状態にある。転写されない、クロモソーム領域のクロマチン(染色質)は、大部分凝縮した状態で存在するが、他方転写される領域は、広がった形と仮定される。S期に於いて、クロモソームDNAは、複製過程で巻き戻されるので、さらに分散される。S期の結論として、凝集が起こり広がった姉妹染色分体の堅い結合が保たれる。一般的に、クロモソームは、前期の間に凝縮を始め、ヒストン及び幾つかの他の促進タンパク質により導かれて数次のスーパーコイリングを受ける。クロモソームは、間期においては、大部分凝縮し、娘細胞が分裂するので、分裂終期の間に再び脱凝縮始め、正常な転写レベルが回復する。従って、細胞周期は、様々な画像技術(例えば、顕微鏡)を通して検定してもよい。
【0159】
本明細書に開示した方法に従い、細胞周期解析は、フローサイトメトリー法、蛍光定量法、細胞画像化、及び蛍光分光法又はこれらの組合せを含むが、これらに制限されない、すべての適切な技術を用いて行うことができる。幾つかの態様において、細胞周期解析は、フローサイトメトリーを含む。幾つかの態様において、細胞周期解析は、細胞集団(例えば、一定時間試験化合物との接触後)の1以上の標識試薬(例えば、DNA結合試薬又は細胞周期指標)を用いた標識を含む。幾つかの態様において、標識試薬は、BrdU、PI、又はこれらの組み合わせである。
【0160】
幾つかの態様において、化学防護化合物を選択する方法はさらに、1以上の追加的な確認検定を含む。例えば、幾つかの態様において、この方法はさらに、試験化合物が、CDK4/6非依存生細胞において、G1期停止の誘導能を持つことの試験を含む。従って、幾つかの態様において、この方法はさらに以下の段階を含む:第2の細胞集団(CDK4-及び/又はCDK6-非依存生細胞を含む)と試験化合物(一定時間CDK4/6依存性細胞にG1期停止を選択的に誘導する)との接触;第2の細胞集団の細胞周期解析の実行;及び第2の細胞集団に選択的G1期停止の誘導を行わない試験化合物の選択。
幾つかの態様において、第2の細胞集団は、化学防護化合物を用いた治療を受けた患者に存在するガンと関連するガン細胞株のような、ガン細胞株である。幾つかの態様において、第2の細胞集団は、網膜芽腫腫瘍抑制タンパク質(RB)−ヌルである。幾つかの態様において、第2の細胞集団は、高活性のCDK1 又はCDK2 、高レベルのMYC発現、増加したサイクリンE又は増加したサイクリンAにより特徴付けられる細胞集団である。
【0161】
この方法はまた、選択した試験化合物が、細胞毒性(例えば、DNA損傷性)化合物と接触した細胞集団における、DNA損傷を減らす、及び/又は細胞生存性を維持することの確認を含むことができる。例えば、DNA損傷の阻止及び/又は細胞生存性の維持は、in vivoにおいて化学防護薬剤が用いられる前に、ex vivo細胞集団(例えば、培養により維持された細胞集団)において検定できる。
従って、幾つかの態様において、確認の検定は、以下の段階を含む:細胞集団と試験化合物との一定時間の接触;又は細胞毒性化合物(例えば、化学療法化合物)と細胞集団との接触前のある時点で、又は同時に、又は接触後、単回投与としての接触。幾つかの態様において、細胞毒性化合物はDNA損傷性化合物である。幾つかの態様において、この本明細書で開示した方法に従って使用されるDNA損傷性化合物は、ドキソルビシン、エトポシド、カルボプラチン又はこれらの組合せを含む。
【0162】
細胞毒性化合物で処理された細胞において、試験化合物によりもたらされたDNA損傷の減少、又は試験化合物によりもたらされた細胞生存性の維持は、すべての適切な方法で検定できる。例えば、細胞集団におけるDNA損傷は、本明細書において以下にさらに記載するように、γ-H2AX検定を行うことにより検定できる。動物細胞は、DNA2重鎖切断を誘発する試薬に対して、ヒストンH2AXの即時の、多量のリン酸化をもって応答する。従って、購入可能な市販の抗体を用いて、リン酸化H2AX(「ガンマ−H2AX(γ-H2AX)」ともいう。)を検出することを、細胞内のDNA損傷の指標として用いることができる。
【0163】
様々な細胞増殖検定がまた、細胞生存性を評価する技術において既知である。幾つかの態様において、細胞生存性は、以下に詳細に記載するように、2-(4-ヨウ化フェニル)-3-(4-ニトロフェニル)-5-(2,4-ジスルホフェニル)-2H-テトラゾリウム1ナトリウム塩(WST-1)を用いた検定を行うことにより評価する。WST-1検定において、WST-1は、生存細胞に存在するミトコンドリア・リダクターゼにより切断され、着色産物(即ち、ホルマザン)を産生し、これは特定の波長(例えば、420〜480nm)の吸光度を測定して検出できる。比色基質として用いることができる他のテトラゾリウム塩としては、WST-8、TTC、INT、MTS、MTT及びXTTがある。このCellTiter-Glo(R)検定(CTG assay; Promega, Madison, Wisconsin, USA)は、細胞溶解物中のATP濃度を測定することにより、細胞生存性を測定する。細胞生存性はまた、DNA合成(例えば、核酸類似体の取り込みにより)の測定及び他の既知の技術により評価することができる。
【実施例】
【0164】
以下の実施例は、例証となる実施形態を提供する。本発明及び当業者の一般的レベルを考えて、以下の実施例は例証のみを意図しており、当業者は、本発明の範囲から離れることなく、無数の変更、修正、及び変更を行うことができることを理解することができる。
【0165】
方法
化合物:
以下の研究に用いた化合物を以下の表1に示した。フラボピリドール以外の化合物は、既知の文献手順により新しく合成したか、又は市販のものを購入した。
フラボピリドールは、Kwok-Kin Wong 博士(Dana-Farber Cancer Institute, Harvard Medical School, Boston, Massachusetts, USA)より提供されたものを用いた。ロスコビチン及びゲニステインは、LC Laboratories (Woburn, Massachusetts, USA)から購入した。2BrICを、本研究のためにOTAVA Chemicals (Kiev, Ukraine)は新たに合成したが、例えば、OTAVA Chemicals (Kiev, Ukraine)及びAlexis Biochemicals (EnzoLife Sciences, Inc., Farmingdale, New York, USA)から市販品が入手可能である。2BrICは、Zhu et al., J. Med. Chem., 46, 2027-2030 (2003)に記載の方法に従って合成できる。PD0332991は、以下の実施例1に記載した手順で合成した。すべての化合物の構造及び純度は、NMR及びLC-MSにより確認した。すべての化合物は>94%純度であった。
【0166】
表1.選択的及び非選択的CDK4/6阻害化合物
【表1−1】

【0167】
【表1−2】

【0168】
【表1−3】

【0169】
細胞株:
不死化ヒト二倍体繊維芽細胞(HS68)を、添加化合物と共に、Dulbecco改変Eagle培地(DMEM)+10%仔牛胎児血清(FBS)中で培養した。A2058及びWM2664に対して同じ条件を用いた。網膜芽腫腫瘍抑制タンパク質(RB)-経路突然変異で知られているヒト・メラノーマ細胞株A2058はRB-ヌルであり、WM2664はINK4a/ARFを欠く。従って、A2058細胞はCDK4/6非依存性であり、WM2664はCDK4/6依存性である。これらの細胞をDMEM+10%FBS中で培養した。
【0170】
細胞周期解析:
胞周期解析は、製造者の手順に従い、BrdU及びヨウ化プロピジウム(両者ともBD Biosciences Pharmigen, San Jose, California, USAから入手)を用いて行った。細胞は、15分間のBrdUパルス前に、所定の濃度で、試験化合物と24時間処理し、細胞採取し、固定し、染色し、フローサイトメトリーにより解析した。HS68、WM2664及びA2058細胞におけるPD332991及び2BrICの用量作用曲線の棒グラフを、Mod-Fit(R) software from Verity Software House (Topsham, Maine, USA)を用いて解析した。
【0171】
γ-H2AX検定:
γ-H2AX検定のために、これらの細胞を24時間PD332991又は2BrICの用量作用をもって処理した。細胞を固定し、透過性にし、γ-H2AX Flow Kit (Millipore, Billerica, Massachusetts, USA)に従って抗-γ-H2AX抗体で染色した。γ-H2AXレベルをフローサイトメトリーにより検定した。
【0172】
細胞増殖検定:
細胞増殖検定を、1x103細胞を100μLの増殖培地を加えた96ウェル組織培養プレートに蒔種して行った。細胞を、表1の化合物、及びドキソルビシン(以下「DOX」とも表示する。)、エトポシド(以下「ETOP」とも表示する。)又はカルボプラチン(以下「CARBO」とも表示する。)で、指示されたように処理した。処理後、細胞を正常の増殖培地中で7日間回復させた。回復期間の終わりに、細胞数をWST-1細胞増殖検定(TaKaRa Bio USA, Madison, Wisconsin, USA)又はCellTiter-Glo(R)assay(CTG; Promega, Madison, Wisconsin, USA))を用いて定量した。データを、WST検定に対して450nmの吸光度として、又はCTG検定に対して相対的光単位(RLU)として表示した。
【0173】
In Vivo薬物動力学検定(BrdU取り込み):
処理:
PD0332991:
造血幹細胞及び前駆細胞(HSPC)増殖実験に対し、マウスには、2日間、毎日PD0332991 150mg/kgの経口強制給餌を行い、殺処分24時間前に6時間毎に1mg BrdUの腹腔内注射(i.p.)を行った。
2BrIC:
HSPC増殖実験に対し、マウスには、2回の2-ブロモ-12,13-ジヒドロ-5H-インドロ[2,3-a]ピロロ[3,4-c]カルバゾール-5,7(6H)-ジオン (2BrIC)300mg/kg経口強制給餌又は媒体対照で処理を行った。2BrICは、経口強制給餌のために、Hot Rod formulation kit (Pharmatek, Inc., San Diego, California, USA)の処方#6を用いて可溶化した。2BrICをBrdU投与2時間前に投与し、BrdU1mgの腹腔内注射(i.p.)の時に再投与した。表示した時間のBrdU +/- 2BrIC処理後、マウスを殺処分し、免疫表現型質検査及びBrdU解析のために骨髄を採取した。
【0174】
フローサイトメトリーによるBrdU取り込みの解析:
骨髄(BM)をマウスの胎児から採取し、プールし、骨髄単核球細胞(BM-MNCs)を精製するために遠心した。細胞を5分間ACK緩衝液中でインキュベートし、赤血球を溶解させた。特に記載しない限り、すべての抗体は、BD Pharmingen (San Jose, California, USA)から入手した。精製したBM-MNCs細胞を、マウスリネージ混合物ビオチン結合抗体とインキュベートし、その後ストレプトアビジン-FITCとインキュベートした。その後、細胞をSca-1-PE-Cy7 及びc-kit-APC-アレクサ750抗体により染色した。細胞生存性は、LIVE/DEAD Aqua Dead Cell Stain Kit (Invitrogen Corporation, Carlsbad, California, USA)を用いて検定した。BrdU取り込み検定に対しては、細胞を固定し、透過性にし、製造者の手順に従い、APC BrdU Flowキットにより染色した。すべての実験において、PE-Cy7, FITC, APC-アレクサ750, 及び Aqua Dead細胞染色アイソタイプ対照を適宣含めた。フローサイトメトリー解析をa CyAn ADP (Dako, Glostrup, Denmark)を用いて行った。各試料に対し、最低500,000細胞を解析し、データをFlowJo software (Tree Star, Ashland, Oregon, USA)を用いて解析した。
【0175】
骨髄抑制検定:毎週の全血球計数:
処理:
PD0332991:
カルボプラチン実験において、マウスを、単回のPD0332991 150mg/kgの経口強制給餌又は媒体対照で処理し、その後カルボプラチン100mg/kgの腹腔内注射(i.p.)を行った。ドキソルビシン実験において、マウスを、第0日目に、ドキソルビシン10mg/kgの腹腔内注射(i.p.)の1時間前に、単回のPD0332991 150mg/kgの経口強制給餌又は媒体対照で処理し、その後7日目に繰り返した。
2BrIC:
マウスを単回のカルボプラチン100mg/kgの腹腔内注射(i.p.)により処理し、2回の2BrIC 150mg/kgの経口強制給餌又は媒体対照処理を行った。マウスをカルボプラチン投与2時間前に2BrICで前処理し、その後カルボプラチン注射時に2回目の2BrIC再投与を行った。
【0176】
血液採取及び血小板定量:
ベースライン全血球計数(CBC)分析は、薬剤投与前に一部のマウスについて行った。薬剤投与後(化学療法薬剤+/−表示したCDK4/6阻害剤又は対照)、マウスを毎週CBC分析による骨髄抑制の存在について観察した。CBC分析をK2E(K2-EDTA)の入ったBD Microtainerチューブを用いて行い、尾静脈ニックにより40μLの血液を採取した。血液をHESKA CBC-Diff Veterinary Hematology Systemを用いて分析した。全血球計数(CBC)分析は、白血球、リンパ球、顆粒球、単球、ヘマトクリット、赤血球細胞、ヘモグロビン、血小板、及び他の通常の血液学的パラメーターの測定を含む。
【0177】
TOXILIGHT(TM)検定:
細胞毒性をToxilight(R) Bioassay kit (Lonza, Basel, Switzerland)を用いて検定したが、このキットは、アデニレートキナーゼの培地への放出を定量することにより細胞溶解を測る。簡単には、96穴プレートの細胞の各ウェルから20μLを吸引し、様々な濃度のPD0332991又はスタウロスポリン(以下「STAUR」とも表示する。)で処理した。100μLのTOXILIGHT(TM)試薬を加え、5分間インキュベートし、1秒/ウェルの速度で発光計で測定した。
【0178】
実施例1
PDの合成
【化3】

【0179】
反応機構1:PD合成
PDを、反応機構1(化3)に示すように合成した。反応機構1(化3)に示す反応は、化合物Dの化合物Eへの変換、及び化合物Fの化合物Gへの変換反応を除いて、一般的に以前に報告された経路に従う(VandelWel et al., J. Med Chem., 48, 2371-2387 (2005); and Toogood et al., J. Med. Chem., 48, 2388-2406 (2005))。
【0180】
化合物Dの化合物Eへの変換:
【化4】

化合物D(40g、169mmol)を無水THF(800mL)に窒素下で溶かし、及びこの溶液を氷槽で冷却し、ここにMeMgBrをゆっくり加え(エーテル中3M、160mL、480mmol)及び1時間攪拌した。水とEtOAcに分配する飽和NH4Cl水溶液を加えて反応を休止した。有機層を分離し、及び水層をEtOAcで抽出した。混合した有機層を塩水で洗浄し、MgSO4上で乾燥した。濃縮して中間産物をオイルとして得た(41.9g,98%)。
上記中間産物(40g、158mmol)を乾燥CHCl3(700mL)に溶かした。MnO2(96g、1.11mol)を加え、混合物を18時間攪拌しつつ加熱乾留し、再度のMnO2(34g、395mmol)を加え、4時間乾留を続けた。Celiteパッドを通して濾過し、固体をCHCl3で洗浄した。濾過物を濃縮し、黄色固体化合物E(35g、88%)、Mp:75.8〜76.6℃。
【0181】
化合物Fの化合物Gへの変換
【化5】

化合物F(5g、18.2mmol)を無水DMF(150mL)に溶かし、及びNBS(11.3g、63.6mmol)を加えた。反応混合物を3.5時間、室温で攪拌し、H2O(500mL)に注ぎ、沈殿物を濾過し、H2Oで洗浄した。固体をEtOHから再結晶化し、化合物Gを白色固体(5.42g、80.7%)として得た。mp:210.6〜211.3℃。
【0182】
PDの特徴付けデータ
LC-MS: 448.5 (ESI, M+H). 純度: 〜99%
1H NMR(300MHz, D2O): 9.00(s, 1H), 8.12 (dd, J = 9.3 Hz, 2.1Hz, 1H), 7.81(d, J = 2.4 Hz, 1H), 7.46(d, J = 9.6Hz, 1H), 5.80-5.74 (m, 1H), 3.57-3.48(m, 8H), 2.48(s, 3H), 2.37(s, 3H), 2.13-1.94(m, 6H), 1.73-1.71(m, 2H).
13C NMR (75MHz, D2O): 203.6, 159.0, 153.5, 153.3, 152.2, 139.9, 139.4, 139.2, 133.1, 129.0, 118.7, 113.8, 107.4, 51.8, 42.2, 40.0, 28.0, 25.2, 22.6, 10.8.
【0183】
実施例2
CDK4/6依存生細胞株における選択的G1期停止
幾つかのヒト細胞株を多くの低分子キナーゼ阻害剤に曝露した。そして、その細胞周期解析を、本明細書で既に記した方法で行った。
不死化ヒト二倍体繊維芽細胞(HS68)及びヒトメラノーマ細胞株(WM2664)を含め、Cdk4/6依存性細胞株は、強力な選択的Cdk4/6阻害剤であるPD0332991又はBrICに曝露後、強く、クリーンで、可逆的なG1期停止を示した(図2A〜2E)。さらにCDK1/2を標的とするより選択性の低いCDK阻害剤である化合物1〜6、フラボピリドール(図20A)、化合物7(即ちR547;図21A)、ロスコビチン(図22A)、ゲニステイン及び化合物8〜14(図24A〜24C)は、これらの種類の細胞に、気紛れに、G2/M遮断、S期内停止又は細胞死(亜G0)をもたらした。一方、RB−ヌルメラノーマ株A2058は、予期したように、CDK4/6阻害に対して感受性が無いが、より選択性の低いCDK阻害剤に曝露後、G2/M遮断又はS期内停止及び/又は細胞死(亜G0)を同様にもたらした。7株のRB欠失ヒト肺小細胞ガン細胞株の増殖もまた、CDK4/6阻害剤に対して抵抗性であった。
これらのデータは、構造的に明確な強い選択的Cdk4/6阻害剤は、感受性細胞株(CDK4/6依存生細胞株)において、純粋な(即ち、"クリーンな")G1期停止をもたらすことを示し、他方、より汎用の非特異的CDK阻害剤の細胞周期効果は、予想不可能であり、かつ細胞毒性と関係することを示している。
【0184】
実施例3
化学療法薬剤で処理した細胞におけるDNA損傷からの防護
カボプラチン(CARBO)、エトポシド(ETOP)及びドキソルビシン(DOX)のようなDNA損傷性化合物に曝露した細胞中のDNA損傷を減少させる選択的CDK4/6阻害剤の能力を、上記方法項で記載したように細胞をベースとした検定で評価した。
カルボプラチン、エトポシド及びドキソルビシンは、CDK4/6依存性及び非依存生細胞株におけるγ-H2AXフォーカス形成測定で示されるように、広範囲のDNA損傷を引き起こす(図3A〜3C、4及び5)。カルボプラチン、エトポシド又はドキソルビシン処理前のPD0332991(図中「PD」で示す。)(図6A〜6C、7及び8)又は2BrIC(図3A〜3C、4及び5)の処理により、γ-H2AX(%)が低下したことは、PD0332991又は2BrICにより誘導されたG1期停止が、化学療法薬剤誘発性DNA損傷から細胞を防護したことを示唆する。
【0185】
実施例4
化学療法薬剤で処理した細胞における細胞毒性からの防護
選択的CDK4/6阻害剤が、化学療法薬剤誘発性細胞毒性から細胞を防護する防護能を、本明細書で既に記載した方法で、細胞をベースとした増殖検定により評価した。
CDK4/6依存性及び非依存性細胞株を、カルボプラチン、エトポシド又はドキソルビシン添加前に、PD0332991又は BrICで前処理した。
PD0332991及び2BrICの両者は、CDK4/6依存性細胞の顕著な防護を示したが、CDK4/6非依存生細胞に対しては否定的であった(図9〜14及び25A〜25C)。これに対し、フラボピリドール(図20B〜20D)、化合物7(即ち、R547;図21B〜21D)、ロスコビチン(図22B〜22D)、ゲニステイン(図23A〜23C)及び化合物8,9及び11(図24D〜24I)のような、さらにCDK1/2を標的とする、かつCDK4/6依存性及び非依存性細胞にクリーンなG1期停止を誘導しない、より選択性のないCDK阻害剤は、化学療法薬剤誘発性細胞毒性から細胞を防護しなかった。より選択性のない阻害剤が防護できないことは、G1期以外の細胞周期の細胞期における停止(例えば、G2/M)は、遺伝子毒性への曝露から防護しないことを示唆する。
【0186】
幾つかのCDK4/6感受性細胞株において、CDK4/6の強い阻害剤であること、及びG1停止をもたらすことだけでは、細胞毒性化合物から最適の防護をするための十分条件ではないことに注意することが重要である。幾つかの態様において、他のCDK又は他の非CDKキナーゼに対してではなく、これらのキナーゼに対して強力であるばかりでなく、選択性の高い、CDK4/6阻害剤の使用が、本明細書に開示されている。例えば、図26Aにおいて、強力であるが、非選択的CDK4/6阻害剤であるスタウロスポリン(STAUR)は、ある種のCDK4/6依存性細胞(HS68)において実質的に純粋なG1期停止を誘導する。しかしこの停止は、化学療法薬剤細胞毒性から防護しない(図26B)。図25D〜25Fにおいて、スタウロスポリン(STAUR)処理は、WM2664(CDK4/6-依存性)及びA2058(CDK4/6-非依存性)細胞株の両者において細胞毒性を高める。同様に、スタウロスポリン(STAUR)は、H2AXフォーカスで測定したように、cdk4/6依存性又はcdk4/6非依存性細胞をDNA損傷から防護しない(図27A〜27C)。従って、全体として、これらの結果により、この化合物のオフターゲット、CDK4/6非依存性効果、が幾つかの状況で細胞死を誘導することが示唆され、化学防護に関して、スタウロスポリンのような多能キナーゼ阻害剤は、気紛れであり、及び細胞種依存的であることが示唆され、これらの薬剤の主要な効果が直接的又は間接的なG1期停止誘導に対してである幾つかの細胞種ではin vitro防護を示し(Chen et al., J. Natl. Cancer Inst., 92, 1999-2008 (2000))、細胞生存性に対してオフターゲット効果が有害な細胞種において、細胞死又は、他の好ましくない結果をもたらす。本発明の幾つかの態様において、多重検定スクリーニング(例えば、細胞周期停止、H2AX防護及び/又は7日目の細胞増殖)を行い、有効なin vivo化学防護剤を決定することができる。このようなスクリーニングにおいて、スタウロスポリンは、そのオフターゲット効果及び矛盾した効果により、候補から落ちる。
【0187】
さらに、これらのオフターゲット効果は、in vivoで用いられた時、毒性及び化学療法薬剤への感受性の上昇もたらし、及びこれらの毒性は、多能キナーゼ阻害剤を臨床的化学防護に用いることを不可能にする。増殖細胞のある分画(即ち、初期造血幹細胞及び前駆細胞(HSPC))に対する選択的CDK4/6阻害剤の優れた特異性は、そのような化合物は、用量規定毒性を起こすことなく、in vivoでの臨床的化学療法薬剤防護に使うことができるという、期待してなかった発見を、本発明の幾つかの態様と一致して開示した。
【0188】
実施例5
in vivo 化学防護
選択的CDK4/6阻害剤を用いたin vivo 医薬的休止(PQ)提供能を検定した。経口的に生物利用可能なPD0332991を、経口強制給餌により、成体野生型C57Bl/6マウスに投与した。造血幹細胞(HSC; Lin-Kit+Sca1+CD48-CD150+)の増殖を、Ki67発現及び24時間にわたるBrdUの取り込みにより測定したが、予想より遅かった(図16A〜16D)(Passegue et al., 2005; Wilson et al., 2008; and Kiel et al., 2007)。48時間のPD0332991処理は、Ki67発現への効果の方が多かったが、Ki67の発現及びBrdU(図16B)に対して二重にポジティブな造血幹細胞(HSC)の割合を顕著に減らした。より明確な増殖抑制は、より早く増殖する多分化能前駆細胞区分(MPP; Lin-Kit+Sca1+CD48-CD150-)において目立った(図16B〜16C)。オリゴポテント前駆細胞(Lin-Kit+Sca1-)は中程度の増殖阻害を示し(図16C)、最も強い効果は、骨髄共通前駆細胞(CMP)及びリンパ球共通前駆細胞(CLP)において見られ、それに対してより弱い効果は、より分化した顆粒球単球前駆細胞(GMP)及び赤芽球系前駆細胞(MEP)に見られた(図16B〜16C)。これらの初期造血幹細胞及び前駆細胞(HSPC)細胞への効果と対照的に、より完全に分化したLin-Kit-Sca1- 及び Lin+細胞において、これらの分画は不均一であり、部分集団への効果ははっきりしないかも知れないが、増殖の変化は見られなかった。
【0189】
2BrICを溶解し、経口強制給餌により、BrdU注射2時間前に与え、更なる投与をBrdU注射の際に与えた。2BrICは、BrdUのLin-Kit+Sca1+細胞への取り込みを、処方物単独処理のマウスと比べ阻害した(図15A〜15B)。
選択的CDK4/6阻害剤が化学療法薬剤に曝露されたマウスの血球数を防護することができるかどうか測定するために、PD0332991処理したマウスの血液細胞数を研究した。PD0332991で前処理し、その後ドキソルビシン(図18)又はカルボプラチン(図19)を処理したマウスにおいて、全4リネージ(血小板、ヘモグロビン、リンパ球、及び顆粒球)は、防護された。
PD0332991の投与に対して、赤血球、血小板、及び骨髄性(単球+顆粒球)リネージの減少が観察され、及び連続的にPD0332991の投与を受けていた担腫瘍マウス(Ramsey et al., Cancer Res., 67, 4732-4741 (2007); and Fry et al., Mol. Cancer Ther., 3, 1427-1438 (2004))、及び悪性腫瘍を持つヒト患者(O'Dwyer et al., "A Phase I does escalation trial of a daily oral CDK4/6 Inhibitor PD 0332991" in American Society of Clinical Oncology (ASCO, Chicago, Illinois, 2007)参照)において、PD0332991の停止に際してリネージの増加が観察された。注目された減少は、化学療法において投与された細胞毒性化合物の不都合な効果を増強させたと推定される。しかしながら、本明細書で示したように、意外にも、造血細胞は、不都合な効果から防護された。
【0190】
本発明の様々な詳細は本発明の範囲から離れることなく変更できることを理解すべきである。さらに、上記の記載は、説明のみの目的のためであり、制限付けを目的としたものではない。
【技術分野】
【0001】
本出願は、2008年10月1日出願の米国特許出願61/101,824に基づく優先権を主張し、本明細書にはその全体が取り込まれている。
本発明は、米国国立保健研究所から助成金番号R01AG024379-01及びK08CA90679の援助を国立加齢研究所及び国立癌研究所を通して受けた。従って、合衆国連邦政府は本発明の一定の権利を有する。
この発明は、DNA損傷性化合物のような細胞毒性化合物から健康な細胞を防護する方法に関し、より詳細には、細胞毒性化合物に曝露した、これから曝露する、又は曝露する危険性のある患者に投与されたサイクリン依存性キナーゼ4(CDK4)及び/又はサイクリン依存性キナーゼ6(CDK6)阻害剤の防護作用に関する。
【背景技術】
【0002】
化学療法において、ガン細胞及び腫瘍を絶つために、シクロホスファミド、ドキソルビシン、ダウノルビシン、ビンブラスチン、ビンクリスチン、ブレオマイシン、エトポシド、トポテカン、イリノテカン、タキソテール、タキソール、5−フルオロウラシル、メトレキサート、ゲムシタビン、シスプラチン、カルボプラチン、又はクロランフェニコールのような、しかしこれらに制限されない、細胞毒性(例えば、DNA損傷性)薬剤が使用されている。化学療法化合物は非特異的であり、特に多量に投与した場合、正常で活発に分裂する細胞に対して毒性がある傾向がある。このことは、化学療法を受ける患者に様々な副作用をもたらしている。
【0003】
骨髄における血液生産の重篤な減少である骨髄抑制はこのような副作用の1つである。これは、骨髄抑制(貧血症、好中球減少症、顆粒球減少症、及び血小板減少症)及びリンパ球減少症の両者により特徴付けられる。好中球減少症は、循環好中球数の選択的減少及びバクテリア感染に対する感受性の増加により特徴付けられる。赤血球(erythrocyteとも表現)数、ヘモグロビン量又は赤血球濃縮液の体積(ヘマクリット測定により特徴付けられる)の減少である貧血症は、米国において、化学療法を受けるガン患者の約67%に影響を及ぼしている(非特許文献1)。化学療法薬剤の細胞毒性は、投与できる量を制限し、治療サイクルに影響を及ぼし、ガン患者の生活クオリティを深刻に危うくする。血小板減少症は、血小板数を減少させ、より出血し易くさせる。リンパ球減少症は、循環リンパ球数(T−及びB−細胞とも呼ばれる)を減少させることにより特徴付けられる化学療法の一般的な副作用である。リンパ球減少症は、多くの種類の感染を受けやすくする。
【0004】
ある種の化学療法化合物の副作用の幾つかを減らすために、低分子が用いられてきた。例えば、ロイコボリンは、骨髄細胞及び胃腸粘膜細胞へのメトレキサートの影響を緩和するために用いられてきた。アミホスチンはアルキル化剤又は白金含有化学療法薬剤を受ける患者の、好中球減少症関連発熱及び粘膜炎の発生を減らすために用いられてきた。また、デクスラゾキサンは、アントラサイクリン抗ガン化合物からの心臓防護を提供するために用いられてきた。不幸なことに、デクスラゾキサン及びアミノホスチンのような、多くの化学防護剤は、同時に投与する化学療法の効果を減じることがあるという懸念がある。
【0005】
特に貧血症及び好中球減少症に関連する化学療法に関して、更なる化学防護治療は、成長ホルモンの使用を含む。造血成長因子は、組み換えタンパク質として、市場で入手可能である。これらのタンパク質としては、好中球減少症の治療のために、顆粒球コロニー刺激因子(G-CSF)及び顆粒球−マクロファージコロニー刺激因子(GM-CSF)及びこれ等の誘導体、及び貧血の治療のために、赤血球生成促進因子(EPO, エリスロポエチン)及びこの誘導体が含まれる。しかしながら、これらの組み換えタンパク質は高価である。さらに、EPOはガン患者においてかなり毒性があり、幾つかの大規模な無作為治験において、血栓症、再発及び死の増加をもたらす。G-CSF及び GM-CSFは、白血病及び脊髄異形成のような続発性骨髄異常の遅延性リスク(>2年治療後)を増加させることが可能である。従って、これらの使用は限定され、かつ必要な全ての患者に入手可能ではない。さらに、成長因子は幾つかの種類の血液細胞リネージ(造血系細胞へ分化する細胞)の回復を早めることができるが、血小板、マクロファージ、T−細胞又はB−細胞の抑制を処置する治療は存在しない。
【0006】
非選択的キナーゼ阻害剤スタウロスポリンは、幾つかの培養細胞種において、DNA損傷作用物からの防護を行うことが示された(非特許文献2、3)。スタウロスポリンは天然産物であり、及び大部分の哺乳類キナーゼに高親和性で結合する非選択的キナーゼ阻害剤である(非特許文献4)。スタウロスポリン処理は、細胞種類、薬剤濃度、及び処理時間に応じて、アポトーシス、細胞周期停止及び細胞周期チェックポイント失効を含む一連の細胞応答を誘導することができる。例えば、スタウロスポリンは、G2チェックポイント応答の失効を含む幾つかの主張されたメカニズムにより、電離放射線及び化学療法のようなDNA損傷作用物に対する細胞の感受性を高めることが示された(非特許文献5〜15)。幾つかの培養細胞腫においてスタウロスポリン処理がDNA損傷作用物からの防護を提供するメカニズムははっきりしないが、幾つかの可能なメカニズムとして、タンパク質キナーゼCの阻害、又はCDK4タンパク質レベルの減少が示唆されている(非特許文献16,17)。スタウロスポリンは、造血前駆細胞に効果が無いことが示され、DNA損傷作用物曝露後充分後のスタウロスポリン使用は、防護を示さなかった。スタウロスポリンの非選択的キナーゼ阻害は、哺乳類へのin vivo投与後、細胞周期への効果に無関係の顕著な毒性(例えば、高血糖症)をもたらすことが示され、これらの毒性は、スタウロスポリンの臨床的使用を不可能にした。
【先行技術文献】
【非特許文献】
【0007】
【非特許文献1】BioWorld Today, page 4, July 23, 2002
【非特許文献2】Chen et al., J. Natl. Cancer Inst., 92, 1999-2008 (2000)
【非特許文献3】Ojeda et al., Int. J. Radiat. Biol., 61, 663-667 (1992)
【非特許文献4】Karaman et al., Nat. Biotechnol., 26, 127-132 (2008)
【非特許文献5】Bernhard et al., Int. J. Radiat. Biol., 69, 575-584 (1996)
【非特許文献6】Teyssier et al., Bull. Cancer, 86, 345-357 (1999)
【非特許文献7】Hallahan et al., Radiat. Res., 129, 345-350 (1992)
【非特許文献8】Zhang et al., J. Neurooncol., 15, 1-7 (1993)
【非特許文献9】Guo et al., Int. J. Radiat. Biol., 82, 97-109 (2006)
【非特許文献10】Bucher and Britten, Br. J. Cancer, 98, 523-528 (2008)
【非特許文献11】Laredo et al., Blood, 84, 229-237 (1994)
【非特許文献12】Luo et al., Neoplasia, 3, 411-419 (2001)
【非特許文献13】Wang et al., Yao Xue Xue Bao, 31, 411-415 (1996)
【非特許文献14】Chen et al., J. Natl. Cancer Inst., 92, 1999-2008 (2000)
【非特許文献15】Hirose et al., Cancer Res., 61, 5843-5849 (2001))
【非特許文献16】Chen et al., J. Natl. Cancer Inst., 92, 1999-2008 (2000)
【非特許文献17】Ojeda et al., Int. J. Radiat. Biol., 61, 663-667 (1992)
【発明の概要】
【発明が解決しようとする課題】
【0008】
上記載の方法の欠陥のため、化学療法を受けつつある、受ける予定がある、又は受けた患者を防護するための実際的方法が継続的に必要とされている。特に骨髄抑制及びリンパ球減少症から、化学療法の患者を防護することが特別に必要とされている。さらに、化学防護方法には、ガン患者の化学療法の効果を減少させないことが求められる。
本発明の目的は、患者に有効量の選択的CDK4/6阻害化合物を投与することにより、患者の健康な細胞をDNA損傷性化合物の影響から防護する方法を提供することである。
上記の目的は、本発明により全体的に又は部分的に達せられる。また、明細書及び図面が以下に最善に開示するに従って、この他の目的も明らかとなるであろう。
【課題を解決するための手段】
【0009】
本発明は、細胞毒性化合物に曝露した、これから曝露する、又は曝露する虞のある患者の健康な細胞に対する細胞毒性化合物の影響を低下させる又は防止する方法であって、この患者に有効量の阻害化合物又はその医薬的に許容可能な塩を投与することから成り、この健康な細胞が造血幹細胞又は造血前駆細胞であり、この阻害化合物がサイクリン依存性キナーゼ4(CDK4)及び/又はサイクリン依存性キナーゼ6(CDK6)を選択的に阻害することを特徴とする方法である。
幾つかの態様において、この阻害化合物はCDK4-及びCDK6の両者を選択的に阻害する。幾つかの態様において、この阻害化合物は、非天然化合物である。
【0010】
幾つかの態様において、この阻害化合物は、実質的にオフターゲット効果(標的非依存的効果)なしである。幾つかの態様において、このオフターゲット効果は、長期の毒性、抗酸化効果、発情効果、チロシンキナーゼ阻害、サイクリン依存性キナーゼ4/6(CDK4/6)以外のサイクリン依存性キナーゼ類(CDKs)阻害、及びCDK4/6非依存性細胞における細胞周期停止からなる群の1又はそれ以上の効果である。
幾つかの態様において、この阻害剤化合物は、CDK4/6依存性細胞において、G1期停止を選択的に誘導する。幾つかの態様において、この阻害化合物は、CDK4/6-依存性細胞において、実質的に純粋なG1期停止を誘動する。
【0011】
幾つかの態様において、この阻害化合物は、ピリド[2,3-d]ピリミジン、トリアミノピリミジン、アリール[a]ピロロ[3,4-c]カルバゾール、窒素含有ヘテロアリール置換尿素、5-ピリミジニル-2-アミノチアゾール、ベンゾチアジアジン、及びアクリジンチオンから成る群から選択される。
幾つかの態様において、このピリド[2,3-d]ピリミジンは、ピリド[2,3-d]ピリミジン-7-オン又は 2-アミノ-6-シアノ-ピリド[2,3-d]ピリミジン-4-オンである。幾つかの態様において、このピリド[2,3-d]ピリミジン-7-オンは、2-(2'-ピリジル)アミノピリド[2,3-d]ピリミジン-7-オンである。幾つかの態様において、このピリド[2,3-d]ピリミジン-7-オンは、6-アセチル-8-シクロペンチル-5-メチル-2-(5-ピペラジン-1-イル-ピリジン-2-イルアミノ)-8H-ピリド-[2,3-d]ピリミジン-7-オンである。
幾つかの態様において、アリール[a]ピロロ[3,4-c]カルバゾールは、ナフチル[a]ピロロ[3,4-c]カルバゾール, インドロ[a]ピロロ[3,4-c]カルバゾール、キノリニル[a]ピロロ[3,4-c]カルバゾール、及びイソキノリニル[a]ピロロ[3,4-c]カルバゾールからなる群から選択される。幾つかの態様において、このアリール[a]ピロロ[3,4-c]カルバゾールは、2-ブロモ-12,13-ジヒドロ-5H-インドロ[2,3-a]ピロロ[3,4]-カルバゾール-5,6-ジオンである。
【0012】
幾つかの態様において、この患者は哺乳類である。幾つかの態様において、この阻害化合物を患者に対して、経口投与、局所投与、鼻腔内投与、吸入、及び静脈内投与からなる群の1投与法により行う。
幾つかの態様において、この阻害化合物を、細胞毒性化合物の曝露前、曝露中、曝露後、又はこれらのすべての組合せの際、患者に投与する。幾つかの態様において、細胞毒性化合物曝露の前、約24時間以内に、この阻害化合物を患者に投与する。幾つかの態様において、この阻害化合物を、細胞毒性化合物曝露後約24時間又はそれ以後に患者に投与される。
幾つかの態様において、細胞毒性化合物は、DNAを損傷する化合物である。
幾つかの態様において、健康な細胞は、長期造血幹細胞(LT-HSCs)、短期造血幹細胞(ST-HSCs)、多分化能前駆細胞(MPPs)、骨髄共通前駆細胞(CMPs)、リンパ球共通前駆細胞(CLPs)、顆粒球単球前駆細胞(GMPs)及び赤芽球系前駆細胞(MEPs)からなる群から選択される。幾つかの態様において、この阻害化合物の投与により、造血幹細胞及び/又は造血前駆細胞が、一時的に薬理学的に休止する。
【0013】
幾つかの態様において、患者は、疾患を治療するために細胞毒性化合物を用いた医学的治療を受けた、受けている又はこれから受ける。幾つかの態様において、阻害化合物の投与は、疾患にかかった細胞の増殖に効果を持たない。
幾つかの態様において、この疾患は、ガンである。幾つかの態様において、このガンは、サイクリン依存性キナーゼ1(CDK1)の活性増加、サイクリン依存性キナーゼ2(CDK2)の活性増加、網膜芽腫腫瘍抑制タンパク質(RB)の欠失又は不在、高レベルのMYC発現、サイクリンEの増加、及びサイクリンAの増加からなる群の1以上の特徴を持つ。
幾つかの態様において、阻害化合物の投与により、阻害化合物の投与なしの場合に用いられる投与量より多量の細胞毒性化合物を用いて、疾患を治療することが可能になる。
幾つかの態様において、この患者は、誤って細胞毒性化合物に曝露される、又は過剰投与量の細胞毒性化合物に曝露される。
幾つかの態様において、この方法には、長期の血液学的毒性がない。幾つかの態様において、阻害化合物の投与は、阻害化合物の投与無しで細胞毒性化合物に曝露した場合に予想される結果と比べて、貧血を減少させ、リンパ球減少症を減らし、血小板減少症を減らし、又は好中球減少症を減らす結果をもたらす。
【0014】
幾つかの態様において、本発明は、健康な細胞における細胞毒性化合物の効果を防ぐために使用する化合物のスクリーニング方法であって、
(i)試験化合物をCDK4/6依存性細胞集団に一定時間接触させる段階、
(ii)前記細胞集団の細胞周期を解析する段階、及び
(iii)前記細胞集団において選択的にG1期停止を誘導する試験化合物を選択する段階
から成る方法である。
幾つかの態様において、このCDK4/6依存性細胞集団は、不死化ヒト二倍体繊維芽細胞又はINK4a/ARF欠失メラノーマ細胞から成る。
幾つかの態様において、上記細胞周期の解析は、フローサイトメトリー、蛍光測定法、細胞画像化及び蛍光分光法から成る群から選択される少なくとも1の技術を用いて行われる。幾つかの態様において、上記細胞周期の解析は、前記細胞集団を、5−ブロモ−2−デオキシウリジン(BrdU)及びヨウ化プロピジウム(PI)から成る群から選択される少なくとも1の標識試薬を用いて標識することから成る。
【0015】
幾つかの態様において、上記スクリーニング方法は、更に、
(iV)CDK4/6依存性細胞のG1期停止を誘導する前記試験化合物を、第2の細胞集団に一定時間接触させる段階、但し、この第2の細胞集団はCDK4/6非依存性細胞を含む、
(V)前記第2の細胞集団の細胞周期を解析する段階、及び
(Vi)前記第2の細胞集団においてG1期停止を選択的に誘導しない試験化合物を選択する段階、を含む。
幾つかの態様において、第2の細胞集団はガン細胞株である。幾つかの態様において、第2の細胞集団は、網膜芽腫腫瘍抑制タンパク質(RB)ヌルである。
幾つかの態様において、上記スクリーニング方法は、更に、
(Vii)前記試験化合物が、細胞毒性化合物と接触したex vivo細胞集団において、DNA損傷を減少させる、細胞生存を維持させる、又はその両者を行うことができるかどうかを検定することによって、該試験化合物の保護能の確認を行う段階、を含む。
幾つかの態様において、上記細胞集団におけるDNA損傷は、γ-H2AX検定を行うことで検定される。幾つかの態様において、細胞生存は、細胞増殖検定を行うことで検定される。
幾つかの態様において、細胞毒性化合物はDNAを損傷する化合物である。幾つかの態様において、このDNAを損傷する化合物は、ドキソルビシン、エトポシド及びカルボプラチンから成る群から選択される。
【図面の簡単な説明】
【0016】
【図1】血液新生、造血幹細胞(HSC)の階層的増殖、及び増殖に際し分化が進む前駆細胞の概略図である。
【図2A】0nM(対照)、15nM、30nM、89nM又は270nM(上から下)の6-アセチル-8-シクロペンチル-5-メチル-2-(5-ピペラジン-1-イル-ピリジン-2-イルアミノ)-8H-ピリド-[2,3-d]-ピリミジン-7-オン (PD 0332991)で24時間処理したサイクリン依存性キナーゼ4/6(CDK4/6)依存性細胞(INK4a/ARF欠失ヒトメラノーマ細胞;WM2664)の細胞周期解析の一組の代表的ヒストグラムである。データを、Mod-Fit(R) software (Varity Software House, Topsham, Maine, USA)を用いてフィットさせた。
【0017】
【図2B】0nM(対照)、122nM、370nM、1.1μM又は3.3μM(上部から下部へ)の2-ブロモ-12,13-ジヒドロ-5H-インドロ[2,3-a]ピロロ[3,4]カルバゾール-5,6-ジオン (2BrIC)で24時間処理したサイクリン依存性キナーゼ4/6(CDK4/6)依存性細胞(WM2664)の細胞周期解析の一組の代表的ヒストグラムである。データを、Mod-Fit(R) softwareを用いてフィットさせた。
【0018】
【図2C】0nM(対照)、15nM、30nM、89nM又は270nMのPD 0332991又は0nM(対照)、122nM、370nM、1.1μM又は3.3μMの2BrICでサイクリン依存性キナーゼ4/6(CDK4/6)依存性細胞(WM2664)を24時間処理後、G1期における細胞の割合(%)を示すグラフである。
【0019】
【図2D】0nM(対照)、15nM、30nM、89nM又は270nMのPD 0332991又は0nM(対照)、122nM、370nM、1.1μM又は3.3μMの2BrICでサイクリン依存性キナーゼ4/6(CDK4/6)依存性細胞(WM2664)を24時間処理後、G2/M期における細胞の割合(%)を示すグラフである。
【0020】
【図2E】0nM(対照)、15nM、30nM、89nM又は270nMのPD 0332991又は0nM(対照)、122nM、370nM、1.1μM又は3.3μMの2BrICでサイクリン依存性キナーゼ4/6(CDK4/6)依存性細胞(WM2664)を24時間処理後、S期における細胞の割合(%)を示すグラフである。
【0021】
【図3A】サイクリン依存性キナーゼ4/6(CDK4/6)依存性細胞をカルボプラチン誘発性DNA損傷から防護する2-ブロモ-12,13-ジヒドロ-5H-インドロ[2,3-a]ピロロ[3,4]カルバゾール-5,6-ジオン (2BrIC)の防護能を示す(棒グラフ)。INK4a/ARF欠損ヒトメラノーマ細胞(WM2664)を16時間2BrICで前処理し、その後8時間カルボプラチン処理を行い、DNA損傷をγ-H2AX検定を用いて検定した。WM2664細胞について、γ-H2AXポジティブ細胞の割合(%)を、2BrIC前処理なしのカルボプラチン(CARBO)処理、及び0.122, 0.37, 1.1又は3.3μMの2BrICによる前処理後カルボプラチン(CARBO)処理について示す。
【0022】
【図3B】サイクリン依存性キナーゼ4/6(CDK4/6)依存性細胞をエトポシド誘発性DNA損傷から防護する2-ブロモ-12,13-ジヒドロ-5H-インドロ[2,3-a]ピロロ[3,4]カルバゾール-5,6-ジオン(2BrIC)の防護能を示す(棒グラフ)。INK4a/ARF欠損ヒトメラノーマ細胞(WM2664)を16時間2BrICで前処理し、その後8時間エトポシド処理を行い、DNA損傷をγ-H2AX検定を用いて検定した。WM2664細胞について、γ-H2AXポジティブ細胞の割合(%)を、2BrIC前処理なしのエトポシド(ETOP)処理、及び0.122, 0.37, 1.1又は3.3μMの2BrICによる前処理後エトポシド(ETOP)処理について示す。
【0023】
【図3C】サイクリン依存性キナーゼ4/6(CDK4/6)依存性細胞をドキソルビシン誘発性DNA損傷から防護する2BrICの防護能を示す(棒グラフ)。INK4a/ARF欠損ヒトメラノーマ細胞(WM2664)を16時間2BrICで前処理し、その後8時間ドキソルビシン処理を行い、DNA損傷をγ-H2AX検定を用いて検定した。WM2664細胞について、γ-H2AXポジティブ細胞の割合(%)を、2BrIC前処理なしのドキソルビシン(DOX)処理、及び0.122, 0.37, 1.1又は3.3μMの2BrICによる前処理後ドキソルビシン(DOX)処理について示す。
【0024】
【図4】γ-H2AXレベルを検定することにより、サイクリン依存性キナーゼ4/6(CDK4/6)依存性細胞を、ドキソルビシン−、カルボプラチン−又はエトポシド−誘発性DNA損傷から防護する2BrICの防護能を示す。非処理不死化ヒト二倍体繊維芽細胞(HS68細胞)について、γ-H2AXポジティブ細胞の割合(%)を、122nM、370nM、1.1又は3.3μMの2BrICで16時間処理したもの、2BrICの前処理なしでカルボプラチン(CARBO)、エトポシド(ETOP)又はドキソルビシン(DOX)の何れかで8時間処理したもの、122nM、370nM、1.1又は3.3μMの2BrICで16時間前処理した後、CARBO、ETOP又はDOXの何れかで8時間を処理したものを示す。
【0025】
【図5】γ-H2AXレベルを検定することにより、サイクリン依存性キナーゼ4/6(CDK4/6)非依存性細胞(ヒトRB-ヌルメラノーマ細胞A2058)を、ドキソルビシン−、カルボプラチン−又はエトポシド−誘発性DNA損傷から2BrICが防護できないことを示す。A2058細胞について、γ-H2AXポジティブ細胞の割合(%)を、122nM、370nM、1.1又は3.3μMの2BrICで16時間処理したもの、2BrICの前処理なしでカルボプラチン(CARBO)、エトポシド(ETOP)又はドキソルビシン(DOX)の何れかで8時間処理したもの、122nM、370nM、1.1又は3.3μMの2BrICで16時間前処理した後、CARBO、ETOP又はDOX何れかで8時間処理したものを示す。
【0026】
【図6A】サイクリン依存性キナーゼ4/6(CDK4/6)依存性細胞をカルボプラチン誘発DNA損傷から防護するPD 0332991(「PD」と表示する。)の防護能を示す(棒グラフ)。INK4a/ARF欠損ヒトメラノーマ細胞(WM2664)を16時間PD0332991で前処理し、その後8時間カルボプラチン(CARBO)処理を行い、DNA損傷をγ-H2AX検定を用いて検定した。WM2664細胞について、γ-H2AXポジティブ細胞の割合(%)を、PDの前処理なしでカルボプラチン処理したもの、15nM、30nM、89nM又は270nMのPDにより前処理した後カルボプラチン(CARBO)処理したものを示す。
【0027】
【図6B】サイクリン依存性キナーゼ4/6(CDK4/6)依存性細胞をエトポシド誘発DNA損傷から防護するPD 0332991(「PD」と表示する。)の防護能を示す(棒グラフ)。INK4a/ARF欠損ヒトメラノーマ細胞(WM2664)を16時間PD0332991で前処理し、その後8時間エトポシド(ETOP)処理を行い、DNA損傷をγ-H2AX検定を用いて検定した。WM2664細胞について、γ-H2AXポジティブ細胞の割合(%)を、PDの前処理なしでカルボプラチン処理したもの、15nM、30nM、89nM又は270nMのPDにより前処理した後エトポシド(ETOP)処理したものを示す。
【0028】
【図6C】サイクリン依存性キナーゼ4/6(CDK4/6)依存性細胞をドキソルビシン誘発DNA損傷から防護するPD 0332991(「PD」と表示する。)の防護能を示す(棒グラフ)。INK4a/ARF欠損ヒトメラノーマ細胞(WM2664)を16時間PD0332991で前処理し、その後8時間ドキソルビシン(DOX)処理を行い、DNA損傷をγ-H2AX検定を用いて検定した。WM2664細胞について、γ-H2AXポジティブ細胞の割合(%)を、PDの前処理なしでカルボプラチン処理したもの、15nM、30nM、89nM又は270nMのPDにより前処理した後ドキソルビシン(DOX)処理したものを示す。
【0029】
【図7】γ-H2AXレベルを検定することにより、サイクリン依存性キナーゼ4/6(CDK4/6)依存性細胞を、ドキソルビシン−、カルボプラチン−又はエトポシド−誘発性DNA損傷から防護するPD 0332991(「PD」と表示する。)の防護能を示す。非処理不死化ヒト二倍体繊維芽細胞(HS68細胞)について、γ-H2AXポジティブ細胞の割合(%)を、122nM、370nM、1.1又は3.3μMの2BrICで16時間処理したもの、PDの前処理なしでカルボプラチン(CARBO)、エトポシド(ETOP)又はドキソルビシン(DOX)の何れかで8時間処理したもの、122nM、370nM、1.1又は3.3μMのPDで16時間前処理した後、CARBO、ETOP又はDOXの何れかで8時間を処理したものを示す。
【0030】
【図8】γ-H2AXレベルを検定することにより、サイクリン依存性キナーゼ4/6(CDK4/6)非依存性細胞(ヒトRB-ヌルメラノーマ細胞A2058)を、ドキソルビシン−、カルボプラチン−又はエトポシド−誘発性DNA損傷からPD 0332991(「PD」と表示する。)が防護できないことを示す。A2058細胞について、γ-H2AXポジティブ細胞の割合(%)を、122nM、370nM、1.1又は3.3μMの2BrICで16時間処理したもの、PDの前処理なしでカルボプラチン(CARBO)、エトポシド(ETOP)又はドキソルビシン(DOX)の何れかで8時間処理したもの、122nM、370nM、1.1又は3.3μMのPDで16時間前処理した後、CARBO、ETOP又はDOX何れかで8時間処理したものを示す。
【0031】
【図9】WST-1検定を用いて細胞生存性を検定することにより、ドキソルビシン誘発性細胞毒性からINK4a/ARF欠損ヒトメラノーマ細胞(WM2664)を防護する2-ブロモ-12,13-ジヒドロ-5H-インドロ[2,3-a]ピロロ[3,4]カルバゾール-5,6-ジオン(2BrIC)の防護能を示す(棒グラフ)。相対的細胞数を、450nmの吸光度により測定した。2BrIC単独(0.0μM, 0.120μM, 0.370μM, 1.1μM又は3.3μM)(縞模様棒);2BrIC(0.0μM, 0.120μM, 0.370μM, 1.1μM又は3.3μM)及びドキソルビシン(DOX)(黒塗り棒);又はDOX単独(白棒)の処理細胞に対する結果を示す。
【0032】
【図10】WST-1検定を用いて細胞生存性を検定することにより、ドキソルビシン誘発性細胞毒性からINK4a/ARF欠損ヒトメラノーマ細胞(WM2664)を防護する6-アセチル-8-シクロペンチル-5-メチル-2-(5-ピペラジン-1-イル-ピリジン-2-イルアミノ)-8H-ピリド-[2,3-d]-ピリミジン-7-オン(PD 0332991)の防護能を示す(棒グラフ)。相対的細胞数を、450nmの吸光度により測定した。PD0332991単独 (0.0μM, 0.120μM, 0.370μM, 1.1μM又は3.3μM)(縞模様棒);PD0332991(0.0μM, 0.120μM, 0.370μM, 1.1μM又は3.3μM)及びドキソルビシン(DOX)(黒塗り棒);又はDOX単独(白棒)の処理細胞に対する結果を示す。
【0033】
【図11】WST-1検定を用いて細胞生存性を検定することにより、ドキソルビシン誘発性細胞毒性から不死化ヒト二倍体繊維芽細胞(tHDF; HS68)を防護する2-ブロモ-12,13-ジヒドロ-5H-インドロ[2,3-a]ピロロ[3,4]カルバゾール-5,6-ジオン (2BrIC)の防護能を示す(棒グラフ)。相対的細胞数を、450nmの吸光度により測定した。2BrIC単独(0.0μM, 0.120μM, 0.370μM, 1.1μM又は3.3μM)(縞模様棒);2BrIC(0.0μM, 0.120μM, 0.370μM, 1.1μM又は3.3μM)及びドキソルビシン(DOX)(黒塗り棒);又はDOX単独(白棒)の処理細胞に対する結果を示す。
【0034】
【図12】WST-1検定を用いて細胞生存性を検定することにより、ドキソルビシン誘発性細胞毒性から不死化ヒト二倍体繊維芽細胞(tHDF; HS68)を防護する6-アセチル-8-シクロペンチル-5-メチル-2-(5-ピペラジン-1-イル-ピリジン-2-イルアミノ)-8H-ピリド-[2,3-d]-ピリミジン-7-オン (PD 0332991)の防護能を示す(棒グラフ)。相対的細胞数を、450nmの吸光度により測定した。PD0332991単独(0.0μM, 0.120μM, 0.370μM, 1.1μM又は3.3μM)(縞模様棒);PD0332991(0.0μM, 0.120μM, 0.370μM, 1.1μM又は3.3μM)及びドキソルビシン(DOX)(黒塗り棒);又はDOX単独(白棒)の処理細胞に対する結果を示す。
【0035】
【図13】WST-1検定を用いて細胞生存性を検定することにより、ドキソルビシン誘発性細胞毒性から、2-ブロモ-12,13-ジヒドロ-5H-インドロ[2,3-a]ピロロ[3,4]カルバゾール-5,6-ジオン (2BrIC)は、ヒトRB-ヌルメラノーマ細胞(A2058)を防護できないことを示す(棒グラフ)。相対的細胞数を、450nmの吸光度により測定した。2BrIC単独(0.0μM, 0.120μM, 0.370μM, 1.1μM又は3.3μM)(縞模様棒);2BrIC(0.0μM, 0.120μM, 0.370μM, 1.1μM又は3.3μM)及びドキソルビシン(DOX)(黒塗り棒);又はDOX単独(白棒)の処理細胞に対する結果を示す。
【0036】
【図14】WST-1検定を用いて細胞生存性を検定することにより、ドキソルビシン誘発性細胞毒性からヒトRB-ヌル・メラノーマ細胞(A2058)を防護する6-アセチル-8-シクロペンチル-5-メチル-2-(5-ピペラジン-1-イル-ピリジン-2-イルアミノ)-8H-ピリド-[2,3-d]-ピリミジン-7-オン (PD 0332991)の防護能を示す(棒グラフ)。相対的細胞数を、450nmの吸光度により測定した。PD0332991単独(0.0μM, 0.120μM, 0.370μM, 1.1μM又は3.3μM)(縞模様棒);PD0332991(0.0μM, 0.120μM, 0.370μM, 1.1μM又は3.3μM)及びドキソルビシン(DOX)(黒塗り棒);又はDOX単独(白棒)の処理細胞に対する結果を示す。
【0037】
【図15A】細胞表面抗原を用いた、非処理多分化能前駆細胞(MPP)(上部)及び2-ブロモ-12,13-ジヒドロ-5H-インドロ[2,3-a]ピロロ[3,4]カルバゾール-5,6-ジオン (2BrIC)処理MPP細胞(下部)に対するフローサイトメトリー・ゲート図である。24時間2BrIC処理又は非処理に加えて、細胞はまた、5−ブロモ−2−デオキシウリジン(BrdU)存在下にあった。
【0038】
【図15B】図15AからのLin-Kit+Sca-1ポジティブな、非処理及び2-ブロモ-12,13-ジヒドロ-5H-インドロ[2,3-a]ピロロ[3,4]カルバゾール-5,6-ジオン (2BrIC)-処理細胞集団における、5−ブロモ−2−デオキシウリジン(BrdU)ポジティブ細胞の割合を示す(棒グラフ)。BrdU取り込みは、in vivo 2BrIC処理が明白にMPPの増殖を減少させることを示し、G1期からS期への細胞周期移行の尺度を表す。
【0039】
【図16A】細胞表面抗原を用いた、造血幹細胞(HSC)、多分化能前駆細胞(MPP)(上部)及び骨髄系前駆細胞(下部)に対するフローサイトメトリー・ゲート図である。
【図16B】6-アセチル-8-シクロペンチル-5-メチル-2-(5-ピペラジン-1-イル-ピリジン-2-イルアミノ)-8H-ピリド-[2,3-d]-ピリミジン-7-オン (PD 0332991)の48時間の処理又は非処理(N=6)、及びBrdUの24時間曝露後の、5−ブロモ−2−デオキシウリジン(BrdU)取り込み、及びKi67発現による、造血幹細胞及び前駆細胞(HSPC)集団における増殖の代表的等高線プロットである。等高線は5%密度を表す。G1期からS期への細胞周期移行の尺度としてのBrdU取り込み、及びKi67発現は、増殖細胞のマーカーである。PD0332991処理は、明らかにこれらの初期HSPCの増殖を減少させる。
【0040】
【図16C】図16BからのPD0332991処理(影付き棒)及び非処理(白棒)細胞集団における5−ブロモ−2−デオキシウリジン(BrdU)及びKi67の定量データを示す一組の棒グラフである。*p,0.05; **p<0.01, ***p<0.001。誤差バーは、平均の標準誤差を表す。
【図16D】48時間のPD0332991処理(影付き棒)及び非処理(白棒)、及び24時間の5−ブロモ−2−デオキシウリジン(BrdU)曝露後の細胞集団におけるLin-, HSC, MPP、又は Lin-cKit+Sca1-集団の相対的な割合を示す。*p,0.05; **p<0.01, ***p<0.001。誤差バーは、平均の標準誤差を表す。CDK4/6阻害剤存在下で、多くの分化した骨髄細胞が、かなり多く増えて分裂及び分化を続けるので、サイクリン依存性キナーゼ4/6(CDK4/6)阻害剤処理により、HSCとMPPは相対的に増える。
【0041】
【図17】2-ブロモ-12,13-ジヒドロ-5H-インドロ[2,3-a]ピロロ[3,4]カルバゾール-5,6-ジオン (2BrIC;150mg/kg、強制経口給餌による)が、マウスin vivoにおいて、カルボプラチン(Carbo;100mg/kg、i.p.)の効果からの、赤血球及びヘモグロビンの防護を提供することを示す、一組の棒グラフを示す。マウスには、Carbo注射1時間前に、2BrIC処理を行った。Carbo注射後6日目に、血液を採取し、全赤血球数を測定した。影付き棒は、Carbo及び3BrIC処理した動物からのデータを表すが、他方、白棒は、Carbo単独処理した動物からのデータを表す。誤差バーは、平均の標準誤差である。
【0042】
【図18】6-アセチル-8-シクロペンチル-5-メチル-2-(5-ピペラジン-1-イル-ピリジン-2-イルアミノ)-8H-ピリド-[2,3-d]-ピリミジン-7-オン (PD 0332991;150mg/kg、強制経口給餌による)が、マウスin vivoにおいて、ドキソルビシン(DOX;10mg/kg、i.p.)の効果からの、4種リネージの防護を提供することを示す、一組の棒グラフを示す。マウスには、DOX注射1時間前に、PD0332991処理を行った。DOX注射を、7日後繰り返した。初回のDOX注射後14日目に、血液を採取し、全赤血球数を測定した。影付き棒は、DOX及びPD0332991処理した動物からのデータを表すが、他方、白棒は、DOX単独処理した動物からのデータを表す。誤差バーは、平均の標準誤差である。
【0043】
【図19】6-アセチル-8-シクロペンチル-5-メチル-2-(5-ピペラジン-1-イル-ピリジン-2-イルアミノ)-8H-ピリド-[2,3-d]-ピリミジン-7-オン (PD 0332991;150mg/kg、強制経口給餌による)が、マウスin vivoにおいて、カルボプラチン(Carbo;10mg/kg、i.p.)の効果からの、4種リネージの防護を提供することを示す、一組の棒グラフを示す。マウスには、Carbo注射1時間前に、PD0332991処理を行った。血液を、7日間隔で採取し、全赤血球数を測定した。より淡い影付き棒は、Carbo及びPD0332991処理した動物からのデータを表すが、他方、より濃い影付け棒は、Carbo単独処理した動物からのデータを表す。誤差バーは、平均の標準誤差である。
【0044】
【図20A】フラボピリドール及び5−ブロモ−2−デオキシウリジン(BrdU)処理した様々な種類の細胞に対するフローサイトメトリーゲート図を示す。この図は、フラボピリドールはサイクリン依存性キナーゼ4/6(CDK4/6)−依存性細胞においてG1期停止を誘導しないことを示している。上の図は、INK4a/ARFを欠損したヒトメラノーマ細胞(WM2664)に対する図を示し、中間の図は、不死化したヒト二倍体繊維芽細胞(tHDF; HS68)に対する図を示し、下の図は、ヒトRB-ヌル・メラノーマ細胞(A2058)に対する図を示す。
【0045】
【図20B】サイクリン依存キナーゼ4/6(CDK4/6)−依存性細胞において、フラボピリドールは化学防護効果を持たないことを示す(棒グラフ)。データを、非処理INK4a/ARFを欠損したヒトメラノーマ細胞(WM2664細胞);900, 300, 100又は30nMフラボピリドール(16時間)で処理したWM2664細胞;ドキソルビシン(DOX;122nM、8時間)処理したWM2664細胞;DOX(122nM)8時間処理後、16時間の900, 300, 100又は30nMフラボピリドール処理したWM2664細胞に対して提供する。処理培地を交換し、細胞生存性を7日後に、CellTiter-Glo(R)assay (CTG; Promega, Madison, Wisconsin, USA)を用いて測定し、データを相対的光単位(RLU)で表す。誤差バーを平均の標準誤差で表す。
【0046】
【図20C】サイクリン依存キナーゼ4/6(CDK4/6)−依存性細胞において、フラボピリドールは化学防護効果を持たないことを示す(棒グラフ)。データを、非処理不死化ヒト二倍体繊維芽細胞(tHDF;HS68細胞);900, 300, 100又は30nMフラボピリドール(16時間)で処理したHS68細胞;ドキソルビシン(DOX;370nM、8時間)処理したHS68細胞;16時間の900, 300, 100又は30nMフラボピリドール前処理後、DOX(370nM)8時間処理したHS68細胞に対して提供する。処理培地を交換し、細胞生存性を7日後に、CellTiter-Glo(R)assay (CTG; Promega, Madison, Wisconsin, USA)を用いて測定し、データを相対的光単位(RLU)で表す。誤差バーを平均の標準誤差で表す。
【0047】
【図20D】サイクリン依存キナーゼ4/6(CDK4/6)−非依存性細胞において、フラボピリドールは化学防護効果を持たないことを示す(棒グラフ)。データを、非処理ヒト網膜芽腫腫瘍抑制タンパク質(RB)−ヌル・メラノーマ細胞(A2058; 細胞);900, 300, 100又は30nMフラボピリドール(16時間)で処理したA2058細胞;ドキソルビシン(DOX;370nM、8時間)処理したA2058細胞;及び16時間の900, 300, 100又は30nMフラボピリドール前処理後、DOX(370nM)8時間処理したA2058細胞に対して提供する。処理培地を交換し、細胞生存性を7日後に、CellTiter-Glo(R) assay (CTG; Promega, Madison, Wisconsin, USA)を用いて測定し、データを相対的光単位(RLU)で表す。誤差バーを平均の標準誤差で表す。
【0048】
【図21A】化合物7(R547)及び5−ブロモ−2−デオキシウリジン(BrdU)処理した様々な種類の細胞に対するフローサイトメトリーゲート図を示し、これは化合物7はサイクリン依存性キナーゼ4/6(CDK4/6)−依存性細胞においてG1期停止を誘導しないことを示す。上の図は、INK4a/ARFを欠損したヒトメラノーマ細胞(WM2664)に対する図;中間の図は、不死化したヒト二倍体繊維芽細胞(tHDF; HS68)に対する図;及び下の図は、ヒト網膜芽腫腫瘍抑制タンパク質(RB)−ヌル・メラノーマ細胞(A2058)に対する図である。
【0049】
【図21B】サイクリン依存性キナーゼ4/6(CDK4/6)−依存性細胞において、化合物7(R547)は化学防護効果を持たないことを示す(棒グラフ)。データを、非処理INK4a/ARF欠損ヒトメラノーマ細胞(WM2664細胞);900, 300, 100又は30nMの化合物7(16時間)で処理したWM2664細胞;ドキソルビシン(DOX;122nM、8時間)処理したWM2664細胞;16時間の900, 300, 100又は30nMの化合物7前処理後、DOX(122nM)8時間処理したWM2664細胞に対して提供する。処理培地を交換し、細胞生存性を7日後に、CellTiter-Glo(R) assay (CTG; Promega, Madison, Wisconsin, USA)を用いて測定し、データを相対的光単位(RLU)で表す。誤差バーを平均の標準誤差で表す。
【0050】
【図21C】サイクリン依存性キナーゼ4/6(CDK4/6)−依存性細胞において、化合物7(R547)は化学防護効果を持たないことを示す(棒グラフ)。データを、非処理不死化ヒト二倍体繊維芽細胞(tHDF; HS68細胞);900, 300, 100又は30nM化合物7(16時間)で処理したHS68細胞;ドキソルビシン(DOX;370nM、8時間)処理したHS568細胞;16時間の900, 300, 100又は30nMの化合物7前処理後、DOX(370nM)8時間処理したHS68細胞に対して提供する。処理培地を交換し、細胞生存性を7日後に、CellTiter-Glo(R) assay (CTG; Promega, Madison, Wisconsin, USA)を用いて測定し、データを相対的光単位(RLU)で表す。誤差バーを平均の標準誤差で表す。
【0051】
【図21D】サイクリン依存性キナーゼ4/6(CDK4/6)−非依存性細胞において、化合物7(R547)は化学防護効果を持たないことを示す(棒グラフ)。データを、非処理ヒト網膜芽腫腫瘍抑制タンパク質(RB)−ヌル・メラノーマ細胞(A2058細胞);900, 300, 100又は30nM化合物7(16時間)で処理したA2058細胞;ドキソルビシン(DOX;370nM、8時間)処理したA2058細胞;16時間の900, 300, 100又は30nMの化合物7前処理後、DOX(370nM)8時間処理したA2058細胞に対して提供する。処理培地を交換し、細胞生存性を7日後に、CellTiter-Glo(R) assay (CTG; Promega, Madison, Wisconsin, USA)を用いて測定し、データを相対的光単位(RLU)で表す。誤差バーを平均の標準誤差で表す。
【0052】
【図22A】ロスコビチン及び5−ブロモ−2−デオキシウリジン(BrdU)処理した様々な種類の細胞に対するフローサイトメトリーゲート図を示し、これはロスコビチンは、サイクリン依存性キナーゼ4/6(CDK4/6)−依存性細胞においてG1期停止を誘導しないことを示す。上の図は、INK4a/ARFを欠損したヒトメラノーマ細胞(WM2664)に対する図;中間の図は、不死化したヒト二倍体繊維芽細胞(tHDF; HS68)に対する図;及び下の図は、ヒト(RB)−ヌル・メラノーマ細胞(A2058)に対する図である。
【0053】
【図22B】サイクリン依存性キナーゼ4/6(CDK4/6)−依存性細胞において、ロスコビチンは化学防護効果を持たないことを示す(棒グラフ)。データを、非処理INK4a/ARF欠損ヒトメラノーマ細胞(WM2664細胞);900, 300, 100又は30nMロスコビチン(16時間)で処理したWM2664細胞;ドキソルビシン(DOX;122nM、8時間)処理したWM2664細胞;16時間の900, 300, 100又は30nMのロスコビチン前処理後、DOX(122nM)8時間処理したWM2664細胞に対して提供する。処理培地を交換し、細胞生存性を7日後に、CellTiter-Glo(R) assay (CTG; Promega, Madison, Wisconsin, USA)を用いて測定し、データを相対的光単位(RLU)で表す。誤差バーを平均の標準誤差で表す。
【0054】
【図22C】サイクリン依存性キナーゼ4/6(CDK4/6)−依存性細胞において、ロスコビチンは化学防護効果を持たないことを示す(棒グラフ)。データを、非処理不死化ヒト二倍体繊維芽細胞(tHDF;HS68細胞);900, 300, 100又は30nMロスコビチン(16時間)で処理したHS68細胞;ドキソルビシン(DOX;370nM、8時間)処理したHS68細胞;16時間の900, 300, 100又は30nMロスコビチン前処理後、DOX(370nM)8時間処理したHS68細胞に対して提供する。処理培地を交換し、細胞生存性を7日後に、CellTiter-Glo(R) assay (CTG; Promega, Madison, Wisconsin, USA)を用いて測定し、データを相対的光単位(RLU)で表す。誤差バーを平均の標準誤差で表す。
【0055】
【図22D】サイクリン依存性キナーゼ4/6(CDK4/6)−非依存性細胞において、ロスコビチンは化学防護効果を持たないことを示す(棒グラフ)。データを、非処理ヒト網膜芽腫腫瘍抑制タンパク質(RB)−ヌル・メラノーマ細胞(A2058細胞);900,300,100又は30nMロスコビチン(16時間)で処理したA2058細胞;ドキソルビシン(DOX;370nM、8時間)処理したA2058細胞;16時間の900, 300, 100又は30nMロスコビチン前処理後、DOX(370nM)8時間処理したA2058細胞に対して提供する。処理培地を交換し、細胞生存性を7日後に、CellTiter-Glo(R) assay (CTG; Promega, Madison, Wisconsin, USA)を用いて測定し、データを相対的光単位(RLU)で表す。誤差バーを平均の標準誤差で表す。
【0056】
【図23A】サイクリン依存性キナーゼ4/6(CDK4/6)−依存性細胞において、ゲニステインは化学防護効果を持たないことを示す棒グラフである。データを、非処理INK4a/ARF欠損ヒトメラノーマ細胞(WM2664細胞);100, 30, 10又は3μMゲニステイン(16時間)で処理したWM2664細胞;ドキソルビシン(DOX;122nM、8時間)処理したWM2664細胞;16時間の100, 30, 10又は3μMのゲニステイン前処理後、DOX(122nM)8時間処理したWM2664細胞に対して提供する。処理培地を交換し、細胞生存性を7日後に、CellTiter-Glo(R)assay (CTG; Promega, Madison, Wisconsin, USA)を用いて測定し、データを相対的光単位(RLU)で表す。誤差バーを平均の標準誤差で表す。
【0057】
【図23B】サイクリン依存性キナーゼ4/6(CDK4/6)−依存性細胞において、ゲニステインは化学防護効果を持たないことを示す棒グラフである。データを、非処理不死化ヒト二倍体繊維芽細胞(tHDF;HS68細胞);300, 100, 30又は3μMゲニステイン(16時間)で処理したHS68細胞;ドキソルビシン(DOX;370nM、8時間)処理したHS68細胞;16時間の300, 100, 30又は3μMゲニステイン前処理後、DOX(370nM)8時間処理したHS68細胞に対して提供する。処理培地を交換し、細胞生存性を7日後に、CellTiter-Glo(R) assay (CTG; Promega, Madison, Wisconsin, USA)を用いて測定し、データを相対的光単位(RLU)で表す。誤差バーを平均の標準誤差で表す。
【0058】
【図23C】サイクリン性依存キナーゼ4/6(CDK4/6)−非依存性細胞において、ゲニステインは化学防護効果を持たないことを示す(棒グラフ)。データを、非処理ヒト網膜芽腫腫瘍抑制タンパク質(RB)−ヌル・メラノーマ細胞(A2058細胞);100, 30, 10又は3μMゲニステイン(16時間)で処理したA2058細胞;ドキソルビシン(DOX;370nM、8時間)処理したA2058細胞;16時間の100, 30, 10又は3μMゲニステイン前処理後、DOX(370nM)8時間処理したA2058細胞に対して提供する。処理培地を交換し、細胞生存性を7日後に、CellTiter-Glo(R)assay (CTG; Promega, Madison, Wisconsin, USA)を用いて測定し、データを相対的光単位(RLU)で表す。誤差バーを平均の標準誤差で表す。
【0059】
【図24A】1.1又は3.3μMの非CDK4/6選択性化合物8、9、11、14、10、13又は12で処理した後、G1期にあるサイクリン依存性キナーゼ4/6(CDK4/6)依存性細胞の割合(%)を示す(棒グラフ)。比較のために、非処理細胞集合に対するデータも示した(対照1〜4)。
【0060】
【図24B】1.1又は3.3μMの化合物8、9、11、14、10、13又は12で処理した後、G2/M期にあるサイクリン依存性キナーゼ4/6(CDK4/6)依存性細胞の割合(%)を示す(棒グラフ)。比較のために、非処理細胞集合に対するデータも示した(対照1〜4)。
【図24C】1.1又は3.3μMの化合物8、9、11、14、10、13又は12で処理した後、S期にあるサイクリン依存性キナーゼ4/6(CDK4/6)依存性細胞の割合(%)を示す棒グラフである。比較のために、非処理細胞集合に対するデータも示した(対照1〜4)。
【0061】
【図24D】細胞処理7日後のWST-1検定を用いた細胞生存性により測定した、化合物8が、サイクリン非依存キナーゼ4/6(CDK4/6)−依存性細胞(INK4a/ARF欠損ヒトメラノーマ細胞(WM2664))を、ドキソルビシン誘発の細胞毒性から防護することができないことを示す(棒グラフ)。細胞数を、450nmの吸光度から測定した。化合物8のみを16時間処理(縞模様棒、0.0μM, 0.120μM, 0.370μM, 1.1μM又は3.3μM);16時間化合物8(0.0μM, 0.120μM, 0.370μM, 1.1μM又は3.3μM)を処理後、8時間のドキソルビシン処理(DOX;122nM;黒塗り棒);又はDOXのみ(122nM;8時間;白棒)を処理した細胞に対して、結果を示す。誤差バーを平均の標準誤差で表す。
【0062】
【図24E】細胞処理7日後のWST-1検定を用いた細胞生存性により測定した、化合物9が、サイクリン性依存キナーゼ4/6(CDK4/6)−依存性細胞(INK4a/ARF欠損ヒトメラノーマ細胞(WM2664))を、ドキソルビシン誘導の細胞毒性から防護することができないことを示す(棒グラフ)。細胞数を、450nmの吸光度から測定した。化合物9のみを16時間処理(縞模様棒、0.0μM, 0.120μM, 0.370μM, 1.1μM又は3.3μM);16時間化合物9(0.0μM, 0.120μM, 0.370μM, 1.1μM又は3.3μM)を処理後、8時間のドキソルビシン処理(DOX;122nM;黒塗り棒);又はDOXのみ(122nM;白棒)を8時間処理した細胞に対して、結果を示す。誤差バーを平均の標準誤差で表す。
【0063】
【図24F】細胞処理7日後のWST-1検定を用いた細胞生存性により測定した、化合物11が、サイクリン依存性キナーゼ4/6(CDK4/6)−依存性細胞(INK4a/ARF欠損ヒトメラノーマ細胞(WM2664))を、ドキソルビシン誘導の細胞毒性から防護することができないことを示す(棒グラフ)。細胞数を、450nmの吸光度から測定した。化合物11のみを16時間処理(縞模様棒、0.0μM, 0.120μM, 0.370μM, 1.1μM又は3.3μM);16時間化合物11(0.0μM, 0.120μM, 0.370μM, 1.1μM又は3.3μM)を処理後、8時間のドキソルビシン処理(DOX;122nM;黒塗り棒);又はDOXのみ(122nM;白棒)を8時間処理した細胞に対して、結果を示す。誤差バーを平均の標準誤差で表す。
【0064】
【図24G】細胞処理7日後のWST-1検定を用いた細胞生存性により測定した、化合物8が、サイクリン依存性キナーゼ4/6(CDK4/6)−依存性細胞(不死化ヒト二倍体繊維芽細胞(tHDF; HS68))を、ドキソルビシン誘導の細胞毒性から防護することができないことを示す(棒グラフ)。細胞数を、450nmの吸光度から測定した。化合物8のみを16時間処理(縞模様棒、0.0μM, 0.120μM, 0.370μM, 1.1μM又は3.3μM);16時間化合物8(0.0μM, 0.120μM, 0.370μM, 1.1μM又は3.3μM)を処理後、8時間のドキソルビシン処理(DOX;370nM;黒塗り棒);又はDOXのみ(370nM;白棒)を8時間処理した細胞に対して、結果を示す。誤差バーを平均の標準誤差で表す。
【0065】
【図24H】細胞処理7日後のWST-1検定を用いた細胞生存性により測定した、化合物9が、サイクリン依存性キナーゼ4/6(CDK4/6)−依存性細胞(不死化ヒト二倍体繊維芽細胞(tHDF; HS68))を、ドキソルビシン誘導の細胞毒性から防護することができないことを示す(棒グラフ)。細胞数を、450nmの吸光度から測定した。化合物9のみを16時間処理(縞模様棒、0.0μM, 0.120μM, 0.370μM, 1.1μM又は3.3μM);16時間化合物9(0.0μM, 0.120μM, 0.370μM, 1.1μM又は3.3μM)を処理後、8時間のドキソルビシン処理(DOX;370nM;黒塗り棒);又はDOXのみ(370nM;白棒)を8時間処理した細胞に対して、結果を示す。誤差バーを平均の標準誤差で表す。
【0066】
【図24I】細胞処理7日後のWST-1検定を用いた細胞生存性により測定した、化合物11が、サイクリン依存性キナーゼ4/6(CDK4/6)−依存性細胞(不死化ヒト二倍体繊維芽細胞(tHDF; HS68))を、ドキソルビシン誘導の細胞毒性から防護することができないことを示す(棒グラフ)。細胞数を、450nmの吸光度から測定した。化合物11のみを16時間処理(縞模様棒、0.0μM, 0.120μM, 0.370μM, 1.1μM又は3.3μM);16時間化合物11(0.0μM, 0.120μM, 0.370μM, 1.1μM又は3.3μM)を処理後、8時間のドキソルビシン処理(DOX;370nM;黒塗り棒);又はDOXのみ(370nM;白棒)を8時間処理した細胞に対して、結果を示す。誤差バーを平均の標準誤差で表す。
【0067】
【図25A】6-アセチル-8-シクロペンチル-5-メチル-2-(5-ピペラジン-1-イル-ピリジン-2-イルアミノ)-8H-ピリド-[2,3-d]-ピリミジン-7-オン (PD 0332991)が、サイクリン依存性キナーゼ4/6(CDK4/6)依存的様式で、化学療法誘発性細胞毒性を阻害することを示す(棒グラフ)。非処理INK4a/ARF欠損ヒトメラノーマ細胞(WM2664細胞);15nM、30nM、89nM又は270nMのPD0332991と16時間インキュベートしたWM2664細胞;カルボプラチン(Carbo;50μM)、ドキソルビシン(DOX;122nM)又はエトポシド(Etop;2.5μM)を8時間処理したWM2664細胞;15nM、30nM、89nM又は270nMのPD0332991を16時間処理後、DOX(122nM)、Carbo(50μM)、又はEtop(2.5μM)を8時間処理したWM2664細胞に対してデータを提供する。インキュベーション後、培養培地の一部を取りだし、細胞毒性をアデニル酸キナーゼ量を定量して検定した。データは相対的光単位(RLU)で示す。
【0068】
【図25B】PD 0332991が、サイクリン依存性キナーゼ4/6(CDK4/6)依存的様式で、化学療法誘発性細胞毒性を阻害することを示す(棒グラフ)。非処理ヒトHS68細胞;15nM、30nM、89nM又は270nMのPD0332991と16時間インキュベートしたHS68細胞;カルボプラチン(Carbo;50μM)、ドキソルビシン(DOX;122nM)又はエトポシド(Etop;2.5μM)を8時間処理したHS68細胞;及び15nM、30nM、89nM又は270nMのPD0332991を16時間処理後、DOX(122nM)、Carbo(50μM)、又はEtop(2.5μM)を8時間処理したHS68細胞に対してデータを提供する。インキュベーション後、培養培地の一部を取りだし、細胞毒性をアデニル酸キナーゼ量を定量して検定した。データは相対的光単位(RLU)で示す。
【0069】
【図25C】PD 0332991が、サイクリン依存性キナーゼ4/6(CDK4/6)依存的様式で、化学療法誘発性細胞毒性を阻害することを示す(棒グラフ)。非処理網膜芽腫腫瘍抑制タンパク質(RB−ヌル)ヒトメラノーマ細胞(A2058細胞);15nM、30nM、89nM又は270nMのPD0332991と16時間インキュベートしたA2058細胞;カルボプラチン(Carbo;50μM)、ドキソルビシン(DOX;122nM)又はエトポシド(Etop;2.5μM)を8時間処理したA2058細胞;及び15nM、30nM、89nM又は270nMのPD0332991を16時間処理後、DOX(122nM)、Carbo(50μM)、又はEtop(2.5μM)を8時間処理したA2058細胞に対してデータを提供する。インキュベーション後、培養培地の一部を取りだし、細胞毒性をアデニル酸キナーゼ量を定量して検定した。データは相対的光単位(RLU)で示す。
【0070】
【図25D】スタウロスポリン(STAUR)が、サイクリン依存性キナーゼ4/6(CDK4/6)非依存的様式で、化学療法誘発性細胞毒性を高めることを示す(棒グラフ)。非処理INK4a/ARF欠損ヒトメラノーマ細胞(WM2664細胞);160pM,500pM,1.5nM又は4.5nMのスタウロスポリンと16時間インキュベートしたWM2664細胞;カルボプラチン(Carbo;50μM)、ドキソルビシン(DOX;122nM)又はエトポシド(Etop;2.5μM)を8時間処理したWM2664細胞;及び160pM,500pM,1.5nM又は4.5nMのスタウロスポリンを16時間処理後、DOX(122nM)、Carbo(50μM)、又はEtop(2.5μM)を8時間処理したWM2664細胞に対してデータを提供する。インキュベーション後、培養培地の一部を取りだし、細胞毒性をアデニル酸キナーゼ量を定量して検定した。データは相対的光単位(RLU)で示す。
【0071】
【図25E】スタウロスポリン(STAUR)が、サイクリン依存性キナーゼ4/6(CDK4/6)非依存的様式で、化学療法誘発性細胞毒性を高めることを示す(棒グラフ)。非処理HS68細胞;160pM,500pM,1.5nM又は4.5nMのスタウロスポリンと16時間インキュベートしたHS68細胞;カルボプラチン(Carbo;50μM)、ドキソルビシン(DOX;122nM)又はエトポシド(Etop;2.5μM)を8時間処理したHS68細胞;及び160pM,500pM,1.5nM又は4.5nMのスタウロスポリンを24時間処理後、DOX(122nM)、Carbo(50μM)、又はEtop(2.5μM)を8時間処理後したHS68細胞に対してデータを提供する。インキュベーション後、培養培地の一部を取りだし、細胞毒性をアデニル酸キナーゼ量を定量して検定した。データは相対的光単位(RLU)で示す。
【0072】
【図25F】スタウロスポリン(STAUR)が、サイクリン依存性キナーゼ4/6(CDK4/6)非依存的様式で、化学療法誘発性細胞毒性を高めることを示す(棒グラフ)。非処理網膜芽腫腫瘍抑制タンパク質(RB-ヌル)ヒトメラノーマ細胞(A2058細胞);160pM,500pM,1.5nM又は4.5nMのスタウロスポリンと16時間インキュベートしたA2058細胞;カルボプラチン(Carbo;50μM)、ドキソルビシン(DOX;122nM)又はエトポシド(Etop;2.5μM)を8時間処理したA2058細胞;及び160pM,500pM,1.5nM又は4.5nMのスタウロスポリンを16時間前処理後、カルボプラチン(Carbo;50μM)、ドキソルビシン(DOX;122nM)又はエトポシド(Etop;2.5μM)を8時間処理したA2058細胞に対してデータを提供する。インキュベーション後、培養培地の一部を取りだし、細胞毒性をアデニル酸キナーゼ量を定量して検定した。データは相対的光単位(RLU)で示す。
【0073】
【図26A】160pM,500pM,1.5nM又は4.5nMのスタウロスポリン(STAUR)を24時間処理後、サイクリン依存性キナーゼ4/6(CDK4/6)依存性細胞(HS68)が、G1期(淡い影付き棒)、G2/M期(濃い影付き棒)及びS期(白棒)にある割合(%)を示す棒グラフである。スタウロスポリンは、HS68細胞において、G1細胞周期停止を誘導するようである。
【0074】
【図26B】サイクリン依存性キナーゼ4/6(CDK4/6)依存性細胞において、スタウロスポリン(STAUR)が化学防護効果を持たないことを示す(棒グラフ)。非処理HS68細胞;160pM,500pM,1.5nM又は4.5nMのスタウロスポリンで処理(16時間)したHS68細胞;ドキソルビシン(DOX;122nM;8時間)処理HS68細胞;DOX(122nM)8時間処理後、160pM,500pM,1.5nM又は4.5nMのスタウロスポリンで処理(16時間)したHS68細胞;カルボプラチン(Carbo;50μM;8時間)HS68細胞;Carbo(50μM)8時間処理後、160pM,500pM,1.5nM又は4.5nMのスタウロスポリンで処理(16時間)したHS68細胞;エトポシド(Etop;2.5μM;8時間)処理したHS68細胞;160pM,500pM,1.5nM又は4.5nMのスタウロスポリンを前処理(16時間)後、Etop(2.5μM)8時間処理したHS68細胞データを提供する。処理培地は置き換え、及び細胞生存性は7日後にCellTiter-Glo(R)assay (CTG; Promega, Madison, Wisconsin, USA)を用いて測定し、及び細胞毒性は、アデニル酸キナーゼ量の定量により検定した。データを相対的光単位(RLU)で示した。
【0075】
【図27A】γ-H2AXレベルを検定することにより、スタウロスポリン(STAUR)が、サイクリン依存性キナーゼ4/6(CDK4/6)依存性細胞(ヒトINKa/ARFメラノーマ細胞(WM2664)を、ドキソルビシン、カルボプラチン−又はエトポシド−誘発性DNA損傷から防護できないことを示す棒グラフである。γ-H2AXポジティブ細胞の割合(%)を、非処理WM2664細胞に対して;16時間、160pM,500pM,1.5nM又は4.5nMのスタウロスポリン処理したWM2664細胞に対して;8時間、カルボプラチン(Carbo、50μM), エトポシド(Etop、2.5μM)又はドキソルビシン(Dox、122nM)の何れかを単独処理したWM2664細胞に対して;及び16時間、160pM,500pM,1.5nM又は4.5nMのスタウロスポリン前処理後、8時間のCarbo(50μM), Etop(2.5μM)又は Dox(122nM)の何れかを処理したWM2664細胞に対して示す。スタウロスポリンは、WM2664細胞を化学療法誘発性DNA損傷から防護しないようである。
【0076】
【図27B】γ-H2AXレベルを検定することにより、スタウロスポリン(STAUR)が、サイクリン依存性キナーゼ4/6(CDK4/6)依存性細胞(ヒト不死化二倍体繊維芽細胞(tHDF;HS68)を、ドキソルビシン、カルボプラチン−又はエトポシド−誘発性DNA損傷から、防護することができないことを示す(棒グラフ)。γ-H2AXポジティブ細胞の割合(%)を、非処理HS68細胞に対して;16時間、160pM,500pM,1.5nM又は4.5nMのスタウロスポリン処理したHS68細胞に対して;8時間、カルボプラチン(Carbo、50μM), エトポシド(Etop、2.5μM)又はドキソルビシン(Dox、122nM)の何れかを単独処理したHS68細胞に対して;及び16時間、160pM,500pM,1.5nM又は4.5nMのスタウロスポリン前処理後、8時間のCarbo(50μM)、Etop(2.5μM)又は Dox(122nM)の何れかを処理したHS68細胞に対して示す。スタウロスポリンは、HS68細胞を化学療法誘発性DNA損傷から防護しないようである。
【0077】
【図27C】γ-H2AXレベルを検定することにより、スタウロスポリン(STAUR)が、サイクリン依存性キナーゼ4/6(CDK4/6)非依存性細胞(ヒトRB−ヌルメラノーマ細胞(A2058)を、ドキソルビシン、カルボプラチン−又はエトポシド−誘発性DNA損傷から、防護することができないことを示す(棒グラフ)。γ-H2AXポジティブ細胞の割合(%)を、非処理A2058細胞に対して;16時間、160pM,500pM,1.5nM又は4.5nMのスタウロスポリン処理したA2058細胞に対して;8時間、カルボプラチン(Carbo、50μM), エトポシド(Etop、2.5μM)又はドキソルビシン(Dox、122nM)の何れかを単独処理したA2058細胞に対して;及び16時間、160pM,500pM,1.5nM又は4.5nMのスタウロスポリン前処理後、8時間のCarbo(50μM), Etop(2.5μM)又は Dox(122nM)の何れかを処理したA2058細胞に対して示す。スタウロスポリンは、A2058細胞を化学療法誘発性DNA損傷から防護しないようである。
【発明を実施するための最良の形態】
【0078】
代表的実施形態を示す実施例を参考にして、本明細書で本発明を詳細に説明する。しかしながら、本発明は、異なる形式に具体化することができる、また本明細書に記載された実施形態に制限されると考えるべきではない。むしろ、これらの実施形態は、本開示が充分であり完全であり、及び当業者にとって実施形態の範囲を完全に伝達するために提供されている。
もし、別なやり方で定義しなければ、本明細書に用いる全ての技術的及び科学的用語は、本発明が属する技術分野の当業者が通常理解するのと同じ意味を持つ。本明細書で述べた全ての出版物、特許申請、特許、及び他の参照をその全体について参考文献として取り込む。
明細書及び特許請求の範囲を通して、与えられた化学式、又は化学名は、全ての光学的、及び立体的異性体、及びこれらの異性体及び混合物が存在するラセミ体を包含する。
【0079】
本明細書で用いる略語は次の意味である:
℃=摂氏、%=パーセント、μL=マイクロリットル、μM=マイクロモル(数)、2BrIC=2-ブロモ-12,13-ジヒドロ-5H-インドロ[2,3-a]ピロロ[3,4]-カルバゾール-5,6-ジオン、BM=骨髄、BM-MNC=骨髄単核細胞、BrdU=5-ブロモ-2-デオキシウリジン、Carbo=カルボプラチン、CAFC=敷石状領域形成細胞、CBC=全血球計数、CDK=サイクリン依存性キナーゼ、CDK4/6=サイクリン依存性キナーゼ4 及び/又はサイクリン依存性キナーゼ 6、CLP=リンパ球共通前駆細胞、CMP=骨髄共通前駆細胞、CNS=中枢神経、DMEM=Dulbeccoの改変Eagle培地、DMF=ジメチルホルムアミド、DNA=デオキシリボ核酸、DOX=ドキソルビシン、EPO=エリスロポエチン(赤血球生成促進因子)、ESI=電気スプレイ電離、EtOAc=酢酸エチル、EtOH=エタノール、Etop=エトポシド、FBS=仔牛胎児血清、g=グラム、G-CSF=顆粒球コロニー刺激因子、GM-CSF=顆粒球マクロファージコロニー刺激因子、GMP=顆粒球単球前駆細胞、h=時間、HSC=造血幹細胞、HSPC=造血幹細胞及び前駆細胞、IC50=50% 阻害濃度、i.p.=腹腔、kg=キログラム、LC-MS=液体クロマトグラフィー質量分析器、LT-HSC=長期造血幹細胞、M=モル(濃度)、MEP=赤芽球系前駆細胞、mg=ミリグラム、MHz=メガヘルツ、mL=ミリリットル、mmol=ミリモル(数)、mol=モル(数)、Mp=融点、Mpk=ミリグラム/キログラム、MPP=多分化能前駆細胞、NBS=N-ブロモスクシンイミド、nm=ナノメートル、nM=ナノモル(濃度)、NMR=核磁気共鳴、PD=6-アセチル-8-シクロペンチル-5-メチル-2-(5-ピペラジン-1-イル-ピリジン-2-イルアミノ)-8-ピリド- [2,3-d]-ピリミジン-7-オン(PD 0332991とも呼ばれる)、PI=ヨウ化プロピジウム、PQ=医薬学的休止、RB=網膜芽腫腫瘍抑制タンパク質、RLU=相対的光単位、r.t.=室温、ST-HSC=短期造血幹細胞、tHDF=不死化ヒト二倍体繊維芽細胞、THF=テトラヒドロフラン、UV=紫外線
【0080】
I.定義
以下の用語は、当業者により良く理解されると信ずるが、以下の定義は本発明の説明を円滑にするために示すものである。
長年の特許法慣習に従い用語"a(1つ、ある)"、"an(1つ、ある)"及び"the(その、この)"は、請求の範囲を含めて本申請で用いる際"1以上"を表す。従って、例えば、"a compound(ある化合物)"又は"a cell(ある細胞)"に関しては、複数のこのような化合物又は細胞等々を含む。
2個の項目又は条件の記載に用いる場合、例えば、CDK4及び/又はCDK6、用語"及び/又は"は、両項目又は条件が存在する又は適用可能である状況に対して、及び両項目又は条件の1つだけが存在する、又は適用可能である状況を表す。従って、CDK4及び/又はCDK6阻害剤は、CDK4及びCDK6の両者を阻害する化合物であること、CDK4のみを阻害する化合物、又はCDK6のみを阻害する化合物であってもよい。
【0081】
"健康な細胞"又は"正常な細胞"は、疾病(ガン又は他の増殖性疾患)の症候又はマーカーを示さない患者のいかなる細胞をも意味する。幾つかの態様において、健康な細胞は、造血幹細胞又は造血前駆細胞である。前駆細胞としては、長期造血幹細胞(LT-HSCs)、短期造血幹細胞(ST-HSCs)、多分化能前駆細胞(MPPs)、骨髄共通前駆細胞(CMPs)、リンパ球共通前駆細胞(CLPs)、顆粒球単球前駆細胞(GMPs)、及び赤芽球系前駆細胞(MEPs)を含むことができるが、これらに制限されない。
【0082】
本明細書で用いる用語"ガン"は、制御不能な細胞分裂、転移能を持つ、又は他の部位に新増殖を樹立できる細胞により引き起こされる疾患を表す。用語"悪性""新生物""腫瘍"及びこれ等の類似語は、ガン細胞又はガン細胞群を表す。ガンの特異な種類としては、皮膚癌、結合組織癌、脂肪腫瘍、乳癌、肺癌、胃癌、膵臓癌、卵巣癌、子宮頸癌、子宮癌、肛門性器癌、腎臓癌、膀胱癌、結腸癌、前立腺癌、頭頚部癌、脳腫瘍、中枢神経(CNS)癌、網膜癌、血液ガン、及びリンパ球ガンなどがあるが、これらに制限されない。
【0083】
本明細書で用いるように、用語"化学療法"は、細胞毒性化合物(例えば、DNA損傷性化合物)を用いて、ガン細胞のような、しかしこれに制限されない、望ましくない細胞の成長又は増殖を減らす、又は除くために、治療することを表す。従って、本明細書で用いるように、"化学療法化合物"は、ガンを治療するために用いられる細胞毒性化合物を表す。化合物の細胞毒性効果は、核酸インターカレーション、又は結合、DNA又はRNAアルキル化、RNA又はDNA合成の阻害、他の核酸関連活性(例えば、タンパク質合成)の阻害、又はすべての他の細胞毒性効果の中の1以上の結果であることが可能である。
【0084】
従って"細胞毒性化合物"は、"抗癌剤"又は"化学療法薬剤"としても記載された如何なる1つ又は如何なる組合せの化合物もあることができる。このような化合物としては、DNA損傷性化合物及び細胞を殺すことができる他の化学物質があるが、これらに制限されない。"DNA損傷性化合物"としては、アルキル化剤、DNAインターカレーター、タンパク質合成阻害剤、DNA又はRNA合成阻害剤、DNA塩基類似体、トポイソメラーゼ阻害剤、及びテロメラーゼ阻害剤又はテロメアDNA結合化合物があるが、これらに制限されない。例えば、アルキル化剤は、ブスルファン、インプロスルファン、及びピポスルファンのようなアルキルスルホン酸塩;ベンゾジゼパ、カルボコン、メツレデパ、及びウレデパのようなアジリジン;アルトレタミン、トリエチレンメラミン、トリエチレンホスホラミド、トリエチレンチオホスホラミド、及びトリメチロールメラミンのような、エチレンイミン及びメチルメラミン;クロランブシル、クロルナファジン、シクロホスファミド、エストラムスチン、イホスファミド、メクロレタミン、メクロレタミンオキシド塩酸塩、メルファラン、ノベンビチン、フェネステリン、プレドニマスチン、トロホスファミド、及びウラシルマスタードのようなナイトロジェンマスタード;及びカルムスチン、クロロゾトシン、ホテムスチン、ロムスチン、ニムスチン、及びラニムスチンのようなニトロソウレアを含む。
【0085】
ガンの治療に用いられる抗生物質としては、ダクチノマイシン、ダウノルビシン、ドキソルビシン、イダルビシン、ブレオマイシン硫酸塩、マイトマイシン、プリカマイシン、及びストレプトゾシンがある。化学治療のための抗代謝物質としては、メルカプトプリン、チオグアニン、クラドリビン、フルダラビンリン酸塩、フルオロウラシル(5-FU)、フロクスウリジン、シタラビン、ペントスタチン、メトレキサート及びアザチオプリン、アシクロビル、アデニンβ−1−D-アラビノシド、アメトプテリン、アミノプテリン、2−アミノプリン、アフィジコリン、8−アザグアニン、アザセリン、6−アザウラシル、2'−アジド−2'−デオキシヌクレオシド、5−ブロモデオキシシチジン、シトシン、β−1−D−アラビノシド、ジアゾオキシノルロイシン、ジデオキシヌクレオシド、5−フルオロデオキシシチジン、5−フルオロデオキシウリジン、及びヒドロキシウレアを含む。
【0086】
化学療法タンパク質構成阻害剤は、アブリン、アウリントリカルボン酸、クロランフェニコール、コリシンE3,シクロヘキシミド、ジフテリア毒素、エデインA,エメチン、エリスロマイシン、エチオニン、フッ化物、5−フルオロトリプトファン、フシジン酸、グアニリルメチレンジホスホネート、及びグアニリルイミド2リン酸塩、カナマイシン、カスガマイシン、キロマイシン、及びO−メチルスレオニンを含む。更なる、タンパク質合成阻害剤は、モデシン、ネオマイシン、ノルバリン、パクタマイシン、パロモマイシン、ピューロマイシン、リシン、シガ毒素、ショウドマイシン、スパルソマイシン、スペクチノマイシン、ストレプトマイシン、テトラサイクリン、チオストレプトン、及びトリメトプリムを含む。DNA合成阻害剤は、硫酸ジメチル、マイトマイシンC,ナイトロジェン及びスルファマスタードのようなアルキル化剤、アクリジン色素、アクチノマイシン、アドリアマイシン、アントラセン、ベンゾピレン、臭化エチジウム、2ヨウ化プロピジウム−インタートウィニングのようなインターカレート薬剤;及びジスタマイシン、ネトロプシンのような他の薬剤が含まれる。クメルマイシン、ナリジクス酸、ノボビオシン、及びオキソリン酸のようなトポイソメラーゼ阻害剤;コルセミド、コルヒチン、ビンブラスチン、及びビンクリスチンのような細胞分裂阻害剤;及びアクチノマイシンD,α−アマニチン、及び他の菌類のアマトキシン、コルジセピン(3'−デオキシアデノシン)、ジクロロリボフラノシル・ベンズイミダゾール、リファンピシン、ストレプトバリシンを含むRNA合成阻害剤を含み、及びストレプトリジギンもまたDNA損傷性化合物である。
【0087】
従って、その毒性が本明細書で開示した選択的CDK4/6阻害剤で緩和することができる、現在の化学療法化合物として、アドリアマイシン、5−フッ化ウラシル(5FU)、エトポシド、カンプトテシン、アクチノマイシン−D、マイトマイシン、シスプラチン、過酸化水素、カルボプラチン、プロカルバジン、メクロレタミン、シクロホスファミド、イホスファミド、メルファラン、クロランブシル、ビスルファン、ニトロソウレア、ダクチノマイシン、ダウノルビシン、ドキソルビシン、ブレオマイシン、プリコマイシン、タモキシフェン、タキソール、トランスプラチナ、ビンブラスチン、及びメトレキサート、等々が含まれる。
【0088】
"細胞毒性化合物による治療を受ける危険性"は、将来細胞毒性化合物(例えば、DNA障害性)の治療を受ける予定のある患者(計画された化学療法診察により)、又は将来気付かずに細胞毒性化合物への曝露の機会を有する患者を意味する。気付かない曝露は、事故、又は計画されてない環境又は職業上の曝露又は医学的治療の一部として被った細胞毒性化合物の過剰投与を含む。
【0089】
"有効量の阻害化合物"は、患者の健康な造血幹細胞及び前駆細胞(HSPC)における化学療法又は細胞毒性化合物の他の曝露に関連した毒性を減少又は除去するに有効な量を意味する。幾つかの態様において、有効量は、患者において、一時的(例えば、数時間又は数日)に造血幹細胞の増殖を阻害する(即ち、造血幹細胞の休止状態を誘導する)に必要な量である。
【0090】
"長期血液学的毒性"は、細胞毒性化合物の投与後、1週間以上、数ヶ月又は数年以上続く期間患者に作用する血液学的毒性を意味する。長期血液学的毒性は、血液細胞の非効率的産生(即ち、骨髄異形成)及び/又はリンパ球の非効率的産生(をひき起こすことが可能な骨髄障害をもたらすことができる。血液学的毒性は、例えば、貧血、血小板数の減少(即ち、血小板減少症)として、又は白血球数の減少(好中球減少症)として、観察することができる。幾つかの症例において、骨髄異形成は白血病の進行をもたらす。化学療法に関係する長期毒性はまた、血液細胞に加えて、患者の他の自己再生細胞を損傷することが可能である。従って、長期毒性はまた、白髪及び虚弱をもたらすことが可能である。
【0091】
"〜からフリー(〜がない)"は、本明細書に開示した方法に従い選択的CDK4/6阻害剤で治療した患者は、長期血液学的毒性の検知できる徴候又は症候を示さず、又はCDK4/6阻害剤の1回又は複数回の投与を受けずに細胞毒性化合物治療を受けた患者に示されるであろう徴候/症候と比較して、顕著に減少した(例えば、10分の1に減少、又は100分の1より少なく減少)長期血液学的毒性の徴候又は症候を示す。
"〜からフリー(〜がない)"はまた、特にin vivo又は細胞をベースとした検定による検査で好ましくない、又はオフターゲット効果を持たない、選択的CDK4/6阻害化合物を表すことができる。従って、"からフリー"は、長期毒性、抗酸化効果、エストロゲン様作用、チロシンキナーゼ阻害効果、CDK4/6以外のCDKへの阻害効果、及びCDK4/6非依存性細胞における細胞周期停止のような、しかしこれらに制限されない、オフターゲット効果を持たない、選択的CDK4/6阻害剤を表すことができる。
【0092】
オフターゲット効果"から実質的にフリーな"CDK4/6阻害剤は、幾つかの軽微なオフターゲット効果を持つことができるCDK4/6阻害剤であり、このオフターゲット効果は、CDK4/6依存性細胞を細胞毒性化合物から防護する阻害剤の防護能を妨害しない。例えば、オフターゲット効果"から実質的にフリーな"CDK4/6阻害剤は、この阻害剤がCDK4/6依存性細胞の選択的G1期停止をもたらす限り、他のCDKに対する幾つかの軽微な阻害効果(例えば、CDK1又はCDK2に対するIC50が、>0.5μM;>1.0μM;又は>5.0μM)を持つことができる。
【0093】
"減少した"又は"妨げた"又はこれらの文法的同義語は、夫々、医学的治療の好ましくない副作用を低下させる、又は好ましくない副作用が完全に発生しないようにすることである。
幾つかの態様において、本明細書に記載した方法は、全ての脊椎動物種について有効であり、これらも用語"患者"に含むことを意図するが、本発明で治療を受けた患者は、好ましくは、ヒトである。
【0094】
より詳細には、本明細書に、ヒト及び、絶滅の危機にある重要な哺乳類(例えば、シベリアトラ)、ヒトに対し経済的に重要な哺乳類(ヒトにより消費されるために農場で飼育されている動物)及び/又は、例えば、ヒト以外の肉食動物(例えば、ネコ及びイヌ、)ブタ類(ブタ、去勢ブタ、及びヨーロッパイノシシ)、反芻動物(畜牛、去勢ウシ、ヒツジ、キリン、シカ、ヤギ、バイソン、及びラクダのような)及びウマのように、ヒトに対し社会的に重要な哺乳類(ペットとして、又は動物園で飼われている動物)のような哺乳類の治療が含まれている。従って、本明細書に記載した本方法の態様は、家畜性ブタ類(ブタ及び去勢ブタ)、反芻動物、馬、家禽類等々の治療を含むが、これらに制限されない。
【0095】
本明細書で用いるように、用語"アルキル基"は、線型(即ち、直鎖)、分枝型、又は環状、飽和、又は少なくとも部分的に飽和、及び幾つかの場合完全に不飽和型(即ち、アルケニル基及びアルキニル基)炭化水素鎖を含むC1〜20を表わし、例えば、メチル基、エチル基、プロピル基、イソプロピル基、ブチル基、イソブチル基、tert-ブチル基、ペンチル基、ヘキシル基、オクチル基、エテニル基、プロペニル基、ブテニル基、ペンテニル基、ヘキセニル基、オクテニル基、ブタジエニル基、プロピニル基、ブチニル基、ペンチニル基、ヘキシニル基、ヘプチニル基、及びアレニル基が含まれる。"分枝型"は、メチル基、エチル基又はプロピル基のような低級アルキル基が線型アルキル鎖に付加したアルキル基を表す。"低級アルキル基"は、1から8炭素原子(即ち、C1〜8アルキル基)例えば、1,2,3,4,5,6,7又は8炭素原子、を有するアルキル基を表す。"高級アルキル基"は、約10から約20炭素原子、例えば、10,11,12,13,14,15,16,17,18,19,又は20炭素原子、を有するアルキル基を表す。ある態様において、"アルキル基"は特に、C1〜8直鎖アルキル基を表す。他の態様において、"アルキル基"は特に、C1〜8分枝鎖アルキル基を表す。
【0096】
アルキル基を、任意に1個以上の、同一又は異なる、アルキル基置換基により置換することができる("置換アルキル基")。用語"アルキル基置換基"はアルキル基、置換アルキル基、ハロ基、アリールアミノ基、アシル基、ヒドロキシル基、アリールオキシル基、アルコキシル基、アルキルチオ基、アリールチオ基、アラルキルオキシル基、アラルキルチオ基、カルボキシル基、アルコキシカルボニル基、オキソ基及びシクロアルキル基を含むが、これらに制限されない。アルキル鎖に沿って、任意に、1以上の酸素原子、イオウ原子又は置換窒素原子又は非置換窒素原子を挿入することができて、ここで、窒素置換基は、水素原子、低級アルキル基(本明細書ではまた、"アルキルアミノアルキル基"と表す)又はアリール基である。
【0097】
従って、本明細書で用いるように、用語"置換アルキル基"は、本明細書で定義したように、アルキル基を含み、ここでアルキル基の1以上の原子又は官能基が他の原子又は官能基に置き換えられ、例えば、アルキル基、置換アルキル基、ハロゲン原子、アリール基、置換アリール基、アルコキシル基、ヒドロキシル基、ニトロ基、アミノ基、アルキルアミノ基、ジアルキルアミノ基、硫酸基及びメルカプト基が含まれる。
【0098】
本明細書で用いる用語"アリール基"は、単一芳香族環、又は互いに融合した、又は共有結合で連結した、又はメチレン基又はエチレン基部分のような、しかしこれらに制限されない、一般的な置換基に結合した芳香族部分を表す。一般的な連結基はまた、ベンゾフェノンにおける様なカルボニル基、又はジフェニルエーテルにおける様な酸素原子、又はジフェニルアミンにおける様な窒素原子であってもよい。用語"アリール基"は、とりわけ複素環式芳香族化合物を含む。この芳香族環(複数もあり)は、フェニル基、ナフチル基、ビフェニル基、ジフェニルエーテル基、ジフェニルアミン基及びベンゾフェノン基を含むことができる。特別の実施形態において、用語"アリール基"は、約5から約10炭素原子、即ち5,6,7,8,9又は10炭素原子を含む環状芳香族基を意味し、及び5−及び6−員環の炭化水素、及び複素環式芳香族環を含む。
【0099】
アリール基は、任意に、1以上の同一又は異なる、アリール基置換基と置き換えることができて("置換アリール基")、ここで"アリール基置換基は"アルキル基、置換アルキル基、アリール基、置換アリール基、アラルキル基、ヒドロキシル基、アルコキシル基、アリールオキシル基、アラルキルオキシル基、カルボキシル基、カルボニル基、アシル基、ハロ基、ニトロ基、アルコキシカルボニル基、アリールオキシカルボニル基、アラルコキシカルボニル基、アシルオキシル基、アシルアミノ基、アロイルアミノ基、カルバモイル基、アルキルカルバモイル基、ジアルキルカルバモイル基、アリールチオ基、アルキルチオ基、アルキレン基及びNR'R"を含み、ここでR'及びR"は、夫々独立に、水素原子、アルキル基、置換アルキル基、アリール基、置換アリール基、及びアラルキル基である。
【0100】
従って、本明細書で用いるように、用語"置換アリール基"は、本明細書で定義したように、アリール基を含み、ここでアリール基の1以上の原子又は官能基は、他の原子又は官能基と置き換えられ、官能基としては、例えば、アルキル基、置換アルキル基、ハロゲン原子、アリール基、置換アリール基、アルコキシル基、ヒドロキシル基、ニトロ基、アミノ基、アルキルアミノ基、ジアルキルアミノ基、硫酸基及びメルカプト基が含まれる。
アリール基の特別な例としては、シクロペンタジエニル基、フェニル基、フラン基、チオフェン基、ピロール基、ピラン基、ピリジン基、イミダゾール基、ベンズイミダゾール基、イソチアゾール基、イソクサゾール基、ピラゾール基、ピラジン基、トリアジン基、ピリミジン基、キノリン基、イソキノリン基、インドール基、カルバゾール基等々が含まれるが、これらに制限されない。
用語"ヘテロアリール基"は、芳香族環又は芳香族環類の骨格の少なくとも1原子が、炭素以外の原子である、アリール基を表す。従って、ヘテロアリール基は、窒素、酸素、イオウ原子を含むが、これらに制限されない、群から選択された1以上の非炭素原子を有する。
【0101】
本明細書で用いるように、用語"アシル基"は、有機カルボン酸基を表し、ここでカルボキシル基の−OHは他の置換体(即ち、RCO−で表せるように、ここでRは、アルキル基、又は本明細書で定義されたアリール基である)で置換される。従って、用語"アシル基"は、特に、アセチルフラン基及びフェナシル基のような、アリールアシル基を含む。アシル基の特別な例として、アセチル基及びベンゾイル基が含まれる。
【0102】
"環状"及び"シクロアルキル基"は、約3から約10個の炭素原子、例えば、3,4,5,6,7,8,9又は10炭素原子の、非芳香属性単環式又は多環式環状システムを表す。このシクロアルキル基は、任意に、部分的に不飽和であってもよい。シクロアルキル基は、任意に、本明細書で定義したように、オキソ基及び/又はアルキレン基のような、アルキル基置換体により置換されてもよい。環状アルキル鎖に沿って、任意に、1以上の酸素、硫黄、又は置換した又は非置換の窒素原子を挿入することができて、ここで、窒素置換基は、水素、アルキル基、置換アルキル基、アリール基、又は置換アリール基であり、従って、複素環式置換基を提供する。代表的な単環式シクロアルキル環は、シクロペンチル基、シクロヘキシル基、及びシクロヘプチル基を含む。多環式シクロアルキル環は、アダマンチル、オクタヒドロナフチル基、デカリン、樟脳、カンファン、及びノラダマンチルを含む。
【0103】
用語"複素環"又は"複素環式基"は、環状環の1以上の骨格炭素原子が、ヘテロ原子(例えば、窒素、硫黄、又は酸素原子)により置き換えられたシクロアルキル基(即ち、本明細書に記載された非芳香環、環状基)を表す。複素環の例としては、テトラヒドロフラン、テトラヒドロピラン、モルホリン、ジオキサン、ピペリジン、ピペラジン、及びピロリジンが含まれるが、これらに制限されない。
"アルコキシル基"又は"アルコキシ基"は、アルキル−O−基を表し、ここでアルキル基は、既述の通りである。本明細書の用語"アルコキシル基"は、例えば、メトキシル基、エトキシル基、プロポキシル基、イソプロポキシル基、ブトキシル基、t−ブトキシル基、及びペントキシル基と表すことができる。用語"オキシアルキル基"は、"アルコキシル基"と互換的に用いることができる。
【0104】
"アリールオキシル基"又は"アリールオキシ基"は、アリール−O−基を表し、ここでアリール基は、置換アリール基を含み、既述の通りである。本明細書で用いる用語"アリールオキシル基"は、フェニルオキシル基又はヘキシルオキシル基、及びアルキル基、置換アルキル基、ハロ、又はアルコキシル置換フェニルオキシル基又はヘキシルオキシル基と表すことができる。
"アラルキル基"は、アリール−アルキル基を表し、ここでアリール基及びアルキル基は既述通りであり、また置換アリール基及び置換アルキル基を含む。アラルキル基の例として、ベンジル基、フェニルエチル基、及びナフチルメチル基が含まれる。
"アラルキルオキシル基"又は"アラルキルオキシ基"は、アラルキル−O−基を表し、ここでアラルキル基は既述通りである。アラルキルオキシル基の例として、ベンジルオキシル基がある。
【0105】
用語"アミノ基"は、-NR'R"基を表し、ここでR'及びR"は夫々独立に、H原子、置換及び非置換アルキル基、シクロアルキル基、複素環式基、アラルキル基、アリール基、及びヘテロアリール基を含む群から選択される。幾つかの態様において、このアミノ基は-NH2である。"アミノアルキル基"及び"アミノアリール基"は、-NR'R"基を表し、ここでR'はアミノ基に対して定義されたものであり、及びR"は、夫々、置換又は非置換のアルキル基、又はアリール基である。
"アシルアミノ基"は、アシル−NH−基を表し、ここでアシル基は、既述の通りである。
用語"カルボニル基"は-(C=O)-又は前に名付けた親置換基の炭素原子に付加した2重結合酸素置換体を表す。
用語"カルボキシル基"は、-COOH基を表す。
本明細書で用いる用語"ハロ"、"ハロゲン化物"又は"ハロゲン"は、フルオロ基、クロロ基、ブロモ基、及びヨード基を表す。
用語"ヒドロキシル基"及び"ヒドロキシ基"は、-OH基を表す。
用語"オキソ基"は本明細書に既載の化合物を表し、炭素原子が、酸素原子に置き換えられる。
用語"シアノ基"は、-CN基を表す。
用語"ニトロ基"は、-NO2基を表す。
用語"チオ基"は、本明細書に記載の化合物を表し、炭素原子又は酸素原子が、イオウ原子に置き換えられる。
【0106】
II.造血幹細胞及び前駆細胞及びサイクリン依存性キナーゼ阻害剤
組織特異的幹細胞は、自己再生能があり、これは成熟した哺乳類の一生を通して制御された複製により、これらの細胞自体を置き換える能力があることを意味する。さらに、幹細胞は、非対称的に分裂して、与えられた器官の様々な構成要素を次々に産生する"子孫"又は"前駆"細胞を作り出す。例えば、造血システムにおいて、造血幹細胞は、次々に血液中の全ての分化した構成要素(例えば、白血球、赤血球、リンパ球及び血小板)を産生する前駆細胞を産み出す(図1)。
【0107】
本発明は、成熟哺乳類の初期の造血幹細胞/前駆細胞(HSPC)の特異的生化学的要求に関する。より詳細には、これらの細胞は、細胞複製のために、増殖キナーゼであるサイクリン依存性キナーゼ4(CDK4)及び/又はサイクリン依存性キナーゼ6(CDK6)の酵素活性を要求する。対照的に、成熟哺乳類の大部分の増殖細胞は、CDK4及び/又はCDK6(即ちCDK4/6)の活性を要求しない。これらの分化した細胞は、サイクリン依存性キナーゼ2(CDK2)又はサイクリン依存性キナーゼ1(CDK1)のような、他の増殖性キナーゼを用いて、CDK4/6活性無しに増殖することができる。従って、哺乳類を選択的CDK4/6阻害剤で処理すると非常に制限された幹細胞及び前駆構成要素の増殖阻害(即ち、医薬的休止(PQ))をもたらすことができる。
【0108】
大部分の急性及び重篤な化学療法の毒性は、幹細胞及び前駆細胞への効果を通してである。従って、造血幹細胞及び前駆細胞(HSPC)を化学療法抵抗性にすることは、全生物体を化学療法の急性及び慢性毒性から防護できる。本発明は、選択的CDK4/6阻害剤の投与により、患者の造血幹細胞及び前駆細胞(HSPC)を細胞毒性化合物から防護する方法に関する。如何なる理論に囚われることなく、このような阻害剤の投与は、患者の幹細胞及び前駆細胞を医薬的休止(PQ)状態にさせて、造血幹細胞及び前駆細胞(HSPC)が化学療法化合物の細胞毒効果に対して、増殖細胞より、抵抗性があるようにすることが期待される。
【0109】
従って、幾つかの態様において、本発明は、非毒性の選択的CDK4/6阻害剤(例えば、少なくとも約48,24,20,16,12,10,8,6,4,2,又は1時間より短い間)の一時的処理(例えば、経口摂取可能、非毒性CDK4/6阻害剤)により、造血幹細胞及び前駆細胞を休止状態に誘導することにより、化学療法化合物の急性及び慢性毒性から哺乳類を防護する方法を提供する。休止期の間、患者の造血幹細胞及び前駆細胞(HSPC)は、化学療法化合物の効果から防護される。阻害剤処理が止まった後、造血幹細胞及び前駆細胞(HSPC)は、一時的休止期間から回復して、その後正常に機能する。従って、選択的CDK4/6阻害剤を用いた化学療法抵抗性は、著しい骨髄防護を提供し、及び化学療法後、末梢血液数(ヘマクリット、血小板、リンパ球、及び骨髄細胞)のより急速な回復をもたらすことができる。
【0110】
Davisらの米国特許第6,369,086号(本明細書では、以後「086特許」という。)は、選択的CDK阻害剤は細胞毒性薬剤の毒性を制限する上で重要であり、化学療法誘導性脱毛症から防護するために使用できることを記載する。特に、この086特許は、特異的CDK2阻害剤としてオキシインドール化合物を記載する。関係する雑誌文献(Davis et al., Science, 291, 134-137 (2001))は、CDK2阻害は、細胞周期停止をもたらし、細胞周期活性抗腫瘍薬剤に対する上皮細胞の感受性を減少させ、化学療法誘導性脱毛症を防護することができることを記載するようである。しかしながら、この雑誌文献は後に結果に再現性がないという理由で撤回された。雑誌論文の撤回により疑問が生じた、噂で言われるこれらの選択的CDK2阻害剤の防護的効果と反対に、本発明は、造血幹細胞及び前駆細胞(HSPC)の防護に関係し及び血液学的毒性からの防護に関係する。
【0111】
幹細胞/前駆細胞の防護能は、ガンの治療及び、細胞毒性化学物質への偶然の曝露又は過剰投与効果の緩和の両者において望ましい。阻害剤の前処理(即ち、細胞毒性化合物への曝露が計画されている、又は曝露の危険性がある、患者に対するCDK4/6阻害剤の前処理)、CDK4/6阻害剤及び細胞毒性化合物の同時処理、又はCDK4/6阻害剤の後処理(細胞毒性化合物への曝露後に、CDK4/6阻害剤の処理)を通して、選択的CDK4/6阻害剤の防護的効果を、患者に提供することができる。従って、幾つかの態様において、本発明の方法は、化学療法化合物による治療を受けつつある、又は受けようとする患者に対する化学療法抵抗を提供するための、また患者を細胞毒性化合物に対する他の曝露から防護するための、選択的CDK4/6阻害化合物の使用に関する。
【0112】
本明細書では、用語"選択的CDK4/6阻害化合物"とは、CDK4及びCDK6の少なくとも1つを選択的に阻害する化合物、又はその主な作用がCDK4及び/又はCDK6の阻害によるものである化合物を表す。従って、選択的CDK4/6阻害剤は、一般的に、CDK4及び/又はCDK6に対して、他のキナーゼに対する50%阻害濃度(IC50)より低いIC50を有する化合物である。また幾つかの態様において、選択的CDK4/6阻害剤は、CDK4及び/又はCDK6に対して、他のCDK(例えば、CDK1及び CDK2)に対する化合物のIC50より、少なくとも2,3,4,5,6,7,8,9又は10倍低いIC50を有することができる。また幾つかの態様において、選択的CDK4/6阻害剤は、CDK4及び/又はCDK6に対して、他のCDKに対する化合物のIC50より、少なくとも20,30,40,50,60,70,80,90又は100倍低いIC50を有することができる。また幾つかの態様において、選択的CDK4/6阻害剤は、CDK4及び/又はCDK6に対して、他のCDKに対する化合物のIC50より100倍又は1000倍を超えて低いIC50を有することができる。幾つかの態様において、選択的CDK4/6阻害化合物は、CDK4及びCDK6の両者を選択的に阻害する化合物である。
【0113】
幾つかの態様において、選択的CDK4/6阻害剤は、CDK4/6依存性細胞の選択的G1期停止を誘導する(例えば、細胞をベースとしたin vitro検定で測定されたように)ことができる化合物である。従って、本発明の方法に従い選択的CDK4/6阻害剤を用いて処理した場合、G1期におけるCDK4/6依存性細胞の割合は増加するが、G2/M期及びS期のCDK4/6依存性細胞の割合は減少する。幾つかの態様において、選択的CDK4/6阻害剤は、CDK4/6依存性細胞の、実質的に純粋な(即ち、"きれいな")G1細胞周期停止を誘導する化合物である(例えば、選択的CDK4/6阻害剤を用いた処理は、細胞の大部分が、標準的方法(例えば、ヨウ化プロピジウム(PI)染色又は他の方法)で定義されたG1期停止するように細胞周期停止を誘導し、G2/M期及びS期を合わせた周期にある細胞集団が、全細胞集団の中、20%、15%、12%、10%、8%、6%、5%、4%、3%、2%、1%又はそれ未満である。)
【0114】
非特異的キナーゼ阻害剤である、スタウロスポリンは、幾つかの種類の細胞においてG1期停止を間接的に誘導すると報告されているが(Chen et al., J. Nat. Cancer Inst., 92, 1999-2008 (2000))。細胞におけるG1細胞周期停止(造血幹細胞及び前駆細胞(HSPC)の特定の部分)を直接及び選択的に誘導するために、選択的CDK4/6阻害剤の本発明での使用は、化学的防護を提供することができて、これは長期の毒性が少なく、及びDNA損傷化合物への曝露前に阻害剤を用いた長期にわたる(例えば、48時間又はより長期)治療の必要が無い。特に、幾つかの非選択的キナーゼ阻害剤が、CDK4タンパク質レベルを低下させることにより、幾つかの種類の細胞においてG1期停止を起こすことができるが、本発明の方法の利点は、いかなる理論に束縛されることなく、造血幹細胞及び前駆細胞(HSPC)において細胞内濃度を減らすことなく、CDK4/6のキナーゼ活性を直接阻害する、選択的CDK4/6阻害剤の持つ阻害能に少なくとも部分的によると信じられる。
【0115】
幾つかの態様において、選択的CDK4/6阻害化合物は、実質的にオフターゲット効果(特にCDK4及び/又はCDK6以外のキナーゼの阻害に関係する)がない化合物である。幾つかの態様において、選択的CDK4/6阻害化合物は、CDK4/6以外のCDK(例えば、CDK1 及びCDK2)について阻害剤として劣る(例えば、>1μM IC50)。幾つかの態様において、CDK4/6阻害化合物は、選択的CDK4/6非依存性細胞の細胞周期停止を誘導しない。幾つかの態様において、選択的CDK4/6阻害化合物は、チロシンキナーゼの阻害剤として劣る(例えば、>1μM IC50)。さらに、好ましくないオフターゲット効果として、長期毒性、抗酸化効果、及びエストロゲン様効果がある、がこれらに制限されない。
【0116】
抗酸化効果は、当業者に既知の標準的検定で測定することができる。例えば、最早顕著な抗酸化効果を持たない化合物は、酸素ラジカルのような、フリーラジカルを顕著に捕捉しない。化合物の抗酸化効果は、ゲニステインのような、既知の抗酸化活性を持つ化合物と比較することができる。従って、顕著な抗酸化活性を持たない化合物は、ゲニステインに比べると、抗酸化活性が約2,3,5,10,30,又は100倍低い化合物である。エストロゲン様活性もまた、既知の検定により測定することができる。例えば、非エストロゲン様化合物は、エストロゲン受容体と顕著に結合せず、及びこの受容体を活性化しない化合物である。実質的にエストロゲン様効果フリーである化合物は、エストロゲン様活性を持つ化合物、例えば、ゲニステイン、と比較して、エステロゲン様活性が約2,3,5,10,20,又は100倍低い化合物である。
【0117】
本発明の方法に従って用いることができる選択的CDK4/6阻害剤は、全ての既知の低分子(例えば、<1000ダルトン、<750ダルトン又は<500ダルトンより低分子である)、選択的CDK4/6阻害剤、又はこれらの医薬的に許容された塩を含む。幾つかの態様において、その阻害剤は非天然化合物(即ち、自然界に見出されない化合物)である。幾つかの種類の化学化合物がCDK4/6阻害能を持つとして報告された(例えば、無細胞型検定において)。本発明法において有用な選択的CDK4/6阻害剤は、ピリド[2,3-d]ピリミジン(例えば、ピリド[2,3-d]ピリミジン-7-オン、及び2-アミノ-6-シアノ-ピリド[2,3-d]ピリミジン-4-オン)、トリアミノピリミジン、アリール[a]ピロロ[3,4-d]カルバゾール、窒素含有ヘテロアリール置換尿素、5-ピリミジニルl-2-アミノチアゾール、ベンゾチアジアジン、アクリジンチオン、及びイソキノロンを含むが、これらに制限されない。
【0118】
幾つかの態様において、このピリド[2,3-d]ピリミジンは、ピリド[2,3-d]ピリミジノンである。幾つかの態様において、このピリド[2,3-d]ピリミジノンは、ピリド[2,3-d]ピリミジン-7-オンである。幾つかの態様において、このピリド[2,3-d]ピリミジン-7-オンは、アミノアリール基又はアミノヘテロアリール基により置換される。幾つかの態様において、このピリド[2,3-d]ピリミジン-7-オンは、アミノピリジン基により置換される。幾つかの態様において、このピリド[2,3-d]ピリミジン-7-オンは、2-(2-ピリジニル)アミノ-ピリド[2,3-d]ピリミジン-7-オンである。例えば、このピリド[2,3-d]ピリミジン-7-オン化合物は、その全体が参照文献として取り込まれているBarvianらの米国特許公開2007/0179118に記載の化学式(II)の構造であってもよい。幾つかの態様において、このピリド[2,3-d]ピリミジン化合物は、6-アセチル-8-シクロペンチル-5-メチル-2-(5-ピペラジン-1-イル-ピリジン-2-イルアミノ)-8H-ピリド-[2,3-d]-ピリミジン-7-オン(即ち、PD 0332991)又はこの医薬的に許容可能な塩である(Toogood et al., J. Med. Chem., 2005, 48, 2388-2406)。
幾つかの態様において、このピリド[2,3-d]ピリミジノンは、2-アミノ-6-シアノ-ピリド[2,3-d]ピリミジン-4-オンである。2-アミノ-6-シアノ-ピリド[2,3-d]ピリミジン-4-オンを含む選択的CDK4/6阻害剤は、例えば、Tu等により開示されている(Tu et al., Bioorg. Med. Chem. Lett., 2006, 16, 3578-3581)。
【0119】
本明細書の"トリアミノピリミジン"は、ピリミジン環の少なくとも3個の炭素が、化学式-NR1R2を持つ置換基で置き換えられているピリミジン化合物であり、ここでR1及びR2は、水素原子、アルキル基、アラルキル基、シクロアルキル基、複素環、アリール基、及びヘテロアリール基からなる群から独立に選択される。各R1及びR2のアルキル基、アラルキル基、シクロアルキル基、複素環、アリール基、及びヘテロアリール基は、さらに1以上の水酸基、ハロ基、アミノ基、アルキル基、アラルキル基、シクロアルキル基、複素環式基、アリール基、又はヘテロアリール基により置換されてもよい。幾つかの態様において、アミノ基の少なくとも1個は、構造-NHRを持つアルキルアミノ基であり、ここでRは、C1〜C6アルキル基である。幾つかの態様において、少なくとも1つのアミノ基は、化学式-NHRを持つシクロアルキルアミノ基、又は水酸基により置換されたシクロアルキルアミノ基であり、ここでRは、水酸基により置換された、又は非置換の、C3〜C7シクロアルキル基である。幾つかの態様において、少なくとも1個のアミノ基は、ヘテロアリール基−置換アミノアルキル基であり、ここでヘテロアリール基は、さらに、アリール基置換体により置換されてもよい。
【0120】
アリール[a]ピロロ[3,4-d]カルバゾールは、ナフチル[a]ピロロ[3,4-c]カルバゾール、インドロ[a]ピロロ[3,4-c]カルバゾール、キノリニル[a]ピロロ[3,4-c]カルバゾール及びイソキノリニル[a]ピロロ[3,4-c]カルバゾールを含むが、これらに制限されない(Engler et al., Bioorg. Med. Chem. Lett., 2003, 13, 2261-2267; Sanchez-Martinez et al., Bioorg. Med. Chem. Lett., 2003, 13, 3835-3839; Sanchez-Martinez et al., Bioorg. Med. Chem. Lett., 2003, 13, 3841-3846; Zhu et al., Bioorg. Med. Chem. Lett., 2003, 13, 1231-1235; 及びZhu et al., J. Med Chem., 2003, 46, 2027-2030)。適切な、アリール[a]ピロロ[3,4-d]カルバゾールはまた、米国特許公開2003/0229026及び2004/0048915に開示されている。
【0121】
含窒素ヘテロアリール置換尿素は、尿素の窒素原子の1個が、含窒素ヘテロアリール基により置換されている、尿素部分を含む化合物である。含窒素ヘテロアリール基は、少なくとも1個の窒素原子を含む5から10員のアリール基を含むが、これらに制限されない。従って、含窒素ヘテロアリール基は、例えば、ピリジン、ピロール、インドール、カルバゾール、イミダゾール、チアゾール、イソクサゾール、ピラゾール、イソチアゾール、ピラジン、トリアゾール、テトラゾール、ピリミジン、ピリダジン、プリン、キノリン、イソキノリン、キノクサリン、シンノリン、キナゾリン、ベンズイミダゾール、フタリミド、等々を含む。幾つかの態様において、この含窒素ヘテロアリール基は、1個以上のアルキル基、シクロアルキル基、複素環式基、アラルキル基、アリール基、ヘテロアリール基、ヒドロキシル基、ハロ基、カルボニル基、カルボキシル基、ニトロ基、シアノ基、アルコキシル基、又はアミノ基により置換されてもよい。幾つかの態様において、含窒素ヘテロアリール置換尿素は、ピラゾール-3-イル尿素である。ピラゾールはさらに、シクロアルキル基又は複素環式基により置換されてもよい。
【0122】
幾つかの態様において、このピラゾール-3-イル尿素は:
【化1】

である(Ikuta, et al., J. Biol. Chem., 2001, 276, 27548-27554)。本発明に従い使用することができる更なる尿素としては、米国特許公開2007/0027147に記載された化学式(I)のビアリール尿素化合物である。また、Honma et al., J. Med. Chem., 2001, 44, 4615-4627; 及び Honma et al., J. Med. Chem., 2001, 44, 4628-4640を参照されたい。
【0123】
適切な5-ピリミジニル-2-アミノチアゾールCDK4/6阻害剤は、Shimamura等により開示載されている(Shimamura et al., Bioorg. Med. Chem. Lett., 2006, 16, 3751-3754)。幾つかの態様において、この5-ピリミジニル2-アミノチアゾールは:
【化2】

の構造を有する。
【0124】
有用なベンゾチアジアジン及びアクリジンチオン化合物は、例えば、Kubo等により開示された化合物を含む(Kubo et al., Clin. Cancer Res. 1999, 5, 4279-4286 及びその全体が参考文献に取り込まれている米国特許公開2004/0006074)。幾つかの態様において、このベンゾチアジアジンは、1個以上のハロ基、ハロアリール基、又はアルキル基により置換される。幾つかの態様において、このベンゾチアジアジンは、4-(4-フルオロベンジルアミノ)-1,2,3-ベンゾチアジアジン-1,1-ジオキシド、3-クロロ-4-メチル-4H-ベンゾ[e][1,2,4]チアジアジン1,1-ジオキシド、及び3-クロロ-4-エチル-4H-ベンゾ[e][1,2,4]チアジアジン-1,1-ジオキシドからなる群より選択される。幾つかの態様において、このアクリジンチオンは、1個以上のアミノ基又はアルコキシ基により置換される。幾つかの態様において、このアクリジンチオンは、3-アミノ-10H-アクリドン-9-チオン (3ATA)、9(10H)-アクリジンチオン、1,4-ジメトキシ-10H-アクリジン-9-チオン、及び2,2'-ジフェニルジアミン-bis-[N,N'-[3-アミド-N-メチルアミノ]-10H-アクリジン-9-チオン]]からなる群から選択される。
【0125】
幾つかの態様において、本発明の方法の患者は、細胞増殖性の疾患に対する治療の間に、化学療法化合物の曝露を受けた、曝露を受けている途中である、又は曝露される予定である患者である。このような疾患は、ガン性の又は非癌性の増殖性疾病である。例えば、本発明の化合物は、乳癌、前立腺癌、卵巣癌、皮膚癌、肺癌、結腸癌、脳腫瘍(即ち、神経膠腫)及び腎臓癌を含むが、これらに制限されない、幅広い種類の腫瘍の化学療法治療の間に、健康な造血幹細胞及び前駆細胞を防護する上で有効であると信じられている。
【0126】
選択的CDK4/6阻害剤は、それ自体が、ガン細胞の増殖を停止させることにより、化学療法化合物の有効性を失効させないことが好ましいので、理想的には、化学療法化合物により治療されているガンの増殖は、選択的CDK4/6阻害剤により影響を受けるべきでない。大部分のガンは、増殖性キナーゼ類を無差別に用いることができる(例えば、CDK1/2/4/又は6を用いることができる)、又はCDKにより不活性化される網膜芽腫腫瘍抑制タンパク質(RB)機能を欠失しているので、増殖に対して、CDK4/6の活性に依存しないようである。従って、CDK4/6単独の阻害は、大部分のガンの化学療法応答に影響するはずがない。当業者は理解するように、ある種の腫瘍のCDK4/6阻害に対する潜在的な感受性は、腫瘍の種類及び分子遺伝学に基づいて推量することができる。CDK4/6の阻害の影響を受けないと予想されるガンは、CDK1又はCDK2の活性増加、網膜芽腫腫瘍抑制タンパク質(RB)の喪失又は不在、高いMYC発現、サイクリンEの増加及びサイクリンAの増加を含む、がこれらに制限されない、群の1以上により特徴付けられるガンである。このようなガンとしては、肺小細胞癌、網膜芽腫、子宮頸癌、及びある種の頭頚部ガンのようなHPV陽性悪性腫瘍、Burkittsリンパ腫のようなMYC増幅腫瘍、及びトリプルネガティブ乳癌;ある種の肉腫、ある種の非肺小細胞癌、ある種のメラノーマ、ある種の膵臓癌、ある種の白血病、ある種のリンパ腫、ある種の脳腫瘍、ある種の大腸癌、ある種の前立腺癌、ある種の卵巣癌、ある種の子宮癌、ある種の甲状腺及び他の内分泌組織癌、ある種の唾腺癌、ある種の胸腺腫、ある種の腎臓癌、ある種の膀胱癌、及びある種の睾丸癌が含まれる、がこれらに制限されない。
【0127】
例えば、幾つかの態様において、ガンは、肺小細胞癌、網膜芽腫、及びトリプルネガティブ(ER/PR/Her2陰性)又は基底膜細胞型(basal-like)乳癌から選択される。肺小細胞癌及び網膜芽腫は、殆ど常に、網膜芽腫腫瘍抑制タンパク質(RB)を不活性化しており、従って、増殖のためにCDK4/6活性を要求しない。従って、CDK4/6阻害剤処理は、骨髄及び他の正常宿主の医薬的休止(PQ)に影響するであろうが、腫瘍の医薬的休止(PQ)には影響しないであろう。トリプルネガティブ(基底膜細胞型)乳癌もまた、殆ど常に、網膜芽腫腫瘍抑制タンパク質(RB)-ヌルである。また、ある種のウィルス誘発性ガン(例えば、子宮頸癌、及び頭頚部癌の一部)はウィルスタンパク質(E7)を発現し、これは網膜芽腫腫瘍抑制タンパク質(RB)を不活性化しこれらの腫瘍を機能的にRB-ヌルにする。幾つかの肺癌はまた、HPVにより引き起こされると信じられている。当業者に理解されるように、CDK4/6阻害剤により影響を受けないと予想されるガン(例えば、RB-ヌルのガン、ウィルスタンパク質E7を発現するガン、又はMYCを過剰発現するガン)は、DNA解析、免疫染色、Westernブロット解析、及び遺伝子発現プロファイリングを含む、がこれらに制限されない、方法により決定される。
【0128】
部分的に、選択的CDK4/6阻害剤を用いた化学防護処理の効果は、外因性成長因子(例えば、顆粒球コロニー刺激因子(G-CSF)及びエリスロポエチン)の使用で見られる効果と比較しうることが予期される。しかしながら、選酪的CDK4/6阻害化合物を用いた処理は、以前報告された治療では、有効に行うことができなかった、血小板及びリンパ球の抑制を改善することができるという点に多くの利点を有するはずである。従って、本発明の方法を、化学療法薬剤誘導性血小板減少症及びリンパ球減少症を緩和するために用いることができる。
【0129】
さらに、選択的CDK4/6阻害剤を用いた治療は、幹細胞により早い速度の増殖を強いないであろう。強いられた増殖は、DNA損傷の影響を改善することを意図した成長因子補助を受けたヒト及びマウスにおいて見られる後期の、及び長期の骨髄毒性を、強めることができるのでこのことは好ましい(Herodin et al., Blood, 2003, 101, 2609-2616; Hershman et al., J. Natl. Cancer Inst., 2007, 99, 196-205; 及び Le Deley et al., J. Clin. Oncol., 2007, 25, 292-300)。幾つかのグループは、顆粒球コロニー刺激因子(G-CSF)の使用は、ガンを克服したガン患者において、後期の(化学療法後>3年)骨髄毒性(例えば、骨髄形成異常症)の発生を顕著に増やすということを報告した。幾つかのグループはまた、EPO及び関連する赤血球増加刺激化合物は、化学療法を受けた患者の癌関連死亡率を増加させる様であると報告した(Khuri, N. Engl. J. Med., 2007, 356, 2445-2448)。このことはEPOが、腫瘍増殖又は腫瘍脈管形成の刺激能を表すかどうかは確かではないが、これらの治験は、腫瘍学の分野におけるEPOの使用に対する主要な障害を指摘する。医薬的休止(PQ)は、腫瘍増殖を促進するとは期待されず、及びEPOの使用が禁忌された場合に、赤血球細胞数を増加させるために、治療において安全に用いることができるであろう。
【0130】
幾つかの他の利点を、選択的CDK4/6阻害剤を用いた化学防護方法は結果として生ずることができる。健康な細胞に関して、選択的CDK4/6阻害剤により与えられた化学毒性の減少は、ガン細胞の成長及び増殖を減少させる化学療法化合物の効力に影響を与えないと予想される。さらに、化学毒性の減少は、投与の強化(例えば、より高い投与量及び/又は与えられた期間又はより短い投与期間でのより高い投与量)を可能にすることが期待され、このことはより良い有効性と言い換えられるだろう。従って、本明細書で開示した方法は、より少ない毒性及びより高い有効性である、化学療法体制をもたらすことができる。
【0131】
また、外因性の生物成長因子を用いた防護的治療と比較して選択的CDK4/6阻害剤は、多くの低価格の、経口的に可能な低分子を含み、これらの低分子を、多くの異なる経路を経て投与するために処方することができる。ふさわしい場合には、このような低分子を、経口、局所、鼻腔内、吸入、静脈内、又はすべての他の投与法のために処方することができる。さらに、生物製剤と反対に、安定な低分子はより容易に備蓄し、保存することができる。従って、細胞毒性(例えばDNA損傷性)化合物に対して化学事故により曝露された患者が、報告できる救急室に、又は化学物質又は薬剤製造設備又は化学研究実験室を含め、化学的曝露が特に生じ易い場所に、選択的CDK4/6阻害化合物を、より容易に、安価に常備することができる。
【0132】
選択的CDK4/6阻害剤を、非ガン性増殖性疾患における異常組織への化学療法薬剤治療の間、健康な造血幹細胞及び前駆細胞を防護する上でも用いることができるが、非ガン性増殖性疾患としては、新生児の多発性血管腫症、二次的進行性多発性硬化症、慢性進行性骨髄萎縮症、神経線維腫症、神経節神経腫症、ケロイド形成、骨のPaget病、乳房線維嚢胞病、Perony及びDuputren線維症、再発狭窄症、及び肝硬変が含まれるが、これらに制限されない。さらに、選択的CDK4/6阻害剤は、化学事故による曝露又は過剰投与(例えば、メトレキサート過剰投与)におけるDNA損傷性(例えば、インターカレーション、又はアルキル化を起こす)化合物の影響を改善するために用いることができる。従って、本明細書に開示した方法は、化学プラント作業者、化学研究者、及び例えば、化学物質流出のような、職業上の曝露からの救急報告者、を防護するために用いることができる。
【0133】
本発明に従い、化学防護化合物が、化学療法薬剤の投与前、投与中、又は投与後に投与される限り、化学療法薬剤を、治療の所定の進行と一致した如何なる計画でも、及び如何なる投与量でも、患者に対して投与することができる。一般的に、化学防護化合物は、化学治療化合物への曝露の24時間前から曝露24時間後までの範囲の時間内に患者に投与される。しかしながら、この時間期間は、化学療法薬剤への曝露前24時間より前の時間に延ばすことができる(化合物が適切な血漿濃度に達するに要する時間及び/又は化合物の血漿内での半減期に基づいて)。さらに、CDK4/6阻害剤のより遅い投与が、少なくとも幾らかの防護効果をもたらす限り、この時間期間は、化学療法化合物又は他のDNA損傷性化合物に対する曝露後24時間より長く伸ばすことができる。このような、曝露後治療は、事故による曝露又は過剰投与の場合特に有用であることができる。
【0134】
幾つかの態様において、この選択的CDK4/6阻害剤を、化学療法薬剤の投与前のある時間期間に患者に投与することができて、その結果選択的CDK4/6阻害剤の血漿レベルは、化学療法化合物の投与時にピークとなる。もし都合良ければ、治療投薬計画を簡単にするために、この選択的CDK4/6阻害剤を、化学療法薬剤と同時に投与することができる。幾つかの態様において、化学防護剤及び化学療法薬剤を、単一処方物として提供することができる。
必要ならば、化学防護化合物の多数回投与を患者に行うことができる。あるいは、患者は、単回の選択的CDK4/6投与を受けることができる。化学治療及び化学防護剤治療のコースは、患者から患者で異なることができて、及び与えられた臨床施設において、当業者は、直ちに適切な投与量及び化学療法薬剤及び関係する化学防護剤治療計画を決めることができる。
【0135】
III.活性化合物、塩、及び処方物
本明細書で用いる用語"活性化合物"は、選択的CDK4/6阻害剤化合物又はこれらの医薬的に許容された塩である。活性化合物を、いかなる適切な方法でも患者に投与することができる。投与された活性化合物の量及びタイミングは、勿論、治療される患者、患者が被爆中の、被爆した、又は被爆すると予想されるDNA損傷性化合物の投与量、投与の方法、活性化合物の薬物動力学的特徴、及び処方する医師の判断に依存する。従って、患者が多様なので、以下の投与量は、ガイドラインであり、及び医師が患者に対して適切と考える治療するために、医師は化合物の投与量を徐々に増量することができる。望ましい治療を考えて、医師は、年齢、患者の体重、既往症の存在、及び他の疾患の存在のような様々な因子をバランスすることができる。医薬処方物は、以下により詳細に考察するように、経口、静脈内、又は噴霧剤投与を含むが、これらに制限されない、いかなる投与ルートに対しても調製することができる。
【0136】
この使用が本明細書の態様の範囲内である、特定の活性化合物の治療上有効な投与量は、化合物から化合物、患者によって幾らか異なってもよく、患者の状態及び投与経路により異なってもよい。一般的提案として、約0.1から約200mg/kgの投与量は、治療上の有効性を持ち、ここで全ての重さは、活性化合物の重さに基づいて計算され、塩を用いる場合を含む。幾つかの態様において、投与量は、活性化合物の血清濃度が約1及び5μMの間まで、又はより高い濃度を提供するに必要な化合物の量であってもよい。より高い濃度における毒性が心配ならば、静脈内投与量を、約10mg/kgまでのような、より低レベルに制限してもよく、ここで全ての重さは、活性化合物の重さに基づいて計算され、塩を用いる場合を含む。経口投与の場合、約10mg/kgから約50mg/kgまでの投与量を用いることができる。一般的に、約0.5mg/kgから5mg/kgまでの投与量を筋肉内注射に用いることができる。幾つかの態様において、投与量は約1μmol/kgから約50μmol/kgであってもよく、又は、任意に、静脈内又は経口投与に対して、約22μmol/kg及び約33μmol/kgであってもよい。
【0137】
本発明の方法に従い、本明細書に記載した医薬的に活性な化合物を、固体又は液体として経口的に、又は溶液、懸濁物又は乳濁液として、筋肉内、静脈内、又は吸入により投与することができる。幾つかの態様において、この化合物又は塩を、リポソーム懸濁液として、吸入、静脈内、又は筋肉内に投与することができる。吸入を通して投与する際、この活性化合物又は塩は、約0.5から約5μmの、任意に約1から約2μmまでの粒子サイズを持つ、複数の固体粒子又はドロップ状であってもよい。
【0138】
医薬処方物は、全ての医薬的に許容された担体中の、本明細書に記載した活性化合物又はこの化合物の医薬的に許容された塩を含むことができる。溶液を望む場合、水溶性の化合物又は塩に関しては、水が選択される担体である。水溶性の化合物又は塩に関して、グリセロール、プロピレングリコール、ポリエチレングリコール、又はこれらの混合物のような有機媒体が適切である。後者の場合、有機媒体は、かなりの量の水を含むことができる。どちらの場合の溶液も、当業者が既知の適切な処方で滅菌することができて、及び一般的には0.22μmフィルターを通す。滅菌の後、この溶液を、ピロゲンを除いたガラスバイアルのような、適切な容器に分配することができる。この分配を、任意に無菌的方法で行うことができる。滅菌的密封をガラスバイアルに施し、必要なら、バイアルの内容物を凍結乾燥することができる。
【0139】
活性化合物又はその塩に加えて、医薬処方物は、pH調節添加物のような、他の添加物を含むことができる。特に、有用なpH調節試薬は、塩酸のような酸、塩基、乳酸ナトリウム、酢酸ナトリウム、リン酸ナトリウム、クエン酸ナトリウム、ホウ酸ナトリウム、又はグルコン酸ナトリウムのような緩衝剤を含む。さらに、この処方物は、抗菌保存剤を含むことができる。有用な抗菌保存剤としては、メチルパラベン、プロピルパラベン、及びベンジルアルコールがある。抗菌保存剤は、一般的に、処方物が、複数回投与使用のためにデザインされたバイアルに置かれる際に用いられる。本明細書に記載した医薬処方物は、当業者に既知の方法で、凍結乾燥できる。
【0140】
経口投与のために、医薬組成物は、溶液、懸濁液、錠剤、ピル、カプセル、粉末等々の形をとることができる。クエン酸ナトリウム、炭酸カルシウム、リン酸カルシウムのような様々な賦形剤を含む錠剤が、ポリビニルピロリドン、砂糖、ゼラチン、及びアカシアのような結合剤と共に、澱粉、(例えば、ジャガイモ、又はタピオカ澱粉)及びある種の複合ケイ酸塩のような錠剤分解物質と共に用いられる。さらに、ステアリン酸マグネシウム、ラウリル硫酸ナトリウム、及び滑石のような潤滑剤が錠剤作成目的に非常に有用である。同様の種類の固体組成物がまた、硬軟に調合したジェラチンカプセルの充填物として用いられる。これに関連する材料としてまた、ラクトース又はミルク砂糖及び高分子量ポリエチレングリコールが含まれる。経口投与のために、水性の懸濁物及び/又はエリクシルを好む場合、本発明の化合物を様々な甘味料、芳香剤、着色剤、乳化剤、及び/又は懸濁化剤、及び水、エタノール、プロピレングリコール、グリセリン及びこれらの類似の組合せのような稀釈剤と組み合わせることができる。
【0141】
本明細書に記載した発明の他の態様において、本明細書で記載した活性化合物、又はこの塩を、密閉した容器内に単位投与量の形で含む、注射可能な、安定な、滅菌した処方物を提供する。この化合物又は塩は、適切な医薬的に許容可能な担体とともに再構成し、患者へのこの化合物の注射に適した液体処方物を作成することができる、凍結乾燥物の形で提供される。この化合物又は塩が、実質的に非水溶性の場合、医薬的に許容された、充分量の乳化剤を充分量使って、水溶性担体中の化合物又は塩を乳化することができる。特に有用な乳化剤は、ホスファチジルコリン及びレシチンである。
【0142】
本明細書で提供された他の態様は、本明細書に開示した活性化合物のリポソーム処方物を含む。リポソーム懸濁液の作成法は、当業者に既知である。化合物が水溶性の塩である時、従来のリポソーム技術を用いて、脂質小胞にこの化合物を取り込むことができる。このような例として、活性化合物が水に溶解度があるので、活性化合物は実質的に親水性中心又はリポソームのコアに取り込まれる。用いられる脂質層は、全ての従来の組成であることができて、及びコレステロールを含むことができるか、又はコレステロールフリーであってもよい。当該の活性化合物が、水に不溶な場合、再び従来のリポソーム作成技術を用いて、塩を、リポソームの構造をとる実質的に疎水性脂質2重層に取り込むことができる。どちらの場合も標準的超音波処理及び均一化技術を用いて、作成するリポソームはサイズを小さくできる。本明細書に開示した活性化合物を含むリポソーム処方物を、凍結乾燥して、凍結乾燥物とさせ、水のような医薬的に許容された担体を用いて再構成して、リポソーム懸濁物を再構成することができる。
【0143】
吸入による噴霧物としての投与に適した医薬処方物がまた提供される。これらの処方物は、本明細書に記載した所望の化合物又はこの塩の溶液又は懸濁液、又はこの化合物又は塩の複数の固体粒子を含む。所望の処方物を小チャンバーに入れて噴霧化する。噴霧化は、圧縮空気又は超音波エネルギーにより行い、この化合物又は塩を含む複数の液滴又は固体粒子を形成することができる。この液滴又は固体粒子は、約0.5から約10μm、任意に約0.5から約5μmの粒子サイズの範囲に有るべきである。この固体粒子は、微粉化のような、当業者に既知のいかなる適切な方法によってでも、固体化合物又はこの塩を加工して得ることができる。任意に、固体粒子又は液滴のサイズは、約1μmから約2μmであってもよい。この点に関して、この目的を達成するために市販の噴霧器を用いることができる。この化合物を、その開示全体が本明細書の参考文献に取り込まれている米国特許第5,628,984号に示された方法で、吸入できる粒子の煙霧状の懸濁物を通して投与してもよい。
投与に適した煙霧剤としての医薬処方物が液体状の場合、この処方物は、水を含む担体中の水溶性活性化合物を含むことができる。処方物の表面張力を充分低下させ、噴霧器で使われた時、所定のサイズ範囲内の液滴を作ることができる、界面活性剤は存在してもよい。
【0144】
指摘したように、水溶性及び非水溶性活性化合物が提供される。本明細書で用いるように、用語"水溶性"は、約50mg/mLより多量に水に可溶な全ての組成物を定義することを意味する。また、本明細書で用いるように、用語"非水溶性"は、約20mg/mL未満の水への溶解度を持つ全ての組成物を定義することを意味する。幾つかの態様において、水溶性化合物又は塩は、好ましいが、他の態様において、非水溶性化合物又は塩は同様に好ましい。
【0145】
本明細書の用語"医薬的に許容される塩"は、充分な医学的判定の範囲で、過度な毒性、炎症、アレルギー反応、等々無しに、患者(例えば、ヒト患者)と接触した使用に適し、合理的な利点/危険性比と釣り合い、意図した使用に有効であり、さらに本発明の化合物のできたら両性イオンの型である塩を表す。
従って、用語"塩"は、本発明の化合物の相対的に非毒性の、無機酸及び有機酸の付加塩を表す。これらの塩を、化合物の最終的分離と精製の間in situで製造することができる、又は塩基フリーの形に精製した化合物を適切な有機酸又は無機酸と別々に反応させ、及びこのように作成した塩を単離して製造してもよい。本発明の化合物が塩基性化合物である限り、様々な無機酸及び有機酸と反応して広く様々な異なる塩を形成してもよい。このような塩は、動物に投与するためには、医薬的に許可されなければならないが、実際上、最初、反応混合物から塩基性化合物を医薬的に許可されない塩として分離し、その後アルカリ性試薬との処理で、フリー塩基化合物に変換し、その後、このフリー塩基を医薬的に許可される酸付加塩に変換することがしばしば望ましい。塩基性化合物の酸付加塩は、従来の方法で塩を作成するために、フリー塩基型を十分量の所定の酸と接触させて調製する。このフリー塩基型は、塩型を塩基と接触させ、フリー塩基を従来の方法で単離して、産生できる。このフリー塩基型は、夫々の塩型と、極性溶媒への溶解度のようなある種の物理的特徴において幾らか異なるが、他の点で、本発明の目的のために、塩は夫々のフリー塩基と等価である。
【0146】
医薬的に許可される塩基付加塩は、アルカリ及びアルカリ土金属水酸化物のような金属又はアミンと共に、又は有機アミンの形で作成される。カチオンとして用いられる金属の例は、ナトリウム、カリウム、マグネシウム、カルシウム、等々を含む、がこれらに制限されない。適切なアミンの例として、N,N'-ジベンジルエチレンジアミン、クロロプロカイン、コリン、ジエタノールアミン、エチレンジアミン、N-メチルグルカミン及びプロカインが含まれる、がこれらに制限されない。
酸性化合物の塩基付加塩は、従来の方法で塩を作成するために、フリー酸型を十分な量の所定の塩基と接触させて調製する。フリー酸型は、塩型を酸と接触させ、及び従来の方法でフリー酸を単離して産生してもよい。フリー酸型は、それぞれの塩型と、極性溶媒への溶解度のようなある種の物理的特徴において幾らか異なるが、他の点で、本発明の目的のために、塩は夫々のフリー酸と等価である。
【0147】
塩を、塩化水素の、硝酸の、リン酸の、硫酸の、臭化水素の、ヨウ化水素の、リン酸の、等々のような、無機酸硫酸塩、ピロ硫酸塩、重硫酸塩、亜硫酸塩、重亜硫酸塩、硝酸塩、リン酸塩、リン酸1水素塩、リン酸2水素塩、メタリン酸塩、ピロリン酸塩、塩化物、臭化物、ヨウ化物から作成してもよい。代表的塩としては、臭化水素塩、塩化水素塩、硫酸塩、重硫酸塩、硝酸塩、酢酸塩、シュウ酸塩、吉草酸塩、オレイン酸塩、パルミチン酸塩、ステアリン酸塩、ラウリン酸塩、ホウ酸塩、安息香酸塩、乳酸塩、リン酸塩、トシラート、クエン酸塩、マレイン酸塩、フマル酸塩、コハク酸塩、酒石酸塩、ナフチル酸塩メシラート、グルコヘプタン酸塩、ラクトビオン酸塩、ラウリルスルホン酸塩及びイセチオン酸塩、等々を含む。塩はまた、脂肪族モノー、及びジカルボン酸、フェニル置換アルカン酸、ヒドロキシアルカン酸、アルカン二酸、芳香族酸、脂肪族及び芳香族スルホン酸、他、等々のような有機酸から作成される。代表的塩としては、酢酸塩、プロピオン酸塩、カプリル酸塩、イソブチル酸塩、シュウ酸塩、マロン酸塩、コハク酸塩、スベリン酸塩、セバシン酸塩、フマル酸塩、マレイン酸塩、マンデル酸塩、安息香酸塩、クロロ安息香酸塩、メチル安息香酸塩、ジニトロ安息香酸塩、フタル酸塩、ベンゼンスルホン酸塩、トルエンスルホン酸塩、フェニル酢酸塩、クエン酸塩、乳酸塩、マレイン酸塩、酒石酸塩、メタンスルホン酸塩、等々を含む。医薬的に許容される塩は、ナトリウム、リチウム、カリウム、カルシウム、マグネシウム、等々のような、アルカリ及びアルカリ土金属をベースとしたカチオン、及び非毒性アンモニウム、第四級アンモニウム、及びアンモニウム、テトラメチルアンモニウム、テトラエチルアンモニウム、メチルアミン、ジメチルアミン、トリメチルアミン、トリエチルアミン、エチルアミン等々を含む、がこれらに制限されない、アミンカチオンを含むことができる。アルギニン塩、グルコン酸塩、ガラクツロン酸塩等々のアミノ酸塩もまた検討される。参考文献に取り込まれている、Berge et al., J. Pharm. Sci., 1977, 66, 1-19を参照。
【0148】
IV. 化学防護活性を持つ化合物をスクリーニングする方法
幾つかの態様において、本発明は、化学防護化合物を選択する方法を提供する。特に、本発明は、健康な細胞において、一時的休止を作り出し、腫瘍を細胞毒性(例えば、DNA損傷性)化合物又は他の試薬(例えば、電離放射線)を用いて治療することを可能にするが、長期の(又は他の不都合な)毒性を引き起こさない、及び長期の前処理期間無しに化学防護を提供することができる化学防護化合物を選択する方法を提供する。幾つかの態様において、1以上の細胞をベースとした検定により、試験化合物又は化合物類をスクリーニングすることが望まれる。細胞をベースとした検定の使用は、非細胞ベースの検定においてCDK4/6阻害能を持つ化合物の有効性を確認することができて、不都合なオフターゲット効果を持つ化合物を除外する上で役立つ。本明細書に記載する、この細胞に基づく検定スクリーニング法が、化合物のin vivoでの化学防護能を予言することを示す。
【0149】
幾つかの態様において、本発明は、健康な細胞における細胞毒性化合物の効果を防ぐために使用する化合物のスクリーニング方法であって、(i)試験化合物をCDK4/6依存性細胞集団に一定時間接触させる段階、(ii)前記細胞集団の細胞周期を解析する段階、及び(iii)前記細胞集団において選択的にG1期停止を誘導する試験化合物を選択する段階から成る方法である。
幾つかの態様において、このスクリーニングは、実質的に純粋なG1停止(即ち、実質的にG2/M又はS期停止がない、又は20, 15, 12, 10, 8, 6, 5, 4, 3, 2又は1%より少ないG2/M及び/又はS期停止)を誘導する試験化合物を選択することを含む。
【0150】
適切な試験化合物は、様々な異なる化合物を含む。例えば、この試験化合物は、CDK4/6阻害効果を有すると知られている、又は疑われている化合物であってもよい。試験化合物は、無細胞検定によりCDK4/6阻害効果が知られている化合物を含むことができる。幾つかの態様において、この試験化合物を、本明細書で既に記載した化合物のような、ピリド[2,3-d]ピリミジン(例えば、ピリド[2,3-d]ピリミジン7-オン及び2-アミノ-6-シアノ-ピリド[2,3-d]ピリミジン-4-オン)、トリアミノピリミジン アリールl[a]ピロロ[3,4-d]カルバゾール、窒素含有 ヘテロアリール-置換尿素、5-ピリミジニル-2-アミノチアゾール、ベンゾチアジアジン、アクリジンチオン、及びイソキノロンを含むが、これらに制限されない群から選択してもよい。
【0151】
本明細書に開示した方法に従う使用のために適した細胞集団は、不死化ヒト二倍体繊維芽細胞(tHDF)又はCDK4/6依存性ガン細胞株を含むが、これらに制限されない。幾つかの態様において、このCDK4/6依存性ガン細胞株は、INK4a/ARF欠失ガン細胞株である。幾つかの態様において、この細胞集団を、細胞集団の細胞周期解析を行う前に、24時間以下の間(例えば、24, 23, 22, 21, 20, 19, 18, 17, 16, 15, 14, 13, 12, 11, 10, 9, 8, 7, 6, 5, 4, 3, 2又は1時間)試験化合物と接触してもよい。すべての適切な試験化合物量を細胞集団との接触に用いることができる。例えば、細胞集団と接触するために用いる試験化合物の適切な量は、化合物に関する既知のデータ(例えば、無細胞キナーゼ阻害研究により測定される既知のIC50)に基づくことができる。スクリーニングはさらに、複数の細胞集団の試験化合物処理を含むことができるが、処理用量依存効果を測定するために、ここで複数の細胞集団の各々は、異なる濃度の特定の試験化合物で処理される。
【0152】
細胞集団を試験化合物と所定の時間接触させた後、特定の細胞周期(例えば、G1期、G2/M期、又はS期)又は複数の周期にある細胞の割合(%)を測定するために、細胞周期解析を行った。比較のために、試験化合物で処理してない細胞集団についても細胞周期解析を行うことができる。
細胞集団の細胞周期を検定する方法は当業者には既知であり、及び、例えば、米国特許公開2002/0224522に記載される。細胞周期は、フローサイトメトリー解析、顕微鏡解析、密度勾配遠心法、エルトリエーション法、及び免疫蛍光法(例えば、前記のどの技術との組合せで用いることもできる)を含む蛍光技術を含む様々の方法で検定できる。フローサイトメトリー法は、例えば、ヨウ化プロピジウム(PI)のようなDNA結合色素のような標識試薬又は標識染色剤で細胞を処理すること、及び細胞DNA含量をフローサイトメトリーにより解析すること、を含む。免疫蛍光法は、例えば、蛍光抗体を伴うチミジン類似体(例えば、5−ブロモ−2−デオキシウリジン(BrdU)又はヨウ化デオキシウリジン)のような特異的細胞周期指示薬の検出を含む。
【0153】
フローサイトメトリーを用いた細胞周期解析の1方法において、細胞の核DNA量を細胞周期の指標として、定量的に高速度で測定することができる。細胞のDNA含量は、細胞周期の幾つかの期の間で変化するので、DNA含量は、細胞周期の指標である。G0/1期にある細胞は、1単位のDNAに等しいDNA含量を有し;S期において細胞はDNAを複製し、S期を通過する間に比例してその含量を増加させ;及びG2期、その後M期に入り、細胞はG0/1期のDNA含量の2倍となる(即ち、2単位のDNA)。従って、S期細胞は、G1期及びG2/M期(G1期の細胞の2倍のDNAを持つ)の細胞の間の中間となるDNA含量を有する。細胞DNA含量の単変量解析により、G0/1、S及びG2/M期細胞を識別することができる。
【0154】
細胞DNA含量のフローサイトメトリー測定は、一般的に、透過性細胞又は核の懸濁液における、DNAに化学量論的に結合する色素の添加を伴う。一般的に、細胞は固定化又は例えば、界面活性剤を用いて、透過化され、その後DNA結合色素を用いて染色される。このような色素の例としては、核酸特異的蛍光色素、ヨウ化プロピジウム(PI)、又は4'6'−ジアミジノ−2−フェニルインドール(DAPI)があるが、これらに制限されない。PIは、DNA以外にRNAも染色する;従って、細胞中のDNA含量を測定する場合RNAによる蛍光の測定の含有を避けるために、RNaseとのインキュベーションによりRNAを除くことが望ましい。このDNA結合PIは、青色光(488nm)で励起した時、赤色蛍光を発する。DAPI-DNA複合体を、紫外(UV)光(360nm)で励起することができて、青色蛍光を発する。DNAをまた、生細胞においてUV光励起可能蛍光色素Hoeschst33242(これも、青色蛍光を発する)で染色してもよい。他のDNA結合色素としては、Hoechst 33258、7-AAD、LDS 751、及びSYTO 16(例えば、Molecular Probes Handbook of Fluorescent Probes and Research Chemicals, Haugland, Sixth Ed.; 特に、第8章及び第16 章参照)があるが、これらに制限されない。一般的に、DNA結合色素は、細胞により、受け身的に取り込まれ、及びDNAとインターカレーションにより結合するが、幾つかのDNA結合色素は、DNAの主溝又は副溝結合化合物である。
【0155】
染色材料はDNA量に比例した色素量を取り込む。この染色材料は、その後、フローサイトメーターにおいて測定され、発光した蛍光シグナルは、細胞からの全蛍光発光に比例した高さ(振幅)を持つ電気パルスを発生する。蛍光測定の結果はまた、細胞DNA含量頻度棒グラフとしても表示できて、これは蛍光強度の差異に基づいた細胞周期の様々な期にある細胞の割合を示す。単一項のDNA棒グラフにフィットする数学モデルを含むソフトウェアが開発され、細胞周期の異なる期にある細胞の割合を計算する。幾つかの製造者は、細胞周期解析のためのソフトウェア、例えば、CELLFIT(TM)(Becton, Dickinson and Company , Franklin Lakes, New Jersey, USA)を提供する。
【0156】
様々な核酸類似体を、細胞複製の間にDNAに取り込むことができる。例えば、BrdUは、類似体処理した細胞の複製の間に、DNAに取り込まれる。類似体を取り込んだDNAは、蛍光色素標識した抗BrdU抗体を用いて、免疫細胞化学的に検出できる。DNA含量は、例えば、PI又は7−アミノアクチノマイシンD(7-AAD)のような赤色のインターカレートする蛍光色素による、例えば、対比染色により検定できる。抗BrdU抗体の免疫蛍光に対するDNA含量の二変数解析により、G1又はG2/M期細胞からのDNA含量の差異に基づき、及びまた、緑色蛍光抗BrdU抗体の取り込みに基づき、S期細胞を識別する。
【0157】
遠心法及び遠心エルトリエーション法を用いて、細胞をサイズにより分画することができる。異なる細胞周期にある細胞は、サイズを異にするので、これらの方法を用いて、細胞を細胞周期により分類することができて、これにより細胞の周期を検定できる。例えば、初期G1期細胞は、分裂期又は後期G2細胞のサイズの約半分である。
【0158】
クロモソーム(染色体)は、細胞周期の進行に従い、形態的、超微細構造的及びトポロジー的に変化する。従って、細胞周期の異なる期にある細胞からのクロモソームは、特徴的であることができる。クロモソームのトポロジーは、細胞周期の異なる期にある細胞で異なる。間期クロモソームDNAは、遺伝子発現に役立つために、様々に凝縮した状態にある。転写されない、クロモソーム領域のクロマチン(染色質)は、大部分凝縮した状態で存在するが、他方転写される領域は、広がった形と仮定される。S期に於いて、クロモソームDNAは、複製過程で巻き戻されるので、さらに分散される。S期の結論として、凝集が起こり広がった姉妹染色分体の堅い結合が保たれる。一般的に、クロモソームは、前期の間に凝縮を始め、ヒストン及び幾つかの他の促進タンパク質により導かれて数次のスーパーコイリングを受ける。クロモソームは、間期においては、大部分凝縮し、娘細胞が分裂するので、分裂終期の間に再び脱凝縮始め、正常な転写レベルが回復する。従って、細胞周期は、様々な画像技術(例えば、顕微鏡)を通して検定してもよい。
【0159】
本明細書に開示した方法に従い、細胞周期解析は、フローサイトメトリー法、蛍光定量法、細胞画像化、及び蛍光分光法又はこれらの組合せを含むが、これらに制限されない、すべての適切な技術を用いて行うことができる。幾つかの態様において、細胞周期解析は、フローサイトメトリーを含む。幾つかの態様において、細胞周期解析は、細胞集団(例えば、一定時間試験化合物との接触後)の1以上の標識試薬(例えば、DNA結合試薬又は細胞周期指標)を用いた標識を含む。幾つかの態様において、標識試薬は、BrdU、PI、又はこれらの組み合わせである。
【0160】
幾つかの態様において、化学防護化合物を選択する方法はさらに、1以上の追加的な確認検定を含む。例えば、幾つかの態様において、この方法はさらに、試験化合物が、CDK4/6非依存生細胞において、G1期停止の誘導能を持つことの試験を含む。従って、幾つかの態様において、この方法はさらに以下の段階を含む:第2の細胞集団(CDK4-及び/又はCDK6-非依存生細胞を含む)と試験化合物(一定時間CDK4/6依存性細胞にG1期停止を選択的に誘導する)との接触;第2の細胞集団の細胞周期解析の実行;及び第2の細胞集団に選択的G1期停止の誘導を行わない試験化合物の選択。
幾つかの態様において、第2の細胞集団は、化学防護化合物を用いた治療を受けた患者に存在するガンと関連するガン細胞株のような、ガン細胞株である。幾つかの態様において、第2の細胞集団は、網膜芽腫腫瘍抑制タンパク質(RB)−ヌルである。幾つかの態様において、第2の細胞集団は、高活性のCDK1 又はCDK2 、高レベルのMYC発現、増加したサイクリンE又は増加したサイクリンAにより特徴付けられる細胞集団である。
【0161】
この方法はまた、選択した試験化合物が、細胞毒性(例えば、DNA損傷性)化合物と接触した細胞集団における、DNA損傷を減らす、及び/又は細胞生存性を維持することの確認を含むことができる。例えば、DNA損傷の阻止及び/又は細胞生存性の維持は、in vivoにおいて化学防護薬剤が用いられる前に、ex vivo細胞集団(例えば、培養により維持された細胞集団)において検定できる。
従って、幾つかの態様において、確認の検定は、以下の段階を含む:細胞集団と試験化合物との一定時間の接触;又は細胞毒性化合物(例えば、化学療法化合物)と細胞集団との接触前のある時点で、又は同時に、又は接触後、単回投与としての接触。幾つかの態様において、細胞毒性化合物はDNA損傷性化合物である。幾つかの態様において、この本明細書で開示した方法に従って使用されるDNA損傷性化合物は、ドキソルビシン、エトポシド、カルボプラチン又はこれらの組合せを含む。
【0162】
細胞毒性化合物で処理された細胞において、試験化合物によりもたらされたDNA損傷の減少、又は試験化合物によりもたらされた細胞生存性の維持は、すべての適切な方法で検定できる。例えば、細胞集団におけるDNA損傷は、本明細書において以下にさらに記載するように、γ-H2AX検定を行うことにより検定できる。動物細胞は、DNA2重鎖切断を誘発する試薬に対して、ヒストンH2AXの即時の、多量のリン酸化をもって応答する。従って、購入可能な市販の抗体を用いて、リン酸化H2AX(「ガンマ−H2AX(γ-H2AX)」ともいう。)を検出することを、細胞内のDNA損傷の指標として用いることができる。
【0163】
様々な細胞増殖検定がまた、細胞生存性を評価する技術において既知である。幾つかの態様において、細胞生存性は、以下に詳細に記載するように、2-(4-ヨウ化フェニル)-3-(4-ニトロフェニル)-5-(2,4-ジスルホフェニル)-2H-テトラゾリウム1ナトリウム塩(WST-1)を用いた検定を行うことにより評価する。WST-1検定において、WST-1は、生存細胞に存在するミトコンドリア・リダクターゼにより切断され、着色産物(即ち、ホルマザン)を産生し、これは特定の波長(例えば、420〜480nm)の吸光度を測定して検出できる。比色基質として用いることができる他のテトラゾリウム塩としては、WST-8、TTC、INT、MTS、MTT及びXTTがある。このCellTiter-Glo(R)検定(CTG assay; Promega, Madison, Wisconsin, USA)は、細胞溶解物中のATP濃度を測定することにより、細胞生存性を測定する。細胞生存性はまた、DNA合成(例えば、核酸類似体の取り込みにより)の測定及び他の既知の技術により評価することができる。
【実施例】
【0164】
以下の実施例は、例証となる実施形態を提供する。本発明及び当業者の一般的レベルを考えて、以下の実施例は例証のみを意図しており、当業者は、本発明の範囲から離れることなく、無数の変更、修正、及び変更を行うことができることを理解することができる。
【0165】
方法
化合物:
以下の研究に用いた化合物を以下の表1に示した。フラボピリドール以外の化合物は、既知の文献手順により新しく合成したか、又は市販のものを購入した。
フラボピリドールは、Kwok-Kin Wong 博士(Dana-Farber Cancer Institute, Harvard Medical School, Boston, Massachusetts, USA)より提供されたものを用いた。ロスコビチン及びゲニステインは、LC Laboratories (Woburn, Massachusetts, USA)から購入した。2BrICを、本研究のためにOTAVA Chemicals (Kiev, Ukraine)は新たに合成したが、例えば、OTAVA Chemicals (Kiev, Ukraine)及びAlexis Biochemicals (EnzoLife Sciences, Inc., Farmingdale, New York, USA)から市販品が入手可能である。2BrICは、Zhu et al., J. Med. Chem., 46, 2027-2030 (2003)に記載の方法に従って合成できる。PD0332991は、以下の実施例1に記載した手順で合成した。すべての化合物の構造及び純度は、NMR及びLC-MSにより確認した。すべての化合物は>94%純度であった。
【0166】
表1.選択的及び非選択的CDK4/6阻害化合物
【表1−1】

【0167】
【表1−2】

【0168】
【表1−3】

【0169】
細胞株:
不死化ヒト二倍体繊維芽細胞(HS68)を、添加化合物と共に、Dulbecco改変Eagle培地(DMEM)+10%仔牛胎児血清(FBS)中で培養した。A2058及びWM2664に対して同じ条件を用いた。網膜芽腫腫瘍抑制タンパク質(RB)-経路突然変異で知られているヒト・メラノーマ細胞株A2058はRB-ヌルであり、WM2664はINK4a/ARFを欠く。従って、A2058細胞はCDK4/6非依存性であり、WM2664はCDK4/6依存性である。これらの細胞をDMEM+10%FBS中で培養した。
【0170】
細胞周期解析:
胞周期解析は、製造者の手順に従い、BrdU及びヨウ化プロピジウム(両者ともBD Biosciences Pharmigen, San Jose, California, USAから入手)を用いて行った。細胞は、15分間のBrdUパルス前に、所定の濃度で、試験化合物と24時間処理し、細胞採取し、固定し、染色し、フローサイトメトリーにより解析した。HS68、WM2664及びA2058細胞におけるPD332991及び2BrICの用量作用曲線の棒グラフを、Mod-Fit(R) software from Verity Software House (Topsham, Maine, USA)を用いて解析した。
【0171】
γ-H2AX検定:
γ-H2AX検定のために、これらの細胞を24時間PD332991又は2BrICの用量作用をもって処理した。細胞を固定し、透過性にし、γ-H2AX Flow Kit (Millipore, Billerica, Massachusetts, USA)に従って抗-γ-H2AX抗体で染色した。γ-H2AXレベルをフローサイトメトリーにより検定した。
【0172】
細胞増殖検定:
細胞増殖検定を、1x103細胞を100μLの増殖培地を加えた96ウェル組織培養プレートに蒔種して行った。細胞を、表1の化合物、及びドキソルビシン(以下「DOX」とも表示する。)、エトポシド(以下「ETOP」とも表示する。)又はカルボプラチン(以下「CARBO」とも表示する。)で、指示されたように処理した。処理後、細胞を正常の増殖培地中で7日間回復させた。回復期間の終わりに、細胞数をWST-1細胞増殖検定(TaKaRa Bio USA, Madison, Wisconsin, USA)又はCellTiter-Glo(R)assay(CTG; Promega, Madison, Wisconsin, USA))を用いて定量した。データを、WST検定に対して450nmの吸光度として、又はCTG検定に対して相対的光単位(RLU)として表示した。
【0173】
In Vivo薬物動力学検定(BrdU取り込み):
処理:
PD0332991:
造血幹細胞及び前駆細胞(HSPC)増殖実験に対し、マウスには、2日間、毎日PD0332991 150mg/kgの経口強制給餌を行い、殺処分24時間前に6時間毎に1mg BrdUの腹腔内注射(i.p.)を行った。
2BrIC:
HSPC増殖実験に対し、マウスには、2回の2-ブロモ-12,13-ジヒドロ-5H-インドロ[2,3-a]ピロロ[3,4-c]カルバゾール-5,7(6H)-ジオン (2BrIC)300mg/kg経口強制給餌又は媒体対照で処理を行った。2BrICは、経口強制給餌のために、Hot Rod formulation kit (Pharmatek, Inc., San Diego, California, USA)の処方#6を用いて可溶化した。2BrICをBrdU投与2時間前に投与し、BrdU1mgの腹腔内注射(i.p.)の時に再投与した。表示した時間のBrdU +/- 2BrIC処理後、マウスを殺処分し、免疫表現型質検査及びBrdU解析のために骨髄を採取した。
【0174】
フローサイトメトリーによるBrdU取り込みの解析:
骨髄(BM)をマウスの胎児から採取し、プールし、骨髄単核球細胞(BM-MNCs)を精製するために遠心した。細胞を5分間ACK緩衝液中でインキュベートし、赤血球を溶解させた。特に記載しない限り、すべての抗体は、BD Pharmingen (San Jose, California, USA)から入手した。精製したBM-MNCs細胞を、マウスリネージ混合物ビオチン結合抗体とインキュベートし、その後ストレプトアビジン-FITCとインキュベートした。その後、細胞をSca-1-PE-Cy7 及びc-kit-APC-アレクサ750抗体により染色した。細胞生存性は、LIVE/DEAD Aqua Dead Cell Stain Kit (Invitrogen Corporation, Carlsbad, California, USA)を用いて検定した。BrdU取り込み検定に対しては、細胞を固定し、透過性にし、製造者の手順に従い、APC BrdU Flowキットにより染色した。すべての実験において、PE-Cy7, FITC, APC-アレクサ750, 及び Aqua Dead細胞染色アイソタイプ対照を適宣含めた。フローサイトメトリー解析をa CyAn ADP (Dako, Glostrup, Denmark)を用いて行った。各試料に対し、最低500,000細胞を解析し、データをFlowJo software (Tree Star, Ashland, Oregon, USA)を用いて解析した。
【0175】
骨髄抑制検定:毎週の全血球計数:
処理:
PD0332991:
カルボプラチン実験において、マウスを、単回のPD0332991 150mg/kgの経口強制給餌又は媒体対照で処理し、その後カルボプラチン100mg/kgの腹腔内注射(i.p.)を行った。ドキソルビシン実験において、マウスを、第0日目に、ドキソルビシン10mg/kgの腹腔内注射(i.p.)の1時間前に、単回のPD0332991 150mg/kgの経口強制給餌又は媒体対照で処理し、その後7日目に繰り返した。
2BrIC:
マウスを単回のカルボプラチン100mg/kgの腹腔内注射(i.p.)により処理し、2回の2BrIC 150mg/kgの経口強制給餌又は媒体対照処理を行った。マウスをカルボプラチン投与2時間前に2BrICで前処理し、その後カルボプラチン注射時に2回目の2BrIC再投与を行った。
【0176】
血液採取及び血小板定量:
ベースライン全血球計数(CBC)分析は、薬剤投与前に一部のマウスについて行った。薬剤投与後(化学療法薬剤+/−表示したCDK4/6阻害剤又は対照)、マウスを毎週CBC分析による骨髄抑制の存在について観察した。CBC分析をK2E(K2-EDTA)の入ったBD Microtainerチューブを用いて行い、尾静脈ニックにより40μLの血液を採取した。血液をHESKA CBC-Diff Veterinary Hematology Systemを用いて分析した。全血球計数(CBC)分析は、白血球、リンパ球、顆粒球、単球、ヘマトクリット、赤血球細胞、ヘモグロビン、血小板、及び他の通常の血液学的パラメーターの測定を含む。
【0177】
TOXILIGHT(TM)検定:
細胞毒性をToxilight(R) Bioassay kit (Lonza, Basel, Switzerland)を用いて検定したが、このキットは、アデニレートキナーゼの培地への放出を定量することにより細胞溶解を測る。簡単には、96穴プレートの細胞の各ウェルから20μLを吸引し、様々な濃度のPD0332991又はスタウロスポリン(以下「STAUR」とも表示する。)で処理した。100μLのTOXILIGHT(TM)試薬を加え、5分間インキュベートし、1秒/ウェルの速度で発光計で測定した。
【0178】
実施例1
PDの合成
【化3】

【0179】
反応機構1:PD合成
PDを、反応機構1(化3)に示すように合成した。反応機構1(化3)に示す反応は、化合物Dの化合物Eへの変換、及び化合物Fの化合物Gへの変換反応を除いて、一般的に以前に報告された経路に従う(VandelWel et al., J. Med Chem., 48, 2371-2387 (2005); and Toogood et al., J. Med. Chem., 48, 2388-2406 (2005))。
【0180】
化合物Dの化合物Eへの変換:
【化4】

化合物D(40g、169mmol)を無水THF(800mL)に窒素下で溶かし、及びこの溶液を氷槽で冷却し、ここにMeMgBrをゆっくり加え(エーテル中3M、160mL、480mmol)及び1時間攪拌した。水とEtOAcに分配する飽和NH4Cl水溶液を加えて反応を休止した。有機層を分離し、及び水層をEtOAcで抽出した。混合した有機層を塩水で洗浄し、MgSO4上で乾燥した。濃縮して中間産物をオイルとして得た(41.9g,98%)。
上記中間産物(40g、158mmol)を乾燥CHCl3(700mL)に溶かした。MnO2(96g、1.11mol)を加え、混合物を18時間攪拌しつつ加熱乾留し、再度のMnO2(34g、395mmol)を加え、4時間乾留を続けた。Celiteパッドを通して濾過し、固体をCHCl3で洗浄した。濾過物を濃縮し、黄色固体化合物E(35g、88%)、Mp:75.8〜76.6℃。
【0181】
化合物Fの化合物Gへの変換
【化5】

化合物F(5g、18.2mmol)を無水DMF(150mL)に溶かし、及びNBS(11.3g、63.6mmol)を加えた。反応混合物を3.5時間、室温で攪拌し、H2O(500mL)に注ぎ、沈殿物を濾過し、H2Oで洗浄した。固体をEtOHから再結晶化し、化合物Gを白色固体(5.42g、80.7%)として得た。mp:210.6〜211.3℃。
【0182】
PDの特徴付けデータ
LC-MS: 448.5 (ESI, M+H). 純度: 〜99%
1H NMR(300MHz, D2O): 9.00(s, 1H), 8.12 (dd, J = 9.3 Hz, 2.1Hz, 1H), 7.81(d, J = 2.4 Hz, 1H), 7.46(d, J = 9.6Hz, 1H), 5.80-5.74 (m, 1H), 3.57-3.48(m, 8H), 2.48(s, 3H), 2.37(s, 3H), 2.13-1.94(m, 6H), 1.73-1.71(m, 2H).
13C NMR (75MHz, D2O): 203.6, 159.0, 153.5, 153.3, 152.2, 139.9, 139.4, 139.2, 133.1, 129.0, 118.7, 113.8, 107.4, 51.8, 42.2, 40.0, 28.0, 25.2, 22.6, 10.8.
【0183】
実施例2
CDK4/6依存生細胞株における選択的G1期停止
幾つかのヒト細胞株を多くの低分子キナーゼ阻害剤に曝露した。そして、その細胞周期解析を、本明細書で既に記した方法で行った。
不死化ヒト二倍体繊維芽細胞(HS68)及びヒトメラノーマ細胞株(WM2664)を含め、Cdk4/6依存性細胞株は、強力な選択的Cdk4/6阻害剤であるPD0332991又はBrICに曝露後、強く、クリーンで、可逆的なG1期停止を示した(図2A〜2E)。さらにCDK1/2を標的とするより選択性の低いCDK阻害剤である化合物1〜6、フラボピリドール(図20A)、化合物7(即ちR547;図21A)、ロスコビチン(図22A)、ゲニステイン及び化合物8〜14(図24A〜24C)は、これらの種類の細胞に、気紛れに、G2/M遮断、S期内停止又は細胞死(亜G0)をもたらした。一方、RB−ヌルメラノーマ株A2058は、予期したように、CDK4/6阻害に対して感受性が無いが、より選択性の低いCDK阻害剤に曝露後、G2/M遮断又はS期内停止及び/又は細胞死(亜G0)を同様にもたらした。7株のRB欠失ヒト肺小細胞ガン細胞株の増殖もまた、CDK4/6阻害剤に対して抵抗性であった。
これらのデータは、構造的に明確な強い選択的Cdk4/6阻害剤は、感受性細胞株(CDK4/6依存生細胞株)において、純粋な(即ち、"クリーンな")G1期停止をもたらすことを示し、他方、より汎用の非特異的CDK阻害剤の細胞周期効果は、予想不可能であり、かつ細胞毒性と関係することを示している。
【0184】
実施例3
化学療法薬剤で処理した細胞におけるDNA損傷からの防護
カボプラチン(CARBO)、エトポシド(ETOP)及びドキソルビシン(DOX)のようなDNA損傷性化合物に曝露した細胞中のDNA損傷を減少させる選択的CDK4/6阻害剤の能力を、上記方法項で記載したように細胞をベースとした検定で評価した。
カルボプラチン、エトポシド及びドキソルビシンは、CDK4/6依存性及び非依存生細胞株におけるγ-H2AXフォーカス形成測定で示されるように、広範囲のDNA損傷を引き起こす(図3A〜3C、4及び5)。カルボプラチン、エトポシド又はドキソルビシン処理前のPD0332991(図中「PD」で示す。)(図6A〜6C、7及び8)又は2BrIC(図3A〜3C、4及び5)の処理により、γ-H2AX(%)が低下したことは、PD0332991又は2BrICにより誘導されたG1期停止が、化学療法薬剤誘発性DNA損傷から細胞を防護したことを示唆する。
【0185】
実施例4
化学療法薬剤で処理した細胞における細胞毒性からの防護
選択的CDK4/6阻害剤が、化学療法薬剤誘発性細胞毒性から細胞を防護する防護能を、本明細書で既に記載した方法で、細胞をベースとした増殖検定により評価した。
CDK4/6依存性及び非依存性細胞株を、カルボプラチン、エトポシド又はドキソルビシン添加前に、PD0332991又は BrICで前処理した。
PD0332991及び2BrICの両者は、CDK4/6依存性細胞の顕著な防護を示したが、CDK4/6非依存生細胞に対しては否定的であった(図9〜14及び25A〜25C)。これに対し、フラボピリドール(図20B〜20D)、化合物7(即ち、R547;図21B〜21D)、ロスコビチン(図22B〜22D)、ゲニステイン(図23A〜23C)及び化合物8,9及び11(図24D〜24I)のような、さらにCDK1/2を標的とする、かつCDK4/6依存性及び非依存性細胞にクリーンなG1期停止を誘導しない、より選択性のないCDK阻害剤は、化学療法薬剤誘発性細胞毒性から細胞を防護しなかった。より選択性のない阻害剤が防護できないことは、G1期以外の細胞周期の細胞期における停止(例えば、G2/M)は、遺伝子毒性への曝露から防護しないことを示唆する。
【0186】
幾つかのCDK4/6感受性細胞株において、CDK4/6の強い阻害剤であること、及びG1停止をもたらすことだけでは、細胞毒性化合物から最適の防護をするための十分条件ではないことに注意することが重要である。幾つかの態様において、他のCDK又は他の非CDKキナーゼに対してではなく、これらのキナーゼに対して強力であるばかりでなく、選択性の高い、CDK4/6阻害剤の使用が、本明細書に開示されている。例えば、図26Aにおいて、強力であるが、非選択的CDK4/6阻害剤であるスタウロスポリン(STAUR)は、ある種のCDK4/6依存性細胞(HS68)において実質的に純粋なG1期停止を誘導する。しかしこの停止は、化学療法薬剤細胞毒性から防護しない(図26B)。図25D〜25Fにおいて、スタウロスポリン(STAUR)処理は、WM2664(CDK4/6-依存性)及びA2058(CDK4/6-非依存性)細胞株の両者において細胞毒性を高める。同様に、スタウロスポリン(STAUR)は、H2AXフォーカスで測定したように、cdk4/6依存性又はcdk4/6非依存性細胞をDNA損傷から防護しない(図27A〜27C)。従って、全体として、これらの結果により、この化合物のオフターゲット、CDK4/6非依存性効果、が幾つかの状況で細胞死を誘導することが示唆され、化学防護に関して、スタウロスポリンのような多能キナーゼ阻害剤は、気紛れであり、及び細胞種依存的であることが示唆され、これらの薬剤の主要な効果が直接的又は間接的なG1期停止誘導に対してである幾つかの細胞種ではin vitro防護を示し(Chen et al., J. Natl. Cancer Inst., 92, 1999-2008 (2000))、細胞生存性に対してオフターゲット効果が有害な細胞種において、細胞死又は、他の好ましくない結果をもたらす。本発明の幾つかの態様において、多重検定スクリーニング(例えば、細胞周期停止、H2AX防護及び/又は7日目の細胞増殖)を行い、有効なin vivo化学防護剤を決定することができる。このようなスクリーニングにおいて、スタウロスポリンは、そのオフターゲット効果及び矛盾した効果により、候補から落ちる。
【0187】
さらに、これらのオフターゲット効果は、in vivoで用いられた時、毒性及び化学療法薬剤への感受性の上昇もたらし、及びこれらの毒性は、多能キナーゼ阻害剤を臨床的化学防護に用いることを不可能にする。増殖細胞のある分画(即ち、初期造血幹細胞及び前駆細胞(HSPC))に対する選択的CDK4/6阻害剤の優れた特異性は、そのような化合物は、用量規定毒性を起こすことなく、in vivoでの臨床的化学療法薬剤防護に使うことができるという、期待してなかった発見を、本発明の幾つかの態様と一致して開示した。
【0188】
実施例5
in vivo 化学防護
選択的CDK4/6阻害剤を用いたin vivo 医薬的休止(PQ)提供能を検定した。経口的に生物利用可能なPD0332991を、経口強制給餌により、成体野生型C57Bl/6マウスに投与した。造血幹細胞(HSC; Lin-Kit+Sca1+CD48-CD150+)の増殖を、Ki67発現及び24時間にわたるBrdUの取り込みにより測定したが、予想より遅かった(図16A〜16D)(Passegue et al., 2005; Wilson et al., 2008; and Kiel et al., 2007)。48時間のPD0332991処理は、Ki67発現への効果の方が多かったが、Ki67の発現及びBrdU(図16B)に対して二重にポジティブな造血幹細胞(HSC)の割合を顕著に減らした。より明確な増殖抑制は、より早く増殖する多分化能前駆細胞区分(MPP; Lin-Kit+Sca1+CD48-CD150-)において目立った(図16B〜16C)。オリゴポテント前駆細胞(Lin-Kit+Sca1-)は中程度の増殖阻害を示し(図16C)、最も強い効果は、骨髄共通前駆細胞(CMP)及びリンパ球共通前駆細胞(CLP)において見られ、それに対してより弱い効果は、より分化した顆粒球単球前駆細胞(GMP)及び赤芽球系前駆細胞(MEP)に見られた(図16B〜16C)。これらの初期造血幹細胞及び前駆細胞(HSPC)細胞への効果と対照的に、より完全に分化したLin-Kit-Sca1- 及び Lin+細胞において、これらの分画は不均一であり、部分集団への効果ははっきりしないかも知れないが、増殖の変化は見られなかった。
【0189】
2BrICを溶解し、経口強制給餌により、BrdU注射2時間前に与え、更なる投与をBrdU注射の際に与えた。2BrICは、BrdUのLin-Kit+Sca1+細胞への取り込みを、処方物単独処理のマウスと比べ阻害した(図15A〜15B)。
選択的CDK4/6阻害剤が化学療法薬剤に曝露されたマウスの血球数を防護することができるかどうか測定するために、PD0332991処理したマウスの血液細胞数を研究した。PD0332991で前処理し、その後ドキソルビシン(図18)又はカルボプラチン(図19)を処理したマウスにおいて、全4リネージ(血小板、ヘモグロビン、リンパ球、及び顆粒球)は、防護された。
PD0332991の投与に対して、赤血球、血小板、及び骨髄性(単球+顆粒球)リネージの減少が観察され、及び連続的にPD0332991の投与を受けていた担腫瘍マウス(Ramsey et al., Cancer Res., 67, 4732-4741 (2007); and Fry et al., Mol. Cancer Ther., 3, 1427-1438 (2004))、及び悪性腫瘍を持つヒト患者(O'Dwyer et al., "A Phase I does escalation trial of a daily oral CDK4/6 Inhibitor PD 0332991" in American Society of Clinical Oncology (ASCO, Chicago, Illinois, 2007)参照)において、PD0332991の停止に際してリネージの増加が観察された。注目された減少は、化学療法において投与された細胞毒性化合物の不都合な効果を増強させたと推定される。しかしながら、本明細書で示したように、意外にも、造血細胞は、不都合な効果から防護された。
【0190】
本発明の様々な詳細は本発明の範囲から離れることなく変更できることを理解すべきである。さらに、上記の記載は、説明のみの目的のためであり、制限付けを目的としたものではない。
【特許請求の範囲】
【請求項1】
細胞毒性化合物に曝露した、これから曝露する、又は曝露する虞のある患者の健康な細胞に対する細胞毒性化合物の影響を低下させる又は防止する方法であって、この患者に有効量の阻害化合物又はその医薬的に許容可能な塩を投与することから成り、この健康な細胞が造血幹細胞又は造血前駆細胞であり、この阻害化合物がサイクリン依存性キナーゼ4(CDK4)及び/又はサイクリン依存性キナーゼ6(CDK6)を選択的に阻害することを特徴とする方法。
【請求項2】
前記阻害化合物が、CDK4及びCDK6の両者を阻害する請求項1に記載の方法。
【請求項3】
前記阻害化合物が、非天然化合物である請求項1に記載の方法。
【請求項4】
前記阻害化合物が、実質的にオフターゲット効果がない請求項1に記載の方法。
【請求項5】
前記オフターゲット効果が、長期の毒性、抗酸化効果、発情効果、チロシンキナーゼ阻害、サイクリン依存性キナーゼ4/6(CDK4/6)以外のサイクリン依存性キナーゼ類(CDKs)阻害、及びCDK4/6非依存性細胞における細胞周期停止からなる群の1又はそれ以上の効果である請求項4に記載の方法。
【請求項6】
前記阻害化合物が、CDK4-及び/又はCDK6-依存性細胞において、G1期停止を誘導する請求項1に記載の方法。
【請求項7】
前記阻害化合物が、CDK4-及び/又はCDK6-依存性細胞において、実質的に純粋なG1期停止を選択的に誘導する請求項6に記載の方法。
【請求項8】
前記阻害化合物が、ピリド[2,3-d]ピリミジン、トリアミノピリミジン、アリール[a]ピロロ[3,4-c]カルバゾール、窒素含有ヘテロアリール置換尿素、5-ピリミジニル-2-アミノチアゾール、ベンゾチアジアジン、及びアクリジンチオンから成る群から選択される請求項1に記載の方法。
【請求項9】
前記ピリド[2,3-d]ピリミジンが、ピリド[2,3-d]ピリミジン-7-オン又は2-アミノ-6-シアノ-ピリド[2,3-d]ピリミジン-4-オンである請求項8に記載の方法。
【請求項10】
前記ピリド[2,3-d]ピリミジン-7-オンが、2-(2'-ピリジル)アミノピリド[2,3-d]ピリミジン-7-オンである請求項9に記載の方法。
【請求項11】
前記ピリド[2,3-d]ピリミジン-7-オンが、6-アセチル-8-シクロペンチル-5-メチル-2-(5-ピペラジン-1-イル-ピリジン-2-イルアミノ)-8H-ピリド-[2,3-d]ピリミジン-7-オンである請求項10に記載の方法。
【請求項12】
前記アリール[a]ピロロ[3,4-c]カルバゾールが、ナフチル[a]ピロロ[3,4-c]カルバゾール、インドロ[a]ピロロ[3,4-c]カルバゾール、キノリニル[a]ピロロ[3,4-c]カルバゾール、及びイソキノリニル[a]ピロロ[3,4-c]カルバゾールからなる群から選択される請求項8に記載の方法。
【請求項13】
前記アリール[a]ピロロ[3,4-c]カルバゾールが、2-ブロモ-12,13-ジヒドロ-5H-インドロ[2,3-a]ピロロ[3,4]-カルバゾール-5,6-ジオンである請求項12に記載の方法。
【請求項14】
前記患者が、哺乳類である請求項1に記載の方法。
【請求項15】
前記阻害化合物が、経口投与、局所投与、鼻腔内投与、吸入、及び静脈内投与から成る群から選択される1の方法により患者に投与される請求項1に記載の方法。
【請求項16】
前記阻害化合物が、細胞毒性化合物の曝露前、曝露中、曝露後、又はこれらの組合せの際、患者に投与される請求項1に記載の方法。
【請求項17】
前記阻害化合物が、細胞毒性化合物曝露前の約24時間以内に、患者に投与される請求項16に記載の方法。
【請求項18】
前記阻害化合物が、細胞毒性化合物曝露後約24時間又はそれ以後に患者に投与される請求項16に記載の方法。
【請求項19】
前記細胞毒性化合物が、DNAを損傷する化合物である請求項1に記載の方法。
【請求項20】
前記健康な細胞が、長期造血幹細胞(LT-HSCs)、短期造血幹細胞(ST-HSCs)、多分化能前駆細胞(MPPs)、骨髄共通前駆細胞(CMPs)、リンパ球共通前駆細胞(CLPs)、顆粒球単球前駆細胞(GMPs)及び赤芽球系前駆細胞(MEPs)からなる群から選択される請求項1に記載の方法。
【請求項21】
前記阻害化合物の投与により、造血幹細胞及び/又は造血前駆細胞が、一時的に薬理学的に休止する請求項1に記載の方法。
【請求項22】
前記患者が、疾患を治療するために細胞毒性化合物を用いた医学的治療を受けた、受けている又はこれから受ける請求項1に記載の方法。
【請求項23】
前記阻害化合物の投与が、疾患にかかった細胞の増殖に効果を持たない請求項22に記載の方法。
【請求項24】
前記疾患が、ガンである請求項22に記載の方法。
【請求項25】
前記ガンが、サイクリン依存性キナーゼ1(CDK1)の活性増加、サイクリン依存性キナーゼ2(CDK2)の活性増加、網膜芽腫腫瘍抑制タンパク質(RB)の欠失又は不在、高レベルのMYC発現、サイクリンEの増加、及びサイクリンAの増加からなる群の1以上の特徴を持つ請求項24に記載の方法。
【請求項26】
前記阻害化合物の投与により、阻害化合物の投与なしの場合に用いられる投与量より多量の細胞毒性化合物を用いて、疾患を治療することが可能になる請求項22に記載の方法。
【請求項27】
前記患者が、偶然に細胞毒性化合物に曝露された、又は過剰投与量の細胞毒性化合物に曝露された請求項1に記載の方法。
【請求項28】
前記方法に、長期の血液学的毒性がない請求項1に記載の方法。
【請求項29】
前記阻害化合物の投与が、阻害化合物の投与無しで細胞毒性化合物に曝露した場合に予想される結果と比べて、貧血を減少させ、リンパ球減少症を減らし、血小板減少症を減らし、又は好中球減少症を減らす結果をもたらす請求項1に記載の方法。
【請求項30】
健康な細胞における細胞毒性化合物の効果を防ぐために使用する化合物のスクリーニング方法であって、
(i)試験化合物をCDK4/6依存性細胞集団に一定時間接触させる段階、
(ii)前記細胞集団の細胞周期を解析する段階、及び
(iii)前記細胞集団において選択的にG1期停止を誘導する試験化合物を選択する段階
から成る方法。
【請求項31】
前記CDK4/6依存性細胞集団が、不死化ヒト二倍体繊維芽細胞又はINK4a/ARF欠失メラノーマ細胞から成る請求項30に記載の方法。
【請求項32】
前記細胞周期の解析が、フローサイトメトリー、蛍光測定法、細胞画像化及び蛍光分光法から成る群から選択される少なくとも1の技術を用いて行われる請求項30に記載の方法。
【請求項33】
前記細胞周期の解析が、前記細胞集団を、5−ブロモ−2−デオキシウリジン(BrdU)及びヨウ化プロピジウム(PI)から成る群から選択される少なくとも1の標識試薬を用いて標識することから成る請求項30に記載の方法。
【請求項34】
更に、
(iV)CDK4/6依存性細胞のG1期停止を誘導する前記試験化合物を、第2の細胞集団に一定時間接触させる段階、但し、この第2の細胞集団はCDK4/6非依存性細胞を含む、
(V)前記第2の細胞集団の細胞周期を解析する段階、及び
(Vi)前記第2の細胞集団においてG1期停止を選択的に誘導しない試験化合物を選択する段階
を含む請求項30に記載の方法。
【請求項35】
前記第2の細胞集団が、ガン細胞株である請求項34に記載の方法。
【請求項36】
前記第2の細胞集団が、網膜芽腫腫瘍抑制タンパク質(RB)ヌルである請求項30に記載の方法。
【請求項37】
更に、
(Vii)前記試験化合物が、細胞毒性化合物と接触したex vivo細胞集団において、DNA損傷を減少させる、細胞生存を維持させる、又はその両者を行うことができるかどうかを検定することによって、該試験化合物の保護能の確認を行う段階
を含む請求項30に記載の方法。
【請求項38】
前記細胞集団におけるDNA損傷が、γ-H2AX検定を行うことで検定される請求項37に記載の方法。
【請求項39】
前記細胞生存が、細胞増殖検定を行うことで検定される請求項37に記載の方法。
【請求項40】
前記細胞毒性化合物が、DNAを損傷する化合物である請求項37に記載の方法。
【請求項41】
前記DNAを損傷する化合物が、ドキソルビシン、エトポシド及びカルボプラチンから成る群から選択される請求項37に記載の方法。
【請求項1】
細胞毒性化合物に曝露した、これから曝露する、又は曝露する虞のある患者の健康な細胞に対する細胞毒性化合物の影響を低下させる又は防止する方法であって、この患者に有効量の阻害化合物又はその医薬的に許容可能な塩を投与することから成り、この健康な細胞が造血幹細胞又は造血前駆細胞であり、この阻害化合物がサイクリン依存性キナーゼ4(CDK4)及び/又はサイクリン依存性キナーゼ6(CDK6)を選択的に阻害することを特徴とする方法。
【請求項2】
前記阻害化合物が、CDK4及びCDK6の両者を阻害する請求項1に記載の方法。
【請求項3】
前記阻害化合物が、非天然化合物である請求項1に記載の方法。
【請求項4】
前記阻害化合物が、実質的にオフターゲット効果がない請求項1に記載の方法。
【請求項5】
前記オフターゲット効果が、長期の毒性、抗酸化効果、発情効果、チロシンキナーゼ阻害、サイクリン依存性キナーゼ4/6(CDK4/6)以外のサイクリン依存性キナーゼ類(CDKs)阻害、及びCDK4/6非依存性細胞における細胞周期停止からなる群の1又はそれ以上の効果である請求項4に記載の方法。
【請求項6】
前記阻害化合物が、CDK4-及び/又はCDK6-依存性細胞において、G1期停止を誘導する請求項1に記載の方法。
【請求項7】
前記阻害化合物が、CDK4-及び/又はCDK6-依存性細胞において、実質的に純粋なG1期停止を選択的に誘導する請求項6に記載の方法。
【請求項8】
前記阻害化合物が、ピリド[2,3-d]ピリミジン、トリアミノピリミジン、アリール[a]ピロロ[3,4-c]カルバゾール、窒素含有ヘテロアリール置換尿素、5-ピリミジニル-2-アミノチアゾール、ベンゾチアジアジン、及びアクリジンチオンから成る群から選択される請求項1に記載の方法。
【請求項9】
前記ピリド[2,3-d]ピリミジンが、ピリド[2,3-d]ピリミジン-7-オン又は2-アミノ-6-シアノ-ピリド[2,3-d]ピリミジン-4-オンである請求項8に記載の方法。
【請求項10】
前記ピリド[2,3-d]ピリミジン-7-オンが、2-(2'-ピリジル)アミノピリド[2,3-d]ピリミジン-7-オンである請求項9に記載の方法。
【請求項11】
前記ピリド[2,3-d]ピリミジン-7-オンが、6-アセチル-8-シクロペンチル-5-メチル-2-(5-ピペラジン-1-イル-ピリジン-2-イルアミノ)-8H-ピリド-[2,3-d]ピリミジン-7-オンである請求項10に記載の方法。
【請求項12】
前記アリール[a]ピロロ[3,4-c]カルバゾールが、ナフチル[a]ピロロ[3,4-c]カルバゾール、インドロ[a]ピロロ[3,4-c]カルバゾール、キノリニル[a]ピロロ[3,4-c]カルバゾール、及びイソキノリニル[a]ピロロ[3,4-c]カルバゾールからなる群から選択される請求項8に記載の方法。
【請求項13】
前記アリール[a]ピロロ[3,4-c]カルバゾールが、2-ブロモ-12,13-ジヒドロ-5H-インドロ[2,3-a]ピロロ[3,4]-カルバゾール-5,6-ジオンである請求項12に記載の方法。
【請求項14】
前記患者が、哺乳類である請求項1に記載の方法。
【請求項15】
前記阻害化合物が、経口投与、局所投与、鼻腔内投与、吸入、及び静脈内投与から成る群から選択される1の方法により患者に投与される請求項1に記載の方法。
【請求項16】
前記阻害化合物が、細胞毒性化合物の曝露前、曝露中、曝露後、又はこれらの組合せの際、患者に投与される請求項1に記載の方法。
【請求項17】
前記阻害化合物が、細胞毒性化合物曝露前の約24時間以内に、患者に投与される請求項16に記載の方法。
【請求項18】
前記阻害化合物が、細胞毒性化合物曝露後約24時間又はそれ以後に患者に投与される請求項16に記載の方法。
【請求項19】
前記細胞毒性化合物が、DNAを損傷する化合物である請求項1に記載の方法。
【請求項20】
前記健康な細胞が、長期造血幹細胞(LT-HSCs)、短期造血幹細胞(ST-HSCs)、多分化能前駆細胞(MPPs)、骨髄共通前駆細胞(CMPs)、リンパ球共通前駆細胞(CLPs)、顆粒球単球前駆細胞(GMPs)及び赤芽球系前駆細胞(MEPs)からなる群から選択される請求項1に記載の方法。
【請求項21】
前記阻害化合物の投与により、造血幹細胞及び/又は造血前駆細胞が、一時的に薬理学的に休止する請求項1に記載の方法。
【請求項22】
前記患者が、疾患を治療するために細胞毒性化合物を用いた医学的治療を受けた、受けている又はこれから受ける請求項1に記載の方法。
【請求項23】
前記阻害化合物の投与が、疾患にかかった細胞の増殖に効果を持たない請求項22に記載の方法。
【請求項24】
前記疾患が、ガンである請求項22に記載の方法。
【請求項25】
前記ガンが、サイクリン依存性キナーゼ1(CDK1)の活性増加、サイクリン依存性キナーゼ2(CDK2)の活性増加、網膜芽腫腫瘍抑制タンパク質(RB)の欠失又は不在、高レベルのMYC発現、サイクリンEの増加、及びサイクリンAの増加からなる群の1以上の特徴を持つ請求項24に記載の方法。
【請求項26】
前記阻害化合物の投与により、阻害化合物の投与なしの場合に用いられる投与量より多量の細胞毒性化合物を用いて、疾患を治療することが可能になる請求項22に記載の方法。
【請求項27】
前記患者が、偶然に細胞毒性化合物に曝露された、又は過剰投与量の細胞毒性化合物に曝露された請求項1に記載の方法。
【請求項28】
前記方法に、長期の血液学的毒性がない請求項1に記載の方法。
【請求項29】
前記阻害化合物の投与が、阻害化合物の投与無しで細胞毒性化合物に曝露した場合に予想される結果と比べて、貧血を減少させ、リンパ球減少症を減らし、血小板減少症を減らし、又は好中球減少症を減らす結果をもたらす請求項1に記載の方法。
【請求項30】
健康な細胞における細胞毒性化合物の効果を防ぐために使用する化合物のスクリーニング方法であって、
(i)試験化合物をCDK4/6依存性細胞集団に一定時間接触させる段階、
(ii)前記細胞集団の細胞周期を解析する段階、及び
(iii)前記細胞集団において選択的にG1期停止を誘導する試験化合物を選択する段階
から成る方法。
【請求項31】
前記CDK4/6依存性細胞集団が、不死化ヒト二倍体繊維芽細胞又はINK4a/ARF欠失メラノーマ細胞から成る請求項30に記載の方法。
【請求項32】
前記細胞周期の解析が、フローサイトメトリー、蛍光測定法、細胞画像化及び蛍光分光法から成る群から選択される少なくとも1の技術を用いて行われる請求項30に記載の方法。
【請求項33】
前記細胞周期の解析が、前記細胞集団を、5−ブロモ−2−デオキシウリジン(BrdU)及びヨウ化プロピジウム(PI)から成る群から選択される少なくとも1の標識試薬を用いて標識することから成る請求項30に記載の方法。
【請求項34】
更に、
(iV)CDK4/6依存性細胞のG1期停止を誘導する前記試験化合物を、第2の細胞集団に一定時間接触させる段階、但し、この第2の細胞集団はCDK4/6非依存性細胞を含む、
(V)前記第2の細胞集団の細胞周期を解析する段階、及び
(Vi)前記第2の細胞集団においてG1期停止を選択的に誘導しない試験化合物を選択する段階
を含む請求項30に記載の方法。
【請求項35】
前記第2の細胞集団が、ガン細胞株である請求項34に記載の方法。
【請求項36】
前記第2の細胞集団が、網膜芽腫腫瘍抑制タンパク質(RB)ヌルである請求項30に記載の方法。
【請求項37】
更に、
(Vii)前記試験化合物が、細胞毒性化合物と接触したex vivo細胞集団において、DNA損傷を減少させる、細胞生存を維持させる、又はその両者を行うことができるかどうかを検定することによって、該試験化合物の保護能の確認を行う段階
を含む請求項30に記載の方法。
【請求項38】
前記細胞集団におけるDNA損傷が、γ-H2AX検定を行うことで検定される請求項37に記載の方法。
【請求項39】
前記細胞生存が、細胞増殖検定を行うことで検定される請求項37に記載の方法。
【請求項40】
前記細胞毒性化合物が、DNAを損傷する化合物である請求項37に記載の方法。
【請求項41】
前記DNAを損傷する化合物が、ドキソルビシン、エトポシド及びカルボプラチンから成る群から選択される請求項37に記載の方法。
【図1】


【図2AB】


【図2C】


【図2D】


【図2E】


【図3A】


【図3B】


【図3C】


【図4】


【図5】


【図6A】


【図6B】


【図6C】


【図7】


【図8】


【図9】


【図10】


【図11】


【図12】


【図13】


【図14】


【図15A】


【図15B】


【図16A】


【図16B】


【図16C】


【図16D】


【図17】


【図18】


【図19】


【図20A】


【図20B】


【図20C】


【図20D】


【図21A】


【図21B】


【図21C】


【図21D】


【図22A】


【図22B】


【図22C】


【図22D】


【図23A】


【図23B】


【図23C】


【図24A】


【図24B】


【図24C】


【図24D】


【図24E】


【図24F】


【図24G】


【図24H】


【図24I】


【図25A】


【図25B】


【図25C】


【図25D】


【図25E】


【図25F】


【図26A】


【図26B】


【図27A】


【図27B】


【図27C】




【図2AB】


【図2C】


【図2D】


【図2E】


【図3A】


【図3B】


【図3C】


【図4】


【図5】


【図6A】


【図6B】


【図6C】


【図7】


【図8】


【図9】


【図10】


【図11】


【図12】


【図13】


【図14】


【図15A】


【図15B】


【図16A】


【図16B】


【図16C】


【図16D】


【図17】


【図18】


【図19】


【図20A】


【図20B】


【図20C】


【図20D】


【図21A】


【図21B】


【図21C】


【図21D】


【図22A】


【図22B】


【図22C】


【図22D】


【図23A】


【図23B】


【図23C】


【図24A】


【図24B】


【図24C】


【図24D】


【図24E】


【図24F】


【図24G】


【図24H】


【図24I】


【図25A】


【図25B】


【図25C】


【図25D】


【図25E】


【図25F】


【図26A】


【図26B】


【図27A】


【図27B】


【図27C】


【公表番号】特表2012−504646(P2012−504646A)
【公表日】平成24年2月23日(2012.2.23)
【国際特許分類】
【出願番号】特願2011−530251(P2011−530251)
【出願日】平成21年10月1日(2009.10.1)
【国際出願番号】PCT/US2009/059281
【国際公開番号】WO2010/039997
【国際公開日】平成22年4月8日(2010.4.8)
【出願人】(501345323)ザ ユニバーシティ オブ ノース カロライナ アット チャペル ヒル (52)
【氏名又は名称原語表記】THE UNIVERSITY OF NORTH CAROLINA AT CHAPEL HILL
【住所又は居所原語表記】308 Bynum Hall,Campus Box 4105,Chapel Hill,North Carolina 27599−4105, United States of America
【Fターム(参考)】
【公表日】平成24年2月23日(2012.2.23)
【国際特許分類】
【出願日】平成21年10月1日(2009.10.1)
【国際出願番号】PCT/US2009/059281
【国際公開番号】WO2010/039997
【国際公開日】平成22年4月8日(2010.4.8)
【出願人】(501345323)ザ ユニバーシティ オブ ノース カロライナ アット チャペル ヒル (52)
【氏名又は名称原語表記】THE UNIVERSITY OF NORTH CAROLINA AT CHAPEL HILL
【住所又は居所原語表記】308 Bynum Hall,Campus Box 4105,Chapel Hill,North Carolina 27599−4105, United States of America
【Fターム(参考)】
[ Back to top ]

