遺伝子多型検出法
【課題】検出サイトの自由度が高く、誤認識の危険性が著しく少なく、かつ簡便な操作によって遺伝子多型を検出する方法、簡便な操作によるものでありながら感度良く遺伝子多型を検出する方法、及び検出機器の汎用性が高い遺伝子多型検出法を提供する。
【解決手段】特定の配列(下流から順に連続する第1領域、第2領域及び第3領域からなり、第2領域は検出すべき多型の塩基から構成される)を有する、試料中の特定の核酸に、第1オリゴヌクレオチド(第3領域の相補配列、第2領域の相補配列、非相補的フラップ配列、及び第3領域の相補配列に捕捉可能なタグを有する)と、第2オリゴヌクレオチド(第1領域の相補配列、及び任意の配列を有する)とを、ハイブリダイズさせて3本鎖構造体を形成させ、FENによりフラップ配列を含む核酸断片を遊離させ、タグを捕捉する手段によってタグを捕捉し、核酸断片を検出することによって多型を確認する、遺伝子多型検出方法。
【解決手段】特定の配列(下流から順に連続する第1領域、第2領域及び第3領域からなり、第2領域は検出すべき多型の塩基から構成される)を有する、試料中の特定の核酸に、第1オリゴヌクレオチド(第3領域の相補配列、第2領域の相補配列、非相補的フラップ配列、及び第3領域の相補配列に捕捉可能なタグを有する)と、第2オリゴヌクレオチド(第1領域の相補配列、及び任意の配列を有する)とを、ハイブリダイズさせて3本鎖構造体を形成させ、FENによりフラップ配列を含む核酸断片を遊離させ、タグを捕捉する手段によってタグを捕捉し、核酸断片を検出することによって多型を確認する、遺伝子多型検出方法。
【発明の詳細な説明】
【技術分野】
【0001】
本発明は、SNPなどの検出を簡便に行うことができる標的核酸の検出方法、及び、その方法により得られた結果を用いて薬剤投与や病気罹患率などの診断を行う方法に関する。
この遺伝子多型検出方法は、遺伝子解析の研究や臨床分野において利用することができる。
【背景技術】
【0002】
フラップエンドヌクレアーゼ(FEN-1)が、ダブルフラップ(Double FLAP)構造と呼ばれる3塩基の立体構造を認識して、フラップ(FLAP)と呼ばれるオリゴヌクレオチドが遊離することが知られている(例えば、Harrington JJ and Lieber MR, Journal of Biological Chemistry, 1995 Mar 3; 270 (9): 4503-4508. Fig. 5.B参照)。
【0003】
一方、SNP部位の塩基を判別する、いわゆるタイピングについては多くの手法が報告されている。そのうちの代表的なものとして、インベーダー法、タックマンPCR法、モレキュラービーコン法、プライマーエクステンション法などが挙げられる(例えば、Kirk BW, Feinsod M, Favis R, Kliman RM and Barany F, Nucleic Acids Research, 2002 Aug 1; 30 (15): 3295-3311参照)。
【0004】
インベーダー法は、2段階の酵素反応により、フラップ(FLAP)プローブから遊離した蛍光物質を測定する手法である。
具体的には、インベーダー法は、フラッププローブとインベーダープローブとが鋳型DNAにハイブリダイズしたダブルフラップ構造を形成し、酵素クリベース(Cleavase)がこの構造を認識しフラッププローブを切断することによってフラップ部分を遊離する工程を第1段階として;遊離したフラップをフレットと結合させ、再度クリベースで切断することで、フレットにおける消光物質と蛍光物質とを遊離させる工程を第2段階として含む。その結果、発生した蛍光を検出することで、SNPのアレル判定を行う。
この方法は、フレット(FRET)配列を共通化することにより、2段階目の反応を共通に行うことができるように工夫されているのが特徴である(例えば、特表2002−515737号公報参照)。
【0005】
インベーダー法の利点を挙げると以下の通りである。1)ゲノム上の広い範囲でプローブを設計することが可能であり、その自由度は比較的高い;2)遺伝子変異部を含む領域を予めPCRで増幅しておくことを必ずしも必要としない;及び、3)合成にコストがかかるフレットを共通配列とすることで、SNPごとのプローブ設定費用が安価で済む。
【0006】
タックマンPCR法、モレキュラービーコン法、プライマーエクステンション法、アレル特異的競合PCR法などは、PCRを基本とした手法である。
【0007】
PCRを用いた多型検出法としては、他にもPCR−RFLP(Restriction Fragment Length Polymorphism;制限酵素断片長多型)法などが挙げられる。
【0008】
PCR−RFLP法においては、電気泳動によって多型を検出する。この方法は、PCR産物の中に遺伝子変異部を認識する制限酵素が存在する場合、共通配列部位にプライマーを設定し、その内側、すなわちPCR産物内に多型性を持たせて増幅する。PCR増幅産物を上記制限酵素で切断し、得られた断片を電気泳動により展開し、断片の長さに基づいて多型の有無を判定する。
【0009】
PCRを用いた多型検出法としては、さらにシーケノムによって報告されたマスアレイ(MASSARAY)システム(特表2002−507883号公報参照)なども挙げられる。
【0010】
マトリックス介助レーザー脱離イオン化−飛行時間型マススペクトロメトリー(MALDI−TOF MS)は、一般的にタンパク質を対象に用いられることが多く、DNAへの適用は少ないが、マスアレイシステムは、MALDI−TOF MSも利用するSNP解析法である。マスアレイシステムにおいては、ダイデオキシヌクレオチドとデオキシヌクレオチドとの混合反応を用いた一塩基伸長により、質量数の異なるオリゴヌクレオチドを生成し、生成したオリゴヌクレオチドをMALDI−TOF MSで検出することでSNPの判別を行う。
【0011】
特開2002−171992号公報においては、ダブルフラップ構造を形成するフラップ含有プローブの5´末端を担体に固定化し、ダブルフラップ構造形成に関与しない別のプローブと前記フラップとを、前記担体上でアニールさせ、前記別のプローブを鋳型としてポリメラーゼ反応により多型を検出する方法が記載されている。
【0012】
また、特開2001−103999号公報においては、検出すべき特定の核酸配列に対するプローブを、そのプローブが有する標識やフラッグ配列が検出すべき特定の核酸ごとに異なるように設計し、特定の核酸配列を検出する方法が記載されている。
【0013】
【非特許文献1】カーク・BW(Kirk BW)、ファインソード・M(Feinsod M)、ファビス・R(Favis R)、クリーマン・RM(Kliman RM)、及びバーラーニ・F(Barany F)、複雑な疾患との長期関連性を探求する一塩基多型(Single nucleotide polymorphism seeking long term association with complex disease)、「ヌクレイック・アシッズ・リサーチ(Nucleic Acids Research)」、第30巻、第15号、p.3295−3311、2002年8月1日
【非特許文献2】ハリントン・JJ(Harrington JJ)及びリーバー・MR(Lieber MR)、FEN−1結合に必要なDNA構造要素(DNA structural elements required for FEN-1 binding)、「ジャーナル・オブ・バイオロジカル・ケミストリー(Journal of Biological Chemistry)」、第270巻、第9号、p.4503−4508、第5.B図、1995年3月3日
【特許文献1】特表2002−515737号公報
【特許文献2】特表2002−507883号公報
【特許文献3】特開2002−171992号公報
【特許文献4】特開2001−103999号公報
【発明の開示】
【発明が解決しようとする課題】
【0014】
従来の方法では、例えば以下のような問題点がある。
RFLP法では、以下に述べるように、検出サイトの自由度の低さ、操作の煩雑さ、誤認識の危険性などの問題がある。
【0015】
すなわち、電気泳動を用いたタイピング法のうち、PCR−RFLP法が利用できるのは、PCR産物の中に遺伝子変異部を認識する制限酵素が存在する場合に限られており、また制限酵素サイトが都合よく調べたい場所にあるとは限らない。このため、検出サイトの自由度が低い。
【0016】
また、PCRの増幅産物や、制限酵素で切断された増幅産物の長さが短い場合には、アクリルアミド電気泳動や高濃度のアガロースゲルなどで電気泳動を行うため、操作が煩雑である。或いは、予めプライマーの末端を蛍光でラベル化し、蛍光シーケンサーなどで検出する必要があるため、高額な機器が必要となる。
【0017】
RFLP法では、制限酵素サイトの有無で判定を行うため、仮に、制限酵素認識配列があるにもかかわらず酵素反応が進まなかった場合は、認識配列が無かった(すなわち変異が無かった)と判定される危険性がある。さらに、制限酵素による切断断片のパターンによって判断を行うため、切れ残りがミスジャッジを引き起こす問題を常にはらんでいる。
【0018】
プライマーエクステンション法は、通常、伸長反応時のddNTPとdNTPの取り込みの違いにより、一塩基程度の長さを判別しなければならない。このため、検出器の分解能に高い性能が備わっていないと判別を行うことができない。
【0019】
タックマンPCR法、モレキュラービーコン法は、個別の特許が成立しており、実際の試験では、権利にかかわるコストが問題になる。
【0020】
アレル特異的競合PCR法では、判定は、各アレルに対する、PCR反応時のプライマーの認識のみに依存している。このため、PCR反応の早い時期に間違いを起こした場合には、非特異反応として検出されてしまう。
【0021】
その他、PCR反応を基本とした手法の一般的な問題点としては、以下が挙げられる。
例えばプライマーエクステンション法や競合PCR法などにおいて、PCRで遺伝子変異部位を含む領域を増幅した後、別のプライマーで反応を行う場合、最初の増幅に用いたプライマーやdNTPを予め除く必要がある。特に、プライマーエクステンション法の場合は、ダイデオキシで伸長を止めるため、完全にdNTPを除く必要がある。そして、必ずPCR産物の精製工程を要する。マスアレイシステムにおいても最初に核酸増幅が行われるが、やはり最初の増幅に用いたプライマーやdNTPは予め除く必要がある。
このため、操作が煩雑であり、反応のコストも高かった。
【0022】
マスアレイシステムをはじめ、MALDI−TOF MSを用いた手法の一般的な問題点としては、以下が挙げられる。例えば、プローブの配列により、イオン化の際に分解が起こり、ピークの検出が難しい場合がある。また、一塩基の差(約300−400Da)を比較するため、質量分析装置について精度の高い調整が必要であり、未反応のオリゴヌクレオチドプローブとの区別がつけにくい場合がある。
【0023】
従来のインベーダー法には、以下の問題点がある。
インベーダー法では、特定のアレルに反応して、切断され遊離したDNA断片をFRETカセットにて検出する。すなわち、インベーダー法では、検出用にFRETのカセットを用意しなければ検出を行うことができない。このように、インベーダー法では検出器の汎用性に関する問題がある。
そして、インベーダー法の検出の手段は蛍光検出法のみに限られ、他の方法によって検出を行うことはできない。
【0024】
<1>そこで本発明の目的は、検出サイトの自由度が高く、誤認識の危険性が著しく少なく、かつ簡便な操作によって遺伝子多型を検出する方法を提供することにある。
<2>また、本発明の目的は、簡便な操作によるものでありながら感度良く遺伝子多型を検出する方法を提供することにある。
<3>さらに、本発明の目的は、検出機器の汎用性が高い遺伝子多型検出法を提供することにある。
【0025】
本発明は、以下の発明を含む。
下記(1)においては、特定の核酸、捕捉可能なタグを有する第1オリゴヌクレオチド、及び第2オリゴヌクレオチドがダブルフラップ構造を形成し、フラップエンドヌクレアーゼが当該構造を認識するとともに核酸断片(本明細書ではフラップ断片と記載することがある)を遊離させ、前記捕捉可能なタグの捕捉と前記遊離した核酸断片の検出とを行うことを記載する。
【0026】
(1)
(i)特定の配列として、第1領域、第2領域及び第3領域からなる配列であって、前記第1領域は前記第2領域に隣接した下流に位置し、前記第2領域は検出すべき多型の塩基から構成され且つ前記第3領域に隣接した下流に位置する特定の配列を有する、試料中の特定の核酸に、
第1オリゴヌクレオチドとして、前記第3領域に相補的な配列、前記第2領域に相補的な配列、前記特定の配列と相補性のないフラップ配列、及び前記第3領域に相補的な配列において捕捉可能なタグを有するオリゴヌクレオチドであって、前記第3領域に相補的な配列は前記第2領域に相補的な配列に隣接した下流に位置し、前記第2領域に相補的な配列は前記フラップ配列に隣接した下流に位置するオリゴヌクレオチドと、
第2オリゴヌクレオチドとして、前記第1領域に相補的な配列、及び任意の配列を有するオリゴヌクレオチドであって、前記任意の配列は前記第1領域に相補的な配列に隣接した下流に位置するオリゴヌクレオチドとを、ハイブリダイズさせることによって、3本鎖構造体を形成させる工程と、
(ii)前記3本鎖構造体の3重鎖部分をフラップエンドヌクレアーゼに認識させることにより前記フラップ配列を含む核酸断片を遊離させる工程と、
(iii)前記捕捉可能なタグを捕捉する手段を用いることによって、前記遊離した核酸断片を精製する工程と、
(iv)前記遊離した核酸断片を検出することによって前記多型を検出する工程とを含む、遺伝子多型検出法。
【0027】
(2)
前記第1オリゴヌクレオチドが有する前記タグは、前記第1オリゴヌクレオチドの3´末端に位置する、(1)に記載の遺伝子多型検出法。
【0028】
(3)
さらに前記第2オリゴヌクレオチドが捕捉可能なタグを有する、(1)又は(2)に記載の遺伝子多型検出法。
【0029】
(4)
前記捕捉可能なタグは、ビオチンタグ、ヒスチジンタグ、ストレプトアビジンタグ、FLAGタグ、GSTタグ、MBPタグからなる群から選ばれる、(1)〜(3)のいずれかに記載の遺伝子多型検出法。
【0030】
下記(5)〜(10)は、前記核酸断片(フラップ断片)を、電気泳動を用いて検出する形態に向けられる。
【0031】
(5)
前記工程(iv)において、前記核酸断片を、電気泳動装置を用いて検出する、(1)〜(4)のいずれかに記載の遺伝子多型検出法。
【0032】
下記(6)〜(10)は、前記核酸断片(フラップ断片)を、電気泳動を用いて検出する形態における、フラップ配列の設計に関する。
【0033】
(6)
前記工程(i)において、前記第1オリゴヌクレオチドとして、前記多型のアレルのそれぞれに応じて異なる前記フラップ配列を有するように設計されたオリゴヌクレオチドを用いる、(5)に記載の遺伝子多型検出法。
【0034】
(7)
前記試料中に検出すべき多型部位が複数箇所存在し、前記工程(i)において、前記第1オリゴヌクレオチドとして、前記複数の検出すべき多型のそれぞれに応じて異なる前記フラップ配列を有するように設計されたオリゴヌクレオチドを用いる、(5)又は(6)に記載の遺伝子多型検出法。
【0035】
(8)
前記異なるフラップ配列はそれぞれ互いに長さにおいて異なる、(6)又は(7)に記載の遺伝子多型検出法。
【0036】
(9)
前記工程(i)において、前記第1オリゴヌクレオチドとして、前記フラップ配列において蛍光物質をさらに有するオリゴヌクレオチドを用い、
前記工程(iv)において、前記蛍光物質に基づいて前記遊離した核酸断片を検出する、(5)〜(8)のいずれかに記載の遺伝子多型検出法。
【0037】
(10)
前記蛍光物質は、前記第1オリゴヌクレオチドの5´末端に位置する、(9)に記載の遺伝子多型検出法。
【0038】
下記(11)〜(15)は、前記核酸断片(フラップ断片)を、質量分析によって検出する形態に向けられる。
【0039】
(11)
前記工程(iv)において、前記核酸断片を、質量分析装置を用いて検出する、(1)〜(4)のいずれかに記載の遺伝子多型検出法。
【0040】
下記(12)は、前記核酸断片(フラップ断片)を、質量分析によって検出する形態における、質量分析装置の具体例に関する。
(12)
前記質量分析装置がマトリックス介助レーザー脱離イオン化(MALDI)/飛行時間型(TOF)マススペクトロメトリーである、(11)に記載の遺伝子多型検出法。
【0041】
下記(13)〜(15)は、前記核酸断片(フラップ断片)を、質量分析によって検出する形態における、フラップ配列の設計に関する。
【0042】
(13)
前記工程(i)において、前記第1オリゴヌクレオチドとして、前記多型のアレルのそれぞれに応じて異なる前記フラップ配列を有するように設計されたオリゴヌクレオチドを用いる、(11)又は(12)に記載の遺伝子多型検出法。
【0043】
(14)
前記試料中に検出すべき多型部位が複数箇所存在し、前記工程(i)において、前記第1オリゴヌクレオチドとして、前記複数の検出すべき多型部位のそれぞれに応じて異なる前記フラップ配列を有するように設計されたオリゴヌクレオチドを用いる、(11)〜(13)のいずれかに記載の遺伝子多型検出法。
【0044】
(15)
前記異なるフラップ配列は、それぞれ互いに長さにおいて異なる、(13)又は(14)に記載の遺伝子多型検出法。
【0045】
下記(16)〜(20)は、第3オリゴヌクレオチドをさらに用い、前記核酸断片(フラップ断片)が第3オリゴヌクレオチドにハイブリダイズして生じる2本鎖構造を検出することによって前記核酸断片(フラップ断片)を検出する形態に向けられる。
【0046】
(16)
前記工程(iv)において、第3オリゴヌクレオチドとして、前記フラップ配列と相補的な配列を有するオリゴヌクレオチドを用い、前記第3オリゴヌクレオチドと前記遊離した核酸断片とをハイブリダイズさせることによって形成する2本鎖構造を検出することによって前記遊離した核酸断片を検出する、(1)〜(4)のいずれかに記載の遺伝子多型検出法。
【0047】
下記(17)〜(20)は、第3オリゴヌクレオチドを用いる形態において、核酸断片と第3オリゴヌクレオチドとのハイブリダイズの際に蛍光共鳴エネルギー移動を生じさせることによって、前記2本鎖構造を検出する場合について記載する。前記ハイブリダイズの際に核酸断片と第3オリゴヌクレオチドとの間で蛍光共鳴エネルギー移動が可能となるように、第1オリゴヌクレオチド及び第3オリゴヌクレオチドには、予め蛍光エネルギー供与体や蛍光エネルギー受容体が設けられている。
【0048】
(17)
前記工程(i)において、第1オリゴヌクレオチドとして、前記フラップ配列において蛍光エネルギー供与体又は蛍光エネルギー受容体をさらに有するオリゴヌクレオチドを用い、
前記工程(iv)において、
前記第1オリゴヌクレオチドにおける前記フラップ配列が蛍光エネルギー供与体を有する場合、第3オリゴヌクレオチドとして、蛍光エネルギー受容体をさらに有するオリゴヌクレオチドと、前記遊離した核酸断片とをハイブリダイズさせることによって2本鎖構造を形成させるか、又は、
前記第1オリゴヌクレオチドにおける前記フラップ配列が蛍光エネルギー受容体を有する場合、第3オリゴヌクレオチドとして、蛍光エネルギー供与体をさらに有するオリゴヌクレオチドと、前記遊離した核酸断片とをハイブリダイズさせることによって2本鎖構造を形成させ、
前記2本鎖構造において、前記蛍光エネルギー供与体と前記蛍光エネルギー受容体とが近接することにより発せられる蛍光に基づいて、前記2本鎖構造を検出する、(16)に記載の遺伝子多型検出方法。
【0049】
下記(18)は、蛍光共鳴エネルギー移動を利用して第3オリゴヌクレオチドを検出する場合の、蛍光エネルギー供与体及び蛍光エネルギー受容体の、オリゴヌクレオチドにおける位置に関する。
【0050】
(18)
前記第1オリゴヌクレオチドにおける前記フラップ配列が蛍光エネルギー供与体を有する場合、前記蛍光エネルギー供与体は前記フラップ配列の5´末端に位置し、前記蛍光エネルギー受容体は前記第3オリゴヌクレオチドの3´末端に位置し、
前記第1オリゴヌクレオチドにおける前記フラップ配列が蛍光エネルギー受容体を有する場合、前記蛍光エネルギー受容体は前記フラップ配列の5´末端に位置し、前記蛍光エネルギー供与体は前記第3オリゴヌクレオチドの3´末端に位置する、(17)に記載の遺伝子多型検出方法。
【0051】
下記(19)は、蛍光共鳴エネルギー移動を利用して第3オリゴヌクレオチドを検出する場合の、蛍光の検出方法に関する。
(19)
前記蛍光エネルギー供与体又は前記蛍光エネルギー受容体の蛍光の変化を測定することによって、前記多型を検出する、(17)又は(18)に記載の遺伝子多型検出方法。
特に、上記(19)において蛍光エネルギー供与体側の蛍光の経時変化を測定する場合は、蛍光強度が下降していくことを確認することで、容易に検出することができる。
【0052】
下記(20)は、蛍光共鳴エネルギー移動を利用して第3オリゴヌクレオチドを検出する場合の、アレル及び/又は多型部位に対応したオリゴヌクレオチドの設計に関する。
(20)
前記第1オリゴヌクレオチド及び前記第3オリゴヌクレオチドが、前記蛍光エネルギー供与体と前記蛍光エネルギー受容体との組み合わせが前記多型のアレルのそれぞれに応じて異なるように設計されている、(17)〜(19)のいずれかに記載の遺伝子多型検出方法。
【発明の効果】
【0053】
本発明は、以下の効果を奏する。
<1>本発明によると、検出サイトの自由度が高く、誤認識の危険性が著しく少なく、かつ簡便な操作によって遺伝子多型を検出する方法を提供することができる。
【0054】
すなわち、本発明は、インベーダー反応のように検出サイトについて高い自由度を有する。このため、例えば従来の電気泳動法を用いた遺伝子多型検出法に比べ、検出できる多型部位の数が飛躍的に大きくなる。
【0055】
そして、本発明では、酵素反応(すなわちフラップエンドヌクレアーゼによる反応)が起こらなかった場合には、フラップ配列を有するオリゴヌクレオチドプローブ(すなわち本発明における第1オリゴヌクレオチド)のバンド又はピークが残り、いずれのアレルについてもフラップ断片のバンド又はピークが検出されない。このため、例えば従来の制限酵素反応によるPCR−RFLP法を用いた遺伝子多型検出法に比べ、誤認識の危険性が極めて低い。
【0056】
また、本発明は、検出のための装置として、既存のもの(例えば既存の電気泳動装置、既存の質量分析装置、既存の蛍光検出装置などの汎用性の高い装置)を用いることができる。このため、例えば従来のインベーダー法を用いた遺伝子多型検出法に比べ、簡便且つ安価に遺伝子多型検出を行うことができる。
【0057】
<2>本発明によると、簡便な操作によるものでありながら感度良く遺伝子多型を検出する方法を提供することができる。
すなわち、本発明は、オリゴヌクレオチドプローブのフラップ配列を、例えば長さにおいて任意に設定することができる。このように、各アレルに対応した2種類のオリゴヌクレオチドプローブ間において、フラップ配列を、長さにおいて任意に設定することにより、検出される各アレルに対応したフラップ断片の判別を容易にすることができる。さらに、オリゴヌクレオチドプローブのフラップ配列を、例えばPoly-Tなどのように、イオン化の条件下においても分解を受けにくい配列とすることができるため、ピークの検出を常に容易にすることができる。従って、感度のよい検出を容易に行うことができる。しかも、質量分析装置に特別な精度を求めることなく、このような感度の良い検出を行うことができる。
【0058】
<3>本発明によると、検出機器の汎用性が高い遺伝子多型検出法を提供することができる。
本発明では、検出のための方法として、電気泳動法、質量分析法、蛍光検出法などの方法を適用することが可能である。それだけでなく、いずれの検出法を用いても精度良く検出を行うことが可能である。
すなわち、本発明では、検出機器として、電気泳動法、質量分析法、蛍光検出法などの検出法におけるものを用いることが可能である。このため、本発明で使用できる検出機器の汎用性が高い。それだけでなく、これらの機器としては特別なものを用意する必要がなく、すでに述べたように、既存のものを用いることが可能である。この点からも、本発明で使用できる検出機器の汎用性は非常に高い。
【0059】
例えば、従来のインベーダー法による多型検出法では、検出用にFRETのカセットを別に用意しなければならなかったが、本発明では、蛍光共鳴エネルギー移動法を用いて検出を行う場合であっても、そのようなFRETのカセットを用意する必要はない。
【0060】
本発明は、特定の形態においてさらに以下の効果を奏する。
【0061】
例えば、従来のインベーダー法による多型検出法では、検出機器の汎用性に関して更なる問題がある。すなわち、通常、励起と蛍光との適正なスペクトルは、それぞれの物質にあわせて決まっており、蛍光共鳴エネルギー移動などのように、励起と蛍光との組み合わせが変わる場合、リアルタイムサイクラーや蛍光検出器では対応できない場合も多い。特に安価な機器では、予めこの組み合わせが決まっており、変更も出来ない。しかしながら本発明において蛍光共鳴エネルギー移動法を用いて検出を行う場合、励起波長と蛍光波長との双方を特に変えることなく、単一の蛍光物質(例えば蛍光供与体側)の蛍光に合わせた測定を行うだけで、検出が可能になる。
【0062】
さらに例えば、従来のインベーダー法では、クリベースを含む専用のキットに加えて蛍光検出用のプレートリーダが必要になる。そして、遊離した蛍光物質を測定するため、蛍光の拡散が起こり、クローズドなウェル内でしか測定が出来ない。
しかしながら本発明において蛍光共鳴エネルギー移動法を用いて検出を行う場合、蛍光物質が遊離することが無いので、第3オリゴヌクレオチド(例えば蛍光受容体が付与されたオリゴヌクレオチド)を固定化しておくことで、開放系での検出が可能になる。このため、例えば従来のインベーダー法に比べ、簡便且つ検出器の汎用性の高い遺伝子多型検出を行うことができる。
【0063】
本発明においては、検出のための装置として電気泳動装置や質量分析装置を用いる場合に、オリゴヌクレオチドプローブに対して高価な標識が必要なくなるため、例えば従来のインベーダー法を用いた遺伝子多型検出法に比べ、安価に遺伝子多型検出を行うことができる。
【0064】
本発明においては、予め検出すべき多型を含む領域をPCR増幅する場合であっても、増幅後に再度伸長反応を行うことがないため、余剰のプライマーやdNTPを除去する必要がない。このため、例えば従来のPCR反応を基本とした遺伝子多型検出法に比べ、簡便に遺伝子多型検出を行うことができる。
【発明を実施するための最良の形態】
【0065】
本発明は、検出すべき多型を有する特定の核酸を鋳型核酸とし、鋳型核酸に対し、フラップ配列と捕捉可能なタグを有する第1オリゴヌクレオチドと、第2オリゴヌクレオチドとをハイブリダイズさせることにより、3本鎖構造体を形成し、フラップエンドヌクレアーゼによってフラップ配列を含む核酸断片を遊離し、捕捉可能なタグを捕捉する一方で遊離した核酸断片を検出することにより、多型を検出する方法である。鋳型核酸は、予め増幅されても良い。遊離した核酸断片の検出は、例えば、電気泳動法、質量分析法、及び蛍光共鳴エネルギー移動法などを用いて行うことができる。
【0066】
[1.検出の対象]
[1−1.遺伝子の種類]
本発明における検出の対象としては、特に限定されないが、例えば、cDNA、ヒトを含む様々な生物のゲノミック遺伝子、ウイルス及び細菌を含む様々な微生物の遺伝子などが挙げられる。従って、これら核酸の配列を有するものを鋳型核酸とすることができる。また、これら検出対象となる遺伝子としては、DNAの遺伝子及びRNAの遺伝子を問わない。
【0067】
[1−2.試料]
鋳型核酸を含む試料としても特に限定されない。すなわち、生体試料、生体由来試料、抽出核酸試料などに対して多型検出を行うことができる。ここで、生体試料や生体由来試料は、核酸の抽出操作を行わず、核酸包含体(例えば細胞、真菌、細菌、ウイルスなど、核酸を内部に含有する膜構造体)を維持した形態の試料である。生体試料の例としては、臓器、組織、体液、排泄物などが挙げられる。体液には、血液試料、髄液、唾液、乳等が含まれる。血液試料には、全血、血漿、血清等が含まれる。排泄物には、尿、便などが含まれる。生体由来試料は、生体試料から核酸包含体を回収した試料をいう。核酸包含体の回収方法としては特に限定されないが、遠心・超遠心操作、ポリエチレングリコールなどの共沈剤、吸着担体などを用いた方法が挙げられる。抽出核酸試料は、核酸の抽出操作を行った試料であり、抽出後さらに核酸を精製した試料であっても良い。抽出方法としては、酵素、界面活性剤、カオトロピック剤などを用いた方法が挙げられ、精製方法としては、フェノール/クロロホルム、イオン交換樹脂、ガラスフィルター、ガラスビーズ、磁気ビーズ、タンパク凝集作用を有する試薬などを用いた方法が挙げられる。
【0068】
[1−3.多型]
本発明で検出できる多型は特に限定されず、いわゆる単一ヌクレオチド多型(1塩基多型:single nucleotide polymorphism:SNP)及び複数ヌクレオチドからなる配列にわたる多型の両方を含む。本発明においては、多型にはさらに変異も含むものとする。具体的には、本発明で検出できる多型の例としては、一塩基多型、挿入多型、欠失多型などが挙げられる。
【0069】
[2.3本鎖構造体]
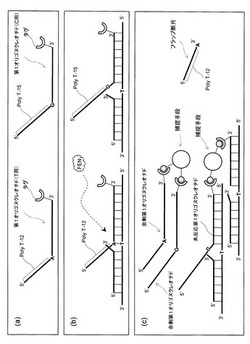
本発明の3本鎖構造体の例を、図1(a)及び(b)に示す。
[2−1.鋳型核酸の構成]
本発明において、特定の核酸である鋳型核酸は、第1領域、第2領域及び第3領域から構成される特定の配列を含む。第1領域は第2領域に隣接した下流に位置し、第2領域は第3領域に隣接した下流に位置する。このうち第2領域が、検出すべき多型の塩基から構成される領域である。
【0070】
[2−2.第1オリゴヌクレオチドの構成]
第1オリゴヌクレオチドは、フラップ配列と、捕捉可能なタグと、第2領域から第3領域に特異的な配列とを有するオリゴヌクレオチドである。フラップ配列は、特定の配列と相補性のない配列(具体的には、第1領域に相補性のない配列)である。すなわち第1オリゴヌクレオチドは、第3領域に相補的な配列、第2領域に相補的な配列、及び特定の配列と相補性のないフラップ配列を有する。そして、第3領域に相補的な配列は第2領域に相補的な配列に隣接した下流に位置し、第2領域に相補的な配列はフラップ配列に隣接した下流に位置する。さらに、第1オリゴヌクレオチドは、第3領域に相補的な配列に隣接する上流に、鋳型核酸と相補性のない配列(具体的には、鋳型核酸における、特定の配列に隣接する下流の配列と相補性のない配列)を有していても良い。
【0071】
[2−2−1.捕捉可能なタグ]
捕捉可能なタグとしては特に限定されるものではなく、特定の物質と特異的に結合することによって自身が捕捉され得るものであればよい。例えば、ビオチンタグ、ヒスチジンタグ、ストレプトアビジンタグ、FLAGタグ、GSTタグ、MBPタグからなる群から選択することができる。
タグの位置としては、第1オリゴヌクレオチドにおける、鋳型核酸の第3領域に相補的な領域であればよい。フラップエンドヌクレアーゼによる反応の際の立体的要因を考慮し、第3領域に相補的な領域の、より3’末端側に近い位置が好ましい。特に、第1オリゴヌクレオチドの3’末端にタグが位置していることが好ましい。
【0072】
また、捕捉可能なタグは、第1オリゴヌクレオチドに加えて、第2オリゴヌクレオチドに付されていても良い。この場合については、後述の2−3.第2オリゴヌクレオチドの構成において述べる。
【0073】
[2−2−2.蛍光物質を有する場合のフラップ配列]
蛍光共鳴エネルギー移動法を用いた検出を行う場合(後述6C.)や、電気泳動法において蛍光検出による検出を行う場合(後述6A−3−1.)、第1オリゴヌクレオチドのフラップ配列は蛍光物質を有する。フラップ配列における蛍光物質の位置は特に限定されないが、蛍光物質は、フラップ配列の5´末端に設けることができる。
【0074】
蛍光共鳴エネルギー移動法を用いた検出を行う場合(後述6C.)、第1オリゴヌクレオチドのフラップ配列は、蛍光エネルギー供与体又は蛍光エネルギー受容体を有する。図1(b)は、蛍光エネルギー供与体“d”が第1オリゴヌクレオチドの5´末端に位置した第1オリゴヌクレオチドを用いた場合の3本鎖構造体の例を模式的に示したものである。
【0075】
蛍光エネルギー供与体は、サイバーゴールド、サイバーグリーンI、FAM、フルオレセイン(FITC)系発色団などから選ぶことができる。また、蛍光エネルギー受容体は、Cy5、ローダミン、TAMRA、Red640、Red705、及びROXなどから選ぶことができる。
【0076】
電気泳動法において蛍光検出による検出を行う場合(後述6A−3−1.)の、第1オリゴヌクレオチドにおける蛍光物質としては、FITC系発色団、6−FAM、HEX、TET、TAMRA、テキサスレッド、Cy3、Cy5、ローダミンなどから選ぶことができる。これらの蛍光物質は、電気泳動による検出の際に使用される、フラップ断片検出用標識と特異的に結合するものである。
【0077】
[2−3.第2オリゴヌクレオチドの構成]
第2オリゴヌクレオチドは、第1領域に特異的なオリゴヌクレオチドである。第2オリゴヌクレオチドは、第1領域に相補的な配列、及び、任意の配列を有する。そして、任意の配列は、第1領域に相補的な配列に隣接した下流に位置する。さらに、第2オリゴヌクレオチドは、第1領域に相補的な配列に隣接する下流に、鋳型核酸と相補性のない配列(具体的には、鋳型核酸における、特定の配列に隣接する上流の配列と相補性のない配列)を有していても良い。
【0078】
また、第2オリゴヌクレオチドは、上述の捕捉可能なタグを有していて良い。この場合、タグの位置としては、第2オリゴヌクレオチドにおける、鋳型核酸の第1領域に相補的な領域であればよい。フラップエンドヌクレアーゼによる反応の際の立体的要因を考慮し、第1領域に相補的な領域の、より5’末端に近い位置が好ましい。特に、第2オリゴヌクレオチドの5’末端にタグが位置していることが好ましい。
【0079】
[2−4.フラップエンドヌクレアーゼ]
フラップエンドヌクレアーゼは、核酸の特殊な構造、すなわち3本鎖構造(ダブルフラップ構造)を認識し、第1オリゴヌクレオチドを切断することによってフラップ配列を含む核酸断片を遊離することができるものであれば特に限定されない。具体的には、鋳型核酸、第1オリゴヌクレオチド及び第2オリゴヌクレオチドが3本鎖構造体を形成したとき、3重鎖部分を認識し、第1オリゴヌクレオチドを切断する酵素であれば良い。例えば、クリベース(cleavase)などのフラップエンドヌクレアーゼや、特開平11−75849号公報に記載されている熱耐性フラップエンドヌクレアーゼが挙げられる。
【0080】
例えば多型がSNPでフラップエンドヌクレアーゼを用いる場合、図2に示すように、3本鎖構造体のSNPの部位の構造がフラップエンドヌクレアーゼによって認識され(図2(a))、SNP部位に対応する塩基の3´側で第1オリゴヌクレオチドが切断され、フラップ配列及びSNP部位に対応する塩基を有する核酸断片(以下、フラップ断片と記載する。)が遊離する(図2(b))。
【0081】
一方、図2のような特殊な3本鎖構造体が形成されなかった場合、図3(a)に示すように、フラップエンドヌクレアーゼはSNPの部位の構造を認識することができない。このため、第1オリゴヌクレオチドの切断が起こらず、フラップ断片は遊離しない。
【0082】
[3.オリゴヌクレオチド設計]
[3−1.第1オリゴヌクレオチドの設計]
第1オリゴヌクレオチドは、通常、試料中の多型部位一箇所つき、多型のアレルそれぞれに応じて設計されている。例えば、第1オリゴヌクレオチドとしては、アレル特異的な2種のオリゴヌクレオチドを用いることができる。そして、これらアレル特異的な第1オリゴヌクレオチドの一方及び/又は他方から生じるフラップ断片が検出工程において識別可能となるように、第1オリゴヌクレオチドそれぞれのフラップ部分を設定することができる。
いずれのアレルが検出されたかの区別が可能となるように、第1オリゴヌクレオチドのそれぞれは、フラップ部分の配列において、アレルに応じて異なるように設計することができる。
【0083】
遺伝子多型検出法においては、試料中の複数の多型部位を検出ターゲットにする場合が多い。この場合、第1オリゴヌクレオチドは、検出すべき複数の多型部位の箇所それぞれに応じて設計されている。例えば、第1オリゴヌクレオチドとしては、アレル特異的な2種の第1オリゴヌクレオチドのセットを、多型部位の種類の数だけ用いることができる。そして、これら多型部位に応じて設計された第1オリゴヌクレオチドから生じるフラップ断片のそれぞれが検出工程において識別可能となるように、第1オリゴヌクレオチドそれぞれのフラップ部分を設定することができる。いずれの部位の多型が検出されたかの区別が可能となるように、第1オリゴヌクレオチドのそれぞれは、フラップ部分の配列において、多型の部位に応じて異なるように設計することができる。
【0084】
フラップ配列が互いに異なる第1オリゴヌクレオチドにおいては、フラップ配列の長さが互いに異なるものが好ましい。例えば、フラップ配列が、単一の塩基から構成され長さにおいてのみ互いに異なるものとすることができる。
【0085】
第1オリゴヌクレオチド及びフラップ配列の長さとしては特に限定されず、当業者が適宜設定することができる。
例えば、電気泳動法や質量分析法を用いて検出を行う場合は、用いる電気泳動装置や質量分析装置の分離能を考慮して設定することができる。より具体的には、一方のアレルに対応するフラップ断片と他方のアレルに対応するフラップ断片とが電気泳動やマススペクトルにおいて判別がつくように、それぞれの長さを設定すると良い。
【0086】
例えば、第1オリゴヌクレオチドを、例えば25〜140merの長さに設定することができる。この設定された長さのうち、フラップ配列を例えば10〜50merの長さに設定することができる。さらに、異なる第1オリゴヌクレオチド間においては、フラップ配列は、互いに1〜20merの長さの差をもって設定すると良い。また、上の設定された長さのうち、第2及び第3領域に相補的な配列は例えば15〜80merの長さに設定することができる。
【0087】
なお、質量分析法によって検出を行う場合は、フラップ配列自体は、質量分析におけるイオン化の条件下において分解を受けにくい配列とすることが好ましい。このような配列としては、例えばTのみからなる配列(poly-T)などが挙げられる。
【0088】
また、異なる第1オリゴヌクレオチド間においては、フラップ配列自体は、Tm値ができるだけそろうように設計されることが好ましい。
【0089】
蛍光共鳴エネルギー移動法によって検出を行う場合は、アレルに応じて、フラップ配列が異なるように設計したり、フラップ配列の蛍光物質が異なるように設計したり、またフラップ配列と蛍光物質の両方とが異なるように設計したりすることができる(後の6C−6.に詳述)。
【0090】
[3−2.第2オリゴヌクレオチドの設計]
第2オリゴヌクレオチドの長さとしては特に限定されないが、例えば15〜60merの長さに設定することができる。この設定された長さのうち、第2オリゴヌクレオチドにおける任意の配列は、例えば多型を構成する配列と同じ長さにすることができる。例えば、SNPを検出する場合、任意の配列は1merとすると良い。上の設定された長さのうち、第1領域に相補的な配列は例えば9〜59merの長さに設定することができる。
【0091】
[4.3本鎖構造体形成及びフラップ断片の遊離]
3本鎖構造体形成及びフラップ断片の遊離を行うためには、以下の操作手順を行うことができる。例えば、検出したい多型を有する鋳型核酸を含む試料を、適当な希釈液と混合し、第1オリゴヌクレオチド、第2オリゴヌクレオチド、及びフラップエンドヌクレアーゼを含む反応液と混合し、以下の条件下で反応を行う。
【0092】
3本鎖構造体の形成及びフラップ断片の遊離のための反応は、例えば以下の条件で行うことができる。用いるフラップエンドヌクレアーゼにもよるが等温で55〜75℃、5分〜18時間の条件下で反応行うことができる。クリベースを用いる場合は、55〜68℃、5分〜18時間で反応を行うことができ、例えば63℃で30分程度の条件で反応を行うと良い。この反応に先立って核酸増幅を行った場合(後述7.)、用いたプライマーなどの試薬類は除去する必要はない。
【0093】
また、この反応の直前に、一本鎖にするための条件に供することが好ましい。このために、試料と反応液との混合物を例えば90℃以上で5分以上保持することができる。
【0094】
[5.タグの捕捉]
第1オリゴヌクレオチド、又は、第1オリゴヌクレオチド及び第2オリゴヌクレオチドが有していたタグは、タグを捕捉する手段によって捕捉される。タグを捕捉する工程は、用いる捕捉手段の形態にもよるが、フラップ断片の検出工程の前であればいつ行っても良い。例えば、タグの捕捉、上記の反応(すなわちタグを捕捉した状態で反応)、及びタグの除去をこの順番で行ってもよいし、上記の反応、タグの捕捉、及びタグの除去をこの順番で行ってもよい。
【0095】
ここで、上記の反応とは、3本鎖構造体を形成する反応と、フラップエンドヌクレアーゼによる認識反応とを含む。タグの捕捉は、捕捉手段と、タグを有する核酸種とを接触させることによって実現される。タグの除去は、捕捉手段を除去することによって実現される。例えば下記の5−2.で述べるような支持体を除去することによって実現されうる。
【0096】
[5−1.捕捉される核酸種]
当該手段によって捕捉することができる核酸種としては、余剰の第1オリゴヌクレオチド(たとえば図5(c)、図6、図7(c)など参照);余剰の第2オリゴヌクレオチド(ただし第2オリゴヌクレオチドがタグを有していた場合);鋳型核酸にハイブリダイズした未反応(すなわちフラップエンドヌクレアーゼによる認識反応が未反応)の第1オリゴヌクレオチド(たとえば図3(c)、図5(c)、図6、図7(c)など参照);鋳型核酸にハイブリダイズした第2オリゴヌクレオチド(ただし第2オリゴヌクレオチドがタグを有していた場合);及び、3重鎖構造体からフラップ断片が遊離した残部(たとえば図2(c)、図5(c)、図6、図7(c)など参照)、が挙げられる。
【0097】
上記の核酸種が捕捉により除去されることによって、フラップ断片が精製される。より具体的には、主としてフラップ断片を含む液(以下、フラップ断片液と記載する)が得られる。フラップ断片液中のその他の成分としては、鋳型核酸、場合により余剰の第2オリゴヌクレオチド、及び場合により鋳型核酸にハイブリダイズした第2オリゴヌクレオチドなどが挙げられる。
【0098】
[5−2.タグを捕捉する手段]
タグを捕捉する手段としては、第1オリゴヌクレオチド、又は、第1オリゴヌクレオチド及び第2オリゴヌクレオチド、が有するタグに応じて、当業者が適宜決定することができる。すなわち、タグを捕捉する手段としては、当該タグが特異的に結合することができる物質を含んでいるものであれば特に限定されない。
【0099】
タグが特異的に結合することができる物質としては、例えば、ビオチンタグに対してはアビジン、ヒスチジンタグに対してはニッケル、ストレプトアビジンタグに対してはビオチン、FLAGタグに対しては抗FLAG抗体、GSTタグに対してはグルタチオン、及びMBPタグに対してはマルトースが挙げられる。
【0100】
タグを捕捉する手段は、タグが特異的に結合することができる物質が、適当な支持体或いは担体に結合した形態で提供されうる。このような支持体或いは担体の材質及び形状も、当業者が適宜決定することができる。例えば、レジン、ガラスなどの材質の支持体、又は磁性体を含む材質の支持体(磁性ビーズとして提供されることが多い)が、カラム、ビーズ、チップ、その他さまざまな形状で提供されうる。
【0101】
[5−3.操作方法の例]
具体的な操作方法の例としては、チューブ等の容器に、鋳型核酸、必要な核酸種、及びフラップエンドヌクレアーゼなどを入れて反応させて得られた反応液に、捕捉手段(ここでは例としてビーズ状のものを用いたとする)を入れ、混合し、タグを捕捉する。そして、限外ろ過や遠心分離などの手法を用いてタグを捕捉したビーズを除去する。これにより、フラップ断片が精製される。
【0102】
具体的な操作方法の他の例としては、チューブ等の容器に、鋳型核酸、必要な核酸種、及びフラップエンドヌクレアーゼなどを入れて反応させて得られた反応液に、捕捉手段(ここでは例として磁性ビーズを用いたとする)を入れ、混合し、タグを捕捉する。そして、磁気ビーズ分離用スタンドを用いて磁場をかけることによって、フラップ断片液を溶出させる。
【0103】
[5−4.タグの捕捉を行うことの利点]
タグの捕捉を行うことによって、検出に不要な核酸種の大部分の除去、或いはそれに加えて、検出することができる核酸種をフラップ断片のみに絞り込むことが可能になる。
[5−4−1.電気泳動法によって検出を行う場合]
フラップ断片を電気泳動法によって検出する場合(後の6A.に詳述)においては、バックグラウンドが非常に少ないといえる。仮にタグの捕捉を行わない場合でも、フラップ断片自体の検出は可能である。しかしながら、タグの捕捉を行わない場合は、フラップ断片とともに、検出に不要な核酸種も検出されうる。本発明のようにタグの捕捉を行うと、例えば図5(c)に示すように、当該検出に不要な核酸種の中から、大部分の核酸種(すなわち上記捕捉することができる核酸種)を除去することが可能になる。このため、フラップ断片を非常に感度高く検出することが可能になる。このように、データの精度が良いという利点がある。
【0104】
フラップ断片を、電気泳動法によって検出する場合であって、さらに、第1オリゴヌクレオチドとして蛍光物質が付されたフラップ配列を有する場合(後述6A−3−1.)、タグの捕捉によって、蛍光を有する核酸種をフラップ断片のみに絞り込むことができる。具体的には、図5において、蛍光物質を有する第1オリゴヌクレオチドを用いた場合に相当する。図5において、蛍光物質を有する第1オリゴヌクレオチドを用いた場合の、図5(c)に相当する工程を図6に示す。図6においては、第1オリゴヌクレオチドに付された蛍光物質をFで示している。図6が示すように、蛍光物質を有する核酸種でフラップ断片以外のものは、捕捉手段によって捕捉され、除去される。すなわち、フラップ断片のみを検出することが可能である。このため、フラップ断片をさらに感度良く検出することが可能になる。
【0105】
このようにフラップ断片のみを検出できるため、複数の多型の部位に応じてフラップ断片が異なるように(例えば長さにおいて異なるように)設計された複数の第1オリゴヌクレオチドを用いた場合などに、1回の電気泳動で複数のフラップ断片を区別して検出することが可能である。すなわち、1回の電気泳動で複数の多型検出を同時に行うことが可能である。
【0106】
[5−4−2.質量分析法によって検出を行う場合]
フラップ断片を質量分析法によって検出する場合(後の6B.に詳述)にも、電気泳動法によって検出する場合の利点において述べたことと同様に、バックグラウンドが非常に少ないといえる。仮にタグの捕捉を行わない場合でも、フラップ断片自体の検出は可能である。しかしながら、タグの捕捉を行わない場合は、フラップ断片とともに、検出に不要な核酸種も検出されうる。本発明のようにタグの捕捉を行うと、例えば図5(c)に示すように、当該検出に不要な核酸種の中から、大部分の核酸種(すなわち上記捕捉することができる核酸種)を除去することが可能になる。このため、フラップ断片を非常に感度高く検出することが可能になる。このように、データの精度が良いという利点がある。
【0107】
[5−4−3.蛍光共鳴エネルギー移動法によって検出を行う場合]
フラップ断片を蛍光共鳴エネルギー移動法によって検出する場合(後の6C.に詳述)には、以下の利点がある。
【0108】
ここで、フラップエンドヌクレアーゼの反応後で且つタグの捕捉が行われる前において、第3オリゴヌクレオチドがハイブリダイズしうる核酸種としては、フラップ断片以外に、余剰の第1オリゴヌクレオチド、及び、鋳型核酸にハイブリダイズした未反応(すなわちフラップエンドヌクレアーゼによる認識反応が未反応)の第1オリゴヌクレオチドが挙げられる。
【0109】
仮にタグの捕捉を行わない場合でも、フラップ断片自体の検出は可能である。この場合、第3オリゴヌクレオチドは、上記ハイブリダイズしうる核酸種へ競合してハイブリダイズしうる。すなわち、第3オリゴヌクレオチドは、フラップ断片にハイブリダイズする以外に、余剰の第1オリゴヌクレオチドの一部分としてのフラップ配列や、鋳型核酸にハイブリダイズした未反応の第1オリゴヌクレオチドの一部分としてのフラップ配列、にハイブリダイズすることも可能ではある。しかしながら、余剰の第1オリゴヌクレオチドや未反応の第1オリゴヌクレオチドへのハイブリダイズの速度は、遊離したフラップ断片へのハイブリダイズの場合に比べて非常に遅い。従って、蛍光エネルギー受容体の蛍光が可能な強度に達するためには非常に時間がかかる。このため、フラップ断片自体の検出を行うためには、競合ハイブリダイズの速度差を利用し、第3オリゴヌクレオチドのハイブリダイズをリアルタイムで調べる必要がある。すなわち、最も早い第3オリゴヌクレオチドとフラップ断片とのハイブリダイズに起因して起こる蛍光強度の経時変化を調べる必要がある(後述実験例C)。
【0110】
本発明のようにタグの捕捉を行うと、例えば図7(c)に示すように、上記の第3オリゴヌクレオチドがハイブリダイズしうる核酸種から、フラップ断片以外の核酸種を除去することができる。このため、上記したようなハイブリダイズの競合が防がれ、図7(d)に示すように、検出される蛍光は、第3オリゴヌクレオチドとフラップ断片とのハイブリダイズによる蛍光のみとなる。このため、蛍光強度をリアルタイムで調べる必要がなくなり、したがって検出が非常に簡便になる。
【0111】
[6.多型の検出]
フラップ断片は、検出すべき多型を含んでいる。すなわち、フラップ断片を検出することによって多型を検出することができる。検出法としては特に限定されず、当業者によって適宜決定されてよい。例えば、検出法として、フラップ断片自身を直接検出するための方法を用いてもよいし、他の核酸プローブを用い、フラップ断片と当該核酸プローブとのハイブリダイズによって形成される構造体を検出するための方法を用いても良い。
フラップ断片自身を直接検出するための方法としては、例えば、電気泳動法を用いた検出法(後述6A.)、質量分析法を用いた検出法(後述6B.)などが挙げられる。他の核酸プローブを用いてフラップ断片を検出するための方法としては、蛍光共鳴エネルギー移動法を用いた検出法(後述6C.)、電気化学的方法を用いた検出法(後述6D.)、光化学的方法を用いた検出法(後述6E.)などが挙げられる。
【0112】
[6A.電気泳動法を用いた検出]
電気泳動法を用いた検出法においては、フラップ断片を直接検出することができる。以下、当該検出法についてさらに詳細に説明する。
【0113】
タグの除去を行った後のフラップ断片液は、電気泳動に供される。フラップ断片液は、必要に応じ、希釈用バッファーで適切な濃度に希釈することができる。このような希釈用バッファーとしては、TAEバッファー、TBEバッファー、TPEバッファー、TEバッファーなどが挙げられる。
【0114】
[6A−1.電気泳動装置]
本発明で用いることができる電気泳動装置としては、例えば、スラブゲル電気泳動装置やキャピラリー電気泳動装置が挙げられる。
スラブゲル電気泳動装置を用いる場合は、公知の方法を特に限定することなく用いることができる。好ましくは、分離媒体としてポリアクリルアミドゲルを用いる方法を行う。
【0115】
本発明においては、特に、操作簡便性と分離能との観点から、キャピラリー電気泳動装置を用いることが好ましい。ここで、キャピラリー電気泳動装置には、毛細管を分離流路として用いるキャピラリー電気泳動装置や、マイクロエレクトロメカニカルシステム技術を用いて基板内に微細流路を形成したデバイス(いわゆるマイクロチップ)を用いて、基板内の微細流路を分離流路とするキャピラリー電気泳動装置のいずれも含む。
【0116】
キャピラリー電気泳動装置におけるキャピラリーもしくは基板の材質としては、ガラス、溶融石英、含フッ素炭化水素樹脂製などが挙げられる。分離流路(本明細書においては、単に、キャピラリーと記載することがある)の内径としては、10〜1000μm、好ましくは50〜200μmである。マイクロチップを用いたキャピラリー電気泳動装置としては、MCE−2010(島津製作所製)、SV1210(日立製作所製)、2100バイオアナライザー(アジレント社製)などが挙げられる。
【0117】
キャピラリー電気泳動装置を用いる場合は、適切な容器に切断反応後の試料を入れ、装置にセットする。装置に試料をセットするための容器としては、連結チューブやマイクロタイタープレートなどが挙げられる。連結チューブとしては、8連チューブ、12連チューブなどが挙げられる。チューブの容量としては、0.2mlや0.5ml容量のものが挙げられる。マイクロタイタープレートとしては、96MTP(96ウェルマイクロタイタープレート)、384MTP(384ウェルマイクロタイタープレート)などが挙げられる。
【0118】
キャピラリー電気泳動装置における泳動方式としては、ミセル導電クロマトグラフィー(Micellar electrokinetic capillary chromatography;以下、MECCと記載する)や、キャピラリーゲル電気泳動(Capillary Gel Electrophoresis;以下、CGEと記載する)が挙げられる。MECCでは、キャピラリー内に臨界ミセル濃度以上にイオン性界面活性剤を含んだ泳動用緩衝液を満たして、核酸種の分離を行う。核酸種の分離においては、イオン性界面活性剤として、硫酸ドデシルナトリウムを使用することが好ましい。CGEは、キャピラリー内にポリアクリルアミドやアガロースなどのゲルと泳動液とを満たし、ゲルによる分子ふるい効果を利用して試料に含まれる核酸種の各成分イオンの分離を行う。CGEには、キャピラリーに、ゲルではなく非架橋のポリアクリルアミド、デキストラン、セルロース誘導体などの親水性高分子が溶解した電解液を満たして、CGEと同様に分子ふるい効果を利用して核酸種の各成分イオンの分離を行うキャピラリー電気泳動も含まれる。比較的低分子の核酸種の分離を行う際には、分離媒体として、ヒドロキシエチルセルロース、高濃度(例えば8〜15w/w%)トリス-ホウ酸-EDTA系のポリアクリルアミドゲル、濃度勾配(例えば、2〜8w/w%の勾配)トリス-ホウ酸-EDTA系のポリアクリルアミドゲル、POP−7ポリマー(アプライドバイオシステムズ社製)や、Long Ranger(宝酒造社製)などを用いることができる。
【0119】
[6A−2.電気泳動測定条件]
本発明では、第1オリゴヌクレオチドにおけるフラップ配列を任意に設定することができるため、電気泳動の条件としては、フラップ断片液に含まれる核酸種(すなわち、鋳型核酸、フラップ断片、及び場合により第2オリゴヌクレオチド)が、互いに識別可能に分離されるほどの分解能でもって分離できる条件であれば、特に限定されない。
【0120】
[6A−3.蛍光検出法を用いた場合]
[6A−3−1.蛍光物質を有しない第1オリゴヌクレオチドを用いた場合]
電気泳動において展開したフラップ断片液中の核酸種の検出には、蛍光検出法を用いることができる。蛍光検出法の具体的方法としては、公知の方法を特に限定することなく用いることができる。検出のために用いられる試薬としては、トラッキングダイやインターカレイターなどが挙げられる。トラッキングダイは、グリセロールやスクロースなどの、比重を大きくするための添加物など混合されたローディングバッファとして使用される。トラッキングダイの具体例としては、キシレンシアノールやブロモフェノールブルー、オレンジII、オレンジGなどから少なくとも1種が選ばれる。インターカレイターとしては、蛍光やUVで検出可能な、核酸種の2本鎖にインターカレイトして蛍光を発する物質であれば特に限定されることなく、例えば、エチジウムブロマイド、アクリジンオレンジ、サイバーグリーン、サイバーゴールドなどが挙げられる。これらインターカレイターは、例えば、分離媒体に含ませて使用することができる。
【0121】
[6A−3−2.蛍光物質を有する第1オリゴヌクレオチドを用いた場合]
すでに2−2−2.において述べたように、第1オリゴヌクレオチドとしてフラップ配列に蛍光物質を有するものを用いることができる。この場合は、上記の6A−3−1.とは異なる手法でフラップ断片の検出が可能である。
【0122】
フラップ断片の検出には、第1オリゴヌクレオチドのフラップ配列が有していた蛍光標識に特異的に結合するフラップ断片検出用標識を用いることができる。
このようなフラップ断片検出用標識の具体例としては、サイバーグリーンI、エチジウムブロマイド、アクリジンオレンジ、チアゾールオレンジ、オキサゾールイエロー、ローダミンなどが挙げられる。これら列挙した標識は、2本鎖にインターカレイトするものの例である。
【0123】
フラップ断片液中で、この方法において検出される核酸種は、蛍光物質を有するフラップ断片のみである(図6)。したがって、すでに5−3−1.において述べたように、複数の多型の部位に応じてフラップ断片が異なるように(例えば長さにおいて異なるように)設計された複数の第1オリゴヌクレオチドを用いた場合などに、1回の電気泳動で複数のフラップ断片を区別して検出することが可能である。すなわち、1回の電気泳動で複数の多型検出を同時に行うことが可能である。
【0124】
[6A−4.フラップ断片の検出]
[6A−4−1.メカニズム]
第1オリゴヌクレオチドとして設計したオリゴヌクレオチドにおける、第2領域(すなわち多型塩基)に対応する塩基が、鋳型核酸において想定した多型部位とマッチする場合は、3本鎖構造を形成し(図2(a))、クリベースがこの構造を認識することによって第1オリゴヌクレオチドを切断し、フラップ断片が遊離する(図2(b))。そして、タグを捕捉する手段によって、タグを有する核酸種が除去される(図2(c))。また、余剰の第1オリゴヌクレオチドも存在していれば同様に除去される(図5(c)、図6)。したがって、電気泳動の結果は、第1オリゴヌクレオチドが検出されず、フラップ配列が検出される。
【0125】
反対に、第1オリゴヌクレオチドとして設計したオリゴヌクレオチドにおける、多型塩基に対応する塩基が、鋳型核酸において想定した多型部位とマッチしない場合は、クリベースが認識することができる3本鎖構造が形成されないため、第1オリゴヌクレオチドは切断されず、フラップ断片は遊離しない(図3(a))。そして、タグを捕捉する手段によって、タグを有する核酸種、すなわち、鋳型核酸にハイブリダイズした未反応の第1オリゴヌクレオチド、が除去される(図3(b))。また、余剰の第1オリゴヌクレオチドも存在していれば同様に除去される(図5(c)、図6)。したがって、電気泳動の結果は、第1オリゴヌクレオチドが検出され、フラップ断片は検出されない。
【0126】
[6A−4−2.フラップ断片検出の判断方法]
電気泳動による展開後、設定したフラップ配列のサイズに基づき、フラップ断片の存在を確認することによって、多型を検出することができる。フラップエンドヌクレアーゼによる切断反応の前において検出される第1オリゴヌクレオチドのバンド又はピークが、切断反応後に消失するとともに、フラップ断片のバンド又はピークが検出されていることを確認することが好ましい。
【0127】
[6A−5.SNP検出の具体例]
例えば、あるSNP部位がT又はCを取りうる場合、第1オリゴヌクレオチドとして、T用のオリゴヌクレオチド及びC用のオリゴヌクレオチドを用意する。T用オリゴヌクレオチドとC用オリゴヌクレオチドとは、第2領域(すなわちSNP)に相補的な塩基としてそれぞれAとGとを有し、フラップ配列が互いに異なるように設計される。フラップ配列は、T用オリゴヌクレオチドとC用オリゴヌクレオチドとで互いに長さが異なるように設計されることが好ましい(図5(a)参照)。
【0128】
例えば、T用オリゴヌクレオチドのフラップ配列をPoly-T12(すなわち12個のTで構成される配列)とした場合、図4(a)に模式的に示した反応が起これば、Poly-T12の長さのフラップ配列を有するフラップ断片を検出することによってSNPを検出することができる(具体的には図5(b)、(c)参照)。一方、C用オリゴヌクレオチドのフラップ配列をPoly-T15(すなわち15個のTで構成される配列)とした場合、図4(b)に模式的に示した反応が起これば、Poly-T15の長さのフラップ配列を有するフラップ断片を検出することによってSNPを検出することができる。そして、検出の結果、フラップ配列Poly-T12を有するフラップ断片が検出され、フラップ配列Poly-T15を有するフラップ断片が検出されない場合は、SNPがT/Tのホモ接合体であるとのタイピングを行うことができる。また、フラップ配列Poly-T12を有するフラップ断片とフラップ配列Poly-T15を有するフラップ断片との両方が検出される場合は、SNPがT/Cのヘテロ接合体であるとタイピングできる。さらに、フラップ配列Poly-T12を有するフラップ断片が検出されず、フラップ配列Poly-T15を有するフラップ断片が検出される場合は、SNPがC/Cのホモ接合体であるとのタイピングを行うことができる。
その他の多型についても同様にタイピングを行うことができる。
【0129】
[6B.質量分析法を用いた検出]
質量分析法を用いた検出法においても、フラップ断片を直接検出することができる。以下、当該検出法についてさらに詳細に説明する。
【0130】
タグの除去を行った後のフラップ断片液は、脱塩処理に供し、マトリックスと混合し、測定用プレートにアプライすると良い。脱塩処理には、脱塩カラムを用いると良い。脱塩カラムとしては、ZipTip(ミリポア社製)などが挙げられる。脱塩カラムは、フィルター付きチップの形状のものなどを用いることができる。
【0131】
[6B−1.マトリックス]
マトリックスとしては、2,4,6−トリヒドロキシアセトフェノン(2,4,6-trihydroxyacetophenone)、2,3,4−トリヒドロキシアセトフェノン(2,3,4-trihydroxyacetophenone)、3−ヒドロキシピコリン酸 (3-hydroxypicolinic acid;3-HPA)、α−シアノ−4−ヒドロキシケイ皮酸メチルエステル(α-cyano-4-hydroxycinnamic acid methyl ester)などから選ぶことができる。これらマトリックスは、例えば適当な溶媒に溶解することにより調製された溶液として用いられる。このような溶媒としては、例えばアセトニトリル−トリフルオロ酢酸水溶液などが挙げられる。マトリックス溶液の組成は、当業者が適宜決定することができる。
【0132】
[6B−2.質量分析装置]
測定プレートを、質量分析装置に導入し、通常の方法に従って測定を行う。本発明では、第1オリゴヌクレオチドにおけるフラップ配列を任意に設定することができるため、用いる質量分析装置としては特に限定されることなく、既存の質量分析装置を用いることができる。質量分析装置としては、マトリックス介助レーザー脱離イオン化(MALDI)イオン源を有するものが好ましい。そして、MALDIイオン源は、飛行時間(TOF)型質量分析計と組み合わせて用いられることがさらに好ましい。MALDI−TOF MSとしては、例えば、AXIMA(島津製作所製)やABI Voyager(パセプティブ・バイオシステムズ社製)などが挙げられる。
【0133】
本発明においては、試料の脱塩、試料とマトリックスとの混合、及びMS検出用プレート作製までの工程が自動で行われても良い。このように自動化された場合、多検体について効率よく遺伝子多型検出を行うことが可能である。
【0134】
[6B−3.フラップ断片の検出]
[6B−3−1.メカニズム]
第1オリゴヌクレオチドとして設計したオリゴヌクレオチドにおける、第2領域(すなわち多型塩基)に対応する塩基が、鋳型核酸において想定した多型部位とマッチする場合は、3本鎖構造を形成し(図2(a))、クリベースがこの構造を認識することによって第1オリゴヌクレオチドを切断し、フラップ断片が遊離する(図2(b))。そして、タグを捕捉する手段によって、タグを有する核酸種が除去される(図2(c))。また、余剰の第1オリゴヌクレオチドも存在していれば同様に除去される(図5(c))。したがって、質量分析の結果は、第1オリゴヌクレオチドが検出されず、フラップ配列が検出される。
【0135】
反対に、第1オリゴヌクレオチドとして設計したオリゴヌクレオチドにおける、多型塩基に対応する塩基が、鋳型核酸において想定した多型部位とマッチしない場合は、クリベースが認識することができる3本鎖構造が形成されないため、第1オリゴヌクレオチドは切断されず、フラップ断片は遊離しない(図3(a))。そして、タグを捕捉する手段によって、タグを有する核酸種、すなわち、鋳型核酸にハイブリダイズした未反応の第1オリゴヌクレオチド、が除去される(図3(b))。また、余剰の第1オリゴヌクレオチドも存在していれば同様に除去される(図5(c))。したがって、質量分析の結果は、第1オリゴヌクレオチドが検出されず、フラップ断片も検出されない。
【0136】
[6B−3−2.フラップ断片検出の判断方法]
マススペクトルにおいては、設定したフラップ配列の質量数に基づき、フラップ断片の存在を確認することによって、多型を検出することができる。フラップエンドヌクレアーゼによる切断反応の前において検出される第1オリゴヌクレオチドのピークが、切断反応後に消失するとともに、フラップ断片のピークが検出されていることを確認することが好ましい。
【0137】
[6B−4.SNP検出の具体例]
例えば、あるSNP部位がT又はCを取りうる場合、第1オリゴヌクレオチドとして、T用のオリゴヌクレオチド及びC用のオリゴヌクレオチドを用意する。T用オリゴヌクレオチドとC用オリゴヌクレオチドとは、第2領域(すなわちSNP)に相補的な塩基としてそれぞれAとGとを有し、フラップ配列が互いに異なるように設計される。フラップ配列は、T用オリゴヌクレオチドとC用オリゴヌクレオチドとで互いに長さが異なるように設計されることが好ましい(図5(a)参照)。
【0138】
例えば、T用オリゴヌクレオチドのフラップ配列をPoly-T12(すなわち12個のTで構成される配列)とした場合、図4(a)に模式的に示した反応が起これば、Poly-T12の長さのフラップ配列を有するフラップ断片を検出することによってSNPを検出することができる(具体的には図5(b)、(c)参照)。一方、C用オリゴヌクレオチドのフラップ配列をPoly-T15(すなわち15個のTで構成される配列)とした場合、図4(b)に模式的に示した反応が起これば、Poly-T15の長さのフラップ配列を有するフラップ断片を検出することによってSNPを検出することができる。そして、検出の結果、フラップ配列Poly-T12を有するフラップ断片が検出され、フラップ配列Poly-T15を有するフラップ断片が検出されない場合は、SNPがT/Tのホモ接合体であるとのタイピングを行うことができる。また、フラップ配列Poly-T12を有するフラップ断片とフラップ配列Poly-T15を有するフラップ断片との両方が検出される場合は、SNPがT/Cのヘテロ接合体であるとタイピングできる。さらに、フラップ配列Poly-T12を有するフラップ断片が検出されず、フラップ配列Poly-T15を有するフラップ断片が検出される場合は、SNPがC/Cのホモ接合体であるとのタイピングを行うことができる。
その他の多型についても同様にタイピングを行うことができる。
【0139】
[6C.蛍光共鳴エネルギー移動法を用いた検出]
蛍光共鳴エネルギー移動法を用いる場合は、タグの除去を行った後のフラップ断片液を、第3オリゴヌクレオチドと接触させ、フラップ断片と第3オリゴヌクレオチドとの2本鎖構造体を検出する。第1オリゴヌクレオチドのフラップ配列が蛍光エネルギー供与体/受容体を有していたため、フラップ断片は、蛍光エネルギー受容体/供与体を有する第3オリゴヌクレオチドとハイブリダイズすることにより検出される。すなわち、遊離した核酸断片と第3オリゴヌクレオチド間における蛍光共鳴エネルギー移動による蛍光に基づいて多型を検出する(例えば図7(d))。第3オリゴヌクレオチドは、固体支持体上に固定されていても良い(例えば図11(c))。以下、当該検出法についてさらに詳細に説明する。
【0140】
[6C−1.第3オリゴヌクレオチドの構成]
第3オリゴヌクレオチドは、フラップ配列に相補的な配列と、蛍光エネルギー受容体又は蛍光エネルギー供与体とを有するオリゴヌクレオチドである。第1オリゴヌクレオチドが蛍光エネルギー供与体を有している場合は、第3オリゴヌクレオチドは蛍光エネルギー受容体を有し、第1オリゴヌクレオチドが蛍光エネルギー受容体を有している場合は、第3オリゴヌクレオチドは蛍光エネルギー供与体を有する。
【0141】
蛍光エネルギー受容体及び蛍光エネルギー供与体については、上記2−2.第1オリゴヌクレオチドの構成の2−2−2.蛍光物質において述べたとおりである。蛍光エネルギー供与体と蛍光エネルギー受容体との組み合わせは、蛍光エネルギー供与体の蛍光スペクトルが、蛍光エネルギー受容体の励起光スペクトルと重なるような組み合わせであれば、どのような組み合わせを採用しても良い。
【0142】
本発明の方法では、従来のインベーダー法のように蛍光物質が遊離することがないため、固体支持体上に固定された第3オリゴヌクレオチドを用いることによって、予め決められた場所で蛍光を検出することができる。例えば、第3オリゴヌクレオチドは、その5´末端において、リンカーを介して固体支持体上の特定の位置に固定されていても良い。
【0143】
[6C−2.第3オリゴヌクレオチドの設計及びフラップ配列とのハイブリダイズ]
第3オリゴヌクレオチドの長さとしては特に限定されないが、第1オリゴヌクレオチドのフラップ配列との兼ね合いを考慮し、例えば15〜50merの長さに設定することができる。
【0144】
[6C−2−1.第3オリゴヌクレオチドを固定化しない場合]
第3オリゴヌクレオチドを支持体に固定しない場合は、例えばウェルなどの容器を用い、検出対象となる多型のアレル及び/又は多型部位に応じて第3オリゴヌクレオチド液を配置し、配置された反応液に対してフラップ断片液を分注することができる。
また、フラップ断片液を検出対象となる多型のアレル及び/又は多型部位の数に基づいて配置し、配置されたフラップ断片液に対して前記アレル及び/又は多型部位に応じた第3オリゴヌクレオチド液を分注することができる。
【0145】
[6C−2−2.第3オリゴヌクレオチドを固定化する場合]
支持体に固定された第3オリゴヌクレオチドを用いる場合は、検出対象となる多型のアレル及び/又は多型部位に応じて定められた位置に第3オリゴヌクレオチドが固定された支持体を用い、各位置に対してフラップ断片液を分注することができる。
【0146】
固体支持体上に固定する場合、例えば、上記例示した第3オリゴヌクレオチドの長さのうち5´末端の7〜35merを、リンカーとしての配列とすることができる。
【0147】
固体支持体上における配置、すなわち例えば図11(c)におけるP1とP2との距離としては、例えばP1においてf1配列を有するフラップ断片と第3オリゴヌクレオチドIII1とがハイブリダイズしたときに、f1配列を有するフラップ断片の蛍光エネルギー供与体と第3オリゴヌクレオチドIII2の蛍光エネルギー受容体との間で蛍光共鳴エネルギー移動が起こらない程度の距離を確保できるような距離を、第3オリゴヌクレオチドの長さなどを考慮して、当業者が適宜決定することができる。
【0148】
第3オリゴヌクレオチドを固定化する固体支持体の種類及び形状、固体支持体への第3オリゴヌクレオチドの固定化方法及び条件、及び、固体支持体上の第3オリゴヌクレオチドへのアニーリング法及び条件などについては、当業者が適宜決定することができる。例えば、特開2002−171992号公報に記載の方法に準じることができる。
【0149】
[6C−3.蛍光共鳴エネルギー移動]
フラップ断片と第3オリゴヌクレオチドとがハイブリダイズすることにより、蛍光エネルギー供与体と蛍光エネルギー受容体とが近接し、蛍光共鳴エネルギー移動(FRETと記載することがある)によって蛍光が発せられる。フラップ断片と第3オリゴヌクレオチドとの間における蛍光エネルギー供与体と蛍光エネルギー受容体との距離は、FRETが起こる距離(例えば1〜10nm)であればよい。例えば、第1オリゴヌクレオチドにおける蛍光エネルギー供与体又は蛍光エネルギー受容体が第1オリゴヌクレオチドの5´末端に設けられた場合は、第3オリゴヌクレオチドにおける蛍光エネルギー受容体又は蛍光エネルギー供与体は、第3オリゴヌクレオチドの3´末端に設けることができる。例えば図7(d)は、蛍光エネルギー供与体d1を5´末端に有するフラップ断片と蛍光エネルギー受容体aを3´末端に有する第3オリゴヌクレオチドとがハイブリダイズし、FRETが起こり蛍光エネルギー受容体の蛍光強度が増強することにより、蛍光が発せられたことを例示する模式図である。
【0150】
[6C−4.フラップ断片の検出]
[6C−4−1.メカニズム]
第1オリゴヌクレオチドとして設計したオリゴヌクレオチドにおける、第2領域(すなわち多型塩基)に対応する塩基が、鋳型核酸において想定した多型部位とマッチする場合は、3本鎖構造体を形成し、クリベースがこの構造を認識することによって第1オリゴヌクレオチドを切断し、フラップ断片が遊離する。そして、タグを捕捉する手段によって、タグを有する核酸種が除去される。また、余剰の第1オリゴヌクレオチドも存在していれば同様に除去される。(例えば図7(c)参照)
【0151】
第3オリゴヌクレオチドが速やかに、遊離したフラップ断片のフラップ配列とハイブリダイズし、2本鎖構造体を形成する(例えば図7(d))。このとき、近接した蛍光エネルギー供与体と蛍光エネルギー受容体との間でエネルギー転移が起こる。そして、エネルギー転移による蛍光強度の変化を認識することによって、フラップ断片を検出する。このようにして、多型が検出される。なお、この場合、蛍光エネルギー受容体の蛍光は可能な強度(すなわちフラップ断片と第3オリゴヌクレオチドとの2本鎖構造体が、全てのフラップ断片について形成され、全ての2本鎖構造体で蛍光エネルギー受容体の蛍光が発せられたときの蛍光強度)まで速やかに達する。(本明細書では、蛍光エネルギー受容体の蛍光が可能な強度まで速やかに達することを、単に蛍光が発せられると記載する場合がある。)
【0152】
反対に、第1オリゴヌクレオチドとして設計したオリゴヌクレオチドにおける、多型塩基に対応する塩基が、鋳型核酸において想定した多型部位とマッチしない場合は、クリベースが認識することができる3本鎖構造体が形成されないため、第1オリゴヌクレオチドは切断されず、フラップ断片は遊離しない。
【0153】
[6C−4−2.フラップ断片検出の判断方法1]
多型が検出されたか否かの判断は、フラップ断片と第3オリゴヌクレオチドとのハイブリダイズによるFRET現象で生じる、蛍光強度の変化に基づくが、そのためには、従来からの蛍光検出法を特に限定することなく用いることができる。例えば、少なくとも一定時間経過後の蛍光強度を調べることによって判断してよい。具体的には、以下のように検出を行うことができる。
【0154】
例えば、蛍光スペクトルに基づいて判断する場合は、適当な励起波長のもと、蛍光波長を変化させて、蛍光強度を波長ごとにプロットし、少なくとも一定時間経過後の最大蛍光強度や最大蛍光波長の値から判断することができる。
【0155】
[6C−4−3.フラップ断片検出の判断方法2]
本発明では、上記の方法以外にも、フラップ断片と第3オリゴヌクレオチドとのハイブリダイズによるFRET現象で生じる、蛍光エネルギー供与体及び蛍光エネルギー受容体の蛍光強度の変化のいずれかを測定する方法が可能である。すなわち、エネルギー供与体に対して励起を行い、少なくとも一定時間経過後のエネルギー供与体側の蛍光強度の値を測定することで、エネルギー供与体側の蛍光強度の変化を調べるか、或いは、エネルギー供与体に対して励起を行い、少なくとも一定時間経過後のエネルギー受容体側の蛍光強度の値を測定することで、エネルギー受容体側の蛍光強度の変化を調べることができる。好ましくは、エネルギー供与体に対して励起を行い、エネルギー供与体側の蛍光強度の変化を調べる。エネルギー供与体側の蛍光強度が減衰すると、多型が検出できたことになる。このように、本発明では、単一の蛍光物質のシグナルのみで検出が可能である。
【0156】
[6C−5.蛍光検出装置]
蛍光の検出は、上述の6C−4−2.の場合、例えば、リアルタイムPCR装置やプレートリーダなどを用い、適当な励起波長及び蛍光波長を固定して行うことができる。リアルタイムPCR装置としては、例えばストラタジーン社製MX3000pなどが挙げられる。プレートリーダとしては、例えば大塚電子社製FluoDia T70などが挙げられる。このような場合、通常、蛍光物質ごとにフィルターセットを用意する必要がある。
【0157】
一方、上述の6C−4−3.の場合、蛍光物質ごとにフィルターセットを用意する必要がない。この場合による方法においては、検出器としては特に限定されることなく、さまざまな機種を用いることができる。
【0158】
ここで、蛍光物質ごとにフィルターセットを用意する場合は、異なる励起/蛍光のセットによる検出系を用意することが必要である。しかしながら、特に廉価版の装置では、フィルターの組み合わせを変えることができない場合がある。例えば上述のMX3000pなどでは、設定した蛍光以外のフィルターの変更は困難で、また、組み合わせの変更もできない。異なる励起/蛍光の組み合わせを実現するには、高額な機械や専用機を用意する必要がある。上述6C−4−3.のような、単一の蛍光物質のシグナルのみによる検出は、例えばこのように異なる励起/蛍光のセットによる検出系を用意することが困難な場合に行うことが好ましい。
【0159】
またすでに上記6C−2.で述べたように、本発明の方法では、従来のインベーダー法のように蛍光物質が遊離することがないため、第3オリゴヌクレオチドを固体支持体上に固定し、予め決められた場所で蛍光を検出することができる。このため、従来のインベーダー法と異なり、開放系での検出が可能になる。したがって、上述の6C−2−2.のように第3オリゴヌクレオチドを支持体上に固定化して用いる場合は、蛍光の検出のためにマイクロアレイのイメージャーやその他の蛍光イメージャーを利用することができる。
【0160】
[6C−6.多型検出の具体例]
第1オリゴヌクレオチドは、通常、試料中の多型部位一箇所つき、多型のアレルそれぞれに応じて設計されている。例えば、第1オリゴヌクレオチドとしては、アレル特異的な2種のオリゴヌクレオチドを用いることができる(以下、第1オリゴヌクレオチドとしてアレル特異的な2種のオリゴヌクレオチドを用いる場合を挙げて説明を行う)。この場合、第3オリゴヌクレオチドとしては、アレル特異的な2種の第1オリゴヌクレオチドそれぞれに対応するように(すなわちアレル特異的な2種の第1オリゴヌクレオチドの、それぞれのフラップ配列に相補的な配列を有するように)設計された2種類のオリゴヌクレオチドが用いられる。そして、これらアレル特異的な第1オリゴヌクレオチドの一方及び/又は他方から生じるフラップ断片と第3オリゴヌクレオチドとから形成される2本鎖構造体において発せられる蛍光が識別可能となるように、第1オリゴヌクレオチド及び対応する第3オリゴヌクレオチドを設定することができる。蛍光からアレルの識別を可能にする(すなわちそれぞれのアレルをID化する)具体的な方法としては、アレルごとに異なる挙動を示す蛍光に基づく方法と、アレルごとに異なる固体支持体上の位置における蛍光に基づく方法とが挙げられる。各オリゴヌクレオチドの設計の仕方によっては、アレルごとに、蛍光及び固体支持体上における位置の両方が異なるようにすることも可能である。
【0161】
以下に、蛍光からアレルの識別を可能にする具体的な方法について例を挙げて説明する。ここで、第1オリゴヌクレオチドとして、一方のアレル(アレル1とする)に特異的なものを第1オリゴヌクレオチドI1とし、他方のアレル(アレル2とする)に特異的なものを第1オリゴヌクレオチドI2とする。そして、第3オリゴヌクレオチドとして、第1オリゴヌクレオチドI1に対応するものを第3オリゴヌクレオチドIII1とし、第1オリゴヌクレオチドI2に対応するものを第3オリゴヌクレオチドIII2とする。
【0162】
[6C−6−1.アレル識別法1]
アレルごとに異なる挙動を示す蛍光に基づいてアレル識別を行うためには、以下に挙げる方法を行うことができる。
【0163】
[アレル識別法1−第1オリゴヌクレオチドが蛍光エネルギー供与体を有する場合1]
まず、第1オリゴヌクレオチドが蛍光エネルギー供与体を有する場合、一例としては、アレルごとに第1オリゴヌクレオチドの蛍光エネルギー供与体が異なるようにすることができる(より具体的な例を図7に挙げる)。この例では、蛍光エネルギー供与体の蛍光強度の減衰に基づいて各アレルを識別することができる。具体的には、第1オリゴヌクレオチドI1は、アレル1に応じた相補配列と、アレル1の識別のための蛍光エネルギー供与体d1とを有する。第1オリゴヌクレオチドI2は、アレル2に応じた相補配列と、アレル2の識別のための蛍光エネルギー供与体d2とを有する。第1オリゴヌクレオチドI1とI2とのフラップ配列は、互いに同じであっても良いし、互いに異なっていても良い。
【0164】
第3オリゴヌクレオチドIII1は、第1オリゴヌクレオチドI1のフラップ配列に相補的な配列と、蛍光エネルギー受容体とを有する。第3オリゴヌクレオチドIII2は、第1オリゴヌクレオチドI2のフラップ配列に相補的な配列と、蛍光エネルギー受容体とを有する。第1オリゴヌクレオチドI1とI2とのフラップ配列が互いに同じである場合、用意する第3オリゴヌクレオチドとしては、当該フラップ配列に相補的な配列を有するもの1種類でよい。第3オリゴヌクレオチドIII1とIII2との蛍光エネルギー受容体は、第1オリゴヌクレオチドの蛍光エネルギー供与体d1及びd2それぞれに対応したものとするため、互いに同じである場合と、互いに異なる場合とがあり得る。
【0165】
このような第1オリゴヌクレオチド及び第3オリゴヌクレオチドを、あるSNP部位がT(アレル1)又はC(アレル2)を取りうる場合に用いた例が、図7に示される。この例では第1オリゴヌクレオチドI1とI2とのフラップ配列が互いに同じものとした(図7(a))。仮に鋳型核酸が有するSNPがTであった場合、第1オリゴヌクレオチドI1がハイブリダイズした鋳型核酸において、フラップエンドヌクレアーゼが認識可能な3本鎖構造体が形成され(図7(b))、フラップ断片が遊離する。その後、タグが捕捉される(図7(c))。フラップ断片は第3オリゴヌクレオチドと2本鎖構造体を形成し、FRETによりaの蛍光強度が増強し、d1の蛍光強度が減衰する(図7(d))。d1の蛍光強度の減衰に基づいて、SNPとしてTを検出することができる。
【0166】
アレルごとに蛍光エネルギー供与体が異なる上記の例は、すでに述べたように、単一の蛍光物質のシグナルのみに基づいて検出する方法を用いることができる点で好ましい。
【0167】
[アレル識別法1−第1オリゴヌクレオチドが蛍光エネルギー供与体を有する場合2]
第1オリゴヌクレオチドが蛍光エネルギー供与体を有する場合の他の一例としては、アレルごとに第3オリゴヌクレオチドの蛍光エネルギー受容体が異なるようにすることができる(より具体的な例を図8に挙げる)。この例では、蛍光エネルギー受容体の蛍光強度の増強に基づいて各アレルを識別することができる。この例では、アレルごとに第1オリゴヌクレオチドのフラップ配列が異なるようにする必要がある。具体的には、第1オリゴヌクレオチドI1は、アレル1に応じた相補配列と、アレル1の識別のためのフラップ配列f1とを有する。第1オリゴヌクレオチドI2は、アレル2に応じた相補配列と、アレル2の識別のためのフラップ配列f2とを有する。第1オリゴヌクレオチドI1とI2との蛍光エネルギー供与体は、第3オリゴヌクレオチドの蛍光エネルギー受容体a1及びa2それぞれに対応したものとするため、互いに同じである場合と、互いに異なる場合とがあり得る。
【0168】
第3オリゴヌクレオチドIII1は、第1オリゴヌクレオチドI1のフラップ配列f1に相補的な配列と、アレル1の識別のための蛍光エネルギー受容体a1とを有する。第3オリゴヌクレオチドIII2は、第1オリゴヌクレオチドI2のフラップ配列f2に相補的な配列と、アレル2の識別のための蛍光エネルギー受容体a2とを有する。
【0169】
このような第1オリゴヌクレオチド及び第3オリゴヌクレオチドを、あるSNP部位がT(アレル1)又はC(アレル2)を取りうる場合に用いた例が、図8に示される。この例では、第1オリゴヌクレオチドI1及びI2は、図8(a)のように模式的に表される。仮に鋳型核酸が有するSNPがTであった場合、第1オリゴヌクレオチドI1がハイブリダイズした鋳型核酸において、フラップエンドヌクレアーゼが認識可能な3本鎖構造体が形成され(図8(b))、フラップ断片が遊離する。フラップ断片は第3オリゴヌクレオチドIII1と2本鎖構造体を形成し、FRETによりa1の蛍光強度が増強し、dの蛍光強度が減衰する(図8(c))。a1の蛍光強度の増強に基づいて、SNPとしてTを検出することができる。
【0170】
[アレル識別法1−第1オリゴヌクレオチドが蛍光エネルギー受容体を有する場合1]
次に、第1オリゴヌクレオチドが蛍光エネルギー受容体を有する場合、一例としては、アレルごとに第3オリゴヌクレオチドの蛍光エネルギー供与体が異なるようにすることができる(より具体的な例を図9に挙げる)。この例では、蛍光エネルギー供与体の蛍光強度の減衰に基づいて各アレルを識別することができる。この例では、アレルごとに第1オリゴヌクレオチドのフラップ配列が異なるようにする必要がある。具体的には、第1オリゴヌクレオチドI1は、アレル1に応じた相補配列と、アレル1の識別のためのフラップ配列f1とを有する。第1オリゴヌクレオチドI2は、アレル2に応じた相補配列と、アレル2の識別のためのフラップ配列f2とを有する。第1オリゴヌクレオチドI1とI2との蛍光エネルギー受容体は、第3オリゴヌクレオチドの蛍光エネルギー供与体d1及びd2それぞれに対応したものとするため、互いに同じである場合と、互いに異なる場合とがあり得る。
【0171】
第3オリゴヌクレオチドIII1は、第1オリゴヌクレオチドI1のフラップ配列f1に相補的な配列と、アレル1の識別のための蛍光エネルギー供与体d1とを有する。第3オリゴヌクレオチドIII2は、第1オリゴヌクレオチドI2のフラップ配列f2に相補的な配列と、アレル2の識別のための蛍光エネルギー供与体d2とを有する。
【0172】
このような第1オリゴヌクレオチド及び第3オリゴヌクレオチドを、あるSNP部位がT(アレル1)又はC(アレル2)を取りうる場合に用いた例が、図9に示される。この例では、第1オリゴヌクレオチドI1及びI2は、図9(a)のように模式的に表される。仮に鋳型核酸が有するSNPがTであった場合、第1オリゴヌクレオチドI1がハイブリダイズした鋳型核酸において、フラップエンドヌクレアーゼが認識可能な3本鎖構造体が形成され(図9(b))、フラップ断片が遊離する。フラップ断片は第3オリゴヌクレオチドIII1と2本鎖構造体を形成し、FRETによりaの蛍光強度が増強し、d1の蛍光強度が減衰する(図9(c))。d1の蛍光強度の減衰に基づいて、SNPとしてTを検出することができる。
【0173】
アレルごとに蛍光エネルギー供与体が異なる上記の例は、すでに述べたように、単一の蛍光物質のシグナルのみに基づいて検出する方法を用いることができる点で好ましい。
【0174】
[アレル識別法1−第1オリゴヌクレオチドが蛍光エネルギー受容体を有する場合2]
第1オリゴヌクレオチドが蛍光エネルギー受容体を有する場合の他の一例としては、アレルごとに第1オリゴヌクレオチドの蛍光エネルギー受容体が異なるようにすることができる(より具体的な例を図10に挙げる)。この例では、蛍光エネルギー受容体の蛍光強度の増強に基づいて各アレルを識別することができる。具体的には、第1オリゴヌクレオチドI1は、アレル1に応じた相補配列と、アレル1の識別のための蛍光エネルギー受容体a1とを有する。第1オリゴヌクレオチドI2は、アレル2に応じた相補配列と、アレル2の識別のための蛍光エネルギー受容体a2とを有する。第1オリゴヌクレオチドI1とI2とのフラップ配列は、互いに同じであっても良いし、互いに異なっていても良い。
【0175】
第3オリゴヌクレオチドIII1は、第1オリゴヌクレオチドI1のフラップ配列に相補的な配列と、蛍光エネルギー受容体とを有する。第3オリゴヌクレオチドIII2は、第1オリゴヌクレオチドI2のフラップ配列に相補的な配列と、蛍光エネルギー受容体とを有する。第1オリゴヌクレオチドI1とI2とのフラップ配列が互いに同じである場合、用意する第3オリゴヌクレオチドとしては、当該フラップ配列に相補的な配列を有するもの1種類でよい。第3オリゴヌクレオチドIII1とIII2との蛍光エネルギー供与体は、第1オリゴヌクレオチドの蛍光エネルギー受容体a1及びa2それぞれに対応したものとするため、互いに同じである場合と、互いに異なる場合とがあり得る。
【0176】
このような第1オリゴヌクレオチド及び第3オリゴヌクレオチドを、あるSNP部位がT(アレル1)又はC(アレル2)を取りうる場合に用いた例が、図10に示される。この例では、第1オリゴヌクレオチドI1及びI2は、図10(a)のように模式的に表される。仮に鋳型核酸が有するSNPがTであった場合、第1オリゴヌクレオチドI1がハイブリダイズした鋳型核酸において、フラップエンドヌクレアーゼが認識可能な3本鎖構造体が形成され(図10(b))、フラップ断片が遊離する。フラップ断片は第3オリゴヌクレオチドIII1と2本鎖構造体を形成し、FRETによりa1の蛍光強度が増強し、dの蛍光強度が減衰する(図10(c))。a1の蛍光強度の増強に基づいて、SNPとしてTを検出することができる。
【0177】
[アレル識別法1−判断基準及びその他]
いずれの例においても、第3オリゴヌクレオチドは固体支持体上に固定されていなくとも良いし、固定されていても良い。いずれにしても、強度に変化があった蛍光に基づいてSNP検出やタイピングを行うことができる。例えば、d1に由来する蛍光スペクトルの変化(すなわち、蛍光強度の減衰による変化。以下において同じ。)のみ検出され、d2に由来する蛍光スペクトルの変化が検出されなければ、SNPがT/Tのホモ接合体であるとのタイピングを行うことができる。また、d1とd2との両方に由来する蛍光スペクトルの変化が検出されれば、SNPがT/Cのヘテロ接合体であるとのタイピングを行うことができる。さらに、d2に由来する蛍光スペクトルの変化のみ検出され、d1に由来する蛍光スペクトルの変化が検出されなければ、SNPがC/Cのホモ接合体であるとのタイピングを行うことができる。
第3オリゴヌクレオチドが固体支持体上に固定されている場合は、蛍光だけでなく固体支持体上の位置によって、確実かつ容易にSNP検出やタイピングを行うことができる点で好ましい。
【0178】
なお、オリゴヌクレオチドを固体支持体上に固定する方法としては特に限定されないが、例えばビオチンを用いる方法が挙げられる。固体支持体の種類としても、特に限定されず、例えば、通常DNAチップとして用いられる支持体などが挙げられる。
【0179】
[6C−6−2.アレル識別法2]
一方、アレルごとに異なる固体支持体上の位置における蛍光に基づいてアレル識別を行うためには、以下に挙げる方法を行うことができる。
【0180】
[アレル識別法2−第1オリゴヌクレオチドが蛍光エネルギー供与体を有する場合]
まず、第1オリゴヌクレオチドが蛍光エネルギー供与体を有する場合、一例としては、フラップ配列がアレルごとに異なるようにすると良い(より具体的な例を図11に挙げる)。具体的には、第1オリゴヌクレオチドI1は、アレル1に応じた相補配列と、アレル1の識別のためのフラップ配列f1とを有する。第1オリゴヌクレオチドI2は、アレル2に応じた相補配列と、アレル2の識別のためのフラップ配列f2とを有する。第1オリゴヌクレオチドI1とI2との蛍光エネルギー供与体は、それぞれ、第3オリゴヌクレオチドIII1とIII2との蛍光エネルギー受容体に対応していれば良く、互いに同じであっても良いし、互いに異なっていても良い。
【0181】
第3オリゴヌクレオチドIII1は、第1オリゴヌクレオチドI1のフラップ配列f1に相補的な配列と、蛍光エネルギー受容体とを有し、アレル1の識別のための固体支持体上の特定の位置P1に固定化される。第3オリゴヌクレオチドIII2は、第1オリゴヌクレオチドI2のフラップ配列f2に相補的な配列と、蛍光エネルギー受容体とを有し、アレル2の識別のための、固体支持体上のP1とは異なる位置P2に固定化される。第3オリゴヌクレオチドIII1とIII2との蛍光エネルギー受容体は、互いに同じであっても良いし、互いに異なっていても良い。
【0182】
このような第1オリゴヌクレオチド及び第3オリゴヌクレオチドを、あるSNP部位がT(アレル1)又はC(アレル2)を取りうる場合に用いた例が図11に示される。この例では第1オリゴヌクレオチドI1とI2との蛍光エネルギー供与体が互いに同じものとした(図11(a))。仮に鋳型核酸が有するSNPがTであった場合、第1オリゴヌクレオチドI1がハイブリダイズした鋳型核酸において、フラップエンドヌクレアーゼが認識可能な3本鎖構造体が形成され(図11(b))、フラップ断片が遊離する。固体支持体上のP1の位置で、フラップ断片が第3オリゴヌクレオチドと2本鎖構造体を形成し、FRETによりaが発光する(図11(c))。固体支持体上のP1の位置における、aの蛍光強度の増強、又はdの蛍光強度の減衰に基づいて、SNPとしてTを検出することができる。
【0183】
[アレル識別法2−第1オリゴヌクレオチドが蛍光エネルギー受容体を有する場合]
次に、第1オリゴヌクレオチドが蛍光エネルギー受容体を有する場合、一例としては、フラップ配列がアレルごとに異なるようにすると良い(より具体的な例を図12に挙げる)。具体的には、第1オリゴヌクレオチドI1は、アレル1に応じた相補配列と、アレル1の識別のためのフラップ配列f1とを有する。第1オリゴヌクレオチドI2は、アレル2に応じた相補配列と、アレル2の識別のためのフラップ配列f2とを有する。第1オリゴヌクレオチドI1とI2との蛍光エネルギー受容体は、それぞれ、第3オリゴヌクレオチドIII1とIII2との蛍光エネルギー受容体に対応していれば良く、互いに同じであっても良いし、互いに異なっていても良い。
【0184】
そして、第3オリゴヌクレオチドIII1は、第1オリゴヌクレオチドI1のフラップ配列f1に相補的な配列と、蛍光エネルギー供与体とを有し、アレル1の識別のための固体支持体上の特定の位置P1に固定化される。第3オリゴヌクレオチドIII2は、アレル2の識別のための、第1オリゴヌクレオチドI2のフラップ配列f2に相補的な配列と、蛍光エネルギー供与体とを有し、固体支持体上のP1とは異なる位置P2に固定化される。第3オリゴヌクレオチドIII1とIII2との蛍光エネルギー供与体は、互いに同じであっても良いし、互いに異なっていても良い。
【0185】
このような第1オリゴヌクレオチド及び第3オリゴヌクレオチドを、あるSNP部位がT(アレル1)又はC(アレル2)を取りうる場合に用いた例が図12に示される。この例では、第1オリゴヌクレオチドI1及びI2は、図12(a)のように模式的に表される。第3オリゴヌクレオチドの蛍光供与体は同じものとした。仮に鋳型核酸が有するSNPがTであった場合、第1オリゴヌクレオチドI1がハイブリダイズした鋳型核酸において、フラップエンドヌクレアーゼが認識可能な3本鎖構造体が形成され(図12(b))、フラップ断片が遊離する。固体支持体上のP1の位置で、フラップ断片が第3オリゴヌクレオチドと2本鎖構造体を形成し、FRETによりaが発光する(図12(c))。固体支持体上のP1の位置における、aの蛍光強度の増強、又はdの蛍光強度の減衰に基づいて、SNPとしてTを検出することができる。
【0186】
[アレル識別法2−判断基準及びその他]
いずれの例においても、蛍光強度の変化があった場所によってSNP検出やタイピングを行うことができる。例えば、P1の位置のみで増強された蛍光が検出され、P2の位置で増強された蛍光が検出されなければ、SNPがT/Tのホモ接合体であるとのタイピングを行うことができる。また例えば、P1とP2との両方の位置で増強された蛍光が検出されれば、SNPがT/Cのヘテロ接合体であるとのタイピングを行うことができる。さらに例えば、P2の位置のみで増強された蛍光が検出され、P1の位置で増強された蛍光が検出されなければ、SNPがC/Cのホモ接合体であるとのタイピングを行うことができる。アレルごとに蛍光エネルギー供与体が異なる場合、或いはアレルごとに蛍光エネルギー受容体が異なる場合は、固体支持体上の位置の違いだけでなく蛍光の違いによって、確実かつ容易にSNP検出やタイピングを行うことができる点で好ましい。
【0187】
[6C−6−3.複数の多型部位を検出ターゲットにする場合]
遺伝子多型検出法においては、試料中の複数の多型部位を検出ターゲットにする場合が多い。この場合、第1オリゴヌクレオチドは、検出すべき複数の多型部位の箇所それぞれに応じて設計されている。例えば、第1オリゴヌクレオチドとしては、アレル特異的な2種の第1オリゴヌクレオチドのセットを、多型部位の種類の数だけ用いることができる。この場合、第3オリゴヌクレオチドとしては、第1オリゴヌクレオチドのそれぞれに対応するように設計されたオリゴヌクレオチドを用いる。そして、これら多型部位に応じて設計された第1オリゴヌクレオチドから生じるフラップ断片のそれぞれが、蛍光発色後に識別可能となるように、第1オリゴヌクレオチド及び対応する第3オリゴヌクレオチドを設定することができる。蛍光発色後のフラップ断片から多型部位の識別を可能にする具体的な方法としては、多型部位ごとに異なる蛍光が発光するようにする方法と、固体支持体上において多型部位ごとに異なる位置で蛍光が発光するようにする方法とが挙げられる。第1オリゴヌクレオチドの設計の仕方によっては、多型部位ごとに、蛍光及び固体支持体上における位置の両方が異なるようにすることも可能である。これらの具体的な方法については、上述の、蛍光からアレルの識別を可能にする具体的な方法において、アレルごとに異なるように設計されたオリゴヌクレオチド(具体的には、アレル1に特異的なオリゴヌクレオチドI1及びアレル2に特異的なオリゴヌクレオチドI2)を、多型部位ごとに異なるように設計されたオリゴヌクレオチド(具体的には、部位1に特異的なオリゴヌクレオチドI1及び部位2に特異的なオリゴヌクレオチドI2)として読み代えることで、上述の方法と同様に説明することができる。
【0188】
[6D.電気化学的方法を用いた検出]
電気化学的方法を用いた検出法においても、上記6C.における蛍光共鳴エネルギー移動法を用いる場合と同様、フラップ断片と第3オリゴヌクレオチドとの2本鎖構造体を検出する。第3オリゴヌクレオチドは、電極表面に固定化して用いることができる。電極表面に固定化した第3オリゴヌクレオチドは、フラップ断片とハイブリダイズして2本鎖構造体を形成する。2本鎖構造体は、当該2本鎖構造体に特異的に結合し且つ電気化学的に活性な物質(2本鎖認識体)を用いて検出することができる。
【0189】
[6D−1.使用する核酸種]
使用する核酸種は、すでに述べた方法において用いられる核酸種に準じる。
第1オリゴヌクレオチドとしては、上記2−2.(上記2−2−2.の場合を除く)及び上記3−1.におけるものを用いることができる。
第2オリゴヌクレオチドとしては、上記2−3.及び上記3−2.におけるものを用いることができる。
第3オリゴヌクレオチドとしては、固定先が電極であることを除いて、上記6C−1.及び上記6C−2−2.(蛍光エネルギー供与体又は蛍光エネルギー受容体を有しないものを用いる)におけるものを用いることができる。
【0190】
[6D−2.2本鎖認識体]
2本鎖認識体は、2本鎖構造体に特異的に結合し且つ電気的に活性な物質であれば特に限定されず、例えば、金属錯体や生体高分子などを用いることができる。
【0191】
[6D−3.判断方法]
フラップ断片が検出されたことの判断は、2本鎖構造体に結合した2本鎖構造体と、第3オリゴヌクレオチドを固定している電極との間で生じる電気化学的信号に基づいて行うことができる。
[6D−4.その他]
具体的なアレル識別法としては、電極上の位置における電気化学的信号に基づいて識別を行うことができる(参考:上記6C−6−2.固体支持体上の位置における蛍光に基づいてアレル識別を行うための方法)。
電気化学的方法を用いた検出のより具体的な事項については、特許第2573443号明細書に記載されている。
【0192】
[6E.光化学的方法を用いた検出]
光化学的方法を用いた検出法においても、上記6C.における蛍光共鳴エネルギー移動法を用いる場合と同様、フラップ断片と第3オリゴヌクレオチドとの2本鎖構造体を検出する。第3オリゴヌクレオチドは、光ファイバーに固定化して用いることができる。光ファイバーに固定化した第3オリゴヌクレオチドは、フラップ断片とハイブリダイズして2本鎖構造体を形成する。2本鎖構造体は、当該2本鎖構造体に特異的に結合し且つ光化学的に活性な物質(2本鎖認識体)を用いて検出することができる。
【0193】
[6E−1.使用する核酸種]
使用する核酸種は、すでに述べた方法において用いられる核酸種に準じる。
第1オリゴヌクレオチドとしては、上記2−2.(上記2−2−2.の場合を除く)及び上記3−1.におけるものを用いることができる。
第2オリゴヌクレオチドとしては、上記2−3.及び上記3−2.におけるものを用いることができる。
第3オリゴヌクレオチドとしては、固定先が光ファイバーであることを除いて、上記6C−1.及び上記6C−2−2.(蛍光エネルギー供与体又は蛍光エネルギー受容体を有しないものを用いる)におけるものを用いることができる。
【0194】
[6E−2.2本鎖認識体]
2本鎖認識体は、2本鎖構造体に特異的に結合し且つ光化学的に活性な物質であれば特に限定されず、例えば、生体高分子などを用いることができる。
【0195】
[6E−3.判断方法]
フラップ断片が検出されたことの判断は、2本鎖構造体に結合した2本鎖構造体と、第3オリゴヌクレオチドを固定している光ファイバーとの間で生じる光化学的信号に基づいて行うことができる。
[6E−4.その他]
具体的なアレル識別法としては、光ファイバー上の位置における光化学的信号に基づいて識別を行うことができる(参考:上記6C−6−2.固体支持体上の位置における蛍光に基づいてアレル識別を行うための方法)。
光化学的方法を用いた検出のより具体的な事項については、特許第2573443号明細書に記載されている。
【0196】
[7.核酸増幅反応を行う場合]
本発明においては、ゲノムから直接3本鎖構造体形成及びフラップエンドヌクレアーゼによる切断反応を行ってもよいし、検出すべき多型を含む特定の配列を含む領域を予め増幅させておいても良い。特定の配列を含む領域を増幅させるための方法としては特に限定されないが、例えばPCRを行うことができる。試料中の複数の多型を検出する場合は、相当する複数の特定の配列に対し、マルチプレックスPCRを行うことができる。
【0197】
核酸増幅においては、ホットスタート法を用いることが好ましい。ホットスタート法を用いることによって、プライマーのミスアニーリングやオリゴマー化を防止することができ、望ましくない核酸増幅を防止することができる。また、ホットスタート法を用いると、多くの領域を同時に増幅することができるため、効率よく多型検出を行うことを可能にする。
【0198】
ゲノムの増幅において、1つの多型部位を増幅するためにはその多型部位をはさんで結合する1対のプライマーを用いる。対象となる試料中の検出すべき多型が複数である場合、検出すべき多型部位が互いに離れた位置に存在する場合には、多型部位の種類の数の2倍のプライマーを用いる。しかし、例えば複数の多型、たとえば2つの多型が接近している場合には、2つの多型部位それぞれを挟んでプライマーを結合させて増幅を行っても良い、2つの多型部位の間にプライマーを結合させず、2つの多型部位の両端に1対のプライマーを結合させて増幅を行っても良い。
【0199】
PCR反応液は、pH緩衝液、MgCl2、KClなどの塩類、プライマー、デオキシリボヌクレオチド類、及び熱安定性合成酵素を含む。その他に、界面活性剤やタンパク質などの物質を必要に応じて添加することができる。
【0200】
pH緩衝液は、トリス(ヒドロキシメチル)アミノメタンと、塩酸、硝酸、硫酸などの鉱酸とを組み合わせたもの、及び、その他種々のpH緩衝液を用いることができる。pH調製された緩衝液は、PCR反応液の中で10mMから100mMの間の濃度で使用することが好ましい。
【0201】
プライマーはPCR反応による核酸合成の開始点として働くオリゴヌクレオチドをいう。プライマーは合成したものであっても良く、生物界から単離したものであっても良い。
熱安定性合成酵素はプライマー付加による核酸合成のための酵素であり、化学合成系も含む。適切な合成酵素としては、E.coliのDNAポリメラーゼ、E.coliのDNAポリメラーゼのクレノーフラグメント、T4DNAポリメラーゼ、TaqDNAポリメラーゼ、T.litoralisDNAポリメラーゼ、TthDNAポリメラーゼ、PfuDNAポリメラーゼ、Hot Start Taqポリメラーゼ、KODDNAポリメラーゼ、EX TaqDNAポリメラーゼ、逆転写酵素などがあるが、これらに限定されるものではない。なお、熱安定性とは、高温下、好ましくは65〜95℃でもその活性を保持する化合物の性質を意味する。
【0202】
増幅反応におけるその他の条件としては特に限定されず、公知の方法における条件に基づいて反応を行うことができる。試料に生体試料や生体由来試料を用いる場合は、増幅反応を、25℃におけるpHが8.5〜9.5となる反応液中で行うことが好ましい。そうすることにより、生体試料や生体由来試料に、直接核酸増幅反応液を作用させ、反応を行うことも可能である。
【実施例】
【0203】
<実験例A>
以下に、実験例A1及び実験例A2で用いたオリゴヌクレオチドの配列を挙げる。右肩に*印を付している塩基は、多型部位として想定した塩基、又は、その塩基に対応する相補塩基又は非相補塩基である。
Inv_A:AGTCTGTACTAATTGCACATG*TATTGTTGGGGATTTTCCAT(配列番号1)
Inv_Cw1:TTTTTTTTTTTTC*ATGTGCAATTAGTACAGACT(配列番号2)
Inv_Cm:TTTTTTTTTTTTTTTA*ATGTGCAATTAGTACAGACT(配列番号3)
Inv_B1:ATGGAAAATCCCCAACAATAG*(配列番号4)
【0204】
<実験例A1>
A1−1.オリゴヌクレオチドの調製
鋳型核酸として、配列番号1に示される塩基配列を有するオリゴヌクレオチドInv_Aと、第1オリゴヌクレオチドとして、配列番号2に示される塩基配列を有するオリゴヌクレオチドInv_Cw1と、第2オリゴヌクレオチドとして、配列番号4に示される配列を有するオリゴヌクレオチドInv_B1とについて、プロリゴ・ジャパン株式会社に合成を委託し、合成されたそれぞれのオリゴヌクレオチドを、DW(蒸留水)で100pmol/mlになるよう調製した。
【0205】
ここで、鋳型核酸Inv_Aの21番目の塩基をSNPとして想定する。第1オリゴヌクレオチドInv_Cw1が有する塩基配列(配列番号2)は、鋳型核酸が有する塩基配列(配列番号1)の1〜21番目の塩基配列に相補的な塩基配列と、フラップ配列(Poly-T12)とを有する。第2オリゴヌクレオチドInv_B1の塩基配列(配列番号4)は、鋳型核酸が有する塩基配列(配列番号1)の22〜32番目の塩基配列に相補的な塩基配列と、鋳型核酸と無関係な配列とを有する。
【0206】
A1−2.ダブルフラップ構造の形成及びフラップの切断
以下の成分をDW中に含む反応溶液7μlを調製した。
Inv_A(鋳型核酸)水溶液 0.5μl
Inv_Cw1(第1オリゴヌクレオチド)水溶液 1μl
Inv_B1(第2オリゴヌクレオチド)水溶液 1μl
Enzyme Mix(フラップエンドヌクレアーゼ) 0.3μl
Buffer(0.8g/ml PEG800、0.2mmol/ml MOPS) 0.3μl
なお、Enzyme Mixは、Invader DNA Assay (THIRD WAVE TECHNOLOGIES)のKitに含まれているものを使用した。
反応溶液7μlを、0.5mlマイクロチューブに入れ、さらに、蒸発を防ぐため、ミネラルオイルを反応液に重層した。サーマルサイクラーにマイクロチューブをセットし、95℃3分、60℃60分の反応を行なった。
【0207】
A1−3.マイクロチップ電気泳動装置によるフラップ切断の確認
反応終了後、マイクロチューブ内の反応溶液から1μlを取り出し、泳動バッファ50μlで希釈し、測定用サンプルとした。泳動バッファは、0.125×Tris-Borate-EDTA(TBE):ホルムアミドが3:1(v/v)の混合液を使用した。
調製された測定用サンプルを、MCE2010 レーザー誘起蛍光機(島津製作所製)を用いて、蛍光色素サイバーゴールド(モレキュラーブローブ社製)を用いた低分子分離用ゲルを用いて測定した。
【0208】
電気泳動の結果を図13(a)に示す。図13(a)においては、横軸は秒(sec)、縦軸は蛍光強度(mV)を示す(後述の図13(b)においても同じ)。図13(a)が示すように、13merのピーク(図中(i)の位置におけるピーク)及び20merのピーク(図中(ii) の位置におけるピーク)が検出された。これは、第1オリゴヌクレオチドInv_Cw1が切断されることにより、第1オリゴヌクレオチドInv_Cw1から、(Poly-T12)+(1塩基)の13merのフラップ断片と、残りの20merのオリゴヌクレオチド断片とが生成したためと考えられる。また、第1オリゴヌクレオチドInv_Cw1の33merのピーク(図中(iii) の位置におけるピーク)が消失していることからも、ダブルフラップ構造が認識されてフラップが切断されたと考えられる。
【0209】
<実験例A2>
第1オリゴヌクレオチドとして、配列番号3に示される塩基配列を有するオリゴヌクレオチドInv_Cm(プロリゴ・ジャパン株式会社に合成を委託)を用いたこと以外は、実験例A1の方法と同じ操作を行った。ここで、第1オリゴヌクレオチドInv_Cmが有する塩基配列(配列番号3)は、鋳型核酸が有する塩基配列(配列番号1)の1〜20番目の塩基配列に相補的な塩基配列と、21番目の塩基に相補的でない塩基と、フラップ配列(Poly-T15)とを有する。
【0210】
電気泳動の結果を図13(b)に示す。図13(b)が示すように、36merのピーク(図中(iii’) の位置におけるピーク)が検出された。すなわち、第1オリゴヌクレオチドInv_Cmがそのまま検出された。さらに、フラップ断片に相当する16merのピーク(図中(i’) の位置におけるピーク)と、第1オリゴヌクレオチドからフラップ断片が遊離した場合の残りのオリゴヌクレオチド断片に相当する20merのピーク(図中(ii) の位置におけるピーク)とは検出されなかった。このことから、Inv_Aの21番目の塩基がInv_Cmと相補的でないために、ダブルフラップ構造を形成することができず、認識サイトが存在しなかったため、酵素が働かなかったと考えられる。
【0211】
以上のように、実験例A1において、SNPがプローブと相補的であればフラップエンドヌクレアーゼによる反応が起こりSNPが検出され、一方、実験例A2において、SNPがプローブと相補的でなければフラップエンドヌクレアーゼによる反応が起こらないことが確認できた。これにより、SNPを判別することができたといえる。
【0212】
さらに、上記実験例A1及びA2において用いられる第1オリゴヌクレオチドがタグを有するものである場合は、以下のようにSNPの識別を行うことができる。
【0213】
上記実験例A1において、第1オリゴヌクレオチドInv_Cw1の、例えば3’末端に、捕捉可能なタグがついている場合は、以下のような結果が得られる。
上記A1−3.の工程の前にタグを捕捉する工程を行うことにより、第1オリゴヌクレオチドからフラップ断片が遊離して残った部分(すなわち図13(a)中(ii) 位置のピークとして検出されたオリゴヌクレオチド断片にタグが付いたもの)が除去される。このため、電気泳動の結果としては、多型の判断に不要なピーク(すなわち少なくとも図13(a)中(ii) 位置のピークに対応するもの)が検出されることなく、多型の判断に直接かかわるフラップ断片のピーク(すなわち図13(a)中(i)位置のピークに相当するもの)が検出される。このことにより、SNPが検出される。
【0214】
上記実験例A2において、第1オリゴヌクレオチドInv_Cmの、例えば3’末端に、捕捉可能なタグがついている場合は、以下のような結果が得られる。
上記A1−3.の工程の前にタグを捕捉する工程を行うことにより、未反応第1オリゴヌクレオチド(すなわち図13(b)中(iii’)位置のピークとして検出されたオリゴヌクレオチドにタグが付いたもの)が除去される。このため、電気泳動の結果としては、多型の判断に不要なピーク(すなわち少なくとも図13(b)中(iii’)位置のピークに対応するもの)も検出されない。
【0215】
以上のように、タグつき第1オリゴヌクレオチドを用いることによって、SNPの判別が可能であり、さらに、上記実験例A1及びA2において検出されたような不要なピークが検出されないため、SNPの判断をより容易に行うことができる。
【0216】
<実験例B>
以下に、実験例B1及び実験例B2で用いたオリゴヌクレオチドの配列を挙げる。右肩に*印を付している塩基は、多型部位として想定した塩基、又は、その塩基に対応する相補塩基又は非相補塩基である。
Inv_A:AGTCTGTACTAATTGCACATG*TATTGTTGGGGATTTTCCAT(配列番号1)
Inv_A40merA:AGTCTGTACTAATTGCACATG*TATTGTTGGGGAT(配列番号5)
Inv_Cw1:TTTTTTTTTTTTC*ATGTGCAATTAGTACAGACT(配列番号2)
Inv_Cm:TTTTTTTTTTTTTTTA*ATGTGCAATTAGTACAGACT(配列番号3)
Inv_B1:ATGGAAAATCCCCAACAATAG*(配列番号4)
【0217】
<実験例B1>
B1−1.オリゴヌクレオチドの調製
鋳型核酸として、配列番号1に示される塩基配列を有するオリゴヌクレオチドInv_Aと、第1オリゴヌクレオチドとして、配列番号2に示される塩基配列を有するオリゴヌクレオチドInv_Cw1と、第2オリゴヌクレオチドとして、配列番号4に示される配列を有するオリゴヌクレオチドInv_B1とについて、プロリゴ・ジャパン株式会社に合成を委託し、合成されたそれぞれのオリゴヌクレオチドを、DW(蒸留水)で100pmol/mlになるよう調製した。
【0218】
ここで、鋳型核酸Inv_Aの21番目の塩基をSNPとして想定する。第1オリゴヌクレオチドInv_Cw1が有する塩基配列(配列番号2)は、鋳型核酸が有する塩基配列(配列番号1)の1〜21番目の塩基配列に相補的な塩基配列と、フラップ配列(Poly-T12)とを有する。第2オリゴヌクレオチドInv_B1の塩基配列(配列番号4)は、鋳型核酸が有する塩基配列(配列番号1)の22〜32番目の塩基配列に相補的な塩基配列と、鋳型核酸と無関係な配列とを有する。
【0219】
B1−2.ダブルフラップ構造の形成及びフラップの切断
以下の成分をDW中に含む反応溶液7μlを調製した。
Inv_A(鋳型核酸)水溶液 0.5μl
Inv_Cw1(第1オリゴヌクレオチド)水溶液 1μl
Inv_B1(第2オリゴヌクレオチド)水溶液 1μl
Enzyme Mix(フラップエンドヌクレアーゼ) 0.3μl
Buffer(0.8g/ml PEG800、0.2mmol/ml MOPS) 0.3μl
なお、Enzyme Mixは、Invader DNA Assay (THIRD WAVE TECHNOLOGIES)のKitに含まれているものを使用した。
反応溶液7μlを、0.5mlマイクロチューブに入れ、さらに、蒸発を防ぐため、ミネラルオイルを反応液に重層した。サーマルサイクラーにマイクロチューブをセットし、95℃3分、60℃60分の反応を行なった。
【0220】
B1−3.質量分析装置によるフラップ断片の確認
反応終了後、マイクロチューブ内の反応溶液から2μlを取り出し、ZipTipC18で脱塩処理を行い、測定用サンプルとした。測定用サンプルは、MSプレート上に50v/v%アセトニトリル水溶液0.5μlで溶出した。さらに、マトリックス液として、3-HPA(3−ヒドロキシピコリン酸)溶液
(0.3M 3-HPA−0.07Mアンモニウムリン酸塩水溶液とアセトニトリルとの50v/v%溶液)を0.5μl重層した。測定は、AXIMA-CFR(島津製作所製)を用いて、Linear-Negativeモードで行った。
【0221】
得られたマススペクトルを図14(a)に示す。図14において、横軸は質量/電荷、縦軸は相対強度(%Int.)を示す。図14(a)が示すように、13merのピーク及び20merのピークが検出された。これは、第1オリゴヌクレオチドInv_Cw1が切断されることにより、第1オリゴヌクレオチドInv_Cw1から、(Poly-T12)+(1塩基:G)の13merのフラップ断片と、残りの20merのオリゴヌクレオチド断片とが生成したためと考えられる。また、図14(a)に示したスペクトルにおいては、第1オリゴヌクレオチドInv_Cw1に相当する33mer付近の質量/電荷の範囲は示されていないが、33merのピークは消失している。このことからも、ダブルフラップ構造が認識されてフラップが切断されたと考えられる。
【0222】
<実験例B2>
鋳型核酸として、配列番号5に示される塩基配列を有するオリゴヌクレオチドInv_A40merAと、第1オリゴヌクレオチドとして、配列番号3に示される塩基配列を有するオリゴヌクレオチドInv_Cm(いずれもプロリゴ・ジャパン株式会社に合成を委託)を用いたこと以外は、実験例B1の方法と同じ操作を行った。ここで、第1オリゴヌクレオチドInv_Cmが有する塩基配列(配列番号3)は、鋳型核酸が有する塩基配列(配列番号5)の1〜20番目の塩基配列に相補的な塩基配列と、21番目の塩基に相補的でない塩基と、フラップ配列(Poly-T15)とを有する。
【0223】
得られたマススペクトルを図14(b)に示す。図14(b)が示すように、フラップ断片に相当する16merのピークと、第1オリゴヌクレオチドからフラップ断片が遊離した場合の残りのオリゴヌクレオチド断片に相当する20merのピークとは検出されなかった。また、図14(b)に示したスペクトルにおいては、第1オリゴヌクレオチドInv_Cmに相当する36mer付近の質量/電荷の範囲は示されていないが、36merのピークが検出されている。このことから、Inv_A40merAの21番目の塩基がInv_Cmと相補的でないために、ダブルフラップ構造を形成することができず、認識サイトが存在しなかったため、酵素が働かなかったと考えられる。
【0224】
以上のように、実験例B1において、SNPがプローブと相補的であればフラップエンドヌクレアーゼによる反応が起こりSNPが検出され、一方、実験例B2において、SNPがプローブと相補的でなければフラップエンドヌクレアーゼによる反応が起こらないことが確認できた。これにより、SNPを判別することができたといえる。
【0225】
さらに、上記実験例B1及びB2において用いられる第1オリゴヌクレオチドがタグを有するものである場合は、以下のようにSNPの識別を行うことができる。
【0226】
上記実験例B1において、第1オリゴヌクレオチドInv_Cw1の、例えば3’末端に、捕捉可能なタグが付いている場合は、以下のような結果が得られる。
上記B1−3.の工程の前にタグを捕捉する工程を行うことにより、第1オリゴヌクレオチドからフラップ断片が遊離して残った部分(すなわち図14(a)中20merのピークとして検出されたオリゴヌクレオチド断片にタグが付いたもの)が除去される。このため、質量分析の結果としては、多型の判断に不要なピーク(すなわち少なくとも図14(a)中20merのピークに対応するもの)も検出されることなく、多型の判断に直接かかわるフラップ断片のピーク(図14(a)中13merのピークに相当するもの)が検出される。このことにより、SNPが検出される。
【0227】
上記実験例B2において、第1オリゴヌクレオチドInv_Cmの、例えば3’末端に、捕捉可能なタグが付いている場合は、以下のような結果が得られる。
上記B1−3.の工程の前にタグを捕捉する工程を行うことにより、未反応第1オリゴヌクレオチド(すなわち上記実験例B2での36merのピークとして検出されたオリゴヌクレオチドにタグが付いたもの)が除去される。このため、質量分析の結果としては、多型の判断に不要なピーク(すなわち少なくとも上記実験例B2での36merのピークに対応するもの)も検出されない。
【0228】
以上のように、タグつき第1オリゴヌクレオチドを用いることによって、SNPの判別が可能であり、さらに、上記実験例B1及びB2において検出されたような不要なピークが検出されないため、SNPの判断をより容易に行うことができる。
【0229】
<実験例C>
<実験例C1:反応系の確認>
以下に、本実験例で用いたオリゴヌクレオチドの配列を挙げる。右肩に*印を付している塩基は、多型部位として想定した塩基、又はその塩基に対応する相補塩基又は非相補塩基である。
Inv_A_C:AGTCTGTACTAATTGCACATC*TATTGTTGGGGATTTTCCAT(配列番号6)
Inv_FCwC:CGCGCCGAGGG*ATGTGCAATTAGTACAGACT(配列番号7)
Inv_B1_T:ATGGAAAATCCCCAACAATAT*(配列番号8)
InvFR_w:TCTCGTCTCGGTTTTCCGAGACCTCGGCGCG(配列番号9)
【0230】
C1−1.ダブルフラップ構造を構成するオリゴヌクレオチドの合成
鋳型核酸として、配列番号6に示される塩基配列を有するオリゴヌクレオチドInv_A_Cと、第1オリゴヌクレオチドとして、配列番号7に示される塩基配列を有し且つ5’ 末端がCy5で標識されたオリゴヌクレオチドInv_FCwCと、第2オリゴヌクレオチドとして、配列番号8の塩基配列を有するオリゴヌクレオチドInv_B1_Tと、第3オリゴヌクレオチドとして、配列番号9に示される塩基配列を有し且つ3’ 末端をフルオレセインで標識されたオリゴヌクレオチドInvFR_wとについて、プロリゴ・ジャパン株式会社に合成を委託し、合成されたそれぞれのオリゴヌクレオチドを、DW(蒸留水)で100pmol/mlになるように調製した。
【0231】
ここで、鋳型核酸Inv_A_Cの21番目の塩基をSNPとして想定する。第1オリゴヌクレオチドInv_FCwCが有する塩基配列(配列番号7)は、11〜31番目の塩基配列として、鋳型核酸が有する塩基配列(配列番号6)の1〜21番目の塩基配列と相補的な塩基配列、及び、1〜10番目の塩基配列としてフラップ配列を有する。第2オリゴヌクレオチドInv_B1_Tの塩基配列(配列番号8)は、鋳型核酸が有する塩基配列(配列番号6)の22番目以降の塩基配列と相補的な塩基配列、及び、鋳型核酸と無関係な塩基を有する。第3オリゴヌクレオチドInvFR_wの塩基配列(配列番号9)は、22〜31番目の塩基配列として、第1オリゴヌクレオチドにおける1〜10番目のフラップ配列と相補的な塩基配列を有する。
【0232】
C1−2.FRET(蛍光共鳴エネルギー移動)による蛍光シグナルの確認
Cy5で標識されたInv_FCwCと、フルオレセインで標識されたInvFR_wとを等量混合した混合試料をポジティブコントロール、フルオレセインで標識されたInvFR_wの単独試料をネガティブコントロールとし、それぞれについて、分光蛍光光度計(RF-5300PC:島津製作所製)を用いた測定を行った。励起波長486nmとし、蛍光強度をスキャンニングしたものを図15に示した。図15において、横軸は蛍光波長(nm)、縦軸は蛍光強度を示す。図15が示すように、ネガティブコントロール(Negative)では、490nm付近で蛍光スペクトルのピークがあるのに対し、ポジティブコントロール(Positive)では、490nm付近の蛍光スペクトルのピークが消失し、630nm付近に蛍光スペクトルのピークが出現している。
【0233】
C1−3.ダブルフラップ構造の形成、フラップの切断、及びシグナル検出
以下の成分をDW中に含む反応溶液3μlを調製した。
Inv_A_C(鋳型核酸) 20pM
Inv_FCwC(第1オリゴヌクレオチド) 20nM
Inv_B1_T(第2オリゴヌクレオチド) 20pM
InvFR_w(第3オリゴヌクレオチド) 20nM
Enzyme Mix(フラップエンドヌクレアーゼ) 0.15μl
Buffer(0.04mg/ml PEG6000, 0.2mmol/ml MOPS, 10mM MgCl2)0.15μl
なお、Enzyme Mixは、Invader DNA Assay (THIRD WAVE TECHNOLOGIES)のKitに含まれているものを使用した。
【0234】
反応溶液3μlを、0.5mlマイクロチューブに入れ、さらに、蒸発を防ぐため、ミネラルオイルを反応溶液に重層した。リアルタイムPCR装置MX-3000p(Stratagene社製)にマイクロチューブをセットし、95℃3分の処理後、60℃で反応を行った。10秒毎に一回の測定を行った。
【0235】
C1−4.特異性の確認
上記C1−3.の反応溶液から酵素及び/又は鋳型を除いた反応溶液を、比較用に調製した。すなわち、反応系A用に、Inv_A_CとEnzyme Mixとを除いた以外は上記C1−3.と同様の反応溶液3μlを、反応系B用に、Enzyme Mixを除いた以外は上記C1−3.と同様の反応溶液3μlを、及び、反応系C用に、Inv_A_Cを除いた以外は上記C1−3.と同様の反応溶液3μlを調製した。それぞれ、0.5mlマイクロチューブに加え、さらに、蒸発を防ぐため、ミネラルオイルを反応溶液に重層した。リアルタイムPCR装置MX-3000p(Stratagene社製)にマイクロチューブをセットし、95℃3分の処理後、60℃で反応を行った。励起波長495nm /蛍光波長520nmで、10秒毎に一回の測定を行った。
【0236】
上記C1−3.を反応系Dとし、反応系Dと、上記C1−4.の比較用の反応系A、B及びCとについて、MX-3000pによる測定で得られたシグナルをプロットした結果を、図16及び図17に示す。図16及び図17において、横軸は時間(サイクル(cycle)として表示)、縦軸は蛍光強度を示す。図16は、反応系C及びDについて、FITCの蛍光強度の経時変化を示しており、測定条件は、励起波長492nm/蛍光波長520nm:FITCである。図17は、反応系A、B、C及びDについて、FITCの蛍光強度の経時変化を示しており、測定条件は、励起波長492nm/蛍光波長520nm:FITCである。
【0237】
図16では、反応系CのシグナルとDのシグナルとの間で少しの差が見られる程度であるが、特に図17において、経時変化に伴い若干の蛍光強度の下降を示した反応系Dのシグナルは、経時変化に伴い若干の蛍光強度の上昇を示した他の反応系のシグナルと比較して、明らかに異なる挙動を示していることから、上記C1−3.の反応系の特異性が確認できた。
【0238】
<実験例C2:SNP部位認識の特異性確認>
以下に、本実験例で用いたオリゴヌクレオチドの配列を挙げる。右肩に*印を付している塩基は、多型部位として想定した塩基、又はその塩基に対応する相補塩基又は非相補塩基である。
Inv_A_C:AGTCTGTACTAATTGCACATC*TATTGTTGGGGATTTTCCAT(配列番号6)
Inv_A40merA_T:AGTCTGTACTAATTGCACATT*TATTGTTGGGGATTTTCCAT(配列番号10)
Inv_A50mer:AAAAGTTTACAGTCTGTACTAATTGCACATG*TATTGTTGGGGATTTTCCATGTTTTCTAAA(配列番号11)
Inv_FCwC:CGCGCCGAGGG*ATGTGCAATTAGTACAGACT(配列番号7)
Inv_B1_T:ATGGAAAATCCCCAACAATAT*(配列番号8)
InvFR_w:TCTCGTCTCGGTTTTCCGAGACCTCGGCGCG(配列番号9)
【0239】
C2−1.特異性確認のためのオリゴヌクレオチドの合成
鋳型核酸として、配列番号6に示される塩基配列を有するオリゴヌクレオチドInv_A_C、配列番号10に示される塩基配列を有するオリゴヌクレオチドInv_A40merA_T、及び配列番号11に示される塩基配列を有するオリゴヌクレオチドInv_A50merと、第1オリゴヌクレオチドとして、配列番号7に示される塩基配列を有し且つ5’ 末端がCy5で標識されたオリゴヌクレオチドInv_FCwCと、第2オリゴヌクレオチドとして、配列番号8の塩基配列を有するオリゴヌクレオチドInv_B1_Tと、第3オリゴヌクレオチドとして、配列番号9に示される塩基配列を有し且つ3’ 末端をフルオレセインで標識されたオリゴヌクレオチドInvFR_wとについて、プロリゴ・ジャパン株式会社に合成を委託し、合成されたそれぞれのオリゴヌクレオチドを、DW(蒸留水)で100pmol/mlになるように調製した。
【0240】
ここで、鋳型核酸Inv_A_Cの21番目の塩基CをSNPとして想定する。鋳型核酸Inv_A40merA_Tは、21番目の塩基を鋳型核酸Inv_A_CのSNP(C)と異なるSNP(T)として想定する。鋳型核酸Inv_A50merは、31番目の塩基を、鋳型核酸Inv_A_CのSNP(C)及び鋳型核酸Inv_A40merA_TのSNP(T)のいずれとも異なるSNP(G)として想定するとともに、1〜10番目の塩基配列及び52〜61番目の塩基配列がさらに加わった配列としている。
【0241】
C2−2.ダブルフラップ構造の切断とシグナル検出
以下の成分をDW中に含む反応溶液3μlを、反応系F、G及びH構築用にそれぞれ調製した。
(鋳型核酸) 20pM
Inv_FCwC(第1オリゴヌクレオチド) 20nM
Inv_B1_T(第2オリゴヌクレオチド) 20pM
InvFR_w(第3オリゴヌクレオチド) 20nM
Enzyme Mix(フラップエンドヌクレアーゼ) 0.15μl
Buffer(0.04mg/ml PEG6000, 0.2mmol/ml MOPS, 10mM MgCl2)0.15μl
なお、Enzyme Mixは、Invader DNA Assay (THIRD WAVE TECHNOLOGIES)のKitに含まれているものを使用した。
具体的には、反応系F構築用反応溶液には、鋳型核酸として、Inv_A_CとInv_A40merA_Tとの等量混合物を用い、反応系G構築用反応溶液には、鋳型核酸として、Inv_A_CとInv_A50merとの等量混合物を用い、反応系H構築用反応溶液には、鋳型核酸として、Inv_A40merA_TとInv_A50merとの等量混合物を用いた。
さらに別途、反応系E(比較用)構築用に、鋳型核酸を加えない以外は上記と同じ組成の反応溶液を調製した。
【0242】
反応溶液3μlを、0.5mlマイクロチューブに入れ、さらに、蒸発を防ぐため、ミネラルオイルを反応溶液に重層した。リアルタイムPCR装置MX-3000p(Stratagene社製)にマイクロチューブをセットし、95℃3分の処理後、60℃で反応を行った。上記実験例C1のC1−4.で、本発明の反応系と比較用の反応系との差が明らかであった、励起波長492nm/蛍光波長520nm:FITCの条件で、10秒毎に一回の測定を行った。
【0243】
反応系E(比較用)、F、G及びHについて、MX-3000pによる測定で得られたシグナルをプロットした結果を、図18に示す。図18において、横軸は時間(サイクル(cycle)として表示)、縦軸は蛍光強度を示す。
【0244】
C2−3.特異性の確認
SNP部位においてInvF_CwCに相補的な塩基を持つInv_A_Cを鋳型とした反応系F及びGにおいては、2サイクル目まで蛍光強度の上昇がみられるものの、3サイクル以降、明らかなシグナルの減少が確認できた。それに対し、Inv_A_Cを鋳型として含まない反応系、すなわちSNP部位においてInvF_CwCに非相補的な塩基を持つInv_A40merA_T及びInv_A50merを鋳型とした反応系Hや、鋳型を含まない反応系Eにおいては、反応系F及びGで見られたような蛍光強度の下降が見られなかった。このことから、本実験例において、一塩基の違いを認識することができたと考えられる。
【0245】
上記実験例C2における第1オリゴヌクレオチドがタグを有するものである場合は、以下のようにしてSNPの識別を行うことができる。
第1オリゴヌクレオチドInv_FCwCの、例えば3’末端に、捕捉可能なタグが付いていることと、第3オリゴヌクレオチドInvFR_wが除かれること以外は上記C2−2.の反応溶液(反応系E、F、G及びH)と同様の反応溶液(それぞれ反応系E’、F’、G’及びH’とする)を調製する。
【0246】
ここで、反応系E’は、余剰の第1オリゴヌクレオチドが存在する場合に相当し;反応系F’及びG’は、フラップエンドヌクレアーゼによる認識反応によりフラップ断片が遊離する場合に相当し;反応系H’は、当該認識反応が起こらずフラップ断片が遊離しないため、鋳型核酸にハイブリダイズした未反応第1オリゴヌクレオチドが存在する場合に相当する。
【0247】
調製した反応溶液について、それぞれ、上記C2−2.と同じ条件で反応を行う。反応後、捕捉手段を用いてタグを捕捉する工程を行う。捕捉手段を除去した後、第3オリゴヌクレオチドInvFR_wを加え、60℃で反応を行う。リアルタイムPCR装置MX-3000p(Stratagene社製)を使用し、励起波長492nm/蛍光波長520nm:FITCの条件で60℃、10秒ごとに一回の測定を行う。もしくは、別の温調装置で、60℃で10分反応後、蛍光プレートリーダなどを用い、励起波長492nm/蛍光波長520nm:FITCの条件で測定する。
【0248】
MX-3000pを使用した場合、C2−3.と同様の反応が起こる。この際、シグナルの減少はC2−3.の場合に比較して、より大きくなることが期待される。E'及びH'のシグナル強度に比較して、F'及びG'のシグナルは経時的に低くなり、その差はC2−3.の結果と較べてもより大きい。同様に、蛍光プレートリーダによる測定でも、十分に差が認識できると予想される。
【0249】
以上のように、タグつき第1オリゴヌクレオチドを用いることによって、SNPの判別が可能であり、さらに、上記C2−3.では、蛍光強度の差が小さいためにシグナル観察を反応中に経時的に行う必要性があることに対し、そのような必要性がなくなる。このため、SNPの判断をより容易に、且つ簡便な装置で行うことが出来る。
【図面の簡単な説明】
【0250】
【図1】本発明の鋳型核酸、第1オリゴヌクレオチド及び第2オリゴヌクレオチドが3本鎖構造体を形成したときの一例を示した模式図(a)、及び、当該第1オリゴヌクレオチドが蛍光エネルギー供与体を有している場合に3本鎖構造体を形成したときの一例を示した模式図(b)である。
【図2】第1オリゴヌクレオチドとして設計したオリゴヌクレオチドが多型部位において鋳型核酸とマッチすることにより形成した本発明の3本鎖構造体の模式図(a)、3本鎖構造体がフラップエンドヌクレアーゼによって切断反応を受け、フラップ断片が遊離した様子を示す模式図(b)、及び、タグが捕捉される様子を示す模式図(c)である。
【図3】第1オリゴヌクレオチドとして設計したオリゴヌクレオチドが多型部位において鋳型核酸とマッチしない場合を表した模式図(a)、及び、タグが捕捉される様子を示す模式図(b)である。
【図4】SNPとしてTが検出される場合を表した模式図(a)、及び、SNPとしてCが検出される場合を表した模式図(b)である。
【図5】フラップ断片を直接検出することによる本発明の形態における、第1オリゴヌクレオチド(a)、各第1オリゴヌクレオチド及び第2オリゴヌクレオチドの鋳型核酸へのハイブリダイズ(b)、及び、タグを捕捉する手段による、遊離したフラップ断片とタグを有する核酸種との分離(c)を示した模式図である。
【図6】図5において第1オリゴヌクレオチドが蛍光物質を有していた場合における、タグを捕捉する手段による、遊離したフラップ断片とタグを有する核酸種との分離を示した模式図である。
【図7】蛍光エネルギー供与体の蛍光強度の減衰に基づいて多型検出を行う本発明の形態における、蛍光エネルギー供与体を有する第1オリゴヌクレオチド(a)、各第1オリゴヌクレオチド及び第2オリゴヌクレオチドの鋳型核酸へのハイブリダイズ(b)、タグを捕捉する手段による、遊離したフラップ断片とタグを有する核酸種との分離(c)、及び、フラップ断片と第3オリゴヌクレオチドとのハイブリダイズによる蛍光発光(d)を表した模式図である。
【図8】蛍光エネルギー受容体の蛍光強度の増強に基づいて多型検出を行う本発明の形態における、蛍光エネルギー供与体を有する第1オリゴヌクレオチド(a)、各第1オリゴヌクレオチド及び第2オリゴヌクレオチドの鋳型核酸へのハイブリダイズ(b)、及びフラップ断片と第3オリゴヌクレオチドとのハイブリダイズによる蛍光発光(c)を表した模式図である。
【図9】蛍光エネルギー供与体の蛍光強度の減衰に基づいて多型検出を行う本発明の形態における、蛍光エネルギー受容体を有する第1オリゴヌクレオチド(a)、各第1オリゴヌクレオチド及び第2オリゴヌクレオチドの鋳型核酸へのハイブリダイズ(b)、及びフラップ断片と第3オリゴヌクレオチドとのハイブリダイズによる蛍光発光(c)を表した模式図である。
【図10】蛍光エネルギー受容体の蛍光強度の増強に基づいて多型検出を行う本発明の形態における、蛍光エネルギー受容体を有する第1オリゴヌクレオチド(a)、各第1オリゴヌクレオチド及び第2オリゴヌクレオチドの鋳型核酸へのハイブリダイズ(b)、及びフラップ断片と第3オリゴヌクレオチドとのハイブリダイズによる蛍光発光(c)を表した模式図である。
【図11】固体支持体上の位置に基づいて多型検出を行う本発明の形態における、蛍光エネルギー供与体を有する第1オリゴヌクレオチド(a)、各第1オリゴヌクレオチド及び第2オリゴヌクレオチドの鋳型核酸へのハイブリダイズ(b)、及びフラップ断片と第3オリゴヌクレオチドとのハイブリダイズによる蛍光発光(c)を表した模式図である。
【図12】固体支持体上の位置に基づいて多型検出を行う本発明の形態における、蛍光エネルギー受容体を有する第1オリゴヌクレオチド(a)、各第1オリゴヌクレオチド及び第2オリゴヌクレオチドの鋳型核酸へのハイブリダイズ(b)、及びフラップ断片と第3オリゴヌクレオチドとのハイブリダイズによる蛍光発光(c)を表した模式図である。
【図13】実験例A1において得られた電気泳動の結果(a)及び実験例A2において得られた電気泳動の結果(b)である。
【図14】実験例B1において得られたマススペクトル(a)及び実験例B2において得られたマススペクトル(b)である。
【図15】実験例C1で得られた、FITCを有するオリゴヌクレオチド及びCy5を有するオリゴヌクレオチドの混合試料(Positive)と、FITCを有するオリゴヌクレオチドの単独試料(Negative)との蛍光スペクトルである。
【図16】実験例C1で得られた、反応系Cと反応系Dとについて、FITCの蛍光強度の経時変化を示すグラフである。
【図17】実験例C1で得られた、反応系A、B及びCと、反応系Dとについて、FITCの蛍光強度の経時変化を示すグラフである。
【図18】実験例C2で得られた、反応系Eと、反応系F及びGと、反応系Hとについて、FITCの蛍光強度の経時変化を示すグラフである。
【配列表フリーテキスト】
【0251】
配列番号1〜11は、合成オリゴヌクレオチドである。
【技術分野】
【0001】
本発明は、SNPなどの検出を簡便に行うことができる標的核酸の検出方法、及び、その方法により得られた結果を用いて薬剤投与や病気罹患率などの診断を行う方法に関する。
この遺伝子多型検出方法は、遺伝子解析の研究や臨床分野において利用することができる。
【背景技術】
【0002】
フラップエンドヌクレアーゼ(FEN-1)が、ダブルフラップ(Double FLAP)構造と呼ばれる3塩基の立体構造を認識して、フラップ(FLAP)と呼ばれるオリゴヌクレオチドが遊離することが知られている(例えば、Harrington JJ and Lieber MR, Journal of Biological Chemistry, 1995 Mar 3; 270 (9): 4503-4508. Fig. 5.B参照)。
【0003】
一方、SNP部位の塩基を判別する、いわゆるタイピングについては多くの手法が報告されている。そのうちの代表的なものとして、インベーダー法、タックマンPCR法、モレキュラービーコン法、プライマーエクステンション法などが挙げられる(例えば、Kirk BW, Feinsod M, Favis R, Kliman RM and Barany F, Nucleic Acids Research, 2002 Aug 1; 30 (15): 3295-3311参照)。
【0004】
インベーダー法は、2段階の酵素反応により、フラップ(FLAP)プローブから遊離した蛍光物質を測定する手法である。
具体的には、インベーダー法は、フラッププローブとインベーダープローブとが鋳型DNAにハイブリダイズしたダブルフラップ構造を形成し、酵素クリベース(Cleavase)がこの構造を認識しフラッププローブを切断することによってフラップ部分を遊離する工程を第1段階として;遊離したフラップをフレットと結合させ、再度クリベースで切断することで、フレットにおける消光物質と蛍光物質とを遊離させる工程を第2段階として含む。その結果、発生した蛍光を検出することで、SNPのアレル判定を行う。
この方法は、フレット(FRET)配列を共通化することにより、2段階目の反応を共通に行うことができるように工夫されているのが特徴である(例えば、特表2002−515737号公報参照)。
【0005】
インベーダー法の利点を挙げると以下の通りである。1)ゲノム上の広い範囲でプローブを設計することが可能であり、その自由度は比較的高い;2)遺伝子変異部を含む領域を予めPCRで増幅しておくことを必ずしも必要としない;及び、3)合成にコストがかかるフレットを共通配列とすることで、SNPごとのプローブ設定費用が安価で済む。
【0006】
タックマンPCR法、モレキュラービーコン法、プライマーエクステンション法、アレル特異的競合PCR法などは、PCRを基本とした手法である。
【0007】
PCRを用いた多型検出法としては、他にもPCR−RFLP(Restriction Fragment Length Polymorphism;制限酵素断片長多型)法などが挙げられる。
【0008】
PCR−RFLP法においては、電気泳動によって多型を検出する。この方法は、PCR産物の中に遺伝子変異部を認識する制限酵素が存在する場合、共通配列部位にプライマーを設定し、その内側、すなわちPCR産物内に多型性を持たせて増幅する。PCR増幅産物を上記制限酵素で切断し、得られた断片を電気泳動により展開し、断片の長さに基づいて多型の有無を判定する。
【0009】
PCRを用いた多型検出法としては、さらにシーケノムによって報告されたマスアレイ(MASSARAY)システム(特表2002−507883号公報参照)なども挙げられる。
【0010】
マトリックス介助レーザー脱離イオン化−飛行時間型マススペクトロメトリー(MALDI−TOF MS)は、一般的にタンパク質を対象に用いられることが多く、DNAへの適用は少ないが、マスアレイシステムは、MALDI−TOF MSも利用するSNP解析法である。マスアレイシステムにおいては、ダイデオキシヌクレオチドとデオキシヌクレオチドとの混合反応を用いた一塩基伸長により、質量数の異なるオリゴヌクレオチドを生成し、生成したオリゴヌクレオチドをMALDI−TOF MSで検出することでSNPの判別を行う。
【0011】
特開2002−171992号公報においては、ダブルフラップ構造を形成するフラップ含有プローブの5´末端を担体に固定化し、ダブルフラップ構造形成に関与しない別のプローブと前記フラップとを、前記担体上でアニールさせ、前記別のプローブを鋳型としてポリメラーゼ反応により多型を検出する方法が記載されている。
【0012】
また、特開2001−103999号公報においては、検出すべき特定の核酸配列に対するプローブを、そのプローブが有する標識やフラッグ配列が検出すべき特定の核酸ごとに異なるように設計し、特定の核酸配列を検出する方法が記載されている。
【0013】
【非特許文献1】カーク・BW(Kirk BW)、ファインソード・M(Feinsod M)、ファビス・R(Favis R)、クリーマン・RM(Kliman RM)、及びバーラーニ・F(Barany F)、複雑な疾患との長期関連性を探求する一塩基多型(Single nucleotide polymorphism seeking long term association with complex disease)、「ヌクレイック・アシッズ・リサーチ(Nucleic Acids Research)」、第30巻、第15号、p.3295−3311、2002年8月1日
【非特許文献2】ハリントン・JJ(Harrington JJ)及びリーバー・MR(Lieber MR)、FEN−1結合に必要なDNA構造要素(DNA structural elements required for FEN-1 binding)、「ジャーナル・オブ・バイオロジカル・ケミストリー(Journal of Biological Chemistry)」、第270巻、第9号、p.4503−4508、第5.B図、1995年3月3日
【特許文献1】特表2002−515737号公報
【特許文献2】特表2002−507883号公報
【特許文献3】特開2002−171992号公報
【特許文献4】特開2001−103999号公報
【発明の開示】
【発明が解決しようとする課題】
【0014】
従来の方法では、例えば以下のような問題点がある。
RFLP法では、以下に述べるように、検出サイトの自由度の低さ、操作の煩雑さ、誤認識の危険性などの問題がある。
【0015】
すなわち、電気泳動を用いたタイピング法のうち、PCR−RFLP法が利用できるのは、PCR産物の中に遺伝子変異部を認識する制限酵素が存在する場合に限られており、また制限酵素サイトが都合よく調べたい場所にあるとは限らない。このため、検出サイトの自由度が低い。
【0016】
また、PCRの増幅産物や、制限酵素で切断された増幅産物の長さが短い場合には、アクリルアミド電気泳動や高濃度のアガロースゲルなどで電気泳動を行うため、操作が煩雑である。或いは、予めプライマーの末端を蛍光でラベル化し、蛍光シーケンサーなどで検出する必要があるため、高額な機器が必要となる。
【0017】
RFLP法では、制限酵素サイトの有無で判定を行うため、仮に、制限酵素認識配列があるにもかかわらず酵素反応が進まなかった場合は、認識配列が無かった(すなわち変異が無かった)と判定される危険性がある。さらに、制限酵素による切断断片のパターンによって判断を行うため、切れ残りがミスジャッジを引き起こす問題を常にはらんでいる。
【0018】
プライマーエクステンション法は、通常、伸長反応時のddNTPとdNTPの取り込みの違いにより、一塩基程度の長さを判別しなければならない。このため、検出器の分解能に高い性能が備わっていないと判別を行うことができない。
【0019】
タックマンPCR法、モレキュラービーコン法は、個別の特許が成立しており、実際の試験では、権利にかかわるコストが問題になる。
【0020】
アレル特異的競合PCR法では、判定は、各アレルに対する、PCR反応時のプライマーの認識のみに依存している。このため、PCR反応の早い時期に間違いを起こした場合には、非特異反応として検出されてしまう。
【0021】
その他、PCR反応を基本とした手法の一般的な問題点としては、以下が挙げられる。
例えばプライマーエクステンション法や競合PCR法などにおいて、PCRで遺伝子変異部位を含む領域を増幅した後、別のプライマーで反応を行う場合、最初の増幅に用いたプライマーやdNTPを予め除く必要がある。特に、プライマーエクステンション法の場合は、ダイデオキシで伸長を止めるため、完全にdNTPを除く必要がある。そして、必ずPCR産物の精製工程を要する。マスアレイシステムにおいても最初に核酸増幅が行われるが、やはり最初の増幅に用いたプライマーやdNTPは予め除く必要がある。
このため、操作が煩雑であり、反応のコストも高かった。
【0022】
マスアレイシステムをはじめ、MALDI−TOF MSを用いた手法の一般的な問題点としては、以下が挙げられる。例えば、プローブの配列により、イオン化の際に分解が起こり、ピークの検出が難しい場合がある。また、一塩基の差(約300−400Da)を比較するため、質量分析装置について精度の高い調整が必要であり、未反応のオリゴヌクレオチドプローブとの区別がつけにくい場合がある。
【0023】
従来のインベーダー法には、以下の問題点がある。
インベーダー法では、特定のアレルに反応して、切断され遊離したDNA断片をFRETカセットにて検出する。すなわち、インベーダー法では、検出用にFRETのカセットを用意しなければ検出を行うことができない。このように、インベーダー法では検出器の汎用性に関する問題がある。
そして、インベーダー法の検出の手段は蛍光検出法のみに限られ、他の方法によって検出を行うことはできない。
【0024】
<1>そこで本発明の目的は、検出サイトの自由度が高く、誤認識の危険性が著しく少なく、かつ簡便な操作によって遺伝子多型を検出する方法を提供することにある。
<2>また、本発明の目的は、簡便な操作によるものでありながら感度良く遺伝子多型を検出する方法を提供することにある。
<3>さらに、本発明の目的は、検出機器の汎用性が高い遺伝子多型検出法を提供することにある。
【0025】
本発明は、以下の発明を含む。
下記(1)においては、特定の核酸、捕捉可能なタグを有する第1オリゴヌクレオチド、及び第2オリゴヌクレオチドがダブルフラップ構造を形成し、フラップエンドヌクレアーゼが当該構造を認識するとともに核酸断片(本明細書ではフラップ断片と記載することがある)を遊離させ、前記捕捉可能なタグの捕捉と前記遊離した核酸断片の検出とを行うことを記載する。
【0026】
(1)
(i)特定の配列として、第1領域、第2領域及び第3領域からなる配列であって、前記第1領域は前記第2領域に隣接した下流に位置し、前記第2領域は検出すべき多型の塩基から構成され且つ前記第3領域に隣接した下流に位置する特定の配列を有する、試料中の特定の核酸に、
第1オリゴヌクレオチドとして、前記第3領域に相補的な配列、前記第2領域に相補的な配列、前記特定の配列と相補性のないフラップ配列、及び前記第3領域に相補的な配列において捕捉可能なタグを有するオリゴヌクレオチドであって、前記第3領域に相補的な配列は前記第2領域に相補的な配列に隣接した下流に位置し、前記第2領域に相補的な配列は前記フラップ配列に隣接した下流に位置するオリゴヌクレオチドと、
第2オリゴヌクレオチドとして、前記第1領域に相補的な配列、及び任意の配列を有するオリゴヌクレオチドであって、前記任意の配列は前記第1領域に相補的な配列に隣接した下流に位置するオリゴヌクレオチドとを、ハイブリダイズさせることによって、3本鎖構造体を形成させる工程と、
(ii)前記3本鎖構造体の3重鎖部分をフラップエンドヌクレアーゼに認識させることにより前記フラップ配列を含む核酸断片を遊離させる工程と、
(iii)前記捕捉可能なタグを捕捉する手段を用いることによって、前記遊離した核酸断片を精製する工程と、
(iv)前記遊離した核酸断片を検出することによって前記多型を検出する工程とを含む、遺伝子多型検出法。
【0027】
(2)
前記第1オリゴヌクレオチドが有する前記タグは、前記第1オリゴヌクレオチドの3´末端に位置する、(1)に記載の遺伝子多型検出法。
【0028】
(3)
さらに前記第2オリゴヌクレオチドが捕捉可能なタグを有する、(1)又は(2)に記載の遺伝子多型検出法。
【0029】
(4)
前記捕捉可能なタグは、ビオチンタグ、ヒスチジンタグ、ストレプトアビジンタグ、FLAGタグ、GSTタグ、MBPタグからなる群から選ばれる、(1)〜(3)のいずれかに記載の遺伝子多型検出法。
【0030】
下記(5)〜(10)は、前記核酸断片(フラップ断片)を、電気泳動を用いて検出する形態に向けられる。
【0031】
(5)
前記工程(iv)において、前記核酸断片を、電気泳動装置を用いて検出する、(1)〜(4)のいずれかに記載の遺伝子多型検出法。
【0032】
下記(6)〜(10)は、前記核酸断片(フラップ断片)を、電気泳動を用いて検出する形態における、フラップ配列の設計に関する。
【0033】
(6)
前記工程(i)において、前記第1オリゴヌクレオチドとして、前記多型のアレルのそれぞれに応じて異なる前記フラップ配列を有するように設計されたオリゴヌクレオチドを用いる、(5)に記載の遺伝子多型検出法。
【0034】
(7)
前記試料中に検出すべき多型部位が複数箇所存在し、前記工程(i)において、前記第1オリゴヌクレオチドとして、前記複数の検出すべき多型のそれぞれに応じて異なる前記フラップ配列を有するように設計されたオリゴヌクレオチドを用いる、(5)又は(6)に記載の遺伝子多型検出法。
【0035】
(8)
前記異なるフラップ配列はそれぞれ互いに長さにおいて異なる、(6)又は(7)に記載の遺伝子多型検出法。
【0036】
(9)
前記工程(i)において、前記第1オリゴヌクレオチドとして、前記フラップ配列において蛍光物質をさらに有するオリゴヌクレオチドを用い、
前記工程(iv)において、前記蛍光物質に基づいて前記遊離した核酸断片を検出する、(5)〜(8)のいずれかに記載の遺伝子多型検出法。
【0037】
(10)
前記蛍光物質は、前記第1オリゴヌクレオチドの5´末端に位置する、(9)に記載の遺伝子多型検出法。
【0038】
下記(11)〜(15)は、前記核酸断片(フラップ断片)を、質量分析によって検出する形態に向けられる。
【0039】
(11)
前記工程(iv)において、前記核酸断片を、質量分析装置を用いて検出する、(1)〜(4)のいずれかに記載の遺伝子多型検出法。
【0040】
下記(12)は、前記核酸断片(フラップ断片)を、質量分析によって検出する形態における、質量分析装置の具体例に関する。
(12)
前記質量分析装置がマトリックス介助レーザー脱離イオン化(MALDI)/飛行時間型(TOF)マススペクトロメトリーである、(11)に記載の遺伝子多型検出法。
【0041】
下記(13)〜(15)は、前記核酸断片(フラップ断片)を、質量分析によって検出する形態における、フラップ配列の設計に関する。
【0042】
(13)
前記工程(i)において、前記第1オリゴヌクレオチドとして、前記多型のアレルのそれぞれに応じて異なる前記フラップ配列を有するように設計されたオリゴヌクレオチドを用いる、(11)又は(12)に記載の遺伝子多型検出法。
【0043】
(14)
前記試料中に検出すべき多型部位が複数箇所存在し、前記工程(i)において、前記第1オリゴヌクレオチドとして、前記複数の検出すべき多型部位のそれぞれに応じて異なる前記フラップ配列を有するように設計されたオリゴヌクレオチドを用いる、(11)〜(13)のいずれかに記載の遺伝子多型検出法。
【0044】
(15)
前記異なるフラップ配列は、それぞれ互いに長さにおいて異なる、(13)又は(14)に記載の遺伝子多型検出法。
【0045】
下記(16)〜(20)は、第3オリゴヌクレオチドをさらに用い、前記核酸断片(フラップ断片)が第3オリゴヌクレオチドにハイブリダイズして生じる2本鎖構造を検出することによって前記核酸断片(フラップ断片)を検出する形態に向けられる。
【0046】
(16)
前記工程(iv)において、第3オリゴヌクレオチドとして、前記フラップ配列と相補的な配列を有するオリゴヌクレオチドを用い、前記第3オリゴヌクレオチドと前記遊離した核酸断片とをハイブリダイズさせることによって形成する2本鎖構造を検出することによって前記遊離した核酸断片を検出する、(1)〜(4)のいずれかに記載の遺伝子多型検出法。
【0047】
下記(17)〜(20)は、第3オリゴヌクレオチドを用いる形態において、核酸断片と第3オリゴヌクレオチドとのハイブリダイズの際に蛍光共鳴エネルギー移動を生じさせることによって、前記2本鎖構造を検出する場合について記載する。前記ハイブリダイズの際に核酸断片と第3オリゴヌクレオチドとの間で蛍光共鳴エネルギー移動が可能となるように、第1オリゴヌクレオチド及び第3オリゴヌクレオチドには、予め蛍光エネルギー供与体や蛍光エネルギー受容体が設けられている。
【0048】
(17)
前記工程(i)において、第1オリゴヌクレオチドとして、前記フラップ配列において蛍光エネルギー供与体又は蛍光エネルギー受容体をさらに有するオリゴヌクレオチドを用い、
前記工程(iv)において、
前記第1オリゴヌクレオチドにおける前記フラップ配列が蛍光エネルギー供与体を有する場合、第3オリゴヌクレオチドとして、蛍光エネルギー受容体をさらに有するオリゴヌクレオチドと、前記遊離した核酸断片とをハイブリダイズさせることによって2本鎖構造を形成させるか、又は、
前記第1オリゴヌクレオチドにおける前記フラップ配列が蛍光エネルギー受容体を有する場合、第3オリゴヌクレオチドとして、蛍光エネルギー供与体をさらに有するオリゴヌクレオチドと、前記遊離した核酸断片とをハイブリダイズさせることによって2本鎖構造を形成させ、
前記2本鎖構造において、前記蛍光エネルギー供与体と前記蛍光エネルギー受容体とが近接することにより発せられる蛍光に基づいて、前記2本鎖構造を検出する、(16)に記載の遺伝子多型検出方法。
【0049】
下記(18)は、蛍光共鳴エネルギー移動を利用して第3オリゴヌクレオチドを検出する場合の、蛍光エネルギー供与体及び蛍光エネルギー受容体の、オリゴヌクレオチドにおける位置に関する。
【0050】
(18)
前記第1オリゴヌクレオチドにおける前記フラップ配列が蛍光エネルギー供与体を有する場合、前記蛍光エネルギー供与体は前記フラップ配列の5´末端に位置し、前記蛍光エネルギー受容体は前記第3オリゴヌクレオチドの3´末端に位置し、
前記第1オリゴヌクレオチドにおける前記フラップ配列が蛍光エネルギー受容体を有する場合、前記蛍光エネルギー受容体は前記フラップ配列の5´末端に位置し、前記蛍光エネルギー供与体は前記第3オリゴヌクレオチドの3´末端に位置する、(17)に記載の遺伝子多型検出方法。
【0051】
下記(19)は、蛍光共鳴エネルギー移動を利用して第3オリゴヌクレオチドを検出する場合の、蛍光の検出方法に関する。
(19)
前記蛍光エネルギー供与体又は前記蛍光エネルギー受容体の蛍光の変化を測定することによって、前記多型を検出する、(17)又は(18)に記載の遺伝子多型検出方法。
特に、上記(19)において蛍光エネルギー供与体側の蛍光の経時変化を測定する場合は、蛍光強度が下降していくことを確認することで、容易に検出することができる。
【0052】
下記(20)は、蛍光共鳴エネルギー移動を利用して第3オリゴヌクレオチドを検出する場合の、アレル及び/又は多型部位に対応したオリゴヌクレオチドの設計に関する。
(20)
前記第1オリゴヌクレオチド及び前記第3オリゴヌクレオチドが、前記蛍光エネルギー供与体と前記蛍光エネルギー受容体との組み合わせが前記多型のアレルのそれぞれに応じて異なるように設計されている、(17)〜(19)のいずれかに記載の遺伝子多型検出方法。
【発明の効果】
【0053】
本発明は、以下の効果を奏する。
<1>本発明によると、検出サイトの自由度が高く、誤認識の危険性が著しく少なく、かつ簡便な操作によって遺伝子多型を検出する方法を提供することができる。
【0054】
すなわち、本発明は、インベーダー反応のように検出サイトについて高い自由度を有する。このため、例えば従来の電気泳動法を用いた遺伝子多型検出法に比べ、検出できる多型部位の数が飛躍的に大きくなる。
【0055】
そして、本発明では、酵素反応(すなわちフラップエンドヌクレアーゼによる反応)が起こらなかった場合には、フラップ配列を有するオリゴヌクレオチドプローブ(すなわち本発明における第1オリゴヌクレオチド)のバンド又はピークが残り、いずれのアレルについてもフラップ断片のバンド又はピークが検出されない。このため、例えば従来の制限酵素反応によるPCR−RFLP法を用いた遺伝子多型検出法に比べ、誤認識の危険性が極めて低い。
【0056】
また、本発明は、検出のための装置として、既存のもの(例えば既存の電気泳動装置、既存の質量分析装置、既存の蛍光検出装置などの汎用性の高い装置)を用いることができる。このため、例えば従来のインベーダー法を用いた遺伝子多型検出法に比べ、簡便且つ安価に遺伝子多型検出を行うことができる。
【0057】
<2>本発明によると、簡便な操作によるものでありながら感度良く遺伝子多型を検出する方法を提供することができる。
すなわち、本発明は、オリゴヌクレオチドプローブのフラップ配列を、例えば長さにおいて任意に設定することができる。このように、各アレルに対応した2種類のオリゴヌクレオチドプローブ間において、フラップ配列を、長さにおいて任意に設定することにより、検出される各アレルに対応したフラップ断片の判別を容易にすることができる。さらに、オリゴヌクレオチドプローブのフラップ配列を、例えばPoly-Tなどのように、イオン化の条件下においても分解を受けにくい配列とすることができるため、ピークの検出を常に容易にすることができる。従って、感度のよい検出を容易に行うことができる。しかも、質量分析装置に特別な精度を求めることなく、このような感度の良い検出を行うことができる。
【0058】
<3>本発明によると、検出機器の汎用性が高い遺伝子多型検出法を提供することができる。
本発明では、検出のための方法として、電気泳動法、質量分析法、蛍光検出法などの方法を適用することが可能である。それだけでなく、いずれの検出法を用いても精度良く検出を行うことが可能である。
すなわち、本発明では、検出機器として、電気泳動法、質量分析法、蛍光検出法などの検出法におけるものを用いることが可能である。このため、本発明で使用できる検出機器の汎用性が高い。それだけでなく、これらの機器としては特別なものを用意する必要がなく、すでに述べたように、既存のものを用いることが可能である。この点からも、本発明で使用できる検出機器の汎用性は非常に高い。
【0059】
例えば、従来のインベーダー法による多型検出法では、検出用にFRETのカセットを別に用意しなければならなかったが、本発明では、蛍光共鳴エネルギー移動法を用いて検出を行う場合であっても、そのようなFRETのカセットを用意する必要はない。
【0060】
本発明は、特定の形態においてさらに以下の効果を奏する。
【0061】
例えば、従来のインベーダー法による多型検出法では、検出機器の汎用性に関して更なる問題がある。すなわち、通常、励起と蛍光との適正なスペクトルは、それぞれの物質にあわせて決まっており、蛍光共鳴エネルギー移動などのように、励起と蛍光との組み合わせが変わる場合、リアルタイムサイクラーや蛍光検出器では対応できない場合も多い。特に安価な機器では、予めこの組み合わせが決まっており、変更も出来ない。しかしながら本発明において蛍光共鳴エネルギー移動法を用いて検出を行う場合、励起波長と蛍光波長との双方を特に変えることなく、単一の蛍光物質(例えば蛍光供与体側)の蛍光に合わせた測定を行うだけで、検出が可能になる。
【0062】
さらに例えば、従来のインベーダー法では、クリベースを含む専用のキットに加えて蛍光検出用のプレートリーダが必要になる。そして、遊離した蛍光物質を測定するため、蛍光の拡散が起こり、クローズドなウェル内でしか測定が出来ない。
しかしながら本発明において蛍光共鳴エネルギー移動法を用いて検出を行う場合、蛍光物質が遊離することが無いので、第3オリゴヌクレオチド(例えば蛍光受容体が付与されたオリゴヌクレオチド)を固定化しておくことで、開放系での検出が可能になる。このため、例えば従来のインベーダー法に比べ、簡便且つ検出器の汎用性の高い遺伝子多型検出を行うことができる。
【0063】
本発明においては、検出のための装置として電気泳動装置や質量分析装置を用いる場合に、オリゴヌクレオチドプローブに対して高価な標識が必要なくなるため、例えば従来のインベーダー法を用いた遺伝子多型検出法に比べ、安価に遺伝子多型検出を行うことができる。
【0064】
本発明においては、予め検出すべき多型を含む領域をPCR増幅する場合であっても、増幅後に再度伸長反応を行うことがないため、余剰のプライマーやdNTPを除去する必要がない。このため、例えば従来のPCR反応を基本とした遺伝子多型検出法に比べ、簡便に遺伝子多型検出を行うことができる。
【発明を実施するための最良の形態】
【0065】
本発明は、検出すべき多型を有する特定の核酸を鋳型核酸とし、鋳型核酸に対し、フラップ配列と捕捉可能なタグを有する第1オリゴヌクレオチドと、第2オリゴヌクレオチドとをハイブリダイズさせることにより、3本鎖構造体を形成し、フラップエンドヌクレアーゼによってフラップ配列を含む核酸断片を遊離し、捕捉可能なタグを捕捉する一方で遊離した核酸断片を検出することにより、多型を検出する方法である。鋳型核酸は、予め増幅されても良い。遊離した核酸断片の検出は、例えば、電気泳動法、質量分析法、及び蛍光共鳴エネルギー移動法などを用いて行うことができる。
【0066】
[1.検出の対象]
[1−1.遺伝子の種類]
本発明における検出の対象としては、特に限定されないが、例えば、cDNA、ヒトを含む様々な生物のゲノミック遺伝子、ウイルス及び細菌を含む様々な微生物の遺伝子などが挙げられる。従って、これら核酸の配列を有するものを鋳型核酸とすることができる。また、これら検出対象となる遺伝子としては、DNAの遺伝子及びRNAの遺伝子を問わない。
【0067】
[1−2.試料]
鋳型核酸を含む試料としても特に限定されない。すなわち、生体試料、生体由来試料、抽出核酸試料などに対して多型検出を行うことができる。ここで、生体試料や生体由来試料は、核酸の抽出操作を行わず、核酸包含体(例えば細胞、真菌、細菌、ウイルスなど、核酸を内部に含有する膜構造体)を維持した形態の試料である。生体試料の例としては、臓器、組織、体液、排泄物などが挙げられる。体液には、血液試料、髄液、唾液、乳等が含まれる。血液試料には、全血、血漿、血清等が含まれる。排泄物には、尿、便などが含まれる。生体由来試料は、生体試料から核酸包含体を回収した試料をいう。核酸包含体の回収方法としては特に限定されないが、遠心・超遠心操作、ポリエチレングリコールなどの共沈剤、吸着担体などを用いた方法が挙げられる。抽出核酸試料は、核酸の抽出操作を行った試料であり、抽出後さらに核酸を精製した試料であっても良い。抽出方法としては、酵素、界面活性剤、カオトロピック剤などを用いた方法が挙げられ、精製方法としては、フェノール/クロロホルム、イオン交換樹脂、ガラスフィルター、ガラスビーズ、磁気ビーズ、タンパク凝集作用を有する試薬などを用いた方法が挙げられる。
【0068】
[1−3.多型]
本発明で検出できる多型は特に限定されず、いわゆる単一ヌクレオチド多型(1塩基多型:single nucleotide polymorphism:SNP)及び複数ヌクレオチドからなる配列にわたる多型の両方を含む。本発明においては、多型にはさらに変異も含むものとする。具体的には、本発明で検出できる多型の例としては、一塩基多型、挿入多型、欠失多型などが挙げられる。
【0069】
[2.3本鎖構造体]
本発明の3本鎖構造体の例を、図1(a)及び(b)に示す。
[2−1.鋳型核酸の構成]
本発明において、特定の核酸である鋳型核酸は、第1領域、第2領域及び第3領域から構成される特定の配列を含む。第1領域は第2領域に隣接した下流に位置し、第2領域は第3領域に隣接した下流に位置する。このうち第2領域が、検出すべき多型の塩基から構成される領域である。
【0070】
[2−2.第1オリゴヌクレオチドの構成]
第1オリゴヌクレオチドは、フラップ配列と、捕捉可能なタグと、第2領域から第3領域に特異的な配列とを有するオリゴヌクレオチドである。フラップ配列は、特定の配列と相補性のない配列(具体的には、第1領域に相補性のない配列)である。すなわち第1オリゴヌクレオチドは、第3領域に相補的な配列、第2領域に相補的な配列、及び特定の配列と相補性のないフラップ配列を有する。そして、第3領域に相補的な配列は第2領域に相補的な配列に隣接した下流に位置し、第2領域に相補的な配列はフラップ配列に隣接した下流に位置する。さらに、第1オリゴヌクレオチドは、第3領域に相補的な配列に隣接する上流に、鋳型核酸と相補性のない配列(具体的には、鋳型核酸における、特定の配列に隣接する下流の配列と相補性のない配列)を有していても良い。
【0071】
[2−2−1.捕捉可能なタグ]
捕捉可能なタグとしては特に限定されるものではなく、特定の物質と特異的に結合することによって自身が捕捉され得るものであればよい。例えば、ビオチンタグ、ヒスチジンタグ、ストレプトアビジンタグ、FLAGタグ、GSTタグ、MBPタグからなる群から選択することができる。
タグの位置としては、第1オリゴヌクレオチドにおける、鋳型核酸の第3領域に相補的な領域であればよい。フラップエンドヌクレアーゼによる反応の際の立体的要因を考慮し、第3領域に相補的な領域の、より3’末端側に近い位置が好ましい。特に、第1オリゴヌクレオチドの3’末端にタグが位置していることが好ましい。
【0072】
また、捕捉可能なタグは、第1オリゴヌクレオチドに加えて、第2オリゴヌクレオチドに付されていても良い。この場合については、後述の2−3.第2オリゴヌクレオチドの構成において述べる。
【0073】
[2−2−2.蛍光物質を有する場合のフラップ配列]
蛍光共鳴エネルギー移動法を用いた検出を行う場合(後述6C.)や、電気泳動法において蛍光検出による検出を行う場合(後述6A−3−1.)、第1オリゴヌクレオチドのフラップ配列は蛍光物質を有する。フラップ配列における蛍光物質の位置は特に限定されないが、蛍光物質は、フラップ配列の5´末端に設けることができる。
【0074】
蛍光共鳴エネルギー移動法を用いた検出を行う場合(後述6C.)、第1オリゴヌクレオチドのフラップ配列は、蛍光エネルギー供与体又は蛍光エネルギー受容体を有する。図1(b)は、蛍光エネルギー供与体“d”が第1オリゴヌクレオチドの5´末端に位置した第1オリゴヌクレオチドを用いた場合の3本鎖構造体の例を模式的に示したものである。
【0075】
蛍光エネルギー供与体は、サイバーゴールド、サイバーグリーンI、FAM、フルオレセイン(FITC)系発色団などから選ぶことができる。また、蛍光エネルギー受容体は、Cy5、ローダミン、TAMRA、Red640、Red705、及びROXなどから選ぶことができる。
【0076】
電気泳動法において蛍光検出による検出を行う場合(後述6A−3−1.)の、第1オリゴヌクレオチドにおける蛍光物質としては、FITC系発色団、6−FAM、HEX、TET、TAMRA、テキサスレッド、Cy3、Cy5、ローダミンなどから選ぶことができる。これらの蛍光物質は、電気泳動による検出の際に使用される、フラップ断片検出用標識と特異的に結合するものである。
【0077】
[2−3.第2オリゴヌクレオチドの構成]
第2オリゴヌクレオチドは、第1領域に特異的なオリゴヌクレオチドである。第2オリゴヌクレオチドは、第1領域に相補的な配列、及び、任意の配列を有する。そして、任意の配列は、第1領域に相補的な配列に隣接した下流に位置する。さらに、第2オリゴヌクレオチドは、第1領域に相補的な配列に隣接する下流に、鋳型核酸と相補性のない配列(具体的には、鋳型核酸における、特定の配列に隣接する上流の配列と相補性のない配列)を有していても良い。
【0078】
また、第2オリゴヌクレオチドは、上述の捕捉可能なタグを有していて良い。この場合、タグの位置としては、第2オリゴヌクレオチドにおける、鋳型核酸の第1領域に相補的な領域であればよい。フラップエンドヌクレアーゼによる反応の際の立体的要因を考慮し、第1領域に相補的な領域の、より5’末端に近い位置が好ましい。特に、第2オリゴヌクレオチドの5’末端にタグが位置していることが好ましい。
【0079】
[2−4.フラップエンドヌクレアーゼ]
フラップエンドヌクレアーゼは、核酸の特殊な構造、すなわち3本鎖構造(ダブルフラップ構造)を認識し、第1オリゴヌクレオチドを切断することによってフラップ配列を含む核酸断片を遊離することができるものであれば特に限定されない。具体的には、鋳型核酸、第1オリゴヌクレオチド及び第2オリゴヌクレオチドが3本鎖構造体を形成したとき、3重鎖部分を認識し、第1オリゴヌクレオチドを切断する酵素であれば良い。例えば、クリベース(cleavase)などのフラップエンドヌクレアーゼや、特開平11−75849号公報に記載されている熱耐性フラップエンドヌクレアーゼが挙げられる。
【0080】
例えば多型がSNPでフラップエンドヌクレアーゼを用いる場合、図2に示すように、3本鎖構造体のSNPの部位の構造がフラップエンドヌクレアーゼによって認識され(図2(a))、SNP部位に対応する塩基の3´側で第1オリゴヌクレオチドが切断され、フラップ配列及びSNP部位に対応する塩基を有する核酸断片(以下、フラップ断片と記載する。)が遊離する(図2(b))。
【0081】
一方、図2のような特殊な3本鎖構造体が形成されなかった場合、図3(a)に示すように、フラップエンドヌクレアーゼはSNPの部位の構造を認識することができない。このため、第1オリゴヌクレオチドの切断が起こらず、フラップ断片は遊離しない。
【0082】
[3.オリゴヌクレオチド設計]
[3−1.第1オリゴヌクレオチドの設計]
第1オリゴヌクレオチドは、通常、試料中の多型部位一箇所つき、多型のアレルそれぞれに応じて設計されている。例えば、第1オリゴヌクレオチドとしては、アレル特異的な2種のオリゴヌクレオチドを用いることができる。そして、これらアレル特異的な第1オリゴヌクレオチドの一方及び/又は他方から生じるフラップ断片が検出工程において識別可能となるように、第1オリゴヌクレオチドそれぞれのフラップ部分を設定することができる。
いずれのアレルが検出されたかの区別が可能となるように、第1オリゴヌクレオチドのそれぞれは、フラップ部分の配列において、アレルに応じて異なるように設計することができる。
【0083】
遺伝子多型検出法においては、試料中の複数の多型部位を検出ターゲットにする場合が多い。この場合、第1オリゴヌクレオチドは、検出すべき複数の多型部位の箇所それぞれに応じて設計されている。例えば、第1オリゴヌクレオチドとしては、アレル特異的な2種の第1オリゴヌクレオチドのセットを、多型部位の種類の数だけ用いることができる。そして、これら多型部位に応じて設計された第1オリゴヌクレオチドから生じるフラップ断片のそれぞれが検出工程において識別可能となるように、第1オリゴヌクレオチドそれぞれのフラップ部分を設定することができる。いずれの部位の多型が検出されたかの区別が可能となるように、第1オリゴヌクレオチドのそれぞれは、フラップ部分の配列において、多型の部位に応じて異なるように設計することができる。
【0084】
フラップ配列が互いに異なる第1オリゴヌクレオチドにおいては、フラップ配列の長さが互いに異なるものが好ましい。例えば、フラップ配列が、単一の塩基から構成され長さにおいてのみ互いに異なるものとすることができる。
【0085】
第1オリゴヌクレオチド及びフラップ配列の長さとしては特に限定されず、当業者が適宜設定することができる。
例えば、電気泳動法や質量分析法を用いて検出を行う場合は、用いる電気泳動装置や質量分析装置の分離能を考慮して設定することができる。より具体的には、一方のアレルに対応するフラップ断片と他方のアレルに対応するフラップ断片とが電気泳動やマススペクトルにおいて判別がつくように、それぞれの長さを設定すると良い。
【0086】
例えば、第1オリゴヌクレオチドを、例えば25〜140merの長さに設定することができる。この設定された長さのうち、フラップ配列を例えば10〜50merの長さに設定することができる。さらに、異なる第1オリゴヌクレオチド間においては、フラップ配列は、互いに1〜20merの長さの差をもって設定すると良い。また、上の設定された長さのうち、第2及び第3領域に相補的な配列は例えば15〜80merの長さに設定することができる。
【0087】
なお、質量分析法によって検出を行う場合は、フラップ配列自体は、質量分析におけるイオン化の条件下において分解を受けにくい配列とすることが好ましい。このような配列としては、例えばTのみからなる配列(poly-T)などが挙げられる。
【0088】
また、異なる第1オリゴヌクレオチド間においては、フラップ配列自体は、Tm値ができるだけそろうように設計されることが好ましい。
【0089】
蛍光共鳴エネルギー移動法によって検出を行う場合は、アレルに応じて、フラップ配列が異なるように設計したり、フラップ配列の蛍光物質が異なるように設計したり、またフラップ配列と蛍光物質の両方とが異なるように設計したりすることができる(後の6C−6.に詳述)。
【0090】
[3−2.第2オリゴヌクレオチドの設計]
第2オリゴヌクレオチドの長さとしては特に限定されないが、例えば15〜60merの長さに設定することができる。この設定された長さのうち、第2オリゴヌクレオチドにおける任意の配列は、例えば多型を構成する配列と同じ長さにすることができる。例えば、SNPを検出する場合、任意の配列は1merとすると良い。上の設定された長さのうち、第1領域に相補的な配列は例えば9〜59merの長さに設定することができる。
【0091】
[4.3本鎖構造体形成及びフラップ断片の遊離]
3本鎖構造体形成及びフラップ断片の遊離を行うためには、以下の操作手順を行うことができる。例えば、検出したい多型を有する鋳型核酸を含む試料を、適当な希釈液と混合し、第1オリゴヌクレオチド、第2オリゴヌクレオチド、及びフラップエンドヌクレアーゼを含む反応液と混合し、以下の条件下で反応を行う。
【0092】
3本鎖構造体の形成及びフラップ断片の遊離のための反応は、例えば以下の条件で行うことができる。用いるフラップエンドヌクレアーゼにもよるが等温で55〜75℃、5分〜18時間の条件下で反応行うことができる。クリベースを用いる場合は、55〜68℃、5分〜18時間で反応を行うことができ、例えば63℃で30分程度の条件で反応を行うと良い。この反応に先立って核酸増幅を行った場合(後述7.)、用いたプライマーなどの試薬類は除去する必要はない。
【0093】
また、この反応の直前に、一本鎖にするための条件に供することが好ましい。このために、試料と反応液との混合物を例えば90℃以上で5分以上保持することができる。
【0094】
[5.タグの捕捉]
第1オリゴヌクレオチド、又は、第1オリゴヌクレオチド及び第2オリゴヌクレオチドが有していたタグは、タグを捕捉する手段によって捕捉される。タグを捕捉する工程は、用いる捕捉手段の形態にもよるが、フラップ断片の検出工程の前であればいつ行っても良い。例えば、タグの捕捉、上記の反応(すなわちタグを捕捉した状態で反応)、及びタグの除去をこの順番で行ってもよいし、上記の反応、タグの捕捉、及びタグの除去をこの順番で行ってもよい。
【0095】
ここで、上記の反応とは、3本鎖構造体を形成する反応と、フラップエンドヌクレアーゼによる認識反応とを含む。タグの捕捉は、捕捉手段と、タグを有する核酸種とを接触させることによって実現される。タグの除去は、捕捉手段を除去することによって実現される。例えば下記の5−2.で述べるような支持体を除去することによって実現されうる。
【0096】
[5−1.捕捉される核酸種]
当該手段によって捕捉することができる核酸種としては、余剰の第1オリゴヌクレオチド(たとえば図5(c)、図6、図7(c)など参照);余剰の第2オリゴヌクレオチド(ただし第2オリゴヌクレオチドがタグを有していた場合);鋳型核酸にハイブリダイズした未反応(すなわちフラップエンドヌクレアーゼによる認識反応が未反応)の第1オリゴヌクレオチド(たとえば図3(c)、図5(c)、図6、図7(c)など参照);鋳型核酸にハイブリダイズした第2オリゴヌクレオチド(ただし第2オリゴヌクレオチドがタグを有していた場合);及び、3重鎖構造体からフラップ断片が遊離した残部(たとえば図2(c)、図5(c)、図6、図7(c)など参照)、が挙げられる。
【0097】
上記の核酸種が捕捉により除去されることによって、フラップ断片が精製される。より具体的には、主としてフラップ断片を含む液(以下、フラップ断片液と記載する)が得られる。フラップ断片液中のその他の成分としては、鋳型核酸、場合により余剰の第2オリゴヌクレオチド、及び場合により鋳型核酸にハイブリダイズした第2オリゴヌクレオチドなどが挙げられる。
【0098】
[5−2.タグを捕捉する手段]
タグを捕捉する手段としては、第1オリゴヌクレオチド、又は、第1オリゴヌクレオチド及び第2オリゴヌクレオチド、が有するタグに応じて、当業者が適宜決定することができる。すなわち、タグを捕捉する手段としては、当該タグが特異的に結合することができる物質を含んでいるものであれば特に限定されない。
【0099】
タグが特異的に結合することができる物質としては、例えば、ビオチンタグに対してはアビジン、ヒスチジンタグに対してはニッケル、ストレプトアビジンタグに対してはビオチン、FLAGタグに対しては抗FLAG抗体、GSTタグに対してはグルタチオン、及びMBPタグに対してはマルトースが挙げられる。
【0100】
タグを捕捉する手段は、タグが特異的に結合することができる物質が、適当な支持体或いは担体に結合した形態で提供されうる。このような支持体或いは担体の材質及び形状も、当業者が適宜決定することができる。例えば、レジン、ガラスなどの材質の支持体、又は磁性体を含む材質の支持体(磁性ビーズとして提供されることが多い)が、カラム、ビーズ、チップ、その他さまざまな形状で提供されうる。
【0101】
[5−3.操作方法の例]
具体的な操作方法の例としては、チューブ等の容器に、鋳型核酸、必要な核酸種、及びフラップエンドヌクレアーゼなどを入れて反応させて得られた反応液に、捕捉手段(ここでは例としてビーズ状のものを用いたとする)を入れ、混合し、タグを捕捉する。そして、限外ろ過や遠心分離などの手法を用いてタグを捕捉したビーズを除去する。これにより、フラップ断片が精製される。
【0102】
具体的な操作方法の他の例としては、チューブ等の容器に、鋳型核酸、必要な核酸種、及びフラップエンドヌクレアーゼなどを入れて反応させて得られた反応液に、捕捉手段(ここでは例として磁性ビーズを用いたとする)を入れ、混合し、タグを捕捉する。そして、磁気ビーズ分離用スタンドを用いて磁場をかけることによって、フラップ断片液を溶出させる。
【0103】
[5−4.タグの捕捉を行うことの利点]
タグの捕捉を行うことによって、検出に不要な核酸種の大部分の除去、或いはそれに加えて、検出することができる核酸種をフラップ断片のみに絞り込むことが可能になる。
[5−4−1.電気泳動法によって検出を行う場合]
フラップ断片を電気泳動法によって検出する場合(後の6A.に詳述)においては、バックグラウンドが非常に少ないといえる。仮にタグの捕捉を行わない場合でも、フラップ断片自体の検出は可能である。しかしながら、タグの捕捉を行わない場合は、フラップ断片とともに、検出に不要な核酸種も検出されうる。本発明のようにタグの捕捉を行うと、例えば図5(c)に示すように、当該検出に不要な核酸種の中から、大部分の核酸種(すなわち上記捕捉することができる核酸種)を除去することが可能になる。このため、フラップ断片を非常に感度高く検出することが可能になる。このように、データの精度が良いという利点がある。
【0104】
フラップ断片を、電気泳動法によって検出する場合であって、さらに、第1オリゴヌクレオチドとして蛍光物質が付されたフラップ配列を有する場合(後述6A−3−1.)、タグの捕捉によって、蛍光を有する核酸種をフラップ断片のみに絞り込むことができる。具体的には、図5において、蛍光物質を有する第1オリゴヌクレオチドを用いた場合に相当する。図5において、蛍光物質を有する第1オリゴヌクレオチドを用いた場合の、図5(c)に相当する工程を図6に示す。図6においては、第1オリゴヌクレオチドに付された蛍光物質をFで示している。図6が示すように、蛍光物質を有する核酸種でフラップ断片以外のものは、捕捉手段によって捕捉され、除去される。すなわち、フラップ断片のみを検出することが可能である。このため、フラップ断片をさらに感度良く検出することが可能になる。
【0105】
このようにフラップ断片のみを検出できるため、複数の多型の部位に応じてフラップ断片が異なるように(例えば長さにおいて異なるように)設計された複数の第1オリゴヌクレオチドを用いた場合などに、1回の電気泳動で複数のフラップ断片を区別して検出することが可能である。すなわち、1回の電気泳動で複数の多型検出を同時に行うことが可能である。
【0106】
[5−4−2.質量分析法によって検出を行う場合]
フラップ断片を質量分析法によって検出する場合(後の6B.に詳述)にも、電気泳動法によって検出する場合の利点において述べたことと同様に、バックグラウンドが非常に少ないといえる。仮にタグの捕捉を行わない場合でも、フラップ断片自体の検出は可能である。しかしながら、タグの捕捉を行わない場合は、フラップ断片とともに、検出に不要な核酸種も検出されうる。本発明のようにタグの捕捉を行うと、例えば図5(c)に示すように、当該検出に不要な核酸種の中から、大部分の核酸種(すなわち上記捕捉することができる核酸種)を除去することが可能になる。このため、フラップ断片を非常に感度高く検出することが可能になる。このように、データの精度が良いという利点がある。
【0107】
[5−4−3.蛍光共鳴エネルギー移動法によって検出を行う場合]
フラップ断片を蛍光共鳴エネルギー移動法によって検出する場合(後の6C.に詳述)には、以下の利点がある。
【0108】
ここで、フラップエンドヌクレアーゼの反応後で且つタグの捕捉が行われる前において、第3オリゴヌクレオチドがハイブリダイズしうる核酸種としては、フラップ断片以外に、余剰の第1オリゴヌクレオチド、及び、鋳型核酸にハイブリダイズした未反応(すなわちフラップエンドヌクレアーゼによる認識反応が未反応)の第1オリゴヌクレオチドが挙げられる。
【0109】
仮にタグの捕捉を行わない場合でも、フラップ断片自体の検出は可能である。この場合、第3オリゴヌクレオチドは、上記ハイブリダイズしうる核酸種へ競合してハイブリダイズしうる。すなわち、第3オリゴヌクレオチドは、フラップ断片にハイブリダイズする以外に、余剰の第1オリゴヌクレオチドの一部分としてのフラップ配列や、鋳型核酸にハイブリダイズした未反応の第1オリゴヌクレオチドの一部分としてのフラップ配列、にハイブリダイズすることも可能ではある。しかしながら、余剰の第1オリゴヌクレオチドや未反応の第1オリゴヌクレオチドへのハイブリダイズの速度は、遊離したフラップ断片へのハイブリダイズの場合に比べて非常に遅い。従って、蛍光エネルギー受容体の蛍光が可能な強度に達するためには非常に時間がかかる。このため、フラップ断片自体の検出を行うためには、競合ハイブリダイズの速度差を利用し、第3オリゴヌクレオチドのハイブリダイズをリアルタイムで調べる必要がある。すなわち、最も早い第3オリゴヌクレオチドとフラップ断片とのハイブリダイズに起因して起こる蛍光強度の経時変化を調べる必要がある(後述実験例C)。
【0110】
本発明のようにタグの捕捉を行うと、例えば図7(c)に示すように、上記の第3オリゴヌクレオチドがハイブリダイズしうる核酸種から、フラップ断片以外の核酸種を除去することができる。このため、上記したようなハイブリダイズの競合が防がれ、図7(d)に示すように、検出される蛍光は、第3オリゴヌクレオチドとフラップ断片とのハイブリダイズによる蛍光のみとなる。このため、蛍光強度をリアルタイムで調べる必要がなくなり、したがって検出が非常に簡便になる。
【0111】
[6.多型の検出]
フラップ断片は、検出すべき多型を含んでいる。すなわち、フラップ断片を検出することによって多型を検出することができる。検出法としては特に限定されず、当業者によって適宜決定されてよい。例えば、検出法として、フラップ断片自身を直接検出するための方法を用いてもよいし、他の核酸プローブを用い、フラップ断片と当該核酸プローブとのハイブリダイズによって形成される構造体を検出するための方法を用いても良い。
フラップ断片自身を直接検出するための方法としては、例えば、電気泳動法を用いた検出法(後述6A.)、質量分析法を用いた検出法(後述6B.)などが挙げられる。他の核酸プローブを用いてフラップ断片を検出するための方法としては、蛍光共鳴エネルギー移動法を用いた検出法(後述6C.)、電気化学的方法を用いた検出法(後述6D.)、光化学的方法を用いた検出法(後述6E.)などが挙げられる。
【0112】
[6A.電気泳動法を用いた検出]
電気泳動法を用いた検出法においては、フラップ断片を直接検出することができる。以下、当該検出法についてさらに詳細に説明する。
【0113】
タグの除去を行った後のフラップ断片液は、電気泳動に供される。フラップ断片液は、必要に応じ、希釈用バッファーで適切な濃度に希釈することができる。このような希釈用バッファーとしては、TAEバッファー、TBEバッファー、TPEバッファー、TEバッファーなどが挙げられる。
【0114】
[6A−1.電気泳動装置]
本発明で用いることができる電気泳動装置としては、例えば、スラブゲル電気泳動装置やキャピラリー電気泳動装置が挙げられる。
スラブゲル電気泳動装置を用いる場合は、公知の方法を特に限定することなく用いることができる。好ましくは、分離媒体としてポリアクリルアミドゲルを用いる方法を行う。
【0115】
本発明においては、特に、操作簡便性と分離能との観点から、キャピラリー電気泳動装置を用いることが好ましい。ここで、キャピラリー電気泳動装置には、毛細管を分離流路として用いるキャピラリー電気泳動装置や、マイクロエレクトロメカニカルシステム技術を用いて基板内に微細流路を形成したデバイス(いわゆるマイクロチップ)を用いて、基板内の微細流路を分離流路とするキャピラリー電気泳動装置のいずれも含む。
【0116】
キャピラリー電気泳動装置におけるキャピラリーもしくは基板の材質としては、ガラス、溶融石英、含フッ素炭化水素樹脂製などが挙げられる。分離流路(本明細書においては、単に、キャピラリーと記載することがある)の内径としては、10〜1000μm、好ましくは50〜200μmである。マイクロチップを用いたキャピラリー電気泳動装置としては、MCE−2010(島津製作所製)、SV1210(日立製作所製)、2100バイオアナライザー(アジレント社製)などが挙げられる。
【0117】
キャピラリー電気泳動装置を用いる場合は、適切な容器に切断反応後の試料を入れ、装置にセットする。装置に試料をセットするための容器としては、連結チューブやマイクロタイタープレートなどが挙げられる。連結チューブとしては、8連チューブ、12連チューブなどが挙げられる。チューブの容量としては、0.2mlや0.5ml容量のものが挙げられる。マイクロタイタープレートとしては、96MTP(96ウェルマイクロタイタープレート)、384MTP(384ウェルマイクロタイタープレート)などが挙げられる。
【0118】
キャピラリー電気泳動装置における泳動方式としては、ミセル導電クロマトグラフィー(Micellar electrokinetic capillary chromatography;以下、MECCと記載する)や、キャピラリーゲル電気泳動(Capillary Gel Electrophoresis;以下、CGEと記載する)が挙げられる。MECCでは、キャピラリー内に臨界ミセル濃度以上にイオン性界面活性剤を含んだ泳動用緩衝液を満たして、核酸種の分離を行う。核酸種の分離においては、イオン性界面活性剤として、硫酸ドデシルナトリウムを使用することが好ましい。CGEは、キャピラリー内にポリアクリルアミドやアガロースなどのゲルと泳動液とを満たし、ゲルによる分子ふるい効果を利用して試料に含まれる核酸種の各成分イオンの分離を行う。CGEには、キャピラリーに、ゲルではなく非架橋のポリアクリルアミド、デキストラン、セルロース誘導体などの親水性高分子が溶解した電解液を満たして、CGEと同様に分子ふるい効果を利用して核酸種の各成分イオンの分離を行うキャピラリー電気泳動も含まれる。比較的低分子の核酸種の分離を行う際には、分離媒体として、ヒドロキシエチルセルロース、高濃度(例えば8〜15w/w%)トリス-ホウ酸-EDTA系のポリアクリルアミドゲル、濃度勾配(例えば、2〜8w/w%の勾配)トリス-ホウ酸-EDTA系のポリアクリルアミドゲル、POP−7ポリマー(アプライドバイオシステムズ社製)や、Long Ranger(宝酒造社製)などを用いることができる。
【0119】
[6A−2.電気泳動測定条件]
本発明では、第1オリゴヌクレオチドにおけるフラップ配列を任意に設定することができるため、電気泳動の条件としては、フラップ断片液に含まれる核酸種(すなわち、鋳型核酸、フラップ断片、及び場合により第2オリゴヌクレオチド)が、互いに識別可能に分離されるほどの分解能でもって分離できる条件であれば、特に限定されない。
【0120】
[6A−3.蛍光検出法を用いた場合]
[6A−3−1.蛍光物質を有しない第1オリゴヌクレオチドを用いた場合]
電気泳動において展開したフラップ断片液中の核酸種の検出には、蛍光検出法を用いることができる。蛍光検出法の具体的方法としては、公知の方法を特に限定することなく用いることができる。検出のために用いられる試薬としては、トラッキングダイやインターカレイターなどが挙げられる。トラッキングダイは、グリセロールやスクロースなどの、比重を大きくするための添加物など混合されたローディングバッファとして使用される。トラッキングダイの具体例としては、キシレンシアノールやブロモフェノールブルー、オレンジII、オレンジGなどから少なくとも1種が選ばれる。インターカレイターとしては、蛍光やUVで検出可能な、核酸種の2本鎖にインターカレイトして蛍光を発する物質であれば特に限定されることなく、例えば、エチジウムブロマイド、アクリジンオレンジ、サイバーグリーン、サイバーゴールドなどが挙げられる。これらインターカレイターは、例えば、分離媒体に含ませて使用することができる。
【0121】
[6A−3−2.蛍光物質を有する第1オリゴヌクレオチドを用いた場合]
すでに2−2−2.において述べたように、第1オリゴヌクレオチドとしてフラップ配列に蛍光物質を有するものを用いることができる。この場合は、上記の6A−3−1.とは異なる手法でフラップ断片の検出が可能である。
【0122】
フラップ断片の検出には、第1オリゴヌクレオチドのフラップ配列が有していた蛍光標識に特異的に結合するフラップ断片検出用標識を用いることができる。
このようなフラップ断片検出用標識の具体例としては、サイバーグリーンI、エチジウムブロマイド、アクリジンオレンジ、チアゾールオレンジ、オキサゾールイエロー、ローダミンなどが挙げられる。これら列挙した標識は、2本鎖にインターカレイトするものの例である。
【0123】
フラップ断片液中で、この方法において検出される核酸種は、蛍光物質を有するフラップ断片のみである(図6)。したがって、すでに5−3−1.において述べたように、複数の多型の部位に応じてフラップ断片が異なるように(例えば長さにおいて異なるように)設計された複数の第1オリゴヌクレオチドを用いた場合などに、1回の電気泳動で複数のフラップ断片を区別して検出することが可能である。すなわち、1回の電気泳動で複数の多型検出を同時に行うことが可能である。
【0124】
[6A−4.フラップ断片の検出]
[6A−4−1.メカニズム]
第1オリゴヌクレオチドとして設計したオリゴヌクレオチドにおける、第2領域(すなわち多型塩基)に対応する塩基が、鋳型核酸において想定した多型部位とマッチする場合は、3本鎖構造を形成し(図2(a))、クリベースがこの構造を認識することによって第1オリゴヌクレオチドを切断し、フラップ断片が遊離する(図2(b))。そして、タグを捕捉する手段によって、タグを有する核酸種が除去される(図2(c))。また、余剰の第1オリゴヌクレオチドも存在していれば同様に除去される(図5(c)、図6)。したがって、電気泳動の結果は、第1オリゴヌクレオチドが検出されず、フラップ配列が検出される。
【0125】
反対に、第1オリゴヌクレオチドとして設計したオリゴヌクレオチドにおける、多型塩基に対応する塩基が、鋳型核酸において想定した多型部位とマッチしない場合は、クリベースが認識することができる3本鎖構造が形成されないため、第1オリゴヌクレオチドは切断されず、フラップ断片は遊離しない(図3(a))。そして、タグを捕捉する手段によって、タグを有する核酸種、すなわち、鋳型核酸にハイブリダイズした未反応の第1オリゴヌクレオチド、が除去される(図3(b))。また、余剰の第1オリゴヌクレオチドも存在していれば同様に除去される(図5(c)、図6)。したがって、電気泳動の結果は、第1オリゴヌクレオチドが検出され、フラップ断片は検出されない。
【0126】
[6A−4−2.フラップ断片検出の判断方法]
電気泳動による展開後、設定したフラップ配列のサイズに基づき、フラップ断片の存在を確認することによって、多型を検出することができる。フラップエンドヌクレアーゼによる切断反応の前において検出される第1オリゴヌクレオチドのバンド又はピークが、切断反応後に消失するとともに、フラップ断片のバンド又はピークが検出されていることを確認することが好ましい。
【0127】
[6A−5.SNP検出の具体例]
例えば、あるSNP部位がT又はCを取りうる場合、第1オリゴヌクレオチドとして、T用のオリゴヌクレオチド及びC用のオリゴヌクレオチドを用意する。T用オリゴヌクレオチドとC用オリゴヌクレオチドとは、第2領域(すなわちSNP)に相補的な塩基としてそれぞれAとGとを有し、フラップ配列が互いに異なるように設計される。フラップ配列は、T用オリゴヌクレオチドとC用オリゴヌクレオチドとで互いに長さが異なるように設計されることが好ましい(図5(a)参照)。
【0128】
例えば、T用オリゴヌクレオチドのフラップ配列をPoly-T12(すなわち12個のTで構成される配列)とした場合、図4(a)に模式的に示した反応が起これば、Poly-T12の長さのフラップ配列を有するフラップ断片を検出することによってSNPを検出することができる(具体的には図5(b)、(c)参照)。一方、C用オリゴヌクレオチドのフラップ配列をPoly-T15(すなわち15個のTで構成される配列)とした場合、図4(b)に模式的に示した反応が起これば、Poly-T15の長さのフラップ配列を有するフラップ断片を検出することによってSNPを検出することができる。そして、検出の結果、フラップ配列Poly-T12を有するフラップ断片が検出され、フラップ配列Poly-T15を有するフラップ断片が検出されない場合は、SNPがT/Tのホモ接合体であるとのタイピングを行うことができる。また、フラップ配列Poly-T12を有するフラップ断片とフラップ配列Poly-T15を有するフラップ断片との両方が検出される場合は、SNPがT/Cのヘテロ接合体であるとタイピングできる。さらに、フラップ配列Poly-T12を有するフラップ断片が検出されず、フラップ配列Poly-T15を有するフラップ断片が検出される場合は、SNPがC/Cのホモ接合体であるとのタイピングを行うことができる。
その他の多型についても同様にタイピングを行うことができる。
【0129】
[6B.質量分析法を用いた検出]
質量分析法を用いた検出法においても、フラップ断片を直接検出することができる。以下、当該検出法についてさらに詳細に説明する。
【0130】
タグの除去を行った後のフラップ断片液は、脱塩処理に供し、マトリックスと混合し、測定用プレートにアプライすると良い。脱塩処理には、脱塩カラムを用いると良い。脱塩カラムとしては、ZipTip(ミリポア社製)などが挙げられる。脱塩カラムは、フィルター付きチップの形状のものなどを用いることができる。
【0131】
[6B−1.マトリックス]
マトリックスとしては、2,4,6−トリヒドロキシアセトフェノン(2,4,6-trihydroxyacetophenone)、2,3,4−トリヒドロキシアセトフェノン(2,3,4-trihydroxyacetophenone)、3−ヒドロキシピコリン酸 (3-hydroxypicolinic acid;3-HPA)、α−シアノ−4−ヒドロキシケイ皮酸メチルエステル(α-cyano-4-hydroxycinnamic acid methyl ester)などから選ぶことができる。これらマトリックスは、例えば適当な溶媒に溶解することにより調製された溶液として用いられる。このような溶媒としては、例えばアセトニトリル−トリフルオロ酢酸水溶液などが挙げられる。マトリックス溶液の組成は、当業者が適宜決定することができる。
【0132】
[6B−2.質量分析装置]
測定プレートを、質量分析装置に導入し、通常の方法に従って測定を行う。本発明では、第1オリゴヌクレオチドにおけるフラップ配列を任意に設定することができるため、用いる質量分析装置としては特に限定されることなく、既存の質量分析装置を用いることができる。質量分析装置としては、マトリックス介助レーザー脱離イオン化(MALDI)イオン源を有するものが好ましい。そして、MALDIイオン源は、飛行時間(TOF)型質量分析計と組み合わせて用いられることがさらに好ましい。MALDI−TOF MSとしては、例えば、AXIMA(島津製作所製)やABI Voyager(パセプティブ・バイオシステムズ社製)などが挙げられる。
【0133】
本発明においては、試料の脱塩、試料とマトリックスとの混合、及びMS検出用プレート作製までの工程が自動で行われても良い。このように自動化された場合、多検体について効率よく遺伝子多型検出を行うことが可能である。
【0134】
[6B−3.フラップ断片の検出]
[6B−3−1.メカニズム]
第1オリゴヌクレオチドとして設計したオリゴヌクレオチドにおける、第2領域(すなわち多型塩基)に対応する塩基が、鋳型核酸において想定した多型部位とマッチする場合は、3本鎖構造を形成し(図2(a))、クリベースがこの構造を認識することによって第1オリゴヌクレオチドを切断し、フラップ断片が遊離する(図2(b))。そして、タグを捕捉する手段によって、タグを有する核酸種が除去される(図2(c))。また、余剰の第1オリゴヌクレオチドも存在していれば同様に除去される(図5(c))。したがって、質量分析の結果は、第1オリゴヌクレオチドが検出されず、フラップ配列が検出される。
【0135】
反対に、第1オリゴヌクレオチドとして設計したオリゴヌクレオチドにおける、多型塩基に対応する塩基が、鋳型核酸において想定した多型部位とマッチしない場合は、クリベースが認識することができる3本鎖構造が形成されないため、第1オリゴヌクレオチドは切断されず、フラップ断片は遊離しない(図3(a))。そして、タグを捕捉する手段によって、タグを有する核酸種、すなわち、鋳型核酸にハイブリダイズした未反応の第1オリゴヌクレオチド、が除去される(図3(b))。また、余剰の第1オリゴヌクレオチドも存在していれば同様に除去される(図5(c))。したがって、質量分析の結果は、第1オリゴヌクレオチドが検出されず、フラップ断片も検出されない。
【0136】
[6B−3−2.フラップ断片検出の判断方法]
マススペクトルにおいては、設定したフラップ配列の質量数に基づき、フラップ断片の存在を確認することによって、多型を検出することができる。フラップエンドヌクレアーゼによる切断反応の前において検出される第1オリゴヌクレオチドのピークが、切断反応後に消失するとともに、フラップ断片のピークが検出されていることを確認することが好ましい。
【0137】
[6B−4.SNP検出の具体例]
例えば、あるSNP部位がT又はCを取りうる場合、第1オリゴヌクレオチドとして、T用のオリゴヌクレオチド及びC用のオリゴヌクレオチドを用意する。T用オリゴヌクレオチドとC用オリゴヌクレオチドとは、第2領域(すなわちSNP)に相補的な塩基としてそれぞれAとGとを有し、フラップ配列が互いに異なるように設計される。フラップ配列は、T用オリゴヌクレオチドとC用オリゴヌクレオチドとで互いに長さが異なるように設計されることが好ましい(図5(a)参照)。
【0138】
例えば、T用オリゴヌクレオチドのフラップ配列をPoly-T12(すなわち12個のTで構成される配列)とした場合、図4(a)に模式的に示した反応が起これば、Poly-T12の長さのフラップ配列を有するフラップ断片を検出することによってSNPを検出することができる(具体的には図5(b)、(c)参照)。一方、C用オリゴヌクレオチドのフラップ配列をPoly-T15(すなわち15個のTで構成される配列)とした場合、図4(b)に模式的に示した反応が起これば、Poly-T15の長さのフラップ配列を有するフラップ断片を検出することによってSNPを検出することができる。そして、検出の結果、フラップ配列Poly-T12を有するフラップ断片が検出され、フラップ配列Poly-T15を有するフラップ断片が検出されない場合は、SNPがT/Tのホモ接合体であるとのタイピングを行うことができる。また、フラップ配列Poly-T12を有するフラップ断片とフラップ配列Poly-T15を有するフラップ断片との両方が検出される場合は、SNPがT/Cのヘテロ接合体であるとタイピングできる。さらに、フラップ配列Poly-T12を有するフラップ断片が検出されず、フラップ配列Poly-T15を有するフラップ断片が検出される場合は、SNPがC/Cのホモ接合体であるとのタイピングを行うことができる。
その他の多型についても同様にタイピングを行うことができる。
【0139】
[6C.蛍光共鳴エネルギー移動法を用いた検出]
蛍光共鳴エネルギー移動法を用いる場合は、タグの除去を行った後のフラップ断片液を、第3オリゴヌクレオチドと接触させ、フラップ断片と第3オリゴヌクレオチドとの2本鎖構造体を検出する。第1オリゴヌクレオチドのフラップ配列が蛍光エネルギー供与体/受容体を有していたため、フラップ断片は、蛍光エネルギー受容体/供与体を有する第3オリゴヌクレオチドとハイブリダイズすることにより検出される。すなわち、遊離した核酸断片と第3オリゴヌクレオチド間における蛍光共鳴エネルギー移動による蛍光に基づいて多型を検出する(例えば図7(d))。第3オリゴヌクレオチドは、固体支持体上に固定されていても良い(例えば図11(c))。以下、当該検出法についてさらに詳細に説明する。
【0140】
[6C−1.第3オリゴヌクレオチドの構成]
第3オリゴヌクレオチドは、フラップ配列に相補的な配列と、蛍光エネルギー受容体又は蛍光エネルギー供与体とを有するオリゴヌクレオチドである。第1オリゴヌクレオチドが蛍光エネルギー供与体を有している場合は、第3オリゴヌクレオチドは蛍光エネルギー受容体を有し、第1オリゴヌクレオチドが蛍光エネルギー受容体を有している場合は、第3オリゴヌクレオチドは蛍光エネルギー供与体を有する。
【0141】
蛍光エネルギー受容体及び蛍光エネルギー供与体については、上記2−2.第1オリゴヌクレオチドの構成の2−2−2.蛍光物質において述べたとおりである。蛍光エネルギー供与体と蛍光エネルギー受容体との組み合わせは、蛍光エネルギー供与体の蛍光スペクトルが、蛍光エネルギー受容体の励起光スペクトルと重なるような組み合わせであれば、どのような組み合わせを採用しても良い。
【0142】
本発明の方法では、従来のインベーダー法のように蛍光物質が遊離することがないため、固体支持体上に固定された第3オリゴヌクレオチドを用いることによって、予め決められた場所で蛍光を検出することができる。例えば、第3オリゴヌクレオチドは、その5´末端において、リンカーを介して固体支持体上の特定の位置に固定されていても良い。
【0143】
[6C−2.第3オリゴヌクレオチドの設計及びフラップ配列とのハイブリダイズ]
第3オリゴヌクレオチドの長さとしては特に限定されないが、第1オリゴヌクレオチドのフラップ配列との兼ね合いを考慮し、例えば15〜50merの長さに設定することができる。
【0144】
[6C−2−1.第3オリゴヌクレオチドを固定化しない場合]
第3オリゴヌクレオチドを支持体に固定しない場合は、例えばウェルなどの容器を用い、検出対象となる多型のアレル及び/又は多型部位に応じて第3オリゴヌクレオチド液を配置し、配置された反応液に対してフラップ断片液を分注することができる。
また、フラップ断片液を検出対象となる多型のアレル及び/又は多型部位の数に基づいて配置し、配置されたフラップ断片液に対して前記アレル及び/又は多型部位に応じた第3オリゴヌクレオチド液を分注することができる。
【0145】
[6C−2−2.第3オリゴヌクレオチドを固定化する場合]
支持体に固定された第3オリゴヌクレオチドを用いる場合は、検出対象となる多型のアレル及び/又は多型部位に応じて定められた位置に第3オリゴヌクレオチドが固定された支持体を用い、各位置に対してフラップ断片液を分注することができる。
【0146】
固体支持体上に固定する場合、例えば、上記例示した第3オリゴヌクレオチドの長さのうち5´末端の7〜35merを、リンカーとしての配列とすることができる。
【0147】
固体支持体上における配置、すなわち例えば図11(c)におけるP1とP2との距離としては、例えばP1においてf1配列を有するフラップ断片と第3オリゴヌクレオチドIII1とがハイブリダイズしたときに、f1配列を有するフラップ断片の蛍光エネルギー供与体と第3オリゴヌクレオチドIII2の蛍光エネルギー受容体との間で蛍光共鳴エネルギー移動が起こらない程度の距離を確保できるような距離を、第3オリゴヌクレオチドの長さなどを考慮して、当業者が適宜決定することができる。
【0148】
第3オリゴヌクレオチドを固定化する固体支持体の種類及び形状、固体支持体への第3オリゴヌクレオチドの固定化方法及び条件、及び、固体支持体上の第3オリゴヌクレオチドへのアニーリング法及び条件などについては、当業者が適宜決定することができる。例えば、特開2002−171992号公報に記載の方法に準じることができる。
【0149】
[6C−3.蛍光共鳴エネルギー移動]
フラップ断片と第3オリゴヌクレオチドとがハイブリダイズすることにより、蛍光エネルギー供与体と蛍光エネルギー受容体とが近接し、蛍光共鳴エネルギー移動(FRETと記載することがある)によって蛍光が発せられる。フラップ断片と第3オリゴヌクレオチドとの間における蛍光エネルギー供与体と蛍光エネルギー受容体との距離は、FRETが起こる距離(例えば1〜10nm)であればよい。例えば、第1オリゴヌクレオチドにおける蛍光エネルギー供与体又は蛍光エネルギー受容体が第1オリゴヌクレオチドの5´末端に設けられた場合は、第3オリゴヌクレオチドにおける蛍光エネルギー受容体又は蛍光エネルギー供与体は、第3オリゴヌクレオチドの3´末端に設けることができる。例えば図7(d)は、蛍光エネルギー供与体d1を5´末端に有するフラップ断片と蛍光エネルギー受容体aを3´末端に有する第3オリゴヌクレオチドとがハイブリダイズし、FRETが起こり蛍光エネルギー受容体の蛍光強度が増強することにより、蛍光が発せられたことを例示する模式図である。
【0150】
[6C−4.フラップ断片の検出]
[6C−4−1.メカニズム]
第1オリゴヌクレオチドとして設計したオリゴヌクレオチドにおける、第2領域(すなわち多型塩基)に対応する塩基が、鋳型核酸において想定した多型部位とマッチする場合は、3本鎖構造体を形成し、クリベースがこの構造を認識することによって第1オリゴヌクレオチドを切断し、フラップ断片が遊離する。そして、タグを捕捉する手段によって、タグを有する核酸種が除去される。また、余剰の第1オリゴヌクレオチドも存在していれば同様に除去される。(例えば図7(c)参照)
【0151】
第3オリゴヌクレオチドが速やかに、遊離したフラップ断片のフラップ配列とハイブリダイズし、2本鎖構造体を形成する(例えば図7(d))。このとき、近接した蛍光エネルギー供与体と蛍光エネルギー受容体との間でエネルギー転移が起こる。そして、エネルギー転移による蛍光強度の変化を認識することによって、フラップ断片を検出する。このようにして、多型が検出される。なお、この場合、蛍光エネルギー受容体の蛍光は可能な強度(すなわちフラップ断片と第3オリゴヌクレオチドとの2本鎖構造体が、全てのフラップ断片について形成され、全ての2本鎖構造体で蛍光エネルギー受容体の蛍光が発せられたときの蛍光強度)まで速やかに達する。(本明細書では、蛍光エネルギー受容体の蛍光が可能な強度まで速やかに達することを、単に蛍光が発せられると記載する場合がある。)
【0152】
反対に、第1オリゴヌクレオチドとして設計したオリゴヌクレオチドにおける、多型塩基に対応する塩基が、鋳型核酸において想定した多型部位とマッチしない場合は、クリベースが認識することができる3本鎖構造体が形成されないため、第1オリゴヌクレオチドは切断されず、フラップ断片は遊離しない。
【0153】
[6C−4−2.フラップ断片検出の判断方法1]
多型が検出されたか否かの判断は、フラップ断片と第3オリゴヌクレオチドとのハイブリダイズによるFRET現象で生じる、蛍光強度の変化に基づくが、そのためには、従来からの蛍光検出法を特に限定することなく用いることができる。例えば、少なくとも一定時間経過後の蛍光強度を調べることによって判断してよい。具体的には、以下のように検出を行うことができる。
【0154】
例えば、蛍光スペクトルに基づいて判断する場合は、適当な励起波長のもと、蛍光波長を変化させて、蛍光強度を波長ごとにプロットし、少なくとも一定時間経過後の最大蛍光強度や最大蛍光波長の値から判断することができる。
【0155】
[6C−4−3.フラップ断片検出の判断方法2]
本発明では、上記の方法以外にも、フラップ断片と第3オリゴヌクレオチドとのハイブリダイズによるFRET現象で生じる、蛍光エネルギー供与体及び蛍光エネルギー受容体の蛍光強度の変化のいずれかを測定する方法が可能である。すなわち、エネルギー供与体に対して励起を行い、少なくとも一定時間経過後のエネルギー供与体側の蛍光強度の値を測定することで、エネルギー供与体側の蛍光強度の変化を調べるか、或いは、エネルギー供与体に対して励起を行い、少なくとも一定時間経過後のエネルギー受容体側の蛍光強度の値を測定することで、エネルギー受容体側の蛍光強度の変化を調べることができる。好ましくは、エネルギー供与体に対して励起を行い、エネルギー供与体側の蛍光強度の変化を調べる。エネルギー供与体側の蛍光強度が減衰すると、多型が検出できたことになる。このように、本発明では、単一の蛍光物質のシグナルのみで検出が可能である。
【0156】
[6C−5.蛍光検出装置]
蛍光の検出は、上述の6C−4−2.の場合、例えば、リアルタイムPCR装置やプレートリーダなどを用い、適当な励起波長及び蛍光波長を固定して行うことができる。リアルタイムPCR装置としては、例えばストラタジーン社製MX3000pなどが挙げられる。プレートリーダとしては、例えば大塚電子社製FluoDia T70などが挙げられる。このような場合、通常、蛍光物質ごとにフィルターセットを用意する必要がある。
【0157】
一方、上述の6C−4−3.の場合、蛍光物質ごとにフィルターセットを用意する必要がない。この場合による方法においては、検出器としては特に限定されることなく、さまざまな機種を用いることができる。
【0158】
ここで、蛍光物質ごとにフィルターセットを用意する場合は、異なる励起/蛍光のセットによる検出系を用意することが必要である。しかしながら、特に廉価版の装置では、フィルターの組み合わせを変えることができない場合がある。例えば上述のMX3000pなどでは、設定した蛍光以外のフィルターの変更は困難で、また、組み合わせの変更もできない。異なる励起/蛍光の組み合わせを実現するには、高額な機械や専用機を用意する必要がある。上述6C−4−3.のような、単一の蛍光物質のシグナルのみによる検出は、例えばこのように異なる励起/蛍光のセットによる検出系を用意することが困難な場合に行うことが好ましい。
【0159】
またすでに上記6C−2.で述べたように、本発明の方法では、従来のインベーダー法のように蛍光物質が遊離することがないため、第3オリゴヌクレオチドを固体支持体上に固定し、予め決められた場所で蛍光を検出することができる。このため、従来のインベーダー法と異なり、開放系での検出が可能になる。したがって、上述の6C−2−2.のように第3オリゴヌクレオチドを支持体上に固定化して用いる場合は、蛍光の検出のためにマイクロアレイのイメージャーやその他の蛍光イメージャーを利用することができる。
【0160】
[6C−6.多型検出の具体例]
第1オリゴヌクレオチドは、通常、試料中の多型部位一箇所つき、多型のアレルそれぞれに応じて設計されている。例えば、第1オリゴヌクレオチドとしては、アレル特異的な2種のオリゴヌクレオチドを用いることができる(以下、第1オリゴヌクレオチドとしてアレル特異的な2種のオリゴヌクレオチドを用いる場合を挙げて説明を行う)。この場合、第3オリゴヌクレオチドとしては、アレル特異的な2種の第1オリゴヌクレオチドそれぞれに対応するように(すなわちアレル特異的な2種の第1オリゴヌクレオチドの、それぞれのフラップ配列に相補的な配列を有するように)設計された2種類のオリゴヌクレオチドが用いられる。そして、これらアレル特異的な第1オリゴヌクレオチドの一方及び/又は他方から生じるフラップ断片と第3オリゴヌクレオチドとから形成される2本鎖構造体において発せられる蛍光が識別可能となるように、第1オリゴヌクレオチド及び対応する第3オリゴヌクレオチドを設定することができる。蛍光からアレルの識別を可能にする(すなわちそれぞれのアレルをID化する)具体的な方法としては、アレルごとに異なる挙動を示す蛍光に基づく方法と、アレルごとに異なる固体支持体上の位置における蛍光に基づく方法とが挙げられる。各オリゴヌクレオチドの設計の仕方によっては、アレルごとに、蛍光及び固体支持体上における位置の両方が異なるようにすることも可能である。
【0161】
以下に、蛍光からアレルの識別を可能にする具体的な方法について例を挙げて説明する。ここで、第1オリゴヌクレオチドとして、一方のアレル(アレル1とする)に特異的なものを第1オリゴヌクレオチドI1とし、他方のアレル(アレル2とする)に特異的なものを第1オリゴヌクレオチドI2とする。そして、第3オリゴヌクレオチドとして、第1オリゴヌクレオチドI1に対応するものを第3オリゴヌクレオチドIII1とし、第1オリゴヌクレオチドI2に対応するものを第3オリゴヌクレオチドIII2とする。
【0162】
[6C−6−1.アレル識別法1]
アレルごとに異なる挙動を示す蛍光に基づいてアレル識別を行うためには、以下に挙げる方法を行うことができる。
【0163】
[アレル識別法1−第1オリゴヌクレオチドが蛍光エネルギー供与体を有する場合1]
まず、第1オリゴヌクレオチドが蛍光エネルギー供与体を有する場合、一例としては、アレルごとに第1オリゴヌクレオチドの蛍光エネルギー供与体が異なるようにすることができる(より具体的な例を図7に挙げる)。この例では、蛍光エネルギー供与体の蛍光強度の減衰に基づいて各アレルを識別することができる。具体的には、第1オリゴヌクレオチドI1は、アレル1に応じた相補配列と、アレル1の識別のための蛍光エネルギー供与体d1とを有する。第1オリゴヌクレオチドI2は、アレル2に応じた相補配列と、アレル2の識別のための蛍光エネルギー供与体d2とを有する。第1オリゴヌクレオチドI1とI2とのフラップ配列は、互いに同じであっても良いし、互いに異なっていても良い。
【0164】
第3オリゴヌクレオチドIII1は、第1オリゴヌクレオチドI1のフラップ配列に相補的な配列と、蛍光エネルギー受容体とを有する。第3オリゴヌクレオチドIII2は、第1オリゴヌクレオチドI2のフラップ配列に相補的な配列と、蛍光エネルギー受容体とを有する。第1オリゴヌクレオチドI1とI2とのフラップ配列が互いに同じである場合、用意する第3オリゴヌクレオチドとしては、当該フラップ配列に相補的な配列を有するもの1種類でよい。第3オリゴヌクレオチドIII1とIII2との蛍光エネルギー受容体は、第1オリゴヌクレオチドの蛍光エネルギー供与体d1及びd2それぞれに対応したものとするため、互いに同じである場合と、互いに異なる場合とがあり得る。
【0165】
このような第1オリゴヌクレオチド及び第3オリゴヌクレオチドを、あるSNP部位がT(アレル1)又はC(アレル2)を取りうる場合に用いた例が、図7に示される。この例では第1オリゴヌクレオチドI1とI2とのフラップ配列が互いに同じものとした(図7(a))。仮に鋳型核酸が有するSNPがTであった場合、第1オリゴヌクレオチドI1がハイブリダイズした鋳型核酸において、フラップエンドヌクレアーゼが認識可能な3本鎖構造体が形成され(図7(b))、フラップ断片が遊離する。その後、タグが捕捉される(図7(c))。フラップ断片は第3オリゴヌクレオチドと2本鎖構造体を形成し、FRETによりaの蛍光強度が増強し、d1の蛍光強度が減衰する(図7(d))。d1の蛍光強度の減衰に基づいて、SNPとしてTを検出することができる。
【0166】
アレルごとに蛍光エネルギー供与体が異なる上記の例は、すでに述べたように、単一の蛍光物質のシグナルのみに基づいて検出する方法を用いることができる点で好ましい。
【0167】
[アレル識別法1−第1オリゴヌクレオチドが蛍光エネルギー供与体を有する場合2]
第1オリゴヌクレオチドが蛍光エネルギー供与体を有する場合の他の一例としては、アレルごとに第3オリゴヌクレオチドの蛍光エネルギー受容体が異なるようにすることができる(より具体的な例を図8に挙げる)。この例では、蛍光エネルギー受容体の蛍光強度の増強に基づいて各アレルを識別することができる。この例では、アレルごとに第1オリゴヌクレオチドのフラップ配列が異なるようにする必要がある。具体的には、第1オリゴヌクレオチドI1は、アレル1に応じた相補配列と、アレル1の識別のためのフラップ配列f1とを有する。第1オリゴヌクレオチドI2は、アレル2に応じた相補配列と、アレル2の識別のためのフラップ配列f2とを有する。第1オリゴヌクレオチドI1とI2との蛍光エネルギー供与体は、第3オリゴヌクレオチドの蛍光エネルギー受容体a1及びa2それぞれに対応したものとするため、互いに同じである場合と、互いに異なる場合とがあり得る。
【0168】
第3オリゴヌクレオチドIII1は、第1オリゴヌクレオチドI1のフラップ配列f1に相補的な配列と、アレル1の識別のための蛍光エネルギー受容体a1とを有する。第3オリゴヌクレオチドIII2は、第1オリゴヌクレオチドI2のフラップ配列f2に相補的な配列と、アレル2の識別のための蛍光エネルギー受容体a2とを有する。
【0169】
このような第1オリゴヌクレオチド及び第3オリゴヌクレオチドを、あるSNP部位がT(アレル1)又はC(アレル2)を取りうる場合に用いた例が、図8に示される。この例では、第1オリゴヌクレオチドI1及びI2は、図8(a)のように模式的に表される。仮に鋳型核酸が有するSNPがTであった場合、第1オリゴヌクレオチドI1がハイブリダイズした鋳型核酸において、フラップエンドヌクレアーゼが認識可能な3本鎖構造体が形成され(図8(b))、フラップ断片が遊離する。フラップ断片は第3オリゴヌクレオチドIII1と2本鎖構造体を形成し、FRETによりa1の蛍光強度が増強し、dの蛍光強度が減衰する(図8(c))。a1の蛍光強度の増強に基づいて、SNPとしてTを検出することができる。
【0170】
[アレル識別法1−第1オリゴヌクレオチドが蛍光エネルギー受容体を有する場合1]
次に、第1オリゴヌクレオチドが蛍光エネルギー受容体を有する場合、一例としては、アレルごとに第3オリゴヌクレオチドの蛍光エネルギー供与体が異なるようにすることができる(より具体的な例を図9に挙げる)。この例では、蛍光エネルギー供与体の蛍光強度の減衰に基づいて各アレルを識別することができる。この例では、アレルごとに第1オリゴヌクレオチドのフラップ配列が異なるようにする必要がある。具体的には、第1オリゴヌクレオチドI1は、アレル1に応じた相補配列と、アレル1の識別のためのフラップ配列f1とを有する。第1オリゴヌクレオチドI2は、アレル2に応じた相補配列と、アレル2の識別のためのフラップ配列f2とを有する。第1オリゴヌクレオチドI1とI2との蛍光エネルギー受容体は、第3オリゴヌクレオチドの蛍光エネルギー供与体d1及びd2それぞれに対応したものとするため、互いに同じである場合と、互いに異なる場合とがあり得る。
【0171】
第3オリゴヌクレオチドIII1は、第1オリゴヌクレオチドI1のフラップ配列f1に相補的な配列と、アレル1の識別のための蛍光エネルギー供与体d1とを有する。第3オリゴヌクレオチドIII2は、第1オリゴヌクレオチドI2のフラップ配列f2に相補的な配列と、アレル2の識別のための蛍光エネルギー供与体d2とを有する。
【0172】
このような第1オリゴヌクレオチド及び第3オリゴヌクレオチドを、あるSNP部位がT(アレル1)又はC(アレル2)を取りうる場合に用いた例が、図9に示される。この例では、第1オリゴヌクレオチドI1及びI2は、図9(a)のように模式的に表される。仮に鋳型核酸が有するSNPがTであった場合、第1オリゴヌクレオチドI1がハイブリダイズした鋳型核酸において、フラップエンドヌクレアーゼが認識可能な3本鎖構造体が形成され(図9(b))、フラップ断片が遊離する。フラップ断片は第3オリゴヌクレオチドIII1と2本鎖構造体を形成し、FRETによりaの蛍光強度が増強し、d1の蛍光強度が減衰する(図9(c))。d1の蛍光強度の減衰に基づいて、SNPとしてTを検出することができる。
【0173】
アレルごとに蛍光エネルギー供与体が異なる上記の例は、すでに述べたように、単一の蛍光物質のシグナルのみに基づいて検出する方法を用いることができる点で好ましい。
【0174】
[アレル識別法1−第1オリゴヌクレオチドが蛍光エネルギー受容体を有する場合2]
第1オリゴヌクレオチドが蛍光エネルギー受容体を有する場合の他の一例としては、アレルごとに第1オリゴヌクレオチドの蛍光エネルギー受容体が異なるようにすることができる(より具体的な例を図10に挙げる)。この例では、蛍光エネルギー受容体の蛍光強度の増強に基づいて各アレルを識別することができる。具体的には、第1オリゴヌクレオチドI1は、アレル1に応じた相補配列と、アレル1の識別のための蛍光エネルギー受容体a1とを有する。第1オリゴヌクレオチドI2は、アレル2に応じた相補配列と、アレル2の識別のための蛍光エネルギー受容体a2とを有する。第1オリゴヌクレオチドI1とI2とのフラップ配列は、互いに同じであっても良いし、互いに異なっていても良い。
【0175】
第3オリゴヌクレオチドIII1は、第1オリゴヌクレオチドI1のフラップ配列に相補的な配列と、蛍光エネルギー受容体とを有する。第3オリゴヌクレオチドIII2は、第1オリゴヌクレオチドI2のフラップ配列に相補的な配列と、蛍光エネルギー受容体とを有する。第1オリゴヌクレオチドI1とI2とのフラップ配列が互いに同じである場合、用意する第3オリゴヌクレオチドとしては、当該フラップ配列に相補的な配列を有するもの1種類でよい。第3オリゴヌクレオチドIII1とIII2との蛍光エネルギー供与体は、第1オリゴヌクレオチドの蛍光エネルギー受容体a1及びa2それぞれに対応したものとするため、互いに同じである場合と、互いに異なる場合とがあり得る。
【0176】
このような第1オリゴヌクレオチド及び第3オリゴヌクレオチドを、あるSNP部位がT(アレル1)又はC(アレル2)を取りうる場合に用いた例が、図10に示される。この例では、第1オリゴヌクレオチドI1及びI2は、図10(a)のように模式的に表される。仮に鋳型核酸が有するSNPがTであった場合、第1オリゴヌクレオチドI1がハイブリダイズした鋳型核酸において、フラップエンドヌクレアーゼが認識可能な3本鎖構造体が形成され(図10(b))、フラップ断片が遊離する。フラップ断片は第3オリゴヌクレオチドIII1と2本鎖構造体を形成し、FRETによりa1の蛍光強度が増強し、dの蛍光強度が減衰する(図10(c))。a1の蛍光強度の増強に基づいて、SNPとしてTを検出することができる。
【0177】
[アレル識別法1−判断基準及びその他]
いずれの例においても、第3オリゴヌクレオチドは固体支持体上に固定されていなくとも良いし、固定されていても良い。いずれにしても、強度に変化があった蛍光に基づいてSNP検出やタイピングを行うことができる。例えば、d1に由来する蛍光スペクトルの変化(すなわち、蛍光強度の減衰による変化。以下において同じ。)のみ検出され、d2に由来する蛍光スペクトルの変化が検出されなければ、SNPがT/Tのホモ接合体であるとのタイピングを行うことができる。また、d1とd2との両方に由来する蛍光スペクトルの変化が検出されれば、SNPがT/Cのヘテロ接合体であるとのタイピングを行うことができる。さらに、d2に由来する蛍光スペクトルの変化のみ検出され、d1に由来する蛍光スペクトルの変化が検出されなければ、SNPがC/Cのホモ接合体であるとのタイピングを行うことができる。
第3オリゴヌクレオチドが固体支持体上に固定されている場合は、蛍光だけでなく固体支持体上の位置によって、確実かつ容易にSNP検出やタイピングを行うことができる点で好ましい。
【0178】
なお、オリゴヌクレオチドを固体支持体上に固定する方法としては特に限定されないが、例えばビオチンを用いる方法が挙げられる。固体支持体の種類としても、特に限定されず、例えば、通常DNAチップとして用いられる支持体などが挙げられる。
【0179】
[6C−6−2.アレル識別法2]
一方、アレルごとに異なる固体支持体上の位置における蛍光に基づいてアレル識別を行うためには、以下に挙げる方法を行うことができる。
【0180】
[アレル識別法2−第1オリゴヌクレオチドが蛍光エネルギー供与体を有する場合]
まず、第1オリゴヌクレオチドが蛍光エネルギー供与体を有する場合、一例としては、フラップ配列がアレルごとに異なるようにすると良い(より具体的な例を図11に挙げる)。具体的には、第1オリゴヌクレオチドI1は、アレル1に応じた相補配列と、アレル1の識別のためのフラップ配列f1とを有する。第1オリゴヌクレオチドI2は、アレル2に応じた相補配列と、アレル2の識別のためのフラップ配列f2とを有する。第1オリゴヌクレオチドI1とI2との蛍光エネルギー供与体は、それぞれ、第3オリゴヌクレオチドIII1とIII2との蛍光エネルギー受容体に対応していれば良く、互いに同じであっても良いし、互いに異なっていても良い。
【0181】
第3オリゴヌクレオチドIII1は、第1オリゴヌクレオチドI1のフラップ配列f1に相補的な配列と、蛍光エネルギー受容体とを有し、アレル1の識別のための固体支持体上の特定の位置P1に固定化される。第3オリゴヌクレオチドIII2は、第1オリゴヌクレオチドI2のフラップ配列f2に相補的な配列と、蛍光エネルギー受容体とを有し、アレル2の識別のための、固体支持体上のP1とは異なる位置P2に固定化される。第3オリゴヌクレオチドIII1とIII2との蛍光エネルギー受容体は、互いに同じであっても良いし、互いに異なっていても良い。
【0182】
このような第1オリゴヌクレオチド及び第3オリゴヌクレオチドを、あるSNP部位がT(アレル1)又はC(アレル2)を取りうる場合に用いた例が図11に示される。この例では第1オリゴヌクレオチドI1とI2との蛍光エネルギー供与体が互いに同じものとした(図11(a))。仮に鋳型核酸が有するSNPがTであった場合、第1オリゴヌクレオチドI1がハイブリダイズした鋳型核酸において、フラップエンドヌクレアーゼが認識可能な3本鎖構造体が形成され(図11(b))、フラップ断片が遊離する。固体支持体上のP1の位置で、フラップ断片が第3オリゴヌクレオチドと2本鎖構造体を形成し、FRETによりaが発光する(図11(c))。固体支持体上のP1の位置における、aの蛍光強度の増強、又はdの蛍光強度の減衰に基づいて、SNPとしてTを検出することができる。
【0183】
[アレル識別法2−第1オリゴヌクレオチドが蛍光エネルギー受容体を有する場合]
次に、第1オリゴヌクレオチドが蛍光エネルギー受容体を有する場合、一例としては、フラップ配列がアレルごとに異なるようにすると良い(より具体的な例を図12に挙げる)。具体的には、第1オリゴヌクレオチドI1は、アレル1に応じた相補配列と、アレル1の識別のためのフラップ配列f1とを有する。第1オリゴヌクレオチドI2は、アレル2に応じた相補配列と、アレル2の識別のためのフラップ配列f2とを有する。第1オリゴヌクレオチドI1とI2との蛍光エネルギー受容体は、それぞれ、第3オリゴヌクレオチドIII1とIII2との蛍光エネルギー受容体に対応していれば良く、互いに同じであっても良いし、互いに異なっていても良い。
【0184】
そして、第3オリゴヌクレオチドIII1は、第1オリゴヌクレオチドI1のフラップ配列f1に相補的な配列と、蛍光エネルギー供与体とを有し、アレル1の識別のための固体支持体上の特定の位置P1に固定化される。第3オリゴヌクレオチドIII2は、アレル2の識別のための、第1オリゴヌクレオチドI2のフラップ配列f2に相補的な配列と、蛍光エネルギー供与体とを有し、固体支持体上のP1とは異なる位置P2に固定化される。第3オリゴヌクレオチドIII1とIII2との蛍光エネルギー供与体は、互いに同じであっても良いし、互いに異なっていても良い。
【0185】
このような第1オリゴヌクレオチド及び第3オリゴヌクレオチドを、あるSNP部位がT(アレル1)又はC(アレル2)を取りうる場合に用いた例が図12に示される。この例では、第1オリゴヌクレオチドI1及びI2は、図12(a)のように模式的に表される。第3オリゴヌクレオチドの蛍光供与体は同じものとした。仮に鋳型核酸が有するSNPがTであった場合、第1オリゴヌクレオチドI1がハイブリダイズした鋳型核酸において、フラップエンドヌクレアーゼが認識可能な3本鎖構造体が形成され(図12(b))、フラップ断片が遊離する。固体支持体上のP1の位置で、フラップ断片が第3オリゴヌクレオチドと2本鎖構造体を形成し、FRETによりaが発光する(図12(c))。固体支持体上のP1の位置における、aの蛍光強度の増強、又はdの蛍光強度の減衰に基づいて、SNPとしてTを検出することができる。
【0186】
[アレル識別法2−判断基準及びその他]
いずれの例においても、蛍光強度の変化があった場所によってSNP検出やタイピングを行うことができる。例えば、P1の位置のみで増強された蛍光が検出され、P2の位置で増強された蛍光が検出されなければ、SNPがT/Tのホモ接合体であるとのタイピングを行うことができる。また例えば、P1とP2との両方の位置で増強された蛍光が検出されれば、SNPがT/Cのヘテロ接合体であるとのタイピングを行うことができる。さらに例えば、P2の位置のみで増強された蛍光が検出され、P1の位置で増強された蛍光が検出されなければ、SNPがC/Cのホモ接合体であるとのタイピングを行うことができる。アレルごとに蛍光エネルギー供与体が異なる場合、或いはアレルごとに蛍光エネルギー受容体が異なる場合は、固体支持体上の位置の違いだけでなく蛍光の違いによって、確実かつ容易にSNP検出やタイピングを行うことができる点で好ましい。
【0187】
[6C−6−3.複数の多型部位を検出ターゲットにする場合]
遺伝子多型検出法においては、試料中の複数の多型部位を検出ターゲットにする場合が多い。この場合、第1オリゴヌクレオチドは、検出すべき複数の多型部位の箇所それぞれに応じて設計されている。例えば、第1オリゴヌクレオチドとしては、アレル特異的な2種の第1オリゴヌクレオチドのセットを、多型部位の種類の数だけ用いることができる。この場合、第3オリゴヌクレオチドとしては、第1オリゴヌクレオチドのそれぞれに対応するように設計されたオリゴヌクレオチドを用いる。そして、これら多型部位に応じて設計された第1オリゴヌクレオチドから生じるフラップ断片のそれぞれが、蛍光発色後に識別可能となるように、第1オリゴヌクレオチド及び対応する第3オリゴヌクレオチドを設定することができる。蛍光発色後のフラップ断片から多型部位の識別を可能にする具体的な方法としては、多型部位ごとに異なる蛍光が発光するようにする方法と、固体支持体上において多型部位ごとに異なる位置で蛍光が発光するようにする方法とが挙げられる。第1オリゴヌクレオチドの設計の仕方によっては、多型部位ごとに、蛍光及び固体支持体上における位置の両方が異なるようにすることも可能である。これらの具体的な方法については、上述の、蛍光からアレルの識別を可能にする具体的な方法において、アレルごとに異なるように設計されたオリゴヌクレオチド(具体的には、アレル1に特異的なオリゴヌクレオチドI1及びアレル2に特異的なオリゴヌクレオチドI2)を、多型部位ごとに異なるように設計されたオリゴヌクレオチド(具体的には、部位1に特異的なオリゴヌクレオチドI1及び部位2に特異的なオリゴヌクレオチドI2)として読み代えることで、上述の方法と同様に説明することができる。
【0188】
[6D.電気化学的方法を用いた検出]
電気化学的方法を用いた検出法においても、上記6C.における蛍光共鳴エネルギー移動法を用いる場合と同様、フラップ断片と第3オリゴヌクレオチドとの2本鎖構造体を検出する。第3オリゴヌクレオチドは、電極表面に固定化して用いることができる。電極表面に固定化した第3オリゴヌクレオチドは、フラップ断片とハイブリダイズして2本鎖構造体を形成する。2本鎖構造体は、当該2本鎖構造体に特異的に結合し且つ電気化学的に活性な物質(2本鎖認識体)を用いて検出することができる。
【0189】
[6D−1.使用する核酸種]
使用する核酸種は、すでに述べた方法において用いられる核酸種に準じる。
第1オリゴヌクレオチドとしては、上記2−2.(上記2−2−2.の場合を除く)及び上記3−1.におけるものを用いることができる。
第2オリゴヌクレオチドとしては、上記2−3.及び上記3−2.におけるものを用いることができる。
第3オリゴヌクレオチドとしては、固定先が電極であることを除いて、上記6C−1.及び上記6C−2−2.(蛍光エネルギー供与体又は蛍光エネルギー受容体を有しないものを用いる)におけるものを用いることができる。
【0190】
[6D−2.2本鎖認識体]
2本鎖認識体は、2本鎖構造体に特異的に結合し且つ電気的に活性な物質であれば特に限定されず、例えば、金属錯体や生体高分子などを用いることができる。
【0191】
[6D−3.判断方法]
フラップ断片が検出されたことの判断は、2本鎖構造体に結合した2本鎖構造体と、第3オリゴヌクレオチドを固定している電極との間で生じる電気化学的信号に基づいて行うことができる。
[6D−4.その他]
具体的なアレル識別法としては、電極上の位置における電気化学的信号に基づいて識別を行うことができる(参考:上記6C−6−2.固体支持体上の位置における蛍光に基づいてアレル識別を行うための方法)。
電気化学的方法を用いた検出のより具体的な事項については、特許第2573443号明細書に記載されている。
【0192】
[6E.光化学的方法を用いた検出]
光化学的方法を用いた検出法においても、上記6C.における蛍光共鳴エネルギー移動法を用いる場合と同様、フラップ断片と第3オリゴヌクレオチドとの2本鎖構造体を検出する。第3オリゴヌクレオチドは、光ファイバーに固定化して用いることができる。光ファイバーに固定化した第3オリゴヌクレオチドは、フラップ断片とハイブリダイズして2本鎖構造体を形成する。2本鎖構造体は、当該2本鎖構造体に特異的に結合し且つ光化学的に活性な物質(2本鎖認識体)を用いて検出することができる。
【0193】
[6E−1.使用する核酸種]
使用する核酸種は、すでに述べた方法において用いられる核酸種に準じる。
第1オリゴヌクレオチドとしては、上記2−2.(上記2−2−2.の場合を除く)及び上記3−1.におけるものを用いることができる。
第2オリゴヌクレオチドとしては、上記2−3.及び上記3−2.におけるものを用いることができる。
第3オリゴヌクレオチドとしては、固定先が光ファイバーであることを除いて、上記6C−1.及び上記6C−2−2.(蛍光エネルギー供与体又は蛍光エネルギー受容体を有しないものを用いる)におけるものを用いることができる。
【0194】
[6E−2.2本鎖認識体]
2本鎖認識体は、2本鎖構造体に特異的に結合し且つ光化学的に活性な物質であれば特に限定されず、例えば、生体高分子などを用いることができる。
【0195】
[6E−3.判断方法]
フラップ断片が検出されたことの判断は、2本鎖構造体に結合した2本鎖構造体と、第3オリゴヌクレオチドを固定している光ファイバーとの間で生じる光化学的信号に基づいて行うことができる。
[6E−4.その他]
具体的なアレル識別法としては、光ファイバー上の位置における光化学的信号に基づいて識別を行うことができる(参考:上記6C−6−2.固体支持体上の位置における蛍光に基づいてアレル識別を行うための方法)。
光化学的方法を用いた検出のより具体的な事項については、特許第2573443号明細書に記載されている。
【0196】
[7.核酸増幅反応を行う場合]
本発明においては、ゲノムから直接3本鎖構造体形成及びフラップエンドヌクレアーゼによる切断反応を行ってもよいし、検出すべき多型を含む特定の配列を含む領域を予め増幅させておいても良い。特定の配列を含む領域を増幅させるための方法としては特に限定されないが、例えばPCRを行うことができる。試料中の複数の多型を検出する場合は、相当する複数の特定の配列に対し、マルチプレックスPCRを行うことができる。
【0197】
核酸増幅においては、ホットスタート法を用いることが好ましい。ホットスタート法を用いることによって、プライマーのミスアニーリングやオリゴマー化を防止することができ、望ましくない核酸増幅を防止することができる。また、ホットスタート法を用いると、多くの領域を同時に増幅することができるため、効率よく多型検出を行うことを可能にする。
【0198】
ゲノムの増幅において、1つの多型部位を増幅するためにはその多型部位をはさんで結合する1対のプライマーを用いる。対象となる試料中の検出すべき多型が複数である場合、検出すべき多型部位が互いに離れた位置に存在する場合には、多型部位の種類の数の2倍のプライマーを用いる。しかし、例えば複数の多型、たとえば2つの多型が接近している場合には、2つの多型部位それぞれを挟んでプライマーを結合させて増幅を行っても良い、2つの多型部位の間にプライマーを結合させず、2つの多型部位の両端に1対のプライマーを結合させて増幅を行っても良い。
【0199】
PCR反応液は、pH緩衝液、MgCl2、KClなどの塩類、プライマー、デオキシリボヌクレオチド類、及び熱安定性合成酵素を含む。その他に、界面活性剤やタンパク質などの物質を必要に応じて添加することができる。
【0200】
pH緩衝液は、トリス(ヒドロキシメチル)アミノメタンと、塩酸、硝酸、硫酸などの鉱酸とを組み合わせたもの、及び、その他種々のpH緩衝液を用いることができる。pH調製された緩衝液は、PCR反応液の中で10mMから100mMの間の濃度で使用することが好ましい。
【0201】
プライマーはPCR反応による核酸合成の開始点として働くオリゴヌクレオチドをいう。プライマーは合成したものであっても良く、生物界から単離したものであっても良い。
熱安定性合成酵素はプライマー付加による核酸合成のための酵素であり、化学合成系も含む。適切な合成酵素としては、E.coliのDNAポリメラーゼ、E.coliのDNAポリメラーゼのクレノーフラグメント、T4DNAポリメラーゼ、TaqDNAポリメラーゼ、T.litoralisDNAポリメラーゼ、TthDNAポリメラーゼ、PfuDNAポリメラーゼ、Hot Start Taqポリメラーゼ、KODDNAポリメラーゼ、EX TaqDNAポリメラーゼ、逆転写酵素などがあるが、これらに限定されるものではない。なお、熱安定性とは、高温下、好ましくは65〜95℃でもその活性を保持する化合物の性質を意味する。
【0202】
増幅反応におけるその他の条件としては特に限定されず、公知の方法における条件に基づいて反応を行うことができる。試料に生体試料や生体由来試料を用いる場合は、増幅反応を、25℃におけるpHが8.5〜9.5となる反応液中で行うことが好ましい。そうすることにより、生体試料や生体由来試料に、直接核酸増幅反応液を作用させ、反応を行うことも可能である。
【実施例】
【0203】
<実験例A>
以下に、実験例A1及び実験例A2で用いたオリゴヌクレオチドの配列を挙げる。右肩に*印を付している塩基は、多型部位として想定した塩基、又は、その塩基に対応する相補塩基又は非相補塩基である。
Inv_A:AGTCTGTACTAATTGCACATG*TATTGTTGGGGATTTTCCAT(配列番号1)
Inv_Cw1:TTTTTTTTTTTTC*ATGTGCAATTAGTACAGACT(配列番号2)
Inv_Cm:TTTTTTTTTTTTTTTA*ATGTGCAATTAGTACAGACT(配列番号3)
Inv_B1:ATGGAAAATCCCCAACAATAG*(配列番号4)
【0204】
<実験例A1>
A1−1.オリゴヌクレオチドの調製
鋳型核酸として、配列番号1に示される塩基配列を有するオリゴヌクレオチドInv_Aと、第1オリゴヌクレオチドとして、配列番号2に示される塩基配列を有するオリゴヌクレオチドInv_Cw1と、第2オリゴヌクレオチドとして、配列番号4に示される配列を有するオリゴヌクレオチドInv_B1とについて、プロリゴ・ジャパン株式会社に合成を委託し、合成されたそれぞれのオリゴヌクレオチドを、DW(蒸留水)で100pmol/mlになるよう調製した。
【0205】
ここで、鋳型核酸Inv_Aの21番目の塩基をSNPとして想定する。第1オリゴヌクレオチドInv_Cw1が有する塩基配列(配列番号2)は、鋳型核酸が有する塩基配列(配列番号1)の1〜21番目の塩基配列に相補的な塩基配列と、フラップ配列(Poly-T12)とを有する。第2オリゴヌクレオチドInv_B1の塩基配列(配列番号4)は、鋳型核酸が有する塩基配列(配列番号1)の22〜32番目の塩基配列に相補的な塩基配列と、鋳型核酸と無関係な配列とを有する。
【0206】
A1−2.ダブルフラップ構造の形成及びフラップの切断
以下の成分をDW中に含む反応溶液7μlを調製した。
Inv_A(鋳型核酸)水溶液 0.5μl
Inv_Cw1(第1オリゴヌクレオチド)水溶液 1μl
Inv_B1(第2オリゴヌクレオチド)水溶液 1μl
Enzyme Mix(フラップエンドヌクレアーゼ) 0.3μl
Buffer(0.8g/ml PEG800、0.2mmol/ml MOPS) 0.3μl
なお、Enzyme Mixは、Invader DNA Assay (THIRD WAVE TECHNOLOGIES)のKitに含まれているものを使用した。
反応溶液7μlを、0.5mlマイクロチューブに入れ、さらに、蒸発を防ぐため、ミネラルオイルを反応液に重層した。サーマルサイクラーにマイクロチューブをセットし、95℃3分、60℃60分の反応を行なった。
【0207】
A1−3.マイクロチップ電気泳動装置によるフラップ切断の確認
反応終了後、マイクロチューブ内の反応溶液から1μlを取り出し、泳動バッファ50μlで希釈し、測定用サンプルとした。泳動バッファは、0.125×Tris-Borate-EDTA(TBE):ホルムアミドが3:1(v/v)の混合液を使用した。
調製された測定用サンプルを、MCE2010 レーザー誘起蛍光機(島津製作所製)を用いて、蛍光色素サイバーゴールド(モレキュラーブローブ社製)を用いた低分子分離用ゲルを用いて測定した。
【0208】
電気泳動の結果を図13(a)に示す。図13(a)においては、横軸は秒(sec)、縦軸は蛍光強度(mV)を示す(後述の図13(b)においても同じ)。図13(a)が示すように、13merのピーク(図中(i)の位置におけるピーク)及び20merのピーク(図中(ii) の位置におけるピーク)が検出された。これは、第1オリゴヌクレオチドInv_Cw1が切断されることにより、第1オリゴヌクレオチドInv_Cw1から、(Poly-T12)+(1塩基)の13merのフラップ断片と、残りの20merのオリゴヌクレオチド断片とが生成したためと考えられる。また、第1オリゴヌクレオチドInv_Cw1の33merのピーク(図中(iii) の位置におけるピーク)が消失していることからも、ダブルフラップ構造が認識されてフラップが切断されたと考えられる。
【0209】
<実験例A2>
第1オリゴヌクレオチドとして、配列番号3に示される塩基配列を有するオリゴヌクレオチドInv_Cm(プロリゴ・ジャパン株式会社に合成を委託)を用いたこと以外は、実験例A1の方法と同じ操作を行った。ここで、第1オリゴヌクレオチドInv_Cmが有する塩基配列(配列番号3)は、鋳型核酸が有する塩基配列(配列番号1)の1〜20番目の塩基配列に相補的な塩基配列と、21番目の塩基に相補的でない塩基と、フラップ配列(Poly-T15)とを有する。
【0210】
電気泳動の結果を図13(b)に示す。図13(b)が示すように、36merのピーク(図中(iii’) の位置におけるピーク)が検出された。すなわち、第1オリゴヌクレオチドInv_Cmがそのまま検出された。さらに、フラップ断片に相当する16merのピーク(図中(i’) の位置におけるピーク)と、第1オリゴヌクレオチドからフラップ断片が遊離した場合の残りのオリゴヌクレオチド断片に相当する20merのピーク(図中(ii) の位置におけるピーク)とは検出されなかった。このことから、Inv_Aの21番目の塩基がInv_Cmと相補的でないために、ダブルフラップ構造を形成することができず、認識サイトが存在しなかったため、酵素が働かなかったと考えられる。
【0211】
以上のように、実験例A1において、SNPがプローブと相補的であればフラップエンドヌクレアーゼによる反応が起こりSNPが検出され、一方、実験例A2において、SNPがプローブと相補的でなければフラップエンドヌクレアーゼによる反応が起こらないことが確認できた。これにより、SNPを判別することができたといえる。
【0212】
さらに、上記実験例A1及びA2において用いられる第1オリゴヌクレオチドがタグを有するものである場合は、以下のようにSNPの識別を行うことができる。
【0213】
上記実験例A1において、第1オリゴヌクレオチドInv_Cw1の、例えば3’末端に、捕捉可能なタグがついている場合は、以下のような結果が得られる。
上記A1−3.の工程の前にタグを捕捉する工程を行うことにより、第1オリゴヌクレオチドからフラップ断片が遊離して残った部分(すなわち図13(a)中(ii) 位置のピークとして検出されたオリゴヌクレオチド断片にタグが付いたもの)が除去される。このため、電気泳動の結果としては、多型の判断に不要なピーク(すなわち少なくとも図13(a)中(ii) 位置のピークに対応するもの)が検出されることなく、多型の判断に直接かかわるフラップ断片のピーク(すなわち図13(a)中(i)位置のピークに相当するもの)が検出される。このことにより、SNPが検出される。
【0214】
上記実験例A2において、第1オリゴヌクレオチドInv_Cmの、例えば3’末端に、捕捉可能なタグがついている場合は、以下のような結果が得られる。
上記A1−3.の工程の前にタグを捕捉する工程を行うことにより、未反応第1オリゴヌクレオチド(すなわち図13(b)中(iii’)位置のピークとして検出されたオリゴヌクレオチドにタグが付いたもの)が除去される。このため、電気泳動の結果としては、多型の判断に不要なピーク(すなわち少なくとも図13(b)中(iii’)位置のピークに対応するもの)も検出されない。
【0215】
以上のように、タグつき第1オリゴヌクレオチドを用いることによって、SNPの判別が可能であり、さらに、上記実験例A1及びA2において検出されたような不要なピークが検出されないため、SNPの判断をより容易に行うことができる。
【0216】
<実験例B>
以下に、実験例B1及び実験例B2で用いたオリゴヌクレオチドの配列を挙げる。右肩に*印を付している塩基は、多型部位として想定した塩基、又は、その塩基に対応する相補塩基又は非相補塩基である。
Inv_A:AGTCTGTACTAATTGCACATG*TATTGTTGGGGATTTTCCAT(配列番号1)
Inv_A40merA:AGTCTGTACTAATTGCACATG*TATTGTTGGGGAT(配列番号5)
Inv_Cw1:TTTTTTTTTTTTC*ATGTGCAATTAGTACAGACT(配列番号2)
Inv_Cm:TTTTTTTTTTTTTTTA*ATGTGCAATTAGTACAGACT(配列番号3)
Inv_B1:ATGGAAAATCCCCAACAATAG*(配列番号4)
【0217】
<実験例B1>
B1−1.オリゴヌクレオチドの調製
鋳型核酸として、配列番号1に示される塩基配列を有するオリゴヌクレオチドInv_Aと、第1オリゴヌクレオチドとして、配列番号2に示される塩基配列を有するオリゴヌクレオチドInv_Cw1と、第2オリゴヌクレオチドとして、配列番号4に示される配列を有するオリゴヌクレオチドInv_B1とについて、プロリゴ・ジャパン株式会社に合成を委託し、合成されたそれぞれのオリゴヌクレオチドを、DW(蒸留水)で100pmol/mlになるよう調製した。
【0218】
ここで、鋳型核酸Inv_Aの21番目の塩基をSNPとして想定する。第1オリゴヌクレオチドInv_Cw1が有する塩基配列(配列番号2)は、鋳型核酸が有する塩基配列(配列番号1)の1〜21番目の塩基配列に相補的な塩基配列と、フラップ配列(Poly-T12)とを有する。第2オリゴヌクレオチドInv_B1の塩基配列(配列番号4)は、鋳型核酸が有する塩基配列(配列番号1)の22〜32番目の塩基配列に相補的な塩基配列と、鋳型核酸と無関係な配列とを有する。
【0219】
B1−2.ダブルフラップ構造の形成及びフラップの切断
以下の成分をDW中に含む反応溶液7μlを調製した。
Inv_A(鋳型核酸)水溶液 0.5μl
Inv_Cw1(第1オリゴヌクレオチド)水溶液 1μl
Inv_B1(第2オリゴヌクレオチド)水溶液 1μl
Enzyme Mix(フラップエンドヌクレアーゼ) 0.3μl
Buffer(0.8g/ml PEG800、0.2mmol/ml MOPS) 0.3μl
なお、Enzyme Mixは、Invader DNA Assay (THIRD WAVE TECHNOLOGIES)のKitに含まれているものを使用した。
反応溶液7μlを、0.5mlマイクロチューブに入れ、さらに、蒸発を防ぐため、ミネラルオイルを反応液に重層した。サーマルサイクラーにマイクロチューブをセットし、95℃3分、60℃60分の反応を行なった。
【0220】
B1−3.質量分析装置によるフラップ断片の確認
反応終了後、マイクロチューブ内の反応溶液から2μlを取り出し、ZipTipC18で脱塩処理を行い、測定用サンプルとした。測定用サンプルは、MSプレート上に50v/v%アセトニトリル水溶液0.5μlで溶出した。さらに、マトリックス液として、3-HPA(3−ヒドロキシピコリン酸)溶液
(0.3M 3-HPA−0.07Mアンモニウムリン酸塩水溶液とアセトニトリルとの50v/v%溶液)を0.5μl重層した。測定は、AXIMA-CFR(島津製作所製)を用いて、Linear-Negativeモードで行った。
【0221】
得られたマススペクトルを図14(a)に示す。図14において、横軸は質量/電荷、縦軸は相対強度(%Int.)を示す。図14(a)が示すように、13merのピーク及び20merのピークが検出された。これは、第1オリゴヌクレオチドInv_Cw1が切断されることにより、第1オリゴヌクレオチドInv_Cw1から、(Poly-T12)+(1塩基:G)の13merのフラップ断片と、残りの20merのオリゴヌクレオチド断片とが生成したためと考えられる。また、図14(a)に示したスペクトルにおいては、第1オリゴヌクレオチドInv_Cw1に相当する33mer付近の質量/電荷の範囲は示されていないが、33merのピークは消失している。このことからも、ダブルフラップ構造が認識されてフラップが切断されたと考えられる。
【0222】
<実験例B2>
鋳型核酸として、配列番号5に示される塩基配列を有するオリゴヌクレオチドInv_A40merAと、第1オリゴヌクレオチドとして、配列番号3に示される塩基配列を有するオリゴヌクレオチドInv_Cm(いずれもプロリゴ・ジャパン株式会社に合成を委託)を用いたこと以外は、実験例B1の方法と同じ操作を行った。ここで、第1オリゴヌクレオチドInv_Cmが有する塩基配列(配列番号3)は、鋳型核酸が有する塩基配列(配列番号5)の1〜20番目の塩基配列に相補的な塩基配列と、21番目の塩基に相補的でない塩基と、フラップ配列(Poly-T15)とを有する。
【0223】
得られたマススペクトルを図14(b)に示す。図14(b)が示すように、フラップ断片に相当する16merのピークと、第1オリゴヌクレオチドからフラップ断片が遊離した場合の残りのオリゴヌクレオチド断片に相当する20merのピークとは検出されなかった。また、図14(b)に示したスペクトルにおいては、第1オリゴヌクレオチドInv_Cmに相当する36mer付近の質量/電荷の範囲は示されていないが、36merのピークが検出されている。このことから、Inv_A40merAの21番目の塩基がInv_Cmと相補的でないために、ダブルフラップ構造を形成することができず、認識サイトが存在しなかったため、酵素が働かなかったと考えられる。
【0224】
以上のように、実験例B1において、SNPがプローブと相補的であればフラップエンドヌクレアーゼによる反応が起こりSNPが検出され、一方、実験例B2において、SNPがプローブと相補的でなければフラップエンドヌクレアーゼによる反応が起こらないことが確認できた。これにより、SNPを判別することができたといえる。
【0225】
さらに、上記実験例B1及びB2において用いられる第1オリゴヌクレオチドがタグを有するものである場合は、以下のようにSNPの識別を行うことができる。
【0226】
上記実験例B1において、第1オリゴヌクレオチドInv_Cw1の、例えば3’末端に、捕捉可能なタグが付いている場合は、以下のような結果が得られる。
上記B1−3.の工程の前にタグを捕捉する工程を行うことにより、第1オリゴヌクレオチドからフラップ断片が遊離して残った部分(すなわち図14(a)中20merのピークとして検出されたオリゴヌクレオチド断片にタグが付いたもの)が除去される。このため、質量分析の結果としては、多型の判断に不要なピーク(すなわち少なくとも図14(a)中20merのピークに対応するもの)も検出されることなく、多型の判断に直接かかわるフラップ断片のピーク(図14(a)中13merのピークに相当するもの)が検出される。このことにより、SNPが検出される。
【0227】
上記実験例B2において、第1オリゴヌクレオチドInv_Cmの、例えば3’末端に、捕捉可能なタグが付いている場合は、以下のような結果が得られる。
上記B1−3.の工程の前にタグを捕捉する工程を行うことにより、未反応第1オリゴヌクレオチド(すなわち上記実験例B2での36merのピークとして検出されたオリゴヌクレオチドにタグが付いたもの)が除去される。このため、質量分析の結果としては、多型の判断に不要なピーク(すなわち少なくとも上記実験例B2での36merのピークに対応するもの)も検出されない。
【0228】
以上のように、タグつき第1オリゴヌクレオチドを用いることによって、SNPの判別が可能であり、さらに、上記実験例B1及びB2において検出されたような不要なピークが検出されないため、SNPの判断をより容易に行うことができる。
【0229】
<実験例C>
<実験例C1:反応系の確認>
以下に、本実験例で用いたオリゴヌクレオチドの配列を挙げる。右肩に*印を付している塩基は、多型部位として想定した塩基、又はその塩基に対応する相補塩基又は非相補塩基である。
Inv_A_C:AGTCTGTACTAATTGCACATC*TATTGTTGGGGATTTTCCAT(配列番号6)
Inv_FCwC:CGCGCCGAGGG*ATGTGCAATTAGTACAGACT(配列番号7)
Inv_B1_T:ATGGAAAATCCCCAACAATAT*(配列番号8)
InvFR_w:TCTCGTCTCGGTTTTCCGAGACCTCGGCGCG(配列番号9)
【0230】
C1−1.ダブルフラップ構造を構成するオリゴヌクレオチドの合成
鋳型核酸として、配列番号6に示される塩基配列を有するオリゴヌクレオチドInv_A_Cと、第1オリゴヌクレオチドとして、配列番号7に示される塩基配列を有し且つ5’ 末端がCy5で標識されたオリゴヌクレオチドInv_FCwCと、第2オリゴヌクレオチドとして、配列番号8の塩基配列を有するオリゴヌクレオチドInv_B1_Tと、第3オリゴヌクレオチドとして、配列番号9に示される塩基配列を有し且つ3’ 末端をフルオレセインで標識されたオリゴヌクレオチドInvFR_wとについて、プロリゴ・ジャパン株式会社に合成を委託し、合成されたそれぞれのオリゴヌクレオチドを、DW(蒸留水)で100pmol/mlになるように調製した。
【0231】
ここで、鋳型核酸Inv_A_Cの21番目の塩基をSNPとして想定する。第1オリゴヌクレオチドInv_FCwCが有する塩基配列(配列番号7)は、11〜31番目の塩基配列として、鋳型核酸が有する塩基配列(配列番号6)の1〜21番目の塩基配列と相補的な塩基配列、及び、1〜10番目の塩基配列としてフラップ配列を有する。第2オリゴヌクレオチドInv_B1_Tの塩基配列(配列番号8)は、鋳型核酸が有する塩基配列(配列番号6)の22番目以降の塩基配列と相補的な塩基配列、及び、鋳型核酸と無関係な塩基を有する。第3オリゴヌクレオチドInvFR_wの塩基配列(配列番号9)は、22〜31番目の塩基配列として、第1オリゴヌクレオチドにおける1〜10番目のフラップ配列と相補的な塩基配列を有する。
【0232】
C1−2.FRET(蛍光共鳴エネルギー移動)による蛍光シグナルの確認
Cy5で標識されたInv_FCwCと、フルオレセインで標識されたInvFR_wとを等量混合した混合試料をポジティブコントロール、フルオレセインで標識されたInvFR_wの単独試料をネガティブコントロールとし、それぞれについて、分光蛍光光度計(RF-5300PC:島津製作所製)を用いた測定を行った。励起波長486nmとし、蛍光強度をスキャンニングしたものを図15に示した。図15において、横軸は蛍光波長(nm)、縦軸は蛍光強度を示す。図15が示すように、ネガティブコントロール(Negative)では、490nm付近で蛍光スペクトルのピークがあるのに対し、ポジティブコントロール(Positive)では、490nm付近の蛍光スペクトルのピークが消失し、630nm付近に蛍光スペクトルのピークが出現している。
【0233】
C1−3.ダブルフラップ構造の形成、フラップの切断、及びシグナル検出
以下の成分をDW中に含む反応溶液3μlを調製した。
Inv_A_C(鋳型核酸) 20pM
Inv_FCwC(第1オリゴヌクレオチド) 20nM
Inv_B1_T(第2オリゴヌクレオチド) 20pM
InvFR_w(第3オリゴヌクレオチド) 20nM
Enzyme Mix(フラップエンドヌクレアーゼ) 0.15μl
Buffer(0.04mg/ml PEG6000, 0.2mmol/ml MOPS, 10mM MgCl2)0.15μl
なお、Enzyme Mixは、Invader DNA Assay (THIRD WAVE TECHNOLOGIES)のKitに含まれているものを使用した。
【0234】
反応溶液3μlを、0.5mlマイクロチューブに入れ、さらに、蒸発を防ぐため、ミネラルオイルを反応溶液に重層した。リアルタイムPCR装置MX-3000p(Stratagene社製)にマイクロチューブをセットし、95℃3分の処理後、60℃で反応を行った。10秒毎に一回の測定を行った。
【0235】
C1−4.特異性の確認
上記C1−3.の反応溶液から酵素及び/又は鋳型を除いた反応溶液を、比較用に調製した。すなわち、反応系A用に、Inv_A_CとEnzyme Mixとを除いた以外は上記C1−3.と同様の反応溶液3μlを、反応系B用に、Enzyme Mixを除いた以外は上記C1−3.と同様の反応溶液3μlを、及び、反応系C用に、Inv_A_Cを除いた以外は上記C1−3.と同様の反応溶液3μlを調製した。それぞれ、0.5mlマイクロチューブに加え、さらに、蒸発を防ぐため、ミネラルオイルを反応溶液に重層した。リアルタイムPCR装置MX-3000p(Stratagene社製)にマイクロチューブをセットし、95℃3分の処理後、60℃で反応を行った。励起波長495nm /蛍光波長520nmで、10秒毎に一回の測定を行った。
【0236】
上記C1−3.を反応系Dとし、反応系Dと、上記C1−4.の比較用の反応系A、B及びCとについて、MX-3000pによる測定で得られたシグナルをプロットした結果を、図16及び図17に示す。図16及び図17において、横軸は時間(サイクル(cycle)として表示)、縦軸は蛍光強度を示す。図16は、反応系C及びDについて、FITCの蛍光強度の経時変化を示しており、測定条件は、励起波長492nm/蛍光波長520nm:FITCである。図17は、反応系A、B、C及びDについて、FITCの蛍光強度の経時変化を示しており、測定条件は、励起波長492nm/蛍光波長520nm:FITCである。
【0237】
図16では、反応系CのシグナルとDのシグナルとの間で少しの差が見られる程度であるが、特に図17において、経時変化に伴い若干の蛍光強度の下降を示した反応系Dのシグナルは、経時変化に伴い若干の蛍光強度の上昇を示した他の反応系のシグナルと比較して、明らかに異なる挙動を示していることから、上記C1−3.の反応系の特異性が確認できた。
【0238】
<実験例C2:SNP部位認識の特異性確認>
以下に、本実験例で用いたオリゴヌクレオチドの配列を挙げる。右肩に*印を付している塩基は、多型部位として想定した塩基、又はその塩基に対応する相補塩基又は非相補塩基である。
Inv_A_C:AGTCTGTACTAATTGCACATC*TATTGTTGGGGATTTTCCAT(配列番号6)
Inv_A40merA_T:AGTCTGTACTAATTGCACATT*TATTGTTGGGGATTTTCCAT(配列番号10)
Inv_A50mer:AAAAGTTTACAGTCTGTACTAATTGCACATG*TATTGTTGGGGATTTTCCATGTTTTCTAAA(配列番号11)
Inv_FCwC:CGCGCCGAGGG*ATGTGCAATTAGTACAGACT(配列番号7)
Inv_B1_T:ATGGAAAATCCCCAACAATAT*(配列番号8)
InvFR_w:TCTCGTCTCGGTTTTCCGAGACCTCGGCGCG(配列番号9)
【0239】
C2−1.特異性確認のためのオリゴヌクレオチドの合成
鋳型核酸として、配列番号6に示される塩基配列を有するオリゴヌクレオチドInv_A_C、配列番号10に示される塩基配列を有するオリゴヌクレオチドInv_A40merA_T、及び配列番号11に示される塩基配列を有するオリゴヌクレオチドInv_A50merと、第1オリゴヌクレオチドとして、配列番号7に示される塩基配列を有し且つ5’ 末端がCy5で標識されたオリゴヌクレオチドInv_FCwCと、第2オリゴヌクレオチドとして、配列番号8の塩基配列を有するオリゴヌクレオチドInv_B1_Tと、第3オリゴヌクレオチドとして、配列番号9に示される塩基配列を有し且つ3’ 末端をフルオレセインで標識されたオリゴヌクレオチドInvFR_wとについて、プロリゴ・ジャパン株式会社に合成を委託し、合成されたそれぞれのオリゴヌクレオチドを、DW(蒸留水)で100pmol/mlになるように調製した。
【0240】
ここで、鋳型核酸Inv_A_Cの21番目の塩基CをSNPとして想定する。鋳型核酸Inv_A40merA_Tは、21番目の塩基を鋳型核酸Inv_A_CのSNP(C)と異なるSNP(T)として想定する。鋳型核酸Inv_A50merは、31番目の塩基を、鋳型核酸Inv_A_CのSNP(C)及び鋳型核酸Inv_A40merA_TのSNP(T)のいずれとも異なるSNP(G)として想定するとともに、1〜10番目の塩基配列及び52〜61番目の塩基配列がさらに加わった配列としている。
【0241】
C2−2.ダブルフラップ構造の切断とシグナル検出
以下の成分をDW中に含む反応溶液3μlを、反応系F、G及びH構築用にそれぞれ調製した。
(鋳型核酸) 20pM
Inv_FCwC(第1オリゴヌクレオチド) 20nM
Inv_B1_T(第2オリゴヌクレオチド) 20pM
InvFR_w(第3オリゴヌクレオチド) 20nM
Enzyme Mix(フラップエンドヌクレアーゼ) 0.15μl
Buffer(0.04mg/ml PEG6000, 0.2mmol/ml MOPS, 10mM MgCl2)0.15μl
なお、Enzyme Mixは、Invader DNA Assay (THIRD WAVE TECHNOLOGIES)のKitに含まれているものを使用した。
具体的には、反応系F構築用反応溶液には、鋳型核酸として、Inv_A_CとInv_A40merA_Tとの等量混合物を用い、反応系G構築用反応溶液には、鋳型核酸として、Inv_A_CとInv_A50merとの等量混合物を用い、反応系H構築用反応溶液には、鋳型核酸として、Inv_A40merA_TとInv_A50merとの等量混合物を用いた。
さらに別途、反応系E(比較用)構築用に、鋳型核酸を加えない以外は上記と同じ組成の反応溶液を調製した。
【0242】
反応溶液3μlを、0.5mlマイクロチューブに入れ、さらに、蒸発を防ぐため、ミネラルオイルを反応溶液に重層した。リアルタイムPCR装置MX-3000p(Stratagene社製)にマイクロチューブをセットし、95℃3分の処理後、60℃で反応を行った。上記実験例C1のC1−4.で、本発明の反応系と比較用の反応系との差が明らかであった、励起波長492nm/蛍光波長520nm:FITCの条件で、10秒毎に一回の測定を行った。
【0243】
反応系E(比較用)、F、G及びHについて、MX-3000pによる測定で得られたシグナルをプロットした結果を、図18に示す。図18において、横軸は時間(サイクル(cycle)として表示)、縦軸は蛍光強度を示す。
【0244】
C2−3.特異性の確認
SNP部位においてInvF_CwCに相補的な塩基を持つInv_A_Cを鋳型とした反応系F及びGにおいては、2サイクル目まで蛍光強度の上昇がみられるものの、3サイクル以降、明らかなシグナルの減少が確認できた。それに対し、Inv_A_Cを鋳型として含まない反応系、すなわちSNP部位においてInvF_CwCに非相補的な塩基を持つInv_A40merA_T及びInv_A50merを鋳型とした反応系Hや、鋳型を含まない反応系Eにおいては、反応系F及びGで見られたような蛍光強度の下降が見られなかった。このことから、本実験例において、一塩基の違いを認識することができたと考えられる。
【0245】
上記実験例C2における第1オリゴヌクレオチドがタグを有するものである場合は、以下のようにしてSNPの識別を行うことができる。
第1オリゴヌクレオチドInv_FCwCの、例えば3’末端に、捕捉可能なタグが付いていることと、第3オリゴヌクレオチドInvFR_wが除かれること以外は上記C2−2.の反応溶液(反応系E、F、G及びH)と同様の反応溶液(それぞれ反応系E’、F’、G’及びH’とする)を調製する。
【0246】
ここで、反応系E’は、余剰の第1オリゴヌクレオチドが存在する場合に相当し;反応系F’及びG’は、フラップエンドヌクレアーゼによる認識反応によりフラップ断片が遊離する場合に相当し;反応系H’は、当該認識反応が起こらずフラップ断片が遊離しないため、鋳型核酸にハイブリダイズした未反応第1オリゴヌクレオチドが存在する場合に相当する。
【0247】
調製した反応溶液について、それぞれ、上記C2−2.と同じ条件で反応を行う。反応後、捕捉手段を用いてタグを捕捉する工程を行う。捕捉手段を除去した後、第3オリゴヌクレオチドInvFR_wを加え、60℃で反応を行う。リアルタイムPCR装置MX-3000p(Stratagene社製)を使用し、励起波長492nm/蛍光波長520nm:FITCの条件で60℃、10秒ごとに一回の測定を行う。もしくは、別の温調装置で、60℃で10分反応後、蛍光プレートリーダなどを用い、励起波長492nm/蛍光波長520nm:FITCの条件で測定する。
【0248】
MX-3000pを使用した場合、C2−3.と同様の反応が起こる。この際、シグナルの減少はC2−3.の場合に比較して、より大きくなることが期待される。E'及びH'のシグナル強度に比較して、F'及びG'のシグナルは経時的に低くなり、その差はC2−3.の結果と較べてもより大きい。同様に、蛍光プレートリーダによる測定でも、十分に差が認識できると予想される。
【0249】
以上のように、タグつき第1オリゴヌクレオチドを用いることによって、SNPの判別が可能であり、さらに、上記C2−3.では、蛍光強度の差が小さいためにシグナル観察を反応中に経時的に行う必要性があることに対し、そのような必要性がなくなる。このため、SNPの判断をより容易に、且つ簡便な装置で行うことが出来る。
【図面の簡単な説明】
【0250】
【図1】本発明の鋳型核酸、第1オリゴヌクレオチド及び第2オリゴヌクレオチドが3本鎖構造体を形成したときの一例を示した模式図(a)、及び、当該第1オリゴヌクレオチドが蛍光エネルギー供与体を有している場合に3本鎖構造体を形成したときの一例を示した模式図(b)である。
【図2】第1オリゴヌクレオチドとして設計したオリゴヌクレオチドが多型部位において鋳型核酸とマッチすることにより形成した本発明の3本鎖構造体の模式図(a)、3本鎖構造体がフラップエンドヌクレアーゼによって切断反応を受け、フラップ断片が遊離した様子を示す模式図(b)、及び、タグが捕捉される様子を示す模式図(c)である。
【図3】第1オリゴヌクレオチドとして設計したオリゴヌクレオチドが多型部位において鋳型核酸とマッチしない場合を表した模式図(a)、及び、タグが捕捉される様子を示す模式図(b)である。
【図4】SNPとしてTが検出される場合を表した模式図(a)、及び、SNPとしてCが検出される場合を表した模式図(b)である。
【図5】フラップ断片を直接検出することによる本発明の形態における、第1オリゴヌクレオチド(a)、各第1オリゴヌクレオチド及び第2オリゴヌクレオチドの鋳型核酸へのハイブリダイズ(b)、及び、タグを捕捉する手段による、遊離したフラップ断片とタグを有する核酸種との分離(c)を示した模式図である。
【図6】図5において第1オリゴヌクレオチドが蛍光物質を有していた場合における、タグを捕捉する手段による、遊離したフラップ断片とタグを有する核酸種との分離を示した模式図である。
【図7】蛍光エネルギー供与体の蛍光強度の減衰に基づいて多型検出を行う本発明の形態における、蛍光エネルギー供与体を有する第1オリゴヌクレオチド(a)、各第1オリゴヌクレオチド及び第2オリゴヌクレオチドの鋳型核酸へのハイブリダイズ(b)、タグを捕捉する手段による、遊離したフラップ断片とタグを有する核酸種との分離(c)、及び、フラップ断片と第3オリゴヌクレオチドとのハイブリダイズによる蛍光発光(d)を表した模式図である。
【図8】蛍光エネルギー受容体の蛍光強度の増強に基づいて多型検出を行う本発明の形態における、蛍光エネルギー供与体を有する第1オリゴヌクレオチド(a)、各第1オリゴヌクレオチド及び第2オリゴヌクレオチドの鋳型核酸へのハイブリダイズ(b)、及びフラップ断片と第3オリゴヌクレオチドとのハイブリダイズによる蛍光発光(c)を表した模式図である。
【図9】蛍光エネルギー供与体の蛍光強度の減衰に基づいて多型検出を行う本発明の形態における、蛍光エネルギー受容体を有する第1オリゴヌクレオチド(a)、各第1オリゴヌクレオチド及び第2オリゴヌクレオチドの鋳型核酸へのハイブリダイズ(b)、及びフラップ断片と第3オリゴヌクレオチドとのハイブリダイズによる蛍光発光(c)を表した模式図である。
【図10】蛍光エネルギー受容体の蛍光強度の増強に基づいて多型検出を行う本発明の形態における、蛍光エネルギー受容体を有する第1オリゴヌクレオチド(a)、各第1オリゴヌクレオチド及び第2オリゴヌクレオチドの鋳型核酸へのハイブリダイズ(b)、及びフラップ断片と第3オリゴヌクレオチドとのハイブリダイズによる蛍光発光(c)を表した模式図である。
【図11】固体支持体上の位置に基づいて多型検出を行う本発明の形態における、蛍光エネルギー供与体を有する第1オリゴヌクレオチド(a)、各第1オリゴヌクレオチド及び第2オリゴヌクレオチドの鋳型核酸へのハイブリダイズ(b)、及びフラップ断片と第3オリゴヌクレオチドとのハイブリダイズによる蛍光発光(c)を表した模式図である。
【図12】固体支持体上の位置に基づいて多型検出を行う本発明の形態における、蛍光エネルギー受容体を有する第1オリゴヌクレオチド(a)、各第1オリゴヌクレオチド及び第2オリゴヌクレオチドの鋳型核酸へのハイブリダイズ(b)、及びフラップ断片と第3オリゴヌクレオチドとのハイブリダイズによる蛍光発光(c)を表した模式図である。
【図13】実験例A1において得られた電気泳動の結果(a)及び実験例A2において得られた電気泳動の結果(b)である。
【図14】実験例B1において得られたマススペクトル(a)及び実験例B2において得られたマススペクトル(b)である。
【図15】実験例C1で得られた、FITCを有するオリゴヌクレオチド及びCy5を有するオリゴヌクレオチドの混合試料(Positive)と、FITCを有するオリゴヌクレオチドの単独試料(Negative)との蛍光スペクトルである。
【図16】実験例C1で得られた、反応系Cと反応系Dとについて、FITCの蛍光強度の経時変化を示すグラフである。
【図17】実験例C1で得られた、反応系A、B及びCと、反応系Dとについて、FITCの蛍光強度の経時変化を示すグラフである。
【図18】実験例C2で得られた、反応系Eと、反応系F及びGと、反応系Hとについて、FITCの蛍光強度の経時変化を示すグラフである。
【配列表フリーテキスト】
【0251】
配列番号1〜11は、合成オリゴヌクレオチドである。
【特許請求の範囲】
【請求項1】
(i)特定の配列として、第1領域、第2領域及び第3領域からなる配列であって、前記第1領域は前記第2領域に隣接した下流に位置し、前記第2領域は検出すべき多型の塩基から構成され且つ前記第3領域に隣接した下流に位置する特定の配列を有する、試料中の特定の核酸に、
第1オリゴヌクレオチドとして、前記第3領域に相補的な配列、前記第2領域に相補的な配列、前記特定の配列と相補性のないフラップ配列、及び前記第3領域に相補的な配列において捕捉可能なタグを有するオリゴヌクレオチドであって、前記第3領域に相補的な配列は前記第2領域に相補的な配列に隣接した下流に位置し、前記第2領域に相補的な配列は前記フラップ配列に隣接した下流に位置するオリゴヌクレオチドと、
第2オリゴヌクレオチドとして、前記第1領域に相補的な配列、及び任意の配列を有するオリゴヌクレオチドであって、前記任意の配列は前記第1領域に相補的な配列に隣接した下流に位置するオリゴヌクレオチドとを、ハイブリダイズさせることによって、3本鎖構造体を形成させる工程と、
(ii)前記3本鎖構造体の3重鎖部分をフラップエンドヌクレアーゼに認識させることにより前記フラップ配列を含む核酸断片を遊離させる工程と、
(iii)前記捕捉可能なタグを捕捉する手段を用いることによって、前記遊離した核酸断片を精製する工程と、
(iv)前記遊離した核酸断片を検出することによって前記多型を検出する工程とを含む、遺伝子多型検出法。
【請求項2】
前記第1オリゴヌクレオチドが有する前記タグは、前記第1オリゴヌクレオチドの3´末端に位置する、請求項1に記載の遺伝子多型検出法。
【請求項3】
さらに、前記第2オリゴヌクレオチドが捕捉可能なタグを有する、請求項1又は2に記載の遺伝子多型検出法。
【請求項4】
前記捕捉可能なタグは、ビオチンタグ、ヒスチジンタグ、ストレプトアビジンタグ、FLAGタグ、GSTタグ、MBPタグからなる群から選ばれる、請求項1〜3のいずれか1項に記載の遺伝子多型検出法。
【請求項5】
前記工程(iv)において、前記核酸断片を、電気泳動装置を用いて検出する、請求項1〜4のいずれか1項に記載の遺伝子多型検出法。
【請求項6】
前記工程(i)において、前記第1オリゴヌクレオチドとして、前記多型のアレルのそれぞれに応じて異なる前記フラップ配列を有するように設計されたオリゴヌクレオチドを用いる、請求項5に記載の遺伝子多型検出法。
【請求項7】
前記試料中に検出すべき多型部位が複数箇所存在し、前記工程(i)において、前記第1オリゴヌクレオチドとして、前記複数の検出すべき多型のそれぞれに応じて異なる前記フラップ配列を有するように設計されたオリゴヌクレオチドを用いる、請求項5又は6に記載の遺伝子多型検出法。
【請求項8】
前記異なるフラップ配列はそれぞれ互いに長さにおいて異なる、請求項6又は7に記載の遺伝子多型検出法。
【請求項9】
前記工程(i)において、前記第1オリゴヌクレオチドとして、前記フラップ配列において蛍光物質をさらに有するオリゴヌクレオチドを用い、
前記工程(iv)において、前記蛍光物質に基づいて前記遊離した核酸断片を検出する、請求項5〜8のいずれか1項に記載の遺伝子多型検出法。
【請求項10】
前記蛍光物質は、前記第1オリゴヌクレオチドの5´末端に位置する、請求項9に記載の遺伝子多型検出法。
【請求項11】
前記工程(iv)において、前記核酸断片を、質量分析装置を用いて検出する、請求項1〜4のいずれか1項に記載の遺伝子多型検出法。
【請求項12】
前記質量分析装置がマトリックス介助レーザー脱離イオン化(MALDI)/飛行時間型(TOF)マススペクトロメトリーである、請求項11に記載の遺伝子多型検出法。
【請求項13】
前記工程(i)において、前記第1オリゴヌクレオチドとして、前記多型のアレルのそれぞれに応じて異なる前記フラップ配列を有するように設計されたオリゴヌクレオチドを用いる、請求項11又は12に記載の遺伝子多型検出法。
【請求項14】
前記試料中に検出すべき多型部位が複数箇所存在し、前記工程(i)において、前記第1オリゴヌクレオチドとして、前記複数の検出すべき多型部位のそれぞれに応じて異なる前記フラップ配列を有するように設計されたオリゴヌクレオチドを用いる、請求項11〜13のいずれか1項に記載の遺伝子多型検出法。
【請求項15】
前記異なるフラップ配列は、それぞれ互いに長さにおいて異なる、請求項13又は14に記載の遺伝子多型検出法。
【請求項16】
前記工程(iv)において、第3オリゴヌクレオチドとして、前記フラップ配列と相補的な配列を有するオリゴヌクレオチドを用い、前記第3オリゴヌクレオチドと前記遊離した核酸断片とをハイブリダイズさせることによって2本鎖構造を形成させ、前記2本鎖構造を検出することによって前記遊離した核酸断片を検出する、請求項1〜4のいずれか1項に記載の遺伝子多型検出法。
【請求項17】
前記工程(i)において、第1オリゴヌクレオチドとして、前記フラップ配列において蛍光エネルギー供与体又は蛍光エネルギー受容体をさらに有するオリゴヌクレオチドを用い、
前記工程(iv)において、
前記第1オリゴヌクレオチドにおける前記フラップ配列が蛍光エネルギー供与体を有する場合、第3オリゴヌクレオチドとして、蛍光エネルギー受容体をさらに有するオリゴヌクレオチドと、前記遊離した核酸断片とをハイブリダイズさせることによって2本鎖構造を形成させるか、又は、
前記第1オリゴヌクレオチドにおける前記フラップ配列が蛍光エネルギー受容体を有する場合、第3オリゴヌクレオチドとして、蛍光エネルギー供与体をさらに有するオリゴヌクレオチドと、前記遊離した核酸断片とをハイブリダイズさせることによって2本鎖構造を形成させ、
前記2本鎖構造において、前記蛍光エネルギー供与体と前記蛍光エネルギー受容体とが近接することにより発せられる蛍光に基づいて、前記2本鎖構造を検出する、請求項16に記載の遺伝子多型検出方法。
【請求項18】
前記第1オリゴヌクレオチドにおける前記フラップ配列が蛍光エネルギー供与体を有する場合、前記蛍光エネルギー供与体は前記フラップ配列の5´末端に位置し、前記蛍光エネルギー受容体は前記第3オリゴヌクレオチドの3´末端に位置し、
前記第1オリゴヌクレオチドにおける前記フラップ配列が蛍光エネルギー受容体を有する場合、前記蛍光エネルギー受容体は前記フラップ配列の5´末端に位置し、前記蛍光エネルギー供与体は前記第3オリゴヌクレオチドの3´末端に位置する、請求項17に記載の遺伝子多型検出方法。
【請求項19】
前記蛍光エネルギー供与体又は前記蛍光エネルギー受容体の蛍光の変化を測定することによって、前記多型を検出する、請求項17又は18に記載の遺伝子多型検出方法。
【請求項20】
前記第1オリゴヌクレオチド及び前記第3オリゴヌクレオチドが、前記蛍光エネルギー供与体と前記蛍光エネルギー受容体との組み合わせが前記多型のアレルのそれぞれに応じて異なるように設計されている、請求項17〜19のいずれか1項に記載の遺伝子多型検出方法。
【請求項1】
(i)特定の配列として、第1領域、第2領域及び第3領域からなる配列であって、前記第1領域は前記第2領域に隣接した下流に位置し、前記第2領域は検出すべき多型の塩基から構成され且つ前記第3領域に隣接した下流に位置する特定の配列を有する、試料中の特定の核酸に、
第1オリゴヌクレオチドとして、前記第3領域に相補的な配列、前記第2領域に相補的な配列、前記特定の配列と相補性のないフラップ配列、及び前記第3領域に相補的な配列において捕捉可能なタグを有するオリゴヌクレオチドであって、前記第3領域に相補的な配列は前記第2領域に相補的な配列に隣接した下流に位置し、前記第2領域に相補的な配列は前記フラップ配列に隣接した下流に位置するオリゴヌクレオチドと、
第2オリゴヌクレオチドとして、前記第1領域に相補的な配列、及び任意の配列を有するオリゴヌクレオチドであって、前記任意の配列は前記第1領域に相補的な配列に隣接した下流に位置するオリゴヌクレオチドとを、ハイブリダイズさせることによって、3本鎖構造体を形成させる工程と、
(ii)前記3本鎖構造体の3重鎖部分をフラップエンドヌクレアーゼに認識させることにより前記フラップ配列を含む核酸断片を遊離させる工程と、
(iii)前記捕捉可能なタグを捕捉する手段を用いることによって、前記遊離した核酸断片を精製する工程と、
(iv)前記遊離した核酸断片を検出することによって前記多型を検出する工程とを含む、遺伝子多型検出法。
【請求項2】
前記第1オリゴヌクレオチドが有する前記タグは、前記第1オリゴヌクレオチドの3´末端に位置する、請求項1に記載の遺伝子多型検出法。
【請求項3】
さらに、前記第2オリゴヌクレオチドが捕捉可能なタグを有する、請求項1又は2に記載の遺伝子多型検出法。
【請求項4】
前記捕捉可能なタグは、ビオチンタグ、ヒスチジンタグ、ストレプトアビジンタグ、FLAGタグ、GSTタグ、MBPタグからなる群から選ばれる、請求項1〜3のいずれか1項に記載の遺伝子多型検出法。
【請求項5】
前記工程(iv)において、前記核酸断片を、電気泳動装置を用いて検出する、請求項1〜4のいずれか1項に記載の遺伝子多型検出法。
【請求項6】
前記工程(i)において、前記第1オリゴヌクレオチドとして、前記多型のアレルのそれぞれに応じて異なる前記フラップ配列を有するように設計されたオリゴヌクレオチドを用いる、請求項5に記載の遺伝子多型検出法。
【請求項7】
前記試料中に検出すべき多型部位が複数箇所存在し、前記工程(i)において、前記第1オリゴヌクレオチドとして、前記複数の検出すべき多型のそれぞれに応じて異なる前記フラップ配列を有するように設計されたオリゴヌクレオチドを用いる、請求項5又は6に記載の遺伝子多型検出法。
【請求項8】
前記異なるフラップ配列はそれぞれ互いに長さにおいて異なる、請求項6又は7に記載の遺伝子多型検出法。
【請求項9】
前記工程(i)において、前記第1オリゴヌクレオチドとして、前記フラップ配列において蛍光物質をさらに有するオリゴヌクレオチドを用い、
前記工程(iv)において、前記蛍光物質に基づいて前記遊離した核酸断片を検出する、請求項5〜8のいずれか1項に記載の遺伝子多型検出法。
【請求項10】
前記蛍光物質は、前記第1オリゴヌクレオチドの5´末端に位置する、請求項9に記載の遺伝子多型検出法。
【請求項11】
前記工程(iv)において、前記核酸断片を、質量分析装置を用いて検出する、請求項1〜4のいずれか1項に記載の遺伝子多型検出法。
【請求項12】
前記質量分析装置がマトリックス介助レーザー脱離イオン化(MALDI)/飛行時間型(TOF)マススペクトロメトリーである、請求項11に記載の遺伝子多型検出法。
【請求項13】
前記工程(i)において、前記第1オリゴヌクレオチドとして、前記多型のアレルのそれぞれに応じて異なる前記フラップ配列を有するように設計されたオリゴヌクレオチドを用いる、請求項11又は12に記載の遺伝子多型検出法。
【請求項14】
前記試料中に検出すべき多型部位が複数箇所存在し、前記工程(i)において、前記第1オリゴヌクレオチドとして、前記複数の検出すべき多型部位のそれぞれに応じて異なる前記フラップ配列を有するように設計されたオリゴヌクレオチドを用いる、請求項11〜13のいずれか1項に記載の遺伝子多型検出法。
【請求項15】
前記異なるフラップ配列は、それぞれ互いに長さにおいて異なる、請求項13又は14に記載の遺伝子多型検出法。
【請求項16】
前記工程(iv)において、第3オリゴヌクレオチドとして、前記フラップ配列と相補的な配列を有するオリゴヌクレオチドを用い、前記第3オリゴヌクレオチドと前記遊離した核酸断片とをハイブリダイズさせることによって2本鎖構造を形成させ、前記2本鎖構造を検出することによって前記遊離した核酸断片を検出する、請求項1〜4のいずれか1項に記載の遺伝子多型検出法。
【請求項17】
前記工程(i)において、第1オリゴヌクレオチドとして、前記フラップ配列において蛍光エネルギー供与体又は蛍光エネルギー受容体をさらに有するオリゴヌクレオチドを用い、
前記工程(iv)において、
前記第1オリゴヌクレオチドにおける前記フラップ配列が蛍光エネルギー供与体を有する場合、第3オリゴヌクレオチドとして、蛍光エネルギー受容体をさらに有するオリゴヌクレオチドと、前記遊離した核酸断片とをハイブリダイズさせることによって2本鎖構造を形成させるか、又は、
前記第1オリゴヌクレオチドにおける前記フラップ配列が蛍光エネルギー受容体を有する場合、第3オリゴヌクレオチドとして、蛍光エネルギー供与体をさらに有するオリゴヌクレオチドと、前記遊離した核酸断片とをハイブリダイズさせることによって2本鎖構造を形成させ、
前記2本鎖構造において、前記蛍光エネルギー供与体と前記蛍光エネルギー受容体とが近接することにより発せられる蛍光に基づいて、前記2本鎖構造を検出する、請求項16に記載の遺伝子多型検出方法。
【請求項18】
前記第1オリゴヌクレオチドにおける前記フラップ配列が蛍光エネルギー供与体を有する場合、前記蛍光エネルギー供与体は前記フラップ配列の5´末端に位置し、前記蛍光エネルギー受容体は前記第3オリゴヌクレオチドの3´末端に位置し、
前記第1オリゴヌクレオチドにおける前記フラップ配列が蛍光エネルギー受容体を有する場合、前記蛍光エネルギー受容体は前記フラップ配列の5´末端に位置し、前記蛍光エネルギー供与体は前記第3オリゴヌクレオチドの3´末端に位置する、請求項17に記載の遺伝子多型検出方法。
【請求項19】
前記蛍光エネルギー供与体又は前記蛍光エネルギー受容体の蛍光の変化を測定することによって、前記多型を検出する、請求項17又は18に記載の遺伝子多型検出方法。
【請求項20】
前記第1オリゴヌクレオチド及び前記第3オリゴヌクレオチドが、前記蛍光エネルギー供与体と前記蛍光エネルギー受容体との組み合わせが前記多型のアレルのそれぞれに応じて異なるように設計されている、請求項17〜19のいずれか1項に記載の遺伝子多型検出方法。
【図1】


【図2】


【図3】


【図4】


【図5】


【図6】


【図7】


【図8】


【図9】


【図10】


【図11】


【図12】


【図14】


【図13】


【図15】


【図16】


【図17】


【図18】




【図2】


【図3】


【図4】


【図5】


【図6】


【図7】


【図8】


【図9】


【図10】


【図11】


【図12】


【図14】


【図13】


【図15】


【図16】


【図17】


【図18】


【公開番号】特開2008−228684(P2008−228684A)
【公開日】平成20年10月2日(2008.10.2)
【国際特許分類】
【出願番号】特願2007−75325(P2007−75325)
【出願日】平成19年3月22日(2007.3.22)
【出願人】(000001993)株式会社島津製作所 (3,708)
【Fターム(参考)】
【公開日】平成20年10月2日(2008.10.2)
【国際特許分類】
【出願日】平成19年3月22日(2007.3.22)
【出願人】(000001993)株式会社島津製作所 (3,708)
【Fターム(参考)】
[ Back to top ]

