遺伝子導入剤及び核酸複合体
【課題】遺伝子導入効率が高く、細胞毒性を低く抑えることができる分岐型重合体よりなる遺伝子導入剤、及びこの遺伝子導入剤と核酸とを複合させた核酸複合体を提供する。
【解決手段】芳香環を核とし、それから伸延した複数の分岐鎖を有する分岐型重合体からなる遺伝子導入剤において、該分岐鎖は、基端側の、非イオン性親水性モノマーを重合させてなる非イオン性親水性ポリマーブロックと、先端側の、カチオン性ビニル系モノマーを重合させてなるカチオン性ポリマーブロックとを有し、該分岐型重合体は、芳香環よりなる核に該非イオン性親水性ポリマーブロック鎖を導入して1次ポリマーを形成させた後、該1次ポリマーに該カチオン性ポリマーブロック鎖を導入して2次ポリマーを形成させたもの、および該遺伝子導入剤と核酸とを複合させた核酸複合体。
【解決手段】芳香環を核とし、それから伸延した複数の分岐鎖を有する分岐型重合体からなる遺伝子導入剤において、該分岐鎖は、基端側の、非イオン性親水性モノマーを重合させてなる非イオン性親水性ポリマーブロックと、先端側の、カチオン性ビニル系モノマーを重合させてなるカチオン性ポリマーブロックとを有し、該分岐型重合体は、芳香環よりなる核に該非イオン性親水性ポリマーブロック鎖を導入して1次ポリマーを形成させた後、該1次ポリマーに該カチオン性ポリマーブロック鎖を導入して2次ポリマーを形成させたもの、および該遺伝子導入剤と核酸とを複合させた核酸複合体。
【発明の詳細な説明】
【技術分野】
【0001】
本発明は、遺伝子導入剤に係り、特にカチオン性分岐型重合体からなる遺伝子導入剤と、この遺伝子導入剤と核酸とを複合させた核酸複合体とに関する。
【背景技術】
【0002】
安全性、品質安定性、製造コストに問題があるウイルスベクターに代わる遺伝子導入技術として、合成高分子ベクター、カチオン性脂質ベクターが研究開発され、例えば、ポリエチレンイミン、ポリリジン、ポリアミドアミンデンドリマー、ポリアミノスチレンなどのカチオン性ポリマーからなる遺伝子導入剤が報告されている(非特許文献1)。
【0003】
このようなカチオン性ポリマーを用いた遺伝子導入剤の研究は、
(a)RNAやDNAなどの核酸は、mRNAへ転写されタンパクへ翻訳される過程において、スペルミンやスペルミジンなどのカチオン性物質とイオン結合を形成することにより安定に存在している。
(b)一般的に分子量が50,000以下のカチオン性物質の場合、カチオン性物質が核酸を凝集する速度と、解離速度するとが同一である平衡状態に達する。従って、遺伝子導入剤としては、分子量が50,000以上のカチオン性物質を用いなければ核酸を凝集することができない。
といった知見に基いてなされている。
【0004】
本出願人らは、合成高分子ベクターとして、ベンゼンなどの芳香環を核としてカチオン性ポリマー鎖が放射状に伸延する分岐構造のスター型ポリマーよりなるベクターが、DNAを高密度で凝縮させて小さな核酸複合体微粒子を形成させ、効率良く細胞へ遺伝子導入できることを発明した(下記特許文献1,2)。この複合体微粒子が細胞膜を透過するメカニズムとしては、カチオン性ポリマー鎖による陽電荷が細胞膜表面の陰電荷と静電的に結合しエンドサイトーシスにより細胞内へ取り込まれる作用に大きく依存していると考えられる。
【0005】
本出願人らはまた、核となる芳香環に非イオン性モノマーを重合して非イオン性ポリマーブロックを形成させた後、さらに、この非イオン性ポリマーブロックにカチオン性ビニル系モノマーを重合して、カチオン性ポリマーブロックを形成させた分岐鎖、即ち、分岐鎖の基端側が非イオン性ポリマーブロック鎖にて構成され、それよりも先端側がカチオン性ポリマーブロック鎖にて構成されている分岐鎖を有するカチオン性分岐型重合体よりなる遺伝子導入剤を提案した(下記特許文献3)。
【先行技術文献】
【特許文献】
【0006】
【特許文献1】WO2004/092388号公報
【特許文献2】特開2007−70579号公報
【特許文献3】特願2008−128569
【非特許文献】
【0007】
【非特許文献1】Smedt,S.,Demeester,J.,Hennik,W.,(2000),Cationic polymer based gene delivery system, J Pharmaceutical research 17,113-126
【発明の概要】
【発明が解決しようとする課題】
【0008】
上記特許文献1〜3に記載されるカチオン性分岐型重合体よりなる遺伝子導入剤は、その構造上電荷密度を高く配置することが可能であるため、DNAやRNAなどの核酸と遺伝子導入剤との複合体をより強く凝集させることが可能であり、より粒子径の小さいポリプレックス粒子を形成することが可能である。しかしながら、アニオン性ポリマーである核酸分子は分子中の単位のリン酸残基が互いに静電反発し合っており、これらを強く、かつ、効率良く凝集させるためには、単にカチオン性ポリマーの電荷密度が高いだけでなくカチオン性ポリマー分子が多点で核酸分子とイオン結合させるのが良いと考えられている。このカチオン性ポリマーとアニオン性ポリマー(核酸)の多点結合を達成するにはカチオン性ポリマー分子のサイズが大きいこと、つまり、カチオン性ポリマーを高分子量体にする戦略が自明であるがこの戦略には細胞毒性の懸念がある。
【0009】
この細胞毒性は、一般的にはカチオン性ポリマー分子が負に帯電している細胞膜と結合して細胞膜に歪を発生させるような機械的な作用に起因するものの他に、細胞内外の電解質バランスの崩壊やpHが非生体的環境まで上昇することより生じるものと考えられており、カチオン性ポリマーを用いた遺伝子導入剤の場合にあっては、カチオン性官能基の数が多いほどその可能性が高くなる。
【0010】
また、特許文献3のように分岐型重合体の分岐鎖を非カチオン性(非イオン性)ポリマーブロックとカチオン性ポリマーブロックとで構成した場合であっても、カチオン性ポリマーブロックの分子量が大きい場合は、同様に細胞に与える影響が大きくなる。
【0011】
このようなことから、カチオン性ポリマーからなる遺伝子導入剤にあっては、
(1)細胞毒性を軽減するために、カチオン性ポリマーのブロック部分の分子量を下げる
必要がある一方で、
(2)核酸を効率良く凝集して遺伝子導入効率を高くするために、遺伝子導入剤の分子量を上げる
必要があるという二律背反の分子設計を満たすことが課題となる。
【0012】
本発明は上記従来の課題に鑑みてなされたものであり、遺伝子導入効率が高く、細胞毒性を低く抑えることができる分岐型重合体よりなる遺伝子導入剤、即ち、カチオン性ポリマーブロック部分の分子量を抑えた上で、分岐型重合体の分子量ないしはその粒子径を大きくした遺伝子導入剤を提供することを目的とする。
【0013】
本発明はまた、この遺伝子導入剤と核酸とを複合させてなる核酸複合体を提供することを目的とする。
【課題を解決するための手段】
【0014】
本発明の遺伝子導入剤(請求項1)は、芳香環を核とし、それから伸延した複数の分岐鎖を有する分岐型重合体からなる遺伝子導入剤において、該分岐鎖は、基端側の、非イオン性親水性モノマーを重合させてなる非イオン性親水性ポリマーブロックと、先端側の、カチオン性ビニル系モノマーを重合させてなるカチオン性ポリマーブロックとを有し、該分岐型重合体は、芳香環よりなる核に該非イオン性親水性ポリマーブロック鎖を導入して1次ポリマーを形成させた後、該1次ポリマーに該カチオン性ポリマーブロック鎖を導入して2次ポリマーを形成させたものであって、該1次ポリマーの乾燥した状態の重量(Wdry)と、該1次ポリマーの湿潤した状態の重量(Wwet)との関係が下記(I)式を満たすことを特徴とするものである。
【0015】
{(Wwet)−(Wdry)}/(Wdry)≧2.0 (I)
【0016】
請求項2の遺伝子導入剤は、請求項1において、前記分岐型重合体は、N,N−ジ置換−ジチオカルバミルメチル基を同一分子内に3個以上有する化合物をイニファターとし、これに前記非イオン性親水性ポリマーブロック鎖を導入して1次ポリマーを形成させた後、該1次ポリマーに前記カチオン性ポリマーブロック鎖を導入して2次ポリマーを形成させた分岐型重合体であることを特徴とするものである。
【0017】
請求項3の遺伝子導入剤は、請求項2において、N,N−ジ置換−ジチオカルバミルメチル基を同一分子内に3個以上有する化合物は、ベンゼン環を核とし、この核に分岐鎖として3個以上の該N,N−ジ置換−ジチオカルバミルメチル基が結合していることを特徴とするものである。
【0018】
請求項4の遺伝子導入剤は、請求項2又は3において、前記N,N−ジ置換−ジチオカルバミルメチル基は、N,N−ジアルキル−ジチオカルバミルメチル基であることを特徴とするものである。
【0019】
請求項5の遺伝子導入剤は、請求項1ないし4のいずれか1項において、前記非イオン性親水性モノマーは、N,N−ジメチルアクリルアミド、N−ビニルピロリドン、ヒドロキシアルキルアクリル酸、ビニル酢酸鹸化物、およびヒアルロン酸修飾ビニルモノマーからなる群より選択される少なくとも1種であることを特徴とするものである。
【0020】
請求項6の遺伝子導入剤は、請求項1ないし5のいずれか1項において、前記カチオン性ビニル系モノマーが3−N,N−ジメチルアミノプロピルアクリルアミド、及び/又は2−N,N−ジメチルアミノエチルメタクリレートであることを特徴とするものである。
【0021】
請求項7の遺伝子導入剤は、請求項1ないし6のいずれか1項において、前記1次ポリマーの分子量が、10,000〜100,000であることを特徴とするものである。
【0022】
請求項8の遺伝子導入剤は、請求項1ないし7のいずれか1項において、前記カチオン性ポリマーブロックの分子量が、1,000〜30,000であることを特徴とするものである。
【0023】
請求項9の遺伝子導入剤は、請求項1ないし8のいずれか1項において、前記分岐型重合体の分子量が、12,000〜12,000であることを特徴とするものである。
【0024】
本発明の核酸複合体(請求項10)は、請求項1ないし9のいずれか1項の遺伝子導入剤と核酸とを複合させてなるものである。
【発明の効果】
【0025】
本発明の遺伝子導入剤は、芳香環よりなる核に非イオン性親水性ポリマーブロック鎖を導入してなる前述の(I)式を満たす膨潤性の高い1次ポリマーに対して、カチオン性ポリマーブロック鎖を導入してなるものであり、膨潤性の非イオン性親水性ポリマーブロックを分岐鎖の基端側に配置しているため、膨潤性のポリマーブロックを分岐型重合体の内郭に配置していないものと比較して、遺伝子導入剤である分岐型重合体の粒子径を大きくすることができ、且つ同程度の粒子径を有する分岐型重合体に比べて分子量を低く抑えることができる。即ち、本発明の遺伝子導入剤は、内郭に膨潤性のポリマーブロックを配置することにより、低分子量の分岐型重合体でありながら、擬似的に高分子量の分岐型重合体と同程度の粒子径とすることができる。
【0026】
また、分岐型重合体の外層部分、即ち分岐鎖の先端側にのみカチオン性ポリマーブロックを配置しているため、この分岐型重合体の外層側の部分が核酸と親和し、核酸の凝集に有効に機能するので、遺伝子導入効率が高く、且つ、分岐鎖全体がカチオン性ポリマーブロックよりなる分岐型重合体と比較してカチオン性官能基が少ないため、細胞毒性を軽減することができる。
【0027】
即ち、本発明者らは、前述の(1)カチオン性ポリマーブロックの分子量を低減した上で、(2)遺伝子導入剤(分岐型重合体)自体の分子量を上げるべく、次のような知見に基いて検討を重ねた。
【0028】
前述の特許文献1、2のように、分岐鎖がカチオン性ポリマーのみで構成されている分岐型重合体の場合、分岐型重合体の外層に露出するカチオン性官能基、即ち分岐鎖の先端側のカチオン性官能基は、DNAのリン酸残基と結合するが、分岐型重合体の内郭のカチオン性官能基、即ち分岐鎖の基端側のカチオン性官能基は、DNAのリン酸残基と立体構造上、直接結合し得ない。また、静電結合力は電荷間の距離の2乗に反比例するというクーロンの法則を考慮すると、DNAとの距離が大きい分岐型重合体の内郭のカチオン性官能基は、静電的にもDNAと結合し得ない。
【0029】
即ち、分岐鎖がカチオン性ポリマーブロックのみで構成される分岐型重合体の場合、内郭のカチオン性の官能基は、分岐型重合体の分岐鎖間に自由に拡散するイオンなどの電解質や炭酸ガスなどの低分子化合物と相互作用するのみであって、実質的にDNAとの結合に関与せず、細胞培養環境に与える影響、結果的につまり、細胞に与える影響のみが大きくなる。
【0030】
従って、分岐鎖の基端側は、DNAとの結合に関与しない非イオン性のポリマーブロックとし、先端側のみをカチオン性ポリマーブロックとした分子設計であっても、十分に核酸を凝集させることができ、(1)カチオン性ポリマーブロックの分子量を低減した上で、(2)分岐型重合体自体の分子量を上げることができる。
【0031】
しかし、前述の特許文献3のように、単に、分岐鎖の基端側を非イオン性ポリマーブロックとし、先端側をカチオン性ポリマーブロックとしたのみでは、その効果は十分ではない。核酸を効率的に凝集させるためには、非イオン性ポリマーブロックで構成される分岐型重合体の内郭部分が十分に大きな粒子径を有し、先端側のカチオン性ポリマーブロック部分を密集させることなく外周部分局在的に広域に分散させることが重要となる。
【0032】
本発明に係る核酸複合体は、芳香環よりなる核に非イオン性親水性ポリマーブロックを導入してなる1次ポリマーの膨潤性が十分に大きく、その実際の分子量に見合う粒子径よりも大きな粒子となりうるため、分岐鎖の先端側のカチオン性ポリマーブロックを三次元的に局在配置した状態とすることができる。
【0033】
本発明において、前記分岐型重合体は、N,N−ジ置換−ジチオカルバミルメチル基を同一分子内に3個以上有する化合物をイニファターとし、これに前記非イオン性親水性ポリマーブロック鎖を導入して1次ポリマーを形成させた後、該1次ポリマーに前記カチオン性ポリマーブロック鎖を導入して2次ポリマーを形成させたものであることが好ましい(請求項2)。
【0034】
このN,N−ジ置換−ジチオカルバミルメチル基を同一分子内に3個以上有する化合物は、ベンゼン環を核とし、この核に分岐鎖として3個以上の該N,N−ジ置換−ジチオカルバミルメチル基が結合していることが好ましく(請求項3)、前記N,N−ジ置換−ジチオカルバミルメチル基は、N,N−ジアルキル−ジチオカルバミルメチル基であることが好ましい(請求項4)。
【0035】
非イオン性親水性モノマーとしては、N,N−ジメチルアクリルアミド、N−ビニルピロリドン、ヒドロキシアルキルアクリル酸、ビニル酢酸鹸化物、およびヒアルロン酸修飾ビニルモノマーからなる群より選択される少なくとも1種であることが好ましく(請求項5)、カチオン性ビニル系モノマーとしては、3−N,N−ジメチルアミノプロピルアクリルアミド、及び/又は2−N,N−ジメチルアミノエチルメタクリレートであることが好ましい(請求項6)。
【0036】
前記1次ポリマーの分子量としては、10,000〜100,000であることが好ましく(請求項7)、この分子量が上記範囲内であると、これにカチオン性ポリマーブロックを導入してなる分岐型重合体の高分子量化を抑えた上で、粒子径の大きい、遺伝子導入効率に優れた遺伝子導入剤を得ることができる。
【0037】
また、前記カチオン性ポリマーブロックの分子量としては、1,000〜30,000であることが好ましく(請求項8)、このカチオン性ポリマーブロックの分子量が上記範囲内であると、細胞毒性を軽減した上で、効率的に核酸を凝集することができる分岐型重合体を得ることができる。
【0038】
また、前記分岐型重合体(2次ポリマー)の分子量は、12,000〜120,000であることが好ましく(請求項9)、分岐型重合体の分子量が上記範囲内であると、高分子量化を抑えた上で、より効率的に遺伝子導入剤と核酸とを複合させることができ、低分子量で遺伝子導入効率に優れた遺伝子導入剤を得ることができる。
【0039】
本発明の核酸複合体(請求項10)は、上記本発明の遺伝子導入剤と核酸とを複合させてなるものであり、生体適合性、遺伝子導入効率に優れたものである。
【図面の簡単な説明】
【0040】
【図1】実施例1及び比較例1,2の遺伝子導入剤の細胞毒性の評価結果を示すグラフである。
【図2】実施例1及び比較例1,2の遺伝子導入剤の遺伝子導入活性の評価結果を示すグラフである。
【発明を実施するための形態】
【0041】
以下に本発明の実施の形態を詳細に説明する。
【0042】
[遺伝子導入剤]
本発明の遺伝子導入剤は、芳香環を核とし、それから伸延した複数の分岐鎖を有する分岐型重合体からなる遺伝子導入剤において、該分岐鎖は、基端側の、非イオン性親水性モノマーを重合させてなる非イオン性親水性ポリマーブロックと、先端側の、カチオン性ビニル系モノマーを重合させてなるカチオン性ポリマーブロックとを有し、該分岐型重合体は、芳香環よりなる核に該非イオン性親水性ポリマーブロック鎖を導入して1次ポリマーを形成させた後、該1次ポリマーに該カチオン性ポリマーブロック鎖を導入して2次ポリマーを形成させたものであって、該1次ポリマーの乾燥した状態の重量(Wdry)と、該1次ポリマーの湿潤した状態の重量(Wwet)との関係が下記(I)式を満たすことを特徴とするものである。
【0043】
{(Wwet)−(Wdry)}/(Wdry)≧2.0 (I)
【0044】
本明細書において、1次ポリマーの湿潤した状態の重量(Wwet)とは、1次ポリマー1gと水1gとを混練してペースト状にし、このペーストの25℃の条件下での1mlの重量を指し、1次ポリマーの乾燥した状態の重量(Wdry)とは、このペースト1mlを24時間真空乾燥することにより得られた乾燥ポリマーの重量を指す。
【0045】
本発明では、この1次ポリマーの湿潤した状態の重量(Wwet)と、1次ポリマーの乾燥した状態の重量(Wdry)とが、上記(I)式の関係(以下、(I)式で算出される値を「膨潤率」と称す場合がある。)を満たすことを特徴とする。この膨潤率が2以上であれば、低分子量の分岐型重合体であっても、大きな粒子径を有する分岐型重合体とすることができる。膨潤率は大きい程、分子量に対する粒子径の増大効果が大きく好ましいが、大きすぎると安定な分岐型重合体を形成し得ないおそれがあるため、好ましくは10.0〜2.0、特に好ましくは8.0〜3.0程度である。なお、比重が1.0程度であって、乾燥時と湿潤時に体積の変化がないポリマーの場合、膨潤率の値は1.0となる。
【0046】
前記分岐型重合体としては、N,N−ジ置換−ジチオカルバミルメチル基を同一分子内に3個以上有する化合物をイニファターとし、これに前記非イオン性親水性ポリマーブロック鎖を導入して1次ポリマーを形成させた後、該1次ポリマーに前記カチオン性ポリマーブロック鎖を導入して2次ポリマーを形成させたものであることが好ましい。
【0047】
なお、本明細書において、イニファターとは、光照射によりラジカルを発生させる重合開始剤、連鎖移動剤としての機能と共に、成長末端と結合して成長を停止する機能、さらに光照射が停止すると重合を停止させる重合開始・重合停止剤として機能する分子のことである。
【0048】
イニファターとなるN,N−ジ置換−ジチオカルバミルメチル基を同一分子内に3個以上有する化合物としては、ベンゼン環に該N,N−ジ置換−ジチオカルバミルメチル基、特にN,N−ジアルキル−ジチオカルバミルメチル基又はN,N−ジフェニル−ジチオカルバミルメチル基が3個以上分岐鎖として結合しているものが好適であり、具体的には次が例示される。即ち、3分岐鎖化合物としては、1,3,5−トリ(ブロモメチル)ベンゼンとN,N−ジアルキル−ジチオカルバミン酸ナトリウム(ナトリウムN,N−ジアルキル−ジチオカルバメート)とをエタノール中で付加反応させて得られる1,3,5−トリ(N,N−ジアルキル−ジチオカルバミルメチル)ベンゼンであり、4分岐鎖化合物としては、1,2,4,5−テトラキス(ブロモメチル)ベンゼンとN,N−ジアルキル−ジチオカルバミン酸ナトリウム(ナトリウムN,N−ジアルキル−ジチオカルバメート)とをエタノール中で付加反応させて得られる1,2,4,5−テトラキス(N,N−ジアルキル−ジチオカルバミルメチル)ベンゼンであり、6分岐鎖化合物としては、ヘキサキス(ブロモメチル)ベンゼンとN,N−ジアルキル−ジチオカルバミン酸ナトリウム(ナトリウムN,N−ジアルキル−ジチオカルバメート)とをエタノール中で付加反応させて得られるヘキサキス(N,N−ジアルキル−ジチオカルバミルメチル)ベンゼンが挙げられる。なお、ここで、N,N−ジアルキル−ジチオカルバミルメチル基としては、N,N−ジアルキル−ジチオカルバミルメチル基に限らず、N,N−ジフェニル−ジチオカルバミルメチルなどのN,N−ジアリール−ジチオカルバミルメチル基等であってもよいが、特にエチル基等の炭素数2〜18個のアルキル基で置換されたN,N−ジアルキル−ジチオカルバミルメチル基が好ましい。
【0049】
上記のイニファターは、アルコール等の極性溶媒に対しては殆ど不溶であるが、非極性溶媒には易溶である。この非極性溶媒としては炭化水素、ハロゲン化炭化水素が好適であり、特に、ベンゼン、トルエン、クロロホルム又は塩化メチレン、中でも特にトルエンが好適である。
【0050】
このイニファターに重合させる非イオン性親水性モノマーとしては、前述の膨潤率を満たす1次ポリマーを実現する上で、好ましくは、N,N−ジメチルアクリルアミド、N−ビニルピロリドン、ヒドロキシアルキルアクリル酸、ビニル酢酸鹸化物、およびヒアルロン酸修飾ビニルモノマー等を挙げることができる。
【0051】
これらの非イオン性親水性モノマーは、1種を単独で用いてもよく、2種以上を混合して用いてもよい。即ち、非イオン性親水性ポリマーブロック鎖は、2種以上の非イオン性親水性モノマーの共重合体であってもよい。
【0052】
本発明では、上記イニファターに対し、まず、上記非イオン性親水性モノマーを重合させて、非イオン性親水性ホモポリマー(上述の如く、これは共重合体であってよい。)である1次ポリマーを得、これにカチオン性ビニル系モノマーを重合させることが好ましい。
【0053】
イニファターと上記非イオン性親水性モノマーとを反応させるには、イニファター及びモノマーを含んでなる原料溶液を調製し、これに光照射することによって、イニファターに対しモノマーが結合した反応生成物を生成させる。この溶液の溶媒としては、アルカン、アルケン、アロマチック、ハロゲン化炭化水素が好適であり、具体的にはベンゼン、トルエン、クロロホルム、四塩化炭素又は塩化メチレンが挙げられ、中でもトルエン又はクロロホルムが好適である。
【0054】
このモノマーの該原料溶液中の濃度は0.5M以上、例えば0.5〜2.5Mが好適である。イニファターの濃度は0.1〜100mM程度が好適である。
【0055】
照射する光の波長は250〜400nmが好適である。光の照射時間は照射強度にも依存するが、1〜60分程度が好適であり、1μW/cm2〜10mW/cm2程度の低い照射強度で1分〜30分程度が特に好適である。
【0056】
この光照射により、反応液中に目的とするイニファターに対し非イオン性親水性ポリマーよりなる分岐鎖が結合した分岐型重合体が生成するので、必要に応じ精製して分岐型重合体よりなる非イオン性親水性ホモポリマー(1次ポリマー)を得る。
【0057】
このようにして得られる1次ポリマーの分子量としては、10,000〜100,000程度、特に25,000〜75,000程度であることが好ましい。この分子量が上記範囲を超えると、これにカチオン性ポリマーブロックを導入して得られる分岐型重合体の分子量が大きくなり過ぎ、この分岐型重合体よりなる遺伝子導入剤の生体内における代謝性、分解性並びに生体からの排出性が損なわれるおそれがある。前記分子量が上記下限未満であると、これにカチオン性ポリマーブロックを導入して得られる分岐型重合体の分子量が小さいために、核酸の凝集効果を十分に得ることができないおそれがあり、また、分子量に対する粒子径の増大効果が得られにくくなる。
【0058】
本発明においては、このようにして生成した非イオン性親水性ホモポリマーである1次ポリマーに対し、カチオン性ビニル系モノマーを重合させて本発明の遺伝子導入剤を得る。
【0059】
このカチオン性ビニル系モノマーとしては、アクリル酸誘導体、スチレン誘導体等のビニル系モノマーが好適であり、特に、耐加水分解性に優れることから、3−N,N−ジメチルアミノプロピルアクリルアミドCH2=CHCONHC3H6N(CH3)2、2−N,N−ジメチルアミノエチルメタクリレートが好ましい。これらのカチオン性ビニル系モノマーは1種を単独で用いてもよく、2種以上を混合して用いてもよい。
【0060】
カチオン性ビニル系モノマーを重合させるには、上記のように合成した非イオン性親水性ホモポリマーをメタノール等の溶媒に溶解させ、これにカチオン性ビニル系モノマーを混合し、光を照射して重合させればよい。この重合反応を開始する際の溶液中における非イオン性親水性ホモポリマーの濃度は0.01〜10重量%程度が好適であり、カチオン性ビニル系モノマーの濃度は0.3〜30重量%程度が好適である。光の照射条件は、光波長250〜400nm、照射時間1〜150分、照射強度100〜10,000μW/cm2程度が好適である。
【0061】
このようにして1次ポリマーに導入したカチオン性ポリマーブロック鎖の分子量(得られる分岐型重合体(2次ポリマー)内のカチオン性ポリマーブロック全体の分子量)としては、1,000〜30,000程度、特に10,000〜25,000程度であることが好ましい。カチオン性ポリマーブロックの分子量が上記上限を超えると、カチオン性官能基が細胞に与える影響が大きくなり、上記下限未満であると、分岐型重合体の核酸凝集能が低下する。なお、このカチオン性ポリマーブロックの分子量は、後述の2次ポリマーである分岐型重合体の分子量と、前述の1次ポリマーの分子量との差から求めることができる。
【0062】
また、2次ポリマーである分岐型重合体の分子量としては、12,000〜120,000程度、特に30,000〜80,000程度が好ましい。分岐型重合体の分子量が上記範囲内であると、分岐型重合体の過度な高分子量化を抑えた上で、核酸の凝集能に優れた遺伝子導入剤を得ることができる。
【0063】
なお、本明細書において、分子量とは、特記しないかぎり、GPC(ゲルパーミエーションクロマトグラフィー)によるポリエチレングリコール換算の数平均分子量をさす。
【0064】
[核酸複合体]
本発明の核酸複合体は、上記遺伝子導入剤(ベクター)と核酸とを複合させたものである。本発明の遺伝子導入剤(ベクター)と核酸とを複合させるには、このベクターの濃度1〜1000μg/mL程度の分散液に対し、常温にて核酸を添加し、混合すればよい。核酸に対してベクターを過剰量添加し、ベクターを核酸に対し飽和状態に核酸含有複合体として複合化させるのが好ましい。
【0065】
核酸の好ましい例としては、単純ヘルペスウイルスチミジンキナーゼ遺伝子(HSV1−TK遺伝子),p53癌抑制遺伝子及びBRCA1癌抑制遺伝子やサイトカイン遺伝子としてTNF−α遺伝子,IL−2遺伝子,IL−4遺伝子,HLA−B7/IL−2遺伝子,HLA−B7/B2M遺伝子,IL−7遺伝子,GM−CSF遺伝子,IFN−γ遺伝子及びIL−12遺伝子などのサイトカイン遺伝子並びにgp−100,MART−1及びMAGE−1などの癌抗原ペプチド遺伝子が癌治療に利用できる。
【0066】
また、VEGF遺伝子,HGF遺伝子及びFGF遺伝子などのサイトカイン遺伝子並びにc−mycアンチセンス,c−mybアンチセンス,cdc2キナーゼアンチセンス,PCNAアンチセンス,E2Fデコイやp21(sdi−1)遺伝子が血管治療に利用できる。また、上記のようなDNAの導入、遺伝子発現のみならず、細胞内のmRNAを破壊するRNA干渉をsiRNAの導入で行うことも可能である。かかる一連の遺伝子は当業者には良く知られたものである。
【0067】
核酸含有複合体の粒径は50〜200nm程度、特に50〜170nm程度が好適である。これよりも小さいと、核酸含有複合体内部の核酸にまで酵素の作用が及ぶおそれ、あるいは腎臓にて濾過排出されるおそれがある。また、これよりも大きいと、細胞に導入されにくくなるおそれがある。
【0068】
核酸は、細胞に導入されることによりその細胞内で機能を発現することができるような形態で用いる。例えばDNAの場合、導入された細胞内で当該DNAが転写され、それにコードされるポリペプチドの産生を経て機能発現されるように当該DNAが配置されたプラスミドとして用いる。好ましくは、プロモーター領域、開始コドン、所望の機能を有する蛋白質をコードするDNA、終止コドン及びターミネーター領域が連続的に配列されている。
【0069】
所望により2種以上の核酸をひとつのプラスミドに含めることも可能である。
【0070】
核酸を導入する対象として望ましい「細胞」としては、当該核酸の機能発現が求められるものであり、このような細胞としては、例えば使用する核酸(すなわちその機能)に応じて種々選択され、例えば心筋細胞、平滑筋細胞、繊維芽細胞、骨格筋細胞、血管内皮細胞、骨髄細胞、骨細胞、血球幹細胞、血球細胞等が挙げられる。また、単球、樹状細胞、マクロファージ、組織球、クッパー細胞、破骨細胞、滑膜A細胞、小膠細胞、ランゲルハンス細胞、類上皮細胞、多核巨細胞等、消化管上皮細胞・尿細管上皮細胞などである。
【0071】
本発明の遺伝子導入剤を用いた核酸含有複合体は任意の方法で生体に投与することができる。
【0072】
当該投与方法としては静脈内又は動脈内への注入が特に好ましいが、筋肉内、脂肪組織内、皮下、皮内、リンパ管内、リンパ節内、体腔(心膜腔、胸腔、腹腔、脳脊髄腔等)内、骨髄内への投与の他に病変組織内に直接投与することも可能である。
【0073】
この核酸含有複合体を有効成分とする医薬は、更に必要に応じて製剤上許容し得る担体(浸透圧調整剤,安定化剤、保存剤、可溶化剤、pH調整剤、増粘剤等)と混合することが可能である。これら担体は公知のものが使用できる。
【0074】
また、この核酸含有複合体を有効成分とする医薬は、含まれる核酸の種類が異なる2種以上の核酸含有複合体を含めたものも包含される。このような複数の治療目的を併せ持つ医薬は、多様化する遺伝子治療の分野で特に有用である。
【0075】
投与量としては、動物、特にヒトに投与される用量は目的の核酸、投与方法及び治療される特定部位等、種々の要因によって変化する。しかしながら、その投与量は治療的応答をもたらすに十分であるべきである。
【0076】
この核酸含有複合体は、好ましくは遺伝子治療に適用される。適用可能な疾患としては、当該複合体に含められる核酸の種類によって異なるが、末梢動脈疾患、冠動脈疾患、動脈拡張術後再狭窄等の病変を生じる循環器領域での疾患に加え、癌(悪性黒色腫、脳腫瘍、転移性悪性腫瘍、乳癌等)、感染症(HIV等)、単一遺伝病(嚢胞性線維症、慢性肉芽腫、α1−アンチトリプシン欠損症、Gaucher病等)等が挙げられる。
【0077】
また、この核酸を複合した遺伝子導入剤の水溶液を基材に塗布などにより付着させ、必要に応じ乾燥させることにより、核酸を担持したポリマーのコーティング等が形成される。
【0078】
上記の核酸複合遺伝子導入剤を基材に付着させる場合、基材としてはシート状のものが好適である。このシート状基材の厚さは0.05〜10mm程度であることが好ましく、シート面の大きさは、方形の場合、一辺が1〜20mmであり他辺が1〜20mmであり、円形又は楕円形の場合、径は1〜20mm程度が好ましい。基材の材料としては、ポリオレフィン、ポリスチレン、ポリエステル、ポリアミド、ポリウレタン、シリコン樹脂、フッ素樹脂などの合成樹脂が好適である。この基材は多孔質であってもよい。
【0079】
この基材に対する核酸複合遺伝子導入剤の付着量は、基材表面1cm2当り0.001〜10mg程度が好ましい。
【0080】
核酸複合遺伝子導入剤を担持させた基材よりなる遺伝子導入材料は、皮下組織、心筋組織、病変組織、病変血管を包囲するようにシート状基材を配置したり、カバードステントのフィルムへ塗布することによって生体内に配置したり、生体外面に粘着テープを用いて貼り付けたりするようにして用いられる。
【実施例】
【0081】
以下に実施例を挙げて本発明をより具体的に説明するが、本発明はその要旨を超えない限り、以下の実施例に限定されるものではない。
【0082】
[遺伝子導入剤の合成]
i)イニファターの合成
下記反応式に従って、1,2,4,5−テトラキス(N,N−ジエチルジチオカルバミルメチル)ベンゼンを次のようにして合成した。
【0083】
1,2,4,5−テトラキス(ブロモメチルベンゼン)5.0gとN,N−ジエチルジチオカルバミル酸ナトリウム34.0gをエタノール100mL中へ加え、遮光下、室温で4日間攪拌した。沈殿物を濾過し、3Lのメタノールへ投入して30分間撹拌して濾過した。この操作を繰り返して合計4回行った。沈殿物をトルエン200mLへ溶解した後、100mLのメタノールを加えて50℃に加温し、冷蔵庫中で15時間保管して再結晶させ結晶を濾別後、大量のメタノールで洗浄した。結晶を室温で減圧乾燥して白色の1,2,4,5−テトラキス(N,N−ジエチルジチオカルバミルメチル)ベンゼンの針状結晶を得た(収率90%)。高速液体クロマトグラフィーにより、原料ピークが消失し、精製物が単一物質であることを確認した。
【0084】
1H NMR(in CDCl3)の測定結果はδ1.26−1.31ppm(t,24H,CH2CH3),δ3.69−3.77ppm(q,8H,N(CH2CH3)2),δ3.99−4.07ppm(q,8H,N(CH2CH3)2),δ4.57ppm(s,8H,Ar−CH2),δ7.49ppm(s,2H,Ar−H)となった。
【0085】
【化1】

【0086】
ii)4分岐型スター型重合体の合成(1次ポリマーの合成)
N,N−ジメチルアクリルアミドを非イオン性親水性モノマーとして用い、1,2,4,5−テトラキス[(N,N−ジエチルジチオカルバミル)ポリ(N,N−ジメチルアクリルアミド)−メチル]ベンゼン(以下、pDMAAmと記載することがある。)よりなる1次ポリマーの合成を行った。
【0087】
即ち、上記i)により合成した1,2,4,5−テトラキス(N,N−ジエチルジチオカルバミルメチル)ベンゼン45.6mgを20mLのトルエンへ溶解し、N,N−ジメチルアクリルアミド(N,N−DMAAm)を7.4gを加えて混合し、全量をトルエンで50mLに調整した。3mm厚軟質ガラスセル中で激しく攪拌しながら高純度窒素ガスで5分間パージした後、300Wショートアークキセノンランプ(朝日分光社製、MAX−301)で250nm〜400nmの混合紫外線を20分間照射した。照射強度はウシオ電機社のUIT−150へUVD−C405(検出波長範囲320nm〜470nm)を装着して2.5mW/cm2に調整した。重合溶液をエバポレーターで濃縮し、ジエチルエーテルで重合物を再沈殿させ、クロロホルム/ジエチルエーテル系で3回再沈殿を繰り返して精製し、エーテルを蒸散させた後に少量の水へ溶解し、0.2μmフィルターで濾過してから凍結乾燥させて4分岐型スター型重合体(pDMAAm)を得た(重合率37%)。この1次ポリマーの分子量はポリエチレングリコール換算のGPCにより、50,000(Mw/Mn=1.8)と測定された。
【0088】
1H NMR(in D2O)の測定結果は、δ1.6−1.9ppm(br,2H,−CH2−C),δ2.9−3.1ppm(br,6H,N−CH3)となった。
【0089】
【化2】

【0090】
iii)4分岐型スター型重合体(1次ポリマー)の水膨潤性
上記ii)で合成した1次ポリマー1.0gを1.0gの水を加えて混練し、ペースト状にした。25℃の条件下で、このペーストを1.0mL正確に分取し重量を計測したところ、1.11g(Wwet)であった。このペーストをプラスチックトレイへ移し、24時間真空乾燥した。得られた乾燥ポリマーの重量を測定したところ0.13±0.03g(Wdry)であった。前記(I)式よりこの1次ポリマーの膨潤率を計算したところ7.5であった。計算式は以下の通りである。
【0091】
(Wwet−Wdry)/Wdry (I)
(1.11−0.13)/0.13=7.5
【0092】
この結果より、上記ii)で合成した1次ポリマーは、水を含むと、膨潤率2以上で大きく膨潤することがわかる。
【0093】
iv)4分岐型スター型共重合体の合成(2次ポリマーの合成)
【0094】
上記ii)で合成した4分岐型スター型重合体よりなる非イオン性親水性ホモポリマー2.0g及び3−N,N−ジメチルアミノプロピルアクリルアミド4.0gを約30mLのトルエンへ溶解し、全量をトルエンで50mLとした。ガラス容器中で激しく攪拌しながら高純度窒素ガス(G1グレード,流量は2L/分)で10分間パージした後に、光照射時間を15分とした以外は上記ii)と同様の手法で光照射重合を行い、クロロホルム/ジエチルエーテル系で3回再沈殿処理を行い、エーテルを蒸散させた後に少量の水へ溶解し、0.2μmフィルターで濾過してから凍結乾燥させて4分岐型スター型共重合体を得た(重合率22%)。得られた2次ポリマーの分子量はGPCにより55,000(Mw/Mn=2.5)と測定された。以上より、ベンゼンを中心核として放射状にN,N−ジメチルアクリルアミドのポリマーブロック(分子量50,000)と3−N,N−ジメチルアミノプロピルアクリルアミドのポリマーブロック(分子量5,000)とが導入された4分岐型スター型共重合体が合成されたことが確認された。
この2次ポリマーを実施例1の遺伝子導入剤とした。
【0095】
【化3】

【0096】
iv)高分子量4分岐型スター型カチオン性重合体の光重合による合成(比較例1)
3−N,N−ジメチルアミノプロピルアクリルアミドをカチオン性モノマーとして用い、1,2,4,5−テトラキス[(N,N−ジエチルジチオカルバミル)ポリ(N,N−ジメチルアクリルアミド)−メチル]ベンゼン(以下、pDMAPAAmと記載することがある。)よりなる高分子量4分岐型スター型カチオン性重合体(高分子量カチオン性ホモポリマー)の合成を行った。
【0097】
即ち、上記i)により合成した1,2,4,5−テトラキス(N,N−ジエチルジチオカルバミルメチル)ベンゼン45.6mgを20mLのトルエンへ溶解し、N,N−ジメチルアミノプロピルアクリルアミド(N,N−DMAPAAm)7.9gを加えて混合し、全量をトルエンで50mLに調整した。3mm厚軟質ガラスセル中で激しく攪拌しながら高純度窒素ガスで5分間パージした後、300Wショートアークキセノンランプ(朝日分光社製、MAX−301)で250nm〜400nmの混合紫外線を50分間照射した。照射強度はウシオ電機社のUIT−150へUVD−C405(検出波長範囲320nm〜470nm)を装着して2.5mW/cm2に調整した。重合溶液をエバポレーターで濃縮し、ジエチルエーテルで重合物を再沈殿させ、クロロホルム/ジエチルエーテル系で3回再沈殿を繰り返して精製し、エーテルを蒸散させた後に少量の水へ溶解し、0.2μmフィルターで濾過してから凍結乾燥させて高分子量4分岐型スター型カチオン性重合体pDMAPAAmよりなる高分子量カチオン性ホモポリマーを得た(重合率32%)。この高分子量カチオン性ホモポリマーの分子量はポリエチレングリコール換算のGPCにより、50,000(Mw/Mn=1.5)と測定された。
この高分子量カチオン性ホモポリマーを比較例1の遺伝子導入剤とした。
【0098】
1H NMR(in D2O)の測定結果は、δ1.5−1.8ppm(br,2H,−CH2CH2CH2−),δ2.1−2.2ppm(br,6H,N−CH3),δ2.2−2.4ppm(br,2H,CH2−N),δ3.0−3.4ppm(br,2H,NH−CH2),δ7.4−7.8ppm(br,1H,−NH−)となった。
【0099】
【化4】

【0100】
vi)低分子量4分岐型スター型カチオン性重合体の光重合による合成
カチオン性モノマーとして3−N,N−ジメチルアミノプロピルアクリルアミドを4.0g使用することと光重合時間を20分としたこと以外は、上記v)と同様の手法により低分子量4分岐型スター型カチオン性重合体(低分子量カチオン性ホモポリマー)を合成した。この低分子量カチオン性ホモポリマーの分子量はポリエチレングリコール換算のGPCにより、5,000(Mw/Mn=1.5)と測定された。
この低分子量カチオン性ホモポリマーを比較例2の遺伝子導入剤とした。
【0101】
【化5】

【0102】
vii)実施例1及び比較例1,2の遺伝子導入剤と核酸との複合体の形成
実施例1及び比較例1,2の遺伝子導入剤と核酸との複合体(ポリプレックス微粒子)のゼーター電位及び光散乱粒子径を測定した。DNAにはpGL3コントロールベクターを使用した。各遺伝子導入剤中の単位重量あたりの陽電荷数は、各遺伝子導入剤の分子量と非イオン性ポリマーのモノマー単位の分子量99.5とカチオン性ポリマーのモノマー単位の分子量156.5から計算して求めた。DNA中の単位重量あたりの陰電荷数は配列マップによる塩基対数と核酸塩基の平均的分子量660とから計算した。陽電荷と陰電荷の比(所謂CA比)は、20となるように調整した。得られたポリプレックス微粒子のゼーター電位および動的光散乱をシスメックス社のゼーターサイザーナノを使用して測定した。
【0103】
比較例1の遺伝子導入剤である高分子量カチオン性ホモポリマーは、ゼーター電位が高く(29mV)、粒子径も小さい(186nm)ところからDNAが効率良く凝集されていることがわかる。比較例2の遺伝子導入剤である低分子量カチオン性ホモポリマーは、ゼーター電位が低い(10mV)ことから不安定なマクロ粒子が形成されていると考えられる。また、比較例2の低分子量カチオン性ホモポリマーとDNAとからなるポリプレックス微粒子の粒径は、約1200nmであり、細胞膜を透過するのに適した粒径(200nm)ではなく、DNAが十分に凝集されていないことが分かった。実施例1の遺伝子導入剤では、カチオン性ポリマーブロックの分子量が比較例2のカチオン性ポリマーブロックの分子量と同等であるにもかかわらず、比較例1と同程度のゼーター電位(27mV)を示し、ポリプレックス微粒子の粒径も230nmと十分に小さい値を示した。
【0104】
viii)細胞毒性の評価
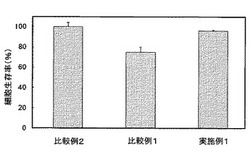
実施例1、及び比較例1,2の遺伝子導入剤を用いて細胞毒性をMTT法にて比較した。上記vii)で形成させたポリプレックス微粒子をMTT試薬のロイコ色素が正常に機能している(細胞が傷害を受けていない)ミトコンドリアにより紫色のホルマザンへ還元される量を測定し、盲検の値と比較して相対的なミトコンドリア活性(細胞生存率(%))として計算した。結果を図1に示す。
【0105】
図1より、比較例1と比較例2を比較すると、細胞毒性は、カチオン性ポリマーブロックの分子量に依存して増大する傾向が確認された。実施例1では、比較例2と同等のミトコンドリア活性が確認され、分岐型重合体の分子量が大きくてもカチオン性ポリマーブロックの分子量が小ければ細胞毒性を抑制することができることが確認された。
【0106】
ix)遺伝子導入活性の評価
細胞にはアフリカミドリサル腎細胞の由来のCOS-1を使用し、DNAにはpGL3コントロールベクターを使用した。COS-1細胞は細胞数を4万個/mLへ調整して24Well培養皿へ播種し、培養24時間後に遺伝子導入を行った。
【0107】
上記実施例1、比較例1,2の遺伝子導入剤をそれぞれ使用し、上記vii)と同様の方法で調製したポリプレックス微粒子を150μLのOPTI−MEM中で30分間インキュベートした。ドーズ数としては0.5μgのDNAが各Wellへ投与されるように溶液を調整し、培養細胞へ加えた。3時間の培養の後、OPTI−MEMを除去し、PBSで洗浄した後に完全培地を加えてさらに48時間培養を行った。トランスフェクションの48時間後にルシフェラーゼアッセにより遺伝子導入活性の評価を行った(プロメガ社、アッセイキット試薬)。補正はタンパク濃度で行い、タンパク定量はBioRad社のBradford試薬で行った。結果を図2に示す。
【0108】
図2より、比較例1と比較例2を比較すると、遺伝子導入活性はカチオン性ポリマーブロックの分子量に依存し、カチオン性ポリマーブロックの分子量が大きい比較例1のほうが遺伝子導入活性に優れていることが分かる。一方、実施例1及び比較例2の遺伝子導入剤は、カチオン性ポリマーブロックの分子量が同じであるが、実施例1の方が遺伝子導入活性に優れている。これは、実施例1の方が分岐型重合体の粒径が大きいためであると考えられる。
【0109】
以上の結果より、本発明の遺伝子導入剤の分岐型重合体は、カチオン性ポリマーブロックの分子量が同程度の分岐型重合体に比べて遺伝子導入活性に優れ、且つ分岐型重合体の分子量が同程度であって、分岐鎖がカチオン性ポリマーブロックのみからなる分岐型重合体に比べて細胞毒性を軽減することができることが分かる。
【技術分野】
【0001】
本発明は、遺伝子導入剤に係り、特にカチオン性分岐型重合体からなる遺伝子導入剤と、この遺伝子導入剤と核酸とを複合させた核酸複合体とに関する。
【背景技術】
【0002】
安全性、品質安定性、製造コストに問題があるウイルスベクターに代わる遺伝子導入技術として、合成高分子ベクター、カチオン性脂質ベクターが研究開発され、例えば、ポリエチレンイミン、ポリリジン、ポリアミドアミンデンドリマー、ポリアミノスチレンなどのカチオン性ポリマーからなる遺伝子導入剤が報告されている(非特許文献1)。
【0003】
このようなカチオン性ポリマーを用いた遺伝子導入剤の研究は、
(a)RNAやDNAなどの核酸は、mRNAへ転写されタンパクへ翻訳される過程において、スペルミンやスペルミジンなどのカチオン性物質とイオン結合を形成することにより安定に存在している。
(b)一般的に分子量が50,000以下のカチオン性物質の場合、カチオン性物質が核酸を凝集する速度と、解離速度するとが同一である平衡状態に達する。従って、遺伝子導入剤としては、分子量が50,000以上のカチオン性物質を用いなければ核酸を凝集することができない。
といった知見に基いてなされている。
【0004】
本出願人らは、合成高分子ベクターとして、ベンゼンなどの芳香環を核としてカチオン性ポリマー鎖が放射状に伸延する分岐構造のスター型ポリマーよりなるベクターが、DNAを高密度で凝縮させて小さな核酸複合体微粒子を形成させ、効率良く細胞へ遺伝子導入できることを発明した(下記特許文献1,2)。この複合体微粒子が細胞膜を透過するメカニズムとしては、カチオン性ポリマー鎖による陽電荷が細胞膜表面の陰電荷と静電的に結合しエンドサイトーシスにより細胞内へ取り込まれる作用に大きく依存していると考えられる。
【0005】
本出願人らはまた、核となる芳香環に非イオン性モノマーを重合して非イオン性ポリマーブロックを形成させた後、さらに、この非イオン性ポリマーブロックにカチオン性ビニル系モノマーを重合して、カチオン性ポリマーブロックを形成させた分岐鎖、即ち、分岐鎖の基端側が非イオン性ポリマーブロック鎖にて構成され、それよりも先端側がカチオン性ポリマーブロック鎖にて構成されている分岐鎖を有するカチオン性分岐型重合体よりなる遺伝子導入剤を提案した(下記特許文献3)。
【先行技術文献】
【特許文献】
【0006】
【特許文献1】WO2004/092388号公報
【特許文献2】特開2007−70579号公報
【特許文献3】特願2008−128569
【非特許文献】
【0007】
【非特許文献1】Smedt,S.,Demeester,J.,Hennik,W.,(2000),Cationic polymer based gene delivery system, J Pharmaceutical research 17,113-126
【発明の概要】
【発明が解決しようとする課題】
【0008】
上記特許文献1〜3に記載されるカチオン性分岐型重合体よりなる遺伝子導入剤は、その構造上電荷密度を高く配置することが可能であるため、DNAやRNAなどの核酸と遺伝子導入剤との複合体をより強く凝集させることが可能であり、より粒子径の小さいポリプレックス粒子を形成することが可能である。しかしながら、アニオン性ポリマーである核酸分子は分子中の単位のリン酸残基が互いに静電反発し合っており、これらを強く、かつ、効率良く凝集させるためには、単にカチオン性ポリマーの電荷密度が高いだけでなくカチオン性ポリマー分子が多点で核酸分子とイオン結合させるのが良いと考えられている。このカチオン性ポリマーとアニオン性ポリマー(核酸)の多点結合を達成するにはカチオン性ポリマー分子のサイズが大きいこと、つまり、カチオン性ポリマーを高分子量体にする戦略が自明であるがこの戦略には細胞毒性の懸念がある。
【0009】
この細胞毒性は、一般的にはカチオン性ポリマー分子が負に帯電している細胞膜と結合して細胞膜に歪を発生させるような機械的な作用に起因するものの他に、細胞内外の電解質バランスの崩壊やpHが非生体的環境まで上昇することより生じるものと考えられており、カチオン性ポリマーを用いた遺伝子導入剤の場合にあっては、カチオン性官能基の数が多いほどその可能性が高くなる。
【0010】
また、特許文献3のように分岐型重合体の分岐鎖を非カチオン性(非イオン性)ポリマーブロックとカチオン性ポリマーブロックとで構成した場合であっても、カチオン性ポリマーブロックの分子量が大きい場合は、同様に細胞に与える影響が大きくなる。
【0011】
このようなことから、カチオン性ポリマーからなる遺伝子導入剤にあっては、
(1)細胞毒性を軽減するために、カチオン性ポリマーのブロック部分の分子量を下げる
必要がある一方で、
(2)核酸を効率良く凝集して遺伝子導入効率を高くするために、遺伝子導入剤の分子量を上げる
必要があるという二律背反の分子設計を満たすことが課題となる。
【0012】
本発明は上記従来の課題に鑑みてなされたものであり、遺伝子導入効率が高く、細胞毒性を低く抑えることができる分岐型重合体よりなる遺伝子導入剤、即ち、カチオン性ポリマーブロック部分の分子量を抑えた上で、分岐型重合体の分子量ないしはその粒子径を大きくした遺伝子導入剤を提供することを目的とする。
【0013】
本発明はまた、この遺伝子導入剤と核酸とを複合させてなる核酸複合体を提供することを目的とする。
【課題を解決するための手段】
【0014】
本発明の遺伝子導入剤(請求項1)は、芳香環を核とし、それから伸延した複数の分岐鎖を有する分岐型重合体からなる遺伝子導入剤において、該分岐鎖は、基端側の、非イオン性親水性モノマーを重合させてなる非イオン性親水性ポリマーブロックと、先端側の、カチオン性ビニル系モノマーを重合させてなるカチオン性ポリマーブロックとを有し、該分岐型重合体は、芳香環よりなる核に該非イオン性親水性ポリマーブロック鎖を導入して1次ポリマーを形成させた後、該1次ポリマーに該カチオン性ポリマーブロック鎖を導入して2次ポリマーを形成させたものであって、該1次ポリマーの乾燥した状態の重量(Wdry)と、該1次ポリマーの湿潤した状態の重量(Wwet)との関係が下記(I)式を満たすことを特徴とするものである。
【0015】
{(Wwet)−(Wdry)}/(Wdry)≧2.0 (I)
【0016】
請求項2の遺伝子導入剤は、請求項1において、前記分岐型重合体は、N,N−ジ置換−ジチオカルバミルメチル基を同一分子内に3個以上有する化合物をイニファターとし、これに前記非イオン性親水性ポリマーブロック鎖を導入して1次ポリマーを形成させた後、該1次ポリマーに前記カチオン性ポリマーブロック鎖を導入して2次ポリマーを形成させた分岐型重合体であることを特徴とするものである。
【0017】
請求項3の遺伝子導入剤は、請求項2において、N,N−ジ置換−ジチオカルバミルメチル基を同一分子内に3個以上有する化合物は、ベンゼン環を核とし、この核に分岐鎖として3個以上の該N,N−ジ置換−ジチオカルバミルメチル基が結合していることを特徴とするものである。
【0018】
請求項4の遺伝子導入剤は、請求項2又は3において、前記N,N−ジ置換−ジチオカルバミルメチル基は、N,N−ジアルキル−ジチオカルバミルメチル基であることを特徴とするものである。
【0019】
請求項5の遺伝子導入剤は、請求項1ないし4のいずれか1項において、前記非イオン性親水性モノマーは、N,N−ジメチルアクリルアミド、N−ビニルピロリドン、ヒドロキシアルキルアクリル酸、ビニル酢酸鹸化物、およびヒアルロン酸修飾ビニルモノマーからなる群より選択される少なくとも1種であることを特徴とするものである。
【0020】
請求項6の遺伝子導入剤は、請求項1ないし5のいずれか1項において、前記カチオン性ビニル系モノマーが3−N,N−ジメチルアミノプロピルアクリルアミド、及び/又は2−N,N−ジメチルアミノエチルメタクリレートであることを特徴とするものである。
【0021】
請求項7の遺伝子導入剤は、請求項1ないし6のいずれか1項において、前記1次ポリマーの分子量が、10,000〜100,000であることを特徴とするものである。
【0022】
請求項8の遺伝子導入剤は、請求項1ないし7のいずれか1項において、前記カチオン性ポリマーブロックの分子量が、1,000〜30,000であることを特徴とするものである。
【0023】
請求項9の遺伝子導入剤は、請求項1ないし8のいずれか1項において、前記分岐型重合体の分子量が、12,000〜12,000であることを特徴とするものである。
【0024】
本発明の核酸複合体(請求項10)は、請求項1ないし9のいずれか1項の遺伝子導入剤と核酸とを複合させてなるものである。
【発明の効果】
【0025】
本発明の遺伝子導入剤は、芳香環よりなる核に非イオン性親水性ポリマーブロック鎖を導入してなる前述の(I)式を満たす膨潤性の高い1次ポリマーに対して、カチオン性ポリマーブロック鎖を導入してなるものであり、膨潤性の非イオン性親水性ポリマーブロックを分岐鎖の基端側に配置しているため、膨潤性のポリマーブロックを分岐型重合体の内郭に配置していないものと比較して、遺伝子導入剤である分岐型重合体の粒子径を大きくすることができ、且つ同程度の粒子径を有する分岐型重合体に比べて分子量を低く抑えることができる。即ち、本発明の遺伝子導入剤は、内郭に膨潤性のポリマーブロックを配置することにより、低分子量の分岐型重合体でありながら、擬似的に高分子量の分岐型重合体と同程度の粒子径とすることができる。
【0026】
また、分岐型重合体の外層部分、即ち分岐鎖の先端側にのみカチオン性ポリマーブロックを配置しているため、この分岐型重合体の外層側の部分が核酸と親和し、核酸の凝集に有効に機能するので、遺伝子導入効率が高く、且つ、分岐鎖全体がカチオン性ポリマーブロックよりなる分岐型重合体と比較してカチオン性官能基が少ないため、細胞毒性を軽減することができる。
【0027】
即ち、本発明者らは、前述の(1)カチオン性ポリマーブロックの分子量を低減した上で、(2)遺伝子導入剤(分岐型重合体)自体の分子量を上げるべく、次のような知見に基いて検討を重ねた。
【0028】
前述の特許文献1、2のように、分岐鎖がカチオン性ポリマーのみで構成されている分岐型重合体の場合、分岐型重合体の外層に露出するカチオン性官能基、即ち分岐鎖の先端側のカチオン性官能基は、DNAのリン酸残基と結合するが、分岐型重合体の内郭のカチオン性官能基、即ち分岐鎖の基端側のカチオン性官能基は、DNAのリン酸残基と立体構造上、直接結合し得ない。また、静電結合力は電荷間の距離の2乗に反比例するというクーロンの法則を考慮すると、DNAとの距離が大きい分岐型重合体の内郭のカチオン性官能基は、静電的にもDNAと結合し得ない。
【0029】
即ち、分岐鎖がカチオン性ポリマーブロックのみで構成される分岐型重合体の場合、内郭のカチオン性の官能基は、分岐型重合体の分岐鎖間に自由に拡散するイオンなどの電解質や炭酸ガスなどの低分子化合物と相互作用するのみであって、実質的にDNAとの結合に関与せず、細胞培養環境に与える影響、結果的につまり、細胞に与える影響のみが大きくなる。
【0030】
従って、分岐鎖の基端側は、DNAとの結合に関与しない非イオン性のポリマーブロックとし、先端側のみをカチオン性ポリマーブロックとした分子設計であっても、十分に核酸を凝集させることができ、(1)カチオン性ポリマーブロックの分子量を低減した上で、(2)分岐型重合体自体の分子量を上げることができる。
【0031】
しかし、前述の特許文献3のように、単に、分岐鎖の基端側を非イオン性ポリマーブロックとし、先端側をカチオン性ポリマーブロックとしたのみでは、その効果は十分ではない。核酸を効率的に凝集させるためには、非イオン性ポリマーブロックで構成される分岐型重合体の内郭部分が十分に大きな粒子径を有し、先端側のカチオン性ポリマーブロック部分を密集させることなく外周部分局在的に広域に分散させることが重要となる。
【0032】
本発明に係る核酸複合体は、芳香環よりなる核に非イオン性親水性ポリマーブロックを導入してなる1次ポリマーの膨潤性が十分に大きく、その実際の分子量に見合う粒子径よりも大きな粒子となりうるため、分岐鎖の先端側のカチオン性ポリマーブロックを三次元的に局在配置した状態とすることができる。
【0033】
本発明において、前記分岐型重合体は、N,N−ジ置換−ジチオカルバミルメチル基を同一分子内に3個以上有する化合物をイニファターとし、これに前記非イオン性親水性ポリマーブロック鎖を導入して1次ポリマーを形成させた後、該1次ポリマーに前記カチオン性ポリマーブロック鎖を導入して2次ポリマーを形成させたものであることが好ましい(請求項2)。
【0034】
このN,N−ジ置換−ジチオカルバミルメチル基を同一分子内に3個以上有する化合物は、ベンゼン環を核とし、この核に分岐鎖として3個以上の該N,N−ジ置換−ジチオカルバミルメチル基が結合していることが好ましく(請求項3)、前記N,N−ジ置換−ジチオカルバミルメチル基は、N,N−ジアルキル−ジチオカルバミルメチル基であることが好ましい(請求項4)。
【0035】
非イオン性親水性モノマーとしては、N,N−ジメチルアクリルアミド、N−ビニルピロリドン、ヒドロキシアルキルアクリル酸、ビニル酢酸鹸化物、およびヒアルロン酸修飾ビニルモノマーからなる群より選択される少なくとも1種であることが好ましく(請求項5)、カチオン性ビニル系モノマーとしては、3−N,N−ジメチルアミノプロピルアクリルアミド、及び/又は2−N,N−ジメチルアミノエチルメタクリレートであることが好ましい(請求項6)。
【0036】
前記1次ポリマーの分子量としては、10,000〜100,000であることが好ましく(請求項7)、この分子量が上記範囲内であると、これにカチオン性ポリマーブロックを導入してなる分岐型重合体の高分子量化を抑えた上で、粒子径の大きい、遺伝子導入効率に優れた遺伝子導入剤を得ることができる。
【0037】
また、前記カチオン性ポリマーブロックの分子量としては、1,000〜30,000であることが好ましく(請求項8)、このカチオン性ポリマーブロックの分子量が上記範囲内であると、細胞毒性を軽減した上で、効率的に核酸を凝集することができる分岐型重合体を得ることができる。
【0038】
また、前記分岐型重合体(2次ポリマー)の分子量は、12,000〜120,000であることが好ましく(請求項9)、分岐型重合体の分子量が上記範囲内であると、高分子量化を抑えた上で、より効率的に遺伝子導入剤と核酸とを複合させることができ、低分子量で遺伝子導入効率に優れた遺伝子導入剤を得ることができる。
【0039】
本発明の核酸複合体(請求項10)は、上記本発明の遺伝子導入剤と核酸とを複合させてなるものであり、生体適合性、遺伝子導入効率に優れたものである。
【図面の簡単な説明】
【0040】
【図1】実施例1及び比較例1,2の遺伝子導入剤の細胞毒性の評価結果を示すグラフである。
【図2】実施例1及び比較例1,2の遺伝子導入剤の遺伝子導入活性の評価結果を示すグラフである。
【発明を実施するための形態】
【0041】
以下に本発明の実施の形態を詳細に説明する。
【0042】
[遺伝子導入剤]
本発明の遺伝子導入剤は、芳香環を核とし、それから伸延した複数の分岐鎖を有する分岐型重合体からなる遺伝子導入剤において、該分岐鎖は、基端側の、非イオン性親水性モノマーを重合させてなる非イオン性親水性ポリマーブロックと、先端側の、カチオン性ビニル系モノマーを重合させてなるカチオン性ポリマーブロックとを有し、該分岐型重合体は、芳香環よりなる核に該非イオン性親水性ポリマーブロック鎖を導入して1次ポリマーを形成させた後、該1次ポリマーに該カチオン性ポリマーブロック鎖を導入して2次ポリマーを形成させたものであって、該1次ポリマーの乾燥した状態の重量(Wdry)と、該1次ポリマーの湿潤した状態の重量(Wwet)との関係が下記(I)式を満たすことを特徴とするものである。
【0043】
{(Wwet)−(Wdry)}/(Wdry)≧2.0 (I)
【0044】
本明細書において、1次ポリマーの湿潤した状態の重量(Wwet)とは、1次ポリマー1gと水1gとを混練してペースト状にし、このペーストの25℃の条件下での1mlの重量を指し、1次ポリマーの乾燥した状態の重量(Wdry)とは、このペースト1mlを24時間真空乾燥することにより得られた乾燥ポリマーの重量を指す。
【0045】
本発明では、この1次ポリマーの湿潤した状態の重量(Wwet)と、1次ポリマーの乾燥した状態の重量(Wdry)とが、上記(I)式の関係(以下、(I)式で算出される値を「膨潤率」と称す場合がある。)を満たすことを特徴とする。この膨潤率が2以上であれば、低分子量の分岐型重合体であっても、大きな粒子径を有する分岐型重合体とすることができる。膨潤率は大きい程、分子量に対する粒子径の増大効果が大きく好ましいが、大きすぎると安定な分岐型重合体を形成し得ないおそれがあるため、好ましくは10.0〜2.0、特に好ましくは8.0〜3.0程度である。なお、比重が1.0程度であって、乾燥時と湿潤時に体積の変化がないポリマーの場合、膨潤率の値は1.0となる。
【0046】
前記分岐型重合体としては、N,N−ジ置換−ジチオカルバミルメチル基を同一分子内に3個以上有する化合物をイニファターとし、これに前記非イオン性親水性ポリマーブロック鎖を導入して1次ポリマーを形成させた後、該1次ポリマーに前記カチオン性ポリマーブロック鎖を導入して2次ポリマーを形成させたものであることが好ましい。
【0047】
なお、本明細書において、イニファターとは、光照射によりラジカルを発生させる重合開始剤、連鎖移動剤としての機能と共に、成長末端と結合して成長を停止する機能、さらに光照射が停止すると重合を停止させる重合開始・重合停止剤として機能する分子のことである。
【0048】
イニファターとなるN,N−ジ置換−ジチオカルバミルメチル基を同一分子内に3個以上有する化合物としては、ベンゼン環に該N,N−ジ置換−ジチオカルバミルメチル基、特にN,N−ジアルキル−ジチオカルバミルメチル基又はN,N−ジフェニル−ジチオカルバミルメチル基が3個以上分岐鎖として結合しているものが好適であり、具体的には次が例示される。即ち、3分岐鎖化合物としては、1,3,5−トリ(ブロモメチル)ベンゼンとN,N−ジアルキル−ジチオカルバミン酸ナトリウム(ナトリウムN,N−ジアルキル−ジチオカルバメート)とをエタノール中で付加反応させて得られる1,3,5−トリ(N,N−ジアルキル−ジチオカルバミルメチル)ベンゼンであり、4分岐鎖化合物としては、1,2,4,5−テトラキス(ブロモメチル)ベンゼンとN,N−ジアルキル−ジチオカルバミン酸ナトリウム(ナトリウムN,N−ジアルキル−ジチオカルバメート)とをエタノール中で付加反応させて得られる1,2,4,5−テトラキス(N,N−ジアルキル−ジチオカルバミルメチル)ベンゼンであり、6分岐鎖化合物としては、ヘキサキス(ブロモメチル)ベンゼンとN,N−ジアルキル−ジチオカルバミン酸ナトリウム(ナトリウムN,N−ジアルキル−ジチオカルバメート)とをエタノール中で付加反応させて得られるヘキサキス(N,N−ジアルキル−ジチオカルバミルメチル)ベンゼンが挙げられる。なお、ここで、N,N−ジアルキル−ジチオカルバミルメチル基としては、N,N−ジアルキル−ジチオカルバミルメチル基に限らず、N,N−ジフェニル−ジチオカルバミルメチルなどのN,N−ジアリール−ジチオカルバミルメチル基等であってもよいが、特にエチル基等の炭素数2〜18個のアルキル基で置換されたN,N−ジアルキル−ジチオカルバミルメチル基が好ましい。
【0049】
上記のイニファターは、アルコール等の極性溶媒に対しては殆ど不溶であるが、非極性溶媒には易溶である。この非極性溶媒としては炭化水素、ハロゲン化炭化水素が好適であり、特に、ベンゼン、トルエン、クロロホルム又は塩化メチレン、中でも特にトルエンが好適である。
【0050】
このイニファターに重合させる非イオン性親水性モノマーとしては、前述の膨潤率を満たす1次ポリマーを実現する上で、好ましくは、N,N−ジメチルアクリルアミド、N−ビニルピロリドン、ヒドロキシアルキルアクリル酸、ビニル酢酸鹸化物、およびヒアルロン酸修飾ビニルモノマー等を挙げることができる。
【0051】
これらの非イオン性親水性モノマーは、1種を単独で用いてもよく、2種以上を混合して用いてもよい。即ち、非イオン性親水性ポリマーブロック鎖は、2種以上の非イオン性親水性モノマーの共重合体であってもよい。
【0052】
本発明では、上記イニファターに対し、まず、上記非イオン性親水性モノマーを重合させて、非イオン性親水性ホモポリマー(上述の如く、これは共重合体であってよい。)である1次ポリマーを得、これにカチオン性ビニル系モノマーを重合させることが好ましい。
【0053】
イニファターと上記非イオン性親水性モノマーとを反応させるには、イニファター及びモノマーを含んでなる原料溶液を調製し、これに光照射することによって、イニファターに対しモノマーが結合した反応生成物を生成させる。この溶液の溶媒としては、アルカン、アルケン、アロマチック、ハロゲン化炭化水素が好適であり、具体的にはベンゼン、トルエン、クロロホルム、四塩化炭素又は塩化メチレンが挙げられ、中でもトルエン又はクロロホルムが好適である。
【0054】
このモノマーの該原料溶液中の濃度は0.5M以上、例えば0.5〜2.5Mが好適である。イニファターの濃度は0.1〜100mM程度が好適である。
【0055】
照射する光の波長は250〜400nmが好適である。光の照射時間は照射強度にも依存するが、1〜60分程度が好適であり、1μW/cm2〜10mW/cm2程度の低い照射強度で1分〜30分程度が特に好適である。
【0056】
この光照射により、反応液中に目的とするイニファターに対し非イオン性親水性ポリマーよりなる分岐鎖が結合した分岐型重合体が生成するので、必要に応じ精製して分岐型重合体よりなる非イオン性親水性ホモポリマー(1次ポリマー)を得る。
【0057】
このようにして得られる1次ポリマーの分子量としては、10,000〜100,000程度、特に25,000〜75,000程度であることが好ましい。この分子量が上記範囲を超えると、これにカチオン性ポリマーブロックを導入して得られる分岐型重合体の分子量が大きくなり過ぎ、この分岐型重合体よりなる遺伝子導入剤の生体内における代謝性、分解性並びに生体からの排出性が損なわれるおそれがある。前記分子量が上記下限未満であると、これにカチオン性ポリマーブロックを導入して得られる分岐型重合体の分子量が小さいために、核酸の凝集効果を十分に得ることができないおそれがあり、また、分子量に対する粒子径の増大効果が得られにくくなる。
【0058】
本発明においては、このようにして生成した非イオン性親水性ホモポリマーである1次ポリマーに対し、カチオン性ビニル系モノマーを重合させて本発明の遺伝子導入剤を得る。
【0059】
このカチオン性ビニル系モノマーとしては、アクリル酸誘導体、スチレン誘導体等のビニル系モノマーが好適であり、特に、耐加水分解性に優れることから、3−N,N−ジメチルアミノプロピルアクリルアミドCH2=CHCONHC3H6N(CH3)2、2−N,N−ジメチルアミノエチルメタクリレートが好ましい。これらのカチオン性ビニル系モノマーは1種を単独で用いてもよく、2種以上を混合して用いてもよい。
【0060】
カチオン性ビニル系モノマーを重合させるには、上記のように合成した非イオン性親水性ホモポリマーをメタノール等の溶媒に溶解させ、これにカチオン性ビニル系モノマーを混合し、光を照射して重合させればよい。この重合反応を開始する際の溶液中における非イオン性親水性ホモポリマーの濃度は0.01〜10重量%程度が好適であり、カチオン性ビニル系モノマーの濃度は0.3〜30重量%程度が好適である。光の照射条件は、光波長250〜400nm、照射時間1〜150分、照射強度100〜10,000μW/cm2程度が好適である。
【0061】
このようにして1次ポリマーに導入したカチオン性ポリマーブロック鎖の分子量(得られる分岐型重合体(2次ポリマー)内のカチオン性ポリマーブロック全体の分子量)としては、1,000〜30,000程度、特に10,000〜25,000程度であることが好ましい。カチオン性ポリマーブロックの分子量が上記上限を超えると、カチオン性官能基が細胞に与える影響が大きくなり、上記下限未満であると、分岐型重合体の核酸凝集能が低下する。なお、このカチオン性ポリマーブロックの分子量は、後述の2次ポリマーである分岐型重合体の分子量と、前述の1次ポリマーの分子量との差から求めることができる。
【0062】
また、2次ポリマーである分岐型重合体の分子量としては、12,000〜120,000程度、特に30,000〜80,000程度が好ましい。分岐型重合体の分子量が上記範囲内であると、分岐型重合体の過度な高分子量化を抑えた上で、核酸の凝集能に優れた遺伝子導入剤を得ることができる。
【0063】
なお、本明細書において、分子量とは、特記しないかぎり、GPC(ゲルパーミエーションクロマトグラフィー)によるポリエチレングリコール換算の数平均分子量をさす。
【0064】
[核酸複合体]
本発明の核酸複合体は、上記遺伝子導入剤(ベクター)と核酸とを複合させたものである。本発明の遺伝子導入剤(ベクター)と核酸とを複合させるには、このベクターの濃度1〜1000μg/mL程度の分散液に対し、常温にて核酸を添加し、混合すればよい。核酸に対してベクターを過剰量添加し、ベクターを核酸に対し飽和状態に核酸含有複合体として複合化させるのが好ましい。
【0065】
核酸の好ましい例としては、単純ヘルペスウイルスチミジンキナーゼ遺伝子(HSV1−TK遺伝子),p53癌抑制遺伝子及びBRCA1癌抑制遺伝子やサイトカイン遺伝子としてTNF−α遺伝子,IL−2遺伝子,IL−4遺伝子,HLA−B7/IL−2遺伝子,HLA−B7/B2M遺伝子,IL−7遺伝子,GM−CSF遺伝子,IFN−γ遺伝子及びIL−12遺伝子などのサイトカイン遺伝子並びにgp−100,MART−1及びMAGE−1などの癌抗原ペプチド遺伝子が癌治療に利用できる。
【0066】
また、VEGF遺伝子,HGF遺伝子及びFGF遺伝子などのサイトカイン遺伝子並びにc−mycアンチセンス,c−mybアンチセンス,cdc2キナーゼアンチセンス,PCNAアンチセンス,E2Fデコイやp21(sdi−1)遺伝子が血管治療に利用できる。また、上記のようなDNAの導入、遺伝子発現のみならず、細胞内のmRNAを破壊するRNA干渉をsiRNAの導入で行うことも可能である。かかる一連の遺伝子は当業者には良く知られたものである。
【0067】
核酸含有複合体の粒径は50〜200nm程度、特に50〜170nm程度が好適である。これよりも小さいと、核酸含有複合体内部の核酸にまで酵素の作用が及ぶおそれ、あるいは腎臓にて濾過排出されるおそれがある。また、これよりも大きいと、細胞に導入されにくくなるおそれがある。
【0068】
核酸は、細胞に導入されることによりその細胞内で機能を発現することができるような形態で用いる。例えばDNAの場合、導入された細胞内で当該DNAが転写され、それにコードされるポリペプチドの産生を経て機能発現されるように当該DNAが配置されたプラスミドとして用いる。好ましくは、プロモーター領域、開始コドン、所望の機能を有する蛋白質をコードするDNA、終止コドン及びターミネーター領域が連続的に配列されている。
【0069】
所望により2種以上の核酸をひとつのプラスミドに含めることも可能である。
【0070】
核酸を導入する対象として望ましい「細胞」としては、当該核酸の機能発現が求められるものであり、このような細胞としては、例えば使用する核酸(すなわちその機能)に応じて種々選択され、例えば心筋細胞、平滑筋細胞、繊維芽細胞、骨格筋細胞、血管内皮細胞、骨髄細胞、骨細胞、血球幹細胞、血球細胞等が挙げられる。また、単球、樹状細胞、マクロファージ、組織球、クッパー細胞、破骨細胞、滑膜A細胞、小膠細胞、ランゲルハンス細胞、類上皮細胞、多核巨細胞等、消化管上皮細胞・尿細管上皮細胞などである。
【0071】
本発明の遺伝子導入剤を用いた核酸含有複合体は任意の方法で生体に投与することができる。
【0072】
当該投与方法としては静脈内又は動脈内への注入が特に好ましいが、筋肉内、脂肪組織内、皮下、皮内、リンパ管内、リンパ節内、体腔(心膜腔、胸腔、腹腔、脳脊髄腔等)内、骨髄内への投与の他に病変組織内に直接投与することも可能である。
【0073】
この核酸含有複合体を有効成分とする医薬は、更に必要に応じて製剤上許容し得る担体(浸透圧調整剤,安定化剤、保存剤、可溶化剤、pH調整剤、増粘剤等)と混合することが可能である。これら担体は公知のものが使用できる。
【0074】
また、この核酸含有複合体を有効成分とする医薬は、含まれる核酸の種類が異なる2種以上の核酸含有複合体を含めたものも包含される。このような複数の治療目的を併せ持つ医薬は、多様化する遺伝子治療の分野で特に有用である。
【0075】
投与量としては、動物、特にヒトに投与される用量は目的の核酸、投与方法及び治療される特定部位等、種々の要因によって変化する。しかしながら、その投与量は治療的応答をもたらすに十分であるべきである。
【0076】
この核酸含有複合体は、好ましくは遺伝子治療に適用される。適用可能な疾患としては、当該複合体に含められる核酸の種類によって異なるが、末梢動脈疾患、冠動脈疾患、動脈拡張術後再狭窄等の病変を生じる循環器領域での疾患に加え、癌(悪性黒色腫、脳腫瘍、転移性悪性腫瘍、乳癌等)、感染症(HIV等)、単一遺伝病(嚢胞性線維症、慢性肉芽腫、α1−アンチトリプシン欠損症、Gaucher病等)等が挙げられる。
【0077】
また、この核酸を複合した遺伝子導入剤の水溶液を基材に塗布などにより付着させ、必要に応じ乾燥させることにより、核酸を担持したポリマーのコーティング等が形成される。
【0078】
上記の核酸複合遺伝子導入剤を基材に付着させる場合、基材としてはシート状のものが好適である。このシート状基材の厚さは0.05〜10mm程度であることが好ましく、シート面の大きさは、方形の場合、一辺が1〜20mmであり他辺が1〜20mmであり、円形又は楕円形の場合、径は1〜20mm程度が好ましい。基材の材料としては、ポリオレフィン、ポリスチレン、ポリエステル、ポリアミド、ポリウレタン、シリコン樹脂、フッ素樹脂などの合成樹脂が好適である。この基材は多孔質であってもよい。
【0079】
この基材に対する核酸複合遺伝子導入剤の付着量は、基材表面1cm2当り0.001〜10mg程度が好ましい。
【0080】
核酸複合遺伝子導入剤を担持させた基材よりなる遺伝子導入材料は、皮下組織、心筋組織、病変組織、病変血管を包囲するようにシート状基材を配置したり、カバードステントのフィルムへ塗布することによって生体内に配置したり、生体外面に粘着テープを用いて貼り付けたりするようにして用いられる。
【実施例】
【0081】
以下に実施例を挙げて本発明をより具体的に説明するが、本発明はその要旨を超えない限り、以下の実施例に限定されるものではない。
【0082】
[遺伝子導入剤の合成]
i)イニファターの合成
下記反応式に従って、1,2,4,5−テトラキス(N,N−ジエチルジチオカルバミルメチル)ベンゼンを次のようにして合成した。
【0083】
1,2,4,5−テトラキス(ブロモメチルベンゼン)5.0gとN,N−ジエチルジチオカルバミル酸ナトリウム34.0gをエタノール100mL中へ加え、遮光下、室温で4日間攪拌した。沈殿物を濾過し、3Lのメタノールへ投入して30分間撹拌して濾過した。この操作を繰り返して合計4回行った。沈殿物をトルエン200mLへ溶解した後、100mLのメタノールを加えて50℃に加温し、冷蔵庫中で15時間保管して再結晶させ結晶を濾別後、大量のメタノールで洗浄した。結晶を室温で減圧乾燥して白色の1,2,4,5−テトラキス(N,N−ジエチルジチオカルバミルメチル)ベンゼンの針状結晶を得た(収率90%)。高速液体クロマトグラフィーにより、原料ピークが消失し、精製物が単一物質であることを確認した。
【0084】
1H NMR(in CDCl3)の測定結果はδ1.26−1.31ppm(t,24H,CH2CH3),δ3.69−3.77ppm(q,8H,N(CH2CH3)2),δ3.99−4.07ppm(q,8H,N(CH2CH3)2),δ4.57ppm(s,8H,Ar−CH2),δ7.49ppm(s,2H,Ar−H)となった。
【0085】
【化1】

【0086】
ii)4分岐型スター型重合体の合成(1次ポリマーの合成)
N,N−ジメチルアクリルアミドを非イオン性親水性モノマーとして用い、1,2,4,5−テトラキス[(N,N−ジエチルジチオカルバミル)ポリ(N,N−ジメチルアクリルアミド)−メチル]ベンゼン(以下、pDMAAmと記載することがある。)よりなる1次ポリマーの合成を行った。
【0087】
即ち、上記i)により合成した1,2,4,5−テトラキス(N,N−ジエチルジチオカルバミルメチル)ベンゼン45.6mgを20mLのトルエンへ溶解し、N,N−ジメチルアクリルアミド(N,N−DMAAm)を7.4gを加えて混合し、全量をトルエンで50mLに調整した。3mm厚軟質ガラスセル中で激しく攪拌しながら高純度窒素ガスで5分間パージした後、300Wショートアークキセノンランプ(朝日分光社製、MAX−301)で250nm〜400nmの混合紫外線を20分間照射した。照射強度はウシオ電機社のUIT−150へUVD−C405(検出波長範囲320nm〜470nm)を装着して2.5mW/cm2に調整した。重合溶液をエバポレーターで濃縮し、ジエチルエーテルで重合物を再沈殿させ、クロロホルム/ジエチルエーテル系で3回再沈殿を繰り返して精製し、エーテルを蒸散させた後に少量の水へ溶解し、0.2μmフィルターで濾過してから凍結乾燥させて4分岐型スター型重合体(pDMAAm)を得た(重合率37%)。この1次ポリマーの分子量はポリエチレングリコール換算のGPCにより、50,000(Mw/Mn=1.8)と測定された。
【0088】
1H NMR(in D2O)の測定結果は、δ1.6−1.9ppm(br,2H,−CH2−C),δ2.9−3.1ppm(br,6H,N−CH3)となった。
【0089】
【化2】

【0090】
iii)4分岐型スター型重合体(1次ポリマー)の水膨潤性
上記ii)で合成した1次ポリマー1.0gを1.0gの水を加えて混練し、ペースト状にした。25℃の条件下で、このペーストを1.0mL正確に分取し重量を計測したところ、1.11g(Wwet)であった。このペーストをプラスチックトレイへ移し、24時間真空乾燥した。得られた乾燥ポリマーの重量を測定したところ0.13±0.03g(Wdry)であった。前記(I)式よりこの1次ポリマーの膨潤率を計算したところ7.5であった。計算式は以下の通りである。
【0091】
(Wwet−Wdry)/Wdry (I)
(1.11−0.13)/0.13=7.5
【0092】
この結果より、上記ii)で合成した1次ポリマーは、水を含むと、膨潤率2以上で大きく膨潤することがわかる。
【0093】
iv)4分岐型スター型共重合体の合成(2次ポリマーの合成)
【0094】
上記ii)で合成した4分岐型スター型重合体よりなる非イオン性親水性ホモポリマー2.0g及び3−N,N−ジメチルアミノプロピルアクリルアミド4.0gを約30mLのトルエンへ溶解し、全量をトルエンで50mLとした。ガラス容器中で激しく攪拌しながら高純度窒素ガス(G1グレード,流量は2L/分)で10分間パージした後に、光照射時間を15分とした以外は上記ii)と同様の手法で光照射重合を行い、クロロホルム/ジエチルエーテル系で3回再沈殿処理を行い、エーテルを蒸散させた後に少量の水へ溶解し、0.2μmフィルターで濾過してから凍結乾燥させて4分岐型スター型共重合体を得た(重合率22%)。得られた2次ポリマーの分子量はGPCにより55,000(Mw/Mn=2.5)と測定された。以上より、ベンゼンを中心核として放射状にN,N−ジメチルアクリルアミドのポリマーブロック(分子量50,000)と3−N,N−ジメチルアミノプロピルアクリルアミドのポリマーブロック(分子量5,000)とが導入された4分岐型スター型共重合体が合成されたことが確認された。
この2次ポリマーを実施例1の遺伝子導入剤とした。
【0095】
【化3】

【0096】
iv)高分子量4分岐型スター型カチオン性重合体の光重合による合成(比較例1)
3−N,N−ジメチルアミノプロピルアクリルアミドをカチオン性モノマーとして用い、1,2,4,5−テトラキス[(N,N−ジエチルジチオカルバミル)ポリ(N,N−ジメチルアクリルアミド)−メチル]ベンゼン(以下、pDMAPAAmと記載することがある。)よりなる高分子量4分岐型スター型カチオン性重合体(高分子量カチオン性ホモポリマー)の合成を行った。
【0097】
即ち、上記i)により合成した1,2,4,5−テトラキス(N,N−ジエチルジチオカルバミルメチル)ベンゼン45.6mgを20mLのトルエンへ溶解し、N,N−ジメチルアミノプロピルアクリルアミド(N,N−DMAPAAm)7.9gを加えて混合し、全量をトルエンで50mLに調整した。3mm厚軟質ガラスセル中で激しく攪拌しながら高純度窒素ガスで5分間パージした後、300Wショートアークキセノンランプ(朝日分光社製、MAX−301)で250nm〜400nmの混合紫外線を50分間照射した。照射強度はウシオ電機社のUIT−150へUVD−C405(検出波長範囲320nm〜470nm)を装着して2.5mW/cm2に調整した。重合溶液をエバポレーターで濃縮し、ジエチルエーテルで重合物を再沈殿させ、クロロホルム/ジエチルエーテル系で3回再沈殿を繰り返して精製し、エーテルを蒸散させた後に少量の水へ溶解し、0.2μmフィルターで濾過してから凍結乾燥させて高分子量4分岐型スター型カチオン性重合体pDMAPAAmよりなる高分子量カチオン性ホモポリマーを得た(重合率32%)。この高分子量カチオン性ホモポリマーの分子量はポリエチレングリコール換算のGPCにより、50,000(Mw/Mn=1.5)と測定された。
この高分子量カチオン性ホモポリマーを比較例1の遺伝子導入剤とした。
【0098】
1H NMR(in D2O)の測定結果は、δ1.5−1.8ppm(br,2H,−CH2CH2CH2−),δ2.1−2.2ppm(br,6H,N−CH3),δ2.2−2.4ppm(br,2H,CH2−N),δ3.0−3.4ppm(br,2H,NH−CH2),δ7.4−7.8ppm(br,1H,−NH−)となった。
【0099】
【化4】

【0100】
vi)低分子量4分岐型スター型カチオン性重合体の光重合による合成
カチオン性モノマーとして3−N,N−ジメチルアミノプロピルアクリルアミドを4.0g使用することと光重合時間を20分としたこと以外は、上記v)と同様の手法により低分子量4分岐型スター型カチオン性重合体(低分子量カチオン性ホモポリマー)を合成した。この低分子量カチオン性ホモポリマーの分子量はポリエチレングリコール換算のGPCにより、5,000(Mw/Mn=1.5)と測定された。
この低分子量カチオン性ホモポリマーを比較例2の遺伝子導入剤とした。
【0101】
【化5】

【0102】
vii)実施例1及び比較例1,2の遺伝子導入剤と核酸との複合体の形成
実施例1及び比較例1,2の遺伝子導入剤と核酸との複合体(ポリプレックス微粒子)のゼーター電位及び光散乱粒子径を測定した。DNAにはpGL3コントロールベクターを使用した。各遺伝子導入剤中の単位重量あたりの陽電荷数は、各遺伝子導入剤の分子量と非イオン性ポリマーのモノマー単位の分子量99.5とカチオン性ポリマーのモノマー単位の分子量156.5から計算して求めた。DNA中の単位重量あたりの陰電荷数は配列マップによる塩基対数と核酸塩基の平均的分子量660とから計算した。陽電荷と陰電荷の比(所謂CA比)は、20となるように調整した。得られたポリプレックス微粒子のゼーター電位および動的光散乱をシスメックス社のゼーターサイザーナノを使用して測定した。
【0103】
比較例1の遺伝子導入剤である高分子量カチオン性ホモポリマーは、ゼーター電位が高く(29mV)、粒子径も小さい(186nm)ところからDNAが効率良く凝集されていることがわかる。比較例2の遺伝子導入剤である低分子量カチオン性ホモポリマーは、ゼーター電位が低い(10mV)ことから不安定なマクロ粒子が形成されていると考えられる。また、比較例2の低分子量カチオン性ホモポリマーとDNAとからなるポリプレックス微粒子の粒径は、約1200nmであり、細胞膜を透過するのに適した粒径(200nm)ではなく、DNAが十分に凝集されていないことが分かった。実施例1の遺伝子導入剤では、カチオン性ポリマーブロックの分子量が比較例2のカチオン性ポリマーブロックの分子量と同等であるにもかかわらず、比較例1と同程度のゼーター電位(27mV)を示し、ポリプレックス微粒子の粒径も230nmと十分に小さい値を示した。
【0104】
viii)細胞毒性の評価
実施例1、及び比較例1,2の遺伝子導入剤を用いて細胞毒性をMTT法にて比較した。上記vii)で形成させたポリプレックス微粒子をMTT試薬のロイコ色素が正常に機能している(細胞が傷害を受けていない)ミトコンドリアにより紫色のホルマザンへ還元される量を測定し、盲検の値と比較して相対的なミトコンドリア活性(細胞生存率(%))として計算した。結果を図1に示す。
【0105】
図1より、比較例1と比較例2を比較すると、細胞毒性は、カチオン性ポリマーブロックの分子量に依存して増大する傾向が確認された。実施例1では、比較例2と同等のミトコンドリア活性が確認され、分岐型重合体の分子量が大きくてもカチオン性ポリマーブロックの分子量が小ければ細胞毒性を抑制することができることが確認された。
【0106】
ix)遺伝子導入活性の評価
細胞にはアフリカミドリサル腎細胞の由来のCOS-1を使用し、DNAにはpGL3コントロールベクターを使用した。COS-1細胞は細胞数を4万個/mLへ調整して24Well培養皿へ播種し、培養24時間後に遺伝子導入を行った。
【0107】
上記実施例1、比較例1,2の遺伝子導入剤をそれぞれ使用し、上記vii)と同様の方法で調製したポリプレックス微粒子を150μLのOPTI−MEM中で30分間インキュベートした。ドーズ数としては0.5μgのDNAが各Wellへ投与されるように溶液を調整し、培養細胞へ加えた。3時間の培養の後、OPTI−MEMを除去し、PBSで洗浄した後に完全培地を加えてさらに48時間培養を行った。トランスフェクションの48時間後にルシフェラーゼアッセにより遺伝子導入活性の評価を行った(プロメガ社、アッセイキット試薬)。補正はタンパク濃度で行い、タンパク定量はBioRad社のBradford試薬で行った。結果を図2に示す。
【0108】
図2より、比較例1と比較例2を比較すると、遺伝子導入活性はカチオン性ポリマーブロックの分子量に依存し、カチオン性ポリマーブロックの分子量が大きい比較例1のほうが遺伝子導入活性に優れていることが分かる。一方、実施例1及び比較例2の遺伝子導入剤は、カチオン性ポリマーブロックの分子量が同じであるが、実施例1の方が遺伝子導入活性に優れている。これは、実施例1の方が分岐型重合体の粒径が大きいためであると考えられる。
【0109】
以上の結果より、本発明の遺伝子導入剤の分岐型重合体は、カチオン性ポリマーブロックの分子量が同程度の分岐型重合体に比べて遺伝子導入活性に優れ、且つ分岐型重合体の分子量が同程度であって、分岐鎖がカチオン性ポリマーブロックのみからなる分岐型重合体に比べて細胞毒性を軽減することができることが分かる。
【特許請求の範囲】
【請求項1】
芳香環を核とし、それから伸延した複数の分岐鎖を有する分岐型重合体からなる遺伝子導入剤において、
該分岐鎖は、基端側の、非イオン性親水性モノマーを重合させてなる非イオン性親水性ポリマーブロックと、先端側の、カチオン性ビニル系モノマーを重合させてなるカチオン性ポリマーブロックとを有し、
該分岐型重合体は、芳香環よりなる核に該非イオン性親水性ポリマーブロック鎖を導入して1次ポリマーを形成させた後、該1次ポリマーに該カチオン性ポリマーブロック鎖を導入して2次ポリマーを形成させたものであって、
該1次ポリマーの乾燥した状態の重量(Wdry)と、該1次ポリマーの湿潤した状態の重量(Wwet)との関係が下記(I)式を満たすことを特徴とする遺伝子導入剤。
{(Wwet)−(Wdry)}/(Wdry)≧2.0 (I)
【請求項2】
請求項1において、前記分岐型重合体は、N,N−ジ置換−ジチオカルバミルメチル基を同一分子内に3個以上有する化合物をイニファターとし、これに前記非イオン性親水性ポリマーブロック鎖を導入して1次ポリマーを形成させた後、該1次ポリマーに前記カチオン性ポリマーブロック鎖を導入して2次ポリマーを形成させた分岐型重合体であることを特徴とする遺伝子導入剤。
【請求項3】
請求項2において、N,N−ジ置換−ジチオカルバミルメチル基を同一分子内に3個以上有する化合物は、ベンゼン環を核とし、この核に分岐鎖として3個以上の該N,N−ジ置換−ジチオカルバミルメチル基が結合していることを特徴とする遺伝子導入剤。
【請求項4】
請求項2又は3において、前記N,N−ジ置換−ジチオカルバミルメチル基は、N,N−ジアルキル−ジチオカルバミルメチル基であることを特徴とする遺伝子導入剤。
【請求項5】
請求項1ないし4のいずれか1項において、前記非イオン性親水性モノマーは、N,N−ジメチルアクリルアミド、N−ビニルピロリドン、ヒドロキシアルキルアクリル酸、ビニル酢酸鹸化物、およびヒアルロン酸修飾ビニルモノマーからなる群より選択される少なくとも1種であることを特徴とする遺伝子導入剤。
【請求項6】
請求項1ないし5のいずれか1項において、前記カチオン性ビニル系モノマーが3−N,N−ジメチルアミノプロピルアクリルアミド、及び/又は2−N,N−ジメチルアミノエチルメタクリレートであることを特徴とする遺伝子導入剤。
【請求項7】
請求項1ないし6のいずれか1項において、前記1次ポリマーの分子量が、10,000〜100,000であることを特徴とする遺伝子導入剤。
【請求項8】
請求項1ないし7のいずれか1項において、前記カチオン性ポリマーブロックの分子量が、1,000〜30,000であることを特徴とする遺伝子導入剤。
【請求項9】
請求項1ないし8のいずれか1項において、前記分岐型重合体の分子量が、12,000〜120,000であることを特徴とする遺伝子導入剤。
【請求項10】
請求項1ないし9のいずれか1項の遺伝子導入剤と核酸とを複合させてなる核酸複合体。
【請求項1】
芳香環を核とし、それから伸延した複数の分岐鎖を有する分岐型重合体からなる遺伝子導入剤において、
該分岐鎖は、基端側の、非イオン性親水性モノマーを重合させてなる非イオン性親水性ポリマーブロックと、先端側の、カチオン性ビニル系モノマーを重合させてなるカチオン性ポリマーブロックとを有し、
該分岐型重合体は、芳香環よりなる核に該非イオン性親水性ポリマーブロック鎖を導入して1次ポリマーを形成させた後、該1次ポリマーに該カチオン性ポリマーブロック鎖を導入して2次ポリマーを形成させたものであって、
該1次ポリマーの乾燥した状態の重量(Wdry)と、該1次ポリマーの湿潤した状態の重量(Wwet)との関係が下記(I)式を満たすことを特徴とする遺伝子導入剤。
{(Wwet)−(Wdry)}/(Wdry)≧2.0 (I)
【請求項2】
請求項1において、前記分岐型重合体は、N,N−ジ置換−ジチオカルバミルメチル基を同一分子内に3個以上有する化合物をイニファターとし、これに前記非イオン性親水性ポリマーブロック鎖を導入して1次ポリマーを形成させた後、該1次ポリマーに前記カチオン性ポリマーブロック鎖を導入して2次ポリマーを形成させた分岐型重合体であることを特徴とする遺伝子導入剤。
【請求項3】
請求項2において、N,N−ジ置換−ジチオカルバミルメチル基を同一分子内に3個以上有する化合物は、ベンゼン環を核とし、この核に分岐鎖として3個以上の該N,N−ジ置換−ジチオカルバミルメチル基が結合していることを特徴とする遺伝子導入剤。
【請求項4】
請求項2又は3において、前記N,N−ジ置換−ジチオカルバミルメチル基は、N,N−ジアルキル−ジチオカルバミルメチル基であることを特徴とする遺伝子導入剤。
【請求項5】
請求項1ないし4のいずれか1項において、前記非イオン性親水性モノマーは、N,N−ジメチルアクリルアミド、N−ビニルピロリドン、ヒドロキシアルキルアクリル酸、ビニル酢酸鹸化物、およびヒアルロン酸修飾ビニルモノマーからなる群より選択される少なくとも1種であることを特徴とする遺伝子導入剤。
【請求項6】
請求項1ないし5のいずれか1項において、前記カチオン性ビニル系モノマーが3−N,N−ジメチルアミノプロピルアクリルアミド、及び/又は2−N,N−ジメチルアミノエチルメタクリレートであることを特徴とする遺伝子導入剤。
【請求項7】
請求項1ないし6のいずれか1項において、前記1次ポリマーの分子量が、10,000〜100,000であることを特徴とする遺伝子導入剤。
【請求項8】
請求項1ないし7のいずれか1項において、前記カチオン性ポリマーブロックの分子量が、1,000〜30,000であることを特徴とする遺伝子導入剤。
【請求項9】
請求項1ないし8のいずれか1項において、前記分岐型重合体の分子量が、12,000〜120,000であることを特徴とする遺伝子導入剤。
【請求項10】
請求項1ないし9のいずれか1項の遺伝子導入剤と核酸とを複合させてなる核酸複合体。
【図1】


【図2】




【図2】


【公開番号】特開2010−275199(P2010−275199A)
【公開日】平成22年12月9日(2010.12.9)
【国際特許分類】
【出願番号】特願2009−126717(P2009−126717)
【出願日】平成21年5月26日(2009.5.26)
【出願人】(591108880)国立循環器病センター総長 (159)
【出願人】(000005278)株式会社ブリヂストン (11,469)
【Fターム(参考)】
【公開日】平成22年12月9日(2010.12.9)
【国際特許分類】
【出願日】平成21年5月26日(2009.5.26)
【出願人】(591108880)国立循環器病センター総長 (159)
【出願人】(000005278)株式会社ブリヂストン (11,469)
【Fターム(参考)】
[ Back to top ]

