遺伝子導入剤及び核酸複合体
【課題】血清を含む培地において、より効率的に、細胞に遺伝子を導入することができる遺伝子導入剤を提供する。この遺伝子導入剤と核酸とを複合させてなる核酸複合体を提供する。
【解決手段】芳香環を核とし、それから伸延した複数の分岐鎖を有する分岐型重合体を用いた遺伝子導入剤。該分岐鎖は、少なくとも2−N,N−ジメチルアミノエチルメタクリレート及び/又はその誘導体と、3−N,N−ジメチルアミノプロピルアクリルアミドとをランダム共重合してなる重合体よりなり、該重合体を構成する2−N,N−ジメチルアミノエチルメタクリレート及び/又はその誘導体由来の構成単位と、3−N,N−ジメチルアミノプロピルアクリルアミド由来の構成単位との合計に対する該3−N,N−ジメチルアミノプロピルアクリルアミド由来の構成単位の割合が、30mol%以下である。この遺伝子導入剤と核酸との核酸複合体。
【解決手段】芳香環を核とし、それから伸延した複数の分岐鎖を有する分岐型重合体を用いた遺伝子導入剤。該分岐鎖は、少なくとも2−N,N−ジメチルアミノエチルメタクリレート及び/又はその誘導体と、3−N,N−ジメチルアミノプロピルアクリルアミドとをランダム共重合してなる重合体よりなり、該重合体を構成する2−N,N−ジメチルアミノエチルメタクリレート及び/又はその誘導体由来の構成単位と、3−N,N−ジメチルアミノプロピルアクリルアミド由来の構成単位との合計に対する該3−N,N−ジメチルアミノプロピルアクリルアミド由来の構成単位の割合が、30mol%以下である。この遺伝子導入剤と核酸との核酸複合体。
【発明の詳細な説明】
【技術分野】
【0001】
本発明は、遺伝子導入剤及び核酸複合体に係り、特に分岐型重合体を用いた遺伝子導入剤と、この遺伝子導入剤と核酸とを複合させた核酸複合体に関する。
【背景技術】
【0002】
近年、ヒト疾患の分子遺伝学的要因が明らかになるにつれ、遺伝子治療研究がますます重要視されている。遺伝子治療法は標的とする部位でのDNAの発現を目的としており、いかにDNAを標的部位に到達させるか、いかにDNAを標的部位に効率的に導入し、当該部位で機能的に発現させるかということが重要となる。外来DNAの導入のためのベクターとして、レトロウイルス、アデノウイルス、アデノ付随ウイルス、レンチウイルス、センダイウイルス又はヘルペスウイルスを含む多くのウイルスが、治療用遺伝子を運搬するように改変されて、遺伝子治療のヒトの臨床試験に使用されている。しかし、感染及び免疫反応の危険性は依然として残されているため、これらのベクターに代わる遺伝子導入技術として、合成高分子ベクター、カチオン性脂質ベクターが研究開発されている。
【0003】
本出願人らは、pKaの値が高く、中性条件においてもプロトン化されている3−N,N−ジメチルアミノプロピルアクリルアミドを主モノマーとして重合してなる分岐鎖を有する分岐型重合体からなる遺伝子導入剤が、効率よく細胞に遺伝子を導入することができることを見出し、先に特許出願した(特許文献1)。
【0004】
本出願人らはまた、より分子量が大きく、より複雑な構造を有する分岐型重合体の方が遺伝子導入活性に優れるという知見、及び前記3−N,N−ジメチルアミノプロピルアクリルアミドを重合してなる分岐鎖の側鎖は、基端側のアミド基と、先端側のアミノ基との間にプロピレン基を有するため、側鎖間における架橋反応が生じ易いという知見に基き、前記分岐型重合体同士を架橋してなる遺伝子導入剤を提案した(特許文献2)。
【0005】
このようなカチオン性モノマーを重合してなる分岐鎖を有する遺伝子導入剤にあっては、その構造上、電荷密度を高く配置することが可能であるため、DNAやRNAなどの核酸をより強く凝集させることが可能であり、より粒子径の小さい微細なポリプレックス粒子を形成させることができるが、以下の問題がある。
【0006】
即ち、細胞に遺伝子を導入する際の細胞を培養する培地としては、細胞へのストレスを軽減する観点から血清を含む培地を用いるが、前述の高pKaの分岐鎖を有する遺伝子導入剤は、その高いカチオン性により、血清中のアニオン性タンパクを吸着してしまう。従って、この遺伝子導入剤は、血清を含む培地において用いた場合、この遺伝子導入剤と核酸とからなる核酸複合体が血清中のアニオン性タンパクを吸着し、マクロ粒子を形成するため、細胞内に取り込まれにくくなったり、核酸がトランスポーターに認識されにくくなり、細胞に対して遺伝子を効率的に導入することができない。
【0007】
この問題に対して、本出願人らは、血清を含む培地における遺伝子導入方法として、所定温度(T)未満ではカチオン性を示すが、所定温度(T)以上では疎水性を示す2−N,N−ジメチルアミノエチルメタクリレートを重合してなる感温性カチオン性ポリマー鎖よりなる分岐鎖を有する遺伝子導入剤を用い、この遺伝子導入剤と核酸とを含む溶液を所定温度(T)未満で混合した後、該溶液を所定温度(T)以上に加温して、遺伝子導入剤と核酸とを複合させることにより核酸複合体を得、この核酸複合体と細胞とを、血清を含む培地において、該所定温度(T)以上で接触させて、細胞に遺伝子を導入する遺伝子導入方法を提案した(特許文献3)。
【先行技術文献】
【特許文献】
【0008】
【特許文献1】WO2004/092388号公報
【特許文献2】特開2008−289468号公報
【特許文献3】特願2009−126718
【発明の概要】
【発明が解決しようとする課題】
【0009】
前記特許文献3に記載される2−N,N−ジメチルアミノエチルメタクリレートを重合してなる分岐鎖は、pKaの値が低く、中性条件下においてほとんど電荷を持っていないため、DNAの凝集力が弱いものの、血清に含まれるアニオン性タンパクなどの影響を受けにくい。従って、この2−N,N−ジメチルアミノエチルメタクリレートを重合してなる分岐鎖を有する遺伝子導入剤は、血清を含まない培地においては、前述の3−N,N−ジメチルアミノプロピルアクリルアミドを重合してなる遺伝子導入剤よりも低い遺伝子導入活性を示すものの、血清を含む培地においては、高い遺伝子導入活性を示す。
【0010】
しかしながら、この2−N,N−ジメチルアミノエチルメタクリレートは、3−N,N−ジメチルアミノプロピルアクリルアミドに比べて重合性に乏しいため、遺伝子の導入に有利な、分子量の大きい分岐型重合体を合成することが困難である。また、2−N,N−ジメチルアミノエチルメタクリレートを重合してなる分岐鎖の側鎖は、側鎖の先端側のアミノ基と基端側のエステル結合との間がエチレン基であるため、プロピレン基を有する3−N,N−ジメチルアミノプロピルアクリルアミドを重合してなる分岐鎖の側鎖に比べて分岐型重合体同士の架橋反応が起こり難い。従って、2−N,N−ジメチルアミノエチルメタクリレートを重合してなる分岐鎖を有する分岐型重合体は、前述の3−N,N−ジメチルアミノプロピルアクリルアミドを重合してなる分岐鎖を有する分岐型重合体のように、分岐型重合体同士を架橋することにより、遺伝子導入活性に優れる分子量の高い架橋分岐型重合体を得ることが困難であった。
【0011】
本発明は上記従来の課題に鑑みてなされたものであり、血清を含む培地において、より効率的に、細胞に遺伝子を導入することができる遺伝子導入剤を提供することを目的とする。
本発明はまた、この遺伝子導入剤と核酸とを複合させてなる核酸複合体を提供することを目的とするものである。
【課題を解決するための手段】
【0012】
本発明(請求項1)の遺伝子導入剤は、芳香環を核とし、それから伸延した複数の分岐鎖を有する分岐型重合体を用いた遺伝子導入剤において、該分岐鎖は、少なくとも2−N,N−ジメチルアミノエチルメタクリレート及び/又はその誘導体と、3−N,N−ジメチルアミノプロピルアクリルアミドとをランダム共重合してなる重合体よりなり、該重合体を構成する2−N,N−ジメチルアミノエチルメタクリレート及び/又はその誘導体由来の構成単位と、3−N,N−ジメチルアミノプロピルアクリルアミド由来の構成単位との合計に対する該3−N,N−ジメチルアミノプロピルアクリルアミド由来の構成単位の割合が、30mol%以下であることを特徴とするものである。
【0013】
請求項2の遺伝子導入剤は、請求項1において、前記重合体を構成する2−N,N−ジメチルアミノエチルメタクリレート及び/又はその誘導体由来の構成単位と、3−N,N−ジメチルアミノプロピルアクリルアミド由来の構成単位との合計に対する該3−N,N−ジメチルアミノプロピルアクリルアミド由来の構成単位の割合が、1〜15mol%であることを特徴とするものである。
【0014】
請求項3の遺伝子導入剤は、請求項1又は2において、前記遺伝子導入剤は、前記分岐型重合体に対して光照射することにより該分岐型重合体同士が架橋した架橋分岐型重合体よりなるものであり、該架橋分岐型重合体の数平均分子量は、該分岐型重合体の数平均分子量の1.2倍以上であることを特徴とするものである。
【0015】
請求項4の遺伝子導入剤は、請求項3において、前記架橋分岐型重合体の数平均分子量は、前記分岐型重合体の数平均分子量の1.2〜5.0倍であることを特徴とするものである。
【0016】
請求項5の遺伝子導入剤は、請求項1ないし4のいずれか1項において、前記分岐型重合体は、N,N−ジ置換−ジチオカルバミルメチル基を同一分子内に3個以上有する化合物をイニファターとし、これに少なくとも前記2−N,N−ジメチルアミノエチルメタクリレート及び/又はその誘導体と、3−N,N−ジメチルアミノプロピルアクリルアミドとを光照射リビング重合させてなるものであることを特徴とするものである。
【0017】
請求項6の遺伝子導入剤は、請求項5において、前記N,N−ジ置換−ジチオカルバミルメチル基を同一分子内に3個以上有する化合物は、ベンゼン環を核とし、この核に分岐鎖として3個以上の該N,N−ジ置換−ジチオカルバミルメチル基が結合していることを特徴とするものである。
【0018】
請求項7の遺伝子導入剤は、請求項5又は6において、前記N,N−ジ置換−ジチオカルバミルメチル基は、N,N−ジアルキル−ジチオカルバミルメチル基であることを特徴とするものである。
【0019】
請求項8の遺伝子導入剤は、請求項1ないし7のいずれか1項において、前記分岐鎖が、前記2−N,N−ジメチルアミノエチルメタクリレート及び/又はその誘導体と、3−N,N−ジメチルアミノプロピルアクリルアミドとのランダム共重合体よりなることを特徴とするものである。
【0020】
請求項9の遺伝子導入剤は、請求項1ないし8のいずれか1項において、前記分岐鎖の1本当たりの分子量は、300〜20,000であることを特徴とするものである。
【0021】
請求項10の遺伝子導入剤は、請求項1ないし9のいずれか1項において、前記分岐型重合体の分子量は、2,000〜150,000であることを特徴とするものである。
【0022】
本発明(請求項11)の核酸複合体は、請求項1ないし10のいずれか1項に記載の遺伝子導入剤と核酸とを複合させてなるものである。
【発明の効果】
【0023】
本発明の遺伝子導入剤が有する分岐鎖は、少なくとも2−N,N−ジメチルアミノエチルメタクリレート及び/又はその誘導体(以下、2−N,N−ジメチルアミノエチルメタクリレート及び/又は誘導体を、「DMAEM」と略記する場合がある。)と、3−N,N−ジメチルアミノプロピルアクリルアミド(以下、3−N,N−ジメチルアミノプロピルアクリルアミドを、単に、「DMAPAA」と略記する場合がある。)とをランダム共重合してなる重合体であって、この分岐鎖の重合体を構成するDMAEM由来の構成単位(以下、「DMAEM単位」と称す場合がある。)と、該重合体のDMAPAA由来の構成単位(以下、「DMAPAA単位」と称す場合がある。)との合計に対するDMAPAA単位の割合(以下、この割合を、単に、「DMAPAA単位割合」と称す場合がある。)が、30mol%以下であることを特徴とする。
【0024】
本発明の遺伝子導入剤にあっては、その分岐鎖が、少なくともDMAEMと、DMAPAAとをランダム共重合してなるポリマー鎖であるため、アニオン性タンパクなどの影響を受けにくいDMAEM単位に起因する効果と、重合性に富み、分子量が大きい分岐型重合体を合成することができるDMAPAA単位に起因する効果とを有する。
【0025】
また、本発明にあっては、前記DMAPAA単位割合を30mol%以下、特に1〜15mol%(請求項2)としているため、遺伝子導入剤全体としてはDMAEM単位に起因する疎水性を示すことから、この遺伝子導入剤を血清を含む培地で用いた場合であっても、血清に含まれるアニオン性タンパクの影響を受けにくく、細胞に対して効率的に遺伝子を導入することができる。
【0026】
本発明の遺伝子導入剤は、前記分岐型重合体に対して、光照射することにより該分岐型重合体同士が架橋した架橋分岐型重合体よりなるものであってもよく、この場合の該架橋分岐型重合体の数平均分子量は、該分岐型重合体の数平均分子量の1.2倍以上(請求項3)、特に、1.2〜5.0倍であることが好ましい(請求項4)。前記分岐型重合体を架橋することにより、弱塩基性の2−N,N−ジメチルアミノエチルメタクリレートを主モノマーとして用いた分岐鎖を有する架橋体分岐型重合体を得ることができる。また、架橋分岐型重合体の数平均分子量が、架橋前の分岐型重合体の数平均分子量の1.2倍以上、特に2.0〜3.0倍であれば、架橋分岐型重合体が複雑なネットワーク構造を備えると共に、架橋前の分岐型重合体が有する水への良好な溶解性を維持するため、核酸をより効率的に包接することが可能となる。
【0027】
前記分岐型重合体は、N,N−ジ置換−ジチオカルバミルメチル基を同一分子内に3個以上有する化合物をイニファターとし、これに少なくとも前記2−N,N−ジメチルアミノエチルメタクリレート及び/又はその誘導体と、3−N,N−ジメチルアミノプロピルアクリルアミドとを光照射リビング重合させてなるものであることが好ましく(請求項5)、前記N,N−ジ置換−ジチオカルバミルメチル基を同一分子内に3個以上有する化合物としては、ベンゼン環を核とし、この核に分岐鎖として3個以上のN,N−ジ置換−ジチオカルバミルメチル基が結合していることが好ましく(請求項6)、このN,N−ジ置換−ジチオカルバミルメチル基としては、N,N−ジアルキル−ジチオカルバミルメチル基であることが好ましい(請求項7)。
【0028】
前記分岐鎖は、前記DMAEM単位と、DMAPAA単位とのランダム共重合体であることが好ましい(請求項8)。
【0029】
前記分岐鎖1本当たりの分子量は、300〜20,000であることが好ましい(請求項9)。分岐鎖1本当たりの分子量がこの範囲内であると、遺伝子導入剤の高分子量化を抑えた上で、効率的に遺伝子を導入することができる遺伝子導入剤を得ることができる。また、前記分岐型重合体の分子量は、2,000〜150,000でることが好ましい(請求項10)。分岐型重合体の分子量が上記範囲内であると、高分子量化を抑えた上で、より効率的に遺伝子導入剤と核酸とを複合化させることができ、比較的低分子量で遺伝子導入効率に優れた遺伝子導入剤を得ることができる。
【0030】
本発明の核酸複合体は、前記遺伝子導入剤と核酸とを複合させてなる核酸複合体である(請求項11)。
【図面の簡単な説明】
【0031】
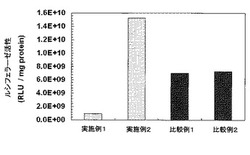
【図1】実施例1,2及び比較例1,2の遺伝子導入剤の遺伝子導入活性の評価結果を示すグラフである。
【発明を実施するための形態】
【0032】
以下に本発明の実施の形態を詳細に説明する。
【0033】
[遺伝子導入剤]
<分岐型重合体>
本発明の遺伝子導入剤は、芳香環を核とし、それから伸延した複数の分岐鎖を有する分岐型重合体を用いた遺伝子導入剤において、該分岐鎖が、少なくともDMAEMと、DMAPAAとをランダム共重合してなる重合体であって、前記DMAPAA単位割合が、30mol%以下であることを特徴とする。
【0034】
本発明の遺伝子導入剤は、前述の通り、分岐鎖が少なくともDMAEM単位とDMAPAA単位とを含むため、DMAPAA単位を分岐鎖に有することによる重合性向上効果により、分岐型重合体の高分子量化、分子構造の複雑化を図ることができ、且つ、DMAEM単位を分岐鎖に有することによる分岐型重合体の疎水化効果により、アニオン性タンパクなどの影響を受けにくいという特徴を併せ持つため、この遺伝子導入剤は、核酸を包接する能力が高く、且つ、血清を含む培地においても効率的に遺伝子を導入することができる。
【0035】
本発明において用いる分岐型重合体は、N,N−ジ置換ジチオカルバミルメチル基を同一分子内に3個以上有する化合物をイニファターとし、このイニファターに少なくともDMAEM及びDMAPAAを光照射リビング重合によりランダム共重合させたものが好ましい。
【0036】
なお、本明細書において、イニファターとは、光照射によりラジカルを発生させる重合開始剤、連鎖移動剤としての機能と共に、成長末端と結合して成長を停止する機能、さらに光照射が停止すると重合を停止させる重合開始・重合停止剤として機能する分子のことである。
【0037】
イニファターとなるN,N−ジ置換ジチオカルバミルメチル基を同一分子内に3個以上有する芳香族化合物としては、ベンゼン環に該N,N−ジ置換ジチオカルバミルメチル基、好ましくはN,N−ジアルキルジチオカルバミルメチル基が3個以上分岐鎖として結合しているものが好適であり、具体的には次が例示される。即ち、3分岐鎖化合物としては、1,3,5−トリ(ブロモメチル)ベンゼンとN,N−ジアルキルジチオカルバミン酸ナトリウム(ナトリウムN,N−ジアルキルジチオカルバメート)とをエタノール中で付加反応させて得られる1,3,5−トリ(N,N−ジアルキルジチオカルバミルメチル)ベンゼンであり、4分岐鎖化合物としては、1,2,4,5−テトラキス(ブロモメチル)ベンゼンとN,N−ジアルキルジチオカルバミン酸ナトリウム(ナトリウムN,N−ジアルキルジチオカルバメート)とをエタノール中で付加反応させて得られる1,2,4,5−テトラキス(N,N−ジアルキルジチオカルバミルメチル)ベンゼンであり、6分岐鎖化合物としては、ヘキサキス(ブロモメチル)ベンゼンとN,N−ジアルキルジチオカルバミン酸ナトリウム(ナトリウムN,N−ジアルキルジチオカルバメート)とをエタノール中で付加反応させて得られるヘキサキス(N,N−ジアルキルジチオカルバミルメチル)ベンゼンが挙げられる。なお、ここで、N,N−ジアルキルジチオカルバミルメチル基に含まれるジアルキル部分のアルキル基としては、エチル基等の炭素数2〜18個のアルキル基が好ましいが、アルキル基に限らず、フェニル基など芳香族系の炭化水素基であっても構わない。即ち、N,N−ジアルキルジチオカルバミルメチル基に限らず、N,N−ジアリールジチオカルバミルメチル基等を含む、脂肪族炭化水素基及び/又は芳香族炭化水素基で置換されたN,N−ジ置換ジチオカルバミルメチル基であれば目的を達成することができる。
【0038】
上記のイニファターは、アルコール等の極性溶媒に対しては殆ど不溶であるが、非極性溶媒には易溶である。この非極性溶媒としては炭化水素、ハロゲン化アルキル又はハロゲン化アルキレンが好適であり、特に、ベンゼン、トルエン、クロロホルム又は塩化メチレン、特にトルエンが好適である。
【0039】
上記イニファターとDMAEM及びDMAPAAとを反応させるには、イニファター、DMAEM、及びDMAPAAを含んでなる原料溶液を調製し、これに光照射することが好ましく、これにより、イニファターに対し、DMAEM及びDMAPAAがランダム共重合した分岐鎖を導入することができる。
【0040】
該原料溶液中のDMAEM及びDMAPAAの合計の濃度は0.5M以上、例えば0.5M〜2.5Mが好適であり、イニファターの濃度は1〜20mM程度が好適である。
【0041】
照射する光の波長は250〜400nmが好適であり、例えばショートアークキセノンランプ、低圧水銀灯、高圧水銀灯などを用いることができる。光の照射時間は照射強度にも依存するが、1〜90分程度が好適であり、1μW/cm2〜10mW/cm2程度の低い照射強度で1〜60分程度が特に好適である。
【0042】
この光照射により、反応液中に目的とする分岐型重合体が生成するので、必要に応じ精製することにより、分岐鎖部分にDMAEM単位及びDMAPAA単位よりなるポリマー鎖が導入され、分岐鎖の末端がN,N−ジ置換ジチオカルバミルメチル基であるポリマーを得る。
【0043】
本発明に係る分岐型重合体の分岐鎖は、通常、DMAEMとDMAPAAとをランダム共重合してなるポリマー鎖であるが、DMAEM及びDMAPAAと、その他の1種以上のモノマーとをランダム共重合してなるポリマー鎖であってもよい。
【0044】
この場合の他のモノマーとしては、アクリル酸誘導体、スチレン誘導体等のビニル系モノマーが好適であり、具体的には、N,N−ジメチルアクリルアミド、メトキシエチル(メタ)アクリレート、4−N,N-ジメチルアミノスチレン、及び4−アミノスチレンの誘導体からなる群から選択されるビニル系モノマーが挙げられる。これらのビニル系モノマーは1種を単独で用いてもよく、2種以上を混合して用いてもよい。
【0045】
イニファターと、DMAEM及びDMAPAAと、その他のモノマーとを反応させるには、前述のイニファターとDMAEM及びDMAPAAとを反応させる場合と同様に、イニファター、DMAEM、DMAPAA、及びその他のモノマーを含んでなる原料溶液を調製し、これに光照射することによって、イニファターに対し、DMAEM、DMAPAA、及びその他のモノマーのランダム共重合体よりなる分岐鎖を導入することができる。
【0046】
本発明の遺伝子導入剤の分岐鎖は、DMAPAA単位割合が30mol%以下、好ましくは、1〜15mol%である。DMAPPA単位割合が30mol%を超えると、DMAEM単位とDMAPAA単位との合計に対するDMAEM単位の割合が少なくなるため、遺伝子導入剤が疎水性を示しにくくなり、血清を含む培地において、アニオン性タンパクなどの影響を受けやすくなる。ただし、DMAPPA単位が少なすぎると、DMAPAA単位を導入することによる重合性向上効果を十分に得ることができないため、上記下限以上とすることが好ましい。
【0047】
また、本発明の遺伝子導入剤の分岐鎖が、DMAEM単位、DMAPAA単位、及びその他のモノマー由来の構成単位により構成される場合、その他のモノマー由来の構成単位の割合は、DMAEM単位、DMAPAA単位、及びその他のモノマー由来の構成単位の合計に対して、10mol%以下とすることが好ましい。この上限を超えると、分岐鎖にDMAEM単位及びDMAPAA単位を導入することによる疎水化効果や、重合性向上効果を得にくくなる。
【0048】
本発明において、このような分岐型重合体の分岐鎖の1本当たりの分子量は、300〜20,000程度、特に1,000〜10,000程度が好ましい。この分子量は、光照射の時間を制御することにより調整することができる。即ち、反応時間を長くすることにより、重合反応を進行させて分子量の大きい分岐型重合体を得ることができる。
【0049】
また、この分岐型重合体の分子量としては、2,000〜150,000程度、特に8,000〜50,000程度であることが好ましい。
【0050】
なお、本明細書において、分子量とは、GPC(ゲルパーミエーションクロマトグラフィー)によるポリエチレングリコール換算の数平均分子量をさす。
【0051】
<架橋分岐型重合体>
本発明の遺伝子導入剤は、上述の分岐型重合体を用いるものであるが、本発明の遺伝子導入剤は、この分岐型重合体に対して光照射することにより当該分岐型重合体同士を架橋させた架橋分岐型重合体であってもよい。
【0052】
上述の分岐型重合体よりなる遺伝子導入剤であっても、遺伝子導入剤全体として疎水性を示すため、血清を含む培地において高い遺伝子導入活性を示すが、この分岐型重合体を架橋させることにより、より遺伝子導入活性に優れる架橋分岐型重合体よりなる遺伝子導入剤を得ることができる。
【0053】
このように前記分岐型重合体に対して光照射することにより架橋してなる架橋分岐型重合体にあっては、前記DMAPAA単位の優れた反応性を利用することにより、遺伝子導入剤の高分子量化を図ることができると共に、DMAPAA単位の塩基性が遺伝子の導入に与える影響を最小限に抑えることができる。
即ち、前記架橋分岐型重合体は、前記分岐型重合体に比べて複雑なネットワーク構造を有しており、アニオン性タンパクとDMAPAA単位の3級アミンとがその立体障害により接近し難くいため、結果として、アニオン性タンパクとDMAPAA単位の3級アミンとの相互作用を抑えることができる。また、架橋反応を行うことにより、DMAPAA単位の3級アミン脱離したり、2級アミン、1級アミンなどに変化し、塩基性を消失するため、血清を含む培地においても優れた遺伝子導入活性を示す。
【0054】
前記分岐型重合体同士を架橋する方法としては、例えば、分岐型重合体及び回転子を滅菌瓶に入れ、容器内部の気体を窒素で置換した後、この滅菌瓶を密封し、回転子などを用いて分岐型重合体を粉砕し、光を照射して分岐型重合体同士を架橋する方法、もしくは、溶媒に前記分岐型重合体を溶解及び/又は分散させ、この溶液及び/又は分散液に光を照射して前記分岐型重合体同士を架橋する方法を採用することができる。
【0055】
前記分岐型重合体同士を架橋する際の光の照射条件は、光波長180〜700nm、照射時間1分〜30,000時間、照射強度0.001〜10,000μW/cm2程度が好適である。
【0056】
この分岐型重合体を溶媒に溶解及び/又は分散させて架橋する場合に用いる溶媒としては、アルコールが好ましく、例えば、メタノール、エタノール、1−プロパノール、2−プロパノール、ブタノール、ペンタノール、ヘキサノールのような低級アルコールが好ましく、特にメタノール、エタノール及び2−プロパノールが好ましい。また、アルコール以外の溶媒としては、水、クロロホルム、トルエン、ベンゼン、キシレン、ジエチルエーテルなどのエーテル、アセトン、メチルエチルケトン、テトラヒドロフラン、塩化メチレンおよび塩化ベンゼンなどを挙げることができる。これらの溶媒は、1種を単独で用いてもよく、2種以上を併用してもよい。
【0057】
前記溶媒中の分岐型重合体の濃度は、3〜60重量%、特に6〜30重量%であることが好ましい。分岐型重合体の濃度が極端に高いと反応が進行しにくくなり、分岐型重合体の濃度が極端に低いと分岐鎖の末端同士の衝突確率が低くなるため好ましくない。
【0058】
このように架橋してなる架橋分岐型重合体の数平均分子量は、前記分岐型重合体の数平均分子量の1.2倍以上、特に1.2〜5.0倍、即ち、数平均分子量として10,000〜300,000程度、特に15,000〜200,000程度であることが好ましい。架橋分岐型重合体の数平均分子量が、分岐型重合体の分子量の1.2倍未満であると、架橋による構造的な優位性を得ることができず、また、5.0倍を超えると、水への溶解性が低下し、架橋分岐型重合体がゲル化するという問題が生じたり、核酸が細胞内に取り込まれにくくなったり、細胞毒性が発現するおそれがある。また、この架橋分岐型重合体と核酸との複合体を生体血管内へ投与する場合には、代謝、排泄の観点から好ましくない。
【0059】
[核酸複合体]
上記の本発明の遺伝子導入剤(ベクター)が核酸を核酸含有複合体として包囲することによって、生体内の酵素による核酸の失活、分解を抑制することができる。
【0060】
上記遺伝子導入剤と核酸とを複合させるには、遺伝子導入剤の濃度0.1〜1000μg/mL程度の溶液に対し、核酸を添加し、混合すればよい。核酸に対して遺伝子導入剤を過剰量添加し、核酸に対して遺伝子導入剤を飽和状態にして遺伝子導入剤と核酸とを複合化することが好ましい。
【0061】
核酸の好ましい例としては、単純ヘルペスウイルスチミジンキナーゼ遺伝子(HSV1−TK遺伝子),p53癌抑制遺伝子及びBRCA1癌抑制遺伝子やサイトカイン遺伝子としてTNF−α遺伝子,IL−2遺伝子,IL−4遺伝子,HLA−B7/IL−2遺伝子,HLA−B7/B2M遺伝子,IL−7遺伝子,GM−CSF遺伝子,IFN−γ遺伝子及びIL−12遺伝子などのサイトカイン遺伝子並びにgp−100,MART−1及びMAGE−1などの癌抗原ペプチド遺伝子が癌治療に利用できる。
【0062】
また、VEGF遺伝子,HGF遺伝子及びFGF遺伝子などのサイトカイン遺伝子並びにc−mycアンチセンス,c−mybアンチセンス,cdc2キナーゼアンチセンス,PCNAアンチセンス,E2Fデコイやp21(sdi−1)遺伝子が血管治療に利用できる。かかる一連の遺伝子は当業者には良く知られたものである。
【0063】
核酸複合体の粒径は50〜400nm程度が好適である。この粒径は、例えばレーザを用いた動的光散乱法によって測定される。粒径がこれよりも小さいと、核酸複合体内部の核酸にまで酵素の作用が及ぶおそれ、あるいは腎臓にて濾過排出されるおそれがある。また、これよりも大きいと、細胞に導入されにくくなるおそれがある。
【0064】
核酸は、細胞に導入されることによりその細胞内で機能を発現することができるような形態で用いる。例えばDNAの場合、導入された細胞内で当該DNAが転写され、それにコードされるポリペプチドの産生を経て機能発現されるように当該DNAが配置されたプラスミドとして用いる。好ましくは、プロモーター領域、開始コドン、所望の機能を有する蛋白質をコードするDNA、終止コドンおよびターミネーター領域が連続的に配列されている。
【0065】
所望により2種以上の核酸をひとつのプラスミドに含めることも可能である。
【0066】
本発明において、核酸を導入する対象として望ましい「細胞」としては、当該核酸の機能発現が求められるものであり、このような細胞としては、例えば使用する核酸(すなわちその機能)に応じて種々選択され、例えば心筋細胞、平滑筋細胞、繊維芽細胞、骨格筋細胞、血管内皮細胞、骨髄細胞、骨細胞、血球幹細胞、血球細胞等が挙げられる。また、単球、樹状細胞、マクロファージ、組織球、クッパー細胞、破骨細胞、滑膜A細胞、小膠細胞、ランゲルハンス細胞、類上皮細胞、多核巨細胞等、消化管上皮細胞・尿細管上皮細胞などである。
【0067】
本発明の核酸複合体は培養試験に用いるほか、任意の方法で生体に投与することができる。
【0068】
生体への投与方法としては静脈内又は動脈内への注入が特に好ましいが、筋肉内、脂肪組織内、皮下、皮内、リンパ管内、リンパ節内、体腔(心膜腔、胸腔、腹腔、脳脊髄腔等)内、骨髄内への投与の他に病変組織内に直接投与することも可能である。
【0069】
この核酸複合体を有効成分とする医薬は、更に必要に応じて製剤上許容し得る担体(浸透圧調整剤,安定化剤、保存剤、可溶化剤、pH調整剤、増粘剤等)と混合することが可能である。これら担体は公知のものが使用できる。
【0070】
また、この核酸複合体を有効成分とする医薬は、含まれる核酸の種類が異なる2種以上の核酸含有複合体を含めたものも包含される。このような複数の治療目的を併せ持つ医薬は、多様化する遺伝子治療の分野で特に有用である。
【0071】
投与量としては、動物、特にヒトに投与される用量は目的の核酸、投与方法および治療される特定部位等、種々の要因によって変化する。しかしながら、その投与量は治療的応答をもたらすに十分であるべきである。
【0072】
この核酸複合体は、好ましくは遺伝子治療に適用される。適用可能な疾患としては、当該複合体に含められる核酸の種類によって異なるが、末梢動脈疾患、冠動脈疾患、動脈拡張術後再狭窄等の病変を生じる循環器領域での疾患に加え、癌(悪性黒色腫、脳腫瘍、転移性悪性腫瘍、乳癌等)、感染症(HIV等)、単一遺伝病(嚢胞性線維症、慢性肉芽腫、α1−アンチトリプシン欠損症、Gaucher病等)等が挙げられる。
【実施例】
【0073】
以下に実施例を挙げて本発明をより具体的に説明するが、本発明はその要旨を超えない限り、以下の実施例に限定されるものではない。
【0074】
i)イニファターの合成
イニファターとしての1,2,4,5−テトラキス(N,N−ジエチルジチオカルバミルメチル)ベンゼンを次のようにして合成した。
【0075】
1,2,4,5−テトラキス(ブロモメチルベンゼン)5.0gとN,N−ジエチルジチオカルバミン酸ナトリウム34.0gをエタノール100mL中へ加え、遮光下、室温で4日間攪拌した。沈殿物を濾過し、3Lのメタノール中に投入して30分間攪拌した後、濾過した。この操作を繰り返し合計4回行った。沈殿物をトルエン200mLに溶解した後、100mLのメタノールを加えて50℃に加温し、冷蔵庫内で15時間保管して再結晶させ、結晶を濾別後、大量のメタノールで洗浄した。結晶を室温で減圧乾燥して、白色の1,2,4,5−テトラキス(N,N−ジエチルジチオカルバミルメチル)ベンゼンの針状結晶を得た(収率90%)。高速液体クロマトグラフィーにより、原料ピークが消失し、精製物が単一物質であることを確認した。
【0076】
1H−NMR(in CDCl3)の測定結果は、δ1.26−1.31ppm(t,24H,CH2CH3),δ3.69−3.77ppm(q,8H,N(CH2CH3)2),δ3.99−4.07ppm(q,8H,N(CH2CH3)2),δ4.57ppm(s,8H,Ar−CH2),δ7.49ppm(s,2H,Ar−H)であった。
【0077】
【化1】

【0078】
ii)4分岐型重合体よりなるカチオン性コポリマーの光重合による合成
2−N,N−ジメチルアミノエチルメタクリレート及び3−N,N−ジメチルアミノプロピルアクリルアミドを混合モノマーとして用い、4分岐型重合体よりなるカチオン性コポリマーの光重合による合成を行った。
【0079】
即ち、上記i)により合成した1,2,4,5−テトラキス(N,N−ジエチルジチオカルバミルメチル)ベンゼン45.6mgを20mLのトルエンに溶解し、2−N,N−ジメチルアミノエチルメタクリレート8.5g及び3−N,N−ジメチルアミノプロピルアクリルアミド1.0gを加えて混合し、全量をトルエンで50mLに調整した。3mm厚軟質ガラスセル中で激しく攪拌しながら高純度窒素ガスで10分間パージした後に、300Wショートアークキセノンランプ(朝日分光社製、MAX−301)で波長250〜400nmの混合紫外線を60分間照射した。照射強度はウシオ電機社のUIT−150へUVD−C405(検出波長範囲320〜470nm)を装着して2.5mW/cm2に調整した。なお、この反応においては、波長が250〜400nmである混合紫外線を照射しているが、反応容器として用いた3mm厚軟質ガラスセルが、短波長の紫外光を透過しないため、実際には340〜400nm、波長ごとのガラス透過率も考慮すれば、350〜400nm程度の波長の光を照射したことになる。光照射後の重合溶液をエバポレーターで濃縮し、300mLのエーテル/n−ヘキサンの混合溶媒(1/3:v/v)で再沈殿させた。得られた水飴状のポリマーを300mLのエーテル/n−ヘキサンの混合溶媒(1/3:v/v)で3回抽出して精製し、溶媒を蒸散させた。次いで、得られた固体を少量のベンゼンに溶解し、0.2μmフィルターで濾過した後、凍結乾燥させて、4分岐型重合体よりなるカチオン性コポリマーを得た。この4分岐型重合体よりなるカチオン性コポリマーのポリエチレングリコールを標準物質とした数平均分子量は、GPCにより、13,500(Mw/Mn=1.4)と測定された。この測定値より、4分岐型重合体の分岐鎖1本当たりの分子量は、3195であることが分かった。また、1H−NMR(in CD3OD)より共重合比は、2−N,N−ジメチルアミノエチルメタクリレート93mol%、3−N,N−ジメチルアミノプロピルアクリルアミド7mol%と計算された。
【0080】
【化2】

iii)4分岐型重合体よりなるカチオン性コポリマーの光架橋
上記ii)により合成した4分岐型重合体よりなるカチオン性コポリマー0.2gと3角柱形の回転子とを100mL滅菌瓶に入れ、滅菌瓶の内部の気体を高純度窒素で置換した後、上蓋として3mm厚軟質ガラス板を用い、この滅菌瓶を密封した。回転子を使用して前記4分岐型重合体を粉末状に粉砕した後、これに300Wショートアークキセノンランプ(朝日分光社製、MAX−301)を用いて落射式により、波長250〜400nmの混合紫外線を3.5時間照射した。照射強度は、1.0mW/cm2に調整した。この光照射により、前記粉末は、若干黄色に変色した。この粉末に対して約30mLのメタノールを加えたところ、少量の不溶性化合物が生成した。この不溶性化合物を濾別し、濾液をエバポレーターで濃縮した後、この濃縮液をエーテル中に滴下することにより、再沈殿を行った。得られた沈殿物をエーテルで3回洗浄して精製し、溶媒を蒸散させて固体を得た。次いで、この固体を少量のベンゼンに溶解させ、0.2μmフィルターで濾過した後、凍結乾燥させて、4分岐型重合体よりなるカチオン性コポリマーの光架橋体を得た。この4分岐型重合体よりなるカチオン性コポリマーの光架橋体の数平均分子量は、GPCにより、22,000(Mw/Mn=1.9)と測定され、NMRスペクトル(300MHz)からは、3−N,N−ジメチルアミノプロピルアクリルアミドへ帰属されるべきジメチルアミノ基のピークが確認されなかった。
【0081】
iv)4分岐型重合体よりなるカチオン性ホモポリマーの光重合による合成
3−N,N−ジメチルアミノプロピルアクリルアミドを用いず、2−N,N−ジメチルアミノエチルメタクリレート7.9gをモノマーとして用いたこと以外は、上記ii)と同様の方法で4分岐型重合体よりなるカチオン性ホモポリマーを合成した。得られた4分岐型重合体よりなるカチオン性ホモポリマーは、クロロホルム/n−ヘキサン系により3回再沈殿を行うことにより精製し、得られた固体をベンゼンに溶解させて、この溶液を凍結乾燥することで4分岐型重合体よりなるカチオン性ホモポリマーを得た。この4分岐型重合体よりなるカチオン性ホモポリマーの分子量は、GPCにより13,000(Mw/Mn=1.35)と測定された。
【0082】
1H−NMR(in CD3OD)の測定結果は、δ0.8−1.2ppm(br,3H,−CH2−CH3−),δ1.6−2.0ppm(br,2H,−CH2−CH3−),δ2.2−2.4ppm(br,6H,N−CH3),δ2.5−2.7ppm(br,2H,CH2−N),δ4.0−4.2ppm(br,2H,O−CH2)であった。
【0083】
【化3】

【0084】
v)4分岐型重合体よりなるカチオン性ホモポリマーの光架橋の検討
4分岐型重合体よりなるカチオン性コポリマーの代わりに、前記iv)により得られた4分岐型重合体よりなるカチオン性ホモポリマーを用いたこと以外は、前記iii)と同様に光照射を行ったが、光照射後の分子量は、12,800(Mw/Mn=1.40)であり、照射前後で分子量は、ほとんど変化しなかった。
【0085】
vi)遺伝子導入活性
細胞にはアフリカミドリサル腎細胞の由来のCOS-1を使用し、DNAにはpGL3コントロールベクターを使用した。COS-1細胞は細胞数を4万個/mLに調整して24Well培養皿へ播種し、培養24時間後に遺伝子導入を行った。上記ii)において合成したカチオン性コポリマーを実施例1の遺伝子導入剤とし、iii)にて合成した架橋体を実施例2の遺伝子導入剤とし、iv)にて合成したカチオン性ホモポリマーを比較例1の遺伝子導入剤とし、v)において光照射した後のカチオン性ホモポリマーを比較例2の遺伝子導入剤として、それぞれ生理食塩水へ溶解し、濃度(遺伝子導入剤/食塩水)を8μg/60μLとした。DNAはTEバッフアーへ溶解し、濃度(DNA/バッファー)を3μg/90μLとした。室温で遺伝子導入剤溶液とDNA溶液を混合した後、温度を37℃に加温して核酸複合体を形成させた。この核酸複合体25μLを1mLの完全培地(DMEM+10重量%FCS+抗生物質)へ加え、30分間インキュベートした。この約1mLの核酸複合体完全培地溶液と、37℃のPBSで洗浄した培養細胞とを接触させ、48時間培養を行った。48時間後、ルシフェラーゼアッセにより遺伝子導入活性の評価を行った(プロメガ社、アッセイキット試薬)。補正はタンパク濃度で行い、タンパク定量はBioRad社のBradford試薬で行った。上記の評価結果を図1に示す。
【0086】
比較例1,2の遺伝子導入剤は、同程度の遺伝子導入活性を示した。これは、比較例1の分岐型重合体に対して光照射を行っても架橋反応が生じにくく、光照射前後で分子量がほとんど変化しなかったためであると考えられる。これに対して、実施例1の分岐型重合体を架橋した実施例2の架橋分岐型重合体よりなる遺伝子導入剤は、実施例1に比べて遺伝子導入活性が10倍程度向上した。これは、光照射により、分岐鎖に含まれるDMAPAA単位を分岐鎖に有する分岐型重合体同士が、遺伝子の導入に有利な分子量及び構造を備える架橋分岐型重合体に変化したためであると考えられる。
【0087】
なお、上記実施例1,2及び比較例1,2の遺伝子導入剤を用いて、血清を含まない培地において同様の実験を行ったところ、実施例1の遺伝子導入剤は、比較例1,2の遺伝子導入剤に比べて優れた遺伝子導入活性を示し、実施例2の遺伝子導入剤は、実施例1の遺伝子導入剤に比べて、遺伝子導入活性が4〜6倍程度優れていた。
【0088】
これらの結果より、DMAEM単位と共に、DMAPAA単位を分岐鎖に有する分岐型重合体は、この分岐型重合体同士を光照射するだけで容易に架橋することができ、この架橋反応により得られる架橋分岐型重合体は、遺伝子導入に有利な構造を備えた化合物であることがわかる。また、血清を含む培地において、実施例2の方が実施例1に比べて優れた遺伝子導入活性を示すのは、血清を含む培地における遺伝子導入の妨げとなるアミン部分が、架橋反応により、アニオン性物質と相互作用しにくい構造に変化したため、もしくは、架橋によりDMAPAA単位の塩基性が消失したためであると考えられる。即ち、この架橋反応によって、分岐鎖中のDMAPAA部分が架橋点として寄与することにより、分岐鎖の側鎖の3級アミンが脱離したり、3級アミンから2級アミン、1級アミンへと変化し、塩基性が消失したためであると考えられる。
【技術分野】
【0001】
本発明は、遺伝子導入剤及び核酸複合体に係り、特に分岐型重合体を用いた遺伝子導入剤と、この遺伝子導入剤と核酸とを複合させた核酸複合体に関する。
【背景技術】
【0002】
近年、ヒト疾患の分子遺伝学的要因が明らかになるにつれ、遺伝子治療研究がますます重要視されている。遺伝子治療法は標的とする部位でのDNAの発現を目的としており、いかにDNAを標的部位に到達させるか、いかにDNAを標的部位に効率的に導入し、当該部位で機能的に発現させるかということが重要となる。外来DNAの導入のためのベクターとして、レトロウイルス、アデノウイルス、アデノ付随ウイルス、レンチウイルス、センダイウイルス又はヘルペスウイルスを含む多くのウイルスが、治療用遺伝子を運搬するように改変されて、遺伝子治療のヒトの臨床試験に使用されている。しかし、感染及び免疫反応の危険性は依然として残されているため、これらのベクターに代わる遺伝子導入技術として、合成高分子ベクター、カチオン性脂質ベクターが研究開発されている。
【0003】
本出願人らは、pKaの値が高く、中性条件においてもプロトン化されている3−N,N−ジメチルアミノプロピルアクリルアミドを主モノマーとして重合してなる分岐鎖を有する分岐型重合体からなる遺伝子導入剤が、効率よく細胞に遺伝子を導入することができることを見出し、先に特許出願した(特許文献1)。
【0004】
本出願人らはまた、より分子量が大きく、より複雑な構造を有する分岐型重合体の方が遺伝子導入活性に優れるという知見、及び前記3−N,N−ジメチルアミノプロピルアクリルアミドを重合してなる分岐鎖の側鎖は、基端側のアミド基と、先端側のアミノ基との間にプロピレン基を有するため、側鎖間における架橋反応が生じ易いという知見に基き、前記分岐型重合体同士を架橋してなる遺伝子導入剤を提案した(特許文献2)。
【0005】
このようなカチオン性モノマーを重合してなる分岐鎖を有する遺伝子導入剤にあっては、その構造上、電荷密度を高く配置することが可能であるため、DNAやRNAなどの核酸をより強く凝集させることが可能であり、より粒子径の小さい微細なポリプレックス粒子を形成させることができるが、以下の問題がある。
【0006】
即ち、細胞に遺伝子を導入する際の細胞を培養する培地としては、細胞へのストレスを軽減する観点から血清を含む培地を用いるが、前述の高pKaの分岐鎖を有する遺伝子導入剤は、その高いカチオン性により、血清中のアニオン性タンパクを吸着してしまう。従って、この遺伝子導入剤は、血清を含む培地において用いた場合、この遺伝子導入剤と核酸とからなる核酸複合体が血清中のアニオン性タンパクを吸着し、マクロ粒子を形成するため、細胞内に取り込まれにくくなったり、核酸がトランスポーターに認識されにくくなり、細胞に対して遺伝子を効率的に導入することができない。
【0007】
この問題に対して、本出願人らは、血清を含む培地における遺伝子導入方法として、所定温度(T)未満ではカチオン性を示すが、所定温度(T)以上では疎水性を示す2−N,N−ジメチルアミノエチルメタクリレートを重合してなる感温性カチオン性ポリマー鎖よりなる分岐鎖を有する遺伝子導入剤を用い、この遺伝子導入剤と核酸とを含む溶液を所定温度(T)未満で混合した後、該溶液を所定温度(T)以上に加温して、遺伝子導入剤と核酸とを複合させることにより核酸複合体を得、この核酸複合体と細胞とを、血清を含む培地において、該所定温度(T)以上で接触させて、細胞に遺伝子を導入する遺伝子導入方法を提案した(特許文献3)。
【先行技術文献】
【特許文献】
【0008】
【特許文献1】WO2004/092388号公報
【特許文献2】特開2008−289468号公報
【特許文献3】特願2009−126718
【発明の概要】
【発明が解決しようとする課題】
【0009】
前記特許文献3に記載される2−N,N−ジメチルアミノエチルメタクリレートを重合してなる分岐鎖は、pKaの値が低く、中性条件下においてほとんど電荷を持っていないため、DNAの凝集力が弱いものの、血清に含まれるアニオン性タンパクなどの影響を受けにくい。従って、この2−N,N−ジメチルアミノエチルメタクリレートを重合してなる分岐鎖を有する遺伝子導入剤は、血清を含まない培地においては、前述の3−N,N−ジメチルアミノプロピルアクリルアミドを重合してなる遺伝子導入剤よりも低い遺伝子導入活性を示すものの、血清を含む培地においては、高い遺伝子導入活性を示す。
【0010】
しかしながら、この2−N,N−ジメチルアミノエチルメタクリレートは、3−N,N−ジメチルアミノプロピルアクリルアミドに比べて重合性に乏しいため、遺伝子の導入に有利な、分子量の大きい分岐型重合体を合成することが困難である。また、2−N,N−ジメチルアミノエチルメタクリレートを重合してなる分岐鎖の側鎖は、側鎖の先端側のアミノ基と基端側のエステル結合との間がエチレン基であるため、プロピレン基を有する3−N,N−ジメチルアミノプロピルアクリルアミドを重合してなる分岐鎖の側鎖に比べて分岐型重合体同士の架橋反応が起こり難い。従って、2−N,N−ジメチルアミノエチルメタクリレートを重合してなる分岐鎖を有する分岐型重合体は、前述の3−N,N−ジメチルアミノプロピルアクリルアミドを重合してなる分岐鎖を有する分岐型重合体のように、分岐型重合体同士を架橋することにより、遺伝子導入活性に優れる分子量の高い架橋分岐型重合体を得ることが困難であった。
【0011】
本発明は上記従来の課題に鑑みてなされたものであり、血清を含む培地において、より効率的に、細胞に遺伝子を導入することができる遺伝子導入剤を提供することを目的とする。
本発明はまた、この遺伝子導入剤と核酸とを複合させてなる核酸複合体を提供することを目的とするものである。
【課題を解決するための手段】
【0012】
本発明(請求項1)の遺伝子導入剤は、芳香環を核とし、それから伸延した複数の分岐鎖を有する分岐型重合体を用いた遺伝子導入剤において、該分岐鎖は、少なくとも2−N,N−ジメチルアミノエチルメタクリレート及び/又はその誘導体と、3−N,N−ジメチルアミノプロピルアクリルアミドとをランダム共重合してなる重合体よりなり、該重合体を構成する2−N,N−ジメチルアミノエチルメタクリレート及び/又はその誘導体由来の構成単位と、3−N,N−ジメチルアミノプロピルアクリルアミド由来の構成単位との合計に対する該3−N,N−ジメチルアミノプロピルアクリルアミド由来の構成単位の割合が、30mol%以下であることを特徴とするものである。
【0013】
請求項2の遺伝子導入剤は、請求項1において、前記重合体を構成する2−N,N−ジメチルアミノエチルメタクリレート及び/又はその誘導体由来の構成単位と、3−N,N−ジメチルアミノプロピルアクリルアミド由来の構成単位との合計に対する該3−N,N−ジメチルアミノプロピルアクリルアミド由来の構成単位の割合が、1〜15mol%であることを特徴とするものである。
【0014】
請求項3の遺伝子導入剤は、請求項1又は2において、前記遺伝子導入剤は、前記分岐型重合体に対して光照射することにより該分岐型重合体同士が架橋した架橋分岐型重合体よりなるものであり、該架橋分岐型重合体の数平均分子量は、該分岐型重合体の数平均分子量の1.2倍以上であることを特徴とするものである。
【0015】
請求項4の遺伝子導入剤は、請求項3において、前記架橋分岐型重合体の数平均分子量は、前記分岐型重合体の数平均分子量の1.2〜5.0倍であることを特徴とするものである。
【0016】
請求項5の遺伝子導入剤は、請求項1ないし4のいずれか1項において、前記分岐型重合体は、N,N−ジ置換−ジチオカルバミルメチル基を同一分子内に3個以上有する化合物をイニファターとし、これに少なくとも前記2−N,N−ジメチルアミノエチルメタクリレート及び/又はその誘導体と、3−N,N−ジメチルアミノプロピルアクリルアミドとを光照射リビング重合させてなるものであることを特徴とするものである。
【0017】
請求項6の遺伝子導入剤は、請求項5において、前記N,N−ジ置換−ジチオカルバミルメチル基を同一分子内に3個以上有する化合物は、ベンゼン環を核とし、この核に分岐鎖として3個以上の該N,N−ジ置換−ジチオカルバミルメチル基が結合していることを特徴とするものである。
【0018】
請求項7の遺伝子導入剤は、請求項5又は6において、前記N,N−ジ置換−ジチオカルバミルメチル基は、N,N−ジアルキル−ジチオカルバミルメチル基であることを特徴とするものである。
【0019】
請求項8の遺伝子導入剤は、請求項1ないし7のいずれか1項において、前記分岐鎖が、前記2−N,N−ジメチルアミノエチルメタクリレート及び/又はその誘導体と、3−N,N−ジメチルアミノプロピルアクリルアミドとのランダム共重合体よりなることを特徴とするものである。
【0020】
請求項9の遺伝子導入剤は、請求項1ないし8のいずれか1項において、前記分岐鎖の1本当たりの分子量は、300〜20,000であることを特徴とするものである。
【0021】
請求項10の遺伝子導入剤は、請求項1ないし9のいずれか1項において、前記分岐型重合体の分子量は、2,000〜150,000であることを特徴とするものである。
【0022】
本発明(請求項11)の核酸複合体は、請求項1ないし10のいずれか1項に記載の遺伝子導入剤と核酸とを複合させてなるものである。
【発明の効果】
【0023】
本発明の遺伝子導入剤が有する分岐鎖は、少なくとも2−N,N−ジメチルアミノエチルメタクリレート及び/又はその誘導体(以下、2−N,N−ジメチルアミノエチルメタクリレート及び/又は誘導体を、「DMAEM」と略記する場合がある。)と、3−N,N−ジメチルアミノプロピルアクリルアミド(以下、3−N,N−ジメチルアミノプロピルアクリルアミドを、単に、「DMAPAA」と略記する場合がある。)とをランダム共重合してなる重合体であって、この分岐鎖の重合体を構成するDMAEM由来の構成単位(以下、「DMAEM単位」と称す場合がある。)と、該重合体のDMAPAA由来の構成単位(以下、「DMAPAA単位」と称す場合がある。)との合計に対するDMAPAA単位の割合(以下、この割合を、単に、「DMAPAA単位割合」と称す場合がある。)が、30mol%以下であることを特徴とする。
【0024】
本発明の遺伝子導入剤にあっては、その分岐鎖が、少なくともDMAEMと、DMAPAAとをランダム共重合してなるポリマー鎖であるため、アニオン性タンパクなどの影響を受けにくいDMAEM単位に起因する効果と、重合性に富み、分子量が大きい分岐型重合体を合成することができるDMAPAA単位に起因する効果とを有する。
【0025】
また、本発明にあっては、前記DMAPAA単位割合を30mol%以下、特に1〜15mol%(請求項2)としているため、遺伝子導入剤全体としてはDMAEM単位に起因する疎水性を示すことから、この遺伝子導入剤を血清を含む培地で用いた場合であっても、血清に含まれるアニオン性タンパクの影響を受けにくく、細胞に対して効率的に遺伝子を導入することができる。
【0026】
本発明の遺伝子導入剤は、前記分岐型重合体に対して、光照射することにより該分岐型重合体同士が架橋した架橋分岐型重合体よりなるものであってもよく、この場合の該架橋分岐型重合体の数平均分子量は、該分岐型重合体の数平均分子量の1.2倍以上(請求項3)、特に、1.2〜5.0倍であることが好ましい(請求項4)。前記分岐型重合体を架橋することにより、弱塩基性の2−N,N−ジメチルアミノエチルメタクリレートを主モノマーとして用いた分岐鎖を有する架橋体分岐型重合体を得ることができる。また、架橋分岐型重合体の数平均分子量が、架橋前の分岐型重合体の数平均分子量の1.2倍以上、特に2.0〜3.0倍であれば、架橋分岐型重合体が複雑なネットワーク構造を備えると共に、架橋前の分岐型重合体が有する水への良好な溶解性を維持するため、核酸をより効率的に包接することが可能となる。
【0027】
前記分岐型重合体は、N,N−ジ置換−ジチオカルバミルメチル基を同一分子内に3個以上有する化合物をイニファターとし、これに少なくとも前記2−N,N−ジメチルアミノエチルメタクリレート及び/又はその誘導体と、3−N,N−ジメチルアミノプロピルアクリルアミドとを光照射リビング重合させてなるものであることが好ましく(請求項5)、前記N,N−ジ置換−ジチオカルバミルメチル基を同一分子内に3個以上有する化合物としては、ベンゼン環を核とし、この核に分岐鎖として3個以上のN,N−ジ置換−ジチオカルバミルメチル基が結合していることが好ましく(請求項6)、このN,N−ジ置換−ジチオカルバミルメチル基としては、N,N−ジアルキル−ジチオカルバミルメチル基であることが好ましい(請求項7)。
【0028】
前記分岐鎖は、前記DMAEM単位と、DMAPAA単位とのランダム共重合体であることが好ましい(請求項8)。
【0029】
前記分岐鎖1本当たりの分子量は、300〜20,000であることが好ましい(請求項9)。分岐鎖1本当たりの分子量がこの範囲内であると、遺伝子導入剤の高分子量化を抑えた上で、効率的に遺伝子を導入することができる遺伝子導入剤を得ることができる。また、前記分岐型重合体の分子量は、2,000〜150,000でることが好ましい(請求項10)。分岐型重合体の分子量が上記範囲内であると、高分子量化を抑えた上で、より効率的に遺伝子導入剤と核酸とを複合化させることができ、比較的低分子量で遺伝子導入効率に優れた遺伝子導入剤を得ることができる。
【0030】
本発明の核酸複合体は、前記遺伝子導入剤と核酸とを複合させてなる核酸複合体である(請求項11)。
【図面の簡単な説明】
【0031】
【図1】実施例1,2及び比較例1,2の遺伝子導入剤の遺伝子導入活性の評価結果を示すグラフである。
【発明を実施するための形態】
【0032】
以下に本発明の実施の形態を詳細に説明する。
【0033】
[遺伝子導入剤]
<分岐型重合体>
本発明の遺伝子導入剤は、芳香環を核とし、それから伸延した複数の分岐鎖を有する分岐型重合体を用いた遺伝子導入剤において、該分岐鎖が、少なくともDMAEMと、DMAPAAとをランダム共重合してなる重合体であって、前記DMAPAA単位割合が、30mol%以下であることを特徴とする。
【0034】
本発明の遺伝子導入剤は、前述の通り、分岐鎖が少なくともDMAEM単位とDMAPAA単位とを含むため、DMAPAA単位を分岐鎖に有することによる重合性向上効果により、分岐型重合体の高分子量化、分子構造の複雑化を図ることができ、且つ、DMAEM単位を分岐鎖に有することによる分岐型重合体の疎水化効果により、アニオン性タンパクなどの影響を受けにくいという特徴を併せ持つため、この遺伝子導入剤は、核酸を包接する能力が高く、且つ、血清を含む培地においても効率的に遺伝子を導入することができる。
【0035】
本発明において用いる分岐型重合体は、N,N−ジ置換ジチオカルバミルメチル基を同一分子内に3個以上有する化合物をイニファターとし、このイニファターに少なくともDMAEM及びDMAPAAを光照射リビング重合によりランダム共重合させたものが好ましい。
【0036】
なお、本明細書において、イニファターとは、光照射によりラジカルを発生させる重合開始剤、連鎖移動剤としての機能と共に、成長末端と結合して成長を停止する機能、さらに光照射が停止すると重合を停止させる重合開始・重合停止剤として機能する分子のことである。
【0037】
イニファターとなるN,N−ジ置換ジチオカルバミルメチル基を同一分子内に3個以上有する芳香族化合物としては、ベンゼン環に該N,N−ジ置換ジチオカルバミルメチル基、好ましくはN,N−ジアルキルジチオカルバミルメチル基が3個以上分岐鎖として結合しているものが好適であり、具体的には次が例示される。即ち、3分岐鎖化合物としては、1,3,5−トリ(ブロモメチル)ベンゼンとN,N−ジアルキルジチオカルバミン酸ナトリウム(ナトリウムN,N−ジアルキルジチオカルバメート)とをエタノール中で付加反応させて得られる1,3,5−トリ(N,N−ジアルキルジチオカルバミルメチル)ベンゼンであり、4分岐鎖化合物としては、1,2,4,5−テトラキス(ブロモメチル)ベンゼンとN,N−ジアルキルジチオカルバミン酸ナトリウム(ナトリウムN,N−ジアルキルジチオカルバメート)とをエタノール中で付加反応させて得られる1,2,4,5−テトラキス(N,N−ジアルキルジチオカルバミルメチル)ベンゼンであり、6分岐鎖化合物としては、ヘキサキス(ブロモメチル)ベンゼンとN,N−ジアルキルジチオカルバミン酸ナトリウム(ナトリウムN,N−ジアルキルジチオカルバメート)とをエタノール中で付加反応させて得られるヘキサキス(N,N−ジアルキルジチオカルバミルメチル)ベンゼンが挙げられる。なお、ここで、N,N−ジアルキルジチオカルバミルメチル基に含まれるジアルキル部分のアルキル基としては、エチル基等の炭素数2〜18個のアルキル基が好ましいが、アルキル基に限らず、フェニル基など芳香族系の炭化水素基であっても構わない。即ち、N,N−ジアルキルジチオカルバミルメチル基に限らず、N,N−ジアリールジチオカルバミルメチル基等を含む、脂肪族炭化水素基及び/又は芳香族炭化水素基で置換されたN,N−ジ置換ジチオカルバミルメチル基であれば目的を達成することができる。
【0038】
上記のイニファターは、アルコール等の極性溶媒に対しては殆ど不溶であるが、非極性溶媒には易溶である。この非極性溶媒としては炭化水素、ハロゲン化アルキル又はハロゲン化アルキレンが好適であり、特に、ベンゼン、トルエン、クロロホルム又は塩化メチレン、特にトルエンが好適である。
【0039】
上記イニファターとDMAEM及びDMAPAAとを反応させるには、イニファター、DMAEM、及びDMAPAAを含んでなる原料溶液を調製し、これに光照射することが好ましく、これにより、イニファターに対し、DMAEM及びDMAPAAがランダム共重合した分岐鎖を導入することができる。
【0040】
該原料溶液中のDMAEM及びDMAPAAの合計の濃度は0.5M以上、例えば0.5M〜2.5Mが好適であり、イニファターの濃度は1〜20mM程度が好適である。
【0041】
照射する光の波長は250〜400nmが好適であり、例えばショートアークキセノンランプ、低圧水銀灯、高圧水銀灯などを用いることができる。光の照射時間は照射強度にも依存するが、1〜90分程度が好適であり、1μW/cm2〜10mW/cm2程度の低い照射強度で1〜60分程度が特に好適である。
【0042】
この光照射により、反応液中に目的とする分岐型重合体が生成するので、必要に応じ精製することにより、分岐鎖部分にDMAEM単位及びDMAPAA単位よりなるポリマー鎖が導入され、分岐鎖の末端がN,N−ジ置換ジチオカルバミルメチル基であるポリマーを得る。
【0043】
本発明に係る分岐型重合体の分岐鎖は、通常、DMAEMとDMAPAAとをランダム共重合してなるポリマー鎖であるが、DMAEM及びDMAPAAと、その他の1種以上のモノマーとをランダム共重合してなるポリマー鎖であってもよい。
【0044】
この場合の他のモノマーとしては、アクリル酸誘導体、スチレン誘導体等のビニル系モノマーが好適であり、具体的には、N,N−ジメチルアクリルアミド、メトキシエチル(メタ)アクリレート、4−N,N-ジメチルアミノスチレン、及び4−アミノスチレンの誘導体からなる群から選択されるビニル系モノマーが挙げられる。これらのビニル系モノマーは1種を単独で用いてもよく、2種以上を混合して用いてもよい。
【0045】
イニファターと、DMAEM及びDMAPAAと、その他のモノマーとを反応させるには、前述のイニファターとDMAEM及びDMAPAAとを反応させる場合と同様に、イニファター、DMAEM、DMAPAA、及びその他のモノマーを含んでなる原料溶液を調製し、これに光照射することによって、イニファターに対し、DMAEM、DMAPAA、及びその他のモノマーのランダム共重合体よりなる分岐鎖を導入することができる。
【0046】
本発明の遺伝子導入剤の分岐鎖は、DMAPAA単位割合が30mol%以下、好ましくは、1〜15mol%である。DMAPPA単位割合が30mol%を超えると、DMAEM単位とDMAPAA単位との合計に対するDMAEM単位の割合が少なくなるため、遺伝子導入剤が疎水性を示しにくくなり、血清を含む培地において、アニオン性タンパクなどの影響を受けやすくなる。ただし、DMAPPA単位が少なすぎると、DMAPAA単位を導入することによる重合性向上効果を十分に得ることができないため、上記下限以上とすることが好ましい。
【0047】
また、本発明の遺伝子導入剤の分岐鎖が、DMAEM単位、DMAPAA単位、及びその他のモノマー由来の構成単位により構成される場合、その他のモノマー由来の構成単位の割合は、DMAEM単位、DMAPAA単位、及びその他のモノマー由来の構成単位の合計に対して、10mol%以下とすることが好ましい。この上限を超えると、分岐鎖にDMAEM単位及びDMAPAA単位を導入することによる疎水化効果や、重合性向上効果を得にくくなる。
【0048】
本発明において、このような分岐型重合体の分岐鎖の1本当たりの分子量は、300〜20,000程度、特に1,000〜10,000程度が好ましい。この分子量は、光照射の時間を制御することにより調整することができる。即ち、反応時間を長くすることにより、重合反応を進行させて分子量の大きい分岐型重合体を得ることができる。
【0049】
また、この分岐型重合体の分子量としては、2,000〜150,000程度、特に8,000〜50,000程度であることが好ましい。
【0050】
なお、本明細書において、分子量とは、GPC(ゲルパーミエーションクロマトグラフィー)によるポリエチレングリコール換算の数平均分子量をさす。
【0051】
<架橋分岐型重合体>
本発明の遺伝子導入剤は、上述の分岐型重合体を用いるものであるが、本発明の遺伝子導入剤は、この分岐型重合体に対して光照射することにより当該分岐型重合体同士を架橋させた架橋分岐型重合体であってもよい。
【0052】
上述の分岐型重合体よりなる遺伝子導入剤であっても、遺伝子導入剤全体として疎水性を示すため、血清を含む培地において高い遺伝子導入活性を示すが、この分岐型重合体を架橋させることにより、より遺伝子導入活性に優れる架橋分岐型重合体よりなる遺伝子導入剤を得ることができる。
【0053】
このように前記分岐型重合体に対して光照射することにより架橋してなる架橋分岐型重合体にあっては、前記DMAPAA単位の優れた反応性を利用することにより、遺伝子導入剤の高分子量化を図ることができると共に、DMAPAA単位の塩基性が遺伝子の導入に与える影響を最小限に抑えることができる。
即ち、前記架橋分岐型重合体は、前記分岐型重合体に比べて複雑なネットワーク構造を有しており、アニオン性タンパクとDMAPAA単位の3級アミンとがその立体障害により接近し難くいため、結果として、アニオン性タンパクとDMAPAA単位の3級アミンとの相互作用を抑えることができる。また、架橋反応を行うことにより、DMAPAA単位の3級アミン脱離したり、2級アミン、1級アミンなどに変化し、塩基性を消失するため、血清を含む培地においても優れた遺伝子導入活性を示す。
【0054】
前記分岐型重合体同士を架橋する方法としては、例えば、分岐型重合体及び回転子を滅菌瓶に入れ、容器内部の気体を窒素で置換した後、この滅菌瓶を密封し、回転子などを用いて分岐型重合体を粉砕し、光を照射して分岐型重合体同士を架橋する方法、もしくは、溶媒に前記分岐型重合体を溶解及び/又は分散させ、この溶液及び/又は分散液に光を照射して前記分岐型重合体同士を架橋する方法を採用することができる。
【0055】
前記分岐型重合体同士を架橋する際の光の照射条件は、光波長180〜700nm、照射時間1分〜30,000時間、照射強度0.001〜10,000μW/cm2程度が好適である。
【0056】
この分岐型重合体を溶媒に溶解及び/又は分散させて架橋する場合に用いる溶媒としては、アルコールが好ましく、例えば、メタノール、エタノール、1−プロパノール、2−プロパノール、ブタノール、ペンタノール、ヘキサノールのような低級アルコールが好ましく、特にメタノール、エタノール及び2−プロパノールが好ましい。また、アルコール以外の溶媒としては、水、クロロホルム、トルエン、ベンゼン、キシレン、ジエチルエーテルなどのエーテル、アセトン、メチルエチルケトン、テトラヒドロフラン、塩化メチレンおよび塩化ベンゼンなどを挙げることができる。これらの溶媒は、1種を単独で用いてもよく、2種以上を併用してもよい。
【0057】
前記溶媒中の分岐型重合体の濃度は、3〜60重量%、特に6〜30重量%であることが好ましい。分岐型重合体の濃度が極端に高いと反応が進行しにくくなり、分岐型重合体の濃度が極端に低いと分岐鎖の末端同士の衝突確率が低くなるため好ましくない。
【0058】
このように架橋してなる架橋分岐型重合体の数平均分子量は、前記分岐型重合体の数平均分子量の1.2倍以上、特に1.2〜5.0倍、即ち、数平均分子量として10,000〜300,000程度、特に15,000〜200,000程度であることが好ましい。架橋分岐型重合体の数平均分子量が、分岐型重合体の分子量の1.2倍未満であると、架橋による構造的な優位性を得ることができず、また、5.0倍を超えると、水への溶解性が低下し、架橋分岐型重合体がゲル化するという問題が生じたり、核酸が細胞内に取り込まれにくくなったり、細胞毒性が発現するおそれがある。また、この架橋分岐型重合体と核酸との複合体を生体血管内へ投与する場合には、代謝、排泄の観点から好ましくない。
【0059】
[核酸複合体]
上記の本発明の遺伝子導入剤(ベクター)が核酸を核酸含有複合体として包囲することによって、生体内の酵素による核酸の失活、分解を抑制することができる。
【0060】
上記遺伝子導入剤と核酸とを複合させるには、遺伝子導入剤の濃度0.1〜1000μg/mL程度の溶液に対し、核酸を添加し、混合すればよい。核酸に対して遺伝子導入剤を過剰量添加し、核酸に対して遺伝子導入剤を飽和状態にして遺伝子導入剤と核酸とを複合化することが好ましい。
【0061】
核酸の好ましい例としては、単純ヘルペスウイルスチミジンキナーゼ遺伝子(HSV1−TK遺伝子),p53癌抑制遺伝子及びBRCA1癌抑制遺伝子やサイトカイン遺伝子としてTNF−α遺伝子,IL−2遺伝子,IL−4遺伝子,HLA−B7/IL−2遺伝子,HLA−B7/B2M遺伝子,IL−7遺伝子,GM−CSF遺伝子,IFN−γ遺伝子及びIL−12遺伝子などのサイトカイン遺伝子並びにgp−100,MART−1及びMAGE−1などの癌抗原ペプチド遺伝子が癌治療に利用できる。
【0062】
また、VEGF遺伝子,HGF遺伝子及びFGF遺伝子などのサイトカイン遺伝子並びにc−mycアンチセンス,c−mybアンチセンス,cdc2キナーゼアンチセンス,PCNAアンチセンス,E2Fデコイやp21(sdi−1)遺伝子が血管治療に利用できる。かかる一連の遺伝子は当業者には良く知られたものである。
【0063】
核酸複合体の粒径は50〜400nm程度が好適である。この粒径は、例えばレーザを用いた動的光散乱法によって測定される。粒径がこれよりも小さいと、核酸複合体内部の核酸にまで酵素の作用が及ぶおそれ、あるいは腎臓にて濾過排出されるおそれがある。また、これよりも大きいと、細胞に導入されにくくなるおそれがある。
【0064】
核酸は、細胞に導入されることによりその細胞内で機能を発現することができるような形態で用いる。例えばDNAの場合、導入された細胞内で当該DNAが転写され、それにコードされるポリペプチドの産生を経て機能発現されるように当該DNAが配置されたプラスミドとして用いる。好ましくは、プロモーター領域、開始コドン、所望の機能を有する蛋白質をコードするDNA、終止コドンおよびターミネーター領域が連続的に配列されている。
【0065】
所望により2種以上の核酸をひとつのプラスミドに含めることも可能である。
【0066】
本発明において、核酸を導入する対象として望ましい「細胞」としては、当該核酸の機能発現が求められるものであり、このような細胞としては、例えば使用する核酸(すなわちその機能)に応じて種々選択され、例えば心筋細胞、平滑筋細胞、繊維芽細胞、骨格筋細胞、血管内皮細胞、骨髄細胞、骨細胞、血球幹細胞、血球細胞等が挙げられる。また、単球、樹状細胞、マクロファージ、組織球、クッパー細胞、破骨細胞、滑膜A細胞、小膠細胞、ランゲルハンス細胞、類上皮細胞、多核巨細胞等、消化管上皮細胞・尿細管上皮細胞などである。
【0067】
本発明の核酸複合体は培養試験に用いるほか、任意の方法で生体に投与することができる。
【0068】
生体への投与方法としては静脈内又は動脈内への注入が特に好ましいが、筋肉内、脂肪組織内、皮下、皮内、リンパ管内、リンパ節内、体腔(心膜腔、胸腔、腹腔、脳脊髄腔等)内、骨髄内への投与の他に病変組織内に直接投与することも可能である。
【0069】
この核酸複合体を有効成分とする医薬は、更に必要に応じて製剤上許容し得る担体(浸透圧調整剤,安定化剤、保存剤、可溶化剤、pH調整剤、増粘剤等)と混合することが可能である。これら担体は公知のものが使用できる。
【0070】
また、この核酸複合体を有効成分とする医薬は、含まれる核酸の種類が異なる2種以上の核酸含有複合体を含めたものも包含される。このような複数の治療目的を併せ持つ医薬は、多様化する遺伝子治療の分野で特に有用である。
【0071】
投与量としては、動物、特にヒトに投与される用量は目的の核酸、投与方法および治療される特定部位等、種々の要因によって変化する。しかしながら、その投与量は治療的応答をもたらすに十分であるべきである。
【0072】
この核酸複合体は、好ましくは遺伝子治療に適用される。適用可能な疾患としては、当該複合体に含められる核酸の種類によって異なるが、末梢動脈疾患、冠動脈疾患、動脈拡張術後再狭窄等の病変を生じる循環器領域での疾患に加え、癌(悪性黒色腫、脳腫瘍、転移性悪性腫瘍、乳癌等)、感染症(HIV等)、単一遺伝病(嚢胞性線維症、慢性肉芽腫、α1−アンチトリプシン欠損症、Gaucher病等)等が挙げられる。
【実施例】
【0073】
以下に実施例を挙げて本発明をより具体的に説明するが、本発明はその要旨を超えない限り、以下の実施例に限定されるものではない。
【0074】
i)イニファターの合成
イニファターとしての1,2,4,5−テトラキス(N,N−ジエチルジチオカルバミルメチル)ベンゼンを次のようにして合成した。
【0075】
1,2,4,5−テトラキス(ブロモメチルベンゼン)5.0gとN,N−ジエチルジチオカルバミン酸ナトリウム34.0gをエタノール100mL中へ加え、遮光下、室温で4日間攪拌した。沈殿物を濾過し、3Lのメタノール中に投入して30分間攪拌した後、濾過した。この操作を繰り返し合計4回行った。沈殿物をトルエン200mLに溶解した後、100mLのメタノールを加えて50℃に加温し、冷蔵庫内で15時間保管して再結晶させ、結晶を濾別後、大量のメタノールで洗浄した。結晶を室温で減圧乾燥して、白色の1,2,4,5−テトラキス(N,N−ジエチルジチオカルバミルメチル)ベンゼンの針状結晶を得た(収率90%)。高速液体クロマトグラフィーにより、原料ピークが消失し、精製物が単一物質であることを確認した。
【0076】
1H−NMR(in CDCl3)の測定結果は、δ1.26−1.31ppm(t,24H,CH2CH3),δ3.69−3.77ppm(q,8H,N(CH2CH3)2),δ3.99−4.07ppm(q,8H,N(CH2CH3)2),δ4.57ppm(s,8H,Ar−CH2),δ7.49ppm(s,2H,Ar−H)であった。
【0077】
【化1】

【0078】
ii)4分岐型重合体よりなるカチオン性コポリマーの光重合による合成
2−N,N−ジメチルアミノエチルメタクリレート及び3−N,N−ジメチルアミノプロピルアクリルアミドを混合モノマーとして用い、4分岐型重合体よりなるカチオン性コポリマーの光重合による合成を行った。
【0079】
即ち、上記i)により合成した1,2,4,5−テトラキス(N,N−ジエチルジチオカルバミルメチル)ベンゼン45.6mgを20mLのトルエンに溶解し、2−N,N−ジメチルアミノエチルメタクリレート8.5g及び3−N,N−ジメチルアミノプロピルアクリルアミド1.0gを加えて混合し、全量をトルエンで50mLに調整した。3mm厚軟質ガラスセル中で激しく攪拌しながら高純度窒素ガスで10分間パージした後に、300Wショートアークキセノンランプ(朝日分光社製、MAX−301)で波長250〜400nmの混合紫外線を60分間照射した。照射強度はウシオ電機社のUIT−150へUVD−C405(検出波長範囲320〜470nm)を装着して2.5mW/cm2に調整した。なお、この反応においては、波長が250〜400nmである混合紫外線を照射しているが、反応容器として用いた3mm厚軟質ガラスセルが、短波長の紫外光を透過しないため、実際には340〜400nm、波長ごとのガラス透過率も考慮すれば、350〜400nm程度の波長の光を照射したことになる。光照射後の重合溶液をエバポレーターで濃縮し、300mLのエーテル/n−ヘキサンの混合溶媒(1/3:v/v)で再沈殿させた。得られた水飴状のポリマーを300mLのエーテル/n−ヘキサンの混合溶媒(1/3:v/v)で3回抽出して精製し、溶媒を蒸散させた。次いで、得られた固体を少量のベンゼンに溶解し、0.2μmフィルターで濾過した後、凍結乾燥させて、4分岐型重合体よりなるカチオン性コポリマーを得た。この4分岐型重合体よりなるカチオン性コポリマーのポリエチレングリコールを標準物質とした数平均分子量は、GPCにより、13,500(Mw/Mn=1.4)と測定された。この測定値より、4分岐型重合体の分岐鎖1本当たりの分子量は、3195であることが分かった。また、1H−NMR(in CD3OD)より共重合比は、2−N,N−ジメチルアミノエチルメタクリレート93mol%、3−N,N−ジメチルアミノプロピルアクリルアミド7mol%と計算された。
【0080】
【化2】

iii)4分岐型重合体よりなるカチオン性コポリマーの光架橋
上記ii)により合成した4分岐型重合体よりなるカチオン性コポリマー0.2gと3角柱形の回転子とを100mL滅菌瓶に入れ、滅菌瓶の内部の気体を高純度窒素で置換した後、上蓋として3mm厚軟質ガラス板を用い、この滅菌瓶を密封した。回転子を使用して前記4分岐型重合体を粉末状に粉砕した後、これに300Wショートアークキセノンランプ(朝日分光社製、MAX−301)を用いて落射式により、波長250〜400nmの混合紫外線を3.5時間照射した。照射強度は、1.0mW/cm2に調整した。この光照射により、前記粉末は、若干黄色に変色した。この粉末に対して約30mLのメタノールを加えたところ、少量の不溶性化合物が生成した。この不溶性化合物を濾別し、濾液をエバポレーターで濃縮した後、この濃縮液をエーテル中に滴下することにより、再沈殿を行った。得られた沈殿物をエーテルで3回洗浄して精製し、溶媒を蒸散させて固体を得た。次いで、この固体を少量のベンゼンに溶解させ、0.2μmフィルターで濾過した後、凍結乾燥させて、4分岐型重合体よりなるカチオン性コポリマーの光架橋体を得た。この4分岐型重合体よりなるカチオン性コポリマーの光架橋体の数平均分子量は、GPCにより、22,000(Mw/Mn=1.9)と測定され、NMRスペクトル(300MHz)からは、3−N,N−ジメチルアミノプロピルアクリルアミドへ帰属されるべきジメチルアミノ基のピークが確認されなかった。
【0081】
iv)4分岐型重合体よりなるカチオン性ホモポリマーの光重合による合成
3−N,N−ジメチルアミノプロピルアクリルアミドを用いず、2−N,N−ジメチルアミノエチルメタクリレート7.9gをモノマーとして用いたこと以外は、上記ii)と同様の方法で4分岐型重合体よりなるカチオン性ホモポリマーを合成した。得られた4分岐型重合体よりなるカチオン性ホモポリマーは、クロロホルム/n−ヘキサン系により3回再沈殿を行うことにより精製し、得られた固体をベンゼンに溶解させて、この溶液を凍結乾燥することで4分岐型重合体よりなるカチオン性ホモポリマーを得た。この4分岐型重合体よりなるカチオン性ホモポリマーの分子量は、GPCにより13,000(Mw/Mn=1.35)と測定された。
【0082】
1H−NMR(in CD3OD)の測定結果は、δ0.8−1.2ppm(br,3H,−CH2−CH3−),δ1.6−2.0ppm(br,2H,−CH2−CH3−),δ2.2−2.4ppm(br,6H,N−CH3),δ2.5−2.7ppm(br,2H,CH2−N),δ4.0−4.2ppm(br,2H,O−CH2)であった。
【0083】
【化3】

【0084】
v)4分岐型重合体よりなるカチオン性ホモポリマーの光架橋の検討
4分岐型重合体よりなるカチオン性コポリマーの代わりに、前記iv)により得られた4分岐型重合体よりなるカチオン性ホモポリマーを用いたこと以外は、前記iii)と同様に光照射を行ったが、光照射後の分子量は、12,800(Mw/Mn=1.40)であり、照射前後で分子量は、ほとんど変化しなかった。
【0085】
vi)遺伝子導入活性
細胞にはアフリカミドリサル腎細胞の由来のCOS-1を使用し、DNAにはpGL3コントロールベクターを使用した。COS-1細胞は細胞数を4万個/mLに調整して24Well培養皿へ播種し、培養24時間後に遺伝子導入を行った。上記ii)において合成したカチオン性コポリマーを実施例1の遺伝子導入剤とし、iii)にて合成した架橋体を実施例2の遺伝子導入剤とし、iv)にて合成したカチオン性ホモポリマーを比較例1の遺伝子導入剤とし、v)において光照射した後のカチオン性ホモポリマーを比較例2の遺伝子導入剤として、それぞれ生理食塩水へ溶解し、濃度(遺伝子導入剤/食塩水)を8μg/60μLとした。DNAはTEバッフアーへ溶解し、濃度(DNA/バッファー)を3μg/90μLとした。室温で遺伝子導入剤溶液とDNA溶液を混合した後、温度を37℃に加温して核酸複合体を形成させた。この核酸複合体25μLを1mLの完全培地(DMEM+10重量%FCS+抗生物質)へ加え、30分間インキュベートした。この約1mLの核酸複合体完全培地溶液と、37℃のPBSで洗浄した培養細胞とを接触させ、48時間培養を行った。48時間後、ルシフェラーゼアッセにより遺伝子導入活性の評価を行った(プロメガ社、アッセイキット試薬)。補正はタンパク濃度で行い、タンパク定量はBioRad社のBradford試薬で行った。上記の評価結果を図1に示す。
【0086】
比較例1,2の遺伝子導入剤は、同程度の遺伝子導入活性を示した。これは、比較例1の分岐型重合体に対して光照射を行っても架橋反応が生じにくく、光照射前後で分子量がほとんど変化しなかったためであると考えられる。これに対して、実施例1の分岐型重合体を架橋した実施例2の架橋分岐型重合体よりなる遺伝子導入剤は、実施例1に比べて遺伝子導入活性が10倍程度向上した。これは、光照射により、分岐鎖に含まれるDMAPAA単位を分岐鎖に有する分岐型重合体同士が、遺伝子の導入に有利な分子量及び構造を備える架橋分岐型重合体に変化したためであると考えられる。
【0087】
なお、上記実施例1,2及び比較例1,2の遺伝子導入剤を用いて、血清を含まない培地において同様の実験を行ったところ、実施例1の遺伝子導入剤は、比較例1,2の遺伝子導入剤に比べて優れた遺伝子導入活性を示し、実施例2の遺伝子導入剤は、実施例1の遺伝子導入剤に比べて、遺伝子導入活性が4〜6倍程度優れていた。
【0088】
これらの結果より、DMAEM単位と共に、DMAPAA単位を分岐鎖に有する分岐型重合体は、この分岐型重合体同士を光照射するだけで容易に架橋することができ、この架橋反応により得られる架橋分岐型重合体は、遺伝子導入に有利な構造を備えた化合物であることがわかる。また、血清を含む培地において、実施例2の方が実施例1に比べて優れた遺伝子導入活性を示すのは、血清を含む培地における遺伝子導入の妨げとなるアミン部分が、架橋反応により、アニオン性物質と相互作用しにくい構造に変化したため、もしくは、架橋によりDMAPAA単位の塩基性が消失したためであると考えられる。即ち、この架橋反応によって、分岐鎖中のDMAPAA部分が架橋点として寄与することにより、分岐鎖の側鎖の3級アミンが脱離したり、3級アミンから2級アミン、1級アミンへと変化し、塩基性が消失したためであると考えられる。
【特許請求の範囲】
【請求項1】
芳香環を核とし、それから伸延した複数の分岐鎖を有する分岐型重合体を用いた遺伝子導入剤において、
該分岐鎖は、少なくとも2−N,N−ジメチルアミノエチルメタクリレート及び/又はその誘導体と、3−N,N−ジメチルアミノプロピルアクリルアミドとをランダム共重合してなる重合体よりなり、
該重合体を構成する2−N,N−ジメチルアミノエチルメタクリレート及び/又はその誘導体由来の構成単位と、3−N,N−ジメチルアミノプロピルアクリルアミド由来の構成単位との合計に対する該3−N,N−ジメチルアミノプロピルアクリルアミド由来の構成単位の割合が、30mol%以下であることを特徴とする遺伝子導入剤。
【請求項2】
請求項1において、前記重合体を構成する2−N,N−ジメチルアミノエチルメタクリレート及び/又はその誘導体由来の構成単位と、3−N,N−ジメチルアミノプロピルアクリルアミド由来の構成単位との合計に対する該3−N,N−ジメチルアミノプロピルアクリルアミド由来の構成単位の割合が、1〜15mol%であることを特徴とする遺伝子導入剤。
【請求項3】
請求項1又は2において、前記遺伝子導入剤は、前記分岐型重合体に対して光照射することにより該分岐型重合体同士が架橋した架橋分岐型重合体よりなるものであり、
該架橋分岐型重合体の数平均分子量は、該分岐型重合体の数平均分子量の1.2倍以上であることを特徴とする遺伝子導入剤。
【請求項4】
請求項3において、前記架橋分岐型重合体の数平均分子量は、前記分岐型重合体の数平均分子量の1.2〜5.0倍であることを特徴とする遺伝子導入剤。
【請求項5】
請求項1ないし4のいずれか1項において、前記分岐型重合体は、N,N−ジ置換−ジチオカルバミルメチル基を同一分子内に3個以上有する化合物をイニファターとし、これに少なくとも前記2−N,N−ジメチルアミノエチルメタクリレート及び/又はその誘導体と、3−N,N−ジメチルアミノプロピルアクリルアミドとを光照射リビング重合させてなるものであることを特徴とする遺伝子導入剤。
【請求項6】
請求項5において、前記N,N−ジ置換−ジチオカルバミルメチル基を同一分子内に3個以上有する化合物は、ベンゼン環を核とし、この核に分岐鎖として3個以上の該N,N−ジ置換−ジチオカルバミルメチル基が結合していることを特徴とする遺伝子導入剤。
【請求項7】
請求項5又は6において、前記N,N−ジ置換−ジチオカルバミルメチル基は、N,N−ジアルキル−ジチオカルバミルメチル基であることを特徴とする遺伝子導入剤。
【請求項8】
請求項1ないし7のいずれか1項において、前記分岐鎖が、前記2−N,N−ジメチルアミノエチルメタクリレート及び/又はその誘導体と、3−N,N−ジメチルアミノプロピルアクリルアミドのランダム共重合体よりなることを特徴とする遺伝子導入剤。
【請求項9】
請求項1ないし8のいずれか1項において、前記分岐鎖の1本当たりの分子量は、300〜20,000であることを特徴とする遺伝子導入剤。
【請求項10】
請求項1ないし9のいずれか1項において、前記分岐型重合体の分子量は、2,000〜150,000であることを特徴とする遺伝子導入剤。
【請求項11】
請求項1ないし10のいずれか1項に記載の遺伝子導入剤と核酸とを複合させてなる核酸複合体。
【請求項1】
芳香環を核とし、それから伸延した複数の分岐鎖を有する分岐型重合体を用いた遺伝子導入剤において、
該分岐鎖は、少なくとも2−N,N−ジメチルアミノエチルメタクリレート及び/又はその誘導体と、3−N,N−ジメチルアミノプロピルアクリルアミドとをランダム共重合してなる重合体よりなり、
該重合体を構成する2−N,N−ジメチルアミノエチルメタクリレート及び/又はその誘導体由来の構成単位と、3−N,N−ジメチルアミノプロピルアクリルアミド由来の構成単位との合計に対する該3−N,N−ジメチルアミノプロピルアクリルアミド由来の構成単位の割合が、30mol%以下であることを特徴とする遺伝子導入剤。
【請求項2】
請求項1において、前記重合体を構成する2−N,N−ジメチルアミノエチルメタクリレート及び/又はその誘導体由来の構成単位と、3−N,N−ジメチルアミノプロピルアクリルアミド由来の構成単位との合計に対する該3−N,N−ジメチルアミノプロピルアクリルアミド由来の構成単位の割合が、1〜15mol%であることを特徴とする遺伝子導入剤。
【請求項3】
請求項1又は2において、前記遺伝子導入剤は、前記分岐型重合体に対して光照射することにより該分岐型重合体同士が架橋した架橋分岐型重合体よりなるものであり、
該架橋分岐型重合体の数平均分子量は、該分岐型重合体の数平均分子量の1.2倍以上であることを特徴とする遺伝子導入剤。
【請求項4】
請求項3において、前記架橋分岐型重合体の数平均分子量は、前記分岐型重合体の数平均分子量の1.2〜5.0倍であることを特徴とする遺伝子導入剤。
【請求項5】
請求項1ないし4のいずれか1項において、前記分岐型重合体は、N,N−ジ置換−ジチオカルバミルメチル基を同一分子内に3個以上有する化合物をイニファターとし、これに少なくとも前記2−N,N−ジメチルアミノエチルメタクリレート及び/又はその誘導体と、3−N,N−ジメチルアミノプロピルアクリルアミドとを光照射リビング重合させてなるものであることを特徴とする遺伝子導入剤。
【請求項6】
請求項5において、前記N,N−ジ置換−ジチオカルバミルメチル基を同一分子内に3個以上有する化合物は、ベンゼン環を核とし、この核に分岐鎖として3個以上の該N,N−ジ置換−ジチオカルバミルメチル基が結合していることを特徴とする遺伝子導入剤。
【請求項7】
請求項5又は6において、前記N,N−ジ置換−ジチオカルバミルメチル基は、N,N−ジアルキル−ジチオカルバミルメチル基であることを特徴とする遺伝子導入剤。
【請求項8】
請求項1ないし7のいずれか1項において、前記分岐鎖が、前記2−N,N−ジメチルアミノエチルメタクリレート及び/又はその誘導体と、3−N,N−ジメチルアミノプロピルアクリルアミドのランダム共重合体よりなることを特徴とする遺伝子導入剤。
【請求項9】
請求項1ないし8のいずれか1項において、前記分岐鎖の1本当たりの分子量は、300〜20,000であることを特徴とする遺伝子導入剤。
【請求項10】
請求項1ないし9のいずれか1項において、前記分岐型重合体の分子量は、2,000〜150,000であることを特徴とする遺伝子導入剤。
【請求項11】
請求項1ないし10のいずれか1項に記載の遺伝子導入剤と核酸とを複合させてなる核酸複合体。
【図1】




【公開番号】特開2011−72256(P2011−72256A)
【公開日】平成23年4月14日(2011.4.14)
【国際特許分類】
【出願番号】特願2009−227404(P2009−227404)
【出願日】平成21年9月30日(2009.9.30)
【出願人】(510094724)独立行政法人国立循環器病研究センター (52)
【出願人】(000005278)株式会社ブリヂストン (11,469)
【上記1名の代理人】
【識別番号】100086911
【弁理士】
【氏名又は名称】重野 剛
【Fターム(参考)】
【公開日】平成23年4月14日(2011.4.14)
【国際特許分類】
【出願日】平成21年9月30日(2009.9.30)
【出願人】(510094724)独立行政法人国立循環器病研究センター (52)
【出願人】(000005278)株式会社ブリヂストン (11,469)
【上記1名の代理人】
【識別番号】100086911
【弁理士】
【氏名又は名称】重野 剛
【Fターム(参考)】
[ Back to top ]

