遺伝子導入剤組成物及びその製造方法
【課題】遺伝子導入活性に優れ、従来の非ウイルスベクターでは遺伝子導入が困難であった幹細胞や初代細胞(プライマリーセル:生体組織から分離した直後の細胞)にも遺伝子導入が可能な非ウイルスベクターよりなる遺伝子導入剤組成物を提供する。
【解決手段】2−N,N−ジメチルアミノエチルメタクリルアミド、2−N,N−ジメチルアミノエチルメタクリレート及び3−N,N−ジメチルアミノプロピルアクリルアミドよりなる群から選ばれる1種又は2種以上の含窒素モノマーに由来する構造単位を含む含窒素ポリマーと核酸とを含む複合体と、細胞破砕物とを混合してなる遺伝子導入剤組成物。含窒素ポリマーと核酸との複合体に、細胞破砕物を混合して遺伝子導入剤組成物を形成することにより、遺伝子導入活性が飛躍的に向上し、幹細胞や初代細胞への遺伝子導入も可能となる。
【解決手段】2−N,N−ジメチルアミノエチルメタクリルアミド、2−N,N−ジメチルアミノエチルメタクリレート及び3−N,N−ジメチルアミノプロピルアクリルアミドよりなる群から選ばれる1種又は2種以上の含窒素モノマーに由来する構造単位を含む含窒素ポリマーと核酸とを含む複合体と、細胞破砕物とを混合してなる遺伝子導入剤組成物。含窒素ポリマーと核酸との複合体に、細胞破砕物を混合して遺伝子導入剤組成物を形成することにより、遺伝子導入活性が飛躍的に向上し、幹細胞や初代細胞への遺伝子導入も可能となる。
【発明の詳細な説明】
【技術分野】
【0001】
本発明は、含窒素ポリマーと核酸とから形成された核酸複合体に、細胞破砕物を付与してなる新規遺伝子導入剤組成物及びその製造方法に関する。
【背景技術】
【0002】
近年、ヒト疾患の分子遺伝学的要因が明らかになるにつれ、遺伝子治療研究がますます重要視されている。遺伝子治療法は標的とする部位でのDNAの発現や宿主細胞DNAの発現抑制を目的としており、いかにDNAやRNA(siRNA、miRNAなど)を標的部位に到達させるか、いかにDNAやRNAを標的部位に効率的に導入し、当該部位で機能的に発現や発現抑制させるかということが重要となる。
【0003】
遺伝子導入技術には大きく分けてウイルスベクターと非ウイルスベクターとの2つが存在する。
ウイルスベクターによる遺伝子導入は、アデノウイルス、アデノ付随ウイルス、センダイウイルス、レトロウイルスなどを改変(野生型ウイルスを無毒化し、目的の核酸を挿入して作成)し、細胞へ作用させることで外来遺伝子を細胞へ導入する技術であり、当業者の間で広く行われている。
非ウイルスベクターは高分子ポリマーやカチオン性脂質と核酸で形成させた複合体を細胞へ取り込ませる食作用(エンドサイトーシス)を利用したものが多く、他にはエレクトロポレーションや金コロイド銃など機械的に細胞膜を突き破って核酸を挿入する技術もある。
【0004】
非ウイルスベクターに関して、本発明者らは、ベンゼン環から放射状にポリマー鎖が伸延するスター型ポリマーによる遺伝子導入技術を開発し、多くの提案を行ってきた(例えば、特許文献1〜3)。該スター型ポリマーベクターはベンゼン環に結合する直鎖状ポリマー鎖の本数に依存して遺伝子導入活性が向上し、最大で6本のポリマー鎖を有するスター型ポリマーが最も遺伝子導入活性の高いものとなる。
【0005】
また、同じモノマーの重合物であっても、該スター型ポリマーには、例えば、高CA比(ベクターの陽電荷数とDNAの陰電荷数の比)でも細胞毒性を発現することなく遺伝子導入が可能である;スター型ポリマーに核酸を複合化させてなる核酸複合体の粒子径が大きくても(即ち、通常、粒子径が小さいほど細胞膜の透過に有利とされているが、スター型ポリマーは200μm〜300μm、直鎖状ポリマーでは100μmほどであり、粒子径の面ではスター型ポリマーは不利であると考えられるが)、細胞膜透過性が高い;などといった、直鎖状ポリマーにはない特長を有する。
【0006】
一方で、本発明者らは、特定の含窒素モノマーが光照射により開裂し、ラジカルを生成し、このラジカルを利用して分岐型重合体を速やかに生成すること、この分岐型重合体が血清を含む培地においても優れた遺伝子導入活性を示すことを見出した(特許文献4)。
この特許文献4に開示される技術によれば、特定の含窒素モノマーを主成分とする反応液に対して光を照射することにより、この含窒素モノマーが光照射によりラジカルを生成するという性質を利用して、イニファターや、重合開始剤を用いることなく、また、複数の反応工程を経ることなく、複雑な構造を有する分岐型重合体を短時間で安価に得ることができ、しかも得られた分岐型重合体は、これを構成する当該含窒素モノマーの加水分解されにくいという性質、及び温度の変化により化合物の性質が変化しにくいという性質、さらに、一部の含窒素モノマーはpKaの値が中性を示し、血清を含む培地においてアニオン性のタンパクの影響を受けにくいという性質により、細胞に対して効率的に遺伝子を導入することができ、しかも、分子量が100万程度であってもゲル化せず、水に易溶であるため、遺伝子導入剤として扱いやすいという優れた特長を有する。
【0007】
しかし、ウイルスベクターと比較して、特許文献1〜4で提案されているような高分子ベクターやカチオン性脂質のベクター等の非ウイルスベクターは、遺伝子導入活性が低いという欠点があった。
即ち、通常の高分子ベクターによる核酸複合体は、異物として食作用(エンドサイトーシス)で細胞内に取り込まれているため、小胞体中で分解するものが多く、運搬効率が悪いとされている(非特許文献1)。
特に、造血幹細胞、筋芽細胞、骨芽細胞、ES細胞、iPS細胞などの幹細胞や神経細胞、心筋細胞など食作用の少ない細胞へはほとんど導入ができなかった。
このため、従来、生体(動物)での使用例もウイルスベクターによる研究が主流で、高分子ベクターによる生体内使用は報告がほとんどなされていないのが実状である。これは、株化細胞(試験管での実験用に、容易に培養が可能で継代による細胞の性質の変化がないように処理された細胞)には高分子ベクターも適用が可能であるものの、初代細胞(プライマリーセル:生体組織から分離した直後の細胞)にはほとんど遺伝子導入ができないことによる。
【0008】
これに対して、ウイルスベクターは、その強い感染力を利用して核酸を種々の細胞へ導入できる利点がある一方で、次のような欠点がある。
(1) 新種のウイルスを作成してしまう危険性(例えば、(1)一般にウイルスベクターの作成の前に組換え遺伝子を作成するが、この組換え遺伝子の作成の際に目的遺伝子に突然変異が入ってしまうことやE1領域の消化が十分でなく自己増殖能が残ってしまうなどの危険性や、(2)ウイルスベクターの継代中、ウイルス遺伝子の複製過程でパッケージング細胞のDNAとの相同組換えによってE1領域を取得し、自己増殖能を獲得したウイルスが産生してしまう可能性など)や研究者自身が感染する危険性がある。
(2) −70℃以下の温度で保存しても経時性に力価(タイター)が低下してしまうので、高力価とするために使用前に力価の確認試験や再調製や精製の工程が必要であり、感染力の強いウイルスベクターの調製には多大な時間や労力コストを必要とする。
(3) ウイルス自体にサイズがあるので、物理的に内部へ挿入できる核酸のサイズに限界があり、大きなDNAなどは挿入できない。
(4) ウイルスベクターは細胞膜表面の受容体(例えばCAR(コサッキー・アデノウイルス・レセプター))を介して侵入するため、受容体を持っていない細胞へは使用できない。
(5) 組換え遺伝子実験として承認申請などが必要なケースが多く、企画から実験を行うまでに多大な時間や専用の施設が必要になる。
【先行技術文献】
【特許文献】
【0009】
【特許文献1】WO2004/092388号公報
【特許文献2】特開2007−70579号公報
【特許文献3】特願2009−239496
【特許文献4】特願2010−158853
【非特許文献】
【0010】
【非特許文献1】Hama,S.,Quantitative comparsion of intracellular trafficking,(2006),Mol Ther 13,786−794
【発明の概要】
【発明が解決しようとする課題】
【0011】
上述のように、ウイルスベクターには多くの欠点があるため、非ウイルスベクターについて、その遺伝子導入活性をより一層高め、ウイルスベクターの遺伝子導入活性に近づけることが、遺伝子導入技術の進展に望まれる。
【0012】
本発明は、上記従来の実状に鑑みてなされたものであって、遺伝子導入活性に優れ、従来の非ウイルスベクターでは遺伝子導入が困難であった幹細胞や初代細胞(プライマリーセル:生体組織から分離した直後の細胞)にも遺伝子導入が可能な非ウイルスベクターよりなる遺伝子導入剤組成物を提供することを課題とする。
【課題を解決するための手段】
【0013】
本発明者らは上記課題を解決すべく鋭意検討を重ねた結果、特定の含窒素ポリマーと核酸との複合体に、細胞破砕物を混合して遺伝子導入剤組成物を形成することにより、遺伝子導入活性が飛躍的に向上し、幹細胞や初代細胞への遺伝子導入も可能となることを見出した。
【0014】
本発明はこのような知見に基いて達成されたものであり、以下を要旨とする。
【0015】
[1] 2−N,N−ジメチルアミノエチルメタクリルアミド、2−N,N−ジメチルアミノエチルメタクリレート及び3−N,N−ジメチルアミノプロピルアクリルアミドよりなる群から選ばれる1種又は2種以上の含窒素モノマーに由来する構造単位を含む含窒素ポリマーと核酸とを含む複合体と、細胞破砕物とを混合してなることを特徴とする遺伝子導入剤組成物。
【0016】
[2] [1]において、前記含窒素ポリマーと核酸とを含む複合体のN/P比が5〜15であることを特徴とする遺伝子導入剤組成物。
【0017】
[3] [1]又は[2]において、前記含窒素ポリマーは、前記含窒素モノマーを重合してなることを特徴とする遺伝子導入剤組成物。
【0018】
[4] [3]において、前記含窒素ポリマーは、前記含窒素モノマーのみを重合してなることを特徴とする遺伝子導入剤組成物。
【0019】
[5] [3]又は[4]において、前記含窒素ポリマーの分子量が10,000〜5,000,000であることを特徴とする遺伝子導入剤組成物。
【0020】
[6] [1]又は[2]において、前記含窒素ポリマーは、前記含窒素モノマーに由来する構造単位を含む重合鎖よりなる分岐鎖を有する分岐型重合体であって、該分岐型重合体は、ベンゼン環を核とし、この核から3本以上の前記分岐鎖が伸延していることを特徴とする遺伝子導入剤組成物。
【0021】
[7] [6]において、前記分岐鎖は前記含窒素モノマーに由来する構造単位のみからなることを特徴とする遺伝子導入剤組成物。
【0022】
[8] [6]又は[7]において、1本当たりの前記分岐鎖の分子量が1,500〜150,000であり、前記分岐型重合体の分子量が10,000〜10,000,000であることを特徴とする遺伝子導入剤組成物。
【0023】
[9] 2−N,N−ジメチルアミノエチルメタクリルアミド、2−N,N−ジメチルアミノエチルメタクリレート及び3−N,N−ジメチルアミノプロピルアクリルアミドよりなる群から選ばれる1種又は2種以上の含窒素モノマーに由来する構造単位を含む含窒素ポリマーと核酸とを含む複合体と、細胞破砕物とを混合する工程を有することを特徴とする遺伝子導入剤組成物の製造方法。
【発明の効果】
【0024】
特定の含窒素モノマーから得られる含窒素ポリマーと核酸との複合体(以下、含窒素ポリマーと核酸との核酸複合体を「一次核酸複合体」と称す場合がある。)と細胞破砕物とを混合してなる本発明の遺伝子導入剤組成物によれば、非ウイルスベクターである含窒素ポリマーを用いて、従来の高分子ベクターを用いたものに比べて遺伝子導入活性が著しく高い遺伝子導入剤組成物が提供される。しかも、本発明の遺伝子導入剤組成物であれば、従来の非ウイルスベクターでは遺伝子導入が不可能又は困難であった幹細胞や初代細胞(プライマリーセル:生体組織から分離した直後の細胞)への遺伝子導入も可能となる。
【0025】
本発明の遺伝子導入剤組成物により、従来の核酸複合体を一次核酸複合体として、この一次核酸複合体に細胞破砕物を混合することにより、遺伝子導入活性が飛躍的に向上し、幹細胞や初代細胞への遺伝子導入も可能となる作用機構の詳細は明らかではないが、以下の通り推定される。
即ち、核酸複合体が細胞内へ侵入する際、本発明の遺伝子導入剤組成物では、一次核酸複合体の表面に細胞破砕物由来の成分が吸着ないしは何らかの吸引作用で近接して存在するので、従来の非ウイルスベクターのような食作用(エンドサイトーシス)を利用した遺伝子導入ではなく、受容体を介した取込み作用、所謂、ピノサイトーシスと呼ばれる細胞にとって有用成分として取り込まれるようにして導入されるようになり、この結果、遺伝子導入活性が高められ、また、幹細胞や初代細胞への遺伝子導入も可能となることが考えられる。
また、細胞破砕物のタンパク中に、細胞に導入した核酸の転写を促進する何らかの成分が存在し、この成分により遺伝子導入活性が向上していることも考えられる。
【0026】
本発明に係る一次核酸複合体のN/P比は5〜15程度であることが好ましい(請求項2)。
【0027】
本発明に係る含窒素ポリマーの一態様としては、前記特定の含窒素モノマーを重合してなるもの、好ましくは前記特定の含窒素モノマーのみを重合してなるものが挙げられ、このような含窒素ポリマーの分子量は、10,000〜5,000,000であることが好ましい(請求項3〜5)。
【0028】
また、本発明に係る含窒素ポリマーの他の態様としては、ベンゼン環を核とし、この核から、前記特定の含窒素モノマーに由来する構造単位を含む重合鎖よりなる分岐鎖、好ましくは前記特定の含窒素モノマーに由来する構造単位のみからなる分岐鎖が伸延している分岐型重合体が挙げられ、このような含窒素ポリマーにおいて、1本当たりの分岐鎖の分子量が1,500〜150,000であり、含窒素ポリマーである分岐型重合体の分子量が10,000〜10,000,000であるものが好ましい(請求項6〜8)。
【図面の簡単な説明】
【0029】
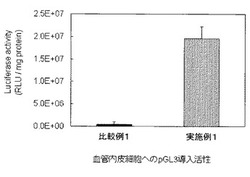
【図1】実施例1及び比較例1の遺伝子導入活性の評価結果を示すグラフである。
【発明を実施するための形態】
【0030】
以下に、本発明の実施の形態を詳細に説明する。
【0031】
[遺伝子導入剤組成物]
本発明の遺伝子導入剤組成物は、特定の含窒素モノマーから得られる含窒素ポリマーと核酸との複合体と細胞破砕物とを混合してなるものであり、通常、含窒素ポリマーと核酸とを混合して一次核酸複合体を形成させた後に細胞破砕物を混合し、一次核酸複合体に細胞破砕物を複合させたものとして提供される。
【0032】
なお、本発明の遺伝子導入剤組成物において、含窒素ポリマーと核酸とで形成される一次核酸複合体に対して、細胞破砕物がどのような状態で存在しているかは明らかにされていないが、以下、説明の便宜上、含窒素ポリマーと核酸との一次核酸複合体に細胞破砕物を混合してなるものを「二次核酸複合体」と称す場合がある。
【0033】
<含窒素ポリマー>
本発明に係る含窒素ポリマー(以下「本発明の含窒素ポリマー」と称す場合がある。)は、下記の2−N,N−ジメチルアミノエチルメタクリルアミド、2−N,N−ジメチルアミノエチルメタクリレート及び3−N,N−ジメチルアミノプロピルアクリルアミドよりなる群から選ばれる1種又は2種以上の含窒素モノマーに由来する構造単位を含むものである。
【0034】
【化1】

【0035】
本発明の含窒素ポリマーは、重合鎖に上記2−N,N−ジメチルアミノエチルメタクリルアミド、2−N,N−ジメチルアミノエチルメタクリレート、及び3−N,N−ジメチルアミノプロピルアクリルアミドのうちのいずれかに由来する構造単位を含むものであればよく、その形態には特に制限はないが、例えば、以下の(1)又は(2)が好ましいものとして挙げられる。
【0036】
(1) 前記特定の含窒素モノマーを重合してなる含窒素ポリマー。好ましくは前記特定の含窒素モノマーのみを重合してなる含窒素ポリマー(以下、この含窒素ポリマーを「含窒素ポリマー(1)」と称す場合がある。)。
(2) ベンゼン環を核とし、この核から3本以上の、前記特定の含窒素モノマーを含む重合鎖よりなる分岐鎖が伸延している分岐型重合体(以下、この分岐型重合体を「含窒素ポリマー(2)」と称す場合がある。)。この分岐型重合体において、分岐鎖は前記特定の含窒素モノマーのみからなることが好ましい。
【0037】
上記含窒素ポリマー(1)としては、特に、2−N,N−ジメチルアミノエチルメタクリルアミド及び/又は3−N,N−ジメチルアミノプロピルアクリルアミドを重合してなるものが好ましく、このような含窒素ポリマー(1)を製造する方法に特に制限はないが、2−N,N−ジメチルアミノエチルメタクリルアミド及び/又は3−N,N−ジメチルアミノプロピルアクリルアミドを主成分とする反応液に対して、光を照射することによりこれらの含窒素モノマーを重合させて含窒素ポリマー(1)を製造することが好ましい。この方法によれば、2−N,N−ジメチルアミノエチルメタクリルアミド及び3−N,N−ジメチルアミノプロピルアクリルアミドが、光照射されると容易にラジカルを生成するという性質を利用して含窒素ポリマー(1)を非常に短時間で製造することが可能である。
【0038】
以下に、この製造方法について説明する。
【0039】
含窒素ポリマー(1)は、前述の通り、2−N,N−ジメチルアミノエチルメタクリルアミド及び/又は3−N,N−ジメチルアミノプロピルアクリルアミド(以下これらを「含窒素モノマー(1)」と称す場合がある。)を主成分とする反応液に対して光を短時間照射することにより容易に製造することができ、短時間の光照射により、分岐状の高分子量体を得ることができる。その理由は、次のように考えられる。即ち、光照射により生じる主な反応が、まず、光照射された含窒素モノマー(1)のアミド基が光開裂することによりラジカルを生成し、このラジカルが、含窒素モノマー(1)のビニル基と反応することにより重合反応が開始され、さらに、この重合反応により生成した重合体のペンダント側鎖(重合反応により生成した分子鎖の基本構造の一部分を構成する側鎖)の未反応のアミド基が光解裂してラジカルを生成し、このラジカルと未反応の含窒素モノマーとがさらに反応することにより、高分子鎖からなる分岐鎖が導入され、このように逐次的に重合反応が進行していくため、複数の分岐点を有し、複雑な構造を備える含窒素ポリマー(1)を短時間で得ることができると考えられる。
【0040】
含窒素モノマー(1)の重合反応は、反応液中に含窒素モノマー(1)が含まれていれば、含窒素モノマー(1)以外の重合反応に関与しない化合物、例えば、溶媒の存在下で反応を行ってもよいが、重合反応に関与しない化合物を用いずに、実質的に含窒素モノマー(1)のみからなる反応液で重合を行うことが好ましい。これは、重合反応に関与しない化合物が、重合反応に直接的に関与しない場合であっても、生成したラジカルを吸収し、重合反応の反応速度を低下させる場合があるためである。溶媒等の重合反応に関与しない化合物の存在下で反応を行う場合に用いることができる当該重合反応に関与しない化合物としては、含窒素モノマー(1)の光開裂を阻害するラジカルスカベンジャーや、重合反応自体を阻害する連鎖移動剤などでなければどのようなものであってもよく、例えば、ベンゼン、トルエンなどの無極性溶媒を挙げることができる。このような重合反応に影響を与えないものを溶媒として用いた場合、反応液全体の粘度が低下するため撹拌効率を向上させることが可能であり、また、反応終了後、目的とする含窒素ポリマー(1)の回収が容易になる。
【0041】
溶媒等の重合反応に関与しない化合物を用いる場合、その使用量は反応液中の含有量として20重量%以下であることが好ましい。なお、溶媒等の重合反応に関与しない化合物の存在下で反応を行う場合には、重合収率や得られる含窒素ポリマー(1)の分子量が低下する場合があるため、製造プロセスの生産能力や製造目的などに応じて、用いる化合物の種類や使用量を適宜選択することが重要である。
ただし、反応後、溶媒などの重合反応に関与しない化合物を除去する工程などを考慮すると、該化合物を用いずに反応を行うことが好ましい。なお、この重合反応においては、含窒素モノマー(1)が、モノマーとしての役割だけでなく、重合開始剤としての役割も担っている。従って、後述の含窒素ポリマー(2)の製造で用いられるイニファターやAIBNなどの重合開始剤を別途用いることなく、複雑な枝葉の多い構造の高分子を容易に合成することができる。
【0042】
前記溶媒を用いる場合、反応液に含まれる含窒素モノマー(1)の濃度は、80重量%以上、特に90重量%以上であることが好ましい。
【0043】
なお、含窒素ポリマー(1)は、1種の含窒素モノマー(1)に由来する構造単位からなるものであってもよく、2種の含窒素モノマー(1)に由来する構造単位からなってもよく、さらには、含窒素モノマー(1)に由来する構造単位と含窒素モノマー(1)以外のモノマーに由来する構造単位を含むものであってもよい。含窒素モノマー(1)以外のモノマーに由来する構造単位を含む含窒素ポリマー(1)は、含窒素モノマー(1)と含窒素モノマー(1)以外のモノマーとを含む反応液に対して光照射を行うことにより製造することができるが、この場合においても、含窒素モノマー(1)の濃度が80重量%以上になるように反応液を調製することが好ましい。
【0044】
反応液に対して照射する光としては、単色光であっても、混合光であってもよいが、本発明者らが、照射光の波長と重合反応性との関係について検討を重ねたところ、特定の波長の光を照射することにより前記含窒素モノマー(1)を効率的に重合させることができることを見出した。即ち、390nmを超える長波長の光を照射した場合には、反応が進行しなかったり、反応速度が極端に低下するため生産効率が低くなる。これは390nmを超える長波長の光が、前記含窒素モノマー(1)の側鎖のラジカル解裂を効率よく起こすだけのエネルギーを有していないか、前記光のエネルギーが量子化された励起バンドと大きく異なるなどの理由が考えられる。また、290nm未満の短波長の光を照射した場合にも、含窒素ポリマー(1)がほとんど生成しない。これは、含窒素モノマー(1)分子が290nm未満のUVを吸収する性質を有しており、照射光が反応液内に十分に到達せず、重合反応に寄与する側鎖の光開裂が起こらないためであると考えられる。従って、反応液に対して照射する光の波長は、290〜390nm程度、特に300〜380nm程度、とりわけ310nm〜370nmが好適であり、例えばショートアークキセノンランプ、低圧水銀灯、高圧水銀灯、ブラックライトなどを用いることができ、ガラス板や分光フィルターの併用などで波長を選択することも可能である。光の照射強度としては、反応容器のスケールや、照射強度に依存するが0.01〜50.0mW/cm2程度、特に0.1〜10.0mW/cm2程度好ましい。照射強度が高いと、反応を制御しにくくなるおそれがあるため好ましくない。また、照射強度が低いと、重合時間が徒に長くなるため効率的ではない。
【0045】
光の照射時間としては、反応容器のスケールや照射強度に依存するが10秒〜1440分、特に1分〜360分、とりわけ3〜60分程度が好ましい。即ち、上述のような製造方法であれば、このような短時間の光照射でも、含窒素ポリマー(1)を容易に製造することができる。
【0046】
この光照射により、反応液中に目的とする含窒素ポリマー(1)が生成するので、必要に応じ精製することにより、本発明の含窒素ポリマー(1)を得ることができる。
【0047】
含窒素モノマー(1)を重合してなる含窒素ポリマー(1)は、含窒素モノマー(1)のpKaの値が中性であり、加水分解されにくいという性質、及び温度の変化により化合物の性質が変化(特に、N,N−ジメチルアミノエチルメタクリレートなどで確認されている温度変化によって脱溶媒和してグロビュール化するなどの変化)しにくいという性質を備えている。従って、この含窒素モノマー(1)を重合してなる含窒素ポリマー(1)は、血清中のアニオン性タンパクや脂質などの成分との相互作用が低く、実際に細胞へ遺伝子導入する際に血清や血液の影響を受けにくいという特長を有する。
【0048】
含窒素ポリマー(1)の分子量としては、30,000〜5,000,000程度、特に100,000〜1,000,000程度が好ましい。この分子量は、前記光照射の時間、及び反応液に含まれる含窒素モノマー(1)の濃度を制御することにより調整することができる。即ち、照射時間を長くすることにより、重合反応を進行させて分子量の大きい含窒素ポリマー(1)を得ることができる。また、この他にも光開裂反応の量子化エネルギーバンドの存在を考慮すれば、照射する光の波長を選択することでも反応を制御できる可能性があると推測される。
含窒素ポリマー(1)は、分子量が100万以上の超高分子量体となってもゲル化することがなく水に易溶であるので、取り扱い性に優れる。
【0049】
なお、本明細書において、含窒素ポリマーの分子量とは、GPC(ゲルパーミエーションクロマトグラフィー)によるポリエチレングリコール換算の数平均分子量をさす。
【0050】
前述の如く、含窒素ポリマー(1)は、2−N,N−ジメチルアミノエチルメタクリルアミド又は3−N,N−ジメチルアミノプロピルアクリルアミドのみを重合してなるものであってもよいが、2−N,N−ジメチルアミノエチルメタクリルアミド及び3−N,N−ジメチルアミノプロピルアクリルアミドを重合してなるものであってもよく、さらには、これら含窒素モノマー(1)以外のモノマーに由来する構造単位を含むように構成してもよい。このように複数のモノマーからなる含窒素ポリマー(1)は、前述の如く、含窒素モノマー(1)と含窒素モノマー(1)以外のモノマーとからなる反応液に対して光照射を行うことにより製造することができるが、この場合においても、反応液に含まれる含窒素モノマー(1)が80重量%以上になるように調製することが好ましい。
【0051】
この場合の他のモノマーとしては、アクリル酸誘導体、スチレン誘導体等のビニル系モノマーが好適であり、具体的には、N,N−ジメチルアクリルアミド、2−メトキシエチル(メタ)アクリレート、N-ジメチルアミノスチレン、及び4−アミノスチレンの誘導体からなる群から選択される少なくとも1種のビニル系モノマーが挙げられる。これらのビニル系モノマーは1種を単独で用いてもよく、2種以上を混合して用いてもよい。
【0052】
一方、前記含窒素ポリマー(2)を製造する方法も特に制限はないが、好ましくは、N,N−ジ置換ジチオカルバミルメチル基を3個以上有するベンゼン化合物をイニファターとし、このイニファターに少なくとも2−N,N−ジメチルアミノエチルメタクリルアミド、2−N,N−ジメチルアミノエチルメタクリレート及び3−N,N−ジメチルアミノプロピルアクリルアミドの1種又は2種以上の含窒素モノマー(以下「含窒素モノマー(2)」と称す場合がある。)を光照射リビング重合により重合させることにより製造することができる。
【0053】
なお、本明細書において、イニファターとは、光照射によりラジカルを発生させる重合開始剤、連鎖移動剤としての機能と共に、成長末端と結合して成長を停止する機能、さらに光照射が停止すると重合を停止させる重合開始・重合停止剤として機能する分子のことである。
【0054】
イニファターとなるN,N−ジ置換ジチオカルバミルメチル基を同一分子内に3個以上有するベンゼン化合物としては、ベンゼン環にN,N−ジ置換ジチオカルバミルメチル基、好ましくはN,N−ジアルキルジチオカルバミルメチル基が3個以上分岐鎖として結合しているものが好適であり、具体的には次が例示される。
即ち、3分岐鎖ベンゼン化合物としては、1,3,5−トリ(ブロモメチル)ベンゼンとN,N−ジアルキルジチオカルバミン酸ナトリウム(ナトリウムN,N−ジアルキルジチオカルバメート)とをエタノール中で付加反応させて得られる1,3,5−トリ(N,N−ジアルキルジチオカルバミルメチル)ベンゼンであり、4分岐鎖ベンゼン化合物としては、1,2,4,5−テトラキス(ブロモメチル)ベンゼンとN,N−ジアルキルジチオカルバミン酸ナトリウム(ナトリウムN,N−ジアルキルジチオカルバメート)とをエタノール中で付加反応させて得られる1,2,4,5−テトラキス(N,N−ジアルキルジチオカルバミルメチル)ベンゼンであり、6分岐鎖ベンゼン化合物としては、ヘキサキス(ブロモメチル)ベンゼンとN,N−ジアルキルジチオカルバミン酸ナトリウム(ナトリウムN,N−ジアルキルジチオカルバメート)とをエタノール中で付加反応させて得られるヘキサキス(N,N−ジアルキルジチオカルバミルメチル)ベンゼンが挙げられる。なお、ここで、N,N−ジアルキルジチオカルバミルメチル基に含まれるジアルキル部分のアルキル基としては、エチル基等の炭素数2〜18個のアルキル基が好ましいが、アルキル基に限らず、フェニル基など芳香族系の炭化水素基であっても構わない。即ち、N,N−ジアルキルジチオカルバミルメチル基に限らず、N,N−ジアリールジチオカルバミルメチル基等を含む、脂肪族炭化水素基及び/又は芳香族炭化水素基で置換されたN,N−ジ置換ジチオカルバミルメチル基であれば目的を達成することができる。
【0055】
上記のイニファターは、アルコール等の極性溶媒に対しては殆ど不溶であるが、非極性溶媒には易溶である。この非極性溶媒としては炭化水素、ハロゲン化アルキル又はハロゲン化アルキレンが好適であり、特に、ベンゼン、トルエン、クロロホルム又は塩化メチレン、特にトルエンが好適である。
【0056】
上記イニファターと含窒素モノマー(2)とを反応させるには、イニファターと含窒素モノマー(2)を含んでなる原料溶液を調製し、これに光照射することが好ましく、これにより、イニファターに対し、含窒素モノマー(2)が重合又は共重合した分岐鎖を導入することができる。
【0057】
該原料溶液中の含窒素モノマー(2)の濃度は0.05M以上、例えば0.05M〜2.5Mが好適であり、イニファターの濃度は0.5〜20mM程度が好適である。
【0058】
照射する光の波長は360〜390nm程度が好適であり、例えばショートアークキセノンランプ、低圧水銀灯、高圧水銀灯などを用いてガラス板や分光フィルターを併用することによって好適な波長を選択的に照射することができ、光の照射強度としては、0.5mW/cm2以下が好ましく、特に0.03〜0.3mW/cm2程度が好ましい。照射強度を高くすると、副反応を生じさせる330〜350nm程度の影響が大きくなるため好ましくない。また、照射強度が低いと、重合時間を著しく長くする必要があるため、効率的ではない。
【0059】
光の照射時間としては、5時間以上で、用いた光の照射強度、目的とする含窒素モノマー(2)の重合度(含窒素ポリマー(2)の分子量)に応じて適宜設定されるが、通常、10〜500時間、特に24〜168時間程度が好ましい。照射強度を低く設定した場合は、重合反応が緩やかに進行するため照射時間を長めに設定することが好ましいが、照射時間が徒に長いと、製造効率が低下する。
【0060】
この光照射により、反応液中に目的とする分岐鎖を有する分岐型重合体よりなる含窒素ポリマー(2)が生成するので、必要に応じ精製することにより、分岐鎖部分に含窒素モノマー(2)に由来する構造単位よりなるポリマー鎖が導入され、分岐鎖の末端がN,N−ジ置換ジチオカルバミルメチル基であるホモポリマーを得る。
【0061】
このような分岐型重合体である含窒素ポリマー(2)の分岐鎖の1本当たりの分子量としては、1,500〜150,000程度、特に3,000〜100,000程度が好ましく、含窒素ポリマー(2)の分子量としては、分岐鎖の鎖数にもよるが、10,000〜10,000,000程度、特に150,000〜600,000程度が好ましい。含窒素ポリマー(2)の分子量が小さいと、効率的に遺伝子を導入することができず、分子量が大きすぎると、生体内において異物として認識されるおそれがある。この分子量は、光照射の時間を制御することにより調整することができる。即ち、照射時間を長くすることにより、重合反応を進行させて分子量の大きい含窒素ポリマー(2)を得ることができる。
【0062】
なお、本明細書において、含窒素ポリマーの分子量とは、前述の如く、GPC(ゲルパーミエーションクロマトグラフィー)によるポリエチレングリコール換算の数平均分子量をさす。
【0063】
含窒素ポリマー(2)の分岐鎖は、含窒素モノマー(2)のみからなるポリマー鎖であることが好ましいが、含窒素モノマー(2)と含窒素モノマー(2)とは異なる1種以上のモノマーを導入したブロックコポリマー鎖又はランダムコポリマー鎖であってもよい。
【0064】
この場合の他のモノマーとしては、アクリル酸誘導体、スチレン誘導体等のビニル系モノマーが好適であり、具体的には、N,N−ジメチルアクリルアミド、メトキシエチル(メタ)アクリレート、4−N,N-ジメチルアミノスチレン、及び4−アミノスチレンの誘導体からなる群から選択される少なくとも1種のビニル系モノマーが挙げられる。これらのビニル系モノマーは1種を単独で用いてもよく、2種以上を混合して用いてもよい。
【0065】
<核酸>
核酸は、細胞に導入されることによりその細胞内で機能を発現することができるような形態で用いる。例えばDNAの場合、導入された細胞内で当該DNAが転写され、それにコードされるポリペプチドの産生を経て機能発現されるように当該DNAが配置されたプラスミドとして用いる。好ましくは、プロモーター領域、開始コドン、所望の機能を有する蛋白質をコードするDNA、終止コドンおよびターミネーター領域が連続的に配列されている。
【0066】
所望により2種以上の核酸をひとつのプラスミドに含めることも可能である。
【0067】
この核酸としては、デオキシリボ核酸(DNA)及びリボ核酸(RNA)のようなポリヌクレオチド特にDNAが好適であるが、リボ核タンパク質であってもよい。
【0068】
本発明で用いる核酸の好ましい例としては、次のようなものが挙げられる。
単純ヘルペスウイルスチミジンキナーゼ遺伝子(HSV1−TK遺伝子)、p53癌抑制遺伝子及びBRCA1癌抑制遺伝子やサイトカイン遺伝子としてTNF−α遺伝子、IL−2遺伝子、IL−4遺伝子、HLA−B7/IL−2遺伝子、HLA−B7/B2M遺伝子、IL−7遺伝子、GM−CSF遺伝子、IFN−γ遺伝子及びIL−12遺伝子などのサイトカイン遺伝子並びにgp−100、MART−1及びMAGE−1などの癌抗原ペプチド遺伝子が癌治療に利用できる。
【0069】
また、VEGF遺伝子、HGF遺伝子及びFGF遺伝子などのサイトカイン遺伝子並びにc−mycアンチセンス、c−mybアンチセンス、cdc2キナーゼアンチセンス、PCNAアンチセンス,E2Fデコイやp21(sdi−1)遺伝子が血管治療に利用できる。かかる一連の遺伝子は当業者には良く知られたものである。
【0070】
また、アンチセンスによるリプレッシングの他に、21〜23塩基の二本鎖RNAを使用したRNA干渉によるmRNA破壊などに利用することも可能である。
【0071】
<細胞破砕物>
細胞破砕物(cell lysate)は、哺乳類細胞を培養して死滅又は生きた状態で破砕して得ることができる。
【0072】
ここで用いる細胞としては、接着細胞でも浮遊細胞でも使用可能であり、初代細胞のように株化も樹立もされていない細胞でも樹立細胞でも良い。また、初代細胞の場合は、由来の組織や臓器は不問であり、ソーティングなどの分離処理を行なったホモ細胞でもヘテロ細胞でも良い。樹立細胞の例としては、293細胞(ヒト胎児腎細胞へアデノウイルスのE1遺伝子を導入したトランスフォーマント)やCOS細胞などSV−40で形質転換されたことでLarge−T抗原を発現している細胞由来のものや、その他、当業者に良く知られるCHO、NIH3T3、RBL、A9、SN10、MB66MCA、GM637、REV2、P3XX63−AG−8、FM3A、HepG、Hela、Jurkat、K562、THP−1、PC12なども使用可能である。
これらの樹立細胞は1種を単独で用いてもよく、2種以上を併用してもよい。
【0073】
また、遺伝子導入を行う細胞と破砕組成物を調製するための細胞(破砕する細胞)は異なっていても同一でも良く、細胞の由来動物種や由来臓器などを同一又は近縁のものを使用したり、あえて異種動物種の細胞を使用することも可能である。
例えば、
(1) ヒト血管内皮細胞への遺伝子導入にイヌ血管内皮細胞の破砕物を使用するような細胞種が同一であるケース
(2) Hela細胞(ヒト子宮頚部癌細胞)に293細胞(ヒト胎児腎細胞)の破砕物を使用するような由来動物種が同一であるケース
(3) ヤギ心筋線維芽細胞(ヤギ心臓)への遺伝子導入に293細胞(ヒト腎臓)の破砕物を使用するような細胞種も動物種も異なるケース
(4) イヌ血管内皮細胞への遺伝子導入にイヌ血管内皮細胞の破砕物を使用するような細胞種も動物種も同一であるケース
など組合せは種々存在する。
【0074】
また、細胞破砕物の調製に使用する細胞はアデノウイルスに感染したものであっても良い。ただし、アデノウイルスに感染させた細胞と、感染させていない細胞とで、遺伝子導入活性は、細胞の種類毎に異なるため、細胞毎にアデノウイルスの感染の有無を使い分けることが好ましい。また、アデノウイルスに感染していない細胞を用いる方が、前述のウイルスベクターに付随する欠点がないことから好ましい。
【0075】
これらの細胞の破砕方法としては特に制限はなく、例えば、超音波処理や、凍結融解(例えば−70℃凍結と37℃加温融解の繰り返し)などにより破砕することができる。その他、ホモジナイザーによる破砕、ガラスビーズによる破砕、界面活性剤を用いる方法などを採用することもできる。
【0076】
また、哺乳類細胞は、破砕に先立ち、培養した細胞を洗浄してもよく、この洗浄方法としては、例えば、遠心分離で培地を除去した後、等張液や緩衝溶液などを加えて遠心分離して細胞浮遊液とする方法が挙げられる。
【0077】
細胞破砕処理後は、遠心分離や濾過の工程を経て固形物(不溶性成分)を除去することが好ましく、この場合、濾過には10.0〜0.22μm程度の孔径のフィルターを用いることが好ましい。フィルターの材質としてはタンパクの吸着性が高いニトロセルロース膜やナイロン膜よりも酢酸セルロース膜やPTFE(ポリテトラフルオロエチレン)膜、PDVF(ポリフッ化ビニリデン)膜が好適である。また、遠心分離の際には比重液を併用した遠心分離処理で成分の分画や選択などを行なうことも可能である。
細胞破砕物は更に高圧蒸気滅菌、放射線滅菌(ガンマ線滅菌、電子線滅菌など)、濾過滅菌などを行なっても良い。
【0078】
このようにして細胞を破砕して得られる細胞破砕物は、通常、水、生理食塩水等の水系溶媒、或いは、アルコール等の溶媒中に細胞破砕物を含む細胞破砕物含有液として得られる。この細胞破砕物含有液中の細胞破砕物含有量は、総タンパク濃度として0.001mg/L〜20,000mg/L程度、特に0.01mg/L〜2,000mg/L程度であることが好ましい。ここで、総タンパク濃度は当業者に周知のBradfold法、Coomassie Bule法、ビシンコニン酸法、Lowry法などの方法で定量が可能である。この細胞破砕物含有液の総タンパク濃度が高過ぎると前述の含窒素ポリマーと核酸とを複合化させて得た核酸複合体(一次核酸複合体)の微粒子に多量のタンパクが吸着することで表面の性質が変化し、微粒子同士の会合や凝集を惹起したり、微粒子のデコンデンス(一次核酸複合体粒子にアニオン性物質が作用し、ポリアニオンである核酸との交換作用で微粒子が解離して核酸が露出する現象)する可能性があり、低過ぎると一次核酸複合体の微粒子が溶液中で安定に分散し、細胞破砕物の吸着などの相互作用が得らず(元々、核酸複合体は溶液中の酵素など種々のタンパク成分の作用から核酸を保護するために形成させている)、本発明の効果を得ることができない。
【0079】
<遺伝子導入剤組成物の調製方法>
本発明の遺伝子導入剤組成物を製造するには、まず、前述の含窒素ポリマーと核酸とを複合化させて核酸複合体(一次核酸複合体)とし、この一次核酸複合体と細胞破砕物を混合して二次核酸複合体を形成させることが好ましい。
【0080】
含窒素ポリマーと核酸とを複合させるには、含窒素ポリマーの濃度0.1〜1000μg/mL程度の溶液に対し、核酸を添加して混合すればよい。この際、核酸に対して含窒素ポリマーを過剰量添加し、核酸に対して含窒素ポリマーを飽和状態にして含窒素ポリマーと核酸とを複合化させることが好ましい。
【0081】
このようにして得られる一次核酸複合体のN/P比(含窒素ポリマーのアミノ基由来の窒素原子と核酸中のリン原子とのモル比)は、5〜15程度であることが好ましい。即ち、従来の含窒素ポリマーを遺伝子導入剤とする場合、N/P比30以上で高い遺伝子導入活性を示し、50程度で最も高い遺伝子導入活性が得られるが、本発明では、このN/P比が5〜15程度で最大の遺伝子導入活性を得ることができる。このように小さいN/P比で高い遺伝子導入活性が得られること、即ち、核酸に対する含窒素ポリマー量の割合を小さくすることができることは、遺伝子導入効率の面で好ましい。
【0082】
なお、電気的に中性に近い2−N,N−ジメチルアミノエチルメタクリルアミドを重合してなる含窒素ポリマー以外のカチオン性の含窒素モノマーを重合してなる含窒素ポリマーを用いた一次核酸複合体にあっては、上述の一次核酸複合体のN/P比は、C/A比(含窒素ポリマーのカチオン当量/核酸のアニオン当量)に等しい。
【0083】
また、この一次核酸複合体の粒子径は通常、50〜400nm程度である。一次核酸複合体の粒子径が小さ過ぎると、一次核酸複合体内部の核酸にまで酵素の作用が及ぶおそれ、あるいは腎臓にて濾過排出されるおそれがある。また、一次核酸複合体の粒子径が大き過ぎると細胞に導入されにくくなるおそれがある。
【0084】
ところで、核酸複合体の粒子径については、200nm以上であると細胞内に取り込まれにくいとされ、エンドサイトーシスによる遺伝子導入に最適な粒子径は約50nmのウィルスサイズであるとの報告(遺伝子・デリバリー研究会 第4回シンポジウム(2004年5月10日)「糖クラスター被覆量子ドットの合成と細胞導入〜エンドサイトーシスにおけるサイズの効果〜(大崎史雄 他)」)がなされているが、本発明の遺伝子導入剤組成物では、180〜300nm程度の比較的大きな粒子径の一次核酸複合体であっても細胞への遺伝子導入が可能である。このように大きな粒子径の一次核酸複合体で遺伝子導入を行えることは、一次核酸複合体と細胞との接触頻度が高くなることから、遺伝子導入効率の面で好ましい。
【0085】
なお、一次核酸複合体の粒子径は、例えばレーザーを用いた動的光散乱法によって測定される。
【0086】
含窒素ポリマーと核酸とを混合して一次核酸複合体を形成させた後は、この一次核酸複合体に前述の細胞破砕物含有液を添加して混合することにより本発明の遺伝子導入剤組成物を調製する。一次核酸複合体と細胞破砕物との混合割合には特に制限はなく、用いた含窒素ポリマーや核酸、細胞破砕物の種類などに応じて、高い遺伝子導入活性が得られるような割合に適宜調整される。添加された細胞破砕物は、一次核酸複合体に吸着ないし近接して二次核酸複合体を形成する。この二次核酸複合体は、形成させてから細胞へ遺伝子導入するまでの時間(通常の研究では10分間から数時間)、水等の液中で安定な分散状態を維持する。この二次核酸複合体の粒子径は通常一次核酸複合体の粒子径とほぼ同等である。
【0087】
[遺伝子導入方法]
本発明の遺伝子導入剤組成物を用いて、細胞に遺伝子を導入するには、好ましくは、上述のようにして調製された遺伝子導入剤組成物をその細胞に適した条件のもとで接触させれば良い。例えばIn
Vitro系で培養細胞へ遺伝子導入する場合は、その細胞に合わせて当業者によって適宜選択された完全培地(例えば10%のウシ胎児血清を含むDMEM培地)へあらかじめ適切な量の二次核酸複合体の分散液を混合しておき、そのまま培地交換を行ない、さらにそのまま培養を行えば良い。つまり、本発明の遺伝子導入剤組成物では、細胞を培養している時とほぼ同等の状態で遺伝子導入が行えるため、細胞への負荷が少なくてすむという特長を有する。即ち、従来の遺伝子導入剤は、遺伝子導入する直前に細胞をPBS洗浄して血清成分を除去したり遺伝子導入の際の数時間を無血清培地と交換することが必要な場合が多く、更に、その数時間後には再度のPBS洗浄や培地交換が必要であったので、これらの操作自体が細胞へ大きな負荷をかけるだけでなく培養ディッシュへの細菌、カビのコンタミの危険性も高く、作業者にとっても大きな労力を要するものであったが、本発明においては、このような問題が解消ないしは改善される。
【0088】
本発明において、核酸を導入する対象として望ましい「細胞」としては、当該核酸の機能発現が求められるものであり、このような細胞としては、例えば使用する核酸(すなわちその機能)に応じて種々選択され、例えばES細胞、iPS細胞、造血幹細胞、脂肪幹細胞、心筋細胞、平滑筋細胞、繊維芽細胞、骨格筋細胞、血管内皮細胞、骨髄細胞、骨細胞、血球幹細胞、血球細胞等が挙げられる。また、単球、樹状細胞、マクロファージ、組織球、クッパー細胞、破骨細胞、滑膜A細胞、小膠細胞、ランゲルハンス細胞、類上皮細胞、多核巨細胞等、消化管上皮細胞・尿細管上皮細胞などである。なお、これら細胞は分化の程度は問わず、ヘテロ細胞でもホモ細胞でも良く、さらに、株化や樹立された細胞でも初代細胞でも良い。
【0089】
本発明の遺伝子導入剤組成物は培養試験に用いるほか、任意の方法で生体に投与することができる。
【0090】
生体への投与方法としては静脈内又は動脈内への注入が特に好ましいが、筋肉内、脂肪組織内、皮下、皮内、リンパ管内、リンパ節内、体腔(心膜腔、胸腔、腹腔、脳脊髄腔等)内、骨髄内への投与の他に病変組織内に直接投与することも可能である。
【0091】
この遺伝子導入剤組成物を有効成分とする医薬は、更に必要に応じて製剤上許容し得る担体(浸透圧調整剤、安定化剤、保存剤、可溶化剤、pH調整剤、増粘剤等)と混合することが可能である。これら担体は公知のものが使用できる。
【0092】
また、この遺伝子導入剤組成物を有効成分とする医薬は、含まれる核酸の種類が異なる2種以上の核酸を含有する遺伝子導入剤組成物を含むものも包含される。このような複数の治療目的を併せ持つ医薬は、多様化する遺伝子治療の分野で特に有用である。
【0093】
投与量としては、動物、特にヒトに投与される用量は目的の核酸、投与方法および治療される特定部位等、種々の要因によって変化する。しかしながら、その投与量は治療的応答をもたらすに十分であるべきである。
【0094】
この遺伝子導入剤組成物は、好ましくは遺伝子治療に適用される。適用可能な疾患としては、当該遺伝子導入剤組成物に含有水される核酸の種類によって異なるが、末梢動脈疾患、冠動脈疾患、動脈拡張術後再狭窄等の病変を生じる循環器領域での疾患に加え、癌(悪性黒色腫、脳腫瘍、転移性悪性腫瘍、乳癌等)、感染症(HIV等)、単一遺伝病(嚢胞性線維症、慢性肉芽腫、α1−アンチトリプシン欠損症、Gaucher病等)等が挙げられる。
【実施例】
【0095】
以下に実施例及び比較例を挙げて本発明をより具体的に説明する。
【0096】
[実施例1]
(i) 含窒素ポリマー(1)(2−N,N−ジメチルアミノエチルメタクリルアミド重合体)の合成
暗室で、2−N,N−ジメチルアミノエチルメタクリルアミド5.0グラムを10mL容の軟質ガラスバイアル瓶に採取し、高純度窒素ガスを10分間パージ(流量:2リットル/分)した後、密栓して激しく攪拌しながら光照射した。光照射には、東芝製ブラックライト丸管型蛍光灯20型を使用し、軟質ガラスバイアル瓶を丸管型蛍光灯の中央へ配置することで全周方向からバイアル瓶内に均質に光(波長375nm、照射強度4mW/cm2)を照射できるようにした。15分間の光照射でモノマーはガラス状に固化した。5mLの水を入れて固化物を溶解させ、透析チューブへ入れて18Lの水で24時間透析した。透析を5回繰り返した後、固化物の水溶液を凍結乾燥させて2−N,N−ジメチルアミノエチルメタクリルアミドの重合体(含窒素ポリマー(1))を得た(収率:5.9%)
【0097】
GPCによるポリエチレングリコールを標準物質とした2−N,N−ジメチルアミノエチルメタクリルアミド重合体の数平均分子量は、98,400(Mw/Mn=2.40)であった。
1H−NMR(in chloroform-d1):δ0.8-1.1ppm(br,3H,-CH3,m/r=1/2),δ1.7-2.1ppm(br,2H,-CH2-CH3-),δ2.2-2.3ppm(br,6H,N-CH3),δ2.5-2.6ppm(br,2H,CH2-N),δ4.0-4.12ppm(br,2H,CON-CH2)
【0098】
(ii) 細胞破砕物(COS−1細胞破砕物)の調製
10%FCS添加DMEM培地でCOS−1細胞を培養した。培養2日後、90%コンフェルトの状態で培地を除去し、EDTAを添加したトリプシンを加えて培養皿から剥がし、完全培地でトリプシンを失活させた後に遠心分離で培地を除去した。PBSに分散させてから遠心分離と上澄み除去により細胞を洗浄した。回収した細胞を生理食塩水へ分散させて細胞浮遊液を調製した。液中の生細胞の密度はビルケルチルク血算板により60万個/mLと測定された。細胞の生死はトリパンブルー排泄で判定した。この細胞浮遊液を1時間の−70℃凍結と30分の37℃融解を6回繰り返して破砕した。
その後、細胞浮遊液を3,000rpm、10分間の遠心分離を行って不溶性成分を除去し、0.2μmフィルターで濾過することにより細胞破砕物含有液を得た。このものの総タンパク濃度は20μg/mLであった。
【0099】
(iii) 一次核酸複合体の形成
上記(i)で得た含窒素ポリマー(1)とDNAを用いて一次核酸複合体粒子を形成した。含窒素ポリマー(1)の単位重量あたりのポリマー側鎖3級アミンの数は、含窒素ポリマー(1)の含窒素モノマー(2−N,N−ジメチルアミノエチルメタクリルアミド)単位の分子量156から計算により求めた(1モノマー単位に1個の3級アミンが存在する)。また、DNA中の単位重量あたりの陰電荷数は配列MAPによる塩基対数と核酸塩基の平均的分子量660とから計算した。
上記(i)で得た含窒素ポリマー(1)をDNAと150μLのTE緩衝溶液中で混合して30分間インキュベートした。混合比は含窒素ポリマー(1)の側鎖の3級アミンの数とDNA中の陰電荷数の関係が、3級アミン数が陰電荷数の10倍となるように(N/P比=10)調整し、混合溶液150μLで0.5μgのDNAが各Wellへ投与されるように溶液の終濃度を調整した。
動的光散乱法(シスメックス社、ゼーターサイザー・ナノ)により測定した一次核酸複合体粒子の粒子径はポリスチレン材として180nm〜220nmであった。
【0100】
(iv) 遺伝子導入実験
遺伝子を導入する細胞には、犠牲死させたイヌ大動脈血管の内壁から採取し、形態観察と免疫染色によりホモ細胞であることを確認してから継代回数が3回未満の血管内皮細胞を使用した。血管内皮細胞は細胞数を4万個/mLに調整して、24Well培養皿へ播種し、培養24時間後に遺伝子導入を行った。
上記(iii)で得られた一次核酸複合体溶液150μLに、上記(ii)で得た細胞破砕物含有液を70μL混合して二次核酸複合体を形成させてから、10%FCS添加DMEM培地6mLに加えて混合し、5分間インキュベートしてから上記培養細胞の各Wellへ1mLづつ合計6Wellへ加え、そのまま48時間培養を行った。48時間後にルシフェラーゼアッセイキットにより遺伝子導入活性の評価を行った。補正は総タンパク濃度で行い、総タンパク定量はBiO Rad社のBradford試薬で行った。
導入結果を図1に示す。
【0101】
[比較例1]
実施例1における遺伝子導入実験において、一次核酸複合体溶液150μLに、細胞破砕物含有液70μLの代りに生理食塩水70μLを混合したこと以外は同様にして遺伝子導入活性の評価を行い、結果を図1に示した。
【0102】
図1より、核酸と合成高分子ベクターとで形成した核酸複合体(本発明に係る一次核酸複合体)に細胞破砕物を混合することにより、この一次核酸複合体のみでは殆ど不可能であった血管内皮細胞への遺伝子導入が可能となることが分かる。
【技術分野】
【0001】
本発明は、含窒素ポリマーと核酸とから形成された核酸複合体に、細胞破砕物を付与してなる新規遺伝子導入剤組成物及びその製造方法に関する。
【背景技術】
【0002】
近年、ヒト疾患の分子遺伝学的要因が明らかになるにつれ、遺伝子治療研究がますます重要視されている。遺伝子治療法は標的とする部位でのDNAの発現や宿主細胞DNAの発現抑制を目的としており、いかにDNAやRNA(siRNA、miRNAなど)を標的部位に到達させるか、いかにDNAやRNAを標的部位に効率的に導入し、当該部位で機能的に発現や発現抑制させるかということが重要となる。
【0003】
遺伝子導入技術には大きく分けてウイルスベクターと非ウイルスベクターとの2つが存在する。
ウイルスベクターによる遺伝子導入は、アデノウイルス、アデノ付随ウイルス、センダイウイルス、レトロウイルスなどを改変(野生型ウイルスを無毒化し、目的の核酸を挿入して作成)し、細胞へ作用させることで外来遺伝子を細胞へ導入する技術であり、当業者の間で広く行われている。
非ウイルスベクターは高分子ポリマーやカチオン性脂質と核酸で形成させた複合体を細胞へ取り込ませる食作用(エンドサイトーシス)を利用したものが多く、他にはエレクトロポレーションや金コロイド銃など機械的に細胞膜を突き破って核酸を挿入する技術もある。
【0004】
非ウイルスベクターに関して、本発明者らは、ベンゼン環から放射状にポリマー鎖が伸延するスター型ポリマーによる遺伝子導入技術を開発し、多くの提案を行ってきた(例えば、特許文献1〜3)。該スター型ポリマーベクターはベンゼン環に結合する直鎖状ポリマー鎖の本数に依存して遺伝子導入活性が向上し、最大で6本のポリマー鎖を有するスター型ポリマーが最も遺伝子導入活性の高いものとなる。
【0005】
また、同じモノマーの重合物であっても、該スター型ポリマーには、例えば、高CA比(ベクターの陽電荷数とDNAの陰電荷数の比)でも細胞毒性を発現することなく遺伝子導入が可能である;スター型ポリマーに核酸を複合化させてなる核酸複合体の粒子径が大きくても(即ち、通常、粒子径が小さいほど細胞膜の透過に有利とされているが、スター型ポリマーは200μm〜300μm、直鎖状ポリマーでは100μmほどであり、粒子径の面ではスター型ポリマーは不利であると考えられるが)、細胞膜透過性が高い;などといった、直鎖状ポリマーにはない特長を有する。
【0006】
一方で、本発明者らは、特定の含窒素モノマーが光照射により開裂し、ラジカルを生成し、このラジカルを利用して分岐型重合体を速やかに生成すること、この分岐型重合体が血清を含む培地においても優れた遺伝子導入活性を示すことを見出した(特許文献4)。
この特許文献4に開示される技術によれば、特定の含窒素モノマーを主成分とする反応液に対して光を照射することにより、この含窒素モノマーが光照射によりラジカルを生成するという性質を利用して、イニファターや、重合開始剤を用いることなく、また、複数の反応工程を経ることなく、複雑な構造を有する分岐型重合体を短時間で安価に得ることができ、しかも得られた分岐型重合体は、これを構成する当該含窒素モノマーの加水分解されにくいという性質、及び温度の変化により化合物の性質が変化しにくいという性質、さらに、一部の含窒素モノマーはpKaの値が中性を示し、血清を含む培地においてアニオン性のタンパクの影響を受けにくいという性質により、細胞に対して効率的に遺伝子を導入することができ、しかも、分子量が100万程度であってもゲル化せず、水に易溶であるため、遺伝子導入剤として扱いやすいという優れた特長を有する。
【0007】
しかし、ウイルスベクターと比較して、特許文献1〜4で提案されているような高分子ベクターやカチオン性脂質のベクター等の非ウイルスベクターは、遺伝子導入活性が低いという欠点があった。
即ち、通常の高分子ベクターによる核酸複合体は、異物として食作用(エンドサイトーシス)で細胞内に取り込まれているため、小胞体中で分解するものが多く、運搬効率が悪いとされている(非特許文献1)。
特に、造血幹細胞、筋芽細胞、骨芽細胞、ES細胞、iPS細胞などの幹細胞や神経細胞、心筋細胞など食作用の少ない細胞へはほとんど導入ができなかった。
このため、従来、生体(動物)での使用例もウイルスベクターによる研究が主流で、高分子ベクターによる生体内使用は報告がほとんどなされていないのが実状である。これは、株化細胞(試験管での実験用に、容易に培養が可能で継代による細胞の性質の変化がないように処理された細胞)には高分子ベクターも適用が可能であるものの、初代細胞(プライマリーセル:生体組織から分離した直後の細胞)にはほとんど遺伝子導入ができないことによる。
【0008】
これに対して、ウイルスベクターは、その強い感染力を利用して核酸を種々の細胞へ導入できる利点がある一方で、次のような欠点がある。
(1) 新種のウイルスを作成してしまう危険性(例えば、(1)一般にウイルスベクターの作成の前に組換え遺伝子を作成するが、この組換え遺伝子の作成の際に目的遺伝子に突然変異が入ってしまうことやE1領域の消化が十分でなく自己増殖能が残ってしまうなどの危険性や、(2)ウイルスベクターの継代中、ウイルス遺伝子の複製過程でパッケージング細胞のDNAとの相同組換えによってE1領域を取得し、自己増殖能を獲得したウイルスが産生してしまう可能性など)や研究者自身が感染する危険性がある。
(2) −70℃以下の温度で保存しても経時性に力価(タイター)が低下してしまうので、高力価とするために使用前に力価の確認試験や再調製や精製の工程が必要であり、感染力の強いウイルスベクターの調製には多大な時間や労力コストを必要とする。
(3) ウイルス自体にサイズがあるので、物理的に内部へ挿入できる核酸のサイズに限界があり、大きなDNAなどは挿入できない。
(4) ウイルスベクターは細胞膜表面の受容体(例えばCAR(コサッキー・アデノウイルス・レセプター))を介して侵入するため、受容体を持っていない細胞へは使用できない。
(5) 組換え遺伝子実験として承認申請などが必要なケースが多く、企画から実験を行うまでに多大な時間や専用の施設が必要になる。
【先行技術文献】
【特許文献】
【0009】
【特許文献1】WO2004/092388号公報
【特許文献2】特開2007−70579号公報
【特許文献3】特願2009−239496
【特許文献4】特願2010−158853
【非特許文献】
【0010】
【非特許文献1】Hama,S.,Quantitative comparsion of intracellular trafficking,(2006),Mol Ther 13,786−794
【発明の概要】
【発明が解決しようとする課題】
【0011】
上述のように、ウイルスベクターには多くの欠点があるため、非ウイルスベクターについて、その遺伝子導入活性をより一層高め、ウイルスベクターの遺伝子導入活性に近づけることが、遺伝子導入技術の進展に望まれる。
【0012】
本発明は、上記従来の実状に鑑みてなされたものであって、遺伝子導入活性に優れ、従来の非ウイルスベクターでは遺伝子導入が困難であった幹細胞や初代細胞(プライマリーセル:生体組織から分離した直後の細胞)にも遺伝子導入が可能な非ウイルスベクターよりなる遺伝子導入剤組成物を提供することを課題とする。
【課題を解決するための手段】
【0013】
本発明者らは上記課題を解決すべく鋭意検討を重ねた結果、特定の含窒素ポリマーと核酸との複合体に、細胞破砕物を混合して遺伝子導入剤組成物を形成することにより、遺伝子導入活性が飛躍的に向上し、幹細胞や初代細胞への遺伝子導入も可能となることを見出した。
【0014】
本発明はこのような知見に基いて達成されたものであり、以下を要旨とする。
【0015】
[1] 2−N,N−ジメチルアミノエチルメタクリルアミド、2−N,N−ジメチルアミノエチルメタクリレート及び3−N,N−ジメチルアミノプロピルアクリルアミドよりなる群から選ばれる1種又は2種以上の含窒素モノマーに由来する構造単位を含む含窒素ポリマーと核酸とを含む複合体と、細胞破砕物とを混合してなることを特徴とする遺伝子導入剤組成物。
【0016】
[2] [1]において、前記含窒素ポリマーと核酸とを含む複合体のN/P比が5〜15であることを特徴とする遺伝子導入剤組成物。
【0017】
[3] [1]又は[2]において、前記含窒素ポリマーは、前記含窒素モノマーを重合してなることを特徴とする遺伝子導入剤組成物。
【0018】
[4] [3]において、前記含窒素ポリマーは、前記含窒素モノマーのみを重合してなることを特徴とする遺伝子導入剤組成物。
【0019】
[5] [3]又は[4]において、前記含窒素ポリマーの分子量が10,000〜5,000,000であることを特徴とする遺伝子導入剤組成物。
【0020】
[6] [1]又は[2]において、前記含窒素ポリマーは、前記含窒素モノマーに由来する構造単位を含む重合鎖よりなる分岐鎖を有する分岐型重合体であって、該分岐型重合体は、ベンゼン環を核とし、この核から3本以上の前記分岐鎖が伸延していることを特徴とする遺伝子導入剤組成物。
【0021】
[7] [6]において、前記分岐鎖は前記含窒素モノマーに由来する構造単位のみからなることを特徴とする遺伝子導入剤組成物。
【0022】
[8] [6]又は[7]において、1本当たりの前記分岐鎖の分子量が1,500〜150,000であり、前記分岐型重合体の分子量が10,000〜10,000,000であることを特徴とする遺伝子導入剤組成物。
【0023】
[9] 2−N,N−ジメチルアミノエチルメタクリルアミド、2−N,N−ジメチルアミノエチルメタクリレート及び3−N,N−ジメチルアミノプロピルアクリルアミドよりなる群から選ばれる1種又は2種以上の含窒素モノマーに由来する構造単位を含む含窒素ポリマーと核酸とを含む複合体と、細胞破砕物とを混合する工程を有することを特徴とする遺伝子導入剤組成物の製造方法。
【発明の効果】
【0024】
特定の含窒素モノマーから得られる含窒素ポリマーと核酸との複合体(以下、含窒素ポリマーと核酸との核酸複合体を「一次核酸複合体」と称す場合がある。)と細胞破砕物とを混合してなる本発明の遺伝子導入剤組成物によれば、非ウイルスベクターである含窒素ポリマーを用いて、従来の高分子ベクターを用いたものに比べて遺伝子導入活性が著しく高い遺伝子導入剤組成物が提供される。しかも、本発明の遺伝子導入剤組成物であれば、従来の非ウイルスベクターでは遺伝子導入が不可能又は困難であった幹細胞や初代細胞(プライマリーセル:生体組織から分離した直後の細胞)への遺伝子導入も可能となる。
【0025】
本発明の遺伝子導入剤組成物により、従来の核酸複合体を一次核酸複合体として、この一次核酸複合体に細胞破砕物を混合することにより、遺伝子導入活性が飛躍的に向上し、幹細胞や初代細胞への遺伝子導入も可能となる作用機構の詳細は明らかではないが、以下の通り推定される。
即ち、核酸複合体が細胞内へ侵入する際、本発明の遺伝子導入剤組成物では、一次核酸複合体の表面に細胞破砕物由来の成分が吸着ないしは何らかの吸引作用で近接して存在するので、従来の非ウイルスベクターのような食作用(エンドサイトーシス)を利用した遺伝子導入ではなく、受容体を介した取込み作用、所謂、ピノサイトーシスと呼ばれる細胞にとって有用成分として取り込まれるようにして導入されるようになり、この結果、遺伝子導入活性が高められ、また、幹細胞や初代細胞への遺伝子導入も可能となることが考えられる。
また、細胞破砕物のタンパク中に、細胞に導入した核酸の転写を促進する何らかの成分が存在し、この成分により遺伝子導入活性が向上していることも考えられる。
【0026】
本発明に係る一次核酸複合体のN/P比は5〜15程度であることが好ましい(請求項2)。
【0027】
本発明に係る含窒素ポリマーの一態様としては、前記特定の含窒素モノマーを重合してなるもの、好ましくは前記特定の含窒素モノマーのみを重合してなるものが挙げられ、このような含窒素ポリマーの分子量は、10,000〜5,000,000であることが好ましい(請求項3〜5)。
【0028】
また、本発明に係る含窒素ポリマーの他の態様としては、ベンゼン環を核とし、この核から、前記特定の含窒素モノマーに由来する構造単位を含む重合鎖よりなる分岐鎖、好ましくは前記特定の含窒素モノマーに由来する構造単位のみからなる分岐鎖が伸延している分岐型重合体が挙げられ、このような含窒素ポリマーにおいて、1本当たりの分岐鎖の分子量が1,500〜150,000であり、含窒素ポリマーである分岐型重合体の分子量が10,000〜10,000,000であるものが好ましい(請求項6〜8)。
【図面の簡単な説明】
【0029】
【図1】実施例1及び比較例1の遺伝子導入活性の評価結果を示すグラフである。
【発明を実施するための形態】
【0030】
以下に、本発明の実施の形態を詳細に説明する。
【0031】
[遺伝子導入剤組成物]
本発明の遺伝子導入剤組成物は、特定の含窒素モノマーから得られる含窒素ポリマーと核酸との複合体と細胞破砕物とを混合してなるものであり、通常、含窒素ポリマーと核酸とを混合して一次核酸複合体を形成させた後に細胞破砕物を混合し、一次核酸複合体に細胞破砕物を複合させたものとして提供される。
【0032】
なお、本発明の遺伝子導入剤組成物において、含窒素ポリマーと核酸とで形成される一次核酸複合体に対して、細胞破砕物がどのような状態で存在しているかは明らかにされていないが、以下、説明の便宜上、含窒素ポリマーと核酸との一次核酸複合体に細胞破砕物を混合してなるものを「二次核酸複合体」と称す場合がある。
【0033】
<含窒素ポリマー>
本発明に係る含窒素ポリマー(以下「本発明の含窒素ポリマー」と称す場合がある。)は、下記の2−N,N−ジメチルアミノエチルメタクリルアミド、2−N,N−ジメチルアミノエチルメタクリレート及び3−N,N−ジメチルアミノプロピルアクリルアミドよりなる群から選ばれる1種又は2種以上の含窒素モノマーに由来する構造単位を含むものである。
【0034】
【化1】

【0035】
本発明の含窒素ポリマーは、重合鎖に上記2−N,N−ジメチルアミノエチルメタクリルアミド、2−N,N−ジメチルアミノエチルメタクリレート、及び3−N,N−ジメチルアミノプロピルアクリルアミドのうちのいずれかに由来する構造単位を含むものであればよく、その形態には特に制限はないが、例えば、以下の(1)又は(2)が好ましいものとして挙げられる。
【0036】
(1) 前記特定の含窒素モノマーを重合してなる含窒素ポリマー。好ましくは前記特定の含窒素モノマーのみを重合してなる含窒素ポリマー(以下、この含窒素ポリマーを「含窒素ポリマー(1)」と称す場合がある。)。
(2) ベンゼン環を核とし、この核から3本以上の、前記特定の含窒素モノマーを含む重合鎖よりなる分岐鎖が伸延している分岐型重合体(以下、この分岐型重合体を「含窒素ポリマー(2)」と称す場合がある。)。この分岐型重合体において、分岐鎖は前記特定の含窒素モノマーのみからなることが好ましい。
【0037】
上記含窒素ポリマー(1)としては、特に、2−N,N−ジメチルアミノエチルメタクリルアミド及び/又は3−N,N−ジメチルアミノプロピルアクリルアミドを重合してなるものが好ましく、このような含窒素ポリマー(1)を製造する方法に特に制限はないが、2−N,N−ジメチルアミノエチルメタクリルアミド及び/又は3−N,N−ジメチルアミノプロピルアクリルアミドを主成分とする反応液に対して、光を照射することによりこれらの含窒素モノマーを重合させて含窒素ポリマー(1)を製造することが好ましい。この方法によれば、2−N,N−ジメチルアミノエチルメタクリルアミド及び3−N,N−ジメチルアミノプロピルアクリルアミドが、光照射されると容易にラジカルを生成するという性質を利用して含窒素ポリマー(1)を非常に短時間で製造することが可能である。
【0038】
以下に、この製造方法について説明する。
【0039】
含窒素ポリマー(1)は、前述の通り、2−N,N−ジメチルアミノエチルメタクリルアミド及び/又は3−N,N−ジメチルアミノプロピルアクリルアミド(以下これらを「含窒素モノマー(1)」と称す場合がある。)を主成分とする反応液に対して光を短時間照射することにより容易に製造することができ、短時間の光照射により、分岐状の高分子量体を得ることができる。その理由は、次のように考えられる。即ち、光照射により生じる主な反応が、まず、光照射された含窒素モノマー(1)のアミド基が光開裂することによりラジカルを生成し、このラジカルが、含窒素モノマー(1)のビニル基と反応することにより重合反応が開始され、さらに、この重合反応により生成した重合体のペンダント側鎖(重合反応により生成した分子鎖の基本構造の一部分を構成する側鎖)の未反応のアミド基が光解裂してラジカルを生成し、このラジカルと未反応の含窒素モノマーとがさらに反応することにより、高分子鎖からなる分岐鎖が導入され、このように逐次的に重合反応が進行していくため、複数の分岐点を有し、複雑な構造を備える含窒素ポリマー(1)を短時間で得ることができると考えられる。
【0040】
含窒素モノマー(1)の重合反応は、反応液中に含窒素モノマー(1)が含まれていれば、含窒素モノマー(1)以外の重合反応に関与しない化合物、例えば、溶媒の存在下で反応を行ってもよいが、重合反応に関与しない化合物を用いずに、実質的に含窒素モノマー(1)のみからなる反応液で重合を行うことが好ましい。これは、重合反応に関与しない化合物が、重合反応に直接的に関与しない場合であっても、生成したラジカルを吸収し、重合反応の反応速度を低下させる場合があるためである。溶媒等の重合反応に関与しない化合物の存在下で反応を行う場合に用いることができる当該重合反応に関与しない化合物としては、含窒素モノマー(1)の光開裂を阻害するラジカルスカベンジャーや、重合反応自体を阻害する連鎖移動剤などでなければどのようなものであってもよく、例えば、ベンゼン、トルエンなどの無極性溶媒を挙げることができる。このような重合反応に影響を与えないものを溶媒として用いた場合、反応液全体の粘度が低下するため撹拌効率を向上させることが可能であり、また、反応終了後、目的とする含窒素ポリマー(1)の回収が容易になる。
【0041】
溶媒等の重合反応に関与しない化合物を用いる場合、その使用量は反応液中の含有量として20重量%以下であることが好ましい。なお、溶媒等の重合反応に関与しない化合物の存在下で反応を行う場合には、重合収率や得られる含窒素ポリマー(1)の分子量が低下する場合があるため、製造プロセスの生産能力や製造目的などに応じて、用いる化合物の種類や使用量を適宜選択することが重要である。
ただし、反応後、溶媒などの重合反応に関与しない化合物を除去する工程などを考慮すると、該化合物を用いずに反応を行うことが好ましい。なお、この重合反応においては、含窒素モノマー(1)が、モノマーとしての役割だけでなく、重合開始剤としての役割も担っている。従って、後述の含窒素ポリマー(2)の製造で用いられるイニファターやAIBNなどの重合開始剤を別途用いることなく、複雑な枝葉の多い構造の高分子を容易に合成することができる。
【0042】
前記溶媒を用いる場合、反応液に含まれる含窒素モノマー(1)の濃度は、80重量%以上、特に90重量%以上であることが好ましい。
【0043】
なお、含窒素ポリマー(1)は、1種の含窒素モノマー(1)に由来する構造単位からなるものであってもよく、2種の含窒素モノマー(1)に由来する構造単位からなってもよく、さらには、含窒素モノマー(1)に由来する構造単位と含窒素モノマー(1)以外のモノマーに由来する構造単位を含むものであってもよい。含窒素モノマー(1)以外のモノマーに由来する構造単位を含む含窒素ポリマー(1)は、含窒素モノマー(1)と含窒素モノマー(1)以外のモノマーとを含む反応液に対して光照射を行うことにより製造することができるが、この場合においても、含窒素モノマー(1)の濃度が80重量%以上になるように反応液を調製することが好ましい。
【0044】
反応液に対して照射する光としては、単色光であっても、混合光であってもよいが、本発明者らが、照射光の波長と重合反応性との関係について検討を重ねたところ、特定の波長の光を照射することにより前記含窒素モノマー(1)を効率的に重合させることができることを見出した。即ち、390nmを超える長波長の光を照射した場合には、反応が進行しなかったり、反応速度が極端に低下するため生産効率が低くなる。これは390nmを超える長波長の光が、前記含窒素モノマー(1)の側鎖のラジカル解裂を効率よく起こすだけのエネルギーを有していないか、前記光のエネルギーが量子化された励起バンドと大きく異なるなどの理由が考えられる。また、290nm未満の短波長の光を照射した場合にも、含窒素ポリマー(1)がほとんど生成しない。これは、含窒素モノマー(1)分子が290nm未満のUVを吸収する性質を有しており、照射光が反応液内に十分に到達せず、重合反応に寄与する側鎖の光開裂が起こらないためであると考えられる。従って、反応液に対して照射する光の波長は、290〜390nm程度、特に300〜380nm程度、とりわけ310nm〜370nmが好適であり、例えばショートアークキセノンランプ、低圧水銀灯、高圧水銀灯、ブラックライトなどを用いることができ、ガラス板や分光フィルターの併用などで波長を選択することも可能である。光の照射強度としては、反応容器のスケールや、照射強度に依存するが0.01〜50.0mW/cm2程度、特に0.1〜10.0mW/cm2程度好ましい。照射強度が高いと、反応を制御しにくくなるおそれがあるため好ましくない。また、照射強度が低いと、重合時間が徒に長くなるため効率的ではない。
【0045】
光の照射時間としては、反応容器のスケールや照射強度に依存するが10秒〜1440分、特に1分〜360分、とりわけ3〜60分程度が好ましい。即ち、上述のような製造方法であれば、このような短時間の光照射でも、含窒素ポリマー(1)を容易に製造することができる。
【0046】
この光照射により、反応液中に目的とする含窒素ポリマー(1)が生成するので、必要に応じ精製することにより、本発明の含窒素ポリマー(1)を得ることができる。
【0047】
含窒素モノマー(1)を重合してなる含窒素ポリマー(1)は、含窒素モノマー(1)のpKaの値が中性であり、加水分解されにくいという性質、及び温度の変化により化合物の性質が変化(特に、N,N−ジメチルアミノエチルメタクリレートなどで確認されている温度変化によって脱溶媒和してグロビュール化するなどの変化)しにくいという性質を備えている。従って、この含窒素モノマー(1)を重合してなる含窒素ポリマー(1)は、血清中のアニオン性タンパクや脂質などの成分との相互作用が低く、実際に細胞へ遺伝子導入する際に血清や血液の影響を受けにくいという特長を有する。
【0048】
含窒素ポリマー(1)の分子量としては、30,000〜5,000,000程度、特に100,000〜1,000,000程度が好ましい。この分子量は、前記光照射の時間、及び反応液に含まれる含窒素モノマー(1)の濃度を制御することにより調整することができる。即ち、照射時間を長くすることにより、重合反応を進行させて分子量の大きい含窒素ポリマー(1)を得ることができる。また、この他にも光開裂反応の量子化エネルギーバンドの存在を考慮すれば、照射する光の波長を選択することでも反応を制御できる可能性があると推測される。
含窒素ポリマー(1)は、分子量が100万以上の超高分子量体となってもゲル化することがなく水に易溶であるので、取り扱い性に優れる。
【0049】
なお、本明細書において、含窒素ポリマーの分子量とは、GPC(ゲルパーミエーションクロマトグラフィー)によるポリエチレングリコール換算の数平均分子量をさす。
【0050】
前述の如く、含窒素ポリマー(1)は、2−N,N−ジメチルアミノエチルメタクリルアミド又は3−N,N−ジメチルアミノプロピルアクリルアミドのみを重合してなるものであってもよいが、2−N,N−ジメチルアミノエチルメタクリルアミド及び3−N,N−ジメチルアミノプロピルアクリルアミドを重合してなるものであってもよく、さらには、これら含窒素モノマー(1)以外のモノマーに由来する構造単位を含むように構成してもよい。このように複数のモノマーからなる含窒素ポリマー(1)は、前述の如く、含窒素モノマー(1)と含窒素モノマー(1)以外のモノマーとからなる反応液に対して光照射を行うことにより製造することができるが、この場合においても、反応液に含まれる含窒素モノマー(1)が80重量%以上になるように調製することが好ましい。
【0051】
この場合の他のモノマーとしては、アクリル酸誘導体、スチレン誘導体等のビニル系モノマーが好適であり、具体的には、N,N−ジメチルアクリルアミド、2−メトキシエチル(メタ)アクリレート、N-ジメチルアミノスチレン、及び4−アミノスチレンの誘導体からなる群から選択される少なくとも1種のビニル系モノマーが挙げられる。これらのビニル系モノマーは1種を単独で用いてもよく、2種以上を混合して用いてもよい。
【0052】
一方、前記含窒素ポリマー(2)を製造する方法も特に制限はないが、好ましくは、N,N−ジ置換ジチオカルバミルメチル基を3個以上有するベンゼン化合物をイニファターとし、このイニファターに少なくとも2−N,N−ジメチルアミノエチルメタクリルアミド、2−N,N−ジメチルアミノエチルメタクリレート及び3−N,N−ジメチルアミノプロピルアクリルアミドの1種又は2種以上の含窒素モノマー(以下「含窒素モノマー(2)」と称す場合がある。)を光照射リビング重合により重合させることにより製造することができる。
【0053】
なお、本明細書において、イニファターとは、光照射によりラジカルを発生させる重合開始剤、連鎖移動剤としての機能と共に、成長末端と結合して成長を停止する機能、さらに光照射が停止すると重合を停止させる重合開始・重合停止剤として機能する分子のことである。
【0054】
イニファターとなるN,N−ジ置換ジチオカルバミルメチル基を同一分子内に3個以上有するベンゼン化合物としては、ベンゼン環にN,N−ジ置換ジチオカルバミルメチル基、好ましくはN,N−ジアルキルジチオカルバミルメチル基が3個以上分岐鎖として結合しているものが好適であり、具体的には次が例示される。
即ち、3分岐鎖ベンゼン化合物としては、1,3,5−トリ(ブロモメチル)ベンゼンとN,N−ジアルキルジチオカルバミン酸ナトリウム(ナトリウムN,N−ジアルキルジチオカルバメート)とをエタノール中で付加反応させて得られる1,3,5−トリ(N,N−ジアルキルジチオカルバミルメチル)ベンゼンであり、4分岐鎖ベンゼン化合物としては、1,2,4,5−テトラキス(ブロモメチル)ベンゼンとN,N−ジアルキルジチオカルバミン酸ナトリウム(ナトリウムN,N−ジアルキルジチオカルバメート)とをエタノール中で付加反応させて得られる1,2,4,5−テトラキス(N,N−ジアルキルジチオカルバミルメチル)ベンゼンであり、6分岐鎖ベンゼン化合物としては、ヘキサキス(ブロモメチル)ベンゼンとN,N−ジアルキルジチオカルバミン酸ナトリウム(ナトリウムN,N−ジアルキルジチオカルバメート)とをエタノール中で付加反応させて得られるヘキサキス(N,N−ジアルキルジチオカルバミルメチル)ベンゼンが挙げられる。なお、ここで、N,N−ジアルキルジチオカルバミルメチル基に含まれるジアルキル部分のアルキル基としては、エチル基等の炭素数2〜18個のアルキル基が好ましいが、アルキル基に限らず、フェニル基など芳香族系の炭化水素基であっても構わない。即ち、N,N−ジアルキルジチオカルバミルメチル基に限らず、N,N−ジアリールジチオカルバミルメチル基等を含む、脂肪族炭化水素基及び/又は芳香族炭化水素基で置換されたN,N−ジ置換ジチオカルバミルメチル基であれば目的を達成することができる。
【0055】
上記のイニファターは、アルコール等の極性溶媒に対しては殆ど不溶であるが、非極性溶媒には易溶である。この非極性溶媒としては炭化水素、ハロゲン化アルキル又はハロゲン化アルキレンが好適であり、特に、ベンゼン、トルエン、クロロホルム又は塩化メチレン、特にトルエンが好適である。
【0056】
上記イニファターと含窒素モノマー(2)とを反応させるには、イニファターと含窒素モノマー(2)を含んでなる原料溶液を調製し、これに光照射することが好ましく、これにより、イニファターに対し、含窒素モノマー(2)が重合又は共重合した分岐鎖を導入することができる。
【0057】
該原料溶液中の含窒素モノマー(2)の濃度は0.05M以上、例えば0.05M〜2.5Mが好適であり、イニファターの濃度は0.5〜20mM程度が好適である。
【0058】
照射する光の波長は360〜390nm程度が好適であり、例えばショートアークキセノンランプ、低圧水銀灯、高圧水銀灯などを用いてガラス板や分光フィルターを併用することによって好適な波長を選択的に照射することができ、光の照射強度としては、0.5mW/cm2以下が好ましく、特に0.03〜0.3mW/cm2程度が好ましい。照射強度を高くすると、副反応を生じさせる330〜350nm程度の影響が大きくなるため好ましくない。また、照射強度が低いと、重合時間を著しく長くする必要があるため、効率的ではない。
【0059】
光の照射時間としては、5時間以上で、用いた光の照射強度、目的とする含窒素モノマー(2)の重合度(含窒素ポリマー(2)の分子量)に応じて適宜設定されるが、通常、10〜500時間、特に24〜168時間程度が好ましい。照射強度を低く設定した場合は、重合反応が緩やかに進行するため照射時間を長めに設定することが好ましいが、照射時間が徒に長いと、製造効率が低下する。
【0060】
この光照射により、反応液中に目的とする分岐鎖を有する分岐型重合体よりなる含窒素ポリマー(2)が生成するので、必要に応じ精製することにより、分岐鎖部分に含窒素モノマー(2)に由来する構造単位よりなるポリマー鎖が導入され、分岐鎖の末端がN,N−ジ置換ジチオカルバミルメチル基であるホモポリマーを得る。
【0061】
このような分岐型重合体である含窒素ポリマー(2)の分岐鎖の1本当たりの分子量としては、1,500〜150,000程度、特に3,000〜100,000程度が好ましく、含窒素ポリマー(2)の分子量としては、分岐鎖の鎖数にもよるが、10,000〜10,000,000程度、特に150,000〜600,000程度が好ましい。含窒素ポリマー(2)の分子量が小さいと、効率的に遺伝子を導入することができず、分子量が大きすぎると、生体内において異物として認識されるおそれがある。この分子量は、光照射の時間を制御することにより調整することができる。即ち、照射時間を長くすることにより、重合反応を進行させて分子量の大きい含窒素ポリマー(2)を得ることができる。
【0062】
なお、本明細書において、含窒素ポリマーの分子量とは、前述の如く、GPC(ゲルパーミエーションクロマトグラフィー)によるポリエチレングリコール換算の数平均分子量をさす。
【0063】
含窒素ポリマー(2)の分岐鎖は、含窒素モノマー(2)のみからなるポリマー鎖であることが好ましいが、含窒素モノマー(2)と含窒素モノマー(2)とは異なる1種以上のモノマーを導入したブロックコポリマー鎖又はランダムコポリマー鎖であってもよい。
【0064】
この場合の他のモノマーとしては、アクリル酸誘導体、スチレン誘導体等のビニル系モノマーが好適であり、具体的には、N,N−ジメチルアクリルアミド、メトキシエチル(メタ)アクリレート、4−N,N-ジメチルアミノスチレン、及び4−アミノスチレンの誘導体からなる群から選択される少なくとも1種のビニル系モノマーが挙げられる。これらのビニル系モノマーは1種を単独で用いてもよく、2種以上を混合して用いてもよい。
【0065】
<核酸>
核酸は、細胞に導入されることによりその細胞内で機能を発現することができるような形態で用いる。例えばDNAの場合、導入された細胞内で当該DNAが転写され、それにコードされるポリペプチドの産生を経て機能発現されるように当該DNAが配置されたプラスミドとして用いる。好ましくは、プロモーター領域、開始コドン、所望の機能を有する蛋白質をコードするDNA、終止コドンおよびターミネーター領域が連続的に配列されている。
【0066】
所望により2種以上の核酸をひとつのプラスミドに含めることも可能である。
【0067】
この核酸としては、デオキシリボ核酸(DNA)及びリボ核酸(RNA)のようなポリヌクレオチド特にDNAが好適であるが、リボ核タンパク質であってもよい。
【0068】
本発明で用いる核酸の好ましい例としては、次のようなものが挙げられる。
単純ヘルペスウイルスチミジンキナーゼ遺伝子(HSV1−TK遺伝子)、p53癌抑制遺伝子及びBRCA1癌抑制遺伝子やサイトカイン遺伝子としてTNF−α遺伝子、IL−2遺伝子、IL−4遺伝子、HLA−B7/IL−2遺伝子、HLA−B7/B2M遺伝子、IL−7遺伝子、GM−CSF遺伝子、IFN−γ遺伝子及びIL−12遺伝子などのサイトカイン遺伝子並びにgp−100、MART−1及びMAGE−1などの癌抗原ペプチド遺伝子が癌治療に利用できる。
【0069】
また、VEGF遺伝子、HGF遺伝子及びFGF遺伝子などのサイトカイン遺伝子並びにc−mycアンチセンス、c−mybアンチセンス、cdc2キナーゼアンチセンス、PCNAアンチセンス,E2Fデコイやp21(sdi−1)遺伝子が血管治療に利用できる。かかる一連の遺伝子は当業者には良く知られたものである。
【0070】
また、アンチセンスによるリプレッシングの他に、21〜23塩基の二本鎖RNAを使用したRNA干渉によるmRNA破壊などに利用することも可能である。
【0071】
<細胞破砕物>
細胞破砕物(cell lysate)は、哺乳類細胞を培養して死滅又は生きた状態で破砕して得ることができる。
【0072】
ここで用いる細胞としては、接着細胞でも浮遊細胞でも使用可能であり、初代細胞のように株化も樹立もされていない細胞でも樹立細胞でも良い。また、初代細胞の場合は、由来の組織や臓器は不問であり、ソーティングなどの分離処理を行なったホモ細胞でもヘテロ細胞でも良い。樹立細胞の例としては、293細胞(ヒト胎児腎細胞へアデノウイルスのE1遺伝子を導入したトランスフォーマント)やCOS細胞などSV−40で形質転換されたことでLarge−T抗原を発現している細胞由来のものや、その他、当業者に良く知られるCHO、NIH3T3、RBL、A9、SN10、MB66MCA、GM637、REV2、P3XX63−AG−8、FM3A、HepG、Hela、Jurkat、K562、THP−1、PC12なども使用可能である。
これらの樹立細胞は1種を単独で用いてもよく、2種以上を併用してもよい。
【0073】
また、遺伝子導入を行う細胞と破砕組成物を調製するための細胞(破砕する細胞)は異なっていても同一でも良く、細胞の由来動物種や由来臓器などを同一又は近縁のものを使用したり、あえて異種動物種の細胞を使用することも可能である。
例えば、
(1) ヒト血管内皮細胞への遺伝子導入にイヌ血管内皮細胞の破砕物を使用するような細胞種が同一であるケース
(2) Hela細胞(ヒト子宮頚部癌細胞)に293細胞(ヒト胎児腎細胞)の破砕物を使用するような由来動物種が同一であるケース
(3) ヤギ心筋線維芽細胞(ヤギ心臓)への遺伝子導入に293細胞(ヒト腎臓)の破砕物を使用するような細胞種も動物種も異なるケース
(4) イヌ血管内皮細胞への遺伝子導入にイヌ血管内皮細胞の破砕物を使用するような細胞種も動物種も同一であるケース
など組合せは種々存在する。
【0074】
また、細胞破砕物の調製に使用する細胞はアデノウイルスに感染したものであっても良い。ただし、アデノウイルスに感染させた細胞と、感染させていない細胞とで、遺伝子導入活性は、細胞の種類毎に異なるため、細胞毎にアデノウイルスの感染の有無を使い分けることが好ましい。また、アデノウイルスに感染していない細胞を用いる方が、前述のウイルスベクターに付随する欠点がないことから好ましい。
【0075】
これらの細胞の破砕方法としては特に制限はなく、例えば、超音波処理や、凍結融解(例えば−70℃凍結と37℃加温融解の繰り返し)などにより破砕することができる。その他、ホモジナイザーによる破砕、ガラスビーズによる破砕、界面活性剤を用いる方法などを採用することもできる。
【0076】
また、哺乳類細胞は、破砕に先立ち、培養した細胞を洗浄してもよく、この洗浄方法としては、例えば、遠心分離で培地を除去した後、等張液や緩衝溶液などを加えて遠心分離して細胞浮遊液とする方法が挙げられる。
【0077】
細胞破砕処理後は、遠心分離や濾過の工程を経て固形物(不溶性成分)を除去することが好ましく、この場合、濾過には10.0〜0.22μm程度の孔径のフィルターを用いることが好ましい。フィルターの材質としてはタンパクの吸着性が高いニトロセルロース膜やナイロン膜よりも酢酸セルロース膜やPTFE(ポリテトラフルオロエチレン)膜、PDVF(ポリフッ化ビニリデン)膜が好適である。また、遠心分離の際には比重液を併用した遠心分離処理で成分の分画や選択などを行なうことも可能である。
細胞破砕物は更に高圧蒸気滅菌、放射線滅菌(ガンマ線滅菌、電子線滅菌など)、濾過滅菌などを行なっても良い。
【0078】
このようにして細胞を破砕して得られる細胞破砕物は、通常、水、生理食塩水等の水系溶媒、或いは、アルコール等の溶媒中に細胞破砕物を含む細胞破砕物含有液として得られる。この細胞破砕物含有液中の細胞破砕物含有量は、総タンパク濃度として0.001mg/L〜20,000mg/L程度、特に0.01mg/L〜2,000mg/L程度であることが好ましい。ここで、総タンパク濃度は当業者に周知のBradfold法、Coomassie Bule法、ビシンコニン酸法、Lowry法などの方法で定量が可能である。この細胞破砕物含有液の総タンパク濃度が高過ぎると前述の含窒素ポリマーと核酸とを複合化させて得た核酸複合体(一次核酸複合体)の微粒子に多量のタンパクが吸着することで表面の性質が変化し、微粒子同士の会合や凝集を惹起したり、微粒子のデコンデンス(一次核酸複合体粒子にアニオン性物質が作用し、ポリアニオンである核酸との交換作用で微粒子が解離して核酸が露出する現象)する可能性があり、低過ぎると一次核酸複合体の微粒子が溶液中で安定に分散し、細胞破砕物の吸着などの相互作用が得らず(元々、核酸複合体は溶液中の酵素など種々のタンパク成分の作用から核酸を保護するために形成させている)、本発明の効果を得ることができない。
【0079】
<遺伝子導入剤組成物の調製方法>
本発明の遺伝子導入剤組成物を製造するには、まず、前述の含窒素ポリマーと核酸とを複合化させて核酸複合体(一次核酸複合体)とし、この一次核酸複合体と細胞破砕物を混合して二次核酸複合体を形成させることが好ましい。
【0080】
含窒素ポリマーと核酸とを複合させるには、含窒素ポリマーの濃度0.1〜1000μg/mL程度の溶液に対し、核酸を添加して混合すればよい。この際、核酸に対して含窒素ポリマーを過剰量添加し、核酸に対して含窒素ポリマーを飽和状態にして含窒素ポリマーと核酸とを複合化させることが好ましい。
【0081】
このようにして得られる一次核酸複合体のN/P比(含窒素ポリマーのアミノ基由来の窒素原子と核酸中のリン原子とのモル比)は、5〜15程度であることが好ましい。即ち、従来の含窒素ポリマーを遺伝子導入剤とする場合、N/P比30以上で高い遺伝子導入活性を示し、50程度で最も高い遺伝子導入活性が得られるが、本発明では、このN/P比が5〜15程度で最大の遺伝子導入活性を得ることができる。このように小さいN/P比で高い遺伝子導入活性が得られること、即ち、核酸に対する含窒素ポリマー量の割合を小さくすることができることは、遺伝子導入効率の面で好ましい。
【0082】
なお、電気的に中性に近い2−N,N−ジメチルアミノエチルメタクリルアミドを重合してなる含窒素ポリマー以外のカチオン性の含窒素モノマーを重合してなる含窒素ポリマーを用いた一次核酸複合体にあっては、上述の一次核酸複合体のN/P比は、C/A比(含窒素ポリマーのカチオン当量/核酸のアニオン当量)に等しい。
【0083】
また、この一次核酸複合体の粒子径は通常、50〜400nm程度である。一次核酸複合体の粒子径が小さ過ぎると、一次核酸複合体内部の核酸にまで酵素の作用が及ぶおそれ、あるいは腎臓にて濾過排出されるおそれがある。また、一次核酸複合体の粒子径が大き過ぎると細胞に導入されにくくなるおそれがある。
【0084】
ところで、核酸複合体の粒子径については、200nm以上であると細胞内に取り込まれにくいとされ、エンドサイトーシスによる遺伝子導入に最適な粒子径は約50nmのウィルスサイズであるとの報告(遺伝子・デリバリー研究会 第4回シンポジウム(2004年5月10日)「糖クラスター被覆量子ドットの合成と細胞導入〜エンドサイトーシスにおけるサイズの効果〜(大崎史雄 他)」)がなされているが、本発明の遺伝子導入剤組成物では、180〜300nm程度の比較的大きな粒子径の一次核酸複合体であっても細胞への遺伝子導入が可能である。このように大きな粒子径の一次核酸複合体で遺伝子導入を行えることは、一次核酸複合体と細胞との接触頻度が高くなることから、遺伝子導入効率の面で好ましい。
【0085】
なお、一次核酸複合体の粒子径は、例えばレーザーを用いた動的光散乱法によって測定される。
【0086】
含窒素ポリマーと核酸とを混合して一次核酸複合体を形成させた後は、この一次核酸複合体に前述の細胞破砕物含有液を添加して混合することにより本発明の遺伝子導入剤組成物を調製する。一次核酸複合体と細胞破砕物との混合割合には特に制限はなく、用いた含窒素ポリマーや核酸、細胞破砕物の種類などに応じて、高い遺伝子導入活性が得られるような割合に適宜調整される。添加された細胞破砕物は、一次核酸複合体に吸着ないし近接して二次核酸複合体を形成する。この二次核酸複合体は、形成させてから細胞へ遺伝子導入するまでの時間(通常の研究では10分間から数時間)、水等の液中で安定な分散状態を維持する。この二次核酸複合体の粒子径は通常一次核酸複合体の粒子径とほぼ同等である。
【0087】
[遺伝子導入方法]
本発明の遺伝子導入剤組成物を用いて、細胞に遺伝子を導入するには、好ましくは、上述のようにして調製された遺伝子導入剤組成物をその細胞に適した条件のもとで接触させれば良い。例えばIn
Vitro系で培養細胞へ遺伝子導入する場合は、その細胞に合わせて当業者によって適宜選択された完全培地(例えば10%のウシ胎児血清を含むDMEM培地)へあらかじめ適切な量の二次核酸複合体の分散液を混合しておき、そのまま培地交換を行ない、さらにそのまま培養を行えば良い。つまり、本発明の遺伝子導入剤組成物では、細胞を培養している時とほぼ同等の状態で遺伝子導入が行えるため、細胞への負荷が少なくてすむという特長を有する。即ち、従来の遺伝子導入剤は、遺伝子導入する直前に細胞をPBS洗浄して血清成分を除去したり遺伝子導入の際の数時間を無血清培地と交換することが必要な場合が多く、更に、その数時間後には再度のPBS洗浄や培地交換が必要であったので、これらの操作自体が細胞へ大きな負荷をかけるだけでなく培養ディッシュへの細菌、カビのコンタミの危険性も高く、作業者にとっても大きな労力を要するものであったが、本発明においては、このような問題が解消ないしは改善される。
【0088】
本発明において、核酸を導入する対象として望ましい「細胞」としては、当該核酸の機能発現が求められるものであり、このような細胞としては、例えば使用する核酸(すなわちその機能)に応じて種々選択され、例えばES細胞、iPS細胞、造血幹細胞、脂肪幹細胞、心筋細胞、平滑筋細胞、繊維芽細胞、骨格筋細胞、血管内皮細胞、骨髄細胞、骨細胞、血球幹細胞、血球細胞等が挙げられる。また、単球、樹状細胞、マクロファージ、組織球、クッパー細胞、破骨細胞、滑膜A細胞、小膠細胞、ランゲルハンス細胞、類上皮細胞、多核巨細胞等、消化管上皮細胞・尿細管上皮細胞などである。なお、これら細胞は分化の程度は問わず、ヘテロ細胞でもホモ細胞でも良く、さらに、株化や樹立された細胞でも初代細胞でも良い。
【0089】
本発明の遺伝子導入剤組成物は培養試験に用いるほか、任意の方法で生体に投与することができる。
【0090】
生体への投与方法としては静脈内又は動脈内への注入が特に好ましいが、筋肉内、脂肪組織内、皮下、皮内、リンパ管内、リンパ節内、体腔(心膜腔、胸腔、腹腔、脳脊髄腔等)内、骨髄内への投与の他に病変組織内に直接投与することも可能である。
【0091】
この遺伝子導入剤組成物を有効成分とする医薬は、更に必要に応じて製剤上許容し得る担体(浸透圧調整剤、安定化剤、保存剤、可溶化剤、pH調整剤、増粘剤等)と混合することが可能である。これら担体は公知のものが使用できる。
【0092】
また、この遺伝子導入剤組成物を有効成分とする医薬は、含まれる核酸の種類が異なる2種以上の核酸を含有する遺伝子導入剤組成物を含むものも包含される。このような複数の治療目的を併せ持つ医薬は、多様化する遺伝子治療の分野で特に有用である。
【0093】
投与量としては、動物、特にヒトに投与される用量は目的の核酸、投与方法および治療される特定部位等、種々の要因によって変化する。しかしながら、その投与量は治療的応答をもたらすに十分であるべきである。
【0094】
この遺伝子導入剤組成物は、好ましくは遺伝子治療に適用される。適用可能な疾患としては、当該遺伝子導入剤組成物に含有水される核酸の種類によって異なるが、末梢動脈疾患、冠動脈疾患、動脈拡張術後再狭窄等の病変を生じる循環器領域での疾患に加え、癌(悪性黒色腫、脳腫瘍、転移性悪性腫瘍、乳癌等)、感染症(HIV等)、単一遺伝病(嚢胞性線維症、慢性肉芽腫、α1−アンチトリプシン欠損症、Gaucher病等)等が挙げられる。
【実施例】
【0095】
以下に実施例及び比較例を挙げて本発明をより具体的に説明する。
【0096】
[実施例1]
(i) 含窒素ポリマー(1)(2−N,N−ジメチルアミノエチルメタクリルアミド重合体)の合成
暗室で、2−N,N−ジメチルアミノエチルメタクリルアミド5.0グラムを10mL容の軟質ガラスバイアル瓶に採取し、高純度窒素ガスを10分間パージ(流量:2リットル/分)した後、密栓して激しく攪拌しながら光照射した。光照射には、東芝製ブラックライト丸管型蛍光灯20型を使用し、軟質ガラスバイアル瓶を丸管型蛍光灯の中央へ配置することで全周方向からバイアル瓶内に均質に光(波長375nm、照射強度4mW/cm2)を照射できるようにした。15分間の光照射でモノマーはガラス状に固化した。5mLの水を入れて固化物を溶解させ、透析チューブへ入れて18Lの水で24時間透析した。透析を5回繰り返した後、固化物の水溶液を凍結乾燥させて2−N,N−ジメチルアミノエチルメタクリルアミドの重合体(含窒素ポリマー(1))を得た(収率:5.9%)
【0097】
GPCによるポリエチレングリコールを標準物質とした2−N,N−ジメチルアミノエチルメタクリルアミド重合体の数平均分子量は、98,400(Mw/Mn=2.40)であった。
1H−NMR(in chloroform-d1):δ0.8-1.1ppm(br,3H,-CH3,m/r=1/2),δ1.7-2.1ppm(br,2H,-CH2-CH3-),δ2.2-2.3ppm(br,6H,N-CH3),δ2.5-2.6ppm(br,2H,CH2-N),δ4.0-4.12ppm(br,2H,CON-CH2)
【0098】
(ii) 細胞破砕物(COS−1細胞破砕物)の調製
10%FCS添加DMEM培地でCOS−1細胞を培養した。培養2日後、90%コンフェルトの状態で培地を除去し、EDTAを添加したトリプシンを加えて培養皿から剥がし、完全培地でトリプシンを失活させた後に遠心分離で培地を除去した。PBSに分散させてから遠心分離と上澄み除去により細胞を洗浄した。回収した細胞を生理食塩水へ分散させて細胞浮遊液を調製した。液中の生細胞の密度はビルケルチルク血算板により60万個/mLと測定された。細胞の生死はトリパンブルー排泄で判定した。この細胞浮遊液を1時間の−70℃凍結と30分の37℃融解を6回繰り返して破砕した。
その後、細胞浮遊液を3,000rpm、10分間の遠心分離を行って不溶性成分を除去し、0.2μmフィルターで濾過することにより細胞破砕物含有液を得た。このものの総タンパク濃度は20μg/mLであった。
【0099】
(iii) 一次核酸複合体の形成
上記(i)で得た含窒素ポリマー(1)とDNAを用いて一次核酸複合体粒子を形成した。含窒素ポリマー(1)の単位重量あたりのポリマー側鎖3級アミンの数は、含窒素ポリマー(1)の含窒素モノマー(2−N,N−ジメチルアミノエチルメタクリルアミド)単位の分子量156から計算により求めた(1モノマー単位に1個の3級アミンが存在する)。また、DNA中の単位重量あたりの陰電荷数は配列MAPによる塩基対数と核酸塩基の平均的分子量660とから計算した。
上記(i)で得た含窒素ポリマー(1)をDNAと150μLのTE緩衝溶液中で混合して30分間インキュベートした。混合比は含窒素ポリマー(1)の側鎖の3級アミンの数とDNA中の陰電荷数の関係が、3級アミン数が陰電荷数の10倍となるように(N/P比=10)調整し、混合溶液150μLで0.5μgのDNAが各Wellへ投与されるように溶液の終濃度を調整した。
動的光散乱法(シスメックス社、ゼーターサイザー・ナノ)により測定した一次核酸複合体粒子の粒子径はポリスチレン材として180nm〜220nmであった。
【0100】
(iv) 遺伝子導入実験
遺伝子を導入する細胞には、犠牲死させたイヌ大動脈血管の内壁から採取し、形態観察と免疫染色によりホモ細胞であることを確認してから継代回数が3回未満の血管内皮細胞を使用した。血管内皮細胞は細胞数を4万個/mLに調整して、24Well培養皿へ播種し、培養24時間後に遺伝子導入を行った。
上記(iii)で得られた一次核酸複合体溶液150μLに、上記(ii)で得た細胞破砕物含有液を70μL混合して二次核酸複合体を形成させてから、10%FCS添加DMEM培地6mLに加えて混合し、5分間インキュベートしてから上記培養細胞の各Wellへ1mLづつ合計6Wellへ加え、そのまま48時間培養を行った。48時間後にルシフェラーゼアッセイキットにより遺伝子導入活性の評価を行った。補正は総タンパク濃度で行い、総タンパク定量はBiO Rad社のBradford試薬で行った。
導入結果を図1に示す。
【0101】
[比較例1]
実施例1における遺伝子導入実験において、一次核酸複合体溶液150μLに、細胞破砕物含有液70μLの代りに生理食塩水70μLを混合したこと以外は同様にして遺伝子導入活性の評価を行い、結果を図1に示した。
【0102】
図1より、核酸と合成高分子ベクターとで形成した核酸複合体(本発明に係る一次核酸複合体)に細胞破砕物を混合することにより、この一次核酸複合体のみでは殆ど不可能であった血管内皮細胞への遺伝子導入が可能となることが分かる。
【特許請求の範囲】
【請求項1】
2−N,N−ジメチルアミノエチルメタクリルアミド、2−N,N−ジメチルアミノエチルメタクリレート及び3−N,N−ジメチルアミノプロピルアクリルアミドよりなる群から選ばれる1種又は2種以上の含窒素モノマーに由来する構造単位を含む含窒素ポリマーと核酸とを含む複合体と、細胞破砕物とを混合してなることを特徴とする遺伝子導入剤組成物。
【請求項2】
請求項1において、前記含窒素ポリマーと核酸とを含む複合体のN/P比が5〜15であることを特徴とする遺伝子導入剤組成物。
【請求項3】
請求項1又は2において、前記含窒素ポリマーは、前記含窒素モノマーを重合してなることを特徴とする遺伝子導入剤組成物。
【請求項4】
請求項3において、前記含窒素ポリマーは、前記含窒素モノマーのみを重合してなることを特徴とする遺伝子導入剤組成物。
【請求項5】
請求項3又は4において、前記含窒素ポリマーの分子量が10,000〜5,000,000であることを特徴とする遺伝子導入剤組成物。
【請求項6】
請求項1又は2において、前記含窒素ポリマーは、前記含窒素モノマーに由来する構造単位を含む重合鎖よりなる分岐鎖を有する分岐型重合体であって、該分岐型重合体は、ベンゼン環を核とし、この核から3本以上の前記分岐鎖が伸延していることを特徴とする遺伝子導入剤組成物。
【請求項7】
請求項6において、前記分岐鎖は前記含窒素モノマーに由来する構造単位のみからなることを特徴とする遺伝子導入剤組成物。
【請求項8】
請求項6又は7において、1本当たりの前記分岐鎖の分子量が1,500〜150,000であり、前記分岐型重合体の分子量が10,000〜10,000,000であることを特徴とする遺伝子導入剤組成物。
【請求項9】
2−N,N−ジメチルアミノエチルメタクリルアミド、2−N,N−ジメチルアミノエチルメタクリレート及び3−N,N−ジメチルアミノプロピルアクリルアミドよりなる群から選ばれる1種又は2種以上の含窒素モノマーに由来する構造単位を含む含窒素ポリマーと核酸とを含む複合体と、細胞破砕物とを混合する工程を有することを特徴とする遺伝子導入剤組成物の製造方法。
【請求項1】
2−N,N−ジメチルアミノエチルメタクリルアミド、2−N,N−ジメチルアミノエチルメタクリレート及び3−N,N−ジメチルアミノプロピルアクリルアミドよりなる群から選ばれる1種又は2種以上の含窒素モノマーに由来する構造単位を含む含窒素ポリマーと核酸とを含む複合体と、細胞破砕物とを混合してなることを特徴とする遺伝子導入剤組成物。
【請求項2】
請求項1において、前記含窒素ポリマーと核酸とを含む複合体のN/P比が5〜15であることを特徴とする遺伝子導入剤組成物。
【請求項3】
請求項1又は2において、前記含窒素ポリマーは、前記含窒素モノマーを重合してなることを特徴とする遺伝子導入剤組成物。
【請求項4】
請求項3において、前記含窒素ポリマーは、前記含窒素モノマーのみを重合してなることを特徴とする遺伝子導入剤組成物。
【請求項5】
請求項3又は4において、前記含窒素ポリマーの分子量が10,000〜5,000,000であることを特徴とする遺伝子導入剤組成物。
【請求項6】
請求項1又は2において、前記含窒素ポリマーは、前記含窒素モノマーに由来する構造単位を含む重合鎖よりなる分岐鎖を有する分岐型重合体であって、該分岐型重合体は、ベンゼン環を核とし、この核から3本以上の前記分岐鎖が伸延していることを特徴とする遺伝子導入剤組成物。
【請求項7】
請求項6において、前記分岐鎖は前記含窒素モノマーに由来する構造単位のみからなることを特徴とする遺伝子導入剤組成物。
【請求項8】
請求項6又は7において、1本当たりの前記分岐鎖の分子量が1,500〜150,000であり、前記分岐型重合体の分子量が10,000〜10,000,000であることを特徴とする遺伝子導入剤組成物。
【請求項9】
2−N,N−ジメチルアミノエチルメタクリルアミド、2−N,N−ジメチルアミノエチルメタクリレート及び3−N,N−ジメチルアミノプロピルアクリルアミドよりなる群から選ばれる1種又は2種以上の含窒素モノマーに由来する構造単位を含む含窒素ポリマーと核酸とを含む複合体と、細胞破砕物とを混合する工程を有することを特徴とする遺伝子導入剤組成物の製造方法。
【図1】




【公開番号】特開2012−244925(P2012−244925A)
【公開日】平成24年12月13日(2012.12.13)
【国際特許分類】
【出願番号】特願2011−118034(P2011−118034)
【出願日】平成23年5月26日(2011.5.26)
【出願人】(000005278)株式会社ブリヂストン (11,469)
【出願人】(510094724)独立行政法人国立循環器病研究センター (52)
【Fターム(参考)】
【公開日】平成24年12月13日(2012.12.13)
【国際特許分類】
【出願日】平成23年5月26日(2011.5.26)
【出願人】(000005278)株式会社ブリヂストン (11,469)
【出願人】(510094724)独立行政法人国立循環器病研究センター (52)
【Fターム(参考)】
[ Back to top ]

