遺伝子導入治療剤
【課題】ウィルスベクターは副作用が強く、そのため投与経路も限定され、転移巣を広くターゲットとすることが出来ない。一方、非ウィルスベクターでは発現の効率が比較的低いため、高い治療効果は期待できない。前発明により、腫瘍組織内でこれまでにない高い発現を達成する非ウィルスベクターが出来たが、その腫瘍細胞における発現率は100%ではないため、p53等の自殺遺伝子を導入しても、腫瘍の完全な、あるいは十分な治癒効果は得られなかった。本発明の目的は、これらの問題を解決すべく、安全で、より高い抗腫瘍活性を発揮し、かつ癌転移の抑制にも有効な非ウィルス型の癌の遺伝子治療剤を提供することにある。
【解決手段】 GM−CSF遺伝子をコードしたプラスミドを用いて小さなDNA複合体を調製し、マウスに動・静脈内、腹腔内に投与することにより高い治癒効果の得られる、安全な癌遺伝子治療剤を創製する。
【解決手段】 GM−CSF遺伝子をコードしたプラスミドを用いて小さなDNA複合体を調製し、マウスに動・静脈内、腹腔内に投与することにより高い治癒効果の得られる、安全な癌遺伝子治療剤を創製する。
【発明の詳細な説明】
【技術分野】
【0001】
本発明は、プラスミドDNAの複合体からなる、生体内で遺伝子を高発現する遺伝子治療薬に関する。
【背景技術】
【0002】
GM−CSF(Granulocyte Macrophage Colony−Stimulating Factor)は、多能性造血幹細胞に分化を促すサイトカインの一種であり、IL(インターロイキン)−3,5などと協力し、多能性造血幹細胞を骨髄系前駆細胞(CFU−GEMM)に分化させ、これを前期赤芽球系前駆細胞(BFU−E)、顆粒球単球コロニー形成細胞(CFU−GM)、好酸球コロニー形成細胞(CFU−Eo)、好塩基球コロニー形成細胞(CFU−Ba)らに分化させると言われている。更に、CFU−GMを好中球と単球に、CFU−Eoを好酸球に分化させる働きを持つと言われる。
このように主に細胞性免疫の主役である白血球(顆粒球、単球)の分化誘導作用をもつため、免疫賦活や骨髄刺激に用いられている。
【0003】
GM−CSFを用いた癌ワクチン治療の臨床研究は、広く進められており、アメリカにおいては、GM−CSF遺伝子導入腫瘍細胞株を用いた臨床研究が、前立腺癌、肺非小細胞癌、膵癌について検討され、これらの安全性についても確かめられている。日本でも、1998年から東大医科学研究所付属病院で腎癌に対する臨床研究が始まり、GM−CSF遺伝子導入自家腎癌細胞の接種は安全性を有し、患者体内にある程度の抗腫瘍免疫を誘導することが認められた。
【0004】
GM−CSFを導入した腫瘍ワクチン細胞は、免疫細胞を引き付け、免疫細胞がガン細胞表面上の抗原蛋白を認識する。その結果、腫瘍ワクチンが免疫細胞に患者の体内の他のところのがん細胞を探求させ、それらを破壊させる。
さらに最近、GM−CSFの遺伝子を直接生体内に投与し、免疫を賦活化する治療も試みられている。遺伝子のベクター(運搬体)としては、GM−CSFの遺伝子を組み込んだウィルスベクターが用いられ、限定的ではあるがその効果が報告されている。
【0005】
しかし、GM−CSF遺伝子を組み込んだウィルスを生体内に投与しても、抗体による中和のため、その発現は大きく抑制される。
【0006】
転移した癌を治癒するためには、腹腔内や動脈・静脈内投与による広範囲を標的にした治療が必要である。しかし、腹腔内や静脈内に投与すると、その毒性のため大きな副作用がある。さらに、血流中への投与では、ウィルスの肝集積性のため、標的組織・細胞への十分なデリバリーがなされない。そのため、その投与部位は腫瘍局所内に限定され、腹腔内や静脈内へで高い治癒効果を示すものは報告がない。
【0007】
このように、これまで生体への直接的な遺伝子導入は、その多くがウィルスをベクターとして用いて試みられてきた。一部のものはその効果が確認され、2003年にp53遺伝子挿入ウィルス製剤が、また2005年には殺腫瘍ウィルス製剤がいずれも中国FDAに承認された。
一方では、1999年米国のアデノウイルス製剤による死亡事故をはじめ、2002年、フランスでのレトロウイルス製剤による白血病様症状の発症、2007年には米国でアデノ随伴ウィルスの投与直後の被験者の死亡など、重大な副作用が報告され、ウィルスベクターの安全性が問題となっている。
【0008】
そこでこれらにかわる、安全性に関する懸念がなく、効率がよく、免疫原性がなく、また調製が容易である非ウィルス型ベクターとして、カチオン性ポリマー、カチオン性リポソーム、カチオン性脂質などのカチオン性物質が研究されている。
【0009】
しかし、これらのカチオン性ポリマーやカチオン性物質を用いる方法では、DNAとカチオン性物質の複合体が正に荷電しているため、血液細胞及びアルブミンなどの血液成分と相互作用することにより凝集してしまい、細胞への導入の障害となっていた。この問題を解消するために、核酸とカチオン性ポリマーの複合体をヒアルロン酸誘導体で被覆したり(特許文献1:特開2005−176830号公報);カルボキシル基含有側鎖及び糖残基含有側鎖を有するポリエチレングリコール(PEG)で被覆したり(特許文献2:特開2003−231748号公報);遊離カルボン酸ペンダント基を有するPEGを用いて複合体の凝集を防止する(非特許文献1:J.Biomater.Sci.Polymer Edn.,Vol.14,No.6,pp.515−531(2003))といった方法が検討されている。
【0010】
このようにして調製されたDNAとカチオン性物質の複合体は、低い凝集性を示し、また細胞における遺伝子発現も良好である。しかし、このような複合体は、不均一な懸濁液であるため保存性が低く調製後速やかに使用する必要があり、また高濃度で調製すると凝集してしまうため、濃度の調整が困難であり、取り扱いも煩雑であるという欠点があった。また、再現性の良い調製にも難があった。
【0011】
一方、上記のようなDNAとカチオン性物質との複合体を、遺伝子などの導入に用いる場合、複合体のサイズ(粒径)の制御もまた重要である。組織内や血流中に投与した場合、その後の複合体の拡散や、細胞への送達、取り込みの効率がその薬理効果に大きく影響するためである。しかし、一般に、カチオン性ポリマーのようなイオン性高分子を混合して複合体化する場合、高分子の凝集が起こり、非常に大きな粒子や繊維状の複合体ができやすい。
【0012】
これを防ぐには、混合する溶液の濃度を極端に薄くすることが必要である。しかし、遺伝子導入などに利用される製剤では、ある程度以上の濃度が必要であるため、大きな凝集塊の生成を回避できないという問題があった。また、一旦薄い溶液を混合して小さな複合体を形成させた後、濃縮する方法も考えられるが、複合体粒子が速やかに凝集してしまうため、適切な濃縮手段がなかった。
【0013】
そこでこれらの問題を解決するために、生物製剤を容易に輸送可能にし、貯蔵安定性を高めるための一般的方法である凍結乾燥法も検討されていた。しかし、核酸、オリゴ核酸、又はその誘導体とポリカチオン性物質の複合体を凍結乾燥したものでは、凍結乾燥により複合体の構造が破壊されてしまうため、遺伝子導入やオリゴ核酸の導入に用いてもほとんど遺伝子やアンチセンスとしての機能の発現を示さないことが確認されている(非特許文献2:J.Pharm.Sci.,Vol90,pp1445−1455(2001))。
【0014】
これらを解決する手法として、高濃度の単糖や二糖などを加えて凍結乾燥する方法が提唱された(非特許文献3:Biochim Biophys Acta.2000Sep29;1468(1−2):127−138.)。しかし、ここで必要な糖の量は、重量比にしてDNAの500倍から1000倍であり、再水和後の溶液が生理条件よりもはるかに高浸透圧になってしまうことを考えると実用的ではない。また、単糖や二糖自体には、遺伝子発現に対する有利な効果はない。また、再水和後の浸透圧を軽減するために、中性多糖であるデキストランの利用が試みられた(非特許文献4:J.Pharm.Sci.,Vol94,pp1226−1236(2005))。しかし、高分子量のデキストランは遺伝子発現を大きく阻害し、また、低分子量(分子量3000程度)のデキストランを用いた場合、凍結乾燥による凝集を防止するためには、重量比にしてDNAの100倍以上の、かなりの高濃度のデキストランの添加が必要であった(非特許文献4:J.Pharm.Sci.,Vol94,pp1226−1236(2005))。このような凍結乾燥体のin vivoでの利用に際しては、必要なDNA濃度を得るために、凍結乾燥後は少量の水又は溶媒で再水和し、さらに高濃度に濃縮する必要がある。そうすると再水和後のデキストラン濃度は10%を超えてしまい、また凍結乾燥時のDNA濃度、冷却温度なども限定されており、その実用面での応用は困難である。
【0015】
凍結乾燥しても活性が失われず、かつ濃縮可能な製剤法として、ポリアニオンを加えたDNA複合体を用いる方法が開発された(特許文献3:特願2006−138201号)。
【0016】
この技術によって、非ウィルス型の遺伝子デリバリーシステムによる、生体内での高い遺伝子発現が、はじめて可能となった。しかし、その腫瘍細胞における発現率は100%ではない。そのため、p53等の自殺遺伝子を導入しても、腫瘍の完全な、あるいは十分な治癒効果は得られなかった。
【特許文献1】 特開2005−176830号 公報
【特許文献2】 特開2003−231748号 公報
【特許文献3】 特願2006−138201号 公報
【非特許文献1】 J.Biomater.Sci.Polymer Edn.,Vol.14,No.6,pp.515−531(2003)
【非特許文献2】 J.Pharm.Sci.,vol90,pp1445−1455(2001)
【非特許文献3】 Biochim Biophys Acta.2000Sep29;1468(1−2):127−138
【非特許文献4】 J.Pharm.Sci.,vol94,pp1226−1236(2005)
【発明が解決しようとする課題】
【0017】
以上のように、ウィルスベクターは副作用が強く、そのため投与経路も限定され、転移巣を広くターゲットとすることが出来ない。一方、非ウィルスベクターでは発現の効率が比較的低いため、高い治療効果は期待できない。
【0018】
本発明の目的は、これらの問題を解決すべく、より高い抗腫瘍活性を発揮し、かつ癌転移の抑制にも有効な非ウィルス型の癌の遺伝子治療剤を提供することにある。
【課題を解決するための手段】
【0019】
免疫活性化因子GM−CSFは分泌型の因子であり、腫瘍組織内の一部の腫瘍細胞に発現させることが出来れば、分泌されたGM−CSFが免疫細胞を引き付け、免疫細胞がガン細胞表面上の抗原蛋白を認識し、その癌細胞を標的とした免疫系が活性化される。そこで、GM−CSF遺伝子をコードしたプラスミドを用いて上述の小さな三元複合体を調製し、マウスに動・静脈内、腹腔内に投与することにより、高い治癒効果の得られる安全な癌遺伝子治療剤を創製する。
【発明の効果】
【0020】
本発明の核酸乾燥体は、濃度調節が容易で、取り扱いが簡便で、分散性が良く、保存性にも優れている。また、本発明の凍結乾燥体は、アニオン性ポリマーを含むため、使用するに際して溶媒に再水和して懸濁液または希釈液とした際にも、極めて微少なサイズの複合体を含む安定な分散体を、任意の濃度で得ることができる。そして、遺伝子導入に際しても、凝集を起こさずに、細胞に対して効率よく核酸およびその誘導体を導入することができ、かつ局所投与、腹腔内投与、動脈内投与、静脈内投与などの各種投与法によって、良好な治癒効果を示す。
【発明を実施するための最良の形態】
【0021】
本発明の複合体は、GM−CSF遺伝子をコードした核酸、又はその誘導体;カチオン性ポリマー又はカチオン性脂質若しくはそれを含む集合体を含む複合体であり、あるいはさらにアニオン性ポリマーを含む複合体である。本複合体中で核酸、又はその誘導体は、カチオン性ポリマー又はカチオン性脂質若しくはそれを含む集合体とイオン結合による複合体を形成しており、アニオン性ポリマーを加えた場合は、アニオン性ポリマーはカチオン性ポリマー又はカチオン性脂質とイオン結合している。これらは、混合比、混合順序等によっては、主にアニオン性ポリマーで覆われた複合体を形成することができる。
【0022】
本発明の複合体に用いることができるカチオン性ポリマーとしては、正に荷電された分子量が1000〜300万程度の天然由来又は合成高分子であって、水中でDNAと複合体を形成できる官能基を1分子中に複数、好ましくは5個以上有する高分子を使用することができ、このような官能基としては、例えば置換されていてもよいアミノ基若しくはアンモニウム基又はその塩(これらの基は、例えば炭素数1〜6のアルキル基、フェニル基などで単又は多置換されていてもよい)、イミノ基、イミダゾリル基、グアニジノ基などの有機アミノ基を挙げることができる。このようなカチオン性ポリマーとしては、例えば、正に荷電された蛋白質やポリペプチド;正に荷電されたデンドリマー;正に荷電された合成ポリマー;及び正に荷電された多糖類誘導体、又はそれらの塩、並びにそれらの組み合わせが挙げられる。
【0023】
本発明の複合体にカチオン性ポリマーとして用いることができる正に荷電された蛋白質、正に荷電されたポリペプチドの分子量は、好ましくは1000〜50万程度である。このような蛋白質、ポリペプチドとしては、具体的にはプロタミン、ヒストン、HelΔ1、ゼラチンなどのタンパク質及びポリペプチドを例示することができ、また、正に荷電されたアミノ酸残基を含むポリアミノ酸もまた例示することができる。このような正に荷電されたアミノ酸残基を含むポリアミノ酸としては、具体的にはポリ−L−リジン、ポリアルギニン、ポリオルニチンなどを例示することができる。これらの蛋白質、及びポリペプチドの塩としては、塩酸塩、硫酸塩、リン酸塩、ホウ酸塩などを例示することができる。
【0024】
カチオン性ポリマーとして用いることができる上記のような官能基を有する正に荷電されたデンドリマーとは、分岐した分子鎖の末端または内部に、置換されていてもよいアミノ基若しくはアンモニウム基又はその塩(これらの基は、例えば炭素数1〜6のアルキル基、フェニル基などで単又は多置換されていてもよい)を有するデンドリマーであり、その分子量は、好ましくは1000〜50万程度である。デンドリマーとしては、具体的にはポリアミドアミンデンドリマー、ポリリジンデンドリマーなどを例示することができる。また、デンドリマーの塩としては、塩酸塩、硫酸塩、リン酸塩、ホウ酸塩などを例示することができる。
【0025】
カチオン性ポリマーとして用いることができる正に荷電された合成ポリマーは、上記のような、水中でDNAと複合体を形成できる官能基を1分子中に複数、好ましくは5個以上有する合成ポリマーであって、分子量が好ましくは1000〜300万である合成ポリマーである。合成ポリマーとしては具体的には、ポリエチレンイミン(直鎖状ポリエチレンイミン、又はポリ分岐型エチレンイミンを含む)、2−ジメチルアミノエチルメタクリレートの重合体又は共重合体、2−トリメチルアミノエチルメタクリレートの重合体又は共重合体などを例示することができる。合成ポリマーの一例であるポリエチレンイミンの分子量は、好ましくは1000〜50万程度であり、より好ましくは5000〜20万程度であり、もっとも好ましくは1万〜10万程度である。また、ポリエチレンイミンの塩として、塩酸塩、硫酸塩、リン酸塩、ホウ酸塩などを例示することができる。
【0026】
カチオン性ポリマーとして用いることができる正に荷電された多糖類誘導体は、水中でDNAと複合体を形成できる官能基を1分子中に複数、好ましくは5個以上有する、分子量が、好ましくは1000〜300万であり、より好ましくは5000〜500000である多糖類誘導体である。このような多糖類としては、具体的にはキトサン、上記のような官能基を導入したデキストラン誘導体などを例示することができる。これらのうちキトサンの分子量は、好ましくは1000〜50万程度であり、より好ましくは5000〜20万程度であり、もっとも好ましくは1万〜10万程度である。キトサンの塩としては、塩酸塩、酢酸塩などを例示することができる。また、デキストラン誘導体の分子量は、好ましくは3000〜100万である。このようなデキストラン誘導体としては、具体的にはジエチルアミノエチル−デキストランなどを例示することができる。
【0027】
上記のカチオン性ポリマーは、従来正に荷電していないものにアミノ基などの官能基を導入し、正に荷電するようにしたものでも良い。また、通常は正に荷電されていないものであっても、複合体形成時に正に荷電されるものであれば使用可能であり、また、必要により糖鎖、オリゴペプチド、抗体などで更に修飾されていてもよい。
【0028】
本発明の複合体に用いることができるカチオン性脂質(カチオン性コレステロール誘導体を含む)としては、DC−Chol(3β−(N−(N′,N′−ジメチルアミノエタン)カルバモイル)コレステロール)、DDAB(N,N−ジステアリル−N,N−ジメチルアンモニウムブロミド)、DMRI(N−(1,2−ジミリスチルオキシプロパ−3−イル)−N,N−ジメチル−N−ヒドロキシエチルアンモニウムブロミド)、DODAC(N,N−ジオレイル−N,N−ジメチルアンモニウムクロリド)、DOGS(ジヘプタデシルアミドグリシルスペルミジン)、DOSPA(N−(1−(2,3−ジオレイルオキシ)プロピル)−N−(2−(スペルミンカルボキサミド)エチル)−N,N−ジメチルアンモニウムトリフルオロアセタート)、DOTAP(N−(1−(2,3−ジオレオイルオキシ)プロピル)−N,N,N−トリメチルアンモニウムクロリド)、又はDOTMA(N−(1−(2,3−ジオレイルオキシ)プロピル)−N,N,N−トリメチルアンモニウムクロリド)、並びにそれらの組み合わせが挙げられる。
【0029】
また、カチオン性脂質を含む集合体としては、上記カチオン性脂質(たとえばDOSPA)と、例えばDOPE(ジオレオイルホスファチジルエタノールアミン)、コレステロールなどの中性物質を混合したものを使用することができる。例えばカチオン性脂質を含む集合体としては、リポフェクタミン(上記DOSPAとDOPEの3:1w/w混合体リポソーム)、リポフェクチン(上記DOTMAとDOPEの1:1w/w混合体リポソーム)、またはこれらの混合物などを好ましく挙げることができる。
【0030】
本発明の複合体においては、カチオン性ポリマーとしては、ポリエチレンイミン;プロタミン;HelΔ1;ポリアミドアミンデンドリマー、ポリリジンデンドリマーなどのデンドリマー;キトサン;2−ジメチルアミノエチルメタクリレートの重合体又は共重合体;2−トリメチルアミノエチルメタクリレートの重合体又は共重合体などを好ましく用いることができ、ポリエチレンイミン、ポリアミドアミンデンドリマー、ポリリジンデンドリマー、キトサンを特に好ましく用いることができる。また、カチオン性脂質若しくはそれを含む集合体としては、リポフェクタミン(上記DOSPAとDOPEの3:1w/w混合体リポソーム)を好ましくは用いることができる。
【0031】
本発明の複合体において使用するアニオン性ポリマーとしては、分子中にアニオン性基を含む、負に荷電された、分子量が500〜400万程度の天然由来又は合成高分子であって、水中でポリカチオンと複合体を形成できる官能基を1分子中に複数、好ましくは5個以上有する高分子を使用することができ、このような官能基としては、例えばカルボキシル基、−OSO3H基、−SO3H基、リン酸基、及びこれらの塩を挙げることができる。このようなアニオン性ポリマーとしては、両イオン性ポリマーも含まれる。
【0032】
本発明の複合体においては、アニオン性ポリマーとしては、カルボキシル基、−OSO3H基、−SO3H基、リン酸基、及びこれらの塩から選択される官能基を有する多糖類又はその誘導体;負に荷電した側鎖を有するアミノ酸残基を含むポリアミノ酸;カルボキシル側鎖を持つPEG誘導体;カルボキシル基、−OSO3H基、−SO3H基、リン酸基、及びこれらの塩から選択される官能基を有する合成高分子;カルボキシル基、−OSO3H基、−SO3H基、リン酸基、及びこれらの塩から選択される官能基、並びに置換されていてもよいアミノ基若しくはアンモニウム基又はその塩(これらの基は、例えば炭素数1〜6のアルキル基、フェニル基などで単又は多置換されていてもよい)を有する高分子;並びにそれらの組み合わせを用いることができる。
【0033】
本発明の複合体においてアニオン性ポリマーとして用いることができる上記のような官能基を有する多糖類又はその誘導体としては、好ましくはグルコサミノグリカンを用いることができる。このようなグルコサミノグリカンの分子量は、好ましくは1000〜400万、より好ましくは4000〜300万である。このようなグルコサミノグリカンとして、具体的には例えばヒアルロン酸、コンドロイチン、コンドロイチン硫酸、ケラタン硫酸、ヘパリン、デルマタン硫酸などを例示することができる。なかでもヒアルロン酸を好ましく用いることができる。ヒアルロン酸は、その塩又は負に荷電した誘導体としても用いることができる。その分子量は、5,000以上であればよいが、10,000以上が好ましく、10万〜300万がより好ましい。ヒアルロン酸の塩としては、ナトリウム塩、カリウム塩、アンモニウム塩などを例示することができる。また、ヒアルロン酸の誘導体としては、例えば、ヒアルロン酸にポリエチレングリコール、ペプチド、糖、蛋白質、ヨウ酸、抗体又はその一部などを導入することによって得られるものが挙げられ、スペルミン、スペルミジン等を導入し、プラスに荷電した部分を持つ両イオン性の誘導体も含まれる。
【0034】
本発明の複合体においてアニオン性ポリマーとして用いることができる、負に荷電した側鎖を有するアミノ酸残基を含むポリアミノ酸とは、カルボキシル基、−O−SO3H基、−SO3H基、リン酸基、及びこれらの塩などの基を側鎖として有するアミノ酸残基を含む、好ましくは500〜100万の分子量を有するポリアミノ酸である。このようなポリアミノ酸としては、具体的にはポリグルタミン酸、ポリアスパラギン酸などを例示することができる。
【0035】
本発明の複合体においてアニオン性ポリマーとして用いることができるカルボキシル側鎖を持つPEG誘導体とは、PEG1分子当たりカルボキシル側鎖を複数、好ましくは5個以上有する、500以上、好ましくは2,000以上、より好ましくは4,000〜40,000の分子量を有するPEG誘導体である。カルボキシル側鎖を持つPEG誘導体は、その塩又は負に荷電した誘導体としても用いることができる。これらの塩としては、ナトリウム塩、カリウム塩、アンモニウム塩などを例示することができる。このようなPEG誘導体としては、具体的には非特許文献1(J.Biomater.Sci.Polymer Edn.Vol.14,pp515−531(2003))に記載されたPEG誘導体を例示することができる。
【0036】
本発明の複合体においてアニオン性ポリマーとして用いることができるカルボキシル基、−OSO3H基、−SO3H基、リン酸基、及びこれらの塩から選択される官能基を有する合成高分子とは、1分子当たり複数、好ましくは5個以上の、カルボキシル基、−O−SO3H基、−SO3H基、リン酸基、及びこれらの塩から選択される官能基を有する重合体又は共重合体であって、好ましくは500〜400万の分子量を有する重合体又は共重合体である。このような重合体又は共重合体としては、具体的には分子量1000〜300万のアクリル酸又はメタクリル酸の重合体又は共重合体、あるいはポリビニルアルコールの硫酸エステル体、サクシニミジル化ポリ−L−リジンなどを例示することができる。
【0037】
本発明の複合体においてアニオン性ポリマーとして用いることができるカルボキシル基、−OSO3H基、−SO3H基、リン酸基、及びこれらの塩から選択される官能基、並びに置換されていてもよいアミノ基若しくはアンモニウム基又はその塩(これらの基は、例えば炭素数1〜6のアルキル基、フェニル基などで単又は多置換されていてもよい)を有する高分子とは、1分子当たりカルボキシル基、−OSO3H基、−SO3H基、リン酸基、及びこれらの塩から選択される官能基を複数、好ましくは5個以上、並びに上記のように置換されていてもよいアミノ基若しくはアンモニウム基又はその塩を有する、500以上、好ましくは2,000以上、より好ましくは4,000〜40,000の分子量を有する高分子である。このような高分子としては、好ましくは、カルボキシル側鎖とその当量以下の上記のアミノ基若しくはアンモニウム基又はその塩を持つPEG誘導体を挙げることができ、具体的には非特許文献5(Macromol.Biosci.Vol.2,pp251−256(2002))に記載されている方法で調製することができるPEG誘導体を例示することができる。
【0038】
本発明の複合体において用いることができるアニオン性ポリマーは、従来負に荷電していないものにカルボキシル基などの官能基を導入し、負に荷電するようにしたものでも良い。通常は負に荷電されていないものであっても、複合体形成時に負に荷電されるものであれば使用可能であり、また必要により糖鎖、オリゴペプチド、抗体などで更に修飾されていてもよい。
【0039】
本発明の複合体においては、アニオン性ポリマーとしては、ヒアルロン酸、カルボキシル側鎖を持つPEG誘導体、ポリアクリル酸などのアニオン性ポリマー又はそれらの塩を好ましく用いることができ、ヒアルロン酸、カルボキシル側鎖を持つPEG誘導体又はそれらの塩などを特に好ましく用いることができる。
【0040】
また、アニオン性ポリマーとして、核酸導入の標的細胞に対して特異的接着能を有するものを用いることにより、標的細胞に対して特異的に核酸導入を行うことが可能である。例えばアニオン性ポリマーとしてヒアルロン酸を用いる場合、ヒアルロン酸と特異的に結合するCD44などの細胞表面分子を有する細胞を標的とすることができる。また、RGDペプチドを導入したアニオン性ポリマーを用いることにより、多くの種類の腫瘍細胞を標的とすることができ、またガラクトース側鎖を導入したアニオン性ポリマーを用いることにより肝細胞又は肝由来の細胞を標的とすることができる。
【0041】
本発明の複合体において、カチオン性ポリマー又はカチオン性脂質若しくはそれを含む集合体と、アニオン性ポリマーの組み合わせとしては、ポリエチレンイミンとヒアルロン酸;ポリエチレンイミンとカルボキシル側鎖を持つPEG誘導体;DOSPAを含む集合体(例えばリポフェクタミン(DOSPAとDOPEの3:1w/w混合体リポソーム))とヒアルロン酸;DOSPAを含む集合体(例えばリポフェクタミン)とカルボキシル側鎖を持つPEG誘導体を好ましく挙げることができる。
【0042】
本発明の複合体において使用する核酸、又はその誘導体と、カチオン性ポリマー又はカチオン性脂質若しくはそれを含む集合体の各荷電基のモル比(負電荷:正電荷比)は、標的細胞・核酸等・カチオン性ポリマー等の種類により異なるが、1:0.8〜1:100であるとよく、好ましくは1:1〜1:50であり、より好ましくは1:1.2〜1:30である。ここでいう核酸、オリゴ核酸、又はその誘導体と、カチオン性ポリマー又はカチオン性脂質若しくはそれを含む集合体の配合比とは、各荷電基のモル比であり、具体的には核酸、オリゴ核酸、又はその誘導体のリン酸アニオンによる負電荷:カチオン性ポリマー又はカチオン性脂質若しくはそれを含む集合体の正電荷又は正に帯電できる官能基のモル比を指す。
【0043】
本発明の複合体において使用する核酸、又はその誘導体と、アニオン性ポリマーの各荷電基のモル比(負電荷:負電荷比)は、標的細胞・核酸等・アニオン性ポリマーの種類により異なるが、1:0.2〜1:1000であるとよく、好ましくは1:0.2〜1:100であり、より好ましくは1:1〜1:60である。ここでいう核酸、オリゴ核酸、又はその誘導体酸と、アニオン性ポリマーの配合比とは、各荷電基のモル比であり、具体的には核酸、オリゴ核酸、又はその誘導体のリン酸アニオンによる負電荷:アニオン性ポリマーの負電荷又は負に帯電できる官能基のモル比を指す。
【0044】
例えばアニオン性ポリマーとしてヒアルロン酸を用いる場合、核酸とヒアルロン酸との配合比は、1:0.2〜1:1000であるとよく、好ましくは1:0.2〜1:100であり、より好ましくは1:1〜1:60である。
【0045】
例えばアニオン性ポリマーとしてカルボキシル側鎖を持つPEG誘導体を用いる場合、核酸とカルボキシル側鎖を持つPEG誘導体との配合比は、1:0.2〜1:1000であるとよく、好ましくは1:0.2〜1:100であり、より好ましくは1:1〜1:60である。
【0046】
特に、カチオン性ポリマーとしてポリエチレンイミンを、アニオン性ポリマーとしてヒアルロン酸を用いる場合、核酸:ポリエチレンイミン:ヒアルロン酸配合比は、1:2〜60:1〜240、好ましくは1:4〜24:1〜160であり、より好ましくは1:7〜20:2〜60、特に好ましくは1:8〜14:2〜32である。
【0047】
特に、カチオン性ポリマーとしてポリエチレンイミンを、アニオン性ポリマーとしてカルボキシル側鎖を持つPEG誘導体を用いる場合、核酸:ポリエチレンイミン:カルボキシル側鎖を持つPEG誘導体配合比は、1:2〜60:1〜240、好ましくは1:4〜24:2〜160であり、より好ましくは1:7〜20:2〜60、特に好ましくは1:8〜14:4〜32である。
【0048】
特に、カチオン性脂質を含む集合体としてリポフェクタミン(DOSPAとDOPEの3:1w/w混合体リポソーム)を、アニオン性ポリマーとしてヒアルロン酸を用いる場合、核酸:リポフェクタミン:ヒアルロン酸配合比は、1:1〜50:0.2〜240、好ましくは1:1.2〜48:0.2〜160であり、より好ましくは1:1.5〜30:0.5〜60、特に好ましくは1:1.8〜16:1〜32である。
【0049】
特に、カチオン性脂質を含む集合体としてリポフェクタミンを、アニオン性ポリマーとしてカルボキシル側鎖を持つPEG誘導体を用いる場合、核酸:リポフェクタミン:カルボキシル側鎖を持つPEG誘導体配合比は、1:1〜50:0.1〜160、好ましくは1:1.2〜48:0.2〜160であり、より好ましくは1:1.5〜30:0.5〜60特に好ましくは1:1.8〜16:2〜32である。
【0050】
本発明の複合体に含まれる核酸、又はその誘導体;カチオン性ポリマー又はカチオン性脂質若しくはそれを含む集合体;及びアニオン性ポリマーの好ましい配合比は、上述のとおりであるが、核酸などを導入する細胞の数や種類により最適な条件は変動するため、配合比は、当業者が、用いる細胞、核酸等の種類に応じて、適宜決定することができる。
【0051】
本発明の複合体は、上述した核酸、又はその誘導体;カチオン性ポリマー又はカチオン性脂質若しくはそれを含む集合体;及び必要であればアニオン性ポリマーを、上述した配合比で、混合することによって複合体を形成させる工程、必要ならばこれに次いでこれを凍結乾燥する工程によって調製することができる。混合する順序としては、[1]核酸、又はその誘導体;[2]カチオン性ポリマー又はカチオン性脂質若しくはそれを含む集合体、[3]アニオン性ポリマーの順、又は、[1]核酸、又はその誘導体;[2]アニオン性ポリマー、[3]カチオン性ポリマー又はカチオン性脂質若しくはそれを含む集合体の順が好ましい。核酸、又はその誘導体は、カチオン性ポリマー又はカチオン性脂質若しくはそれを含む集合体とイオン結合によって結合し、さらにカチオン性ポリマー又はカチオン性脂質若しくはそれを含む集合体が、アニオン性ポリマーともイオン結合した複合体が形成される。あるいは、各成分の配合組成によっては、このような複合体構造の外殻を主にアニオン性ポリマーが被覆し、負の表面電位を有する態様が形成される
【0052】
次いで、必要であれば得られた複合体を凍結乾燥する。凍結乾燥は、通常の凍結乾燥条件下で行うことができ、例えば減圧下(好ましくは、5〜100mmHg、より好ましくは10mmHg)、外気温−78℃〜60℃、好ましくは−30℃〜40℃で乾燥することによって行うことができる。乾燥に要する時間は、減圧度、溶媒の量によって異なり、通常は1時間〜2日間で完了する。
【0053】
このようにして調製した本発明の複合体は、ヒトや動物に対する各種の遺伝子治療、免疫治療、あるいはGM−CSF遺伝子を導入した実験動物や細胞の作成に利用することができる。凍結乾燥を施した場合には、使用前に本発明の複合体を水、生理食塩水、緩衝液、ブドウ糖溶液、培地液などの溶媒に懸濁又は溶解することにより再水和物としてから用いることができる。再水和に際しては、凍結乾燥体を、例えば核酸、又はその誘導体の100〜10000倍(重量比)の溶媒を用いて懸濁又は稀釈する。凍結乾燥前と異なる量、異なる種類の溶媒を用いることができるため、従来困難であった比較的高濃度の懸濁液や溶液(たとえば1ml中にDNAを1mg含む液)も容易に調製することができる。
【0054】
このようにして再水和した本発明の複合体は、細胞への核酸等の導入に際しては、具体的には、例えば、ウェル中、体外に取り出した標的細胞を、水和した本発明の複合体で処理することにより遺伝子を導入した後、該細胞を生体内に戻して、目的とする遺伝子を発現させるex vivo法(ワクチン療法)、あるいは、in vivo、in situ法などの直接的な遺伝子導入法など、生体細胞への核酸、又はその誘導体の導入に通常用いられる任意の方法を用いることができる。
また、本発明の複合体は、凍結乾燥後、再水和することなく、そのまま核酸等の導入を行う細胞と接触させたり、核酸等の導入を行う動物に皮下移殖する、核酸等の導入の標的である組織内、組織表面、または近傍に移殖するなどの手段によって投与することもできる。
【0055】
本発明の複合体の細胞への適用量は、上述した導入方法、疾患の種類などによって異なるが、例えば核酸、又はその誘導体の量にして、ex vivo法、in situ法では、直径1〜2cmのウェル当たりで0.2〜10μg/104〜7個・細胞、in vivo法では、投与部位によって大きく異なるが、腫瘍内への局所投与では例えば5〜1000μg/cm3・腫瘍、膀胱などの臓器への投与では例えば0.1μg〜100mg/臓器、全身投与では例えば0.1ng〜10mg/Kg・体重とすることができる。
【0056】
生体に直接投与するin vivo法としては、本発明の複合体、または水和させた本発明の凍結乾燥体水和物を、静脈、皮下又は筋肉、腹腔、腫瘍内、腫瘍近傍などへ注射し;鼻腔、口腔、肺などから吸入させ;膀胱内、直腸内に直接注入し;病変部組織ないし近傍の血管内に直接投与し;あるいは、ゲル状物、スポンジなどの多孔体、不織布などに担持させて留置するなど、遺伝子治療技術の如何なる方法も用いることができる。
また、本発明の凍結乾燥体水和物を再水和することなく用いる際においても、上記の量の凍結乾燥体を、上述したようなex vivo法、in situ法、またはin vivo法により、用いることができる。
【0057】
本発明の複合体においては、通常の核酸、又はその誘導体と、カチオン性ポリマー又はカチオン性脂質若しくはそれを含む集合体との複合体が持つ正の荷電を、アニオン性ポリマーが中和すると共に、その中和作用が、生体、細胞への投与後においても保持されていることによって、複合体と、血清タンパク質、血球細胞、細胞外マトリックスなどとによる凝集等の相互作用が阻止され、また、核酸、オリゴ核酸、又はその誘導体の酵素分解が阻止されるため、核酸が細胞に効率的に取り込まれ、その発現効率も高い。
上記より、本発明の複合体は、核酸、又はその誘導体の導入用製剤又は試薬として、あるいは核酸、又はその誘導体の導入用キットとして使用することができる。
【0058】
本発明に使用するプラスミドまたはその誘導体のGM−CSF遺伝子は、対象とする動物種によって、ヒトGM−CSF、マウスGM−CSF、ドッグGM−CSFなどから、効果のあるものを自由に選ぶことが出来る。
【0059】
本発明に使用するプラスミドまたはその誘導体のプロモーターは、対象とする動物種、細胞種によって、サイトメガウィルス由来プロモーター、癌選択性プロモーターなどから、自由に選ぶことが出来る。
【0060】
本発明を、実施例により更に具体的に説明する。なお、これらの実施例は、本発明を説明するためのものであって、本発明を何ら限定するものではない。
【実施例1】
【0061】
マウスGM−CSFの遺伝子をコードしたプラスミド/ポリエチレンイミン(PEI)/ヒアルロン酸(HA)複合体の静脈内注射による皮下移植B16細胞に対する治癒効果
マウスGM−CSFの遺伝子をコードしたプラスミド・PEI・HAからなる三成分の複合体をマウスのメラノーマ細胞由来のB16を皮下に移植したマウスに静脈内投与し、腫瘍増大抑制効果を確認した。
【0062】
HAは、ナカライテスク株式会社の「微生物由来」のヒアルロン酸を用いた。PBSはRoman Industries社製のPhosphate Buffered Salts(Tablet)を蒸留したイオン交換水に溶解したものを用いた。これらは以降の実施例でも同様である。PEIは、Polyscience社製の直鎖状PEI(従来品)(Mw=25000)を用いた。
【0063】
[操作手順]
[1]コマウスGM−CSFの遺伝子をコードしたプラスミドは、以下の通り作成した。
RT(reverse transcriptase)によりマウスリンパ球mRNAよりcDNAを作製し、PCRによりヌクレオタイド21番より480番のところを増幅した。
これをTAクローニングキット(Biodynamics Laboratory Inc.Tokyo)によりプラスミド(pTAC−1−mGM−CSF)に導入し、sequencerによりsequenceを確認した。さらに、BamHI、XhoIによりmGM−CSFを切り出し、同様に酵素処理したpcDNA3.1(+)ベクター(Invitrogen)に導入しプラスミドpcDNA3.1(+)−mGM−CSFを作製した。
[2]細胞培養ディッシュにB16細胞をまき、EMEM培地を用いてインキュベートし、移植用細胞を準備した。
[3]移植する直前に培養した培地を取り除き、10%FBSと25Uのペニシリンと25μgのストレプトマイシンを含むEMEM加え、細胞を剥離した。
[4]7x105個の細胞を5週令の雄のddYマウスの腹部の皮下に移植した。
[5]導入する数日前にマウスGM−CSFの遺伝子をコードしたプラスミド40μgを含む水溶液50μlに、584μgのHAを含む水溶液6500μlを加え、さらにDNAに対する+/−比(電荷モル比)が12となるPEIの50μlの水溶液とように混合し、数回ピペッティングして撹拌し、30分室温で放置後、マイナス30℃で凍結した。その後、凍結乾燥して、本発明の複合体を調製した。
[6][4]で作成した担癌マウスモデルの腫瘍サイズが長径6mm以上になったところで、[5]で調製した凍結乾燥体に5%グルコース溶液200μlを加え、十分に溶解、分散させたものを、マウスの尾静脈内に投与した。
[7]2日〜3日おきに腫瘍のサイズを測定した。
【0064】
[結果]
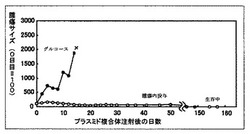
結果を図1に示す。ここで、図中の腫瘍サイズは、(4/3)x短径x長径x長径x3.14として計算したものをDNA複合体投与日のサイズに対する相対値示したものである。
【0065】
ブドウ糖溶液を投与したコントロール群では急激な腫瘍の増大が見られ、マウスは15〜20で死亡したのに対して、マウスGM−CSFの遺伝子をコードしたプラスミド/ポリエチレンイミン(PEI)/ヒアルロン酸(HA)複合体を静脈内投与したマウスでは明確な腫瘍増大抑制が見られ、顕著な延命効果が確認された。
【実施例2】
【0066】
マウスGM−CSFの遺伝子をコードしたプラスミド/ポリエチレンイミン(PEI)/ヒアルロン酸(HA)複合体の腫瘍局所内注射による皮下移植B16細胞に対する治癒効果
マウスGM−CSFの遺伝子をコードしたプラスミド・PEI・HAからなる三成分の複合体をマウスのメラノーマ細胞由来のB16を皮下に移植したマウスに腫瘍局所内投与し、腫瘍増大抑制効果を確認した。
PEIは実施例1と同様、従来品を使用した。
【0067】
[操作手順]
[1]実施例1と同様に担癌モデルマウス、およびマウスGM−CSFの遺伝子をコードしたプラスミド/ポリエチレンイミン(PEI)/ヒアルロン酸(HA)複合体を用意した。
[2][3]で担癌マウスモデルの腫瘍サイズが長径6mm以上になったところで、上記凍結乾燥体に5%グルコース溶液100μlを加え、十分に溶解、分散させたものを、腫瘍組織内に投与した。
[3]2日〜3日おきに腫瘍のサイズを測定した。
【0068】
[結果]
結果を図2に示す。ここで、図中の腫瘍サイズは、(4/3)x短径x長径x長径x3.14として計算したものをDay0のサイズに対する相対値示したものである。
【0069】
ブドウ糖溶液を投与したコントロール群では急激な腫瘍の増大が見られ、マウスは40日前後で死亡したのに対して、マウスGM−CSFの遺伝子をコードしたプラスミド/ポリエチレンイミン(PEI)/ヒアルロン酸(HA)複合体を腫瘍組織内投与したマウスでは腫瘍が完全に消滅し、150日以上経過しても再発は見られなかった。
【実施例3】
【0070】
マウスGM−CSFの遺伝子をコードしたプラスミド/ポリエチレンイミン(PEI)/ヒアルロン酸(HA)複合体の静脈内注射による肺転移B16細胞に対する治癒効果
マウスGM−CSFの遺伝子をコードしたプラスミド・PEI・HAからなる三成分の複合体をマウスのメラノーマ細胞由来のB16を用いて作成した肺転移モデルマウスに静脈内投与し、転移抑制効果を確認した。
PEIは実施例1と同様、従来品を使用した。
【0071】
[操作手順]
[1]実施例1と同様にマウスGM−CSFの遺伝子をコードしたプラスミド/ポリエチレンイミン(PEI)/ヒアルロン酸(HA)複合体を用意した。
[2]実施例1と同様に用意したB16細胞を、マウス一匹あたり約106個の割合で、5週令の雄のddYマウスの尾静脈内に投与した。細胞投与から7日目に、上記凍結乾燥体に5%グルコース溶液200μlを加え、十分に溶解、分散させたものを、マウスの静脈内に投与した。
[3]さらに7日後、マウスの胸部を開き、肺への転移を観察した。
【0072】
[結果]
結果を図3に示す。ブドウ糖溶液を投与したコントロール群では無数の黒色の転移巣が肺一面に見られたのに対し、マウスGM−CSFの遺伝子をコードしたプラスミド/ポリエチレンイミン(PEI)/ヒアルロン酸(HA)複合体を静脈内投与したマウスではわずかな数の転移巣しか検出されなかった。
【実施例4】
【0073】
マウスGM−CSFの遺伝子をコードしたプラスミド/ポリエチレンイミン(PEI)/ヒアルロン酸(HA)複合体の腹腔内注射によるOVHM細胞移植マウスに対する治癒効果
マウスの卵巣癌細胞由来のOVHMを腹腔内に投与して作成した腹腔転移モデルマウスに、マウスGM−CSFの遺伝子をコードしたプラスミド・PEI・HAからなる三成分の複合体を腹腔内投与し、治癒効果を確認した。
PEIはPolyscience社製のPolyethyleneimine“Max”(塩酸塩;Mw=40000)を用いた。
【0074】
[操作手順]
[1]実施例1と同様にマウスGM−CSFの遺伝子をコードしたプラスミド/ポリエチレンイミン(PEI)/ヒアルロン酸(HA)複合体を用意した。
[2]実施例1と同様の手法で用意したOVHM細胞を、マウス一匹あたり106個の割合で、雌の(C57BL/6xC3/He)F1マウスの腹腔内に投与した。
[3]細胞投与から5日目より上記凍結乾燥体にPBS5000μlを加え、十分に溶解、分散させたものを、三日連続で三回マウスの腹腔内に投与し、生存日数を調べた。
【0075】
[結果]
何も投与していないコントロール群では腫瘍移植後18 ±2.1日で死亡した。一方、マウスGM−CSFの遺伝子をコードしたプラスミド/ポリエチレンイミン(PEI)/ヒアルロン酸(HA)複合体を腹腔内投与したマウスは53.5±11.0日の長い生存が確認された。
【実施例5】
【0076】
マウスGM−CSFの遺伝子をコードしたプラスミド/ポリエチレンイミン(PEI)/ヒアルロン酸(HA)複合体の腹腔内注射によるB16細胞移植マウスに対する治癒効果
マウスのメラノーマ細胞由来のB16を腹腔内に投与して作成した腹腔転移モデルマウスに、マウスGMCSFの遺伝子をコードしたプラスミド・PEI・HAからなる三成分の複合体を腹腔内投与し、治癒効果を確認した。
PEIは実施例1と同様、従来品を使用した。
【0077】
[操作手順]
[1]実施例1と同様にマウスGM−CSFの遺伝子をコードしたプラスミド/ポリエチレンイミン(PEI)/ヒアルロン酸(HA)複合体を用意した。
[2]実施例1と同様に用意したB16細胞を、マウス一匹あたり約4x105個の割合で、5週令の雄のddYマウスの腹腔内に投与した。
[3]細胞投与から5日目より上記凍結乾燥体にPBS1000μlを加え、十分に溶解、分散させたものを、中2日で三回マウスの腹腔内に投与し、各部の転移巣を観察しながら、生存日数を調べた。
【0078】
[結果]
コントロール群(PBS1ml投与)では腫瘍移植10〜14日後から刺入部付近に大きな腫瘍が形成し始め、増大した。一方、マウスGM−CSFの遺伝子をコードしたプラスミド/ポリエチレンイミン(PEI)/ヒアルロン酸(HA)複合体を腹腔内投与したマウスではほとんど刺入部の腫瘍形成は見られなかった。
また、コントロール群は腹腔内に腫瘍が出来ていることが触診で分かったが、治癒群には明確な腫瘍の形成は見られなかった。
【図面の簡単な説明】
【0079】
【図1】 マウスGM−CSFの遺伝子をコードしたプラスミド/ポリエチレンイミン(PEI)/ヒアルロン酸(HA)複合体の静脈内注射による皮下移植B16細胞に対する治癒効果
【図2】 マウスGM−CSFの遺伝子をコードしたプラスミド/ポリエチレンイミン(PEI)/ヒアルロン酸(HA)複合体の腫瘍局所内注射による皮下移植B16細胞に対する治癒効果
【図3】 マウスGM−CSFの遺伝子をコードしたプラスミド/ポリエチレンイミン(PEI)/ヒアルロン酸(HA)複合体の静脈内注射による肺転移B16細胞に対する治癒効果
【技術分野】
【0001】
本発明は、プラスミドDNAの複合体からなる、生体内で遺伝子を高発現する遺伝子治療薬に関する。
【背景技術】
【0002】
GM−CSF(Granulocyte Macrophage Colony−Stimulating Factor)は、多能性造血幹細胞に分化を促すサイトカインの一種であり、IL(インターロイキン)−3,5などと協力し、多能性造血幹細胞を骨髄系前駆細胞(CFU−GEMM)に分化させ、これを前期赤芽球系前駆細胞(BFU−E)、顆粒球単球コロニー形成細胞(CFU−GM)、好酸球コロニー形成細胞(CFU−Eo)、好塩基球コロニー形成細胞(CFU−Ba)らに分化させると言われている。更に、CFU−GMを好中球と単球に、CFU−Eoを好酸球に分化させる働きを持つと言われる。
このように主に細胞性免疫の主役である白血球(顆粒球、単球)の分化誘導作用をもつため、免疫賦活や骨髄刺激に用いられている。
【0003】
GM−CSFを用いた癌ワクチン治療の臨床研究は、広く進められており、アメリカにおいては、GM−CSF遺伝子導入腫瘍細胞株を用いた臨床研究が、前立腺癌、肺非小細胞癌、膵癌について検討され、これらの安全性についても確かめられている。日本でも、1998年から東大医科学研究所付属病院で腎癌に対する臨床研究が始まり、GM−CSF遺伝子導入自家腎癌細胞の接種は安全性を有し、患者体内にある程度の抗腫瘍免疫を誘導することが認められた。
【0004】
GM−CSFを導入した腫瘍ワクチン細胞は、免疫細胞を引き付け、免疫細胞がガン細胞表面上の抗原蛋白を認識する。その結果、腫瘍ワクチンが免疫細胞に患者の体内の他のところのがん細胞を探求させ、それらを破壊させる。
さらに最近、GM−CSFの遺伝子を直接生体内に投与し、免疫を賦活化する治療も試みられている。遺伝子のベクター(運搬体)としては、GM−CSFの遺伝子を組み込んだウィルスベクターが用いられ、限定的ではあるがその効果が報告されている。
【0005】
しかし、GM−CSF遺伝子を組み込んだウィルスを生体内に投与しても、抗体による中和のため、その発現は大きく抑制される。
【0006】
転移した癌を治癒するためには、腹腔内や動脈・静脈内投与による広範囲を標的にした治療が必要である。しかし、腹腔内や静脈内に投与すると、その毒性のため大きな副作用がある。さらに、血流中への投与では、ウィルスの肝集積性のため、標的組織・細胞への十分なデリバリーがなされない。そのため、その投与部位は腫瘍局所内に限定され、腹腔内や静脈内へで高い治癒効果を示すものは報告がない。
【0007】
このように、これまで生体への直接的な遺伝子導入は、その多くがウィルスをベクターとして用いて試みられてきた。一部のものはその効果が確認され、2003年にp53遺伝子挿入ウィルス製剤が、また2005年には殺腫瘍ウィルス製剤がいずれも中国FDAに承認された。
一方では、1999年米国のアデノウイルス製剤による死亡事故をはじめ、2002年、フランスでのレトロウイルス製剤による白血病様症状の発症、2007年には米国でアデノ随伴ウィルスの投与直後の被験者の死亡など、重大な副作用が報告され、ウィルスベクターの安全性が問題となっている。
【0008】
そこでこれらにかわる、安全性に関する懸念がなく、効率がよく、免疫原性がなく、また調製が容易である非ウィルス型ベクターとして、カチオン性ポリマー、カチオン性リポソーム、カチオン性脂質などのカチオン性物質が研究されている。
【0009】
しかし、これらのカチオン性ポリマーやカチオン性物質を用いる方法では、DNAとカチオン性物質の複合体が正に荷電しているため、血液細胞及びアルブミンなどの血液成分と相互作用することにより凝集してしまい、細胞への導入の障害となっていた。この問題を解消するために、核酸とカチオン性ポリマーの複合体をヒアルロン酸誘導体で被覆したり(特許文献1:特開2005−176830号公報);カルボキシル基含有側鎖及び糖残基含有側鎖を有するポリエチレングリコール(PEG)で被覆したり(特許文献2:特開2003−231748号公報);遊離カルボン酸ペンダント基を有するPEGを用いて複合体の凝集を防止する(非特許文献1:J.Biomater.Sci.Polymer Edn.,Vol.14,No.6,pp.515−531(2003))といった方法が検討されている。
【0010】
このようにして調製されたDNAとカチオン性物質の複合体は、低い凝集性を示し、また細胞における遺伝子発現も良好である。しかし、このような複合体は、不均一な懸濁液であるため保存性が低く調製後速やかに使用する必要があり、また高濃度で調製すると凝集してしまうため、濃度の調整が困難であり、取り扱いも煩雑であるという欠点があった。また、再現性の良い調製にも難があった。
【0011】
一方、上記のようなDNAとカチオン性物質との複合体を、遺伝子などの導入に用いる場合、複合体のサイズ(粒径)の制御もまた重要である。組織内や血流中に投与した場合、その後の複合体の拡散や、細胞への送達、取り込みの効率がその薬理効果に大きく影響するためである。しかし、一般に、カチオン性ポリマーのようなイオン性高分子を混合して複合体化する場合、高分子の凝集が起こり、非常に大きな粒子や繊維状の複合体ができやすい。
【0012】
これを防ぐには、混合する溶液の濃度を極端に薄くすることが必要である。しかし、遺伝子導入などに利用される製剤では、ある程度以上の濃度が必要であるため、大きな凝集塊の生成を回避できないという問題があった。また、一旦薄い溶液を混合して小さな複合体を形成させた後、濃縮する方法も考えられるが、複合体粒子が速やかに凝集してしまうため、適切な濃縮手段がなかった。
【0013】
そこでこれらの問題を解決するために、生物製剤を容易に輸送可能にし、貯蔵安定性を高めるための一般的方法である凍結乾燥法も検討されていた。しかし、核酸、オリゴ核酸、又はその誘導体とポリカチオン性物質の複合体を凍結乾燥したものでは、凍結乾燥により複合体の構造が破壊されてしまうため、遺伝子導入やオリゴ核酸の導入に用いてもほとんど遺伝子やアンチセンスとしての機能の発現を示さないことが確認されている(非特許文献2:J.Pharm.Sci.,Vol90,pp1445−1455(2001))。
【0014】
これらを解決する手法として、高濃度の単糖や二糖などを加えて凍結乾燥する方法が提唱された(非特許文献3:Biochim Biophys Acta.2000Sep29;1468(1−2):127−138.)。しかし、ここで必要な糖の量は、重量比にしてDNAの500倍から1000倍であり、再水和後の溶液が生理条件よりもはるかに高浸透圧になってしまうことを考えると実用的ではない。また、単糖や二糖自体には、遺伝子発現に対する有利な効果はない。また、再水和後の浸透圧を軽減するために、中性多糖であるデキストランの利用が試みられた(非特許文献4:J.Pharm.Sci.,Vol94,pp1226−1236(2005))。しかし、高分子量のデキストランは遺伝子発現を大きく阻害し、また、低分子量(分子量3000程度)のデキストランを用いた場合、凍結乾燥による凝集を防止するためには、重量比にしてDNAの100倍以上の、かなりの高濃度のデキストランの添加が必要であった(非特許文献4:J.Pharm.Sci.,Vol94,pp1226−1236(2005))。このような凍結乾燥体のin vivoでの利用に際しては、必要なDNA濃度を得るために、凍結乾燥後は少量の水又は溶媒で再水和し、さらに高濃度に濃縮する必要がある。そうすると再水和後のデキストラン濃度は10%を超えてしまい、また凍結乾燥時のDNA濃度、冷却温度なども限定されており、その実用面での応用は困難である。
【0015】
凍結乾燥しても活性が失われず、かつ濃縮可能な製剤法として、ポリアニオンを加えたDNA複合体を用いる方法が開発された(特許文献3:特願2006−138201号)。
【0016】
この技術によって、非ウィルス型の遺伝子デリバリーシステムによる、生体内での高い遺伝子発現が、はじめて可能となった。しかし、その腫瘍細胞における発現率は100%ではない。そのため、p53等の自殺遺伝子を導入しても、腫瘍の完全な、あるいは十分な治癒効果は得られなかった。
【特許文献1】 特開2005−176830号 公報
【特許文献2】 特開2003−231748号 公報
【特許文献3】 特願2006−138201号 公報
【非特許文献1】 J.Biomater.Sci.Polymer Edn.,Vol.14,No.6,pp.515−531(2003)
【非特許文献2】 J.Pharm.Sci.,vol90,pp1445−1455(2001)
【非特許文献3】 Biochim Biophys Acta.2000Sep29;1468(1−2):127−138
【非特許文献4】 J.Pharm.Sci.,vol94,pp1226−1236(2005)
【発明が解決しようとする課題】
【0017】
以上のように、ウィルスベクターは副作用が強く、そのため投与経路も限定され、転移巣を広くターゲットとすることが出来ない。一方、非ウィルスベクターでは発現の効率が比較的低いため、高い治療効果は期待できない。
【0018】
本発明の目的は、これらの問題を解決すべく、より高い抗腫瘍活性を発揮し、かつ癌転移の抑制にも有効な非ウィルス型の癌の遺伝子治療剤を提供することにある。
【課題を解決するための手段】
【0019】
免疫活性化因子GM−CSFは分泌型の因子であり、腫瘍組織内の一部の腫瘍細胞に発現させることが出来れば、分泌されたGM−CSFが免疫細胞を引き付け、免疫細胞がガン細胞表面上の抗原蛋白を認識し、その癌細胞を標的とした免疫系が活性化される。そこで、GM−CSF遺伝子をコードしたプラスミドを用いて上述の小さな三元複合体を調製し、マウスに動・静脈内、腹腔内に投与することにより、高い治癒効果の得られる安全な癌遺伝子治療剤を創製する。
【発明の効果】
【0020】
本発明の核酸乾燥体は、濃度調節が容易で、取り扱いが簡便で、分散性が良く、保存性にも優れている。また、本発明の凍結乾燥体は、アニオン性ポリマーを含むため、使用するに際して溶媒に再水和して懸濁液または希釈液とした際にも、極めて微少なサイズの複合体を含む安定な分散体を、任意の濃度で得ることができる。そして、遺伝子導入に際しても、凝集を起こさずに、細胞に対して効率よく核酸およびその誘導体を導入することができ、かつ局所投与、腹腔内投与、動脈内投与、静脈内投与などの各種投与法によって、良好な治癒効果を示す。
【発明を実施するための最良の形態】
【0021】
本発明の複合体は、GM−CSF遺伝子をコードした核酸、又はその誘導体;カチオン性ポリマー又はカチオン性脂質若しくはそれを含む集合体を含む複合体であり、あるいはさらにアニオン性ポリマーを含む複合体である。本複合体中で核酸、又はその誘導体は、カチオン性ポリマー又はカチオン性脂質若しくはそれを含む集合体とイオン結合による複合体を形成しており、アニオン性ポリマーを加えた場合は、アニオン性ポリマーはカチオン性ポリマー又はカチオン性脂質とイオン結合している。これらは、混合比、混合順序等によっては、主にアニオン性ポリマーで覆われた複合体を形成することができる。
【0022】
本発明の複合体に用いることができるカチオン性ポリマーとしては、正に荷電された分子量が1000〜300万程度の天然由来又は合成高分子であって、水中でDNAと複合体を形成できる官能基を1分子中に複数、好ましくは5個以上有する高分子を使用することができ、このような官能基としては、例えば置換されていてもよいアミノ基若しくはアンモニウム基又はその塩(これらの基は、例えば炭素数1〜6のアルキル基、フェニル基などで単又は多置換されていてもよい)、イミノ基、イミダゾリル基、グアニジノ基などの有機アミノ基を挙げることができる。このようなカチオン性ポリマーとしては、例えば、正に荷電された蛋白質やポリペプチド;正に荷電されたデンドリマー;正に荷電された合成ポリマー;及び正に荷電された多糖類誘導体、又はそれらの塩、並びにそれらの組み合わせが挙げられる。
【0023】
本発明の複合体にカチオン性ポリマーとして用いることができる正に荷電された蛋白質、正に荷電されたポリペプチドの分子量は、好ましくは1000〜50万程度である。このような蛋白質、ポリペプチドとしては、具体的にはプロタミン、ヒストン、HelΔ1、ゼラチンなどのタンパク質及びポリペプチドを例示することができ、また、正に荷電されたアミノ酸残基を含むポリアミノ酸もまた例示することができる。このような正に荷電されたアミノ酸残基を含むポリアミノ酸としては、具体的にはポリ−L−リジン、ポリアルギニン、ポリオルニチンなどを例示することができる。これらの蛋白質、及びポリペプチドの塩としては、塩酸塩、硫酸塩、リン酸塩、ホウ酸塩などを例示することができる。
【0024】
カチオン性ポリマーとして用いることができる上記のような官能基を有する正に荷電されたデンドリマーとは、分岐した分子鎖の末端または内部に、置換されていてもよいアミノ基若しくはアンモニウム基又はその塩(これらの基は、例えば炭素数1〜6のアルキル基、フェニル基などで単又は多置換されていてもよい)を有するデンドリマーであり、その分子量は、好ましくは1000〜50万程度である。デンドリマーとしては、具体的にはポリアミドアミンデンドリマー、ポリリジンデンドリマーなどを例示することができる。また、デンドリマーの塩としては、塩酸塩、硫酸塩、リン酸塩、ホウ酸塩などを例示することができる。
【0025】
カチオン性ポリマーとして用いることができる正に荷電された合成ポリマーは、上記のような、水中でDNAと複合体を形成できる官能基を1分子中に複数、好ましくは5個以上有する合成ポリマーであって、分子量が好ましくは1000〜300万である合成ポリマーである。合成ポリマーとしては具体的には、ポリエチレンイミン(直鎖状ポリエチレンイミン、又はポリ分岐型エチレンイミンを含む)、2−ジメチルアミノエチルメタクリレートの重合体又は共重合体、2−トリメチルアミノエチルメタクリレートの重合体又は共重合体などを例示することができる。合成ポリマーの一例であるポリエチレンイミンの分子量は、好ましくは1000〜50万程度であり、より好ましくは5000〜20万程度であり、もっとも好ましくは1万〜10万程度である。また、ポリエチレンイミンの塩として、塩酸塩、硫酸塩、リン酸塩、ホウ酸塩などを例示することができる。
【0026】
カチオン性ポリマーとして用いることができる正に荷電された多糖類誘導体は、水中でDNAと複合体を形成できる官能基を1分子中に複数、好ましくは5個以上有する、分子量が、好ましくは1000〜300万であり、より好ましくは5000〜500000である多糖類誘導体である。このような多糖類としては、具体的にはキトサン、上記のような官能基を導入したデキストラン誘導体などを例示することができる。これらのうちキトサンの分子量は、好ましくは1000〜50万程度であり、より好ましくは5000〜20万程度であり、もっとも好ましくは1万〜10万程度である。キトサンの塩としては、塩酸塩、酢酸塩などを例示することができる。また、デキストラン誘導体の分子量は、好ましくは3000〜100万である。このようなデキストラン誘導体としては、具体的にはジエチルアミノエチル−デキストランなどを例示することができる。
【0027】
上記のカチオン性ポリマーは、従来正に荷電していないものにアミノ基などの官能基を導入し、正に荷電するようにしたものでも良い。また、通常は正に荷電されていないものであっても、複合体形成時に正に荷電されるものであれば使用可能であり、また、必要により糖鎖、オリゴペプチド、抗体などで更に修飾されていてもよい。
【0028】
本発明の複合体に用いることができるカチオン性脂質(カチオン性コレステロール誘導体を含む)としては、DC−Chol(3β−(N−(N′,N′−ジメチルアミノエタン)カルバモイル)コレステロール)、DDAB(N,N−ジステアリル−N,N−ジメチルアンモニウムブロミド)、DMRI(N−(1,2−ジミリスチルオキシプロパ−3−イル)−N,N−ジメチル−N−ヒドロキシエチルアンモニウムブロミド)、DODAC(N,N−ジオレイル−N,N−ジメチルアンモニウムクロリド)、DOGS(ジヘプタデシルアミドグリシルスペルミジン)、DOSPA(N−(1−(2,3−ジオレイルオキシ)プロピル)−N−(2−(スペルミンカルボキサミド)エチル)−N,N−ジメチルアンモニウムトリフルオロアセタート)、DOTAP(N−(1−(2,3−ジオレオイルオキシ)プロピル)−N,N,N−トリメチルアンモニウムクロリド)、又はDOTMA(N−(1−(2,3−ジオレイルオキシ)プロピル)−N,N,N−トリメチルアンモニウムクロリド)、並びにそれらの組み合わせが挙げられる。
【0029】
また、カチオン性脂質を含む集合体としては、上記カチオン性脂質(たとえばDOSPA)と、例えばDOPE(ジオレオイルホスファチジルエタノールアミン)、コレステロールなどの中性物質を混合したものを使用することができる。例えばカチオン性脂質を含む集合体としては、リポフェクタミン(上記DOSPAとDOPEの3:1w/w混合体リポソーム)、リポフェクチン(上記DOTMAとDOPEの1:1w/w混合体リポソーム)、またはこれらの混合物などを好ましく挙げることができる。
【0030】
本発明の複合体においては、カチオン性ポリマーとしては、ポリエチレンイミン;プロタミン;HelΔ1;ポリアミドアミンデンドリマー、ポリリジンデンドリマーなどのデンドリマー;キトサン;2−ジメチルアミノエチルメタクリレートの重合体又は共重合体;2−トリメチルアミノエチルメタクリレートの重合体又は共重合体などを好ましく用いることができ、ポリエチレンイミン、ポリアミドアミンデンドリマー、ポリリジンデンドリマー、キトサンを特に好ましく用いることができる。また、カチオン性脂質若しくはそれを含む集合体としては、リポフェクタミン(上記DOSPAとDOPEの3:1w/w混合体リポソーム)を好ましくは用いることができる。
【0031】
本発明の複合体において使用するアニオン性ポリマーとしては、分子中にアニオン性基を含む、負に荷電された、分子量が500〜400万程度の天然由来又は合成高分子であって、水中でポリカチオンと複合体を形成できる官能基を1分子中に複数、好ましくは5個以上有する高分子を使用することができ、このような官能基としては、例えばカルボキシル基、−OSO3H基、−SO3H基、リン酸基、及びこれらの塩を挙げることができる。このようなアニオン性ポリマーとしては、両イオン性ポリマーも含まれる。
【0032】
本発明の複合体においては、アニオン性ポリマーとしては、カルボキシル基、−OSO3H基、−SO3H基、リン酸基、及びこれらの塩から選択される官能基を有する多糖類又はその誘導体;負に荷電した側鎖を有するアミノ酸残基を含むポリアミノ酸;カルボキシル側鎖を持つPEG誘導体;カルボキシル基、−OSO3H基、−SO3H基、リン酸基、及びこれらの塩から選択される官能基を有する合成高分子;カルボキシル基、−OSO3H基、−SO3H基、リン酸基、及びこれらの塩から選択される官能基、並びに置換されていてもよいアミノ基若しくはアンモニウム基又はその塩(これらの基は、例えば炭素数1〜6のアルキル基、フェニル基などで単又は多置換されていてもよい)を有する高分子;並びにそれらの組み合わせを用いることができる。
【0033】
本発明の複合体においてアニオン性ポリマーとして用いることができる上記のような官能基を有する多糖類又はその誘導体としては、好ましくはグルコサミノグリカンを用いることができる。このようなグルコサミノグリカンの分子量は、好ましくは1000〜400万、より好ましくは4000〜300万である。このようなグルコサミノグリカンとして、具体的には例えばヒアルロン酸、コンドロイチン、コンドロイチン硫酸、ケラタン硫酸、ヘパリン、デルマタン硫酸などを例示することができる。なかでもヒアルロン酸を好ましく用いることができる。ヒアルロン酸は、その塩又は負に荷電した誘導体としても用いることができる。その分子量は、5,000以上であればよいが、10,000以上が好ましく、10万〜300万がより好ましい。ヒアルロン酸の塩としては、ナトリウム塩、カリウム塩、アンモニウム塩などを例示することができる。また、ヒアルロン酸の誘導体としては、例えば、ヒアルロン酸にポリエチレングリコール、ペプチド、糖、蛋白質、ヨウ酸、抗体又はその一部などを導入することによって得られるものが挙げられ、スペルミン、スペルミジン等を導入し、プラスに荷電した部分を持つ両イオン性の誘導体も含まれる。
【0034】
本発明の複合体においてアニオン性ポリマーとして用いることができる、負に荷電した側鎖を有するアミノ酸残基を含むポリアミノ酸とは、カルボキシル基、−O−SO3H基、−SO3H基、リン酸基、及びこれらの塩などの基を側鎖として有するアミノ酸残基を含む、好ましくは500〜100万の分子量を有するポリアミノ酸である。このようなポリアミノ酸としては、具体的にはポリグルタミン酸、ポリアスパラギン酸などを例示することができる。
【0035】
本発明の複合体においてアニオン性ポリマーとして用いることができるカルボキシル側鎖を持つPEG誘導体とは、PEG1分子当たりカルボキシル側鎖を複数、好ましくは5個以上有する、500以上、好ましくは2,000以上、より好ましくは4,000〜40,000の分子量を有するPEG誘導体である。カルボキシル側鎖を持つPEG誘導体は、その塩又は負に荷電した誘導体としても用いることができる。これらの塩としては、ナトリウム塩、カリウム塩、アンモニウム塩などを例示することができる。このようなPEG誘導体としては、具体的には非特許文献1(J.Biomater.Sci.Polymer Edn.Vol.14,pp515−531(2003))に記載されたPEG誘導体を例示することができる。
【0036】
本発明の複合体においてアニオン性ポリマーとして用いることができるカルボキシル基、−OSO3H基、−SO3H基、リン酸基、及びこれらの塩から選択される官能基を有する合成高分子とは、1分子当たり複数、好ましくは5個以上の、カルボキシル基、−O−SO3H基、−SO3H基、リン酸基、及びこれらの塩から選択される官能基を有する重合体又は共重合体であって、好ましくは500〜400万の分子量を有する重合体又は共重合体である。このような重合体又は共重合体としては、具体的には分子量1000〜300万のアクリル酸又はメタクリル酸の重合体又は共重合体、あるいはポリビニルアルコールの硫酸エステル体、サクシニミジル化ポリ−L−リジンなどを例示することができる。
【0037】
本発明の複合体においてアニオン性ポリマーとして用いることができるカルボキシル基、−OSO3H基、−SO3H基、リン酸基、及びこれらの塩から選択される官能基、並びに置換されていてもよいアミノ基若しくはアンモニウム基又はその塩(これらの基は、例えば炭素数1〜6のアルキル基、フェニル基などで単又は多置換されていてもよい)を有する高分子とは、1分子当たりカルボキシル基、−OSO3H基、−SO3H基、リン酸基、及びこれらの塩から選択される官能基を複数、好ましくは5個以上、並びに上記のように置換されていてもよいアミノ基若しくはアンモニウム基又はその塩を有する、500以上、好ましくは2,000以上、より好ましくは4,000〜40,000の分子量を有する高分子である。このような高分子としては、好ましくは、カルボキシル側鎖とその当量以下の上記のアミノ基若しくはアンモニウム基又はその塩を持つPEG誘導体を挙げることができ、具体的には非特許文献5(Macromol.Biosci.Vol.2,pp251−256(2002))に記載されている方法で調製することができるPEG誘導体を例示することができる。
【0038】
本発明の複合体において用いることができるアニオン性ポリマーは、従来負に荷電していないものにカルボキシル基などの官能基を導入し、負に荷電するようにしたものでも良い。通常は負に荷電されていないものであっても、複合体形成時に負に荷電されるものであれば使用可能であり、また必要により糖鎖、オリゴペプチド、抗体などで更に修飾されていてもよい。
【0039】
本発明の複合体においては、アニオン性ポリマーとしては、ヒアルロン酸、カルボキシル側鎖を持つPEG誘導体、ポリアクリル酸などのアニオン性ポリマー又はそれらの塩を好ましく用いることができ、ヒアルロン酸、カルボキシル側鎖を持つPEG誘導体又はそれらの塩などを特に好ましく用いることができる。
【0040】
また、アニオン性ポリマーとして、核酸導入の標的細胞に対して特異的接着能を有するものを用いることにより、標的細胞に対して特異的に核酸導入を行うことが可能である。例えばアニオン性ポリマーとしてヒアルロン酸を用いる場合、ヒアルロン酸と特異的に結合するCD44などの細胞表面分子を有する細胞を標的とすることができる。また、RGDペプチドを導入したアニオン性ポリマーを用いることにより、多くの種類の腫瘍細胞を標的とすることができ、またガラクトース側鎖を導入したアニオン性ポリマーを用いることにより肝細胞又は肝由来の細胞を標的とすることができる。
【0041】
本発明の複合体において、カチオン性ポリマー又はカチオン性脂質若しくはそれを含む集合体と、アニオン性ポリマーの組み合わせとしては、ポリエチレンイミンとヒアルロン酸;ポリエチレンイミンとカルボキシル側鎖を持つPEG誘導体;DOSPAを含む集合体(例えばリポフェクタミン(DOSPAとDOPEの3:1w/w混合体リポソーム))とヒアルロン酸;DOSPAを含む集合体(例えばリポフェクタミン)とカルボキシル側鎖を持つPEG誘導体を好ましく挙げることができる。
【0042】
本発明の複合体において使用する核酸、又はその誘導体と、カチオン性ポリマー又はカチオン性脂質若しくはそれを含む集合体の各荷電基のモル比(負電荷:正電荷比)は、標的細胞・核酸等・カチオン性ポリマー等の種類により異なるが、1:0.8〜1:100であるとよく、好ましくは1:1〜1:50であり、より好ましくは1:1.2〜1:30である。ここでいう核酸、オリゴ核酸、又はその誘導体と、カチオン性ポリマー又はカチオン性脂質若しくはそれを含む集合体の配合比とは、各荷電基のモル比であり、具体的には核酸、オリゴ核酸、又はその誘導体のリン酸アニオンによる負電荷:カチオン性ポリマー又はカチオン性脂質若しくはそれを含む集合体の正電荷又は正に帯電できる官能基のモル比を指す。
【0043】
本発明の複合体において使用する核酸、又はその誘導体と、アニオン性ポリマーの各荷電基のモル比(負電荷:負電荷比)は、標的細胞・核酸等・アニオン性ポリマーの種類により異なるが、1:0.2〜1:1000であるとよく、好ましくは1:0.2〜1:100であり、より好ましくは1:1〜1:60である。ここでいう核酸、オリゴ核酸、又はその誘導体酸と、アニオン性ポリマーの配合比とは、各荷電基のモル比であり、具体的には核酸、オリゴ核酸、又はその誘導体のリン酸アニオンによる負電荷:アニオン性ポリマーの負電荷又は負に帯電できる官能基のモル比を指す。
【0044】
例えばアニオン性ポリマーとしてヒアルロン酸を用いる場合、核酸とヒアルロン酸との配合比は、1:0.2〜1:1000であるとよく、好ましくは1:0.2〜1:100であり、より好ましくは1:1〜1:60である。
【0045】
例えばアニオン性ポリマーとしてカルボキシル側鎖を持つPEG誘導体を用いる場合、核酸とカルボキシル側鎖を持つPEG誘導体との配合比は、1:0.2〜1:1000であるとよく、好ましくは1:0.2〜1:100であり、より好ましくは1:1〜1:60である。
【0046】
特に、カチオン性ポリマーとしてポリエチレンイミンを、アニオン性ポリマーとしてヒアルロン酸を用いる場合、核酸:ポリエチレンイミン:ヒアルロン酸配合比は、1:2〜60:1〜240、好ましくは1:4〜24:1〜160であり、より好ましくは1:7〜20:2〜60、特に好ましくは1:8〜14:2〜32である。
【0047】
特に、カチオン性ポリマーとしてポリエチレンイミンを、アニオン性ポリマーとしてカルボキシル側鎖を持つPEG誘導体を用いる場合、核酸:ポリエチレンイミン:カルボキシル側鎖を持つPEG誘導体配合比は、1:2〜60:1〜240、好ましくは1:4〜24:2〜160であり、より好ましくは1:7〜20:2〜60、特に好ましくは1:8〜14:4〜32である。
【0048】
特に、カチオン性脂質を含む集合体としてリポフェクタミン(DOSPAとDOPEの3:1w/w混合体リポソーム)を、アニオン性ポリマーとしてヒアルロン酸を用いる場合、核酸:リポフェクタミン:ヒアルロン酸配合比は、1:1〜50:0.2〜240、好ましくは1:1.2〜48:0.2〜160であり、より好ましくは1:1.5〜30:0.5〜60、特に好ましくは1:1.8〜16:1〜32である。
【0049】
特に、カチオン性脂質を含む集合体としてリポフェクタミンを、アニオン性ポリマーとしてカルボキシル側鎖を持つPEG誘導体を用いる場合、核酸:リポフェクタミン:カルボキシル側鎖を持つPEG誘導体配合比は、1:1〜50:0.1〜160、好ましくは1:1.2〜48:0.2〜160であり、より好ましくは1:1.5〜30:0.5〜60特に好ましくは1:1.8〜16:2〜32である。
【0050】
本発明の複合体に含まれる核酸、又はその誘導体;カチオン性ポリマー又はカチオン性脂質若しくはそれを含む集合体;及びアニオン性ポリマーの好ましい配合比は、上述のとおりであるが、核酸などを導入する細胞の数や種類により最適な条件は変動するため、配合比は、当業者が、用いる細胞、核酸等の種類に応じて、適宜決定することができる。
【0051】
本発明の複合体は、上述した核酸、又はその誘導体;カチオン性ポリマー又はカチオン性脂質若しくはそれを含む集合体;及び必要であればアニオン性ポリマーを、上述した配合比で、混合することによって複合体を形成させる工程、必要ならばこれに次いでこれを凍結乾燥する工程によって調製することができる。混合する順序としては、[1]核酸、又はその誘導体;[2]カチオン性ポリマー又はカチオン性脂質若しくはそれを含む集合体、[3]アニオン性ポリマーの順、又は、[1]核酸、又はその誘導体;[2]アニオン性ポリマー、[3]カチオン性ポリマー又はカチオン性脂質若しくはそれを含む集合体の順が好ましい。核酸、又はその誘導体は、カチオン性ポリマー又はカチオン性脂質若しくはそれを含む集合体とイオン結合によって結合し、さらにカチオン性ポリマー又はカチオン性脂質若しくはそれを含む集合体が、アニオン性ポリマーともイオン結合した複合体が形成される。あるいは、各成分の配合組成によっては、このような複合体構造の外殻を主にアニオン性ポリマーが被覆し、負の表面電位を有する態様が形成される
【0052】
次いで、必要であれば得られた複合体を凍結乾燥する。凍結乾燥は、通常の凍結乾燥条件下で行うことができ、例えば減圧下(好ましくは、5〜100mmHg、より好ましくは10mmHg)、外気温−78℃〜60℃、好ましくは−30℃〜40℃で乾燥することによって行うことができる。乾燥に要する時間は、減圧度、溶媒の量によって異なり、通常は1時間〜2日間で完了する。
【0053】
このようにして調製した本発明の複合体は、ヒトや動物に対する各種の遺伝子治療、免疫治療、あるいはGM−CSF遺伝子を導入した実験動物や細胞の作成に利用することができる。凍結乾燥を施した場合には、使用前に本発明の複合体を水、生理食塩水、緩衝液、ブドウ糖溶液、培地液などの溶媒に懸濁又は溶解することにより再水和物としてから用いることができる。再水和に際しては、凍結乾燥体を、例えば核酸、又はその誘導体の100〜10000倍(重量比)の溶媒を用いて懸濁又は稀釈する。凍結乾燥前と異なる量、異なる種類の溶媒を用いることができるため、従来困難であった比較的高濃度の懸濁液や溶液(たとえば1ml中にDNAを1mg含む液)も容易に調製することができる。
【0054】
このようにして再水和した本発明の複合体は、細胞への核酸等の導入に際しては、具体的には、例えば、ウェル中、体外に取り出した標的細胞を、水和した本発明の複合体で処理することにより遺伝子を導入した後、該細胞を生体内に戻して、目的とする遺伝子を発現させるex vivo法(ワクチン療法)、あるいは、in vivo、in situ法などの直接的な遺伝子導入法など、生体細胞への核酸、又はその誘導体の導入に通常用いられる任意の方法を用いることができる。
また、本発明の複合体は、凍結乾燥後、再水和することなく、そのまま核酸等の導入を行う細胞と接触させたり、核酸等の導入を行う動物に皮下移殖する、核酸等の導入の標的である組織内、組織表面、または近傍に移殖するなどの手段によって投与することもできる。
【0055】
本発明の複合体の細胞への適用量は、上述した導入方法、疾患の種類などによって異なるが、例えば核酸、又はその誘導体の量にして、ex vivo法、in situ法では、直径1〜2cmのウェル当たりで0.2〜10μg/104〜7個・細胞、in vivo法では、投与部位によって大きく異なるが、腫瘍内への局所投与では例えば5〜1000μg/cm3・腫瘍、膀胱などの臓器への投与では例えば0.1μg〜100mg/臓器、全身投与では例えば0.1ng〜10mg/Kg・体重とすることができる。
【0056】
生体に直接投与するin vivo法としては、本発明の複合体、または水和させた本発明の凍結乾燥体水和物を、静脈、皮下又は筋肉、腹腔、腫瘍内、腫瘍近傍などへ注射し;鼻腔、口腔、肺などから吸入させ;膀胱内、直腸内に直接注入し;病変部組織ないし近傍の血管内に直接投与し;あるいは、ゲル状物、スポンジなどの多孔体、不織布などに担持させて留置するなど、遺伝子治療技術の如何なる方法も用いることができる。
また、本発明の凍結乾燥体水和物を再水和することなく用いる際においても、上記の量の凍結乾燥体を、上述したようなex vivo法、in situ法、またはin vivo法により、用いることができる。
【0057】
本発明の複合体においては、通常の核酸、又はその誘導体と、カチオン性ポリマー又はカチオン性脂質若しくはそれを含む集合体との複合体が持つ正の荷電を、アニオン性ポリマーが中和すると共に、その中和作用が、生体、細胞への投与後においても保持されていることによって、複合体と、血清タンパク質、血球細胞、細胞外マトリックスなどとによる凝集等の相互作用が阻止され、また、核酸、オリゴ核酸、又はその誘導体の酵素分解が阻止されるため、核酸が細胞に効率的に取り込まれ、その発現効率も高い。
上記より、本発明の複合体は、核酸、又はその誘導体の導入用製剤又は試薬として、あるいは核酸、又はその誘導体の導入用キットとして使用することができる。
【0058】
本発明に使用するプラスミドまたはその誘導体のGM−CSF遺伝子は、対象とする動物種によって、ヒトGM−CSF、マウスGM−CSF、ドッグGM−CSFなどから、効果のあるものを自由に選ぶことが出来る。
【0059】
本発明に使用するプラスミドまたはその誘導体のプロモーターは、対象とする動物種、細胞種によって、サイトメガウィルス由来プロモーター、癌選択性プロモーターなどから、自由に選ぶことが出来る。
【0060】
本発明を、実施例により更に具体的に説明する。なお、これらの実施例は、本発明を説明するためのものであって、本発明を何ら限定するものではない。
【実施例1】
【0061】
マウスGM−CSFの遺伝子をコードしたプラスミド/ポリエチレンイミン(PEI)/ヒアルロン酸(HA)複合体の静脈内注射による皮下移植B16細胞に対する治癒効果
マウスGM−CSFの遺伝子をコードしたプラスミド・PEI・HAからなる三成分の複合体をマウスのメラノーマ細胞由来のB16を皮下に移植したマウスに静脈内投与し、腫瘍増大抑制効果を確認した。
【0062】
HAは、ナカライテスク株式会社の「微生物由来」のヒアルロン酸を用いた。PBSはRoman Industries社製のPhosphate Buffered Salts(Tablet)を蒸留したイオン交換水に溶解したものを用いた。これらは以降の実施例でも同様である。PEIは、Polyscience社製の直鎖状PEI(従来品)(Mw=25000)を用いた。
【0063】
[操作手順]
[1]コマウスGM−CSFの遺伝子をコードしたプラスミドは、以下の通り作成した。
RT(reverse transcriptase)によりマウスリンパ球mRNAよりcDNAを作製し、PCRによりヌクレオタイド21番より480番のところを増幅した。
これをTAクローニングキット(Biodynamics Laboratory Inc.Tokyo)によりプラスミド(pTAC−1−mGM−CSF)に導入し、sequencerによりsequenceを確認した。さらに、BamHI、XhoIによりmGM−CSFを切り出し、同様に酵素処理したpcDNA3.1(+)ベクター(Invitrogen)に導入しプラスミドpcDNA3.1(+)−mGM−CSFを作製した。
[2]細胞培養ディッシュにB16細胞をまき、EMEM培地を用いてインキュベートし、移植用細胞を準備した。
[3]移植する直前に培養した培地を取り除き、10%FBSと25Uのペニシリンと25μgのストレプトマイシンを含むEMEM加え、細胞を剥離した。
[4]7x105個の細胞を5週令の雄のddYマウスの腹部の皮下に移植した。
[5]導入する数日前にマウスGM−CSFの遺伝子をコードしたプラスミド40μgを含む水溶液50μlに、584μgのHAを含む水溶液6500μlを加え、さらにDNAに対する+/−比(電荷モル比)が12となるPEIの50μlの水溶液とように混合し、数回ピペッティングして撹拌し、30分室温で放置後、マイナス30℃で凍結した。その後、凍結乾燥して、本発明の複合体を調製した。
[6][4]で作成した担癌マウスモデルの腫瘍サイズが長径6mm以上になったところで、[5]で調製した凍結乾燥体に5%グルコース溶液200μlを加え、十分に溶解、分散させたものを、マウスの尾静脈内に投与した。
[7]2日〜3日おきに腫瘍のサイズを測定した。
【0064】
[結果]
結果を図1に示す。ここで、図中の腫瘍サイズは、(4/3)x短径x長径x長径x3.14として計算したものをDNA複合体投与日のサイズに対する相対値示したものである。
【0065】
ブドウ糖溶液を投与したコントロール群では急激な腫瘍の増大が見られ、マウスは15〜20で死亡したのに対して、マウスGM−CSFの遺伝子をコードしたプラスミド/ポリエチレンイミン(PEI)/ヒアルロン酸(HA)複合体を静脈内投与したマウスでは明確な腫瘍増大抑制が見られ、顕著な延命効果が確認された。
【実施例2】
【0066】
マウスGM−CSFの遺伝子をコードしたプラスミド/ポリエチレンイミン(PEI)/ヒアルロン酸(HA)複合体の腫瘍局所内注射による皮下移植B16細胞に対する治癒効果
マウスGM−CSFの遺伝子をコードしたプラスミド・PEI・HAからなる三成分の複合体をマウスのメラノーマ細胞由来のB16を皮下に移植したマウスに腫瘍局所内投与し、腫瘍増大抑制効果を確認した。
PEIは実施例1と同様、従来品を使用した。
【0067】
[操作手順]
[1]実施例1と同様に担癌モデルマウス、およびマウスGM−CSFの遺伝子をコードしたプラスミド/ポリエチレンイミン(PEI)/ヒアルロン酸(HA)複合体を用意した。
[2][3]で担癌マウスモデルの腫瘍サイズが長径6mm以上になったところで、上記凍結乾燥体に5%グルコース溶液100μlを加え、十分に溶解、分散させたものを、腫瘍組織内に投与した。
[3]2日〜3日おきに腫瘍のサイズを測定した。
【0068】
[結果]
結果を図2に示す。ここで、図中の腫瘍サイズは、(4/3)x短径x長径x長径x3.14として計算したものをDay0のサイズに対する相対値示したものである。
【0069】
ブドウ糖溶液を投与したコントロール群では急激な腫瘍の増大が見られ、マウスは40日前後で死亡したのに対して、マウスGM−CSFの遺伝子をコードしたプラスミド/ポリエチレンイミン(PEI)/ヒアルロン酸(HA)複合体を腫瘍組織内投与したマウスでは腫瘍が完全に消滅し、150日以上経過しても再発は見られなかった。
【実施例3】
【0070】
マウスGM−CSFの遺伝子をコードしたプラスミド/ポリエチレンイミン(PEI)/ヒアルロン酸(HA)複合体の静脈内注射による肺転移B16細胞に対する治癒効果
マウスGM−CSFの遺伝子をコードしたプラスミド・PEI・HAからなる三成分の複合体をマウスのメラノーマ細胞由来のB16を用いて作成した肺転移モデルマウスに静脈内投与し、転移抑制効果を確認した。
PEIは実施例1と同様、従来品を使用した。
【0071】
[操作手順]
[1]実施例1と同様にマウスGM−CSFの遺伝子をコードしたプラスミド/ポリエチレンイミン(PEI)/ヒアルロン酸(HA)複合体を用意した。
[2]実施例1と同様に用意したB16細胞を、マウス一匹あたり約106個の割合で、5週令の雄のddYマウスの尾静脈内に投与した。細胞投与から7日目に、上記凍結乾燥体に5%グルコース溶液200μlを加え、十分に溶解、分散させたものを、マウスの静脈内に投与した。
[3]さらに7日後、マウスの胸部を開き、肺への転移を観察した。
【0072】
[結果]
結果を図3に示す。ブドウ糖溶液を投与したコントロール群では無数の黒色の転移巣が肺一面に見られたのに対し、マウスGM−CSFの遺伝子をコードしたプラスミド/ポリエチレンイミン(PEI)/ヒアルロン酸(HA)複合体を静脈内投与したマウスではわずかな数の転移巣しか検出されなかった。
【実施例4】
【0073】
マウスGM−CSFの遺伝子をコードしたプラスミド/ポリエチレンイミン(PEI)/ヒアルロン酸(HA)複合体の腹腔内注射によるOVHM細胞移植マウスに対する治癒効果
マウスの卵巣癌細胞由来のOVHMを腹腔内に投与して作成した腹腔転移モデルマウスに、マウスGM−CSFの遺伝子をコードしたプラスミド・PEI・HAからなる三成分の複合体を腹腔内投与し、治癒効果を確認した。
PEIはPolyscience社製のPolyethyleneimine“Max”(塩酸塩;Mw=40000)を用いた。
【0074】
[操作手順]
[1]実施例1と同様にマウスGM−CSFの遺伝子をコードしたプラスミド/ポリエチレンイミン(PEI)/ヒアルロン酸(HA)複合体を用意した。
[2]実施例1と同様の手法で用意したOVHM細胞を、マウス一匹あたり106個の割合で、雌の(C57BL/6xC3/He)F1マウスの腹腔内に投与した。
[3]細胞投与から5日目より上記凍結乾燥体にPBS5000μlを加え、十分に溶解、分散させたものを、三日連続で三回マウスの腹腔内に投与し、生存日数を調べた。
【0075】
[結果]
何も投与していないコントロール群では腫瘍移植後18 ±2.1日で死亡した。一方、マウスGM−CSFの遺伝子をコードしたプラスミド/ポリエチレンイミン(PEI)/ヒアルロン酸(HA)複合体を腹腔内投与したマウスは53.5±11.0日の長い生存が確認された。
【実施例5】
【0076】
マウスGM−CSFの遺伝子をコードしたプラスミド/ポリエチレンイミン(PEI)/ヒアルロン酸(HA)複合体の腹腔内注射によるB16細胞移植マウスに対する治癒効果
マウスのメラノーマ細胞由来のB16を腹腔内に投与して作成した腹腔転移モデルマウスに、マウスGMCSFの遺伝子をコードしたプラスミド・PEI・HAからなる三成分の複合体を腹腔内投与し、治癒効果を確認した。
PEIは実施例1と同様、従来品を使用した。
【0077】
[操作手順]
[1]実施例1と同様にマウスGM−CSFの遺伝子をコードしたプラスミド/ポリエチレンイミン(PEI)/ヒアルロン酸(HA)複合体を用意した。
[2]実施例1と同様に用意したB16細胞を、マウス一匹あたり約4x105個の割合で、5週令の雄のddYマウスの腹腔内に投与した。
[3]細胞投与から5日目より上記凍結乾燥体にPBS1000μlを加え、十分に溶解、分散させたものを、中2日で三回マウスの腹腔内に投与し、各部の転移巣を観察しながら、生存日数を調べた。
【0078】
[結果]
コントロール群(PBS1ml投与)では腫瘍移植10〜14日後から刺入部付近に大きな腫瘍が形成し始め、増大した。一方、マウスGM−CSFの遺伝子をコードしたプラスミド/ポリエチレンイミン(PEI)/ヒアルロン酸(HA)複合体を腹腔内投与したマウスではほとんど刺入部の腫瘍形成は見られなかった。
また、コントロール群は腹腔内に腫瘍が出来ていることが触診で分かったが、治癒群には明確な腫瘍の形成は見られなかった。
【図面の簡単な説明】
【0079】
【図1】 マウスGM−CSFの遺伝子をコードしたプラスミド/ポリエチレンイミン(PEI)/ヒアルロン酸(HA)複合体の静脈内注射による皮下移植B16細胞に対する治癒効果
【図2】 マウスGM−CSFの遺伝子をコードしたプラスミド/ポリエチレンイミン(PEI)/ヒアルロン酸(HA)複合体の腫瘍局所内注射による皮下移植B16細胞に対する治癒効果
【図3】 マウスGM−CSFの遺伝子をコードしたプラスミド/ポリエチレンイミン(PEI)/ヒアルロン酸(HA)複合体の静脈内注射による肺転移B16細胞に対する治癒効果
【特許請求の範囲】
【請求項1】
GM−CSF遺伝子をコードしたプラスミドまたはその誘導体とカチオン性ポリマー又はカチオン性脂質若しくはそれを含む集合体を用いた癌治療剤
【請求項2】
請求項1に記載された治療剤で、さらにアニオン性ポリマーを含むもの。
【請求項3】
請求項2に記載された治療剤で、凍結乾燥を施したもの。
【請求項4】
請求項1に記載された治療剤で、カチオン性ポリマーが、ポリエチレンイミン(直鎖状ポリエチレンイミン、又はポリ分岐型エチレンイミンを含む)、2−ジメチルアミノエチルメタクリレートの重合体又は共重合体、2−トリメチルアミノエチルメタクリレートの重合体又は共重合体、ポリアミドアミンデンドリマー、ポリリジンデンドリマー、プロタミン、ヒストン、HelΔ1、ゼラチン、ポリ−L−リジン、ポリアルギニン、ポリオルニチン、及びその塩であるもの、およびカチオン性脂質若しくはそれを含む集合体カチオン性脂質(カチオン性コレステロール誘導体を含む)が、DC−Chol(3β−(N−(N′,N′−ジメチルアミノエタン)カルバモイル)コレステロール)、DDAB(N,N−ジステアリル−N,N−ジメチルアンモニウムブロミド)、DMRI(N−(1,2−ジミリスチルオキシプロパ−3−イル)−N,N−ジメチル−N−ヒドロキシエチルアンモニウムブロミド)、DODAC(N,N−ジオレイル−N,N−ジメチルアンモニウムクロリド)、DOGS(ジヘプタデシルアミドグリシルスペルミジン)、DOSPA(N−(1−(2,3−ジオレイルオキシ)プロピル)−N−(2−(スペルミンカルボキサミド)エチル)−N,N−ジメチルアンモニウムトリフルオロアセタート)、DOTAP(N−(1−(2,3−ジオレオイルオキシ)プロピル)−N,N,N−トリメチルアンモニウムクロリド)、又はDOTMA(N−(1−(2,3−ジオレイルオキシ)プロピル)−N,N,N−トリメチルアンモニウムクロリド)、並びにそれらの組み合わせであるもの。
【請求項5】
請求項2に記載された治療剤で、アニオン性ポリマーが、カルボキシル側鎖を持つPEG誘導体、アクリル酸又はメタクリル酸の重合体又は共重合体、ポリビニルアルコールの硫酸エステル体、サクシニミジル化ポリ−L−リジン、ポリグルタミン酸、ポリアスパラギン酸、ヒアルロン酸、コンドロイチン、コンドロイチン硫酸、ケラタン硫酸、ヘパリン、デルマタン硫酸またはその誘導体、及びその塩であるもの。
【請求項1】
GM−CSF遺伝子をコードしたプラスミドまたはその誘導体とカチオン性ポリマー又はカチオン性脂質若しくはそれを含む集合体を用いた癌治療剤
【請求項2】
請求項1に記載された治療剤で、さらにアニオン性ポリマーを含むもの。
【請求項3】
請求項2に記載された治療剤で、凍結乾燥を施したもの。
【請求項4】
請求項1に記載された治療剤で、カチオン性ポリマーが、ポリエチレンイミン(直鎖状ポリエチレンイミン、又はポリ分岐型エチレンイミンを含む)、2−ジメチルアミノエチルメタクリレートの重合体又は共重合体、2−トリメチルアミノエチルメタクリレートの重合体又は共重合体、ポリアミドアミンデンドリマー、ポリリジンデンドリマー、プロタミン、ヒストン、HelΔ1、ゼラチン、ポリ−L−リジン、ポリアルギニン、ポリオルニチン、及びその塩であるもの、およびカチオン性脂質若しくはそれを含む集合体カチオン性脂質(カチオン性コレステロール誘導体を含む)が、DC−Chol(3β−(N−(N′,N′−ジメチルアミノエタン)カルバモイル)コレステロール)、DDAB(N,N−ジステアリル−N,N−ジメチルアンモニウムブロミド)、DMRI(N−(1,2−ジミリスチルオキシプロパ−3−イル)−N,N−ジメチル−N−ヒドロキシエチルアンモニウムブロミド)、DODAC(N,N−ジオレイル−N,N−ジメチルアンモニウムクロリド)、DOGS(ジヘプタデシルアミドグリシルスペルミジン)、DOSPA(N−(1−(2,3−ジオレイルオキシ)プロピル)−N−(2−(スペルミンカルボキサミド)エチル)−N,N−ジメチルアンモニウムトリフルオロアセタート)、DOTAP(N−(1−(2,3−ジオレオイルオキシ)プロピル)−N,N,N−トリメチルアンモニウムクロリド)、又はDOTMA(N−(1−(2,3−ジオレイルオキシ)プロピル)−N,N,N−トリメチルアンモニウムクロリド)、並びにそれらの組み合わせであるもの。
【請求項5】
請求項2に記載された治療剤で、アニオン性ポリマーが、カルボキシル側鎖を持つPEG誘導体、アクリル酸又はメタクリル酸の重合体又は共重合体、ポリビニルアルコールの硫酸エステル体、サクシニミジル化ポリ−L−リジン、ポリグルタミン酸、ポリアスパラギン酸、ヒアルロン酸、コンドロイチン、コンドロイチン硫酸、ケラタン硫酸、ヘパリン、デルマタン硫酸またはその誘導体、及びその塩であるもの。
【図1】


【図2】


【図3】




【図2】


【図3】


【公開番号】特開2010−116383(P2010−116383A)
【公開日】平成22年5月27日(2010.5.27)
【国際特許分類】
【出願番号】特願2008−315041(P2008−315041)
【出願日】平成20年11月14日(2008.11.14)
【出願人】(508363225)株式会社アルファ・ナノ・メディカ (4)
【Fターム(参考)】
【公開日】平成22年5月27日(2010.5.27)
【国際特許分類】
【出願日】平成20年11月14日(2008.11.14)
【出願人】(508363225)株式会社アルファ・ナノ・メディカ (4)
【Fターム(参考)】
[ Back to top ]

