遺伝子検出方法
【課題】 電気的活性基を有する有機金属錯体を用いる手段によって、電極上での電子の授受を効率良く行わせる事が可能な方法を提供する。さらに、本発明は前記電気化学的な測定は、電極に対して電圧を印加し前記電気化学的に活性である物質による電気化学発光量の測定を提供する。
【解決手段】 電気化学発光法において、フェロセンに代表される有機金属錯体による自己組織化膜を用いた発光は、金電極のみで発光させるよりも高効率に発光を行わせる事が可能となる。
【解決手段】 電気化学発光法において、フェロセンに代表される有機金属錯体による自己組織化膜を用いた発光は、金電極のみで発光させるよりも高効率に発光を行わせる事が可能となる。
【発明の詳細な説明】
【技術分野】
【0001】
本発明は、試料中に存在する特定の遺伝子配列を、高感度に検出するための遺伝子検出方法に関する。
【背景技術】
【0002】
従来の、電気化学的に特定の遺伝子配列を検出するDNAチップは、検出すべき目的遺伝子に対して相補的な塩基配列を有する一本鎖の核酸プローブを電極表面に固定化し、該核酸プローブと一本鎖に変性された目的遺伝子サンプルとをハイブリダイズさせた後、該核酸プローブと目的遺伝子サンプルとで形成された二本鎖核酸に特異的に結合し且つ電気化学的に活性な標識剤を、該核酸プローブと遺伝子サンプルとの反応系に添加し、電極を介した電気化学的な測定により、前記二本鎖核酸に結合した標識剤を検出することで、目的遺伝子サンプルとハイブリダイズした前記核酸プローブを検出し、目的とする遺伝子の存在を確認する(例えば、特許文献1及び特許文献2参照)。
【0003】
ここで、前記標識剤とは、前記二本鎖の核酸を認識して、該二本鎖核酸と特異的に結合する物質を指す。前記標識剤は、何れも分子中にフェニル基等の平板状挿入基を有し、該挿入基が二本鎖核酸の塩基対と塩基対との間に挿入することによって、二本鎖核酸と結合する。この標識剤と二本鎖核酸との結合は、静電気的相互作用あるいは疎水的相互作用での結合であって、前記標識剤の二本鎖核酸の塩基対間への挿入、及びその塩基対間からの離脱が一定の速度で繰り返される平衡反応による結合である。
【0004】
また、従来生化学アッセイに用いられる光の測定法には、吸光・蛍光法や発光法等がある。この内発光法による測定は、高感度に測定が可能であることが知られている。この内電気エネルギーによって励起され発光する現象を、電気化学発光と呼ぶ。電気化学発光する物質としてルテニウム錯体やオスミウム錯体が挙げられる。電気化学発光の反応は、例えば電気化学発光を示す代表的な物質にルテニウムビピリジル錯体(Ru(bpy)3)2+ がある。電気化学発光の作用機序は、電極上でトリプロピルアミン等によりラジカルを発生させ、ルテニウムビピリジル錯体に電子を渡し、励起状態(Ru(bpy)3)3+となり、基底状態(Ru(bpy)3)2+に戻る時に発光を生じる(例えば、非特許文献1及び非特許文献2参照)。この様に電気化学発光は、電気化学エネルギーにより発光種を励起し、その励起状態が放射失括する際に可視光線を放出する。発光種の励起には電気化学エネルギーを利用するため、吸光法や蛍光法に比べバックグランドノイズを減らすことが可能である。このため、電気化学発光法は、吸光法や蛍光法よりも高感度に測定が可能となる。電気化学発光による測定は、DNA等の核酸測定や、抗原や抗体の測定として種々のアッセイに利用されつつある(例えば、特許文献3参照)。しかし電気化学発光は、電気二重層と呼ばれる電極表面から数nmの領域といった非常に狭い範囲で行われるため、電気化学発光物質の利用効率が悪いという課題があった。
【特許文献1】特開平5−199898号公報
【特許文献2】特開平9−288080号公報
【特許文献3】特開2002−34561号公報
【非特許文献1】Anal.Chem.,2004,76,5379−5386
【非特許文献2】Chem.Rev.,2004,104,3003−3036
【発明の開示】
【発明が解決しようとする課題】
【0005】
従来、電気化学発光を行う場合では、電極付近で電子の授受を行わせる必要があり、電子の授受が可能な領域は電気二重層と呼ばれる非常に狭い範囲であった。本発明は、電気的活性基を有する有機金属錯体を用いる事により、電極上での電子の授受を効率良く行わせる事が可能な方法を提供することである。
【課題を解決するための手段】
【0006】
前記課題を解決するため、本発明の遺伝子検出方法は、特定の配列を有する遺伝子を検出する遺伝子検出方法であって、前記検出すべき遺伝子配列に対して相補的な塩基配列を有する一本鎖の捕捉プローブを作製し、該捕捉プローブを固相に固定化する固定化工程と、
前記検出すべき遺伝子を一本鎖に変性して遺伝子サンプルを作製する遺伝子サンプル作製工程と、前記遺伝子サンプルに電気化学的に活性である物質を添加し、前記遺伝子サンプルと該電気化学的に活性である物質とを化学結合させる、電気化学的に活性である物質結合遺伝子サンプル作製工程と、前記電気化学的に活性である物質が結合した遺伝子サンプルと前記固相に固定された一本鎖の捕捉プローブとをハイブリダイズさせ、前記遺伝子サンプルを前記固相に捕捉させる遺伝子サンプル捕捉工程と、前記固相に固定された前記遺伝子サンプルに結合した前記電気化学的に活性である物質を、電気化学的な測定により検出する検出工程と、を含むものである。
【0007】
これにより、前記遺伝子サンプルが微量でも電気化学的に活性である物質を複数結合させることができるので、高感度検出が可能となる。また、検体ごとに標識プローブの設計を行う必要もなくなる。
【0008】
また、本発明の遺伝子検出方法は、検体試料中の特定の配列を有する遺伝子を検出する遺伝子検出方法であって、前記検出すべき遺伝子を一本鎖に変性して遺伝子サンプルを作製する遺伝子サンプル作製工程と、前記遺伝子サンプルに電気化学的に活性である物質を添加し、前記遺伝子サンプルと該電気化学的に活性である物質とを化学結合させる、電気化学的に活性である物質結合遺伝子サンプル作製工程と、前記検出すべき遺伝子配列に対して相補的な塩基配列を有する一本鎖の捕捉プローブを作製し、前記電気化学的に活性である物質が結合した遺伝子サンプルとハイブリダイズさせ、二本鎖核酸を形成する二本鎖核酸形成工程と、前記二本鎖核酸を形成した捕捉プローブを固相に固定化する固定化工程と、前記固相に固定された前記遺伝子サンプルに結合した前記電気化学的に活性である物質を、電気化学的な測定により検出する検出工程と、を含むものである。
【0009】
これにより、前記遺伝子サンプルが微量でも電気化学的に活性である物質を複数結合させることができるので、高感度検出が可能となる。また、検体ごとに標識プローブの設計を行う必要もなくなる。
【0010】
さらに、本発明の遺伝子検出方法は、前記電気的活性基を有する有機金属錯体は、フェロセン分子であるものである。
【0011】
さらに、本発明の遺伝子検出方法は、前記電気的活性基を有する有機金属錯体は、電気的活性基を有する分子とチオール分子からなり、チオール分子により電極上に自己組織化膜を形成するものである。
【0012】
さらに、本発明の遺伝子検出方法は、電気的活性基を有する分子とチオール分子は、メチレン基(−CH2−)nをスペーサーとし、n数は2〜11であるものである。電気化学発光は酸化還元性を有する化合物である。
【0013】
さらに、本発明の遺伝子検出方法は、前記酸化還元性を有する化合物は、電気化学発光を示す化合物である。
【0014】
さらに、本発明の遺伝子検出方法は、前記電気化学発光を示す化合物は、配位子に複素環系化合物を有する金属錯体、ルブレン、アントラセン、コロネン、ピレン、フルオランテン、クリセン、フェナントレン、ペリレン、ビナフチル、あるいはオクタテトラエンのいずれかである。
【0015】
さらに、本発明の遺伝子検出方法は、前記配位子に複素環系化合物を有する金属錯体は、配位子にピリジン部位を有する金属錯体である。
【0016】
さらに、本発明の遺伝子検出方法は、前記配位子にピリジン部位を有する金属錯体は、金属ビピリジン錯体、あるいは金属フェナントロリン錯体のいずれかであるものである。
【0017】
さらに、本発明の遺伝子検出方法は、前記電気化学発光を示す化合物は、金属錯体である。
【0018】
さらに、本発明の遺伝子検出方法は、前記金属錯体の中心金属は、ルテニウム、あるいはオスニウムのいずれかである。
【0019】
さらに、本発明の遺伝子検出方法は、ルテニウムを有する有機金属錯体を、核酸またはタンパク質にラベル化することにより、電気化学発光量によりラベル化された核酸量またはタンパク質を定量する。
【0020】
さらに、本発明の遺伝子検出方法は、前記磁気ビーズの粒径が、1nm以上、前記磁気ビーズの平均粒径以下(もしくは500nm以下)である。
【発明の効果】
【0021】
本発明の遺伝子検出方法によれば、電気化学測定の際に、電解液に分散した導電性物質を介して、電気二重層領域が電極表面から離れた部分にも広がり、電極表面に接触していない電気化学発光物質でも電気化学反応が起きるため、電気化学発光物質の利用効率を高めることが可能となる。
【発明を実施するための最良の形態】
【0022】
以下に、本発明の遺伝子検出方法について詳細に説明する。なお、以下の実施の形態における遺伝子サンプルとは、例えば、血液、白血球、血清、尿、糞便、精液、唾液、培養細胞、各種臓器細胞のような組織細胞、その他遺伝子を含有する任意の試料から、該試料中の細胞を破壊して二本鎖核酸を遊離させ、熱処理あるいはアルカリ処理によって、一本鎖の核酸に解離させたものである。また、本実施の形態における遺伝子サンプルは、制限酵素で切断して電気泳動による分離等で精製した核酸断片でもよい。
【0023】
(実施の形態1)
以下、実施の形態1における遺伝子検出方法について説明する。まず、検査対象となる遺伝子サンプルを作製する。この遺伝子サンプルは、前述したように、任意の試料中の細胞を破壊して二本鎖核酸を遊離させ、熱処理あるいはアルカリ処理によって、一本鎖に変性させる。
【0024】
このとき、前記試料中の細胞の破壊は、常法により行うことができ、例えば、振とう、超音波等の物理的作用を外部から加えて行うことができる。また、核酸抽出溶液(例えば、SDS、Triton−X、Tween−20等の界面活性剤、又はサポニン、EDTA、プロテア−ゼ等を含む溶液等)を用いて、細胞から核酸を遊離させることもできる。
【0025】
次に、前記一本鎖の遺伝子サンプルに、後述する標識プローブを含む溶液を接触させる。これにより、前記標識プローブがもつ標識結合用プローブと、該標識結合用プローブと相補的な配列を有する遺伝子サンプルがハイブリダイズし、標識化遺伝子サンプルが形成される。この標識プローブと遺伝子サンプルをハイブリダイズさせる方法は周知であるため、ここでは説明を省略する。
【0026】
以下、本発明に用いられる標識プローブについて説明する。標識プローブは、検出すべき遺伝子配列に対して相補的な塩基配列を有し、且つ電気化学的に活性である物質で標識された一本鎖核酸である。
【0027】
前述の電気化学的に活性である物質は、電気化学的に検出可能な物質であれば特に制限無く何を用いてもよく、例えば、可逆な酸化還元反応時に生じる酸化還元電流を測定することで物質の検出が可能な、酸化還元性を有する化合物が挙げられる。そしてこのような酸化還元性を有する化合物としては、例えば、フェロセン、カテコールアミン、配位子に複素環系化合物を有する金属錯体、ルブレン、アントラセン、コロネン、ピレン、フルオランテン、クリセン、フェナントレン、ペリレン、ビナフチル、オクタテトラエンもしくはビオローゲン等がある。
【0028】
なお、前述した、配位子に複素環系化合物を有する金属錯体、ルブレン、アントラセン、コロネン、ピレン、フルオランテン、クリセン、フェナントレン、ペリレン、ビナフチル、オクタテトラエンには、酸化還元反応時に電気化学発光を生じるものもあり、前記Eとしてこれらを用いた場合は、後述する検出工程にてその発光を測定することで、遺伝子サンプルの検出を行うこともできる。
【0029】
また、前述の配位子に複素環系化合物を有する金属錯体としては、酸素や窒素等を含む複素環系化合物、例えば、ピリジン部位、ピラン部位等を配位子に有する金属錯体等を挙げることができ、特に、ピリジン部位を配位子に有する金属錯体が好ましく、該ピリジン部位を配位子に有する金属錯体としては、例えば、金属ビピリジン錯体、金属フェナントロリン錯体等が例に挙げられる。
【0030】
さらに、前記配位子に複素環系化合物を有する金属錯体の中心金属としては、例えば、ルテニウム、オスニウム、亜鉛、コバルト、白金、クロム、モリブデン、タングステン、テクネチウム、レニウム、ロジウム、イリジウム、パラジウム、銅、インジウム、ランタン、プラセオジム、ネオジム、サマリウム等を挙げることができる。特に該中心金属が、ルテニウム、オスニウムである錯体は、良好な電気化学発光特性を有し、このような良好な電気化学発光特性を有する物質としては、例えば、ルテニウムビピリジン錯体、ルテニウムフェナントロリン錯体、オスニウムビピリジン錯体、オスニウムフェナントロリン錯体等を挙げることができる。
【0031】
そしてこの後、前述したようにして形成された標識化遺伝子サンプルを含む溶液を、磁気ビーズに固定化された捕捉プローブに接触させる。これにより、前記捕捉プローブと、該捕捉プローブと相補的な配列を有する遺伝子サンプルとがハイブリダイズし、前記標識化遺伝子サンプルが磁気ビーズに固定化される。この前記捕捉プローブと前記標識化遺伝子サンプルをハイブリダイズさせる方法は周知であるため、ここでは説明を省略する。
【0032】
前記捕捉プローブとしては、化学合成で得た一本鎖の核酸、あるいは生物試料から抽出した核酸を制限酵素で切断し、電気泳動による分離等で精製した核酸を用いることができる。なお、生物試料から抽出した核酸の場合には、熱処理あるいはアルカリ処理によって、一本鎖の核酸に解離させておくことが好ましい。
【0033】
また、前記捕捉プローブを固定化する磁気ビーズとしては、特に限定されるものではなく、医用で一般的に用いられている磁気ビーズが使用可能である。前記磁気ビーズは、電気絶縁材料であるポリスチレンやデキストランのようなポリマーに酸化鉄のような可磁化物質を分散させたものである。前記磁気ビーズの粒径は、10nm〜10μmと幅広く選択可能であり、特に限定されるものではないが、溶液中での分散性および分離、回収性から、100nm〜5μmが好ましい。
【0034】
前記捕捉プローブを前記磁気ビーズに固定化する方法としては、例えば、磁気ビーズにアビジンコーティングを施し、末端をビオチン修飾した核酸プローブと結合させるなどの公知の方法が用いることができる。
【0035】
なお、前述の説明では、まず遺伝子サンプルと標識プローブとをハイブリダイズさせて標識化遺伝子サンプルを形成する遺伝子サンプル標識化工程の後、該標識化遺伝子サンプルと磁気ビーズに固定化された捕捉プローブとをハイブリダイズさせて、遺伝子サンプルを磁気ビーズに固定化する遺伝子サンプル捕捉工程を行なうものとしたが、前記遺伝子サンプル捕捉工程と前記遺伝子サンプル標識化工程とを同時に行うものでもよい。この場合、遺伝子サンプルと、標識プローブと、磁気ビーズに固定化した捕捉プローブとを同時に接触させて、標識された遺伝子サンプルを磁気ビーズに固定化する。
【0036】
前述のようにして前記標識化遺伝子サンプルを磁気ビーズに固定化後、磁気ビーズを磁力で収集し、未反応の遺伝子サンプルと標識プローブを除去することで、B/F分離を行う。
【0037】
B/F分離を行った後、磁気ビーズを電解液とともに電極上に展開し、前記磁気ビーズは磁力により電極表面に捕捉する。そして、電極に電圧を印加することで、該磁気ビーズに固定化された前記標識化遺伝子サンプルの、電気化学的に活性である物質由来の電気化学的な信号を測定する。
【0038】
電気化学的な信号の測定は、標識された電気化学的に活性である物質によって異なり、前記電気化学的に活性である物質として、酸化還元電流を生じる電気化学的に活性である物質を用いた場合には、該電気化学的に活性である物質由来の電気化学的な信号を、前記ポテンショスタット、ファンクションジェネレータ等からなる計測系で測定できる。一方、前記電気化学的に活性である物質として、電気化学発光を生じる物質を用いた場合には、フォトマルチプライヤー等を用いて計測が可能である。
【0039】
以下、本発明に用いられる電解液について説明する。本発明の電解液は、磁気ビーズが添加されたものであり、電解液に分散した導電性物質を介して、電気二重層領域が電極表面から離れた部分にも広がり、電極表面に接触していない部分の電気化学的に活性である物質でも電気化学反応が起きるため、標識剤の利用効率を高めることが可能となる。
【0040】
前記導電性粒子は、金属電極と前記電気化学的に活性である物質との間で電子の移動が可能であり、前記電気化学的に活性である物質を、酸化還元することができる物質であれば、特に制限無く何を用いてもよい。
【0041】
特に好適な材料としては、化学的に安定であり、溶解電位が高い金属材料、例えば、金、白金、銀、パラジウム、ロジウム、イリジウム、タングステン等、また、酸化および還元方向の電位窓の広いカーボン等が挙げられる。
【0042】
また、前記磁力により電極表面に捕捉された磁気ビーズは、凝集、積層した状態で電極表面に存在するため、前記導電性粒子の粒径は、1nm以上、前記磁気ビーズの粒径以下(もしくは500nm以下)が好ましい。これにより、導電性粒子が磁気ビーズの間隙に入り込み、凝集、積層した磁気ビーズ全体の標識剤を反応させることで、標識剤の利用効率を高めることが可能となる。
【0043】
このような磁気ビーズとしては、例えば、免疫測定の呈色剤や燃料電池の触媒等で使用されるコロイド粒子等が挙げられる。
【実施例1】
【0044】
以下、本発明の実施例を示すが、本発明はこれに限定されるものではない。
(1)遺伝子サンプル
遺伝子サンプルには、ヒト由来Cytochrome P−450の遺伝子配列の5’−末端より599−698番目に位置するAATTGAATGA AAACATCAGG ATTGTAAGCA CCCCCTGGAT CCAGATATGC AATAATTTTC CCACTATCAT TGATTATTTC CCGGGAACCC ATAACAAATTの配列を有する100塩基のオリゴデオキシヌクレオチドを使用した。
【0045】
(2)磁気ビーズ表面への核酸プローブの固定化
磁気ビーズには、Bangs Laboratories社製のCM01N/5896ストレプトアビジン磁気ビーズを用いた(粒径0.35μm)。捕捉プローブには、5’末端よりAATTTGTTAT GGGTTCCCGG GAAATAATCAの遺伝子サンプルと相補的な配列を有し、5’末端のリン酸基を介してビオチンを修飾したプローブを使用した。
【0046】
まず、磁気ビーズを1mgを採取し、TTLバッファー(500mM Tris−HCl(pH8.0):Tween20:2M塩化リチウム:超純水=2:10:5:3の体積比になるよう調製)で洗浄後、20μLのTTLバッファーに置換した。その後、100nMの核酸プローブを5μL添加し、室温で15分穏やかに振とうした。
【0047】
溶液をデカントし、残留した磁気ビーズを0.15Mの水酸化ナトリウム水溶液で洗浄後、TTバッファー(500mM Tris−HCl(pH8.0):Tween20:超純水=1:2:1の体積比になるよう調製)で洗浄した。
【0048】
洗浄後、TTEバッファーに溶液を置換し、80℃で10分間インキュベートすることにより、不安定な結合を除去した。これにより、捕捉プローブが固定化された磁気ビーズを得た。
【0049】
さらに、本実施例1においては、比較対象として、遺伝子サンプルと非相補的な配列を有する捕捉プローブを使用して、前記捕捉プローブと同様の処理を行った。なお、ここでは、非相補的な捕捉プローブとして、30merのPoly−A、AAAAAAAAAA AAAAAAAAAA AAAAAAAAAAの配列を有する5’末端のリン酸基を介してにビオチンを修飾したプローブを使用した。
【0050】
(3)標識プローブ
標識プローブには、5’末端からTGCTTACAAT CCTGATGTTT TCATTCAATTの配列を有し、5’末端のリン酸基を介して、電気化学的に活性である物質であるルテニウム錯体を修飾し、下記(化1)に示すような30塩基のオリゴデオキシヌクレオチドを使用した。
【0051】
【化1】

(化1)で示される標識プローブは、以下のようにして得る。まず、THF60.0mLに溶解させた4,4’−ジメチル−2,2’ビピリジン2.50g(13.5mmol)溶液を窒素雰囲気の容器に注入した後、リチウムジイソプロピルアミド2M溶液16.9mL(27.0mmol)を滴下し、冷却しながら30分撹拌した。一方、同様に窒素気流中で乾燥させた容器に、1,3−ジブロモプロパン4.2mL(41.1mmol)とTHF10mLとを加え、冷却しながら撹拌させた。この容器に、先程の反応液をゆっくり滴下させて2.5時間反応させた。反応溶液は2Nの塩酸で中和し、THFを留去した後、クロロホルムで抽出した。溶媒を留去して得た粗生成物をシリカゲルカラムで精製し、生成物Cを得た(収率47%)。
【0052】
窒素雰囲気の容器に、前記生成物C1.0g(3.28mmol)、フタルイミドカリウム0.67g(3.61mmol)、及びジメチルホルムアミド(脱水)30.0mLを加え、オイルバスで18時間還流した。反応後、クロロホルムで抽出し、0.2N水酸化ナトリウム50mLで蒸留水洗浄した。溶媒を留去して酢酸エチルとヘキサンから再結晶を行い、生成物Dを得た(収率61・5%)。
【0053】
塩化ルテニウム(III)(2.98g、0.01mol)、及び2,2’−ビピリジン(3.44g、0.022mol)をジメチルホルムアミド(80.0mL)中で6時間還流した後、溶媒を留去した。その後、アセトンを加え、一晩冷却することで得られた黒色沈殿物を採取し、エタノール水溶液170mL(エタノール:水=1:1)を加え1時間加熱還流を行った。ろ過後、塩化リチウムを20g加え、エタノールを留去し、さらに一晩冷却した。析出した黒色物質は吸引ろ過で採取し、生成物Eを得た(収率68.2%)。
【0054】
窒素置換した容器に、前記生成物D0.50g(1.35mmol)、前記生成物E0.78g(1.61mmol)、及びエタノール50mLを加えた。9時間窒素雰囲気で還流した後、溶媒を留去し、蒸留水で溶解させ、1.0Mの過塩素酸水溶液で沈殿させた。この沈殿物を採取し、メタノールで再結晶を行い、生成物Fを得た(収率81.6%)。
【0055】
さらに、前記生成物F1.0g(1.02mmol)、及びメタノール70.0mLを1時間還流した。室温まで冷却した後、ヒドラジン一水和物0.21mL(4.21mmol)を加え再び13時間還流した。反応後、蒸留水を15mL加え、メタノールを留去した。
【0056】
次に、濃塩酸を5.0mL加え、2時間還流して得られた反応液を一晩冷蔵し、不純物を自然ろ過で除去した。
【0057】
これを炭酸水素ナトリウムで中和した後、水を留去し、無機物をアセトニトリルで除去した。溶媒を留去して得た粗生成物をシリカゲルカラムで精製し、生成物Gを得た(収率71.4%)。
アルミホイルで遮光した容器に、前記生成物G0.65g(0.76mmol)を加え、アセトニトリル10mLに溶解させた。次に、トリエチルアミン0.23g(2.29mmol)を加えた後、アセトニトリル20mLに溶解したグルタル酸無水物0.87g(7.62mmol)を滴下した。
【0058】
9時間反応後、エバポレーターでアセトニトリルを留去して得た粗生成物を高速液体クロマトグラフィー(HPLC)で精製し、下記(化2)に示すルテニウム錯体を得た(収率87.5%)。
【0059】
【化2】

また下表は、前述のようにして得た(化2)に示す物質の1H-NMR結果である。
【0060】
1H-NMR(300MHz、DMSO d−6)
σ:
1.46 (2H,m)
1.69 (4H,m)
2.10 (4H,m)
2.54 (3H,s)
2.81 (2H,t)
3.08 (2H,m)
7.41 (2H,t)
7.57 (6H,m)
7.77 (4H,m)
8.19 (1H,t)
8.79 (4H,t)
8.88 (6H,m)
次に、オリゴデオキシヌクレオチド786μg(83.4pmol)を蒸留水0.3mLに溶解させ、該オリゴデオキシヌクレオチドの水溶液に、ルテニウム錯体0.5mg(0.12μmol)、N−ヒドロキシスクシンイミド0.3mg(2.5μmol)、WSC1.4mg(7.5μmol)、0.1Mトリエチルアミン2.5μL(0.25μmol)を添加し、2日間室温で反応させた。HPLCで精製後、目的物のフラクションを採取し、溶液を留去して式(1)に示す標識プローブを得た(収率74.1%)。
【0061】
(4)ハイブリダイゼーション
前記捕捉プローブを固定した磁気ビーズに、2XSSCを14μL加え、そこに5μMに調製した遺伝子サンプル及び標識プローブをそれぞれ4μL添加し、70℃で穏やかに振とうさせた。1時間振とうさせた後、磁石で磁気ビーズを収集後、溶液をデカントし、40℃に加温した2XSSCで洗浄し、二本鎖核酸が形成された磁気ビーズαを得た。
【0062】
なお、非相補的な捕捉プローブを固定した磁気ビーズについても、上記と同様の処理を行い、二本鎖核酸が形成されていない磁気ビーズβを得た。
【0063】
(5)電気化学測定
以上の工程の後、二本鎖核酸が形成された磁気ビーズα及び二本鎖核酸が形成されていない磁気ビーズβに0.2MのPBSを10μLと0.2Mのトリエチルアミンを10μL混合した溶液を加え、懸濁した後、それぞれ5μLずつ電極に滴下した。
前記電極には、ガラス基板上にスパッタ装置(アルバック製SH−350)によりチタン10nmを下地に金200nmを成膜し、フォトリソグラフィ工程により電極パターンを形成したものを使用した。また、電極の下には永久磁石のシートを取り付けており、作用極のみに磁気ビーズが集約するようにした。
【0064】
5分静置後、前記磁気ビーズα,βが集約した電極xα,yβそれぞれに、電解液を75μL滴下した。
【0065】
図1は本発明に用いた電気的活性基を有する有機金属錯体である。Aはメチレン基が11の長鎖であり、Bはメチレン基が5である。フェロセンは、鉄の上下にシクロペンタジエニル環が配位した非常に安定なサンドイッチ構造を有する有機金属化合物である。フェロセン内の鉄は2価イオンとなっているが、酸化されて3価のフェリシニウムとなる。この反応は可逆的酸化還元反応であり、電位をかけることによりフェロセンの量に比例した電流を取り出すことが可能である。
【0066】
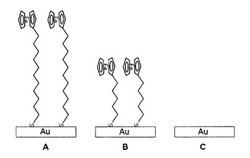
図2にフェロセン膜の自己組織化膜の模式図を示す。図1に示したA物質(メチレン基11)の自己組織化膜であり、Bは図1に示したB物質(メチレン基5)の自己組織化膜であり、Cは金電極のみを示す。自己組織化膜の作成方法は、A・B各分子2.5mMエタノール溶液を調製し、ガラス基板上に金膜を形成した金電極を各溶液中に室温下、24時間浸漬し自己組織化膜を形成させた。自己組織化膜を形成させた後、エタノール溶液にて洗浄し、自己組織化膜を得た。
【0067】
図3に図2で作成した金電極を用いて測定した結果を示す。電気化学発光の測定方法は、A・B・Cの各作用電極表面に電気化学発光剤としてルテニウム錯体を風乾させCCDカメラを用いて発光強度を測定した。作用電極上に1mMのルテニウム錯体1.5マイクロリッタ滴下し常温で風乾させ、金電極表面に物理吸着させた。完全に乾燥した後、電解液50マイクロリッタ滴下し測定を行った。電解液は0.2M リン酸緩衝液pH8.0及び0.2M トリエチルアミンの混合溶液を用いた。電圧は、1秒間0Vから1.3Vまで印加しプロピルアミンをラジカル化させ、その後、4秒間1.3Vを印加した。尚、電圧は参照電極を用いて正確に電位をかけた。金電極のみの場合は、発光強度は80であったが、メチレン基が5の場合では、最高発光強度は180であり、メチレン基が11の場合では、480であった。フェロセンのメチレン基を長鎖にするにつれルテニウムの電気化学発光強度が増加することが示された。ルテニウム錯体の電気化学発光の機序は、電解液中に過剰量に存在するプロピルアミンが酸化反応によりプロピルアミンラジカル(+)となり、即座に水素イオンを失いプロピルアミンラジカルを形成する。基底状態ルテニウム錯体((Ru(bpy)3)2+)は電極上で酸化され(Ru(bpy)3)3+となり、プロピルアミンラジカルとの反応により電子が移動し、励起状態の(Ru(bpy)3)3+*を形成する。励起状態から基底状態に戻る際に、620nmの光を放出する。発光した後、基底状態((Ru(bpy)3)2+)に戻るので、電気化学発光を何回も反応させることが可能である。反応の開始、終了が電気的にコントロールでき、電極に流す電流によって、得られる発光量を調節できる。また、その電荷の量も、レファレンスの電極によって、モニターできる。すなわち、電極に与える電荷の量・時間を調節することにより、測定物・測定系によって適正な発光量を得ることができるメリットがある。
【産業上の利用可能性】
【0068】
本発明にかかる測定方法は、高感度に検出することができ、電気化学発光物質の利用効率を高めることが可能となり、遺伝子診断、感染症診断、ゲノム創薬等の用途に適用できる。
【図面の簡単な説明】
【0069】
【図1】本発明の実施の形態に用いた電気的活性基を有する有機金属錯体の模式図
【図2】同実施の形態に用いた自己組織化膜の模式図
【図3】有機金属錯体の鎖長の長さによる電気化学発光量の変化を示す説明図
【技術分野】
【0001】
本発明は、試料中に存在する特定の遺伝子配列を、高感度に検出するための遺伝子検出方法に関する。
【背景技術】
【0002】
従来の、電気化学的に特定の遺伝子配列を検出するDNAチップは、検出すべき目的遺伝子に対して相補的な塩基配列を有する一本鎖の核酸プローブを電極表面に固定化し、該核酸プローブと一本鎖に変性された目的遺伝子サンプルとをハイブリダイズさせた後、該核酸プローブと目的遺伝子サンプルとで形成された二本鎖核酸に特異的に結合し且つ電気化学的に活性な標識剤を、該核酸プローブと遺伝子サンプルとの反応系に添加し、電極を介した電気化学的な測定により、前記二本鎖核酸に結合した標識剤を検出することで、目的遺伝子サンプルとハイブリダイズした前記核酸プローブを検出し、目的とする遺伝子の存在を確認する(例えば、特許文献1及び特許文献2参照)。
【0003】
ここで、前記標識剤とは、前記二本鎖の核酸を認識して、該二本鎖核酸と特異的に結合する物質を指す。前記標識剤は、何れも分子中にフェニル基等の平板状挿入基を有し、該挿入基が二本鎖核酸の塩基対と塩基対との間に挿入することによって、二本鎖核酸と結合する。この標識剤と二本鎖核酸との結合は、静電気的相互作用あるいは疎水的相互作用での結合であって、前記標識剤の二本鎖核酸の塩基対間への挿入、及びその塩基対間からの離脱が一定の速度で繰り返される平衡反応による結合である。
【0004】
また、従来生化学アッセイに用いられる光の測定法には、吸光・蛍光法や発光法等がある。この内発光法による測定は、高感度に測定が可能であることが知られている。この内電気エネルギーによって励起され発光する現象を、電気化学発光と呼ぶ。電気化学発光する物質としてルテニウム錯体やオスミウム錯体が挙げられる。電気化学発光の反応は、例えば電気化学発光を示す代表的な物質にルテニウムビピリジル錯体(Ru(bpy)3)2+ がある。電気化学発光の作用機序は、電極上でトリプロピルアミン等によりラジカルを発生させ、ルテニウムビピリジル錯体に電子を渡し、励起状態(Ru(bpy)3)3+となり、基底状態(Ru(bpy)3)2+に戻る時に発光を生じる(例えば、非特許文献1及び非特許文献2参照)。この様に電気化学発光は、電気化学エネルギーにより発光種を励起し、その励起状態が放射失括する際に可視光線を放出する。発光種の励起には電気化学エネルギーを利用するため、吸光法や蛍光法に比べバックグランドノイズを減らすことが可能である。このため、電気化学発光法は、吸光法や蛍光法よりも高感度に測定が可能となる。電気化学発光による測定は、DNA等の核酸測定や、抗原や抗体の測定として種々のアッセイに利用されつつある(例えば、特許文献3参照)。しかし電気化学発光は、電気二重層と呼ばれる電極表面から数nmの領域といった非常に狭い範囲で行われるため、電気化学発光物質の利用効率が悪いという課題があった。
【特許文献1】特開平5−199898号公報
【特許文献2】特開平9−288080号公報
【特許文献3】特開2002−34561号公報
【非特許文献1】Anal.Chem.,2004,76,5379−5386
【非特許文献2】Chem.Rev.,2004,104,3003−3036
【発明の開示】
【発明が解決しようとする課題】
【0005】
従来、電気化学発光を行う場合では、電極付近で電子の授受を行わせる必要があり、電子の授受が可能な領域は電気二重層と呼ばれる非常に狭い範囲であった。本発明は、電気的活性基を有する有機金属錯体を用いる事により、電極上での電子の授受を効率良く行わせる事が可能な方法を提供することである。
【課題を解決するための手段】
【0006】
前記課題を解決するため、本発明の遺伝子検出方法は、特定の配列を有する遺伝子を検出する遺伝子検出方法であって、前記検出すべき遺伝子配列に対して相補的な塩基配列を有する一本鎖の捕捉プローブを作製し、該捕捉プローブを固相に固定化する固定化工程と、
前記検出すべき遺伝子を一本鎖に変性して遺伝子サンプルを作製する遺伝子サンプル作製工程と、前記遺伝子サンプルに電気化学的に活性である物質を添加し、前記遺伝子サンプルと該電気化学的に活性である物質とを化学結合させる、電気化学的に活性である物質結合遺伝子サンプル作製工程と、前記電気化学的に活性である物質が結合した遺伝子サンプルと前記固相に固定された一本鎖の捕捉プローブとをハイブリダイズさせ、前記遺伝子サンプルを前記固相に捕捉させる遺伝子サンプル捕捉工程と、前記固相に固定された前記遺伝子サンプルに結合した前記電気化学的に活性である物質を、電気化学的な測定により検出する検出工程と、を含むものである。
【0007】
これにより、前記遺伝子サンプルが微量でも電気化学的に活性である物質を複数結合させることができるので、高感度検出が可能となる。また、検体ごとに標識プローブの設計を行う必要もなくなる。
【0008】
また、本発明の遺伝子検出方法は、検体試料中の特定の配列を有する遺伝子を検出する遺伝子検出方法であって、前記検出すべき遺伝子を一本鎖に変性して遺伝子サンプルを作製する遺伝子サンプル作製工程と、前記遺伝子サンプルに電気化学的に活性である物質を添加し、前記遺伝子サンプルと該電気化学的に活性である物質とを化学結合させる、電気化学的に活性である物質結合遺伝子サンプル作製工程と、前記検出すべき遺伝子配列に対して相補的な塩基配列を有する一本鎖の捕捉プローブを作製し、前記電気化学的に活性である物質が結合した遺伝子サンプルとハイブリダイズさせ、二本鎖核酸を形成する二本鎖核酸形成工程と、前記二本鎖核酸を形成した捕捉プローブを固相に固定化する固定化工程と、前記固相に固定された前記遺伝子サンプルに結合した前記電気化学的に活性である物質を、電気化学的な測定により検出する検出工程と、を含むものである。
【0009】
これにより、前記遺伝子サンプルが微量でも電気化学的に活性である物質を複数結合させることができるので、高感度検出が可能となる。また、検体ごとに標識プローブの設計を行う必要もなくなる。
【0010】
さらに、本発明の遺伝子検出方法は、前記電気的活性基を有する有機金属錯体は、フェロセン分子であるものである。
【0011】
さらに、本発明の遺伝子検出方法は、前記電気的活性基を有する有機金属錯体は、電気的活性基を有する分子とチオール分子からなり、チオール分子により電極上に自己組織化膜を形成するものである。
【0012】
さらに、本発明の遺伝子検出方法は、電気的活性基を有する分子とチオール分子は、メチレン基(−CH2−)nをスペーサーとし、n数は2〜11であるものである。電気化学発光は酸化還元性を有する化合物である。
【0013】
さらに、本発明の遺伝子検出方法は、前記酸化還元性を有する化合物は、電気化学発光を示す化合物である。
【0014】
さらに、本発明の遺伝子検出方法は、前記電気化学発光を示す化合物は、配位子に複素環系化合物を有する金属錯体、ルブレン、アントラセン、コロネン、ピレン、フルオランテン、クリセン、フェナントレン、ペリレン、ビナフチル、あるいはオクタテトラエンのいずれかである。
【0015】
さらに、本発明の遺伝子検出方法は、前記配位子に複素環系化合物を有する金属錯体は、配位子にピリジン部位を有する金属錯体である。
【0016】
さらに、本発明の遺伝子検出方法は、前記配位子にピリジン部位を有する金属錯体は、金属ビピリジン錯体、あるいは金属フェナントロリン錯体のいずれかであるものである。
【0017】
さらに、本発明の遺伝子検出方法は、前記電気化学発光を示す化合物は、金属錯体である。
【0018】
さらに、本発明の遺伝子検出方法は、前記金属錯体の中心金属は、ルテニウム、あるいはオスニウムのいずれかである。
【0019】
さらに、本発明の遺伝子検出方法は、ルテニウムを有する有機金属錯体を、核酸またはタンパク質にラベル化することにより、電気化学発光量によりラベル化された核酸量またはタンパク質を定量する。
【0020】
さらに、本発明の遺伝子検出方法は、前記磁気ビーズの粒径が、1nm以上、前記磁気ビーズの平均粒径以下(もしくは500nm以下)である。
【発明の効果】
【0021】
本発明の遺伝子検出方法によれば、電気化学測定の際に、電解液に分散した導電性物質を介して、電気二重層領域が電極表面から離れた部分にも広がり、電極表面に接触していない電気化学発光物質でも電気化学反応が起きるため、電気化学発光物質の利用効率を高めることが可能となる。
【発明を実施するための最良の形態】
【0022】
以下に、本発明の遺伝子検出方法について詳細に説明する。なお、以下の実施の形態における遺伝子サンプルとは、例えば、血液、白血球、血清、尿、糞便、精液、唾液、培養細胞、各種臓器細胞のような組織細胞、その他遺伝子を含有する任意の試料から、該試料中の細胞を破壊して二本鎖核酸を遊離させ、熱処理あるいはアルカリ処理によって、一本鎖の核酸に解離させたものである。また、本実施の形態における遺伝子サンプルは、制限酵素で切断して電気泳動による分離等で精製した核酸断片でもよい。
【0023】
(実施の形態1)
以下、実施の形態1における遺伝子検出方法について説明する。まず、検査対象となる遺伝子サンプルを作製する。この遺伝子サンプルは、前述したように、任意の試料中の細胞を破壊して二本鎖核酸を遊離させ、熱処理あるいはアルカリ処理によって、一本鎖に変性させる。
【0024】
このとき、前記試料中の細胞の破壊は、常法により行うことができ、例えば、振とう、超音波等の物理的作用を外部から加えて行うことができる。また、核酸抽出溶液(例えば、SDS、Triton−X、Tween−20等の界面活性剤、又はサポニン、EDTA、プロテア−ゼ等を含む溶液等)を用いて、細胞から核酸を遊離させることもできる。
【0025】
次に、前記一本鎖の遺伝子サンプルに、後述する標識プローブを含む溶液を接触させる。これにより、前記標識プローブがもつ標識結合用プローブと、該標識結合用プローブと相補的な配列を有する遺伝子サンプルがハイブリダイズし、標識化遺伝子サンプルが形成される。この標識プローブと遺伝子サンプルをハイブリダイズさせる方法は周知であるため、ここでは説明を省略する。
【0026】
以下、本発明に用いられる標識プローブについて説明する。標識プローブは、検出すべき遺伝子配列に対して相補的な塩基配列を有し、且つ電気化学的に活性である物質で標識された一本鎖核酸である。
【0027】
前述の電気化学的に活性である物質は、電気化学的に検出可能な物質であれば特に制限無く何を用いてもよく、例えば、可逆な酸化還元反応時に生じる酸化還元電流を測定することで物質の検出が可能な、酸化還元性を有する化合物が挙げられる。そしてこのような酸化還元性を有する化合物としては、例えば、フェロセン、カテコールアミン、配位子に複素環系化合物を有する金属錯体、ルブレン、アントラセン、コロネン、ピレン、フルオランテン、クリセン、フェナントレン、ペリレン、ビナフチル、オクタテトラエンもしくはビオローゲン等がある。
【0028】
なお、前述した、配位子に複素環系化合物を有する金属錯体、ルブレン、アントラセン、コロネン、ピレン、フルオランテン、クリセン、フェナントレン、ペリレン、ビナフチル、オクタテトラエンには、酸化還元反応時に電気化学発光を生じるものもあり、前記Eとしてこれらを用いた場合は、後述する検出工程にてその発光を測定することで、遺伝子サンプルの検出を行うこともできる。
【0029】
また、前述の配位子に複素環系化合物を有する金属錯体としては、酸素や窒素等を含む複素環系化合物、例えば、ピリジン部位、ピラン部位等を配位子に有する金属錯体等を挙げることができ、特に、ピリジン部位を配位子に有する金属錯体が好ましく、該ピリジン部位を配位子に有する金属錯体としては、例えば、金属ビピリジン錯体、金属フェナントロリン錯体等が例に挙げられる。
【0030】
さらに、前記配位子に複素環系化合物を有する金属錯体の中心金属としては、例えば、ルテニウム、オスニウム、亜鉛、コバルト、白金、クロム、モリブデン、タングステン、テクネチウム、レニウム、ロジウム、イリジウム、パラジウム、銅、インジウム、ランタン、プラセオジム、ネオジム、サマリウム等を挙げることができる。特に該中心金属が、ルテニウム、オスニウムである錯体は、良好な電気化学発光特性を有し、このような良好な電気化学発光特性を有する物質としては、例えば、ルテニウムビピリジン錯体、ルテニウムフェナントロリン錯体、オスニウムビピリジン錯体、オスニウムフェナントロリン錯体等を挙げることができる。
【0031】
そしてこの後、前述したようにして形成された標識化遺伝子サンプルを含む溶液を、磁気ビーズに固定化された捕捉プローブに接触させる。これにより、前記捕捉プローブと、該捕捉プローブと相補的な配列を有する遺伝子サンプルとがハイブリダイズし、前記標識化遺伝子サンプルが磁気ビーズに固定化される。この前記捕捉プローブと前記標識化遺伝子サンプルをハイブリダイズさせる方法は周知であるため、ここでは説明を省略する。
【0032】
前記捕捉プローブとしては、化学合成で得た一本鎖の核酸、あるいは生物試料から抽出した核酸を制限酵素で切断し、電気泳動による分離等で精製した核酸を用いることができる。なお、生物試料から抽出した核酸の場合には、熱処理あるいはアルカリ処理によって、一本鎖の核酸に解離させておくことが好ましい。
【0033】
また、前記捕捉プローブを固定化する磁気ビーズとしては、特に限定されるものではなく、医用で一般的に用いられている磁気ビーズが使用可能である。前記磁気ビーズは、電気絶縁材料であるポリスチレンやデキストランのようなポリマーに酸化鉄のような可磁化物質を分散させたものである。前記磁気ビーズの粒径は、10nm〜10μmと幅広く選択可能であり、特に限定されるものではないが、溶液中での分散性および分離、回収性から、100nm〜5μmが好ましい。
【0034】
前記捕捉プローブを前記磁気ビーズに固定化する方法としては、例えば、磁気ビーズにアビジンコーティングを施し、末端をビオチン修飾した核酸プローブと結合させるなどの公知の方法が用いることができる。
【0035】
なお、前述の説明では、まず遺伝子サンプルと標識プローブとをハイブリダイズさせて標識化遺伝子サンプルを形成する遺伝子サンプル標識化工程の後、該標識化遺伝子サンプルと磁気ビーズに固定化された捕捉プローブとをハイブリダイズさせて、遺伝子サンプルを磁気ビーズに固定化する遺伝子サンプル捕捉工程を行なうものとしたが、前記遺伝子サンプル捕捉工程と前記遺伝子サンプル標識化工程とを同時に行うものでもよい。この場合、遺伝子サンプルと、標識プローブと、磁気ビーズに固定化した捕捉プローブとを同時に接触させて、標識された遺伝子サンプルを磁気ビーズに固定化する。
【0036】
前述のようにして前記標識化遺伝子サンプルを磁気ビーズに固定化後、磁気ビーズを磁力で収集し、未反応の遺伝子サンプルと標識プローブを除去することで、B/F分離を行う。
【0037】
B/F分離を行った後、磁気ビーズを電解液とともに電極上に展開し、前記磁気ビーズは磁力により電極表面に捕捉する。そして、電極に電圧を印加することで、該磁気ビーズに固定化された前記標識化遺伝子サンプルの、電気化学的に活性である物質由来の電気化学的な信号を測定する。
【0038】
電気化学的な信号の測定は、標識された電気化学的に活性である物質によって異なり、前記電気化学的に活性である物質として、酸化還元電流を生じる電気化学的に活性である物質を用いた場合には、該電気化学的に活性である物質由来の電気化学的な信号を、前記ポテンショスタット、ファンクションジェネレータ等からなる計測系で測定できる。一方、前記電気化学的に活性である物質として、電気化学発光を生じる物質を用いた場合には、フォトマルチプライヤー等を用いて計測が可能である。
【0039】
以下、本発明に用いられる電解液について説明する。本発明の電解液は、磁気ビーズが添加されたものであり、電解液に分散した導電性物質を介して、電気二重層領域が電極表面から離れた部分にも広がり、電極表面に接触していない部分の電気化学的に活性である物質でも電気化学反応が起きるため、標識剤の利用効率を高めることが可能となる。
【0040】
前記導電性粒子は、金属電極と前記電気化学的に活性である物質との間で電子の移動が可能であり、前記電気化学的に活性である物質を、酸化還元することができる物質であれば、特に制限無く何を用いてもよい。
【0041】
特に好適な材料としては、化学的に安定であり、溶解電位が高い金属材料、例えば、金、白金、銀、パラジウム、ロジウム、イリジウム、タングステン等、また、酸化および還元方向の電位窓の広いカーボン等が挙げられる。
【0042】
また、前記磁力により電極表面に捕捉された磁気ビーズは、凝集、積層した状態で電極表面に存在するため、前記導電性粒子の粒径は、1nm以上、前記磁気ビーズの粒径以下(もしくは500nm以下)が好ましい。これにより、導電性粒子が磁気ビーズの間隙に入り込み、凝集、積層した磁気ビーズ全体の標識剤を反応させることで、標識剤の利用効率を高めることが可能となる。
【0043】
このような磁気ビーズとしては、例えば、免疫測定の呈色剤や燃料電池の触媒等で使用されるコロイド粒子等が挙げられる。
【実施例1】
【0044】
以下、本発明の実施例を示すが、本発明はこれに限定されるものではない。
(1)遺伝子サンプル
遺伝子サンプルには、ヒト由来Cytochrome P−450の遺伝子配列の5’−末端より599−698番目に位置するAATTGAATGA AAACATCAGG ATTGTAAGCA CCCCCTGGAT CCAGATATGC AATAATTTTC CCACTATCAT TGATTATTTC CCGGGAACCC ATAACAAATTの配列を有する100塩基のオリゴデオキシヌクレオチドを使用した。
【0045】
(2)磁気ビーズ表面への核酸プローブの固定化
磁気ビーズには、Bangs Laboratories社製のCM01N/5896ストレプトアビジン磁気ビーズを用いた(粒径0.35μm)。捕捉プローブには、5’末端よりAATTTGTTAT GGGTTCCCGG GAAATAATCAの遺伝子サンプルと相補的な配列を有し、5’末端のリン酸基を介してビオチンを修飾したプローブを使用した。
【0046】
まず、磁気ビーズを1mgを採取し、TTLバッファー(500mM Tris−HCl(pH8.0):Tween20:2M塩化リチウム:超純水=2:10:5:3の体積比になるよう調製)で洗浄後、20μLのTTLバッファーに置換した。その後、100nMの核酸プローブを5μL添加し、室温で15分穏やかに振とうした。
【0047】
溶液をデカントし、残留した磁気ビーズを0.15Mの水酸化ナトリウム水溶液で洗浄後、TTバッファー(500mM Tris−HCl(pH8.0):Tween20:超純水=1:2:1の体積比になるよう調製)で洗浄した。
【0048】
洗浄後、TTEバッファーに溶液を置換し、80℃で10分間インキュベートすることにより、不安定な結合を除去した。これにより、捕捉プローブが固定化された磁気ビーズを得た。
【0049】
さらに、本実施例1においては、比較対象として、遺伝子サンプルと非相補的な配列を有する捕捉プローブを使用して、前記捕捉プローブと同様の処理を行った。なお、ここでは、非相補的な捕捉プローブとして、30merのPoly−A、AAAAAAAAAA AAAAAAAAAA AAAAAAAAAAの配列を有する5’末端のリン酸基を介してにビオチンを修飾したプローブを使用した。
【0050】
(3)標識プローブ
標識プローブには、5’末端からTGCTTACAAT CCTGATGTTT TCATTCAATTの配列を有し、5’末端のリン酸基を介して、電気化学的に活性である物質であるルテニウム錯体を修飾し、下記(化1)に示すような30塩基のオリゴデオキシヌクレオチドを使用した。
【0051】
【化1】

(化1)で示される標識プローブは、以下のようにして得る。まず、THF60.0mLに溶解させた4,4’−ジメチル−2,2’ビピリジン2.50g(13.5mmol)溶液を窒素雰囲気の容器に注入した後、リチウムジイソプロピルアミド2M溶液16.9mL(27.0mmol)を滴下し、冷却しながら30分撹拌した。一方、同様に窒素気流中で乾燥させた容器に、1,3−ジブロモプロパン4.2mL(41.1mmol)とTHF10mLとを加え、冷却しながら撹拌させた。この容器に、先程の反応液をゆっくり滴下させて2.5時間反応させた。反応溶液は2Nの塩酸で中和し、THFを留去した後、クロロホルムで抽出した。溶媒を留去して得た粗生成物をシリカゲルカラムで精製し、生成物Cを得た(収率47%)。
【0052】
窒素雰囲気の容器に、前記生成物C1.0g(3.28mmol)、フタルイミドカリウム0.67g(3.61mmol)、及びジメチルホルムアミド(脱水)30.0mLを加え、オイルバスで18時間還流した。反応後、クロロホルムで抽出し、0.2N水酸化ナトリウム50mLで蒸留水洗浄した。溶媒を留去して酢酸エチルとヘキサンから再結晶を行い、生成物Dを得た(収率61・5%)。
【0053】
塩化ルテニウム(III)(2.98g、0.01mol)、及び2,2’−ビピリジン(3.44g、0.022mol)をジメチルホルムアミド(80.0mL)中で6時間還流した後、溶媒を留去した。その後、アセトンを加え、一晩冷却することで得られた黒色沈殿物を採取し、エタノール水溶液170mL(エタノール:水=1:1)を加え1時間加熱還流を行った。ろ過後、塩化リチウムを20g加え、エタノールを留去し、さらに一晩冷却した。析出した黒色物質は吸引ろ過で採取し、生成物Eを得た(収率68.2%)。
【0054】
窒素置換した容器に、前記生成物D0.50g(1.35mmol)、前記生成物E0.78g(1.61mmol)、及びエタノール50mLを加えた。9時間窒素雰囲気で還流した後、溶媒を留去し、蒸留水で溶解させ、1.0Mの過塩素酸水溶液で沈殿させた。この沈殿物を採取し、メタノールで再結晶を行い、生成物Fを得た(収率81.6%)。
【0055】
さらに、前記生成物F1.0g(1.02mmol)、及びメタノール70.0mLを1時間還流した。室温まで冷却した後、ヒドラジン一水和物0.21mL(4.21mmol)を加え再び13時間還流した。反応後、蒸留水を15mL加え、メタノールを留去した。
【0056】
次に、濃塩酸を5.0mL加え、2時間還流して得られた反応液を一晩冷蔵し、不純物を自然ろ過で除去した。
【0057】
これを炭酸水素ナトリウムで中和した後、水を留去し、無機物をアセトニトリルで除去した。溶媒を留去して得た粗生成物をシリカゲルカラムで精製し、生成物Gを得た(収率71.4%)。
アルミホイルで遮光した容器に、前記生成物G0.65g(0.76mmol)を加え、アセトニトリル10mLに溶解させた。次に、トリエチルアミン0.23g(2.29mmol)を加えた後、アセトニトリル20mLに溶解したグルタル酸無水物0.87g(7.62mmol)を滴下した。
【0058】
9時間反応後、エバポレーターでアセトニトリルを留去して得た粗生成物を高速液体クロマトグラフィー(HPLC)で精製し、下記(化2)に示すルテニウム錯体を得た(収率87.5%)。
【0059】
【化2】

また下表は、前述のようにして得た(化2)に示す物質の1H-NMR結果である。
【0060】
1H-NMR(300MHz、DMSO d−6)
σ:
1.46 (2H,m)
1.69 (4H,m)
2.10 (4H,m)
2.54 (3H,s)
2.81 (2H,t)
3.08 (2H,m)
7.41 (2H,t)
7.57 (6H,m)
7.77 (4H,m)
8.19 (1H,t)
8.79 (4H,t)
8.88 (6H,m)
次に、オリゴデオキシヌクレオチド786μg(83.4pmol)を蒸留水0.3mLに溶解させ、該オリゴデオキシヌクレオチドの水溶液に、ルテニウム錯体0.5mg(0.12μmol)、N−ヒドロキシスクシンイミド0.3mg(2.5μmol)、WSC1.4mg(7.5μmol)、0.1Mトリエチルアミン2.5μL(0.25μmol)を添加し、2日間室温で反応させた。HPLCで精製後、目的物のフラクションを採取し、溶液を留去して式(1)に示す標識プローブを得た(収率74.1%)。
【0061】
(4)ハイブリダイゼーション
前記捕捉プローブを固定した磁気ビーズに、2XSSCを14μL加え、そこに5μMに調製した遺伝子サンプル及び標識プローブをそれぞれ4μL添加し、70℃で穏やかに振とうさせた。1時間振とうさせた後、磁石で磁気ビーズを収集後、溶液をデカントし、40℃に加温した2XSSCで洗浄し、二本鎖核酸が形成された磁気ビーズαを得た。
【0062】
なお、非相補的な捕捉プローブを固定した磁気ビーズについても、上記と同様の処理を行い、二本鎖核酸が形成されていない磁気ビーズβを得た。
【0063】
(5)電気化学測定
以上の工程の後、二本鎖核酸が形成された磁気ビーズα及び二本鎖核酸が形成されていない磁気ビーズβに0.2MのPBSを10μLと0.2Mのトリエチルアミンを10μL混合した溶液を加え、懸濁した後、それぞれ5μLずつ電極に滴下した。
前記電極には、ガラス基板上にスパッタ装置(アルバック製SH−350)によりチタン10nmを下地に金200nmを成膜し、フォトリソグラフィ工程により電極パターンを形成したものを使用した。また、電極の下には永久磁石のシートを取り付けており、作用極のみに磁気ビーズが集約するようにした。
【0064】
5分静置後、前記磁気ビーズα,βが集約した電極xα,yβそれぞれに、電解液を75μL滴下した。
【0065】
図1は本発明に用いた電気的活性基を有する有機金属錯体である。Aはメチレン基が11の長鎖であり、Bはメチレン基が5である。フェロセンは、鉄の上下にシクロペンタジエニル環が配位した非常に安定なサンドイッチ構造を有する有機金属化合物である。フェロセン内の鉄は2価イオンとなっているが、酸化されて3価のフェリシニウムとなる。この反応は可逆的酸化還元反応であり、電位をかけることによりフェロセンの量に比例した電流を取り出すことが可能である。
【0066】
図2にフェロセン膜の自己組織化膜の模式図を示す。図1に示したA物質(メチレン基11)の自己組織化膜であり、Bは図1に示したB物質(メチレン基5)の自己組織化膜であり、Cは金電極のみを示す。自己組織化膜の作成方法は、A・B各分子2.5mMエタノール溶液を調製し、ガラス基板上に金膜を形成した金電極を各溶液中に室温下、24時間浸漬し自己組織化膜を形成させた。自己組織化膜を形成させた後、エタノール溶液にて洗浄し、自己組織化膜を得た。
【0067】
図3に図2で作成した金電極を用いて測定した結果を示す。電気化学発光の測定方法は、A・B・Cの各作用電極表面に電気化学発光剤としてルテニウム錯体を風乾させCCDカメラを用いて発光強度を測定した。作用電極上に1mMのルテニウム錯体1.5マイクロリッタ滴下し常温で風乾させ、金電極表面に物理吸着させた。完全に乾燥した後、電解液50マイクロリッタ滴下し測定を行った。電解液は0.2M リン酸緩衝液pH8.0及び0.2M トリエチルアミンの混合溶液を用いた。電圧は、1秒間0Vから1.3Vまで印加しプロピルアミンをラジカル化させ、その後、4秒間1.3Vを印加した。尚、電圧は参照電極を用いて正確に電位をかけた。金電極のみの場合は、発光強度は80であったが、メチレン基が5の場合では、最高発光強度は180であり、メチレン基が11の場合では、480であった。フェロセンのメチレン基を長鎖にするにつれルテニウムの電気化学発光強度が増加することが示された。ルテニウム錯体の電気化学発光の機序は、電解液中に過剰量に存在するプロピルアミンが酸化反応によりプロピルアミンラジカル(+)となり、即座に水素イオンを失いプロピルアミンラジカルを形成する。基底状態ルテニウム錯体((Ru(bpy)3)2+)は電極上で酸化され(Ru(bpy)3)3+となり、プロピルアミンラジカルとの反応により電子が移動し、励起状態の(Ru(bpy)3)3+*を形成する。励起状態から基底状態に戻る際に、620nmの光を放出する。発光した後、基底状態((Ru(bpy)3)2+)に戻るので、電気化学発光を何回も反応させることが可能である。反応の開始、終了が電気的にコントロールでき、電極に流す電流によって、得られる発光量を調節できる。また、その電荷の量も、レファレンスの電極によって、モニターできる。すなわち、電極に与える電荷の量・時間を調節することにより、測定物・測定系によって適正な発光量を得ることができるメリットがある。
【産業上の利用可能性】
【0068】
本発明にかかる測定方法は、高感度に検出することができ、電気化学発光物質の利用効率を高めることが可能となり、遺伝子診断、感染症診断、ゲノム創薬等の用途に適用できる。
【図面の簡単な説明】
【0069】
【図1】本発明の実施の形態に用いた電気的活性基を有する有機金属錯体の模式図
【図2】同実施の形態に用いた自己組織化膜の模式図
【図3】有機金属錯体の鎖長の長さによる電気化学発光量の変化を示す説明図
【特許請求の範囲】
【請求項1】
特定の配列を有する遺伝子を検出する遺伝子検出方法であって、
前記検出すべき遺伝子を一本鎖に変性して遺伝子サンプルを作製する遺伝子サンプル作製工程と、
電気化学的に活性である物質で標識された、前記検出すべき遺伝子配列に対して相補的な塩基配列を有する一本鎖の標識プローブを作製し、該一本鎖の標識プローブと前記一本鎖の遺伝子サンプルとをハイブリダイズさせ、標識化遺伝子サンプルを形成する遺伝子サンプル標識化工程と、
前記検出すべき遺伝子配列に対して相補的な塩基配列で、且つ前記標識プローブと異なる塩基配列を有する一本鎖の捕捉プローブを作製し、該捕捉プローブを磁気ビーズに固定化する固定化工程と、
前記磁気ビーズに固定された一本鎖の捕捉プローブと前記標識化遺伝子サンプルとをハイブリダイズさせ、前記遺伝子サンプルを前記磁気ビーズに捕捉する遺伝子サンプル捕捉工程と、
前記磁気ビーズを磁力により収集し、未反応の遺伝子サンプルおよび標識プローブを除去する洗浄工程と、
収集した前記磁気ビーズを電解質とともに電極上に展開し、前記磁気ビーズに捕捉された前記標識化遺伝子サンプル中の前記電気化学的に活性である物質を、電気化学的な測定により検出する検出工程と、を含み、
前記電極上に電気的活性基を有する有機金属錯体を配置することを特徴とする遺伝子検出方法。
【請求項2】
請求項1に記載の遺伝子検出方法において、
前記電気的活性基を有する有機金属錯体は、フェロセン分子であることを特徴とする遺伝子検出方法。
【請求項3】
請求項1に記載の遺伝子検出方法において、
前記電気的活性基を有する有機金属錯体は、電気的活性基を有する分子とチオール分子からなり、前記チオール分子により電極上に自己組織化膜を形成することを特徴とする遺伝子検出方法。
【請求項4】
請求項3に記載の遺伝子検出方法において、
前記電気的活性基を有する分子と前記チオール分子は、メチレン基(−CH2−)nをスペーサーとし、n数は2〜11である遺伝子検出方法。
【請求項5】
請求項1に記載の遺伝子検出方法において、
電気化学発光は酸化還元性を有する化合物であることを特徴とする遺伝子検出方法。
【請求項6】
請求項5に記載の検出方法において、
前記酸化還元性を有する化合物は、電気化学発光を示す化合物である、ことを特徴とする遺伝子検出方法。
【請求項7】
請求項6に記載の検出方法において、
前記電気化学発光を示す化合物は、金属錯体であることを特徴とする遺伝子検出方法。
【請求項8】
請求項7に記載の検出方法において、
前記金属錯体の中心金属は、ルテニウム、あるいはオスニウムのいずれかであることを特徴とする遺伝子検出方法。
【請求項9】
請求項1に記載の検出方法において、
ルテニウムを有する有機金属錯体を、核酸またはタンパク質にラベル化することにより、電気化学発光量によりラベル化された核酸量またはタンパク質を定量する事が可能な遺伝子検出方法。
【請求項10】
請求項1に記載の遺伝子検出方法において、
前記磁気ビーズの粒径が、1nm以上、前記磁気ビーズの平均粒径以下(もしくは500nm以下)であることを特徴とする遺伝子検出方法。
【請求項1】
特定の配列を有する遺伝子を検出する遺伝子検出方法であって、
前記検出すべき遺伝子を一本鎖に変性して遺伝子サンプルを作製する遺伝子サンプル作製工程と、
電気化学的に活性である物質で標識された、前記検出すべき遺伝子配列に対して相補的な塩基配列を有する一本鎖の標識プローブを作製し、該一本鎖の標識プローブと前記一本鎖の遺伝子サンプルとをハイブリダイズさせ、標識化遺伝子サンプルを形成する遺伝子サンプル標識化工程と、
前記検出すべき遺伝子配列に対して相補的な塩基配列で、且つ前記標識プローブと異なる塩基配列を有する一本鎖の捕捉プローブを作製し、該捕捉プローブを磁気ビーズに固定化する固定化工程と、
前記磁気ビーズに固定された一本鎖の捕捉プローブと前記標識化遺伝子サンプルとをハイブリダイズさせ、前記遺伝子サンプルを前記磁気ビーズに捕捉する遺伝子サンプル捕捉工程と、
前記磁気ビーズを磁力により収集し、未反応の遺伝子サンプルおよび標識プローブを除去する洗浄工程と、
収集した前記磁気ビーズを電解質とともに電極上に展開し、前記磁気ビーズに捕捉された前記標識化遺伝子サンプル中の前記電気化学的に活性である物質を、電気化学的な測定により検出する検出工程と、を含み、
前記電極上に電気的活性基を有する有機金属錯体を配置することを特徴とする遺伝子検出方法。
【請求項2】
請求項1に記載の遺伝子検出方法において、
前記電気的活性基を有する有機金属錯体は、フェロセン分子であることを特徴とする遺伝子検出方法。
【請求項3】
請求項1に記載の遺伝子検出方法において、
前記電気的活性基を有する有機金属錯体は、電気的活性基を有する分子とチオール分子からなり、前記チオール分子により電極上に自己組織化膜を形成することを特徴とする遺伝子検出方法。
【請求項4】
請求項3に記載の遺伝子検出方法において、
前記電気的活性基を有する分子と前記チオール分子は、メチレン基(−CH2−)nをスペーサーとし、n数は2〜11である遺伝子検出方法。
【請求項5】
請求項1に記載の遺伝子検出方法において、
電気化学発光は酸化還元性を有する化合物であることを特徴とする遺伝子検出方法。
【請求項6】
請求項5に記載の検出方法において、
前記酸化還元性を有する化合物は、電気化学発光を示す化合物である、ことを特徴とする遺伝子検出方法。
【請求項7】
請求項6に記載の検出方法において、
前記電気化学発光を示す化合物は、金属錯体であることを特徴とする遺伝子検出方法。
【請求項8】
請求項7に記載の検出方法において、
前記金属錯体の中心金属は、ルテニウム、あるいはオスニウムのいずれかであることを特徴とする遺伝子検出方法。
【請求項9】
請求項1に記載の検出方法において、
ルテニウムを有する有機金属錯体を、核酸またはタンパク質にラベル化することにより、電気化学発光量によりラベル化された核酸量またはタンパク質を定量する事が可能な遺伝子検出方法。
【請求項10】
請求項1に記載の遺伝子検出方法において、
前記磁気ビーズの粒径が、1nm以上、前記磁気ビーズの平均粒径以下(もしくは500nm以下)であることを特徴とする遺伝子検出方法。
【図1】


【図2】


【図3】




【図2】


【図3】


【公開番号】特開2009−139308(P2009−139308A)
【公開日】平成21年6月25日(2009.6.25)
【国際特許分類】
【出願番号】特願2007−318158(P2007−318158)
【出願日】平成19年12月10日(2007.12.10)
【出願人】(000005821)パナソニック株式会社 (73,050)
【Fターム(参考)】
【公開日】平成21年6月25日(2009.6.25)
【国際特許分類】
【出願日】平成19年12月10日(2007.12.10)
【出願人】(000005821)パナソニック株式会社 (73,050)
【Fターム(参考)】
[ Back to top ]

