遺伝子検出用担体、及びインターフェロン療法の有効性を検出するためのその使用
【課題】患者に対してインターフェロン療法が有効であるか否かを治療前に予測するための手段を提供すること。
【解決手段】遺伝子検出用担体、個体に対するインターフェロン療法の有効性の検出方法、遺伝子検出用装置、及びインターフェロン療法の有効性を検出するためのキットを提供する。
【解決手段】遺伝子検出用担体、個体に対するインターフェロン療法の有効性の検出方法、遺伝子検出用装置、及びインターフェロン療法の有効性を検出するためのキットを提供する。
【発明の詳細な説明】
【技術分野】
【0001】
本発明は、遺伝子検出用担体、個体に対するインターフェロン療法の有効性の検出方法、個体に対するインターフェロン療法の有効性の検出するための遺伝子検出用装置、及びインターフェロン療法の有効性を検出するための遺伝子検出用キットに関する。
【背景技術】
【0002】
近年、C型肝炎ウイルス(以下、HCVと称する)の感染者が急増しており、大きな社会問題となっている。
【0003】
他のウイルス性疾患と同様に、C型肝炎には、インターフェロン療法が一定の効果を有することが明らかとなっているが、インターフェロン療法は、全ての感染者に対して有効なわけではなく、インターフェロン療法が効果を示さない感染者も少なからず存在する。インターフェロン療法が効果を示さない感染者にインターフェロン療法を継続することは、感染者に発熱や貧血などの副作用を引き起こすのみならず、他の治療の開始を遅らせることになる。
【0004】
このため、治療を施すべきHCV感染者に対してインターフェロン療法が有効であるか否かを、治療前に予測することが切望されていたが、現在まで、かかる予測を行うことは全く不可能であった。
【発明の開示】
【発明が解決しようとする課題】
【0005】
上記事情に鑑み、本発明は、患者にインターフェロン療法が有効であるか否かを治療前に予測するための手段を提供することを課題とするものである。
【課題を解決するための手段】
【0006】
上記課題は、下記の本発明によって達成される。
【0007】
本発明の第一の側面に従えば、
基体と、
前記基体に固定化されてなるポリヌクレオチドとを備え、
前記ポリヌクレオチドは、
(at) 下記配列表の配列番号1に示されるポリヌクレオチド、
(bt) 前記(at)に示されるポリヌクレオチド中の455位を除く1もしくは数個のヌクレオチドが欠失、置換、又は付加された修飾ポリヌクレオチド、
(ct) 配列番号1の441〜455位に示される配列を含むポリヌクレオチド、
(dt) 配列番号1の449〜459位に示される配列を含むポリヌクレオチド、
(et) それらの相補鎖
からなる群から選択されるポリヌクレオチドを含むことを特徴とする遺伝子検出用担体が提供される。
【0008】
本発明の第二の側面に従えば、
基体と、
前記基体に固定化されてなるポリヌクレオチドとを備え、
前記ポリヌクレオチドは、
(ag) 下記配列表の配列番号2に示されるポリヌクレオチド、
(bg) 前記(ag)に示されるポリヌクレオチド中の455位を除く1もしくは数個のヌクレオチドが欠失、置換、又は付加された修飾ポリヌクレオチド、
(cg) 配列番号2の441〜455位に示される配列を含むポリヌクレオチド、
(dg) 配列番号2の449〜459位に示される配列を含むポリヌクレオチド、
(eg) それらの相補鎖
からなる群から選択されるポリヌクレオチドを含むことを特徴とする遺伝子検出用担体が提供される。
【0009】
本発明の第三の側面に従えば、
基体と、
前記基体に固定化されてなるポリヌクレオチドとを備え、
前記ポリヌクレオチドは、
(aa) 下記配列表の配列番号3に示されるポリヌクレオチド、
(ba) 前記(aa)に示されるポリヌクレオチド中の455位を除く1もしくは数個のヌクレオチドが欠失、置換、又は付加された修飾ポリヌクレオチド、
(ca) 配列番号3の441〜455位に示される配列を含むポリヌクレオチド、
(da) 配列番号3の449〜459位に示される配列を含むポリヌクレオチド、
(ea)それらの相補鎖
からなる群から選択されるポリヌクレオチドを含むことを特徴とする遺伝子検出用担体が提供される。
【0010】
本発明の第四の側面に従えば、
基体と、
前記基体に固定化されてなるポリヌクレオチドとを備え、
前記ポリヌクレオチドは、
(ac) 下記配列表の配列番号4に示されるポリヌクレオチド、
(bc) 前記(ac)に示されるポリヌクレオチド中の455位を除く1もしくは数個のヌクレオチドが欠失、置換、又は付加された修飾ポリヌクレオチド、
(cc) 配列番号4の441〜455位に示される配列を含むポリヌクレオチド、
(dc) 配列番号4の449〜459位に示される配列を含むポリヌクレオチド、
(ec) それらの相補鎖
からなる群から選択されるポリヌクレオチドを含むことを特徴とする遺伝子検出用担体が提供される。
【0011】
本発明の第五の側面に従えば、上記遺伝子検出用担体を用いたDNAチップが提供される。
【0012】
本発明の第六の側面に従えば、個体に対するインターフェロン療法の有効性の検出方法であって、
1)前記個体から採取した試料ポリヌクレオチドを前記遺伝子検出用担体に接触させる工程と、
2)前記試料ポリヌクレオチドと前記遺伝子検出用担体に固定化されたポリヌクレオチドとのハイブリダイゼーション反応を検知し、前記試料中のポリヌクレオチドの塩基配列を決定する工程とを備える方法が提供される。
【0013】
また、本発明の第七の側面に従えば、個体に対するインターフェロン療法の有効性の検出方法であって、
1)前記個体から採取した試料ポリヌクレオチドが基体上に固定化されてなる遺伝子検出用担体にプローブポリヌクレオチドを接触させる工程と、
2)前記基体上に固定化された試料ポリヌクレオチドと前記ポリヌクレオチドとのハイブリダイゼーション反応を検知し、前記試料ポリヌクレオチドの塩基配列を決定する工程とを備える方法が提供される。
【0014】
前記プローブポリヌクレオチドは、
(at) 下記配列表の配列番号1に示されるポリヌクレオチド、
(bt) 前記(at)に示されるポリヌクレオチド中の455位を除く1もしくは数個のヌクレオチドが欠失、置換、又は付加された修飾ポリヌクレオチド、
(ct) 配列番号1の441〜455位に示される配列を含むポリヌクレオチド、
(dt) 配列番号1の449〜459位に示される配列を含むポリヌクレオチド、
(et) それらの相補鎖
(ag) 下記配列表の配列番号2に示されるポリヌクレオチド、
(bg) 前記に示されるポリヌクレオチド中の455位を除く1もしくは数個のヌクレオチドが欠失、置換、又は付加された修飾ポリヌクレオチド、
(cg) 配列番号2の441〜455位に示される配列を含むポリヌクレオチド、
(dg) 配列番号2の449〜459位に示される配列を含むポリヌクレオチド、
(eg) それらの相補鎖
(aa) 下記配列表の配列番号3に示されるポリヌクレオチド、
(ba) 前記(aa)に示されるポリヌクレオチド中の455位を除く1もしくは数個のヌクレオチドが欠失、置換、又は付加された修飾ポリヌクレオチド、
(ca) 配列番号3の441〜455位に示される配列を含むポリヌクレオチド、
(da) 配列番号3の449〜459位に示される配列を含むポリヌクレオチド、
(ea) それらの相補鎖
(ac) 下記配列表の配列番号4に示されるポリヌクレオチド、
(bc) 前記(ac)に示されるポリヌクレオチド中の455位を除く1もしくは数個のヌクレオチドが欠失、置換、又は付加された修飾ポリヌクレオチド、
(cc) 配列番号4の441〜455位に示される配列を含むポリヌクレオチド、
(dc) 配列番号4の449〜459位に示される配列を含むポリヌクレオチド、
(ec) それらの相補鎖
からなる群より選択されるポリヌクレオチドを含む。
【0015】
本発明の第八の側面に従えば、
前記遺伝子検出用担体と、
前記基体上に固定化されたポリヌクレオチドと標識が付されたポリヌクレオチドとを含む試料とを接触させ、前記基体上に固定化されたポリヌクレオチドと前記標識が付されたポリヌクレオチドとをハイブリタイゼーション反応条件下に置く反応部と、
前記標識が付されたポリヌクレオチドに付された標識を検出する標識検出装置を少なくとも備えるインターフェロン療法の有効性を検出するための遺伝子検出用装置が提供される。
【0016】
本発明の第九の側面に従えば、
前記遺伝子検出用担体と、
対極と、
前記遺伝子検出用担体及び前記対極間に電圧を印加する電圧印加部と、
前記遺伝子検出用担体に固定化された前記ポリヌクレオチドとポリヌクレオチドとを含む試料とを接触させ、前記基体上に固定化されたポリヌクレオチドと前記試料中のポリヌクレオチドとをハイブリダイゼーション反応条件下に置く反応部と、
前記ハイブリダイゼーション反応後に前記電圧印加手段により電圧を印加させた際に前記遺伝子検出用担体及び前記対極間に生じた電気信号を測定する測定部とを備えたインターフェロン療法の有効性を検出するための遺伝子検出用装置が提供される。
【0017】
本発明の第十の側面に従えば、前記遺伝子検出用担体と、緩衝液とを備えることを特徴とするインターフェロン治療の有効性を測定するためのキットが提供される。
【0018】
本発明の第十一の側面に従えば、前記遺伝子検出用担体と、二本鎖認識体と、緩衝液とを備えることを特徴とする個体に対するインターフェロン治療の有効性を検出するためのキットが提供される。
【発明の効果】
【0019】
本発明によって、患者にインターフェロン療法が有効であるか否かを治療前に予測するための手段が提供された。
【発明を実施するための最良の形態】
【0020】
以下、本発明を詳細に説明する。
【0021】
配列番号1、配列番号2、配列番号3、及び配列番号4のポリヌクレオチドは、ヒトMxA遺伝子のプロモーター領域を包含するポリヌクレオチドであり、本発明者らによって、これらのポリヌクレオチドの455位に存在する一塩基多型(single nucleotide polymorphism)(以下、SNPと称する)がインターフェロン療法の効果に対する応答性に関与していることが初めて見出された。
【0022】
各々のポリヌクレオチドの441〜456位には、インターフェロン応答配列(interferon-stimulated response element)(以下、ISREと称する)が存在している。
【0023】
配列番号1の441〜456位のISREの塩基配列は、「GGTTTCGTTTCTG CTC」(配列番号5)であり、ISREの15番目(配列番号1の455位に相当する。配列番号1における455位は、転写開始部位を+1とする通常の表記によれば、-88位に相当する)がチミンである。
【0024】
配列番号2の441〜456位のISREの塩基配列は、「GGTTTCGTTTCTGCGC」(配列番号6)であり、ISREの15番目(配列番号2の455位に相当する。配列番号2における455位は、転写開始部位を+1とする通常の表記によれば、-88位に相当する)がグアニンである。
【0025】
また、配列番号3の441〜456位のISREの塩基配列は、「GGTTTCGTTTCTGCAC」(配列番号7)であり、ISREの15番目(配列番号3の455位に相当する。配列番号3における455位は、転写開始部位を+1とする通常の表記によれば、-88位に相当する)はアデニンである。
【0026】
配列番号4の441〜456位のISREの塩基配列は、「GGTTTCGTTTCTGCCC」(配列番号8)であり、ISREの15番目(配列番号4の455位に相当する。配列番号4における455位は、転写開始部位を+1とする通常の表記によれば、-88位に相当する)はシトシンである。
【0027】
以下、本明細書を通じて、配列番号1、配列番号2、配列番号3及び配列番号4の455位をSNP部位(SNP site)と称する。
【0028】
これらのISREのSNP部位以外の領域は各配列ともに共通である。これらのISREの15番目のヌクレオチドがチミンであるISRE(配列番号5)を有するHCV感染者は、インターフェロン療法が有効であるのに対して、15番目のヌクレオチドがチミンであるISRE(配列番号5)を持たないHCV感染者は、インターフェロン療法が有効でないことが本発明者らにより疫学的に実証された。
【0029】
つまり、実施例に詳述されているように、455位のヌクレオチドがグアニンである配列番号1のポリヌクレオチドをホモ接合で有する(以下、G/Gホモと略記する) HCV感染者は、455位のヌクレオチドがチミンである配列番号1のポリヌクレオチドと、455位のヌクレオチドがグアニンである配列番号1のプロモーター領域をヘテロ接合で有する (以下、G/Tヘテロと略記する)HCV感染者、又は配列番号1のポリヌクレオチドをホモ接合で有する(以下、T/Tホモと略記する)HCV感染者と比べて、インターフェロン療法が有効でないことが実証された。
【0030】
あるいは、455位のヌクレオチドがチミンでないMxA遺伝子のプロモーター領域をホモ接合で有するHCV感染者(以下、non-T/non-Tホモと略記する)は、T/non-Tヘテロ又はT/TホモのHCV感染者と比べて、インターフェロン療法が有効でないことが示された。non-T/non-Tホモの組み合わせとしては、G/G、G/A、G/C、A/A、A/C、C/Cがある。T/non-Tの組み合わせとしては、T/G、T/A、T/Cがある。
【0031】
従って、インターフェロン療法の実施に先立って、例えばHCV感染者が有するヒトMxA遺伝子のプロモーター領域を包含するポリヌクレオチドのISREにおけるSNP部位のヌクレオチドを決定することによって、該HCV感染者に対して、インターフェロン療法の有効性を検知することができる。
【0032】
本発明の遺伝子検出用担体等は、被験者から抽出されたポリヌクレオチドの核酸鎖の配列を検出するプローブとして、前記SNP部位を含み当該SNP部位の塩基配列がチミンである配列番号1のポリヌクレオチド、その断片又はそれらの相補鎖が用いられている。
【0033】
この本発明の遺伝子検出用担体等を用いれば、被験者が有するヒトMxA遺伝子のプロモーター領域を包含するポリヌクレオチドの前記SNP部位がチミンであるか否かを治療の前に調べることができる。それにより前記被験者に対するインターフェロン療法の有効性を予測することができる。
【0034】
また、本発明の遺伝子検出用担体などは被験者から抽出されたポリヌクレオチドの核酸鎖の配列を検出するプローブとして前記SNP部位を含み、当該SNP部位の塩基配列がgである配列番号2のポリヌクレオチド、その断片またはそれらの相補鎖、又は当該SNP部位の塩基配列がaである配列番号3のポリヌクレオチド、その断片またはそれらの相補鎖、又は当該SNP部位の塩基配列がcである配列番号4のポリヌクレオチド、その断片またはそれらの相補鎖が用いられている。
【0035】
この本発明の遺伝子検出用担体などを用いれば、被験者が有するヒトMxA遺伝子のプロモーター領域を包含するポリヌクレオチドの前記SNP部位の配列を調べることができ、それにより前記被験者に対するインターフェロン療法の有効性を予測することができる。
【0036】
インターフェロン療法を施すべき疾病には、C型肝炎以外にも、膠芽腫、髄芽腫瘍、星細胞腫、皮膚悪性黒色腫、B型肝炎、腎癌、多発性骨髄腫、ヘアリー細胞白血病、慢性骨髄性白血病、亜急性硬化性全脳炎、ウイルス性脳炎、免疫抑制患者の全身性帯状疱疹及び水痘、上咽頭未分化癌、聴力低下を伴うウイルス性内耳感染症、ヘルペス性角膜炎、偏平コンジローマ、尖圭コンジローマ、アデノウイルス及びヘルペスウイルス感染による結膜炎、性器ヘルペス、口唇ヘルペス、子宮頚癌、癌性胸水症、角化棘細胞腫、基底細胞癌、δ型慢性活動性肝炎などが含まれる。前記インターフェロン療法で用いられるインターフェロンとしては、インターフェロンα、βまたはω等がある。
【0037】
本発明の遺伝子検出用担体等は、これらの疾病に罹患した被験者にインターフェロン療法を実施する前に、インターフェロン療法の有効性を検知するために使用できる。
【0038】
次に、本発明の夫々の側面について、さらに詳細に説明する。
【0039】
第一に、本発明は、インターフェロン療法の実施に先立って、インターフェロン療法が有効であり得る疾病に罹患した患者に対するインターフェロン療法の有効性を検知するために使用できる遺伝子検出用担体を提供する。
【0040】
<遺伝子検出用担体の概略>
本発明の遺伝子検出用担体は、基板、多孔質体、マイクロタイタープレート、ビーズ等の基体に、前記所定のポリヌクレオチドを固定化することによって作成することができる。
【0041】
ポリヌクレオチドを固定化すべき基体の材質、大きさ、形状などは特に限定されるものではなく、ポリヌクレオチドを固定化することができる任意の基体を使用できる。
【0042】
基体の材質としては、例えば、シリコン、ガラス、石英ガラス、アルミナ、サファイヤ、フォルステライト、炭化珪素、酸化珪素、窒化珪素、磁性体などの無機材料や、ポリエチレン、ポリプロピレン、ポリイソブチレン、ポリエチレンテレフタレート、不飽和ポリエステル、含フッ素樹脂、ポリ塩化ビニル、ポリ塩化ビニリデン、ポリ酢酸ビニル、ポリビニルアルコール、ポリビニルアセタール、アクリル樹脂、ポリアクリロニトリル、ポリスチレン、アセタール樹脂、ポリカーボネート、ポリアミド、フェノール樹脂、ユリア樹脂、エポキシ樹脂、メラミン樹脂、スチレン・アクリロニトリル共重合体、アクリロニトリルブタジエンスチレン重合体、シリコーン樹脂、ポリフェニレンオキサイド、ポリスルホン、ニトロセルロース、ナイロン、ポリメチルメタクリレート、ポリフェにレンスルホン、ポリエーテルスルホン、ポリエーテルケトン、フルオロエチレン共重合体、ポリメチルペンテン等の有機材料を用いることができる。さらに上記無機材料と有機材料の複合体を用いることもできる。
【0043】
基体にポリヌクレオチドを固定化する方法は、例えば、Science 251:767-773(1991)に開示された方法を用いることができる。また、該方法以外にも、ポリヌクレオチドを基体に固定化するための改良法が知られており、このような改良法を用いてポリヌクレオチドを固定化してもよい。
【0044】
有機材料やガラスからなる基体を用いる場合には、基体の表面をポリリジンやアミノシラン等で表面を被覆しておくと、ポリヌクレオチドを安定に固定化することができる。
【0045】
本明細書において、「ポリヌクレオチド」とは、2以上のヌクレオシドがリン酸エステル結合で結合されてなる物質を意味する。「ヌクレオシド」には、デオキシリボヌクレオシド及びリボヌクレオシドが含まれるが、これらに限定されない。
【0046】
さらに、本発明の基体に固定化するポリヌクレオチドは、RNA,DNA,PNA,メチルフォスホネート核酸、S-オリゴなどのオリゴヌクレオチドや、cDNA、cRNAなどのポリヌクレオチドなどを用いることができる。
【0047】
なお、本明細書において、「プロモーター領域」とは、TATAボックス等の転写開始反応に直接関与する領域のみを指すのではなく、該領域の近傍又は遠隔に存在して転写開始反応の効率に影響を与える調節配列を含む配列も指称するものとする。従って、「プロモーター領域」なる語には、転写開始反応に関与する配列のみ、調節配列のみ、及びその両者が連結された配列が含まれることに留意しなければならない。
【0048】
また、「ISRE」とは、インターフェロンα、β、又はγの刺激によって誘導される遺伝子の転写調節領域に存在する約12〜15のヌクレオチドからなる塩基配列を意味する。
【0049】
基体に固定化されるポリヌクレオチドとしては、以下の(a)〜(e)を含むものが挙げられる。
【0050】
(a)配列番号1、2、3、4のいずれかに示されるポリヌクレオチド。
【0051】
(b)前記(a)に示されるポリヌクレオチドにおいて、455位を除く1もしくは数個のヌクレオチドが欠失、置換、または付加されたポリヌクレオチド。
【0052】
欠失の例としては、128位、133位、152位、508位、及び543位の欠失、置換の例としては330位の置換(G→T)、542位の置換(C→G)、付加の例としては501位への付加(C)を挙げることができる。
【0053】
更に、前記配列番号1、2、3、4のポリヌクレオチド又は前記ポリヌクレオチドの断片に、プロモーター、エンハンサー、上流活性化配列、サイレンサー、上流抑制配列、アテニュエーター、ポリAテール、核移行シグナル、Kozak配列、ISRE、薬物耐性因子、シグナルペプチドの遺伝子、膜貫通領域の遺伝子、ルシフェリン、緑色蛍光タンパク質、フィコシアニン、西洋ワサビペルオキシダーゼを含むマーカータンパク質の遺伝子、インターフェロン応答性タンパク質の遺伝子、非インターフェロン応答性タンパク質の遺伝子からなる群から選択される少なくとも1つの機能的ポリヌクレオチドが連結されてなる修飾ポリヌクレオチドを用いてよい。
【0054】
また、配列番号1、2、3、4に示される前記ポリヌクレオチドの塩基配列のうち、インターフェロン療法の有効性に関与しているのは455位に位置するSNP部位に存在する1個のヌクレオチドなので、基体に固定化すべきポリヌクレオチドは、前記455位のSNP部位を含むポリヌクレオチドの断片であってよい。
【0055】
基体に固定化するポリヌクレオチドとして前記断片を用いる場合は、11ヌクレオチド以上30ヌクレオチド以下であることが望ましい。基体に固定化するポリヌクレオチドの長さが過度に長いと、1個のヌクレオチドの相違を識別することが困難になる。一方、基体に固定化するポリヌクレオチドの長さが過度に短いと試料中に含まれるポリヌクレオチドの塩基配列の決定が困難になる。
【0056】
特に基体に固定化すべき好適なポリヌクレオチドとしては
(c)前記455位のSNP部位を含む配列番号1、配列番号2、配列番号3、配列番号4のポリヌクレオチドの断片であって、配列番号1、配列番号2、配列番号3、配列番号4の441〜456位に相当する配列番号5,配列番号6,配列番号7,配列番号8で示される配列を有するポリヌクレオチド(すなわち前記ISRE)を含む断片。
【0057】
(d)前記455位のSNP部位を含む配列番号1、配列番号2、配列番号3、配列番号4のポリヌクレオチドの断片であって、配列番号1乃至配列番号4の449〜459位に相当する配列番号9、10、11、12のポリヌクレオチドを含む断片。特に(d)は前記SNPをほぼ中心とし、前後同等の長さの塩基配列を含むものであるため、精度の高く塩基配列の決定が行われる。更に精度の高い検出を行うためには、望ましくは配列番号1ないし配列番号4の447〜461位に相当するポリヌクレオチドを含む断片である。
【0058】
さらに、基体に固定化すべき好適なポリヌクレオチドとしては
(e)前記(a)〜(d)に示されるポリヌクレオチドの相補鎖であってもよい。
【0059】
前記配列番号5,配列番号6,配列番号7,配列番号8で示される配列(すなわち前記ISRE)の相補鎖は、配列番号13,14、15、16で表される配列である。
【0060】
前記配列番号9,配列番号10,配列番号11,配列番号12で示される配列の相補鎖は、それぞれ配列番号17、配列番号18、配列番号19、配列番号20で示される配列である。
【0061】
本発明の遺伝子検出用担体は、基体に固定化された上記所定のポリヌクレオチドをプローブとし、このプローブと被験者から抽出したポリヌクレオチドとのハイブリダイゼーション反応を検出し、被験者のヒトMxA遺伝子のプロモーター領域を包含するポリヌクレオチド配列を決定し、前記SNP部位に何れを有しているかを調べるために使用される。
【0062】
<遺伝子検出用担体の使用法>
以下に、前記遺伝子検出用担体を用いて具体的に被験者から抽出したポリヌクレオチドの配列を決定する方法について説明する。
【0063】
前記遺伝子検出用担体を用い、被験者から抽出したポリヌクレオチドの配列の決定を行う手段は、(1)標識物質を用いる方法と、(2)電気化学的方法の2種類ありえる。
【0064】
まず(1)の標識物質を用いる方法について具体的に説明する。
【0065】
まず、ヒトを含む哺乳動物等の被験者からポリヌクレオチドを含む試料(血液などの体液、血球成分、生検組織、培養細胞など)を採取する。ポリヌクレオチドは体内に広く含まれているので個体から採取した任意の試料であってもよい。好ましい試料は血液である。
【0066】
続いて、必要に応じて、フェノール抽出やエタノール沈殿などの分離抽出操作、PCRなどの増幅操作を行った後、前記試料中に含まれる試料ポリヌクレオチドを抽出する。ポリヌクレオチドを抽出する方法としては、例えばフェノール抽出、エタノール沈殿の他、任意の抽出方法を使用し得る。mRNAを抽出する場合には、オリゴdTカラムにかけてもよい。試料ポリヌクレオチドの量が少ないときには必要に応じて試料ポリヌクレオチドを増幅する操作を行っても良い。
【0067】
その後試料ポリヌクレオチドに標識物質を付与して、標識ポリヌクレオチドを得る標識操作を行う。また、試料ポリヌクレオチドに標識付与せずに標識物質を付与したポリヌクレオチドを含む2次プローブを混合しても良い。
【0068】
標識物質としては、蛍光物質などの発光物質、ハプテン、酵素、放射性同位体、電極活物質などの検出可能な物質をあげることができるが特に限定されるものではない。試料ポリヌクレオチドに対する標識はプロモーター領域を標識することが望ましい。プロモーター領域を標識するには、様々な公知の手法を使用し得るが、標識したプライマーを用いたPCR反応によれば、増幅操作と標識操作を同時に行うことができるので有用であろう。
【0069】
続いて、試料ポリヌクレオチドと基体上のポリヌクレオチドとをハイブリダイゼーション反応条件下に置く。すなわち、まず、前記標識された試料ポリヌクレオチドをハイブリダイゼーション用の反応溶液に添加した後、該反応溶液を本発明の遺伝子検出用担体と接触させる。試料ポリヌクレオチドに基体上のヌクレオチドの相補鎖が存在すれば、その試料ポリヌクレオチドは基体上のポリヌクレオチドとハイブリダイゼーション反応し基体上に固定化される。
【0070】
ハイブリダイゼーション反応条件は、反応温度は10〜90℃の範囲、反応時間は1分以上1晩程度であり得る。反応中は、撹拌、あるいは振とうなどの操作で反応速度を高めることもできる。ハイブリダイゼーション用の反応溶液は、イオン強度0.01〜5の範囲、pH5〜10の範囲の緩衝液であり得る。反応溶液中にはハイブリダイゼーション促進剤である硫酸デキストランや、サケ精子DNA、牛胸DNA、EDTA、界面活性剤などを添加してもよい。
【0071】
その後、適宜洗浄を行う。
【0072】
続いて、被験者が前記SNP部位に何れを有しているかを決定するために、試料ポリヌクレオチドと基体上のポリヌクレオチドとの間のハイブリダリゼーション反応の有無を検出する。
【0073】
基体上に、固定化された前記(a)〜(e)のいずれかを含むポリヌクレオチドのうち、前記SNP部位がチミンであるポリヌクレオチド又はその相補鎖に試料ポリヌクレオチドがハイブリタイズされたことが検出されれば、被験者のヒトMxA遺伝子のプロモーター領域を包含するポリヌクレオチドのSNP部位がチミンである。一方、前記SNP部位がグアニンであるポリヌクレオチド又はその相補鎖に試料ポリヌクレオチドがハイブリタイズされたことが検出されれば、被験者のヒトMxA遺伝子のプロモーター領域を包含するポリヌクレオチドのSNP部位がグアニンである。アデニン、シトシンの場合も同様である。
【0074】
この検出は、標識の種類に応じた適宜の検出装置を用いて、試料中の標識されたポリヌクレオチド又は2次プローブ中の標識を検出することによって行う。標識が蛍光物質の場合には、例えば、蛍光検出器を用いて標識を検出すればよい。
【0075】
遺伝子検出用担体としては、1つの基体上に、前記(a)〜(e)のいずれかのポリヌクレオチドのうち前記SNP部位がチミンであるもの又はその相補鎖と、グアニンであるものまたはその相補鎖、アデニンであるものまたはその相補鎖、シトシンであるものまたはその相補鎖からなる群から選ばれる少なくとも1種とを共に固定化してもよいが、その場合、ポリヌクレオチドの種類と、基体上の各ポリヌクレオチドの位置および標識の種類の少なくとも一方を予め特定しておくことが必要である。検出された標識の位置および標識の種類の少なくとも一方によって、試料中のポリヌクレオチドが基体上の何れのポリヌクレオチドとハイブリダイズしたかが明らかとなる。
【0076】
(1)の標識物質を用いる方法において、被験者から採取した試料ポリヌクレオチドを基体上に固定化した遺伝子検出用担体を用いた場合にも、試料ポリヌクレオチドの配列を決定することができる。すなわち、あらかじめ異なる標識を付与された配列が既知の(a)〜(e)から選ばれるポリヌクレオチドであって前記SNPの塩基の種類が異なるポリヌクレオチドの溶液を接触させ、溶液中のポリヌクレオチドと電極上の試料ポリヌクレオチドとをハイブリダイゼーション反応条件下に置く。溶液中に基体上の試料ポリヌクレオチドの相補鎖が存在すれば、その試料ポリヌクレオチドは基体上のポリヌクレオチドとハイブリダイゼーション反応し基体上に固定化される。その後どの配列のポリヌクレオチドとハイブリダイゼーション反応が生じたかを標識物質の種類を検知することによって検知でき、試料ポリヌクレオチドの配列を知ることが可能となる。
【0077】
以上の方法にて、試料ポリヌクレオチドが、前記SNP部位にチミンを有するポリヌクレオチド又はその相補鎖とハイブリダイズしたときには、被験者は、前記SNP部位にチミンを有しており、それ故、インターフェロン療法が有効であると予測できる。これに対して、試料中のポリヌクレオチドが、前記SNP部位にグアニンを有するポリヌクレオチド又はその相補鎖とハイブリダイズし、かつ前記SNP部位にチミンを有するポリヌクレオチド又はその相補鎖とハイブリダイズしなかったときには、被験者は、前記SNP部位にチミンを有しておらず、それ故、インターフェロン療法が有効でないと予測できる。
【0078】
次に(2)の電気化学的方法について具体的に説明する。
【0079】
上記(1)の標識物質を用いる方法では試料ポリヌクレオチドと基体上のポリヌクレオチドとのハイブリダイゼーション反応の有無を、標識物質の検出にて行ったが、(2)の電気化学的方法では、ハイブリダイゼーション反応の有無を電気化学的に検出する。
【0080】
電気化学的方法では、遺伝子検出用担体としてポリヌクレオチド固定化電極電極を用いる。ポリヌクレオチド固定化電極(以下、本発明の電極という)は、導電性物質からなる基体に前記(a)〜(e)のいずれかのポリヌクレオチドが固定化されてなる。
【0081】
ポリヌクレオチドを固定化すべき好ましい導電性物質は金であるが、他の材料も使用可能である。例えば、金の合金、銀、プラチナ、水銀、ニッケル、パラジウム、シリコン、ゲルマニウム、ガリウム、タングステン等の金属単体及びそれらの合金、あるいはグラファイト、グラシーカーボン等の炭素等、またはこれらの酸化物、化合物を用いる事ができる。これらの導電性物質は、別の基板上にメッキ、印刷、スパッタ、蒸着などで形成されていてもよい。
【0082】
導電性物質よりなる基体にポリヌクレオチドを固定化する方法は特に限定されるものではない。例えば、ポリヌクレオチドに導入したチオール基と金との結合を利用すると簡単に行うことができる。その他、物理吸着、化学吸着、疎水結合、抱埋、共有結合等でも固定化が可能である。また、ビオチン−アビジン結合やカルボジイミドなどの縮合剤を用いることもできる。これらの場合、あらかじめ官能基を有する分子で導電性物質表面を修飾することにより、固定化を容易にすることができる。更に、基体表面へのポリヌクレオチドの非特異的な吸着を抑制するために、基体面をメルカプトエタノール等のメルカプタンや、ステアリルアミンなどの脂質で被覆することが望ましい。
【0083】
以下、一例として、金基体にポリヌクレオチドを固定化する方法を述べる。
【0084】
まず、脱イオン水で金基体を洗浄した後、活性化処理を行う。活性化には、0.1〜10 mmol/Lの硫酸溶液を用いる。この溶液中で、−0.5〜2V (vs Ag/AgCl)の範囲で、1 v/s〜100000 v/sの範囲で電位を走査させる。これにより、金基体表面はポリヌクレオチドを固定化できる状態にまで活性化される。
【0085】
固定化すべきポリヌクレオチドには5’あるいは3’末端にチオール基を導入しておく。チオール化したポリヌクレオチドは、固定化直前までDTT等の還元剤の溶液に溶解しておき、使用直前にゲル濾過あるいは酢酸エチルによる抽出操作等でDTTを除去する。固定化は、イオン強度0.01〜5の範囲でpH5〜10の範囲内の緩衝液中にプローブを1 ng/ml〜1 mg/mLの範囲になるように溶解し、活性化した直後の基体を浸漬する。固定化反応は、4〜100℃の範囲で10分から1晩程度行う。ポリヌクレオチドを固定化した後の基体は、核酸分解酵素(ヌクレアーゼ)が存在しない条件、できれば遮光して保存することが望ましい。
【0086】
基体上にポリヌクレオチドを固定化する際には、DNAスポッターやDNAアレイヤ−と呼ばれる固定化装置を用いると比較的容易にポリヌクレオチドを固定化することができる。この際、基体の表面を傷つけないために、インクジェット方式や静電方式のスポッターを用いることが望ましい。また、基体表面で直接ポリヌクレオチドの合成を行うことも可能である。
【0087】
本発明の電極は、導電体と、該導電体に電気的に接続された前記本発明の電極とが基板上に配置されたいわゆるDNAチップを構成していることが望ましい。DNAチップは、基板上、望ましくは絶縁性基板上に、絶縁材料で適切に被覆された金属線などの導電体を配設した後、予め前記所定のポリヌクレオチドを固定化した前記電極を前記導電体に通電可能に接続することにより作成する。
【0088】
異なる配列を有するポリヌクレオチドは、それぞれ、互いに絶縁された異なる複数の電極上に固定化されていることが必要である。複数の電極を基板上に設置する場合、基板上に設置すべき電極の数は、実用的には101〜105個であり得る。
【0089】
基板上に本発明の電極を複数設置するときには、さらに走査線を設置し、前記導電体と走査線との各交点にスイッチング素子を配してもよい。それにより、各電極に順次電圧を印加して、電極毎にハイブリダイゼーション反応が起こったか否かを迅速に決定することが可能となる。
【0090】
本発明の電極を用いたハイブリダイゼーション反応の有無の検出では、他の一般的な電気化学的検出法と同じように、本発明の電極の他に、少なくとも対極、必要に応じて参照極を適宜配置する。参照極を配置する場合、例えば、銀/塩化銀電極や水銀/塩化水銀電極などの一般的な参照極を使用し得る。これらの電極は本発明の電極と同一の基板上に配置されていることが望ましい。
【0091】
本発明の電極を用いて、被験者から採取したポリヌクレオチドの配列の決定するには、以下の操作を行う。
【0092】
まず、ヒトを含む哺乳動物等の被験者から核酸を含む試料を採取し、必要に応じて上述した抽出操作、増幅操作、必要に応じて標識付与を行う。これらの操作は(1)の方法と同じである。但し標識の付与は必ずしも必要ではない。
【0093】
次に、前記試料を含む溶液を本発明の電極と接触させて、試料ポリヌクレオチドと電極上のポリヌクレオチドとをハイブリダイゼーション反応条件下に置く。試料ポリヌクレオチドに基体上のヌクレオチドの相補鎖が存在すれば、その試料ポリヌクレオチドは基体上のポリヌクレオチドとハイブリダイゼーション反応し基体上に固定化される。その操作、及び条件は(1)の方法と同様である。その後、本発明の電極を洗浄する。
【0094】
さらに、本発明の電極近傍に導電性の二本鎖認識体の溶液を添加することにより、電極に固定化されたポリヌクレオチドと試料ポリヌクレオチドとがハイブリダイズすることによって形成された二本鎖のポリヌクレオチドに二本鎖認識体をインターカレートさせる。試料ポリヌクレオチドと基体上のポリヌクレオチドとの間のハイブリダリゼーション反応の有無の検出は、電極に電圧を印加したときに、電極上の二本鎖のポリヌクレオチドにインターカレートされた二本鎖認識体から生じる電気的な信号を検出することによって行われる。
【0095】
ここで用いられる二本鎖認識体は特に限定されるものではないが、例えば、ヘキスト33258、アクリジンオレンジ、キナクリン、ドウノマイシン、メタロインターカレーター、ビスアクリジン等のビスインターカレーター、トリスインターカレーター、ポリインターカレーター等を用いることが可能である。メタロインターカレーターと呼ばれるルテニウム、コバルト、鉄などの金属錯体や、エチジウムブロマイド等の有機化合物を用いることができる。また、これら以外にもヘキスト33258やシアニン色素などのグルーブバインダー、抗体、酵素などの生体高分子を用いることも可能である。
【0096】
二本鎖認識体の濃度は、その種類によって異なるが、一般的には1 ng/ml〜1 mg/mlの範囲で使用する。この際、イオン強度0.001〜5の範囲で、pH5〜10の範囲の緩衝液を用いる。
【0097】
本発明の電極を二本鎖認識体と反応させた後、必要に応じて、さらに電極を洗浄する。さらに本発明の電極を作用電極とし、この作用電極と別途設けられた対極との間に電位を印加し、両極間の電流測定をすることによって電気化学的な信号を検出する。電気化学的な信号の検出は、このような2電極(作用電極及び対極)で行っても良いが、あるいは作用電極、対極、参照極を用いた3電極で行っても良い。電気化学的信号の検出において、電位は定速で掃引するか、あるいはパルスで印加するか、あるいは、定電位を印加することができる。測定には、ポテンショスタット、デジタルマルチメーター、ファンクションジェネレーター等の装置を用いて電流、電圧を制御する。得られた電流値を基に、検量線から標的遺伝子の濃度を算出する。
【0098】
前記(a)〜(e)のいずれかのポリヌクレオチドのうち、前記SNP部位がチミンであるもの又はその相補鎖と、前記SNP部位がグアニンであるもの又はその相補鎖、前記SNP部位がアデニンであるもの又はその相補鎖、前記SNP部位がシトシンであるもの又はその相補鎖は、それぞれ互いに絶縁された異なる電極に固定化されて同一の基板上に配設されたDNAチップを構成していることが精度の高い測定を行う上で望ましい。その場合、各電極から各ポリヌクレオチドに対応した電気化学的信号を検知する。
【0099】
(2)の電気化学的方法を用い、被験者から採取した試料ポリヌクレオチドを電極上に固定化した電極を用いても、試料ポリヌクレオチドの配列を決定することもできる。すなわち、あらかじめ配列が既知である(a)〜(e)のいずれかのポリヌクレオチドの溶液を接触させることによって、溶液中のポリヌクレオチドと電極上の試料ポリヌクレオチドとをハイブリダイゼーション反応条件下に置く。溶液中に基体上の試料ポリヌクレオチドの相補鎖が存在すれば、その試料ポリヌクレオチドは基体上のポリヌクレオチドとハイブリダイゼーション反応し基体上に固定化される。そのハイブリダイゼーション反応を検知することによって、試料ポリヌクレオチドの配列を知ることが可能となる。
【0100】
上記の方法にて、試料ポリヌクレオチドと、前記SNP部位にチミンを有するポリヌクレオチド又はその相補鎖とのハイブリダイズ反応が検出されたときには、被験者は、前記SNP部位にチミンを有しており、それ故、インターフェロン療法が有効であると予測できる。これに対して、試料中のポリヌクレオチドと、前記SNP部位にチミン以外を有するポリヌクレオチド又はその相補鎖とのハイブリダイズ反応が検出され、かつ前記SNP部位にチミンを有するポリヌクレオチド又はその相補鎖とのハイブリダイズ反応が検出されなかったときには、被験者は、前記SNP部位にチミンを有しておらず、それ故、インターフェロン療法が有効でないと予測できる。
【0101】
<電気的な検出装置>
以下に本発明の電極を用いて被験者から抽出したポリヌクレオチドの配列の決定を行うための遺伝子検出装置の一例を示す。即ち、前記本発明の電極と、電極上に固定化されたポリヌクレオチドとのハイブリダイゼーション反応を実行するための反応部と、前記電極に固定化された核酸に電圧を印加する印加手段と、該印加手段の動作によって生じた信号を測定する測定手段とを備えた遺伝子検出用装置である。
【0102】
<電気的な検出装置の基本的構成>
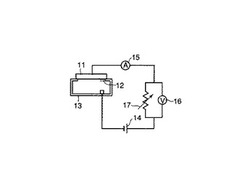
図1には、このような遺伝子検出用装置の基本的な実施形態が示されている。
【0103】
図1において、11は、ポリヌクレオチド12が固定化された電極である。13は反応槽であり、電源14が電極11と反応槽13を介して回路を形成するように接続されている。また、回路の内部には、電流計15、電圧計16、及び可変抵抗17が配置されており、反応槽13内でハイブリダイゼーション反応を行った後に、電圧を印加して回路に流れる電流等を測定するように構成されている。
【0104】
図1の遺伝子検出用装置を用いて検査を行うには、反応槽13の内部に緩衝液と被験者から採取したポリヌクレオチド含有試料を保持させ、試料ポリヌクレオチドと電極11上のポリヌクレオチド12との間でハイブリダイゼーション反応を行う。ハイブリダイゼーションの温度及び時間などの条件は、上述したとおりである。続いて、好ましくは反応槽13及び電極11を洗浄し、挿入剤を含むハイブリダイゼーション溶液を反応槽13に満たして電源14を作動させ、電流計15や電圧計16を用いて電源値あるいは電圧値等を測定する。
【0105】
図1には、本発明の遺伝子検出用装置の最も基本的な態様を示したが、検査を完全に自動化するために、本発明の遺伝子検出用装置は、図2のように、さらに、複雑な構成をとってもよい。
【0106】
<自動化した電気的検出装置の構成>
図2に示した検出装置20は、ポリヌクレオチド固定化電極を保持するための電極ホルダ21、反応槽22、第1洗浄槽23、挿入剤反応槽24、第2洗浄槽25、及び電気化学測定槽26、並びに反応槽22、第1洗浄槽23、挿入剤反応槽24、第2洗浄槽25、及び電気化学測定槽26を載せた移動装置27、並びに分析ユニット28、及び操作ユニット29を具備している。これらの槽の間での電極の移動は、移動装置27を使って反応槽等を動かすことにより達成される。
【0107】
<自動化した電気的検出装置の使用法>
検出装置20の使用法は以下のとおりである。
【0108】
まず、反応槽22に、試料又は予め試料から抽出しておいたポリヌクレオチドを含有した溶液を入れておき、電極固定ホルダ21に固定された上記電極を反応槽22に浸漬する。次いで、反応槽22中で、ハイブリダイゼーション反応を行った後、電極固定ホルダ21を第1洗浄槽23に移す。第1洗浄槽23では、洗浄を行って、非特異的に電極に結合した核酸やタンパク質等を除去する。洗浄後、電極固定ホルダ21を挿入剤反応槽24に移し、ハイブリダイゼーション反応によって形成された二本鎖ポリヌクレオチドに挿入剤をインターカレートする。続いて、電極固定ホルダ21を第2洗浄槽25に移し、洗浄を行った後、電極固定ホルダ21を電気化学測定槽26に移し、電気化学的な測定を行う。測定終了後、分析ユニット28に予め記録されている検量線を参考にして試料中のポリヌクレオチドの濃度が出力される。以上の操作は、それぞれの槽及びユニットと電気的につながれた操作ユニット29を通じて行う。
【0109】
本発明は、本発明の遺伝子検出用担体と緩衝液とを備えたキットを提供する。このように、本発明の遺伝子検出用担体と緩衝液とをセットにして提供すれば、直ちに検査を行うことができるので便利である。
【0110】
本発明のキットに使用すべき緩衝液は、ハイブリダイゼーション反応に用いられる任意の緩衝液であり得る。例えば、リン酸緩衝液、炭酸緩衝液、トリス緩衝液などがあげられるが、これらに限定されるものではない。
【0111】
キットには、緩衝液とともに、又は緩衝液に代えて、遺伝子増幅用のプライマー、蛍光色素標識ヌクレオチド、酵素、精製用のカラム等を添付してもよい。
【0112】
本発明は、本発明の電極と二本鎖認識体とを備えたキットを提供する。
【0113】
本発明のキットに使用すべき二本鎖認識体は、例えば、本発明の電極について上述した二本鎖認識体であり得る。
【0114】
キットには、二本鎖認識体とともに、又は二本鎖認識体に代えて、遺伝子増幅用のプライマー、酵素、緩衝液、ヌクレオチド等を添付してもよい。
【実施例】
【0115】
以下、実施例に従って本発明を更に詳細に説明する。
【0116】
実施例1:
この実施例では、MxA遺伝子のプロモーター領域の-88位(配列番号1の塩基配列では、455位に相当する)のヌクレオチドがチミンである遺伝子(以下MxA(T)と表記する)をヘテロ又はホモ接合で有するHCV感染者が、該ヌクレオチドがグアニンである遺伝子(以下MxA(G)と表記する)をホモ接合で有するHCV感染者に比べて、インターフェロン療法に対する応答性がよいことを実証した。
【0117】
<被験者>
組織学的に慢性C型肝炎であると証明され、インターフェロン療法を行っている115人の患者と、抗HCV陰性の健康な者42人が本研究に参加した。これらの者は、全員日本人であり、互いに血縁関係はない。
【0118】
115人の患者のうち、52人の患者は、インターフェロン療法終了後の少なくとも6月の追跡期間中、血清アラニンアミノトランスフェラーゼのレベルが正常な範囲にあり、且つHCVのRNAが常に陰性である持続的応答者(以下、SRと表記する)であり、63人の患者は、ALTレベルに関わらず、追跡期間中に、HCVのRNAが陽性のままであり、又はC型肝炎を再発した非応答者(以下、NRと表記する)であった。全ての患者には、総用量300万ユニットを超えるインターフェロンα及び/又はβを投与した。
【0119】
<MxA遺伝子分析>
患者と健康な対照から採取したPBMCから核酸を抽出した。該核酸をPCRに供し、MxA遺伝子のプロモーター領域を包含する599ヌクレオチドのDNAを増幅した。
【0120】
PCRの概略は、以下のとおりである。
【0121】
0.05μgの核酸をTaq-Gold(パーキンエルマー)、配列番号12のオリゴヌクレオチドプライ マー#MXAF01(フォワードプライマー、-569〜-540位)、及び配列番号6のオリゴヌクレオチドプライマー#MXAF02(リバースプライマー、+30〜+1位)と混合した後、[95℃10分]、[95℃10秒、68℃60秒]×55、[72℃7分]のサイクル条件で、反応させた。PCR産物を直接解読することによって、157の試料のうち12個を配列決定した。
【0122】
配列決定により、増幅した領域中のSNP部位を同定した後、対立遺伝子のヌクレオチドを識別可能に検出するためのRFLPシステムを構築した。全患者の599ヌクレオチドのPCR産物をHhaI(GCG↓C)で消化し、アガロースゲル中で電気泳動して、482ヌクレオチドのバンド及び533ヌクレオチドバンドの何れか又は両者が生成するか否かを調べた。
【0123】
<統計分析>
イエーツの補正を行って、又は行わずに、フィッシャーの正確な確率テストによってグループデータを比較した。p<0.05を統計学的に有意と見做した。
【0124】
<結果>
12のサンプルの配列決定を行うことによって、MxA遺伝子のプロモーター領域中に、多型部位が同定された。該プロモーター領域の-88位には、SNPが存在し(GとT)、該SNPは、図3に示されているISREに類似する領域中に含まれていた。
【0125】
続くHhaIによるRFLPでは、全157サンプルについて、MxA遺伝子の遺伝子型を決定した。該アッセイでは、多型部位にグアニンを有する試料は、電気泳動ゲルに482ヌクレオチドのバントを示した。これに対して、グアニンがチミンに置換されると、HhaIが認識する制限部位が消失するので、533ヌクレオチドのバンドを示した。多型部位がグアニンであるプロモーター領域と多型部位がチミンであるプロモーター領域をヘテロ接合で有する場合には、482ヌクレオチドのバンドと533ヌクレオチドのバンドが共に検出される(図4参照)。
【0126】
表1に示されているように、NR群では、患者の62%が、前記多型部位がグアニンであるプロモーター領域をホモ接合で有していたが(G・Gホモ)、SR群では、患者の31%がG・Gホモであった(p=0.0009;SR vs NR)。反対に、NR群では、患者の35%が、前記多型部位がグアニンであるプロモーター領域と前記多型部位がチミンであるプロモーター領域をヘテロ接合で有していたが(G・Tヘテロ)、SR群では、患者の60%が、G・Tヘテロであった(p=0.0082;SR vs.NR)。T・Tホモの患者は、それぞれ、NR群で3.2%、SR群で10%であった(p=0.2956;SR vs NR)。
【0127】
前記多型部位がグアニンであるプロモーター領域を有する対立遺伝子の頻度は、SR群では0.606であったのに対して、NR群では0.794であった(p=0.0018;SR vsNR)。
【表1】

【0128】
さらに、NR群に比べてSR群ではG・Gホモの個体が有意に少ないという上記の結果は、患者が感染したHCVの遺伝子型に依存しないことも明らかとなった。
【表2】

【0129】
表2から明らかなように、遺伝子型が1bであるHCVに感染した患者群(HCV 1b群)と遺伝子型が2a又は2bであるHCVに感染した患者群(HCV 2a/2b群)では、共にNR群は62%がG・Gホモの個体であるのに対して、SR群は、それぞれ28%及び32%がG・Gホモの個体であった。表2に示した結果から、患者が感染したHCVの遺伝子型にかかわらず、SR群ではG・Gホモの個体が有意に少ないことが明らかとなった(HCV 1b群;p=0.0321、HCV 2a/2b群;p=0.0318)。
【0130】
以上、本実施例によって、前記多型部位がチミンであるMxAプロモーター領域をヘテロ接合又はホモ接合で有しているHCV感染者は、感染したHCVの遺伝子型によらず、インターフェロン療法に高い応答性を示すことが実証された。
【0131】
また、本実施例は、前記多型部位がグアニンでないMxAプロモーター領域をヘテロ接合又はホモ接合で有しているHCV感染者は、インターフェロン療法に高い応答性を示すことも示唆している。
【0132】
さらに、前記多型部位はISRE中に存在するので、これらのことは、C型肝炎以外の疾患についても当てはまるといえる。
【0133】
実施例2:
実施例1で明らかになったように、MxAプロモーターのSNPがT型であるHCV感染者はインターフェロン投与による肝炎の治療効果が高い。一方、そのSNPがG型である場合には治療効果が低い。この理由として、ISREの機能を果たすための塩基配列であるT型はインターフェロンの刺激に正しく応答するが、G型はその配列と1塩基だけ異なるために、インターフェロンの刺激に応答せずMxA蛋白質の生成量が低いためと解釈される。
【0134】
このような状況から考えるとMxAプロモーターのSNPがC型並びにA型のHCV肝炎の患者も、G型と同様にインターフェロンにMxAプロモーターは応答せず、その治療効果は低いと推定される。
【0135】
これらの事を証明するために、MxAプロモーターの下流にルシフェラーゼ遺伝子を有するプラスミドを構築し、これをヒト細胞(HeLa細胞、並びに卵巣癌細胞)にトランスフェクションした。そして、4種類のSNP(T型、G型、A型、C型)を有するMxAプロモーターの夫々について、これらがインターフェロンに応答した結果として産生されるルシフェラーゼ活性を調べた。
【0136】
その結果を図5〜図8に示す。図5は、インターフェロンαを用いてHela細胞内で誘導した例、図6は、インターフェロンαを用いて卵巣癌細胞内で誘導した例、図7は、インターフェロンβを用いてHela細胞内で誘導した例、図8は、インターフェロンβを用いて卵巣癌細胞内で誘導した例である。また、これらの図において、+はインターフェロンを添加した場合のルシフェラーゼ活性を示し、−はインターフェロンを添加しないときのルシフェラーゼ活性を示している。これらの結果は何れも3回の実験の平均値であり、その標準偏差をバーで表示した。
【0137】
図から明らかなように、何れの場合もT型のMxAプロモーターが最も高い値を示し、A型とC型のSNPを有するHCV肝炎の患者はG型の場合と同様に、インターフェロンα並びにインターフェロンβに対する応答が低い。従って、インターフェロンによる治療効果が低い事が予測される。
【0138】
実施例3:
本実施例では、図9を参照しながら、本発明の遺伝子検出用担体を用いてインターフェロン療法の有効性を予測するための操作について説明する。
【0139】
まず、本発明の遺伝子検出用担体を作成するために、配列番号21と配列番号22のプライマーを用いて、配列番号1のポリヌクレオチド断片であって前記SNP部位を含み当該SNP部位がチミンであるT型断片31と、配列番号2のポリヌクレオチドの前記SNP部位を含み当該SNP部位がグアニンであるG型断片32とを増幅し、2μg/μLになるように蒸留水で調製した。
【0140】
次に、各断片に等量の4mg/mLのニトロセルロース(DMSO溶液)を添加し、熱変性後、ポリリジンで被覆されているスライドガラス33上にスポッティングした。スポットが充分乾燥した後、紫外線照射による固定化処理を行い、T型断片31とG型断片32が固定化された遺伝子検出用担体を得た。
【0141】
次に配列番号20と配列番号21のプライマーによって、被験者の血液から抽出した試料ポリヌクレオチドを増幅処理した後、ファルマシア製のECLラベリングシステムでFITC標識を行い、予め調製しておいた前記遺伝子検出用担体と12時間、65℃で反応させた。反応後に、蛍光検出器でシグナルを測定した。
【0142】
その結果、T型の断片を固定化したスポットから蛍光シグナルが観察され、本試験に用いた試料ポリヌクレオチドのSNPはT型であることが判明した。
【0143】
実施例4:
本実施例では、図10を参照しながら、試料中の断片を固定化した遺伝子検出用担体を用いた検査について説明する。
【0144】
被験者から検出したポリヌクレオチドを配列番号21、配列番号22のプライマーを用いて増幅した断片(試料A:41、試料B:42)を、2μg/μLになるように蒸留水で調製した。次に、等量の4mg/Lニトロセルロース(DMSO溶液)を添加した後、熱変性させ、ポリリジンで被覆されているスライドガラス43上にスポッティングした。スポットが充分乾燥した後、紫外線照射による固定化処理を行った。
【0145】
予め蛍光標識した、配列番号1のポリヌクレオチド断片であって前記SNP部位を含み当該SNP部位がチミンであるT型断片(JOE標識)と、予め蛍光標識した、配列番号2のポリヌクレオチド断片であって前記SNP部位を含み当該SNP部位がグアニンであるG型断片(5−FAM標識)、予め蛍光標識した、配列番号3のポリヌクレオチド断片であって前記SNP部位を含み当該SNP部位がアデニンであるA型断片(TAMRA標識)、予め蛍光標識した、配列番号4のポリヌクレオチド断片であって前記SNP部位を含み当該SNP部位がシトシンであるC型断片(ROX標識)とを予め調製しておいたDNAチップと1時間、50℃で反応させた。
【0146】
反応後蛍光検出器でシグナルを測定した。その結果、HEXの蛍光に由来する信号のみが得られ、本試料ポリヌクレオチドのSNPは、T型のみであることが判明した。
【0147】
実施例5:
本実施例では、図11を参照しながら、電気化学的な検出を利用した遺伝子検出用担体について説明する。
【0148】
配列番号21と配列番号22のプライマーを用いて、配列番号1のT型断片51とG型断片52とを増幅し、2μg/μLになるように蒸留水で調製した。次に、2−ヒドロキシエチルジスルフィドと1−シクロヘキシル−3−(2−モルフォリノエチル)−カルボジイミドと反応させ、増幅産物の末端にチオール基を導入した。予め作製しておいた金電極53上にスポッティングし、乾燥しないように1時間反応させた。サンプルは、配列番号21と配列番号22のプライマーを用いて増幅、熱変性後、予め調製しておいたDNAチップと1時間、65℃で反応させた。反応後、10μmol/Lのヘキスト33258溶液中でボルタンメトリーを行い、ヘキスト33258の酸化電流値を測定した。その結果、G型の断片を固定化した電極からのみ有意な信号が得られ、本試料はG型であることが判明した。
【図面の簡単な説明】
【0149】
【図1】図1は、本発明の実施例に係る遺伝子検出用装置の一例を示す図である。
【図2】図2は、本発明の実施例に係る自動化された本発明の電子検出用装置の一例を示す図である。
【図3】図3は、MxA遺伝子のプロモーター領域の塩基配列を示す図である。
【図4】図4は、実施例に係るHhaIを用いたRFLPの電気泳動結果を示す写真である。
【図5】図5は、4種類のSNP(T型、G型、A型、C型)を有するMxAプロモーターの夫々について、Hela細胞内におけるインターフェロンαに対する応答性を、該プロモーターの支配下にあるルシフェラーゼ活性を指標として比較した結果を示すグラフである。
【図6】図6は、4種類のSNP(T型、G型、A型、C型)を有するMxAプロモーターの夫々について、卵巣癌細胞内におけるインターフェロンαに対する応答性を、該プロモーターの支配下にあるルシフェラーゼ活性を指標として比較した結果を示すグラフである。
【図7】図7は、4種類のSNP(T型、G型、A型、C型)を有するMxAプロモーターの夫々について、Hela細胞内におけるインターフェロンβに対する応答性を、該プロモーターの支配下にあるルシフェラーゼ活性を指標として比較した結果を示すグラフである。
【図8】図8は、4種類のSNP(T型、G型、A型、C型)を有するMxAプロモーターの夫々について、卵巣癌細胞内におけるインターフェロンβに対する応答性を、該プロモーターの支配下にあるルシフェラーゼ活性を指標として比較した結果を示すグラフである。
【図9】図9は、本発明の一実施例になる遺伝子検出用担体を示す図である。
【図10】図10は、本発明の他の実施例になる遺伝子検出用担体を示す図である。
【図11】図11は、本発明のもう一つの実施例になる遺伝子検出用担体を示す図である。
【符号の説明】
【0150】
11.電極 12.ポリヌクレオチド 13.反応槽 14.電源 15.電流計 16.電圧計 17.可変抵抗 20.検出装置 21.電極ホルダ 22.反応槽 23.第1洗浄槽 24.挿入剤反応槽 25.第2洗浄槽 26.電気化学測定槽 27.移動装置 28.分析ユニット 29.操作ユニット 31.T型断片 32.G型断片 33.スライドガラス 41.試料A 42.試料B 43.スライドガラス 51.T型断片 52.G型断片 53.金電極
【技術分野】
【0001】
本発明は、遺伝子検出用担体、個体に対するインターフェロン療法の有効性の検出方法、個体に対するインターフェロン療法の有効性の検出するための遺伝子検出用装置、及びインターフェロン療法の有効性を検出するための遺伝子検出用キットに関する。
【背景技術】
【0002】
近年、C型肝炎ウイルス(以下、HCVと称する)の感染者が急増しており、大きな社会問題となっている。
【0003】
他のウイルス性疾患と同様に、C型肝炎には、インターフェロン療法が一定の効果を有することが明らかとなっているが、インターフェロン療法は、全ての感染者に対して有効なわけではなく、インターフェロン療法が効果を示さない感染者も少なからず存在する。インターフェロン療法が効果を示さない感染者にインターフェロン療法を継続することは、感染者に発熱や貧血などの副作用を引き起こすのみならず、他の治療の開始を遅らせることになる。
【0004】
このため、治療を施すべきHCV感染者に対してインターフェロン療法が有効であるか否かを、治療前に予測することが切望されていたが、現在まで、かかる予測を行うことは全く不可能であった。
【発明の開示】
【発明が解決しようとする課題】
【0005】
上記事情に鑑み、本発明は、患者にインターフェロン療法が有効であるか否かを治療前に予測するための手段を提供することを課題とするものである。
【課題を解決するための手段】
【0006】
上記課題は、下記の本発明によって達成される。
【0007】
本発明の第一の側面に従えば、
基体と、
前記基体に固定化されてなるポリヌクレオチドとを備え、
前記ポリヌクレオチドは、
(at) 下記配列表の配列番号1に示されるポリヌクレオチド、
(bt) 前記(at)に示されるポリヌクレオチド中の455位を除く1もしくは数個のヌクレオチドが欠失、置換、又は付加された修飾ポリヌクレオチド、
(ct) 配列番号1の441〜455位に示される配列を含むポリヌクレオチド、
(dt) 配列番号1の449〜459位に示される配列を含むポリヌクレオチド、
(et) それらの相補鎖
からなる群から選択されるポリヌクレオチドを含むことを特徴とする遺伝子検出用担体が提供される。
【0008】
本発明の第二の側面に従えば、
基体と、
前記基体に固定化されてなるポリヌクレオチドとを備え、
前記ポリヌクレオチドは、
(ag) 下記配列表の配列番号2に示されるポリヌクレオチド、
(bg) 前記(ag)に示されるポリヌクレオチド中の455位を除く1もしくは数個のヌクレオチドが欠失、置換、又は付加された修飾ポリヌクレオチド、
(cg) 配列番号2の441〜455位に示される配列を含むポリヌクレオチド、
(dg) 配列番号2の449〜459位に示される配列を含むポリヌクレオチド、
(eg) それらの相補鎖
からなる群から選択されるポリヌクレオチドを含むことを特徴とする遺伝子検出用担体が提供される。
【0009】
本発明の第三の側面に従えば、
基体と、
前記基体に固定化されてなるポリヌクレオチドとを備え、
前記ポリヌクレオチドは、
(aa) 下記配列表の配列番号3に示されるポリヌクレオチド、
(ba) 前記(aa)に示されるポリヌクレオチド中の455位を除く1もしくは数個のヌクレオチドが欠失、置換、又は付加された修飾ポリヌクレオチド、
(ca) 配列番号3の441〜455位に示される配列を含むポリヌクレオチド、
(da) 配列番号3の449〜459位に示される配列を含むポリヌクレオチド、
(ea)それらの相補鎖
からなる群から選択されるポリヌクレオチドを含むことを特徴とする遺伝子検出用担体が提供される。
【0010】
本発明の第四の側面に従えば、
基体と、
前記基体に固定化されてなるポリヌクレオチドとを備え、
前記ポリヌクレオチドは、
(ac) 下記配列表の配列番号4に示されるポリヌクレオチド、
(bc) 前記(ac)に示されるポリヌクレオチド中の455位を除く1もしくは数個のヌクレオチドが欠失、置換、又は付加された修飾ポリヌクレオチド、
(cc) 配列番号4の441〜455位に示される配列を含むポリヌクレオチド、
(dc) 配列番号4の449〜459位に示される配列を含むポリヌクレオチド、
(ec) それらの相補鎖
からなる群から選択されるポリヌクレオチドを含むことを特徴とする遺伝子検出用担体が提供される。
【0011】
本発明の第五の側面に従えば、上記遺伝子検出用担体を用いたDNAチップが提供される。
【0012】
本発明の第六の側面に従えば、個体に対するインターフェロン療法の有効性の検出方法であって、
1)前記個体から採取した試料ポリヌクレオチドを前記遺伝子検出用担体に接触させる工程と、
2)前記試料ポリヌクレオチドと前記遺伝子検出用担体に固定化されたポリヌクレオチドとのハイブリダイゼーション反応を検知し、前記試料中のポリヌクレオチドの塩基配列を決定する工程とを備える方法が提供される。
【0013】
また、本発明の第七の側面に従えば、個体に対するインターフェロン療法の有効性の検出方法であって、
1)前記個体から採取した試料ポリヌクレオチドが基体上に固定化されてなる遺伝子検出用担体にプローブポリヌクレオチドを接触させる工程と、
2)前記基体上に固定化された試料ポリヌクレオチドと前記ポリヌクレオチドとのハイブリダイゼーション反応を検知し、前記試料ポリヌクレオチドの塩基配列を決定する工程とを備える方法が提供される。
【0014】
前記プローブポリヌクレオチドは、
(at) 下記配列表の配列番号1に示されるポリヌクレオチド、
(bt) 前記(at)に示されるポリヌクレオチド中の455位を除く1もしくは数個のヌクレオチドが欠失、置換、又は付加された修飾ポリヌクレオチド、
(ct) 配列番号1の441〜455位に示される配列を含むポリヌクレオチド、
(dt) 配列番号1の449〜459位に示される配列を含むポリヌクレオチド、
(et) それらの相補鎖
(ag) 下記配列表の配列番号2に示されるポリヌクレオチド、
(bg) 前記に示されるポリヌクレオチド中の455位を除く1もしくは数個のヌクレオチドが欠失、置換、又は付加された修飾ポリヌクレオチド、
(cg) 配列番号2の441〜455位に示される配列を含むポリヌクレオチド、
(dg) 配列番号2の449〜459位に示される配列を含むポリヌクレオチド、
(eg) それらの相補鎖
(aa) 下記配列表の配列番号3に示されるポリヌクレオチド、
(ba) 前記(aa)に示されるポリヌクレオチド中の455位を除く1もしくは数個のヌクレオチドが欠失、置換、又は付加された修飾ポリヌクレオチド、
(ca) 配列番号3の441〜455位に示される配列を含むポリヌクレオチド、
(da) 配列番号3の449〜459位に示される配列を含むポリヌクレオチド、
(ea) それらの相補鎖
(ac) 下記配列表の配列番号4に示されるポリヌクレオチド、
(bc) 前記(ac)に示されるポリヌクレオチド中の455位を除く1もしくは数個のヌクレオチドが欠失、置換、又は付加された修飾ポリヌクレオチド、
(cc) 配列番号4の441〜455位に示される配列を含むポリヌクレオチド、
(dc) 配列番号4の449〜459位に示される配列を含むポリヌクレオチド、
(ec) それらの相補鎖
からなる群より選択されるポリヌクレオチドを含む。
【0015】
本発明の第八の側面に従えば、
前記遺伝子検出用担体と、
前記基体上に固定化されたポリヌクレオチドと標識が付されたポリヌクレオチドとを含む試料とを接触させ、前記基体上に固定化されたポリヌクレオチドと前記標識が付されたポリヌクレオチドとをハイブリタイゼーション反応条件下に置く反応部と、
前記標識が付されたポリヌクレオチドに付された標識を検出する標識検出装置を少なくとも備えるインターフェロン療法の有効性を検出するための遺伝子検出用装置が提供される。
【0016】
本発明の第九の側面に従えば、
前記遺伝子検出用担体と、
対極と、
前記遺伝子検出用担体及び前記対極間に電圧を印加する電圧印加部と、
前記遺伝子検出用担体に固定化された前記ポリヌクレオチドとポリヌクレオチドとを含む試料とを接触させ、前記基体上に固定化されたポリヌクレオチドと前記試料中のポリヌクレオチドとをハイブリダイゼーション反応条件下に置く反応部と、
前記ハイブリダイゼーション反応後に前記電圧印加手段により電圧を印加させた際に前記遺伝子検出用担体及び前記対極間に生じた電気信号を測定する測定部とを備えたインターフェロン療法の有効性を検出するための遺伝子検出用装置が提供される。
【0017】
本発明の第十の側面に従えば、前記遺伝子検出用担体と、緩衝液とを備えることを特徴とするインターフェロン治療の有効性を測定するためのキットが提供される。
【0018】
本発明の第十一の側面に従えば、前記遺伝子検出用担体と、二本鎖認識体と、緩衝液とを備えることを特徴とする個体に対するインターフェロン治療の有効性を検出するためのキットが提供される。
【発明の効果】
【0019】
本発明によって、患者にインターフェロン療法が有効であるか否かを治療前に予測するための手段が提供された。
【発明を実施するための最良の形態】
【0020】
以下、本発明を詳細に説明する。
【0021】
配列番号1、配列番号2、配列番号3、及び配列番号4のポリヌクレオチドは、ヒトMxA遺伝子のプロモーター領域を包含するポリヌクレオチドであり、本発明者らによって、これらのポリヌクレオチドの455位に存在する一塩基多型(single nucleotide polymorphism)(以下、SNPと称する)がインターフェロン療法の効果に対する応答性に関与していることが初めて見出された。
【0022】
各々のポリヌクレオチドの441〜456位には、インターフェロン応答配列(interferon-stimulated response element)(以下、ISREと称する)が存在している。
【0023】
配列番号1の441〜456位のISREの塩基配列は、「GGTTTCGTTTCTG CTC」(配列番号5)であり、ISREの15番目(配列番号1の455位に相当する。配列番号1における455位は、転写開始部位を+1とする通常の表記によれば、-88位に相当する)がチミンである。
【0024】
配列番号2の441〜456位のISREの塩基配列は、「GGTTTCGTTTCTGCGC」(配列番号6)であり、ISREの15番目(配列番号2の455位に相当する。配列番号2における455位は、転写開始部位を+1とする通常の表記によれば、-88位に相当する)がグアニンである。
【0025】
また、配列番号3の441〜456位のISREの塩基配列は、「GGTTTCGTTTCTGCAC」(配列番号7)であり、ISREの15番目(配列番号3の455位に相当する。配列番号3における455位は、転写開始部位を+1とする通常の表記によれば、-88位に相当する)はアデニンである。
【0026】
配列番号4の441〜456位のISREの塩基配列は、「GGTTTCGTTTCTGCCC」(配列番号8)であり、ISREの15番目(配列番号4の455位に相当する。配列番号4における455位は、転写開始部位を+1とする通常の表記によれば、-88位に相当する)はシトシンである。
【0027】
以下、本明細書を通じて、配列番号1、配列番号2、配列番号3及び配列番号4の455位をSNP部位(SNP site)と称する。
【0028】
これらのISREのSNP部位以外の領域は各配列ともに共通である。これらのISREの15番目のヌクレオチドがチミンであるISRE(配列番号5)を有するHCV感染者は、インターフェロン療法が有効であるのに対して、15番目のヌクレオチドがチミンであるISRE(配列番号5)を持たないHCV感染者は、インターフェロン療法が有効でないことが本発明者らにより疫学的に実証された。
【0029】
つまり、実施例に詳述されているように、455位のヌクレオチドがグアニンである配列番号1のポリヌクレオチドをホモ接合で有する(以下、G/Gホモと略記する) HCV感染者は、455位のヌクレオチドがチミンである配列番号1のポリヌクレオチドと、455位のヌクレオチドがグアニンである配列番号1のプロモーター領域をヘテロ接合で有する (以下、G/Tヘテロと略記する)HCV感染者、又は配列番号1のポリヌクレオチドをホモ接合で有する(以下、T/Tホモと略記する)HCV感染者と比べて、インターフェロン療法が有効でないことが実証された。
【0030】
あるいは、455位のヌクレオチドがチミンでないMxA遺伝子のプロモーター領域をホモ接合で有するHCV感染者(以下、non-T/non-Tホモと略記する)は、T/non-Tヘテロ又はT/TホモのHCV感染者と比べて、インターフェロン療法が有効でないことが示された。non-T/non-Tホモの組み合わせとしては、G/G、G/A、G/C、A/A、A/C、C/Cがある。T/non-Tの組み合わせとしては、T/G、T/A、T/Cがある。
【0031】
従って、インターフェロン療法の実施に先立って、例えばHCV感染者が有するヒトMxA遺伝子のプロモーター領域を包含するポリヌクレオチドのISREにおけるSNP部位のヌクレオチドを決定することによって、該HCV感染者に対して、インターフェロン療法の有効性を検知することができる。
【0032】
本発明の遺伝子検出用担体等は、被験者から抽出されたポリヌクレオチドの核酸鎖の配列を検出するプローブとして、前記SNP部位を含み当該SNP部位の塩基配列がチミンである配列番号1のポリヌクレオチド、その断片又はそれらの相補鎖が用いられている。
【0033】
この本発明の遺伝子検出用担体等を用いれば、被験者が有するヒトMxA遺伝子のプロモーター領域を包含するポリヌクレオチドの前記SNP部位がチミンであるか否かを治療の前に調べることができる。それにより前記被験者に対するインターフェロン療法の有効性を予測することができる。
【0034】
また、本発明の遺伝子検出用担体などは被験者から抽出されたポリヌクレオチドの核酸鎖の配列を検出するプローブとして前記SNP部位を含み、当該SNP部位の塩基配列がgである配列番号2のポリヌクレオチド、その断片またはそれらの相補鎖、又は当該SNP部位の塩基配列がaである配列番号3のポリヌクレオチド、その断片またはそれらの相補鎖、又は当該SNP部位の塩基配列がcである配列番号4のポリヌクレオチド、その断片またはそれらの相補鎖が用いられている。
【0035】
この本発明の遺伝子検出用担体などを用いれば、被験者が有するヒトMxA遺伝子のプロモーター領域を包含するポリヌクレオチドの前記SNP部位の配列を調べることができ、それにより前記被験者に対するインターフェロン療法の有効性を予測することができる。
【0036】
インターフェロン療法を施すべき疾病には、C型肝炎以外にも、膠芽腫、髄芽腫瘍、星細胞腫、皮膚悪性黒色腫、B型肝炎、腎癌、多発性骨髄腫、ヘアリー細胞白血病、慢性骨髄性白血病、亜急性硬化性全脳炎、ウイルス性脳炎、免疫抑制患者の全身性帯状疱疹及び水痘、上咽頭未分化癌、聴力低下を伴うウイルス性内耳感染症、ヘルペス性角膜炎、偏平コンジローマ、尖圭コンジローマ、アデノウイルス及びヘルペスウイルス感染による結膜炎、性器ヘルペス、口唇ヘルペス、子宮頚癌、癌性胸水症、角化棘細胞腫、基底細胞癌、δ型慢性活動性肝炎などが含まれる。前記インターフェロン療法で用いられるインターフェロンとしては、インターフェロンα、βまたはω等がある。
【0037】
本発明の遺伝子検出用担体等は、これらの疾病に罹患した被験者にインターフェロン療法を実施する前に、インターフェロン療法の有効性を検知するために使用できる。
【0038】
次に、本発明の夫々の側面について、さらに詳細に説明する。
【0039】
第一に、本発明は、インターフェロン療法の実施に先立って、インターフェロン療法が有効であり得る疾病に罹患した患者に対するインターフェロン療法の有効性を検知するために使用できる遺伝子検出用担体を提供する。
【0040】
<遺伝子検出用担体の概略>
本発明の遺伝子検出用担体は、基板、多孔質体、マイクロタイタープレート、ビーズ等の基体に、前記所定のポリヌクレオチドを固定化することによって作成することができる。
【0041】
ポリヌクレオチドを固定化すべき基体の材質、大きさ、形状などは特に限定されるものではなく、ポリヌクレオチドを固定化することができる任意の基体を使用できる。
【0042】
基体の材質としては、例えば、シリコン、ガラス、石英ガラス、アルミナ、サファイヤ、フォルステライト、炭化珪素、酸化珪素、窒化珪素、磁性体などの無機材料や、ポリエチレン、ポリプロピレン、ポリイソブチレン、ポリエチレンテレフタレート、不飽和ポリエステル、含フッ素樹脂、ポリ塩化ビニル、ポリ塩化ビニリデン、ポリ酢酸ビニル、ポリビニルアルコール、ポリビニルアセタール、アクリル樹脂、ポリアクリロニトリル、ポリスチレン、アセタール樹脂、ポリカーボネート、ポリアミド、フェノール樹脂、ユリア樹脂、エポキシ樹脂、メラミン樹脂、スチレン・アクリロニトリル共重合体、アクリロニトリルブタジエンスチレン重合体、シリコーン樹脂、ポリフェニレンオキサイド、ポリスルホン、ニトロセルロース、ナイロン、ポリメチルメタクリレート、ポリフェにレンスルホン、ポリエーテルスルホン、ポリエーテルケトン、フルオロエチレン共重合体、ポリメチルペンテン等の有機材料を用いることができる。さらに上記無機材料と有機材料の複合体を用いることもできる。
【0043】
基体にポリヌクレオチドを固定化する方法は、例えば、Science 251:767-773(1991)に開示された方法を用いることができる。また、該方法以外にも、ポリヌクレオチドを基体に固定化するための改良法が知られており、このような改良法を用いてポリヌクレオチドを固定化してもよい。
【0044】
有機材料やガラスからなる基体を用いる場合には、基体の表面をポリリジンやアミノシラン等で表面を被覆しておくと、ポリヌクレオチドを安定に固定化することができる。
【0045】
本明細書において、「ポリヌクレオチド」とは、2以上のヌクレオシドがリン酸エステル結合で結合されてなる物質を意味する。「ヌクレオシド」には、デオキシリボヌクレオシド及びリボヌクレオシドが含まれるが、これらに限定されない。
【0046】
さらに、本発明の基体に固定化するポリヌクレオチドは、RNA,DNA,PNA,メチルフォスホネート核酸、S-オリゴなどのオリゴヌクレオチドや、cDNA、cRNAなどのポリヌクレオチドなどを用いることができる。
【0047】
なお、本明細書において、「プロモーター領域」とは、TATAボックス等の転写開始反応に直接関与する領域のみを指すのではなく、該領域の近傍又は遠隔に存在して転写開始反応の効率に影響を与える調節配列を含む配列も指称するものとする。従って、「プロモーター領域」なる語には、転写開始反応に関与する配列のみ、調節配列のみ、及びその両者が連結された配列が含まれることに留意しなければならない。
【0048】
また、「ISRE」とは、インターフェロンα、β、又はγの刺激によって誘導される遺伝子の転写調節領域に存在する約12〜15のヌクレオチドからなる塩基配列を意味する。
【0049】
基体に固定化されるポリヌクレオチドとしては、以下の(a)〜(e)を含むものが挙げられる。
【0050】
(a)配列番号1、2、3、4のいずれかに示されるポリヌクレオチド。
【0051】
(b)前記(a)に示されるポリヌクレオチドにおいて、455位を除く1もしくは数個のヌクレオチドが欠失、置換、または付加されたポリヌクレオチド。
【0052】
欠失の例としては、128位、133位、152位、508位、及び543位の欠失、置換の例としては330位の置換(G→T)、542位の置換(C→G)、付加の例としては501位への付加(C)を挙げることができる。
【0053】
更に、前記配列番号1、2、3、4のポリヌクレオチド又は前記ポリヌクレオチドの断片に、プロモーター、エンハンサー、上流活性化配列、サイレンサー、上流抑制配列、アテニュエーター、ポリAテール、核移行シグナル、Kozak配列、ISRE、薬物耐性因子、シグナルペプチドの遺伝子、膜貫通領域の遺伝子、ルシフェリン、緑色蛍光タンパク質、フィコシアニン、西洋ワサビペルオキシダーゼを含むマーカータンパク質の遺伝子、インターフェロン応答性タンパク質の遺伝子、非インターフェロン応答性タンパク質の遺伝子からなる群から選択される少なくとも1つの機能的ポリヌクレオチドが連結されてなる修飾ポリヌクレオチドを用いてよい。
【0054】
また、配列番号1、2、3、4に示される前記ポリヌクレオチドの塩基配列のうち、インターフェロン療法の有効性に関与しているのは455位に位置するSNP部位に存在する1個のヌクレオチドなので、基体に固定化すべきポリヌクレオチドは、前記455位のSNP部位を含むポリヌクレオチドの断片であってよい。
【0055】
基体に固定化するポリヌクレオチドとして前記断片を用いる場合は、11ヌクレオチド以上30ヌクレオチド以下であることが望ましい。基体に固定化するポリヌクレオチドの長さが過度に長いと、1個のヌクレオチドの相違を識別することが困難になる。一方、基体に固定化するポリヌクレオチドの長さが過度に短いと試料中に含まれるポリヌクレオチドの塩基配列の決定が困難になる。
【0056】
特に基体に固定化すべき好適なポリヌクレオチドとしては
(c)前記455位のSNP部位を含む配列番号1、配列番号2、配列番号3、配列番号4のポリヌクレオチドの断片であって、配列番号1、配列番号2、配列番号3、配列番号4の441〜456位に相当する配列番号5,配列番号6,配列番号7,配列番号8で示される配列を有するポリヌクレオチド(すなわち前記ISRE)を含む断片。
【0057】
(d)前記455位のSNP部位を含む配列番号1、配列番号2、配列番号3、配列番号4のポリヌクレオチドの断片であって、配列番号1乃至配列番号4の449〜459位に相当する配列番号9、10、11、12のポリヌクレオチドを含む断片。特に(d)は前記SNPをほぼ中心とし、前後同等の長さの塩基配列を含むものであるため、精度の高く塩基配列の決定が行われる。更に精度の高い検出を行うためには、望ましくは配列番号1ないし配列番号4の447〜461位に相当するポリヌクレオチドを含む断片である。
【0058】
さらに、基体に固定化すべき好適なポリヌクレオチドとしては
(e)前記(a)〜(d)に示されるポリヌクレオチドの相補鎖であってもよい。
【0059】
前記配列番号5,配列番号6,配列番号7,配列番号8で示される配列(すなわち前記ISRE)の相補鎖は、配列番号13,14、15、16で表される配列である。
【0060】
前記配列番号9,配列番号10,配列番号11,配列番号12で示される配列の相補鎖は、それぞれ配列番号17、配列番号18、配列番号19、配列番号20で示される配列である。
【0061】
本発明の遺伝子検出用担体は、基体に固定化された上記所定のポリヌクレオチドをプローブとし、このプローブと被験者から抽出したポリヌクレオチドとのハイブリダイゼーション反応を検出し、被験者のヒトMxA遺伝子のプロモーター領域を包含するポリヌクレオチド配列を決定し、前記SNP部位に何れを有しているかを調べるために使用される。
【0062】
<遺伝子検出用担体の使用法>
以下に、前記遺伝子検出用担体を用いて具体的に被験者から抽出したポリヌクレオチドの配列を決定する方法について説明する。
【0063】
前記遺伝子検出用担体を用い、被験者から抽出したポリヌクレオチドの配列の決定を行う手段は、(1)標識物質を用いる方法と、(2)電気化学的方法の2種類ありえる。
【0064】
まず(1)の標識物質を用いる方法について具体的に説明する。
【0065】
まず、ヒトを含む哺乳動物等の被験者からポリヌクレオチドを含む試料(血液などの体液、血球成分、生検組織、培養細胞など)を採取する。ポリヌクレオチドは体内に広く含まれているので個体から採取した任意の試料であってもよい。好ましい試料は血液である。
【0066】
続いて、必要に応じて、フェノール抽出やエタノール沈殿などの分離抽出操作、PCRなどの増幅操作を行った後、前記試料中に含まれる試料ポリヌクレオチドを抽出する。ポリヌクレオチドを抽出する方法としては、例えばフェノール抽出、エタノール沈殿の他、任意の抽出方法を使用し得る。mRNAを抽出する場合には、オリゴdTカラムにかけてもよい。試料ポリヌクレオチドの量が少ないときには必要に応じて試料ポリヌクレオチドを増幅する操作を行っても良い。
【0067】
その後試料ポリヌクレオチドに標識物質を付与して、標識ポリヌクレオチドを得る標識操作を行う。また、試料ポリヌクレオチドに標識付与せずに標識物質を付与したポリヌクレオチドを含む2次プローブを混合しても良い。
【0068】
標識物質としては、蛍光物質などの発光物質、ハプテン、酵素、放射性同位体、電極活物質などの検出可能な物質をあげることができるが特に限定されるものではない。試料ポリヌクレオチドに対する標識はプロモーター領域を標識することが望ましい。プロモーター領域を標識するには、様々な公知の手法を使用し得るが、標識したプライマーを用いたPCR反応によれば、増幅操作と標識操作を同時に行うことができるので有用であろう。
【0069】
続いて、試料ポリヌクレオチドと基体上のポリヌクレオチドとをハイブリダイゼーション反応条件下に置く。すなわち、まず、前記標識された試料ポリヌクレオチドをハイブリダイゼーション用の反応溶液に添加した後、該反応溶液を本発明の遺伝子検出用担体と接触させる。試料ポリヌクレオチドに基体上のヌクレオチドの相補鎖が存在すれば、その試料ポリヌクレオチドは基体上のポリヌクレオチドとハイブリダイゼーション反応し基体上に固定化される。
【0070】
ハイブリダイゼーション反応条件は、反応温度は10〜90℃の範囲、反応時間は1分以上1晩程度であり得る。反応中は、撹拌、あるいは振とうなどの操作で反応速度を高めることもできる。ハイブリダイゼーション用の反応溶液は、イオン強度0.01〜5の範囲、pH5〜10の範囲の緩衝液であり得る。反応溶液中にはハイブリダイゼーション促進剤である硫酸デキストランや、サケ精子DNA、牛胸DNA、EDTA、界面活性剤などを添加してもよい。
【0071】
その後、適宜洗浄を行う。
【0072】
続いて、被験者が前記SNP部位に何れを有しているかを決定するために、試料ポリヌクレオチドと基体上のポリヌクレオチドとの間のハイブリダリゼーション反応の有無を検出する。
【0073】
基体上に、固定化された前記(a)〜(e)のいずれかを含むポリヌクレオチドのうち、前記SNP部位がチミンであるポリヌクレオチド又はその相補鎖に試料ポリヌクレオチドがハイブリタイズされたことが検出されれば、被験者のヒトMxA遺伝子のプロモーター領域を包含するポリヌクレオチドのSNP部位がチミンである。一方、前記SNP部位がグアニンであるポリヌクレオチド又はその相補鎖に試料ポリヌクレオチドがハイブリタイズされたことが検出されれば、被験者のヒトMxA遺伝子のプロモーター領域を包含するポリヌクレオチドのSNP部位がグアニンである。アデニン、シトシンの場合も同様である。
【0074】
この検出は、標識の種類に応じた適宜の検出装置を用いて、試料中の標識されたポリヌクレオチド又は2次プローブ中の標識を検出することによって行う。標識が蛍光物質の場合には、例えば、蛍光検出器を用いて標識を検出すればよい。
【0075】
遺伝子検出用担体としては、1つの基体上に、前記(a)〜(e)のいずれかのポリヌクレオチドのうち前記SNP部位がチミンであるもの又はその相補鎖と、グアニンであるものまたはその相補鎖、アデニンであるものまたはその相補鎖、シトシンであるものまたはその相補鎖からなる群から選ばれる少なくとも1種とを共に固定化してもよいが、その場合、ポリヌクレオチドの種類と、基体上の各ポリヌクレオチドの位置および標識の種類の少なくとも一方を予め特定しておくことが必要である。検出された標識の位置および標識の種類の少なくとも一方によって、試料中のポリヌクレオチドが基体上の何れのポリヌクレオチドとハイブリダイズしたかが明らかとなる。
【0076】
(1)の標識物質を用いる方法において、被験者から採取した試料ポリヌクレオチドを基体上に固定化した遺伝子検出用担体を用いた場合にも、試料ポリヌクレオチドの配列を決定することができる。すなわち、あらかじめ異なる標識を付与された配列が既知の(a)〜(e)から選ばれるポリヌクレオチドであって前記SNPの塩基の種類が異なるポリヌクレオチドの溶液を接触させ、溶液中のポリヌクレオチドと電極上の試料ポリヌクレオチドとをハイブリダイゼーション反応条件下に置く。溶液中に基体上の試料ポリヌクレオチドの相補鎖が存在すれば、その試料ポリヌクレオチドは基体上のポリヌクレオチドとハイブリダイゼーション反応し基体上に固定化される。その後どの配列のポリヌクレオチドとハイブリダイゼーション反応が生じたかを標識物質の種類を検知することによって検知でき、試料ポリヌクレオチドの配列を知ることが可能となる。
【0077】
以上の方法にて、試料ポリヌクレオチドが、前記SNP部位にチミンを有するポリヌクレオチド又はその相補鎖とハイブリダイズしたときには、被験者は、前記SNP部位にチミンを有しており、それ故、インターフェロン療法が有効であると予測できる。これに対して、試料中のポリヌクレオチドが、前記SNP部位にグアニンを有するポリヌクレオチド又はその相補鎖とハイブリダイズし、かつ前記SNP部位にチミンを有するポリヌクレオチド又はその相補鎖とハイブリダイズしなかったときには、被験者は、前記SNP部位にチミンを有しておらず、それ故、インターフェロン療法が有効でないと予測できる。
【0078】
次に(2)の電気化学的方法について具体的に説明する。
【0079】
上記(1)の標識物質を用いる方法では試料ポリヌクレオチドと基体上のポリヌクレオチドとのハイブリダイゼーション反応の有無を、標識物質の検出にて行ったが、(2)の電気化学的方法では、ハイブリダイゼーション反応の有無を電気化学的に検出する。
【0080】
電気化学的方法では、遺伝子検出用担体としてポリヌクレオチド固定化電極電極を用いる。ポリヌクレオチド固定化電極(以下、本発明の電極という)は、導電性物質からなる基体に前記(a)〜(e)のいずれかのポリヌクレオチドが固定化されてなる。
【0081】
ポリヌクレオチドを固定化すべき好ましい導電性物質は金であるが、他の材料も使用可能である。例えば、金の合金、銀、プラチナ、水銀、ニッケル、パラジウム、シリコン、ゲルマニウム、ガリウム、タングステン等の金属単体及びそれらの合金、あるいはグラファイト、グラシーカーボン等の炭素等、またはこれらの酸化物、化合物を用いる事ができる。これらの導電性物質は、別の基板上にメッキ、印刷、スパッタ、蒸着などで形成されていてもよい。
【0082】
導電性物質よりなる基体にポリヌクレオチドを固定化する方法は特に限定されるものではない。例えば、ポリヌクレオチドに導入したチオール基と金との結合を利用すると簡単に行うことができる。その他、物理吸着、化学吸着、疎水結合、抱埋、共有結合等でも固定化が可能である。また、ビオチン−アビジン結合やカルボジイミドなどの縮合剤を用いることもできる。これらの場合、あらかじめ官能基を有する分子で導電性物質表面を修飾することにより、固定化を容易にすることができる。更に、基体表面へのポリヌクレオチドの非特異的な吸着を抑制するために、基体面をメルカプトエタノール等のメルカプタンや、ステアリルアミンなどの脂質で被覆することが望ましい。
【0083】
以下、一例として、金基体にポリヌクレオチドを固定化する方法を述べる。
【0084】
まず、脱イオン水で金基体を洗浄した後、活性化処理を行う。活性化には、0.1〜10 mmol/Lの硫酸溶液を用いる。この溶液中で、−0.5〜2V (vs Ag/AgCl)の範囲で、1 v/s〜100000 v/sの範囲で電位を走査させる。これにより、金基体表面はポリヌクレオチドを固定化できる状態にまで活性化される。
【0085】
固定化すべきポリヌクレオチドには5’あるいは3’末端にチオール基を導入しておく。チオール化したポリヌクレオチドは、固定化直前までDTT等の還元剤の溶液に溶解しておき、使用直前にゲル濾過あるいは酢酸エチルによる抽出操作等でDTTを除去する。固定化は、イオン強度0.01〜5の範囲でpH5〜10の範囲内の緩衝液中にプローブを1 ng/ml〜1 mg/mLの範囲になるように溶解し、活性化した直後の基体を浸漬する。固定化反応は、4〜100℃の範囲で10分から1晩程度行う。ポリヌクレオチドを固定化した後の基体は、核酸分解酵素(ヌクレアーゼ)が存在しない条件、できれば遮光して保存することが望ましい。
【0086】
基体上にポリヌクレオチドを固定化する際には、DNAスポッターやDNAアレイヤ−と呼ばれる固定化装置を用いると比較的容易にポリヌクレオチドを固定化することができる。この際、基体の表面を傷つけないために、インクジェット方式や静電方式のスポッターを用いることが望ましい。また、基体表面で直接ポリヌクレオチドの合成を行うことも可能である。
【0087】
本発明の電極は、導電体と、該導電体に電気的に接続された前記本発明の電極とが基板上に配置されたいわゆるDNAチップを構成していることが望ましい。DNAチップは、基板上、望ましくは絶縁性基板上に、絶縁材料で適切に被覆された金属線などの導電体を配設した後、予め前記所定のポリヌクレオチドを固定化した前記電極を前記導電体に通電可能に接続することにより作成する。
【0088】
異なる配列を有するポリヌクレオチドは、それぞれ、互いに絶縁された異なる複数の電極上に固定化されていることが必要である。複数の電極を基板上に設置する場合、基板上に設置すべき電極の数は、実用的には101〜105個であり得る。
【0089】
基板上に本発明の電極を複数設置するときには、さらに走査線を設置し、前記導電体と走査線との各交点にスイッチング素子を配してもよい。それにより、各電極に順次電圧を印加して、電極毎にハイブリダイゼーション反応が起こったか否かを迅速に決定することが可能となる。
【0090】
本発明の電極を用いたハイブリダイゼーション反応の有無の検出では、他の一般的な電気化学的検出法と同じように、本発明の電極の他に、少なくとも対極、必要に応じて参照極を適宜配置する。参照極を配置する場合、例えば、銀/塩化銀電極や水銀/塩化水銀電極などの一般的な参照極を使用し得る。これらの電極は本発明の電極と同一の基板上に配置されていることが望ましい。
【0091】
本発明の電極を用いて、被験者から採取したポリヌクレオチドの配列の決定するには、以下の操作を行う。
【0092】
まず、ヒトを含む哺乳動物等の被験者から核酸を含む試料を採取し、必要に応じて上述した抽出操作、増幅操作、必要に応じて標識付与を行う。これらの操作は(1)の方法と同じである。但し標識の付与は必ずしも必要ではない。
【0093】
次に、前記試料を含む溶液を本発明の電極と接触させて、試料ポリヌクレオチドと電極上のポリヌクレオチドとをハイブリダイゼーション反応条件下に置く。試料ポリヌクレオチドに基体上のヌクレオチドの相補鎖が存在すれば、その試料ポリヌクレオチドは基体上のポリヌクレオチドとハイブリダイゼーション反応し基体上に固定化される。その操作、及び条件は(1)の方法と同様である。その後、本発明の電極を洗浄する。
【0094】
さらに、本発明の電極近傍に導電性の二本鎖認識体の溶液を添加することにより、電極に固定化されたポリヌクレオチドと試料ポリヌクレオチドとがハイブリダイズすることによって形成された二本鎖のポリヌクレオチドに二本鎖認識体をインターカレートさせる。試料ポリヌクレオチドと基体上のポリヌクレオチドとの間のハイブリダリゼーション反応の有無の検出は、電極に電圧を印加したときに、電極上の二本鎖のポリヌクレオチドにインターカレートされた二本鎖認識体から生じる電気的な信号を検出することによって行われる。
【0095】
ここで用いられる二本鎖認識体は特に限定されるものではないが、例えば、ヘキスト33258、アクリジンオレンジ、キナクリン、ドウノマイシン、メタロインターカレーター、ビスアクリジン等のビスインターカレーター、トリスインターカレーター、ポリインターカレーター等を用いることが可能である。メタロインターカレーターと呼ばれるルテニウム、コバルト、鉄などの金属錯体や、エチジウムブロマイド等の有機化合物を用いることができる。また、これら以外にもヘキスト33258やシアニン色素などのグルーブバインダー、抗体、酵素などの生体高分子を用いることも可能である。
【0096】
二本鎖認識体の濃度は、その種類によって異なるが、一般的には1 ng/ml〜1 mg/mlの範囲で使用する。この際、イオン強度0.001〜5の範囲で、pH5〜10の範囲の緩衝液を用いる。
【0097】
本発明の電極を二本鎖認識体と反応させた後、必要に応じて、さらに電極を洗浄する。さらに本発明の電極を作用電極とし、この作用電極と別途設けられた対極との間に電位を印加し、両極間の電流測定をすることによって電気化学的な信号を検出する。電気化学的な信号の検出は、このような2電極(作用電極及び対極)で行っても良いが、あるいは作用電極、対極、参照極を用いた3電極で行っても良い。電気化学的信号の検出において、電位は定速で掃引するか、あるいはパルスで印加するか、あるいは、定電位を印加することができる。測定には、ポテンショスタット、デジタルマルチメーター、ファンクションジェネレーター等の装置を用いて電流、電圧を制御する。得られた電流値を基に、検量線から標的遺伝子の濃度を算出する。
【0098】
前記(a)〜(e)のいずれかのポリヌクレオチドのうち、前記SNP部位がチミンであるもの又はその相補鎖と、前記SNP部位がグアニンであるもの又はその相補鎖、前記SNP部位がアデニンであるもの又はその相補鎖、前記SNP部位がシトシンであるもの又はその相補鎖は、それぞれ互いに絶縁された異なる電極に固定化されて同一の基板上に配設されたDNAチップを構成していることが精度の高い測定を行う上で望ましい。その場合、各電極から各ポリヌクレオチドに対応した電気化学的信号を検知する。
【0099】
(2)の電気化学的方法を用い、被験者から採取した試料ポリヌクレオチドを電極上に固定化した電極を用いても、試料ポリヌクレオチドの配列を決定することもできる。すなわち、あらかじめ配列が既知である(a)〜(e)のいずれかのポリヌクレオチドの溶液を接触させることによって、溶液中のポリヌクレオチドと電極上の試料ポリヌクレオチドとをハイブリダイゼーション反応条件下に置く。溶液中に基体上の試料ポリヌクレオチドの相補鎖が存在すれば、その試料ポリヌクレオチドは基体上のポリヌクレオチドとハイブリダイゼーション反応し基体上に固定化される。そのハイブリダイゼーション反応を検知することによって、試料ポリヌクレオチドの配列を知ることが可能となる。
【0100】
上記の方法にて、試料ポリヌクレオチドと、前記SNP部位にチミンを有するポリヌクレオチド又はその相補鎖とのハイブリダイズ反応が検出されたときには、被験者は、前記SNP部位にチミンを有しており、それ故、インターフェロン療法が有効であると予測できる。これに対して、試料中のポリヌクレオチドと、前記SNP部位にチミン以外を有するポリヌクレオチド又はその相補鎖とのハイブリダイズ反応が検出され、かつ前記SNP部位にチミンを有するポリヌクレオチド又はその相補鎖とのハイブリダイズ反応が検出されなかったときには、被験者は、前記SNP部位にチミンを有しておらず、それ故、インターフェロン療法が有効でないと予測できる。
【0101】
<電気的な検出装置>
以下に本発明の電極を用いて被験者から抽出したポリヌクレオチドの配列の決定を行うための遺伝子検出装置の一例を示す。即ち、前記本発明の電極と、電極上に固定化されたポリヌクレオチドとのハイブリダイゼーション反応を実行するための反応部と、前記電極に固定化された核酸に電圧を印加する印加手段と、該印加手段の動作によって生じた信号を測定する測定手段とを備えた遺伝子検出用装置である。
【0102】
<電気的な検出装置の基本的構成>
図1には、このような遺伝子検出用装置の基本的な実施形態が示されている。
【0103】
図1において、11は、ポリヌクレオチド12が固定化された電極である。13は反応槽であり、電源14が電極11と反応槽13を介して回路を形成するように接続されている。また、回路の内部には、電流計15、電圧計16、及び可変抵抗17が配置されており、反応槽13内でハイブリダイゼーション反応を行った後に、電圧を印加して回路に流れる電流等を測定するように構成されている。
【0104】
図1の遺伝子検出用装置を用いて検査を行うには、反応槽13の内部に緩衝液と被験者から採取したポリヌクレオチド含有試料を保持させ、試料ポリヌクレオチドと電極11上のポリヌクレオチド12との間でハイブリダイゼーション反応を行う。ハイブリダイゼーションの温度及び時間などの条件は、上述したとおりである。続いて、好ましくは反応槽13及び電極11を洗浄し、挿入剤を含むハイブリダイゼーション溶液を反応槽13に満たして電源14を作動させ、電流計15や電圧計16を用いて電源値あるいは電圧値等を測定する。
【0105】
図1には、本発明の遺伝子検出用装置の最も基本的な態様を示したが、検査を完全に自動化するために、本発明の遺伝子検出用装置は、図2のように、さらに、複雑な構成をとってもよい。
【0106】
<自動化した電気的検出装置の構成>
図2に示した検出装置20は、ポリヌクレオチド固定化電極を保持するための電極ホルダ21、反応槽22、第1洗浄槽23、挿入剤反応槽24、第2洗浄槽25、及び電気化学測定槽26、並びに反応槽22、第1洗浄槽23、挿入剤反応槽24、第2洗浄槽25、及び電気化学測定槽26を載せた移動装置27、並びに分析ユニット28、及び操作ユニット29を具備している。これらの槽の間での電極の移動は、移動装置27を使って反応槽等を動かすことにより達成される。
【0107】
<自動化した電気的検出装置の使用法>
検出装置20の使用法は以下のとおりである。
【0108】
まず、反応槽22に、試料又は予め試料から抽出しておいたポリヌクレオチドを含有した溶液を入れておき、電極固定ホルダ21に固定された上記電極を反応槽22に浸漬する。次いで、反応槽22中で、ハイブリダイゼーション反応を行った後、電極固定ホルダ21を第1洗浄槽23に移す。第1洗浄槽23では、洗浄を行って、非特異的に電極に結合した核酸やタンパク質等を除去する。洗浄後、電極固定ホルダ21を挿入剤反応槽24に移し、ハイブリダイゼーション反応によって形成された二本鎖ポリヌクレオチドに挿入剤をインターカレートする。続いて、電極固定ホルダ21を第2洗浄槽25に移し、洗浄を行った後、電極固定ホルダ21を電気化学測定槽26に移し、電気化学的な測定を行う。測定終了後、分析ユニット28に予め記録されている検量線を参考にして試料中のポリヌクレオチドの濃度が出力される。以上の操作は、それぞれの槽及びユニットと電気的につながれた操作ユニット29を通じて行う。
【0109】
本発明は、本発明の遺伝子検出用担体と緩衝液とを備えたキットを提供する。このように、本発明の遺伝子検出用担体と緩衝液とをセットにして提供すれば、直ちに検査を行うことができるので便利である。
【0110】
本発明のキットに使用すべき緩衝液は、ハイブリダイゼーション反応に用いられる任意の緩衝液であり得る。例えば、リン酸緩衝液、炭酸緩衝液、トリス緩衝液などがあげられるが、これらに限定されるものではない。
【0111】
キットには、緩衝液とともに、又は緩衝液に代えて、遺伝子増幅用のプライマー、蛍光色素標識ヌクレオチド、酵素、精製用のカラム等を添付してもよい。
【0112】
本発明は、本発明の電極と二本鎖認識体とを備えたキットを提供する。
【0113】
本発明のキットに使用すべき二本鎖認識体は、例えば、本発明の電極について上述した二本鎖認識体であり得る。
【0114】
キットには、二本鎖認識体とともに、又は二本鎖認識体に代えて、遺伝子増幅用のプライマー、酵素、緩衝液、ヌクレオチド等を添付してもよい。
【実施例】
【0115】
以下、実施例に従って本発明を更に詳細に説明する。
【0116】
実施例1:
この実施例では、MxA遺伝子のプロモーター領域の-88位(配列番号1の塩基配列では、455位に相当する)のヌクレオチドがチミンである遺伝子(以下MxA(T)と表記する)をヘテロ又はホモ接合で有するHCV感染者が、該ヌクレオチドがグアニンである遺伝子(以下MxA(G)と表記する)をホモ接合で有するHCV感染者に比べて、インターフェロン療法に対する応答性がよいことを実証した。
【0117】
<被験者>
組織学的に慢性C型肝炎であると証明され、インターフェロン療法を行っている115人の患者と、抗HCV陰性の健康な者42人が本研究に参加した。これらの者は、全員日本人であり、互いに血縁関係はない。
【0118】
115人の患者のうち、52人の患者は、インターフェロン療法終了後の少なくとも6月の追跡期間中、血清アラニンアミノトランスフェラーゼのレベルが正常な範囲にあり、且つHCVのRNAが常に陰性である持続的応答者(以下、SRと表記する)であり、63人の患者は、ALTレベルに関わらず、追跡期間中に、HCVのRNAが陽性のままであり、又はC型肝炎を再発した非応答者(以下、NRと表記する)であった。全ての患者には、総用量300万ユニットを超えるインターフェロンα及び/又はβを投与した。
【0119】
<MxA遺伝子分析>
患者と健康な対照から採取したPBMCから核酸を抽出した。該核酸をPCRに供し、MxA遺伝子のプロモーター領域を包含する599ヌクレオチドのDNAを増幅した。
【0120】
PCRの概略は、以下のとおりである。
【0121】
0.05μgの核酸をTaq-Gold(パーキンエルマー)、配列番号12のオリゴヌクレオチドプライ マー#MXAF01(フォワードプライマー、-569〜-540位)、及び配列番号6のオリゴヌクレオチドプライマー#MXAF02(リバースプライマー、+30〜+1位)と混合した後、[95℃10分]、[95℃10秒、68℃60秒]×55、[72℃7分]のサイクル条件で、反応させた。PCR産物を直接解読することによって、157の試料のうち12個を配列決定した。
【0122】
配列決定により、増幅した領域中のSNP部位を同定した後、対立遺伝子のヌクレオチドを識別可能に検出するためのRFLPシステムを構築した。全患者の599ヌクレオチドのPCR産物をHhaI(GCG↓C)で消化し、アガロースゲル中で電気泳動して、482ヌクレオチドのバンド及び533ヌクレオチドバンドの何れか又は両者が生成するか否かを調べた。
【0123】
<統計分析>
イエーツの補正を行って、又は行わずに、フィッシャーの正確な確率テストによってグループデータを比較した。p<0.05を統計学的に有意と見做した。
【0124】
<結果>
12のサンプルの配列決定を行うことによって、MxA遺伝子のプロモーター領域中に、多型部位が同定された。該プロモーター領域の-88位には、SNPが存在し(GとT)、該SNPは、図3に示されているISREに類似する領域中に含まれていた。
【0125】
続くHhaIによるRFLPでは、全157サンプルについて、MxA遺伝子の遺伝子型を決定した。該アッセイでは、多型部位にグアニンを有する試料は、電気泳動ゲルに482ヌクレオチドのバントを示した。これに対して、グアニンがチミンに置換されると、HhaIが認識する制限部位が消失するので、533ヌクレオチドのバンドを示した。多型部位がグアニンであるプロモーター領域と多型部位がチミンであるプロモーター領域をヘテロ接合で有する場合には、482ヌクレオチドのバンドと533ヌクレオチドのバンドが共に検出される(図4参照)。
【0126】
表1に示されているように、NR群では、患者の62%が、前記多型部位がグアニンであるプロモーター領域をホモ接合で有していたが(G・Gホモ)、SR群では、患者の31%がG・Gホモであった(p=0.0009;SR vs NR)。反対に、NR群では、患者の35%が、前記多型部位がグアニンであるプロモーター領域と前記多型部位がチミンであるプロモーター領域をヘテロ接合で有していたが(G・Tヘテロ)、SR群では、患者の60%が、G・Tヘテロであった(p=0.0082;SR vs.NR)。T・Tホモの患者は、それぞれ、NR群で3.2%、SR群で10%であった(p=0.2956;SR vs NR)。
【0127】
前記多型部位がグアニンであるプロモーター領域を有する対立遺伝子の頻度は、SR群では0.606であったのに対して、NR群では0.794であった(p=0.0018;SR vsNR)。
【表1】

【0128】
さらに、NR群に比べてSR群ではG・Gホモの個体が有意に少ないという上記の結果は、患者が感染したHCVの遺伝子型に依存しないことも明らかとなった。
【表2】

【0129】
表2から明らかなように、遺伝子型が1bであるHCVに感染した患者群(HCV 1b群)と遺伝子型が2a又は2bであるHCVに感染した患者群(HCV 2a/2b群)では、共にNR群は62%がG・Gホモの個体であるのに対して、SR群は、それぞれ28%及び32%がG・Gホモの個体であった。表2に示した結果から、患者が感染したHCVの遺伝子型にかかわらず、SR群ではG・Gホモの個体が有意に少ないことが明らかとなった(HCV 1b群;p=0.0321、HCV 2a/2b群;p=0.0318)。
【0130】
以上、本実施例によって、前記多型部位がチミンであるMxAプロモーター領域をヘテロ接合又はホモ接合で有しているHCV感染者は、感染したHCVの遺伝子型によらず、インターフェロン療法に高い応答性を示すことが実証された。
【0131】
また、本実施例は、前記多型部位がグアニンでないMxAプロモーター領域をヘテロ接合又はホモ接合で有しているHCV感染者は、インターフェロン療法に高い応答性を示すことも示唆している。
【0132】
さらに、前記多型部位はISRE中に存在するので、これらのことは、C型肝炎以外の疾患についても当てはまるといえる。
【0133】
実施例2:
実施例1で明らかになったように、MxAプロモーターのSNPがT型であるHCV感染者はインターフェロン投与による肝炎の治療効果が高い。一方、そのSNPがG型である場合には治療効果が低い。この理由として、ISREの機能を果たすための塩基配列であるT型はインターフェロンの刺激に正しく応答するが、G型はその配列と1塩基だけ異なるために、インターフェロンの刺激に応答せずMxA蛋白質の生成量が低いためと解釈される。
【0134】
このような状況から考えるとMxAプロモーターのSNPがC型並びにA型のHCV肝炎の患者も、G型と同様にインターフェロンにMxAプロモーターは応答せず、その治療効果は低いと推定される。
【0135】
これらの事を証明するために、MxAプロモーターの下流にルシフェラーゼ遺伝子を有するプラスミドを構築し、これをヒト細胞(HeLa細胞、並びに卵巣癌細胞)にトランスフェクションした。そして、4種類のSNP(T型、G型、A型、C型)を有するMxAプロモーターの夫々について、これらがインターフェロンに応答した結果として産生されるルシフェラーゼ活性を調べた。
【0136】
その結果を図5〜図8に示す。図5は、インターフェロンαを用いてHela細胞内で誘導した例、図6は、インターフェロンαを用いて卵巣癌細胞内で誘導した例、図7は、インターフェロンβを用いてHela細胞内で誘導した例、図8は、インターフェロンβを用いて卵巣癌細胞内で誘導した例である。また、これらの図において、+はインターフェロンを添加した場合のルシフェラーゼ活性を示し、−はインターフェロンを添加しないときのルシフェラーゼ活性を示している。これらの結果は何れも3回の実験の平均値であり、その標準偏差をバーで表示した。
【0137】
図から明らかなように、何れの場合もT型のMxAプロモーターが最も高い値を示し、A型とC型のSNPを有するHCV肝炎の患者はG型の場合と同様に、インターフェロンα並びにインターフェロンβに対する応答が低い。従って、インターフェロンによる治療効果が低い事が予測される。
【0138】
実施例3:
本実施例では、図9を参照しながら、本発明の遺伝子検出用担体を用いてインターフェロン療法の有効性を予測するための操作について説明する。
【0139】
まず、本発明の遺伝子検出用担体を作成するために、配列番号21と配列番号22のプライマーを用いて、配列番号1のポリヌクレオチド断片であって前記SNP部位を含み当該SNP部位がチミンであるT型断片31と、配列番号2のポリヌクレオチドの前記SNP部位を含み当該SNP部位がグアニンであるG型断片32とを増幅し、2μg/μLになるように蒸留水で調製した。
【0140】
次に、各断片に等量の4mg/mLのニトロセルロース(DMSO溶液)を添加し、熱変性後、ポリリジンで被覆されているスライドガラス33上にスポッティングした。スポットが充分乾燥した後、紫外線照射による固定化処理を行い、T型断片31とG型断片32が固定化された遺伝子検出用担体を得た。
【0141】
次に配列番号20と配列番号21のプライマーによって、被験者の血液から抽出した試料ポリヌクレオチドを増幅処理した後、ファルマシア製のECLラベリングシステムでFITC標識を行い、予め調製しておいた前記遺伝子検出用担体と12時間、65℃で反応させた。反応後に、蛍光検出器でシグナルを測定した。
【0142】
その結果、T型の断片を固定化したスポットから蛍光シグナルが観察され、本試験に用いた試料ポリヌクレオチドのSNPはT型であることが判明した。
【0143】
実施例4:
本実施例では、図10を参照しながら、試料中の断片を固定化した遺伝子検出用担体を用いた検査について説明する。
【0144】
被験者から検出したポリヌクレオチドを配列番号21、配列番号22のプライマーを用いて増幅した断片(試料A:41、試料B:42)を、2μg/μLになるように蒸留水で調製した。次に、等量の4mg/Lニトロセルロース(DMSO溶液)を添加した後、熱変性させ、ポリリジンで被覆されているスライドガラス43上にスポッティングした。スポットが充分乾燥した後、紫外線照射による固定化処理を行った。
【0145】
予め蛍光標識した、配列番号1のポリヌクレオチド断片であって前記SNP部位を含み当該SNP部位がチミンであるT型断片(JOE標識)と、予め蛍光標識した、配列番号2のポリヌクレオチド断片であって前記SNP部位を含み当該SNP部位がグアニンであるG型断片(5−FAM標識)、予め蛍光標識した、配列番号3のポリヌクレオチド断片であって前記SNP部位を含み当該SNP部位がアデニンであるA型断片(TAMRA標識)、予め蛍光標識した、配列番号4のポリヌクレオチド断片であって前記SNP部位を含み当該SNP部位がシトシンであるC型断片(ROX標識)とを予め調製しておいたDNAチップと1時間、50℃で反応させた。
【0146】
反応後蛍光検出器でシグナルを測定した。その結果、HEXの蛍光に由来する信号のみが得られ、本試料ポリヌクレオチドのSNPは、T型のみであることが判明した。
【0147】
実施例5:
本実施例では、図11を参照しながら、電気化学的な検出を利用した遺伝子検出用担体について説明する。
【0148】
配列番号21と配列番号22のプライマーを用いて、配列番号1のT型断片51とG型断片52とを増幅し、2μg/μLになるように蒸留水で調製した。次に、2−ヒドロキシエチルジスルフィドと1−シクロヘキシル−3−(2−モルフォリノエチル)−カルボジイミドと反応させ、増幅産物の末端にチオール基を導入した。予め作製しておいた金電極53上にスポッティングし、乾燥しないように1時間反応させた。サンプルは、配列番号21と配列番号22のプライマーを用いて増幅、熱変性後、予め調製しておいたDNAチップと1時間、65℃で反応させた。反応後、10μmol/Lのヘキスト33258溶液中でボルタンメトリーを行い、ヘキスト33258の酸化電流値を測定した。その結果、G型の断片を固定化した電極からのみ有意な信号が得られ、本試料はG型であることが判明した。
【図面の簡単な説明】
【0149】
【図1】図1は、本発明の実施例に係る遺伝子検出用装置の一例を示す図である。
【図2】図2は、本発明の実施例に係る自動化された本発明の電子検出用装置の一例を示す図である。
【図3】図3は、MxA遺伝子のプロモーター領域の塩基配列を示す図である。
【図4】図4は、実施例に係るHhaIを用いたRFLPの電気泳動結果を示す写真である。
【図5】図5は、4種類のSNP(T型、G型、A型、C型)を有するMxAプロモーターの夫々について、Hela細胞内におけるインターフェロンαに対する応答性を、該プロモーターの支配下にあるルシフェラーゼ活性を指標として比較した結果を示すグラフである。
【図6】図6は、4種類のSNP(T型、G型、A型、C型)を有するMxAプロモーターの夫々について、卵巣癌細胞内におけるインターフェロンαに対する応答性を、該プロモーターの支配下にあるルシフェラーゼ活性を指標として比較した結果を示すグラフである。
【図7】図7は、4種類のSNP(T型、G型、A型、C型)を有するMxAプロモーターの夫々について、Hela細胞内におけるインターフェロンβに対する応答性を、該プロモーターの支配下にあるルシフェラーゼ活性を指標として比較した結果を示すグラフである。
【図8】図8は、4種類のSNP(T型、G型、A型、C型)を有するMxAプロモーターの夫々について、卵巣癌細胞内におけるインターフェロンβに対する応答性を、該プロモーターの支配下にあるルシフェラーゼ活性を指標として比較した結果を示すグラフである。
【図9】図9は、本発明の一実施例になる遺伝子検出用担体を示す図である。
【図10】図10は、本発明の他の実施例になる遺伝子検出用担体を示す図である。
【図11】図11は、本発明のもう一つの実施例になる遺伝子検出用担体を示す図である。
【符号の説明】
【0150】
11.電極 12.ポリヌクレオチド 13.反応槽 14.電源 15.電流計 16.電圧計 17.可変抵抗 20.検出装置 21.電極ホルダ 22.反応槽 23.第1洗浄槽 24.挿入剤反応槽 25.第2洗浄槽 26.電気化学測定槽 27.移動装置 28.分析ユニット 29.操作ユニット 31.T型断片 32.G型断片 33.スライドガラス 41.試料A 42.試料B 43.スライドガラス 51.T型断片 52.G型断片 53.金電極
【特許請求の範囲】
【請求項1】
基体と、
前記基体に固定化されてなるポリヌクレオチドとを備えてなり、
前記ポリヌクレオチドは、
(at) 下記配列表の配列番号1に示されるポリヌクレオチド、
(bt) 前記(at)に示されるポリヌクレオチド中の455位を除く1もしくは数個のヌクレオチドが欠失、置換、又は付加された修飾ポリヌクレオチド、
(ct) 配列番号1の441〜455位に示される配列を含むポリヌクレオチド、
(dt) 配列番号1の449〜459位に示される配列を含むポリヌクレオチド、
(et) それらの相補鎖
からなる群から選択されるポリヌクレオチドを含むことを特徴とする遺伝子検出用担体。
【請求項2】
基体と、
前記基体に固定化されてなるポリヌクレオチドとを備えてなり、
前記ポリヌクレオチドは、
(ag) 下記配列表の配列番号2に示されるポリヌクレオチド、
(bg) 前記(ag)に示されるポリヌクレオチド中の455位を除く1もしくは数個のヌクレオチドが欠失、置換、又は付加された修飾ポリヌクレオチド、
(cg) 配列番号2の441〜455位に示される配列を含むポリヌクレオチド、
(dg) 配列番号2の449〜459位に示される配列を含むポリヌクレオチド、
(eg) それらの相補鎖
からなる群から選択されるポリヌクレオチドを含むことを特徴とする遺伝子検出用担体。
【請求項3】
基体と、
前記基体に固定化されてなるポリヌクレオチドとを備えてなり、
前記ポリヌクレオチドは、
(aa) 下記配列表の配列番号3に示されるポリヌクレオチド、
(ba) 前記(aa)に示されるポリヌクレオチド中の455位を除く1もしくは数個のヌクレオチドが欠失、置換、又は付加された修飾ポリヌクレオチド、
(ca) 配列番号3の441〜455位に示される配列を含むポリヌクレオチド、
(da) 配列番号3の449〜459位に示される配列を含むポリヌクレオチド、
(ea) それらの相補鎖
からなる群から選択されるポリヌクレオチドを含むことを特徴とする遺伝子検出用担体。
【請求項4】
基体と、
前記基体に固定化されてなるポリヌクレオチドとを備えてなり、
前記ポリヌクレオチドは、
(ac) 下記配列表の配列番号4に示されるポリヌクレオチド、
(bc) 前記(ac)に示されるポリヌクレオチド中の455位を除く1もしくは数個のヌクレオチドが欠失、置換、又は付加された修飾ポリヌクレオチド、
(cc) 配列番号4の441〜455位に示される配列を含むポリヌクレオチド、
(dc) 配列番号4の449〜459位に示される配列を含むポリヌクレオチド、
(ec) それらの相補鎖
からなる群から選択されるポリヌクレオチドを含むことを特徴とする遺伝子検出用担体。
【請求項5】
前記基体上に固定化されるポリヌクレオチドの長さは15ヌクレオチド以上30ヌクレオチド以下である請求項1乃至4の何れか1項記載の遺伝子検出用担体。
【請求項6】
前記基体は導電物質よりなり、前記遺伝子検出用担体が電極であることを特徴とする請求項1乃至4の何れか1項記載の遺伝子検出用担体。
【請求項7】
基板と、
基板上に形成された第1及び第2の電極とを備えてなり、
前記第1の電極は、導電性基体と、該導電性基体上に固定化された下記(at)乃至(et)から選択される少なくとも1種のポリヌクレオチドを備え、
(at) 下記配列表の配列番号1に示されるポリヌクレオチド、
(bt) 前記(at)に示されるポリヌクレオチド中の455位を除く1もしくは数個のヌクレオチドが欠失、置換、又は付加された修飾ポリヌクレオチド、
(ct) 配列番号1の441〜455位に示される配列を含むポリヌクレオチド、
(dt) 配列番号1の449〜459位に示される配列を含むポリヌクレオチド、
(et) それらの相補鎖
前記第2の電極は、導電性物質からなる基体と、該基体上に固定化された下記(ag)乃至(eg)、(aa)乃至(ea)、(ac)乃至(ec)から選択される少なくとも1種のポリヌクレオチド
(ag) 下記配列表の配列番号2に示されるポリヌクレオチド、
(bg) 前記(ag)に示されるポリヌクレオチド中の455位を除く1もしくは数個のヌクレオチドが欠失、置換、又は付加された修飾ポリヌクレオチド、
(cg) 配列番号2の441〜455位に示される配列を含むポリヌクレオチド、
(dg) 配列番号2の449〜459位に示される配列を含むポリヌクレオチド、
(eg) それらの相補鎖
(aa) 下記配列表の配列番号3に示されるポリヌクレオチド、
(ba) 前記(aa)に示されるポリヌクレオチド中の455位を除く1もしくは数個のヌクレオチドが欠失、置換、又は付加された修飾ポリヌクレオチド、
(ca) 配列番号3の441〜455位に示される配列を含むポリヌクレオチド、
(da) 配列番号3の449〜459位に示される配列を含むポリヌクレオチド、
(ea) それらの相補鎖
(ac) 下記配列表の配列番号4に示されるポリヌクレオチド、
(bc) 前記(ac)に示されるポリヌクレオチド中の455位を除く1もしくは数個のヌクレオチドが欠失、置換、又は付加された修飾ポリヌクレオチド、
(cc) 配列番号4の441〜455位に示される配列を含むポリヌクレオチド、
(dc) 配列番号4の449〜459位に示される配列を含むポリヌクレオチド、
(ec) それらの相補鎖
を備えてなるDNAチップ。
【請求項8】
前記導電性基体に固定化されるポリヌクレオチドの長さは15ヌクレオチド以上30ヌクレオチド以下である請求項7記載の遺伝子検出用担体。
【請求項9】
個体に対するインターフェロン療法の有効性の検出方法であって、
1)前記個体から採取した試料ポリヌクレオチドを請求項1、請求項2、請求項3、請求項4のいずれかに記載の遺伝子検出用担体に接触させる工程と、
2)前記試料ポリヌクレオチドと前記遺伝子検出用担体に固定化されたポリヌクレオチドとのハイブリダイゼーション反応を検知し、前記試料中のポリヌクレオチドの塩基配列を決定する工程とを備える方法。
【請求項10】
請求項9記載の検出方法であって
前記塩基配列を決定する工程によって決定された前記試料ポリヌクレオチドの塩基配列が下記(at)〜(et)を含んでいれば前記個体に対してインターフェロン療法が有効であると検出する工程をさらに備える方法:
(at) 配列番号1に記載のポリヌクレオチド
(bt) 前記(at)に示される配列番号1に記載のポリヌクレオチドにおいて455位を除く1もしくは数個のポリヌクレオチドが欠失、置換、又は付加された修飾ヌクレオチド
(ct) 配列番号1の441〜456位に位置する配列を含むポリヌクレオチド
(dt) 配列番号1の449〜459位に示される配列を含むポリヌクレオチド
(et) 前記(at)〜(dt)に記載のポリヌクレオチドの相補鎖。
【請求項11】
遺伝子検出用担体に接触させる工程の前に、前記個体から採取されたポリヌクレオチドに標識を付す工程を行うことを特徴とする請求項9記載の検出方法。
【請求項12】
前記標識は蛍光色素、ハプテン、酵素、放射性同位体、電極活物質から選ばれる少なくとも1種であることを特徴とする請求項11記載の検出方法。
【請求項13】
前記遺伝子検出用担体は、請求項6に記載の遺伝子検出用担体であり、
前記試料中のポリヌクレオチドの塩基配列を決定する工程におけるハイブリダイゼーション反応の検知は、前記ハイブリダイゼーション反応に伴なって生じる電気化学的変化を検知することにより行なわれることを特徴とする請求項9記載の検出方法。
【請求項14】
前記ハイブリダイゼーション反応に伴なって生じる電気化学的変化の検知は、
遺伝子検出用担体及び対極間に電圧を印加したときの、前記遺伝子検出用担体及び前記対極間に生じた電気信号を測定することにより行われることを特徴とする請求項13記載の治療予測方法。
【請求項15】
前記ハイブリダイゼーション反応時に二本鎖ポリヌクレオチドに特異的に付加する導電性の二本鎖認識体が添加され、前記遺伝子検出用担体及び前記対極間に生じた電気信号は導電性の二本鎖認識体から直接または間接的に生じるものであることを特徴とする請求項14記載の遺伝子検出用装置。
【請求項16】
個体に対するインターフェロン療法の有効性の検出方法であって、
1)前記個体から採取した試料ポリヌクレオチドが基体上に固定化されてなる遺伝子検出用担体にプローブポリヌクレオチドを接触させる工程と、
2)前記基体上に固定化された試料ポリヌクレオチドと前記ポリヌクレオチドとのハイブリダイゼーション反応を検知し、前記試料ポリヌクレオチドの塩基配列を決定する工程とを備え、
前記プローブポリヌクレオチドは、
(at) 下記配列表の配列番号1に示されるポリヌクレオチド、
(bt) 前記(at)に示されるポリヌクレオチド中の455位を除く1もしくは数個のヌクレオチドが欠失、置換、又は付加された修飾ポリヌクレオチド、
(ct) 配列番号1の441〜455位に示される配列を含むポリヌクレオチド、
(dt) 配列番号1の449〜459位に示される配列を含むポリヌクレオチド、
(et) それらの相補鎖
(ag) 下記配列表の配列番号2に示されるポリヌクレオチド、
(bg) 前記(ag)に示されるポリヌクレオチド中の455位を除く1もしくは数個のヌクレオチドが欠失、置換、又は付加された修飾ポリヌクレオチド、
(cg) 配列番号2の441〜455位に示される配列を含むポリヌクレオチド、
(dg) 配列番号2の449〜459位に示される配列を含むポリヌクレオチド、
(eg) それらの相補鎖
(aa) 下記配列表の配列番号3に示されるポリヌクレオチド、
(ba) 前記(aa)に示されるポリヌクレオチド中の455位を除く1もしくは数個のヌクレオチドが欠失、置換、又は付加された修飾ポリヌクレオチド、
(ca) 配列番号3の441〜455位に示される配列を含むポリヌクレオチド、
(da) 配列番号3の449〜459位に示される配列を含むポリヌクレオチド、
(ea) それらの相補鎖
(ac) 下記配列表の配列番号4に示されるポリヌクレオチド、
(bc) 前記(ac)に示されるポリヌクレオチド中の455位を除く1もしくは数個のヌクレオチドが欠失、置換、又は付加された修飾ポリヌクレオチド、
(cc) 配列番号4の441〜455位に示される配列を含むポリヌクレオチド、
(dc) 配列番号4の449〜459位に示される配列を含むポリヌクレオチド、
(ec) それらの相補鎖
からなる群より選択されるポリヌクレオチドを含む方法。
【請求項17】
請求項16記載の検出方法であって
前記塩基配列を決定する工程によって決定された前記試料ポリヌクレオチドの塩基配列が下記(at)〜(et)を含んでいれば前記個体に対してインターフェロン療法が有効であると検出する工程をさらに備える方法:
(at) 配列番号1に記載のポリヌクレオチド
(bt) 前記(at)に示される配列番号1に記載のポリヌクレオチドにおいて455位を除く1もしくは数個のポリヌクレオチドが欠失、置換、又は付加された修飾ポリヌクレオチド
(ct) 配列番号1の441〜456位に位置する配列を含むポリヌクレオチド
(dt) 配列番号1の449〜459位に示される配列を含むポリヌクレオチド
(et) 前記(at)〜(dt)に記載のポリヌクレオチドの相補鎖
【請求項18】
遺伝子検出用担体に接触させる工程の前に、前記プローブポリヌクレオチドに標識を付す工程を行うことを特徴とする請求項18記載の検出方法。
【請求項19】
前記標識は蛍光色素、ハプテン、酵素、放射性同位体、電極活物質から選ばれる少なくとも1種であることを特徴とする請求項18記載の検出方法。
【請求項20】
前記遺伝子検出用担体は、導電性基体に前記個体から採取した試料ポリヌクレオチドが固定された電極であり、
前記試料中のポリヌクレオチドの塩基配列を決定する工程におけるハイブリダイゼーション反応の検知は、前記ハイブリダイゼーション反応に伴なって生じる電気化学的変化を検知することにより行なわれることを特徴とする請求項18記載の検出方法。
【請求項21】
前記ハイブリダイゼーション反応に伴ない生じる電気化学的変化の検知は、遺伝子検出用担体及び対極間に電圧を印加したときの、前記遺伝子検出用担体及び前記対極間に生じた電気信号を測定することにより行われることを特徴とする請求項20記載の検出方法。
【請求項22】
前記ハイブリダイゼーション反応時に二本鎖ポリヌクレオチドに特異的に付加する導電性の二本鎖認識体が添加され、前記遺伝子検出用担体及び前記対極間に生じた電気信号は導電性の二本鎖認識体から直接または間接的に生じるものであることを特徴とする請求項21記載の検出方法。
【請求項23】
請求項1、請求項2、請求項3、請求項4から選ばれる少なくとも1種の遺伝子検出用担体と、
前記基体上に固定化されたポリヌクレオチドと標識が付されたポリヌクレオチドとを含む試料とを接触させ、前記基体上に固定化されたポリヌクレオチドと前記標識が付されたポリヌクレオチドとをハイブリタイゼーション反応条件下に置く反応部と、
前記標識が付されたポリヌクレオチドに付された標識を検出する標識検出装置を少なくとも備えるインターフェロン療法の有効性を検出するための遺伝子検出用装置。
【請求項24】
前記標識は蛍光色素、ハプテン、酵素、放射性同位体、電極活物質から選ばれる少なくとも一種である事を特徴とする請求項23記載の遺伝子検出用担体。
【請求項25】
請求項6に記載の遺伝子検出用担体と、
対極と、
前記遺伝子検出用担体及び前記対極間に電圧を印加する電圧印加部と、
前記遺伝子検出用担体に固定化された前記ポリヌクレオチドとポリヌクレオチドとを含む試料とを接触させ、前記基体上に固定化されたポリヌクレオチドと前記試料中のポリヌクレオチドとをハイブリダイゼーション反応条件下に置く反応部と、
前記ハイブリダイゼーション反応後に前記電圧印加手段により電圧を印加させた際に前記遺伝子検出用担体及び前記対極間に生じた電気信号を測定する測定部とを備えたインターフェロン療法の有効性を検出するための遺伝子検出用装置。
【請求項26】
前記反応部においては、前記ハイブリダイゼーション反応により生じた二本鎖ポリヌクレオチドに特異的に付加する導電性の二本鎖認識体が添加され、前記遺伝子検出用担体及び前記対極間に生じた電気信号は前記二本鎖認識体から生じるものであることを特徴とする請求項25載のインターフェロン療法の有効性を検出するための遺伝子検出用装置。
【請求項27】
請求項1、請求項2、請求項3、請求項4記載の遺伝子検出用担体と、緩衝液とを備えることを特徴とするインターフェロン治療の有効性を測定するためのキット。
【請求項28】
請求項6記載の遺伝子検出用担体と、二本鎖認識体と、緩衝液とを備えることを特徴とする個体に対するインターフェロン治療の有効性を検出するためのキット。
【請求項1】
基体と、
前記基体に固定化されてなるポリヌクレオチドとを備えてなり、
前記ポリヌクレオチドは、
(at) 下記配列表の配列番号1に示されるポリヌクレオチド、
(bt) 前記(at)に示されるポリヌクレオチド中の455位を除く1もしくは数個のヌクレオチドが欠失、置換、又は付加された修飾ポリヌクレオチド、
(ct) 配列番号1の441〜455位に示される配列を含むポリヌクレオチド、
(dt) 配列番号1の449〜459位に示される配列を含むポリヌクレオチド、
(et) それらの相補鎖
からなる群から選択されるポリヌクレオチドを含むことを特徴とする遺伝子検出用担体。
【請求項2】
基体と、
前記基体に固定化されてなるポリヌクレオチドとを備えてなり、
前記ポリヌクレオチドは、
(ag) 下記配列表の配列番号2に示されるポリヌクレオチド、
(bg) 前記(ag)に示されるポリヌクレオチド中の455位を除く1もしくは数個のヌクレオチドが欠失、置換、又は付加された修飾ポリヌクレオチド、
(cg) 配列番号2の441〜455位に示される配列を含むポリヌクレオチド、
(dg) 配列番号2の449〜459位に示される配列を含むポリヌクレオチド、
(eg) それらの相補鎖
からなる群から選択されるポリヌクレオチドを含むことを特徴とする遺伝子検出用担体。
【請求項3】
基体と、
前記基体に固定化されてなるポリヌクレオチドとを備えてなり、
前記ポリヌクレオチドは、
(aa) 下記配列表の配列番号3に示されるポリヌクレオチド、
(ba) 前記(aa)に示されるポリヌクレオチド中の455位を除く1もしくは数個のヌクレオチドが欠失、置換、又は付加された修飾ポリヌクレオチド、
(ca) 配列番号3の441〜455位に示される配列を含むポリヌクレオチド、
(da) 配列番号3の449〜459位に示される配列を含むポリヌクレオチド、
(ea) それらの相補鎖
からなる群から選択されるポリヌクレオチドを含むことを特徴とする遺伝子検出用担体。
【請求項4】
基体と、
前記基体に固定化されてなるポリヌクレオチドとを備えてなり、
前記ポリヌクレオチドは、
(ac) 下記配列表の配列番号4に示されるポリヌクレオチド、
(bc) 前記(ac)に示されるポリヌクレオチド中の455位を除く1もしくは数個のヌクレオチドが欠失、置換、又は付加された修飾ポリヌクレオチド、
(cc) 配列番号4の441〜455位に示される配列を含むポリヌクレオチド、
(dc) 配列番号4の449〜459位に示される配列を含むポリヌクレオチド、
(ec) それらの相補鎖
からなる群から選択されるポリヌクレオチドを含むことを特徴とする遺伝子検出用担体。
【請求項5】
前記基体上に固定化されるポリヌクレオチドの長さは15ヌクレオチド以上30ヌクレオチド以下である請求項1乃至4の何れか1項記載の遺伝子検出用担体。
【請求項6】
前記基体は導電物質よりなり、前記遺伝子検出用担体が電極であることを特徴とする請求項1乃至4の何れか1項記載の遺伝子検出用担体。
【請求項7】
基板と、
基板上に形成された第1及び第2の電極とを備えてなり、
前記第1の電極は、導電性基体と、該導電性基体上に固定化された下記(at)乃至(et)から選択される少なくとも1種のポリヌクレオチドを備え、
(at) 下記配列表の配列番号1に示されるポリヌクレオチド、
(bt) 前記(at)に示されるポリヌクレオチド中の455位を除く1もしくは数個のヌクレオチドが欠失、置換、又は付加された修飾ポリヌクレオチド、
(ct) 配列番号1の441〜455位に示される配列を含むポリヌクレオチド、
(dt) 配列番号1の449〜459位に示される配列を含むポリヌクレオチド、
(et) それらの相補鎖
前記第2の電極は、導電性物質からなる基体と、該基体上に固定化された下記(ag)乃至(eg)、(aa)乃至(ea)、(ac)乃至(ec)から選択される少なくとも1種のポリヌクレオチド
(ag) 下記配列表の配列番号2に示されるポリヌクレオチド、
(bg) 前記(ag)に示されるポリヌクレオチド中の455位を除く1もしくは数個のヌクレオチドが欠失、置換、又は付加された修飾ポリヌクレオチド、
(cg) 配列番号2の441〜455位に示される配列を含むポリヌクレオチド、
(dg) 配列番号2の449〜459位に示される配列を含むポリヌクレオチド、
(eg) それらの相補鎖
(aa) 下記配列表の配列番号3に示されるポリヌクレオチド、
(ba) 前記(aa)に示されるポリヌクレオチド中の455位を除く1もしくは数個のヌクレオチドが欠失、置換、又は付加された修飾ポリヌクレオチド、
(ca) 配列番号3の441〜455位に示される配列を含むポリヌクレオチド、
(da) 配列番号3の449〜459位に示される配列を含むポリヌクレオチド、
(ea) それらの相補鎖
(ac) 下記配列表の配列番号4に示されるポリヌクレオチド、
(bc) 前記(ac)に示されるポリヌクレオチド中の455位を除く1もしくは数個のヌクレオチドが欠失、置換、又は付加された修飾ポリヌクレオチド、
(cc) 配列番号4の441〜455位に示される配列を含むポリヌクレオチド、
(dc) 配列番号4の449〜459位に示される配列を含むポリヌクレオチド、
(ec) それらの相補鎖
を備えてなるDNAチップ。
【請求項8】
前記導電性基体に固定化されるポリヌクレオチドの長さは15ヌクレオチド以上30ヌクレオチド以下である請求項7記載の遺伝子検出用担体。
【請求項9】
個体に対するインターフェロン療法の有効性の検出方法であって、
1)前記個体から採取した試料ポリヌクレオチドを請求項1、請求項2、請求項3、請求項4のいずれかに記載の遺伝子検出用担体に接触させる工程と、
2)前記試料ポリヌクレオチドと前記遺伝子検出用担体に固定化されたポリヌクレオチドとのハイブリダイゼーション反応を検知し、前記試料中のポリヌクレオチドの塩基配列を決定する工程とを備える方法。
【請求項10】
請求項9記載の検出方法であって
前記塩基配列を決定する工程によって決定された前記試料ポリヌクレオチドの塩基配列が下記(at)〜(et)を含んでいれば前記個体に対してインターフェロン療法が有効であると検出する工程をさらに備える方法:
(at) 配列番号1に記載のポリヌクレオチド
(bt) 前記(at)に示される配列番号1に記載のポリヌクレオチドにおいて455位を除く1もしくは数個のポリヌクレオチドが欠失、置換、又は付加された修飾ヌクレオチド
(ct) 配列番号1の441〜456位に位置する配列を含むポリヌクレオチド
(dt) 配列番号1の449〜459位に示される配列を含むポリヌクレオチド
(et) 前記(at)〜(dt)に記載のポリヌクレオチドの相補鎖。
【請求項11】
遺伝子検出用担体に接触させる工程の前に、前記個体から採取されたポリヌクレオチドに標識を付す工程を行うことを特徴とする請求項9記載の検出方法。
【請求項12】
前記標識は蛍光色素、ハプテン、酵素、放射性同位体、電極活物質から選ばれる少なくとも1種であることを特徴とする請求項11記載の検出方法。
【請求項13】
前記遺伝子検出用担体は、請求項6に記載の遺伝子検出用担体であり、
前記試料中のポリヌクレオチドの塩基配列を決定する工程におけるハイブリダイゼーション反応の検知は、前記ハイブリダイゼーション反応に伴なって生じる電気化学的変化を検知することにより行なわれることを特徴とする請求項9記載の検出方法。
【請求項14】
前記ハイブリダイゼーション反応に伴なって生じる電気化学的変化の検知は、
遺伝子検出用担体及び対極間に電圧を印加したときの、前記遺伝子検出用担体及び前記対極間に生じた電気信号を測定することにより行われることを特徴とする請求項13記載の治療予測方法。
【請求項15】
前記ハイブリダイゼーション反応時に二本鎖ポリヌクレオチドに特異的に付加する導電性の二本鎖認識体が添加され、前記遺伝子検出用担体及び前記対極間に生じた電気信号は導電性の二本鎖認識体から直接または間接的に生じるものであることを特徴とする請求項14記載の遺伝子検出用装置。
【請求項16】
個体に対するインターフェロン療法の有効性の検出方法であって、
1)前記個体から採取した試料ポリヌクレオチドが基体上に固定化されてなる遺伝子検出用担体にプローブポリヌクレオチドを接触させる工程と、
2)前記基体上に固定化された試料ポリヌクレオチドと前記ポリヌクレオチドとのハイブリダイゼーション反応を検知し、前記試料ポリヌクレオチドの塩基配列を決定する工程とを備え、
前記プローブポリヌクレオチドは、
(at) 下記配列表の配列番号1に示されるポリヌクレオチド、
(bt) 前記(at)に示されるポリヌクレオチド中の455位を除く1もしくは数個のヌクレオチドが欠失、置換、又は付加された修飾ポリヌクレオチド、
(ct) 配列番号1の441〜455位に示される配列を含むポリヌクレオチド、
(dt) 配列番号1の449〜459位に示される配列を含むポリヌクレオチド、
(et) それらの相補鎖
(ag) 下記配列表の配列番号2に示されるポリヌクレオチド、
(bg) 前記(ag)に示されるポリヌクレオチド中の455位を除く1もしくは数個のヌクレオチドが欠失、置換、又は付加された修飾ポリヌクレオチド、
(cg) 配列番号2の441〜455位に示される配列を含むポリヌクレオチド、
(dg) 配列番号2の449〜459位に示される配列を含むポリヌクレオチド、
(eg) それらの相補鎖
(aa) 下記配列表の配列番号3に示されるポリヌクレオチド、
(ba) 前記(aa)に示されるポリヌクレオチド中の455位を除く1もしくは数個のヌクレオチドが欠失、置換、又は付加された修飾ポリヌクレオチド、
(ca) 配列番号3の441〜455位に示される配列を含むポリヌクレオチド、
(da) 配列番号3の449〜459位に示される配列を含むポリヌクレオチド、
(ea) それらの相補鎖
(ac) 下記配列表の配列番号4に示されるポリヌクレオチド、
(bc) 前記(ac)に示されるポリヌクレオチド中の455位を除く1もしくは数個のヌクレオチドが欠失、置換、又は付加された修飾ポリヌクレオチド、
(cc) 配列番号4の441〜455位に示される配列を含むポリヌクレオチド、
(dc) 配列番号4の449〜459位に示される配列を含むポリヌクレオチド、
(ec) それらの相補鎖
からなる群より選択されるポリヌクレオチドを含む方法。
【請求項17】
請求項16記載の検出方法であって
前記塩基配列を決定する工程によって決定された前記試料ポリヌクレオチドの塩基配列が下記(at)〜(et)を含んでいれば前記個体に対してインターフェロン療法が有効であると検出する工程をさらに備える方法:
(at) 配列番号1に記載のポリヌクレオチド
(bt) 前記(at)に示される配列番号1に記載のポリヌクレオチドにおいて455位を除く1もしくは数個のポリヌクレオチドが欠失、置換、又は付加された修飾ポリヌクレオチド
(ct) 配列番号1の441〜456位に位置する配列を含むポリヌクレオチド
(dt) 配列番号1の449〜459位に示される配列を含むポリヌクレオチド
(et) 前記(at)〜(dt)に記載のポリヌクレオチドの相補鎖
【請求項18】
遺伝子検出用担体に接触させる工程の前に、前記プローブポリヌクレオチドに標識を付す工程を行うことを特徴とする請求項18記載の検出方法。
【請求項19】
前記標識は蛍光色素、ハプテン、酵素、放射性同位体、電極活物質から選ばれる少なくとも1種であることを特徴とする請求項18記載の検出方法。
【請求項20】
前記遺伝子検出用担体は、導電性基体に前記個体から採取した試料ポリヌクレオチドが固定された電極であり、
前記試料中のポリヌクレオチドの塩基配列を決定する工程におけるハイブリダイゼーション反応の検知は、前記ハイブリダイゼーション反応に伴なって生じる電気化学的変化を検知することにより行なわれることを特徴とする請求項18記載の検出方法。
【請求項21】
前記ハイブリダイゼーション反応に伴ない生じる電気化学的変化の検知は、遺伝子検出用担体及び対極間に電圧を印加したときの、前記遺伝子検出用担体及び前記対極間に生じた電気信号を測定することにより行われることを特徴とする請求項20記載の検出方法。
【請求項22】
前記ハイブリダイゼーション反応時に二本鎖ポリヌクレオチドに特異的に付加する導電性の二本鎖認識体が添加され、前記遺伝子検出用担体及び前記対極間に生じた電気信号は導電性の二本鎖認識体から直接または間接的に生じるものであることを特徴とする請求項21記載の検出方法。
【請求項23】
請求項1、請求項2、請求項3、請求項4から選ばれる少なくとも1種の遺伝子検出用担体と、
前記基体上に固定化されたポリヌクレオチドと標識が付されたポリヌクレオチドとを含む試料とを接触させ、前記基体上に固定化されたポリヌクレオチドと前記標識が付されたポリヌクレオチドとをハイブリタイゼーション反応条件下に置く反応部と、
前記標識が付されたポリヌクレオチドに付された標識を検出する標識検出装置を少なくとも備えるインターフェロン療法の有効性を検出するための遺伝子検出用装置。
【請求項24】
前記標識は蛍光色素、ハプテン、酵素、放射性同位体、電極活物質から選ばれる少なくとも一種である事を特徴とする請求項23記載の遺伝子検出用担体。
【請求項25】
請求項6に記載の遺伝子検出用担体と、
対極と、
前記遺伝子検出用担体及び前記対極間に電圧を印加する電圧印加部と、
前記遺伝子検出用担体に固定化された前記ポリヌクレオチドとポリヌクレオチドとを含む試料とを接触させ、前記基体上に固定化されたポリヌクレオチドと前記試料中のポリヌクレオチドとをハイブリダイゼーション反応条件下に置く反応部と、
前記ハイブリダイゼーション反応後に前記電圧印加手段により電圧を印加させた際に前記遺伝子検出用担体及び前記対極間に生じた電気信号を測定する測定部とを備えたインターフェロン療法の有効性を検出するための遺伝子検出用装置。
【請求項26】
前記反応部においては、前記ハイブリダイゼーション反応により生じた二本鎖ポリヌクレオチドに特異的に付加する導電性の二本鎖認識体が添加され、前記遺伝子検出用担体及び前記対極間に生じた電気信号は前記二本鎖認識体から生じるものであることを特徴とする請求項25載のインターフェロン療法の有効性を検出するための遺伝子検出用装置。
【請求項27】
請求項1、請求項2、請求項3、請求項4記載の遺伝子検出用担体と、緩衝液とを備えることを特徴とするインターフェロン治療の有効性を測定するためのキット。
【請求項28】
請求項6記載の遺伝子検出用担体と、二本鎖認識体と、緩衝液とを備えることを特徴とする個体に対するインターフェロン治療の有効性を検出するためのキット。
【図1】


【図2】


【図3】


【図4】


【図5】


【図6】


【図7】


【図8】


【図9】


【図10】


【図11】




【図2】


【図3】


【図4】


【図5】


【図6】


【図7】


【図8】


【図9】


【図10】


【図11】


【公開番号】特開2008−22857(P2008−22857A)
【公開日】平成20年2月7日(2008.2.7)
【国際特許分類】
【出願番号】特願2007−225997(P2007−225997)
【出願日】平成19年8月31日(2007.8.31)
【分割の表示】特願2001−62372(P2001−62372)の分割
【原出願日】平成13年3月6日(2001.3.6)
【特許番号】特許第4034818号(P4034818)
【特許公報発行日】平成20年1月16日(2008.1.16)
【出願人】(000003078)株式会社東芝 (54,554)
【Fターム(参考)】
【公開日】平成20年2月7日(2008.2.7)
【国際特許分類】
【出願日】平成19年8月31日(2007.8.31)
【分割の表示】特願2001−62372(P2001−62372)の分割
【原出願日】平成13年3月6日(2001.3.6)
【特許番号】特許第4034818号(P4034818)
【特許公報発行日】平成20年1月16日(2008.1.16)
【出願人】(000003078)株式会社東芝 (54,554)
【Fターム(参考)】
[ Back to top ]

